Российские клинические рекомендации
Под редакцией Ю.Г. Аляева, П.В. Глыбочко, Д.Ю. Пушкаря
Москва
Медфорум
2017
УДК 616.61(083.1)
ББК56.9я81
У71
Клинические рекомендации разработаны и рекомендованы Российским обществом урологов
Урология. Российские клинические рекомендации / под ред. Ю.Г. Аляева, П.В. Глыбочко, Д. Ю. Пушкаря. — 2017. — 544 с.
ISBN 978-5-9906972-6-3
Российские клинические рекомендации подготовлены специалистами ведущих урологических клиник и кафедр при поддержке Российского общества урологов на базе европейских клинических рекомендаций. Издание содержит информацию по наиболее распространенным урологическим заболеваниям, алгоритмы действия врача при диагностике, лечении и профилактике заболеваний и реабилитации пациентов.
Соблюдение международной методологии в подготовке клинических рекомендаций гарантирует их современность, достоверность, обобщение лучшего мирового опыта и знаний, применимость на практике. Именно поэтому клинические рекомендации имеют преимущества перед традиционными источниками информации (учебники, монографии, руководства) и позволяют врачу принимать обоснованные решения в сложных клинических ситуациях.
Клинические рекомендации предназначены для практикующих врачей (урологов, онкоурологов, онкологов, терапевтов, хирургов и других специалистов смежных дисциплин), а также для обучения ординаторов, студентов старших курсов.
УДК 616.61(083.1)
ББК 56.9я81
У71
ISBN 978-5-9906972-6-3
Агентство медицинской информации «Медфорум»
Авторский коллектив
Главные редакторы
Аляев Юрий Геннадьевич – член-корреспондент РАН, доктор медицинских наук, профессор, директор Клиники урологии и заведующий кафедрой урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, заслуженный деятель науки РФ, председатель Российского общества урологов, главный редактор журнала «Урология»
Глыбочко Петр Витальевич – член-корреспондент РАН, доктор медицинских наук, профессор, ректор ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, председатель Совета ректоров медицинских и фармацевтических вузов России, директор НИИ уронефрологии и репродуктивного здоровья человека ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Пушкарь Дмитрий Юрьевич – доктор медицинских наук, профессор, заведующий кафедрой урологии МГМСУ им. А. И. Евдокимова, заслуженный врач РФ, главный уролог МЗ РФ
Редакторы
Каприн Андрей Дмитриевич – доктор медицинских наук, профессор, член-корреспондент РАН, член-корреспондент РАО, заслуженный врач Российской Федерации, заведующий кафедрой урологии и оперативной нефрологии с курсoм онкоурологии Российского Университета Дружбы Народов, генеральный директор ФГБУ «НМИРЦ» МЗ РФ, главный уролог АН РФ
Коган Михаил Иосифович – доктор медицинских наук, профессор, заведующий кафедрой урологии РГМУ, главный уролог Ростовского городского управления здравоохранения
Корнеев Игорь Алексеевич – доктор медицинских наук, профессор кафедры урологии СПбГМУ им. акад. И.П. Павлова, заслуженный врач РФ
Лоран Олег Борисович – доктор медицинских наук, профессор, член-корреспондент РАН, заведующий кафедрой урологии и хирургической андрологии РМАПО, заслуженный деятель науки РФ, главный редактор газеты «Вестник РОУ».
Мартов Алексей Георгиевич – доктор медицинских наук, профессор, заведующий кафедрой урологии ФМБА, заместитель председателя Российского общества урологов, заместитель главного редактора журнала «Урология»
Матвеев Всеволод Борисович – доктор медицинских наук, профессор, заведующий урологическим отделением РОНЦ им. Н.Н. Блохина, президент Российского общества онкоурологов
Щеплев Петр Андреевич – доктор медицинских наук, профессор, кафедры эндоурологии РМАПО, президент профессиональной ассоциации андрологов России, заместитель председателя Российского общества урологов, главный редактор журнала «Андрология и генитальная хирургия»
Разработчики клинических рекомендаций
Акопян Гагик Нерсесович – кандидат медицинских наук, доцент кафедры урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Алексеев Борис Яковлевич – доктор медицинских наук, профессор, заместитель генерального директора по науке ФГБУ «НМИРЦ» Минздрава России
Ахвледиани Ника Джумберович – доктор медицинских наук, профессор, заведующий отделом андрологии и генитальной хирургии НИИ уронефрологии и репродуктивного здоровья человека ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Безруков Евгений Алексеевич – доктор медицинских наук, профессор кафедры урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова», заведующий урологическим отделением УКБ №2 ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Берников Александр Николаевич – кандидат медицинских наук, доцент кафедры урологии МГМСУ им. А.И. Евдокимова, заведующий отделением урологии КМЦ МГМСУ им. А.И. Евдокимова
Борисов Владимир Викторович – доктор медицинских наук, профессор кафедры нефрологии и гемодиализа Института профессионального образования ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, заместитель председателя Российского общества урологов
Бутнару Денис Викторович – кандидат медицинских наук, доцент кафедры урологии, заместитель директора НИИ уронефрологии и репродуктивного здоровья человека ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Воробьев Николай Владимирович – кандидат медицинских наук, руководитель отделения онкоурологии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИРЦ» Минздрава России
Гаджиева Заида Камалудиновна – доктор медицинских наук, врач-уролог клиники урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, научный редактор журнала «Урология», помощник председателя Российского общества урологов по работе с регионами
Гаджиев Нариман Казиханович – кандидат медицинских наук, врач-уролог урологического отделения ФГБУ «ВЦЭРМ им. Никифорова», МЧС, Россия
Газимиев Магомед Алхазурович – доктор медицинских наук, профессор кафедры урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, исполнительный директор Российского общества урологов, заместитель главного редактора газеты «Вестник РОУ»
Говоров Александр Викторович – кандидат медицинских наук, доцент кафедры урологии МГМСУ им. А.И. Евдокимова
Головащенко Максим Петрович – кандидат медицинских наук, научный сотрудник отделения онкоурологии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИРЦ» Минздрава России
Еникеев Михаил Эликович – доктор медицинских наук, профессор кафедры урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, заведующий урологическим отделением УКБ №2 ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Зайцев Андрей Владимирович – доктор медицинских наук, профессор кафедры урологии МГМСУ им. А.И. Евдокимова
Корнеев Игорь Алексеевич – доктор медицинских наук, профессор кафедры урологии ПСПБ ГМУ им. академика И.П. Павлова
Касян Геворг Рудикович – доктор медицинских наук, профессор кафедры урологии МГМСУ им. А.И. Евдокимова
Калпинский Алексей Сергеевич – кандидат медицинских наук, старший научный сотрудник отделения онкоурологии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИРЦ» Минздрава России
Колонтарев Константин Борисович – доктор медицинских наук, доцент кафедры урологии МГМСУ им. А.И. Евдокимова
Костин Андрей Александрович – доктор медицинских наук, профессор кафедры урологии и оперативной нефрологии с курсом онкоурологии Российского Университета Дружбы Народов, заведующий кафедрой урологии, онкологии и радиологии ФПК МР, первый заместитель генерального директора ФГБУ "НМИРЦ" МЗ РФ, эксперт РАН
Крашенинников Алексей Артурович – младший научный сотрудник отделения онкоурологии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИРЦ» Минздрава России
Крупинов Герман Евгеньевич – доктор медицинских наук, профессор кафедры урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова», заведующий учебной частью кафедры урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»
Малхасян Виген Андреевич – кандидат медицинских наук, ассистент кафедры урологии МГМСУ им. А.И. Евдокимова
Пушкарь Дмитрий Юрьевич – доктор медицинских наук, профессор, заведующий кафедрой урологии МГМСУ им. А. И. Евдокимова, заслуженный врач РФ, главный уролог МЗ РФ
Рапопорт Леонид Михайлович – доктор медицинских наук, профессор кафедры урологии, заместитель директора по лечебной работе НИИ уронефрологии и репродуктивного здоровья человека ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»
Раснер Павел Ильич – доктор медицинских наук, доцент кафедры урологии МГМСУ им. А.И. Евдокимова , заведующий 4 урологического отделения ГКБ им. С.И.Спасокукоцкого
Руденко Вадим Игоревич – доктор медицинских наук, профессор, заведующий отделением рентген-ударноволновой литотрипсии УКБ №2 ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»
Семенякин Игорь Владимирович – доктор медицинских наук, заместитель главного врача по хирургической помощи ГКБ им. С.И.Спасокукоцкого, ассистент кафедры урологии МГМСУ им. А. И. Евдокимова
Смирнова Светлана Владимировна – кандидат медицинских наук, врач-онколог Клиники урологии Первого МГМУ им. И. М. Сеченова
Спивак Леонид Григорьевич – кандидат медицинских наук, доцент кафедры урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова», председатель Совета Ассоциации специалистов консервативной терапии в урологии «АСПЕКТ»
Фиев Дмитрий Николаевич – доктор медицинских наук, ведущий научный сотрудник НИИ уронефрологии и репродуктивного здоровья человека урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Харчилава Реваз Ревазович – кандидат медицинских наук, заместитель директора учебного центра врачебной практики «Praxi Medica» ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Цариченко Дмитрий Георгиевич – доктор медицинских наук, профессор кафедры урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Чалый Михаил Евгеньевич – доктор медицинских наук, профессор кафедры урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, директор центра инновационных образовательных программ «Медицина будущего» ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Шегай Петр Викторович – кандидат медицинских наук, научный сотрудник отделения онкоурологии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИРЦ» Минздрава России
Шилов Евгений Михайлович – доктор медицинских наук, профессор, заведующий кафедрой нефрологии и гемодиализа Института профессионального образования ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Шпоть Евгений Валерьевич – кандидат медицинских наук, доцент кафедры урологии ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Предисловие
Уважаемые коллеги!
Представляем вам новые российские клинические рекомендации по урологии, разработанные и рекомендованные ведущими специалистами Российского общества урологов. Рекомендации охватывают наиболее распространённые урологические заболевания и предназначены врачам-урологам, работающим как в поликлиниках, так и в стационарах.
Клинические рекомендации — это систематически разрабатываемые и обновляемые документы, описывающие действия врача по диагностике, лечению и профилактике заболеваний и помогающие ему принимать правильные клинические решения. Цель клинических рекомендаций — применение во врачебной практике наиболее эффективных и безопасных медицинских технологий и лекарственных средств, отказ от необоснованных вмешательств, повышение качества медицинской помощи. Рекомендации профессиональных медицинских обществ служат методологической основой для создания других документов и используются для контроля качества медицинской помощи в системе непрерывного медицинского образования.
Клинические рекомендации отражают как многолетний опыт российских урологов, так и международный опыт — они разработаны на основе признанной международной методологии (подробнее см. раздел «Методология создания клинических рекомендаций»). За рубежом клинические рекомендации наиболее активно разрабатывают профессиональные медицинские общества, например Европейская ассоциация урологов, Американское общество урологов и др. В России разработкой рекомендаций по урологии занимается профессиональная общественная организация урологов — Российское общество урологов. Ведущие урологи и специалисты общества приняли участие в подготовке этого издания в качестве научных редакторов и авторов-составителей. По каждой теме авторы проводили поиск и анализ компьютеризированных источников информации: клинических рекомендаций профессиональных медицинских обществ, систематических обзоров, материалов клинических испытаний и др.
Надеемся, что предлагаемые рекомендации окажутся полезными в вашей повседневной работе и помогут в оказании высококвалифицированной помощи пациентам.
Главные редакторы
член-корреспондент РАМН, профессор Ю.Г. Аляев
член-корреспондент РАМН, профессор П.В. Глыбочко
профессор Д.Ю. Пушкарь
Список сокращений
ААТ — антиандрогенная терапия
АГ — артериальная гипертензия
АД — артериальное давление
АПЖ — аденома предстательной железы
АПФ — ангиотензинпревращающий фермент
АСАТ — антиспермальные антитела
АТФ — аденозинтрифосфат
АФК — активная форма кислорода
АФП — α-фетопротеин
БЛРС — бета-лактамазы расширенного спектра (extended spectrum beta lactamases)
ВМП — верхние мочевыводящие пути
ВОЗ — Всемирная организация здравоохранения
ВРТ — вспомогательные репродуктивные технологии
ГПТ — гиперпаратиреоидизм
ГСПГ — глобулин, связывающий половые гормоны
ГТ — гормональная терапия
ДАЭ — дискуляторная атеросклеротическая энцефалопатия
ДГПЖ — доброкачественная гиперплазия предстательной железы
ДЛТ — дистанционная лучевая терапия
ДУВЛ — дистанционная ударно-волновая литотрипсия
ЗЛАЭ — забрюшинная лимфаденэктомия
ИБС — ишемическая болезнь сердца
ИВЛ — искусственная вентиляция лёгких
ИМП — инфекция мочевыводящих путей
ИППП — инфекции, передаваемые половым путём
ИФН — интерферон
КЛТ — контактная литотрипсия
КОЕ — колониеобразующая единица
КТ — компьютерная томография
КУЛ — контактная уретеролитотрипсия
ЛГ — лютеинизирующий гормон
ЛГРГ — лютеинизирующий гормон рилизинг-гормона
ЛДГ — лактатдегидрогеназа
ЛМС — лоханочно-мочеточниковый сегмент
ЛТ — лучевая терапия
ЛУ — лимфатические узлы
МКБ — мочекаменная болезнь
МКБ-10 — Международная классификация болезней 10-го пересмотра
МП — мочевой пузырь
МРТ — магнитно-резонансная томография
НПВС — нестероидные противовоспалительные средства
ОЗМ — острая задержка мочеиспускания
ОПН — острая почечная недостаточность
ПКР — почечно-клеточный рак
ПНЛ — перкутанная нефролитолапаксия
ППС — пентозан полисульфат
ПРИ — пальцевое ректальное исследование
ПСА — простатоспецифический антиген
ПЦР — полимеразная цепная реакция
РМП — рак мочевого пузыря
РПЖ — рак предстательной железы
РПЧ — рак полового члена
САГ — спермальный антиген
СГ — стадия по Глиссону
СИОЗС — селективные ингибиторы обратного захвата серотонина
СКФ — скорость клубочковой фильтрации
СН — сердечная недостаточность
СНМП — симптомы нижних мочевыводящих путей
СОД — суммарная очаговая доза
СОЭ — скорость оседания эритроцитов
СПИД — синдром приобретённого иммунодефицита
СР — степень рекомендации
ТРУЗИ — трансректальное ультразвуковое исследование
ТТГ — тиреотропный гормон
ТУР — трансуретральная резекция предстательной железы
УД — уровень доказательности
УЗИ — ультразвуковое исследование
ФДЭ-5 — фосфодиэстераза 5-го типа
ФСГ — фолликулостимулирующий гормон
ХГ — хорионический гонадотропин
ХГЧ — хорионический гонадотропин человека
ХПН — хроническая почечная недостаточность
ХТ — химиотерапия
ЦИ — цитологическое исследование
ЧКНЛ — чрескожная нефролитолапаксия и литоэкстракция
ЧПНС — чрескожная пункционная нефростомия
ЩФ — щёлочная фосфотаза
ЭД — эректильная дисфункция
ЭКГ — электрокардиография
ЭКО — экстракорпоральное оплодотворение
ICS — International Continence Society (Международное общество по удержанию мочи)
IPSS — International Prostate Symptom Score (Международный индекс симптомов при заболеваниях простаты)
NYHA — New York Heart Association
PCPT — Prostate Cancer Prevention Trial
Методология создания и программа обеспечения качества
Настоящее издание — дополненная и переработанная версия российских клинических рекомендаций по урологии. Цель проекта — представить практикующему врачу рекомендации по профилактике, диагностике и лечению наиболее распространённых урологических заболеваний.
Почему необходимы клинические рекомендации? Потому что в условиях лавинообразного роста медицинской информации, количества диагностических и лечебных вмешательств врач должен затратить много времени и иметь специальные навыки для поиска и анализа информации. При составлении клинических рекомендаций эти этапы уже выполнены разработчиками.
Качественные клинические рекомендации создаются по определённой методологии, которая гарантирует их современность, достоверность, обобщённость лучшего мирового опыта и знаний, применимость на практике и удобство в использовании. В этом преимущество клинических рекомендаций перед традиционными источниками информации (учебники, монографии, руководства).
Набор международных требований к клиническим рекомендациям разработан в 2003 г. специалистами из Великобритании, Канады, Германии, Франции, Финляндии и других стран. Среди них — инструмент оценки качества клинических рекомендаций AGREE1, методология разработки клинических рекомендаций SIGN 502 и др.
Предлагаем вашему вниманию описание требований и мероприятий, которые выполнялись при подготовке этого издания.
1. КОНЦЕПЦИЯ И УПРАВЛЕНИЕ ПРОЕКТОМ
Для работы над проектом была создана группа управления в составе руководителей проекта и администратора.
Для разработки концепции и системы управления проектом руководители проекта провели консультации с отечественными и зарубежными специалистами (эпидемиологи, экономисты и организаторы здравоохранения, специалисты в области поиска медицинской информации, представители страховых компаний, представители промышленности — производители лекарственных средств и медицинской техники, руководители профессиональных обществ, ведущие разработчики клинических рекомендаций, практикующие врачи). Проанализированы отзывы на первое переводное издание клинических рекомендаций, основанных на доказательной медицине, а также на клинические рекомендации для врачей общей практики.
1 Appraisal of Guidelines for Research and Evaluation — инструмент оценки качества клинических рекомендаций, http://www.agreecollaboration.org.
2 Scottish Intercollegiate Guidelines Network — Шотландская межколлегиальная организация по разработке клинических рекомендаций.
В результате была разработана концепция проекта, сформулированы этапы, их последовательность и сроки исполнения, требования к этапам и исполнителям; утверждены инструкции и методы контроля.
2. ЦЕЛИ
Общие: назначение эффективных вмешательств, избегание необоснованных вмешательств, снижение числа врачебных ошибок, повышение качества медицинской помощи.
Конкретные: см. в разделе «Цели лечения» клинических рекомендаций.
3. АУДИТОРИЯ
Предназначены урологам, врачам общей практики, интернам, ординаторам и студентам старших курсов медицинских вузов.
Составители и редакторы оценивали выполнимость рекомендаций в условиях практики уролога и врача общей практики в России.
4. ЭТАПЫ РАЗРАБОТКИ
Создание системы управления, концепции, выбор тем, создание группы разработчиков, поиск литературы, формулирование рекомендаций и их ранжирование по уровню достоверности, экспертиза, редактирование и независимое рецензирование, публикация, распространение, внедрение.
5. СОДЕРЖАНИЕ
Рекомендации включают детальное и чёткое описание действий врача в определённых клинических ситуациях.
Инструкции для авторов требовали последовательного изложения вмешательств, схем лечения, доз лекарственных препаратов, альтернативных схем лечения и по возможности влияния вмешательств на исходы.
Выбор заболеваний и синдромов. Были отобраны заболевания и синдромы, наиболее часто встречающиеся в практике уролога. Окончательный перечень утверждался главным редактором издания.
6. ПРИМЕНИМОСТЬ К ГРУППАМ БОЛЬНЫХ
Чётко очерчена группа больных, к которой применимы данные рекомендации (пол, возраст, степень тяжести заболевания, сопутствующие заболевания).
Инструкция обязывала авторов-составителей приводить чёткое описание групп больных, к которым применимы конкретные рекомендации.
7. РАЗРАБОТЧИКИ
Авторы-составители (известные клиницисты, имеющие опыт клинической работы и написания научных статей), главные редакторы (ведущие отечественные эксперты, руководители ведущих научно-исследовательских учреждений, профессиональных обществ, заведующие кафедрами), научные редакторы и независимые рецензенты (профессорско-преподавательский состав учебных и научно-исследовательских учреждений), редакторы издательства (практикующие врачи с опытом написания научных статей, знающие английский язык, владеющие навыками работы на компьютере, с опытом работы в издательстве не менее 5 лет) и руководители проекта (опыт руководства проектами с большим числом участников при ограниченных сроках создания, владение методологией создания клинических рекомендаций).
8. НЕЗАВИСИМОСТЬ
Мнение разработчиков не зависит от производителей лекарственных средств и медицинской техники.
В инструкциях для составителей указывались необходимость подтверждать эффективность (польза/вред) вмешательств, пользуясь доказательствами независимых источников информации, недопустимость упоминания каких-либо коммерческих наименований. Приведены международные непатентованные наименования лекарственных препаратов, которые проверялись редакторами издательства по Государственному реестру лекарственных средств.
9. УРОВНИ ДОСТОВЕРНОСТИ
Авторы клинических рекомендаций использовали единые критерии для присвоения уровней достоверности.
В инструкциях для составителей расшифрованы уровни достоверности; представлены таблицы перевода уровней достоверности из других источников информации (если они не соответствуют принятым в данных рекомендациях).
Достоверность условно разделяют на четыре уровня: А, В, С и D.
| А | Высокая достоверность | Основана на заключениях систематических обзоров. Систематический обзор получают путём системного поиска данных из всех опубликованных клинических испытаний, критической оценки их качества и обобщения результатов методом метаанализа |
|---|---|---|
В |
Умеренная достоверность |
Основана на результатах по меньшей мере нескольких независимых рандомизированных контролируемых клинических испытаний |
С |
Ограниченная достоверность |
Основана на результатах по меньшей мере одного клинического испытания, не удовлетворяющего критериям качества, например, без рандомизации |
D |
Неопределенная достоверность |
Утверждение основано на мнении экспертов; клинические исследования отсутствуют |
10. СТРУКТУРА ИЗДАНИЯ И ФОРМАТ СТАТЬИ
Формат рекомендации: определение, код МКБ-10, эпидемиология (заболеваемость, распространённость, смертность, особенности по полу, возрасту), профилактика, скрининг, классификация, диагностика (анамнез и физикальное обследование, лабораторные и инструментальные исследования, дифференциальная диагностика, показания к консультации других специалистов), лечение (цели лечения, показания к госпитализации, немедикаментозное лечение, медикаментозное лечение, обучение пациента, показания к консультации других специалистов), дальнейшее ведение, прогноз.
Если информация по отдельным рубрикам отсутствовала (часто по рубрикам «Профилактика», «Скрининг»), эти рубрики исключались.
11. СТИЛЬ ИЗЛОЖЕНИЯ
В требованиях к авторам-составителям подчёркнуто, что рекомендации должны кратко и конкретно отвечать на клинические вопросы.
Рекомендации должны иметь заданный объём. После редактирования текст согласовывали с авторами.
12. СПОРНЫЕ ВОПРОСЫ
Описана процедура разрешения спорных вопросов и ситуаций, при которых однозначные доказательства отсутствуют. В таких ситуациях подчёркивали неопределённость в отношении диагностического или лечебного вмешательства, приводили порядок принятия решения.
Глава 1. СИМПТОМЫ НИЖНИХ МОЧЕВЫВОДЯЩИХ ПУТЕЙ И ДОБРОКАЧЕСТВЕННАЯ ГИПЕРПЛАЗИЯ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Д.Ю. Пушкарь, П.И. Раснер, Р.Р. Харчилава
Доброкачественная гиперплазия предстательной железы (ДГПЖ) — полиэтиологическое заболевание, возникающее вследствие разрастания периуретральной железистой зоны предстательной железы, приводящего к обструкции нижних мочевыводящих путей.
Морфологический диагноз ДГПЖ подразумевает наличие стромальной и эпителиальной гиперплазии. Клинически ДГПЖ проявляется различными расстройствами мочеиспускания, связанными с нарушением пассажа мочи по нижним мочевыводящим путям и ухудшением накопительной функции мочевого пузыря:
Зачастую к перечисленным выше симптомам присоединяется затруднение в начале акта мочеиспускания, более выраженное утром и заставляющее пациентов натуживаться, чтобы начать мочиться. Все перечисленные симптомы, как правило, объединяют под общим названием «симптомы нижних мочевыводящих путей (СНМП)». При отсутствии адекватного лечения, особенно на конечных стадиях заболевания, резко возрастает риск возникновения острой задержки мочеиспускания и почечной недостаточности, а также развития таких осложнений ДГПЖ, как дивертикулы и камни мочевого пузыря, хронические воспалительные заболевания нижних мочевыводящих путей.
Симптомы нижних мочевыводящих путей встречаются не только при доброкачественном увеличении предстательной железы, но могут присутствовать также:
В соответствии с современными представлениями о классификации симптомов расстройств мочеиспускания при ДГПЖ их принято подразделять на три категории. Одна из основных причин возникновения этих симптомов — увеличение предстательной железы в размерах. Именно увеличение предстательной железы служит неоспоримым доказательством наличия заболевания и наиболее частым проявлением его прогрессии. У мужчин с объемом простаты более 50 см3 риск развития умеренных или тяжелых симптомов нижних мочевыводящих путей повышается в 5 раз и в 3 раза повышен риск возникновения выраженной инфравезикальной обструкции, соответствующей снижению максимальной скорости потока мочи Qmax <10 мл/с. Эти факты свидетельствуют о тесной связи между симптомами нижних мочевыводящих путей, инфравезикальной обструкцией и объемом предстательной железы.
Это условное деление симптомов нижних мочевыводящих путей помогает врачу при первичном осмотре выявить превалирующую симптоматику. Симптомы нижних мочевыводящих путей разнообразны и неспецифичны, кроме того, специалисты различного уровня подготовки трактуют их по-разному. Внедрение в широкую практику некоторых элементов искусственного интеллекта, в частности экспертных систем и номограмм, значительно облегчает диагностику [47].
МКБ-10 • N40 Гиперплазия предстательной железы. Аденома простаты.
Эпидемиология
Средний возраст появления симптомов заболевания — 60 лет, хотя в США симптомы ДГПЖ выявляют у 40% мужчин 50–59 лет. У 30% мужчин старше 65 лет обнаруживают развернутую клиническую картину заболевания. У мужчин, чьи отцы страдали ДГПЖ, заболеваемость выше [21]. У мужчин моложе 30 лет гистологические признаки ДГПЖ не встречаются. С возрастом частота выявления ДГПЖ возрастает, достигая пика к девятому десятилетию жизни (90%). Пальпируемое увеличение простаты обнаруживают в 20% случаев у мужчин 60 лет и в 43% случаев у мужчин 80 лет. Однако увеличение простаты не всегда сочетается с клиническими проявлениями. Симптомы нижних мочевыводящих путей к 60 годам в какой-либо степени проявляются у 60% мужчин. При обследовании мужчин европеоидной расы симптомы нижних мочевыводящих путей (от средних до значительных проявлений) были выявлены у 13% пациентов 40–49 лет, а у пациентов старше 70 лет — в 28% случаев. В Канаде симптомы нижних мочевыводящих путей (от сильных до умеренных проявлений) обнаружили у 23% обследованных. В Шотландии и Нидерландах частота проявления симптомов возрастает с 14% в 40 лет до 43% в 60 лет. Распространенность от умеренных до тяжелых симптомов варьирует от 14% во Франции до 30% в Нидерландах. С каждой последующей декадой жизни удваивается количество мужчин с симптомами нижних мочевыводящих путей. В Германии приблизительно у 30% мужчин от 50 до 80 лет есть проявления этих симптомов.
Факторы риска
Причина развития данной болезни до сих пор окончательно не установлена, но общепризнанным считают влияние двух факторов: изменения гормонального статуса мужчины и старения. Основываясь на многочисленных данных эпидемиологических и долгосрочных клинических рандомизированных исследований, ДГПЖ рассматривают как хроническое прогрессирующее заболевание. Доказанными факторами риска прогрессирования считают [2, 3, 23]:
-
симптомы нижних мочевыводящих путей средней и тяжелой степени выраженности [47].
Сахарный диабет и ДГПЖ сочетаются чаще, чем предполагает слу
чайная вероятность, возможно, это связано с патогенезом данных заболеваний.
Профилактика
Не разработана.
Скрининг
Мужчины старше 50 лет зачастую отмечают изменения мочеиспускания, поэтому у них следует проводить скрининг ДГПЖ, выявляя симптомы опорожнения и накопления. Скрининг наиболее эффективен у мужчин с отягощенной наследственностью. Оптимальная частота контрольных обследований является предметом обсуждения, однако большинство специалистов согласны с необходимостью ежегодных осмотров. Последние включают пальцевое ректальное обследование, ультразвуковое исследование органов мочевой системы, урофлоуметрию, определение наличия и количества остаточной мочи (УЗИ после мочеиспускания) и определение уровня общего ПСА сыворотки крови. У пациентов возрастной группы до 50–55 лет при отсутствии приведенных выше факторов риска возможно проведение контрольных обследований 1 раз в 2 года.
Классификация
В клинической практике в настоящее время считают, что нормальный объем простаты — до 25–30 см3, малым называют объем простаты от 30 до 40 см3, средним — от 40 до 80 см3, более 80 см3 — крупным, превышающий 250 см3 — гигантским.
Симптомы нарушенного мочеиспускания классифицируют по степени, исходя из значений суммарного балла Международного индекса симптомов при заболеваниях простаты (IPSS — International Prostate Symptom Score), представленного в приложении 1:
В России иногда используется устаревшая классификация Гюйона, согласно которой выделяют три стадии болезни:
-
I стадия — компенсации (незначительная дизурия при отсутствии остаточной мочи);
-
II стадия — субкомпенсации (симптоматика заболевания прогрессирует, имеется остаточная моча, почки и верхние мочевыводящие пути проходят этапы снижения функционального состояния, часто возникают осложнения болезни);
-
III стадия — декомпенсации (полная декомпенсация функции мочевого пузыря, парадоксальная ишурия, выраженный уретерогидронефроз и хроническая почечная недостаточность (ХПН)) [3].
Диагностика
ЖАЛОБЫ И АНАМНЕЗ
Диагностика ДГПЖ основывается на жалобах, анамнезе, данных физического обследования, лабораторных и инструментальных методов исследования. Жалобы больных выявляют и анализируют с помощью вопросника IPSS (см. приложение 1), который обладает высокой специфичностью (79%) и чувствительностью (83%)в [8, 30]. Следует отметить отсутствие корреляции между интенсивностью жалоб пациентов, объективной выраженностью расстройств мочеиспускания и размерами предстательной железы [19].
Большой диагностической ценностью обладает «Дневник регистрации качества и частоты мочеиспусканий», который заполняется пациентом в течение 3 сут и включает информацию о времени каждого мочеиспускания, объеме выделенной мочи, объеме и характеристике потребляемой жидкости, наличии ургентных позывов к мочеиспусканию, эпизодов недержания мочи и необходимости прерывать сон для опорожнения мочевого пузыря. Дневник прост в заполнении, не требует материальных затрат и предоставляет врачу наиболее полную клиническую картину заболевания, позволяя уточнить жалобы больного, например отличить никтурию от ноктурии (ночная поллакиурия) [9, 28, 41].
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Пальцевое ректальное исследование (ПРИ) предстательной железы. Входе его выполнения определяются примерный размер предстательной железы, ее консистенция и болезненность при пальпации, выраженность срединной бороздки, подвижность слизистой оболочки прямой кишки над железой и тонуса сфинктера прямой кишки. Наличие асимметрии предстательной железы, участков уплотнения, зон хрящевидной консистенции является основанием для дополнительного обследования, цель которого — исключения рака предстательной железы. Нарушение тонуса сфинктера прямой кишки может свидетельствовать о неврологической этиологии расстройств мочеиспускания. Размеры предстательной железы при ПРИ не всегда коррелируют с жалобами пациента [32].
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
-
Общий анализ мочи необходим для диагностики заболеваний почек, мочевого пузыря и уретры.
-
Концентрацию креатинина в сыворотке крови определяют для уточнения суммарного функционального состояния почек и исключения почечной недостаточности. Было обнаружено, что азотемия встречается в 15–30% случаев при ДГПЖ.
-
Всем больным ДГПЖ для исключения РПЖ целесообразно исследовать концентрацию общего простатоспецифического антигена (ПСА) в сыворотке крови. Условной границей нормы ПСА по-прежнему считается 4 нг/мл, однако нельзя забывать, что большое значение имеет также возраст пациента и объем предстательной железы. Чувствительность определения общего ПСА в диагностике рака простаты 70%, в то время как специфичность этого показателя колеблется в пределах 65–70%. Существует понятие возрастной нормы ПСА. Так, у пациента с ДГПЖ объемом 40 см3 уровень ПСА должен быть менее 1,6 нг/мл в 50 лет, менее 2,0 нг/мл в 60 лет и должен превышать 2,3 нг/мл в 70-летнем возрасте [48]. Более подробные рекомендации по интерпретации уровня общего ПСА сыворотки крови смотрите в главе настоящих рекомендаций, посвященной диагностике и лечению рака предстательной железы.
В особых случаях, например при наличии сопутствующих неврологических заболеваний, а также у больных, имевших в анамнезе травмы позвоночника и органов таза, у больных моложе 50 и старше 80 лет целесообразно проведение комплексного уродинамического обследования — цистометрии наполнения, исследования соотношения давление/ поток, электромиографии тазового дна. Комплексное уродинамическое исследование позволяет дифференцировать причины расстройства мочеиспускания — инфравезикальную обструкцию, нарушение сократительной способности мочевого пузыря и сложные нейрогенные расстройства мочеиспускания, такие, как детрузорно-сфинктерная диссинергия, гиперактивность и гипоактивность детрузора и т.д. [37].
Показания к комбинированному уродинамическому исследованию:
Из всех уродинамических исследований «соотношение давление/ поток» обладает наибольшей диагностической ценностью. Методика исследования подразумевает измерение давления детрузора в момент максимальной скорости потока мочи (при урофлоуметрии). Пациенты с высоким давлением детрузора и низкой скоростью потока мочи имеют лучшие результаты оперативного лечения, чем пациенты с низким внутрипузырным давлением и низкой скоростью потока мочи [4, 24, 32, 33], поскольку у первых имеется доказанная инфравезикальная обструкция, в то время как у вторых причина СНМП кроется в нарушении сократительной способности мочевого пузыря.
-
Обзорную и экскреторную урографию не считают обязательными исследованиями у больных ДГПЖ. Их выполняют по следующим показаниям:
-
При наличии гематурии для исключения опухоли мочевого пузыря показана уретроцистоскопия.
-
В отдельных случаях для исключения рака мочевого пузыря (РМП) и РПЖ выполняют компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ). В рутинной практике они не применяются.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику проводят с заболеваниями и патологическими состояниями, представленными ниже.
-
Фимоз — невозможность отведения крайней плоти за головку полового члена.
-
Сужение наружного отверстия уретры (меатостеноз), требующее либо дилатации, либо оперативного лечения — меатотомии, меатопластики.
-
Камни мочевого пузыря, вызывающие дизурию, боль в надлобковой области с иррадиацией в головку полового члена, прерывистую струю мочи, диагностируемые обычно у мужчин с инфравезикальной обструкцией.
-
Камни уретры, которые бывают первичными (крайне редко), вторичными (мигрировавшие в уретру из вышележащих отделов мочевыводящих путей). Заболевание проявляется дизурией, слабостью струи мочи или острой задержкой мочи.
-
Уретриты диагностируют по наличию дизурии, сочетающейся со слизисто-гнойными выделениями из уретры.
-
РПЖ, проявляющийся СНМП, как фазы опорожнения, так и накопления. В ходе ПРИ в предстательной железе могут выявляться очаги уплотнения.
-
Острый простатит (абсцесс простаты) проявляется выраженным дискомфортом или болью в перианальной области, болью в пояснично-крестцовой области, высокой лихорадкой. Предстательная железа при ПРИ увеличена, отечна, резко болезненна. При абсцессе обнаруживают очаги размягчения.
-
Хронический простатит, для которого характерно сочетание нормальных (либо несколько увеличенных) размеров простаты с симптомами инфекционно-воспалительного процесса, подтверждаемыми исследованием секрета простаты.
-
Склероз простаты, характеризуемый дизурией на фоне уменьшения размеров и/или уплотнения простаты.
-
Склероз шейки мочевого пузыря (болезнь Мариона), обычно встречаемый в более молодом, чем при ДГПЖ, возрасте и проявляемый постепенным нарастанием симптоматики в течение длительного периода времени.
-
Нейрогенные расстройства мочеиспускания, которые могут быть обусловлены травмой спинного мозга, рассеянным склерозом, инсультом, болезнью Паркинсона, сахарным диабетом.
-
РМП нередко манифестирует безболевой макроили микрогематурией; 30% пациентов с этим заболеванием могут страдать от дизурии, вплоть до ургентных позывов на мочеиспускание.
-
Цистит редко возникает у мужчин. Больных беспокоят дизурия, боль в надлобковой области. Характерны усиление боли в конце акта мочеиспускания и временное уменьшение боли после его завершения.
-
Побочное действие лекарственных средств, снижающих сократительную способность мочевого пузыря или увеличивающих тонус шейки мочевого пузыря.
Лечение
Пациенту следует подробно рассказать обо всех возможных видах лечения. Больным с незначительно и умеренно выраженными СНМП можно рекомендовать поведенческую терапию, динамическое наблюдение или медикаментозную терапию. При выраженной симптоматике показано хирургическое вмешательство. Больным с выраженной симптоматикой ДГПЖ и абсолютными противопоказаниями к оперативному лечению также назначают лекарственную терапию.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Пациентов экстренно госпитализируют:
После разрешения острой задержки мочи необходимо проводить мониторинг объема циркулирующей жидкости, АД, концентрации электролитов в связи с возможным развитием угрожающих жизни нарушений водно-электролитного баланса [4]. Дренирование мочевого пузыря (катетеризация, установка троакарной цистостомы) может спровоцировать развитие макрогематурии.
Плановую госпитализацию пациентов осуществляют для оперативного лечения или при необходимости обследования, которое невозможно выполнить в амбулаторных условиях.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ — ПОВЕДЕНЧЕСКАЯ ТЕРАПИЯ
Поведенческая терапия показана пациентам с незначительной симптоматикой.
Тактика выжидательного наблюдения при ДГПЖ заключается в образовании пациента, динамическом наблюдении и рекомендациях по изменению образа жизни (поведенческая терапия).
Больному рекомендуются следующие мероприятия:
| Рекомендации [47] | УД | CP |
|---|---|---|
Пациентам с легкой симптоматикой должно быть предложено динамическое наблюдение |
lb |
А |
Изменение образа жизни должно быть предложено до начала терапии или совместно с основной терапией |
lb |
А |
Пациентам, имеющим СНМП с расстройствами фазы «наполнения», при наличии гиперактивного мочевого пузыря (ГМП), можно рекомендовать упражнения по тренировке мышц мочеполовой диафрагмы (упражнения Кегеля, лечебную гимнастику).
Контрольные обследования у уролога каждые 6–12 мес.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Учитывая прогрессирующий характер данного заболевания, медикаментозную терапию СНМП следует проводить длительно (иногда в течение всей жизни пациента). В зависимости от превалирования симптомов фазы опорожнения или наполнения, медикаментозная терапия может существенно различаться.
-
Пациентам с симптомами ДГПЖ фазы опорожнения при отсутствии задержки мочи лекарственную терапию следует начинать с α-адреноблокаторов [26, 27]. Эта группа препаратов долгие годы считается «терапией первой линии» в лечении больных ДГПЖ и представлена 5 медикаментами, эффективность которых при назначении в приведенных ниже дозах одинакова. Препараты различаются профилем безопасности — вероятностью развития побочных эффектов, наиболее частым из которых является снижение артериального давления. Международные данные свидетельствуют о высокой эффективности этих препаратов, заключающейся в 30–40% уменьшении балла IPSS и увеличении максимальной скорости потока мочи приблизительно на 20–25%. Эти препараты могут уменьшать выраженность как симптомов фазы наполнения, так и опорожнения.
-
Тамсулозин в дозе 0,4 мг/сут. Препараты на основе тамсулозина самые популярныевРоссииивовсеммире,средидругихα-адреноблокаторов обладают благоприятным профилем безопасности и удобством приема (не требуют подбора дозы, принимаются 1 раз в сутки).
Помимо тамсулозина в виде капсул с модифицированным высвобождением в клинической практике широко применяется тамсулозин ОКАС в виде таблеток с контролируемым высвобождением. Эта форма является особой системой, позволяющей лекарственному веществу выделяться равномерно и длительно на протяжении всего желудочно-кишечного тракта, вне зависимости от приемов пищи и содержания воды в пищеварительном тракте. Более равномерное выделение действующего вещества из лекарственной формы тамсулозина ОКАС позволяет создать плавную концентрацию тамсулозина в плазме крови, что находит отражение в лучшем профиле безопасности. -
Альфузозин назначается в дозе 10 мг/сут и также обладает высоким уровнем безопасности.
-
Силодозин применяется в дозе 8 мг 1 раз в сутки [46]. Это α-адреноблокатор, который обладает наибольшей избирательностью в отношении α1А -адренорецепторов предстательной железы по сравнению с α1В-адренорецепторами гладких мышц сосудов и селективностью к рецепторам а А-подтипа по сравнению с подтипами α1В и α1D. При его назначении следует учитывать тот факт, что на фоне лечения силодозином более 20% пациентов отмечают расстройства эякуляции. Эффект является преходящим, исчезает вскоре после отмены препарата и очень редко бывает причиной отказа от лечения у пациентов с СНМП, развившимися на фоне ДГПЖ.
-
Теразозин — α-адреноблокатор, на фоне которого может регистрироваться некоторое снижение артериального давления. Дозу препарата повышают постепенно с 1 до 10 мг/сут и принимают преимущественно перед сном.
-
Доксазозин также относится к препаратам, нуждающимся в титровании дозы. Его назначают начиная с 1 мг/сут, постепенно увеличивая дозу до 8 мг/сут. При его назначении также следует контролировать уровень артериального давления.
-
-
Больным с объемом предстательной железы 40 см3 и более или повышенным значением ПСА (> 1,4–1,6 нг/мл) [47] оправдано назначение ингибиторов 5а-редуктазы, которые при нормальной переносимости необходимо принимать длительно или пожизненно [20]. Ингибиторы 5α-редуктазы — единственная группа препаратов, уменьшающая объем предстательной железы в среднем на 25–30%, предотвращающая дальнейший ее рост и развитие ДГПЖ. При этом происходит уменьшение балла IPSS на 15–30%. При постоянном длительном приеме ингибиторы 5а-редуктазы снижают риск оперативного вмешательства и острой задержки мочи.
-
Финастерид назначается в дозе 5 мг/сут [44].
-
Эффект действия препаратов отсрочен во времени и проявляется не ранее чем через 6 мес (дутастерид) и 12 мес (финастерид). Применение коротких курсов ингибиторов 5α-редуктазы не оправдано.
Наиболее часто встречающийся побочный эффект препаратов этой группы — ухудшение сексуальной функции. В недавних исследованиях было показано, что выраженность этого эффекта уменьшается после года непрерывного приема препаратов. Важно помнить, что ингибиторы 5α-редуктазы снижают концентрацию ПСА сыворотки крови в 2 раза, что имеет большое значение для диагностики рака простаты. На фоне терапии препаратами этой фармакологической группы следует для получения истинного значения ПСА увеличивать лабораторные показатели в 2 раза.
| Рекомендации [47] | УД | CP |
|---|---|---|
а-Адреноблокаторы должны быть назначены пациентам сумеречными и тяжелыми симптомами нижних мочевыводящих путей |
1а |
А |
Ингибиторы 5АР необходимо назначать пациентам с умеренными и тяжелыми СНМП и увеличенным объемом простаты (>40 см3) или повышенным значением ПСА (>1,4-1,6 нг/мл). Применение ингибиторов 5АР может привести к предотвращению прогрессии заболевания в аспекте развития острой задержки мочи и необходимости хирургического лечения |
lb |
А |
Антагонисты мускариновых рецепторов. Эти препараты также называются медикаментозными средствами с антихолинергической активностью. Они могут назначаться как терапия первой линии у больных с выраженными расстройствами мочеиспускания фазы наполнения при отсутствии или минимальной выраженности расстройств фазы опорожнения. Еще одним официальным показанием для их назначения являются сохраняющиеся СНМП после месяца непрерывной терапии α-адреноблокаторами в активной терапевтической дозировке. При их назначении отмечается положительная динамика в отношении ноктурии, частоты дневных мочеиспусканий и выраженности ургентносги. Отмечено также некоторое уменьшение балла IPSS. Основной принцип их действия — блокирование проводимости по волокнам парасимпатической нервной системы. Блокаторы мускариновых рецепторов уже более 20 лет являются препаратами «выбора» в лечении гиперактивного мочевого пузыря. Опыт лечения пациентов с ДГПЖ этими препаратами пока небольшой. Назначение антимускариновых препаратов у пациентов с выраженной инфравезикальной обструкцией и большим количеством остаточной мочи не показано. При соблюдении этих принципов вероятность развития ОЗМ на фоне терапии антимускариновыми препаратами не превышает 1 случай на 10 000 назначений.
Пациентам с СНМП на фоне ДГПЖ могут назначаться солифенацин, толтеродин в стандартных терапевтических дозировках. Эффективность применения этих препаратов доказана в немногочисленных международных клинических исследованиях. Применение антимускариновых препаратов требует ультразвукового мониторинга количества остаточной мочи [47].
| Рекомендации [47] | УД | CP |
|---|---|---|
Антагонисты мускариновых рецепторов должны быть назначены пациентам с умеренными и тяжелыми симптомами нижних мочевыводящих путей с преобладанием симптомов накопления |
lb |
В |
Препараты должны применяться с осторожностью у пациентов с инфравезикальной обструкцией |
4 |
С |
Ингибиторы фосфодиэстеразы 5-го типа (иФДЭ5). Препараты этой фармакологической группы за счет увеличения внутриклеточной концентрации циклического гуанозинмонофосфата снижают тонус гладких мышц детрузора, предстательной железы и уретры [51]. Другим доказанным механизмом их воздействия на органы малого таза является улучшение кровотока в этой области [52]. Они также способствуют уменьшению активности хронических воспалительных процессов в простате и мочевом пузыре [53].
Единственным препаратом из этой группы, официально разрешенным к применению для лечения СНМП у больных ДГПЖ, является тадалафил, назначаемый ежедневно в дозировке 5 мг/сут. Он вызывает снижение балла IPSS на 22–37% за счет уменьшения выраженности обеих групп симптомов — фазы опорожнения и наполнения. При этом существенного изменения максимальной скорости потока мочи в большинстве проведенных исследований не зарегистрировано.
Тадалафил может назначаться в режиме монотерапии и в комбинации с α-адреноблокаторами. Безопасным сочетанием является его одновременное назначение с тамсулозином и силодозином. Стандартное противопоказание к назначению ингибиторов фосфодиэстеразы 5-го типа из-за высокого риска гипотонии — их сочетание с нитратами.
Информация о влиянии иФДЭ5 на объем простаты и риск прогрессии заболевания отсутствует.
| Рекомендации [47] | УД | CP |
|---|---|---|
Ингибиторы фосфодиэстеразы 5-го типа устраняют нарушения мочеиспускания фазы опорожнения и накопления у пациентов с СНМП на фоне ДГПЖ, как при наличии,так и при отсутствии нарушения эректильной функции |
1а |
А |
Органотропные препараты на основе экстракта простаты.
Механизм действия до конца не изучен (имеются отдельные российские исследования, подтверждающие положительный эффект препаратов). Международные исследования, позволяющие рассматривать возможность назначения органотропных препаратов с позиций "доказательной медицины", не проводились, в связи с чем сформулировать показания к их применению не представляется возможным.
Препараты из растительного сырья. Несмотря на отсутствие доказанной эффективности лекарственных препаратов растительного происхождения в международных клинических исследованиях, фитотерапия ДГПЖ остается популярной в России и еще в нескольких странах мира. Сложный механизм действия фитопрепаратов труден для детального изучения, поскольку последние состоят из различных растительных компонентов. Учитывая тот факт, что большинство этих препаратов во всем мире относятся к классу «биологически активных добавок», их сравнительного изучения не проводилось. В России распространены фитопрепараты на основе экстракта Serenoa repens, Pigeum Africanum, Hypoxisrooperi, Urticadioica и еще нескольких растений.
| Рекомендации [47] |
|---|
Ввиду выраженной гетерогенности препаратов и методологической сложности выполнения метаанализов в настоящее время отсутствуют достаточные основания для формулировки рекомендаций по применению растительных препаратов у пациентов с СНМП на фоне ДГПЖ |
Аналоги вазопрессина. Десмопрессин — синтетический аналог антидиуретического гормона, позволяющий значительно увеличить реабсорбцию в канальцах почек и снизить объем выделяемой мочи. Препарат является эффективным методом борьбы с никтурией, если ее причиной является ночная полиурия. Десмопрессин не оказывает влияния на все прочие СНМП. Применять следует с осторожностью, контролируя уровень натрия в сыворотке крови через 3 дня, неделю, месяц после начала использования и далее каждые 3–6 мес при постоянном приеме. Назначать этот препарат лучше после консультации и под контролем терапевта [47].
| Рекомендации [47] | УД | CP |
|---|---|---|
Десмопрессин необходимо назначать для терапии никтурии вследствие ночной полиурии |
lb |
А |
Комбинированная медикаментозная терапия
Комбинированное применение ингибиторов 5α-редуктазы и α-адреноблокаторов
Работы последних лет доказали сложный патогенез расстройств мочеиспускания у больных ДГПЖ. Причины нарушения мочеиспускания — инфравезикальная обструкция и ослабление функции детрузора.
Известно, что действие ингибиторов 5α-редуктазы основывается на снижении активности тканевых факторов роста и активации апоптоза, что при длительном применении способствует уменьшению размеров предстательной железы и снижению выраженности механического компонента инфравезикальной обструкции. Выше приводилась информация о способности ингибиторов 5α-редуктазы снижать риск прогрессирования ДГПЖ. В основе механизма действия α-адреноблокаторов лежит расслабление гладкой мускулатуры шейки мочевого пузыря и уретры вследствие блокады α1-адренорецепторов и устранения динамического компонента инфравезикальной обструкции. При этом действие α-адреноблокаторов сказывается вскоре после начала лечения. Очевидно, комбинированное назначение препаратов двух различных фармакологических групп позволяет оказывать воздействие на сложные механизмы патогенеза СНМП и вызывать существенное улучшение качества жизни больных ДГПЖ.
В последние годы все больше урологов уделяют особое внимание комбинированному лечению ДГПЖ. Наиболее значительные результаты в этой области достигнуты благодаря исследованиям MTOPS и CombAT. В первом риск прогрессии ДГПЖ на фоне комбинированной терапии финастеридом и доксазозином оказался на 64% ниже, чем в группе плацебо. А вероятность оперативного вмешательства была ниже на 67%. Результаты 4-летнего комбинированного назначения ингибитора обоих типов 5α-редуктазы — дутастерида и суперселективного α-адреноблокатора тамсулозина (исследование CombAT) показали, что общий риск прогрессии ДГПЖ снизился на 41%, вероятность развития острой задержки мочи — на 68%, а необходимость оперативного вмешательства — на 71%. Следует отметить, что CombAT — единственное в своем роде исследование, включавшее пациентов высокого риска прогрессии ДГПЖ. В MTOPS и CombAT было доказано однозначное преимущество длительной комбинированной терапии над монотерапией ингибитором 5α-редуктазы или α-адреноблокатором по всем исследуемым параметрам — динамике симптомов нижних мочевыводящих путей, показателю качества жизни и риску прогрессирования заболевания. Причем эффективность комбинированной терапии была доказана для всех пациентов, включенных в исследование, независимо от исходных данных (первоначальной степени тяжести симптомов, исходного объема простаты, предыдущей терапии, возраста пациента, исходного значения ПСА и других факторов).
Это оптимальная медикаментозная терапия для пациентов высокого риска прогрессии заболевания: пациенты со среднетяжелыми и тяжелыми симптомами ДГПЖ. До начала лечения необходимо оговорить с пациентом длительный характер такого лечения — более 12 мес. У больных с умеренно выраженными симптомами нижних мочевыводящих путей может обсуждаться возможность последующей (по прошествии 6 мес) отмены α-адреноблокатора [47].
| Рекомендации [47] | УД | CP |
|---|---|---|
Комбинированная терапия a-адреноблокатором и ингибитором 5а-редуктазы должна быть назначена пациентам с умеренными и тяжелыми симптомами нижних мочевыводящих путей, увеличенным объемом предстательной железы (>40 см3) и сниженным значением Qmax (высоким риском прогрессии заболевания). При этом длительность терапии должна быть не менее 12 мес |
lb |
А |
Комбинированное применение α-адреноблокаторов и антагонистов мускариновых рецепторов
Для понимания патогенеза симптомов нижних мочевыводящих путей определенный интерес представляет теория, объясняющая значение мышцы мочевого пузыря (детрузора) в процессе формирования симптомов расстройства мочеиспускания. Доказано, что спонтанные сокращения детрузора приводят к возникновению частых, а иногда и ургентных позывов к мочеиспусканию. Такая совокупность симптомов расстройства фазы наполнения объединяется понятием «гиперактивный мочевой пузырь». Современные эпидемиологические исследования указывают на широкую распространенность симптомов гиперактивного мочевого пузыря у взрослого населения Европы. До сих пор предметом обсуждения остается первичность или вторичность гиперактивности мочевого пузыря у пациентов с инфравезикальной обструкцией, но никто из специалистов не отрицает наличие причинно-следственной связи между этими двумя состояниями.
Одним из перспективных направлений медикаментозного лечения симптомов нижних мочевыводящих путей является комбинированное назначение α-адреноблокатора и средств с антимускариновой активностью. Первый класс препаратов эффективно устраняет симптомы инфравезикальной обструкции, в то время как второй способен значительно снизить выраженность расстройств фазы наполнения мочевого пузыря. Такое лечение может быть рекомендовано пациентам со средней и тяжелой симптоматикой при отсутствии эффекта от монотерапии этими препаратами. Больным, у которых имеется выраженная инфравезикальная обструкция, это лечение следует назначать с осторожностью, под контролем количества остаточной мочи [47].
Комбинированная терапия является более эффективной в устранении ургентности, ургентного недержания мочи, учащенного мочеиспускания, ноктурии, снижении IPSS и улучшении качества жизни по сравнению с монотерапией α-адреноблокатором или плацебо. Проведен ряд исследований эффективности и безопасности комбинированного лечения α-адреноблокаторов и антимускариновых препаратов (солифенацин, толтеродин,) у мужчин с СНМП. В 2015 г. Mancheng Gong с соавторами был представлен мета-анализ 7 крупных исследований по данной проблеме. Работа включала данные 3063 пациентов, а именно 1985 (64,81%), получавших комбинированную терапию, и 1078 (35,19%) – монотерапию. Авторами было показано, что комбинированная терапия тамсулозином с солифенацином в сравнении с монотерапией имеет преимущество по показателям подшкалы симптомов наполнения IPSS, уменьшению частоты мочеиспусканий и ургентных эпизодов в течение 24 часов и улучшению качества жизни. Частота побочных эффектов в группе комбинированной терапии тамсулозином и солифенацином (30,82%) была сопоставимой с группой монотерапии тамсулозином (25,75%). Частота острой задержки мочи была низкой в исследованиях и по данным мета-анализа не было выявлено клинически значимого изменения Qmax. Применение комбинированной терапии в виде фиксированной дозы FDC, содержащей солифенацин 6 мг и тамсулозин ОКАС 0,4 мг у мужчин с СНМП на фоне ДГПЖ продемонстрировало ее потенциальное превосходство в сравнении с монотерапией в отношении уменьшения выраженности симптомов наполнения, частоты мочеиспусканий и эпизодов ургентности, улучшения качества жизни. Кроме того, комбинированная терапия может улучшить приверженность пациентов к лечению и уменьшить стоимость терапии.
| Рекомендации [47] | УД | CP |
|---|---|---|
Комбинированная терапия а-адреноблокатором и антагонистом мускариновых рецепторов может быть назначена пациентам с умеренными и тяжелыми симптомами нижних мочевыводящих путей при неэффективности предшествующей монотерапии одной из групп препаратов |
lb |
В |
Комбинированная терапия должна назначаться с осторожностью пациентам с выраженной инфравезикальной обструкцией |
2b |
В |
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Суть любого оперативного вмешательства при ДГПЖ — устранение механической обструкции на уровне простатического отдела мочеиспускательного канала. Операции по поводу ДГПЖ—одни из наиболее распространенных хирургических вмешательств у пожилых мужчин [25]. В среднем 30% мужчин в течение жизни переносят ту или иную операцию по поводу этого заболевания [10, 43]. Из всех пациентов, у которых первым проявлением заболевания стала острая задержка мочи, 60% переносят оперативное лечение в течение 1 года и 80% — в течение 7 лет [14].
Существуют общепринятые показания к оперативному лечению ДГПЖ. К ним относятся выраженная инфравезикальная обструкция, неэффективность предшествующей медикаментозной терапии, выраженная симптоматика, наличие осложнений ДГПЖ (ХПН, камни мочевого пузыря), интермиттирующая макрогематурия, большое количество остаточной мочи (хроническая задержка мочи), рецидивирующая задержка мочи [1, 3]. Относительным показанием к операции является наличие «средней доли», присутствие которой, как известно, существенно снижает вероятность успеха медикаментозной терапии. Увеличение простаты, даже весьма выраженное, не сопровождаемое тяжелой симптоматикой, показанием к выполнению оперативного вмешательства не является, но в то же время это один из факторов прогрессии заболевания.
Наиболее популярные виды оперативного вмешательства у больных ДГПЖ: монополярная или биполярная трансуретральная резекция простаты (ТУРП), монополярная трансуретральная вапоризация простаты (ТУВП), лазерная энуклеация простаты гольмиевым лазером (HoLEP), позадилонная и чреспузырная аденомэктомия (простатэктомия).
Необходимо отметить, что в особенно тяжелых случаях декомпенсированной ДГПЖ при выраженной хронической задержке мочи, тяжелой ХПН и других состояниях возможно выполнение «двухэтапного лечения». При этом первым этапом является суправезикальная деривация мочи (цистостомия), позволяющая в последующем назначить пациенту специфическую терапию по восстановлению сократительной способности мочевого пузыря и устранению клинических проявлений ХПН. Позднее выполняется «отсроченная операция» по удалению аденоматозных узлов одним из перечисленных выше способов. Система скрининга заболеваний предстательной железы, приведенная нами в начале данной главы, существенно сократила количество пациентов, нуждающихся в «двухэтапном лечении».
ТУР предстательной железы — золотой стандарт оперативного лечения ДГПЖ. Применяется при объеме простаты от 30 до 80 см3. В отдельных клиниках, располагающих большим опытом выполнения ТУРП, верхняя граница объема простаты, подлежащей ТУРП, может повышаться до 120 см3. Метод эффективен у 80% пациентов. Результатом этой операции является увеличение максимальной скорости потока мочи на 163%, снижение балла IPSS на 70% и балла QoL на 69%. Количество остаточной мочи уменьшается на 77% [54]. Имеются данные исследований эффективности ТУРП с продолжительностью наблюдения за пациентами более 20 лет. Ни один другой метод не имеет столь убедительной доказательной базы.
В зависимости от объема удаленной ткани простаты следует различать следующие виды ТУРП:
-
«псевдо-ТУР» (удаляется лишь небольшая часть гиперплазированной ткани — 10—20% объема, не более 10—15 г) преимущественно из области шейки мочевого пузыря, или часть средней доли ДГП (создание «мочевой дорожки»);
-
«парциальная ТУР» (удаляется 30—80%). В зависимости от объема резекции «парциальную ТУР» подразделяют на «паллиативную ТУР» и «субтотальную ТУР»;
-
«тотальная ТУР» (трансуретральная простатэкгомия): удаляется практически 90—100% объема гиперплазированной ткани, что соответствует открытой операции.
Радикальность выполнения ТУРП определяет риск необходимости повторного вмешательства. В среднем этот риск составляет 1—2% в год. На примере более чем 20 000 пациентов было продемонстрировано, что повторная операция (реТУРП, уретротомия или резекция шейки мочевого пузыря) потребовалась 5,8, 12,3 и 14,7% пациентов через 1 год, 5 и 8 лет наблюдения [55]. Смертность после этой операции составляет 0,1% [56]. Наиболее часто встречающиеся осложнения — кровотечение (2,9%), тампонада мочевого пузыря (4,9%), инфекционные осложнения (4,1%), эректильная дисфункция (6,5%), ретроградная эякуляция (65,4%), стриктура уретры (5—7%), склероз шейки мочевого пузыря (2— 4%), недержание мочи (1—2%), ТУР-синдром (0,8%) [39, 57].
Биполярная трансуретральная резекция простаты — одна из модификаций традиционной трансуретральной резекции простаты с применением биполярной плазмокинетической технологии. Техника выполнения оперативного вмешательства идентична монополярной трансуретральной резекции простаты. Отличие состоит в том, что операция выполняется в физиологическом растворе, а энергия не проходит через тело пациента, распространяясь между двумя полюсами на петле (истинная биполярная резекция) или петлей и тубусом резектоскопа (псевдобиполярная резекция). У биполярной резекции более выраженный коагуляционный эффект и лучшая безопасность у пациентов с повышенной кровоточивостью и/ или использующими кардиостимуляторы. Тем не менее по-прежнему имеется дефицит данных по отсроченным результатам биполярного ТУРП, что не позволяет достоверно оценить преимущества биполярной технологии над традиционным монополярным оперативным вмешательством [47].
Открытая аденомэктомия (чреспузырная, позадилонная, промежностная) описана более 100 лет назад и по-прежнему актуальна у пациентов с большим объемом предстательной железы (>80—100 см3). При высокой эффективности этот вариант оперативного вмешательства наиболее травматичный и сопряжен с высоким риском осложнений. Выраженность СНМП после операции снижается на 63—86% (балл IPSS с 12,5— 23,3), балл QoL уменьшается на 60—87%, максимальная скорость потока мочи возрастает на 375% (+16,5—20,2 мл/с), а объем остаточной мочи снижается на 86—98% [58, 59]. Эффект операции стойкий, рецидивы регистрируются очень редко и в основном являются «ложными» (обусловлены разрастанием резидуальной аденоматозной ткани, не удаленной в ходе первой операции. Смертность после этой операции менее 1%, частота гемотрансфузии — 7—14%, вероятность недержания мочи — до 10%), склероз шейки мочевого пузыря и стриктуры уретры регистрируются у 6% пациентов) [58, 59].
Трансуретральная инцизия предстательной железы (ТУИП) показана пациентам с небольшим размером простаты (менее 30 см3). Эффективность вмешательства составляет 78—83%, а частота осложнений значительно ниже по сравнению с ТУР: ретроградная эякуляция возникает не более чем в 25% случаев [1, 3].
Современные лазерные технологии: гольмиевая энуклеация (HoLEP), лазерная резекция аденомы предстательной железы, вапоризация аденоматозной ткани с помощью лазера с «зеленым» излучением (с длиной волны 532 нм) или диодным лазером, энуклеовапоризация с помощью тулиевого лазера позволяют достичь эффекта, аналогичного открытой аденомэктомии, однако сопровождаются значительно меньшим количеством послеоперационных осложнений. Техника выполнения этих операций имеет свои особенности и требует специального обучения. Отдаленные результаты 5и 7-летних исследований демонстрируют результаты, сравнимые с ТУРП. Это утверждение правомочно также в отношении частоты повторных операций, риска и характера осложнений [58, 59].
Трансуретральная игольчатая абляция предстательной железы менее эффективна, чем ТУР, однако не требует госпитализации пациента и общего обезболивания при проведении вмешательства. Может быть предложена для пациентов с отягощенным терапевтическим статусом и противопоказаниями к проведению более масштабных вмешательств. Частота осложнений (недержание мочи и эректильная дисфункция) после игольчатой абляции крайне низкая. Послеоперационная задержка мочи наблюдается в 13,3—41,6% случаев и продолжается 1—3 дня; в течение недели 90—95% пациентов не нуждаются в катетере. Балл IPSS уменьшается на 50%, а максимальная скорость потока мочи увеличивается на 70% к исходу первого года после операции [66].
Интерстициальная лазерная коагуляция — метод выбора у больных, принимающих антикоагулянты [38, 40], характерна высокая безопасность, но чаще возникает необходимость повторного оперативного леченияА [22].
После трансуретральной микроволновой термотерапии существует большая вероятность длительного дренирования мочевого пузыря. Физическая основа метода — коагуляционный некроз ткани простаты, которая нагревается до 45 °С антенной, помещаемой в простатический отдел уретры. Длительная катетеризация необходима в 25% случаев. Эффективность приблизительно на 20% ниже, чем после ТУРП, и зависит от используемого оборудования, поставляемого различными производителями. Доказательная база эффективности применения трансуретральной микроволновой терапии пока недостаточна для формулировки рекомендаций по ее широкому применению [5, 15, 17, 36, 42].
Простатические стенты могут быть постоянными и временными и, будучи эндоскопически помещенными в простатический отдел мочеиспускательного канала, расширяют его просвет. Их применение показано у пациентов, которым невозможно выполнить более масштабное оперативное лечение вследствие наличия отягощенного соматического или психического статуса. Метаанализ результатов их применения свидетельствует, что у 16% больных эффективность применения стентов может быть признана неудовлетворительной в первые 12 мес. после установки. Основная причина — произвольная миграция стента (37%) и рецидив инфравезикальной обструкции (14%). В течение первых 5 лет после установки стенты оказываются неэффективными приблизительно у 1/3 пациентов [61].
| Рекомендации [47] | УД | CP |
|---|---|---|
Монополярная трансуретральная резекция простаты — стандарт оперативного лечения у пациентов с умеренными и тяжелыми симптомами нижних мочевыводящих путей/ДГПЖ с объемом предстательной железы 30-80 см3. ЭффективностьТУРП превышает таковую при сравнении с медикаментозной терапией и малоинвазивными хирургическими методиками |
1а |
А |
Биполярная трансуретральная резекция простаты характеризуется схожими с традиционной монополярной техникой результатами при анализе доступных сегодня краткосрочных наблюдений, обладая при этом несколько лучшей периоперационной безопасностью |
1а |
А |
Трансуретральная инцизия простаты показана пациентам с объемом простаты менее 30 см3 без средней доли, у которых регистрируется наличие умеренно выраженных и тяжелых симптомов расстройства мочеиспускания |
1а |
А |
Открытое вмешательство и лазерная энуклеация гольмиевым лазером (HoLEP) служат методом выбора у пациентов с медикаментозно-рефрактерными симптомами нижних мочевыводящих путей и объемом предстательной железы >80-100 см3 |
lb |
А |
Дальнейшее ведение пациентов, получающих медикаментозную терапию или перенесших оперативное вмешательство
Цели дальнейшего наблюдения за пациентом — регистрация динамики симптоматики, раннее выявление осложнений и побочных эффектов лечения0. Для наблюдения за динамикой симптоматики при ДГПЖ следует использовать шкалу международного индекса этого заболевания (IPSS).
Для своевременного выявления РПЖ следует выполнять ПРИ и контролировать уровень ПСА в сыворотке крови каждые 12 мес.
Для контроля наличия ИМП и функции почек необходимо регулярно выполнять общий анализ мочи, определять концентрацию креатинина в сыворотке крови.
Для своевременного выявления побочных эффектов медикаментозной терапии следует регулярно (при каждом посещении) интересоваться у пациента, как он переносит прием препаратов.
Информирование больного
Пациента информируют о клинической картине ДГПЖ, знакомят с различными методами лечения и их потенциальными результатами. Выбор метода лечения следует выполнять в результате такого собеседования после того, как пациент имел возможность задать все интересующие его вопросы.Необходимо убедить пациента не стыдиться болезни и ознакомиться с научно-популярной литературой о ДГПЖ.
Следует информировать пациента о симптоматике, различных осложнениях ДГПЖ, включая инфекционные и обструктивные.
Осложнения
Прогноз
За последние десятилетия прогноз при ДГПЖ стал значительно более благоприятным. Это связано с внедрением:лекарств, воздействующих на этиопатогенетические механизмы развития и прогрессирования болезни;
малоинвазивных оперативных технологий при этом заболевании (ТУР и др.) в повседневную клиническую практику, что позволяет добиться лучших послеоперационных результатов при минимальном количестве осложнений, угрожающих жизни больных.
Кроме того, появившиеся современные диагностические технологии способствуют выявлению ДГПЖ на ранних стадиях развития болезни, а динамическое диспансерное наблюдение позволяет своевременно начинать лекарственную терапию либо проводить малоинвазивное оперативное вмешательство, не дожидаясь осложнений болезни.
Литература
-
Избранные главы гериатрической урологии / под общ. ред. Л.М. Гори ловского. – М.: Ньюдиамед, 2000. – 374 с.
-
Мартов А.Г., Корниенко С.И., Гущин Б.Л. и др. Интраоперационные осложнения при трансуретральных оперативных вмешательствах по поводу доброкачественной гиперплазии предстательной (ТУР) железы // Урология. – 2005. – С. 3–8.
-
Руководство по урологии: В 3 т. / под общ. ред. Н.А. Лопаткина. – М.: Медицина, 1998. – Т. 3.
-
Abrams Р.Н., Farrar D.J., TumerWarwick R.T. et al. The results ofprostatec tomy: A symptomatic and urodynamic analysis of 152 patients // J. Urol. – 1979. – Vol. 121. P. 640642.
-
Ahmed M., Bell T., Lawrence W.T. et al. Transurethral microwave thermo therapy (Prostatron version 2.5) compared with transurethral resection of thepros tate for the treatment of benign prostatic hyperplasia: A randomized controlled parallel study // Br.J. Urol. 1997. Vol. 79. P. 181185.
-
Alsikafi N.F., Gerber G.S. Bilateral metachronous testicular seminomaasso ciated with microlithiasis // J. Urol. – 1998. – Vol. 159. – P. 1643–1644.
-
Barry M J. Prostate specific antigen. Testing for early diagnosis of prostate cancer // N.Eng. J. Med. 2001. Vol. 344. 13731377.
-
Barry M.J., Fowler F.J.Jr., O’Leary M.P. et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association // J. Urol. – 1992. –Vol. 148. – P. 15491557.
-
Blanker M. H., Bohnen A. M., Groeneveld F. P. et al. Normal voiding pat tems and determinants of increased diurnal and nocturnal voiding frequency in el derlymen // J. Urol. – 2000. – Vol. 164. – P. 1201–1205.
-
Boyle P. Epidemiology of benign prostatic hyperplasia: risk factors and concomitance with hypertension // Br.J. Clin. Pract. – 1994. – Vol. 74. – P. 18–22.
-
Boyle P., Robertson C., Lowe E, Roehbom C. Metaanalysis of clinical trials of Permixon in the treatment of benign prostatic hyperplasia // Urology. – 2000. Vol. 55. P. 533539.
-
Brawer М.К. Diagnosis of lower urinary tract symptoms // Postgrad. Med. Special. Report. – 1999. – P. 7–10.
-
Cecil R.L. Cecil Textbook of Medicine. 20th ed. // Philadelphia: WBSaun ders. 1996. 2233 p.
-
Craigen A., Hickling J., Saunders C., Carpenter R. The natural history of prostatic obstruction: A prospective survey // J.R. Coll. Gen. Pract. – 1969. – Vol.18. P. 226232.
-
Djavan B., Roehrbom C.G., Shariat S. et al. Prospective randomized comparison of high energy transurethral microwave thermotherapy versus alpha blocker treatment of patients with benign prostatic hyperplasia // J. Urol. –1999. – Vol. 161. P. 139143.
-
Flanigan R.C., Reda D.J., Wasson J.H. et al. 5year outcome of surgical resection and watchful waiting for men with moderately symptomatic benign prostatic hyperplasia: A Department of Veterans Aff airs Cooperative Study // J. Urol. – 1998.Vol. 160.P. 1216.
-
Francisca E.A., d’Ancona F. C., Meuleman E.J. et al. Sexual function fol lowinghigh energy microwave thermotherapy: results of a randomized controlled studycomparing transurethral microwave thermotherapy to transurethral prostati cresection // J. Urol. 1999. Vol. 161. P. 486490.
-
Gerber G.S. Benign prostatic hyperplasia in older men // Clin. Geriatr. Med. 1998. Vol. 14. P. 317331.
-
Girman C.J., Jacobsen S.J., Guess H.A. et al. Natural history of prostatism: relationship among symptoms, prostate volume and peak urinary flow // J.Urol. – 1995. Vol. 153. P. 15101515.
-
Gormley G.J., Stoner E., Bruskewitz R.C. et al. The effect of finasteride in men with benign prostatic hyperplasia. The Finasteride Study Group // N.Eng. J.Med. 1992. Vol. 327. P. 11851191.
-
Guess H.A. Epidemiology and natural history off benign prostatic hyperplasia // Urol. Clin. North. Am. 1995. Vol. 22. P. 247261.
-
Hoff man R M., MacDonald R, Wilt T.J. Laser prostatectomy for benign prostatic obstruction (Cochrane Review) // The Cochrane Library. –2004. – Vol. 1. – P.24.
-
Isaacs J.T., Coffey D.S. Etiology and disease process of benign prostatic hyperplasia // Prostate. – 1989. – Vol. 2. – P. 33–50.
-
Jensen K.M.E. Clinical evaluation of routine urodynamic investigations in prostatism // Neurourol. Urodynam. – 1989. – Vol. 8. – P. 545–578.
-
Kirby R., Boyle P., Fitzpatrick J. et al. Textbook of Benign Prostatic Hyperplasia. – Oxford: Isis Medical Media, 1996. – P. 125–135.
-
Lepor H., Williford W.O., Barry M.J. et al. The efficacy of terazosin, finasteride, or both in benign prostatic hyperplasia. Veterans Affairs Cooperative Studies Benign Prostatic Hyperplasia Study Group // N.Eng. J. Med. – 1996. – Vol. 335. – P.533539.
-
Lepor H., Williford W. O., Barry M. J. et al. The impact of medical therapy on bother due to symptoms, quality of life and global outcome, and factors predicting response. Veterans Affairs Cooperative Studies Benign Prostatic Hyperplasia StudyGroup // J. Urol. 1998. Vol. 160. P. 13581367.
-
Lowe F.C., Fagelman E. Phytotherapy in the treatment of benign prostatic hyperplasia: an update // Urology. – 1999. – Vol. 53. – P. 671–678.
-
MatthiesenT.B., RittigS., MortensenJ.T., DjurhuusJ.C. Nocturia and polyuriain men referred with lower urinary tract symptoms, assessed using a 7 day frequency volume chart // Br.J. Urol. Int. – 1999. – Vol. 83. – P. 1017–1022.
-
Medina J.J., Parra R.O., Moore R.G. Benign prostatic hyperplasia (the agingprostate) // Med. Clin. North. Alll. 1999. Vol. 83. P. 12131229.
-
MeyhoflH.H., Ingemann L., Nordling J., Hald T. Accuracy in preoperative estimation of prostatic size. A comparative evaluation of rectal palpation, intra venous pyelography, urethral closure pressure profile recording and cystourethros copy // Scand. J. Urol. Nephrol. – 1981. – Vol. 15. – P. 45–51.
-
Neal D.E., Ramsden P.D., Sharpies L. et al. Outcome of elective prostatectomy // BMJ. – 1989. – Vol. 299. – P. 762–767.
-
Neal D.E., Styles R.A., Powell P.H. et al. Relationship between voiding pressure, symptoms and urodynamic findings in 253 men undergoing prostatectomy // Br.J. Urol. 1987. Vol. 60. P. 554559.
-
Nyman M.A., Schwenk N.M., Silverstein M.D. Management of urinary retention: rapid versus gradual decompression and risk of complications // MayoClin. Proc. 1997. Vol. 72. P. 951956.
-
Riehmann M., Knes J.M., Heisey D. et al. Transurethral resection versus incision of the prostate: a randomized, prospective study // Urology. – 1995. Vol. 45. P.768775.
-
Roehrbom C.G., Preminger G., Newhall P. et al. Microwave thermotherapy for benign prostatic hyperplasia with the Domier Urowave: Results of a randomized double blind multicenter sham controlled trial // Urology. – 1998.Vol. 51.P. 1928.
-
Rowan D., James E.D., Kramer AE. et al. Urodynamic equipment: technical aspects. Produced by the International Continence Society Working Party on Urodynamic Equipment // J.Med. Eng. Technol. – 1987. – Vol. 11. – P.57–64.
-
Shingleton W.B., Farabaugh P., May W. Threeyear followup of laser prostatectomy versus transurethral resection of the prostate in men with benign prostatic hyperplasia // Urology. – 2002. – Vol. 60. – P. 305–308.
-
Toscano I.L., Maciel L. C., Martins F.G. et al. Transurethral resection of the prostate: Prospective randomized study of catheter removal after 24 or 48 hours following surgery // Braz.J. Urol. – 2001. – Vol. 27. – P. 144–147.
-
Van Melick H.H., Van Venrooij G.E., Eckhardt M. D et al. A randomized controlled trial comparing transurethral resection of the prostate, contact laser prostatectomy and electro vaporization in men with benign prostatic hyperplasia: urodynamic effects // J. Urol. – 2002. – Vol. 168. – P. 1058–1062.
-
Van Venrooij G.E., Eckhardt M.D,, Gisholf K.W., Boon T.A. Data from frequency volume charts versus symptom scores and quality of life score in men with lower urinary tract symptoms due to benign prostatic hyperplasia // Eur. Urol. 2001. Vol. 39. P. 4247.
-
Wagrell L., Schelin S., Nordling J. et al. Feedback microwave thermotherapy versus TURP for clinical BPH: A randomized controlled multicenter study // Urology. 2002. Vol. 60. P. 292299.
-
Wasson J., Reda D., Bmskewitz R.C. et al. A comparison of tiansurethral suigery with watchful waiting for moderate symptoms of benign prostatic hyperplasia. The Veterans Affairs Cooperative Study Group on Transurethral Resection of theProstate // N.Eng. J. Med. 1994. Vol. 334. P. 7579.
-
Wilde M.I., Goa K.L. Finasteride: an update of its use in the management of symptomatic benign prostatic hyperplasia // Drugs. – 1999. – 57. – P. 557– 581.
-
Wilt T., Ishani A., MacDonald R. Serenoa repens for benign prostatic hyperplasia (Cochrane Review) // The Cochrane Library. – 2004. – Vol. 1. – P. 24.
-
Montorsi F. Summary of product characteristics // Eur. Urol. – 2010. – Vol. 9. P. 491495.
-
http://uroweb.otg/guideline/treatmentofnonneurogenicmaleluts/
-
Roehrbom C.G., et al. Serum prostatespecific antigen as a predictor of prostate volume in men with benign prostatic hyperplasia // Urology – 1999. – Vol. 53. P. 581 589.
-
Boyle P., et al. Metaanalysis of randomized trials of terazosin in the treatment of benign prostatic hyperplasia // Urology – 2001. – Vol. 58. – P. 717–722.
-
Roehrbom C.G., et al. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4year results from the CombAT study // Eur. Urol. – 2010. – Vol. 57.P. 123131.
-
Giuliano F., et al. The mechanism of action of phosphodiesterase type 5 inhibitors in the treatment of lower urinary tract symptoms related to benign prostatic hyperplasia // Eur. Urol. – 2013. – Vol. 63. – P. 506–616. http://www.ncbi.nlm.nih.gov/pubmed/23018163
-
Morelli A., et al. Phosphodiesterase type 5 expression in human and rat lower urinary tract tissues and the effect of tadalafil on prostate gland oxygenation in spontaneously hypertensive rats // J. Sex. Med. – 2011. – Vol. 8. – P. 2746– 2760. http://www.ncbi.nlm.nih.gov/pubmed/21812935
-
Vignozzi L., et al. PDE5 inhibitors blunt inflammation in human BPH: a potential mechanism of action for PDE5 inhibitors in LUTS // Prostate. – 2013. – Vol. 73. – P. 1391–1402. http://www.ncbi.nlm.nih.gov/pubmed/23765639
-
Ahyai S.A., et al. Metaanalysis of functional outcomes and complications following transurethral procedures for lower urinary tract symptoms resulting from benign prostatic enlargement // Eur.Urol. – 2010. – Vol. 58. – P. 384–397.
-
Madersbacher S., et al. Reoperation, myocardial infarction and mortality after transurethral and open prostatectomy: a nationwide, longterm analysis of 23,123 cases // Eur. Urol. – 2005. – Vol. 47. – P. 499–504. http://www.ncbi.nlrn.nih.gov/pubmed/15774249
-
Reich O., et al. Morbidity, mortality and early outcome of transurethral resection of the prostate: a prospective multicenter evaluation of 10,654 patients // J. Urol. 2008. Vol. 180. P. 246249.
-
Madersbacher S, et al. Is transurethral resection of the prostate still justified // BJU Int. 1999. Vol. 83. P. 227237.
-
Naspro R., et al. Holmium laser enucleation of the prostate versus open prostatectomy for prostates >70 g: 24month followup // Eur.Urol. – 2006. – Vol. 50. – P. 563–568. http://www.ncbi.nlm.nih.gov/pubmed/16713070
-
Skolarikos A., et al. Eighteenmonth results of a randomized prospective study comparing transurethral photoselective vaporization with transvesical open enucleation for prostatic adenomas greater than 80 cc. // J. Endourol. – 2008. – Vol. 22. P. 23332340.
-
Boyle P., et al. A metaanalysis of trials of transurethral needle ablation for treating symptomatic benign prostatic hyperplasia // BJU Int. – 2004 –Vol. 94. – P. 8388.
-
Armitage J.N., et al. Epithelializing stent for benign prostatic hyperplasia: a systematic review of the literature // J. Urol. – 2007. – Vol. 177. – P. 1619–1624
Глава 2. ГЕМАТУРИЯ
Е.В. Шпоть, В.А. Малхасян, Г.Н. Акопян
При наборе достаточного количества доказательств обоснованности какого-либо метода лечения ему присваивался уровень доказательности (А — высокая, B — средняя, С — низкая) и разрабатывались стандарты, рекомендации или альтернативные методы. При недостаточном количестве доказательств обоснованности какого-либо метода дополнительная информация предоставлялась в качестве экспертного мнения или клинического опыта. Дефиниция микрогематурии, информация о детальной диагностике данного заболевания, оценке состояния пациентов с ним и наблюдении за больными представлены в тексте и в алгоритме [15].
Клинические рекомендации
-
Бессимптомная микрогематурия выражается в наличии ≥3 эритроцитов в поле зрения микроскопа при изучении должным образом забранного образца мочи при отсутствии каких-либо очевидных доброкачественных заболеваний. Положительный анализ на кровь в моче с помощью тест-полосок не может являться критерием постановки диагноза бессимптомной микрогематурии. Для постановки диагноза необходимо микроскопическое исследование мочевого осадка, а не постановка проб с тест-полосками. Положительный анализ на кровь в моче, выполненный с помощью тест-полосок, свидетельствует о необходимости проведения микроскопического исследования для подтверждения или исключения бессимптомной микрогематурии. Экспертное мнение.
-
Обследование пациента с бессимптомной микрогематурией включает: тщательный сбор анамнеза, физикальное обследование и проведение лабораторных исследований с целью исключения «доброкачественных» причин бессимптомной микрогематурии — таких, как инфекционные заболевания, менструация, силовые упражнения, хроническая болезнь почек, вирусные заболевания, травмы или недавно перенесенные урологические манипуляции. Клинический опыт.
-
После исключения доброкачественных причин бессимптомной микрогематурии необходимо провести урологическое обследование. Рекомендация (уровень доказательности С).
-
При первичном поступлении больного необходимо оценить почечную функцию (может включать расчет скорости клубочковой фильтрации, уровня креатинина и мочевины), так как хроническая болезнь почек ассоциирована с соответствующими рисками при оценке и лечении больных бессимптомной микрогематурией. Клинический опыт.
-
Наличие микрогематурии, протеинурии, цилиндрурии и/или почечной недостаточности или других клинических признаков, указывающих на наличие поражений почечной паренхимы, свидетельствует о необходимости консультации нефролога, но не исключает необходимости урологического обследования. Рекомендация (уровень доказательности С).
-
При возникновении микрогематурии на фоне приема антикоагулянтов требуется консультация уролога и нефролога независимо от типа и дозировки антикоагулянтов. Рекомендация(уровень доказательности С).
-
Для исключения урологических причин бессимптомной микрогематурии всем пациентам в возрасте 35 лет и старше необходимо провести цистоскопию. Рекомендация (уровень доказательности С).
-
У лиц моложе 35 лет решение о необходимости или отсутствии необходимости проведения цистоскопии принимает лечащий врач. Альтернативный метод (уровень доказательности С).
-
Цистоскопия показана всем пациентам независимо от возраста при наличии факторов риска развития злокачественных опухолей мочевыводящих путей (например, ирритативные симптомы, курение на данный момент или в анамнезе, подверженность воздействию химических факторов). Клинический опыт.
-
Первичное обследование пациентов с бессимптомной микрогематурией включает УЗИ и МСКТ органов мочевой системы. МСКТ (с внутривенным контрастированием или без него) с достаточной визуализацией паренхиматозной фазы для исключения опухоли почки и экскреторной фазы с целью оценки верхних отделов мочевыводящих путей служит методом выбора, так как она характеризуется самой высокой чувствительностью и специфичностью при визуализации верхних отделов мочевыводящих путей. Рекомендация (уровень доказательности С).
-
При наличии относительных или абсолютных противопоказаний к проведению МСКТ (таких, как почечная недостаточность, аллергическая реакция на контраст, беременность) в качестве альтернативного метода визуализации можно использовать магнитно-резонансную (МР) урографию (с внутривенным контрастированием или без него). Альтернативный метод (уровень доказательности С).
-
При наличии персистирующей микрогематурии и невозможности постановки диагноза с помощью стандартных методов или наличии факторов риска развития карциномы in situ (например, при ирритативных симптомах, курении на данный момент или в анамнезе, воздействии химических веществ) целесообразно провести цитологическое исследование. Альтернативный метод (степень рекомендаций С).
-
Флюоресцентная цистоскопия в синем свете не рекомендуется для обследования пациентов с бессимптомной микрогематурией. Клинические рекомендации (уровень доказательности С).
-
Если у пациента с персистирующей бессимптомной микрогематурией в анамнезе при двух последних ежегодных анализах мочи гематурия не отмечается (один анализ в год в течение двух лет с момента первого анализа), то дополнительные анализы с целью исключения бессимптомной микрогематурии не требуются. Экспертное мнение.
-
Если в ходе урологического обследования у пациента с персистирующей бессимптомной микрогематурией не было выявлено соответствующей урологической патологии, в дальнейшем рекомендуется ежегодно выполнять анализ мочи. Рекомендация (уровень доказательности С) [15].
Гематурия — выделение эритроцитов с мочой, обнаруживаемое при:
-
микроскопии осадка мочи во время исследования 2 из 3 анализов (>3 эритроцитов в поле зрения микроскопа);
-
исследовании мочи по Нечипоренко — >1000 эритроцитов в 1 мл средней порции мочиA [11].
МКБ-10 • N02 Рецидивирующая и устойчивая гематурия • R31 Неспецифическая гематурия.
-
Эпидемиология
С помощью микроскопии мочи и использования тест-полосок в исследовании, в котором принимали участие более 80 000 испытуемых, проходящих медосмотр, было установлено, что распространенность микрогематурии в популяции варьирует от 2,4 до 31,1%. Микрогематурия чаще была диагностирована у мужчин старше 60 лет и у курящих или ранее куривших мужчин [15].
Распространенность гематурии в зависимости от возраста приведена в табл. 2.1.
| Возрастная группа больных | Распространенность, % |
|---|---|
Дети младше 12 лет |
1–4 |
Мужчины в возрасте 18–33 лет |
5,2 |
Пожилой возраст (старше 50 лет) |
4–18 (мужчины), 14 (женщины) |
Старческий возраст (старше 75 лет) |
13 (мужчины), 9 (женщины) |
При дообследовании пациентов с гематурией у 3,4–56,0% обнаруживают заболевания, требующие леченияC [11].
Факторы риска
В соответствии со стратегией обследования выделяют следующие категории факторов риска.
-
Для больных с высоким риском развития нефрологического заболеванияA [10]:
При выявлении гематурии у данной группы больных необходимо направить их для лечения к нефрологу.
-
Для больных с высоким риском развития урологического заболеванияA [11]:
При выявлении микрогематурии хотя бы в одном анализе мочи у пациентов с высоким риском урологического заболевания необходимо направить их на углубленное обследование. Обязательно выполнение цистоскопии, УЗИ почек, рентгенологического исследования мочевыводящих путей, цитологического исследования мочи.
Профилактика
Связана со своевременной диагностикой и лечением тех болезней, в структуру которых входит этот симптом. Так, проведение терапии ингибиторами 5-α-редуктазы в течение 6 мес и более является профилактикой гематурии, обусловленной гиперплазией предстательной железыB [6].
Скрининг
Не рекомендовано проведение общепопуляционного скрининга на выявление микрогематурииB [11].
Классификация
По величине разделяют:
По этиологии выделяют:
Лишь в небольшом проценте случаев бессимптомная микрогематурия оказывается следствием злокачественной опухоли мочевыводящих путей, требующей лечения. Данный вывод основан на результатах трех видов исследований: скрининговые исследования, в ходе которых у лиц с неизвестным статусом здоровья была выявлена бессимптомная микрогематурия, после чего были проведены соответствующие исследования; первичные диагностические исследования, в ходе которых пациенты со случайно (например, при медицинском осмотре) диагностированной бессимптомной микрогематурией подвергались соответствующему урологическому обследованию; специализированные диагностические исследования, в ходе которых на начальном этапе пациентам с бессимптомной микрогематурией не удалось поставить диагноз и они были направлены в специализированные учреждения для более детального обследования. В 17 скрининговых исследованиях лишь у 98 (2,6%) из 3762 пациентов с бессимптомной микрогематурией была диагностирована злокачественная опухоль мочевыводящих путей. В отдельных скрининговых исследованиях данный показатель варьировал от 0 до 25,8%, при этом при повторных тестах у пациентов из группы высокого риска (например, курильщики мужского пола в возрасте 60 лет или старше) были получены более высокие показатели, чем в исследуемой когорте в целом. В ходе 32 исследований, в которых оценивалась первичная урологическая диагностика 9206 пациентов с бессимптомной микрогематурией, было установлено, что злокачественные опухоли явились причиной микрогематурии в 368 случаях (4,0%). В отдельных исследованиях данный показатель варьировал от 0 до 9,3%. Еще 8 исследований были посвящены изучению частоты встречаемости злокачественных опухолей. Из 1475 больных, которым при первичном урологическом обследовании не удалось поставить диагноз, направленных в более специализированные учреждения для дообследования, в конечном счете злокачественная опухоль мочевыводящих путей была диагностирована у 41 пациента (2,8%). Более того, урологическое обследование зачастую способствовало диагностике других заболеваний, которые поддавались активному лечению. Так, по данным различных исследований, частота выявления мочекаменной болезни составила 1,4–25,6%, при этом в большинстве из исследований вероятность наличия данной патологии как причины бессимптомной гематурии равнялась 5,0%. Диагноз доброкачественной гиперплазии предстательной железы был установлен в 1,0–47,1% случаев, при этом не менее чем в половине исследований частота выявления данной патологии как причины бессимптомной микрогематурии составляла >10,0%. Наличие стриктур уретры отмечалось у 1–7,1% пациентов, при этом более 1/3 исследований свидетельствовали в пользу того, что вероятность наличия стриктур уретры как причины бессимптомной микрогематурии составляет >2,0%. Группа экспертов на основании полученных результатов пришла к выводу, что бессимптомная микрогематурия достаточно часто является симптомом заболеваний, которые могут быть жизнеугрожающими и/или хорошо поддаваться лечению, поэтому при развитии бессимптомной микрогематурии требуется соответствующее обследование пациентов [15].
Рекомендации, основанные на результатах, представленных выше исследований, соответствуют уровню доказательности С, так как большинство из них были монокогортными обсервационными исследованиями, а также исследования существенно отличались друг от друга по особенностям пациентов, протоколам обследования больных и длительности периода наблюдения. Группа экспертов отметила, что существует серьезный пробел в знаниях, касающихся бессимптомной микрогематурии. В частности, необходимо проводить исследования, посвященные бессимптомной микрогематурии и диагностической мощности различных исследований при данной патологии, на пациентах, которые тщательно обследованы, отслежены в течение длительного периода времени и стратифицированы по возрасту, полу и другим предполагаемым факторам риска. При отсутствии данной информации выявление различий между подгруппами пациентов для разработки протоколов дифференциальной диагностики характеризуется низким уровнем достоверности. Учитывая результаты исследований, представленных в научной литературе, группа экспертов пришла к выводу, что польза от выявления и последующего лечения жизнеугрожающих злокачественных опухолей или других заболеваний мочевыводящих путей превышает риски, ассоциированные с урологическим обследованием больного.
Нефрологическая патология, требующая соответствующего лечения, отмечается лишь у небольшой доли пациентов с бессимптомной микрогематурией. Выявление дисморфных эритроцитов в моче с помощью стандартной микроскопии, фазово-контрастной микроскопии или автоматического анализатора характеризуется широким диапазоном чувствительности (31,9–100%) и специфичности (33,3–100%), поэтому данный метод в монорежиме нельзя использовать для диагностики гломерулярных причин микрогематурии. Тем не менее обнаружение дисморфных эритроцитов может быть полезным как дополнение к иным клиническим данным (например, анамнез, физикальное обследование, данные лабораторных методов исследования — такие, как протеинурия или почечная недостаточность), как стимул для поиска клубочковых причин гематурии.
Хотя наличие дисморфных эритроцитов указывает на наличие гломерулопатии, оно не исключает вероятности присутствия урологических заболеваний. Ввиду сказанного выше при наличии сопутствующих факторов риска и клинических данных, указывающих на возможную урологическую патологию, следует проводить урологическое обследование пациента. Более того, необходимо отметить, что наличие протеинурии и почечной недостаточности у пациентов с микрогематурией является показанием к консультации нефролога независимо от морфологических особенностей эритроцитов. При этом патология почек не исключает возможность одновременного наличия урологического заболевания, поэтому наличие микрогематурии и других особенностей, указанных в этих клинических рекомендациях, является показанием для проведения исследований, нацеленных на исключение урологических патологий. Уровень доказательности — С, так как большинство исследований, на результатах которых рекомендации основаны, были монокогортными обсервационными исследованиями, а также исследования существенно отличались друг от друга по особенностям пациентов, протоколам обследования больных и длительности периода наблюдения. Более того, в исследованиях, посвященных дисморфным эритроцитам, критерии положительного анализа, постановки диагноза гломерулопатии, методы подготовки образцов и референсные стандарты различались [15]:
-
интерстициальными нефритами лекарственной этиологии (антибиотики, диуретики, НПВС, противосудорожные средства, противоопухолевые препараты);
-
интерстициальными нефритами инфекционной этиологии (сифилис, токсоплазмоз, цитомегаловирус, вирус Эпштейна–Барр);
-
интерстициальными нефритами, вызванными системными заболеваниями (саркоидоз, лимфома, синдром Шегрена);
-
урологическим заболеванием почек (почечно-клеточный рак, опухоль Вильмса, кисты почек);
-
болезнями сосудов (артериовенозная фистула, стеноз почечной артерии, тромбоз или тромбоэмболия почечной артерии, тромбоз почечной вены);
-
заболеванием системы крови (лейкозы, лимфомы, серповидно-клеточная анемия, снижение свертывания крови в результате приема антиагрегантов и антикоагулянтов);
-
травмами почек (почечная и внепочечная, маршевая гематурия);
-
неспецифическими или специфическими воспалительными заболеваниями верхних мочевыводящих путей и мочевого пузыря;
-
наличием конкрементов в чашечно-лоханочной системе, мочеточниках, мочевом пузыре и задней уретре;
ДИАГНОСТИКА
Существует множество причин бессимптомной микрогематурии, при которых не требуется использовать диагностический алгоритм в полном объеме. К этим причинам относятся тяжелые силовые упражнения, хроническая болезнь почек, инфекционные или вирусные заболевания, начавшаяся или недавно закончившаяся менструация, травмы, недавно проведенные урологические манипуляции (например, установка катетера). Пациентов с бессимптомной микрогематурией следует расспрашивать о наличии этих потенциальных причин микрогематурии, при выявлении патологий проводить соответствующее лечение, а после коррекции состояния — повторно проводить обследование. В некоторых случаях, в частности при известной доброкачественной причине бессимптомной микрогематурии (например, бессимптомная мочекаменная болезнь, катетеризация), сохраняется риск наличия сопутствующих заболеваний, поэтому диагностические манипуляции периодически должны назначаться на усмотрение врача [15].
Анамнез
При обследовании пациента с макрогематурией в первую очередь необходимо визуально оценить мочу.
Важно уточнить условия, степень, характер и длительность гематурии:
-
при окрашивании кровью только начальной порции мочи диагностируют инициальную гематурию, возникающую в результате травмы, воспаления или роста опухоли уретры. Возможно сочетание этой формы с уретроррагией — выделением крови из мочеиспускательного канала вне акта мочеиспускания;
-
равномерное окрашивание всех порций мочи кровью — признак тотальной гематурии. Она характерна для болезней почек, мочеточника, мочевого пузыря и простаты;
-
терминальная гематурия, или выделение крови в конце акта мочеиспускания, указывает на локализацию патологического процесса в шейке мочевого пузыря (цистит, уретротригонит — у женщин; простатит, воспаление или опухоль семенного бугорка — у мужчин, опухоль шейки мочевого пузыря);
-
при наличии болевого симптома его локализация может указывать на возможную причину кровотечения:
-
боль в поясничной области на стороне поражения до начала гематурии, а также появление ее после купирования болевого симптома — на наличие камней в мочеточнике;
-
появление этой боли после гематурии — на обструкцию мочеточника сгустками крови;
-
затруднение мочеиспускания после появления примеси крови в моче свидетельствует о развитии тампонады мочевого пузыря.
-
Кроме того, необходимо уточнить:
-
условия, способствующие появлению гематурии (гипертермия, физическая нагрузка, половой акт, травма, связь с менструальным циклом);
-
анамнестические данные о путешествиях в тропические страны для исключения паразитарных болезней (шистосоматоз, малярия);
-
особенности семейного анамнеза для выявления наследственных заболеваний, приводящих к развитию макрогематурии (болезни Фабри, Альпорта и др.);
-
наличие в анамнезе ранее перенесенных заболеваний (ангина, мочекаменная болезнь, опухоль мочевого пузыря и др.);
-
лекарственный анамнез пациента (особенно данные о приеме аминогликозидов, амитриптилина, НПВС, противосудорожных и про тивомалярийных лекарственных средств, циклофосфамида, диуретиков, оральных контрацептивов, антибиотиков пенициллинового ряда, антиагрегантов и антикоагулянтов).
Интенсивность гематурии не всегда коррелирует с тяжестью заболевания, определившего появление этого симптомаA.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
При осмотре обращают внимание на:
-
геморрагические высыпания на коже и слизистых оболочках, свидетельствующие о возможных заболеваниях системы гемостаза, геморрагической лихорадке с почечным синдромом;
-
отеки, повышение АД, указывающие на вероятные нефрологические заболевания;
-
повышение температуры тела, возможно, вызванное инфекционным заболеванием;
-
увеличение лимфатических узлов, характерное для инфекционных заболеваний, болезней крови, онкологических заболеваний.
Пальпация живота зачастую позволяет выявить увеличение печени, селезенки, опухоль органов брюшной полости и забрюшинного пространства.
Пациентам мужского пола необходимо выполнить пальцевое ректальное, а женщинам — вагинальное обследование. Кроме того, всем больным проводят осмотр наружного отверстия уретры.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Исследование мочи на наличие гемоглобина — доступный и чувствительный метод диагностики, особенно для врачей общей практики при визите на дом к пациентуA. Ложноположительные результаты возможны при гемоглобинурии и миоглобинурии, ложноотрицательные — при приеме пациентами препаратов аскорбиновой или ацетилсалициловой кислоты, так как их метаболиты, выделяясь с мочой, могут препятствовать изменению цвета тест-полоски.
Положительный результат, полученный при проведении этого метода диагностики, должен быть подтвержден данными общего анализа мочи и микроскопии осадка. В отдельных случаях дополнительную диагностическую ценность могут иметь исследования по Нечипоренко (содержание эритроцитов в 1 мл мочи). В общем анализе мочи обращают внимание на содержание белка, так как при выраженной протеинурии высока вероятность нефрологического заболевания. В сомнительных случаях необходимо выполнение исследования на селективность протеинурии.
Микроскопия осадка с использованием современного фазового контрастного микроскопа позволяет провести топическую диагностику гематурии:
Лейкоцитурия и пиурия свидетельствуют об ИМП. При выявлении данных изменений в анализе мочи показано проведение бактериологического исследования с определением чувствительности к антибиотикам.
Наличие пиурии при повторных отрицательных результатах бактериологического исследования считают показанием к проведению анализа мочи на микобактерии туберкулеза, рентгенографии грудной клетки и консультации фтизиатра.
В топической диагностике гематурии помогает выполнение трехстаканной пробы:
При выполнении биохимического анализа крови у таких больных необходимо обратить внимание на уровень общего белка, глюкозы, креатинина, мочевины и ПСА (у мужчин).
У пациентов с гематурией не обязательно проведение рутинного цитологического исследования мочи, направленного на выявление опухолевых клеток и рака уротелияA.
Микроскопическое исследование. Необходимо собрать среднюю порцию свежевыпущенной мочи (во время мочеиспускания), которую сразу же в течение 10 мин центрифугируют в 15-миллиметровой колбе с числом оборотов, равным 2000 в 1 мин (или в течение 5 мин при 3000 оборотах в 1 мин). Надосадочную жидкость сливают, а образовавшийся осадок разбавляют 3 мл надосадочной жидкости и/или физиологическим раствором. После этого осадок помещают на предметное стекло (75×25 мм) и закрывают покровным стеклом (22×22 см).
В ходе микроскопического исследования необходимо оценить не менее 10–20 полей под 400-кратным увеличением. Наличие ≥3 эритроцитов в микроскопическом поле свидетельствует о микрогематурии [15].
Для диагностики микрогематурии не годится моча, полученная после длительного пребывания пациента в положении лежа (первое утреннее мочеиспускание), после тяжелой физической или сексуальной активности. Также следует помнить, что в разбавленной моче, имеющей осмоляльность менее 308 мОсм, большинство эритроцитов подвергаются лизису, в результате чего количество эритроцитов при микроскопии под 400-кратном увеличении может быть искусственно снижено [15].
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
При наличии макрогематурии в обязательном порядке должны быть выполнены следующие инструментальные исследования:
По показаниям могут быть выполнены следующие обследования:
МСКТ и МРТ — более предпочтительные методы визуализации по сравнению с УЗИ и экскреторной урографией.
-
КТ-урография позволяет детально визуализировать анатомические особенности мочевыводящих путей. МР-урография, хотя и менее точный метод визуализации, чем КТ-урография, но позволяет избежать воздействия ионизирующего излучения. Оба указанных метода характеризуются более высокой точностью и специфичностью диагностики различных урологических заболеваний, ассоциированных с бессимптомной микрогематурией, по сравнению с внутривенной урографией и ультразвуковым исследованием. В связи с этим группа экспертов рекомендует использовать КТи МР-урографию с целью диагностики патологий мочевыводящих путей, проявляющихся бессимптомной микрогематурией (описаны в соответствующих разделах диагностики). Тем не менее необходимо отметить, что выбор метода визуализации должен делать лечащий врач, который ориентирован в особенностях пациента и оснащенности лечебного учреждения [15].
-
Ретроградная уретеропиелография и уретеропиелокаликоскопия для диагностики папиллярных опухолевых заболеваний верхних мочевыводящих путей [5].
Среди 98 пациентов, у которых в ходе скрининговых исследований были диагностированы злокачественные опухоли мочевыводящих путей, 95 пациентов (97%) были старше 35 лет. Из 409 пациентов с онкологическими заболеваниями мочевыводящих путей, диагностированными при первичном и последующем обследовании, 406 (99,3%) были старше 35 лет. Основываясь на этих данных, рабочая группа экспертов пришла к выводу, что цистоскопия показана пациентам в возрасте ≥35 лет. Риск развития инфекционных заболеваний после цистоскопии низкий, и согласно рекомендациям по антимикробной профилактике в урологии [Best Practice Policy Statement on Urologic Surgery Antimicrobial Prophylaxis (2008)] рутинная цистоскопия не требует назначения антибактериальной терапии. Данная рекомендация имеет уровень доказательности С, так как большинство из исследований были монокогортными обсервационными, а также существенно отличались друг от друга по характеристикам пациентов, протоколам обследования больных и длительности периода наблюдения. К факторам риска наличия значимого заболевания мочевыводящих путей у пациентов с бессимптомной микрогематурией были отнесены курение на данный момент или в анамнезе, эпизоды иррадиации болей в область таза в анамнезе, прием алкилирующих химиотерапевтических препаратов (таких, как циклофосфамид) и воздействие профессиональных факторов риска, включая красители, бензол и ароматические амины. Всем пациентам с факторами риска цистоскопия рекомендуется независимо от возраста [15].
Дифференциальная диагностика
Дифференциальная диагностика представлена на рис. 2.1.

Лечение
ЦЕЛЬ ЛЕЧЕНИЯ
Устранение причины, вызвавшей развитие гематурии.
При обучении пациентов особенно важно обратить внимание на необходимость экстренного обращения за медицинской помощью при появлении примеси крови в моче.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Макрогематурия является показанием к экстренной госпитализации в урологический стационарA.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Не имеет основного значения и состоит в исключении тяжелых физических нагрузок у больных маршевой гематурией. Если гематурия обусловлена лекарственной терапией, показана отмена препарата.
В отдельных случаях при гематурии, обусловленной травмой почки, больным назначают строгий постельный режим, местную гипотермию, рекомендуют обильное питье.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
При наличии у больного гематологических заболеваний показано лечение компонентами крови или переливание свежезамороженной плазмы в зависимости от диагностированного дефекта системы гемостаза.
При инфекционных и воспалительных заболеваниях мочевой системы проводят антибактериальную, противовоспалительную и инфузионно-дезинтоксикационную терапию.
При развитии гиповолемии назначают инфузионную терапию коллоидными и кристаллоидными растворами.
При нефрологических заболеваниях проводят патогенетическую терапию основного заболевания глюкокортикоидами и цитостатиками.
Помимо данных методов лечения, в большинстве случаев назначают неспецифическую гемостатическую терапию.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Цель оперативного лечения при гематурии — окончательная остановка кровотечения.
Показания
При гематурии, обусловленной травмой почки, в зависимости от величины повреждений применяют ревизию почки, ушивание разрыва, резекцию почки или нефрэктомию. При опухолях почки, приводящих к развитию гематурии, также показана резекция органа или нефрэктомия. При тяжелом состоянии больного или неоперабельной опухоли возможно проведение эмболизации кровоточащих сосудов после выполнения ангиографии.
При гематурии, обусловленной травмой мочевого пузыря, проводят ревизию органа, ушивание разрыва, цистостомию.
При гематурии, обусловленной опухолью мочевого пузыря, в зависимости от конкретной клинической ситуации, стадии и размеров опухоли могут быть выполнены следующие оперативные вмешательстваC [2]:
При гематурии, обусловленной гиперплазией предстательной железы, возможно выполнение трансуретральной или открытой аденомэктомииB [1].
Дальнейшее ведение [15]
При определении причины гематурии и установлении диагноза последующее ведение больного проводят в соответствии со стандартами лечения выявленного заболевания. При неясной причине гематурии необходимо рекомендовать проведение перечисленных ниже исследований в указанном порядкеB [11].
При неинформативных результатах обследования пациентов с микрогематурией или при наличии у больных других факторов риска развития карциномы in situ (например, ирритативные симптомы, курение в анамнезе, воздействие химических факторов) целесообразно проведение цитологического исследования. Альтернативный метод.
Обсуждение (уровень доказательности С; соотношение рисков и пользы не установлено). Хотя цитологическое исследование мочевого осадка при использовании в качестве единственного метода диагностики не позволяет достоверно судить о наличии или отсутствии злокачественной опухоли, в совокупности с другими исследованиями у пациентов из группы высокого риска позволяет заподозрить злокачественную опухоль. Согласно научным данным, чувствительность метода варьирует от 0 до 100%, специфичность — от 62,5 до 100% (см. обсуждение пункта 12 клинических рекомендаций). Однако следует отметить, что в 18 из 22 исследований специфичность метода составляла ≥90%. Таким образом, результаты цитологического исследования могут быть ложноотрицательными, однако маловероятно, что они окажутся ложноположительными. Решение о целесообразности проведения цитологического исследования как одного из методов диагностического обследования пациента с бессимптомной микрогематурией должно приниматься лечащим врачом, который осведомлен об анамнезе пациента, результатах физикального обследования и других клинических данных. Однако следует отметить, что отрицательные результаты цитологического исследования не являются основанием для отказа от проведения других диагностических исследований, включенных в алгоритм обследования пациентов с бессимптомной микрогематурией. Оценку маркеров в моче не рекомендуется включать в алгоритм диагностического обследования больного (см. раздел «Обсуждение» пункта 14 клинических рекомендаций). Представленные выше рекомендации соответствуют степени С, так как большинство из них основаны на результатах монокогортных обсервационных исследований, которые существенно отличались друг от друга по характеристикам пациентов с невозможностью обобщения результатов исследования на всех пациентов с бессимптомной мигрогематурией. Кроме того, в этих исследованиях отсутствовала детальная информация об используемых методах обследования, а полученные результаты были неоднозначными.
Флюоресцентная цистоскопия в синем свете не рекомендуется для обследования пациентов с бессимптомной микрогематурией. Рекомендация.
Обсуждение (уровень доказательности С; риски превышают пользу). Цистоскопия в синем свете — разновидность флюоресцентной цистоскопии, при которой фотосенсибилизирующее вещество вводят в мочевой пузырь, где оно связывается преимущественно с опухолевыми клетками и излучает видимое флюоресцентное излучение в синем свете. В научной литературе представлено 18 исследований, в ходе которых сравнивались результаты цистоскопии в белом свете с результатами цистоскопии в синем свете (в исследовании принимали участие 2233 пациента, при этом 1605 пациентов обследовались при использовании 5-аминолавулиновой кислоты, а 628 пациентов — при использовании гексиламинолевлината). Все исследования проводились на пациентах с раком мочевого пузыря, что ограничивает обобщаемость результатов исследования для всех пациентов с бессимптомной микрогематурией. Чувствительность цистоскопии в белом свете варьировала от 17,3 до 83,2%; специфичность — от 66,4 до 93%. При применении 5-аминолавулиновой кислоты чувствительность равнялась 86,5–98,3%; специфичность — 35–65%. При использовании гексиламинолевлината чувствительность исследования составляла 76–97%, специфичность — 61–95%. Использование 5-аминолавулиновой кислоты, гексиламинолевлината и цистоскопии в синем свете с целью обследования пациентов с подозрением на папиллярный рак мочевого пузыря одобрено Управлением по контролю качества пищевых продуктов и лекарственных средств (FDA). Хотя большинство побочных реакций были слабо выраженными, иногда также отмечались такие значимые осложнения, как анафилактический шок, реакции гиперчувствительности, боли в области мочевого пузыря, цистит, спазм мочевого пузыря, дизурия и гематурия (инструкция FDA к гексиламинолевлинату). Более того, результаты опубликованных исследований свидетельствуют о том, что цистоскопия в синем свете характеризуется более высокой чувствительностью и отчасти более низкой специфичностью по сравнению с цистоскопией в белом свете, при этом более низкая специфичность повышает риск выполнения нецелесообразных биопсий. Ввиду отсутствия каких-либо исследований, касающихся пациентов с микрогематурией, и наличия информации о рисках у данных пациентов, рабочая группа экспертов пришла к выводу, что риски и нежелательные эффекты от использования цистоскопии в синем свете при первичной оценке пациентов с микрогематурией превышают пользу от проведения данного исследования. Данные рекомендации соответствуют степени С ввиду невозможности обобщения результатов исследования на всех пациентов с бессимптомной мигрогематурией, плохо смоделированного дизайна исследования, разнородности результатов исследования и небольшой выборки пациентов.
Если у пациента с персистирующей бессимптомной микрогематурией в анамнезе при двух последних ежегодных анализах мочи гематурия не отмечается (один анализ в год в течение двух лет с момента первого анализа), то дополнительные анализы с целью исключения бессимптомной микрогематурии не требуются. Экспертное мнение. Обсуждение. Если в ходе адекватного обследования пациента с бессимптомной микрогематурией не удается выявить соответствующее урологическое или нефрологическое заболевание, рекомендуется ежегодно, как минимум в течение двух лет после первичного обследования больного, проводить исследование мочи. При отсутствии микрогематурии в течение двух лет подряд риск развития урологического или нефрологического заболевания не превышает таковой в популяции в целом. В качестве примера следует привести ситуацию, когда пациенты с впервые выявленной бессимптомной микрогематурией и отсутствием каких-либо ассоциированных с данным состоянием заболеваний по результатам первичного обследования (например, обзорная рентгенография, ультразвуковое исследование, цистоскопия, внутривенная урография) наблюдались в течение 4 лет. Вероятность наличия злокачественной опухоли, обусловливающей появление микрогематурии, у пациентов моложе 90 лет составила <1%. Более того, в другом когортном исследовании, в котором принимали участие 234 пациента мужского пола в возрасте ≥50 лет, у которых при первичном обследовании, проведенном в полном объеме (например, цитологическое исследование мочевого осадка, внутривенная урография или КТ, цистоскопия), не было выявлено рака мочевого пузыря, наблюдались в течение 14 лет. У двух пациентов развился рак мочевого пузыря через 6,7 года и 11,4 лет после первичного обследования, при котором вероятность развития рака составляла <1%. Результаты представленных исследований свидетельствуют в пользу того, что у большинства пациентов, прошедших тщательное обследование по поводу бессимптомной микрогематурии, в ходе которого не было выявлено ее причины, злокачественные опухоли мочевыводящих путей не разовьются. Следовательно, дальнейшие исследования мочи нецелесообразны для обнаружения случаев гематурии у таких пациентов.
Если в ходе урологического обследования у пациента с бессимптомной микрогематурией не было выявлено соответствующей урологической патологии, в дальнейшем рекомендуется ежегодно выполнять анализ мочи. Рекомендация. Обсуждение (уровень доказательности С; польза превышает риски). Целесообразность проведения ежегодного исследования мочи у пациентов с персистирующей бессимптомной микрогематурией, у которых при первичном обследовании не было выявлено никаких ее причин, заключается в ранней диагностике неподдающихся визуализации урологических патологий. Риски, ассоциированные с исследованием мочи, минимальны. Рабочая группа экспертов проанализировала 26 исследований, в которых была представлена информация об исходах течения бессимптомной микрогематурии у 29 063 пациентов, при этом в 27 624 случаях имелись данные о результатах обследования в периоде наблюдения. Рекомендации, основанные на результатах данных исследований, соответствуют уровню доказательности С, так как исследования характеризовались разнородностью в отношении протокола первичного обследования больных, неустановленной длительностью интервалов наблюдения и неустановленным протоколом обследований в периоде наблюдения. Тем не менее полученные результаты позволили сделать некоторые выводы относительно ведения пациентов. Согласно результатам анализа, большинство патологических состояний удается выявить при первичном диагностическом обследовании пациентов с бессимптомной микрогематурией, но в небольшом проценте случаев на начальном этапе диагностировать заболевание, проявляющееся микрогематурией, не удается. Однако по мере прогрессирования заболевания его удается диагностировать в ходе последующих исследований. Следует отметить, что ввиду увеличения частоты развития урологических патологий с возрастом наблюдение за пациентами из группы риска может способствовать ранней диагностике и лечению потенциально жизнеугрожающих заболеваний. У пациентов с бессимптомной микрогематурией, у которых при первичном диагностическом обследовании не удалось выявить никаких ее причин, в дальнейшем помимо риска развития злокачественных опухолей существует вероятность возникновения других неонкологических заболеваний.
К этим заболеваниям относят мочекаменную болезнь, обструкцию мочевыводящих путей, включая стриктуры, инфекционные заболевания (такие, как туберкулез), и болезни почек, включая клубочковую нефропатию. В небольшом проценте наблюдений у пациентов с бессимптомной микрогематурией в конечном счете диагностируют нефрологическое заболевание, требующее соответствующего лечения. При патологии почек могут отмечаться дисморфные эритроциты, которые удается обнаружить с помощью традиционной микроскопии, фазовоконтрастной микроскопии или автоматизированного анализа. Данных пациентов целесообразно направлять на консультацию к нефрологу, особенно если гематурия сопровождается артериальной гипертензией, протеинурией или другими проявлениями поражения клубочкового аппарата почек. Наиболее нуждающимися в проведении ежегодных анализов пациентами с бессимптомной микрогематурией являются больные, относящиеся к группе риска развития заболеваний в отдаленном периоде. К факторам риска относятся возраст старше 35 лет, курение на данный момент или в анамнезе, эпизоды иррадиации болей в область таза в анамнезе, прием алкилирующих химиотерапевтических препаратов (таких, как циклофосфамид) и воздействие профессиональных факторов риска, включая красители, бензол и ароматические амины. Высокая значимость наблюдения за пациентами с данными факторами риска обусловлена тем, что микрогематурия может задолго предшествовать раку мочевого пузыря.
При персистирующей или рецидивирующей бессимптомной микрогематурии и отсутствии соответствующей урологической патологии в ходе первичного урологического обследования рекомендуют повторное урологическое обследование через некоторое время. Экспертное мнение.
Обсуждение. Согласно опубликованным данным, при первичном диагностическом обследовании пациентов с бессимптомной микрогематурии приблизительно в 37,3–80,6% случаев заболевание, обусловливающее наличие микрогематурии, установить не удается. Доля пациентов с неустановленной причиной микрогематурии в скрининговой популяции больных бессимптомной микрогематурией, по всей видимости, может быть еще больше. Таким образом, случаи выявления бессимптомной микрогематурии, для которой не было обнаружено причин при первичном диагностическом обследовании, не являются редкостью в клинической практике и заслуживают внимания. Хотя группа экспертов выявила ряд когортных исследований, в которых сообщалось об исходах бессимптомной микрогематурии у пациентов, у которых в ходе диагностического обследования не удалось выявить этиологического фактора микрогематурии, в исследованиях отсутствовали детальная информация (например, о частоте повторных обследований, показаниях к дополнительному обследованию и длительности периода наблюдения) и сравнение различных протоколов наблюдения, что необходимо для составления заключений об оптимальной стратегии ведения данных пациентов. Как следует ожидать, вероятность выявления серьезных урологических заболеваний (в частности злокачественных опухолей мочевыводящих путей) при повторном и последующем обследовании пациентов с микрогематурией зависит от наличия факторов риска в исследуемой когорте. Доля выявления злокачественных опухолей у пациентов с бессимптомной микрогематурией была выше среди больных, направленных на первичное диагностическое обследование (по сравнению с таковой в скрининговой группе), возрастных пациентов и больных мужского пола. Злокачественные опухоли реже выявлялись у пациентов, находящихся на этапе наблюдения, прошедших до этого адекватное диагностическое обследование по поводу бессимптомной микрогематурии, и у пациентов на этапе наблюдения, информация о которых в большей степени собиралась с помощью анализа карты больного, нежели чем с помощью повторных обследований через определенные интервалы времени. К примеру, группа ученых изучила 372 пациента с бессимптомной микрогематурией (медиана возраста составляла 58 лет), у которых при первичном обследовании в объеме цитологического исследования, цистоскопии и ультразвукового исследования почек какой-либо патологии выявить не удалось. Ученые включили в период наблюдения 75 пациентов, которым была проведена внутривенная урография в связи с персистирующей бессимптомной микрогематурией, установленной на основании результатов повторных исследований мочи.
В результате у 2 больных был выявлен рак мочеточника, а у 1 больного — рак почки (4%). В сравниваемой скорректированной по возрасту когорте женщин в ходе длительного наблюдения развития злокачественных опухолей не отмечалось (при первичной диагностике женщинам проводилась внутривенная урография). Основываясь на результатах, указанных выше исследований и лимитирующих факторах, ассоциированных с используемыми диагностическими методиками, группа экспертов пришла к заключению, что при бессимптомной микрогематурии и отсутствии патологии по результатам первичного диагностического обследования необходимо ежегодно хотя бы в течение 2 лет проводить исследование мочи. При отсутствии микрогематурии в течение периода наблюдения пациента можно снять с наблюдения с рекомендациями о необходимости консультации врача в случае появления новых симптомов или возобновления микрогематурии. Изменения клинических проявлений (например, значительное увеличение степени микрогематурии, выявление дисморфных эритроцитов, сопровождающееся артериальной гипертензией и/или протеинурией, развитие макрогематурии, появление болей или других новых симптомов) могут являться показанием к проведению повторного обследования больных в более ранние сроки и/или направлению пациентов на консультацию к другим специалистам, таким, как нефрологи. При решении вопроса о целесообразности повторного диагностического обследования пациентов следует учитывать факторы риска наличия урологических заболевания (таких, как злокачественные опухоли), а также то, что при отсутствии патологий при первичном диагностическом обследовании риск возникновения злокачественных опухолей низок.
Пациенты с такими причинами персистирующей бессимптомной микрогематурии, которые не требуют агрессивного лечения (включая доброкачественную гиперплазию предстательной железы, ломкость поверхностных сосудов, бляшки Рэндалла и необструктивную мочекаменную болезнь), заслуживают отдельного внимания, так как данные патологии могут маскировать наличие злокачественных опухолей. Рабочая группа экспертов считает, что эти пациенты должны сдавать образцы мочи на исследование по тому же алгоритму, что и пациенты с отсутствием каких-либо причин бессимптомной микрогематурии по результатам первичного диагностического обследования. Решение о необходимости и сроках проведения повторного обследования пациентов должно учитывать особенности больного и наличие/отсутствие факторов риска [15].
Прогноз
Определяется основным заболеванием.
ЛИТЕРАТУРА
-
Диапевтика в урологии / под ред. А.В. Морозова. — М.: ИПО «Полигран», 1993.
-
Урология: учебник / под ред. П.В. Глыбочко, Ю.Г. Аляева. — Ростов н/Д: Феникс, 2013. — 528 с.
-
Урология. От симптомов к диагнозу и лечению. Иллюстрированное руководство: учебное пособие/ под ред. П.В. Глыбочко, Ю.Г. Аляева, Н.А. Григорьева. — М.: ГЭОТАР-Медиа, 2014. — 148 с.
-
Руководство по урологии в 3 т. / под ред. Н.А. Лопаткина. — М., 1998.
-
Филип М. Ханно, С. Брюс Малкович, Алан Дж. Вейн. Руководство по клинической урологии. Clinical Manual of Urology. — M.: МИА, 2006.
-
Donat M.D., Herr H.W. Transitional cell carcinoma of the renal pelvis and ureter: diagnosis, staging, management and prognosis. In: Urologic Oncology / Eds.J. E. Osterling, J.P. Richie. — Philadelphia: WB Saunders Harcourt Brace Co, 1997. — P. 215.
-
Foley S.J., Soloman L.Z., Wedderburn A.W. et al. A prospective study of the natural history of hematuria associated with benign prostatic hyperplasia and the efffect of finasteride // J. Urol. — 2000. — Vol. 163. — P. 496.
-
Friedenberg R.M. Excretory urography in the аdult. — Philadelphia: Saunders, 1992. — P. 412–434.
-
Jones G.R., Newhouse I. Sport-related hematuria: A review // Clin.J. Sport Med. — 1997. — Vol. 7. — P. 119–125.
-
Landman J., Chang Y., Kavaler E. et al. Sensitivity and specificity of NMP22, telomerase, and BTA in the detection of human bladder cancer // J. Urol. – 1998. — Vol. 52. — P. 398–402.
-
Lang E.K., Macchia R.J., Thomas R. et al. Computerized tomography tailored for the assessment of microscopic hematuria // J. Urol. — 2002. — Vol. 167. — P. 547.
-
Mariani A.J. The evaluation of adult hematuria: a clinical update // AUA Update Series. — 1998. —Vol. XVII. — P. 186–191.
-
McGregor D. O., Lynn K.O., Bailey R.R. et al. Clinical audit of the use of renal biopsy in the management of isolated microscopic hematuria // Clin. Nephrol. — 1998. — Vol. 49. — P. 345.
-
Messing E.M., Catalona W. Urothelial tumors of the urinary tract. — Philadelphia: Saunders, 1998. — P. 2327–2410.
-
http://www.auanet.org/education/guidelines/asymptomatic-microhematuria.cfm
Глава 3. ГИДРОНЕФРОЗ, УРЕТЕРОГИДРОНЕФРОЗ
В.А. Григорян, М.Э. Еникеев, В.А. Малхасян, И.В. Семенякин
Гидронефроз (гидронефротическая трансформация) — стойкое и прогрессивно нарастающее расширение чашечно-лоханочной системы, сопровождающееся застоем мочи, которое обусловлено препятствием, возникшим в следствие органического или функционального (при нарушении иннервации) поражения стенки мочевыводящих путей. Если препятствие располагается в лоханочно-мочеточниковом сегменте (ЛМС), говорят о простом гидронефрозе. Препятствие, расположенное в других отделах мочеточника, вызывает уретерогидронефроз. Заболевание, прогрессируя, приводит к гипоили атрофии почечной паренхимы, нарушению работы почки вследствие нарушения оттока мочи и последующего нарушения почечного кровотока [4, 10].
МКБ-10 • N13.0 Гидронефроз, обусловленный стриктурой лоханочно-мочеточникового сегмента. • N13.1 Гидронефроз, обусловленный стриктурой мочеточника.
Эпидемиология
Гидронефроз — относительно частое заболевание почек.
Двустороннюю обструкцию мочевыводящих путей диагностируют у детей в 15% случаев. Гидронефроз встречается у 1% пациентов 20–40 летC, причем у женщин в 1,5 раза чаще, чем у мужчин [15]. У больных старше 40 лет гидронефроз часто служит проявлением других заболеваний. Признаки сужения ЛМС могут выявляться у детей во всех возрастных группах. В настоящее время с развитием ультразвуковой диагностики и проведением мониторинга состояния плода на ранних стадиях беременности удается выявлять данную патологию еще внутриутробно. По данным Colodny (1980), обструкция ЛМС составляет до 80% всех аномалий фетальной почки, сопровождающихся расширением коллекторной системы. Расширение лоханки и чашечек на ранних стадиях беременности наблюдается довольно часто — у 1:800 плодов. К моменту родов расширение чашечно-лоханочной системы выявляют в два раза реже — у 1:1500 новорожденных (Ritchey M., 2003). Однако диагноз «гидронефроз» подтверждается только у 1/3 из этих детей. В отельных наблюдениях сужение ЛМС может возникать в пубертатном периоде или во взрослом возрасте. Причиной гидронефроза у подобных больных бывает сдавление мочеточника дополнительным сосудом, идущим к нижнему полюсу почки. Препятствие току мочи может быть не постоянным (перемежающийся гидронефроз) и зависеть от положения тела больного. У мальчиков обструкция в ЛМС наблюдается в два раза чаще, особенно при выявлении патологии в периоде новорожденности (Robson, 1977). Доминирует левостороннее поражение почки: в неонатальном периоде гидронефроз слева встречается у 66% больных. Двусторонний стеноз ЛМС наблюдается в 5–15% случаев (Williams, 1977).
Факторы риска
Гидронефроз (уретерогидронефроз) всегда развивается в результате формирования препятствий для оттока мочи, локализующихся на любом участке мочевыводящих путей, чаще в области ЛМС. Все факторы риска этого заболевания подразделяют на пять группB [10]:
Профилактика
Профилактика первичного гидронефроза не разработана. Профилактика вторичного гидронефроза соответствует профилактике болезней, его вызвавших.
Скрининг
УЗИ плода на 16-й неделе беременности служит эффективным скрининг-методом диагностики врожденного гидронефрозаА [17].
Классификация
С практической точки зрения и исходя из современных теоретических представлений о гидронефрозе, наиболее целесообразно выделить две группы этого заболевания:
-
первичный, или врожденный, гидронефроз, развивающийся вследствие какой-либо аномалии верхних мочевыводящих путей (ВМП);
-
вторичный, или приобретенный, гидронефроз как осложнение какого-либо заболевания (мочекаменная болезнь, опухоль почки, лоханки, мочеточника, повреждение мочевыводящих путей и др.).
Каждый из этих видов гидронефроза подразделяют на:
-
инфицированныйC [8].
Кроме того, гидронефроз может быть односторонним и двусторонним. В России для определения тактики лечения при простом гидронефрозе принята классификация академика Н.А. Лопаткина [6]:
-
1-я стадия — начальный гидронефроз, характеризующийся пиелоэктазией без развития значимого гидрокаликоза и нарушения функции почки;
-
2-я стадия — ранний гидронефроз, при котором расширение чашечно-лоханочной системы сопровождается ухудшением функции почки;
-
3-я стадия — терминальный гидронефроз, характеризующийся гигантским расширением чашечно-лоханочной системы и практически необратимыми изменениями почечной паренхимы.
АНАМНЕЗ
Наличие указанных выше симптомов и время их появления от момента осмотра.
Перенесенные операции или заболевания органов малого таза, брюшной полости и забрюшинного пространства.
ФИЗИЧЕСКОЕ ОБСЛЕДОВАНИЕ
Обнаружение пальпируемого образования в подреберье, а при выраженном гидронефрозе — в соответствующей половине живота.
Тупой звук при перкуссии свидетельствует о значительном гидронефрозе и оттеснении органов брюшной полости.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Вобщем анализе крови необходимо обратить внимание на общее количество лейкоцитов, лейкоцитарную формулу, величину СОЭ. При этом лейкоцитоз со сдвигом формулы влево и увеличение СОЭ свидетельствуют о присоединении мочевой инфекции. При билатеральном гидронефрозе пониженное содержание гемоглобина указывает на наличие почечной недостаточности.
При нефростомическом дренаже анализ мочи позволяет достоверно судить о функции почки (проба Реберга). Возможны лейкоцитурия, канальцевая протеинурия, гематурия, снижение относительной плотности мочи при двустороннем поражении.
Общий анализ мочи позволяет судить об активности воспалительного процесса.
Бактериологический анализ мочи с определением чувствительности микрофлоры к антибиотикам позволяет определить возбудителя инфекции верхних мочевыводящих путей. При выявлении лейкоцитурии и многократных негативных бактериологических анализах мочи необходимо исключить туберкулез мочеполовой системы. Как правило, простой гидронефроз носит асептический характер. Присоединение септического компонента, особенно в случаях выраженных структурных изменений мочевыводящих путей, как правило, ухудшает прогноз заболевания [14].
В биохимическом анализе крови определяют содержание креатинина и мочевины, а также электролитов (калия и натрия). Повышение уровня креатинина и мочевины может указывать на двусторонний характер процесса.
При подозрении на вторичный гидронефроз (уретерогидронефроз) лабораторная диагностика включает тесты, необходимые для определения основного заболевания (анализ крови на ПСА, цитологическое исследование мочи).
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
В настоящее время приоритетным методом диагностики считают компьютерную томографию (КТ). Это исследование обычно проводят пациентам с острой болью в подреберье и поясничной области (Fielding et al., 1997; Dalrymple et al., 1998; Vieweg et al., 1998). КТ и УЗИ играют важную роль в дифференциальной диагностике приобретенных причин обструкции, таких, как конкременты, дающие области пониженной КТ плотности, или уротелиальные опухоли. Обычно в качестве лучевого метода исследования первой линии выполняют УЗИ почек [21].
УЗИ позволяет:
-
оценить степень расширения чашечно-лоханочной системы и мочеточника;
-
определить состояние контралатеральной почки [16].
Допплерография необходима для оценки кровоснабжения почки, выявления добавочных сосудов.
Рентгенологические исследования необходимо проводить для оценки структуры мочевыводящих путей. Обзорная урография позволяет определить наличие конкрементов как причину или осложнение гидронефроза.
Экскреторная урография остается оправданным методом исследования первой линии при проведении лучевой диагностики. На ранних снимках (7-я и 10-я минуты) обращают внимание на состояние контралатеральной почки, ее чашечно-лоханочной системы и мочеточника. Оценку пораженной почки и ВМП с ипсилатеральной стороны проводят на отсроченных снимках (1 ч и более). Исследование заканчивают при контрастировании мочеточника ниже уровня обструкции для определения ее протяженности. Классическим признаком гидронефроза считают снижение функциональной способности почки на стороне поражения, связанное с расширением чашечно-лоханочной системы. У некоторых пациентов симптомы интермиттирующие, и результаты экскреторной урографии, проведенной между болевыми приступами, могут быть нормальными. В таких случаях исследование необходимо повторить в период обострения при наличии клинических проявлений (Nesbit, 1956). В некоторых случаях поставить диагноз помогает фармакоурография с диуретиком (Malek, 1983).
Микционная цистоуретрография — метод выявления пузырно-мочеточникового рефлюкса. В 14% случаев отмечают его сочетание со стриктурой ЛМС или мегауретером [20].
Мультиспиральная КТ (МСКТ) с болюсным контрастным усилением показана при:
В отличие от экскреторной урографии мультиспиральная КТ позволяет оценить не только локализацию и протяженность стриктуры, но и состояние окружающих тканей (сосуды, степень периуретерального фиброза).
Динамическая нефросцинтиграфия предоставляет информацию о функции почек и ВМП. Данное исследование проводят для определения:
-
состояния контралатеральной почки [15].
При установленном диагнозе гидронефроза по показаниям применяют специальные методы исследования.
-
Антеградная пиелоуретерография проводится при наличии нефростомического дренажа. Метод позволяет визуализировать ВМП, установить локализацию и протяженность обструкции. Когда остаются какие-либо сомнения в состоятельности мочевыводящих путей, установка нефростомы позволяет провести динамическое исследование перфузионного давления.
-
Ретроградная уретеропиелография применяется перед операцией для определения протяженности обструкции. Показанием считают отсутствие визуализации мочеточника ниже уровня обструкции по результатам иных методов исследований, таких как экскреторная урография, антеградная пиелоуретерография, мультиспиральная КТ.
-
Диапевтическая уретеропиелоскопия — инвазивное эндоскопическое вмешательство, применяемое при отсутствии четких данных о состоянии мочеточника по данным неинвазивных методов или как первый этап при эндоскопической операции по коррекции стриктуры ВМП.
-
Эндолюминальная ультрасонография — дорогостоящий метод исследования, требующий специального обучения при использовании и интерпретации получаемой информации, однако позволяющий детально оценить состояние стенки мочеточника и окружающих тканей.
-
Перфузионная пиеломанометрия (Whitaker’s test) показана для дифференциальной диагностики обструктивного и необструктивного расширения чашечно-лоханочной системы и мочеточника. Для ее выполнения необходимы нефростомический дренаж, специальное уродинамическое оборудование и электронно-оптический преобразователь. В лоханку по дренажу вводят жидкость со скоростью 10 мл/мин. Проводят измерение давления в лоханке и в мочевом пузыре. Интерпретация результатов:
-
наличие обструкции подтверждают при разнице более 22 мм рт.ст.;
-
при разнице более 15 мм рт.ст., но менее 22 мм рт.ст. скорость введения повышают до 15 мл/мин;
-
признаком обструкции считают разницу более 18 мм рт.ст.C [13].
Для уточнения диагноза возможно выполнение УЗИ, экскреторной урографии и динамической нефросцинтиграфии с одновременным введением диуретика, что позволяет повысить диагностическую ценность данных методов.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Гидронефроз необходимо дифференцировать от различных заболеваний почек и органов брюшной полости, в зависимости от преобладающего в клинической картине проявлений гидронефрозаA [18].
-
При наличии боли следует проводить дифференциальную диагностику с нефролитиазом и нефроптозом. Обзорная урография или мультиспиральная КТ позволяют подтвердить или опровергнуть нефролитиаз при наличии конкрементов низкой плотности. В отличие от гидронефроза при нефроптозе боль возникает при движении и физическом напряжении и быстро стихает в покое. Сравнение экскреторных урограмм в положении лежа и стоя позволяет диагностировать заболевание. Нередко встречается сочетание стриктуры ЛМС и нефроптоза.
-
При пальпируемом образовании в забрюшинном пространстве следует дифференцировать гидронефроз от опухоли, поликистоза и простой кисты почки.
-
При опухоли почка малоподвижна, плотной консистенции, с бугристой поверхностью. На пиелограмме видна характерная деформация лоханки со сдавлением или «ампутацией» чашечек.
-
При поликистозе обе почки увеличены, бугристы. Выявляют признаки почечной недостаточности. На пиелограмме видны удлиненная лоханка и ветвистые чашечки, вытянутые в виде полулуний.
-
При простой кисте почки на пиелограмме обнаруживают сдавление чашечно-лоханочной системы соответственно расположению кисты. Диагноз устанавливают после выполнения мультиспиральной КТ.
-
-
При гематурии и пиурии гидронефроз следует дифференцировать от опухоли лоханки, пионефроза и туберкулеза почки (в основном рентгенологическими методами).
-
При выявлении пиелокаликоэктазии гидронефроз необходимо дифференцировать от следующих состояний и заболеваний (проведение радиоизотопного исследования при большинстве указанных состояний не выявляет нарушения функции почки):
-
При обнаружении уретеропиелокаликоэктазии уретрогидронефроз необходимо дифференцировать от:
Диагноз помогают установить экскреторная урография и мультиспиральная КТ.
Лечение
ЦЕЛЬ ЛЕЧЕНИЯ
Лечение должно быть направлено на устранение причины, вызвавшей развитие гидронефроза (уретрогидронефроза). При необходимости — на уменьшение размеров лоханки и сохранение почки [17].
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Динамическое наблюдение используют при нормальной функции ипсилатеральной почки и отсутствии клинических проявлений. В этом случае у детей во избежание ошибочного выбора лечения (при функциональном гидронефрозе, вариантах развития лоханки) предпочтительно динамическое наблюдение в течение 6–8 мес с последующим повторным комплексным обследованием ребенкаB [5]. Динамическое наблюдение проводят при начальном гидронефрозе [11, 14].
КОНСЕРВАТИВНАЯ ТЕРАПИЯ
Не имеет основного значения и играет вспомогательную роль при подготовке больного к оперативному лечению и ликвидации осложнений гидронефроза [7].
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Целью оперативного лечения считают восстановление нормального пассажа мочи, сохранение функции почки, профилактику прогрессирования хронического пиелонефрита и гибели почечной паренхимы.
Пластическая операция показана:
-
в случае сохранности функции паренхимы почки и возможности устранения причины болезни [9].
Показания к оперативному лечению
Выполнение чрескожной пункционной нефростомии (ЧПНС) или установка внутреннего стентаB в предоперационном периоде показаны в следующих ситуациях:
-
прогрессирование ХПН при двустороннем процессе или гидронефрозе единственной анатомической либо функционирующей почки;
-
у пациентов с выраженными сопутствующими заболеваниями для купирования болевого симптома;
-
в терминальных стадиях гидронефроза при необходимости решения вопроса о выборе между нефрэктомией и органосохраняющей операцией [6, 11, 14].
Прямая связь степени расширения чашечно-лоханочной системы и сужения ЛМС отсутствует. Сохраненная сократительная способность лоханки позволяет долгое время обеспечивать эвакуацию мочи через суженный участок мочеточника. Провокационные пробы с диуретической нагрузкой позволяют определить особенности эвакуации мочи из лоханки при увеличенном объеме выделения мочи [19]. Поэтому показаниями к оперативному лечению в настоящее время служат не только большие размеры лоханки, но и наличие доказанных (специальными обследованиями) признаков обструкции (сужения) ЛМС.
Для восстановления проходимости ЛМС используют следующие виды оперативного лечения [9].
Роботассистированные трансабдоминальные реконструктивные пособия.
Методом выбора в лечении данного заболевания считают реконструктивно-пластические операции, направленные на восстановление анатомической и функциональной целостности мочевыводящих путей и сохранение органа. Эффективность этого вида вмешательств составляет 95–100%A [7].
Преимуществами открытых операций считают:
-
осведомленность большинства урологов в технике данных операций. К недостаткам следует отнести:
-
наличие разреза (боль, травма мышц передней брюшной стенки, косметический дефект);
-
длительные сроки госпитализации и низкую экономическую эффективность;
-
проведение в случае неудачи (5–10%) органоуносящих операций.
Недостатков открытых операций лишены аналогичные по эффективности лапароскопические и роботассистированные вмешательстваВ.
Основными факторами, ограничивающими распространенность данных операций, считаютсяD:
Основными противопоказаниями к выполнению данного вида оперативных вмешательств считают:
Эндоскопическое вмешательство на мочевыводящих путях для лечения обструкции ЛМС было предложено Ramsay и соавторами в 1984 г., называлось «чрескожный пиелолизис», а затем стало широко использоваться в США Badlani и его коллегами (1986), который предложил термин «эндопиелотомия». Несмотря на то что описаны различные нюансы в технике проведения методики (Korth et al., 1988; Van Cangh et al., 1989; Ono et al., 1992), основная концепция остается неизменной и включает в себя полнослойный разрез проксимальной части суженного мочеточника по направлению от просвета мочеточника к окололоханочной и околомочеточниковой жировой клетчатке. На основании оригинальной работы Davis (1943), который выполнил «интубационную уретеротомию» для устранения обструкции ЛМС, стент устанавливается через разрез и остается до заживления. Впоследствии были разработаны альтернативные методы, использующие ретроградный доступ к ЛМС. В настоящее время доступны ретроградные методы лечения, включающие в себя использование режущего баллонного катетера с электрокаутерной струной, при котором рассечение суженного ЛМС проводят под контролем рентгеноскопии, и уретероскопический метод, при котором обычно используют гольмиевый лазер для ликвидации обструкции ЛМС под непосредственным визуальным контролем. Наконец, описаны сочетанные подходы, такие как антеградная пиелотомия (Desai et al., 2004) [21].
Эффективность рентгеноэндоскопических методов лечения, выполняемых из перкутанного или трансуретрального доступа, составляет 75– 100% при первичных вмешательствах и 65–90% — при повторныхC [12].
Эндопиелотомию, проведенную из перкутанного или трансуретрального доступа с последующим шинированием зоны стриктуры внутренним стентом в течение 4–6 нед, считают наиболее патогенетически обоснованным из рентгеноэндоскопических вмешательствC.
Благоприятные прогностические критерии эффективности рентгеноэндоскопического вмешательства [1–3, 12]:
-
отсутствие в анамнезе указаний на проводимые операции (первичная стриктура);
-
ранние сроки выполнения в случае формирования вторичной стриктуры ВМП (до 3 мес);
-
незначительный (до 25%) или умеренный (26–50%) дефицит секреции ипсилатеральной почки;
-
отсутствие конфликта с добавочным сосудом и значительного парауретерального фиброза в зоне сужения.
При терминальных необратимых изменениях почки в результате стриктуры ЛМС выполняют нефрэктомию, а при стриктурах мочеточника — нефруретерэктомию с удалением мочеточника ниже зоны сужения. При гибели почки в результате пузырно-мочеточникового рефлюкса или мегауретера проводят нефруретерэктомию с эндоскопической резекцией устья мочевого пузыря.
Лечение стриктуры лоханочно-мочеточникового сегмента [21]
-
Современными показаниями для проведения оперативного вмешательства по поводу обструкции ЛМС считают наличие:
-
При наличии показаний к оперативному вмешательству методом выбора исторически было открытое оперативное вмешательство по устранению обструкции ЛМС, обычно резекция лоханки, верхней трети мочеточника, уретеропиелостомия. Однако во многих центрах эндопиелотомия приобрела ключевую роль в качестве первоначального метода лечения.
-
Преимущества эндоскопических вмешательств на мочевыводящих путях заключаются в значительном уменьшении времени пребывания в стационаре и сроков послеоперационного восстановления. Однако вероятность успешного проведения операции неодинакова при стандартной открытой и эндоскопической пиелопластике. В то время как открытое или лапароскопическое оперативное вмешательство может быть выполнено практически при любом анатомическом варианте обструкции ЛМС, при рассмотрении вопроса о проведении менее инвазивных альтернативных вмешательств хирург обязан учитывать:
-
Наличие уровазального конфликта как возможной причины гидронефроза требует проведения операции, одновременно и устраняющей этот конфликт, и восстанавливающей нормальный отток мочи по ВМП. Антевазальная пластика мочевыводящих путей не всегда достигает поставленной задачи из-за остающихся добавочных сосудов в зоне сформированного уретеропиелоанаcтомоза, только не спереди, а сзади.
-
Резекция лоханки, верхней трети мочеточника, уретеропиелостомия может быть выполнена при высоком отхождении мочеточника, выраженном расширении почечной лоханки и/или наличии сосудов, пересекающих почечные структуры. С помощью данной методики возможно иссечение суженного ЛМС. Это универсальный способ пиелопластики. Однако он не очень хорошо подходит для устранения стриктур на большом протяжении, при наличии нескольких стриктур в проксимальной части мочеточника или небольших стриктур, относительно недоступной внутрипочечно расположенной лоханки.
-
Лоскутная пластика (лоскутные операции) при стенозе ЛМС может быть оправданной при относительно протяженном сужении мочеточника. Из всех существующих различных методов лоскутной пластики спиралеобразный лоскут может ликвидировать стриктуру большой длины. Нецелесообразно проведение лоскутной пластики при наличии сосудов, пересекающих мочевыводящие пути. Уретерокаликостомия может быть выполнена или при обструкции ЛМС, или при стриктуре проксимального отдела мочеточника при относительно небольшой внутрипочечно расположенной лоханке. Также может быть использована как операция спасения при неудачной пиелопластике.
-
При далеко зашедших изменениях мочевыводящих путей и почечной паренхимы, соответствующих терминальным стадиям, для оценки возможной обратимости заболевания и определения тактики лечения целесообразно выполнение пункционной нефростомии, позволяющей провести раздельные функциональные тесты на фоне восстановленного пассажа мочи.
-
Трансперитонеальный лапароскопический доступ используют наиболее широко вследствие значительной величины рабочей поверхности и хорошо изученной анатомии органов.
-
Ретроперитонеальный лапароскопический доступ и передний экстраперитонеальный доступ предполагает создание рабочего пространства с использованием баллонной или пальцевой дилатации.
-
Лапароскопическое лечение обструкции ЛМС обеспечивает низкую частоту периоперационных осложнений, небольшую продолжительность пребывания в стационаре и успешный результат в 95% случаев и более при проведении операции опытными специалистами.
Дальнейшее ведение
Спустя 4–6 нед после эндоскопической или лапароскопической операции удаляют внутренний стент, проводят УЗИ и при необходимости экскреторную урографию. После открытой операции нефростомический и/или интубирующий дренажи удаляют через 3–6 нед. Радиоизотопное исследование выполняют 1 раз в год. Контрольное лабораторное обследование (общий анализ крови, общий анализ мочи) проводят перед удалением внутреннего стента (спустя 1 мес) и в последующем 1 раз в 3 мес в течение первого года после операцииB [10].
Через год после операции при отсутствии жалоб контроль функции почек выполняют 1 раз в год, а УЗИ — 1 раз в 6 мес.
Прогноз
Прогноз в отношении выздоровления при гидронефрозе определяется сохраненным пассажем мочи по ВМП и степенью снижения функции почки. Прогноз для жизни при одностороннем гидронефрозе относительно благоприятный. При двусторонней локализации прогноз весьма серьезный из-за развития ХПН вследствие прогрессирования атрофии паренхимы почек, а также пиелонефритического и нефросклеротического процессов.
ЛИТЕРАТУРА
-
Мартов А.Г. Рентгеноэндоскопические методы диагностики и лечения заболеваний почек и верхних мочевых путей: автореф. дис. … д-ра мед. наук. — М., 1993. — 76с.
-
Мартов А.Г., Серебрянный С.А. Трансуретральная эндопиелотомия // Урол. и нефрол. — 1996. — № 6. — С. 3–7.
-
Чепуров А.К., Неменова А.А., Зенков С.С. и др. Гольмиевый лазер в эндоскопическом лечении стриктур мочеточника //Урол. и нефрол. — 1997. —
-
Кучера Я. Хирургия гидронефроза и уретерогидронефроза //Государственное издательство медицинской литературы. — Прага, 1963. — С. 13–14.
-
Anton Pacheco Sanchez J., Gomez Fraile A., Aransay Brantot A. et al. Diuresis renography in the diagnosis and follow-up of non-obstructive primary megaureter //Eur. J. Pediatr. Surg. — 1995. — Vol. 5. — P. 338–341.
-
Лопаткин Н.А. Руководство по урологии //Москва: Медицина, 1998. — Т. 2. — С. 190.
-
Belman A.B. A perspective on vesicoureteral reflux //Urol. Clin. North. Am. — 1995. — Vol. 22. — P. 139–150.
-
Bomalaski M.D., Hirschl R.B., Bloom D.A. Vesicoureteral reflux and ureteropelvic junction obstruction: association, treatment options and outcome //J. Urol. — 1997. — Vol. 157. — P. 969–974.
-
Borhan A., Kogan B.A., Mandell J. Upper ureteral reconstructive surgery //Urol. Clin. North. Am. — 1999. — Vol. 26. — P.175–181.
-
Chevalier R.L., Klahr S. Therapeutic approaches in obstructive uropathy //Semin. Nephrol. — 1998. — Vol. 18. — P. 652–658.
-
Григорян В.А. Хирургическое лечение гидронефроза: Автореферат дис.
-
Khan A.M., Holman E., Pasztor I. et al. Endopyelotomy: experience with 320 cases //J. Endourol. — 1997. — Vol. 11. — P. 243–246.
-
King L.R. Hydronephrosis. When is obstruction not obstruction? //Urol. Clin. North. Am. — 1995. — Vol. 22. — P. 31–42.
-
Еникеев М.Э. Гидронефроз: современные технологии в диагностике и лечении. Автореферат дис. … д-ра мед. наук. — М., 2008. — 48 с.
-
Nonomura K., Yamashita T., Kanagawa K. et al. Management and outcome of antenatally diagnosed hydronephrosis //Int. J. Urol. — 1994. — Vol. 1. — P. 121–128.
-
Rascher W., Bonzel K.E., Guth-Tougelidis B. et al. Angeborene Fehlbildungendes Harntrakts //Rationelle postpartale Diagnostik. Monatsschr. Kinderheilkd. –1992. — Vol. 140. — P. 78–83.
-
Reddy P.P., Mandell J. Prenatal diagnosis. Therapeutic implications //Urol. Clin. North. Am. — 1998. — Vol. 25. — P. 171–180.
-
Ringert R.H., Kallerhoff M. Leitlinie zur Diagnostik der Harntransportstörungen in der Kinderurologie //UrologeA. —1998. —Vol.37. — P. 573–574.
-
Амосов А.В. Ультразвуковые методы функциональный диагностики вурологическойпрактике.Авторефератдис.…д-рамед.наук. —М.,1999. — 52 с.
-
Wilcox D., Mouriquand P. Management of megaureter in children //Eur. Urol. — 1998. — Vol. 34. — P. 73–78.
-
http://uroweb.org/fileadmin/guidelines/Guidelines_2014_5_June_2014.pdf
Глава 4. МОЧЕКАМЕННАЯ БОЛЕЗНЬ
В.И. Руденко, И.В. Семенякин, В.А. Малхасян, Н.К. Гаджиев
Мочекаменная болезнь, несмотря на значительный прорыв как в диагностике, так и в лечении, продолжает занимать важное место в повседневной практике уролога и практикующих врачей общего профиля.
В основе развития мочекаменной болезни (МКБ) лежат нарушения обменных процессов, связанных как с алиментарными факторами, так и с заболеваниями эндокринной системы, наследственной предрасположенности, а также климатогеографических условий.
В среднем риск заболеваемости уролитиазом колеблется от 1 до 20% [1]. Заболеваемость уролитиазом выше среди мужчин, чем среди женщин (соотношение около 3:1), и наиболее часто проявляется в возрасте 40–50 лет, однако в последние десятилетия это соотношение имеет обратную тенденцию, так, по данным Stamatelou и соавт., на основании регистра NHANES, эта пропорция составила 1,75 к 1 [2].
Прогрессирующее и рецидивирующее камнеобразование — особая отличительность для всех типов конкрементов.
Факторы и группы риска
Учитывая высокий риск рецидивирования, а именно — порядка 50% пациентов с мочекаменной болезнью имеют минимум 1 рецидив, и от 10 до 20% имеют 3 рецидива и более [3, 4], знание факторов риска имеет наиважнейшее значение (табл. 4.1).
Семейный анамнез мочекаменной болезни |
|
Эндемичные регионы страны |
|
Однообразная пища, богатая камнеобразующими веществами |
|
Заболевания, связанные с камнеобразованием |
Гиперпаратиреоз |
Еюноилеакальный анастомоз Болезнь Крона |
|
Лекарственные препараты, связанные с камнеобразованием |
Препараты кальция Препараты витамина D |
Аномалии строения мочевой |
Канальцевая эктазия |
системы, связанные с кам- |
Стриктура ЛМС |
необразованием |
Дивертикул/киста чашечки |
Стриктура мочеточника |
|
Пузырно-мочеточниковый рефлюкс |
|
Уретероцеле |
|
Подковообразная почка |
|
Инфекция мочевыводящих путей |
|
Среди факторов, влияющих на формирование кальциево-оксалатных камней, часто можно выявить заболевания эндокринной системы (паращитовидных желез), желудочно-кишечного тракта и непосредственно почек (тубулопатии). Нарушение пуринового обмена приводит к уратному нефролитиазу. К развитию гиперкальциемии, гиперфосфатемии, гиперкальциурии и гиперфосфатурии приводят заболевания, представленные на рис. 4.1.
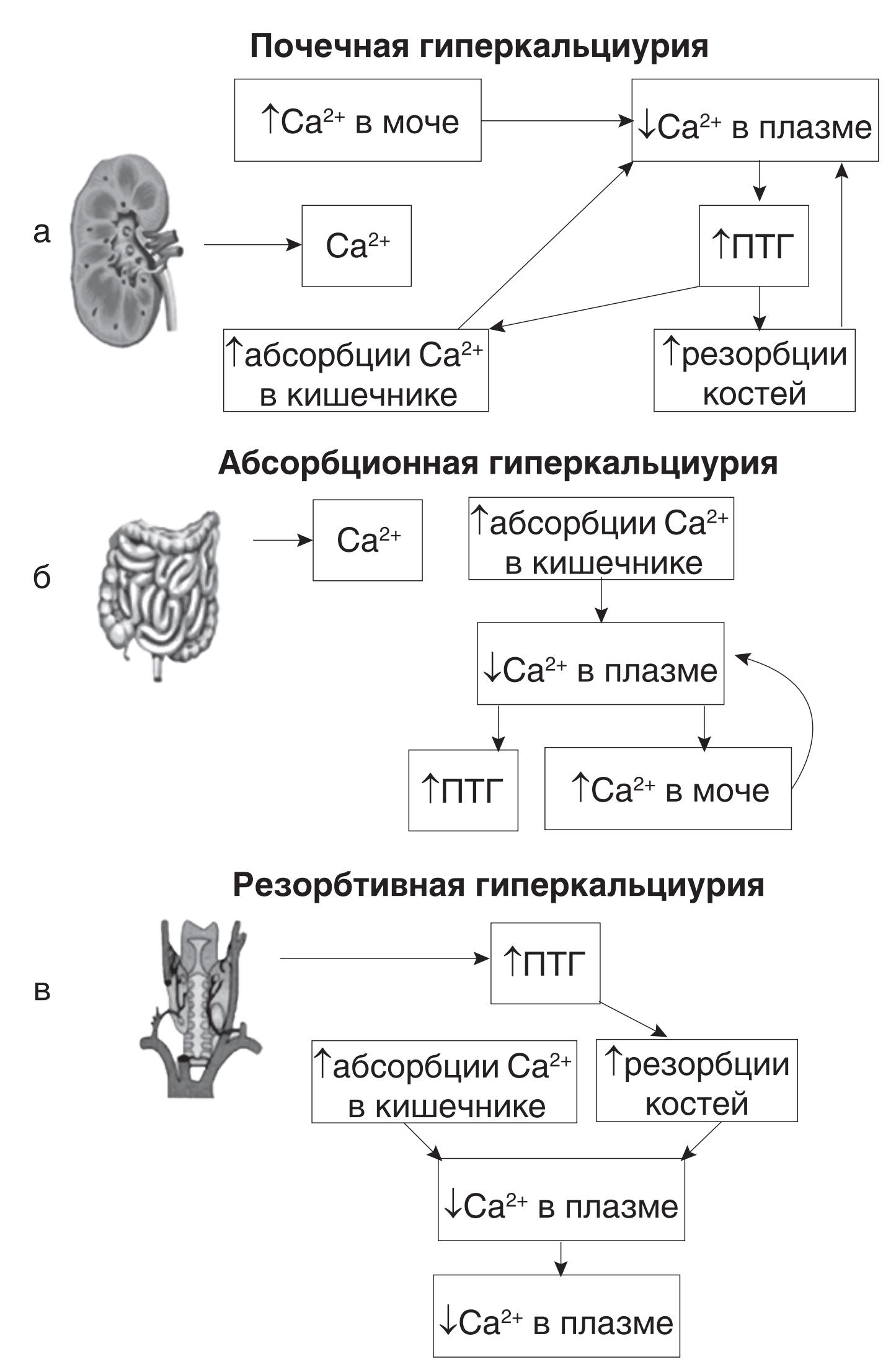
Хронические воспалительные заболевания мочеполовой системы могут способствовать образованию инфицированных фосфатных (струвитных) камней (рис. 4.2).
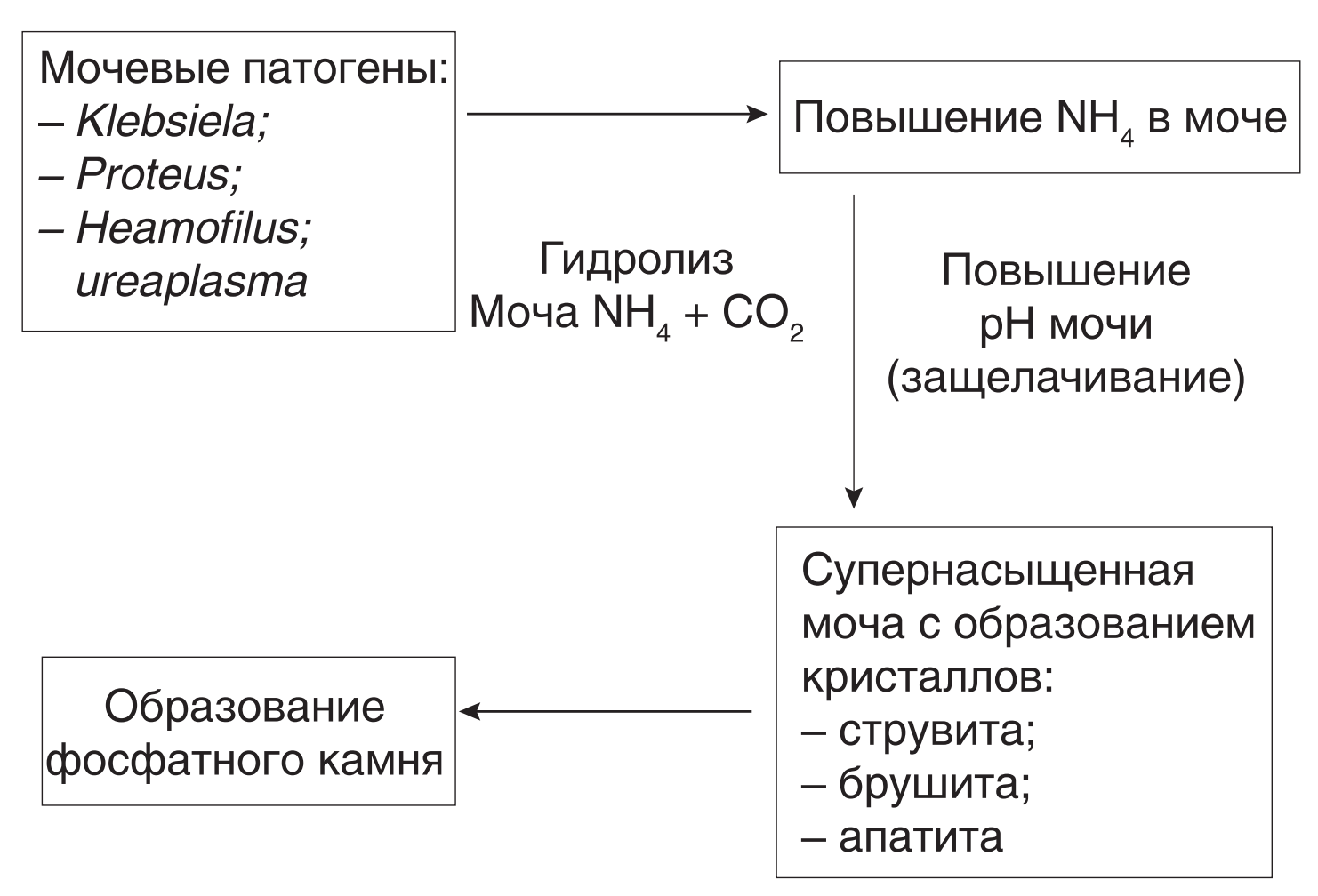
В зависимости от факторов и развивающихся метаболических нарушений формируются различные по химическому составу мочевые камни.
Классификация химических видов камнеобразующих веществ
Кальциевые камни (обнаруживают у 75–85% больных) чаще находят у мужчин старше 20 лет. Рецидив регистрируют в 30–40% наблюдений (брушит — в 65%).
Струвитные камни связаны с инфекционным агентом. Их выявляют в 45–65% случаев, чаще у женщин. Отличаются высоким риском воспалительных осложнений. Рецидив заболевания быстрый (до 70%) при неполном удалении камня и отсутствии лечения.
Цистиновые (1%) и ксантиновые камни связаны с врожденными нарушениями обмена веществ на уровне организма в целом. Рецидив достигает 80–90%. Метафилактика крайне сложная и не всегда эффективна.
Таким образом, под сочетанным воздействием экзогенных, эндогенных и генетических факторов происходят нарушения метаболизма в организме, сопровождаемые усилением выделения почками камнеобразующих веществ.
Процесс формирования камня может быть длительным и нередко протекает без клинических проявлений, что наиболее характерно для коралловидных камней, а может проявиться острой почечной коликой, обусловленной отхождением микрокристалла.
К сожалению, действующая в настоящее время классификация МКБ не отражает всех клинических форм мочекаменной болезни и не позволяет дать правильную оценку активности процесса, эффективности лечения и адекватно интерпретировать осложнения (Лопаткин Н.А., 2004; Tiselius H., 2006).
Теории камнеобразования
Существует несколько теорий камнеобразования, каждая из которых имеет право на существование.
-
Матричная теория, в основе которой лежат инфекция и десквамация эпителия, закладывающие ядро формирующегося камня.
-
Коллоидная теория — когда защитные коллоиды переходят из лиофильного состояния в лиофобное, создавая благоприятные условия для патологической кристаллизации.
-
Ионная теория базируется на недостаточности протеолиза мочи, что в условиях измененного рН приводит к камнеобразованию.
-
Теория преципитации и кристаллизации рассматривает образование камня при перенасыщенной моче с интенсивным процессом кристаллизации (Buck А., 1990).
-
Ингибиторная теория объясняет образование камней нарушением баланса ингибиторов и промоторов, поддерживающих метастабильность мочи (Sommeren А., 1989).
Несмотря на обилие теорий, основным условием для формирования ядра нового конкремента или нуклеации является выход за пределы метастабильного состояния мочи по основным камнеобразующим соединениям, над произведением формирования [5] (рис. 4.3).
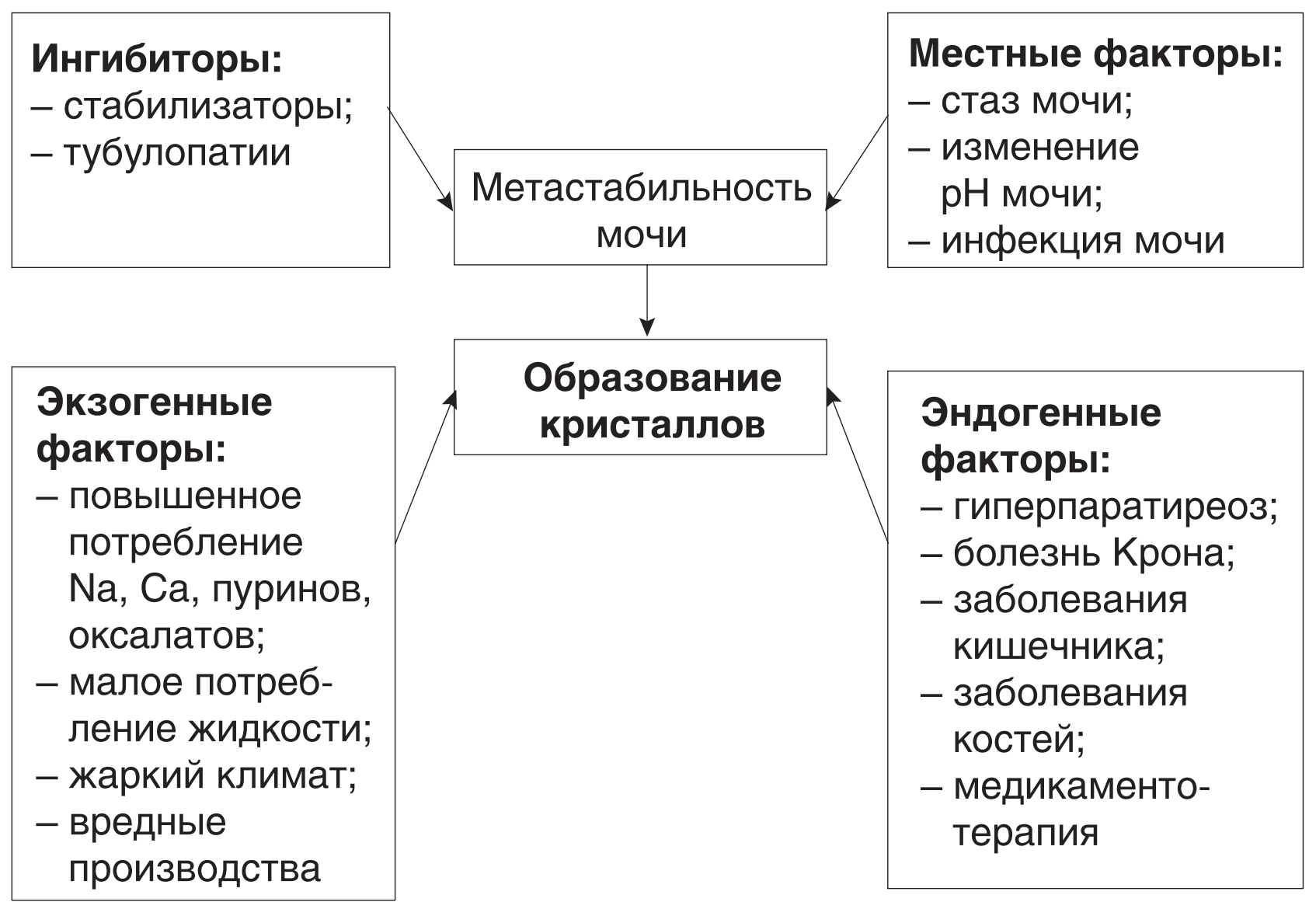
Для оценки состояния насыщения мочи основными камнеобразующими соединениями и выбора оптимального метода метафилактики камнеобразования мочи в настоящее время используется ряд компьютерных программ, наиболее популярными из которых являются EQUIL 2, разработанная Finlayson и соавт. [6], и JESS (Joint Expert Speciation System), разработанная Rogers и соавт. [7].
Клиническая классификация мочекаменной болезни
В зависимости от локализации камня в мочевыделительной системе выделяют:
В Российской и Европейской ассоциациях урологов камни мочеточников подразделяют на три зоны, в соответствии с анатомической классификацией сегментарного строения мочеточников, где средняя треть проецируется на крестец, тогда как в Американской ассоциации урологов принято подразделение на 2 зоны, где мочеточник делится на абдоминальную и тазовую части, где границей раздела являются подвздошные сосуды. (Сегура, 2002).
Диагностика
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Обзорный снимок органов брюшной полости, также включающий область почек, мочеточников и мочевого пузыря, позволяет диагностировать рентгенопозитивные камни, однако метод зависит от многих факторов (метеоризм, ожирение, состояние рентгеновской пленки, реактивов и т.д.).
Чувствительность и специфичность обзорного рентгеновского снимка органов мочевой системы (урограммы) зависит от многих факторов и поэтому составляет 44–77 и 80–87% соответственно [8]. Не следует назначать обзорный снимок пациентам, которым планируется проведение КТ [9].
Ультразвуковое исследование почек. Диагностическая значимость УЗИ зависит от класса ультразвуковой аппаратуры и профессионализма врача. При подозрении на камень мочеточника чувствительность УЗИ составляет лишь 45%, а специфичность 94% и при подозрении на камень почки эти параметры составляют 45 и 88% соответственно [10].
Экскреторная урография способна дать полное представление об анатомо-функциональном состоянии почек, верхних и нижних мочевыводящих путей. Однако на интерпретацию снимков влияют те же факторы, что и на результаты обзорной рентгенографии.
Чувствительность метода составляет 86%. Специфичность достигает 94% (Miller et al., 2002).
Экскреторную урографию не рекомендуется выполнять пациентам:
-
с содержанием креатинина в крови более 172 мкмоль/л [11];
Спиральная компьютерная томография. Наиболее информативным и чувствительным методом при МКБ является нативная МСКТ (без контрастного усиления) с чувствительностью 96% и специфичностью до 100%.
Она дает возможность определить точное количество, локализацию и плотность камня, тогда как знание последнего позволяет выявить противопоказания к применению дистанционной литотрипсии [12-15].
Единственный тип камней, не определяющийся на КТ, это индинавировые камни [16].
Обследование пациентов с почечной коликой
В настоящее время золотым стандартом диагностики при острой боли в области поясницы является нативная или бесконтрастная КТ. Этот метод пришел на смену экскреторной урографии (ЭУ), которая долгое время считалась золотым стандартом. КТ позволяет определить размер конкремента, его локализацию и плотность.
При диагностике конкрементов мочевыводящих путей бесконтрастная КТ обладает более высокой чувствительностью и специфичностью по сравнению с ЭУ (табл. 4.2) [17-22].
Ссылка |
Бесконтрастная КТ, % |
ЭУ, % |
|
Чувствительность |
Специфичность |
Чувствительность |
|
Miller |
96 |
100 |
87 |
Niall |
100 |
92 |
64 |
Sourtzis |
100 |
100 |
66 |
Yilmaz |
94 |
97 |
52 |
Wang |
99 |
100 |
51 |
Бесконтрастная КТ способна выявить рентгенонегативные камни, позволяет определить плотность конкремента, его внутреннюю структуру и расстояние от конкремента до кожи — параметры, которые дают возможность прогнозировать эффективность применения дистанционной ударно-волновой литотрипсии (ДУВЛ) [24, 13-15].
Тем не менее, наряду с преимуществами бесконтрастной КТ, следует иметь в виду, что, в отличие от ЭУ, она не предоставляет данных о функции почек и анатомических особенностях мочевыводящей системы, а также сопровождается высокой лучевой нагрузкой на пациента (табл. 4.3). В этой связи пациентам с индексом массы тела менее 30 был разработан метод низкодозной компьютерной томографии [25], с чувствительностью и специфичностью 96,6 и 94,9 соответственно [26].
| Метод | Доза облучения, мЗв |
|---|---|
Обзорный снимок органов мочевой системы |
0,5–1 |
ЭУ |
1,3–3,5 |
Обычная бесконтрастная КТ |
4,5–5 |
Низкодозная бесконтрастная КТ |
0,97–1,9 |
КТ с контрастированием |
25–35 |
Клинический анализ и биохимический анализ крови позволяет судить о признаках воспаления (лейкоцитоз, сдвиг лейкоцитарной формулы влево, увеличение СОЭ), почечной недостаточности, степени электролитных расстройств.
Общий анализ мочи, посев мочи — уровень рН мочи, наличие воспалительных изменений, а также определение бактериального агента.
При планировании оперативного вмешательства — скрининговая коагулограмма.
| Рекомендации | УД | СР |
|---|---|---|
Пациентам с лихорадкой, единственной почкой, а также, когда диагноз МКБ вызывает сомнение, показана немедленная визуализация конкремента |
4 |
A |
Для подтверждения диагноза МКБ у пациентов с острой болью в поясничной области следует выполнить бесконтрастную КТ, так как она более информативна, чем обзорный снимок и ЭУ |
1a |
A |
При обследовании пациентов с ИМТ <30 бесконтрастную КТ следует применять в низкодозном режиме |
1b |
A |
Контрастное исследование рекомендуется в случаях, если планируется удаление камня и/или необходимо оценить анатомические особенности мочевыводящих путей или функции почек |
3 |
A |
Применение контрастного КТ предпочтительно, так как с ее помощью можно получить объемную реконструкцию собирательной системы почки, а также измерить плотность конкремента и расстояние от камня до кожи. При отсутствии МСКТ — ЭУ является альтернативой второй линии |
4 |
С |
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальная диагностика в остром периоде, который проявился почечной коликой, осложнившейся обструктивным пиелонефритом, необходима со следующими хирургическими заболеваниями:
Основной отличительной особенностью является отсутствие симптомов раздражения брюшины, которые возникают при заболеваниях желудочно-кишечного тракта при отсутствии четкой связи с движениями.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ (ТАБЛ. 4.4, 4.5)
| Анализ химического состава конкремента | Анализ крови | Анализ мочи |
|---|---|---|
У каждого больного должен быть исследован химический со став камня |
Кальций. Альбумин (также определение содержания кальция и альбумина или свободного ионизированного кальция). Креатинин. Мочевая кислота. Ураты (дополнительный анализ) |
Анализ утренней мочи с исследованием осадка. Исследования с использованием тест-полосок: рН; определение количества лейкоцитов, бактерий (исследование культуры бактерий при выявлении бактериурии); определение количества цистина (если цистинурия не может быть исключена другими способами) |
Крайне важны своевременные консультации и подключение к лечению МКБ соответствующего специалиста (эндокринолога, диетолога, гастроэнтеролога).
| Рекомендации | УД | СР |
|---|---|---|
Во всех случаях первичной диагностики МКБ следует проводить анализ химического состава конкремента с помощью достоверного метода (дифракции рентгеновских лучей или инфракрасной спектроскопии) |
2 |
A |
Повторный анализ конкрементов следует проводить пациентам: с рецидивом на фоне медикаментозной профилактики; ранним рецидивом после полного удаления конкремента; поздним рецидивом после длительного отсутствия камней, поскольку состав конкремента может изменяться |
2 |
B |
| Анализ химического состава конкремента | Анализ крови | Анализ мочи |
|---|---|---|
У каждого больного должен быть исследован химический состав камня |
|
Анализ утренней мочи с исследованием осадка. Исследования с использованием тест-полосок:
|
Лечение
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Первый этап лечения при почечной колике — купирование боли [27, 28]. Нестероидные противовоспалительные средства (НПВС) эффективны у пациентов с почечной коликой [29, 30] и оказывают лучший аналгезирующий эффект по сравнению с опиатами. Пациентам, принимающим НПВС, в краткосрочной перспективе дальнейшая аналгезия требуется реже.
Применение опиатов по сравнению с НПВС связано с более частым развитием рвоты и чаще требует проведения повторной аналгезии.
При камнях мочеточника, сопровождающихся симптомами почечной колики, допустимо проведение срочного удаления камня в качестве терапии первой линии (УД: 1b).
Купирование болевого синдрома достигается при применении различных комбинаций следующих препаратов:
Лечение должно быть начато сразу при возникновении боли. Следует помнить, что диклофенак снижает уровень гломерулярной фильтрации у больных с почечной недостаточностью, у пациентов с нормальной функцией почек этого не происходит.
По классификации Европейской ассоциации урологов (EAU), вероятность спонтанного отхождения камней размером 4–6 мм составляет 80%:
По мнению Американской ассоциации урологов (AUA), в 75% случаев камни спонтанно отходят:
Однако и мелкие камни (до 6 мм) могут стать показанием к их активному лечению в следующих случаях:
ПРОФИЛАКТИКА ПОВТОРНЫХ ПРИСТУПОВ ПОЧЕЧНОЙ КОЛИКИ
У пациентов с конкрементами мочеточника, которые могут отойти самостоятельно, назначение НПВС в таблетированной форме или в форме суппозиториев (диклофенак натрия, 100–150 мг/сут в течение 3–10 дней) снижает риск повторного возникновения боли [31, 32]. Диклофенак может негативно влиять на почечную функцию у пациентов с почечной недостаточностью (УД: 1b) [33]. Согласно результатам, двойного слепого плацебо-контролируемого исследования повторные приступы почечной колики отмечались значительно реже у пациентов, получавших НПВС (по сравнению с пациентами, не получавшими терапии) в течение первых 7 дней лечения [34].
Ежедневный прием α-адреноблокаторов также снижает вероятность повторного эпизода почечной колики (УД: 1a).
Если обезболивание не может быть достигнуто лекарственными средствами и эффект от проводимой консервативной терапии отсутствует, необходимо прибегнуть к хирургическим методам дренирования верхних мочевыводящих путей или дезинтеграции камня. При наличии признаков пиелонефрита следует выполнить дренирование почки с помощью внутреннего мочеточникового стента или чрескожной пункционной нефростомии (ЧПНС). Различий между этими методами дренирования не выявлено, однако, по утверждению ряда авторов, при инфицированном гидронефрозе перкутанное дренирование может иметь больший успех [35, 36].
| Рекомендации | УД | СР |
|---|---|---|
При почечной колике следует незамедлительно купировать болевой синдром |
1a |
A |
При выборе препарата первой линии терапии следует по мере возможности отдавать предпочтение НПВС |
1a |
A |
Первая линия терапии: лечение следует начинать с назначения таких НПВС, как диклофенак натрия, индометацин, ибупрофен |
1b |
A |
Вторая линия терапии: трамадол |
4 |
C |
Для уменьшения вероятности возникновения повторных приступов почечной колики рекомендуется использовать α-адреноблокаторы |
1a |
A |
ДРЕНИРОВАНИЕ ПОЧКИ
Показаниями для экстренного дренирования почки являются:
Существуют 2 метода дренирования почки при обструкции ВМП:
Для декомпрессии ЧЛС мочеточниковые стенты и чрескожные нефростомические дренажи имеют одинаковую эффективность (УД: 1b) [35-38].
При любом виде дренирования почки, особенно у больных пиелонефритом, необходимо выполнять забор мочи на посев до назначения антибактериальных препаратов.
Выбор метода остается за врачом и зависит от хирургических навыков врача и технического оснащения медицинского учреждения. В настоящее время не существует данных, способных сформировать четкие рекомендации относительно сроков выполнения дренирования почки.
Окончательное лечение, направленное на удаление камней, следует начинать только после полноценного курса противомикробной терапии и купирования пиелонефрита (не раньше, чем через 10–14 дней после нормализации показателей крови). В редких, тяжелых случаях, при крупном камне верхней трети мочеточника и доказанном гнойно-деструктивном пиелонефрите (карбункул, абсцесс почки) может потребоваться выполнение экстренной открытой операции.
ДАЛЬНЕЙШИЕ МЕРОПРИЯТИЯ
После дренирования почки в случае инфекции, возникшей на фоне обструкции мочевыводящих путей, следует незамедлительно назначить курс антибиотиков. Схему лечения необходимо скорректировать с учетом результатов бактериального посева и антибиотикограммы.
| Рекомендации | УД | СР |
|---|---|---|
Пациентам с обструкцией и признаками острого пиелонефрита показано срочное дренирование ЧЛС с помощью мочеточникового стента либо чрескожной нефростомы |
1b |
A |
Лечение, направленное на удаление камней, следует начинать только после устранения активного инфекционного процесса |
1b |
A |
После дренирования почки рекомендуется выполнить посев мочи |
A |
|
После этого следует незамедлительно начать лечение антибиотиками |
||
После получения результатов антибиотикограммы следует скорректировать схему лечения антибиотиками |
НАБЛЮДЕНИЕ ЗА ПАЦИЕНТАМИ С КОНКРЕМЕНТАМИ В МОЧЕТОЧНИКЕ
Частота отхождения конкрементов
В настоящее время в литературе нет точных и убедительных данных о вероятности самостоятельного отхождения конкрементов в зависимости от их размера. В частности, вероятность отхождения конкрементов мочеточника размером <10 мм исследовалась в метаанализе у 328 больных (табл. 4.6) [39-41]. Исследования, включенные в метаанализ, имели некоторые ограничения, например в ряде исследований отсутствовал стандартный метод измерения размера конкремента, в других исследованиях не проводился анализ локализации конкремента и фактов самостоятельного отхождения конкрементов.
| Размер камня, мм | Среднее время отхождения, дней | Процент отхождения (95% ДИ) |
|---|---|---|
<5 (n=224) |
|
68 (46–85) |
>5 (n=104) |
|
47 (36–58) |
<2 |
31 |
|
2–4 |
40 |
|
4–6 |
39 |
|
95% конкрементов до 4 мм проходят в течение 40 дней [42].
| Рекомендации | УД | СР |
|---|---|---|
Для пациентов с впервые диагностированным конкрементом мочеточника <10 мм при отсутствии показаний к активному удалению камня возможным методом лечения является динамическое наблюдение |
1a |
A |
Во время наблюдения таким пациентам необходимо назначать лекарственную терапию для облегчения отхождения камня |
НАБЛЮДЕНИЕ ЗА ПАЦИЕНТАМИ С КОНКРЕМЕНТАМИ В ПОЧКАХ
Естественное течение МКБ при небольших, не вызывающих обструкции и клинических проявлений, конкрементах нижней чашечки изучено недостаточно, по этой причине риск прогрессирования остается неясным. Показаниями к лечению таких камней служат рост конкремента, появление обструкции, присоединение инфекции и острая и/или хроническая боль.
Риск развития почечной колики или необходимости хирургического лечения приблизительно составляет ~10–25% в год, или 48,5% в перспективе 5 лет [42]. В другом ретроспективном исследовании было показано, что у 77% пациентов с асимптоматичными камнями будет отмечена прогрессия, а 26% потребуют хирургического вмешательства [43].
В ретроспективном исследовании Hubner и Porpaczy было показано, что 83% конкрементов чашечек потребуют оперативного вмешательства в течение 5 лет после установления диагноза [44]. Inci и соавт. провели исследование камней нижней чашечки и заметили, что в течение последующих 52,3 мес у 9 (33,3%) пациентов наблюдался рост конкрементов, а 3 (11%) потребовалось оперативное лечение [45]. В ходе другого проспективного РКИ с периодом клинического наблюдения 2,2 года Keeley и соавт. исследовали две группы пациентов с бессимптомными конкрементами нижних чашечек <15 мм. Пациентам первой группы выполнялась ДУВЛ, а пациенты второй группы подвергались динамическому наблюдению. При оценке показателя полного отсутствия камней (stone free), симптомов, необходимости дополнительного лечения, качества жизни, функции почек и частоты госпитализации авторы не обнаружили существенной разницы между группами [46]. Osman и соавт. показали, что в течение 5 лет после проведения ДУВЛ 21,4% пациентов с небольшими резидуальными фрагментами будут нуждаться в лечении. Похожие цифры приводят и Rebuck и соавт. Несмотря на то что эти исследования включали пациентов с резидуальными камнями после ДУВЛ и УРС, они могут служить источником информации о естественном течении МКБ [47]. После удаления небольших конкрементов чашечек с помощью ДУВЛ, ЧНЛ и УРС отмечаются высокие показатели полного избавления от конкрементов и купирования боли, что свидетельствует о необходимости удаления конкрементов чашечек, сопровождаемых клиническими проявлениями [47-49].
| Рекомендации | УД |
|---|---|
Как правило, при бессимптомных конкрементах чашечек все чаще выбирается тактика активного наблюдения с ежегодной оценкой симптомов и состояния конкремента с помощью соответствующих методов (обзорный снимок, УЗИ, бесконтрастная КТ) в течение первых 2–3 лет, по прошествии этого периода следует назначать лечение при условии, что пациент надлежащим образом проинформирован о возможных исходах лечения. |
C |
Тактика наблюдения сопряжена с более высоким риском выполнения впоследствии более инвазивных вмешательств |
МЕДИКАМЕНТОЗНАЯ ЭКСПУЛЬСИВНАЯ ТЕРАПИЯ
Существуют убедительные доказательства, подтверждающие, что медикаментозная экспульсивная терапия (МЕТ) способствует самостоятельному отхождению конкремента мочеточника или его фрагментов, образующихся после дистанционной ударно-волновой литотрипсии (ДУВЛ), а также уменьшает боль (УД: 1a) [34, 50-61]. Согласно данным метаанализа, у пациентов с конкрементами мочеточника (особенно в нижней трети), принимающих α-адреноблокаторы или нифедипин, вероятность отхождения конкремента выше, а вероятность возникновения почечной колики ниже, чем у пациентов, не получающих такого лечения [34, 50].
Лекарственные препараты
Тамсулозин — один из наиболее часто используемых для МЕТ α-адреноблокаторов [34, 50–52, 62–65]. Однако результаты одного исследования тамсулозина, теразозина и доксазозина продемонстрировали их одинаковую эффективность [66]. Эффективность этой группы препаратов также подтверждается несколькими исследованиями, продемонстрировавшими увеличение частоты отхождения конкрементов на фоне приема доксазозина [66, 67], теразозина [66, 68], альфузозина [69-72], нафтопидила℘ [73, 74] и силодозина (УД: 1b) [75, 76]. Назначение тамсулозина и нифедипина безопасно и эффективно у пациентов с почечной коликой при конкрементах, локализованных в дистальном отделе мочеточника. Однако тамсулозин значительно лучше, чем нифедипин, купирует приступ почечной колики, облегчает и ускоряет отхождение камней мочеточника [56, 77, 78]. К сожалению, ограниченное количество пациентов, принимавших участие в исследованиях [79, 80] (УД: 1b), не позволяет сформировать четких рекомендаций относительно применения глюкокортикоидов в качестве монотерапии или в комбинации с α-адреноблокаторами при проведении МЕТ.
Факторы, влияющие на эффективность медикаментозной экспульсивной терапии тамсулозином
Размер конкремента
Ввиду высокой вероятности самостоятельного отхождения конкрементов размером около 5 мм применение МЕТ может лишь незначительно увеличить частоту отхождения камней этого размера (УД: 1b). Тем не менее применение МЕТ снижает необходимость приема анальгетиков [81-84] (УД: 1a).
Локализация конкремента
Подавляющее большинство исследований было посвящено изучению конкрементов в дистальном отделе мочеточника [34]. В ходе одного РКИ оценивалась эффективность α-адреноблокатора тамсулозина для облегчения самостоятельного отхождения конкрементов размером 5–10 мм из проксимального отдела мочеточника. Основным эффектом тамсулозина было продвижение конкрементов в более дистальные отделы мочеточника либо его отхождение [85] (УД: 1b).
Медикаментозная экспульсивная терапия после дистанционной ударно-волновой литотрипсии
Согласно результатам клинических исследований и нескольких метаанализов, проведение ЛКТ после ДУВЛ при конкрементах в мочеточнике или почках позволяет ускорить отхождение и увеличить частоту полного избавления от камней, а также снизить необходимость применения анальгетиков [52, 57, 86-92] (УД: 1a).
Медикаментозная экспульсивная терапия после уретероскопии
Проведение MET после контактной уретеролитотрипсии увеличивает частоту полного избавления от камней и снижает частоту приступов почечной колики в послеоперационном периоде (УД: 1b) [93].
Медикаментозная экспульсивная терапия и стентирование мочеточника. Продолжительность медикаментозной экспульсивной терапии
Большая часть исследований проводилась в течение 30 дней. В экспериментах доказано, что нахождение камня в одном месте мочеточника уже к 14-м суткам приводит к выраженному отеку и гиперплазии слизистой оболочки, перимускулярному склерозу (Кудрявцев Ю.В., 2004).
Эти же причины влияют на неэффективность как ДУВЛ, так и УРС.
| Рекомендации | УД | СР |
|---|---|---|
При проведении МЕТ рекомендуется назначать α-адреноблокаторы |
1a |
A |
Пациентов следует проинформировать о рисках, сопутствующих МЕТ, включая побочные эффекты препаратов, а также о том, что такое применение препаратов не предусмотрено их инструкцией |
A* |
|
У пациентов, которые принимают решение в пользу самостоятельного отхождения конкремента или МЕТ, следует надлежащим образом купировать боль, исключить клинические признаки острого воспалительного процесса и убедиться в достаточной функции почек |
A |
|
В дальнейшем пациентов следует обследовать в промежутке между 1-м и 14- м днем на предмет продвижения конкремента и наличия гидронефроза |
4 |
A* |
ХЕМОЛИТИЧЕСКОЕ РАСТВОРЕНИЕ КАМНЕЙ
Пероральный хемолиз конкрементов и их фрагментов при правильном его проведении может быть эффективной терапией 1-й линии. Также его можно применять в качестве дополнительного метода к ДУВЛ, чрескожной нефролитолапаксии (ЧНЛ), уретерореноскопии (УРС) или открытому оперативному вмешательству для облегчения элиминации камня. Комбинированное лечение ДУВЛ + хемолиз может также рассматриваться как малоинвазивный способ лечения пациентов с коралловидными «инфекционными» камнями, полностью или частично выполняющими ЧЛС, при котором существуют противопоказания к выполнению ЧНЛТ. Дробление конкремента приводит к увеличению его поверхности, что повышает эффективность хемолиза (или литолиза). Применение хемолиза возможно только при определенном составе конкрементов.
Пероральный хемолиз
Пероральный хемолиз эффективен только при конкрементах из мочевой кислоты. В основе лечения лежит ощелачивание мочи посредством перорального приема цитратных смесей или двууглекислого натрия [94-97]. При планировании хемолиза следует отрегулировать уровень pH в диапазоне 7,0–7,2. Для профилактики камнеобразования достаточно поддерживать рН в диапазоне 6,4–6,8. Следует назначать ощелачивающие препараты не по однократному исследованию рН мочи, а по средним показателям суточного колебания рН (утро, обед, вечер), за 2–3 дня исследования. В пределах этих значений хемолиз наиболее эффективен, при более высоких значениях рН возрастает риск формирования конкрементов из фосфата кальция. В случае обструкции мочевыводящих путей конкрементом из мочевой кислоты целесообразно назначить пероральный хемолиз после дренирования мочевыводящих путей стентом [98]. Ощелачивание мочи с параллельным применением тамсулозина позволяет достичь более высокой частоты полного избавления пациента от конкрементов, расположенных в дистальном отделе мочеточника [99].
| Рекомендации | СР |
|---|---|
При уратных камнях первым этапом осуществляется пероральный хемолиз под контролем pH мочи с помощью тест-полосок через равные промежутки времени в течение дня |
A |
Дозу ощелачивающего препарата необходимо корректировать в каждом конкретном случае с учетом уровня pH мочи пациента |
A |
Необходимо измерять уровень pH мочи с помощью тест-полосок через равные промежутки времени в течение дня. Также следует измерить уровень pH утренней мочи |
A |
Врач должен четко объяснить пациенту важность точного соблюдения предписаний |
A |
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Показания к активному удалению конкрементов и выбор операции
В отличие от камней мочеточника, конкременты почек могут существовать длительное время, не причиняя пациенту никаких неудобств. Миграция камня в мочеточник в большинстве случаев приводит к возникновению острой боли (почечной колики). Решение об активном удалении конкрементов верхних отделов мочевыводящих путей принимается на основании таких факторов, как состав и размер камня, а также симптоматики.
Показания к активному удалению камней почек
Выбор метода активного удаления почечных конкрементов
Камни почечной лоханки или верхней/средней чашечки
Ударно-волновая литотрипсия, ПНЛ и гибкая УРС являются современными способами лечения камней почек. Эффективность ПНЛ зависит от размера конкремента, тогда как частота полного избавления от конкрементов после ДУВЛ или УРС обратно пропорциональны размеру камня [100-103]. Ударно-волновая литотрипсия позволяет достичь отличных показателей полного избавления от конкрементов при лечении камней до 20 мм, за исключением камней, расположенных в нижней чашечке [102, 104]. ДУВЛ остается методом выбора для лечения таких камней. Методом выбора для удаления более крупных конкрементов (>20 мм) является ПНЛ, так как при ДУВЛ часто требуется проведение нескольких сеансов и имеется риск возникновения обструкции мочеточника «каменной дорожкой» с необходимостью выполнения дополнительных вмешательств (рис. 4.4) [105]. Несмотря на обнадеживающие результаты, ретроградные вмешательства (гибкая уретероскопия) в настоящее время не могут быть рекомендованы в качестве терапии первой линии для камней >20 мм, при которых могут понадобиться многоэтапные вмешательства [106, 107]. Однако гибкая УРС может выполняться с большим успехом в центрах с большим опытом применения данного метода [103, 108]. Ряд исследований свидетельствуют о том, что гибкая УРС может выполняться для лечения камней почки с эффективностью, сопоставимой с ПНЛ, однако эффективность УРС достоверно ниже при камнях более 3 см [109-114]. Несмотря на то что гибкая УРС позволяет добиться сопоставимых результатов с миниПНЛ, стандартная ПНЛ по своим результатам пока превосходит гибкую УРС. Преимуществами гибкой УРС являются малая травматичность, низкий риск таких осложнений, как кровотечение и повреждение смежных органов, и менее продолжительное пребывание в стационаре [115].
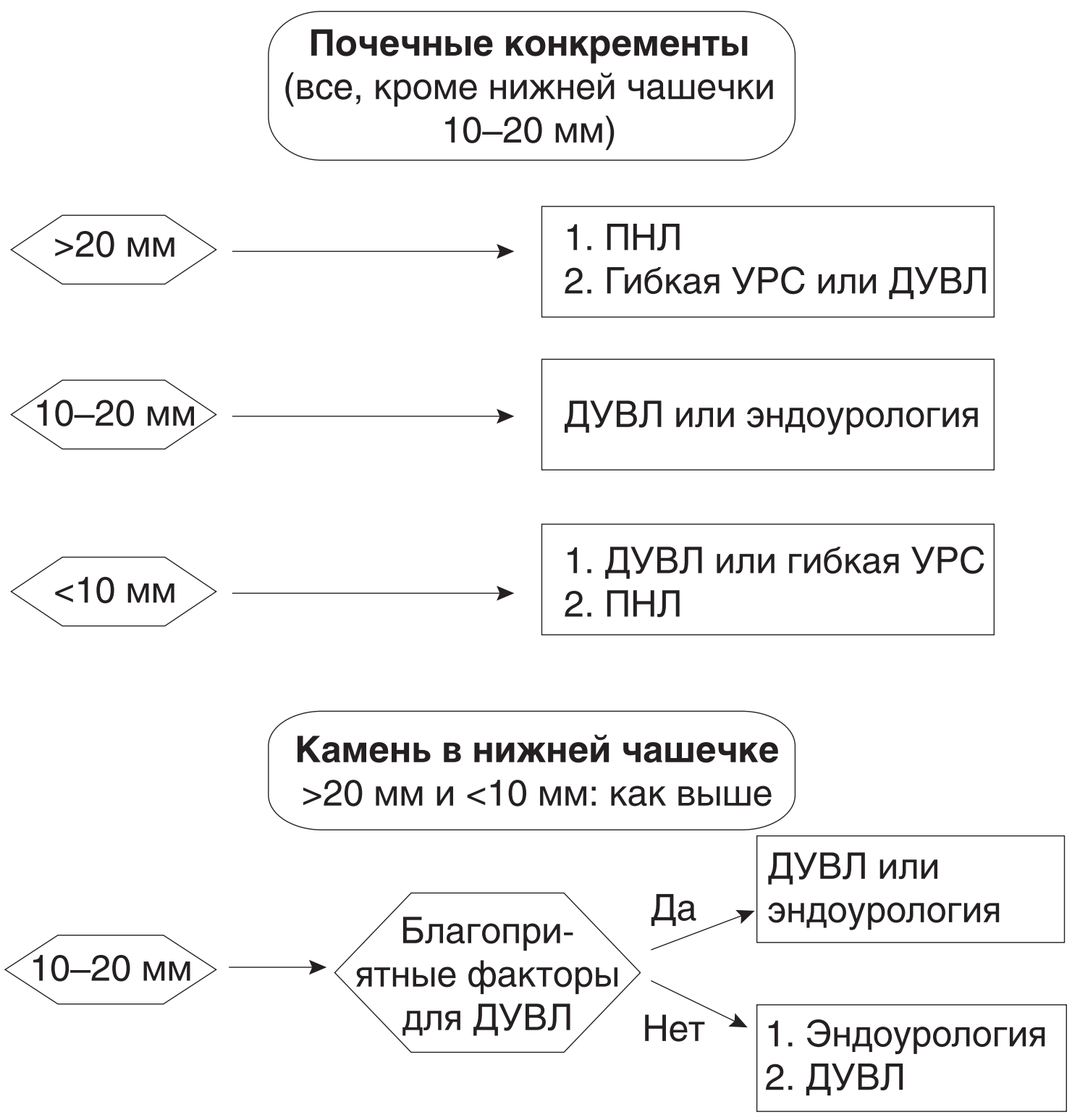
Камни в нижней почечной чашечке
Частота полного избавления от конкрементов при ДУВЛ более низкая для камней нижней чашечки. Эффективность самой фрагментации камня не зависит от локализации, однако резидуальные фрагменты часто остаются в нижней чашечке, вызывая рецидив камнеобразования. Показатель полного избавления от конкрементов нижней чашечки (SFR) при ДУВЛ составляет 25–85% [100-105].
Следующие факторы могут нарушать отхождение резидуальных конкрементов из нижней чашечки, снижая эффективность ДУВЛ:
Результаты ДУВЛ камней нижней чашечки часто неудовлетворительны, поэтому для конкрементов >15 мм в настоящее время рекомендуется выполнять эндоскопические операции (ПНЛ и/или гибкую УРС). При наличии неблагоприятных для ДУВЛ прогностических факторов ПНЛ и гибкая УРС могут быть альтернативой даже при лечении конкрементов меньшего размера. Эффективность ретроградных вмешательств на почках сравнима [104, 105], а, согласно некоторым исследованиям, достоверно выше ДУВЛ [121]. Результаты недавних клинических исследований с использованием уретерореноскопов последнего поколения показали преимущества УРС перед ДУВЛ, однако этот метод более инвазивен [122, 123]. В зависимости от квалификации хирурга крупные камни до 3 см могут эффективно удаляться с помощью гибкой УРС [110, 124-126]. В сложных случаях может быть показано комбинирование антеградного и ретроградного доступов [127-129]. Однако в таком случае часто требуются многоэтапные операции. В сложных случаях МКБ в качестве возможной альтернативы прибегают к открытому и лапароскопическому вмешательству (см. соответствующие главы).
| Рекомендации | СР |
|---|---|
ДУВЛ остается методом для лечения камней <2 см, расположенных в почечной лоханке или верхней/средней почечных чашечках. Конкременты большего размера следует лечить с помощью ПНЛ |
B* |
В случае невозможности выполнения ПНЛ гибкая УРС может применяться для лечения камней >2 см |
B* |
Для конкрементов нижней чашечки рекомендуются ПНЛ и гибкая УРС, даже для камней >1,5 см, так как эффективность ДУВЛ ограничена (зависит от благоприятных и неблагоприятных факторов ДУВЛ) |
B* |
Показания к активному удалению камней мочеточника
-
Конкременты с низкой вероятностью самостоятельного отхождения.
-
Рецидивирующая или некупируемая боль, несмотря на адекватное обезболивание.
-
Нарушение функции почек (почечная недостаточность, двусторонняя обструкция или единственная почка).
-
Отсутствие эффекта литокинетической терапии, несмотря на правильное лечение.
Сравнение дистанционной ударно-волновой литотрипсии и уретероскопии
В исследованиях при локализации конкрементов в верхней трети мочеточника после ДУВЛ и УРС не отмечалось различий показателя полного избавления от камней. Однако после проведения стратификации исследования по размеру конкремента при локализации конкремента <10 мм в верхней трети мочеточника (n=1285) оказалось, что ДУВЛ позволяла получить более высокие показатели избавления от камней по сравнению с УРС, а при конкрементах >10 мм (n=819) лучшие показатели были получены после УРС. Это различие объясняется тем, что при лечении конкрементов, расположенных в проксимальном отделе мочеточника, с помощью УРС данный показатель практически не зависит от размера конкремента, тогда как после ДУВЛ его значение обратно пропорционально размеру конкремента. При анализе лечения конкрементов средней трети мочеточника УРС оказалась более эффективным методом по сравнению с ДУВЛ; однако стратификация по размеру конкремента не позволила получить статистически значимые данные из-за небольшого числа пациентов, включенных в метаанализ. При локализации конкрементов в дистальном отделе мочеточника УРС демонстрирует более высокие показатели избавления от камней, чем другие методы активного удаления конкрементов, независимо от их размера.
ЭФФЕКТИВНОСТЬ (ПОКАЗАТЕЛЬ ПОЛНОГО ИЗБАВЛЕНИЯ ОТ КОНКРЕМЕНТОВ)
В табл. 4.7 представлены результаты метаанализа, изучавшего показатели полного избавления от конкрементов (Мед или Медиана) [40].
Локализация и размер конкремента |
ДУВЛ |
УРС |
|
Количество пациентов |
Мед или Медиана, % (95 ДИ) |
Количество пациентов |
|
Дистальный отдел мочеточника |
7217 |
74 (73–75) |
10,372 |
<10 мм |
1684 |
86 (80–91) |
2,013 |
>10 мм |
966 |
74 (57–87) |
668 |
Средний отдел мочеточника |
1697 |
73 (71–75) |
1,140 |
<10 мм |
44 |
84 (65–95) |
116 |
>10 мм |
15 |
76 (36–97) |
110 |
Проксимальный отдел мочеточника |
6682 |
82 (81–83) |
2,448 |
<10 мм |
967 |
89 (87–91) |
318 |
>10 мм |
481 |
70 (66–74) |
338 |
К сожалению, в настоящий момент проведено недостаточное количество рандомизированных исследований, посвященных сравнению этих методов лечения. Тем не менее при сравнении УРС и ДУВЛ показатели избавления от камней после УРС были значительно выше, чем после ДУВЛ при лечении конкрементов размерами <10 и >10 мм в дистальном отделе мочеточника, а также размерами >10 мм в проксимальном отделе мочеточника. При лечении конкрементов в среднем отделе мочеточника с помощью ДУВЛ и УРС значительных различий не отмечалось.
В табл. 4.8 представлены методы лечения в зависимости от размера и локализации камней.
| Локализация и размер конкремента | Первая линия | Вторая линия |
|---|---|---|
Проксимальный отдел мочеточника <10 мм |
ДУВЛ |
УРС |
Проксимальный отдел мочеточника >10 мм |
УРС (ретроградная или нтеградная) или ДУВЛ |
|
Дистальный отдел мочеточника <10 мм |
УРС или ДУВЛ |
|
Дистальный отдел мочеточника >10 мм |
УРС |
ДУВЛ |
В настоящее время накоплено недостаточно данных для получения статистически значимых результатов сравнения гибкой и жесткой УРС при проксимальной локализации конкрементов мочеточника, более высокие показатели частоты полного избавления от конкрементов отмечаются при использовании гибкой УРС (87%) по сравнению с полужесткой и гибкой УРС (77%) [40]. По мере распространения гибкой УРС и ее дальнейшего технического усовершенствования данные показатели, вероятно, будут улучшаться.
ОСЛОЖНЕНИЯ
Несмотря на то что выполнение УРС высокоэффективно при камнях мочеточника, она несет более высокий риск развития осложнений. На современном этапе развития эндоурологии, вследствие появления возможности использовать новые, тонкие ригидные и гибкие инструменты и мелкокалиберные контактные литотриптеры, уровень осложнений от уретероскопии значительно снизился [134]. Пациентов следует информировать о том, что вероятность избавления от камня за одну операцию выше при УРС, однако это связано с более высоким риском развития осложнений (см. соответствующие разделы).
Чрескожная антеградная уретероскопия
Чрескожное антеградное удаление камней мочеточника возможно в особых случаях. Например, в случае больших (>15 мм) вколоченных конкрементов, расположенных в проксимальном отделе мочеточника [135-138], или в случаях, когда ретроградное вмешательство невозможно [139-141]. В ряде исследований было оценено преимущество данного метода по сравнению со стандартными техниками. Показатель полного избавления от конкрементов при этом составил 85–100% [135, 138, 139, 142]. Частота осложнений была более низкой или не отличалась от таковой при других чрескожных операциях. Однако чрескожное антеградное удаление камней мочеточника связано с более длительным временем операции, пребывания в стационаре и более поздним возвращением к нормальному образу жизни [139-141].
Другие методы удаления камней мочеточника
Удалению конкрементов с помощью лапароскопической и открытой операции (см. разд. «Открытое и лапароскопическое удаление камней почек») посвящено мало исследований. Данные операции обычно применяются лишь в особых случаях, поэтому представленные результаты нельзя использовать для сравнения этой методики с ДУВЛ и УРС.
| Рекомендации | СР |
|---|---|
Чрескожное антеградное удаление камней мочеточника следует выполнять в случаях, когда ДУВЛ не показана или оказалась неэффективной или когда состояние верхних мочевыводящих путей не позволяет выполнить ретроградное вмешательство |
A |
Выбор метода лечения следует делать, основываясь на размере и локализации камня, наличии доступного оборудования и предпочтениях пациента |
A |
ОБЩИЕ РЕКОМЕНДАЦИИ И ПРЕДОСТОРОЖНОСТИ ПРИ УДАЛЕНИИ КОНКРЕМЕНТОВ
Инфекция
Если планируется активное удаление конкрементов, в обязательном порядке следует провести лечение инфекции мочевыводящих путей. Недавние исследования показали, что назначение антибактериальной терапии пациентам с исходно отрицательным посевом мочи значительно сокращает частоту послеоперационных инфекционных осложнений [143].
Антикоагулянты и лечение мочекаменной болезни
Пациенты с геморрагическим диатезом или пациенты, получающие терапию антикоагулянтами, должны направляться на консультацию к терапевту (кардиологу) для принятия соответствующих терапевтических мер перед и в течение удаления конкремента [144-148]. Пациентам с неоткорректированным геморрагическим диатезом противопоказаны:
Несмотря на то что проведение ДУВЛ вполне безопасно после коррекции коагулопатии [13, 152, 153], УРС может служить в качестве оптимального и наиболее безопасного альтернативного метода лечения, связанного с меньшей частотой осложнений.
Плотность конкремента
Камни, состоящие из брушита, оксалата кальция, моногидрата или цистина, обладают особой твердостью. Чрескожная нефролитотомия или гибкая УРС являются альтернативным методом удаления крупных камней плотностью более 1000 HU, резистентных к ДУВЛ.
Рентгенонегативные конкременты
Камни, состоящие из мочевой кислоты (кроме уратов натрия и аммония), могут быть растворены с помощью орального хемолиза. Послеоперационный мониторинг рентгенопрозрачных камней вовремя хемолиза проводится с помощью УЗИ, однако может потребовать выполнения повторной бесконтрастной КТ.
«Каменная дорожка»
«Каменная дорожка» представляет собой скопление фрагментов камней в мочеточнике, которые не отходят в течение определенного времени и препятствуют пассажу мочи [154, 155]. Она образуется в 4–7% случаях после ДУВЛ [156], главный фактор ее формирования — размер камня [157].
Некоторые исследования показывают, что установка мочеточникового стента перед ДУВЛ конкрементов диаметром >15 мм позволяет предотвратить образование «каменной дорожки» [158]. «Каменная дорожка» может не вызывать никаких симптомов, а может сопровождаться клинической картиной почечной колики, лихорадкой либо симптомами раздражения мочевого пузыря. Основная опасность заключается в обструкции мочеточника, которая может быть бессимптомной в 23% случаев [159] и приводить к почечной недостаточности [161] или обструктивному пиелонефриту. При образовании «каменной дорожки» в единственной почке отмечается анурия [159].
Если «каменная дорожка» не вызывает симптомов, начинать лечение следует с применения консервативных методов в зависимости от предпочтений пациента и его готовности придерживаться протокола динамического наблюдения (табл. 4.9).
| Без клинических проявлений | УД | С клиническими проявлениями | УД | С клиническими проявлениями и лихорадкой | УД |
|---|---|---|---|---|---|
1. ЛКТ |
1b |
1. УРС |
3 |
1. ПНЛ |
1 |
2. ДУВЛ |
3 |
1. ПНЛ |
3 |
2. Стентирование |
2 |
3. УРС |
3 |
1. ДУВЛ |
3 |
||
2. Стентирование |
3 |
Примечание. Нумерация от 1 до 3 означает первую, вторую и третью линии терапии.
Литокинетическая терапия увеличивает частоту отхождения конкрементов при «каменной дорожке» (УД: 1b).
Если спонтанное отхождение камней маловероятно, назначается дальнейшее лечение.
ДУВЛ показана в случаях с клиническими проявлениями и без них, при отсутствии признаков инфекции мочевыводящих путей и наличии крупных фрагментов.
Уретероскопия имеет одинаковую с ДУВЛ эффективность лечения «каменной дорожки».
Установка чрескожной нефростомы или мочеточникового стента выполняется при обструкции мочеточника, сопровождаемой клиническими проявлениями, при наличии или отсутствии признаков ИМП.
| Рекомендации | УД | СР |
|---|---|---|
Перед началом активного лечения следует обязательно провести бактериальный посев мочи и микроскопию осадка мочи |
A* |
|
Перед удалением конкремента следует прекратить антикоагулянтную терапию |
3 |
B |
В случае если необходимо оперативное удаление конкрементов, а антикоагулянтную терапию нельзя прерывать, предпочтительно выполнение ретроградной уретерореноскопии |
||
Перед выбором метода удаления камня следует обратить внимание на его состав и плотность. Камни плотностью >1,000 HU с меньшим успехом поддаются дроблению с помощью ДУВЛ [14] |
2a |
B |
Обязателен тщательный мониторинг рентгенонегативных камней вовремя/после операции |
A* |
|
ЧПНС показана при наличии подтвержденной ИМП/лихорадки, вызванной «каменной дорожкой» |
4 |
C |
ДУВЛ показана для лечения «каменной дорожки» при наличии крупных фрагментов |
4 |
C |
Уретероскопия показана при «каменной дорожке», сопровождаемой клиническими проявлениями, и при неэффективности другого лечения |
4 |
C |
Основные методы активного удаления камней
ДИСТАНЦИОННАЯ УДАРНО-ВОЛНОВАЯ ЛИТОТРИПСИЯ
Тем не менее эффективность ДУВЛ зависит и от таких факторов, как:
Каждый из этих факторов оказывает большое влияние на частоту повторных сеансов лечения и исход ДУВЛ.
Хотя камень разрушается на мелкодисперсную массу, в 15–18% случаев выявляют фрагменты размером до 3–4 мм, что может приводить к формированию «каменной дорожки» в мочеточнике. Камни до 2 см оптимальны для выполнения ДУВЛ. Обязательное условие эффективности и наименьшей травматичности сеанса ДУВЛ — идеально точное выведение камня в фокальную зону. Это осуществляют под рентгеновским и ультразвуковым наведением (такой возможностью оснащены все современные литотриптеры, табл. 4.10).
| Метод | Преимущества | Недостатки |
|---|---|---|
Рентгеноскопия |
Легкость выполнения. |
Радиационное облучение больного и врача. |
Ультразвуковое исследование |
Отсутствие излучения. |
Более сложное выполнение. |
На дробление одного камня размером до 2 см приходится до 1500– 3000 импульсов и в среднем 1,6 сеанса. Смешанные камни разрушаются легче, в отличие от моноструктурных камней. Наиболее сложно поддаются дроблению цистиновые камни. Камни больших размеров требуют применения более высокоэнергетичных импульсов и нескольких сеансов дробления.
Требования, обеспечивающие эффективность дистанционной ударно-волновой литотрипсии
Противопоказания к дистанционной ударно-волновой литотрипсии
-
Беременность [164]. Нарушения свертываемости крови (гемофилия, прием антикоагулянтов, период менструаций у женщин [165].
-
Деформации опорно-двигательного аппарата или тяжелая степень ожирения, не позволяющая правильно позиционировать пациента и точно навести ударную волну на конкремент.
-
Аневризма аорты или любой артерии, расположенная в зоне действия ударной волны [166].
-
Обструкция мочевыводящих путей ниже места расположения камня.
Стентирование перед проведением дистанционной ударно-волновой литотрипсии
Стентирование мочеточника перед проведением ДУВЛ выполняется не для повышения частоты полного избавления от конкрементов (УД: 1b) [167], а для предотвращения обструкции мочеточника. Использование J-J-стента уменьшает риск возникновения приступа почечной колики и снижает риск образования «каменной дорожки» в раннем послеоперационном периоде, развития инфекционных осложнений [168]. Кроме того, установка стента диаметром 5–7 Сh не препятствует активному отхождению фрагментов (до 3 мм). Установка стента должна осуществляться только под рентгенотелевизионным контролем. В некоторых случаях стент может сопровождаться дизурией, рефлюксом, миграцией его в мочеточник, развитием острого пиелонефрита, что требует немедленной его замены или установки нефростомы. Длительное нахождение стента может привести к его инкрустации. Если эти осложнения сопровождаются развитием острого пиелонефрита, несмотря на правильно установленный стент, необходимо удалить его, заменить новым или выполнить чрескожное дренирование почки. В Рекомендациях по конкрементам мочеточника, изданных совместно AUA и ЕАU в 2007 г., отмечается, что при ДУВЛ по поводу конкрементов мочеточника не рекомендуется обязательное стентирование [40].
В то же время установка внутреннего стента в обход камня или заведение камня в почку создает более благоприятные условия для его эффективного дробления [169].
Передовой клинический опыт
Кардиостимулятор
Пациентам с кардиостимулятором можно выполнять ДУВЛ при условии предварительной консультации кардиолога. Особенно внимательного подхода требуют пациенты с имплантированным кардиовертером, некоторые приборы на время проведения ДУВЛ необходимо выключать. Тем не менее этого может не потребоваться при использовании литотриптеров нового поколения [170]. Частота импульсов выбирается с учетом дыхательной экскурсии почки и выраженностью смещения камня в фокусе ударной волны. Так, значительное смещение камня из фокальной зоны приводит к тому, что более 50% ударной волны попадает мимо камня и приходится на ткань почки, что может привести к ее травматизации.
Количество, частота импульсов ударной волны, мощность и повторные сеансы дистанционной ударно-волновой литотрипсии
Оптимальной частотой является 1,0–1,5 Гц, 60–90 в 1 мин (1a A). Дальнейшее увеличение частоты приводит к большей травматизации тканей без изменения показателей эффективности [171-174]. Количество импульсов ударной волны, которые можно использовать за 1 сеанс, зависит от типа литотриптера, мощности применяемой энергии ударной волны и исходного состояния почечной паренхимы, размера и плотности камня. Чем более выражены нарушения функции почки (выраженное замещение ее склеротической тканью), тем меньше количество применяемых высокоэнергетичных импульсов и импульсов во время сеанса. При нормальной функции почки и отсутствии обструктивных осложнений восстановление функции почки осуществляется на 7–8-е сутки, при снижении функции и применении высоких энергий ДУВЛ восстановление занимает более длительное время — 12–14 дней. С учетом особенностей первого сеанса повторное дробление камней почки может быть осуществлено не ранее чем через 7 дней. При дроблении камней мочеточника интервал может быть сокращен до 1–2 дней [168, 175, 176]. Режим «рампинга» или литотрипсия на низком энергетическом уровне с постепенным переходом на большую мощность позволяют сократить травматизацию почки и улучшить результаты [177-180].
Улучшение проведения ударной волны
Большое значение имеют система подготовки и контроль ее состояния. Со временем в жидкости ударно-волновой головки накапливаются пузырьки газа, которые гасят ударно-волновой импульс, что снижает эффективность дробления. Использование контактного геля между головкой и телом пациента препятствует образованию воздушных пузырьков. Оптимальным доступным контактным веществом для литотрипсии считается гель для УЗИ [181].
Контроль результата
Результаты лечения зависят от врача, выполняющего процедуру; более эффективные результаты достигаются урологами с максимальным опытом и владеющими знаниями о влиянии высоких энергий на биологические ткани человека. Контроль за нахождением камня в фокусе, дроблением и его эффективностью должен осуществляться рентгенологическими методами через каждые 250–500 импульсов. При УЗИнаведении контроль осуществляется постоянно.
Обезболивание
На литотриптерах с пьезокерамическими генераторами возможно проведение ДУВЛ без наркоза. Боль во время литотрипсии формируется в кожных рецепторах при воздействии на них ударно-волновых импульсов, и для их ликвидации не требуется эндотрахеального, эпидурального наркоза, но в то же время во время процедуры необходимо обеспечить адекватное обезболивание, чтобы не допустить движения пациента и увеличения дыхательных экскурсий [182-184].
Антибактериальная профилактика
Перед ДУВЛ не рекомендуется проводить рутинную антибактериальную терапию, не зная микрофлоры и ее чувствительности к антибиотикам, а также при нарушенном оттоке мочи. Тем не менее профилактику рекомендуется проводить пациентам с мочеточниковым стентом и с высокой вероятностью инфекционных осложнений при малейшем нарушении оттока после ДУВЛ (например, постоянный катетер, нефростомическая трубка, инфекционные конкременты) [185, 186].
Камнеизгоняющая терапия после дистанционной ударно-волновой литотрипсии
Проведение МЕТ после ДУВЛ при конкрементах мочеточника или почек позволяет ускорить отхождение и увеличить частоту полного избавления от конкрементов, а также снизить необходимость в дополнительных анальгетиках [52, 57, 87, 90, 187–193]. Если сравнивать метод ДУВЛ с ЧНЛ и уретероскопией, ДУВЛ сопряжена с меньшей частотой осложнений (табл. 4.11) [91, 92]. Особое внимание должно быть уделено заболеваниям желудочно-кишечного тракта, так как выполнение ДУВЛ и прохождении ударных волн через острую язву, колит может спровоцировать кровотечение, разрыв. Также при прохождении ударных волн через воздушную среду (легкие, аэроколия), на границе вода–воздух возникает травматический кавитационный эффект и, как следствие, разрыв слизистой оболочки, кровотечение.
| Осложнения | Количество, % | ||
|---|---|---|---|
Обусловленные наличием фрагментов камней |
«Каменная дорожка» |
4–7 |
|
Рост резидуальных фрагментов |
21–59 |
||
Почечная колика |
2–4 |
||
Инфекционные |
Бактериурия при неинфекционных конкрементах |
7,7–23 |
|
Сепсис |
1–2,7 |
||
Повреждение тканей |
Почечные |
Гематома, сопровождающаяся клиническими проявлениями |
<1 |
Бессимптомная гематома |
4–19 |
||
Сердечнососудистые |
Нарушения ритма |
11–59 |
|
Угрожающие жизни кардиогенные состояния |
Единичные случаи |
||
Желудочнокишечные |
Перфорация кишечника |
Единичные случаи |
|
Связь между ДУВЛ, артериальной гипертензией и диабетом остается неясной. Опубликованные данные противоречивы и не дают возможности сделать четкие выводы [40, 193-195].
Влияние дистанционной ударно-волновой литотрипсии на функцию почки
По имеющимся данным, ДУВЛ не приводит к острому повреждению почек и повышению концентрации в крови маркера повреждения почечной паренхимы (NGAL) [196].
| Рекомендации | УД | СР |
|---|---|---|
При лечении конкрементов в мочеточнике с помощью ДУВЛ рутинное стентирование не рекомендуется |
1b |
A |
Оптимальная частота ударной волны составляет 1,0–1,5 Гц [176] |
1a |
A |
Необходимо обеспечить правильное использование контактного геля, так как от этого непосредственно зависит эффективность проведения ударной волны [180] |
2a |
B |
Следует проводить процедуру под тщательным рентгеноскопическим и/ или ультразвуковым контролем |
4 |
A |
Следует применять адекватную анестезию, поскольку это благоприятно сказывается на результатах лечения, предупреждая вызванные болью движения пациента и увеличение дыхательной экскурсии |
4 |
C |
В случае инфекционных конкрементов, бактериурии, наличии стента перед ДУВЛ необходимо назначение антибиотиков |
4 |
C |
ЭНДОСКОПИЧЕСКИЕ МЕТОДЫ УДАЛЕНИЯ КАМНЕЙ
Уретероскопия
Эффективность эндоскопических методов в удалении камней не уступает, а при крупных и сложных камнях превосходит ДУВЛ. До сих пор не прекращаются дебаты относительно выбора метода удаления камней почек больших размеров. Приблизительно в 15–20% случаев при контактной уретеролитотрипсии (особенно при камнях верхней трети мочеточника) конкременты мигрируют в почку, что требует выполнения в последующем ДУВЛ. В то же время УРС в 18–20% случаев позволяет ликвидировать «каменные дорожки», образующиеся после ДУВЛ. Таким образом, ДУВЛ и УРС служат взаимодополняющими миниинвазивными методами удаления камней мочеточников, сочетание которых позволяет добиться 98–99% эффективности.
Противопоказания
Кроме общих противопоказаний, например, относящихся к общей анестезии или неконтролируемой ИМП, либо наличия аденомы предстательной железы больших размеров, УРС может проводиться всем пациентам без каких-либо особых ограничений. Специфические проблемы, такие, как стриктура мочеточника, выраженная девиация мочеточника, могут не позволить успешно выполнить ретроградное вмешательство на мочеточнике. В случае затрудненного доступа к мочеточнику альтернативой его дилатации может служить установка J-J-стента (пассивная дилатация) с последующим проведением УРС через 5–7 дней (Smith’s textbook of endourology, 2012).
Кожухи для доступа в мочеточник
Кожухи с гидрофильным покрытием для доступа в мочеточник обычно имеют внутренний диаметр 9 Шр и выше, их можно вводить в мочеточник с помощью проводника и устанавливать в проксимальный отдел мочеточника. Кожухи обеспечивают свободный многократный доступ к верхним мочевыводящим путям, а также значительно облегчают проведение УРС. Использование кожухов для доступа в мочеточник помогает улучшить качество изображения за счет постоянного оттока жидкости, снижая при этом внутрипочечное давление и уменьшая потенциальную продолжительность операции [197, 198]. Применение кожухов для доступа в мочеточник может приводить к повреждениям мочеточника до 40%, однако в настоящее время данные, свидетельствующие о долгосрочных последствиях, отсутствуют [199]. Использование кожухов для доступа в мочеточник определяется предпочтениями хирурга.
Профилактика осложнений уретероскопии
-
Выполнение УРС под рентгенотелевизионным контролем (особенно при длительно стоящих камнях).
-
Комплексная и противовоспалительная предоперационная подготовка почки к УРС.
-
Предоперационное дренирование почки при длительно стоящих и крупных камнях мочеточника с урете рогидронефрозом выше места расположения камня.
Использование проводников при уретероскопии
Прекращение лечения ингибиторами агрегации тромбоцитов/антикоагулянтами. Эта мера в ряде случаев может быть необязательной, поскольку УРС может проводиться пациентам с нарушением свертываемости крови, при этом отмечается лишь умеренное увеличение осложнений [200, 201].
Дренирование почки катетером или стентом после УРС не обязательно. При непродолжительной (до 45 мин) и без бужирования устья УРС и атравматичном удалении небольшого камня катетер можно не устанавливать. Однако большинство урологов продолжают устанавливать стент после УРС, хотя, как показывают результаты нескольких рандомизированных проспективных исследований, рутинного стентирования выполнение УРС (с полным удалением конкрементов) не требует (УД: 1a); стентирование может быть связано с более высокой частотой побочных эффектов [202-205]. С тем же успехом возможна установка постоянного мочеточникового катетера на более короткое время (1 день). Стент следует устанавливать пациентам с повышенным риском развития осложнений (например, при миграции фрагментов в почку, кровотечении, перфорации, ИМП и беременности). Также стент следует устанавливать во всех сомнительных случаях, чтобы избежать стрессовых неотложных ситуаций. Оптимальная продолжительность стентирования не определена. Большинство урологов предпочитают устанавливать его после УРС на 1–2 нед. Впоследствии пациентам следует проводить обзорный снимок органов мочевой системы, КТ или УЗИ.
α-Адреноблокаторы уменьшают неприятную симптоматику, связанную со стентированием мочеточника, и улучшают его переносимость (УД: 1a) [205]. Недавно опубликованный метаанализ приводит доказательства в пользу улучшения переносимости стентирования мочеточника при приеме тамсулозина [206].
Средняя частота осложнений УРС составляет 9–25% [40, 207] (табл. 4.12). Большинство из них незначительны и не требуют вмешательства. Отрыв и стриктура мочеточника являются серьезными осложнениями, но в настоящее время среди опытных хирургов они отмечаются крайне редко (<1%).
| Осложнения | Частота, % |
|---|---|
Внутриоперационные |
3,6 |
Повреждение слизистой оболочки |
1,5 |
Перфорация мочеточника |
1,7 |
Значительное кровотечение |
0,1 |
Отрыв мочеточника |
0,1 |
Ранние осложнения |
6,0 |
Лихорадка или уросепсис |
1,1 |
Стойкая гематурия |
2,0 |
Почечная колика |
2,2 |
Поздние осложнения |
0,2 |
Стриктура мочеточника |
0,1 |
Стойкий пузырно-мочеточниковый рефлюкс |
0,1 |
ДУВЛ |
УРС |
|||
Пациенты |
Мед/95% ДИ |
Пациенты |
Мед/95% ДИ |
|
Дистальный отдел |
||||
Сепсис |
6 |
3% |
7 |
2% |
2019 |
(2–5)% |
1954 |
(1–4)% |
|
Каменная дорожка |
1 |
4% |
||
26 |
(0–17)% |
|||
Дистальный отдел |
||||
Стриктура |
2 |
0% |
16 |
1% |
609 |
(0–1)% |
1911 |
(1–2)% |
|
Повреждение мочеточника |
1 |
1% |
23 |
3% |
45 |
(0–5)% |
4529 |
(3–4)% |
|
Мочевая инфекция |
3 |
4% |
3 |
4% |
87 |
(1–12)% |
458 |
(2–7)% |
|
Средний отдел |
||||
Сепсис |
2 |
5% |
4 |
4% |
398 |
(0–20)% |
199 |
(1–11)% |
|
Каменная дорожка |
1 |
8% |
||
37 |
(2–20)% |
|||
Стриктура |
1 |
1% |
7 |
4% |
43 |
(0–6)% |
326 |
(2–7)% |
|
Повреждение мочеточника |
10 |
6% |
||
514 |
(3–8)% |
|||
Мочевая инфекция |
1 |
6% |
1 |
2% |
37 |
(1–16)% |
63 |
(0–7)% |
|
Проксимальный отдел |
||||
Сепсис |
5 |
3% |
8 |
4% |
704 |
(2–4)% |
360 |
(2–6)% |
|
Каменная дорожка |
3 |
5% |
1 |
0% |
235 |
(2–10)% |
109 |
(0–2)% |
|
Стриктура |
2 |
2% |
8 |
2% |
124 |
(0–8)% |
987 |
(1–5)% |
|
Повреждение мочеточника |
2 |
2% |
10 |
6% |
124 |
(0–8)% |
1005 |
(3–9)% |
|
Мочевая инфекция |
5 |
4% |
2 |
4% |
360 |
(2–7)% |
224 |
(1–8)% |
|
Согласно данным крупнейшего мультицентрового исследования по уретероскопии, включившим 11 885 пациентов [267], эффективность метода составила 85,6%, 89,4 из них не требовали дальнейшего лечения, частота осложнений составила:
Лечение при осложнениях
-
Обязательное дренирование почки: пункционная нефростомия или установка внутреннего стента.
-
Активная противовоспалительная дезинтоксикационная терапия на фоне дренирования при развитии острого пиелонефрита.
-
Открытая операция (уретеро-уретероанастомоз + нефростомия + интубация мочеточника) при отрыве мочеточника.
| Рекомендации | УД | СР |
|---|---|---|
Если говорить о гибких инструментах, в настоящее время наиболее эффективным аппаратом считается гольмиевый лазер |
||
Рекомендуется установка в мочеточник страховочного проводника |
A* |
|
Не следует выполнять извлечение конкрементов с помощью корзинки без эндоскопической визуализации («слепое» извлечение корзинкой) |
4 |
A* |
При выполнении гибкой УРС предпочтительно использовать литотрипсию гольмиевым лазером |
3 |
B |
Чрескожная нефролитотрипсия и литоэкстракция
Единственным недостатком чрескожной нефролитотрипсии и литоэкстракции (ПНЛ) являются ее инвазивность, необходимость в наркозе и травматичность как на этапе доступа к ЧЛС почки, так и непосредственно при сеансе литотрипсии, как следствие — больший риск осложнений, особенно на этапе овладения методом. Совершенствование эндоскопического оборудования и инструментария для дренирования почки позволило существенно снизить риск травматических осложнений. Квалифицированная подготовка уролога, знание топографической анатомии и владение ультразвуковыми методами диагностики обязательны для эффективного проведения операции, так как эффективность результата ПНЛ и процент осложнений зависят от самого ответственного этапа операции — создания доступа и бужирования хода. Современные исследования кривой обучения выделяют следующие этапы: 24 — средний уровень, 60 — мастер, более 115 — экспертный уровень [208-210].
В зависимости от места расположения камня, вход в полостную систему почки осуществляется через чашечки нижней, средней либо верхней группы. При коралловидных или множественных камнях возможно дробление через два нефростомических хода и более. Для облегчения визуализации чашечек и в целях предотвращения миграции разрушенных фрагментов в мочеточник перед операцией устанавливается катетер, оптимально обтурационный с баллоном с пиелографией.
Используя электрогидравлический, ультразвуковой, пневматический, электроимпульсный или лазерный литотриптер, проводят разрушение камня и одновременную литоэкстракцию фрагментов. Специальный кожух, не теряя нефротомического хода, позволяет не только удалять крупные фрагменты, но и препятствует повышению внутрилоханочного давления. Разработка нового миниатюрного эндоскопического инструментария (мини, ультрамини, микромини и микроперк) позволила существенно расширить показания к применению ПНЛ. Операцию заканчивают установкой через нефротомический ход дренажа, стента либо вовсе без дренирования. Принятие решения, как будет дренироваться почка после операции, лежит на оперирующем урологе, основывается на следующих параметрах:
Предоперационная визуализация
Что касается ПНЛ, информацию об органах, расположенных по ходу прохождения инструментов при осуществлении доступа к ЧЛС (например, селезенке, печени, толстой кишке, плевре, легкому), можно получить с помощью УЗИ или КТ [211]. Адекватная визуализация позволяет избежать такого грозного осложнения, как повреждение кишки. Последнее возможно у пациентов с аномальным ретроренальным расположением отделов толстой кишки, встречаемого с частотой до 1%. Частота встречаемости подобной позиции кишки составляет от 1 до 10% и зависит от положения пациента (на животе или на спине) [212, 213].
Положение пациента
Традиционно пациент при ПНЛ находится в положении лежа на животе. Также возможно выполнение операции в положении лежа на спине с подложенным под поясницу валиком или без него. Оба положения одинаково безопасны. Достоинствами положения лежа на спине при ПНЛ являются [214, 215]:
Существуют работы, свидетельствующие о том, что интерпозиция толстой кишки по ходу пункционного канала встречается реже при положении на спине [215, 216].
Кроме того, заболевания сердечно-сосудистой системы не позволяют больному длительно находиться на животе.
Пункция
Как отмечено выше, расположение толстой кишки на пути доступа к почке может привести к ее повреждению. Хотя такие повреждения случаются довольно редко, они более вероятны при операции на левой почке и положении больного на животе. Предоперационная МСКТ с контрастированием либо интраоперационное УЗИ позволяют идентифицировать ткани, расположенные между кожей и почкой, уменьшая риск повреждений кишечника [216-219]. Пункция лоханки должна осуществляться только под рентгенотелевизионным контролем с предварительной ретроградной пиелографией либо под УЗИ-наведением.
Дилатация
Расширения чрескожного доступа осуществляется с помощью металлических телескопических бужей, одиночных или баллонного тефлоновых дилататоров. Разница в результатах в большей степени зависит от подготовленности и опыта оперирующего хирурга, чем от выбора инструмента [217]. Результаты глобального исследования CROES свидетельствуют о предпочтительности небаллонного бужирования [219].
Нефростомия и стентирование
Решение вопроса об оставлении нефростомического дренажа после ПНЛ зависит от нескольких факторов, среди которых:
Есть данные, свидетельствующие о том, что установка нефростом большего размера ассоциирована с меньшей вероятностью кровотечений в послеоперационном периоде [220].
Бездренажной (tubless) ПНЛ называется литотрипсия, которая выполняется без установки нефростомического дренажа. Если не устанавливается ни нефростомический дренаж, ни мочеточниковый стент, такую операцию называют полностью бездренажной (totally tubless) ПНЛ. Выполнение полностью бездренажной ПНЛ возможна при МИНИ-ПЕРКе и в неосложненных случаях, что позволяет сократить время пребывания в стационаре и более раннюю реабилитацию без каких-либо отрицательных последствий для пациента [221-228].
Противопоказания
К противопоказаниям к ПНЛ следует отнести все противопоказания к общей анестезии. Также она противопоказана пациентам, получающим антикоагулянтную терапию. Последние должны тщательно наблюдаться до и после операции. Антитромботическая терапия должна быть прекращена перед проведением ПНЛ в соответствии с механизмом действия препарата и по рекомендации кардиолога и может быть возвращена не ранее 5 сут после операции во избежание геморрагических осложнений [229]. Для снижения риска тромбоэмболии на период отмены антикоагулянтной терапии показаны компрессия нижних конечностей (трикотажная либо пневматическая) и ранняя активизация.
Другие важные противопоказания:
Осложнения чрескожной нефролитотрипсии и литоэкстракции (табл. 4.14)
| Осложнения | Диапазон, % | n=11,929, % | УД |
|---|---|---|---|
Гемотрансфузия |
0–20 |
7 |
1a |
Эмболизация |
0–1,5 |
0,4 |
|
Мочевой затек |
0–1 |
0,2 |
|
Лихорадка |
0–32,1 |
10,8 |
|
Сепсис |
0,3–1,1 |
0,5 |
|
Торакальные осложнения |
0–11,6 |
1,5 |
|
Повреждения органов |
0–1,7 |
0,4 |
|
Смерть |
0–0,3 |
|
|
Согласно данным глобального исследования CROES, в которое было включено 5803 пациента [230], показатель полного избавления от камней составил 75,7%, а 84,5% не требовали дополнительного лечения.
У 85,5% не наблюдалось каких-либо осложнений. Среди наблюдавшихся осложнений отмечено: кровотечение (7,8%), перфорации ЧЛС (3,4%), гидроторакс (1,8%), гемотрансфузии (5,7%), лихорадка >38,5 °C (10,5%).
По классификации Clavien (79,5%), I (11,1%), II (5,3%), IIIa (2,3%), IIIb (1,3%), IVa (0,3%), IVb (0,2%), V (0,03%).
Профилактика осложнений чрескожной нефролитотрипсии и литоэкстракции
-
Квалифицированная сертифицируемая подготовка специалистов по эндоурологии.
-
Трансуретральное дренирование почки катетером как возможность выполнения пиелографии и создание условий для пункции, профилактика миграции фрагментов.
-
Владение ультразвуковой диагностикой позволит минимизировать процент осложнений на этапе пункции.
-
Установка в лоханку страховой струны позволит при любой ситуации восстановить нефротомический ход.
-
Недопустимо неконтролируемое введение ирригационных растворов.
Согласно данным глобального исследования CROES [231], позитивный посев отмечается у 16% пациентов, подвергающихся ПНЛ. 40% из числа пациентов с позитивным посевом приходится на E. coli. Лихорадка отмечается у 8,8% с негативным посевом и у 18,2% с позитивным. В 10% лихорадка наблюдается, несмотря на антибактериальную терапию. Факторами риска служат коралловидный камень, позитивный посев, нефростома и сахарный диабет. В другом исследовании [232] было показано, что превентивная антибактериальная терапия пациентов с негативным посевом мочи снижает частоту инфекционных осложнений — 2,5% по сравнению с 7,4%.
Мини-перкутанные операции
Ряд исследований [233-235] свидетельствуют о том, что минии ультрамини-перкутанные вмешательства могут выполняться с одинаковой эффективностью, что и стандартные операции. К преимуществам данной методики следует прежде всего отнести меньший риск кровотечения, однако в литературе отсутствуют результаты крупных исследований высокого качества, поддерживающие данное утверждение путем прямого сравнения стандартной методики и мини-перкутанного вмешательства. Отдельного внимания заслуживает микроперкутанная операция: данная техника подразумевает доступ к почке и удаление камня через инструмент (иглу) размером 4,85 Fr. Согласно проведенным исследованиям, данный метод позволяет удалять небольшие конкременты с эффективностью, сопоставимой со старндартной ПНЛ, при этом частота гемотрансфузии составляет не более 0,71%.
В табл. 4.15 указаны рекомендованные методы удаления конкрементов в зависимости от их размеров и состава.
| Тип конкремента | Камни почек размером менее 2 см | Камни почек размером более 2 см | Полные или частичные коралловидные камни |
|---|---|---|---|
Рентгенопозитивные камни |
ДУВЛ |
ПНЛ ПНЛ |
ПНЛ |
Инфицированные камни, камни на фоне инфекции |
Антибактериальная терапия + ДУВЛ |
Антибактериальная терапия + ПНЛ |
ПНЛ |
Камни из мочевой кислоты |
Литолитическая терапия. |
Литолитическая терапия |
Литолитическая терапия |
Цистиновые камни |
ДУВЛ ПНЛ УРС |
ПНЛ УРС |
ПНЛ |
Для конкрементов больших размеров (более 2 см) или высокой плотности, плохо поддающихся ДУВЛ, чрескожное удаление камня — лучшая альтернатива для лечения МКБ. Эффективность одноэтапной ПНЛ достигает 74–85%. При комбинированном подходе ПНЛ и ДУВЛ эффективность всего 66% (AUA, Guidelines on staghorn calculi, 2009).
В то же время низкая плотность мочевых камней и высокая эффективность ДУВЛ, быстрое отхождение фрагментов по мочевыводящим путям делают метод приоритетным при дроблении даже крупных камней почек. Исследование отдаленных результатов (5–8 лет) применения ДУВЛ у детей не выявило ни у одного больного травматического повреждения почки (Дзеранов Н.К., 1998).
| Рекомендации | УД | СР |
|---|---|---|
При проведении контактной литотрипсии в течение ПНЛ рекомендуется использовать ультразвуковые, пневматические и гольмиевые литотриптеры |
A |
|
Если говорить о гибких инструментах, в настоящее время наиболее эффективным аппаратом считается гольмиевый лазер |
||
Перед ПНЛ обязательно проведение визуализации мочевыводящих путей с контрастированием для получения полной информации о камне, анатомических особенностях ЧЛС и обеспечения безопасного доступа к конкременту почки |
A |
|
В несложных случаях бездренажная или полностью ПНЛ является безопасным альтернативным методом |
1b |
A |
Следует назначать непродолжительный профилактический курс антибиотиков |
4 |
A |
ОТКРЫТОЕ И ЛАПАРОСКОПИЧЕСКОЕ УДАЛЕНИЕ КАМНЕЙ ПОЧЕК
Во всех случаях, когда мини-инвазивные методы (ДУВЛ, УРС, ПНЛ) не могут быть применены по техническим либо медицинским показаниям, больным проводят открытую или лапароскопическую операцию.
Эффективность ДУВЛ и эндоурологической хирургии (УРС и ПНЛ) значительно уменьшили количество показаний к открытым операциям, которые теперь являются методами терапии второй и третьей линии и применяются только в 1,0–5,4% случаев [236-240]. Открытые операции составляют около 1,5% всех вмешательств по поводу удаления конкрементов в развитых странах, а в развивающихся государствах количество таких операций за последние годы снизилось с 26 до 3,5% [238, 240]. Однако открытые операции все еще необходимы в сложных случаях, когда требуются навыки и опыт выполнения таких открытых хирургических вмешательств на почках и мочеточнике, как обширная пиелолитотомия, пиелонефролитотомия, анатрофическая нефролитотомия, множественная радиальная нефротомия, резекция почки и операции на почках с гипотермией [241-245].
Недавно для определения бессосудистых участков в паренхиме почек, расположенных близко к конкременту или чашечкам, были применены интраоперационное сканирование в В-режиме и допплерография. Это позволяет удалять крупные коралловидные конкременты с помощью множества небольших радиальных разрезов без потери почкой ее функции. Оценка эффективности открытых операций по сравнению с малоинвазивными методами при сравнении частоты полного избавления от конкрементов должна проводиться на основании данных анамнеза. Однако в настоящий момент нет доступных данных сравнительных исследований в этой области [246-249].
Виды открытых операций
Показания к открытой операции
-
Неэффективность или невозможность проведения ДУВЛ и/или ПНЛ, а также уретероскопической операции.
-
Анатомические аномалии почки: инфундибулярный стеноз, конкремент в дивертикуле чашечки (особенно в передней чашечке), обструкция лоханочно-мочеточникового сегмента, стриктура.
-
Деформация опорно-двигательного аппарата, контрактуры, стойкая деформация таза и нижних конечностей.
-
Нефункционирующий нижний полюс (резекция почки), нефункционирующая почка (нефрэктомия).
-
Выбор пациента после неэффективной минимально инвазивной операции (пациент может отдать предпочтение одной операции, чтобы не подвергаться риску многократных вмешательств).
-
Конкремент в аномально расположенной почке, при которой чрескожный доступ и ДУВЛ могут быть затруднены или невозможны.
-
В педиатрии учитываются те же факторы, что и при лечении взрослых пациентов.
Существует единодушное мнение специалистов, что наиболее сложные случаи МКБ, включая случаи коралловидных конкрементов, должны лечиться в первую очередь с помощью ПНЛ или комбинации ПНЛ и ДУВЛ. Если велика вероятность, что допустимое количество чрескожных вмешательств окажется неэффективным, или если неоднократные эндоурологические операции не привели к желаемому результату, то приемлемым способом лечения является открытая операция.
Осложнения открытых операций
Осложнения можно разделить на общие и урологические.
К общим осложнениям относят обострение следующих сопутствующих заболеваний.
Профилактика осложнений
-
Выполнение высококвалифицированными урологами (особенно при повторных операциях).
-
Минимальная травматизация почечной паренхимы во время операции.
-
Выполнение пиелонефролитотомий при пережатой почечной артерии.
-
Адекватное дренирование почки нефростомическим дренажом достаточного диаметра (16–18 Сн) с фиксацией ее к паренхиме и коже.
-
Герметичное ушивание разреза почечной лоханки и лигирование раненых сосудов.
-
Тщательный уход и наблюдение за работой нефростомического дренажа.
-
Наибольшее количество (до 75%) осложнений регистрируют при повторных операциях, когда в силу рубцовых процессов изменяется топографическая анатомия забрюшинного пространства.
Лапароскопические операции
Открытые операции стремительно вытесняются лапароскопическими вмешательствами. В настоящее время лапароскопическая хирургия применяется для удаления конкрементов как почек, так и мочеточников в определенных ситуациях, например при сложных формах конкрементов, при неэффективности проведенной ДУВЛ и/или эндоурологических операций, анатомических аномалиях и тяжелой степени ожирения, а также если запланирована нефрэктомия по поводу нефункционирующей почки с конкрементом. Несмотря на то что пиелолитотомия применяется редко (см. ниже), в отдельных случаях может выполняться лапароскопическое удаление камня с резекцией и пластикой расширенной лоханки [250] или конкремента дивертикула передней чашечки [251]. Частота полного избавления от конкрементов при ПНЛ и лапароскопической ретроперитонеальной пиелолитотомии представляется одинаковой, однако при применении лапароскопического доступа более высок риск осложнений [252]. Кроме того, лапароскопическая нефролитотомия как малоинвазивный способ эффективна при удалении сложных коралловидных камней. ПНЛ является методом выбора, в то время как лапароскопическое удаление конкрементов следует отнести к резервным методам, применяемым в отдельных случаях [253, 255].
Это довольно несложная операция, при которой, при условии наличия опыта лапароскопической хирургии, частота полного избавления от конкрементов достигает 100% [256-259]. В большинстве случаев она может заменить открытую операцию [248, 259]. В специальной литературе описаны как ретроперитонеальный, так и трансперитонеальный лапароскопические доступы ко всем участкам мочеточника [258, 260-265]. Лапароскопическая уретеролитотомия в дистальном отделе мочеточника несколько уступает по эффективности операции в среднем и проксимальном отделах, но размер конкремента не влияет на результат операции. Несмотря на свою эффективность, в большинстве случаев лапароскопическая уретеролитотомия не считается терапией первой линии ввиду ее инвазивности, более длительного срока восстановления и более высокого риска осложнений по сравнению с ДУВЛ и УРС [255-258].
Показания к лапароскопическому удалению конкремента
-
Показания к лапароскопическому удалению камней почек включают:
-
Показания к лапароскопическому удалению камней мочеточника включают:
-
необходимость хирургического вмешательства по поводу сопутствующих заболеваний;
-
когда другие неинвазивные или малоинвазивные вмешательства оказались неэффективными;
-
в отношении камней верхнего отдела мочеточника лапароскопическая уролитотомия имеет более высокую частоту полного избавления от конкрементов по сравнению с УРС и ДУВЛ [266] (УД: 1b).
| Рекомендации | УД | СР |
|---|---|---|
Лапароскопическую или открытую операцию по поводу конкрементов можно выполнять в отдельных случаях, когда ДУВЛ и УРС либо оказались неэффективными, либо имеют низкие шансы на успех |
3 |
C |
При наличии соответствующего опыта, прежде чем рассматривать открытую операцию, следует отдать предпочтение лапароскопическому вмешательству. Исключения составляют сложная форма и/или локализация конкрементов почек |
3 |
C |
Лапароскопическое удаление камней мочеточника рекомендуется при наличии крупных вколоченных конкрементов либо в тех случаях, когда эндоскопическая литотрипсия и ДУВЛ оказались неэффективными |
2 |
B |
ПРОФИЛАКТИЧЕСКОЕ ЛЕЧЕНИЕ БОЛЬНЫХ КАЛЬЦИЕВОЙ ФОРМОЙ УРОЛИТИАЗА
Лечение необходимо начинать с консервативных мероприятий. Фармакологическое лечение назначают только в том случае, когда консервативный режим оказался неэффективным.
У здорового взрослого человека суточный диурез должен составлять 2000 мл, однако необходимо использовать уровень гипернасыщенности мочи как показатель степени растворения в ней веществ.
Диета должна содержать разнообразные продукты, различные по химическому составу; нужно избегать всевозможных излишеств.
В основе рекомендаций по питанию лежат индивидуальные нарушения обмена каждого конкретного больного.
ФАРМАКОЛОГИЧЕСКОЕ ЛЕЧЕНИЕ БОЛЬНЫХ КАЛЬЦИЕВОЙ ФОРМОЙ УРОЛИТИАЗА
Рекомендации по фармакологическому лечению уролитиаза представлены в табл. 4.16.
| Лечение | Группы |
|---|---|
Тиазидные диуретики. |
Гиперкальциурия. |
Цитратные смеси |
Гипоцитратурия. |
Аллопуринол/фебуксостат℘ |
Гиперурикозурия |
Пиридоксин |
Первичная гипероксалурия 1-го типа. |
Препараты кальция |
Кишечная гипероксалурия |
Ортофосфат℘ (это не препарат первой линии, но его можно использовать у пациентов с гиперкальциурией с непереносимостью тиазидных диуретиков) |
Гиперкальциурия |
Назначение тиазидов повышает реабсорбцию кальция в проксимальных и дистальных канальцах, снижая его экскрецию мочой. Альтернативой может служить назначение ортофосфатов (ингибиторов кристаллизации) и ингибиторов простагландина (диклофенак, индометацин).
Назначение натрия гидрокарбоната (4–5 мг/сут) показано пациентам, устойчивым к терапии цитратными смесями.
Два вида камней из фосфата кальция формируются и зависят от рН мочи. Струвитные камни (смесь аммония магния фосфата и карбонатного апатита) встречаются в инфицированной щелочной моче. Только максимально полное удаление камней может дать результат последующей метафилактики. Брушиты формируются в моче рН, диапазон которой варьирует от 6,5–6,8 — не связан с инфекцией.
ФАРМАКОЛОГИЧЕСКОЕ ЛЕЧЕНИЕ БОЛЬНЫХ УРОЛИТИАЗОМ В ПРИСУТСТВИИ ИНФЕКЦИИ
У пациентов, у которых камни состоят из магния-аммония фосфата и карбонат-апатита, что вызвано уреаза-синтезирующими микроорганизмами, во время операции необходимо добиваться настолько полного удаления конкрементов, насколько это возможно. Антибактериальную терапию назначают в соответствии с данными посева мочи. Рекомендованы длительные курсы антибактериальной терапии для максимальной санации мочевыводящих путей.
ФАРМАКОЛОГИЧЕСКОЕ ЛЕЧЕНИЕ БОЛЬНЫХ УРАТНОЙ ФОРМОЙ УРОЛИТИАЗА
Предотвратить формирование камней из мочевой кислоты можно назначением большого количества жидкости (соответственно с диурезом более 2000 мл/сут). Нормализации содержания мочевой кислоты можно достичь строгим соблюдением диеты. Увеличение растительных продуктов и уменьшение мясных, содержащих много пуринов, позволит предотвратить рецидив камнеобразования.
Подщелачивание мочи имеет основное значение, поэтому 3–7 ммоль калия гидрокарбоната и/или 9 ммоль натрия цитрата назначают 2 или 3 раза в сутки. В тех случаях, когда сывороточная концентрация уратов или мочевой кислоты повышена, показан аллопуринол в суточной дозе 300 мг или фебуксостат℘ 80–120 мг в день. Чтобы достичь растворения камней, состоящих из мочевой кислоты, необходимо потребление большого количества жидкости в комбинации с приемом 6–10 ммоль калия гидрокарбоната и/или 9–18 ммоль натрия цитрата 5 раз в сутки, а также 300 мг аллопуринола, когда содержание уратов в сыворотке крови и моче нормальное.
Химическое растворение камней из урата аммония невозможно.
ФАРМАКОЛОГИЧЕСКОЕ ЛЕЧЕНИЕ БОЛЬНЫХ ЦИСТИНОВОЙ ФОРМОЙ УРОЛИТИАЗА
Потребление жидкости должно составлять более 3000 мл/сут. Чтобы достичь этого, необходимо пить 150 мл жидкости каждый час. Подщелачивание необходимо проводить до тех пор, пока рН мочи не закрепится в пределах более 7,5. Этого можно добиться, принимая 3–10 ммоль калия гидрокарбоната, разделенных на 2–3 дозы. Пациентам с суточным уровнем экскреции цистина более 3 ммоль необходимо применение 250–2000 мг тиопронина℘ в сутки или 75–150 мг каптоприла в сутки.
Заключение
Формирование конкрементов в мочевом тракте — патологическое состояние, которое поражает людей разных возрастных групп большинства стран мира и имеет широкую распространенность. Таким образом, уролитиаз и рецидивный его характер, нередко тяжелые осложнения и инвалидизация пациентов имеют большое медико-социальное значение для здравоохранения в целом. Пациенты с мочекаменной болезнью должны находиться под постоянным диспансерным наблюдением и лечиться не менее 5 лет после полного удаления камня. Коррекция метаболических нарушений должна осуществляться урологами с подключением к лечебному процессу консультантов: эндокринологов, диетологов, гастроэнтерологов, педиатров. Важно не только удаление конкремента из мочевого тракта, но и предотвращение рецидивов камнеобразования, назначение соответствующей терапии, направленной на коррекцию метаболических нарушений для каждого конкретного пациента.
Наименее инвазивные технологии удаления конкрементов, широко внедренные в отечественную практику, позволили сделать один этап лечения МКБ относительно безопасным и рутинным. Отсутствие в арсенале лечебного учреждения малоинвазивных высокотехнологичных методов не может быть основанием для выполнения пациентам травматичных оперативных вмешательств. Настало время организации второго, наиболее важного и эффективного этапа лечения МКБ — консервативной и медикаментозной метафилактики. Это стало возможно с недавних пор, благодаря созданию «Национального регистра хирургического лечения мочекаменной болезни» (http:// uroreg.org/) при поддержке Российского общества урологов (Н. Гаджиев, В. Малхасян, Н. Тагиров, проф. Б. Гулиев, проф. А. Мартов, проф. С. Петров, проф. Д. Пушкарь), в котором выполняется не только мониторинг хирургического лечения мочекаменной болезни и ее метафилактики, но и также проводится анализ полученных данных для решения новых клинических вопросов и задач. И как следствие — улучшение результатов хирургического лечения МКБ.
ЛИТЕРАТУРА
-
Trinchieri A., Curhan G., Karlsen S., Jun Wu K. Epidemiology // Stone Disease / Eds J. Segura, P. Conort, S. Khoury. — Paris: Health Publications, 2003. — P. 13–30.
-
Stamatelou K.K., Francis M.E., Jones C.A., Nyberg L.M. Time trends in reported prevalence of kidney stones in the United States: 1976–1994 // Kidney Int. — 2003. — Vol. 63. — P. 1817–1823.
-
Allen A.R., Thompson E.M., Williams G., Watts R.W. et al. Selective renal transplantation in primary hyperoxaluria type 1 // Am. J. Kidney Dis. — 1996. — Vol. 27. P. 891–895.
-
Allerheiligen D.A., Schoeber J., Houston R.E., Mohl V.K. et al. Hyperparathyroidism // Am. Fam. Physician. — 1998. — Vol. 57. — P. 1795–1798.
-
Meyer J.L. Physicochemistry of stone formation // Urolithiasis: A Medical and Surgical Reference / Eds M.I. Resnick, C.Y.C. Pak. — Philadelphia: W.B. Saunders, 1990. — P. 11–34.
-
Werness P.G., Brown C.M., Smith L.H., Finlayson B. EQUIL2: a BASIC computer program for the calculation of urinary saturation // J. Urol. — 1985. — Vol. 134. — P. 1242–1244 .
-
Rodgers A., Allie-Hamdulay S., Jackson G. Therapeutic action of citrate in urolithiasis explained by chemical speciation: increase in pH is the determinant factor // Nephrol. Dial. Transplant. — 2006. — Vol. 21. — P. 361– 369.
-
Heidenreich A., Desgrandschamps F., Terrier F. Modern approach of diagnosis and management of acute flank pain: review of all imaging modalities // Eur. Urol. — 2002 Apr. — Vol. 41, N 4. P. 351–362.
-
Kennish S.J., Bhatnagar P., Wah T.M. et al. Is the KUB radiograph redundant for investigating acute ureteric colic in the non-contrast enhanced computed tomography era? // Clin. Radiol. — 2008 Oct. — Vol. 63, N 10. P. 1131–1135.
-
Ray A.A., Ghiculete D., Pace K.T. et al. Limitations to ultrasound in the detection and measurement of urinary tract calculi // Urology. — 2010 Aug. — Vol. 76, N 2. P. 295–300.
-
Elicker B.M., Cypel Y.S., Weinreb J.C. IV contrast administration for CT: a survey of practices for the screening and prevention of contrast nephropathy // AJR Am. J. Roentgenol. — 2006. — Vol. 186. P. 1651–1658.
-
Kim S.C., Burns E.K., Lingeman J.E. et al. Cystine calculi: correlation of CTvisible structure, CT number, and stonemorphology with fragmentation by shock wave lithotripsy // Urol. Res. — 2007 Dec. — Vol. 35, N 6. P. 319–324.
-
El-Nahas A.R., El-Assmy A.M., Mansour O. et al. A prospective multivariate analysis of factors predicting stone disintegration by extracorporeal shock wave lithotripsy: the value of high-resolution noncontrast computed tomography // Eur. Urol. — 2007 Jun. — Vol. 51, N 6. — P. 1688–1693; discussion 93–94.
-
Patel T., Kozakowski K., Hruby G. et al. Skin to stone distance is an independent predictor of stone-free status following shockwave lithotripsy // J. Endourol. — 2009 Sep. — Vol. 23, N 9. — P. 1383–1385.
-
Zarse C.A., Hameed T.A., Jackson M.E. et al. CT visible internal stone structure, but not Hounsfield unit value, of calcium oxalate monohydrate (COM) calculi predicts lithotripsy fragility in vitro // Urol. Res. — 2007 Aug. — Vol. 35, N 4. — P. 201–206.
-
Schwartz B.F., Schenkman N., Armenakas N.A. et al. Imaging characteristics of indinavircalculi // J. Urol. — 1999. — Vol. 161. — P. 1085–1087.
-
Sourtzis S., Thibeau J.F., Damry N. et al. Radiologic investigation of renal colic: unenhanced helical CT compared with excretory urography // AJR Am. J. Roentgenol. — 1999 Jun. — Vol. 172, N 6. — P. 1491–1494.
-
Miller O.F., Rineer S.K., Reichard S.R. et al. Prospective comparison of unenhanced spiral computed tomography and intravenous urogram in the evaluation of acute flank pain // Urology. — 1998 Dec. — Vol. 52, N 6. — P.982– 987.
-
Yilmaz S., Sindel T., Arslan G. et al. Renal colic: comparison of spiral C.T, US and IVU in the detection of ureteral calculi // Eur. Radiol. — 1998. — Vol. 8, N2. — P. 212–217.
-
Niall O., Russell J., MacGregor R. et al. A comparison of noncontrast computerized tomography with excretory urography in the assessment of acute flank pain // J.Urol. — 1999 Feb. — Vol. 161, N 2. — P. 534–537.
-
Wang J.H., Shen S.H., Huang S.S. et al. Prospective comparison of unenhanced spiral computed tomography and intravenous urography in the evaluation of acute renal colic // J. Chin. Med. Assoc. — 2008 Jan. — Vol. 71, N 1. — P.30–36.
-
Shine S. Urinary calculus: IVU vs. CT renal stone? A critically appraised topic // Abdom. Imaging. — 2008 Jan–Feb. — Vol. 33, N 1. — P. 41–43.
-
Thomson J.M., Glocer J., Abbott C. et al. Computed tomography versus intravenous urography in diagnosis of acute flank pain from urolithiasis: a randomized study comparing imaging costs and radiation dose // Australas Radiol. — 2001 Aug. — Vol. 45, N 3. — P. 291–297.
-
Kim S.C., Burns E.K., Lingeman J.E. et al. Cystine calculi: correlation of CTvisible structure, CT number, and stonemorphology with fragmentation by shock wave lithotripsy // Urol. Res. — 2007 Dec. — Vol. 35, N 6. — P. 319–324.
-
Jellison F.C., Smith J.C., Heldt J.P. et al. Efffect of low dose radiation computerized tomography protocols on distal ureteral calculus detection // J. Urol. — 2009 Dec. — Vol. 182, N 6. — P. 2762–2767.
-
Niemann T., Kollmann T., Bongartz G. Diagnostic performance of low-dose CT for the detection of urolithiasis: a meta-analysis // AJR Am. J. Roentgenol. — 2008 Aug. — Vol. 191, N 2. — P. 396–401.
-
Phillips E., Kieley S., Johnson E.B. et al. Emergency room management of ureteral calculi: current practices // J. Endourol. — 2009 Jun. — Vol. 23, N 6. — P. 1021– 1024.
-
Micali S., Grande M., Sighinolfi M.C. et al. Medical therapy of urolithiasis // J.Endourol. — 2006 Nov. — Vol. 20, N 11. — P. 841–847.
-
Engeler D.S., Schmid S., Schmid H.P. The ideal analgesic treatment for acute renal colic-theory and practice // Scand. J. Urol. Nephrol. — 2008. — Vol. 42, N2. — P. 137–142.
-
Shokeir A.A., Abdulmaaboud M., Farage Y. et al. Resistive index in renal colic: the efffect of nonsteroidal antiinflammatorydrugs // BJU Int. — 1999 Aug. — Vol. 84, N 3. — P. 249–251.
-
Ebell M.H. NSAIDs vs. opiates for pain in acute renal colic // Am. Fam. Physician. — 2004 Nov. — Vol. 70, N 9. — P. 1682.
-
Holdgate A., Pollock T. Systematic review of the relative effificacy of non-steroidal anti-inflammatory drugs and opioids in the treatment of acute renal colic // BMJ. — 2004 Jun. — Vol. 328, N 7453. — P. 1401.
-
Lee A., Cooper M.G., Craig J.C. et al. Efffects of nonsteroidal anti-inflammatory drugs on postoperative renal function in adults with normal renal function // Cochrane Database Syst. Rev. — 2007. — Vol. 18, Issue 2:CD002765.
-
Seitz C., Liatsikos E., Porpiglia F. et al. Medical therapy to facilitate the passage of stones: What Is the Evidence? // Eur. Urol. — 2009 Sep. — Vol. 56, N 3.4. — P.55–71.
-
Ramsey S., Robertson A., Ablett M.J. et al. Evidence-based drainage of infected hydronephrosis secondary to ureteric calculi // J. Endourol. — 2010 Feb. — Vol. 24, N 2. — P. 185–189.
-
Lynch M.F., Anson K.M., Patel U. Percutaneous nephrostomy and ureteric stent insertion for acute renal deobstruction. Consensus based guidelines // Br. J.Med. Surg. Urol. — 2008 Nov. — Vol. 1, N 3. — P. 120–125.
-
Pearle M.S., Pierce H.L., Miller G.L. et al. Optimal method of urgent decompression of the collecting system for obstruction and infection due to ureteral calculi // J. Urol. — 1998 Oct. — Vol. 160, N 4. — P. 1260–1264.
-
Mokhmalji H., Braun P.M., Portillo F.J. et al. Percutaneous nephrostomy versus ureteral stents for diversion of hydronephrosis caused by stones: A prospective, randomized clinical trial // J. Urol. — 2001 Apr. — Vol. 165, N 4. — P. 1088– 1092.
-
Skolarikos A., Laguna M.P., Alivizatos G. et al. The role for active monitoring in urinary stones: a systematic review // J. Endourol. — 2010 Jun. — Vol. 24, N6. — P. 923–930.
-
Preminger G.M., Tiselius H.G., Assimos D.G. et al. American Urological Association Education and Research, Inc; European Association of Urology. 2007 Guideline for the management of ureteral calculi // Eur. Urol. — 2007 Dec. — Vol. 52, N 6. — P. 1610–1631.
-
Miller O.F., Kane C.J. Time to stone passage for observed ureteral calculi: a guide for patient education // J. Urol. — 1999 Sep. — Vol. 162, N 3. — Pt 1. — P.688–690; discussion 690–691.
-
Glowacki L.S., Beecroft M.L., Cook R.J. et al. The natural history of asymptomatic urolithiasis // J. Urol. — 1992 Feb. — Vol. 147, N 2. — P. 319–321.
-
Burgher A., Beman M., Holtzman J.L. et al. Progression of nephrolithiasis: long-term outcomes with observation of asymptomatic calculi // J. Endourol. — 2004 Aug. — Vol. 18, N 6. — P. 534–539.
-
Hubner W., Porpaczy P. Treatment of caliceal calculi // Br. J. Urol. — 1990 Jul. — Vol. 66, N 1. — P. 9–11.
-
_Inci K., Sahin A., Islamoglu E. et al. Prospective long-term followup of ptients with asymptomatic lower pole caliceal stones // J. Urol. — 2007 Jun. — Vol. 177, N6. — P. 2189−2192.
-
Keeley F.X. Jr, Tilling K., Elves A. et al. Preliminary results of a randomized controlled trial of prophylactic shock wave lithotripsy for small asymptomatic renal calyceal stones // BJU Int. — 2001 Jan. — Vol. 87, N 1. — P. 1–8.
-
Osman M.M., Alfano Y., Kamp S. et al. 5-year-follow-up of patients with clinically insignificant residual fragments after extracorporeal shockwave lithotripsy // Eur. Urol. — 2005 Jun. — Vol. 47, N 6. — P. 860–864.
-
Collins J.W., Keeley F.X. Is there a role for prophylactic shock wave lithotripsy for asymptomatic calyceal stones? // Curr. Opin. Urol. — 2002 Jul. — Vol. 12, N4. — P. 281−286.
-
Rebuck D.A., Macejko A., Bhalani V. et al. The natural history of renal stone fragments following ureteroscopy // Urology. — 2011 Mar. — Vol. 77, N 3. — P.564–568.
-
Liatsikos E.N., Katsakiori P.F., Assimakopoulos K. et al. Doxazosin for the management of distal-ureteral stones // J. Endourol. — 2007 May. — Vol. 21, N5. — P. 538–541.
-
Hollingsworth J.M., Rogers M.A., Kaufman S.R. et al. Medical therapy to facilitate urinary stone passage: a meta-analysis // Lancet. — 2006 Sep. — Vol. 368, N9542. — P. 1171–1179.
-
Gravina G.L., Costa A.M., Ronchi P. et al. Tamsulosin treatment increases clinical success rate of single extracorporeal shock wave lithotripsy of renal stones // Urology. — 2005 Jul. — Vol. 66, N 1. — P. 24–28.
-
Resim S., Ekerbicer H.C., Ciftci A. Role of tamsulosin in treatment of patients with steinstrasse developing after extracorporeal shock wave lithotripsy // Urology. — 2005 Nov. — Vol. 66, N 5. — P. 945–948.
-
Borghi L., Meschi T., Amato F. et al. Nifedipine and methylprednisolone in facilitating ureteral stone passage: a randomized, double-blind, placebo-controlled study // J. Urol. — 1994 Oct. — Vol. 152, N 4. — P. 1095–1098.
-
Porpiglia F., Destefanis P., Fiori C. et al. Efffectiveness of nifedipine and deflazacort in the management of distal ureter stones // Urology. — 2000 Oct. — Vol. 56, N4. — P. 579–582.
-
Dellabella M., Milanese G., Muzzonigro G. Randomized trial of the effificacy of tamsulosin, nifedipine and phloroglucinol in medical expulsive therapy for distal ureteral calculi // J. Urol. — 2005 Jul. — Vol. 174, N 1. — P. 167–172.
-
Naja V., Agarwal M.M., Mandal A.K. et al. Tamsulosin facilitates earlier clearance of stone fragments and reduces pain after shockwave lithotripsy for renal calculi; results from an open-label randomized study // Urology. — 2008 Nov. — Vol. 72, N 5. — P. 1006–1011.
-
Schuler T.D., Shahani R., Honey R.J. et al. Medical expulsive therapy as an adjunct to improve shockwave lithotripsy outcomes: a systematic review and metaanalysis // J. Endourol. — 2009 Mar. — Vol. 23, N 3. — P. 387–393.
-
Parsons J.K., Hergan L.A., Sakamoto K. et al. Effificacy of alpha blockers for the treatment of ureteral stones // J. Urol. — 2007 Mar. — Vol. 177, N 3. – P. 983– 987.
-
Singh A., Alter H.J., Littlepage A. A systematic review of medical therapy to facilitate passage of ureteral calculi // Ann. Emerg. Med. — 2007 Nov. — Vol. 50, N 5. — P. 552–563.
-
Arrabal-Martin M., Valle-Diaz de la Guardia F., Arrabal-Polo M.A. et al. Treatment of ureteral lithiasis with tamsulosin: literature review and metaanalysis // Urol. Int. — 2010. — Vol. 84, N 3. — P. 254–259.
-
Lojanapiwat B., Kochakarn W., Suparatchatpan N. et al. Efffectiveness of low-dose and standard-dose tamsulosin in the treatment of distal ureteric stones: A randomized controlled study // J. Int. Med. Res. — 2008 May–Jun. — Vol. 36, N3. — P. 529–536.
-
Wang C.J., Huang S.W., Chang C.H. Effificacy of an alpha1 blocker in expulsive therapy of lower ureteral stones // J. Endourol. — 2008 Jan. — Vol. 22, N 1. — P.41–46.
-
Kaneko T., Matsushima H., Morimoto H. et al. Effificacy of low dose tamsulosin medical expulsive therapy for ureteral stones in Japanese male patients: a randomized controlled study // Int. J. Urol. — 2010 May. — Vol. 17, N 5. — P.462–465.
-
Al-Ansari A., Al-Naimi A., Alobaidy A. et al. Effificacy of tamsulosin in the ma nagementoflowerureteralstones: arandomizeddouble-blindplacebo-controlled study of 100 patients // Urology. — 2010 Jan. — Vol. 75, N 1. — P. 4–7.
-
Yilmaz E., Batislam E., Basar M.M. et al. The comparison and effificacy of 3 diffferent alpha1-adrenergic blockers for distal ureteral stones // J. Urol. — 2005 Jun. — Vol. 173, N 6. — P. 2010–2012.
-
Zehri A.A., Ather M.H., Abbas F. et al. Preliminary study of effificacy of doxazosin as a medical expulsive therapy of distal ureteric stones in a randomized clinical trial // Urology. — 2010 Jun. — Vol. 75, N 6. — P. 1285–1288.
-
Mohseni M.G., Hosseini S.R., Alizadeh F. Effificacy of terazosin as a facilitator agent for expulsion of the lower ureteral stones // Saudi Med. J. — 2006 Jun. — Vol. 27, N 6. — P. 838–840.
-
Agrawal M., Gupta M., Gupta A. et al. Prospective Randomized Trial Comparing Effificacy of Alfuzosin and Tamsulosin in Management of Lower Ureteral Stones // Urology. — 2009 Apr. — Vol. 73, N 4. — P. 706–709.
-
Pedro R.N., Hinck B., Hendlin K. et al. Alfuzosin stone expulsion therapy for distal ureteral calculi: a double-blind, placebo controlled study // J. Urol. — 2008 Jun. — Vol. 179, N 6. — P. 2244–2247; discussion 2247.
-
Ahmed A.F., Al-Sayed A.Y. Tamsulosin versus Alfuzosin in the Treatment of Patients with Distal Ureteral Stones: Prospective, Randomized, Comparative Study // Korean J. Urol. — 2010 Mar. — Vol. 51, N 3. — P. 193–197.
-
Chau L.H., Tai D.C., Fung B.T. et al. Medical expulsive therapy using alfuzosin for patient presenting with ureteral stone less than 10 mm: a prospective randomized controlled trial // Int. J. Urol. — 2011 Jul. — Vol. 18, N 7. — P. 510– 514.
-
Sun X., He L., Ge W. et al. Effificacy of selective alpha1D-Blocker Naftopidil as medical expulsive therapy for distal ureteral stones // J. Urol. — 2009 Apr. — Vol. 181, N 4. — P. 1716–1720.
-
Zhou S.G., Lu J.L., Hui J.H. Comparing effificacy of < (1)D-receptor antagonist naftopidil and < 1A/Dreceptor antagonist tamsulosin in management of distal ureteral stones // World J. Urol. — 2011 Dec. — Vol. 29, N 6. — P. 767–771.
-
Tsuzaka Y., Matsushima H., Kaneko T. et al. Naftopidil vs silodosin in medical expulsive therapy for ureteral stones: a randomized controlled study in Japanese male patients // Int. J. Urol. — 2011 Nov. — Vol. 18, N 11. — P. 792–795.
-
Itoh Y., Okada A., Yasui T. et al. Effificacy of selective alpha1A adrenoceptor antagonist silodosin in the medical expulsive therapy for ureteral stones // Int. J.Urol. — 2011 Sep. — Vol. 18, N 9. — P. 672–674.
-
Porpiglia F., Ghignone G., Fiori C. et al. Nifedipine versus tamsulosin for the management of lowerureteral stones // J. Urol. — 2004 Aug. — Vol. 172, N 2. — P.568–571.
-
Ye Z., Yang H., Li H. et al. A multicentre, prospective, randomized trial: comparative effificacy of tamsulosin and nifedipine in medical expulsive therapy for distal ureteric stones with renal colic // BJU Int. — 2011 Jul. — Vol. 108, N2. — P. 276–279.
-
Porpiglia F., Vaccino D., Billia M. et al. Corticosteroids and tamsulosin in the medical expulsive therapy for symptomatic distal ureter stones: single drug or association? // Eur. Urol. — 2006 Aug. — Vol. 50, N 2. — P. 339.
-
Dellabella M/, Milanese G/, Muzzonigro G. Medical-expulsive therapy for distal ureterolithiasis: randomized prospective study on role of corticosteroids used in combination with tamsulosin simplified treatment regimen and health-related quality of life // Urology. — 2005 Oct. — Vol. 66, N4. — P. 712–715.
-
Ferre R.M., Wasielewski J.N., Strout T.D. et al. Tamsulosin for ureteral stones in the emergency department: a Randomized controlled trial // Ann. Emerg. Med. — 2009 Sep. — Vol. 54, N 3. — P. 432–439.
-
Hermanns T., Sauermann P., Rufibach K. et al. Is there a role for tamsulosin in the treatment of distal ureteral stones of 7 mm or less? Results of a randomised, double-blind, placebo-controlled trial // Eur. Urol. — 2009 Sep. — Vol. 56, N3. — P. 407–412.
-
Vincendeau S., Bellissant E., Houlgatte A. et al.; Tamsulosin Study GrouP. Tamsulosin hydrochloride vsplacebo for management of distal ureteral stones: a multicentric, randomized, double-blind trial // Arch. Intern. Med. — 2010 Dec. — Vol. 170, N 22. — P. 2021–2027.
-
Ochoa-Gomez R., Prieto-Diaz-Chavez E., Trujillo-Hernandez B. et al. Tamsulosin does not have greater effificacy than conventional treatment for distal ureteral stone expulsion in Mexican patients // Urol. Res. — 2011 Dec. — Vol. 39, N6. — P. 491–495.
-
Yencilek F., Erturhan S., Canguven O. et al. Does tamsulosin change the management of proximallylocated ureteral stones? // Urol. Res. — 2010 Jun. — Vol. 38, N 3. — P. 195–199.
-
Kupeli B., Irkilata L., Gurocak S. et al. Does tamsulosin enhance lower ureteral stone clearance with or without shock wave lithotripsy? // Urology. — 2004 Dec. — Vol. 64, N 6. — P. 1111–1115.
-
Wang H., Liu K., Ji Z. et al. Efffect of alpha1-adrenergic antagonists on lower ureteral stones with extracorporeal shock wave lithotripsy // Asian J. Surg. — 2010 Jan. — Vol. 33, N 1. — P. 37–41.
-
Zhu Y., Duijvesz D., Rovers M.M. et al. Alpha-blockers to assist stone clearance after extracorporealshock wave lithotripsy: a meta-analysis // BJU Int. — 2010 Jul. — Vol. 106, N 2. — P. 256–261.
-
Hussein M.M. Does tamsulosin increase stone clearance after shockwave lithotripsy of renal stones? A prospective, randomized controlled study // Scand. J. Urol. Nephrol. — 2010 Feb. — Vol. 44, N 1. — P. 27–31.
-
Singh S.K., Pawar D.S., Griwan M.S. et al. Role of tamsulosin in clearance of upper ureteral calculi after extracorporeal shock wave lithotripsy: a randomized controlled trial // Urol. J. — 2011 Winter. — Vol. 8, N 1. — P. 14–20.
-
Zheng S., Liu L.R., Yuan H.C. et al. Tamsulosin as adjunctive treatment after shockwave lithotripsy in patients with upper urinary tract stones: a systematic review and meta-analysis // Scand. J. Urol. Nephrol. — 2010 Dec. — Vol. 44, N6. — P. 425–432.
-
Falahatkar S., Khosropanah I., Vajary A.D. et al. Is there a role for tamsulosin after shock wave lithotripsy in the treatment of renal and ureteral calculi? // J.Endourol. — 2011 Mar. — Vol. 25, N 3. — P. 495–498.
-
John T.T., Razdan S. Adjunctive tamsulosin improves stone free rate after ureteroscopic lithotripsy of large renal and ureteric calculi: a prospective randomized study // Urology. — 2010 May. — Vol. 75, N 5. — P. 1040– 1042.
-
Honda M., Yamamoto K., Momohara C. et al. Oral chemolysis of uric acid stones // Hinyokika Kiyo. — 2003 Jun. — Vol. 49, N 6. — P. 307–310. [Article in Japanese]
-
Chugtai M.N., Khan F.A., Kaleem M. et al. Management of uric acid stone // J.Pak. Med. Assoc. — 1992 Jul. — Vol. 42, N 7. — P. 153–155.
-
Rodman J.S. Intermittent versus continuous alkaline therapy for Uric acid stones and urethral stones of uncertain composition // Urology. — 2002 Sep. — Vol. 60, N 3. — P. 378–382.
-
Becker A. Uric acid stones // Nephrology. — 2007. — Vol. 12, suppl. 1. — P.S21–S25.
-
Weirich W., Frohneberg D., Ackermann D. et al. Practical experiences with antegrade local chemolysis of struvite/apatite, uric acid and cystine calculi in the kidney // Urologe A. — 1984 Mar. — Vol. 23, N 2. — P. 95–98.
-
El-Gamal O., El-Bendary M., Ragab M. et al. Role of combined use of potassium citrate and tamsulosin in the management of uric acid distal ureteral calculi // Urol. Res. — 2012 Jun. — Vol. 40, N 3. — P. 219–224.
-
Argyropoulos A.N., Tolley D.A. Evaluation of outcome following lithotripsy // Curr. Opin. Urol. — 2010 Mar. — Vol. 20, N 2. — P. 154–158.
-
Srisubat A., Potisat S., Lojanapiwat B. et al. Extracorporeal shock wave lithotripsy (ESWL) versus percutaneous nephrolithotomy (PCNL) or retrograde intrarenal surgery (RIRS) for kidney stones // Cochrane Database Syst. Rev. — 2009 Oct. — Vol. 7, Issue 4:CD007044.
-
Sahinkanat T., Ekerbicer H., Onal B. et al. Evaluation of the efffects of relationships between main spatial lower pole calyceal anatomic factors on the success of shock-wave lithotripsy in patients with lower pole kidney stones // Urology. — 2008. — Vol. 71, N 5. — P. 801–805.
-
Danuser H., Muller R., Descoeudres B. et al. Extracorporeal shock wave lithotripsy of lower calyx calculi: how much is treatment outcome influenced by the anatomy of the collecting system? // Eur. Urol. — 2007 Aug. — Vol. 52, N 2. — P. 539–546.
-
Preminger G.M. Management of lower pole renal calculi: shock wave lithotripsy versus percutaneous nephrolithotomy versus flexible ureteroscopy // Urol. Res. — 2006 Apr. — Vol. 34, N 2. — P. 108–111.
-
Pearle M.S., Lingeman J.E., Leveillee R. et al. Prospective, randomized trial comparing shock wave lithotripsy and ureteroscopy for lower pole caliceal calculi 1 cm or less // J. Urol. — 2005 Jun. — Vol. 173, N 6. — P. 2005–2009.
-
Albanis S., Ather H.M., Papatsoris A.G. et al. Inversion, hydration and diuresis during extracorporeal shock wave lithotripsy: does it improve the stone-free rate for lower pole stone clearance? // Urol. Int. — 2009. — Vol. 83, N 2. — P. 211–216.
-
Kosar A., Ozturk A., Serel T.A. et al. Efffect of vibration massage therapy after extracorporeal shockwave lithotripsy in patients with lower caliceal stones // J.Endourol. — 1999 Dec. — Vol. 13, N 10. — P. 705–797.
-
Aboumarzouk O.M., Monga M., Kata S.G. et al. Flexible ureteroscopy and laser lithotripsy for stones >2 cm: a systematic review and meta-analysis // J.Endourol. — 2012 Oct. — Vol. 26, N 10. — P. 1257–1263.
-
Akar E.C., Knudsen B.E. Flexible Ureteroscopy Versus Percutaneous Nephrolithotomy as Primary Treatment for Renal Stones 2 cm or Greater. — Columbus, USA: Department of Urology, Ohio State University Wexner Medical Center, 2013.
-
Hyams E.S., Munver R., Bird V.G., Uberoi J. et al. Flexible ureterorenoscopy and holmium laser lithotripsy for the management of renal stone burdens that measure 2 to 3 cm: a multi-institutional experience // J. Endourol. — 2010. — Vol. 24. — P. 1583–1588.
-
Hyams E.S., Shah O. Percutaneous nephrostolithotomy versus flexible ureteroscopy/holmium laser lithotripsy: cost and outcomes analysis // J. Urol. — 2009. — Vol. 182. — P. 1012–1017.
-
Breda A., Ogunyemi O., Leppert J.T., Lam J.S. et al. Flexible ureteroscopy and laser lithotripsy for single intrarenal stones 2 cm or greater — is this the new frontier? // J. Urol. — 2008. — Vol. 179. — P. 981–984.
-
Takazawa R., Kitayama S., Tsujoo T. Successful outcome of flexible ureteroscopy with holmium laser lithotripsy for renal stones 2 cm or greater // Int. J. Urol. — 2012. — Vol. 19. — P. 264–267.
-
Ricchiuti D.J., Smaldone M.C., Jacobs B.L., Smaldone A.M. et al. Staged retrograde endoscopic lithotripsy as alternative to PCNL in select patients with large renal calculi // J. Endourol. — 2007. — Vol. 21. — P. 1421–1424.
-
De S. et al. Percutaneous nephrolithotomy versus retrograde intrarenal surgery: a systematic review and meta-analysis // Eur. Urol. — 2015.
-
Handa R.K., Bailey M.R., Paun M. et al. Pretreatment with low-energy shock waves induces renal vasoconstriction during standard shock wave lithotripsy (SWL): a treatment protocol known to reduce SWL-induced renal injury // BJU Int. — 2009 May. — Vol. 103, N 9. — P. 1270–1274.
-
Manikandan R., Gall Z., Gunendran T. et al. Do anatomic factors pose a significant risk in the formation of lower pole stones? // Urology. — 2007 Apr. — Vol. 69, N 4. — P. 620–624.
-
Juan Y.S., Chuang S.M., Wu W.J. et al. Impact of lower pole anatomy on stone clearance after shock wave lithotripsy // Kaohsiung J. Med. Sci. — 2005 Aug. — Vol. 21, N 8. — P. 358–364.
-
Ruggera L., Beltrami P., Ballario R. et al. Impact of anatomical pielocaliceal topography in the treatment of renal lower calyces stones with extracorporeal shock wave lithotripsy // Int. J. Urol. — 2005 Jun. — Vol. 12, N 6. — P. 525–532.
-
Knoll T., Musial A., Trojan L. et al. Measurement of renal anatomy for prediction of lower-pole caliceal stone clearance: reproducibility of diffferent parameters // J. Endourol. — 2003 Sep. — Vol. 17, N 7. — P. 447–451.
-
El-Nahas A., Ibrahim H., Youssef R., Sheir K. Flexible ureterorenoscopy versus extracorporeal shock wave lithotripsy for treatment of lower pole stones of 10– 20 mm // BJU Int. — 2012. — Vol. 110, N 6. — P. 898–902.
-
Hussain M., Acher P., Penev B. et al. Redefining the limits of flexible ureterorenoscopy // J. Endourol. — 2011 Jan. — Vol. 25, N 1. — P. 45–49.
-
Wendt-Nordahl G., Mut T., Krombach P. et al. Do new generation flexible ureterorenoscopes offfer a higher treatment success than their predecessors? // Urol. Res. — 2011 Jun. — Vol. 39, N 3. — P. 185–188.
-
_Prabhakar M. Retrograde ureteroscopic intrarenal surgery for large(1.6–3.5cm) upper ureteric/renal calculus // Indian J. Urol. — 2010 Jan–Mar. — Vol. 26, N 1. — P. 46–49.
-
Riley J.M., Stearman L., Troxel S. Retrograde ureteroscopy for renal stones larger than 2.5 cm // J. Endourol. — 2009 Sep. — Vol. 23, N 9. — P. 1395–1398.
-
Aboumarzouk O.M., Kata S.G., Keeley F.X. et al. Extracorporeal shock wave lithotripsy (ESWL) versus ureteroscopic management for ureteric calculi // Cochrane Database Syst. Rev. — 2012. — Issue 5:CD006029.
-
Chang C.H., Wang C.J., Huang S.W. Totally tubeless percutaneous nephrolithotomy: a prospective randomized controlled study // Urol. Res. — 2011 Dec. — Vol. 39, N 6. — P. 459–465.
-
Agarwal M., Agrawal M.S., Jaiswal A. et al. Safety and effificacy of ultrasonography as an adjunct to fluoroscopy for renal access in percutaneous nephrolithotomy (PCNL) // BJU Int. — 2011 Oct. — Vol. 108, N 8. — P. 1346–1349.
-
Deem S., Defade B., Modak A. et al. Percutaneous nephrolithotomy versus extracorporeal shock wave lithotripsy for moderate sized kidney stones // Urology. — 2011 Oct. — Vol. 78, N 4. — P. 739–743.
-
Tiselius H.G. How effificient is extracorporeal shockwave lithotripsy with modern lithotripters for removal of ureteral stones? // J. Endourol. — 2008 Feb. — Vol. 22, N 2. — P. 249–255.
-
Elashry O.M., Elgamasy A.K., Sabaa M.A. et al. Ureteroscopic management of lower ureteric calculi: a 15-year single-centre experience // BJU Int. — 2008 Sep. — Vol. 102, N 8. — P. 1010–1017.
-
Fuganti P.E., Pires S., Branco R. et al. Predictive factors for intraoperative complications in semirigid ureteroscopy: analysis of 1235 ballistic ureterolithotripsies // Urology. — 2008 Oct. — Vol. 72, N 4. — P. 770–774.
-
Tugcu V., Tasci A.I., Ozbek E. et al. Does stone dimension afffect the efffectiveness of ureteroscopic lithotripsy in distal ureteral stones? // Int. Urol. Nephrol. — 2008. — Vol. 40, N 2. — P. 269–275.
-
Hong Y.K., Park D.S. Ureteroscopic lithotripsy using Swiss Lithoclast for treatment of ureteral calculi:12-years experience // J. Korean Med. Sci. — 2009 Aug. — Vol. 24, N 4. — P. 690–694.
-
Kumar V., Ahlawat R., Banjeree G.K. et al. Percutaneous ureterolitholapaxy: the best bet to clear large bulk impacted upper ureteral calculi // Arch. EsP. Urol. — 1996 Jan–Feb. — Vol. 49, N 1. — P. 86–91.
-
Goel R., Aron M., Kesarwani P.K. et al. Percutaneous antegrade removal of impacted upper-ureteral calculi: still the treatment of choice in developing countries // J. Endourol. — 2005 Jan–Feb. — Vol. 19, N 1. — P. 54–57.
-
Berczi C., Flasko T., Lorincz L. et al. Results of percutaneous endoscopic ureterolithotomy compared to that of ureteroscopy // J. Laparoendosc. Adv. Surg. Tech. A. — 2007 Jun. — Vol. 17, N 3. — P. 285–289.
-
Sun X., Xia S., Lu J. et al. Treatment of Large Impacted Proximal Ureteral Stones: Randomized Comparison of Percutaneous Antegrade Ureterolithotripsy versus Retrograde Ureterolithotripsy//J.Endourol. —2008May. —Vol.22,N5. —P.913–917.
-
El-Nahas A.R., Eraky I., el-Assmy A.M. et al. Percutaneous treatment of large upper tract stones after urinary diversion // Urology. — 2006 Sep. — Vol. 68, N 3. — P. 500–504.
-
El-Assmy A., El-Nahas A.R., Mohsen T. et al. Extracorporeal shock wave lithotripsy of upper urinary tract calculi in patients with cystectomy and urinary diversion // Urology. — 2005 Sep. — Vol. 66, N 3. — P. 510–513.
-
Rhee B.K., Bretan P.N. Jr, Stoller M.L. Urolithiasis in renal and combined pancreas/renal transplant recipients // J. Urol. — 1999 May. — Vol. 161, N 5. — P.1458–1462.
-
Gravas S., Montanari E., Geavlete P., Onal B., Skolarikos A. et al. Postoperative infection rates in low risk patients undergoing percutaneous nephrolithotomy with and without antibiotic prophylaxis: a matched case control study // J.Urol. — 2012 Sep. — Vol. 188, N 3. — P. 843–847.
-
Watterson J.D., Girvan A.R., Cook A.J. et al. Safety and effificacy of holmium: YAG laser lithotripsy in patients with bleeding diatheses // J. Urol. — 2002 Aug. — Vol. 168, N 2. — P. 442–445.
-
Kuo R.L., Aslan P., Fitzgerald K.B. et al. Use of ureteroscopy and holmium: YAG laser in patients with bleeding diatheses // Urology. — 1998 Oct. — Vol. 52, N4. — P. 609–613.
-
Kufer R., Thamasett S., Volkmer B. et al. New-generation lithotripters for treatment of patients with implantable cardioverter defibrillator: experimental approach and review of literature // J. Endourol. — 2001 Jun. — Vol. 15, N 5. — P.479–484.
-
Rassweiler J.J., Renner C., Chaussy C. et al. Treatment of renal stones by extracorporeal shockwave lithotripsy: an update // Eur. Urol. — 2001 Feb. — Vol. 39, N 2. — P. 187–199.
-
Klingler H.C., Kramer G., Lodde M. et al. Stone treatment and coagulopathy // Eur. Urol. — 2003 Jan. — Vol. 43, N 1. — P. 75–79.
-
Fischer C., Wohrle J., Pastor J. et al. Extracorporeal shock-wave lithotripsy induced ultrastructural changes to the renal parenchyma under aspirin use. Electron microscopic findings in the rat kidney // Urologe A. — 2007 Feb. — Vol. 46, N 2. — P. 150–155.
-
Becopoulos T., Karayannis A., Mandalaki T. et al. Extracorporeal lithotripsy in patients with hemophilia // Eur. Urol. — 1988. — Vol. 14, N 4. — P. 343–345.
-
Ruiz Marcellan F.J., Mauri Cunill A., Cabre Fabre P. et al. Extracorporeal shockwave lithotripsy in patients with coagulation disorders // Arch. EsP. Urol. — 1992 Mar. — Vol. 45, N 2. — P. 135–137.
-
Ishikawa J., Okamoto M., Higashi Y. et al. Extracorporeal shock wave lithotripsy in von Willebrand’s disease // Int. J. Urol. — 1996 Jan. — Vol. 3, N 1. — P. 58–60.
-
Coptcoat M.J., Webb D.R., Kellet M.J. et al. The steinstrasse: a legacy of extracorporeal lithotripsy? // Eur. Urol. — 1988. — Vol. 14, N 2. — P. 93–95.
-
Resim S., Ekerbicer H.C., Ciftci A. Role of tamsulosin in treatment of patients with steinstrasse developing after extracorporeal shock wave lithotripsy // Urology. — 2005 Nov. — Vol. 66, N 5. — P. 945–948.
-
Sayed M.A., el-Taher A.M., Aboul-Ella H.A. et al. Steinstrasse after extracorporeal shockwave lithotripsy: aetiology, prevention and management // BJU Int. — 2001 Nov. — Vol. 88, N 7. — P. 675–678.
-
Goyal R., Dubey D., Khurana N. et al. Does the type of steinstrasse predict the outcome of expectant therapy? // Indian J. Urol. — 2006. — Vol. 22, N 2. — P.135–138.
-
Rabbani S.M. Treatment of steinstrasse by transureteral lithotripsy // Urol. J. — 2008 Spring. — Vol. 5, N 2. — P. 89–93.
-
Al-Awadi K.A., Abdul Halim H., Kehinde E.O. et al. Steinstrasse: a comparison of incidence with and without J stenting and the efffect of J stenting on subsequent management // BJU Int. — 1999 Oct. — Vol. 84, N 6. — P. 618–621.
-
Madbouly K., Sheir K.Z., Elsobky E. et al. Risk factors for the formation of a steinstrasse after extracorporeal shock wave lithotripsy: a statistical model // J.Urol. — 2002 Mar. — Vol. 167, N 3. — P. 1239–1242.
-
Hardy M.R., McLeod D.G. Silent renal obstruction with severe functional loss after extracorporeal shock wave lithotripsy: a report of 2 cases // J. Urol. — 1987 Jan. — Vol. 137, N 1. — P. 91–92.
-
Wen C.C., Nakada S.Y. Treatment selection and outcomes: renal calculi // Urol. Clin. North Am. — 2007 Aug. — Vol. 34, N 3. — P. 409–419.
-
Miller N.L., Lingeman J.E. Management of kidney stones // BMJ. — 2007 Mar. — Vol. 334, N 7591. — P. 468–472.
-
Galvin D.J., Pearle M.S. The contemporary management of renal and ureteric calculi // BJU Int. — 2006 Dec. — Vol. 98, N 6. — P. 1283–1288.
-
Ohmori K., Matsuda T., Horii Y. et al. Efffects of shock waves on the mouse fetus // J. Urol. — 1994 Jan. — Vol. 151, N 1. — P. 255–258.
-
Streem S.B., Yost A. Extracorporeal shock wave lithotripsy in patients with bleeding diatheses // J. Urol. — 1990 Dec. — Vol. 144, N 6. — P. 1347–1348.
-
Carey S.W., Streem S.B. Extracorporeal shock wave lithotripsy for patients with calcified ipsilateral renalarterial or abdominal aortic aneurysms // J. Urol. — 1992 Jul. — Vol. 148, N 1. — P. 18–20.
-
Musa A.A. Use of double-J stents prior to extracorporeal shock wave lithotripsy is not beneficial: results of a prospective randomized study // Int. Urol. Nephrol. — 2008. — Vol. 40, N 1. — P. 19–22.
-
Mohayuddin N., Malik H.A., Hussain M. et al. The outcome of extracorporeal shockwave lithotripsy for renal pelvic stone with and without JJ stent — a comparative study // J. Pak. Med. Assoc. — 2009 Mar. — Vol. 59, N 3. — P.143–146.
-
Ghoneim I.A., El-Ghoneimy M.N., El-Naggar A.E. et al. Extracorporeal shock wave lithotripsy in impacted upper ureteral stones: a prospective randomized comparison between stented and non-stented techniques // Urology. — 2010 Jan. — Vol. 75, N 1. — P. 45–50.
-
Platonov M.A., Gillis A.M., Kavanagh K.M. Pacemakers, implantable cardioverter/defibrillators, and extracorporeal shockwave lithotripsy: evidencebased guidelines for the modern era // J. Endourol. — 2008 Feb. — Vol. 22, N 2. — P. 243–247.
-
Pishchalnikov Y.A., McAteer J.A., Williams J.C. Jr. et al. Why stones break better at slow shockwave rates than at fast rates: in vitro study with a research electrohydraulic lithotripter // J. Endourol. — 2006 Aug. — Vol. 20, N 8. — P.537– 541.
-
Connors B.A., Evan A.P., Blomgren P.M. et al. Extracorporeal shock wave lithotripsy at 60 shock waves/min reduces renal injury in a porcine model // BJU Int. — 2009 Oct. — Vol. 104, N 7. — P. 1004–1008.
-
Ng C.F., Lo A.K., Lee K.W. et al. A prospective, randomized study of the clinical efffects of shock wave delivery for unilateral kidney stones: 60 versus 120 shocks per minute // J. Urol. — 2012 Sep. — Vol. 188, N 3. — P. 837–842.
-
Moon K.B., Lim G.S., Hwang J.S. et al. Optimal shock wave rate for shock wave lithotripsy in urolithiasis treatment: a prospective randomized study // Korean J.Urol. — 2012 Nov. — Vol. 53, N 11. — P. 790–794.
-
Yilmaz E., Batislam E., Basar M. et al. Optimal frequency in extracorporeal shock wave lithotripsy: prospective randomized study // Urology. — 2005 Dec. — Vol. 66, N 6. — P. 1160–1164.
-
Semins M.J., Trock B.J., Matlaga B.R. The efffect of shock wave rate on the outcome of shock wave lithotripsy: a meta-analysis // J. Urol. — 2008 Jan. — Vol. 179, N 1. — P. 194–197; discussion 197.
-
Connors B.A., Evan A.P., Blomgren P.M. et al. Efffect of initial shock wave voltage on shock wave lithotripsy-induced lesion size during step-wise voltage ramping // BJU Int. — 2009 Jan. — Vol. 103, N 1. — P. 104–107.
-
Handa R.K., McAteer J.A., Connors B.A. et al. Optimising an escalating shockwave amplitude treatment strategy to protect the kidney from injury during shockwave lithotripsy // BJU Int. — 2012 Dec. — Vol. 110, N 11. — P.E1041– E1047.
-
Maloney M.E., Marguet C.G., Zhou Y. et al. Progressive increase of lithotripter output produces better in-vivo stone comminution // J. Endourol. — 2006 Sep. — Vol. 20, N 9. — P. 603–606.
-
Demirci D., Sofikerim M., Yalcin E. et al. Comparison of conventional and step-wise shockwave lithotripsy in management of urinary calculi // J. Endourol. — 2007 Dec. — Vol. 21, N 12. — P. 1407–1410.
-
Honey R.J., Ray A.A., Ghiculete D. et al. Shock wave lithotripsy: a randomized, double-blind trial tocompare immediate versus delayed voltage escalation // Urology. — 2010 Jan. — Vol. 75, N 1. — P. 38–43.
-
Neucks J.S., Pishchalnikov Y.A., Zancanaro A.J. et al. Improved acoustic coupling for shock wave lithotripsy // Urol. Res. — 2008 Feb. — Vol. 36, N 1. — P. 61–66.
-
Logarakis N.F., Jewett M.A., Luymes J. et al. Variation in clinical outcome following shock wave lithotripsy // J. Urol. — 2000 Mar. — Vol. 163, N 3. — P. 721–725.
-
Eichel L., Batzold P., Erturk E. Operator experience and adequate anesthesia improve treatmentoutcome with third-generation lithotripters // J. Endourol. — 2001 Sep. — Vol. 15, N 7. — P. 671–673.
-
Sorensen C., Chandhoke P., Moore M. et al. Comparison of intravenous sedation versus general anesthesia on the effificacy of the Doli 50 lithotriptor // J. Urol. — 2002 Jul. — Vol. 168, N 1. — P. 35–37.
-
Cleveland R.O., Anglade R., Babayan R.K. Efffect of stone motion on in vitro comminution effificiency of Storz Modulith SLX // J. Endourol. — 2004 Sep. — Vol. 18, N 7. — P. 629–633.
-
Bierkens A.F., Hendrikx A.J., Ezz el Din K.E. et al. The value of antibiotic prophylaxis during extracorporeal shock wave lithotripsy in the prevention of urinary tract infections in patients with urine proven sterile prior to treatment // Eur. Urol. — 1997. — Vol. 31, N 1. — P. 30–35.
-
Deliveliotis C., Giftopoulos A., Koutsokalis G. et al. The necessity of prophylactic antibiotics during extracorporeal shock wave lithotripsy // Int. Urol. Nephrol. — 1997. — Vol. 29, N 5. — P. 517–521.
-
Honey R.J., Ordon M., Ghiculete D. et al. A prospective study examining the incidence of bacteriuria and urinary tract infection after shock wave lithotripsy with targeted antibiotic prophylaxis // J. Urol. — 2013 Jun. — Vol. 189, N 6. — P.2112–2117.
-
Lu Y., Tianyong F., Ping H. et al. Antibiotic prophylaxis for shock wave lithotripsy in patients with sterile urine before treatment may be unnecessary: a systematic review and meta-analysis // J. Urol. — 2012 Aug. — Vol. 188, N2. — P. 441–448.
-
Bhagat S.K., Chacko N.K., Kekre N.S. et al. Is there a role for tamsulosin in shock wave lithotripsy for renal and ureteral calculi? // J. Urol. — 2007 Jun. — Vol. 177, N6. — P. 2185–2188.
-
Hussein M.M. Does tamsulosin increase stone clearance after shockwave lithotripsy of renal stones? A prospective, randomized controlled study // Scand. J. Urol. Nephrol. — 2010 Feb. — Vol. 44, N 1. — P. 27–31.
-
Maker V., Layke J. Gastrointestinal injury secondary to extracorporeal shock wave lithotripsy: a review of the literature since its inception // J. Am. Coll. Surg. — 2004 Jan. — Vol. 198, N 1. — P. 128–135.
-
Kim T.B., Park H.K., Lee K.Y. et al. Life-threatening complication after extracorporeal shock wave lithotripsy for a renal stone: a hepatic subcapsular hematoma // Korean J. Urol. — 2010 Mar. — Vol. 51, N 3. — P. 212–215.
-
Ng C.F., Law V.T., Chiu P.K. et al. Hepatic haematoma after shockwave lithotripsy for renal stones // Urol. Res. — 2012 Dec. — Vol. 40, N 6. — P. 785–789.
-
Zekey F., Senkul T., Ates F., Soydan H. et al. Evaluation of the impact of shock wave lithotripsy on kidneys using a new marker: how do neutrophil gelatineseassociated lypocalin values change after shock wave lithotripsy? // Urology. — 2012 Aug. — Vol. 80, N 2. — P. 267–272.
-
Dickstein R.J., Kreshover J.E., Babayan R.K. et al. Is a safety wire necessary during routine flexible ureteroscopy? // J. Endourol. — 2010 Oct. — Vol. 24, N10. — P. 1589–1592.
-
Eandi J.A., Hu B., Low R.K. Evaluation of the impact and need for use of a safety guidewire during ureteroscopy // J. Endourol. — 2008 Aug. — Vol. 22, N 8. — P.1653–1658.
-
Ng Y.H., Somani B.K., Dennison A. et al. Irrigant flow and intrarenal pressure during flexible ureteroscopy: the efffect of diffferent access sheaths, working channel instruments, and hydrostatic pressure // J. Endourol. 2010 Dec. — Vol. 24, N 12. — P. 1915–1920.
-
Humphreys M.R., Miller N.L., Williams J.C. Jr et al. A new world revealed: early experience with digital ureteroscopy // J. Urol. — 2008 Mar. — Vol. 179, N 3. — P.970–975.
-
Gupta P.K. Is the holmium: YAG laser the best intracorporeal lithotripter for the ureter? A 3-year retrospective study // J. Endourol. — 2007 Mar. — Vol. 21, N3. — P. 305–309.
-
Ahmed M., Pedro R.N., Kieley S. et al. Systematic evaluation of ureteral occlusion devices: insertion, deployment, stone migration, and extraction // Urology. — 2009 May. — Vol. 73, N 5. — P. 976–980.
-
Rubenstein R.A., Zhao L.C., Loeb S. et al. Prestenting improves ureteroscopic stone-free rates // J. Endourol. — 2007 Nov. — Vol. 21, N 11. — P. 1277–1280.
-
Song T., Liao B., Zheng S., Wei Q. Meta-analysis of postoperatively stenting or not in patients underwent ureteroscopic lithotripsy // Urol. Res. — 2012 Feb. — Vol. 40, N 1. — P. 67–77.
-
Nabi G., Cook J., N’Dow J., McClinton S. Outcomes of stenting after uncomplicated ureteroscopy: systematic review and meta-analysis // BMJ. — 2007 Mar. — Vol. 334, N 7593. — P. 572.
-
Moon T.D. Ureteral stenting — an obsolete procedure? // J. Urol. — 2002 May. — Vol. 167, N 5. — P. 1984.
-
Geavlete P., Georgescu D., Nita G. et al. Complications of 2735 retrograde semirigid ureteroscopyprocedures: a single-center experience // J. Endourol. — 2006 Mar. — Vol. 20, N 3. — P. 179–185.
-
de la Rosette J.J.M.C.H., Laguna M.P., Rassweiler J.J., Conort P. Training in Percutaneous Nephrolithotomy — A Critical Review // Eur. Urol. — 2008 Nov. — Vol. 54, N 5. — P. 994–1003.
-
Allen D., O’Brien T., Tiptaft R. Glass J. Defining the learning curve for percutaneous nephrolithotomy // J. Endourol. — 2005. — Vol. 19, N 3. — P. 279– 282.
-
Tanriverdi O., Boylu U., Kendirci M., Kadihasanoglu M. The learning curve in the training of percutaneous nephrolithotomy // Eur. Urol. — 2007 Jul. — Vol. 52, N 1. — P. 206–211.
-
Andonian S., Scoffone C.M., Louie M.K. et al. Does imaging modality used for percutaneous renalaccess make a diffference? A matched case analysis // J.Endourol. — 2013 Jan. — Vol. 27, N 1. — P. 24–28.
-
Hopper K.D., Sherman J.L., Luethke J.M., Ghaed N. The retrorenal colon in the supine and prone patient // Radiology. — 1987 Feb. — Vol. 162, N 2. — P. 443.
-
Sherman J.L., Hopper K.D., Greene A.J., Johns T.T. The retrorenal colon on computed tomography: a normal variant // J. Comput. Assist. Tomogr. — 1985 Mar–Apr. — Vol. 9, N 2. — P. 339–341.
-
De Sio M., Autorino R., Quarto G. et al. Modified supine versus prone position in percutaneous nephrolithotomy for renal stones treatable with a single percutaneous access: a prospectiverandomized trial // Eur. Urol. — 2008. — Vol. 54, N 1. — P. 196–202.
-
Valdivia J.G., Scarpa R.M., Duvdevani M. et al. Supine versus prone position during percutaneous nephrolithotomy: a report from the clinical research offifice of the endourological society percutaneous nephrolithotomy global study // J. Endourol. — 2011 Oct. — Vol. 25, N 10. — P. 1619–1625.
-
El-Nahas A.R., Shokeir A.A., El-Assmy A.M. et al. Colonic perforation during percutaneous nephrolithotomy: study of risk factors // Urology. — 2006 May. — Vol. 67, N 5. — P. 937–941.
-
Osman M., Wendt-Nordahl G., Heger K. et al. Percutaneous nephrolithotomy with ultrasonographyguided renal access: experience from over 300 cases // BJU Int. — 2005 Oct. — Vol. 96, N 6. — P. 875–878.
-
Jessen J.P., Honeck P., Knoll T. et al. Percutaneous nephrolithotomy under combined sonographic/radiologic guided puncture: results of a learning curve using the modified Clavien grading system // World J. Urol. — 2013 Dec. — Vol. 31, N 6. — P. 1599–1603.
-
Lopes T., Sangam K., Alken P., Barroilhet B.S. et al. The Clinical Research Offifice of the Endourological Society Percutaneous Nephrolithotomy Global Study: tract dilation comparisons in 5537 patients // J. Endourol. — 2011. — Vol. 25, N 5. — P. 755–762.
-
Cormio L., Preminger G., Saussine C., Buchholz N.P. et al. Nephrostomy in percutaneous nephrolithotomy (PCNL): does size matter? Results from the Global PCNL study from the Clinical Research Offifice Endourology Society // World J. Urol. — 2013. — Vol. 31, N 6. — P. 1563–1568.
-
Singh I., Singh A., Mittal G. Tubeless percutaneous nephrolithotomy: is it really less morbid? // J. Endourol. — 2008 Mar. — Vol. 22, N 3. — P. 427–434.
-
Kara C., Resorlu B., Bayindir M. et al. A randomized comparison of totally tubeless and standard percutaneous nephrolithotomy in elderly patients // Urology. — 2010 Aug. — Vol. 76, N 2. — P. 289–293.
-
Istanbulluoglu M.O., Ozturk B., Gonen M. et al. Efffectiveness of totally tubeless percutaneous nephrolithotomy in selected patients: a prospective randomized study // Int. Urol. Nephrol. — 2009. — Vol. 41, N 3. — P. 541–545.
-
Gonen M., Cicek T., Ozkardes H. Tubeless and stentless percutaneous nephrolithotomy in patients requiring supracostal access // Urol. Int. — 2009. — Vol. 82, N 4. — P. 440–443.
-
Amer Kamran T., Ahmed K., Bultitude M., Khan S. et al. Standard versus tubeless percutaneous nephrolithotomy: A Systematic Review // Urol. Int. — 2012. — Vol. 88. — P. 373–382.
-
Wang J., Zhao C., Zhang C., Fan X. et al. Tubeless vs standard percutaneous nephrolithotomy: a meta-analysis // BJU Int. — 2012 Mar. — Vol. 109, N 6. — P.918–924.
-
Zhong Q., Zheng C., Zhou Y., Piao Y. et al. Total tubeless versus standard percutaneous nephrolithotomy: A Meta-Analysis // J. Endourol. 2013. — Vol. 27. — P. 420–426.
-
_Cogain M.R., Krambeck A.E. Advances in tubeless percutaneous nephrolithotomy and patient selection: an update // Curr. Urol. Rep. — 2013 Apr. — Vol. 14, N2. — P. 130–137.
-
Nerli R.B., Reddy M.N., Devaraju S., Hiremath M.B. Percutaneous nephrolithotomy in patients on chronic anticoagulant/antiplatelet therapy // Chonnam. Med. J. — 2012. — Vol. 48.
-
de la Rosette J., Assimos D., Desai M., Gutierrez J. et al.; CROES PCNL Study GrouP. The Clinical Research Offifice of the Endourological Society Percutaneous Nephrolithotomy Global Study: indications, complications, and outcomes in 5803 patients // J. Endourol. — 2011 Jan. — Vol. 25, N 1. — P. 11–17.
-
Gutierrez G., Smith A., Geavlete P., Shah H. et al. Urinary tract infections and post-operative fever in percutaneous nephrolithotomy // World J. Urol. — 2013. — Vol. 31, N 5. — P. 1135–1140.
-
Gravas S., Montanari E., Geavlete P., Onal B. et al. Post-operative infection rates in low risk PCNL patients with and without antibiotic prophylaxis: A Matched Case Control Study // J. Urol. — 2012. — Vol. 188, N 3. — P. 843–847.
-
Zeng G. et al. Minimally invasive percutaneous nephrolithotomy for simple and complex renal caliceal stones: a comparative analysis of more than 10 000 cases // J. Endourol. — 2013. — Vol. 27, N 10. — P. 1203–1208.
-
Abdelhafez M.F. et al. Minimally invasive percutaneous nephrolitholapaxy (PCNL) as an efffective and safe procedure for large renal stones // BJU Int. — 2012. — Vol. 110, N 11. — Pt C. — P. E1022–E1026.
-
Desai J., Solanki R. Ultra-mini percutaneous nephrolithotomy (UMP): one more armamentarium // BJU Int. — 2013. — Vol. 112, N 7. — P. 1046–1049.
-
Assimos D.G., Boyce W.H., Harrison L.H. et al. The role of open stone surgery since extracorporeal shock wave lithotripsy // J. Urol. — 1989 Aug. — Vol. 142, N2. — Pt 1. — P. 263–267.
-
Segura J.W. Current surgical approaches to nephrolithiasis // Endocrinol. Metab. Clin. North Am. — 1990 Dec. — Vol. 19, N 4. — P. 919–935.
-
Honeck P., Wendt-Nordahl G., Krombach P. et al. Does open stone surgery still play a role in the treatment of urolithiasis? Data of a primary urolithiasis center // J. Endourol. — 2009 Jul. — Vol. 23, N 7. — P. 1209–1212.
-
Bichler K.H., Lahme S., Strohmaier W.L. Indications for open stone removal of urinary calculi // Urol. Int. — 1997. — Vol. 59, N 2. — P. 102–108.
-
Paik M.L., Resnick M.I. Is there a role for open stone surgery? // Urol. Clin. North Am. — 2000 May. — Vol. 27, N 2. — P. 323–331.
-
Matlaga B.R., Assimos D.G. Changing indications of open stone surgery // Urology. — 2002 Apr. — Vol. 59, N 4. — P. 490–493; discussion 493–494.
-
Ansari M.S., Gupta N.P. Impact of socioeconomic status in etiology and management of urinary stonedisease // Urol. Int. — 2003. — Vol. 70, N4. — P. 255–261.
-
Alivizatos G., Skolarikos A. Is there still a role for open surgery in the management of renal stones? // Curr. Opin. Urol. — 2006 Mar. — Vol. 16, N 2. — P. 106–111.
-
Kerbl K., Rehman J., Landman J. et al. Current management of urolithiasis: Progress or regress? // J. Endourol. — 2002 Jun. — Vol. 16, N 5. — P. 281–288.
-
Preminger G.M., Assimos D.G., Lingeman J.E. et al. Chapter 1: AUA guideline on management ofstaghorn calculi: Diagnosis and treatment recommendations // J.Urol. — 2005 Jun. — Vol. 173, N 6. — P. 1991–2000.
-
Kane C.J., Bolton D.M., Stoller M.L. Current indications for open stone surgery in an endourology center // Urology. — 1995 Feb. — Vol. 45, N 2. — P. 218–221.
-
Sy F.Y., Wong M.Y., Foo K.T. Current indications for open stone surgery in Singapore // Ann. Acad. Med. Singapore. — 1999 Mar. — Vol. 28, N 2. — P. 241–244.
-
Goel A., Hemal A.K. Upper and mid-ureteric stones: a prospective unrandomized comparison of retroperitoneoscopic and open ureterolithotomy // BJU Int. — 2001 Nov. — Vol. 88, N 7. — P. 679–682.
-
Skrepetis K., Doumas K., Siafakas I. et al. Laparoscopy versus open ureterolithomy. Acomparative study // Eur. Urol. — 2001. — Vol. 40, N 1. — P. 32-37.
-
Al-Hunayan A., Khalil M., Hassabo M. et al. Management of solitary renal pelvic stone: laparoscopic retroperitoneal pyelolithotomy versus percutaneous nephrolithotomy // J. Endourol. — 2011 Jun. — Vol. 25, N 6. — P. 975–978.
-
Skolarikos A., Papatsoris A.G., Albanis S. et al. Laparoscopic urinary stone surgery: an updated evidence based review // Urol. Res. — 2010 Oct. — Vol. 38, N5. — P. 337–344.
-
Al-Hunayan A., Khalil M., Hassabo M. et al. Management of solitary renal pelvic stone: laparoscopicretroperitoneal pyelolithotomy versus percutaneous nephrolithotomy // J. Endourol. — 2011 Jun. — Vol. 25, N 6. — P. 975–978.
-
Giedelman C., Arriaga J., Carmona O. et al. Laparoscopic anatrophic nephrolithotomy: developments of the technique in the era of minimally invasive surgery // J. Endourol. — 2012 May. — Vol. 26, N 5. — P. 444–450.
-
_Zhou L., Xuan Q., Wu B. et al. Retroperitoneal laparoscopic anatrophic nephrolithotomy for large staghorn calculi // Int. J. Urol. — 2011 Feb. — Vol. 18, N2. — P. 126–129.
-
Fan T., Xian P., Yang L. et al. Experience and learning curve of retroperitoneal laparoscopicureterolithotomy for upper ureteral calculi // J. Endourol. — 2009 Nov. — Vol. 23, N 11. — P. 1867–1870.
-
Khaladkar S., Modi J., Bhansali M. et al. Which is the best option to treat large (> 1.5 cm) miduretericcalculi? // J. Laparoendosc. Adv. Surg. Tech. A. — 2009 Aug. — Vol. 19, N 4. — P. 501–504.
-
Jeong B.C., Park H.K., Byeon S.S. et al. Retroperitoneal laparoscopic ureterolithotomy for upper ureter stones // J. Korean Med. Sci. — 2006 Jun. — Vol. 21, N 3. — P. 441–444.
-
Hruza M., Zuazu J.R., Goezen A.S. et al. Laparoscopic and open stone surgery // Arch. Ital. Urol. Androl. 2010 Mar. — Vol. 82, N 1. — P. 64–71.
-
Skrepetis K., Doumas K., Siafakas I. et al. Laparoscopic versus open ureterolithotomy. A comparative study // Eur. Urol. — 2001 Jul. — Vol. 40, N 1. — P. 32–36; discussion 37.
-
El-Feel A., Abouel-Fettouh H., Abdel-Hakim A.M. Laparoscopic transperitoneal ureterolithotomy // J. Endourol. — 2007 Jan. — Vol. 21, N 1. — P. 50–54.
-
Gaur D.D., Trivedi S., Prabhudesai M.R., Madhusudhana H.R. et al. Laparoscopic ureterolithotomy: technical considerations and long term follow up // BJU Int. — 2002 Mar. — Vol. 89, N 4. — P. 339–343.
-
Flasko T., Holman E., Kovacs G. et al. Laparoscopic ureterolithotomy: the method of choice in selectedcases // J. Laparoendosc. Adv. Surg. Tech. A. — 2005 Apr. — Vol. 15, N 2. — P. 149–152.
-
Kijvikai K., Patcharatrakul S. Laparoscopic ureterolithotomy: its role and some controversial technical considerations // Int. J. Urol. — 2006 Mar. — Vol. 13, N 3. — P. 206–210.
-
Wang Y., Hou J., Wen D. et al. Comparative analysis of upper ureteral stones (> 15 mm) treated with retroperitoneoscopic ureterolithotomy and ureteroscopic pneumatic lithotripsy // Int. Urol. Nephrol. — 2010 Dec. — Vol. 42, N 4. — P. 897–901.
-
Lopes Neto A.C., Korkes F., Silva J.L. 2nd et al. Prospective randomized study of treatment of large proximal ureteral stones: extracorporeal shock wave lithotripsy versus ureterolithotripsy versus laparoscopy // J. Urol. — 2012 Jan. — Vol. 187, N 1. — P. 164–168.
-
Tefekli A., Tepeler A., Akman T. et al. The comparison of laparoscopic pyelolithotomy and percutaneous nephrolithotomy in the treatment of solitary large renal pelvic stones // Urol. Res. — 2012 Oct. — Vol. 40, N 5. — P. 549–555.
-
de la Rosette J., Denstedt J., Geavlete P., Keeley F., Matsuda T., Pearle M., Preminger G., Traxer O. The clinical research offifice of the endourological society ureteroscopy global study: indications, complications, and outcomes in 11885 patients; CROES URS Study Group // J. Endourol. — 2014 Feb. — Vol. 28, N 2. — P.131-139.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
-
Александров В.П., Тиктинский О.Л. и др. Особенности камнеобразования в почках у больных в семьях, отягощенных уролитиазом // Урол. и нефрол. — 1993. — № 4. — С. 16–19.
-
Голованов С.А. Клинико-биохимические и физико-химические критерии течения и прогноза мочекаменной болезни: Дис. … д-ра мед. наук. — М., 2003.
-
Дзеранов Н.К. Дистанционная ударно-волновая литотрипсия в лечении мочекаменной болезни у взрослых и детей: Дис. …. д-ра мед. наук. — М., 1994.
-
Дутов В.В. Современные способы лечения некоторых форм мочекаменной болезни у детей: Дис. … д-ра мед. наук. — М., 2001.
-
Лопаткин Н.А. Руководство по урологии: В 3 т. — М.: Медицина, 1998.
-
Мартов А.Г. Рентгеноэндоскопические методы диагностики и лечения заболеваний почек и верхних мочевых путей: Дис. …. д-ра мед. наук. — М., 1993.
-
Мартов А.Г. Чрескожное лечение нефроуролитиаза: Дис. … канд. мед. наук. — М., 1987.
-
Рапопорт Л.М. Профилактика и лечение осложнений дистанционной литотрипсии: Дис. … д-ра мед. наук. — М., 1998.
-
Руденко В.И. Мочекаменная болезнь — актуальные вопросы диагностики и выбор метода лечения: Дис. … д-ра мед. наук. — М., 2004.
-
Румянцев А.А. Современные методы диагностики и лечения мочекаменной болезни у детей: Дис. … д-ра мед. наук. — М., 2004.
-
Саенко В.С. Метафилактика мочекаменной болезни: Дис. … д-ра мед. наук. — М., 2007.
-
Татевосян А.С. Диагностика и лечение местных факторов риска почечнокаменной болезни: Дис. … д-ра мед. наук. — М., 2000.
-
Чиглинцев А.Ю. Факторы риска и клинико-патогенетические характеристики уролитиаза на Южном Урале: Дис. … д-ра мед. наук. — М., 2007.
-
Фукс С.В. Мультиспиральная КТ в диагностике и выборе методов лечения больных нефролитиазом: Дис. … д-ра мед. наук. — М., 2003.
-
Яненко Э.К. Коралловидный нефролитиаз: Дис. … д-ра мед. наук. — М., 1980.
-
Auer B.L., Auer D., Rodger A.L. The efffects of ascorbic acid ingestion on thebiochemical and physico-chemical risk factors associated with calcium oxalate kidneystone formation // Clin. Chem. Lab. Med. — 1998. — Vol. 36. — P. 143–148.
-
Arias F.F., Garcia C.E., Lovaco C.F. et al. Epidemiologia de la litiasis urinariaen nuestra Unidad. Evolucion en el tiempo y factores predictivos. Epidemiology of urinary lithiasis in our Unit. Clinical course in time and predictive factors // Arch. Esp. Urol. — 2000. — Vol. 53, N 4. — P. 343–347.
-
Ettinger B. Hyperuricosuric calcium stone disease // Kidney Stones: Medical and Surgical Management / Eds F.L. Сое, M.J. Favus, C.Y.C. Pak. — Philadelphia: Lippincott-Raven Publishers, 1996. — P. 851–858.
-
Tiselius H.-G., Ackermann D., Alken P. et al. EAU. Guidelines on urolithiasis // Eur. Urol. —2001. — Vol. 40, N 4. — P. 362–371.
-
Tiselius H.-G. Risk formulas in calcium oxalate urolithiasis // World J. Urol. — 1997. — Vol. 15. — P. 176–185.
-
Tiselius H. G., Ackermann D., Alken P. et al. Guidelines on urolithiasis // Eur. Urol. — 2001. — Vol. 40. — P. 362–371.
-
Segura J.W., Preminger G.M., Assimos D.G. et al. Nephrolithiasis Clinical Guidelines Panel: summary report on the management of staghorn calculi. The American Urological Association Nephrolithiasis Clinical Guidelines Panel // J.Urol. — 1997 Nov. — Vol. 158, N 5. — P. 1915–1921.
-
Serrano P.A., Fernandez F.E., Burgos R.F. J. et al. Therapeutic advantages of rigid transurethral ureteroscopy in ureteral lithiasic pathology: retrospective study of 735 cases // Arch. Esp. Urol. — 2002. — Vol. 55, N 4. — P. 405–421.
-
Volmer M., de Vries J.C., Goldschmidt H.M. Infrared analysis of urinarycalculi by a single reflection accessory and a neural network interpretation algorithm // Clin. Chem. — 2001. — Vol. 47, N 7. — P. 1287–1296.
-
Hofbauer J., Hobarth K., Szabo N., Marberger M. Alkali citrate prophylaxisin idiopathic recurrent calcium oxalate nephrolithiasis: A prospective randomized study // Br. J. Urol. — 1994. — Vol. 73. — P. 362–365.
-
Hiatt R.A., Ettinger B., Caan B. et al. Randomized controlled trial f low animal protein, high fiber diet in the prevention of recurrent calcium oxalate kidneystones // Am. J. Epidemiol. — 1996. — Vol. 144. — P. 25–33.
-
Rocco F., Mandressi A., Larcher P. Surgical classification of renal calculi // Eur. Urol. — 1984. — Vol. 10. — P. 12–125.
-
Marberger M., Hofbauer J. Problems and complications in stone disease // Curr. Opin. Urol. — 1994. — Vol. 4. — P. 234–238.
-
Лишманов Ю.Б., Чернов В.И. Радионуклеидная диагностика для практических врачей. — Томск, 2004. — С. 160.
-
Pippi Sale J.K., Cook A.O., Papanikolaou F.K. Theimportance of obtaining conjugate on renographic evaluation of large hydronefronic kidneys: an in vitro and ex vivo analisis // J. Urol. — 2008. — Vol. 180. — P. 1559–1565.
-
Hindas G.O. et al. Functional significance of using tissue adhesive substance in nephron-sparing: assessment by quantitative SPECT of 99mTc Dimercaptosuccinic acid scintigraphy // Eur. Urol. — 2007 Sep. — Vol. 52, N3. — P. 785–789.
-
http:// www.auanet.org/education/guidelines/management-kidney-stones.
Глава 5. МУЖСКОЕ БЕСПЛОДИЕ
М.Е. Чалыи, Н.Д. Ахвледиани, Р.Р. Харчилава
Диагноз бесплодия у семейной пары ставится при условии отсутствия зачатия в течение 1 года регулярной половой жизни без контрацепции [8].
МКБ-10 • N46 Мужское бесплодие.
Профилактика
-
Раннее выявление и лечение инфекционных заболеваний мочеполовой системы, в том числе заболеваний, передаваемых половым путем; коррекция сахарного диабета; своевременное оперативное лечение по поводу крипторхизма, варикоцеле, гидроцеле [7, 29].
-
Отказ от вредных привычек: курения, употребления алкоголя, наркотиков.
-
Исключение профессиональных вредностей: ионизирующего излучения, контакта с анилиновыми красителями, пестицидами, тяжелыми металлами.
-
Отказ от приема анаболических стероидов, частых тепловых процедур (баня).
Классификация
-
Секреторное бесплодие, обусловленное врожденными и приобретенными заболеваниями.
-
Экскреторное бесплодие, обусловленное нарушением транспорта сперматозоидов по семявыносящим путям.
-
Бесплодие, когда секреторная недостаточность половых желез сочетается с обструктивным, иммунологическим или воспалительным процессами.
-
Относительное бесплодие [1].
-
По отношению к основному органу репродуктивной системы, яичку, выделяют претестикулярные, тестикулярные и посттестикулярные причины [1, 7, 8, 24].
КЛАССИФИКАЦИЯ ВОЗ (1992) [1]
Диагностика
Диагностика мужского бесплодия включает сбор анамнеза, обследование обоих половых партнеров, физикальное и инструментальное обследования, исследование спермы, определение уровней гормонов, инфекционный скрининг, проведение иммунологических тестов и проб на совместимость партнеров. На основании полученных данных выбирают метод лечения: медикаментозное, хирургическое, эмпирическое лечение [1, 7, 20, 29, 30]. Обязательно исследование каждого пациента, состоящего в бесплодном браке, независимо от характера его репродуктивной функции в прошлом. Правильно собранный анамнез, проведенное урогенитальное обследование и выполненный анализ эякулята представляют достаточно полную информацию об основных причинах мужского бесплодия.
| Рекомендации [48] | СР |
|---|---|
Для определения причины бесплодия необходимо проводить одновременное обследование обоих партнеров |
C |
При диагностике и лечении мужского бесплодия необходимо учитывать фертильный статус женщины, так как он может влиять на конечный результат [9] |
B |
Уролог-андролог должен обследовать каждого мужчину с бесплодием на наличие нарушений со стороны мочеполовой сферы. Это относится ко всем пациентам со снижением качества эякулята. Для назначения соответствующего лечения (лекарственное лечение, операция, вспомогательные репродуктивные технологии) необходимо поставить диагноз |
C |
МЕТОДЫ ДИАГНОСТИКИ МУЖСКОГО БЕСПЛОДИЯ
Жалобы и анамнез
Важно узнать у пациента о подробностях половой жизни. Большинство мужчин (80%) не знают, когда зачатие наиболее вероятно. Тем не менее оценить эту вероятность несложно, если узнать, насколько регулярна половая жизнь. Как правило, сперматозоиды сохраняют жизнеспособность в слизи и железах шейки матки в течение 2–5 сут, а значит, в большинстве случаев одного полового акта через день для зачатия достаточно [1, 3, 20].
Собирая анамнез, необходимо выяснить у пациента следующие сведения.
Физикальное обследование
Осмотр
При общем физическом обследовании оценивают рост, массу тела, АД, особенности телосложения, тип распределения волосяного покрова и подкожной жировой клетчатки. Форму и степень развития грудных и половых желез оценивают по шкале Таннера (Tanner). Проводят осмотр и пальпацию грудных желез для выявления ложной и истинной гинекомастии.
Урогенитальный статус
Проводят осмотр и пальпаторное обследование органов мошонки с указанием положения, консистенции и размеров яичек, придатков и семявыносящих протоков, при этом нормальные размеры яичка соответствуют 15 см3 и больше и определяются с помощью орхидометра Прадера.
-
по степени изменения варикозного расширения семенного канатика, определяемого в ортостазе:
-
субклиническая степень варикоцеле определяется только с помощью скротальной термографии и/или допплеровского УЗИ;
-
варикоцеле I степени определяется пальпаторно с использованием приема Вальсальвы;
-
варикоцеле II степени определяется пальпаторно без приема Вальсальвы;
-
варикоцеле III степени определяется визуально и пальпаторно;
Для выявления состояния придаточных половых желез выполняется пальцевое ректальное обследование предстательной железы и семенных пузырьков, которые в норме не пальпируются.
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Исследование эякулята [48]
В стандартное обследование мужчин входит, помимо анамнеза и физикального обследования, анализ эякулята. Показатели анализа эякулята (табл. 5.1) стандартизируются ВОЗ и распространяются в публикациях ВОЗ по лабораторной проверке и обработке человеческого эякулята (5-е издание).
| Критерии | Нижняя граница показателя |
|---|---|
Объем эякулята, мл |
1,5 (1,4–1,7) |
Общее количество сперматозоидов (106 в эякуляте) |
39 (33–46) |
Концентрация сперматозоидов (106 в мл) |
15 (12–16) |
Общая подвижность (поступательные и непоступательные движения сперматозоидов) |
40 (38–42) |
Сперматозоиды с поступательным движением, % |
32 (31–34) |
Жизнеспособность (количество живых сперматозоидов), % |
58 (55–63) |
Морфология — нормальная форма, % |
4 (3,0–4,0) |
Другие пороговые значения, определенные консенсусом pH |
>7,2 |
Пероксидаза-позитивные лейкоциты (106/мл) |
<1,0 |
Дополнительные исследования MAR-тест — подвижные сперматозоиды, покрытые антителами, % |
<50 |
Тест на иммуногенность подвижных сперматозоидов с адгезированными частицами, % |
<50 |
Содержание цинка в эякуляте, ммоль/эякулят |
>2,4 |
Содержание фруктозы в эякуляте, ммоль/эякулят |
>13 |
Содержание нейтральной α-глюкозидазы в эякуляте, мЕД/эякулят |
<20 |
Частота выполнения анализа эякулята
Если в соответствии с критериями ВОЗ показатели эякулята находятся в пределах нормативных показателей, то достаточно выполнения 1 теста. Если имеются отклонения от нормы по крайней мере 2 показателей, то это является показанием к обследованию у уролога.
Важно различать следующие понятия для описания отклонений от нормативных показателей эякулята:
Довольно часто все 3 параметра встречаются вместе (ОАТ-синдром). В случаях выраженного ОАТ-синдрома (<1 млн сперматозоидов/мл), как при азооспермии, отмечается высокая встречаемость обструкции семенных путей, а также генетических аномалий.
| Рекомендации [48] | СР |
|---|---|
Если, в соответствии с критериями ВОЗ, имеются отклонения от нормы по крайней мере 2 показателей, то это является показанием к андрологическому обследованию |
A |
Оценка андрогенного статуса должна проводиться в соответствии со стандартами ВОЗ по обследованию, постановке диагноза и лечению бесплодных пар. Это позволяет использовать методы доказательной медицины в такой междисциплинарной области, как репродуктивная медицина |
C |
Анализ эякулята должен проводиться согласно рекомендациям, отраженным в ВОЗ по лабораторному исследованию эякулята человека и взаимодействию сперматозоидов с цервикальной слизью (5-е издание) |
A* |
* Степень доказательности повышена на основании Консенсуса группы специалистов.
Гормональное обследование
Для выявления эндокринных нарушений и уточнения генеза бесплодия необходимо определение следующих половых гормонов в крови: ФСГ, ЛГ (лютеинизирующий гормон), тестостерона, пролактина, Е2 (эстрадиол) и, желательно, тестостерона, связанного глобулинами.
При азооспермии или выраженной олигоастенотератозооспермии необходимо различать обструктивные и необструктивные причины. Нормальный уровень ФСГ и достаточный размер обоих яичек может стать критерием для того, чтобы заподозрить обструкцию. Однако у 29% мужчин с нормальным уровнем ФСГ тем не менее имеются нарушения сперматогенеза.
Забор крови для определения гормонов выполняют с 9.00 до 11.00 для исключения влияния циркадианного ритма и при половом воздержании не менее 2 дней. Перед исследованием не следует проводить каких-либо обследований, включая инструментальные. Если полученные результаты не соответствуют предполагаемому диагнозу или противоречивы, исследование следует повторить.
Достоверный показатель андрогенной функции половых желез — определение тестостерона как гормона, обладающего наиболее важным, специфическим и общим действием на мужской организм. Наиболее часто определяют концентрацию общего тестостерона, который циркулирует в крови в связанном с белками (98%) и в свободном состоянии (2%). Однако именно свободный тестостерон взаимодействует с рецепторами и обладает биологической активностью. В связи с этим знание уровня свободного тестостерона позволяет выявить различные гормонально-поведенческие корреляции и объективно оценить эффективность гормонотерапии.
Гипергонадотропный гипогонадизм
Первичный гипогонадизм развивается в результате непосредственного поражения яичек патологическим процессом, при этом наблюдаются недостаточная продукция андрогенов яичками и ответное повышение продукции гонадотропинов. Причины могут быть врожденными и приобретенными.
Гипогонадотропный гипогонадизм
Вторичный гипогонадизм развивается вследствие гипоталамогипофизарной дисфункции, что выражается снижением секреции гонадотропинов. Его причины следующие.
-
Врожденные: синдромы Кальмана, Лоренса–Муна–Барде–Бидля, Прадера–Вилли, атаксия Фридрейха.
-
Приобретенные: постэнцефалитический, посттравматический, опухолевый, при гранулематозных заболеваниях, системных заболеваниях.
-
Врожденные: аплазия, изолированная недостаточность гонадотропинов с преимущественным дефицитом ЛГ и ФСГ, синдром Мэддока.
-
Приобретенные: травма, опухоль, гипофизэктомия, сосудистая недостаточность.
При подозрении на гипогонадотропный гипогонадизм необходимо в плане обследования выполнять МРТ головного мозга (гипофиза) и тест со стимуляцией ЛГ рилизинг-гормона (люлиберина). Базальный (фоновый) уровень гормонов чаще характеризует заболевание в общем, и по нему не всегда можно определить степень эндокринных нарушений. Проведение в таких сомнительных случаях функциональных и гормональных проб [проба с хорионическим гонадотропином (ХГ), тест с ЛГ рилизинг-гормоном] позволяет оценить состояние различных звеньев репродуктивной системы, уточнить характер поражения и разграничить патологические отклонения и варианты физиологической нормы.
Измерение концентрации тестостерона в крови следует проводить у мужчин с клиническими признаками гипогонадизма, нарушениями сексуальной функции и при патозооспермии.
Определение уровня ФСГ в крови выполняют для дифференциальной диагностики гипогонадизма, оно имеет прогностическую ценность для пациентов с варикоцеле и патозооспермией, поскольку высокая его концентрация не позволяет надеяться на восстановление фертильности.
По данным ряда авторов, целесообразность определения ЛГ в крови заключается в выявлении соотношения ЛГ/тестостерон, что будет указывать на резистентность клеток Лейдига и плохой прогноз в терапии бесплодия. Показания для измерения уровня пролактина в крови — ЭД, клинические признаки гипоандрогении и низкая концентрация тестостерона. Определение концентрации Е2 в крови проводят пациентам с гинекомастией, которая может наблюдаться при опухолях надпочечников или яичек.
Микробиологическое исследование
Воспалительный процесс мужской репродуктивной системы является одной из частых причин мужского бесплодия. Высокая частота инфекций половых органов в браке обусловлена распространенностью воспалительного процесса, возможностью длительного бессимптомного поражения половых желез, имеющего часто хроническое и рецидивирующее течение.
Выделяют различные патогенетические механизмы влияния инфекции на физиологию репродуктивного процесса:
микроорганизмы оказывают прямое и непосредственное действие на сперматозоиды, вызывая их агглютинацию и иммобилизацию
(например, хламидии активизируют процессы апоптоза сперматозоидов или, локализуясь на сперматозоидах, снижают подвижность за счет механического фактора);
нарушение секреторной функции половых желез приводит к изменению реологических и химических компонентов эякулята, поддерживающих и защищающих факторов, тем самым влияя на функциональное состояние сперматозоидов (большинство ИППП);
вызывая воспаление и склероз в тканях, инфекция создает условия для нарушения проходимости путей для сперматозоидов (гонококковое поражение органов половой системы);
инфекции активизируют возникновение иммунологических реакций, с появлением антиспермальных антител (АСАТ) становится невозможным продвижение сперматозоидов к яйцеклетке. Показания для проведения микробиологического исследования: изменения в анализе мочи, нормального объема спермы, нарушение подвижности и агглютинация сперматозоидов, отклонения в биохимических показателях спермы и секрета половых желез, ИМП, простатит, эпидидимит, скрытые инфекции семявыносящих путей и заболевания, передаваемые половым путем.
Проведение инфекционного скрининга основывается на выполнении следующих исследований: цитологического анализа отделяемого уретры, секрета простаты и семенных пузырьков, бактериологического анализа спермы и секрета простаты: ПЦР-диагностики хламидий, микоплазм, уреаплазм, цитомегаловируса, вируса герпеса.
Генетическое обследование
Значительная часть случаев мужского бесплодия, расценивавшихся ранее как идиопатические, связана с генетическими отклонениями, которые могут быть выявлены при тщательном изучении родословной и анализе кариотипа, что в конечном счете позволит правильно поставить диагноз и провести адекватное лечение. Среди причин, приводящих к нарушению фертильности мужчин, патологические изменения хромосом составляют 5–15%. У мужчин с олигозооспермией хромосомные аномалии определяют в 11% случаев, а при азооспермии — в 21% случаев [5, 8, 24]. Патозооспермия может быть обусловлена хромосомными аберрациями как в соматических, так и в половых клетках. В связи с этим не вызывает сомнения тот факт, что в определенных клинических ситуациях необходимо проводить цитогенетический и морфологический анализ хромосом. В этом случае исследование включает изучение кариотипа соматических клеток, позволяющих определить числовые и структурные аномалии митотических хромосом по лимфоцитам периферической крови и половых клеток в эякуляте и/или биоптате яичка. Высокая информативность количественного кариологического и цитологического анализа половых клеток позволяет выявить различные нарушения на всех стадиях сперматогенеза, что во многом предопределяет тактику ведения бесплодной супружеской пары.
Синдром Клайнфелтера — самый частый генетический дефект, вызвающий азооспермию [2, 8]. На него приходится 14% случаев мужского бесплодия (распространенность — 1 на 600 мужчин). Классический синдром Клайнфелтера проявляется триадой симптомов — недоразвитыми плотными яичками, гинекомастией и азооспермией [2, 8]. В 90% случаев синдром Клайнфелтера обусловлен полисомией по Х-хромосоме (кариотип 47 ХХY), в 10% — мозаицизмом 46 ХY/47 ХХY. Фертильность больных возможна при мозаицизме и легких формах синдрома.
Кариотип 46 ХХ
Эта аномалия хромосом обусловлена изменением их структуры и числа, она представляет собой вариант синдрома Клайнфелтера и проявляется у мальчиков пубертатного возраста гинекомастией, а у мужчин — азооспермией.
Кариотип 47 ХYY
Эта хромосомная аномалия встречается примерно с той же частотой, что и синдром Клайнфелтера, но отличается большим разнообразием фенотипических проявлений. При исследовании спермы выявляют олиго- или азооспермию. При биопсии яичка картина бывает разной, чаще всего это отсутствие сперматогенеза или изолированная аплазия сперматогенного эпителия.
Синдром Нунан, или мужской синдром Тернера
Клинические проявления обоих синдромов весьма сходны, хотя при синдроме Нунан кариотип нормальный (46 ХY) или мозаичный (45 Х/46 ХY).
Делеции Y-хромосомы
Примерно у 7% больных олигозооспермией и у 13% больных азооспермией находят структурные изменения длинного плеча Y-хромосомы [6, 14, 24, 26]. Ген SRY, определяющий развитие яичка, не изменен, однако обширные делеции других участков проявляются нарушением сперматогенеза. Делеции хромосом выявляют в клетках крови с помощью ПЦР. Вероятно, в будущем частью исследования спермы станет и анализ дезоксирибонуклеиновой кислоты сперматозоидов. Поскольку у мужчин с делециями Y-хромосомы азооспермия бывает не всегда, при искусственном оплодотворении генетический дефект будет наверняка передаваться сыновьям.
Проведение генетического обследования особенно важно перед использованием вспомогательных репродуктивных технологий, в частности интрацитоплазматической инъекции сперматозоида, так как дефектный генетический материал может стать причиной невынашивания беременности, а в случае родоразрешения быть переданным следующим поколениям.
| Рекомендации [48] | СР |
|---|---|
Стандартный анализ кариотипа следует выполнять всем мужчинам с нарушениями сперматогенеза (<10 млн сперматозоидов/мл), которые для лечения бесплодия обращаются к методу ЭКО |
B |
Генетическое консультирование является обязательным как для пар, у которых при клиническом или генетическом обследовании были найдены генетические дефекты, так и для пациентов, которые могут быть потенциальными носителями наследственных болезней |
A |
Мужчинам с синдромом Клайнфелтера требуется длительное наблюдение у эндокринолога, а с возрастом может возникнуть потребность в андрогензаместительной терапии |
A |
Мужчинам с тяжелыми нарушениями сперматогенеза (<5 млн сперматозоидов/ мл) настоятельно рекомендуется выполнять тест на микроделеции Yq |
A |
Если у мужчины выявлены структурные аномалии семявыносящего протока (одноили двустороннее отсутствие семявыносящего протока), важно исключить наличие у него и партнерши мутаций гена, вызывающего муковисцидоз (CFTR) |
A |
Биохимическое исследование спермы
Проводят для изучения морфологических и физиологических свойств семенной жидкости, что важно в оценке патологических изменений сперматогенеза. Практическое значение получило определение в сперме лимонной кислоты, кислой фосфатазы, ионов цинка, фруктозы. Секреторную функцию простаты оценивают по содержанию лимонной кислоты, кислой фосфатазы и цинка. Отмечена четкая корреляция между этими показателями, поэтому можно определять только два показателя: лимонную кислоту и цинк. Функцию семенных пузырьков оценивают по содержанию фруктозы. Это исследование особенно важно выполнять при азооспермии, когда низкий уровень фруктозы, рН и ненормально высокое содержание лимонной кислоты указывают на врожденное отсутствие семенных пузырьков [1, 6, 10, 24].
Инструментальные исследования
Включают термографию и УЗИ. Термографический анализ органов мошонки, позволяющий выявлять субклинические стадии варикоцеле и контролировать эффективность хирургического лечения, проводят с помощью специальной термографической пластины или дистанционного тепловизора.
У больных варикоцеле при термографии отмечается термоасимметрия правой и левой половины мошонки в пределах от 0,5 до 3,0 °C. Данный метод позволяет устанавливать температурные соотношения также при гидроцеле, паховой грыже, воспалительных заболеваниях органов мошонки. УЗИ выполняют для оценки анатомо-функционального состояния простаты и семенных пузырьков в сагиттальной и поперечной плоскостях с помощью наружного либо трансректального датчика; ультразвуковая допплерометрия имеет аналогичные с термометрией показания.
Иммунологическое обследование
Для определения АСАТ применяются радиоиммунный анализ, твердофазный иммуноферментный анализ и иммуноглобулиновый тест на полиакриловых микросферах (IBT). В настоящее время описано более 90 антигенов сперматозоидов, которые являются как полифункциональными, так и блокирующими тот или иной сегмент взаимодействия сперматозоида и яйцеклетки. Наиболее подробно изучены несколько спермальных антигенов (САГ), ассоциированных с бесплодием, а также кодирующие их гены. Эти САГ: YWK-ll, BE-20, rSMP-B, BS-63, BS-ll, HED-2, каждый из которых отличается от остальных по структуре и синтезируется разными клетками репродуктивного тракта (половыми клетками, клетками эпителия придатка яичка и клетками Сертоли). Все изучаемые АСАТ обладают агглютинирующими или иммобилизирующими сперматозоиды свойствами. К методам диагностики иммунологического бесплодия, связанного с выработкой АСАТ, относятся следующие.
-
Посткоитальный тест, или тест взаимодействия сперматозоидов со слизью шейки матки. Он проводится в двух вариантах:
-
тест in vivo (проба Шуварского–Симса–Хюнера). Пациентка приезжает на исследование после полового акта в дни, предшествующие овуляции. Исследуется содержимое влагалища и шейки матки. Хотя допустимый срок между половым актом и исследованием 24 ч, рекомендуется проведение этой пробы через 3–12 ч после полового акта. Отрицательный («плохой») тест — когда подвижность сперматозоидов в половых путях женщины часто снижается;
-
тест in vitro (проба Курцрока–Миллера). Супруги приезжают на исследование в дни, предшествующие овуляции. Муж сдает сперму, а у жены берется капелька слизи шейки матки. Оценивается взаимодействие сперматозоидов и слизи шейки матки под микроскопом. Отрицательным («плохим») результатом теста является снижение поступательного движения сперматозоидов в слизи шейки матки.
-
-
MAR-тест. Тест, который определяет процент сперматозоидов, связанных с антителами классов IgG и IgA (прямой MAR-тест), и титр антиспермальных антител в биологических жидкостях (спермоплазма, слизь шейки матки, плазма крови) (непрямой MAR-тест). Тест является международно признанным стандартом диагностики АСАТ, обладает средней специфичностью и не всегда высокой чувствительностью.
-
Immunobead-тест. Является аналогом MAR-теста. Спектры антител, определяемых тестами MAR и immunobead, не всегда совпадают, что объясняет часто наблюдаемое расхождение между результатами тестов у одного и того же пациента.
-
Иммуноферментный метод (ELISA). Обычно используется для определения АСАТ в плазме крови. Является дополнительным методом диагностики АСАТ. Высокие титры АСАТ, определяемые методом ELISA, в крови у женщин не всегда связаны с ухудшением прогноза наступления беременности. Следует помнить, что самой частой причиной отрицательного посткоитального теста является наличие АСАТ в сперме (т.е. проблема связана с мужем), а не в шейке матки. Однако очень часто наблюдается сочетание роли как мужских, так и женских факторов. Посткоитальный тест является одним из самых «капризных» тестов в обследовании бесплодия. Достаточно велик процент ложных результатов этого исследования. Поэтому посткоитальный тест необходимо дополнять проведением специальных исследований на АСАТ [1, 8, 13, 27].
Тестикулярную биопсию проводят у пациентов с азооспермией, отсутствием в эякуляте клеток сперматогенеза, нормальными объемом яичек и концентрацией ФСГ в плазме крови. Результат теста оценивают, как нормо-, гипо- и асперматогенез. Рекомендуют применять открытую биопсию и при наличии сохраненного сперматогенеза проводить хирургическую коррекцию семявыносящих путей одновременно. Данную манипуляцию желательно проводить в условиях клиники ВРТ, чтобы предотвратить потери биопсийного материала и минимизировать риск развития аутоиммунного бесплодия, возникающий при повторном повреждении гематотестикулярного барьера. Данный метод позволяет выполнять дифференциальную диагностику между обтурационной и необтурационной формами азооспермии, определяя степень патологического процесса.
Лечение
В зависимости от выявленных причин заболевания предусматривают различные виды лечения, которые можно разделить на консервативные, хирургические и альтернативные.
Инфекции добавочных мужских половых желез и бесплодие
[48]
Инфекции урогенитального тракта у мужчин относятся к числу потенциально излечимых заболеваний при мужском бесплодии [1-3].
В соответствии с рекомендациями ВОЗ, различают уретрит, простатит, орхит и эпидидимит. Все они объединены общим понятием — инфекции добавочных мужских половых желез. Однако не существует прямых данных, подтверждающих отрицательное влияние инфекций на качество эякулята и фертильность мужчин.
АНАЛИЗ ЭЯКУЛЯТА
Анализ эякулята позволяет определить степень поражения инфекционным процессом предстательной железы и получить информацию о качестве спермы. Кроме того, анализ числа лейкоцитов позволяет дифференцировать синдром хронической тазовой боли — воспалительного и невоспалительного характера (NIH IIa против IIIb NIH).
Результаты микробиологического исследования
После исключения уретрита и цистита наличие пероксидаза положительных лейкоцитов в количестве более 106 на 1 мл эякулята свидетельствует о воспалительном процессе. В этих случаях проводится бактериологический анализ на часто встречающиеся уропатогены, и особенно на грамотрицательной бактерии.
Концентрация патогенов мочевого тракта в эякуляте >103 КОЕ/мл свидетельствует о значительной бактериоспермии. В клиниках, занимающихся бесплодием, из мочеполового тракта мужчин выделяются и идентифицируются разнообразные микроорганизмы, при этом в большинстве случаев обнаруживается более 1 штамма возбудителей [1]. Время взятия анализа может влиять на уровень представленности микроорганизмов в эякуляте и частоту выделения различных штаммов [6]. В настоящее время идеального диагностического теста для Chlamydia trachomatis в эякуляте мужчин не создано [7]. В отличие от результатов серологических исследований у женщин антитела к C. trachomatis в плазме эякулята отражают наличие инфекции, если не используются специфические методы [7].
Ureplasma urealyticum обладает патогенными свойствами только при высокой концентрации (>103 КОЕ/мл эякулята). Такие концентрации уреаплазмы обнаруживаются не более чем в 10% проанализированных образцов [8]. При анализе эякулята колонизация мочеиспускательного канала нормальной микрофлорой затрудняет выделение инфекций, ассоциированных с урогенитальными микоплазмами [9].
Лейкоциты
Клиническое значение повышения концентрации лейкоцитов в эякуляте противоречиво [10]. На инфекцию указывает повышение уровня лейкоцитов (особенно полиморфноядерных) и продуктов их метаболизма (например, лейкоцитарной эластазы), выделяемых в семенную жидкость. Большинство лейкоцитов составляют нейтрофилы, на это указывает специфическое окрашивание при пероксидазной реакции [2]. И хотя лейкоцитоспермия (пиоспермия) является признаком воспаления, она не всегда ассоциирована с бактериальной или вирусной инфекцией [11]. Более ранние исследования показали, что повышение уровня лейкоцитов в эякуляте не служит истинной причиной мужского бесплодия [12].
В соответствии с классификацией ВОЗ наличие >1×106 лейкоцитов/мл определяется как лейкоцитоспермия. Только в двух исследованиях проведен анализ содержания лейкоцитов в эякуляте при доказанном простатите [13, 14]. Оба исследования показали, что при простатите количество лейкоцитов в эякуляте больше, чем при отсутствии воспаления (синдром хронической тазовой боли, тип NIH IIIb).
Качество эякулята
Обсуждается отрицательное влияние хронического простатита на плотность, подвижность и морфологию сперматозоидов [1]. Все исследования показывают противоречивые результаты и не подтверждают негативного влияния хронического простатита на параметры качества сперматозоидов [15-17].
Изменения в семенной плазме
Эластаза в семенной плазме служит биохимическим индикатором активности полиморфноядерных лейкоцитов в эякуляте [1, 18, 19]. Считается, что верхняя граница нормы (пороговая концентрация) эластазы составляет приблизительно 600 нг/мл [1]. В процессе воспаления участвуют различные цитокины, которые могут влиять на функции сперматозоидов. В ряде исследований изучалась связь между уровнями интерлейкина (ИЛ), лейкоцитов и функциями сперматозоидов [20-22] — корреляций не обнаружено. Следует отметить, что предстательная железа является основным источником продукции ИЛ-6 и ИЛ-8 в семенной плазме. Цитокины, особенно ИЛ-6, играют важную роль в процессах воспаления добавочных мужских желез [23]. Тем не менее увеличение уровней цитокинов напрямую не связано с числом лейкоцитов в секрете предстательной железы [24].
Нарушение секреции добавочных мужских половых желез
Инфекции половых желез могут влиять на их секреторную функцию. Индикаторами нарушения нормальной секреции предстательной железы являются снижение уровня лимонной кислоты, фосфатазы, фруктозы, цинка и активности α-глутамилтрансферазы [1]. Снижение концентрации фруктозы отражает нарушение функции семенных пузырьков [8, 25].
Антитела к сперматозоидам
Определение антител плазмы крови к антигенам сперматозоидов при обследовании по поводу бесплодия у мужчин имеет небольшую ценность. В более ранних сообщениях указывалось на связь между высоким уровнем антител к сперматозоидам в плазме крови и абактериальным простатитом [26, 27]. Тем не менее за исключением случаев подозрения на хламидийную инфекцию [28] только вазэктомия в анамнезе является предиктором образования антител [29].
Активные формы кислорода
ЛЕЧЕНИЕ
Лечение хронического простатита обычно направлено на устранение симптомов болезни [31, 32]. При нарушениях в составе эякулята у мужчин с воспалительными процессами в урогенитальном тракте назначения андролога должны быть нацелены на:
-
уменьшение числа или эрадикацию микроорганизмов в простатическом секрете и эякуляте;
-
нормализацию лабораторных показателей воспаления (например, лейкоцитов) и секреторной функции;
-
улучшение показателей эякулята для восстановления нарушенной фертильности [33].
Лечение включает назначение антибиотиков, противовоспалительных препаратов, хирургические процедуры, нормализацию уродинамики, физиотерапию, а также изменение образа жизни и полового поведения. Только антибиотикотерапия при хроническом простатите (ХБП, NIH II) позволяет устранить симптомы болезни, обеспечить эрадикацию патогенных микроорганизмов, снизить клеточные и гуморальные параметры воспаления в урогенитальных секретах. Использование α-адреноблокаторов для устранения симптомов болезни спорно. Хотя антибиотики могут улучшить качество эякулята [33], не существует доказательств того, что лечение хронического простатита увеличивает способность к зачатию [1, 34].
ЭПИДИДИМИТ
Воспаление придатка яичка проявляется односторонней болью и отеком, как правило, имеет острое начало. Среди сексуально активных мужчин младше 35 лет эпидидимит чаще всего вызывается Chlamydia trachomatis или Neisseria gonorrhoea [35, 36]. Эпидидимит, передаваемый половым путем, обычно сопровождается уретритом. Эпидидимит, не ассоциированный с половыми инфекциями, связан с инфекциями мочевыводящих путей и чаще наблюдается у мужчин старше 35 лет, которым проводились эндоуретральные процедуры, операции на мочевыводящих путях или при наличии аномалий мочевыводящих путей [37].
Анализ эякулята
Анализ эякулята по критериям ВОЗ должен включать анализ лейкоцитов, выявляющий активность воспалительного процесса. В большинстве случаев наблюдается транзиторное снижение числа сперматозоидов и их поступательного движения [36, 38, 39]. Вялотекущий ипсилатеральный орхит [40, 41] может стать причиной незначительных изменений качества эякулята (табл. 5.2) [42].
Наиболее серьезными последствиями двустороннего эпидидимита являются развитие стеноза эпидидимального протока, снижение числа сперматозоидов и азооспермия. Частота развития азооспермии после эпидидимита неизвестна.
Таблица 5.2. Острый эпидидимит и его влияние на параметры спермы
Авторы |
Негативное влияние |
|||
Плотность |
Подвижность |
Морфология |
Комментарии |
|
Ludwig и Haselberger [43] |
+ |
+ |
+ |
Пиоспермия в 19 из 22 случаев |
Berger и соавт. [36] |
+ |
|
||
Weidner и соавт. [44] |
+ |
+ |
+ |
Азооспермия у 3 из 70 мужчин |
Haidl [45] |
+ |
Хронические инфекции; повышение числа макрофагов |
||
Cooper и соавт. [46] |
Снижение активности эпидидимальных маркеров: α-глюкозидазы, L-карнитина |
|||
Лечение
Антибактериальная терапия показана до получения результатов посева. Лечение эпидидимита приводит к:
Спациентами, у которых выявлен или подозревается эпидидимит, вызванный N. gonorrhoea или C. trachomatis, следует провести беседу о необходимости обследования и лечения полового партнера [47].
КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ
Патогенетическое лечение
Направлено на устранение механизма бесплодия. Как правило, оно оправданно с экономической точки зрения. Иногда достаточно скорректировать образ жизни пациентов, их пристрастия, устранить вредные факторы воздействия для восстановления нормального сперматогенеза.
Рекомендации по половой жизни
Супружеским парам нужно рассказать, когда зачатие наиболее вероятно, как установить момент овуляции (по изменению базальной температуры или по уровню ЛГ в моче, который повышается менее чем за 24 ч до овуляции) и какие вещества снижают фертильность. Поскольку сперматозоиды выживают в шеечной слизи в течение 48 ч, не обязательно, чтобы половой акт точно совпадал с овуляцией. Об этом тоже нужно рассказать и тем самым уменьшить психологическое напряжение, которое испытывает бесплодная супружеская пара. Достаточно одного полового акта через день незадолго до и после овуляции. В качестве увлажняющих средств лучше пользоваться растительным, например оливковым, маслом или вазелином.
Консервативные методы лечения применяют в основном при инфекции половых органов, патозооспермии, эндокринном бесплодии и сексуально-эякуляторных нарушениях.
Ретроградная эякуляция — результат неполного закрытия шейки мочевого пузыря во время эякуляции [1, 7, 8, 13]. Диагноз подтверждают, выявляя сперматозоиды в моче, полученной из мочевого пузыря после эякуляции. Лечение начинают с адреномиметиков, которые частично устраняют ретроградную эякуляцию в 20% случаев. За несколько суток до полового акта назначают имипрамин по 25–50 мг внутрь 2 раза в сутки. Из-за побочных эффектов эти препараты часто приходится отменять. При неэффективности медикаментозного лечения прибегают к ЭКО.
Встречается и другое нарушение — преждевременная эякуляция. В таких случаях бывает очень эффективна психотерапия в сочетании с трициклическими антидепрессантами или ингибиторами обратного захвата серотонина (например, флуоксетином).
Бесплодие при иммунных нарушениях
Этот вид бесплодия трудно поддается лечению. Применяют глюкокортикоиды, отмывание сперматозоидов, искусственное осеменение, экстракорпоральное оплодотворение с микроинъекцией сперматозоидов в цитоплазму яйцеклетки.
Лечение супружеских пар с выявленным повышением уровня АСАТ проводится по-разному, в зависимости от всего комплекса данных обследования. Начинают обычно с применения барьерного метода (презерватив) в постоянном режиме сроком на 3–6 мес или в прерывистом режиме (половая жизнь без презерватива только в дни, благоприятные для наступления беременности). Параллельно может назначаться терапия, снижающая вязкость слизи шейки матки (гвайфенезин) и подавляющая продукцию АСАТ у супругов. При неудаче консервативной терапии проводятся курсы внутриматочной инсеминации спермой мужа или оплодотворение in vitro (ЭКО).
Для снижения уровня АСАТ назначают преднизолон (Божедомов В.А. и др., 2000) в дозе 40 мг/сут курсами до 3–5 дней. Назначение преднизолона короткими курсами в указанной дозе подавляет выработку антиспермальных антител. Модификацией способа является назначение преднизолона в течение 5 дней ежедневно, в суточной дозе 1,2 мг на 1 кг массы тела больного (по 30 мг per os 3 раза в день, что составляет 90 мг при средней массе тела больного 75 кг). После окончания лечения преднизолоном пациенту через день проводят курс плазмафереза, до нормализации показателей (Кореньков Д.Г. и др., 2004). Как сообщают авторы, у 89% больных улучшились основные показатели спермограммы, а эффективность лечения подтвердилась наступлением беременности в большинстве наблюдений.
В последнее время появились сообщения об экспериментальном назначении антиоксиданта эмоксипина при высоком уровне АСАТ. Препарат обладает антитоксическим и мембраностабилизирующим действием. Назначение раствора эмоксипина в дозе 0,3–0,5 мл внутримышечно мужчине в первые 14 дней овуляторного цикла у партнерши приводит к выраженному снижению уровня АСАТ с высокой долей вероятности. Для эффективного снижения АСАТ необходимо два подобных курса (Божедомов В.А. и др., 2011). Полученные результаты неоднозначны и ввиду отсутствия эффективных методик по снижению АСАТ заслуживают самого пристального внимания.
В целом лечение показано, если с АСАТ связано более 10% сперматозоидов.
Бесплодие при эндокринных нарушениях
Проводят корригирующую гормональную терапию. Она должна быть целенаправленной, а не эмпирической. При выявлении эндокринных расстройств необходимо подключение эндокринологов.
При гиперпролактинемии прекращается импульсный выброс гонадолиберина. При макроаденоме гипофиза показана трансфеноидальная аденомэктомия. При микроаденоме — терапия бромокриптином 5–10 мг/сут внутрь [8, 13, 22].
Бесплодие возможно при заболеваниях щитовидной железы. На сперматогенез влияют и снижение, и повышение уровней тиреоидных гормонов. С заболеваниями щитовидной железы связано 0,5% случаев мужского бесплодия, причем они хорошо поддаются лечению [8]. Поскольку и гипотиреоз, и тиреотоксикоз обычно проявляются клинически, определять уровни тиреоидных гормонов у всех бесплодных мужчин нецелесообразно.
При врожденной гиперплазии коры надпочечников чаще всего наблюдают недостаточность 21-гидроксилазы, яички не развиваются, так как секреция гонадотропных гормонов подавлена высоким уровнем андрогенов коры надпочечников. Эта болезнь встречается редко и обычно проявляется в период полового развития. Диагноз устанавливают лабораторными методами. У больных обоего пола для лечения и основного заболевания, и бесплодия применяют глюкокортикоиды.
Избыток и дефицит тестостерона
Для синдрома Кальманна характерен дефицит гонадолиберина, необходимого для нормального функционирования гипофиза. При этом синдроме весьма эффективным бывает ХГ по 1000–2000 ЕД внутримышечно 3 раза в сутки и менотропин (комбинация ЛГ и ФСГ) 75 МЕ ФСГ и 75 МЕ ЛГ внутримышечно 2 раза в неделю. При патологических изменениях гипофиза наиболее эффективны ХГ и менотропин. При бесплодии на фоне изолированного дефицита ЛГ (синдром Паскуалини) назначают ХГ. Поскольку эти препараты предназначены для инъекции и дороги, как только в эякуляте появляются подвижные сперматозоиды, следует сразу прибегнуть к их криоконсервации. Как правило, для этого требуется 6–9 мес лечения.
Эмпирическое медикаментозное лечение [48]
-
У 44% мужчин с бесплодием достоверные причины его возникновения обнаружить не удается [1].
-
Несмотря на большой выбор препаратов для лечения идиопатического мужского бесплодия, научная доказательность эмпирического подхода в терапии невелика [2].
-
Андрогены, ХГЧ/человеческий менопаузальный гонадотропин, бромкриптин, α-адреноблокаторы, системные кортикостероиды и препараты магния неэффективны в лечении ОАТ-синдрома.
-
Фоликулостимулирующий гормон может оказывать положительное воздействие на определенных пациентов [3].
-
Кокрейновское исследование показало, что у мужчин, принимающих антиоксиданты перорально, значительно увеличивался коэффициент рождаемости [ОШ = 4,85, 95% ДИ: 1,92–12,24, р=0,0008; I (2) = 0%] по сравнению с мужчинами, получавшими контрольную терапию.
-
Отсутствуют исследования, которые показали бы вредные побочные эффекты от антиоксидантной терапии.
-
Данные свидетельствуют о том, что применение антиоксидантов у субфертильных мужчин может улучшить результаты живорождения и частоты наступления беременности для пар, проходящих циклы вспомогательных репродуктивных технологий.
| Рекомендации [48] | СР |
|---|---|
Медикаментозное лечение мужского бесплодия рекомендуется проводить только в случаях гипогонадотропного гипогонадизма |
A |
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Время доказало эффективность хирургических методов лечения бесплодия — они нередко помогают устранить его причину и избежать искусственного оплодотворения, сопряженного с большими финансовыми затратами.
Варикоцеле
Хотя большинство мужчин с варикоцеле фертильны, причинно-следственная связь между этим заболеванием и бесплодием подтверждена клиническими наблюдениями, а также ретроспективными и проспективными исследованиями. При варикоцеле применяют открытые и малоинвазивные вмешательства. Среди них лапароскопическая или открытая перевязка яичковой вены забрюшинным, паховым или подпаховым доступом и эмболизация яичковой вены. Цель любого из этих вмешательств — прекращение ретроградного тока венозной крови по яичковой вене. Следует учесть, что частота зачатия при выжидательной тактике составляет 16%, при экстракорпоральном оплодотворении — 35% [8, 13, 23]. Частота осложнений после открытого вмешательства по поводу варикоцеле — 1%, после лапароскопической операции — 4%, после эмболизации — 10–15%. Последний показатель отражает и те случаи, когда яичковую вену не удается катетеризировать и эмболизировать.
Тем не менее следует учитывать, что хирургическое лечение варикоцеле, по данным многих рандомизированных исследований (Krause et al., 2002; Unalet al., 2001; Grasso et al., 2000; Yamamoto et al., 1996; Madgar et al., 1995; Nilsson et al., 1979; Nieschlag et al., 1998), не увеличивает количество и подвижность сперматозоидов.
| Рекомендации [48] | СР |
|---|---|
Проводить лечение варикоцеле рекомендуется подросткам, у которых имеется прогрессирующее нарушение развития яичек, доказанное клиническим осмотром в динамике |
B |
Нет доказательств эффективности лечения варикоцеле у бесплодных мужчин с нормальными показателями спермограммы или у мужчин с субклинической формой варикоцеле. В этой ситуации проводить лечение варикоцеле не рекомендуется [15-17] |
A |
Рассмотреть необходимость лечения при клинических признаках варикоцеле, олигоспермии, бесплодии продолжительностью более 2 лет, отсутствии других причин бесплодия у супружеской пары |
A |
Обструктивная азооспермия
Оперативное лечение в зависимости от места наложения анастомоза делят на три группы: вазовазоанастомоз, вазоэпидидимоанастомоз, вазотестикулоанастомоз [1].
Вазовазостомия
О непроходимости семявыносящих путей следует думать при нормальных уровнях половых и гонадотропных гормонов, нормальных размерах яичек и азооспермии.
Разработано несколько равноценных по эффективности методик вазовазостомий. Использование операционного микроскопа позволяет точнее сопоставить концы семявыносящего протока. Обычно накладывают одно или двухрядный анастомоз.
Независимо от методики успех любой операции зависит главным образом от искусства хирурга. Через 8 лет после операции успешность вазовазостомий составляет менее 50% [24]. При длинном (более 2,7 см) участке семявыносящего протока между яичком и местом перевязки, а также при поступлении из просвета пересеченного участка прозрачной жидкости, содержащей сперматозоиды, прогноз благоприятный. В этом случае вазовазостомия оказывается эффективной более чем в 95% случаев. Если в жидкости, полученной из семявыносяшего протока, сперматозоиды отсутствуют, скорее всего, при этом поврежден достаточно уязвимый проток придатка яичка, длина которого составляет примерно 5,5 мм. Чем больше срок после вазэктомии, тем выше давление в дистальной культе семявыносяшего протока, в результате может происходить разрыв протока придатка яичка — самого слабого участка семявыносящих путей. Заживая, поврежденный участок становится непроходимым. В этом случае показана эпидидимовазостомия, при которой семявыносящий проток соединяют с протоком придатка яичка проксимальнее уровня обструкции.
| Рекомендации [48] | СР |
|---|---|
При азооспермии с обструкцией на уровне придатка яичка стандартные процедуры включают в себя вазовазостомию и туболовазостомию |
B |
Дополнительно могут быть использованы методики по выделению сперматозоидов, такие как аспирация сперматозоидов из семявыносящего протока, придатков или получение сперматозоидов из яичка. Эти методы должны использоваться только тогда, когда возможна криоконсервация полученного материала |
B |
При азооспермии, вызванной обструкцией на уровне придатка яичка, необходимо выполнять ревизию мошонки с микрохирургической аспирацией сперматозоидов из придатка яичка и их криоконсервацией по возможности в сочетании с микрохирургической реконструкцией. Результаты реконструктивной микрохирургической коррекции зависят от причины, вызвавшей обструкцию, ее локализации, а также от опыта хирурга |
B |
Для микрохирургических операций по восстановлению фертильности после вазэктомии характерны относительно низкая стоимость и высокая эффективность |
B |
Применение методов аспирации сперматозоидов из семявыносящего протока, придатков или получение сперматозоидов из яичка и ЭКО следует рассматривать в случаях неэффективности восстановительных операций после вазэктомии |
A |
Для пар, которые хотят иметь детей, ЭКО (хирургическое выделение сперматозоидов с их последующим интрацитоплазматическим введением) является методом 2-й линии, который применяется избирательно и в случаях неудачи вазовазостомии |
B |
Эпидидимовазостомия устраняет азооспермию в 60–65% случаев, ее микрохирургическая модификация еще эффективнее [8, 11].
Как правило, после вазовазостомий беременность наступает не более чем в 67% случаев, поэтому, прежде чем решаться на операцию, нужно исключить женское бесплодие. Вазоэпидидимоанастомоз рекомендуют совмещать с аспирацией семенной жидкости и криоконсервацией полученных сперматозоидов для возможного использования в последуюшем экстракорпоральных методов оплодотворения.
Тестикуловазоанастомоз выполняют после резекции придатка в зоне rete testis [1].
Аспирация сперматозоидов
Применяют при нарушении транспорта сперматозоидов из-за аплазии семявыносящих путей или их неустранимой непроходимости на любом уровне от придатка яичка до семенного бугорка. Примеры — аплазия семявыносящего протока или неудачный исход вазовазостомии. Сперматозоиды можно получить из семявыносящего протока, яичка или его придатка. Безусловно, в таких случаях зачатие без экстракорпорального оплодотворения невозможно. В этой связи конечный результат зависит от правильного выбора методики искусственного оплодотворения. При аспирации сперматозоидов из яичка или его придатка перед экстракорпоральным оплодотворением необходимы микроманипуляции. Понятно, что это возможно только при сохраненном сперматогенезе. Косвенно наличие сперматогенеза подтверждают по уровням гормонов и объему яичка, но самый точный метод диагностики в данном случае — биопсия яичка.
Аспирация сперматозоидов из семявыносящего протока
Процедуру выполняют под местной анестезией через разрез на мошонке. Под операционным микроскопом рассекают семявыносящий проток, вытекающую сперму аспирируют и помещают в питательную среду. Когда получено достаточное количество сперматозоидов (10– 20 млн), на семявыносящий проток накладывают швы. Самые зрелые и жизнеспособные сперматозоиды получают именно из семявыносящего протока, так как они уже прошли придаток яичка, где происходит их окончательное созревание.
Аспирация сперматозоидов из придатка яичка
К этому методу прибегают в том случае, когда семявыносящий проток либо отсутствует, либо непроходим на обширном участке после перенесенных операций, травмы или инфекции. Доступ к придатку яичка такой же, как к семявыносящему протоку, через разрез на мошонке, хотя часто выполняют простую пункцию. Сперматозоиды получают из одного выделенного протока — аспирируют 10–20 млн (их используют для экстракорпорального оплодотворения), после чего проток придатка яичка ушивают. Сперматозоиды, полученные из придатка яичка, не столь зрелые, как те, которые прошли через придаток яичка в семявыносяший проток, поэтому, как уже говорилось, перед экстракорпоральным оплодотворением требуются микроманипуляции. При использовании материала из придатка яичка оплодотворение наблюдается в 65% случаев, беременность — в 50%, но в каждом случае вероятность успеха определяется характеристиками и сперматозоидов, и яйцеклеток [8, 17, 24].
Получение сперматозоидов из яичка
Эта методика появилась в 1995 г. Ее успешность доказала, что сперматозоидам не обязательно проходить через придаток яичка, чтобы приобрести способность к оплодотворению. Получение сперматозоидов из яичка показано при обструкции придатка в месте соединения с яичком и непроходимости выносящих канальцев [8, 19, 25]. Еще одно показание — тяжелая тестикулярная недостаточность, при которой вырабатывается так мало сперматозоидов, что они не попадают в эякулят. Техника манипуляции такая же, как при биопсии, — получение участка ткани яичка под местной анестезией. Затем полученный материал обрабатывают в лаборатории, чтобы отделить сперматозоиды от других клеток. При использовании сперматозоидов, полученных из яичка, оплодотворение может наступать в 50–65% случаев, беременность — в 40–50%.
Анэякуляторный синдром
Отсутствие эякуляции чаще всего обусловлено повреждением спинного мозга и операциями на органах малого таза или забрюшинно го пространства с повреждением симпатических нервов. В этом случае при введении электрода в прямую кишку (метод трансректальной электроэякуляции) удается стимулировать сокращение семявыносящих протоков и семенных пузырьков и вызвать рефлекторную эякуляцию. Сперму, предназначенную для искусственного оплодотворения, собирают из полового члена и мочевого пузыря, так как после электростимуляции эякуляция часто бывает ретроградной.
Трансректальная электроэякуляция эффективна после забрюшинной лимфаденэктомии. При этом подвижность сперматозоидов снижена, что нельзя объяснить ни воздействием электрического тока, ни выделением тепла во время процедуры. У мужчин с повреждением спинного мозга выше сегмента T5 эякуляцию нередко удается вызвать с помощью высокочастотного (100 Гц) вибратора для полового члена с амплитудой колебаний 2–3 мм. Мужчину обучают этой методике. Для сбора спермы и искусственного осеменения используют шеечный колпачок [8, 10].
| Рекомендации [48] | СР |
|---|---|
Этиотропную терапию эякуляторных нарушений следует проводить до сбора эякулята и применения вспомогательных репродуктивных технологий |
B |
Преждевременная эякуляция хорошо купируется использованием анестезирующих кремов или СИОЗС |
A |
У мужчин с повреждением спинного мозга наиболее эффективными методами эякуляции для получения спермы являются вибростимуляция полового члена и трансректальная электростимуляция |
B |
Орхипексия
На первом году жизни крипторхизм выявляют у 0,8% мальчиков. В возрасте старше 1 года вероятность самопроизвольного опускания яичка в мошонку очень мала. Хотя орхипексию выполняют в основном из-за высокого риска злокачественной опухоли яичка, чтобы в случае развития опухоли своевременно выявить ее при пальпации, целью операции является и сохранение фертильности (как уже отмечалось выше, эффективность орхипексии в этом отношении сомнительна). При гистологических исследованиях не опустившегося в мошонку яичка обнаружено, что к 2 годам в нем значительно уменьшается число сперматогониев. Орхипексию рекомендуют выполнять не позже этого возраста, чтобы предотвратить изменения, хотя теоретические предпосылки на практике не оправдываются. Однако поскольку сперматозоиды для искусственного оплодотворения можно получить даже из атрофированного яичка со сниженной функцией, предпочтительна именно орхипексия, а не орхэктомия [8, 21]. Следует отметить, что при наличии признаков атрофии возникает высокий риск развития аутоиммунного бесплодия за счет повышения уровня антиспермальных антител, которые могут повреждать сперматогенез в здоровом яичке, при полной сохранности его гормонпродуцирующей функции, поэтому чем раньше пациент перенесет данную операцию, тем больше шансов на восстановление уровня сперматогенеза. Минимальный возраст для выполнения операции составляет 3 мес (после 2 курсов ХГЧ-стимулирующей терапии).
Перекрут яичка — неотложное урологическое заболевание. Результаты экспериментов на животных показывают, что после перекрута одного яичка во втором нарушается сперматогенез. Этот процесс называют симпатической орхипатией, и ее причиной считают аутоиммунную реакцию. Тем не менее в литературе почти нет доказательств, что у человека происходит аналогичный процесс. Сторонники гипотезы о симпатической орхипатии для ее профилактики рекомендуют удалять перекрученное яичко сразу после постановки диагноза [28]. Однако при современных методах лечения бесплодия сперматозоиды можно получить даже при тестикулярной недостаточности, поэтому в настоящее время упомянутая тактика не рекомендуется.
ИСКУССТВЕННОЕ ОПЛОДОТВОРЕНИЕ
Если мужское бесплодие не поддается медикаментозному и хирургическому лечению, прибегают к искусственному оплодотворению.
Искусственное осеменение (внутриматочная инсеминация)
Принцип искусственного осеменения — введение отмытой спермы непосредственно в полость матки. Главное показание — гибель сперматозоидов в шеечной слизи. В этом случае беременность возможна, если сперматозоиды минуют шейку матки. Другие показания — неудовлетворительные показатели исследования спермы, иммунные нарушения и пороки развития (например, гипоспадия), из-за которых нарушен транспорт сперматозоидов. Искусственное осеменение дает шансы на успех, если в эякуляте содержится 5–40 млн подвижных сперматозоидов. Эффективность этой методики очень непостоянна и зависит от репродуктивной функции женщины. Частота беременности после одного цикла лечения при мужском бесплодии составляет 8–16%. Сроки искусственного осеменения определяют с помощью УЗИ и по уровню ЛГ в сыворотке крови [8, 16, 29].
Экстракорпоральное оплодотворение и микроинъекция сперматозоидов в цитоплазму яйцеклетки
Экстракорпоральное оплодотворение — технически более сложная, чем искусственное осеменение, процедура. Она позволяет избежать любые нарушения транспорта сперматозоидов по женским половым органам. Экстракорпоральное оплодотворение включает индукцию овуляции и взятие яйцеклеток из яичников под контролем УЗИ до наступления овуляции с последующим оплодотворением их в чашке Петри 0,5–5,0 млн сперматозоидов. Эта методика весьма эффективна при тяжелом мужском бесплодии, когда число подвижных сперматозоидов резко снижено. Экстракорпоральное оплодотворение со временем дополнили принципиально новой процедурой — микроинъекцией сперматозоидов в цитоплазму яйцеклетки. С этого времени необходимость использовать сотни сперматозоидов для экстракорпорального оплодотворения отпала, так как для микроманипуляции достаточно одного жизнеспособного сперматозоида. В свою очередь, эта методика ускорила появление новых хирургических методов, предназначенных для получения сперматозоидов у мужчин с азооспермией. Вместо эякулята для получения сперматозоидов начали использовать семявыносящие пути. В настоящее время сперматозоиды для микроинъекции в цитоплазму яйцеклетки берут из семявыносяшего протока, яичка и его придатка. Недостаток экстракорпорального оплодотворения с микроманипуляциями — устранение естественного отбора, который действует при обычном оплодотворении, из-за чего генетические дефекты, вызывающие бесплодие, с высокой вероятностью наследуются потомством [8, 16, 18]. Это сопряжено с целым рядом этических проблем, особенно при лечении мужчин с синдромом Клайнфелтера, который может проявиться у внуков мужчины, страдающего излечимым, благодаря современным методам, бесплодием.
ЛИТЕРАТУРА
-
Аляев.Ю.Г., Григорян В.А., Чалый М.Е. Нарушения половой и репродуктивной функции у мужчин. — М.: Литтерра-2006. — С. 52–96.
-
Воробьева О.А., Леонтьева О.А., Корсак В.С. Методы оценки морфологии сперматозоидов и их прогностическое значение в программе ЭКО //Пробл. репрод. — 1995. — № 3. — С. 71.
-
Глыбочко П.В., Аляев Ю.Г., Чалый М.Е., Ахвледиани Н.Д. Половые расстройства у мужчин. — М.: ГЭОТАР-Медиа 2012. — С. 71–90.
-
Горюнов В.Г., Жиборев Б.Н., Евдокимов В.В. Причины и признаки мужского бесплодия. — Рязань, 1993.
-
Резников А.Г., Варга С.В. Антиандрогены. — М.: Медицина, 1998.
-
Руководство по урологии / под ред. Н.А. Лопаткина. — М.: Медицина, 1998. — Т. 3. — С. 590—601.
-
Тер-Аванесов Г.В. Андрологические аспекты бесплодного брака. — М., 2000.
-
Урология по Дональду Смиту / под ред. Э. Танаго и Дж. Маканинича. — М.: Практика, 2005.
-
Aitken R., Clarkson J., Hargreave T.B. et al. Analysis of the relationship between defective sperm function and the generation of reactive oxygen species incases of oligo-zoospermia //J. Androl. — 1989. — Vol. 10. — P. 214.
-
Aitken R.J., West K., Buckingham D. Lеukocytic infiltration into the human ejaculate and its association with semen quality, oxidative stress, and spermfun ction //J. Androl. — 1994. — Vol. 15. — P. 343.
-
Belker A.M., Thomas A.J., Fuchs E.F. et al. Results of 1,469 microsurgical vasectomy reversals by the vasovasostomy study group //J. Urol. — 1991. — Vol. 145. — P. 505.
-
Bennett C.J., Seager S.W., Vasher E.A. et al. Sexual dysfunction and electroejaculation in men with spinal cord injury: Review //J. Urol. — 1988. — Vol. 139. — P. 453.
-
Campbell’s Urology. — 8th ed. / Ed.P. C. Walsh. — Vein, 2002.
-
Clarke G.N., Elliot P.J., Smaila C. Detection of sperm antibodies in semenusing the immunobead test: A survey of 813 consecutive patients //Am.J. Reprod. Immunol. Microbiol. — 1985. — Vol. 7. — P. 118.
-
Coburn M., Wheeler T.M., Lipshultz L.I. Testicular biopsy: its uses andlimitations //Urol. Clin. North. Am. — 1987. — Vol. 14. — P. 551.
-
Cohen J. In vitro fertilization: A treatment for male infertility //Fertil. Steril. — 1985. — Vol. 43. — P. 422.
-
Devroey P., Liu J., Nagy Z. et al. Pregnancies after testicular sperm extractionand intracytoplasmic sperm injection in nonobstructive azoospermia //Hum. Reprod. — 1995. — Vol. 10. — P. 1457.
-
Enquist E., Stein B.S., Sigman M. Laparoscopic versus subinguinal varicocelectomy: A comparative study //Fertil. Steril. — 1994. — Vol. 61. — P. 1092.
-
ESHRE Andrology Special Interest Group. Consensus workshop on advanced diagnostic andrology techniques //Hum. Reprod. — 1996. — Vol. 11. — P. 1463–1479.
-
Goldstein M., Gilber B.R., Dicker A.P. Microsurgical inguinal varicocelectomy with delivery of the lestis: An artery and lymphatic sparing technique //J. Urol. – 1992. — Vol. 148. — P. 1808.
-
Goldstein M. The Surgery of Male Infertility. — Saunders, 1995.
-
Gorelick J., Goldstein M. Loss of fertility in men with varicocele //Fertil. Steril. — 1993. — Vol. 59. — P. 613.
-
Handelsman D.J., Conway A.J., Boylan L.M. et al. Young’s syndrome: Obstructive azoospermia and chronic sinopulmonary infections // N. Engl.J. Med. — 1984. — Vol. 310. — P. 3.
-
Hendry W.F., Hughes L., Scammell G. et al. Comparison of prednisoloneand placebo in subfertile men with antibodies to spermatozoa //Lancet. — 1990. — Vol. 335. — P. 85.
-
Jarow J.P., Sanzone J.J. Risk factors for male partner antisperm antibodies //J. Urol. — 1992. — Vol. 148. — P. 1805–1807.
-
Kent-First M.G., Kol S., Muallem A. et al. Infertility in intra cytoplasmic sperminjection-derived sons //Lancet. — 1996. — Vol. 348. — P. 332.
-
World Health Organization. WHO manual for the standardized investigation, diagnosis and management of the infertile male. — Cambridge: Cambridge University Press, 2000.
-
World Health Organization. WHO laboratory manual for the examination of human semen and sperm-cervical mucus interaction. — 4th ed. — Cambridge: Cambridge University Press, 1999.
-
Lees G.E. Epidemiology of naturally occurring bacterial urinary tract infection. Vet Clin North Am Small Anim Pract. 1984; 14:471–479.
-
Kruger J.M., Osborne C.A., Goyal S.M. et al. Clinical evaluation of cats with lower urinary tract disease. J Am Vet Med Assoc. 1991;199:211–216.
-
Mitchell D.M., Swindell R., Elliott T., Wylie J.P., Taylor C.M., Logue J.P. Analysis of prostate-specific bounce after I (125) permanent seed implant for localized prostate cancer. Radiother Oncol 2008; 88:102–107.
-
Benson M.C., Whang I.S., Pontuk A. et al. Prostate specific antigen density: a means of distinguishin benign prostatic hypertrophy and prostate cancer. J Urol 1992; 147:815–6.
-
Trojian T. H1, Lishnak T.S., Heiman D. Epididymitis and orchitis: an overview. — Am Fam Physician. 2009 Apr 1;79 (7):583–587.
-
Redfern T.R., English P.J., Baumber C.D., McGhie D. The aetiology and management of acute epididymitis Br J Surg. 1984;71 (9):703–705.
-
Ciftci A.O., Senocak M.E., Tanyel F.C., Büyükpamukçu N. Clinical predictors for diffferential diagnosis of acute scrotum. Eur J Pediatr Surg. 2004; 14 (5):333–338.
-
Deeg K.H., Wild F. Colour Doppler imaging — a new method to diffferentiate torsion of the spermatic cord and epididymoorchitis. Eur J Pediatr. 1990;149:253– 255.
-
Mufti R.A., Ogedegbe A.K., Lafferty K. The use of Doppler ultrasound in the clinical management of acute testicular pain. Br J Urol. 1995;76:625–627.
-
Benchimol M., de Andrade Rosa I., da Silva Fontes R., Burla Dias A.J. Trichomonas adhere and phagocytose sperm cells: adhesion seems to be a prominent stage during interaction. Parasitol Res. 2008;102:597–604.
-
Adamopoulos D.A., Lawrence D.M., Vassilopoulos P., Contoyiannis P.A., Swyer GIM. Pituitary-testicular interrelationships in mumps orchitis and other viral infections. Br Med J. 1978;1:1177–1180.
-
Palladino M.A., Savarese M.A., Chapman J.L., Dughi M.-K., Plaska D. Localization of Toll-like receptors on epididymal epithelial cells and spermatozoa. Am J Reprod Immunol. 2008;60:541–555.
-
Fearon D.T., Locksley R.M. The instructive role of innate immunity in the acquired immune response. Science. 1996;272:50–54.
-
Weidner W., Krause W., Ludwig M. Relevance of male accessory gland infection for subsequent fertility with special focus on prostatitis. Hum Reprod Update. 1999 Sep-Oct; 5 (5):421–432.
-
Haidl G., Allam J.P., Schuppe H.C. Chronic epididymitis: impact on semen parameters and therapeutic options. Andrologia. 2008 Apr; 40 (2):92–96. doi: 10.1111/j. 1439–0272.2007.00819.x.
-
Cooper E.L., Hirabayashi K. Origin of Innate Immune Responses: Revelation of Food and Medicinal Applications. J Tradit Complement Med. 2013 Oct; 3 (4):204–212.
-
Centers for Disease Control and Prevention. Sexually transmitted diseases. Treatmentguidelines 2006. Epididymitis. http://www.cdc.gov/std/treatment/2006/ epididymitis. Accessed January 23, 2009.
-
http://uroweb.org/fileadmin/guidelines/Guidelines_2014_5_June_2014.pdf
Глава 6. НЕДЕРЖАНИЕ МОЧИ У ЖЕНЩИН
З.К. Гаджиева, М.А. Газимиев, Г.Р. Касян
Недержание мочи, или инконтиненция, — любое непроизвольное вы деление мочи из наружного отверстия мочеиспускательного канала вне зависимости от приведших к нему ситуаций и обстоятельств. Это заболевание является и социальной, и медицинской проблемой [1, 2]. Недержание мочи возникает, если давление в мочевом пузыре превышает давление внутри мочеиспускательного канала.
-
Экстрауретральное непроизвольное выделение мочи может быть связано с врожденными или приобретенными дефектами мочеточника, мочевого пузыря или мочеиспускательного канала, например, при экстрофии мочевого пузыря (врожденном отсутствии его передней стенки), тотальной эписпадии уретры (отсутствии передней стенки мочеиспускательного канала), тотальной гипоспадии уретры (отсутствии задней стенки мочеиспускательного канала), эктопии устьев мочеточников с необычным их расположением, например в уретре или влагалище. Приобретенные дефекты, ведущие к ложному недержанию мочи, как правило, связаны с травмой, в результате которой нарушается целостность мочевыводящих путей с последующим образованием мочевых свищей, открывающихся на кожу, во влагалище или прямую кишку.
-
Истинным недержанием мочи, по определению Международного общества по удержанию мочи (ICS), считается «непроизвольная потеря мочи, объективно доказуемая и вызывающая социальные и гигиенические проблемы» [3, 4]. Истинное недержание мочи возникает при повреждениях спинного мозга, спинномозговой грыже, запущенном цистите, осложненном сморщиванием мочевого пузыря. Истинное недержание мочи при напряжении может появляться при изменении положения тела, физической нагрузке той или иной степени выраженности, т.е. при увеличении внутрибрюшного давления. Оно обусловлено снижением тонуса мышц тазового дна, ослаблением сфинктеров мочевого пузыря.
МКБ-10 • N39.3 Непроизвольное мочеиспускание • N39.4 Другие уточненные виды недержания мочи • N39.9 Расстройство мочевыделительной системы неуточненное • R32 Недержание мочи неуточненное
F98.0 Энурез неорганической природы.
Факторы риска
Факторы риска могут быть разделены на:
Курение, диета, депрессия, инфекции мочеполового тракта и физическая нагрузка не являются факторами риска.
Предрасполагающие факторы
-
Раса — у белых женщин недержание мочи встречается значительно чаще, чем у афроамериканок и азиаток [5].
-
Наследственность — женщины, у матерей или старших сестер которых наблюдаются симптомы недержания мочи, наиболее часто страдают этим заболеванием [6].
-
Нарушения анатомии — наличие маточно-пузырных, пузырновлагалищных или уретровлагалищных свищей может приводить к непроизвольному выделению мочи [7].
-
Неврологические нарушения — такие состояния и заболевания, как травмы головного или спинного мозга, инсульты, инфаркты мозга, болезнь Паркинсона, рассеянный склероз, полиомиелит, нарушения периферической нервной системы при тазовой хирургии и другие заболевания, могут привести к развитию нейрогенного мочевого пузыря и недержанию мочи [8].
Провоцирующие факторы
-
Возраст — чем старше женщина, тем вероятнее непроизвольное выделение мочи. Это связано с общими возрастными изменениями организма [9, 10].
-
Сопутствующие заболевания — провоцирующими могут быть такие заболевания как сахарный диабет, сердечно-сосудистая недостаточность и т.д. [9, 10].
-
Ожирение приводит к недержанию мочи за счет увеличения внутрибрюшного и внутрипузырного давления, а также ослабления мышц тазового дна. По данным исследований, женщины с ожирением в 4,2 раза чаще страдают стрессовой формой и в 2,2 раза чаще — ургентной формой данного заболевания. Отмечено также, что при уменьшении массы тела уровень заболеваемости стрессовым недержанием снижается с 61 до 12% [8, 10, 11].
-
Курение способствует возникновению хронического бронхита, при этом кашель сопровождается систематическим повышением внутрибрюшного давления, что, в свою очередь, может привести к развитию стрессового недержания мочи. Непосредственная роль никотина в патогенезе недержания мочи до конца не ясна и требует дальнейших исследований [12].
-
Мочевая инфекция — причина транзиторного недержания мочи [9].
-
Климактерический период — атрофические изменения, происходящие в постменопаузе, повышают риск развития мочевой инфекции и недержания мочи.
Акушерские и гинекологические факторы
-
Беременность — у 8–85% женщин во время беременности появляется недержание мочи.
-
Роды — родоразрешение через естественные родовые пути, эпизиотомия, инструментальное родовспоможение, масса плода более 4 кг приводят к развитию инконтиненции за счет повреждения мышц тазового дна и нарушения иннервации органов малого таза.
-
Перенесенные операции на органах малого таза и лучевая терапия [8].
-
Пролапс тазовых органов [13].
Классификация
Согласно классификации Международного общества по удержанию мочи (ICS), выделяют следующие виды недержания мочи [1].
-
Стрессовое недержание, или недержание мочи при напряжении, — непроизвольное выделение мочи при внезапном повышении внутрибрюшного давления и недостаточности сфинктерного аппарата уретры, которые возникают при кашле, чихании, физических нагрузках и т.д.
-
Императивное (ургентное) недержание — непроизвольное выделение мочи при внезапном нестерпимом повелительном позыве к мочеиспусканию, обусловленном непроизвольными сокращениями детрузора. Чаще всего служит проявлением гиперактивного мочевого пузыря [3].
-
Смешанное (комбинированное) недержание мочи сопровождается симптомами и стрессового, и ургентного недержания.
-
Описанные типы недержания мочи встречаются наиболее часто, однако существует еще несколько редко встречающихся типов.
-
Энурез, или ночное недержание мочи, — возникает во время сна.
-
Ситуационное недержание — непроизвольное выделение мочи при различных обстоятельствах, например при половом акте, смехе и т.д.
-
Недержание мочи при переполнении мочевого пузыря (ишурия парадокса).
Для определения тяжести недержания мочи при напряжении в настоящее время используют международную классификацию, предложенную и модифицированную McGuire и J. Blaivas в 1988 г. Эта классификация рекомендована к применению Международным обществом по удержанию мочи (ICS) и общепринята.
В клинической практике широко применяют более простую и приемлемую для практического здравоохранения классификацию Д.В. Кана (1978), определяющую степень недержания мочи при напряжении. По Д.В. Кану, различают три степени недержания мочи: легкую, среднюю и тяжелую.
-
При легкой степени непроизвольное выделение мочи отмечают только во время резкого и внезапного повышения внутрибрюшного давления: сильного кашля, быстрой ходьбы. При этом потеря мочи исчисляется всего несколькими каплями.
-
При средней тяжести клинические признаки появляются во время спокойной ходьбы, при легкой физической нагрузке и т.д.
-
При тяжелой степени больные полностью или почти полностью теряют мочу даже при изменении положения тела.
Диагностика
Для диагностики различных форм недержания мочи используют следующие диагностические тесты и исследования:
-
Настоятельно рекомендуемые (обязательные) исследования, которые необходимо выполнить каждому пациенту.
-
Рекомендуемые тесты, которые имеют проверенные значения в оценке большинства пациентов, и их использование настоятельно рекомендуется во время первоначального обследования.
-
Необязательные тесты, которые являются проверкой ранее полученных результатов обследования в оценке отдельных пациентов; их использование остается на усмотрение врача.
ИССЛЕДОВАНИЯ, ВЫСОКОРЕКОМЕНДУМЫЕ ПРИ ПЕРВИЧНОМ ОБСЛЕДОВАНИИ
Рекомендации предназначены для детей и взрослых, в том числе здоровых лиц старше 65 лет. Недержание мочи весьма распространено, но часто пациенты не сообщают об этом. Поэтому настоятельно рекомендуется активное выявление всех случаев, особенно в группах высокого риска.
Анамнез заболевания и оценка общего состояния
Обследование и лечение таких заболеваний, как недержание мочи, требует комплексного подхода. Многие факторы могут влиять на проявление заболевания у конкретного человека, некоторые из них могут вызвать недержание мочи, повлиять на выбор метода и успех лечения.
Наиболее значимы следующие пункты в истории болезни пациентов.
-
-
Наличие симптомов со стороны мочевыводящих путей и толстой кишки или урогенитального пролапса, степень тяжести,продолжительность и степень беспокойства. Выявление симптомов в соответствующих органах и системах имеет решающее значение для эффективного планирования лечения. Для оценки симптомов целесообразно использовать проверенные анкеты.
-
Влияние каких-либо симптомов на половую функцию: подтверждение данными анкеты, включая воздействие на качество жизни, помогает адекватно оценить состояния больного.
-
Наличие и тяжесть симптомов, включая неврологическое заболевание.
-
-
-
Сбор данных о предыдущем консервативном, медикаментозном и хирургическом лечении, в частности, того, как они влияют на мочеполовой тракт и толстую кишку. Следует отметить эффективность и побочные эффекты предыдущего лечения.
-
Выявление сопутствующих заболеваний, которые могут иметь огромное влияние на развитие недержания мочи или кала и урогенитальный пролапс. Например, больные бронхиальной астмой во время приступов будут страдать стрессовым недержанием мочи. Некоторые болезни также могут приводить к изменениям в анализе мочи, особенно у ослабленных пожилых людей.
-
Выявление медикаментозных препаратов, которые принимает пациент по поводу других заболеваний, так как важно понимать, способствуют ли эти препараты возникновению недержания мочи.
-
-
Другие вопросы, влияющие на выбор лечения
-
Необходимо учитывать желание пациента лечиться и продолжать лечение.
-
Когнитивные функции: все пациенты должны быть оценены на предмет их способности в полной мере описать свои симптомы — в отношении беспокойства, влияния на качество жизни, их предпочтения и цели по уходу, а также понимании предложенных планов обследования и лечения, обсуждения, где это уместно, альтернативных вариантов лечения.
-
В некоторых группах пациентов важно формальное тестирование. Например, тестирование когнитивных функций у пациентов с возможным нарушениями памяти и/или внимания, которые могут повлиять на ответы (табл. 6.1). Если пациент не может принять решение о лечении самостоятельно, в обсуждении истории болезни пациента, целей лечения и ухода за ним могут участвовать члены семьи и лица, осуществляющие уход.
| Симптомы | Ургентное недержание мочи (гиперактивный мочевой пузырь) | Стрессовое недержание мочи |
|---|---|---|
Ургентные (повелительные) позывы |
Да |
Нет |
Неоднократные прерывания ночного сна, вызванные позывами к мочеиспусканию |
Часто |
Редко |
Способность вовремя добраться до туалета после позыва |
Нет |
Да |
Количество мочи при каждом эпизоде недержания |
Большое |
Малое |
Недержание при кашле, смехе, чихании и т.д. |
Нет |
Да |
Медицинский осмотр
Чем сложнее история болезни и более обширна и/или инвазивна предложенная терапия, тем более полным должно быть обследование. В зависимости от симптомов пациентов и их тяжести, есть целый ряд компонентов в обследовании больных с недержанием мочи и/или пролапса тазовых органов.
-
Абдоминальное обследование: пальпация живота, области мочевого пузыря, выявление послеоперационных рубцов.
-
-
оценка состояния промежности и наружных половых органов, в том числе качества тканей и ощущений, эстрогенового статуса;
-
вагинальный (в зеркалах) осмотр, выявление опущения, выпадения половых органов или прямой кишки. При влагалищном исследовании необходимо обратить внимание на размер влагалища, состояние слизистой оболочки и характер выделений (видимые признаки кольпита или атрофические изменения слизистой оболочки), рубцовую деформацию влагалища и уретры (вследствие оперативных пособий или лучевой терапии), наличие и форму цистоцеле и уретероцеле (сочетаются с симптомами недержания мочи в 50% наблюдений). Особое значение имеют размер переднего влагалищного свода, положение уретры и шейки мочевого пузыря, шейки и тела матки (часто выявляется опущение матки или элонгация ее шейки). Выявляют такие симптомы, как непроизвольное выделение мочи при кашле или натуживании (дает основание для предварительного диагноза недержания мочи при напряжении), гипермобильность шейки мочевого пузыря и проксимальной уретры при напряжении (косвенные признаки сфинктерной недостаточности даже при отсутствии первого симптома);
-
бимануальное обследование таза и аноректальный осмотр, оценка функции мышц тазового дна и т.д.;
-
стресс-тест для выявления недержания мочи при напряжении (кашлевая проба).
-
-
Неврологическое обследование. Следует проводить независимо от пола, возраста и наличия выявленных ранее неврологических заболеваний.
Анализ мочи
По данным общего анализа мочи, среди пациентов с расстройствами мочеиспускания легко обнаружить группу больных с инфекцией мочевыводящих путей, которая служит причиной симптомов со стороны нижних мочевыводящих путей. Такие пациенты легко поддаются лечению. Проведение анализа мочи может варьировать от использования тест-полосок до микроскопии мочи и бактериологического исследования (при наличии показаний).
| Рекомендации [19] | СР |
|---|---|
Первичное обследование больного с недержанием мочи должно включать анализ мочи |
А |
У больных с недержанием мочи и сопутствующей мочевой инфекцией необходимо устранить проявления инфекции |
А |
Попытки лечения бессимптомной бактериурии у пожилых пациентов в надежде устранить недержание мочи не оправданы |
В |
РЕКОМЕНДУЕМЫЕ МЕТОДЫ ОБСЛЕДОВАНИЯ
Приведенные ниже тесты рекомендуются при наличии соответствующих клинических проявлений. Некоторые исследования становятся высокорекомендуемыми в определенных конкретных ситуациях.
Дальнейшая оценка симптомов и качества жизни
У пациентов с симптомами со стороны нижних мочевыводящих путей настоятельно рекомендуется ведение дневников мочеиспусканий, в которых пациент записывает частоту мочеиспусканий, объем мочи при каждом мочеиспускании, эпизоды недержания мочи, использование прокладок при недержании мочи.
| Рекомендации [19] | СР |
|---|---|
Для оценки сопутствующих нарушений резервуарной функции и функции опорожнения мочевого пузыря рекомендуется ведение дневника мочеиспускания |
А |
Для получения надежной информации о функции мочеиспускания необходимо ведение дневника в течение не менее 3 дней |
в |
Рекомендуется использование самых качественных анкет-опросников (класс А, где это возможно) для оценки перспектив симптома недержания мочи и их влияния на качество жизни.
Для базовой оценки перспектив пациента с недержанием мочи рекомендуется ICIQ (уровень А) совместно с другими анкетами класса A для более детальной оценки. При наличии пролапса тазовых органов, болевом синдроме мочевого пузыря и недержании кала, для конкретных групп пациентов доступно и возможно использование анкет класса.
Оценка функции почек
Стандартные биохимические тесты для оценки функции почек рекомендуются пациентам с недержанием мочи и вероятностью нарушения функции почек.
Урофлоуметрия
Урофлоуметрия с измерением остаточной мочи рекомендуется в качестве скринингового теста при наличии симптомов, указывающих на вероятную дисфункцию нижних мочевыводящих путей, или при физических признаках пролапса половых органов, или растяжения (гипотонии) мочевого пузыря.
Выявление остаточной мочи
У пациентов с подозрением на дисфункции мочевыводящих путей определение остаточной мочи должно быть частью первоначального обследования, особенно если результат исследования, скорее всего, будет влиять на выбор лечения (например, у неврологических больных). Ультразвуковое исследование по выявлению остаточной мочи проводится также при осложненном недержании мочи или использовании медикаментозных препаратов, которые могут привести к развитию дисфункции нижних мочевыводящих путей.
| Рекомендации [19] | СР |
|---|---|
Для измерения остаточного объема мочи рекомендуется УЗИ |
A |
У больных с недержанием мочи, у которых нарушено опорожнение мочевого пузыря, следует измерить остаточный объем мочи |
B |
При обследовании больного с осложненным недержанием мочи следует измерить остаточный объем мочи |
C |
У больных, получающих препараты, которые могут вызвать нарушение мочеиспускания или усугубить его, необходим мониторинг остаточного объема мочи |
A |
Методы визуализации
Хотя выполнение методов визуализации при недержании мочи не рекомендуется, визуализация нижних мочевыводящих путей и органов малого таза рекомендуется тогда, когда при первоначальном обследовании есть подозрение на возможно совместно существующую патологию нижних мочевыводящих путей и органов малого таза. Начальным может быть ультразвуковое исследование или обзорная рентгенография.
Визуализация верхних мочевыводящих путей рекомендуется в конкретных ситуациях. К ним относятся:
-
наличие нейрогенного недержания мочи, например при миелодисплазии, травмах спинного мозга;
-
наличие недержания мочи, которое ассоциировано с наличием значительного количества остаточной мочи;
-
выявление выраженного пролапса тазовых органов, ранее не леченного;
-
полученные результаты уродинамического исследования показывают низкий комплаенс мочевого пузыря.
Эндоскопические исследования
Хотя цистоуретроскопия не рекомендуется всем больным, все же это исследование должно быть выполнено в определенных случаях:
-
у пациентов с осложненным и рецидивирующим недержанием мочи (например, после неудачной хирургической операции).
-
при первоначальном обследовании выявлена другая патология, например гематурия;
-
при наличии боли или дискомфорта в области МП у пациентов с симптомами со стороны мочевыводящих путей эндоскопия может выявить внутрипузырное поражение (например, опухоль);
-
при подозрении на наличие урогенитальных свищей и экстрауретрального недержания мочи.
Сложность для диагностики (с целью выявления ложного недержания мочи) в основном представляют различные эктопии устья мочеточника, особенно при удвоении мочеточников. Эктопированное устье находят при инструментальном исследовании (уретроскопии, осмотре влагалища в зеркалах, ректоскопии). Иногда целесообразно одновременное применение индигокарминовой пробы. Внутривенно вводят 5 мл 0,4% раствора индигокармина и наблюдают за его выделением с мочой из эктопированного устья.
Уродинамическое исследование
Уродинамическое исследование рекомендуется:
-
в случаях, когда результаты могут изменить выбор лечения, например выбор более инвазивного метода лечения недержания мочи и урогенитального пролапса;
-
после неудачного лечения, если требуется больше информации для планирования дальнейшей терапии;
-
в рамках начальной и долгосрочной программы наблюдения при некоторых типах нейрогенной дисфункции нижних мочевыводящих путей;
-
у больных с рецидивами недержания мочи после хирургических операций по устранению недержания;
-
в случае осложненного недержания мочи. Уродинамическое исследование выполняется с целью:
-
воспроизведения симптомов пациента и их корреляции с результатами уродинамического исследования;
-
оценки уретрального сопротивления (выявления инфравезикальной обструкции) во время мочеиспускания;
| Рекомендации [19] | СР |
|---|---|
Врач, исследующий уродинамику у больного с недержанием мочи, должен: |
|
|
C |
Объяснить больному, что комплексное уродинамическое исследование помогает выбрать оптимальный метод лечения, хотя данных о том, что оно позволяет прогнозировать эффективность коррекции неосложненного недержания мочи, недостаточно |
C |
Рутинное выполнение комплексного уродинамического исследования всем больным при проведении консервативного лечения недержания мочи нецелесообразно |
B |
Всегда следует выполнять комплексное уродинамическое исследование, если его результаты могут повлиять на выбор инвазивного метода лечения |
B |
Рутинное выполнение профилометрии уретрального давления нецелесообразно |
C |
Для уточнения поведения мочевого пузыря и его сфинктеров в фазах наполнения и опорожнения наиболее объективным и информативным методом исследования больных служит комплексное уродинамическое исследование с предварительным ведением дневника мочеиспусканий в течение 3–4 дней.
ДОПОЛНИТЕЛЬНЫЕ ДИАГНОСТИЧЕСКИЕ ТЕСТЫ
Дополнительное уродинамическое исследование
Видеоуродинамическое исследование может быть полезным в лечении недержания мочи у детей, у пациентов с неудачными результатами оперативного лечения, а также у некоторых нейрогенных пациентов с целью получения дополнительной анатомической информации. Могут быть использованы и УЗИ, и рентгенография.
Если необходима более подробная оценка функции мочеиспускательного канала, следующие дополнительные тесты могут дать полезную информацию:
Если начальное уродинамическое исследование не смогло продемонстрировать причину недержания у пациента, обязательно проводят:
Тест с прокладкой
[19]
Тест с прокладкой — дополнительное исследование в рутинной оценке недержания мочи и, если его проводят, предлагают 24-часовой тест, позволяющий оценить изменение веса, использованных в течение суток абсорбирующих прокладок.
| Рекомендации [19] | СР |
|---|---|
Когда необходимо количественно определить объем потерянной мочи, следует выполнить тест с прокладкой |
C |
Для получения точных данных о количестве непроизвольно выделяемой мочи необходимо провести тест с прокладкой несколько раз |
C |
Нейрофизиологическое обследование и визуализирующие исследования
Информацию, полученную с помощью клинического и уродинамического обследования, можно дополнить за счет нейрофизиологического тестирования поперечнополосатых мышц и нервных проводящих путей. Данные исследования должен выполнять специалист, подготовленный соответствующим образом.
Следующие нейрофизиологические тесты можно считать оправданными у пациентов с поражениями периферической нервной системы до начала лечения нижних мочевыводящих путей или при аноректальной дисфункции:
Исследование латентности полового нерва не рекомендуется.
Применение методов визуализации центральной нервной системы, в том числе спинного мозга, с помощью миелографии, КТ и МРТ, может оказаться полезным, если простые методы визуализации (например, рентгенография позвоночника) у пациентов с подозрением на неврологическое заболевание не выявляют патологических изменений.
Другие визуализационные методы обследования
Цистоуретрография, УЗИ, КТ и МРТ используют в следующих случаях:
Аноректальное исследование
Анальная манометрия позволяет оценить давление при сокращении и расслаблении ануса.
Лечение
Алгоритм начального лечения предназначен для использования всеми клиницистами, в том числе медицинскими сестрами, физиотерапевтами, врачами широкого профиля и семейными врачами, а также специалистами (урологами и гинекологами).
Специализированные алгоритмы предназначены для использования врачами-специалистами.
Каждый алгоритм лечения основывается на результатах базового обследования (методов диагностики).
В каждом алгоритме лечения процедуры перечислены в порядке усложнения, т.е. наименее инвазивные методы указаны первыми. Этот порядок не предполагает шкалу эффективности или затрат. Алгоритм начального лечения предложен на эмпирической основе, в то время как алгоритм специализированного лечения, как правило, зависит от точного диагноза, подтвержденного результатами различных методов обследования, включая уродинамические.
Использование прокладок. Использование прокладок направлено на повышение качества жизни у тех пациенток, которые:
ПЕРВОНАЧАЛЬНЫЙ ЭТАП ЛЕЧЕНИЯ
При первоначальной оценке определяют следующее.
При выявлении дефицита эстрогенов и/или инфекции мочевыводящих путей состояние пациентки оценивают при первоначальном обследовании, а затем повторно через определенный интервал времени(В).
Первоначальное лечение должно проводиться в течение 8–12 нед до переоценки и возможного направления к специалисту для дальнейшего лечения, если улучшение состояния пациентки не достигнуто или недостаточно выражено.
У пациенток с комбинированным недержанием мочи клиницисты предпочитают лечить наиболее беспокоящий симптом(С).
У некоторых пациенток со значительным пролапсом тазовых органов возможно использование вагинальных устройств, которые помогают справиться как с недержанием мочи, так и с пролапсом (вагинальные кольца и колпачки).
| Рекомендации [19] | СР |
|---|---|
Следует рекомендовать больным, страдающим ожирением недержанием мочи, похудеть для устранения недержания |
A |
Проинформируйте взрослых больных с недержанием мочи о необходимости уменьшить употребление кофеина: это позволит уменьшить позывы к мочеиспусканию и частоту мочеиспускания, но не улучшит удержание мочи |
B |
Пациентам, принимающим избыточное или недостаточное количество жидкости, следует рекомендовать откорректировать соответствующим образом объем потребляемой жидкости |
C |
Спортсменкам, у которых на фоне интенсивных тренировок, появилось недержание мочи, следует разъяснить, что это не повышает риск появления недержания мочи в более позднем периоде жизни |
C |
Курильщикам, страдающим недержанием мочи, следует рекомендовать бросить курить, хотя однозначных данных о том, что это уменьшит недержание мочи, нет |
A |
ЭТАП СПЕЦИАЛИЗИРОВАННОГО ЛЕЧЕНИЯ
Оценка состояния пациентки
Пациенткам с осложненным недержанием мочи до выбора лечения необходимо провести дополнительные методы обследования:
Пациентки, которые не смогли пройти первоначальный этап лечения или качество жизни которых ухудшается на фоне лечения, должны пройти дополнительное обследование.
До оперативного вмешательства рекомендуется выполнение уродинамического обследования, на основании результатов которого возможно изменение или определение вида лечения. Оно используется для диагностики типа недержание мочи. При проведении оценки функционального состояния уретры обязательными считают:
Рекомендуется системная оценка пролапса тазовых органов. Пациенток с сосуществующим пролапсом тазовых органов обследуют с целью хирургического его устранения в случае необходимости.
Лечение
Недержание мочи устраняют консервативными и оперативными методами. Неоперативные методы лечения показаны больным с легкой степенью недержания мочи при напряжении, ургентным недержанием мочи, обусловленным гиперактивностью детрузора, а также при сочетании стрессового и ургентного недержания мочи.
Если стрессовое недержание мочи подтверждается уродинамически, рекомендуемые варианты лечения включают полный диапазон нехирургических методов лечения, а также позадилонную или трансобтураторную слинговую операциюА.
Для пациентов с ограниченной мобильностью шейки мочевого пузыря могут быть рекомендованы слинговые операцииА, объемообразующие парауретральные инъекцииB и установка искусственного сфинктера мочевого пузыряB.
Использование ботулинического токсина у больных, страдающих ургентным недержанием мочи при лечении гиперактивности детрузора, если он не реагирует на медикаментозную терапию холинолитиками. При рефрактерном ургентном недержании мочи вследствие идиопатической гиперактивности детрузора применяют нейромодуляциюА или аугментацию мочевого пузыря при снижении комплаенса мочевого пузыря(С).
| Рекомендации [19] | СР |
|---|---|
При ургентном недержании мочи, рефрактерном к м-холиноблокаторам, рекомендуют интравезикальные инъекции онаботулинического токсина типа A |
A |
Перед применением препаратов ботулинотоксина следует уточнить торговую марку, так как дозы разных препаратов не эквивалентны |
A |
Для снижения риска задержки мочи и развития инфекции мочевыводящих путей рекомендуется начать инъекции онаботулинического токсина типа A с дозы 100 ЕД |
A |
Больных, которым планируется введение онаботулинического токсина типа A следует предупредить о том, что может понадобиться длительная периодическая самостоятельная катетеризация мочевого пузыря (необходимо заручиться согласием больного и обучить его методике) и что она связана с высоким риском развития мочевой инфекции |
A |
Больных следует также проинформировать о лицензионных препаратах онаботулинического токсина типа A, а также о том, что отдаленные побочные эффекты, хотя и маловероятны, пока не изучены |
A |
Пациенты с дисфункцией нижних мочевыводящих путей, приводящей к значительному количеству остаточной мочи (например, более 30% общего объема мочевого пузыря) могут иметь инфравезикальную обструкцию или снижение сократительной способности детрузора. Урогенитальный пролапс может являться наиболее распространенной причиной развития дисфункции.
Методы лечения гиперактивного мочевого пузыря и обусловленного им ургентного недержания мочи
Тренировка мочевого пузыря. Заключается в соблюдении больным заранее установленного и согласованного с врачом плана мочеиспусканий, т.е. пациент должен мочиться через определенные промежутки времени. Программа тренировки мочевого пузыря направлена на прогрессивное повышение интервала между мочеиспусканиями.
Упражнения для тазовых мышц с применением метода биологической обратной связи. Основа клинического использования упражнений для тазовых мышц у больных с гиперактивным мочевым пузырем — наличие анально-детрузорного и уретрально-детрузорного рефлексов (рефлекторное торможение сократительной активности детрузора при произвольных сокращениях наружных анального и уретрального сфинктеров). Рекомендуют выполнять 30–50 сокращений в день длительностью от 1 до 15–20 с. Задача метода биологической обратной связи — приобретение пациентом умения сокращать специфические мышечные группы под самостоятельным контролем. Недостатки поведенческой терапии:
-
существует мало данных о продолжительности положительной динамики, а также о том, как долго пациенты способны придерживаться условий терапии;
-
лечение по методу поведенческих реакций ограничивается тем, что оно зависит от активного участия в нем пациента, желающего лечиться (т.е. ценность данного метода может быть ограничена у пациентов с психическими дефектами, а также при отсутствии мотивации к лечению).
Электрическая стимуляция:
Стимуляция афферентных нервных волокон способствует увеличению емкости мочевого пузыря, так как снижает его чувствительность. Длительность лечения должна быть не менее 3 мес. Побочные реакции (редкие) включают болевые ощущения и дискомфорт в области воздействия.
Фармакотерапия
Фармакотерапия — один из первых и самых распространенных методов лечения гиперактивного мочевого пузыря и обусловленного им ургентного недержания мочи. Медикаментозную терапию применяют в качестве первичного метода для всех пациентов с гиперактивным мочевым пузырем и ургентным недержанием мочи. Метод вызывает интерес, прежде всего, благодаря доступности, возможности длительного применения, индивидуального подбора дозы и режима терапии.
Ее цель — устранение ведущих симптомов, что непосредственно связано с улучшением уродинамических показателей: снижением активности детрузора, увеличением функциональной емкости мочевого пузыря. Требования к препаратам для фармакологической коррекции:
Связь гиперактивности детрузора с повышением активности парасимпатического отдела вегетативной нервной системы доказана и объясняет лечебный эффект применения блокаторов периферических мускариновых холинорецепторов (холинолитиков). На их фоне влияние парасимпатического звена ослабевает, а симпатического — возрастает, вследствие этого:
М-холинолитики — препараты выбора в лечении данного состояния. В настоящий момент наиболее часто при лечении гиперактивного мочевого пузыря и ургентного недержания мочи применяют препараты, воздействующие на мускариновые рецепторы мочевого пузыря — м-холинолитики. Большинство из этих препаратов вызывает неизбежные нежелательные явления, что обусловливает необходимость поддержания баланса между их преимуществами и недостатками. Антимускариновое действие иногда вызывает:
Препараты нельзя назначать больным с сильно нарушенным оттоком мочи из мочевого пузыря (обструктивной уропатией), обструкцией кишечника, язвенным колитом, глаукомой и миастенией. На фоне приема этих лекарственных средств у пациентов развивается замедленная реакция, им нужно проявлять осторожность при вождении автомобиля или работе с опасными механизмами.
Одним из самых известных антихолинергических препаратов является атропин, оказывающий выраженное системное действие. Отсутствие селективности действия препарата, вне всякого сомнения, становится негативным фактором, так как определяет низкую эффективность его терапевтических доз в отношении симптомов гиперактивности. Препарат в настоящий момент представляет больше исторический интерес, его не назначают при гиперактивности детрузора.
В настоящее время при ургентном недержании мочи применяются следующие м-холинолитики.
-
Оксибутинин. Необходим индивидуальный подбор дозы. Пациентов предупреждают, что это займет определенный период времени, в течение которого необходимо посещать врача. Оптимальной считают дозу, дающую нужный эффект при минимальных побочных действиях. Дозы для приема внутрь составляют от 2,5 мг однократно до 5 мг 4 раза в день. Стандартная стартовая доза для взрослых составляет 5 мг 2–3 раза в день. У пожилых пациентов рациональная стартовая доза составляет 2,5 мг 2–3 раза в день. Доза должна оставаться неизменной в течение 7 дней до корректировки (уменьшения или увеличения, в зависимости от выраженности клинического эффекта). Несмотря на достаточную эффективность, оксибутинин обладает рядом особенностей. Это, прежде всего, отсутствие селективности в отношении мочевого пузыря, что обусловливает возможную плохую переносимость, необходимость титрования дозы, а также наличие побочных эффектов со стороны центральной нервной системы и расстройства когнитивной функции.
-
Толтеродин — лекарственное средство с антимускариновым действием, оказывающее на мочевой пузырь такое же влияние, как и оксибутинин, но обладающее незначительным влиянием на мускариновые рецепторы слюнных желез. Толтеродин переносится лучше, обеспечивает большую комплаентность (приверженность лечению) пациентов по сравнению с оксибутинином. Применяют таблетки 2 мг 2 раза в день или капсулы пролонгированного действия по 4 мг, используемые 1 раз в день (за исключением больных с выраженными нарушениями функций печени и почек — в этом случае применяют капсулы по 2 мг 1 раз в день).
-
Солифенацин — наиболее селективный специфический конкурентный ингибитор мускариновых рецепторов. Селективность солифенацина по отношению к мочевому пузырю значительно выше в сравнении с толтеродином и оксибутинином, что обусловливает возможность его длительного применения при минимальном количестве побочных эффектов. Используемые дозировки — по 5 мг/ сут, а при необходимости с целью повышения эффективности препарата дозу можно повысить до 10 мг 1 раз в сутки. В настоящее время подтверждено положительное влияние возможности увеличения дозировки солифенацина в лечении основных симптомов ГМП и актуализирована необходимость применения 10 мг препарата на старте терапии. Эффективность 10 мг солифенацина сопровождается благоприятным профилем безопасности и переносимости, не оказывает значимого влияния на когнитивную функцию у пожилых пациентов в отличие от оксибутинина (24, 25).
-
Троспия хлорид — парасимпатолитик с периферическим, атропиноподобным действием, а также ганглионарным миотропным действием, подобным таковому у папаверина. Дозу подбирают индивидуально: от 30 до 90 мг/сут. Кратность приема до 3 раз в сутки. Концентрация троспия хлорида при однократном приеме от 20 до 60 мг пропорциональна принятой дозе.
В настоящее время становится интересным использование в лечении гиперактивного мочевого пузыря β-адреномиметиков, что продиктовано наличием побочных эффектов м-холиноблокаторов. Стимуляция β-адренорецепторов уротелия приводит к расслаблению детрузора.
Мирабегрон – это новый препарат для лечения гиперактивного мочевого пузыря, который относится к β-адреномиметикам – классу лекарственных средств впервые применяющихся для лечения расстройств мочеиспускания. Недавно мирабегрон, после тщательных многолетних мультицентровых рандомизированных исследований, был одобрен к применению в странах Европы, Северной Америки и в России.
Расслабление детрузора, как и других гладкомышечных органов, обусловлено циклическим аденозинмонофосфатом (ц-АМФ). Стимуляция норадреналином β-адренорецепторов приводит к увеличению количества цАМФ и релаксации.
За последние 10 лет действие мирабегрона было исследовано у более чем 10 000 пациентов. Эффективность и профиль безопасности препарата были изучены в 6 мультицентровых исследованиях, в которых препарат применялся не менее 12 недель.
Концепция лечения гиперактивного мочевого пузыря мирабегроном была подтверждена в исследовании BLOSSOM, которое было опубликовано Chapple и соавторами (26). В данном исследовании клинические центры из 6 европейских стран и, в общей сложности включали 260 пациентов. Больные гиперактивным мочевым пузырем были случайным образом распределены в 4 группы и принимали соответственно плацебо, мирабегрон 100 мг 2 раза в день, мирабегрон 150 мг 2 раза в день или пролонгированный толтеродин 4 мг 1 раз в день на протяжении 4 недель. Анализ полученных данных указал на значительные преимущества обеих доз мирабегрона по сравнению с плацебо и толтеродином в лечении поллакиурии, а также несомненное преимущество мирабегрона перед плацебо в лечении ургентных позывов, недержания мочи и ноктурии.
Основываясь на положительных результатах предыдущего исследования было инициировано европейское исследование по поиску оптимальной дозы мирабегрона, в которое было включено 919 больных, которые были распределены в пять групп: плацебо, мирабегрон 25 мг, 50 мг, 100 мг и 200 мг. Лечение проводилось на протяжении 12 недель. Это исследование показало, что эффективность доз 50 мг, 100 мг и 200 мг незначительно отличаются друг от друга. Именно на основании этого стандартной дозой препарата являются 50 мг мирабегрона в сутки и 25 мг. мирабегрона в сутки для пациентов с нарушением функции почек и печени (27). Наиболее частыми побочными эффектами были гипертензия, сухость во рту, запоры и головная боль.
Существенного удлинения QT интервала на ЭКГ не было отмечено при длительном приеме мирабегрона (27, 28).
Частота таких нежелательных явлений как сухость во рту, задержка мочи была значительно ниже чем при приеме холинолитиков.
Основываясь на данных клинических исследований, мирабегрон может быть рекомендован пациентам, как первая линия терапии (50 мг 1 раз в сутки) страдающим гиперактивным мочевым пузырем и ургентным недержанием мочи (28). Препарат также показал свою эффективность у пациентов, которые ранее безуспешно применяли холинолитики или же отказались от приема холинолитиков вследствие выраженных побочных эффектов.
Так в исследовании Nitti V., опубликованном в 2012 году, мирабегрон показал значительные преимущества по снижению частоты недержаний и мочеиспусканий в сравнении с толтерадином у пациентов, прекративших лечение холинолитиками по причине их недостаточной эффективности (27). Это открывает дополнительные возможности для терапии пациентов, резистентных к м-холиноблокаторам.
| Рекомендации | СР |
|---|---|
Предлагайте мирабегрон пациентам с ургентным недержанием мочи, но предупреждайте их о об отсутствии данных о возможных отдаленных побочных эффектах |
B |
Традиционный метод лечения нейрогенной гиперактивности мочевого пузыря — стимуляция сакрального нерва, снижающая сократительную активность детрузора, повышающая растяжимость детрузора и уменьшающая выраженность детрузорно-сфинктерной диссинергии. Однако для достижения клинического эффекта необходимо проводить электростимуляцию не менее 3 мес, что проблематично для неврологических больных, а побочные эффекты (болевые ощущения и дискомфорт в области воздействия) нередко вынуждают больных отказаться от этого метода.
Метод нейромодуляции тибиального нерва для лечения нейрогенных нарушений мочеиспускания имеет свои преимущества при неэффективности других видов лечения.
| Рекомендации [19] | СР |
|---|---|
Лечение взрослых пациентов с ургентным недержанием мочи рекомендуется начать с назначения м-холиноблокаторов короткого или пролонгированного действия |
A |
Если лечение взрослых с ургентным недержанием мочи м-холиноблокаторами короткого действия оказалось неэффективным, целесообразно перейти на препараты более длительного действия |
A |
При лечении больных ургентным недержанием мочи м-холиноблокаторами необходим ранний анализ эффективности и побочных эффектов (в первые 30 дней) |
A |
При назначении м-холиноблокаторов пожилым больным следует помнить о риске побочных эффектов в виде нарушения когнитивной функции, особенно у тех, кто получает антихолинэстеразные препараты |
C |
Следует избегать назначения оксибутинина быстрого действия больным с нарушенной когнитивной функцией |
A |
Больным, у которых имеется нарушение когнитивной функции, желательно назначить троспия хлорид |
B |
Больным с нарушением когнитивной функции назначать м-холиноблокаторы следует с осторожностью |
B |
Необходимо постараться изменить прием других препаратов у пожилых пациентов, которые принимают антимускариновые препараты для лечения недержания мочи, чтобы уменьшить антихолинергическую нагрузку |
C |
Отсутствуют убедительные данные в отношении влияния троспия хлорида и толтеродина на когнитивные функции (уровень доказательности 3)
Солифенацин, дарифенацин, фезотеродин не вызывают усиления когнитивной дисфункции у пожилых пациенток (уровень доказательности 1b).
Десмопрессин — синтетический аналог вазопрессина (известен также как антидиуретический гормон), который усиливает реабсорбцию воды в собирательных трубочках почек, не повышая при этом артериального давления. Его можно назначать внутрь, интраназально или в виде инъекций. Десмопрессин — наиболее часто применяют для лечения несахарного диабета, а также ночного энуреза (назначают на ночь) [19].
-
Непроизвольное выделение мочи при недержании уменьшается в течение первых 4 ч после приема десмопрессина, после 4 ч этот эффект препарата исчезает (УД: 1b).
-
Длительный прием десмопрессина не уменьшает и не устраняет симптомов недержания мочи (УД: 1b).
-
Регулярный прием десмопрессина вызывает гипонатриемию (УД: 3) [19].
| Рекомендации [19] | СР |
|---|---|
Десмопрессин рекомендуется назначать в тех случаях, когда необходимо уменьшить симптомы недержания мочи на непродолжительное время, при этом больных следует предупредить, что применение десмопрессина с этой целью выходит за рамки утвержденных показаний |
B |
Не следует применять десмопрессин для длительной терапии недержания мочи |
A |
Интравезикальная инъекция ботулинотоксина A
Инъекции ботулинотоксина в стенку мочевого пузыря все чаще применяют для лечения персистирующего или рефрактерного ургентного недержания мочи у взрослых женщин. Почти во всех исследованиях был использован онаботулинический токсин типа A. Методика инъекционной терапии не стандартизирована, поэтому данные, приводимые в разных работах, отличаются по количеству инъекций, месту инъекции препарата и введенной дозе (табл. 6.2). Хирургам следует знать о существовании разных форм ботулинотоксина, в частности онаботулинотоксина A (в Европе известен как ботокс), абоботулинотоксина A (в Европе известен как Dysport), инкоботулинотоксина (Xeomin), и что дозы этих препаратов не равнозначны. Эффект повторных инъекций у больных императивным недержанием мочи изучен недостаточно. Наиболее серьезный побочный эффект — увеличение объема остаточной мочи, что повышает риск инфекции мочевыводящих путей и требует выполнения периодической катетеризации мочевого пузыря в стерильных условиях.
-
Курс лечения одним лишь онаботулинотоксином A (100–300 ЕД) более эффективен, чем прием инъекции плацебо и при наблюдении в течение 12 мес позволяет достичь более высокого показателя выздоровления и уменьшения симптомов ургентного недержания мочи (УД: 1a).
-
Инъекции онаботулинотоксина в дозе, превышающей 100 ЕД, сопровождаются повышением частоты необходимости выполнения периодической катетеризации мочевого пузыря (УД: 1a).
-
Инъекции онаботулинотоксина AТ в дозе, превышающей 100 ЕД,не приводят к дальнейшему повышению качества жизни больных, страдающих идиопатическим гиперактивным мочевым пузырем и ургентным недержанием мочи (УД: 1b).
-
Нет данных, указывающих на снижение эффективности ботулинотоксина A при повторных его инъекциях (УД: 3).
-
При лечении инъекциями ботулинотоксином A пожилых людей вероятность увеличения объема остаточной мочи выше, чем у молодых пациентов (УД: 3).
-
Выполнение периодической самостоятельной катетеризации мочевого пузыря повышает риск развития мочевой инфекции (УД: 1b).
-
Преимущество какого-либо одного способа инъекции ботулинотоксина A перед другими не доказано (УД: 1b).
-
При тяжелых формах ургентного недержания мочи онаботулинотоксин AТ более эффективен, чем холинолитики (УД: 1a).
-
При повторных курсах лечения онаботулинотоксином AТ необходимость прервать последующее лечение возникает чаще, чем после первой инъекции (УД: 2) [19].
| BTX (онаботулинотоксин A), доза (ЕД) | Достижение сухости. Отношение шансов (95% ДИ) |
|---|---|
50 |
2,28 (0,95–5,49; p=0,07) |
100 |
4,39 (1,91–10,12; p=0,0005) |
150 |
4,96 (2,14–11,53; p=0,0002) |
200 |
4,34 (2,49–7,59; p<0,00001) |
300 |
7,05 (2,68–18,51; p<0,0001) |
| Рекомендации [19] | СР |
|---|---|
При ургентном недержании мочи, рефрактерном к м-холинолитикам, рекомендуются интравезикальные инъекции ботулинотоксина A |
A |
Перед применением препаратов ботулинотоксина следует уточнить торговую марку препарата, так как дозы разных препаратов не эквивалентны |
A |
Для снижения риска задержки мочи и развития инфекции мочевыводящих путей рекомендуется начать инъекции ботулинотоксина A с дозы 100 ЕД |
A |
Больных следует предупредить о том, что после инъекции может понадобиться длительная периодическая самостоятельная катетеризация мочевого пузыря (необходимо заручиться согласием больного и обучить его методике) и что она ассоциирована с высоким риском развития мочевой инфекции |
A |
Больных следует также проинформировать о лицензионных препаратах ботулинотоксина A, а также о том, что отдаленные побочные эффекты, хотя и маловероятны, пока не изучены |
A |
Деривация мочи
Необходимость в деривации мочи при ургентном недержании мочи, не связанном с нейрогенным механизмом, возникает редко. Исследования, специально посвященные изучению результатов этих операций при ургентном недержании, не связанном с нейрогенным механизмом, не проводились, хотя кокрановская группа представила обзор по этой теме, результаты которого приведены ниже [24, 27].
-
Данные об эффективности аугментационной цистопластики и отведения мочи у больных с гиперактивностью детрузора неубедительны (УД: 3).
-
Как аугментационная цистопластика, так и операция по отведению мочи характеризуются очень высокой частотой осложнений в раннем и отдаленном периоде (УД: 3).
-
Необходимость в периодической самостоятельной катетеризации мочевого пузыря после аугментационной цистопластики возникает очень часто (УД: 3).
-
Сравнительное изучение эффективности и побочных эффектов аугментационной цистопластики и отведения мочи не проводилось (УД: 3).
-
Эффективность миэктомии детрузора в отдаленном периоде у больных идиопатической гиперактивностью детрузора не доказана (УД: 3) [19].
| Рекомендации [19] | СР |
|---|---|
Аугментационную цистопластику можно предложить лишь тем больным с гиперактивностью детрузора и недержанием мочи, у которых консервативная терапия оказалась безуспешной, и рассматривался вопрос о возможности выполнения инъекций ботулинотоксина и электростимуляции сакрального нерва |
C |
Больных, которым предполагается выполнить аугментационную цистопластику, следует предупредить о высоком риске периодической самостоятельной катетеризации мочевого пузыря; важно заручиться их согласием на операцию и обучить самостоятельной катетеризации мочевого пузыря |
C |
Не следует предлагать миэктомию детрузора в качестве лечения недержания мочи |
C |
Отведение мочи целесообразно выполнить лишь тем больным, которым менее инвазивные методы и способы лечения недержания мочи не помогли и которым будет наложена стома |
C |
Больных, которым предполагается выполнить аугментационную цистопластику или операцию отведения мочи, следует предупредить о высоком риске ранних и поздних осложнений, а также о незначительно повышенном риске рака |
C |
Больных, которым была выполнена аугментационная цистопластика или операция отведения мочи, необходимо наблюдать пожизненно |
C |
Согласно общепринятым рекомендациям, методом выбора в лечении ургентного недержания мочи, обусловленного гиперактивностью мочевого пузыря, служит фармакотерапия, затем следуют поведенческая терапия, физиотерапия и остальные виды лечения.
Лечение стрессового недержания мочи
Как было указано выше, в медикаментозном лечении возможно использование дулоксетина — антидепрессанта, ингибитора обратного захвата серотонина и норадреналина. Лечебный эффект данного препарата при стрессовом недержании мочи связан с улучшением сократительной способности уретры, поддержанием высокого тонуса уретры во время фазы наполнения мочевого пузыря. Препарат назначают в однократной дозе 30 мг на ночь с последующим повышением ее каждый 3-й день на 30 мг до тех пор, пока пациенты не начинают удерживать мочу, либо до достижения дозы 150 мг. Дулоксетин:
-
не устраняет недержания мочи, а дает лишь временное устранение симптомов при приеме препарата (УД: 1a);
-
в дозе 80 мг/сут может уменьшить симптомы стрессового и смешанного недержания мочи у женщин (УД: 1a);
-
часто вызывает побочные эффекты со стороны желудочно-кишечного тракта и ЦНС, которые могут стать причиной отмены этого препарата (УД: 1a);
-
в дозе 80–120 мг/сут может уменьшить симптомы недержания мочи у женщин (УД: 1b) [19].
| Рекомендации [19] | СР |
|---|---|
Дулоксетин не следует предлагать в качестве средства для лечения недержания мочи у женщин |
A |
Дулоксетин можно рекомендовать женщинам в качестве средства для времен ного устранения симптомов недержания мочи |
В |
В связи с частыми побочными эффектами терапию дулоксетином начинают с небольшой дозы, которую постепенно увеличивают |
A |
Полагают, что в климактерическом периоде стрессовое и ургентное недержание мочи — последствие нарастающего эстрогенного дефицита.
Местную терапию в виде вагинального крема или суппозиториев с эстриолом можно использовать в следующих случаях:
-
неполное купирование при системной терапии симптомов атрофического вагинита и атрофических расстройств мочеиспускания (возможно сочетание системной и местной терапии);
-
нежелание пациентки подвергаться системной заместительной гормональной терапии;
-
при первом обращении к гинекологу-эндокринологу по поводу урогенитальных расстройств в возрасте старше 65 лет.
При выборе системной или местной заместительной гормонотерапии учитывают следующие факторы:
У женщин с недержанием мочи в климактерическом периоде назначение эстрогенов сопровождается достоверным увеличением внутриуретрального давления. Считают, что независимо от способа введения эстрогенов (приема внутрь, влагалищного, трансдермального, внутримышечного) эстрогенотерапия приводит к положительным результатам в лечении стрессового недержания мочи легкой степени у женщин в периоде менопаузы. До настоящего времени распространено мнение об урогенитальных расстройствах как о локальном заболевании, требующем местной терапии. Одним из наиболее часто встречающихся методов лечения было применение эстриола.
Если урогенитальные расстройства развиваются у женщины в климактерическом периоде изолированно, вопрос можно решить в пользу локального применения эстрогенов. В случае сочетания симптомов урогенитальной атрофии с климактерическим синдромом, при необходимости проведения профилактики или лечения сердечно-сосудистых заболеваний и остеопороза вопрос должен быть решен в пользу системной заместительной гормонотерапии.
Как известно, эстрогены повышают количество α-адренорецепторов в уретре в 2–3 раза. Это обусловливает положительный и более значимый эффект от сочетанного применения заместительной гормональной терапии и α-адреномиметиков. В ответ на стимуляцию α-адренорецепторов гладкие мышцы уретры сокращаются, увеличивается уретральное сопротивление.
С учетом положительного влияния препаратов для заместительной гормональной терапии на мочеполовой тракт, возможно повышение эффективности лечения недержания мочи у женщин в климактерическом периоде при использовании следующих рекомендаций.
| Рекомендации [19] | СР |
|---|---|
Предлагайте женщинам постменопаузального возраста с недержанием мочи вагинальную терапию эстрогенами, особенно при наличии других симптомов вульвовагинальной атрофии |
A |
Проводя комплексную консервативную терапию недержания мочи при напряжении, необходимо увеличить физические нагрузки и нормализовать диету, поскольку масса тела у многих больных превышает норму приблизительно на 30%. Лечебная физкультура улучшает кровоснабжение органов малого таза, укрепляет мышечно-связочный аппарат, повышает компенсаторную функцию сердечно-сосудистой и дыхательной систем, улучшает психический статус больных. Разработано несколько видов лечебной гимнастики для органов малого таза, при их выборе следует учитывать возраст, степень тренированности и сопутствующие заболевания. Физические упражнения проводят под контролем уродинамического исследования. Занятия лечебной физкультурой показаны 3 раза в неделю, начиная с 20 до 50 мин, продолжительность курса в среднем составляет 6 нед. Удовлетворительные результаты получены после электростимуляции органов и тканей таза. При легкой степени недержания мочи эффективно иглоукалывание.
К малоинвазивным хирургическим методам лечения недержания мочи при напряжении относится инъекционная терапия парауретральными объемообразующими средствами, которую назначают женщинам при отсутствии выраженного опущения стенок влагалища и мочевого пузыря, а также нейрогенных расстройств мочеиспускания. Для проведения инъекционной терапии используют различные субстанции:
Однако широкое применение инъекционной терапии в комплексном лечении больных с недержанием мочи при напряжении требует дальнейшего изучения.
Среди оперативных методов лечения недержания мочи при напряжении ранее чаще всего использовались модифицированные методики, предложенные Marchall Marchetti, Krantz, Burch, уретроцервикопексия, предложенная Raz, операции Pereyra и др. В настоящее время широко применяют операции с примнением субуретральных слингов [20, 21]. В качестве свободной петли в последнее время все чаще используют различные синтетические материалы, выполненные из монофиламентного полипропилена. Эффективность и безопасность операций с применением петель TVT и TVT-O в настоящее время наиболее известны как в России, так и за рубежом, а отдаленные результаты изучены на протяжении 17 лет и продолжают оставаться удовлетворительными [22, 23].
Окончательные результаты любого хирургического лечения стрессового недержания мочи у женщин следует оценивать не ранее чем через 3 года после проведенной операции.
| Рекомендации по хирургическому лечению неосложненного стрессового недержания мочи у женщин | СР |
|---|---|
Предлагайте синтетические слинги женщинам с неосложненным стрессовым недержанием мочи, поскольку они представляются наиболее предпочтительным методом хирургического лечения |
A |
Предупреждайте женщин, которым планируется установка слинга позадилонным доступом об относительно более высоком риске периоперационных осложнений по сравнению с трансобтураторным доступом. |
A |
Предупреждайте женщин, которым планируется установка синтетического слинга трансобтураторным доступом о более высоком риске хронической боли и диспареунии в отдаленном периоде |
A |
Предупреждайте женщин, которым планируется установка слингов одного разреза, об отсутствии данных по отдаленной эффективности |
A |
Проводите уретроцистоскопию во время установки синтетических слингов. |
C |
Рекомендуйте кольпосуспензию (открытую или лапароскопическую) или аутологичный фасциальный слинг женщинам со стрессовым недержанием мочи, если нельзя установить синтетические слинги |
A |
Предупреждайте женщин, которым планируется установка аутологичного фасциального слинга о более высоком риске появления симптомов нарушенного мочеиспускания и возможной необходимости чистой периодической самокатетеризации; убедитесь, что они хотят и могут ее проводить |
C |
Информируйте женщин пожилого возраста со стрессовым недержанием мочи о более высоком риске осложнений и, возможно, более низкой эффективности лечения |
B |
Информируйте женщин о возможном влиянии влагалищных операций на сексуальную функцию |
B |
Предлагайте новые операции, для которых нет доказательств 1 уровня, только в рамках исследований |
A |
Предлагайте регулируемые слинги в качестве первой линии лечения стрессового недержания мочи только в рамках исследований |
A |
Не предлагайте объемообразующие препараты женщинам, которым необходимо длительное устранение стрессового недержания мочи |
A |
Лечение осложненного стрессового недержания мочи необходимо проводить только в экспертных центрах |
A |
Выбор хирургического лечения рецидивного стрессового недержания мочи зависит от результатов тщательного обследования конкретного пациента, включая многоканальное КУДИ и, при необходимости, методы визуализации |
C |
Предупреждайте женщин с рецидивным стрессовым недержанием мочи, что результаты повторного хирургического лечения обычно хуже, чем у первичного, с более низкой эффективностью и более высоким риском осложнений |
C |
Рекомендуйте установку синтетического или аутологичного слинга или кольпосуспензию в качестве первой линии лечения женщин с осложненным стрессовым недержанием мочи |
C |
Предупреждайте женщин, которым планируется установка искусственного сфинктера или регулируемых компрессионных устройств, что, даже в экспертных центрах сохраняется высокий риск осложнений, механической поломки или необходимости удаления устройства |
C |
Осложнения минимально инвазивных операций
Интраоперационные осложнения и осложнения в ближайшем послеоперационном периоде (до 24 ч) относятся к ранним [10, 13, 26]:
Если после хирургического лечения возникло осложнение (инфекция операционной раны или мочевыводящих путей, острая задержка мочеиспускания, кровотечение, запор, повреждение соседних органов), в послеоперационном периоде необходимо проводить регулярные осмотры пациентки и зачастую более инвазивные манипуляции. При продолжающейся задержке мочи через 3 нед после операции и более применяют рассечение петли [19].
Женщины с пролапсом тазовых органов и недержанием мочи [19]
-
Одновременная хирургическая коррекция пролапса тазовых органов и стрессового недержания мочи приводит к лучшим результатам лечения в краткосрочном периоде, чем выполнение оперативного вмешательства только по поводу пролапса тазовых органов (УД: 1а).
-
Однако существуют противоречивые данные по достижению относительного положительного эффекта в течение длительного времени от проведения комплексной хирургической коррекции (УД: 1b).
-
Одновременная комплексная хирургическая коррекция пролапса тазовых органов и стрессового недержания мочи характеризуется более высоким риском развития неблагоприятных исходов (УД: 1b).
Женщины с пролапсом тазовых органов без недержания мочи
[19]
-
Существует риск послеоперационного развития недержания мочи после устранения пролапса гениталий (УД: 1а).
-
Дополнительная профилактическая операция, направленная на предотвращение возникновения недержания мочи, снижает риск развития послеоперационного недержания мочи (УД: 1b).
-
Дополнительная профилактическая операция, направленная на предотвращение возникновения недержания мочи, увеличивает риск развития послеоперационных осложнений (УД: 1b).
Женщины с пролапсом тазовых органов и латентным стрессовым недержанием мочи
[19]
Одновременная хирургическая коррекция пролапса тазовых органов и стрессового недержания мочи приводит к лучшим результатам лечения в краткосрочном периоде, чем выполнение оперативного вмешательства только по поводу пролапса тазовых органов (УД: 1а).
Комплексная хирургическая коррекция пролапса тазовых органов и стрессового недержания мочи приводит к более высокому риску развития неблагоприятных исходов (УД: 1b).
| Рекомендации для женщин с симптоматическим пролапсом органов малого таза (ОМТ) и симптоматическим или скрытым стрессовым недержанием мочи | СР |
|---|---|
Предлагайте одновременную коррекцию пролапса ОМТ и стрессового недержания мочи |
A |
Предупреждайте женщин о более высоком риске осложнений при комбинированном лечении по сравнению с коррекцией только пролапса |
A |
Рекомендации для женщин с симптоматическим пролапсом ОМТ без симптоматического или скрытого стрессового недержания мочи Предупреждайте женщин о риске развития стрессового недержания мочи после коррекции пролапса |
A |
Информируйте женщин об отсутствии убедительных данных о преимуществе профилактической антистрессовой операции |
C |
Предупреждайте женщин о том, что более высокий риск осложнений комбинированного лечения по сравнению только с коррекцией пролапса может перевешивать возможные преимущества антистрессовой операции |
A |
Чего нельзя делать
Самое главное в отношении больных с недержанием мочи — проведение правильной дифференциальной диагностики как истинного и ложного недержания, так и различных форм истинного недержания мочи, так как патогенез их развития совершенно разный, и, соответственно, способы лечения тоже отличаются. Лечение ложного недержания мочи предусматривает устранение анатомического врожденного или приобретенного дефекта. Невыявление этого дефекта и отнесение пациентки к группе больных с истинным недержанием мочи, т.е. проведение неполного обследования больной, не приведет к желаемому положительному успеху лечения.
При назначении медикаментозного лечения истинного недержания мочи необходимо учесть все противопоказания к назначению того или иного лекарственного препарата и провести оценку возникших побочных эффектов при его применении.
Выполнение слинговой операции пациентке с ургентным недержанием мочи может усугубить ее состояние и привести к осложнениям не только со стороны мочевого пузыря, но и почек.
При подтверждении стрессовой формы недержания мочи, определении необходимости хирургического лечения и выборе слинговой операции специалист должен понимать суть выполнения данной операции и ни в коем случае не допустить создания инфравезикальной обструкции, которая приведет к затрудненному мочеиспусканию, появлению большого количества остаточной мочи (более 100 мл), вплоть до острой задержки мочеиспускания и необходимости удаления использованного сетчатого протеза.
Когда необходим консилиум
Недержание мочи может быть спровоцировано различными факторами, включая заболевания со стороны женских половых органов, центральной и периферической нервной системы, органов эндокринной системы и др. Для проведения полного обследования пациентки и выявления факторов, приведших или, возможно, усугубляющих состояние больной, а также для определения тактики и назначения адекватного лечения привлекают врачей-специалистов — акушеров-гинекологов, неврологов и нейрохирургов, эндокринологов и др.
СПИСОК ЛИТЕРАТУРЫ
-
Abrams P., Cardozo L., Fall M. et al. The standartization of terminology of lower urinary tract function: Report from the standartization sub-committee of the International Continence Society // Neurol. Urodyn. — 2002. — Vol. 21. — P.167–178.
-
Гаджиева З.К. Нарушения мочеиспускания / под ред. Ю.Г. Аляева. — М.: ГЭОТАР-Медиа, 2010. — 176 с.
-
Abrams P., Blaivas J.G., Stanton S.L. Andersen J.T. Thestandardisation of terminology of lower urinary tract function recommended by International Continence Society // Int. Urogynec. J. — 1990. — Vol. 1. — P. 45.
-
Bates P., Glen E., Griffiths D. et al. The International Continent Commitee on standardisation and terminology (1977) — Second report on standardisation of terminology of lower urinary tract function // Scand. J. Urol. Nephrol. — Vol. 11. — P. 197–199.
-
Graham C.A., Mallet V.T. Race as a predictor of urinary incontinence and pelvicorgan prolaps // Am.J. Obstet. Gynecol. — 2001. — Vol. 185. — P. 116–120.
-
Hannestad Y.S., Lie R.T., Rortveight G., Hanskaar S. Female urinaryincontinence — running in the family? // Neurol. Urodyn. — 2003. — Vol. 22. — P. 449 (abs. 60).
-
Abrams P., Artibani W., Cardozo L. et al. Clinical Manual of Incontinence in Women. — New York: Healh Publications, 2005.
-
Moller L.A., Lose G., Jorgensen T. The prevalence and bothersomeness of lower urinary tract symptoms in women 40–60 years of age // Acta. Obstet. Gynecol. Scand. — 2000. — Vol. 79. — P. 298–305.
-
Bump R.C., Norton R.A. Epidemiology and natural history of pelvic floordisoders // Obstet. Gynecol. Clin. North. Am. — 1998. — Vol. 25. — P.723–746.
-
Cheater F., Castleden M. Epidemiology and classification of urinary incontinence // Baillires Best Pract. Res. Clin. Obstet. Gynecol. — 2000. — Vol. 14. — P. 183–205.
-
Parazzini F., Colli E., Origgy G. et al. Risk factors for urinary incontinencein women // Eur. Urol. — 2000. — Vol. 37. — P. 637–643.
-
Bump R.C., McClish D.K. Cigarette smoking and pure genuine stress incontinence of urine: a comparison of risk factors and determinants between smokers and nonsmokers // Am.J. Obstet. Gynecol. — 1994. — Vol. 170. — P. 579–582.
-
Brubaker L., Bump R., Jacquetin B. Pelvic organ prolapse In: Incontinence // P.Abrams et al. — Plymouth: Plymbridge Distributors Ltd, 2002. — P. 243–265.
-
Мазо Е.Б., Кривобородов Г.Г., Школьников М.Е. Стандартизация терминологии функции нижних мочевых путей // Доклад стандартизационного подкомитета Международного общества по удержанию мочи. — М., 2003.
-
Abrams P. et al. 4th International Consultation on Incontinence Recommendations of the International Scientific Committee: Evaluation and Treatment of Urinary Incontinence, Pelvic Organ Prolapse and Faecal Incontinence. — 2009. — P. 1767–1820.
-
Херт Г. Оперативная урогинекология. — М.: ГЭОТАР-Медиа, 2003. — 54 с.
-
Lucas M.G. et al. Guidelines on urinary incontinence. EAU pocket guidelines. — 2013. — p. 175–198.
-
Лопаткин Н.А. Урология. Клинические рекомендации (2-е издание). — М.: ГЭОТАР-Медиа, 2013. — 416 с.
-
Касян Г.Р., Гвоздев М.Ю., Годунов Б.Н., Прокопович М.А., Пушкарь Д.Ю. Анализ результатов лечения недержания мочи у женщин с использованием свободной субуретральной синтетической петли: опыт 1000 операций // Урология. — 2013. — №4. — С. 5–11.
-
Pushkar DY, Godunov BN, Gvozdev M, Kasyan GR. Complications of midurethral slings for treatment of stress urinary incontinence. Int J Gynaecol Obstet. 2011 Apr; 113 (1):54–7. doi: 10.1016/j. ijgo. 2010.10.024.
-
Пушкарь Д.Ю., Касян Г.Р. Отдаленные результаты использования свободной синтетической петли в лечении недержания мочи у женщин (восьмилетние результаты). Пушкарь Д.Ю., Касян Г.Р., // Урология. 2010. №2. С. 32
-
Nilsson CG, Palva K, Aarnio R, Morcos E, Falconer C. Seventeen years’ followup of the tension-free vaginal tape procedure for female stress urinary incontinence.. Int Urogynecol J. 2013 Aug; 24 (8):1265–9. doi: 10.1007/s00192-013-2090-2. Epub 2013 Apr 6
-
Chapple, C., Yamaguchi, O., Ridder, A., Liehne, J., Carl, S., Mattiasson, A. et al. (2008) Clinical proof of concept study (Blossom) shows novel b3 adrenoceptor agonist YM178 is efffective and well tolerated in the treatment of symptoms of overactive bladder. Eur Urol Suppl 7: 239
-
Chapple, C., Wyndaele, J., Van Kerrebroeck, P., Radziszewski, P., Dvorak, V. and Boerrigter, P. (2010) Dose-ranging study of once-daily mirabegron (YM178), a novel selective 3-adrenoceptor agonist, in patients with overactive bladder (OAB). Eur Urol Suppl 9: 249.
-
Chapple CR, Kaplan SA, Mitcheson D, et al. Randomized double-blind, activecontrolled phase 3 study to assess 12-month safety and effificacy of mirabegron, a beta3-adrenoceptor agonist, in overactive bladder. Eur Urol 2013 Feb:63(2):296-305.
-
Nitti V. W. et.al. Mirobegron for the treatment of overactive bladder: a prespecified pooled efficacy analysis and pooled safety analysis of three randomised, doubleblind, placebo-controlled, phase III studies int J Clin Pract 2013. doi: 10.1111/ijcp.12194
Глава 7. БОЛЕЗНЬ ПЕЙРОНИ
Д.В. Бутнару, Н.Д. Ахвледиани
Болезнь Пейрони — заболевание соединительной ткани, характеризующееся образованием фиброзных поражений и/или бляшек в белочной оболочке, которые могут приводить к эректильной деформации полового члена.
Синонимы: пластическая индурация полового члена; пенильный фиброматоз; болезнь Ван-Бурена [1].
МКБ-10 • N48.6 — баланит, пластическая индурация полового члена. Первые упоминания о болезни Пейрони встречаются в трудах
Fallopius (1561). Заболевание впервые описано в 1743 г. Франсуа Пейрони (Francois Gigot de la Peyronie). Общие сведения о заболевании представлены в табл. 7.1.
| Общие сведения | УД |
|---|---|
Болезнь Пейрони — заболевание соединительной ткани, которое сопровождается фиброзными изменениями или образованием бляшек в белочной оболочке, что может приводить к эректильной деформации полового члена |
2 |
Влияние сопутствующих заболеваний и факторов риска (например, сахарный диабет, гипертоническая болезнь, контрактура Дюпюитрена, нарушения липидного обмена и др.) на развитие болезни Пейрони до сих пор остается не до конца выясненным |
3 |
Выделяют 2 стадии заболевания |
2 |
Первая стадия — стадия острого воспаления (болезненные эрекции, наличие мягкой бляшки |
|
Самоизлечение встречается редко (3–13%). |
2 |
Эпидемиология
За последние десятилетия отмечают увеличение заболеваемости болезнью Пейрони. Распространенность заболевания в мужской популяции колеблется от 0,4 до 9% [2-8]. Возраст 65% пациентов 40–60 лет [9]. У мужчин моложе 20 лет встречается в 0,6–1,5% случаев. Не менее 25% больных болезнью Пейрони имеют эректильную дисфункцию (ЭД).
Этиология и патогенез, факторы риска
Этиология болезни Пейрони полностью не изучена. Одна из основных гипотез — повторяющиеся микротравмы белочной оболочки (на уровне микрососудистого русла) на фоне генетической предрасположенности. Заболевание начинается с острого воспалительного процесса между слоями белочной оболочки. Увеличивается количество фибробластов, часть из которых дифференцируется в миофибробласты с избыточным отложением коллагена и деградацией эластиновых волокон. Длительно протекающий воспалительный процесс приводит к формированию грубой рубцовой ткани и образованию бляшки (бляшек) в толще белочные оболочки. В этом месте белочная оболочка теряет свою эластичность, что приводит к искривлению полового члена во время эрекции. Как правило, половой член искривляется в ту сторону, где находится бляшка. При значительном градусе искривления введение полового члена во влагалище становится затруднительным или невозможным.
Классификация
В течении болезни Пейрони выделяют две стадии, от которых зависит характер предпринимаемых лечебных мероприятий:
-
стадия острого воспаления, которая может протекать с болевыми ощущениями в половом члене, как при эрекции, так и без нее. В этой стадии бляшка мягкая, пациент отмечает эректильную деформацию полового члена;
-
стадия стабилизации (организации бляшки), во время которой происходит рубцевание бляшки, а в некоторых случаях и ее кальцификация. Точно оценить конец воспалительной стадии сложно, однако длительность заболевания больше 1 года и стабильность бляшки в течение 3 мес могут служить ориентиром перехода болезни в стабильную стадию [12].
Также встречаются и другие классификации болезни Пейрони.
-
-
I. Боль:
0 — отсутствие;
1 — незначительная боль во время эрекции;
2 — значительная боль, затрудняющая половую жизнь;
3 — боль во время эрекции и без эрекции. -
II. Искривление:
0 — отсутствие;
1 — до 30° (без ограничения половой жизни);
2 — до 60° (ограничивающее половую жизнь);
3 — больше 60° (невозможность половой жизни). -
III. Уплотнение:
0 — отсутствие;
1 — диаметр до 1 см;
2 — размеры 1–3 см;
3 — более 3 см.
-
Диагностика
ЖАЛОБЫ И АНАМНЕЗ. ФИЗИЧЕСКОЕ ОБСЛЕДОВАНИЕ
Как правило, для диагностики болезни Пейрони достаточно жалоб пациента и осмотра полового члена. Основные симптомы болезни следующие:
-
наличие бляшки или участка уплотнения на белочной оболочке полового члена, которые выявляются при пальпации полового члена в виде плотных безболезненных узелков или продольной хорды, хрящевидной плотности, четко отграниченных от окружающих тканей, не смещаемых относительно подлежащих тканей и отмечающихся у всех пациентов, причем в 60% случаев бляшка располагается на дорсальной поверхности полового члена [13];
-
эректильная деформация полового члена (бляшки на вентральной и латеральных поверхностях наблюдаются реже, но они чаще вызывают нарушение эректильной функции, так как быстрее приводят к развитию деформации полового члена);
-
в воспалительной стадии заболевания больного может беспокоить боль в половом члене, носящая, как правило, неинтенсивный характер и самостоятельно проходящая в течение 3–6 мес;
-
эректильная дисфункция развивается у 25–55% пациентов [2, 11], причины развития ЭД [14]:
-
деформация полового члена, делающая невозможным половой акт;
-
недостаточная эрекция и нестабильность полового члена, возникающие при распространении фиброза на кавернозную ткань;
-
несостоятельность веноокклюзивного механизма эрекции, возникающая у 30% пациентов с болезнью Пейрони [15].
Крайне важный момент — определение стадии заболевания, так как от этого зависит выбор метода лечения. Переход в стабильную стадию заболевания наступает, как правило, не ранее 8–12 мес от начала заболевания и характеризуется исчезновением боли при эрекции, а также наличием плотной бляшки при пальпации полового члена.
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
УЗИ позволяет уточнить локализацию и размеры бляшек, которые выявляются в виде гиперэхогенной структуры, которая при кальцификации дает четкую акустическую тень. Более точную информацию о локализации, размерах, конфигурации и плотности бляшек можно получить с помощью КТ.
Если пациент не может точно описать деформацию полового члена, а также перед планированием оперативного вмешательства следует вызвать эрекцию путем интракавернозной инъекции вазоактивного препарата [16, 17] либо с помощью вакуум-эректора.
| Клинические рекомендации по диагностике болезни Пейрони | УД | СР |
|---|---|---|
Анамнестические данные должны включать следующие аспекты: |
2 |
B |
|
||
Физикальное обследование должно включать следующие моменты: |
2 |
B |
наличие потенциально связанных заболеваний:
|
||
Ультразвуковая оценка размеров бляшки зависит от специалиста, выполняющего исследования, и не является точным методом. Не рекомендуется для рутинной клинической практики |
3 |
C |
Фармакодопплерография сосудов полового члена требуется для оценки васкулогенной эректильной дисфункции |
2 |
B |
Лечение
ЦЕЛИ ЛЕЧЕНИЯ
Цель лекарственной терапии — остановка воспалительного процесса и максимальное сохранение белочной оболочки. Цель оперативного лечения — исправление деформации полового члена.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Необходимость оперативного лечения.
НЕМЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
Пациенту следует оказать психологическую помощь. Ему объясняют, что образовавшиеся бляшки не являются злокачественными новообразованиями и не представляют никакой опасности для жизни, болевые ощущения скоро прекратятся, а любую деформацию полового члена можно будет исправить небольшим оперативным вмешательством.
Локальное применение инфракрасного и гелиево-неонового лазерного облучения в сочетании с магнитотерапией повторными курсами на протяжении 6–8 мес и локальная ультразвуковая терапия в некоторых случаях приводят к уменьшению боли, регрессии фиброзных бляшек, уменьшению искривления полового члена [18].
Низкие дозы лучевой терапии эффективны при упорном болевом симптоме, однако их применение ограничено высокой частотой развития ЭД, возникающей после лечения [19].
Лекарственная терапия
Пероральная терапия
-
Витамин Е. Естественный антиоксидант. Широко используется при болезни Пейрони из-за своей доступности, низкой стоимости, хорошей переносимости и низкого уровня побочных эффектов. Назначают в дозировке 400–800 мг/сут, в 2 приема. Однако двойное слепое рандомизированное перекрестное исследование показало отсутствие значимого эффекта витамина Е в отношении размера бляшки и степени эректильной деформации [20].
-
Парааминобензоат калия℘ (потаба℘). Предполагается, что потаба℘ обладает антифибротическим эффектом за счет улучшения оксигенации тканей. Требуется длительный прием (не менее года). В двух проспективных плацебо-контролируемых двойных слепых исследованиях не выявлено влияния пара-аминобензоата калия℘ (12 мг/ сут, 12 мес) на степень эректильной деформации [21, 22]. Прием потабы сопровождался следующими побочными эффектами: тошнотой, анорексией, зудом, беспокойством, ознобом, холодным потом, спутанностью сознания и трудностями в концентрации. Однако никаких серьезных нежелательных явлений отмечено не было.
-
Тамоксифен. Нестероидный антагонист эстрогеновых рецепторов. Считается, что тамоксифен обладает модулирующим влиянием на трансформирующий фактор роста (TGF1), секретируемый фибробластами. Результаты исследований противоречивы. Ранее указывалось, что тамоксифен (20 мг 2 раза в день, 3 мес) уменьшает размер бляшки, боль, а также степень искривления полового члена [23]. Однако более позднее рандомизированное плацебо-контролируемое исследование не выявило какого-либо существенного влияния тамоксифена (20 мг 2 раза в день, 3 мес) на боль, размеры бляшки и степень искривления полового члена [24]. Следует отметить, что в данном исследовании приняло участие 25 пациентов с длительностью заболевания около 20 мес.
-
Колхицин⊗. Препарат, используемый для купирования приступов подагры. Использование колхицина⊗ при болезни Пейрони основывается на его возможном противовоспалительном действии. Несколько исследований указали на эффективность колхицина⊗ в отношении боли, размеров бляшки и степень искривления полового члена [25-27]. Дозировки колебались от 0,6 до 2,0 мг/сут, в течение 3–5 мес. Сочетание витамина Е с колхицином⊗ (600 мг/сут и 1 мг каждые 12 ч, в течение 6 мес) вызывало уменьшение размеров бляшки и степени эректильной деформации у пациентов с ранней стадией болезни Пейрони [28]. Прием колхицина⊗ сопровождается различными расстройствами со стороны желудочно-кишечного тракта: тошнотой, рвотой, диареей.
-
Пентоксифиллин. Неспецифический ингибитор фосфодиэстеразы. Уменьшает выработку трансформирующего фактора роста, повышает фибринолитическую активность. В ряде работ [29, 30] отмечено положительное влияние пентоксифиллина (400 мг 3 раза в сутки, 6 мес) на степень искривления полового члена, размеры бляшки, а также на степень кальцификации бляшки.
-
Ингибиторы фосфодиэстеразы 5-го типа (ингибиторы ФДЭ5). В исследованиях на животных показано, что ингибиторы ФДЭ5 способны повышать индекс апоптоза в бляшках, подобных тем, которые возникают при болезни Пейрони [31]. В ретроспективном контролируемом исследовании выявлено уменьшение септальной бляшки при приеме тадалафила (2,5 мг/сут в течение 6 мес) у 69% пациентов (р<0,05). В данном исследовании принимали участие только пациенты с септальными бляшками. Данные о влиянии на искривление полового члена отсутствуют. Таким образом, ингибиторы ФДЭ5 пока не могут быть обоснованно рекомендованы пациентам с болезнью Пейрони.
Инъекционная терапия
Инъекционная терапия предполагает введение различных активных препаратов непосредственно в бляшку.
-
Стероидные гормоны. Возможно, могут положительно влиять на бляшку за счет подавления иммунного ответа и снижения синтеза коллагена. Опубликованы данные лишь одного простого слепого плацебо-контролируемого исследования, в котором в бляшку вводили бетаметазон [32]. Никаких значимых различий в отношении боли, степени эректильной деформации и размеров бляшки выявлено не было. Введение стероидных препаратов в бляшку может сопровождаться атрофией тканей, истончением кожи и иммуносупрессией.
-
Верапамил. Блокатор медленных кальциевых каналов. Транспорт коллагена, гликозаминогликанов и фибронектина в межклеточном веществе — кальцийзависимый процесс. Верапамил повышает коллагеназную активность, оказывает модулирующее действие на воспалительный процесс и тормозит пролиферацию фибробластов в бляшке. Во многих исследованиях показан положительный эффект инъекционного введения верапамила в бляшку, который проявляется в уменьшении размеров бляшки и степени эректильной деформации [33-37]. В этих исследованиях 10 мг верапамила растворяли в 10 мл раствора и обкалывали бляшку (с интервалом в 2 нед, на протяжении 6 мес). Однако в единственном простом слепом плацебо-контролируемом исследовании не выявлено статистической разницы между размером бляшки, степенью ее размягчения, болью в половом члене при эрекции и степенью искривления полового члена в двух группах [38].
-
Клостридиальная коллагеназа. Избирательно разрушает молекулы коллагена. В проспективном рандомизированном двойном слепом исследовании эффективность (размер бляшки и степень искривления полового члена) инъекционного введения клостридиальной коллагеназы составила 36% против 4% в контрольной группе [39].
-
Интерферон. Интерферон альфа-2b подавляет пролиферацию фибробластов, синтез коллагена и межклеточного вещества, улучшает заживление ран. В двух исследованиях [40, 41] инъекционное введение интерферона альфа-2b существенно уменьшило боль, размеры бляшки и степень эректильной деформации полового члена по сравнению с плацебо. Побочные эффекты (гриппоподобные состояния) эффективно лечились предварительным назначением нестероидных противовоспалительных средств.
Местная терапия
-
Верапамил. Местное применение 15% геля с верапамилом (2 раза в сутки на область бляшки) существенно снижает боль, степень искривления и размеры бляшки по сравнению с плацебо [42]. Эффективность становится более значимой, при увеличении срока применения геля с 3 до 9 мес.
-
Ионофорез. Неконтролируемые исследования показывают обнадеживающие результаты [43-45]. Рандомизированное двойное слепое контролируемое исследование (верапамил 5 мг и дексаметазон 8 мг) выявило существенное уменьшение размеров бляшки и степени искривления полового члена [46]. Тем не менее в другом рандомизированном двойном слепом плацебо-контролируемом исследовании (верапамил 10 мг) статистически значимых различий в группах не выявлено [47]. Каких-либо побочных эффектов обнаружено не было.
-
Ударно-волновая терапия. Большинство неконтролируемых исследований не показали существенного эффекта от использования дистанционной терапии при болезни Пейрони [48-50]. Проспективное двойное слепое плацебо-контролируемое исследование выявило существенное улучшение только в отношении боли [51].
-
Пенильные экстендеры. Результаты использования пенильных экстендеров представлены лишь в неконтролируемых исследованиях. Результаты этих исследований противоречивы [52, 53].
-
Вакуум-эректорная терапия. Результаты неконтролируемого исследования [54] указывают на существенное уменьшение боли, увеличение длины полового члена в растянутом состоянии, уменьшении его искривления.
Показания и противопоказания к неоперативному лечению болезни Пейрони приведены в табл. 7.3.
| Рекомендации [91] | УД | СР |
|---|---|---|
Консервативная терапия при болезни Пейрони в первую очередь показана пациентам на ранней стадии заболевания. Кроме того, консервативное лечение может быть использовано у пациентов, которым оперативное лечение выполнено быть не может либо при отказе пациента от операции |
3 |
C |
Пероральный прием пара-аминобензоата калия℘ может благоприятно повлиять на боль, размер бляшки и степень искривления полового члена |
1b |
B |
Инъекционная терапия верапамилом может существенно уменьшить объем бляшки и степень эректильной деформации |
1b |
C |
Инъекционная терапия клостридиальной коллагеназой может существенно уменьшить объем бляшки и степень эректильной деформации |
2b |
C |
Инъекционная терапия интерфероном может существенно уменьшить размер и плотность бляшки, боль и степень искривления полового члена |
1b |
B |
Местное применение 15% геля с верапамилом может уменьшить искривление полового члена и размер бляшки |
1b |
B |
Ионофорез с 5 мг верапамила и 8 мг дексаметазона может уменьшить искривление полового члена и размер бляшки |
1b |
B |
Ударно-волновая терапия не влияет на степень эректильной деформации и размер бляшки, поэтому не может быть рекомендована для лечения этих проявлений заболевания. Ударно-волновая терапия может применяться для уменьшения боли в половом члене |
1b |
B |
Вакуум-эректорная терапия и пенильные экстендеры могут уменьшить степень искривления полового члена и увеличить длину полового члена |
3 |
C |
Рекомендации «ПРОТИВ» |
||
Инъекционная терапия стероидными препаратами не может быть рекомендована, так как не влияет на размеры бляшки, степень искривления и выраженность боли |
1b |
B |
Пероральная терапия витамином Е и тамоксифеном существенно не влияет на размеры бляшки, выраженность боли и степень эректильной деформации. Следовательно, данные препараты не должны быть рекомендованы для коррекции этих проявлений заболевания |
2b |
B |
Прочие пероральные препараты не рекомендуются для использования при болезни Пейрони |
3 |
C |
Хирургическое лечение
Универсального способа оперативного лечения при болезни Пейрони не существует. Выбор методики основывается на степени выраженности девиации полового члена, его геометрических параметрах и гемодинамическом статусе, состоянии эректильной функции. Оперативное лечение проводят в стабильной стадии болезни пациентам, не ранее чем через 6–12 мес от начала заболевания.
Пациент должен быть проинформирован о возможных осложнениях оперативного вмешательства, а также об особенностях послеоперационного периода.
В настоящее время существует два основных вида оперативных вмешательств при болезни Пейрони:
Среди методик, укорачивающих половой член, выделяют:
-
операцию Несбита и ее модификации (производится иссечение фрагмента белочной оболочки на выгнутой части полового члена, с последующим сшиванием краев белочной оболочки);
-
пликационные операции, при которых белочная оболочка не иссекается, а на выгнутой части полового члена формируется складка белочной оболочки с помощью нерассасывающегося шовного материала.
Методики, удлиняющие половой член (заместительные корпоропластики) предполагают рассечение бляшки (вогнутая часть полового члена) и замещение возникшего дефекта в белочной оболочке с помощью трансплантата.
Большинство указанных выше операций выполняют из субкоронарного доступа с последующим дегловингом. Как правило, операции завершаются обрезанием крайней плоти, хотя это не обязательное условие.
При сочетании болезни Пейрони с некоррегируемой эректильной дисфункцией следует предпочесть протезирование полового члена с заместительной корпоропластикой или без нее.
Выбор метода оперативного лечения зависит от:
Методики, укорачивающие половой член
-
Операция Несбита. В 1965 г. Несбит предложил эллипсовидное иссечение и последующее сшивание белочной оболочки на выгнутой части полового члена для хирургического лечения врожденного искривления полового члена [55]. Спустя 14 лет данная методика начала широко использоваться при болезни Пейрони [56]. Максимальная ширина эллипса колеблется от 0,5 до 1,0 см, по 1 мм на каждые 10° искривления [57]. Краткосрочные и долгосрочные результаты хорошие. Полное выпрямление полового члена достигается более чем в 80% случаев [58].
-
Пликационные методики. Пликационные методики основываются на том же принципе, что и операция Несбита, но не предусматривают иссечения фрагмента белочной оболочки. Вместо иссечения на выгнутой поверхности полового члена выполняется один или несколько продольных разрезов белочной оболочки, которые сшиваются в поперечном направлении, согласно принципу Гейнеке–Микулича. При некоторых модификациях белочная оболочка не рассекается вовсе; складка формируется с помощью специальных пликационных швов [59-64]. Результаты данных методик, а также степень удовлетворенности пациентов результатами лечения сопоставимы с таковыми при операции Несбита [57].
Методики, удлиняющие половой член
-
Суть данного вида оперативного пособия заключается в рассечении белочной оболочки на ее короткой стороне (вогнутая часть полового члена) и удлинении белочной оболочки за счет «вставки» трансплантата. Иссечение бляшки не рекомендуется из-за высокого риска развития венозной утечки.
-
Идеального материала для заместительной корпоропластики в настоящее время не существует. Заместительная корпоропластика может приводить в последующем к развитию эректильной дисфункции в 25% случаев; риск повторного оперативного вмешательства на протяжении последующих 10 лет составляет около 17% [65].
-
Венозные трансплантаты обладают теоретическим преимуществом, за счет формирования эндотелиально-эндотелиального анастомоза. Чаще всего используется большая подкожная вена бедра, а также глубокая дорсальная вена полового члена (в последнем случае нет необходимости в дополнительном разрезе) [57]. При использовании венозных трансплантатов возможны следующие риски [66-68]: рецидив эректильной деформации (20%), укорочение полового члена (17%), грыжевое выпячивание в зоне трансплантата (5%).
-
Влагалищная оболочка яичка: относительно аваскулярна, может быть легко получена, низкий риск сокращения [70].
-
Дермальные трансплантаты: последующая контракция с развитием рецидива искривления полового члена (35%), прогрессирующее укорочение (40%), риск повторного оперативного вмешательства на протяжении последующих 10 лет (17%) [81].
-
Трупный перикард: прекрасные эластические свойства, риск рецидива эректильной деформации — 44%, однако большинство из пациентов были удовлетворены своей сексуальной жизнью и не нуждались в повторной операции [73, 81].
-
Подслизистая основа тонкой кишки (Small intestinal submucosa) — представляет собой децеллюляризированную коллагеновую матрицу, получаемую из подслизистой основы тонкой кишки свиньи. Она обладает свойствами специфической тканевой регенерации, в результате чего способна замещаться окружающей тканью. Продемонстрирована высокая эффективность использования ее при выраженной хорде и болезни Пейрони, однако данные пока ограничены [77].
-
Заместительная корпоропластика. Наиболее подходящим кандидатом для этого способа лечения является пациент с углом искривления более 60°, отсутствием эректильной дисфункции и который предупрежден о риске развития нарушений эрекции в послеоперационном периоде [82]. Наличие эректильной дисфункции перед операцией, возраст старше 60 лет, вентральная эректильная деформация, большой размер дефекта белочной оболочки — плохие прогностические факторы в отношении функционального результата после заместительной корпоропластики [83]. Ежедневное (по 8–12 ч) использование пенильных экстендеров предложено в качестве безопасного и эффективного средства для профилактики укорочения полового члена после оперативного лечения по поводу болезни Пейрони [84].
-
Протезирование полового члена. Протезирование полового члена при болезни Пейрони наиболее показано пациентам с эректильной дисфункцией, при неэффективности ингибиторов ФДЭ5 [57]. Несмотря на то, что при болезни Пейрони можно использовать любые протезы, трехкомпонентные имплантаты представляются наиболее эффективными [85]. Пациентам с легкой или умеренной степенью искривления достаточно простой имплантации цилиндров протезов без дополнительных действий. В случае выраженной эректильной деформации можно с успехом использовать ручное «моделирование» полового члена при наполненных цилиндрах протеза. Этот маневр осуществляется путем ручного выпрямления полового члена (90 с), что может сопровождаться характерным хрустом [86, 87]. Если после ручного «моделирования» сохраняется искривление менее 30°, дополнительных мероприятий не требуется, так как цилиндры протеза будут выступать в роли внутреннего экстендера, что приведет к выпрямлению полового члена в последующие 3 мес [86]. В большинстве случаев ручное «моделирование» оказывается эффективным. Если же требуется достичь полного выпрямления полового члена, можно использовать операцию Несбита, пликационные методики или заместительную корпоропластику [88-90]. Риск осложнений не превышает такового в общей популяции. Существует небольшой риск (3%) повреждения уретры при ручном«моделировании» в случае использования трехкомпонентных протезов [87].
Клинические рекомендации по хирургическому лечению болезни Пейрони и врожденного искривления полового члена приведены в табл. 7.4.
| Рекомендации [91] | УД | СР |
|---|---|---|
Оперативное лечение болезни Пейрони показано только в стабильной стадии заболевания, не менее чем через 3 мес после стабилизации процесса (отсутствие боли, нет продолжающегося искривления). Как правило, оперативное лечение допустимо спустя 12 мес от начала заболевания |
3 |
C |
Перед оперативным лечением должны быть оценены следующие параметры: длина полового члена, степень эректильной деформации, состояние эректильной функции (эффективность фармакотерапии, при наличии эректильной дисфункции), ожидания пациента от предстоящего оперативного вмешательства |
3 |
C |
Методики, укорачивающие половой член, должны рассматриваться в качестве метода выбора при врожденном искривлении полового члена и болезни Пейрони, если угол искривления не более 60°, имеется адекватная длина полового члена, отсутствуют специфические виды эректильной деформации (по типу «песочных часов», «бутылочного горлышка») |
2b |
B |
Заместительная корпоропластика является предпочтительным методом лечения: при неадекватной длине полового члена, угле искривления более 60°, в случае специфической эректильной деформации (по типу «песочных часов», «бутылочного горлышка») |
2b |
B |
Протезирование полового члена (с ручным «моделированием» или без него, операции Несбита, заместительной корпоропластики и др.) рекомендуется при болезни Пейрони, в случае наличия эректильной дисфункции, толерантной к фармакотерапии |
2b |
B |
Прогноз
С учетом возможностей оперативного лечения прогноз благоприятный.
ЛИТЕРАТУРА
-
Щеплев П.А., Гарин Н.Н., Данилов И.А. и др. Болезнь Пейрони. — М.: ИД «АБВ-пресс», 2012. — 216 с.
-
Schwarzer U., Sommer F., Klotz T. et al. The prevalence of Peyronie’s disease: results of a large survey //B.J. U. Int — 2001. — Vol. 88 (7). — 727–730. http:// www.ncbi.nlm.nih.gov/pubmed/11890244
-
Rhoden E.L., Teloken C., Ting H.Y. et al. Prevalence of Peyronie’s disease in men over 50-y-old from Southern Brazil //Int.J. Impot. Res. — 2001. — Vol. 13 (5). — 291–293. http://www.ncbi.nlm.nih.gov/pubmed/11890516
-
Mulhall J.P., Creech S.D., Boorjian S.A. et al. Subjective and objective analysis of the prevalence of Peyronie’s disease in a population of men presenting for prostate cancer screening //J. Urol. — 2004. — Vol. 171 (6 Pt 1). — P. 2350– 2353. http://www.ncbi.nlm.nih.gov/pubmed/15126819
-
La Pera G., Pescatori E.S., Calabrese M. et al. Peyronie’s disease: prevalence and association with cigarette smoking. A multicenter population-based study in men aged 50–69 years //Eur. Urol. — 2001. — Vol. 40. — P. 525–530. http:// www.ncbi.nlm.nih.gov/pubmed/11752860
-
Kumar B., Narang T., Gupta S. et al. A clinico-aetiological and ultrasonographic study of Peyronie’s disease. Sex Health 2006 May; 3 (2):113–118 http://www. ncbi.nlm.nih.gov/pubmed/16800397
-
Lindsay M.B., Schain D.M., Grambsch P. et al. The incidence of Peyronie’s disease in Rochester, Minnesota, 1950 through 1984. J Urol 1991 Oct; 146 (4):1007–9. http://www.ncbi.nlm.nih.gov/pubmed/1895413
-
Sommer F., Schwarzer U., Wassmer G. et al. Epidemiology of Peyronie’s disease. Int J Impot Res 2002 Oct; 14 (5):379–383. http://www.ncbi.nlm.nih.gov/pubmed/12454689
-
Pryor J.P., Ralph D.J. Clinical presentations of Peyronie’s disease //Int.J. Impot. Res. — 2002. — Vol. 14. — P. 414–417.
-
Rhoden E.L., Riedner C.E., Fuchs S.C. et al. A cross-sectional study for the analysis of clinical, sexual and laboratory conditions associated to Peyronie’s disease. J Sex Med 2010 Apr; 7 (4 Pt 1):1529–1537. http://www.ncbi.nlm.nih.gov/pubmed/19912489
-
Kadioglu A., Tefekli A., Erol B. et al. A retrospective review of 307 men with Peyronie’s disease. J Urol 2002 Sep; 168 (3):1075–1079.
-
Ralph D.J., Al-Akraa M., Pryor J.P. The Nesbitis operation for Peyronie’sdisease: 16-year experience //J. Urol. — 1995. — Vol. 154. — P. 1362–1372.
-
Hinman F. Etiologic factors in Peyronie’s disease //Urol. Int. — 1980. — Vol. 35. — P. 407–413.
-
Pryor J.P. Peyronie’s disease and impotence //Acta Urol. Belg. — 1988. — Vol. 56. — P. 317–321.
-
Gasior B.L., Levine F.J., Howannesian A. et al. Plaque-associated corporalveno-occlusive dysfunction in idiopathic Peyronie’s disease: A pharmacavernosometric and pharmacavernosographic study //World J. Urol. — 1990. — Vol. 8. — P. 90–96.
-
Desai K.M., Gingell J.C. Out-patient assessment of penile curvature // Br.J. Urol. — 1987. — Vol. 60. — P. 470–471.
-
Kelami A. Classification of congenital and acquired penile deviation //Urol. Int. — 1983. — Vol. 38. —P. 229–233.
-
Руководство по урологии / под ред. Н.А. Лопаткина. — М.: Медицина, 1998. — Т. 3. — С. 632.
-
Incrocci L., Slob A.K., Hop W.C. et al. Low-dose radiotherapyin 179 patients with Peyronie’s disease: treatment, outcome and current sexual function // Int.J. Radiat. Oncol. Biol. Phys. — 2000. — Vol. 47. — P. 1353–1356.
-
Pryor J.P., Farell C.F. Controlled clinical trial of Vitamin E in Peyronie’s disease //Prog. Reprod. Biol. — 1983. — Vol. 9. — P. 41–45.
-
Shah P.J.R., Green N.A., Adib R.S. et al. A multicentre double-blind controlled clinical trial of potassium para-amino-benzoate (POTABA1) in Peyronie’s disease //Progr. Reprod. Biol. Med. — 1983. — Vol. 9. — P. 61–67.
-
Weidner W., Hauck E.W., Schnitker J. Potassium paraaminobenzoate (POTABA) in the treatment of Peyronie’s disease: a prospective, placebocontrolled, randomized study //Eur. Urol. — 2005. — Apr. — Vol. 47 (4). — P. 530–535. http://www.ncbi.nlm.nih.gov/pubmed/15774254
-
Ralph D.J., Brooks M.D., Bottazzo G.F. et al. The treatment of Peyronie’s disease with tamoxifen //Br.J. Urol. — 1992. — Dec. — Vol. 70 (6). — P. 648–651. http://www.ncbi.nlm.nih.gov/pubmed/1486392
-
Teloken C., Rhoden E.L., Grazziotin T.M. et al. Tamoxifen versus placebo in the treatment of Peyronie’s disease //J. Urol. — 1999. — Dec. — Vol. 162 (6). — P.2003–2005. http://www.ncbi.nlm.nih.gov/pubmed/10569556
-
Kadioglu A., Tefekli A., Koksal T. et al. Treatment of Peyronie’s disease with oral colchicine: long-term results and predictive parameters of successful outcome // Int.J. Impot. Res. — 2000. — Jun. — Vol. 12 (3). — P. 169–175. http:// www. ncbi.nlm.nih.gov/pubmed/11045911
-
Akkus E., Carrier S., Rehman J. et al. Is colchicine efffective in Peyronie’s disease? Apilot study //Urology. — 1994. — Aug. — Vol. 44 (2). — P. 291–295. http:// www.ncbi.nlm.nih.gov/pubmed/8048212
-
Akman T., Sanli O., Uluocak N. et al. The most commonly altered type of Peyronie’s disease deformity under oral colchicine treatment is lateral curvature that mostly shifts to the dorsal side //Andrologia. — 2011. — Feb. — Vol. 43 (1). — P. 28–33. http://www.ncbi.nlm.nih.gov/pubmed/21219379
-
Prieto Castro R.M., Leva Vallejo M.E., Regueiro Lopez J.C. et al. Combined treatment with vitamin E and colchicine in the early stages of Peyronie’s disease //B.J. U. Int. — 2003. — Apr. — 91 (6). — P. 522–524. http://www.ncbi.nlm.nih.gov/pubmed/12656907
-
Brant W.O., Dean R.C., Lue T.F. Treatment of Peyronie’s disease with oral pentoxifylline //Nat. Clin. Pract. Urol. — 2006. — Feb. — Vol. 3 (2). — P. 111– 115; quiz 6. http://www.ncbi.nlm.nih.gov/pubmed/16470210
-
Smith J.F., Shindel A.W., Huang Y.C. et al. Pentoxifylline treatment and penile calcifications in men with Peyronie’s disease //Asian J. Androl. — 2011. — Mar. — Vol. 13 (2). — P. 322–325. http://www.ncbi.nlm.nih.gov/pubmed/21102473
-
Ferrini M.G., Kovanecz I., Nolazco G. et al. Efffects of long-term vardenafil treatment on the development of fibrotic plaques in a rat model of Peyronie’s disease //B.J. U. Int. — 2006. — Mar. — Vol. 97 (3). — P. 625–633. http://www. ncbi.nlm.nih.gov/pubmed/16469038
-
Cipollone G., Nicolai M., Mastroprimiano G. et al. [Betamethasone versus placebo in Peyronie’s disease] //Arch. Ital. Urol. Androl. — 1998. — Sep. — Vol. 70 (4). — P. 165–168. http://www.ncbi.nlm.nih.gov/pubmed/9823662
-
Levine L.A., Goldman K.E., Greenfield J.M. Experience with intraplaque injection of verapamil for Peyronie’s disease //J. Urol. — 2002. — Aug. — Vol. 168 (2). — P. 621–625; discussion 5–6. http://www.ncbi.nlm.nih.gov/ pubmed/12131321
-
Anderson M.S., Shankey T.V., Lubrano T. et al. Inhibition of Peyronie’s plaque fibroblast proliferation by biologic agents //Int.J. Impot. Res. — 2000. — Sep. — Vol. 12. — Suppl. 3. — P. S25–31. http://www.ncbi.nlm.nih.gov/pubmed/11002396
-
Rehman J., Benet A., Melman A. Use of intralesional verapamil to dissolve Peyronie’s disease plaque: a long-term single-blind study // Urology. — 1998. — Apr. — Vol. 51 (4). — P. 620–626. http://www.ncbi.nlm.nih.gov/pubmed/9586617
-
Bennett N.E., Guhring P., Mulhall J.P. Intralesional verapamil prevents the progression of Peyronie’s disease //Urology. — 2007. — Jun. — Vol. 69 (6). — P. 1181–1184. http://www.ncbi.nlm.nih.gov/pubmed/17572211
-
Cavallini G., Modenini F., Vitali G. Open preliminary randomized prospective clinical trial of effificacyand safety of three diffferent verapamil dilutions for intraplaque therapy of Peyronie’s disease //Urology. — 2007. — May. — Vol. 69 (5). — P. 950–954. http://www.ncbi.nlm.nih.gov/pubmed/17482941
-
Shirazi M., Haghpanah A.R., Badiee M. et al. Efffect of intralesional verapamil for treatment of Peyronie’s disease: a randomized single-blind, placebo-controlled study //Int. Urol. Nephrol. — 2009. — Vol. 41 (3). — P. 467–471. http://www.ncbi.nlm.nih.gov/pubmed/19199072
-
Gelbard M.K., James K., Riach P. et al. Collagenase versus placebo in the treatment of Peyronie’s disease: a double-blind study //J. Urol. — 1993. — Jan. — Vol. 149 (1). — P. 56–58. http://www.ncbi.nlm.nih.gov/pubmed/8417217
-
Kendirci M., Usta M.F., Matern R.V. et al. The impact of intralesional interferon alpha-2b injection therapy on penile hemodynamics in men with Peyronie’s disease //J.Sex. Med. — 2005. — Sep. — Vol. 2 (5). — P. 709–715. http://www.ncbi.nlm.nih.gov/pubmed/16422829
-
Hellstrom W.J., Kendirci M., Matern R. et al. Single-blind, multicenter, placebo controlled, parallel study to assess the safety and effificacy of intralesional interferon alpha-2B for minimally invasive treatment for Peyronie’s disease //J. Urol. — 2006. — Jul. — Vol. 176 (1). — P. 394–398. http://www.ncbi.nlm.nih.gov/pubmed/16753449
-
Fitch W.P. 3rd, Easterling W.J., Talbert R.L. et al. Topical verapamil HCl, topical trifluoperazine, and topical magnesium sulfate for the treatment of Peyronie’s disease—a placebo-controlled pilot study //J.Sex. Med. — 2007. — Mar. — Vol. 4 (2). — P. 477–484. http://www.ncbi.nlm.nih.gov/pubmed/17367443
-
Di Stasi S.M., Giannantoni A., Capelli G. et al. Transdermal electromotive administration of verapamil and dexamethasone for Peyronie’s disease //B.J. U. Int. — 2003. — Jun. — Vol. 91 (9). — P. 825–829. http://www.ncbi.nlm.nih.gov/pubmed/12780842
-
Riedl C.R., Plas E., Engelhardt P. et al. Iontophoresis for treatment of Peyronie’s disease //J. Urol. — 2000. — Jan. — Vol. 163 (1). — P. 95–99. http://www.ncbi.nlm.nih.gov/pubmed/10604323
-
Tuygun C., Ozok U.H., Gucuk A. et al. The efffectiveness of transdermal electromotive administration with verapamil and dexamethasone in the treatment of Peyronie’s disease //Int. Urol. Nephrol. — 2009. — Vol. 41 (1). — P. 113–118. http://www.ncbi.nlm.nih.gov/pubmed/18592390
-
Di Stasi S.M., Giannantoni A., Stephen R.L. et al. A prospective, randomized study using transdermal electromotive administration of verapamil and dexamethasone for Peyronie’s disease //J. Urol. — 2004. — Apr. — Vol. 171 (4). — P. 1605–1608. http://www.ncbi.nlm.nih.gov/pubmed/15017231
-
Greenfield J.M., Shah S.J., Levine L.A. Verapamil versus saline in electromotive drug administration for Peyronie’s disease: a double-blind, placebo controlled trial //J. Urol. — 2007. — Mar. — Vol. 177 (3). — P. 972–5. http://www.ncbi.nlm.nih.gov/pubmed/17296390
-
Strebel R.T., Suter S., Sautter T. et al. Extracorporeal shockwave therapy for Peyronie’s disease does not correct penile deformity //Int.J. Impot. Res. — 2004. — Oct. — Vol. 16 (5). — P. 448–451. http://www.ncbi.nlm.nih.gov/pubmed/14973523
-
Hauck E.W., Hauptmann A., Bschleipfer T. et al. Questionable effificacy of extracorporeal shock wave therapy for Peyronie’s disease: results of a prospective approach //J. Urol. — 2004. — Jan. — Vol. 171 (1). — P. 296–299. http://www.ncbi.nlm.nih.gov/pubmed/14665898
-
Srirangam S.J., Manikandan R., Hussain J. et al. Long-term results of extracorporeal shockwave therapy for Peyronie’s disease //J. Endourol. — 2006. — Nov. — Vol. 20 (11). — P. 880–884. http://www.ncbi.nlm.nih.gov/pubmed/17144855
-
Palmieri A., Imbimbo C., Longo N. et al. A first prospective, randomized, double-blind, placebocontrolled clinical trial evaluating extracorporeal shock wave therapy for the treatment of Peyronie’s disease //Eur. Urol. — 2009. — Aug. — Vol. 56 (2). — P. 363–369. http://www.ncbi.nlm.nih.gov/pubmed/19473751
-
Levine L.A., Newell M., Taylor F.L. Penile traction therapy for treatment of Peyronie’s disease: a singlecenter pilot study //J.Sex. Med. — 2008. — Jun. — Vol. 5 (6). — P. 1468–1473. http://www.ncbi.nlm.nih.gov/pubmed/18373527
-
Gontero P., Di Marco M., Giubilei G. et al. Use of penile extender device in the treatment of penile curvature as a result of Peyronie’s disease. Results of a phase II prospective study //J.Sex. Med. — 2009. — Feb. — Vol. 6 (2). — P. 558–566. http://www.ncbi.nlm.nih.gov/pubmed/19138361
-
Raheem A.A., Garaffa G., Raheem T.A. et al. The role of vacuum pump therapy to mechanically straighten the penis in Peyronie’s disease //B.J. U. Int. — 2010. — Oct. — Vol. 106 (8). — P. 1178–80. http://www.ncbi.nlm.nih.gov/pubmed/20438558
-
Nesbit R. Congenital curvature of the phallus: Report of three cases with description of corrective operation //J. Urol. — 1965. — Feb. — Vol. 93. — P. 230–2.
-
Pryor J.P., Fitzpatrick J.M. A new approach to the correction of the penile deformity in Peyronie’s disease //J Urol. — 1979. — Nov. — Vol. 122 (5). — P.622–623. http://www.ncbi.nlm.nih.gov/pubmed/501814
-
Langston J.P., Carson C.C. 3rd. Peyronie disease: plication or grafting //Urol. Clin. North. Am. — 2011. — Vol. 38. — P. 207–216.
-
Pryor J.P. Correction of penile curvature and Peyronie’s disease: why I prefer the Nesbit technique //Int.J. Impot. Res. — 1998. — Jun. — Vol. 10 (2). — P. 129– 131. http://www.ncbi.nlm.nih.gov/pubmed/9647952
-
Lemberger R.J., Bishop M.C., Bates C.P. Nesbit’s operation for Peyronie’s disease //Br.J. Urol. — 1984. — Dec. — Vol. 56 (6). — P. 721–723. http://www.ncbi.nlm.nih.gov/pubmed/6534497
-
Sassine A.M., Wespes E., Schulman C.C. Modified corporoplasty for penile curvature: 10 years’ experience //Urology. — 1994. — Sep. — Vol. 44 (3). — P.419–321. http://www.ncbi.nlm.nih.gov/pubmed/8073558
-
Licht M.R., Lewis R.W. Modified Nesbit procedure for the treatment of Peyronie’s disease: a comparative outcome analysis //J. Urol. — 1997. — Aug. — Vol. 158 (2). — P. 460–463. http://www.ncbi.nlm.nih.gov/pubmed/9224323
-
Yachia D. Modified corporoplasty for the treatment of penile curvature //J. Urol. — 1990. — Jan. — Vol. 143 (1). — P. 80–82. http://www.ncbi.nlm.nih.gov/pubmed/2294269
-
Essed E., Schroeder F.H. New surgical treatment for Peyronie disease // Urology. — 1985. — Jun. — Vol. 25 (6). — P. 582–587. http://www.ncbi.nlm.nih.gov/pubmed/4012950
-
Ebbehoj J., Metz P. New operation for «krummerik» (penile curvature) //Urology. — 1985. — Jul. — Vol.26(1). — P.76–78. http://www.ncbi.nlm.nih.gov/pubmed/3892851
-
Kadioglu A., Akman T., Sanli O. et al. Surgical treatment of Peyronie’s disease: a critical analysis //Eur. Urol. — 2006. — Aug. — Vol. 50 (2). — P. 235– http:// www.ncbi.nlm.nih.gov/pubmed/16716495
-
Montorsi F., Salonia A., Maga T. et al. Evidence based assessment of longterm results of plaque incision and vein grafting for Peyronie’s disease //J. Urol. — 2000. — Jun. — Vol. 163 (6). — P. 1704–1708. http://www.ncbi.nlm.nih.gov/pubmed/10799165
-
Kadioglu A., Tefekli A., Usta M. et al. Surgical treatment of Peyronie’s disease with incision and venous patch technique //Int.J. Impot. Res. — 1999. — Apr. — Vol. 11 (2). — P. 75–81. http://www.ncbi.nlm.nih.gov/pubmed/10356666
-
El-Sakka A.I., Rashwan H.M., Lue T.F. Venous patch graft for Peyronie’s disease. Part II: outcome analysis //J. Urol. — 1998. — Dec. — Vol. 160 (6 Pt 1). — P.2050–2053. http://www.ncbi.nlm.nih.gov/pubmed/9817321
-
Hatzichristou D.G., Hatzimouratidis K., Apostolidis A. et al. Corporoplasty using tunica albuginea free grafts for penile curvature: surgical technique and longterm results //J. Urol. — 2002. — Mar. — Vol. 167 (3). — P. 1367–1370. http://www.ncbi.nlm.nih.gov/pubmed/11832734
-
Das S. Peyronie’s disease: excision and autografting with tunica vaginalis //J. Urol. — 1980. — Dec. — Vol. 124 (6). — P. 818–819. http://www.ncbi.nlm.nih.gov/pubmed/7441830
-
Gelbard M.K., Hayden B. Expanding contractures of the tunica albuginea due to Peyronie’s disease with temporalis fascia free grafts //J. Urol. — 1991. — Apr. — Vol. 145 (4). — P. 772–776. http://www.ncbi.nlm.nih.gov/pubmed/2005698
-
Cormio L., Zucchi A., Lorusso F. et al. Surgical treatment of Peyronie’s disease by plaque incision and grafting with buccal mucosa //Eur. Urol. — 2009. — Jun. — Vol. 55 (6). — P. 1469–1475. http://www.ncbi.nlm.nih.gov/pubmed/19084325 22 FEBRUARY 2012
-
Taylor F.L., Levine L.A. Surgical correction of Peyronie’s disease via tunica albuginea plication or partial plaque excision with pericardial graft: long-term follow up //J.Sex. Med. — 2008. — Sep. — Vol. 5 (9). — P. 2221–2228. http://www.ncbi.nlm.nih.gov/pubmed/18637996
-
Burnett A.L. Fascia lata in penile reconstructive surgery: a reappraisal of the fascia lata graft //Plast. Reconstr. Surg. — 1997. — Apr. — Vol. 99 (4). — P.1061– 1067. http://www.ncbi.nlm.nih.gov/pubmed/9091903
-
Fallon B. Cadaveric dura mater graft for correction of penile curvature in Peyronie disease //Urology. — 1990. — Feb. — Vol. 35 (2). — P. 127–129. http:// www.ncbi.nlm.nih.gov/pubmed/2305535
-
Leungwattanakij S., Bivalacqua T.J., Yang D.Y. et al. Comparison of cadaveric pericardial, dermal, vein, and synthetic grafts for tunica albuginea substitution using a rat model //B.J. U. Int. — 2003. — Jul. — Vol. 92 (1). — P. 119–124. http:// www.ncbi.nlm.nih.gov/pubmed/12823395
-
Knoll L.D. Use of porcine small intestinal submucosal graft in the surgical management of Peyronie’s disease //Urology. — 2001. — Apr. — Vol. 57 (4). — P.753–757. http://www.ncbi.nlm.nih.gov/pubmed/11306396
-
Bokarica P., Parazajder J., Mazuran B. et al. Surgical treatment of Peyronie’s disease basedonpenilelengthanddegreeofcurvature//Int.J.Impot.Res. —2005. —Mar.— Apr. — 17 (2). — Vol. 170–174. http://www.ncbi.nlm.nih.gov/pubmed/15215882
-
Faerber G.J., Konnak J.W. Results of combined Nesbit penile plication with plaque incision and placement of Dacron patch in patients with severe Peyronie’s disease //J. Urol. — 1993. — May. — Vol. 149 (5 Pt 2). — P. 1319–1320. http://www.ncbi.nlm.nih.gov/pubmed/8479026
-
Egydio P.H., Lucon A.M., Arap S. A single relaxing incision to correct diffferent types of penile curvature: surgical technique based on geometrical principles //B.J. U. Int. — 2004. — Nov. — Vol. 94 (7). — P. 1147–1157. http://www.ncbi.nlm.nih.gov/pubmed/15541152
-
Chun J.L., McGregor A., Krishnan R. et al. A comparison of dermal and cadaveric pericardial grafts in the modified Horton-Devine procedure for Peyronie’s disease //J. Urol. — 2001. — Jul. — Vol. 166 (1). — P. 185–1888. http://www.ncbi.nlm.nih.gov/pubmed/11435853
-
Chung E., Clendinning E., Lessard L. et al. Five-year follow-up of Peyronie’s graft surgery: outcomes and patient satisfaction //J.Sex. Med. — 2011. — Feb. — Vol. 8 (2). — P. 594–600. http://www.ncbi.nlm.nih.gov/pubmed/21054805
-
Mulhall J., Anderson M., Parker M. A surgical algorithm for men with combined Peyronie’s disease and erectile dysfunction: functional and satisfaction outcomes //J.Sex. Med. — 2005. — Jan. — Vol. 2 (1). — P. 132–138. http://www.ncbi.nlm.nih.gov/pubmed/16422916
-
Taylor F.L., Levine L.A. Peyronie’s Disease //Urol. Clin. North. Am. — 2007. — Nov. — Vol. 34 (4). — P. 517–534. http://www.ncbi.nlm.nih.gov/pubmed/17983892
-
Montorsi F., Guazzoni G., Barbieri L. et al. AMS 700 CX inflatable penile implants for Peyronie’s disease: functional results, morbidity and patient-partner satisfaction //Int.J. Impot. Res. — 1996. — Jun. — Vol. 8 (2). — P. 81–85; discussion 5–6. http://www.ncbi.nlm.nih.gov/pubmed/8858396
-
Wilson S.K. Surgical techniques: modeling technique for penile curvature // J.Sex. Med. — 2007. — Jan. — Vol. 4 (1). — P. 231–234. http://www.ncbi.nlm.nih.gov/pubmed/17233788
-
Wilson S.K., Delk J.R. 2nd. A new treatment for Peyronie’s disease: modeling the penis over an inflatable penile prosthesis //J. Urol. — 1994. — Oct. — Vol. 152 (4). — P. 1121–1123. http://www.ncbi.nlm.nih.gov/pubmed/8072079
-
Carson C.C. Penile prosthesis implantation in the treatment of Peyronie’s disease //Int.J. Impot. Res. — 1998. — Jun. — 10 (2). — Vol. 125–128. http://www.ncbi.nlm.nih.gov/pubmed/9647951
-
Montague D.K., Angermeier K.W., Lakin M.M. et al. AMS 3-piece inflatable penile prosthesis implantation in men with Peyronie’s disease: comparison of CX and Ultrex cylinders //J. Urol. — 1996. — Nov. — Vol. 156 (5). — P. 1633–1635. http://www.ncbi.nlm.nih.gov/pubmed/8863557
-
Chaudhary M., Sheikh N., Asterling S. et al. Peyronie’s disease with erectile dysfunction: penile modelling over inflatable penile prostheses //Urology. — 2005. — Apr — Vol. 65 (4). — P. 760–764. http://www.ncbi.nlm.nih.gov/pubmed/15833523
-
http://uroweb.org/fileadmin/guidelines/Guidelines_2014_5_June_2014.pdf
Глава 8. РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Д.Ю. Пушкарь, А.Д. Каприн, Б.Я. Алексеев, Е.А. Безруков, А.В. Говоров, К.Б. Колонтарев, Г.Е. Крупинов, Н.В. Воробьев, А.А. Крашенинников
Эпидемиология
Рак предстательной железы (РПЖ) является одним из наиболее распространённых злокачественных заболеваний у мужчин. Ежегодно в мире регистрируют более 550 тыс. новых случаев РПЖ. Именно с этим связан тот факт, что диагностике и лечению данной патологии в последнее время уделяется все больше внимания как за рубежом, так и в Российской Федерации.
Наиболее высокие показатели заболеваемости РПЖ отмечены в США, Канаде и в ряде стран Европы, где он выходит на 1-е место в структуре онкологических заболеваний. Рак предстательной железы (РПЖ) занимает второе место в структуре заболеваемости злокачественными новообразованиями мужского населения России и составляет 14,3% [140]. У мужчин в возрасте старше 60 лет этот показатель увеличивается до 18,5%. В 2014 г. в России выявлено 37168 новых случаев РПЖ, при этом средний возраст мужчин с впервые выявленным РПЖ составил 64,4 лет (в 2003 году данный показатель был несколько выше – 70,4 лет). Стандартизованный показатель заболеваемости РПЖ в 2014 году в России составил 39,38на 100 тысяч мужского населения. При среднегодовом темпе прироста 7,11%, прирост заболеваемости РПЖ с 2004 по 2014 годы составил 116,68%. В 2014 году по сравнению с 2004 у мужчин на фоне значительного снижения стандартизованного показателя смертности (-12,3%) от всех злокачественных новообразований идет нарастание показателя смертности от злокачественных опухолей предстательной железы (26,2%). Так у мужчин 60-69 лет, РПЖ является причиной смерти в 6,2% случаев, а в возрастной группе >70 лет достигает 14,16%, занимая второе место после опухолей трахеи, бронхов и легкого [140].
Распространённость РПЖ зависит от этнических и географических особенностей. Как мы уже писали, наиболее высокая заболеваемость у афроамериканцев, проживающих в США (на 60% выше, чем у белых американцев), наименее высокая — у китайцев, проживающих в Китае [107].
Помимо расовых особенностей факторами риска развития РПЖ считают генетическую предрасположенность, возраст мужчины и особенности питанияА. Вероятность развития опухоли предстательной железы у мужчины, у которого один из ближайших родственников первой степени родства (отец или брат) болел РПЖ, вдвое выше, чем в популяции; если болели двое родственников или более, риск заболевания РПЖ возрастает в 5–11 раз [41, 108]. Показатель заболеваемости белых американцев в возрасте до 65 лет составляет 44 на 100 тыс., а в возрасте 65–74 лет — 900 на 100 тыс. [107]. Риск развития РПЖ повышается у мужчин, употребляющих большое количество жиров животного происхождения [29].
Скрининг
Популяционным или массовым скринингом считают обследование мужчин (входящих в группу риска) без симптомов заболевания. Обычно оно проводится в рамках клинического исследования и инициируется исследователем. В отличие от этого, ранняя диагностика проводится в отдельных клинических случаях и инициируется лицом (пациентом), проходящим обследование, и/или его лечащим врачом. Оба типа обследований преследуют 2 цели:
-
снижение смертности от РПЖ (цель обследования заключается не в выявлении как можно большего количества новообразований, а в увеличении продолжительности выживаемости, что в значительной мере зависит от своевременной диагностики);
-
повышение качества жизни (при оценке увеличения продолжительности жизни используется индекс QUALYs «поправка на качество жизни»).
В 2009 г. опубликованы результаты европейского мультицентрового рандомизированного исследования скрининга рака простаты (ERSPC), включавшего более 180 тыс. мужчин, согласно которым проведение скрининга РПЖ с помощью ПСА через 9 лет наблюдения снизило смертность от данного заболевания на 20%. В последующие годы было отмечено, что при увеличении срока наблюдения за пациентами снижение смертности стало ещё более значительным. Так, через 14 лет смертность от РПЖ в одном из центров, участвовавших в исследовании, снизилась на 44%. При медиане наблюдения 12 лет частота метастатического рака простаты в группе скрининга оказалась меньше на 31%.
В 2009 г. вышли в свет результаты американского исследования по скринингу рака простаты, лёгких, кишечника и яичников (PLCO), где статистически доказано, что скрининг РПЖ с помощью ПСА не привёл к уменьшению смертности от РПЖ. Нужно отметить, что в отличие от европейского протокола, американское исследование было менее массовым и продолжительным. Предварительное тестирование на ПСА 44% мужчин до рандомизации уже уменьшило число выявленных случаев РПЖ, т.е. фактически данный протокол сравнивал более интенсивный скрининг РПЖ с менее интенсивным, что неоднократно отмечено в научной литературе.
Классификация
Классификация по системе TNM
Т — первичная опухоль
-
Т1 — клинически неопределяемая опухоль (не пальпируется и не визуализируется):
-
Т1а — опухоль случайно выявлена при операции (объем опухолевой ткани не более 5% резецированной ткани предстательной железы);
-
T1b — опухоль случайно выявлена при операции (объем опухолевой ткани более 5% резецированной ткани предстательной железы);
-
Т1с — опухоль выявлена при игольчатой биопсии (выполненной в связи с повышением уровня ПСА).
-
-
Т2 — опухоль локализуется в предстательной железе[1]:
-
Т3 — опухоль выходит за пределы капсулы предстательной железы[2]:
-
Т4 — опухоль прорастает в окружающие органы и ткани, кроме семенных пузырьков (шейку мочевого пузыря, наружный сфинктер, прямую кишку, мышцу, поднимающую задний проход, и/или переднюю брюшную стенку).
N — регионарные лимфатические узлы[3]
М — отдаленные метастазы[4]
рТ — патоморфологическая оценка первичной опухоли
Группировка РПЖ по стадиям представлена в табл. 8.1
| Стадия | Т | N | М |
|---|---|---|---|
I |
Т1а |
N0 |
М0 |
|
Т1а |
N0 |
М0 |
|
T1b |
N0 |
М0 |
II |
T1c |
N0 |
М0 |
|
Т2 |
N0 |
М0 |
III |
Т3 |
N0 |
М0 |
IV |
Т4 |
N0 |
М0 |
|
Любая Т |
N1 |
М0 |
|
Любая Т |
Любая N |
Ml |
Морфологическая классификация РПЖ
Морфологическая классификация по шкале Глисона
Для оценки степени дифференцировки РПЖ наибольшее распространение получила классификация, предложенная канадским патоморфологом Глисоном (Gleason). По классификации Глисона степень дифференцировки опухоли оценивают по 5-балльной шкале: 1 балл — наиболее высокодифференцированная опухоль, 5 баллов — низкодифференцированная опухоль. Поскольку РПЖ, как правило, представляет собой опухоль с неоднородной морфологической структурой, принято выделять наиболее распространенную гистологическую градацию (первичный балл) и следующую по частоте встречаемости градацию дифференцировки (вторичный балл). При сложении первичной и вторичной оценки получают сумму Глисона (от 2 до 10 баллов). Классификация Глисона имеет особое прогностическое значение для предсказания патоморфологической стадии процесса и оценки результатов лечения РПЖ.
В 2014 г. на съезде общества уропатологов (International Society of Urological Pathology (ISUP)) описана классификация прогностических групп в зависимости от дифференцировки опухоли предстательной железы по данным биопсии, см. таблицу 8.2. Авторы делают вывод, что опухоли с дифференцировкой 7 (3+4) или 7 (4+3) баллов по Глисону имеют различное прогностическое значение. Ряд авторов рекомендует использовать предложенную классификацию, однако для избежания путаницы, рекомендовано дополнительно указывать привычную классификацию по Глисону.
| Дифференцировка по Глисону | Группа ISUP |
|---|---|
6 (3+3) |
1 |
7 (3+4) |
2 |
7 (4+3) |
3 |
8 (4+4) или (3+5) или (5+3) |
4 |
9-10 |
5 |
Группы International Society of Urological Pathology (ISUP).
Диагностика
АНАМНЕЗ
Как правило, на ранних стадиях РПЖ симптоматика отсутствует, так как чаще всего поражаются периферические отделы простаты. При новообразованиях появляются симптомы, которые можно разделить на три группы:
-
симптомы инфравезикальной обструкции: ослабление и прерывистость струи мочи, ощущение неполного опорожнения мочевого пузыря, учащение мочеиспускания, императивные позывы к мочеиспусканию, стрессовое недержание мочи;
-
симптомы, связанные с местным прогрессированием опухоли: гемоспермия, гематурия, недержание мочи, эректильная дисфункция, боль в надлобковой области и промежности;
-
симптомы, связанные с отдаленными метастазами: боль в костях, пояснице (при обструкции мочеточников), отек нижних конечностей (лимфостаз), параплегия (компрессия спинного мозга), потеря массы тела, анемия, уремия, кахексия.
Основные методы диагностики — пальцевое ректальное исследование, определение концентрации ПСА в сыворотке крови и трансректальное УЗИА [37].
Пальцевое ректальное исследование
Позволяет выявить РПЖ в периферических отделах при объеме узлов не менее 0,2 мл. Проведение этого обследования для скрининга у бессимптомных мужчин приводит к выявлению РПЖ только в 0,1–4% случаев [19, 80].
Определение простатоспецифического антигена
ПСА — калликреинподобная сериновая протеаза, секретируемая эпителиальными клетками предстательной железы. Это не опухолеспецифический, а органоспецифический маркер, поэтому сывороточный уровень ПСА может повышаться не только при РПЖ, но и при доброкачественной гиперплазии предстательной железы и хроническом простатите.
Острая задержка мочеиспускания, биопсия предстательной железы, оперативные вмешательства (трансуретральная резекция, аденомэктомия) также приводят к повышению уровня ПСА в течение нескольких недель, что необходимо учитывать при интерпретации данных. Пальцевое ректальное обследование влечет клинически значимое повышение уровня этого маркера [23].
Средним нормальным уровнем ПСА считают 2,5 нг/мл. Кроме того, следует учитывать возрастные нормы уровня маркера: в возрасте 40– 49 лет — 0–2,5 нг/мл, 50–59 лет — 0–3,5 нг/мл, 60–69 лет — 0–4,5 нг мл, 70–79 лет — 0–6,5 нг/млВ [71]. Терапия финастеридом доброкачественной гиперплазии предстательной железы приводит к снижению концентрации ПСА, при этом нормальным следует считать уровень 2 нг/ млА [31].
При повышении уровня ПСА выше нормы показана биопсия предстательной железы.
При показателе ПСА 2,5–10,0 нг/мл у большинства пациентов (75%) диагностируют доброкачественные заболевания предстательной железы, при уровне ПСА выше 10 нг/мл наиболее вероятен РПЖА [15]. В то же время у 13,2% мужчин в возрасте 50–66 лет с сывороточной концентрацией ПСА 3–4 нг/мл при биопсии диагностируют клинически значимый РПЖС [64].
В 2006 г. на основании результатов крупного исследования, включавшего 9459 мужчин, продемонстрировано, что дискриминационный уровень ПСА 4 нг/мл не является адекватным, и введены его возрастные нормы (табл. 8.3, 8.4) А [111]. Также показано, что снижение дискриминационного уровня ПСА приводит к ненужным биопсиям и увеличению диагностики клинически незначимого рака. Таким образом, общепризнанным дискриминационным уровнем ПСА у мужчин старше 60 лет принят уровень 2,5 нг/мл. При повышении уровня ПСА более 2,5 нг/мл рекомендуется проведение детального обследования (ПРИ, ТРУ-ЗИ с биопсией предстательной железы).
| Уровень ПСА, нг/мл | Вероятность выявления РПЖ при биопсии, % |
|---|---|
До 0,5 |
6,6 |
0,6–1,0 |
10,1 |
1,1–2,0 |
17,0 |
2,1–3,0 |
23,9 |
3,1–4,0 |
26,9 |
| Возрастная группа, лет | Среднее значение ПСА, нг/мл |
|---|---|
40–49 |
0,7 |
50–59 |
0,9 |
60–70 |
1,4 |
Для повышения специфичности маркерной диагностики при выявлении раннего РПЖ применяют следующие модификации определения ПСА:
-
плотность — отношение уровня ПСА к объему предстательной железы (в см3), вычисленному по данным трансректального УЗИ. Для РПЖ более характерна плотность >0,15В [6];
-
плотность переходных зон — отношение уровня ПСА к объему переходных зон предстательной железы (в см3), вычисленному по данным трансректального УЗИ. Для РПЖ характерна плотность переходных зон >0,35В [132];
-
молекулярные формы (фракции) — отношение уровня свободного ПСА к уровню общего ПСА. Для РПЖ более характерно отношение <0,1А [14, 17];
-
скорость прироста ПСА — увеличение уровня ПСА в течение определенного времени. При увеличении концентрации ПСА более чем на 0,35 нг/мл в год возрастает вероятность РПЖC [13].
Модификации, повышающие специфичность ПСА-диагностики раннего РПЖ, применяют не только для первичной диагностики, но и для определения показаний к повторной биопсии предстательной железы у мужчин с отсутствием данных о РПЖ при первичной биопсии [14]. Помимо основного теста для ранней диагностики РПЖ, определение уровня ПСА используют также для стадирования опухолевого процесса и мониторинга больных после проведенного местного лечения или в процессе системного леченияА [56, 75, 106].
Применение индекса здоровья простаты (показателя PHI — от англ. Prostate health index), основанного на определении фракции свободного ПСА (-2проПСА), позволяет повысить диагностическую и прогностическую ценность исследования, в особенности при значении общего ПСА от 2,5 до 10 нг/мл.
Анализ ПСА3 [139]
ПСА3 является одним из наиболее изученных новых биомаркеров, определяемых в моче, полученной после 3-кратного массажа ПЖ во время ПРИ. В настоящее время доступны дорогостоящие коммерческие тест-системы Progensa для определения в моче ПСА3. Показатель ПСА3 превосходит общий ПСА и процент свободного ПСА при выявлении РПЖ у мужчин с повышенным уровнем ПСА.
Уровень ПСА3 отражает небольшие, но значимые увеличения частоты положительного результата биопсии. Показатель ПСА3 может применяться вместе с ПСА и другими клиническими факторами риска в номограммах или других системах стратификации риска для принятия решения о проведении первичной или повторной биопсии. Уровень ПСА3 нарастает с увеличением объема РПЖ. Существуют противоречивые данные о том, что ПСА3 является независимым предиктором суммы Глисона.
Применение ПСА3 в качестве средства мониторирования при активном наблюдении не подтверждено. В настоящее время основным показанием для определения ПСА3 в моче является решение вопроса о повторной биопсии после отрицательного результата первоначально проведенного исследования. Экономическая эффективность данной методики требует дополнительной оценки.
Индекс здоровья простаты
Определение индекса PHI успешно используют в клинической практике для оптимизации клинической чувствительности и специфичности при определении вероятности наличия РПЖ в диапазоне общего ПСА (оПСА) от 2 до 10 нг/мл и отрицательном («нормальном») результате ПРИ.
Индекс PHI — расчетный показатель, формула которого объединяет значения трех сывороточных тестов: оПСА, свПСА и -2проПСА.
-2проПСА является изоформой свободного ПСА и концентрируется в ткани периферической зоны предстательной железы.
В ходе мультицентрового проспективного исследования было показано, что использование PHI позволяет избежать до 20% так называемых «необязательных» биопсий. Показана корреляция величины PHI со степенью злокачественности (агрессивности) РПЖ по шкале Глисона.
Включение в формулу индекса PHI значений трех маркеров обусловливает необходимость точного следования требованиям преаналитического этапа исследования для каждого из них. Образцы крови пациентов необходимо центрифугировать, сыворотку отделить от сгустка и исследовать или заморозить не позднее, чем через 3 ч после отбора крови у пациента. В противном случае в сыворотке крови порисходят возрастание концентрации -2проПСА и понижение концентрации свПСА, что приведет к получению ложно завышенного значения индекса PHI.
В ходе многоцентрового проспективно-ретроспективного исследования были определены клиническая чувствительность и специфичность PHI с разными пороговыми значениями (табл. 8.5).
Клиническая чувствительность, % |
Калибровка Hybritech |
Калибровка ВОЗ |
||
Пороговое значение для показателя PHI |
Клиническая специфичность, % |
Пороговое значение для показателя PHI |
Клиническая специфичность, % |
|
99 |
17,78 |
8,7 |
19,96 |
8,4 |
98 |
18,44 |
10,5 |
20,57 |
9,8 |
95 |
21,13 |
18,2 |
23,45 |
16,1 |
90 |
23,82 |
30,4 |
26,93 |
28,3 |
85 |
26,34 |
38,8 |
29,98 |
40,2 |
80 |
27,58 |
45,1 |
31,57 |
45,1 |
75 |
29,25 |
49,3 |
33,34 |
50,7 |
70 |
30,44 |
54,2 |
35,01 |
55,6 |
65 |
31,69 |
58,0 |
36,90 |
59,8 |
60 |
33,98 |
66,1 |
38,79 |
66,1 |
55 |
36,22 |
72,7 |
40,63 |
71,3 |
50 |
37,63 |
75,2 |
42,76 |
76,6 |
45 |
39,34 |
80,1 |
45,03 |
80,8 |
40 |
42,14 |
84,6 |
46,97 |
82,5 |
35 |
45,11 |
88,1 |
50,94 |
88,1 |
Также показана корреляция индекса PHI с вероятностью наличия РПЖ: чем выше значение PHI, тем выше риск наличия РПЖ (табл. 8.6).
| Калибровка Hybritech | Калибровка ВОЗ | ||||
|---|---|---|---|---|---|
Диапазон значений PHI |
Вероятность рака |
95% доверительный интервал |
Диапазон значений PHI |
Вероятность рака |
95% доверительный интервал |
0–21 |
8,4% |
1,9–16,1% |
0–23 |
8,7% |
2,0–17,0% |
21–40 |
21,0% |
17,3–24,6% |
23–45 |
20,6% |
17,1–24,1% |
40+ |
44,0% |
36,0–52,9% |
45+ |
43,8% |
35,8–52,2% |
Индекс PHI в сочетании с другими показателями целесообразно использовать также в номограммах и калькуляторах риска наличия РПЖ.
Определение порогового значения того или иного маркера онкологического заболевания является важнейшей задачей для его внедрения в широкую клиническую практику. На основе анализа многоцентровых исследований для индекса здоровья простаты PHI были выведены пороговые значения, которые указаны в инструкции к реагенту на определение -2проПСА. Так, чувствительности метода, равной 90%, на которую наиболее часто ориентируются при использовании того или иного лабораторного метода, соответствует пороговое значение PHI — 23,82 (калибровка Hybritech). Окончательное решение об оптимальном пороговом значении для российской популяции можно будет принять, основываясь на результатах продолжающегося в настоящее время Российского исследования по диагностической значимости [-2] проПСА и индекса PHI. Предварительные результаты исследования были доложены на прошедшем в Саратове конгрессе Российского общества урологов в 2014 году. Целью исследования являлось определение выявляемости РПЖ на основании собственных результатов с использованием индекса здоровья простаты PHI (Beckman Coulter) и трансректальной биопсии простаты. Для этого в клинике урологии МГСМУ им. А.И. Евдокимова с сентября 2013 г. по июнь 2014 г. включительно проводился набор биоматериала у 147 пациентов. Определения общего ПСА, свободного ПСА и -2проПСА в сыворотке крови проводились на иммунохимическом анализаторе Beckman Coulter UniCel DxI методами Hybritech PSA, Hybritech free PSA и Hybritech proPSA в Научном Центре «ЭфиС». Индекс PHI рассчитывался автоматически программным обеспечением анализатора. Критерии включения пациентов в исследование были: возраст 45–75 лет, уровень общего ПСА крови 2,5–10 нг/мл, отсутствие изменений простаты по данным пальцевого ректального исследования, отсутствие биопсии простаты в анамнезе. Из всего собранног оматериала 128 образцов сыворотки были исследованы. Всем пациентам впоследствии была выполнена трансректальная биопсия простаты по стандартной методике из 12 точек, материал исследовался патоморфологами клиники, гистологическое заключение предоставлялось по современной схеме. На основании результатов патогистологических заключений, все пациенты были разделены на 3 группы: группа с верифицированным РПЖ, группа с ДГПЖ, группа с хроническим простатитом (ХП). Средний возраст пациентов составил 58,2 (50–77) года. Средний уровень общего ПСА крови всех групп составил 6,16 (3,63–9,98) нг/мл, в группе РПЖ средний уровень общего ПСА — 6,52 (4,13–9,3) нг/мл, в группе ДГПЖ — 5,71 (3,63–9,98) нг/мл, в группе ХП — 6,22 (3,7–9,8) нг/мл. По данным патогистологического исследования, сумма баллов по Глисону 6 (3+3), 7 (3+4), 7(4+3), 8 (4+4) имела место у 26, 14, 4 и 3 пациентов соответственно. Среднее значение индекса PHI в группе пациентов с РПЖ составило 42,69 (17,82–115,33), в группе пациентов с ДГПЖ — 30,84 (12,17– 86,14), а в группе с ХП — 30,33 (10,38–50,83). При анализе результатов различных групп пациентов была получена статистически достоверная разница уровня индекса PHI между группами РПЖ и ДГПЖ (р<0,01), РПЖ и ХП (р<0,003). Статистически достоверной разницы индекса РHI между группой ДГПЖ и ХП не получено (р=0,18). Прослеживается выраженный тренд возрастания индекса PHI по мере увеличения суммы баллов по Глисону гистологического материала по системе градации Глисона: медиана Индекса PHI для группы с cуммой баллов по Глисону 6 составила 34,3; по Глисону 7–43,3 и по Глисону 8–49,3.
При этом для общего ПСА и %свПСА статистически достоверной зависимости данных показателей от увеличения суммы баллов по Глисону отмечено не было. Медианы для групп с суммой баллов по Глисону 6, 7 и 8 составили: для оПСА 6,8; 6,5; 7,5 нг/мл и для %свПСА: 10,8%; 9,9%; 11,0% соответственно. На основании полученных данных можно сделать вывод о целесообразности проведения дальнейших исследований, направленных на уточнение диагностической ценности PHI. Планируется набор статистически значимого количества материала, анализ, формулировка показаний и рекомендаций по применению и использованию индекса PHI в РФ.
Трансректальное ультразвуковое исследование
Эхографическая картина РПЖ неоднородна. Классическая ультразвуковая семиотика РПЖ описывает гипоэхогенные очаговые зоны в периферических отделах предстательной железы [61]. С увеличением размеров опухолевых очагов они могут содержать как гипо-, так и гиперэхогенные участки. 37,6% опухолей предстательной железы, диагностированных при биопсии, представлены изоэхогенными участками при трансректальном УЗИС [33].
Трансректальное УЗИ проводят для решения двух важных задач:
В настоящее время изучается целесообразность применения новейших методов ультразвуковой диагностики (соноэластография, УЗИ с контрастным усилением, а также компьютеризированное ультразвуковое исследование – гистосканинг). Рутинное применение данных методов сегодня не оправдано в связи с недостаточностью доказательной базы [78].
Результаты хотя бы одного из трех методов базисной диагностики, указывающие на вероятность РПЖ, — показание к выполнению трансректальной мультифокальной биопсии предстательной железыВ [66].
Мультипараметрическое МРТ (мМРТ)
Проведенные исследования указали на наличие хорошей чувствительности данного метода для диагностики рака простаты с наличием суммы балов по шкале Глисона 7 и более [140]. Имеются данные о способности мМРТ диагностировать опухоли передних отделов простаты недоступных при выполнении стандартной биопсии [144, 145].
Биопсия предстательной железы
Стандартная методика выполнения биопсии предстательной железы — трансректальная мультифокальная биопсия под контролем трансректального УЗИВ [49].
Для выполнения трансректального УЗИ чаще всего применяют ректальный датчик с частотой 5,0–8,5 МГц. Стандартная биопсийная игла имеет диметр 18 G и позволяет забирать столбик ткани длиной 15–20 мм. Стандартная техника биопсии подразумевает забор материала билатерально от апекса к основанию железы. Выполнение секстантной биопсии не является более приемлемой. При объеме предстательной железы 30-40 мл возможно выполнение забора материала из 8 и более участков. Во всех остальных случаях необходимо выполнять 12-точечную биопсию.
Трансуретральная резекция простаты (ТУРП) не должна применяться в качестве диагностики рака предстательной железы.
Подготовка больного к биопсии:
Выполнение повторной биопсии показано при отрицательных результатах первичной биопсии и сохраняющихся показаниях к проведению исследованияА. Повторная биопсия выявляет РПЖ у 20% мужчин при отсутствии опухоли в первичном гистологическом исследованииВ [57].
Показания к повторной биопсии:
-
изменения при пальцевом ректальном исследовании (риск наличия рака 5-30%);
-
наличие атипичной ацинарной пролиферации (т.е. атипичные железы подозрительные в отношении рака простаты – риск наличия рака 40%);
-
простатическая интерстициальная неоплазия высокой степени (при наличии множественной (три и более фрагмента) тяжелой неоплазии в биоптатах вероятность выявления инвазивного РПЖ при повторной биопсии 50–100%)А [43, 133].
Наличие простатической интерстициальной неоплазии высокой степени в одном или двух биоптатах не является более показанием к повторной биопсии.
Сатурационная биопсия [139]
Частота РПЖ, выявленного при повторной сатурационной биопсии (>20 столбиков), варьирует от 30 до 43% и зависит от количества столбиков ткани (УД: 2а). В особых случаях сатурационную биопсию можно выполнять трансперинеально. Это позволяет диагностировать РПЖ дополнительно в 38% случаев. Следует отметить, что у 10% больных после этого исследования развивается острая задержка мочеиспускания (УД: 2b).
Биопсия семенных пузырьков
Показания к выполнению биопсии семенных пузырьков определены в настоящее время не четко. Решение о выполнении следует принимать индивидуально, принимая во внимание, что вероятность инвазии опухоли в семенные пузырьки при значении ПСА более 15 нг/мл составляет 20-25%. Биопсия семенных пузырьков является полезной лишь при наличии влияния на выбор тактики лечения (выбор между лучевой терапией и радикальным оперативным лечением).
ОПРЕДЕЛЕНИЕ РАСПРОСТРАНЕННОСТИ ОПУХОЛЕВОГО ПРОЦЕССА (СТАДИРОВАНИЕ)
Для оценки распространенности первичной опухоли (локализованный или экстракапсулярный процесс) применяют пальцевое ректальное исследование (положительная корреляция со стадией процесса менее, чем в 50% случаев), методы лучевой диагностики и прогностические факторы.
Методы лучевой диагностики экстракапсулярной инвазии опухоли предстательной железы
Трансректальное УЗИ. Точность дифференциальной диагностики стадии Т2 и Т3, по данным только трансректального УЗИ, довольно низкая. До 60% экстракапсулярных опухолей не диагностируют до операции [34], в связи с чем трансректальное УЗИ не может быть рекомендовано как для диагностики рака простаты, так и для определения распространенности первичной опухолиС [95].
МРТ. Более чувствительный метод диагностики экстрапростатической инвазии опухоли. А применение динамической магнитно-резонансной простатовезикулографии с контрастным усилением и эндоректальной магнитной катушкой повышает точность стадирования еще на 16% [98].
КТ предстательной железы менее информативна, чем МРТ, для дифференциальной диагностики локализованного и экстрапростатического процесса, но КТ чаще назначают для планирования дистанционной лучевой терапии [86].
При подозрении на инвазию семенных пузырьков выполняют их биопсию под контролем трансректального УЗИ.
Основные прогностические факторы, определяющие стадию опухолевого процесса
На основе комбинации данных прогностических факторов разработаны таблицы и номограммы, с высокой точностью предсказывающие вероятность патоморфологической стадии опухолиА. Наибольшую популярность получили таблицы Партина (Partin) и номограммы Каттана (Kattan) [75, 77].
Кроме основных, используют дополнительные факторы прогноза:
Для определения состояния внутритазовых лимфатических узлов вы полняют КТ или МРТ малого таза, но чувствительность этих методов низкая и составляет 0–70%С [50]. Точность лучевых методов диагностики повышает пункционная биопсия лимфатических узлов под контролем КТ или УЗИА [127].
Наиболее точный метод выявления метастазов в регионарные лимфатические узлы (золотой стандарт) — двусторонняя тазовая лимфаденэктомия, которую можно выполнять из надлобкового (открытого) и лапароскопического доступовА [63]. Лимфаденэктомию проводят в тех случаях, когда планируется местное лечение РПЖ.
У больных с уровнем ПСА <10 нг/мл, клинической стадией T1a–T2a и суммой баллов по шкале Глисона <7 вероятность метастатического поражения тазовых лимфатических узлов не превышает 3%, поэтому в этих случаях тазовую лимфаденэктомию можно не выполнятьА [32].
МЕТОДЫ ДИАГНОСТИКИ ОТДАЛЕННЫХ МЕТАСТАЗОВ
Косвенный признак метастатического поражения скелета — повышение активности щелочной фосфатазы в сыворотке крови, которое выявляют у 70% больных с генерализацией процессаС [126]. Сцинтиграфию костей можно не выполнять у больных с суммой по шкале Глисона <10, отсутствием клинической симптоматики поражения скелета и высокоили умеренно дифференцированными опухолямиА [70, 72].
ВЫВОДЫ И РЕКОМЕНДАЦИИ [139]
Несмотря на высокую специфичность в определении экстракапсулярного прорастания и инвазии в семенные пузырьки, применение ТРУЗИ ограничено его низкой чувствительностью и тенденцией к занижению стадии РПЖ. Даже с появлением цветного допплера и контрастного усиления точность ТРУЗИ в определении стадии РПЖ остается недостаточной, и в значительной степени зависит от врача, выполняющего исследование. По сравнению с ПРИ, ТРУЗИ и КТ, МРТ демонстрирует более высокую точность диагностики РПЖ в 1 или 2 долях (T2), экстрапростатического прорастания и инвазии в семенные пузырьки (T3), в окружающие ткани (T4).
В настоящее время только удаление сторожевых ЛУ или расширенная тазовая лимфаденэктомия позволяют с высокой чувствительностью обнаружить метастазы в ЛУ при патоморфологическом исследовании.
| Рекомендации [139] | СР |
|---|---|
Диагностика РПЖ |
|
Биопсия и другие методы стадирования проводятся только тогда, когда они могут повлиять на тактику лечения пациентов |
С |
Трансуретральная резекция простаты не должна применяться для диагностики рака простаты |
А |
При подозрении на наличие рака простаты при отрицательных результатах биопсии рекомендовано выполнение биопсии под контролем МРТ |
В |
В большинстве случаев при подозрении на РПЖ рекомендуется проведение биопсии под контролем ТРУЗИ |
В |
При первичной биопсии не рекомендуется забор ткани из переходной зоны из-за низкой частоты обнаружения опухоли |
С |
При первичной биопсии показан забор материала из 10-12 точек под контролем УЗИ |
В |
Проведение повторной биопсии оправдано в случаях с сохраняющимися показаниями (выявление патологии при ПРИ, повышенный уровень ПСА, подозрение на злокачественную опухоль при первичной биопсии в результате патоморфологического исследования) |
В |
Общих рекомендаций для проведения последующих (3 и более) биопсий нет; решение необходимо принимать индивидуально в каждом конкретном случае |
С |
Для эффективного обезболивания при биопсии ПЖ пациентам может быть предложено трансректальное перипростатическое введение местного анестетика |
А |
Определение стадии РПЖ |
|
Определение стадии (Т) локализованного РПЖ может быть основано на результатах МРТ. Дополнительную информацию получают по количеству и локализации положительных биоптатов, степени злокачественности опухоли и уровню ПСА в сыворотке крови |
С |
Не рекомендуется использовать ТРУЗИ для определения стадии локализованного РПЖ, поскольку у данного метода низкая чувствительность и тенденция к занижению стадии РПЖ |
|
Состояние ЛУ (стадия N) необходимо оценивать при планировании радикального лечения. У пациентов со стадией T2 или меньше, уровнем ПСА <20 нг/мл и суммой Глисона <6 вероятность наличия метастазов в ЛУ не превышает 10%, поэтому им можно не проводить стадирование поражения ЛУ |
В |
С учетом ограниченных возможностей дооперационных методов визуализации при диагностике микрометастазов (<5 мм), единственным надежным методом стадирования при клинически локализованном РПЖ остается тазовая лимфаденэктомия |
|
Метастазы в кости (стадия М) наиболее эффективно диагностируются при проведении остеосцинтиграфии. Исследование можно не проводить пациентам без клинических проявлений со стороны костной системы с уровнем ПСА |
|
<20 нг/мл при высокоили умеренно дифференцированном РПЖ |
В |
В сомнительных случаях целесообразно проводить ПЭТ/КТ с 11С-холином, 18F-фторидом или МРТ всего тела |
С |
Лечение
ТЩАТЕЛЬНОЕ НАБЛЮДЕНИЕ (ОТСРОЧЕННОЕ ЛЕЧЕНИЕ)
Тактика тщательного наблюдения (отсроченного лечения) предполагает отказ от немедленного лечения больного при выявлении РПЖ с динамическим наблюдением и проведением терапии при признаках прогрессирования болезни. Такой тактический вариант предлагают пациентам с выраженной интеркуррентной патологией, что позволяет избежать осложнений и побочных реакций радикальных методов лечения.
Показания к проведению тщательного наблюдения:
При анализе результатов тактики отсроченного лечения отмечено, что 10-летняя опухолеспецифическая выживаемость больных с высоко- и умеренно дифференцированными опухолями составляет 87%, а больных с низкодифференцированными опухолями — 34%В [20]. Риск смерти от РПЖ при проведении тщательного наблюдения в различных возрастных группах при дифференцировке опухоли 2–4 балла по шкале Глисона составляет 4–7%, 5 баллов — 6–11%, 6 баллов — 18–30%, 7 баллов — 42–70%, 8–10 баллов — 67–80%С [2].
При появлении признаков прогрессирования процесса или по желанию больного назначают гормональное лечение, однако пациента следует информировать, что немедленное начало гормонотерапии РПЖ приводит к более продолжительной опухолеспецифической выживаемости, чем при отсроченном начале леченияВ [65].
АКТИВНОЕ НАБЛЮДЕНИЕ [139]
Термин «активное наблюдение» известен как «активный мониторинг», отражает консервативное лечение РПЖ. Термин принят в прошлом десятилетии и означает то, что нет необходимости в немедленном назначении лечения пациенту. За пациентом тщательно наблюдают и проводят лечение на заранее установленных этапах прогрессирования, определяемых такими параметрами, как короткое время удвоения ПСА и ухудшение патоморфологических результатов при повторной биопсии. Тактика лечения при этом направлена на полное излечение пациента.
Активное наблюдение было предложено с целью уменьшения процента случаев излишнего лечения пациентов с клинически локализованным РПЖ группы очень низкого риска прогрессирования без отказа от радикального лечения, как при выжидательной тактике. Был проведен ряд дополнительных исследований активного наблюдения при клинически локализованном РПЖ (табл. 8.7 и 8.8). Исследованиями подтверждено, что у отобранных по строгим показаниям пациентов с РПЖ группы очень низкого риска наблюдаются очень медленное прогрессирование и низкая смертность от рака, и только ограниченному числу пациентов требуется отсроченное радикальное лечение.
| Автор | Число пациентов | Средний возраст | Критерии |
|---|---|---|---|
Dall’Era |
321 |
64 |
СГ <3+3, ПСАd <0,15 нг/мл, T1–T2a, <33% биоптатов +, <50% положительных столбиков |
Van den Berg |
616 |
66 |
СГ <3+3, ПСА <10 нг/мл, ПСАd <0,2 нг/мл, T1C–T2, < 2 биоптатов + |
Van As |
326 |
67 |
СГ <3+4, ПСА <15 нг/мл, T1– T2a, N0Nx, M0MX <T2a, <50% биоптатов + |
Soloway |
230 |
64 |
СГ <6, ПСА <10 нг/мл, T1a–T2, <2 биоптатов +, <20% столбиков + |
Klotz |
453 |
70 |
СГ <6, ПСА <10 нг/мл (до 1999: СГ<3+4, ПСА<15 нг/мл) <3 биоптатов +, <50% опухоли в каждом столбике |
Tosoain |
769 |
66 |
СГ <3+3, ПСАd <0,15 нг/мл, T1, < 2 биоптатов +, <50% столбиков |
Adamy |
238 |
64 |
СГ <3+3, ПСА <10 нг/мл, T1–T2a, < 3 био птатов +, <50% столбиков |
Автор |
Средняя продолжительность наблюдения, мес |
Прогрессирование |
РПЭ, % |
Выживаемость, % |
|||
Биопсия, % |
ПСА / ПСА DT |
Количество пациентов |
Общая |
Раковоспецифическая |
Без признаков прогрессии |
||
Dall’Era |
47 |
35 |
5 |
8 |
97 |
100 |
54 |
Van den Berg |
52 |
- |
13 |
18 |
91 |
100 |
68 |
Van As |
22 |
13 |
18 |
2 |
98 |
100 |
73 |
Soloway |
32 |
10 |
- |
- |
100 |
100 |
86 |
Klotz |
82 |
9 |
14 |
3 |
78.6 |
97.2 |
70 |
Tosoain |
32 |
14 |
- |
9 |
98 |
100 |
54 |
Adamy |
22 |
13 |
14 |
11 |
- |
- |
- |
Критерии для начала лечения после активного наблюдения определены менее четко, однако для большинства групп использовались следующие:
-
время удвоения ПСА с пороговым значением от 2 до 4 лет. Этот критерий ставится под сомнение из-за слабой связи между временем удвоения ПСА и степенью прогрессии опухоли при повторной биопсии;
-
повышение суммы Глисона >7 при систематическом проведении последующих биопсий, проведенных с интервалом 1–4 года;
-
обеспокоенность пациентов зачастую определяет необходимость лечения. Это является важным фактором и может наблюдаться у 10% пациентов. Недостаточно данных по отношению к активному наблюдению.
| Рекомендации в отношении отсроченного лечения у больных РПЖ | УД |
|---|---|
Показания |
|
При предположительно локализованном РПЖ (Nx–N0, M0) |
|
Стадия Т1а: высоко- и умеренно дифференцированные опухоли. Молодым пациентам с ожидаемой продолжительностью жизни >10 лет рекомендуется проведение повторного анализа уровня ПСА, ТРУЗИ и биопсии ПЖ |
2а |
Стадия T1b–T2b: высоко- и умеренно дифференцированные опухоли. Для пациентов без клинических проявлений с ожидаемой продолжительностью жизни <10 лет |
2а |
Активное наблюдение |
|
Критерии для включения в протокол активного наблюдения при минимальном риске прогрессирования опухоли: стадия cT1–2a, ПСА <10 нг/мл, сумма Глисона <6 (биопсия как минимум из 10 точек), <2 положительных столбиков, <50% опухоли в биоптате |
2а |
При наличии показаний к выполнению оперативного лечения или лучевой терапии пациентам должны быть предложены данные опции 4 |
|
Отбор пациентов для активного наблюдения подтверждается результатами биопсии. Последующее наблюдение основано на проведении ПРИ, определении ПСА и повторных биопсиях. Оптимальные временные промежутки для последующего наблюдения до сих пор не определены (ежегодно или 1 раз в 2 года) |
|
Причиной назначения активного лечения может быть увеличение степени злокачественности опухоли при проведении повторных биопсий или желание пациентов |
|
ПСА-прогрессия остается спорным вопросом |
|
Возможные варианты лечения |
|
При предположительно локализованном РПЖ (N0, M0) |
|
Хорошо информированные пациенты с РПЖ в стадии T1b–T2b с высокодифферен цированным РПЖ и ожидаемой продолжительностью жизни 10–15 лет |
|
Все пациенты, желающие избежать осложнений активного лечения |
|
Хорошо информированные пациенты с высоким уровнем ПСА, без клинических проявлений с неблагоприятным прогнозом |
3 |
При местнораспространенном РПЖ (стадия T3–T4) |
|
Пациенты без клинических проявлений с высокои умеренно дифференцированным РПЖ и небольшой ожидаемой продолжительностью жизни |
3 |
ПСА <50 нг/мл и время удвоения ПСА >12 мес |
1 |
При метастатическом РПЖ (M1) |
|
В редких случаях при бессимптомном течении и без возможности тщательного наблюдения |
4 |
Хирургическое лечение
РАДИКАЛЬНАЯ ПРОСТАТЭКТОМИЯ
Оперативное лечение (радикальная простатэктомия) подразумевает удаление предстательной железы с семенными пузырьками и участком мочеиспускательного канала. Цель операции при локализованном и некоторых вариантах местнораспространенного РПЖ — полное излечение больного. Реже радикальную простатэктомию выполняют с паллиативной целью при лечении местнораспространенного РПЖ. В этих случаях задача оперативного вмешательства — удаление основной массы опухоли для повышения эффективности консервативных методов лечения.
Варианты операционного доступа при выполнении радикальной простатэктомии:
Радикальное хирургическое лечение обычно выполняют у больных РПЖ с ожидаемой продолжительностью жизни более 10 лет.
Показания к радикальной простатэктомии:
Противопоказания к радикальной простатэктомии следующие.
Хирургическое вмешательство — наиболее радикальный метод лечения, и большинство урологов рассматривают его как метод выбора при лечении локализованного РПЖА [118].
Преимущества радикальной простатэктомии перед консервативными методами лечения [58]:
Относительные недостатки радикальной простатэктомии [58]:
Наиболее распространенный вариант операции — радикальная позадилонная простатэктомия (РПЭ). При этом варианте операционного доступа можно выполнять двустороннюю тазовую лимфаденэктомию. Кроме того, в некоторых исследованиях демонстрируется более высокая частота положительных хирургических краев при выполнении промежностной простатэктомии по сравнению с позадилонным доступомС [10, 124].
Преимущества промежностной простатэктомии [100]:
Недостатки промежностной простатэктомии [100]:
Для оценки состоянии тазовых лимфатических узлов перед промеж тазовую лимфаденэктомиюА [100].
В последние годы широкое распространение получила лапароскопическая радикальная простатэктомия, которую можно выполнить чрезбрюшинным и внебрюшинным доступами. Онкологические и функциональные результаты лапароскопической простатэктомии не отличаются от таковых позадилонной и промежностной операций, в то же время применение лапароскопической техники приводит к снижению числа осложнений и более быстрой реабилитации больных после операцииА [45, 93].
Один из вариантов лапароскопической операции — роботассистированная радикальная простатэктомия [92]. В Guidelines EAU 2015 г. отмечено, что робот-ассистированная радикальная простатэктомия (РАРП) продолжает активно «вытеснять» радикальную позадилонную простатэктомию (РПЭ) в качестве золотого стандарта оперативного лечения локализованного РПЖ по всему миру. При РАРП по сравнению с РПЭ достоверно меньше объем кровопотери и частота гемотрансфузий, а также имеются преимущества при оценке восстановления удержания мочи и эректильной функции [139].
Осложнения радикальной простатэктомии [46, 62, 131]:
Эректильная дисфункция развивается у всех больных после выполнения радикальной простатэктомии без применения нервосберегаюшей техники. Для сохранения эректильной функции разработана техника операции, при которой сохраняют кавернозные нервно-сосудистые пучки [121].
Показания к применению нервосберегающей техники:
Результаты радикальной простатэктомии при лечении больных локализованным и местнораспространенным РПЖ представлены в табл. 8.9 [16, 73, 76, 114, 131].
| Автор | Число больных | Средний срок наблюдения, мес | 5-летняя безрецидивная выживаемость, % | 10-летняя безрецидивная выживаемость, % |
|---|---|---|---|---|
А. Partin и соавт. (1993) |
894 |
53 |
87 |
77 |
W. Catalona и соавт. (1994) |
925 |
28 |
78 |
65 |
M. Ohori и соавт. (1994) |
500 |
36 |
76 |
73 |
J. Trapasso и соавт. (1994) |
601 |
34 |
69 |
47 |
H. Zincke и соавт. (1994) |
3170 |
60 |
70 |
52 |
| Рекомендации | УД |
|---|---|
Проведение неоадъювантной гормональной терапии (ГТ) перед РПЭ не дает достоверного преимущества в показателе общей выживаемости по сравнению с проведением одной только РПЭ |
|
Проведение неоадъювантной ГТ перед РПЭ не дает достоверного преимущества в показателе безрецидивной выживаемости по сравнению с проведением одной только РПЭ |
|
Проведение неоадъювантной ГТ перед РПЭ достоверно улучшает патоморфологические показатели, такие, как частота локализованного РПЖ, снижение стадии по данным патоморфологического исследования, положительный хирургический край и частота поражения лимфатических узлов |
|
Адъювантная ГТ после РПЭ не дает преимущества в показателе 10-летней выживаемости |
|
Адъювантная ГТ после РПЭ: общая оценка эффективности по показателю безрецидивной выживаемости достоверно выше (р <0,00001) в пользу ГТ |
|
Абсолютные показания к радикальной простатэктомии |
|
Пациенты с локализованным РПЖ низкого и промежуточного риска (стадия cT1a–T2b, СГ 2–7 и ПСА <20 нг/мл) и ожидаемой продолжительностью жизни >10 лет. |
|
Относительные показания к радикальной простатэктомии |
|
Пациенты с РПЖ стадии Т1а и ожидаемой продолжительностью жизни >15 лет или сумма Глисона равна 7 |
3 |
Отдельные пациенты с локализованным РПЖ небольшого объема высокого риска (стадия cT3a или СГ 8–10, или ПСА >20 нг/мл) |
3 |
Тщательно отобранные пациенты с РПЖ очень высокого риска (стадия cT3b– T4 N0 или любая стадия TN1) при комбинированном лечении |
3 |
У пациентов с РПЖ стадии Т1–Т2 не рекомендуется проводить короткие (3 мес) или длительные (9 мес) курсы неоадъювантной терапии аналогами гонадотропин-рилизинг гормона |
1а |
У пациентов с нормальной эректильной функцией до операции и низким риском экстракапсулярного прорастания можно проводить нервосберегающую РПЭ (стадия T1c–2с, СГ <7, ПСА <10 нг/мл или на основании таблиц/номограмм Партина) |
3 |
У пациентов с РПЖ стадии T2a–T3a возможным вариантом лечения является односторонняя нервосберегающая РПЭ |
4 |
ЛУЧЕВАЯ ТЕРАПИЯ
Как и радикальная простатэктомия, лучевая терапия относится к радикальным методам лечения локализованного РПЖ. При местно-распространенном РПЖ лучевую терапию проводят с целью улучшения выживаемости больных и чаще комбинируют с гормонотерапией.
Цель лучевой терапии — максимально точное достижение терапевтической дозы ионизирующего излучения в ткани предстательной железы при минимальном лучевом воздействии на окружающие органы и ткани [105].
Варианты лучевой терапии
ДИСТАНЦИОННАЯ ЛУЧЕВАЯ ТЕРАПИЯ
Наиболее распространенный способ лучевой терапии РПЖ — дистанционное фотонное облучение.
Показания к дистанционной лучевой терапии:
Противопоказания к дистанционной лучевой терапии:
Преимущества дистанционной лучевой терапии:
Недостатки дистанционной лучевой терапии:
При стандартной (конвенциальной) лучевой терапии используются методики планирования, при которых предстательная железа и семенные пузырьки идентифицируются исходя из анатомического строения окружающих органов (костные структуры, контрастированные мочевой пузырь и прямая кишка)A [83].
Облучение проводят, как правило, с четырех полей. Суммарная очаговая доза (СОД) на предстательную железу должна составлять 65–70 Гр, на тазовые лимфатические узлы — 45–50 Гр, ежедневная доза облучения — 1,8–2,0 ГрA [82]. При низком риске метастатического поражения лимфатических узлов облучение регионарных зон не проводят.
Факторы, влияющие на эффективность лучевой терапии локализованного РПЖ:
Повышение СОД, подводимой к предстательной железе, приводит к улучшению результатов лучевого лечения РПЖ. В четырех рандомизированных исследованиях, включавших 1465 больных локализованным РПЖ, увеличение дозы облучения >66 Гр приводило к снижению смертности от РПЖ на 29% по сравнению с пациентами, получившими дозу <66 ГрВ [117]. В другом исследовании 5-летняя безрецидивная выживаемость больных, получивших дозу ≥72 Гр, составила 87% по сравнению с 55% в группе больных, получивших дозу <72 ГрВ [117].
Повышение СОД при проведении конвенциальной лучевой терапии неизбежно ведет к увеличению побочных реакций и осложнений, связанных с увеличением лучевой нагрузки на окружающие органы и ткани. Для повышения эффективности лучевого лечения с одновременным снижением радиационных осложнений разработана методика 3D-конформной лучевой терапии, при который клинический объем облучения соответствует индивидуальной кривизне границ и форме предстательной железы. Методика 3D-конформного облучения предусматривает проведение ряда мероприятий:
Применение конформной лучевой терапии позволяет существенно уменьшить лучевую нагрузку на мочевой пузырь и прямую кишку. Так, объем прямой кишки, на который попадает доза 66 Гр и выше, составляет 33,7% при конформном облучении и 62,7% при конвенциальном, объем мочевого пузыря — соответственно 22,0 и 50,5%C [82].
Осложнения дистанционной лучевой терапииА [82]:
Результаты дистанционной лучевой терапии при лечении локализованного РПЖ представлены в табл. 8.10 [35, 60, 87, 130].
| Автор | Число больных | Характеристика больных | Доза, Гр | Срок наблюдения, годы | Безрецидивная, % |
|---|---|---|---|---|---|
I. Fiveash и соавт. (2000) |
102 |
T1–2, сумма баллов по шкале Глисона 8–10 |
<70 |
5 |
88 65 |
A. Pollack и соавт. (2002) |
301 |
Т1–3, ПСА >10 нг/мл |
78 70 |
6 |
62 43 |
P. Kupelian и соавт. (2000) |
1041 |
Т1–2 |
>72 |
8 |
87 51 |
M. Zelefsky и соавт. (1998) |
743 |
Промежуточный риск |
>75,6 |
4 |
79 55 |
Более современными методиками лучевой терапии являются лучевая терапия с модуляцией интенсивности (IMRT) и лучевая терапия, ориентированная на положение простаты в режиме реального времени (IGRT) [139].
Рецидивом РПЖ после проведенной лучевой терапии, по определению ASTRO, принято считать три последовательных повышения уровня ПСА после минимального уровня маркера, достигнутого по окончании лучевой терапии [21].
БРАХИТЕРАПИЯ (ВНУТРИТКАНЕВАЯ ЛУЧЕВАЯ ТЕРАПИЯ)
Заключается во введении (имплантации) радиоактивных источников в ткань предстательной железы. Для терапии РПЖ применяют постоянную (низкодозную) и временную (высокодозную) брахитерапию.
Для временного введения применяют изотоп 192Ir, после подведения необходимой дозы к предстательной железе радиоактивные иглы удаляют. Высокодозную брахитерапию используют при местнораспространенном РПЖ (T3N0M0) в сочетании с дистанционным облучением.
При локализованном РПЖ чаще применяют постоянную брахитерапию, при которой в предстательную железу вводят радиоактивные зерна (гранулы) 125I (период полураспада — 60 дней) или 103Pd (период полураспада 17 дней). Благодаря более гомогенному распределению ионизирующего излучения брахитерапия позволяет подвести более высокую СОД к предстательной железе с меньшим лучевым воздействием на окружающие ткани, чем при проведении дистанционной лучевой терапии. Радиоактивные источники внедряют через промежность под контролем трансректального УЗИ. Доза облучения при имплантации 125I составляет 140–160 Гр, при имплантации 103Pd — 115–120 Гр.
Показания к брахитерапииА [68]:
Противопоказания к брахитерапии:
Преимущества брахитерапииА
[96]:
Недостатки брахитерапии:
Результаты брахитерапии представлены в табл. 8.11 [8, 11, 91, 129].
| Автор | Число больных | Количество опухолей Т1/Т2, % | Количество опухолей >6 баллов по шкале Глисона, % | Средний уровень ПСА, нг/мл | Средний срок наблюдения, мес | Выживаемость, % |
|---|---|---|---|---|---|---|
J. Blasko и соавт. (2000) |
230 |
30/70 |
40 |
7,3 |
41,5 |
83,5 |
D. Brachmаn и соавт. (2000) |
695 |
17/83 |
15 |
– |
51 |
64 |
M. Zelefsky и соавт. (2000) |
248 |
58/42 |
25 |
7 |
48 |
71 |
H. Ragde и соавт. (2000) |
147 |
22/78 |
0 |
8,8 |
93 |
66 |
У больных с местнораспространенным РПЖ брахитерапию проводят только в комбинации с дистанционным облучением, при этом радиоактивные источники имплантируют через 2 нед после наружной лучевой терапии в дозе 45 Гр. Доза брахитерапии составляет 110 Гр для 125I и 90 Гр для 103Pd.
| Рекомендации [139] | УД | СР |
|---|---|---|
3D-конформная ЛТ с или без ЛТ с модуляцией интенсивности рекомендуется даже у молодых пациентов с локализованным РПЖ стадии T1c–T2cN0M0, которые отказались от хирургического лечения |
1b |
В |
Для пациентов с высоким риском рекомендовано проведение долгосрочной ААТ до или во время ДЛТ, так как это улучшает показатели общей выживаемости |
2а |
В |
Пациентам с местнораспространенным РПЖ (T3–4, N0M0), которым достаточно проведения ДЛТ, рекомендуется проводить лечение по схеме ДЛТ + долгосрочная ААТ, а использование одной только ААТ считается нецелесообразным |
1b |
А |
Трансперинеальная интерстициальная брахитерапия с установкой постоянных имплантатов может быть альтернативным методом лечения для пациентов с РПЖ стадии cT1–T2a, суммой Глисона <7 (или 3+4), ПСА <10 нг/мл, объемом ПЖ <50 мл, без предыдущей ТУР ПЖ и с низким показателем по шкале IPSS |
2а |
В |
Проведение ранней послеоперационной ДЛТ после РПЭ может улучшить биохимические показатели и показатель выживаемости без клинического рецидива у пациентов с патоморфологической стадией T3N0M0; при этом наибольший эффект достигается у пациентов с положительным хирургическим краем |
1b |
А |
У пациентов с патоморфологической стадией опухоли T2–3N0M0 «спасительная» ДЛТ показана в случае сохраняющегося повышенного уровня ПСА или биохимического рецидива, но до повышения уровня ПСА до 0,5 нг/мл |
3 |
В |
Комбинация сопутствующей и адъювантной ГТ общей продолжительностью 3 года с ДЛТ улучшает показатели общей выживаемости у пациентов с местнораспространенным РПЖ стадии T3–4N0M0 и общим состоянием по шкале ВОЗ 0–2 |
1b |
А |
Короткий курс ГТ до и во время проведения ДЛТ может благоприятно влиять на показатель общей выживаемости у пациентов с местнораспространенным РПЖ стадии T2c–T3N0–X и суммой Глисона 2–6 |
1b |
А |
У пациентов с РПЖ группы очень высокого риска стадии c — pN1M0 без тяжелых сопутствующих заболеваний проведение ДЛТ на область таза и длительный курс ранней адъювантной ГТ улучшают биохимические показатели, показатели общей выживаемости, частоты рецидивов, метастазирования |
2b |
В |
Минимально инвазивные методы лечения РПЖ [139]
К минимально инвазивным методам лечения РПЖ относятся криоабляция простаты, и абляция предстательной железы с помощью высокоинтенсивного сфокусированного ультразвука (HIFU).
Криоабляция простаты является хорошо изученным альтернативным методом терапии РПЖ, в то время как HIFU продолжает оставаться изучаемым методом.
Фокальная терапия РПЖ с помощью различных методик (криоабляции, ультразвуковой или лазерной абляции и пр.) активно изучается во многих клиниках.
| Рекомендации | УР |
|---|---|
Пациентам, которым не может быть проведено оперативное лечение и лучевая терапия может быть предложена криоабляция простаты в качестве альтернативного метода лечения рака простаты |
С |
При принятии решения о выполнении HIFU с пациентом должно быть обсуждено отсутствие результатов сравнительных исследований с длительным (более 10 лет) периодом наблюдения |
С |
Фокальная терапия не может быть рекомендована в качестве альтернативного метода лечения рака простаты |
А |
ГОРМОНАЛЬНАЯ ТЕРАПИЯ
Гормонотерапию как самостоятельный вариант лечения РПЖ проводят с паллиативной целью, но гормональные препараты могут быть показаны в сочетании с радикальным оперативным или лучевым лечением как комбинированная противоопухолевая терапия.
В основе механизма действия эндокринного лечения лежит снижение концентрации тестостерона в клетках предстательной железы, которое может быть реализовано двумя механизмами:
-
подавлением секреции андрогенов яичками (достигается снижение концентрации сывороточного тестостерона);
-
конкурентным взаимодействием с андрогенными рецепторами в ядрах клеток предстательной железы (достигается снижение внутриклеточной концентрации тестостерона, уровень сывороточного тестостерона не снижается).
Методы гормональной терапии
Двусторонняя орхидэктомия
Это основной способ (золотой стандарт) гормональной терапии РПЖ, с которым сравнивают остальные методы эндокринного леченияВ [67].
Преимущества хирургической кастрации:
Основные побочные эффекты и осложнения хирургической кастрации
[27]:
Побочные эффекты двусторонней орхидэктомии существенно ухудшают качество жизни больных РПЖ. Кроме того, хирургическая кастрация не позволяет проводить у больного интермиттирующую андрогенную блокаду.
Показания к хирургической кастрации:
Агонисты лютеинизирующего гормона рилизинг-гормона
Это синтетические аналоги нативного гипоталамического ЛГРГ. В основе механизма действия агонистов ЛГРГ лежит десенсибилизация рецепторов к рилизинг-гормону, ведущая к снижению продукции лютеинизирующего гормона гипофиза и в дальнейшем к снижению выработки тестостерона клетками Лейдига в яичках. После введения агонистов ЛГРГ отмечают кратковременное повышение концентрации тестостерона на 3–5-й день (синдром вспышки) с последующим снижением ее до посткастрационного уровня на 21–28-й день [36, 59]. Для профилактики синдрома вспышки у больных метастатическим РПЖ перед введением агониста ЛГРГ и в течение 1-й недели терапии следует назначать антиандрогены.
Побочные эффекты и осложнения терапии агонистами ЛГРГ такие же, как при хирургической кастрации.
Показания к применению агонистов ЛГРГ:
-
локализованный РПЖ (Т1–2N0M0) при невозможности проведения радикального лечения или в качестве неоадъювантной терапии перед радикальным оперативным или лучевым лечением;
-
местнораспространенный РПЖ (T3–4N0M0) — в качестве самостоятельного лечения или неоадъювантной и адъювантной терапии в сочетании с оперативным или лучевым лечением;
В настоящее время для лечения РПЖ применяют следующие агонисты ЛГРГ.
-
Гозерелин 3,6 мг под кожу передней брюшной стенки 1 раз в 28 дней или 10,8 мг под кожу передней брюшной стенки 1 раз в 3 мес; препарат находится в депонированной форме в шприц-тюбике, готов к употреблению.
-
Лейпрорелин 7,5 мг внутримышечно 1 раз в 28 дней, 22,5 мг 1 раз в три месяца, 45 мг 1 раз в шесть месяцев; препарат растворяют непосредственно перед инъекцией, вводят в виде суспензии.
-
Декапептил 3,75 мг внутримышечно 1 раз в 28 дней; препарат растворяют непосредственно перед инъекцией, вводят в виде суспензии.
-
Бусерелин 3,75 мг внутримышечно 1 раз в 28 дней; препарат растворяют непосредственно перед инъекцией, вводят в виде суспензии. Лечение агонистами ЛГРГ проводят длительно, до развития рефрактерности к гормональному воздействию. Некоторые авторы рекомендуют применение агонистов ЛГРГ в режиме прерывистой (интермиттирующей) терапии, однако эффективность интермиттирующей блокады остается дискутабельнойD [125].
Антагонисты лютеинизирующего гормона рилизинг-гормона
[139]
В отличие от агонистов ЛГРГ, антагонисты конкурентно связываются с ЛГРГ рецепторами в гипофизе; при этом не возникает эффекта «вспышки». Многие антагонисты ЛГРГ прошлого поколения вызывали развитие тяжелых гистамин-опосредованных побочных эффектов. До недавнего времени не существовало депоформ этих препаратов.
Дегареликс — наиболее изученный антагонист ЛГРГ для подкожного введения 1 раз в месяц.
Основываясь на результатах крупного рандомизированного исследования (n=610), стандартная доза дегареликса должна составлять 240 мг в первый месяц с последующим применением инъекций по 80 мг ежемесячно. Основным специфическим побочным эффектом дегареликса была боль в зоне инъекции (средней или легкой степени), выявленная у 40% пациентов преимущественно после первого введения.
Эстрогены
В основе механизма действия эстрогенных препаратов лежит блокирование по механизму обратной связи синтеза лютеинизирующего и фолликулостимулирующего гормонов, что приводит к снижению концентрации тестостерона в сыворотке. Кроме того, эстрогены оказывают прямое ингибирующее действие на яички. Исторически эстрогены являются первой группой гормональных препаратов, которые стали применять для лечения РПЖ. Однако эстрогенные препараты обладают выраженными побочными свойствами, наиболее опасными из которых является кардиотоксичность, которая существенно ограничивает применение эстрогенов в клинической практикеВ [12, 36].
Побочные реакции и осложнения эстрогенотерапии:
Показания к применению эстрогенов:
Наиболее эффективный препарат из группы эстрогенов — диэтилстильбэстрол. Его назначают в дозе 1 или 3 мг ежедневно внутримышечно. Пероральное применение препарата и доза 5 мг/сут приводят к более высокой кардиоваскулярной токсичностиВ [47].
При сравнении эффективности двусторонней орхидэктомии, терапии агонистами ЛГРГ и эстрогенами в различных рандомизированных исследованиях получены одинаковые показатели выживаемости и длительности ремисииА [81, 102, 123].
Антиандрогены
К антиандрогенам относятся стероидные и нестероидные препараты. В основе механизма действия стероидных антиандрогенов лежит не только блокирование андрогенных рецепторов в клетках предстательной железы, но и центральное прогестиноподобное действие, что приводит к снижению сывороточной концентрации тестостерона, дигидротестостерона и ЛГРГ. К стероидным антиандрогенам относятся ципротерон, мегестрол и хлормадинон. Ципротерон назначают в комбинации с хирургической кастрацией или агонистами ЛГРГ в дозе 100–150 мг перорально ежедневно, в виде монотерапии — 250–300 мг перорально ежедневно.
Побочные эффекты стероидных антиандрогенов:
Ципротерон чаще назначают в комбинации с хирургической или медикаментозной кастрацией (в том числе для профилактики синдрома вспышки). В режиме монотерапии ципротерон имеет равную эффективность с диэтилстильбэстролом и флутамидомВ [79, 99].
Механизм действия нестероидных (чистых) антиандрогенов связан с конкурентным взаимодействием с андрогенными рецепторами и их ингибированием. При применении нестероидных антиандрогенов в режиме монотерапии концентрация сывороточного тестостерона возрастает. К нестероидным антиандрогенным препаратам относят бикалутамид, флутамид (флуцином), нилутамид (анандрон).
Показания к назначению антиандрогенов:
Флутамид (флуцином) назначают по 250 мг 3 раза в сутки перорально. Препарат применяют в режиме максимальной андрогенной блокады, реже в режиме монотерапии [9, 18].
Побочные эффекты флуцинома:
Нилутамид (анандрон) назначают по 150 мг 2 раза в сутки в течение 4 нед, в дальнейшем в дозе 150 мг/сут. Препарат применяют в комбинации с хирургической или медикаментозной кастрацией.
Побочные эффекты анандрона [28]:
Бикалутамид в режиме максимальной андрогенной блокады назначают в дозе 50 мг перорально ежедневно. В режиме монотерапии препарат назначают в дозе 150 мг/сут. При сравнении монотерапии бикалутамида в дозе 150 мг с хирургической или медикаментозной кастрацией отмечаются одинаковая эффективность данных схем лечения у больных с местнораспространенным РПЖ (М0) и преимущество кастрации в отношении выживаемости у больных с метастатическим РПЖ (М1), при этом качество жизни и сексуальная функция при терапии бикалутамидом в дозе 150 мг достоверно лучше [52, 115].
Побочные эффекты бикалутамида:
Гормональные препараты других классов
Кетоконазол — противогрибковый препарат, угнетающий синтез андрогенов надпочечников. Применяют в качестве второй линии гормональной терапии метастатического РПЖ на фоне прогрессирования процесса после проведения максимальной андрогенной блокады. Кетоконазол назначают перорально в дозе 400 мг 3 раза в сутки. Лечение необходимо проводить под контролем печеночных проб и в сочетании с гидрокортизоном для профилактики надпочечниковой недостаточностиВ [89, 113].
Аминоглутатемид также ингибирует продукцию андрогенов надпочечниками за счет блокирования цитохрома Р450. Препарат назначают при рефрактерности к основным гормональным препаратам [44].
Показания к проведению гормональной терапии (табл. 8.12) [139]
| Показания для кастрации | Преимущества | УД |
|---|---|---|
Стадия М1, наличие симптомов заболевания |
Снижение симптомов и риска возможных серьезных осложнений распространенного рака (компрессия спинного мозга, патологические переломы, обструкция мочеточников, висцеральные метастазы) |
1b |
Даже без РКИ этот метод лечения является стандартным и должен применяться и рассматриваться как метод с уровнем доказательности 1 |
1 |
|
Стадия М1, без симптомов заболевания |
Ранняя кастрация замедляет прогрессирование симптомов и предотвращает серьезные осложнения, связанные с прогрессией РПЖ |
1b |
Для хорошо информированных пациентов приемлемым вариантом может быть протокол активного клинического наблюдения, если основной целью является выживаемость |
3 |
|
Антиандрогены |
||
Короткий курс |
Снижение риска возникновения эффекта «вспышки» у пациентов с метастатическим РПЖ, которые получают аналоги ЛГРГ |
1b |
Необходимо начать лечение одновременно, т.е. в день первого приема аналога ЛГРГ, или осуществлять прием в течение 7 дней до первой инъекции ЛГРГ. Продолжительность лечения — 3 нед |
4 |
|
Длительный курс |
Этот вариант возможен у тщательно отобранных и мотивированных пациентов с низким уровнем ПСА |
3 |
Интермиттирующее лечение |
||
Критерии начала и прекращения ААТ |
Критерии выбраны эмпирически. При проведении клинических исследований терапию прекращали при уровне ПСА <4 нг/мл (М1) и <0,5–4 нг/мл (при рецидиве РПЖ после потенциально курабельного лечения) |
4 |
Лечение назначалось повторно при уровне ПСА >4–10 (при рецидиве) и >10–15 нг/мл (М1) |
||
Препараты |
Аналоги ЛГРГ + комбинированное лечение для предотвращения эффекта «вспышки» |
1 |
Популяция |
Пациенты с метастатическим РПЖ: с бессимптомным течением, мотивированные, с хорошим ПСА-ответом после периода индукции |
2* |
Рецидивирование после ЛТ: пациенты с хорошим ответом после индукционного периода |
1b |
|
*Данные основаны на результатах опубликованного единственно проведённого исследования по изучению пациентов с РПЖ стадии M1b и двух когортных исследований смешанных популяций.
Противопоказания для различных видов терапии (табл. 8.13) [139]
| Вид терапии | Противопоказания |
|---|---|
Двусторонняя орхидэктомия |
Отрицательный психологический настрой пациента в отношении возможности подвергнуться хирургической кастрации |
Терапия эстрогенами |
Наличие сердечно-сосудистых заболеваний |
Монотерапия агонистами ЛГРГ |
Пациенты с метастатическим РПЖ с высоким риском развития эффекта «вспышки» |
Терапия антиандрогенами |
В качестве первичной терапии локализованного РПЖ |
Краткие рекомендации по первичному лечению рака предстательной железы (табл. 8.14) [139]
| Стадия | Лечение | Комментарий | СР |
|---|---|---|---|
Т1а |
Выжидательная тактика |
Стандартная тактика лечения при сумме Глисона <6 и 7, с ожидаемой продолжительности жизни <10 лет |
В |
Активное наблюдение |
Пациентам с ожидаемой продолжительностью жизни >10 лет рекомендуется проводить повторное стадирование с помощью биопсии под ТРУЗИ-контролем |
В |
|
РПЭ |
Вариант лечения для молодых пациентов с большой ожидаемой продолжительностью жизни, особенно при СГ>7 |
В |
|
ЛТ |
Вариант лечения для молодых пациентов с большой ожидаемой продолжительностью жизни, особенно при низкодифференцированных опухолях. Более высокий риск осложнений, если проводится после ТУР ПЖ, особенно для брахитерапии |
В |
|
ГТ |
Не применяется |
А |
|
Комбинированная терапия |
Не применяется |
С |
|
T1b–T2b |
Активное наблюдение |
Вариант лечения для пациентов с РПЖ стадии cT1c–cT2a, уровнем ПСА <10 нг/мл, СГ <6 по результатам биопсии, <2 положительных столбиков при биопсии, <50% опухолевых клеток в каждом столбике |
В |
Пациенты с ожидаемой продолжительностью жизни <10 лет |
|||
Пациенты с ожидаемой продолжительностью жизни >10 лет, если они информированы об отсутствии данных по выживаемости при наблюдении >10 лет |
|||
Пациенты, которые хотят избежать осложнений, связанных с лечением |
|||
T1a–T2c |
РПЭ |
Возможный вариант лечения у пациентов с РПЖ стадии pT1a. Стандартный вариант лечения для пациентов с ожидаемой продолжительностью жизни >10 лет, которые считают приемлемыми осложнения, связанные с лечением |
А |
ДЛТ |
Пациенты с ожидаемой продолжительностью жизни >10 лет, которые считают приемлемыми осложнения, связанные с лечением. Пациенты с противопоказаниями к хирургическому лечению Пациенты с плохим состоянием здоровья, ожидаемой продолжительностью жизни 5–10 лет и низкодифференцированным РПЖ (рекомендуется комбинированная терапия; см. ниже) |
В |
|
Брахитерапия |
Можно рассматривать низкодозную брахитерапию у пациентов с РПЖ низкого риска, объёмом ПЖ <50 мл и суммой баллов по шкале IPSS <12 |
В |
|
ГТ |
Пациенты с клиническими проявлениями, которым необходима паллиативная терапия, при наличии противопоказаний к радикальному лечению |
С |
|
Антиандрогены не рекомендуются, так как дают худшие результаты по сравнению с активным наблюдением |
А |
||
Комбинированная терапия |
У пациентов высокого риска применение неоадъювантной ГТ и одновременной ГТ и ДЛТ даёт более высокие показатели выживаемости |
А |
|
Т3–Т4 |
Выжидательная тактика |
Возможный вариант для пациентов без симптомов заболевания с хорошо и умеренно дифференцированным РПЖ стадии Т3 и ожидаемой продолжительностью жизни <10 лет, которым противопоказано местное лечение |
А |
РПЭ |
Вариант лечения для отобранных по строгим показаниям пациентов с РПЖ стадии Т3а, уровнем ПСА <20 нг/мл, СГ <8 по данным биопсии и ожидаемой продолжительностью жизни >10 лет Необходимо информировать пациентов о том, что при РПЭ имеется повышенный риск положительного хирургическо го края, а также определения неблагоприятных характеристик при гистологическом исследовании и поражения ЛУ, поэтому может быть показана адъювантная или спасительная терапия, например ДЛТ или ААТ |
С |
|
ДЛТ |
У пациентов с РПЖ стадии Т3 и ожидаемой продолжительностью жизни >5–10 лет. Эскалация дозы >74 Гр дает положительные результаты. Можно рекомендовать комбинацию с ГТ (см. ниже) |
С |
|
ГТ |
Пациенты с клиническими проявлениями, с обширными опухолями стадии Т3–Т4, высоким уровнем ПСА (>25– 50 нг/мл), с временем удвоения ПСА (ВУ) <1 года По выбору пациентов, пациенты с плохим состоянием здоровья. Для пациентов, которым не противопоказана ДЛТ, монотерапия гормональными препаратами не является вариантом лечения |
А |
|
Комбинированная терапия |
Комбинация одновременной и адъювантной ГТ (3 года) с ДЛТ увеличивает показатель общей выживаемости |
А |
|
Неоадъювантная ГТ + РПЭ: не показана |
В |
||
N+, M0 |
Выжидательная тактика |
Пациенты без симптомов заболевания. По выбору пациентов (при уровне ПСА <20–50 нг/мл), времени удвоения ПСА >12 мес. Требуется очень тщательное наблюдение |
В |
РПЭ |
Вариант лечения для отобранных по строгим показаниям пациентов с ожидаемой продолжительностью жизни >10 лет как часть мультимодального подхода к лечению |
С |
|
ДЛТ |
Вариант лечения для отобранных по строгим показаниям пациентов с ожидаемой продолжительностью жизни >10 лет, обязательно комбинирование с адъювантной ААТ в течение 3 лет |
С |
|
ГТ |
Стандартная адъювантная терапия при более чем 2 поражённых ЛУ после ДЛТ или РПЭ, проводимых как первичное локальное лечение. У пациентов, которым противопоказана локальная (направленная на простату) терапия, ГТ следует применять только в виде монотерапии |
А |
|
Комбинированная терапия |
Нет стандартных вариантов. По выбору пациентов |
В |
|
М+ |
Выжидательная тактика |
Нет стандартных вариантов. Может давать более низкий показатель выживаемости/больше осложнений, чем ранняя ГТ. Требует очень тщательного наблюдения |
В |
РПЭ |
Не является стандартным вариантом лечения |
С |
|
ЛТ |
Не должна применяться, как радикальное лечение; вариант терапии в комбинации с ААТ для лечения симптомов, связанных с локальным РПЖ |
С |
|
ГТ |
Стандартный вариант лечения. Обязательна у пациентов с симптомами заболевания |
А |
КАСТРАЦИОННО-РЕФРАКТЕРНЫЙ РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ (КР РПЖ)
[139]
Нарушение нормальной регуляции функции андрогенов занимает центральную роль в патогенезе КР РПЖ. Оно опосредованно двумя основными перекрещивающимися механизмами — независимым и зависимым от андрогеновых рецепторов (АР).
Андрогенонезависимые механизмы
АР-независимые механизмы могут быть связаны с нарушением процесса апоптоза в результате нарушения регуляции онкогенеза. При прогрессировании РПЖ чаще наблюдается высокий уровень экспрессии bcl-2, а предотвращение разрушения микротрубочек может быть тем механизмом, через который bcl-2 индуцирует свое антиапоптозное влияние.
Действительно, большинство препаратов, активных при КР РПЖ, замедляет процесс формирования микротрубочек. При КР РПЖ чаще определяется мутация опухоль-супрессорного гена p53. Было показано, что гиперэкспрессия белков bcl-2 и p53 в тканях после простатэктомии — фактор прогноза агрессивного клинического течения опухоли.
В настоящее время продолжаются клинические исследования, направленные на изучение механизма действия bcl-2, поскольку в процесс могут быть также вовлечены онкоген MDM2 и ген-супрессор PTEN (гомолог фосфатазы и тензина).
Андрогенозависимые механизмы
ВАР-независимых опухолях большее значение может иметь аутокринная стимуляция, которая способна поддерживать нерегулируемый рост опухоли. В 1/3 гормонорефрактерных опухолей наблюдается амплификация и гиперэкспрессия АР, которая может привести к гиперчувствительности АР. Мутации АР могут привести к нарушению их функции. Недавно открытое слияние гена TMPRSS2, регулируемого андрогенами, и семейства онкогенов EGR-ETS поднимает вопрос о возможной андрогенной регуляции онкогенов. Даже у пациентов после кастрации в ткани метастазов неоднократно обнаруживали высокий уровень андрогенов, что свидетельствует о высоком уровне интракринного синтеза. Возможно, что высокий интрапростатический уровень холестерина может активировать определенные андрогенные механизмы.
Определение кастрационно-рефрактерного рака предстательной железы
В последние годы стали чаще использовать термин КР РПЖ, чем гормонорефрактерный или андрогенонезависимый РПЖ.
Критерии кастрационно-рефрактерного рака предстательной железы
-
Кастрационный уровень тестостерона в крови (<50 нг/дл или <1,7 нмоль/л).
-
Три последовательных повышения уровня ПСА, определенные с интервалом не менее 1 нед, в результате чего уровень ПСА увеличился в 2 раза по сравнению с самым низким уровнем (надиром); при этом уровень общего ПСА >2 нг/мл.
-
Антиандрогены отменяются как минимум на 4 нед для флутамида и как минимум на 6 нед для бикалутамида[5].
-
ПСА-прогрессия, несмотря на последующие стандартные гормональные манипуляции[6].
Критерии оценки результатов лечения кастрационно-рефрактерного рака предстательной железы
Оценивать результаты лечения необходимо в соответствии с клиническими рекомендациями по оценке ответа на терапию у пациентов с солидными опухолями, недавно опубликованными группой RECIST. Для оценки метастазов можно использовать МРТ.
Уровень ПСА как маркер ответа
Было показано, что снижение ПСА >50% от исходного уровня связано с достоверным преимуществом в показателе выживаемости. В соответствии с последней оценкой исследований TAX 327 и SWOG 99–16, снижение уровня ПСА >30% связано с достоверным преимуществом в показателе выживаемости.
Другие параметры
В нескольких исследованиях показано, что число циркулирующих опухолевых клеток (ЦОК) имеет достоверную связь с показателем выживаемости, поэтому может стать ее суррогатным маркером. У пациентов с клиническими проявлениями костных метастазов можно использовать снижение интенсивности боли или ее полное купирование в качестве критерия оценки ответа на паллиативное лечение.
Рекомендации по оценке ответа на лечение
В повседневной практике оценка ответа на лечение должна быть основана на уменьшении выраженности симптомов заболевания, увеличении показателя выживаемости и других критериях.
| Рекомендации | УД | СР |
|---|---|---|
Положительный эффект по отношению к уровню ПСА может быть отсрочен на срок >12 нед даже при применении цитотоксических препаратов. При определении ПСА-ответа не следует обращать внимание на ранний рост ПСА (менее чем через 12 нед от начала терапии) |
1а |
А |
При поражении костей регистрируется как новое поражение, так и уже имеющееся у пациента |
||
Первая запланированная переоценка: нет новых очагов поражения: продолжить терапию |
||
При внекостных метастазах КР РПЖ оценку ответа на лечение необходимо проводить в соответствии с критериями RECIST |
1b |
А |
У пациентов с распространённым метастатическим КР РПЖ с клиническими проявлениями ответ на лечение лучше всего оценивать по снижению выраженности симптомов заболевания. Болевой синдром и проведение обезболивания регистрируются в начале лечения и оцениваются с интервалом 3–4 нед. |
1b |
А |
АНТИАНДРОГЕННАЯ ТЕРАПИЯ ПРИ КАСТРАЦИОННО-РЕФРАКТЕРНОМ РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Наличие андрогенорезистентного РПЖ говорит о том, что прогрессирование болезни происходит несмотря на кастрацию. Необходимо определять кастрационный уровень тестостерона и при первом рецидиве на фоне ГТ следует убедиться в том, что уровень тестостерона составляет <50 нг/дл (1,7 нмоль/л).
При отсутствии проспективных исследований даже небольшое потенциальное преимущество продолжения кастрационной терапии перевешивает минимальный риск лечения, поэтому у пациентов с КР РПЖ необходимо продолжать андрогенную супрессию до конца жизни.
Вторая линия гормональной терапии
Существует много вариантов лечения пациентов с прогрессированием РПЖ на фоне ГТ. На рис. 8.1 суммированы варианты лечения и ожидаемый ответ.
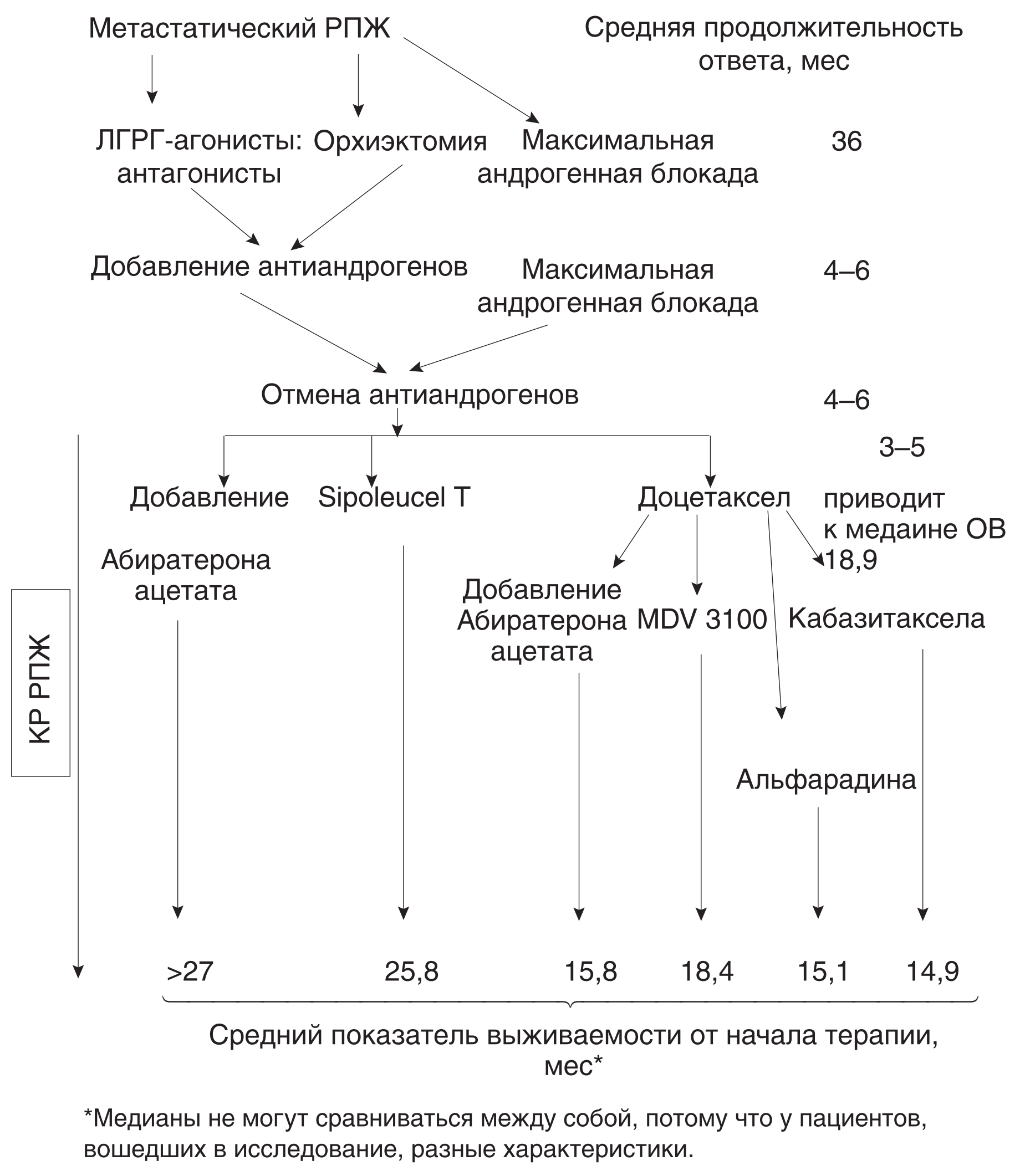
Синдром отмены антиандрогенов
Приблизительно у 1/3 пациентов наблюдается улучшение состояния после отмены антиандрогенов, что отражается снижением уровня ПСА >50% с медианой продолжительности эффекта около 4 мес. Ответ на отмену антиандрогенов также описан для бикалутамида и мегестрола ацетата.
Необходимо рассматривать отмену антиандрогенов как терапию первой линии у пациентов с рецидивом РПЖ, даже несмотря на его ограниченную эффективность (УД: 2).
Альтернативные варианты лечения после первичной гормональной терапии
Бикалутамид
Бикалутамид — препарат с дозозависимым ответом, т.е. при более высоких дозах наблюдается большее снижение уровня ПСА. Назначение дополнительного нестероидного антиандрогена на фоне кастрационной терапии при биохимическом рецидиве приводит к снижению уровня ПСА лишь у небольшого числа пациентов.
Переход на альтернативную антиандрогенную терапию
-
Недавно появился интерес к другому простому методу, называемому альтернативной антиандрогенной терапией.
-
Вторая линия ГТ проводится с применением другого нестероидного препарата (например, первоначальный флутамид заменяется бикалутамидом и наоборот).
-
Чем выше уровень ПСА на момент начала 2-й линии терапии, тем короче выживаемость без признаков прогрессии и ниже частота биохимического ответа.
Отмена антиандрогенов с одновременным назначением кетоконазола
Одновременное добавление кетоконазола при отмене антиандрогенов вызывает снижение уровня ПСА у достоверно большего числа пациентов (32 и 11%) и удлиняет время снижения уровня ПСА (8,6 и 5,9 мес) по сравнению с отменой антиандрогенов без терапии кетоконазолом.
Эстрогены
У 24–80% пациентов при терапии ДЭС было получено снижение уровня ПСА с установленным показателем 2-летней общей выживаемости 63%. Однако даже при низких дозах ДЭС примерно у 1/3 пациентов (31%) развивается тромбоз глубоких вен, а у 7% — инфаркт миокарда.
ВЫБОР НАИБОЛЕЕ РАЦИОНАЛЬНОЙ СХЕМЫ ПРОВЕДЕНИЯ ВТОРОЙ ЛИНИИ ТЕРАПИИ ПРИ КАСТРАЦИОННО-РЕФРАКТЕРНОМ РПЖ
Сроки проведения 2-й линии терапии при метастатическом КР РПЖ до сих пор остаются неясными.
Определение показаний для проведения химиотерапии у пациентов с неметастатическим КР РПЖ требует дальнейших клинических исследований.
Спасительная терапия
Поскольку у всех пациентов с КР РПЖ, которые получали химиотерапию на основе доцетаксела, наблюдалось прогрессирование, проводились многочисленные клинические исследования по изучению роли спасительной терапии. Результаты свидетельствуют о том, что наиболее приемлемыми режимами являются терапия кабазитакселом, интермиттирующая химиотерапия доцетакселом и молекулярно-направленная терапия.
Методы паллиативной терапии: терапия, направленная на лечение поражений костной системы при кастрационно-резистентном раке предстательной железы
Мультидисциплинарный подход часто требует совместного участия онкологов, радиологов, урологов, психологов, медицинских сестер и социальных работников.
Метастазы, сопровождающиеся болевым синдромом
У большинства пациентов с КР РПЖ костные метастазы сопровождаются выраженным болевым синдромом. Два радиоизотопа, Sr-89 и Sа-153, могут уменьшить или купировать боль в костях у 70% пациентов, однако не рекомендуется проводить ДЛТ слишком поздно, когда боль становится некупируемой. У пациентов с костными метастазами, сопровождающимися болевым синдромом, применение Rа-233 (альфарадин или «Ксофиго») оказало выраженный паллиативный эффект и положительное влияние на показатель общей выживаемости.
Частые осложнения, вызванные костными метастазами
К наиболее частым осложнениям, вызванным костными метастазами, относятся боль в костях, разрушение позвонков, деформирующие патологические переломы и компрессия спинного мозга. Остеопороз также может быть причиной патологических переломов, поэтому необходимо проводить его профилактику (см. выше).
Применение костного цемента — эффективный метод лечения болезненных переломов, позволяющий существенно уменьшить болевой синдром и повысить качество жизни. При подозрении на компрессию спинного мозга необходимо как можно скорее назначить высокие дозы кортикостероидов и выполнить МРТ.
Бифосфонаты
Бифосфонаты применяются для ингибирования резорбции костной ткани, опосредованной предшественниками остеокластов у пациентов с КРРПЖ.
При применении золедроновой кислоты отмечалось удлинение времени до первого скелетного осложнения, что улучшало качество жизни пациентов (по данным самого крупного исследования 3-й фазы).
В настоящее время бифосфонаты показаны пациентам с КР РПЖ с костными метастазами для профилактики скелетных осложнений, хотя пока неизвестен оптимальный интервал между приемами (сейчас он составляет 3 нед или менее). Всегда нужно помнить о побочных эффектах этих препаратов, особенно аминобисфосфонатов (например, некроз верхней челюсти).
Бисфосфонаты необходимо назначать на раннем этапе лечения КР РПЖ с клиническими проявлениями. При дополнительной системной терапии следует находить способы устранения возможных побочных эффектов, развивающихся при проведении паллиативного лечения, таких как болевой синдром, запор, отсутствие аппетита, тошнота, усталость и депрессия (лечение включает паллиативную ДЛТ, кортизон, анальгетики и противорвотные средства).
Ингибиторы лиганд RANK-рецептора-активатора ядерного фактора
Денозумаб — моноклональное антитело человека, направленное против рецептора-активатора ядерного фактора/В-лиганда, является ключевым медиатором образования остеокластов. У пациентов с КР РПЖ стадии М0 денозумаб привел к увеличению показателя выживаемости без костного метастазирования по сравнению с плацебо. При проведении 3-й фазы лечения было отмечено, что эффективность и безопасность денозумаба сопоставима с золедроновой кислотой у пациентов с метастатическим КР РПЖ. Денозумаб разрешен к применению Управлением по контролю качества пищевых продуктов и лекарственных средств США для профилактики скелетных осложнений у пациентов с костными метастазами, обусловленными наличием солидных опухолей.
| Рекомендации | УД | СР |
|---|---|---|
После терапии доцетакселом при прогрессии РПЖ применение кабазитаксела является эффективным методом лечения КР РПЖ |
1b |
А |
После терапии доцетакселом при прогрессии РПЖ применение абиратерона и энзалутамида является эффективным методом лечения КР РПЖ |
1b |
А |
До сих пор не разработана окончательная стратегия в отношении выбора лечения (какой из препаратов использовать для проведения терапии) |
4 |
| Рекомендации | УД | СР |
|---|---|---|
Рекомендуется прекращать терапию антиандрогенами при выявлении биохимической (ПСА) прогрессии |
В |
|
Невозможно дать чёткие рекомендации по наиболее эффективному препарату для 2-й линии терапии (гормональная терапия или химиотерапия), так как не существует чётких прогностических факторов |
С |
|
Одним из возможных вариантов считается спасительная гормональная терапия 2-й линии с использованием абиратерона ацетата. Следует помнить, что одна из двух первично поставленных целей основополагающего исследования (улучшение общей выживаемости) не была достигнута |
А |
|
Комментарий: через 4–6 нед после прекращения приёма флутамида или бикалутамида становится очевидным эффект отмены антиандрогенов |
| Рекомендации | СР |
|---|---|
При консультировании, наблюдении и лечении пациентов с КР РПЖ необходимо использовать мультидисциплинарный подход |
|
При неметастатическом КР РПЖ цитотоксическую терапию следует применять только в рамках клинических исследований |
В |
У пациентов с изолированным повышением уровня ПСА необходимо определить 2 последовательных увеличения уровня ПСА выше предыдущего значения |
В |
Терапию 2-й линии не назначают до тех пор, пока уровень тестостерона в крови пациентов не достигнет значения <50 нг/дл |
В |
Терапию 2-й линии не назначают до тех пор, пока уровень ПСА в крови пациентов не достигнет значения >2 нг/дл. Это необходимо для правильной интерпретации эффективности лечения |
В |
До начала лечения необходимо обсуждать индивидуально с каждым пациентом потенциальные преимущества и возможные побочные эффекты 2-й линии терапии |
С |
У пациентов с метастатическим КР РПЖ, которым показана цитотоксическая терапия, препаратом выбора является доцетаксел в дозе 75 мг/м2 каждые 3 нед, потому что он дает достоверное преимущество в показателе выживаемости |
А |
У пациентов с клиническими проявлениями костных метастазов при КР РПЖ возможными вариантами являются терапия доцетакселом или митоксантроном в комбинации с преднизолоном или гидрокортизоном. При отсутствии противопоказаний преимущество отдается доцетакселу, так как он достоверно уменьшает болевой синдром |
А |
У пациентов с рецидивом после первой линии ХТ доцетакселом препаратами выбора для 2-й линии терапии являются кабазитаксел, абиратерон и энзалутамид |
А |
2-я линия терапии доцетакселом может быть предложена пациентам, у которых был ответ на предыдущий курс терапии данным препаратом |
В |
В противном случае лечение может быть осуществлено с учетом индивидуальных особенностей пациента. В случаях когда пациентам не подходит кабазитаксел, абиратерон или энзалутамид, возможным вариантом может быть повторное назначение доцетаксела |
А |
При лечении с использованием альфарадина можно добиться лучших показателей выживаемости у пациентов с симптомами костных метастазов при КР РПЖ, которым невозможно провести лечение доцетакселом, или если наблюдается прогрессирование заболевания после приема доцетаксела |
А |
| Рекомендации | СР |
|---|---|
Лечение пациентов с клиническими проявлениями обширных костных метастазов должно быть направлено на улучшение качества жизни пациентов и, главным образом, на купирование болевого синдрома |
А |
Основная цель терапии — достижение высокой эффективности лечения и низкой частоты побочных эффектов |
А |
Пациентам со скелетными метастазами для профилактики скелетных осложнений можно назначать определенные препараты с протективным действием (денозумаб эффективнее, чем золедроновая кислота). Однако необходимо взвесить преимущества и недостатки (токсичность) данных препаратов, в особенности избегать развития некроза верхней челюсти |
А |
При использовании денозумаба или бифосфонатов необходимо систематически назначать препараты кальция и витамина D |
А |
При лечении костных метастазов, сопровождающихся болевым синдромом, рекомендуется проводить паллиативную терапию на раннем этапе, например радионуклидное облучение, ДЛТ и адекватное применение анальгетиков |
В |
У пациентов с неврологическими симптомами необходимо срочное оперативное лечение или декомпрессионная лучевая терапия. Во всех случаях первоначально необходимо назначать высокие дозы кортикостероидов |
А |
НАБЛЮДЕНИЕ ЗА ПАЦИЕНТАМИ ПОСЛЕ РАЗЛИЧНЫХ МЕТОДОВ ЛЕЧЕНИЯ РПЖ — ОТДЕЛЬНЫЕ МОМЕНТЫ
-
После радикальной простатэктомии определение уровня ПСА рекомендуется каждые 3 мес в течение 1 года, каждые 6 мес в течение 2-го и 3-го года, далее ежегодно.
-
Три последовательных повышения уровня ПСА после минимального значения, достигнутого после лучевой терапии (надира), определяют как рецидив заболевания.
-
Пальпируемый опухолевый узел и повышение уровня ПСА свидетельствуют о развитии местного рецидива.
-
Биопсия рецидивной опухоли под контролем трансректального УЗИ показана при планировании второй линии радикального лечения.
-
При боли в костях показана сцинтиграфия скелета (независимо от уровня ПСА).
Прогноз
Прогноз определяется стадией, на которой выявлен РПЖ, а также степенью дифференцировки опухоли и уровнем ПСА. Пятилетняя безрецидивная выживаемость больных с I–II стадией после проведения радикального лечения (радикальной простатэктомии и лучевой терапии) составляет 70–90%, общая выживаемость — 85–97%. При выявлении РПЖ на стадии метастатического процесса средний период до прогрессирования процесса на фоне лечения составляет 24–36 мес.
ЛИТЕРАТУРА
-
Alavi A.S., Soloway M.S., Vaidya A. et al. Local anesthesia for ultrasound guided prostate biopsy: A prospective randomized trial comparing 2 methods // J. Urol. — 2001. — Vol. 166. — № 4. — Р. 1343–1345.
-
Albertsen P.C., Hanley J.A., Gleason D.F., Barry M.J. Competing risk analysis of men aged 55 to 74 years at diagnosis managed conservatively for clinically localized prostate cancer // JAMA. — 1998. — Vol. 280. — Р. 975–980.
-
Allepus Losa C.A., Sana Velez J.I., Gil Sanz M.J. et al. Seminal vesical biopsy in prostate cancer staging // J. Urol. — 1995. — Vol. 154. — Р. 1407–1411.
-
Andersson S.B., Gunnarsson P.O., Nilsson T. et al. Metabolism of estramustine phosphaye (Estracyt) in patients with prostatic carcinoma // Eur.J. Drug. Metab. Pharmacokinet. — 1981. — Vol. 6. — Р. 149–154.
-
Aron M., Rajeev T.P., Gupta N.P. Antibiotic prophylaxis for transrectal needle biopsy of the prostate: A randomized controlled study // B.J. U. Int. — 2000. — Vol. 85. — № 6. — Р. 682–685.
-
Benson M.C., Olsson C.A. Prostate specific antigen density — roles in patient evaluation and management // Cancer. — 1994. — Vol. 74. — Р. 1667–1673.
-
Black R.J., Bray F., Ferlay J., Parkin D.M. Cancer incidence and mortality in the European Union: cancer registry data and estimates of national incidence for 1990 // Eur.J. Cancer. — 1997. — Vol. 33. — Р. 1075–1107.
-
Blasko J.C., Grimm P.D., Sylvester J.E. et al. Palladium103 brachytherapy for prostate carcinoma // Int.J. Radiat. Oncol. Biol. Phys. — 2000. — Vol. 46. — Р. 839–850.
-
BocconGibod L., Fournier G., Bottet P. et al. Flutamide versus orchidectomyin the treatment of metastatic prostate carcinoma // Eur. Urol. — 1997. — Vol. 32. — Р. 391–395; discussion 395–396.
-
BocconGibod L., Ravery V., Vordos D. et al. Radical prostatectomy for prostatecancer: the perineal approach increases the risk of surgically induced positive marginsand capsular incisions // Urol. — 1998. — Vol. 160. — Р. 1383–1385.
-
Brachman D.G., Thomas T., Hilbe J., Beyer D.C. Failure free survival following brachytherapy alone or external beam irradiation alone for T12 prostate tumors in 2222 patients: results from a single practice // Int.J. Radiat. Oncol. Biol.
-
Byar D.P., Corle D.K. Hormone therapy for prostate cancer: results of the Veterans Administration Cooperative Urological Research Group studies // NCI Monogr. — 1988. — № 7. — Р. 165–170.
-
Carter H.B., Pearson J.D., Metter E.J. et al. Longitudinal evaluation of prostatespecific antigen levels in men with and without prostate disease // JAMA. — 1992. — Vol. 267. — Р. 2215–2220.
-
Catalona W.J., Beiser J.A., Smith D.S. Serum free prostatespecifi c antigen and prostatespecific antigen density measurements for predicning cancer in men with prior negative prostatic biopsies // J. Urol. — 1997. — Vol. 158. — Р.2162–2167.
-
Catalona W.J., Richie J.P., Ahmann F.R. et al. Comparison of digital rectal examination and serum prostate specific antigen (PSA) in the early detection of prostate cancer: results of a multicenter clinical trial of 6630 men // J. Urol. — 1994. — Vol. 151. — Р. 1283–1290.
-
Catalona W.J., Smith D.S. 5-year tumor recurrence rates after anatomicalradical retropubic prostatectomy for prostate cancer // J. Urol. — 1994. — Vol. 152. — Р.1837–1842.
-
Catalona W.J., Southwick P.C., Slawin K.M. et al. Comparison of percent free PSA, PSA density and age specific PSA cutofffs for prostate cancer detection and staging // Urology. — 2000. — Vol. 56. — № 2. — Р. 255–260.
-
Chang A., Yeap B., Davis T. et al. Doubleblind randomized study of primary hormonal treatment of stage D2 prostate carcinoma: flutamide versus diethylstilbestrol // J. Clin. Oncol. — 1996. — Vol. 14. — Р. 2250–2257.
-
Chodak G.W. Early detection and screening for prostatic cancer // Urology. — 1989. — V. 34. — Suppl. 4. — Р. 10–12.
-
Chodak G.W., Thisted R.A., Gerber G.S. Results of conservative management of clinically localized prostate cancer // N.Eng. J. Med. — 1994. — Vol. 330. — Р.242–248.
-
Consensus statement: guidelines for PSA following radiation therapy. American Society for Therapeutic Radiology and Oncology Consensus Panel // Int.J. Radiat. Oncol. Biol. Phys. — 1997. — Vol. 37. — Р. 1035–1040.
-
Cox R.L., Crawford E.D. Estrogens in the treatment of prostate cancer // J. Urol. — 1995. — V. 154. — Р. 1991–1998.
-
Crawford E.D., Schutz M.J., Clejan S. et al. The efffect of digital rectal examination on prostatespecific antigen levels // JAMA. — 1992. — Vol. 267. — Р. 2227– 2228.
-
Culig Z., Hobisch A., Cronauer M.V. et al. Androgen recettor activation inprostate tumor cell lines by insulin like growth factor 1, keratinocyte growth factor, and epidermal growth factor // Cancer. Res. — 1994. — Vol. 54. — Р.5474–5478.
-
Davidson P.J., van den Ouden D., Schroeder F.H. Radical prostatectomy: prospective assessment of mortality and morbidity // Eur. Urol. — 1996. — Vol. 29. — Р. 168–173.
-
Davis M., Sofer M., Kim S.S., Soloway M.S. The procedure of transrectalultra sound guided biopsy of the prostate: a survey of patient preparation and biopsy technique // J. Urol. — 2002. — Vol. 167. — № 2. — Pt. 1. — Р. 566–570.
-
Debruyne F. Hormonal therapy of prostate cancer // Semin. Urol. Oncol. — 2002. — Vol. 3. — Suppl. 1. — Р. 4–9.
-
Decensi A.U., Boccardo F., Guarneri D. et al. Monotherapy with nilutamide, a pure nonsteroidal antiandrogen, in untreated patients with metastatic carcinoma of the prostate. The Italian Prostatic Cancer Project // J. Urol. — 1991. — Vol. 146. — Р. 377–381.
-
Denis L., Morton M.S., Griffi ths K. Diet and its preventive role in prostatic disease // Eur. Urol. — 1999. — Vol. 35. — Р. 377–387.
-
Djavan B., Remzi M., Marberger M. Prostate biopsy: who, how and when? In: Prostate Cancer (science and clinical practice) J.H. Mydlo, C.J. Godec (eds.) — Elseiver Ltd, London, 2003. — P. 77–85.
-
Edwards J.E., Moore R.A. Finasteride in the treatment of clinical benignprostatic hyperplasia: A systematic review of randomized trials // BMC Urology. — 2002. — Vol. 2. — Р. 14.
-
Ekman P. Predicting pelvic lymph node involvement in patients with localized prostate cancer // Eur. Urol. — 1997. — Vol. 32. — Suppl. 3. — Р. 60–64.
-
Ellis W.J., Chetner M.Р., Preston S.D., Brawer M.K. Diagnosis of prostatecarcinoma: the yield of serum prostate specific antigen, digital restal examination, and transrectal ultrasonography // J. Urol. — 1994. — Vol. 152. — Р.1520–1525.
-
Enlund A., Pedersen K., Boeryd B., Varenhorst E. Transrectal ultrasonography compared to histopathological assessment for local staging of prostatic carcinoma // Acta. Radiol. — 1990. — Vol. 31. — № 6. — Р. 597–600.
-
Fiveash J.B., Hanks G., Roach M. et al. 3D conformal radiation therapy (3DCRT) for high grade prostate cancer: A multiinstitutional review // Int.J. Radiat. Oncol. Biol. Phys. — 2000. — Vol. 47. — Р. 335–342.
-
Garnick M.B. Leuprolide versus diethylstilbestrol for previously untreated stage D2 prostate cancer: results of a prospectively randomized trial //Urology. — 1986. — Vol. 27. — Р. 21–28.
-
Gerber G.S., Chodak G.W. Routine screening for cancer of the prostate // J. Natl. Cancer. Inst. — 1991. — Vol. 83. — Р. 329–335.
-
Giovannucci E., Rimm E.B., Liu Y. et al. A prospective study of tomato products, lycopene, and prostate cancer risk // J. Natl. Cancer. Inst. — 2002. — Vol. 94. — № 5. — Р. 391–398.
-
_Gittes R. Carcinoma of the prostate // N.Eng. J. Med. — 1991. — Vol. 324. — Р.236–245.
-
Greenlee R.T., HillHarmon M. B., Murray T. et al. Cancer statistics, 2001 // CA. Cancer. J. Clin. — 2001. — Vol. 51. — Р. 15–36.
-
Gronberg H., Damber L., Damber J.E. Familian prostate cancer in Sweden: A nationwide register cohort study // Cancer. — 1996. — Vol. 77. — Р. 138–143.
-
Gullionneu B., Debras B., Veillon B. et al. Indications for preoperative vesicle biopsies in staging of clinically localized prostatic cancer // Eur. Urol. — 1997. — Vol. 32. — Р. 160–165.
-
Haggman M.J., Macoska J.A., Wojno K.J., Oesterling J.E. The relationship between prostatic intraepithelial neoplasia and prostate cancer: critical issues // J. Urol. — 1997. — Vol. 158. — № 1. — Р. 12–22.
-
Harnett D.R., Raghavan D., Caterson I. Aminoglutethimide in advanced prostate carcinoma // Br.J. Urol. — 1987. — Vol. 59. — Р. 323–327.
-
Hasan W.A., Gill I.S. Laparoscopic radical prostatectomy: current status // BJU Int. — 2004. — Vol. 94. — Р. 7–11.
-
Hautmann R.E., Sauter T.W., Wenderoth U.K. Radical retropubic prostatectomy: morbidity and urinary continence in 418 consecutive cases // Urology. — 1994. — Vol. 43. — Р. 47–51.
-
Hedlund P.O., Henriksson P. Parenteral estrogen versus total androgen ablation in the treatment of advanced prostate carcinoma: efffects on overall survival and cardiovascular mortality. The Scandinavian Prostatic Cancer Group (SPCG) 5 Trial Study // Urology. — 2000. — Vol. 55. — Р. 328–333.
-
Heinonen O.P., Albanes D., Virtamo J. et al. Prostate cancer and supplementation with alphatocopherol and betacarotene: incidence and mortality in a controlled trial // J. Natl. Cancer. Inst. — 1998. — Vol. 90. — №6. — Р. 440–446.
-
Hodge K.K., McNeal J. E., Terris M.K., Stamey T.A. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate // J. Urol. — 1989. — Vol. 142. — № 1. — Р. 71–74; discussion 74–75.
-
Hricak H., Dooms G.C., Jeffrey R. B. et al. Prostatic carcinoma: staging byclinical assessment, CT, and MR imaging // Radiology. — 1987. — Vol. 162. — Р. 331–336.
-
Issa M.M., Bux S., Chun T. et al. A randomized prospective trial of intrarectal lidocaine for pain control during transrectal prostate biopsy: the Emory University experience // J. Urol. — 2000. — Vol. 164. — № 2. — Р. 397–399.
-
Iversen P., Tyrrell C.J., Kaisary A.V. Bicalutamide monotherapy compared with castration in patients with nonmetastatic locally advanced prostate cancer: 6.3 years of follow-up // J. Urol. — 2000. — Nov. — Vol. 164. — № 5. — Р. 1579– 1582.
-
Jacobsen B.K., Knutsen S.F., Fraser G.E. Does high soy milk intake reduceprostate cancer incidence. The Adventist Health Study (United States) Cancer Causes Control. — 1998. — Vol. 9. — № 6. — Р. 553–557.
-
Jensen O.M., Esteve J., Moller H., Renard H. Cancer in European Community and its member status // Eur.J. Cancer. — 1990. — Vol. 26. — Р. 1167–1256.
-
Kajaer T.B., Nilsson T., Madsen P.O. Efffect of estramustine phosphate on plasma testosterone during treatment of carcinoma of the prostate // Urology. — 1975. — Vol. 5. — Р. 802–804.
-
Kattan M.W., Zelefsky M.J., Kupelian P.A. et al. Pretreatment nomogram for predicting the outcome of three dimensional conformal radiotherapy in prostate cancer // J. Clin. Oncol. — 2000. — Vol. 19. — Р. 3352–3359.
-
Keetch D.W., Catalona W.J., Smith D.S. Serial prostatic biopsies in men with persistently elevated serum prostate specific antigen values // J. Urol. — 1994. — Vol. 151. — № 6. — Р. 1571–1574.
-
Kirby R.S., Christmas T.J., Brawer M.K. Treatment of localized prostatecancer: radical prostatectomy and radiation therapy. In: Prostate Cancer (2nd ed.). — Mosby, London, 2001. — P. 115–138.
-
Kuhn J.M., Billebaud T., Navratil H. et al. Prevention of the transient adverse efffects of a gonadotropin releasing hormone analogue (buserelin) in metastaticprostatic carcinoma by administration of an antiandrogen (nilutamide) // N.Eng. J. Med. — 1989. — Vol. 321. — Р. 413–418.
-
Kupelian P.A., Mohan D.S., Lyons J. et al. Higher than standard radiation doses (> or =72 Gy) with or without androgen deprivation in the treatment of localized prostate cancer // Int.J. Radiat. Oncol. Biol. Phys. — 2000. — Vol. 46. — Р. 567–574.
-
Lee F., TorpPedersen S. T., Siders D.B. et al. Transrectal ultrasound in the diagnosis and staging of prostate cancer // Radiology. — 1989. — Vol. 170. — Р. 609–615.
-
Lerner S.E., Blute M.L., Lieber M.M., Zincke H. Morbidity of contemporaryradical retropubic prostatectomy for localized prostate cancer // Oncology. — 1995. — Vol. 9. — Р. 379–382.
-
Link R.E., Morton R.A. Indications for pelvic lymphadenectomy in prostatecancer // Urol. Clin. North. Am. — 2001. — Vol. 28. — №3. — Р. 491–498.
-
Lodding P., Aus G., Bergdahl S. et al. Characteristics of screening detected prostate cancer in men 50 to 66 years old with 3 to 4 ng/ml prostate specifi c antigen // J. Urol. — 1998. — Vol. 159. — Р. 899–903.
-
Lundgren R., Nordle O., Josefsson K. Immediate estrogen or estramustine phosphate therapy versus deferred endocrine treatment in nonmetastatic prostate cancer: A randomized multicenter study with 15 years of follow-up. The South Sweden Prostate Cancer Study Group // J. Urol. — 1995. — Vol. 153. — Р. 1580–1586.
-
Mettlin C., Murphy G.P., Babaian R.J. et al. The results of a five-year early prostate cancer detection intervention. Investigators of the American Cancer Society National Prostate Cancer Detection Project // Cancer. — 1996. — Vol. 77. — № 1. — Р. 150–159.
-
Murphy G.P., Beckley S., Brady M.F. et al. Treatment of newly diagnosed metastatic prostate cancer patients with chemotherapy agents in combination with hormones versus hormones alone // Cancer. — 1983. — Vol. 51. — Р. 1264–1272.
-
Nag S., Beyer D., Friedland J. et al. American Brachytherapy Society (ABS) recommendations for transperineal permanent brachytherapy of prostate cancer.
-
Nazareth I.V., Weigel N.L. Activation of the human androgen receptor through a protein kinase A signaling pathway // J. Biol. Chem. — 1996. — Vol. 271. — Р. 19900–19907.
-
Oesterling J.E. PSA leads the way for detecting and following prostate cancer // Contemp. Urol. — 1993. — Vol. 5. — Р. 60–81.
-
Oesterling J.E., Jacobsen S.J., Chute C.G. et al. Serum prostate specifi c antigen in a community based population of healthy men: establishment of age specific reference ranges // JAMA. — 1993. — Vol. 270. — Р. 860–864.
-
Oesterling J.E., Martin S.K., Bergstralh E.J., Lowe F.C. The use of prostate specific antigen in staging patients with newly diagnosed prostate cancer //JAMA. — 1993. — Vol. 69. — Р. 7–60.
-
Ohori M., Goad J.R., Wheeler T.M. et al. Can radical prostatectomy alter the progression of poorly diffferentiated prostate cancer // J. Urol. — 1994. — Vol. 152. — Р. 1843–1849.
-
Parkin D.M., Pisani P., Ferlay J. Estimates of worldwide incidence of eighteenmajor cancers in 1985 // Int.J. Cancer. — 1993. — Vol. 54. — Р. 594–606.
-
Partin A.W., Kattan M.W., Subong E.N. P. et al. Combination of prostatespecific antigen, clinical stage and Gleason score to predict pathological stage of localized prostate cancer // JAMA. — 1997. — Vol. 227. — Р. 1445–1451.
-
Partin A.W., Pound C.R., Clemens J.Q. et al. Serum PSA after anatomic radical prostatectomy. The Johns Hopkins experience after 10 years // Urol. Clin. North. Am. — 1993. — Vol. 20. — Р. 713–725.
-
Partin A.W., Yoo J., Carter H.B. et al. The use of prostate specifi c antigen, clinical stage and Gleason score to predict pathological stage in men with localized prostate cancer // J. Urol. — 1993. — Vol. 150. — Р. 110–114.
-
Patel U., Rickards D. The diagnostic value of colour Doppler flow in the peripheral zone of the prostate, with histological correlation // Br.J. Urol. — 1994. — Vol. 74. — № 5. — Р. 590–595.
-
PavoneMacaluso M., de Voogt H.J., Viggiano G. et al. Comparison of diethylstilbestrol, cyproterone acetate and medroxyprogesterone acetate in the treatmentof advanced prostatic cancer: Final analysis of a randomized phase III trial of the European Organization for Research on Treatment of Cancer Urological Group // J. Urol. — 1986. — Vol. 136. — Р. 624–631.
-
Pedersen K.V., Carlson P., Varenhorst E. et al. Screening for carcinoma of the prostate by digital rectal examination in a randomly selected population // B.M. J. — 1990. — Vol. 300. — Р. 1041–1044.
-
Peeling W.B. Phase III studies to compare goserelin (Zoladex) with orchiectomy and with diethylstilbestrol in treatment of prostatic carcinoma // Urology. — 1989. — Vol. 33. — Р. 45–52.
-
Perez C.A. Prostate. In: Principles and Practice of Radiation Oncology (3rd ed.) / C.A. Perez, L.W. Brady (eds.). — Lippincott, Philadelphia, 1998. — P. 1583– 1694.
-
Perez C.A., Hanks G.E., Leibel S.A. et al. Localized carcinoma of the prostate (stages T1B, T1C, T2, and T3). Review of management with external beam radiation therapy // Cancer. — 1993. — Vol. 72. — Р. 3156–3159.
-
Petrylak D.P., Macarthur R.B., O’Connor J. et al. Phase I trial of docetaxel with estramustine in androgenin-dependent prostate cancer // J. Clin. Oncol. — 1999. — Vol. 17. — Р. 958–967.
-
Pienta K.J., Redman B.G., Bandekar R. et al. A phase II trial of oral etoposidein hormonal refractory prostate cancer // Urology. — 1997. — Vol. 50. — Р. 401– 406.
-
Platt J.F., Bree R.L., Schwab R.E. The accuracy of CT in the staging of carcinoma of the prostate // Am.J. Roentgenol. — 1987. — Vol. 149. — Р. 315–318.
-
Pollack A., Zagars G.K., Starkschall G. et al. Prostate cancer radiation dose response: results of the M.D. Anderson phase III randomized trial // Int.J. Radiat. Oncol. Biol. Phys. — 2002. — Vol. 53. — Р. 1097–1105.
-
Pollack J.M. Radiation therapy options in the treatment of prostate cancer // Cancer. Invest. — 2000. — Vol. 18. — Р. 66–71.
-
Pont A. Long-term experience with high dose ketokonazole therapy in patients with D2 prostate carcinoma // J. Urol. — 1987. — Vol. 137. — Р. 902–904.
-
Quinn M., Babb P. Patterns and trends in prostate cancer incidence, survival, prevalence and mortality. Part I: international comparisons // BJU Int. — 2002. — Jul. — Vol. 90. — № 2. — Р. 162–173.
-
Ragde H., Korb L.J., Elgamal A.A. et al. Modern prostate brachytherapy. Prostate specific antigen results in 219 patients with up to 12 years of observed followup // Cancer. — 2000. — Vol. 89. — Р. 135–141.
-
Rassweiler J., Frede T. Robotics, telesurgery and telementoring — their position in modern urological laparoscopy.
-
Rassweiler J., Schulze M., Teber D. et al. Laparoscopic radical prostatectomy: functional and oncological outcomes // Curr. Opin. Urol. — 2004. — Vol. 14. — Р.75–82.
-
Ries L.A. G., Kosary C.L., Hankey B.F. et al. SEER Cancer Statistics Review 1973–1995. Bethesda, MD. — National Cancer Institute, 1998.
-
Rorvik J.,Halvorsen O.J.,Servoll E., Haukaas S. Transrectalultrasonographyto assess local extent of prostatic cancer before radical prostatectomy // Br.J. Urol. — 1994. — Vol. 73. — № 1. — Р. 65–69.
-
Scardino R.T., Abbas F., Bolla M. et al. Management of Localized and Regional Diseases. In: Prostate Cancer. L. Denis, G. Bartsch, S. Khoury et al. (eds.). — 2003. — P. 217–249.
-
Schellhammer P.F. Combined androgen blocade for the treatment of metastatic cancer of the prostate // Urology. — 1996. — Vol. 47. — Р. 622–628.
-
Schnall M.D., Imai Y., Tomaszewski J. et al. Prostate cancer: local staging with endorectal surface coil MR imaging // Radiology. — 1991. — Vol. 178. — Р.797–802.
-
Schroeder F.H., Whelan P., Kurth K.H. et al. Antiandrogens as mono-therapy for metastatic prostate cancer: A preliminary report of EORTC protocol30892. In: Recent Advances in Prostate Cancer and BPH. — London: Parthenon, 1997. — P. 141–146.
-
Scolieri M.J., Resnick M.I. The technique of radical perineal prostatectomy// Urol. Clin. North. Am. — 2001. — Vol. 28. — Р. 521–533. Screening for prostate cancer: an update of the evidence for the US Preventive Services Task Force // Ann. Intern. Med. — 2002. — Vol. 137. — Р. 917–929.
-
Seidenfeld J., Samson D.J., Hasselblad V. et al. Single therapy androgen suppression in men with advanced prostate cancer: A systematic review and metaanalysis // Ann. Intern. Med. — 2000. — Vol. 32. — Р. 566–577.
-
Sharief Y., Wilson E.M., Hall S.H. et al. Androgen receptor gene mutations associated with prostatic carcinoma. — Proc 86th AACR Meeting, Toronto, Ontario, Canada, 1995. — Vol. 36 (abstr.). — P. 1605.
-
Shekarriz B., Upadhyay J., Wood D.P. Intraoperative, perioperative, and longterm complications of radical prostatectomy // Urol. Clin. North. Am. — 2001. — Vol. 28. — Р. 639–653.
-
Shipley W.U., Zietman A.L., Hanks G.E. et al. Treatment related sequelae following external beam radiation for prostate cancer: A review with an update in patients with stages T1 and T2 tumor // J. Urol. — 1994. — Vol. 152. — Р. 1799–1805.
-
Smith J.A., Lange R.A., Janknegt R.A. et al. Serum markers as a predictor of response duration and patient survival after hormonal therapy for metastatic carcinoma of the prostate // J. Urol. — 1997. — Vol. 157. — Р. 1329–1334.
-
Stanford J.L., Stephenson R.A., Coyle L.M. et al. Prostate Cancer Trends 1973–1995, SEER Program, National Cancer Institute, NIH Pub., N 99–4543, Bethesda, MD, 1999.
-
Steinberg G.D., Carter B.S., Beaty T.H. et al. Family history and the risk of prostate cancer // Prostate. — 1990. — Vol. 17. — Р. 337–437.
-
Suzuki H., Sato N., Watabe Y. et al. Androgen receptor gene mutations in human prostate cancer // J. Steroid. Biochem. Mol. Biol. — 1993. — Vol. 46. — Р. 759–765.
-
Tannock I.F., Osoba D., Stockler M.R. et al. Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone resistant prostate cancer: a Canadian randomized trial with palliative end points // J. Clin. Oncol. — 1996. — Vol. 14. — Р. 1756–1764.
-
Thompson I.M., Goodman P.J., Tangen C.M. et al. The influence of fi nasteride on the development of prostate cancer // N.Eng. J. Med. — 2006. — Vol. 349. — Р. 213–222.
-
Tilley W.D., Buchanan G., Hickey T.E. et al. Mutations in the androgen receptor gene are associated with progression of human prostate cancer to androgen independence // Clin. Cancer. Res. — 1996. — Vol. 2. — Р. 227–285.
-
Trachtenberg J., Halpern N., Pont A. Ketokonazole: a novel and rapid treatment for advanced prostatic cancer // J. Urol. — 1983. — Vol. 130. — Р. 152–153.
-
Trapasso J.G., de Kernion J.B., Smith R.B., Dorey F. The incidence and significance of detectable levels of serum prostate specific antigen after radical prostatectomy // J. Urol. — 1994. — Vol. 152. — Р. 1821–1825.
-
Tyrrell C.J., Kaisary A.V., Iversen P. et al. A randomized comparison of «Casodex» (bicalutamide) 150 mg monotherapy versus castration in the treatment of metastatic and locally advanced prostate cancer // Eur. Urol. — 1998. — Vol. 33. — № 5. — Р. 447–456.
-
US Preventive Services Task Force. Guide to Clinical Preventive Services, 2nd ed. — Washington, DC: Offifice of Disease Prevention and Health Promotion, 1996.
-
Valicenti R., Lu J., Pilepich M. et al. Survival advantage from higher doseradiation therapy for clinically localized prostate cancer treated on the Radiation Therapy Oncology Group trials // J. Clin. Oncol. — 2000. — Vol. 18. — Р. 2740–2746.
-
Veldscholte J., RisStalpers C., Kuiper G. et al. A mutation in the ligand binding domain of the androgen receptor of human LNCaP cells afffects steroid binding characteristics and response to antiandrogens // Biochem. Biophis. Res. Commun. — 1990. — Vol. 173. — Р. 534–540.
-
Visacorpi T., Hyytinen E., Koivisto P. et al. In vivo amplification of the androgen receptor gene and progression of human prostate cancer // Nature Genet. — 1995. — Vol. 9. — Р. 401–406.
-
Walsh P.C., Donker P.J. Impotence following radical prostatectomy: insight into etiology and prevention // J. Urol. — 1982. — Vol. 128. — Р. 492–497.
-
Waselenko J.K., Dawson N.A. Management of progressive metastatic prostate cancer // Oncology. — 1997. — Vol. 11. — Р. 1551–1560.
-
Waymont B., Lynch T.H., Dunn J.A. et al. Phase III randomized study of zoladex versus stilboestrol in the treatment of advanced prostate cancer // Br.J. Urol. — 1992. — Vol. 69. — Р. 614–620.
-
Weldon V.E., Tavel F.R., Neuwirth H., Cohen R. Patterns of positive specimen margins and detectable prostate specific antigen after radical perineal prostatectomy // J. Urol. — 1995. — Vol. 153. — Р. 1565–1569.
-
Wolff J.M. Intermittent androgen ablation as a treatment for prostate cancer // Front. Radiat. Ther. Oncol. — 2002. — Vol. 36. — Р. 66–71.
-
Wolff J.M., Ittel T.H., Borchers H. et al. Metastatic workup of patients with prostate cancer employing alkaline phosphatase and skeletal alkaline phosphatase // Anticancer Res. — 1999. — Vol. 19. — Р. 2653–2655.
-
Wolf J.S. Jr., Cher M., Dall’era M. et al. The use and accuracy of cross-sectional imaging and fine needle aspiration cytology for detection of pelvic lymph node metastases before radical prostatectomy // J. Urol. — 1995. — Vol. 153. — Р. 993–999.
-
Yoshizawa K., Willett W.C., Morris S.J. et al. Study of prediagnostic selenium level in toenails and the risk of advanced prostate cancer // J. Natl. Cancer. Inst. — 1998. — Vol. 90. — №16. — Р. 1219–1224.
-
Zelefsky M.J., Hollister T., Raben A. et al. Five-year biochemical outcome and toxicity with transperineal CT planned permanent I125 prostate implantation for patients with localized prostate cancer // Int.J. Radiat. Oncol. Biol. Phys. — 2000. — Vol. 47. — Р. 1261–1266.
-
Zelefsky M.J., Leibel S.A., Gaudin P.B. et al. Dose escalation with three dimensional conformal radiation therapy afffects the outcome in prostate cancer // Int.J. Radiat. Oncol. Biol. Phys. — 1998. — Vol. 41. — Р. 491–500.
-
Zincke H., Oesterling J.E., Blute M.L. et al. Long-term (15 years) resultsafter radical prostatectomy for clinically localized (stage T2c or lower) prostate cancer // J. Urol. — 1994. — Vol. 152. — Р. 1850–1857.
-
Zlotta A.R., Djavan B., Marberger M., Schulman C.C. Prostate specifi c antigen of the transition zone: a new parameter for prostate cancer prediction // J.Urol. — 1997. — Vol. 157. — Р. 1315–1321.
-
Zlotta A.R., Raviv G., Schulman C.C. Clinical prognostic criteria for later diagnosis of prostate carcinoma in patients with initial isolated prostatic intraepithelial neoplasia // Eur. Urol. — 1996. — Vol. 30. — № 2. — Р. 249–255.
-
Tannock I.F., de Wit R., Berry W.R. et al. Docetaxel plus prednisone ormitoxantrone plus prednisone for advanced prostate cancer // N.Eng. J.Med. — 2004, Oct 7. — Vol. 351. — №15. — Р. 1502–1512.
-
Andriole G.L., Grubb R.L., Buys S.S. et al. Mortality results from a randomized prostate-cancer screening trial. N Engl J Med 2009;360:1310.
-
Schroder F.H., Hugosson J., Roobol M.J. et al. Screening and prostate-cancer mortality in a randomized European study. N Engl J Med 2009;360:1320.
-
Hugosson J., Carlsson S., Aus G. et al. Mortality results from the Göteborg randomized population-based prostate-canser screening trial// Lancet Oncol. 2010. Vol. 11(8). P. 725–732.
-
Schloder F.H. et al. Prostate-Cancer mortality at 11 years of follow-up. NEJM 366(1):981–990.
-
Andriole G.L., Crawford E.D. Grubb III R.L. et al. Prostate cancer screening in the randomized Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial: mortality results after 13 years of follow-up. J Natl Cancer Inst. 2012;104:125–132.
-
http://uroweb.org/fileadmin/guidelines/Guidelines_2014_5_June_2014.pdf
Глава 9. РАК ПОЧКИ
А.Д. Каприн, А.А. Костин, Б.Я. Алексеев, А.В. Говоров, Е.В. Шпоть, Д.Н. Фиев, Г.Н. Акопян, Н.В. Воробьев, А.С. Калпинский
Эпидемиология
Среди злокачественных новообразований мочеполовой системы одно из ведущих мест в мире по заболеваемости занимает почечно-клеточный рак (ПКР). Так, в 2012 г. зарегистрировано более 337 000 первичных больных ПКР и 143 369 пациентов погибло от этого заболевания [1].
В России в 2014 г. выявлено 22 234 больных со злокачественными новообразованиями почки. В структуре злокачественных новообразований ПКР составляет 4,7% у мужчин и 3,3% у женщин. По темпам прироста онкологической заболеваемости за период с 2004 по 2014 г. ПКР устойчиво занимает одно из ведущих мест (29,39%). Средний возраст больных ПКР составил 61,8 года (60,6 года у мужчин и 63,1 года у женщин). Стандартизованный показатель заболеваемости населения России злокачественными опухолями почки составил 9,7 на 100 000 населения. Рост заболеваемости ПКР обусловлен как истинными причинами, так и улучшением ранней диагностики. В настоящее время в 60% наблюдений заболевание выявляют случайно при профилактическом обследовании [2].
Несмотря на улучшение методов диагностики данной патологии, высокую частоту (40–60%) локализованного ПКР, у 25–30% больных ПКР при первичном обследовании выявляют отдаленные метастазы. Таким образом, заболеваемость запущенными формами и смертность от ПКР в России остаются высокими. Так, в 2014 г. в России от ПКР умерло 8430 человек, что составило 2,94% в структуре смертности от злокачественных новообразований, причем в последние три года впервые отмечен спад смертности на 7,08%, который, вероятно, обусловлен ранней диагностикой и улучшением лечения поздних стадий заболевания. Стандартизованный показатель смертности населения России от злокачественных опухолей почки составил 3,36 на 100 000 населения [2].
ПКР составляет 2–3% в общей структуре злокачественных новообразований [3], с высоким уровнем заболеваемости в западных странах. За последние два десятилетия заболеваемость ПКР выросла на 2% во всем мире и в Европе и продолжает снижаться в Дании и Швеции [4]. В 2012 г. в Европейском Союзе зарегистрировали 84 400 новых случаев ПКР и 34 700 больных умерли от ПКР. [5] В Европе показатели смертности от ПКР увеличивались до начала 1990-х гг. и затем стабилизировались и начали постепенно снижаться [6]. Смертность снизилась в скандинавских странах с 1980-х годов и во Франции, Германии, Австрии, Нидерландах и Италии с начала 1990-х годов. В некоторых европейских странах (Хорватия, Эстония, Греция, Ирландия, Словакия) по-прежнему показатели смертности сохраняют тенденцию роста [6].
ПКР преобладает у мужчин в соотношении 1,5:1, с пиком заболеваемости в возрасте от 60 до 70 лет. Этиологические факторы включают курение, ожирение [7], артериальную гипертензию, прием нестероидных противовоспалительных препаратов и ацетаминофена [8], вирусный гепатит [9-13]. Риск ПКР также увеличивается при наличии семейного анамнеза [14]. Ряд других факторов, связанных с более высоким или низким риском ПКР, включает конкретные пищевые продукты и профессиональные вредности, обусловленные контактом с определенными канцерогенными веществами, однако рекомендаций на этот счет пока не существует [15, 16]. Умеренное употребление алкоголя, как и овощей семейства капустных, по неизвестным причинам оказывает профилактическое действие [17-19]. Эффективная профилактика включает в себя отказ от курения и борьбу с ожирением.
Этиология
Наследственные факторы риска
Приобретенные факторы риска
-
Курение: в ряде исследований показано возрастание риска на 30– 60% у курящих по сравнению с некурящими.
-
Ожирение (увеличивает частоту заболеваемости раком почки на 20%), сахарный диабет.
-
Артериальная гипертензия: увеличивает риск развития заболевания на 20%.
-
Лекарственные препараты: длительное применение мочегонных препаратов увеличивает риск развития рака почки на 30% и более.
Профилактика
Отказ от курения и борьба с ожирением.
Скрининг
В настоящее время не проводится.
| Рекомендация | СР |
|---|---|
Наиболее важными мерами первичной профилактики ПКР являются отказ от курения и борьба с ожирением |
B |
СР – степень рекомендации.
Стадирование и классификация
-
-
Т1 Опухоль ≤ 7 см в самом большом измерении, ограниченная почкой
-
T2 Опухоль > 7 см в самом большом измерении, ограниченная почкой
-
T3 Опухоль распространяется в крупные вены, непосредственно прорастает в надпочечник, но не в ипсилатеральный надпочечник и не распространяется за пределы фасции Герота
-
T3a Опухоль распространяется в почечную вену или ее сегментарные ветви, надпочечник или распространяется на паранефральную и/или парапельвикальную клетчатку, но в пределах фасции Герота
-
T3b Опухоль распространяется в нижнюю полую вену ниже диафрагмы
-
T3c Опухоль распространяется в нижнюю полую вену выше диафрагмы или врастает в стенку нижней полой вены
-
-
T4 Опухоль распространяется за пределы фасции Герота, включая прорастание в ипсилатеральный надпочечник
Соответствие стадий опухолевого процесса в зависимости от категорий TNM представлено в табл. 9.2.
| Стадия | Категория T | Категория N | Категория M |
|---|---|---|---|
I |
T1 |
N0 |
M0 |
II |
T2 |
N0 |
M0 |
III |
T3 |
N0 |
M0 |
IV |
T1, T2, T3 |
N1 |
M0 |
|
T4 |
N любое |
M0 |
|
T любое |
N любое |
M1 |
Анатомические классификации
Анатомические классификации, такие как шкалы PADUA, R.E.N.A.L. и C-индекс, необходимы для того, чтобы стандартизировать описание опухолей почек. Эти классификации включают в себя оценку размеров опухоли, экзофитного или эндофитного характера роста, близость к собирательной системе почки и переднее или заднее расположение. Использование таких шкал полезно, поскольку оно позволяет объективно прогнозировать потенциальную сложность выполнения резекции почки и аблативных методик [26-28].
Гистологические варианты ПКР
ПКР включают широкий спектр гистологических вариантов, описанных в 2004 г. в классификации Всемирной организации здравоохранения (ВОЗ) [29] и модифицированных в Ванкуверской классификации Международного общества урологических патоморфологов (ISUP) [30]. Существуют три основных варианта ПКР: светлоклеточный, папиллярный I и II типа и хромофобный. Варианты ПКР были подтверждены с помощью цитогенетических и генетических анализов [31-33] (уровень доказательности (УД) 2b). Рак собирательных трубочек и другие редкие опухоли почек обсуждаются в разделе 3.3.
Гистологический диагноз включает помимо варианта ПКР степень ядерной дифференцировки, наличие саркоматоидного компонента, сосудистой инвазии, некрозов в опухоли и распространение в паранефральную клетчатку и собирательную систему почки. Наиболее приемлемой считается классификация по Фурману [34]. Общество ISUP предложило упрощенную классификацию как альтернативу классификации Фурмана, основанную только на размере и форме ядер [30].
Светлоклеточный рак
Светлоклеточные варианты опухолей почки, как правило, хорошо ограничены, капсула отсутствует. На срезе опухоль золотисто-желтого цвета, часто с очагами кровоизлияния и некрозом. Наиболее часто используется классификация Фурмана [34]. Наиболее часто диагностируют следующие генетические изменения: делецию 3р хромосомы и мутацию гена VHL (von Hippel – Lindau) в хромосоме 3p25. Светло-клеточный вариант ПКР имеет худший прогноз по сравнению с папиллярным и хромофобным вариантами [35, 36], даже при стратификации по стадиям [37]. Пятилетняя опухолевоспецифическая выживаемость составила 91, 74, 67 и 32% для TNM стадий I, II, III и IV соответственно (у больных, пролеченных в 1987–1998 гг.) [38]. Вялотекущим вариантом светлоклеточного ПКР является многокамерная киста почки, которая встречается в 4% всех светлоклеточных вариантов ПКР [30].
Папиллярный рак
Макроскопически папиллярный ПКР окружен псевдокапсулой чаще желтого или коричневого цвета и мягкой консистенции. Наиболее часто диагностируют следующие генетические изменения: трисомии хромосом 7 и 17 и делецию хромосомы Y. PRCC является гетерогенным, с тремя различными типами: два основных (1-й и 2-й) и третий онкоцитарный тип. По сравнению со светлоклеточным ПКР папиллярный ПКР чаще диагностируют на уровне локализованного опухолевого процесса (pT1-2N0M0). Для папиллярного ПКР характерны высокие показатели пятилетней опухолевоспецифической выживаемости [39]. Прогноз для папиллярного ПКР 2-го типа хуже, чем для 1-го типа [40-42]. Экзофитный характер роста, псевдонекротические изменения и наличие псевдокапсулы являются типичными признаками папиллярного ПКР 1-го типа. Формирование псевдокапсул и обширный некроз формируют сферическую экзофитную опухоль. Опухоли с массивными некрозами хрупки и склонны к спонтанным разрывам с последующим кровотечением в результате минимальной травмы забрюшинного пространства. Хорошо развитая псевдокапсула в pRCCs 1-го типа, вероятно, предотвращает разрыв этих опухолей, несмотря на наличие некрозов. Некротические изменения чаще формируются в центральной части опухоли, окруженной живой тканью опухоли, и при КТ рассматриваются как серпигинозные края с усиленным контрастированием [43]. Некоторые авторы считают, что онкоцитарный папиллярный ПКР не формирует псевдокапсулы или массивного некроза, редко распространяется экстраренально и обладает низким злокачественным потенциалом [42], хотя этот вид не является общепринятым [30].
Хромофобный рак
Хромофобный ПКР представлен опухолью бледно-коричневого цвета, относительно гомогенной и плотной, как правило с хорошо ограниченными массами без капсулы. G.P. Paner и соавт. в 2010 г. вместо классификации Фурмана предложили новую классификацию [44]. Наиболее часто диагностируют следующие генетические изменения: потерю хромосом 2, 10, 13, 17 и 21 [46]. Прогноз относительно благоприятный с высокими показателями пятилетней безрецидивной и десятилетней опухолевоспецифической выживаемости [47].
Другие опухоли почек
Редкие варианты опухоли почек составляют 10–15% от всех опухолей почек.
| Вариант ПКР | Потенциал злокачественности опухоли | Лечение локализованного/метастатического ПКР |
|---|---|---|
Саркоматоидные варианты ПКР |
Высокий |
Хирургическое лечение/сунитиниб, опционально гемцитабин + доксорубицин |
Мультилокальный светлоклеточный ПКР |
Низкий, без метастазов |
Хирургия, ОСЛ* |
Рак собирательных трубочек Беллини |
Высокий, очень агрессивный рак. Медиана общей выживаемости – 30 мес |
Хирургия/ответ на таргетную терапию плохой |
Медуллярная Карцинома почки |
Высокий, очень агрессивный рак. Медиана общей выживаемости – 5 мес |
Хирургическое лечение/различные режимы химиотерапии, радиочувствительная опухоль |
Транслокационный ПКР Хр11.2 |
Высокий |
Хирургическое лечение/ VEGF-таргетная терапия |
Транслокационный ПКР t(6:11) |
Низкий/промежуточный |
Хирургия, ОСЛ/VEGF-таргетная терапия |
Муцинозная тубулярная и веретеноклеточная карцинома |
Средний |
Хирургия, ОСЛ |
ПКР, ассоциированный с поликистозом |
Низкий |
Хирургическое лечение |
Тубулокистозный ПКР |
Низкий (90% индолентных опухолей) |
Хирургия, ОСЛ |
Светлоклеточный (тубулярный) папиллярный рак |
Низкий |
Хирургия, ОСЛ |
Гибридная онкоцитомно-хромофобная опухоль |
Низкий или доброкачественное образование |
Хирургия, ОСЛ |
Метанефральные опухоли |
Доброкачественное образование Хирургия, ОСЛ |
Кистозная нефрома/смешанная эпителиальностромальная опухоль |
Низкий/доброкачественное образование |
Хирургия, ОСЛ |
Онкоцитома |
Доброкачественное образование |
Наблюдение (при наличии гистологического подтверждения)/операция, ОСЛ |
Врожденные опухоли почек |
Высокий |
Хирургия, ОСЛ |
Ангиомиолипома |
Доброкачественное образование |
Лечение рассматривается только для очень тщательно отобранных пациентов |
Карцинома, связанная с нейробластомой |
Различная |
Хирургия, ОСЛ |
Фолликулярная карцинома почки, схожая с карциномой щитовидной железы |
Низкий |
Хирургия, ОСЛ |
Неклассифицированный ПКР |
ОСЛ – органосберегающее лечение.
| Рекомендации | УД | СР |
|---|---|---|
Большинство ангиомиолипом требуют активного наблюдения.
|
||
При кистозных поражениях почки, соответствующих III и IV категории по классификации Босниака, показано хирургическое лечение. При кистозных образованиях III категории следует выполнить резекцию почки (органосберегающая операция) |
3 |
С |
Если диагноз онкоцитомы верифицирован с помощью биопсии, то лучше прибегнуть к активно-выжидательной тактике |
3 |
|
При ангиомиолипоме методы лечения, направленные на ее удаление (нефрэктомия или резекция почки) либо разрушение (термоабляция или селективная эмболизация питающей артерии), показаны лишь в отдельных случаях, при этом предпочтительно выполнение органосберегающей операции |
3 |
С |
При редких вариантах опухолей почки в распространенной стадии стандартизированного подхода к лечению не существует, необходим индивидуальный подход |
3 |
С |
УД – уровень достоверности.
Диагностика
Симптомы
На ранних стадиях рак почки протекает бессимптомно. Клинические симптомы (классическая триада), такие как гематурия, пальпируемая опухоль, боль в поясничной области, в настоящее время встречаются относительно редко – лишь у 6–10% больных – и свидетельствуют об агрессивном гистологическом варианте и распространенной стадии ПКР.
Паранеопластические синдромы встречаются у 30% пациентов, имеющих клинические признаки ПКР. Наиболее распространенными паранеопластическими синдромами являются следующие:
У некоторых больных наряду с клиническими признаками проявляются также симптомы метастатического заболевания:
В 50% случаев и более ПКР диагностируют случайно при УЗИ и/или КТ. При гематурии (см. соответствующую главу) необходимо исключить опухоли верхних мочевыводящих путей и мочевого пузыря. У 15% больных отмечают артериальную гипертензию. При опухолевом тромбозе нижней полой вены (НПВ) может возникать синдром сдавления НПВ (отеки ног, расширение подкожных вен живота, тромбоз глубоких вен нижних конечностей, появление варикоцеле) [52-55].
Физикальное обследование
Физикальное обследование используется редко в диагностике ПКР. Результаты физикального обследования, как правило, становятся инициаторами дальнейшего дообследования в следующих случаях:
Лабораторные исследования
Наиболее часто исследуются следующие лабораторные тесты:
-
общий анализ крови – уровень гемоглобина, лейкоцитов с формулой, тромбоцитов, СОЭ;
-
биохимический анализ крови – уровень креатинина, щелочной фосфатазы, лактатдегидрогеназы (ЛДГ), скорость клубочковой фильтрации (СКФ) и сывороточный уровень кальция;
-
цитологическое исследование мочи для исключения уротелиального рака [56, 57].
Ультразвуковое исследование
УЗИ органов брюшной полости целесообразно применять в следующих случаях:
Диагностическая эффективность УЗИ зависит от стадии опухолевого процесса и варьирует от 79% при стадии T1a-b/T2 до 77–85% при стадии Т3а и 87–100% при стадии T3b-c.
Компьютерная томография
КТ органов брюшной полости и забрюшинного пространства позволяет диагностировать ПКР и получить информацию:
КТ с контрастированием целесообразно применять для получения детальной информации об ангиоархитектонике почки у больных ПКР, которым планируется выполнить органосберегающее лечение. Диагностическая эффективность КТ зависит от стадии опухолевого процесса и варьирует от 94% при стадии T1a-b/T2 до 93–95% при стадии Т3а и 98–100% при стадии T3b-c. Точность метода в диагностике увеличенных регионарных лимфатических узлов составляет от 83 до 88% [62-68].
Магнитно-резонансная томография
МРТ органов брюшной полости и забрюшинного пространства позволяет получить дополнительную информацию относительно:
-
выявления контрастирования опухолей почки (включая накопление контраста в сложных кистозно-солидных образованиях);
-
изучения степени поражения венозной системы в случаях, если при КТ-исследовании затруднительно четко визуализировать распространение опухолевого тромба в НПВ и расположение его верхушки (УД 3).
МРТ органов брюшной полости и забрюшинного пространства также показана пациентам с аллергией на внутривенный контраст и беременным без нарушения функции почек (УД 3). Общая диагностическая точность метода в диагностике опухолевого тромбоза составляет 95–100%. Точность метода в диагностике увеличенных регионарных лимфатических узлов составляет от 83 до 88% [69-75].
Другие виды исследований
Почечная артериография и кавография имеют ограниченные показания и используются в качестве дополнительных средств диагностики у отдельных пациентов (УД 3). Ангиография выполняется при планируемой резекции почки, опухоли почки больших размеров, наличии опухолевого тромбоза НПВ, планируемой эмболизации почечной артерии.
Динамическая нефросцинтиграфия показана больным с малейшими признаками снижения функции почек с целью оптимизации планируемого лечения при необходимости сохранения почечной функции (УД 2а).
Позитронно-эмиссионная томография (ПЭТ) в настоящее время не является стандартным методом исследования (УД 1b). Роль ПЭТ в диагностике ПКР и последующем наблюдении за больными еще предстоит определить [76].
Исследования при метастатическом ПКР
На сегодняшний день считается, что большая часть метастазов в костях скелета и головном мозге имеют те или иные клинические проявления к моменту постановки диагноза, поэтому рутинное выполнение сканирования костей скелета и КТ головного мозга обычно не показано. Тем не менее при наличии соответствующих показаний (клинические или лабораторные признаки) могут быть выполнены следующие исследования (УД 3) [76-83]:
Классификация Босниака кистозных образований почки
В классификации Босниака кистозные образования почки делят на пять категорий в зависимости от данных КТ и МРТ, что позволяет оценить риск злокачественного перерождения [84, 85] (УД 3). В этой классификации указывается также способ лечения в зависимости от категории кисты (табл. 9.4).
| Категория по Босниаку | Особенности | Результат исследования |
|---|---|---|
I |
Простая доброкачественная с тонкой стенкой, не содержит септ, очагов обызвествлений и солидных компонентов. По плотности соответствует воде и не контрастируется |
Доброкачественная киста |
II |
Доброкачественная киста, в которой могут быть немногочисленные тонкие септы. В стенке или септах возможны мелкие очаги обызвествления. Гомогенное гипоинтенсивное по сравнению с паренхимой образование диаметром < 3 см, с четкими границами, не накапливающее контраст |
Доброкачественная киста |
IIF |
В кистах, относящихся к этой категории, может быть больше тонких септ. Возможно незначительное усиление септ и стенки кисты, а также минимальное утолщение их. В кисте могут быть относительно крупные очаги обызвествления, имеющие нодулярную структуру, но не накапливающие контрастное вещество. Мягкотканные элементы, усиливающие сигналы, отсутствуют. К этой категории относятся также расположенные полностью интраренально кистозные образования диаметром ≥ 3 см, не накапливающие контрастное вещество, имеющие четко очерченные границы и повышенную плотность |
Необходимо наблюдение больного. Иногда возможно злокачественное перерождение |
III |
Кистозные образования с неровными утолщенными стенками или септами, в которых может накапливаться контрастное вещество (контрастное усиление) |
Показано хирургическое лечение или наблюдение в динамике. Более чем в 50% случаев кисты III категории бывают злокачественными |
IV |
Явно злокачественные кисты, содержащие мягкотканный компонент, для которого характерно контрастное усиление |
Рекомендуется хирургическое удаление. В основном это злокачественные новообразования |
Биопсия опухоли почки
Чрескожную биопсию опухоли почки в настоящее время применяют в следующих случаях:
-
для гистологической верификации суспициозного опухолевого образования почки;
-
у выбранных пациентов с небольшой опухолью почки при выборе тактики активного наблюдения;
-
для получения гистологического исследования при выборе аблативных методов лечения;
-
для выбора наиболее подходящих препаратов таргетной терапии у больных метастатическим ПКР (УД 3) [86-91].
Возможно выполнение как толстоигольной, так и аспирационной чрескожной биопсии. Целью биопсии является определение злокачественности, гистологического варианта и степени дифференцировки оцениваемого новообразования почки. В большинстве случаев чрескожную биопсию выполняют под местной анестезией (УД 3). В зависимости от локализации опухоли и конституции больного биопсию проводят под контролем УЗИ или КТ (УД 2b).
Целесообразно использовать иглы калибра 18 gauge для биопсии опухоли почки, поскольку их применение связано с низким количеством осложнений и позволяет обеспечить достаточное количество ткани для постановки диагноза в большинстве случаев (УД 2b). Должна применяться коаксиальная техника, позволяющая выполнить множественные биопсии и избежать риска имплантационных метастазов (УД 3) [92].
Толстоигольная биопсия более предпочтительна в диагностике злокачественного характера и гистологического типа ПКР по сравнению с тонкоигольной аспирационной биопсией (УД 2b). Количество необходимых биоптатов в настоящее время не определено, однако для обеспечения максимальной диагностической ценности биопсии необходимо получение по крайней мере двух биопсийных столбиков хорошего качества (нефрагментированных, длиной > 10 мм) без зон некроза (УД 4). Выполнение биопсии из периферических областей предпочтительно у больных с большими опухолями почки для исключения попадания в зону центрального некроза (УД 2b).
По результатам метаанализа, включившего 57 исследований и 5228 больных, толстоигольная биопсия продемонстрировала высокую диагностическую эффективность, высокую специфичность (99,7%) и чувствительность (99,1%) в определении злокачественного характера опухолевых образований почки (УД 2b). Хотя следует отметить, что 0–22% толстоигольных биопсий безрезультатны (УД 4). Применение толстоигольной биопсии у больных с кистозными образованиями почки нецелесообразно в связи с низкой диагностической эффективностью (УД 2b) [93].
Точность в определении морфологического варианта опухоли почки высокая. Медиана совпадения между гистологическим вариантом ПКР по результатам биопсии и планового морфологического исследования после резекции почки или нефрэктомии в метаанализе составила 90,3%. Оценка степени злокачественности опухоли при толстоигольной биопсии является сложной задачей. Оценка степени дифференцировки по классификации Фурмана в биопсийном материале затруднительна (62,5%), но может быть улучшена с использованием упрощенной двухуровневой системы high-grade vs. low grade (87%) [93].
Частота осложнений чрескожной биопсии опухоли почки низка. Спонтанно разрешающиеся субкапсулярные, перинефральные гематомы и гематурия являются наиболее частыми осложнениями и встречаются в 4,3% случаев по результатам метаанализа, а клинически значимые кровотечения редки (0–1,4% и 0,7% по результатам метаанализа) [93].
| Рекомендации | СР |
|---|---|
КТ и МРТ брюшной полости рекомендуется выполнять всем больным ПКР как для постановки диагноза, так и для стадирования |
B |
Больным ПКР необходимо выполнить КТ и МРТ брюшной полости и забрюшинного пространства с контрастным усилением. Это наиболее информативные методы исследования, выполняемые для уточнения стадии опухолевого процесса перед выполнением хирургического вмешательства |
С |
КТ грудной клетки – наиболее чувствительный метод оценки состояния легких и средостения |
С |
Сцинтиграфия скелета не относится к рутинным методикам |
С |
Перед проведением аблационной и системной терапии (если ранее не было выполнено патогистологическое исследование) всегда необходимо выполнить чрескожную биопсию опухоли почки |
С |
Выполнение чрескожной биопсии почки при активно-выжидательной тактике необходимо, чтобы стратифицировать процесс наблюдения в отдаленном периоде в соответствии с результатами гистологического исследования опухоли |
С |
В тех случаях, когда показана биопсия, необходимо получить образцы хорошего качества с помощью коаксиальной методики, чтобы повысить безопасность биопсии и максимально увеличить ее информативность |
С |
Прогностические факторы
Факторы, которые влияют на прогноз заболевания у больных ПКР, делят на анатомические, гистологические, клинические и молекулярные.
Анатомические факторы
Анатомические прогностические факторы следующие:
В классификацию TNM все эти факторы включены [24].
Гистологические факторы
Гистологические прогностические факторы включают:
Градация по Фурману, основанная на морфологических особенностях клеточного ядра, – наиболее распространенная гистологическая система градации ПКР. Несмотря на то что оценка при градации по Фурману подвержена внутрии межисследовательской вариабельности, она является независимым прогностическим фактором. Некоторые авторы предлагают упростить ее, считая, что двухили трехуровневая градация не менее точно характеризует степень злокачественности опухоли, чем классическая четырехуровневая градация по Фурману (УДД 3) [94-98].
В однофакторном анализе больные хромофобным ПКР по сравнению с папиллярным ПКР против светлоклеточного ПКР имеют лучший прогноз. Однако прогностическая значимость вариантов ПКР теряется при стратификации на стадии заболевания (см. табл. 9,5, 9,6 и 9.7) [97, 98].
Для всех вариантов ПКР прогноз ухудшается со стадией и гистологическими вариантами (табл. 9.6 и 9.7). Пятилетняя общая выживаемость для всех вариантов ПКР составляет 49%, однако с 2006 г. наблюдается улучшение показателей выживаемости, вероятно из-за увеличения доли случайно выявленного ПКР и появления ингибиторов тирозинкиназ (ИТК) [100].
| Вариант ПКР | Доля в структуре ПКР | Распространенный характер заболевания (T34, N+, M+) | Степень дифференцировки по Fuhrman 3 или 4 [32] | ОСВ (ОР) |
|---|---|---|---|---|
Светлоклеточный |
80–90% |
28% |
28,5% |
– |
Папиллярный |
6–15% |
17,6% |
28,8% |
0,64–0,85 |
Хромофобный |
2–5% |
16,9% |
32,7% |
0,24–0,56 |
Клинические факторы
При прогнозировании по клиническим факторам учитывают:
| Стадия | Отношение рисков (95% ДИ) |
|---|---|
T1N0M0 |
|
– |
|
T2N0M0 |
2,71 (2,17–3,39) |
T3N0M0 |
5,20 (4,36–6,21) |
T4N0M0 |
16,88 (12,40–22,98) |
N+M0 |
16,33 (12,89–20,73) |
M+ |
33,23 (28,18–39,18) |
Степень дифференцировки |
Отношение рисков (95% ДИ) |
Степень 1 |
– |
Степень 2 |
1,16 (0,94–1,42) |
Степень 3 |
1,97 (1,60–2,43) |
Степень 4 |
2,82 (2,08–3,31) |
Молекулярные факторы
В настоящее время проводится исследование целого ряда молекулярных маркеров, включая карбоангидразу IX, фактор роста сосудистого эндотелия (VEGF), фактор, индуцируемый гипоксией (HIF), клеточный маркер пролиферации Ki67, белок р53, фосфатазу с двойной субстратной специфичностью, кодируемую геном PTEN (регулирует клеточный цикл), Е-кадгерин, С-реактивный белок (CRP), остеопонтин и гликопротеин CD44 (играет важную роль в клеточной адгезии) (УДЦ 3). Пока не удалось доказать, что учет какого-либо из перечисленных факторов при определении прогноза у больных ПКР повышает прогностическую ценность системы, поэтому определять уровень этих факторов при рутинном обследовании таких больных не рекомендуется. Наконец, несмотря на перспективность исследования профиля экспрессии генов, до сих пор с помощью этого метода не удалось идентифицировать у больных ПКР новые релевантные прогностические факторы [105-111].
Прогностические системы и номограммы
Созданы и успешно апробированы послеоперационные прогностические системы и номограммы. Эти системы, возможно, имеют большую прогностическую значимость по сравнению с классификацией TNM и градацией степени злокачественности опухоли по Фурману (УДЦ 3). Важное достоинство разработанных номограмм – их высокая прогностическая точность и объективность оценки любого нового прогностически значимого параметра. Перед включением в прогностическую систему нового прогностического фактора следует проверить, превосходит ли он по своей прогностической значимости принятую в качестве эталонной прогностическую систему, основанную на результатах гистологического исследования. Недавно были разработаны новые номограммы с очень высокой точностью дооперационного прогнозирования. В табл. 9.8 подытожены сведения о созданных к настоящему времени системах оценки прогноза при ПКР [112-121].
Показатель |
Прогностическая модель |
||||
Локализованный ПКР |
Метастатический ПКР |
||||
UISS |
SSIGN |
Послеоперационные номограммы по Каракевичу |
MSKCC |
Модель Хенга |
|
Число тромбоцитов |
Х |
Х |
|||
Число нейтрофилов |
Х |
||||
Гемоглобин |
Х |
Х |
|||
Скорректированный уровень кальция |
Х |
Х |
|||
ЛДГ |
Х |
||||
Промежуток между постановкой диагноза и началом лечения |
Х |
Х |
|||
Размер опухоли |
Х |
Х |
|||
Некроз опухоли |
Х |
||||
Степень дифференцировки по Фурману |
Х |
Х |
Х |
||
Симптомы, связанные с ПКР |
Х |
||||
Статус по Карновскому |
Х |
Х |
|||
Статус по ECOG |
Х |
||||
Стадирование по TNM |
Х |
Х |
Х |
||
Примечания. ECOG PS (Eastern Cooperative Oncology Group performance status) – статус по шкале Западной кооперированной онкологической научно-исследовательской группы; ЛДГ – лактатдегидрогеназа; MSKCC – Memorial Sloan Kettering Cancer Center; PS (performance status) – общее состояние (качество жизни); SSIGN (Stage Size Grade Necrosis) – прогностическая шкала, учитывающая стадию, размер, степень злокачественности опухоли и наличие в ней очагов некроза; UISS (University of California Los Angeles Integrated Staging System) – интегрированная прогностическая шкала, разработанная в Калифорнийском университете в Лос-Анджелесе.
| Рекомендации | СР |
|---|---|
Рекомендуется использовать современную классификацию TNM |
В |
Следует указывать степень дифференцировки по Фурману и классифицировать гистологический вариант ПКР |
В |
При метастатическом раке необходимо использовать систему стратификации, чтобы выбрать адекватный метод лечения первой линии |
В |
При локализованном раке рутинное использование интегральных прогностических систем и номограмм не рекомендуется, даже если такие системы могут обосновать включение больного в клиническое исследование |
С |
В настоящее время нет каких-либо молекулярных прогностических факторов, которые можно было бы рекомендовать для клинического использования |
С |
Лечение
ЛЕЧЕНИЕ ЛОКАЛИЗОВАННОГО ПКР
Хирургическое лечение
Единственным эффективным методом лечения ПКР является хирургическое лечение. Основными вариантами хирургического лечения ПКР являются резекция почки и нефрэктомия открытым, лапароскопическим и робот-ассистированным доступами.
Показания к резекции почки:
-
абсолютные – единственная почка (анатомически или функционально);
-
относительные – снижение функции контралатеральной («здоровой») почки; функционирующая контралатеральная почка, пораженная процессом, который может привести к ухудшению ее функции в будущем;
-
элективные – локализованный ПКР при наличии здоровой контралатеральной почки (стадия T1a – предпочтительно, стадия T1b – при возможности).
Противопоказания к резекции почки:
Преимущества резекции почки:
На основании имеющихся в настоящее время данных об онкологических результатах и качестве жизни больных локализованным ПКР после хирургического лечения, резекция почки является более предпочтительной, чем нефрэктомия, вне зависимости от варианта доступа. Показатели пятилетней опухолевоспецифической выживаемости были сопоставимы при использовании этих хирургических методик [122-126]. Схожие результаты получили в исследовании, в которое включили больных с солитарной опухолью почки стадии T1-2N0M0 размером < 5 см с нормально функционирующей контралатеральной почкой и соматическим статусом по шкале ВОЗ 0–2. Медиана времени наблюдения составила 9,3 года. За период наблюдения были живы 198 пациентов в группе нефрэктомии и 173 больных, которым выполнили резекцию почки. Опухолевоспецифическая выживаемость составила 98,5% против 97% соответственно. Местные рецидивы диагностировали у 1 больного в группе нефрэктомии и 6 пациентов в группе резекции почки [127].
В ряде исследований, сравнивающих резекцию почки с нефрэктомией (открытой или лапароскопической) у больных с опухолью размером < 4 см [127-131], в группе пациентов, которым выполнили нефрэктомию, отметили более высокую частоту смертности от всех причин. В преждевременно закончившемся рандомизированном исследовании у больных с опухолью почки < 5 см, сравнивающем резекцию почки с нефрэктомией, достоверной разницы в показателях общей выживаемости не выявили [126]. В исследованиях с когортой больных ПКР с размером опухоли 4–7 см также не наблюдали достоверных различий в опухолевоспецифической выживаемости в группе резекции и нефрэктомии [130, 132-139]. При сравнении лапароскопической резекции почки с лапароскопической нефрэктомией у больных ПКР с опухолью > 4 см группы больных были сопоставимы по показателям общей, опухолевоспецифической и безрецидивной выживаемости [140]. Кроме того, в ретроспективном исследовании у пожилых пациентов [141] опухолевоспецифическая выживаемость также была сопоставима между группами и составила 98% у больных, которым выполнили резекцию почки, по сравнению с 95% в группе больных с нефрэктомией. В других исследованиях, сравнивающих различные аспекты качества жизни и безопасности применения резекции почки и нефрэктомии открытым доступом, также различий не зарегистрировали [131, 132, 119, 137–140].
Проспективных сравнительных исследований минимально инвазивных аблативных методик в сравнении с резекцией почки нет. В одном из ретроспективных исследований сравнили радиочастотную абляцию с нефрэктомией и резекцией почки у больных со стадией сТ1а. Опухолевоспецифическая выживаемость составила 100% во всех трех группах лечения [141].
Адреналэктомия
В настоящее время адреналэктомия не рекомендуется для рутинного использования у больных локализованным ПКР при отсутствии рентгенологически подтвержденного вовлечения надпочечника или подозрения относительно наличия в нем метастазов. В проспективном нерандомизированном исследовании, сравнивающем радикальную нефрэктомию и/или резекцию почки с адреналэктомией или без нее, при многофакторном анализе достоверное влияние оказывал только размер опухоли, расположение опухоли в верхнем полюсе не оказывало влияния на выявление метастазов в надпочечник. Никакой разницы в общей пяти- и десятилетней выживаемости не выявили. В данном исследовании только 48 из 2065 пациентов выполнили одномоментную ипсилатеральную адреналэктомию, у 42 из которых выявили доброкачественные образования.
Лимфаденэктомия у больных с отсутствием данных за увеличенные лимфатические узлы
Расширенная лимфодиссекция не улучшает выживаемость при выполнении нефрэктомии. По данным проспективного рандомизированного исследования III фазы, выполненного Европейской организацией по исследованию и лечению рака (EORTC – European Organization for the Research and Treatment of Cancer), сравнивающем радикальную нефрэктомию с выполнением лимфодиссекции и без лимфодиссекции, достоверных различий в показателях общей выживаемости, времени до прогрессирования заболевания или безрецидивной выживаемости между двумя исследуемыми группами не выявили, только у 4% больных со стадией cN0 выявили метастазы в лимфатических узлах по результатам планового морфологического исследования. Однако при оценке прогностических факторов оказалось, что такие патологические характеристики опухоли, как степень дифференцировки, наличие саркоматоидного компонента, размер опухоли, стадия и наличие некроза в опухоли, влияют на вероятность выявления метастазов в региональных лимфатических узлах. Таким образом, лимфаденэктомия может быть ограничена областью ворот почки. У больных с пальпируемыми или диагностированными предоперационно по данным КТ увеличенными лимфатическими узлами показано выполнение регионарной лимфаденэктомии для адекватного стадирования [142-149].
Объем лимфодиссекции при ПКР определяется особенностями лимфатической системы и частотой развития метастазов в различных группах лимфатических узлов. При наличии опухоли правой почки метастазы выявляются в ретрокавальных, межаортокавальных, латерокавальных и прекавальных лимфатических узлах. Перекрестное метастазирование отмечается редко и практически всегда сочетается с наличием гомолатеральных лимфогенных метастазов. Метастазы опухолей левой почки преимущественно локализуются в парааортальных лимфоузлах, поражение межаортокавальных и контралатеральных лимфатических узлов отмечается редко. Верхней границей лимфаденэктомии является уровень ножек диафрагмы, нижней границей – бифуркация аорты и НПВ [142-149].
Эмболизация
Преимуществ выполнения эмболизации перед проведением нефрэктомии не выявлено. Неоперабельным больным и пациентам, которые не перенесут оперативного вмешательства, выполнение эмболизации позволяет уменьшить выраженность симптомов, например таких, как гематурия или боль в боку. Осуществление эмболизации до проведения резекции гиперваскулярных метастазов в кости или позвоночник способствует уменьшению интраоперационной кровопотери. Некоторым больным с костными или паравертебральными метастазами с наличием болевой симптоматики выполнение эмболизации помогает устранить симптомы [150-154].
| Рекомендации | УД | СР |
|---|---|---|
Хирургическое вмешательство – единственный радикальный метод лечения локализованного ПКР |
– |
В |
Больным ПКР со стадией Т1а следует выполнять резекцию почки |
– |
А |
При наличии соответствующих технических возможностей резекция почки более предпочтительна, чем нефрэктомия, у больных ПКР со стадией Т1b |
– |
В |
Проведение расширенной лимфаденэктомии не рекомендовано всем больным в связи с отсутствием данных об улучшении выживаемости. Расширенную лимфаденэктомию следует выполнять для осуществления стадирования больным с пальпируемыми и/или увеличенными лимфатическими узлами |
1b |
A |
Выполнение адреналэктомии не рекомендовано больным, у которых по данным предоперационного обследования не выявлено метастазов в надпочечнике или прямого врастания опухоли в надпочечник, так как не влияет на выживаемость |
3 |
В |
Больным, у которых отмечается массивная гематурия или боль в боку, целесообразно выполнить в качестве паллиативной меры эмболизацию артерии, питающей опухоль |
3 |
|
Онкологические результаты выполнения резекции почки при локализованном ПКР стадии сТ1 сопоставимы с результатами нефрэктомии |
1b |
– |
Принципы выполнения радикальной нефрэктомии
Принципы выполнения радикальной нефрэктомии включают раннюю перевязку почечной артерии и вены, удаление почки вместе с окружающей паранефральной клетчаткой, удаление ипсилатерального надпочечника и выполнение регионарной лимфаденэктомии.
Рандомизированных исследований, оценивающих онкологические результаты радикальной нефрэктомии лапароскопическим и открытым доступами, не существует. В существующих проспективных когортных исследованиях и ретроспективных исследованиях получены сопоставимые онкологические результаты. В ряде исследований продемонстрировано достоверное уменьшение койко-дня и снижение потребности в обезболивающих препаратах в группе больных, которым выполняли лапароскопическую радикальную нефрэктомию, по сравнению с группой больных, которым выполняли оперативное вмешательство открытым доступом. Несмотря на достоверно меньшую интраоперационную кровопотерю в группе лапароскопической радикальной нефрэктомии, различий в частоте переливания крови в группах не выявили. Частота хирургических осложнений была низкой в обеих группах, но время выполнения оперативного вмешательства значительно дольше в группе открытого доступа. Послеоперационное качество жизни было схожим в обеих группах. Выполнение радикальной нефрэктомии из забрюшинного или трансперитонеального доступа не влияло на отдаленные онкологические результаты и качество жизни больных [155-163].
В небольшом проспективном когортном исследовании, сравнивающем робот-ассистированную радикальную нефрэктомию с лапароскопической радикальной нефрэктомией, достоверных различий по частоте местного рецидивирования и отдаленного метастазирования не выявили [164, 165].
Принципы выполнения резекции почки
В большинстве клинических исследований достоверных различий в показателях общей выживаемости у больных, которым выполнили резекцию почки лапароскопическим и открытыми доступами, не выявлено [166-169]. В группе больных, которым выполнили лапароскопическую резекцию, отмечены более короткий койко-день и меньшая интраоперационная кровопотеря. Несмотря на более продолжительное время проведения оперативного вмешательства в группе лапароскопической резекции почки, частота осложнений в обеих группах была сопоставимой, количество послеоперационных осложнений, таких как тромбоз глубоких вен, легочная эмболия и смерть, была аналогичной в обеих группах [166, 168]. Снижение СКФ было более выражено в группе лапароскопической резекции почки в раннем послеоперационном периоде, но отсутствовало по прошествии 3,6 года. По данным другого сравнительного исследования, хирургический подход не являлся независимым предиктором хронической болезни почек в послеоперационном периоде [170]. Выбор хирургического доступа к почке не имел значительной разницы, ретроперитонеальная и трансперитонеальная лапароскопические резекции имели одинаковые периоперационные результаты. Выполнение энуклеации опухоли по сравнению с резекцией и нефрэктомией имеет аналогичные показатели безрецидивной и опухолевоспецифической выживаемости.
Исследований, сравнивающих онкологические результаты в группе робот-ассистированной резекции почки с группой лапароскопической резекции почки, нет. В ретроспективном исследовании, оценивающем непосредственные результаты и СКФ, достоверных различий при робот-ассистированном и лапароскопическом доступе не выявили [9].
Целесообразность выполнения лапароскопических резекций почек без аноксии и использования однопортовой лапароскопии была показана в ряде случаев, но для подтверждения безопасности выполнения и их клинической роли требуются масштабные исследования [171, 172].
По данным литературы, исследований, сравнивающих отдаленные онкологические результаты роботизированной, лапароскопической и открытой техники резекций почек, не проводилось. Недавно проводилось сравнительное исследование периоперационных результатов робот-ассистированных и открытых резекций почки, выполненных одним хирургом. При робот-ассистированных операциях зарегистрировали меньшую кровопотерю и продолжительность госпитализации. Время тепловой ишемии, операции, ранние и отсроченные послеоперационные осложнения, изменения уровня креатинина и положительные хирургические края были одинаковыми в обеих группах [9].
В недавно проведенном метаанализе сравнили послеоперационные результаты робот-ассистированных и лапароскопических резекций почек. В группе робот-ассистированной хирургии реже использовали конверсию во время операции; время тепловой ишемии, изменение показателей креатинина в раннем послеоперационном периоде и продолжительность госпитализации также были меньше. Не наблюдали никаких существенных различий в отношении осложнений, времени операции, кровопотери, частоты положительного хирургического края и изменения уровня сывороточного креатинина [6].
| Рекомендации | УДД | СР |
|---|---|---|
Лапароскопическая радикальная нефрэктомия имеет меньший уровень смертности по сравнению с открытой операцией |
1b |
– |
Онкологические результаты радикальной нефрэктомии у больных ПКР стадии Т1-Т2а эквивалентны для лапароскопического и открытого доступов |
2а |
– |
Резекция почки может быть выполнена открытым способом, лапароскопическим или робот-ассистированным доступом в зависимости от опыта и навыка хирурга |
2b |
– |
Радикальную нефрэктомию не следует выполнять у пациентов с опухолями стадии Т1, которым показана резекция почки |
– |
В |
Радикальная лапароскопическая нефрэктомия показана больным с локализованными опухолями стадии Т2, которым невозможно выполнить резекцию |
– |
В |
Альтернативные варианты лечения ПКР
Активное наблюдение
Пожилые больные и пациенты с тяжелой сопутствующей патологией с небольшими случайно выявленными опухолями почки имеют относительно низкий риск смерти от ПКР и значительно больший риск смерти от сопутствующих заболеваний. Тактика активного наблюдения подразумевает постоянный контроль размера опухоли на основании современных методик визуализации органов брюшной полости (УЗИ, КТ или МРТ) с возможностью отложенного вмешательства в случае клинической прогрессии в течение периода наблюдения. В самых больших сериях наблюдений у большинства больных вероятность роста опухолей почек низка и прогрессирование с развитием метастазов наблюдается у ограниченного количества больных (1–2%). Как кратко-, так и среднесрочные онкологические результаты показывают, что стратегия активного наблюдения является подходящей для осуществления начального мониторинга малых новообразований в почках, которые при необходимости могут затем быть подвергнуты лечению при прогрессировании [173-177].
Целесообразность:
Преимущества:
Недостатки:
Аблативные методики
Существующие альтернативы хирургическому лечению ПКР включают чрескожные малоинвазивные процедуры, выполняемые под контролем современных средств визуализации, таких как чрескожная радиочастотная абляция (РЧТА), криоабляция, микроволновая и лазерная абляция, а также абляция высокоинтенсивным сфокусированным ультразвуком (HIFU) [177-180].
Преимущества:
Показания для применения малоинвазивных аблативных методик:
-
наличие небольших случайно выявленных новообразований в корковом веществе почек у пожилых пациентов;
-
генетическая предрасположенность больных к развитию множественных опухолей;
-
наличие у больного единственной почки и высокий риск развития ренопривного состояния после хирургического вмешательства (УД 2b).
Противопоказания для применения аблятивных методик:
Абсолютные противопоказания для применения аблятивных методик:
Среди имеющихся аблятивных методик РЧТА и криоабляция наиболее полно изучены в отношении практичности их использования, частоты возникновения осложнений и онкологических результатов.
Перед применением аблативных методик необходимо выполнить предварительную биопсию для выяснения гистологического варианта новообразования почки.
По сравнению с РЧТА криоабляцию чаще осуществляют лапароскопическим доступом. Лапароскопическая криоабляция более эффективная методика, но частота возникающих осложнений выше, чем при РЧТА. Частота местных рецидивов после проведения РЧТА значительно выше, чем при криоабляции, что приводит к большей частоте повторных сеансов РЧТА. Показатели опухолевоспецифической выживаемости у больных, которым провели криоабляцию и РЧТА, хуже, чем те же показатели в группе хирургического вмешательства [181, 182].
В исследованиях, посвященных сравнению лапароскопической резекции почки с РЧТА, различий между группами по частоте положительного хирургического края и рецидивов не выявили, авторы отметили очень небольшое количество завершенных случаев, высокую частоту доброкачественных опухолей и непродолжительный период наблюдения [141].
В исследованиях, сравнивающих лапароскопическую криоабляцию с лапароскопической резекцией, рецидивов не зарегистрировано в обеих группах за период наблюдения менее 12 месяцев. Следует отметить, что в эти исследования также включили доброкачественные опухоли и к интерпретации результатов этих исследований следует относиться с осторожностью. Достоверных различий в непосредственных результатах лечения, времени восстановления, частоте осложнений или послеоперационном уровне креатинина сыворотки между лапароскопической криоабляцией и лапароскопической резекцией почки не выявлено. Кровопотеря и время оперативного вмешательства были меньше в группе лапароскопической криоабляции, чем лапароскопической резекции почки [183-185].
В исследовании, сравнивающем лапароскопическую криоабляцию с открытой резекцией почки, различий по частоте местного рецидивирования или метастазирования не найдено. Продолжительность пребывания в стационаре была короче и средняя кровопотеря значительно меньше в группе лапароскопической криоабляции, но достоверных различий по частоте необходимого переливания крови или длительности оперативного вмешательства не выявили. Однако в каждую группу включили только по 20 пациентов и период последующего наблюдения был короткий [183-185].
| Рекомендации | СР | УД |
|---|---|---|
Ввиду низкого качества имеющихся данных нельзя дать какие-либо рекомендации относительно радиочастотной абляции и криоабляции |
С |
– |
Пожилые пациенты с небольшими опухолями почки и/или тяжелой сопутствующей патологией, с противопоказаниями к выполнению хирургического вмешательства и ограниченной ожидаемой продолжительностью жизни могут рассматриваться как кандидаты на проведение радиочастотной абляции, криоабляции и активного наблюдения |
С |
– |
Анализ популяционных данных продемонстрировал значительно меньшую частоту опухолевоспецифической смертности у пациентов, которым выполнили хирургическое лечение, по сравнению с пациентами, которых лечили нехирургическими методами. Однако это преимущество в отношении опухолевоспецифической смертности не подтвердилось в анализе группы пациентов пожилого возраста (старше 75 лет) |
– |
3 |
В когортах больных, находящихся под активным наблюдением, возможен небольшой рост маленьких опухолей почки в большинстве случаев, а прогрессирование с появлением метастазов встречается крайне редко (1–2%) |
– |
3 |
Качество имеющихся данных не позволяет сделать однозначных выводов относительно смертности и онкологических результатов применения криоабляции и радиочастотной абляции |
– |
3 |
В исследованиях низкого качества высказывается предположение о том, что для минимально инвазивных видов лечения по сравнению с резекцией характерна большая частота местных рецидивов |
– |
3 |
ЛЕЧЕНИЕ МЕСТНОРАСПРОСТРАНЕННОГО ПКР
Лечение больных со стадией сN+
При наличии клинически измененных лимфоузлов (стадия сN+) выполнение лимфаденэктомии оправданно [40]. Однако рекомендуемый объем лимфодиссекции в настоящее время спорный [143].
Лечение местнораспространенного неоперабельного ПКР
У больных с нерезектабельным ПКР выполнение эмболизации позволяет уменьшить выраженность симптомов, таких как гематурия или боль в боку. Использование неоадъювантной таргетной терапии для уменьшения объема опухолевой массы является экспериментальным и не может быть рекомендовано вне клинических исследований [152-154].
Рак почки с опухолевым тромбозом почечной и нижней полой вен ПКР имеет тенденцию к вовлечению почечной и нижней полой вен, возможно распространение опухолевого тромба до уровня правого предсердия. При отсутствии метастатического поражения приблизительно у половины пациентов, у которых опухоли распространяются в НПВ, хирургическое лечение повышает выживаемость. Вопрос о сердечно-легочном шунтировании с глубокой гипотермической остановкой сердца необходимо рассмотреть при распространении опухолевого тромба в полость сердца. Данная манипуляция позволяет провести визуальную экспертизу правого предсердия, уменьшает риск смертельных осложнений. Хирургическое лечение опухоли с вовлечением НПВ сложно, его необходимо выполнять в специализированных центрах. Интраоперационная летальность составляет 5–10% [186-189].
| Рекомендации | СР | УД |
|---|---|---|
У пациентов с местнораспространенным ПКР с клинически увеличенными лимфатическими узлами лимфаденэктомия не увеличивает выживаемость и должна выполняться для стадирования или улучшения местного контроля |
С |
3 |
Нефрэктомия с тромбэктомией из НПВ рекомендуется больным ПКР без метастазов |
С |
– |
Низкое качество данных позволяет предположить, что опухолевый тромбоз в условиях отсутствия метастазов существующего ракового заболевания должен быть иссечен |
– |
3 |
Эмболизация или установка фильтра в НПВ не дают никаких дополнительных преимуществ |
– |
3 |
Адъювантная терапия
Согласно данным существующих исследований, адъювантная вакцинотерапия может способствовать снижению риска возникновения рецидива после выполнения нефрэктомии у больных ПКР стадии Т3, однако необходимо проведение дальнейших исследований для подтверждения влияния данной терапии на общую выживаемость (УД 1b). Применение прогностических алгоритмов, возможно, позволит идентифицировать больных, у которых адъювантная вакцинотерапия окажется наиболее эффективным методом лечения [190-194].
Проведение адъювантной терапии цитокинами больным после радикальной нефрэктомии не способствует улучшению выживаемости последних (УД 1b).
В 2015 г. опубликовали результаты одного из крупнейших исследований (ASSURE), посвященных адъювантной таргетной терапии сунитинибом и сорафенибом по сравнению с плацебо. Согласно полученным результатам, достоверных различий в безрецидивной и общей выживаемости между группами терапии сорафенибом, сунитинибом и плацебо не выявлено [101].
Адъювантная лучевая терапия после выполнения нефрэктомии не продемонстрировала эффективности даже у больных с метастатическим поражением лимфатических узлов и нерадикально выполненным хирургическим вмешательством.
| Рекомендации | СР | УД |
|---|---|---|
Проведение адъювантной терапии цитокинами больным после радикальной нефрэктомии не способствует улучшению выживаемости последних |
– |
1b |
Адъювантная таргетная терпаия сунитинибом и сорафенибом не должна использоваться, так как не улучшает безрецидивной и общей выживаемости |
А |
1b |
Вне рамок клинических исследований проведение адъювантной терапии после радикального хирургического лечения ПКР не показано |
А |
– |
Лечение метастатического ПКР
Хирургическое лечение метастатического ПКР (паллиативная нефрэктомия)
Хирургическое лечение приводит к излечению лишь при условии удаления всех определяемых опухолевых очагов. У большинства больных метастатическим ПКР нефрэктомия носит паллиативный характер, в связи с этим им необходимо проведение дальнейшего системного лечения. В метаанализе двух рандомизированных исследований, сравнивающих результаты проведения нефрэктомии в сочетании с иммунотерапией и результаты только иммунотерапии, продемонстрировано, что у больных, перенесших удаление пораженной опухолью почки, общая выживаемость оказалась лучше. В настоящее время имеются лишь ограниченные данные ретроспективных исследований относительно ценности использования циторедуктивной нефрэктомии в сочетании с таргетной терапией сунитинибом, сорафенибом и другими препаратами. Циторедуктивная нефрэктомия в настоящее время показана больным метастатическим ПКР с хорошим соматическим статусом, с большими первичными опухолями и небольшим объемом метастатического поражения. У пациентов с плохим соматическим статусом или неблагоприятным прогнозом по шкале IMDC (International Metastatic Renal Cancer Database Consortium), с небольшими первичными опухолями и большим объемом метастатического поражения и/или с наличием опухоли с саркомоподобным компонентом выполнение циторедуктивной нефрэктомии не показано [195].
Показания к паллиативной нефрэктомии:
Противопоказания к паллиативной нефрэктомии:
| Рекомендации | СР | УД |
|---|---|---|
Циторедуктивная нефрэктомия в комбинации с интерфероном-альфа (ИФН-α) улучшает выживаемость больных метастатическим ПКР хорошего соматического статуса |
– |
1b |
Циторедуктивная нефрэктомия в случае пациентов, которым одновременно удаляется единственный метастаз или несколько метастазов, может улучшить выживаемость и отсрочить необходимость проведения системной терапии |
– |
3 |
Циторедуктивная нефрэктомия показана отдельным пациентам с метастатическим ПКР |
С |
– |
Удаление метастазов ПКР
Рандомизированных исследований, посвященных сравнению метастазэктомии с другими методами лечения, не проводили. В систематическом обзоре 8 нерандомизированных сравнительных исследований в ряде исследований сравнивали полное удаление метастазов с неполным удалением метастазов у больных метастатическим ПКР. Согласно полученным результатам, выявлено преимущество в общей выживаемости в группе больных, которым выполнили полное удаление метастазов. При сравнении полного удаления метастазов с отсутствием метастазэктомии выявлено значительное преимущество в общей выживаемости больных, которым выполнили полную метастазэктомию (медиана общей и опухолевоспецифической выживаемости составила 40,75 месяца (ДИ 23–122 месяца)) по сравнению с выживаемостью больных с неполной метастазэктомией и/или с отсутствием метастазэктомии (медиана общей и опухолевоспецифической выживаемости составила 14,8 месяца (ДИ 8,4–55,5 месяца)). Из двух оставшихся исследований в одном [197] не продемонстрировали достоверных различий в опухолевоспецифической выживаемости у больных с полной метастазэктомией и без нее. В еще одном исследовании [201] сообщили о более продолжительной общей выживаемости в группе метастазэктомии, но р-значения не предоставлено [196-203].
При лечении костных метастазов метастазэктомия в сочетании с местной стабилизацией процесса обеспечивает значительное преимущество в выживаемости по сравнению с больными, которым хирургического лечения не проводили [204].
У больных с метастазами во внутренние органы, такие как печень и поджелудочная железа, метастазэктомия продемонстрировала значительное увеличение длительности общей выживаемости по сравнению с нехирургическим лечением. У пациентов с метастазами в печени радикальная резекция приводила к значительно лучшей общей выживаемости по сравнению с неполной резекцией или абляцией [205-207].
В исследовании, сравнивающем метастазэктомию с последующей лучевой терапией на область всего мозга со стереотаксической фракционированой лучевой терапией или обычной дистанционной лучевой терапией, достоверных различий в опухолевоспецифической выживаемости не выявили, хотя оперативное лечение несколько улучшало местный контроль над опухолью.
Показания к метастазэктомии:
Противопоказания к метастазэктомии:
Удаление метастазов играет важную роль в улучшении клинического прогноза для пациентов с ПКР (УД 3). Следовательно, возможность выполнения резекции метастазов должна каждый раз оцениваться заново, даже при назначении таргетной системной терапии.
Применение лучевой терапии при метастатическом ПКР
В трех существующих нерандомизированных исследованиях сравнивали различные варианты лучевой терапии. Согласно полученным результатам, продемонстрировано улучшение местного контроля над опухолью, однако значимого увеличения выживаемости при применении лучевой терапии не выявлено. Тем не менее в двух исследованиях, проведенных с включением больных с метастазами в кости, показано уменьшение болевого синдрома в костях при использовании лучевой терапии с различными модальностями. В исследовании, сравнивающем лучевую терапию на область всего мозга со стереотаксической лучевой терапией или их комбинацию у больных ПКР с метастазами в головной мозг, продемонстрирован хороший местный контроль над опухолью с использованием индивидуальный модальности у больных с 1–3 метастазами в головном мозге [208, 209].
Показания к лучевой терапии при метастатическом ПКР:
| Рекомендации | СР | УД |
|---|---|---|
Все включенные в обзор исследования были ретроспективными нерандомизированными сравнительными, что приводит к значительному риску системной ошибки, ассоциируемой с отсутствием рандомизации, естественной убылью и селективным включением данных в отчеты |
– |
3 |
Метастазэктомия по умолчанию остается наиболее подходящим вариантом местного лечения для большинства органов метастазирования, за исключением метастазов в головном мозге и, возможно, в костях |
– |
3 |
Ретроспективные сравнительные исследования единогласно указывают на пользу от полной метастазэктомии у пациентов с метастатическим ПКР в отношении общей и опухолевоспецифической выживаемости и отсрочки системной терапии |
– |
3 |
В отдельных случаях применение стереотаксической лучевой терапии у больных с метастатическим поражением головного мозга и наличием костных метастазов может существенно снизить выраженность симптоматики и улучшить локальный контроль |
С |
3 |
Невозможно дать общие рекомендации. Решение о метастазэктомии должно приниматься в каждом медицинском учреждении индивидуально для каждого случая; при этом следует учитывать общее состояние больного, группы риска, желание пациента и использовать альтернативные методики достижения местного контроля, такие как стереотаксическая лучевая терапия |
С |
– |
СИСТЕМНАЯ ТЕРАПИЯ МЕТАСТАТИЧЕСКОГО ПКР
Химиотерапия
В связи с тем что ПКР развивается из проксимальных канальцев собирательной системы, в клетках данной опухоли наблюдается высокий уровень экспрессии гликопротеина P (белок множественной лекарственной устойчивости), что является причиной резистентности этого вида рака к большинству химиопрепаратов. По-видимому, единственная умеренно эффективная схема терапии – комбинация 5-фторурацила (5-ФУ) с иммунопрепаратами. Тем не менее в проспективном рандомизированном исследовании интерферон-альфа (ИФН-альфа) продемонстрировал эквивалентную эффективность в сравнении с комбинацией «ИФН-альфа + интерлейкин 2 (ИЛ-2) + 5-ФУ» [210, 211].
Иммунотерапия
Интерферон-альфа в монорежиме и в сочетании с бевацизумабом
В рандомизированных исследованиях отмечена более высокая эффективность использования ИФН-альфа при метастатическом ПКР по сравнению с гормональной терапией. Частота ответов на лечение ИФН-альфа составила 6–15%, с 25%-ным снижением риска прогрессирования и небольшим улучшением специфической выживаемости на 3–5 месяцев по сравнению с данными показателями, полученными при использовании плацебо. Положительный эффект от терапии ИФН-альфа возможен только у пациентов с метастатическим светлоклеточным ПКР, благоприятном прогнозе по шкале Motzer и наличием только легочных метастазов. В одном из проспективных рандомизированных исследований продемонстрировано, что эффективность ИФН-альфа эквивалентна эффективности комбинации «ИФН-альфа + ИЛ 2 и 5-ФУ». Умеренная эффективность иммунотерапии также подтверждена в метаанализе Cochrane, включившем 42 исследования [56, 212-214].
Во всех проведенных недавно рандомизированных исследованиях таргетных препаратов (сунитиниб, ИФН-альфа в сочетании с бевацизумабом, темсиролимус), использующихся в качестве терапии первой линии, продемонстрировано их преимущество по сравнению с монотерапией ИФН-альфа [215-218].
R.J. Motzer и соавт. разработали шкалу критериев для прогнозирования выживаемости больных метастатическим ПКР. Прогноз основывается на наличии или отсутствии пяти факторов риска (табл. 9.9). Благоприятному (низкому) риску соответствует наличие 0 факторов риска, промежуточному – 1–2, плохому (высокому) – ≥ 3 факторов.
| Фактор риска | Пороговое значение фактора |
|---|---|
Индекс общего состояния по Карновскому, % |
< 80 |
Время от постановки диагноза до начала терапии ИФН-альфа, мес |
< 12 |
Содержание гемоглобина |
Менее нижней границы нормы, установленной для данной лаборатории |
Уровень ЛДГ |
Более чем в 1,5 раза выше верхней границы нормы, установленной для данной лаборатории |
Содержание скорректированного кальция в сыворотке крови, мг/дл (ммоль/л) |
> 10 (2,4) |
Интерлейкин 2
ИЛ-2 используют для лечения метастатического ПКР с 1985 г., частота объективных ответов при его применении варьирует от 7 до 27%. Оптимальная схема лечения ИЛ-2 не установлена, однако использование высоких доз препарата в болюсном режиме способствует достижению длительных (10 лет) полных ответов у некоторых больных метастатическим ПКР. Побочные эффекты при терапии ИЛ-2 значительно более выражены, чем при лечении ИФН-альфа. Ответ на иммунотерапию наблюдается только у пациентов со светлоклеточным ПКР. Рандомизированные контролируемые исследования по сравнению эффективности применения ИЛ-2 с проведением оптимальной поддерживающей терапии пока не проводились [218, 220].
Иммуноонкологические препараты
Иммуноонкологические препараты совместно с моноклональными антителами определяют и блокируют ингибирующий Т-клеточный рецептор программированной смерти PD-1 (Programmed Death-1) или цитотоксический Т-лимфоцит-ассоциированный антиген CTLA-4 (cytotoxic T-lymphocyte associated antigen 4), тем самым восстанавливая опухолеспецифический Т-клеточный иммунитет. В то время как точкой приложения пембролизумаба и ниволумаба является PD-1, атезолизумаб и дурвалумаб блокируют лиганд рецептора программированной смерти (PD-L1), ипилимумаб – CTLA-4.
В рандомизированном исследовании II фазы у пациентов с метастатическим ПКР ниволумаб продемонстрировал высокую частоту объективных ответов с быстрым и продолжительным ответом у пациентов с интенсивной предшествующей терапией в анамнезе. В настоящее время проводится сравнительное исследование III фазы для ниволумаба и ипилимумаба против сунитиниба в терапии первой линии (CHECKMATE 214, NCT 02231749). В III фазе исследования ниволумаба против эверолимуса, применяемых у больных, спрогрессировавших после нескольких линий VEGF-таргетной терапии (CheckMate 025, NCT01668784), зарегистрировали увеличение общей выживаемости, лучшее качество жизни, меньшее количество нежелательных явлений 3-й и 4-й степени при приеме ниволумаба, чем эверолимуса [222-224].
Ниволумаб продемонстрировал более продолжительную общую выживаемость по сравнению с эверолимусом (HR 0,73, 95% ДИ 0,57–0,93, р < 0,002) у пациентов, рефрактерных к VEGF-тарапии, – 25 и 19,6 месяца при приеме эверолимуса (УД 1b). Пациенты с несколькими неэффективными линиями VEGF-терапии также были включены в исследование, что делает возможным более широкое применение ниволумаба. В исследование включили 15% пациентов с неблагоприятным прогнозом по MSKCC. Несмотря на преимущество ниволумаба в общей выживаемости, в выживаемости без прогрессирования достоверных различий не выявили [222-224].
| Рекомендации | СР | УД |
|---|---|---|
Терапия 5-ФУ в сочетании с иммунотерапией у больных метастатическим ПКР обладает такой же эффективностью, как и монотерапия ИФН-альфа |
1b |
– |
У больных метастатическим светлоклеточным ПКР монохимиотерапия неэффективна и не должна назначаться |
3 |
В |
ИФН-альфа в качестве монотерапии больных метастатическим ПКР менее эффективен, чем таргетная терапия VEGF- и mTOR-ингибиторами |
1b |
– |
Высокодозная терапия ИЛ-2 у ограниченного количества больных позволяет добиться длительного полного ответа. Однако не существует клинических факторов или биомаркеров, которые бы позволили точно предсказать вероятность полного ответа у этих больных |
lb |
– |
Побочные эффекты у ИЛ-2 более выражены и наблюдаются чаще, чем у ИФН-альфа |
2–3 |
– |
ИЛ-2 можно применять в виде монотерапии у отдельных больных с благоприятным прогнозом (хороший соматический статус, светлоклеточный ПКР, метастазы только в легких) |
2 |
– |
Сочетанная терапия цитокинами и химиопрепаратами по сравнению с монотерапией цитокинами не повышает общую выживаемость больных |
lb |
– |
Терапия бевацизумабом в комбинации с ИФН-альфа более эффективна по сравнению с монотерапией ИФН-альфа у больных благоприятного и промежуточного прогноза Вакцинотерапия опухолевым антигеном 5Т4 не улучшает выживаемость по сравнению со стандартной терапией первой линии |
lb |
|
Терапия ниволумабом показана больным метастатическим ПКР после одной или двух линий VEGF-таргетной терапии |
– |
А |
Монотерапия ИФН-альфа или ИЛ-2 не рекомендуется в качестве терапии первой линии лечения больных метастатическим ПКР |
– |
А |
Таргетная терапия метастатического ПКР
Последние достижения в области молекулярной биологии привели к созданию нескольких новых препаратов, используемых для лечения метастатического ПКР.
В процессе канцерогенеза при спорадическом ПКР происходит аккумуляция фактора, индуцированного гипоксией, – HIF (HIF – hypoxia-inducible factor) вследствие инактивации гена фон Хиппеля – Линдау (VHL – von Hippel–Lindau), приводящая к гиперэкспрессии сосудисто-эндотелиального фактора роста VEGF (VEGF – vascular endothelial growth factor) и тромбоцитарного фактора роста (PDGF – platelet-derived growth factor), каждый из которых участвует в стимуляции неоангиогенеза [225-227].
Данный процесс играет важную роль в развитии и прогрессировании ПКР. На сегодняшний день в США, Европе и России для лечения метастатического ПКР зарегистрированы и разрешены к применению следующие таргетные препараты:
Большинство крупных рандомизированных опубликованных исследований включали преимущественно больных светлоклеточным метастатическим ПКР, в связи с чем в настоящее время не существует четких рекомендаций по лечению больных с несветлоклеточными вариантами метастатического ПКР.
В большинстве клинических исследований с применением таргетных препаратов больных стратифицировали в соответствии с прогностической шкалой MSKCC (см. табл. 9.10). Поскольку критерии MSKCC были приняты в эру цитокинов, D. Heng и соавт. предложили шкалу IMDC, которая была разработана в эру таргетных препаратов и позволяет дать более точную оценку прогноза больных метастатическим ПКР, получающих таргетную терапию в настоящее время. В модель IMDC (см. табл. 9.6) по сравнению с моделью MSKCC добавлены в качестве факторов риска нейтрофилез и тромбоцитоз, а ЛДГ убрана из прогностических факторов. Эта модель успешно прошла внешнюю валидацию, что позволяет применять ее в эру таргетной терапии [222, 228].
| Прогноз | Больные | % | Медиана общей выживаемости, мес | Двухлетняя общая выживаемость (95% ДИ) |
|---|---|---|---|---|
Благоприятный |
157 |
18 |
43,2 |
75% (65–82%) |
Промежуточный |
440 |
52 |
22,5 |
53% (46–59%) |
Плохой |
252 |
30 |
7,8 |
7% (2–16%) |
Сорафениб
Сорафениб – пероральный мультикиназный ингибитор, угнетающий активность серин/треониновой киназы Raf-1, B-Raf, рецепторов VEGF-2 (VEGFR-2) и PDGF (PDGFR), FMS-подобной тирозинкиназы-3 (FLT-3) и c-KIT. В исследовании III фазы сравнивали эффективность применения сорафениба и плацебо после прогрессирования, отмеченного на фоне проведения предыдущей иммунотерапии. По данным исследования выявлено, что выживаемость без прогрессирования в группе применения сорафениба была на 3 месяца дольше (5,5 против 2,8 месяца, p < 0,01). Окончательный анализ общей выживаемости после исключения пациентов из группы плацебо, получивших в последующем сорафениб, также выявил достоверное преимущество показателей общей выживаемости в группе сорафениба по сравнению с группой плацебо: 17,8 и 14,3 месяца соответственно (р = 0,0287) [229, 230].
Сунитиниб
Сунитиниб – пероральный ингибитор оксиндольной тирозинкиназы. Данный препарат селективно подавляет PDGFR, VEGFR, с-KIT и FLT-3 и обладает противоопухолевой и антиангиогенной активностью. В исследованиях II фазы, проведенных у больных метастатическим ПКР, которые получали монотерапию сунитинибом во второй линии, частичный ответ наблюдался в 34–40% случаев, а в 27–29% наблюдений зафиксировано отсутствие прогрессирования в течение ≥ 3 месяцев.
В проведенном исследовании III фазы выживаемость до прогрессирования при монотерапии сунитинибом в первой линии была выше, чем при монотерапии ИФН-альфа (11 против 5 месяцев соответственно, p <0,000001). Результаты позволили заключить, что монотерапия ИФН-альфа при метастатическом ПКР уступает терапии сунитинибом в группах благоприятного и промежуточного прогноза. Общая выживаемость составила 26,4 и 21,8 месяца в группах сунитиниба и ИФН-альфа соответственно (p =0,05) [231, 232].
В исследовании EFFECT оценили результаты применения сунитиниба в дозе 50 мг/сут в стандартном режиме «4 недели лечения, 2 недели перерыв» с результатами непрерывной терапии сунитинибом в дозе 37,5 мг/сут у больных метастатическим светлоклеточным ПКР. Медиана времени до прогрессирования в группе сунитиниба в дозе 50 мг/сут оказалась более продолжительной по сравнению с больными, получавшими дозу 37,5 мг/сут, и составила 9,9 против 7,1 месяца соответственно. Достоверных различий в показателях общей выживааемости не выявили (23,1 против 23,5 месяца; p = 0,615). Токсичность была сопоставима в обеих группах. Авторы рекомендуют придерживаться стандартного режима терапии сунитинибом в дозе 50 мг/сут (4/2 нед), учитывая, что показатели выживаемости в этой группе были несколько выше, чем в группе, получавшей сунитиниб в непрерывном режиме [233].
Пазопаниб
Пазопаниб – это пероральный ингибитор ангиогенеза, оказывающий целенаправленное воздействие на VEGFR, PDGFR и c-KIT. В проспективном рандомизированном исследовании, сравнивающем эффективность использования пазопаниба и плацебо у пациентов, ранее не получавших медикаментозного лечения, и у больных, которым проводилось лечение цитокинами, выявлено существенное улучшение показателей выживаемости без прогрессирования и повышение частоты объективных ответов опухоли (9,2 против 4,2 месяца).
Медиана выживаемости до прогрессирования в группе пазопаниба по сравнению с плацебо составила:
-
9,2 месяца по сравнению с 4,2 месяца в общей популяции больных исследования;
-
11,1 месяца по сравнению с 2,8 месяца у больных, ранее не получавших никакого лечения;
-
7,4 месяца по сравнению с 4,2 месяца у больных, ранее получавших цитокины [234].
В исследованиях PISCES и COMPARZ, сравнивающих пазопаниб с сунитинибом, пазопаниб продемонстрировал не худшие показатели выживаемости и лучшую переносимость, чем сунитиниб [235, 236].
Акситиниб
Акситиниб – это пероральный селективный ингибитор ангиогенеза второго поколения, который блокирует VEGF-1, -2 и -3, рецепторы VEGFR.
В рандомизированном исследовании AXIS сравнивали эффективность акситиниба против сорафениба у пациентов, спрогрессировавших на терапии цитокинами. Сорафениб был выбран в качестве препарата сравнения, поскольку на момент начала исследования не было зарегистрировано препарата второй линии терапии метастатического ПКР после прогрессирования на ингибиторах VEGF-таргетной терапии. Медиана выживаемости без прогрессирования заболевания составила 6,7 месяца для пациентов, принимавших акситиниб, по сравнению с 4,7 месяца для больных, принимавших сорафениб. Однако разница в выживаемости без прогрессирования была наибольшей у пациентов, спрогрессировавших на терапии цитокинами. Выживаемость без прогрессирования в подгруппе больных, спрогрессировавших на фоне приема препарата сунитиниб и затем получавших акситиниб, составила 4,8 месяца, а в группе сорафениба – 3,4 месяца. Показатели общей выживаемости значимо не отличались в группе акситиниба и сорафениба [237, 239].
Кабозантиниб
Кабозантиниб является пероральным ингибитором тирозинкиназ, ингибирующим МЕТ, VEGF и AXL. Кабозантиниб в исследовании I фазы у пациентов, устойчивых к ингибиторам VEGFR и MTOR, продемонстрировал объективный ответ и контроль над заболеванием. На основании этих результатов в рандомизированном исследовании III фазы (METEOR) провели сравнение кабозантиниба и эверолимуса у больных метастатическим ПКР, спрогрессировавших на терапии ингибиторами VEGF. Риск прогрессирования оказался на 42% ниже в группе кабозантиниба, чем эверолимуса(HR0,58, 95% ДИ 0,45–0,75) (УД 1b). Медиана выживаемости до прогрессирования в группе кабозантиниба составила 7,4 месяца (95% ДИ 5,6–9,1) по сравнению с 3,8 месяца (95% ДИ 3,7–5,4) в группе эверолимуса. В исследование включили 658 пациентов, хотя выживаемость оценивали только у 375 пациентов. Промежуточные результаты общей выживаемости в группе кабозантиниба были гораздо выше, чем в группе эверолимуса (HR 0,67, 95% ДИ 0,51–0,89, р =0,005), однако эти данные не были статистически значимыми на промежуточном этапе исследования, окончательный анализ общей выживаемости планируется в 2016 г. Нежелательные явления 3-го и 4-го класса зарегистрировали в 74% случаев при приеме кабозантиниба и в 65% – эверолимуса. Контроль над нежелательными явлениями осуществлялся путем редукции дозы; дозу уменьшили у 60% пациентов, получавших кабозантиниб. Частота отмены препаратов из-за токсичности лечения достоверно не различалась в обеих группах. В исследование включили 16% пациентов с неблагоприятным прогнозом MSKCC [240].
Моноклональное антитело, связывающееся с VEGF
Бевацизумаб в монотерапии и в комбинации с интерфероном-альфа
Бевацизумаб представляет собой гуманизированное антитело, связывающееся с VEGF-A. Применение бевацизумаба в режиме 10 мг/кг каждые 2 недели у больных, рефрактерных к иммунотерапии, способствовало увеличению количества объективных ответов (10%) и показателей выживаемости без прогрессирования по сравнению с таковыми, отмеченными при использовании плацебо. В проведенном двойном слепом исследовании AVOREN III фазы (n = 649) сравнивали эффективность применения комбинации бевацизумаба и ИФН-альфа с использованием ИФН-альфа в монотерапии. Общий ответ составил 31% в группе применения бевацизумаба в комбинации с ИФН-альфа по сравнению с 13% в группе монотерапии (p < 0,0001). Зарегистрировано увеличение медианы выживаемости без прогрессирования с 5,4 месяца при терапии ИФН-альфа до 10,2 месяца при использовании комбинации «бевацизумаб + ИФН-альфа» (p < 0,0001), но только в группе благоприятного и промежуточного прогноза. В группе пациентов плохого прогноза преимущества не отмечено. Медиана общей выживаемости составила 23,3 месяца для комбинации «бевацизумаб + ИФН-альфа» по сравнению с 21,3 месяца для ИФН-альфа. В проведенном недавно исследовании продемонстрировано, что применение ИФН-альфа в сочетании с бевацизумабом в первой линии терапии метастатического ПКР способствует увеличению частоты объективных ответов и времени до прогрессирования по сравнению с показателями, полученными при проведении монотерапии ИФН-альфа [215, 241].
В аналогичном клиническом исследовании CALGB 90206, проведенном у 732 больных, сравнение комбинированной терапии бевацизумабом (в дозе 10 мг/кг внутривенно каждые 2 недели) + ИФН-альфа (9 млн ЕД подкожно 3 раза в неделю) и монотерапии ИФН-альфа (в дозе 9 млн ЕД подкожно 3 раза в неделю) показало, что при комбинированной терапии медиана выживаемости до прогрессирования составила 8,5 месяца, в то время как при монотерапии ИФН-альфа – 5,2 месяца. Частота объективных ответов также оказалась более высокой в группе комбинированной терапии бевацизумабом и ИФН-альфа по сравнению с монотерапией ИФН-альфа (25,5%, 95% ДИ 20,9–30,6% по сравнению с 13,1%, 95% ДИ 9,5–17,3%; р < 0,0001) [215, 241-243].
Ингибиторы mTOR
Темсиролимус
Темсиролимус – специфический ингибитор мишени рапамицина млекопитающих (mTOR – mammalian target of rapamicin). Эффективность темсиролимуса подтверждена в исследовании, в котором принимали участие пациенты с метастатическим ПКР неблагоприятного прогноза. Больных рандомизировали на три группы в зависимости от принимаемого препарата: темсиролимус, ИФН-альфа или их комбинация. В группе больных, получавших темсиролимус, общая выживаемость составила 10,9 месяца по сравнению с 7,3 месяца в группе ИФН-альфа (p < 0,0069). Тем не менее у пациентов, получавших темсиролимус в сочетании с ИФН-альфа, существенного увеличения общей выживаемости не зарегистрировано.
В исследовании INTORSECT оценили эффективность применения темсиролимуса и сорафениба у пациентов, спрогрессировавших на приеме сунитиниба. Несмотря на отсутствие данных за улучшение выживаемости до прогрессирования, было выявлено достоверное увеличение общей выживаемости в группе больных, принимавших сорафениб. Основываясь на этих результатах, темсиролимус не рекомендуется к применению у больных, спрогрессировавших на ингибиторах VEGF [217, 244].
Эверолимус
Эверолимус – пероральный ингибитор киназы mTOR. В исследовании III фазы RECORD-1 оценили результаты применения эверолимуса и плацебо у пациентов, спрогрессировавших на ингибиторах VEGF. Медиана выживаемости без прогрессирования составила 4 месяца в группе эверолимуса и 1,9 месяца в группе плацебо (p < 0,001). Достоверных различий в показателях общей выживаемости не выявлено: медиана общей выживаемости в группе больных, принимавших эверолимус, составила 14,78 месяца, в группе плацебо – 14,39 месяца (p = 0,177). Возможно, это обусловлено перекрестным влиянием, поскольку в группе плацебо 79 (81%) из 98 пациентов после регистрации прогрессирования заболевания перевели на открытый прием эверолимуса. При проведении подгруппового анализа у пациентов, получавших только одну линию таргетной терапии ингибиторами VEFG, выживаемость без прогрессирования составила 5,4 месяца. В исследование RECORD-1 включили также пациентов, спрогрессировавших на нескольких линиях таргетной терапии и получивших эверолимус в качестве третьей и четвертой линии [245].
В рандомизированном исследовании II фазы RECORD-3, изучавшем последовательную таргетную терапию сунитинибом в первой линии и эверолимусом во второй линии в сравнении с обратной последовательностью «эверолимус – сунитиниб» у не леченных ранее больных метастатическим ПКР, продемонстрировано преимущество применения сунитиниба в первой линии терапии в связи с более продолжительной медианой выживаемости до прогрессирования [247-249].
Последовательная таргетная терапия
В нескольких исследованиях изучали эффективность разных препаратов у пациентов, спрогрессировавших на ингибиторах VEGF, использованных в первой линии таргетной терапии, в том числе изучались варианты как после одной, так и нескольких неэффективных линий VEGF-терапии. В исследовании RECORD-1 продемонстрировано, что использование ингибиторов VEGF в первой линии с последующим назначением эверолимуса может использоваться как одна из схем лечения метастатического ПКР. Однако применение ниволумаба и кабозантиниба в исследованиях со схожим дизайном продемонстрировало превосходящие эверолимус результаты. Эти препараты можно рассматривать как новый стандарт терапии больных метастатическим ПКР всех групп риска, получавших ранее терапию ингибиторами VEGF [245].
Ниволумаб может быть рекомендован всем пациентам, не имеющим противопоказаний и рефрактерным к VEGF-терапии, благодаря достоверному преимуществу в общей выживаемости по сравнению с эверолимусом, а также его удовлетворительныму профилю токсичности. Кабозантиниб является первым ингибитором тирозинкиназ, показавшим лучшие результаты выживаемости до прогрессирования, чем эверолимус. Тенденция к более высокой общей выживаемости у кабозантиниба, по данным промежуточного анализа (ОР 0,67; 95% ДИ 0,51–0,89; р= 0,005), только подтверждает эти данные. Если эти результаты станут статистически достоверными, то и рекомендации по применению кабозантиниба, как и ниволумаба, по применению во второй линии таргетной терапии ПКР станут актуальными [110].
Акситиниб продемонстрировал преимущество во второй линии после ингибиторов тирозинкиназ по сравнению с сорафенибом в исследовании AXIS, однако ни ниволумаб, ни кабозантиниб на прямую не сравнивали с акситинибом в качестве второй линии таргетной терапии [238].
Комбинированная таргетная терапия
Дать какие-либо рекомендации по сочетанной таргетной терапии пока невозможно. К настоящему времени клинических исследований III фазы, в которых бы сравнивалась эффективность сочетанной терапии двумя таргетными препаратами и монотерапии таргегным препаратом, не проводилось. В ранее проведенных клинических исследованиях II фазы сообщалось о неприемлемо высокой токсичности препаратов. В клиническом протоколе TORAVA было показано, что токсичность сочетания темсиролимуса и бевацизумаба существенно выше, чем можно было ожидать, и это ограничивает возможность длительного применения этих препаратов по сравнению со стандартной терапией сунитинибом или бевацизумабом и ИФН-альфа. Кроме того, клиническая активность была низкой по сравнению с пользой, ожидаемой от последовательного применения каждого таргетного препарата. Это сочетание больше не рекомендовалось для применения или исследования. В фазе II нерандомизированных клинических исследований было показано, что сочетание эверолимуса и бевацизумаба оказалось эффективным и характеризовалось приемлемым уровнем токсичности, если не считать протеинурию, которая соответствовала 3-й степени и была выявлена у 25% больных [250-254].
НЕСВЕТЛОКЛЕТОЧНЫЙ ПОЧЕЧНО-КЛЕТОЧНЫЙ РАК
Клинических исследований III фазы по изучению таргетной терапии у больных несветлоклеточным ПКР в литературе нет. В исследованиях расширенного доступа при проведении подгруппового анализа продемонстрирована худшая эффективность таргетной терапии в группе несветлоклеточного ПКР по сравнению со светлоклеточным. Таргетная терапия несветлоклеточного ПКР сфокусирована преимущественно на темсиролимусе, эверолимусе, сорафенибе и сунитинибе [217, 255-257].
В клиническом исследовании II фазы больных папиллярным ПКР лечили форетинибом (ингибитором MET/VEGFR2), который продемонстрировал активность по отношению к ПКР с мутациями гена МЕТ и характеризуется приемлемой токсичностью и высокой частотой ответа.
Наиболее распространенные подтипы несветлоклеточного ПКР – папиллярный рак 1-го и 2-го типа. В исследовании RAPTOR у больных этой группы применяли эверолимус. Согласно промежуточным результатам, медиана выживаемости до прогрессирования составила 3,7 месяца, а медиана общей выживаемости – 21 месяц [257-260].
В другом рандомизированном исследовании II фазы (ESPN) сравнивали эффективность применения эверолимуса против сунитиниба с перекрестным дизайном у больных несветлоклеточным ПКР. В исследование включили 73 пациента (27 больных папиллярным ПКР) [261]. Согласно окончательным результатам, сунитиниб продемонстрировал недостоверный тренд в улучшении выживаемости (6,1 против 4,1 месяца). На основании результатов исследований ESPN, RECORD-3 и ASPEN сунитиниб и эверолимус остаются препаратами выбора для несветлоклеточного ПКР, причем с большим предпочтением в пользу сунитиниба [262, 263]. Целесообразно включать больных несветлоклеточными вариантами ПКР в клинические исследования (табл. 9.11).
| Вариант ПКР | Группа риска по MSKCC | Первая линия | УД | Вторая линия | УД | Третья линия | УД | Следующие линии | УД |
|---|---|---|---|---|---|---|---|---|---|
Светлоклеточный |
Благоприятная, промежуточная и неблагоприятная |
Сунитиниб, пазопаниб, бевацизумаб + ИФН (только для группы благоприятного или промежуточного прогноза) |
1b |
Основываясь на ОВ: ниволумаб |
2a |
После VEGF: ниволумаб, кабозантиниб, эверолимус |
2a |
Любой таргетный препарат |
4 |
Основываясь на ВБП: кабозантиниб, сорафениб, акситиниб, пазопаниб |
2а |
После VEGF и mTOR: сорафениб |
1b |
||||||
После VEGF и mTOR: кабозантиниб, акситиниб, эверолимус |
4 |
||||||||
Светлоклеточный |
Неблагоприятная |
Темсиролимус |
1b |
Любой таргетный препарат |
4 |
||||
Несветлоклеточный |
Любая |
Сунитиниб, эверолимус, темсиролимус |
2a |
Любой таргетный препарат |
4 |
ОВ – общая выживаемость, ВБП – выживаемость без прогрессирования.
| Рекомендации | СР | УД |
|---|---|---|
Системная терапия метастатического ПКР должна применяться с использованием таргетных и иммуноонкологичсеких препаратов |
А |
– |
Сунитиниб и пазопаниб рекомендованы для применения в качестве терапии первой линии метастатического светлоклеточного ПКР |
А |
– |
Бевацизумаб в сочетании с ИФН-альфа рекомендован для использования в качестве терапии первой линии у пациентов благоприятного и промежуточного прогноза |
А |
– |
Темсиролимус рекомендован для применения в качестве терапии первой линии у пациентов неблагоприятного прогноза, так как увеличивает общую выживаемость больных. Данных для применения темсиролимуса в последующих линиях в настоящее время недостаточно |
А |
1b |
Акситиниб рекомендован для использования в качестве терапии второй линии после прогрессирования, возникшего на фоне приема цитокинов или ингибиторов тирозинкиназ в случае, если другие препараты недоступны или плохо переносимы |
А |
– |
Эверолимус может быть рекомендован для использования в качестве терапии второй линии после прогрессирования, возникшего на фоне приема ингибиторов тирозинкиназ, в случае если другие препараты недоступны или плохо переносимы. Эверолимус улучшал показатели выживаемости до прогрессирования у больных, спрогрессировавших на VEGF-таргетной терапии. |
А |
1b |
Кабозантиниб показан к применению у больных светлоклеточным ПКР, спрогрессировавших после одной или двух линий VEGF-таргетной терапии, на основании преимущества в улучшении показателей выживаемости до прогрессирования в сравнении с эверолимусом |
А |
1b |
Ниволумаб рекомендован для лечения больных светлоклеточным ПКР, спрогрессировавших после одной или двух линий VEGF-таргетной терапии, на основании преимущества в улучшении показателей общей выживаемости в сравнении с эверолимусом |
A |
1b |
Рекомендуется последовательное применение таргетных препаратов |
A |
– |
Сунитиниб или эверолимус рекомендованы для применения в первой линии таргетной терапии несветлоклеточного метастатического ПКР |
В |
– |
Пазопаниб рекомендован для использования в качестве терапии первой линии или при прогрессировании, возникшем на фоне приема цитокинов, у больных благоприятного и промежуточного прогноза |
А |
|
Сорафениб рекомендован для применения в качестве второй линии терапии метастатического ПКР после прогрессирования, возникшего на фоне приема цитокинов |
A |
– |
Ингибиторы тирозинкиназы улучшают выживаемость без прогрессирования и/или общую выживаемость как препараты первой и второй линии лечения светлоклеточного метастатического ПКР |
– |
1b |
Акситиниб продемонстрировал доказанную эффективность и преимущество в отношении выживаемости без прогрессирования в качестве препарата второй линии лечения после неэффективности цитокинов и VEGF-таргетной терапии по сравнению с сорафенибом |
– |
1b |
Сунитиниб более эффективен, чем ИФН-альфа, у пациентов, не принимавших ранее никаких подобных препаратов |
– |
1b |
Сочетание бевацизумаба и ИФН-альфа более эффективно, чем один только ИФН-альфа, у не получавших ранее такого лечения больных ПКР благоприятного и промежуточного риска |
– |
1b |
Пазопаниб более эффективен, чем плацебо, у больных метастатическим ПКР, которые не получали до этого никакой системной терапии, и у получавших ранее цитокины |
– |
1b |
Пазопаниб не хуже сунитиниба у больных светлоклеточным метастатическим ПКР |
– |
1b |
Сорафениб обладает широким спектром активности в разных ситуациях у пациентов со светлоклеточным ПКР, которые ранее получали лечение цитокинами или таргетными препаратами. Сорафениб хуже, чем сунитиниб, в отношении больных, ранее получавших цитокины и сунитиниб и спрогрессировавших на фоне их применения |
– |
4 |
Как ингибиторы mTOR (эверолимус и темсиролимус), так и VEGF-таргетные препараты (сунитиниб или сорафениб) могут использоваться у больных несветлоклеточным ПКР |
– |
3 |
Ни одна из комбинаций не оказалась лучше, чем лечение с применением одного из таргетных препаратов |
– |
1а |
ДИНАМИЧЕСКОЕ НАБЛЮДЕНИЕ ПОСЛЕ ПРИМЕНЕНИЯ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ И АБЛАТИВНЫХ МЕТОДИК
Динамическое наблюдение проводится после выполнения хирургического лечения и аблативных методик с целью:
Методам и срокам проведения контрольных обследований посвящено множество публикаций. В настоящее время нет единого мнения о необходимости проведения динамического наблюдения за пациентами после получения ими лечения по поводу ПКР, также отсутствуют данные о том, что раннее выявление рецидива способствует улучшению выживаемости по сравнению с поздним его обнаружением.
Интенсивное обследование не является необходимым для всех пациентов. Например, при выполнении операций по поводу опухолей стадии Т1а и новообразований низких стадий почти всегда достигаются хорошие результаты. В связи с этим в зависимости от риска рецидивирования и метастазирования целесообразно осуществлять дифференцированный режим наблюдения. Данных рандомизированных исследований пока что не существует, но результаты исследований прогностических факторов с большим сроком наблюдения больных уже позволяют сделать некоторые выводы (УД 4).
При низкой вероятности развития рецидива может быть достаточно выполнения рентгенографии грудной клетки и УЗИ. Однако рентгенография малочувствительна к небольшим метастазам, а УЗИ имеет ограничения.
При наличии среднего или высокого риска возникновения рецидива методом выбора является КТ органов грудной клетки и брюшной полости, хотя при этом следует учитывать побочное действие облучения, возникающее при проведении повторных КТ-исследований.
В зависимости от наличия новых эффективных методов лечения может потребоваться применение более жестких схем послеоперационного контроля и наблюдения, в частности при известном более высоком риске развития местного рецидива после проведения криоабляции или РЧТА. Проблемой является определение оптимального срока наблюдения за больным. Существует мнение, что проведение наблюдения при помощи методов визуализации после 5 лет выживаемости уже не является экономически эффективным, однако поздние метастазы с большей вероятностью будут одиночными, и для их излечения понадобится применение более агрессивной терапии. Кроме того, пациенты, у которых опухоль дает рецидив в контралатеральную почку, могут быть излечены посредством выполнения органосохраняющей операции, если обнаруженная опухоль будет иметь небольшие размеры. Более того, для опухолей диаметром < 4 см в ходе послеоперационного наблюдения не выявлено разницы в частоте возникновения рецидивов после осуществления нефрэктомии или резекции почки (УД 3) [264-271].
Некоторые авторы, в частности M.W. Kattan, J.S. Lam, B.C. Liebovich и P.I. Karakiewicz, разработали системы баллов и номограммы для количественного определения вероятности возникновения рецидива, метастазов и последующей смерти пациента. Эти системы сравнивались и проходили валидацию (УД 2). Было предложено несколько режимов осуществления динамического наблюдения в зависимости от стадии заболевания с использованием прогностических переменных, но ни один из них не включал применение аблационных методов терапии. Разработаны послеоперационные номограммы, позволяющие оценить вероятность достижения безрецидивной пятилетней выживаемости. Совсем недавно была опубликована и прошла валидацию дооперационная прогностическая модель, основанная на возрасте, симптомах и стадировании по TNM (УД 3). Соответственно для осуществления мониторинга пациентов с ПКР необходимо использование алгоритма динамического наблюдения, в котором учитывался бы не только риск развития рецидива или появления метастазов, но также и эффективность проведенного лечения (см. табл. 9.12) [271, 272].
Профиль риска |
Вид лечения |
Длительность динамического наблюдения |
||||||
6 мес |
1 год |
2 года |
3 года |
4 года |
5 лет |
> 5 лет |
||
Низкий |
Только НЭ/РП |
УЗИ |
КТ |
УЗИ |
КТ |
УЗИ |
КТ |
Отмена |
Средний |
НЭ/РП/крио/РЧТА |
КТ |
КТ |
КТ |
УЗИ |
КТ |
КТ |
КТ каждые 2 года |
Высокий |
НЭ/РП/крио/РЧТА |
КТ |
КТ |
КТ |
КТ |
КТ |
КТ |
КТ каждые 2 года |
НЭ – нефрэктомия, РП – резекция почки, КТ или МРТ – компьютерная томография или магнитно-резонансная томография органов грудной клетки и брюшной полости, крио – криоабляция, УЗИ – ультразвуковое исследование органов брюшной полости, забрюшинного пространства, почек и ложа почки.
| Рекомендации | УД | СР |
|---|---|---|
Интенсивность программы динамического наблюдения для каждого отдельного пациента должна подбираться индивидуально в соответствии с присущим ему риском возникновения рецидива и типом проведенного лечения |
– |
С |
КТ/МРТ-исследования для больных благоприятного прогноза должны применяться нечасто |
– |
С |
Для больных промежуточного прогноза интенсивность динамического наблюдения с применением КТ/МРТ-исследования должна применяться согласно риск-ассоциированным номограммам |
– |
С |
Для больных неблагоприятного прогноза динамическое наблюдение должно включать рутинное выполнение КТ/МРТ-исследования |
– |
С |
В случае выявления больших (> 7 см) опухолей почки при выполнении органосохраняющей операции или при наличии положительного края резекции имеется повышенный риск развития внутрипочечных рецидивов. Таким пациентам требуется проведение более тщательного наблюдения в послеоперационном периоде |
3 |
С |
Стратификация на группы риска должна проводиться с использованием существующих систем классификации, таких как UISS (http://urology.ucla.edu/body.cfm?id=443) |
– |
С |
Список литературы
-
International Agency for Research on Cancer. The GLOBOCAN project: cancer incidence and mortality worldwide in 2012. Доступно по адресу: http://globocan.iarc.fr/Pages/fact_sheets_population.aspx
-
Злокачественные новообразования в России в 2014 году: заболеваемость и смертность. Под ред. Каприна А.Д., Старинского В.В., Петровой Г.В. М., 2016.
-
European Network of Cancer Registries. Eurocim version 4.0. European incidence database V2.3, 730 entity dictionary (2001), Lyon, 2001.
-
Lindblad P. Epidemiology of renal cell carcinoma. Scand. J. Surg. 2004; 93: 88.
-
Ferlay J. et al. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur. J. Cancer. 2013; 49: 1374.
-
Levi F. et al. The changing pattern of kidney cancer incidence and mortality in Europe. BJU Int. 2008; 101: 949.
-
Kovacs G. et al. The Heidelberg classification of renal cell tumours. J. Pathol. 1997; 183: 131.
-
Sun M. et al. 1634 Management of localized kidney cancer: calculating cancer-specific mortality and compteing-risks of death tradeoffs between surgery and active surveillance. J. Urol. 2013; 189: e672.
-
Masson-Lecomte A. et al. A prospective comparison of the pathologic and surgical outcomes obtained after elective treatment of renal cell carcinoma by open or robot-assisted partial nephrectomy. Urol. Oncol. 2013; 31: 924.
-
Choi J.E. et al. Comparison of perioperative outcomes between robotic and laparoscopic partial nephrectomy: a systematic review and meta-analysis. Eur. Urol. 2015; 67: 891.
-
Lipworth L. et al. The epidemiology of renal cell carcinoma. J. Urol. 2006; 176: 2353.
-
Bergstrom A. et al. Obesity and renal cell cancer – a quantitative review. Br. J. Cancer. 2001; 85: 984.
-
International Agency for Research on Cancer (IARC). WHO IARC monographs. 2004. 83 p.
-
Weikert S. et al. Blood pressure and risk of renal cell carcinoma in the European prospective investigation into cancer and nutrition. Am. J. Epidemiol. 2008; 167: 438.
-
Clague J. et al. Family history and risk of renal cell carcinoma: results from a case-control study and systematic meta-analysis. Cancer Epidemiol. Biomarkers Prev. 2009; 18: 801.
-
Pierorazio P.M. et al. Five-year analysis of a multi-institutional prospective clinical trial of delayed intervention and surveillance for small renal masses: the DISSRM registry. Eur. Urol. 2015; 68: 408.
-
Daniel C.R. et al. Large prospective investigation of meat intake, related mutagens, and risk of renal cell carcinoma. Am. J. Clin. Nutr. 2012; 95: 155.
-
Bellocco R. et al. Alcohol drinking and risk of renal cell carcinoma: results of a meta-analysis. Ann. Oncol. 2012; 23: 2235.
-
Song D.Y. et al. Alcohol intake and renal cell cancer risk: a meta-analysis. Br. J. Cancer. 2012; 106: 1881.
-
Wood C. et al. An adjuvant autologous therapeutic vaccine (HSPPC-96; vitespen) versus observation alone for patients at high risk of recurrence after nephrectomy for renal cell carcinoma: a multicentre, open-label, randomised phase III trial. Lancet. 2008; 372: 145.
-
Patard J.J. et al. Prognostic significance of the mode of detection in renal tumours. BJU Int. 2002; 90: 358.
-
Kato M. et al. Natural history of small renal cell carcinoma: evaluation of growth rate, histological grade, cell proliferation and apoptosis. J. Urol. 2004; 172: 863.
-
Tsui K.H. et al. Renal cell carcinoma: prognostic significance of incidentally detected tumors. J. Urol. 2000; 163: 426.
-
Sobin L.H., Gospodariwicz M., Wittekind C. (eds). TNM classification of malignant tumors. UICC International Union Against Cancer. 7th edn. Wiley-Blackwell, 2009. 255 p.
-
Wittekind B.J., Compton C.C., Sobin L.H. (eds). A Commentary on Uniform Use. UICC International Union against cancer. 4th edn. Wiley-Blackwell. 106 p.
-
Ficarra V. et al. Preoperative aspects and dimensions used for an anatomical (PADUA) classification of renal tumours in patients who are candidates for nephron-sparing surgery. Eur. Urol. 2009; 56: 786.
-
Kutikov A. et al. The R.E.N.A.L. nephrometry score: a comprehensive standardized system for quantitating renal tumor size, location and depth. J. Urol. 2009; 182:844.
-
Simmons M.N. et al. Kidney tumor location measurement using the C-index method. J. Urol. 2010; 183: 1708.
-
Eble J.N., Sauter G., Epstein J.I. et al. (eds). In: Pathology and genetics of tumours of the urinarysystem and male genital organs. World Health Organization Classification of Tumours. Lyon: IARC Press, 2004.
-
Srigley J.R. et al. The International Society of Urological Pathology (ISUP) Vancouver Classification of Renal Neoplasia. Am. J. Surg. Pathol. 2013; 37: 1469.
-
Yang X.J. et al. A molecular classification of papillary renal cell carcinoma. Cancer Res. 2005; 65: 5628.
-
Linehan W.M. et al. Genetic basis of cancer of the kidney: disease-specific approaches to therapy. Clin. Cancer Res. 2004; 10: 6282S.
-
Furge K.A. et al. Identification of deregulated oncogenic pathways in renal cell carcinoma: an integrated oncogenomic approach based on gene expression profiling. Oncogene. 2007; 26: 1346.
-
Fuhrman S.A. et al. Prognostic significance of morphologic parameters in renal cell carcinoma. Am. J. Surg. Pathol. 1982; 6: 655.
-
Capitanio U. et al. A critical assessment of the prognostic value of clear cell, papillary and chromophobe histological subtypes in renal cell carcinoma: a population-based study. BJU Int. 2009; 103: 1496.
-
Keegan K.A. et al. Histopathology of surgically treated renal cell carcinoma: survival differences by subtype and stage. J. Urol. 2012; 188: 391.
-
Beck S.D. et al. Effect of papillary and chromophobe cell type on disease-free survival after nephrectomy for renal cell carcinoma. Ann. Surg. Oncol. 2004; 11:71.
-
Tsui K.H. et al. Prognostic indicators for renal cell carcinoma: a multivariate analysis of 643 patients using the revised 1997 TNM staging criteria. J. Urol. 2000; 163: 1090.
-
Steffens S. et al. Incidence and long-term prognosis of papillary compared to clear cell renal cell carcinoma – a multicentre study. Eur. J. Cancer. 2012; 48: 2347.
-
Pignot G. et al. Survival analysis of 130 patients with papillary renal cell carcinoma: prognostic utility of type 1 and type 2 subclassification. Urology. 2007; 69:230.
-
Gontero P. et al. Prognostic factors in a prospective series of papillary renal cell carcinoma. BJU Int. 2008; 102: 697.
-
Sukov W.R. et al. Clinical and pathological features associated with prognosis in patients with papillary renal cell carcinoma. J. Urol. 2012; 187: 54.
-
Urge T. et al. Typical signs of oncocytic papillary renal cell carcinoma in everyday clinical praxis. World J. Urol. 2010; 28: 513.
-
Paner G.P. et al. A novel tumor grading scheme for chromophobe renal cell carcinoma: prognostic utility and comparison with Fuhrman nuclear grade. Am. J. Surg. Pathol. 2010; 34: 1233.
-
Cheville J.C. et al. Chromophobe renal cell carcinoma: the impact of tumor grade on outcome. Am. J. Surg. Pathol. 2012; 36: 851.
-
Vera-Badillo F.E. et al. Chromophobe renal cell carcinoma: a review of an uncommon entity. Int. J. Urol. 2012; 19: 894.
-
Volpe A. et al. Chromophobe renal cell carcinoma (RCC): oncological outcomes and prognostic factors in a large multicentre series. BJU Int. 2012; 110: 76.
-
Roubaud G. et al. Combination of gemcitabine and doxorubicin in rapidly progressive metastatic renal cell carcinoma and/or sarcomatoid renal cell carcinoma. Oncology. 2011; 80: 214.
-
Abern M.R. et al. Characteristics and outcomes of tumors arising from the distal nephron. Urology. 2012; 80: 140.
-
Husillos A. et al. Collecting duct renal cell carcinoma. Actas Urol. Esp. 2011; 35:368.
-
Hora M. et al. MiT translocation renal cell carcinomas: two subgroups of tumours with translocations involving 6p21 [t (6; 11)] and Xp11.2 [t (X;1 or X or 17)]. Springerplus. 2014; 3: 245.
-
Jayson M. et al. Increased incidence of serendipitously discovered renal cell carcinoma. Urology. 1998; 51: 203.
-
Lee C.T. et al. Mode of presentation of renal cell carcinoma provides prognostic information. Urol. Oncol. 2002; 7: 135.
-
Patard J.J. et al. Correlation between symptom graduation, tumor characteristics and survival in renal cell carcinoma. Eur. Urol. 2003; 44: 226.
-
Kim H.L. et al. Paraneoplastic signs and symptoms of renal cell carcinoma: implications for prognosis. J. Urol. 2003; 170: 1742.
-
Motzer R.J. et al. Interferon-alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma. J. Clin. Oncol. 2002; 20:289.
-
Sufrin G. et al. Paraneoplastic and serologic syndromes of renal adenocarcinoma. Semin Urol. 1989; 7: 158.
-
Israel G.M. et al. How I do it: evaluating renal masses. Radiology. 2005; 236: 441.
-
Fan L. et al. Diagnostic efficacy of contrast-enhanced ultrasonography in solid renal parenchymal lesions with maximum diameters of 5 cm. J. Ultrasound Med. 2008; 27: 875.
-
Correas J.M. et al. Guidelines for contrast enhanced ultrasound (CEUS) – update 2008. J. Radiol. 2009; 90: 123.
-
Mitterberger M. et al. Contrast-enhanced ultrasound for diagnosis of prostate cancer and kidney lesions. Eur. J. Radiol. 2007; 64: 231.
-
Israel G.M. et al. Pitfalls in renal mass evaluation and how to avoid them. Radiographics. 2008; 28: 1325.
-
Rosenkrantz A.B. et al. MRI features of renal oncocytoma and hromophobe renal cell carcinoma. AJR Am. J. Roentgenol. 2010; 195: W421.
-
Hindman N. et al. Angiomyolipoma with minimal fat: can it be differentiated from clear cell renal cell carcinoma by using standard MR techniques? Radiology. 2012; 265: 468.
-
Pedrosa I. et al. MR imaging of renal masses: correlation with findings at surgery and pathologic analysis. Radiographics. 2008; 28: 985.
-
Gong I.H. et al. Relationship among total kidney volume, renal function and age. J. Urol. 2012; 187: 344.
-
Ferda J. et al. Assessment of the kidney tumor vascular supply by two-phase MDCT-angiography. Eur. J. Radiol. 2007; 62: 295.
-
Shao P. et al. Precise segmental renal artery clamping under the guidance of dual-source computed tomography angiography during laparoscopic partial nephrectomy. Eur. Urol. 2012; 62: 1001.
-
Adey G.S. et al. Lower limits of detection using magnetic resonance imaging for solid components in cystic renal neoplasms. Urology. 2008; 71: 47.
-
Janus C.L. et al. Comparison of MRI and CT for study of renal and perirenal masses. Crit. Rev. Diagn. Imaging. 1991; 32: 69.
-
Krestin G.P. et al. The importance of magnetic resonance tomography in the diagnosis and staging of renal cell carcinoma. Radiologe. 1992; 32: 121.
-
Mueller-Lisse U.G. et al. Imaging of advanced renal cell carcinoma. World J. Urol. 2010; 28: 253.
-
Kabala J.E. et al. Magnetic resonance imaging in the staging of renal cell carcinoma. Br. J. Radiol. 1991; 64: 683.
-
Putra L.G. et al. Improved assessment of renal lesions in pregnancy with magnetic resonance imaging. Urology. 2009; 74: 535.
-
Giannarini G. et al. Potential and limitations of diffusion-weighted magnetic resonance imaging in kidney, prostate, and bladder cancer including pelvic lymph node staging: a critical analysis of the literature. Eur. Urol. 2012; 61: 326.
-
Park J.W. et al. Significance of 18F-fluorodeoxyglucose positron-emission tomography/computed tomography for the postoperative surveillance of advanced renal cell carcinoma. BJU Int. 2009; 103: 615.
-
Bechtold R.E. et al. Imaging approach to staging of renal cell carcinoma. Urol. Clin. North Am. 1997; 24: 507.
-
Miles K.A. et al. CT staging of renal carcinoma: a prospective comparison of three dynamic computed tomography techniques. Eur. J. Radiol. 1991; 13: 37.
-
Lim D.J. et al. Computerized tomography in the preoperative staging for pulmonary metastases in patients with renal cell carcinoma. J. Urol. 1993; 150: 1112.
-
Marshall M.E. et al. Low incidence of asymptomatic brain metastases in patients with renal cell carcinoma. Urology. 1990; 36: 300.
-
Koga S. et al. The diagnostic value of bone scan in patients with renal cell carcinoma. J. Urol. 2001; 166: 2126.
-
Henriksson C. et al. Skeletal metastases in 102 patients evaluated before surgery for renal cell carcinoma. Scand. J. Urol. Nephrol. 1992; 26: 363.
-
Seaman E. et al. Association of radionuclide bone scan and serum alkaline phosphatase in patients with metastatic renal cell carcinoma. Urology. 1996; 48:692.
-
Warren K.S. et al. The Bosniak classification of renal cystic masses. BJU Int. 2005; 95: 939.
-
Bosniak M.A. The use of the Bosniak classification system for renal cysts and cystic tumors. J. Urol. 1997; 157: 1852.
-
Shannon B.A. et al. The value of preoperative needle core biopsy for diagnosing benign lesions among small, incidentally detected renal masses. J. Urol. 2008; 180:1257.
-
Maturen K.E. et al. Renal mass core biopsy: accuracy and impact on clinical management. AJR Am. J. Roentgenol. 2007; 188: 563.
-
Volpe A. et al. Contemporary results of percutaneous biopsy of 100 small renal masses: a single center experience. J. Urol. 2008; 180: 2333.
-
Veltri A. et al. Diagnostic accuracy and clinical impact of imaging-guided needle biopsy of renal masses. Retrospective analysis on 150 cases. Eur. Radiol. 2011; 21: 393.
-
Leveridge M.J. et al. Outcomes of small renal mass needle core biopsy, nondiagnostic percutaneous biopsy, and the role of repeat biopsy. Eur. Urol. 2011; 60:578.
-
Abel E.J. et al. Percutaneous biopsy of primary tumor in metastatic renal cell carcinoma to predict high risk pathological features: comparison with nephrectomy assessment. J. Urol. 2010; 184: 1877.
-
Breda A. et al. Comparison of accuracy of 14-, 18and 20-G needles in ex-vivo renal mass biopsy: a prospective, blinded study. BJU Int. 2010; 105: 940.
-
Marconi L. et al. Systematic review and meta-analysis of diagnostic accuracy of percutaneous renal tumour biopsy. Eur. Urol. 2016; 69 (4): 660–673.
-
Lang H. et al. Multicenter determination of optimal interobserver agreement using the Fuhrman grading system for renal cell carcinoma: Assessment of 241 patients with > 15-year follow-up. Cancer. 2005; 103: 625.
-
Rioux-Leclercq N. et al. Prognostic ability of simplified nuclear grading of renal cell carcinoma. Cancer. 2007; 109: 868.
-
Sun M. et al. A proposal for reclassification of the Fuhrman grading system in patients with clear cell renal cell carcinoma. Eur. Urol. 2009; 56: 775.
-
Cheville J.C. et al. Comparisons of outcome and prognostic features among histologic subtypes of renal cell carcinoma. Am. J. Surg. Pathol. 2003; 27: 612.
-
Patard J.J. et al. Prognostic value of histologic subtypes in renal cell carcinoma: a multicenter experience. J. Clin. Oncol. 2005; 23: 2763.
-
Leibovich B.C. et al. Histological subtype is an independent predictor of outcome for patients with renal cell carcinoma. J. Urol. 2010; 183: 1309.
-
Wahlgren T. et al. Treatment and overall survival in renal cell carcinoma: a Swedish population based study (2000-2008). Br. J. Cancer. 2013; 108: 1541.
-
Haas N.B. et al. Initial results from ASSURE (E2805): Adjuvant sorafenib or sunitinib for unfavorable renal carcinoma, an ECOG-ACRIN-led, NCTN phase III trial. ASCO Meeting Abstracts. 33: 403.
-
Bensalah K. et al. Prognostic value of thrombocytosis in renal cell carcinoma. J. Urol. 2006; 175: 859.
-
Kim H.L. et al. Cachexia-like symptoms predict a worse prognosis in localized t1 renal cell carcinoma. J. Urol. 2004; 171: 1810.
-
Patard J.J. et al. Multi-institutional validation of a symptom based classification for renal cell carcinoma. J. Urol. 2004; 172: 858.
-
A phase 3, randomized, open-label study of nivolumab combined with ipilimumab versus sunitinib monotherapy in subjects with previously untreated, advanced or metastatic renal cell carcinoma. 2015 p. NCT02231749.
-
Sim S.H. et al. Prognostic utility of pre-operative circulating osteopontin, carbonic anhydrase IX and CRP in renal cell carcinoma. Br. J. Cancer. 2012; 107: 1131.
-
Sabatino M. et al. Serum vascular endothelial growth factor and fibronectin predict clinical response to high-dose interleukin-2 therapy. J. Clin. Oncol. 2009; 27: 2645.
-
Li G. et al. Serum carbonic anhydrase 9 level is associated with postoperative recurrence of conventional renal cell cancer. J. Urol. 2008; 180: 510.
-
Choueiri T.K. et al. A phase I study of cabozantinib (XL184) in patients with renal cell cancer. Ann. Oncol. 2014; 25: 1603.
-
Motzer R.J. et al. Nivolumab versus everolimus in advanced renal-cell carcinoma. N. Engl. J. Med. 2015; 373: 1803.
-
Zhao H. et al. Gene expression profiling predicts survival in conventional renal cell carcinoma. PLoS Med. 2006; 3: e13.
-
Sorbellini M. et al. A postoperative prognostic nomogram predicting recurrence for patients with conventional clear cell renal cell carcinoma. J. Urol. 2005; 173: 48.
-
Zisman A. et al. Improved prognostication of renal cell carcinoma using an integrated staging system. J. Clin. Oncol. 2001; 19: 1649.
-
Frank I. et al. An outcome prediction model for patients with clear cell renal cell carcinoma treated with radical nephrectomy based on tumor stage, size, grade and necrosis: the SSIGN score. J. Urol. 2002; 168: 2395.
-
Leibovich B.C. et al. Prediction of progression after radical nephrectomy for patients with clear cell renal cell carcinoma: a stratification tool for prospective clinical trials. Cancer. 2003; 97: 1663.
-
Patard J.J. et al. Use of the University of California Los Angeles integrated staging system to predict survival in renal cell carcinoma: an international multicenter study. J. Clin. Oncol. 2004; 22: 3316.
-
Karakiewicz P.I. et al. Multi-institutional validation of a new renal cancer-specific survival nomogram. J. Clin. Oncol. 2007; 25: 1316.
-
Zigeuner R. et al. External validation of the Mayo Clinic stage, size, grade, and necrosis (SSIGN) score for clear-cell renal cell carcinoma in a single European centre applying routine pathology. Eur. Urol. 2010; 57: 102.
-
Isbarn H. et al. Predicting cancer-control outcomes in patients with renal cell carcinoma. Curr. Opin. Urol. 2009; 19: 247.
-
Raj G.V. et al. Preoperative nomogram predicting 12-year probability of metastatic renal cancer. J. Urol. 2008; 179: 2146.
-
Karakiewicz P.I. et al. A preoperative prognostic model for patients treated with nephrectomy for renal cell carcinoma. Eur. Urol. 2009; 55: 287.
-
Butler B.P. et al. Management of small unilateral renal cell carcinomas: radical versus nephronsparing surgery. Urology. 1995; 45: 34.
-
Gratzke C. et al. Quality of life and perioperative outcomes after retroperito-neoscopic radical nephrectomy (RN), open RN and nephron-sparing surgery in patients with renal cell carcinoma. BJU Int. 2009; 104: 470.
-
D’Armiento M. et al. Elective conservative surgery for renal carcinoma versus radical nephrectomy: a prospective study. Br. J. Urol. 1997; 79: 15.
-
Lee J.H., Min G.E. et al. Comparison of the surgical outcome and renal function between radical and nephron-sparing surgery for renal cell carcinomas. Korean J.Urol. 2007: 671.
-
Van Poppel H. et al. A prospective, randomised EORTC intergroup phase 3 study comparing the oncologic outcome of elective nephron-sparing surgery and radical nephrectomy for low-stage renal cell carcinoma. Eur. Urol. 2011; 59: 543.
-
Huang W.C. et al. Partial nephrectomy versus radical nephrectomy in patients with small renal tumors – is there a difference in mortality and cardiovascular outcomes? J. Urol. 2009; 181: 55.
-
Zini L. et al. Radical versus partial nephrectomy: effect on overall and noncancer mortality. Cancer. 2009; 115: 1465.
-
Thompson R.H. et al. Radical nephrectomy for pT1a renal masses may be associated with decreased overall survival compared with partial nephrectomy. J.Urol. 2008; 179: 468.
-
Patard J.J. et al. Radical nephrectomy is not superior to nephron sparing surgery in PT1B-PT2N0M0 renal tumours: A matched comparison analysis in 546 cases. Eur. Urol. Suppl. 2008; 2008: 194.
-
Jang H.A. et al. Oncologic and functional outcomes after partial nephrectomy versus radical nephrectomy in T1b renal cell carcinoma: a multicentre, matched case-control study in Korean patients. J. Urol. 2013; 189: e675.
-
Thompson R.H. et al. Contemporary use of partial nephrectomy at a tertiary care center in the United States. J. Urol. 2009; 181: 993.
-
Dash A. et al. Comparison of outcomes in elective partial vs radical nephrectomy for clear cell renal cell carcinoma of 4-7 cm. BJU Int. 2006; 97: 939.
-
Weight C.J. et al. Nephrectomy induced chronic renal insufficiency is associated with increased risk of cardiovascular death and death from any cause in patients with localized cT1b renal masses. J. Urol. 2010; 183: 1317.
-
Crépel M. et al. Nephron-sparing surgery is equally effective to radical nephrectomy for T1BN0M0 renal cell carcinoma: a population-based assessment. Urology. 2010; 75: 271.
-
Patard J.J. et al. Safety and efficacy of partial nephrectomy for all T1 tumors based on an international multicenter experience. J. Urol. 2004; 171: 2181.
-
Antonelli A. et al. Elective partial nephrectomy is equivalent to radical nephrectomy in patients with clinical T1 renal cell carcinoma: results of a retrospective, comparative, multi-institutional study. BJU Int. 2012; 109: 1013.
-
Iizuka J. et al. Similar functional outcomes after partial nephrectomy for clinical T1b and T1a renal cell carcinoma. Int. Urol. 2012; 19: 980.
-
Badalato G.M. et al. Survival after partial and radical nephrectomy for the treatment of stage T1bN0M0 renal cell carcinoma (RCC) in the USA: a propensity scoring approach. BJU Int. 2012; 109: 1457.
-
Simmons M.N. et al. Laparoscopic radical versus partial nephrectomy for tumors > 4 cm: intermediate-term oncologic and functional outcomes. Urology. 2009; 73: 1077.
-
Takaki H. et al. Midterm results of radiofrequency ablation versus nephrectomy for T1a renal cell carcinoma. Jpn J. Radiol. 2010; 28: 460.
-
Blom J.H. et al. Radical nephrectomy with and without lymph-node dissection: final results of European Organization for Research and Treatment of Cancer (EORTC) randomized phase 3 trial 30881. Eur. Urol. 2009; 55: 28.
-
Capitanio U. et al. Lymph node dissection in renal cell carcinoma. Eur. Urol. 2011; 60: 1212.
-
Herrlinger A. et al. What are the benefits of extended dissection of the regional renal lymph nodes in the therapy of renal cell carcinoma. J. Urol. 1991; 146: 1224.
-
Peters P.C. et al. The role of lymphadenectomy in the management of renal cell carcinoma. Urol. Clin. North Am. 1980; 7: 705.
-
Yamashita Y. A.A., Sakamoto K. The therapeutic value of lymph node dissection for renal cell carcinoma. Nishinihon J. Urol. 1989: 777.
-
Sullivan L.D. et al. Surgical management of renal cell carcinoma at the Vancouver General Hospital: 20-year review. Can. J. Surg. 1979; 22: 427.
-
Siminovitch J.P. et al. Lymphadenectomy in renal adenocarcinoma. J. Urol. 1982; 127: 1090.
-
Kim S. et al. The relationship of lymph node dissection with recurrence and survival for patients treated with nephrectomy for high-risk renal cell carcinoma. J. Urol. 2012; 187: e233.
-
May M. et al. Pre-operative renal arterial embolisation does not provide survival benefit in patients with radical nephrectomy for renal cell carcinoma. Br. J. Radiol. 2009; 82: 724.
-
Subramanian V.S. et al. Utility of preoperative renal artery embolization for management of renal tumors with inferior vena caval thrombi. Urology. 2009; 74: 154.
-
Maxwell N.J. et al. Renal artery embolisation in the palliative treatment of renal carcinoma. Br. J. Radiol. 2007; 80: 96.
-
Hallscheidt P. et al. Preoperative and palliative embolization of renal cell carcinomas: follow-up of 49 patients. Rofo. 2006; 178: 391.
-
Lamb G.W. et al. Management of renal masses in patients medically unsuitable for nephrectomy – natural history, complications, and outcome. Urology. 2004; 64:909.
-
Hemal A.K. et al. Laparoscopic versus open radical nephrectomy for large renal tumors: a longterm prospective comparison. J. Urol. 2007; 177: 862.
-
Brewer K. et al. Perioperative and renal function outcomes of minimally invasive partial nephrectomy for T1b and T2a kidney tumors. J. Endourol. 2012; 26:244.
-
Sprenkle P.C. et al. Comparison of open and minimally invasive partial nephrectomy for renal tumors 4-7 centimeters. Eur. Urol. 2012; 61: 593.
-
Peng B. et al. Retroperitoneal laparoscopic nephrectomy and open nephrectomy for radical treatment of renal cell carcinoma: A comparison of clinical outcomes. Acad. J. of Second Mil. Med. Univ. 2006: 1167.
-
Ebbing J. et al. Evaluation of perioperative complications in open and laparoscopic surgery for renal cell cancer with tumor thrombus involvement using the Clavien-Dindo classification. Eur. J. Surg. Oncol. 2015; 41: 941.
-
Laird A. et al. Matched pair analysis of laparoscopic versus open radical nephrectomy for the treatment of T3 renal cell carcinoma. World J. Urol. 2015; 33:25.
-
Steinberg A.P. et al. Laparoscopic radical nephrectomy for large (greater than 7 cm, T2) renal tumors. J. Urol. 2004; 172: 2172.
-
Desai M.M. et al. Prospective randomized comparison of transperitoneal versus retroperitoneal laparoscopic radical nephrectomy. J. Urol. 2005; 173: 38.
-
Nambirajan T. et al. Prospective, randomized controlled study: transperitoneal laparoscopic versus retroperitoneoscopic radical nephrectomy. Urology. 2004; 64:919.
-
Soga N. et al. Comparison of radical nephrectomy techniques in one center: minimal incision portless endoscopic surgery versus laparoscopic surgery. Int. J. Urol. 2008; 15: 1018.
-
Park Y. et al. Laparoendoscopic single-site radical nephrectomy for localized renal cell carcinoma: comparison with conventional laparoscopic surgery. J. Endourol. 2009; 23: A19.
-
Gill I.S. et al. Comparison of 1,800 laparoscopic and open partial nephrectomies for single renal tumors. J. Urol. 2007; 178: 41.
-
Lane B.R. et al. 7-year oncological outcomes after laparoscopic and open partial nephrectomy. J. Urol. 2010; 183: 473.
-
Gong E.M. et al. Comparison of laparoscopic and open partial nephrectomy in clinical T1a renal tumors. J. Endourol. 2008; 22: 953.
-
Marszalek M. et al. Laparoscopic and open partial nephrectomy: a matched-pair comparison of 200 patients. Eur. Urol. 2009; 55: 1171.
-
Muramaki M. et al. Prognostic factors influencing postoperative development of chronic kidney disease in patients with small renal tumors who underwent partial nephrectomy. Curr. Urol. 2013; 6: 129.
-
Rais-Bahrami S. et al. Off-clamp versus complete hilar control laparoscopic partial nephrectomy: comparison by clinical stage. BJU Int. 2012; 109: 1376.
-
Bazzi W.M. et al. Comparison of laparoendoscopic single-site and multiport laparoscopic radical and partial nephrectomy: a prospective, nonrandomized study. Urology. 2012; 80: 1039.
-
Lane B.R. et al. Active treatment of localized renal tumors may not impact overall survival in patients aged 75 years or older. Cancer. 2010; 116: 3119.
-
Hollingsworth J.M. et al. Five-year survival after surgical treatment for kidney cancer: a populationbased competing risk analysis. Cancer. 2007; 109: 1763.
-
Volpe A. et al. The natural history of incidentally detected small renal masses. Cancer. 2004; 100: 738.
-
Jewett M.A. et al. Active surveillance of small renal masses: progression patterns of early stage kidney cancer. Eur. Urol. 2011; 60: 39.
-
Smaldone M.C. et al. Small renal masses progressing to metastases under active surveillance: a systematic review and pooled analysis. Cancer. 2012; 118: 997.
-
Sisul D.M. et al. RENAL nephrometry score is associated with complications after renal cryoablation: a multicenter analysis. Urology. 2013; 81: 775.
-
Kim E.H. et al. Outcomes of laparoscopic and percutaneous cryoablation for renal masses. J. Urol. 2013; 189: e492.
-
Goyal J. et al. Single-center comparative oncologic outcomes of surgical and percutaneous cryoablation for treatment of renal tumors. J. Endourol. 2012; 26: 1413.
-
Atwell T.D. et al. Percutaneous ablation of renal masses measuring 3.0 cm and smaller: comparative local control and complications after radiofrequency ablation and cryoablation. AJR Am. J. Roentgenol. 2013; 200: 461.
-
Samarasekera D. et al. Percutaneous radiofrequency ablation versus percutaneous cryoablation: long-term outcomes following ablation for renal cell carcinoma. J. Urol. 2013; 189: e737.
-
O’Malley R.L. et al. A matched-cohort comparison of laparoscopic cryoablation and laparoscopic partial nephrectomy for treating renal masses. BJU Int. 2007; 99: 395.
-
Ko Y.H. et al. A matched-cohort comparison of laparoscopic renal cryoablation using ultra-thin cryoprobes with open partial nephrectomy for the treatment of small renal cell carcinoma. Cancer Res. Treat. 2008; 40: 184.
-
Desai M.M. et al. Laparoscopic partial nephrectomy versus laparoscopic cryoablation for the small renal tumor. Urology. 2005; 66: 23.
-
Moinzadeh A. et al. Prognostic significance of tumor thrombus level in patients with renal cell carcinoma and venous tumor thrombus extension. Is all T3b the same? J. Urol. 2004; 171: 598.
-
Faust W. et al. Minimal access versus median sternotomy for cardiopulmonary bypass in the management of renal cell carcinoma with vena caval and atrial involvement. J. Urol. 2013; 189 (Suppl.): e255.
-
Chan A.A. et al. Impact of preoperative renal artery embolization on surgical outcomes and overall survival in patients with renal cell carcinoma and inferior vena cava thrombus. J. Urol. 2011: e707.
-
Orihashi K. et al. Deep hypothermic circulatory arrest for resection of renal tumor in the inferior vena cava: beneficial or deleterious? Circ. J. 2008; 72: 1175.
-
Galligioni E. et al. Adjuvant immunotherapy treatment of renal carcinoma patients with autologous tumor cells and bacillus Calmette-Guerin: five-year results of a prospective randomized study. Cancer. 1996; 77: 2560.
-
Figlin R.A. et al. Multicenter, randomized, phase III trial of CD8(+) tumor-infiltrating lymphocytes in combination with recombinant interleukin-2 in metastatic renal cell carcinoma. J. Clin. Oncol. 1999; 17: 2521.
-
Clark J.I. et al. Adjuvant high-dose bolus interleukin-2 for patients with high-risk renal cell carcinoma: a cytokine working group randomized trial. J. Clin. Oncol. 2003; 21: 3133.
-
Atzpodien J. et al. Adjuvant treatment with interleukin-2and interferon-alpha2a-based chemoimmunotherapy in renal cell carcinoma post tumour nephrectomy: results of a prospectively randomised trial of the German Cooperative Renal Carcinoma Chemoimmunotherapy Group (DGCIN). Br. J. Cancer. 2005; 92: 843.
-
Jocham D. et al. Adjuvant autologous renal tumour cell vaccine and risk of tumour progression in patients with renal-cell carcinoma after radical nephrectomy: phase III, randomised controlled trial. Lancet. 2004; 363: 594.
-
Flanigan R.C. et al. Cytoreductive nephrectomy in patients with metastatic renal cancer: a combined analysis. J. Urol. 2004; 171: 1071.
-
Alt A.L. et al. Survival after complete surgical resection of multiple metastases from renal cell carcinoma. Cancer. 2011; 117: 2873.
-
Brinkmann O.A., Semik M., Gosherger G. et al. The role of residual tumor resection in patients with metastatic renal cell carcinoma and partial remission following immunotherapy. Eur. Urol. 2007: 641.
-
Kwak C. et al. Metastasectomy without systemic therapy in metastatic renal cell carcinoma: comparison with conservative treatment. Urol. Int. 2007; 79: 145.
-
Lee S.E. et al. Metastatectomy prior to immunochemotherapy for metastatic renal cell carcinoma. Urol. Int. 2006; 76: 256.
-
Petralia G. et al. Complete metastasectomy is an independent predictor of cancer-specific survival in patients with clinically metastatic renal cell carcinoma. Eur. Urol. Suppl. 2010; 2010: 162.
-
Russo P. et al. Cytoreductive nephrectomy and nephrectomy/complete metastasectomy for metastatic renal cancer. ScientificWorld Journal. 2007; 7: 768.
-
Staehler M. et al. Metastasectomy significantly prolongs survival in patients with metastatic renal cancer. Eur. Urol. Suppl. 2009; 2009: 181.
-
Eggener S.E. et al. Risk score and metastasectomy independently impact prognosis of patients with recurrent renal cell carcinoma. J. Urol. 2008; 180: 873.
-
Fuchs B. et al. Solitary bony metastasis from renal cell carcinoma: significance of surgical treatment. Clin. Orthop. Relat. Res. 2005: 187.
-
Staehler M.D. et al. Liver resection for metastatic disease prolongs survival in renal cell carcinoma: 12-year results from a retrospective comparative analysis. World J. Urol. 2010; 28: 543.
-
Amiraliev A. et al. Treatment strategy in patients with pulmonary metastases of renal cell cancer. Int. Cardio Thor. Surgery. 2012: S20.
-
Zerbi A. et al. Pancreatic metastasis from renal cell carcinoma: which patients benefit from surgical resection? Ann. Surg. Oncol. 2008; 15: 1161.
-
Fokas E. et al. Radiotherapy for brain metastases from renal cell cancer: should whole-brain radiotherapy be added to stereotactic radiosurgery?: analysis of 88 patients. Strahlenther Onkol. 2010; 186: 210.
-
Ikushima H. et al. Fractionated stereotactic radiotherapy of brain metastases from renal cell carcinoma. Int. J. Radiat. Oncol. Biol. Phys. 2000; 48: 1389.
-
Gore M.E. et al. Interferon alfa-2a versus combination therapy with interferon alfa-2a, interleukin-2, and fluorouracil in patients with untreated metastatic renal cell carcinoma (MRC RE04/EORTC GU 30012): an open-label randomised trial. Lancet. 2010; 375: 641.
-
Stadler W.M. et al. Prognostic factors for survival with gemcitabine plus 5-fluorouracil based regimens for metastatic renal cancer. J. Urol. 2003; 170: 1141.
-
Interferon-alpha and survival in metastatic renal carcinoma: early results of a randomised controlled trial. Medical Research Council Renal Cancer Collaborators. Lancet. 1999; 353: 14.
-
Coppin C. et al. Immunotherapy for advanced renal cell cancer. Cochrane Database Syst. Rev. 2005: CD001425.
-
Negrier S. et al. Medroxyprogesterone, interferon alfa-2a, interleukin 2, or combination of both cytokines in patients with metastatic renal carcinoma of intermediate prognosis: results of a randomized controlled trial. Cancer. 2007; 110: 2468.
-
Escudier B. et al. Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: a randomised, double-blind phase III trial. Lancet. 2007; 370: 2103.
-
Motzer R.J. et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N. Engl. J. Med. 2007; 356: 115.
-
Hudes G. et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N. Engl. J. Med. 2007; 356: 2271.
-
Rosenberg S.A. et al. Prospective randomized trial of high-dose interleukin-2 alone or in conjunction with lymphokine-activated killer cells for the treatment of patients with advanced cancer. J. Natl. Cancer Inst. 1993; 85: 622.
-
Fyfe G. et al. Results of treatment of 255 patients with metastatic renal cell carcinoma who received high-dose recombinant interleukin-2 therapy. J. Clin. Oncol. 1995; 13: 688.
-
McDermott D.F. et al. Randomized phase III trial of high-dose interleukin-2 versus subcutaneous interleukin-2 and interferon in patients with metastatic renal cell carcinoma. J. Clin. Oncol. 2005; 23: 133.
-
Ribas A. Tumor immunotherapy directed at PD-1. N. Engl. J. Med. 2012; 366: 2517.
-
Motzer R.J. et al. Nivolumab for metastatic renal cell carcinoma: results of a randomized phase II trial. J. Clin. Oncol. 2015; 33: 1430.
-
Nivolumab combined with ipilimumab versus sunitinib in previously untreated advanced or metastatic renal cell carcinoma (CheckMate 214). 2015.
-
Study of nivolumab (BMS-936558) vs. everolimus in pre-treated advanced or metastatic clear-cell renal cell carcinoma (CheckMate 025). 2015.
-
Patel P.H. et al. Targeting von Hippel-Lindau pathway in renal cell carcinoma. Clin. Cancer Res. 2006; 12: 7215.
-
Yang J.C. et al. A randomized trial of bevacizumab, an anti-vascular endothelial growth factor antibody, for metastatic renal cancer. N. Engl. J. Med. 2003; 349: 427.
-
Patard J.J. et al. Understanding the importance of smart drugs in renal cell carcinoma. Eur. Urol. 2006; 49: 633.
-
Heng D.Y. et al. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results from a large, multicenter study. J. Clin. Oncol. 2009; 27: 5794.
-
Escudier B. et al. Sorafenib in advanced clear-cell renal-cell carcinoma. N. Engl. J.Med. 2007; 356: 125.
-
Bellmunt J. et al. The medical treatment of metastatic renal cell cancer in the elderly: position paper of a SIOG Taskforce. Crit. Rev. Oncol. Hematol. 2009; 69: 64.
-
Motzer R.J. et al. Activity of SU11248, a multitargeted inhibitor of vascular endothelial growth factor receptor and platelet-derived growth factor receptor, in patients with metastatic renal cell carcinoma. J. Clin. Oncol. 2006; 24: 16.
-
Figlin R.A. et al. Overall survival with sunitinib versus interferon alfa as first-line treatment in metastatic renal-cell carcinoma. ASCO Annual Meeting Proceedings 2008. J. Clin. Oncol. 2008.
-
Motzer R.J. et al. Randomized phase II trial of sunitinib on an intermittent versus continuous dosing schedule as first-line therapy for advanced renal cell carcinoma. J. Clin. Oncol. 2012; 30: 1371.
-
Sternberg C.N. et al. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J. Clin. Oncol. 2010; 28: 1061.
-
Motzer R.J. et al. Pazopanib versus sunitinib in metastatic renal-cell carcinoma. N.Engl. J. Med. 2013; 369: 722.
-
Escudier B.J. et al. Patient preference between pazopanib (Paz) and sunitinib (Sun): Results of a randomized double-blind, placebo-controlled, cross-over study in patients with metastatic renal cell carcinoma (mRCC) – PISCES study, NCT 01064310. J. Clin. Oncol. 2012; 30.
-
Rini B.I. et al. Comparative effectiveness of axitinib versus sorafenib in advanced renal cell carcinoma (AXIS): a randomised phase 3 trial. Lancet. 2011; 378: 1931.
-
Dror Michaelson M. et al. Phase III AXIS trial of axitinib versus sorafenib in metastatic renal cell carcinoma: Updated results among cytokine-treated patients. J. Clin. Oncol. 2012; 30 (suppl.): 4546.
-
Motzer R.J. et al. Axitinib versus sorafenib as second-line treatment for advanced renal cell carcinoma: overall survival analysis and updated results from a randomised phase 3 trial. Lancet Oncol. 2013; 14: 552.
-
Choueiri T.K. et al. Cabozantinib versus everolimus in advanced renal-cell carcinoma. N. Engl. J. Med. 2015; 373: 1814.
-
Escudier B.J., Négrier S., Bajetta E. et al. Phase III trial of bevacizumab plus interferon alfa-2a in patients with metastatic renal cell carcinoma (AVOREN): final analysis of overall survival. J. Clin. Oncol. 2010; 28: 2144.
-
Rini B.I. et al. Phase III trial of bevacizumab plus interferon alfa versus interferon alfa monotherapy in patients with metastatic renal cell carcinoma: final results of CALGB 90206. J. Clin. Oncol. 2010; 28: 2137.
-
Rini B.I. et al. Bevacizumab plus interferon alfa compared with interferon alfa monotherapy in patients with metastatic renal cell carcinoma: CALGB 90206. J. Clin. Oncol. 2008; 26: 5422.
-
Hutson T.E. et al. Randomized phase III trial of temsirolimus versus sorafenib as second-line therapy after sunitinib in patients with metastatic renal cell carcinoma. J. Clin. Oncol. 2014; 32: 760.
-
Motzer R.J. et al. Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo-controlled phase III trial. Lancet. 2008; 372: 449.
-
Motzer R.J. et al. Phase 3 trial of everolimus for metastatic renal cell carcinoma: final results and analysis of prognostic factors. Cancer. 2010; 116: 4256.
-
Calvo E. et al. Everolimus in metastatic renal cell carcinoma: Subgroup analysis of patients with 1 or 2 previous vascular endothelial growth factor receptortyrosine kinase inhibitor therapies enrolled in the phase III RECORD-1 study. Eur. J. Cancer. 2012; 48: 333.
-
Bracarda S. et al. Everolimus in metastatic renal cell carcinoma patients intolerant to previous VEGFr-TKI therapy: a RECORD-1 subgroup analysis. Br. J. Cancer. 2012; 106: 1475.
-
Motzer R.J. et al. Record-3: Phase II randomized trial comparing sequential first-line everolimus (EVE) and second-line sunitinib (SUN) versus first-line SUN and second-line EVE in patients with metastatic renal cell carcinoma (mRCC). J. Clin. Oncol. 2013; 31.
-
Bukowski R.M. et al. Randomized phase II study of erlotinib combined with bevacizumab compared with bevacizumab alone in metastatic renal cell cancer. J. Clin. Oncol. 2007; 25: 4536.
-
Negrier S. et al. Temsirolimus and bevacizumab, or sunitinib, or interferon alfa and bevacizumab for patients with advanced renal cell carcinoma (TORAVA): a randomised phase 2 trial. Lancet Oncol. 2011; 12: 673.
-
McDermott D.F. et al. The BEST trial (E2804): A randomized phase II study of VEGF, RAF kinase, and mTOR combination targeted therapy (CTT) with bevacizumab (bev), sorafenib (sor), and temsirolimus (tem) in advanced renal cell carcinoma (RCC). J. Clin. Oncol. 2013; 31 (suppl. 6): 345.
-
Rini B.I. et al. Randomized phase III trial of temsirolimus and bevacizumab versus interferon alfa and bevacizumab in metastatic renal cell carcinoma: INTORACT trial. J. Clin. Oncol. 2014. 32: 752.
-
Ravaud A. et al. Randomized phase II study of first-line everolimus (EVE) + bevacizumab (BEV) versus interferon alfa-2A (IFN) + BEV in patients (pts) with metastatic renal cell carcinoma (MRCC): RECORD-2., in The Annual Meeting of the European Society for Medical Oncology 2012, ESMO: (Vienna, Austria).
-
Gore M.E. et al. Safety and efficacy of sunitinib for metastatic renal-cell carcinoma: an expanded access trial. Lancet Oncol. 2009; 10: 757.
-
Sánchez P., Calvo E., Durán I. Non-clear cell advanced kidney cancer: is there a gold standard? Anticancer Drugs. 2011; 22: S9.
-
Koh Y. et al. Phase II trial of everolimus for the treatment of nonclear-cell renal cell carcinoma. Ann. Oncol. 2013; 24: 1026.
-
Tannir N.M. et al. A phase 2 trial of sunitinib in patients with advanced non-clear cell renal cell carcinoma. Eur. Urol. 2012; 62: 1013.
-
Ravaud A. et al. First-line sunitinib in type I and II papillary renal cell carcinoma (PRCC): SUPAP, a phase II study of the French Genito-Urinary Group (GETUG) and the Group of Early Phase trials (GEP). J. Clin Oncol. 2009; 15S: 5146.
-
Escudier B.J. et al. Open-label phase II trial of first-line everolimus monotherapy in patients with papillary metastatic renal cell carcinoma: RAPTOR final analysis. Eur. J. Cancer. 2013; 49 (Suppl. 2): 49.
-
Tannir N.M. et al. Everolimus versus sunitinib prospective evaluation in metastatic non-clear cell renal cell carcinoma (The ESPN Trial): A multicenter randomized phase 2 trial. J. Clin. Oncol. 2014; 32.
-
Armstrong A.J. et al. Final clinical results of a randomized phase II international trial of everolimus vs. sunitinib in patients with metastatic non-clear cell renal cell carcinoma (ASPEN). J. Clin. Oncol. 2015; 33.
-
Motzer R.J. et al. Phase II randomized trial comparing sequential first-line everolimus and second line sunitinib versus first-line sunitinib and second-line everolimus in patients with metastatic renal cell carcinoma. J. Clin. Oncol. 2014; 32: 2765.
-
Pettus J.A. et al. Effect of baseline glomerular filtration rate on survival in patients undergoing partial or radical nephrectomy for renal cortical tumors. Mayo Clin. Proc. 2008; 83: 1101.
-
Snow D.C. et al. Rapid communication: chronic renal insufficiency after laparoscopic partial nephrectomy and radical nephrectomy for pathologic t1a lesions. J.Endourol. 2008; 22: 337.
-
Jeldres C. et al. Partial versus radical nephrectomy in patients with adverse clinical or pathologic characteristics. Urology. 2009; 73: 1300.
-
Bruno J.J. 2nd et al. Renal cell carcinoma local recurrences: impact of surgical treatment and concomitant metastasis on survival. BJU Int. 2006; 97: 933.
-
Sandhu S.S. et al. Surgical excision of isolated renal-bed recurrence after radical nephrectomy for renal cell carcinoma. BJU Int. 2005; 95: 522.
-
Bani-Hani A.H. et al. Associations with contralateral recurrence following nephrectomy for renal cell carcinoma using a cohort of 2,352 patients. J. Urol. 2005; 173: 391.
-
Lam J.S. et al. Renal cell carcinoma 2005: new frontiers in staging, prognostication and targeted molecular therapy. J. Urol. 2005; 173: 1853.
-
Scoll B.J. et al. Age, tumor size and relative survival of patients with localized renal cell carcinoma: a surveillance, epidemiology and end results analysis. J.Urol. 2009; 181: 506.
-
Cindolo L. et al. Comparison of predictive accuracy of four prognostic models for nonmetastatic renal cell carcinoma after nephrectomy: a multicenter European study. Cancer. 2005; 104: 1362.
-
Skolarikos A. et al. A review on follow-up strategies for renal cell carcinoma after nephrectomy. Eur. Urol. 2007; 51: 1490.
-
Chin A.I. et al. Surveillance strategies for renal cell carcinoma patients following nephrectomy. Rev. Urol. 2006; 8: 1.
Глава 10. РАК МОЧЕВОГО ПУЗЫРЯ
А.Д. Каприн, А.А. Костин, Л.М. Рапопорт, Д.Г. Цариченко, А.Н. Берников, Н.В. Воробьев, М.П. Головащенко
КОДЫ ПО МКБ-10
Класс II – новообразования.
Блок C64–C68 – злокачественные новообразования мочевыводящих путей.
C67 – злокачественное новообразование:
C67.0 – треугольника мочевого пузыря;
C67.1 – купола мочевого пузыря;
C67.2 – боковой стенки мочевого пузыря;
C67.3 – передней стенки мочевого пузыря;
C67.4 – задней стенки мочевого пузыря;
C67.5 – шейки мочевого пузыря; внутреннего уретрального отверстия;
C67.6 – мочеточникового отверстия;
C67.7 – первичного мочевого протока (урахуса);
C67.8 – поражение мочевого пузыря, выходящее за пределы одной и более вышеуказанных локализаций;
C67.9 – мочевого пузыря неуточненной части.
Рак мочевого пузыря (РМП) – тяжелое инвалидизирующее заболевание, для которого не разработано системы активного выявления, требующее тщательной дифференциальной диагностики, имеющее большую склонность к рецидивированию и прогрессированию.
ЭПИДЕМИОЛОГИЯ
РМП – наиболее часто встречаемая злокачественная опухоль мочевыводящих путей, по распространенности занимает 11-е место в структуре онкологических заболеваний в мире для обоих полов [80]. В структуре онкологической заболеваемости населения России РМП занимает 9-е место среди мужчин и 17-е – среди женщин [3]. По возрастному составу преобладают пациенты старше 60 лет, в России они составляют 78,4%. Средний возраст заболевших в России мужчин – 66,4 года, женщин – 69,2 года [3].
В США в структуре онкологической заболеваемости РМП составляет 6% у мужчин и 2% у женщин, всего в год заболевают 56,9 тыс. человек. Смертность составляет 12 600 человек в год (8600 мужчин и 4000 женщин) [37].
В зависимости от географического положения уровень заболеваемости РМП в разных странах отличается примерно в десятки раз. Так, в Западной Европе и США она выше, чем в Восточной Европе и странах Азии.
РМП встречается у мужчин чаще, чем у женщин (соотношение 6:1), что связано с большим распространением среди мужчин курения и профессий, связанных с канцерогенными веществами, увеличивающими риск развития заболевания [21].
Имеются расовые различия в заболеваемости РМП. Так, в США среди чернокожих мужчин и американских индейцев она соответственно в 2 и 8 раз ниже, а в азиатских поселениях на 60% ниже, чем среди белых американцев [59].
ФАКТОРЫ РИСКА
РМП – полиэтиологическое заболевание. Значительное число случаев РМП связано с влиянием канцерогенных веществ, выделяемых с мочой, на уротелий.
Профессиональные вредности
Взаимосвязь профессиональных вредностей с РМП известна более 100 лет. Было продемонстрировано, что у рабочих красильных и резиновых предприятий смертность от РМП в 30 раз выше, чем в популяции. Большинство канцерогенов – ароматические амины и их производные. В настоящее время установлено около 40 потенциально опасных производств: красильные, резиновые, каучуковые, нефтяные, алюминиевые, текстильные, с использованием смол и пластмасс и т.д. [23, 39, 65].
Имеются данные о повышенном риске развития РМП среди водителей автотранспорта. Так, в одном из исследований было установлено, что у водителей грузовиков относительный риск заболевания повышен в 1,17 раза, а у водителей автобусов – в 1,33 раза [16].
Отмечено повышение риска развития заболевания при потреблении воды с высоким содержанием мышьяка (Чили, Аргентина, Тайвань), побочными продуктами хлорирования, полученными при взаимодействии хлора с органическими веществами, содержащимися в воде, которые могут быть канцерогенами. В работе Wilkins и соавт. показано, что риск развития заболевания при потреблении хлорированной воды возрастает у мужчин в 1,8, а у женщин – в 1,6 раза [16].
Лекарственные вещества
На возникновение РМП способны влиять следующие лекарственные вещества:
-
фенацетинсодержащие анальгетики – было проведено несколько исследований, показывающих повышение в 2,0–6,5 раза риска заболевания РМП при их постоянном применении [55];
-
циклофосфамид – алкалоидное средство, применявшееся для лечения злокачественных опухолей. Результаты проведенных международных исследований (145 больных с гранулематозом Вегенера, 6000 больных с неходжкинской лимфомой) продемонстрировали увеличение риска развития РМП более чем в 4,5 раза при его применении [69, 71].
Курение
Риск развития РМП у курящих в 2–3 раза выше, чем у некурящих [46, 72]. Имеется прямая связь между риском развития заболевания, количеством выкуриваемых сигарет, длительностью курения, видом табачной продукции. При большом количестве выкуриваемых сигарет риск развития заболевания может увеличиваться в 6–10 раз по сравнению с некурящими [19]. Наибольшему риску подвергают себя курильщики папирос и сигарет без фильтра, так как риск увеличивается в 2 раза по сравнению с теми, кто курит сигареты с фильтром. Потребление черного табака, в котором более высокие концентрации ароматических аминов и их производных, повышает риск развития РМП в 2–3 раза по сравнению с курением светлого табака. Продолжительность воздержания после прекращения курения пропорционально сокращает риск развития заболевания [9].
Радиация
Увеличивает риск развития РМП. У больных, перенесших облучение области таза по поводу рака цервикального канала, яичников, предстательной железы, риск возникновения РМП повышался в 1,5–4 раза и был пропорционален величине дозы облучения. Наибольший риск развития заболевания выявлен у больных, перенесших облучение 5–10 лет назад. Для них характерно развитие высокодифференцированного инвазивного рака [60].
Отмечено повышение в 3 раза риска развития РМП у больных, перенесших терапию радиоактивным йодом по поводу рака щитовидной железы.
Шистосоматоз
Эндемичные районы: Ближний Восток, Юго-Восточная Азия, Северная Африка. Среди заболевших шистосоматозом РМП развивается чаще, чем в популяции. У мужчин риск развития заболевания повышается в 3,9 раза, у женщин – в 5,7 раза. Характерно развитие плоскоклеточного рака [75].
Хронический цистит
Риск развития РМП повышается у больных хроническим циститом, с камнями мочевого пузыря, явлениями уростаза. Для больных с длительно стоящими в мочевом пузыре катетерами характерно повышение риска развития аденокарциномы мочевого пузыря [28].
ПРОФИЛАКТИКА
Направлена на устранение воздействующих на уротелий канцерогенных веществ, предотвращение и лечение хронических инфекций мочевыводящих путей, снижение количества курящих среди населения.
КЛАССИФИКАЦИЯ
Классификация TNM
Т – первичная опухоль
Добавление (m) должно быть сделано к соответствующей категории Т для указания множественности поражения. Добавление (is) может быть сделано к категории Т для указания одновременного присутствия карциномы in situ.
N – регионарные лимфатические узлы
М – отдаленные метастазы
рTNM – патологоанатомическая классификация
Категории рТ, рN, рМ соответствуют категориям T, N, M.
G – гистологическая градация (ВОЗ, 1973 г.)
Группировка рака мочевого пузыря по стадиям представлена в табл.10.1.
| Стадия | Т | N | М |
|---|---|---|---|
Стадия 0а |
Та |
N0 |
М0 |
Стадия 0is |
0is |
N0 |
М0 |
Стадия I |
Т1 |
N0 |
М0 |
Стадия II |
Т2а |
N0 |
М0 |
Т2b |
N0 |
М0 |
|
Стадия III |
Т3а |
N0 |
М0 |
Т3b |
N0 |
М0 |
|
Т4а |
N0 |
М0 |
|
Стадия IV |
Т4b |
N0 |
М0 |
Любая Т |
N1, 2, 3 |
М0 |
|
Любая Т |
Любая N |
M1 |
Гистологическая классификация рака мочевого пузыря [80]
В 1998 г. Всемирной организацией здравоохранения (ВОЗ) и Международным обществом по урологической патоморфологии была предложена, а в 2004 г. опубликована новая классификация неинвазивных уротелиальных опухолей (классификация WHO/ISUP, 1998).
Основная ценность этой классификации заключается в детальном определении различных степеней анаплазии на основании определенных цитологических и гистологических критериев. Для более точного применения данной классификации был разработан веб-сайт (http://www.pathology.jhu.edu/bladder), где приведены примеры изображений опухолей с различной степенью анаплазии.
Классификация ВОЗ (2004)
-
-
уротелиальная папиллома (полностью доброкачественное поражение);
-
папиллярное уротелиальное новообразование низкого злокачественного потенциала (PUNLMP);
-
папиллярная уротелиальная карцинома низкой степени злокачественности (low grade);
-
папиллярная уротелиальная карцинома высокой степени злокачественности (high grade).
-
По классификации ВОЗ (2004), к плоским новообразованиям относятся уротелиальная гиперплазия, реактивная уротелиальная атипия, атипия неизвестного злокачественного потенциала, дисплазия и рак in situ. Среди неинвазивных папиллярных уротелиальных новообразований (по классификации 2004 г.) различают папиллярную опухоль уротелия с низким злокачественным потенциалом, уротелиальную карциному низкой и высокой степеней злокачественности. PUNLMP – образование, у которого нет цитологических признаков малигнизации, анормальные клетки уротелия объединяются в папиллярные структуры. Хотя эти опухоли имеют незначительный риск прогрессирования, они не являются абсолютно доброкачественными и имеют тенденцию к рецидивированию.
Умеренная степень дифференцировки (G2), которая была предметом дискуссий в классификации ВОЗ 1973 г., была удалена. Однако опубликованные данные сравнительных исследований достоверно не подтвердили, что классификация 2004 г. имеет более высокую воспроизводимость, чем 1973 г. Обе классификации подтвердили свою прогностическую ценность. Однако попытки продемонстрировать прогностическое преимущество одной из них привели к противоречивым результатам. Большинство клинических исследований по изучению опухолей Ta, T1, опубликованных до настоящего времени, выполнялись с использованием классификации ВОЗ 1973 г., поэтому последующие рекомендации основываются на данной классификации. До тех пор пока прогностическая ценность классификации 2004 г. не будет подтверждена большим количеством проспективных исследований, следует пользоваться обеими классификациями.
Классификация CIS
Первичная: изолированная CIS без предшествующих или имеющихся папиллярных опухолей, без предшествующей CIS.
Вторичная: CIS выявлена при наблюдении за больным с первичной папиллярной опухолью.
Конкурентная: СIS, присутствующая одновременно с другой опухолью мочевого пузыря.
Рецидивная: рецидивная CIS после успешной внутрипузырной терапии предшествующей CIS.
Опухоли Та, Т1 и Tis (CIS), которые могут быть удалены радикально с помощью трансуретральной резекции мочевого пузыря (ТУР) и которые ранее назывались поверхностными, предложено называть мышечнонеинвазивным РМП (МНИРМП), а все остальные (Т2–Т4) – мышечноинвазивным РМП (МИРМП).
ДИАГНОСТИКА
Анамнез
Клинические проявления заболевания зависят от стадии РМП. Начальные стадии заболевания чаще всего протекают бессимптомно либо сходны с симптомами других заболеваний мочевыделительной системы, такими как инфекции мочевыделительной системы, простатит, мочекаменная болезнь и т.д.
-
Гематурия – ведущий симптом РМП. Частота бессимптомной микрогематурии в популяции может достигать от 2,5 до 13%. РМП проявляется как однократным эпизодом гематурии или микрогематурией, так и тотальной макрогематурией, приводящей к тампонаде мочевого пузыря. Степень гематурии не отражает размеры опухоли и стадии заболевания [41, 51]. При начальных стадиях заболевания однократные или повторяющиеся эпизоды гематурии могут быть единственным проявлением болезни, что приводит к позднему обращению больного за медицинской помощью и дезориентирует врача.
-
Дизурия – учащенное и болезненное мочеиспускание с наличием императивных позывов. Патогенез дизурии при разных формах и стадиях болезни различен. Так, у больных c карциномой in situ дизурия, вероятнее всего, обусловлена изменением порога чувствительности рецепторного аппарата в структурах, формирующих позыв на мочеиспускание. При инфильтрирующих формах рака учащение мочеиспускания связано с ригидностью стенок и уменьшением емкости мочевого пузыря вследствие обширного поражения опухолью [2].
-
Боль над лоном первоначально связана с актом мочеиспускания, в дальнейшем становится постоянной. Возникает боль в промежности, области крестца. Эти симптомы свидетельствуют о местнораспространенном опухолевом процессе. Появление боли в поясничной области связано с блоком устьев мочеточника опухолью и развитием гидронефроза. Боль в костях часто возникает при метастатическом поражении скелета.
-
Симптомы, свидетельствующие о генерализации процесса: слабость, быстрая утомляемость, резкая потеря массы тела, анорексия.
Физикальное обследование
При осмотре важно оценить общее состояние больного. При массивной гематурии имеются проявления анемии: бледность кожных покровов, слабость, вялость. При тампонаде мочевого пузыря, острой задержке мочи больного беспокоят постоянные позывы на мочеиспускание, ощущение распирания в проекции мочевого пузыря, боль в надлобковой области. В данной ситуации переполненный мочевой пузырь пальпируется над лоном. При увеличении объема опухоли снижается емкость мочевого пузыря, нарушается его резервуарная функция, что проявляется постоянными позывами на мочеиспускание с небольшим количеством выделяемой мочи, частичным недержанием. При блоке опухолью устья мочеточника и развитии гидронефроза положителен симптом поколачивания, пальпируется увеличенная почка. Кроме того, необходимы тщательный осмотр и пальпация зон возможного лимфогенного метастазирования. При местнораспространенном процессе информативна бимануальная пальпация мочевого пузыря, которая позволяет оценить размеры, подвижность опухоли, наличие инфильтрации окружающих тканей.
Лабораторные исследования
Микрогематурия – показание для исследования мочевой системы с целью исключения конкрементов и опухоли слизистой оболочки верхних мочевыводящих путей и мочевого пузыря. Трехстаканная проба и состояние эритроцитов в моче позволяют локализовать уровень микрогематурии.
При локализации опухоли в области верхушки мочевого пузыря микрогематурия выявляется во всех пробах.
Материал для цитологического исследования – осадок мочи. Чувствительность метода различна для опухолей разной дифференцировки:
Наиболее информативно цитологическое исследование мочи при карциноме in situ (более 90%) [29, 41, 54]. Однократный отрицательный ответ не является убедительным аргументом в пользу отсутствия злокачественного поражения. Также проводят определение опухолевого маркера рака мочевого пузыря UBC (urinary bladder antigen) (специфичность – 72%, для первичных пациентов – 81%, для больных с рецидивом – 63%, чувствительность – 87,5%) [8] или BTA (bladder tumor antigen) (специфичность – 79%, чувствительность – 67%) в моче для первичной диагностики и мониторинга [5].
Молекулярная диагностика [80]
Существуют определенные требования к тестам, применяемым для качественного определения молекулярных маркеров РМП:
-
тест должен быть технически простым в исполнении (желательно, чтобы проводился в учреждении, где наблюдается пациент, с легкодоступными результатами, легко выполнимый, не требующий длительного обучения);
-
для отдельных групп пациентов и в определенных клинических ситуациях тест должен быть высокоспецифичным, чтобы избежать дополнительных обследований вследствие ложноположительных результатов, и высокочувствительным во избежание случаев необнаружения опухоли;
-
в клинической практике имеет огромное значение определение высокого риска возникновения уротелиального рака для того, чтобы избежать радикального лечения.
Учитывая низкую чувствительность цитологического исследования мочи, в результате обширных лабораторных исследований разработаны многочисленные тесты для исследования мочи с целью определения РМП. В последнее время появились многочисленные обзоры по определению маркеров рецидивирующего уротелиального рака в моче. Ни один из них не был принят в стандарты диагностических или дополнительных методов исследования в традиционной урологической практике. В табл. 10.2 представлены некоторые диагностические тесты мочи, результаты которых были оценены в нескольких научных лабораториях/центрах и исследованиях с достаточным количеством пациентов.
| Маркеры (спецификация тестов) | Общая чувствительность, % | Общая специфичность, % | Чувствительность по отношению к высокодифференцированным опухолям, % | Диагностика в учреждении, где наблюдается пациент | УД |
|---|---|---|---|---|---|
UroVysion |
30–86 |
63–95 |
66–70 |
Нет |
3 |
Микросателлитный анализ |
58–92 |
73–100 |
90–92 |
Нет |
1b |
Immunocyt/uCyt + |
52–100 |
63–75 |
62–92 |
Нет |
3 |
Определение белка ядерного матрикса 22 |
47–100 |
55–98 |
75–83 |
Да |
3 |
BTA stat |
29–83 |
56–86 |
62–75 |
Да |
3 |
BTA TRAK |
53–91 |
28–83 |
74–77 |
Нет |
3 |
Цитокератины |
12–88 |
73–95 |
33–100 |
Нет |
3 |
BTA – антиген опухоли мочевого пузыря.
Чувствительность и специфичность должны быть использованы для сравнения исследований с использованием данных тестов, потому что они остаются неизмененными, в то время как положительные и отрицательные прогностические значения варьируют между популяциями с разным количеством положительных и отрицательных результатов. О представленных тестах можно сделать следующие выводы. По сравнению с цитологическим исследованием мочи чувствительность выше за счет низкой специфичности. Благоприятные условия и БЦЖ влияют на многочисленные диагностические тесты по определению маркеров в моче. Чувствительность и специфичность тестов зависят от конкретной клинической ситуации пациента (скрининг, первичное выявление, последующие наблюдения опухоли с высоким, низким или средним риском). Например, чувствительность одного из маркеров выше при определении первичного поражения, чем рецидивирующего процесса. Для отбора пациентов необходим широкий диапазон определяемых маркеров, представленных в табл. 2. В отличие от других диагностических тестов некоторые ложноположительные результаты теста UroVysion и микросателлитного анализа могут быть расценены как наличие невыявленной болезни, следовательно, у пациентов с такими результатами чаще возникает повторный рецидив. Это может быть полезно для прогнозирования ответа на внутрипузырную терапию. Микросателлитный анализ является наиболее перспективным методом из всех представленных в таблице.
Инструментальные методы исследования
Уретроцистоскопия c биопсией – основной и обязательный метод обследования. При осмотре мочевого пузыря обращают внимание на количество новообразований, их расположение, размеры, характер роста (экзофитный, эндофитный, смешанный). Оценивают состояние не вовлеченной в процесс слизистой оболочки. Осматривают также слизистую оболочку мочеиспускательного канала: ее состояние важно для выработки тактики лечения больного. Выполняют биопсию выявленных опухолевых образований или участка измененной слизистой оболочки. Гистологическое подтверждение наличия опухоли необходимо для постановки диагноза РМП, выработки плана лечения больного. Во время цистоскопического исследования проводится фотодинамическая диагностика. При флюоресцентной цистоскопии материал забирают из всех светящихся участков; при цистоскопии в обычном свете мочевой пузырь делится на условные секторы, из каждого берется материал, но не менее чем из шести точек (случайная, или рандомная, биопсия) [13]. Чувствительность флюоресцентной диагностики составляет 80–96%, специфичность – 65–70%. Разработанный в МНИОИ им. П.А. Герцена метод комплексной флюоресцентной диагностики очагов поверхностного РМП, включающий цистоскопию в белом свете, флюоресцентную цистоскопию и локальную флюоресцентную спектроскопию с препаратом аласенс, позволяет повысить специфичность метода флюоресцентной диагностики до 85% [10].
Более информативным вариантом биопсии является проведение ТУР-биопсии. Больному проводится трансуретральное удаление опухоли мочевого пузыря с подлежащим мышечным слоем в случае отсутствия верификации процесса при наличии опухоли по данным осмотра и лучевых методов диагностики, оценка степени инвазии опухоли.
Ультразвуковое исследование:
УЗИ проводят при наполненном мочевом пузыре. Оно дает возможность оценить расположение, размеры, структуру, характер роста, распространенность опухоли. Оценивают емкость мочевого пузыря, деформацию стенок, характер роста опухоли, выход за пределы органа. Осматривают зоны регионарного метастазирования, верхние мочевыводящие пути, наличие или отсутствие гидронефроза. Необходимо выполнять УЗИ печени [6]. Информативность метода резко снижается при опухолях размером менее 5 мм. При выявлении увеличенных или измененных лимфатических узлов необходимо выполнять пункцию под контролем УЗИ с последующим цитологическим исследованием [26, 76].
Компьютерная томография. Магнитно-резонансная томография
Исследование наиболее информативно при местнораспространенных опухолях (Т3, Т4) для оценки экстравезикальной распространенности опухоли, состояния регионарных лимфатических узлов и верхних мочевыводящих путей [36, 70].
Экскреторная урография
Метод позволяет полностью визуализировать мочевыводящий тракт, выявить новообразования как в верхних мочевыводящих путях, так и в мочевом пузыре, оценить проходимость мочеточников. В 3–10% случаев РМП ассоциируется с опухолью лоханки или мочеточника.
Динамическая нефросцинтиграфия
Выполняют для оценки паренхиматозно-выделительной функции почек (это имеет значение для оценки функционального нарушения субренальной обструкции, при проведении химиотерапии, выполнении отведения мочи).
Рентгенография легких
Необходимо выполнять всем больным для оценки состояния легочной ткани. При подозрении на наличие метастатического поражения легких выполняют КТ грудной клетки.
Сканирование костей скелета
Показано при подозрении на их метастатическое поражение.
Цистоскопия [80]
Диагностика РМП зависит от цистоскопического исследования мочевого пузыря и гистологической оценки удаленной ткани. РМП диагностируется посредством комплексного обследования: цистоскопии, цитологического исследования мочи и гистологической оценки биоптатов, взятых с разных участков мочевого пузыря.
Первоначально цистоскопия проводится в стационаре. С помощью гибкого цистоскопа с трансуретральным введением местного анестетика достигается лучшая переносимость, особенно у мужчин. Для предупреждения пропуска опухоли должен быть выполнен тщательный осмотр всего эпителия, выстилающего полость мочевого пузыря. Если опухоль мочевого пузыря обнаружена при ранее выполненных визуальных методах исследования, диагностическую цистоскопию можно не выполнять, так как этим пациентам будет выполнена ТУР. Необходимо тщательное описание полученных данных, описание локализации, размеров, количества, внешнего вида (папиллярная или солидная) опухолей, состояния слизистой оболочки.
Трансуретральная резекция Та, Т1 опухолей мочевого пузыря
[80]
Цель ТУР при опухолях Та, Т1 мочевого пузыря – поставить правильный диагноз и удалить все видимые участки поражения. Является одной из самых важных процедур в диагностике и лечении РМП. ТУР должна быть выполнена следующим образом:
-
процедура начинается с тщательной (осторожной) бимануальной пальпации под общей или спинномозговой анестезией;
-
введение резектоскопа, у мужчин под визуальным контролем с осмотром всей уретры;
-
осмотр всего эпителия, выстилающего полость мочевого пузыря;
-
биопсия из простатической части уретры (при необходимости осмотр нижележащих отделов);
-
«холодная» биопсия мочевого пузыря (при необходимости осмотр нижележащих отделов);
Объем резекции зависит от размера поражения. Малые опухоли (< 1 см) могут быть резецированы единым блоком, который включает всю опухоль и часть подлежащей стенки мочевого пузыря. Большие опухоли должны быть резецированы отдельными фракциями, включающими экзофитную часть опухоли, часть подлежащей стенки мочевого пузыря с детрузором и края резецируемой области.
Такой подход обеспечивает определение вертикальных и горизонтальных размеров опухоли и помогает повысить эффективность резекции. Нет необходимости в глубокой резекции небольших низкозлокачественных поражений с наличием в анамнезе предшествующей высокодифференцированной опухоли. Образцы различных биоптатов и удаленных фракций должны быть направлены на исследование патоморфологу в отдельных контейнерах и отдельно промаркированы. Для предотвращения деструкции ткани следует избегать прижигания при проведении ТУР. Полная и правильно проведенная ТУР необходима для достижения благоприятного прогноза у пациента.
Доказано, что отсутствие детрузора в препарате связано с достоверно высоким риском развития остаточной опухоли или раннего рецидива.
Было показано, что большой хирургический опыт влияет на качество выполняемой резекции.
У пациентов с небольшими опухолями (Та, G1) возможно выполнение коагуляции мелких рецидивных опухолей в амбулаторном порядке.
Биопсия мочевого пузыря и простатической части уретры
[80]
РМП представляет собой красноватые, бархатистые образования, которые ничем не отличаются от участков воспаления или могут быть и вовсе не видны. Когда видны аномальные участки уротелия, рекомендуется применять «холодную» биопсию или биопсию резекционной петлей.
Биопсия внешне нормальных участков слизистой оболочки называется случайной (произвольной) биопсией. Ее следует выполнять в качестве дополнения к диагностическому исследованию РМП у пациентов с положительными результатами цитологического исследования мочи и отсутствием видимой опухоли мочевого пузыря.
Рекомендуется брать биоптаты из области треугольника, дна мочевого пузыря, из правой, левой, передней, задней стенок мочевого пузыря. У пациентов с опухолями Та, Т1 обычно не рекомендуется выполнение случайной биопсии. Вероятность выявления РМП, особенно при низкодифференцированных опухолях, чрезвычайно мала (2%). Материал, полученный с помощью произвольной или целенаправленной биопсии, должен быть отправлен на морфологическое исследование в отдельных контейнерах, как описывалось ранее.
Новые методы трансуретральной резекции [80]
По сравнению с монополярной резекцией система биполярной электрорезекции может снизить риск развития осложнений (перфорация мочевого пузыря, обусловленная раздражением запирательного нерва). Однако это преимущество должно быть подтверждено проспективным исследованием.
Новые методы визуализации опухоли
[80]
При проведении стандартной процедуры цистоскопии и ТУР используется белый свет. Однако использование белого света может привести к пропуску поражения, которое имеется, но не визуализируется, поэтому в настоящее время разрабатываются новые технологии.
Фотодинамическое исследование (флюоресцентная цистоскопия)
[80]
Фотодинамическое исследование (ФДИ) выполняется с использованием фиолетового света после внутрипузырного введения 5-аминолевуленовой (АЛК) и гексаминолевуленовой кислот (ГАЛК). Доказано, что флюоресцентно-опосредованная биопсия и резекция более чувствительны к выявлению злокачественных опухолей, особенно в случае карциномы in situ, чем стандартные манипуляции.
При проведении систематического обзора и метаанализа выявлено, что у ФДИ выше чувствительность, чем у эндоскопии с использованием белого света, в обеих группах пациентов (92% против 71%) и при оценке данных биопсии (93% против 65%). У ФДИ более низкая специфичность, чем у эндоскопии с использованием белого света (63% против 81%). Ложноположительные результаты могут быть обусловлены воспалением, недавно проведенной ТУР и наблюдаются в течение первых трех месяцев после инстилляции БЦЖ (УД 3).
Таким образом, флюоресцентная цистоскопия повышает вероятность определения опухоли, особенно РМП. Флюоресцентно-опосредованная ТУР с использованием ГАЛК, но не АЛК оказывает положительный эффект на частоту рецидивов заболевания. ФДИ рекомендовано пациентам с подозрением на скрытую высокодифференцированную опухоль, например для контроля биопсии у пациентов с положительными результатами цитологического исследования или наличием опухоли с высокой степенью малигнизации в анамнезе. Необходимо учитывать дополнительные затраты на оборудование и инстилляции для проведения ФДИ.
Повторная трансуретральная резекция
[80]
После ТУР очагов Та и Т1 отмечается достоверный риск развития резидуальной (остаточной) опухоли. После резекции опухолей Т1 остаточная опухоль определяется у 33–53% пациентов (УД 2a). Более того, стадия опухоли часто недооценивается при первоначальной резекции.
Вероятность того, что Т1-опухоль была недооценена и при повторной резекции будет обнаружен рак с инвазией в мышечный слой, находится в диапазоне от 4 до 25%. В некоторых исследованиях, изучавших эффективность цистэктомии, риск увеличивался до 50% при проведении серии радикальных цистэктомий, хотя они были выполнены только отобранным пациентам (УД 2а). Лечение высокодифференцированных опухолей Та, Т1 и опухолей Т2 полностью отличается, поэтому важно правильное определение стадии опухоли. Показано, что повторная ТУР может увеличить показатели безрецидивной выживаемости (УД 2а).
Повторная ТУР рекомендована в следующих ситуациях:
Нет единого мнения по стратегии и времени выполнения повторной ТУР. Большинство авторов рекомендуют резекцию через 2–6 недель после первоначальной резекции. Процедура должна включать резекцию первичной локализации опухоли.
Морфологическое заключение
[80]
Морфологическое исследование образцов, полученных при проведении ТУР и биопсии, – этап в диагностике и принятии решений по лечению РМП. Для правильной морфологической оценки обязательным условием является высокое качество резецированной ткани. Присутствие достаточного количества мышечной ткани необходимо для правильного определения категории Т.
В гистологическом заключении следует указать:
Уролог и патоморфолог должны работать вместе.
| Рекомендации [80] | УР |
|---|---|
В истории болезни должна быть отражена вся важная информация, включая факторы риска и описание подозрительных симптомов, с целью выявления связи с РМП |
А |
УЗИ почек и мочевого пузыря необходимо назначать при первичном обследовании пациентов с гематурией |
С |
При первичной диагностике РМП КТ-урография или внутривенная урография должны быть выполнены только в определенных случаях (опухоль локализуется в области треугольника мочевого пузыря) |
В |
Цистоскопия рекомендована всем пациентам с симптомами, подтверждающими РМП. Она не должна заменять цитологическое исследование или какие-либо другие неинвазивные тесты |
А |
При проведении цистоскопии следует описать все макроскопические характеристики опухоли (локализация, размер, количество и внешний вид) и патологические участки слизистой оболочки. Рекомендуется использовать схему строения мочевого пузыря |
С |
Перед выполнением ТУР цитологическое исследование мочи из полости мочевого пузыря позволяет заподозрить наличие опухоли высокой степени малигнизации |
С |
Для проведения цитологического иссследования необходима свежая порция мочи в достаточном количестве. Утренняя моча не подходит из-за часто встречающегося цитолиза |
С |
ТУР следует выполнять в определенном порядке: бимануальная пальпация под анестезией; затем под визуальным контролем вводят резектоскоп, осматривая всю уретру; осматривают весь эпителий, выстилающий мочевой пузырь; выполняют биопсию простатической части уретры (если необходимо); «холодную» биопсию (если необходимо); удаление опухоли; бимануальную пальпацию после резекции; оформление протокола; оформление бланка- заявки для проведения гистологического исследования |
С |
Выполнение резекции единым блоком при наличии небольших папиллярных опухолей (< 1 см), включая часть подлежащей стенки мочевого пузыря |
В |
Выполнение резекции по частям (включая мышечную ткань) для опухолей диаметром > 1 см |
В |
Биопсию следует брать из патологического участка уротелия. Биопсия неизмененного участка слизистой оболочки (треугольник, дно мочевого пузыря, правая, левая, передняя, задняя стенки мочевого пузыря) рекомендована в случаях, когда есть положительные результаты цитологического исследования или у опухоли с экзофитным типом роста отсутствует папиллярный компонент |
С |
Биопсия простатической части уретры рекомендована в случаях опухоли шейки мочевого пузыря; когда присутствует или подозревается РМП; когда существуют положительные результаты цитологического исследования без доказательства наличия опухоли в мочевом пузыре или когда визуализируются патологические участки простатической части уретры. Если при проведении первичной диагностики биопсия не выполнена, она должна быть сделана во время повторной резекции |
С |
Биопсию простатической части уретры следует брать из патологических участков или из преколликулярной области (в проекции между 5 и 7 часами) с использованием резекционной петли. При первичных неинвазивных опухолях, когда не подозревается стромальная инвазия, может быть использована «холодная» биопсия щипцами |
С |
При подозрении на РМП или наличии опухоли с высоким малигнизирующим потенциалом (положительные результаты цитологического исследования, рецидивирующая опухоль с высоким малигнизирующим потенциалом в анамнезе) следует выполнить ФБ вместо случайных биопсий, если позволяют технические возможности |
В |
Биоптаты из различных участков и резецированные участки тканей следует отправить на гистологическое исследование в отдельных контейнерах, промаркированных по отдельности |
С |
В протоколе ТУР должны быть описаны все этапы процедуры, степень и полнота резекции |
С |
Повторная ТУР рекомендована в следующих случаях: после неполной первоначальной ТУР для исключения опухолей TaG1 и первичного РМП, если после первоначальной резекции в образце не было мышечной ткани во всех случаях опухолей и при всех опухолях G3, за исключением первичного РМП |
А |
Повторную ТУР следует проводить через 2–6 недель после первичной ТУР |
С |
Глубина опухолевой инвазии классифицируется в соответствии с системой TNM |
А |
Для гистологической классификации используются классификации ВОЗ 1973 и 2004 гг. Следует использовать обе классификации до тех пор, пока прогностическая роль классификации ВОЗ 2004 г. не будет подтверждена большинством проспективных исследований |
А |
Всякий раз, когда в отдельных случаях используется термин «РМП без инвазии в мышечный слой», следует указывать стадию и степень опухолевого процесса |
А |
В гистологическом заключении следует указать локализацию опухоли, степень, глубину инвазии, наличие РМП, присутствие детрузора в образце |
А |
В гистологическом заключении следует указать наличие аберрантной гистологии |
С |
Дифференциальная диагностика
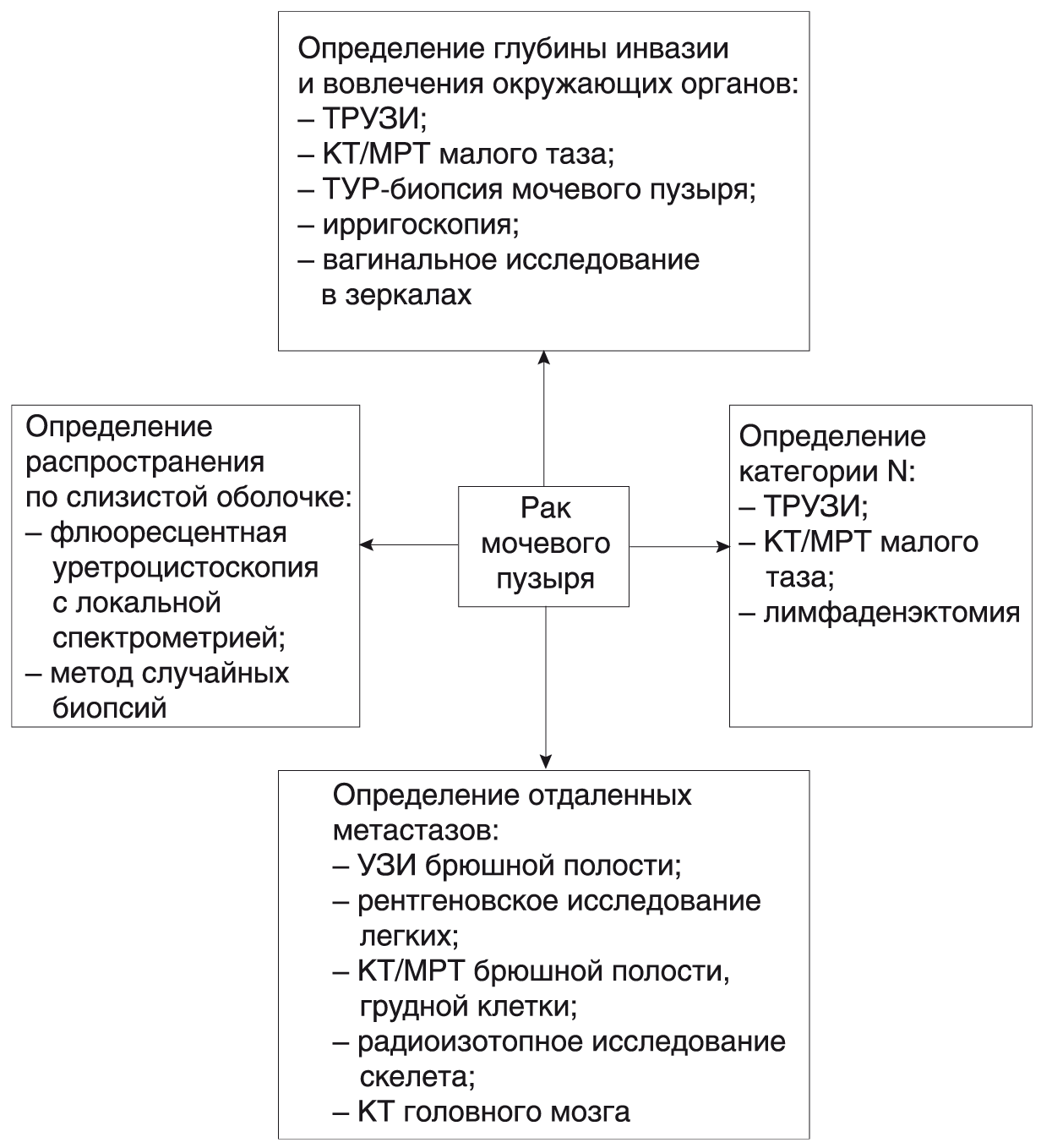
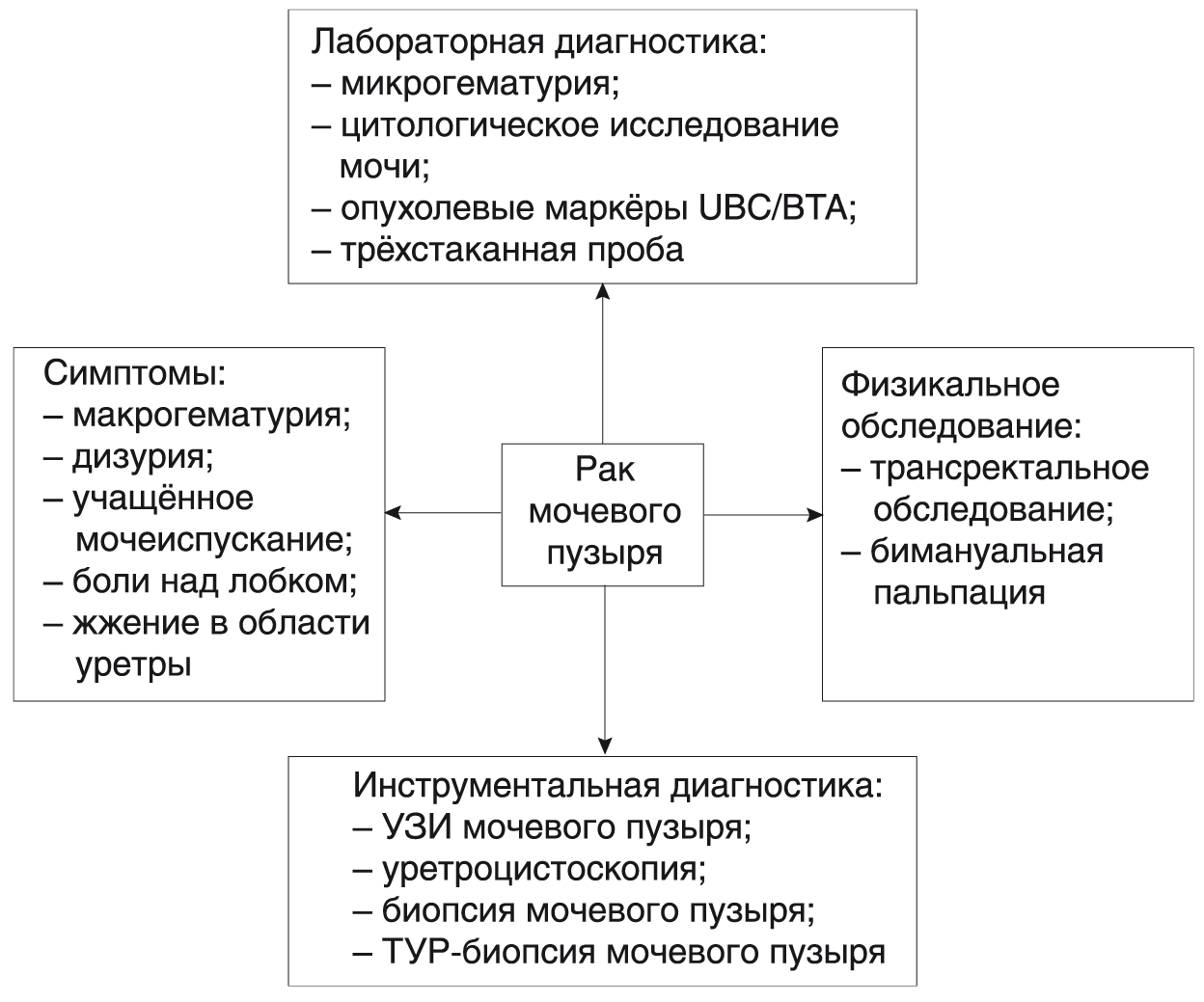
ЛЕЧЕНИЕ
Поверхностный рак мочевого пузыря
Среди больных с впервые выявленным РМП у 70% имеется поверхностная опухоль. У 30% больных отмечается мультифокальное поражение слизистой оболочки мочевого пузыря. В 40–80% случаев после ТУР в течение 6–12 месяцев развивается рецидив, а у 10–25% больных – инвазивный рак.
Поверхностный рак включает следующие нозологииТа – неинвазивная папиллярная карцинома (60%);
Цели лечения:
Трансуретральная резекция мочевого пузыря
Лечение поверхностного РМП начинают с ТУР мочевого пузыря (за исключением больных с тотальным поражением мочевого пузыря, им показана цистэктомия). При ТУР удаляют все видимые опухоли. Отдельно удаляют экзофитный компонент и основание опухоли. Это необходимо для правильного установления стадии заболевания (рТ), так как в зависимости от результатов вырабатывают дальнейшую тактику лечения больного.
Осложнения ТУР мочевого пузыря:
Резекция мочевого пузыря
Значение открытой резекции при поверхностном РМП: может выполняться больным при больших размерах опухоли, расположенной вне шейки мочевого пузыря.
Дальнейшее ведение
В зависимости от прогностических факторов возникновения рецидива и прогрессии вырабатывают дальнейшую тактику лечения больного.
Группа низкого риска: рТа, дифференцировка G1, единичная опухоль < 3 см, отсутствие карциномы in situ, безрецидивный период не менее 3 месяцев после ТУР. Риск прогрессирования опухоли в данной группе за 5 лет – 7,1%. Смертность от РМП за 10 лет – 4,3%.
Группа промежуточного риска. К этой группе относятся все больные, не вошедшие в группу низкого или высокого риска. В данной категории больных адъювантная внутрипузырная химиотерапия должна проводиться всем больным. Риск прогрессирования опухоли за 5 лет – 17,4%. Смертность от РМП за 10 лет – 12,8%.
Группа высокого риска: рТ1, G3 множественные и рецидивные опухоли; карцинома in situ, а также большие опухоли (> 3 см), pTaG1G2 при возникновении рецидива в течение 6 месяцев после операции; pTis, диффузный характер. Эта группа прогностически наиболее неблагоприятная. Риск прогрессирования опухоли за 5 лет – 41,6%. Смертность от РМП за 10 лет – 36,1%. Адъювантная терапия должна проводиться всем больным. Предпочтение стоит отводить БЦЖ-терапии или ее комбинации с другими химиоиммунными препаратами. Эффективность внутрипузырной химиотерапии значительно ниже. Вариант выбора у данных пациентов при неэффективности комбинированного органосохраняющего лечения – цистэктомия.
Европейское общество урологов на основании анализа лечения 2596 пациентов с Та, Т1 в рандомизированных крупных исследованиях разработало шкалу оценки риска развития прогрессии и рецидивирования в зависимости от факторов риска (степень дифференцировки опухоли, количество опухолей к моменту лечения, частота рецидивирования в течение первого года после ТУР мочевого пузыря, размеры первичной опухоли) (табл. 10.3–10.5) [34].
| Фактор | Рецидив | Прогрессия |
|---|---|---|
Число опухолей |
||
Единичная |
0 |
0 |
2-7 |
3 |
3 |
>8 |
6 |
3 |
Диаметр опухоли |
||
<3 см |
0 |
0 |
>3 см |
3 |
3 |
Частота рецидива |
||
Первичная опухоль |
0 |
0 |
Меньше одного рецидива в год |
2 |
2 |
Больше одного рецидива в год |
4 |
2 |
Категория |
||
Та |
0 |
0 |
Т1 |
1 |
4 |
Наличие ds |
||
Нет |
0 |
0 |
|
1 |
6 |
Степень дифференцировки (ВОЗ, 1973) |
||
G1 |
0 |
0 |
G2 |
1 |
0 |
G3 |
2 |
5 |
Общий счет |
0–17 |
0–23 |
| Риск рецидива | Возможность рецидива в течение года (95% CI) | Возможность рецидива в течение 5 лет (95% CI) |
|---|---|---|
0 |
15% (10–19%) |
31% (24–37%) |
1–4 |
24% (21–26%) |
46% (42–49%) |
5–9 |
38% (35–41%) |
62% (58–65%) |
10–17 |
61% (55–67%) |
78% (73–85%) |
| Риск прогрессии | Возможность прогрессии в течение года (95% CI) | Возможность прогрессии в течение 5 лет (95% CI) |
|---|---|---|
0 |
0,2% (0–0,7%) |
0,8% (0–1,7%) |
2–6 |
1% (0,4–1,6%) |
6% (5–8%) |
7–13 |
5% (4–7%) |
17% (14–20%) |
14–23 |
17% (10–24%) |
45% (35–55%) |
Внутрипузырная БЦЖ-терапия
Вакцина БЦЖ – наиболее эффективный препарат, применение которого после ТУР приводит к снижению частоты возникновения рецидивов, по разным данным, в 32–68% случаев. Внутрипузырная БЦЖ-терапия – метод выбора, и его можно применять как самостоятельное лечение при раке in situ, эффективность, по данным литературы, достигает 70%. Лечение повышает продолжительность безрецидивного течения болезни. Внутрипузырная БЦЖ-терапия – единственный метод, приводящий к снижению частоты прогрессирования поверхностного РМП. Точный механизм действия БЦЖ-терапии неизвестен. Показано, что контакт микобактерий со стенкой мочевого пузыря формирует локальный иммунный ответ против инфекционного агента, в котором задействованы Т-лимфоциты, ряд цитокинов, макрофаги. Данные реакции оказывают противоопухолевое действие [17, 57].
Индукционные инстилляции вакцины БЦЖ классически выполняются в соответствии с эмпирической 6-недельной схемой, которая была предложена Моралесом в 1976 г. (шесть еженедельных инстилляций вакцины БЦЖ в дозе 120 мг). Для достижения оптимальной эффективности БЦЖ-терапия должна быть выполнена по регламентированной (поддерживающей) схеме (УД 1а). В метаанализе положительный эффект наблюдался только у пациентов, получавших БЦЖ-терапию по поддерживающей схеме. Используется много различных поддерживающих режимов, от 10 инстилляций, проведенных в течение 18 недель, до 27 более чем за 3 года. С помощью метаанализа невозможно было определить, какая поддерживающая схема БЦЖ была наиболее эффективной. Основываясь на данных метаанализа, Боуль и соавт. пришли к выводу, что преимущество БЦЖ перед митомицином С в предупреждении развития рецидива и прогрессирования появляется только при применении БЦЖ-терапии продолжительностью не менее одного года (УД 1а). Оптимальное количество, частота и длительность поддерживающих индукционных инстилляций остаются неизвестными. Однако результаты рандомизированного клинического исследования, куда вошли 1355 пациентов, показали, что проведение поддерживающей БЦЖ-терапии в течение трех лет с использованием полной дозы вакцины снижает частоту рецидивирования по сравнению с одним годом лечения пациентов из группы высокого риска, но это не относится к пациентам со средним риском. Не наблюдалось различий при сравнении показателей прогрессирования или общей выживаемости (УД 1b). Положительный эффект от двух дополнительных лет поддерживающей терапии у пациентов с высоким риском должен быть соизмерим с дополнительными расходами и неудобствами.
Внутрипузырная БЦЖ-терапия оказывает большее количество побочных эффектов по сравнению с внутрипузырной химиотерапией (УД 1a). Однако опасные побочные эффекты встречаются менее чем у 5% пациентов и в большинстве случаев могут быть эффективно излечены (УД 1b). Показано, что поддерживающая схема лечения не ассоциирована с повышенным риском побочных эффектов в сравнении с индукционным курсом терапии. Системные осложнения могут развиться после системной абсорбции лекарственного препарата. Таким образом, следует учитывать противопоказания к внутрипузырной инстилляции.
БЦЖ не назначается (абсолютные противопоказания):
Наличие лейкоцитурии или асимптоматической бактериурии не является противопоказанием для проведения БЦЖ-терапии, в этих случаях нет необходимости в проведении антибиотикопрофилактики (УД 3). БЦЖ следует использовать с осторожностью (относительные противопоказания) у иммунокомпрометированных пациентов (иммуносупрессия, ВИЧ), хотя некоторые небольшие исследования показали аналогичную эффективность и отсутствие увеличения количества осложнений по сравнению с неиммунокомпрометированными пациентами (УД 3) [80].
При описании побочных эффектов после БЦЖ следует указывать их тип и степень. Рекомендации для конкретных ситуаций представлены Международной группой по изучению РМП (IBCG) и группой испанских ученых (табл. 10.6) [80].
Хотя БЦЖ-терапия является очень эффективным методом лечения, есть мнение, что в связи с риском развития токсического эффекта не всем пациентам с РМП без инвазии в мышечный слой следует проводить лечение с использованием БЦЖ. В конечном счете выбор метода лечения зависит от риска развития рецидива и прогрессирования у каждого конкретного больного.
| Порядок действий при возникновении местных побочных эффектов (модифицированные IBCG) | |
|---|---|
Симптомы цистита |
Ненаркотические анальгетики или НПВС |
Если симптомы улучшаются в течение нескольких дней: |
|
Если симптомы сохраняются или ухудшаются:
|
|
Если симптомы сохраняются даже при лечении антибиотиками:
|
|
Если симптомы сохраняются: противотуберкулезные препараты и кортикостероиды |
|
Если нет ответа на лечение и/или сморщенный мочевой пузырь: радикальная цистэктомия |
|
Гематурия |
Сделать посев мочи для исключения геморрагического цистита, если присутствуют другие симптомы |
Если гематурия сохраняется, выполнить цистоскопию для определения наличия опухоли мочевого пузыря |
|
Симптоматический гранулематозный простатит |
Редко присутствуют симптомы: сделать посев мочи |
Фторхинолоны |
|
Если хинолоны неэффективны: изониазид (300 мг в день) и рифампицин (600 мг в день) в течение 3 месяцев |
|
Прекращение внутрипузырной терапии |
|
Эпидидимоорхит |
Сделать посев мочи и назначить хинолоны |
Прекращение внутрипузырной терапии |
|
Орхиэктомия, если сформировался абсцесс или нет ответа на проводимую терапию |
|
Действия при возникновении системных побочных эффектов |
|
Общее недомогание, лихорадка |
Обычно проходит в течение 48 часов с приемом или без жаропонижающих препаратов |
Артралгии и/или артрит |
Редкое осложнение и обусловлено аутоиммунной реакцией |
Артралгия: лечение с применением НПВС |
|
Артрит: НПВС, если нет ответа/частичный ответ, перейти на кортикостероиды, высокие дозы хинолонов или противотуберкулезные препараты |
|
Прекращение БЦЖ-инстилляций на длительное время |
|
Немедленная оценка: посев мочи, анализы крови, рентгенологическое исследование органов грудной клетки |
|
Немедленное лечение двумя и более противомикробными препаратами, в то время как проводится диагностика |
|
Консультация инфекциониста |
|
БЦЖ-сепсис |
Профилактика: выполнение первоначальной БЦЖ по меньшей мере через 2 недели после ТУР (если нет проявлений и симптомов гематурии) |
Прекращение БЦЖ-терапии |
|
При тяжелой инфекции: высокие дозы хинолонов или изониазида, рифампицина и этамбутола 1,2 г/сут ежедневно в течение 6 месяцев, раннее применение высоких доз кортикостероидов при сохранении симптомов Рассмотреть эмпирические неспецифические антибиотики с учетом того, чтобы в спектр действия входили грамотрицательные бактерии и/или энтерококки |
|
Аллергические реакции |
Антигистаминные и противовоспалительные препараты |
Применять высокие дозы хинолонов или изониазида и рифампицина для купирования присутствующих симптомов |
|
Приостановить терапию до исчезновения реакции |
|
-
БЦЖ не меняет естественного течения опухолей с низким риском развития рецидива и может рассматриваться как излишнее лечение для этой категории пациентов.
-
Пациентам с наличием опухолей с высоким риском развития рецидива, которым не выполняется радикальная цистэктомия, показана продолжительная БЦЖ-терапия в течение 1–3 лет с использованием полной дозы. У пациентов с высоким риском развития рецидивов дополнительный положительный эффект от второго и третьего года терапии должен быть соизмерим с дополнительными расходами и неудобствами.
-
У пациентов со средним риском БЦЖ-терапия в течение 1 года с использованием полной дозы более эффективна для предупреждения рецидивирования, чем химиотерапия; однако у нее больше побочных эффектов, чем у химиотерапии. По этой причине оба вида лечения (БЦЖ-терапия и внутрипузырная химиотерапия) остаются возможными методами терапии. При окончательном выборе следует учитывать риск рецидивирования и прогрессирования для каждого пациента в отдельности так же, как и эффективность и побочные эффекты каждого метода лечения.
Внутрипузырная химиотерапия
Хотя внедренная в практику ТУР сама по себе может привести к полному удалению опухолей Та, Т1, они часто рецидивируют и могут прогрессировать в инвазивные формы. Высокая вероятность развития рецидива в первые три месяца показывает, что ТУР является недостаточной или провоцирует рецидивы у значительного числа пациентов [80]. Поэтому необходимо рассматривать назначение адъювантной терапии всем пациентам. Применяют внутрипузырные инстилляции таких препаратов, как доксорубицин, эпирубицин, гемцитабин, митомицин С. Применение внутрипузырной химиотерапии приводит к снижению рецидивов, увеличению продолжительности безрецидивного течения, однако не сказывается на частоте прогрессирования процесса и выживаемости.
Показано, что ранняя послеоперационная однократная инстилляция способствует разрушению циркулирующих опухолевых клеток, образовавшихся в результате ТУР, оказывает абляционный эффект (химиорезекция) на остаточные опухолевые клетки в области резекции и на небольшие, упущенные из виду опухоли.
Метаанализ данных 1476 пациентов показал, что одна немедленная послеоперационная инстилляция химиопрепаратов после ТУР достоверно снижает развитие рецидивов на 11,7% по сравнению с проведением только ТУР. У большинства пациентов (> 80%), вошедших в метаанализ, была единичная опухоль. Аналогичные данные представлены в двух более поздних исследованиях с подгрупповым анализом, согласно которому ранняя послеоперационная инстилляция является наиболее эффективной при опухолях с наиболее низкой тенденцией к рецидивированию, т.е. при единичной первичной или небольших опухолях. Митомицин С, эпирубицин, доксорубицин оказывают положительный эффект при отсутствии сравнений эффективности между препаратами [130].
Данные одного подгруппового анализа и одного комбинированного анализа свидетельствуют о том, что ранняя инстилляция может оказать влияние на возникновение рецидивов даже при дальнейшем выполнении адъювантных инстилляций. Процедуры по предотвращению имплантации опухолевых клеток следует начинать в течение первых часов после их диссеминации. Тем не менее вполне вероятно, что непосредственные послеоперационные инстилляции более эффективны в предупреждении рецидивов, чем какие-либо другие инстилляции, следующие за непосредственной послеоперационной инстилляцией. Очевидно, необходимо больше исследований, сравнивающих непосредственно послеоперационные и отсроченные схемы проведения инстилляций.
Во всех исследованиях, изучавших эффективность однократной инстилляции, введения проводили в течение 24 часов. С целью максимального повышения эффективности ранней послеоперационной инстилляции следует разработать гибкие условия, позволяющие осуществить инстилляцию как можно раньше, в послеоперационной палате или даже в операционной. Раннюю послеоперационную инстилляцию химиопрепаратов следует отменить в случаях явной или предполагаемой интра- или экстраперитонеальной перфорации, которая появляется в большинстве случаев после обширной ТУР; в ситуациях, сопровождающихся кровотечением, когда требуется орошение мочевого пузыря. Среднему медицинскому персоналу необходимо давать четкие инструкции по контролю над свободным оттоком жидкости по мочевому катетеру после окончания инстилляции.
Необходимость в проведении дальнейшей адъювантной интравезикальной терапии зависит от прогноза рецидива заболевания. У пациентов с низким риском однократные ранние инстилляции снижают риск развития рецидивов и рассматриваются в качестве стандартного лечения. Им не требуется лечения до последующего рецидива. Однако для других пациентов однократная немедленная инстилляция является недостаточной из-за высокой вероятности развития рецидива и/или прогрессирования. Метаанализ данных 3703 пациентов, включенных в 11 рандомизированных исследований, показал значительное снижение (на 44%) вероятности развития рецидивов в течение года при использовании химиотерапии по сравнению с ТУР. Это соответствует абсолютной разнице (на 13–14%) в количестве пациентов с рецидивами.
В проведенных рандомизированных исследованиях было показано преимущество БЦЖ-терапии по сравнению с внутрипузырной химиотерапией.
До сих пор остается спорным вопрос о продолжительности и частоте инстилляций химиопрепаратов. Из систематического обзора литературных данных по изучению РМП, где сравнивались различные режимы внутрипузырных инстилляций химиопрепаратов, можно сделать вывод, что идеальная продолжительность и интенсивность режимов остаются неопределенными из-за противоречивых данных [146]. Имеющиеся данные не подтверждают проведение лечения продолжительностью более 1 года [80].
Схемы проведения дальнейшей внутрипузырной химиотерапии
-
Митомицин С: 40 мг, первая инстилляция в день выполнения ТУР, далее 1 раз в неделю интравезикально 6–10 доз. Экспозиция – 1–2 часа. Частота рецидива после лечения – 10–41%.
-
Доксорубицин: 30–50 мг ежедневно, № 10 либо 20–50 мг 3 раза в неделю. Частота рецидива – 25–56%.
-
Эпирубицин: 30–80 мг ежедневно, № 3, 4 суток перерыв, еще 3 инстилляции. Экспозиция – 1–2 часа. Частота рецидива после адъювантной химиотерапии составляет 25–56%.
-
Гемцитабин: 1000–3000 мг 1–2 раза в неделю, № 6. Экспозиция – 1–2 часа. Частота полного ответа – 22–56% (II стадия исследования).
| Рекомендации [80] | УР |
|---|---|
Немедленная однократная химиотерапия рекомендована при опухолях, у которых предполагается низкий или средний риск развития рецидива и прогрессирования |
|
У пациентов с опухолями Та с низким риском развития рецидива немедленная однократная химиотерапия рекомендована в качестве полной (завершенной) адъювантной терапии |
А |
У пациентов с опухолями Та, Т1 со средним риском развития рецидивов немедленная однократная химиотерапия должна быть продолжена введением вакцины БЦЖ в течение 1 года с использованием полной дозы БЦЖ или дальнейшими инстилляциями химиопрепаратов в течение 1 года (максимальная продолжительность) |
А |
Пациентам с опухолями с высоким риском развития рецидива и прогрессирования показана внутрипузырная БЦЖ-терапия с использованием полной дозы в течение 1–3 лет |
А |
Пациентам с РМП эпителия простатической части уретры методом выбора является ТУР простаты с последующими внутрипузырными инстилляциями БЦЖ |
С |
У пациентов с самым высоким риском прогрессирования опухоли в качестве варианта лечения следует рассмотреть выполнение срочной радикальной цистэктомии |
С |
При БЦЖ-рефрактерных опухолях показана радикальная цистэктомия |
В |
Выполнение однократной немедленной химиотерапии должно быть запрещено в случаях явной или подозреваемой интраили экстраперитонеальной перфорации (после обширной ТУР или кровотечения, требующего орошения мочевого пузыря) |
С |
Оптимальная схема дальнейшей внутрипузырной химиотерапии и ее продолжительность не определены и не должны превышать 1 года |
С |
При проведении внутрипузырной химиотерапии рекомендуется использовать лекарственные препараты при оптимальной pH и поддерживать концентрацию ЛП в течение инстилляции при снижении потребления жидкости |
В |
Продолжительность индивидуальной инстилляции должна быть 1–2 часа |
С |
Абсолютные противопоказания для проведения внутрипузырной инстилляции БЦЖ: в течение первых 2 недель после ТУР; пациентам с макроскопической гематурией; после травматичной катетеризации; пациентам с наличием симптомов инфекции мочевыводящих путей |
С |
При описании побочных эффектов после внутрипузырной инстилляции БЦЖ необходимо отражать их тип и степень |
С |
Фотодинамическая терапия
После внутривенного введения фотосенсибилизатора с помощью лазера проводят обработку слизистой оболочки мочевого пузыря. В ряде работ сообщается об уменьшении количества рецидивов после фотодинамической терапии, в настоящее время отрабатываются схемы и накапливается материал. Дозы препаратов, сроки и режимы лечения зависят от распространенности опухоли по слизистой оболочке мочевого пузыря, характера фотосенсибилизатора и доз лазерного излучения. Данный метод лечения выступает в настоящее время как вариант второй линии противоопухолевой терапии поверхностного РМП.
Лучевая терапия
Неэффективна при поверхностном раке мочевого пузыря.
Радикальная цистэктомия
[80]
Если цистэктомия показана до гистологического подтверждения перехода в инвазивную опухоль, радикальная цистэктомия может быть разделена на срочную (незамедлительную – сразу после установления диагноза РМП без инвазии в мышечный слой) и раннюю (после неэффективной БЦЖ-терапии). Есть несколько причин для рассмотрения радикальной цистэктомии в качестве метода лечения отобранных пациентов с РМП без инвазии в мышечный слой:
-
точное стадирование опухолей Т1 посредством ТУР низкое, несмотря на то что у 27–51% пациентов инвазивная опухоль исчезает при радикальной цистэктомии;
-
как показывает опыт, у некоторых пациентов с неинвазивными опухолями наблюдается прогрессирование в инвазивные формы;
-
ретроспективно показано, что пациентам с РМП с высоким риском развития рецидива лучше провести раннюю, чем отсроченную цистэктомию рецидива опухоли, после первоначального лечения с использованием ТУР и БЦЖ, так как при этом становятся лучше показатели выживаемости.
Потенциальный положительный эффект от радикальной цистэктомии должен быть соизмеримым с возможными рисками, показателями заболеваемости. Необходимо учитывать влияние радикальной цистэктомии на качество жизни пациентов.
Целесообразно предлагать немедленную радикальную цистэктомию тем пациентам с неивазивным раком, у которых самый высокий риск прогрессирования опухоли. К ним относятся:
Радикальная цистэктомия настоятельно рекомендуется пациентам с БЦЖ-рефрактерными опухолями (табл. 10.7). Отсрочка в выполнении радикальной цистэктомии может привести к снижению показателей выживаемости. У пациентов, которым радикальная цистэктомия проводится при морфологическом подтверждении наличия опухоли без инвазии в мышечный слой, показатель пятилетней безрецидивной выживаемости превышает 80% .
| Категория | Рекомендации по лечению | УР |
|---|---|---|
БЦЖ-рефрактерная опухоль |
Радикальная цистэктомия. |
В |
Высокая степень рецидивирования после БЦЖ-терапии |
Радикальная цистэктомия. Повторение курса БЦЖ. Органосохраняющие технологии мочевого пузыря |
С |
Невысокая степень рецидивирования после БЦЖ-терапии вследствие наличия первичных опухолей со средним риском рецидивирования |
Повторение БЦЖ-терапии или внутрипузырной химиотерапии. Радикальная цистэктомия |
С |
Наблюдение за пациентами с опухолями мочевого пузыря без инвазии в мышечный слой
[80]
Учитывая риск рецидивирования и прогрессирования, пациенты с опухолями Та, Т1 мочевого пузыря и с РМП нуждаются в дальнейшем наблюдении; частота и продолжительность цистоскопии и других методов визуализации зависят от индивидуальной степени риска для пациента. При планировании схемы и методов наблюдения необходимо учитывать следующие аспекты:
-
быстрое обнаружение рецидива инвазивной и неинвазивной опухоли с высокой степенью рецидивирования имеет решающее значение, потому что промедление в диагностике и терапии может быть опасно для жизни;
-
рецидив опухоли в группе низкого риска почти всегда низкой стадии и низкой степени. Небольшие, неинвазивные (Та), низкой степени папиллярные рецидивы не представляют непосредственной опасности для пациентов, и раннее выявление не считается обязательным для успешной терапии;
-
фульгурация небольших папиллярных рецидивов в амбулаторных условиях может быть безопасным вариантом лечения, который снижает терапевтическую нагрузку. Некоторые авторы настаивают на временном наблюдении в отдельных случаях;
-
результаты первой цистоскопии через 3 месяца после ТУР являются очень важными прогностическими показателями рецидивирования и прогрессирования опухоли. У всех пациентов с РМП Та, Т1 первая цистоскопия всегда должна выполняться через 3 месяца после ТУР;
-
у опухолей с низким риском наблюдается низкий риск развития рецидива в течение 5 лет наблюдения. Может быть рассмотрено прекращение выполнения цистоскопии или замены ее на менее инвазивные методы;
-
среди опухолей изначально со средним или высоким риском возникновение рецидивов спустя 10 лет наблюдения является обычной ситуацией, поэтому рекомендовано пожизненное наблюдение;
-
риск возникновения рецидива заболевания в верхних мочевыводящих путях увеличивается у пациентов с многочисленными опухолями и с опухолями с высоким риском рецидивирования;
-
положительные результаты анализа мочи оказывают положительное влияние на качество выполнения последующих цистоскопий. Это подтверждает дополнительную роль анализов мочи в течение периода наблюдения.
Из-за отсутствия неинвазивного метода, который смог бы заменить цистоскопию, для последующего наблюдения используют регулярные цистоскопии. Проведено недостаточно рандомизированных исследований, которые изучали бы возможность безопасного снижения частоты последующих цистоскопий. Таким образом, следующие рекомендации основаны преимущественно на ретроспективном опыте.
Схема лечения поверхностного рака мочевого пузыря представлена на рис.10.3.
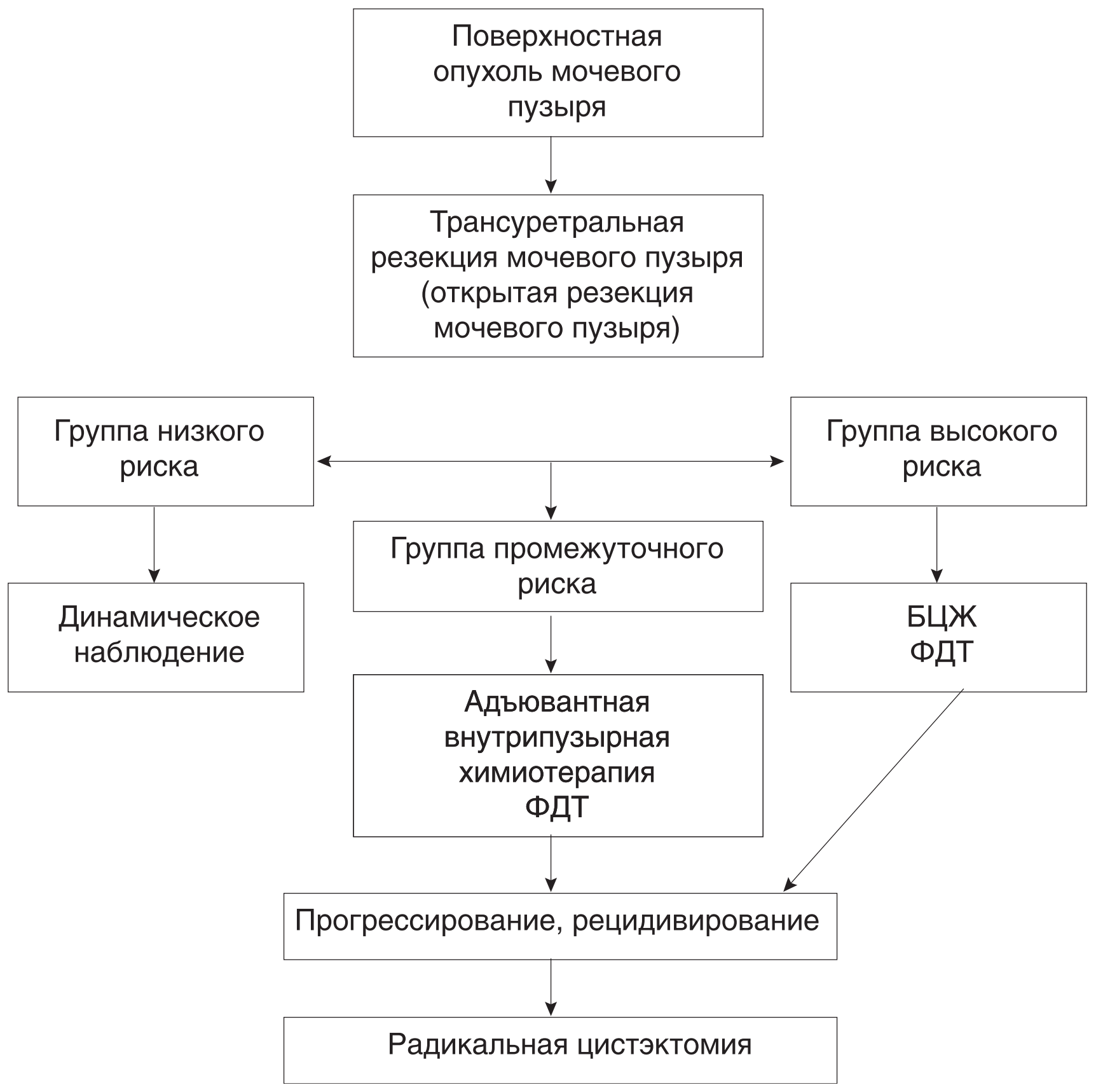
| Рекомендации [80] | УР |
|---|---|
Наблюдение за опухолями Та, Т1 основано на регулярном проведении цистоскопий |
А |
Пациентам с опухолями Та с низким риском развития рецидива должна быть проведена цистоскопия через 3 месяца. Если результат отрицательный, последующую цистоскопию рекомендуется проводить через 9 месяцев, а затем ежегодно в течение 5 лет |
С |
Пациентам с опухолями высокого риска рецидивирования должны быть проведены цистоскопия и цитологическое исследование мочи через 3 месяца. Если результат отрицательный, последующую цистоскопию и цитологическое исследование необходимо повторять каждые 3 месяца в течение 2 лет и затем каждые 6 месяцев до 5 лет, а затем 1 раз в год |
С |
У пациентов с опухолями Та, Т1 со средним риском развития рецидива должны быть промежутки между последующими наблюдениями с использованием цистоскопии и цитологического исследования, которые адаптированы в соответствии с персональными и субъективными факторами |
С |
При опухолях с высоким риском развития рецидива рекомендовано ежегодное (регулярное) обследование верхних мочевыводящих путей (КТ-урография или внутривенная урография) |
С |
Следует выполнять эндоскопию и биопсию мочевого пузыря под анестезией, если при проведении цистоскопии врачом получены подозрительные результаты или если есть положительные результаты цитологического исследования мочи |
В |
В процессе наблюдения за пациентами с положительными результатами цитологического исследования и без видимой опухоли мочевого пузыря рекомендуется проведение мультифокальной биопсии или биопсии с использованием ФДИ (если оборудование позволяет) и исследование экстравезикальных локализаций (КТ-урография, биопсия простатической части уретры) |
В |
Инвазивный рак мочевого пузыря
Оперативное лечение
Ведущее значение в лечении больных инвазивным раком мочевого пузыря имеет оперативное лечение. Стандартный хирургический подход к лечению этих больных – радикальная цистэктомия. Несмотря на лучшие онкологические результаты радикальной цистэктомии, актуальными остаются органосохраняющие операции (ТУР, резекция мочевого пузыря).
Радикальная цистэктомия
У мужчин стандартный объем радикальной цистэктомии – удаление единым блоком мочевого пузыря с покрывающей его брюшиной и паравезикальной клетчаткой, предстательной железы с семенными пузырьками, двусторонняя тазовая (подвздошно-обтураторная) лимфаденэктомия. При опухолевом поражении простатической части уретры выполняют уретерэктомию.
У женщин стандартный объем радикальной цистэктомии включает двустороннюю тазовую лимфаденэктомию и переднюю экзентерацию таза: удаление мочевого пузыря с покрывающей его брюшиной и паравезикальной клетчаткой, удаление матки с придатками, резекцию передней стенки влагалища [12, 42].
Поскольку при стандартной радикальной цистэктомии у мужчин возникает эректильная дисфункция, возможно выполнение нервосберегающей операции с сохранением кавернозных сосудисто-нервных пучков. Данная методика обеспечивает сохранение потенции у 60% больных [20].
В настоящее время имеются данные о возможности выполнения радикальной цистэктомии с помощью робот-ассистированной техники.
Для определения точного места роботической техники выполнения радикальной цистэктомии необходимо проведение дальнейших исследований. Несмотря на это, сегодня лапароскопическая цистэктомия и тазовая лимфаденэктомия (с роботической ассистенцией или без таковой) с экстракорпоральным этапом отведения мочи являются возможной опцией хирургического лечения инвазивного РМП (УД 3) [80].
Осложнения после радикальной цистэктомии
Общее количество осложнений составляет 9,7–30,0%. Частота гнойно-септических осложнений достигает 0,28–30%. Летальность после цистэктомии – 1,2–5,1%. Интраоперационные осложнения достигают 5,3–9,7%. Кровотечения составляют 3–7%. Ранения прямой кишки при наличии лучевой терапии в анамнезе – 20–27%, без лучевой терапии – 0,5–7,0%.
Послеоперационные осложнения:
Наиболее типичные операции
Реконструктивно-пластические операции – неотъемлемый компонент лечения РМП во всех случаях, когда страдает резервуарная функция. Необходимо, чтобы выбранный способ деривации мочи обеспечивал больному высокий уровень качества жизни, наименьшее количество послеоперационных осложнений.
Классификация видов деривации мочи:
-
наружное отведение мочи (уретерокутанеостомия, кишечная пластика с формированием «сухих» и «влажных» стом);
-
отведение мочи в непрерывный кишечник (уретеросигмостомия, операция Mainz pouch II);
-
создание мочевых резервуаров, обеспечивающих возможность самостоятельного контролируемого мочеиспускания. Наиболее распространенные методики отведения мочи с неконтролируемым отделением мочи:
-
операция типа Бриккера (уретероилеокутанеостомия) – операция по отведению мочи в выделенный участок подвздошной кишки. Широко распространенная методика. Показания: отведение мочи после цистэктомии;
-
уретерокутанеостомия – самый простой способ отведения мочи. Показание: отведение мочи у пациентов с генерализованным или обширным местнораспространенным процессом.
Основные осложнения после операции:
Предпочтение следует отдавать формированию удерживающего резервуара с выведением уростомы на переднюю брюшную стенку [30] или ортотопической пластике мочевого резервуара. Операция проводится при опухолевом поражении уретры ниже семенного бугорка, т.е. в случаях низкой резекции уретры.
Субстрат для гетеротопической пластики – илеоцекальный угол (Indiana, Florida, Mainz, Charleston, LeBag, Duke).
Осложнения:
Наиболее перспективный метод отведения мочи – формирование ортотопических мочевых резервуаров, обеспечивающих контролируемое мочеиспускание по нативной уретре.
Для создания ортотопического мочевого резервуара предложено использовать:
Общая пятилетняя выживаемость после цистэктомии составляет 40–60%:
Органосохраняющие операции
Их необходимо дополнять неоадъювантной и адъювантной химиотерапией, химиолучевым лечением.
| Заключение [80] | УД |
|---|---|
Радикальная цистэктомия у пациентов с инвазивным раком мочевого пузыря является методом, способным излечить заболевание |
3 |
Показатели смертности и морбидности ниже в центрах с большим опытом выполнения радикальной цистэктомии |
3 |
Региональные лимфатические узлы должны быть удалены в ходе выполнения радикальной цистэктомии |
3 |
Расширенная лимфаденэктомия улучшает показатели выживаемости после радикальной цистэктомии по сравнению со стандартной методикой |
3 |
Выполнение радикальной цистэктомии не должно включать в себя удаление уретры, которая может служить в дальнейшем для отведения мочи |
3 |
Тип отведения мочи не оказывает влияния на онкологические результаты 3 Лапароскопическая и робот-ассистированная цистэктомия может применяться, однако до сих пор остается в фазе изучения |
3 |
У пациентов с инвазивным раком мочевого пузыря старше 80 лет выполнение радикальной цистэктомии является опциональным методом |
3 |
| Рекомендации [80] | СР |
|---|---|
Радикальная цистэктомия рекомендована для выполнения пациентам высокого риска с раком мочевого пузыря Т2–Т4а, N0M0 |
А |
Нельзя откладывать выполнение радикальной цистэктомии более чем на 3 месяца в связи с высоким риском прогрессии заболевания и раковоспецифической смерти |
В |
Лучевая терапия до оперативного лечения нецелесообразна при выборе оперативного лечения с отведением мочи |
А |
Выполнение лимфаденэктомии должно являться частью радикальной цистэктомии. Рекомендовано выполнение расширенной техники |
В |
Целесообразно сохранение уретры при отсутствии позитивного хирургического края |
В |
Лапароскопическая и робот-ассистированная техника могут применяться для лечения больных инвазивным РМП. Однако на сегодняшний день нет убедительных данных о преимуществе минимально-инвазивных методик в функциональных и/или онкологических аспектах |
С |
Пациент должен быть полностью информирован обо всех достоинствах и возможных рисках радикальной цистэктомии |
В |
Предоперационная подготовка кишечника не обязательна С Ортотопическая пластика должна быть предложена каждому пациенту при отсутствии противопоказаний и опухоли мочеиспускательного канала |
В |
Резекция мочевого пузыря
Показания к выбору органосохраняющего хирургического и комплексного лечения должны вырабатываться только в высокоспециализированном онкологическом стационаре при наличии комплекса флюоресцентной уточняющей диагностики, позволяющей оценивать состояние слизистой оболочки мочевого пузыря, и современных диагностических методов, направленных на диагностику регионарных и отдаленных метастазов на различных этапах мониторинга, а также возможности длительного и тщательного наблюдения за больным. Оперативное вмешательство должно выполняться чрезбрюшинным доступом с целью тщательной ревизии органов брюшной полости и зон метастазирования.
Условия проведения резекции мочевого пузыря [11]:
-
одиночная и единичная опухоли мочевого пузыря, локализующиеся вне шейки мочевого пузыря;
-
отсутствие данных уточняющей диагностики, включающей комплекс флюоресцентного исследования (флюоресцентная диагностика с локальной флюоресцентной спектроскопией) и множественную биопсию из зон свечения с повышенным уровнем диагностического параметра, о наличии злокачественной опухоли мочевого пузыря вне основной опухоли мочевого пузыря и мочеиспускательного канала;
-
нормальный показатель простатоспецифического антигена (ПСА) (исследование общей и свободной фракции крови);
-
отрицательный результат многоточковой биопсии предстательной железы;
-
отсутствие в анамнезе указаний на резекцию мочевого пузыря, или чреспузырную аденомэктомию, или чреспузырное удаление конкрементов мочевого пузыря;
-
отсутствие в анамнезе указаний на лучевую терапию на область малого таза;
-
отсутствие протяженных стриктур мочеиспускательного канала. При возможности проводится тщательный мониторинг пациента.
Показания к проведению предоперационной и послеоперационной полихимиотерапии в плане комплексного органосохраняющего лечения [10]:
-
одиночная и единичные опухоли мочевого пузыря, локализующиеся вне шейки мочевого пузыря с макрогематурией или без таковой;
-
отсутствие данных уточняющей диагностики, включающей комплекс флюоресцентного исследования (флюоресцентная диагностика с локальной флюоресцентной спектроскопией) и множественную биопсию из зон свечения с повышенным уровнем диагностического параметра, о наличии злокачественной опухоли мочевого пузыря вне основной опухоли мочевого пузыря и мочеиспускательного канала;
-
отсутствие данных о тяжелой степени нарушения паренхиматозно-выделительной функции обеих почек;
-
нормальный показатель ПСА (исследование общей и свободной фракции крови);
-
отрицательный результат многоточковой биопсии предстательной железы;
-
отсутствие в анамнезе указаний на проводимую системную полихимиотерапию;
-
отсутствие в анамнезе указаний на резекцию мочевого пузыря, или чреспузырную аденомэктомию, или чреспузырное удаление конкрементов мочевого пузыря;
-
отсутствие в анамнезе указаний на лучевую терапию на область малого таза;
При возможности проводится тщательный мониторинг пациента.
Осложнения:
В 38–76% случаев возникает рецидив заболевания, пятилетняя выживаемость составляет 32,5–79%.
Трансуретральная резекция мочевого пузыря
Ряд авторов считают возможным выполнение ТУР у больных с Т2а-стадией при высокодифференцированных и умеренно дифференцированных опухолях. Частота рецидивов достигает 70%. ТУР мочевого пузыря комбинируют с адъювантной терапией, в первую очередь БЦЖ.
| Рекомендация [80] | УД | СР |
|---|---|---|
Трансуретральная резекция мочевого пузыря изолированно не является методом, позволяющим излечить заболевание в большинстве случаев |
2а |
В |
Химиотерапия
К химиотерапии чувствителен переходно-клеточный рак мочевого пузыря.
Неоадъювантная химиотерапия
Проводят перед хирургическим или лучевым лечением. Цели неоадъювантной химиотерапии:
Главное преимущество неоадъювантной химиотерапии – возможность оценить ее воздействие на первичный очаг, что может влиять на тактику дальнейшего лечения [63]. Неоадъювантная химиотерапия играет важную роль в последующем решении об органосохраняющем лечении. Показание к неоадъювантной химиотерапии – стадии рака Т2–Т4а.
По результатам рандомизированных исследований было проведено три метаанализа, которые продемонстрировали статистически значимое увеличение общей выживаемости на 5% у пациентов, получавших неоадъювантную химиотерапию. Стандартными режимами для проведения неадъювантной химиотерапии являются: MVAC, CMV и GC. Таким образом, последние данные свидетельствуют в поддержку проведения неоадъювантной химиотерапии больным с Т2-Т4a/cN0/cM0 стадией при наличии сохраненной функции почек (клиренс креатинина > 60 мл/мин) и общего удовлетворительного состояния (ECOG < 2) [25, 33, 35, 73].
| Рекомендация [80] | СР |
|---|---|
Химиотерапия в качестве монотерапии не рекомендована как терапия первой линии у больных с инвазивным раком мочевого пузыря |
А |
Адъювантная химиотерапия
В настоящее время продолжается дискуссия о целесообразности проведения адъювантной химиотерапии у больных с высоким риском развития рецидива заболевания после радикальной (R0) цистэктомии (при опухолях рТ3-4 и/или метастатическом поражении регионарных лимфоузлов (N+) и отсутствии клинически определяемых отдаленных метастазов). Некоторые авторы считают, что адъювантная химиотерапия позволяет улучшить отдаленные результаты лечения в данной группе больных в среднем на 20–30%. Однако вопрос о целесообразности адъювантного лечения, оптимальном режиме химиотерапии и сроках ее проведения остается предметом клинических исследований. В настоящее время нет достаточно убедительных доказательств в пользу рутинного применения адъювантной химиотерапии [15, 44, 45, 74].
| Рекомендация [80] | СР |
|---|---|
Адъювантная химиотерапия рекомендована для применения в рамках клинических исследований, но не в качестве рутинного метода лечения |
А |
Лучевая терапия
Воздействию лучевой терапии подлежат переходно-клеточные и плоскоклеточные опухоли.
Самостоятельная лучевая терапия
Проводят у больных инвазивным переходно-клеточным РМП, которым по местной распространенности процесса, соматическому состоянию или вследствие отказа не выполнялась радикальная цистэктомия.
Лучевой терапии могут быть подвергнуты больные с нормальной функцией мочевого пузыря, достаточной емкостью мочевого пузыря и при отсутствии инфекции мочевыводящих путей.
В большинстве случаев проводят дистанционную лучевую терапию, однако больным с небольшими (< 5 см) солитарными образованиями может быть выполнена брахитерапия. Подведенная суммарная очаговая доза менее 60 Гр малоэффективна. По данным разных авторов, пятилетняя выживаемость колеблется в пределах 24–46%. При стадии Т2 пятилетняя выживаемость составляет 25,3–59,0%, при стадии Т3 – 9–38%, при стадии Т4 – 0–16%. Ответ на проведенное лечение наблюдается у 35–70% больных. Частота развития местных рецидивов составляет около 50%.
Осложнения возникают у 15% больных, наиболее распространенными были цистит, гематурия, дизурические явления, проктит, диарея. Более чем у 2/3 мужчин развивается эректильная дисфункция.
Проведен анализ результатов рандомизированных исследований, в которых сравнивалась выживаемость больных после лучевой терапии и оперативного лечения, которая была выше при оперативном лечении [27, 32, 38, 48, 56]. Однако данный вывод основан на небольшом количестве исследований и включенных в них больных.
Предоперационная лучевая терапия
Цели: снижение степени инвазии опухоли и предотвращение развития местного рецидива после хирургического вмешательства.
Суммарная очаговая доза составляет от 20 до 45 Гр. В ряде проведенных исследований отмечают снижение числа местных рецидивов после проведенной предоперационной терапии, однако в других исследованиях не отмечено ее влияния на выживаемость и частоту местного рецидивирования [22].
Послеоперационная лучевая терапия
Показания: местнораспространенные опухоли (рТ3-4) и наличие положительного хирургического края.
Подведенная суммарная очаговая доза составляет 50–60 Гр. Выполняют в срок до 4 недель после операции. В связи с изменением топографо-анатомических соотношений после удаления мочевого пузыря отмечают увеличение постлучевых осложнений, особенно со стороны желудочно-кишечного тракта. Эффективность послеоперационной лучевой терапии не доказана.
Схема лечения инвазивного рака мочевого пузыря представлена на рис. 10.4.
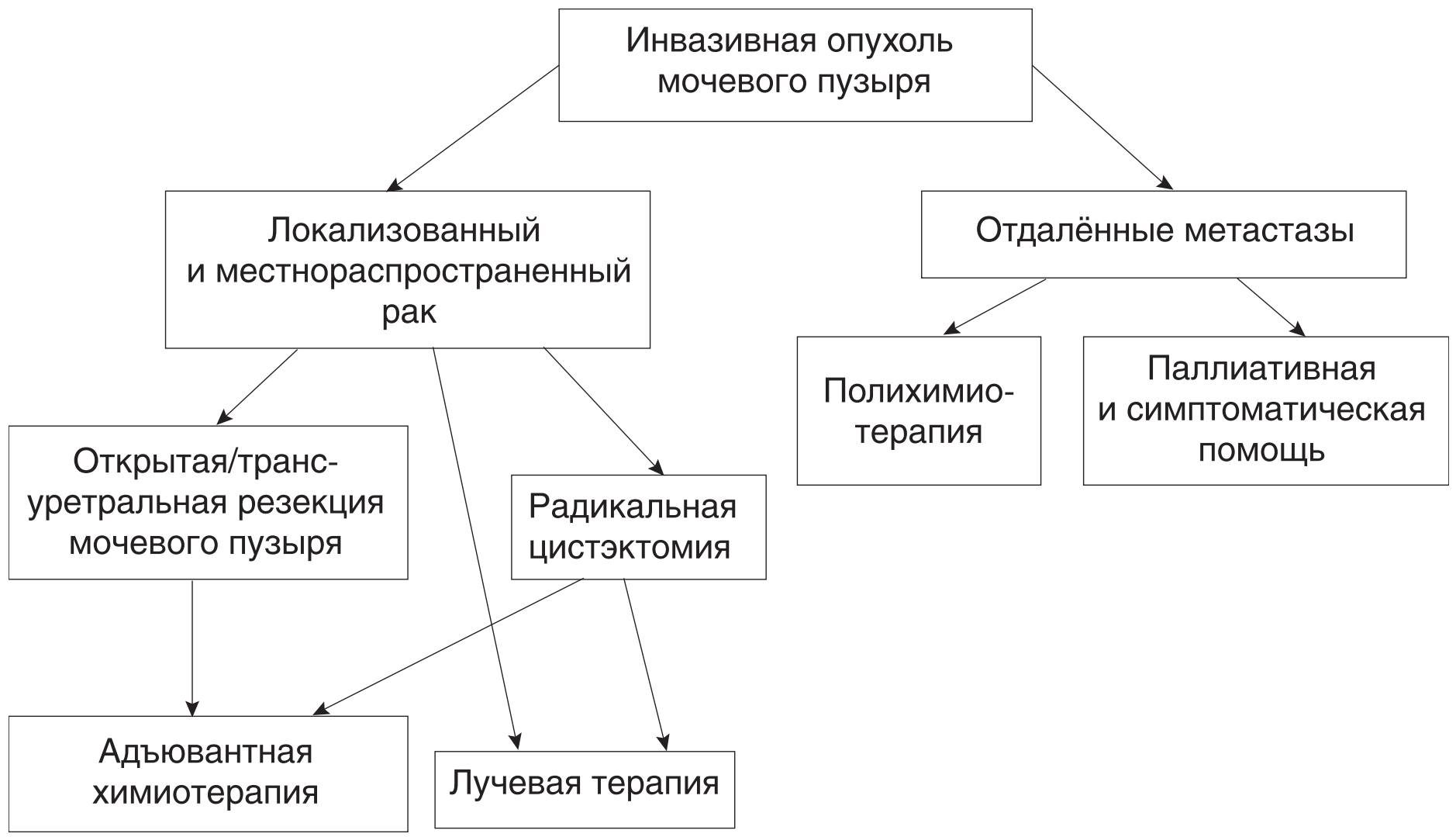
Метастатический рак мочевого пузыря
РМП метастазирует как лимфогенным, так и гематогенным путем. Лимфогенные метастазы:
Гематогенные метастазы:
Химиотерапия
Приблизительно 10–15% пациентов на момент постановки диагноза уже имеют отдаленные метастазы и у 30% больных инвазивным РМП развивается рецидив заболевания (местный рецидив и/или отдаленные метастазы) после радикального лечения. До разработки эффективных схем химиотерапии медиана выживаемости больных с отдаленными метастазами переходно-клеточного рака составляла 3–6 месяцев [44, 58, 31, 35].
Прогностические факторы и выбор терапии
РМП относится к химиочувствительным опухолям. Частота объективных ответов различается в зависимости от прогностических факторов и распространения болезни до начала терапии. Независимыми факторами, негативно влияющими на общую выживаемость при проведении химиотерапии, являются: статус по шкале Карновского > 80% и наличие висцеральных метастазов. Медиана продолжительности жизни пациентов при отсутствии всех факторов риска достигает 33 месяцев, при наличии одного фактора – 13 месяцев, при наличии двух факторов – 9 месяцев. В дальнейшем было установлено дополнительное прогностическое влияние уровня щелочной фосфатазы, числа зон, пораженных метастазами (> 3), и уровня гемоглобина < 10 мг/дл.
| Схема химиотерапии | Препарат | Доза | Путь введения | Дни приема | Длительность цикла, дни |
|---|---|---|---|---|---|
Монотерапия |
Цисплатин |
80–100 мг/м2 |
в/в |
1-й |
21 |
Монотерапия |
Карбоплатин |
AUC* = 6 |
в/в |
1-й |
21 |
Монотерапия |
Гемцитабин |
1200 мг/м2/сут |
в/в |
1-й, 8-й |
21 |
Монотерапия |
Паклитаксел |
200 мг/м2 |
в/в |
1-й |
21 |
Монотерапия |
Доцетаксел |
100 мг/ м2 |
в/в |
1-й |
21 |
Монотерапия |
Винфлунин (вторая линия) |
320 мг/м2 |
в/в |
1-й |
1 |
CDDP + Gem |
Цисплатин |
80–100 мг/м2 |
в/в |
1-й |
21 |
MVAC |
Метотрексат |
30 мг/м2 |
в/в |
1, 15, 22-й |
28 |
HD-MVAC (высокодозный) |
Метотрексат |
30 мг/м2 |
в/в |
1-й |
15 |
MCAVI |
Метотрексат |
30 мг/м2 |
в/в |
1, 15, 22-й |
28 |
Carbo + Gem |
Карбоплатин |
AUC* = 5 |
в/в |
1-й |
21 |
Осложнения:
В 3–5% случаев возникает летальный исход от осложнений химиотерапии.
| Рекомендации [80] | УР |
|---|---|
Терапия первой линии |
|
Применение цисплатин-содержащей комбинации препаратов |
А |
Комбинации с карбоплатином не рекомендованы |
В |
Терапия первой линии у пациентов, не подходящих для лечения цисплатином |
|
Комбинация с карбоплатином рекомендована |
А |
Терапия второй линии |
|
Винфлунин должен быть назначен при неэффективности химиотерапии цисплатин-содержащей комбинацией препаратов |
А |
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ
Рекомендуют придерживаться следующих алгоритмов динамического наблюдения.
При органосохраняющем лечении: цистоскопическое исследование с цитологическим анализом мочи, УЗИ малого таза, брюшной полости, биохимический и общий анализы крови в первые 2 года 1 раз в 3 месяца, в 3–4-й год 1 раз в 6 месяцев, затем 1 раз в год;
-
рентгенографическое исследование грудной клетки 1 раз в 6 месяцев;
-
КТ, МРТ, внутривенная урография 1 раз в 1–2 года. При радикальной цистэктомии:
-
УЗИ малого таза, брюшной полости, почек, рентгенография грудной клетки, общий и биохимический анализы крови 1 раз в 3 месяца в течение 1-го года, в следующие 3 года 1 раз в 6 месяцев, затем 1 раз в год;
Сканирование костей скелета, КТ грудной клетки выполняют при подозрении на наличие отдаленных метастазов для динамического наблюдения у больных генерализованным РМП.
ЛИТЕРАТУРА
-
Болотина Л.В. Химиотерапия распространенного рака мочевого пузыря: дис. … канд. мед. наук. М., 2002.
-
Воробьев А.В. Классификация и диагностика рака мочевого пузыря, вопросы дифференциальной диагностики. Практическая онкология. 2003; 4 (4): 200–201.
-
Злокачественные новообразования в России в 2014 г. (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2016.
-
Коган М.И., Перепечай В.А. Современная диагностика и хирургия рака мочевого пузыря. Ростов-на-Дону, 2002.
-
Лекции цикла «Онкоурология». Сост. И.Н. Денисов, А.Д. Каприн. М., 2008.
-
Матвеев Б.П., Фигурин К.М., Карякин О.Б. Pак мочевого пузыря. М., 2001.
-
Митина Л.А., Казакевич В.И., Степанов С.О. Ультразвуковая онкоурология. Под ред. В.И. Чиссова, И.Г. Русакова. М.: Медиа Сфера, 2005. 200 с.
-
Перепечай В.А. Обоснование ортотопической сигмопластики для восстановления мочевого пузыря: Дис. … канд. мед. наук. Ростов-на-Дону, 2000.
-
Сергеева Н.С., Маршутина Н.В. Новые серологические и уринологические опухолевые маркеры в уточняющей диагностике и мониторинге онкологических больных. Материалы VII Российской онкологической конференции. М., 2003.
-
Camey M., Botto H. The ileal neobladder: development and long-term experience, Carney I and II. Scand. J. Urol. Nephrol. (Suppl.). 1992; 142: 98–100.
-
Теплов А.А. Хирургическое и комплексное лечение больных раком мочевого пузыря: дис. … д-ра мед. наук. М., 2006.
-
Теплов А.А. Хирургическое и комплексное лечение больных инвазивным раком мочевого пузыря. Состояние проблемы. Выбор лечебной тактики. Материалы Международного научного форума «Онкология на рубеже XXI века. Возможности и перспективы». М., 1999. С. 382–383.
-
Урология: иллюстрированное руководство. От симптомов к диагнозу и лечению. Под ред. П.В. Глыбочко, Ю.Г. Аляева, Н.А. Григорьева. М.: ГЭОТАР-Медиа, 2014.
-
Урология. Под ред. П.В. Глыбочко, Ю.Г. Аляева. Ростов-на-Дону: Феникс, 2014.
-
Чиссов В.И., Соколов В.В., Булгакова Н.Н., Филоненко Е.В. Флюоресцентная эндоскопия, дермаскопия, спектрофотометрия в диагностике злокачественных опухолей основных локализаций. Российский биотерапевтический журнал. 2003; 4 (2): 45–56.
-
Advanced Bladder Cancer Overview Collaboration. Neoadjuvant cisplatin for advanced bladder cancer. In: The Cochrane Library 2, 2004. Chichester, UK: John Wiley.
-
Bajorin D.F. Plenary debate of randomized phase III trial of neoadjuvant MVAC plus cystectomy versus cystectomy alone in patients with locally advanced bladder cancer. J. Clin. Oncol. 2001; 19: 17S.
-
Bofetta P., Silverman D.T. A metaanalysis of bladder cancer and diesel exhaust exposure. Epidemiology. 2001; 12: 125.
-
Bohle A., Brandau S. Immune mechanisms in bacillus Calmette – Guerin immunotherapy for superficial bladder cancer. J. Urol. 2003; 170: 964.
-
Bono A.V., Benvenuti C., Reali L. et al. Adjuvant chemotherapy in advanced bladder cancer. Italian Uro-Oncologic Cooperative Group. Prog. Clin. Biol. Res. 1989; 303: 533.
-
Brennan P., Bogillot O., Cordier S. et al. Cigarette smoking and bladder cancer in men: a pooled analysis of 11 case-control studies. Int. J. Cancer. 2000; 86: 289.
-
Campbell’s Urology. Eds. P.C. Walsh et al. 8th edn. Philadelphia, 2002; 1–4.
-
Castelao J.E., Yuan J.M., Skipper P.L. et al. Gender- and smoking-related bladder cancer risk. J. Natl. Cancer. Inst. 2001; 93: 538.
-
Cole C.J., Pollack A., Zagars G.K. et al. Local control of muscle-invasive bladder cancer: preoperative radiotherapy and cystectomy versus cystectomy alone. Int. J.Radiat. Oncol. Biol. Phys. 1995; 32: 331.
-
Cole P., Hoover R., Friedell G.H. Occupation and cancer of the lower urinary tract. Cancer. 1972; 29: 1250.
-
Cookson M.S., Chang S.S., Wells N., Parekh D.J. Complications of radical cystectomy for nonmuscle invasive disease: comparison with muscle invasive disease. J.Urol. 2003; 169: 101.
-
Cortesi E. Neoadjuvant treatment for locally advanced bladder cancer: A prospective randomized clinical trial. Proc. Am. Soc. Clin. Oncol. 1995; 14: 237.
-
Datta S.N., Allen G.M., Evans R. et al. Urinary tract ultrasonography in the evaluation of haematuria: A report of over 1,000 cases. Ann. R. Coll. Surg. Eng. 2002; 84: 203.
-
De Neve W., Lybeert M.L., Goor C. et al. Radiotherapy for T2 and T3 carcinoma of the bladder: The influence of overall treatment time. Radiother. Oncol. 1995; 36: 183.
-
Delnay K.M., Stonehill W.H., Goldman H. et al. Bladder histological changes associated with chronic indwelling urinary catheter. J. Urol. 1999; 161: 1106.
-
Donat M.D., Herr H.W. Transitional cell carcinoma of the renal pelvis and ureter: diagnosis, staging, management, and prognosis. In: Urologic Oncology. Eds. J.E. Osterling, J.P. Richie. Philadelphia: WB Saunders Harcourt Brace & Co, 1997. P. 215.
-
Elmajian D.A., Stein J.P., Esrig D. et al. The Kock ileal neobladder: updated experience in 295 male patients. J. Urol. 1996; 156 (3): 920–925.
-
Freiha F., Reese J., Torti F. A randomized trial of radical cystectomy versus radical cystectomy plus cisplatin, vinblastine and methotrexate chemotherapy for muscle-invasive bladder cancer. J. Urol. 1996; 155: 495.
-
Gospodarowicz M.K., Quilty P.M., Scalliet P. et al. The place of radiation therapy as definitive treatment of bladder cancer. Int. J. Urol. 1995; 2 (Suppl. 2): 41.
-
Grossman H.B., Natale R.B., Tangen C.M. et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N. Eng. J. Med. 2003; 349: 859.
-
Hall R.R. Updated results of a randomised controlled trial of neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer. Proc. Am. Soc. Clin. Oncol. 2002; 21: 178.
-
Herr H.W. Routine CT scan in cystectomy patients: does it change management? Urology. 1996; 47: 324.
-
Jemal A., Thomas A., Murray T., Thun M. Cancer statistics. CA Cancer. J. Clin. 2002; 52: 23.
-
Jenkins B.J., Caulfield M.J., Fowler C.G. et al. Reappraisal of the role of radical radiotherapy and salvage cystectomy in the treatment of invasive bladder cancer. Br. J. Urol. 1988; 62: 343.
-
Jung I., Messing E. Molecular mechanisms and pathways in bladder cancer development and progression. Cancer Control. 2000; 7: 325.
-
Kaufman D., Raghavan D., Carducci M. et al. Phase II trial of gemcitabine plus cisplatin in patients with metastatic urothelial cancer. J. Clin. Oncol. 2000; 18: 1921.
-
Khadra M.H., Pickard R.S., Charlton M. et al. A prospective analysis of 1,930 patients with hematuria to evaluate current diagnostic practice. J. Urol. 2000; 163: 524.
-
Lerner S.P., Skinner D.G. Radical cystectomy for bladder cancer. Comprehensive textbook of genitourinary oncology. Baltimore: Williams and Wilkins, 1996. P. 442–463.
-
Light J.K., Engelmann U.H. Le bag: total replacement of the bladder using an ileocolonic pouch. J. Urol. 1986; 135: 27–31.
-
Loehrer P., Einhorn L.H., Elson P.J. et al. A randomized comparison of cisplatin alone or in combination with methotrexate, vinblastine, and doxorubicin in patients with metastatic urothelial carcinoma: A Cooperative Group Study. J. Clin. Oncol. 1992; 10: 1066.
-
Logothetis C.J., Dexeus F., Sella A. et al. A prospective randomized trial comparing CISCA to MVAC chemotherapy in advanced metastatic urothelial tumors. J. Clin. Oncol. 1990; 8: 1050.
-
Logsetty S. Screening for bladder cancer. In: Canadian Task Force on the Periodic Health Examination. Canadian Guide to Clinical Preventive Health Care. Ottawa: Health Canada, 1994. P. 826–836.
-
Lutzeyer W., Rubben H., Dahm H. Prognostic parameters in superficial bladder cancer: an analysis of 315 cases. J. Urol. 1982; 127: 250.
-
Mameghan H., Fisher R., Mameghan J. Analysis of failure following definitive radiotherapy for invasive transitional cell carcinoma of the bladder. Int. J. Radiat. Oncol. Biol. Phys. 1995; 31: 247.
-
Matsui U., Topoll B., Miller K., Hautmann R.E. Metabolic long-term follow up of the ideal neobladder. Eur. Urol. 1993; 24 (2): 197–200.
-
McDougal W.S. Use of intestinal segments and urinary diversion. In: P.C. Walsh, A.B. Retik, E.D. Vaughan et al. (eds.) Campbell’s Urology. Vol. 3. 7th edn. Philadelphia, Pa: W.B. Saunders, 1997. P. 3121–3161.
-
Mohr D.N. et al. Asymptomatic microhematuria and urologic disease. A population-based study. JAMA. 1986; 256: 224.
-
Moore M.J., Winquist E.W., Murray N. et al. Gemcitabine plus cisplatin, an active regimen in advanced urothelial cancer: A phase II trial of the National Cancer Institute of Canada Clinical Trials Group. J. Clin. Oncol. 1999; 17: 2876.
-
Nakamura I. Postoperative care of neobladder using a detubularized intestinal segment. Hinyokika Kiyo. 1995; 41 (11): 441–541.
-
Pfister C., Chautard D., Devonec M. et al. Immunocyt test improves the diagnostic accuracy of urinary cytology: results of a French multicenter study. J. Urol. 2003; 169: 921.
-
Piper J.M., Tonascia J., Matanoski G.M. Heavy phenacetin use and bladder cancer in women aged 20 to 49 years. N. Engl. J. Med. 1985; 313: 292.
-
Pollack A., Zagars G.Z. Radiotherapy for stage T3b transitional cell carcinoma of the bladder. Semin. Urol. Oncol. 1996; 14: 86.
-
Prescott S., Jackson A.M., Hawkyard S.J. et al. Mechanisms of action of intravesical bacille Calmette – Guerin: local immune mechanisms. Clin. Infect. Dis. 2000; 31 (Suppl. 3) : 91.
-
Saxman S., Propert K., Einhorn L. et al. Long-term follow-up of a phase III intergroup study of cisplatin alone or in combination with methotrexate, vinblastine and doxorubicin in patients with metastaic urothelial cancer: A Cooperative Group Study. J. Clin. Oncol. 1997; 15: 2564.
-
Schatte E., Grunenfelder J., Fradet Y., Miles B.J. Epidemiology of bladder cancer. In: Comprehensive Textbook of Genitourinary Oncology. N.J. Vogelzang, P.T. Scardino, W.U. Shipley, D.S. Coffey (eds.). Lippincott, Williams, and Wilkins, Philadelphia, 2000. P. 283.
-
Sella A., Dexeus F.H., Chong C. et al. Radiation therapy associated invasive bladder tumors. Urology. 1989; 33: 185.
-
Shelley M.D., Court J.B., Kynaston H. et al. Intravesical bacillus Calmette – Guerin in Ta and T1 bladder cancer. Cochrane Database of Systematic Reviews. 2000. CD001986.
-
Skinner D.G., Daniels J.R., Russell C.A. et al. The role of adjuvant chemotherapy following cystectomy for invasive bladder cancer: A prospective comparative trial. J. Urol. 1991; 145: 459.
-
Solsona E., Iborra I., Ricos J.V. et al. Effectiveness of a single immediate mitomycin C instillation in patients with low risk superficial bladder cancer: short and long-term follow-up. J. Urol. 1999; 161: 1120.
-
Splinter T.A., Scher H.I., Denis L. et al. The prognostic value of the pathological response to combination chemotherapy before cystectomy in patients with invasive bladder cancer. European Organization for Research on Treatment of Cancer-Genitourinary Group. J. Urol. 1992; 147: 606.
-
Stadler W. Molecular events in the initiation and progression of bladder cancer. Int. J. Oncol. 1993; 3: 549.
-
Stein J.P., Lieskovsky G., Cote R. et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. J. Clin. Oncol. 2001; 19: 666.
-
Stockle M., Meyenburg W., Wellek S. et al. Advanced bladder cancer (stages pT3b, pT4a, pN1 and pN2): improved survival after radical cystectomy and 3 adjuvant cycles of chemotherapy. Results of a controlled prospective study. J. Urol. 1992; 148: 302.
-
Studer U., Bacchi M., Biederman C. et al. Adjuvant cisplatin chemotherapy following cystectomy for bladder cancer. Results of a prospective randomized trial. J. Urol. 1994; 152: 81.
-
Talar-Williams C., Hijazi Y.M., Walther M.M. et al. Cyclophosphamide induced cystitis and bladder cancer in patients with Wegener granulomatosis. Ann. Intern. Med. 1996; 124: 477.
-
Tekes A., Kamel I., Imam K. et al. Dynamic MRI of bladder cancer: evaluation of staging accuracy. AJR. 2005; 184: 121–127.
-
Travis L.B., Curtis R.E., Glimelius B. et al. Bladder and kidney cancer following cyclophosphamide therapy for non-Hodgkin’s lymphoma. J. Natl. Cancer. Inst. 1995; 87: 524.
-
U. S. Preventive Services Task Force. Screening for Bladder Cancer in Adults: Recommendation Statement. June 2004. Agency for Healthcare Research and Quality. Rockville, MD, 2004.
-
Vale C. Neoadjuvant chemotherapy in invasive bladder cancer: a systematic review and metaanalysis. Lancet. 2003; 361: 1927.
-
von der Maase H., Hansen S.W., Robeerts J.T. et al. Gemcitabine and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advanced or metastatic bladder cancer: results of a large, randomized, multinational, multi-center, phase III study. J. Clin. Oncol. 2000; 18: 3068.
-
Wright W. Geographical distribution of schistosomes and their intermediate hosts. In: Epidemiology and control of schistosomiasis (bilharziasis). N. Ansari (ed.). Karger S., Basel, 1973. P. 32.
-
Yaman O., Baltaci S., Arikan N. et al. Staging with computed tomography, transrectal ultrasonography and transurethral resection of bladder tumour: comparison with final pathological stage in invasive bladder carcinoma. Br. J. Urol. 1996; 78 (2): 197–200.
Глава 11. РАК ПОЛОВОГО ЧЛЕНА
А.В. Говоров, С.В. Смирнова, Н.В. Воробьев, П.В. Шегай
Рак полового члена (РПЧ) — относительно редкое заболевание, частота возникновения от 0,1 до 7,9 случая на 100 000 мужчин. Заболеваемость им существенно различается в разных географических регионах. В Европе заболеваемость составляет 0,1–0,9 случая на 100 000 мужского населения, в США — 0,7–0,9. В некоторых странах Азии, Африки и Южной Америки заболеваемость достигает 19 на 100 000 мужчин, в этих регионах рак полового члена составляет 10–20% всех онкологических заболеваний у мужчин. В то же время в странах с мусульманским вероисповеданием РПЧ встречается крайне редко. Средний возраст пациентов составляет 55–58 лет, однако данное заболевание встречается и у молодых мужчин (30–40 лет) [2, 22, 30, 38]. В России в 2014 г. рак полового члена диагностирован у 554 больных, стандартизованный показатель заболеваемости равен 0,82 на 100 000 мужского населения. Среднегодовой прирост заболеваемости составил 1,86%, прирост заболеваемости в период с 2004 по 2014 г. — 20,78%. [39].
Первичная опухоль чаще всего локализуется на головке полового члена — 85%, крайней плоти — 15%, одновременно на головке и крайней плоти — 9%, в области венечной борозды — 6%, на теле полового члена — менее чем 2%. Увеличенные лимфатические узлы пальпируются у 58% больных (20–96%). Из этих пациентов у 17–45% определяется метастатическое поражение регионарных лимфатических узлов, в то время как у остальных больных увеличение лимфатических узлов связано с присоединением вторичной инфекции. В то же время почти у 20% больных имеются микрометастазы в паховых лимфатических узлах без явных признаков их увеличения. Наличие метастазов определяется такими факторами, как глубина инвазии, уровень дифференцировки опухоли, инвазия в лимфатические или кровеносные сосуды, вовлечение в процесс пещеристых тел, а также факторами роста или совокупностью данных факторов [7, 22, 24, 30, 34, 37].
Чаще всего РПЧ метастазирует по лимфатическим путям посредством фиксации раковых эмболов в регионарных лимфатических узлах. Отдаленные метастазы возникают крайне редко и являются результатом гематогенной диссеминации. Метастазирование, как правило, происходит ступенчато: сначала появляются метастазы в паховых лимфатических узлах, затем — во внутритазовых (подвздошно-обтураторная зона). Дистанционные метастазы появляются на заключительном этапе заболевания. Таким образом, поражение внутритазовых лимфатических узлов и отдаленные метастазы без признаков метастатического поражения паховых лимфатических узлов встречаются крайне редко [32].
При РПЧ 5-летняя выживаемость в среднем составляет 91%. Она колеблется от 94% у больных без поражения регионарных лимфатических узлов до 80% с метастазами в паховые лимфатические узлы. При наличии метастазов во внутритазовых лимфатических узлах 5-летняя выживаемость составляет 0–38,4% [37]. Летальный исход при РПЧ чаще возникает в результате развития всевозможных осложнений, таких как присоединение вторичной инфекции, кровотечение из эрозированной поверхности опухоли либо из изъязвленных метастазов [28, 33].
Этиология и патогенез
в настоящее время не выявлено какой-либо одной достоверной причины, приводящей к развитию РПЧ. Считают, что такие факторы, как фимоз, лечение псориаза у мужчин с использованием препарата споралена и фотохимиотерапия с использованием ультрафиолетового излучения (спектр А), хроническое раздражение из-за плохой гигиены полового члена, вызывают скопление смегмы в препуциальном мешке и часто сочетаются с раком полового члена. Смегма состоит из специфической бактериальной флоры (Mycobacterium smegmatis), свободного холестерина, жирных кислот, сложных липидов (холестериновые эфиры, нейтральные жиры, фосфатидилхолин), слущенного эпителия головки полового члена и внутреннего листка крайней плоти. Mycobacterium smegmatis ассимилируют холестерин, входящий в состав смегмы, и превращают его в стерины, являющиеся канцерогенами [38]. В то же время иссечение крайней плоти (обрезание) — обязательный обряд в некоторых странах с мусульманским и иудаистским вероисповеданием предохраняет от возникновения данного заболевания.
Отмечена взаимосвязь персистенции вируса папилломы человека типов 16 и 18 с развитием рака полового члена: инвазивный рак полового члена, а также бородавчатого и базального вариантов рака полового члена сочетается с наличием вируса в 40–50% случаев; сочетание карциномы in situ, плоских и остроконечных кондилом с персистенцией данных вирусов составляет 70–100% [2, 12, 30, 34, 38].
Профилактика
Основные мероприятия по профилактике развития рака полового члена:
Скрининг
Ежегодные диспансерные осмотры взрослого населения мужского пола с участием врача-уролога.
Классификация
Основная гистологическая форма рака полового члена — плоскоклеточный рак, который составляет 95% всех новообразований полового члена. Значительно реже встречаются злокачественная меланома и базально-клеточный рак. Мезенхимальные опухоли (саркома Капоши, ангиосаркома, эпителиоидная гемангиоэндотелиома) встречаются очень редко — менее 3% [30, 34, 38].
Предопухолевые заболевания полового члена можно разделить на факультативные (с низким риском развития РПЧ) и облигатные (с высоким риском развития РПЧ). К факультативным предопухолевым заболеваниям относятся кожный рог и боуэноидный папулез полового члена, а так-же склеротический лихен (BXO — balanitis xerotica obliterans). Облигатными заболеваниями считаются интраэпителиальная неоплазия полового члена (carcinoma in situ) — эритроплазия Квейра, болезнь Боуэна [29, 38].
Классификация TNM
[38]
Т — первичная опухоль
-
Та — неинвазивная бородавчатая карцинома без деструктивного инвазивного роста.
-
Т1 — опухоль распространяется на субэпителиальную соединительную ткань.
-
Т1а — опухоль врастает в субэпителиальную соединительную ткань без лимфоваскулярной инвазии и не является низкодифференцированной или недифференцированной (T1G1–2).
-
Т1b — опухоль врастает в субэпителиальную соединительную ткань без лимфоваскулярной инвазии или является низкодифференцированной, или недифференцированной (T1G3–4).
-
-
Т2 — опухоль распространяется на губчатое или пещеристое тело.
-
Т4 — опухоль распространяется на другие окружающие структуры.
N — регионарные лимфатические узлы (поверхностные и глубокие паховые и тазовые лимфатические узлы)
-
Nх — недостаточно данных для оценки состояния регионарных лимфатических узлов.
-
N0 — нет пальпируемых или визуально увеличенных паховых лимфатических узлов.
-
N1 — имеется пальпируемый подвижный паховый лимфатический узел с одной стороны.
-
N2 — имеются множественные или двусторонние подвижные паховые лимфатические узлы.
-
N3 — неподвижный конгломерат паховых лимфатических узлов или метастазы в лимфатический узел (узлы) таза с одной или с обеих сторон.
М — отдаленные метастазы
G — гистологическая градация (уровень дифференцировки клеток опухоли)
Клиническая картина
поскольку опухоль развивается на наружных половых органах, диагностика не вызывает особых трудностей. У больных без врожденного сужения препуциального мешка в начальном периоде болезни превалируют жалобы на появление на головке полового члена или внутренней поверхности крайней плоти патологических образований: эрозий, язвочек, папиллом, узелков, трещин или уплотнений бледного, или красноватого цвета. Появившиеся образования могут быть покрыты сероватым налетом, коркой, выделять серозную жидкость. Мужчины с врожденным фимозом как первое проявление болезни отмечают гнойные выделения из закрытого препуциального мешка, прощупываемое внутри его уплотнение. Особенностью РПЧ является то, что опухолевый процесс практически во всех случаях сопровождает воспаление, начиная с ранних стадий рака.
Патологическое образование может быть безболезненным. При этом, даже несмотря на наличие плотного, заметного на глаз образования, больные редко обращаются к врачу. Настораживают мужчин симптомы, возникающие при дальнейшем росте РПЧ. При прорастании опухолью мочеиспускательного канала или пещеристых тел возникают расстройство мочеиспускания, приапизм. Больные предъявляют жалобы на напряженное мочеиспускание, слабость или узость струи, ее разбрызгивание, зуд, жжение, неприятные ощущения во время мочеиспускания, длительную эрекцию.
Общее состояние пациентов долгое время остается вполне удовлетворительным. При распаде опухоли заметно усиливается параканкрозное воспаление, которое усугубляет течение болезни. При этом обращают на себя внимание обильные серозно-гнойные выделения из препуциального мешка с неприятным запахом, изъязвление крайней плоти с образованием свищевых ходов. Встречаются также перфорации препуциального мешка с разрастающимися опухолевыми тканями. Пациенты обращаются также к врачу с жалобами на увеличение паховых лимфатических узлов, их болезненность, слияние в конгломерат с развитием некроза и появлением свищевых ходов с зловонным некротическим отделяемым.
Кахексия возникает лишь на самых поздних стадиях РПЧ, когда распаду подвергается не только первичный опухолевый очаг, но и регионарные метастазы.
Диагностика
В целях детальной диагностики РПЧ важно принимать во внимание особенности первичного очага опухоли, регионарных и отдаленных метастазов.
Первичный очаг
Пациенты с любыми изменениями покровного эпителия полового члена должны пройти тщательное физикальное обследование. Этого часто бывает достаточно для того, чтобы не только поставить диагноз, но и провести дифференциальную диагностику по стадии и определить первоначальный план лечения. При первичном осмотре необходимо определить:
Цель данных исследований — не только установление патоморфологического диагноза, но и определение уровня дифференцировки опухолевых клеток, что чрезвычайно важно для выбора лечебной тактики. Можно использовать различные методы биопсии — инцизионную, щипковую, игольчатую аспирацию, взятие мазков-отпечатков. Эксцизионная биопсия (удаление всего очага) также может быть использована для взятия материала при его небольших размерах и расположении на визуализируемых досягаемых участках [26, 27].
УЗИ, а также МРТ могут быть полезны для определения уровня опухолевой инвазии, особенно в случае инфильтрации кавернозных тел. При диагностике микроскопической инвазии кавернозных тел результаты УЗИ следует интерпретировать осторожно.
Регионарные лимфатические узлы
Обязательна пальпация паховых лимфатических узлов, которая может дать следующие результаты.
Непальпируемые лимфатические узлы. Нет ориентиров для гистологического исследования или методик визуализации (УЗИ, МРТ), если лимфатические узлы не увеличены и не пальпируются. Если в первичной опухоли прогностические факторы были плохие (низкий уровень дифференцировки, глубокая инвазия опухоли), рекомендуют провести инцизионную биопсию паховых лимфатических узлов с помощью лимфосцинтиграфии. Для этого в область первичного поражения вводят раствор красителя (метиленового синего) и через 20–24 ч удаляют лимфатические узлы, накопившие краситель, с их гистологическим исследованием. Можно также использовать радиоизотопную лимфосцинтиграфию. В данной ситуации применяют коллоидный раствор препарата, меченного изотопом 99mТс. Лимфатические узлы, накопившие радиофармпрепарат, обнаруживают с помощью счетчика γ-квантов. Последний метод диагностики предпочтительнее, так как показал 100% специфичность при чувствительности 78–80% [1, 18, 23, 35].
Пальпируемые лимфатические узлы. При наличии пальпируемых лимфатических узлов необходимо определить:
Как правило, у больных с пальпируемыми паховыми узлами в 50% случаев выявляют реактивно измененные лимфатические узлы. При динамическом наблюдении за больным после проведенного лечения все появившиеся увеличенные паховые лимфатические узлы являются метастатическими. Таким образом, наблюдение за регионарными лимфатическими узлами необходимо продолжать еще несколько недель после окончания лечения первичной опухоли с тем, чтобы прошел период, необходимый для регрессии воспалительного процесса [10, 21, 25].
Для морфологического исследования регионарных лимфатических узлов следует выполнить игольчатую аспирационную или открытую инцизионную биопсию. В случае отрицательного результата при наличии клинически подозрительных лимфатических узлов показана повторная биопсия. Для получения более точного результата биопсии следует применять лучевые методы визуализации (УЗИ, КТ, МРТ) [3, 18].
Отдаленные метастазы
Диагностику отдаленных метастазов необходимо проводить у тех больных, у которых доказано их наличие. КТ органов таза и брюшной полости выполняют для определения состояния внутритазовых и забрюшинных лимфатических узлов у больных с наличием паховых метастазов. Рентгенографию грудной клетки также необходимо выполнить у пациентов с наличием метастазов в паховых лимфатических узлах. Сцинтиграфия скелета показана только при наличии соответствующих симптомов (боль в костях, спонтанные переломы). Также целесообразно проведение оценки уровня антигена плоскоклеточного рака (SCCантиген) как до лечения, так и в процессе лечения и динамического наблюдения [24, 25, 30].
Алгоритм диагностики
Алгоритм диагностики РПЧ представлен в табл. 11.1 [38].
| Обязательные методы исследования | Рекомендуемые методы исследования | Дополнительные методы исследования | |
|---|---|---|---|
Первичная опухоль |
Физикальное обследование, биопсия с цитологической или гистологической верификацией. SCC-опухолевый маркер |
УЗИ (при подозрении на инвазию пещеристого тела) |
МРТ (при неэффективности УЗИ) |
Обязательные методы исследования |
Рекомендуемые методы исследования |
Дополнительные методы исследования |
|
Регионарные метастазы |
|||
Пальпируемые |
Физикальное обследование, биопсия с цитологической или гистологической верификацией |
Биопсия сторожевых лимфатических узлов |
|
Непальпируемые |
Радиоизотопная лимфосцинтиграфия. КТ органов малого таза |
||
Отдаленные метастазы |
КТ малого таза (при наличии паховых метастазов). |
||
Лечение
Интраэпителиальная неоплазия полового члена (Tis)
Выбор того или иного воздействия зависит от предпочтений самого хирурга и больного, размеров очага, глубины инвазии и наличия необходимого оборудования.
Опухоли Та–Т1а (G1–2)
Больным, за которыми после лечения проводят регулярное наблюдение, показаны органосохраняющие методики лечения. К ним относятся лазерная деструкция опухоли, локальная эксцизия с реконструктивной операцией, дистанционная лучевая или брахитерапия, ампутация головки полового члена. При частичной ампутации необходимо отступить не менее чем на 2 см от края опухоли; размер, на который нужно отступить, может варьировать в зависимости от уровня дифференцировки опухоли. Так, при G1 10 мм резерва будет вполне достаточно, а при G3 — только не менее 15 мм резерва сможет гарантировать отсутствие опухоли по краю резекции.
При использовании лучевой или лазеротерапии вероятность излечения с органосохраняющим эффектом составляет 55–84%. Вероятность возникновения локального рецидива при использовании дистанционной лучевой, брахитерапии и лазерного воздействия составляет 15–25%. При применении традиционной хирургии вероятность локальных рецидивов составляет 11–50%. Гистологический контроль за состоянием краев резекции позволяет снизить этот показатель до 9–24%. Регулярное дальнейшее наблюдение строго обязательно, так как очень важно своевременно диагностировать локальный рецидив РПЧ и начать его лечение. Как правило, локальные рецидивы при их своевременной диагностике и лечении не ухудшают показатели 5-летней выживаемости.
Лечение опухолей Т1G3, Т ≥ 2
Стандартный метод лечения — частичная или полная ампутация полового члена или эмаскуляция в зависимости от объема поражения.
Лечение опухолей Т3–4
При категории Т3 стандартным хирургическим лечением является полная ампутация полового члена с промежностной уретростомией. Пациентам с категорией Т4 показано проведение неоадъювантной химиотерапии с последующим хирургическим вмешательством в случае ее эффективности, а также возможности выполнения самого оперативного вмешательства.
Локальный рецидив
Если после проведения органосохраняющего лечения развивается локальный рецидив, проведение повторного органосохраняющего лечения возможно только при исключении опухолевой инвазии кавернозных тел. При наличии глубокой опухолевой инвазии (инвазия кавернозного тела и глубже) или большого опухолевого очага показана частичная либо полная ампутация полового члена. Основные факторы при выборе органосохраняющей тактики лечения рака полового члена на начальной стадии — простота, удобство выполнения, личный опыт хирурга, а также наличие необходимой аппаратуры [31].
Лучевая терапия
Может быть использована как самостоятельный метод лечения на начальных стадиях заболевания и как компонент комбинированного метода лечения.
У больных с поражением кожи без инфильтрации пещеристых тел либо без их глубокой инвазии шансы на стойкое излечение весьма велики. В таких случаях осуществляют только наружное облучение либо прибегают к сочетанной лучевой терапии и начинают с наружного облучения. Мишень включает зону поражения плюс 2–3 см на неизмененную кожу. Предпочтительнее облучение электронами, но возможно при отсутствии таковых использовать дистанционную гамма-терапию. Ежедневная доза должна составлять не более 2–3 Гр во избежание ранних реакций со стороны окружающих нормальных тканей. Суммарную дозу доводят до 60 Гр. При поражении кожи полового члена в большинстве случаев, как и при раке кожи другой локализации, достигается излечение.
При инфильтрации пещеристого тела или наличии остаточной опухоли прибегают затем к контактному аппликационному облучению. Для этого изготавляют специальные маски. Суммарная доза — 30 Гр. Если изначально известно об инфильтрации пещеристых тел и планируется сочетанная лучевая терапия, суммарную дозу от наружного облучения снижают до 50 Гр и затем контактно подводят не менее 30 Гр. При небольших остаточных опухолях кожи полового члена после подведения 60 Гр лучше всего завершить лечение фотодинамическим воздействием.
У больных с большими поражениями и глубокой инфильтрацией пещеристых тел к предоперационному дистанционному облучению в дозе 40–50 Гр прибегают только в случае сомнений в радикализме ампутации полового члена, например при распространении опухоли на основание полового члена.
При отсутствии клинических данных об опухолевом поражении паховых лимфатических узлов и самостоятельном лучевом лечении паховые лимфатические узлы подвергают облучению с отдельных полей при использовании электронных пучков либо включают в единое поле с первичным очагом при дистанционной гамма-терапии. Поскольку наличие микрометастазов в регионарных узлах вероятно, к ним подводят дозу не менее 60 Гр. Такая тактика оправданна, если излеченный больной может находиться под строгим динамическим наблюдением, поскольку микрометастазы нередко развиваются и после подведения указанной дозы. В противном случае выполняют превентивную пахово-бедренную лимфаденэктомию.
При наличии регионарных метастазов более стойкого лечения удается добиться при использовании комбинированного воздействия: предоперационного облучения с последующей лимфаденэктомией, которую по показаниям расширяют до подвздошно-пахово-бедренной. В этих случаях подводят СОД 40 Гр, поскольку при эскалации дозы развиваются выраженные лучевые реакции кожи паховых зон, что неоправданно отодвигает выполнение основного этапа комбинированного лечения — операции.
Развитие отдаленных осложнений (рубцевание, некроз кожи) встречается нередко. Использование отдельной методики позволяет достичь лучших результатов по сравнению с комбинацией дистанционной лучевой и брахитерапии [5, 19, 36]. Наиболее частыми осложнениями данного метода являются рубцевание (15–30%), стриктуры уретры (20– 35%), телеангиэктазии (более 90%), а также поздние лучевые изменения в виде некрозов, которые зачастую бывает сложно дифференцировать от рецидива опухоли [5, 19, 36]
Регионарные лимфатические узлы
При РПЧ успех в лечении, а также прогноз зависят от состояния лимфатических узлов. Радикальная лимфаденэктомия — стандартное лечение больных с метастазами в лимфатические узлы [22]. При этой операции границы резекции, следующие: паховая связка, приводящая мышца, портняжная мышца, а также бедренная вена и артерия. Однако ее выполнение сопряжено с высоким риском развития осложнений, вплоть до смертельного исхода (30–50%), даже при использовании современных методик вмешательства. При лимфаденэктомии рекомендуют закрывать бедренные сосуды влажными салфетками во избежание некроза их стенки. На бедренную артерию нужно положить салфетку, смоченную 0,25% раствором прокаина, во избежание спазма артерии и развития аортального тромбоза. Лучше использовать негрубые ретракторы для кожи во избежание ее некроза. После выполнения лимфаденэктомии сосудисто-нервный пучок удобнее закрывать портняжной мышцей. Как до, так и после операции показано назначение антикоагулянтной терапии.
Непальпируемые лимфатические узлы
-
Низкий риск развития регионарных метастазов. К данной группе относят больных с характеристикой первичного очага pTis, pTaG1– G2, pT1G1. Вероятность возникновения метастазов у этих больных составляет менее 16,5%. Больным данной группы, у которых невозможно проводить динамическое наблюдение в силу различных обстоятельств, показана паховая лимфаденэктомия.
-
Средний риск развития регионарных метастазов. К данной группе относят больных с характеристикой первичного очага pТ1G2. Риск наличия регионарных метастазов в данной группе достигает 30%. У больных без признаков сосудистой или лимфатической инвазии опухоли по данным гистологического исследования первичного очага рекомендуют тщательное обследование. При инвазии опухоли в лимфатические или кровеносные сосуды показана паховая лимфаденэктомия. Если возможно дальнейшее динамическое обследование, больным данной группы можно выполнить биопсию лимфатических узлов под контролем радиоизотопной лимфосцинтиграфии с 99mТс. При отсутствии признаков метастазирования по данным биопсии рекомендуют выжидательную тактику в отношении лимфаденэктомии под контролем обязательного динамического наблюдения.
-
Высокий риск регионарного метастазирования. В эту группу входят больные с характеристиками опухолевого очага рТ ≥2 или рТ1G3. Риск определения метастазов в лимфатических узлах составляет 68–73%. В данном случае обязательно выполнение радикальной паховой лимфаденэктомии, которая может быть расширена до тазовой (может быть выполнена лапароскопическая тазовая лимфаденэктомия) при наличии метастазов в лимфатических узлах при плановом гистологическом исследовании. Границы тазовой лимфаденэктомии: сверху — бифуркация подвздошных сосудов, медиально — обтураторный нерв, латерально — подвздошнопаховый нерв.
Пальпируемые лимфатические узлы
При определении позитивных лимфатических узлов (по данным биопсии) обязательно выполнение пахово-бедренной лимфаденэктомии. Выполнение отсроченной или одновременной тазовой лимфаденэктомии показано при обнаружении двух метастазов и более в паховых лимфатических узлах или инвазии опухоли за пределы капсулы лимфатического узла. В данной ситуации вероятность наличия метастазов в тазовых лимфатических узлах повышается до 30%. Так, при наличии 2–3 метастазов в паховых лимфатических узлах вероятность тазового метастазирования составляет 23%, при наличии более трех пораженных паховых лимфатических узлов — 56%. В данном случае вероятность излечения снижается до 14–54% [32].
С контралатеральной стороны при отсутствии пальпируемых лимфатических узлов лимфаденэктомию следует выполнять изначально, и она может быть расширена до тазовой при обнаружении метастазов в паховых лимфатических узлах при плановом гистологическом исследовании.
Фиксированные паховые конгломераты или позитивные тазовые лимфатические узлы (по данным КТ и МРТ)
При наличии объемных образований в паховых областях (метастазы) или увеличенных лимфатических узлах таза (по данным КТ и МРТ) показана адъювантная химиотерапия, которая может привести к частичной или полной регрессии опухоли в 21–60% случаев [13]. Паллиативная пахово-подвздошно-обтураторная лимфаденэктомия — обязательный метод лечения. Другим вариантом лечения в данной ситуации является предоперационная лучевая терапия с последующей лимфаденэктомией. Однако необходимо учитывать статистически достоверное повышение смертности больных от лимфаденэктомии после лучевой терапии [36].
Появление пальпируемых лимфатических узлов в период динамического наблюдения
Если при очередном обследовании у больного выявляют увеличенные паховые лимфатические узлы, это свидетельствует об их метастатическом поражении практически в 100% случаев. В данной ситуации показаны следующие методы лечения [4].
-
Двусторонняя радикальная лимфаденэктомия по описанным выше критериям.
-
Паховая лимфаденэктомия на стороне позитивных лимфатических узлов при наличии длительной ремиссии. Метастазирование в паховые области происходит синхронно с двух сторон или с небольшим интервалом. Таким образом, если в процессе длительного наблюдения за пациентом у него появляются метастазы в паховых лимфатических узлах с одной стороны, то вероятность их развития с контралатеральной стороны по истечении значительного времени ничтожно мала — 10% [4]. В данном случае может быть рекомендована унилатеральная лимфаденэктомия с последующим тщательным наблюдением. Однако при наличии метастазов более чем в одном лимфатическом узле с одной стороны вероятность возникновения микрометастазов с контралатеральной стороны увеличивается до 30% [4, 10]. В данной ситуации показана билатеральная лимфаденэктомия.
Адъювантная терапия
Показана при поражении двух лимфатических узлов и более либо при инвазии опухоли за пределы капсулы лимфатического узла, так как у данной группы больных прогноз значительно ухудшается по сравнению с больными, у которых определяется метастатическое поражение только одного лимфатического узла. Результаты II фазы рандомизированных исследований, проводимых в настоящее время в США и посвященных данной проблеме, говорят в пользу назначения адъювантной химиотерапии [11, 14].
Комбинированная терапия
Включает химиолучевое воздействие и хирургическое вмешательство. Пациентам с первично диагностированным РПЧ с наличием метастатического поражения тазовых лимфатических узлов показана неоадъювантная химиотерапия. Радикальную или паллиативную операцию либо лучевую терапию проводят с учетом ответа опухоли на химиотерапию. При плохом ответе на химиотерапию паллиативное оперативное лечение может быть применено у выборочной группы больных (соматически сохранные, с большой ожидаемой продолжительностью жизни).
Химиотерапия
Используют как в различных сочетаниях с другими методами, так и в качестве самостоятельного метода лечения, особенно при наличии отдаленных метастазов. Так, химиотерапию комбинируют с лучевым методом при фимозе (после циркумцизии). Ее также сочетают с лучевым лечением и криодеструкцией или лазерным воздействием [11, 13].
Адъювантная химиотерапия. Наиболее целесообразны следующие режимы адъювантной химиотерапии.
-
Цисплатин 75–100 мг/м2, внутривенная инфузия со скоростью не более 1 мг/мин с преди постгидратацией в 1-й день.
-
Фторурацил 750–1000 мг/м2 в день внутривенно в виде непрерывной 96-часовой инфузии (с 1-го по 4-й день включительно).
-
Цисплатин 75 мг/м2, внутривенная инфузия со скоростью не более 1 мг/мин с преди постгидратацией в 1-й день.
-
Блеомицин 10 мг/м2 внутривенно в течение 10 мин в 1-й и 8-й день.
Неоадъювантную химиотерапию назначают по тем же схемам, что и адъювантную.
Самостоятельную химиотерапию при наличии отдаленных метастазов проводят комбинацией цисплатина с 5-фторурацилом либо используют стандартные схемы воздействия.
Лучевая терапия
Проводят как в самостоятельном варианте, так и в комбинации с другими методами лечения. При комбинации лучевой терапии с оперативным методом облучению подвергают первичный опухолевый очаг, а также зоны пахово-бедренных лимфатических узлов. При отсутствии клинических данных об опухолевом поражении паховых лимфатических узлов и самостоятельном лучевом лечении паховые лимфатические узлы подвергают облучению с отдельных полей при использовании электронных пучков либо включают в единое поле с первичным очагом при дистанционной гамма-терапии.
Алгоритм терапии рака полового члена
Общий алгоритм терапии РПЧ (табл. 11.2) может быть представлен следующим образом.
-
-
Стадия Та — 1G1–2 — органосохраняющая тактика. У больных при невозможности проведения динамического наблюдения показана частичная ампутацияВ [8, 22].
-
Стадия Т1G3, Т ≥2 — частичная или тотальная ампутация либо эмаскуляция в зависимости от локализации и размеров опухоли. Консервативная терапия возможна только у ограниченной выборочной группы больных с обязательным динамическим наблюдением [8].
-
Локальный рецидив при консервативной терапии — повторный курс консервативной терапии при отсутствии инвазии опухоли в кавернозные телаВ. При большом рецидиве и наличии инвазии кавернозных тел показана частичная или полная ампутация полового члена [17].
-
Непальпируемые лимфатические узлы:
-
Низкий риск регионарного метастазирования (рТis, рТаG1–G2, рТ1G1) — динамическое наблюдение. Для больных, у которых невозможно провести плановое обследование через фиксированный промежуток времени, показана паховая лимфаденэктомия [4, 22].
-
Средний риск регионарного метастазирования (pТ1G2) — при возможности показана радиоизотопная лимфосцинтиграфия с 99mТс с последующей биопсией лимфатических узлов, накопивших радиофармпрепарат. При обнаружении метастатического поражения лимфатических узлов показано их удаление. При невозможности выполнить радиоизотопную лимфосцинтиграфию показана паховая лимфаденэктомия. Отказ от паховой лимфаденэктомии возможен только у строго отобранной группы больных с обязательным тщательным динамическим наблюдением. Паховую лимфаденэктомию необходимо дополнить тазовой при наличии двух метастазов и более в паховых лимфатических узлах или экстракапсулярной инвазии [22, 32].
-
Высокий риск регионарного метастазирования (рТ ≥2 или G3) — радикальная паховая лимфаденэктомия, которая может быть дополнена тазовой при соответствующих гистологических находках.
-
-
Метастатическое поражение пальпируемых лимфатических узлов:
-
Показана радикальная паховая лимфаденэктомия, которая может быть расширена до тазовой при соответствующих гистологических находках. Больным с массивными паховыми конгломератами или с увеличенными тазовыми лимфатическими узлами (по данным КТ и МРТ) показана предоперационная химиоили лучевая терапия. Однако неоадъювантная лучевая терапия статистически достоверно повышает смертность пациентов при последующей лимфаденэктомии. В случае появления лимфатических узлов в процессе динамического наблюдения показано выполнение паховой лимфаденэктомии с возможностью расширения до тазовой при соответствующих гистологических находках [22].
-
| Уровень распространения опухоли | Лечение | Обязательные | Оптимальные |
|---|---|---|---|
Первичная опухоль |
Консервативная терапия |
Первичная или рецидивная Tis, Ta–1G1–2 |
T1G3, Т2, поражающие менее 50% головки |
Тотальная или частичная ампутация |
Первичная или рецидивная T1G3, T >2 |
Первичная или рецидивная Ta–1G1–2 (консервативная терапия невозможна) |
|
Лучевая терапия |
Т1–2 <4 см |
||
Непальпируемые регионарные лимфатические узлы |
Наблюдение |
Tis, TaG1–2, Т1G1, Т1G2, поверхностный рост или сосудистый либо отрицательная динамика биопсии сторожевого узла |
ТЗ, Т2 (при возможности диспансерного наблюдения) |
Модифицированная лимфаденэктомия |
Т1G2 узловой рост или сосудистый либо отрицательная динамика биопсии сторожевого узла, ТЮЗ или любая Т2 |
Т1G2, сосудистый поверхностный рост или отрицательная динамика биопсии сторожевого узла (при невозможности динамического наблюдения) |
|
Пальпируемые регионарные лимфатические узлы |
Радикальная лимфаденэктомия |
Положительные узлы при обращении |
+ Адъювантная химиотерапия или лучевая терапия (более одного положительного узла) |
Положительные узлы после наблюдения |
+ Односторонняя лимфаденэктомия на стороне положительного узла |
||
Химиотерапия +/лимфаденэктомия |
Фиксированные паховые конгломераты. Тазовые узлы |
||
Лучевая терапия +/лимфаденэктомия |
Фиксированные конгломераты (при невозможности проводить химиотерапию) |
||
Отдаленные метастазы |
Химиотерапия или паллиативная терапия (соответственно состоянию и возрасту пациента) |
Дальнейшее ведение
при дальнейшем наблюдении за больным раком полового члена рекомендуют придерживаться следующих алгоритмов (табл. 11.3).
Уровень распространения опухоли |
Лечение |
Интервал |
Обследование |
|||
1–2й год |
3-й год |
4–5й год |
Обязательное |
Дополнительное |
||
Первичная опухоль |
Органосохраняющее лечение |
Каждые 3 мес |
Каждые 6 мес |
Каждые 6 мес |
Физикальное |
Цитология или биопсия в неясных случаях |
Частичная или тотальная пенилэктомия |
Каждые 3 мес |
Каждые 12 мес |
Каждые 12 мес |
Физикальное |
||
Регионарные метастазы |
Наблюдение |
Каждые 3 мес |
Каждые 6 мес |
Каждые 6 мес |
Физикальное |
Цитология или биопсия в неясных случаях |
Лимфаденэктомия |
Каждые 3 мес |
Каждые 6 мес |
Каждые 12 мес |
Физикальное, УЗИ брюшной полости, таза. Рентгенография грудной клетки |
Остеосцинтиграфия. КТ таза |
|
Первичная опухоль
Пациентов, у которых проведена консервативная терапия, необходимо обследовать каждые 3 мес в течение первых 2 лет, затем каждые 6 мес в течение 5 лет. Больной должен иметь навыки самообследования. Пациентов, которым выполнена частичная либо тотальная ампутация, обследуют каждые 3 мес в течение первых 2 лет, затем каждые 12 мес.
Регионарные лимфатические узлы и отдаленные метастазы
-
После удаления первичного очага при динамическом наблюдении показано регулярное обследование каждые 3 мес в течение первых 2 лет, затем каждые 6 мес в течение последующего года, затем каждые 6 мес в последующие 2 года.
-
После паховой лимфаденэктомии (рN0) показано контрольное обследование каждые 3 мес в течение первых 2 лет, затем каждые 6 мес в течение 1 года. Дальнейшее наблюдение при отсутствии признаков метастазирования можно не проводить.
-
После паховой лимфаденэктомии (рN1–3) показано тщательное обследование (КТ малого таза, МРТ, рентгенография грудной клетки, УЗИ органов брюшной полости, малого таза) каждые 3 мес по меньшей мере в течение 2 лет. Сканирование костей показано только при наличии симптомов поражения костной ткани [4, 10].
Прогноз
Зависит от стадии заболевания. При начальных формах заболевания прогноз вполне благоприятный: можно добиться стойкого излечения практически в 100% случаев. При II–III стадии процесса при комбинированном лечении 5-летняя выживаемость больных достигает 60–70%. При IV стадии выживаемость гораздо ниже. Без лечения больные живут в среднем около 3 лет [22, 30, 32].
ЛИТЕРАТУРА
-
Akduman B., Fleshner N.E., Ehrlich L., Klotz L. Early experience inintermediaterisk penile cancer with sentinel node id entification using the gamma probe // Urology. — 2001. — Vol. 58. — Р. 65–68.
-
Bezerra A.L., Lopes A., Landman G. et al. Clinicopathologic features and human papillomavirus DNAprevalence of warty and squamous cell carcinoma of the penis // Am. J. Surg. Pathol. — 2001. — Vol. 25. — Р. 673–678.
-
Burgers J.K., Badalament R.A., Drago J.R. Penile cancer: clinical presentation, diagnosis and staging // Urol. Clin. North. Am. — 1992. — Vol. 19. — Р. 247–256.
-
Colberg J.W., Andriole G.L., Catalona W.J. Long-term follow-up of men under going modified inguinal lymphadenectomy for carcinoma of the penis // B. J. U. — 1997. — Vol. 79. — Р. 54–57.
-
Crook J., Grimard L., Tsihlias J. et al. Interstitial brachytherapy for penile cancer: an alternative to amputation // J. Urol. — 2002. — Vol. 167. — Р. 506–511.
-
Culkin D.J., Beer T.M. Advanced penile carcinoma // J. Urol. — 2003. — Vol. 170. — Р. 359–365.
-
d’Ancona C.A., de Lucena R.G., Querne F.A., Martins M.H. et al. Long-term follow-up of penile carcinoma treated with penectomy and bilateral modifiedinguinal lymphadenectomy // J. Urol. — 2004. — Vol. 172. — Р. 498–501.
-
Davis J.W., Schellhammer P.F., Schlossberg S.M. Conservative surgicaltherapy for penile and urethral carcinoma // Urology. — 1999. — Vol. 53. — Р. 386–392.
-
Demkow T. The treatment of penile carcinoma: experience in 64 cases // Int. Urol. Nephrol. — 1999. — Vol. 31. — Р. 525–531.
-
Derakshani P., Neubauer S., Braun M. et al. Results and 10-year followupin patients with squamous cell carcinoma of the penis // Urol. Int. — 1999. — Vol. 62. — Р. 238–244.
-
Dexeus F.H., Logothetis C.J., Sella A. et al. Combination chemotherapy with methotrexate, bleomycin and cisplatin for advanced squamous cell carcinoma of the male genital tract // J. Urol. — 1991. — Vol. 146. — Р. 1284–1287.
-
Dillner J., von Krogh G., Horenblas S., Meijer C.J. Etiology of squamous cellcarcinoma of the penis // Scand. J. Urol. Nephrol. — 2000. — Vol. 205 (Suppl.). — Р. 189–193.
-
Eisenberger M.A. Chemotherapy for carcinoma of the penis and urethra // Urol. Clin. North. Am. — 1992. — Vol. 19. — Р. 333–338.
-
Fisher H.A., Barada J.H., Horton J. Neoadjuvant therapy with cisplatin and 5-fluorouracil for stage III squamous cell carcinoma of the penis // Acta Oncol. — 1990. — Vol. 27A. — Р. 653 (abstract 352A).
-
Frimberger D., Hungerhuber E., Zaak D. et al. Penile carcinoma. Is Nd: YAG laser therapy radical enough // J. Urol. — 2002. — Vol. 168. — Р.2418–2421.
-
Horenblas S. Lymphadenectomy for squamous cell carcinoma of the penile. Part 2: the role and technique of lymph node dissection // B.J. U. Int. — 2001. — Vol. 88. — Р. 473–483.
-
Koch M.O., Smith J.A. Jr. Local recurrence of squamous cell carcinoma of the penis // Urol. Clin. North. Am. — 1994. — Vol. 21. — Р. 739–743.
-
Laniado M.E., Lowdell C., Mitchell H., Christmas T.J. Squamous cell carcinomaantigen: a role in the early identification of nodal metastases in men with squamouscell carcinoma of the penis // B.J. U. Int. — 2003. — Vol. 92. — Р.248–250.
-
Mahlmann B., Doehn C., Feyerabend T. Radiochemotherapy of penis carcinoma //Urologie. — 2001. — Vol. 40. — Р. 308–312.
-
Maiche A.G., Pyrhonen S., Karkinen M. Histological grading of squamouscell carcinoma of the penis: a new score system // Br.J. Urol. — 1991. — Vol. 67. — Р.522–526.
-
Montie J.E. Follow-up after penectomy for penile carcinoma // Urol. Clin. North. Am. — 1994. — Vol. 21. — Р. 725–727.
-
Ornellas A.A., Seixas A.L.C., Marota A. et al. Surgical treatment of invasivesquamous cell carcinoma of the penis: retrospective analysis of 350 cases // J. Urol. — 1994. — Vol. 151. — Р. 1244–1249.
-
Pettaway C.A., Pisters L.L., Dinney C.P.N. et al. Sentinel lymph nodedissection for penile carcinoma: the M.D. Anderson Cancer Center Experience // J. Urol. — 1995. — Vol. 154. — Р. 1999–2003.
-
Ravi R. Correlation between the extent of nodal involvement and survival following groin dissection for carcinoma of the penis // Br. J. Urol. — 1993. — Vol. 72. — Р. 817–819.
-
Sarin R., Norman A.R., Steel G.G., Horwich A. Treatment results and prognostic factors in 101 men treated for squamous carcinoma of the penis // Int. J. Radiat. Oncol. Biol. Phys. — 1997. — Vol. 38. — Р. 713–722.
-
Senthil Kumar M.P., Ananthakrishnan N., Prema V. Predicting regional nodemetastasis in carcinoma of the penis: a comparison between fi ne-needle aspiration cytology, sentinel lymph node biopsy and medial inguinal lymph node biopsy // B.J. U. — 1998. — Vol. 81. — Р. 453–457.
-
Skoog I., Collins B.T., Tani E., Ramos R.R. Fine-needle aspiration cytologyof penile tumors // Acta Cytol. — 1998. — Vol. 42. — Р. 1336–1340.
-
Slaton J.W., Morgenstern N., Levy D.A. et al. Tumor stage, vascular invasionand the percentage of poorly diffferentiated cancer: independent prognosticators for inguinal lymph node metastasis in penile squamous cancer // J. Urol. — 2001. — Vol. 165. — Р. 1138–1142.
-
Sobin L.H., Wittekind Ch. TNM Classification of Malignant Tumors. — 6th ed. — New York: Wiley-Liss, 2002.
-
Solsona E., Agaba F., Horenblas S. et al. Guidelines on penile cancer // Recomendations of European Association of Urology. — 2004.
-
Solsona E., Iborra I., Ricуs J.V. et al. Corpus cavernosum invasion and tumorgrade in the prediction of lymph node condition in penile carcinoma // Eur. Urol. — 1992. — Vol. 22. — Р. 115–118.
-
Solsona E., Iborra I., Rubio J. et al. Prospective validation of the association of local tumor stage grade as a predictive factor for occult lymph node micrometastasis in patients with penile carcinoma and clinically negative inguinal lymphnodes // J. Urol. — 2001. — Vol. 165. — Р. 1506–1509.
-
Soria J.C., Fizazi K., Piron D. et al. Squamous cell carcinoma of the penis: multivariate analysis prognostic factors and natural history in monocentric study with a conservative policy // Ann. Oncol. — 1997. — Vol. 8. — Р. 1089–1098.
-
Stancik I., Holtl W. Penile cancer: A review of the recent literature // Curr. Opin. Urol. — 2003. — Vol. 13. — Р. 467–472.
-
Tanis P.J., Lont A.P., Meinhardt W. et al. Dynamic sentinel node biopsy for penile cancer: reliability of a staging technique // J. Urol. — 2002. — Vol. 168. — Р. 76–80.
-
Zouhair A., Coucke P.A., Jeanneret W. et al. Radiation therapy alone or combined surgery and radiation therapy in squamous cell carcinoma of the penis //Eur. J. Cancer. — 2001. — Vol. 37. — Р. 198–203.
-
Guidelines European Association of Urology. — 2008. — P. 58–69.
-
Guidelines European Association of Urology. — 2013. — P. 1–24.
-
Злокачественные новообразования в России в 2014г. (заболеваемость и смертность). Под ред. А.Д.Каприна, В.В.Старинского, Г.В.Петровой. М. 2016г.
Глава 12. ОПУХОЛИ ЯИЧКА И ПАРАТЕСТИКУЛЯРНЫХ ТКАНЕЙ
А.А. Костин, Б.Я. Алексеев, Н.В. Воробьев, П.В. Шегай, К.Б. Колонтарев
Эпидемиология
Опухоли яичка составляют 1–2% злокачественных новообразований у мужчин и являются основной причиной смерти от онкологических заболеваний в возрастной группе 14–44 лет [21, 27, 29]. Увеличение заболеваемости раком яичка было отмечено в 70–80-е годы XX в., особенно в странах Северной Европы. В последние 30 лет отмечают существенные различия в частоте заболеваемости в большинстве промышленно развитых стран в зависимости от географических зон (Северная и Южная Америка, Европа и Океания) [15]. В США в период с 1973 по 1998 г. отмечалось увеличение риска заболеваемости раком яичка [24], при этом в 1–2% случаев наблюдался двусторонний процесс. В гистологической структуре 90–95% составляют герминогенные опухоли [27]. Наибольший риск развития рака яичка — у молодых людей в возрасте 20–30 лет. Отмечена высокая вероятность развития рака яичка у ближайших родственников [24].
В России в 2014 г. рак яичка выявлен у 1470 больных, стандартизован ныи показатель заболеваемости равен 2,17 на 100 000 мужского населения. Среднегодовой прирост заболеваемости составил 1,66%, прирост заболеваемости в период с 2004 по 2014 г. — 18,28% [38].
Факторы риска
Отмечают следующие факторы риска развития рака яичка:
-
травма яичка в анамнезе — отмечают у 20% больных раком яичка;
-
генетическая предрасположенность — высокая вероятность развития рака яичка у ближайших родственников [3];
-
контралатеральная опухоль или интратубулярная (внутрипротоковая) герминогенная опухоль;
-
гормональный дисбаланс — у большинства больных с герминогенными опухолями отмечено снижение концентрации половых гормонов и повышение концентрации гонадотропинов [7, 26].
Профилактика
Профилактические мероприятия не разработаны.
Скрининг
Хотя не было наблюдений, показывающих преимущество скрининговых программ, прогноз прямо связан с ранней диагностикой. Регулярное обследование показано больным с факторами риска в анамнезе [21].
Классификация
ПАТОГИСТОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ (ВОЗ, 1998, С МОДИФИКАЦИЯМИ) [21]
Герминогенные опухоли (развивающиеся из семенного эпителия).
Предраковые изменения — интратубулярные злокачественные герминогенные клетки (carcinoma in situ).
Опухоли одного гистологического типа:
Опухоли стромы полового тяжа
Опухоли и опухолеподобные поражения, содержащие герминативные клетки и клетки стромы полового тяжа
Опухоли прямых канальцев, сети яичка, придатка, семенного канатика, капсулы, поддерживающих структур, рудиментарных образований
Неклассифицируемые опухоли
КЛАССИФИКАЦИЯ TNM ОПУХОЛЕЙ ЯИЧКА (UICC, 2009)
[21]
pT — первичная опухоль
-
pT1 — опухоль ограничена яичком и придатком, нет инвазии в лимфатические сосуды.
-
pT2 — опухоль ограничена яичком и придатком, есть инвазия в венозные и лимфатические сосуды.
-
pT3 — опухоль распространяется на семенной канатик с или без вовлечения венозных и лимфатических сосудов.
-
pT4 — опухоль прорастает в мошонку с или без вовлечения венозных и лимфатических сосудов.
N — регионарные лимфатические узлы
-
N1 — метастазы в лимфатических узлах (менее 2 см) или множественное поражение лимфатических узлов диаметром не более 2 см.
-
N2 — метастазы в лимфатических узлах (менее 2 см) или множественное поражение лимфатических узлов диаметром от 2 до 5 см.
-
N3 — метастазы в лимфатических узлах (менее 2 см) или множественное поражение лимфатических узлов диаметром более 5 см.
pN — гистологические признаки
-
pN1 — метастазы в лимфатических узлах размером менее 2 см или множественное поражение лимфатических узлов суммарным диаметром не более 2 см.
-
pN2 — метастазы в лимфатических узлах размером менее 2 см или множественное поражение лимфатических узлов суммарным диаметром от 2 до 5 см.
-
pN3 — метастазы в лимфатических узлах размером менее 2 см или множественное поражение лимфатических узлов суммарным диаметром более 5 см.
M — отдаленные метастазы
S — сывороточные опухолевые маркеры
-
S0 — концентрации сывороточных маркеров в норме (табл. 12.1).
| ЛДГ, МЕ/л | β-ХГ, МЕ/л | АФП, нг/мл | |
|---|---|---|---|
S1 |
<1,5×ВГН |
<5000 |
<1000 |
S2 |
1,5–10,0×ВГН |
5000–50 000 |
1000–10 000 |
S3 |
10×ВГН |
>50 000 |
>10 000 |
Диагностика
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
На ранних стадиях рак яичка протекает бессимптомно, однако у 20% больных первым симптомом может быть боль в мошонке. Наличие опухоли в яичке часто больной выявляет самостоятельно. Иногда выявлению опухоли способствует травма мошонки. Могут развиться также гинекомастия (7%) и боль в спине (11%) [34]. У 10% больных опухоль может протекать под маской эпидидимита, что затрудняет своевременное установление диагноза. Физикальное обследование с пальпацией опухоли должно всегда сопровождаться общим осмотром, при котором можно выявить метастазы в надключичные лимфатические узлы, пальпируемое образование брюшной полости, гинекомастию.
МЕТОДЫ ЛУЧЕВОЙ ДИАГНОСТИКИ
УЗИ применяют для подтверждения наличия образования яичка, исследования контралатерального яичка, оценки состояния забрюшинных лимфатических узлов, органов брюшной полости. Чувствительность метода при выявлении опухолей яичка составляет 100% [8]. УЗИ также следует выполнять у молодых мужчин без пальпируемого образования в мошонке, но имеющих забрюшинные и висцеральные образования или повышенную концентрацию β-субъединицы хорионического гонадотропина (β-ХГ) или α-фетопротеина (АФП) в сыворотке крови [2, 11, 16, 30].
КТ выполняют для оценки состояния забрюшинных лимфатических узлов, органов брюшной полости, легких.
МРТ обладает большей чувствительностью и специфичностью, чем УЗИ [17], и способностью дифференцировать семиномные и несеминомные опухоли.
ОПУХОЛЕВЫЕ МАРКЕРЫ
У больных раком яичка необходимо определять следующие маркеры [19]: АФП (продуцируется клетками желточного мешка), β-ХГ (вырабатывается клетками трофобласта), лактатдегидрогеназу (ЛДГ; маркер тканевой деструкции). Концентрация опухолевых маркеров повышена более чем у 51% больных раком яичка.
ОРХИФУНИКУЛЭКТОМИЯ
Орхифуникулэктомию выполняют у всех больных и после гистологического исследования проводят стадирование по символу Т.
СТАДИРОВАНИЕ
Необходимо оценить концентрацию опухолевых маркеров после орхифуникулэктомии, состояние надключичных и абдоминальных лимфатических узлов и печени, наличие или отсутствие вовлечения лимфатических узлов средостения и метастазов в легких, состояние головного мозга и костей, если подозревается их метастатическое поражение.
Диагностические тесты в настоящее время включают повторное исследование крови на опухолевые маркеры, рентгенографию органов грудной клетки, КТ брюшной полости и органов грудной клетки, УЗИ, МРТ, позитронно-эмиссионную томографию (ПЭТ) и другие методы диагностики по необходимости [21].
Рекомендации по использованию диагностических тестов с учетом уровня достоверности представлены в табл. 12.2.
| Тест | Рекомендации уровня В | Рекомендации уровня С |
|---|---|---|
Сывороточные опухолевые маркеры |
АФП, β-ХГ, ЛДГ |
|
КТ брюшной полости |
Все пациенты |
Худые юноши |
Рентгенография грудной клетки |
Семинома |
|
КТ органов грудной клетки |
Несеминомные герминогенные опухоли |
|
УЗИ яичек |
Подозрение на опухоль яичка, норма при пальпации мошонки |
|
МРТ |
Неопределенный результат КТ |
Все случаи |
ПЭТ |
Последующее наблюдение при семиноме |
Последующее наблюдение при семиноме |
Другие |
При необходимости |
В 1997 г. Международная группа по изучению герминогенных опухолей яичка (International Germ Cell Cancer Collaborative Group, IGCCCG) предложила систему стадирования с разделением на прогностические группы (табл. 12.3).
| Прогностическая группа | Диагностические критерии |
|---|---|
Группа с хорошим прогнозом |
|
Несеминомные опухоли |
Все перечисленные критерии |
Семиномы |
Все перечисленные критерии |
Группа с промежуточным прогнозом |
|
Несеминомные опухоли |
Все перечисленные критерии |
Семиномы |
Любой из перечисленных критериев |
Группа с плохим прогнозом |
|
Несеминомные опухоли |
Любой из перечисленных критериев |
Семиномы |
— |
Рекомендации по диагностике и стадированию опухолей яичка с учетом их достоверности представлены ниже [21].
-
Физикальное обследование может быть достаточным для диагностики рака яичкаВ.
-
УЗИ яичек следует проводить в обязательном порядке, если есть подозрение на опухоль яичка, а пальпация мошонки не выявляет отклонений от нормы, или если есть сомнения после физикального обследованияВ.
-
Орхифуникулэктомия и гистологическое исследование яичек необходимы для подтверждения диагноза и определения стадии первичной опухоли (pT)В.
-
Концентрацию опухолевых маркеров (АФП, β-ХГ, ЛДГ) следует определять до и после орхифуникулэктомии для установления стадии и оценки прогнозаВ.
-
Состояние забрюшинных, медиастинальных, надключичных лимфатических узлов и внутренних органов у больных раком яичкаВ обязательно следует оценивать.
Лечение
Первый этап лечения всех опухолей яичка — орхифуникулэктомия.
Цели орхифуникулэктомии:
Орхифуникулэктомия — удаление яичка с семенным канатиком. Операцию выполняют через паховый доступ. Семенной канатик необходимо выделять и отсекать у внутреннего пахового кольца.
Через 5–7 дней после орхифуникулэктомии определяют концентрацию опухолевых маркеров. Сохранение повышенного уровня маркеров после орхифуникулэктомии может быть единственным признаком наличия субклинических метастазов.
ЧИСТАЯ СЕМИНОМА
Составляет примерно 50% всех герминогенных опухолей. Для чистой семиномы не характерно повышение концентрации опухолевых маркеров, однако в 20% случаев отмечают повышенный уровень β-ХГ. Поскольку чистая семинома высокочувствительна к лучевой и химиотерапии, в 90% случаев прогноз лечения хороший.
СЕМИНОМА I СТАДИИ
На первом этапе выполняют орхифуникулэктомию. Учитывая наличие у 15–20% больных субклинических микрометастазов в регионарных лимфатических узлах [32], с профилактической целью проводят дистанционную лучевую терапию на парааортальные и ипсилатеральные тазовые лимфатические узлы. Суммарная очаговая доза составляет 20–24 Гр. Однако были проведены рандомизированные исследования, в которых у больных облучали только парааортальные зоны, в результате значительно снизилось число побочных эффектов, а число рецидивов выросло всего на 2%A [9, 18].
Осложнения профилактической лучевой терапии:
Профилактическая химиотерапия
В ряде работ отмечают высокую эффективность профилактической химиотерапии (цисплатин 50 мг/м2, 2 курса), которую рекомендуют как альтернативу адъювантной лучевой терапии [1, 36]. По данным исследований EORTC 30942 и MRC TE19, не было выявлено достоверной разницы в частоте возникновения рецидивов после одного курса адъювантной химиотерапии карбоплатином, адъювантной ДЛТ или при тщательном наблюдении. Таким образом, проведение одного курса химиотерапии карбоплатином может стать альтернативой ДЛТ или тщательному наблюдению у больных с семиномой I стадии. Ожидается, что два курса химиотерапии карбоплатином позволят снизить частоту рецидивирования до 1–3%, но для подтверждения этого требуется дальнейшее наблюдение и накопление опыта.
Динамическое наблюдение
Безрецидивная 5-летняя выживаемость составляет 82,3%. Пятилетняя выживаемость — 97–100%, смертность — 0,6%. Используя размеры опухоли >4 см и инвазию в сеть яичка, можно подразделить больных семиномой I стадии на группы низкого и высокого риска развития метастазов. Этот вывод был сделан на основании метаанализа ретроспективных исследований. У больных с отсутствием или наличием обоих факторов риска вероятность прогрессирования составляет 12 и 32% соответственно. Большинство рецидивов возникало в забрюшинных лимфатических узлах. Для развития рецидива неблагоприятными считают следующие прогностические факторы [28]:
ЛЕЧЕНИЕ РАСПРОСТРАНЕННОЙ СЕМИНОМЫ
Лучевая терапия
У больных семиномой IIа и IIb стадий стандартным методом лечения является лучевая терапия 30 и 36 Гр соответственно. Поле облучения захватывает ипсилатеральные подвздошные лимфатические узлы, образуя поле в виде хоккейной клюшки. Латеральные границы поля облучения должны отступать не менее чем на 1,0–1,5 см от края метастатических лимфатических узлов при IIb стадии. При этом шестилетняя безрецидивная выживаемость составляет 95 и 89% при IIа и IIb стадиях соответственно. Общая выживаемость составляет около 100%. Лучевая терапия позволяет добиваться положительных результатов у больных с конгломератом забрюшинных лимфатических узлов размером менее 10 см: безрецидивная 2-летняя выживаемость составляет до 91%, а общая выживаемость — 95%. При размере забрюшинной опухоли более 10 см в 38–50% случаев развивается рецидив заболевания.
Химиотерапия
У больных IIb стадии возможно проведение трех курсов адъювантной химиотерапии по схеме BEP (блеомицин 30 мг на 2, 9 и 16-й день, этопозид 120 мг/м2 в 1, 3, 5-й день или 100 мг/м2 в 1–5-й день, цисплатин 20 мг/м2 в 1–5-й день) или четырех курсов по схеме EP (этопозид, цисплатин) в группе хорошего прогноза в качестве альтернативы лучевой терапии или при наличии противопоказаний к применению блеомицина.
Безрецидивная выживаемость у больных, перенесших химиотерапию, достигает 90%А.
При прогрессировании заболевания проводят четыре курса химиотерапии второй линии PEI (цисплатин, этопозид, ифосфамид) или высокодозную химиотерапию.
Неблагоприятными прогностическими факторами у больных, получающих химиотерапию, являются:
Остаточная опухоль после химиотерапии, постепенно уменьшаясь в размерах, исчезает, хирургически ее не удаляют. При отрицательной динамике (увеличение резидуальной опухоли) выполняют биопсию для исключения несеминомного компонента.
ЛЕЧЕНИЕ НЕСЕМИНОМНЫХ ГЕРМИНОГЕННЫХ ОПУХОЛЕЙ ЯИЧКА
У 30% больных с несеминомными опухолями яичка I стадии без повышения уровня маркеров имеются субклинические метастазы.
Больных с несеминомными опухолями можно разделить на группы риска в зависимости от результатов патоморфологического исследования. Главным патоморфологическим критерием является инвазия опухоли в микрососудистое русло. Отсутствие сосудистой инвазии позволяет отнести пациентов к группе низкого риска и оставить под тщательным наблюдением при желании больного. Наличие сосудистой инвазии имеет 53% предсказательное значение в развитии метастазов. Этих пациентов относят к группе высокого риска.
ЛЕЧЕНИЕ НЕСЕМИНОМНЫХ ГЕРМИНОГЕННЫХ ОПУХОЛЕЙ ЯИЧКА I СТАДИИ
Забрюшинную лимфаденэктомию (ЗЛАЭ) выполняют у больных с высоким риском забрюшинных метастазовА. Забрюшинная лимфаденэктомия с последующим морфологическим исследованием удаленного материала остается наиболее точным методом стадирования опухолевого процесса у больных раком яичка. У 30% пациентов выявляются метастазы в забрюшинных лимфатических узлах при II клинической стадии. У 10% больных без метастазов в забрюшинные лимфатические узлы (I клиническая стадия) возникают отдаленные рецидивы.
Показания к забрюшинной лимфаденэктомии:
Границы лимфаденэктомии:
Осложнения забрюшинной лимфаденэктомии:
В связи с пересечением во время операции постганглионарных эфферентных симпатических волокон, располагающихся в межаортокавальном пространстве ниже уровня отхождения нижней брыжеечной артерии, у больных развиваются ретроградная эякуляция и бесплодие. Для их устранения разработана и выполняется нервосберегающая техника операции.
Возможно выполнение лапароскопической забрюшинной лимфаденэктомии, преимущества которой:
-
снижение сроков послеоперационной реабилитации. Выживаемость в группе больных после хирургического лечения:
-
у больных, не имевших метастазов в забрюшинных лимфатических узлах, — до 95%;
-
при наличии микрометастазов — от 50 до 75%. У 87% пациентов с повышенным уровнем маркеров АФП и β-ХГЧ при выполнении ЗЛАЭ имелись метастазы в забрюшинных лимфатических узлах.
При имеющемся повышенном уровне серологических маркеров следует также выполнить УЗИ контралатерального яичка, если это не было выполнено ранее.
Химиотерапия
Было проведено несколько исследований по использованию двух курсов адъювантной химиотерапии в качестве основного лечения у пациентов из группы высокого риска. Два курса химиотерапии по схеме BEP не приводили к ухудшению фертильности или сексуальной активности [9, 24]. Количество рецидивов составило 2,7% [33]. Следует помнить, что после химиотерапии возникает риск развития медленно растущих забрюшинных тератом и повышается риск химиорезистентного рецидива.
Динамическое наблюдение
Под динамическим наблюдением могут находиться больные с низким риском развития рецидива. Учитывая, что до 80% рецидивов возникает в 1-й год наблюдения, 12% — на 2-й и 6% — в течение 3-го года, больные в 1-й и 2-й год наблюдения должны быть под постоянным тщательным контролемВ. Динамическое наблюдение включает:
Следует иметь в виду, что у 35% больных с рецидивом опухолевого процесса повышения концентрации опухолевых маркеров может не происходить.
ЛЕЧЕНИЕ НЕСЕМИНОМНЫХ ГЕРМИНОГЕННЫХ ОПУХОЛЕЙ ЯИЧКА II СТАДИИ
В настоящий момент большинство исследователей полагают, что лечение несеминомных опухолей IIа и IIb стадий должно начинаться со стартовой химиотерапии 3–4 курсами BEP/EP в группах хорошего и умеренного прогноза с последующим удалением резидуальных масс, за исключением случаев без повышения уровня маркеров, когда можно выполнить ЗЛАЭ или оставить пациента под тщательным наблюдением. Забрюшинные образования без повышения уровня маркеров представляют собой метастатически дифференцированную тератому.
Общеприняты следуюшие схемы первой линии химиотерапии.
При сравнении четырех курсов ЕР и трех курсов ВЕР доказана их одинаковая эффективность.
При неэффективности химиотерапии первой линии проводят химиотерапию в следующих режимах:
Неблагоприятный прогностический признак у больных после индукционной химиотерапии — сохранение положительных результатов при определении опухолевых маркеров.
Индукционная химиотерапия + забрюшинная лимфаденэктомия
Забрюшинную лимфаденэктомию выполняют у больных, у которых не достигнут полный эффект после индукционной химиотерапии (остаточная опухоль размером более 1 см). При гистологическом исследовании удаленного препарата фиброзно-некротические массы выявляют в 40% случаев, жизнеспособные раковые клетки — в 10%, зрелую тератому — в 50% случаев [37].
Индукционная химиотерапия позволяет достичь ремиссии и избежать хирургического вмешательства при IIa стадии у 87%, при IIb стадии — у 67% больных.
Забрюшинная лимфаденэктомия + адъювантная химиотерапия
При изолированном хирургическом лечении у 25 и 50% больных с IIa и IIb стадиями соответственно процесс прогрессирует. В связи с этим проводят два курса адъювантной химиотерапии по схеме ВЕР. Эффективность данной методики высока, рецидивы возникают в 3–4% случаевА.
ЛЕЧЕНИЕ НЕСЕМИНОМНЫХ ГЕРМИНОГЕННЫХ ОПУХОЛЕЙ С ОТДАЛЕННЫМИ МЕТАСТАЗАМИ
Больным проводят индукционную химиотерапию по схемам ВЕР (блеомицин 30 мг во 2, 9, 16-й дни, этопозид 120 мг/м2 в 1, 3, 5-й или 100 мг/м2 в 1–5-й день; цисплатин 20 мг/м2 в 1–5-й день), всего 3 курса, или ЕР (этопозид 100 мг/м2 в 1–5-й день, цисплатин 20 мг/м2 в 1–5-й день), всего 4 курса. В дальнейшем оправдан агрессивный хирургический подход с выполнением забрюшинной и/или медиастинальной лимфаденэктомии, удалением солитарных метастазов, попыткой удаления всех опухолевых очаговА. После хирургического этапа проводят еще 4 курса полихимиотерапии. При неэффективности схемы ВЕР проводят химиотерапию второй линии.
Больным из группы умеренного прогноза проводят 4 курса по схеме BEP. Пятилетняя выживаемость составляет 80%.
Cтандартная терапия пациентов из группы неблагоприятного прогноза состоит из 4 курсов по схеме BEP. Проведение химиотерапии по схеме PEI имеет такую же эффективность, но является более токсичным. Пятилетняя безрецидивная выживаемость составляет 45–50%. В настоящий момент проводятся исследования улучшения.
ЛЕЧЕНИЕ НЕГЕРМИНОГЕННЫХ ОПУХОЛЕЙ
Негерминогенные опухоли составляют до 3% всех опухолей яичка, из них до 90% являются доброкачественными:
В основном лечение негерминогенных опухолей заключается в выполнении орхифуникулэктомии и динамическом наблюдении. При развитии забрюшинных метастазов проводят забрюшинную лимфаденэктомию. В редких случаях возможно органосохраняющее лечение.
Динамическое наблюдение
Обследование |
Годы |
||||
1-й |
2-й |
3-й |
4–5-й |
6–10-й |
|
Клиническое обследование |
6 раз |
4 раза в год |
3 раза в год |
2 раза в год |
1 раз в год |
Маркеры |
6 раз |
4 раза в год |
3 раза в год |
2 раза в год |
1 раз в год |
Рентгенография грудной клетки |
6 раз |
4 раза в год |
3 раза в год |
2 раза в год |
1 раз в год |
КТ брюшной полости |
4 раза |
4 раза в год |
3 раза в год |
1 раз в год |
По показаниям |
УЗИ брюшнойполости |
— |
— |
2 раза в год |
1 раз в год |
По показаниям |
Обследование |
Годы |
|||
1-й |
2-й |
3-й |
4–5-й |
|
Клиническое обследование |
6 раз |
4 раза в год |
3 раза в год |
2 раза в год |
Маркёры |
6 раз |
4 раза в год |
3 раза в год |
2 раза в год |
Рентгенография грудной клетки |
6 раз |
4 раза в год |
3 раза в год |
2 раза в год |
КТ брюшной полости |
1 раз |
1 раз в год |
По показаниям |
По показаниям |
УЗИ брюшнойполости |
1 раз |
1 раз в год |
2 раза в год |
По показаниям |
Обследование |
Годы |
||||
1-й |
2-й |
3-й |
4–5-й |
6–10-й |
|
Клиническое обследование |
6 раз |
4 раза в год |
3 раза в год |
2 раза в год |
1 раз в год |
Маркёры |
6 раз |
4 раза в год |
3 раза в год |
2 раза в год |
1 раз в год |
Рентгенография грудной клетки |
6 раз |
4 раза в год |
3 раза в год |
2 раза в год |
1 раз в год |
КТ брюшной полости и малого таза |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
КТ грудной полости |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
Обследование |
Годы |
|||
1-й |
2-й |
3-5-й |
6–10-й |
|
линическое обследование |
Ежемесячно |
4–6 раз в год |
2 раза в год |
1 раз в год |
Маркеры |
9–12 раз |
4–6 раз в год |
2 раз в год |
1 раз в год |
Рентгенография грудной клетки |
9–12 раз |
4–6 раз в год |
2 раз в год |
1 раз в год |
КТ брюшной полости |
3–4 раза |
2 раза в год |
1 раз в год |
По показаниям |
Обследование |
Годы |
|||
1-й |
2-й |
3–5-й |
6–10-й |
|
Клиническое обследование |
6 раз |
3 раза в год |
2 раза в год |
1 раз в год |
Маркёры |
6 раз |
3 раза в год |
2 раза в год |
1 раз в год |
Рентгенография грудной клетки |
6 раз |
3 раза в год |
2 раза в год |
1 раз в год |
КТ брюшной полости |
2 раза |
1 раз в год |
1 раз в год |
По показаниям |
УЗИ брюшной полости |
2 раза |
2 раза в год |
2 раза в год |
1 раз в год |
Обследование |
Годы |
|||
1-й |
2-й |
3–5-й |
Впоследствии |
|
Клиническое обследование |
6 раз |
4 раза в год |
2 раза в год |
1 раз в год |
Маркёры |
6 раз |
4 раза в год |
2 раза в год |
1 раз в год |
Рентгенография грудной клетки |
6 раз |
4 раза в год |
2 раза в год |
1 раз в год |
КТ брюшной полости |
1 раз, далее по показаниям |
По показаниям |
По показаниям |
По показаниям |
УЗИ брюшной полости |
2 раза |
2 раза в год |
По показаниям |
По показаниям |
Обследование |
Годы |
|||||
1й |
2й |
3–5й |
4й |
5й |
Впоследствии |
|
Клиническое обследование |
12 раз |
6 раз в год |
4 раза в год |
3 раза в год |
2 раза в год |
1 раз в год |
Маркеры |
12 раз |
6 раз в год |
4 раза в год |
3 раза в год |
2 раза в год |
1 раз в год |
Рентгенография грудной клетки |
12 раз |
6 раз в год |
4 раза в год |
3 раза в год |
2 раза в год |
1 раз в год |
КТ брюшной полости |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
КТ грудной полости |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
КТ головного мозга |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
По показаниям |
Прогноз
Зависит от гистологической структуры опухоли, стадии заболевания, возраста больного, концентрации опухолевых маркеров. Наиболее благоприятный прогноз у семиномы, менее благоприятный — у эмбрионального рака и тератобластомы, наихудший — у хорионэпителиомы и смешанных опухолей с элементами хорионэпителиомы. Саркомы яичка протекают очень агрессивно. Плохой прогностический признак — стойкое повышение концентрации опухолевых маркеров, отсутствие изменений в процессе лечения. Прогноз у людей молодого возраста хуже, чем у пациентов старшего возрастаВ,С.
ЛИТЕРАТУРА
-
Aparicio J., Garciadel Muro X., Maroto P. et al. Spanish Germ Cell Cancer Cooperative Group (GG). Multicenter study evaluating a dual policy of postorchiectomy surveillance and selective adjuvant singliagent carboplatin for patients with clinical stage I seminoma // Ann. Oncol. — 2003. — Vol. 14. — Р. 867–872.
-
Bockrath J.M., Schaeffr A.J., Kiess M.S., Nieman H.L. Ultrasound identifi cation of impalpable testicle tumor // J. Urol. — 1983. — Vol. 130. — Р. 355–356.
-
Bosl G.J., Motzer R.J. Testicular germ cell cancer // N. Engl. J. Med. — 1997. — Vol. 337. — Р. 242–253.
-
Cullen M.H., Stenning S.P., Parkinson M.C. et al. Short-course adjuvant chemotherapy in highrisk stage I nonseminomatous germ cell tumours of the testis: a Medical Research Council Report // J. Clin. Oncol. — 1996. — Vol. 14. — Р. 1106–1113.
-
De Wit R., Stoter G., Kaye S.B. et al. Importance of bleomycin in combination chemotherapy for good-prognosis testicular nonseminoma: A randomized study of the European Organization for Research and Treatment of Cancer Genitourinary TractCancer Cooperative Group // J. Clin. Oncol. — 1997. — Vol. 15. — Р. 1837–1843.
-
Debono D.J., Heilman D.K., Einhorn L.H., Donohue J.P. Decision analysis for avoiding postchemotherapy surgery in patients with disseminated nonseminomatousgerm cell tumors // J. Clin. Oncol. — 1997. — Vol. 15. — Р. 1455–1464.
-
Dieckmann K.P., Loy V., Buttner P. Prevalence of bilateral germ cell tumors and early detection based on contralateral testicular intraepithelial neoplasia // Br. J. Urol. — 1993. — Vol. 71. — Р. 340–345.
-
Doherty F.J. Ultrasound of the nonacute scrotum. In: Seminars in Ultrasound, CT and MRI / H.W. Raymond et al. (ed.). — New York: W.B. Saunders Co, 1991. — P. 131–156.
-
Fossa S.D., Horwich A., Russell J.M. et al. Optimal planning target volume for stage I testicular seminoma: A Medical Research Council randomized trial // J. Clin. Oncol. — 1999. — Vol. 17. — Р. 1146–1154.
-
Fossa S.D., Stenning S.P., Gerl A. et al. Prognostic factors in patients progressing after cisplatin-based chemotherapy for malignant nonseminomatous germcell tumours // Br. J. Cancer. — 1999. — Vol. 80. — Р. 1392–1399.
-
Friedrich M., Claussen C.D., Felix R. Immersion ultrasound of testicular pathology // Radiology. — 1981. — Vol. 141. — Р. 235–237.
-
Harland S.J., Cook P.A., Fossa S.D. et al. Intratubular germ cell neoplasia of contralateral testis in testicular cancer: defining high risk group // J. Urol. — 1998. — Vol. 160. — Р. 1353–1357.
-
Heidenreich A., Moul J.W. Contralateral testicular biopsy procedure in patients with unilateral testis cancer: is it indicated? // Sem. Urol. Oncol. — 2002. — Vol. 20. — №4. — Р. 234–238.
-
Horwich A., Bell J. Mortality and cancer incidence following treatment for seminoma of the testis // Radiother. Oncol. — 1994. — Vol. 30. — Р. 193–198.
-
Huyghe E., Matsuda T., Thonneau P. Increasing incidence of testicular cancer worldwide: a review // J. Urol. — 2003. — Vol. 170. — №1. — Р. 5–11.
-
Glazer H.S., Lee J.K. T., Melson G.L., McClennan B.L. Sonographic detection of occult testicular neoplasm // Am. J. Roentgenol. — 1982. — Vol. 138. — Р. 673–675.
-
Johnson H.O., Mattrey R.F., Phillipson J. Diffferentiation of seminomatous from nonseminomatous testicular tumors by MRI // Am.J. Roentgenol. –1990. — Vol. 154. — Р. 539–543.
-
Jones W.G., Fossa S.D., Mead G.M. et al. A randomized trial of two radiotherapy schedules in the adjuvant treatment of stage I seminoma (MRC TE 18) // E.J. Cancer. — 2001; 37 (1) abstract book: S. 157, abstract 572.
-
Klein E.A. Tumor markers in testis cancer // Urol. Clin. North. Am. –1993. — Vol. 20. — Р. 67–73.
-
Klepp O., Dahl O., Flodgren P., Stierner U. et al. Risk-аdapted treatment of clinical stage 1 nonseminoma testis cancer // Eur. J. Cancer. — 1997. — Vol. 33. — Р. 1038–1044.
-
Laguna M.P., Klepp O., Horwich A. et al. Guidelines on testicular cancer // Update. — 2004, March.
-
Lashley D.B., Lowe B.A. A rational approach to managing stage I nonseminomatous germ cell cancer // Urol. Clin. North. Am. — 1998. — Vol. 25. — Р. 405– 423.
-
Loehrer P.J., Gonin R., Nichols C.R. et al. Vinblastine plus iofosfamide plus cisplatin as initial salvage therapy in recurrent germ cell tumor // J. Clin. Oncol. — 1998. — Vol. 16. — Р. 2500–2504.
-
McGlynn K. A., Devesa S.S., Sigurdson A.J. et al. Trends in the incidence of testicular germ cell tumors in the United States // Cancer. — 2003. — Vol. 97. — №1. — Р. 63–70.
-
Oliver R.T. D., Raja M.A., Ong J., Gallagher C.J. Pilot study to evaluateimpact of a policy of adjuvant chemotherapy for high risk stage I malignant teratoma on overall relapse rate of stage I cancer patients // J. Urol. — 1992. — Vol. 148. — Р. 1453–1456.
-
Osterlind A., Berthelsen J.G., Abildgaard N. et al. Risk of bilateral testicular germ cell tumors in Denmark: 1960–1984 // J. Natl. Cancer. Inst. — 1991. — Vol. 83. — Р. 1391–1395.
-
Richie J.P. Neoplasms of the testis. In: Campbell’s Urology / P.C. Walsh et al. (eds). — Philadelphia: WB Saunders Co., 1997. — P. 2411–2452.
-
Saxman S., Finch D., Gonin R., Einhorn L.H. Long-term follow up of a phase III study of three versus four cycles of bleomycin, etoposide and cisplatin in favorable prognosis germcell tumors: the Indiana University Experience // J. Clin. Oncol. — 1998. — Vol. 16. — Р. 702–706.
-
Schottenfeld D., Warshauer M.E., Sherlock S. et al. The epidemiology of testicular cancer in young adults // Am.J. Epidemiol. — 1980. — Vol. 112. — Р. 232– 246.
-
Shawker T.H., Javadpour N., O’Leary T. et al. Ultrasonographic detection of burned out primary testicular germ cell tumors in clinically normal testes // J. Ultrasound. Med. — 1983. — Vol. 2. — Р. 477–479.
-
Shelley M.D., Burgon K., Mason M.D. Treatment of testicular germ cellcancer: a Cochrane evidence-based systematic review // Cancer treatment reviews. — 2002. — Vol. 28. — P. 237–253.
-
Sternberg C.N. The management of stage I testis cancer // Urol. Clin. North. Am. — 1998, Aug. — Vol. 25. — № 3. — Р. 435–449.
-
Travis L.B., Curtis R.E., Storm H. et al. Risk of second malignant neoplasms among long-term survivors of testicular cancer // J. Natl. Cancer. Inst. — 1997. — Vol. 89. — Р. 1429–1439.
-
Wanderas E.H., Tretli S., Fossa S.D. Trends in incidence of testicular cancer in Norway 1955–1992 // Eur.J. Cancer. — 1995. — Vol. 31A. — Р. 2044–2048.
-
Warde P., Jewett M.A. S. Surveillance for stage I testicular seminoma. Is it a good option? // Urol. Clin. North. Am. — 1998. — Vol. 25. — Р. 425–433.
-
Warde P., Specht L., Horwich A. et al. Prognostic factors for relapse in stage I seminoma managed by surveillance: a pooled analysis // J. Clin. Oncol. — 2002. — Vol. 20. — № 22. — Р. 4448–4452.
-
Xiao H., Mazumdar M., Bajorin D.F. et al. Long-term follow-up of patients with good risk germ cell tumors treated with etoposide and cisplatin // J. Clin. Oncol. — 1997. — Vol. 15. — Р. 2553–2558.
-
Злокачественные новообразования в России в 2014 г. (заболеваемость и смертность). Под ред. А.Д.Каприна, В.В.Старинского, Г.В.Петровой. М.2016г.
Глава 13. ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
В.В. Борисов, Е.М. Шилов
Острая почечная недостаточность (ОПН) — это внезапное (в течение нескольких часов или дней) потенциально обратимое нарушение всех функций обеих почек или единственной почки вследствие воздействия различных экзогенных или эндогенных факторов с задержкой продуктов азотистого обмена, нарушением водно-электролитного и кислотно-основного баланса [8].
МКБ-10 • N17 Острая почечная недостаточность.
Эпидемиология
В среднем на 1 млн населения в год в различных странах приходится от 30 до 60 случаев ОПН, причем с возрастом ее вероятность увеличивается. Половина госпитальных случаев ОПН — ятрогенные, обусловленные хирургическими вмешательствами. Доля нефрологических больных с ОПН в отделениях интенсивной терапии составляет 10–15%.
Профилактика
Состоит в адекватной терапии основного заболевания, при котором возможно развитие ОПН, например назначение аллопуринола в больших дозах перед началом химиотерапии миелои лимфопролиферативных заболеваний. Профилактика преренальной ОПН — обеспечение достаточного для адекватной фильтрации почечного кровотока, в первую очередь коррекция гиповолемии. Больным с заболеваниями почек, у которых может иметь место ХПН, дозировки нефротоксичных препаратов необходимо адаптировать к СКФ.
Скрининг
У тяжелых больных с высокой вероятностью ОПН оправдан ежедневный контроль диуреза, уровня калия и креатинина плазмы. Это позволит, своевременно корректируя назначения, если не предотвратить ОПН, то как можно раньше начать терапию и тем самым улучшить прогноз.
Классификация
Согласно этиологии, большинство исследователей делят ОПН на четыре вида, имеющие принципиально разные базовые схемы терапии [5, 15, 18]. Наиболее часто (около 70%) встречается преренальная ОПН (функциональная), далее по частоте следует ренальная форма (около 25% всех случаев), на третьем месте — постренальная (не более 5% общего числа больных ОПН), ренопривная ОПН (возникает у единичных больных) [9].
ПРЕРЕНАЛЬНАЯ ОПН
Возникает вследствие падения эффективного почечного кровотока. Наиболее часто преренальная ОПН развивается в результате нарушеия почечной гемодинамики вследствие тяжелой гипотензии. При падении систолического артериального давления до 50 мм рт.ст. клубочковая фильтрация прекращается и развивается анурия [10, 12].
Причины преренальной ОПН
Первое место по частоте развития гипотензии и ОПН занимают тяжелые соматические (шоковые) состояния, сопровождающиеся уменьшением сердечного выброса: кардиогенный шок, тампонада сердца, тяжелые нарушения сердечного ритма, сердечная недостаточность, эмболия легочной артерии.
Важное место занимают состояния, приводящие к перераспределению жидкостей в организме: нефротический синдром, перитонит, цирроз печени, кишечная непроходимость, панкреатит.
Иногда ОПН развивается из-за прямой дегидратации вследствие ожогов, кровопотери, рвоты, диареи, неадекватного применения сильных мочегонных средств [10, 12].
При некоторых видах шока дополнительными повреждающими факторами выступают продукты массивного распада тканей, синдром диссеминированного внутрисосудистого свертывания.
Иногда приходится наблюдать ОПН на фоне приема ингибиторов АПФ, реже — блокаторов рецепторов к ангиотензину. Механизм дефицита фильтрации здесь чисто гемодинамический, т.е. преренальный. Особенно велик риск такой ОПН на фоне двустороннего стеноза почечных артерий или множественного поражения почечных артерий атеросклеротическим процессом.
Развитие преренальной ОПН возможно и при прямом остром поражении сосудов: расслаивающей аневризме аорты, двустороннем тромбозе почечных артерий или вен, тромбозе сосудов единственной почки (некоторые исследователи ОПН при прямом остром поражении магистральных почечных сосудов относят к ренальной форме).
РЕНАЛЬНАЯ ОПН
Развивается при поражении паренхимы почек.
Ниже представлены основные причины ренальной ОПН по убыванию частоты встречаемости. Острый канальцевый некроз.
Около 85% случаев ренальной ОПН связано с острым канальцевым некрозом, который, в свою очередь, бывает токсическим и ишемическим (гемодинамическим).
Наиболее часто встречается токсический острый канальцевый некроз. Он вызывается действием нефротоксичных веществ: соединений тяжелых металлов (особенно ртути), органических растворителей, уксусной кислоты, суррогатов алкоголя. Ряд лекарственных препаратов вызывает повреждение почек, наиболее клинически значимые из них — аминогликозиды, гликопептиды, амфотерицин В, препараты платины, алкилирующие противоопухолевые средства, рентгеноконтрастные вещества. В последнее время участились случаи почечной недостаточности на фоне введения опиатов и вследствие приема с целью похудания неофицинальных фитосборов («тайские травы» и т.д.). Указанные токсичные агенты действуют на канальцевый эпителий, вызывая его повреждение и гибель [10, 12].
Наряду с экзогенными веществами в роли нефротоксина могут выступать миоглобин и гемоглобин. Миоглобиновый рабдомиолиз является следствием мышечной травмы, мышечных дистрофий, тяжелых метаболических нарушений — диабетического кетоацидоза, гипои гипернатриемии, гипокалиемии, гипотиреоза и т.д. Из лекарственных средств, способных вызвать миоглобиновый рабдомиолиз, наиболее известны гиполипидемические препараты: статины и фибраты (кстати, практически лишенные прямой нефротоксичности).
Состояния, сопровождающиеся гемоглобинурией, встречаются чаще: трансфузиологические осложнения, гемолитические анемии, малярия, интоксикации широко распространенными в быту и промышленности производными бензола, анилина и т.д.
Острый канальцевый некроз по токсическому механизму может также развиваться в рамках крайне тяжелого течения заболеваний почек: подагрической нефропатии, первичного оксалоза, множественной миеломы (миеломной почки).
С развитием оперативной техники постишемическая ОПН все чаще возникает у больных, перенесших продолжительное оперативное вмешательство на открытом сердце, магистральных сосудах, почке, когда вмешательство сопровождается пережатием почечной артерии, особенно единственной. От ишемии почки в большей степени страдает проксимальный отдел прямого канальца [15, 16, 18].
Вторая по частоте причина ренальной ОПН — острый интерстициальный нефрит (около 10%).
Чаще всего встречается лекарственный острый интерстициальный нефрит, возникающий в ответ на введение антибактериальных препаратов или НПВС. Важная особенность лекарственного интерстициального нефрита в том, что, в отличие от канальцевого некроза, это состояние является дозонезависимым. Отметим, что причинный препарат может практически не иметь прямого нефротоксического эффекта. Существенно реже острый интерстициальный нефрит развивается в рамках системных заболеваний (системная красная волчанка, саркоидоз), как паранеопластическая нефропатия, а также как идиопатическое заболевание.
Среди сосудистых поражений в качестве причины ренальной ОПН выступают васкулиты мелких почечных сосудов, тромботическая микроангиопатия (гемолитико-уремический синдром, тромботическая тромбоцитопеническая пурпура). В рамках антифосфолипидного синдрома могут развиваться тромбозы сосудов любого диаметра и локализации, в том числе и почечных.
Сравнительно нечасто ренальная ОПН связана непосредственно с клубочковыми поражениями: острым гломерулонефритом, геморрагической лихорадкой с почечным синдромом и т.д. [10, 12]. На сосудистые и гломерулярные поражения приходится около 5% всех случаев ренальной ОПН.
Одна из наиболее редких в настоящее время причин ренальной ОПН — острый кортикальный некроз. Он развивается на фоне ишемии коркового слоя почек вследствие стойкой гипотонии. Классической причиной коркового некроза считаются акушерские кровотечения. Вне акушерской и гинекологической клинической картины корковый некроз следует иметь в виду у больного ОПН, перенесшего длительную гипотонию на фоне предсуществующего поражения мелких почечных сосудов — диабетической нефропатии.
Ренальная ОПН может возникать в результате механического блока канальцев почек парапротеинами при миеломной болезни, кристаллами мочевой кислоты при подагрической нефропатии, а также при химиотерапии болезней крови вследствие массивной гибели клеток (некоторые исследователи относят это состояние к постренальной форме ОПН) [10, 12, 13].
ПОСТРЕНАЛЬНАЯ ОПН
Связана с резким нарушением проходимости верхних мочевыводящих путей вследствие обструкции их просвета камнями, сгустками крови с обеих сторон или при единственной почке либо сдавлением извне при ретроперитонеальном фиброзе, опухолях (метастазах в лимфатических узлах) забрюшинного пространства [8].
РЕНОПРИВНАЯ ОПН
Возникает при механическом разрушении или удалении всей функционирующей почечной паренхимы. Основной контингент этих больных — перенесшие нефрэктомию единственной почки по жизненным показаниям в связи с новообразованием. Разрушение двух почек или единственной почки в результате травмы встречается редко [8].
СТАДИИ ОСТРОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ (В КЛАССИЧЕСКОМ ВАРИАНТЕ)
-
Начальная стадия — сам момент воздействия фактора, повреждающего почечную паренхиму.
-
Диуретическая стадия подразделяется на раннюю диуретическую фазу и фазу полиурии.
-
Стадия выздоровления — медленное восстановление почечных функций [8].
Диагностика
ЖАЛОБЫ И АНАМНЕЗ
Если состояние позволяет больному адекватно отвечать на вопросы, а причина ОПН непонятна, следует выяснить наличие у него хронических болезней, которые закономерно осложняются ОПН: подагра, множественная миелома, мочекаменная болезнь (особенно при единственной почке), системные васкулиты, нефротический синдром независимо от его этиологии и т.д. Нужно узнать, принимал ли пациент лекарственные препараты, спиртсодержащие жидкости и имел ли контакты с потенциально опасными химическими веществами. Необходимо определить, имеются ли признаки интоксикации и такие симптомы заболевания, как рвота, понос, кровотечение (возможность гиповолемии). У женщин обязательно выясняют наличие беременности, ее сроки, течение. У лечащего врача больных, перенесших обширные операции, необходимо выяснить течение операции и наркоза (была ли длительная гипотония) и время ишемии почек (если перекрывали кровоток в аорте или почечной артерии).
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
При выявлении резкого сокращения диуреза или при отсутствии мочи диагноз ОПН сомнений не вызывает. При выраженной полиурии на фоне ухудшения общего состояния требуется определение уровня креатинина сыворотки крови.
Яркие симптомы уремии (см. главу «Хроническая почечная недостаточность») развиваются постепенно и сравнительно небыстро, в диагностике ОПН они малозначимы. Однако их появление, особенно энцефалопатии, служит показанием к началу гемодиализа.
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Острая почечная недостаточность — остро возникший дефицит фильтрации, который необходимо подтвердить лабораторными данными.
При анурии дефицит фильтрации очевиден без исследований, а при неолигурической форме диагноз ставят на основании низкой плотности мочи (одновременно свидетельствует о прямом поражении канальцев), высокого уровня креатинина сыворотки крови, а главное — выраженного снижения СКФ.
УСТАНОВЛЕНИЕ ФОРМЫ ОПН
Относительная плотность мочи выше 1018 характерна для преренальной ОПН, ниже 1017 — для ренальной.
При преренальной ОПН изменения в осадке мочи минимальны, для ренальной характерны протеинурия, гематурия, зернистые или клеточные цилиндры. Наличие микрогематурии, пиурии может свидетельствовать о мочекаменной болезни, мочевой инфекции, опухоли.
УЗИ почек (желательно с допплерографией) позволяет выявить или исключить постренальную форму ОПН. При постренальной форме обнаруживают выраженное расширение мочевыводящих путей выше уровня обструкции. При тромбозе почечных сосудов при допплерографии наблюдают отсутствие адекватного кровотока в почке. Для подтверждения диагноза тромбоза почечных сосудов и определения объема поражения показана экстренная ангиография [8].
Для дифференциального диагноза между преренальной и ренальной формами ОПН следует иметь в виду, что преренальная ОПН возникает на здоровой почке, которая некоторое время еще остается здоровой (при достаточной сохранности кровотока), сохраняя все свои функции, в то время как ренальная ОПН развивается, когда разрушен чуть ли не весь канальцевый эпителий. Однако нередко вполне реально и сочетание двух причин. При преренальной форме содержание натрия в моче ниже чем 20 ммоль/л, соотношение креатинин крови/креатинин мочи более 40, на фоне ренальной ОПН эти показатели составляют соответственно 40 ммоль/л и более или менее 20.
Более точно отражает сохранность функции канальцевого эпителия показатель экскретируемой фракции натрия, рассчитываемый по формуле: натрий мочи/натрий крови: креатинин мочи/креатинин крови.
При преренальной форме экскретируемая фракция натрия менее 1%, при ренальной форме — более 1% [2, 9, 15].
Длительное нарушение почечного кровотока может привести к некрозу коркового слоя почек. Тем самым ОПН из преренальной переходит в ренальную, а из потенциально обратимой становится полностью необратимой [9].
ПЛАН ОБСЛЕДОВАНИЯ БОЛЬНОГО
Исследования выполняют не только для установления факта ОПН, ее формы или стадии в неясных случаях, но и для оценки общего состояния больных.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
В ситуации, когда у больных имеется развернутая клиническая картина ОПН (олигурия или анурия), а ее причина не вызывает сомнения, установление этого диагноза не составляет трудности.
Некоторые сомнения могут возникнуть при неолигурической форме ОПН, но они легко разрешимы, если учесть, что в острую фазу ОПН уровень креатинина значительно ниже, чем тот, который обычно соответствует реально имеющемуся уровню клубочковой фильтрации. В условиях олигурии проба Реберга (клиренс креатинина) неинформативна, а на фоне растущего уровня креатинина определение СКФ затруднительно, так как все широко распространенные методики (проба Реберга, формула Кокрофта–Голта и т.д.) рассчитаны на стабильные равновесные концентрации креатинина [9, 11].
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Всем пациентам с подозрением на ОПН показана консультация нефролога, который лечит либо контролирует лечение больного.
При постренальной форме также в экстренном порядке больной нуждается в консультации уролога, а при его отсутствии — хирурга, которые при подтверждении диагноза должны в первую очередь решить проблему отведения мочи из почек.
При подозрении на тромбоз почечных сосудов или на расслоение аневризмы аорты показаны консультация сосудистого хирурга и при необходимости перевод в стационар соответствующего профиля для экстренного оперативного лечения.
При тяжелых экзогенных интоксикациях необходима консультация специалиста-токсиколога и при подтверждении диагноза — госпитализация в токсикологическое отделение.
При других причинах ОПН больного в обязательном порядке должен осмотреть врач, в обязанность которого входит лечение того заболевания, которое стало причиной ОПН.
Лечение
ЦЕЛИ ЛЕЧЕНИЯ
Создание условий для нормальной работы почек, если ОПН не связана с прямым поражением почечной паренхимы.
Предотвращение и коррекция опасных для жизни проявлений ОПН на время, необходимое для восстановления почечных функций.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Все больные с подозрением или установленным диагнозом ОПН подлежат экстренной госпитализации в стационар, в котором есть возможность проведения экстренного гемодиализа.
ПРИНЦИПЫ ЛЕЧЕНИЯ
При постренальной ОПН основное лечебное мероприятие — дренирование верхних мочевыводящих путей [8], после чего у больного развивается полиурия, что требует контроля электролитного состава крови, а при необходимости — коррекции выявленных нарушений.
У преобладающего большинства больных этих лечебных мероприятий для купирования ОПН достаточно, но иногда при поступлении больного в состоянии высокой (более 7 мэкв/л) гиперкалиемии требуется экстренный сеанс гемодиализа.
Ренопривная ОПН требует постоянной заместительной почечной терапии. Если предполагается удаление единственной почки, больному целесообразно заранее сформировать артериовенозную фистулу для последующего заместительного гемодиализа [8].
При преренальной ОПН необходимы восстановление объема циркулирующей крови и нормализация артериального давления; проводимую терапию определяет основное заболевание, вызвавшее нарушение гемодинамики. Необходимо отменить ингибиторы АПФ и блокаторы рецепторов к ангиотензину. При расслаивающей аневризме аорты лечение начинают с хорошего обезболивания с применением наркотических анальгетиков и при необходимости адекватной (с учетом дефицита фильтрации) гипотензивной терапии. Иногда эти мероприятия приводят к восстановлению диуреза, однако при расслоении аневризмы аорты, как и при тромбозах почечных сосудов, надеяться на благоприятный исход заболевания позволяет только немедленное хирургическое лечение.
Лечение ренальной ОПН представляет собой сложную проблему. Прежде всего, при возможности необходимо проводить специфическое лечение заболевания или отравления, приведшего к ОПН. Химические вещества и болезни, способные спровоцировать ОПН, отличаются крайним многообразием, требуется их специфическая терапия, которую должен проводить токсиколог.
ЛЕЧЕНИЕ НЕОЛИГУРИЧЕСКОЙ ФОРМЫ
При неолигурической форме ОПН объем поражения почек несколько меньше, она протекает более доброкачественно по сравнению с классической формой [9, 10, 13].
Немедикаментозное лечение
С учетом выраженного дефицита фильтрации назначают диету с ограничением белка, который должен быть животным, т.е. более полноценным, до 20–25 г/сут. Больные плохо переносят эти меры, но диету назначают на небольшой срок — пока не начнет возрастать СКФ.
В дальнейшем ограничения постепенно снижают, вплоть до их отмены. Необходим ежедневный контроль уровня электролитов в крови для решения вопроса о необходимости ограничения потребления калия или, наоборот, о его назначении при склонности к гипокалиемии. Прием жидкости рассчитывают по диурезу: больному разрешено на 300 мл больше жидкости по сравнению с тем, сколько он выделил за прошедшие сутки. При увеличении СКФ выше 15 мл/мин больному можно разрешить употребление жидкости по потребности [1, 2, 5, 9].
Медикаментозное лечение
Обязательны контроль АД и коррекция выявленных нарушений. Гипотензивная терапия с учетом СКФ необходима при повышении артериального давления (контроль его значений не реже 2 раз в сутки). При выборе гипотензивных средств, кроме обычных показателей — величины артериального давления, частоты сердечных сокращений, наличия или отсутствия недостаточности кровообращения, необходимо учитывать еще и выведение препарата. Предпочтительнее назначать лекарства с преимущественно или полностью печеночным путем выведения (см. «Хроническая почечная недостаточность»), что существенно облегчает подбор дозы. Ведение больных неолигурической ОПН очень близко к таковому у больных тяжелой ХПН.
Гиперкалиемия возможна, гипокалиемия вследствие нарушения процессов реабсорбции и секреции может иметь место. При ее выявлении корригируют диету и проводимую препаратами калия терапию.
ЛЕЧЕНИЕ ОПН С КЛАССИЧЕСКОЙ КЛИНИЧЕСКОЙ КАРТИНОЙ
Ситуация существенно сложнее при классической клинической картине ОПН с олигурией.
Немедикаментозное лечение
Больному назначают диету с ограничением белка до 20 г/сут и продуктов, богатых калием, но необходимо обеспечить калорийность не менее 1500 ккал/сут, а лучше 2000 ккал/сут за счет углеводов и жиров. В крайнем случае возможно применение препаратов для парентерального питания. При отсутствии признаков дегидратации или гипергидратации на фоне анурии следует вводить не более 500 мл жидкости в сутки [8, 10, 11, 13].
Медикаментозное лечение
Если на момент осмотра у больного сохранен диурез, назначают петлевые диуретики (фуросемид до 200 мг, буметанид до 4 мг 4 раза в сутки). Необходимо отметить, что нарушение секреторной функции проксимального канальца, а также значительная клубочковая протеинурия существенно снижают эффект фуросемида, поэтому могут потребоваться особенно высокие дозы. При эффективности диуретиков лечение ими продолжают до развития стадии полиурии.
Однако фуросемид в больших дозах сам по себе нефротоксичен и может усиливать нефротоксичность аминогликозидов. В таких ситуациях лучше применять осмотический диуретик маннитол 1,0–1,5 г на 1 кг массы тела внутривенно капельно.
При отсутствии эффекта от максимальных доз диуретики отменяют. Следует отметить, что диуретики, если они достигают своего эффекта, делают лечение больного технически проще, так как появляется возможность инфузионной терапии, облегчается питание больного, уменьшается необходимость в гемодиализе. Однако диуретики не оказывают влияния на прогноз и смертность от ОПН.
То же самое можно сказать и в отношении допамина, который не оказывает влияния на скорость восстановления почечных функций у больных с ОПН. Допамин имеет смысл назначать только с целью коррекции стойкой гипотонии.
С целью снижения белкового катаболизма и стимуляции регенерации канальцевого эпителия рекомендуют анаболические стероиды. Вследствие гепатотоксичности они противопоказаны при сопутствующих поражениях печени.
Принципиально важен жесткий контроль за состоянием углеводного обмена. Гипергликемия существенно ухудшает прогноз. При необходимости снижения гликемии используются только инсулины короткого действия.
Гиперкалиемия
Обязателен контроль уровня электролитов крови и креатинина не реже 1 раза в сутки, а при минимальном подозрении на ухудшение состояния — экстренно. Для снижения гиперкалиемии показано введение 500 мл 5% раствора глюкозы с 8 ЕД инсулина внутривенно капельно, 20–30 мл 10% раствора глюконата кальция или 200 мл 4% раствора гидрокарбоната натрия внутривенно капельно. Все перечисленные выше мероприятия снижают уровень калия лишь на небольшое время и являются средствами интенсивной терапии. Выраженная гиперкалиемия (7 ммоль/л и выше) — абсолютное показание к проведению экстренного сеанса гемодиализа [7, 19-22].
При отсутствии эффекта от консервативной терапии показан гемодиализ, который проводят по интенсивной программе до наступления диуретической стадии. Во время гемодиализа несколько расширяют диету — белок до 40 г/сут, жидкость до 1000 мл сверх диуреза [1–3, 5, 8, 9, 11–13].
Показания к гемодиализу
Полиурическая стадия
Полиурия возникает из-за нарушения реабсорбции воды в канальцах. Больному разрешают пить столько жидкости, сколько он хочет. Поваренную соль ограничивать не следует. В эту стадию особенно необходим контроль за содержанием электролитов в крови. Постепенно отменяют диетические ограничения, основываясь на СКФ, — при достижении 40 мл/мин все ограничения снимают.
В стадию восстановления почечной функции лечение определяется основным заболеванием.
Дальнейшее ведение
После разрешения ОПН дальнейшее лечение зависит от основного заболевания, однако необходим ежемесячный контроль уровня креатинина в течение года, при возможности больному нужно избегать контактов с нефротоксичными веществами. Дальнейшая медикаментозная терапия любых заболеваний у этой группы пациентов проводится с обязательным учетом СКФ.
Примерные сроки временной нетрудоспособности — от 1 до 4 мес, в тяжелых случаях и более в зависимости от основного заболевания и объема поражения почечной ткани.
Прогноз
Выживаемость при ОПН зависит от возраста больного и основного заболевания. При ОПН в акушерской практике летальность составляет 8–15%, при ОПН на фоне легочной, сердечной или печеночной недостаточности — превышает 70%.
Летальность обусловлена нарушениями гемодинамики, сепсисом, уремической комой и составляет при классической ОПН с олигурией 50%, при неолигурической форме — 26%. У детей летальность составляет 30–60%, а при ОПН вследствие септического процесса достигает 74% [8, 9].
Критерием тяжести ОПН может служить продолжительность периода олигоанурии. Чем он дольше, тем ОПН тяжелее и прогноз хуже. Восстановление почечных функций после ОПН зависит от ее причины. При преренальной и постренальной ОПН восстановление почечных функций происходит у преобладающего большинства больных. Ренальная форма ОПН имеет менее благоприятный прогноз. При остром канальцевом некрозе (наиболее частая причина ОПН) через 1 год нормальную функцию почек имеют 63% больных, частичное восстановление — 31%, заместительной почечной терапии требуют 6% больных. Через 1 год после перенесенного острого интерстициального нефрита с ОПН полное восстановление отмечено у 75% больных. При ОПН на фоне гломерулонефрита прогноз существенно хуже. Через 1 год менее половины больных имеют сохранную функцию почек, четверть — находятся на заместительной почечной терапии, а через 5 лет заместительной терапии требуют уже 47% больных.
ЛИТЕРАТУРА
-
Болезни почек / под ред. Г. Маждракова и Н. Попова. — София: Медицина и физкультура, 1976.
-
Клиническая нефрология / под ред. Е.М. Тареева. — М.: Медицина, 1983.
-
Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология. — М.: Медицина, 1991.
-
Маколкин В.И., Подзолков В.И., Самойленко В.В. ЭКГ: анализ и толкование. — М.: ГЭОТАР-Медицина, 2000.
-
Мухин Н.А., Тареева И.Е. Диагностика и лечение болезней почек. — М.: Медицина, 1985.
-
Никифоров Ю.В., Максименко В.А., Чудаков И.Е. Критерии выбора метода экстракорпоральной детоксикации у больных с послеоперационной острой почечной недостаточностью //Анест. и реаниматол. — 1995. — № 4. — С. 38–41.
-
Руководство по урологии / под ред. Н.А. Лопаткина. — М.: Медицина, 1998.
-
Нефрология: руководство для врачей / под ред. И.Е. Тареевой. — М.: Медицина, 2000.
-
Сандриков В.А., Садовников В.И. Клиническая физиология трансплантированной почки. — М., 2001.
-
Шулутко Б.И. Нефрология 2002. Современное состояние проблемы. — СПб.: Ренкор, 2002.
-
Alexopolos E., Vakianis P., Kokolina E. et al. Acute renal failure in medical setting: changing patterns and prognostic factors //Renal Fail. — 1994. — Vol. 16. — P. 273–284.
-
Bonventre J. Mechanisms of ischemic acute renal failure //Kidney Int. — 1993. — Vol. 43. — P. 1160–1178.
-
Brenner B., Lasarius J. Acute renal failure. — Philadelphia: Saunders, 1983.
-
Cohen A. Two cases of renal failure of unknown etiology //Am. J. Med. — 1987. — Vol. 7. — P. 330–335.
-
Frendshorst W., Finn W., Gottschalk C. Pathogenesis of acute renal failurefollowing renal ischemia in the rat //Circl. Res. — 1975. — Vol. 37. — P.558–568.
-
Gillum D., Dixon B., Yanover M. еt al. The role of intensive dialysis in acuterenal failure //Clin. Nephrol. — 1986. — Vol. 25. — P. 249–255.
-
Hakim R., Wingard R., Parker R. Efffect of dialysis membrane in the treatment of patients with acute renal failure //N. Eng. J. Med. — 1994. — Vol. 331. — P. 1338–1341.
-
Kellerman P. Perioperative care of renal patients //Arch. Intern. Med. — 1994. — Vol. 154. — P. 1674–1688.
-
Kleiknecht D., Pallot J.-L. Epidemiologie et prognosis de l insuffifisancerenale aigue en 1997. Donnees recentes //Nephrologie. — 1998. — Vol. 19. — P. 49–55.
Список рекомендуемой литературы
-
Рациональная фармакотерапия в нефрологии: руководство для практикующих врачей / под ред. Н.А. Мухина, Л.В. Козловской, Е.М. Шилова. — 2006.
-
Даугирдас Д.Т., Блейк П.Д., Инг Т. Руководство по диализу / пер. с англ.: под ред. А.Ю. Денисова, В.Ю. Шило. — Тверь: Триада, 2003. — 744 с.
-
Ермоленко В.М., Николаев А.Ю. Острая почечная недостаточность: Библиотека врача-специалиста. — М.: ГЭОТАР-Медиа, 2010. — 230 с.
-
Николаев А.Ю. Милованов Ю.С. Лечение почечной недостаточности: руководство для врачей / 2-е изд. — М.: Медицинское информационное агентство, 2010. — 592 с.
-
The Kidney / B.M. Brener (ed). — 7th ed. — Sanders, 2003. — 3072 p.
-
Kellum J.A., Bellomo R., Ronco C. (ed). Acute kidney injury. Contributions to hephrology. — Karder, Basel. 2007. — 464 p.
Глава 14. ХРОНИЧЕСКАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
В.В. Борисов, Е.М. Шилов
Хроническая почечная недостаточность (ХПН) — необратимая утрата почкой своей функциональной способности, развивающаяся в результате постепенной гибели нефронов при любом прогрессирующем заболевании почек, который включает в себя не только уремию, но и проявления нарушений гомеостаза в результате постепенного склерозирования и гибели нефронов [8].
МКБ-10 • N18 Хроническая почечная недостаточность.
Эпидемиология
Заболеваемость ХПН в различных странах колеблется от 5 до 10 случаев, а распространенность — от 20 до 60 случаев на 100 тыс. взрослого населения с ежегодным увеличением на 10–15%. Среди детей в возрасте до 15 лет ХПН встречается в 5–14 случаях на 1 млн детского населения.
Необходимо отметить, что прогрессирование и скорость наступления терминальной стадии болезни зависят от степени активности нефропатии и тяжести нефросклероза. При этом высокоактивные и резистентные к лечению нефропатии чаще возникают у больных с первичноклубочковыми поражениями, в таком случае быстрее прогрессирует гибель почечной паренхимы и возникает ХПН.
Более 50% случаев ХПН у детей развивается в дошкольном и школьном возрасте.
Для урологических заболеваний характерно поражение канальцевого аппарата, более медленное развитие терминальной стадии болезни. Интермиттирующая стадия ХПН чаще протекает с периодами ухудшения и частичного восстановления функции после лечения воспалительного процесса в почках, ликвидации обструкции в нижних или верхних мочевыводящих путях.
В настоящее время наблюдается рост числа больных ХПН, что связано прежде всего с увеличением заболеваемости сахарным диабетом 2-го типа, успехами фармакотерапии, улучшающимся качеством и доступностью заместительной почечной терапии и как следствие — большей продолжительностью жизни хронических больных.
Среди всех причин летальных исходов ХПН занимает 11-е место.
Причины и факторы риска ХПН
-
Первичные поражения канальцев и интерстиция: хронический пиелонефрит, интерстициальный нефрит, балканская эндемическая нефропатия.
-
Первичные поражения сосудов почек: первичный нефросклероз (на фоне злокачественной артериальной гипертензии), атеросклероз почечных артерий, васкулиты.
-
Системные болезни соединительной ткани: системная красная волчанка, узелковый периартериит, ревматоидный артрит.
-
Болезни обмена веществ: сахарный диабет, подагра, первичный оксалоз, цистиноз.
-
Врожденные болезни почек: поликистоз, синдром Альпорта (врожденный нефрит с глухотой), врожденный синдром Де Тони–Дебре–Фанкони, амилоидоз.
-
Заболевания, вызывающие нарушение оттока мочи: стриктуры ЛМС и мочеточников; ретроперитонеальный фиброз, аденома и РПЖ, опухоли мочеточников и мочевого пузыря с поражением устьев мочеточников, опухоли, сдавливающие мочевыводящие пути извне, аномалии мочевыводящих путей, затрудняющие отток мочи из почек.
Если ХПН обусловлена нарушением пассажа мочи, при его восстановлении изменения частично обратимы.
Отдельно следует рассмотреть мочекаменную болезнь, травмы и опухоли почек. Нарушение обмена веществ, вызывающее рецидивирующий нефролитиаз, нередко приводит к развитию хронического интерстици ального нефрита и снижению функции почек; это происходит, например, при рецидивирующем уратном нефролитиазе на фоне подагры. Кроме того, затруднение оттока мочи из почек конкрементами также ведет к развитию вторичного нефросклероза. Однако основная причина ХПН у больных с мочекаменной болезнью — рецидивирующий хронический обструктивный пиелонефрит.
Односторонняя травма почек редко приводит к ХПН, но развивающийся после тяжелой травмы нефросклероз может быть причиной тяжелой артериальной гипертензии, результатом которой станет нефроангиосклероз контралатеральной почки.
Особо тяжелый контингент — больные с двусторонними опухолями почек и опухолью единственной почки. Новообразование в процессе своего роста замещает и сдавливает почечную паренхиму, сокращая число функционирующих нефронов. Непосредственно из-за опухолевого поражения почки ХПН развивается крайне редко и встречается уже в терминальной стадии онкологического процесса. Больные, как правило, умирают раньше этого срока. В настоящее время больным с двусторонними опухолями и опухолью единственной почки стараются выполнить органосохраняющие операции, что не всегда возможно. В этом случае пациента переводят в ренопривное состояние путем нефрэктомии с последующей заместительной почечной терапией (гемодиализ) [5, 6, 8].
Профилактика
Своевременное и адекватное лечение основного заболевания почек и устранение факторов риска (артериальная гипертензия, сахарный диабет, анемия, дислипидемия и др.) не всегда предотвращают ХПН, но, снижая активность патологического процесса, замедляют ее наступление и прогрессирование.
Скрининг
Задача скрининга — выявлять незначительно выраженную ХПН при различных хронических заболеваниях почек, а также у больных с длительным течением заболеваний, способствующих нарушению почечных функций (гипертоническая болезнь, сахарный диабет, хронический пиелонефрит и др.), чтобы в результате раннего начала терапии снизить активность нефропатии и улучшить прогноз. При диспансеризации больным выполняют общий анализ мочи, биохимический анализ крови, определяют клиренс креатинина.
Классификация и установление стадии ХПН
В настоящее время существует множество классификаций ХПН. Удобную для клинического применения классификацию предложил Е.М. Тареев (1972). Он выделяет три стадии в зависимости от СКФ: стадия I — 80–40 мл/мин, стадия II — 40–15 мл/мин, стадия III — ниже 15 мл/мин. В терапевтической практике чаще используют эту классификацию.
При I стадии ХПН лечат основное заболевание для замедления ее прогрессирования. На II стадии возможности терапии основного заболевания снижаются (особенно при лечении иммуносупрессантами из-за их токсичности). Требуется ограничение потребления белка, иногда специфическое лечение состояний, развившихся вследствие ХПН, — анемии, остеодистрофии. На III стадии ХПН (СКФ ниже 15 мл/мин) терапия основного заболевания отходит на задний план, если оно не является системным (системная красная волчанка, сахарный диабет и т.д.). Консервативная терапия ХПН становится малоэффективной, появляется необходимость в заместительной почечной терапии.
Не менее удобна более подробная классификация ХПН, предложенная Н.А. Лопаткиным и И.Н. Кучинским (1972). Она также основана на степени снижения СКФ. Выделяют четыре стадии: латентную, компенсированную, интермиттирующую, терминальную, которая, в свою очередь, подразделяется на четыре стадии. Этой классификацией чаще пользуются урологи с соответствующим контингентом больных, а также клиники по пересадке почки, где все первичные больные имеют терминальную ХПН и требуется четкость в определении показаний и противопоказаний к трансплантации почки.
В настоящее время все большее распространение получает классификация Национального почечного фонда США. Американские исследователи предлагают полностью отказаться от понятия «хроническая почечная недостаточность», заменив его на «хроническую болезнь почек» (ХБП). По своей сути эта классификация близка к отечественным и также основывается на определении СКФ: I стадия ХБП соответствует нормальной или повышенной СКФ (гиперфильтрация); II стадия — СКФ 89–60 мл/мин; III стадия — 59–30 мл/мин, IV стадия — 29–15 мл/мин; V стадия (терминальная) — СКФ ниже 15 мл/мин.
Диагностика
Проводят в амбулаторных условиях.
ЖАЛОБЫ И АНАМНЕЗ
Необходимо выяснить у больного наличие заболеваний, приводящих к ХПН, и их продолжительность. Встречаются больные, которые, не имея в анамнезе заболевания почек, впервые обращаются за помощью уже в терминальной стадии ХПН.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
На ранних стадиях ХПН ее клиническими симптомами являются полиурия и отчасти анемия. Все остальные приведенные ниже симптомы характерны для тяжелой декомпенсации болезни в терминальной стадии.
-
Сухая бледная кожа, иногда с желтым оттенком и петехиальными кровоизлияниями, кожный зуд.
-
Энцефалопатия: нарушение сна, снижение памяти, истощаемость внимания, при прогрессировании процесса — тремор, судороги, кома.
-
Полинейропатия: нарушения чувствительности по типу «носков» и «перчаток», синдром «беспокойных ног», парестезии, позже парезы и параличи.
-
Поражения костей: признаки рахита у детей, патологические переломы, боль в костях, по ходу позвоночника, корешковая боль.
-
Изменения крови: анемия, лимфопения, эозинопения, геморрагический диатез.
-
Поражения органов желудочно-кишечного тракта: тошнота, рвота, анорексия, запах аммиака изо рта, боль в проекции пораженного органа.
-
Нарушения обмена электролитов и воды: полиурия с потерей электролитов, затем олигурия и отеки с задержкой электролитов.
-
Сердечно-сосудистая система: артериальная гипертензия, сердечная недостаточность, дистрофия миокарда, перикардит, нарушения ритма сердца как из-за прямого токсического поражения проводящей системы, так и из-за нарушения электролитного баланса.
-
Органы дыхания: плеврит, интерстициальный отек легких [2, 5, 8, 9, 12–14].
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Определение уровня креатинина и удельной плотности мочи — при плотности более 1017 диагноз декомпенсированной ХПН крайне маловероятен.
Определение СКФ позволяет достаточно точно оценить имеющийся дефицит фильтрации и определить стадию заболевания.
Следующие диагностические мероприятия будут определяться основным заболеванием, стадией ХПН и ее проявлениями:
УЗИ почек позволяет оценить их размеры, толщину паренхимы, состояние чашечно-лоханочной системы, выявить конкременты, кисты, опухоли.
Динамическая нефросцинтиграфия дает возможность раздельно оценить функциональное состояние каждой почки и суммарно обеих почек. Перечисленные далее методы имеют особое значение в диагностике поздних стадий ХПН (преддиализный период).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Расчет СКФ решает все проблемы дифференциального диагноза. Если дефицит клубочковой фильтрации есть, можно ставить диагноз ХПН, если нет — она отсутствует. Неолигурическая форма ОПН является единственной ситуацией, когда существует некоторая неоднозначность в трактовании диагноза по СКФ. Необходимо помнить, что в острую фазу ОПН уровень креатинина всегда достаточно грубо не соответствует СКФ. Кроме того, для ОПН не характерны гипертрофия миокарда, поражения костей, анемия и другие изменения, развивающиеся в течение многих недель или даже месяцев.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Консультация нефролога желательна для всех больных и обязательна при признаках декомпенсации почечной недостаточности.
При развитии терминальной стадии больного следует поставить на учет в нефрологическом центре по месту жительства для решения вопроса о возможной заместительной почечной терапии. Одновременно с этим необходима консультация трансплантолога при планировании трансплантации почки.
При подозрении на обструктивную нефропатию показана консультация уролога. При артериальной гипертензии для осмотра больного привлекают окулиста, кардиолога.
Консультация эндокринолога необходима при диабетической нефропатии.
Лечение
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Плановая госпитализация показана больным с впервые выявленной выраженной ХПН, особенно неясной этиологии, главным образом для обследования.
Однозначно нуждаются в госпитализации больные декомпенсированной ХПН — при выраженной гиперазотемии (креатинин 700–1000 мкмоль/л), гиперкалиемии, олигурии, подозрении на уремический перикардит, при неконтролируемой гипертензии, выраженной недостаточности кровообращения. Гиперкалиемия выше 7 ммоль/л — показание к проведению экстренного сеанса гемодиализа [6].
ОБЩИЕ ДАННЫЕ ПО НЕФРОПРОТЕКЦИИ
ХПН — исход всех хронических заболеваний почек, однако сроки ее возникновения и скорость прогрессирования при разных заболеваниях разные. Причем срок возникновения ХПН определяется как особенностями нефропатии, так и неспецифическими факторами, из которых наибольшее значение имеют протеинурия, артериальная гипертензия и снижение числа действующих нефронов, в то время как скорость прогрессирования ХПН зависит почти исключительно от перечисленных выше неспецифических факторов.
Значительное снижение числа действующих нефронов даже при отсутствии основного патологического процесса в почечной паренхиме (например, после резекции единственной почки по поводу опухоли) приводит к гемодинамической перегрузке оставшихся клубочков, их гипертрофии и постепенному склерозированию. Гемодинамическую перегрузку клубочка возможно уменьшить посредством назначения ингибиторов АПФ и/или блокаторов рецепторов ангиотензина. Эти лекарственные препараты снижают внутрипочечную гипертензию, а также обладают выраженным антипротеинурическим действием. Антипротеинурический эффект указанных препаратов потенцируют ограничение потребления соли и диуретики.
Примерно такой же механизм прогрессирования нефросклероза и вследствие системной гипертензии. В настоящее время многими исследователями доказана обратная связь между уровнем системного АД и скоростью прогрессирования ХПН.
Клубочковая протеинурия приводит к повреждению клеток канальцевого эпителия, развитию воспалительного процесса в интерстициальной ткани почки и в конечном счете к тубулоинтерстициальному фиброзу. Этот механизм является одним из важнейших в отношении прогрессирования ХПН. Протеинурия нефротического уровня способ на более чем в 2 раза увеличить скорость прогрессирования ХПН.
Основные принципы современной тактики нефропротекции: нормализация и контроль системного артериального давления, назначение ингибиторов АПФ и/или блокаторов рецепторов ангиотензина даже при нормальном уровне артериального давления, уменьшение уровня протеинурии. Кроме того, обязательна своевременная коррекция анемии и нарушений минерального обмена вследствие вторичного гиперпаратиреоза.
Требует отдельного упоминания необходимость коррекции нарушений липидного обмена, способствующих прогрессированию нефросклероза. Нефропротективное действие ингибиторов гидроксиметилглутарил-КоА-редуктазы (статинов) в настоящее время известно. Наряду с гиполипидемическим действием всей группе препаратов свойственен антипротеинурический эффект, что делает их особенно показанными при протеинурических нефропатиях. Использование статинов при любой этиологии ХПН оправданно не только из-за нефропротективного эффекта, но и с точки зрения улучшения сердечно-сосудистого прогноза. Все статины имеют печеночный путь выведения и потенциально гепатотоксичны. Отсюда следуют возможность их применения в полной дозе на фоне ХПН и необходимость регулярного контроля уровня трансаминаз. При изначально нарушенной функции печени предпочтение отдается правастатину, имеющему двойной (печень + почки) путь выведения и несколько меньшую гепатотоксичность.
СТАДИЯ ХПН
Цель терапии — уменьшить скорость прогрессирования ХПН за счет лечения основного заболевания и неспецифических мероприятий (нормализация артериального давления, липидного и углеводного обмена). Следует по возможности избегать назначения нефротоксичных препаратов. Диета с ограничением соли. Показан длительный прием ингибиторов АПФ и/или блокаторов рецепторов ангиотензина.
Хирургическое лечение
Операции, восстанавливающие адекватный пассаж мочи при его нарушении.
Операции, восстанавливающие кровоснабжение почек.
СТАДИЯ ХПН
Цель терапии — предотвратить или уменьшить азотемическую интоксикацию.
Немедикаментозное лечение
Гипопротеиновая диета
Доказано, что гипопротеиновая диета замедляет скорость прогрессирования ХПНB [8, 16-20]. Однако резкое ограничение белка ведет к дистрофии практически всех тканей и органов, поэтому особо важную роль играет качество разрешенного количества белка. Наиболее полноценен животный белок. Больные ХПН обязательно должны включать в рацион мясо, рыбу, яйца, сыр, хотя и в уменьшенном количестве. Количество разрешенного в сутки белка определяется выраженностью ХПН. При СКФ 30–40 мл/мин показано умеренное ограничение белка до 0,8–1,0 г/кг, т.е. до 2 раз по 50–60 г/сут, из них животный белок должен составлять 40 г.
При СКФ 20–30 мл/мин разрешенное количество белка уменьшается до 0,5–0,6 г/кг, т.е. до 2 раз по 40 г/сут, из них 30 г белка животного происхождения. Эту диету больные переносят довольно тяжело.
Обеспечение организма протеинами до некоторой степени можно компенсировать кетостерилом. При этом количество необходимых калорий придется набирать исключительно с помощью продуктов питания. В качестве высококалорийных продуктов рекомендуют сало и жирную свинину, растительное и сливочное масло, сливки, мед, сладкие фрукты, варенье. За исключением алкогольного нефрита, не имеет смысла категорически запрещать спиртные напитки в небольших количествах, так как они высококалорийны и не содержат белок.
Гипокалиемия при ХПН может развиваться на фоне полиурии, состояние больных усугубляют неоправданные диетические ограничения и прием мочегонных, выводящих калийB [8, 16].
При выявлении гипокалиемии необходимо скорректировать диету и схему терапии, однако иногда это состояние разрешают назначением препаратов калия.
Учитывая важную роль гипертензии в прогрессировании ХПН, необходимо ограничение употребления поваренной соли.
Медикаментозное лечение
-
Ингибиторы АПФ и/или блокаторы рецепторов ангиотензина. Кетостерил по 4–8 таблеток 3 раза в день во время еды (в зависимости от массы тела больного и степени ограничения потребления белка).
-
Анаболические стероиды или андрогены (мужчинам) особенно показаны при сопутствующей мышечной дистрофии, анемии, остеопорозе.
-
По жестким показаниям и особым схемам — препараты железа, кальция.
-
При необходимости — витамины группы В, аскорбиновая кислота, лекарственные средства, улучшающие микроциркуляцию.
Оперативное лечение
СТАДИЯ ХПН
На III стадии ХПН (СКФ ниже 15 мл/мин) возникает ее декомпенсация. Проводимая консервативная терапия малоэффективна, постепенно нарастает уровень азотемии, на фоне чего усиливаются симптомы интоксикации.
Основная цель консервативной терапии в терминальной стадии ХПН — предотвратить развитие тяжелых токсических поражений внутренних органов (перикардит, дистрофия миокарда, энцефалопатия и т.д.) до начала заместительной почечной терапии.
Немедикаментозное лечение
Показано исключение продуктов, богатых калием, резкое ограничение потребляемого белка до 20 г/сут, при этом весь белок животный. Важно по возможности сохранить калорийность питания за счет жиров и углеводов.
Показания к ограничению жидкости
При тяжелом дефиците фильтрации (СКФ ниже 15 мл/мин) количество жидкости, разрешенной к употреблению, рассчитывают по диурезу. Больной может употребить на 300–500 мл жидкости больше, чем он выделил мочи за предыдущие сутки.
Поваренную соль ограничивают при отеках и сердечной недостаточности, а также при артериальной гипертензии. Практически не ограничивают употребление соли при «сольтеряющей почке». При ХПН на фоне первичных клубочковых поражений разрешают 3–5 г/сут поваренной соли, при ХПН на фоне первичных канальцевых поражений — 10–15 г/сут при полиурии и потере солей.
Медикаментозное лечение
-
Кетостерил по 4–8 таблеток 3 раза в день во время еды (в зависимости от массы тела больного и степени ограничения потребления белка).
-
Анаболические стероиды или андрогены (мужчинам), особенно при сопутствующей мышечной дистрофии, анемии, остеопорозе. При невозможности проведения заместительной почечной терапии — энтеросорбция.
Гиперкалиемия
При содержании калия 6,5–7,0 ммоль/л необходимо срочно ввести 500 мл 5% раствора глюкозы с 8 ЕД инсулина внутривенно капельно; при его содержании 7 ммоль/л и выше — 500 мл 5% раствора глюкозы с 8 ЕД инсулина, 20–30 мл 10% раствора глюконата или 200 мл 4% раствора гидрокарбоната натрия внутривенно капельно. Все перечисленные выше мероприятия снижают уровень калия на короткий срок.
Они лишь являются средствами скорой помощи при угрозе нарушений сердечной деятельности. Выраженная гиперкалиемия (7 ммоль/л и выше) — показание к проведению экстренного сеанса гемодиализаA [1, 2, 5, 8, 9, 12–15].
Лечение анемии
Лечение почечной остеодистрофии
Препараты выбора — активные метаболиты витамина D. Дозу подбирают индивидуально от 0,25 мкг 2 раза в неделю до 1 мкг/сут. При грубом поражении тел позвонков с угрозой патологического перелома дополнительно назначают препараты фтора — натрия фторид, тридин или кальцитонин, являющийся препаратом резерваC [1, 3, 4, 10].
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ (ДЛЯ ВСЕХ СТАДИЙ)
Основные препараты
Базовыми гипотензивными средствами являются ингибиторы АПФ, которые наряду с системным гипотензивным эффектом снижают внутриклубочковую гипертензию и уменьшают протеинурию.
Ингибиторы АПФ. Двусторонний стеноз или поражение артерии единственной (единственно функционирующей) почки — противопоказание к применению этих препаратов. При выборе препарата внутри группы необходимо стремиться к назначению 1 раз в сутки, а также учитывать способ выведения препарата. Что касается продолжительности действия, все ингибиторы АПФ, кроме каптоприла и в некоторой степени эналаприла, можно назначать однократно. Ингибиторы АПФ, выводящиеся в неизмененном виде исключительно почками, требуют точного подбора дозы даже на самых ранних стадиях ХПН и последующей корректировки ее по мере прогрессирования заболевания (лизиноприл, каптоприл). Препараты, выводящиеся почками в виде метаболитов или имеющие смешанный почечно-печеночный путь выведения (эналаприл, цилазаприл, трандолаприл, фозиноприл, периндоприл, рамиприл), назначают в полной дозе при компенсированной ХПН, а затем, по достижении СКФ 30 мл/мин, требуется коррекция доз.
Блокаторы АТ1-рецепторов в настоящее время также применяют все чаще. Нефропротективный эффект их хорошо доказан многими исследованиями. В последнее время появились рекомендации одновременного назначения ингибиторов АПФ и блокаторов рецепторов ангиотензина. Из всей группы выделяют лозартан и телмисартан, имеющие практически полностью печеночный путь выведенияC [8, 9, 24, 25].
При высоком АД в сочетании с редким пульсом, что при заболеваниях почек не является редкостью, особенно показаны блокаторы медленных кальциевых каналов. Лучше назначать препараты II–III поколения, применяемые 1 раз в сутки. Возможно назначение пролонгированных форм блокаторов медленных кальциевых каналов I поколения. Они также рассчитаны на однократный прием. Особо следует отметить благоприятное влияние на почечную гемодинамику всех препаратов этой группы: увеличение почечного кровотока, снижение почечного сосудистого сопротивления, увеличение СКФ. В наибольшей степени этот эффект присущ дилтиазему, нифедипину, амлодипину.
При протеинурических нефропатиях более целесообразны негидропиридиновые блокаторы кальциевых каналов (верапамил и дилтиазем), имеющие антипротеинурический эффект.
При задержке жидкости, отеках, застойной сердечной недостаточности обязательно назначение диуретиков. Назначение тиазидных диуретиков при ХПН допускается, однако при СКФ 30 мл/мин их эффективность резко снижается. Тиазидные диуретики противопоказаны при подагрической нефропатии. Петлевые диуретики можно применять и при более низкой СКФ. Калийсберегающие диуретики при самых начальных стадиях ХПН вполне приемлемы, однако при выраженном дефиците СКФ из соображений безопасности их лучше не применять.
При протеинурических нефропатиях следует иметь в виду, что диуретики потенцируют антипротеинурический эффект ингибиторов АПФ и блокаторов рецепторов ангиотензина.
При артериальной гипертензии на фоне тахикардии показаны β-адреноблокаторы. Безопасней и легче подобрать дозу при применении препаратов длительного действия с преимущественно печеночным путем выведения — бетаксолол, небиволол, применяемые 1 раз в сутки. Бисопролол элиминируется и почками, и печенью. При ХПН все большую роль начинает играть печеночный путь выведения, поэтому бисопролол также можно рекомендовать этим пациентам.
Препараты резерва
С гипотензивной целью можно назначать длительно действующие α-адреноблокаторы: теразозин, доксазозин, альфузозин. Их применение особенно оправданно при сопутствующей ДГПЖ с нарушением мочеиспускания.
Препараты центрального действия
Клонидин можно назначать для купирования гипертонических кризов. Моксонидин и рилменидин применяют редко, однако у них есть ряд важных свойств. Их можно использовать при высоком АД без сопутствующей тахикардии, они не снижают почечный кровоток при падении артериального давления и усиливают чувствительность рецепторов к инсулину, что важно при сопутствующем сахарном диабете 2-го типа или метаболическом синдроме. Значительная часть введенной дозы этих препаратов выводится почками, поэтому требуется коррекция дозировок уже при СКФ 60 мл/мин.
ТРАНСПЛАНТАЦИЯ ПОЧКИ
Принципиальное показание к трансплантации почки — тяжелая прогрессирующая ХПН, независимо от причины, вызвавшей ее.
Абсолютные противопоказания (при которых трансплантация в принципе не может быть выполнена).
Относительные противопоказания (те, которые могут быть устранены или компенсированы, после чего проведение трансплантации почки становится возможным).
Обучение больного
При ХПН успех лечения во многом зависит от больного, его мотивации и усердия в выполнении назначений. В связи с этим с пациентом необходимо подробно обсудить объем и последовательность терапии, обращая особое внимание на диетические рекомендации (иногда трудновыполнимые) и водно-солевой режим, тогда исполнение их будет осмысленным, а значит и более эффективным. Всем больным показан ежедневный самоконтроль артериального давления, и желательны принципы коррекции повышений АД. Следует обратить внимание на то, что, к какому бы врачу ни попал пациент, первое, что он должен сделать, — это сообщить о своем почечном заболевании и ХПН, так как они сильно влияют на любое лечение. Врачу следует написать больному список препаратов, которые ему категорически противопоказаны и которых по возможности следует избегать. Понятно, что перечень этот определяется не только ХПН, но и основным заболеванием.
Прогноз
В стадиях ХПН, когда возможна консервативная терапия, прогноз в большей степени определяется степенью коррекции артериальной гипертензии и уровнем протеинурии. Некоторую роль играет и активность основной нефропатии. Очевидно, что при отсутствии активности прогноз лучше. При диабетической нефропатии дополнительным важнейшим фактором является степень компенсации сахарного диабета. Согласно исследованиям, при достижении среднего АД 92 мм рт.ст. скорость снижения СКФ уменьшается на 0,6 мл/мин в год, а продолжительность додиализного периода увеличивается в среднем на 1,24 года; длительный прием рамиприла увеличил продолжительность додиализного периода практически на 3 года. При отсутствии системных заболеваний прогноз существенно благоприятнее. Так, пятилетняя выживаемость молодых больных на гемодиализе при отсутствии системных заболеваний составляет более 90%, а при диабетической нефропатии — всего 20%. Основная причина смерти больных, получающих заместительную почечную терапию, — сердечно-сосудистые осложнения (около 45%). Непосредственной причиной смерти больных на гемодиализе, по данным Московского городского нефрологического центра, в 22,9% случаев стала уремия.
ЛИТЕРАТУРА
-
Болезни почек / под ред. Г. Маждракова и Н. Попова. — София: Медицина и физкультура, 1976.
-
Клиническая нефрология / под ред. Е.М. Тареева. — М.: Медицина, 1983.
-
Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология. — М.: Медицина, 1991.
-
Маколкин В.И., Подзолков В.И., Самойленко В.В. ЭКГ: анализ и толкование. — М.: ГЭОТАР-Медицина, 2000.
-
Мухин Н.А., Тареева И.Е. Диагностика и лечение болезней почек. — М.: Медицина, 1985.
-
Никифоров Ю.В., Максименко В.А., Чудаков И.Е. Критерии выбора метода экстракорпоральной детоксикации у больных с послеоперационной острой почечной недостаточностью // Анест. и реаниматол. — 1995. — № 4. — С. 38–41.
-
Руководство по урологии / под ред. Н.А. Лопаткина. — М.: Медицина, 1998.
-
Нефрология: руководство для врачей / под ред. И.Е. Тареевой. — М.: Медицина, 2000.
-
Сандриков В.А., Садовников В.И. Клиническая физиология трансплантированной почки. — М., 2001.
-
Шулутко Б.И. Нефрология 2002. Современное состояние проблемы. — СПб.: Ренкор, 2002.
-
Alexopolos E., Vakianis P., Kokolina E. et al. Acute renal failure in medical setting: changing patterns and prognostic factors //Renal Fail. — 1994. — Vol. 16. — P. 273–284.
-
Bonventre J. Mechanisms of ischemic acute renal failure //Kidney Int. – 1993. — Vol. 43. — P. 1160–1178.
-
Brenner B., Lasarius J. Acute renal failure. — Philadelphia: Saunders, 1983.
-
Cohen A. Two cases of renal failure of unknown etiology //Am. J. Med. — 1987. — Vol. 7. — P. 330–335.
-
Frendshorst W., Finn W., Gottschalk C. Pathogenesis of acute renal failurefollowing renal ischemia in the rat // Circl. Res. — 1975. — Vol. 37. — P. 558–568.
-
Gillum D., Dixon B., Yanover M. еt al. The role of intensive dialysis in acuterenal failure //Clin. Nephrol. — 1986. — Vol. 25. — P. 249–255.
-
Hakim R., Wingard R., Parker R. Efffect of dialysis membrane in the treatment of patients with acute renal failure // N. Eng. J. Med. — 1994. — Vol. 331. — P.1338–1341.
-
Kellerman P. Perioperative care of renal patients // Arch. Intern. Med. – 1994. — Vol. 154. — P. 1674–1688.
-
Kleiknecht D., Pallot J.-L. Epidemiologie et prognosis de l insuffifisancerenale aigue en 1997. Donnees recentes //Nephrologie. — 1998. — Vol. 19. — P. 49–55.
Список рекомендуемой литературы
-
Рациональная фармакотерапия в нефрологии: руководство для практикующих врачей / под ред. Н.А. Мухина, Л.В. Козловской, Е.М. Шилова. — 2006.
-
Даугирдас Д.Т., Блейк П.Д., Инг Т. Руководство по диализу / пер. с англ.: под ред. А.Ю. Денисова, В.Ю. Шило. — Тверь: Триада, 2003. — 744 с.
-
Ермоленко В.М., Николаев А.Ю. Острая почечная недостаточность: Библиотека врача-специалиста. — М.: ГЕОТАР-Медиа, 2010. — 230 с.
-
Николаев А.Ю. Милованов Ю.С. Лечение почечной недостаточности: руководство для врачей / 2-е изд. — М.: Медицинское информационное агентство, 2010. — 592 с.
-
The Kidney / B.M. Brener (ed). — 7th ed. — Sanders, 2003. — 3072 p.
-
Kellum J.A., Bellomo R., Ronco C. (ed). Acute kidney injury. Contributions to hephrology. — Karder, Basel. 2007. — 464 p.
Глава 15. ОСТРЫЙ ПИЕЛОНЕФРИТ
Н.А. Григорьев, А.В. Зайцев, Р.Р. Харчилава
Пиелонефрит — неспецифический инфекционно-воспалительный процесс, характеризующийся одновременным или последовательным поражением чашечно-лоханочной системы и паренхимы почек (преимущественно интерстициальная ткань) [3].
МКБ-10 • N10 Острый пиелонефрит.
Эпидемиология
Заболеваемость острым пиелонефритом составляет 100 больных на 100 тыс. человек [3].
Профилактика
Общая профилактика заключается:в исключении переохлаждений;
Профилактика вторичного пиелонефрита состоит в своевременном восстановлении нарушений пассажа мочи по мочевыводящим путям.
Скрининг
В качестве скринингового теста используют общий анализ мочи и УЗИ органов мочевыделительной системы, дополненные расспросом больного о характерных проявлениях острого пиелонефрита и заболеваниях, способствующих его развитию.
Классификация
Выделяют:
По локализации процесс может быть одноили двусторонним. Выделяют стадии острого пиелонефрита [2–4, 8]:
Диагностика
ЖАЛОБЫ
Для острого пиелонефрита характерна триада клинических признаков:
Кроме того, возможны неспецифические жалобы на:
Дизурия — учащенное болезненное мочеиспускание различной степени выраженности, особенно если течению острого пиелонефрита сопутствует цистит [1–3, 5, 8, 9].
АНАМНЕЗ
Первичный острый пиелонефрит может возникать у практически здоровых людей после переохлаждения или стрессовых ситуаций. Часто это заболевание осложняет течение цистита [3].
При опросе необходимо уточнить наличие у больного:
Важны сведения о перенесенных воспалительных заболеваниях инфекционной этиологии, приеме антибактериальных препаратов и их эффективности. У беременных необходимо выяснять срок беременности и особенности ее течения.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
При развернутой клинической картине острого пиелонефрита отмечают:
Выраженность симптомов может варьировать от несильной боли в поясничной области и субфебрильной температуры до гектической лихорадки и резкой болезненности при пальпации в области почки (при гнойном пиелонефрите) [1–3, 5, 6, 8, 9].
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
В общем анализе мочи выявляют повышение количества лейкоцитов (в большинстве случаев нейтрофилов) и бактериурию. Возможны небольшая протеинурия (до 1 г/сут) и микрогематурия [1–3, 5, 6, 8, 9]. Бактериологический анализ мочи помогает выявить возбудителя заболевания и назначить адекватную антибактериальную терапию. Бактериурия > 10×4 КОЕ/мл при остром пиелонефрите считается клинически значимой. В 80% случаев возбудителем является E. Coli (штаммы, имеющие дополнительные факторы вирулентности, особенно P. pili). Другими уропатогенами могут быть Enterococci (Streptococcus faecalis), Klebsiella spp., Proteus spp. и Pseudomonas spp. Однако до получения результатов обязательно проведение эмпирического лечения. Особое значение данный анализ приобретает при неэффективности проводимой терапии [7, 10, 11, 16].
УЗИ позволяет диагностировать отек паренхимы почки и ее очаговые изменения, а допплерография — степень нарушения кровотока. Расширение чашечно-лоханочной системы свидетельствует о нарушении оттока мочи из почки и вторичном характере заболевания [1–3, 5, 6, 8, 9].
В общем анализе крови обращают внимание на гематологические признаки острого пиелонефрита:
Биохимический анализ крови выполняют для уточнения функционального состояния почек и печени.
Пробу Реберга проводят при подозрении на ХБП.
Обзорная урография помогает диагностировать калькулезный характер острого пиелонефрита.
По данным экскреторной урографии определяют состояние почек и мочевыводящих путей, а также пассаж мочи. КТ и МРТ позволяют выявить:
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Пионефроз (гнойное воспаление почки с расплавлением ее паренхимы) проявляется утратой функции почки и персистирующей интоксикацией у больного с длительным анамнезом.
Инфаркт почки характеризуют интенсивная боль и гематурия на фоне мерцательной аритмии, инфекционного эндокардита, аортоартериита. Инфаркт почки может быть проявлением антифосфолипидного синдрома. При расспросе больного необходимо акцентировать внимание на ранее перенесенные тромбозы сосудов.
Расслоение аневризмы аорты сопровождается интенсивной болью на фоне высокого артериального давления и часто снижения диуреза. При аускультации слышен шум над аневризмой. Диагноз подтверждают данными УЗИ.
При остром аппендиците с тазовым расположением червеобразного отростка возможно учащенное мочеиспускание. Однако быстро прогрессирующая боль в паховой и подвздошной областях, симптомы раздражения брюшины и ПРИ помогают в дифференциальной диагностике. Для ретроцекального аппендицита характерна типичная локализация боли, однако симптомы раздражения брюшины могут отсутствовать. Важно помнить, что для пиелонефрита нехарактерен симптом Кохера (постепенное перемещение боли из эпигастральной области в правую подвздошную).
Острый холецистит и желчная колика проявляются болью в правом подреберье с характерной иррадиацией (зоны Захарьина–Геда), выраженной болезненностью при пальпации в этой области и симптомом раздражения брюшины. Диагноз подтверждают данными УЗИ.
При нижнедолевой плевропневмонии боль вызвана раздражением плевры. Жалобы, характерные для этого заболевания, перкуторные и аускультативные признаки, а также рентгенография грудной клетки помогают в дифференциальной диагностике.
Инфаркт селезенки проявляется резкой болью в левом подреберье, рефлекторной рвотой, парезом кишечника, лихорадкой и тахикардией. Он характерен для больных с пороком сердца (чаще митральным) или септическим эндокардитом.
Острый панкреатит отличают интенсивная опоясывающая боль и боль в эпигастральной области, а также болезненность при пальпации в левом реберно-позвоночном углу и симптом раздражения брюшины. В анамнезе часто выявляют желчнокаменную болезнь, алкогольные эксцессы. При подозрении на острый панкреатит обязательно исследование уровня амилазы в моче [1-6, 8].
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИМИ СПЕЦИАЛИСТАМИ
В отсутствие уролога больным с подозрением на острый пиелонефрит показана консультация хирурга для исключения острой хирургической патологии и в связи с возможной необходимостью оперативного лечения.
Если заболевание возникло на фоне декомпенсированного сахарного диабета, показана консультация эндокринолога, а в его отсутствие — терапевта. Консультация терапевта также необходима при возникновении острого пиелонефрита на фоне сопутствующих заболеваний, требующих соответствующего лечения.
Консультация нефролога показана:
Лечение
ЦЕЛЬ ЛЕЧЕНИЯ
Заключается в ликвидации инфекционно-воспалительного процесса и санации мочевыводящих путей на фоне адекватного оттока мочи из почки.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
При остром вторичном пиелонефрите необходима экстренная госпитализация в урологический стационар в связи с необходимостью экстренного восстановления пассажа мочи с целью предотвращения опасных для жизни осложнений (бактериотоксический шок). При остром первичном пиелонефрите также желательна госпитализация с целью адекватной парентеральной терапии. Кроме того, при этой форме заболевания серозная фаза может быстро прогрессировать в гнойную, требующую экстренного оперативного лечения. В крайнем случае, при уверенности в диагнозе острого первичного (необструктивного) пиелонефрита, антибактериальную терапию можно начать и амбулаторно.
Однозначно нуждаются в экстренной госпитализации больные:
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
При остром пиелонефрите и восстановленном пассаже мочи необходимо поддерживать достаточный диурез. Объем выпиваемой жидкости должен составлять 2000–2500 мл/сут. Рекомендовано применение мочегонных сборов, витаминизированных отваров (морсов) с антисептическими свойствами (клюква, брусника, шиповник).
Назначать обильное питье или значительные по объему инфузии нельзя при сопутствующей застойной сердечной недостаточности, высокой артериальной гипертензии. При нарушении углеводного обмена выпиваемая жидкость не должна содержать сахар.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
В лечении острого пиелонефрита ведущее значение имеет антибактериальная терапия. Выбор препарата должен определяться:
Адекватно подобрать антибактериальную терапию возможно только после выполнения бактериологического анализа мочи с идентификацией возбудителя и определением его чувствительности к антибиотикам. Однако при остром пиелонефрите успех напрямую зависит от эмпирического подбора антибактериального лечения. По получении результатов бактериологического анализа необходимо скорректировать антибактериальную терапию.
Принципы эмпирического назначения антибактериальной терапии
-
Предположение возможного возбудителя (или нескольких возбудителей) позволяет определить природную чувствительность этого микроорганизма к антибактериальным препаратам.
-
Анализ предшествующей антибактериальной терапии с учетом пробелов в спектре действия ранее применяемых неэффективных препаратов.
-
Учет функционального состояния почек и печени (при ХПН и/или циррозе печени схема терапии может значительно измениться).
-
Предотвращение развития антибактериальной резистентности микроорганизмов (назначение адекватных доз препаратов, ограничение использования антисинегнойных антибиотиков).
-
Учет экономических аспектов (по возможности избегать назначения дорогостоящих антибактериальных средств).
Если острый пиелонефрит возник впервые в жизни, больной поступил из дома и не получал ранее антибактериальные препараты, то предполагаемый возбудитель заболевания — кишечная палочка (нельзя исключить и грамположительную флору).
Препаратами выбора для лечения острого пиелонефрита являются фторхинолоны 7–10 дней в качестве терапии первой линии, если уровень резистентности E. coli к ним в данном регионе составляет <10%.
Россия относится к региону с высоким уровнем распространения фторхинолонрезистентных штаммов (согласно данным исследования ДАРМИС, резистентность кишечной палочки к фторхинолонам при неосложненных ИМП 10,9% (23).
В связи с последними рекомендациями FDA рекомендует ограничить применение фторхинолонов (при некоторых неосложненных инфекциях – синуситы, бронхиты, ИМП), когда существует возможность альтернативной антибиотикотерапии, в связи с участившимися случаями тяжелых побочных явлений, затрагивающих периферическую и ЦНС. FDA требует обновить информацию по безопасности на этикетках и руководствах всех фторхинолонов (24).
При увеличении суточной дозы фторхинолона курс лечения может быть сокращен до 5 дней. Увеличение числа штаммов E. coli, резистентной к фторхинолонам, ограничивает в настоящее время эмпирическое применение препаратов этой группы. Необходимо помнить, что фторхинолоны противопоказаны при беременности.
Альтернативными препаратами являются пероральные цефалоспорины 3-го поколения: цефтибутен или цефиксим. амоксиклав не рекомендован для эмпирического перорального лечения острого пиелонефрита. Антибиотик может быть назначен при выявлении чувствительных к нему грамположительных микроорганизмов.
Врегионах с высоким уровнем распространения фторхинолонрезистентных и продуцирующих бета-лактамазы расширенного спектра действия (БЛРС) штаммов E. coli (> 10%), рекомендуется начальная эмпирическая терапия аминогликозидами или карбапенемами до получения данных бактериологического исследования о чувствительности к другим антибиотикам (21,22).
При тяжелом течении пиелонефрита показана экстренная госпитализация для исключения наличия осложняющих факторов и проведения парентеральной антибактериальной терапии. После улучшения состояния больного возможен дальнейший пероральный прием антибиотиков (ступенчатая терапия).
Острый неосложненный пиелонефрит нетяжелого течения
| Антибиотик | Суточная доза | Продолжительность курса лечения |
|---|---|---|
Ципрофлоксацин |
500750 мг 2 р/сут |
7–10 дней |
Ципрофлоксацин |
1000 мг 1 раз/сут |
7 дней |
Левофлоксацин |
500 мг 1 р/сут |
7–10 дней |
Левофлоксацин |
750 мг 1 р/сут |
5 дней |
Альтернативные препараты (эквивалентная клиническая, но не микробиологическая эффективность по сравнению с фторхинолонами) |
||
Цефтибутен |
400 мг 1 р/сут |
10 дней |
Цефиксим |
400 мг 1 р/сут |
10 дней |
Острый неосложненный пиелонефрит тяжелого течения
| Антибиотик | Суточная доза | Продолжительность курса лечения |
|---|---|---|
Стартовая парентеральная терапия |
||
Эртапенем |
в/в, в/м 1 г 1р/сут |
7–10 дней |
Имипенем/циластатин |
в/в 500–мг 4 р/сут |
7–10 дней |
Меропенем |
в/в 1 г 3–р/сут |
7–10 дней |
Пиперациллин/тазобактам |
в/в 2,25 г 4 р/сут |
7–10 дней |
Тикарциллин/клавуланат |
в/в 3,2 г 3–р/сут |
7–10 дней |
± Амикацин |
в/в 15 мг/кг 1 р/сут |
|
Альтернативная терапия (при известной чувствительности и если БЛРС<10%) |
||
Цефтазидим |
в/в, в/м 2 г 3 р/сут |
14 дней |
Цефотаксим |
в/в, в/м 2 г 3 р/сут |
14 дней |
Цефтриаксон |
в/в, в/м 1–2 г 2 р/сут |
14 дней |
Цефепим |
в/в, в/м 2 г 2 р/сут |
14 дней |
± Амикацин |
в/в 15 мг/кг 1 р/сут |
|
Только при известной чувствительности возбудителя и если БЛРС<10% |
||
Левофлоксацин |
в/в 500 мг 1–2 р/сут |
7–10 дней |
Ципрофлоксацин |
в/в 800 мг 2 р/сут |
7–10 дней |
± Амикацин |
в/в 15 мг/кг 1 р/сут |
|
У больных декомпенсированным сахарным диабетом в связи с высокой вероятностью наличия стафилококка препаратами выбора являются ингибиторзащищенные аминопенициллины и ципрофлоксацин.
Если острый пиелонефрит развивается у больных, имеющих выраженную почечную недостаточность (скорость клубочковой фильтрации менее 40 мл/мин), необходимо учитывать фармакокинетику лекарственных средств. Предпочтение отдается препаратам, имеющим печеночный или двойной (печень + почки) путь выведения, — пефлоксацину, цефтриаксону, цефоперазону. Это существенно упрощает подбор дозы и значительно увеличивает безопасность лечения. При любой выраженности ХПН крайне нежелательно применение нефротоксичных антибиотиков — аминогликозидов и гликопептидов.
Острый пиелонефрит у ВИЧ-инфицированных больных, а также у«внутривенных» наркоманов нередко обусловлен редкими и нехарактерными возбудителями, особенно грамположительными, что диктует необходимость применения схем антибактериальной терапии с максимально широким спектром действия. Кроме того, препараты антиретровирусной терапии, назначаемые для подавления репликации HIV, достаточно токсичны и обладают большим количеством лекарственных взаимодействий, поэтому предпочтение отдается антибактериальным средствам, не метаболизирующимся в организме и имеющим почечный путь выведения, — фторхинолонам (особенно офлоксацину и левофлоксацину), аминогликозидам, цефалоспоринам (кроме цефотаксима, цефтриаксона и цефоперазона).
Острый пиелонефрит, вызванный госпитальными полирезистентными штаммами. В реальной клинической практике встречается нечасто. В большинстве случаев он является следствием длительного пребывания в стационаре, ошибочной антибактериальной профилактики или неадекватной функции дренажей после вмешательства на органах мочеполовой системы. При высокой вероятности полирезистентной грамотрицательной инфекции препаратом выбора является цефтазидим в режиме монотерапии или в сочетании с амикацином. Препараты резерва — карбапенемы, кроме эртапенема.
Острый пиелонефрит у больных с нейтропенией является жизнеугрожающей ситуацией. Принципиально важна возможность наличия госпитальных полирезистентных штаммов. Обычно сразу назначается цефтазидим или карбапенем с ванкомицином. Поскольку в условиях нейтропении существует реальная опасность глубоких микозов или даже грибкового сепсиса, есть смысл схему терапии превентивно дополнить флуконазолом.
СИМПТОМАТИЧЕСКОЕ ЛЕЧЕНИЕ
Направлено на коррекцию дефицита жидкости в организме и уменьшение симптомов интоксикации. С этой целью назначают внутривенные инфузии солевых и коллоидных растворов и препараты, улучшающие микроциркуляцию. Схему в каждом конкретном случае определяют в зависимости от объема поражения и состояния больного. При показаниях в комплекс лечения включают эфферентные методы.
НАБЛЮДЕНИЕ
После окончания курса лечения, при отсутствии симптомов пиелонефрита, контрольное бактериологическое исследование мочи выполнять не обязательно, за исключением беременных женщин.
Больным с сохраняющимися выраженными симптомами пиелонефрита в течение 3 суток или при рецидиве заболевания в течение 2-х недель, показано повторное бактериологическое исследование мочи и определение чувствительности микроорганизмов к антибиотикам, а также выполнение УЗИ, КТ или нефросцинтиграфии.
При отсутствии анатомо-функциональных изменений мочевыводящих путей, следует предположить, что инфекционный агент не был чувствителен к применявшемуся антибиотику и показана альтернативная терапия, основанная на результатах бактериологического исследования.
У больных с рецидивом заболевания, вызванного тем же самым уропатогеном диагноз неосложненный пиелонефрит должен быть пересмотрен. Необходимо исключить наличие осложняющих факторов.
ОПЕРАТИВНОЕ ЛЕЧЕНИЕ
Острый вторичный пиелонефрит рассматривают как показание к экстренному оперативному лечению [3].
Катетеризацию мочеточника (установку наружного или внутреннего стента) проводят при остром вторичном пиелонефрите в качестве неотложной помощи с целью восстановления пассажа мочи или как одно из основных лечебных мероприятий при крайне тяжелом общем состоянии больного и невозможности проведения оперативного лечения.
ЧПНС — один из основных методов отведения мочи при остром обструктивном пиелонефрите в стадии серозного воспаления. Нередко данный вид оперативного вмешательства считают методом выбора у мужчин в связи с опасностью трансуретральных манипуляций. Она показана больным, которым необходимо относительно длительное дренирование почек. ЧПНС, так же, как и установка внутреннего стента, дает возможность избежать открытой операции у больных острым калькулезным пиелонефритом, позволяет купировать приступ заболевания и через некоторое время (3–4 нед) после проведения адекватной предоперационной подготовки удалить камень с помощью малоинвазивных методов (ДЛТ, эндоскопические, лапароскопические и ретроперитонеоскопические операции).
Показания к открытому оперативному лечению
Острый пиелонефрит в стадии гнойного воспаления.
Невозможность дренирования почки малоинвазивными методами независимо от причины.
Отрицательная динамика на фоне адекватной антибактериальной терапии и функционирующей нефростомы. Объем операции:
По возможности удаление конкрементов из почки и из верхней трети мочеточника (если это существенно не увеличивает объем вмешательства).
Показания к нефрэктомии
Дальнейшее ведение
Прогноз
Прогноз для жизни при остром пиелонефрите, как правило, благоприятный. Адекватная антибактериальная терапия и своевременные оперативные вмешательства практически всегда позволяют улучшить состояние больного. Однако у пациентов с особенно тяжелыми сопутствующими заболеваниями, а также при развитии токсического шока летальность остается высокой — около 20%.
Если острый пиелонефрит удалось полностью купировать, то прогноз для функции пораженной почки также оценивают как благоприятный. Однако не исключено развитие прогрессирующего нефросклероза, вероятность которого напрямую зависит от тяжести перенесенных инфекционно-воспалительных заболеваний [2, 3, 6].
ЛИТЕРАТУРА
-
Лопаткин Н.А. Руководство по урологии. — М.: Медицина, 1998.
-
Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология. — М.: Медицина, 1991.
-
Маждраков Г., Попов Н. Болезни почек. — София: Медицина и физкультура, 1976.
-
Мухин Н.А., Тареева И.Е. Диагностика и лечение болезней почек. — М.: Медицина, 1985.
-
Страчунский Л.С., Козлов С.Н. Современная антимикробная химиотерапия. — М.: Боргес, 2002.
-
Тареева И.Е. Нефрология: руководство для врачей. — М.: Медицина, 2000.
-
Шулутко Б.И. Нефрология 2002. Современное состояние проблемы. — СПб.: Ренкор, 2002.
-
Kellerman P. Perioperative care of renal patients // Arch. Intern. Med. – 1994. — Vol. 154. — P. 1674–1688.
-
Klahr S. Obstructive nephropathy // Kidney Int. — 1998. — Vol. 54. — P. 286– 300.
-
Kucers A., Crowe S., Grayson M.L. et al. The Use of Antibiotics. — Oxford: Butterworth Heinman, 1997.
-
Kunin C.M. Urinary Tract Infections: Detection, Prevention and Management. — Philadelphia: Williams and Wilkins, 1997. — P. 419.
-
Naber K.G., Bergman B., Bishop M.C. et al. Guidelines on Urinary and Male Genital Tract Infections / Eur. Ass. Urol. — 2000. — P. 71.
-
Nosocomial and Health Care Associated Infections in Urology // Health Publication / K.G. Naber et al. (eds.). — Berlin, 2001. — P. 207.
-
Scholar E.M., Pratt W.B. The Antimicrobial Drugs. — 2nd ed. — Oxford University Press, 2000.
-
Urinary Tract Infections / T. Bergan (ed.). — Oxford, 1997. — P. 142.
-
Zsolt F. Hospital-acquired infections // Causes and Control. — London. — Philadelphia: Whurr. Publishers, 2002. — P. 289.
-
Лопаткин Н.А., Аполихин О.И., Пушкарь Д.Ю. и др. //Российские национальные рекомендации «Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов». — М., 2014.
-
Палагин И.С. с соавт. Современное состояние антибиотикорезистентности возбудителей внебольничных инфекций мочевых путей в России: результаты исследования «ДАРМИС» (2010–2011). Клиническая микробиология антимикробной терапии 2012; 14 (4): 280 – 302.
Глава 16. ХРОНИЧЕСКИЙ ПИЕЛОНЕФРИТ
А.В. Зайцев, Г.Р. Касян, Р.Р. Харчилава
Пиелонефрит — неспецифический инфекционно-воспалительный процесс, протекающий преимущественно в тубулоинтерстициальной зоне почки [2, 9].
МКБ-10 • N11.0 Необструктивный хронический пиелонефрит, связанный с рефлюксом • N11.1 Хронический обструктивный пиелонефрит • N20.9 Калькулезный пиелонефрит.
Факторы риска
Факторы риска (ФР) при инфекциях мочевыводящих путей представлены в табл. 16.1.
| Категория фактора риска | Примеры факторов риска |
|---|---|
ФР не выявлено |
Здоровая женщина в пременопаузальном периоде |
ФР рецидивирующей ИМП, но без риска тяжелого исхода |
Половое поведение и использование контрацептивов |
Экстраурогенитальные ФР с более тяжелым исходом |
Беременность |
Нефропатия с риском более тяжелого исхода |
Выраженная почечная недостаточность |
Урологические ФР с более тяжелым исходом, которые могут быть устранены во время лечения |
Обструкция мочеточника (камень, стриктура) |
Наличие постоянного мочевого катетера и неустраняемые урологические ФР с более тяжелым исходом |
Длительное лечение с использованием катетера |
Профилактика
Общая профилактика данного заболевания:
Скрининг
В качестве скринингового метода используют общий анализ мочи и УЗИ почек, дополненные расспросом больного о характерных проявлениях хронического пиелонефрита и заболеваниях, способствующих его развитию.
Классификация
Выделяют:
По локализации процесс может быть одноили двусторонним. Выделяют фазы хронического пиелонефрита:
ДИАГНОСТИКА
Жалобы
В активную фазу хронического пиелонефрита больной жалуется на тупую боль в поясничной области. Дизурия нехарактерна, хотя и может присутствовать в виде учащенного болезненного мочеиспускания различной степени выраженности. При детальном расспросе пациент может привести массу неспецифических жалоб:
При развитии ХПН или канальцевой дисфункции жалобы часто определяются этими симптомами. В латентную фазу заболевания жалобы могут вообще отсутствовать, диагноз подтверждают лабораторными исследованиями. В стадию ремиссии основываются на анамнестических данных (в течение не менее 5 лет); жалоб и лабораторных изменений не выявляют [2–9, 11].
Анамнез
При опросе необходимо обратить внимание на характерные эпизоды боли в поясничной области, сопровождающиеся лихорадкой, на эффективность антибактериальной терапии, а также на симптомы ХПН в анамнезе.
Важно выяснить наличие у больного:
Важны сведения о перенесенных воспалительных заболеваниях инфекционной этиологии, приеме антибактериальных препаратов и их эффективности. У беременных необходимо выяснять срок беременности и особенности ее течения [2–9, 11].
Физикальное обследование
При обследовании больного хроническим пиелонефритом обращают внимание:
Обязательно измерение артериального давления, температуры тела. Особую склонность к артериальной гипертензии выявляют у больных вторичным хроническим пиелонефритом на фоне аномалий почек [2–9, 11].
Лабораторные и инструментальные методы исследования
-
При лабораторном исследовании выявляют лейкоцитурию (в большинстве случаев нейтрофильную) и бактериурию. Возможны небольшая протеинурия (до 1 г/сут), микрогематурия, гипостенурия, щелочная реакция мочи.
-
уменьшение размеров почки, ее деформацию, повышенную эхогенность паренхимы (признаки нефросклероза) при длительно текущем пиелонефрите вне обострения.
Расширение чашечно-лоханочной системы свидетельствует о нарушении пассажа мочи. Кроме того, допплеровское исследование позволяет уточнить степень нарушения кровотока.
Дальнейшее обследование для уточнения диагноза хронического пиелонефрита в активной стадии индивидуально для каждого больного.
-
Бактериологический анализ мочи показан всем больным для выявления возбудителя заболевания и назначения адекватной антибактериальной терапии. При количественной оценке степени бактериурии значимым считают уровень 104 ×КОЕ/мл. В нестандартных случаях (при полиурии или иммуносупрессии) клинически значимой может быть и меньшая степень бактериурии.
-
В общем анализе крови обращают внимание на гематологические признаки воспаления:
-
Биохимический анализ крови позволяет уточнить функциональное состояние печени и почек.
-
Анализ на суточную протеинурию и качественные исследования экскретируемых белков выполняют в спорных случаях для дифференциальной диагностики с первичными клубочковыми поражениями почек.
-
По данным экскреторной урографии выявляют специфические рентгенологические признаки пиелонефрита. Однако основная цель ее выполнения — уточнение состояния мочевыводящих путей и диагностика нарушения пассажа мочи.
-
Ранними рентгенологическими признаками ХП являются снижение тонуса верхних мочевыводящих путей, уплощенность и закругленность углов форниксов, сужение и вытянутость чашечек.
-
В поздних стадиях отмечается резкая деформация чашечек, их сближение, пиелоренальные рефлюксы, пиелоэктазия. Характерны симптом Ходсона и снижение ренальнокортикального индекса (выявление на экскреторных урограммах уменьшения толщины паренхимы почек на полюсах по сравнению с толщиной в среднем сегменте). В норме толщина паренхимы (расстояние от наружного контура почки до сосочков пирамид) составляет в среднем сегменте почки 2,5 см, на полюсах 3–4 см.
-
Радиоизотопные методы исследования проводят для решения вопроса о симметричности нефропатии и оценки функционального состояния почки.
-
Для выявления пузырно-мочеточникового рефлюкса и других изменений в нижних мочевыводящих путях применяется микционная цистоуретрография и/или радиоизотопная ренография.
-
КТ и МРТ показаны для диагностики заболеваний, провоцирующих развитие пиелонефрита:
-
Биопсию почки применяют для дифференциальной диагностики с другими диффузными поражениями почечной ткани, особенно при решении вопроса о необходимости проведения иммуносупрессивной терапии.
-
При выраженной артериальной гипертензии и проблемах в подборе гипотензивной терапии важно выполнить анализ крови на содержание ренина, ангиотензина и альдостеронаC [2–5, 7–9, 11].
-
Для рутинной диагностики рекомендуется проведение общего анализа мочи с определением лейкоцитов, эритроцитов и нитритов [19] (уровень доказательности 4, степень рекомендаций C) [23].
-
При определении количества колоний возбудителя >104 КОЕ/мл бактериурия считается клинически значимой [20] (уровень доказательности 2b, степень рекомендаций C) [23].
-
Для исключения обструкции мочевыводящих путей или мочекаменной болезни необходимо выполнить оценку верхних МП с помощью УЗИ (уровень доказательности 4, степень рекомендаций C) [23].
-
При сохранении у пациента лихорадки через 72 ч от начала лечения необходимо выполнить дополнительные исследования, такие как спиральная компьютерная томография, экскреторная урография или нефросцинтиграфия (уровень доказательности 4, степень рекомендаций C) [23].
Дифференциальная диагностика
Хронический тубулоинтерстициальный нефрит характеризуется:
-
анамнестическими данными о хронических интоксикациях и длительном приеме больших доз противовоспалительных препаратов. Очень характерны жалобы на жажду и выделение неадекватно большого количества мочи (полиурия). Для анальгетической нефропатии характерна кальцификация почечных сосочков с эпизодами медуллярного некроза и форникальной гематурии.
Хронический тубулоинтерстициальный нефрит иногда развивается в рамках системных заболеваний — саркоидозе, подагре, реже других.
Туберкулез почки — длительный асимметричный вялотекущий воспалительный процесс с незначительным эффектом от многочисленных курсов антибактериальной терапии. Характерны:
Поскольку туберкулез почек всегда носит вторичный характер, необходимо выявить в анамнезе признаки перенесенного первичного поражения легких, выполнить рентгенографию грудной клетки.
Диагноз хронического гломерулонефрита не вызывает сомнений при наличии у больного нефротического синдрома или выраженной клубочковой эритроцитурии. Однако дифференциальная диагностика усложняется при стойкой артериальной гипертензии (особенно в молодом возрасте) в сочетании с изменениями в анализах мочи, характерными для хронической инфекции мочевыводящих путей или половых органов. В пользу гломерулонефрита свидетельствуют:
В спорных случаях показана пункционная биопсия почки.
Гипертоническая болезнь носит доброкачественный характер. Больные — обычно среднего возраста с длительным анамнезом заболевания. Признаки поражения почек появляются поздно и редко определяют общее состояние. Быстрое развитие артериальной гипертензии в молодом возрасте на фоне обострений пиелонефрита или гипоплазии почек позволяет исключить диагноз гипертонической болезни.
Вазоренальная гипертензия, возникающая на фоне врожденного или приобретенного поражения магистральных артерий почки, характерна повышенным уровнем ренина в сыворотке крови.
Нефроангиосклероз отличают признаки ХПН у пациентов с длительным анамнезом тяжелой гипертонической болезни или симптоматической гипертензии непочечного происхождения на фоне возможной небольшой протеинурии и эритроцитурииB [2–5, 7–9, 11].
При обострении хронического пиелонефрита дифференциальную диагностику необходимо проводить с рядом острых заболеваний брюшной полости и забрюшинного пространства (см. «Клинические рекомендации по острому пиелонефриту»).
Однако зачастую у врачей наибольшие сложности вызывает дифференциальный диагноз хронического пиелонефрита с отсутствием поражения почек. Существует множество ситуаций, при которых возможны изменения в анализах мочи без заболеваний почек, а у пациента диагностируют хронический пиелонефрит или цистит (простатит, уретрит). Часто при остром инфекционном заболевании и отсутствии поражения почек можно выявить небольшую лейкоцитурию, эритроцитурию и протеинурию, которые зависят от особенностей организма и степени интоксикации. Лейкоцитурия возникает при раздражении канальцев любыми нефротоксичными веществами, может сопровождать лихорадку различной этиологии (не только инфекционной) и физическую нагрузку, особенно в неблагоприятных условиях или несоразмерную с тренированностью человека. В целом ситуация, когда лейкоцитурия незначительна и когда не выявляют другие клинические симптомы хронического пиелонефрита, возможно, связана с функциональными изменениями.
Показания к консультации других специалистов
Всем пациентам при обострении первичного хронического пиелонефрита, а при вторичном — и вне обострения показана консультация уролога. При появлении признаков ХПН, канальцевой дисфункции, а также при сомнении в диагнозе необходима консультация нефролога. В ситуации, когда нельзя исключить острое хирургическое заболевание, требуется заключение хирурга. При подозрении на туберкулез — консультация фтизиатра.
ЛЕЧЕНИЕ
Цель лечения
Ликвидация или уменьшение активности воспалительного процесса, что возможно лишь при восстановлении оттока мочи и санации мочевыводящих путей.
Показания к госпитализации
При обострении вторичного пиелонефрита показана экстренная госпитализация в урологическое отделение в связи с потенциальной необходимостью оперативного лечения. При обострении первичного необструктивного пиелонефрита антибактериальную терапию можно начать в амбулаторных условиях; госпитализируют только больных с осложнениями или при неэффективности проводимой терапии.
Плановая госпитализация показана в неясных случаях для стационарного обследования и при выраженной гипертензии для проведения дополнительных исследований и подбора гипотензивной терапии.
Необходима госпитализация в стационар при невозможности устранения факторов, осложняющих течение заболевания, доступными диагностическими методами и/или если у пациента определяются клинические признаки и симптомы сепсиса (уровень доказательности 4, степень рекомендаций В).
Немедикаментозное лечение
При хроническом пиелонефрите необходимо поддерживать достаточный диурез. Объем выпиваемой жидкости должен составлять 2000–2500 мл/сут. Рекомендовано применение мочегонных сборов, витаминизированных отваров (морсов) с антисептическими свойствами (клюква, брусника, шиповник).
Вне обострения возможно санаторно-курортное лечение в Ессентуках, Железноводске, Пятигорске, Трускавце и на курортах местного значения, ориентированных на лечение почечных заболеваний.
Больным хроническим пиелонефритом, осложненным артериальной гипертензией при отсутствии полиурии и потери электролитов, показано ограничение потребления поваренной соли (5–6 г/сут) и жидкости (до1000 мл/сут) B [2–5, 8, 9, 11].
Медикаментозное лечение
В лечении хронического пиелонефрита ведущее значение имеет антибактериальная терапия.
Лечение антибактериальными препаратами при хроническом пиелонефрите предпочтительно проводить после выполнения бактериологического анализа мочи с идентификацией возбудителя и определением его чувствительности к антибиотикам. Сложности вызывает эмпирический подбор препаратов [2, 4, 6, 7, 9, 10, 12–18]. Тем не менее данный вид терапии при этом заболевании используют редко (в основном при обострении заболевания, см. «Клинические рекомендации по острому пиелонефриту»).
Гипотензивную терапию при хроническом пиелонефрите проводят по обычным схемам. Однако необходимо отметить, что артериальная гипертензия в большинстве случаев связана с повышением уровня ренина крови, поэтому базовыми препаратами считают ингибиторы АПФ. В случае их непереносимости (в основном из-за кашля) препаратами выбора будут антагонисты рецепторов ангиотензина II. Дозы лекарственных средств таким пациентам в связи с частым нефросклерозом (возможно, двусторонним) обязательно подбирают с учетом пробы РебергаB 2, 4, 6, 7, 9, 10, 12–18].
При обострении/рецидивировании пиелонефрита назначение антибиотикотерапии допустимо только после устранения нарушений пассажа мочи и должно сопровождаться эрадикацией корригируемых факторов риска, при возможности удалением или сменой ранее установленных дренажей (см. ФР в табл. 16.1).
-
При рецидивировании острого неосложненного пиелонефрита легкой и средней степени тяжести достаточно назначения пероральной терапии в течение 10–14 дней (уровень рекомендаций 1b, степень рекомендаций B) (табл. 16.2) [23].
| Антибиотики | Ежедневная доза | Продолжительность терапии, дней | Литература |
|---|---|---|---|
Ципрофлоксацин1 |
500–750 мг 2 раза в день |
7–10 |
[21] |
Левофлоксацин1 |
250–500 мг 1 раз в день |
7–10 |
[27] |
Левофлоксацин |
750 мг 1 раз в день |
5 |
|
Альтернативные препараты (эквивалентны фторхинолонам клинически, но не микробиологически) |
|||
Цефиксим |
400 мг 1 раза в день |
10 |
[25] |
Цефтибутен |
400 мг 1 раз в день |
10 |
[24] |
Только при известной чувствительности микроорганизма (не для начальной эмпирической терапии) |
|||
Ко-амоксиклав2,3 |
0,5/0,125 г 3 раза в день |
14 (только при доказанной чувствительности, не для стартовой эмпирической терапии) |
|
1 Изучается применение более низкой дозы, эксперты рекомендуют прием более высокой дозы.
2 Не исследовался в качестве монотерапии острого неосложненного пиелонефрита.
3 Главным образом для грамположительных микроорганизмов.
Россия относится к региону с высоким уровнем распространения фторхинолонрезистентных штаммов (согласно данным исследования ДАРМИС, резистентность кишечной палочки к фторхинолонам при неосложненных ИМП 10,9% (25).
В связи с последними рекомендациями FDA рекомендует ограничить применение фторхинолонов (при некоторых неосложненных инфекциях – синуситы, бронхиты, ИМП), когда существует возможность альтернативной антибиотикотерапии, в связи с участившимися случаями тяжелых побочных явлений, затрагивающих периферическую и ЦНС. FDA требует обновить информацию по безопасности на этикетках и руководствах всех фторхинолонов (26).
-
Пациентам с рецидивом острого неосложненного пиелонефрита тяжелой степени показана терапия одним из приведенных парентеральных антибиотиков (табл. 16.3):
-
парентеральные фторхинолоны пациентам, у которых показатель резистентности E. сoli к данным препаратам составляет<10% (уровень рекомендаций 1b, степень рекомендаций В) [23];
-
цефалоспорины III поколения пациентам, у которых показатель резистентности БЛРС-продуцирующих штаммов E. сoli к данным препаратам составляет <10% (уровень рекомендаций 1b, степень рекомендаций В) [23];
-
аминопенициллины + ингибиторы β-лактамаз при известной чувствительности к ним грамположительных микроорганизмов (уровень рекомендаций 4, степень рекомендаций В) [23];
-
аминогликозиды или карбапенемы пациентам, у которых показатель резистентности E. сoli к фторхинолонам и/или БЛРСпродуцирующих штаммов E. сoli к данным препаратам составляет >10% (уровень рекомендаций 1b, степень рекомендаций В) [23].
-
| Антибиотики | Ежедневная доза | Литература |
|---|---|---|
Ципрофлоксацин |
400 мг 2 раза в день |
[21] |
Левофлоксацин1 |
250–500 мг 1 раз в день |
[27] |
Левофлоксацин |
750 мг 1 раз в день |
[22] |
Альтернативные препараты |
||
Цефотаксим2 |
2 г 3 раза в день |
|
Цефтриаксон1,4 |
1–2 г 1 раз в день |
[28] |
Цефтазидим2 |
1–2 г 3 раза в день |
[29] |
Цефепим1,4 |
1–2 г 2 раза в день |
[30] |
Ко-амоксиклав2,3 |
1,5 г 3 раза в день** |
|
Пиперациллин/тазобактам1,4 |
2/0,25–4/0,5 г 3 раза в день |
[31] |
Гентамицин2 |
5 мг/кг 1 раз в день |
|
Амикацин2 |
15 мг/кг 1 раз в день |
|
Эртапенем4 |
1 г 1 раз в день |
[28] |
Имипенем/циластатин4 |
0,5/0,5 г 3 раза в день |
[31] |
Меропенем4 |
1 г 3 раза в день |
[29] |
Дорипенем4 |
0,5 г 3 раза в день |
[32] |
* После улучшения пациент может быть переведен на пероральный прием одного из перечисленных выше антибиотиков (если он активен в отношении возбудителя) для завершения 1–2-недельного курса лечения. Указана только ежедневная доза и нет продолжительности терапии.
** Только при доказанной чувствительности, не для стартовой эмпирической терапии.
1 Изучается применение более низкой дозы, эксперты рекомендуют прием более высокой дозы.
2 Не исследовался в качестве монотерапии острого неосложненного пиелонефрита.
3 Главным образом для грамположительных микроорганизмов.
4 Одинаковый режим терапии для острого неосложненного пиелонефрита и осложненной ИМП (стратификация не всегда возможна).
Хирургическое лечение
При хроническом пиелонефрите оперативное лечение направлено в основном на восстановление пассажа мочи. При обострении этого заболевания, перешедшего в гнойную фазу (апостематозный нефрит или карбункул почки), показаны декапсуляция почки и нефростомия [4].
Показания к нефрэктомии при хроническом пиелонефрите
-
Выраженный односторонний нефросклероз с утратой функции органа в случае, если пораженная почка становится очагом хронической инфекции.
-
Односторонний нефросклероз с утратой или значительным снижением функции органа в случае, если пораженная почка обусловливает тяжелую, трудно контролируемую артериальную гипертензию.
Дальнейшее ведение
При отсутствии обострений показана длительная терапия отварами мочегонных и антисептических трав или официнальными растительными препаратами: цистоном, канефроном Н и т.д.
Обучение больного
Необходимо довести до сведения пациента:
Прогноз
Прогноз для жизни при хроническом пиелонефрите благоприятен. Адекватная антибактериальная терапия и своевременные оперативные вмешательства позволяют длительное время поддерживать функции почки. Однако прогноз существенно различается при разных формах заболевания. Так, при первичном хроническом двустороннем пиелонефрите ХПН развивается в среднем через 5–8 лет, достигая терминальной стадии через 10–15 лет. При вторичном процессе прогноз в значительной степени определяется урологическим заболеванием, лежащим в основе пиелонефрита. В среднем терминальная стадия ХПН у этих больных при адекватном лечении развивается через 10–20 лет. При ретроспективном анализе получены данные о том, что в течение 10 лет хронический пиелонефрит приводит к терминальной стадии ХПН у 47,8% пациентов [3, 4, 9].
ЛИТЕРАТУРА
-
Лопаткин Н.А. Руководство по урологии. — М.: Медицина, 1998.
-
Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология. — М.: Медицина, 1991.
-
Маждраков Г., Попов Н. Болезни почек. — София: Медицина и физкультура, 1976.
-
Мухин Н.А., Тареева И.Е. Диагностика и лечение болезней почек. — М.: Медицина, 1985.
-
Пытель А.Я., Голигорский С.Д. Пиелонефрит. — М.: Медицина, 1977.
-
Тареева И.Е. Нефрология: руководство для врачей. — М.: Медицина, 2000.
-
Шулутко Б.И. Нефрология 2002. Современное состояние проблемы. — СПб.: Ренкор, 2002.
-
Kass E.N. Progress in pyelonephritis. — Pyiladelphia: F.A. Davis, 1965.
-
Kellerman P. Perioperative care of renal patients // Arch. Intern. Med. – 1994. — Vol. 154. — P. 1674–1688.
-
Klahr S. Obstructive nephropathy // Kidney Int. — 1998. — Vol. 54. — P. 286–300.
-
Kucers A., Crowe S., Grayson M.L. et al. The Use of Antibiotics. — Oxford: Butterworth Heinman, 1997.
-
Kunin C.M. Urinary Tract Infections: Detection, Prevention and Management. — 5th ed. — Philadelphia: Williams and Wilkins, 1997. — P. 419.
-
Naber K.G., Bergman B., Bishop M.C. et al. Guidelines on Urinary and Male Genital Tract Infections. — London, 2000. — P. 71.
-
Nosocomial and Health Care Associated Infections in Urology // Health Publication. — Berlin, 2001. — P. 207.
-
Scholar E.M., Pratt W.B. The Antimicrobial Drugs. — Oxford, 2000.
-
_Zsolt F.- Hospital-acquired infections // Causes and Control. — London. — Philadelphia: Whurr. Publishers, 2002. — P. 289.
-
Naber K. et al. Urogenital infections. European Association of Urology — International Consultation on Urological Diseases. 1-st Edition, 2010. — P.1182.
-
Grabe M. et al. Guidelines on Urological Infections. EAU Clinical Guidelines, 2013. http://www.uroweb.org/gls/pdf/18_Urological%20infections_LR.pdf
-
Лопаткин Н.А., Аполихин О.И., Пушкарь Д.Ю. и др. //Российские национальные рекомендации «Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов». — М., 2014.
-
Палагин И.С. с соавт. Современное состояние антибиотикорезистентности возбудителей внебольничных инфекций мочевых путей в России: результаты исследования «ДАРМИС» (2010–2011). Клиническая микробиология антимикробной терапии 2012; 14 (4): 280 – 302.
Глава 17. ЦИСТИТ
А.В. Зайцев, Г.Р. Касян, Л.Г. Спивак
Цистит — это инфекционно-воспалительный процесс в стенке мочевого пузыря, локализующийся преимущественно в слизистой оболочке [7].
МКБ-10 • N30.0 Острый цистит • N30.1 Интерстициальный цистит (хронический) • N30.2 Другой хронический цистит • N30.3 ТригонитN30.4 Лучевой цистит • N30.8 Другие циститы • N30.9 Цистит неуточненный.
Эпидемиология
Циститом болеют преимущественно женщины, что связано с анатомо-физиологическими и гормональными особенностями их организма.
В России ежегодно регистрируют 26–36 млн случаев цистита. В течение жизни острый цистит переносят 20–25% женщин, у каждой третьей из них в течение года возникает рецидив заболевания, а у 10% оно переходит в хроническую рецидивирующую форму.
Факторы риска
-
Анатомо-физиологические особенности женского организма (короткая и широкая уретра, близость к естественным резервуарам инфекции — анус, влагалище; аномалии развития — дистопия, гипермобильность уретры).
-
Способность грамотрицательных микроорганизмов, вызывающих инфекционный процесс в уретре и мочевом пузыре, к адгезии к клеткам эпителия вследствие наличия фимбрий и ворсин.
-
Частые сопутствующие гинекологические заболевания — воспалительные процессы во влагалище, гормональные нарушения (в том числе гипоэстрогенемия), приводящие к дисбиозу влагалища и размножению в нем патогенной микрофлоры.
-
Частота половых актов (наличие ИППП), частая смена половых партнеров и характер применяемых контрацептивов.
ПРОФИЛАКТИКА РАЗВИТИЯ РЕЦИДИВИРУЮЩИХ ИНФЕКЦИЙ НИЖНИХ МОЧЕВЫВОДЯЩИХ ПУТЕЙ
-
Строгое соблюдение гигиенических приемов у новорожденных девочек для предотвращения развития вагинитов, а затем уретритов и циститов.
-
Своевременная коррекция анатомических нарушений (аномалии расположения наружного отверстия мочеиспускательного канала) при наличии показаний.
-
Адекватное лечение гинекологических заболеваний, инфекций, передаваемых половым путем, причем у обоих половых партнеров.
-
Контроль за состоянием биоциноза влагалища при длительном применении спермицидов
-
Адекватная оценка и лечение бессимптомной бактериурии беременных.
-
Антибиотикопрофилактика перед инвазивными урологическими вмешательствами, особенно при наличии факторов риска.
-
Лечение урологических заболеваний, приводящих к нарушению уродинамики.
ПРОФИЛАКТИКА РЕЦИДИВОВ У БОЛЬНЫХ ПОСТКОИТАЛЬНЫМ ЦИСТИТОМ
РЕКОМЕНДАЦИИ EAU (2015) ДЛЯ ПРОФИЛАКТИКИ ИМП [20]
-
До начала профилактической антибиотикотерапии необходимо подтвердить эрадикацию предыдущей ИМП отрицательным результатом посева мочи через 1–2 нед после лечения (УД: 4, СР: A).
-
Постоянная или посткоитальная антибактериальная профилактика должна применяться у женщин с рецидивирующим неосложненным циститом, у которых другие методы неэффективны (табл. 17.1 и 17.2) (УД: 1a, СР: A) [9].
| Режимы | Ожидаемое число циститов в год |
|---|---|
Фосфомицин 3 г каждые 10 дней |
0,14 |
ТМП-СМК* 40/200 мг 1 раз в день |
0–0,2 |
ТМП-СМК 40/200 мг 3 раза в неделю |
0,1 |
Триметоприм 100 мг 1 раз в день |
0–1,5** |
Нитрофурантоин 50 мг 1 раз в день |
0–0,6 |
Нитрофурантоин 100 мг 1 раз в день |
0–0,7 |
Цефиксим 400 мг 1 раз в день |
0,2 |
Цефаклор 250 мг 1 раз в день |
0,0 |
Цефалексин 125 мг 1 раз в день |
0,1 |
Цефалексин 250 мг 1 раз в день |
0,2 |
Ципрофлоксацин 125 мг 1 раз в день |
0,0 |
* ТМП-СМК — триметоприм-сульфометоксазол.
** Наблюдается высокая частота рецидивов при использовании триметоприма, что связано с развитием резистентности к препарату.
| Режимы | Ожидаемое число циститов в год |
|---|---|
ТМП-СМК* 40/200 мг |
0,30 |
ТМП-СМК 80/400 мг |
0,00 |
Нитрофурантоин 50 или 100 мг |
0,10 |
Цефиксим 400 мг |
|
Цефалексин 250 мг |
0,03 |
Ципрофлоксацин 125 мг |
0,00 |
Офлоксацин 100 мг |
0,06 |
* ТМП-СМК — триметоприм-сульфометоксазол.
Иммунологическая профилактика
-
Уро-Ваксом доказал свою эффективность в ряде клинических исследований и может быть рекомендован для иммунопрофилактики у женщин с рецидивирующими неосложненными ИМП (УД: 1a, СР: B) [13].
-
Для других иммунотерапевтических продуктов на рынке пока еще отсутствуют крупные клинические исследования третьей фазы.
В сравнительно небольших исследованиях второй фазы определенную эффективность показали препараты StroVac® и Solco-Urovac® в случае их назначения в режиме периодически повторяющихся иммунизаций (повторных введений вакцин с определенной периодичностью) (УД: 1a, СР: C). Для иммунотерапевтических препаратов, таких как Urostim® и Urvakol®, не было проведено контролированных исследований, в связи с чем рекомендовать к применению их нельзя.
Профилактика пробиотиками
-
Целесообразно применение интравагинальных пробиотиков, которые содержат лактобактерии, 1 или 3 раза в неделю для профилактики рецидивирующих циститов (УД: 4, СР: C).
-
Ежедневное применение пероральных препаратов, содержащих штаммы L. rhamnosus GR-1 и L. reuteri RC-14, препятствует развитию бактериального вагиноза, который увеличивает риск развития циститов (УД: 1b, СР: C).
Профилактика с использованием клюквы
-
Прием клюквы (Vaccinium macrocarpon) эффективен для снижения количества инфекций нижних МП у женщин (УД: 1b, СР: C).
-
В повседневной практике рекомендуется ежедневное употребление клюквы в количестве 36 мг/сут проантоцианидина А (в пересчете на активное вещество) (УД: 1b, СР: C).
-
Согласно последним рекомендациям ЕАУ, клюква не может быть рекомендована, т.к. мета-анализ, включающий 24 исследования в различных подгруппах пациентов (n=4437) показал, что препараты клюквы значительно не уменьшали симптомы ИМП во всех подгруппах.В Европейских рекомендациях 2016 года УД и СР в рекомендациях отсутствуют.
-
Из фитопрепаратов эффективно применение препарата Канефрон Н. Это комбинированный препарат растительного происхождения,в состав которого входят трава золототысячника, корень любистока и листья розмарина. Препарат обладает мочегонным, противовоспалительным, спазмолитическим, антимикробным, сосудорасширяющим и нефропротекторным действиями. Препарат назначают взрослым перорально по 50 капель или по 2 драже 3 р/сут. После купирования острой фазы заболевания следует продолжить лечение еще 2–4 недели, возможно применение до 3-х месяцев непрерывно.
-
Эндовезикальные инстилляции гиалуроновой кислоты и хондроитин сульфата могут использоваться для восстановления, разрушенного гликозаминогликанового слоя слизистой оболочки мочевого пузыря у пациентов, не только с интерстициальным циститом, лучевым циститом, гиперактивным мочевым пузырем, но и для профилактики рецидивов бактериального цистита.
-
У женщин в постменопаузе вагинальное (но не пероральное) применение эстрогенов (эстриол, крем, свечи), способствует профилактике рецидивов бактериального цистита, дизурии
-
Альтернативным методом лечения является также бактериофаготерапия рецидивирующей ИМП.
Классификация
Цистит классифицируют по различным признакам.
По этиологии выделяют инфекционный (бактериальный); неинфекционный (лекарственный, лучевой, токсический, химический, аллергический и др.).
По течению цистит делят на острый и хронический (рецидивирующий), который подразделяют на фазу обострения и фазу ремиссии.
Выделяют также первичный (неосложненный) цистит (самостоятельное заболевание, возникающее на фоне условно-нормального пассажа мочи у женщин 18–45 лет без сопутствующих заболеваний) и вторичный (осложненный) у всех остальных, т.е. возникающий на фоне нарушения уродинамики как осложнение другого заболевания: туберкулез, камень, опухоль мочевого пузыря, когда повышен риск отсутствия эффекта от эмпирически назначенной антибактериальной терапии.
По характеру морфологических изменений возможен катаральный, язвенно-фибринозный, геморрагический, гангренозный и интерстициальный цистит [7]. Последний считают самостоятельным заболеванием, при котором происходит смена фаз течения воспалительного процесса, приводящая к выраженной боли в области мочевого пузыря, постепенному уменьшению его емкости, вплоть до сморщивания, и нарастанию дизурии.
Диагностика
При обследовании больных с длительной, рецидивирующей дизурией необходимо решение нескольких принципиальных задач.
-
В первую очередь должно быть подтверждено предположение об инфекционно-воспалительном поражении мочевой системы.
-
Затем необходимы топическая диагностика инфекционно-воспалительного процесса, конкретизация уровня поражения мочевой системы (нижние или верхние мочевыводящие пути), а также исключение сочетания цистита с другими заболеваниями почек.
-
Дифференциальная диагностика должна быть направлена на исключение сочетания цистита с другими заболеваниями мочевого пузыря (камень, опухоль, нейрогенная дисфункция мочевого пузыря, рак in situ), определение особых форм воспалительного поражения (туберкулез), а также фазы, степени распространенности воспалительного процесса в мочевом пузыре.
-
Следует определить факторы этиологии и патогенеза хронического цистита, присущие обследуемой пациентке.
Жалобы и анамнез
Признаки острого цистита — частое болезненное мочеиспускание малыми порциями мочи, боль в проекции мочевого пузыря, императивные позывы к мочеиспусканию; иногда ложные позывы на мочеиспускание, примесь крови в моче (особенно в последней порции) [2, 6, 8, 15]. Характерно острое начало. При наличии двух обострений в течение полугода или трех — в течение года говорят о хроническом рецидивирующем цистите.
Заполнение дневников мочеиспускания является важным этапом обследования больных, длительное время страдающих дизурией.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Несмотря на определенное беспокойство, причиняемое пациентам, для цистита не характерно тяжелое их состояние. Часто пальпация в надлобковой области в проекции мочевого пузыря болезненна, в той или иной степени.
Тяжелое состояние пациента с признаками интоксикации (тахикардия, рвота, лихорадка) обычно характерно для острого цистита язвенно-фибринозной и гангренозной форм, возникающих у больных с выраженным иммунодефицитом, а также осложняющегося пиелонефритом. Болезненность при вагинальном исследовании характерна для заболеваний женских половых органов (вагинит, аднексит, сальпингит и др.).
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
При неосложненном цистите обязательно проведение общего анализа мочи (иногда выполняется с помощью тест-полосок), при этом характерны выраженная лейкоцитурия, бактериурия, незначительная протеинурия, гематурия не всегда различной степени выраженности. Бактериологическое исследование мочи при остром неосложненном цистите не проводят, так как в 85–90% случаев возбудителем заболевания являются E. coli, реже другие грамотрицательные бактерии. Эмпирическая терапия высокоэффективна. При неэффективности эмпирической терапии бактериологический анализ мочи с определением чувствительности уропатогена к антибактериальным препаратам существенно облегчит выбор следующего препарата [1–3, 8, 9, 15].
Обследование при осложненном или рецидивирующем цистите, помимо общего анализа мочи, включает:
-
бактериологическое исследование мочи, которое проводят для точного выявления возбудителя и его чувствительности к антибактериальным лекарственным средствам;
-
обследование на инфекции, передаваемые половым путем (ПЦР из двух локусов — уретра, цервикальный канал);
-
обследование на вирусные инфекции (ИФА для определения иммуноглобулинов к герпесу, цитомегаловирусу), мазок и посев отделяемого из влагалища с количественным определением лактобактерий) для исключения дисбиоза.
-
Анализ мочи с использованием тест-полосок — альтернатива общему анализу мочи, который используется для постановки диагноза острого неосложненного цистита (УД: 2а; СР: В) [20].
-
Посев мочи рекомендован в следующих случаях: при подозрении на острый пиелонефрит; при цистите с симптомами, которые не купируются или рецидивируют в течение 2–4 нед после окончания лечения; у женщин с атипичными симптомами (УД: 4; СР: В) [20].
-
Бактериурия >10×3 КОЕ/мл служит микробиологическим подтверждением диагноза у женщин с симптомами острого неосложненного цистита [9] (УД: 3; СР: В) [20].
Клинически значимыми являются следующие показатели бактериурии (количество бактерий) [20]:
Обнаружение любого количества бактерий в моче, полученной при надлобковой пункции мочевого пузыря, является клинически значимым.
Асимптоматическая бактериурия диагностируется в случае выделения одного и того же штамма бактерий (в большинстве случаев определяют только род бактерий) в 2 образцах, взятых с интервалом >24 ч, а количество бактерий достигает значения> 10×5 КОЕ/мл.
ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Инструментальные вмешательства при остром цистите или обострении рецидивирующего цистита противопоказаны.
УЗИ почек или органов малого таза, экскреторную урографию, цистоуретрографию, КТ или МРТ малого таза проводят при подозрении на камень, опухолевые или другие заболевания, требующие оперативного вмешательства, а также при рецидивах мочевой инфекции и отсутствии положительной динамики на антимикробную терапию.
УЗИ почек и мочевого пузыря показано всем больным, страдающим рецидивирующим циститом, хотя его диагностическая ценность при цистите невелика. Для выполнения УЗИ требуется наполнение мочевого пузыря мочой (не менее 100 мл), вследствие чего при императивных позывах на мочеиспускание выполнить его технически не удается. При цистите можно увидеть утолщенную, отечную слизистую оболочку мочевого пузыря, однако главная задача УЗИ — исключение опухоли мочевого пузыря; камня предпузырного или интрамурального отдела мочеточника, который может вызывать дизурию; остаточной мочи, что может иметь место при пролапсе тазовых органов у женщин, склеротических изменениях в шейке мочевого пузыря, псевдополипах.
Обзорную и экскреторную урографию проводят при необходимости определения состояния почек и мочевого пузыря, например, при подозрении на камень или опухоль мочевыводящих путей. Цистоскопия при активном воспалении противопоказана. При рецидивирующем цистите, гематурии, а также при подозрении на новообразование или туберкулез мочевого пузыря показана цистоскопия с биопсией из подозрительных участков [2, 6, 8, 15].
Уродинамическое исследование (урофлоуметрия с определением остаточной мочи) показано больным, длительное время страдающим учащенным мочеиспусканием, при отсутствии эффекта от проводимого лечения.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Если клиническая картина цистита характерна, никакого дифференциального диагноза не требуется — терапию назначают сразу.
При учащенном мочеиспускании необходимо исключить истинную полиурию, определив порцию мочи, выделяемую единовременно. Учащенное мочеиспускание может быть обусловлено камнем нижней трети мочеточника, однако дизурии, как правило, предшествует эпизод выраженной боли (почечная колика), а УЗИ при расположении камня в интрамуральном отделе мочеточника может выявить конкремент и неизмененную стенку мочевого пузыря, за исключением области устья мочеточника на стороне поражения.
В сомнительной ситуации выполняют экскреторную урографию, которая может выявить стаз контрастного вещества над конкрементом в мочеточнике.
У мужчин дизурия в большинстве случаев связана с заболеваниями предстательной железы, а цистит почти всегда вторичен.
При выраженной гематурии на фоне острого цистита необходимо исключить опухоль мочевыводящих путей, туберкулез, форникальное кровотечение, реже болезнь Берже или другие нефрологические заболевания. При не угрожающей жизни гематурии, не характерной для цистита, сначала купируют острое воспаление, а затем, если сомнения сохранились, проводят необходимое обследование.
Простатит, везикулит, уретрит, аднексит и ряд других заболеваний имеют специфическую клиническую картину, но одновременно могут сочетаться с циститом. Эффективность эмпирической терапии определяется чувствительностью возбудителя к назначенному препарату, поэтому при ее назначении важнее выбрать адекватный препарат на основании знания наиболее вероятного возбудителя заболевания, чем поставить топический диагноз воспалительного процесса.
Болезненное учащенное мочеиспускание может встречаться без признаков активного воспаления мочевого пузыря и быть связано с нарушением нервной регуляции акта мочеиспускания или органической инфравезикальной обструкцией. Общий анализ мочи позволяет исключить поражение слизистой оболочки пузыря. Для исключения инфравезикальной обструкции проводят урофлоуметрию, при остающихся сомнениях можно выполнить цистоскопию и убедиться в отсутствии поражения слизистой оболочки мочевого пузыря. Неврологическое происхождение дизурии также подтверждают исследованием уродинамики, по результатам которого определяют функциональный диагноз и назначают соответствующее патогенетическое лечение. Полное обследование таких больных обязательно включает рентгенографию поясничного и крестцового отделов позвоночника в двух проекциях, а иногда и их КТ или МРТ.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При выраженной и однозначной клинической картине цистита дополнительных консультаций не требуется.
При выраженной гематурии показана экстренная госпитализация, больной должен быть осмотрен урологом, а при его отсутствии — хирургом. При подозрении на диффузное поражение почечной ткани необходима консультация нефролога.
При наличии сопутствующих гинекологических заболеваний показана консультация гинеколога.
Лечение
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
-
Тяжелое состояние больного, особенно с декомпенсированным сахарным диабетом, иммунодефицитом любой этиологии, выраженной недостаточностью кровообращения и т.д.
-
Цистит на фоне неадекватно функционирующего цистостомического дренажа.
-
Неэффективность лечения и невозможность проведения адекватной антибактериальной терапии в амбулаторных условиях.
НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Диета с исключением соленой, острой, раздражающей пищи (стол №10); питье, достаточное для поддержания диуреза 2000–2500 мл (после разрешения дизурии). При рецидивирующем цистите — инстилляции препаратов в мочевой пузырь вне стадии обострения [5, 8]. Фитотерапия при цистите самостоятельного значения не имеет, но широко используется как вспомогательное лечение на этапе долечивания.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Острый неосложненный бактериальный цистит у большинства небеременных эффективно лечат в амбулаторных условиях антибактериальными препаратами, назначаемыми эмпирически. Продолжительность терапии острого несложненного цистита — 1–3–5–7 сут — зависит от выбранного препарата и отсутствия или наличия факторов риска [1, 2, 4, 8, 10, 17].
Показания к 7-дневному курсу антибактериальной терапии острого цистита
Эмпирическая терапия
Цистит острый (неосложненный), развившийся у ранее здоровой женщины без тяжелых сопутствующих заболеваний (табл. 17.3).
| Антибиотики | Суточная доза | Продолжительность Терапии |
|---|---|---|
Фосфомицина трометамол |
внутрь 3 г |
однократно |
Фуразидина калиевая соль с карбонатом магния |
внутрь 100 мг 3 р/сут |
5 дней |
Нитрофурантоин |
внутрь 100 мг 3-4 р/сут |
5 дней |
Альтернативная терапия |
||
Цефиксим |
Внутрь 400 мг 1 р/сут |
5 дней |
Офлоксацин |
внутрь 200-мг 2-р/сут |
3 дня |
Ципрофлоксацин |
внутрь 500 мг 2 р/сут |
3дня |
Левофлоксацин |
внутрь 500 мг 1 р/сут |
3 дня |
Препаратами выбора при эмпирической терапии, т.е. без данных бактериологического анализа мочи от конкретной больной или не дожидаясь результатов этого анализа являются антимикробные препараты, к которым по данных современных исследований резистентности возбудителей мочевой инфекции выявлен наименьший процент резистентных штаммов уропатогенов.
Препараты выбора: фосфомицина трометамол (монурал) 3 г однократно; фуразидина калиевая соль с карбонатом магния (фурамаг) по 100 мг 3 раза в день — 5 дней; альтернативные препараты: цефиксим внутрь 400 мг 1 р/сут 5 дней, офлоксацин внутрь 200 мг 2 р/сут, 3 дня или ципрофлоксацин внутрь 500 мг 2 р/сут, 3дня или левофлоксацин внутрь 500 мг 1 р/сут, 3 дня [20, 21].
Учитывая, что уровень резистентности кишечной палочки к ампициллину, амоксициллину, триметоприм/сульфаметоксазолу в России выше 20% — эти препараты не рекомендованы для эмпирической терапии острой неосложненной ИМП. Аминопенициллины в комбинации с ингибиторами бета-лактамаз, такие как ампициллин/ сульбактам или амоксициллин/клавулановая кислота в целом не так эффективны, как короткие курсы терапии и не рекомендуются для эмпирической терапии. Фторхинолоны и цефалоспорины из-за экологического коллатерального эффекта (селекция полирезистентных возбудителей) не рекомендуется назначать рутинно, а следует применять в отдельных случаях, при наличии подтвержденной чувствительности к ним, а также при подозрении на наличие инфекции верхних мочевыводящих путей.
Более того, рекомендуется резервировать фторхинолоны, как препараты с хорошим проникновением в ткани и органы, для лечения более серьезных инфекций паренхиматозных органов – пиелонефрит, простатит [20].
В связи с последними рекомендациями FDA рекомендует ограничить применение фторхинолонов (при некоторых неосложненных инфекциях – синуситы, бронхиты, ИМП), когда существует возможность альтернативной антибиотикотерапии, в связи с участившимися случаями тяжелых побочных явлений, затрагивающих периферическую и ЦНС. FDA требует обновить информацию по безопасности на этикетках и руководствах всех фторхинолонов.
Если симптомы цистита не разрешились к концу курса терапии или вернулись через 2 недели рекомендуется провести бактериологический анализ мочи с определением чувствительности к антибиотикам. В таких случаях необходимо сменить антимикробный препарат и длительность терапии увеличить до 7 суток. При часто рецидивирующем цистите, неосложненном пиелонефрите необходимо проведение детального урологического обследования.
Цистит после случайного полового акта или у пациента, ведущего беспорядочную половую жизнь (ситуация, когда высока вероятность инфекции, передаваемой половым путем)
Препараты выбора: офлоксацин, левофлоксацин в сочетании с любым нитроимидазолом. Если при бактериоскопии выявлен грамположительный диплококк, дополнительно назначается цефиксим 400–800 мг. однократно, или цефтриаксон 1 г. однократно.
Цистит у больного с нейрогенным мочевым пузырем, аномалией мочевыводящих путей, длительно стоящим цистостомическим дренажом на фоне его неадекватной функции
Эмпирическая терапия определяется ранее назначенными антибактериальными средствами. Препарат выбора должен попадать в «пробелы их спектра». Обычно назначается ципрофлоксацин. Если же больной уже получал фторхинолоны с сомнительным эффектом или обострение развилось на фоне их приема, то необходимы антибиотики антисинегнойного ряда — базовый препарат цефтазидим.
ПАТОГЕНЕТИЧЕСКОЕ ЛЕЧЕНИЕ
Коррекция анатомических нарушений: пациенткам, у которых хронический цистит развился на фоне вагинализации наружного отверстия уретры, показана операция транспозиции уретры, рассечение уретрогименальных спаек вне обострения хронического процесса. При наличии псевдополипов в шейке мочевого пузыря — трансуретральная электрорезекция или вапоризация псевдополипов [20].
Лечение ИППП: макролиды (джозамицин, азитромицин, мидекамицин), тетрациклины (доксициклин), фторхинолоны (моксифлоксацин, левофлоксацин, офлоксацин).
При исключении ИППП — посткоитальная профилактика.
Лечение воспалительных и дисбиотических гинекологических заболеваний:
-
гормонозаместительная терапия у женщин в постменопаузальном периоде — периуретральное или интравагинальное применение гормональных кремов, содержащих эстрогены;
-
применение вакцин и неспецифических иммуномодуляторов — Уро-Ваксом, метилурацил;
-
внутрипузырная терапия: мукополисахариды (гепарин 25 000 ЕД на одну процедуру) в сочетании с местным анестетиком (лидокаин 2% — 2 мл, общий объем раствора доводится до 20 мл добавлением физиологического раствора), инстилляции гиалуроновой кислоты и хондроитин сульфата. Длительность терапии от 1 до 3 мес;
-
применение растительных препаратов в качестве метода профилактики рецидивов инфекции мочевыводящих путей и на этапе амбулаторного долечивания.
Этиологическое лечение — антибактериальная терапия. Длительная (до 7–10 дней). Выбор препарата с учетом выделенного возбудителя и антибиотикограммы. Назначение антибиотиков с бактерицидным действием. Препараты выбора:
Рост резистентности основных возбудителей рецидивирующих инфекций нижних мочевыводящих путей к фторхинолонам заставляет ограничивать их применение, поэтому расширяются показания к применению фосфомицина трометамола длительными курсами (3 г 1 раз в 10 дней в течение 3 мес).
Симптоматическая терапия
При выраженной боли показаны нестероидные противовоспалительные средства (НПВС), которые способны привести к регрессу основных симптомов цистита
Инфекция мочевыводящих путей у беременных женщин
[20]
У большинства женщин асимптоматическая бактериурия выявляется еще до беременности; у 20-40% женщин с асимптоматической бактериурией во время беременности могут появиться клинические проявления инфекции мочевыводящих путей (табл. 17.4).
| Антибиотики | Продолжительность терапии | Комментарии |
|---|---|---|
Фосфомицина трометамол |
внутрь 3 г однократно |
|
Нитрофурантоин |
100 мг 2 р/сут 5–7 дней |
(только не в последних неделях беременности, для избегания дефицита глюкозо–6–фосфатдегидрогеназы) |
Альтернативная терапия |
||
Цефиксим |
внутрь 400 мг 1 р/сут 5–7 дней |
|
Цефтибутен |
внутрь 400 мг 1 р/сут 3–7 дней |
|
Только при известной чувствительности возбудителя: Амоксициллин/клавуланат |
внутрь 625 мг 3 р/сут, 3–7 дней |
|
Острый пиелонефрит беременных чаще встречается во втором и третьем триместрах беременности. При лечении острого пиелонефрита беременных при наличии расширения верхних мочевыводящих путей рекомендуется установка мочеточникового самоудерживающегося катетера (стент). При стабильном состоянии возможно проведение пероральной терапии. При начале стартовой терапии с парентерального введения антибиотика, после стабилизации состояния возможен переход на пероральный прием того же препарата (или другого препарата из этой же группы).
Общая рекомендуемая длительность терапии – 14 дней.
Терапия выбора*:
При легком течении пиелонефрита возможен пероральный прием в течение 14 суток:
Цефиксим внутрь 400 мг 1 р/сут
или, Цефтибутен внутрь 400 мг 1 р/сут
или Цефотаксим в/в или в/м 1 г 3-4 р/сут или Цефтриаксон в/в или в/м 1г 1-2 р/сут или Азтреонам 2г в/в 3 р/сут
Альтернативная терапия
Эртапенем в/в, в/м 1 г 1р/сут 10-14 сут, или Меропенем в/в 1 г 3 р/сут, 14 сут
или Пиперациллин/тазобактам в/в 4,5 г 4 р/сут, 14 сут
Только при известной чувствительности возбудителя:
Амоксициллин/клавуланат в/в 1,2 г 3 р/сут, или внутрь 625 мг 3 р/сут
* при тяжелом течении и угрозе развития уросепсиса предпочтительнее терапия карбапенемами
ДИАГНОСТИКА ИНФЕКЦИИ МОЧЕВЫВОДЯЩИХ ПУТЕЙ У БЕРЕМЕННЫХ ЖЕНЩИН
При цистите рекомендуется проводить физикальный осмотр, общий анализ мочи и посев мочи. При подозрении на пиелонефрит необходимо выполнение УЗИ почек. Для идентификации камней мочеточников возможно выполнение магнитно-резонансной томографии.
Определение клинически значимой бактериурии
-
У беременных асимптоматическая бактериурия считается клинически значимой, если в 2 последовательных образцах мочи, собранных во время самостоятельного мочеиспускания, обнаруживается одинаковый возбудитель в количестве более 105 КОЕ/мл; или в одном образце мочи, полученном с помощью катетера, количество уропатогена >105 КОЕ/мл (УД: 2a, СР: A) [17].
-
У беременных с симптомами ИМП бактериурия считается клинически значимой при выявлении возбудителя в моче, собранной при самостоятельном мочеиспускании или с помощью катетера, >103 КОЕ/мл (УД: 4, СР: B).
Скрининг
Во время I триместра беременности необходимо проводить скрининг на бактериурию (УД: 1a, СР: A) [18].
Наблюдение
Через 1–2 нед после проведения лечения у беременных с асимптоматической бактериурией и симптомами цистита необходимо провести посев мочи (УД: 4, СР: A).
Профилактика
Для снижения риска развития цистита беременным с частыми эпизодами мочевой инфекции в анамнезе следует проводить посткоитальную профилактику (УД: 2b, СР: B) [19].
Обучение больного
Больному разъясняют суть заболевания, возможные меры профилактики, обращая особое внимание на необходимость своевременного опорожнения мочевого пузыря.
Предупреждают о важности применения антибактериальных лекарственных средств, возможности развития побочных эффектов при их приеме; рассказывают о том, что симптомы цистита могут сохраняться в течение нескольких дней после отмены лекарственных средств, а в том случае, если они нарастают после нескольких дней терапии, пациент должен срочно обратиться к врачу.
Пациенту сообщают, что проведение лечения уменьшает вероятность рецидива или персистирования инфекции, которая может развиться при преждевременном прекращении лечения.
Дальнейшее ведение
[20]
-
Рутинное выполнение общего анализа мочи или посева мочи у пациентов без симптомов заболевания после проведенного курса лечения не показано (УД: 2b, СР: B).
-
У женщин при сохранении симптомов к концу лечения, а также при их разрешении, а затем рецидивировании в течение 2 нед, необходимо выполнить посев мочи с определением чувствительности возбудителей к антибиотикам (УД: 4, СР: B).
-
Необходимо провести повторный курс лечения с использованием другого антибактериального препарата в течение 7 дней (УД: 4, СР: C).
Беременных, перенесших острый цистит, осложненный цистит или его рецидив, а также пролеченных от бессимптомной бактериурии, необходимо динамически наблюдать, вплоть до родов, исследуя мочу для доказательства эффективности антибактериальной терапии в связи с угрозой для течения беременности.
У небеременных с осложненным и рецидивирующим циститом по завершении лечения необходимо выполнить общий анализ и посев мочи, затем провести профилактику развития рецидива заболевания.
Прогноз
Прогноз благоприятный при отсутствии нарушений уродинамики и сопутствующих заболеваний, типичном возбудителе и хорошей его чувствительности к антибактериальным лекарственным средствам, рациональной эмпирической антибактериальной терапии. При рецидивирующем цистите лечение может быть эффективным только при соблюдении принципов патогенетической терапии, целенаправленной антибактериальной терапии и профилактики рецидивов заболевания [1, 5, 10–12, 17].
ЛИТЕРАТУРА
-
Naber K.G. et al. International Journal of Antimicrobial Agents. — 2009. — Vol. 33. — Р.111–114.
-
Лоран О.Б. Хронический цистит у женщин // Врач. — 1996. — № 8. — С. 6–9.
-
Лоран О.Б., Синякова Л.А., Косова И.В. Роль урогенитальных инфекций в этиологии цистита и необструктивного пиелонефрита у женщин: обзор. Часть 1 // Урология. — 2005. — № 2. — С. 74–79.
-
Лоран О.Б., Синякова Л.А., Косова И.В. Роль урогенитальных инфекций в этиологии цистита и необструктивного пиелонефрита у женщин: обзор. Часть 2 // Урология. — 2005. — № 3. — С. 63–66.
-
Лоран О.Б., Синякова Л.А., Косова И.В. Рецидивирующие инфекции мочевых путей. Алгоритм диагностики и лечения. — М.: МИА, 2008. — 29 с.
-
Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология. — М.: Медицина, 1993.
-
Руководство по урологии / под ред. Н.А. Лопаткина. — М.: Медицина, 1998.
-
Страчунский Л.С., Белоусова Ю.Б., Козлов С.Н. Практическое руководство по антимикробной химиотерапии. — М.: Боргес, 2002. — С. 243–244.
-
Hooton T.M. Recurrent urinary tract infection in women // Int. J. Antimicrob. Agents. — 2001, Apr. — Vol. 17 (4). — P. 259–268.
-
Naber K.G., Bergman B., Bjerklund-Johansen T.E. et al. Guidelines on urinary and male genital tract infections. In: EAU Guidelines. Edition presentedat the 16th EAU Congress, Geneva, Switzerland, 2001. ISBN 90–806179–3–9.
-
Guay D.R.P. Cranberry and urinary tract infections // Drugs. — 2009. — Vol. 69 (7). — P. 775–807.
-
_Kunin C.M. Urinary Tract Infections: Detection, Prevention and Management. — 5th ed. — Baltimore: Williams & Wilkins, 1997.
-
Naber K.G., Cho Y.H., Matsumoto T. et al. Immunoactive prophylaxis of recurrent urinary tract infections: A metaanalysis // Int. J. Antimicrob. Agents. — 2009, Feb. — Vol. 33 (2). — P. 111–119.
-
Raz R., Stamm W.E. A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infection // N.Eng. J. Med. — 1993. — Vol. 329. — P. 753–756.
-
Scholar E.M., Pratt W.B. The antimicrobial drugs. — 2nd ed. — Oxford: University Press, 2000.
-
Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Российские национальные рекомендации. — M., 2012.
-
Smaill F., Vazquez J.C. Antibiotics for asymptomatic bacteriuria in pregnancy. Cochrane Database Syst. Rev. — 2007. — Apr. 18; (2):CD000490. http://www.ncbi.nlm.nih.gov/pubmed/17443502
-
Pfau A., Sacks T.G. Efffective prophylaxis for recurrent urinary tract infections during pregnancy. Clin Infect Dis 1992 Apr 14; (4): 810–4. http://www.ncbi.nlm.nih.gov/pubmed/1576275
-
Лопаткин Н.А., Аполихин О.И., Пушкарь Д.Ю. и др. //Российские национальные рекомендации «Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов». М., 2014.
Глава 18. ЭРЕКТИЛЬНАЯ ДИСФУНКЦИЯ
М.Е. Чалый, Н.Д. Ахвледиани, Р.Р. Харчилава
Эректильная дисфункция (ЭД) — продолжающаяся более 3 мес неспособность достижения или поддержания эрекции, достаточной для проведения полового акта [23].
Эрекция — нейроваскулотканевой феномен, связанный с гормональным контролем. Он включает расширение кавернозных артерий, расслабление гладкой мускулатуры трабекул и активацию веноокклюзионного механизма кавернозных тел [1, 2] (УД: 2b) [29].
ЭД негативно влияет на физическое и психосоциальное здоровье, а также может снижать качество жизни пациентов и их партнерш [3]. Появляется все больше доказательств того, что ЭД может быть ранним проявлением ишемической болезни сердца и других системных сосудистых заболеваний; таким образом, ЭД не следует рассматривать только с точки зрения качества жизни, но также считать возможным предупредительным сигналом о наличии сердечно-сосудистого заболевания [4-8] (УД: 2b) [29].
МКБ-10 • F52 Сексуальная дисфункция, не обусловленная органическими нарушениями или болезнями • N48.4 Импотенция органического происхождения.
Эпидемиология (СР: С)
Эректильная дисфункция — весьма распространенное заболевание, так как встречается у 52% мужчин в возрасте 40–70 лет: 17% из них страдают ЭД легкой степени, 25% — средней степени, 10% — тяжелой степени (УД: 2b; CР: B) [11]. При обследовании мужчин от 30 до 80 лет встречаемость ЭД составила 19,2%. Частота новых случаев эректильной дисфункции на 1000 мужчин в Бразилии составляет 65,6, в Дании — 19,2 и в США — 26. Частота указанного сексуального расстройства увеличивается с возрастом: в 40–50 лет его выявляют у 40% мужчин, в 50– 60 лет — практически у половины обследованных (48–57%), а в старшей возрастной группе этим расстройством страдают более 70% мужчин (CР: [11]. Среди курильщиков ЭД встречается на 15–20% чаще, чем среди некурящих мужчин (CР: B) [7].
Факторы риска
К факторам риска ЭД (СР: D) относят:
Устранение неблагоприятных воздействий, связанных с особенностями образа жизни, приводит к уменьшению риска возникновения ЭД (УД: 1b). В частности, увеличение физической активности снижает ее вероятность у мужчин среднего возраста на 70% в течение 8 лет регулярных тренировок (CP: B) [8, 26]. При исследовании двух групп в течение 2 лет польза физических упражнений была подтверждена.
Профилактика
Меры профилактики ЭД (СР: D) — нормализация образа жизни, достаточная физическая активность, исключение табакокурения, ограничение потребления алкоголя, контроль и коррекция массы тела, содержания глюкозы и липидов в крови [12], а также регулярная половая жизнь.
Скрининг
Скрининг не проводят. Следует информировать всех пациентов с факторами риска ЭД о возможности ее развития и убедить их изменить образ жизни.
Диагностика
ЖАЛОБЫ И АНАМНЕЗ
Диагностические мероприятия у пациентов, предъявляющих жалобы на ЭД, преследуют несколько целей.
Диагностический процесс начинается с подробного сбора жалоб и анамнеза, сведений о состоянии здоровья пациента в целом и его психическом статусе. Анализируют данные общего и сексологического анамнеза, а также состояние копулятивной функции в прошлом и в настоящее время. Необходимо получить информацию о характере взаимоотношений с половым партнером, предшествующих консультациях, о лечебных мероприятиях и их эффективности.
Уточняют характер нарушения, его давность, стабильность проявления, влияние отдельных факторов и обстоятельств. Важно детально обсудить с пациентом качество адекватных и спонтанных эрекций, охарактеризовать половое влечение, продолжительность фрикционной стадии копулятивного цикла и оргазм.
Беседа с половым партнером пациента весьма желательна и важна как для уточнения характера и степени выраженности нарушения, так и для успеха планируемой терапии.
С целью объективизации жалоб больного, количественной характеристики копулятивных нарушений, включая ЭД, а также экономии времени врача рекомендуют использовать одну из предложенных анкетных систем, например, наиболее распространенный опросник — Международный индекс эректильной функции (УД: 3; СР: В) [26, 27].
Анализ полученных данных позволяет с достаточной степенью достоверности судить о природе ЭД (табл. 18.1). Ситуационный, избирательный и преходящий характер расстройства, а также наличие спонтанных эрекций свидетельствуют о психогенном генезе нарушения. По результатам заполненного пациентом опросника можно сделать количественное заключение о степени выраженности ЭД.
| Органическая ЭД | Психогенная ЭД |
|---|---|
Возникает постепенно |
Возникает внезапно |
Нарушение или отсутствие утренних эрекций |
Нормальные утренние эрекции |
Нормальный сексуальный анамнез |
Проблемы в сексуальном анамнезе |
Нормальное либидо |
Проблемы в отношениях с партнером |
Постоянство ЭД |
ЭД при определенных обстоятельствах |
Необходимо выяснить, страдает ли больной сахарным диабетом, артериальной гипертензией, атеросклерозом, гипогонадизмом, почечной недостаточностью, неврологическими и психическими нарушениями, собрать сведения о перенесенных оперативных вмешательствах на органах мочевой и половой систем, прямой кишке, о длительном приеме лекарственных средств и злоупотреблении алкоголем [5, 9]. В недавних исследованиях была выявлена связь между кардиоваскулярными факторами риска, метаболическими факторами и сексуальной дисфункцией обоих полов.
ФИЗИЧЕСКОЕ ОБСЛЕДОВАНИЕ
Физическое обследование предполагает оценку состояния сердечно-сосудистой, нервной, эндокринной и половой систем (УД: 4; СР: В).
В оценку состояния сердечно-сосудистой системы обязательно входят измерение артериального давления и характеристика пульса. Учитывая высокую распространенность заболеваний сердечно-сосудистой системы и метаболического синдрома (возрастной гипогонадизм), объем обследования должен быть достаточным для заключения о допустимости сексуальной активности и об отсутствии противопоказаний к терапии ЭД.
Для стандартизации врачебных рекомендаций по сексуальной активности в случаях сердечного риска на международной конференции (Принстон, 1999) разработали рекомендации по лечению сексуальной дисфункции у больных сердечно-сосудистыми заболеваниями (CP: A) [10]. Согласно Принстонскому консенсусу, больных разделяют на группы низкого, среднего и высокого риска (табл. 18.2).
| Низкий риск | Средний риск | Высокий риск | |
|---|---|---|---|
Сердечно-сосудистое заболевание |
|
|
|
Рекомендации по сексуальной активности |
Сексуальная активность или лечение сексуальных нарушений возможны; переоценку проводят регулярно, 1 раз в 6–12 мес |
Требуется проведение ЭКГ-пробы с нагрузкой и эхокардиографии, на основании которых пациента относят к группе высокого или низкого риска |
Сексуальную активность или лечение сексуальной дисфункции откладывают до стабилизации состояния |
При низкой степени риска сексуальную активность или лечение ЭД считают безопасным, при средней степени перед возобновлением сексуальной активности необходимо дополнительное обследование, при высокой — коррекция сердечно-сосудистого заболевания (рис. 18.1).
В плане терапии ЭД большинство пациентов, страдающих сердечно-сосудистыми заболеваниями, относятся к группе низкого риска (80%); пациенты, относящиеся к группе высокого риска, могут, пройдя курс лечения, перейти в группу низкого риска (СР: В) [6]. Важно учитывать, что клиническим проявлениям ИБС в 49% случаев предшествует ЭД [20].
Исследование вторичных половых признаков позволяет косвенно судить об инкреторной функции яичек, т.е. андрогенной насыщенности организма и своевременности наступающего полового созревания. Анализу подвергают:
Объективное обследование завершают изучением половых органов. Оно включает обнаружение и определение локализации яичек, их размеров и консистенции, пальпацию придатков яичек и предстательной железы, а также осмотр, измерение и пальпацию полового члена.
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Характер и объем лабораторных исследований определяют индивидуально с учетом жалоб, данных анамнеза и физического обследования в зависимости от объективной необходимости и желаний пациента.
Обязательно определяют натощак:
уровень глюкозы в крови;
липидный профиль;
общий тестостерон в утренней порции крови (УД: 4; СР: В).
Для полной оценки андрогенного статуса более информативно определение биодоступного и свободного тестостерона (СР: А) (расчет свободного тестостерона проводят после определения общего связанного с глобулином тестостерона). При сниженном уровне тестостерона показано определение гонадотропинов ЛГ и ФСГ, а также пролактина.
Мониторинг ночных пенильных тумесценций или спонтанных эрекций используют для дифференциальной диагностики органических и психогенных форм ЭД (СР: С). Исследование проводят в течение как минимум двух ночей с помощью прибора Rigiscan, а при его отсутствии — специальными кольцами с тремя контрольными полосами разрывов. У здоровых мужчин в течение ночи в фазе быстрого сна отмечают 4–6 эпизодов эрекций продолжительностью от 5 до 15 мин. Зарегистрированный эпизод эрекции с 60% ригидности вблизи головки полового члена и продолжительностью не менее 10 мин свидетельствует о сохранности механизма эрекций [14, 19]. У мужчин с ЭД выявляется снижение качества и количества ночных пенильных тумесценций во время ночного сна (СР: В).
Тест с интракавернозным введением вазоактивных препаратов (обычно аналога простагландина Е1 — алпростадила в средней дозе 10 мкг) позволяет выявить васкулогенную ЭД. При нормальных гемодинамических показателях примерно через 10 мин после инъекции возникает выраженная эрекция, сохраняющаяся в течение 30 мин и более (СР: С) [3, 19]. Данный тест подтверждает функциональную, но не нормальную эрекцию, так как данная эрекция может сосуществовать с артериальной недостаточностью и веноокклюзивной дисфункцией.
Ультразвуковую допплерографию артерий полового члена широко применяют для диагностики ЭД, хотя результаты исследования во многом зависят от технического совершенства аппаратуры. Этот метод более информативен, если исследование выполняют в состоянии покоя полового члена и индуцированной фармакологическими препаратами эрекции с последующим сравнением результатов. Основные количественные показатели при ультразвуковой допплерографии — максимальная (пиковая) систолическая скорость и конечная диастолическая скорость. На основе абсолютных показателей по стандартным формулам рассчитывают индекс резистентности. В норме пиковая систолическая скорость составляет более 30 см/с2 и индекс резистентности — более 0,8 (СР: А) [19].
При соответствующих показаниях для оценки состояния автономной иннервации полового члена и выявления ее нарушений выполняют исследование бульбокавернозного и кремастерного рефлексов, вызванных потенциалов, электромиографию полового члена, позволяющие в подавляющем большинстве случаев определить причину ЭД и приступить к лечению.
Инвазивные методы диагностики: ангиографию, кавернозометрию, кавернозографию (метод рентгенодиагностики кавернозной веноокклюзивной дисфункции и кавернозного фиброза) — выполняют в тех случаях, когда больной — потенциальный претендент на реконструктивные оперативные вмешательства по поводу ЭД.
| Рекомендации [29] | УД | СР |
|---|---|---|
Использование в клинике утвержденного опросника по ЭД может помочь в оценке всех аспектов сексуальной функции и возможной эффективности специфического лечения |
3 |
B |
Для выявления заболеваний, являющихся причиной ЭД, мужчинам на первом этапе необходимо провести физикальное обследование |
4 |
B |
Рутинные лабораторные исследования, включая исследование профиля глюкоз, липидов и определение концентрации общего тестостерона необходимы для выявления и лечения устранимых факторов риска, а также особенностей стиля жизни, которые можно изменить |
4 |
B |
Специфические диагностические тесты показаны только в отдельных случаях |
4 |
B |
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИМИ СПЕЦИАЛИСТАМИ
Патогенетическая терапия сопутствующих заболеваний должна проводиться совместно со специалистами смежных дисциплин на основе общепринятых современных стратегий. Пациентов следует направлять на консультацию/лечение к следующим специалистам.
К эндокринологу — при выявлении избыточной массы тела (окружность талии более 94 см), гипогонадизма, сахарного диабета (всех типов), гликемии натощак, полинейропатии, любых патологических отклонений гормонов крови.
К кардиологу — при выявлении дислипидемии, артериальной гипертензии, нарушении сердечного ритма, ишемической болезни сердца, клинических проявлений атеросклероза, острого нарушения мозгового кровообращения в анамнезе.
К неврологу — при выявлении заболеваний центральной и/или периферической нервной системы, полинейропатии, острого нарушения мозгового кровообращения в анамнезе.
К психотерапевту/сексологу — при выявлении тревожного и/или депрессивного синдрома, невроза, стойких травмирующих переживаний, акцентуации личности.
Лечение
ЦЕЛИ ЛЕЧЕНИЯ
Цель лечения — восстановление эрекции, достаточной для проведения полноценного полового акта.
Пациента нужно полностью информировать о возможных методах его лечения, их эффективности и вероятных осложнениях.
Больного целесообразно ознакомить с анатомией и физиологией половой системы, объяснить причины и патогенез возникшей у него ЭД. Активное вовлечение пациента в разработку стратегии лечения повышает его эффективность.
ЭД не относится к тяжелым нарушениям, однако она может отрицательно влиять на психический статус мужчины, ухудшать качество его жизни, нарушать партнерские отношения и прочность семьи, поэтому независимо от генеза расстройства психотерапия — обязательный компонент лечения. Во всех случаях врач должен использовать свое влияние для нормализации или улучшения межличностных отношений половых партнеров. Важно, чтобы сексуальная партнерша была вовлечена в терапевтический процесс.
Терапия ЭД должна быть этиотропной и патогенетической. В первую очередь это касается сахарного диабета, артериальной гипертензии, метаболического синдрома. На полное излечение от ЭД можно рассчитывать в случаях психогенной ЭД (рациональная психотерапия), посттравматической артериогенной ЭД у молодых мужчин (оперативная реваскуляризация кавернозных тел), при гормональных нарушениях (гипогонадизм, гиперпролактинемия) (СР: А).
В случаях, когда комплексное обследование не выявило причины ЭД, терапия может носить симптоматический характер.
Перед началом лечения больному указывают на необходимость максимального исключения факторов риска, нормализацию образа жизни и режима сексуальной активности. Следует решить вопрос о возможности отмены или замены получаемых пациентом лекарственных препаратов, способных отрицательно влиять на эрекцию.
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
Госпитализация показана только для выполнения сложных инвазивных исследований и/или оперативных вмешательств.
МЕДИКАМЕНТОЗНОЕ И НЕМЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Следует применять поэтапное лечение.
-
На первом этапе при наличии соответствующих показаний используют препараты, повышающие концентрацию тестостерона, пероральные эректогенные препараты, вакуумные устройства и психо-сексотерапию. Изменение образа жизни и модификация факторов риска должны предшествовать любому варианту медикаментозного лечения ЭД или дополнять его (УД: 1a; СР: A).
-
Второй этап лечения подразумевает внутриуретральное и/или внутрикавернозное введение вазоактивных средств. В дальнейшем при необходимости применяют хирургическое лечение.
Необходимо помнить, что при наличии андрогендефицитного состояния применение других ЛС, направленных на устранение васкулогенной и нейрогенной причин ЭД, будет малоэффективным.
При наличии у мужчины с эректильной дисфункцией низкой концентрации тестостерона при нормальной концентрации других гормонов, нормальных размерах предстательной железы, нормальной концентрации ПСА, отсутствии других противопоказаний для терапии тестостероном (карцинома грудной железы, тяжелая полицитемия, наличие симптомов обструкции нижних мочевыводящих путей) и отсутствии дислипидемии назначают препараты тестостерона. Лекарственное средство, дозу, режим введения и продолжительность курса подбирают индивидуально.
Для андрогензаместительной терапии — лекарственные инъекционные и трансдермальные формы тестостерона. Тестостерона ундеканоат, вводится внутримышечно в дозе 1000 мг. Он поддерживает уровень тестостерона в физиологических пределах в течение 12 нед и не вызывает пиковых концентраций.
Накожно применяют тестостероновый гель, который отличается удобными фармакокинетическими свойствами. Через 1–2 ч после аппликации уровень тестостерона в сыворотке крови достигает физиологических значений и сохраняется в течение суток. Важное обстоятельство — сохранение циркадного суточного ритма концентрации гормона.
Основное противопоказание к назначению препаратов тестостерона — РПЖ или подозрение на него, поэтому перед назначением препаратов тестостерона ПРИ предстательной железы и определение ПСА в сыворотке крови обязательны (СР: А) [22]. Результат андрогензаместительной терапии обязательно оценивают через 2–3 мес, после чего решают вопрос о целесообразности ее продолжения. Гормональная терапия не всегда эффективна в лечении ЭД на фоне гипогонадизма. При хирургической реваскуляризации пациентов с тазовой или перениальной травмой в долгосрочном периоде успех наблюдается в 60–70% случаев. Кавернозная веноокклюзивная дисфункция является противопоказанием к реваскуляризации и должна быть исключена динамической кавернозографией или кавернозометрией. Васкулярная хирургия при веноокклюзивной дисфункции не рекомендована из-за плохих отдаленных результатов.
При лечении ЭД руководствуются принципом поэтапного проведения лечебных мероприятий.
Терапия первой линии
Ингибиторы фосфодиэстеразы 5-го типа (ФДЭ-5)
В настоящее время в России доступны четыре препарата этой группы, выпускаемые выпускаемые в различных дозировках:
Их отличительная особенность — эффективность при всех формах ЭД и хорошая переносимость (CР: В) [13, 24, 25]. Ингибиторы ФДЭ-5 используются эпизодически (по требованию) за определенное время перед половым актом, причем для наступления эффекта от препарата необходима сексуальная стимуляция. Дозы подбирают индивидуально. Выпускаются иФДЭ-5 стандартно в таблетированной форме, за исключением силденафила, который с 2017 года доступен в России еще и в форме пленок, которые растворяются на языке и не требуют запивания водой[7] (препарат «Динамико Форвард»). Ингибирование ФДЭ-5 увеличивает кровоток, что приводит к релаксации гладких мышц, вазодилатации и эрекции. Профиль побочных эффектов варденафила, силденафила и тадалафила схож с плацебо.
Эффект силденафила может наблюдаться в течение 12 ч. После 24 нед его применения улучшения наблюдались у 56, 77 и 84% мужчин, принимавших 25, 50 и 100 мг силденафила соответственно, в сравнении с 25% улучшений у пациентов, принимавших плацебо. У пациентов с сахарным диабетом при использовании силденафила отмечалось 66,6% улучшения эрекции и 63% успешных соитий в сравнении с 28,6 и 33% у мужчин, принимавших плацебо, соответственно.
Варденафил помимо обычных таблетированных форм дозировкой 5, 10 и 20 мг выпускается также в варианте орально диспергированной таблетки, которая растворяется в ротовой полости без воды.
Принципиальное отличие тадалафила — его длительное действие: 36 ч. В премаркетинговых исследованиях после 12 нед применения тадалафила улучшение эрекции наблюдалось у 67 и 81% мужчин, принимавших 10 и 20 мг соответственно, в сравнении с 35% мужчин, принимавших плацебо.
В исследованиях in vitro варденафил демонстрирует в 10 раз более мощный результат, чем силденафил, что не обязательно ведет к более мощному клиническому ответу. После 12 нед применения варденафила улучшение эрекций отметили в 66, 76 и 80% случаев при применении 5, 10 и 20 мг соответственно против 31% мужчин, принимавших плацебо. При приеме варденафила в сочетании с сахарным диабетом 78% пациентов подтвердили положительное изменение эректильной функции, против 13% пациентов, получавших плацебо.
Исследования показали, что ежедневное применение тадалафила приводит к большему улучшению сексуальной функции, чем прием данного препарата по необходимости. В связи с этим данный препарат стали также выпускать в таблетированной форме с дозировкой 5 мг, предназначенной для ежедневного применения.
Было выявлено, что длительное применение тадалафила улучшает эндотелиальные функции, данный эффект сохраняется после прекращения применения препарата.
Ни один из ингибиторов ФДЭ-5 не сказывается отрицательно на продолжительность нагрузки или времени до наступления ишемии при тестировании пациентов со стабильной стенокардией. Ингибиторы ФДЭ5 могут даже улучшать результаты данных тестов.
При сочетании ингибиторов ФДЭ-5 с антигипертензивными средствами наблюдается незначительное усиление снижения давления.
Применение альфа1-адреноблокаторов в сочетании с ингибиторами ФДЭ-5 может приводить к ортостатической гипотензии. С целью профилактики значимого снижения артериального давления ингибиторы ФДЭ-5 целесообразно назначать с тамсулозином.
В виду отсутствия прямых сравнительных исследований трех препаратов анализ их характеристик целесообразно проводить на основании данных регистрации препаратов в Европе и США, которые формируют по единым стандартам (табл. 18.3–18.5).
| Параметр | Силденафил | Тадалафил | Варденафил | Уденафил |
|---|---|---|---|---|
Время достижения максимальной концентрации (Тmax, ч) |
1 |
2 |
1 |
1 |
Период полувыведения (Т1/2, ч) |
4 |
17,5 |
4–5 |
12 |
| Показатель | Силденафил | Тадалафил | Варденафил | Уденафил |
|---|---|---|---|---|
Начало действия, мин |
25 |
30 |
25 |
30 |
Продолжительность действия, ч |
5 |
36 |
5 |
24 |
Частота успешного применения, % |
66 (50–100 мг) |
75 (20 мг) |
65 (20 мг) |
70 |
Диапазон доз, мг |
25–100 |
20 |
5–20 |
50–100 |
| Нежелательные явления, % | Силденафил | Тадалафил | Варденафил | Уденафил |
|---|---|---|---|---|
Головная боль |
>10 |
>10 |
>10 |
1–10 |
Приливы |
>10 |
>1 |
>10 |
>10 |
Диспепсия |
>1 |
>10 |
>1 |
1–10 |
Головокружение |
>1 |
>1 |
>1 |
0,1–1,0% |
Заложенность носа |
>1 |
>1 |
>1 |
1–10% |
Миалгия |
<0,01 |
>1 |
<0,01 |
– |
Нарушения зрения |
>1 |
<0,01 |
>0,1 |
0,1–1,0% |
Ингибиторы ФДЭ-5 нельзя принимать параллельно с органическими нитратами из-за потенцирования гипотензивного действия. Согласно рекомендациям Американской кардиологической ассоциации, органические нитраты можно использовать не ранее чем через 24 ч после приема короткодействующих ингибиторов ФДЭ-5 и не ранее чем через 48 ч после приема тадалафила. При использовании ингибиторов ФДЭ-5 следует учитывать потенциальный риск осложнений, связанных с сексуальной активностью, в течение 90 дней после перенесенного инфаркта миокарда; при нестабильной стенокардии или стенокардии, возникающей во время полового акта; при развившейся в течение последних 6 мес сердечной недостаточности II функционального класса и выше по NYHA, неконтролируемых нарушениях сердечного ритма, артериальной гипотензии (АД ниже 90/50 мм рт.ст.) или неконтролируемой артериальной гипертензии, а также в течение 6 мес после инсульта (СР: В) [10].
Сочетание ингибиторов ФДЭ-5 с другими лекарственными средствами возможно.
Врач должен донести до пациента достоверную и объективную информацию об особенностях каждого из препаратов группы ингибиторов ФДЭ-5 и предоставить ему самому возможность выбора.
Терапия локальным отрицательным давлением
К физическим средствам первой линии лечения ЭД относят терапию локальным отрицательным давлением. Сущность метода заключается в том, что половой член помещают в специальную колбу, где создают отрицательное давление с помощью вакуумного насоса. Это приводит к увеличению притока крови к пещеристым телам, что обусловливает эрекцию, для сохранения которой на основание полового члена накладывают специальное сжимающее кольцо, ограничивающее венозный отток. Достигаемая эрекция нефизиологична. Показания к применению вакуумных устройств — невозможность лекарственной терапии или ее неэффективность, а также предпочтение пациента. К данному виду терапии более склонны пожилые мужчины, которым свойственна низкая сексуальная активность. Эффективность метода и удовлетворенность им составляют от 27 до 94% (СР: В) [16]. Примерно 30% пациентов отказываются от применения вакуумных устройств в связи с возникновением боли, подкожных кровоизлияний, с затрудненной эякуляцией и снижением чувствительности головки полового члена.
Терапия второй линии
При отсутствии эффекта от пероральных препаратов могут быть применены интракавернозные инъекции вазоактивных лекарственных средств. Результативность данной терапии составляет около 85% (СР: В) [28]. Для интракавернозного введения используют несколько препаратов в качестве монотерапии или в комбинации (простагландин Е1, фентоламин, папаверин). Первоначальная (тестирующая) доза для простагландина Е1 составляет 10 мкг (вводится в одно из кавернозных тел после растворения в 1 мл физиологического раствора). При необходимости доза может быть увеличена до 20 мкг. Эрекция наступает через 5–15 мин после введения препарата, ее продолжительность зависит от дозы, составляя в среднем около 90 мин. После подбора необходимого количества препарата и соответствующего обучения пациента переводят на выполнение аутоинъекций, частота не более 3 раз в неделю [3].
В генеральной группе пациентов с ЭД эффективность простагландина 70%, а в субгруппах до 94%. Осложнения: боль в половом члене у 50% пациентов после 11% инъекций, сверхпролонгированная эрекция 5%, приапизм 1% и фиброз 2%. Боль облегчается при использовании раствора бикарбоната и анестезии.
Данная терапия противопоказана пациентам:
Пациента нужно предупредить, что в случае сохранения эрекции более 4 ч ему необходимо обратиться к врачу. Эрекцию необходимо купировать путем пункции кавернозных тел и аспирации крови, а при необходимости — введением минимальных доз адреномиметических препаратов.
Большинство пациентов, применяющих внутрикавернозные инъекции, могут переключиться на ингибиторы ФДЭ-5 во избежание патологических изменений в белочной оболочке полового члена, но, как правило, не делают этого.
Альтернатива интракавернозным инъекциям — внутриуретральное введение алпростадила. Однако данный метод не нашел широкого клинического применения.
Терапия третьей линии (хирургическое лечение)
Оперативные вмешательства на сосудах могут быть показаны больным с окклюзивными поражениями артерий, снабжающих кровью тазовые органы. При этом наилучших результатов можно ожидать у молодых мужчин с изолированными артериальными дефектами вследствие перенесенной травмы, тогда как у мужчин с генерализованным атеросклерозом эффект после этих операций непродолжителен. Хирургические пособия на венах при повышенном оттоке венозной крови от кавернозных тел заключаются в их перевязке и иногда используются у молодых пациентов. Однако эффективность этих операций невысокая и сведения о них противоречивы (СР: D) [2].
Как крайнюю меру (при безуспешности всех остальных методов лечения ЭД), если пациент настаивает на кардинальном решении своей проблемы, применяют фаллоэндопротезирование полужесткими протезами или гидравлическими имплантатами, имитирующими эрекцию (СР: С), основной недостаток которых — их высокая стоимость [1, 4]. Уровень удовлетворенности среди пациентов, подвергшихся фаллопротезированию, составляет 70–87%.
Таким образом, индивидуальный подбор и поэтапное применение современных методов терапии ЭД позволяют в преобладающем большинстве случаев добиться сексуальной реабилитации больных (табл. 18.6).
| Метод лечения/препарат | Преимущества | Недостатки |
|---|---|---|
Ингибиторы ФДЭ-5 |
Высокая эффективность лечение, простота применения |
Противопоказаны при приеме нитратов; взаимодействие с пищей и некоторыми лекарственными препаратами; относительно высокая цена |
Интракавернозное введение простагландина Е1 |
Высокая эффективность (70–80%) терапии, незначительные системные побочные эффекты |
Необходимость аутоинъекций; требуется специальный тренинг; вызывает боль в половом члене |
Вакуумконстрикторные устройства |
Наименее затратный метод; нет системных побочных эффектов |
Ненатуральная эрекция; вызывает мелкие кровоизлияния, отек кожи члена, нарушение эякуляции |
Протезирование |
Высокоэффективный метод |
Требует операции; неестественная эрекция, возможна инфекция; в случае неудачного исхода операции применение других методов лечения ЭД невозможно; вероятна необходимость замены протеза через 5–10 лет |
| Рекомендации [29] | УД | СР |
|---|---|---|
Изменение образа жизни и модификация факторов риска должны предшествовать любому варианту медикаментозного лечения ЭД или дополнять его |
1a |
А |
Лечение, способствующее восстановлению эрекции, необходимо назначать в возможно более ранние сроки после выполнения РПЭ |
1b |
А |
В случае выявления излечимой причины ЭД первоначально необходимо провести её лечение |
1b |
B |
Терапией первой линии является назначение ингибиторов ФДЭ-5 |
1a |
А |
Неадекватное/неправильное назначение и недостаточное информирование пациента являются основными причинами неэффективности ингибиторов ФДЭ-5 |
3 |
B |
Вакуумное эректильное устройство может применяться у пациентов, имеющих стабильные сексуальные отношения |
4 |
C |
Интракавернозные инъекции — терапия второй линии |
1b |
B |
Протезы полового члена — терапия третьей линии |
4 |
C |
Прогноз
В последние десятилетия прогноз при ЭД у преобладающего большинства больных существенно улучшился. Это связано с внедрением в клиническую практику лекарственных средств с этиопатогенетическим механизмом действия (ингибиторы ФДЭ-5) и препаратов тестостерона последнего поколения. В тяжелых случаях ЭД, не поддающейся консервативной терапии, восстановление функции возможно сосудистыми микрохирургическими операциями или фаллоэндопротезированием с применением высокоэффективных современных имплантатов.
ЛИТЕРАТУРА
-
Аляев.Ю.Г., Григорян В.А., Чалый М.Е. Нарушения половой и репродуктивной функции у мужчин. – М.: Литтерра 2006. — С. 52–96.
-
Глыбочко П.В., Аляев Ю.Г. и соавт. Урология: учебник / под ред. — 3-е изд., перераб. и доп. — М.: ГЭОТАР-Медиа, 2013. — С. 543–558.
-
Глыбочко П.В., Аляев Ю.Г., Чалый М.Е., Ахвледиани Н.Д. Половые расстройства у мужчин. — М.: ГЭОТАР-Медиа 2012. — С. 15–65.
-
Лоран О.Б., Сегал А.С., Щеплев П.А. Простагландин Е1 в диагностике и терапии нарушений эрекции // Урол. и нефрол. — 1995. — № 4. — С. 35–38.
-
Мазо Е.Б., Гамидов С.И. Эректильная дисфункция. — М.: Вече, 2004. — 120 с.
-
Пушкарь Д.Ю., Верткин А.Л. Эректильная дисфункция: кардиологические аспекты. — М.: МЕДпресс-информ, 2005.
-
Пушкарь Д.Ю., Сегал А. С., Багаев А.Г., Носовицкий П.Б. Иохимбин в терапии эректильной дисфункции // Урология. — 2002. — № 6. — С. 34–37.
-
Коган М.И. Эректильная дисфункция (текущее мнение). — Ростов-на-Дону, 2005. — 336 с.
-
Кротовский Г.С. Лечение сосудистой импотенции. — М., 1998. — 159 с.
-
Benet A.E. Melman A. The epidemiology of erectile dysfunction. Impotence // Urol. Clin.N. Amer. — 1995. — Vol. 22. — P. 699–709.
-
Carey M.P. Johnson B.T. Efffectiveness of yohimbine in the treatment of erectile disorder: four metaanalytic integrations // Arch.Sex. Behav. — 1996. — Vol. 25. — P. 341–360.
-
DeBusk R., Drory Y., Goldstein I. et al. Management of sexual dysfunction in patients with cardiovascular disease: recommendation of the Princeton consensuspanel // Amer.J. Cardiol. — 2000. — Vol. 86. — P. 175–181.
-
Feldman H.A., Goldstein I., Hatzichristou D. G. et al. Impotence and itsmedical and psychosocial correlates: Results of the Massachusetts Male AgingStudy // J. Urol. — 1994. — Vol. 151. — P. 54–61.
-
Feldman H.A., Johannes C.D., Derby C.A. et al. Erectile dysfunction and coronary risk factors: Prospective results of the Massachusetts Male Aging Study // Prev. Med. — 2000. — Vol. 30. — P. 328–338.
-
Goldstein J. Lue T.F. Padma-Nathan H. et al. Oral Sildenafil in the treatment of erectile dysfunction // NEJM. — 1998. — Vol. 338. — P. 1397–1404.
-
Hatzichristou D.G., Hatzimouratidis K., Ioannides E. et al. Nocturnal peniletumescence and rigidity monitoring in young potent volunteers: reproducibility, evaluation criteria and the efffect of sexual intercourse // J.Urol. — 1998. — Vol. 159. — P. 1921–1926.
-
Kunelius P., Hakkinen J., Lukkarinen O. Is high dose yohimbinehydrochloride efffective in the treatment of mixed-type impotence? A prospective randomized controlled double-blind cross-over study // Urology. — 1997. —Vol. 49. — P.441– 444.
-
Levine L.A., Dimitriou R.J. Vacuum-constriction and external erection devices in erectile dysfunction // Urol. Clin. N. Amer. — 2001. — Vol. 28. — P. 335–341.
-
Lue T.F. Impotence: a patients goal-directed approach to treatment // World J.Urol. — 1990. — Vol. 8. — P. 67–74.
-
Martinez R., Puigvert A., Pomerol J.M., Rodriguez-Villalba R. Clinical experience with apomorphine hydrochloride: the first 107 patients // J. Urol. — 2003. — Vol. 170. — P. 2352–2355.
-
Meuleman E.J., Diemont W.L. Investigation of erectile dysfunction. Diagnostics testing for vascular factors in erectile dysfunction // Urol. Clin.N. Amer. — 1995. — Vol. 22. — P. 803–819.
-
Montorsi F., Briganti A., Salonia A. et al. Erectile dysfunction prevalence, time of onset and association with raisk factors in 300 consecutive patients withacute chest pain and angiographically documented coronary artery disease // Eur. Urol. — 2003. — Vol. 44. — P. 35–38.
-
Montorsi F. Padma-Nathan H. Buvat J. et al. Earliest time to onset of action leading to successful intercourse with vardenafil determined in an at-home setting: A randomized double-blind placebo-controlled trial // J. Sex. Med. — 2004. — Vol. 1. — P. 168–178.
-
Nieschlag E., Swerdloff R., Behre H.M. et al. Investigation, treatment andmonitoring of late-onset hypogonadism in males: ISA, ISSAM and EAU recommendations // Int.J. Androl. — 2005. — Vol. 28. — P. 125–127.
-
NIH Consensus Development Panel of Impotence. Impotence // J.A. M. A. — 1993. — Vol. 270. — P. 83–90.
-
Padma-Nathan H., McMurray J. G., Pullmann W.E. et al. On-demand IC351 enhances erectile function in patients with erectile dysfunction // Int. J. Import. Res. — 2001. — Vol. 13. — P. 2–9.
-
Porst H., Padma-Nathan H. The effificacy and tolerability of vardenafil, a neworal selective phosphodiesterase type 5 inhibitor in patients with erectiledysfunction: The first at-home clinical trial // Int. J. Import. Res. — 2001. — Vol. 13. — P.192–199.
-
Rosen R., Cappelleri J., Smith V. et al. Development and evaluation of anabridged, 5-item version of the International Index of Erectile Function (IIEF5) as a diagnostic tool for erectile dysfunction // Int. J. Import. Res. — 1999. — Vol. 11. — P. 319–326.
-
Rosen R. C., Riley A. Wagner G. et al. The International Index of Erectile Function (IIEF): a multidimensional scale for assessment of erectile dysfunction // Urology. — 1997. — Vol. 49. — P. 822.
-
Shabsigh R., Padma-Nathan H., Gittleman M. et al. Intracavernous alpostadilalfadex (EDEX/VIRIDAL) is efffective and safe in patients with erectile dysfunctionafter failing sildenafil (Viagra) // Urology. — 2000. — Vol. 55. — P. 477–480.
-
http://uroweb.org/fileadmin/guidelines/Guidelines_2014_5_June_2014.pdf
Приложение 1. МЕЖДУНАРОДНЫЙ ИНДЕКС СИМПТОМОВ ПРИ ЗАБОЛЕВАНИЯХ ПРОСТАТЫ
Ответьте на каждый вопрос, помечая выбранный Вами ответ так, как это указано. Если Вы не уверены в том, как ответить на вопрос, пожалуйста, выберите такой ответ, который точнее всего отражает Ваше мнение.
-
Как часто у Вас в течение последнего месяца было ощущение неполного опорожнения мочевого пузыря после мочеиспускания? (Обведите одну цифру.)
Не было
0
Одно мочеиспускание (один раз в сутки)
1
Менее чем в половине мочеиспусканий
2
Примерно в половине мочеиспусканий
3
Более чем в половине мочеиспусканий
4
Почти всегда
5
-
Как часто у Вас в течение последнего месяца возникала потребность мочиться ранее чем через 2 ч после последнего
мочеиспускания? (Обведите одну цифру.)
Не было
0
Одно мочеиспускание (один раз в сутки)
1
Менее чем в половине мочеиспусканий
2
Примерно в половине мочеиспусканий
3
Более чем в половине мочеиспусканий
4
Почти всегда
5
-
Как часто в течение последнего месяца мочеиспускание было прерывистым? (Обведите одну цифру.)
Не было
0
Одно мочеиспускание (один раз в сутки)
1
Менее чем в половине мочеиспусканий
2
Примерно в половине мочеиспусканий
3
Более чем в половине мочеиспусканий
4
Почти всегда
5
-
Как часто в течение последнего месяца Вы находили трудным временно воздержаться от мочеиспускания при возникновении позыва? (Обведите одну цифру.)
Не было
0
Одно мочеиспускание (один раз в сутки)
1
Менее чем в половине мочеиспусканий
2
Примерно в половине мочеиспусканий
3
Более чем в половине мочеиспусканий
4
Почти всегда
5
-
Как часто в течение последнего месяца Вы ощущали слабый напор струи мочи? (Обведите одну цифру.)
Не было
0
Одно мочеиспускание (один раз в сутки)
1
Менее чем в половине мочеиспусканий
2
Примерно в половине мочеиспусканий
3
Более чем в половине мочеиспусканий
4
Почти всегда
5
-
Как часто в течение последнего месяца Вам приходилось прилагать усилия и натуживаться, чтобы начать мочеиспускание? (Обведите одну цифру.)
Не было
0
Одно мочеиспускание (один раз в сутки)
1
Менее чем в половине мочеиспусканий
2
Примерно в половине мочеиспусканий
3
Более чем в половине мочеиспусканий
4
Почти всегда
5
-
Сколько раз за ночь Вам обычно приходилось вставать в течение последнего месяца, чтобы помочиться? (Обведите одну цифру.)
Не было
0
Одно мочеиспускание (один раз в сутки)
1
Менее чем в половине мочеиспусканий
2
Примерно в половине мочеиспусканий
3
Более чем в половине мочеиспусканий
4
Почти всегда
5
Итого:
баллов.
-
Приложение 2. ШКАЛА СИМПТОМОВ ХРОНИЧЕСКОГО ПРОСТАТИТА (NIH-CPS)
Ответьте на каждый вопрос, помечая выбранный Вами ответ так, как это указано. Если Вы не уверены в том, как ответить на вопрос, пожалуйста, выберите такой ответ, который точнее всего отражает Ваше мнение.
Боль или дискомфорт
-
Приходилось ли Вам в течение последней недели испытывать боль в следующих областях?
А. В области промежности. (Обведите одну цифру)
Да
1
Нет
0
Б. В области мошонки. (Обведите одну цифру)
Да
1
Нет
0
B. В области полового члена вне акта мочеиспускания. (Обведите одну цифру)
Да
1
Нет
0
Г. В нижних отделах живота. (Обведите одну цифру)
Да
1
Нет
0
-
На нарисованной ниже прямой отметьте то место, которое, на Ваш взгляд, соответствует силе испытываемой Вами боли, принимая во внимание, что крайняя левая точка соответствует отсутствию боли, а крайняя правая — очень сильной боли. (Обведите одну цифру) БОЛЬ ОТСУТСТВУЕТ БОЛЬ КРАЙНЕ СИЛЬНАЯ
0___1___2___3___4___5___6___7___8___9___10Мочеиспускание
-
Как часто в течение последней недели Вы испытывали чувство неполного опорожнения мочевого пузыря? (Обведите одну цифру)
Никогда
0
Менее чем 1 из 5 раз
1
Менее 50% случаев
2
Около 50% случаев
3
Более 50% случаев
4
Почти всегда
5
-
Как часто Вам приходилось мочиться чаще чем через 2 ч после последнего мочеиспускания? (Обведите одну цифру)
Никогда
0
Менее чем 1 из 5 раз
1
Менее 50% случаев
2
Около 50% случаев
3
Более 50% случаев
4
Почти всегда
5
Влияние на качество жизни
-
Приходилось ли Вам воздерживаться от дел, которые Вы обычно делаете, из-за имеющихся у Вас проявлений заболевания? (Обведите одну цифру)
Нет
0
Изредка
1
Иногда
2
Часто
3
-
Как часто Вам приходилось думать о симптомах болезни в течение последней недели? (Обведите одну цифру)
Нет
0
Изредка
1
Иногда
2
Часто
3
-
Как бы Вы отнеслись к тому, что Вам пришлось бы жить с имеющимися урологическими проблемами до конца жизни? (Обведите одну цифру)
Отлично
0
Хорошо
1
Удовлетворительно
2
Смешанное чувство
3
Неудовлетворительно
4
Плохо
5
С ужасом
6
Итого:
баллов.
Урология
Российские клинические рекомендации
Под редакцией
Ю.Г. Аляева, П.В. Глыбочко, Д.Ю. Пушкаря
Агентство медицинской информации «Медфорум»
127422, Москва, ул. Тимирязевская, д. 1, стр. 3
тел. (495) 234 07 34, www.webmed.ru
Бумага офсетная. Печать офсетная. Объем 34 п.л.
Подписано в печать 06.04.17. Формат 60×90/16
Тираж 7000 экз. Заказ № 2448
Отпечатано в типографии ООО «Буки Веди»
119049, г. Москва, Ленинский проспект, д. 4, стр. 1 А
Тел.: (495) 926-63-96, www.bukivedi.com, info@bukivedi.com
ISBN 978-5-9906972-6-3