
Патологическая анатомия. Т. 1. [Электронный ресурс]: учебник: в 2 т. / под ред. Паукова В.С. - М. : ГЭОТАР- Медиа, 2020. |
Аннотация
Учебник написан группой опытных преподавателей кафедры патологической анатомии им. акад. А.И. Струкова Первого МГМУ им. И.М. Сеченова при участии ведущих специалистов ряда других медицинских университетов. Изложение проблем общей и частной патологической анатомии основывается на принципе единства структуры и функции. Авторы старались показать не только морфологическую основу патологических процессов и болезней, но и их связь с изменениями функций организма, что проявляется в определенных симптомах заболеваний, показать динамику их развития. Это создает базу для последующего изучения всех клинических дисциплин.
В книге, кроме патологической анатомии, описаны общемедицинские понятия, правила написания клинического и патологоанатомического диагнозов, категории и причины расхождения диагнозов и др. Все это способствует развитию у студентов клинического мышления, которое возможно только на основе глубоких знаний и понимания закономерностей развития патологических процессов в больном организме. Тем самым патологическая анатомия является важнейшим этапом подготовки врача, и учебник "Патологическая анатомия" соответствует этой задаче.
Предназначен студентам лечебного, педиатрического, медико-профилактического и стоматологического факультетов медицинских вузов.
Система дыхания включает полость носа, глотку, гортань, трахею, бронхи, бронхиолы и легкие. В состав органов дыхания также входят грудная клетка, собственный эндокринный и нервный аппараты, плевральные полости, межреберные мышцы и диафрагма. Важнейшую роль во всех процессах, протекающих в легких, играют сосуды. Эти органы имеют разную структуру, однако все они служат одной главной функции - обеспечению газообмена. Вместе с тем сама по себе эта функция, весьма многоплановая, включает несколько этапов, начиная от согревания воздуха в носовых ходах и проведения его через трахеобронхиальное дерево и кончая газообменом непосредственно в альвеолах паренхимы легкого. Стенки легочных альвеол имеют однослойную эпителиальную выстилку, в которой имеются пневмоциты I и II типов. Пневмоциты I типа - крупные плоские клетки, покрывающие до 95% поверхности альвеол в тех зонах, где происходит газообмен. Пневмоциты II типа занимают 5% площади альвеол и непосредственно в газообмене не участвуют. Эпителий располагается на базальной мембране, которая примыкает к базальной мембране альвеолярного кровеносного капилляра, выстланного эндотелиальными клетками.
Нейроэндокринные клетки (типа клеток Кульчицкого) расположены среди альвеолярного эпителия, а также в бронхах между базальными эпителиальными клетками, в области расположения нервных окончаний и в строме органа, вблизи сосудов, они получили название пневмоцитов III порядка.
Аэрогематический барьер - основное место газообмена в организме, его формируют капилляры и прилежащие к ним пневмоциты I типа. Аэрогематический барьер имеет толщину 0,5 мкм, из них 0,2 мкм занимают пневмоциты I типа, 0,1 мкм - общая базальная мембрана, 0,2 мкм - уплощенная часть эндотелиальной клетки капилляра. В состав барьера входит также выстилающая альвеолярную поверхность пленка сурфактанта.
Система дыхания открыта для воздействия окружающей среды, прежде всего для вирусов, микробов, грибов и паразитов, а также для различных пылей и вредных газов. И это требует соответствующей системы защиты, также имеющей свое морфологическое выражение. Поэтому система дыхания характеризуется структурным многообразием, включающим различные эпителии, дренажные системы, клетки иммунной и эндокринной систем, осуществляющие клеточную и гуморальную иммунную защиту легких, а также нейроэндокринную регуляцию комплекса сложных процессов, происходящих в легких.
Заболевания легких, как правило, развиваются в результате нарушений механизмов защиты бронхолегочной системы.
Помимо респираторных функций легкие участвуют в регуляции белкового, водно-солевого и углеводного обмена. Для них характерен высокий уровень метаболизма липидов, включающих биогенез сурфактанта, простагландинов, лейкотриенов; легкие выполняют функции, связанные с инактивацией ангиотензинпревращающего фермента, адреналина, норадреналина, серотонина, гистамина, брадикинина, простагландинов с генерацией и инактивацией АФК. Органы дыхания участвуют в терморегуляции, депонировании крови, регуляции ее свертывания, очищении крови от микротромбов и продуктов метаболизма. В регуляции всех этих разнообразных процессов участвуют интегративные системы организма - нервная, эндокринная и иммунная, поэтому любое заболевание, развивающееся в органах дыхания, оказывает системное действие на организм.
Большинство указанных функций выполняет паренхима легких, по существу, огромная биологически активная мембрана, площадь которой составляет 80 м2 при выдохе и 120 м2 при вдохе. Через нее происходит поступление в организм кислорода и вывод углекислого газа. В связи с этим практически каждый патологический процесс, в первую очередь воспаление, пневмосклероз и опухоли, приводит к развитию дыхательной гипоксии. При этом острая гипоксия может обусловить легочно-сердечную недостаточность, а хроническая гипоксия вызывает дистрофические, атрофические и склеротические процессы как в самой легочной ткани, так и во многих внутренних органах, но в первую очередь при этом изменяется и страдает сердечно-сосудистая система. Нарушения функций легких, приводящие к изменению газового состава артериальной крови, а также склеротические изменения в них, требуют максимального напряжения компенсаторных и приспособительных механизмов, что характеризуется соответствующими морфологическими перестройками в различных отделах дыхательной системы. Как часть целого организма система дыхания обладает всеми общебиологическими и стереотипными реакциями, и в то же время в силу структурно-функциональных особенностей различных отделов этой системы в каждой из них патологический процесс может иметь свой, особый характер.
МЕХАНИЗМЫ ЗАЩИТЫ БРОНХОЛЕГОЧНОЙ СИСТЕМЫ
Легкие снабжены сложными защитными системами, препятствующими проникновению инфекционных и других повреждающих агентов в легочную ткань, которая в норме остается стерильной ниже уровня гортани. Механизмы защиты бронхолегочной системы действуют на уровне проводящих и респираторных отделов легкого и осуществляются путем кондиционирования воздуха и его очистки - клиренса, через механическую очистку, эндоцитоз бронхиальным эпителием, гуморальную и клеточную неспецифическую защиту, а также иммунную специфическую защиту.
Кондиционирование воздуха связано с его обогреванием или охлаждением, увлажнением в верхних дыхательных путях и в крупных бронхах. Вдыхаемый воздух согревается и увлажняется; длительная гипервентиляция, обезвоживание организма и низкая влажность вдыхаемого воздуха способствуют высыханию слизистой дыхательных путей. С выдыхаемым воздухом из организма удаляется 5-10% тепла и около 500 мл воды в сутки (всего лишь в 3 раза меньше, чем суточный диурез!). Это количество существенно возрастает в условиях жаркого сухого климата, при длительной интенсивной физической работе, лихорадке, почечной недостаточности. Легочная ткань способна не только выделять, но и поглощать жидкость. Вода, в небольших количествах попадающая в альвеолы, быстро всасывается легочными капиллярами; этому способствует значительное преобладание в капиллярах легких уровня онкотического давления (25-30 мм рт.ст.) над гидродинамическим (8-10 мм рт.ст.). Резкое повышение внутрикапиллярного гидродинамического давления (например, в случае острой сердечной недостаточности), а также гипоонкия крови инициируют противоположный процесс - отек легких. Легкие также участвуют в регуляции кислотно-основного состояния и тесно связанного с ним калиевого обмена. В частности развивающийся вследствие дыхательной недостаточности газовый ацидоз способствует повышению концентрации ионов калия в плазме крови; газовый алкалоз инициирует противоположное изменение.
Клиренс воздуха происходит, начиная с носовой полости, затем на уровне трахеи, бронхов и альвеол. Осаждение частиц зависит от их диаметра. Так, в носовой полости задерживаются частицы диаметром более 50 мкм, трахее - 30-50 мкм, в бронхах - 10-30 мкм, в бронхиолах - 3-10 мкм, в альвеолах - 1-3 мкм. Частицы, диаметр которых меньше 0,5 мкм, в легких практически не задерживаются.
Носовой и трахеобронхиальный клиренс. Механическая очистка воздуха начинается с его фильтрации при прохождении полости носа. При этом происходит осаждение вдыхаемых частиц на слизистых оболочках носа, трахеи и бронхов с последующим удалением их при чихании и кашле. Наиболее важную часть механической очистки воздуха от микроорганизмов и других повреждающих агентов составляет мукоцилиарный клиренс, действующий на уровне бронхов и бронхиол. Этот клиренс обеспечивается выработкой слизистого секрета железами бронхов, бокаловидными клетками и клетками Клара покровного эпителия, а также биением ресничек реснитчатых клеток. В состав слизистого секрета помимо слизи входят различные гликопротеины, протеазы, сурфактант, IgA. Неспецифические защитные факторы секрета продуцируются в основном полиморфно-ядерными лейкоцитами и макрофагами, постоянно присутствующими в дыхательных путях, а также клетками желез - ИФ, лизоцим, лактоферрин, протеазы, антипротеазы, секреторный Ig и др.
Слизистый покров бронхов и бронхиол имеет толщину 5-7 мкм и разделен на 2 слоя: на уровне ресничек он представлен жидкой фазой (золем), что обеспечивает благоприятные условия для их движения, на поверхности эпителия - плотной фазой (гелем). Функционирование мукоцилиарной системы связано с задержкой вдыхаемых частиц слизью с последующим перемещением их за счет биения ресничек по направлению к трахее и удалением их при кашлевом рефлексе.
Известно множество состояний, при которых происходит повреждение мукоцилиарного клиренса, что способствует развитию острых пневмоний: первичная цилиарная дискинезия (синдром Картагенера), холодный или горячий воздух, наркотические препараты, табачный дым, аллергены, медленно реагирующая субстанция анафилаксии, ПГЕ1, ПГЕ2 и лейкотриен (ускоряют биение ресничек) и др.
Альвеолярный клиренс. В респираторных отделах легких нет мукоцилиарной системы, секрета, содержащего гуморальные факторы неспецифической защиты, поэтому здесь наибольшее значение имеют клеточные механизмы неспецифической защиты легочной ткани. Важнейшими клетками этой системы являются альвеолярные макрофаги, полиморфно-ядерные лейкоциты, лаброциты и эозинофилы.
Иммунные механизмы специфической защиты бронхов и легочной паренхимы осуществляются лимфоидными и макрофагальными клетками бронхоассоциированной лимфоидной ткани и лимфатических узлов. Особое значение имеет секреция IgA и IgG. IgA в большом количестве содержится в секрете и защищает легкие от вирусной инфекции, обеспечивает агглютинацию бактерий и нейтрализацию их токсинов. IgG в нижних отделах дыхательных путей агглютинирует и опсонизирует бактерии, активирует комплемент, ускоряя хемотаксис гранулоцитов и макрофагов, нейтрализует бактериальные токсины и вирусы, лизирует грамотрицательные бактерии.
ВРОЖДЕННЫЕ АНОМАЛИИ РАЗВИТИЯ ЛЕГКИХ
Врожденные кисты легкого развиваются вследствие отделения от первичной кишки фрагментов ткани в ходе эмбриогенеза. Наиболее частым вариантом являются бронхогенные кисты, выстланные бронхиальным эпителием. Кисты осложняются развитием гнойного воспаления с формированием абсцессов, а в случае деструктивных изменений тканей - пиотораксом, пневмотораксом, а также легочным кровотечением.
Бронхолегочная секвестрация - порок развития с формированием легочного сегмента, не связанного с бронхиальным деревом и легочной артерией и получающего артериальную кровь из аорты или ее ветвей. Выделяют экстра-лобарную и интралобарную секвестрацию. При экстралобарной секвестрации аномальный легочный сегмент локализуется в средостении.
Данная патология обнаруживается, как правило, у новорожденных и сочетается с другими пороками развития. Интралобарная секвестрация характерна для взрослых, выявляется как очаг внутри легочной паренхимы, манифестирует повторными инфекционными осложнениями.
АТЕЛЕКТАЗЫ
Ателектаз - патологический процесс, характеризующийся обратимым неполным расправлением или коллапсом части или целого легкого. Выделяют 3 вида ателектаза:
-
резорбционный ателектаз, возникающий при полной обструкции бронхиального дерева при обструктивных заболеваниях легких, аспирации инородного тела, опухолевом росте;
-
компрессионный ателектаз при коллапсе легочной ткани за счет скопления жидкости (экссудата, крови), воздуха (при пневмотораксе) в плевральной полости или сдавлении легкого растущей извне опухолью;
-
очаговый ателектаз, развивающийся при дефиците сурфактанта, как это бывает при респираторном дистресс-синдроме новорожденных.
СОСУДИСТАЯ ПАТОЛОГИЯ ЛЕГКИХ
Сосудистая патология легких встречается при различных заболеваниях и проявляется разнообразными синдромами, такими как отек легких, респираторный дистресс-синдром взрослых (РДСВ), синдромы тромбоэмболии легочной артерии, первичной и вторичной легочной гипертензии.
Отек легких
Отек легких - синдромное понятие, осложняет многие заболеваниях легких, сердца и других органов. В ткани отечного легкого аккумулируется более 4-5 мл жидкости на 1 г сухого вещества. Механизм развития отека легких связан с дисбалансом между четырьмя составляющими: гидростатическим внутрикапиллярным давлением, онкотическим давлением, сосудисто-тканевой проницаемостью и работой лимфатического дренажа. При этом в динамике развития отека легких отмечается повышение показателей одного или нескольких из первых трех составляющих и, напротив, снижение работы лимфатического дренажа.
Отек легких чаще развивается вследствие либо повышения гидростатического давления в венозной части малого круга кровообращения (при острой левожелудочковой недостаточности, стенозе митрального клапана сердца, гиперволемии малого круга кровообращения, обструкции легочных вен), либо в результате местного повышения проницаемости капилляров альвеолярной перегородки (при РДСВ). Кроме того, отек легких может развиваться при снижении онкотического давления крови при нефротическом синдроме, болезнях печени, энтеропатиях, сопровождающихся гипоальбуминемией, а также отеке, вызванном обструкцией лимфатического дренажа.
Клиническая картина
Клиническая картина отека легких характеризуется развитием одышки, ортопноэ, кашля, иногда с розовой пенистой мокротой. При аускультации обнаруживается крепитация в базальных отделах легкого. Функциональные пробы указывают на снижение жизненной емкости легких, гипоксемию, гиперкапнию. Радиологически выявляются усиление сосудистого рисунка с расширением сосудов и уровни жидкости в легких (линии Керли).
Морфология
Морфология отека легких складывается из микро- и макроскопических проявлений. Макроскопически легкие красного цвета, тяжелые и влажные. При надавливании с поверхности разреза стекает пенистая красная жидкость. Микроскопически отек легких на разных стадиях своего развития имеет различные проявления. В первую стадию отечная жидкость накапливается в интерстициальной ткани, во вторую - в просвете альвеол, что становится возможно только при разрушении плотных контактов между пневмоцитами I порядка при резком повышении давления интерстициальной отечной жидкости. При прогрессировании отека в просвет альвеол выходят эритроциты и другие клеточные элементы крови.
Отек легких может разрешиться без последствий. Однако нередко в исходе отека развивается интерстициальный фиброз, а при хронизации процесса - склероз и гемосидероз легких.
Респираторный дистресс-синдром взрослых
В литературе РДСВ описывают под разными названиями - шоковое легкое, диффузное повреждение альвеол, острое повреждение альвеол, травматическое мокрое легкое. Клиническая картина и морфологические изменения при РДСВ аналогичны таковым при респираторном дистресс-синдроме новорожденных, что и дало название данному страданию.
РДСВ (от латинского distringo - тяжелое страдание) может осложнять аспирирование желудочного содержимого, ДВС-синдром, инфекционные заболевания легких, прежде всего пневмонии, различные виды шока, а также при вдыхании токсических веществ, в том числе избыточного количества кислорода, передозировку наркотических средств, операции на сердце с экстракорпоральным кровообращением, радиационные воздействия. Более 60-65% больных с РДСВ погибают, несмотря на современные методы лечения. Особенно высока летальность в исходе РДСВ при аспирации желудочного содержимого (93,8%), сепсисе (77,8%) и при пневмониях (60%).
Патогенез и морфогенез
Патогенез и морфогенез РДСВ связаны с повреждением эндотелия капилляров и нередко пневмоцитов I порядка в зоне аэрогематического барьера с развитием дыхательной недостаточности. В патогенезе ранних изменений при РДСВ важную роль играют полиморфно-ядерные лейкоциты. Патогенетическая роль активированных нейтрофилов обусловлена генерацией ими многообразных факторов, таких как:
-
производные арахидоновой кислоты (лейкотриены и простагландины), активирующие фосфолипазу А;
-
фактор активации тромбоцитов, приводящий к агрегации и секвестрации тромбоцитов и продукции фактора роста тромбоцитов, стимулирующего процессы склерозирования. Поэтому не случайно у больных с РДСВ нередко развивается тромбоцитопения, а в исходе - интерстициальный фиброз легких.
Кроме того, происходит нарушение синтеза сурфактанта пневмоцитами II порядка, приводящее к развитию ателектазов.
При ряде состояний в патогенезе РДВС на первое место выходит генерация протеолитических ферментов, свободных кислородных радикалов и оксидов азота не только нейтрофилами, но и альвеолярными макрофагами и эндотелием альвеолярных капилляров (радиация, эндотоксический шок, интоксикации и др.).
РДСВ протекает в 3 стадии.
-
Доклиническая, характеризующаяся морфологическими признаками повреждения капилляров альвеолярных перегородок.
-
Острая, характеризующаяся развитием интерстициального и альвеолярного отека и развивающаяся в течение 1-й недели после действия повреждающего фактора. При этом возникают явления внутриальвеолярного и интерстициального отека, воспалительные изменения с большим количеством полиморфно-ядерных лейкоцитов и фибрина как во внутри-альвеолярном экссудате, так и в тканевых инфильтратах, гиалиновые мембраны, ателектаз.
-
Стадия организации экссудата и пролиферации пневмоцитов II порядка, приводящих к интерстициальному фиброзу. Процессы организации начинаются со 2-3-го дня заболевания.
Клиническая картина
Клинически РДСВ характеризуется рефрактерной гипоксемией, не поддающейся коррекции путем увеличения оксигенации дыхательной смеси; уменьшением жизненной емкости легких; неизмененным внутрикапиллярным и онкотическим давлением; радиологическими симптомами отека легких.
Исход
При прогрессировании РДВС развивается интерстициальный фиброз легких. Смерть наступает от легочно-сердечной недостаточности.
Легочная гипертензия
Синдром легочной гипертензии характеризуется повышением давления в малом круге кровообращения с развитием сначала гипертрофии правого желудочка, а впоследствии и легочного сердца. Синдром легочной гипертензии может быть первичным и вторичным.
Синдром первичной легочной гипертензии встречается крайне редко, как правило, у детей и женщин в возрасте 20-40 лет. Этиология синдрома не установлена. В литературе описаны семейные случаи заболевания, наследуемые как по доминантному, так и по рецессивному типу. Заболевание также относится к полигенным патологиям, не исключается и роль факторов внешней среды.
Патогенез
Патогенез синдрома первичной легочной гипертензии наиболее вероятно связан с аутоиммунными реакциями, на что указывает частое развитие иммунного воспаления сосудов легких, аналогичное легочной артериопатии у больных с доказанными аутоиммунными заболеваниями (склеродермией, ревматоидным полиартериитом, зобом Хашимото, первичным билиарным ЦП и др.), а также характерным развитием фибриноидного некроза в стенках легочных артерий.
Не исключена и роль гормонов в патогенезе легочной артериопатии, что подтверждается развитием заболевания у женщин репродуктивного возраста, а также во время беременности и при приеме пероральных контрацептивов. Нередко диагноз синдрома первичной легочной гипертензии ставят у пациентов с врожденными пороками развития легочной артерии и сердца.
Морфология
Морфологические изменения при синдроме первичной легочной гипертензии характеризуются развитием:
При микроскопическом исследовании обнаруживается спектр изменений, соответствующих разным стадиям прогрессирования плексогенной легочной артериопатии в виде мускуляризации легочной артерии, миграции темных мышечных клеток в интиму, пролиферации клеток интимы и трансформации их в миофибробласты, формирования плексогенных структур и дилатации (микроаневризмы), разрыва микроаневризм, развития фибриноидного некроза.
Синдром вторичной легочной гипертензии развивается в ходе хронических заболеваний легких, а также при хронической левожелудочковой сердечной недостаточности и повторных тромбоэмболиях легочной артерии. В легких при этом развивается пневмосклероз, а при застое венозной крови и легочных васкулитах и эмболиях присоединяется и гемосидероз.
В последние годы особое внимание привлекает развитие синдрома легочной гипертензии в динамике хронических заболеваний печени, а также хронических вирусных инфекций.
ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ ЛЕГКИХ
Инфекционные болезни респираторной системы являются наиболее частой причиной нетрудоспособности человека и нередко осложнением течения других тяжелых заболеваний или сами могут приводить к летальному исходу.
Пневмонии и острый пневмонит
Пневмонии - групповое понятие, включающее острые воспалительные заболевания легких инфекционной природы с различным патогенезом и клинико-морфологическими проявлениями, характеризующиеся развитием острого воспаления преимущественно в респираторных отделах легких. В тех случаях, когда острое воспаление преимущественно распространяется на альвеолярную стенку и интерстициальную ткань респираторных отделов легкого с вторичным накоплением экссудата в просветах альвеол, говорят об интерстициальном воспалении легких и обозначают его терминами «острый пневмонит» и «атипичная пневмония».
Эпидемиология острых пневмоний
Острые пневмонии - наиболее распространенные заболевания с относительно высокой смертностью среди новорожденных и стариков. В России заболеваемость острыми пневмониями мало изменилась за последние 25 лет, несмотря на применение антибактериальной терапии, и составляет для крупозной пневмонии 0,9%, для других пневмоний - 14,5%. В США острые пневмонии вместе с гриппом занимают 3-е место среди причин смерти и обнаруживаются у 3% умерших.
Контагиозные и нозокомиальные пневмонии
В настоящее время все острые пневмонии подразделяют на контагиозные и внутрибольничные (нозокомиальные). Нозокомиальные пневмонии - это пневмонии, развившиеся не ранее чем через 48 ч после госпитализации пациента. Наиболее высокая заболеваемость регистрируется среди пациентов больниц (8,5% госпитализированных), особенно в отделениях интенсивной терапии (13%) и химиотерапии опухолей (30%). Они подразделяются на 2 группы: возникшие в первые 4 сут пребывания в больнице и развившиеся в госпитале позднее 4 сут. Возникновение внутрибольничных пневмоний может быть связано в основном с 2 факторами - проблемами в вентиляционной системе больницы, а также с особой этиологией и измененной реактивностью людей, страдающих другими заболеваниями и нередко получающих иммуносупрессивную и цитостатическую терапию.
Этиология
Основной этиологический фактор пневмоний - Streptococcus pneumoniae, обнаруживаемый более чем в 90% случаев заболеваний. Все 82 серологических типа пневмококка могут вызывать острые пневмонии. Среди взрослых 70% случаев заболеваний связаны с типами 1, 3, 4, 5, 7, 8, 12, 14 и 19. У детей чаще обнаруживают пневмококки 1, 6, 14, 16 типов. Пневмококки 1, 2, 5, 7, 12, 14 типов высоко вирулентны, они могут поражать здоровых людей. Типы 4, 6, 10, 18, 19, 22, 23 менее вирулентны, они проникают, как правило, в ранее измененные ткани, поэтому их чаще выявляют при острых пневмониях у ослабленных пациентов и они могут считаться оппортунистическими инфекциями. Пневмонии, вызванные пневмококком 3-го типа, обладают плохим прогнозом. Следует также отметить, что пневмококки могут стать причиной как крупозной, так и бронхопневмонии.
25% пневмоний вызывают Micoplasma pneumonia. При внутрибольничных острых пневмониях, как правило, речь идет об активации аутофлоры или о грамотрицательных аэробных бактериях, полученных пациентом через медицинский персонал. Нередко при этом обнаруживается смешанная флора. Пневмонии могут быть вызваны и другими микроорганизмами: бактериями (клебсиеллой, синегнойной палочкой, палочкой Пфейффера, стрептококком, стафилококком, кишечной палочкой, протеем, гемофильной палочкой), а также смешанной флорой.
Среди факторов риска острых пневмоний выделяют инфекции верхних дыхательных путей (прежде всего вирусные), обструкцию бронхиального дерева, иммунодефициты, употребление алкоголя, курение, вдыхание токсичных веществ и пыли, травму, нарушения легочной гемодинамики, послеоперационный период, массивную инфузионную терапию, старость, злокачественные опухоли, переохлаждение, стресс.
Патогенез
Известны 4 основные пути попадания микроорганизмов в легкие:
При развитии острых пневмоний наибольшее значение имеют воздушно-капельный и аспирационный пути проникновения инфекта, что сочетается с повреждением барьерных систем легочной защиты.
Вирусные частицы, как правило, способны проникать в респираторные отделы легкого, повреждать пневмоциты I порядка и альвеолярную стенку, приводя к развитию интерстициального воспаления с характерным моно-нуклеарным инфильтратом и реакциями клеточного иммунитета. Напротив, гноеродные бактерии, повреждая легочную паренхиму и обладая хемотаксическим действием на лейкоциты, приводят к экссудативному воспалению со скоплением экссудата в полостях альвеол, альвеолярных ходов, бронхиол.
Классификация пневмоний
В отечественной пульмонологии используется классификация пневмоний Е.В. Гембицкой (1983), базирующаяся на 7 основных принципах:
Знание этиологии острой пневмонии необходимо для выработки правильной лечебной тактики и назначения эффективных антибактериальных препаратов. По патогенезу пневмонии подразделяются на:
-
первичные, при отсутствии у больного какой-либо легочной патологии или заболеваний других органов, способствующих ее возникновению или способных осложниться пневмонией, например, крупозная пневмония, микоплазменная пневмония, болезнь легионеров; первичные острые пневмонии являются самостоятельными заболеваниями;
-
вторичные, которые развиваются у людей, страдающих хроническими заболеваниями бронхолегочной системы, а также являются осложнениями соматических или других инфекционных заболеваний с локализацией первичного аффекта вне легких. Вторичные пневмонии встречаются значительно чаще первичных и имеют разнообразную этиологию.
Следует отметить, что все случаи внутрибольничных острых пневмоний относятся к вторичным.
Остpые интеpстициальные пневмонии, или пневмониты, встречаются при действии определенных возбудителей - вирусов, орнитоза, микоплазмы, риккетсий, хламидий и пневмоцист. В литературе такие заболевания легких обозначаются также термином «атипические пневмонии», подчеркивающим, что данные острые инфекционные заболевания легких отличаются от пневмоний не только клинической картиной, но и требуют других методов лечения. Они могут иметь вторичный характер (пневмоцисты) или быть самостоятельной нозологической формой. Не меньший интерес в последние годы привлекают внутрибольничные или нозокомиальные атипические пневмонии, в том числе и пневмонии у иммуносупрессивных больных, относящиеся в большинстве случаев к оппортунистическим инфекциям.
Согласно клинико-морфологическим особенностям, острые пневмонии подразделяются на лобаpную (крупозную), бронхопневмонию (очаговую) и острую интеpстициальную (острый пневмонит).
По распространенности острые бронхопневмонии могут быть одно- и двусторонние, ацинарные, милиарные, очагово-сливные, сегментарные, полисегментарные долевые, тотальные.
По характеру течения: тяжелые, средней тяжести, легкие; острые и затяжные.
Крупозная (лобарная) пневмония
Лобарная, или крупозная, пневмония - острое инфекционно-аллергическое воспалительное заболевание легких. Имеет несколько синонимов: долевая (лобаpная), поскольку поражается одна, значительно реже несколько долей легкого; плевpопневмония, в связи с вовлечением висцеральной плевры пораженной доли и развитием плеврита; фибpинозная, кpупозная, что отражает характер экссудативного воспаления в легких.
Крупозную пневмонию вызывают пневмококки 1-го, 2-го, 3-го типов, реже диплобацилла Фридлендера (клебсиелла), а также некоторые другие возбудители. Заражение происходит от больного или носителя. Заболевают люди в возрасте около 30 лет и старше 50, не имеющие иммунитета к названным вирулентным штаммам пневмококка. Путь заражения - воздушно-капельный. Распространению бактерий благоприятствуют алкогольная интоксикация, охлаждение, наркоз, вдыхание токсичных ядов и пыли. Летальность составляет около 3%, несмотря на антибиотикотерапию.
Патогенез крупозной пневмонии объясняется развитием реакции ГНТ на территории респираторных отделов легкого, включающих альвеолы и альвеолярные ходы. Существуют 2 точки зрения о ранних этапах патогенеза заболевания. Согласно первой, пневмококки попадают в верхние дыхательные пути и вызывают сенсибилизацию организма. При действии разрешающих факторов (переохлаждение и др.) происходит аспирация возбудителя в альвеолы и завязывается гиперергическая реакция с развитием крупозной пневмонии. Согласно второй точке зрения, возбудитель из носоглотки проникает в легочную паренхиму и органы ретикуло-эндотелиальной системы, где сначала завязываются иммунные реакции, а затем возбудитель попадает в кровоток. В результате бактериемии и повторного попадания пневмококков с кровью в легких происходит иммунокомплексное повреждение микроциркуляторного русла альвеол с характерной экссудативной тканевой реакцией.
Патологическая анатомия. Крупозная пневмония в классическом варианте протекает в 4 стадии, отличающиеся своими макро- и микроскопическими проявлениями: стадия прилива (воспалительного отека), красного опеченения, серого опеченения и разрешения. Однако имеются убедительные данные о том, что стадийность процесса может быть нарушена, в пределах пораженной доли одновременно могут наблюдаться изменения, соответствующие разным стадиям болезни.
-
Стадия прилива продолжается в течение первых суток заболевания и характеризуется резким полнокровием альвеолярных капилляров, отеком интерстиция и накоплением в просветах альвеол жидкого экссудата, напоминающего отечную жидкость. Немаловажную роль в этом играют гемолизины, гиалуронидаза и лейкоцидин, выделяемые пневмококками и усиливающие сосудистую проницаемость. Макроскопически пораженная доля легкого полнокровна и уплотнена. При микроскопическом исследовании экссудат из альвеол по альвеолярным ходам и порам Кона распространяется на территорию всей доли. В экссудате содержится большое количество микробов, которые здесь активно размножаются, а также единичные альвеолярные макрофаги и полиморфно-ядерные лейкоциты. Большую помощь в диагностике этой стадии пневмонии могут оказать методы, позволяющие выявить пневмококк (посевы, окраска мазков). Одновременно происходят отек и воспалительные изменения в плевре, что в клинической картине проявляется острейшими болями в боку на стороне пораженной доли легкого.
-
Стадия красного опеченения возникает на 2-е сутки болезни. Пораженная доля безвоздушная, плотная, красная, напоминает ткань печени, от чего и произошло название этой стадии болезни. На утолщенной плевре видны фибринозные наложения. Микроскопически в экссудате выявляются большое количество эритроцитов, единичные полиморфно-ядерные лейкоциты, макрофаги, выпадает фибрин.
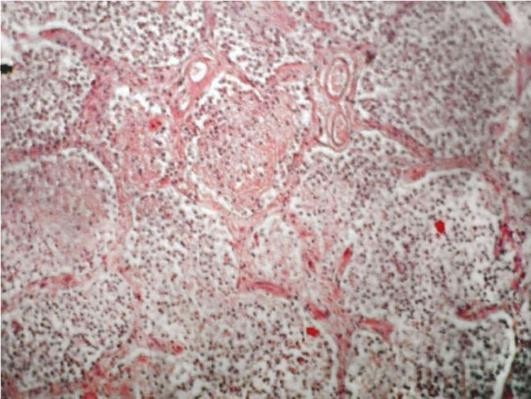
-
Стадия серого опеченения развивается на 4-6-е сутки болезни. Пораженная доля увеличена в размерах, тяжелая, плотная, безвоздушная, на разрезе с зернистой поверхностью (рис. 11.1). Плевра утолщена, мутная, с фибринозными наложениями. В это время отмечаются спадение легочных капилляров, концентрация в экссудате живых и погибших полиморфно-ядерных лейкоцитов, макрофагов и фибрина. Гранулоциты в основном осуществляют фагоцитоз опсонизированных пневмококков и лизис фибрина, а макрофаги - некротического детрита.
-
Стадия разрешения наступает на 9-11-й день болезни. Фибринозный экссудат подвергается расплавлению и фагоцитозу под влиянием протеолитических ферментов гранулоцитов и макрофагов. Экссудат элиминируется по лимфатическим дренажам легкого и отделяется с мокротой. Фибринозные наложения на плевре частично рассасываются. Морфологические изменения обычно несколько запаздывают по сравнению с клиническими проявлениями заболевания и могут быть обнаружены в течение нескольких недель после клинического выздоровления.
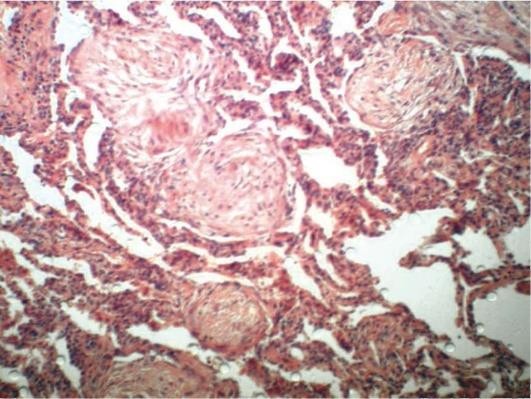
Осложнения крупозной пневмонии подразделяются на легочные и внелегочные. К легочным осложнениям относятся карнификация легкого (от латинского - carno, мясо) - организация экссудата (рис. 11.2). Это осложнение развивается обычно вследствие нарушения оттока экссудата в результате патологических изменений лимфатической системы. При этом возникают механическая недостаточность оттока лимфы, лимфостаз, который стимулирует активность фибробластов. Указывают также на недостаточность функции полиморфно-ядерных лейкоцитов и/или макрофагов, не объясняя при этом причины такой недостаточности. При падении иммунитета и развитии выраженного иммунодефицита может возникнуть острый абсцесс или гангрена легкого. Считают также, что причиной этого является чрезмерная активность полиморфно-ядерных лейкоцитов, что, однако, не доказано, и причина такой реакции лейкоцитов также не объясняется; эмпиема плевры. Смертельным осложнением может явиться также РДСВ.
Внелегочные осложнения связаны с возможностью распространения инфекции по лимфатическим и кровеносным путям. Следует отметить, что бактериемия при крупозной пневмонии регистрируется в 30% случаев. При лимфогенной генерализации возникают гнойный медиастенит и перикардит, при гематогенной - метастатические абсцессы в головном мозге, гнойный менингит, острый язвенный и полипозно-язвенный эндокардит, чаще трехстворчатого клапана, гнойный артрит, перитонит и др.
Патоморфоз крупозной пневмонии проявляется, абортивными формами заболевания и снижением частоты легочных и внелегочных осложнений.
Исход. В большинстве случаев больные выздоравливают, но у людей остаются спайки в плевральных полостях. Смерть при крупозной пневмонии наступает от острой легочно-сердечной недостаточности или гнойных осложнений.
Лобарная пневмония Фридлендера
Встречается относительно редко (0,4-0,5% случаев пневмоний). Может быть отнесена к внутрибольничным инфекциям, так как в стационарах составляет 8-9,8% острых пневмоний. Заражение происходит путем аспирации в верхние дыхательные пути диплобациллы Фридлендера. Распространена среди страдающих алкоголизмом и новорожденных. Мужчины заболевают в 5-7 раз чаще женщин, пожилые - чаще молодых. Локализуется, как правило, в правой верхней доле, но может быть и полилобарной. В отличие от крупозной пневмонии, вызванной пневмококком, характерны экссудат с большим количеством слизи, некроз альвеолярных перегородок с частым формированием абсцессов, очагов карнификации и выраженного интерстициального фиброза в исходе.
Бронхопневмония
Бронхопневмония в подавляющем большинстве случаев развивается как осложнение другой болезни и поэтому является вторичной. Однако есть особые этиологические варианты бронхопневмонии, которые могут рассматриваться как самостоятельные болезни (например, болезнь легионеров), а также бронхопневмонии новорожденных и стариков.
Бронхопневмония, или очаговая пневмония, характеризуется развитием в легочной паренхиме очагов острого воспаления размерами от ацинуса до сегмента, связанных с пораженной бронхиолой. Развитию заболевания предшествуют воспалительные процессы в бронхах, которые можно обнаружить одновременно с очагами бронхопневмонии. Диагностируется у 2/3 больных, госпитализированных по поводу острой пневмонии.
Этиология заболевания разнообразна.
Патогенез бронхопневмонии связан с воздушно-капельным распространением возбудителя, его аспирацией из верхних дыхательных путей, а также распространением гематогенным и реже контактным путями.
Морфогенез. Обязательным условием развития бронхопневмонии является нарушение дренажной функции бронхов, чему могут способствовать переохлаждение, опьянение, наркоз и др. Нарушение дренажной функции бронхов способствует проникновению микроорганизмов в респираторные отделы легкого - альвеолярные ходы и альвеолы. При этом первоначально происходит поражение бронхов, а затем воспалительный процесс, вызванный микроорганизмами, с мелких бронхов и бронхиол распространяется на прилежащие альвеолы. Обычно воспаление переходит на легочную ткань нисходящим путем, интрабронхиально. При развитии деструктивного бронхита и бронхиолита возможен и перибронхиальный путь. При генерализованной инфекции (септикопиемии) наблюдается гематогенный путь проникновения возбудителя в легкие.
Особую группу бронхопневмоний составляют аспиpационная, гипостатическая и послеопеpационная пневмонии, связанные с активацией аутоинфекции. При аспирационной пневмонии на первом этапе развития имеет значение повреждение легочной паренхимы кислотой желудочного содержимого. Гипостатическая и послеоперационная пневмонии развиваются на фоне нарушения мукоцилиарного клиренса в бронхиальной системе и расстройств кровообращения.
Патологическая анатомия. Макроскопически обнаруживаются плотные безвоздушные очаги различных размеров, формирующиеся обычно вокруг бронхов, просвет которых заполнен жидким мутным экссудатом серо-красного цвета и локализованные обычно в задних и задненижних сегментах легких (2, 6, 8, 9, 10). В зависимости от размеров очагов различают милиарную, ацинозную, дольковую, сливную дольковую, сегментарную и полисегментарную бронхопневмонии.
Микроскопические изменения при бронхопневмониях в значительной степени определяются видом возбудителя. Однако имеются и стереотипные изменения, характерные для всех видов бронхопневмоний. К ним можно отнести формирование очага воспаления вокруг мелкого бронха, бронхиолы с явлениями бронхита и/или бронхиолита, который представлен различными формами катара (серозного, слизистого, гнойного, смешанного). Стенки бронхиол инфильтрированы клетками воспалительного инфильтрата. Нарушение дренажной функции бронхов способствует проникновению возбудителей в респираторные отделы легких. При этом воспаление распространяется на респираторные бронхиолы и альвеолы (рис. 11.3). В просветах альвеол и бронхиол, а также бронхов накапливается экссудат, который может иметь серозный, гнойный, геморрагический и смешанный характер, что в значительной степени определяется этиологией заболевания и тяжестью процесса. По периферии очагов располагается непораженная легочная ткань с явлениями перифокальной эмфиземы.
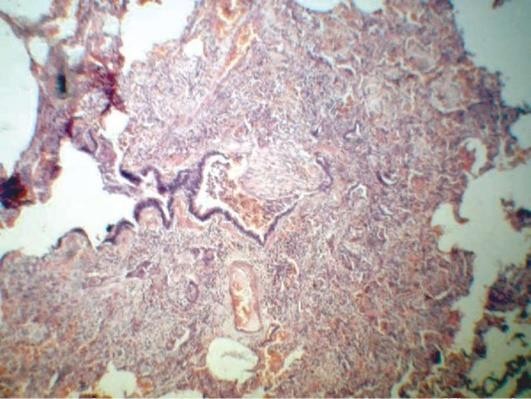
Осложнения во многом определяются этиологией заболевания и тяжестью его течения. Они могут быть подразделены на легочные и внелегочные и представлены теми же вариантами, что и при крупозной пневмонии. Среди легочных осложнений бронхопневмонии следует назвать также плеврит, развивающийся в тех случаях, когда очаг воспаления расположен под плеврой. В последние годы особое внимание уделяется такому осложнению, как РДСВ, характеризующийся высокой летальностью.
Исход. В большинстве случаев при своевременно начатом лечении болезнь заканчивается выздоровлением пациентов. Смерть больных может быть обусловлена самой пневмонией, ее гнойными осложнениями и легочно-сердечной недостаточностью.
Особенности отдельных видов бронхопневмонии
Бронхопневмония, вызываемая пневмококками, - наиболее часто встречающаяся этиологическая форма пневмонии. Характеризуется образованием очагов, связанных с бронхиолами и содержащих фибринозный экссудат. По периферии таких очагов выражен микробный отек, где обнаруживается большое количество возбудителей.
Бронхопневмония, вызываемая стафилококками, встречается редко, в 5-10% острых пневмоний. Может развиться вслед за фарингитом, а также как осложнение после вирусной инфекции (чаще гриппа). Заболевание имеет морфологию типичной бронхопневмонии с геморрагическим и деструктивным бронхитом с наклонностью к нагноениям и некрозу альвеолярных перегородок. В связи с последним нередко развиваются острые абсцессы, гнойный плеврит, пневматоцеле, кисты, а также выраженный фиброз в исходе заболевания.
Бронхопневмония, вызываемая стрептококками, составляет 11-13% острых пневмоний, которую вызывает обычно гемолитический стрептококк групп А и В, нередко в сочетании с вирусами, а также она возникает у больных сахарным диабетом. Характерно поражение нижних долей легких. При микроскопическом исследовании обнаруживаются очаги бронхопневмонии с серозным или серозно-гнойным экссудатом с выраженным интерстициальным компонентом. В ряде случаев возникают острые абсцессы и бронхоэктазы. Заболевание нередко осложняется плевритом.
Бронхопневмония, вызываемая синегнойной палочкой. Это одна из самых частых внутрибольничных острых пневмоний. Возможны 2 варианта проникновения возбудителя в легкие - путем аспирации и через кровь. В первом случаев развивается бронхопневмония с абсцедированием и плевритом. Во втором случае речь идет о больных со злокачественными опухолями или обширными нагноившимися ранами, когда бронхопневмония протекает с выраженным коагуляционным некрозом и геморрагическим компонентом. Прогнозируемая смертность составляет 50%.
Бронхопневмония, вызываемая кишечной палочкой. Обычно возбудитель попадает в легкие гематогенным путем при инфекциях мочевых путей, ЖКТ, после хирургических вмешательств. Пневмония часто двухсторонняя, с геморрагическим характером экссудата, очагами некроза и абсцедирования.
Бронхопневмония, вызываемая грибами. Ее чаще вызывают грибы рода Candida. Очаги пневмонии различных размеров со скоплениями полиморфно-ядерных лейкоцитов и эозинофилов, склонностью к образованию полостей распада, где можно обнаружить нити гриба. При гиперергических реакциях развивается интерстициальное воспаление с последующим фиброзом.
Острая интерстициальная (межуточная) пневмония, или острый пневмонит
Острая интерстициальная (межуточная) пневмония, или острый пневмонит, характеризуется первичным развитием острого воспаления в интерстиции респираторных отделов легких и в альвеолярной стенке с возможным вторичным образованием экссудата в просвете альвеол и бронхиол. В литературе такие заболевания легких обозначают также термином «атипические пневмонии», подчеркивающим, что эти острые инфекционные заболевания легких отличаются от пневмоний не только клинической картиной, но и требуют других методов лечения. Они могут иметь вторичный характер или быть самостоятельной нозологической формой.
Этиология связана с вирусами, микоплазмой, легионеллой, грибами, пневмоцистой, часто остается неустановленной. Хаммен и Рич описали острую межуточную пневмонию неустановленной этиологии с летальным исходом через 2-4 мес от острой легочно-сердечной недостаточности, получившей название болезни Хамена-Рича. Синонимы термина - острая межуточная пневмония и острый пневмонит.
Патогенез острых межуточных пневмоний связан с первичным поражением возбудителями элементов альвеолярной стенки - пневмоцитов I порядка, пневмоцитов II порядка и эндотелия капилляров, что сопровождается развитием на этой территории острого воспаления. Нередко в процессе участвуют иммунопатологические механизмы по типу реакций ГНТ и ГЗТ.
Патологическая анатомия. Морфологические проявления в значительной степени стереотипны и характеризуются повреждением и регенерацией альвеолярного эпителия, полнокровием альвеолярных капилляров, воспалительной инфильтрацией альвеолярной стенки, скоплением белковой жидкости в просветах альвеол нередко с формированием гиалиновых мембран, часто с примесью полиморфно-ядерных лейкоцитов и макрофагов, иногда с характерными включениями. В исходе нередко развивается интерстициальный фиброз.
Осложнения определяются этиологией заболевания и тяжестью его течения.
Исход. Смерть больных может быть обусловлена прогрессирующей легочно-сердечной недостаточностью, однако в большинстве случаев пациенты выздоравливают без каких-либо последствий.
Особенности отдельных видов острой межуточной пневмонии
Острые межуточные пневмонии, вызываемые вирусами. Разнообразные вирусные заболевания (грипп, парагрипп, аденовирусные инфекции и др.) сопровождаются развитием пневмоний как вирусной, так и вирусно-бактериальной природы, в первую очередь развивается гриппозная пневмония. Особую опасность представляет гриппозная пневмония при гриппе H1N1. Нередко вирусные пневмонии возникают и при детских вирусных инфекциях. Особенностью вирусных межуточных пневмоний является преобладание лимфогистиоцитарных элементов в воспалительном инфильтрате интерстиция, что обусловлено реакциями клеточного иммунитета, а также обнаружением в ряде случаев характерных внутриклеточных включений (аденовирусы, цитомегаловирусы) и многоядерных клеток (вирус кори). Достоверная верификация этиологического фактора проводится при иммунолюминесцентном исследовании с антителами к антигенам вирусов.
Микоплазменная межуточная пневмония. Mycoplasma pneumoniae является частым возбудителем инфекционных поражений верхних дыхательных путей. В городах 15-25% случаев пневмоний вызывают эти микроорганизмы. Болеют в основном дети и подростки, а также взрослые старше 45 лет. Поражение, как правило, одностороннее, распространено на определенной территории. Возможна генерализация инфекции с поражением других органов и систем.
При микроскопическом исследовании выявляется картина острой интерстициальной пневмонии с бронхиолитом и характерным мононуклеарным инфильтратом. При ШИК-реакции и окраске по Романовскому-Гимзе в макрофагах можно увидеть характерные ШИК-положительные включения, косвенно подтверждающие присутствие микоплазмы. Достоверным методом верификации возбудителя является иммуногистохимическое исследование с антителами к антигенам микоплазмы.
Пневмоцистная межуточная пневмония. Выявляется у иммуносупрессивных больных с лекарственной и вирусной иммунодепрессией. При ВИЧ-инфекции развивается примерно в 75% случаев. Возбудитель - Pneumocystis carini. Характерно развитие диффузного, двустороннего интерстициального процесса с выраженной дыхательной недостаточностью. При микроскопическом исследовании видна диффузная инфильтрация альвеолярных перегородок со скоплением в просвете альвеол пенистого ШИК-положительного эозинофильного материала с тяжами неокрашенных цист (в некоторых из них видны базофильные спорозоиты). Специфической является окраска по Grocott.
Острая межуточная пневмония, вызываемая L. Pneumophilia (болезнь легионеpов). Заболевание описано в 1970 г., когда впервые была зарегистрирована эпидемия своеобразной пневмонии у американских легионеров в Филадельфии. Среди 182 заболевших погибли 29 человек. Заболевание начинается с головной боли, болей в мышцах, сухого кашля. Возбудитель не окрашивается по Граму, антитела усиливают фагоцитоз бактерии макрофагами, однако в связи со способностью его к эндоцитобиозу в фагоцитах инфект может персистировать в организме длительное время. В легких развивается бронхопневмония с вовлечением нескольких долей. В ряде случаев макроскопически поражение может напоминать крупозную пневмонию в стадии серого опеченения с развитием фибринозного плеврита. При микроскопическом исследовании характерны геморрагический отек, инфильтрация альвеолярных перегородок макрофагами и полиморфно-ядерными лейкоцитами.
ХРОНИЧЕСКИЕ ДИФФУЗНЫЕ ЗАБОЛЕВАНИЯ ЛЕГКИХ
Хронические диффузные заболевания легких являются наиболее распространенными среди хронической патологии бронхолегочной системы. В России рост заболеваемости этими болезнями составляет в среднем 6-7% в год для городского и 2-3% для сельского населения. Количество больных хроническими диффузными заболеваниями легких каждые 10-2 лет практически удваивается. Наибольший удельный вес в структуре хронических диффузных заболеваний легких приходится на хронический бронхит - 65-90% больных. Особую тревогу вызывает рост заболеваемости бронхиальной астмой, эпидемические вспышки которой были зафиксированы в некоторых городах России.
Этиология и патогенез
Отмечается высокая зависимость развития хронических диффузных заболеваний легких от неблагоприятных факторов внешней среды (выброса в атмосферу поллютантов), курения, профессиональных факторов (контакта с органическими и минеральными пылями, токсическими газами, изоцианатами и др.), острых инфекций дыхательных путей (прежде всего вирусных), состояния иммунной системы, наличия генетической предрасположенности (фенотипы PiZZ, PiSS).
Морфогенез
Морфогенез хронических диффузных заболеваний легких развивается по одному из трех морфогенетических путей: бронхитогенному, пневмониогенному или пневмонитогенному. Развитие хронических диффузных заболеваний легких по бронхитогенному механизму обусловлено нарушением дренажной функции легких и бронхиальной проходимости, оно приводит к развитию таких обструктивных заболеваний легких, как хронический бронхит, бронхо-эктатическая болезнь, хроническая обструктивная эмфизема легких. Пневмонитогенный механизм связан с бронхопневмониями, крупозной пневмонией и их осложнениями - острым абсцессом и карнификацией. Развивающиеся в исходе этих осложнений хронический абсцесс и хроническая пневмония имеют выраженный рестриктивный компонент. Пневмонитогенный механизм определяет развитие хронического воспаления и фиброза на территории интерстиция респираторных отделов легких и встречается при интерстициальных заболеваниях легких. В финале все 3 механизма хронических диффузных заболеваний легких ведут к развитию пневмосклероза (пневмоцирроза), вторичной легочной гипертензии, гипертрофии правого желудочка сердца и легочно-сердечной недостаточности, они также являются фоновыми заболеваниями для развития рака легкого. Хронические диффузные заболевания легких в соответствии с функциональными и морфологическими особенностями поражения воздухопроводящих или респираторных отделов легких подразделены на 3 группы:
ХРОНИЧЕСКИЕ ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ ЛЕГКИХ
К обструктивным заболеваниям относят хронический обструктивный бронхит, бронхоэктатическую болезнь, хроническую обструктивную эмфизему легких, хронические бронхиолиты, бронхиальную астму.
В основе хронических обструктивных заболеваний легких (лат. obstructio - помеха, преграда) лежит нарушение дренажной функции бронхов, что является основной причиной их обструкции. Обструктивные расстройства характеризуются уменьшением проходимости дыхательных путей и повышением резистивного (неэластического) сопротивления воздушному потоку за счет частичной или полной обструкции воздухопроводящих путей на любом уровне - от трахеи до респираторных бронхиол. Одновременно увеличивается нагрузка на дыхательную мускулатуру, что вызывает ее утомление. Жизненная емкость легких (максимальный объем воздуха, изгоняемый из легких вслед за максимальным вдохом) обычно снижена, а дыхательный объем (количество воздуха, поступающее в легкие за один вдох при спокойном дыхании) смещен в сторону резервного объема вдоха.
В норме наибольшее сопротивление движению воздуха (80-85%) оказывают верхние дыхательные пути, особенно в области носа (50%). Их обструкция бывает вызвана ринитом, опухолями, западением языка при коме, наркозе или во сне, аспирацией жидкости или инородных тел, закупоркой дыхательных путей мокротой или слизью, отеком гортани, спазмом мышц гортани (при вдыхании раздражающих газов, истерическом припадке), утолщением слизистой оболочки трахеи и бронхов или прорастанием опухоли в их просвет.
Хронический обструктивный бронхит или хроническая обструктивная болезнь легких
Хронический обструктивный бронхит или хроническая обструктивная болезнь легких (ХОБЛ) - заболевание, характеризующееся гиперплазией и избыточной продукцией слизи бронхиальными железами, приводящей к появлению продуктивного кашля, по меньшей мере, в течение 3 мес ежегодно на протяжении 2 лет. Хронический бронхит может быть простым и обструктивным. Обструктивный хронический бронхит отличается от простого обструкцией периферических отделов бронхиального дерева в результате воспаления бронхов и бронхиол (бронхиолита), приводящей к хронической обструктивной эмфиземе легких. В связи с разнообразными проявлениями эта патология в настоящее время называется ХОБЛ. Морфологический субстрат хронического бронхита - хроническое воспаление бронхиальной стенки с гиперплазией продуцирующих слизь бокаловидных клеток и слизистых желез, что в клинике выражается симптомом выделения мокроты.
Взаимоотношения между хроническим бронхитом и эмфиземой сложны. Прежде всего нужно подчеркнуть, что определение эмфиземы является морфологическим, тогда как хронический бронхит выделяют на основе клинических особенностей, таких как хронический и рецидивирующий кашель с чрезмерной секрецией слизи. Имеются и анатомические различия между ними. Так, при хроническом бронхите поражено все бронхиальное дерево, включая бронхиолы (хронический бронхиолит, что подчеркивает уровень вовлеченности дыхательных путей). В отличие от этого эмфизема ограничена поражением ацинуса. Хотя хронический бронхит может не сопровождаться развитием эмфиземы, а эмфизема существовать без хронического бронхита (особенно у больных с наследственным дефицитом α1-антитрипсина), однако эти 2 болезни обычно сосуществуют вместе. Учитывая склонность к сосуществованию этих заболеваний, эмфизему и хронический бронхит клиницисты часто объединяют в одно заболевание под названием ХОБЛ. Развитие первичной необратимой обструкции отличает ХОБЛ от бронхиальной астмы, которая характеризуется обратимой обструкцией дыхательных путей.
Эпидемиология
ХОБЛ - самое распространенное среди хронических заболеваний легких. Примерно 20% мужского населения страдает этим заболеванием. Однако прогрессирующее пристрастие женщин к табакокурению отражается и на росте показателей заболеваемости ХОБЛ среди женщин. В России отмечается рост смертности от ХОБЛ, которая сопоставима с показателями смертности от рака легкого.
Этиология и факторы риска
Курение - наиболее важный этиологический фактор ХОБЛ. При этом в одинаковой мере страдают как сами курильщики, так и некурящие люди, их окружающие (пассивное курение). Табачный дым влияет на активность движения ресничек бронхиального эпителия, что приводит к нарушению мукоцилиарного клиренса, повреждению бронхиального покровного эпителия с его плоскоклеточной метаплазией, а затем дисплазией и развитием рака. Кроме того, табакокурение оказывает ингибирующее действие на активность альвеолярных макрофагов, повреждая тем самым механизмы местной легочной защиты. Вторично происходит гиперплазия клеток, продуцирующих слизь, которая принимает на себя основные защитные функции.
Атмосферные поллютанты также имеют чрезвычайно важное значение в развитии ХОБЛ в индустриально развитых, урбанизированных регионах. Обострения заболевания связаны с выбросами в атмосферу SO2 и NO2. Высокая частота хронического бронхита у рабочих, имеющих по роду своей профессиональной деятельности контакты с органическими, минеральными пылями и токсическими газами, доказывает этиологическую роль этих факторов. Не исключена также этиологическая роль респираторных вирусных инфекций и генетических факторов. Развитие ХОБЛ при наследственных заболеваниях иллюстрируют синдром неподвижных ресничек, или синдром Картагенера, а также муковисцидоз.
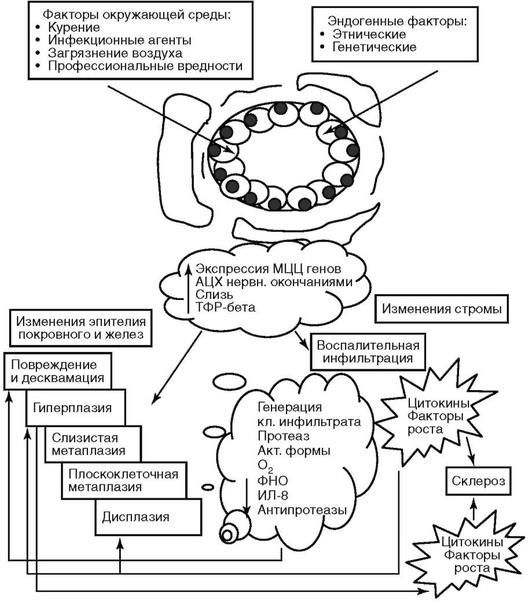
Патогенез
Патогенез ХОБЛ основывается на нарушении дренажной функции прежде всего мелких бронхов в результате длительного воздействия различных этиологических факторов (рис. 11.4). По распространенности хронический бронхит может быть локальным и диффузным. Локальный хронический бронхит чаще развивается в бронхах 2-го, 4-го, 8-го, 9-го и 10-го сегментов, особенно правого легкого.
Патологическая анатомия
Стенки бронхов становятся утолщенными, окружены прослойками соединительной ткани, иногда отмечается деформация бронхов. При длительном течении ХОБЛ могут возникать мешотчатые и цилиндрические бронхоэктазы - расширения просветов бронхов. Микроскопические изменения связаны с развитием в бронхах хронического слизистого или гнойного катарального воспаления с метаплазией покровного эпителия и гиперплазией бронхиальных желез и бокаловидных клеток (рис. 11.5). При этом в стенке бронха выражены воспалительная инфильтрация, разрастание грануляционной ткани, которая может приводить к формированию воспалительных полипов слизистой оболочки бронха, склероз и атрофия мышечного слоя. Следует отметить, что наиболее выраженные изменения наблюдаются на уровне мелких бронхов.
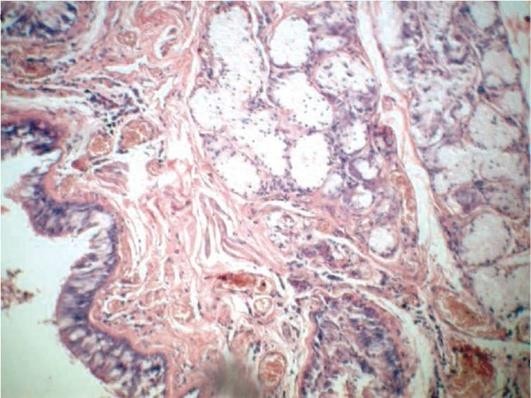
Гиперплазия слизистых желез является одним из основных морфологических признаков ХОБЛ, она оценивается обычно с помощью индекса Рейда, равного отношению толщины желез подслизистого слоя к толщине всей стенки бронха. В норме этот индекс равен 0,44±0,09, при ХОБЛ - 0,52±0,08. На уровне мелких бронхов имеет значение оценка гиперплазии бокаловидных клеток бронхиальной выстилки.
Осложнения
Осложнениями ХОБЛ нередко бывают бронхопневмонии, формирование очагов ателектаза, обструктивной эмфиземы легких, пневмофиброза.
Бронхоэктатическая болезнь
Бронхоэктатическая болезнь - заболевание, характеризующееся определенным комплексом легочных и внелегочных изменений - хронической легочной недостаточностью с признаками тканевой гипоксии и развитием легочного сердца при наличии в бронхах бронхоэктазов. Может протекать с обструктивным компонентом и без него.
Термин «бронхоэктаз» принят для обозначения стойкой патологической дилатации одного или нескольких бронхов, содержащих хрящевые пластинки и слизистые железы, с разрушением эластического и мышечного слоев бронхиальной стенки.
Классификация бронхоэктазов
Бронхоэктазии могут быть врожденными (2-3% всех диффузных заболеваний легких) и приобретенными. Приобретенные бронхоэктазы развиваются при бронхоэктатической болезни и хроническом бронхите. Различия между этими двумя легочными заболеваниями определяются по характерному для бронхоэктатической болезни внелегочному симптомокомплексу и степени выраженности дилатации бронхов.
На основании макроскопических особенностей выделяют следующие виды бронхоэктазов:
-
мешотчатые (кистовидные), которые локализуются преимущественно на уровне проксимальных бронхов, включая бронхи 4-го порядка, и имеют форму мешка;
-
цилиндpические (фузиформные), располагающиеся на уровне бронхов 6-10-го порядка, имеющие вид последовательно соединенных между собой полых бусинок цилиндрической формы, образованных бронхиальной стенкой;
Пато- и морфогенез
Пато- и морфогенез врожденных и приобретенных бронхоэктазов имеют некоторые особенности. Врожденные бронхоэктазы формируются у детей с различными пре- и постнатальными дефектами развития трахеобронхиального дерева, что приводит к застою бронхиального секрета и инфицированию. Нарушения качества секрета при муковисцидозе и функциональной активности ресничек при синдроме Картагенера являются благоприятным фоном для повторных эпизодов бронхолегочного воспаления. Присоединение бактериальной инфекции приводит к деструкции эластического каркаса и мышечной оболочки стенки бронхов, последующему склерозу и дилатации их просветов. В развитии приобретенных бронхоэктазов большое значение имеет механизм обструкции бронхов в сочетании с вторичной бактериальной инфекцией. Поскольку бронхиальная обструкция обычно ограничена одним или несколькими бронхами, приобретенные бронхоэктазы, как правило, имеют локальный характер в отличие от врожденных бронхоэктазов, имеющих диффузный характер. Исключение составляют больные с диффузной бронхиальной обструкцией и распространенными приобретенными бронхоэктазами. Особое место занимают бронхоэктазы, патогенез которых связан с предшествующими им бронхопневмониями с выраженной деструкцией легочной ткани, что наблюдается при осложненной кори, дифтерии, аденовирусной инфекции, гриппе. Иногда бронхоэктазы могут развиваться вследствие попадания в бронхи какого-либо инородного тела, казеозных масс при туберкулезе, сдавливания бронхов опухолью.
Патологическая анатомия
Патологическая анатомия бронхоэктатической болезни складывается из сочетания выраженных бронхоэктазов и внелегочного симптомокомплекса. Бронхоэктазы имеют, как правило, приобретенный характер, связаны с бронхообструктивным синдромом, предшествующей бронхопневмонией, попаданием инородного тела, и поэтому носят локальный характер. Наиболее часто поражаются бронхи нижней доли правого легкого.
При микроскопическом исследовании в полости бронхоэктаза обнаруживается гнойный экссудат, содержащий микробные тела и слущенный эпителий. Покровный эпителий представлен базальными клетками, очагами полипоза и плоскоклеточной метаплазии. Базальная мембрана гиалинизирована, имеет гофрированный вид. Обнаруживаются дистрофия и разрушение хрящевой пластинки бронха, атрофия и разрушения мышечного и эластического слоев, склероз и диффузная гистиолимфоцитарная воспалительная инфильтрация всех слоев стенки бронхоэктаза с примесью полиморфно-ядерных лейкоцитов (рис. 11.6). В прилежащей легочной паренхиме обнаруживаются поля фиброза, очаги обструктивной эмфиземы легких.
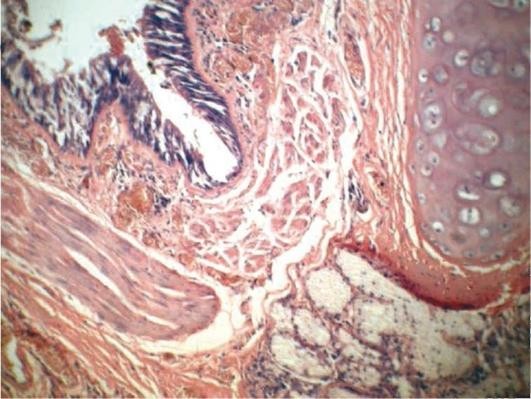
Внелегочный симптомокомплекс при бронхоэктатической болезни обусловлен выраженной дыхательной гипоксией и развитием гипертензии в малом круге кровообращения. У больных обнаруживаются симптомы «барабанных палочек», «часовых стекол», цианоза. Гипертензия малого круга кровообращения ведет к гипертрофии правого желудочка и развитию легочного сердца.
Осложнения
Осложнения бронхоэктатической болезни связаны с возможностью развития легочного кровотечения, абсцессов легкого, эмпиемы плевры, хронической легочно-сердечной недостаточности. Амилоидоз (вторичный - АА-амилоид) и абсцессы головного мозга в настоящее время встречаются относительно редко. Каждое из осложнений может стать причиной смерти больного бронхоэктатической болезнью.
Эмфизема легких
Эмфизема легких (от греч. emphysio - вздуваю) - синдромное понятие, связанное со стойким расширением воздухоносных пространств дистальнее терминальных бронхиол, сопровождающееся нарушением целостности альвеолярных перегородок. По данным вскрытий, примерно у 2/3 мужчин и 1/4 женщин выявляются различные виды эмфиземы легких.
Выделяют следующие виды эмфиземы легких:
Хроническая обструктивная эмфизема легких
Хроническая обструктивная эмфизема легких - заболевание, характеризующееся формированием хронической обструкции воздухоносных путей, наиболее часто вследствие хронического бронхита.
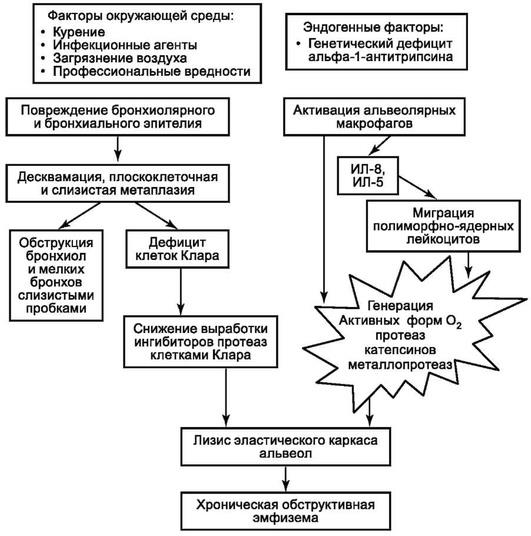
Этиология приобретенной хронической обструктивной эмфиземы легких та же, что и ХОБЛ, которая в большинстве случаев ей и предшествует. Имеется определенная генетическая предрасположенность к развитию этого вида эмфиземы, сцепленная с М-геном. Известны два патологических фенотипа этого гена - PiZZ, PiSS, что обусловливает низкий уровень сывороточного α1-антитрипсина - ингибитора протеаз, разрушающих соединительнотканный каркас альвеолярных перегородок. Основной источник α1-антитрипсина - гепатоциты и клетки Клара терминальных бронхиол.
Патогенез и морфогенез хронической обструктивной эмфиземы легких связан с относительной или абсолютной недостаточностью α1-антитрипсина, что может носить врожденный или приобретенный характер. При врожденной недостаточности ингибитора протеаз даже незначительная воспалительная инфильтрация легочной ткани гистиоцитами, полиморфно-ядерными лейкоцитами, плазмоцитами и другими клетками, выделяющими эластазу, заканчивается лизисом эластических волокон альвеолярной перегородки и развитием эмфиземы. Приобретенная недостаточность ингибитора может быть обусловлена как заболеваниями печени, так и хроническим бронхитом, при котором в результате метаплазии и бокаловидноклеточной трансформации бронхиального эпителия резко снижается количество клеток Клара, синтезирующих α1-антитрипсин и осуществляющих местную защиту альвеолярной перегородки от действия протеаз воспалительного инфильтрата. Относительная недостаточность ингибитора протеаз может возникать при чрезмерно высокой, несбалансированной активности клеток воспалительного инфильтрата. Вентильный (клапанный) механизм патогенеза имеет место при выраженной обструкции бронхов слизью или экссудатом, что позволяет вдыхаемому воздуху поступать в альвеолы, но выдох затруднен. Это приводит к накоплению остаточного воздуха в альвеолах и их растяжению (рис. 11.7).
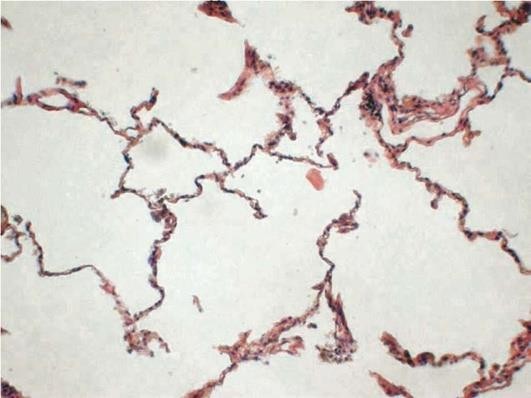
Патологическая анатомия. Легкие увеличены в размерах, прикрывают краями переднее средостение, вздутые, бледные, мягкие, не спадаются, при разрезании слышен хруст. Из просветов бронхов выдавливается слизисто-гнойный экссудат. При микроскопическом исследовании характерно сочетание признаков хронического обструктивного бронхита, бронхиолита и эмфиземы легких. При этом отмечается расширение и уплощение альвеол, истончение альвеолярных перегородок с лизисом и фрагментацией эластики, гипертрофия и гиперэластоз замыкательных пластинок, редукция альвеолярно-капиллярного кровотока с развитием его блока и склероза (рис. 11.8). Нарушения микроциркуляции в малом круге кровообращения являются причиной легочной гипертензии, гипертрофии правого желудочка и развития легочного сердца.
В соответствии с распространенностью изменений в ацинусе выделяют несколько основных морфологических вариантов хронической обструктивной эмфиземы - центроацинарную, панацинарную, парасептальную и иррегулярную.
Центроацинарная эмфизема обусловлена преобладанием расширения респираторных бронхиол и альвеолярных ходов, тогда как периферические отделы долек остаются относительно сохранными. Поскольку легкие обладают большими компенсаторными возможностями, лишь вовлечение в патологический процесс абсолютного большинства долек легочной паренхимы сопровождается развитием вентиляционной недостаточности.
При панацинарной эмфиземе в процесс вовлекаются как центральные, так и периферические отделы ацинусов. При этом развивается блок аэрогематического барьера за счет спадения альвеолярных капилляров и склероза альвеолярных перегородок с быстрым развитием тяжелой вентиляционной недостаточности.
При парасептальной эмфиземе изменена вся дистальная часть ацинуса, а проксимальная часть выглядит неизмененной. Наиболее часто встречается в верхних долях легкого, в субплевральных отделах и вокруг очагов пневмосклероза. Прогрессирование заболевания может приводить к формированию кистозных полостей, заполненных воздухом, до нескольких сантиметров в диаметре, называемых буллами, что послужило основанием называть данный процесс в легких буллезной эмфиземой.
При иррегулярной эмфиземе ацинус поражен неравномерно и клинические проявления эмфиземы, как правило, отсутствуют.
Осложнением хронической обструктивной эмфиземы легкого является прогрессирующая легочно-сердечная недостаточность, быстро приводящая больного к смерти при отсутствии оксигенотерапии и других современных методов лечения.
Бронхиальная астма
Бронхиальная астма - хроническое рецидивирующее воспалительное заболевание легких, характеризующееся повышенной возбудимостью трахеобронхиального дерева в ответ на различные стимулы и приводящее к пароксизмальной констрикции воздухопроводящих путей. Однако бронхиальная астма характеризуется обратимой обструкцией дыхательных путей, что отличает ее от первичной необратимой обструкции бронхов, определяющей ХОБЛ.
Выделяют 2 основных вида заболевания:
Кроме того, встречаются:
Атопическая, экзогенная бронхиальная астма
Атопическая, экзогенная бронхиальная астма - самый частый тип астмы, обычно начинается в детстве. Характерна позитивная семейная история атопии. Астматическим приступам часто предшествуют аллергический ринит, крапивница или экзема.
Этиология. Заболевания связана с аллергенами окружающей среды, такими как пылевые частицы, пыльца растений, пищевые факторы и др. Основным этиологическим фактором астмы является генетическая предрасположенность к развитию реакции гиперчувствительности I типа (атопия), а также острое и хроническое воспаление воздухоносных путей и бронхиальная гиперреактивность в ответ на действие различных раздражителей.
Патогенез связан с IgE-обусловленной реакцией гиперчувствительности I типа. В процесс воспаления вовлекаются разные типы клеток и множество медиаторов воспаления, но роль T- лимфоцитов - хелперов 2-го типа (Th2) в патогенезе астмы является основополагающей. Классическая атопическая форма астмы связана с чрезмерной Th2-реакцией на антигены внешней среды. В развитии симптомов астмы важную роль играют цитокины, продуцируемые Th2-клетками: ИЛ-4, стимулирующие образование IgE, ИЛ-5, который активизирует эозинофилы, ИЛ-13, усиливающий производство слизи. Выброс этих ИЛ приводит к синтезу IgE, который адсорбируется тучными клетками. Последующая IgE-опосредованная реакция на аллергены, поступившие при вдохе, вызывает мгновенный ответ и наступление последней фазы реакции гиперчувствительности I типа. Контакт тучных клеток, покрытых IgE, с тем же антигеном вызывает перекрестное связывание его с IgE и выброс химических медиаторов. Тучные клетки на поверхности респираторной слизистой оболочки уже активированы. Последующий выброс медиаторов открывает межклеточные соединения слизистой оболочки, позволяя антигену проникнуть в ее толщу и контактировать с большим количеством расположенных в ней тучных клеток. Вместе с тем активируются эпителиальные клетки, чтобы продуцировать хемокины, которые играют роль медиаторов, привлекающих в очаг воспаления большее количество Th2-клеток и лейкоцитов, усиливая таким образом воспалительную реакцию. Часть медиаторов воспаления модулирует изменения, возникающие при этом виде бронхиальной астмы. Среди них ведущую роль играют:
-
лейкотриены C4, D4 и E4, вызывающие пролонгированную бронхоконстрикцию, сосудистую проницаемость и секрецию слизи;
-
ацетилхолин внутрилегочных мотонейронов, приводящий к сокращению гладкомышечных клеток бронхов путем прямого возбуждения мускариновых рецепторов;
-
гистамин, который вызывает бронхоспазм и увеличивает сосудистую проницаемость;
-
простагландин D2, вызывающий бронхоконстрикцию и вазодилатацию;
-
фактор, активирующий тромбоциты, - индуцирует агрегацию тромбоцитов и высвобождение гистамина из их гранул.
Кроме того, прямое воздействие на субэпителиальные (парасимпатические) нервные окончания блуждающего нерва вызывает рефлекторную бронхоконстрикцию как через центральные, так и через локальные рефлекторные дуги. Это происходит в течение нескольких минут после возбуждения и поэтому называется остpым, или немедленным ответом, который состоит из бронхоспазма, отека слизистой оболочки (из-за повышенной сосудистой проницаемости) и секреции слизи.
В наступлении pеакции поздней фазы, которая начинается через 4-8 ч после приступа астмы и может длиться в течение 12-24 ч или дольше, принимают участие и тучные клетки, также выделяющие цитокины, обеспечивающие хемотаксис лейкоцитов, таких как нейтрофилы, мононуклеарные клетки и, особенно, эозинофилы, которые вызывают множество эффектов. Содержание в них воспалительных медиаторов столь же велико, как и в тучных клетках и включает главный основной белок и катионный белок эозинофилов, обладающий токсичностью по отношению к эпителию воздухопроводящих путей. Пероксидаза эозинофильных лейкоцитов вызывает повреждение ткани путем оксидативного стресса. Активированные эозинофилы также являются богатым источником лейкотриенов. Таким образом, эозинофильные лейкоциты могут усиливать и поддерживать воспалительный ответ без дополнительного антигенной стимуляции.
Нереагиновая (неатопическая) астма
Механизмы воспаления в бронхах и их гиперчувствительности менее понятны у людей с неатопической астмой. Причиной астмы в таких случаях становятся обычные вирусные инфекции дыхательных путей и поллютанты (двуокись серы, озон и диоксид азота), попадающие в легкие с вдыхаемым воздухом. Эти агенты увеличивают гиперреактивность воздухоносных путей, как у здоровых, так и у страдающих астмой пациентов. В последнем случае, однако, возникает бронхоспазм, что бывает намного серьезнее и продолжается длительное время. Семейный анамнез в таких случаях не является обязательным, уровень IgE в сыворотке крови нормальный, сопутствующие аллергические реакции отсутствуют. Полагают, что вызванное вирусом воспаление слизистой оболочки дыхательных путей понижает порог чувствительности подэпителиальных рецепторов блуждающего нерва к раздражителям. Хотя патогенез заболевания не до конца понят, однако установлено наличие в воздухоносных путях гуморальных и клеточных элементов, вызывающих обструкцию воздухоносных путей (например, эозинофилов), как и в случаях атопической астмы, что позволяет осуществлять их лечение аналогичным способом.
Астма, вызванная лекарствами
Несколько лекарственных препаратов вызывают бронхиальную астму. Примером таких лекарств является аспирин. Люди с повышенной чувствительностью к аспирину страдают рецидивирующим ринитом, у них развиваются носовые полипы, крапивница и бронхоспазм. Точный механизм спазма бронхов остается неизвестным, но предполагают, что аспирин блокирует циклооксигеназный путь метаболизма арахидоновой кислоты, не затрагивая при этом липоксигеназный путь, таким образом способствуя продукции лейкотриенов, вызывающих бронхоспазм.
Профессиональная бронхиальная астма
Эта форма астмы возникает под влиянием паров и дыма (эпоксидной смолы, пластмассы), органической и неорганической химической пыли (древесная, хлопковая, платина), газов (толуол) и других химикатов. Приступы астмы обычно развиваются после повторного воздействия инициирующих антигенов.
Клиническая картина и морфологические изменения бронхолегочной системы принципиально одинаковы при всех видах бронхиальной астмы.
Клиническая картина. Приступ астмы сопровождается тяжелой одышкой с хрипами и затрудненным выдохом. Пациенты вдыхают воздух в легкие, но затем не могут его выдохнуть, вследствие чего возникает прогрессирующая гипервентиляция легких в результате накопления воздуха в их дистальных отделах, где он накапливается в результате бронхоспазма и облитерации бронхов слизью и слущенным эпителием. Обычно приступ длится от 1 ч до нескольких часов и разрешается спонтанно или под действием терапии, обычно с использованием бронходилататоров и кортикостероидов. Интервалы между приступами характеризуются свободным дыханием, но при этом спирометрическими методами можно диагностировать хронические негрубые нарушения дыхания. Иногда может развиться длительный приступ бронхоспазма, который не отвечает на терапию и сохраняется в течение многих дней и даже недель (статус астматикус). Возникающие гиперкапния, ацидоз и серьезная гипоксия могут быть фатальными, хотя в большинстве случаев болезнь приводит к инвалидизации больного, а не к летальному исходу.
Патологическая анатомия. У людей, умерших в результате тяжелых и длительных приступов удушья (статус астматикус), макроскопически отмечается повышенная воздушность легких из-за накопления в них воздуха в связи с затрудненным выдохом, что сочетается с мелкими участками ателектаза. Характерна обструкция бронхов и бронхиол толстыми вязкими пробками слизи. Микроскопически слизистые пробки содержат спирали из слущенного эпителия (спиралиКуршмана). Обнаруживаются также многочисленные эозинофилы и кристаллы Шарко―Лейдена (скопления кристаллоида, состоящего из белков, продуцируемых эозинофилами). В дополнение к воспалению, вызванному клетками Th2-го типа, бронхиальная астма характеризуется структурными изменениями стенки бронха, что называют общим термином «ремоделирование воздухоносных путей». Эти изменения включают:
До недавнего времени ремоделирование воздухоносных путей считали поздним, вторичным изменением при бронхиальной астме. Сейчас предполагается, что оно может начинаться за несколько лет до появления первых симптомов заболевания. Причины ремоделирования пока неясны, хотя не исключена наследственная предрасположенность, связанная с полиморфизмом генов, которая приводит к ускоренной пролиферации гладкомышечных клеток бронхов и фибробластов. Предполагается важная роль недавно открытого гена ADAM33, который экспрессируется типами клеток, участвующих в ремоделировании воздушных путей (гладкомышечные клетки и фибробласты), хотя, несомненно, есть и другие генетические факторы, вовлеченные в этот процесс. Полагают, что тучные клетки как часть воспалительного инфильтрата при астме тоже способствуют ремоделированию воздушных путей путем секреции факторов роста, вызывающих пролиферацию гладкомышечных клеток.
РЕСТРИКТИВНЫЕ БОЛЕЗНИ ЛЕГКИХ
Рестриктивные или интерстициальные болезни легких характеризуются уменьшением объема легочной паренхимы со снижением жизненной емкости легких. В эту группу входят интерстициальные болезни легких. В основе рестриктивных легочных заболеваний лежит развитие, нередко на иммунной основе, воспаления и фиброза в интерстиции респираторных отделов легких, ведущих к интерстициальному фиброзу и блоку аэрогематического барьера, что сопровождается клиническими симптомами прогрессирующей дыхательной недостаточности. Большинство легочных заболеваний на поздних стадиях развития имеют, как правило, одновременно обструктивный и рестриктивный компоненты.
Интерстициальные заболевания легких
К рестриктивным болезням легких относятся интерстициальные заболевания легких (ИБЛ) - гетерогенная группа рестриктивных заболеваний, характеризующихся двусторонним, диссеминированным, острым или хроническим поражением легочного интерстиция респираторных отделов легких, приводящих к интерстициальному фиброзу и снижению жизненной емкости легких.
История изучения ИБЛ связана с именами американских врачей Хаммана и Рича, впервые описавших в 1935 г., а затем в 1944 г. особый вариант тяжелого, быстро прогрессирующего поражения легких с интерстициальным фиброзом и тяжелой дыхательной недостаточностью, который они наблюдали у 6 больных и назвали острым диффузным интерстициальным фиброзом. ИБЛ имеют стереотипные клинические, радиологические и морфологические изменения, что и позволяет объединять более 100 заболеваний в одну группу, часто отличающихся интенсивностью поражения легких и прогнозом. В последние годы достигнут определенный успех в изучении ИБЛ, однако вопросы этиологии, патогенеза и классификации многих из них остаются дискуссионными.
Патологическая анатомия
При большинстве интерстициальных болезней легких развивается фиброзирующий альвеолит. Этим термином следует обозначать патологический процесс, характеризующийся диффузным или очаговым, острым или хроническим негнойным воспалением интерстиция респираторных отделов легких - альвеол, альвеолярных ходов и респираторных бронхиол с исходом в фиброз.
Сложность проблемы фиброзирующего альвеолита связана с употреблением множества терминов для его обозначения, которые часто не являются синонимами: склерозирующий альвеолит, ИФА, диффузный интерстициальный фиброз, интерстициальный пневмонит, болезнь Хаммена-Рича (острый и первичный варианты), синдром Скеддинга, болезнь Ослера-Шарко, фиброзная дисплазия легких. Ситуация усугубляется еще и тем, что часто перечисленными терминами одновременно называют патологический процесс, синдром и заболевание - ИФА. Фиброзирующий альвеолит является характерным морфологическим проявлением большинства ИБЛ и в первую очередь, таких как ИФА, вторичных фиброзирующих альвеолитов при ревматических заболеваниях, аллергических экзогенных альвеолитов и пневмокониозов. Фиброзирующий альвеолит формируется не только при ИБЛ с диффузным поражением интерстиция, но и при гранулематозном воспалении, в его предгранулематозную стадию (пневмокониозы, саркоидоз), а также в легочной ткани, прилежащей к гранулеме.
ИБЛ имеют как стереотипные морфологические признаки, повторяющиеся при разных заболеваниях этой группы, так и нозологические особенности, отличающие их друг от друга. Стереотипным для всех ИБЛ является развитие альвеолита в начале заболевания и интерстициального фиброза - в финале. Крайним выражением интерстициального фиброза является формирование сотового легкого, характеризующегося сочетанием интерстициального фиброза и кистозной трансформации терминальных и респираторных бронхиол, что сопровождается блоком аэрогематического барьера, развитием вторичной легочной гипертензии, гипертрофии правого желудочка и легочного сердца. Нозологические же особенности проявляются преимущественно на ранних стадиях ИБЛ.
Этиология
Причины ИБЛ могут быть различными: вирусы, бактерии, грибы, органическая и неорганическая пыль, радионуклеиды, гипероксия в условиях гипербарической оксигенации, токсические факторы и др. Среди лекарственных препаратов наибольшую опасность представляют цитостатики (блеомицин, бусульфан, кармустин, циклофосфамид, метотрексат, прокарбозид, митомицин) и некоторые другие препараты (амидарон, амитриптилин, нитрофурантоин). В большинстве ИБЛ этиология остается невыясненной, в том числе этиология ИФА и синдрома Гудпасчера.
Патогенез и морфогенез
Патогенез и морфогенез ИБЛ различен и зависит от характера инициального воспаления на территории респираторных отделов легкого. Важная роль в морфогенезе фиброзирующего альвеолита при ИБЛ отводится альвеолярным макрофагам и полиморфно-ядерным лейкоцитам, появляющимся первыми в альвеолах для осуществления защитной функции. Однако в активированном состоянии эти клетки генерируют большие количества АФК, протеаз, а также цитокинов, вызывающих одновременно повреждение и склероз легочной паренхимы. Оно может быть иммунным, как это бывает, например, при ИФА или саркоидозе, или неиммунным - при большинстве пневмокониозов. Однако вне зависимости от природы воспалительной реакции и вида этиологического фактора происходит повреждение альвеолярной перегородки. Морфогенез инициального повреждения может быть связан с попаданием этиологического фактора с воздухом и повреждением первоначально эпителиальной выстилки альвеол, а затем и легочного интерстиция. В случае циркуляции повреждающих агентов (иммунных комплексов, антител, гиперактивированных лейкоцитов и моноцитов) первыми страдают эндотелий альвеолярных капилляров, экстрацеллюлярный матрикс и клеточные элементы интерстиция, после чего возможно повреждение и эпителия альвеол и бронхиол. В случае иммунного патогенеза заболеваний, вызванных аспирированным инфекционным агентом или аллергеном с диаметром частиц менее 1-3 мкм, антитела и сенсибилизированные Т-лимфоциты, двигаясь по направлению к мишени из кровотока, также сначала повреждают капилляры, затем интерстиций и эпителий. При этом возможно также сочетание описанных путей попадания в легких повреждающего агента и одновременного повреждения эпителия и капилляров с интерстицием.
Характерной чертой интерстициальных заболеваний легких является развитие интерстициального фиброза в финале альвеолита. При этом важное значение имеет репарация эпителия, которая зависит от глубины повреждения. Она различна в случаях интактных и поврежденных базальных мембран.
Повреждение при интактной базальной мембране инфекционными агентами, дисциркуляторными нарушениями при шоке, токсическими формами кислорода вызывают сначала повреждение альвеолярного эпителия, затем серозную или серозно-фибринозную экссудацию в просвет альвеол, с последующим рассасыванием экссудата и пролиферацией пневмоцитов II типа с восстановлением структуры альвеол или же организацией экссудата с образованием телец Массона (карнификацией).
Повреждение с разрушением базальной мембраны заканчивается фиброзом и рубцеванием. При этом альвеолярный макрофаг активирует синтез коллагена I типа и протеогликанов клетками легочного интерстиция - фибробластами и миофибробластами, которые мигрируют в просвет альвеол и участвуют в формировании полей фиброза.
Классификация
Существует несколько принципов классификации ИБЛ, основными из них являются следующие.
-
Этиология, согласно которой ИБЛ подразделяются на:
-
заболевания с установленной причиной, такие как пневмокониозы, вызванные пылью, острые межуточные пневмонии (вирусные, грибковые, пневмоцистная, экзогенный аллергический альвеолит и др.);
-
заболевания с неустановленной причиной, к которым относится подавляющее большинство ИБЛ, важнейшими из них являются ИФА (болезнь Хамана-Рича), фиброзирующий альвеолит при синдроме Гудпасчера, вторичный фиброзирующий альвеолит при ревматических болезнях, при инфекции вирусом гепатита B (HBV), легочные васкулиты, саркоидоз, при легочно-почечных синдромах, идиопатический гемосидероз легких, эозинофильная пневмония, гистиоцитоз Х, альвеолярный протеиноз, десквамативная интерстициальная пневмония и др.
-
Клинические и рентгенологические особенности
Клинические и рентгенологические особенности ИБЛ связаны с рестриктивным характером изменений, резким прогрессирующим снижением жизненной емкости легких, диффузионной способности кислорода, развитием одышки, тахипноэ, цианоза. Диагностика ИБЛ базируется на комплексе клинико-лабораторных данных, включающих симптомы крепитации, радиологические подтверждения фиброзирующего альвеолита - симптом матового стекла и др., открытой биопсии легкого, исследование лаважной жидкости. В лаважной жидкости характерно наличие цитоза, увеличение количества нейтрофилов (нейтрофильный характер лаважа) или лимфоцитов (лимфоцитарный характер лаважа), что бывает при некоторых видах ИБЛ, а также на фоне терапии.
Хронические идиопатические интерстициальные пневмонии
Хронические идиопатические интерстициальные пневмонии (альвеолит) ранее в литературе описывали как ИФА - группу диффузных воспалительных заболеваний легких неустановленной этиологии, характеризующихся преобладанием диффузного, острого или хронического поражения легочного интерстиция респираторных отделов легких, с развитием в них воспаления и фиброза, приводящих к прогрессирующей легочно-сердечной недостаточности. Термин «фиброзирующий альвеолит», предложенный J. Scadding в 1964 г., отражает основные ключевые признаки заболевания - воспаление и фиброз. В нашей стране наиболее употребителен термин «идиопатический фиброзирующий альвеолит», также отражающий первичность и неясную природу заболевания. Синонимами ИФА являются идиопатический легочный фиброз (idiopathic lung fibrosis) и криптогенный фиброзирующий альвеолит (cryptogenic fibrosing alveolitis). В последнее время все чаще используют понятие «обычная интерстициальная пневмония» (usual interstitial pneumonia), что отражает наиболее частый морфологический субстрат заболевания.
Стереотипным для ИФА является развитие альвеолита в начале заболевания и интерстициального фиброза - в финале. Крайним выражением интерстициального фиброза является формирование сотового легкого, характеризующегося сочетанием интерстициального фиброза и кистозной трансформацией терминальных и респираторных бронхиол и альвеол (рис. 11.9), что сопровождается блоком аэрогематического барьера, развитием вторичной легочной гипертензии, гипертрофии правого желудочка и легочного сердца.
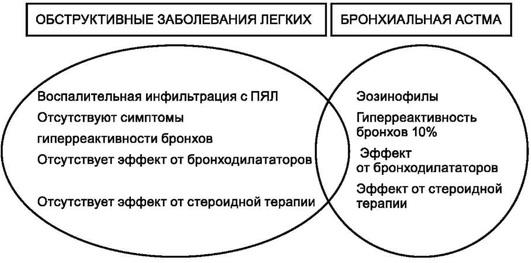
Классификация идиопатического фиброзирующего альвеолита (идиопатических интерстициальных пневмоний)
ИФА - это не одно заболевание, а группа разных болезней, что подтверждается различиями в их морфологических проявлениях, клинической и рентгенологической симптоматике, прогнозе и продолжительности жизни больных. Все это привело к обоснованию клинико-морфологической концепции, предложенной Американским торакальным обществом и Европейским респираторным обществом о существовании различных форм заболевания, а также разработке их клинико-морфологической классификации.
Суть этой концепции заключается в том, что идиопатический фиброз легких отделен от других идиопатических интерстициальных пневмоний, которые до этого составляли общую группу всех фиброзов легких неясной этиологии. В классификации ИФА учтены патологическая и радиологическая картина, а также особенности клиники (табл. 11.1). Формы ИФА, используемые в клинических диагнозах, не всегда аналогичны морфологическим вариантам заболевания, хотя в большинстве случаев они совпадают.
| Морфологические варианты ИФА | Клинические формы ИФА |
|---|---|
Обычная интерстициальная пневмония |
Идиопатический фиброз легких |
Неспецифическая интерстициальная пневмония |
Неспецифическая интерстициальная пневмония |
Организующаяся пневмония |
Криптогенная организующаяся пневмония |
Диффузное поражение альвеол |
Острая интерстициальная пневмония |
Респираторный бронхиолит |
Респираторный бронхиолит с интерстициальной болезнью легких |
Десквамативная интерстициальная пневмония |
Десквамативная интерстициальная пневмония |
Лимфоцитарная интерстициальная пневмония |
Лимфоцитарная интерстициальная пневмония |
Обычная интерстициальная пневмония
Обычная интерстициальная пневмония является самым распространенным вариантом среди идиопатических интерстициальных пневмоний.
Клиническая картина. Клинически она характеризуется постепенным началом, прогрессирующим течением, усиливающейся одышкой напряжения. У большинства больных определяются двусторонние нежные хрипы над базальными отделами легких, лихорадка, слабость, потеря веса. Рентгенологически типично двустороннее усиление легочного рисунка и симптом «матового стекла» в базальных отделах легких.
Патологическая анатомия. В начальной стадии обычной интерстициальной пневмонии легкие могут быть изменены незначительно - неравномерно воздушными, полнокровными, увеличенной плотности. Микроскопические проявления начальных изменений характеризуются экссудативным и экссудативно-продуктивным воспалением. ИФА отличается от других ИБЛ большей выраженностью повреждения и склероза интерстиция респираторных отделов легких с образованием очагов из миофибробластов в интерстиции. При этом обнаруживаются распространенные, мозаично расположенные фокусы поражения среди сохранной легочной паренхимы. Чем дольше длится заболевание, тем меньшую площадь занимают сохранные участки и, наоборот, большая площадь соответствует измененной легочной ткани. В альвеолярных перегородках видны отек, воспалительная инфильтрация и начальные проявления склероза. Нарушение проницаемости сосудов приводит к скоплению серозного экссудата в просветах альвеол, протеинозу, десквамации эпителия, выпадению фибрина, вплоть до образования гиалиновых мембран. В экссудате обнаруживается большое количество альвеолярных макрофагов, лимфоцитов, полиморфно-ядерных лейкоцитов. Воспалительный инфильтрат в интерстиции представлен в основном лимфогистиоцитарными элементами, нередко с примесью нейтрофилов, которые в большей степени локализуются не в интерстиции, а в просвете альвеол и обнаруживаются в лаважной жидкости.
Обычная интерстициальная пневмония отличается большим количеством особого фенотипического варианта альвеолярных макрофагов моноцитоидного типа, характеризующихся отсутствием в них фагоцитарной активности и усилением белкового синтеза. В таких макрофагах много фибронектина, c-fos и c-sis онкопротеинов, стимулирующих пролиферацию клеток. Кроме того, в стадию начальных изменений при ИФА альвеолярные макрофаги интенсивно генерируют АФК, а также ФНО-α. Поступая в легочную ткань, эти факторы могут сами оказывать повреждающее действие, в первую очередь на альвеолярный и бронхиолярный эпителий.
Поздняя стадия обычной интерстициальной пневмонии характеризуется типичными макроскопическими изменениями в виде уплотнения легочной ткани, которая при этом приобретает резиновую плотность, понижения воздушности и эластичности с формированием ячеистых структур, напоминающих пчелиные соты - «сотовое легкое». При микроскопическом исследовании выявляется выраженный склероз интерстиция респираторных отделов легких и кистозная неpестpойка легочной ткани (рис. 11.10). Паренхима легкого замещается грубой соединительной тканью, в которую замурованы кистозно-расширенные воздухоносные пространства, структуры сотового легкого, выстланные изнутри гиперплазированным альвеолярным эпителием. Пневмоциты I типа замещаются гиперплазированными пневмоцитами II типа с признаками атипии и развитием очаговой аденоматозной гиперплазии, а также очагами плоскоклеточной метаплазии и дисплазии эпителия. Аэро-гематичесий барьер блокируется и перестает функционировать как за счет выраженного фиброза интерстиция альвеолярных перегородок, так и за счет дисрегенераторных изменений в эпителиальной выстилке.
Легочный интерстиций расширяется в результате утолщения и редупликации эпителиальных и эндотелиальных базальных мембран, в нем происходит накопление коллагенов при резко увеличенном удельном весе плохо деградируемых коллагенов IV и V типов. В зону аэрогематического барьера внедряется много коллагеновых волокон, активированных миофибробластов и фибробластов, фиброцитов, клеток воспалительного инфильтрата, среди которых в эту стадию преобладают лимфоидные элементы и гистиоциты. Фибробласты легочного интерстиция с признаками высокой синтетической активности выявляются не только в зоне аэрогематического барьера, между утолщенными базальными мембранами («интерпозиция»), но и в просветах альвеол и капилляров, что ведет к запустеванию микрососудов и развитию не только блока аэрогематического барьера, но и гипертензии в малом круге кровообращения. Организация же экссудата и белковой жидкости в просвете альвеол с последующей эпителизацией приводит к формированию телец Массона и карнификации.
Легочный эпителий на поздних стадиях обычной интерстициальной пневмонии подвергается перестройке. Альвеоциты I типа на больших участках замещаются альвеоцитами II типа с незрелыми осмиофильными мультиламеллярными тельцами, нередко с признаками незрелости и клеточного атипизма. В связи с нарушенной продукцией сурфактанта и облитерацией бронхиол развиваются очаги ателектаза легочной ткани.
Интерстициальные миофибробласты и фибробласты являются основными эффекторными клетками в развитии склероза при ИФА различной этиологии. Повреждением переходной зоны можно объяснить развитие ранних и тяжелых дисрегенераторных изменений эпителия вплоть до развития предрака и рака легкого.
Осложнения обычной интерстициальной пневмонии связаны с развитием легочного сердца и прогрессированием легочно-сердечной недостаточности.
Неспецифическая интерстициальная пневмония
Неспецифическая интерстициальная пневмония - одно из самых сложных для диагностики заболеваний, поскольку специфические черты при идиопатической пневмонии отсутствуют, в то время как аналогичная морфологическая картина может иметь разнообразную этиологию.
Клиническая картина. В клинической картине неспецифической интерстициальной пневмонии доминируют медленно прогрессирующая дыхательная недостаточность, медленно нарастающая одышка напряжения. Рентгенологически определяется двустороннее усиление легочного рисунка в базальных отделах легких.
Морфология. Гистологически преобладают воспалительные изменения. В интерстиции легких обнаруживается лимфогистиоцитарная инфильтрация, выраженные изменения микрососудов вплоть до фибриноидного некроза и развития деструктивно-продуктивных васкулитов. Процесс носит мозаичный характер, и пораженные участки могут чередоваться с участками относительно сохранной легочной ткани. На ранней стадии заболевания отмечаются серозное воспаление с участием интерстициальных макрофагов и лимфоцитов и отек интерстиция. На поздней стадии формируется умеренно выраженный фиброз легочного интерстиция,
Исход. Неспецифическая интерстициальная пневмония характеризуется относительно благоприятным течением, достаточно высокой выживаемостью.
Десквамативная интерстициальная пневмония
Средний возраст больных составляет 43 года. Заболевание характеризуется постепенным началом.
Морфогенез. Вероятно, патологические изменения при десквамативной интерстициальной пневмонии, в отличие от обычной интерстициальной пневмонии, начинаются с повреждения альвеолярного эпителия и легочный интерстиций вовлекается лишь вторично.
Морфогенез десквамативной интерстициальной пневмонии также может быть условно поделен на 2 стадии: раннюю и позднюю. Для ранней стадии типичны накопление в просветах альвеол активированных альвеолярных макрофагов с темными гранулами пигмента в цитоплазме, гиперплазия, повреждение и десквамация клеток эпителия в просветы альвеол и умеренно выраженный интерстициальный фиброз. Альвеолярные перегородки незначительно утолщены, инфильтрированы лимфоцитами, иногда эозинофилами. Для поздней стадии характерен более выраженный склероз легочного интерстиция. По мере прогрессирования заболевания в просветах альвеол помимо альвеолярных макрофагов накапливаются и десквамированные клетки гиперплазированного альвеолярного эпителия с выраженной экспрессией панцитокератинов, ТФР-β, FGFb и Кi67. Постепенно остаются лишь пневмоциты II порядка. Плоскоклеточная метаплазия альвеолярного эпителия наблюдается в 70% случаев десквамативной интерстициальной пневмонии. Десквамативная интерстициальная пневмония отличается относительно благоприятным течением и прогнозом, а также хорошим ответом на стероидотерапию.
Организующаяся пневмония (криптогенная организующаяся пневмония)
Это заболевание неустановленной этиологии с клиническими и рентгенологическими проявлениями пневмонии. В литературе его описывают под несколькими названиями: облитерирующий БООП, облитерирующий бронхиолит, организующиеся пневмониеподобные фокусы, неразрешившаяся хроническая пневмония.
Для организующейся пневмонии (ОП) характерно подострое начало с выраженным сухим кашлем, 60% больных отмечают лихорадку. При рентгенографии легких определяются очаговые, «пятнистые» затемнения, не исчезающие после приема антибиотиков. ОП характеризуется подострым началом, относительно благоприятным волнообразным течением, в изменениях функции легких ведущую роль играют обструктивные изменения.
Морфогенез. Патологические изменения при ОП, по-видимому, начинаются с активации альвеолярных макрофагов в бронхиолах, выраженной экссудации в просветах бронхиол и альвеол, с последующей организацией экссудата.
Морфологическая картина при криптогенной организующейся пневмонии отличается от других форм ИФА и характеризуется сочетанием очагов карнификации в дистальных участках респираторного тракта, захватывающих бронхиолы, альвеолярные ходы и альвеолы, с хроническим умеренно выраженным интерстициальным воспалением, сохранением архитектоники легкого и однообразием поражений. Главным морфологическим отличием ОП является локализация поражения на уровне терминальных бронхиол и альвеолярных ходов с выраженной экссудацией в просветах альвеол и бронхиол. На ранних стадиях характерны отек и лимфогистиоцитарная инфильтрация с примесью нейтрофилов, а также образование молодой грануляционной ткани вокруг перибронхиолярной зоны на уровне мелких бронхов и терминальных бронхиол. Наряду с воспалением обнаруживают очаги выраженной базальноклеточной гиперплазии, внутриальвеолярный отек и скопление экссудата в просвете альвеол и бронхиол. На поздней стадии отмечается перибронхиальный склероз. Кроме того, развиваются очаги карнификации, альвеолы замещаются соединительной тканью. Деформированные бронхиолы выстланы гиперплазированными базальными клетками с признаками атипии. Увеличивается экспрессия как TGFβ, так и FGFb эпителиальными клетками и клетками интерстиция.
Дисрегенераторные изменения эпителия при БООП представлены бокало-видноклеточной, базальноклеточной или атипичной базальноклеточной гиперплазией.
Бокаловидноклеточная гиперплазия характеризуется замещением клеток эпителия бокаловидными клетками, отличающимися гиперпродукцией альцианположительной слизи. Клетки небольшого размера, оттеснены к базальной мембране. Между бокаловидными клетками выявляются цилиндрические клетки с темной цитоплазмой, в их апикальных отделах выявляются мелкие слизистые гранулы.
При базальной гиперплазии отмечается увеличение количества слоев базальных клеток с 2 до 8, располагающихся под цилиндрическим эпителием. Эти клетки имеют относительно большое центрально расположенное темноокрашенное ядро с мелкоячеистой структурой хроматина и ровными контурами ядерной мембраны. Цитоплазма представлена тонким базофильным ободком. Характерна тенденция к созреванию клеточных элементов от базальной мембраны к эпителиальной поверхности, где ядра более светлые, а цитоплазма более широкая.
Атипическая базальноклеточная гинеpнлазия характеризуется появлением признаков атипии клеток - появление клеточного и ядерного полиморфизма, клетки и ядра увеличены в размерах, в некоторых можно различить ядрышко.
Острая интерстициальная пневмония (острое диффузное повреждение альвеол)
Острое диффузное повреждение альвеол было впервые описано L. Hamman и A. Rich в 1935 г. (синдром Хаммена-Рича), в самостоятельную нозологическую форму болезнь была выделена в 1986 г. Заболевание характеризуется фульминантным течением, плохим прогнозом - летальность достигает 70%. Морфологические изменения при диффузном повреждении альвеол соответствуют диффузному альвеолярному повреждению, которое наблюдают при РДСВ. В раннюю фазу выявлено сочетание интерстициального отека паренхимы, воспалительная экссудация в просвет альвеол и формирование гиалиновых мембран, тромбоз капилляров, на поздних этапах (обычно после 2-й недели от начала заболевания) - признаки интраальвеолярной и/или интерстициальной организации, обычно ассоциированные с пролиферацией альвеолоцитов II типа.
Респираторный бронхиолит
Респираторный бронхиолит (РБ) с интерстициальной болезнью легких определяется как самостоятельная форма ИФА, характеризующаяся развитием хронического бронхиолита с накоплением в просвете респираторных бронхиол и прилежащих к ним альвеол макрофагов с гранулами пигмента в цитоплазме. Обычно этот тип ИФА обнаруживается у курильщиков.
Морфологическая картина характеризуется наличием интерстициального воспаления и фиброза средней степени выраженности, сочетающегося с хроническим бронхиолитом с дисрегенераторными изменениями эпителия в виде слизистой гиперплазии, плоскоклеточной метаплазии и дисплазии с наличием в просвете респираторных бронхиол и прилежащих к ним альвеол макрофагов с гранулами пигмента в цитоплазме. РБ наименее изучен по сравнению с другими ИФА.
Пневмониты гиперчувствительности (экзогенные аллергические альвеолиты)
Это группа острых и хронических интерстициальных заболеваний, вызванных воздействием вдыхаемых аллергенов.
Этиология гиперергических альвеолитов связана с вдыханием различных аллергенов, с которыми человек сталкивается в своей профессиональной деятельности, а также в быту. Нередко аллерген остается неустановленным. Наиболее часто аллергенами являются вдыхаемые агенты 3 видов:
Вдыхание аллергенов в ходе профессиональной деятельности приводит к развитию профессиональных заболеваний, таких как:
В быту экзогенные аллергические альвеолиты вызывают аллергены, накапливающиеся в кондиционерах, от домашних птиц, нюхательного табака, они классифицируются как:
Патогенез гиперергических альвеолитов до конца не изучен. С одной стороны, имеются доказательства, что механизм развития заболеваний связан с реакциями гиперчувствительности - иммунокомплексным и Т-цитотоксическим (3-го и 4-го типов) к вдыхаемым аллергенам. В сыворотке больных можно обнаружить преципитирующиеся антитела класса IgG к соответствующим аллергенам. Однако не все люди, имеющие преципитирующиеся антитела класса IgG к соответствующим аллергенам, страдают гиперергическими пневмонитами, что может указывать на необходимость генетической предрасположенности для развития заболевания.
Морфология. Морфологическая характеристика экзогенных аллергических альвеолитов во многом стереотипна и включает структурные изменения, которые отражают аэрогенный путь проникновения аллергена в респираторные отделы легкого, патогенез и характер течения воспаления. Путь проникновения аллергена в легкие через респираторное дерево приводит к образованию диссеминированных очагов вокруг респираторных бронхиол (бронхиолита в сочетании с интерстициальной пневмонией). Иммунный патогенез - иммунное воспаление на основе реакций гиперчувствительности, нередко обусловливает образование неказеозных гранулем. Острое течение связано с развитием альвеолита с нейтрофилами в воспалительных инфильтратах, тогда как хроническое течение характеризуется выраженным интерстициальным фиброзом вплоть до развития сотового легкого. Основными морфологическими проявлениями заболевания являются:
Клиническая характеристика экзогенных аллергических альвеолитов острого и хронического течения различна.
Острые аллергические альвеолиты возникают вследствие воздействия высоких концентраций антигена. При этом развиваются тяжелая одышка, кашель, лихорадка и озноб уже через 4-6 ч после контакта. Выздоровление обычно наступает через несколько дней. Однако может наступить рецидив при повторном контакте с аллергеном.
Хронический экзогенный аллергический альвеолит возникает при длительном контакте с низкими концентрациями антигена. Он характеризуется скрытым развитием одышки, кашля и слабости.
Диагностика гиперергических пневмонитов сложна, осуществляется на основе комплекса клинико-рентгенологических и лабораторных данных. Обязательным является использование кожных проб и определение антител в крови. В трудных случаях проводят биопсию легкого. Принципы лечения экзогенных аллергических альвеолитов основаны на устранении контакта с антигеном и назначении стероидов, особенно в острую стадию.
Идиопатические интерстициальные гранулематозные заболевания легких Саркоидоз
Саркоидоз - системное заболевание неустановленной этиологии, характеризующееся развитием неказеозных гранулем (макрофагальных, эпителиоидно-клеточных и гигантоклеточных) в легких, лимфоузлах и других органах (кожа, печень, селезенка, сердце, глаза). Диагноз саркоидоза в соответствии с международным консенсусом ставят на основании клинико-лабораторного и рентгенологического подтверждения поражения более чем одного органа при условии морфологического подтверждения наличия неказеозных гранулем в них, а также при исключении других возможных причин развития гранулем саркоидного типа.
Саркоидоз - наиболее часто встречающееся заболевание среди интерстициальных болезней легких с неустановленной этиологией, распространен повсеместно, его обнаруживают у лиц всех возрастных групп. Пик заболеваемости - 20-40 лет. Заболеваемость саркоидозом выше среди женщин и варьирует среди различных народов и в разных странах. В отдельных расовых и этнических группах саркоидоз встречается чаще, чем в других, что говорит о значении генетической предрасположенности к этому заболеванию. Так, в Северной Америке показатели заболеваемости среди чернокожего населения в 15 раз выше, чем среди белого.
Заболевание часто встречается среди чернокожих жителей Южной Африки и в тропической части Африки. В Европе заболеваемость саркоидозом чрезвычайно высока среди женщин Ирландии, а также скандинавских стран. Заболевание может протекать бессимптомно, и обнаруживают его случайно при лучевом обследовании или уже при аутопсии в виде диссеминированного процесса в легких в сочетании с лимфаденопатией и поражением других органов.
Клиническая картина. Отмечается полиморфизм клинической картины в зависимости от органной патологии и активности процесса. Часто заболевание протекает бессимптомно. Может проявляться в виде лихорадки, ночных потов, узловой эритемы, полиартрита. В сыворотке больных отмечается повышение IgG, ангиотензинконвертазы, в моче - усиление экскреции кальция. Радиологические симптомы: двусторонние интерстициальные инфильтраты и лимфаденопатия. Окончательный диагноз заболевания обычно ставится на основании биопсийного исследования.
Этиология саркоидоза неизвестна. Некоторые авторы высказывают предположение о значении L-форм Mycobacteria tuberculosum, Chlamidia, Borrelia burgdorferi, Propionibacterium acnes, Mycoplasma и вирусов в развитии саркоидоза. В пользу предположения о возможном участии микобактерии туберкулеза свидетельствует обнаружение у больных саркоидозом ряда изменений, типичных для туберкулеза: положительные данные PCR на фрагменты ДНК микобактерий в саркоидных гранулемах и аккумуляция γ-δ-Т клеток (ассоциированные с микобактериальными инфекциями). Однако в целом исследования по изучению инфекционной этиологии саркоидоза нередко приходят к диаметрально противоположным заключениям.
Патогенез саркоидоза - иммунный с развитием реакции гиперчувствительности IV типа с участием избыточного количества CD4+-Т-лимфоцитов. У больных саркоидозом обнаруживаются множественные иммунологические нарушения, такие как изменения кожных реакций ГЗТ, появление циркулирующих иммунокомплексов, признаки активации В-клеток и резкое увеличение количества CD4+-Т-лимфоцитов, что изменяет соотношение CD4/CD8, составляющее 1:10 (по сравнению с нормальным соотношением, равным 1:2). Причины, приводящие к пролиферации и накоплению CD4+-Т-лимфоцитов, пока не установлены. CD4+-Т- лимфоциты продуцируют цитокины, в том числе ИФ-д, индуцирующий трансформацию макрофагов в эпителиоидные, а затем в гигантские многоядерные клетки, что ведет к образованию неказеозных гранулем. В пользу иммунного патогенеза саркоидоза свидетельствуют следующие факты:
-
лимфоцитарный характер альвеолита с аккумуляцией CD4+-Т-лимфоцитов, усиленно продуцирующих γ-ИФ, ИЛ 1-2 и экспрессирующих HLA-DR;
-
активация альвеолярных макрофагов, продуцирующих ИЛ-1, -12, -15. ФНО-α, факторы роста и АФК;
-
снижение циркулирующих Т-лимфоцитов при наличии нормального уровня В-лимфоцитов;
-
неспецифическая поликлональная стимуляция В-лимфоцитов с развитием гипергаммаглобулинемии.
Патологическая анатомия саркоидоза характеризуется наличием различных вариантов болезни в зависимости от характера течения - острого или хронического саркоидоза. При остром саркоидозе развивается острая симптоматика поражения легких в сочетании с лимфаденопатией и поражением других органов. Синдром Лефгрена - особый вариант острого саркоидоза с развитием узелковой эритемы, двусторонней лимфаденопатии грудных лимфоузлов в сочетании с полиарталгией диагностируют у 20-50% пациентов. Этот вариант имеет хороший прогноз с возможностью спонтанной ремиссии в течение 2 лет. Хронический вариант саркоидоза характеризуется скрытым началом и постепенным прогрессированием заболевания с возможными спонтанными ремиссиями.
Гистологическое исследование подтверждает наличие в органах и тканях саркоидных гранулем (рис. 11.11), иммунного воспаления с лимфогистиоцитарной инфильтрацией, васкулитов (в 2/3 наблюдений).
Легкие при саркоидозе поражены в 90-95% случаев. Изменения в них протекают в 2 стадии - лимфоцитарного альвеолита и гранулематозного воспаления. Альвеолит при саркоидозе легких характеризуется минимально выраженными признаками воспаления со слабой лимфогистиоцитарной инфильтрацией и отсутствием характерных гранулем (догранулематозная стадия заболевания). Характерной особенностью саркоидных гранулем являются особенности их строения:
Следует отметить, что в редких случаях саркоидоза в гранулемах можно найти мелкие очаги некроза, что значительно затрудняет их дифференциальную диагностику с туберкулезными гранулемами. Саркоидные гранулемы - типичные гранулемы иммунного типа, состоящие из клеток моноцитарного происхождения - макрофагов, эпителиоидных и гигантских многоядерных клеток типа Пирогова-Лангханса, CD4+-Т лимфоцитов и фибробластов. Примерно в 60% случаев в гигантских многоядерных клетках можно обнаружить характерные цитоплазматические включения - звездчатые или астероидные тельца. Нередко в гранулемах обнаруживают характерные включения и тельца. Астероидные тельца локализуется в цитоплазме гигантских многоядерных клеток и имеют вид звездчатых кристаллов. Кроме того, в ткани легкого выявляются кальцифицированные пластинчатые тельца Шаумана, содержащие соли кальция и железа, а также тельца Хамазаки-Весеберга желто-коричневого цвета со свойствами липофусцина и окрашивающихся фуксинофильно при окраске по Цилю-Нильсену. Поражение бронхов при саркоидозе может сопровождаться развитием эндобронхита с вовлечением слизистой бронхов вплоть до обструкции их просветов гранулематозной тканью, что полезно знать при эндоскопической диагностике заболевания. Сосудистая патология легких при саркоидозе выявляется у 2/3 больных по данным открытой биопсии легких и заключается в развитии васкулитов с поражением веточек легочной артерии и вен. Васкулиты имеют обычно гранулематозный характер, однако описаны и продуктивные васкулиты с лимфоплазмаклеточной инфильтрацией. В результате могут возникать легочная гипертензия и легочное сердце, а также веноокклюзионная болезнь.
Фиброз в исходе заболевания может быть выражен в разной степени, лишь у 10% случаев он достигает значительных масштабов вплоть до сотового легкого, приводит в развитию легочного сердца и хронической легочно-сердечной недостаточности.
Осложнения и исходы. У большинства больных саркоидоз обладает хорошим прогнозом. Излечение может наступать спонтанно. У 65-70% пациентов имеются минимальные остаточные изменения, связанные с незначительным пневмосклерозом. У 20% больных саркоидоз протекает как медленно прогрессирующее хроническое заболевание с эпизодами обострений и ремиссий. И только в 10% случаев саркоидоз приводит к прогрессирующему фиброзу с развитием легочного сердца и легочно-сердечной недостаточности. В единичных случаях описано развитие аспергиллеза с формированием каверн и кровохарканьем.
Некротизирующий саркоидный гранулематоз
Заболевание характеризуется сочетанием сливающихся саркоидных и эпителиоидноклеточных гранулем с гранулематозным васкулитом и крупными полями некроза.
Этиология заболевания не установлена. Однако описывают случаи некротизирующего саркоидного гранулематоза с васкулитами при хронической инфекции, вызванной вирусом гепатита В. О возможной роли вирусной инфекции свидетельствует присутствие вирусных антигенов в лаважной жидкости больных.
Патогенез носит иммунный характер, он основан на развитии реакций гиперчувствительности 3-го и 4-го типов в ответ на неизвестный антиген. Об участии иммунокомплексных реакций косвенно может свидетельствовать развитие васкулита при этом заболевании.
Патологическая анатомия некротизирующего саркоидного гранулематоза отличается от морфологии саркоидоза. Для него характерно гранулематозное поражение только легких без вовлечения бронхопульмональных и других лимфатических узлов. Гранулемы также отличаются от саркоидных наличием в них некроза, а также расположением гранулем вокруг некротизированных тканей. Васкулиты с поражением артерий и вен могут быть как гранулематозными с некрозом и без него, гигантоклеточными и деструктивно-продуктивными с фибриноидным некрозом и лимфогистиоцитарной инфильтрацией.
Легочные васкулиты
Легочные васкулиты могут быть проявлением системных васкулитов, причем среди которых следует выделять системные васкулиты с преимущественным поражением легких или первичные легочные васкулиты. Преимущественный характер поражения легких отмечен при таких системных васкулитах, как гранулематоз Вегенера, микроскопический полиартериит и синдром Черджа-Стросс. Их-то и называют неpвичными легочными васкулитами. Легкие также могут быть поражены при таких системных васкулитах, как узелковый периартериит, микроскопический полиангиит, артериит Такаясу. При развитии одновременно легочной и почечной патологии говорят о легочно-ночечных синдpомах.
Втоpичные васкулиты возникают в легких при многих системных заболеваниях соединительной ткани, саркоидозе, гистиоцитозе из клеток Лангерганса, инфекционной патологии, лимфопролиферативных заболеваниях, трансплантации и других.
Патогенез. В основе легочных васкулитов лежат иммунные механизмы - иммунокомплексный и АНЦА (антитела к цитоплазме нейтрофилов)-ассоциированный. Иммунные комплексы, формирующиеся в крови больных, оседают в стенках сосудов различного калибра. Здесь они активируют систему комплемента, привлекают лейкоциты и запускают воспалительную реакцию.
Таким образом формируются иммунные комплексы при узелковом полиартериите, СКВ и других системных заболеваниях соединительной ткани.
АНЦА выявляют при ряде аутоиммунных заболеваний, например при микроскопическом полиартериите и гранулематозе Вегенера. Несмотря на высокую диагностическую ценность, точная роль АНЦА в патогенезе этих васкулитов остается невыясненной. Считают, что антитела связываются с содержимым цитоплазмы нейтрофилов, а повреждение сосудов происходит в результате выброса гидролитических ферментов активированными нейтрофилами.
Установлено, что антитела к цитоплазме нейтрофилов неоднородны:
-
cANCA (от англ. cytoplasmic - цитоплазматические) - эти антитела связываются с протеиназой 3, содержащейся в азурофильных гранулах нейтрофилов. Наличие cANCA характерно для гранулематоза Вегенера;
-
pANCA (от англ. perinuclear - перинуклеарные) в реакции с нейтрофилами дают перинуклеарное зернистое свечение. Мишенью для этих аутоантител служит миелопероксидаза. pANCA обычно обнаруживают у больных микроскопическим полиартериитом и синдромом Черджа-Стросс.
Стереотипными морфологическими изменениями при легочных васкулитах являются геморрагические инфаркты, очаги некроза, геморрагии и гемосидероз. Тип изменений зависит от типа и калибра пораженных сосудов. При васкулитах с тромбозом веточек легочной артерии среднего и мелкого калибра возникают геморрагические инфаркты в легких, что характерно для узелкового периартериита и артериита Такаясу. В случае поражения мелких сосудов - капилляров - развиваются альвеолиты, каплляриты, геморрагии и гемосидероз, при поражении мелких веточек бронхиальной артерии - некроз и воспаление бронхиальной стенки.
Гранулематоз Вегенера
Это системный некротизирующий артериит, поражающий систему органов дыхания (верхние дыхательные пути, респираторное дерево и паренхиму легкого) и почки. Впервые заболевание было описано в 1936 г. F. Wegener. Заболевание чаще регистрируют в зимний период, оно может поражать людей любого возраста, однако средний возраст пациентов составляет 50 лет.
Этиология заболевания не установлена. Обсуждается возможная роль инфекционных агентов.
Патогенез носит иммунный характер. У 70-99% больных выявляют cANCA в сыворотке крови и лаважной жидкости, они могут считаться фактором неблагоприятного прогноза. Показано, что у пациентов с полной ремиссией cANCA обнаруживаются в 30-40% случаев. Антитела рANCA также могут обнаруживаться в сыворотке больных гранулематозом Вегенера. Однако они более специфичны для идиопатического некротизирующего гломерулонефрита и гломерулонефрита с полулуниями, а также микроскопического полиартериита. Корреляции между морфологическими особенностями изменений в легких и типом антител АНЦА в сыворотке крови не обнаружено. Следует помнить, что диагноз гранулематоза Вегенера ставится на основании клинического и рентгенологического симптомокомплекса, данных биопсии и наличия cANCA.
Поражение почек проявляется некротическим и экстракапиллярным продуктивным гломерулонефритом. Кроме легких и почек могут быть поражены и другие органы - глаза, суставы, кожа, периферическая и ЦНС, слюнные железы, поджелудочная и молочная железа, средостение, ЖКТ, предстательная железа, уретра, влагалище, шейка матки, сердце, селезенка.
Исключительно редко бывают изолированные варианты гранулематоза Вегенера с поражением легких.
Поражение верхних дыхательных путей проявляется изъязвлением слизистой оболочки носоглотки, носовых пазух, гортани и трахеи.
Морфология. Морфологические изменения легких описаны при исследовании аутопсийного и биопсийного материала. Макроскопически в легких обнаруживают множественные узлы и каверны, располагающиеся симметрично в обоих легких темно-красного цвета у пациентов с легочными геморрагиями. При гистологическом исследовании обнаруживают триаду характерных признаков:
Некротические гранулемы в легких имеют неправильную форму и содержат разнообразные клетки: нейтрофильные лейкоциты, лимфоциты, плазматические клетки, макрофаги, гигантские многоядерные гистиоциты, эозинофилы. Гистиоциты могут образовывать характерные палисадные структуры вокруг очагов некроза. Саркоидоподобные гранулемы не характерны для гранулематоза Вегенера, что следует помнить при проведении дифференциального диагноза.
Васкулиты при гранулематозе Вегенера носят деструктивный характер и развиваются в артериях, венах и капиллярах. В стенках сосудов обнаруживают фибриноидный некроз и тромбоз, а также полиморфно-клеточную инфильтрацию.
Участки некроза обнаруживают как в гранулемах, так и в легочной ткани, иногда они напоминают географическую карту. Очаги некроза часто обладают базофилией за счет большого количества разрушенных ядер клеток и, вероятно, возникают в результате гетеролиза при активации нейтрофильных лейкоцитов. Такие очаги напоминают микроабсцессы. Однако, помимо механизма гетеролиза, в формировании очагов некроза большое значение может иметь фактор ишемии с развитием очагов ишемического инфаркта легкого. Ишемический характер инфаркта может быть связан с блоком поступления крови по сосудистым шунтам из веточек бронхиальной артерии вследствие распространенных васкулитов в системе не только легочной, но и бронхиальной артерии. Ишемический некроз описан нами при аутопсии больного, погибшего от гранулематоза Вегенера, не только в легких, но и в ткани головного мозга. Помимо описанных диагностически значимых морфологических изменений при гранулематозе Вегенера могут обнаруживаться альвеолярные геморрагии, интерстициальный фиброз, ОП, БООП, липоидная пневмония, лимфоидная гиперплазия, фолликулярный бронхиолит, хронический бронхиолит, бронхоцентрический гранулематоз, бронхиальный стеноз.
Исход. В отсутствие лечения болезнь быстро прогрессирует, и вскоре наступает почечная недостаточность.
Микроскопический полиангиит
Микроскопический полиангиит - системное заболевание неустановленной этиологии с развитием васкулита. Микроскопический полиангиит отличается от классического узелкового полиартериита. Оба заболевания поражают артерии среднего и мелкого калибра, однако при микроскопическом полиартериите воспаление распространяется на артериолы и более мелкие сосуды, в том числе на капилляры почечных клубочков, а также венулы. Заболевание по праву относится к легочно-почечному синдрому, так как патология почек и легких диагностируется практически у всех больных.
Мужчины заболевают в 1,5 раза чаще женщин, средний возраст пациентов 56 лет.
Этиология заболевания не известна. Патогенез иммунный, связан с pANCA, а в ряде случаев, вероятно, и с иммунными комплексами. Заболевание быстро прогрессирует и заканчивается смертью больного от легочного кровотечения, легочно-сердечной недостаточности и почечной недостаточности.
Морфология. Морфологические изменения в легких соответствуют диагнозу диффузного повреждения альвеол с некоторыми особенностями, связанными с патогенезом заболевания. При этом обнаруживается сочетание диффузного повреждения альвеол с капилляритом, альвеолярными геморрагиями и геморрагическими инфарктами, что позволяет делать заключения о геморрагическом альвеолите. В более поздние стадии развиваются карнификация, гемосидероз, легочный фиброз.
Синдром Черджа-Стросс
Это ангиит, поражающий сосуды среднего и мелкого калибра (как узелковый полиартериит), а также более мелкие сосуды, в том числе капилляры почечных клубочков (как микроскопический полиартериит) с образованием гранулематозного воспаления и развитием характерного симптомокомплекса. Заболевание протекает с бронхиальной астмой, аллергическим ринитом, эозинофилией.
Этиология заболевания не установлена.
Патогенез - иммунный. У 70% больных обнаруживают pANCA. Данные аутопсийных наблюдений позволили выделить диагностическую триаду клинико-лабораторных и морфологических проявлений заболевания:
Морфология. Морфологические проявления и клиническая симптоматика зависят от стадии заболевания.
Инициальная стадия характеризуется развитием аллергических реакций в виде ринита, астмы и периферической эозинофилии. В этот период в легких можно найти морфологию бронхиальной астмы и эозинофильные инфильтраты.
Вторая стадия проявляется прогрессированием заболевания с развитием системных лейкокластических васкулитов в коже, легких, ЦНС, сердце. Почки страдают крайне редко, что часто используют при дифференциальной диагностике синдрома Черджа-Стросс с гранулематозом Вегенера.
Третья стадия характеризуется органопатологией в виде нейропатий и инфаркта головного мозга, желудочно-кишечной патологии с кровотечениями, миокардита и инфаркта миокарда, причем поражение миокарда является плохим прогностическим признаком. В легких развивается многообразная патология: бронхит, эозинофильная пневмония, гранулематоз и васкулиты. Гранулемы построены из гистиоцитов, многоядерных клеток, эозинофилов и содержат зону некроза в центре. Васкулиты захватывают сосуды среднего и мелкого калибра и могут приводить к их тромбозу, что и является причиной инфаркта. Морфологическая особенность таких инфарктов связана с 2 типами изменений:
Узелковый периартериит
Это хронически текущий системный васкулит, поражающий мелкие артерии и артерии среднего калибра. Этиология заболевания неизвестна. В 30% случаев у больных имеется хронический вирусный гепатит B. Распределение артерий по частоте поражения выглядит следующим образом: почечные > венечные > печеночные > брыжеечные > прочие. Важный диагностический признак: никогда не бывают поражены сосуды малого круга кровообращения и капилляры почечных клубочков. В легких васкулит возникает только в веточках бронхиальной артерии. Воспаление сосудов, сопровождающееся фибриноидным некрозом их стенок (чем напоминает феномен Артюса), носит сегментарный характер. Периваскулярное воспаление сопровождается появлением узелков, что нашло отражение в названии заболевания. При ангиографии в половине случаев выявляют микроаневризмы. Закупорка просвета сосудов образующимися тромбами приводит к инфарктам. Поражение почек сопровождается артериальной гипертонией. Классический морфологический признак заболевания - обнаружение всех стадий воспаления и регенерации в различных сосудах - отражает волнообразное течение узелкового полиартериита. Пациенты хорошо отвечают на терапию кортикостероидами и цитостатиками.
Артериит Такаясу
Артериит Такаясу (болезнь Такаясу, неспецифический аортоартериит, болезнь отсутствия пульса, или гигантоклеточного аортита) обычно встречается у молодых женщин (моложе 40 лет) азиатского происхождения. Чаще (в 30% случаев) страдают дуга и ветви дуги аорты, но могут также быть вовлечены и другие отделы аорты, а в 12-86%, по данным разных авторов, - легочный ствол. Стенки пораженных сосудов становятся толще, а просвет суживается.
Морфология. Гистологически неспецифический аортоартериит характеризуется гранулематозной гигантоклеточной реакцией, что сближает его с височным артериитом. Болезнь проявляется отсутствием пульса на лучевых артериях, а также неврологической и офтальмологической симптоматикой. При вовлечении в патологический процесс легочного ствола и его ветвей развивается легочная гипертензия. При этом поражена только система легочной артерии. Поскольку легочная артерия и ее ветви вплоть до альвеолярных капилляров являются сосудами эластического типа, то характерный воспалительный процесс с гигантскими клетками, разрушением эластического каркаса, а также с развитием микроаневризм и стенозов сосудов может наблюдаться на всех уровнях. Тромбоз артерий может приводить к формированию геморрагических инфарктов легкого и массивных полей фиброза.
Течение неспецифического аортоартериита различно: иногда болезнь быстро прогрессирует, оканчиваясь летально через 1-2 года после диагностики, а иногда принимает медленное прогредиентное течение.
РАК ЛЕГКОГО
В легком развиваются разнообразные опухоли. Однако 90-95% всех опухолей составляет рак легкого, около 5% - карциноиды и 2-5% - опухоли мезенхимального происхождения. Ежегодно в мире выявляют более 1 млн новых случаев рака легкого, что составляет более 10% вновь диагностируемых злокачественных опухолей. Около 58% случаев рака легкого диагностируется в развитых странах. По заболеваемости и смертности рак легкого занимает 1-е место в целом в Европе и составляет соответственно 21% и 29% всех опухолей среди мужского населения. Для женского населения аналогичные показатели ниже и составляют 5% и 9%. Рак легкого в литературе именуется также бронхогенной карциномой или бронхогенным раком, что подчеркивает наиболее распространенное мнение о гистогенезе опухоли из эпителия бронхов и бронхиол.
Бронхогенная карцинома является основной причиной смерти в индустриально развитых странах по двум причинам: она является самой распространенной злокачественной опухолью и на ее долю приходится примерно 30% смертей от всех видов злокачественных новообразований среди мужского населения. Хотя среди женщин уровни заболеваемости и смертности от рака легкого значительно ниже, за последние 20 лет отмечается их значительной рост. Поэтому в настоящее время показатели смертности от рака легкого опережают таковые при раке молочной железы среди женского населения.
Кроме того, бронхогенная карцинома является наиболее фатальной злокачественной опухолью человека, так как в подавляющем большинстве (75%) диагностируется на поздних стадиях, когда хирургическое лечение уже не проводится. Но даже после полномасштабной комплексной современной терапии показатели выживаемости пациентов с диагнозом бронхогенной карциномы чрезвычайно низкие.
Установлено, что вероятность развития рака легкого возрастает в 30 раз у мужчин и в 90 раз у женщин в возрасте 35-75 лет. Весьма важное влияние на возникновение рака легкого оказывает географический фактор.
Этиология рака легкого в 98% случаев связана с воздействием экзогенных канцерогенных агентов (курение, профессиональные вредности, радиация) и только в единичных случаях - с генетическими факторами.
Патогенез рака легкого - многостадийный процесс, ему предшествует предраковая дисплазия (интраэпителиальная неоплазия разных степеней) бронхогенного эпителия и аденоматозная атипическая гиперплазия, часто развивающаяся на фоне пневмосклероза. Предположение о взаимосвязи пневмосклероза и рака легкого впервые было высказано C. Friedrich в 1939 г., описавшим развитие рака легкого на фоне туберкулезного пневмосклероза.
Роль рубцов в морфогенезе периферического рака легкого заключается в том, что в рубце может происходить депонирование экзо- и эндогенных канцерогенов, вызывающих активацию протоонкогенов (ras, fos, bcl-2) и потерю антионкогенов (p53), а также возникают местная гипоксия и иммунодепрессия, разобщение межклеточных взаимодействий, изменения состава коллагенов экстрацеллюлярного матрикса. Так, установлено, что в рубцах происходит накопление коллагена III, составляющего основную массу коллагенов интерстиция эмбриональной легочной ткани и регенерирующего легкого в фазу пролиферации. При этом в рубцах резко снижается удельный вес коллагена I, характерного для интерстиция зрелого легкого. Изменения соотношения коллагенов III и I при пневмосклерозе могут способствовать нарушению равновесия между процессами пролиферации и дифференцировки эпителия. Таким образом, пневмосклероз независимо от его происхождения может выполнять роль пробластоматозного, фонового процесса для развития рака.
Патогенез и морфогенез рака легкого подчиняются общим закономерностям, они связаны с нарушением процессов пролиферации, дифференцировки и апоптоза в эпителиальных клетках под действием канцерогенных факторов, появлением очагов гиперплазии, метаплазии и дисплазии бронхиального, бронхиолярного и альвеолярного эпителия. Ключевым моментом патогенеза рака легкого является повреждение генома эпителиальной клетки. При этом выявляются хромосомные аберрации и мутации генов, причем большинство из них не являются строго специфическими и постоянно встречающимися только при раке легкого. Наиболее типичной для определенного типа рака легкого - мелкоклеточного рака - является делеция в коротком плече 3-й хромосомы небольшой области - 3 р14-23.
В крупных бронхах предраковые процессы развиваются при попадании канцерогенов с вдыхаемым воздухом, что приводит к повреждению мукоцилиарного барьера и повреждению клеток базального слоя. Последнее происходит в условиях инкорпорации канцерогенного агента, что приводит к плоскоклеточной метаплазии, дисплазии и злокачественной трансформации. Описанные механизмы имеют большое значение для возникновения рака легкого крупных бронхов.
В мелкие бронхи, бронхиолы и альвеолы канцерогенные агенты могут попадать не только с вдыхаемым воздухом, но и приноситься с кровью и лимфой. Однако, вероятно, концентрации поступаемых таким образом в легкие канцерогенных агентов бывают не достаточными для индукции процессов малигнизации. Это подтверждается данными эксперимента и клиническими наблюдениями. Необходимы дополнительные условия, способствующие концентрации канцерогенов. Такими условиями являются хроническое воспаление и пневмосклероз, благоприятствующие также нарушению иммунологического контроля за появлением мутированных клеток, нарушениям межклеточных регуляторных взаимодействий. Показано, что наибольшее значение для развития рака легкого имеют декомпенсированное хроническое воспаление и пневмосклероз при туберкулезе, ИФА, в рубцах после перенесенного инфаркта легкого, вокруг инородных тел («рак в рубце»). В очагах хронического воспаления и пневмосклероза возникают фокусы пролиферации эпителия бронхов, бронхиол и альвеол, состоящие из базальных, реснитчатых, слизистых клеток, клеток Клара, альвеоцитов II порядка. При прогрессировании процесса развиваются метаплазия и дисплазия бронхиального и бронхиолярного эпителия, очаги аденоматоза с атипией эпителиальных клеток и атипическая гиперплазия эпителия в овальных и щелевидных структурах в очагах пневмосклероза. Описанные изменения имеют большое значение для развития рака легкого мелких бронхов, бронхиол. Дискуссионным остается вопрос о возможности возникновения рака легкого из трансформированных альвеоцитов II типа. Следует помнить о возможности развития рака легкого без предшествующих предраковых изменений de novo.
Молекулярные основы патогенеза рака легкого
Молекулярную патологию рака легкого определяет совокупность морфологических и молекулярно-генетических особенностей этой опухоли. При этом наиболее важными аспектами проблемы являются определение биомолекулярных и гистогенетических маркеров рака, а также патология апоптоза при раке легкого. Биомолекулярные маркеры рака легкого разнообразны, они представлены различными генами, белками, гормонами и другими молекулами.
Клеточные онкогены при раке легкого. В патогенезе рака легкого наибольшее значение имеют клеточные онкогены 4-х семейств myc, ras, bcl, erb-B, отражающих профиль опухолей, что в настоящее время должно учитываться в диагностике и назначении таргетной терапии.
Семейство myc клеточных онкогенов (c-myc, L-myc, N-myc) составляют немедленно реагирующие генами, которые кодируют клеточные регуляторные белки, индуцирующие пролиферацию и подавляющие дифференцировку. Установлено, что в отсутствие факторов роста повышение экспрессии c-myc приводит не к делению клеток, а к апоптозу, который может ингибироваться bcl-2. C-myc амплификация обнаруживается в 10-25% случаев рака легкого, в то время как L-myc и N-myc - только в нейро-эндокринных опухолях легких (10-30%). Экспрессия L-myc обнаружена только в группе нейроэндокринных опухолей легких, а экспрессия с-myc - в группе как мелкоклеточного, так и немелкоклеточного рака легкого. В группе мелкоклеточного рака легкого установлена достоверная корреляция экспрессии L-myc и c-myc с наличием метастазов и размерами опухоли.
Семейство ras клеточных онкогенов нередко подвергается изменениям при опухолевом росте. Гены кодируют синтез белка р21, воздействующего на передачу ростового сигнала в клетке. Описаны мутации, активирующие ras-гены и локализующиеся в 12-м, 13-м и 61-м кодонах. Наиболее часто в раке легкого обнаруживаются мутации K-ras, присущие только немелкоклеточному раку легкого. Частота мутаций K-ras в аденокарциномах легкого составляет до 30%, а в плоскоклеточном раке легкого - только 3%. K-ras мутации обнаружены при предраке легкого - атипической гиперплазии альвеолярного эпителия, в 40% случаев в окружающей легочной ткани вокруг аденокарцином. Обнаружение K-ras мутации лежит в основе таргетной терапии рака легкого.
Семейство bcl-2 состоит из bcl-2, bax, bak, bclXL, bclXS, белковые продукты которых способны образовывать гомо- и гетеродимеры, оказывающие порой диаметрально противоположное действие на пролиферацию и апоптоз опухолевых клеток. Bcl-2 локализуется на внутренней мембране митохондрий, а также в ядре, стимулирует пролиферацию клеток и ингибирует апоптоз. Напротив, bax-протеины, транскрипция и синтез которых регулируется p53, блокируют пролиферацию и стимулируют апоптоз опухолевых клеток. BclXL ингибирует апоптоз и стимулирует пролиферацию, а bclXS, напротив, индуцирует апоптоз. Таким образом, баланс между белковыми продуктами bcl-2-bax, bclXL-bclXS определяет сдвиг равновесия в сторону пролиферации или апоптоза в опухоли.
Гены-супрессоры при раке легкого. Роль генов-супрессоров при развитии опухолей сводится к блокированию апоптоза и снятию их супрессивного влияния на клеточные онкогены, что в итоге заканчивается активацией пролиферации. Для реализации эффекта от повреждений генов-супрессоров, изменения должны затрагивать оба аллеля гена, так как мутированный ген-супрессор всегда относится к сохранному как рецессивный к доминантному. Например, мутация или делеция одной из аллелей гена-супрессора должна сопровождаться потерей или изменениями в другой аллели. Гены-супрессоры p53 и Rb в раке легкого изучены относительно хорошо. Выявление повреждения генома в области локализации генов-супрессоров на стадии предраковых изменений свидетельствует об участии этих генов в ранних стадиях опухолевого роста. При опухолевом росте наиболее частым изменениям подвергается ген p53. «Дикий» тип p53 (природный) является транскрипционным фактором с множественными функциями, включающими регулировку перехода клеток из G1- в S-фазу, репарацию ДНК, апоптоз вслед за повреждением генома. Мутированный p53 фактически действует как клеточный онкоген, стимулирует пролиферацию опухолевых клеток и вызывает образование антител, которые выявляются в крови больных. Показано, что нарушение работы p53 происходит при его взаимодействии с другими белками - регуляторами митотического цикла - р21, Мdm2, bax. Мутация вызывает конформационные изменения в протеине p53, и он накапливается в ядрах клеток, что позволяет определять его иммуногистохимическими методами (рис. 11.12). Имеются доказательства значения мутации p53 на ранних стадиях канцерогенеза легкого. Взаимосвязь накопления p53 при предраке с последующим развитием опухоли в высокой степени достоверна. Вместе с тем примерно 50% случаев рака легкого развивается без мутации p53. Поэтому ни накопление p53, ни его мутации не исчерпывают молекулярные механизмы, через которые p53 может инактивироваться в опухолях.
Классификация
Классификация рака легкого учитывает локализацию опухоли, характер роста, макроскопический вид, стадию процесса, гистогенез. По локализации выделяют:
По характеру роста выделяют рак:
По макроскопической форме выделяют следующие формы рака легкого:
По гистогенезу (микроскопической структуре):
-
плоскоклеточный (варианты по гистологическому строению и уровню дифференцировки);
-
мелкоклеточный: классический (овсяноклеточный, лимфоцитоподобный, промежуточноклеточный), комбинированный;
-
аденокарцинома (рис. 11.13): ацинарная, сосочковая бронхиолоальвеолярная карцинома, солидная с продукцией слизи;
-
крупноклеточный рак: как варианты - гигантоклеточный рак, светло-клеточный рак;
-
рак бронхиальных желез: аденоидно-кистозный рак, мукоэпидермоидный рак и др.
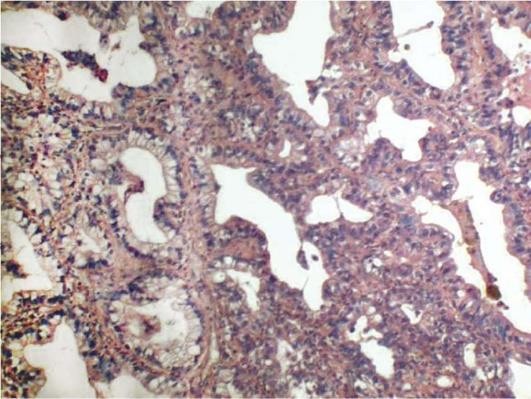
Гистологическая классификация рака легкого постоянно расширяется и уточняется. Последняя гистологическая классификация ВОЗ рака легкого базируется не только на гистологических критериях, но и на иммуногистохимических, что очень важно, поскольку в целом без иммуногистохимии диагностические ошибки могут достигать 40%. Для всех типов рака легкого в той или иной мере характерна экспрессия цитокератинов (рис. 11.14).
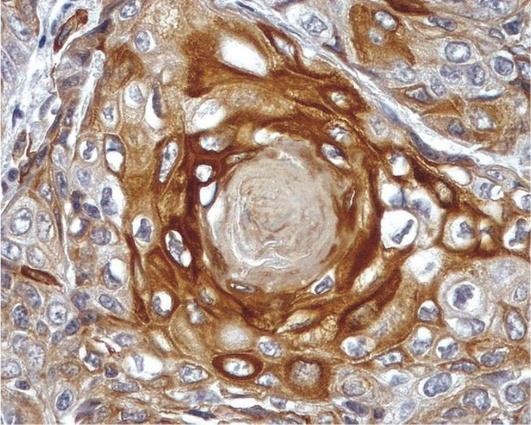
Гистологическая классификация рака легкого ВОЗ (2015 г.). Эпителиальные опухоли легких
Гистологический тип |
Аденокарцинома |
Аденокарцинома с поверхностным ростом |
Ацинарная аденокарцинома |
Папиллярная аденокарцинома |
Микропапиллярная аденокарцинома |
Солидная аденокарцинома |
Инвазивная муцинозная аденокарцинома |
Смешанная инвазивная муцинозная и немуцинозная аденокарцинома |
Коллоидная аденокарцинома |
Фетальная аденокарцинома |
Кишечного типа аденокарцинома |
Микроинвазивная аденокарцинома: |
Преинвазивные поражения |
Атипическая аденоматозная гиперплазия |
Плоскоклеточный рак |
Ороговевающий плоскоклеточный рак |
Преинвазивные поражения |
Плоскоклеточный рак in situ |
Нейроэндокринные карциномы |
Мелкоклеточный рак |
Комбинированный мелкоклеточный рак |
Крупноклеточная нейроэндокринная карцинома |
Крупноклеточная комбинированная нейроэндокринная карцинома |
Карциноидные опухоли: |
Преинвазивные поражения |
Диффузная идиопатическая нейроэндокринная гиперплазия |
Крупноклеточный рак |
Железисто-плоскоклеточный рак |
Саркоматозные карциномы |
Плеоморфная |
Другие неклассифицируемые карциномы |
Лимфоэпителиомоподобная NUT-карцинома |
Опухоли типа слюнных желез |
Мукоэпидермоидный рак |
Папилломы |
Аденомы |
Наихудшим прогнозом обладают крупно- и мелкоклеточный рак. Крупноклеточный рак легкого при световой микроскопии содержит крупные раковые клетки, которые при гистохимическом и электронно-микроскопическом исследованиях обнаруживают признаки плоского или железистого эпителия.
Мелкоклеточный рак легкого - группа опухолей, которые на светооптическом уровне построены из мелких недифференцированных раковых клеток. Однако при гистохимическом и электронно-микроскопическом исследованиях в этой группе обнаруживают опухоли различной дифференцировки: плоскоклеточной, железистой, нейроэндокринной (преобладает), а также неклассифицируемые опухоли.
Среди множества гистологических типов рака легкого в настоящее время выделяют нейроэндокринные карциномы, представленные 3-мя типами опухолей:
-
высокодифференцированной нейроэндокринной карциномой (синоним - типичный, доброкачественный карциноид);
-
умеренно дифференцированной нейроэндокринной карциномой (атипичный, злокачественный карциноид);
-
низкодифференцированной нейроэндокринной карциномой (мелкоклеточный рак с нейроэндокринной дифференцировкой).
Рак легкого представлен опухолями различного гистогенеза. В последние годы все гистологические типы рака легкого делят на мелкоклеточный и немелкоклеточный, которые отличаются не только морфологическими проявлениями, но и клинически, ответом на химиотерапию и прогнозом жизни больных. Мелкоклеточный рак легкого характеризуется и особыми биомолекулярными маркерами из группы клеточных онкогенов, генов-супрессоров и факторов роста, о чем написано в соответствующих разделах. Кроме того, мелкоклеточный рак отличается признаками нейроэндокринной дифференцировки. Более чем в 90% паренхиматозных клеток нейроэндокринной карциномы экспрессируют и хромогранин, и панцитокератины. Хромогранин выявлялся в виде гранул в цитоплазме опухолевых клеток (рис. 11.15).
Немелкоклеточный рак легкого - гетерогенная группа опухолей, относящихся к разным гистогенетическим группам: плоскоклеточный рак (маркерами являются низкомолекулярные цитокератины, кератогиалин), аденокарцинома (высокомолекулярные цитокератины, слизи, сурфактант и др.), а также крупноклеточный рак, который может быть представлен как низкодифференцированной аденокарциномой, так и низкодифференцированным плоскоклеточным раком.
Современная классификация рака легкого включает в себя также и молекулярный профиль опухоли, что необходимо знать для использования таргетной терапии. Так, например, в немелкоклеточном раке легкого, прежде всего в аденокарциномах, определяют наличие мутаций KRAS, EGFR и также наличие гибридного гена ALK.
Патологическая анатомия прикорневого и периферического рака различна. Массивный рак фактически является поздней стадией развития центрального или периферического рака. Поскольку RAS часто мутирует в раковых опухолях человека, то естественно, что было предпринято множество попыток создать анти-RAS методы таргетной терапии. К сожалению, не была доказана эффективность при использовании в клинической практике ни одного из этих методов. Напротив, EGFR может стать мишенью гефитиниба и эрлотиниба, используемых в таргетной терапии РЛ. Ответ на терапию отмечен у 70% пациентов с мутациями EGFR, гибридные-ALK белки являются высокочувствительными к действию ингибиторов ALK (100). Подавление активности гибридных ALK-белков препаратом кpизотиниб лежит в основе таргетной терапии соответствующих типов рака легкого.
Прикорневой рак развивается в крупных бронхах. Предраковые процессы - плоскоклеточная метаплазия и дисплазия бронхиального эпителия, как правило, возникает на фоне хронического воспаления. Преобладающие макроскопические формы - полипозный, узловатый, разветвленный, узловато-разветвленный. Гистогенетически прикорневой рак связан с клетками бронхиального эпителия - базальной, бокаловидной и реснитчатой. Наиболее часто встречающиеся гистологические типы прикорневого рака - плоскоклеточный и мелкоклеточный. Нередко осложняется ретростенотическими абсцессами легких, ателектазами. Опухоль может прорастать в средостение, сердечную сорочку, пищевод, сосудистые стволы, что может стать причиной легочного кровотечения. Основные методы диагностики - бронхоскопия с биопсией, цитологическое исследование мокроты и радиологическое исследование.
Периферический рак легкого во многих случаях развивается на фоне предшествующих хронического воспаления и склеротических изменений - очаговых или диффузных. Предраковые процессы - плоскоклеточная метаплазия, дисплазия эпителия мелких бронхов и бронхиол, аденоматоз с атипией клеток и атипическая гиперплазия эпителия в овальных и щелевидных структурах в рубце. Преобладающие макроскопические формы - узловатая, узловато-разветвленная, полостная и пневмониоподобная. Гистогенез периферического рака связан не только с базальной, бокаловидной и реснитчатой клетками бронхов и бронхиол, но и с клетками Клара и альвеоцитами II порядка. Это определяет существование большего разнообразия гистологических типов периферического рака легкого по сравнению с центральным. Так, в периферических отделах легкого преобладают железистые карциномы, встречается бронхиолоальвеолярная карцинома. Плоскоклеточный рак и мелкоклеточный рак выявляются значительно реже. Основными методами ранней диагностики периферического рака легкого являются рентгенологический и трансторакальная чрескожная биопсия легкого. Осложнения опухоли связаны с прорастанием ее в плевральную полость с развитием серозно-геморрагического или геморрагического плеврита, распространением на крупные бронхи, распадом и нагноением самой опухоли.
Метастазирование рака легкого на начальных стадиях преимущественно лимфогенным путем. Первые метастазы обнаруживаются в регионарных лимфатических узлах. На поздних стадиях лимфогенные метастазы распространяются в бифуркационные, паратрахеальные, медиастинальные и шейные лимфоузлы, может развиться канцероматоз легких, плевры и брюшины, появляются гематогенные метастазы в печени, костях, надпочечниках, головном мозге.
ХРОНИЧЕСКИЕ ЗАБОЛЕВАНИЯ ЛЕГКИХ, СВЯЗАННЫЕ С ВОЗДЕЙСТВИЕМ ПЫЛИ (ПНЕВМОКОНИОЗЫ)
Пневмокониозы (от лат. pneumon - легкие, conia - пыль) - пылевые болезни легких. Пневмокониозы относят к профессиональным заболеваниями, так как их возникновение связано с длительным воздействием промышленной пыли. Промышленной пылью называют образующиеся при производственном процессе мельчайшие частицы твердого вещества, которые, поступая в воздух, находятся в нем во взвешенном состоянии в течение более или менее длительного времени.
Различают неорганическую и органическую пыль. К неорганической пыли относят кварцевую (на 97-99% состоящую из свободной двуокиси кремния - SiO2), силикатную, металлическую, к органической - растительную (мучная, древесная, хлопковая, табачная и др.) и животную (шерстяная, меховая, волосяная и др.). Встречаются смешанная пыль, содержащая, например, в различном соотношении каменноугольную, кварцевую и силикатную пыль, или пыль железной руды, состоящая из железной и кварцевой пыли. Для всех видов пневмокониозов характерно развитие в легких пневмофиброза.
В основе классификации пневмокониозов лежат химический состав и физические свойства действующей пыли. Выделяют следующие виды пневмокониозов:
Силикоз
Силикоз (от лат. silicium - кремний), или халикоз (от греч. chalix - известковый камень), возникает при длительном вдыхании пыли, содержащей свободную двуокись кремния - SiO2. Это наиболее часто встречающаяся форма пневмокониозов, нередко характеризующаяся тяжелым течением.
Заболевание развивается у рабочих горнодобывающей, литейной, металлообрабатывающей и керамической промышленности, проходчиков угольных шахт, каменотесов, пескоструйщиков и др.
Патогенез
Развитие силикоза связывают с химическими, физическими и иммунными процессами, возникающими при взаимодействии пылевой частицы с тканями. При вдыхании пыль попадает в дыхательную систему организма, частично оседает на слизистой оболочке дыхательных путей, проникает в альвеолы, лимфатические сосуды межальвеолярных перегородок, плевру, лимфатические узлы корня легкого и визуализируются при поляризационной микроскопии. Пылевые частицы механически раздражают рецепторный аппарат слизистой оболочки, вызывая усиленную продукцию слизи клетками мерцательного эпителия и подслизистыми железами. На начальных этапах заболевания это способствует осаждению и интенсивному удалению пылевых частиц из организма, в дальнейшем при истощении компенсаторных возможностей легких в них развиваются атрофические процессы, формируется хронический бронхит и обструктивная эмфизема. Наиболее сложным вопросом до сегодняшнего дня остается механизм развития фиброза легкого, существует несколько точек зрения, однако ни одна из них полностью не объясняет его развитие.
Согласно токсико-химической теории, кристаллическая двуокись кремния в тканевых жидкостях медленно растворяется с образованием коллоидного раствора кремниевой кислоты (H2SiO2), которая повреждает ткань и вызывает фиброзный процесс. Однако эта теория не может объяснить сложный механизм развития соединительной ткани при силикозе. Физико-химические теории позволяют объяснить механизм действия частиц кварца нарушением строения его кристаллической решетки, вследствие чего создаются благоприятные условия для активной химической реакции между частицей кварца и окружающей тканью. При медленном растворении частиц кварца образуется кремниевая кислота высокой степени полимеризации, обладающая токсическими свойствами и вызывающая развитие соединительной ткани, причем эта кислота, подобно гликозаминогликанам, принимает участие в построении коллагеновых волокон. Согласно иммунологической теории, при воздействии двуокиси кремния на ткани и клетки при их распаде появляются аутоантигены, что ведет к аутоиммунизации. Возникающий при взаимодействии аутоантигена и антител иммунный комплекс оказывает патогенное влияние на соединительную ткань легких, в результате чего образуется силикотический узелок. Однако специфических антител при силикозе не обнаружено.
Первичной реакцией в патогенезе силикоза является повреждение кварцевой пылью легочных макрофагов, которые называют пылевыми клетками, или кониофагами. По сути, это реакция легких на внедрение инородных тел. Поглощенные частицы кварца повреждают мембраны фаголизосом, в которых они располагаются, нарушая их проницаемость. В результате повышенной проницаемости мембран из фаголизосом выходят в цитоплазму гидролитические ферменты макрофагов, что приводит к аутолизу и гибели последних. В результате в легочной ткани накапливаются молочная кислота и другие недоокисленные соединения. В качестве ответной реакции, направленной на снижение их уровня, активируется синтез коллагена. Согласно этой теории, ведущую роль в патогенезе силикотического фиброза играют кониофаги, гибель которых приводит к последующей стимуляции фибробластов.
Патологическая анатомия
При силикозе изменения обнаруживаются в верхних дыхательных путях, бронхах, легких, плевре, лимфатических узлах и сосудах легких. В слизистой оболочке и в подслизистом слое носовых раковин, гортани и трахеи обнаруживаются атрофия и склероз.
Изменения в легких зависят от стадии и формы заболевания. На начальных этапах скопления пылевых частиц располагаются вокруг бронхов, сосудов, в альвеолах. Вокруг них начинают образовываться коллагеновые волокна, также возникает межуточный склероз. В дальнейшем склеротические процессы прогрессируют, вовлекаются регионарные лимфатические узлы, развивается мелкоочаговая обструктивная эмфизема легких. Легкие увеличены в объеме, плотные вследствие распространенного склероза и резко повышенного содержания двуокиси кремния (в сухом остатке здоровых легких оно составляет 0,04-0,73%, при силикозе - 4,7-12,35%).
Силикоз проявляется в виде двух основных форм: узелковой и диффузно-склеротической (или интерстициальной). При обеих формах характерно диффузное двустороннее поражение легких.
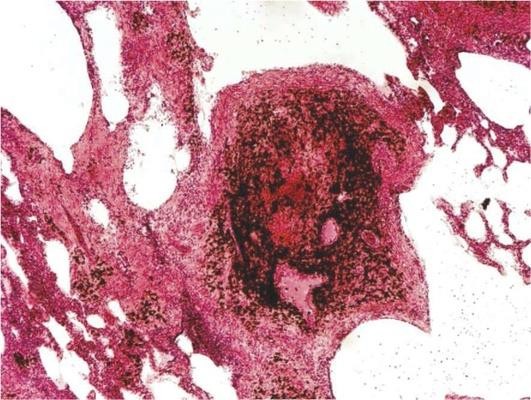
При узелковой форме в легких находят значительное число силикотических узелков и узлов (рис. 11.16), представляющих собой милиарные и более крупные склеротические участки округлой, овальной или неправильной формы, серого или серо-черного цвета. Часто в патологический процесс вовлекается плевра: отмечается ее утолщение (рис. 11.17), уплотнение, образование спаек. При тяжелом силикозе узелки сливаются в крупные силикотические узлы, занимающие большую часть доли или даже целую долю. В таких случаях говорят об опухолевидной форме силикоза легких. Узелковая форма возникает при высоком содержании в пыли свободной двуокиси кремния и при длительном воздействии пыли.
При диффузно-склеротической форме типичные силикотические узелки в легких отсутствуют или их очень мало, они часто обнаруживаются в бифуркационных лимфатических узлах. Эта форма наблюдается при вдыхании промышленной пыли с малым содержанием свободной двуокиси кремния. В легких видны многочисленные тонкие тяжи соединительной ткани, наиболее выраженные сначала вокруг бронхов и сосудов, в дальнейшем проявляющиеся в альвеолярных перегородках. Развиваются распространенная эмфизема, деформация бронхов, сужение и расширение их просвета (бронхоэктазы), различные формы бронхиолита, бронхита (чаще катарально-десквамативного, реже - гнойного). В процесс вовлекаются лимфатические сосуды, в них возникают стазы, склероз стенок с постепенной окклюзией просвета, что приводит к нарушению лимфообращения легких и возникновению некротических изменений в лимфатических узлах. Иногда находят смешанную форму силикоза легких.
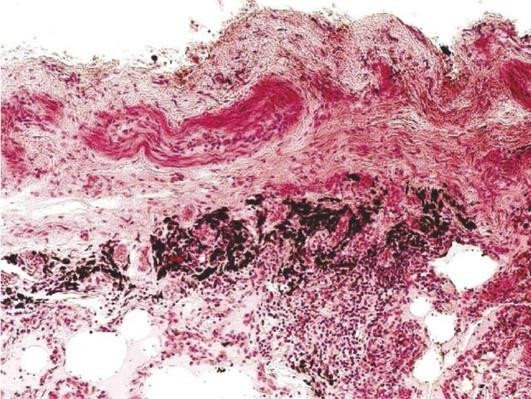
Силикотические узелки могут быть типичными и нетипичными. Строение типичных силикотических узелков двоякое: одни образованы из концентрически располагающихся гиалинизированных пучков соединительной ткани и имеют поэтому округлую форму, другие не имеют округлой формы и состоят из пучков соединительной ткани, вихреобразно идущих в различных направлениях (рис. 11.18). Нетипичные силикотические узелки имеют неправильные очертания, в них отсутствует концентрическое и вихреобразное расположение пучков соединительной ткани. Во всех узелках много частиц пыли, лежащих свободно или в кониофагах.
Силикотические узелки развиваются в просветах альвеол и альвеолярных ходов, а также на месте лимфатических сосудов. Альвеолярные макрофаги фагоцитируют частицы пыли и превращаются в кониофаги (рис. 11.19). При длительном и сильном запылении не все пылевые клетки удаляются, поэтому в просветах альвеол и альвеолярных ходах образуются их скопления. Между клетками появляются коллагеновые волокна, образуется клеточно-фиброзный узелок. Постепенно пылевые клетки гибнут, количество же волокон увеличивается - образуется типичный фиброзный узелок. Аналогичным образом строится силикотический узелок и на месте лимфатического сосуда.
В центре крупных силикотических узлов происходит распад соединительной ткани с образованием силикотических каверн. Распад происходит вследствие изменений в кровеносных сосудах и нервном аппарате легких, а также в результате нестойкости соединительной ткани силикотических узелков и узлов, по биохимическому составу отличающейся от нормальной соединительной ткани. Силикотическая соединительная ткань менее устойчива к воздействию коллагеназы по сравнению с нормальной. В дальнейшем в силикотических кавернах может откладываться известь.
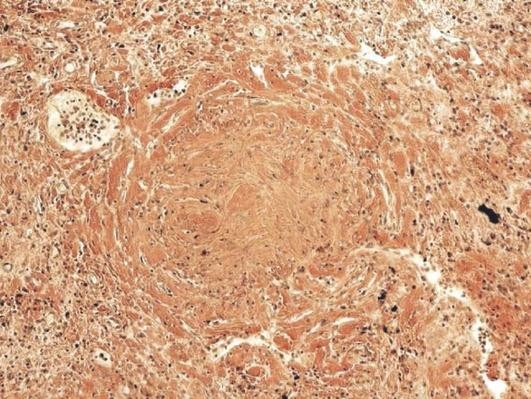
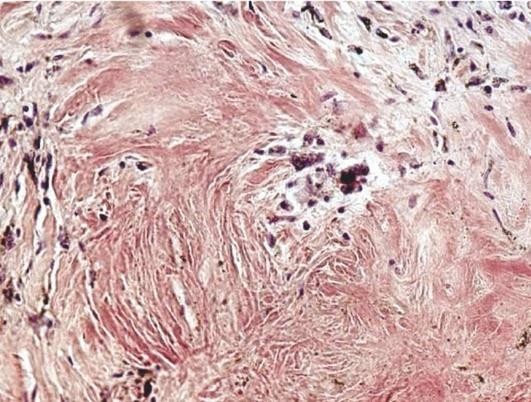
В лимфатических узлах (бифуркационных, прикорневых, реже в околотрахеальных, шейных, надключичных) обнаруживают много кварцевой пыли, распространенный склероз и силикотические узелки. Редко силикотические узелки встречаются в селезенке, печени, костном мозге.
Осложнения
Силикоз может осложняться развитием легочного сердца в результате диффузных склеротических процессов в легких, плевритом, интерстициальной и бронхопневмонией, эмфиземой, с возможностью возникновения спонтанного пневмоторакса (так как при силикозе в плевральной полости часто развивается спаечный процесс вплоть до их полной облитерации полостей, это осложнение возникает редко).
К силикозу часто присоединяется туберкулез. Тогда говорят о силикотубер-кулезе, при котором, помимо силикотических узелков и туберкулезных изменений, находят так называемые силикотуберкулезные очаги.
Течение
Течение силикоза хроническое. Его подразделяют на 3 стадии (силикоз I, II, III). Редко встречается острый силикоз, характеризующийся развитием заболевания и наступлением смерти спустя короткий срок (1-2 года). Этот силикоз развивается при очень высоком содержании в пыли свободной двуокиси кремния. Поздним силикозом называют заболевание, выявляющееся у рабочих спустя несколько лет после оставления ими профессии, связанной с воздействием пыли.
Силикатозы
Силикатозы - пневмокониозы, вызываемые пылью, которая содержит не свободную двуокись кремния, а силикаты (в них она находится в связанном состоянии с другими элементами - магнием, алюминием, железом и др.). Силикаты широко распространены в природе и имеют разнообразное применение в промышленности.
Среди силикатозов выделяют:
Наибольшее значение имеют асбестоз и талькоз.
Асбестоз
Асбестоз - пневмокониоз, развивающийся при длительном контакте с асбестовой пылью. Течение заболевания хроническое с прогрессирующей одышкой, кашлем, легочно-сердечной недостаточностью и может привести к развитию злокачественных опухолей - раку легкого и мезотелиоме.
Асбест (горный лен) - минерал волокнистого строения. По химическому составу это водный силикат магния (3Mg2SiO22Н2О). Волокна асбеста имеют длину 2-5 и даже 125-150 мкм, толщина их 10-60 мкм. Асбест находит широкое применение в промышленности, особенно при строительстве.
Патологическая анатомия. Для заболевания характерны катарально-десквамативный, реже - гнойный бронхит, бронхо- и бронхиолоэктазы с гиперплазией слизистых желез, дистрофическими изменениями в хрящах и их кальцинозом. Поражение бронхов при асбестозе, по-видимому, связано с формой частиц асбеста, длинные острые пылинки которого, застревая в просвете бронхов и бронхиол, постоянно травмируют и раздражают их слизистую оболочку. В грудной полости обнаруживаются распространенные плевральные спайки, плевра значительно утолщена. Легкие увеличены в размере, уплотнены вследствие разрастания соединительной ткани в межальвеолярных перегородках, между дольками, вокруг бронхов и сосудов. На ранних этапах заболевания возникает эмфизема. В отличие от силикоза при асбестозе не образуется четко очерченных склеротических узелков и узлов. В разросшейся соединительной ткани находят значительные скопления пыли и небольшие инфильтраты из гистиоцитов, лимфоидных клеток. Характерно наличие асбестовых телец, представляющих собой светлоили темно-желтые образования длиной 15-150 нм, толщиной 1-5 нм, с булавовидными концами, состоящие как бы из отдельных сегментов; форма и величина их различны. В тяжелых случаях межуточный склероз достигает резкой степени, просветы альвеол становятся едва заметными или их совсем не видно. Лимфатические узлы бифуркации трахеи и прикорневые немного увеличены, плотны, в них содержится много пыли. Отмечается гиперплазия клеток ретикулоэндотелия, очаговый или диффузный склероз, но без развития узелков. На пальцах рук и ног, ладонях, подошвах, реже на голени часто появляются так называемые асбестовые бородавки, характеризующиеся резким гиперкератозом и акантозом. В роговых массах бородавок обнаруживают волокна - кристаллы асбеста, в шиповатом и базальном слоях находят клетки с фигурами деления и гигантские многоядерные клетки инородных тел.
Осложнения. Асбестоз чаще всего осложняется присоединением вторичной инфекции с развитием пневмонии и нагноительных процессов в легких, бронхоэктатической болезни. Диффузные склеротические процессы в легких приводят к возникновению легочного сердца. Часто встречается сочетание асбестоза, мезотелиомы и рака легких.
Смерть при асбестозе наступает от присоединившейся пневмонии, легочно-сердечной недостаточности вследствие эмфиземы и туберкулеза. При сочетании асбестоза с туберкулезом говорят об асбестотуберкулезе, который встречается относительно редко.
Талькоз
Талькоз - пневмокониоз, вызываемый тальком. Тальк - магнезиальный силикат (3MgO4SiO2Н2О), содержащий 29,8-63,5% двуокиси кремния; в воде не растворяется. Тальк применяют в резиновой, керамической, бумажной, текстильной, парфюмерной, лакокрасочной промышленности. Течение заболевания хроническое, медленно прогрессирующее.
Патологическая анатомия. У умерших обнаруживают распространенные плевральные спайки. В легких находят диффузный межуточный склероз с утолщением межальвеолярных перегородок, перибронхиальный и периваскулярный склероз, отложения тальковой пыли. Вокруг волокон талька располагаются инфильтраты из гистиоцитов, лимфоцитов и гигантских многоядерных клеток инородных тел. В цитоплазме последних иногда видны частицы талька. Разросшаяся соединительная ткань имеет вид толстых тяжей, в которых едва заметны просветы сжатых альвеол. Встречаются милиарные или большей величины склеротические участки, не похожие на типичные силикотические узелки. В соединительной ткани появляются иногда так называемые талькозные тельца. Постоянно обнаруживаются бронхоэктазы, эмфизема легких. В бифуркационных и прикорневых лимфатических узлах находят большое количество тальковой пыли и выраженный склероз. Нередко к талькозу присоединяется туберкулез, возникает талькотуберкулез.
Применяемый для припудривания операционных резиновых перчаток тальк может попадать при операциях в брюшной полости на раневую поверхность, брюшину и вызывать воспаление с последующим образованием спаек и узелков - гранулем. В таких случаях говорят о хирургическом талькозе. Гранулемы микроскопически напоминают туберкулезные, но гигантские клетки имеют характер клеток инородных тел. Между клетками гранулемы и в гигантских клетках видны пылинки талька в виде игольчатых кристаллов и пластинок, что также отличает эти гранулемы от туберкулезных.
Металлокониозы
Среди металлокониозов различают сидероз, алюминоз, бериллиоз, титаноз, баритоз, станиоз и др. Наиболее изучены сидероз, алюминоз и бериллиоз.
Сидероз
Сидероз (pneumoconiosis siderotica) - пневмокониоз, который встречается у шахтеров, добывающих гематит (красный железняк, природная окись железа Fe2O3), у рабочих литейных цехов, полировщиков металлических изделий, рабочих гвоздильных производств, гравировщиков, электросварщиков.
Патогенез. Существовало мнение, что фиброз легкого вызывает не железная пыль, а примесь двуокиси кремния, поэтому такие случаи рассматривали как силикосидероз. В настоящее время безвредность железосодержащей пыли отрицается, так как она вызывает фиброз легких. Однако этот фиброз слабее, чем при силикозе и силикатозах, что обусловливает длительное и доброкачественное течение легочного процесса. По-видимому, доброкачественное течение пневмосклероза при сидерозе обусловлено тем, что пыль железа нетоксична и хорошо выводится макрофагами через бронхиальное дерево.
Патологическая анатомия. Различают красный и черный сидероз. Красный сидероз вызван пылью, содержащей окислы железа. Легкие при этом увеличены в объеме, желтовато-буро-красного цвета. Черный сидероз возникает от пыли с закисью железа или углекислого и фосфорнокислого его соединений. Легкие становятся черными и напоминают легкие при антракозе.
При микроскопическом исследовании находят слабовыраженный межуточный склероз, субмилиарные и милиарные узелки, состоящие из скоплений пылевых клеток, заполненных частицами железной пыли (реакция на железо положительная). Между пылевыми клетками обнаруживают немногочисленные коллагеновые волокна. В лимфатических узлах находят много пыли и значительный диффузный склероз.
Карбокониозы
Среди карбокониозов наиболее часты антракоз и графитоз. Наибольшее значение в патологии имеет антракоз.
Антракоз
Антракоз - пневмокониоз, развивающийся при длительном вдыхании угольной пыли. Угольный пигмент вызывает развитие склероза, степень которого зависит от характера угля и состава породы, в которой залегают угольные пласты. Так, вдыхание антрацитовой пыли приводит к развитию более выраженного склероза легких, чем действие пыли битуминозных углей. Древесная угольная пыль почти не вызывает склероза.
По мнению ряда исследователей, склероз легких при антракозе в значительной мере или даже целиком связан с действием двуокиси кремния, содержащейся в различном количестве в угольных пластах, а сама каменноугольная пыль не обладает склерозирующим свойством. Отечественные исследователи считают, что каменноугольная пыль приводит к развитию склероза, но значительно менее выраженного, чем кварцевая пыль.
Как правило, чистый антракоз течет длительнее и доброкачественнее, чем силикоз, потому что угольная пыль хорошо выводится макрофагами через бронхиальное дерево и лимфатические дренажи легких. Склероз бывает более выраженным, если в пыли содержится значительная примесь двуокиси кремния. В таких случаях речь идет о смешанном пневмокониозе - антракосиликозе или силикоантракозе.
Патологическая анатомия. При антракозе легкие прежде всего приобретают характерную серо-черную окраску за счет отложения угольной пыли. Характер отложения пыли и интенсивность окраски зависят от стадии заболевания. В начале заболевания скопление угольного пигмента наблюдается преимущественно в нижних долях легких. В дальнейшем он равномерно распределяется по всем долям легких, возникают эмфизема и пневмосклероз.
Склероз при антракозе характеризуется развитием соединительной ткани в местах отложений угольной пыли - межальвеолярных перегородках, вокруг сосудов и бронхов. Пыль располагается в многочисленных макрофагах и вне их. При антракозе участки новообразованной соединительной ткани с макрофагами называют антракотическими очажками. При слиянии мелких антракотических очажков возникают крупные антракотические узлы.
При диффузном антракотическом пневмосклерозе значительные участки легких оказываются безвоздушными, плотными, серо-черного, аспидного цвета, в связи с чем изменения получили название аспидной, или антракотической, индурации легких.
При антракозе развиваются хронический бронхит и рецидивирующая очаговая пневмония. Обычно выражена эмфизема. Вследствие расстройств кровообращения и непосредственного воздействия значительного количества угольной пыли легочная ткань может подвергаться омертвению и размягчению с образованием каверн неправильной или округлой формы, с крошащимися черными стенками и крошковатым черным содержимым. Эти формы антракоза, сопровождающиеся кровохарканьем и напоминающие легочный туберкулез, называют черной чахоткой.
Лимфатические узлы при резком антракозе спаиваются со стенкой трахеи или бронхов, при этом возможен прорыв угольных масс в просвет бронхиального дерева с последующей аспирацией в легкие и развитием пневмонии, абсцесса и гангрены легких. При значительном пневмосклерозе и эмфиземе легких наблюдается гипертрофия правого сердца.
Пневмокониозы от смешанной пыли
В эту группу входят антракосиликоз, сидеросиликоз, сидеросиликатоз, пневмокониоз электросварщиков и др. Наибольшее значение среди них имеет антракосиликоз, или силикоантракоз (см. Антракоз).
Пневмокониозы от органической пыли
Среди органической пыли велико значение различных бактерий и грибов (особенно спор термофильных актиномицет), пыли, содержащей антигены животного и растительного происхождения, медикаментозных препаратов. Пневмокониозы встречаются у людей, занятых в сельском хозяйстве («легкое фермера»), птицеводстве («легкое птицевода»), животноводстве, а также хлопкообрабатывающей, текстильной (биссиноз - от греч. byssos - лен) и фармацевтической промышленности.
Патогенез. В развитии бронхиальных и легочных изменений при пневмокониозах от органической пыли большое значение имеют аллергические и иммунопатологические процессы. Это атопические реакции и реакции немедленной анафилаксии, характерные для бронхиальной астмы, а также иммунокомплексные реакции с поражением микроциркуляторного русла легких и развитием пневмонита.
Патологическая анатомия. При развитии пневмокониозов, связанных с органической пылью, в легких наблюдаются изменения со стороны бронхов по типу хронического бронхита и изменения легочной ткани, характерные для интерстициальных пневмоний. В зависимости от вида пыли в картине заболевания может преобладать тот или иной компонент. «Легкое фермера», как и «легкое птицевода», имеет в своей основе морфологию экзогенного аллергического альвеолита. Для биссиноза характерны хронический обструктивный бронхит и бронхиальная астма.
Контрольные вопросы
-
Каковы основные различия между обструктивными и рестриктивными заболеваниями легких?
-
Назовите основные медиаторы, вызывающие бронхоспазм при бронхиальной астме.
-
Какие морфологические изменения в легких развиваются при бронхиальной астме?
-
Опишите морфологические изменения в легких при бронхоэктазах.
-
Дайте морфологическую характеристику интерстициальным болезням легких.
-
Перечислите морфологические варианты бронхогенного рака легкого.
-
Дайте характеристику различных форм силикоза легких, объясните, в чем их различия.
-
Дайте определение силикотической каверны, объясните механизм ее формирования.
-
Перечислите основные морфологические проявления асбестоза и объясните механизмы их развития.
-
Дайте морфологическую характеристику изменений органов больных талькозом.
Список литературы
Артамонова В.Г., Мухин Н.А. Профессиональные болезни. - М.: Медицина, 2009. - С. 53-102.
Клеточная биология легких в норме и при патологии / Под ред. В.В. Ерохина, Л.К. Романовой. - М.: Медицина, 2000. - 496 с.
Коган Е.А., Корнев Б.М., Попова Е.Н. с соавт. Интерстициальные болезни легких. - М.: Литтерра, 2007. - 432 с.
Пальцев М.А., Аничков Н.М., Рыбакова М.Г. Руководство к практическим занятиям по патологической анатомии. - М.: Медицина, 2002.
Пальцев М.А., Аничков Н.М. Патологическая анатомия. - М.: Медицина, 2005. - Т. 2, Ч. 1. Гл. 15. - С. 278-349.
Патология органов дыхания: Атлас / Под ред. акад. РАЕН В. С. Паукова. - М.: ГЭОТАР-Медиа, 2013. - 200-218.
Патология: Руководство / Под ред. М.А. Пальцева, В.С. Паукова, Э.Г. Улумбекова. - М.: ГЭОТАР-Медиа, 2002. - 960 с.
Руководство по частной патологии человека / Под ред. Н.К. Хитрова, Д.С. Саркисова, М.А. Пальцева. - М.: Медицина, 2005. - Ч. 1. - С. 247-324.
Струков А.И., Серов В.В. Патологичесая анатомия/6-е изд. Под ред. В.С. Паукова - М.: ГЭОТАР-Медиа, 2013.
Kumar V., Cotran R.S., Robbins S.L. Robbins Basic Pathology. - 7th edition. - Philadelphia, London: Saundress, 2003. - 874 p.
Pathology and Genetics. Tumours of the Respirotary system. WHO Classification of tumours Ed. Trawis. - 2002. - 314 p.
Rubin’s Pathology: Сlinicopathologic foundation of medicine / Ed. E. Rubin, F. Gorstein, R. Rubin, R. Schwarting, D. Strayer. - Philadelphia: Lippincott Williams and Wilkis, 2005. - 1587 p.
Tomashefski J.F., Cagle P.T., Farver C.F., Fraire A.E. Dail and Hammar’s Pulmonary Pathology. 3rd Ed. - Vol. I.