Российская ассоциация специалистов по хирургическим инфекциям |
НОЗОКОМИАЛЬНАЯ ПНЕВМОНИЯ У ВЗРОСЛЫХ
Российские национальные рекомендации
Нозокомиальная пневмония у взрослых: Российские национальные рекомендации / Под ред. акад. РАН Б.Р. Гельфанда; отв. ред. к.м.н., доцент Д.Н. Проценко, к.м.н., доцент Б.З. Бело- церковский. — 2-е изд., перераб. и доп. — М.: ООО «Издательство «Медицинское информационное агентство», 2016. — 176 с. ISBN 978-5-9986-0284-9 |
2-е издание, переработанное и дополненное
Под редакцией академика РАН Б.Р. Гельфанда
Ответственные редакторы к.м.н., доцент Д.Н. Проценко, к.м.н., доцент Б.З. Белоцерковский
Медицинское информационное агентство Москва 2016
УДК |
616.24-002 |
ББК |
55.142 |
Н78 |
Н78 |
Нозокомиальная пневмония у взрослых: Российские национальные рекомендации / Под ред. акад. РАН Б.Р. Гельфанда; отв. ред. к.м.н., доцент Д.Н. Проценко, к.м.н., доцент Б.З. Бело- церковский. — 2-е изд., перераб. и доп. — М.: ООО «Издательство «Медицинское информационное агентство», 2016. — 176 с. |
ISBN 978-5-9986-0284-9
В обновленной версии Российских национальных рекомендаций «Нозокомиальная пневмония у взрослых» представлены современные доказательные данные об эпидемиологии, факторах риска, патогенезе, этиологии и способах профилактики этого весьма распространенного жизнеугрожающего осложнения, отражена современная диагностическая и лечебная концепция. Рекомендации по антимикробной терапии сформулированы с учетом динамики антибиотикорезистентности возбудителей. Подробно освещены особенности респираторной терапии у больных с нозокомиальной пневмонией.
Для терапевтов, пульмонологов, анестизиолгов-реаниматологов, хирургов, патологоанатомов, микробиологов, клинических фармакологов, рентгенологов и врачей функциональной диагностики.
УДК 616.24-002 |
|
ББК 55.142 |
ISBN 978-5-9986-0284-9
© Гельфанд Б.Р. и др., 2016
© Оформление. ООО «Издательство
«Медицинское информационное агентство», 2016
Все права защищены. Никакая часть данной книги не может быть воспроизведена в какой-либо форме без письменного разрешения владельцев авторских прав.
И.Б. Заболотских, Б.Р. Гельфанд, Р.С. Козлов, А.В. Дехнич, А.И. Ярошецкий, Г.М. Галстян, Р.Е. Лахин, Д.Н. Проценко, В.А. Новиков, В.А. Руднов, К.Н. Золотухин, С.Н. Авдеев, А.И. Грицан, И.В. Нехаев
При подозрении на НП все пациенты должны подвергаться определенному клиническому обследованию. Оно включает в себя изучение истории заболевания, учет специфических клинических ситуаций, предполагающих большую вероятность конкретных возбудителей заболевания (см. раздел «Этиология НП»), физикальное обследование. У всех пациентов необходимо определение газов в артериальной крови и/ или проведение пульсоксиметрии с оценкой сатурации SаО2). Целесообразно использовать объективную шкалу диагностики пневмонии, представленную в табл. 8.
Несмотря на умеренную диагностическую эффективность шкалы CPIS (чувствительность — 65%, специфичность — 64%, комбинированное отношение шансов — 4,85 и площадь под характеристической кривой — 0,748), считается, что она все еще может быть полезна в диагностике пневмонии на фоне ИВЛ [190]. У больных с оценкой по шкале CPIS более 6 баллов можно предположить наличие НП.
В 2008 г. Centers for Disease Control and Prevention впервые опубликовали общепринятые в настоящее время диагностические критерии нозокомиальной пневмонии [105].
Рентгенологические критерии (любой из признаков на двух рентгенограммах грудной клетки)
Системные критерии, по крайней мере один из следующих
Легочные критерии, по крайней мере два из следующих
-
Появление гнойной мокроты, или изменение характера мокроты, или увеличение количества секрета трахеобронхиального дерева, или увеличение потребности в аспирационной санации.
-
Ухудшение газообмена (дыхательный коэффициент ≤ 240, увеличение потребности в кислороде, увеличение зависимости от респиратора).
| Показатель | Число баллов |
|---|---|
Температура |
|
> 36,5 °C или < 38,4 °C |
0 |
> 38,5 °C или < 38,9 °C |
1 |
> 39,0 °C или < 36,0 °C |
2 |
Число лейкоцитов крови (в мм3) |
|
> 4000 или < 11 000 |
0 |
< 4000 или > 11 000 |
1 + 1 (при наличии юных форм > 50%) |
Трахеальный секрет Отсутствие трахеального секрета 0 Наличие негнойного трахеального секрета 1 Наличие гнойного трахеального секрета 2 |
|
Оксигенация (PaO2/FiO2, мм рт. ст.) |
|
> 240 или наличие острого респираторного дистресс- синдрома (диагноз острого респираторного дистресс- синдрома ставится при соотношении PaO2/FiO2 < 200 или при давлении заклинивания в легочной артерии < 18 мм рт. ст. и наличии острых двусторонних очагов инфильтрации) |
0 |
< 240 и отсутствие острого респираторного дистресс- синдрома |
2 |
Рентгенография органов грудной клетки |
|
Отсутствие инфильтратов |
0 |
Диффузный инфильтрат |
1 |
Отграниченный инфильтрат |
2 |
Прогрессирование инфильтратов в легких |
|
Отсутствие рентгенографического прогрессирования |
0 |
Рентгенографическое прогрессирование (после исключения острого респираторного дистресс-синдрома и застойной сердечной недостаточности) |
2 |
Культуральное исследование трахеального аспирата |
|
Малое количество патогенных (преобладающих) бактерий или отсутствие роста |
0 |
Умеренное или значительное количество патогенных (преобладающих) бактерий |
1 + 1 (при наличии аналогичных бак- терий при окраске по Граму) |
Общая сумма |
|
Роль биомаркеров в диагностике нозокомиальной пневмонии. Роль биомаркеров инфекции, таких как прокальцитонин, С-реактивный протеин, в диагностике нозокомиальной пневмонии представляется ограниченной, прежде всего, в силу наличия основного заболевания. Содержание в крови этих полипепидов может повышаться при травме, включая операционную, инсульте, раке легкого и при инфекции другой локализации, служащих главными причинами для проведения ИВЛ [51; 120]. Возможности пресепсина в качестве подспорья в диагностике НП не определены.
Лучевая диагностика нозокомиальной пневмонии. Рентгенография грудной клетки в переднезадней и боковой проекциях является обязательной составляющей клинического обследования у больных с подозрением на пневмонию. В большинстве случаев полученных при этом данных достаточно для выявления изменений легких, определения их характеристик (очаговые, инфильтративные изменения), оценки их объема и выявления осложнений (полостей распада, абсцессов, плеврита и т.д.). При этом следует иметь в виду, что примерно у 10% пациентов с пневмонией патологические изменения на рентгенограммах грудной клетки отсутствуют, а у пациентов с иммунодефицитом различного генеза этот процент может достигать 20–30%.
Рентгенологическая картина нозокомиальной пневмонии достаточно разнородна. У большинства пациентов с НП отмечают появление фокусов бронхопневмонической инфильтрации — пятнистых очагов уплотнения легочной ткани. При наличии двусторонней инфильтрации в задних отделах легких всегда следует проводить дифференциальный диагноз с аспирационной пневмонией. Другим рентгенологическим вариантом может быть долевая или сегментарная инфильтрация (плевропневмонический тип) с видимыми на этом фоне просветами бронхов, отграниченная междолевой плеврой. Подобная рентгенологическая картина характерна также для внебольничных пневмоний (в частности, вызванных S. pneumoniae и M. pneumonia).
Установление этиологии нозокомиальной пневмонии по скиалогической картине в большинстве случаев невозможно, однако некоторые особенности рентгеносемиотики при различных видах внутрибольничных пневмоний известны. Клебсиеллезная инфекция чаще всего вызывает верхнедолевую (лобарную) плевропневмонию, резко отграниченную междолевой плеврой, протекающую часто с увеличением объема доли вследствие отека, с характерным прогрессирующим течением, развитием некрозов и полостей распада. Пневмония, вызванная стафилококками, обычно представлена двусторонними случайно распределенными округлыми фокусами уплотнения с быстрым прогрессированием, появлением полостей распада с формированием кольцевидных структур (септическая эмболия). При пневмонии, вызванной синегнойной и кишечной палочками, поражаются преимущественно нижние доли легких с наличием пятнистых участков бронхопневмонической инфильтрации либо множественных узелков с полостями в них.
Динамический рентгенологический или КТ-контроль позволяет оценивать изменения в легочной ткани на фоне проводимой терапии. При оценке повторных исследований, особенно в начальные сроки, очень важно акцентировать внимание на появлении свежих фокусов уплотнения легочной ткани, даже выраженных в минимальной степени, что свидетельствует о прогрессировании заболевания и недостаточной эффективности проводимой антибактериальной терапии. Напротив, уже в ранние сроки лечения обособление фокусов инфильтрации, их подчеркнутые контуры, даже при сохранении их размеров, свидетельствуют о его эффективности. Появление полостей распада в ранее определявшихся фокусах воспалительной инфильтрации при сохранении их размеров является естественным отражением патоморфологических изменений, обусловленных характером флоры, и не должно расцениваться как проявление прогрессирования заболевания. При массивной долевой плевропневмонии восстановление воздушности легочной ткани может имитировать на рентгенограммах появление полостей распада, что легко дифференцируется при проведении КТ.
В более поздние сроки течения нозокомиальных пневмоний длительное сохранение имеющихся изменений, увеличение размеров фокусов инфильтрации с нечеткостью их наружных контуров, появление в них неправильной формы полостей распада, выявление свежих очагов и участков воспалительной инфильтрации, увеличение количества и повышение плотности жидкости в плевральных полостях свидетельствуют о недостаточной эффективности проводимой терапии.
Компьютерная томография органов грудной клетки вследствие высокой разрешающей способности и отсутствия суммационного эффекта является наиболее чувствительным методом оценки легочной паренхимы и органов средостения. При пневмониях она используется главным образом со следующими целями:
-
для исключения предрасполагающих заболеваний (хронической обструктивной болезни легких, опухолей, тромбоэмболии легочной артерии, инфаркта легких, отека легких, респираторного дистресс-синдрома, гиповентиляции и т.д.);
-
для дифференцирования между инфильтративными изменениями, ателектазами и плевральным выпотом;
-
для прослеживания прогрессирования изменений в легочной ткани и оценки эффективности терапии;
-
для точной локализации поражения перед бронхоскопией или бронхоальвеолярным лаважем.
С целью диагностики пневмоний компьютерная томография (КТ) органов грудной клетки показана:
-
больным с высоким клиническим подозрением на наличие легочной инфекции при отсутствии изменений на рентгенограмме, особенно больным с иммунодефицитом (ВИЧ-инфицированные и онкологические больные, получающие иммуносупрессивную и цитостатическую терапию, пациенты со сниженным гуморальным иммунитетом: миелома, хронический лимфолейкоз, болезнь «трансплантат против хозяина» и т.д., пациенты с сахарным диабетом, алкоголики);
-
больным, находящимся на ИВЛ (поскольку диагностическая информация на переднезадней рентгенограмме оказывается недостаточной для выявления изменений в нижних отделах легких).
Стандарт для исследования легких — спиральная КТ. Она позволяет выявить и количественно оценить воспалительные, в том числе и скрытые, легочные поражения, полостные изменения, бронхоэктазы, уточнить локализацию поражений перед выполнением бронхоальвеолярного лаважа, биопсией легкого, дифференцировать легочные и плевральные изменения. Стандартное томографическое исследование в режиме легочного сканирования с толщиной среза 10 мм дополняют компьютерной томографией высокого разрешения, которая осуществляется в режиме высокого пространственного разрешения (костный алгоритм) при коллимации 2 мм с шагом томографа 10–20 мм и ограничением поля зрения (FOV) на высоте максимально глубокого вдоха пациента.
Ультразвуковая диагностика поражений легких и плевры. В последние годы в отделениях интенсивной терапии для выявления легочных поражений широкое применение находит ультразвуковое сканирование [129; 146; 211]. Неинвазивность, быстрота выполнения, точность, доступность, мобильность, отсутствие необходимости в транспортировке больных позволяют рассматривать его как прикроватный метод диагностики. Ультразвук по сравнению с радиологическими методами исследования позволяет получить изображение патологического процесса, основанное на сканировании ультразвуковыми волнами с последующей обработкой отраженных эхосигналов и формированием на экране двухмерной серошкальной картины объектов. Много лет ультразвук не использовали для диагностики легочной патологии, поскольку считали, что из-за содержания воздуха легкие не имеют акустического сопротивления. Однако при отеке легких, пневмонии, фиброзе легких происходит уменьшение содержания воздуха в легких, утолщение интралобулярных септ, которые находятся на поверхности висцеральной плевры, что создает акустическое сопротивление тканей легких, от них отражаются ультразвуковые лучи и на экране монитора формируется изображение. В настоящее время считают, что у больных в отделениях интенсивной терапии по своим диагностическим возможностям ультразвуковое сканирование превышает рентгенографию, а при ряде патологий легких приближается к таковым компьютерной томографии.
Выбор датчика. Для получения общей картины патологических изменений и визуализации глубоко расположенных объектов (например, ателектаз, долевая пневмония) применяют датчик с частотой 3–5 МГц. Для изучения поверхностных структур (плевра, мягкие ткани грудной стенки) применяют датчик с частотой 7–10 МГц.
Техника проведения ультразвукового сканирования. Ультразвуковое исследование легких выполняют в положении больного сидя, полулежа, лежа на спине, лежа на боку [129; 146; 211]. Датчик устанавливают перпендикулярно грудной клетке в межреберном промежутке. Метку датчика располагают по направлению к голове (рис. 1).
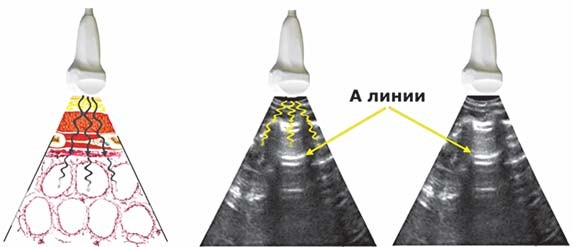
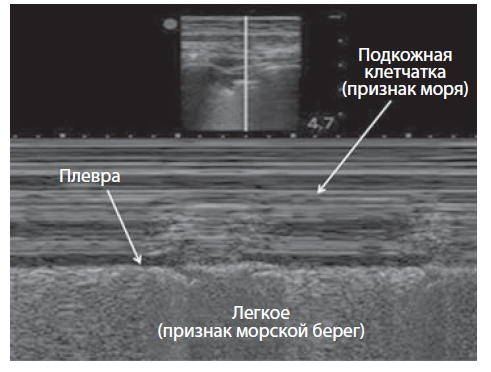
Ультразвуковые признаки поражений легких. При сканировании здорового легкого визуализируются кожа, мягкие ткани, ребра, париетальный и висцеральный листки плевры. При нормальной воздушности легких ультразвук быстро угасает, отражаясь от воздуха в альвеолах. На ультразвуковой картинке визуализируют специфические А-линии — множественные повторяющиеся горизонтальные гиперэхогенные линейные артефакты (артефакт реверберации), расположенные внизу от плевральной линии (рис. 2,3). А-линии могут быть как в норме, так и при патологии, они представляют собой реверберации от кожи и париетальной плевры.
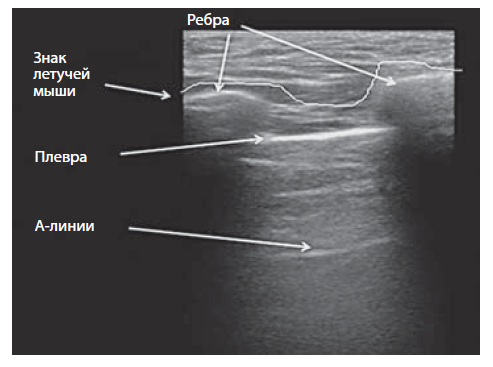
Выделяют признак «летучая мышь» (the bat sign) (см. рис. 3), который можно выявить, размещая датчик вертикально в межреберном пространстве. При этом видны верхние и нижние ребра, изогнутые как лук, соединяющая их плевральная линия, расположенная под ребрами. Этот знак отсутствует при пневмотораксе.
Скольжение легкого (lung sliding) — это ритмичное, синхронное с дыханием движение висцеральной плевры. Присутствует в нормальных легких. Скольжение максимально в нижних легочных полях. При скольжении легкого в М-режиме наблюдается характерный признак «морской берег» (рис. 4). Скольжение легкого становится неопределенным при эмфиземе легких, исчезает при пневмотораксе, ателектазе, плевральном фиброзе и при апноэ.
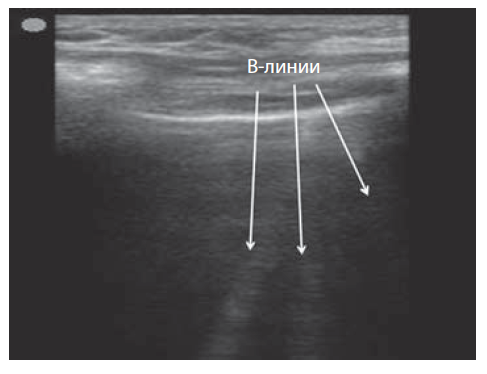
В норме можно увидеть единичные В-линии — гиперэхогенные линейные вертикальные артефакты (рис. 5). В-линии определяют как дискретные вертикали, гиперэхогенные артефакты реверберации, которые возникают от плевральной линии (ранее описаны как «хвосты кометы»), распространяются до нижней части экрана, не исчезая, и двигаются синхронно со скольжением легких. В реальном масштабе времени они движутся синхронно со скольжением легкого, напоминая лазерный луч. В норме их количество не превышает трех в одном межреберном промежутке.
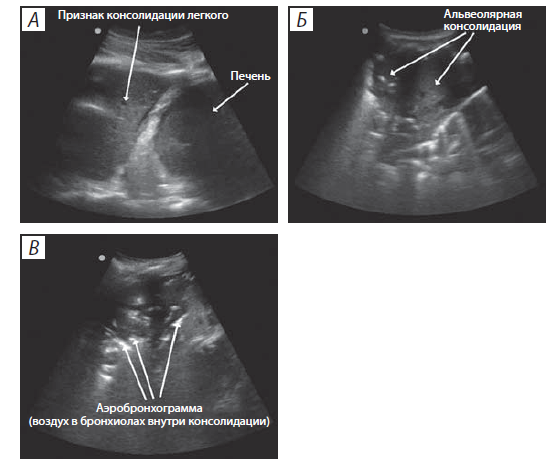
Консолидация. Если воздушность легкого на фоне воспалительной инфильтрации, ателектазирования или других причин полностью исчезает, то ультразвук визуализирует эту зону как ткань, обладающую признаком консолидации. Консолидация (рис. 6) при ультразвуковом сканировании является собирательным понятием и может быть обусловлена пневмонией, тромбоэмболией легочной артерии, новообразованием с метастазами, ателектазом легкого, коллапсом легкого, контузией легкого. Альвеолярная консолидация появляется в результате заполнения жидкостью альвеол, от которых отражается ультразвуковой сигнал. При этом вместо обычного воздушного барьера наблюдаются эхоструктуры, напоминающие печеночную паренхиму («тканевой знак», или the tissue-like sign).
Вокруг зоны консолидации может быть и инфильтрированная ткань легкого (признак В-линий), и нормальная воздушная ткань (рис. 6, В). Внутри зоны консолидации определяется признак бронхограммы — белые гиперэхогенные пятна, которые возникают из-за наличия воздуха в бронхиолах.
Альвеолярно-интерстициальный синдром. Ультразвуковыми признаками альвеолярно-интерстициального синдрома, возникающего при остром респираторном дистресс-синдроме, кардиогенном отеке легких, пневмониях различной этиологии, хронических интерстициальных заболеваниях, являются В-линии (рис. 7), которые также называют «хвостом кометы», «ракетой легких». В-линия — артефакт, который возникает вследствие ревербераций ультразвукового сигнала. Если имеются А-линии, то В-линии располагаются поверх них. В случае, если выявляется несколько В-линий, то измеряют расстояние между ними у самого начала их отхождения от плевры. При альвеолярно-интерстициальном синдроме расстояние между В-линиями составляет 7 мм и менее. При расстоянии между В-линиями менее 3 мм их называют В+-линиями или «ракетами легкого» (lung rockets). Выделяют также сливные В-линии. Множественные В-линии соответствует на компьютерной томографии картине интерстициального отека и «матового стекла».
Определение объема плеврального выпота. Ультразвуковое исследование позволяет с высокой чувствительностью и специфичностью выявлять плевральный выпот, приближаясь по точности к компьютерной томографии. Плевральный выпот визуализируется как анэхогенное пространство между париетальным и висцеральным листками плевры. Если выпот имеет анэхогенную структуру, то это в большинстве случаев транссудат, если эхогенность гомогенная или гетерогенная, то не исключается экссудат. В случае эмпиемы плевры или гемоторакса выпот имеет гетерогенную эхогенность. Когда клеточный компонент оседает вниз, отмечается гипоэхогенный верхний слой и гиперэхогенный нижний. Можно также выявить септы в плевральной полости.
Ультразвуковая диагностика пневмоторакса. Для диагностики пневмоторакса применяют четыре признака: наличие «точки легкого», отсутствие скольжения легкого, отсутствие В-линий, отсутствие пульсации легкого [129; 130; 146; 211].
Точка, в которой в В-режиме прекращается на экране скольжение легкого, называется «точкой легкого» (lung point) и является границей между тканью легкого и пневмотораксом.
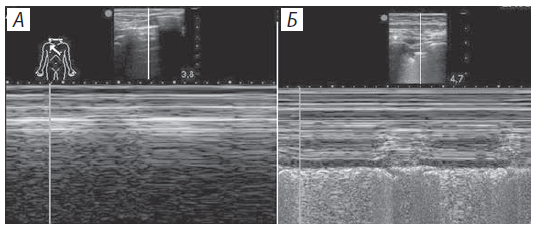
В норме «точки легкого» не бывает. Отсутствие скольжения легкого не всегда характеризует пневмоторакс. Например, при обструкции дыхательных путей опухолью, инородным телом или при пневмонии, эмфиземе легких, при сращении листков плевры скольжение легкого может отсутствовать.
При сканировании в М-режиме признаком пневмоторакса является появление вместо признака «морской берег» признака штрих-кода (barcode sign), или «признака стратосферы» (рис. 8).
В случае наличия А-линий и отсутствия скольжения легкого или отсутствия В-линий специфичность диагностики пневмоторакса возрастает. Наоборот, в случае комбинации А-линий со скольжением легких и/или В-линиями пневмоторакс исключен.
Микробиологическая диагностика нозокомиальной пневмонии. Крайне важным является установление этиологии НП. Программа микробиологической диагностики включает исследование биологического материала из дыхательных путей, крови и, при наличии плеврита, плевральной жидкости.
Микробиологическое исследование крови является необходимым при обследовании пациента с подозрением на НП. До начала АБТ целесообразно взять два образца венозной крови из двух разных вен (предпочтительно в специальные коммерческие флаконы для крови). При этом следует строго соблюдать правила асептики и обрабатывать место венепункции 70% этиловым спиртом, затем 1–2% раствором йода (или другим йодсодержащим антисептиком), затем снова 70% этиловым спиртом.
Пункцию вены следует проводить только после полного высыхания антисептика, причем нельзя пальпировать ее после дезинфекции кожи. У взрослых пациентов необходимо отбирать не менее 20 мл крови на каждый образец, так как это приводит к существенному повышению частоты положительных результатов. К сожалению, чувствительность этого метода не превышает 25%, а специфичность ограничивается большой вероятностью того, что у госпитализированных пациентов (особенно тяжелобольных) могут иметь место многочисленные источники бактериемии. Соответственно, микроорганизмы, выделенные из крови, могут рассматриваться как возбудители НП лишь в тех случаях, если аналогичную микробиологическую «находку» удается обнаружить и при исследовании образцов из нижних отделов дыхательных путей (НОДП).
Микробиологическое исследование образцов клинического материала из НОДП следует проводить всем пациентам с НП. Известно, что диагностическая ценность исследования свободно откашливаемой мокроты (микроскопия окрашенных по Граму мазков, культуральное исследование) у пациентов без ИВЛ ограниченна, этот вид биологического материала является основным в микробиологических лабораториях.
Несмотря на относительно невысокую позитивную прогностическую ценность выделения какого-либо микроорганизма при исследовании мокроты, отрицательная прогностическая ценность исследования данного материала очень высока. Так, например, если при исследовании мокроты не выделена P. Aeruginosa, то с высокой долей вероятности этот микроорганизм не играет этиологической роли.
Обязательной является оценка пригодности образца мокроты до проведения культурального исследования. Мокрота считается удовлетворительной по качеству, если при микроскопии окрашенного по Граму мазка с увеличением × 100 обнаруживается более 25 нейтрофилов и менее 10 эпителиальных клеток в поле зрения.
Значение культурального исследования мокроты состоит и в выявлении резистентных штаммов вероятных возбудителей НП. Следует помнить, что даже при выделении из мокроты микроорганизмов могут возникнуть сложности в правильной интерпретации результата исследования. С целью разграничения колонизации и инфекции следует проводить критическую оценку этиологической значимости выделенных микроорганизмов, так как образцы мокроты часто контаминированы микрофлорой, колонизирующей ротоглотку и верхние дыхательные пути у госпитализированных пациентов.
Трахеальный аспират (ТА) обладает недостатками, присущими свободно откашливаемой мокроте. Но его ценность существенно возрастает при проведении совместного анализа данных микроскопии после окраски по Граму (наличие полиморфноядерных лейкоцитов, макрофагов, эпителиоцитов, микроорганизмов) и культурального исследования (рост микроорганизмов, которые присутствовали в мазке). Было показано, что правильная интерпретация результатов микроскопии ТА приводила к снижению неадекватного выбора эмпирической АБТ.
У интубированных пациентов с подозрением на НП наиболее доступным способом получения материала для микробиологического исследования является эндотрахеальная аспирация (ЭТА). Подобно исследованию мокроты у неинтубированных пациентов, ЭТА характеризуется ограниченной диагностической ценностью: при чувствительности, достигающей 38–82%, специфичность метода не превышает 72–85% [182]. В этой связи основное значение микробиологического исследования эндотрахеальных аспиратов, как и мокроты, состоит в исключении определенных видов возбудителей НП при отрицательных результатах исследования. Так, отсутствие Pseudomonas spp. в материале, полученном при ЭТА, указывает на крайне низкую вероятность синегнойной этиологии заболевания. При количественной оценке диагностически значимыми являются титры микробных тел ≥ 105 КОЕ/мл.
Роль инвазивных диагностических методов при обследовании пациентов с подозрением на НП остается противоречивой. При исследовании образца, полученного при проведении бронхоальвеолярного лаважа (БАЛ), можно судить о микробной обсемененности большого числа альвеол. Чувствительность и специфичность исследования образца БАЛ при титре микробных тел больше 104 КОЕ составляют 63–100 и 66–96% соответственно [99].
Определенной популярностью пользуется метод взятия материала из бронхов с помощью «защищенной» щетки (ЗЩ), которая предотвращает контаминацию микрофлорой верхних дыхательных путей. Диагностически значимым уровнем микробной обсемененности, разделяющим колонизацию и инфекцию, является титр ≥ 103 КОЕ/мл. При этом чувствительность и специфичность метода достигают 58–86 и 71–100% соответственно.
Очевидно, что роль и место неинвазивных (мокрота, ЭТА) и инвазивных (ЗЩ, БАЛ) диагностических методов должны определяться исходя из клинической целесообразности их применения и доступности. «Конечной точкой», определяющей диагностическую ценность неинвазивных и инвазивных методов, сравнительная характеристика которых представлена в табл. 9, являются результаты лечения. В этой связи важно подчеркнуть, что в настоящее время только в одном рандомизированном исследовании получены некоторые доказательства преимуществ использования инвазивных диагностических методов (ЗЩ и БАЛ) по сравнению с неинвазивной тактикой ведения пациентов.
Метаанализ 4 рандомизированных контролируемых исследований, включавших 628 пациентов, в которых определялась ценность инвазивных методов диагностики НПИВЛ, показал, что эти методы не влияют на летальность, но снижают частоту назначения АМП.
Согласно методическим указаниям МУ 4.2.2039–05 «Техника сбора и транспортирования биоматериалов в микробиологические лаборатории», пробу мокроты, полученную в результате глубокого кашля, а также эндотрахеальный аспират и пробу, полученную с помощью бронхоскопа, соби рают в специальный стерильный одноразовый контейнер с завинчивающейся крышкой или в специальным образом подготовленную стерильную стеклянную банку и немедленно доставляют в микробиологическую лабораторию [11]. При невозможности быстрой доставки контейнер с мокротой может храниться в холодильнике при температуре +2–8 °C не более 24 ч.
| Качественные методы | Комментарии | Количественные методы | Комментарии |
|---|---|---|---|
Культуральное исследование крови |
Проводится у всех пациентов с подозрением на НП |
Эндотрахеальная аспирация |
Диагностически значимый титр микробных тел ≥ 105 КОЕ/мл |
Свободно откашливаемая мокрота |
Обязательно проведение оценки качества мокроты |
Бронхоальвеолярный лаваж |
Диагностически значимый титр микробных тел ≥ 104 КОЕ/мл |
Трахеальный аспират |
Достоверность результатов повышается при совместной оценке данных микроскопии и культурального исследования |
«Защищенные» щетки |
Диагностически значимый титр микробных тел ≥ 103 КОЕ/мл |
Диагностический торакоцентез |
При наличии плеврального выпота с толщиной слоя свободно смещаемой жидкости на латерограмме > 10 мм или при тяжелом состоянии пациента |
Диагностический торакоцентез показан только при наличии плеврального выпота c толщиной слоя свободно смещаемой жидкости на латерограмме не менее 10 мм или при тяжелом состоянии пациента — прежде всего для дифференциальной диагностики эмпиемы плевры и парапневмонического выпота. Исследование плевральной жидкости должно включать в себя определение содержания белка, глюкозы, активности лактатдегидрогеназы, рН, подсчет форменных элементов крови, окраску по Граму, тест на кислотоустойчивость, микроскопию мазков с последующим культуральным исследованием.
Серологические исследования имеют ограниченную диагностическую ценность и, как правило, при обследовании пациентов с подозрением на НП не используются. Эти тесты, имеющие эпидемиологическое значение, в части случаев могут оказаться полезными в ретроспективной диагностике, например, легионеллезной инфекции.
Молекулярные методы исследования нативного клинического материала для этиологической диагностики НП в настоящее время большой роли не играют, однако имеют определенные перспективы в будущем при усовершенствовании существующих технологий.
Дифференциальная диагностика. Спектр заболеваний и состояний, с которыми следует проводить дифференциальную диагностику при подозрении на бактериальную нозокомиальную пневмонию, должен включать в себя как самые распространенные повреждения паренхимы легких (ТЭЛА, отек легких, ОРДС), так и специфические повреждения, особенно у пациентов групп высокого риска (например, при нейтропении или приеме системных глюкокортикостероидов).
При внезапном развитии/прогрессировании дыхательной недостаточности, появлении кашля и/или дискомфорта в грудной клетке первым этапом дифференциальной диагностики всегда должно быть исключение тромбоэмболии легочной артерии (ТЭЛА), для чего в большинстве случаев показано проведение КТ грудной клетки с контрастированием легочных артерий (КТ-ангиопульмонографии).
При подозрении на ТЭЛА при артериальной гипотензии и/ или шоке, а также высокой вероятности ТЭЛА без артериальной гипотензии и/или шока (см. табл. 10) следует немедленно выполнить КТ-ангиопульмонографию, при недоступности — ангиографию легочных артерий или сцинтиграфию легких, а при нетранспортабельности пациента — эхокардиографию [19]. При низкой или средней степени вероятности ТЭЛА следует измерить D-димер. Если он не повышен, то диагноз ТЭЛА исключен, если повышен, следует выполнить КТ-ангиопульмонографию [126].
Острый респираторный дистресс-синдром. Общими клиническими признаками этих состояний являются лихорадка, лейкоцитоз, наличие инфильтрации легочной ткани, нарушения оксигенации, гнойный бронхиальный секрет (гнойный трахеобронхит при ОРДС или гнойный секрет при пневмонии). Первый этап диагностики — фронтальная рентгенограмма органов грудной клетки. При выявлении двусторонних инфильтратов показано выполнение КТ легких. Для внелегочного (то есть не связанного с первичным повреждением легких, как при пневмонии или аспирации) ОРДС характерно наличие симметричной диффузной инфильтрации по типу «матового стекла», с вертикальным градиентом плотности и наличием консолидации в нижних (зависимых) отделах легких одновременно с участками нормально аэрированной или перераздутой легочной ткани в верхних (независимых) отделах [191], также характерен сетчатый рисунок, а иногда тракционная дилатация бронхов на фоне очагов по типу «матового стекла». Для поздних стадий ОРДС характерны сетчатый рисунок, участки «матового стекла» в сочетании с буллезными изменениями. При «легочном» ОРДС (вследствие первичной патологии легких — пневмонии, вирусной инфекции, ушиба легких) изменения в легких менее симметричны, характерно сочетание зон «матового стекла» и гравитационно-независимых участков консолидации.
Для нозокомиальной пневмонии характерны очаговые изменения по типу консолидации с симптомом воздушной бронхограммы, которые часто (в отличие от базальных ателектазов и ОРДС) локализованы в гравитационно-независимых участках легких (например, прикорневые, в определенных сегментах легких). Следует отметить, что нозокомиальная пневмония встречается примерно в 3 раза чаще, чем ОРДС [37], что несколько облегчает проблему дифференциальной диагностики.
Значительно сложнее диагностика нозокомиальной пневмонии у пациентов с ОРДС. Известно, что инфекция легких поражает примерно 34–70% больных с ОРДС, часто приводя к развитию сепсиса и синдрома полиорганной недостаточности (СПОН) [62]. Пациенты с ОРДС имеют более высокий риск развития легочных инфекций, поскольку альвеолярные макрофаги и полиморфноядерные лейкоциты у них имеют нарушенную фагоцитарную активность и сниженную способность увеличивать активность после ex vivo стимуляции продуктами бактерий [67].
Клинические критерии, обычно используемые для диагностики НПИВЛ (лихорадка, лейкоцитоз, гнойная мокрота, новые или персистирующие инфильтраты на рентгенограмме), почти всегда присутствуют у пациентов с ОРДС в течение большего периода времени их лечения в ОРИТ. Соответствующие пневмонии рентгенологические изменения трудно выявить на фоне двусторонней легочной инфильтрации [199; 217], при этом большинство больных с ОРДС имеет признаки синдрома системной воспалительной реакции [49] даже в отсутствие инфекции [189].
Так как клинические критерии НПИВЛ имеют недостаточную чувствительность и специфичность, микробиологические исследования играют важную роль в диагностике и дифференциальной диагностике [79]. Из-за высокой частоты колонизации бронхиального дерева у больных при проведении длительной ИВЛ необходимо использовать специальные методы взятия микробиологического материала из нижних дыхательных путей. Следует отметить необходимость исследования секрета нижних дыхательных путей обоих легких (двусторонний БАЛ с микроскопией мазков) [147]. При совместном использовании шкалы CPIS и микробиологических данных увеличивается точность диагностики НПИВЛ у больных с ОРДС [79].
Вероятный или возможный диагноз НПИВЛ у пациентов с ОРДС должен быть основан на наличии не менее трех из четырех критериев: лихорадка более 38,3 °С, лейкоцитоз более 10 тыс./мкл, увеличение количества или гнойности мокроты, появление локального инфильтрата на рентгенограмме.
Колонизация нижних дыхательных путей: выделение микроорганизмов из БАЛ в титре менее 104/мл вне зависимости от наличия клинических критериев НПИВЛ или выделение микроорганизмов из БАЛ в титре 104/мл и более в отсутствие вероятных клинических критериев возможной или вероятной НПИВЛ.
Инфекция нижних дыхательных путей: рост микроорга- низмов БАЛ 104/мл и более и наличие клинических критериев возможной или вероятной НПИВЛ.
Также можно диагностировать НПИВЛ у пациентов с ОРДС, используя критерии ухудшения общего состояния за 48 ч до получения положительных результатов микробиологического исследования: увеличение температуры более чем на 1 °С от исходной, увеличение лейкоцитоза на 20% и более, увеличение количества и гнойности мокроты, новые инфильтраты на рентгенограмме, снижение индекса оксигенации на 20% и более, развитие септического шока.
Антимикробная терапия по поводу НПИВЛ должна быть начата или модифицирована при следующих условиях: выделение микроорганизмов из БАЛ в титре 104/мл и более при наличии вероятных критериев НПИВЛ, а также, независимо от этого, при клинике тяжелого сепсиса или септического шока.
Для дифференциальной диагностики ОРДС и НПИВЛ можно рекомендовать следующий алгоритм.
-
Если произошло снижение индекса PaO2/FiO2, выполнить обзорную рентгенографию органов грудной клетки.
-
Если на рентгенограмме выявлены локальные затемнения, вероятен диагноз НПИВЛ.
-
Если на рентгенограмме выявлены диффузные инфильтраты или обогащение легочного рисунка, выполняют КТ органов грудной клетки при РЕЕР 5 см вод. ст. [170].
-
Если на КТ органов грудной клетки выявлены диффузные инфильтраты, соответствующие ОРДС, то необходимо выполнить КТ при уровне экспираторного давления в 45 см вод. ст. Выполнение КТ при двух уровнях РЕЕР позволит прогнозировать эффект маневров открытия альвеол и РЕЕР — при уменьшении невентилируемых зон показаны маневры окрытия альвеол, настройка РЕЕР [170].
-
Если на КТ грудной клетки выявлены локальные инфильтраты, то наиболее вероятным диагнозом будет нозокомиальная пневмония, связанная с проведением искусственной вентиляции легких (НПИВЛ).
-
Провести микробиологическое исследование секрета нижних дыхательных путей (бронхоальвеолярный лаваж) с обязательным окрашиванием по Граму, оценить полученные данные в соответствии с клиническими критериями НПИВЛ и критериями колонизации и инфекции нижних дыхательных путей.
Отек легких. Дифференциальная диагностика нозокомиальной пневмонии и отека легких в первую очередь основывается на анамнестических данных, диагнозе основного заболевания и его осложнениях (острый инфаркт миокарда, перегрузка жидкостью при терминальной хронической почечной недостаточности, обструкция дыхательных путей инородным телом и так далее).
Быстро возникающий отек легких (например, при отрыве хорды митрального клапана или дисфункции папиллярных мышц, острой левожелудочковой недостаточности) характеризуется специфической КТ-картиной в виде «крыльев летучей мыши» — диффузные изменения по типу «матового стекла», ретикулярный рисунок с негравитационно-зависимым градиентом плотности ткани, когда плотность ткани больше в прикорневых отделах легких [95]. Такой тип отека легких встречается не более чем в 10% случаев.
Чаще для отека легких характерны изменения, типичные для ОРДС. Отличия могут быть связаны с причиной, вызвавшей отек легких, — острой сердечной недостаточностью, легочной гипертензией, отеком легких на фоне ХОБЛ, отеком легких на фоне обострения бронхиальной астмы, отеком легких после утопления и так далее. Для дифференциальной диагностики отека легких и ОРДС (кроме данных об анамнезе и диагнозе) следует использовать эхокардиографию с оценкой локальной и глобальной сократимости левого желудочка, легочной гипертензии, состояния клапанного аппарата. При этом следует учитывать, что и при ОРДС возможна легочная гипертензия и снижение фракции выброса.
Ателектазы — наиболее распространенная причина острой дыхательной недостаточности, требующая дифференцировки с нозокомиальной пневмонией. Факторы риска возникновения ателектазов приведены ниже [7].
Следует отметить быстроту возникновения ателектазов при операциях на верхнем этаже брюшной полости и при торакотомии: они возникают уже через 15 мин после индукции анестезии, развиваются как при спонтанной вентиляции, так и при ИВЛ, сохраняясь в течение 4 суток послеоперационного периода.
Дифференциальная диагностика нозокомиальной пневмонии и ателектазов может быть затруднена, так как после оперативных вмешательств вероятно возникновение лихорадки, лейкоцитоза, острой дыхательной недостаточности, обострение хронического бронхита (ХОБЛ) с выделением гнойной мокроты. Следует учесть временной фактор: нозокомиальная пневмония, как правило, развивается позже — через несколько суток после операции, тогда как ателектазы проявляются чаще в раннем послеоперационном периоде.
При проведении длительной ИВЛ для дифференциальной диагностики ОРДС, НПИВЛ и ателектазов необходимо выполнение КТ легких в сочетании с микробиологическим исследованием секрета нижних дыхательных путей и оценкой по шкале CPIS.
При соблюдении всех правил дифференциальной диагностики ОРДС, НПИВЛ и ателектазы часто выявляют одновременно в различных сочетаниях. Так, в исследовании было установлено, что при проведении КТ легких у пациентов с нарушением оксигенации и двусторонними инфильтратами на фронтальной рентгенограмме на фоне длительной ИВЛ ателектазы в дорсальных отделах были отмечены у большинства пациентов (82,7%), а сопутствующая им НПИВЛ — в 77,9% случаев, при этом ОРДС сопутствовал не более чем в 25% случаев [37].
Дифференциальная диагностика нозокомиальной пневмонии у иммунокомпрометированных пациентов. У иммунокомпрометированных пациентов в спектр заболеваний, с которыми следует проводить дифференциальную диагностику при подозрении на нозокомиальную пневмонию, обязательно следует включать микозы легких, вирусные пневмонии, пневмоцистную пневмонию и туберкулез.
Алгоритм дифференциальной диагностики нозокомиальной пневмонии у иммунокомпрометированных пациентов включает в себя следующее.
-
Выявление факторов риска иммунодефицита: длительный прием кортикостероидов, иммуносупрессивная терапия, состояния после трансплантации органов, онкогематологические заболевания, нейтропения и агранулоцитоз. У больных, длительно получавших иммуносупрессивную терапию препаратами, подавляющими Т-клеточный иммунитет (циклоспорин, глюкокортикоиды, флударабин и т.д.), велика вероятность цитомегаловирусной и/или пневмоцистной пневмонии. При поражении легких в период миелотоксического агранулоцитоза часто развивается бактериальная и/или грибковая пневмония. Если изменения в легких возникают или прогрессируют, несмотря на лечение антибиотиками, то следует исключить инвазивный микоз.
-
Компьютерную томографию легких следует выполнять всем иммунокомпрометированным пациентам с подозрением на нозокомиальную пневмонию. Иногда характерные изменения легких, выявляемые при КТ, являются единственным признаком, позволяющим заподозрить этиологию легочного поражения, например при инвазивном аспергиллезе легких (симптом «серпа», симптом «ореола», кавитация), пневмоцистной пневмонии, и начать этиотропную терапию еще до получения результатов микробиологического исследования. Рентгенография легких малоинформативна у этой категории больных. У 18% пациентов с пневмонией, резвившейся на фоне агранулоцитоза, при рентгенографии не выявляют изменений в легких [97]. С помощью рентгенографии часто невозможно выявить изменения в легких, характерные для инвазивного аспергиллеза легких, пневмоцистной, вирусной пневмонии.
-
Микробиологические исследования — только бронхоальвеолярный лаваж [45]. При выполнении фибробронхоскопии у иммунокомпрометированных больных принципиальное значение имеет выполнение именно бронхоальвеолярного лаважа, а не смыва с трахеи и бронхов, поскольку многие из возбудителей, вызывающих поражение легких у этих больных, находятся в альвеолярных макрофагах и не могут быть выявлены при смыве из трахеи и бронхов. Лаваж выполняют путем заклинивания фибробронхоскопом долевого или сегментарного бронха наиболее пораженного участка легкого (устанавливается по данным компьютерной томографии) и дробным введением с последующей аспирацией одноразовыми шприцами по 20 мл 0,9% раствора натрия хлорида, подогретого до 37 °С. Суммарно вводят 160–200 мл, обратный возврат лаважной жидкости составляет, как правило, 40–60% от введенного объема. В этой жидкости должно содержаться не более 5% эпителиальных клеток, иначе это будет не лаваж, а смыв со слизистых. Основные клетки в лаважной жидкости — макрофаги (в норме до 90%), нейтрофилы (в норме до 1%) и лимфоциты (в норме до 8%). При посеве лаважной жидкости на количественную культуру выявляется рост бактерий. Важно отметить, что в отличие от иммунокомпетентных больных, у которых пороговой величиной для диагностики пневмонии служит выявление бактериальных патогенов 104 КОЕ/мл, у иммунокомпрометированных больных выявление высокопатогенных штаммов даже в более низком титре (102– 103 КОЕ/мл) может быть показанием к началу соответствующей антибактериальной терапии [5].
-
Окраска мазков, полученных при помощи БАЛ. При микроскопии проводят окрашивание по Граму и Романовскому— Гимзе (выявление бактерий и пневмоцист), окрашивание калькофлуором белым (выявление грибов), по Цилю—Нильсену (выявление микобактерий туберкулеза, нокардий). У пациентов с подозрением на инвазивный аспергиллез, если при бронхоскопии обнаруживаются на слизистой трахеи и бронхов белые, а чаще желтые бляшки, с помощью «защищенной» щетки берут с этих бляшек соскоб, который затем наносят на стерильные предметные стекла. Окраска калькофлуором белым позволяет в течение нескольких часов выявить септированный мицелий, свидетельствующий об аспергиллезном поражении [45].
В целом у 62% иммунокомпрометированных больных выявляют бактериальные пневмонии; вторым по частоте является инвазивный аспергиллез легких; примерно у 10% больных обнаруживают пневмоцистные пневмонии. В то же время у 38% больных, несмотря на все проведенное обследование, установить этиологию нозокомиальной пневмонии не удается, и терапия носит эмпирический характер. При выборе антимикробных препаратов учитывают наличие факторов риска, а также клиническую и рентгенологическую картину [1].
Микозы легких. Инвазивные микозы все чаще становятся причиной инфекции легких в ОРИТ. Наиболее частой причиной является инвазивный аспергиллез. Среди пациентов в ОРИТ наиболее часто инвазивный аспергиллез встречается у иммунокомпрометированных больных (70% всех случаев среди больных в ОРИТ) [201].
Факторы риска инвазивного аспергиллеза [82]:
-
высокий риск — нейтропения (менее 0,5 × 109/л), онкогематологические больные, а также больные, перенесшие трансплантацию гемопоэтических стволовых клеток, солидных органов;
-
средний риск — длительная терапия глюкокортикостероидами, ХОБЛ, злокачественные новообразования солидных органов, цирроз печени, ВИЧ-инфекция, трансплантация легких с антифунгальной профилактикой, терапия иммуносупрессорами;
-
низкий риск — ожоги тяжелой степени, трансплантация солидных органов, терапия глюкокортикостероидами менее 7 суток, длительность лечения в ОРИТ больше 21 суток, нутритивная недостаточность, утопление, операция на сердце, СПОН, грипп А (H1N1).
На сегодняшний день основной причиной инвазивного аспергиллеза в ОРИТ является ХОБЛ с длительной терапией глюкокортикостероидами (до 50% всех случаев) [92].
Частота инвазивного аспергиллеза у онкогематологических больных ОРИТ достигает 24% [1].
Для дифференциальной диагностики легочного аспергиллеза с нозокомиальной пневмонией бактериальной этиологии у пациентов групп риска следует использовать тест на галактоманнан (компонент клеточной стенки Aspergillus spp.) в жидкости БАЛ и сыворотке крови (Platelia Aspergillus test), а также КТ легких. Диагностически значимым является индекс более 0,5 в двух последовательно взятых образцах сыворотки и более 1,0 в жидкости БАЛ [9; 45].
Наиболее часто у пациентов в ОРИТ при микробиологическом исследовании секрета дыхательных путей обнаруживают дрожжеподобные грибы Candida spp., но инвазивный кандидоз легких возникает крайне редко. Эта колонизация не является доказательством инфекции легких [148]. Первичная кандидозная пневмония встречаются крайне редко и только у пациентов с глубокой нейтропенией. При отсутствии нейтропении диагноз кандидозной пневмонии следует сразу исключить. Антикандидозная терапия не требуется вне зависимости от количества полученных положительных микробиологических данных и типа взятия микробиологического материала из дыхательных путей [167]. Для подтверждения диагноза необходима биопсия легких и демонстрация микозной инвазии, так как врожденный иммунитет у человека делает его практически невосприимчивым к легочной инвазии грибков рода Candida. Вторичная кандидозная пневмония возникает у 15–30% пациентов с острым диссеминированным кандидозом, то есть кандидемией в сочетании с выявлением Candida spp. при гистологическом или микробиологическом исследовании материала из глубоких тканей (включая подкожную клетчатку) двух и более локализаций [6].
Мукормикозы (роды Mucor, Rhizopus и Lichteimia) встречаются очень редко и практически только у пациентов с нейтропенией из группы высокого риска аспергиллеза, достигая 1,5% у пациентов после трансплантации легких и печени, особенно после длительной терапии вориконазолом [172]. Антифунгальная терапия требуется при выделении возбудителя у группы высокого риска и соответствующей картине на КТ легких; для подтверждения необходима биопсия легких [193].
Пневмоцистная пневмония (возбудитель — Pneumocystis jirovecii, ранее Pneumocystis carinii) возникает при иммунодефицитах, чаще при нарушениях клеточного иммунитета (например, у пациентов с ВИЧ-инфекцией) со снижением CD4+ менее 200 клеток/мкл и особенно при снижении их менее 100 клеток/мкл, при терапии иммуносупрессорами, подавляющими клеточный иммунитет (циклоспорин, глюкокортикоиды). При ВИЧ-инфекции пневмоцистная пневмония обычно возникает во внебольничных условиях, подостро, иногда в течение месяца, с постепенным нарастанием сухого кашля и одышки с последующим развитием ОДН.
У пациентов без ВИЧ-инфекции (например, после трансплантации солидных органов) пневмоцистная пневмония может развиваться как острая нозокомиальная инфекция с быстрым наступлением острой дыхательной недостаточности. Высокий риск пневмоцистной пневмонии у больных без ВИЧ-инфекции (т.е. более, чем у 3,5% больных) отмечен при остром лимфобластном лейкозе, длительном снижении уровня CD4 < 200 клеток /мкл, длительном приеме глюкокортикостероидных гормонов; умеренный риск — при курсах противоопухолевой химиотерапии типа R-CHOP, BEACOPPesc, длительной нейтропении, остром миелоидном лейкозе, терапии высокими дозами цитарабина [158].
Среди онкогематологических больных пневмоцистная пневмония является причиной острой дыхательной недостаточности в 13% случаев [1].
Для диагностики применимы три основных метода.
-
КТ-диагностика, признаки которой неспецифичны — диффузное изменение плотности легочной ткани по типу «матового стекла» в сочетании утолщением междольковых перегородок при прогрессировали заболевания (симптом «сумасшедшей булыжной мостовой») и участками консолидации [111].
-
Выделение микроорганизма из жидкости, полученной при БАЛ. Наиболее доступным методом является выявление пневмоцист в мазках, окрашенных по Романовскому—Гимзе. Недостаток метода — это интенсивная окраска не только микроорганизмов, но и всего мазка, на фоне которого можно не заметить Pneumocystis jirovecii. Для выявления P. Jirovecii используется также импрегнация метенамин-серебряным нитратом по Гомори или серебром по Грокотту, толуидиновым синим, окраска по Граму или реактивом Шифа. Однако все эти виды окраски низкоспецифичны и могут не выявить пневмоцисты при небольшом количестве микроорганизмов в материале.
-
Моноклональные антитела к P. Jirovecii, выделенным из секрета нижних дыхательных путей, которые имеют чувствительность более 90% [56].
Вирусные пневмонии. У иммунокомпрометированных пациентов следует проводить дифференциальную диагностику с пневмониями, вызванными различными вирусами. К таким вирусам относят прежде всего вирусы гриппа, аденовирус, респираторно-синцитиальный вирус, вирус парагриппа, вирус кори и группу Herpesviridae. Большинство вирусов, вызывающих пневмонии, обладает прямым цитопатическим эффектом на альвеолярный и бронхиальный эпителий, следствием чего являются геморрагическое пропитывание альвеол, некрозы, бронхиты и бронхиолиты. Дифференциальная диагностика прежде всего включает эпидемиологический анамнез и клиническую картину.
Для уточнения диагноза обязательны специальные специфические тесты ПЦР-диагностики и КТ легких. Следует отметить, что при ПЦР-диагностике часто возникают ложноотрицательные результаты, а КТ легких не имеет специфичных симптомов не только для разных типов вирусов, но и для диффузного повреждения альвеол (ОРДС, пневмоцистная пневмония, микозы легких).
КТ-признаки вирусных пневмоний представлены в табл. 10.
Туберкулез легких не является эксклюзивной причиной нозокомиальной легочной инфекции. Так, в одном исследовании в Малайзии Mycobacterium tuberculosis выделены у 4,9% пациентов, госпитализированных с тяжелой внебольничной пневмонией [128].
| Вирус | Симптом «матового стела» и консолидация | Узелки, микроузелки и симптом «дерева в почках» | Утолщение междольковых перегородок | Утолщение стенок бронхов и бронхиол |
|---|---|---|---|---|
Грипп А сезонный |
+++ |
+++ |
||
Птичий грипп А(H5N1) |
+++ |
+ |
||
Свиной грипп А(H1N1) |
+++ |
|||
Парагрипп 1–4 |
+++ |
+++ |
||
Респираторно-синцитиальный вирус |
+++ |
+++ |
+++ |
|
Корь |
+++ |
+++ |
++ |
++ |
Хантавирус |
+++ |
++ |
+++ |
|
Коронавирус (ТОРС) |
+++ |
+++ |
||
Аденовирус |
++ |
+++ |
||
Вирус простого герпеса |
+++ |
++ |
||
Вирус Varicella zoster |
++ |
+++ |
||
Цитомегаловирус |
+++ |
++ |
||
Вирус Эпштейна— Барр |
+++ |
+ |
+ |
Первым дифференциально-диагностическим признаком бактериальной пневмонии и туберкулеза легких является клиническая картина. Длительность симптомов более 2 недель, ночная потливость, инфильтрация верхних долей легких, лейкоциты менее 12 тыс./мкл в сочетании с лимфопенией и моноцитозом характерны для БК+ (туберкулеза легких). Кроме того, при легочном туберкулезе в отличие от бактериальной пневмонии быстрого регресса клинических симптомов не происходит даже при адекватном режиме антимикробной терапии. Также для туберкулеза легких характерны низкие концентрации С-реактивного белка и прокальцитонина [188].
Проводить дифференциальную диагностику НП и туберкулеза следует у тех же категорий пациентов, у которых следует исключать микозы легких, вирусные пневмонии и пневмоцистную пневмонию (у ВИЧ-инфицированных, принимающих иммуносупрессоры, кортикостероиды, при нейтропении). Стандартным тестом для скрининга туберкулеза является кожный туберкулиновый тест (реакция Манту), но он не может использоваться для диагностики болезни, так как чувствительность туберкулинового теста составляет в среднем 77%, а специфичность среди привитых вакциной BCG (большинство в РФ) — от 40 до 70% [164]. Низкая специфичность кожного туберкулинового теста объясняется большим количеством антигенов в туберкулине, не имеющих отношения к M. Tuberculosis: антигены M. Bovis (использующиеся для создания вакцины BCG) и антигены нетуберкулезных микобактерий (NTM). Более точными являются современные методы, основанные на оценке клеточного иммунного ответа, в которых используется определение γ-интерферона, высвобождаемого сенсибилизированными Т-клетками, стимулированными специфическими антигенами M. Tuberculosis (Interferon-γ-Release Assays — IGRAs) — Quantiferon-TB Gold, T-SPOT.TB. Чувствительность этих тестов от 73 до 83% в зависимости от типа теста, а специфичность в популяции привитых вакциной BCG — 94–100%. В РФ разработан внутрикожный диагностический тест из специфических антигенов M. Tuberculosis (Диаскинтест), методика применения которого аналогична реакции Манту, а специфичность у привитых вакциной BCG достигает 100%.
Чувствительность микроскопии образцов мокроты на БК очень низка (от 20 до 80% в зависимости от опыта исследователя и выделяемости микобактерий, при открытых формах туберкулеза чувствительность достигает 80%), требуются не менее двух повторных проб [197]. При получении положительного результата микроскопии мазков на БК для подтверждения M. Tuberculosis и выявления резистентности к рифампицину следует использовать ПЦР-методы диагностики (Xpert MTB/RIF).
КТ-признаки специфического повреждения легких для дифференциальной диагностики нозокомиальной инфекции легких у иммунокомпрометированных пациентов представлены в табл. 11.
Легионеллезная пневмония. К факторам риска развития легионеллезной пневмонии относят возраст старше 40 лет, мужской пол (соотношение заболевших болезнью легионеров мужчин и женщин колеблется от 2:1 до 7:1), онкологические заболевания, болезни системы крови, иммуносупрессивное лечение (особенно глюкокортикостероидными гормонами), диабет, курение, хроническую почечную недостаточность [25].
Клиническая диагностика легионеллеза затруднена, поскольку отсутствуют патогномоничные симптомы. Для начала заболевания характерны интенсивная головная боль, озноб, быстрое повышение температуры до фебрильных цифр.
| Нозологическая форма | Признак | Чувствительность, % | Специфичность, % |
|---|---|---|---|
Инвазивный аспергиллез |
Рассеянные или субплевральные узелки >10 мм |
95,2 |
96,7 |
Милиарный туберкулез |
Рассеянные или центрилобулярные узелки 1–4 мм с симптомом «дерева в почках» |
90 |
97 |
Пневмоцистная пневмония |
Диффузные или очаговые тени по типу «матового стекла», утолщение междольковых перегородок и/или очаги консолидации с воздушной бронхограммой |
86,7 |
96,8 |
Бактериальная пневмония |
Участки консолидации с воздушной бронхограммой, гидроторакс, участки «матового стекла» или центрилобулярные очаги |
84,5 |
93,8 |
Почти у 2/3 пациентов лихорадка превышает 38,8 °С, а у 1/3 пациентов — до 40 °С и сопровождается ознобом. Поражение легких при болезни легионеров характеризуется быстрым развитием пневмонии, в большинстве случаев развивается острая дыхательная недостаточность. Со стороны сердечнососудистой системы, помимо септического шока, для легионеллеза характерна относительная брадикардия или симптом Фаже — несоответствие между выраженностью лихорадки и частотой сердечных сокращений. При болезни легионеров в 15–25% случаев наблюдаются рвота, боли в животе и диарея, а в кале выявляют легионеллы. Неврологические нарушения встречаются почти у 50–60% пациентов с болезнью легионеров. Выявляют различные нарушения сознания: от дезориентации в месте и времени до комы. Встречаются фокальные неврологические нарушения, сенсорный дефицит, миоклонус, дизартрия, судороги, мозжечковые и экстрапирамидальные расстройства, менингоэнцефалит. Причинами развития неврологических нарушений могут быть прямая инвазия легионелл в центральную нервную систему, воздействие токсина легионелл на нервную систем, метаболические расстройства (в частности, гипонатриемия). Острая почечная недостаточность развивается в 9–15% случаев болезни легионеров. При легионеллезе нет специфических лабораторных изменений [25].
Для легионеллезной пневмонии характерны рентгенологические признаки тяжелой атипичной бактериальной плевропневмонии, не имеющей патогномоничных признаков, отличающих ее от других атипичных пневмоний. При компьютерной томографии выявляют обширные зоны консолидации легочной ткани с наличием перифокальной альвеолярно-интерстициальной инфильтрации, вовлечение в патологический процесс нижней доли, двустороннее поражение легких, быстрое распространение поражения на смежные участки легких. Лобарная консолидация более характерна для тяжелого течения болезни легионеров у иммунокомпрометированных больных, в то время как изменения по типу «матового стекла» свидетельствуют о более легком течении заболевания и чаще выявляются у иммунокомпетентных больных. Абсцедирование — редкое осложнение легионеллеза легких [2].
Специфическая диагностика легионеллеза включает в себя обнаружение антигенов легионелл в моче, а также выявление легионелл в жидкости бронхоальвеолярного лаважа. Чувствительность метода обнаружения растворимого антигена L. Pneumophila серогруппы 1 в моче составляет 70%, специфичность — 100%. Однако этот метод выявляет только серотип 1, в то время как нозокомиальный легионеллез в большинстве случае вызывается другими серотипами. Диагноз легионеллеза может быть установлен по четырехкратному и более нарастанию титра специфических антител к L. Pneumophila серогруппы 1. Выявление легионелл в жидкости бронхоальвелярного лаважа может быть выполнено с помощью реакция прямой иммунофлюоресценции (чувствительность 75%, специфичность 95%), выделение культуры легионелл из жидкости БАЛ или ткани легкого на угольно-дрожжевом агаре (чувствительность 80%, специфичность 100%) или же выявление их методом полимеразной цепной реакции [25].