Национальное руководство по радионуклидной диагностике/ под ред. Ю.Б. Лишманова, В.И. Чернова. – В 2-х т. – Томск : STT, 2010. – Т. 2. – 418 с. |
NATIONAL GUIDE ON RADIONUCLIDE
DIAGNOSTICS
Volume 2
Interregional Public Organization for Assistant to Development of Nuclear Medicine "SOCIETY OF NUCLEAR MEDICINE"

NATIONAL GUIDE ON RADIONUCLIDE DIAGNOSTICS
Volume 2
Edited by Yu.B. Lishmanov and V.I. Chernov

Тоmsк 2010
Межрегиональная общественая организация содействия развитию ядерной медицины "ОБЩЕСТВО ЯДЕРНОЙ МЕДИЦИНЫ"

НАЦИОНАЛЬНОЕ РУКОВОДСТВО ПО РАДИОНУКЛИДНОЙ ДИАГНОСТИКЕ
Том 2
Под редакцией Ю.Б. Лишманова, В.И. Чернова

Томск 2010
УДК 615.849.1 + 616-073.916(075.8)
Н35
Н35 |
Национальное руководство по радионуклидной диагностике / под ред. Ю.Б. Лишманова, В.И. Чернова. – В 2-х т. – Томск : STT, 2010. – Т. 2. – 418 с. ISBN 980-5-93629-427-3 Руководство подготовлено коллективом ведущих специалистов России в области ядерной медицины. В нем подробно изложены фундаментальные основы гамма-сцинтиграфии и позитронной эмиссионной компьютерной томографии (ПЭТ), общие и частные вопросы радионуклидной диагностики, определены показания к выполнению того или иного метода радиоизотопного исследования, варианты трактовки результатов сцинтиграфии и ПЭТ, использования методов радионуклидной индикации для выбора тактики проводимого лечения, оценки его результатов и анализа прогностической значимости получаемой информации. В руководстве дается исчерпывающая характеристика радионуклидных индикаторов для диагностических исследований. Показана роль и место гамма-сцинтиграфии и ПЭТ в кардиологии, онкологии, пульмонологии, эндокринологии, гастроэнтерологии, сосудистой хирургии, гинекологии, сексопатологии, неврологии, психиатрии, а также при диагностике воспалительных процессов. В основе настоящей книги легли приоритетные работы авторов и обобщенный мировой опыт ядерной медицины. Для лучевых диагностов, кардиологов, онкологов, пульмонологов, эндокринологов, неврологов, гастроэнтерологов, хирургов, гинекологов, сексопатологов, психиатров и врачей других медицинских специальностей. |
|
УДК 615.849.1 + 616-073.916(075.8) |
||
Издано при участии: НИИ кардиологии СО РАМН НТЦ "Амплитуда" ООО "Томскинтерсервис" ОАО В/О "Изотоп" ООО "Сименс" ООО "ДжиИ Хелскеа Россия-СНГ" |
||
|
||
ISBN 980-5-93629-427-3 |
© Ю.Б.Лишманов, В.И.Чернов, 2010 © Оформление. STTTM, 2010 |
|
2.9.2. РАДИОНУКЛИДНАЯ ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ
Паращитовидные железы (ПЩЖ) являются жизненно важными органами. Их функция состоит в продуцировании и секреции паратиреоидного гормона (ПТГ) – одного из основных регуляторов обмена кальция и фосфора. Обычно у человека имеются две пары ПЩЖ (верхняя и нижняя), которые располагаются на задней поверхности щитовидной железы около верхнего и нижнего полюсов, вне ее капсулы (рис. 2-9-2-1). Однако число и локализация ПЩЖ могут варьировать: у 5% пациентов обнаруживаются более 4, а у других 5% – только 3 железы. Кроме того, ПЩЖ могут располагаться в ткани щитовидной и вилочковой желез, в переднем и заднем средостении, в перикарде, позади пищевода, в области бифуркации сонной артерии (рис. 2-9-2-1) [8]. Верхние ПЩЖ имеют форму уплощенного овоида, нижние – шаровидную. Их размеры составляют: продольные примерно 4–6 мм, поперечные – 1,5–3 мм, общая масса от 0,05 до 0,5 г. Кровоснабжение ПЩЖ осуществляется в основном ветвями нижней щитовидной артерии, венозный отток происходит через вены щитовидной железы, пищевода и трахеи. Паренхима ПЩЖ состоит их паратиреоцитов, которые формируют гроздья, тяжи и скопления [1].

Паращитовидные железы секретируют ПТГ в пульсирующем режиме, наиболее интенсивно в ночные часы. Так, через 3–4 ч от начала ночного сна содержание ПТГ в крови в 2,5–3 раза превышает средний дневной уровень. Главной функцией ПТГ является поддержание гомеостаза кальция. В свою очередь, кальций сыворотки крови является основным регулятором секреции ПТГ (снижение уровня кальция стимулирует, а повышение – подавляет секрецию ПТГ), т.е. регуляция осуществляется по принципу обратной связи. Основными мишенями ПТГ являются почки и кости скелета, однако известно влияние ПТГ на адсорбцию кальция в кишечнике, толерантность к углеводам, уровень липидов в сыворотке крови и т.д. [1]. Основными эффектами влияния ПТГ на кости скелета являются: стимуляция роста остеокластов и усиление процессов резорбции кальция из костей.
Наиболее важным воздействием ПТГ на почки является его способность уменьшать реабсорбцию фосфора, увеличивая фосфатурию. Одновременно ПТГ несколько увеличивает суммарную реабсорбцию кальция в почечных канальцах, снижая, соответственно, клиренс кальция с мочой, а также уменьшает канальцевую реабсорбцию натрия и его бикарбоната, что объясняет развитие ацидоза при гиперпаратиреозе.
Гиперпаратиреоз (ГПТ, фиброзно-кистознаая остеодистрофия, болезнь Реклингхаузена) – заболевание, связанное с гиперпродукцией паратиреодного гормона (ПТГ), продуцируемого паращитовидными железами (ПЩЖ) [1]. Диагноз ГПТ ставится на основе обнаружения гиперкальцемии и высокого уровня ПТГ в сыворотке крови. Основным способом лечения ГПТ является, как правило, хирургическое вмешательство – удаление одной или нескольких аденом ПЩЖ. Различное анатомическое расположение желез приводит к затруднениям в определении места оперативного вмешательства, особенно в тех случаях, когда имеются эктопические очаги, или пациент ранее уже перенес операцию на шее. Для визуализации источника аномальной продукции ПТГ у пациентов с гиперпаратиреозом показано проведение сцинтиграфии паращитовидных желез.
Гиперпаратиреоз может быть первичным, вторичным и третичным. Причиной гиперсекреции ПТГ при первичном гиперпаратиреозе являются:
Вторичный гиперпаратиреоз наблюдается при хронической почечной недостаточности, а также при хронической гипокальцемии вледствие заболеваний желудочно-кишечного тракта с нарушением всасывания (синдром мальабсорбции). Это приводит к длительной гипокальцемии, в результате чего развивается компенсаторная гиперплазия ПЩЖ.
Третичный гиперпаратиреоз связан с развитием аденомы ПЩЖ и ее автономным функционированием в условиях длительного существования вторичного гиперпаратиреоза. При первичном и третичном гиперпаратиреозе происходит нарушение обратной связи между уровнем кальция в сыворотке крови и избыточной секрецией ПТГ [1].
Прямым и наиболее информативным методом диагностики ГПТ является определение в крови уровня ПТГ, который при ГПТ всегда повышен. Первичный ГПТ протекает с увеличением содержания ПТГ в 8–12 раз относительно верхней границы нормы и достигает 5–8 нг/ мл и более.
Кроме того, для диагностики ГПТ применяют функциональные тесты, позволяющие оценить степень автономии функционирования ПЩЖ. Большинство из них у здоровых людей вызывают повышение уровня ПТГ в крови, а при наличии аденомы существенно не изменяют и без того повышенную активность секреции ПТГ. Наиболее известны следующие функциональные тесты [1]:
-
а) с инсулиновой гипогликемией – внутривенное введение инсулина в дозе 0,05 ЕД/кг вызывает в течение 15 мин повышение уровня ПТГ до 130% по сравнению с его исходным уровнем;
-
б) с адреналином, который в дозах 2,5–10 мкг/мин повышает уровень ПТГ;
-
в) с секретином, после инъекции которого у здоровых людей резко повышается уровень ПТГ, но не изменяется содержание кальция в крови, повидимому, в связи с кратковременностью действия введенного препарата;
-
г) с кальцитонином – назначение его:
-
у здоровых людей повышает уровень ПТГ и снижает содержание кальция;
-
при первичном ГПТ повышает уровень ПТГ и снижает (но не до нормы) содержание кальция (однако при наличии автономной аденомы ПЩЖ и резко выраженном исходном повышении ПТГ уровень последнего не изменяется);
-
при гиперкальциемии другой этиологии не влияет на содержание ПТГ в крови.
-
Сцинтиграфия паращитовидных желез
Для определения локализации аденомы ПЩЖ у пациентов с первичным гиперпаратиреоидизмом можно использовать комбинированную двуизотопную сцинтиграфию с Na99mТсO4 и 201Tl-хлоридом.
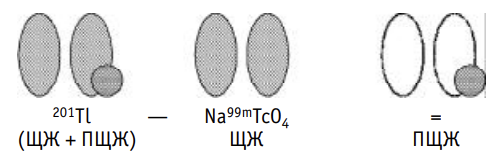
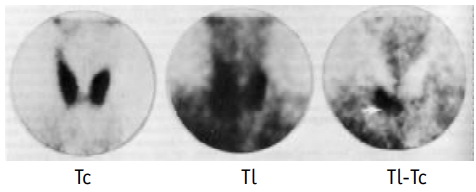
Принцип метода заключается в том, что как щитовидная железа, так и ПЩЖ накапливают таллий, тогда как технеций аккумулируется только в щитовидной железе. Обычно вначале проводят исследование с 201Tl-хлоридом по причине меньшей энергии его излучения по сравнению с технецием. Затем выполняют исследование с Na99mТсO4, после чего из первого изображения вычитают второе (рис. 2-9-2-2, 2-9-2-3). Оставшаяся после вычитания область накопления РФП представляет собой аденому ПЩЖ. Протокол исследования представлен в таблице 2-9-2-1.
| Радиофармпрепарат | 99mТс-пертехнетат и 201Tl | 99mТс-МИБИ |
|---|---|---|
Вводимая активность |
80 МБк (2 мКи) каждого РФП |
925 МБк (25 мКи) |
Лучевая нагрузка |
||
Печень |
12 мГр (1,2 рад) |
5 мГр (0,5 рад) |
Почки |
24 мГр (2,4 рад) |
17 мГр (1,7 рад) |
Сердце |
10 мГр (1 рад) |
5 мГр (0,5 рад) |
Кишечник |
19 мГр (1,9 рад) |
45 мГр (4,5 рад) |
Щитовидная железа |
18 мГр (1,8 рад) |
6 мГр (0,6 рад) |
Яичники |
10 мГр (1 рад) |
13 мГр (1,3 рад) |
Все тело |
4 мГр (0,4 рад) |
5 мГр (0,5 рад) |
Эквивалентная доза облучения |
4,6 мЗв |
5 мЗв |
Подготовка пациента |
Как для сцинтиграфии щитовидной железы |
Специфической подготовки не требуется |
Коллиматор |
Конвергентный |
Низкоэнергетический, параллельный, высокоразрешающий |
Протокол исследования |
Инъекция таллия, сбор информации 20 мин, введение Na99mТсO4, не меняя положения пациента, запись 300–400 тыс. импульсов через 3–4 мин после второй инъекции |
Сбор данных в передней проекции через 15 мин и 2–3 ч после инъекции, запись производится в течение 10 мин над областью ЩЖ и 10 мин над средостением; возможно выполнение ОЭКТ |
Очень важным моментом является стабильность положения пациента во время исследования, поскольку смещение больного между двумя исследованиями может привести к получению как ложноположительных, так и ложноотрицательных результатов.
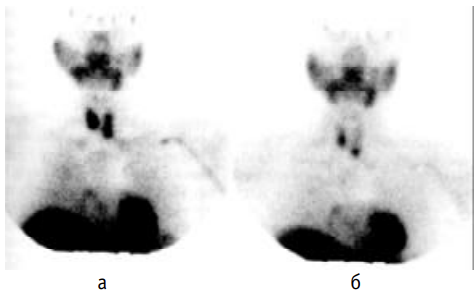
Рассмотрим некоторые причины получения ложноположительных результатов. Так, наличие узлового зоба щитовидной железы, активно захватывающего таллий, не позволяет отличить его от аденомы ПЩЖ. Ложноположительные результаты можно получить при тиреоидите Хашимото, метастатической карциноме и лимфоме. Несмотря на высокую чувствительность и специфичность этого метода в диагностике паратиреоаденом, он оказывается нечувствительным в диагностике гиперплазии или аденом размером менее 300 мг [8].
Кроме того, для сцинтиграфического выявления аденомы ПЩЖ можно использовать 99mТс-МИБИ – препарат, созданный для оценки перфузии миокарда. Кроме того, этот РФП хорошо накапливается в различных опухолях, в частности, в аденомах паращитовидных желез, где он распределяется пропорционально кровотоку и накапливается в митохондриях клетки. Клетки большинства паратиреоидных аденом содержат большое количество митохондрий. Большое количество митохондрий в клетках большинства аденом ПЩЖ, повидимому, приводит к дополнительному поглощению и замедленному вымыванию 99mТс-МИБИ из паратиреоаденомы по сравнению с окружающими тканями щитовидной железы [8]. Для выявления и локализации паратиреоидных аденом можно использовать как одно-, так и двуизотоптное исследование (см. табл. 2-9-2-1). В качестве второго РФП при последнем способе можно использовать либо 123I, либо Na99mТсO4.
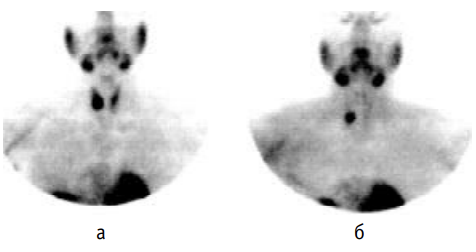
Различия кинетики 99mТс-МИБИ в щитовидной и паращитовидной железах позволили предложить двустадийное исследование после однократного введения данного РФП [11]. Запись сцинтиграмм проводят через 30 мин и 2 ч или позже после инъекции. Сравнение этих изображений позволяет дифференцировать щитовидную и паращитовидные железы. Начальное изображение, полученное при использовании 99mТс-МИБИ, соответствует тиреоидной фазе, а отсроченное – паратиреоидной фазе (рис. 2-9-2-4, 2-9-2-5). Использование данного метода позволяет выявить аденому ПЩЖ в 85– 90% случаев. Как и при исследовании с таллием, патология щитовидной железы и лимфаденопатия могут приводить к получению ложноположительных результатов.
У пациентов с заболеваниями щитовидной железы двуизотопная методика является более предпочтительной. Чувствительность в выявлении аденомы ПЩЖ при использовании метода субтракции составляет 80–100% [2, 4, 7, 11, 12]. Исследование в томографическом режиме позволяет обнаружить патологические изменения, не выявляемые при проведении планарных исследований.
Чувствительность сцинтиграфии ПЩЖ зависит от типа гиперпаратиреоза, а также от используемого РФП. Так, чувствительность метода в случае применения таллия-201 в выявлении аденом ПЩЖ варьирует от 42 до 96%, в среднем 72%. При вторичном гиперпаратиреозе чувствительность более низкая – 32–81% (в среднем 43%). Чувствительность в постоперативных случаях 26–100% (в среднем 45%). Самая высокая чувствительность имеет место при выявлении первичных аденом до операции. Эти данные широко варьируют в различных центрах, причины чего дискутируются [5, 6, 10].
В настоящее время 99mТс-МИБИ все более широко используется для визуализации ПЩЖ по сравнению с таллием. Это обусловлено более высокой чувствительностью сцинтиграфии 99mТс-МИБИ, низкой дозой облучения, сравнительно небольшой стоимостью РФП и возможностью легко получить его готовую форму ex tempore, используя генераторный Na99mТсО4. Кроме того, использование 99mТс-МИБИ является более информативным при проведении послеоперационных исследований [3, 4].
Для визуализации ПЩЖ можно использовать и другие лучевые методики. Все они имеют различную чувствительность. Так, чувствительность УЗИ при выявлении локализации ПЩЖ колеблется от 38 до 92% [10]. Однако этот метод не позволяет обнаружить ПЩЖ при их расположении в средостении. Ультразвуковое исследование не позволяет различить узловое поражение щитовидной железы и паратиреоаденому по причине одинаковой эхо-плотности последних. Сходная проблема имеет место и при использовании КТ. Возможности МРТ в оценке локализации ПЩЖ еще не полностью изучены, но есть надежда, что этот метод будет превосходить рентгеновскую томографию, особенно в послеоперационных случаях.
Т.о. сцинтиграфия ПЩЖ не является строго необходимым методом исследования в дооперационной оценке пациентов с первичным гиперпаратиреозом. Исключением являются пациенты после предшествующего хирургического вмешательства на щитовидной железе, больные с тяжелой гиперкальцемией, а также сопутствующими медицинскими проблемами.
Литература
-
Руководство по клинической эндокринологии // под ред. Н.Т. Старковой. – СПб. : Питер, 1996. – 544 с.
-
Blanco I., Carril J.M., Banzo I. et al. Double-phase Tc-99m sestamibi scintigraphy in the preoperative location of lesions causing hyper-parathyroidism // Сlin. Nucl. Med. – 1998. – [Vol.]23. – P. 291–297.
-
Bugis S.P., Berno E., Rusnak C.H. et al. Technetium-99m sestamibi scanning before initial neck exploration in patients with primary hyperparathyroidism // Eur. Arch. Otol. Rhinol. Laringol. – 1995. – [Vol.]252(3). – P. 149– 152.
-
Caixas A., Bema L., Piera J. et al. Utility of 99mTc-sestamibi scintigraphy as a first-line imaging procedure in the preoperative evaluation of hyperparathyroidism // Clin. Endocrinol. (Oxf). – 1995. – [Vol.]43. – P. 525–530.
-
Coakley A.J. Parathyroid imaging // Nucl. Med. Commun. – 1995. – [Vol.]16. – P. 522–533.
-
Coakley A.J., Wells C.P. Parathyroid // Clinical nuclear medicine / M.N. Maisey, K.E. Britton, B.D. Collier (eds). – P. 381–387.
-
Ishibashi M., Nishida H., Hiromatsu Y. et al. Comparison of technetium-99m-MIBI, technetium-99m-tetrofosmin, ultrasound and MRI for localization of abnormal parathyroid glands // J. Nucl. Med. – 1998. – [Vol.]39. – P. 320–324.
-
Martin W.H., Sandler M.P., Shapiro B. et al. Thyroid, parathyroid and adrenal gland imaging // Practical Nuclear Medicine / P.F. Sharp, H.G. Gemmell, F.W. Smith (eds). – Oxford University Press, 1998. – P. 253–271.
-
Pons F., Torregrosa J.-V., Vidal-Sicart S. et.al. Preoperative parathyroid gland localization wih technetium-99m sestamibi in secondary hyperparathyroidism // Eur. J. Nucl. Med. – 1997. – [Vol.]24/12. – P. 1494–1498.
-
Sandrock D., Merino M.J., Norton J.A. et al. Parathyroid imaging by Tc/Tl scintigraphy // Eur. J. Nucl. Med. – 1990. – [Vol.]16. – P. 607–613.
-
Taillefer R., Boucher Y., Potvin C. Detection and localization of parathyroid adenomas in patients with hyperparathyroidim using a single radionuclide imaging procedure wtih technetium-99m-sestamibi (double-phase study) // J. Nucl. Med. – 1992. – [Vol.]33. – P. 1801– 1807.
-
Torregrosa J.V., Palomar M.R., Pons P. et al. Has double phase MIBI scintigraphy usefulness in the diagnosis of hyperparathyroidism? // Nephrol. Dial. Transpl. – 1998. – [Vol.]13 (Suppl.3). – P. 37–40.