Межрегиональная общественная организация «Альянс клинических химиотерапевтов и микробиологов»
Российская ассоциация специалистов по хирургическим инфекциям (РАСХИ) Национальная ассоциация специалистов по контролю инфекций, связанных с оказанием медицинской помощи (НАСКИ)
Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ)
Общероссийская общественная организация «Федерация анестезиологов и реаниматологов»
Программа СКАТ (Стратегия Контроля Антимикробной Терапии) при оказании стационарной медицинской помощи
Российские клинические рекомендации
Москва – 2018
УДК 615.28
ББК 53.52 П78
П78 Программа СКАТ (Стратегия Контроля Антимикробной Терапии) при оказании стационарной медицинской помощи: Российские клинические рекомендации
/ Под ред. С. В. Яковлева, Н. И. Брико, С. В. Сидоренко, Д. Н. Проценко. – М.: Издательство «Перо», 2018. – 156 с.
ISBN 978-5-00122-157-9
Комплекс необходимых для стационара мероприятий по рационализации использования антимикробных препаратов, сдерживанию антибиотикорезистентности, контролю инфекций, связанных с оказанием медицинской помощи, обозначается как «Стратегия контроля антимикробной терапии» (СКАТ) или управление антибиотикотерапией (Antibiotic Stewardship) и представлен в клинических рекомендациях, обсуждающих стратегию и тактику применения антимикробных препаратов в стационарах России.
Настоящие клинические рекомендации предназначены в помощь врачам, имеющим задачу оптимизировать применение антимикробных препаратов, и адресованы тем специалистам стационаров, которые имеют возможность влиять на принятие решений по стратегическим и тактическим вопросам использования антимикробных препаратов – главным врачам медицинских организаций и их заместителям, клиническим фармакологам, госпитальным эпидемиологам, микробиологам.
The series of actions which is necessary for the hospital aiming in rationalizing the use of antimicrobials, controlling antibiotic resistance and health-care associated infections are referred to as the Antimicrobial Stewardship Strategy (AMS strategy) and presented in the Clinical guidelines discussing the strategy and tactics of antimicrobials usage in Russian hospitals.
These Clinical guidelines are designed to support physicians who are tasked with antimicrobials usage optimization, and addressed to those hospital specialists who are able to influence decision-making on strategic and tactical issues of antimicrobials usage - the chief physicians and their deputies, clinical pharmacologists, hospital epidemiologists, microbiologists.
Учреждения-разработчики:
Межрегиональная общественная организация «Альянс клинических химиотерапевтов и микробиологов»
Российская ассоциация специалистов по хирургическим инфекциям (РАСХИ)
Некоммерческое партнерство «Национальная ассоциация специалистов по контролю инфекций, связанных с оказанием медицинской помощи» (НАСКИ)
Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ)
Общероссийская общественная организация «Федерация анестезиологов и реаниматологов»
Рекомендации обсуждены и одобрены НП «Национальная ассоциация специалистов по контролю инфекций, связанных с оказанием медицинской помощи» (НАСКИ) 27 сентября 2017 г. и МОО «Альянс клинических химиотерапевтов и микробиологов» 10 ноября 2017 г.
Редакторы: профессор С.В.Яковлев, академик РАН, профессор Н.И.Брико, профессор С.В.Сидоренко, к.м.н. Д.Н.Проценко
Авторы: Яковлев С.В., Брико Н.И., Сидоренко С.В., Проценко С.В., Белобородов В.Б., Брусина Е.Б., Козлов Р.С., Елисеева Е.В., Суворова М.П., Замятин М.Н., Климко Н.И., Попов Д.А., Журавлева М.В., Белоцерковский Б.З., Гельфанд Б.Р., Гельфанд Е.Б., Дибиров М.Д., Дронов И.А., Ефименко Н.А., Зырянов С.К., Зубарева Н.А., Кириенко А.И., Клясова Г.А., Кукес В.Г., Левит А.Л., Лобзин Ю.В., Ни О.Г., Очаковская И.Н., Рафальский В.В., Руднов В.А., Феоктистова Ю.В., Шабанова Н.Е., Шляпников С.А., Хачатрян Н.Н.
© С.В.Яковлев, Н.И.Брико, С.В.Сидоренко, Д.Н.Проценко, 2018
© Коллектив авторов, 2018
Авторский коллектив:
Яковлев Сергей Владимирович – доктор медицинских наук, профессор кафедры госпитальной терапии №2 лечебного факультета ФГАОУ ВО Первый МГМУ им. И.М.Сеченова (Сеченовский университет), Президент МОО «Альянс клинических химиотерапевтов и микробиологов.
Брико Николай Иванович – Заслуженный деятель науки РФ, Академик РАН, профессор, зав. кафедрой эпидемиологии и доказательной медицины ФГАОУ ВО Первый МГМУ им. И.М.Сеченова (Сеченовский университет), Председатель НП НАСКИ.
Сидоренко Сергей Владимирович – доктор медицинских наук, профессор, заведующий отделом медицинской микробиологии и молекулярной эпидемиологии Детского научно-клинического центра инфекционных болезней Федерального медико-биологического агентства; профессор кафедры медицинской микробиологии Северо-Западного государственного медицинского университета; Вице-Президент МОО «Альянс клинических химиотерапевтов и микробиологов».
Проценко Денис Николаевич – кандидат медицинских наук, и.о. заведующего кафедрой анестезиологии и реаниматологии ФДПО РНИМУ им. Н.И. Пирогова, главный врач ГКБ им. С.С. Юдина, главный (внештатный) анестезиолог-реаниматолог Департамента здравоохранения Москвы, член правления Федерации анестезиологов-реаниматологов РФ.
Белобородов Владимир Борисович – доктор медицинских наук, профессор кафедры инфекционных болезней ФГБОУ ДПО Российская медицинская академия непрерывного профессионального образования Минздрава России, Вице-Президент МОО «Альянс клинических химиотерапевтов и микробиологов».
Брусина Елена Борисовна – доктор медицинских наук, профессор, заведующая кафедрой эпидемиологии ФГБОУ ВО «Кемеровский государственный медицинский университет « Минздрава России, член НП «НАСКИ».
Козлов Роман Сергеевич – член-корреспондент РАН, д.м.н., профессор, директор НИИ антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России, президент Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ), главный внештатный специалист по клинической микробиологии и антимикробной резистентности МЗ РФ, г. Смоленск.
Елисеева Екатерина Валерьевна – доктор медицинских наук, профессор, заведующая кафедрой общей и клинической фармакологии ФГБОУ ВО «Тихоокеанский государственный медицинский университет МЗ РФ», Главный внештатный клинический фармаколог МЗ РФ по Дальневосточному Федеральному округу.
Суворова Маргарита Петровна – кандидат медицинских наук, доцент кафедры госпитальной терапии №2 лечебного факультета ФГАОУ ВО Первый МГМУ им. И.М.Сеченова (Сеченовский университет), член МОО «Альянс клинических химиотерапевтов и микробиологов.
Замятин Михаил Николаевич – доктор медицинских наук, профессор, заместитель генерального директора на лечебным и научно-образовательным вопросам ФГБУ «НМХЦ им.Н.И.Пирогова» Минздрава России, заведующий кафедрой анестезиологии и реаниматологии ИУВ, член Федерации анестезиологов и реаниматологов.
Климко Николай Николаевич – доктор медицинских наук, профессор, FECMM, заведующий кафедрой клинической микологии, аллергологии и иммунологии Северо-Западного государственного медицинского университета им. И.И.Мечникова, Санкт-Петербург.
Попов Дмитрий Александрович – доктор медицинских наук, руководитель лаборатории клинической микробиологии и антимикробной терапии ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» Минздрава России, член Президиума правления МОО «Альянс клинических химиотерапевтов и микробиологов».
Журавлева Марина Владимировна, доктор медицинских наук, профессор, ФГАОУ ВО Первый МГМУ им. И.М.Сеченова (Сеченовский университет), зам. директора Центра клинической фармакологии ФГБУ «НЦ ЭСМП» Минздрава России, Главный внештатный специалист клинический фармаколог Департамента здравоохранения города Москвы, Вице-президент МАКФФ (Международная Ассоциация Клинических Фармакологов и Фармацевтов).
Белоцерковский Борис Зиновьевич – кандидат медицинских наук, доцент кафедры анестезиологии и реаниматологии факультета дополнительного профессионального образования РНИМУ им. Н.И. Пирогова, заведующий отделением анестезиологии-реанимации Больницы Святителя Алексия, г. Москва.
Гельфанд Борис Романович – Академик РАН, доктор медицинских наук, профессор, заведующий кафедрой анестезиологии и реаниматологии факультета усовершенствования врачей Российского национального исследовательского медицинского университета имени Н.И.Пирогова.
Гельфанд Елизавета Борисовна – кандидат медицинских наук, доцент кафедры анестезиологии и реаниматологии факультета усовершенствования врачей Российского национального исследовательского медицинского университета имени Н.И.Пирогова.
Дибиров Магомед Дибирович – доктор медицинских наук, профессор, заслуженный деятель науки, заслуженный врач, зав кафедрой хирургических болезней и клинической ангиологии МГМСУ им. А.И. Евдокимова, президент РАСХИ.
Дронов Иван Анатольевич – кандидат медицинских наук, доцент кафедры детских болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), врач- клинический фармаколог УДКБ, член Правления МОО «Педиатрическое респираторное общество» и МОО «Альянс клинических химиотерапевтов и микробиологов».
Ефименко Николай Алексеевич – член-корреспондент РАН, доктор медицинских наук, профессор, Главный хирург Филиала № 1 ФГБУ «ГВКГ им. академика Н.Н. Бурденко» МО РФ, Вице-президент РАСХИ .
Зырянов Сергей Кенсаринович – доктор медицинских наук, профессор, заведующий кафедрой общей и клинической фармакологии ФГАОУ ВО «Российский университет дружбы народов» Министерства образования и науки РФ, заместитель главного врача по терапии ГУЗ ГКБ №24 ДЗ г. Москвы.
Зубарева Надежда Анатольевна – доктор медицинских наук, профессор кафедры общей хирургии №1 лечебного факультета Пермской государственной медицинской академии им. акад. Е.А.Вагнера.
Кириенко Александр Иванович – академик РАН, доктор медицинских наук, профессор, заведующий кафедрой факультетской хирургии им. С.И.Спасокукоцкого Российского национального исследовательского медицинского университета им. Н.И.Пирогова, Вице-Президент Российского общества хирургов.
Клясова Галина Александровна – доктор медицинских наук, профессор, заведующий лабораторией клинической микробиологии, микологии и антимикробной терапии, ФГБУ «НМИЦ гематологии» Минздрава России, Национальное гематологическое общество, руководитель рабочей группы по инфекциям.
Кукес Владимир Григорьевич – доктор медицинских наук, профессор, заслуженный деятель науки РФ, лауреат премии Академии медицинских наук СССР им. Г.Ф.Ланга, Государственной премии СССР, премии Мэра г. Москвы; кафедра клинической фармакологии и пропедевтики внутренних болезней ФГАОУ ВО Первый МГМУ им. И.М.Сеченова (Сеченовский университет); Президент МАКФФ (Международная Ассоциация Клинических Фармакологов и Фармацевтов).
Левит Александр Львович – доктор медицинских наук, профессор, заведующий отделением анестезиологии и реанимации ГБУЗ СО «СОКБ №1» Екатеринбурга, главный внештатный анестезиолог-реаниматолог Министерства здравоохранения Свердловской области и Уральского федерального округа, заслуженный врач РФ, Екатеринбург.
Лобзин Юрий Владимирович – Академик РАН, доктор мед. наук, профессор, Заслуженный деятель науки Российской Федерации; директор Детского научно-клинического центра инфекционных болезней Федерального медико-биологического агентства; заведующий кафедрой инфекционных болезней Северо-Западного государственного медицинского университета.
Ни Оксана Геннадьевна – заведующий отделом клинической фармакологии, врач-клинический фармаколог ГБУЗ «Краевая клиническая больница №2» г. Краснодара.
Очаковская Ирина Николаевна – врач-клинический фармаколог отдела клинической фармакологии ГБУЗ «Краевая клиническая больница №2» г. Краснодара, ассистент кафедры клинической фармакологии и функциональной диагностики ФПК и ППС ФГБОУ ВО КубГМУ Минздрава России .
Рафальский Владимир Витальевич – доктор медицинских наук, профессор, зав. курсом клинической фармакологии, Директор центра клинических исследований ФГАОУ ВО Балтийский федеральный университет имени Иммануила Канта, г. Калининград, член Правления МОО «Альянс клинических химиотерапевтов и микробиологов»
Руднов Владимир Александрович – доктор медицинских наук, профессор, зав. каф. анестезиологии, реаниматологии и токсикологии Уральского государственного медицинского университета, зам гл.врача МАУ ГКБ№40 по анестезиологии и реанимации, вице-президент МАКМАХ, председатель Совета экспертов «СепсисФорумРоссия», Екатеринбург.
Феоктистова Юлия Владимировна – кандидат медицинских наук, ведущий клинический фармаколог КГБУЗ «Краевая детская клиническая больница №1» (г. Владивосток), ассистент кафедры общей и клинической фармакологии ФГБОУ ВО «Тихоокеанский государственный медицинский университет МЗ РФ».
Шабанова Наталья Евгеньевна – кандидат медицинских наук, врач-клинический фармаколог отдела клинической фармакологии ГБУЗ «Краевая клиническая больница №2» г. Краснодара, доцент кафедры клинической фармакологии и функциональной диагностики ФПК и ППС ФГБОУ ВО КубГМУ Минздрава России.
Шляпников Сергей Алексеевич – доктор медицинских наук, профессор, Лауреат премии Правительства РФ, руководитель «Городского центра по лечению тяжелого сепсиса» ГБУ НИИ скорой помощи им И.И.Джанелидзе, заведующий кафедрой хирургических инфекций ФГБОУ СЗГМУ им И. И. Мечникова, Председатель «Санкт-Петербургского общества специалистов по сепсису».
Хачатрян Нана Николаевна – доктор медицинских наук, профессор кафедры хирургических болезней и клинической ангиологии МГМСУ им. А.И.Евдокимова.
Предисловие ко второму изданию
В 2012 году экспертами 5 Российских общественных организаций были созданы Российские национальные рекомендации «Стратегия и тактика применения антимикробных средств в лечебных учреждениях России». Данные рекомендации, подготовленные с участием специалистов разного профиля (клинические фармакологи, анестезиологи/реаниматологи, хирурги, терапевты, педиатры, микробиологи, эпидемиологи), охватывали общие проблемы антибиотикорезистентности возбудителей нозокомиальных инфекций, стратегические и тактические вопросы рационального применения антимикробных препаратов в стационаре, подходы к сдерживанию антибиотикорезистентности. В этих рекомендациях впервые были представлены рекомендации по эмпирическому выбору антимикробных препаратов в зависимости от стратификации пациентов по риску наличия антибиотикорезистентных возбудителей и инвазивного кандидоза.
Изданные в 2012 году Российские национальные рекомендации послужили основой для разработки программы СКАТ (Стратегия Контроля Антимикробной Терапии) для стационаров и началом ее активного внедрения и реализации в различных медицинских организациях России. В 2017 году более 60 стационаров РФ осуществляли реализацию программы СКАТ на разных этапах ее выполнения.
За прошедшие после издания рекомендаций 5 лет произошли существенные изменения в состоянии антибиотикорезистентности в стационарах, связанные, прежде всего, с широким распространением в стационарах карбапенемаз. Кроме того, за этот период был накоплен большой опыт реализации программы СКАТ в медицинских организациях. Все это послужило обоснованием разработки нового документа с описанием положительного опыта этапов осуществления программы СКАТ в стационаре, а также указанием на наиболее распространенные ошибки и неудачи.
По сравнению с документом 2012 года в настоящих рекомендациях приведены данные по распространенности нозокомиальных инфекций в стационарах России, организационные вопросы и этапы реализации программы СКАТ, больничный формуляр антимикробных средств, оценке эффективности реализации программы СКАТ, приведены алгоритмы эмпирического выбора антимикробных препаратов при различных заболеваниях в зависимости от стратификации пациента по риску антибиотикорезистентности. Кроме того, существенно переработаны и дополнены разделы по антибиотикорезистентности в РФ, стратификации пациентов по риску антибиотикорезистентности, профилактике инфекций, связанных с оказанием медицинской помощи, и распространения полирезистентных микроорганизмов.
Настоящие клинические рекомендации предназначены в помощь врачам, имеющим задачу оптимизировать применение антимикробных препаратов, и адресованы тем специалистам стационаров, которые имеют возможность влиять на принятие решений по стратегическим и тактическим вопросам использования антимикробных препаратов – главным врачам медицинских организаций и их заместителям, клиническим фармакологам, госпитальным эпидемиологам, микробиологам.
Профессор Яковлев Сергей Владимирович 
|
Раздел 1.Зачем нужна программа СКАТ для медицинских организаций?
Проблема антибиотикорезистентности стала особо актуальной и тревожной в XXI веке. В большинстве регионов мира, в том числе и в России, получили широкое распространение штаммы микроорганизмов, характеризующиеся устойчивостью к большинству антимикробных препаратов (АМП). Полирезистентность характерна для нозокомиальных штаммов грамположительных (стафилококки, энтерококки) и грамотрицательных бактерий (энтеробактерии, P.aeruginosa, Acinetobacter spp.). В стационарах России распространены устойчивые к метициллину (оксациллину) стафилококки (MRSA) и энтеробактерии, устойчивые к цефалоспориновым антибиотикам (продуценты бета-лактамаз расширенного спектра – БЛРС). В последние пять лет особую тревогу вызывает распространение в ОРИТ ацинетобактеров и Klebsiella pneumoniae с множественной резистентностью к большинству антибиотиков, включая карбапенемы.
Исторически появление нозокомиальных инфекций связано с расширением возможности оказания помощи пациентам в критическом состоянии, показаний к инвазивным процедурам, имплантации протезов, концентрации тяжелых пациентов на ограниченном пространстве ОРИТ и другими условиями. Возможности профилактики развития таких инфекций объективно ограничены наличием комменсальной флоры пациента, в определенных условиях становящейся патогенной (энтеробактерии, стафилококки). Широкое применение антибиотиков с лечебной и профилактической целью привело к селекции и распространению полирезистентной флоры. Полирезистентные бактерии – возбудители нозокомиальных инфекций, широко распространены во всех странах мира.
Имеются закономерные сложности в реализации программ профилактики нозокомиальных инфекций в медицинской организации РФ (отсутствие скрининга на носительство пациентами полирезистентных бактерий, сложности изоляции таких пациентов и ограничение контактной передачи инфекции, не всегда адекватная микробиологическая диагностика, слабая подготовка врачей в области антимикробной терапии, недостаток врачей клинических фармакологов). В настоящее время проблема усугубляется тем, что некоторые полирезистентные бактерии (прежде всего, энтеробактерии, продуцирующие БЛРС и карбапенемазы) стали распространяться во внебольничную среду и становиться причиной внебольничных инфекций, что затрудняет проведение ранней адекватной антибактериальной терапии. Такие инфекции, связанные с риском полирезистентных возбудителей, относят к большой новой группе инфекций, связанных с оказанием медицинской помощи (ИСМП).
С другой стороны, в последние годы отмечена устойчивая тенденция к снижению числа появляющихся на рынке новых АМП, преодолевающих антибиотикорезистентность. Перспективы разработки принципиально новых антибиотиков для лечения нозокомиальных инфекций выглядят удручающе.
Решение проблемы лечения в стационаре инфекций, вызванных полирезистентными бактериями, связано в основном не с ожиданием появления новых АМП, а с разработкой и внедрением решительных и адекватных мер по сдерживанию антибиотикорезистентности. Комплекс необходимых для стационаров мероприятий по рационализации использования АМП, сдерживанию антибиотикорезистентности, контролю нозокомиальных инфекций за рубежом обозначается как «Управление антибиотикотерапией» (Antibiotic Stewardship), а в России как «Стратегия Контроля Антимикробной Терапии» (СКАТ), и представлен в настоящих клинических рекомендациях, обсуждающих стратегию и тактику применения АМП в стационарах Российской Федерации.
Целью настоящих Практических рекомендаций являются:
Программа СКАТ реализуется в РФ с 2011 года, в ней участвуют более 60 стационаров из разных регионов РФ. За этот период накоплен конкретный опыт реализации программы СКАТ, как в отдельных медицинских организациях, так и на региональном уровне. Рекомендации по рациональному применению АМП в стационарах и сдерживанию антибиотикорезистентности представлены в опубликованных в 2012 году Российских национальных рекомендациях [1] и практическом руководстве [2].
Задачами реализация программы СКАТ в стационарах являются:
-
профилактика распространения возбудителей нозокомиальных инфекций, резистентных к антибиотикам;
-
рациональное применение АМП с лечебной и профилактической целью, повышение эффективности эмпирической антибактериальной терапии;
-
оптимизация (снижение) расходов медицинской организации на антимикробные средства, пребывание пациента в стационаре, лечение нозокомиальных осложнений.
Как показала реальная клиническая практика, благодаря программе СКАТ можно оптимизировать применение АМП при участии тех специалистов, которые имеют возможность влиять в стационаре на принятие решений по стратегическим и тактическим вопросам использования АМП – главные врачи и заместители главного врача медицинской организации, клинические фармакологи, микробиологи, госпитальные эпидемиологи, ведущие специалисты терапевтических и хирургических направлений. Эффективные программы стратегии рационального использования антибиотиков в стационаре и профилактики нозокомиальных инфекций могут быть финансово самоокупаемыми и повышать качество лечения пациентов (уровень доказательности A-II). Внедрение программы СКАТ может быть проведено в условиях ограниченности ресурсов, и будет способствовать оптимизации взаимодействия служб медицинской организации.
Настоящие клинические рекомендации предназначены в помощь клиническим фармакологам, а также врачам разных специальностей, микробиологам, госпитальным эпидемиологам, руководителям медицинских организаций, ставящим задачу оптимизировать применение АМП.
Литература
-
Стратегия и тактика применения антимикробных средств в лечебных учреждениях России: Российские национальные рекомендации / Под ред. В.С.Савельева, Б.Р.Гельфанда, С.В.Яковлева. – М.: ООО «Компания БОРГЕС», 2012. – 92 с. Текст рекомендаций представлен на сайте www. antimicrob.net
-
Яковлев С.В., Суворова М.П., Елисеева Е.В. Стратегические и тактические вопросы рационального применения антибактериальных препаратов в стационаре. В кн.: Рациональная антимикробная фар макотерапия: руководство для практикующих врачей \ под ред С.В.Яковлева. 2-е изд., перераб.и доп. – М.:Литтерра, 2015. – с. 421-36.
Раздел 2. Распространенность и клиническое значение нозокомиальных инфекций в стационарах России
Исследование ЭРГИНИ 2013 было проведено в 32 многопрофильных скоропомощных стационарах 18 городов РФ в период с января по май 2013 г. Это было первое проспективное многоцентровое исследование распространенности, клинического значения, нозологической и этиологической структуры нозокомиальных инфекций в многопрофильных медицинских организаций России. Методология исследования предполагала проведение активного выявления нозокомиальных инфекций, что позволило существенно повысить достоверность данных по их распространенности по сравнению с данными, отраженными в медицинской документации. Выявление нозокомиальных инфекций проводилось в соответствии с рекомендациями CDC [1], включало анализ клинических, лабораторных и инструментальных данных, отраженных в медицинской документации пациентов. Исследование проводили одновременно во всех 32 центрах в 5 этапов – отдельного дня для каждого типа отделения (хирургические, терапевтические, реанимационные, неврологические и урологические отделения). На каждом этапе в течение одного дня проводилось активное выявление пациентов с внебольничными и нозокомиальными инфекциями. Результаты исследования ЭРГИНИ были опубликованы ранее [2].
В исследование было включено 3809 пациентов в разных отделениях многопрофильных стационаров: 419 пациентов в ОРИТ, 1197 – в терапевтических, 1284 – в хирургических, 342 – в урологических, 262 – в неврологических отделениях. В день исследования диагноз инфекции был документирован у 1377 пациентов, из них у 290 пациентов инфекция была нозокомиальная, у 1087 – внебольничная. У 2432 пациентов инфекции не было.
Распространенность нозокомиальных инфекций во взрослых стационарах Москвы составила 7,61% (95% доверительный интервал 6,81%; 8,50%), внебольничных инфекций – 28,53% (95% ДИ 27,11%; 30,00%).
Наибольшая распространенность нозокомиальных инфекций отмечена в ОРИТ 26,28% и в отделении неврологии – 13,73%; распространенность нозокомиальных инфекций в терапии и хирургии была примерно одинаковой – 4,76% и 4,12%, а в урологии – наименьшей (2,92%). Распространенность нозокомиальных инфекций во взрослых и детских стационарах существенно не различалась.
Среди нозокомиальных инфекций наиболее частыми были инфекции нижних дыхательных путей (42,4%). Данные по нозокомиальным инфекциям другой локализации представлены в табл. 1.
| Инфекции | Количество | Доля среди нозокомиальных инфекций (%) | Распространенность (%) |
|---|---|---|---|
Нижних дыхательных путей |
123 |
42,4 |
3,23 |
Мочевыводящих путей |
55 |
19,0 |
1,44 |
Кожи и мягких тканей |
39 |
13,4 |
1,02 |
Абдоминальные |
33 |
11,4 |
0,87 |
Ангиогенные |
14 |
4,8 |
0,37 |
Костей и суставов |
9 |
3,1 |
0,24 |
Верхних дыхательных путей |
8 |
0,8 |
0,21 |
ЦНС |
6 |
2,1 |
0,16 |
Диарея C.difficile |
3 |
1,0 |
0,08 |
Нозокомиальные инфекции характеризовались более тяжелым течением по сравнению с внебольничными. Тяжелый сепсис с полиорганной недостаточностью (43,8%) и септический шок (12,5%) при нозокомиальной инфекции наблюдались достоверно чаще по сравнению с внебольничными (соответственно, 16,3% и 2,9%).
У 263 пациентов с документированной нозокомиальной инфекцией были выделены 311 микроорганизмов (в среднем 1,2 у одного пациента), которые были признаны исследователями как клинически значимые возбудители. В этиологии нозокомиальных инфекцией доминировали грамотрицательные микроорганизмы 58,8%, реже встречались грамположительные бактерии (32,8%) и грибы (8,4%). Среди 26 штаммов грибов 2/3 были Candida albicans, остальные – Candida non-albicans.
Наиболее актуальные грамотрицательные и грамположительные возбудители нозокомиальных инфекций у взрослых пациентов представлены в табл. 2.
| Грамотрицательные | Грамположительные | ||
|---|---|---|---|
Микроорганизм |
% |
Микроорганизм |
% |
Klebsiella pneumoniae |
19,6 |
Staphylococcus aureus |
11,3 |
Escherichia coli |
12,2 |
Enterococcus faecalis |
7,4 |
Acinetobacter baumannii |
10,9 |
Staphylococci CN |
5,1 |
Pseudomonas aeruginosa |
7,1 |
Enterococcus faecium |
3,2 |
Proteus mirabilis |
4,5 |
Streptococcus spp. |
2,9 |
Enterobacter spp. |
1,9 |
Streptococcus pyogenes |
1,3 |
Другие |
2,6 |
Другие |
1,6 |
Всего |
58,8 |
Всего |
32,8 |
Актуальные возбудители нозокомиальных инфекций у взрослых характеризовались множественной устойчивостью к антибиотикам. Среди энтеробактерий доля штаммов K.pneumoniae, P.mirabilis и E.coli, нечувствительных к цефалоспоринам III-IV поколений составила соответственно 95,1, 78,6 и 60,5%. Частота штаммов неферментирующих бактерий P.aeruginosa и A.baumannii, нечувствительных к карбапенемам, составила соответственно 40,9 и 73,5%. Среди грамположительных микроорганизмов частота MRSA составила 48,6%, частота метициллин-резистентных штаммов среди коагулазонегативных стафилококков была выше – 81,3%. Четыре из 23 штаммов E.faecalis проявляли устойчивость к ампициллину. Не было выявлено энтерококков, устойчивых к ванкомицину. Из 311 выделенных микроорганизмов 274 (88,1%) характеризовались полирезистентностью (устойчивость к 3 и более антибиотикам), 22 штамма (7,1%) были расценены как чрезвычайно резистентные (XDR – Extremely Drug Resistant), то есть сохранявшие чувствительность только к 1 или 2 антибиотикам.
Пациенты с нозокомиальными инфекциями, достоверно более продолжительно находились на стационарном лечении по сравнению с пациентами без нозокомиальной инфекции (в среднем 24,6±11,4 и 16,2±15,3 дней). Таким образом, возникновение нозокомиальной инфекции приводит к увеличению срока госпитализации взрослых пациентов в 1,5 раза или в среднем на 6,6 дней.
Взрослые пациенты с нозокомиальной инфекцией имели в 5,5 более высокую летальность по сравнению с пациентами без нозокомиальной инфекции (16,5 и 3,0% соответственно), различия высоко достоверные ( χ2 = 165,20, Р < 0,0001).
Проведен анализ назначения антимикробных препаратов по поводу нозокомиальной инфекции пациентам включенным в исследование. У взрослых пациентов для лечения 267 случаев нозокомиальной инфекции было назначено 483 антибиотика (в среднем 1,81 антибиотик на 1 пациента).
Наиболее часто назначаемым антибиотиком для лечения нозокомиальных инфекций у взрослых был ципрофлоксацин (12,4% от всех назначений), другие препараты были назначены со следующей частотой: цефтриаксон (9,9%), цефоперазон/сульбактам (9,9%), цефотаксим (6,8%), имипенем (6,2%), метронидазол (6,0%), меропенем (4,8%); остальные антибиотики назначались реже. По группам антибиотиков наиболее часто были назначены цефалоспорины III-IV поколений (23,2%) и фторхинолоны – 19,0% (из них в 82,6% ранние).
Исходя из распространенности нозокомиальных инфекций в стационарах России (7,61%) и примерного количества ежегодно госпитализированных пациентов (30 млн) можно предположить, что прогнозируемая частота нозокомиальных инфекций в России составляет около 2,3 млн случаев в год. С учетом полученных данных необходимо разрабатывать программы по контролю нозокомиальных инфекций и антибиотикорезистентности, как на региональном уровне, так и в стационарах.
Литература
-
Horan T, Andrus M, Dudeck M: CDC/NHSN surveillance definition of healthcare-associated infection and criteria for specific types.
-
Яковлев С.В., Суворова М.П., Белобородов В.Б., Басин Е.Е., Елисеева Е.В., Ковеленов С.В, и члены исследовательской группы ЭРГИНИ. Распространенность и клиническое значение нозокомиальных инфекций в лечебных учреждениях России: исследование ЭРГИНИ. Антибиотики и химиотерапия 2016; т. 61, № 5-6, с. 32-42.
Раздел 3. Современные проблемы и распространение антибиотикорезистентности в РФ
В строгом смысле антибактериальные препараты следует подразделять на антибиотики (вещества биологического происхождения и их полусинтетические производные) и химиопрепараты (полностью синтетические соединения). Однако в настоящее время авторитетная международная организация Европейское общество по клинической микробиологии и инфекционным болезням (European Society of Clinical Microbiology and Infectious Diseases ESCMID) считает возможным использовать термин «антибиотики» применительно как к антибиотикам в узком смысле, так и к химиопрепаратам [1]. В настоящем документе под антибиотикорезистентностью понимается устойчивость к антибиотикам в широком смысле.
Известны два принципиальных генетических механизма формирования и распространения антимикробной резистентности среди бактерий – возбудителей инфекций человека и животных:
Оба указанных механизма вызывают сходные, но не идентичные изменения структуры мишеней действия антибиотиков, механизмов их транспорта и метаболизма, приводящие к фенотипическому проявлению устойчивости к антибиотикам. Необходимо отметить, что указанные генетические и метаболические изменения возникают спонтанно и не являются следствием воздействия антибиотиков. Однако в условиях прессинга антибиотиков устойчивые бактерии получают селективные преимущества для распространения.
Условия существования бактерий, в зависимости от интенсивности контактов с антибактериальными препаратами, можно разделить на несколько основных групп. В подавляющем большинстве естественных экосистем бактерии подвергаются воздействию крайне низких концентраций соединений с антибактериальной активностью, вырабатываемых грибами и бактериями. Интенсивность воздейстия антибиотиков на бактерии, находящиеся в организме условно здоровых людей и в их ближайшем окружении (прежде всего, среди сельскохозяйственных животных) варьирует в разных странах в достаточно широких пределах в зависимости от практики этиотропной терапии амбулаторных инфекций и практики применения антибиотиков в сельском хозяйстве. И, наконец, в условиях лечебных учреждений бактерии подвергаются практически постоянному воздействию высоких концентраций антибактериальных препаратов в различных комбинациях. При этом наиболее интенсивный прессинг отмечается в отделениях интенсивной терапии и реанимации (ОРИТ), что приводит к формированию генетических линий множественно устойчивых бактерий. Сформированные в ОРИТ резистентные бактерии могут выходить за пределы стационаров и распространяться в популяции здоровых людей, сельскохозяйственных и синантропных животных.
Формирование и распространение устойчивых бактерий естественный и неизбежный процесс, однако его скорость напрямую зависит от селективного прессинга антибиотиков, выраженность которого, в свою очередь определяется объемом потребления этих препаратов как в медицине, так и в сельском хозяйстве (животноводстве и ветеринарии). К сожалению, в последние 10-летия рост потребления антибиотиков во всех сегментах приобрел неконтролируемый характер.
Оценивая закономерности распространения резистентности, следует отметить такой феномен как «параллельный ущерб», заключающийся в селекции резистентности не только и не столько среди штаммов возбудителей, на которых была направлена антибактериальная терапия, но и среди микроорганизмов, не являвшихся этиологически значимыми, более того – среди микроорганизмов, изначально даже не входивших в спектр активности препарата.
Учитывая тот факт, что в ближайшие несколько лет появление новых групп антибиотиков, преодолевающих наиболее актуальные механизмы резистентности мало вероятно, особую актуальность приобретают мероприятия, направленные на снижение потребления антибиотиков, такие как стратегия контроля антибактериальной терапии. Необходимо отметить, что полностью предотвратить формирование бактериями устойчивость к антибиотикам, вероятно, невозможно, реалистичной задачей может быть сдерживание распространения этого явления.
При решении любой проблемы, в том числе и сдерживания антибиотикорезистентности необходимо выделить наиболее существенные элементы, воздействие на которые может обеспечить скорейшее достижение цели. В 2013 США (Centers for Disease Control and Prevention – CDC) опубликовал документ, классифицирующий резистентные бактерии по степени их угрозы системе здравоохранения. А в 2017 году классификацию резистентных бактерий по степени приоритетности разработки новых антибактериальных препаратов для их лечения опубликовала ВОЗ. Обе классификации представлены в таблице 3.
| Классификация CDC | Классификация ВОЗ |
|---|---|
Уровень угрозы, требующий немедленных действий
|
Критически высокий уровень приоритетности
|
Уровень угрозы серьезный
|
Высокий уровень приоритетности
|
Уровень угрозы настораживающий
|
Средний уровень приоритетности
|
Устойчивость грамотрицательных бактерий к карбапенемам . Эксперты обеих организаций (CDC и ВОЗ) единогласны в оценке распространения среди грамотрицательных бактерий устойчивости к карбапенемам как наиболее серьезной угрозы, требующей немедленных действий, поскольку выбор препаратов для лечения инфекций, вызываемых этими бактериями, крайне ограничен. В течении первых 20 лет клинического применения карбапенемов эти антибиотики рассматривались как абсолютно надежные, устойчивость к ним среди представителей семейства Enterobacteriaceae описывали крайне редко, хотя среди P. aeruginosa устойчивость выявляли уже в конце 80-х гг. Чаще резистентность была связана со снижением проницаемости внешних структур бактериальной клетки, гиперпродукцией хромосомных β-лактамаз класса С и/или активацией систем выведения препаратов из бактериальной клетки.
Ситуация с резистентностью к карбапенемам принципиально изменилась после появления продуцентов карбапенемаз с плазмидной локализацией кодирующих генов. Количество известных карбапенемаз лавинообразно нарастает, однако, глобальное распространение в настоящее время получили немногие представители класса В (металло-бета-лактамазы – МБЛ) – IMP-тип, VIM-тип и NDM-тип; а также класса А – КРС-тип и класса D – ОХА-тип. Перечисленные карбапенемазы в настоящее время распространены среди основных групп грам-отрицательных бактерий, но при этом можно выделить и определенные особенности. Среди Enterobacteriaceae, премущественно среди Klebsiella spp. распространены карбапенемазы типов КРС, ОХА-48 и NDM; среди P. aeruginosa тип VIM; среди Acinetobacter spp. – типы ОХА-23, ОХА-40, ОХА-51 и ОХА-58.
Первая публикация об обнаружении в 10-ти городах Европейской и Азиатской частей России P. aeruginosa, продуцирующих карбапенемазы VIM-типа относится к 2006 году [2], в дальнейшем было установлено преимущественное распростнение в Российской Федерации генетических линий ST235 и ST234 [3]. В 2012 появились сообщения о выделении у Enterobacteriaceae на территории Российской Федерации карбапенемаз VIM-4 [4], OXA-48 [5], NDM-1 [6, 7]. В 2014 было сообщено об обнаружении карбапенемаз КРС-типа [8].
Оценить скорость распространения продуцентов карбапенемаз в Российской Федерации достаточно сложно. Так в 2014 году были опубликованы результаты многоцентрового исследования, в ходе которого были обнаружены лишь единичные продуценты карбапенемаз NDMи ОХА-48-типа [9]. Однако уже в 2016 г. энтеробактерии, продуцирующие карбапенемазы, выявлили более чем в 10 городах Европейской и Азиатской частей России, при этом 9.2% клебсиелл, циркулирующих в стационарах Санкт-Петербурга, продуцировали карбапенемазы, в 5.9% это были ферменты NDM-типа, в 1.4% ОХА-48-типа, а в 1.9% случаев бактерии продуцировали одновременно оба фермента. [10]. По предварительным неопубликованным данным в 2017 частота продукции карбапенемаз среди клебсиелл в Санкт-Петербурге превысила 20%, из многих городов поступают персональные сообщения об обнаружении продуцентов карбапенемаз. Для продуцентов карбапенемаз характерна высокая частота ассоциированной устойчивости к антибиотикам разных групп, зачастую они сохраняют чувствительность только к тигециклину и полимиксинам (полимиксину В и колистину).
Несмотря на достаточно длительную историю клинического применения, устойчивость к тигециклину среди Enterobacteriaceae по данным международных многоцентровых исследований сохраняется на невысоком уровне (приблизительно 5–10%) [11, 12]. В России частота устойчивости среди продуцентов различных карбапенемаз колебалась в пределах 6.7–14.8% [10], что позволяет оценивать тигециклин как базовый препарат для лечения соответствующих инфекций.
Полимиксины (полимиксин В и колистин) относятся к давно известным, но частично забытым антибиотикам, их «ренессанс» начался именно на фоне распространения карбапенемаз. Серьезным недостатком полимиксинов является возможность развития резистентности в процессе терапии, а также недавно обнаруженная плазмидная локализация генов резистентности [13], что создает потенциальную угрозу ее быстрого распространения.
В распространении на территории России карбапенемаз среди Enterobacteriaceae проявляются некоторые географические различия. Так, если в Санкт-Петербурге превалируют карбапенемазы NDM-типа, то в Москве и других регионах доминирует тип ОХА-48. Эти особенности имеют крайне важное практическое значение для планирования рациональной терапии. В 2017 году в Российской Федерации был разрешен к медцинскому применению новый ингибиторзащищенный цефалоспорин – цефтазидим/авибактам. Входящий в состав комбинированного препарата ингибитор бета-лактамаз авибактам эффективно подавляет бета-лактамазы А, С и частично D типов, но не активен в отношении металло-бета-лактамаз В-типа.
Если среди Enterobacteriaceae продукция карбапенемаз является ведущим механизмом устойчивости к карбапенемам, то среди неферментирующих бактерий механизмы устойчивости более разнообразны. Наряду с продукцией карбапенемаз у P. aeruginosa и Acinetobacter spp. широко распространены комбинации таких механизмов как гиперэкспрессия собственных хоромосомных бета-лактамаз, активация эффлюксных помп, нарушение проницаемости внешних структур, связанное с дефектами пориновых каналов. Превалирование тех или иных механизмов может существенно различаться даже в территориально близких учреждениях, что еще раз подчеркивает актуальность локальных данных о резистентности.
Устойчивость грамотрицательных бактерий к цефалоспоринам . Вторым по важности, но исторически более ранним и широко распространенным механизмом резистентности как на глобальном уровне, так и в России рассматривают бета-лактамазы расширенного спектра (БЛРС). В указанную группу входят многочилсенные ферменты классов А, С и D, их основным свойством является спосбность разрушать все цефалоспориновые антибиотики. Для продуцентов БЛРС также характерна ассоциированная устойчивость к антибиотикам основных значимых групп (аминогликозидам и фторхинолононам), но сохранение чувствительности к карбапенемам. Первое описание БЛРС относится к 1979 г [14], в России первые БЛРС были описаны в 1998 г [15]. Однако, скорее всего, ранние этапы появления и распространения этих ферментов в России прошли незамеченными, поскольку уже в 1999 г. в ОРИТ некоторых стационаров Москвы более 90% клебсиелл демонстрировали устойчивость к цефалоспоринам III поколения [16]. Принципиально сходные данные были получены более чем через 10 лет в ходе многоцентрового исследования в 2011 – 2012 гг [9]. Столь широкое распространение БЛРС привело к утрате клинического значения при госпитальных инфекциях важнйших групп антибиотиков: цефалоспоринов, аминогликозидов и фторхионолонов.
К крайне негативной глобальной тенденции следует отнести выход продуцентов БЛРС за пределы стационаров, такие бактерии обнаруживают не только у пациентов с внебольничными инфекциями, но и в окружающей среде. Продуценты БЛРС были обнаружены даже в сточных водах с полярной станции в Антарктиде [17]. Наибольшее практическое значение имеет появление БЛРС среди возбудителей, внебольничных осложненных интраабдоминальных инфекций и инфекций мочевыводящих путей, поскольку требует пересмотра устоявшихся подходов к эмпирической терапии: перехода с цефалоспоринов III – IV поколений на карбапенемы. Рост частоты продуцентов БЛРС среди возбудителей внебольничных инфекций отмечают как в различных регионах мира [18], так и в России [19]. В российском пилотном многоцентровом исследовании этиологии и антибиотикорезистентости возбудителей перитонитов установлено, что E. coli и Klebsiella spp. являлись наиболее частыми возбудителями перитонитов как внебольничной, так и нозокомиальной этиологии. Обобщенные данные свидетельствуют о более высоком уровне антибиотикорезистентности нозокомиальных штаммов возбудителей по сравнению с внебольничными: продукция БЛРС была выявлена у 21% внебольничных и 59% нозокомиальных штаммов.
Несмотря на крайне высокий уровень распростарнения устойчивости возбудителей госпитальных инфекций к цефалоспоринам, фторхинолонам и аминогликозидам и рост этих показателей среди возбудителей внебольничных инфекций перечисленные антибиотики остаются ведущими по объему потребления в стационарах России. По данным исследования ЭРГИНИ при нозокомальных инфекциях 42% назначений антибиотиков приходилось на фторхинолоны и цефалоспорины, при частоте устойчивости к этим антибиотикам на уровне 60% – 90% [20]. В стационарах Санкт-Петербурга 80% назначений антибиотиков приходится на цефтриаксон, цефотаксим, цефазолин, ципрофлоксацин и метронидазол, при этом несмотря на частоту устойчивости к перечисленным антибиотикам на уровне 60–80% не отмечается скольибудь значительного количества случаев неудачи антибактериальной терапии [21]. Даже если учесть вероятность ошибок при проведении указанных исследований есть все основания признать, что от 30% до 60% назначений антибиотиков в стационарах абсолютно не обоснованы.
Оценивая сложившуюся ситуацию следует отметить, что избыточное и необоснованное назначение цефалоспоринов и фторхинолонов связано со значительным пареллельным ущербом. В ряде исследований выявлена зависимость между предшествующим использованием цефалоспоринов III поколения и риском инфицирования или колонизации БЛРС-продуцирующими энтеробактериями [22, 23, 24, 25]. Предшествующее использование ципрофлоксацина тесно связано с повышением устойчивости P. aeruginosa как к самому препарату, так и к имипенему (коэффициент корреляции – 0,89, р≤0,05) [26].
Clostridium difficile . Эксперты CDC в качестве одной из самых серьезных угроз системе здравоохранения рассматривают распространение инфекций, ассоциированных с Clostridium difficile. Распространение этих инфекций является наиболее выразительным примером проявлений параллельного ущерба антибиотикотерапии, они развиваются в результате нарушения баланса микробиоты желудочно-кишечного тракта на фоне приема антибиотиков. К сожалению, национальные данные, касающиеся эпидемиологии этого вида инфекций, отсутствуют, хотя зарубежные источники относят антибиотикоассоциированную диарею к группе наиболее частых осложнений АБТ у госпитализированных больных [27]. В настоящее время доступны результаты множества исследований, демонстрирующих взаимосвязь между предшествующим использованием цефалоспоринов и развитием антибиотик-ассоциированной диареи [28-30]. Напротив, тотальное ограничение использования инъекционных цефалоспоринов III поколения (на 92%) приводит к снижению частоты возникновения подобной диареи в два раза [31].
Роль фторхинолонов в возникновении антибиотикоассоциированной диареи до настоящего времени остается неясной. Еще недавно считали, что использование фторхинолонов сопровождается относительно низким риском развития такого осложнения, однако исследования последнего времени подтверждают возможную зависимость между применением фторхинолонов и возникновением антибиотик-ассоциированной диареи [28-30]. Так, при исследовании вспышки заболевания было показано, что наряду с цефтриаксоном и клиндамицином использование фторхинолонов является независимым фактором риска диареи (ОШ = 5,4, 4,8 и 2,0 соответственно) [31].
Метициллинрезистентность . Среди грамположительных бактерий наиболее распространенным и важным механизмом устойчивости однозначно рассматривается метициллинрезистентность стафилококков. В России ситуацию с распространением MRSA, c одной стороны, нельзя оценить в силу отсутствия централизованной системы по сбору данных о циркуляции госпитальных и вне-госпитальных патогенов, с другой имеющиеся исследования показывают крайнюю неравномерность их распространения. Так, частота встречаемости MRSA среди стафилококков может колебаться от 0 до 80% взависимости от стационара и географического региона [32].
Согласно данным крупнейшего систематического обзора и метаанализа 76 исследований, в которые было включено 24230 пациентов, предшествующее использование антибиотиков повышает риск развития MRSA-инфекции в 1,8 раза (р<0,001), причем относительный риск (ОР) для отдельных классов антибиотиков, таких, как ФХ, гликопептиды и ЦС, составил 3,1, 2,9 и 2,2 соответственно [33].
Анализ потребления АМП с помощью технологии DDD в 8 отделениях хирургического и терапевтического профиля также подтвердил роль предшествующей терапии ципрофлоксацином как фактора риска MRSA-инфекции (p=0,02) [34]. Интересны данные о влиянии субингибирующих концентраций фторхинолонов на штаммы MRSA, в результате чего индуцируется продукция фибронектин-связывающих белков, являющихся одним из факторов адгезии возбудителя [35].
Устойчивость Enterococcus spp. к гликопептидам . Устойчиивость Enterococcus spp. (в основном E. faecalis) к гликопептидам (ванкомицину) в наибольшей степени распространена в Северной Америке, где в ОРИТ частота резистентности среди энтерококков может достигать 50–80% [36]. В странах Европейского Союза этот показать колеблется в широких пределах: от 0 до 45% [37]. В России ванкомицинрезистентные энтерококкоки впервые были описаны в 2010 г [38], их распространение составляет реальную проблему для специализированных учреждений, таких как онкогематологические.
Понимание актуальности проблемы заметного роста устойчивости микроорганизмов к антибиотикам на фоне относительной стагнации в создании новых препаратов привело к переоценке практики их использования. Исследование тенденций роста резистентности, изучение феномена «параллельного ущерба» и законов распространения «проблемных» микроорганизмов привели к формулированию различных по эффективности принципов рационального использования АМП, реализующихся в локальных и глобальных стратегиях их применения.
Литература
-
European Committee for Antimicrobial Susceptibility Testing European Society of Clinical Microbiology Infectious Diseases: Terminology relating to methods for the determination of susceptibility of bacteria to antimicrobial agents. Clin Microbiol Infect 2000, 6:503-508.
-
Черкашин Е.А., Федорчук В.В., Иванов Д.В., Сидоренко С.В., Тишков В.И. Исследование распространения металло-бета-лактамаз в Российской Федерации. Вестник Московского университета. 2006 Серия 2: Химия. 47(2): 83-86.
-
Shevchenko O, Edelstein M. Epidemic population structure of MBL-producing Pseudomonas aeruginosa in Russia. 47th ICAAC 2007; C2: 1499.
-
Shevchenko, O. V., et al. (2012). «First detection of VIM-4 metallo-beta-lactamase-producing Escherichiacoli in Russia.» Clinical microbiology and infection: the official publication of the European Society of Clinical Microbiology and Infectious Diseases 18(7): E214-217.
-
Sukhorukova M. et al. First outbreak of carbapenem-resistant OXA-48–producing Klebsiella pneumoniae in Russia // 22nd European Congress of Clinical Microbiology and Infectious Diseases.— 2012
-
Агеевец ВА, Партина ИВ, Лисицына ЕС, Батыршин ИМ, Попенко ЛН, Шляпников СА, Ильина ЕН, Сидоренко СВ: Первое обнаружние металло-бета-лактамазы NDM-типа в многопрофильном стационаре в России. Медицинский академический журнал 2012, 12:43-45.
-
Barantsevich EP, Churkina IV, Barantsevich NE, Pelkonen J, Schlyakhto EV, Woodford N: Emergence of Klebsiella pneumoniae producing NDM-1 carbapenemase in Saint Petersburg, Russia. Journal of Antimicrobial Chemotherapy 2013, 68:1204-1206.
-
Ageevets VA, Partina IV, Lisitsyna ES, Ilina EN, Lobzin YV, Shlyapnikov SA, Sidorenko SV: Emergence of carbapenemase-producing Gram-negative bacteria in Saint Petersburg, Russia. Int J Antimicrob Agents 2014, 44:152-155.
-
Сухорукова МВ, Эйдельштейн МВ, Скслеенова ЕЮ, Иванчик НВ, Тимохова АВ, Дехнич АВ, Козлов РС: Антибиотикорезистентность нозокомиальных штаммов Enteroacteriaceae в стационарах России: результаты многоцентрового эпидемиологического исследования Марафон в 2011-2012 гг Клиническая микробиология и антимикробная химиотерапия 2014, 16:254-265
-
Агеевец, В.А., Лазарева, И.В., Ершова, Т.А., и соавт. Распространенность и антибактериальная резистентность грамотрицательных бактерий, продуцирующих карбапенемазы в Санкт-Петербурге и некоторых других регионах Российской Федерации. Антибиотики и химотерапия, 2016, 61, 11-12, 28-38.
-
Sader HS, Castanheira M, Flamm RK, Mendes RE, Farrell DJ, Jones RN: Tigecycline activity tested against carbapenem-resistant Enterobacteriaceae from 18 European nations: results from the SENTRY surveillance program (2010-2013). Diagn Microbiol Infect Dis 2015.
-
Kehl SC, Dowzicky MJ: Global assessment of antimicrobial susceptibility among Gram-negative organisms collected from pediatric patients between 2004 and 2012: results from the Tigecycline Evaluation and Surveillance Trial. J Clin Microbiol 2015, 53:1286-1293.
-
Liu Y-Y, Wang Y, Walsh TR, Yi L-X, Zhang R, Spencer J, Doi Y, Tian G, Dong B, Huang X, et al: Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study. The Lancet Infectious Diseases 2016, 16:161–168.
-
Sanders, C. C. and W. E. Sanders (1979). «Emergence of Resistance to Cefamandole: Possible Role of Cefoxitin-Inducible Beta-Lactamases.» Antimicrobial Agents and Chemotherapy 15(6): 792-797.
-
Gazouli, M., Sidorenko, S. V., Tzelepi, E., Kozlova, N. S., Gladin, D. P., Tzouvelekis, L. S. (1998). «A plasmidmediated beta-lactamase conferring resistance to cefotaxime in a Salmonella typhimurium clone found in St Petersburg, Russia.» J Antimicrob Chemother 41(1): 119-121.
-
Сидоренко С.В., Страчунский Л.С., Ахмедова Л.И., Белобородов В.Б., Богомолова Н.С., Большаков Л.В., Дехнич А.В., Карабак В.И., Маликов В.Е., Поликарпова С.В., Руднов В.А., Яковлев В.П., Павлова М.В. Результаты мноцентрового исследования сравнительной активности цефепима и других антибиотиков в отношении возбудителей тяжелых госпиталь ных инфекций (программа «Micromax»). Антибиотики. 1999. № 11. С. 7.
-
Hernandez, J., Stedt, J., Bonnedahl, J., Molin, Y., Drobni, M., Calisto-Ulloa, N., et al. (2012). «Humanassociated extended-spectrum beta-lactamase in the Antarctic.» Appl Environ Microbiol 78(6): 2056-2058.
-
Chow J.W., Satishchandran V., Snyder T.A., et al. In vitro susceptibilities of aerobic and facultative gramnegative bacilli isolated from patient with intra-abdominal infections worldwide: the 2002 Study for Monitoring Antimicrobial Resistance Trend (SMART). Surg Infect 2005; 6:439-48.
-
Каменева О.А., Морозова С.Е., Пунченко О.Е., Косякова К.Г., Сидоренкол С.В. Этиологическая структура и антибиотикорезистентность возбудителей внебольничных инфекций мочевыводящих путей в Санкт-Петербурге, 2013 2015 гг. Антибиотики и химиотерапия. В печати.
-
Яковлев С.В., Суворова М.П., Белобородов В.Б., Басин Е.Е., Елисеева Е.В., Ковеленов С.В, и члены исследовательской группы ЭРГИНИ. Распространенность и клиническое значение нозокомиальных инфекций в лечебных учреждениях России: исследование ЭРГИНИ. Антибиотики и химиотерапия 2016; т. 61, № 5-6, с. 32-42.
-
Сидоренко С.В., Колбин А.С., Шляпников С.А.и соавт. Фармакоэпидемиологическое исследование использования антибактериальных средств в многопрофильных стационарах Санкт-Петербурга. Антибиотики и химиотерапия. В печати.
-
Saurina G., Quale J.M., Manikal V.M., et al. Antimicrobial resistance in Enterobacteriacea in Brooklyn, NY: epidemiology and relation to antibiotic usage patterns. J Antimicrob Chemother 2000; 45:895-8.
-
Asensio A., Oliver A., Gonzales-Diego P., et al. Outbreak of a multiresistant K. pneumoniae strain in an intensive care unit: antibiotic use as a risk factor for colonization and infection. Clin Infect Dis 2000; 30:55-60.
-
Lautenbach E., Patel J.B., Bilker W.B., et al. Extended-spectrum beta-lactamase-producing E. coli and K. pneumoniae: risk factors for infection and impact of resistance on outcomes. Clin Infect Dis 2001; 32:1162-71.
-
Paterson D.L., Ko W.C., Von Gottberg A., et al. International prospective study of K. pneumoniae bacteremia: implications of extended-spectrum beta-lactamase production in nosocomial infections. Ann Intern Med 2004; 140:26-32.
-
Zavascki A.P., Barth A.L., Gaspareto P.B., et al. Risk factors for nosocomial infections due to Pseudomonas aeruginosa producing metallo-beta-lactamase in two tertiary-care teaching hospitals. J Antimicrob Chemother 2006; 58:882-5.
-
Johnson S., Gerding D.N. C. difficile-associated diarrhea. Clin Infect Dis 1998; 26:1027-36.
-
Nelson D.E., Auerbach S.B., Baltch A.L., et al. Epidemic C. difficile-associated diarrhea: role of secondand third-generation cephalosporins. Infect Control Hosp Epidemiol 1994; 15:88-94.
-
Golledge C.L., McKenzie T., Riley T.V. Extended spectrum cephalosporins and C. difficile. J Antimicrob Chemother 1989; 23:929-31.
-
Schwaber M.J., Simhon. A., Block C., et al. Factors associated with nosocomial diarrhea and C. difficileassociated disease on the adult wards of an urban tertiary care hospital. Eur J Clin Microbiol Infect Dis 2000; 19:9-15.
-
Ludlam H., Brown N., Sule O., et al. An antibiotic policy associated with reduced risk of C. difficileassociated diarrhea. Age Ageing 1999; 28:578-80.
-
Гостев В.В., Сидоренко С.В. «Метициллинрезистентные золотистые стафилококки: проблема распространения в мире и России. .» Фарматека. 2015. (6): 30 38.
-
Tacconelli E., De Angelis G., Cataldo M.A., et al. Does antibiotic exposure increase the risk of methicillinresistant Staphylococcus aureus (MRSA) isolation? A systematic review and meta-analysis. J Antimicrob Chemother 2008; 61:26-38.
-
Sarma J.B., Ahmed G.U. Characterisation of methicillin resistant S. aureus strains and risk factors for acquisition in a teaching hospital in northeast India. Indian J Med Microbiol 2010; 28:127-9.
-
Bisognano C., Vaudaux P., Rohner P., et al. Introduction of fibronectin-binding proteins and increased adhesion of quinolone-resistant S. aureus by subinhibitory levels of ciprofloxacin. Antimicrob Agents Chemother 2000; 44:1428-37
-
Weiner, L. M., et al. (2016). «Antimicrobial-Resistant Pathogens Associated With Healthcare-Associated Infections: Summary of Data Reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2011-2014.» Infect Control Hosp Epidemiol 37(11): 1288-1301.
-
European Centre for Disease Prevention and Control. Antimicrobial resistance surveillance in Europe 2015. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). Stockholm: ECDC; 2017
-
Brilliantova, A. N., Kliasova, G. A. Mironova, A. V. et al. «Spread of vancomycin-resistant Enterococcus faecium in two haematological centres in Russia.» Int J Antimicrob Agents 2010. 35(2): 177-181.
Раздел 4. Организационные вопросы реализации программы СКАТ. Роль отдела клинической фармакологии и комиссии по профилактике инфекций, связанных с оказанием медицинской помощи
Для реализации программы СКАТ в стационаре необходимы:
-
Комиссия по профилактике инфекций, связанных с оказанием медицинской помощи
-
Документы по рационализации использования АМП и контролю нозокомиальных инфекций/антибиотикорезистентности, утвержденные главным врачом медицинской организации:
-
Рекомендации (алгоритмы) по диагностике и антимикробной терапии инфекций.
-
Рекомендации по профилактике нозокомиальных инфекций (катетер-ассоциированные ангиогенные инфекции, катетер-ассоциированные мочевые инфекции, НПивл).
-
Журнал регистрации инфекционных заболеваний ф.60 (НПивл, катетер-ассоциированные ангиогенные и мочевые инфекции, инфекция области хирургического вмешательства, антибиотикоассоциированная диарея и псевдомембранозный колит, вызванные C.difficile) и носителей штаммов-продуцентов карбапенемаз.
Задачами работы отдела клинической фармакологии и комиссии по профи- лактике инфекций, связанных с оказанием медицинской помощи:
-
Учет и создание базы данных инфекций, связанных с оказанием медицинской помощи (определение методологии и активное выявление) и разработка документа по профилактике;
-
Разработка рекомендаций по лечению инфекций (критерии диагноза, выбор антибиотика, дозы, длительность, комбинации, объективные критерии отмены) и их модификация;
-
Реализация мероприятий по ограничению доступности антибиотиков;
-
Обучение на всех уровнях (врачи, клинические ординаторы, сотрудники кафедр, медицинские сестры);
-
Консультации по лечению пациентов с тяжелыми инфекционными процессами;
Основные подходы к реализации стратегии и тактики использования АМП в стационаре и управлению антибиотикотерапией, а также опыт внедрения этой стратегии приведены в отечественных и зарубежных рекомендациях и ряде научных публикаций [1-11].
Указанные задачи не могут быть эффективно решены без участия службы клинической фармакологии, наделенной административными полномочиями. Отмечена четкая зависимость между качеством назначения АМП, наличием службы клинической фармакологии в медицинских организацих и статусом данной службы. Эффективность программ авторизации как компонента системы управления качеством применения АМП является более высокой, чем эффективность образовательных программ. Наиболее высока рациональность назначений АМП в стационаре, где служба клинической фармакологии активно проводит программы авторизации, что свидетельствует о необходимости делегирования административных полномочий клиническому фармакологу на уровне заместителя главного врача.
Служба клинической фармакологии, наделенная административными полномочиями, способна значительно снизить как прямые неоправданные расходы, связанные с использованием АМП, так и косвенные, за счет уменьшения продолжительности пребывания пациентов в стационаре (отказ от избыточных инъекций; сокращение продолжительности лечения в связи с уменьшением риска возникновения инфекции области хирургического вмешательства; повышение приверженности к выполнению стандартов, уменьшение расходов системы ОМС на поликлиническом этапе) [12].
Эффективно работающая служба клинической фармакологии является центральным компонентом системы рационального использования АМП. Деятельность службы клинической фармакологии регламентируется Приказом Министерства здравоохранения и социального развития Российской Федерации (Минздравсоцразвития России) от 22 ноября 2010 г. № 1022н «Об утверждении Порядка оказания медицинской помощи населению по профилю». «Клиническая фармакология» [13].
«Медицинская помощь населению по профилю «Клиническая фармакология» осуществляется в целях повышения эффективности и безопасности лечения путем консультативного сопровождения лекарственной терапии, назначенной пациенту в соответствии с установленными стандартами медицинской помощи в рамках первичной медико-санитарной и специализированной медицинской помощи в виде консультации врача клинического фармаколога, врачебного консилиума с участием врача–клинического фармаколога».
Рекомендуемые штатные нормативы для медицинского персонала кабинета врача – клинического фармаколога и отделения клинической фармакологии изложены в Приложении 3 к Порядку. Согласно данному Приложению, должность врача – клинического фармаколога вводится из расчета 1 должность на 250 коек, 1 должность на 500 посещений в смену; медицинского работника со средним медицинским или фармацевтическим образованием – 1 должность на 2 должности врача – клинического фармаколога.
На должность врача назначается специалист, соответствующий Квалификационным требованиям к специалистам с высшим и послевузовским медицинским и фармацевтическим образованием в сфере здравоохранения, утвержденным приказом Минздравсоцразвития России от 7 июля 2009 г. № 415н (зарегистрирован Минюстом России 9 июля 2009 г. № 14292), по специальности «Клиническая фармакология».
Работа отдела клинической фармакологии в лечебном учреждении является неотъемлемой частью системы контроля применения АМП. Клинические фармакологи должны располагать административными полномочиями при использовании АМП. При необходимости возможно создание в структуре отдела должности антимикробного химиотерапевта.
В рамках направления по оптимизации использования в стационаре АМП работа клинического фармаколога (отдела) заключается в следующем:
-
консультации по вопросам антимикробной терапии, оптимизация протоколов с учетом особенностей каждого клинического случая;
-
организация взаимодействия клинического фармаколога с главным врачом, заместителями главного врача, заведующими отделениями, врачом-эпидемиологом, микробиологом, заведующим аптекой в вопросах применения АМП;
-
организация перманентного мониторинга антибиотикорезистентности в медицинской организации и создание паспорта локальной антибиотико-резистентности в каждом отделении стационара;
-
разработка, создание и внедрение формуляра АМП с основным и резервным перечнем АМП;
-
внедрение программ периоперационной антибиотикопрофилактики и контроль за их выполнением;
-
регистрация нежелательных лекарственных реакций при использовании АМП;
-
организация и проведение клинико-экономического анализа примене ния АМП, в т.ч. ABC/VEN анализа, в целях рационального использования выделяемых финансовых средств;
-
участие в организации и проведении образовательных программ по рациональной антимикробной терапии и профилактике инфекций.
Литература
-
Стратегия и тактика применения антимикробных средств в лечебных учреждениях России: Российские национальные рекомендации / Под ред. В.С.Савельева, Б.Р.Гельфанда, С.В.Яковлева. – М.: ООО «Компания БОРГЕС», 2012. – 92 с. Текст рекомендаций представлен на сайте http://www.antimicrob.net
-
Стратегия и тактика рационального применения антимикробных средств в амбулаторной практике6 Российские практические рекомендации / под ред. С.В.Яковлева, С.В.Сидоренко, В.В.Рафальского, Т.В.Спичак. М.: Издательство «Пре100 принт», 2014. – 121 с. Текст рекомендаций представлен на сайте www.antimicrob.net
-
Dellit TH, Owens RC, McGowan JE, et al. Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America Guidelines for Developing an Institutional Program to Enhance Antimicrobial Stewardship. Clinical Infectious Diseases 2007; 44:159–77.
-
Shlaes DM, Gerding DN, John JF, Jr., et al. Society for Healthcare Epidemiology of America and Infectious Diseases Society of America Joint Committee on the Prevention of Antimicrobial Resistance: Guidelines for the Prevention of Antimicrobial Resistance in Hospitals. Clinical Infectious Diseases 1997;25:584–99.
-
Drew RH. Antimicrobial Stewardship Programs: How to Start and Steer a Successful Program. J Manag Care Pharm. 2009;15(2)(Suppl):S18-S23.
-
Pollack LA, Srinivasan A. Core Elements of Hospital Antibiotic Stewardship Programs From the Centers for Disease Control and Prevention. Clinical Infectious Diseases 2014;59(S3):S97–100.
-
Nagel JL, Stevenson JG, Eiland III EH, Kaye KS. Demonstrating the Value of Antimicrobial Stewardship Programs to Hospital Administrators. Clinical Infectious Diseases 2014;59(S3):S146–53.
-
DePestel DD, Eiland III EH, Lusardi K, et al. Assessing Appropriateness of Antimicrobial Therapy: In the Eye of the Interpreter. Clinical Infectious Diseases 2014;59(S3):S154–61.
-
Bumpass JB, McDaneld PM, DePestel DD, et al. Outcomes and Metrics for Antimicrobial Stewardship: Survey of Physicians and Pharmacists. Clinical Infectious Diseases 2014;59(S3):S108–11.
-
Яковлев С.В. Необходимость внедрения в медицинских организациях программ сдерживания антибиотикорезистентности. Здоровье нации 2013; №3 (26): 22-24.
-
Яковлев С.В., Проценко Д.Н., Шахова Т.В. и соавт. Антибиотикорезистентность в стационаре: контролируем ли мы ситуацию? Антибиотики и химиотерапия 2010; 55(1-2):50-58.
-
Елисеева Е.В., Гайнуллина Ю.И., Гельцер Б.И.. Управление качеством в сфере применения антибактериальных препаратов // Владивосток: Дальнаука, 2010. – 180 с.
-
Приказ Министерства здравоохранения и социального развития Российской Федерации (Минздравсоцразвития России) от 22 ноября 2010 г. № 1022н, г. Москва, «Об утверждении Порядка оказания медицинской помощи населению по профилю «Клиническая фармакология».
Раздел 5. Этапы реализации программы СКАТ
Объем мероприятий СКАТ зависит от уровня антибиотикорезистентности в стационаре, характера потребления АМП и доступных ресурсов лечебного учреждения. Необходимо, чтобы внедрение СКАТ проходило под эгидой повышения качества и безопасности оказания медицинской помощи больным. Основные этапы реализации СКАТ описаны в отечественных и международных рекомендациях [1, 2]. К ним относятся:
-
Формирование мультидисциплинарной команды специалистов, которые имеют возможность влиять на принятие решений по вопросам использования АМП. Возглавить группу специалистов должен представитель администрации медицинской организации (например, заместитель главного врача по лечебной работе), обладающий реальными рычагами управления лечебным процессом и признанным авторитетом среди коллег. Ключевыми фигурами в команде являются клинический фармаколог, клинический микробиолог, врач-эпидемиолог. Данные специалисты должны иметь реальные полномочия для достижения ожидаемых результатов СКАТ. Члены команды в рамках улучшения качества антимикробной терапии и ограничения распространения полирезистентных микроорганизмов в стационаре взаимодействуют с руководителями профильных отделений, группой инфекционного контроля, отделом обеспечения медикаментами и расходным материалом, аптекой, отделом технической поддержки МИС и ЛИС.
-
Принятие стратегии ограничения использования АМП. Существует две основных стратегии, которые могут быть применены одновременно.
Проспективный аудит с обратной связью. При этом варианте ограничительной стратегии каждое назначение антибиотиков с целью лечения согласуется с экспертом по антимикробной терапии, обладающим актуальными знаниями локальной микробиологии в подразделениях стационара. После назначения антимикробной терапии данный специалист осуществляет контроль адекватности терапии и вносит необходимые коррективы. Для эффективной работы этого механизма нагрузка на 1 специалиста в идеале не должна превышать 20 пациентов, одновременно получающих АМП, однако в реальной практике эти показатели труднодостижимы. Поэтому необходимо внедрять в стационаре информационные технологии принятия решений и обеспечить специалистов, осуществляющих контроль за антимикробной терапией мобильными компьютеризированными системами для быстрого принятия решения в критические моменты применения АМП – оценка ранней эффективности, модификация терапии на основании микробиологических данных, отмена АМП и др.).
Протокол эмпирической антимикробной терапии. Протокол должен быть основан на данных о локальной антибиотикорезистентности. Для обеспечения репрезентативности данных необходимо анализировать результаты первичных посевов из очагов инфекции за 6-12 мес. На преаналитическом этапе большую пользу в создании базы данных микроорганизмов могут оказать медицинские информационные системы (МИС, ЛИС). Схемы эмпирической антимикробной терапии должны быть созданы для наиболее частых локусов нозокомиальной инфекции: дыхательные пути и легкие, мочевыводящие пути, кожа и мягкие ткани, брюшная полость, катетер-ассоциированные ангиогенные инфекции. При необходимости следует добавить инфекции другой локализации, актуальные для конкретной медицинской организации. Внутри каждой локализации инфекции важно разработать дифференцированные режимы антимикробной терапии с учетом факторов риска наличия полирезистентных возбудителей у пациента (см. Приложение 2). Для включения в схемы терапии выбирают АМП, уровень чувствительности к которым составляет ≥80% среди 5 наиболее частых возбудителей инфекции данной локализации. В случае наиболее проблемных возбудителей этот порог может быть ниже. В связи с изменением уровня микробной резистентности протокол подлежит пересмотру каждые 6-12 месяцев.
Протокол должен содержать следующие разделы:
-
данные локального микробиологического мониторинга медицинской организации за анализируемый период;
-
показания к антимикробной терапии согласно национальным и международным рекомендациям;
-
действия врача перед назначением антимикробной терапии: стратификация риска резистентных возбудителей и инвазивного кандидоза у пациента, взятие материала для микробиологического исследования;
-
дифференцированные схемы эмпирической антимикробной терапии с комментариями по режимам дозирования, кратности и пути введения препаратов;
-
действия врача после получения результатов микробиологического исследования: деэскалация, эскалация, оптимизация антимикробной терапии и т. д.;
-
ситуации, когда участие клинического фармаколога при назначении антимикробной терапии является обязательным: сепсис и септический шок, неэффективность эмпирической антимикробной терапии АМП 1-й и 2-й линии, выделение полирезистентных возбудителей;
-
критерии оценки и сроки эффективности терапии и лечебная тактика при отсутствии эффекта антимикробной терапии;
-
рекомендуемая длительность антимикробной терапии, критерии отмены АМП.
Протокол эмпирической антимикробной терапии помимо бумажного варианта может быть оформлен в виде наглядного пособия (постера), что значительно облегчает его практическое применение в отделениях стационара (Приложения 2-6). Возможна частичная интеграция протокола в медицинскую информационную систему клиники с созданием программы автоматических напоминаний (или алгоритмов решений) по наиболее частым и возможным для алгоритмизации нозологических форм (например, внебольничная пневмония, пиелонефрит, инфекционный эндокардит).
-
Корректировка больничного формуляра АМП. В формуляр должны быть включены все препараты для периоперационной антибиотикопрофилактики и антимикробной терапии, что обеспечит эффективное применение протоколов. Кроме того, из больничного формуляра необходимо исключить АМП, обладающие низкой эффективностью согласно данным локального мониторинга антибиотикорезистентности медицинской организации.
-
Приказ о правилах назначения АМП в отделениях стационара. Протоколы периоперационной антибиотикопрофилактики и эмпирической антимикробной терапии должны быть утверждены приказом руководителя медицинской организации, с этого момента они приобретают законную силу, их исполнение является обязательным для всех сотрудников и может быть проконтролировано со стороны администрации медицинской организации.
-
Программа контроля инфекций. В рамках эффективной реализации СКАТ необходимо осуществлять как мероприятия по снижению антибиотикорезистентности, так и меры по контролю распространения поли и панрезистентных штаммов нозокомиальных микроорганизмов. Ключевыми моментами являются программа гигиены рук, доступность спиртсодержащих кожных антисептиков, изоляция пациентов с инфекцией/колонизацией полирезистентными возбудителями, эффективная дезинфекция (см. раздел 10).
-
Образовательные программы. Проведение образовательных семинаров для целевой аудитории (хирурги, терапевты, неврологи и др.), а также персональные консультации специалистов по вопросам рационального применения АМП и контроля распространения антибиотикорезистентности позволяют значительно повысить приверженность к выполнению ключевых принципов СКАТ.
-
Внутренний аудит. Необходим текущий контроль исполнения приказа о правилах назначения АМП в отделениях стационара. Такой контроль может включать в себя анализ причин немотивированной выдачи антибиотиков широкого спектра из аптеки в отделения стационара (клинический фармаколог, заместитель главного врача по лечебной работе), наличие и информативность записей в медицинской документации, касающихся обоснования назначения, смены и отмены АМП (экспертный отдел). Эффективной формой является ретроспективный аудит правильности проведения антимикробной терапии у 5-10% пациентов, получавших антибиотики. Внутренний аудит, проводимый в соответствии с положениями больничных протоколов, позволяет выявить системные ошибки, устранение которых также ведет к повышению эффективности программы СКАТ.
-
Поддержка микробиологической лаборатории (см. раздел 11). Базовым принципом реализации СКАТ является анализ локальной антибиотикорезистентности, поэтому одним из приоритетных направлений развития медицинских организаций должно являться формирование собственной современной службы бактериологии. Оценку рентабельности этой структуры необходимо проводить не изолированно, а с учетом общей эффективности СКАТ в плане снижения экономических затрат на закупку АМП и улучшения качества лечения больных инфекцией.
-
Оценка эффективности программы СКАТ (см. раздел 13). Регулярный анализ критериев эффективности позволяет определить, достигнута ли основная цель СКАТ – контроль антибиотикорезистентности, как изменилось потребление АМП и качество медицинской помощи пациентам с инфекцией. Результаты анализа дают возможность своевременно вносить необходимые коррективы в объем и направленность мероприятий СКАТ.
Литература
-
Стратегия и тактика применения антимикробных средств в лечебных учреждениях России: Российские национальные рекомендации / Под ред. В.С.Савельева, Б.Р.Гельфанда, С.В.Яковлева. – М.: ООО «Компания БОРГЕС», 2012. – 92 с. Текст рекомендаций представлен на сайте http://www.antimicrob.net
-
Dellit T.H., Owens R.C., McGowan J.E. Jr. et al. Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America guidelines for developing an institutional program to enhance antimicrobial stewardship // Clin. Infect. Dis. – 2007. – №44. Р. 159–177.
Раздел 6. Больничный Формуляр антимикробных средств
Под формулярным списком понимают перечень препаратов, носящий ограничительно-рекомендательный характер, утвержденный для применения уполномоченными лицами в конкретной системе здравоохранения. Лекарственное средство включают в формуляр, если: в нем существует клиническая необходимость; его клиническая эффективность научно документирована; в формулярном списке нет препарата, удовлетворяющего ту же потребность; препарат приемлем по соотношению затратность/эффективность.
В составлении формуляра АМП принимают участие члены формулярной комиссии: клинические фармакологи, инфекционисты, клинические микробиологи, заведующие профильными клиническими отделениями.
Формулярный список АМП – документ, содержание которого постоянно уточняется и дополняется. При решении вопроса о включении АМП в формулярный список или его исключении эксперты руководствуются информацией о структуре заболеваемости, особенностях локальной резистентности клинически значимых возбудителей, доказательных данных в отношении наиболее эффективных и безопасных схем антибактериальной терапии. Больничный формуляр антибиотиков периодически пересматривают в зависимости от локальных данных по антибиотикорезистентности и появления новых антибактериальных препаратов.
Формирование больничного формуляра АМП производится в зависимости от потребностей медицинской организации для адекватного лечения и профилактики основных нозологических форм внебольничных и нозокомиальных инфекций и определяется профилем медицинской организации и входящих в его состав лечебных отделений. С целью рационального использования включенных в формуляр АМП и сдерживания антибиотикорезистентности необходимо определить авторизацию назначения каждого из АМП. Для этого включенные в формуляр АМП относят к одному из трех ограничительных списков или групп (А, Б, В):
-
в группу «А» входят АМП, которые врач может назначить самостоятельно для лечения или профилактики инфекций в соответствии с утвержденными в медицинской организации рекомендациями по терапии и алгоритмами лечения;
-
в группу «Б» входят АМП, назначение которых должно быть согласовано с клиническим фармакологом;
-
в группу «В» входят резервные АМП, назначение которых должно быть согласовано с клиническим фармакологом (в случае его отсутствия с заместителем главного врача по профилю) и утверждено ЛКК.
В некоторых многопрофильных стационарах ограничительные перечни АМП могут различаться для некоторых отделений. В частности, для ОРИТ допускается расширение перечня АМП, которые врач может назначить самостоятельно, то есть объединение списков А и Б.
Еще одним немаловажным фактором, определяющим отнесение АМП в одну из трех ограничительных групп, является текущая ситуация с локальной антибиотикорезистентностью. Например, в формулярах большинства стационаров цефалоспорины III поколения отнесены к группе А свободного использования, однако при высоком уровне устойчивости к этим препаратам возбудителей нозокомиальных инфекций, целесообразно эти АМП отнести к группе Б или даже В, по крайней мере при нозокомиальных инфекциях.
В медицинских организациях, где отсутствуют специалисты по антимикробной терапии клинические фармакологи, возможно использование упрощенной схемы авторизации использования АМП с отнесением их к одному из двух перечней – А и Б: А – возможность назначения лечащим врачом, Б – необходимость утверждения назначения АМП заместителем главного врача по профилю и ЛКК.
Включение любого АМП в формуляр определяется потребностью стационара, должно быть тщательно обосновано Формулярной комиссией, а также определены основные области применения АМП (внебольничные или нозокомиальные инфекции, локализация инфекции) и профили отделений, в которых он может назначаться. Необходимо подчеркнуть, что Федеральные и региональные списки ЖНВЛП носят исключительно рекомендательный характер. Отсутствие АМП в указанных списках не может быть аргументом для невключения АМП в больничный формуляр, так как любые АМП относятся к жизненноважным препаратам ввиду потенциальной опасности любых инекций для жизни и здоровья пациентов. Кроме того, в резерве больничной аптеки должны быть все потенциально необходимые АМП (антибиотики и антифунгальные средства), даже редко используемые, так как при возникновении неотложной ситуации, например, сепсиса, эффективное лечение может быть достигнуто только при неотложном назначении АМП (в первые часы после установления диагноза), что крайне сложно реализовать при отсутствии необходимого препарата в медицинской организации и необходимости проведении разовой закупки АМП.
Приведенный перечень оптимальных АМП для больничного формуляра носит рекомендательный характер и может быть основой для формирования списка лечебного учреждения с учетом его специфики и указанных выше аргументов (Приложение 1).
Некоторые АМП не должны включаться в больничный формуляр по причине высокого уровня устойчивости, либо отсутствия доказательной базы эффективности, либо неудовлетворительного профиля безопасности или фармакокинетики (ФК). К таким АМП можно отнести:
-
комбинированный препарат ампициллина и оксациллина (низкие дозы, нерациональная комбинация);
-
оксациллин, ампициллин и эритромицин для приема внутрь (низкая биодоступность);
-
карбенициллин (низкая антисинегнойная активность по сравнению с другими антипсевдомонадными антибиотиками; токсичность);
-
цефалотин (по антимикробной активности и ФК уступает цефазолину);
-
цефаклор (по антимикробной активности уступает цефуроксим аксетилу и пероральным цефалоспоринам III поколения);
-
цефамандол (по антимикробной активности уступает другим цефалоспоринам);
-
налидиксовая кислота, пипемидиевая кислота (рост устойчивости уропатогенных штаммов E.coli, в т.ч. внебольничных, лимитирует эффективное использование этого ЛС; использование фторированных хинолонов предпочтительнее также с позиций фармакокинетики);
-
сульфаниламиды (исключение – ко-тримоксазол), хрорамфеникол (в настоящее время в клинической практике есть более эффективные и безопасные АМП); исключение – комбинированный препарат ко-тримоксазол, который необходим в определенных ситуациях (пневмоцистная пневмония, нокардиоз, нетяжелые MRSA инфекции);
-
нитроксолин (нет современных данных по антимикробной активности и эффективности);
-
фосфомицина трометамол (ЛС имеет только одно зарегистрированное показание – острый неосложненный цистит, поэтому в стационаре не применяется);
-
нистатин, леворин (антифунгальные средства, практически не абсорбирующиеся в ЖКТ; не рекомендуются для лечения и профилактики инвазивного кандидоза);
-
кетоконазол (низкая и вариабельная биодоступность при приеме внутрь; не рекомендуется для лечения и профилактики инвазивного кандидоза);
-
амантадин, римантадин (высокая устойчивость вируса гриппа А; не рекомендуются для лечения и профилактики сезонного гриппа)
Раздел 7. Стратегические и тактические вопросы рационализации применения АМП с профилактической и лечебной целью
В современных условиях широкого распространения в стационарах антибиотикорезистентных штаммов микроорганизмов наблюдается закономерное снижение клинической эффективности большинства АМП при лечении нозокомиальных инфекций. В этой связи крайне важно строго соблюдать стратегические принципы рационального использования АМП в стационаре, которые заключаются в разработке правил (алгоритмов) назначения антибиотиков и реализации мероприятий, направленных на уменьшение нерационального использования АМП. Все это имеет важнейшее значение в глобальной стратегии стационаров по сдерживанию антибиотикорезистентности, которая во многом является ятрогенной проблемой и прямо связана с частотой назначений антибиотиков и структурой их потребления.
7.1.Принципы рационального применения АМП в стационаре
Учитывая объективные сложности лечения нозокомиальных инфекций (тяжесть состояния пациентов, сопутствующие заболевания, часто полимикробный характер инфекции, возможность выделения при нозокомиальных инфекциях возбудителей с множественной устойчивостью к антибактериальным средствам), необходимо соблюдать следующие принципы рационального применения антибиотиков в стационаре:
-
Антибактериальную терапию следует начинать неотложно после диагностики инфекции до получения результатов бактериологического исследования. При сепсисе адекватный АМП должен быть введен в течение первого часа после установления диагноза, сразу после взятия материала для микробиологического исследования (кровь и другой биологический материал, полученный из локусов, максимально приближенных к предполагаемому очагу инфекции, желательно инвазивным способом).
-
Выбор стартового эмпирического режима терапии должен быть регла ментирован с учетом вероятного спектра возбудителей (в зависимости от локализации очага инфекции) и их возможной устойчивости (данные локального мониторинга антибиотикорезистентности в медицинской организации). При некоторых локализациях очага инфекции необходимо учитывать фармакокинетику антибиотиков, т.е. способность проникать и накапливаться в различных тканях и жидкостях организма (СМЖ, моча, желчь, кость, клапаны сердца и др.).
-
При тяжелых инфекциях принципиально важно назначение уже на первом этапе лечения адекватного режима антибактериальной терапии, что подразумевает применение эмпирической терапии с максимально полным охватом всех потенциальных возбудителей инфекции данной локализации и учетом возможной антибиотикорезистентности. Этот принцип максимальной стартовой эмпирической терапии (деэскалационной) особенно необходим при лечении сепсиса и септического шока, так как установлено, что в случае неадекватной стартовой терапии достоверно увеличивается риск летального исхода [1-4]. В случае неадекватного выбора стартовой эмпирической терапии НПивл и сепсиса риск летального исхода увеличивается в 2,5-3 раза.
-
Первоначальную оценку эффективности терапии следует проводить в течение 48-72 ч после начала лечения, ориентируясь на динамику симптомов. Если в эти сроки не наблюдается положительного эффекта, то режим антимикробной терапии следует скорректировать. В более ранние сроки после назначения антибиотика (12-24 ч) оценить эффективность терапии затруднительно, так как максимальное бактерицидное действие препарата (киллинг бактерий) развивается, как правило, через 24-48 ч после начала лечения.
-
Во время применения АМП необходимо ежедневно контролировать состояние пациента с целью оценки клинической эффективности лечения, регистрации возможных нежелательных реакций и определения оптимальной продолжительности терапии; в этой связи, наряду с традиционными клиническими и лабораторными показателями ССВР, следует мониторировать маркеры бактериального воспаления (прокальцитонин, С-реактивный белок) и оценивать в динамике суррогатные показатели, такие как SOFA .
-
Профилактическое применение антибиотиков в послеоперационном периоде (при отсутствии клинических признаков инфекции) или с целью профилактики других нозокомиальных инфекций в большинстве случаев следует признать нерациональным и нежелательным (раздел 9).
-
Введение антибиотиков следует осуществлять в соответствии с официальными инструкциями. Основные пути введения – внутривенный, внутримышечный, пероральный, для некоторых антибиотиков ингаляционный. Другие пути введения (интраартериальный, эндолимфатический, внутрибрюшной, в рану) не имеют доказанных преимуществ по сравнению с традиционными, не изучены на безопасность и не разрешены к применению.
Выбор антибактериального препарата может осуществляться на основании установленной этиологии инфекции и уточненной чувствительности возбудителя к антибиотикам – такую терапию определяют как целенаправленную или этиотропную. В других ситуациях, когда возбудитель неизвестен, препарат назначают эмпирически. В последнем случае при выборе антибиотика учитывают вероятный спектр микроорганизмов, вызывающих инфекцию определенной локализации, и основные тенденции антибиотикорезистентности наиболее вероятных возбудителей. Понятно, что в клинической практике наиболее часто врач вынужден назначать антибактериальный препарат эмпирически, до уточнения этиологии заболевания.
Под адекватной эмпирической антибактериальной терапией следует понимать, что:
-
выбранный режим антимикробной терапии охватывает максимально возможное число потенциальных возбудителей инфекции;
-
при выборе антибактериального препарата следует учитывать риск инфицирования полирезистентными возбудителями;
-
антибиотик назначен в адекватной дозе с учетом вероятного (или документированного) возбудителя и локализации инфекции, а также особенностей фармакокинетики АМП при сепсисе;
-
режим антибактериальной терапии не должен способствовать селекции в отделении резистентных штаммов бактерий.
7.2.Мероприятия по ограничению применения АМП в стационаре
Различные проспективные и ретроспективные эпидемиологические исследования показывают, что нерациональное использование АМП в стационаре достигает 40 70% (назначение не по показаниям или неадекватное применение), причем внедрение программ по рациональному применению АМП в стационарах существенно улучшает эти показатели [5-7].
Прежде всего необходимо выделить мероприятия, направленные на уменьшение использования АМП в стационаре в целом:
-
Административные ограничения отпуска антибиотиков; с этой целью можно использовать в стационаре бланки заказов на получение АМП в аптеке с указанием диагноза инфекции или обязательное письменное обоснование показания для назначения АМП в истории болезни.
-
Локальный микробиологический мониторинг . Анализ микробиологических данных (каждые 3 или 6 мес) и на основании этого коррекция рекомендаций по эмпирической антибактериальной терапии нозокомиальных инфекций в отделении – важный компонент в рационализации использования АМП в стационаре для достижения адекватности лечения и ограничения распространения антибиотикорезистентных штаммов.
-
Ограничение комбинированного назначения АМП, которое должно быть строго регламентировано в рекомендациях по терапии инфекций (раздел 7.4.4.). Особенно следует обратить внимание на широко распространенную необоснованную практику назначения аминогликозидов с бета-лактамными антибиотиками, метронидазола с карбапенемами или ингибитор-защищенными бета-лактамами, которые сами обладают антианаэробной активностью, или антифунгальных средств при проведении антибиотикотерапии.
-
Внедрение деэскалационного подхода к назначению АМП при тяжелых инфекциях. Замена антибиотика широкого спектра на препарат с более узким спектром или замена комбинированной терапии на монотерапию после получения результатов бактериологического исследования способствует ослаблению антибиотического прессинга и снижению риска селекции полирезистентных микроорганизмов.
-
Ограничение продолжительности антибактериальной терапии. Необходимо проводить ежедневный мониторинг эффективности лечения и оценку возможности прекращения терапии. С этой целью целесообразно использовать критерии достаточности антибактериальной терапии, как клинические, так и лабораторные (разделы 7.4.5. и 7.4.6.). В большинстве клинических ситуаций обосновано применение АМП в течение 7 8 суток, а при адекватно санированном очаге инфекции эти сроки могут быть меньше.
-
Административные ограничения профилактического использования антибиотиков. В настоящее время доказана эффективность короткой периоперационной антибиотикопрофилактики инфекций области хирургического вмешательства, причем в большинстве случаев достаточно однократного введения антибиотика за 30 минут до кожного разреза. Пролонгирование антибиотикопрофилактики свыше 24 ч в послеоперационном периоде является нерациональным (раздел 9).
-
Исключение назначения АМП при неинфекционном диагнозе . Лихорадка и лейкоцитоз могут возникать не только при бактериальной инфекции, поэтому назначение АМП без тщательного обследования пациентов и уточнения природы системной воспалительной реакции не целесообразно. Следует помнить, что такие диагнозы как «застойная пневмония» и «инфарктная пневмония» не подразумевают инфекционную этиологию; также при бессимптомной бактериурии в большинстве случаев не показано назначение АМП. Выделение грибов рода Candida из нестерильных локусов в большинстве случаев является колонизацией и не требует проведения антифунгальной терапии.
-
Консультация клинического фармаколога во время лечения является важнейшим звеном в уменьшении необоснованного и неадекватного применения АМП. Целесообразно в зависимости от профиля медицинской организации и его возможностей административно установить, в каких ситуациях обязательна консультация клинического фармаколога для определения дальнейшей тактики ведения пациента. Это могут быть следующие клинические ситуации:
-
неэффективность антимикробной терапии 1-й линии (эмпирической, целенаправленной);
-
жизнеугрожающие или проблемные для лечения инфекции (сепсис, септический шок, инфекционный эндокардит, остеомиелит, имплант-ассоциированная инфекция);
-
выделение у пациента полирезистентных микроорганизмов (например, энтеробактерии и ацинетобактер, устойчивые к карбапенемам, MRSA из крови, ванкомицинрезистентный энтерококк, Candida spp., устойчивая к флуконазолу);
-
необходимость продления сроков терапии сверх установленных для данной нозологии (например, внебольничная пневмония или пиелонефрит более 7 дней, перитонит более 10 дней и др.).
-
развитие серьезных нежелательных реакций на АМП (например, антибиотик-ассоциированная клостридиальная диарея, острый гепатит, острая почечная недостаточность, удлинение интервала QT на ЭКГ и желудочковые нарушения ритма);
-
-
Контроль (аудит) за назначением АМП и соблюдением рекомендаций по терапии и профилактике (выборочная проверка историй болезни во время пребывания пациента в стационаре, выписанных пациентов).
-
Раздельное обучение на всех уровнях вопросам диагностики и профилактики инфекций, рациональной антимикробной терапии: врачи (заведующие отделением, ординаторы, интерны); сотрудники кафедр; медсестры.
7.3.Мероприятия, направленные на ограничение использования отдельных классов АМП
Формулярный список. Предназначен для ограничения доступности отдельных групп АМП (раздел 6 и Приложение 1).
Рекомендации по антимикробной терапии инфекций. Административное ограничение использования отдельных групп АМП направлено на снижение риска селекции резистентных штаммов. Так, например, выявлена прямая зависимость между частотой использования цефалоспоринов III поколения и распространением в отделении энтеробактерий (E.coli, Klebsiella spp.), продуцирующих бета-лактамазы расширенного спектра (БЛРС) и устойчивых ко всем цефалоспоринам и некоторым другим классам антибиотиков [8-9]. В тоже время ограничение использования цефалоспоринов III поколения для эмпирической терапии нозокомиальных инфекций и замещение их пиперациллином/тазобактамом или имипенемом способствовало снижению частоты выделения БЛРС-продуцентов [10-11]. Использование эртапенема, в отличие от цефалоспоринов III поколения, не сопровождается селекцией БЛРС-продуцирующих энтеробактерий [12]. Фактором риска селекции полирезистентной синегнойной палочки является широкое применение фторхинолонов и антисинегнойных карбапенемов [13]. Уменьшение использования этих групп антибиотиков, а также замена антисинегнойных карбапенемов (имипенем, меропенем, дорипенем) на эртапенем приводит к снижению частоты выделения полирезистентной P. aeruginosa и восстановлению ее чувствительности к имипенему и другим антибиотикам [14-16].
7.4.Тактические вопросы рационального применения АМП
7.4.1. Обоснование назначения антибактериальных и антифунгальных средств
Показанием для назначения антибиотика является документированная или предполагаемая бактериальная инфекция. Наличие отдельных симптомов системной воспалительной реакции (лихорадка, лейкоцитоз, нейтрофилез, увеличение СОЭ) не всегда является отражением бактериального воспаления и не во всех случаях требует обязательного назначения АМП, так же как и выделение условно-патогенных микроорганизмов из нестерильных локусов не всегда означает инфекционный процесс и требует оценки их клинической значимости.
При решении вопроса о характере системной воспалительной реакции и целесообразности назначения антибиотика рекомендуют исследовать уровень в крови биохимических маркеров воспаления – прокальцитонина и С-реактивного белка, причем первый характеризуется высокой специфичностью, второй – высокой чувствительностью в диагностике бактериальной инфекции.
При решении вопроса о целесообразности назначения АМП необходимо эту концепцию сформулировать в истории болезни.
Риск развития инвазивного микоза на фоне применения АМП у пациентов без специфических факторов риска (нейтропении на фоне применения цитостатиков, трансплантации кроветворных стволовых клеток, трансплантации печени и пр.) невысок, поэтому рутинная первичная антифунгальная профилактика не рекомендуется. У больных в хирургическом ОРИТ показанием для первичной антифунгальной профилактики может быть повторная перфорация ЖКТ или инфицированный панкреонекроз. В этих ситуациях целесообразно назначение системных противогрибковых препаратов (флуконазол 12 мг/кг в сутки в первый день, затем по 6 мг/кг в сутки или каспофунгин 70 мг в 1-е сутки, затем 50 мг/ сут). Назначение для профилактики инвазивного микоза неадсорбируемых полиеновых антибиотиков (нистатина, натамицина и др.) неэффективно и нецелесообразно, так же как и применение флуконазола в суточной дозе менее 400 мг или пероральное назначение кетоконазола.
Эмпирическое назначение противогрибковых препаратов (азолов или эхинокандинов) рекомендовано при рефрактерной к антибактериальным препаратам лихорадке у больных с нейтропенией. У больных без нейтропении показанием для эмпирической антифунгальной терапии (эхинокандины: анидулафунгин, каспофунгин или микафунгин; азолы: флуконазол, если его не применяли профилактически, вориконазол) является сочетание следующих признаков:
-
лихорадка неясной этиологии продолжительностью более 4 сут, отсутствие эффекта от предположительно адекватной антибактериальной терапии;
-
распространенная (от 2 несвязанных между собой локусов) колонизация Candida spp.;
-
наличие двух и более факторов риска развития инвазивного кандидоза (в/в катетер, хирургическое вмешательство на органах брюшной полости, полное парентеральное питание, применение глюкокортикоидов или иммуносупрессантов).
Выделение Candida spp. и других возбудителей инвазивных микозов из стерильных в норме локусов (кровь, ликвор, биоптат и пр.) является показанием для обязательного назначения системных противогрибковых средств. В этом случае проводится целенаправленная антифунгальная терапия эхинокандинами (каспофунгин и др.) или азолами (флуконазол, вориконазол); последние можно назначать только в случае выделении Candida albicans при стабильном состоянии пациента. При выделении Candida non-albicans или при грибковом сепсисе препаратами выбора являются эхинокандины. Парентеральные полиеновые антибиотики (амфотерицин В) ввиду высокой токсичности не рассматриваются как средства 1-й линии терапии.
7.4.2.Рекомендации по дозированию АМП
Основные режимы дозирования АМП указаны в инструкции по медицинскому применению. В данном документе рекомендованные дозы антибиотика были рассчитаны на основании фармакокинетики и фармакодинамики для чувствительных к антибиотику микроорганизмов. Со временем происходит закономерный процесс снижения чувствительности микроорганизмов к АМП (что отражается в увеличении МПК) и появления устойчивых штаммов, однако рекомендованный режим дозирования не претерпевает коррекции в инструкции.
При повышении МПК микроорганизмов для поддержания клинического эффекта антибиотика на прежнем уровне необходимо увеличить его концентрацию в крови (для антибиотиков с концентрационно-зависимым антимикробным действием) или увеличить кратность его введения (для антибиотиков с время-зависимым действием). Это объясняет сложившуюся практику назначения некоторых АМП в дозах, превышающих рекомендуемые в медицинской инструкции.
В настоящее время обоснованным является назначение оксациллина в дозе 8-12 г в сутки и цефазолина в дозе 6-12 г в сутки для лечения стафилококкового сепсиса и ампициллина в дозе 12 г в сутки для лечения энтерококкового сепсиса. Для лечения тяжелых MRSA инфекций возможно (и целесообразно) увеличение суточной дозы ванкомицина до 3-4 г (при выделении штаммов MRSA со сниженной чувствительностью к ванкомицину, что подтверждается определением МПК на уровне 1,5-2 мкг/мл); следует помнить, что максимально разрешенная по инструкции суточная доза даптомицина составляет 6 мг/кг, хотя в отдельных публикациях имеются данные о применении препарата при ангиогенных инфекциях в более высоких дозах 8-10 мг/кг [7]. Также в научной литературе можно встретить рекомендации о применении тигециклина в более высокой (по сравнению с разрешенной в инструкции) суточной дозе – 200 мг при лечении инфекций, вызванных карбапенем-резистентными энтеробактериями и ацинетобактером.
Более адекватный эффект аминогликозидов прогнозируется при применении гентамицина в дозе 5 мг/кг в сутки и амикацина – 20 мг/кг в сутки. Аминогликозиды характеризуются концентрационно-зависимым киллингом, поэтому целесообразно суточную дозу аминогликозида вводить внутривенно однократно в виде болюса.
Антимикробное действие бета-лактамных антибиотиков является концентрационно-независимым и определяется временем сохранения терапевтических концентраций антибиотика (выше МПК) в течение интервала дозирования. Поэтому при необходимости увеличения суточной дозы бета-лактама целесообразно увеличивать кратность введения препарата, а не величину разовой дозы. Оптимизация фармакодинамических показателей достигается также при продленной инфузии бета-лактамных антибиотиков. Клинические данные по продленным инфузиям бета-лактамов ограничены, однако фармакодинамические и клинические исследования документируют преимущество такого введения антибиотиков при лечении инфекций, вызванных полирезистентными микроорганизмами. При лечении тяжелых инфекций целесообразно бета-лактамные антибиотики вводить внутривенно в течение 2-3 часовой инфузии. Продленные инфузии разрешены в инструкции по медицинскому применению дорипенема (оригинальный препарат дорипрекс – 4-часовая инфузия) и оригинального меропенема (меронем – 3-часовая инфузия), однако имеются клинические данные, свидетельствующие об эффективности такого введения и других оригинальных карбапенемов, цефтазидима, цефепима (максипима), пиперациллин/тазобактама (тазоцина). Более длительные инфузии (свыше 3 ч) нежелательны из-за возможной нестабильности антибиотика в инфузионном растворе.
7.4.3.Путь введения АМП
Антибиотики следует вводить в соответствии с официальной инструкцией. Основные пути введения – внутривенный, внутримышечный, пероральный. Другие пути введения (интраартериальный, эндолимфатический, внутрибрюшной и др.) не имеют доказанных преимуществ по сравнению с традиционными и не должны применяться.
В последние годы также появляются данные об ингаляционном пути введения некоторых АМП, в частности аминогликозидов (тобрамицин, амикацин) и полимиксина Е (колистин). Несмотря на теоретические преимущества подобного подхода (доставка антибиотика к очагу инфекции), клинические исследования свидетельствуют о невысокой эффективности ингаляционных антибиотиков в режиме монотерапии при НПивл. В настоящее время обоснованными являются рекомендации о целесообразности комбинированного применения ингаляционного тобрамицина или полимиксина Е с парентеральными АМП при лечении НПивл, вызванной полирезистентными грамотрицательными микроорганизмами. Ингаляционные антибиотики в режиме монотерапии могут быть назначены либо в случае вентилятор-ассоциированного трахеобронхита или при долечивании разрешающейся НПивл с целью эрадикации полирезистентных микроорганизмов.
Некоторые антибиотики применяются исключительно местно для лечения инфекций кожи и мягких тканей, инфицированных ожоговых ран, трофических язв, пролежней. К таким антибиотикам относятся диоксидин (мазь, 0,5 и 1% раствор), бацитрацин, фузидовая кислота, мупироцин, хлорамфеникол (мазь). Наиболее хорошо изучен отечественный препарат диоксидин, который в виде 0,5 или 1% раствора применяется не только для лечения поверхностных и глубоких ран различной локализации, трофических язв, но и может применяться в виде внутриполостного введения при лечении эмпиемы плевры, абсцессов, перитонита, цистита, флегмоны мягких тканей. Некоторые антибиотики для местного применения (грамицидин С, тиамфеникол) могут назначаться при инфекциях верхних дыхательных путей и ЛОР органов, инфекциях полости рта, либо в сочетании с ситемными антибиотиками, либо в монотерапии, когда применение системных антибиотиков не обосновано (например, острый тонзиллит при исключении стрептококковой этиологии).
Выбор пути введения АМП определяется тяжестью состояния пациента, фармакокинетическими и фармакодинамическими особенностями препарата. При нетяжелых инфекциях возможно пероральное назначение антибиотика. При тяжелом течении заболевания пациенты должны получать АМП внутривенно. В дальнейшем у пациентов с клинической эффективностью терапии (при достижении стабильного состояния и нормализации функции ЖКТ) возможно продолжение лечения пероральными лекарственными формами препаратов, обладающих хорошей биодоступностью – так называемая ступенчатая терапия.
7.4.4.Комбинированное назначение АМП
Доказательных данных о преимуществе комбинированной антибактериальной терапии по сравнению с монотерапией при большинстве инфекций, не получено (исключение – тяжелая внебольничная пневмония, септический шок). Следовательно, рутинное использование комбинированных режимов антибактериальной терапии является необоснованным.
Комбинированное назначение АМП оправдано в тех ситуациях, когда один из вероятных возбудителей определенно не будет чувствителен к рекомендованному режиму терапии (например, MRSA или E.faecium к бета-лактамам или фторхинолонам). В этом случае при риске MRSA целесообразно добавление ванкомицина или линезолида или даптомицина (или новых антибиотиков – цефтаролина, тедизолида, телаванцина) к бета-лактамному антибиотику. В случае выделения E.faecium целесообразно к бета-лактаму добавить линезолид или тедизолид или ванкомицин.
Риск летальности меньше при комбинированной антибактериальной терапии в случае выделения штаммов грамотрицательных бактерий (Klebsiella spp., Acinetobacter spp.), устойчивых к карбапенемам. Следует помнить, что в случае карбапенем-резистентных энтеробактерий или Acinetobacter spp. тигециклин или полимиксин необходимо обязательно комбинировать друг с другом или другими АМП (аминогликозид, карбапенем, рифампин, фосфомицин и др.); возможность монотерапии при лечении инфекций, вызванных карбапенем-резистентными энтеробактериями, показана только для нового антибиотика цефтазидим/авибактама. Вероятно, комбинация антисинегнойного цефалоспорина с аминогликозидом оправдана при лечении инфекций, вызванных P.aeruginosa из-за снижения риска формирования устойчивости; возможность монотерапии синегнойной инфекции будет реальной при появлении в клинической практике нового антибиотика цефтолозан/тазобактама.
Преодоление антибиотикорезистентности энтеробактерий и P.aeruginosa возможно при комбинации антисинегнойных цефалоспоринов, фторхинолонов (ципрофлоксацин) или карбапенемов с парентеральным фосфомицином. При проведении комбинированной терапии фосфомицин следует рассматривать в качестве альтернативы аминогликозидам и полимиксину, как препарат, способный проникать в биопленки и обладающий лучшим профилем безопасности.
Комбинированная терапия будет обоснована в случае смешанных аэробно-анаэробных инфекций (интраабдоминальных или малого таза), когда необходимо добавление метронидазола к антибиотикам, не обладающим антианаэробной активностью (аминогликозиды, цефалоспорины, большинство фторхинолонов). Распространенная практика комбинированного назначения метронидазола с карбапенемами или ингибиторозащищенными бета-лактамами не имеет смысла, так как указанные АМП сами обладают высокой активностью против анаэробов.
Традиционно комбинированные режимы антибактериальной терапии используются в определенных ситуациях, в большей степени для предотвращения формирования устойчивости возбудителя к антибиотику (туберкулез, эрадикация H.pylori).
У больных с иммунологическими нарушениями, нейтропенией, подучающих цитостатическую терапию целесообразно коллегиально обсуждать вопрос о комбинации антибактериальных препаратов и антимикотиков.
7.4.5. Критерии и сроки оценки эффективности антибактериальной терапии
Первоначальную оценку эффективности лечения следует проводить в сроки от 48 до 72 ч после начала антибактериальной терапии, ориентируясь на динамику проявлений синдрома системной воспалительной реакции. До этого времени стартовую эмпирическую терапию менять не следует. Исключение составляют случаи быстропрогрессирующего ухудшения состояния пациента или получение результатов микробиологического исследования, требующих коррекции антибактериальной терапии.
У тяжелых пациентов, находящихся в ОРИТ, бывает сложно оценить эффективность антибактериальной терапии только по клиническим симптомам; в таких ситуациях оценку динамики инфекционного процесса проводят по динамике суррогатных показателей: индекса оксигенации (PaO2/FiO2), выраженности полиорганной недостаточности, интегральные шкалы оценки состояния пациента (SOFA, MODS). В качестве информативных показателей адекватности антибактериальной терапии могут быть использованы количественные значения прокальцитонина и С-реактивного белка (с учетом неспецифичности последнего).
Коррекцию эмпирического режима антибактериальной терапии следует проводить через 48–72 ч после начала лечения при отсутствии клинического улучшения и/ или выделения резистентного к проводимой терапии возбудителя.
В некоторых клинических ситуациях может наблюдаться более медленное наступление клинического эффекта антибиотиков (к 5–7-му дню); обычно это наблюдается при локализации инфекции в «труднодоступных» для антибиотика локусах, таких как клапаны сердца, импланты, кость, или в случае малочувствительных к антибиотику возбудителей.
7.4.6.Продолжительность антибактериальной терапии, критерии прекращения лечения
Окончательную оценку эффективности антибактериальной терапии инфекций и решение об ее достаточности выносят на основании комплексной оценки динамики клинических и лабораторных показателей.
В качестве обоснования прекращения антибактериальной терапии могут быть использованы следующие критерии ее достаточности:
-
нормализация температуры (максимальная температура менее 37,5°С);
-
положительная динамика основных лабораторных показателей (снижение лейкоцитоза, нейтрофилеза, уменьшение сдвига лейкоцитарной формулы влево);
-
эрадикация возбудителя из крови или других стерильных локусов, уменьшение количества бактерий в нестерильном локусе (трахеальный аспират, материал из раны, моча);
-
отсутствие полиорганной недостаточности, связанной с инфекцией;
-
восстановление функции ЖКТ при хирургических абдоминальных инфекциях.
Важную информацию о целесообразности отмены АМП можно получить при исследовании в динамике концентраций прокальцитонина и С-реактивного белка (с учетом неспецифичности последнего). Нормализация уровня этих показателей (СРБ < 24 мг/л, прокальцитонина < 0,5 нг/мл) или снижение прокальцитонина более 90% от исходной величины являются веским аргументом в пользу прекращения антибактериальной терапии.
Следует подчеркнуть, что сохранение отдельных симптомов и признаков инфекции (субфебрильная лихорадка, умеренный лейкоцитоз без сдвига, повышение СОЭ), небольшое количество гнойного трахеального секрета и/или остаточная инфильтрация на рентгенограмме при нозокомиальной пневмонии, наличие дренажей в брюшной полости или катетера в мочевых путях не могут служить безусловным обоснованием продолжения антибактериальной терапии или ее замены. Также не является обоснованием продолжения или смены антибактериальной терапии персистирование первоначального возбудителя в малом количестве (102-103 КОЕ/ мл) в нестерильном локусе или веделение из нестерильного локуса нового микроорганизма при отсутствии клинических признаков инфекции.
В большинстве клинических ситуаций обосновано применение АМП в течение 7-8 суток, а при адекватно санированном очаге инфекции эти сроки могут быть меньше. Более длительные сроки антибактериальной терапии можно обсуждать в следующих клинических ситуациях:
-
инфекции, вызванные S.aureus с бактериемией – минимальная продолжительность антистафилококковой терапии составляет 14 суток;
-
НПивл, вызванная P.aeruginosa обсуждается продление антибактериальной терапии до 10 – 14 суток;
-
инфекции в «труднодоступной» для АМП локализации: клапаны сердца, ЦНС, кость, предстательная железа, импланты;
-
инфекции, вызванные полии панрезистентными микроорганизмами – целесообразно достижение их эрадикации с эпидемиологических позиций.
7.4.7.Оригинальные и генерические АМП
Практически все имеющиеся доказательные данные по эффективности и безопасности антимикробной терапии инфекций были получены при исследовании оригинальных препаратов. До настоящего времени число публикаций результатов адекватно спланированных и качественно проведенных исследований, подтверждающих сопоставимую клиническую и микробиологическую эффективность оригинальных и генерических препаратов, ограниченно. Более того, в последние годы в научной медицинской литературе стали появляться результаты исследований, показывающие различия в антимикробной активности и терапевтической эффективности оригинальных и генерических АМП при их сопоставимых фармацевтических характеристиках.
В связи с этим, при выборе АМП у пациентов с тяжелыми инфекциями, сепсисом или проблемных пациентов (ко-морбидность, обострение хронических инфекций), а также в случае инфекций, вызванных полирезистентными возбудителями предпочтительно применять оригинальные препараты. В случае получения качественных данных о сопоставимой клинической и бактериологической эффективности (терапевтической эквивалентности) генерических антибиотиков с оригинальными необходимо отдельно рассмотреть вопрос об их включении в формуляр. Несомненно, что при лечении жизнеугножающих инфекцийфактор стоимости антибиотика не должен превалировать над факторами эффективности и безопасности.
7.4.8.Средства, обладающие антимикробной активностью, но не рекомендуемые для лечения бактериальных инфекций
Обоснованием для включения АМП в формуляр и рекомендации по лечению является документированная антимикробная активность против наиболее актуальных возбудителей с учетом современного состояния антибиотикорезистентности, а также документированная клиническая эффективность в контролируемых рандомизированных клинических исследованиях, а также данные, полученных в исследованиях фармакодинамического моделирования.
В этой связи, комбинированный антибактериальный препарат, имеющий в составе ампициллин и оксациллин, не должен применяться в медицинской практике из-за нерациональной комбинации антибиотиков, к тому же в субтерапевтических дозах.
Применение норфлоксацина при инфекциях нижних отделов мочевыводящих путей (цистит, уретрит) не оптимально, но допустимо, однако назначение этого препарата при пиелонефрите нецелесообразно, так как в ткани почек не создаются терапевтические концентрации. Это утверждение также применимо к фосфомицину трометамолу и нитрофуранам. Применение препарата нитроксолин для лечения мочевых инфекций следует признать необоснованным, так как отсутствуют клинические доказательства его эффективности и антимикробной активности.
7.4.9.Средства «сопровождения» антимикробной терапии
К средствам, не обладающим антимикробными свойствами, но часто рекомендуемым к применению вместе с антибактериальными препаратами или после курса антибиотикотерапии, относятся пробиотики. Доказательная база эффективности этих лекарственных препаратов по профилактике антибиотикоассоциированной диареи или псевдомембранозного колита противоречива.
Следует отметить, что снижение риска антибиотикоассоциированной диареи документирована только для единичных пробиотических микроорганизмов (Saccharomyces boulardii, Lactobacillus rhamnosus GG). Большинство зарегистрированных в РФ пробиотиков имеют в составе микроорганизмы, эффективность которых не доказана. Более того, у некоторых категорий больных (пациенты с нейтропенией или другими формами иммунодефицита, после лапаротомии, трансплантации органов, беременные женщины) эти лекарственные средства могут представлять определенную опасность из-за возможного риска развития бактериемии и других тяжелых суперинфекций, вызванных маловирулентными микроорганизмами (бифидо- и лактобактерии, Saccharomyces boulardii), входящими в состав этих препаратов.
Некоторые лекарственные средства, не обладающие антимикробной активностью и не относящиеся к пробиотикам, настойчиво позиционируются как препараты, «помогающие» антибиотикам реализовать их антимикробное действие, улучшающие доставку антибиотика к очагу инфекции. Эти препараты в качестве активных субстанций содержат в основным различные энзимы (панкреатин, трипсин, липаза, амилаза), «сдобренные» другими малоэффективными веществами – папаин, бромелаин, рутозид. Отношение экспертов к этим препаратам однозначное и категоричное: нет никакой теоретической или клинической доказательной базы для этих утверждений, безопасность этих препаратов не исследована, применение таких лекарственных средств с указанной целью не рекомендуется и ведет только к полипрагмазии.
В последние годы в медицинской практике появились антибиотики, в состав которых входит пребиотик лактулоза. Следует отметить, что в настоящее время отсутствует качественная доказательная база клинического преимущества этих препаратов, кроме определенных теоретических предпосылок. Следует подчеркнуть, что доза лактулозы в лекарственной форме с антибиотиком намного ниже терапевтической и вряд ли следует ожидать какого-либо терапевтического эффекта ее применения, кроме психологического. Более того, известно, что лактулоза, изменяя рН кишечного содержимого, может уменьшать абсорбцию некоторых лекарственных препаратов. В отсутствие результатов экспериментальных и клинических исследований эти данные вызывают определенную настороженность в отношении возможного изменения фармакокинетики антибиотиков, применяемых одновременно с лактулозой.
Литература
-
Kollef MH, Sherman G, Ward S, Fraser VJ. Inadequate antimicrobial treatment of infections: a risk factor for hospital mortality among critically ill patients. Chest 1999;115(2):462-74
-
Iregui M, Ward S, Sherman G, Fraser VJ, Kollef MH. Clinical importance of delays in the initiation of appropriate antibiotic treatment for ventilator-associated pneumonia. Chest 2002;122(1):262-8
-
Yakovlev S, Gelfand B, Protsenko D. Ventilator-associated pneumonia in patients with truma: risk factors concerning mortality [abstract P1603]. 13th European Congress of Clinical Microbiology and Infectious Diseases, Glasgow, May 10-13, 2003. Clin Microbiol Infect 2003;9(6)
-
Проценко Д.Н., Ярошецкий А.И., Гельфанд Б.Р., Игнатенко О.В., Яковлев С.В. Протокол антибактериальной терапии нозокомиальной пневмонии при проведении искусственной вентиляции легких: эффективность внедрения. Инфекции и антимикробная терапия 2005; 7(2): 15-20
-
Owens RC, Fraser GL, Stogsdill P. Antimicrobial stewardship programs as a means to optimize antimicrobial use. Pharmacotherapy 2004; 24:896-908
-
Feucht CL, Rice LB. An interventional program to improve antibiotic use. Ann Pharmacother 2003; 37:646– 51
-
Fraser GL, Stogsdill P, Dickens JD Jr, et al. Antibiotic optimization: an evaluation of patient safety and economic outcomes. Arch Intern Med 1997; 157:1689–94
-
Lautenbach E, Patel JB, Bilker WB, Edelstein PH, Fishman NO. Extended-spectrum b-lactamase–producing Escherichia coli and Klebsiella pneumoniae: risk factors for infection and impact of resistance on outcomes. Clin Infect Dis 2001; 32:1162–71
-
Lin MF, Huang ML, Lai SH. Risk factors in the acquisition of extended-spectrum beta-lactamase Klebsiella pneumoniae: a case-control study in a district teaching hospital in Taiwan. J Hosp Infect 2003; 53:39–45
-
Patterson JE, Hardin TC, Kelly CA, Garcia RC, Jorgensen JH. Association of antibiotic utilization measures and control of multiple-drug resistance in Klebsiella pneumoniae. Infect Control Hosp Epidemiol 2000; 21:4558
-
Lesch CA, Itokazu GS, Danziger LH, Weinstein RA. Multi-hospital analysis of antimicrobial usage and resistance trends. Diagn Microbiol Infect Dis 2001; 41:149–54
-
DiNubile MF et al. Bowel colonization with resistant gram-negative bacilli after antimicrobial therapy of intra-abdominal infections: observations from two randomized comparative clinical trials of ertapenem therapy Eur J Clin Microbiol Infect Dis 2005;24:443–449
-
Cao B, Wang H, San H, et al. Risk factors and clinical outcames of nosocomial multi-drug resistant nosocomial Pseudomonas aeruginosa infections. J Hosp Inf 2004;57(2):112-8
-
Goldstein E, Citron DM, Peraino V, et al. Introduction of Ertapenem into a Hospital Formulary: Effect on Antimicrobial Usage and Improved In Vitro Susceptibility of Pseudomonas aeruginosa, Antimicrob Ag Chemother 2009; 53(12):5122–26
-
Goldstein E, Periano V, Hammer-Reig L, et al. Carbapenem stewardship: sustained, improved imipenem susceptibility of Pseudomonas aeruginosa correlated with eight-years of increased ertapenem usage.
-
Nicolau DP, Carmeli Y, Crank CW, et al. Carbapenem stewardship: does ertapenem affect Pseudomonas susceptibility to other carbapenems? A review of the evidence. Intern J Antimicrob Agents 2012;39:11-15
Раздел 8. Рекомендации по эмпирической АМТ со стратификацией пациентов по риску антибиотикорезистентности
Адекватная эмпирическая антибактериальная терапия предполагает эффективное действие в отношении всех этиологически значимых возбудителей инфекционного процесса данной локализации в достаточной дозе с учетом риска инфицирования полирезистентными возбудителями.
Рациональный выбор эмпирического режима антимикробной терапии невозможен без современных знаний об этиологической структуре инфекций и антибиотикорезистентности возбудителей, которые могут различаться в конкретных клинических ситуациях. В наиболее обобщенной форме выбор эмпирического режима антимикробной терапии должен быть обоснован с учетом следующих факторов:
Для нозокомиальных инфекций характерен широкий круг возбудителей, характеризующихся устойчивостью к антибактериальным средствам. Этиологическая структура нозокомиальных инфекций и уровень устойчивости возбудителей к антибиотикам могут существенно различаться в разных стационарах и даже отделениях одного лечебного учреждения. Поэтому планирование эмпирической антимикробной терапии нозокомиальных инфекций должно быть основано на анализе локальных микробиологических данных о превалирующих возбудителях и их антибиотикорезистентности. Общие принципы и тактические вопросы диагностики и лечения нозокомиальных инфекций подробно изложены в национальных практических рекомендациях по нозокомиальной пневмонии, инфекциям кожи и мягких тканей, абдоминальным инфекциям, сепсису, ежегодно пересматриваемом Федеральном руководстве по использованию лекарственных средств (формулярная система).
Обычно внебольничные инфекции характеризуются определенным кругом потенциальных возбудителей с предсказуемой устойчивостью к антибиотикам.
Однако, у ряда пациентов с внебольничными инфекциями в последние годы все чаще регистрируются инфекции, вызванные возбудителями с нозокомиальным фенотипом устойчивости к антибиотикам. Обычно такие пациенты обращались за помощью в медицинские учреждения или лечились антибиотиками. К факторам риска внебольничных инфекций, вызванных антибиотикорезистентными возбудителями (БЛРС-продуценты), относят:
Антимикробная терапия таких пациентов сходна с тактикой лечения пациентов с нозокомиальными инфекциями вне ОРИТ.
Таким образом, в рекомендациях по эмпирическому назначению АМП целесообразно пациентов с инфекциями стратифицировать на 4 типа или лечебные группы (Приложение 2).
Тип I . Внебольничные инфекции без факторов риска полирезистентных возбудителей;
Тип II . Внебольничные инфекции с факторами риска полирезистентных возбудителей (риск БЛРС среди энтеробактерий, а также устойчивая к фторхинолонам урогенитальная кишечная палочка, полирезистентные пневмококки);
Тип III . Нозокомиальные инфекции. Следует выделять 2 подтипа – а и b:
— IIIa: вне ОРИТ, без предшествующего применения АМП (риск БЛРС);
— IIIb: длительная госпитализация (> 7 дней) и/или нахождение в ОРИТ > 3 дней и/или предшествующее применение АМП (риск БЛРС, карбапенем-резистентных энтеробактерий и ацинетобактера, полирезистентных НФГОБ (P.aeruginosa, Acinetobacter spp.), MRSA);
Тип IV . Нозокомиальные инфекции с риском инвазивного кандидоза.
При антимикробной терапии пациентов с нозокомиальными инфекциями целесообразно уточнять наличие у них факторов риска инфицирования проблемными полирезистентными госпитальными микроорганизмами – MRSA, P.aeruginosa, карбапенем-резистентными энтеробактериями и отнесение их к IIIb типу стратификации.
Факторы риска MRSA:
Факторы риска Pseudomonas aeruginosa:
Факторы риска карбапенем-резистентных энтеробактерий:
Более подробно критерии стратификации пациентов по риску антибиотикорезистентности представлены в Приложении 2. В соответствии с этим, рекомендации по выбору эмпирического режима антимикробной терапии должны быть построены с учетом этих типов инфекции.
В приложениях 3-8 приведены рекомендации по эмпирическому выбору АМП в зависимости от стратификации пациентов по риску антибиотикорезистентности и инвазивного кандидоза. Данные рекомендации могут служить основой для разработки алгоритмов АМТ в медицинских организациях. Более детальные рекомендации могут быть сформулированы с учетом локальных данных антибиотикорезистентности в конкретном стационаре.
1 НФГОБ – неферментирующие грамотрицательные бактерии
Раздел 9. Рекомендации по периоперационной антибиотикопрофилактике
Одним из компонентов оказания качественной хирургической помощи и эффективных подходов к снижению частоты инфекций области хирургического вмешательства (ИОХВ), наряду с совершенствованием хирургической техники и соблюдением правил асептики и антисептики, является периоперационная антибиотикопрофилактика. Периоперационная антибиотикопрофилактика должна применяться у всех пациентов с целью снижения риска развития ИОХВ во время проведения кардиохирургических операций, операций на сосудах, легких, органах брюшной полости и малого таза, артропластике тазобедренного и коленного сустава. Эти операции являются наиболее частыми, и в отношении них не имеется противоречий в необходимости проведения периоперационной профилактики. Пациентам с подтвержденной инфекцией до оперативного лечения проводится антимикробная терапия.
Согласно определению комитета по антимикробным препаратам Американского общества хирургических инфекций, профилактическим применением антибиотиков является их назначение больному до микробной контаминации операционной раны или развития раневой инфекции, а также при наличии признаков контаминации и инфекции, когда методом лечения является хирургическое вмешательство, а назначение антибиотика имеет своей целью снизить до минимума риск развития ИОХВ [1-2].
Другими словами, антибиотикопрофилактика, в отличие от антибиотикотерапии, подразумевает назначение антибактериального средства при отсутствии активного инфекционного процесса, но высокой вероятности контаминации и инфекции операционной раны с целью предупреждения ее развития. Исходя из определения понятия «антибиотикопрофилактика», могут быть сформулированы ее цели и задачи [3].
Цель антибиотикопрофилактики: предупреждение развития ИОХВ в послеоперационном периоде, а также уменьшение стоимости и продолжительности лечения больных в стационаре.
Задачи антибиотикопрофилактики: создание терапевтических (бактерицидных) концентраций антибиотика в тканях, подвергающихся бактериальной контаминации во время операции – от разреза до закрытия раны.
Периоперационная антибиотикопрофилактика показана при всех «условно-чистых» и «загрязненных» операциях. При чистых операциях антибиотикопрофилактика проводится в случаях, когда потенциальная инфекция представляет серьезную угрозу жизни и здоровью больного (протезирование клапанов сердца, аорто-коронарное шунтирование, имплантация суставов), а также при наличии у больного факторов риска ИОХВ: сахарный диабет, ожирение или истощение, цирроз печени, алкоголизм, наркомания, хроническа почечная недостаточность, иммуносупрессия (терапия глюкокортикоидами, цитостатиками, ВИЧ), спленэктомия.
Следует учитывать, что микробная контаминация операционной раны является неизбежной даже при идеальном соблюдении правил асептики и антисептики, и к концу операции в 80-90% случаев раны обсеменены различной микрофлорой, чаще всего стафилококками. Как было показано в классической работе J.Burke [4], если в течение первых трех часов после контаминации операционной раны уменьшить количество попавших в нее бактерий, то тем самым можно существенно снизить риск развития послеоперационной раневой инфекции. Это достигается введением антибиотика за 30-60 минут до начала операции. Введение антибиотика в более ранние сроки до операции, а также интраоперационно или после окончания операции является неэффективным в плане снижения частоты ИОХВ.
Эффективная концентрация антибиотика в операционной ране, превышающая МПК возбудителей раневой инфекции (стафилококков и стрептококков), должна сохраняться на протяжении всей операции и поддерживаться к моменту наложения швов, когда микробная контаминация достигает максимума.
В настоящее время большинство специалистов по антимикробной терапии и хирургическим инфекциям придерживаются сходных взглядов на тактику проведения периоперационной профилактики ИОХВ. Эта позиция подробно отражена в зарубежных и отечественных документах по периоперационной антибиотикопрофилактике [2, 5-7]. Обобщенные рекомендации по проведению интраоперационной антибиотикопрофилактики представлены в табл. 4.
| Операции | Режим профилактики1 |
|---|---|
Экстренные и плановые операции на органах брюшной полости и малого таза |
Цефазолин 2 г ± метронидазол 0,5 г Цефуроксим 1,5 г ± метронидазол 0,5 г Амоксициллин/клавуланат 1,2 г Ампициллин/сульбактам 3 г Эртапенем 1 г [1] При аллергии к бета-лактамам: Клиндамицин 0,9 г |
Торакальные операции, включая кардиохирургические [2] , установка водителей ритма и других имплантируемых устройств |
Цефазолин 2 г Цефуроксим 1,5 г При аллергии к бета-лактамам: Клиндамицин 0,9 г При высоком риске MRSA: [3] Ванкомицин 15 мг/кг [4] |
Эндопротезирование суставов [2] |
Цефазолин 2 г Цефуроксим 1,5 г При высоком риске MRSA: [3] Ванкомицин 15 мг/кг [4] Даптомицин 6 мг/кг [5] |
Операции на сосудах |
Цефазолин 2 г Цефуроксим 1,5 г При аллергии к бета-лактамам: Клиндамицин 0,9 г |
Плановая трепанация черепа, имплантация ликворных шунтов, сопутствующих устройств |
Цефазолин 2 г При высоком риске MRSA: [3] Ванкомицин 15 мг/кг [4] |
Операции на придаточных пазухах носа, носоглотке, ротоглотке |
Амоксициллин/клавуланат 1,2 г Клиндамицин 0,9 г |
Искусственное прерывание беременности (1 триместр) |
Доксициклин моногидрат 100 мг внутрь за 1 час до и 200 мг после операции |
Цистоскопия с дополнительными вмешательствами |
Ципрофлоксацин 500 мг внутрь за 2-3 часа |
Трансректальная биопсия предстательной железы |
Ципрофлоксацин 500 мг внутрь за 12 часов до и 500 мг после биопсии |
Операции на молочной железе, грыжесечение |
Цефазолин 2 г Ампициллин/сульбактам 3 г При аллергии к бета-лактамам: Клиндамицин 0,9 г |
Трансплантация печени.[6] |
Пиперациллин/тазобактам 4,5 г Ампициллин/сульбактам 3 г Эртапенем 1 г (незарегистрированное показание в РФ) |
Трансплантация почки |
Цефазолин 2 г Цефуроксим 1,5 г Эртапенем 1 г [1] |
Примечания.
1 Антибиотик с целью профилактики вводят внутривенно однократно за 30-60 минут до начала операции (ванкомицин – за 120 мин). В большинстве случаев достаточно одной предоперационной дозы антибиотика. При длительных операциях целесообразно введение интраоперационно дополнительной дозы антибиотика: цефазолин, цефуроксим, амоксициллин/клавуланат и клиндамицин – через 4 часа, ампициллин/сульбактам – через 2–3 часа. Продление антибиотикопрофилактики после окончания операции не увеличивает ее эффективность, но повышает риск селекции антибиотикорезистентных штаммов и осложнений, в частности, антибиотикоассоциированной диареи, вызванной C.difficile.
Антибактериальная профилактика является наиболее эффективной, когда антибиотики применяются внутривенно в промежутке от 30 до 60 минут до разреза кожи или в течение 2 часов до разреза при применении ванкомицина. Это позволяет достичь бактерицидной концентрации препарата в тканях и в сыворотке в момент разреза кожи и снизить риск инфекции.
Спектр активности антибиотика для периоперационной профилактики должен охватывать наиболее актуальных возбудителей ИОХВ. Следует учитывать, что перечень потенциальных возбудителей ИОХВ довольно широк, однако первичная этиологическая роль в раневой инфекции принадлежит микрофлоре кожи (стафилококки, стрептококки), которые первыми контаминируют операционную рану.
Различные экспериментальные и клинические исследования показали, что основным условием эффективности антибиотика для интраоперационной профилактики является его высокая и быстрая бактерицидная активность против грамположительных микроорганизмов, прежде всего, стафилококков. Этому требованию, в наибольшей степени, соответствуют бета-лактамные антибиотики, из которых оптимальными являются цефалоспорины I или II поколения – цефазолин и цефуроксим. Попытки использовать для профилактики цефалоспорины с более широким спектром активности (цефалоспорины III поколения) не проводили к увеличению эффекта профилактики (а иногда частота инфекций даже возрастала), но существенно увеличивали риск селекции резистентных бактерий (прежде всего, энтеробактерий, продуцирующих БЛРС, MRSA), а также риск развития осложнений – суперинфекции, вызванной C.difficile [7-8]. Таким образом, в настоящее время использование цефалоспоринов III поколения (цефтриаксон, цефотаксим) с целью профилактики рассматривается как нерациональное.
Рутинное применение ванкомицина с профилактической целью не рекомендуется при любом типе операций, однако рост инфекций связанных с оказанием медицинской помощи, вызванных MRSA, в том числе внебольничными штаммами (CA-MRSA) может быть причиной его применения с учетом данных локального мониторинга микрофлоры. Кроме того, он может применяться наравне с другими указанными препаратами при наличии документированной анафилаксии к бета-лактамам. Примером обоснованного применения ванкомицина с профилактической целью является известная колонизация пациента MRSA, наличие факторов риска инфекций, вызванных MRSA в результате предшествующей госпитализации, проживания в интернате с пациентами с тяжелой хронической патологией, лечение хронических язв, проведение программного гемодиализа, продолжительной госпитализации в отделении с высоким уровнем колонизации пациентов MRSA до проведения операции. Однако, при этом следует учитывать, что природная антистафилококковая активность и бактерицидность ванкомицина существенно уступает бета-лактамным антибиотикам, то есть он не является оптимальным антибиотиком для периоперационной профилактики.
Перспективным является применение даптомицина с целью периоперационной профилактики ИОХВ при эндопротезировании суставов (незарегистрированное в РФ показание). Преимуществом даптомицина по сравнению с ванкомицином является более высокая и быстрая бактерицидная активность в отношении стафилококков, как MRSA, так и чувствительных к оксациллину. Также немаловажным фактором является способность даптомицина воздействовать не только на планктонные, но и сесильные (находящиеся в биопленках) формы стафилококков, что актуально при инфекциях имплантов.
При высоком риске контаминации раны анаэробными бактериями, особенно Bacteroides spp. (в абдоминальной хирургии, операциях на органах малого таза), к цефалоспорину рекомендуется добавить метронидазол, или использовать ингибиторозащищенные пенициллины, обладающие антианаэробной активностью – амоксициллин/клавуланат или ампициллин/сульбактам (последний обладает более коротким периодом полувыведения, поэтому необходимо его интраоперационное введение при продолжительности операции более 2 часов). В отсутствии риска анаэробных инфекций более адекватными для профилактики следует расценивать цефалоспорины I-II поколения, обладающие более высокой антистафилококковой активностью.
При проведении антибиотикопрофилактики в колоректальной хирургии у пациентов с высоким риском послеоперационных инфекционных осложнений (медикаментозная иммуносупрессия, рак толстой кишки, ВИЧ, хроническая алкогольная поливисцеропатия, цирроз печени, ХПН, сахарный диабет, истощение) в этиологии ИОХВ, наряду со стафилококками и анаэробами, актуальными становятся грамотрицательные энтеробактерии. В этой связи расширение спектра антибиотика для интраоперационной профилактики становится оправданным. В таких ситуациях для профилактики рекомендуется использовать карбапенемовый антибиотик эртапенем, который в 2007 году одобрен FDA по этим показаниям (в РФ данное показание не зарегистрировано).
Продолжительность профилактического применения антибиотиков играет важную роль не только в собственно профилактике инфекций, но и в снижении риска селекции резистентности флоры. Поддерживая терапевтический уровень препарата в плазме и тканях во время операции, антибиотики снижают риск возникновения инфекций. Иногда во время продолжительных операций (более 4 часов) или при большой кровопотере (>1500 мл) возникает необходимость повторного введения антибиотика. Однако последующие введения антибиотика (продолжение профилактики после ушивания операционной раны), как правило, не имеет каких-либо преимуществ. Во многих исследованиях было показано, что короткий курс профилактики, который начинается незадолго до разреза кожи, так же эффективен, как продолжительное применение (в течение 24 часов и более) [8-10]. Кроме того, продолжительное введение антибактериального препарата было связано с суперинфекцией Clostridium difficile и способствовало селекции антибиотикорезистентных штаммов бактерий, что было доказано в нескольких проведенных исследованиях [9, 11].
Максимальная продолжительность профилактического введения антибиотика не должна превышать 24 часов после окончания операции (в идеале – одна предоперационная доза). Прекращение профилактики в течение 24 часов одобряется большинством экспертов, при этом достигнуто согласие по безопасности и более высокой эффективности применения препаратов узкого спектра, направленных против наиболее вероятных возбудителей раневой инфекции (стафилококки и стрептококки). Постепенно мнение экспертов и практических врачей склоняются к тому, что профилактика должна проводиться только во время проведения операции, а дополнительная доза должна вводиться, только если продолжительность операции превышает 4 часа или антибиотик имеет короткий период полувыведения. Наличие дренажей в полостях или катетеров не является обоснованным аргументом в пользу продолжения антибиотикопрофилактики [2, 5].
Продление профилактики после хирургического вмешательства на 24-48 часа не рационально, но возможно при очень высоком риске инфекционных осложнений, либо в ситуациях, когда инфекции, несмотря на относительно невысокую частоту развития, представляют непосредственную угрозу жизни и здоровью больного (кардиохирургические операции, трансплантация органов, эндопротезирование суставов). В настоящее время допускается продление профилактики на 24-48 (72) часов при кардиохирургических операциях и протезировании суставов, хотя такое решение не имеет высокого уровня доказательности и основано больше на эмоциональном факторе.
Таким образом, на основании данных доказательной медицины, а также отечественных и международных клинических рекомендаций [2, 6, 12-13] современная концепция адекватной периоперационной антибиотикопрофилактики подразумевает введение первой дозы антибиотика (цефазолин, цефуроксим или амоксициллин/клавуланат в зависимости от операции – см. табл. 3) за 30-60 минут до кожного разреза, ограничение профилактики в большинстве случаев только одной преоперационной дозой антибиотика или прекращение антибиотикопрофилактика в течение 24 часов после операции.
Литература
-
Bratzler DW, Houck PM. Antimicrobial prophylaxix for surgery: an advisory statement from the National Surgical Infection Prevention Project. Clin Infect Dis 2004;38:1706-15.
-
Bratzler DW, Dellinger EP, Olsen KM, et al. Clinical practice guidelines for antimicrobial prophylaxis in surgery. Am J Health-Syst Pharm 2013;70:195-283.
-
Яковлев С.В. Высокотехнологичная периоперационная антибиотикопрофилактика в контексте хирургической концепции Fast Track. Доктор.ру. Анестезиология и реаниматология. Медицинская реабилитация. 2016; №12: ч.1, с. 43-48
-
Burke JF. The effective period of preventive antibiotic action in experimental incisions and dermal lesions. Surgery 1961; 50:161–8.
-
Стратегия и тактика применения антимикробных средств в лечебных учреждениях России: Российские национальные рекомендации. Под ред. В.С.Савельева, Б.Р.Гельфанда, С.В.Яковлева. – М.: ООО «Компания БОРГЕС», 2012. – 92 с.
-
Хирургические инфекции кожи и мягких тканей: Российские национальные рекомендации. Под ред. Б.Р.Гельфанда, А.О.Жукова, А.Б.Земляного, С.В.Яковлева. – М.: ООО «Компания Боргес», 2009 г. – 89 с.
-
Anderson DJ, Kaye KS, Classen D, et al. Strategies to Prevent Surgical Site Infections in Acute Care Hospitals. Infection Control and Hospital Epidemiology, Vol. 29, No. S1: 51-61.
-
Hagel S, Scheuerlein H. Perioperative antibiotic prophylaxis and antimicrobial therapy of intra-abdominal infections. Viszeralmedizin 2014;30:310-6
-
Harbarth S, Samore MH, Lichtenberg D, Carmelli Y. Prolonged antibiotic prophylaxis after cardiovascular surgery and its effect on surgical site infections and antimicrobial resistance. Circulation 2000;101:2916-21.
-
Hirokawa F, Hayashi M, Miyamoto Y, et al. Evaluation of postoperative antibiotic prophylaxis after liver resection: a randomized controlled trial. Am J Surg 2013;206:8-15.
-
Carignan A, Allard C, Pepin J, et al. Risk of Clostridium difficile infection after perioperative antibacterial prophylaxis before and during an outbreak of infection due to a hypervirulent strain. Clin Infect Dis 2008;46:1838-43.
-
Wacha H, Isenmann R, Kujath P, e.a. Perioperative Antibiotika-Prophylaxe. Empflehlungen einer Expertenkomission der Paul-Ehrlich-Geselschaft fur Chemotherapy e.V. Chemother J 2010;19:70-84.
-
New WHO recommendations on preoperative measures for surgical site infection prevention: an evidence- based global perspective www.thelancet.com/infection Published online November 2, 2016 http://dx.doi. org/10.1016/S1473-3099(16)30402-9; www.thelancet.com/infection Vol 16 December 2016
Раздел 10. Профилактика инфекций, связанных с оказанием медицинской помощи и ограничение распространения полирезистентных микроорганизмов
10.1.Определение и эпидемиология
Обеспечение качества и безопасности медицинской помощи – важнейшая стратегическая задача здравоохранения, неотъемлемой составляющей которой является обеспечение безопасности пациентов и медицинского персонала.
Инфекции, связанные с оказанием медицинской помощи (ИСМП) в силу широкого распространения, негативных последствий для здоровья пациентов, персонала и экономики государства имеют особое значение.
Общим критерием для отнесения случаев инфекций к ИСМП является непосредственная связь их возникновения с оказанием медицинской помощи (лечением, диагностическими исследованиями, иммунизацией и т.д.).
Термин «инфекция, связанная с оказанием медицинской помощи» (ИСМП; healthcare-associated infection), используется в нормативных документах большинства стран мира и объединяет [1–4]:
-
инфекции, связанные с оказанием медицинской помощи пациентам в период госпитализации (внутрибольничные инфекции; нозокомиальные инфекции; hospital-acquired infections; nosocomial infections);
-
инфекции, связанные с оказанием медицинской помощи пациентам в амбулаторно-поликлинических условиях (healthcare-associated infections in outpatient departments);
-
инфекции, связанные с оказанием медицинской помощи в других организациях, осуществляющих медицинскую деятельность;
-
инфекции у медицинского персонала, связанные с выполнением профессиональных обязанностей в разных условиях оказания медицинской помощи (healthcare-associated infections of healthcare workers).
Нозокомиальные инфекции (НИ) по определению Центров по контролю заболеваемости США (CDC) – это инфекции, которые возникают в больничной среде, после поступления или выписки пациента из стационара и непосредственно связанные с оказанием медицинской помощи. Дополнительными условиями по определению являются отсутствие признаков инфекции на момент госпитализации пациента или нахождения пациента в инкубационном периоде инфекции.
Характерным условием возникновения НИ является повышенная восприимчивость определенных пациентов к инфекциям в результате физиологических нарушений, связанных с проведенным лечением, тяжестью соматической или другой патологии, применением препаратов, негативно влияющих на резистентность организма, и инвазивных методов диагностики и лечения.
В национальных и многоцентровых исследованиях, охвативших десятки различных стран, установлено, что пораженность пациентов как минимум одной нозологической формой ИСМП составляет от 3,5% до 12% [5]. По данным Европейского Центра по контролю и профилактике заболеваний (ECDC), почти 4 131 000 пациентов поражается ежегодно ИСМП в Европе, число эпизодов составляет около 4 544 100, что соответствует распространённости 7,1%. Сходная распространенность НИ отмечена в стационарах России 7,61% [6]. ИСМП занимают 10-е место среди ведущих причин смерти в США. По данным CDC число случаев ИСМП ежегодно составляет 1,7 миллионов случаев, из которых 99 тыс. со смертельным исходом, а экономический ущерб составляет около 30 миллионов долларов [7].
Обычно возбудителями ИСМП являются бактерии и грибы, реже – вирусы. Особенностью нозокомиальной флоры является резистентность к антибиотикам, которые обычно применяют для лечения внебольничных инфекций.
Потенциальными источниками возбудителей инфекций, связанных с оказанием медицинской помощи, могут быть пациенты, внешняя среда стационара, медицинский персонал, лица, привлекаемые к уходу за больными и посетите ли, навещающие больных. Однако степень их эпидемиологической опасности неравнозначна. Инфекция может передаваться от пациента к медицинскому работнику, от медицинского работника к пациенту, от пациента или медработника в окружающую среду, между медицинскими работниками и между пациентами. При несоблюдении надлежащих мер предосторожности роль медицинских работников в развитии негативной эпидемиологической ситуации в медицинском учреждении увеличивается .
Реализация инфекции в медицинских организациях может происходить как за счет эволюционно сложившихся естественных механизмов и путей передачи, так и искусственно созданными путями, обусловленными лечебно-диагностическим процессом и отсутствующими в естественных условиях (например, заражение ВИЧ-инфекцией, гепатитом В и др. при гемотрансфузиях и инъекциях).
Возможны следующие механизмы и пути передачи возбудителей инфекций, в том числе ИСМП.
Наиболее частыми видами НИ являются: инфекции дыхательных и мочевыводящих путей, инфекции области хирургического вмешательства (ИОХВ), инфекции сосудистого русла, интреабдоминальные инфекции.
Распространению НИ может способствовать широкое применение инвазивных методов диагностики и лечения, нарушающих физиологические барьеры организма; гигиенические нарушения (обработка рук), допускаемые персоналом, непосредственно работающим с пациентами (медицинские сестры, врачи, консультанты); превышение нормативной загрузки отделений; концентрация наиболее тяжелых пациентов и недостаточное количество персонала по уходу за ними (отделения реанимации и интенсивной терапии); отсутствие возможности
немедленной изоляции пациентов с НИ, вызванных полиили панрезистентной госпитальной флорой; несоответствие состояния или устаревшие архитектурно-планировочные решения лечебно-профилактических учреждений.
10.2.Факторы риска распространения ИСМП
-
Тяжелое состояние здоровья пациентов, нарушение устойчивости к бактериальной инвазии, пожилой возраст или преждевременные роды, сопровождающиеся иммунными нарушениями (медикаменты, заболевания или облучение), представляют важнейший фактор риска; другая патология – хронические обструктивные заболевания легких повышают вероятность возникновения инфекций дыхательной системы;
-
Инвазивные устройства, такие, как интубационные трубки, катетеры, хирургические дренажи, трахеостомические трубки, способствуют распространению инфекции. Колонизация патогенной или резистентной флорой значительно повышает риск инфекций при применении инвазивных процедур;
-
Назначение ЛС, обладающих иммуносупрессивным эффектом; антацидов, ингибиторов протонной помпы и H2-блокаторов, снижающих барьерную функцию желудка; применение антибиотиков (подавление собственной флоры и снижение колонизационной резистентности); повторные гемотрансфузии.
10.3.Выявление и регистрации ИСМП
Распространенность нозокомиальных инфекций является одним из критериев качества и безопасности лечения. Разработка процесса мониторинга количества нозокомиальных инфекций служит первым шагом к оценке важности и приоритетности этой проблемы. Сама система контроля является эффективным методом снижения количества нозокомиальных инфекций.
Основными задачами программы контроля ИСМП нозокомиальных инфекций являются:
-
привлечение внимания клиницистов и администрации больницы к проблемам нозокомиальных инфекций и резистентности флоры к антибиотикам, необходимости проведения превентивных мер;
-
мониторинг трендов количества, распространенности, факторов риска возникновения ИСМП;
-
определение необходимости внедрения программ профилактики и оценка их эффективности;
-
выявление перспективных областей улучшения лечения пациентов и проведения эпидемиологических исследований (анализ факторов риска).
Внедрение системы контроля инфекций в стационаре является важной задачей. Ее структура определяется особенностью стационара (набор отделений, особенности оказания медицинской помощи, набор пациентов) и продолжительностью периода наблюдения для всех участников (сотрудники отделений и лабораторий, врач-эпидемиолог медицинской организации, администратор). Первоначально определяется, какая именно информация является наиболее важной для внедрения определенных мер контроля (популяция пациентов, вид и точное описание инфекции, частота и продолжительность мониторинга, методы сбора данных, методы анализа данных, вероятные результаты и методы их распространения, конфиденциальность и анонимность исследования пациентов).
Простой подсчет пациентов (количество) позволяет получить ограниченный объем информации, который сложно интерпретировать. Необходим достаточный объем информации для полного описания проблемы, интерпретации вариантов и проведения сравнений. Анализ факторов риска требует информации об инфицированных и неинфицированных пациентах. Таким образом, могут быть определены количество инфекций и риск инфицирования. «Пассивное наблюдение» (лабораторные данные, ретроспективный анализ историй болезни, диагностика инфекций лечащим врачом) имеет очень низкую чувствительность (низкий уровень диагностики). Имеется несколько видов «активного выявления», которые позволяют определить распространенность или уровень заболеваемости. Современный инфекционный контроль должен удовлетворять четырем основным принципам: быть «активным», целенаправленным, использовать стандартную методологию, оценивать факторы риска. При проведении такого исследования разрабатывают карту пациента, которая содержит исчерпывающую информацию о выбранной категории больных и виде инфекции (например, нозокомиальная пневмония, связанная с искусственной вентиляцией легких; инфекции, связанные с катетеризацией сосудов; послеоперационные инфекции кожи и мягких тканей и др.). Статистическая обработка совокупности таких карт позволяет провести объективную оценку результатов исследования и получить сравнительные данные.
Выявление случаев ИСМП осуществляется с использованием пассивных и активных методов эпидемиологического наблюдения.
-
Выявление случаев ИСМП лечащими врачами, информирование госпитального эпидемиолога и регистрация в журнале учета инфекционных заболеваний (ф.60/у) (пассивное выявление). Данный метод позволяет выявить 10-30% случаев ИСМП.
-
Активное эпидемиологическое наблюдение с применением стандартных определений случая (активное выявление). Исследование эффективности программ контроля ИСМП показало, что в течение 5-летнего периода в больницах, где была внедрена программа активного эпидемиологического наблюдения, частота внутрибольничных инфекций снизилась в среднем на 32%, тогда как в других больницах только на 18%.
Наблюдение может быть сплошным (сплошной скрининг) и, в целях экономии трудозатрат, выборочным (поисковый скрининг). Для активного выявления пациентов с ИСМП могут быть применимы следующие критерии поискового скрининга (косвенные признаки нозокомиальной инфекции):
-
Информация из бактериологической лаборатории о выделении микроорганизма с нозокомиальным фенотипом устойчивости;
-
Информация из больничной аптеки о поданном требовании на АМП, используемый для лечения нозокомиальных инфекций;
-
Информация из отделения о пациентах с лейкоцитозом более 12 х 109/л, сохраняющемся более 3 дней после оперативного вмешательства;
-
Информация из отделения о длительном заживлении послеоперационной раны или продлении длительности стационарного лечения хирургического пациента сверх установленной для данной нозологии;
-
Информация из клинической лаборатории о выявлении у пациента уровня прокальцитонина > 1 нг/мл.
10.4.Критерии диагноза НИ
Диагностика НИ обычно проводится по тем же принципам, что и диагностика внебольничных инфекций. Однако при применении специальных, обычно инвазивных методов диагностики и лечения неинфекционных заболеваний возникают новые вероятные локусы инфекции, колонизация необычной флорой и другие особенности, требующие расширения диагностических возможностей и применения дополнительных методов, таких, как количественные микробиологические исследо вания, определение уровня маркеров (количественное определение концентрации прокальцитонина, С-реактивного белка), инвазивный забор образцов для микробиологического исследования (бронхоальвеолярный лаваж, биопсия тканей) и др. Критерии диагностики важнейших НИ представлены в табл. 5.
| Операции | Режим профилактики1 |
|---|---|
Инфекция области хирургического вмешательства |
Поверхностная ИОХВ (с вовлечением кожи и подкожной клетчатки): – гнойное отделяемое; – выделение микроорганизмов из жидкости или ткани, полученной из поверхностных слоев раны при наличии микроскопических признаков гнойного воспаления; – наличие двух и более симптомов: боль или болезненность, отек, гиперемия, местное повышение температуры – Глубокая ИОХВ: – гнойное отделяемое из глубины разреза; – выделение микроорганизмов из жидкости или ткани, полученной из глубоких слоев раны или мазка из глубины раны при наличии микроскопических признаков гнойного воспаления; – спонтанное расхождение краев раны или ее намеренное открытие хирургом, когда у пациента имеются следующие симптомы: гипертермия > 37,5ºС, локальная боль или болезненность – при непосредственном осмотре, во время повторной операции, при гистологическом или рентгенологическом исследовании обнаружен абсцесс или иные признаки инфекции в глубине раны. – Инфекционные осложнения в области любых анатомических образований и органов, имеющих отношение к оперативному вмешательству: – гнойное отделяемое из дренажа; – выделение микроорганизмов из жидкости или ткани, полученной асептически из органа/полости; – гипертермия; – при непосредственном осмотре, во время повторной операции, при гистологическом или рентгенологическом исследовании обнаружен абсцесс или иные признаки инфекции, вовлекающей (распространяющейся на) орган/полость |
Уроинфекция |
≥ 103 КОЕ/мл микроорганизма в моче + Симптомы: гипертермия, озноб, ухудшение ментального статуса, боль в пояснице, напряжение мышц в костовертебральном углу, остро возникшая гематурия, дискомфорт в области таза |
Респираторная инфекция |
Гипертермия >38,0°С или гипотермия <36,0°С; Гнойный характер мокроты; Лейкоцитоз >11х109/л или лейкопения <4х109/л + Новые или прогрессирующие инфильтраты на рентгенограмме |
Ангиогенная инфекция |
Наличие синдрома системной воспалительной реакции; Локализация источника инфекции в сосудистом русле при отсутствии вне сосудистых очагов Бактериемия, установленная хотя бы в одном из проводимых в динамике микробиологических исследований крови При подозрении на катетер-ассоциированную ангиогенную инфекцию:
|
На самом деле имеются данные CDC и публикации международных конференций, которые указывают на необходимость диагностики нозокомиальных инфекций примерно в 50 вероятных локусах организма человека.
Выделяют 4 наиболее эпидемиологически важные локализации НИ, не указанных в таблице 2, которыми являются:
-
Инфекции кожи и мягких тканей: открытые повреждения кожи, сопровождающиеся бактериальной колонизацией и способные быть причиной генерализованных инфекций (язвы, ожоги и пролежни);
-
Риносинуситы и другие инфекции придаточных пазух носа, инфекции глаз и конъюнктивы;
-
Эндометрит и другие инфекции репродуктивных органов, связанные с родами.
10.5.Профилактика
Любой стационар имеет общие правила стерилизации оборудования, обработки рук и других профилактически мер. Наиболее эффективной мерой профилактики является правильное мытье рук и применение обеззараживания рук с помощью антисептиков на основе спирта.
Несмотря на совершенствование общих гигиенических мер, пациент не может быть изолирован от возбудителей инфекций. Более того, пациентам часто назначают АБ с целью лечения инфекций, которые обладают селекционным давлением, способствующим росту резистентности флоры.
Стерилизация
Целью стерилизации является элиминация живых микроорганизмов в вегетативной и споровой форме, а также прионов с поверхности инструментов с помощью химических соединений, ионизирующей радиации, сухого нагревания или обработкой паром под давлением (автоклавирование).
Изоляция
Меры изоляции позволяют ограничить передачу микроорганизмов, которые могут распространяться в стационаре обычными путями. Из-за сложности контроля взаимодействия микроорганизма и факторов резистентности пациента проще ограничить распространение возбудителей.
Мытье рук и применение перчаток
Мытье рук часто называют самым простым методом ограничения передачи микроорганизмов, контаминирующих кожу одного лица, другому или разных областей тела одного пациента. Правильный подход предполагает мытье рук до и после контакта с пациентом, кровью, различными биологическим жидкостями и оборудованием. Распространение ИСМП у пациентов с иммунными нарушениями связано с контаминацией рук в 40% случаев и является реальной проблемой современных медицинских организаций. Наиболее эффективный путь их профилактики – активное внедрение гигиены рук, которое было поддержано в 2005 г. глобальной программой ВОЗ по безопасности пациентов.
На руках медицинского персонала имеются 2 категории микроорганизмов: транзиторные и резидентные. Транзиторная флора попадает из окружающей среды, способна выживать и некоторое время размножаться на поверхности кожи. Вторая группа микробов представляет собой постоянно живущих на поверхности кожи микроорганизмов (верхний слой эпидермиса). Они способны выживать и активно размножаться на коже человека, обладают низкой патогенностью и инвазивностью, защищают кожу от колонизации более патогенными микробами. Плотность колонизации кожи медицинских работников обычно составляет 3,9 х 104 – 4,6 х 106 КОЕ/см2. К резидентной флоре кожи относятся: Staphylococcus epidermidis, Staphylococcus hominis, Microccoci, Propionibacterium, Corynebacterium, Dermobacterium, Pitosporum, транзиторно могут появляться Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter spp, Enterobacter spp. и Candida spp.
Целью гигиены рук является элиминация транзиторной флоры с помощью мытья рук с мылом (обычным или с антисептиками) и спиртосодержащими антисептиками.
Основной практической проблемой гигиены рук является отсутствие достаточной по тщательности и времени процедуры мытья рук. Наиболее простой метод решения этого вопроса – применение специальных составов на основе спирта, которые позволят ускорить обработку рук. Несмотря на то что мытье рук представляет собой очень простой процесс, его часто проводят неправильно. В стационаре необходимо постоянно напоминать медработникам и посетителям о необходимости правильного мытья рук и контролировать этот процесс. Простые меры, например, использование песочных часов и других устройств для оценки продолжительности обработки рук оказывают неоценимую помощь в профилактике нозокомиальных инфекций.
Все посетители также должны правильно выполнять процедуру мытья рук с целью контроля распространения инфекций. Посетители, и медицинские работники в одинаковой степени могут «участвовать» в передаче инфекций. Более того, полирезистентные микробы могут выходить за пределы стационара и становиться частью внебольничной флоры, если не предпринимать шаги для ограничения этого процесса.
Кроме мытья рук, важное значение в снижении распространения микробов имеет применение перчаток. Имеется три важных причины применения перчаток с целью защиты медицинского персонала и пациента от инфекции:
-
создается барьер, предотвращающий контаминацию рук при работе с кровью, биологическими жидкостями, слизистыми оболочками, поврежденной кожей;
-
снижается вероятность переноса микробов от персонала к пациенту во время инвазивных процедур;
-
ограничивается микробная контаминации при контакте с пациентом, при этом смена перчаток должна производится после каждого контакта с больным, кроме того, следует мыть руки после снятия перчаток.
Применение перчаток не заменяет мытья рук, так как перчатки могут иметь малозаметные дефекты или повреждения, в результате чего руки остаются контаминированными после их снятия. Отказ от снятия перчаток при переходе от одного пациента к другому представляет собой реальный дефект инфекционного контроля.
Дезинфекция поверхностей
Это важная мера, позволяющая предотвратить распространение инфекций при оказании медицинской помощи. Доказана эффективность профилактики распространения возбудителей гастроэнтерита, MRSA и гриппа. Применение перекиси водорода приводит к клинически значимому снижению количества инфекций и риска заболевания даже в случаях борьбы со спорообразующими бактериями (C.difficile), когда применение спирта оказалось неэффективным.
10.6.Обеспечение эпидемиологической безопасности медицинской организации
Эпидемиологическая безопасность медицинской помощи предполагает:
Обеспечение эпидемиологической безопасности медицинских технологий следует рассматривать как в отношении пациентов, так и медицинского персонала.
Эпидемиологическая безопасность реализуется через порядки и стандарты оказания медицинской помощи и эпидемиологическое обеспечение медицинской деятельности.
Реализация эпидемиологической безопасности через порядки и стандарты оказания медицинской помощи – это важнейшее условие достижения качества медицинской помощи. Следовательно, стандарты оказания медицинской помощи должны включать положения по эпидемиологической безопасности и при разработке стандарта необходима его экспертная оценка с точки зрения эпидемиологической безопасности.
Эпидемиологическая безопасность реализуется также через эпидемиологическое обеспечение медицинской деятельности.
Эпидемиологическое обеспечение – комплекс диагностических, санитарно-противоэпидемических (профилактических) мероприятий, направленных на создание безопасной больничной среды, обеспечение качества медицинской помощи и предотвращение случаев инфекционных (паразитарных) заболеваний, включая инфекции, связанные с оказанием медицинской помощи, инфекционные болезни, которые могут привести к возникновению чрезвычайных ситуаций в области санитарно-эпидемиологического благополучия населения, а также актуальных неинфекционных заболеваний среди населения, пациентов и персонала в медицинских организациях.
Организация эпидемиологического обеспечения проводится врачами-эпидемиологами медицинских организаций и помощниками врачей-эпидемиологов. При штатной численности должностных ставок врачей-эпидемиологов три и более в медицинских организациях организуется эпидемиологический отдел. Особенностью и преимуществом российской системы профилактики ИСМП является наличие в медицинских организациях должности врача-эпидемиолога специалиста, полностью ориентированного на проведение эпидемиологической диагностики и организацию профилактических и противоэпидемических мероприятий. Ежедневное знание особенностей эпидемиологической обстановки в медицинской организации и в каждом отдельном подразделении дает возможность оперативного вмешательства для предупреждения и развития групповой заболеваемости. Взаимодействие клинического фармаколога и эпидемиолога – необходимое условие достижения высокой эффективности профилактики ИСМП. В соответствии с действующим санитарным законодательством, все аспекты ИСМП, в том числе контроль распространения резистентных форм микроорганизмов, антимикробная политика в медицинской организации, рассматриваются коллегиально комиссией по профилактике ИСМП.
Эпидемиологическое обеспечение в медицинской организации включает:
-
эпидемиологическое наблюдение в структурных подразделениях медицинской организации, в первую очередь в отделениях риска; активное выявление и регистрацию случаев инфекций, связанных с оказанием медицинской помощи;
-
эпидемиологическую диагностику, причин и условий, способствующих инфицированию пациентов и персонала в медицинских организациях, определение путей и факторов передачи возбудителей инфекций, связанных с оказанием медицинской помощи;
-
оценку риска инфицирования пациентов и медицинского персонала; микробиологическую верификацию случаев инфекционных заболеваний, включая инфекции, связанные с оказанием медицинской помощи;
-
мониторинг резистентности к антимикробным препаратам (антибиотикам, дезинфектантам, антисептикам) основных возбудителей инфекций, связанных с оказанием медицинской помощи, признаков формирования госпитальных штаммов (клонов); стратегию и тактику применения в медицинских организациях антимикробных препаратов;
-
систему профилактических и противоэпидемических мер, в том числе постэкспозиционную химиопрофилактику, антимикробную профилактику, специфическую профилактику, дезинфекционные, стерилизационные, дезинсекционные, дератизационные мероприятия в медицинской организации;
-
оценку проектов реконструкции, текущего и капитального ремонтов, методов и средств защиты медицинского персонала, степени эпидемиологической безопасности оборудования и медицинских изделий, новых медицинских технологий в рамках своей компетенции;
-
систему обращения с медицинскими отходами медицинской организации;
-
стандартизацию мер защиты от инфицирования при различных медицинских технологиях;
-
обучение различных категорий медицинского персонала профилактике инфекционных (паразитарных) заболеваний, включая инфекции, связанные с оказанием медицинской помощи, а также инфекций, случаи заболевания которыми могут привести к возникновению чрезвычайных ситуаций в области санитарно-эпидемиологического благополучия населения, а также повышение мотивации медицинского персонала к обеспечению безопасности и качества медицинской помощи;
-
внедрение принципов доказательной медицины в деятельность медицинского учреждения при выборе, применении и оценке результатов использования различных методов диагностики, лечения и профилактики;
-
консультативную, методическую и организационную помощь в эпидемиологической диагностике и профилактике инфекционных (паразитарных) и актуальных неинфекционных заболеваний;
-
оценку эпидемиологической и экономической эффективности профилактических и противоэпидемических мер на основе принципов доказа тельной медицины;
-
взаимодействие с органами и учреждениями Роспотребнадзора, другими организациями в рамках своей компетенции.
Лабораторное обеспечение верификации диагноза и эпидемиологической диагностики осуществляется лабораториями медицинской организации или по договору с внешними исполнителями, обеспечивающими требования микробиологического мониторинга. Лабораторное обеспечение должно предусматривать возможность типирования возбудителей инфекций, связанных с оказанием медицинской помощи, в том числе молекулярно-биологическими методами.
Раздел 11. Роль микробиологической лаборатории в реализации программы СКАТ
Микробиологическая лаборатория играет ключевую роль в реализации таких элементов программы СКАТ, как обоснование этиотропной терапии инфекционных болезней у отдельных пациентов, формирование стратегии и тактики использования антимикробных средств в медицинских учреждениях, обоснование мероприятий и функционирование системы инфекционного контроля. Для адекватного решения перечисленных задач микробиологическая лаборатория должна располагать современным оборудованием, квалифицированным персоналом, а также эффективной системой управления качеством. Организация работы лаборатории должна обеспечивать максимально качественное выполнение трех основных этапов исследований: преаналитического, аналитического и постаналитического.
В современных условиях составление перечней рекомендованного оборудования представляется не вполне целесообразным. Планирование оснащения лаборатории, а также развитие и совершенствование материальной базы является обязанностью руководителя и зависит от объема и специфики исследований. Отдельной проблемой является централизация микробиологической службы и укрупнение лабораторий. Использование современного высокопроизводительного оборудования может обеспечить доступность микробиологических исследований все 7 дней в неделю, в течение 24 ч, однако, создание лабораторий с таким оборудованием становится экономически целесообразным лишь при значительных потоках исследований: не менее 400 000 – 500 000 в год.
Современный этап развития микробиологии характеризуется революционными изменениями в методологии аналитических методов исследований. Количество новых молекулярных и физико-химических методов нарастает лавинообразно, что создает для практических лабораторий определенные трудности в их выборе и формировании технологических цепочек. Во многих случаях классические культуральные методы остаются «золотым стандартом» в диагностике, однако, количество ситуаций, когда молекулярные методы становятся основными, постоянно возрастает.
Стратегическим направлением развития микробиологических лабораторий должна быть консолидация в рамках одного подразделения методов этиологической диагностики инфекций: классических культуральных, молекулярных и иммунологических. При такой консолидации появляется возможность использовать синдромальный подход к диагностике инфекционных процессов. Так, например, при диагностике кишечных инфекций лаборатория должна иметь возможность выявлять всех потенциальных патогенов (бактерии, вирусы и простейшие), используя для каждого из них наиболее адекватные методы.
Диагностика инфекций у индивидуальных пациентов полностью зависит от преаналитического этапа: корректного выбора биологического материала, направляемого на исследование, способа его получения, соблюдения временных и температурных режимов транспортировки и хранения. Формирование требований к выполнению перечисленных этапов исследования является задачей микробиологов, однако их реализация находятся в сфере ответственности клиницистов. Для координации работы клинических и лабораторных подразделений, а также контроля, порядок проведения преаналитического этапа в каждом стационаре должен быть документально оформлен в виде стандартных операционных процедур (протоколов). Основой для разработки таких документов могут служить Методические указания (МУ 4.2.2039-05) «Техника сбора и транспортирования биоматериалов в микробиологические лаборатории» от 2006 г. Более полно и на современном уровне проблема освещена в рекомендациях, разработанных Американским обществом инфекционных болезней и Американским обществом микробиологов (http://cid.oxfordjournals.org/content/early/2013/06/24/cid.cit278.full [1]
Поскольку эффект этиотропной терапии наиболее тяжелых инфекций во многом зависит от времени назначения адекватных антибиотиков, скорость проведения аналитического этапа микробиологической диагностики становится критичным фактором. К сожалению, в настоящее время при использовании только классических технологий выделить возбудитель инфекции и получить ответ о его чувствительности к антибиотикам быстрее, чем через 48 ч от начала исследования, крайне сложно.
Частично проблема ускорения сроков исследования может быть решена при использовании селективных хромогенных сред. При применении таких сред уже через 18 24 ч после первичного посева биологического материала может быть получен предварительный ответ о наличии в образце MRSA, энтеробактерий продуцентов БЛРС и карбапенемаз, возможна также предварительная идентификация бактерий и грибов.
Значительного ускорения получения предварительных результатов удается добиться при использовании полимеразной цепной реакции (ПЦР) для детекции в биологическом материале ДНК патогенов и/или детерминант резистентности. В Российской Федерации разрешены к применению тест-системы для детекции в биологических образцах ведущих возбудителей инфекций (Pseudomonas aeruginosa, Acinetobacter baumannii, Enterobacteriaceae, Neisseria meningitidis, Streptococcus pneumoniae, Haemophilus influenzae, Streptococcus agalactiae, _ MRSA, C. difficile) и важнейших детерминант резистентности (генов карбапенемаз, генов устойчивости к ванкомицину) методом ПЦР в реальном времени. Использование методов ускоренной детекции патогенов и детерминант резистентности предполагает параллельное проведение диагностики классическими культуральными методами.
Наиболее серьезным технологическим прорывом последних лет стало внедрение в повседневную практику микробиологических лабораторий идентификации бактерий методом MALDI-TOF масс-спектрометрии. Метод позволяет провести идентификацию чистых культур бактерий в течение нескольких минут. Разработаны технологии использования данного метода для идентификации бактерий из флаконов с положительной гемокультурой, а также для детекции продукции бактериями карбапенемаз и других бета-лактамаз. Точная идентификация потенциальных возбудителей менее чем через 24 после начала исследования, позволяет в ряде случаев существенно корректировать эмпирическую терапию, но необходимость в проведении оценки антибиотикочувствительности сохраняется.
К особенностям микробиологической диагностики относятся сложные требования к проведению постаналитического этапа исследований, содержанием которого является анализ результатов, их сопоставление с теоретическими представлениями. Результатом постаналитического этапа является оценка клинической значимости выделенных бактерий и интерпретация данных оценки антибиотикочувствительности. До недавнего времени в Российской Федерации интерпретация результатов оценки антибиотикочувствительности осуществлялась в соответствии с «Методическими указаниями по определению чувствительности микроорганизмов к антибактериальным препаратам», разработанными на основе рекомендаций Института клинических и лабораторных стандартов США (Clinical and Laboratory Standards Institute CLSI). В 2015 г на совещании Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии были утверждены Национальные клинические рекомендации – «Определение чувствительности микроорганизмов к антимикробным препаратам» (доступны в Федеральной электронной медицинской библиотеке http://www.femb.ru/). Документ является переводом рекомендаций Европейского комитета по оценке антибиотикочувствительности (European Committee on Antimicrobial Susceptibility Testing – EUCAST). Документы, разрабатываемые EUCAST, регулярно обновляются, их оригиналы свободно доступны в Интернете (www.eucast.org).
Формирование стратегии и тактики использования антимикробных средств в медицинских учреждениях основывается на анализе результатов идентификации и оценки антибиотикочувствительности возбудителей инфекций, выделенных в учреждении за определенный временной период. Результаты анализа в форме отчета должны периодически доводиться до сведения администраторов в клиницистов. Предоставление ежегодного отчета должно быть правилом, целесообразность более частых отчетов (ежеквартальные или ежемесячные) определяется исходя из местных условий. Структура отчета должна позволять оценивать этиологию и антибиотикочувствительность возбудителей внебольничных и госпитальных инфекций в отдельных подразделениях и при отдельных нозологических формах. Особое внимание целесообразно уделять отделениям реанимации и интенсивной терапии. В учреждениях, обладающих лабораторными информационными системами, подготовка таких отчетов не составляет труда и происходит автоматически при задании программе необходимых параметров. Широкой популярностью пользуется разработанная ВОЗ программа WHONET, ее использование целесообразно в учреждениях, не располагающих информационными системами. К недостаткам программы следует отнести необходимость ручного ввода данных.
Для обоснования мероприятий по сдерживанию распространения множественно устойчивых патогенов, являющихся наиболее важными возбудителями трудно поддающихся лечению госпитальных инфекций, необходима информация об источниках и путях распространения этих бактерий. Соответственно задачей лаборатории является обнаружение патогена в организме пациентов с признаками инфекций или без них, а также в объектах внешней среды. С точки зрения инфекционного контроля наиболее важными патогенами следует рассматривать MRSA и Enterobacteriaceae, продуцирующие карбапенемазы. В настоящее время доступны как классические культуральные методы, так молекулярные методы детекции этих бактерий в объектах окружающей среды и в организме пациентов.
Литература
Раздел 12. Роль и методология образовательных мероприятий в реализации программы СКАТ
Образовательные мероприятия являются неотъемлемой частью реализации проекта СКАТ [1-3]. К сожалению, в программе медицинских ВУЗов вопросу антибиотикорезистентности и рациональному назначению антимикробных препаратов уделяется очень мало внимания, поэтому у будущих медиков не формируется представление о важности и значимости данной проблемы [4]. При составлении же плана своего последипломного образования каждый врач отдает предпочтение узкоспециализированным мероприятиям, дающим знания и навыки, необходимые для лучшего выполнения своей каждодневной работы. По мнению большинства докторов, информация о рациональном назначении антимикробных препаратов не входит в перечень знаний, необходимых для повседневной деятельности, именно поэтому мероприятия, посвященные рациональной антимикробной терапии, в большинстве случаев игнорируются специалистами. Все это приводит к формированию подходов, основанных на ошибочных взглядах и убеждениях. При назначении антимикробных препаратов врачи чаще опираются на сложившуюся в отделении или медицинской организации практику, советы старших коллег и личный предшествующий опыт [4, 5], чем на существующие рекомендации, знания клинической фармакологии антимикробных препаратов и локального микробного пейзажа.
В связи с этим очевидно, что постоянное обучение медицинского персонала один из ключевых факторов, влияющих на приверженность к реализации программы СКАТ в учреждении [3]. Однако при планировании образовательных мероприятий очень важно учесть ряд факторов, способных существенно повлиять на успех как самого обучения, так и реализации программы в целом.
Прежде всего, необходимо понять, с какой именно аудиторией предстоит иметь дело, то есть оценить исходный уровень информированности врачей. Как правило, образовательные мероприятия в данной области проводят люди, глубоко погруженные в проблему антибиотикорезистентности, имеющие обширный теоретический и практический опыт. С другой стороны, знания большинства докторов в вопросах клинической фармакологии антимикробных препаратов, механизмов резистентности и клинической микробиологии являются обрывочными, разрозненными и бессистемными. При таком положении вещей возможна ситуация, когда уровень подготовки аудитории оказывается недостаточным для восприятия той информации, которая преподносится в ходе конференции или семинара. Это, в свою очередь, дискредитирует данное мероприятие, поскольку пропускная способность нервной системы ограничена, и восприятие слишком большого объема совершенно новой информации вызывает трудности и, соответственно, снижение интереса. Повторяясь же из раза в раз, ситуация вызывает негатив и отторжение как к обучающему процессу, так и к самому проекту СКАТ.
Анализ первоначального уровня знаний предполагаемой аудитории составляет основу для подготовки образовательной программы. Прежде всего, он позволяет адаптировать преподносимую информацию и сделать ее максимально понятной и интересной для слушателей. Кроме того, скрининг, охватывающий различные темы, дает возможность выявить наиболее сильные и слабые стороны и акцентировать внимание на тех моментах, которые вызывают максимальные затруднения. Для многопрофильных медицинских организаций может быть полезным проводить оценку отдельно для различных специальностей, чтобы сделать процесс обучения более гибкой.
Методики оценки исходных знаний весьма разнообразны. Это может быть проведение собеседований с сотрудниками, различные варианты устных и письменных опросов, индивидуальные или коллективные задания, интерактивные опросники и т.д.
Одной из таких методик может служить тестирование – опросник с предложенными вариантами ответов, из которых необходимо выбрать один или несколько правильных. Такой способ, с одной стороны, не отнимает много времени у респондентов, а с другой, позволяет опросить большое количество людей по различным темам за короткий промежуток времени. Что важно, результаты тестирования не зависят от личности исследователя, т.е. максимально объективны, а при использовании одного и того же опросника появляется возможность сравнивать результаты разных групп людей или одного и того же человека по прошествии времени.
Также немаловажно правильно выбрать формат мероприятия. Согласно ряду исследований, пассивные формы обучения (лекции, симпозиумы, конференции) являются менее эффективными, чем обучение с личным вовлечением [6], однако последнее является более ресурсоемкими, поскольку требует достаточного количества квалифицированных специалистов. Использование наглядных материалов само по себе, без дополнительной образовательной программы, тоже не является достаточно эффективным [3].
Наиболее целесообразным представляется сочетание различных методов и форм обучения. Так, для подачи базового теоретического материала вполне подходят пассивные формы обучения, такие как семинары, лекции. Однако и здесь необходимо сделать правильный выбор. Более масштабные мероприятия (симпозиумы, конференции) дают возможность представить информацию широкой аудитории, но для эффективного восприятия большого объема новых знаний врачи должны иметь определенный базовый уровень и быть заинтересована в обучении. Для слабо подготовленных слушателей предпочтительно выбирать короткие лекции, затрагивающие не более одной-двух тем одновременно. Также полезно формировать ассоциативные связи между новой информацией и уже известной с целью лучшего понимания и запоминания полученных знаний.
Для закрепления теоретического материала и отработки его практического применения наиболее полезны мероприятия с личным вовлечением. Это могут быть клинические разборы, индивидуальные беседы, интерактивные образовательные программы. Такое обучение лучше проводить для небольшого количества участников, например, в рамках отделения или даже для отдельных врачей отделения. Для клинических разборов можно использовать как абстрактные примеры, так и конкретных пациентов, однако стоит избегать дискуссий «у постели больного», поскольку вступает в силу возможный конфликт интересов лечащего врача и обучающего, в результате чего образовательная ценность такого обсуждения сводится на нет. Предпочтительнее проводить ретроспективные разборы выписанных пациентов или тех, для кого лечебная тактика уже определена.
Использование наглядных обучающих пособий также может быть полезно для закрепления и визуализации полученных знаний. В виде печатных материалов можно оформить микробиологические паспорта отделений, схемы и протоколы стартовой терапии, алгоритмы гигиенической обработки рук, алгоритмы взятия биоматериала для бактериологического исследования и т.д. В подборе информации для визуализации также могут помочь результаты оценки исходного уровня знаний. Так, если большинство неверных ответов врачей связаны с локальным микробным пейзажем, целесообразно создать плакаты с микробиологическими паспортами отделений, если же основную сложность вызывают вопросы по механизмам формирования резистентности, то и наглядные пособия должны содержать именно эти данные.
Для повышения ценности образовательной программы необходима постоянная оценка ее эффективности. С этой целью возможно использовать те же методики, которые применялись для первоначального анализа. Сравнение исходных и конечных результатов позволит понять, насколько успешными были те или иные мероприятия, и проанализировать возможные причины неуспеха, чтобы произвести корректировку дальнейших действий.
Особое внимание хочется обратить на обучение студентов и ординаторов, а также молодых докторов, только поступающих на работу. Именно эта аудитория является наиболее перспективной в плане образовательных мероприятий [3]. С одной стороны, обучение для этой категории врачей еще является неотъемлемой частью жизни и не вызывает отторжения или неприятия. С другой стороны, у них еще нет своего устоявшегося взгляда, и под влиянием получаемой информации как раз и будет происходить его формирование. В то же время именно эти доктора в ближайшем будущем станут наиболее инициативной, динамично развивающейся частью медицинского сообщества, и их взгляд на те или иные вопросы будет во многом определять стратегию и тактику развития медицины. Поэтому для молодых врачей и ординаторов, особенно в клинических лечебных учреждениях, целесообразно проводить дополнительные образовательные мероприятия, как можно чаще актуализировать проблему антибиотикорезистентности, чтобы в дальнейшем сформировать поколение врачей, осознающих важность рационального назначения антимикробных препаратов и обладающих достаточными для этого знаниями.
Кроме того, может быть полезно обучение не только медицинского персонала, но и пациентов [4], особенно в амбулаторном звене. Ведь не секрет, что зачастую доктор в своих действиях идет на поводу у больного, требующего назначить антибиотик. Наглядные материалы в виде плакатов или брошюр, тематические занятия и школы, личные беседы врача и/или медицинской сестры с пациентом и его родственниками могут помочь в формировании правильного взгляда на проблему антибиотикорезистентности среди населения.
Таким образом, обучение в рамках реализации программы СКАТ состоит из следующих основных этапов:
Схематически образовательный процесс можно изобразить следующим образом (рис. 1).
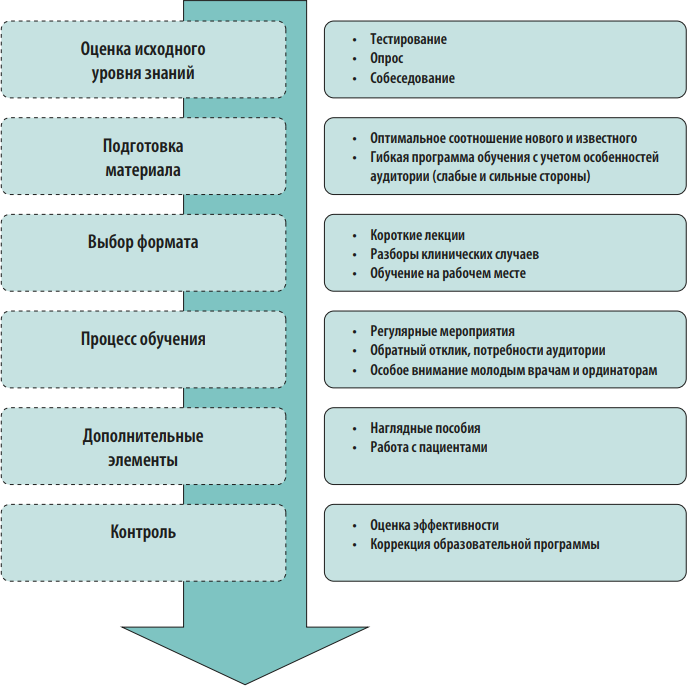
Разумеется, в вопросе обучения, как и в целом в реализации программы СКАТ, не существует универсальных рецептов и методик. Очень многое зависит от специфики конкретного медицинской организации: укомплектованность кадрами, уровень административной поддержки, сложившаяся практика назначения антимикробных препаратов, специальность и личность лидера, возглавляющего команду энтузиастов, и многое другое. Тем не менее, значимость обучения как элемента программы оптимизации антимикробной терапии несомненна. Для большинства медицинских организаций осознанный переход к более рациональному применению антимикробных препаратов и отказ от необоснованного их назначения предпочтительнее, чем строгие ограничительные мероприятия, в силу ряда факторов [2, 3]. Однако для эффективной реализации такой программы очень важно найти взаимопонимание с лечащими врачами, и грамотно построенное обучение может стать тем ключом, который поможет осознать общие цели и найти оптимальный путь к их достижению.
Литература
-
Стратегия и тактика применения антимикробных средств в лечебных учреждениях России: Российские национальные рекомендации / Под ред. В.С. Савельева, Б.Р. Гельфанда, С.В. Яковлева. – М.: ООО «Компания БОРГЕС», 2012. – 92 с.
-
Программа СКАТ (Стратегия Контроля Антимикробной Терапии) при оказании медицинской помощи: методические рекомендации / Под ред. С.В. Яковлева, М.В. Журавлевой, Д.Н. Проценко, В.Б. Белобородова. – М., 2016. – 100 с.
-
Antimicrobial stewardship / Edited by Laundy M, Gilchrist M, Whitney L. – Oxford: Oxford University Press, 2016. – 148 p.
-
Всемирная Организация Здравоохранения. Возрастающая угроза развития антимикробной резистентности: возможные меры. 2013. – 130 с. Интернет ресурс [wwhttp://www.who.int/[w.who.int].]
-
Pulcini C, Williams F, Molinari N, Davey P, Nathwani D. Junior doctor’s knowledge and perceptions of antibiotic resistance and prescribing: a survey in France and Scotland. Clin Microbial Infect 2011;17:80-7.
-
Solomon DH, Van Houten L, Glynn RJ, Baden L, Curtis K, Schrager H, et al. Academic detailing to improve use of broad-spectrum antibiotics at an academic medical center. Arch Intern Med 2001;161:1897-902.
Раздел 13. Показатели качества антимикробной терапии и оценка эффективности реализации программы СКАТ
13.1 Оценка качества в антимикробной терапии
Рациональное применение АМП является одним из важных условий обеспечения качественной медицинской помощи. Между тем качество оказания медицинской помощи в случаях, требующих применения АМП, остается неудовлеторительным из-за высокой частоты дефектов. На стационарном этапе наиболее частыми ошибками являются: нерациональный выбор препаратов и схем их введения, избыточное использование АМП, отказ от периоперационной антибиотикопрофилактики и ее чрезмерная длительность. Частота ошибок достоверно выше в медицинской организации, где отсутствует служба клинической фармакологии.
Для повышения качества использования АМП, кроме оптимизации клинико-фармакологических аспектов их применения, необходим ряд организационных (управленческих, экономических) мер.
Управление качеством в такой сфере, как применение АМП, требует системного подхода и должно осуществляться как на уровне медицинских учреждений, так и региональных и центральных органов здравоохранения, страховых компаний и общества в целом. Структурными компонентами системы являются: совершенствование нормативной базы; принятие решений, основанных на принципах доказательной медицины; мониторинг резистентности, регистрация случаев внутрибольничной инфекции; наличие стандартов и протоколов; разработка и внедрение формулярных списков; совершенствование системы закупок; внедрение программ периоперационной антибиотикопрофилактики; внедрение ограничительных программ при назначении АМП.
Условием соблюдения стандартов антимикробной терапии определены: материальное обеспечение стандарта (наличие АМП в достаточном количестве в соответствии с потребностями медицинской организации); проведение программ авторизации и образовательных программ.
Алгоритм экспертной оценки случаев оказания медицинской помощи с применением АМП включает: формирование базы данных по выписанным и отпущенным антибиотикам, выборку в зависимости от диагноза, формирование ключевых направлений экспертизы по результатам частотного DDD-анализа; анализ основных проблем антимикробной терапии в регионе или медицинской организации; выявление дефектов лечения, их коррекцию и профилактику.
Необходимым условием повышения качества применения антимикробных препаратов является функционирование координационного совета по управлению качеством в сфере применения антимикробных препаратов. В разработке стратегии рационального использования АМП на региональном уровне должны принимать участие все заинтересованные ведомства: Департамент здравоохранения, Росздравнадзор, Роспотребнадзор, территориальный фонд обязательного медицинского страхования (ТФОМС).
Схема взаимодействия субъектов обращения АМП на региональном уровне в составе координационного совета может быть представлена следующим образом. ТФОМС, Департамент здравоохранения и медицинский вуз совместно разрабатывают локальные стандарты, проводят экономическое обоснование клинических рекомендаций и алгоритмов при использовании АМП. Через корпоративную сеть от медицинской организации, внедривших систему персонифицированного учета, поступают сведения по пролеченным больным. По результатам анализа формулируются основные проблемы при использовании АМП, требующие решения, и формируются реестры медицинских карт и историй болезни, подлежащих экспертизе. По результатам экспертной оценки предлагаются образовательные и/или административные мероприятия [1–2].
13.2.Оценка эффективности реализации программы СКАТ
Анализ критериев эффективности СКАТ позволяет оценить степень достижения первичных и вторичных целей, а также своевременно скорректировать объем и направленность мероприятий программы управления назначением АМП. Расчет показателей необходимо проводить регулярно (каждые 6-12 мес.), сравнивая, например, данные IV квартала каждого года до и после внедрения программы СКАТ. Наиболее информативными являются показатели распространенности детерминант антибиотикорезистентности, критерии качества антимикробной терапии и фармакоэкономической эффективности, показатели качества лечения пациентов с инфекцией, комплексные показатели.
Показатели, оценивающие уровень антибиотикорезистентности. Основаны на анализе общей структуры возбудителей, а также структуры возбудителей инфекции различной локализации. Необходимы для назначения эмпирической антимикробной терапии. Особое внимание следует обращать на распространенность возбудителей группы ESKAPE:
-
Enterococcus faecium VR – ванкомицинрезистентный Enterococcus faecium
-
Staphylococcus aureus MR – метициллин-резистентный золотистый стафилококк;
-
Klebsiella pneumoniae KPC – Kl. pneumoniae, продуцирующая карбапенемазы;
-
Acinetobacter baumannii MDR – Ac. baumannii, обладающий полирезистентностью;
-
Pseudomonas aeruginosa MDR – Ps. aeruginosa, обладающая полирезистентностью;
-
Enterobacteriaceae ESBL – грамотрицательные энтеробактерии, продуцирующие БЛРС.
Указанные микроорганизмы обладают наибольшим потенциалом антибиотикорезистентности и создают максимальные трудности при выборе эмпирической АМТ.
Показатели фармакоэкономической эффективности и качества АМТ.
Данная группа включает в себя критерии общего и структурного потребления АМП в стационаре (целесообразно рассчитывать в средних дневных дозах [defined daily dose, DDD]), расходы на закупку антибиотиков, а также показатели качества АМТ у пациентов с инфекцией.
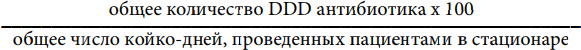

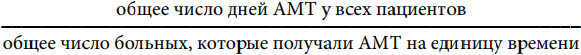
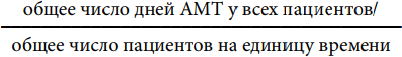
Показатели качества лечения пациентов с инфекцией включают длительность пребывания пациентов с инфекцией в ОРИТ и стационаре, частоту бактериемий, вызванных полирезистентными штаммами, частоту кандидемий, уровень летальности в группе больных с инфекцией.
Комплексные показатели . Индекс лекарственной устойчивости [ИЛУ, Drug Resistance Index (DRI)] – показатель объединяет в себе информацию об устойчивости микроорганизма к АМП и общее потребление антибиотиков. ИЛУ может быть определен для стационара или конкретного отделения [3].
Методика расчета ИЛУ
На первом этапе рассчитывается доля резистентных штаммов выбранного микроорганизма к отдельным группам АМП (Таблица 6). В столбец 3 вносят классы антимикробных препаратов, потенциально эффективных в отношении данного возбудителя. В столбец 4 – общее количество штаммов патогена, к которым производилось определение чувствительности к АМП данного класса. В столбец 5 – общее количество штаммов, резистентных к этому же классу АМП. Частота резистентности (столбец 6) рассчитывается, как отношения количества резистентных штаммов к общему количеству штаммов указанного патогена.
Второй этап включает сбор данных о потреблении анализируемых классов АМП. Для этого подсчитывается сумма использованных DDD антибиотиков каждого класса. Для расчета потребуется ATC/DDD индекс, размещенный на сайте «WHO Collaborating Center for Drug Statistics Methodology» по адресу www.whocc.no/atc_ddd_index/
Например, для класса карбапенемов: За 2012 год по данным аптеки медицинской организации использовано 360 флаконов эртапенема по 1,0 г, 10920 флаконов меропенема по 1,0 г, 2795 флаконов имипенема/циластатина по 0,5 + 0,5 г.
Для эртапенема ATC/DDD индекс = 1,0 г DDD эртапенема = 360/1 = 360.
Для меропенема ATC/DDD индекс = 2,0 г DDD меропенема = 10920 / 2 = 5460.
| Период | Патоген | АМП | Всего изолятов | Количество резистентных изолятов | Частота резистентных изолятов |
|---|---|---|---|---|---|
1 |
2 |
3 |
4 |
5 |
6 |
2012 |
Klebsiella pneumoniae |
Аминогликозиды |
580 |
276 |
0,48 |
Фторхинолоны |
648 |
502 |
0,77 |
||
Аминопенициллины |
648 |
636 |
0,98 |
||
Защищенные пенициллины |
391 |
306 |
0,78 |
||
Цефалоспорины I-IV |
621 |
497 |
0,8 |
||
Карбапенемы |
628 |
105 |
0,17 |
||
Тигециклин |
402 |
67 |
0,17 |
||
Колистин |
648 |
0 |
0 |
||
2014 |
Klebsiella pneumoniae |
Аминогликозиды |
427 |
172 |
0,4 |
Фторхинолоны |
552 |
374 |
0,68 |
||
Аминопенициллины |
494 |
492 |
0,99 |
||
Защищенные пенициллины |
295 |
224 |
0,76 |
||
Цефалоспорины I-IV |
510 |
393 |
0,77 |
||
Карбапенемы |
415 |
48 |
0,11 |
||
Тигециклин |
348 |
5 |
0,01 |
||
Колистин |
552 |
1 |
0 |
Второй этап включает сбор данных о потреблении анализируемых классов АМП. Для этого подсДля имипенема/циластатина ATC/DDD индекс = 2,0 гр. по имипенему. DDD имипенема/циластатина = 2795 / 4 = 699.
Общее DDD для карбапенемов = 360 + 5460 + 699 = 6519.
Далее потребление АМП нужно рассчитать на 100 койко-дней (к/д) по формуле:
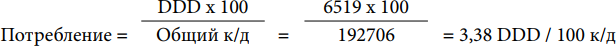
Потребление = Общий к/д = 192706 = 3,38 DDD / 100 к/д Общий к/д можно уточнить в отделе статистики или вычислить по формуле: [кол-во пролеченных больных] х [средний к/д].
Данные о потреблении изучаемых классов АМП вносят в табл. 7: в 3-й столбец – данные о потреблении указанного класса АМП, рассчитанные на 100 койко-дней; в 4-й – общее потребление АМП (суммируют DDD/100 к/д из столбца 3 для каждого периода); частоту потребления АМП (столбец 5) вычисляют, как отношение потребления каждого класса АМП (столбец 3) к общему потреблению в данный период (столбец 4).
| Период | АМП | Потребление DDD/100 к/д | Общее потребление АМП DDD/100 к/д | Частота потребления АМП |
|---|---|---|---|---|
1 |
2 |
3 |
4 |
5 |
2012 |
Аминогликозиды |
1,37 |
41,87 |
0,03 |
Фторхинолоны |
12,3 |
0,29 |
||
Аминопенициллины |
1,44 |
0,03 |
||
Защищенные пенициллины |
6,71 |
0,16 |
||
Цефалоспорины I-IV |
16,28 |
0,39 |
||
Карбапенемы |
3,38 |
0,081 |
||
Тигециклин |
0,34 |
0,008 |
||
Колистин |
0,05 |
0 |
||
2014 |
Аминогликозиды |
1,72 |
35,76 |
0,05 |
Фторхинолоны |
10,07 |
0,28 |
||
Аминопенициллины |
0,75 |
0,02 |
||
Защищенные пенициллины |
8,38 |
0,23 |
||
Цефалоспорины I-IV |
10,14 |
0,28 |
||
Карбапенемы |
4,12 |
0,117 |
||
Тигециклин |
0,37 |
0,01 |
||
Колистин |
0,21 |
0,01 |
Затем рассчитывают ИЛУ (Таблица 8). Лекарственная резистентность (столбец 6) – это произведение частоты резистентных изолятов (столбец 4) на частоту потребления данного класса АМП (столбец 5). ИЛУ представляет собой сумму показателей лекарственной резистентности (столбец 6) ко всем применяемым в данный период классам АМП.
| Период | Патоген | АМП | Частота резистентных изолятов | Частота потребления АМП | Лекарственная резистентность | ИЛУ |
|---|---|---|---|---|---|---|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
2012 |
Klebsiella pneumoniae |
Аминогликозиды |
0,48 |
0,03 |
0,014 |
0,72 |
Фторхинолоны |
0,77 |
0,29 |
0,22 |
|||
Аминопенициллины |
0,98 |
0,03 |
0,03 |
|||
Защищенные пенициллины |
0,78 |
0,16 |
0,13 |
|||
Цефалоспорины I-IV |
0,8 |
0,39 |
0,31 |
|||
Карбапенемы |
0,17 |
0,081 |
0,014 |
|||
Тигециклин |
0,17 |
0,008 |
0,001 |
|||
Колистин |
0 |
0 |
0 |
|||
2014 |
Klebsiella pneumoniae |
Аминогликозиды |
0,4 |
0,05 |
0,02 |
0,64 |
Фторхинолоны |
0,68 |
0,28 |
0,19 |
|||
Аминопенициллины |
0,99 |
0,02 |
0,02 |
|||
Защищенные пенициллины |
0,76 |
0,23 |
0,18 |
|||
Цефалоспорины I-IV |
0,77 |
0,28 |
0,22 |
|||
Карбапенемы |
0,11 |
0,117 |
0,013 |
|||
Тигециклин |
0,01 |
0,01 |
0,0001 |
|||
Колистин |
0 |
0,01 |
0 |
Интерпретация результатов:
В динамике ИЛУ снизился за счет уменьшения потребления цефалоспоринов и снижения резистентности к аминогликозидам, фторхинолонам, карбапенемам и тигециклину.
Для большей информативности ИЛУ может быть рассчитан как «фиксированный» (произведение частоты резистентных изолятов анализируемого периода и потребления АМП за прошлый период) и «адаптированный» (произведение частоты резистентных изолятов анализируемого периода и потребления АМП за анализируемый период) (рис. 2).
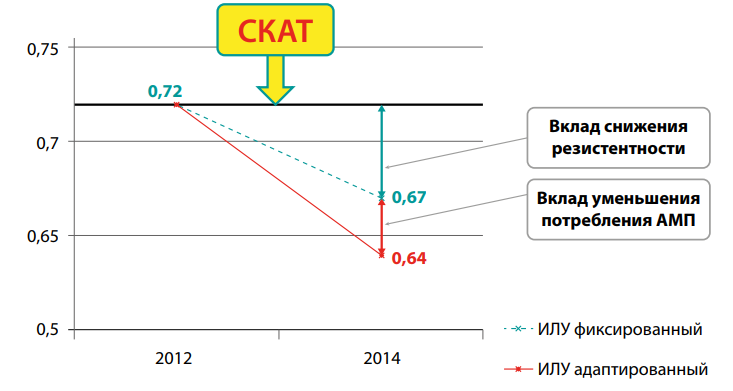
Показатели качества необходимы для сравнительной оценки правильности и адекватности проведения диагностики инфекций и антимикробной терапии между различными отделениями стационара, определения проблемных точек и плана проведения обучающих программ и оценки их эффективности [4-5]. Такие показатели необходимо разработать для некоторых, наиболее проблемных и хорошо стандартизованных компонентов применения АМП: стафилококковая и энтерококковая бактериемия, периоперационная антибиотикопрофилактика, септический шок, тяжелая внебольничная пневмония, ИВЛ-ассоциированная пневмония, инфекционный эндокардит, MRSA-инфекция.
Показатели качества антимикробной терапии на уровне стационара обсуждаются в ряде опубликованных работ [4–10].
Литература
-
Елисеева Е.В., Гайнуллина Ю.И., Гельцер Б.И.. Управление качеством в сфере применения антибактериальных препаратов / // Владивосток: Дальнаука, 2010. – 180 с.
-
Солодовников В.В., Гайнуллина Ю.И., Елисеева Е.В., Кривелевич В.Я. Современное состояние проблемы и значение службы клинической фармакологии в оптимизации использования антибактериальных лекарственных средств // Проблемы стандартизации в здравоохранении. – 2008. № 9. С. 3–7.
-
Laxminarayan R, Klugman KP. Communicating trends in resistance using a drug resistance index. BMJ Open 2011;1:e000135.
-
Gross PA, Trish L, Barret RN, et al. Quality standart for the treatment of bacteremia. Infect Control Hosp Epidemiol 1994;15:189-92.
-
SHEA. An approach to the evaluation of quality indicators of the outcome of care in hospitalized patients with a focus in nosocomial infection indicators. Infect Control Hosp Epidemiol 1995;16:308-16.
-
Rodríguez-Baño J, de Cueto M, Retamar P, Gálvez-Acebal J. Current management of bloodstream infections. Expert Rev Anti Infect Ther. 2010;8(7):815-29
-
Гусаров В.Г., Нестерова Е.Е., Оприщенко И.В., Петрова Н.В., Замятин М.Н. Клинические и фармакоэкономические результаты использования протокола эмпирической антимикробной терапии в многопрофильном стационаре. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 2015; 10 (4): 103-100.
-
Гусаров В.Г., Нестерова Е.Е., Лашенкова Н.Н., Петрова Н.В., Замятин М.Н. Зависимость уровня микробной резистентности от потребления антимикробных препаратов в многопрофильном стационаре // Клиническая патофизиология. 2015; (3): 55-49.
-
NICE quality standard 49. Issued: October 2013. Surgical site infection. guidance.nice.org.uk/qs49.
-
Gyssens IC. Quality Measures of Antimicrobal Drug Use. Intern Journal Antimicrob Agents 2001;17:9-19.
Раздел 14. Контроль за нежелательными лекарственными реакциями при применении антимикробных препаратов
Эффективное и безопасное использование АМП является общемедицинской проблемой, что обусловлено рядом причин.
-
Антибиотики являются одной из наиболее широко применяемых групп лекарств, используемых в различных областях медицины – до 70% от объема назначений лекарств в стационаре.
-
Современные АМП относятся к дорогостоящим лекарственным препаратам, на закупку которых тратится значительная часть лекарственного бюджета – затраты на антибиотики составляют в среднем 25-50% всех расходов на лекарственные средства, закупаемые многопрофильной больницей. По расходам на лечение инфекции занимают в стационарах общего профиля первое место среди всех патологий.
-
Антибиотики являются жизненно важными, но небезопасными средствами, потенциально способными вызывать тяжелые побочные эффекты, в связи с чем их применение следует строго контролировать.
-
В соответствии с данными проведенных исследований, эта группа лекарственных препаратов используется наиболее нерационально. По данным ВОЗ, до 75% назначаемых антибиотиков используются с нарушением указаний инструкции по их применению, что способствует повышению частоты побочных и токсических реакций, росту бактериальной резистентности, удлинению времени госпитализации, а также становится причиной назначения других лекарственных препаратов для лечения основного заболевания и устранения ятрогенных последствий неправильного выбора и применения антибактериальных препаратов.
Нежелательные лекарственные реакции (НЛР), характерные для антимикробных препаратов, наряду с клинической эффективностью и активностью in vitro, являются ключевыми факторами при выборе рациональной антимикробной терапии. НЛР, присущие антимикробным препаратам, можно разделить на общие, класс-специфические и индивидуальные. К первым относят НЛР, присущие, в той или иной мере, всем антимикробным препаратам – экологические нежелательные эффекты (антибиотик-ассоциированная диарея и псевдомембранозный колит, вызванные Clostridium difficile, при применении линкозамидов, фторхинолонов, цефтриаксона), феномен параллельного ущерба, индукция антибиотикорезистентности (например, селекция БЛРС продуцентов на фоне цефалоспоринов III поколения, рост частоты MRSA на фоне фторхинолонов, селекция полирезистентных штаммов P.aeruginosa при применении антисинегнойных карбапенемов). К класс-специфическим относят НЛР, характерные для отдельных классов препаратов – аллергия на бета-лактамы, нефротоксичность аминогликозидов, фототоксичность тетрациклинов и фторхинолонов и др. Индивидуальные НЛР отличают отдельные антимикробные препараты внутри класса, например, фототоксические реакции, которые развиваются при использовании спарфлоксацина и ломефлоксацина гораздо чаще, чем при назначении других фторхинолонов.
По механизму НЛР на антимикробные препараты целесообразно выделять:
-
Токсические реакции, например, нефротоксичность аминогликозидов.
-
Экологические НЛР (нарушение нормального качественного и количественного состава кишечной микробиоты, антибиотик-ассоциированная диарея)
-
Индукция антибиотикорезистентности (появление фторхинолонрезистентных штаммов пневмококков и фторхинолони карбапенемрезистентных штаммов P.aeruginosa при терапии ципрофлоксацином).
-
НЛР в силу лекарственных взаимодействий (повышенный риск рабдомиолиза при совместном применении кларитромицина или кетоконазола и статинов).
В связи с вышеизложенным представляет интерес оценка профиля безопасности современных антибактериальных препаратов (табл. 9).
| Препараты | Типичные, часто развивающиеся НЛР | Редкие, но опасные для жизни, серьезные НЛР | Экологические НЛР, влияние на резистентность | Меры контроля и профилактики |
|---|---|---|---|---|
1 |
2 |
3 |
4 |
5 |
Бета-лактамы: пенициллины, цефалоспорины, карбапенемы |
Диспепсия, крапивница |
Анафилактический шок, отек Квинке |
Кандидоз полости рта и/или вагинальный кандидоз |
Анамнез |
Бета-лактамы: амоксициллин/клавуланат |
Псевдоаллергические реакции («ампициллиновая сыпь»), диарея, транзиторное повышение трансаминаз, холестатический гепатит |
– |
– |
Контроль печеночных ферментов: АСТ, АЛТ, ЩФ |
Бета-лактамы: цефалоспорины III-IV поколения |
Диарея, флебит при в/в введении |
Гемолитическаяанемия; цефтриаксон псевдохолелитиаз |
Селекция продуцентов БЛРС, антибиотико-ассоциированная диарея и псевдомембранозный колит, вызванные C.difficile |
При возникновении диареи – исследование кала на токсины А и В C.difficile |
Бета-лактамы: карбенициллин, тикарциллин/клавуланат, цефоперазон, цефлперазон/сульбактам |
Диарея, флебит при в/в введении |
Нарушение свертываемости крови, риск кровотечений при хирургических операциях |
Селекция продуцентов БЛРС, антибиотико-ассоциированная диарея и псевдомембранозный колит, вызванные C.difficile |
Контроль показателей свертываемости крови: тромбоциты, время кровотечения, МНО |
Бета-лактамы: цефтаролин |
Диарея |
Эозинофильная пневмония, интерстициальный пневмонит |
– |
При появлении или усугублении бронхо-легочной симптоматики – КТ |
Бета:лактамы: антисинегнойные карбапенемы – дорипенем, имипенем, меропенем |
Диарея |
Судороги, эпилепти ческие припадки при заболеваниях ЦНС, ЧМТ, эпилепсии (имипенем) |
Селекция полирези стентных штаммов P.aeruginosa |
При отсутствии риска P.aeruginosa – использовать эртапенем |
Аминогликозиды |
Головокружение, головная боль |
Острая почечная недостаточность, снижение слуха, глухота, блокада нейромышечного проведения – взаимодействие с препаратами для анестезии |
– |
Контроль диуреза и креатинина; длительность терапии не более 7 дней; коррекция дозы по клиренсу креатинина; отменить перед операцией |
Макролиды |
Тошнота, снижение аппетита, диарея, головная боль, транзиторное повышение трансаминаз, холестатический гепатит, флебит при в/в введении |
Пароксизмальная желудочковая тахикардия и увеличение риска внезапной смерти (эзитромицин, азитромицин); некрозпечени |
Селекция резистентных штаммов S.pneumoniae, H.pylori |
Контроль интервала QT и печеночных ферментов во время лечения; не назначать пациентам группы риска аритмий (пожилые, заболевания сердца), не сочетать с ЛС, удлиняющими QT (антиаритмики, флуконазол, кетоконазол, домперидон, лоратадин, аминазин, флуоксетин, галоперидол, дроперидол, фторхинолоны) |
Линкозамиды |
Диарея, глоссит, стоматит, транзиторное повышение уровня печеночных ферментов |
Лейкопения, тромбоцитопения, нарушение нейромышечной проводимости, |
Антибиотико-ассоциированная диарея и псевдомембранозный колит, вызванные C.difficile |
При возникновении диареи – исследование кала на токсины А и В C.difficile |
Фторхинолоны |
Диспепсия, транзиторное повышение трансаминаз, головная боль, бессонница, тахикардия, боль и флебит при в/в введении; гипо и гипергликемия |
Токсическое действие на ЦНС (судороги, галлюцинации); тендиниты, разрыв сухожилий; пароксизмальная желудочковая тахикардия и увеличение риска внезапной смерти (левофлоксацин, моксифлоксацин); миастения, периферическая нейропатия; тромбоцитопения; фототоксичность; некроз печени |
Антибиотик-ассоциированная диарея и псевдомембранозный колит, вызванные C.difficile |
Контроль интервала QT и печеночных ферментов во время лечения, не сочетать с ЛС, удлиняющими QT (антиаритмики, флуконазол, кетоконазол, домперидон, лоратадин, аминазин, флуоксетин, галоперидол, дроперидол, макролиды); не сочетать с теофиллином (ципрофлоксацин) и не назначать пациентам с судорогами в анамнезе |
Ванкомицин |
Сыпь, лихорадка, дозозависимая тромбоцитопения, нейтропения |
Острое почечное повреждение; гистаминовые реакции при в/в введении (синдром красного человека) с тахикардией, снижением АД и возможной ишемией миокарда |
Селекция ванкомицин-резистентных энтерококков |
Медленная внутривенная инфузия (не менее 1 часа); Контроль диуреза и креатинина; коррекция дозы по клиренсу креатинина; не назначать с нефротоксичными средствами и петлевыми диуретиками |
Телаванцин |
Нарушение вкуса, тошнота, головная боль |
Острое почечное повреждение |
– |
Контроль диуреза и креатинина; коррекция дозы по клиренсу креатинина; не назначать при клиренсе креатинина < 450 мл/ мин; не назначать с нефротоксичными средствами и петлевыми диуретиками |
Даптомицин |
Тромбоцитопения |
Миопатия; эозино фильная пневмония |
– |
Контроль КФК при применении > 7 дней; при появлении или усугублении бронхо-легочной симптоматики – КТ |
Линезолид |
Диспепсия, нарушение вкуса, изменение окраски языка, головная боль, бессонница, транзиторное повышение трансаминаз |
Тромбоцитопения; периферическая нейропатия, нейропатия зрительного нерва |
– |
не применять более 28 дней; контроль тромбоцитов; является ингибитором МАО – не назначать вместе с псевдоэфедрином, адреналином, допамином, ингибиторами обратного захвата серотонина |
Доксициклин |
Эрозии и язвы пищевода при применении внутрь лекарственной формы гидрохлорида доксициклина; тошнота |
Фотосенсибилизация |
– |
При приеме внутрь предпочтительнее использовать моногидрат доксициклина в виде таблеток; капсулы запивать большим количеством воды |
Тигециклин |
Тошнота, рвота, |
Острый панкреатит; фототоксичность |
– |
|
Полимиксин В |
Тошнота, рвота, парестезии, онемение рук, нечеткость зрения, раздражительность, атаксия |
Острое почечное повреждение; нейротоксичность (нарушение сознания, блокада нейро-мышечного проведения с ДН, остановка дыхания) |
– |
Контроль диуреза и креатинина; коррекция дозы по клиренсу креатинина; не назначать с нефротоксичными средствами |
Метронидазол |
Металлический привкус во рту, тошнота; дисульфирамоподобный эффект (антабусная реакция) |
Лекарственный гепатит; нейротоксичность (периферическая нейропатия, нейропатия зрительного нерва) |
– |
Не употреблять алкоголь! Контроль трансаминаз |
Нитрофураны |
Диспепсия, гастралгия, головокружение, головная боль, кожная сыпь, транзиторное повышение трансаминаз |
Лекарственный гепатит; нейротоксичность; интерстициальный пневмонит с лихорадкой и эозинофилией; бронхоспазм; гемолитическая анемия |
– |
При появлении или усугублении бронхо легочной симптоматики – КТ |
Ко-тримоксазол |
Диспепсия, нарушение вкуса, головная боль, бессонница, кожная сыпь, изменение окраски языка, транзиторное повышение трансаминаз; кристаллурия; лихорадка |
Синдромы Стивенса-Джонсона, Лайелла; гемолитическая анемия, апластическая анемия, тромбоцитопения; геморрагический васкулит; фототоксичность; |
– |
При длительном применении следует контролировать гемоглобин, тромбоциты, лейкоциты, трансаминазы |
Рифампицин |
Оранжевое окрашивание мочи, пота, слез; лихорадка, миалгии, артралгии |
Интерстициальный нефрит |
– |
Риск лекарственного взаимодействия со многими ЛС; контроль анализа мочи |
Флуконазол |
Диспепсия, транзиторное повышение трансаминаз; головная боль; нарушение зрения; тремор; выпадение волос |
Холестатический гепатит; судороги; тромбоцитопения, агранулоцитоз; удлинение интервала QT |
Селекция Candida spp., устойчивых к флуконазолу |
При длительном применении контроль АСТ, АЛТ, ЩФ, билирубина, тромбоцитов, лейкоцитов |
Итраконазол |
Тошнота, боли в животе; алопеция; нарушение менструального цикла |
Анафилактический шок; сердечная недостаточность; гипокалиемия; острая печеночная недостаточность |
– |
Контроль печеночных ферментов, калия |
Вориконазол |
Лихорадка; периферические отеки; тошнота, рвота, диарея, боли в животе; головная боль; сыпь |
Гриппоподобный синдром; гематоток сические раакции; гипокалиемия; гипогликемия; нарушение сознания, депрессия, тревога, тремор; фототоксичность; отек лица; пурпура; нарушение зрения |
– |
Контроль общего анализа крови, калия, глюкозы в крови |
Позаконазол |
Диспепсия, боли в животе, транзиторное повышение трансаминаз и билирубина; нейтропения; лихорадка |
Острый гепатит; удлинение интервала QT и нарушения ритма сердца |
– |
Контроль нейтрофилов, тромбоцитов, билирубина, АСТ, АЛТ, ЩФ, интервала QT; Риск лекарственного взаимодействия со многими ЛС |
Каспофунгин |
Лихорадка, озноб; головная боль; рвота, диарея; обратимая тромбоцитопения |
– |
– |
Риск лекарственного взаимодействия |
Микафунгин |
Тошнота, рвота; головная боль; транзиторное повышение трансаминаз; |
Острый лекарственный гепатит; Острое почечное повреждение |
– |
При длительном применении контроль печеночных ферментов, креатинина |
Анидулафунгин |
Тошнота, рвота; головная боль |
– |
– |
– |
Ацикловир, валацикловир, фамцикловир |
Диспепсия; кожная сыпь |
Тромбоцитопения; галлюцинации, спутанность сознания, тремор, судороги; обструктивная нефропатия |
– |
– |
Озельтамивир, занамивир |
Общая слабость; бронхит, кашель; головокружение, нарушение сна; кожная сыпь |
– |
– |
– |
Раздел 15. Контроль за нежелательными лекарственными реакциями при применении антимикробных препаратов у беременных
ЛС могут оказать неблагоприятное действие на плод на любом сроке беременности, что несомненно необходимо учитывать при назначении фармакотерапии женщинам детородного возраста. При приеме в I триместре беременности (в период органогенеза) ЛС могут вызвать пороки развития (тератогенное действие). Ни одно ЛС не следует считать абсолютно безопасным для применения в ранние сроки беременности. Во II и III триместрах беременности ЛС могут влиять на рост и развитие плода или оказать на него токсическое действие, а при приеме в конце беременности либо во время родов – оказать влияние на их течение или на новорожденного.
Для классификации лекарственных препаратов по критериям безопасности для плода на территории России используются данные Американской классификации лекарственных и пищевых препаратов Food and Drug Administration. Согласно данной классификации, все ЛС делятся на пять групп, обозначаемые буквами А, В, C, D, X.
А – Исследования у большого количества беременных не выявили риска для плода.
В – ЛС, которые принимали ограниченное количество беременных и женщин детородного возраста без получения каких-либо доказательств их влияния на частоту развития врожденных аномалий или возникновения повреждающего действия на плод. При этом в исследованиях на животных не выявлено увеличения частоты повреждения плода или такие доказательства получены, но доказанной зависимости полученных результатов от применения препарата не выявлено.
С – ЛС, которые в исследованиях на животных продемонстрировали тератогенное или эмбриотоксическое действие. Адекватных и строго контролируемых исследований у человека не проведено. Однако потенциальная польза, связанная с применением ЛС у беременных, может оправдывать его использование, несмотря на возможный риск.
D – ЛС, вызывающие врожденные аномалии или необратимые повреждения плода или подозреваемые в данном отношении. Следует соотносить риск для плода с потенциальной пользой для лечения матери
Х – ЛС с доказанной тератогеностью в эксперименте и клинике. Противопоказаны при беременности
Таким образом, ЛС беременной следует назначать только в том случае, когда ожидаемая польза превышает возможный риск для плода. В связи с недостаточным количеством данных о влиянии новых ЛС на плод и ребенка следует избегать их назначения.
| Наименование препарата | FDA | Использование при беременности |
|---|---|---|
Антибактериальные лекарственные средства |
||
Азитромицин |
B |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Азитромицин |
B |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Азлоциллин |
– |
С осторожностью |
Азтреонам |
В |
С осторожностью |
Амикацин |
D |
Только по жизненным показаниям. Может накапливаться в почках плода, оказывать нефро и ототоксическое действие |
Амоксициллин |
В |
Сведения о вредном влиянии отсутствуют. |
Амоксициллин/клавуланат |
В |
Сведения о вредном влиянии отсутствуют. |
Ампициллин |
В |
Сведения о вредном влиянии отсутствуют. |
Ампициллин/сульбактам |
В |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Бензатин бензилпенициллин |
В |
С осторожностью |
Бензилпенициллин |
В |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Ванкомицин |
С |
Противопоказано в I триместре беременности. Применение во II–III триместре беременности возможно только по жизненным показаниям |
Даптомицин |
– |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Джозамицин |
– |
Возможно. Согласно рекомендациям Европейского отделения ВОЗ является препаратом выбора при лечении хламидийной инфекции у беременных |
Диоксидин |
– |
Противопоказано |
Доксициклин |
D |
Противопоказано; образуя стойкие комплексы с Ca2+ накапливается в костях и зубных зачатках плода, нарушая их минерализацию, может вызывать тяжелые нарушения развития костной ткани |
Дорипенем |
– |
С осторожностью; не оказывал отрицательного влияния на здоровье плода и новорожденного, однако количество наблюдений ограничено |
Изониазид |
С |
Возможно только по строгим показаниям, при сопоставлении предполагаемой пользы для матери и риска для плода (следует применять в дозах до 10 мг/кг/сут) |
Имипенем/циластатин |
С |
Назначается исключительно по жизненным показаниям |
Канамицин |
D |
Только по жизненным показаниям. Оказывает ототоксическое действие на плод. |
Карбенициллин |
– |
Безопасность применения не установлена |
Кларитромицин |
С |
Рекомендуют избегать применения, кроме случаев, когда польза превышает потенциальный риск |
Клиндамицин |
В |
Сведения о вредном влиянии отсутствуют. Проходит через плаценту и может концентрироваться в печени плода, однако осложнений у человека не зарегистрировано |
Линезолид |
С |
Возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода |
Линкомицин |
С |
Возможно по жизненным показаниям |
Ломефлоксацин |
С |
Только по жизненным показаниям, когда ожидаемый эффект терапии у матери превышает потенциальный риск для плода |
Меропенем |
В |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Метронидазол |
В |
Противопоказано в I триместре, во II–III триместрах с осторожностью |
Мидекамицин |
– |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Моксифлоксацин |
С |
Только по жизненным показаниям, когда ожидаемый эффект терапии у матери превышает потенциальный риск для плода; в эксперименте на животных выявлен токсический эффект |
Налидиксовая кислота |
С |
Противопоказано в I триместре |
Неомицин |
– |
Противопоказано |
Нетилмицин |
D |
Только по жизненным показаниям |
Нитроксолин |
– |
Противопоказано |
Нитрофурантоин |
В |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Нифурател |
– |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Нифуроксазид |
– |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Норфлоксацин |
С |
Только по жизненным показаниям, когда ожидаемый эффект терапии у матери превышает потенциальный риск для плода |
Оксациллин |
В |
С осторожностью |
Орнидазол |
– |
Противопоказано в I триместре |
Офлоксацин |
С |
Противопоказано (только по жизненным показаниям) |
ПАСК |
С |
Противопоказано. Противоречивые сведения о тератогенном эффекте в эксперименте. |
Пефлоксацин |
– |
Противопоказано |
Пиперациллин |
В |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Пиперациллин/ тазобактам |
– |
Строго по показаниям |
Пиразинамид |
С |
С осторожностью |
Полимиксин |
– |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Протионамид |
– |
Противопоказано. Не исключается риск тератогенного эффекта. |
Рифампицин |
С |
В эксперименте тератогенный эффект при использовании высоких доз. Применение препарата в течение нескольких последних недель беременности может привести к после родовым кровотечениям как у матери, так и у новорожденного. |
Рокситромицин |
– |
Противопоказано (безопасность рокситромицина для плода у человека не определена) |
Секнидазол |
– |
Противопоказано |
Спектиномицин |
– |
Рекомендован для лечения гонококковой инфекции у беременных женщин с аллергией на пенициллины, цефалоспорины или пробенецид; в опытах на животных неблагоприятного действия на плод не выявлено. |
Спирамицин |
– |
Возможно |
Стрептомицин |
D |
Оказывает нефро и ототоксическое действие на плод. |
Сульфаметоксазол/триметоприм |
С |
Риск тератогенности (триметоприм активный антагонист фолатов); рекомендуют исключить, либо производить дотацию фолиевой кислоты 5 мг/сутки |
Сульфаниламиды |
С |
Гемолиз и метгемоглобинемия у новорожденного; опасность повышенного риска ядерной желтухи у новорожденных преувеличена |
Тейкопланин |
– |
Не рекомендуется вследствие отсутствия данных |
Тигециклин |
D |
Только по жизненным показаниям, может вызывать задержку оссификации костей, набор веса у плода |
Тигециклин |
D |
Только по жизненным показаниям, может вызывать задержку оссификации костей, набор веса у плода |
Тикарциллин/клавуланат |
– |
С осторожностью |
Тинидазол |
С |
Противопоказан в I триместре беременности. Во II и III триместрах возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода. |
Тобрамицин |
D |
Только по жизненным показаниям. Вызывает полную необратимую двухстороннюю врожденную глухоту и накапливается в почках плода |
Фосфомицин |
В |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Фузидиевая кислота |
– |
Только по жизненным показаниям |
Фуразидин |
– |
Противопоказано |
Фуразолидон |
– |
Противопоказано |
Хлорамфеникол |
С |
Возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода |
Цефадроксил |
В |
Возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода |
Цефазолин |
В |
Сведения о вредном влиянии отсутствуют. |
Цефаклор |
В |
Сведения о вредном влиянии отсутствуют. |
Цефалексин |
В |
Сведения о вредном влиянии отсутствуют. |
Цефепим |
В |
Сведения о вредном влиянии отсутствуют. |
Цефиксим |
В |
Сведения о вредном влиянии отсутствуют. |
Цефоперазон |
В |
Сведения о вредном влиянии отсутствуют. |
Цефоперазон/ сульбактам |
- |
Возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода |
Цефотаксим |
В |
Сведения о вредном влиянии отсутствуют. |
Цефтазидим |
В |
Сведения о вредном влиянии отсутствуют. |
Цефтазидим/авибактам |
В |
Возможно только если потенциальная польза для матери превышает возможный риск для плода |
Цефтаролин |
С |
Не следует применять во время беременности, за исключением случаев, когда потенциальная польза для матери превышает возможный риск для плода |
Цефтобипрол |
– |
Возможно, если эффект от лечения превосходит потенциальный риск для плода |
Цефуроксим |
В |
Сведения о вредном влиянии отсутствуют. |
Ципрофлоксацин |
С |
Только по жизненным показаниям, когда ожидаемый эффект терапии у матери превышает потенциальный риск для плода |
Эритромицин |
В |
Сведения о вредном влиянии отсутствуют. |
Эртапенем |
– |
Возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода; достаточный клинический опыт отсутствует |
Этамбутол |
– |
Применять по строгим показаниям; тератогенный эффект у животных. |
Этионамид |
– |
Противопоказано; в экспериментальных исследованиях на грызунах продемонстрированы тератогенные эффекты при дозах, превышающих рекомендованные для человека. |
Противогрибковые лекарственные средства |
||
Амфотерицин В |
В |
Сведения о вредном влиянии отсутствуют |
Вориконазол |
D |
Противопоказано: есть данные о тератогенном и эмбриотоксическом действии у животных. |
Каспофунгин |
С |
Только по жизненным показаниям, когда ожидаемый эффект терапии у матери превышает потенциальный риск для плода. |
Флуконазол |
С |
Только по жизненным показаниям, когда ожидаемый эффект терапии у матери превышает потенциальный риск для плода. |
Литература
-
Рациональная антимикробная фармакотерапия: Руководство для практикующих врачей / под ред С.В. Яковлева. – 2-е изд., перераб. и доп. М.:Литтерра, 2015. – 1040 с.
-
Практическое руководство по антимикробной химиотерапии. Под редакцией Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. Москва, 2007. – С. 423 434.
-
Елисеева, Е.В., Шмыкова И.И., Феоктистова Ю.В. Безопасность фармакотерапии беременных Владивосток: Медицина ДВ, 2009.-88с. ISBN 978-5-98301-021-5, изд. 2 переработанное и дополненное http://www.fda.gov
Раздел 16. Применение антимикробных препаратов у детей
Правила выбора антимикробных препаратов у пациентов детского возраста в целом строятся на тех же позициях, что и у взрослых пациентов. В тоже время при проведении антимикробной терапии у детей необходимо учитывать ряд принципиальных особенностей:
-
Многие антимикробные препараты имеют возрастные ограничения по применению. Это может быть связано с высоким риском нежелательных реакций, специфичных для определенного возраста и/или отсутствием клинических исследований у детей. В частности, тетрациклины противопоказаны к применению у детей до 8 лет в связи с нежелательным влиянием на костную ткань и зубную эмаль. Фторхинолоны в целом противопоказаны для применения до 18 лет из-за риска нежелательного влияния на хрящевую ткань (установлено для неполовозрелых особей некоторых видов животных). Однако, в ряде стран отдельные фторхинолоны разрешены для использования у детей по определенным показаниям (в России разрешено применение ципрофлоксацина у пациентов детского возраста с муковисцидозом, а также для лечения и профилактики сибирской язвы). По мнению экспертов фторхинолоны могут быть использованы при жизнеугрожающих инфекциях у детей в случае отсутствия более безопасной альтернативы. В этих же ситуациях может рассматриваться возможность применения других антибактериальных препаратов, противопоказанных или не рекомендованных для применения у детей (дорипенем, даптомицин и др.).
-
У многих антимикробных препаратов имеются существенные возрастные особенности фармакокинетики, обусловленные анатомо-физиологической незрелостью детского организма в первые месяцы жизни, в особенности у недоношенных. Это может приводить к увеличению риска развития обычных или появлению специфических нежелательных реакций, что требует использования у детей в определенном возрасте особой дозировки и/или особого режима применения антимикробных препаратов. В частности, применение цефтриаксона и сульфаниламидов у новорожденных сопряжено с риском увеличения билирубинемии и развития ядерной желтухи в связи с высоким сродством препаратов к альбумину, что приводит к вытеснению билирубина из связи с белками плазмы. При использовании хлорамфеникола в первые месяцы жизни возрастает риск характерных нежелательных реакций (в частности, гемотоксичности) в связи с повышением концентрации в крови из-за замедления метаболизма препарата в печени, что требует мониторинга его концентрации в крови.
-
Доза антимикробных препаратов у детей (за редким исключением) рассчитывается на вес пациента. При назначении парентеральных антимикробных препаратов у детей предпочтение отдается внутривенному введению, так как внутримышечное введение болезненно и сопряжено у детей с повышенным риском инъекционных осложнений. Для перорального приема антимикробных препаратов у детей должны использоваться специальные пероральные формы антимикробных препаратов суспензии, диспергированные таблетки, которые могут быть легко проглочены ребенком. Доза антимикробного препарата у детей, также как у взрослых пациентов, обычно определяется тяжестью инфекционного заболевания, в отельных случаях – видом и свойствами возбудителя (в частности, при риске или выявлении пенициллинорезистентного S.pneumoniae дозу амоксициллина рекомендуется увеличить в 2 раза). Режимы дозирования антимикробных препаратов у детей приведены в приложении.
Литература
-
Практическое руководство по антиинфекционной химиотерапии. Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. Смоленск: МАКМАХ, 2007. 464 с.
-
Государственный реестр лекарственных средств. URL: http://grls.rosminzdrav.ru
-
Drug Monograph. URL: _http://www.clinicalkey.com/
Приложение 1. Оптимальный перечень АМП для больничного формуляра стационара для взрослых
| Антибиотик и группа авторизации | Лек-форма | Область применения | Примечания |
|---|---|---|---|
1 |
2 |
3 |
4 |
Пенициллины |
|||
Бензилпенициллин (А) |
ПЭ |
Инфекции ЦНС; анаэробные инфекции КиМТ; актиномикоз |
Может быть заменен другими АМП |
Ампициллин (А) |
ПЭ |
Нетяжелые инфекции НДП; инфекции ЦНС; инфекционный эндокардит стрептококковой этиологии и другие стрептококковые инфекции; инфекции, вызванные E.faecalis |
В таблетках для приема внутрь нецелесообразен – низкая биодоступность |
Амоксициллин (А) |
ПО |
Нетяжелые инфекции НДП (пневмония, бронхит); острый риносинусит, тонзиллит; инфекции, вызванные E.faecalis; в схемах эрадикации H.pylori |
|
Ампициллин/сульбактам (А или Б) |
ПЭ |
Инфекции НДП и ВДП; внебольничные абдоминальные инфекции и инфекции малого таза; нозокомиальная пневмония вне ОРИТ |
|
Амоксициллин/клавуланат или Амоксициллин/сульбактам (А или Б) |
ПЭ и ПО |
Инфекции НДП и ВДП; внебольничные абдоминальные инфекции и инфекции малого таза; нозокомиальная пневмония вне ОРИТ; |
У амоксициллин/клавуланата имеется более полная доказательная база клинической эффективности |
Оксациллин |
ПЭ |
Стафилококковые инфекции (чувствительные к оксациллину) |
Препарат 1-й линии при ангиогенных MSSA инфекциях, вкл. инфекционный эндокардит |
Пиперациллин/ тазобактам (Б) |
ПЭ |
Нозокомиальные инфекции вне ОРИТ: КиМТ, абдоминальные, бронхолегочные, мочевые; инфекции, вызванные P.aeruginosa |
По сравнению с цефалоспоринами и фторхинолонами применение пиперациллин/тазобактама сопровождается существенно меньшим экологическим ущербом, т. е. меньшим риском селекции полирезистентных бактерий, в частности, БЛРС |
Цефалоспорины |
|||
Цефазолин (А) |
ПЭ |
Стафилококковые инфекции, чувствительные к оксациллину; периоперационная профилактика; инфекционный эндокардит |
|
Цефалексин (А) |
ПО |
Нетяжелые стафилококковые инфекции, чувствительные к оксациллину; в качестве средства ступенчатой терапии после применения цефазолина |
|
Цефуроксим (А) |
ПЭ |
Периоперационная профилактика |
|
Цефуроксим аксетил (А) |
ПО |
Нетяжелые внебольничные инфекции дыхательных путей |
Более высокая устойчивость пневмококков (по сравнению с аминопенициллинами) лимитирует эффективное использование |
Цефотаксим или Цефтриаксон (А или Б) |
ПЭ |
Внебольничная пневмония; инфекции мочевыводящих путей; внебольничные абдоминальные инфекции; нозокомиальные инфекции вне ОРИТ; инфекции ЦНС |
Антимикробная активность и клиническая эффективность этих препаратов сходная; высокий уровень устойчивости лимитирует использование этих антибиотиков для лечения нозокомиальных инфекции; высокий риск коллатерального ущерба (селекция БЛРС-продуцирующих энтеробактерий) |
Цефтазидим (Б или В) |
ПЭ |
Инфекции, вызванные P.aeruginosa; Тяжелое обострение ХОБЛ, бронхоэктазы |
По актимикробной активности цефтазидим превосходит цефоперазон; высокий уровень устойчивости лимитирует использование этих антибиотиков для лечения нозокомиальных инфекций; высокий риск коллатерального ущерба (селекция БЛРС-продуцирую щих энтеробактерий) |
Цефиксим или цефтибутен (Б) |
ПО |
Внебольничные инфекции мочевыводящих путей; обострение ХОБЛ, риносинусит; в качестве средства ступенчатой терапии после применения цефотаксима или цефтриаксона |
Низкая антипневмококковая активность лимитирует при менение при респираторных инфекциях |
Цефепим (Б) |
ПЭ |
Внебольничная пневмония; обострение ХОБЛ, риносинусит; в качестве средства ступенчатой терапии после применения цефотаксима или цефтриаксона |
|
Цефепим (Б) |
ПЭ |
Нозокомиальные инфекции вне ОРИТ; Инфекции, вызванные P.aeruginosa |
|
Цефепим/сульбактам (Б или В) |
ПЭ |
Нозокомиальные инфекции с риском полирезистентных возбудителей (БЛРС-продуценты, P.aeruginosa |
Регистрация антибиотика в РФ ожидается в 2018 г. |
Цефоперазон/ сульбак там (В) |
ПЭ |
Нозокомиальные инфекции в ОРИТ; острый деструктивный панкреатит; инфекции, вызванные Acinetobacter spp. при документированной чувствительности |
|
Цефтаролин (В) |
ПЭ |
Тяжелая внебольничная пневмония; осложненная пневмония (абсцесс, эмпиема); тяжелые некротические инфекции КиМТ при риске MRSA |
Препарат 1-й линии при тяжелой внебольничной пневмонии в ОРИТ при риске резистентных пневмококков, при гриппе (риск S.aureus) |
Цефтазидим/ авибактам (В) |
ПЭ |
Инфекции, вызванные энтеробактериями (Klebsiella spp., E.coli и др.), устойчивыми к карбапенемам; нозокомиальные инфекции (пневмония, инфекции мочевыводящих путей, интраабдоминальные инфекции) с риском карбапенем-резистентных энтеробактерий; инфекции, вызванные P.aeruginosa |
При инфекциях, вызванных карбапенем-резистентными энтеробактериями (карбапенемазы KPC или OXA-48) возможно применение в монотерапии или в комбинации с тигециклином |
Цефтолозан/тазобак там (В) |
ПЭ |
Нозокомиальные инфекции с риском P.aeruginosa; инфекции, вызванные полирезистентными штаммами P.aeruginosa, устойчивыми к другим антибиотикам |
Регистрация антибиотика в РФ ожидается в 2018 г. |
Карбапенемы |
|||
Имипенем (В) |
ПЭ |
Нозокомиальные инфекции в ОРИТ; сепсис; инфекции, вызванные БЛРС-продуцентами; острый деструктивный панкреатит |
Полной перекрестной устойчивости к антипсевдомонадным карбапенемам среди неферментирующих возбудителей нозокомиальных инфекций нет, поэтому в формуляре должны присутствовать все три препарата |
Меропенем (В) |
ПЭ |
Нозокомиальные инфекции в ОРИТ; сепсис; инфекции, вызванные БЛРС-продуцентами; острый деструктивный панкреатит; нозокомиальные инфекции ЦНС |
|
Дорипенем (В) |
ПЭ |
Нозокомиальные инфекции в ОРИТ; сепсис; инфекции, вызванные БЛРС-продуцентами; острый деструктивный панкреатит |
|
Эртапенем (В) |
ПЭ |
Тяжелые внебольничные инфекции: абдоминальные, КиМТ, малого таза, мочевые; нозокомиальные инфекции вне ОРИТ: пневмония, перитонит, инфекция области хирургического вмешательства, послеродовый сепсис |
Карбапенем 1-й линии при тяжелом сепсисе (внебольничном и нозокомиальном) при отсутствии риска P.aeruginosa и Acinetobacter spp. (раздел 7.3.) |
Аминогликозиды |
|||
Гентамицин |
ПЭ |
Внебольничные инфекции мочевыводящих путей; комбинированная терапия стафилококковых и энтерококковых инфекций (с оксациллином или ампициллином) |
Высокий уровень устойчивости лимитирует использование гентамицина и тобрамицина для лечения нозокомиальных инфекций |
Нетилмицин (Б) |
ПЭ |
В комбинированной терапии нозокомиальных инфекций, полирезистентными микроорганизмами |
|
Амикацин (Б) |
ПЭ |
В комбинированной терапии нозокомиальных инфекций, полирезистентными микроорганизмами |
|
Макролиды |
|||
Эритромицин (А) |
ПЭ |
В комбинированной терапии тяжелой внебольничной пневмонии |
Существенных различий в природной антимикробной активности среди макролидов нет; высокий уровень устойчивости пневмококков в РФ (20-35%) лимитирует использование эритромицина, кларитромицина и азитромицина при респираторных инфекциях, к джозамицину устойчивость пневмококков в 1,5-2 раза ниже. Исходя из позиций минимальной достаточности в формуляр целесообразно включить один ПЭ макролид (эритромицин или кларитромицин) и два пероральных макролида (джозамицин и кларитромицин) |
Кларитромицин (А) |
ПЭ, ПО |
В комбинированной терапии тяжелой внебольничной пневмонии; в схемах эрадикации H.pylori; в комбинированной терапии инфекций малого таза; хламидийные и микоплазменные инфекции |
|
Азитромицин (А) |
ПЭ, ПО |
В комбинированной терапии инфекций малого таза; хламидийные и микоплазменные инфекции |
|
Джозамицин (А) |
ПО |
Нетяжелая внебольничная пневмония; в схемах эрадикации H.pylori |
|
Линкозамиды |
|||
Клиндамицин или Линкомицин (А) |
ПЭ, ПО |
В комбинированной терапии осложненной внебольничной пневмонии; стафилококковые инфекции; инфекции КиМТ, в т.ч. некротические; инфекции костей и суставов |
Препараты выбора при MSSA инфекциях у пациентов с анафилактисей на бета-лактамы; в формуляр предпочтительнее включить клиндамицин, обладающий более высокой антистафилококковой активностью |
Гликопептиды и липопетиды |
|||
Ванкомицин (В) |
ПЭ |
Инфекции, вызванные MRSA, различной локализации; антибиотик-ассоциированная диарея, вызванная C.difficile (ПО) |
Снижение чувствительности MRSA к ванкомицину лимитирует эффективное использование этого ЛС, особенно в при эндокардите, менингите, пневмонии; целесообразно применение ванкомицина в случае MRSA с МПК ≤ 1 мкг/мл, при более высоких МПК следует применять телаванцин или антибиотики других классов |
Телаванцин (В) |
ПЭ |
Инфекции, вызванные MRSA, различной локализации, в т.ч. в случае штаммов со сниженной чувствительностью к ванкомицину (МПК > 1 мкг/мл) |
Противопоказан при ОПН (Clcr < 50 мл/мин) |
Даптомицин (В) |
ПЭ |
Ангиогенные инфекции, вызванные стафилококком (MRSA или MSSA), в т.ч. в случае штаммов со сниженной чувствительностью к ванкомицину (МПК > 1 мкг/мл); осложненные инфекции КиМТ; инфекционный эндокардит трикуспидального клапана или с документированной стафилококковой этиологией; инфекции мягких тканей с вовлечением импланта сустава и кости |
|
Оксазолидиноны |
|||
Линезолид (В) |
ПЭ, ПО |
Инфекции, вызванные MRSA, раз личной локализации (кроме ангиогенных и мочевых), в т.ч. в случае штаммов со сниженной чувствительностью к ванкомицину (МПК > 1 мкг/мл); в комбинированной терапии ИВЛ-ассоциированной пневмонии; нозокомиальные инфекции КиМТ; |
Риск лекарственного взаимодействия; риск тромбоцитопении при длительном применении (> 3 недель) |
Тедизолид (В) |
ПЭ, ПО |
Инфекции кожи и мягких тканей, вызванные MRSA |
По сравнению с линезолидом отсутствует риск лекарственного взаимодействия и меньше риск тромбоцитопении |
Рифамицины |
|||
Рифампицин (Б) |
ПЭ, ПО |
В комбинированной терапии MRSA инфекций (инфекционный эндокардит, менингит, остеомиелит) |
Риск лекарственного взаимодействия |
Тетрациклины |
|||
Доксициклин (А) |
ПЭ, ПО |
В комбинированной терапии инфекций малого таза; хламидийные и микоплазменные инфекции |
|
Глицилциклины |
|||
Тигециклин (В) |
ПЭ |
Внебольничные и нозокомиальные осложненные абдоминаль ные инфекции; инфекции области хирургического вмешательства; инфекции, вызванные полирезистентными штаммами Acinetobacter spp., E.coli, Klebsiella spp., в том числе продуцентами карбапенемаз |
При инфекциях, вызванных полирезистентными грамотрицательными бактериями применять в составе комбинированной терапии |
Полимиксины |
|||
Колистин (В) |
ИН |
В комбинированной терапии ИВЛ-ассоциированной пневмонии и трахеобронхита с риском полирезистентных возбудителей, а также Acinetobacter spp. и P.aeruginosa, устойчивыми к другим антибиотикам |
|
Полимиксин В (В) |
ПЭ |
Нозокомиальные инфекции, вызванные полирезистентными грамотрицательными бактери ями, прежде всего Acinetobacter spp. и P.aeruginosa, а также E.coli, Klebsiella spp., устойчивыми к карбапенемам |
При инфекциях, вызванных полирезистентными грамотрицательными бактериями применять в составе комбинированной терапии |
Фторхинолоны |
|||
Ципрофлоксацин (Б или В) |
ПЭ, ПО |
Нозокомиальные инфекции различной локализации; инфекции мочевыводящих путей; бактериальный простатит; тяжелая ХОБЛ с бронхоэктазами; инфекции, вызванные чувствительными штаммами P.aeruginosa |
Высокая устойчивость нозокомиальных штаммов грамотрицательных бактерий лимитирует эффективное использование препарата. Высокий риск параллельного ущерба (селекция полирезистентной P.aeruginosa, MRSA) |
Левофлоксацин |
ПЭ, ПО |
В комбинированной терапии смешанных аэробно-анаэробных инфекций (абдоминальные, малого таза, некротических мягких тканей, ЦНС); антибиотикассоциированная диарея, вызванная C.difficile; инфекции печени и желчевыводящих путей, вызванные лямблиями и амебами |
Не активен в отношении аэробных микроорганизмов |
Нитроимидазолы |
|||
Метронидазол (А) |
ПЭ, ПО |
В комбинированной терапии смешанных аэробно-анаэробных инфекций (абдоминальные, малого таза, некротических мягких тканей, ЦНС); антибиотикассоциированная диарея, вызванная C.difficile; инфекции печени и желчевыводящих путей, вызванные лямблиями и амебами |
|
Нитрофураны |
|||
Нитрофурантоин или Фуразидин или Фуразидин калия (А) |
ПО |
Внебольничные инфекции нижних мочевыводящих путей; в комбинированной терапии нозокомиальных инфекций мочевыводящих путей |
С позиций фармакокинетики и удобства дозирования в формуляр предпочтительнее включит фуразидин калия в лекарственной форме с магнием гидрокарбонатом |
Другие АМП |
|||
Ко-тримоксазол (Б) |
ПЭ, ПО |
Пневмоцистная пневмония (документированная или предполагаемая); инфекции, вызванные S.maltophilia, Nocardia spp. |
Высокая устойчивость S.pneumoniae и E.coli лимитирует применение препарата при респираторных и урогенитальных инфекциях |
Фосфомицин (В) |
ПЭ |
Инфекции, вызванные полирезистентными грамотрицательными бактериями, устойчивыми к другим АМП (в комбинированной терапии) |
Эффективная суточная доза при инфекциях, вызванных полирезистентными возбудителями составляет > 6 г |
Диоксидин (А) |
МП и В/П |
Инфекции кожи и мягких тканей, в т.ч. послеоперационные раны, трофические язвы, пролежни, инфицированные ожоги; эмпиема плевры, перитонит, катетер-асс. цистит |
Применяется исключительно для местного или внутриполостного введения; не показан для в/в введения – токсичность. |
Мупироцин (В) |
МП |
Назальная мазь для эрадикации носителей MRSA у медперсонала или у пациентов перед оперативным лечением |
|
Антифунгальные средства – Азолы |
|||
Флуконазол (Б) |
ПЭ, ПО |
Лечение и профилактика инвазивного кандидоза |
Увеличение устойчивости Candida spp. лимитирует эффективное применение этого ЛС |
Вориконазол (В) |
ПЭ, ПО |
Средство выбора при аспергиллезе; альтернативное средство при инвазивном кандидозе |
Риск лекарственного взаимодействия |
Позаконазол |
ПО |
Профилактика инвазивных грибковых инфекций в группе риска; кандидоз пищевода и полости рта; аспергиллез; мукормикоз и др. инвазивные микозы |
Риск лекарственного взаимодействия |
Антифунгальные средства – Эхинокандины |
|||
Анидулафунгин или Каспофунгин или Микафунгин (В) |
ПЭ |
Лечение и профилактика инвазивного кандидоза, особенно при риске или документированной устойчивости Candida spp. к флуконазолу или выделении C.krusei |
Выбор эхинокандина для стационара определяется профилем лечебного учреждения и фармакокинетическим профилем препарата |
Противовирусные средства |
|||
Озельтамивир (В) |
ПО |
Лечение сезонного гриппа |
Различий в антивирусной активности и эффективности между препаратами нет, в формуляр следует включить одно из двух ЛС |
Занамивир (В) |
ИН |
Лечение сезонного гриппа |
|
Ацикловир (Б или В) |
ПЭ, местно |
Инфекция, вызванная вирусами герпесами, в т.ч. инфекция ЦНС; энцефалит |
|
Валацикловир или Фамцикловир (В) |
ПО |
Инфекция, вызванная Herpes simplex, Varicella-zoster |
Различий в антивирусной активности и эффективности между препаратами нет, в формуляр следует включить одно из двух ЛС |
Обозначения: ПЭ – парентеральная лекформа; ПО – пероральная лекформа; ИН – ингаляционная лекформа; МП – лекформа для местного применения; В/П – лекформа для внутриполостного введения
Приложение 2. Стратификация госпитализированных пациентов с инфекцией с учетом риска полирезистентных возбудителей и инвазивного кандидоза
| Тип пациента | Тип I | Тип II | Тип IIIa | Тип IIIb | Тип IV |
|---|---|---|---|---|---|
Характер инфекции |
Внебольничная |
Внебольничная с факторами риска продуцентов БЛРС, энтеробактерий, устойчивых к ФХ и/или DRSP |
Нозокомиальная без факторов риска ПРВ |
Нозокомиальная с факторми риска ПРВ |
Нозокомиальная с факторами риска ИК |
Обращение за медицинской помощью или госпитализация |
Не было обращений за медицинской помощью в последние 3 месяца |
Обращение за медицинской помощью (дневной стационар поликлиники, гемодиализ, нахождение в учреждениях длительного ухода) или госпитализация в последние 3 месяца |
Длительность нахождения в стационаре ≤ 7 дней (вне ОРИТ), отсутствие оперативных вмешательств |
Длительность нахождения в стационаре > 7 дней (в ОРИТ > 3 дней) или инфекция, возникшая после оперативных вмешательств |
Пациенты III типа с лихорадкой >38,0°С более 6 дней, сохраняющейся на фоне адекватной антибактериальной терапии и санированным очагом инфекции при наличии следующих факторов:
– в/в катетер; – лапаротомия; – полное парентеральное питание; – применение глюкокортикоидов или иммуносупрессантов |
Терапия антибиотиками > 1 суток |
Не было АБТ в течение последних 90 дней |
Предшествующая АБТ (в последние 90 дней) |
Не получал АБТ или антибактериальную профилактику более 24 часов |
Предшествующая антибактериальная терапия |
|
Характеристика пациента |
Пациенты без тяжелой сопутствующей патологии |
Тяжелая сопутствующая патология (ХПН, цирроз печени, сахарный диабет, алкогольная висцеропатия, наркомания, ВИЧ) |
Любые пациенты |
Тяжелое течение основного заболевания или наличие тяжелой коморбидности |
|
Дополнительные факторы риска ПРВ |
Нет |
Поездка за границу в регион с высоким уровнем ПРВ |
Нет |
Факторы риска MRSA, карбапенем-устойчивых энтеробактерий, P.aeruginosa/Acinetobacter |
Предшествующая терапия/профилактика азолами |
Вероятные полирезистентные возбудители или грибы Candida |
Нет |
Энтеробактерии – продуценты БЛРС и/или устойчивые к ФХ или DRSP |
Энтеробактерии – продуценты БЛРС |
Энтеробактерии – продуценты БЛРС и карбапенемаз; MRSA; НФГОБ |
Те же бактерии (IIIb тип) |
Обозначения: БЛРС – бета-лактамазы расширенного спектра; ПРВ – полирезистентные возбудители; ИК – инвазивный кандидоз; ФХ – фторхинолоны; DRSP – полирезистентный Streptococcus pneumoniae; MRSA – метициллинорезистентный Staphylococcus aureus; НФГОБ – неферментирующие грамотрицательные бактерии (Pseudomonas aeruginosa, Acinetobacter spp.)
Приложение 3. Эмпирический выбор антимикробной терапии при сепсисе с учётом стратификации риска полирезистетсных возбудителей и инвазивного кандидоза
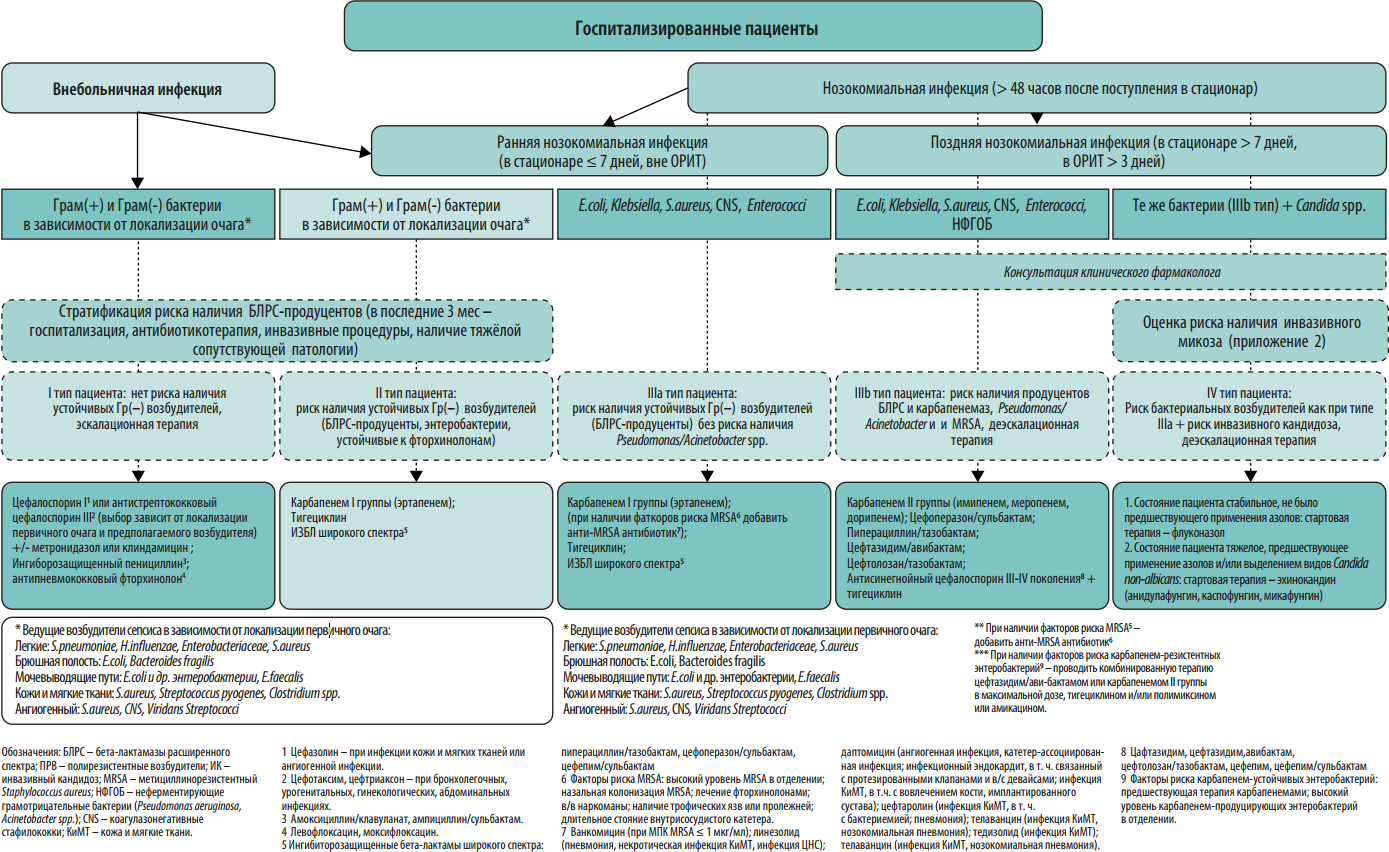
Приложение 4. Эмпирический выбор антимикробной терапии у пациентов с абдоминальной инфекцией (в т. ч. деструктивного панкреатита и инфекций малого таза) с учётом стратификации риска полирезистентных возбудителей и инвазивного кандидоза
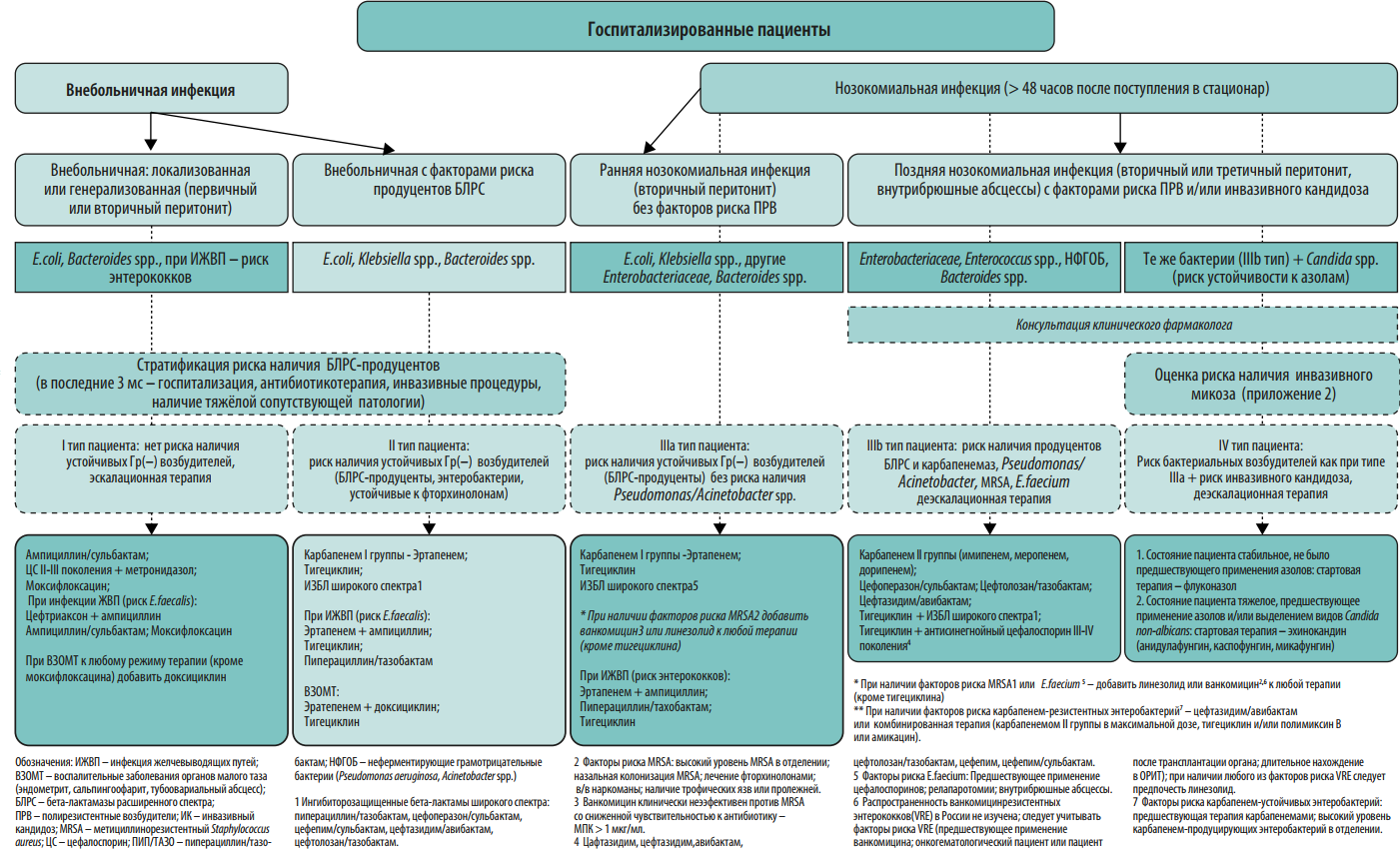
Приложение 5. Эмпирический выбор антимикробной терапии у пациентов с инфекцией мочевыводящих путей с учётом стратификации риска полирезистентных возбудителей и инвазивного кандидоза
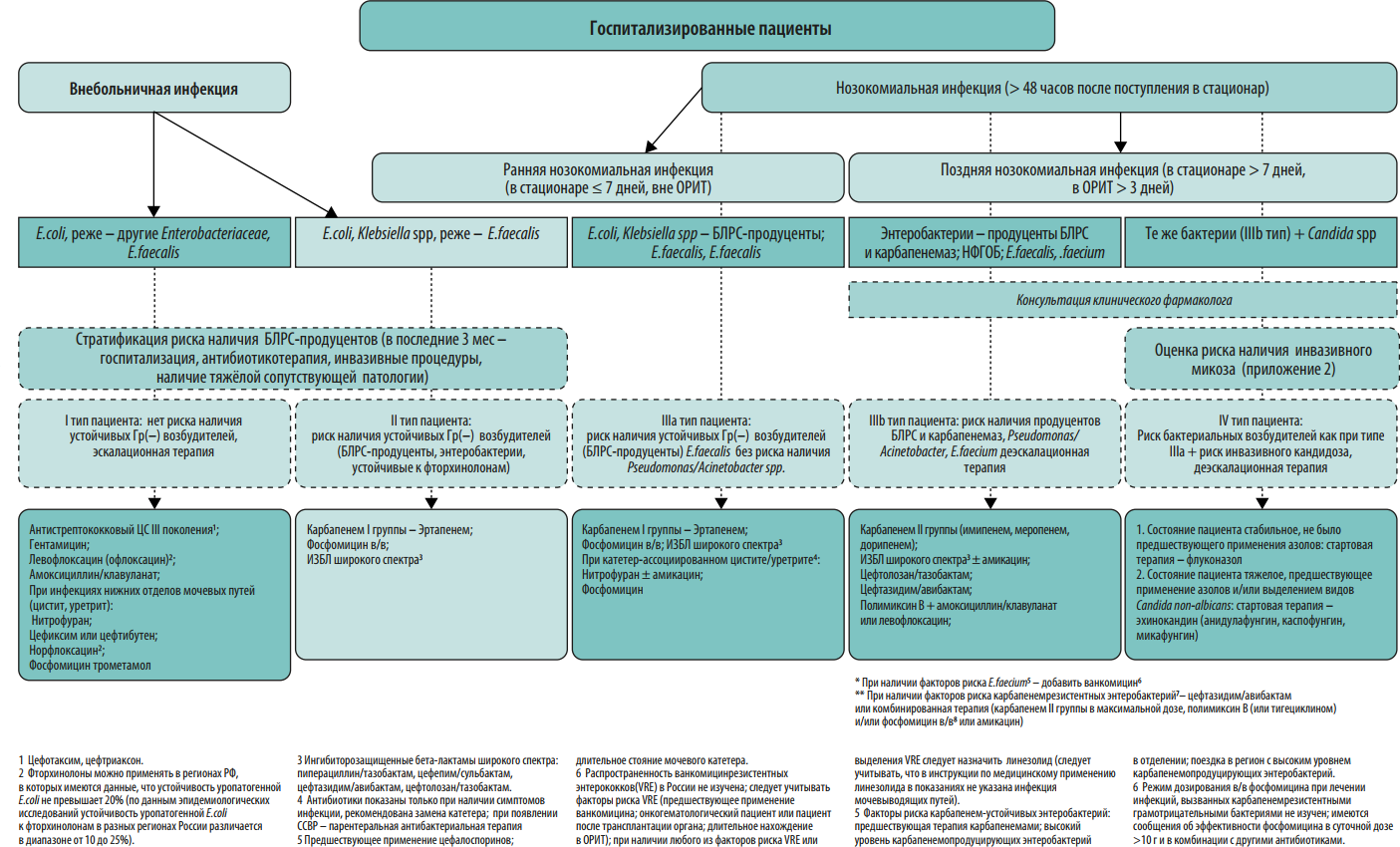
Приложение 6. Эмпирический выбор антимикробной терапии у пациентов с пневмонией с учетом стратификации риска полирезистентных возбудителей и инвазивного кандидоза
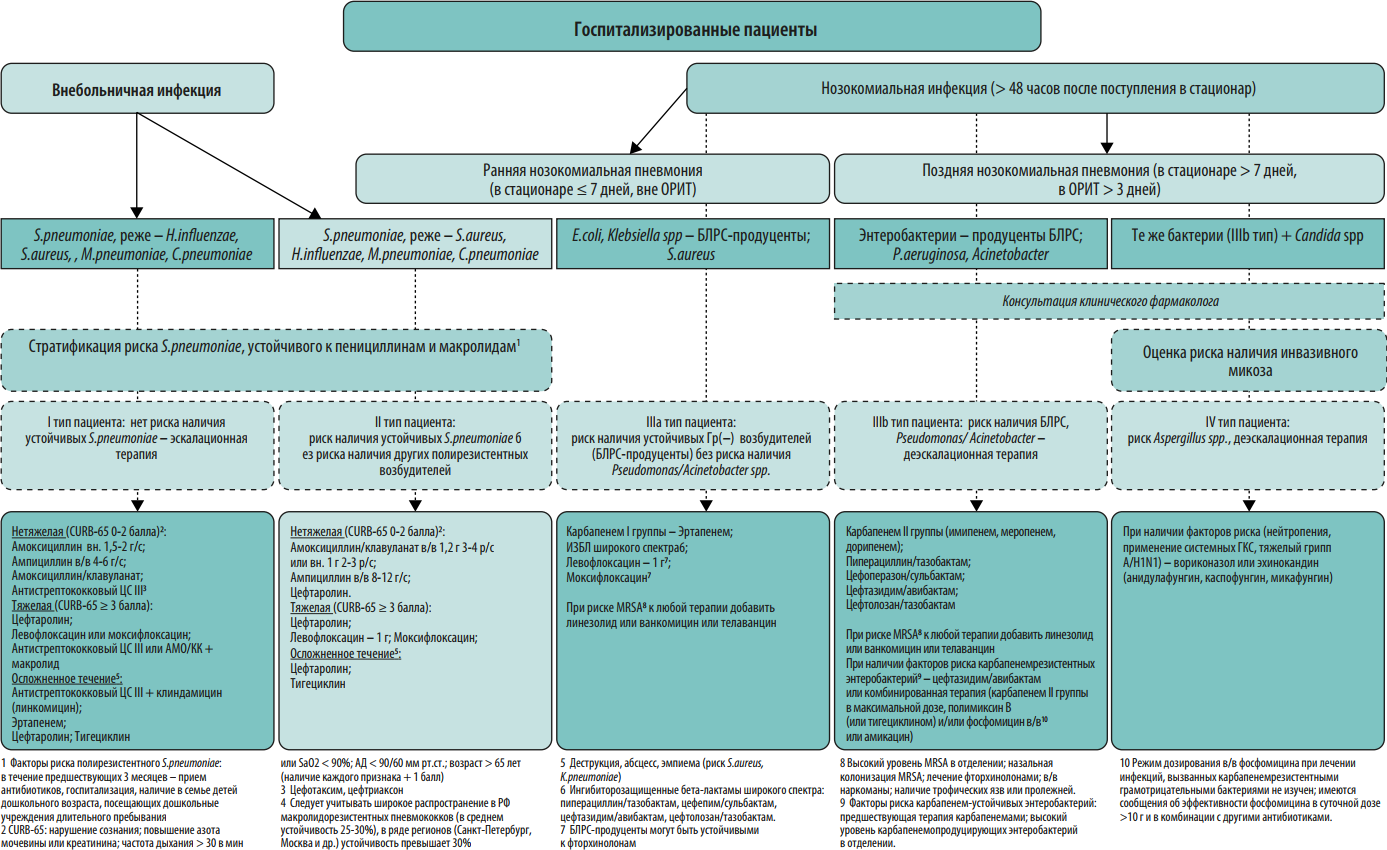
Приложение 7. Эмпирический выбор антимикробной терапии у пациентов с инфекцией кожи и мягких тканей с учётом стратификации риска полирезистентных возбудителей и инвазивного кандидоза
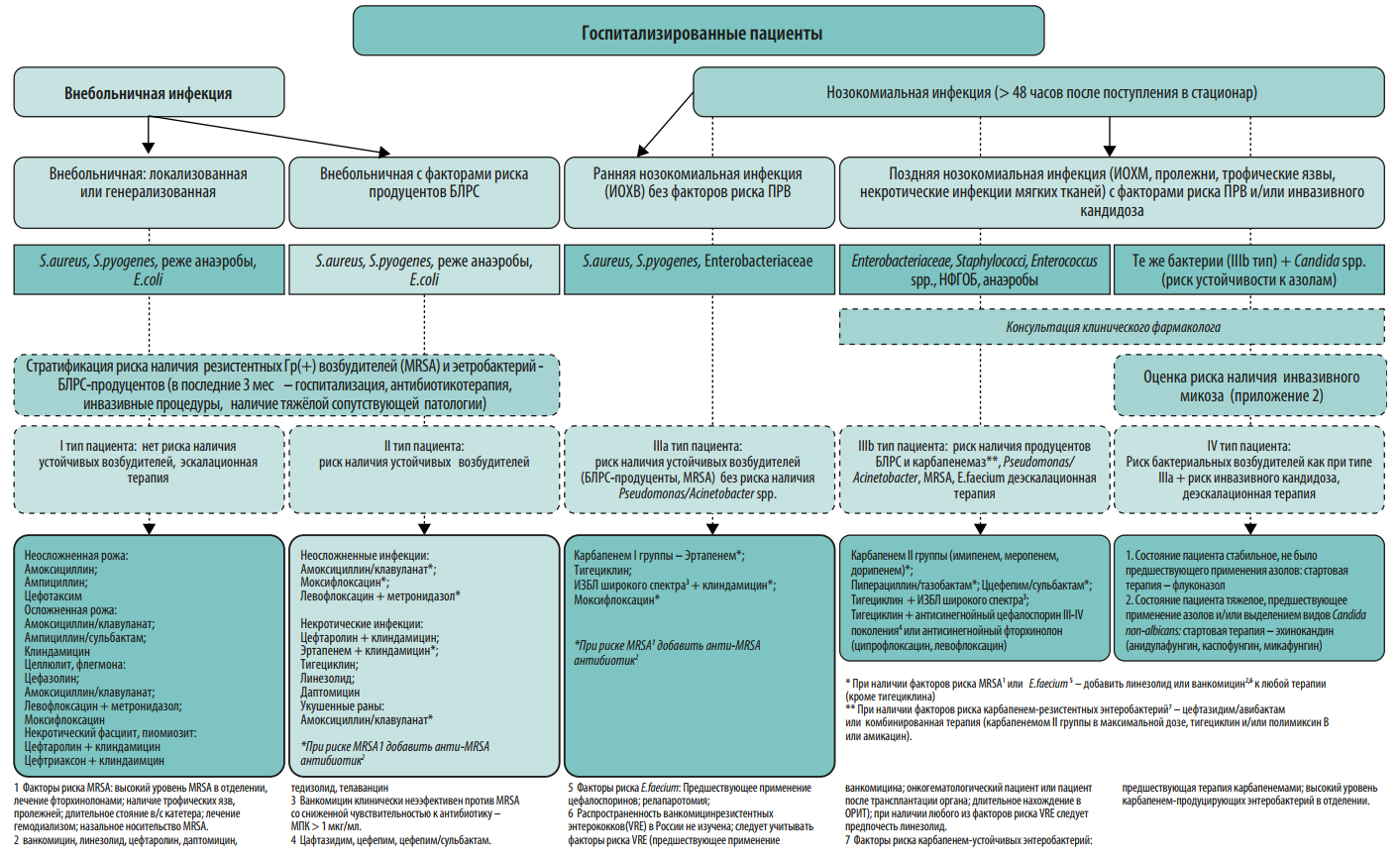
Приложение 8. Эмпирический выбор антимикробной терапии у пациентов с первичной ангиогенной инфекцией (в т. ч. катетер-ассоциированной) с учётом стратификации риска полирезистентных возбудителей и инвазивного кандидоза
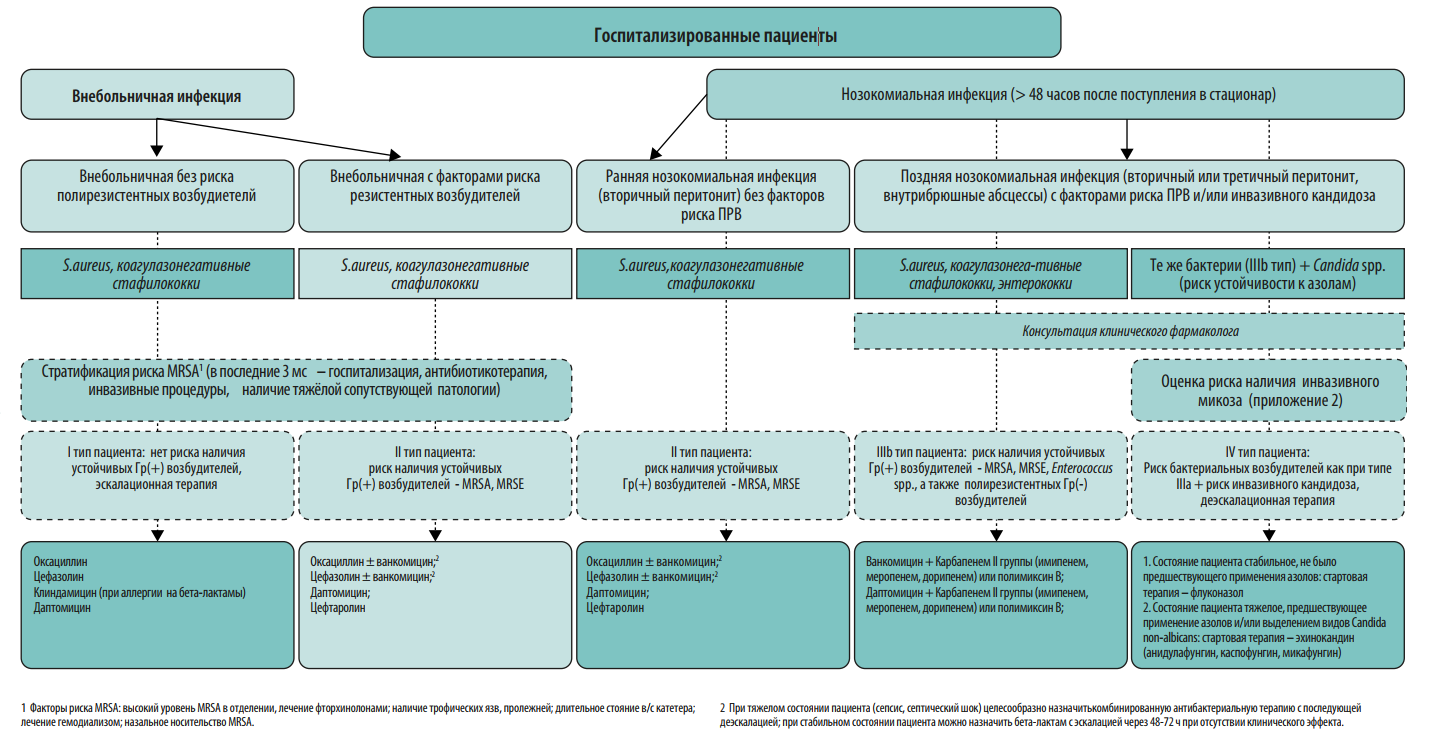
Приложение 9. Антифунгальная терапия при высоком риске инвазивного кандидоза и кандидемии
9.1. Алгоритм лечения пациента с лихорадкой и высоким риском инвазивного кандидоза
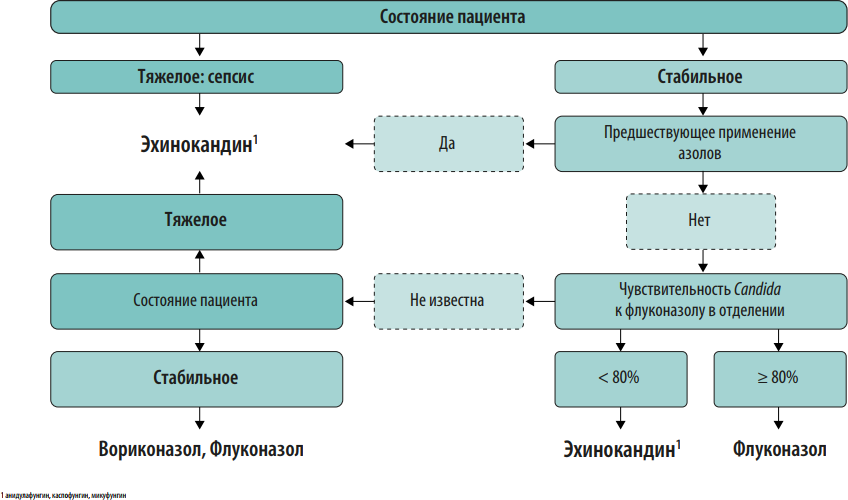
1 - анидулафунгин, каспофунгин, микуфунгин
9.2. Эмпирическая антифунгальная терапия – рекомендации
Показания
Сочетание следующих признаков:
-
лихорадка неясной этиологии продолжительностью более 4–6 сут, резистентная к адекватной антибактериальной терапии
-
распространенная (2 и более локусов) колонизация Candida spp.
-
наличие ≥2 факторов риска развития инвазивного кандидоза (в/в катетер, хирургическое вмешательство на органах брюшной полости, полное парентеральное питание, применение ГКС или иммуносупрессантов)
Препараты выбора
Альтернативный препарат:
9.4. Лечение кандидемии алгоритм
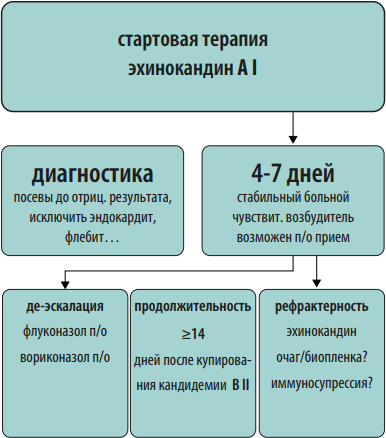
Приложение 10. Выбор антимикробных препаратов для лечения сепсиса установленной этиологии (рекомендации по целенаправленной терапии)
| Микроорганизмы | Антибиотики 1-ой линии [7] | Антибиотики 2-й линии [7] |
|---|---|---|
Грамположительные микроорганизмы |
||
Staphylococcus aureus (MSSA) |
Оксациллин [8] Цефазолин [9] |
Клиндамицин Линкомицин Левофлоксацин Моксифлоксацин Цефтаролин Даптомицин [10] |
MRSA MRCNS |
Ванкомицин [11] Линезолид Цефтаролин Даптомицин [10] |
Тедизолид [12] Телаванцин [13] |
Streptococcus viridans и Streptococcus pyogenes |
Ампициллин Бензилпенициллин Цефотаксим Цефтриаксон |
Цефтаролин Имипенем Меропенем |
Streptococcus pneumoniae |
Ампициллин Цефотаксим Цефтриаксон Цефтаролин |
Левофлоксацин Моксифлоксацин |
Enterococcus faecalis |
Ампициллин |
Ванкомицин Линезолид Левофлоксацин Моксифлоксацин |
Enterococcus faecium |
Линезолид Ванкомицин +/- гентамицин |
Даптомицин Тедизолид [12] |
VRE [14] |
Линезолид |
Даптомицин Тигециклин |
Грамотрицательные |
||
E. coli, P. mirabilis, K.pneumoniae (БЛРС-) |
ЦС III-IV поколения Пиперациллин/тазобактам Цефоперазон/сульбактам Цефепим/сульбактам Фторхинолон |
Карбапенем |
E. coli, P. mirabilis, K.pneumoniae, другие энтеробактерии (БЛРС+) |
Карбапенем |
Цефоперазон/сульбактам Цефепим/сульбактам Цефтазидим/авибактам Цефтолозан/тазобактам Тигециклин [15] |
K.pneumoniae, E.coli (CARB-R) |
При МПК меропенема или дорипенема ≤ 8.0 мкг/мл Максимальные дозы меропенема [16]
или дорипенема [16]
(продленная инфузия) |
|
При МПК меропенема или дорипенема > 8.0 мкг/мл Полимиксин В + тигециклин +/- аминогликозиды +/- фосфомицин [18]; Эртапенем + меропенем; Цефтазидим/авибактам [17] |
||
При отсутствии данных о значениях МПК меропенема Различные комбинации 3-х или 4-х антибиотиков: Карбапенем [16]; тигециклин; полимиксины; бета-лактам + сульбактам; фосфомицин [18]; аминогликозид |
||
Acinetobacter spp. |
Тигециклин; Полимиксин В или колистин [19] |
Цефоперазон/сульбактам; Цефепим/сульбактам; Ампициллин/сульбактам (все ± амикацин); Карбапенем (имипенем, меропенем, дорипенем) |
P.aeruginosa |
Цефтолозан/тазобактам; Цефтазидим; Цефепим |
Карбапенем (меропенем, дорипенем, имипенем); Цефтазидим/авибактам; Ципрофлоксацин или левофлоксацин; Полимиксин В или колистин [19]; Пиперациллин/тазобактам |
Burkholderia cepacia |
Меропенем |
Цефтазидим Ципрофлоксацин |
Stenotrophomonas maltophilia |
Ко-тримоксазол [20] |
Тигециклин [15] Моксифлоксацин |
Candida albicans |
Флуконазол |
Вориконазол Анидулафунгин Каспофунгин Микафунгин |
Candida non-albicans |
Анидулафунгин Каспофунгин Микафунгин |
Вориконазол Амфотерицин В – липидный комплекс |
Aspergillus spp. |
Вориконазол |
Каспофунгин; Амфотерицин В – липидный комплекс |
Использованные сокращения: MSSA – метициллин(оксациллин) чувствительные штаммы; MRCNS – метициллинорезистентные коагулазонегативные стафилококки; VRE – ванкомицинорезистентные энтерококки; CARB-R – карбапенем-резистентные; БЛРС – бета-лактамазы расширенного спектра; ЦС - цефалоспорины
Приложение 11. Дозирование антимикробных препаратов у взрослых.
Пенициллины |
|
Ампициллин |
2 г 4–6 раз в сутки |
Оксациллин |
2 г 4–6 раз в сутки |
Цефалоспорины без антисинегнойной активности |
|
Цефазолин |
2 г 3–4 раза в сутки |
Цефотаксим |
2 г 3–4 раза в сутки [21] (до 12 г/сут при инфекциях ЦНС) |
Цефтриаксон |
2 г 1–2 раза в сутки [21] |
Цефалоспорины III–IV поколения с антисинегнойной активностью |
|
Цефепим |
2 г 2-3 раза в сутки [22] |
Цефтазидим |
2 г 3 раза в сутки |
Цефалоспорины с анти-MRSA активностью |
|
Цефтаролин |
0,6 г 2 раза в сутки |
Карбапенемы |
|
Меропенем |
1-2 г 3-4 раза в сутки (3-х часовая инфузия) [23] |
Имипенем |
1 г 3-4 раза в сутки [23] |
Дорипенем |
0,5-1 г 3 раза в сутки (4-х часовая инфузия) [23] |
Эртапенем |
1 г 1 раз в сутки |
Комбинации β-лактамов с ингибиторами β-лактамаз |
|
Амоксициллин/клавуланат |
1,2 г 3-4 раза в сутки |
Ампициллин/сульбактам |
3 г 3-4 раза в сутки |
Пиперациллин/тазобактам |
4,5 г 3-4 раза в сутки |
Цефепим/сульбактам |
2-4 г 2 раза в сутки |
Цефоперазон/сульбактам |
4 г 2 раза в сутки |
Цефтазидим/авибактам |
2,5 г 3 раза в сутки |
Цефтолозан/тазобактам |
1,5 г 3 раза в сутки |
Аминогликозиды |
|
Амикацин |
15 мг/кг 1 раз в сутки [24] |
Гентамицин |
5-7 мг/кг 1 раз в сутки [24] |
Линкозамиды |
|
Клиндамицин |
600 мг 3-4 раза в сутки |
Линкомицин |
600 мг 3-4 раза в сутки |
Фторхинолоны без антисинегнойной активности |
|
Моксифлоксацин |
400 мг 1 раз в сутки |
Офлоксацин |
400 мг 2 раза в сутки |
Фторхинолоны с антисинегнойной активностью |
|
Левофлоксацин [25] |
500 мг 1-2 раза в сутки или 1 г 1 раз в сутки |
Ципрофлоксацин |
600 мг 2 раза в сутки или 400 мг 2-3 раза в сутки |
Препараты, активные в отношении MRSA |
|
Ванкомицин |
1 г 2 раза в сутки [26] |
Даптомицин |
4-6 мг/кг 1 раз в сутки [27] |
Линезолид |
600 мг 2 раза в сутки |
Тедизолид |
200 мг 1 раз в сутки |
Телаванцин |
10 мг/кг 1 раз в сутки [28] |
Препараты других классов |
|
Тигециклин |
100 мг первая доза, затем 50 мг 2 раза в сутки |
Полимиксин В |
1-1,25 мг/кг 2 раза в сутки или 10000-12500 МЕ/кг 2 раза в сутки [29] |
Колистиметат натрия (колистин, полимиксин Е) |
2-3 млн МЕ (160-240 мг) 2 раза в сутки [30] |
Фосфомицин |
3-4 г 2-3 раза в сутки |
Ко-тримоксазол |
15 мг/кг в сутки по триметроприму в 2-3 введения |
Метронидазол |
500 мг 3-4 раза в сутки |
Рифампицин |
300-450 мг 2 раза в сутки |
Противогрибковые препараты |
|
Вориконазол |
Начинают с в/в введения по 6 мг/кг 2 раза в 1-е сутки, затем по 4 мг/ кг 2 раза в сутки. После стабилизации состояния пациента возможен переход на пероральный прием (200 мг каждый 12 часов у пациен тов с массой тела 40 кг и более и 100 мг каждые 12 часов при массе тела менее 40 кг). У детей от 2 до 12 лет и подростков от 12 до 14 лет с массой тела менее 50 кг насыщающая доза составляет 9 мг/кг каждые 12 часов (в течение первых 24 часов), далее по 8 мг/кг, далее 8 мг/кг 2 раза в сутки. У подростков (12-14 лет) с массой тела 50 кг и более, препарат дозируется как у взрослых. Возможность перехода на перо ральный приём следует рассматривать после клинического улучше ния и возможности пациента приминать пероральные лекарственные средства. Пероральная дозировка у детей и подростков с массой тела менее 50 кг составляет 9 мг/кг 2 раза в сутки, поэтому рекомендуется использовать суспензию, обеспечивающую гибкое дозирование. |
Каспофунгин |
В первые сутки 70 мг, затем по 50 мг 1 раз в сутки |
Анидулафунгин |
В первые сутки 200 мг, затем по 100 мг 1 раз в сутки |
Микафунгин |
100 мг 1 раз в сутки |
Флуконазол |
400-800 мг 1 раз в сутки |
Приложение 12А. Дозирование антимикробных препаратов у детей.
| МНН | Лекарственные формы | Суточная доза | Кратность приема в сутки | Возрастные ограничения |
|---|---|---|---|---|
Пенициллины |
||||
Феноксиметилпенициллин |
Таблетки, суспензия, сироп |
10-30 мг/кг |
4-6 раза |
|
Оксациллин |
Таблетки |
3-6 лет – 2 г >6 лет – 3-8 г |
4-6 раз |
|
Амоксициллин |
Таблетки диспергируемые, таблетки, капсулы, суспензия |
20-90 мг/кг |
2-3 раза |
|
Амоксициллин/клавуланат |
Таблетки диспергируемые, таблетки, суспензия |
20-90 мг/кг (по амоксициллину) |
|
|
Амоксициллин/сульбактам |
Таблетки, суспензия |
|
|
|
Сультамициллин |
Таблетки, суспензия |
25-50 мг/кг |
2 раза |
|
Цефалоспорины |
||||
Цефалексин |
Капсулы, таблетки, суспензия |
25-100 мг/кг |
2-6 раз |
|
Цефуроксимаксетил |
Таблетки, суспензия |
20-30 мг/кг (не более 500 мг) |
2 раза |
Противопоказан детям до 3 мес. |
Цефаклор |
Капсулы, суспензия |
20-40 мг/кг (не более 1500 мг) |
2-3 раза |
|
Цефиксим |
Таблетки диспергируемые, капсулы, суспензия |
8 мг/кг |
1-2 раза |
|
Цефтибутен |
Капсулы, суспензия |
9 мг/кг (не более 400 мг) |
1-2 раза |
Противопоказан детям до 6 мес. |
Цефдиторен |
Таблетки |
200-400 мг |
2 раза |
Противопоказан детям до 12 лет |
Макролиды |
||||
Азитромицин |
Капсулы, таблетки, суспензия |
10-20 мг/кг |
1 раз |
Противопоказан детям до 6 мес. |
Джозамицин |
Таблетки диспергируемые, таблетки |
40-50 мг/кг |
2-3 раза |
Противопоказан детям с массой тела менее 10 кг. |
Кларитромицин |
Таблетки, суспензия |
15 мг/кг (не более 500 мг) |
1-2 раза (1 раз в сутки только таблетки пролонгированного действия). |
|
Мидекамицин |
Таблетки, суспензия |
20-50 мг/кг |
2-3 раза |
|
Рокситромицин |
Таблетки диспергируемые, таблетки, |
5-8 мг/кг (не более 300 мг) |
2 раза |
|
Спирамицин |
Таблетки |
150000-300000 МЕ/кг |
2-3 раза |
Противопоказан детям до 3 лет (в форме таблеток). |
Эритромицин |
Таблетки |
20-50 мг/кг |
2-4 раза |
|
Линкозамиды |
||||
Линкомицин |
Капсулы |
30-60 мг/кг |
2-3 раза |
Противопоказан детям до 2 лет. |
Клиндамицин |
Капсулы |
8-25 мг/кг |
3-4 раза |
|
Тетрациклины |
|
|
|
|
Тетрациклин |
Таблетки |
25-50 мг/кг |
2-4 раза |
Противопоказан детям до 8 лет |
Доксициклин |
Таблетки диспергируемые, таблетки, капсулы |
4 мг/кг или 4мг/кг в 1й день, затем 2 мг/кг |
1-2 раза |
Противопоказан детям до 8 лет |
Гликопептиды |
||||
Ванкомицин |
Раствор для инфузий |
40 мг/кг |
3-4 раза |
|
Оксазолидиноны |
|
|
|
|
Линезолид |
Таблетки, суспензия |
30 мг/кг |
3 раза |
|
Фениколы |
||||
Хлорамфеникол |
Таблетки |
50 мг/кг |
2-4 раза |
Противопоказан детям до 2 лет |
Рифамицины |
||||
Рифампицин |
Капсулы |
10-20 мг/кг |
2-3 раза |
|
Рифаксимин |
Таблетки, суспензия |
800-1200 мг |
3-4 раза |
Противопоказан детям до 12 лет |
Хинолоны |
||||
Налидиксовая кислота |
Таблетки, капсулы |
Вначале 60 мг/кг, затем 30 мг/кг |
3-4 раза |
Противопоказан детям до 2 лет |
Пипемидовая кислота |
Капсулы |
800 мг |
2 раза |
Противопоказан до 15 лет, не рекомендуется в педиатрии |
Ципрофлоксацин |
Таблетки |
30-40 мг/кг |
2 раза |
В России у детей до 18 лет при меняется только по отдельным показаниям |
Норфлоксацин |
Таблетки |
15 мг/кг |
2 раза |
В России противопоказан детям до 18 лет. В зарубежных руководствах допускается применение у детей. |
Офлоксацин |
Таблетки |
15 мг/кг |
2 раза |
|
Пефлоксацин |
Таблетки |
15-20 мг/кг |
2 раза |
|
Левофлоксацин |
Таблетки |
6 мес 5 лет – 16-20 мг/кг 5-16 лет – 8-10 мг/кг (максимально 750 мг) |
6 мес 5 лет – 2 раза 5-16 лет – 1 раз |
|
Моксифлоксацин |
Таблетки |
7,5-10 мг/кг |
1 раз |
|
Нитрофураны |
||||
Нитрофурантоин |
Таблетки Суспензия (в России не зареги стрирована) |
> 6 лет – 200 мг |
4 раза |
|
Нифурател |
Таблетки |
10-60 мг/кг |
2-3 раза |
|
Нифуроксазид |
Таблетки Капсулы Суспензия |
220-660 мг |
2-3 раза |
Противопоказан детям до 1 месяца |
Фуразолидон |
Таблетки |
10 мг/кг |
3-4 раза |
Противопоказан детям до 1 года |
Фуразидин |
Таблетки |
75-150 мг (до 5 мг/кг) |
3 раза |
Противопоказан детям до 1 года |
Нитроимидазолы |
||||
Метронидазол |
Таблетки |
20-40 мг/кг |
2-4 раза |
|
Орнидазол |
Таблетки |
25-40 мг/кг |
1 раз |
|
Тинидазол |
Таблетки |
50-75 мг/кг |
1 раз |
|
Секнидазол |
Таблетки |
30 мг/кг |
1 раз |
|
Сульфаниламиды |
|
|
|
|
Ко-тримоксазол |
Таблетки, Суспензия |
36-120 мг/кг |
2-4 раза |
Противопоказан детям до 6 недель |
Прочие антибактериальные препараты |
||||
Фосфомицин |
Раствор для приема внутрь |
2 г |
1 раз |
Противопоказан детям до 5 лет |
Фузидовая кислота |
Таблетки |
3-4 года – 40-60 мг/кг, после 4 лет – 20-40 мг/кг |
3 раза |
Противопоказан детям до 3 лет |
Приложение 12Б. Дозирование антимикробных препаратов у детей.
| МНН | Лекарственные формы | Суточная доза | Кратность приема в сутки | Возрастные ограничения |
|---|---|---|---|---|
Пенициллины |
||||
Бензилпенициллин |
В/в, в/м |
100000-500000 Ед/кг |
4-6 раза |
|
Бензатин бензилпенициллин |
В/м |
600000-1200000 МЕ, Новорожденные – 50000 МЕ/кг |
1 раз в 1–4 недели |
|
Бензилпенициллин прокаин/ бензатин бензилпенициллин |
В/м |
До 8 лет – 480000 Ед + 120000 Ед, после 8 лет – 960000 Ед + 240000 Ед |
до 8 лет – 1 раз в 3 недели, после 8 лет – 1 раз в 4 недели |
|
Бензилпенициллин/бензилпенициллин прокаин/бензатин бензилпенициллин |
В/м |
300000-1800000 Ед |
1 раз в сутки, по схеме |
|
Ампициллин |
В/в, в/м |
100-200 мг/кг |
4 раза |
|
Оксациллин |
В/в, в/м |
До 1 мес – 20-40 мг/кг, 1-3 мес – 60-80 мг/кг, 3 мес – 2 года – 1 г, 2-6 лет – 2 г, после 6 лет – 2-4 г |
4-6 раз |
|
Амоксициллин/клавуланат |
В/в |
До 3 мес – 60 мг/кг (вес < 4 кг) или 90 мг/кг (вес > 4 кг), после 3 мес – 90-120 мг/кг (не более 4800 мг) |
3-4 раза (до 3 мес – 2-3 раза |
|
Амоксициллин/сульбактам |
В/в, в/м |
До 2 лет – 40-60 мг/кг, 2-6 лет – 750 мг, 6-12 лет – 1,5 г, После 12 лет – 2-3 г |
2-3 раза |
|
Ампициллин/сультактам |
В/в, в/м |
150 мг/кг |
3-4 раза |
|
Пиперациллин/тазобактам |
В/в |
90-112,5 мг/кг |
3-4 раза |
Противопоказан детям до 2 лет |
Тикарциллин/клавуланат |
В/в |
225-300 мг/кг, недоношенные новорожденные с массой тела менее 2 кг – 150 мг/кг |
3-4 раза, недоношенные новорожденные с массой тела менее 2 кг – 2 раза |
Противопоказан недоношенным детям с нарушением функции почек |
Цефалоспорины |
||||
Цефазолин |
В/в, в/м |
20-100 мг/кг |
3-4 раза |
Противопоказан детям до 1 мес |
Цефуроксим |
В/в, в/м |
30-100 мг/кг |
3 раза |
|
Цефокситин |
В/в, в/м |
30-40 мг/кг |
3-4 раза, новорожденным в 1 неделю жизни – 2 раза |
|
Цефотаксим |
В/в, в/м |
50-100 мг/кг |
3-4 раза |
|
Цефтриаксон |
В/в, в/м |
20-80 мг/кг |
1-2 раза |
|
Цефтазидим |
В/в, в/м |
30-150 мг/кг (не более 6 г), до 2 мес 25-60 мг/кг |
2-3 раза |
|
Цефоперазон |
В/в, в/м |
50-200 мг/кг |
2-3 раза |
|
Цефтриаксон/сульбактам |
В/в, в/м |
20-80 мг/кг (по цефтриаксону) |
1-2 раза |
|
Цефоперазон/сульбактам |
В/в, в/м |
40-160 мг/кг |
2-4 раза (до 1 мес – 2 раза) |
|
Цефепим |
В/в, в/м |
100-150 мг/кг |
2-3 раза |
Не рекомендуется у детей до 2 мес |
Цефтаролин |
В/в |
от 2 мес до 2 лет - 8 мг/кг каждые 8 ч;
от 2 лет до 12 лет - 12 мг/кг1 каждые
8 ч; |
3 раза |
Разрешен с 2 месяцев |
Карбапенемы |
||||
Имипенем |
В/в, в/м |
В/в 60 мг/кг, в/м – 1-1,5 г |
В/в 4 раза, в/м – 2 раза |
Противопоказан детям до 3 мес, форма для в/м – до 12 лет |
Меропенем |
В/в |
от 3 мес до 12 лет 10-40 мг/кг каждые 8 ч в зависимости от типа и тяжести инфекции |
3 раза |
Противопоказан детям до 3 мес. При массе тела более 50 кг следует использовать дозы для взрослых |
Эртапенем |
В/в, в/м |
30 мг/кг (не более 1 г) |
2 раза (с 13 лет – 1 раз) |
Противопоказан детям до 3 мес |
Дорипенем |
В/в |
60 мг/кг* |
3 раза |
В России противо показан детям до 18 лет. В зарубежных исследованиях использовался у детей |
Монобактамы |
||||
Азтреонам |
В/в, в/м |
До 2-х лет 90-120 мг/кг, после 2-х лет 150-200 мг/кг |
3-4 раза в сутки |
|
Аминогликозиды |
||||
Амикацин |
В/в, в/м |
10-20 мг/кг |
1-2 раза |
|
Гентамицин |
В/в, в/м |
3-5 мг/кг |
1-2 раза |
|
Нетилмицин |
В/в, в/м |
4-6,5 мг/кг |
1-2 раза |
|
Тобрамицин |
В/в, в/м |
3-5 мг/кг |
1-2 раза |
|
Канамицин |
В/в, в/м |
15 мг/кг |
1-3 раза |
|
Стрептомицин |
В/м |
До 3-х месяцев 10 мг/кг, 3-6 месяцев 15 мг/кг, 6 месяцев-2 года – 20 мг/кг, после 2-х лет 15-20 мг/кг, до 13 лет – не более 500 мг/сут, после 13 лет не более 1гр./сут |
1-2 раза |
|
Макролиды |
||||
Азитромицин |
В/в |
10 мг/кг (не более 500 мг)* |
1 раз |
Противопоказан детям до 16 лет. В зарубежных руководствах допускается применение в любом возрасте |
Эритромицин |
В/в |
30-50 мг/кг, до 3 мес – 20-40 мг/кг |
2-4 раза |
|
Тетрациклины |
||||
Доксициклин |
В/в |
2-4 мг/кг |
1-2 раза |
Противопоказан детям до 8 лет |
Линкозамиды |
||||
Линкомицин |
В/в, в/м |
10-20 мг/кг |
3 раза |
|
Клиндамицин |
В/в, в/м |
20-40 мг/кг |
3-4 раза |
Противопоказан детям до 3 лет |
Гликопептиды |
||||
Ванкомицин |
Раствор для инфузий |
40 мг/кг |
4 раза |
|
Рифамицины |
||||
Рифампицин |
В/в |
10-20 мг/кг (максимально – 600 мг) |
1-3 раза |
Противопоказан детям до 2 мес |
Фениколы |
||||
Хлорамфеникол |
В/в, в/м |
50-100 мг/кг |
2-4 раза |
Противопоказан детям до 1 мес |
Тиамфеникол (тиамфеникола глицинат ацетилцистеинат) |
В/м |
Новорожденные – 25 мг/кг, 1 мес 3 года – 250-500 мг, 3-7 лет – 500 мг – 1г, 7-12 лет – 750 мг – 1,5 г, 13-15 лет – 1-2 г, 16-18 лет – 1-3 г |
2-3 раза |
|
Глицилциклины |
||||
Тигециклин |
В/в |
8-11 лет – 2,4 мг/кг, |
2 раза |
В России разрешен у детей старше 8 лет |
Липопептиды |
||||
Даптомицин |
В/в |
5-10 мг/кг* |
1 раз |
В России противопоказан детям до 18 лет. В зарубежных руководствах допускается применение у детей. |
Фторхолинолы |
||||
Ципрофлоксацин |
В/в |
20-30 мг/кг (не более 1200 мг) |
2 раза |
Противопоказан детям до 18 лет (разрешен для больных муковисцидозом) |
Пефлоксацин |
В/в |
15-20 мг/кг |
2 раза |
В России противопоказан детям до 18 лет. В зарубежных руководствах допускается применение у детей. |
Офлоксацин |
В/в |
15 мг/кг* |
2 раза |
|
Левофлоксацин |
В/в |
До 5 лет 16-20 мг/ кг, после 5 лет - 8-10 мг/кг* |
До 5 лет – 2 раза, после 5 лет – 1 раз |
|
Моксифлоксацин |
В/в |
7,5-10 мг/кг |
1 раз |
|
Нитроимидазолы |
||||
Метронидазол |
В/в |
22,5 мг/кг |
3 раза |
|
Сульфаниламиды |
||||
Триметаприм/сульфаметаксозол |
В/в |
36-120 мг/кг |
2-4 раза |
|
Прочие антибактериальные препараты |
||||
Фосфомицин |
В/в, в/м |
200-400 мг/кг |
3 раза |
|
Спектиномицин |
В/м |
При массе тела до 45 кг 40 мг/ кг, при массе тела более 45 кг – 2г |
1 раз |
Противопоказан детям до 3 лет |
* дозировка приводится по зарубежным источникам, в связи с возрастными ограничениями в РФ
| Противогрибковые ЛС | |||
|---|---|---|---|
Препарат |
Путь введения |
Доза у детей ≤ 12 лет |
Доза у детей >12 лет |
Флуконазол |
В/в, внутрь |
6-12 мг/кг/сут |
6-12 мг/кг/сут |
Вориконазол |
В/в, внутрь |
в/в 12 мг/кг в 1 сут, |
в/в 8 мг/кг/ 2 раза в cут; |
Вориконазол |
В/в, внутрь |
70 мг/м2 в 1 сут, затем 50 мг/м2/сут (≤ 70 мг) |
70 мг в 1 сут, затем 50 мг/cут |
Микафунгин |
В/в |
<40 кг 2 мг/кг/сут; |
<40 кг 2 мг/кг/сут; |
Издательство «Перо»
109052, Москва, Нижегородская ул., д. 29-33, стр. 15, ком. 536
Тел.: (495) 973-72-28, 665-34-36
Подписано в печать 14.02.2018. Формат 60×90/16.
Бумага офсетная. Усл. печ. л. 9,5. Тираж 1000 экз. Заказ 090.
Разработано специалистами общественных организаций: Альянс клинических химиотерапетов и микробиологов, РАСХИ, НАСХИ, МАКМАХ, Федерация анестезиологов-реаниматологов. Напечатано при поддержке медицинского отдела MSD.
Компания MSD не рекомендует применять препараты компании способами, отличными от описанных в инструкции по применению.
ООО «МСД Фармасьютикалс»
Россия, 115093, Москва, ул. Павловская, 7 Бизнес-центр «Павловский»,
Tel.: +7 495 916 7100 Fax: +7 495 916 7094
INFC-1240539-0000; 03.2018