Фролова, Е. В. Нарушение когнитивных функций в пожилом возрасте : руководство для врачей / Е. В. Фролова, А. Ю. Емелин, В. Ю. Лобзин. - Москва : ГЭОТАР-Медиа, 2023. - 208 с. - ISBN 978-5-9704-7515-7, DOI: 10.33029/9704-7515-7-KNP-2023-1-208. |
Аннотация
В руководстве подробно рассмотрены принципы организации современной российской гериатрии, а также ее базис: понятия комплексной гериатрической оценки и гериатрического синдрома. Представлены характеристики основных когнитивных функций, даны критерии диагностики и классификация когнитивных нарушений. Описаны алгоритм дифференциальной диагностики когнитивных расстройств, общие принципы и направления их профилактики и лечения. Дополнительно изложены современные представления об этиологии, патогенезе, особенностях клинических проявлений, возможностях диагностики и лечения основных нозологических форм (болезнь Альцгеймера и другие нейродегенеративные заболевания, цереброваскулярная болезнь и др.). В приложении приведены основные диагностические шкалы и тесты, в том числе и скрининговые оценочные шкалы.
Издание предназначено врачам-гериатрам, врачам общей практики, неврологам, психиатрам, терапевтам, а также может использоваться для обучения студентов, ординаторов и в системе последипломного образования врачей.
Эпидемиология
Сосудистая деменция в большинстве стран по распространенности занимает второе место после болезни Альцгеймера, составляя не менее 20% среди всех случаев [1, 2]. Частота встречаемости сосудистой деменции увеличивается с возрастом, составляя 0,3% в возрастном диапазоне от 65 до 69 лет и 5,2% в возрасте старше 90 лет, а риск развития сосудистой деменции удваивается каждые 5,3 года [3]. В среднем заболеваемость сосудистой деменцией оценивается как 1,5 случая на 1000 человек в год, причем мужчины заболевают чаще, чем женщины [4].
Результаты международных исследований показывают, что от 20 до 30% всех ишемических инсультов в возрасте старше 65 лет приводят к развитию сосудистой деменции, что является одной из основных причин нетрудоспособности [5, 6]. При тяжелых инсультах риск развития деменции в течение года составляет 34% [7]. Кроме того, выявление при нейровизуализации единичных инфарктов сопровождается увеличением риска развития деменции у пожилых лиц более чем в два раза [8].
Тем не менее данные о распространенности сосудистой деменции остаются достаточно противоречивыми, еще сложнее с оценкой распространенности додементных сосудистых когнитивных расстройств, что во многом определяется отсутствием общепринятых критериев диагностики, удобных для практической деятельности. Между тем, совершенно очевидно, что распространенность додементных форм значительно превышает распространенность самой деменции, при этом пациенты с такими нарушениями имеют более высокий риск развития деменции, госпитализации и смертности. Интерес к этой проблеме в мире возрастает, так как в ряде исследований показано, что у 44% пациентов с умеренными сосудистыми когнитивными нарушениями в течение 5 лет наблюдается прогрессирование когнитивного дефицита до стадии деменции [9].
Терминология
Сосудистые когнитивные нарушения (СКН) — это гетерогенные расстройства когнитивных функций различной степени выраженности, имеющие доказанную причинно-следственную связь с цереброваскулярным заболеванием.
Как клинический синдром СКН связаны с неоднородными сосудистыми механизмами и изменениями мозговой паренхимы и имеют различные причины и клинические проявления. При определении выраженности когнитивных нарушений сосудистой этиологии в большинстве классификаций традиционно выделяют сосудистые умеренные когнитивные нарушения и сосудистую деменцию (характеристика и критерии диагностики синдромов даны в главе 3). Сосудистый генез этих синдромов должен доказываться установленной причинно-следственной связью с актуальным острым или хроническим цереброваскулярным заболеванием. Дополнительно используются термины, характеризующие частные варианты сосудистой деменции: «постинсультная деменция» — деменция, развившаяся в течение 6 мес после перенесенного инсульта; «мультиинфарктная деменция» — деменция вследствие множественных инфарктов головного мозга. Большая часть случаев СКН, тем не менее, обусловлена хроническим цереброваскулярным заболеванием.
Для определения хронического прогрессирующего сосудистого поражения головного мозга в нашей стране широко используется термин «дисциркуляторная энцефалопатия» (ДЭ) [10]. Несмотря на ряд дискуссионных моментов, в целом с патогенетической точки зрения термин является удачным, так как подчеркивается связь неврологических симптомов с сосудистым поражением головного мозга. В зависимости от стадий процесса наблюдаются различные патоморфологические, нейровизуализационные и клинические изменения. В клинической картине характерно сочетание очаговых неврологических симптомов и синдромов, эмоциональных, когнитивных нарушений. Диагностика ДЭ предусматривает указание ее генеза и стадии: I стадию (умеренно выраженную), II стадию (выраженную), III стадию (резко выраженную). Когнитивные нарушения являются ядром клинической картины ДЭ, ее облигатным признаком и обнаруживаются на всех стадиях болезни [11]. При этом выраженность и модальность интеллектуально-мнестических расстройств зависит именно от стадии ДЭ. Более того, наличие таких нарушений у пациентов с ДЭ является критерием, позволяющим уточнить стадию заболевания.
Факторы риска развития сосудистых когнитивных нарушений
Традиционно факторы риска развития сосудистых когнитивных расстройств связывают с риском развития инсульта и других цереброваскулярных заболеваний. Во многих эпидемиологических исследованиях показана связь повышенного артериального давления, гипергликемии, резистентности к инсулину, метаболического синдрома, сахарного диабета, гиперлипидемии, ожирения, курения, снижения физической активности, несоблюдения диеты с повышенным риском развития СКН. Такие же связи установлены и в отношении целого ряда сердечно-сосудистых и других хронических заболеваний — ишемической болезни сердца, хронической сердечной недостаточности, фибрилляции предсердий, облитерирующих заболеваний периферических сосудов, хронических заболеваний почек [1, 6, 11, 12]. Кроме того, существуют и другие универсальные факторы риска, которые в систематизированном виде представлены в табл. 3-5 (см. главу 3).
Патогенез
Основные звенья патогенеза можно рассмотреть с различных структурно-функциональных позиций — морфологических, патофизиологических, биологических, нейрохимических. Безусловно, существуют различия в формировании когнитивных расстройств, их выраженности и паттерна в зависимости от клинико-патогенетического варианта. С позиции роли патоморфологических изменений можно сформулировать три основных подхода:
Многие авторы подчеркивают, что для развития деменции важное значение имеют совокупный объем мозговых инфарктов или ишемического поражения белого подкоркового вещества (у лиц с деменцией он в 3–4 раза больше, чем без него), билатеральность инфарктов (достигающая 86–96% среди больных с деменцией) и их локализация [13, 14]. Деменция, несомненно, чаще возникает, если повреждено определенное количество мозговой ткани — так называемый «критический объем поражения», однако топическая локализация инфаркта является не менее важным фактором, что позволило выделить концепцию «стратегической зоны».
При всех клинико-патогенетических вариантах наряду с топической зависимостью паттерна когнитивного дефицита важнейшее значение имеют и универсальные патофизиологические механизмы. При хронических вариантах цереброваскулярной патологии патогенез когнитивных нарушений определяется гипоперфузией глубинных отделов серого и белого вещества головного мозга, что приводит к нарушению связей лобных долей головного мозга и подкорковых структур (феномен разобщения) и определяет особенности клинической картины [15–17]. Феномен разобщения (деафферентации) известен давно, и если ранее основное внимание уделялось нарушению межкортикальных связей (мозолистое тело, межполушарные, внутриполушарные), то в последние годы наибольший интерес с точки зрения развития сосудистых когнитивных расстройств представляет субкортикально-таламо-кортикальная дезинтеграция, приводящая к сочетанию двигательных, когнитивных, эмоциональных и поведенческих расстройств.
Подкорковые структуры головного мозга являются наиболее чувствительными к хронической гипоперфузии, которая играет ключевую роль в развитии основных структурных и функциональных реакций, лежащих в основе патофизиологического и биологического звеньев патогенеза сосудистых когнитивных расстройств, основной мишенью которых является нейроваскулярная единица (НВЕ). Согласно современным данным, НВЕ представлена микроциркуляторным звеном (эндотелиальные клетки, базальная мембрана эндотелия, гладкомышечные клетки, перициты) и клеточно-нейрональным звеном (астроциты, олигодендроциты, нейроны) [18].
Концепция НВЕ подразумевает тесную связь и взаимодействие клеточных элементов головного мозга и цереброваскулярного русла как в обеспечении нормальной физиологической регуляции мозгового кровотока, так и в выработке координированной реакции в ответ на патологическое воздействие. Вазорегуляторная сигнальная система поддерживает перфузионное давление в относительно постоянных границах посредством различных механизмов, сгенерированных синаптической и глиальной активностью, включая работу ионных каналов, метаболизм арахидоновой кислоты, продукцию оксида азота, эндотелина (сосудосуживающий пептид) и простагландинов сосудистым эндотелием [19, 20]. Совместно эти сигнальные медиаторы координируют сосудистый тонус и нейроваскулярные связи, иммунный контроль и гемостаз в ответ на повреждение [21, 22]. Эндотелиальные клетки также играют важнейшую роль в обеспечении нормальной работы гематоэнцефалического барьера (ГЭБ), обеспечивая попадание в головной мозг необходимых веществ и выведение продуктов метаболизма, в частности β-амилоида. Эндотелиальная дисфункция, прогрессирующая с возрастом, играет важнейшую роль в патогенезе церебральной болезни малых сосудов.
Таким образом, в норме в ответ на активность нейронов происходит соответствующее увеличение перфузии с возможностью формирования в последующем новых функциональных связей с целью обеспечения должной энергетической поддержки мозговой деятельности. С другой стороны, поражение микроциркуляторного звена при патологии малых сосудов или нейродегенеративные процессы приводят к нарушению взаимодействия внутри НВЕ и к срыву функциональных и компенсаторных возможностей кровотока, при этом в наибольшей степени страдают наиболее энергетически активные структуры, в частности кора и подкорковые ганглии, а также связи между ними.
В свою очередь, нарушение функционирования НВЕ и гомеостаза запускает целый ряд патологических реакций, среди которых особое значение имеют нарушения метаболизма глюкозы, оксидантный стресс и нейровоспаление. Нарушение проницаемости ГЭБ также играет свою роль в поддержании воспалительно-окислительного стресса, так как белки комплемента и внутримозговой β-амилоид являются активаторами воспаления и продукции свободных радикалов. Таким образом, формируется порочный круг, когда воспалительный и окислительный стрессы, нарушения проницаемости ГЭБ усугубляют гипоксию мозговой ткани. В конечном итоге развивается диффузная нейронально-синаптическая дезактивация с селективной утратой нейронов и нейромедиаторным дефицитом.
В настоящее время с учетом современных возможностей терапии особое внимание уделяется повреждению именно нейромедиаторных систем, и в первую очередь холинергической и глутаматергической, что, помимо развития когнитивных нарушений, приводит к аффективным и поведенческим симптомам. Развитие нейропсихиатрической симптоматики также обусловлено поражением нейротрансмиттерных терминалей клеток, проецирующихся на неокортикальную кору: серотонинергических срединного шва и норадренергических голубоватого ядра [23, 24].
Основные клинико-патогенетические варианты сосудистых когнитивных нарушений
Установление различных вариантов возможно проводить на всех стадиях когнитивного дефицита, однако более объективно это можно сделать на стадии деменции. Для практического применения наиболее удобным является выделение основных вариантов сосудистой деменции с учетом особенностей морфологии и патогенеза их формирования. При этом основным критерием будет являться локализация очаговых и взаимосвязанных с ними функциональных нарушений структур мозга, отвечающих за обеспечение когнитивной деятельности.
Основные гипоперфузионно-постгипоксические варианты сосудистых когнитивных нарушений
-
Когнитивные нарушения в результате развития инфаркта в стратегически значимой зоне.
-
Когнитивные нарушения, связанные с поражением малых сосудов (субкортикальная артериолосклеротическая ишемическая энцефалопатия)
-
Смешанные сосудистые когнитивные нарушения (сочетание с нейродегенеративными заболеваниями).
-
Комбинированные сосудистые когнитивные нарушения (сочетание с актуальным соматическим, онкологическим, психическим заболеванием, метаболическими или посттравматическими нарушениями, способными вызвать когнитивные нарушения).
1. Мультиинфарктная деменция
Крупноочаговые инфаркты и большое количество небольших субкортикальных инфарктов имеют установленную связь с ухудшением когнитивного функционирования и риском развития деменции [25, 26]. В то же время взаимосвязь между объемом поврежденного мозгового вещества и выраженностью когнитивного дефицита не всегда является прямой и обязательной. Крупный единичный очаг корковой локализации может привести к менее выраженному клиническому проявлению, чем единичный стратегически локализованный субкортикальный инфаркт в сочетании с мелкими лакунарными очагами, вследствие повреждения ассоциативных межнейрональных путей [17, 27].
Таким образом, нет устойчивой корреляционной связи между общим объемом поврежденного мозгового вещества и степенью тяжести сосудистых когнитивных расстройств, что определяется разной функциональной значимостью областей головного мозга, влиянием сопутствующей нейродегенеративной патологии, наличием и сохранностью церебрального и когнитивного резервов [28].
2. Постинсультные когнитивные нарушения
Постинсультная деменция. Среди разнообразных неврологических симптомов, развивающихся после ОНМК, особое место занимают нарушения когнитивных функций, наличие которых оказывает выраженное негативное влияние на качество жизни пациентов и их родственников. Различные исследователи ранее показали, что частота постинсультной деменции колеблется от 25 до 41%, а в целом в течение 3 мес после инсульта когнитивные нарушения различного уровня регистрируются у 62% пациентов [5, 29]. По данным большого исследования GRECOG-VASC, распространенность постинсультных когнитивных нарушений составила 49,5%, большинство из которых соответствовали критериям умеренных когнитивных расстройств (39,1%); деменция отмечена у 10,4% пациентов [30].
Частота возникновения когнитивных нарушений зависит как от клинической картины, так и от тяжести инсульта. Установлена пошаговая ассоциация когнитивного снижения с тяжестью инсульта: в течение года после сосудистого события деменция развивается у трети пациентов с тяжелым инсультом (NIHSS [1] >10), у 8% с малым инсультом (NIHSS <3) и у 5% пациентов, перенесших транзиторную ишемическую атаку [7].
Не менее значимым для развития когнитивного снижения, хотя и менее частым, является кровоизлияние в вещество мозга [31, 32]. Как крупные внутримозговые кровоизлияния, так и множественные микрогеморрагии связаны с когнитивным снижением, которое может манифестировать как до, так и после геморрагического события. Лобарные кровоизлияния чаще связаны с церебральной амилоидной ангиопатией, в то время как глубинные микрокровоизлияния — с патологией малых сосудов [31, 33].
Определение временных причинно-следственных связей (развитие когнитивного дефицита в течение 6 мес после острого события) является обязательным для установления постинсультной деменции. Дополнительно необходимо ответить на вопрос: «можно ли объяснить тяжесть и паттерн когнитивной дисфункции локализацией и объемом постинсультного повреждения мозговой ткани?» В целом анализ данных литературы о закономерностях развития когнитивных нарушений позволяет сделать вывод, что определяющее значение имеют локализация повреждения, повторные случаи острых сосудистых событий и сопутствующие дегенеративные или цереброваскулярные изменения.
«Стратегическая» деменция. В основу концепции «стратегических» когнитивных расстройств легли многочисленные наблюдения развития выраженных нарушений при небольших по объему повреждениях, но локализованных в функционально значимых областях [26]. Согласно критериям NINDS-AIREN, наибольшее значение имеет следующая локализация пораженных сосудов и инфарктов: бассейн передних мозговых артерий (билатерально), парамедианных таламических артерий; нижняя медиальная височная кора, теменно-височные и теменно-затылочные ассоциативные области и угловая извилина, верхняя лобная и теменная кора доминантного полушария [34]. Однако данные критерии разработаны преимущественно для научных изысканий и для практической деятельности представляются неудобными и трудоемкими. Более рациональным является выделение классических «стратегических» областей, которые включают гиппокамп, таламус, угловую извилину и базальные ганглии [16, 35–37]. К другим стратегически важным областям относят хвостатое тело и бледный шар, базальные отделы лобных долей головного мозга, поясную извилину, передние отделы внутренней капсулы. В зависимости от локализации поражения предложено выделять следующие клинико-анатомо-функциональные варианты «стратегических» когнитивных расстройств: височный или гиппокампальный; таламический; подкорковый или базальный; корковый [11].
Болезнь малых (мелких) сосудов головного мозга является общим термином, который объединяет как нейровизуализационные, так и нейропатологические изменения, которые имеют отношение к малым сосудам (от 5 мкм до 2 мм) серого и белого вещества, включая артериолы, капилляры и венулы [38]. Предложено классифицировать болезнь малых (мелких) сосудов головного мозга по морфологическому признаку, выделяя амилоидную и неамилоидную микроангиопатию, и по генетическому признаку, выделяя спорадический и наследственный варианты заболевания. Объединительной является классификация, определяющая шесть подтипов:
Поражение малых сосудов — наиболее частая причина развития СКН, классическими радиологическими маркерами микроангиопатии являются лакунарные инфаркты в подкорковом белом и сером веществе и гиперинтенсивный сигнал от белого вещества перивентрикулярных и субкортикальных областей [41].
С расширением диагностических возможностей современных томографов в качестве дополнительных маркеров патологии малых сосудов стали рассматривать расширение периваскулярных пространств Вирхова–Робина, микрокровоизлияния и атрофические изменения [42, 43].
3. Наследственные ангиопатии с поражением малых сосудов
Наиболее частой и хорошо изученной наследственной ангиопатией является церебральная аутосомно-доминантная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией (англ. CADASIL). CADASIL — редкое наследственное заболевание, характеризуемое мутацией Notch3 гена 19-й хромосомы, при котором поражаются мелкие сосуды глубинных отделов белого вещества. Это приводит к диффузной лейкоэнцефалопатии, образованию множественных мелких инфарктов преимущественно в таламусе, базальных ганглиях, внутренней капсуле и мосту.
В последние годы описаны и другие гетерогенные наследственные артериопатии: связанные с мутациями в гене HTRA1 , ретинальная васкулопатия с церебральной лейкодистрофией и системными проявлениями (RVCL), связанная с мутациями в гене TREX1 , мутации генов COL4A1 – COL4A2 , в том числе понтинная аутосомно-доминантная микроангиопатия и лейкоэнцефалопатия (PADMAL), катепсин-связанная артериопатия с инсультами и лейкоэнцефалопатией (CARASIL), болезнь Фабри, митохондриальная энцефалопатия (MELAS) [44].
4. Васкулиты (ангииты) с поражением центральной нервной системы
Поражение сосудов малого калибра может быть обусловлено аутоиммунным и воспалительным процессами, представляя собой весьма гетерогенную группу заболеваний, паттерн клинических проявлений которых зависит от типа, размера и локализации пораженных сосудов и тяжести сопутствующих системных расстройств. Наиболее часто поражение малых сосудов развивается при гранулематозе Вегенера, синдроме Черджа–Стросс, узелковом полиартериите, реже при других заболеваниях (криоглобулинемическом васкулите, микроскопическом полиангиите, болезни Бехчета, саркоидозе, системных заболеваниях соединительной ткани) [45]. В ряде случаев не удается выявить признаки системного поражения и тогда правомерно проводить дифференциальную диагностику с идиопатическим изолированным ангиитом центральной нервной системы.
5. «Гипоперфузионные постгипоксические» когнитивные нарушения
Глобальное снижение мозговой перфузии и гипоксия вследствие транзиторной ишемии на фоне стенозов или окклюзии сонных артерий могут привести к развитию когнитивного дефицита даже при отсутствии значимых макроскопических повреждений головного мозга. В критериях NINDS-AIREN к гипоперфузионной деменции отнесен клинический вариант когнитивных нарушений, возникающий вследствие глобальной ишемии коры головного мозга при остановке сердечной деятельности или выраженной гипотензии.
6. Смешанные сосудисто-нейродегенеративные когнитивные нарушения
Смешанная деменция — это когнитивное снижение, достаточное для ухудшения независимого функционирования в повседневной жизни вследствие сосуществования и взаимного потенциирования болезни Альцгеймера (или другого нейродегенеративного заболевания) и цереброваскулярной патологии, подтвержденных клиническими и/или нейровизуализационными критериями [46, 47]. Цереброваскулярная болезнь и болезнь Альцгеймера формируют порочный круг, основными звеньями которого являются снижение реактивности сосудов микроциркуляторного русла, ишемия, нейрогенное воспаление, нарушение клиренса и накопления β-амилоида.
7. Комбинированные сосудистые когнитивные нарушения устанавливаются при подтверждении влияния актуальной соматической патологии на динамику и характер когнитивных нарушений при цереброваскулярном заболевании.
Клиническая картина
Когнитивные нарушения, возникающие вследствие цереброваскулярного процесса, весьма гетерогенны, что объясняется, с одной стороны, локализацией очагов поражения головного мозга, а с другой — различиями в особенностях формирования основных вариантов сосудистых когнитивных расстройств. В целом сосудистая деменция характеризуется «пятнистостью» когнитивного дефицита, непостоянным паттерном когнитивных расстройств, а также ступенеобразным прогрессированием или флюктуацией симптомов. Важнейшими особенностями сосудистых когнитивных расстройств у лиц пожилого и старческого возраста являются выраженный полиморфизм клинических проявлений и нередкое сочетание нескольких неврологических и нейропсихологических синдромов у одного больного [15].
С учетом особенностей патогенеза СКН наиболее характерными являются нейродинамические и дизрегуляторные нарушения, а мнестические функции страдают в меньшей степени. Снижается скорость когнитивной деятельности, больные испытывают трудности при множественных задачах, отвлекаемы, им трудно сосредоточиться на выполнении заданий, быстро устают и истощаются, не способны к устному счету. Больным трудно принять решение, спланировать поэтапное выполнение задания, осуществлять контроль промежуточного и конечного результатов, вносить соответствующие корректировки. Кроме того, нарушены способность к обобщению, абстрагированию, контроль поведения и торможение неадекватных паттернов поведения, возможности изменения поведения в соответствии с новыми условиями.
Нарушения памяти носят невыраженный характер, преимущественно отмечается нарушение кратковременной вербальной памяти при незначительном ухудшении семантической, зрительной памяти и отсроченного воспроизведения. Больной испытывает трудности, вспоминая недавние события, увеличивается зависимость от ведения списков, следования календарю, требуются напоминания или перечитывание.
Нарушения других высших корковых функций — речи, гнозиса, праксиса, мышления, возникают, как правило, на более поздних этапах формирования когнитивного дефицита и могут быть обусловлены как локализацией очага поражения в определенных зонах головного мозга, так и нарушением межнейрональных взаимоотношений при поражении глубинных отделов мозга.
Достаточно частыми и разнообразными по форме на разных стадиях сосудистого поражения головного мозга являются эмоционально-аффективные расстройства. Вначале они носят в основном признаки так называемых псевдоневротических нарушений и проявляются преимущественно субъективными симптомами. Характерными являются астения, быстрая утомляемость, тревожность, мнительность, депрессия, эмоциональная лабильность, рассеянность. На более выраженных стадиях появляются стойкие нарушения эмоциональной сферы, замедленность, ригидность психических процессов. Обнаруживаются характерологические особенности: многословность, вязкость, «застревание» на деталях, обидчивость и неуживчивость, раздражительность, склонность к конфликтам и слабодушие. Критика к своему состоянию снижается, больные перестают замечать свои дефекты и склонны к собственной переоценке. В последующем присоединяются поведенческие расстройства, оказывающие существенное влияние на качество жизни больного.
У пациентов с цереброваскулярными заболеваниями, наряду с нарушениями в когнитивной и эмоциональной сферах, в неврологическом статусе обязательно выявляют двигательные, чувствительные, координаторные и другие очаговые органические симптомы.
Диагностика
Диагностику СКН проводят согласно алгоритму, представленному в главе 4.
При сборе жалоб и анамнеза у пациента с подозрением на сосудистый генез когнитивных нарушений следует дополнительно уточнить характер развития и динамику когнитивных нарушений; при остром развитии уточнить состояние когнитивных функций и общее функциональное состояние до сосудистого события. Пациенты с СКН нередко не жалуются вовсе, либо таких жалоб слишком много, и среди них преобладают жалобы на забывчивость. Однако при обследовании удается установить, что нарушение памяти отнюдь не является доминирующим клиническим симптомом, в отличие от регуляторной дисфункции.
При объективном осмотре необходимо обращать внимание на выявление симптомов, свидетельствующих о наличии сопутствующих заболеваний и факторов риска, имеющих значение с позиции риска развития цереброваскулярного заболевания. Неврологический осмотр позволяет выявить симптомы, свидетельствующие об очаговом поражении головного мозга. Наиболее часто сосудистый когнитивный дефицит сочетается с псевдобульбарным синдромом, диспраксией ходьбы, пирамидной симптоматикой, больше выраженной в ногах, нарушением регуляции функции тазовых органов.
Подбор нейропсихологических методик для исследования когнитивных функций следует осуществлять таким образом, чтобы максимально полно охватывать все сферы познавательной деятельности. Наиболее информативными методиками для выявления сосудистых когнитивных расстройств являются тест слежения (Trail-making test), батарея лобной дисфункции, тест рисования часов, комплексный монреальский тест (MoCA-test), тест вербальных ассоциаций, символьно-цифровой тест, тест повторения цифр в прямом и обратном порядке, таблицы Шульте (см. главу 4, приложение).
Лабораторная диагностика сосудистых когнитивных нарушений
При лабораторной диагностике чаще выявляют изменения, связанные с риском развития цереброваскулярной патологии: анемию, дислпидемию, гипергликемию, гипергомоцистеинемию, нарушения свертывающей системы крови.
Инструментальная диагностика сосудистых когнитивных нарушений
Согласно любым современным диагностическим критериям, верификация сосудистых когнитивных расстройств невозможна без выполнения нейровизуализационных методов исследования. Вместе с тем значение имеют также и ультразвуковые методы диагностики, результаты которых могут быть достаточно специфичными.
Метод транскраниальной допплерографии позволяет оценивать скорость мозгового кровотока, церебральную вазомоторную реактивность, выявлять косвенные признаки окклюзирующего или стенозирующего процесса. Неинвазивность, простота и доступность метода обусловливают его широкое применение в клинической практике, однако чувствительность и специфичность допплерографии в диагностике СКН остаются недостаточно значимыми.
Использование дуплексного сканирования магистральных артерий позволяет выявлять деформации, прежде всего сонных и позвоночных артерий: перегибы, извитости, петли, которые при повышении артериального давления могут проявлять себя подобно стенозам, вызывая локальные нарушения гемодинамики в дистальном русле. Наиболее частая находка у пациентов с разными вариантами сосудистой деменции — атеросклеротические бляшки. В зависимости от размера обнаруженные атеросклеротические бляшки классифицируют на гемодинамически значимые со степенью стеноза просвета сосуда более 65–70% и на гемодинамически незначимые (или формирующие локальный гемодинамический сдвиг) — рис. 6-1 (см. цв. вклейку).
Для уточнения локализации и характера поражения церебральных сосудов используют МР-ангиографию или селективную церебральную ангиографию.
Пациентам с СКР может потребоваться проведение и других инструментальных обследований (ЭКГ, ЭхоКГ, мониторинг артериального давления и ЭКГ), направленных на выявление болезней сосудов и сердца (артериальная гипертензия, нарушения ритма, структурные изменения стенок, клапанного аппарата), лежащих в основе цереброваскулярного заболевания.
Методы структурной нейровизуализации
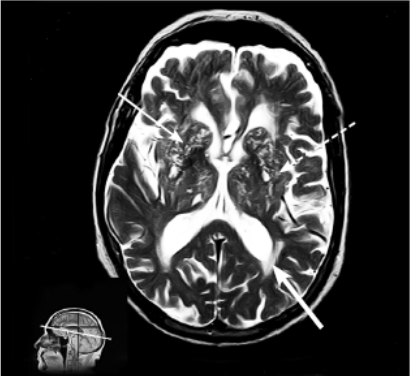
Нейровизуализационная картина при постинсультных вариантах характеризуется наличием множественных корковых или подкорковых ишемических очагов (мультиинфарктная деменция), или единичными крупными постишемическими очагами, или очагами, расположенными в областях мозга, наиболее значимых для мнестико-интеллектуальной деятельности, — так называемых стратегических зонах (таламус, базальные ганглии, медиобазальные отделы лобных долей билатерально, височных долей, угловая извилина, бледный шар) — рис. 6-2, 6-3.
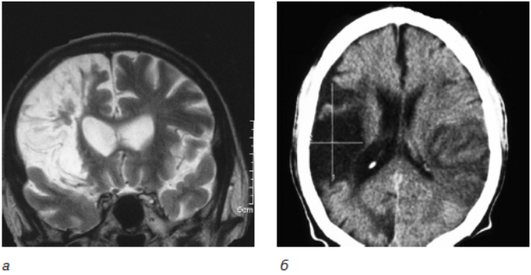
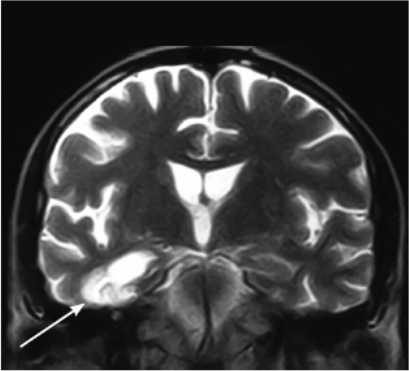
Однако наиболее частой причиной сосудистой деменции является поражение малых сосудов, приводящее к развитию распространенного лейкоареоза, часто сочетающегося с лакунарными инфарктами и постгеморрагическими мелкими очагами в подкорковой области (рис. 6-4).
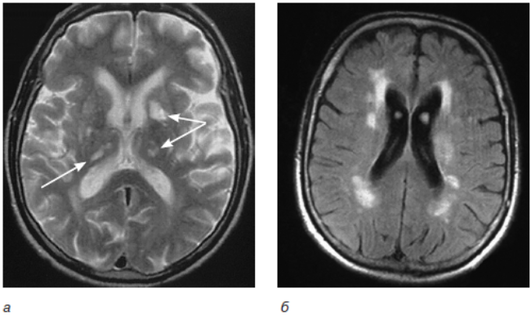
С помощью рейтинговой шкалы Fazekas оценивают повреждение белого вещества, при этом лучше использовать режим FLAIRF [2][48]. Для количественной оценки степени выраженности данного феномена используют визуальную шкалу от 0 до 3, где 0 — нет лейкоареоза; 1 — множественное точечное поражение; 2 — умеренный сливающийся лейкоареоз, 3 — тяжелый сливной лейкоареоз (рис. 6-5).
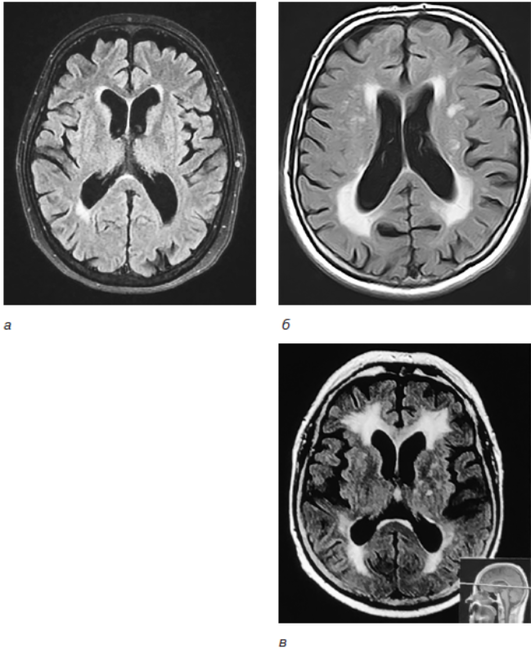
Дополнительными маркерами патологии малых сосудов являются расширение периваскулярных пространств Вирхова–Робина, микрокровоизлияния и атрофические изменения (рис. 6-6).
Магнитно-резонансная волюметрия
При сосудистой патологии мозга вследствие лакунарных повреждений подкоркового белого вещества могут вторично атрофироваться теменные и височные доли мозга. Выраженного снижения объемных показателей при цереброваскулярной болезни следует ожидать лишь на более поздних стадиях и рассматривать их как вторичные, то есть обусловленные присоединением нейродегенеративного процесса.
Магнитно-резонансная спектроскопия
Лишь в немногих исследованиях, посвященных оценке метаболизма при цереброваскулярной болезни, показано снижение NAA и соотношения NAA/Cr (креатин). При этом соотношение NAA/Cr у пациентов с сосудистой деменцией обычно существенно снижено в зоне подкоркового белого вещества, в поясной извилине.
Однофотонная эмиссионная компьютерная томография
Изменения перфузии при СКН носят разнообразный характер, что преимущественно определяется выраженностью и характером цереброваскулярных повреждений головного мозга. Наиболее характерными являются «мозаичное» снижение перфузии в проекции подкорковых образований, базальных и орбитофронтальных отделах лобной коры, выраженные очаговые зоны гипоперфузии при постинсультных вариантах (рис. 6-7, см. цв. вклейку).
Позитронно-эмиссионная томография
Можно выделить несколько паттернов метаболических нарушений у пациентов с сосудистыми когнитивными расстройствами:
-
1) крупные хорошо очерченные зоны резкого снижения метаболизма в корковых и подкорковых отделах головного мозга (рис. 6-8, см. цв. вклейку);
-
2) крупные хорошо очерченные зоны резкого снижения метаболизма, сочетающиеся с диффузным снижением метаболизма в коре;
-
3) множественные мелкоочаговые асимметричные зоны гипометаболизма в проекции базальных ганглиев, сочетающиеся с гипометаболизмом в коре головного мозга;
-
4) множественные мелкоочаговые асимметричные зоны гипометаболизма в проекции базальных ганглиев, сочетающиеся с гипометаболизмом в коре головного мозга, более всего в префронтальной лобной и теменной коре, а также в поясной извилине;
-
5) небольшие хорошо ограниченные зоны резкого снижения метаболизма в области таламуса, сочетающиеся с гомолатеральным снижением метаболизма лобной, височной и теменной коры [49].
В настоящее время продолжается изучение новых биомаркеров сосудистой патологии, в первую очередь связанных с оценкой функционального состояния белого вещества, гематоэнцефалического барьера, перфузии мозговой ткани. С этой целью применяются методики диффузионно-взвешенной и диффузионно-тензорной (трактография) МРТ, бесконтрастной магнитно-резонансной перфузии (методика спиновой маркировки артериальной крови (ASL-перфузия).
С помощью диффузионно-тензорных методик могут быть выявлены микроструктурные изменения белого вещества, значительно выходящие за границы изменений, выявляемых при использовании Т2- и FLAIR-режимов. Кроме того, можно оценивать количественные показатели, такие как коэффициент фракционной анизотропии, коэффициент диффузии и другие, создавать карты проводящих путей.
Диагностика
В качестве общих признаков, лежащих в основе диагноза СКН, должны быть установлены синдром когнитивных нарушений различной выраженности, цереброваскулярное заболевание, наличие временной и причинно-следственной связи между первыми двумя пунктами. Учитывая гетерогенность СКН как по степени тяжести, так и по клинико-патогенетическому варианту, необходим комплексный учет данных (табл. 6-1).
| Признак | Характеристики |
|---|---|
I. Этиологические факторы, способствующие развитию сосудистых когнитивных нарушений |
См. табл. 3-5 в главе 3 |
II. Изменения прецеребральных и церебральных сосудов |
|
III. Синдром когнитивных нарушений различной тяжести, приводящих к ухудшению качества жизни пациента независимо от влияния другой неврологической клинической картины |
|
IV. Клинические признаки поражения головного мозга |
|
V. Нейровизуализационные признаки цереброваскулярной патологии |
|
VI. Причинно-следственная связь когнитивных нарушений с цереброваскулярными заболеваниями |
1. Определенные сосудистые когнитивные нарушения Генетические мутации, связанные с развитием цереброваскулярной патологии (семейные формы). 2. Вероятные сосудистые когнитивные нарушения Доказанная причинно-следственная связь между наличием цереброваскулярной патологии и когнитивными нарушениями: а) явная временная связь между острым цереброваскулярным событием и началом когнитивных нарушений при отсутствии данных о постепенном прогрессировании когнитивного дефицита до или после события; б) явная связь между выраженностью и характером когнитивных нарушений с локализацией и тяжестью цереброваскулярных структурных и/или функциональных изменений; в) наличие убедительных клинических данных о ступенеобразном и/или флюктуирующем прогрессировании когнитивных нарушений, связанных с прогрессированием цереброваскулярной патологии. 3. Возможные сосудистые когнитивные нарушения: а) имеются клинические критерии при отсутствии возможности выполнить методы нейровизуализации; б) нет связи тяжести и паттерна когнитивных нарушений с локализацией и тяжестью цереброваскулярных структурных и/или функциональных изменений; в) имеются данные о другом нейродегенеративном заболевании или состоянии дополнительно к цереброваскулярным заболеваниям, которые могут влиять на когнитивные функции |
VII. Критерии, делающие диагноз сосудистых когнитивных нарушений маловероятным |
|
Примечание: КТ — компьютерная томография; МРТ — магнитно-резонансная томография; ОФЭКТ — однофотонная эмиссионная компьютерная томография; ПЭТ — позитронно-эмиссионная томография.
Для установления СКН необходимо обязательное соответствие критериям III–V при наличии I или II критериев. Применение критериев VI, VII повышает достоверность диагностики.
Профилактика и лечение
Профилактические мероприятия при цереброваскулярной патологии соответствуют задачам общей профилактики когнитивных нарушений (см. главу 4), еще большую значимость приобретают своевременное выявление и коррекция факторов риска.
Лечение сосудистых когнитивных расстройств представляет сложную задачу, зависит от тяжести и клинико-патогенетического варианта [16]. Основным направлением терапии СКН, так же, как и болезни Альцгеймера, в настоящее время является применение препаратов, обладающих модулирующим действием на холинергическую и глутаматергическую системы. ИХЭ на сегодняшний день являются основой базисной терапии сосудистой деменции на ранних стадиях, мемантин — препарат первого выбора при умеренной и тяжелой деменции, но может использоваться и на стадии легкой деменции в качестве монотерапии в случае непереносимости или неэффективности ИХЭ. На стадии умеренно тяжелой и тяжелой деменции целесообразна комбинация мемантина с ингибиторами ИХЭ. Препараты назначают по стандартной схеме.
Назначение антихолинэстеразных средств в качестве базисной терапии рекомендуют пациентам с сосудистой деменцией для коррекции когнитивного дефицита (уровень убедительности рекомендаций — B; уровень достоверности доказательств — 1 ) [50, 51].
Для коррекции когнитивного дефицита и улучшения общего функционирования пациентам с сосудистой деменцией рекомендуют назначение мемантина в качестве базисной терапии (уровень убедительности рекомендаций — В; уровень достоверности доказательств — 1) [50–52].
Кроме того, учитывая патогенез сосудистых когнитивных расстройств для клинического применения, обсуждаются различные лекарственные средства с вазоактивными, метаболическими и ноотропными свойствами, однако, несмотря на отдельные данные, свидетельствующие о положительном влиянии «сосудистых» препаратов на различные проявления когнитивных и функциональных нарушений, более критичный анализ этих данных не позволяет сделать однозначный вывод о целесообразности их использования в лечении пациентов с СКН [53].
Учитывая отдельные данные о положительном влиянии гинкго билоба экстракта стандартизованного Egb 761 при деменциях различного генеза, для уменьшения выраженности когнитивной дисфункции и улучшения повседневной активности пациентам с сосудистой деменцией рекомендуется назначение гинкго билоба экстракта стандартизованного Egb 761 в дозе 240 мг/сут (уровень убедительности рекомендаций — В; уровень достоверности доказательств — 1 ) [50]. Решение должно приниматься индивидуально.
В целом возможность применения вазоактивных и метаболических препаратов в качестве адъювантной терапии в лечении сосудистых когнитивных расстройств соответствует общим принципам, изложенных ранее (см. главу 4).
Список литературы
-
Gorelick P., Scuteri A., Black S., Decarli C. Vascular Contributions to Cognitive Impairment and Dementia: A Statement for Healthcare Professionals From the American Heart Association/American Stroke Association // Stroke. 2011. Vol. 42, N. 9. P. 2672–2713.
-
Wu Y.T., Fratiglioni L., Matthews F.E., Lobo A., Breteler M.M., Skoog I. et al. Dementia in western Europe: epidemiological evidence and implications for policy making // Lancet Neurol. 2016. N 15. P. 116–124.
-
Lobo A., Launer L., Fratiglioni L., Andersen K., Di Carlo A., Breteler M.M. et al. Prevalence of dementia and major subtypes in Europe: A collaborative study of population-based cohorts. Neurologic Diseases in the Elderly Research Group // Neurology. 2000. N 54 (11 Suppl 5). Р. S4–S9.
-
Ruitenberger A., Ott A., van Swieten J., Hofman A., Breteler M. Incidence of dementia: does gender make a difference? // Neurobiol. Aging. 2001. Vol. 22, N 4. P. 575–580.
-
Pohjasvaara T., Erkinjuntti T., Vataja R., Kaste M. Dementia three months after stroke: baseline frequency and effect of different definitions of dementia in the Helsinki Stroke Aging Memory Study (SAM) cohort // Stroke. 1997. Vol. 28, N 4. P. 785–792.
-
Román G. Vascular dementia: distinguishing characteristics, treatment, and prevention // J. Am. Geriatr. Soc. 2003. Vol. 51 (Suppl. Dementia). P. 296–304.
-
Pendlebury S., Rothwell P. Oxford Vascular Study. Incidence and prevalence of dementia associated with transient ischaemic attack and stroke: analysis of the population-based oxford vascular study // Lancet Neurol. 2019. Vol. 18. P. 248–258.
-
Vermeer S.E., Hollander M., van Dijk E.J., Hofman A., Koudstaal P.J., Breteler M.M.; Rotterdam Scan Study. Silent brain infarcts and white matter lesions increase stroke risk in the general population: the Rotterdam scan study // Stroke. 2003. Vol. 34, N 5. Р. 1126–1129.
-
Wentzel C., Rockwood K., MacKnight C., Hachinski V., Hogan D.B., Feldman H. et al. Progression of impairment in patients with vascular cognitive impairment without dementia // Neurology. 2001. N 57. P. 714–716.
-
Шмидт Е.В. Классификация сосудистых поражений головного и спинного мозга // Журнал невропатологии и психиатрии. 1985. Т. 85, № 9. С. 1281–1288.
-
Емелин А. Ю., Лобзин В.Ю., Воробьев С.В. Когнитивные нарушения : руководство для врачей Москва : МЕДпресс-информ, 2019. 416 с.
-
Gorelick P.B., Counts S.E., Nyenhuis D. Vascular cognitive impairment and dementia // Biochim. Biophys. Acta. 2016. Vol. 1862, N 5. P. 860–868.
-
Медведев А.В. Сосудистая деменция // Русский медицинский журнал. 1998. Т. 1, № 4. С. 20–23.
-
Tomlinson B.E., Blessed G., Roth M. Observations on the brains of demented people // J. Neurol. Sci. 1970. N 11. P. 205–242.
-
Яхно Н.Н., Захаров В.В. Когнитивные и эмоционально-аффективные нарушения при дисциркуляторной энцефалопатии // Русский медицинский журнал. 2002. Т. 10, № 12/13. С. 531–551.
-
Одинак М.М., Емелин А.Ю., Лобзин В.Ю. Нарушение когнитивных функ- ций при цереброваскулярной патологии. Санкт-Петербург : ВМедА, 2006. 158 с.
-
Desmond D.W. The neuropsychology of vascular cognitive impairment: is there a specific cognitive deficit? // J. Neurol. Sciences. 2004. N 226. P. 3–7.
-
Касаткин Д.С. Нейроваскулярная единица как точка приложения действия некоторых вазоактивных и нейропротективных препаратов // Журнал неврологии и психиатрии им. С.С. Корсакова. 2012. Т. 112, № 9. С. 103–107.
-
Воробьев С.В., Лобзин В.Ю., Емелин А.Ю. и др. Синаптическая дисфункция на ранних стадиях болезни Альцгеймера // Вестник неврологии, психиатрии и нейрохирургии. 2019. № 12. С. 25–32.
-
Kleinfeld D., Blinder P., Drew P.J., Driscoll J.D., Muller A., Tsai P.S. et al. A guide to delineate the logic of neurovascular signaling in the brain // Front. Neuroenerg. 2011. N 3. Art. 1.
-
Andresen J., Shafi N.I., Bryan R.M. Endothelial influences on cerebrovascular tone // J. Appl. Physiol. 2006. Vol. 100. P. 318–327.
-
Serrats J., Schiltz J.C., Garcia-Bueno B., van Rooijen N., Reyes T.M., Sawchenko P.E. et al. Dual roles for perivascular macrophages in immune-to-brain signaling // Neuron. 2010. Vol. 65. P. 94–106.
-
Васенина Е.Е., Ганькина О.А. Нейропсихиатрические нарушения при деменции: механизмы развития и подходы к коррекции // Журнал неврологии и психиатрии им. С.С. Корсакова. 2017. Т. 117, № 6. С. 58–65.
-
Li X., Hu N., Tan M., Yu J.T., Tan L. Behavioral and Psychological Symptoms in Alzheimer’s Disease // BioMed Research International. 2014. Art. ID 927804.
-
Hachinski V.C., Lassen N.A., Marshall J. Multi-infarct dementia. A case of mental deterioration in the elderly // Lancet. 1974. Vol. 2, N 7874. P. 207–210.
-
Skrobot O., O’Brien J., Black S., Chen C. The Vascular Impairment of Cognition Classification Consensus Study // Alzheimers Dement. 2017. Vol. 13, N 6. P. 624–633.
-
Jellinger K.A. Pathology and pathogenesis of vascular cognitive impairment — a critical update // Front Aging Neurosci. 2013. Vol. 5. Art. 17.
-
Schneider J.A., Wilson R.S., Cochran E.J., Bienias J.L., Arnold S.E., Evans D.A. et al. Relation of cerebral infarctions to dementia and cognitive function in older persons // Neurology. 2003. Vol. 60. P. 1082–1088.
-
Tatemichi T., Desmond D., Stern Y., Paik M., Sano M., Bagiella E. Cognitive impairment after stroke: frequency, patterns, and relationship to functional abilities // J. Neurol. Neurosurg. Psychiatry. 1994. Vol. 57, N 2. P. 202–207.
-
Barbay M., Taillia H., Nédélec-Ciceri C., Bompaire F., Bonnin C., Varvat J. et al. GRECOG–VASC Study Group. Prevalence of Poststroke Neurocognitive Disorders Using National Institute of Neurological Disorders and Stroke–Canadian Stroke Network, VASCOG Criteria (Vascular Behavioral and Cognitive Disorders), and Optimized Criteria of Cognitive Deficit // Stroke. 2018. Vol. 49, N 5. P. 1141–1147.
-
Moulin S., Labreuche J., Bombois S., Rossi C., Boulouis G., Hénon H. et al. Dementia risk after spontaneous intracerebral haemorrhage: a prospective cohort study // Lancet Neurol. 2016. Vol. 15, N 8. P. 820–829.
-
You S., Wang X., Lindley R.I., Robinson T., Anderson C.S., Cao Y. et al. Early cognitive impairment after intracerebral hemorrhage in the INTERACT1 study // Cerebrovasc Dis. 2017. Vol. 44, N (5–6). P. 320–324.
-
Benedictus M., Hochart A., Rossi C., Boulouis G., Hénon H., van der Flier W.M., Cordonnier C. Prognostic factors for cognitive decline after intracerebral hemorrhage // Stroke. 2015. Vol. 46, N 7. P. 2773–2778.
-
Roman G.C., Tatemichi T., Erkinjuntti T., Cummings J.L., Masdeu J.C., Garcia J.H. et al. Vascular dementia: diagnostic criteria for research studies. Report of the NINDS-AIREN International Workshop // Neurology. 1993. Vol. 43, N 2. P. 250–260.
-
Grysiewicz R., Gorelick P.B. Key neuroanatomical structures for post-stroke cognitive impairment // Curr. Neurol. Neurosci Rep. 2012. Vol. 12, N 6. P. 703–708.
-
Kumral E., Deveci E.E., Erdoğan C., Enüstün C. Isolated hippocampal infarcts: vascular and neuropsychological findings // J. Neurol. Sci. 2015. Vol. 356. P. 83–89.
-
Meguro K., Akanuma K., Ouchi Y., Meguro M., Nakamura K., Yamaguchi S. Vascular dementia with left thalamic infarction: neuropsychological and behavioral implications suggested by involvement of the thalamic nucleus and the remote effect on cerebral cortex. The Osaki-Tajiri project // Psychiatry Res. 2013. Vol. 213. P. 56–62.
-
Pantoni L. Cerebral small vessel disease: from pathogenesis and clinical characteristics to therapeutic challenges // Lancet Neurol. 2010. Vol. 9. P. 689–701.
-
Кулеш А.А., Дробаха В.Е., Шестаков В.В. Церебральная спорадическая неамилоидная микроангиопатия: патогенез, диагностика и особенности лечебной тактики // Неврология, нейропсихиатрия, психосоматика. 2018. T. 10, № 4. С. 13–22.
-
Peng D. Guideline for Cognitive Impairment of Cerebral Small Vessel Disease Writing Group // Aging. Med. (Milton). 2019. Vol. 2, N 2. P. 64–73.
-
Rosenberg G.A., Wallin A., Wardlaw J.M., Markus H.S., Montaner J., Wolfson L. et al. Consensus statement for diagnosis of subcortical small vessel disease // J. Cereb. Blood Flow Metab. 2016. Vol. 36, N 1. P. 6–25.
-
Литвиненко И.В., Емелин А.Ю., Лобзин В.Ю., Колмакова К.А. Нейровизуализационные методы диагностики болезни Альцгеймера и цереброваскулярных заболеваний, сопровождающихся когнитивными нарушениями // Неврология, нейропсихиатрия, психосоматика. 2019. Т. 11, № 3. С. 18–25.
-
Wardlaw J.M., Smith E.E., Biessels G.J. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration: a united approach // Lancet Neurol. 2013. Vol. 12, N 8. P. 822–838.
-
Mancuso M., Arnold M., Bersano A. Monogenic cerebral small–vessel diseases: diagnosis and therapy. Consensus recommendations of the European Academy of Neurology // Eur. J. Neurol. 2020. Vol. 27, N 6. P. 909–927.
-
Пизова Н.В. Первичные системные васкулиты и поражение центральной нервной системы // Журнал неврологии и психиатрии. 2014. № 3. С. 98–102.
-
Дамулин И.В. Значение сосудистых нарушений в патогенезе болезни Альцгеймера у пожилых // Лечащий врач. 2002. № 12. С. 72–76.
-
Langa K., Foster N., Larson E. Mixed dementia emerging concepts and therapeutic implications // JAMA. 2004. Vol. 292, N 23. P. 2901–2908.
-
Fazekas F., Kleinert R., Offenbacher H., Schmidt R., Kleinert G., Payer F. et al. Pathologic correlates of incidental MRI white matter signal hyperintensities // Neurology. 1993. N 43. P. 1683–1689.
-
Емелин, А.Ю., Одинак М.М., Труфанов Г.Е. и др. Возможности позитронной эмиссионной компьютерной томографии в дифференциальной диагностике деменций // Вестник Российской Военно-медицинской академии. 2010. № 4 (32). С. 46–51.
-
Ткачева О.Н., Яхно Н.Н., Незнанов Н.Г. и др. Клинические рекомендации «Когнитивные расстройства у лиц пожилого и старческого возраста» (утв. Минздравом России). Москва : Министерство здравоохранения Российской Федерации, 2021. 272 с.
-
Kavirajan H., Schneider L.S. Efficacy and adverse effects of cholinesterase inhibitors and memantine in vascular dementia: a meta-analysis of randomised controlled trials // Lancet Neurol. 2007. Vol. 6, N 9. P.782–792.
-
Jin B.R., Liu H.Y. Comparative efficacy and safety of cognitive enhancers for treating vascular cognitive impairment: systematic review and Bayesian network meta-analysis // Neural. Regen. Res. 2019. Vol. 14, N 5. P. 805–816.
-
Емелин А.Ю., Лобзин В.Ю. Возможности медикаментозной терапии сосудистых когнитивных нарушений: критический взгляд и возможные компромиссы // Неврология, нейропсихиатрия, психосоматика. 2020. Т. 12, №. 4. С. 131–136.