Инсульт и цереброваскулярная патология у детей и подростков : руководство для врачей / под ред. И. О. Щедеркиной. - Москва : ГЭОТАР-Медиа, 2023. - 448 с. - ISBN 978-5-9704-7236-1. |
Аннотация
В книге описаны современное состояние проблемы инсульта и цереброваскулярных заболеваний у детей и подростков, накопленный опыт диагностики и подходов к терапии данной патологии в различных клиниках. Особое внимание уделено этиологическим факторам, приводящим к поражению сосудов головного мозга в педиатрии, что определяет подходы к терапии в острейшем периоде, а также оценке рисков рецидива и вторичной профилактике. Представленный опыт первого в России центра по лечению цереброваскулярной патологии у детей позволяет оценить распространенность детского инсульта в России, стандартизировать подходы к диагностике и лечению инсультов у детей с последующей оценкой наиболее эффективных методов терапии. Накопленные данные показывают, что более результативным является не мультидисциплинарный подход при ведении пациентов с цереброваскулярной патологией, а создание команды специалистов, подготовленных к решению данной проблемы.
Издание предназначено врачам различных педиатрических специальностей, студентам старших курсов медицинских вузов.
5.1. ЛУЧЕВАЯ ДИАГНОСТИКА ОСТРЫХ НАРУШЕНИЙ МОЗГОВОГО КРОВООБРАЩЕНИЯ У ДЕТЕЙ И ПОДРОСТКОВ
Е.В. Селиверстова, А.В. Горбунов
Инсульт подразделяют на ишемический (ИИ) и геморрагический (ΓИ), выделяют также венозный инфаркт (ВИ) вследствие синустромбоза. У детей с подозрением на ОНМК должны быть проведены срочные МРТ или КТ-исследования (Liu A.C., 2006).
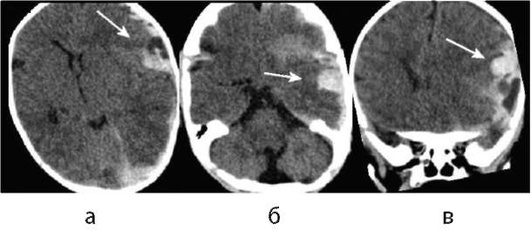
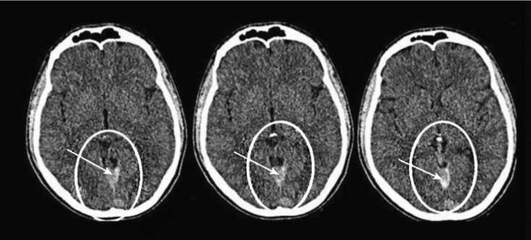
При наличии в учреждении мультиспирального компьютерного томографа, необходимо проведение бесконтрастной КТ для исключения или подтверждения геморрагического инсульта, для подтверждения патологии сосудистого русла рекомендовано проведение КТ-ангиографии. Γеморрагический инсульт может быть спонтанным субарахноидальным, паренхиматозным, интравен-трикулярным, субдуральным и эпидуральным или сочетать эти формы кровоизлияний. Оболочечное кровоизлияние на примере субдурально-субарахноидального представлено на рис. 5-1. В большинстве исследований субдуральные и эпидуральные кровоизлияния не рассматриваются в качестве ΓИ. Ввиду большой лучевой нагрузки проводить КТ-перфузию у детей не рекомендуется, КТ должна быть проведена с учетом оптимизации минимальной дозы облучения, качества снимков, протокол обследования должен быть оптимизирован по возрастным размерам головы ребенка (по Mathews J.D. et al., 2013).
При наличии в учреждении магнитно-резонансного томографа необходимо включить в стандартный протокол (режимы Т2 ВИ, Т1 ВИ, FLAIR/T2dark-flшd-T2d-f/FLAIR→Т2-ВИ с подавлением сигнала от свободной жидкости) и начать исследование с диф-фузионно-взвешенной МРТ (ДВИ - диффузионно-взвешенные изображения) - отражающее процесс диффузии свободной воды в тканях, для выявления «ядра» инфаркта, затем для исключения или подтверждения геморрагического инсульта необходимо использовать импульсную последовательность, чувствительную к крови - Т2* градиентное эхо или SWI (или SWAN - чувствительно взвешенное изображение) - изображения, взвешенные по магнитной восприимчивости. Целесообразно включить в протокол сканирования бесконтрастную МР-ангиографию для выявления уровня окклюзии сосуда и по окончании исследования - МРТ-перфузию контрастную или бесконтрастную для выявления ядра инфаркта и потенциально жизнеспособной зоны вещества (пенумбры) головного мозга (что особенно важно в остром периоде инсульта и при планировании проведения тром-болизиса). Проведение МРТ-перфузии в диагностике геморрагического инсульта не целесообразно, так как результаты перфузии отражают изменения в головном мозге, характерные для ишемического поражения.
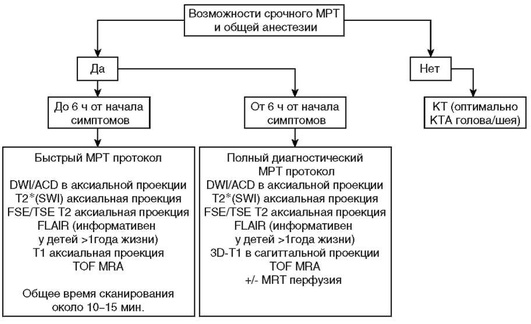
МРТ-исследование (протокол представлен в табл. 5-1) может быть проведено в диагностике ОНМК у детей при отсутствии противопоказаний (стандартные противопоказания к МРТ-исследованию: абсолютные и относительные), в том числе к анестезиологическому пособию. Для проведения МРТ головного мозга и точности диагностики рекомендуется наличие МР-томографа с величиной магнитной индукции не менее 1-1,5 Тл. (или способного сканировать в указанных выше режимах). Наличие соответствующей катушки для исследования головного мозга, при необходимости шприца-инъектора, магнитконтрастных препаратов для в/в введения и расходных материалов.
| Режимы сканирования | |
|---|---|
DWI (ДВИ) |
режим диффузионно-взвешенных изображений, b-фактор, измеряющий степень диффузионного взвешивания, не менее 800-1000 с/мм2 (Kwee T.C. et al.) |
T2* или SWI/SWAN |
импульсные последовательности, чувствительные к компонентам крови, - Т2* градиентное эхо или изображения, взвешенные по магнитной восприимчивости (SWI/SWAN) |
Т1 ВИ |
время продольной релаксации с короткими временами time repetition (TR) и time Echo (TE) |
Т2 ВИ |
время поперечной релаксации с длинными временами TR и TE |
FLAIR/T2d-f |
режим с подавлением сигнала от свободной жидкости в тканях |
3D TOF ангиография |
время-пролетная бесконтрастная ангиография |
МРТ перфузия |
градиентное эхо T2*-GRE последовательность для выявления ядра инфаркта и потенциально жизнеспособной зоны вещества головного мозга |
МРТ и КТ адекватно чувствительны в диагностике интрапа-ренхиматозной крови. Когда МРТ дает возможность выявить сосудистые мальформации без радиологической нагрузки, КТ может иметь преимущества, когда ребенок нуждается в срочной нейрохирургической операции.
При наличии кровоизлияния по данным бесконтрастной КТ, в зависимости от сроков проведения исследования, необходимо выполнить тот или иной вид ангиографического исследования. Если срок от начала заболевания не превышает 14 сут, то предпочтительнее применять МР-ангиографию, так как в эти сроки гематома на КТ имеет повышенную плотность и может помешать адекватной диагностике сосудистой системы в области кровоизлияния. В сроки после 14 сут, напротив, необходимо использовать КТ-ангиографию, так как в эти сроки плотность гематомы на КТ понижается, а на МРТ внеклеточный метгемоглобин, преобладающий в этот период, не позволяет адекватно визуализировать сосудистое русло.
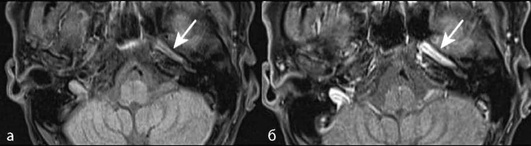
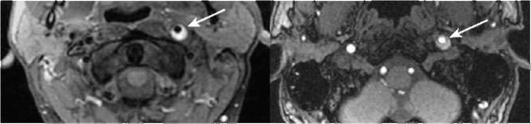
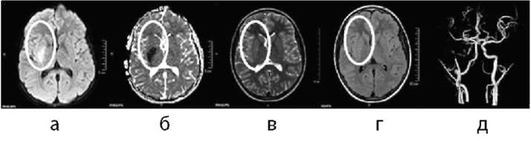
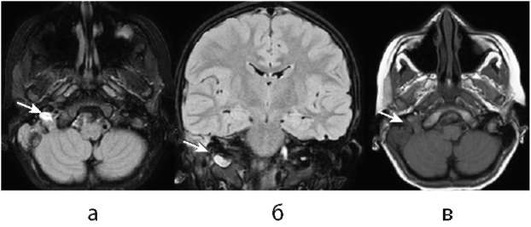
Исследования для исключения артериопатий могут включать дополнительные программы для исследования стенок интракра-ниальных сосудов: аксиальные/коронарные пре- и постконтрастные Т1 ВИ при подозрении на васкулиты (рис. 5-2) или Т1 fat sat режимы при подозрении на диссекцию - для исключения/подтверждения интрамуральных гематом (рис. 5-3).
В остром периоде геморрагического инсульта (≤14 дней) предпочтительнее проводить МР-ангиографию (рис. 5-4), так как в эти сроки гематома на КТ (рис. 5-5, 5-6) имеет повышенную плотность и может помешать адекватной диагностике сосудистой системы при компьютерной ангиографии в области кровоизлияния. Для определения тактики ведения пациентов с кровоизлиянием в головной мозг необходимо измерять объем гематомы.
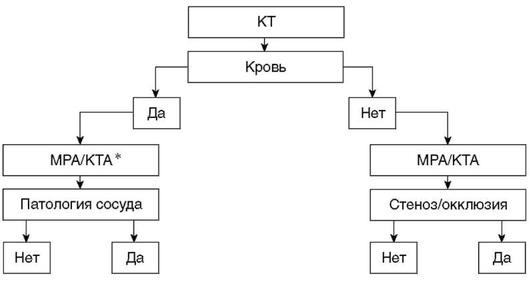
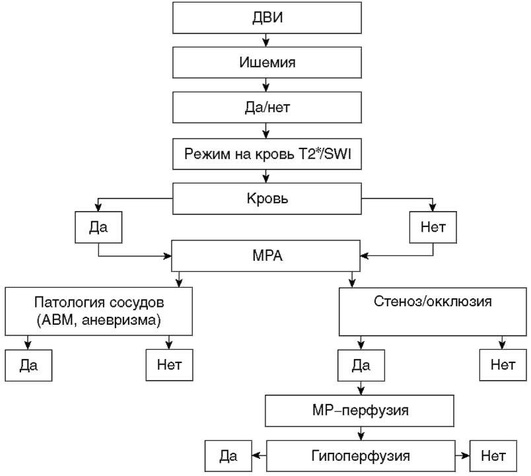
Алгоритм обследования пациентов с венозным инфарктом не отличается от стандартного КТ или МРТ протокола исследования (табл. 5-1). При венозном инфаркте необходимо включить в исследование КТили МР-веносинусографию для подтверждения тромбоза синуса.
Компьютерная томография при ишемическом инсульте головного мозга
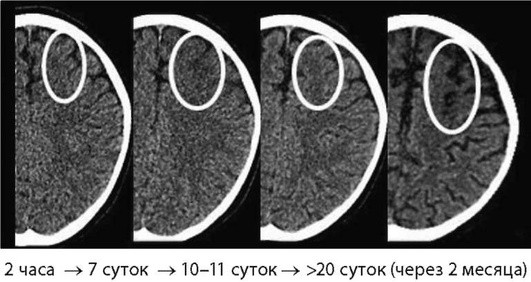
«Острым» периодом инфаркта принято считать временной интервал ишемического инсульта от 0 до 21 сут. В своевременной и точной диагностике определения характера инсультов неоценимую помощь оказывает использование разнообразных методов нейровизуализации (табл. 5-2). Наибольший опыт применения имеет компьютерная томография (КТ) головного мозга. КТ головного мозга позволяет подтвердить диагноз инфаркта, исключить геморрагический характер инсульта, определить характер, локализацию и величину очага поражения. В эволюции инфарктов, по данным КТ (Верещагин Н.В. и др., 1986) выделяют четыре основных стадии, отражающие определенные комплексы структурных изменений в очаге ишемии (см. рис. 5-4), которые проявляются изменением измеряемого коэффициента плотности (Кп) в единицах Хаунсфилда (ед.Х) - табл. 5-2.
Учитывая, что КП в первые часы после инфаркта мозга не меняется и в очаге поражения остается в пределах нормальных значений, для постановки диагноза, по данным КТ, следует руководствоваться ранними косвенными признаками инфаркта, которые могут способствовать в определении показаний и противопоказаний к тромболизису.
Ранние косвенные признаки инфаркта:
-
снижение контрастности между серым и белым веществом головного мозга на определенном участке, соответствующем сосудистому бассейну - признаки возникновения внутриклеточного отека без выраженного изменения КП;
-
сглаженность субарахноидального пространства, нечеткость границ извилин и борозд, в бассейне внутренней сонной артерии (ВСА) - утрата ребристой поверхности островка - признаки нарастания объема внутриклеточной жидкости;
| Стадии | Патоморфологические изменения | Показатели коэффициента плотности (КП) в ед.Х в зоне ИИ | |
|---|---|---|---|
Первая: изоденсивная (первые несколько часов, до суток) |
Нет четких признаков наличия инфаркта, начало внутриклеточного отека |
КП в пределах значений нормы Недоношенные дети:
2-15 лет - сопоставимо взрослым:
|
|
Вторая: гиподен-сивная [2-8 (9) сут] |
2-5 сут |
Нарастание процессов ишемии, некроза, отека (цитотоксического, вазогенного). Возможный масс-эффект |
КП снижен и для серого, и для белого вещества |
5-8 сут |
Реактивный неовазогенез |
КП: серое вещество - изменен до изоденсивных или слабо повышенных значений - «эффект затуманивания», белого вещества - снижен |
|
Третья: стадия организации [8 (9)-14 сут] |
Прогрессируемое увеличение макрофагов с нейтральными липидами, уменьшение отечных изменений |
КП - изоденсивное состояние зоны инфаркта. «эффект затуманивания» сохранен |
|
Активный неовазогенез |
При введении контрастного вещества определяется его накопление в зоне инфаркта |
||
Четвертая: гиподенсивная (с 18-20-х суток) |
Увеличение количества нейтральных липидов, массивные скопления зернистых шаров |
Снижение «эффекта затуманивания». Постепенное выравнивание значений КП серого вещества к белому до пониженных значений относительно нормы |
Формирование постинфарктной кисты |
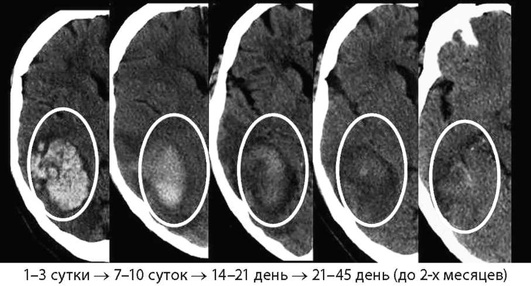
КТ при геморрагическом инсульте головного мозга. Основным КТ-признаком кровоизлияния в головной мозг при ГИ в первые часы-дни нарушения кровообращения является наличие очага повышенной плотности округлой или неправильной формы, часто с неровными границами (табл. 5-3). В подавляющем большинстве случаев гематома окружена зоной пониженной плотности, соответствующей перифокальным изменениям в веществе мозга. По объему паренхиматозные кровоизлияния подразделяют на малые, средние и большие. Условными границами разделения является объем гематомы 35-40 см3 между малыми и средними, 65-75 см3 между средними и большими гематомами. По данным КТ (Верещагин Н.В. и др.) выделяют три стадии организации внутримозгового кровоизлияния (ВМК); как правило, после 2 мес отмечается формирование постгеморрагической псевдокисты; сроки перехода из одной стадии в другую зависят от первоначального объема гематомы (см. табл. 5-3), см. рис. 5-5.
| Стадии | Патоморфологические изменения | Показатели коэффициента плотности (КП) в ед.Х в зоне ГИ | |
|---|---|---|---|
Гиперденсивная |
1 сут, до недели |
Повышение концентрации гемоглобина, возрастание гематокрита |
КП повышенных значений, ≥60- 80 ед.Х. Гомогенное гиперденсивное образование. Возможно возникновение масс-эффекта |
с 7-10 сут до 2-3 нед |
Образование сгустков крови. КП зависят от концентрации гемоглобина, величины гемато-крита. Перифокальное понижение КТ плотности обусловлены отеком и некрозом, прилегающих к кровоизлиянию участков вещества мозга |
Снижение гиперденсивных значений КП от периферии к центру - феномен «тающего кусочка сахара». КП в пределах 60-85-88 ед.Х |
|
Изоденсивная (с 2-3 нед для малых кровоизлияний, для средних и больших кровоизлияний - сроки вариабельны) |
Гемолиз эритроцитов, распад липопротеиновых комплексов, появление макрофагов с остатками эритроцитов и липидов |
КП приближается к показателям нормальных значений |
|
Гиподенсивная (для разных объемов гематомы - разные сроки) |
Через 1-1,5 мес |
Процесс организации ВМК, неовазогенез в «капсуле» гематомы |
КП снижен относительно значений нормы. Размеры гематомы прежние, наличие масс-эффекта |
Более 2 мес |
Формирование постгеморрагической псевдокисты, стенки которой состоят из сосудов, соединительно-тканных волокон, макрофагов и гемосидерина |
КП приближен к ликворной плотности. Уменьшение размеров ВМК, отсутствие объемного воздействия |
|
При любом виде инсульта всегда развивается отек мозга. Отек головного мозга определяется как состояние избыточного накопления жидкости в веществе мозга. Накопление жидкости может быть внутриклеточным, внеклеточным или комбинированным. Существуют два основные типа отека головного мозга. Вазогенный отек - первичный дефект локализуется в гематоэн-цефалическом барьере и приводит к накоплению жидкости преимущественно во внеклеточном пространстве. Внутриклеточный отек - это состояние, при котором первичное повреждение и накопление жидкости происходит в нейронах или глиальных клетках, что характерно для ишемического повреждения головного мозга (цитотоксический тип - частный вариант внутриклеточного отека).
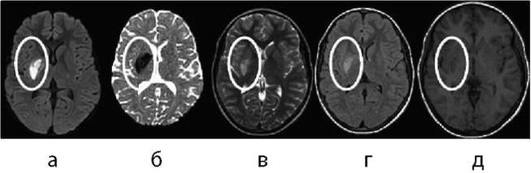
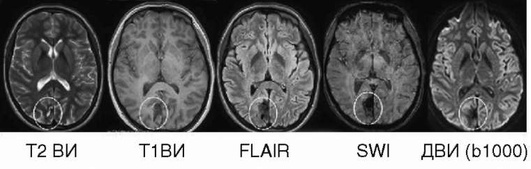
МРТ в диагностике ОНМК по ишемическому типу. Одним из наиболее информативных среди современных методов нейровизуализации является метод МРТ-диагностики. Наиболее достоверным критерием в диагностике острого ИИ по стандартным режимам является изменение интенсивности МР-сигнала от вещества мозга, обнаруживаемое спустя 4-6 ч (примеры стадий ИИ, по данным МРТ представлены на рис. 5-6 - 5-9). По диффузион-но-взвешенным изображениям наличие «острого» ишемического очага можно определить от 0 часов после развития клинической неврологической симптоматики (см. рис. 5-6). При диффузионно-взвешенным изображениям (ДВИ, DWI) визуализируется Броуновское «беспорядочное» движение молекул воды в тканях. Процесс диффузии свободной воды в тканях влияет на амплитуду МР-сигнала в импульсной последовательности спиновое эхо; чем выше коэффициент диффузии (b-0, b-500, b-1000 и т.д.), тем вы-раженнее ослабление измеряемого МР-сигнала (Hahn E.L., 1950). Измеряемый коэффициент диффузии (измеряемый коэффициент диффузии (ИКД или ADC)) является количественной характеристикой диффузии и обратно пропорционален интенсивности (амплитуде) МР-сигнала на диффузно-взвешенных-изображениях (ДВ-изображениях). Сигнальные характеристики ДВИ и Т2 ВИ на разных стадиях ИИ представлены в табл. 5-4.
Основные характеристики ишемических инсультов головного мозга в стандартных режимах МРТ представлены в табл. 5-5.
Временной интервал |
Интенсивность сигнала |
||
|---|---|---|---|
Т2-ВИ |
ДВИ (b=1000) |
ИКД |
|
0-6 ч |
нормальная |
повышенная |
пониженная |
6-48 ч |
от нормальной до повышенной |
повышенная |
пониженная |
3-7 сут |
повышенная |
повышенная |
В зависимости от величины инфаркта, от гетерогенной с участками пониженной и изоинтенсив-ной до повышенной |
7-21 сут |
повышенная |
от повышенной до пониженной |
|
>3-4 нед |
повышенная |
пониженная |
повышенная |
| Стадия | Характеристики инфарктов в стандартных режимах МРТ |
|---|---|
Острая (острейшая) (0-6 ч) |
Отсутствуют четкие признаки инфаркта. Т2 ВИ - уменьшение объема субарахноидального пространства на уровне инфаркта. Т1 ВИ - патологии не отмечается. Т2d-f/FLAIR - может наблюдаться повышенный сигнал от окклюзированной артерии. Т2*/SWI/SWAN - чувствителен к наличию крови |
Острая (6-48 ч) |
Т2 ВИ и Т2d-f/FLAIR - повышение сигнала от очага ишемии, сглаживание борозд. Т2 ВИ - субкортикально может наблюдаться понижение сигнала. Т1 ВИ - слабое понижение сигнала. Т2*/SWI/SWAN - возможно появление петехиаль-ных кровоизлияний вдоль извилин |
Подострая (2 сут-3 нед) |
Т2 ВИ и Т2d-f/FLAIR - повышение сигнала от очага ишемии, вдоль извилин (гирально), сглаживание борозд, нарастание масс-эффекта. Т1 ВИ - зона ИИ пониженного сигнала, петехиаль-ные кровоизлияния по Т1 ВИ повышенного сигнала (вдоль извилин) |
Хроническая (≥4 нед) |
Формирование кистозно-глиозных изменений. Т2 ВИ - повышение сигнала от зоны глиоза, окружающей гиперинтенсивную зону ИИ. Т1 ВИ - снижение сигнала от постинфарктной полости. Т2d-f/FLAIR - снижение сигнала от постинфарктной полости по мере ее формирования. Т2*/SWI/SWAN - снижение сигнала от гемосидерина, как конечной формы гемоглобина. Уменьшение инфаркта в объеме, отрицательный масс-эффект |
МРТ в диагностике ОНМК по геморрагическому типу.
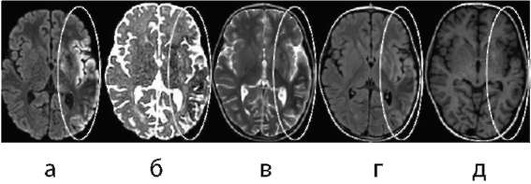
Интенсивность МР-сигнала от гематомы на ДВИ и ИКД-картах меняется в зависимости от стадии развития гематомы и менее специфична, чем при ИИ. МРТ-режимами для диагностики ГИ являются Т2*-градиентное эхо или SWI/SWAN режимы, позволяющие с высокой чувствительностью и специфичностью визуализировать наличие крови во все сроки проведения исследования и должны обязательно быть включены в МРТ-протокол обследования больных с ОНМК. Стандартные (Т2/Т1 ВИ) режимы исследования обладают наибольшими чувствительностью и специфичностью в более поздние сроки заболевания (подострый период), примеры интрапаренхиматозных гематом на разных сроках организации показаны на рис. 5-10 - 5-14 и табл. 5-6.
Визуализация геморрагического инсульта головного мозга в стандартных режимах магнитно-резонансной томографии
Острейшая стадия геморрагического инсульта (до 24 ч от начала заболевания) по данным МРТ характеризуется изоинтенсивным в Т1-ВИ сигналом, слабым повышением интенсивности МР-сигнала с участками пониженного в режимах Т2-ВИ, FLAIR и ДВИ, пониженного - в SWI. Имеются признаки объемного воздействия на прилежащие структуры головного мозга. Острая стадия ГИ по данным МРТ (2-3 сут от начала заболевания) характеризуется гипоинтенсивным МР-сигналом в режимах SWI, Т2-ВИ, FLAIR и ДВИ (см. рис. 5-13), что обусловлено преобладанием парамагнетика - дезоксигемоглобина, который благодаря эффекту магнитной чувствительности имеет «темный цвет» в большинстве используемых режимах в этот период организации ГИ. Особенно это проявляется в импульсной последовательности, чувствительной к компонентам крови (SWI или градиентное эхо Т2* GE (gradient Echo)). Зона перифокальных изменений, окружающая ГИ, имеет гиперинтенсивный МР-сигнал в режимах Т2-ВИ и FLAIR (см. рис. 5-14).
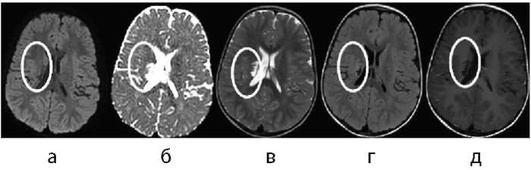
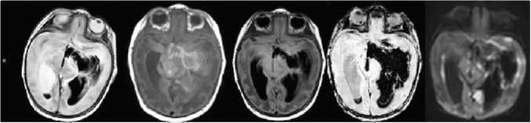
В раннюю подострую стадию ГИ происходит гидроксилиро-вание дезоксигемоглобина в метгемоглобин, который находится внутри интактных эритроцитов (стадия внутриклеточного метге-моглобина) и, как парамагнитное вещество, генерирует локальные градиенты магнитного поля, что сохраняет эффект укорочения времени Т2, подобный тому, который вызывается дезоксигемоглобином. Поэтому внутриклеточный метгемоглобин имеет гипоинтенсивный МР-сигнал на SWI/Т2*-ВИ, Т2-ВИ, FLAIR и ДВИ. В то же время конформационные изменения в молекулах гемоглобина приводят к укорочению времени Т1, при которой метгемоглобин визуализируется гиперинтенсивным сигналом на Т1 (см. рис. 5-14).
Стадия |
Гемоглобин |
Интенсивность сигнала в режимах МРТ |
||||
|---|---|---|---|---|---|---|
Т2 ВИ |
Т1 ВИ |
T2df/FLAIR |
Т2*/SWI/ SWAN |
|||
Острая <24 ч |
окси-Hgb |
слабо повышенная |
изоинтенсивная |
слабо повышенная |
пониженная по периферии |
|
Острая 1-3 сут |
дезокси-Hgb |
сильно пониженная |
слабо пониженная |
сильно пониженная |
сильно пониженная |
|
Подострая ранняя 3-7 сут |
метHgb |
от пониженной-до повышенной |
от пониженной до повышенной |
от пониженной до повышенной |
пониженная |
|
Подострая поздняя 7-21 сут |
сильно повышенная |
сильно повышенная |
сильно повышенная |
повышенная, с гипоин-тенсивным ободком |
||
Хроническая >21 сут |
центр |
от мет-Hgb до ликвора |
сильно повышенная |
от повышенной к пониженной |
сильно повышенная |
повышенная |
периферия |
гемосидерин |
слабо/ сильно пониженная |
слабо повышенная |
от слабо до сильно пониженной |
пониженная |
|
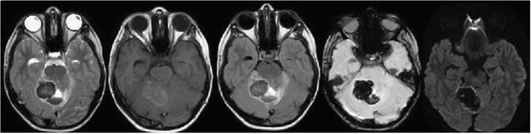
В позднюю подострую стадию наблюдается гиперинтенсивный МР-сигнал от гематомы во всех используемых режимах (рис. 5-15), что обусловлено преобладанием сильнейшего парамагнетика - внеклеточной формы метгемоглобина. Зона перифокальных изменений, окружающая ГИ, имеет также гиперинтенсивный МР-сигнал в режимах Т2-ВИ и FLAIR. К моменту наступления этого периода организации ГИ объем зоны перифокальных изменений является максимальным, в дальнейшем происходит его уменьшение.
Период организации гематомы характеризуется появлением конечных форм распада гемоглобина - гемосидерина и феррити-на. Гемосидерин тоже является сильным парамагнетиком и влияет на укорочение времени Т2, что проявляется гипоинтенсивным сигналом по периферии гематомы в режимах Т2-ВИ и FLAIR и, на SWI/Т2*-ВИ. Центральная часть ГИ имеет гиперинтенсивный сигнал во всех режимах (внеклеточный метгемоглобин) до его полной утилизации сидерофагами (макрофагами) - до 6-9 мес с формированием постгеморрагической псевдокисты (рис. 5-16).
Геморрагическая трансформация при ИИ - по типу пропитывания и кровоизлияния может развиваться спонтанно либо являться осложнением тромболитической терапии, на МРТ выглядят пониженным МР-сигналом на Т2, Т2* или SWI/SWAN, Т2d-F/FLAIR и повышенным по Т1.
Внутрижелудочковые кровоизлияния. Среди геморрагических инсультов одним из наиболее часто встречающимся перинатальным поражением головного мозга (ГМ) являются внутриже-лудочковые кровоизлияния (ВЖК), которые очень свойственны именно периоду новорожденности, особенно у недоношенных детей, и часто сопровождают патологическое течение родов. При формулировке стадий учитываются особенности топографии поражения. Причины развития ВЖК у маленьких детей кардинально отличаются от тех, которые вызывают кровоизлияния у взрослых лиц. У новорожденных кровоизлияние сразу происходит внутрь желудочков либо под их выстилку, а причины связаны с беременностью и родами, среди которых состояние недоношенности; длительный безводный период; тяжелая гипоксия в родах; травмы при акушерских пособиях (редко); вес при рождении менее 1000 г; врожденные нарушения свертывания крови и строения сосудов.
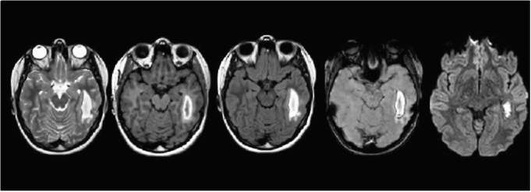
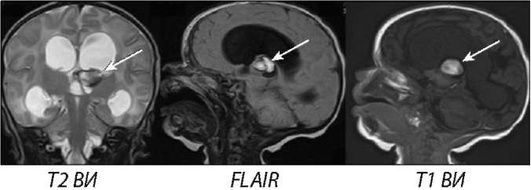
Причинами внутрижелудочкового кровоизлияния 1-й степени (субэпендимальное) - рис. 5-17, являются анте- и интранаталь-ная гипоксия, легкая асфиксия при рождении, повторные приступы апноэ, струйное введение гиперосмолярных растворов. Развивается преимущественно у недоношенных и характеризуется бессимптомным течением и отсутствием специфических неврологических нарушений. После 10-14 дней субэпендимальные гематомы могут трансформироваться в кисты. У недоношенных детей в качестве основной причины внутрижелудочковых кровоизлияний считают наличие так называемого герминального (зародышевого матрикса), который по мере созревания мозга плода и сосудистой системы должен постепенно исчезнуть. Если роды произошли раньше срока, то наличие этой структуры создает предпосылки для ВЖК. Так как незрелый герминальный матрикс несет в себе не созревшие сосуды капиллярного типа, стенки которых однослойные, поэтому очень хрупки и могут разорваться.
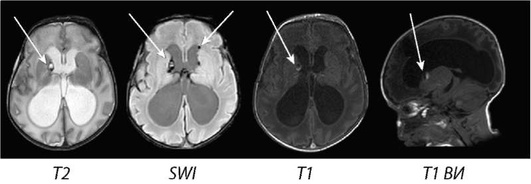
ВЖК 2-й степени - типичное внутрижелудочковое кровоизлияние без выраженного расширения полости желудочков, при этом происходит выход крови из субэпендимального пространства с заполнением менее половины объема желудочка кровью (рис. 5-18, указано стрелкой). Прибывание крови в желудочек с заполнением более половины его объема и расширением его просвета характерно для ВЖК 3-й степени.
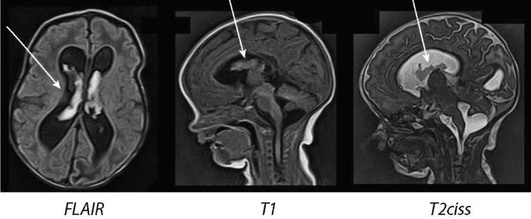
Внутрижелудочковое кровоизлияние 4-й степени - самое тяжелое, сопровождается не только заполнением кровью желудочков мозга, но и с распространением ее в вещество головного мозга (рис. 5-19). На МРТ обнаруживаются признаки ВЖК одной из трех первых степеней наряду с формированием очагов интра-паренхиматозного внутримозгового кровоизлияния.
Характеристика венозных инфарктов и синустромбозов
Венозный инфаркт (ВИ) морфологически отличается от артериального инсульта тем, что полнокровие, стаз, диапедезные кровоизлияния, а также мелкие очаги некроза, характеризующие его, не сопровождаются патологическими изменениями артерий области поражения (в т.ч. ВИ не имеет территориальной привязки и контурирования очага в пределах «бассейна» какой-либо магистральной артерии). Ишемия носит вторичный характер, связанный с внешне обусловленной констрикцией сосудов, питающих область стаза, а отек, который при ВИ имеет более выраженный характер, является фактором, располагающим к кровоизлиянию. Патофизиологические механизмы повреждения мозга в остром периоде ВИ характеризуются полнокровием и вазогенным отеком в отличие от ишемии и цитотоксического отека при артериальном инсульте. Проявления вазогенного отека развиваются раньше, чем цитотоксического, и некоторые авторы причисляют это к особенностям ВИ. Характерной для ВИ считается ранняя геморрагическая трансформация, связанная с венозным застоем и развитием вазогенного отека мозга, которая регистрируется в три раза чаще при ВИ, чем при артериальном инсульте. Однако ВИ может протекать без кровоизлияния (без геморрагической трансформации) (Шатохина М.Г., Томск, 2012). Локализация венозного инфаркта не совпадает с бассейнами кровоснабжения магистральных интракраниальных артерий, наиболее часто поражается теменно-затылочная область. Форма очагов инфаркта мозга при венозном инсульте, как правило, неправильная, а контуры неровные и нечеткие. У пациентов с венозным инсультом достоверно чаще визуализированы МР-признаки церебрального венозного застоя: расширение поверхностных мозговых вен; варианты строения поперечных и сигмовидных синусов (асимметрия и гипоплазия); сочетание с расширением размеров одноименных синусов; увеличение размеров прямого синуса с противоположной стороны; хронические тромбозы синусов.
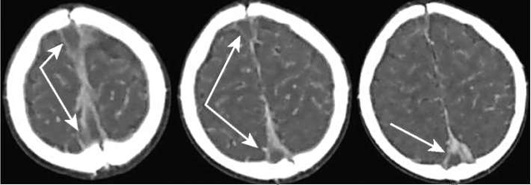
Для предотвращения развития венозного инсульта важно своевременно диагностировать тромбоз венозного синуса. КТ-исследование при подозрении на тромбоз венозного синуса наиболее информативно в острой стадии заболевания. Среди специфических симптомов, характерных для тромбоза выделяют:
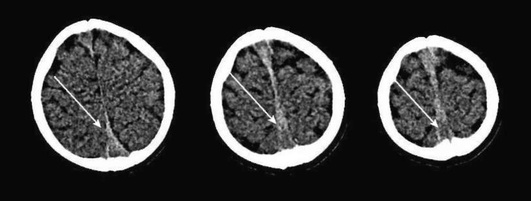
-
симптом «шнура» (обусловлен тромбированием кортикальных вен) или симптом «треугольной гиперденсивности» при окклюзии верхнего сагиттального синуса выявляется при КТ без контрастирования, рис. 5-20;
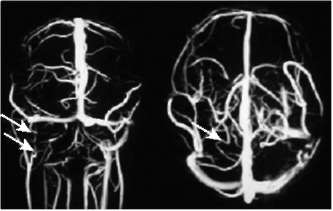
При КТ-венографии интракраниальных вен и венозных синусов - дефекты наполнения, уплотнения стенки синусов, нарушение венозного дренажа через коллатерали, уплотнение мозжечкового намета.
МРТ головного мозга с магнитно-резонансной флебографией является методом выбора исследования при венозных тромбозах. МР-сигнал очага венозного инфаркта в большинстве случаев гетерогенный. Отличительной особенностью ВИ является присутствие признаков вазогенного отека, по данным МРТ, в первые сутки заболевания.
При проведении МРТ выявляются:
-
изменение МР-сигнала нормального тока крови в венозном синусе на патологические (рис. 5-23):
-
подострая стадия (через несколько дней):
-
тромбированный синус (или внутренняя яремная вена) в стандартных режимах Т1 ВИ - гипер/изоинтенсивный, Т2 d-f - гиперинтенсивный;
-
зоны ишемии или инфаркта по ходу синуса, с геморрагическим пропитыванием (рис. 5-25);
-
-
дефект сигнала кровотока (потеря МР-сигнала) в одном или нескольких синусах при МР-венографии (рис. 5-24).
Таким образом, при компьютерной томографии проводится стандартное исследование головного мозга для определения генеза инсульта - ишемический или геморрагический. При отсутствии геморрагических изменений в веществе головного мозга и при наличии очаговой неврологической симптоматики могут быть выявлены косвенные КТ-признаки ишемического инсульта. Далее необходимо обследовать сосудистую систему головного мозга с помощью КТ-ангиографии для верификации окклюзии сосуда при ИИ или наличия аневризмы, АВМ и других сосудистых аномалий при ГИ. Ввиду большой лучевой нагрузки проведение КТ перфузии детям проводить не рекомендуется.
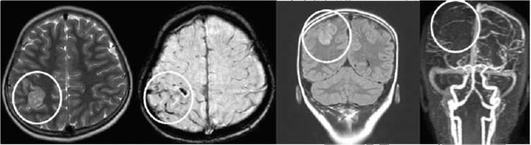
При наличии в учреждении МР-томографа предлагается алгоритм, включающий различные МРТ последовательности, который при подозрении на ИИ необходимо начинать с режима ДВИ для выявления зоны ишемии, характеризующейся понижением измеряемого коэффициента диффузии на ИКД-карте. Для исключения геморрагической природы ОНМК, а также для выявления геморрагической трансформации используются последовательности Swi/SWAN или Т2*-GE, которые позволяют выявлять признаки наличия крови во все сроки проведения исследования. Вне зависимости от выявленных изменений необходимо исследование сосудов мозга при помощи последовательности время-пролетной ангиографии - 3D TOF. Далее для объективизации зоны ишемической полутени проводится МРТ-перфузия.
Может быть также использован совместный КТ/МРТ-протокол при отсутствии наличия крови на КТ. При наличии кровоизлияния по данным бесконтрастной КТ в зависимости от сроков проведения исследования необходимо выполнить тот или иной вид ангиографического исследования.
Использование методов своевременного лучевого исследования позволяет улучшить диагностику ОНМК в детском возрасте, наиболее быстро и точно локализовать зону поражения, выявить причину инсульта, прогнозировать течение заболевания, а также выбирать наиболее адекватную терапию ОНМК различного генеза.
Список литературы
-
Верещагин Н.В., Брагина Л.К., Вавилов С.Б., Левина Г.Я. Компьютерная томография головного мозга. М.: Медицина, 1986. 256 с.
-
Володин Н.Н., Выхристюк О.Ф., Горбунов А.В. и др. Компьютерная и магнитно-резонансная томография в диагностике острого нарушения мозгового кровообращения у детей. ГБУ ДЗМ «научно-практический центр медицинской радиологии департамента здравоохранения города Москвы», Москва, 42 с.
-
Зыков В.П., Васильев С.А., Комарова И.Б. и др. Ишемический инсульт в детском возрасте. Лечебное дело 2009;(2):12-20.
-
Руководство Европейского общества урогенитальной ордиологии (ESUR) по Безопасности Контрастных Средств 9.0 под редакцией проф. В.Е. Синицына Springer, Германия, 2015. 47 С.
-
Кротенкова М.В. Диагностика острого инсульта: нейровизуали-зационные алгоритмы. Дисс… на соискание ученой степени д.м.н. Москва, 2011.
-
Лютая З.А., Кусельман А.И., Чубарова С.П. Перинатальные поражения центральной нервной системы у новорожденных: учебное пособие; под ред. проф. А.И. Кусельмана. Ульяновск : УлГУ, 2016. 100 с.
-
Морозов С.П., Насникова И.Ю., Терновой С.К. Мультиспиральная компьютерная томография в многопрофильном стационаре. Учебно-методическое пособие. ФГУ «Центральная клиническая больница с поликлиникой» УДП РФ, Москва, 2009. 97 С.
-
Al-Jarallah A. et al. Nontraumatic brain hemorrhage in children: etiology and presentation. // J. Child Neurol. 2000. Vol. 15, №5. P. 284-289.
-
Bernson-Leung M.E., Rivkin M.J. Stroke in Neonates and Children. // Pediatr. Rev. 2016. Vol. 37, №11. P. 463-477.
-
Bonduel M., Sciuccati G., Hepner M. et al. Arterial ischemic stroke and cerebral venous thrombosis in children: a 12-year Argentinean registry. Acta Haematol 2006;115(3-4):180-5.
-
Kwee T.C. et al. Whole-body diffusion-weighted magnetic resonance imaging. European journal of radiology. 2009, 70 (3): 409-17.
-
Tuckuviene R., Christensen A.L., Helgestad J. et al. Paediatric arterial is-chaemic stroke and cerebral sinovenous thrombosis in Denmark 1994-2006: a nationwide population-based study. Acta Pæ diatrica 2011;100(4):543-9.