Интенсивная терапия : национальное руководство : в 2 т. / под ред. И. Б. Заболотских, Д. Н. Проценко. - 2-е изд., перераб. и доп. - Москва : ГЭОТАР-Медиа, 2022. - Т. 1. - 1152 с. : ил. - (Серия "Национальные руководства"). - ISBN 978-5-9704-7190-6. |
Аннотация
Второе издание национального руководства "Интенсивная терапия" содержит современную информацию о диагностике и лечении критических состояний различной этиологии и патогенеза. Особое внимание уделено особенностям интенсивной терапии в периоперационный период у пациентов с сопутствующими заболеваниями. Благодаря объединению усилий ведущих специалистов России удалось отразить согласованную позицию по актуальным вопросам современной реаниматологии и интенсивной терапии и учесть сведения доказательной медицины. Все главы прошли этап независимого рецензирования.
Издание предназначено, прежде всего, анестезиологам-реаниматологам, а также врачам всех специальностей, студентам старших курсов медицинских вузов, клиническим ординаторам, аспирантам.
7.4. ТРОМБОЭМБОЛИЯ ЛЕГОЧНЫХ АРТЕРИЙ И ХРОНИЧЕСКАЯ ПОСТЭМБОЛИЧЕСКАЯ ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
А.И. Кириенко, С.Г. Леонтьев, И.С. Лебедев
Тромбоэмболия легочной артерии (ТЭЛА) - окклюзия сосудистого русла легких тромбами, первично образовавшимися в венах большого круга кровообращения либо в правых полостях сердца и принесенными в него током крови.
Классификация
В зависимости от объема поражения легочного артериального русла и тяжести клинических проявлений выделяют три группы: массивную ТЭЛА, под которой обычно понимают эмболическое поражение легочного ствола и/или главных легочных артерий (окклюзия более половины сосудистого русла легких) с выраженной легочной гипертензией (систолическое давление в правых отделах сердца ≥50 мм рт.ст.) и/или системной гипотензией, субмассивную при локализации тромбоэмболов в крупных или нескольких долевых легочных артерий (окклюзия от 30 до 50% артериального русла легких) без значимого гемодинамического ответа и тромбоэмболию мелких ветвей легочных артерий с суммарным поражением менее 30%.
К осложнениям относят:
Патогенез
Источник эмболии легочных артерий в 90% случаев - тромбы, локализующиеся в глубоких венах нижних конечностей, тазовых, почечных венах и в нижней полой вене. Тромботические поражения правых отделов сердца и магистральных вен верхних конечностей крайне редко осложняются ТЭЛА. Эмболия легочного артериального русла возникает при наличии флотирующей верхушки тромба, свободно расположенной в просвете вены и прикрепленной лишь основанием. Ускорение венозного кровотока (при ходьбе, повышении ВБД) способствует миграции тромба в легочную артерию. В зависимости от величины тромбоэмболов могут быть полностью или частично окклюзированы артерии различного калибра - от сегментарных до легочного ствола.
Внезапно возникшая постнагрузка на правые отделы сердца и нарушение газообмена - основные причины запуска патогенетических реакций. Массивное тромбоэмболическое поражение малого круга кровообращения приводит к сни жению сердечного (<2,5 л/мин/м2) и ударного (<30 мл/м2) индекса, подъему конечного диастолического (>12 мм рт.ст.) и систолического (до 60 мм рт.ст.) давления в ПЖ. При критическом эмболическом поражении (ангиографиче-ский индекс составляет 27 баллов и более) легочных артерий возросшее ОПСС поддерживает системное АД. Одновременно падает напряжение кислорода в артериальном русле (paO2 <60 мм рт.ст.) вследствие нарушения вентиляционно-перфузионных соотношений и ускорения легочного кровотока. Гипертензия в правых и гипотензия в левых отделах сердца снижают аортокоронарно-венозный градиент, что уменьшает кровоснабжение сердца. Артериальная гипоксемия усугубляет кислородное голодание миокарда, что может осложниться развитием левожелудочковой недостаточности. Тромбоэмболия периферических ветвей легочных артерий обычно не сопровождается расстройствами гемодинамики и дыхания, она может вызывать инфаркт легочной ткани и вторичную инфарктную пневмонию.
Диагностика
Классический синдром массивной эмболии (коллапс, боли за грудиной, цианоз верхней половины туловища, тахипноэ, набухание шейных вен) встречается не более чем у 15-17% больных. Чаще выявляют один или два характерных признака. Почти у половины больных заболевание начинается с кратковременной потери сознания или обморока, боли за грудиной или в области сердца, удушья. Бледность с цианотичным оттенком кожных покровов при осмотре бывает почти у 60% больных. Одни из наиболее часто встречающихся симптомов - тахикардия и одышка.
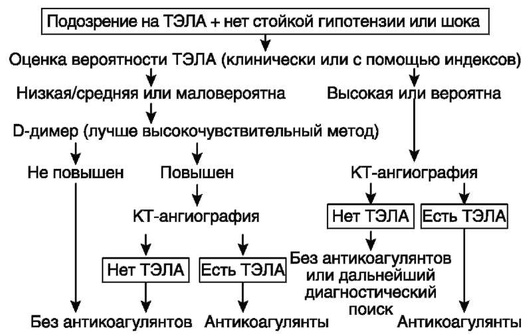
У больных с подозрением на ТЭЛА ее вероятность можно оценить с помощью модифицированного индекса Geneva или индекса Wells (табл. 7.10, 7.11).
По клиническим данным нельзя с достаточной уверенностью ни подтвердить, ни отвергнуть наличие ТЭЛА. Однако такая предварительная оценка необходима, чтобы надлежащим образом интерпретировать результаты инструментальной и лабораторной диагностики.
Инфаркт легкого, который включает плевральные боли, кашель, кровохарканье, плевральный выпот и типичные треугольные тени на рентгенограмме, развивается нечасто. Он относится к поздним проявлениям эмболии легочной артерии и ее ветвей в связи с тем, что для формирования инфаркта необходимо время, исчисляемое нередко днями.
Аускультация сердца и легких может выявить усиление или акцент II тона над трехстворчатым клапаном и легочной артерией, систолический шум в этих точках. Расщепление II тона, ритм галопа - плохие прогностические признаки. Над зоной эмболии возможны ослабление дыхания, при инфарктной пневмонии - влажные хрипы и шум трения плевры. При выраженной правожелудочковой недостаточности набухают и пульсируют шейные вены; возможно увеличение печени.
Критерий |
Число баллов |
|
|---|---|---|
Полная версия |
Упрощенная версия |
|
ТГВ или ТЭЛА в анамнезе |
3 |
1 |
ЧСС 75-94 уд /мин |
3 |
1 |
ЧСС ≥95 уд /мин |
5 |
|
Операция под общим наркозом или перелом нижних конечностей в предшествующий месяц |
2 |
1 |
Кровохарканье |
2 |
1 |
Активное злокачественное новообразование (в настоящее время или в предшествующий год) |
2 |
1 |
Боль в одной ноге |
3 |
1 |
Односторонний отек и болезненная пальпация по ходу глубоких вен |
4 |
1 |
Возраст >65 лет |
1 |
1 |
Вероятность ТЭЛА по клиническим данным |
||
Трехуровневая шкала |
Сумма баллов |
|
Высокая |
0-3 |
0-1 |
Средняя |
4-10 |
2-4 |
Низкая |
≥11 |
≥5 |
Двухуровневая шкала |
Сумма баллов |
|
ТЭЛА маловероятна |
0-5 |
0-2 |
ТЭЛА вероятна |
≥6 |
≥3 |
Критерий |
Число баллов |
|
|---|---|---|
Полная версия |
Упрощенная версия |
|
ТГВ или ТЭЛА в анамнезе |
1,5 |
1 |
ЧСС>100 уд /мин |
1,5 |
1 |
Иммобилизация больше 3 дней подряд или операция в последние 4 нед |
1,5 |
1 |
Кровохарканье |
1 |
1 |
Активное злокачественное новообразование (в настоящее время или в предшествующий год) |
1 |
1 |
Минимальный отек и болезненная пальпация по ходу глубоких вен |
3 |
1 |
Альтернативный диагноз менее вероятен, чем ТЭЛА |
3 |
1 |
Вероятность ТЭЛА по клиническим данным |
||
Трехуровневая шкала |
Сумма баллов |
|
Высокая |
0-1 |
Не оценивается |
Средняя |
2-6 |
Не оценивается |
Низкая |
≥7 |
Не оценивается |
Двухуровневая шкала |
Сумма баллов |
|
ТЭЛА маловероятна |
0-4 |
0-1 |
ТЭЛА вероятна |
≥5 |
≥2 |
В половине случаев в момент развития эмболии (даже массивной) венозный тромбоз протекает бессимптомно, то есть эмболия легочных артерий и ее ветвей часто служит первым проявлением ТГВ нижних конечностей или таза.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
При подозрении на ТЭЛА проводят исключение других заболеваний, протекающих подобно: бактериальной пневмонии, пневмоторакса, ОЛ, перикардита, кардиомиопатии и ИМ. Для этой цели необходимо выполнить ряд исследований (общеклиническое исследование крови и газового состава артериальной крови, рентгенографию органов грудной клетки, ЭКГ, ЭхоКГ и др.).
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
-
ЭКГ: у 9-30% больных отклонений от нормы не отмечается:
-
признаки острой перегрузки ПЖ: отрицательные S в I, Q в III, T в III отведении, смещение переходной зоны (глубокий S в отведениях V5-V6) в сочетании с отрицательными Т в отведениях V1-V4, нарушение проводимости по правой или левой передней ветви пучка Гиса;
-
у ряда больных депрессия или подъем сегмента S-Т в левых отведениях, иногда с инверсией зубца Т (обычно это трактуется как ишемия миокарда ЛЖ).
-
-
Легочная гипертензия тромбоэмболического генеза при рентгенографии органов грудной клетки может проявляться высоким стоянием купола диафрагмы на стороне поражения, расширением правых отделов сердца и корней легкого, обеднением сосудистого рисунка по периферии, наличием дисковидных ателектазов. При сформировавшейся инфарктной пневмонии видны треугольные тени (основание треугольника располагается у париетальной плевры, а вершина направлена в сторону корня легкого), жидкость в синусе на стороне инфаркта. Рентгенологические данные важны для исключения патологии легких и средостения, а также для правильной интерпретации результатов, полученных при сцинтиграфии легких. Однако специфичность рентгенографии легких в диагностике ТЭЛА низкая.
-
Биохимические маркеры. Скрининговый тест для исключения ТЭЛА - определение концентрации D-димера. Специфичность метода - 45%. Он не информативен в послеоперационном, послеродовом периоде, у травматологических больных, при наличии острых воспалительных заболеваний. У только что госпитализированных больных молодого и среднего возраста нормальный уровень D-димера позволяет исключить ТЭЛА и избежать дальнейшего обследования примерно в 30% случаев. Верхняя граница нормы D-димера, определенного иммуноферментными методами, у лиц до 50 лет составляет 500 мкг/л; в более старших возрастных группах ее рекомендуется рассчитывать по формуле: возраст × 10 мкг/л.
Высокий уровень BNP или N-концевого фрагмента его предшественника в крови свидетельствует о повышенной нагрузке на ПЖ, увеличение сердечного тропонина (Т или I) - о повреждении миокарда. Оба признака являются косвенными свидетельствами высокого давления в легочной артерии. Эти биохимические маркеры не используют для диагностики ТЭЛА, но они играют важную роль в оценке риска неблагоприятного исхода. Повышенный уровень сердечного тропонина характеризует тяжесть ТЭЛА и не может быть критерием для дифференциальной диагностики с ИМ; отрицательный результат тропонинового теста полностью исключает ИМ, но не ТЭЛА.
-
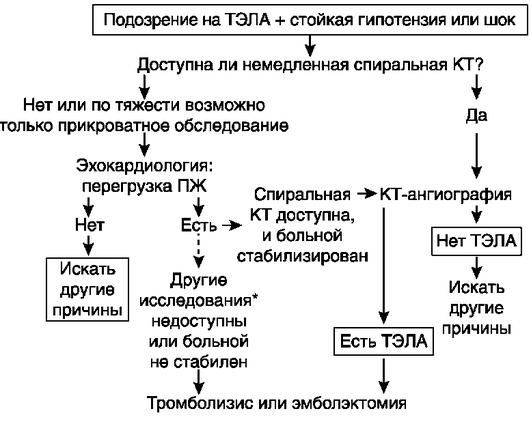
ЭхоКГ используют в основном для стратификации риска смерти у больных с ТЭЛА, подтвержденной другими методами. Она необходима также для дифференциальной диагностики и выявления состояния сердца и его клапанного аппарата.
При артериальной гипотензии или шоке отсутствие перегрузки или дисфункции ПЖ (когда конечнодиастолический размер ПЖ больше такового левого) позволяет практически исключить ТЭЛА, а выявление указанных изменений является основанием для ТЛТ или эмболэктомии.
В редких случаях при ЭхоКГ выявляют подвижные тромбы в правых отделах сердца, что позволяет подтвердить диагноз ТЭЛА. С повышенным риском смерти при ТЭЛА сопряжены признаки дисфункции ПЖ, наличие сброса крови справа налево из-за открытого овального окна, выявление тромбов в правых отделах сердца.
-
Перфузионное сканирование легких - безопасный и высокоинформативный метод диагностики ТЭЛА. Единственное противопоказание - беременность. Метод основан на визуализации распределения радиофармпрепарата по периферическому сосудистому руслу легких. Уменьшенное накопление препарата или полное его отсутствие в каком-либо участке легочного поля свидетельствует о нарушении кровообращения в этой зоне. Характерными признаками считают наличие дефектов треугольной формы в двух и более сегментах. Отсутствие нарушений перфузии легочной ткани исключает наличие эмболии.
-
Компьютерная спиральная томография с контрастированием легочных артерий является информативным и наиболее распространенным методом диагностики ТЭЛА. Обладает широкими возможностями визуализации просвета легочных артерий, характера поражения сосудистого русла, выявления инфарктов легкого; при одновременном выполнении нативного исследования легких необходимо проведение дифференциального диагноза.
Объем эмболического поражения можно оценить в баллах. Сегментарную ветвь, расположенную дистальнее эмбола, независимо от степени окклюзии сосуда, принимают за 1 балл (табл. 7.12). Далее суммируют количество баллов. Каждой сумме соответствует определенный объем ТЭЛА: от 1 до 6 баллов - тромбоэмболия мелких ветвей легочных артерий, от 7 до 10 - субмассивная, от 11 до 16 - массивная ТЭЛА.
Оценка соотношения размеров правого и левого желудочков сердца позволяет выявить наличие гипертензии в малом круге кровообращения. Увеличение соотношения >1 свидетельствует о наличии легочной гипертензии и дисфункции ПЖ. Расширение области исследования дает возможность проводить диагностику ТГВ нижних конечностей. Этот метод диагностики, в отличие от ангиопульмонографии, предпочтителен у беременных с подозрением на ТЭЛА.
Отрицательный результат КТ с контрастированием легочных артерий позволяет с достаточной надежностью исключить ТЭЛА, только когда ее вероятность по клиническим данным низкая или средняя (или по данным упрощенных версий диагностических шкал ТЭЛА маловероятна).
-
Ангиопульмонография. Является информативным методом диагностики ТЭЛА. Позволяет определить характер и объем эмболического поражения. Объем эмболического поражения оценивают в баллах по Miller (максимальное число баллов 34). При эмболизации мелких ветвей легочной артерии, не вызывающей гемодинамических расстройств в малом круге кровообращения, индекс не превышает 16 баллов, при эмболии крупных артерий он составляет 17 и более баллов. Критической, требующей безотлагательного устранения обструкции легочных артерий, считают тромбоэмболию с поражением обеих главных легочных артерий или легочного ствола с индексом Миллера ≥27 баллов. Нормальная легочная ангиограмма позволяет исключить ТЭЛА.
МРТ для диагностики ТЭЛА использовать не следует.
-
Ультразвуковое ангиосканирование вен нижних конечностей и таза необходимо проводить всем больным, чтобы выявить источник эмболии и определить его характер. При отсутствии тромботических масс в магистральных венах нижних конечностей и брюшной полости необходимо исследовать гонадные, внутренние подвздошные, почечные и печеночные вены.
| Область поражения легочного русла | Баллы |
|---|---|
Одна сегментарная ветвь легочной артерии, расположенная дистальнее эмбола, независимо от степени окклюзии сосуда |
1 |
Правая среднедолевая ветвь |
2 |
Левая среднедолевая ветвь |
2 |
Левая верхнедолевая ветвь |
2 |
Правая верхнедолевая ветвь |
3 |
Левая нижнедолевая ветвь |
3 |
Правая нижнедолевая ветвь |
4 |
Левая главная ветвь |
7 |
Правая главная ветвь |
9 |
Лечение
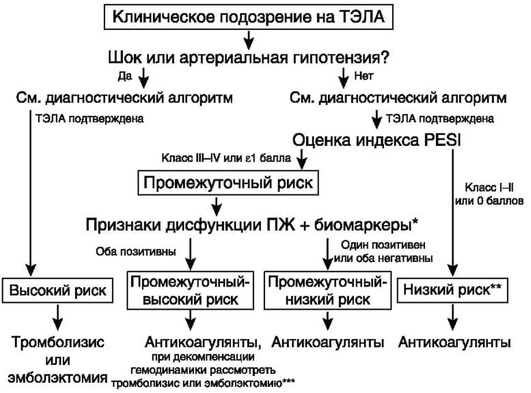
Основная задача терапии больных с ТЭЛА - восстановить проходимость легочных артерий, что приведет к нормализации гемодинамики и предотвратит развитие хронической тромбоэмболической легочной гипертензии (ХТЭЛГ), а также рецидив эмболии. На сегодняшний день основной метод лечения - консервативный. Эмболэктомия показана в крайне тяжелых случаях (массивное поражение легочных артерий при наличии шока или стойкой, клинически значимой гипотензии и ДН, а также неэффективности ТЛТ).
Для выбора необходимого метода лечения следует оценить риск смерти больного в ближайшее после эмболизации время. Для этого целесообразно использовать индекс PESI (табл. 7.13). О чрезвычайно высоком риске смерти свидетельствует крайне тяжелое состояние больного.
Вероятность смерти выше при наличии ряда сопутствующих заболеваний (хронических СН и/или ДН, признаков дисфункции или перегрузки ПЖ, выявленных при ЭхоКГ или КТ, а также повышенном уровне маркеров повреждения миокарда) (рис. 7.24).
КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ
В большинстве случаев при немассивной легочной тромбоэмболии используют гепарины различной молекулярной массы. Антикоагулянты прямого действия.
-
Гепарин натрия не фракционированный (НФГ):
-
первоначально внутривенно болюсно вводят 5 тыс. ЕД гепарина натрия, затем сразу начинают постоянную внутривенную инфузию (табл. 7.14), в последующем подбор дозы осуществляют в зависимости от значения АЧТВ (измерения АЧТВ проводят через 1-2 ч после каждого изменения дозы и как минимум 1 раз в сутки при стабильных значениях показателя, целевое значение АЧТВ - в 1,5-2 раза выше нормального значения для данной лаборатории);
-
альтернативный вариант - подкожное введение, инъекции производят каждые 8 ч, подбирая дозу таким образом, чтобы обеспечить увеличение АЧТВ через 4 ч после инъекции в 1,5-2 раза выше нормального.
-
-
Длительность гепаринизации не менее 5-7 сут при одновременном приеме антагонистов витамина К с последующим переходом на длительный прием последних. Их назначают не менее чем за 4-5 сут до отмены НФГ. Отменять НФГ можно не ранее, чем будет достигнут стойкий терапевтический эффект антагонистов витамина К (МНО от 2 до 3).
-
При использовании НМГ реже развиваются тромбоцитопения. НМГ дозируют в МЕ-активности против Xа-фактора. Подбор дозы осуществляют, ориентируясь на массу тела больного. При использовании стандартных лечебных режимов достигнутый уровень анти-Ха-активности в крови, как правило, не контролируют. В целом НМГ эффективнее и безопаснее НФГ. Противопоказания, предостережения, взаимодействие, передозировка такие же, как и у НФГ. Препараты вводят подкожно в переднюю брюшную стенку. Доза НМГ зависит от выбора препарата (табл. 7.14).
Критерий |
Число баллов |
|
|---|---|---|
Первоначальная версия |
Упрощённая версия |
|
Возраст |
Значение возраста в годах |
1, когда >80 лет |
Мужской пол |
10 |
Не оценивается |
Злокачественное новообразование |
30 |
1 |
ХСН |
10 |
1 |
Хроническое заболевание легких |
10 |
|
ЧСС ≥110 уд /мин |
20 |
1 |
Систолическое АД <100 мм рт.ст. |
30 |
1 |
ЧДД ≥30 в 1 мин |
20 |
Не оценивается |
Температура тела <36 °C |
20 |
Не оценивается |
Измененное сознание |
60 |
Не оценивается |
Насыщение артериальной крови кислородом <90% |
20 |
1 |
Сумма баллов и смертность в ближайшие 30 сут |
||
Класс I (≤65 баллов) - очень низкая ожидаемая смертность (0-1,6%) Класс II (66-85 баллов) - низкая ожидаемая смертность (1,7-3,5%) Класс III (86-105 баллов) - умеренная ожидаемая смертность (3,2-7,1%) Класс IV (106-125 баллов) - высокая ожидаемая смертность (4,0-11,4%) Класс V (>125 баллов) - очень высокая ожидаемая смертность (10,0-24,5%) |
0 баллов - ожидаемая смертность 1,0% (95% ДИ 0-2,1%) ≥1 балла(ов) - ожидаемая смертность 10,9% (95% ДИ 8,5-13,2%) |
|
Примечание: ДИ - доверительный интервал.
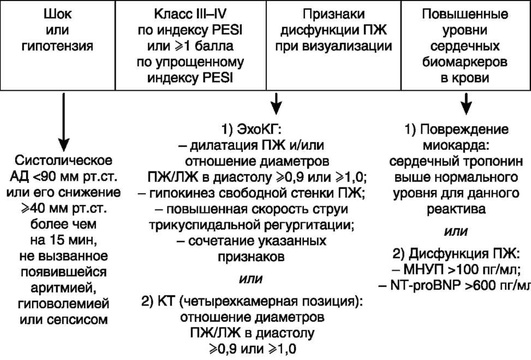
* Уровень биомаркеров в крови можно не определять, если тромболитическую терапию или эмболэктомию не планируют.
** Больные с классами I-II по индексу PESI или нулевой суммой баллов по упрощенному индексу PESI, но с повышенным уровнем сердечных биомаркеров или признаками дисфункции правого желудочка при его визуализации должны быть отнесены к группе промежуточного-низкого риска.
*** Из-за возможного утяжеления проявлений заболевания необходимо тщательное наблюдение за больными с промежуточным-высоким риском летального исхода для своевременного выявления показаний к тромболитической терапии или эмболэктомии из легочных артерий (аналогичный подход может быть оправдан у больных с повышенным уровнем сердечного тропонина в крови, но без признаков дисфункции правого желудочка по данным эхокардиографии или компьютерной томографии).
Препарат |
Рекомендуемая доза |
|
|---|---|---|
Профилактическая |
Лечебная |
|
Антикоагулянты для парентерального введения |
||
НФГ |
Контроль АЧТВ не требуется. У нехирургических больных: подкожно 5000 ЕД 2-3 раза в сутки. В общей хирургии у больных с умеренным риском ВТЭО: подкожно 2500 ЕД за 2-4 ч до операции, затем 2500 ЕД через 6-8 ч после операции, далее по 5000 ЕД 2-3 раза в сутки. В общей хирургии у больных с высоким риском ВТЭО: подкожно 5000 ЕД за 2-4 ч до операции, затем 5000 ЕД через 6-8 ч после операции, далее по 5000 ЕД 3 раза в сутки |
|
Бемипарин натрия |
У нехирургических больных: подкожно 2500 или 3500 МЕ 1 раз в сутки в зависимости от степени риска ВТЭО. В общей хирургии у больных с умеренным риском ВТЭО: подкожно 2500 МЕ за 2 ч до операции или через 6 ч после операции, затем ежедневно по 2500 МЕ 1 раз в сутки. В ортопедической хирургии с высоким риском ВТЭО: подкожно 3500 МЕ за 2 ч до операции или через 6 ч после операции, затем ежедневно по 3500 МЕ 1 раз в сутки |
Подкожно 3500 МЕ 1 раз в сутки |
Далтепарин натрия |
У нехирургических больных: подкожно 5000 МЕ 1 раз в сутки. В общей хирургии у больных с умеренным риском ВТЭО: подкожно 2500 МЕ за 2 ч до операции, затем 2500 МЕ 1 раз в сутки. В общей хирургии у больных с высоким риском ВТЭО:
В ортопедической хирургии с высоким риском ВТЭО:
|
Дозы для лечения больных со злокачественными новообразованиями после эпизода проксимального ТГВ / ТЭЛА: подкожно 200 МЕ/кг (максимально 18 000 МЕ) 1 раз в сутки в течение первого месяца, затем 150 МЕ/кг вплоть до 6 мес |
Надропарин кальция |
У нехирургических больных с высоким риском ВТЭО: подкожно 1 раз в сутки 3800 МЕ (0,4 мл) при массе тела до 70 кг; 5700 МЕ (0,6 мл) при массе тела больше 70 кг. В общей хирургии: подкожно 2850 МЕ (0,3 мл) за 2-4 ч до операции, затем 0,3 мл 1 раз в сутки. В ортопедической хирургии с высоким риском ВТЭО: подкожно 38 МЕ/кг п/к за 12 ч до операции, затем 38 МЕ/кг через 12 ч после окончания операции, затем 38 МЕ/кг 1 раз в сутки на 2-е и 3-и сутки после операции, с 4-х суток после операции доза может быть увеличена до 57 МЕ/кг 1 раз в сутки |
|
Эноксапарин натрия |
У нехирургических больных: подкожно 40 мг 1 раз в сутки. В общей хирургии у больных с умеренным риском ВТЭО: подкожно 20 мг за 2 ч до операции или 20 мг через 12-24 ч после операции, далее 20 мг 1 раз в сутки. В общей хирургии и ортопедической хирургии у больных с высоким риском ВТЭО: подкожно 40 мг за 12 ч до операции или через 12-24 ч после операции, затем 40 мг 1 раз в сутки |
|
Фондапаринукс натрия |
У нехирургических больных: подкожно 2,5 мг 1 раз в сутки. У хирургических больных: подкожно 2,5 мг через 6-24 ч после операции, затем 1 раз в сутки |
Тромбоз подкожных вен нижних конечностей: 2,5 мг 1 раз в сутки. ТГВ, не массивная ТЭЛА: подкожно 1 раз в сутки 5 мг при массе тела до 50 кг; 7,5 мг при массе тела 50-100 кг; 10 мг при массе тела выше 100 кг |
Пероральные антикоагулянты |
||
Антагонисты витамина К |
Внутрь, подбор дозы с целью поддерживать МНО в диапазоне от 2 до 3 |
Внутрь, подбор дозы с целью поддерживать МНО в диапазоне от 2 до 3 |
Апиксабан |
После планового протезирования тазобедренного или коленного суставов: внутрь 2,5 мг 1 раз в сутки, начиная через 12-24 ч после завершения операции по достижении гемостаза |
С самого начала лечения или при переходе с парентерального введения антикоагулянтов в первые 48 ч от начала лечения: внутрь 10 мг 2 раза в сутки первые 7 сут, затем 5 мг 2 раза в сутки в течение 6 мес, затем 2,5 мг 2 раза в сутки |
Дабигатрана этексилат |
После ортопедических операций: внутрь 220 мг 1 раз в сутки (у больных старше 75 лет, при клиренсе креатинина 30-50 мл/мин, у принимающих амиодарон, верапамил или хинидин 150 мг 1 раз в сутки); первый прием - в половинной суточной дозе через 1-4 ч после завершения операции по достижении гемостаза |
После парентерального введения антикоагулянтов (гепаринов) как минимум 5 сут: внутрь 150 мг 2 раза в сутки |
Ривароксабан |
После крупных ортопедических операций на нижних конечностях: внутрь 10 мг 1 раз в сутки, начиная через 6-8 ч после завершения операции по достижении гемостаза |
С самого начала лечения или при переходе с парентерального введения антикоагулянтов в первые 48 ч от начала лечения: внутрь 15 мг 2 раза в сутки в течение 21 сут, затем 20 мг 1 раз в сутки |
Противопоказания к назначению гепаринов: гемофилия и другие геморрагические диатезы; тромбоцитопения меньше 100 000/мм3; тромбоцитопения, вызванная гепарином натрия, в анамнезе; острые язвы желудка и кишечника; продолжающееся тяжелое кровотечение; недавнее внутричерепное кровоизлияние; тяжелая неконтролируемая АГ, тяжелое заболевание печени (в том числе варикозное расширение вен пищевода), тяжелая травма или недавно перенесенное хирургическое вмешательство (особенно на глазах и нервной системе), острый ИЭ, выраженная почечная недостаточность.
Побочные эффекты: геморрагические осложнения, локальная реакция в местах инъекций (раздражение, боль, гематома), тромбоцитопения (в том числе иммунная), остеопороз при длительном применении, аллергическая реакция; редко: головная боль, озноб, гипертермия, тошнота, рвота, запор, повышение активности печеночных ферментов (обычно бессимптомное, при продолжении лечения может нормализоваться).
Передозировка. При возникновении геморрагических осложнений обычно достаточно прекратить введение НФГ. Если необходимо быстрее устранить влияние НФГ, в качестве антидота следует ввести протамина сульфат (внутривенно из расчета 1 мг препарата на 100 ЕД введенного НФГ). При выборе дозы и длительности использования протамина сульфата следует учитывать давность последнего введения и продолжительность эффекта НФГ (после внутривенного введения концентрация НФГ в крови быстро снижается, после подкожной инъекции антикоагулянтное действие сохраняется довольно долго).
-
Фондапаринукс натрия (Арикстра♠) является синтетическим, селективным ингибитором активированного фактора X. Избирательно связываясь с антитромбином, фондапаринукс натрия потенцирует антитромбин нейтрализовывать фактор Ха. Максимальная концентрация в плазме крови (средняя Сmax = 0,34 мг/л) достигалась через 2 ч после введения дозы. Фондапаринукс натрия выводится почками в неизменном виде. У здоровых лиц 64-77% одной дозы препарата, введенной подкожно или внутривенно, выводится с мочой в течение 72 ч. Период полувыведения (Т1/2) составляет около 17 ч у молодых здоровых лиц и около 21 ч - у пожилых здоровых лиц. Применение при беременности и лактации не рекомендуется (см. табл. 7.14).
НОВЫЕ ОРАЛЬНЫЕ АНТИКОАГУЛЯНТЫ
-
Ривароксабан (Ксарелто♠) - высокоселективный прямой ингибитор фактора Ха, обладающий высокой биодоступностью при приеме внутрь. Быстро всасывается; максимальная концентрация (Сmax) достигается через 2-4 ч после приема таблетки с пищей. При приеме внутрь приблизительно 2/3 от назначенной дозы ривароксабана подвергаются метаболизму и в дальнейшем выводятся равными частями с мочой и через кишечник. Оставшаяся 1/3 дозы выводится посредством прямой почечной экскреции в неизмененном виде, главным образом за счет активной почечной секреции. У пожилых пациентов концентрации ривароксабана в плазме крови выше, чем у молодых пациентов.
Максимальная суточная доза составляет 30 мг в течение первых 3 нед лечения и 20 мг при дальнейшем лечении (см. табл. 7.14). Ривароксабан (Ксарелто®♠) следует принимать во время еды. Если пациент не способен проглотить таблетку целиком, таблетка ривароксабана (Ксарелто®♠) может быть измельчена и смешана с водой или жидким питанием через желудочный зонд.
Противопоказания:
-
Повышенная чувствительность к ривароксабану или любым вспомогательным веществам, содержащимся в таблетке.
-
Клинически значимые активные кровотечения (например, внутричерепное кровоизлияние, желудочно-кишечные кровотечения).
-
Повреждение или состояние, связанное с повышенным риском большого кровотечения, например имеющаяся или недавно перенесенная желудочно-кишечная язва, наличие злокачественных опухолей с высоким риском кровотечения, недавние травмы головного мозга или СМ, операции на головном мозге, СМ или глазах, внутричерепное кровоизлияние, диагностированный или предполагаемый варикоз вен пищевода, артериовенозные мальформации, аневризмы сосудов или патология сосудов головного мозга или СМ.
-
Сопутствующая терапия какими-либо другими антикоагулянтами, например НФГ, НМГ (эноксапарин, далтепарин и др.), производными гепарина (фондапаринукс и др.), пероральными антикоагулянтами (варфарин, апиксабан, дабигатран и др.), кроме случаев перехода с или на ривароксабан или при применении НФГ в дозах, необходимых для обеспечения функционирования центрального венозного или артериального катетера.
-
Заболевания печени, протекающие с коагулопатией, которая обусловливает клинически значимый риск кровотечений.
-
Детский и подростковый возраст до 18 лет (эффективность и безопасность у пациентов данной возрастной группы не установлены).
-
Врожденный дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция (в связи с наличием в составе лактозы).
С осторожностью следует использовать препарат:
-
при лечении пациентов с повышенным риском кровотечения (в том числе при врожденной или приобретенной склонности к кровотечениям, неконтролируемой тяжелой артериальной гипертонии, язвенной болезни желудка и двенадцатиперстной кишки в стадии обострения, недавно перенесенной язвенной болезни желудка и двенадцатиперстной кишки, сосудистой ретинопатии, бронхоэктазах или ЛК в анамнезе);
-
при лечении пациентов с почечной недостаточностью (клиренс креатинина 49-30 мл/мин), получающих одновременно препараты, повышающие концентрацию ривароксабана в плазме крови;
-
при лечении пациентов с почечной недостаточностью (клиренс креатинина 29-15 мл/мин), поскольку концентрация ривароксабана в плазме крови у таких пациентов может значительно повышаться (в среднем в 1,6 раза), и вследствие этого они подвержены повышенному риску кровотечения;
-
у пациентов, получающих лекарственные препараты, влияющие на гемостаз (например, НПВП, антиагреганты или другие антитромботические средства).
Ривароксабан (Ксарелто♠) не рекомендуется к применению у пациентов, получающих системное лечение противогрибковыми препаратами азоловой группы (например, кетоконазолом) или ингибиторами протеазы (ИП) ВИЧ (например, ритонавиром). Эти лекарственные препараты являются сильными ингибиторами изофермента CYP3A4 и Р-гликопротеина. Как следствие, эти лекарственные препараты могут повышать концентрацию ривароксабана в плазме крови до клинически значимого уровня (в среднем в 2,6 раза), что увеличивает риск развития кровотечений. Азоловый противогрибковый препарат флуконазол, умеренный ингибитор CYP3A4, оказывает менее выраженное влияние на экспозицию ривароксабана и может применяться с ним одновременно.
Пациенты с почечной недостаточностью (клиренс креатинина 29-15 мл/мин) или повышенным риском кровотечения и пациенты, получающие сопутствующее системное лечение противогрибковыми препаратами азоловой группы или ИП ВИЧ, после начала лечения должны находиться под пристальным контролем для своевременного обнаружения осложнений в форме кровотечений.
Специфический антидот ривароксабана неизвестен. В случае передозировки для снижения всасывания ривароксабана можно использовать активированный уголь. Интенсивное связывание с белками плазмы крови предполагает, что ривароксабан не будет выводиться при проведении диализа.
-
Дабигатрана этексилат (Прадаксаmax</sub>) достигается в течение 0,5-2 ч. Период полувыведения (Т1/2) в среднем составляет около 11 ч. Дабигатран выводится в неизмененном виде преимущественно почками (85%) и только 6% - через ЖКТ. Рекомендовано применение препарата по 150 мг 2 раза в день после парентерального лечения гепаринами, проводящегося в течение как минимум 5 дней.
Противопоказания: дабигатрана этексилат нельзя использовать при почечной недостаточности с клиренсом креатинина (КК) менее 30 мл/мин. Остальные противопоказания см. для ривароксабана.
Применять с осторожностью при состояниях, повышающих риск кровотечения:
-
одновременное применение ингибиторов Р-гликопротеина (за исключением указанных в разделе «Противопоказания»);
-
одновременный прием ацетилсалициловой кислоты, НПВП, клопидогрела, СИОЗС и селективных ингибиторов обратного захвата норадреналина, а также других препаратов, применение которых может нарушать гемостаз;
-
врожденные или приобретенные заболевания свертывающей системы крови;
-
недавно проведенная биопсия или перенесенная обширная травма;
-
эзофагит, гастрит или гастроэзофагеальная рефлюксная болезнь.
-
Апиксабан (Эликвис♠) - прямой ингибитор Xa-фактора, обратимо и селективно блокирующий активный центр фермента. Для реализации антитромботического эффекта апиксабана не требуется наличия антитромбина. Апиксабан не оказывает непосредственного прямого влияния на агрегацию тромбоцитов, но опосредованно ингибирует агрегацию тромбоцитов, индуцированную тромбином. Апиксабан быстро всасывается из ЖКТ, максимальная его концентрация (Сmax) достигается в течение 3-4 ч после перорального приема, период полувыведения (T1/2) - около 12 ч. Коррекции дозы в зависимости от массы тела пациента не требуется.
Начальная доза составляет 20 мг в сутки, через неделю ее уменьшают в 2 раза. Противопоказания (см. Ривароксабан).
Применять с осторожностью при выполнении спинальной, эпидуральной анестезии или пункций, а также у пациентов, получающих системную терапию мощными ингибиторами изофермента CYP3A4 и Р-гликопротеина, такими как азоловые противогрибковые средства (в частности, кетоконазол, итраконазол, вориконазол и позаконазол), ИП ВИЧ (например, ритонавир). Также следует соблюдать осторожность при применении апиксабана с мощными индукторами изофермента CYP3A4 и Р-гликопротеина (в частности, рифампицином, фенитоином, карбамазепином, фенобарбиталом или препаратами зверобоя продырявленного).
ТРОМБОЛИТИЧЕСКИЕ СРЕДСТВА
Чем раньше от момента эмболизации начата ТЛТ, тем она эффективнее (уровень достоверности доказательств - А). Расcчитывать на положительный результат можно при длительности заболевания до 14 сут. Противопоказания: см. табл. 7.15.
-
Стрептокиназа. Вводят 250 000-500 000 МЕ в течение 10-15 мин для нейтрализации естественных ингибиторов фибринолиза и антител к стрептококку, затем в дозе 100 000 МЕ/ч в течение 12-24 ч. Возможна инфузия 1 500 000 МЕ в течение 2 ч при крайне тяжелом состоянии больного или на фоне реанимационных мероприятий. В последующем продолжают внутривенное введение в стандартной дозе. Одновременно вводить гепарины не рекомендуется.
| Абсолютные противопоказания* | Относительные противопоказания |
|---|---|
|
|
* У больных с ТЭЛА, представляющей непосредственную угрозу жизни, абсолютные противопоказания можно рассматривать как относительные.
Противопоказания
Побочные эффекты. Чаще всего кровотечение. При появлении артериальной гипотонии обычно достаточно поднять ноги больного, снизить скорость инфузии или временно остановить инфузию тромболитика. Кровотечения чаще всего ограничиваются местами инъекций, однако возможно развитие внутричерепных и иных тяжелых геморрагических осложнений. Серьезное кровотечение требует прекращения введения тромболитика, а в ряде случаев - переливания СЗП. Возможны аллергические реакции, боль в спине.
Взаимодействие. При сочетанном применении с антиагрегантами и антикоагулянтами увеличивается риск геморрагических осложнений.
Лабораторный контроль. В процессе лечения тромболитиками необходимо как минимум дважды в сутки определять уровень фибриногена (снижение ниже 1 г/л требует переливания СЗП), АЧТВ (стойкое удлинение времени более 100 с также требует переливания СЗП), что позволит уменьшить число геморрагических осложнений.
-
Алтеплаза, тенектеплаза - рекомбинантные препараты человеческого тканевого активатора плазминогена. При системном введении избирательно активируют плазминоген, адсорбированный на фибрине, вызывают фибриноспецифический тромболизис без выраженного снижения уровня фибриногена в кровотоке. Алтеплазу вводят внутривенно в дозе 10 мг в течение 1-2 мин, затем продолжают постоянную инфузию в дозе 90 мг в течение 2 ч. Одновременное введение гепаринов не обязательно. Противопоказания, побочные эффекты, предостережения, взаимодействие - см. «Стрептокиназа». Возможна инфузия до 50 мг в течение 15 мин при крайне тяжелом состоянии больного или на фоне реанимационных мероприятий.
В отличие от стрептокиназы, алтеплаза не иммуногенна и может использоваться повторно. Тканевые активаторы плазминогена при массивной ТЭЛА и длительности заболевания более 5 сут менее эффективны по сравнению с фибриннеспецифичными препаратами.
-
Урокиназа. Больным с массивной ТЭЛА и выраженными нарушениями гемодинамики показан «ускоренный» режим введения препарата (внутривенная инфузия 3 000 000 МЕ за 2 ч). В других случаях возможно проведение инфузии 4400 МЕ/кг за 15-20 мин с переходом на введение 4400 МЕ/кг в час в течение 12-24 ч.
Противопоказания, побочные эффекты, предостережения, взаимодействие см. «Стрептокиназа». В отличие от стрептокиназы, урокиназа не иммуногенна и может использоваться повторно.
Последствия перенесенной тромбоэмболии легочных артерий и ее ветвей
Если тромбоэмболы не лизируются, а подвергаются соединительнотканной трансформации, то формируется персистирующая окклюзия (полная или частичная), которая становится причиной развития хронической постэмболической легочной гипертензии. Она возникает у 10% лиц, перенесших эмболию крупных легочных артерий. В случае поражения легочного ствола и его главных ветвей четырехлетняя выживаемость составляет всего 20%.
Для клинической картины характерно появление прогрессирующей одышки и признаков правожелудочковой недостаточности. Отсутствие признаков перенесенной ранее ТЭЛА и клинической картины посттромботической болезни нижних конечностей не исключает хронической постэмболической легочной гипертензии.
Окончательная верификация диагноза возможна только с помощью ЭхоКГ, зондирования правых отделов сердца, ангиопульмонографии, контрастной КТ.
Добиться снижения уровня легочной гипертензии можно медикаментозно или путем хирургического вмешательства - тромбэндартерэктомии, баллонной ангиопластики или пересадки легких и сердца. Легочную тромбэндартерэктомию выполняют у пациентов с симптомами сердечно-легочной недостаточности, у которых имеются гемодинамические или вентиляционные нарушения в состоянии покоя или при физической нагрузке, при сосудистом сопротивлении от 700 до 1100 дин/с/см-5, а также пациентам с нормальной или почти нормальной легочной гемодинамикой в покое с легочной гипертензией при физической нагрузке. Баллонная ангиопластика является альтернативой оперативному лечению у отдельных неоперабельных пациентов или при стойкой легочной гипертензии после тромбэндартерэктомии в случае неустраненного стеноза крупных легочных артерий. Однако опыт этой эндоваскулярной манипуляции очень ограничен, и ее редко выполняют.
Трансплантация показана пациентам с ожидаемой продолжительностью жизни <1 года, в соответствии с функциональными классами III или IV по NYHA, при недавнем усилении одышки и ухудшении гемодинамических параметров, таких как давление в правом предсердии >12 мм рт.ст., АД в легочной артерии >60 мм рт.ст., СИ <2,2 л/мин/м2.
Консервативную терапию проводят при подготовке к хирургическому вмешательству либо при наличии противопоказаний к его выполнению. Используют аналоги простациклина, антагонисты эндотелиальных рецепторов, ингибиторы фосфодиэстеразы 5-го типа, блокаторы кальциевых каналов и стимулятор растворимой гуанилатциклазы. На сегодняшний день последний наиболее эффективен.
Профилактика
Первичная профилактика.
-
Максимально ранняя активизация больных и сокращение длительности постельного режима (уровень достоверности доказательств - А).
-
Проведение прерывистой пневматической компрессии ног (уровень достоверности доказательств - B).
-
Назначение антикоагулянтов в профилактических дозах (см. табл. 7.14) пациентам группы риска развития венозного тромбоза (возраст старше 40 лет, наличие злокачественных новообразований, СН, паралича, перенесенные ранее венозный тромбоз и ТЭЛА, планируемые длительные оперативные вмешательства и др.).
Все перечисленные мероприятия должны проводиться в полном объеме до полной активизации больного. Вторичная профилактика.
-
При обнаружении флотирующих тромбов в ряде случаев показано хирургическое вмешательство, направленное на предотвращение возможной миграции тромба, - прямые (перевязка вены или ее пликация, удаление флотирующей части тромба) или эндоваскулярные (тромбэктомия с использованием тромбэкстрактора или имплантация различных фильтров) методы. Если необходима ТЛТ, хирургическую профилактику рецидива ТЭЛА целесообразно выполнять после тромболизиса.
-
Всем больным, перенесшим ТЭЛА, назначают антагонисты витамина К под контролем МНО (2,0-3,0) или новые оральные антикоагулянты на срок не менее 3 мес (уровень достоверности доказательств - А).
Список литературы
-
Флебология : руководство для врачей / под ред. В.С. Савельева. М. : Медицина, 2001. 664 с.
-
Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО) // Флебология. 2015. №4. Вып. 2.
-
Levine M.N., Raskob G., Landefeld S. et al. Hemorrhagic complications of anticoagulant treatment // Chest. 2001. Vol. 119. P. 108-121.
-
Anderson D.R., Levine M.N. Thrombolytic therapy for the treatment of acute pulmonary embolism // Can. Med. Assoc. J. 1992. Vol. 146. P. 1317-1324.
-
Goldhaber S.Z., Haire W.D., Feldstein M.L. et al. Alteplase versus heparin in acute pulmonary embolism: randomized trial assessing right-ventricular function and pulmonary perfusion // Lancet. 1993. Vol. 341. P. 507-511.
-
Meyer G., Tamisier D., Sors H. et al. Pulmonary embolectomy: a 20-year experience at one center // Ann. Thorac. Surg. 1991. Vol. 51. P. 232-236.
-
Masuda M., Nakajima N. Our experience of surgical treatment for chronic pulmonary thromboembolism // Ann. Thorac. Cardiovasc. Surg. 2001. Vol. 7. P. 261-265.
-
Barrios D., Rosa-Salazar V., Morillo R. et al. Prognostic significance of right heart thrombi in patients with acute symptomatic pulmonary embolism: systematic review and meta-analysis // Chest. 2017. Vol. 151. P. 409-416.
-
Jimenez D., Bikdeli B., Barrios D. et al. Management appropriateness and outcomes of patients with acute pulmonary embolism // Eur. Respir. J. 2018. Vol. 51. doi: 10.1183/13993003.00445-2018.
-
Aujesky D., Obrosky D.S., Stone R.A. et al. Derivation and validation of a prognostic model for pulmonary embolism // Am. J. Respir. Crit. Care Med. 2005. Vol. 172. P. 1041-1046.
-
Wicki J., Perrier A., Perneger T.V. et al. Predicting adverse outcome in patients with acute pulmonary embolism: a risk score // Thromb. Haemost. 2000. Vol. 84. P. 548-552.
-
Uresandi F., Otero R., Cayuela A. et al. A clinical prediction rule for identifying short-term risk of adverse events in patients with pulmonary thromboembolism // Arch. Bronconeumol. 2007. Vol. 43. P. 617-622.
-
Jimenez D., Kopecna D., Tapson V. et al. Derivation and validation of multimarker prognostication for normotensive patients with acute symptomatic pulmonary embolism // Am. J. Respir. Crit. Care. Med. 2014. Vol. 189. P. 718-726.
-
Jimenez D., Lobo J.L., Fernandez-Golfin C. et al. Effectiveness of prognosticating pulmonary embolism using the ESC algorithm and the Bova score // Thromb. Haemost. 2016. Vol. 115. P. 827-834.
-
Jimenez D., Aujesky D., Moores L. et al. Simplification of the pulmonary embolism severity index for prognostication in patients with acute symptomatic pulmonary embolism // Arch. Intern. Med. 2010. Vol. 170. P. 1383-1389.
-
Kohn C.G., Mearns E.S., Parker M.W. et al. Prognostic accuracy of clinical prediction rules for early post-pulmonary embolism all-cause mortality: a bivariate meta-analysis // Chest. 2015. Vol. 147. P. 1043-1062.
-
Tapson V.F., Platt D.M., Xia F. et al. Monitoring for pulmonary hypertension following pulmonary embolism: The INFORM Study // Am. J. Med. 2016. Vol. 129. P. 978-985.