Интенсивная терапия : национальное руководство : в 2 т. / под ред. И. Б. Заболотских, Д. Н. Проценко. - 2-е изд., перераб. и доп. - Москва : ГЭОТАР-Медиа, 2022. - Т. 1. - 1152 с. : ил. - (Серия "Национальные руководства"). - ISBN 978-5-9704-7190-6. |
Аннотация
Второе издание национального руководства "Интенсивная терапия" содержит современную информацию о диагностике и лечении критических состояний различной этиологии и патогенеза. Особое внимание уделено особенностям интенсивной терапии в периоперационный период у пациентов с сопутствующими заболеваниями. Благодаря объединению усилий ведущих специалистов России удалось отразить согласованную позицию по актуальным вопросам современной реаниматологии и интенсивной терапии и учесть сведения доказательной медицины. Все главы прошли этап независимого рецензирования.
Издание предназначено, прежде всего, анестезиологам-реаниматологам, а также врачам всех специальностей, студентам старших курсов медицинских вузов, клиническим ординаторам, аспирантам.
3.7. СОПУТСТВУЮЩИЕ ЗАБОЛЕВАНИЯ СИСТЕМЫ КРОВООБРАЩЕНИЯ
В.И. Потиевская, А.Е. Баутин
Сердечно-сосудистые заболевания являются основной причиной смертности трудоспособного населения в современном мире, причем в России этот показатель остается очень высоким (около 1500 человек в год). Высокая распространенность кардиальной патологии предопределяет ее встречаемость среди пациентов, в связи с чем лечение сопутствующих сердечно-сосудистых заболеваний является актуальной задачей для анестезиологов-реаниматологов.
В то же время в отечественных руководствах по кардиологии и интенсивной терапии недостаточно освещены особенности стратегии и тактики ведения пациентов с сопутствующими сердечно-сосудистыми заболеваниями в периоперационном периоде. В связи с этим возникла необходимость включения данного раздела в национальное руководство по интенсивной терапии, созданное для анестезиологов-реаниматологов, не имеющих специализации по кардиологии. Не возникает сомнений, что анестезиологи-реаниматологи должны владеть основами знаний по неотложной кардиологии, проводить экстренное лечение и решать вопрос о возможности выполнения плановых хирургических вмешательств с привлечением консультанта-кардиолога.
Артериальная гипертензия
АГ определяется как повышение САД >140 мм рт.ст. и/или диастолического артериального давления (ДАД) >90 мм рт.ст. независимо от возраста. Если повышенное АД сохраняется в течение двух или более месяцев, то этот временной интервал может быть расценен как стабильная АГ [1, 2].
КЛАССИФИКАЦИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
Классификация АГ у пациентов старше 18 лет в зависимости от уровня АД представлена в табл. 3.16 и 3.17. Если уровни САД и ДАД попадают в разные категории, необходимо устанавливать степень АГ по более высокой категории.
СТАДИИ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
Выделяют несколько стадий АГ (табл. 3.17).
К ассоциированным клиническим состояниям относятся:
-
цереброваскулярная болезнь (ишемический и геморрагический мозговой инсульт, транзиторная ишемическая атака);
-
заболевания сердца [ИМ, стенокардия, коронарная реваскуляризация, хроническая сердечная недостаточность (ХСН)];
-
заболевания почек (диабетическая нефропатия, почечная недостаточность: сывороточный креатинин >133 мкмоль/л (1,5 мг/дл) для мужчин и >124 мкмоль/л (1,4 мг/дл) для женщин;
-
заболевания периферических артерий (расслаивающая аневризма аорты, симптомное поражение периферических артерий);
-
гипертоническая ретинопатия (кровоизлияния или экссудаты, отек соска зрительного нерва).
| Категория АД | САД, мм рт.ст. | ДАД, мм рт.ст. | |
|---|---|---|---|
Оптимальное |
<120 |
и |
<80 |
Нормальное |
120-129 |
и/или |
<84 |
Высокое нормальное |
130-139 |
и/или |
85-89 |
АГ 1-й степени |
140-159 |
и/или |
90-99 |
АГ 2-й степени |
160-179 |
и/или |
100-109 |
АГ 3-й степени |
>180 |
и/или |
>110 |
Изолированная систолическая АГ* |
>140 |
и/или |
<90 |
* Изолированная систолическая АГ должна классифицироваться на 1-ю, 2-ю, 3-ю степень согласно уровню САД.
| Стадия АГ | Изменения в организме |
|---|---|
I |
Отсутствие поражений органов-мишеней |
II |
Поражение одного или нескольких органов-мишеней |
III |
Наличие ассоциированных клинических состояний |
Вторичная гипертензия
При вторичной (симптоматической) гипертензии повышение АД чаще является симптомом поражения органов (почек, артериальных сосудов, эндокринных желез) либо может быть вызвано другими причинами.
ЦЕЛЕВОЙ УРОВЕНЬ АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
Во время операции необходимо не допускать снижения САД более 20% от исходного уровня, а ДАД - менее 70 мм рт.ст. [3]. Чрезмерно агрессивная «нормализация» послеоперационной систолической гипертензии может привести к выраженной клинически значимой диастолической гипотензии и гипоперфузии миокарда. Увеличение пульсового давления является предиктором неблагоприятных сердечно-сосудистых событий и маркером выделения пациентов с изолированной систолической гипертензией. Обнаружено, что при лечении изолированной систолической гипертензии понижение ДАД всего на 5 мм рт.ст. значительно увеличивает риск коронарного поражения сердца и инсульта.
НЕОТЛОЖНЫЕ СОСТОЯНИЯ ПРИ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
К неотложным состояниям при АГ относится выраженное повышение САД или ДАД (>180 мм рт.ст. или >120 мм рт.ст. соответственно), сопровождающееся угрозой или прогрессированием поражения органов-мишеней [2], или осложненные гипертонические кризы [1]. К осложненным гипертоническим кризам относятся состояния при резком повышении АД, сопровождающиеся развитием:
а также при:
Лечение резких подъемов артериального давления без признаков поражения органов-мишеней
В рекомендациях Российского медицинского общества по артериальной гипертонии эти состояния определены как неосложненные гипертонические кризы [1]. Подобные клинические ситуации часто развиваются на фоне перерыва в терапии, снижения дозы препаратов, а также тревоги и не относятся к неотложным ситуациям. Повышение АД подлежит коррекции путем возобновления или интенсификации медикаментозной терапии и купирования тревоги [2].
Для медикаментозной терапии в таких случаях рекомендовано пероральное назначение препаратов (табл. 3.18). В первые 2 ч АД необходимо снизить не более чем на 25%, целевые значения АД должны быть достигнуты постепенно [4].
Проведение планового хирургического вмешательства возможно при АД ниже 180/110 мм рт.ст. При возникновении повышения АД при поступлении в операционную в случае АД выше указанных цифр оперативное лечение должно быть отложено до снижения АД до нормальных значений. При экстренных оперативных вмешательствах проводится снижение АД с помощью парентерального введения препаратов. При наличии тахикардии могут быть использованы β-блокаторы [метопролол (Беталок♠), эсмолол], при сопутствующей ИБС и отсутствии повышения ВЧД - нитраты (нитроглицерин), а также эналаприлат, α-адреноблокатор урапидил (Эбрантил♠), магния сульфат или другие препараты, рекомендованные для лечения неотложных состояний при АГ (табл. 3.19).
Лечение резких повышений артериального давления, сопровождающихся признаками поражения органов-мишеней
Резкие повышения артериального давления, сопровождающиеся признаками поражения органов-мишеней, относятся к неотложным состояниям при АГ [2]. Эти клинические ситуации отличаются стремительным повышением САД выше 180 мм рт.ст., ДАД выше 120 мм рт.ст. (у беременных - выше 109 мм рт.ст.). На этом фоне происходит острое или продолжающееся повреждение органов-мишеней (см. выше).
Лечение начинается немедленно, АД должно быть снижено не более чем на 25% в течение 1-2 ч. Резкое дальнейшее снижение АД до нормотензивного уровня может спровоцировать развитие коронарной или церебральной ишемии. Оптимально проведение антигипертензивной терапии постоянной инфузией короткодействующих агентов под контролем АД в условиях отделения или палаты интенсивной терапии (табл. 3.19). Нерационально сублингвальное (в частности, короткодействующий нифедипин) и в/м применение вследствие непредсказуемой фармакодинамики.
Важные особенности имеет тактика антигипертензивной терапии при расслаивающей аневризме аорты: в отличие от всех других клинических состояний, в этой ситуации необходимо очень быстрое снижение АД - на 25% в течение 5-10 мин и до целевых значений (САД 100-110 мм рт.ст. за 20 мин). Более быстрым должно быть снижение АД также при острой левожелудочковой недостаточности (ОЛ) [5]. При остром инсульте снижение АД должно быть медленным и постепенным. Рекомендации по выбору препаратов для неотложной терапии резких повышений АД с поражением органов-мишеней при различных клинических ситуациях представлены в табл. 3.20.
| Препарат | Дозы | Начало действия, мин | Длительность действия | Побочные эффекты | Комментарии |
|---|---|---|---|---|---|
Клонидин |
0,075-0,15 мг (п/о или с/л), ежечасно до общей дозы 0,8 мг |
30-60 |
Более 4 ч |
ep> Угнетение ЦНС, брадикардия, гипотензия |
Ограниченная польза за счет медленного начала и длительного действия |
Каптоприл |
12,5-25 мг (п/о или с/л), повторно через 30-60 мин |
30-60 |
30-60 мин |
Гипотензия, почечная дисфункция, гиперкалиемия |
Противопоказан при двустороннем стенозе почечных артерий |
Нифедипин |
10 мг, повторно через 30-60 мин |
20-30 |
30-60 мин |
Внезапное снижение АД, тахикардия, ишемия миокарда |
Противопоказан при тяжелой СН, тяжелом аортальном стенозе, ишемии миокарда |
Пропранолол |
20 мг с/л, повторно через 30-60 мин, до 80 мг |
10 |
4 ч |
Брадикардия |
Противопоказан при: бронхообструктивном синдроме; АВ-блокадах II-III степени; синдроме слабости синусного узла; выраженной синусовой брадикардии (ЧСС менее 60 уд/мин) |
Моксонидин |
0,2-0,4 г однократно |
30 |
6 ч |
Головная боль, седативный эффект, сонливость, чрезмерно выраженное снижение АД, головокружение, общая слабость, брадикардия, сухость во рту, рвота |
Противопоказан при АВ-блокаде и синоатриальной блокаде II и III степени, синдроме слабости синусового узла (СССУ), выраженной брадикардии (ЧСС <50), ХСН III-IV ФК (nyhA), тяжелой печеночной, почечной недостаточности (СКФ <30 мл/мин, креатинин >160 мл/мин), беременности, лактации, возрасте до 18 лет, одновременном приеме трициклических антидепрессантов (ТЦА) |
Примечание. NYHA (New York Heart Association) - классификация Нью-Йоркской ассоциации кардиологов.
| Класс | Препарат | Режим дозирования | Комментарии |
|---|---|---|---|
Нитраты |
Натрия нитропруссид |
Начальная доза 0,3-0,5 мкг/кг/мин, максимальная - 10 мкг/кг/мин. Титруют до достижения целевого уровня АД |
Для предотвращения передозировки рекомендуется инвазивный мониторинг Ад. При длительном применении часто развивается тахифилаксия. При скорости введения более 4 мкг/кг/мин или длительности введения более 30 мин возрастает риск появления токсических эффектов цианидов |
Нитроглицерин |
Начальная дозировка составляет 0,3-0,5 мкг/кг/мин, максимальная - 1,5 мкг/кг/мин |
Рекомендуется использовать только у пациентов с ОКС или ОЛ (острой левожелудочковой недостаточностью). Не рекомендуется использовать при гиповолемии |
|
Прямые вазодилататоры |
Гидралазин |
Начальная доза составляет 10 мг в/в, медленно, болюсно (максимальная начальная доза составляет 20 мг); при необходимости повторяют каждые 4-6 ч |
АД начинает снижаться в течение 10-30 мин, действие длится 2-4 ч. Непредсказуемость ответа и продолжительности действия не позволяют считать гидралазин препаратом первой линии для экстренного снижения АД |
β1-Селективные адреноблокаторы |
Эсмолол |
Нагрузочная доза составляет 500 мкг/кг, вводят за 1 мин, далее - инфузия в 50 мкг/кг/мин. При необходимости дозу увеличивают до достижения максимальной в 200 мкг/кг/мин |
Противопоказан для пациентов с базовой терапией β-блокаторами, значимой брадикардией или декомпенсированной СН. Высокие дозы препарата могут ингибировать также и β2-рецепторы, что может привести к нарушению функции внешнего дыхания у предрасположенных пациентов |
α-Неселективные адреноблокаторы |
Фентоламин |
В/в, болюс 5 мг. Дополнительные болюсы каждые 10 мин до достижения целевого уровня АД |
Используется при состояниях, вызванных избытком катехоламинов (феохромоцитома, взаимодействие между блокаторами моноаминоксидазы (МАО) и пищевыми продуктами, токсические эффекты кокаина, передозировка амфетамина, синдром рикошета при резкой отмене клонидина) |
α1-Адреноблокаторы |
Урапидил |
25 (10-50) мг в/в медленно, поддержание ~9 мг/ч в/в |
Показан также для купирования рефрактерной гипертензии |
Ингибиторы ангиотен-зинпревращающего фермента (ИАПФ) |
Эналаприлат |
Начальный болюс 1,25 мг за 5 мин. Доза может быть увеличена до 5 мг каждые 6 ч для достижения требуемого уровня АД |
Противопоказан при беременности. Не рекомендуется в острой стадии ИМ и при двухстороннем стенозе почечных артерий. Эффективен при высоком уровне и активности ренина плазмы крови. Препарат характеризуется отсроченным началом действия (15 мин) и непредсказуемостью гипотензивного ответа |
Вазодилататор с седативным эффектом |
Магния сульфат |
1-2 г/ч |
Побочные явления включают гипермагниемию, угнетение дыхательного центра, выраженную брадикардию, АВ-блокаду |
Дигидропиридиновые блокаторы кальциевых каналов |
Нифедипин |
Инфузия 0,63-1,25 мг/ч. Суточная доза препарата не должна превышать 30 мг |
Противопоказан в остром периоде ИМ, при ХСН в стадии декомпенсации |
| Этиология АГ/ повреждение органов-мишеней | Препараты выбора | Предостережения | Примечания |
|---|---|---|---|
Энцефалопатия и ВЧГ |
Натрия нитропруссид, нифедипин |
Церебральная ишемия может быть результатом снижения АД, что изменяет ауторегуляцию. Риск цианидной токсичности. Натрия нитропруссид увеличивает интракраниальное давление |
Снижение давления может уменьшить внутрицеребральное кровотечение |
Миокардиальная ишемия |
Нитроглицерин |
В случае ОСН избегать назначения β-адреноблокаторов |
Антагонисты кальция противопоказаны |
ОЛ |
Нитроглицерин, натрия нитропруссид |
В случае ОСН избегать назначения β-адреноблокаторов |
Антагонисты кальция противопоказаны |
Расслоение аорты |
Эсмолол, нифедипин |
Вазодилататоры могут быть причиной рефлекторной тахикардии |
Цель: уменьшить силу сокращения ЛЖ |
Почечная недостаточность |
Нифедипин |
При использовании фенолдопамаp развивается тахифилаксия |
Может потребоваться ГД. Избегать назначения ИАПФ и блокаторов ангиотензиновых рецепторов |
Преэклампсия и эклампсия |
Метилдопа, гидралазин, магния сульфат, нифедипин |
Блокаторы кальциевых каналов могут подавлять родовую деятельность |
ИАПФ и блокаторы рениновых рецепторов противопоказаны |
Феохромоцитома |
Фентоламин; пропранолол |
Использование α-адренергических препаратов после β-блокаторов усугубляет гипертензию |
После купирования неотложного состояния пациенту должна быть продолжена (или назначена, если не проводилась ранее) базовая антигипертензивная терапия после консультации кардиолога или терапевта. В предоперационном периоде базовая антигипертензивная терапия должна продолжаться до дня оперативного вмешательства. В день операции все препараты, кроме β-адреноблокаторов, должны быть отменены. β-Адреноблокаторы назначаются в день операции утром перорально в обычной или более низкой дозировке с учетом риска развития артериальной гипотензии. После операции базовая терапия должна быть возобновлена при возможности перорального приема препаратов и отсутствии артериальной гипотензии или нестабильности системной гемодинамики. При необходимости назначается консультация кардиолога для коррекции лечения.
Антигипертензивная терапия при сопутствующих заболеваниях
При проведении антигипертензивной терапии следует учитывать особенности имеющихся у пациентов сопутствующих заболеваний. Информация о выборе препаратов в подобных клинических ситуациях представлена в табл. 3.21 и 3.22.
| Клиническая ситуация | Препарат |
|---|---|
Бессимптомное поражение органов-мишеней |
|
ГЛЖ |
ИАПФ, АК, АРА |
Бессимптомный атеросклероз |
АК, ИАПФ |
Микроальбуминурия |
ИАПФ, АРА |
Нарушение функции почек |
ИАПФ, АРА |
Сердечно-сосудистые заболевания |
|
Инсульт в анамнезе |
Любой препарат, эффективно снижающий АД |
ИМ в анамнезе |
ББ, ИАПФ, АРА |
Стенокардия |
ББ, АК |
СН |
Диуретик, ББ, ИАПФ, АРА, антагонисты минералокортикоидных рецепторов |
Аневризма аорты |
ББ |
Сердечно-сосудистые заболевания |
|
Фибрилляция предсердий (ФП), профилактика |
ИАПФ, АРА, ББ |
ФП, контроль ритма желудочков |
ББ, недигидропиридиновые АК |
ТСБП/протеинурия |
ИАПФ, АРА |
Периферическое поражение артерий |
ИАПФ, АК |
Другие клинические ситуации |
|
ИСАГ (пожилой и старческий возраст) |
Диуретик, АК |
Митральный стеноз |
ИАПФ, АРА, АК |
СД |
ИАПФ, АРА |
Беременность |
Метилдопа, ББ, АК |
Негроидная раса |
Диуретик, АК |
Примечание. ИАПФ - ингибитор ангиотензинпревращающего фермента; АРА - антагонист рецепторов ангиотензина IIАК - антагонисты кальция, ББ - β-блокаторы; ТБСП - терминальная стадия болезни почек; ИСАГ - изолированная систолическая артериальная гипертензия; ГЛЖ - гипертрофия левого желудочка.
Ишемическая болезнь сердца
Ключевым положением терапии ИБС считается поддержание адекватного кислородного баланса: повышение доставки и снижение потребления кислорода миокардом. В условиях, когда доставка кислорода к миокарду ограничена поражением коронарных артерий, снижение АД уменьшает ишемию и риск осложнений за счет ограничения потребления и восстановления баланса. Однако выраженное снижение ДАД (менее 60 мм рт.ст.) может увеличить риск осложнений вследствие падения коронарного перфузионного давления (КПД = ДАД - КДД[9] ЛЖ) и уменьшения доставки кислорода к миокарду. При отсутствии противопоказаний у пациентов с ИБС терапию следует начинать с β-адреноблокаторов под контролем частоты и ритма сокращений сердца. При стабильной стенокардии рекомендовано также назначение антагонистов кальция или комбинации препаратов. У пациентов после ИМ β-адреноблокаторы, ИАПФ и БРА уменьшают риск смерти, эффективны также антагонисты альдостерона [2].
| Класс препаратов | Абсолютные противопоказания | Относительные противопоказания |
|---|---|---|
Тиазидные диуретики |
Подагра |
Метаболический синдром, нарушенная толерантность к глюкозе, дислипидемия, беременность |
ББ |
АВ-блокада и СА блокада 3 - II-III степени, выраженная брадикардия (ЧСС менее 60 в 1 минуту) БА |
Заболевания периферических артерий, метаболический синдром, нарушенная толерантность к глюкозе, спортсмены и физически активные пациенты |
АК дигидропиридиновые |
- |
Тахиаритмии, ХСН |
АК недигидропиридиновые |
АВ-блокада и СА-блокада - II-III степени, выраженная брадикардия (ЧСС менее 60 в 1 минуту) ХСН со сниженной систолической функцией (ФВ <40%) |
- |
ИАПФ |
Беременность, гиперкалиемия, двусторонний стеноз почечных артерий, ангионевротический отек |
- |
Блокаторы рецепторов ангиотензина (БРА) |
Беременность, гиперкалиемия, двусторонний стеноз почечных артерий |
- |
Диуретики, антагонисты альдостерона |
Гиперкалиемия, ХПН |
- |
Если при подготовке пациента с ИБС и ишемией миокарда к плановой операции β-адреноблокаторы назначаются впервые, необходим подбор дозы. В этих ситуациях лечение должно быть начато не ранее, чем за 1 день до операции, оптимально - за 1 нед до операции. В случае перорального введения препаратами выбора являются бисопролол и атенолол. Лечение начинается с низких доз до достижения ЧСС 60-70 в минуту и САД не ниже 100 мм рт.ст. [6].
Хроническая сердечная недостаточность
До 40-50% пациентов с хронической сердечной недостаточностью (ХСН) имеют сохраненную систолическую функцию - СН манифестирует гипертензией, дилатацией ЛЖ и изолированной диастолической дисфункцией. Базисная терапия, соответствующая современным международным рекомендациям [8], описана в разделе «Хроническая сердечная недостаточность» настоящей главы. Она предполагает сочетание ИАПФ, β-блокаторов, антагонистов рецепторов минералокортикоидов и диуретиков, при этом контроль АД является обязательным условием эффективного лечения ХСН. Недигидропиридиновые антагонисты кальция (верапамил, дилтиазем) а также α-адреноблокаторы и препараты центрального действия (моксонидин) не используются, так как они могут ухудшать сократительную способность миокарда и усугублять систолическую СН. Целевое АД при ХСН не определено, снижение АД проводится по общим принципам.
Сахарный диабет
АГ характерна для больных СД, с другой стороны, у пациентов с АГ диабет развивается в 2,5 раза чаще. При СД отсутствует нормальное ночное снижение АД, часто сопутствует поражение почек с альбуминурией и/или почечной недостаточностью. ИАПФ и БРА - важный компонент терапии у больных диабетом, при наличии поражения коронарных сосудов показаны β-адреноблокаторы (небиволол, карведилол). Возможно назначение блокаторов кальциевых каналов.
Хроническая почечная недостаточность
Связанное с возрастом снижение функции почек (уменьшение СКФ на 1-2 мл/мин в год) усугубляется при АГ, и при отсутствии контроля снижение функции может ускоряться до 4-8 мл/мин в год. Рекомендованы ИАПФ или БРА в комбинации с диуретиками (чаще петлевыми). Дополнительно: при тяжелой ХПН повышен риск гиперкалиемии, поэтому ИАПФ и БРА назначаются с осторожностью. Предпочтение следует отдавать препаратам с преимущественно внепочечным путем выведения. Также необходим контроль за уровнем креатинина крови, при повышении на 50% и более препараты указанных групп должны быть отменены.
Цереброваскулярные заболевания
Не доказано преимуществ того или иного препарата в профилактике инсульта. Пациенты с цереброваскулярными заболеваниями предрасположены к повышению АД в раннем послеоперационном периоде. Антигипертензивная терапия, как правило, не показана в остром периоде мозгового инсульта и начинается только после стабилизации состояния пациента. При значительном повышении АД (при ишемическом инсульте САД >220 мм рт.ст. или ДАД >120-140 мм рт.ст.) рекомендуется снижение АД на 10-15% под контролем неврологической симптоматики (при низком АД симптоматика может усугубиться за счет снижения центрального перфузионного давления).
Артериальная гипертензия у беременных
Препарат первого выбора при лечении беременных - метилдопа. Препарат нежелательно использовать на 16-20-й неделе беременности в связи с возможностью влияния на содержание допамина у плода. Препаратом второго выбора является нифедипин, возможно использование его пролонгированных форм. Показано также применение таких β-адреноблокаторов, как ацебутолол, метопролол, атенолол. Неселективные β-адреноблокаторы (пропранолол) использовать нежелательно, так как они усиливают сократительную активность матки. Диуретики назначают только при хронической АГ при гиперволемии и отсутствии синдрома задержки роста плода, а также при ХСН. Противопоказано назначение ИАПФ, БРА и препаратов раувольфии в связи с их потенциальным тератогенным действием на плод. Не рекомендованы также индапамид и агонисты имидазолиновых рецепторов, так как их влияние на организм беременной и плода не изучено.
Артериальная гипертензия у пожилых
Начальные дозы антигипертензивных препаратов у пожилых должны быть снижены из-за высокого риска развития побочных эффектов. Необходимо помнить, что снижение ДАД менее 60-70 мм рт.ст. ухудшает прогноз. В настоящее время не доказано, что различные классы антигипертензивных препаратов существенно различаются по своей способности снижать АД и обеспечивать протекцию органов-мишеней у молодых и пожилых пациентов. В то же время для лечения изолированной систолической гипертензии наиболее эффективны дигидропиридиновые антагонисты кальция, тиазидные диуретики и БРА. Показано, что препарат индапамид достоверно снижает общую смертность и риск развития сердечно-сосудистых осложнений у лиц старше 80 лет.
Артериальная гипертензия при заболеваниях легких
При ХОБЛ и БА препаратами выбора являются БРА и антагонисты кальция. При наличии обоснованных показаний больным с ХОБЛ могут быть назначены β-адреноблокаторы [метопролол (Метопролола сукцинат♠) замедленного высвобождения, небиволол, карведилол, бисопролол], ИАПФ, диуретики. Лекарственные препараты, используемые для лечения бронхообструктивного синдрома, часто повышают АД. Наиболее безопасными в этом отношении являются ипратропия бромид и ингаляционные глюкокортикоиды.
ПОСЛЕОПЕРАЦИОННАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ
Помимо стандартных подходов к ведению послеоперационного периода, у пациентов с АГ необходимо обратить особое внимание на своевременность и адекватность обезболивания, так как боль может вызвать гипертензивную реакцию. Если интраоперационно использовали инвазивный мониторинг АД и параметров центральной гемодинамики, он должен быть продолжен в раннем послеоперационном периоде. Следует продолжить обычную гипотензивную терапию, при необходимости дополнительно могут быть использованы препараты для неотложного лечения артериальной гипертензии (табл. 3.18, 3.19). Внутривенные гипотензивные препараты предпочтительнее пероральных форм при условии, что пациенту будет осуществляться тщательный мониторинг. Выбор антигипертензивных препаратов зависит от повреждения органов-мишеней под действием АГ (табл. 3.20).
Изменения артериального давления в послеоперационном периоде
Послеоперационная гипертензия
Встречаемость: у 75% пациентов в раннем послеоперационном периоде, чаще в первые 2 ч после операции. Обычно купируется менее чем за 6 ч. Наибольший риск развития этого состояния характерен для обширных сосудистых операций. Послеоперационная гипертензия опасна вследствие возможности развития осложнений: кровотечения по линии шва, несостоятельности сосудистого шва, внутримозгового кровотечения, левожелудочковой дисфункции, ИМ, ОЛ. Причины: повышение системного сосудистого сопротивления в ответ на циркулирующие стрессорные гормоны, активация ренин-ангиотензин-альдостероновой системы, изменение функции барорецепторов после некоторых видов операций, нарушение дыхания (гипоксемия, гиперкапния), озноб на фоне интраоперационной гипотермии, боль, возбуждение, беспокойство, гиперволемия, тошнота, растяжение мочевого пузыря.
Лечение заключается, прежде всего, в устранении очевидной причины. Подходы к терапии сходны с таковыми при лечении резкого повышения АД с признаками повреждения органов-мишеней, указания по назначению лекарственных препаратов представлены в табл. 3.19 и 3.20. Следует помнить, что чрезмерно агрессивная «нормализация» послеоперационной систолической гипертензии может привести к выраженной клинически значимой диастолической гипотензии и гипоперфузии миокарда [9].
Послеоперационная гипотензия
Причины послеоперационной гипотензии.
-
К частым относятся гиповолемия (кровопотеря, потеря жидкости в третье пространство), вазодилатация (субарахноидальная или эпидуральная блокада), остаточные действия анестетиков и анальгетиков, сепсис, анафилаксия.
-
К нечастым относятся аритмии, ишемия/ИМ, СН, напряженный пневмоторакс, легочная эмболия, тампонада сердца, гипотиреоидное состояние.
Лечение. При гиповолемии (тахикардии, низком ЦВД, снижении диуреза, плохой периферической перфузии, явной кровопотере) рекомендуется инфузионная терапия болюсами по 250-500 мл. При недостаточном ответе на инфузионную терапию - мониторинг ЦВД. При нарушенной функции ЛЖ - терапия под контролем показателей центральной гемодинамики. При продолжающейся кровопотере - повторное хирургическое вмешательство.
Ишемическая болезнь сердца
КОДЫ ПО МЕЖДУНАРОДНОЙ КЛАССИФИКАЦИИ БОЛЕЗНЕЙ 10-ГО ПЕРЕСМОТРА
МКБ-10: Класс 9. Болезни системы кровообращения.
I20-I25 Ишемическая болезнь сердца.
I20.0 Нестабильная стенокардия (нарастающая, напряжения, впервые возникшая, стенокардия напряжения прогрессирующая).
I20.1 Стенокардия с документально подтвержденным спазмом (ангиоспастическая, Принцметала, обусловленная спазмом, вариантная).
I20.8 Другие формы стенокардии.
I21.0-I21.4 Различные формы острого трансмурального инфаркта миокарда.
I21.5 Инфаркт миокарда без подъема сегмента ST.
I21.6 Нетрансмуральный инфаркт миокарда.
I21.9 Острый инфаркт миокарда неуточненный.
I22.0-I22.9 Различные формы повторного инфаркта миокарда.
I23.0-I23.8 Различные текущие осложнения острого инфаркта миокарда.
I24.0 Коронарный тромбоз, не приводящий к инфаркту миокарда.
I24.1 Синдром Дресслера.
I24.8 Другие формы острой ишемической болезни сердца.
I24.9 Острая ишемическая болезнь сердца неуточненная.
I25.0-I25.1 Атеросклеротическая сердечно-сосудистая болезнь.
I25.2 Перенесенный в прошлом инфаркт миокарда.
I25.3 Аневризма сердца (аневризма стенки, аневризма вентрикулярная).
I25.4 Аневризма коронарной артерии и расслоение.
I25.5 Ишемическая кардиомиопатия.
I25.6 Бессимптомная ишемия миокарда.
I25.8 Другие формы хронической ишемической болезни сердца.
I25.9 Хроническая ишемическая болезнь сердца неуточненная.
ОПРЕДЕЛЕНИЕ
Ишемическая болезнь сердца (ИБС) - очень распространенное заболевание, одна из основных причин смертности, а также временной и стойкой утраты трудоспособности населения в развитых странах мира. В Европе ИБС и инсульт ГМ определяют 90% от всех заболеваний сердечно-сосудистой системы. Как следствие вышеизложенного, ИБС с высокой частотой встречается в качестве сопутствующего заболевания, способного самым серьезным образом осложнить течение основного патологического процесса, который привел к необходимости госпитализации.
ИБС - патологическое состояние, характеризующееся абсолютным или относительным нарушением кровоснабжения миокарда вследствие поражения коронарных артерий.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
ИБС представляет собой поражение миокарда, обусловленное расстройством коронарного кровообращения, возникающее в результате нарушения равновесия между коронарным кровотоком и метаболическими потребностями сердечной мышцы. Миокард нуждается в большем количестве кислорода, чем его поступает с кровью. Таким образом, вследствие ограничения коронарного кровотока, баланс между доставкой и потреблением кислорода критичен для пациента с ИБС.
В то же время ряд патологических состояний существенным образом нарушает этот баланс, вызывая усугубление ишемии миокарда. К наиболее распространенным причинам утяжеления течения ИБС у пациентов в послеоперационном периоде относят: нарушения гемодинамики, гипоксию, анемию (особенно острую, на фоне кровотечения), нарушения гликемического профиля, болевой синдром, нарушения ритма сердца, гипердинамические состояния при инфекционных процессах. Отдельно следует подчеркнуть роль свойственной для различных критических состояний гиперкоагуляции, повышающей риск тромбоза стенозированных коронарных артерий. Кроме того, характерная для жизнеугрожающих синдромов системная воспалительная реакция является доказанным фактором дестабилизации атеросклеротических бляшек и эмболии коронарного русла.
Факторы риска развития ИБС
Главные модифицируемые:
Немодифицируемые:
КЛАССИФИКАЦИЯ
-
Внезапная коронарная смерть (или первичная остановка сердца) - внезапно развившееся, непредвиденное состояние, в основе которого предположительно лежит электрическая нестабильность миокарда. Под внезапной коронарной смертью понимается мгновенная или наступившая не позднее 6 ч после сердечного приступа смерть в присутствии свидетелей. Выделяют внезапную коронарную смерть с успешной реанимацией и с летальным исходом.
-
Нарушения сердечной проводимости и ритма (с указанием формы).
Понятие «ОКС» объединяет различные формы ИБС, для которых характерна высокая вероятность развития ИМ и требуются неотложные диагностические и лечебные мероприятия: нестабильную стенокардию, ИМ (с подъемом сегмента ST и без подъема сегмента ST).
Согласно Европейским рекомендациям вместо стабильной ИБС рекомендовано использовать термин «хронические коронарные синдромы» [10]. Наличие у пациента той или иной формы ИБС предполагает совместное участие различных специалистов в выработке наиболее адекватной стратегии ведения, наблюдения и лечения. В зависимости от клинических обстоятельств, ведение такого пациента может потребовать консультации кардиолога, специалистов в области эндоваскулярных вмешательств и кардиохирурга. В конечном счете необходимо решить следующие задачи: определить тяжесть сопутствующей ИБС и ее вклад в течение основного патологического процесса, определить возможность продолжения и модификации базисной консервативной терапии ИБС, указать на необходимость использования дополнительных методов диагностики, при необходимости определить тактику лечения острых форм ИБС.
Периоперационное ведение пациентов с ИБС. Ключевым моментом выбора тактики является комплексная оценка клинического кардиоваскулярного риска и риска хирургического вмешательства. Это позволяет индивидуализировать подход к пациенту и своевременно начинать медикаментозную терапию, интервенционные вмешательства на коронарных сосудах и оптимизировать выбор анестезии и методов хирургического лечения.
Большинство пациентов со стабильным течением сердечно-сосудистых заболеваний, которым предстоят некардиальные хирургические вмешательства низкого и промежуточного риска (табл. 3.23), не нуждаются в дополнительном предоперационном обследовании. Часть пациентов с ИБС, которые подвергаются хирургическим вмешательствам низкого или промежуточного риска, могут быть направлены анестезиологом на консультацию кардиолога для дополнительной оценки состояния и оптимизации терапии (уровень убедительности рекомендаций - 5, уровень достоверности доказательств - С) в том случае, если ожидается, что лечение может уменьшить риск периоперационных осложнений.
| Низкий риск: <1% | Промежуточный риск: 1-5% | Высокий риск: >5% |
|---|---|---|
Хирургические вмешательства на поверхности тела |
Интраперитонеальные: сплен-эктомия, грыжесечение с пластикой, холецистэктомия |
Вмешательства на аорте и крупных сосудах |
На молочной железе |
На каротидных артериях с клинической симптоматикой (каротидная эндартерэктомия или стентирование) |
Открытая реваскуляризация нижней конечности, или ампутация, или тромбоэмболэктомия |
Стоматологические |
Ангиопластика периферических артерий |
Операции на панкреатодуоденальной зоне |
На щитовидной железе |
Эндоваскулярная коррекция аневризм |
Резекция печени, хирургические вмешательства на желчевыводящих путях |
Офтальмологические |
Хирургические вмешательства на голове и шее |
Эзофагоэктомия |
Реконструктивные |
Неврологические или большие ортопедические (на тазобедренном суставе и позвоночнике) |
Операции по поводу перфорации кишки |
На каротидных артериях без клинической симптоматики (каротидная эндартерэктомия или стентирование) |
Большие урологические и гинекологические |
Резекция надпочечников |
Малые гинекологические |
Цистэктомия |
|
Малые ортопедические (менискэктомия) |
Трансплантация почки |
Пневмонэктомия |
Малые урологические (трансуретральная резекция предстательной железы) |
Небольшие внутриторакальные |
Трансплантация легких или печени |
Примечание. Хирургический риск оценивается по вероятности сердечно-сосудистой смерти или ИМ в течение 30 дней с учетом только особенностей хирургического вмешательства без учета состояния и сопутствующих заболеваний пациента.
Решение о предоперационной оценке пациентов с установленным диагнозом сердечно-сосудистого заболевания или при наличии высокого риска сердечнососудистых заболеваний, подвергающихся хирургическому вмешательству высокого риска, принимается мультидисциплинарной командой экспертов (уровень убедительности рекомендаций - 5, уровень достоверности доказательств - C), в которую должны входить все специалисты, участвующие в периоперационном ведении пациента (хирург, анестезиолог-реаниматолог, кардиолог).
Индексы риска кардиальных осложнений. Для определения сердечно-сосудистого риска в периоперационном периоде используют два типа индексов, основанных на клинической оценке состояния пациентов. Первый тип клинических индексов (генерические) определяют риск на основании подсчета общего количества факторов риска (индексы Lee, Goldman, Larsen и Gilbert). Второй тип определяет риск в зависимости от априорной вероятности (частота развития сердечно-сосудистых осложнений в данном лечебном учреждении при данном виде хирургического лечения) и индивидуальных факторов риска пациента (индексы Kumar и Detsky).
Для объективизации сердечно-сосудистого риска следует оценить пациента по одному из индексов, наиболее соответствующему состоянию пациента и диагностическим возможностям на момент оценки.
Индекс Lee удовлетворительно классифицирует пациентов на группы высокого и низкого риска, а также прогнозирует вероятность развития ОСН и полной АВ-блокады. В индексе используются шесть показателей, включая тип предстоящей операции, наличие ИБС, СН, цереброваскулярных заболеваний, потребность в инсулинотерапии перед операцией и показатели креатинина >170 мкМоль/л (2,0 мг/дл) (табл. 3.24).
Обследование пациента с сопутствующей ишемической болезнью сердца
Обследование пациента с сопутствующей ИБС должно верифицировать это патологическое состояние, определить степень его тяжести и указать на риск возможного неблагоприятного течения с развитием ИМ.
Современные международные рекомендации [6, 10, 11] по диагностике и лечению различных форм ИБС содержат развернутые протоколы. Обследование таких пациентов включает клинические, лабораторные и инструментальные подходы. В настоящем разделе сконцентрированы краткие данные об обследовании, необходимом для ведения пациента с сопутствующей ИБС.
Жалобы и анамнез
При опросе пациента или родственников необходимо получить сведения о клинических проявлениях ИБС, функционального класса стенокардии, перенесенных ранее инфарктах миокарда, выраженности СН и наличии нарушений ритма сердца и проводимости. Особое внимание следует уделить информации о базисной медикаментозной терапии ИБС, которую пациент получал до госпитализации. Крайне важны сведения о перенесенных операциях реваскуляризации, как открытых, так и эндоваскулярных (баллонная ангиопластика, стентирование) и связанном с ними приеме антиагрегантов.
Инструментальная диагностика
ЭКГ в 12 отведениях должна быть выполнена всем пациентам с подозрением на ИБС (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [6]. Исследование позволяет получить данные о перенесенном ранее ИМ, нарушениях ритма сердца и проводимости, сделать заключение о наличии гипертрофии миокарда.
| Параметры | Баллы |
|---|---|
Хирургическое вмешательство высокого риска.
|
1 |
ИБС.
|
1 |
Застойная СН.
|
1 |
Церебрально-васкулярные заболевания.
|
1 |
Инсулинозависимый СД |
1 |
Креатинин сыворотки >2,0 мг/дл (170 ммоль/л) |
1 |
| Категория риска | Сумма баллов | Риск развития осложнений, % |
|---|---|---|
I. Очень низкий |
0 |
0,4 |
II. Низкий |
1 |
0,9 |
III. Промежуточный |
2 |
6,6 |
IV. Высокий |
3 и более |
11,0 |
ЭхоКГ должна быть выполнена при развитии ишемии миокарда для подтверждения наличия локальных нарушений сократимости. В случае наличия у пациента СН, ассоциированной с ИБС, ЭхоКГ является методом выбора для оценки систолической функции ЛЖ (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8, 12].
Коронарная ангиография (КАГ) показана пациентам с сопутствующей ИБС в случае наличия признаков ОКС с подъемом сегмента ST (уровень убедительности рекомендаций - I, уровень достоверности доказательств - A) или без подъема сегмента ST (уровень убедительности рекомендаций - I, уровень достоверности доказательств - B), а также перед плановыми внесердечными операциями у пациентов с доказанной ишемией миокарда и сохраняющейся клиникой стенокардии (класс III-IV по классификации Канадского кардиологического общества) на фоне оптимальной медикаментозной терапии, которым предстоит выполнение планового внесердечного хирургического вмешательства (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [6].
Лабораторная диагностика
Тропонины I или T должны быть исследованы при подозрении на развитие ишемии миокарда (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [10]. Кроме того, эти маркеры некроза миокарда должны быть определены во всех случаях развития ОСН (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8]. Необходимо помнить о том, что концентрация тропонинов может повышаться при остром миокардите, ТЭЛА, сепсисе.
Концентрация в плазме крови BNP более 35 пг/мл или NT-proBNP более 125 пг/мл используется как диагностический критерий ХСН, в том числе и ассоциированной с ИБС (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - C) [8]. При развитии ОСН концентрация BNP увеличивается более 100 пг/мл, а NT-proBNP более 300 пг/мл (уровень убедительности рекомендаций - I, уровень достоверности доказательств - A) [8].
Стандартный и дополнительный мониторинг при проведении интенсивной терапии у пациентов с сопутствующей ишемической болезнью сердца
Пациент с сопутствующей стабильной ИБС не нуждается в расширенном относительно стандартного мониторинге. Депрессия сегмента ST длительностью более 10-20 мин является индикатором ишемии миокарда. Существует зависимость между непрерывными эпизодами изменений сегмента ST в течение 30 мин и кардиологическими осложнениями.
Если на фоне развития ОКС у пациента появляются признаки СН, необходимо применение дополнительного мониторинга: инвазивного измерения АД, измерения ЦВД, параметров центральной гемодинамики. Подробно эти подходы описаны в разделе «Ведение пациента с сопутствующей ХСН» настоящей главы.
Дополнительная терапия, необходимая для пациентов с сопутствующей ишемической болезнью сердца
Базисная терапия пациентов с ишемической болезнью сердца
Ключевым положением терапии ИБС считается поддержание адекватного кислородного баланса: повышение доставки и снижение потребления кислорода миокардом. В условиях, когда доставка кислорода ограничена поражением коронарных артерий, адекватного баланса можно достичь, снижая потребление путем контроля АД, ЧСС и объемной нагрузки на миокард. Исходя из этого положения, основу консервативной терапии ИБС составляют β-адреноблокаторы, ИАПФ и антагонисты кальция, в случае неэффективности этой комбинации используются пролонгированные нитропрепараты. Если пациенты с сопутствующей ИБС до госпитализации получали подобную базисную терапию, то, в соответствии с современными международными рекомендациями, прием этих препаратов должен быть обязательно продолжен (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [6], причем особенно опасна отмена β-адреноблокаторов. Совместно с кардиологом анестезиолог-реаниматолог решает вопрос о назначении конкретных препаратов, а также об использовании парентеральных форм в случае невозможности энтерального назначения.
Одиночные приступы ангинозных болей должны быть купированы сублингвальным приемом таблетированных нитратов или спреев, при неэффективности которых следует проводить немедленную дифференциальную диагностику между болями экстракардиального происхождения и ОКС. В случае неэффективности нитратов при их двухкратном повторном введении необходимо использование агонистов опиатных рецепторов.
Дезагрегантная терапия у пациентов с сопутствующей ишемической болезнью сердца
Большинство пациентов с ИБС получают низкодозную терапию ацетилсалициловой кислотой (Аспирином♠). Учитывая опасность нарушений коронарного кровообращения при отмене этого препарата, прием ацетилсалициловой кислоты (Аспирина♠) должен быть продолжен. Отмена препарата возможна только перед оперативными вмешательствами с высоким риском трудно контролируемых кровотечений (уровень убедительности рекомендаций - I, уровень достоверности доказательств - B) [13].
Пациенты, которым были выполнены стентирование коронарных артерий, получают двойную дезагрегантную терапию ацетилсалициловой кислотой (Аспирином♠) и ингибиторами P2Y12-рецепторов (клопидогрель, тикагрелор). После имплантации стентов такая двухкомпонентная терапия должна проводиться не менее одного месяца перед плановым оперативным вмешательством, для современных стентов с лекарственным покрытием и голометаллических стентов эти сроки не различаются (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - B) [13]. Отмена двойной дезагрегантной терапии ранее указанных сроков приводит к тромбозу стентов, развитию ОИМ и может закончиться смертью пациента в случае тромбоза стента левой коронарной артерии. Перед проведением планового оперативного вмешательства ингибиторы P2Y12 должны быть отменены: за 5 дней (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - B). При необходимости после отмены антиагрегантов может быть назначена бридж-терапия гепаринами (уровень убедительности рекомендаций - IIb, уровень достоверности доказательств - C).
Продолжение базисной терапии ИБС способствует снижению потребления кислорода миокардом, тем самым предупреждается развитие ишемии. Необходимо стремиться к удержанию синусового ритма в диапазоне 60-80 в минуту. АД должно соответствовать целевым показателям (САД <130 мм рт.ст., а ДАД <80 мм рт.ст.) [9]. Нельзя забывать о том, что выраженное снижение ДАД (менее 60 мм рт.ст.) может уменьшить коронарное перфузионное давление (КПД = ДАД - КДД ЛЖ) и сократить доставку кислорода к миокарду.
С целью увеличения доставки кислорода в условиях сниженного коронарного кровотока необходимо поддерживать оксигенацию (назначение ингаляции кислорода при SaO2 менее 90% (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [9]) и уровень гемоглобина не ниже 80 г/л.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ПАЦИЕНТОВ С СОПУТСТВУЮЩЕЙ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ НЕКАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Профилактика послеоперационных осложнений
Ранняя диагностика и активное лечение послеоперационных осложнений позволяют уменьшить летальность.
Диагностика
А. Выявление ишемии миокарда.
Послеоперационная ишемия миокарда является частой проблемой. Существует зависимость между непрерывными эпизодами изменений сегмента ST в течение 30 мин и послеоперационными кардиологическими осложнениями. Всем пациентам с повышенным риском осложнений рекомендовано проводить мониторирование ЭКГ в течение 72 ч после операции.
Бессимптомное течение послеоперационной ишемии миокарда возможно за счет превалирования хирургической боли или на фоне использования опиоидов. Большинство неблагоприятных событий происходят в первые 48 ч после операции. В этот период сохраняются факторы, значительно повышающие риск развития ишемии миокарда у пациента с сопутствующей ИБС.
Причинами послеоперационной ишемии миокарда чаще являются тахикардия, гиперволемия и анемия. Тахикардия увеличивает потребность миокарда в кислороде (увеличивает работу миокарда) и уменьшает доставку кислорода к миокарду (сокращение диастолы). Гиперволемия увеличивает растяжение желудочков (увеличивает потребность в кислороде) и приводит к уменьшению кровотока в растянутом желудочке (увеличено КДД ЛЖ). Анемия уменьшает доставку кислорода, а также увеличивает ЧСС и СВ, что повышает потребление кислорода.
Б. Определение биомаркеров.
Согласно рекомендациям Европейского кардиологического общества совместно с Европейским обществом анестезиологов 2014 г., в этом может помочь определение биомаркеров - BNP или NT-proBNP и высокочувствительного тропонина до и после операции у пациентов с низкими функциональными резервами [<4 метаболических эквивалентов нагрузки (MET)] и с пересмотренным индексом сердечно-сосудистого риска Lee >1 для хирургических операций на сосудах и >2 для других внесердечных вмешательств.
Основные подходы к профилактике ишемии миокарда
Учитывая обозначенные выше факторы риска развития ишемии, при лечении в послеоперационном периоде пациента с сопутствующей ИБС основные усилия должны быть направлены на профилактику гипоксемии (назначение ингаляции кислорода при SaO2 менее 90% (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8]), предупреждение снижения уровня гемоглобина ниже 80 г/л, согревание больного с сохранением нормотермии. Чрезвычайно важно обеспечить стабильную гемодинамику, избегать выраженных колебаний АД и тахисистолии. Добиться этого можно максимально быстрым возобновлением дооперационной базисной терапии ИБС и АГ, включающей β-адреноблокаторы и ИАПФ.
Среди профилактических мер особое внимание должно быть уделено адекватному обезболиванию. При отсутствии противопоказаний могут использоваться регионарные методики с применением местных анестетиков (уровень убедительности рекомендаций - IIb, уровень достоверности доказательств - B) [6]. НПВС (особенно ингибиторы циклооксигеназы-2) увеличивают риск сердечно-сосудистых осложнений, а также частоту развития сердечной, почечной недостаточности и тромботических осложнений. Эти средства не следует назначать пациентам с ИБС и ХСН (уровень убедительности рекомендаций - III, уровень достоверности доказательств - C) [6].
Аритмии
Аритмии или нарушения сердечного ритма - различные по механизму, клиническим проявлениям и прогностическому значению нарушения образования и проведения электрического импульса. Аритмии можно классифицировать на основе частоты - брадикардия (ЧСС <60 уд/мин) или <50 уд/мин для пациентов, получающих β-блокаторы, тахикардия (ЧСС >100 уд/мин); ритма (регулярный и нерегулярный); происхождения импульса (синусовые, предсердные, из АВ-соединения, желудочковые и искусственного водителя ритма); проведения импульса (предсердно-желудочкового, желудочково-предсердного, блокады); частоты сокращений желудочков; особых феноменов (например, предвозбуждение).
С точки зрения потенциальной опасности периоперационные аритмии можно разделить на доброкачественные, потенциально опасные и жизнеопасные аритмии, что перекликается с задачей, стоящей перед врачами-анестезиологами-реаниматологами в оценке пациента с аритмией, а именно - идентифицировать «гемодинамически нестабильных» пациентов, принимая во внимание электрокардиографические изменения и наличие таких органических заболеваний сердца, как митральный стеноз, аортальный стеноз, коронарная недостаточность, повышающих вероятность неблагоприятных исходов.
Желудочковые тахиаритмии. Половина всех смертей от сердечно-сосудистой патологии относится к ВСС и связана с жизнеопасными аритмиями, прежде всего с ФЖ.
Желудочковые нарушения ритма при холтеровском мониторировании встречаются у 50-80% лиц без признаков заболеваний сердца и у 90% больных ИБС. Предикторами высокого риска внезапной смерти являются не сами по себе желудочковые нарушения ритма, а их сочетание со значительной дисфункцией ЛЖ (ФВ ниже 40%).
Аритмии часто возникают в периоперационном периоде, особенно у пациентов с органическими заболеваниями сердца. Пусковым фактором аритмий после хирургического вмешательства обычно являются транзиторные изменения, такие как гипоксия, ишемия миокарда, гиперкатехоламинемия или электролитные расстройства. На основе данных периоперационного холтеровского мониторирования было показано, что частота нежизнеопасных желудочковых нарушений ритма (желудочковых экстрасистол и неустойчивой ЖТ) не связана с неблагоприятными кардиологическими событиями. Частота периоперационных нарушений ритма у пациентов с неблагоприятным исходом (8%) не отличалась от таковой у пациентов с хорошим исходом. Пациенты, подвергающиеся кардиохирургическим вмешательствам, имеют большую частоту нарушений сердечного ритма.
ОПРЕДЕЛЕНИЕ
Присутствие трех или более следующих друг за другом преждевременных желудочковых сокращений определяют как ЖТ. Специфическая морфология комплекса QRS может также помочь отличить ЖТ от других аритмий. ЖТ классифицируется по своей продолжительности и морфологии. По продолжительности: неустойчивая ЖТ продолжается от трех сокращений до 30 с, а устойчивая ЖТ продолжается 30 с или более. При мономорфном типе все комплексы имеют одинаковую форму, а при полиморфном типе комплексы постоянно меняют форму. Полиморфную ЖТ с удлиненным QT также называют torsade de pointes («пируэт»).
Характерные признаки ЖТ:
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Большинство желудочковых аритмий (ЖА) возникает у пациентов с атеросклерозом коронарных артерий, более половины которых перенесли ИМ, поэтому наличие постинфарктного кардиосклероза (ПИКС) должно вызывать настороженность в отношении жизнеопасных нарушений ритма. Полиморфная ЖТ - обычно результат острой миокардиальной ишемии. При впервые возникшей в периоперационном периоде ЖТ необходимо исключить ОИМ. Не связанные с перенесенным ИМ ЖА называют неишемическими (некоронарогенными). Причинами некоронарогенных аритмий являются миокардиты, кардиомиопатии, пороки сердца, пролапс митрального клапана (МК), аритмогенная дисплазия ПЖ. От 2 до 10% ЖТ являются идиопатическими и возникают у пациентов без структурных заболеваний сердца.
Классификация аритмий в зависимости от прогноза (табл. 3.26).
Доброкачественные («безопасные») аритмии:
-
любая наджелудочковая экстрасистолия и пароксизмальная наджелудочковая аритмия, протекающие без нарушений гемодинамики независимо от наличия органического поражения сердца;
-
ЖЭ любых градаций, пароксизмальная неустойчивая ЖТ (продолжительностью менее 30 с) без нарушений гемодинамики у больных без органического заболевания сердца.
Потенциально опасные аритмии:
Жизнеопасные аритмии:
| Группа риска | Риск развития ВСС в текущем году, % |
|---|---|
Группа умеренного риска |
|
ОИМ в анамнезе или ФВ ниже 40% + ЖЭ |
5 |
ОИМ + ФВ ниже 40% или ОИМ + частая ЖЭ или ФВ ниже 40% + частая ЖЭ |
10 |
ОИМ + ФВ ниже 40% + ЖЭ |
15 |
Группа высокого риска |
|
Пациенты, пережившие ВСС |
30-50 |
ЖТ + синкопе |
30-50 |
ЖТ + минимальные клинические проявления |
20-30 |
Примечание. ЖЭ - желудочковая экстрасистолия.
ДИАГНОСТИКА
Основным методом диагностики является электрокардиография и холтеровское мониторирование ЭКГ, желательно в течение длительного времени - 48-72 ч и более.
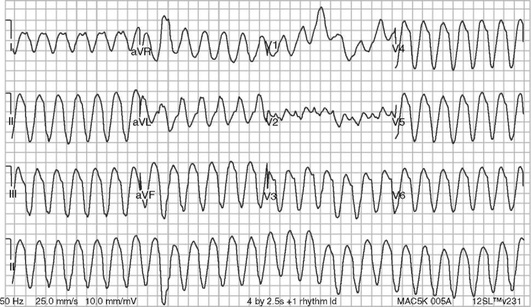
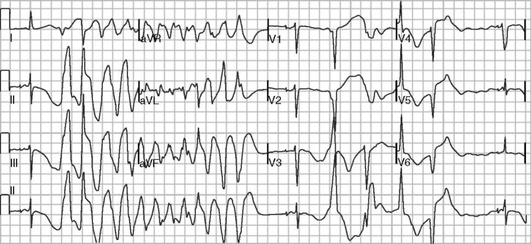
Для мономорфной ЖТ характерны одинаковые по форме комплексы QRS (рис. 3.8), для полиморфной - комплексы QRS различной формы. ЖТ «пируэт» является одной из разновидностей полиморфной ЖТ (рис. 3.9).
Для своевременной диагностики желудочковых аритмий в интраоперационном периоде и необходимо проводить мониторинг ЭКГ с использованием пятиэлектродной системы мониторинга. При этом четыре электрода с конечностей, LA, RA, LL и RL, расположенные на соответствующих для мониторирования местах, позволяют получить любое из шести отведений от конечностей (отведения I, II, III, aVR, aVL и aVF), а пятый грудной электрод может быть размещен в любую стандартную точку для отведений V1-V6. Отведение V1 является предпочтительным для специального мониторинга аритмий. Такой мониторинг следует проводить всем пациентам с высокой вероятностью возникновения периоперационной аритмии: при выраженной систолической дисфункции (ФВ ЛЖ ≤40%), дилатационной или гипертрофической кардиомиопатии, наличии нарушений ритма в анамнезе, вмешательствах на органах грудной клетки и сосудах.
При анализе сердечного ритма большое значение имеет феномен удлинения интервала QT как фактор, приводящий к внезапной смерти. Установлено, что как врожденные, так и приобретенные формы удлинения интервала QT являются предикторами фатальных нарушений ритма, которые, в свою очередь, приводят к внезапной смерти пациентов (рис. 3.10).
Синдром удлинения интервала QT представляет собой сочетание удлиненного интервала QT стандартной ЭКГ и угрожающих жизни полиморфных желудочковых тахикардий (torsade de pointes - «пируэт»). Пароксизмы желудочковых тахикардий типа «пируэт» клинически проявляются эпизодами потери сознания и нередко заканчиваются ФЖ, являющейся непосредственной причиной внезапной смерти.
Длительность интервала QT зависит от ЧСС и пола пациента. Поэтому используют не абсолютную, а корригированную величину интервала QT (QTc), которую рассчитывают по формуле Базетта:
QTc = K × √RR,
где RR - расстояние между соседними зубцами R на ЭКГ в секундах; K = 0,37 для мужчин и K = 0,40 для женщин.
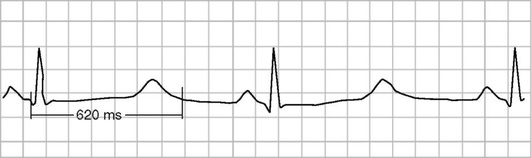
Удлинение интервала QT диагностируют в том случае, если длительность QTc превышает 0,44 с.
Существует ряд лекарственных препаратов, удлиняющих интервал QT. Эти препараты не рекомендованы при исходно удлиненном QT (табл. 3.27).
Антиаритмические |
Iа, Iс, III, IV классы - прокаинамид (Новокаинамид♠), диэтил-аминопропионилэтоксикарбониламинофенотиазин (Этацизин♠), амиодарон, соталол, антагонисты кальция |
Ингаляционные анестетики |
Севофлуран - единичные сообщения об удлинении интервала QT, очень редко связанного с развитием ЖТ типа «пируэт» |
Диуретики |
Кроме калийсберегающих |
Антиангинальные |
Бепридил, прениламин |
Гиполипидемические |
Пробукол |
Сердечно-сосудистые |
Эпинефрин (Адреналин♠), эфедрин, папаверин, вазопрессин, винпоцетин (Кавинтонs), аденозин и др. |
Антигистаминные |
Терфенадин, лоратадин, мизоластин, дифенгидрамин (Димедрол♠), астемизол и др. |
Антибиотики и сульфаниламиды |
Эритромицин, спирамицин, ко-тримоксазол [сульфаметокса-зол + триметоприм] (Бактрим♠), сульфаметоксазол, ципрофлоксацин и др. |
Противомикробные (для лечения лейшманиоза) |
Пентамидин |
Антималярийные |
Налофатрин, хлорохин, хинин, примахин |
Противогрибковые |
Кетоконазол, миконазол, флуконазол, имидазолы и др. |
Прокинетики |
Мозаприд, цизаприд |
Антагонисты допаминовых рецепторов |
Домперидон (Мотилак♠, Мотилиум♠) |
Психотропные |
Нейролептики (галоперидол, дроперидол), необходимо оценивать риск назначения, особенно при проведении седации и лечении делирия, когда вводятся большие дозы препаратов. Антидепрессанты, препараты лития, анксиолитики, транквилизаторы |
Серотонинергические |
Кетансерин, зимелдин, тегасерод |
Иммуносупрессанты |
Такролимус |
Другие препараты |
Фениламин, кокаин, будипин, хлоралгидрат, гепарин и др. |
Дополнительное предоперационное обследование.
Пациентам с ЖТ должна быть произведена оценка функции ЛЖ с использованием методов его визуализации (ЭхоКГ, нагрузочные пробы или фармакологические тесты с возможностью визуализации - ЭхоКГ, изотопное исследование, однофотонная эмиссионная КТ для выявления безболевой формы ишемии, МРТ, коронароангиография).
ЛЕЧЕНИЕ
Лечение пациентов с жизнеопасными нарушениями ритма в предоперационном периоде проводится в ОРИТ.
Любое лечение включает в себя: оценку клинической ситуации, ЭКГ-мониторинг, отмену препаратов, вызывающих развитие аритмии, коррекцию электролитного дисбаланса с поддержанием уровня калия не ниже 4,0 ммоль/л и ликвидацией гипомагниемии, при необходимости - оксигенотерапию, при возможности - гемодинамический мониторинг. ЭКГ и неинвазивное измерение АД должны быть обеспечены в обязательном порядке. Прежде всего, необходимо оценить стабильность гемодинамики. К признакам нестабильной гемодинамики относится гипотензия (САД менее 90 мм рт.ст. или снижение исходного САД на 40 мм рт.ст. и более). Особенно неблагоприятно сочетание гипотензии с клиническими симптомами гипоксии (цианотичность кожных покровов, одышка с участием вспомогательных мышц, нарушения сознания и т.д.).
Показания к неотложной кардиоверсии:
-
нестабильная гемодинамика (гипотензия со снижением САД менее 90 мм рт.ст. или снижение исходного САД на 40 мм рт.ст. и более от исходных значений);
-
ОКС: симптомы (приступ стенокардии) или ишемические изменения на ЭКГ, в том числе ИМ;
-
гипоксия с характерными для нее признаками: цианотичность кожных покровов, одышка с участием вспомогательных мышц;
-
острая левожелудочковая недостаточность (кардиогенный ОЛ, синдром малого СВ).
Устойчивая мономорфная ЖТ с нестабильной гемодинамикой требует немедленного проведения электрической кардиоверсии. При стабильной гемодинамике возможно назначение амиодарона в виде внутривенной инфузии. При неэффективности электрической кардиоверсии или невозможности ее выполнения при ЖТ с нестабильной гемодинамикой также должен быть назначен амиодарон. Рекомендуется следующая схема применения препарата: 300 мг за 10 мин (нагрузочная доза), затем 1 мг/мин в течение 6 ч и 0,5 мг/мин последующие 18 ч.
Устойчивая полиморфная ЖТ с нестабильной гемодинамикой должна быть немедленно купирована ЭИТ. При рецидивирующей устойчивой полиморфной ЖТ рекомендовано назначение β-блокаторов, особенно при ИБС. Амиодарон также может быть назначен при условии отсутствия синдрома удлиненного QT.
Torsade de Pointes («пируэт»). При этой ЖТ необходимо как можно быстрее выполнить кардиоверсию (ЭИТ, медикаментозную), оценить уровень электролитов крови и провести коррекцию гипомагниемии и гипокалиемии. При наличии синдрома удлиненного QT назначается магния сульфат внутривенно. Пируэтная тахикардия часто является следствием электролитных расстройств или приема медикаментов, удлиняющих интервал QT (вторичный синдром удлиненного QT). При развитии torsades de pointes на фоне синусовой брадикардии рекомендовано назначение β-адреноблокаторов (эсмолол, метопролол). Введение β-блокаторов на фоне брадикардии должно сопровождаться установкой временного электрокардиостимулятора, генерирующего импульсы с частотой, превышающей собственный ритм.
При ЖТ с отсутствием пульса или при ФЖ необходима немедленная дефибрилляция (рекомендации по проведению сердечно-легочной реанимации изложены в соответствующих источниках).
Выбор энергии разряда при выполнении ЭИТ:
Кардиоверсия:
Дефибрилляция - максимальный разряд (360 Дж для монофазного дефибриллятора или 150 Дж для бифазного).
При проведении неотложной кардиоверсии рекомендовано проводить аналгоседацию с использованием гипнотиков и анальгетиков. В качестве гипнотика могут быть использованы пропофол, БД (предпочтительно мидозалам), тиопентал натрия или кетамин. Обезболивание осуществляется с помощью наркотических анальгетиков [тримеперидин (Промедол♠), фентанил, морфин]. При проведении ЭИТ ФЖ или ЖТ без наличия пульса применяется несинхронизированный разряд без предварительной подготовки пациента.
Лечение ЖТ у гемодинамически стабильного пациента
У гемодинамически стабильных пациентов с устойчивой ЖТ в отсутствии структурной болезни сердца могут назначаться флекаинид, β-блокаторы, верапамил или амиодарон (уровень убедительности рекомендаций - IIb, уровень достоверности доказательств - C):
Амиодарон вводится в/в 150 мг за 10 мин, затем 1 мг/мин в течение 6 ч и 0,5 мг/мин последующие 18 ч. Амиодарон является препаратом выбора для пациентов с рецидивирующей устойчивой полиморфной ЖТ при отсутствии синдрома удлиненного QT-интервала.
Лидокаин в дозе 1,0-1,5 мг/кг вводится в/в за 2 мин, при ФВ менее 40% 0,5-0,75 мг/кг за 2 мин, при необходимости - повторное введение 0,5-0,75 мг/кг за 2 мин. Суммарная доза за 1 ч - не более 3 мг/кг. Для предупреждения рецидивов - инфузия 1-4 мг/мин.
Если лидокаин неэффективен, рекомендуется: соталол 100 мг внутривенно в течение 5 мин либо прокаинамид 100 мг внутривенно в течение 5 мин, с последующим вторым или третьим болюсом с последующей инфузией 3 мг/мин.
При неэффективности препаратов используется электрическая кардиоверсия, как указано выше.
β-Блокаторы показаны при удлиненном интервале QT (эсмолол 100 мкг/кг/мин за 1 мин в/в, метопролол 5 мг болюсно в течение 2 мин в/в, повторять до 3 раз); β-блокаторы применяются у пациентов с рецидивирующими устойчивыми полиморфными ЖТ, особенно если подозревается или не может быть исключена ишемия.
Блокаторы кальциевых каналов, такие как верапамил и дилтиазем, не должны использоваться у пациентов с тахикардией с широким QRS-комплексом неизвестного происхождения, так как при наличии дополнительного проводящего АВ-пути [синдроме Wolf-Parkirısirı-White (WPW)] их введение может привести к тахикардии с ЧСС более 200 уд/мин и ФЖ. Блокаторы кальциевых каналов также противопоказаны у пациентов, имеющих в анамнезе систолическую дисфункцию миокарда.
Желудочковые тахиаритмии могут быть проявлением выраженных органических нарушений, в связи с этим при их наличии показана консультация кардиолога с возможным назначением дополнительного обследования. В то же время изолированные желудочковые экстрасистолы и неустойчивая мономорфная ЖТ не требуют проведения антиаритмической терапии. В настоящее время нет доказательных данных о каком-либо существенном влиянии изолированных желудочковых экстрасистол или неустойчивой мономорфной ЖТ на исход при проведении вне-сердечных оперативных вмешательств. Этим пациентам не требуется проведение антиаритмической терапии.
Временная отмена планового хирургического вмешательства рекомендована:
В этом случае анестезиолог назначает консультацию кардиолога. Рекомендации по ведению пациентов с желудочковыми аритмиями представлены в табл. 3.28.
| Рекомендации | Уровень убедительности рекомендаций | Уровень достоверности доказательств |
|---|---|---|
Антиаритмическая терапия рекомендована пациентам с рецидивирующей устойчивой ЖТ |
I |
B |
Рекомендовано продолжение терапии амиодароном и ББ в периоперационном периоде, если пациент получал такую терапию прежде |
I |
C |
Тахикардия с широкими комплексами QRS должна рассматриваться как ЖТ, если диагноз не ясен |
I |
C |
Пациентам с устойчивой ЖТ и нестабильной гемодинамикой рекомендована электрическая кардиоверсия |
I |
C |
Назначение антиаритмической терапии может рассматриваться у пациентов со стабильной устойчивой мономорфной тахикардией |
IIa |
B |
Антиаритмическая терапия у пациентов с желудочковой экстрасистолией в периоперационном периоде не рекомендована |
III |
A |
Антиаритмическая терапия у пациентов с неустойчивой ЖТ в периоперационном периоде не рекомендована |
III |
B |
Послеоперационный период у пациентов с желудочковыми аритмиями
В послеоперационном периоде чаще всего причинами аритмии являются электролитный дисбаланс (гипокалиемия, гипомагниемия) и гиперкатехоламинемия, вызванная болью и операционным стрессом. Адекватное послеоперационное обезболивание включает применение наркотических анальгетиков или нейроаксиальную аналгезию, которую при отсутствии противопоказаний можно считать оптимальной для обеспечения послеоперационной аналгезии. Пациентам вновь назначается лекарственная терапия, которую они получали до операции (анти-аритмики, антикоагулянты, гипотензивные препараты).
Следует избегать назначения НПВС (особенно ингибиторов циклооксигеназы-2) в качестве анальгетиков первой линии у пациентов с ИБС, цереброваскулярными нарушениями, почечной недостаточностью. Кроме того, необходимо исключить гипоксию, нарушения кислотно-щелочного равновесия, ишемию миокарда, СН, воспалительные процессы, тромбоэмболические осложнения.
Профилактика и лечение аритмий в послеоперационном периоде
-
Мониторирование ЭКГ в течение 72 ч у пациентов с органической патологией сердца и желудочковыми аритмиями в анамнезе.
-
Контроль уровня электролитов, лечение гипокалиемии и гипомагниемии, особенно после операций с ИК.
-
При выявлении ЖТ - ЭИТ или медикаментозная антиаритмическая терапия (амиодарон - уровень убедительности рекомендаций IIb, лидокаин - неопределенный уровень доказательности).
-
Препараты IС класса [флекаинид, пропафенон, диэтиламинопропионилэток-сикарбониламинофенотиазин (Этацизин♠)] противопоказаны при ИБС.
Хирургическое лечение
В ряде клинических ситуаций медикаментозная терапия является недостаточно эффективной и не может предотвратить развитие жизнеопасных аритмий. В этих случаях может потребоваться имплантация кардиовертера-дефибриллятора.
Профилактические мероприятия и коррекция обратимых причин
Если пациенту с устойчивой ЖТ была ранее назначена антиаритмическая терапия, рекомендуется продолжить прием пероральных антиаритмиков (амиодарона и β-адреноблокаторов) перед операцией.
При электролитном дисбалансе, если пациент регулярно принимает диуретики и предполагается гипомагниемия, необходимо возместить 2 г магния сульфата [20 ммоль MgSO4 в 50 мл 5% декстрозы (Глюкозы♠)] внутривенно. Это помогает стабилизировать мембраны клеток миокарда, что подтверждается контролем ЭКГ до и после коррекции. При уровне K+ в плазме менее 2,0 ммоль/л или тяжелой аритмии (двунаправленно-веретенообразная ЖТ, ФЖ) калия хлорид рекомендуется вводить со скоростью 80-100 ммоль/ч при концентрации раствора 60 ммоль/л под контролем ЭКГ до целевого уровня K+ - 4,5-5,0 ммоль/л.
Брадиаритмии
Относительно «безопасные» брадиаритмии: синусовая брадикардия, АВ-блокада I степени, АВ-блокада II степени типа Мобитц I без нарушений гемодинамики у больных без органического заболевания сердца.
Потенциально опасные брадиаритмии: брадикардии, связанные с тяжелым нарушением проводимости, - АВ-блокада II степени типа Мобитц II, полная АВ-блокада, хроническая бифасцикулярная блокада; СССУ.
Кроме того, нежизнеопасные аритмии могут становиться жизнеугрожающими в ситуации, когда аритмия вызывает значительные гемодинамические расстройства (при сочетании с низким СВ) или является предвестницей другой, более тяжелой аритмии.
Диагностика. В большинстве случаев достаточную информацию дают неинвазивные методы исследования. При постоянной форме БА наружная электрокардиография оказывается вполне информативной. При интермиттирующем течении БА для выявления и клинико-электрокардиографической корреляции требуются методы длительного мониторирования ЭКГ. В случаях, когда преходящие БА предполагаются, но не документированы, требуется использование провоцирующих проб.
При выявлении связанной с лекарственными препаратами природы БА рекомендуется определить, является ли применение причинных препаратов обязательным у данного пациента.
Рекомендуется использовать различные виды длительного мониторирования ЭКГ в зависимости от частоты развития клинических симптомов, связанных с БА.
Непрерывное наблюдение за ритмом сердца может потребовать дифференцировки нормальных явлений и патологических состояний. Физиологическая синусовая брадикардия может наблюдаться в дневное время суток в состоянии покоя и в ночное время в качестве преобладающего ритма сердца. Предельное снижение частоты ритма днем в покое определяется величиной 40 имп/мин, ночью - 35 имп/мин и не зависит от пола и возраста.
Синусовая брадикардия является физиологическим явлением у профессиональных спортсменов, у которых ЧСС в покое может составлять от 40 до 50 в минуту, а во время сна - до 30 в минуту. При мониторировании ЭКГ у спортсменов могут возникать синусовые паузы или АВ блокада II степени I типа с эпизодами асистолии до 2,8 с. Эти состояния не требуют лечения, прогноз благоприятен [16].
ЭхоКГ для оценки функции ЛЖ и диагностики структурной патологии сердца рекомендуется всем пациентам с подозреваемой или известной желудочковой аритмией; при наличии органической патологии сердца, ОИМ в анамнезе, а также при наследственных нарушениях ритма, связанных с ВСС у родственников пациента.
Инвазивные электрофизиологические исследования (ЭФИ) рекомендуются у пациентов с синкопе при подозрении на брадиили тахисистолические формы аритмии на основании клинической картины (например, сердцебиение) или результатов неинвазивного обследования, особенно у пациентов со структурной болезнью сердца. Перед назначением ЭФИ требуется консультация кардиолога или аритмолога.
В случае если аритмия вызывает значительные гемодинамические расстройства, или является предвестницей другой, более опасной аритмии, или в основе ее лежит структурная патология сердца (ИБС, митральный и аортальный стеноз), начинается неотложное лечение. При гемодинамически значимых брадикардиях и нарушениях проведения применяется временная ЭКС.
Синусовая брадикардия
Синусовая брадикардия - синусовый ритм с нормальными P-QRS-T- комплексами, но с ЧСС <60 в мин. Брадикардия может быть частой находкой у спортсменов или пациентов с высоким вагальным тонусом. Обычно при синусовой брадикардии редко требуется коррекция, пока ЧСС не снизится менее 40 уд/мин.
ЭКГ-признаки синусовой брадикардии: уменьшение ЧСС до 60 и ниже в минуту; сохранение правильного синусового ритма; положительный зубец Р в отведениях I, II, aVF, V4.
Лечение синусовой брадикардии
Необходимо прекратить введение препаратов, которые могут вызывать брадикардию (пропофола, дексмедетомидина, амиодарона, β-блокаторов, дигоксина и др.).
В случае отсутствия пульса или асистолии у пациента должна проводиться СЛР в полном объеме.
Чаще всего в роли препаратов первой линии для лечения брадикардии используются холиноблокаторы: атропин внутривенно (0,5-1,0 мг в/в, повторно каждые 3-5 мин до общей дозы 3,0 мг). Если брадикардия устойчива и известно, что пациент принимал β-блокаторы, необходимо назначение эпинефрина (Адреналина♠) (0,05-0,1 мкг/кг/мин в/в) и допамина (5-10 мкг/кг/мин в/в) в виде инфузии.
Возможно также назначение аминофиллина (Эуфиллина♠), который является неспецифическим антагонистом аденозиновых рецепторов, а также ингибитором фосфодиэстеразы, что приводит к увеличению продукции циклического аденозинмонофосфата и активации симпатоадреналовой системы. Аминофиллин (Эуфиллин♠) также уменьшает парасимпатический тонус и снижает выброс ацетилхолина. Аминофиллин (Эуфиллин♠) рекомендуется вводить инфузионно в дозе 5 мг/кг/ч или болюсно до 300 мг.
Если брадикардия является полностью резистентной к лекарственной терапии, требуется временная ЭКС.
Синдром слабости синусового узла
Синдром слабости синусового узла (СССУ) - клинико-электрокардиографический синдром, отражающий структурные повреждения синоатриального узла, его неспособность нормально выполнять функцию водителя ритма сердца и/или обеспечивать регулярное проведение автоматических импульсов к предсердиям.
Этиология: врожденная патология, ревматическая болезнь сердца, атеросклероз, дегенерация/фиброз синусового узла у пожилых пациентов. Клиника обусловлена неспецифическими симптомами вторичной гипоперфузии жизненно важных органов: головокружения, обмороки (во время эпизодов брадикардии), парезы, ОЛ или приступы стенокардии (во время тахикардии).
Тяжелая брадикардия, устойчивая к введению атропина, является признаком СССУ. СССУ на фоне общей анестезии или нейроаксиальной блокады является частой причиной остановки, или ареста, синусового узла.
ЭКГ-признаки СССУ: стойкая синусовая брадикардия; наличие синоатриальной блокады; синдром тахикардии-брадикардии (чередование синусовой брадикардии с тахикардией, трепетанием предсердий или ФП).
При подозрении на наличие СССУ пациентам показана консультация кардиолога и/или аритмолога с целью решения вопроса о выполнении дополнительных исследований, таких как массаж каротидного синуса, тилт-тест (пассивная орто-статическая проба), нагрузочное тестирование (велоэргометрия, тредмил-тест), фармакологические пробы с введением аденозина (АТФ) и атропина, холтеровское мониторирование ЭКГ (ХМЭКГ) различной длительности.
Показания к имплантации кардиостимулятора при СССУ
-
Имплантация постоянного кардиостимулятора показана, если симптомы четко связаны и обусловлены брадикардией.
-
Спонтанная или медикаментозно обусловленная дисфункция синусового узла с ЧСС <40 уд/мин, сопровождающаяся симптоматикой, при отсутствии документального подтверждения наличия более значимой брадикардии.
-
Синкопе (потеря сознания) неясного генеза, когда признаки дисфункции синусового узла выявлены во время электрофизиологического исследования.
-
Имплантация постоянного кардиостимулятора показана пациентам с синусовой брадикардией, если симптомы, вероятнее всего, связаны с брадикардией, даже при отсутствии убедительных доказательств.
-
Имплантация постоянного кардиостимулятора не показана пациентам с асимптомной синусовой брадикардией или при условии, что она связана с обратимыми причинами.
Определяющим фактором для имплантации постоянного ЭКС при СССУ является доказанная и документированная связь между клиническими симптомами и брадикардией. Паузы, выявляемые при ХМЭКГ, сами по себе не являются показанием к имплантации ЭКС, так как в настоящее время не определена их максимальная допустимая продолжительность. В то же время, по данным Европейского общества кардиологов, клинически значимыми считаются паузы более 3 с, так как они часто приводят к развитию синкопальных состояний. При этом показанием к имплантации постоянного ЭКС является регистрация асимптомных пауз >6 c, связанных с арестом синусового узла, синоатриальной или АВ-блокадой при наличии синкопальных состояний в анамнезе [17].
Нарушение проводимости
АВ-блокады - нарушения проведения электрического импульса от предсердий к желудочкам.
Причины возникновения АВ-блокад:
-
органические заболевания сердца: кардиомиопатии, пороки сердца, миокардиты, хронические и острые формы ИБС, кардиосклероз;
-
интоксикация препаратами дигиталиса, хинидина, передозировка β-адреноблокаторов, верапамила и других противоаритмических средств;
-
выраженная конституциональная ваготония (для части случаев АВ-блокады I степени);
-
сильная стимуляция блуждающего нерва (в том числе околовисцеральные синдромы) во время операции;
-
идиопатический фиброз и кальциноз проводящей системы сердца (болезнь Ленегра); фиброз и кальциноз межжелудочковой перегородки, а также колец митрального и аортального клапанов (болезнь Леви) [56].
1. При АВ-блокаде I степени и II степени типа Мобитц I прогноз относительно благоприятен, а сама блокада нередко носит функциональный характер. Эти типы блокады редко трансформируются в полную АВ-блокаду или АВ-блокаду II степени типа Мобитц II.
Происходит прогрессивное удлинение интервала PR с последующим выпадением комплекса QRS. Мобитц I возникает вследствие обратимого блока проведения на уровне АВ-соединения (периодика Самойлова-Венкебаха).
2. Более серьезным представляется прогноз при АВ-блокаде II степени типа Мобитц II и прогрессирующей АВ-блокаде, особенно при дистальной форме нарушения АВ-проводимости. Высокая степень АВ-блокады нарушает регулярную проводимость через АВ-узел каждого электрического импульса от синоатриального узла. Поэтому при блокаде 2 : 1 на каждый комплекс QRS приходится две волны Р, а при блокаде 3 : 1 - три волны P.
Выпадение желудочкового комплекса происходит без прогрессивного удлинения интервала P-R ; P-R-интервал остается постоянным.
Механизм развития АВ-блокады II степени типа Мобитц II.
В 75% случаев блокада возникает дистальнее пучка Гиса и сопровождается широким комплексом QRS.
В остальных 25% случаев - блокада на уровне пучка Гиса с характерным узким комплексом.
АВ-блокада Мобитц II значительно чаще сопровождается гемодинамической нестабильностью, тяжелой брадикардией и прогрессией блокады до III степени. Риск асистолии составляет 35% в год.
Такие нарушения проводимости предполагают проведение тщательного мониторинга, временной кардиостимуляции и имплантации постоянного водителя ритма.
3. При полной АВ-блокаде III степени на ЭКГ регистрируется полная диссоциация между предсердиями и желудочками, при которой отсутствует проведение импульса в АВ-узле. Это обычно приводит к снижению частоты сокращения желудочков с собственной скоростью 45-55 уд/мин с нормальным QRS, если блок находится выше узла АВ.
При расположении блока ниже АВ-узла желудочки обычно сокращаются с частотой 30-40 уд/мин, а комплекс QRS глобально расширен.
Клинически данный вид блокады характеризуется быстрым прогрессированием симптомов СН и ухудшением перфузии жизненно важных органов (стенокардия, ХПН, обмороки и частое развитие синдрома Морганьи-Адамса-Стокса), а также высоким риском ВСС.
В периоперационном периоде полная АВ-блокада иногда происходит на фоне стимуляции блуждающего нерва и купируется при прекращении стимулирования и введения атропина внутривенно. В очень редких случаях АВ-блокада III степени может быть врожденной.
Двухпучковые и трехпучковые блокады. Двухпучковые блокады представляют собой различные сочетания изолированных блокад разветвлений пучка Гиса: блокада правой ножки пучка Гиса в сочетании с блокадой передней верхней ветви левой ножки пучка Гиса или блокадой задней нижней ветви левой ножки пучка Гиса, а также БЛНПГ. Трехпучковая блокада диагностируется при альтернирующей внутрижелудочковой блокаде при чередовании двух разновидностей двухпучковых блокад или при сочетании двухпучковой блокады с АВ-блокадой I-II степени.
Блокады ножек пучка Гиса чаще всего связаны с ИБС, их сочетание может привести к развитию полной блокады сердца. Это особенно вероятно, если рассматривать возможные эффекты анестетиков, антиаритмиков, электролитные нарушения, интубацию, гипотермию, хирургические манипуляции и возможную ишемию миокарда.
БЛНПГ затрудняет интерпретацию ЭКГ при дифференциальной диагностике ОКС, поэтому впервые возникшая БЛНПГ должна трактоваться как признак ОИМ, пока не доказано обратное. Требуется срочное обсуждение с кардиологом необходимости экстренной коронарографии и ангиопластики коронарных сосудов.
Кроме того, надо учитывать, что при катетеризации легочной артерии на фоне БЛНПГ высока вероятность развития блокады правой ножки пучка Гиса (ПНПГ) с формированием полной АВ-блокады и необходимо быть готовым к временной ЭКС.
В то же время неполная блокада ПНПГ может встречаться у здоровых людей.
При хронической бифасцикулярной блокаде временная, а затем, в ряде случаев, постоянная ЭКС показана при гемодинамически значимых брадиаритмиях, обмороках без явной причины. Временная ЭКС также показана при сочетании блокады ветви пучка Гиса с АВ-блокадой II степени типа Мобитц II либо полной АВ-блокаде в анамнезе. Постоянная ЭКС показана также при альтернирующей блокаде ножек пучка Гиса. Пациентам, которые имеют бессимптомное течение биили трифасцикулярной блокады, временная кардиостимуляция не рекомендуется в периоперационном периоде для рутинного управления ритмом.
Имплантируемые антиаритмические устройства
Антиаритмические электронные устройства (cardiac pacing devices), которые имплантируются пациенту для лечения различных нарушений ритма, проводимости и некоторых вариантов ХСН, условно можно разделить на три вида:
Наиболее распространенные показания к временной ЭКС в периоперационном периоде:
При плановой или отсроченной операции после кардиологического обследования устанавливают постоянный кардиостимулятор. Ниже представлены основные показания к установке постоянного кардиостимулятора при АВ-блокадах.
Показания к имплантации ЭКС при АВ-блокадах
Пациентам с приобретенной АВ-блокадой III степени или II степени Мобитц II показана имплантация ЭКС вне зависимости от симптомов.
-
Имплантация постоянного электрокардиостимулятора должна быть рассмотрена у пациентов с АВ-блокадой II степени Мобитц I и I степени, при наличии симптомов или при доказанной на инвазивном ЭФИ интраили инфрагисовской блокаде.
-
Имплантация постоянного электрокардиостимулятора должна быть рассмотрена у пациентов с АВ-блокадой I или II степени с клинической симптоматикой или нарушениям гемодинамики.
-
Нейромышечные заболевания, такие как миотоническая мышечная дистония, синдром Кернс-Сэйра, дистрофия Лейдена, перонеальная мышечная атрофия с АВ-блокадой любой степени (включая АВ-блокаду I степени), с симптомами или без, так как может быть непредсказуемое прогрессирование заболевания и ухудшение предсердно-желудочковой проводимости.
-
При возникновении АВ-блокады в связи с применением препаратов и/или их токсическим воздействием, когда разрешение блокады не ожидается, даже в условиях отмены данного препарата.
-
АВ-блокада I степени с интервалом PQ >0,30 с у пациентов с дисфункцией ЛЖ и симптомами застойной СН, у которых более короткий интервал A-V, приводит к гемодинамическому улучшению, предположительно за счет уменьшения давления в левом предсердии (ДЛП).
Имплантация постоянного электрокардиостимулятора не показана пациентам с приобретенной АВ-блокадой, обусловленной обратимыми причинами
Если у пациента установлен постоянный ЭКС, необходимо проверить адекватность батареи, функцию устройства и степень зависимости пациента от ЭКС. Пациенты, у которых ритм сердца не является оптимальным, в послеоперационном периоде должны пройти проверку кардиостимулятора с адекватным программированием устройства и установкой соответствующих параметров стимуляции и восприятия.
Если у пациента установлен имплантируемый кардиовертер-дефибриллятор, он должен быть выключен на время операции и затем включен в восстановительном режиме перед переводом пациента в палату. Режим дефибрилляции также должен быть инактивирован с помощью постоянного магнита. На время отключения функции дефибрилляции в операционной должен быть в непосредственной доступности внешний дефибриллятор.
В послеоперационном периоде рекомендовано мониторирование ЭКГ в течение 72 ч, коррекция электролитов крови, медикаментозная терапия.
Поражения клапанного аппарата сердца
Пациенты с патологией клапанного аппарата сердца представляют достаточно многочисленную популяцию с высокой вероятностью госпитализации в неспециализированные стационары. Наличие порока сердца в сочетании с СН может значительно утяжелять состояние пациентов, поступивших в ОРИТ в связи с некардиальными причинами (интоксикацией, травмой, после некардиохирургических вмешательств и пр.). Интенсивная терапия у таких больных предполагает решение дополнительных задач коррекции внутрисердечной и системной гемодинамики, а также профилактики и лечения свойственных для пороков клапанного аппарата осложнений.
КОДЫ ПО МЕЖДУНАРОДНОЙ КЛАССИФИКАЦИИ БОЛЕЗНЕЙ 10-ГО ПЕРЕСМОТРА
I05 Ревматические болезни МК.
I06 Ревматические болезни аортального клапана.
I07 Ревматические болезни ТК.
I34 Неревматические поражения МК.
I35 Неревматические поражения аортального клапана.
I36 Неревматические поражения ТК.
I37 Поражения клапана легочной артерии.
I38 Эндокардит, клапан не уточнен.
I39 Эндокардит и поражения клапанов сердца при болезнях, классифицированных в других рубриках.
Q22 Врожденные аномалии [пороки развития] легочного и трехстворчатого клапанов.
Q23 Врожденные аномалии [пороки развития] аортального клапана и МК.
Q24.9 Врожденный порок сердца неуточненный.
ОПРЕДЕЛЕНИЕ
Клапанные пороки сердца - нарушения деятельности сердца, обусловленные врожденными или приобретенными морфологическими изменениями в клапанном аппарате сердца с формированием стеноза или регургитации.
ЭТИОЛОГИЯ
Для любого из клапанов сердца возможен врожденный характер морфологических нарушений с развитием порока.
Ревматическая болезнь сердца ранее была основной причиной повреждения клапанного аппарата. Однако в настоящее время, вследствие эффективной профилактики ревматизма, в развитых странах значимость этого этиологического фактора снизилась.
Инфекционный эндокардит (ИЭ) может быть причиной повреждения любого клапана сердца с формированием недостаточности.
Клапаны сердца могут повреждаться при специфических инфекционных процессах, например при сифилисе.
ИБС может стать причиной формирования недостаточности МК вследствие некроза папиллярных мышц или в случаях развития ишемической дилатационной кардиомиопатии с растяжением фиброзного кольца МК.
Врожденные дефекты соединительной ткани (синдромы Марфана, Элерса-Данлоса) приводят к изменениям в соединительнотканных структурах клапанного аппарата сердца с постепенным формированием недостаточности митрального и/или аортального клапанов.
Атеросклероз является значимой причиной дегенеративно-дистрофических изменений аортального клапана с развитием его стеноза.
Выраженная легочная гипертензия любого типа приводит к развитию недостаточности ПЖ сердца с увеличением его полости и формированием относительной недостаточности трикуспидального клапана (ТК).
Повреждения аортального и митрального клапанов могут быть результатом перенесенных травм с ушибом органов грудной полости.
КЛАССИФИКАЦИЯ
По этиологии:
По поврежденному клапану:
По типу нарушения внутрисердечной гемодинамики:
По выраженности расстройств внутрисердечной гемодинамики:
По наличию симптомов:
В табл. 3.29 указаны обобщенные данные о частоте встречаемости повреждений клапанов сердца в различных странах Европы и Америки.
| Вид клапанного порока | Частота в популяции, % | Источники литературы |
|---|---|---|
Аортальный стеноз |
1-4 |
Stewart B. et al., 1997; Goldberg S. et al., 2007 |
Аортальная регургитация |
0,8 |
Reid C. et al., 2007 |
Митральный стеноз |
0,1 |
Iung B. et al., 2014 |
Митральная регургитация |
2-10,4 |
Chikwe J. et al., 2004; Reid C. et al., 2007 |
НАРУШЕНИЯ ВНУТРИСЕРДЕЧНОЙ И СИСТЕМНОЙ ГЕМОДИНАМИКИ ПРИ ПОРОКАХ КЛАПАННОГО АППАРАТА СЕРДЦА
Последствия повреждений клапанного аппарата сердца необходимо рассматривать как с позиции нарушений внутрисердечной гемодинамики, так и с точки зрения влияния на большой и малый круги кровообращения. Формирование стеноза аортального клапана или клапана легочной артерии приводит к перегрузке постнагрузкой соответственно левого или правого желудочков, с последующим развитием СН. При недостаточности клапанов сердца основной механизм нарушения внутрисердечной гемодинамики - перегрузка объемом, дилатация камер сердца с последующим развитием СН.
Сами по себе клапанные пороки, даже при сохранной сократительной функции миокарда, оказывают значимое влияние на гемодинамику большого и малого кругов кровообращения. Аортальный и митральный стенозы являются типичными примерами ситуации фиксированного СВ, когда УО ограничен механическим препятствием кровотоку. При митральной и аортальной недостаточности часть УО возвращается с потоком регургитации в левое предсердие (ЛП) или ЛЖ. Периферических органов и тканей достигает лишь часть УО ЛЖ (так называемый «эффективный УО»). Влияние на малый круг кровообращения при пороках клапанного аппарата обусловлено повышением давления в ЛП вследствие механического препятствия оттоку крови при митральном стенозе, регургитации в ЛП при митральной недостаточности или росту КДД ЛЖ при аортальном стенозе и аортальной недостаточности. В этих ситуациях рост давления в ЛП приводит к формированию легочной гипертензии II типа (легочная гипертензия, ассоциированная с заболеваниями левых отделов сердца) с высоким риском развития кардиогенного ОЛ.
ОСОБЕННОСТИ ВЕДЕНИЯ ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ПОРОКАМИ КЛАПАННОГО АППАРАТА СЕРДЦА
Сопутствующие по отношению к основному патологическому процессу нарушения со стороны клапанного аппарата сердца, особенно при наличии гемодинамических проявлений, требуют привлечения усилий мультидисциплинарной группы, в состав которой должны входить заведующий ОРИТ, заведующий профильным отделением, лечащий врач и врач-кардиолог (терапевт). Этой группе необходимо решить следующие клинические задачи: определить тяжесть порока сердца и его вклад в течение основного патологического процесса, определить возможность продолжения и модификации базисной консервативной терапии порока сердца, указать на необходимость использования дополнительных методов диагностики и привлечения консультанта-кардиохирурга, оценить необходимость применения расширенного мониторинга и дополнительного лечения, связанных с наличием у пациента порока сердца.
Обследование пациента с сопутствующим пороком клапанного аппарата сердца
Обследование пациента с возможным повреждением клапанного аппарата сердца должно быть нацелено на решение нескольких задач. Во-первых, необходимо верифицировать наличие повреждения клапана сердца и выраженность связанных с ним нарушений внутрисердечной гемодинамики, соответствующих определенной степени тяжести порока. Во-вторых, надо оценить значимость вызванных пороком нарушений сердечно-сосудистой системы, таких как формирование ХСН, дилатация камер сердца, гипертрофия миокарда ЛЖ, развитие легочной гипертензии. Тяжелые гемодинамические нарушения, вызванные пороками клапанов, могут приводить к повреждению внутренних органов, поэтому пристальной оценки требует состояние печени и почек. Современные рекомендации по верификации поражений клапанного аппарата сердца, оценке тяжести пороков и определению показаний к кардиохирургическим вмешательствам представлены в специализированных международных и национальных руководствах [18-20]. В настоящем разделе представлены данные об обследовании, необходимом для периоперационного ведения пациента с сопутствующим пороком клапанного аппарата сердца.
Жалобы и анамнез
Необходимо собирать анамнез с максимально возможным представлением медицинской документации о предшествующих госпитализациях и обследованиях по поводу сопутствующих заболеваний со стороны сердечно-сосудистой системы. Ключевыми моментами при опросе должны быть сведения о клинических проявлениях клапанного порока, таких как стенокардия, одышка при физической нагрузке и в покое, приступы удушья. Чрезвычайно важно определить динамику этих симптомов и факт перенесенных случаев декомпенсации клинического состояния пациента. Необходимо получить информацию о медикаментозной терапии, которую пациент получал до поступления в стационар, уделив особое внимание антиагрегантам и антикоагулянтам.
Инструментальная диагностика
ЭхоКГ является ключевым методом для подтверждения диагноза клапанного порока сердца (уровень убедительности рекомендаций - I, уровень достоверности доказательств - B) [19] и должна быть выполнена пациенту при подозрении на наличие порока сердца. ЭхоКГ позволяет определить важнейшие характеристики порока, такие как градиент давления при стенозе, объем и фракцию регургитации при недостаточности, площадь раскрытия клапана. Именно на эхо-кардиографических данных основано современное определение тяжести того или иного порока. Кроме того, ЭхоКГ позволяет сделать заключение о выраженности связанных с клапанным пороком нарушений сердечно-сосудистой системы - снижении СВ и фракции изгнания ЛЖ, дилатации камер сердца, гипертрофии миокарда и изменении магистральных сосудов, повышении давления в легочной артерии, наличии тромбов в предсердиях и желудочках.
Рентгенография органов грудной клетки рекомендована для пациентов с подозрением на наличие поражения клапанного аппарата сердца (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - C) [б, 19]. Обзорная рентгенография грудной клетки позволяет получить информацию о размерах сердца, легочном кровотоке и кальцификации сердца. Патологические изменения рентгенограммы органов грудной клетки являются показанием к проведению ЭхоКГ.
ЭКГ позволяет предположить наличие порока сердца. Так, Р mitrale (широкие, более 0,12 с, двугорбые зубцы Р) позволяет заподозрить увеличение ЛП, характерное для патологических изменений МК. Высокий вольтаж на ЭКГ в сочетании с отклонением электрической оси сердца влево или вправо позволяет заподозрить гипертрофию соответственно левого или правого желудочков. Также часто на ЭКГ можно выявить нарушения ритма, проводимости, признаки острой ишемии или перенесенных инфарктов миокарда. Весьма часто при клапанной патологии (особенно при повреждениях МК) наблюдается ФП.
Лабораторная диагностика
В данных лабораторных исследований необходимо обратить внимание на признаки развития и утяжеления СН. О значимом снижении производительности сердца, связанном с падением сократительной способности миокарда или с нарушениями внутрисердечной гемодинамики, свидетельствует снижение насыщения кислородом гемоглобина крови центральной вены (SvO2) менее 65% (при условии нормального содержания гемоглобина и отсутствия гипоксемии). Развитие и ухудшение течения СН можно заподозрить при увеличении разницы между парциальным давлением углекислого газа в крови из центральной вены и артериальной крови более 5 мм рт.ст. (pvCO2-paCO2 >5 мм рт.ст.).
Концентрация в плазме крови BNP более 35 пг/мл или NT-proBNP более 125 пг/мл используется как диагностический критерий ХСН [8]. Кроме того, на уровень этого маркера объемной перегрузки миокарда можно ориентироваться при оценке эффективности терапии ХСН, в том числе у пациентов с повреждениями клапанного аппарата сердца.
Стандартный и дополнительный мониторинг при проведении интенсивной терапии у пациентов с сопутствующими повреждениями клапанного аппарата сердца
Необходимость в использовании расширенного мониторинга при проведении интенсивной терапии у пациентов с сопутствующими повреждениями клапанного аппарата сердца возникает в случаях декомпенсации ХСН с развитием синдрома малого СВ или кардиогенного ОЛ.
В подобных клинических ситуациях рекомендовано применение инвазивного мониторинга АД (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8]. Инвазивное измерение АД (иАД) позволяет распознать артериальную гипотонию непосредственно в момент ее развития и, таким образом, ускорить коррекцию. При нарушениях ритма сердца иАД дает возможность быстрого определения гемодинамической значимости аритмий и своевременного принятия решения о рациональных методах их лечения. Форма кривой иАД позволяет анестезиологу получить дополнительные сведения о контрактильности миокарда, истинном значении среднего АД, гемодинамической значимости порока (при аортальной недостаточности). Наконец, постоянный доступ к артериальному руслу значительно упрощает своевременный забор проб для анализа газового состава крови.
Развитие нарушений гемодинамики у пациентов с сопутствующими повреждениями клапанного аппарата сердца требует катетеризации центральной вены и обеспечения мониторинга ЦВД (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C). Детальная характеристика применения этого метода мониторинга у пациентов с сопутствующими заболеваниями сердца представлена в разделе «Хроническая сердечная недостаточность».
В случаях развития у пациентов с сопутствующими повреждениями клапанного аппарата тяжелых, плохо поддающихся коррекции гемодинамических нарушений, с целью уточнения их причины и повышения эффективности терапии может быть рассмотрен вопрос о постановке катетера в легочную артерию (уровень убедительности рекомендаций - IIb, уровень достоверности доказательств - C) [8, 21, 22]. Особенности применения этого метода у пациентов с сопутствующими заболеваниями сердца представлены в разделе «Хроническая сердечная недостаточность».
Дополнительная терапия, необходимая для пациентов ОРИТ с сопутствующими повреждениями клапанного аппарата сердца
Базисная терапия пациентов с повреждениями клапанного аппарата сердца
Большинство пациентов с патологическими изменениями клапанного аппарата сердца до поступления в стационар получали кардиотропную терапию. Такое базисное медикаментозное лечение преследует решение нескольких задач: коррекция ХСН, коррекция/профилактика нарушений ритма сердца, профилактика тромбо-эмболических осложнений.
Пациенты с заболеваниями клапанного аппарата, имеющие ХСН, должны получать терапию, соответствующую современным международным рекомендациям и включающую β-адреноблокаторы, ИАПФ, антагонисты рецепторов минералокортикоидов и диуретики (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [6, 8, 19]. Совместно с кардиологом решается вопрос о продолжении этой базисной терапии и ее модификации с переходом на парентеральное введение препаратов в случае невозможности энтерального пути введения.
Нарушения ритма сердца чрезвычайно характерны для пациентов с повреждением клапанного аппарата. Это обусловлено морфологическими изменениями в миокарде желудочков и предсердий, возникающими при длительной перегрузке объемом и давлением. Увеличение размеров предсердий и желудочков, формирование гипертрофии миокарда и кардиосклероза приводят как к возникновению пароксизмальных и перманентных нарушений возбудимости, так и к повреждениям проводящей системы. Развитие аритмий может катастрофически ухудшить состояние скомпрометированной гемодинамики пациентов с пороками клапанов сердца и стать триггером декомпенсации. Поэтому требуется обязательное продолжение базисной антиаритмической терапии и настойчивая профилактика аритмий, детально описанные в разделе «Ведение пациентов с сопутствующими нарушениями ритма сердца» настоящей главы.
Повышенный риск развития тромбоэмболических осложнений характерен для большей части пациентов с пороками клапанного аппарата сердца. Этот риск определяется частой сопутствующей ФП, увеличением размеров предсердий, перенесенной ранее имплантацией механических протезов клапанов сердца. Опасность тромбоэмболических эпизодов значительно возрастает при критических состояниях различной природы вследствие активации систем тромбоцитарного и коагуляционного гемостаза и снижения антикоагуляционного потенциала. Эти обстоятельства указывают на необходимость оценки рациональности профилактики тромбоэмболических осложнений для каждого пациента с сопутствующими повреждениями клапанного аппарата. Ниже представлены подходы к тромбопрофилактике у пациентов с повреждениями клапанного аппарата, сформулированные в Руководстве Европейского общества кардиологов по ведению пациентов с патологией клапанного аппарата сердца (2017) [19]. У пациентов с аортальной регургитацией, аортальным стенозом и митральной регургитацией при наличии ФП в качестве альтернативы пероральным блокаторам витамина К (варфарин) могут быть рассмотрены прямые пероральные антикоагулянты (прямые блокаторы тромбина или прямые блокаторы X-фактора) (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - B) [19]. При митральном стенозе средней и тяжелой степени выраженности и наличии ФП профилактика тромбоэмболических осложнений предполагает назначение варфарина с поддержанием целевого МНО на уровне 2-3. Применение прямых пероральных антикоагулянтов (прямых блокаторов тромбина или прямых блокаторов X-фактора) для профилактики тромбоэмболических осложнений у пациентов с митральным стенозом и ФП противопоказано [19]. У пациентов с митральным стенозом, имеющих синусовый ритм, антикоагулянтная терапия показана при указаниях на тромбоэмболические эпизоды в анамнезе или при наличии тромба в ЛП (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [19]. У пациентов с митральным стенозом, имеющих синусовый ритм, антикоагулянтная терапия показана при обнаруженном при ЧПЭхоКГ спонтанном контрастировании кровотока в ЛП, а также в случаях увеличения индекса объема последнего более б0 мл/м2 (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - C) [19].
Интенсивная терапия декомпенсации гемодинамики у пациентов с повреждениями клапанного аппарата сердца
Возможны два основных сценария декомпенсации гемодинамики. Первый - снижение производительности левого и/или правого желудочков сердца с развитием синдрома малого СВ. Второй - прогрессирование легочной венозной гипертензии, связанной с ростом ДЛП, и последующее развитие кардиогенного ОЛ. Основной патологический процесс, по поводу которого пациент госпитализирован, является фактором, повышающим риск декомпенсации гемодинамики. Этому способствуют снижение контрактильности миокарда при различных вариантах эндогенной и экзогенной интоксикации, повышенный симпато-адреналовый статус, гиперволемия и гипоксия, часто сопровождающие критические состояния различной природы.
Терапия синдрома малого СВ. Показаниями для терапии синдрома малого СВ являются:
-
снижение АДср. менее 65 мм рт.ст., не связанное с развитием вазоплегии артериального русла или гиповолемии;
-
снижение производительности сердца, сопровождающееся нарушениями тканевой перфузии, что подтверждается падением SvO2 менее 65% (при условии отсутствия анемии и артериальной гипоксемии) и ростом содержания лактата выше 2 ммоль/л.
В случае возможности измерения показателей центральной гемодинамики (катетер Свана-Ганца, система PiCCO, ЭхоКГ) о развитии синдрома малого СВ может свидетельствовать снижение СИ менее 2,2 л/мин/м2. Однако у пациентов с пороками клапанов сердца исходное значение СИ часто меньше указанной величины, о чем можно судить по данным предшествующих ЭхоКГ. В этих случаях терапию синдрома малого СВ следует начинать при прогрессивном снижении СИ на фоне признаков нарушения тканевой перфузии (снижение SvO2, повышение уровня лактата).
Первым этапом терапии синдрома малого СВ должно быть обеспечение адекватной преднагрузки ЛЖ. Решение этой задачи в особой мере затруднено именно у пациентов с пороками клапанов сердца, поскольку для них характерны повышенные значения ДЗЛА (часто более 15 мм рт.ст.), а ЦВД не отражает преднагрузку ЛЖ. В подобной ситуации об адекватности преднагрузки будут свидетельствовать так называемые динамические показатели (тест с пассивным подъемом ног на 40°, пробная инфузия 200,0 кристаллоидного раствора (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8], изменение показателей гемодинамики в ответ на рост внутригрудного давления при искусственном вдохе и т.д.).
В случае уверенности в достижении адекватной преднагрузки и сохранении при этом сниженного СИ с признаками нарушения периферической перфузии назначают инотропную терапию. Необходимо помнить, что при состояниях с фиксированным СВ - аортальном стенозе и особенно митральном стенозе - возможности инотропной терапии значительно ограничены.
Для инотропной терапии возможно использование допамина (Дофамина♠) в дозе 2,5-8 мкг/кг/мин, добутамина в дозе 2,5-20 мкг/кг/мин, эпинефрина (Адреналина♠) в дозе 0,03-0,4 мкг/кг/мин. В случаях рефрактерной артериальной гипотонии, особенно в ситуациях с фиксированным СВ, возможно назначение норэпинефрина (Норадреналина♠) в дозе 0,03-0,5 мкг/кг/мин.
Терапия кардиогенного ОЛ. У пациентов с пороками клапанов сердца причиной кардиогенного ОЛ является повышение ДЛП с развитием выраженной венозной легочной гипертензии. Подобный механизм характерен для митрального стеноза, митральной недостаточности, стеноза аортального клапана и недостаточности аортального клапана. Дополнительными предрасполагающими факторами для пациента ОРИТ могут быть подъем АД со значимым увеличением постнагрузки ЛЖ, волемическая перегрузка с повышением ДЛП и гипопротеинемия при кровопотере, способствующая снижению коллоидно-осмотического давления на фоне повышения гидростатического компонента. О значении ДЛП можно судить по величине ДЗЛА и ряду эхокардиографических показателей (форма и размер ЛП, трансмитральный кровоток, допплерографические характеристики потока в легочных венах) [23].
Основные направления интенсивной терапии в таких клинических ситуациях включают нормализацию газообмена и использование параметров ИВЛ, снижающих объемную перегрузку малого круга, применение венозных и артериальных вазодилататоров, диуретиков, назначение инотропных препаратов.
Коррекция гипоксемии необходима при снижении SaO2 менее 90% (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8], это может потребовать увеличения фракции кислорода во вдыхаемой смеси (FiO2). Дополнительной мерой должно быть назначение положительного давления конца выдоха (ПДКВ), что позволяет не только улучшить газообмен, но и снизить кровоток в малом круге кровообращения.
Если на момент развития кардиогенного ОЛ пациент дышит самостоятельно, то для коррекции нарушений газообмена рекомендуется назначить неинвазивную вентиляцию легких (НвЛ)
(уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - B) [8] в режиме постоянного положительного давления в дыхательных путях (CPAP) или двухфазного положительного давления в дыхательных путях (BiPAP).
При выборе вазодилататоров предпочтение должно отдаваться препаратам с преимущественным воздействием на венозное русло. С этой целью могут быть назначены нитроглицерин или изосорбида динитрат в дозе 0,3-1,5 мкг/кг/мин. Возможно болюсное введение изосорбида динитрата в дозе 250 мкг под контролем АД.
В случаях, когда кардиогенный ОЛ развивается на фоне нормального или сниженного АД и недостаточной производительности сердца, необходимо назначение инотропных препаратов. В этих клинических ситуациях предпочтение необходимо отдать добутамину, учитывая его воздействие как на β1-, так и на β2-рецепторы.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ПАЦИЕНТОВ С СОПУТСТВУЮЩИМИ ПОВРЕЖДЕНИЯМИ КЛАПАННОГО АППАРАТА СЕРДЦА В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ НЕКАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Необходимо выделить следующие ключевые положения в обеспечении раннего послеоперационного периода некардиохирургических вмешательств у пациентов с пороками клапанного аппарата сердца:
У пациентов с тяжелыми пороками клапанного аппарата сердца желательно продолжать мониторинг гемодинамики в течение 24 ч после вмешательства. Крайне важно понимать, что вследствие комплексного характера нарушений сердечнососудистой системы при оценке состояния у этих больных недостаточно опираться на клинические показатели и уровень АД. Интегральными маркерами адекватности гемодинамики в данных случаях служат показатели доставки и потребления кислорода. Об ухудшении состояния свидетельствует снижение Sv O2 менее 65%, а у больных с выраженной дооперационной ХСН - менее исходных значений. В пользу декомпенсации гемодинамики будет говорить уровень лактата более 2 ммоль/л и дальнейшее повышение этого показателя. В случае развития декомпенсации интенсивная терапия синдрома малого СВ и кардиогенного ОЛ должна проводиться в соответствии с принципами, изложенными в соответствующих разделах. В этих ситуациях должна быть выполнена ЭхоКГ для контроля состояния клапанного аппарата, давления легочной артерии (ДЛА), адекватности преднагрузки, сократимости ЛЖ.
При тяжелых пороках клапанного аппарата с высоким риском развития кардиогенного ОЛ - митральном стенозе, митральной недостаточности, стенозе аортального клапана и аортальной недостаточности - особое внимание следует уделять предупреждению гиперволемии и объемной перегрузки сердца и малого круга. О развитии такой неблагоприятной ситуации будет свидетельствовать появление признаков интерстициального застоя на рентгенограмме легких, а также данные ЭхоКГ, такие как рост ДЛАсис, увеличение степени регургитации на трехстворчатом и митральном клапанах, увеличение КДО ЛЖ. В послеоперационном периоде необходимо не только стремиться к поддержанию нулевого жидкостного баланса, но и попытаться компенсировать гиперволемию, допущенную на этапе вмешательства. Для решения этой задачи можно использовать постоянную инфузию фуросемида в дозе 1-5 мг/ч.
При решении вопроса об адекватном послеоперационном обезболивании может быть рассмотрена возможность использования ЭА (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - B) [6].
ОСОБЕННОСТИ ИНТЕНСИВНОЙ ТЕРАПИИ И ВЕДЕНИЯ В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ ПРИ ОТДЕЛЬНЫХ ВИДАХ ПОРОКОВ КЛАПАННОГО АППАРАТА СЕРДЦА Аортальный стеноз
Аортальный стеноз характеризуется механическим препятствием изгнанию крови из ЛЖ в аорту. Это обусловливает невозможность быстрого увеличения в случае необходимости СВ за счет УО - так называемое состояние «фиксированного СВ». В связи с этим при вазоплегии (например, анафилактическом или СШ, спинальной/эпидуральной анестезии и пр.) или резком снижении ОЦК у пациента быстро падают системный кровоток и перфузия, не компенсируемые увеличением работы сердца.
ЭхоКГ позволяет точно оценить тяжесть поражения клапанов (табл. 3.30). Наиболее информативной является оценка градиента давления на аортальном клапане. При этом следует помнить, что на фоне развития левожелудочковой недостаточности у больных с некорригированным аортальным стенозом градиент давления может не возрастать, а снижаться.
| Степень тяжести порока | Скорость потока в аорте, м/с | Средний градиент, мм рт.ст. | Площадь клапана, см2 |
|---|---|---|---|
Норма |
<1,5 |
<5 |
3,0-4,0 |
Средняя тяжесть |
<3,0 |
<25 |
>1,5 |
Выраженный стеноз |
3,0-4,0 |
25-40 |
1,0-1,5 |
Тяжелый стеноз |
>4,0 |
>40 |
<1,0 |
Особенности управления гемодинамикой при проведении интенсивной терапии у пациентов с сопутствующим тяжелым аортальным стенозом
Поддержание правильного сердечного ритма (синусовая нормосистолия) и предупреждение снижения ОПСС являются важнейшими задачами (табл. 3.31). Следует поддерживать ЧСС в пределах 60-90 уд/мин. Очень важно сохранять достаточный УО сердца, в том числе за счет адекватной преднагрузки. Поддержание СВ и нормальных величин ОЦК позволит обеспечить адекватную перфузию тканей. Необходимо избегать артериальной гипотонии - даже короткие эпизоды могут привести к снижению коронарной перфузии и развитию ишемии миокарда. В такой ситуации необходимо раннее неотложное использование α-адреномиметиков.
| Преднагрузка | ЧСС | Сократимость | Системное сосудистое сопротивление | Легочное сосудистое сопротивление |
|---|---|---|---|---|
↑ |
↓ Синусовый ритм |
Поддерживать |
↑ |
Поддерживать |
Аортальная недостаточность
Аортальная недостаточность характеризуется обратным током крови из аорты в ЛЖ через патологически измененный аортальный клапан.
ЭхоКГ позволяет оценить тяжесть поражения клапанов (табл. 3.32).
Особенности управления гемодинамикой при проведении интенсивной терапии у пациентов с сопутствующей тяжелой аортальной недостаточностью
Рекомендуемая в международных руководствах тактика поддержания гемодинамики - Fast, full and forward. Это означает необходимость обеспечения достаточно высокой ЧСС (fast) и сохранения наполнения камер сердца (full) для поддержания приемлемого СВ (forward). Гемодинамические ориентиры, соответствующие этой концепции, представлены в табл. 3.33. Принципиально важным является предупреждение повышения ОПСС, так как рост постнагрузки увеличивает регургитацию. Оптимальная ЧСС - 90 уд/мин. При умеренной тахикардии укорочение диастолы снижает объем аортальной регургитации, что способствует улучшению перфузии тканей. В то же время связанное с тахикардией повышение диастолического давления предупреждает развитие ишемии миокарда. Следует поддерживать компенсаторное повышение преднагрузки и избегать избыточной медикаментозной депрессии миокарда.
| Степень тяжести порока | Отношение ширины потока регургитации к ширине ВТЛЖ, % | Отношение площади потока регургитации к площади ВТЛЖ, % | Реверсия диастолического аортального потока |
|---|---|---|---|
Средняя тяжесть |
25-46 |
4-24 |
Нет |
Выраженная недостаточность |
47-64 |
25-59 |
|
Тяжелая недостаточность |
>65 |
>60 |
Ретроградный ток в нисходящей аорте в течение всей диастолы |
Примечание. ВТЛЖ - выносящий тракт левого желудочка.
| Преднагрузка | ЧСС | Сократимость | Системное сосудистое сопротивление | Легочное сосудистое сопротивление |
|---|---|---|---|---|
↑ |
↑ |
Поддерживать |
↓ |
Поддерживать |
Митральный стеноз
Митральный стеноз - сужение левого АВ-отверстия, препятствующее нормальному току крови из ЛП в ЛЖ. Как и аортальный стеноз, является состоянием с «фиксированным» СВ.
В развитии внутрисердечных и системных нарушений кровообращения у пациентов с митральным стенозом необходимо выделить два ключевых механизма. Первый - повышение ДЛП вследствие затрудненного опорожнения через ограниченное отверстие МК. Формирование венозной легочной гипертензии и перегрузки малого круга с возможным развитием кардиогенного ОЛ. Второй механизм связан с нарушением наполнения ЛЖ через стенозированный МК. Снижение УО ЛЖ на фоне сохраненной сократительной способности вплоть до формирования состояния фиксированного СВ.
ЭхоКГ позволяет более точно оценить тяжесть стеноза МК (табл. 3.34).
| Степень тяжести порока | Средний клапанный градиент давления, мм рт.ст. | Период снижения градиента давления наполовину, мс | Площадь МК, см2 |
|---|---|---|---|
Умеренный стеноз |
6 |
100 |
1,6-2,0 |
Выраженный стеноз |
6-10 |
200 |
1,0-1,5 |
Тяжелый стеноз |
>10 |
>300 |
<1,0 |
Особенности управления гемодинамикой при проведении интенсивной терапии у пациентов с сопутствующим тяжелым митральным стенозом.
Как было указано выше, при митральном стенозе состояние гемодинамики определяется двумя механизмами - легочной венозной гипертензией и фиксированным выбросом ЛЖ. Ориентиры управления гемодинамикой при подобном комплексном нарушении представлены в табл. 3.35.
| Преднагрузка | ЧСС | Сократимость | Системное сосудистое сопротивление | Легочное сосудистое сопротивление |
|---|---|---|---|---|
+/-
|
↓ |
Поддержание
|
Поддержание
|
+/-
|
Достаточно сложной задачей является выбор оптимального уровня преднагрузки, поскольку гиперволемия значимо повышает риск развития ОЛ и должна активно предупреждаться. С другой стороны, чрезмерная гиповолемия приводит к снижению ДЛП и, соответственно, к уменьшению градиента давления наполнения ЛЖ через стенозированный МК, что может способствовать дальнейшему падению СВ. Трудности управления преднагрузкой связаны и со сложностью ее оценки. ЦВД при тяжелом митральном стенозе ни в коей мере не отражает давление наполнения ЛЖ. Вариантом решения этой задачи может быть мониторирование ДЗЛА и использование его исходного значения в качестве ориентира при определении тактики инфузионной терапии в послеоперационном периоде.
Состояние фиксированного СВ диктует необходимость настойчивого предупреждения тахикардии, при которой сокращается фаза диастолического наполнения и снижается УО ЛЖ. С целью контроля ЧСС рационально использовать β-адреноблокаторы с коротким периодом полувыведения (эсмолол). Выброс ЛЖ в данных клинических условиях определяется его ограниченным наполнением, но не сниженной сократительной способностью. Поэтому в случаях развития артериальной гипотонии нет смысла в использовании инотропных препаратов, поддерживать перфузионное давление необходимо маневром инфузии и назначением вазопрессоров.
Митральная недостаточность
Митральная недостаточность - поражение аппарата МК (створок, сухожильных хорд, папиллярных мышц), при котором возникает обратный ток крови из ЛЖ в ЛП во время систолы.
Нарушения внутрисердечной и системной гемодинамики при митральной недостаточности в первую очередь определяются объемной перегрузкой ЛП и ЛЖ. Ведущим проявлением этого становится формирование легочной венозной гипертензии с прогрессирующим ростом ДЛА. Для этого периода характерно венозное полнокровие легких с опасностью развития отека. Постепенно в генезе легочной гипертензии возрастает роль вазоспастического (артериального) компонента, значимо увеличивающего сопротивление малого круга. Это способствует перегрузке ПЖ сопротивлением и развитию его дисфункции. Следствием объемной перегрузки ЛЖ становится рост КДО ЛЖ и КДД ЛЖ с медленным снижением его сократительной способности. Объемная перегрузка и дилатация ЛП провоцируют достаточно раннее появление ФП.
Второй компонент патогенеза митральной недостаточности связан с тем, что УО ЛЖ делится на часть, возвращающуюся в ЛП (иногда более чем 50% от общего УО), и часть, поступающую в аорту и большой круг (так называемый «эффективный УО»). Достаточно долго это нарушение не имеет клинического проявления за счет компенсаторного поддержания контрактильности на фоне роста КДО ЛЖ. Снижение эффективного УО до крайне низких значений с формированием синдрома малого выброса и падением SvO2 характерно для завершающего периода заболевания.
ЭхоКГ позволяет оценить тяжесть поражения клапана (табл. 3.36). Следует учитывать, что измеренная ФВ ЛЖ не отражает фактическую величину СВ, поскольку эффективный УО может быть значительно меньше измеренного при ЭхоКГ общего УО ЛЖ.
| Степень тяжести порока | Площадь потока митральной регургитации, см2 | Процент площади потока митральной регургитации к площади ЛП, % | Фракция регургитации, % |
|---|---|---|---|
Умеренная недостаточность |
<3 |
20-30 |
20-30 |
Выраженная недостаточность |
3,0-6,0 |
30-40 |
30-50 |
Тяжелая недостаточность |
>6 |
>40 |
>50 |
Особенности управления гемодинамикой при проведении интенсивной терапии у пациентов с сопутствующей тяжелой митральной недостаточностью. Изменения гемодинамики во время проведения интенсивной терапии у пациентов с митральной недостаточностью определяются легочной венозной гипертензией и опасностью развития ОЛ. У большинства пациентов систолическая функция ЛЖ удовлетворительная. Даже с учетом уменьшенного эффективного УО проблема снижения СВ не стоит так остро, как при других пороках сердца. ЧСС должна сохраниться в «нормальном повышенном» диапазоне (80-100 уд/мин). Пациенты плохо переносят брадикардию (больше объем заполнения ЛЖ - больше фракция регургитации). Необходимо избегать резкого повышения АД за счет роста постнагрузки, поскольку это приводит к увеличению КДД ЛЖ, КДО ЛЖ и фракции регургитации. По возможности надо стремиться снижать повышенное системное сосудистое сопротивление. Необходимо избегать повышения давления в легочной артерии, для коррекции показано использование вазодилататоров, воздействующих на венозное русло (нитроглицерин, изосорбида динитрат). Агрессивное снижение легочного сосудистого сопротивления с помощью вазодилататоров малого круга (оксида азота, простациклина, силденафила и т.д.) может привести к росту ДЛП вплоть до развития ОЛ. Ориентиры управления гемодинамикой представлены в табл. 3.37.
| Преднагрузка | ЧСС | Сократимость | Системное сосудистое сопротивление | Легочное сосудистое сопротивление |
|---|---|---|---|---|
↓ |
↑
|
Поддержание |
↓ |
+/-
|
ИНТЕНСИВНАЯ ТЕРАПИЯ У ПАЦИЕНТОВ С ПРОТЕЗИРОВАННЫМИ КЛАПАНАМИ СЕРДЦА
Клиническая оценка и определение тактики ведения пациентов ОРИТ, имеющих протезы клапанов сердца
Пораженные клапаны пациента могут быть замещены механическими или биологическими протезами. Механические изготавливают из металлических сплавов или углепластика, они могут быть шаровыми или дисковыми (одно- и двухстворчатыми), в настоящее время наиболее распространены дисковые двухстворчатые протезы. Биологические протезы могут быть каркасными, в этих случаях протезы из телячьего перикарда или свиные аортальные клапаны размещаются на полипропиленовых каркасах. Бескаркасные биологические протезы представляют собой свиные аортальные клапаны, фиксированные в растворе глутаральдегида в условиях низкого давления, такие клапаны имплантируются исключительно в аортальную позицию. Механические протезы долговечны, срок их службы может достигать 20-30 лет, в то время как современные биологические протезы рассчитаны на 10-15 лет.
Механические протезы тромбогенны, поэтому их наличие требует проведения пожизненной антикоагуляции. Биологические клапаны не требуют длительной антикоагулянтной терапии, однако меньший срок службы делает предпочтительной их имплантацию пациентам в возрасте старше 65 лет для аортального клапана и 70 лет для митральной позиции [19]. Кроме того, использование биологических протезов может быть рассмотрено у тех пациентов, которым нежелательно назначать антикоагулянты (например, женщины детородного возраста) [19].
При определении тактики интенсивной терапии различных критических состояний у пациентов с имплантированными механическими или биологическими протезами необходимо решить следующие задачи.
При оценке пациента крайне важно исключить возможные осложнения, связанные с наличием протеза клапана, к таковым относятся:
Функцию искусственных клапанов необходимо оценивать с помощью трансторакальной ЭхоКГ, в случаях затруднений с визуализацией показаны чреспищеводная ЭхоКГ (ЧПЭхоКГ), рентгеновская флюороскопия, МРТ.
В отличие от пациентов с некорригированными пороками клапанного аппарата сердца, больные с имплантированными протезами не имеют выраженных нарушений внутрисердечной гемодинамики, однако для них могут быть характерны резидуальные ХСН и легочная гипертензия.
Профилактика тромбоэмболических осложнений у пациентов с протезами клапанов сердца
Угроза развития тромбоэмболических осложнений делает необходимым поддержание состояния гипокоагуляции пожизненно у пациентов с механическими протезами (уровень убедительности рекомендаций - I, уровень достоверности доказательств - С) [19] и на протяжении первых трех месяцев после имплантации биологических протезов (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - С) [19]. В современных условиях это обеспечивается применением непрямых антикоагулянтов, блокирующих синтез витамин-K-зависимых факторов свертывания крови. Как в международных, так и в национальных рекомендациях препаратом выбора для этих клинических ситуаций обозначен варфарин (уровень убедительности рекомендаций - I, уровень достоверности доказательств - С) [6, 19, 25]. Необходимо отметить, что в настоящее время нет достаточной доказательной базы, подтверждающей эффективность применения у пациентов с механическими протезами клапанов сердца непрямых антикоагулянтов из других групп, например прямых блокаторов тромбина (дабигатран) или прямых блокаторов X-фактора (ривароксабан) (уровень убедительности рекомендаций - III, уровень достоверности доказательств - C) [19]. Доза варфарина зависит от типа протеза, наличия факторов риска тромбоэмболических осложнений и генетически детерминированной способности пациента метаболизировать этот препарат [19]. К факторам риска, требующим поддержания более выраженной гипокоагуляции, относят: митральную или трикуспидальную позицию механического протеза, наличие ФП, ФВ ЛЖ менее 35%, наличие митрального стеноза любой степени выраженности. Контроль степени снижения свертывающей способности проводят на основе определения МНО. В Рекомендациях Европейского общества кардиологов представлен алгоритм верификации целевого значения МНО для пациентов с механическими протезами в зависимости от типа протеза и наличия факторов риска развития тромбоэмболических осложнений [19]. Этот показатель может варьировать от 2,5 до 4, но обычно находится в диапазоне от 2,5 до 3 для механических протезов аортального клапана и от 3 до 3,5 для механических протезов митрального или трикуспидального клапанов.
У пациентов с протезами клапанов сердца тромбопрофилактика варфарином может быть малоэффективна или невозможна при дисфункции ЖКТ. В этих случаях необходима отмена варфарина и переход на использование НМГ в лечебных дозах или на внутривенную инфузию НФГ в дозе, достаточной для поддержания АЧТВ на уровне, в 1,5 раза превышающем верхнюю границу нормы.
Риск серьезного кровотечения значительно возрастает при МНО, превышающем 4,5, и увеличивается экспоненциально при МНО более 6. Поэтому, если МНО превышает 6, требуется реверсия антикоагуляции, которая должна быть достигнута отменой варфарина с дальнейшим постепенным снижением МНО. Немедленная реверсия антикоагуляции с использованием внутривенного введения препаратов протромбинового комплекса показана только в случаях развития серьезных кровотечений (с невозможностью местного хирургического контроля, угрожающих жизни или функции жизненно важных органов, сопровождающихся гемодинамическими проявлениями).
Пациенты с механическими протезами клапанов, принимающие непрямые пероральные антикоагулянты из группы антагонистов витамина К, относятся к категории высокого риска периоперационных геморрагических осложнений. Оперативное вмешательство может быть выполнено при МНО, не превышающем 1,5 [6, 8, 25]. В то же время прерывание терапии антикоагулянтами у этих пациентов опасно ввиду риска тромбоэмболий, и они нуждаются в назначении переходной терапии НФГ, рекомендованной по следующей схеме [6, 19, 25]. Отмена варфарина за 5 дней до операции, после снижения МНО менее 2, назначается внутривенная инфузия НФГ в дозе, достаточной для поддержания АЧТВ на уровне, в 1,5 раза превышающем верхнюю границу нормы. После снижения МНО менее 1,5 может быть выполнена операция, причем утром перед вмешательством проводится контроль МНО. НФГ может быть отменен за 4 ч до операции. Терапия НФГ возобновляется через 12 ч после окончания вмешательства, при условии отсутствия признаков кровотечения. Через сутки после операции возобновляют прием варфарина, внутривенное введение НФГ прекращают только при достижении целевых значений МНО, подтвержденном при двух измерениях (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [19].
При экстренных хирургических вмешательствах быстрой реверсии эффектов варфарина можно достигнуть трансфузией свежезамороженной донорской плазмы (15 мл/кг) или использованием внутривенного введения препаратов протромбинового комплекса [19].
Профилактика протезного эндокардита
Пациенты с протезированными клапанами сердца, а также перенесшие реконструктивные вмешательства на клапанах с использованием искусственных материалов относятся к группе высокого риска развития ИЭ (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - C) [26]. ИЭ протеза клапана значительно ухудшает прогноз, повышает летальность и часто требует выполнения реопераций. Ведущим фактором, предрасполагающим к развитию эндокардита, является бактериемия.
В соответствии с Рекомендациями Европейского общества кардиологов [26], показания к антибиотикопрофилактике для пациентов с имплантированными протезами клапанов и перенесших реконструктивные операции на клапанах с применением искусственных материалов ограничиваются инвазивными стоматологическими процедурами (на деснах, в периапикальной области или с нарушением целостности слизистой оболочки ротовой полости) (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - C) [26]. При абдоминальных, торакальных, урологических и гинекологических оперативных вмешательствах, не предполагающих манипуляции в очагах инфекции, антибиотикопрофилактика ИЭ у пациентов с протезами клапанов сердца не проводится (уровень убедительности рекомендаций - III, уровень достоверности доказательств - C) [26]. В случаях оперативных вмешательств на органах респираторного тракта и покровных тканях, включающих манипуляции в очагах инфекции (абсцессах, флегмонах, инфицированных ранах), у пациентов с протезированными клапанами должна проводиться антибиотикопрофилактика ИЭ препаратами, активными в отношении стафилококка и β-гемолитического стрептококка. При вмешательствах на органах брюшной полости в случае наличия очагов инфекции антибиотикопрофилактика должна включать препараты, активные в отношении энтерококка (ампициллин, амоксициллин) [26].
Хроническая сердечная недостаточность
Частота встречаемости хронической сердечной недостаточности (ХСН) составляет 1% у пациентов в возрасте 50-59 лет и 10% в возрасте более 80 лет, при этом 80% пациентов, поступающих в стационар с диагнозом ХСН, старше 65 лет. Вполне закономерно то, что ХСН является одним из самых частых сопутствующих нарушений со стороны сердечно-сосудистой системы. СН может в значительной степени утяжелить течение основного патологического процесса, по поводу которого больной был госпитализирован, поддерживая снижение перфузии органов и тканей, застой в малом и большом кругах кровообращения и провоцируя нарушения ритма сердца. При развитии декомпенсации с формированием синдрома малого сердечного выброса или кардиогенного ОЛ, СН становится ведущим патологическим синдромом, определяющим прогноз пациента. Эффективная интенсивная терапия у таких больных невозможна без применения базисной терапии ХСН, профилактики декомпенсации, а в случае ее развития - лечения синдрома малого СВ и кардиогенного ОЛ в соответствии с современными требованиями.
КОДЫ ПО МЕЖДУНАРОДНОЙ КЛАССИФИКАЦИИ БОЛЕЗНЕЙ 10-го ПЕРЕСМОТРА
I50.0 Застойная сердечная недостаточность.
I50.1 Левожелудочковая недостаточность.
I50.9 Сердечная недостаточность неуточненная.
ОПРЕДЕЛЕНИЕ
Согласно рекомендациям Европейского общества кардиологов, СН определяется клинически как синдром, при котором пациенты имеют типичные симптомы (одышка, отеки лодыжек, усталость) и признаки (повышенное давление в яремной вене, хрипы в легких, периферические отеки), вызванные нарушением структуры и/или функции сердца, что приводит к уменьшению СВ и/или повышению внутрисердечного давления в покое или во время нагрузки [8].
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
К развитию ХСН может приводить широкий спектр кардиальных и внекардиальных патологических процессов. Тем не менее по механизму все этиологические факторы можно разделить на нарушающие опорожнение желудочков в систолу (систолическая СН вследствие снижения сократимости или повышения постнагрузки) или нарушающие наполнение желудочков в диастолу (диастолическая СН вследствие расстройств расслабления стенок или увеличения их жесткости).
Систолическая ХСН наиболее характерна для пациентов среднего возраста (чаще мужчин). При данном виде СН способность пораженного желудочка выталкивать кровь снижена либо из-за нарушенной сократимости, либо вследствие увеличения постнагрузки. К основным причинам систолической ХСН относят: ИБС, дилатационную кардиомиопатию (ишемического и неишемического генеза), а также состояния, связанные с хронической перегрузкой давлением (аортальный стеноз, гипертоническая болезнь) и хронической перегрузкой объемом (недостаточность клапанов, врожденные пороки сердца). Нередко развитию систолической ХСН способствуют некардиальные факторы: анемия, артериовенозные фистулы, тяжелый гипертиреоидизм, сепсис и др. Причинами поражения миокарда с последующим развитием систолической дисфункции могут быть различные эндогенные и экзогенные интоксикации.
Диастолические нарушения, приводящие к ХСН, могут иметь функциональный характер (например, при ишемии миокарда), однако чаще связаны с морфологическими изменениями при выраженной гипертрофии миокарда или развитии так называемой рестриктивной кардиомиопатии. При этой форме ХСН сохранена ФВ и в большинстве случаев нет выраженного снижения СВ (за исключением случаев рестриктивной кардиомиопатии). Клиническая картина, в первую очередь, определяется застоем в малом круге при поражении ЛЖ или в большом круге при диастолической дисфункции ПЖ.
Влияние СН на гемодинамику принято рассматривать с точки зрения наличия двух компонентов - направленного вперед, обусловленного снижением СВ, и направленного назад (застойного) - ведущего к повышению давления и застою в отделах сердечно-сосудистой системы, предшествующих пораженным левому или правому желудочкам. Проявлением направленного вперед компонента становится снижение перфузии органов и тканей. Застойный компонент патогенеза левожелудочковой недостаточности связан с повышением КДД ЛЖ как при систолической, так и при диастолической дисфункции ЛЖ. Увеличение КДД ЛЖ приводит к ретроградному росту ДЛП и в венозной части русла малого круга, что вызывает развитие легочной гипертензии II типа (иногда ее называют венозной или посткапиллярной). Длительное существование легочной венозной гипертензии вызывает дисфункцию эндотелия капиллярного русла малого круга и появление вазоспастического артериального компонента. Этот этап эволюции легочной гипертензии при ХСН значим не только увеличением ДЛА, но и выраженным повышением постнагрузки для ПЖ с формированием его систолической дисфункции. В соответствии с описанным механизмом, левожелудочковая СН с течением времени трансформируется в бивентрикулярную, сопровождающуюся застоем в большом круге кровообращения.
КЛАССИФИКАЦИЯ
Современная классификация СН основана на учете ФВ ЛЖ [10].
Функциональная классификация ХСН Нью-Йоркской ассоциации сердца [The Criteria Committee of the New York Heart Association (NYHA)] представлена в табл. 3.38.
| Класс | Признаки |
|---|---|
I |
Физическая активность не ограничена |
II |
Легкое ограничение физической активности. Одышка и слабость после умеренной физической нагрузки (например, после быстрого подъема по лестнице) |
III |
Выраженное ограничение физической активности. Одышка и слабость после минимальной физической нагрузки (например, после медленного подъема по лестнице) |
IV |
Тяжелое ограничение физической активности. Симптомы СН в покое |
ОСОБЕННОСТИ ВЕДЕНИЯ ПАЦИЕНТОВ С СОПУТСТВУЮЩЕЙ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ
Как было указано выше, сопутствующая ХСН оказывает значимое утяжеляющее влияние на течение основного внекардиального патологического процесса, по поводу которого пациент получает лечение. С другой стороны, ведущий патологический процесс закономерно усугубляет ХСН вплоть до ее декомпенсации с развитием синдрома малого СВ или кардиогенного ОЛ. Для лечения таких пациентов необходимо привлечь врача-кардиолога (терапевта), который совместно с анестезиологами-реаниматологами должен решить следующие клинические задачи: определить тяжесть сопутствующей ХСН и ее вклад в течение основного патологического процесса, определить возможность продолжения и модификации базисной консервативной терапии ХСН, указать на необходимость использования дополнительных методов диагностики и расширенного мониторинга, при необходимости определить тактику интенсивной терапии декомпенсации ХСН.
Обследование пациента с сопутствующей хронической сердечной недостаточностью
Обследование пациента с сопутствующей ХСН должно верифицировать это патологическое состояние, определить степень его тяжести и указать на ведущий синдром нарушения гемодинамики. Чрезвычайно важной задачей обследования является обнаружение признаков декомпенсации ХСН, свидетельствующих о нарушении перфузии органов и тканей или о развитии интерстициального/альвеолярного кардиогенного ОЛ.
Современные международные и национальные рекомендации по диагностике и лечению СН содержат развернутые алгоритмы обследования таких пациентов, включающие клинические, лабораторные и инструментальные подходы [8, 12]. В настоящем разделе содержатся краткие данные об обследовании, необходимом для лечения пациента ОРИТ с сопутствующей ХСН.
Жалобы и анамнез
При опросе пациента или родственников необходимо получить сведения о клинических проявлениях ХСН, отражающих уменьшение СВ и застой в большом и малом кругах кровообращения. Снижение производительности сердца проявляется падением толерантности к физической нагрузке, крайняя выраженность которой подтверждается невозможностью подъема на второй этаж или ограничениями в самообслуживании в быту. Отражением застойных явлений в малом круге являются указания на одышку при физической нагрузке. О выраженной СН свидетельствует ортопноэ - развитие одышки в горизонтальном положении с вынужденным подъемом головного конца кровати или подкладыванием нескольких подушек при ночном сне. Признаки застоя в большом круге (жалобы на отеки нижних конечностей, асцит, боли в правом подреберье) свидетельствуют о далеко зашедшем процессе с развитием дисфункции ПЖ и формированием бивентрикулярной СН.
При опросе родственников пациента важно оценить динамику указанных выше симптомов и выяснить, были ли ранее случаи декомпенсации ХСН с необходимостью госпитализации. Особое внимание следует уделить информации о базисной медикаментозной терапии ХСН, которую пациент получал до поступления в стационар.
Инструментальная диагностика
ЭхоКГ является методом выбора для оценки систолической и диастолической функции обоих желудочков и рекомендуется к выполнению для всех пациентов с подозрением на СН (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8, 12]. ЭхоКГ позволяет не только подтвердить диагноз ХСН, но и сделать заключение о тяжести процесса. Кроме того, как было указано выше, именно на эхокардиографических показателях построена современная классификация ХСН. В протоколе эхокардиографического исследования анестезиолог-реаниматолог может найти сведения о снижении производительности сердца: снижение ФВ ЛЖ, снижение УО, наличие зон гипо- и акинезии миокарда. О застойной сердечной недостаточности будут свидетельствовать увеличение КДО ЛЖ и объема ЛП, рост систолического давления в легочной артерии. В пользу диастолической дисфункции говорит гипертрофия миокарда ЛЖ и особенности трансмитрального потока крови. Нельзя забывать о том, что ХСН может быть связана с поражением ПЖ или иметь бивентрикулярный характер. Необходимо обратить внимание на размеры ПЖ, наличие регургитации на трехстворчатом клапане, кинетику свободной стенки ПЖ и показатели его систолической функции, такие как амплитуда систолического движения кольца трехстворчатого клапана (TAPSE).
Рентгенография органов грудной клетки рекомендована для всех пациентов с подозрением на ХСН (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8, 12], поскольку позволяет выявить/исключить альтернативную причину одышки. Кроме того, рентгенография может подтвердить наличие венозного полнокровия легких, свидетельствующее о застойном компоненте СН. Патологические изменения рентгенограммы органов грудной клетки являются показанием к проведению ЭхоКГ.
ЭКГ в 12 отведениях должна быть выполнена всем пациентам с подозрением на ХСН (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8, 12]. В то же время необходимо помнить о том, что при стабильном течении ХСН этот метод высокочувствителен, но малоспецифичен [8, 12]. ЭКГ может предоставить дополнительную информацию об этиологии ХСН (признаки перенесенного ИМ, гипертрофии ЛЖ) и имеющихся нарушениях ритма и проводимости.
Лабораторная диагностика
Лабораторные исследования могут предоставить дополнительную информацию о выраженности сопутствующей ХСН и динамике этого патологического процесса.
Концентрация в плазме крови BNP более 35 пг/мл или NT-proBNP более 125 пг/мл используется как диагностический критерий ХСН (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - C) [8]. Современные международные рекомендации указывают на необходимость определения концентрации BNP или NT-proBNP у всех пациентов при подозрении на развитие ОСН (уровень убедительности рекомендаций - I, уровень достоверности доказательств - A) [8], при этом диагностическим считается уровень BNP более 100 пг/мл или NT-proBNP более 300 пг/мл. Кроме того, на уровень этого маркера объемной перегрузки миокарда можно ориентироваться при оценке эффективности терапии ХСН.
Тропонины I или T должны быть исследованы при подозрении на развитие ОСН (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8]. Увеличение сердечного тропонина указывает на некроз миоцитов и свидетельствует о потенциальной возможности реваскуляризации. Увеличение тропонина также происходит при остром миокардите. Умеренный рост сердечных тропонинов часто наблюдается при тяжелой СН или во время эпизодов декомпенсации ХСН у пациентов без признаков ишемии миокарда и в таких ситуациях, как сепсис.
О значимом снижении производительности сердца, связанном с падением сократительной способности миокарда, свидетельствует снижение SvO2 менее 65% (при условии нормального содержания гемоглобина и отсутствия гипоксемии). Развитие и ухудшение течения СН можно заподозрить при увеличении разницы между парциальным давлением углекислого газа в крови из центральной вены и артериальной крови более 5 мм рт.ст. (pvCO2-paCO2 >5 мм рт.ст.).
При оценке биохимических показателей функции печени и почек необходимо помнить о том, что при декомпенсации сопутствующей ХСН возможно развитие ПОН с ростом содержания АЛТ, АСТ, билирубина, креатинина и мочевины.
Стандартный и дополнительный мониторинг при проведении интенсивной терапии у пациентов с сопутствующей хронической сердечной недостаточностью
Необходимость в использовании расширенного мониторинга при проведении интенсивной терапии у пациентов с сопутствующей ХСН возникает в случаях декомпенсации с развитием синдрома малого СВ или кардиогенного ОЛ.
В подобных клинических ситуациях рекомендовано применение инвазивного мониторинга АД (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8]. иАД позволяет распознать артериальную гипотонию непосредственно в момент ее развития и, таким образом, ускорить коррекцию. При нарушениях ритма сердца иАД дает возможность быстрого определения гемодинамической значимости аритмий и своевременного принятия решения о рациональных методах их лечения. Форма кривой иАД позволяет анестезиологу-реаниматологу получить дополнительные сведения о контрактильности миокарда и истинном значении среднего АД. Наконец, постоянный доступ к артериальному руслу значительно упрощает своевременный забор проб для анализа газового состава крови.
Развитие нарушений гемодинамики у пациентов с сопутствующей ХСН требует катетеризации центральной вены и обеспечения мониторинга ЦВД. ЦВД позволяет судить о преднагрузке ПЖ сердца и, с определенными допущениями, о преднагрузке ЛЖ. Наличие катетера в центральной вене дает возможность определить ключевой показатель адекватности доставки и потребления кислорода - SvO2. Этот доступ необходим для обеспечения безопасного применения инотропных, вазоактивных и антиаритмических препаратов, инфузии электролитов.
В случаях развития у пациентов с сопутствующей ХСН тяжелых, плохо поддающихся коррекции гемодинамических нарушений, с целью уточнения их причины и повышения эффективности терапии, может быть рассмотрен вопрос о постановке катетера в легочную артерию (уровень убедительности рекомендаций - IIb, уровень достоверности доказательств - C) [8]. Катетер Свана-Ганца позволяет оценить преднагрузку правого (ЦВД) и левого (ДЗЛА) желудочков, что повышает эффективность целенаправленного управления гемодинамикой. Методика препульмональной термодилюции, реализованная в катетере Свана-Ганца, дает возможность мониторировать СВ. С другой стороны, необходимо учитывать, что относительно безопасное и эффективное использование катетера Свана-Ганца требует достаточного опыта его применения и интерпретации полученных данных. К абсолютным противопоказаниям для катетеризации легочной артерии относятся: наличие механических протезов трикуспидального клапана или клапана легочной артерии, ИЭ, наличие патологических образований в правых камерах сердца [22].
Дополнительная терапия, необходимая для пациентов с сопутствующей хронической сердечной недостаточностью
Базисная терапия пациентов с хронической сердечной недостаточностью
Достаточно часто пациенты с сопутствующей ХСН до поступления в стационар получали базисную терапию этого патологического состояния, включающую ИАПФ, β-адреноблокаторы, антагонисты рецепторов минералокортикоидов и диуретики (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [6, 8]. Необходимо отчетливо понимать, что продолжение такой терапии или ее начало в случае предшествующего отсутствия необходимо не только для контроля за симптомами ХСН, но и для профилактики декомпенсации этого состояния. Совместно с кардиологом решается вопрос о назначении конкретных препаратов, а также об использовании парентеральных форм в случае невозможности энтерального назначения.
ИАПФ являются препаратами первой линии в лечении ХСН. Эффективность этой группы обусловлена вазодилатацией, снижением реабсорбции воды и натрия. ИАПФ доказанно предупреждают ремоделирование миокарда, уменьшают выраженность симптомов ХСН и снижают летальность. Если нет противопоказаний и непереносимости, ИАПФ следует применять у всех пациентов с симптомами ХСН и снижением ФВ ЛЖ менее 40% (уровень убедительности рекомендаций - I, уровень достоверности доказательств - A) [8, 12]. В случае наличия непереносимости и толерантности к ИАПФ альтернативой следует считать назначение антагонистов рецепторов ангиотензина II (уровень убедительности рекомендаций - I, уровень достоверности доказательств - B) [8].
β-Адреноблокаторы необходимо применять при условии отсутствия противопоказаний или непереносимости у всех пациентов с симптомами ХСН и ФВ ЛЖ менее 40% (уровень убедительности рекомендаций - I, уровень достоверности доказательств - A) [8, 12]. Эти препараты улучшают функцию желудочков и состояние больного, снижают частоту госпитализаций по поводу ухудшения ХСН и увеличивают выживаемость [8, 12].
Антагонисты рецепторов минералокортикоидов снижают задержку натрия, задержку воды и экскрецию калия, уменьшают ремоделирование миокарда. Препараты этой группы снижают частоту ухудшений ХСН и увеличивают выживаемость при добавлении к терапии, включающей ИАПФ и β-адреноблокаторы. В связи с этим антагонисты рецепторов минералокортикоидов рекомендуется назначать всем пациентам с симптомами ХСН и ФВ ЛЖ менее 40% (1А) [8, 12].
Диуретики рекомендуются у больных с ХСН при клинических признаках или симптомах застоя (уровень убедительности рекомендаций - I, уровень достоверности доказательств - B) [8, 12]. Кроме того, внутривенные петлевые диуретики являются препаратами выбора для быстрого снижения циркуляторной перегрузки и ОЛ в случаях декомпенсации ХСН (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8, 12]. Клинический эффект развивается в течение нескольких часов, происходит снижение КДД ЛЖ, уменьшение перерастяжения стенки ЛЖ. При рефрактерных отеках возможна комбинация петлевых и тиазидных диуретиков ввиду их синергизма.
Побочными эффектами применения диуретиков являются: гиповолемия, преренальная азотемия, потеря электролитов. Для предупреждения этих ситуаций необходимо прерывать терапию при достижении эуволемического статуса и обеспечивать дополнительное назначение препаратов калия и магния. Пациенты, получавшие петлевые диуретики амбулаторно, могут быть рефрактерны к обычным дозам фуросемида, поэтому может потребоваться длительная внутривенная инфузия фуросемида в дозе 5-20 мг/ч.
Интенсивная терапия декомпенсации хронической сердечной недостаточности
Декомпенсация ХСН может протекать по двум клиническим сценариям. Первый предполагает снижение производительности левого и/или правого желудочков сердца с развитием синдрома малого СВ (в современных международных рекомендациях употребляется термин «кардиогенный шок» [8]). Второй вариант - прогрессирование легочной венозной гипертензии, связанной с ростом ДЛП, и последующее развитие кардиогенного ОЛ. Значимым фактором риска декомпенсации сопутствующей ХСН служит основной патологический процесс, послуживший причиной госпитализации. Этому способствуют снижение контрактильности миокарда при различных вариантах эндогенной и экзогенной интоксикации, повышенный симпато-адреналовый статус, гиперволемия и гипоксия, часто сопровождающие критические состояния различной природы.
Терапия синдрома малого СВ. Показаниями для терапии синдрома малого СВ являются:
-
снижение АД менее 65 мм рт.ст., не связанное с гиповолемией и вазоплегией артериального русла;
-
снижение производительности сердца, сопровождающееся нарушениями тканевой перфузии, что подтверждается падением SvO2 менее 65% (при условии отсутствия анемии и артериальной гипоксемии) и ростом содержания лактата выше 2 ммоль/л.
В случае возможности измерения показателей центральной гемодинамики (катетер Свана-Ганца система PiCCO, ЭхоКГ) о развитии синдрома малого СВ может свидетельствовать снижение СИ менее 2,2 л/мин/м2. Однако у пациентов с ХСН исходные значения СИ часто меньше указанной величины, о чем можно судить по данным ранее выполненных ЭхоКГ. В этих случаях терапию синдрома малого СВ следует начинать при прогрессивном снижении СИ на фоне признаков нарушения тканевой перфузии (снижение SvO2, повышение уровня лактата).
Первым этапом терапии синдрома малого СВ должно быть обеспечение адекватной преднагрузки ЛЖ. У пациентов с ХСН о необходимости дополнительной инфузии лучше судить не по абсолютным значениям ДЗЛА или ЦВД, а по так называемым динамическим показателям преднагрузки. К таковым относят пробную инфузию 200,0 кристаллоидного раствора (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8], тест с пассивным подъемом ног на 40°, изменение показателей гемодинамики в ответ на рост внутригрудного давления при искусственном вдохе и т.д.
В случае уверенности в достижении адекватной преднагрузки и сохранении при этом сниженной производительности сердца, артериальной гипотонии и признаков нарушения периферической перфузии назначают инотропную терапию (уровень убедительности рекомендаций - IIb, уровень достоверности доказательств - C) [8]. Для этой цели можно использовать допамин (Дофамин♠) в дозе 2,5-8 мкг/кг/мин, добутамин в дозе 2,5-20 мкг/кг/мин, эпинефрин (Адреналин♠) в дозе 0,03-0,4 мкг/кг/мин. В случаях рефрактерной артериальной гипотонии необходимо назначение вазопрессора - норэпинефрина (Норадреналина♠) в дозе 0,03-0,5 мкг/кг/мин. Следует избегать использования допамина (Дофамина♠) в качестве вазопрессора, поскольку это требует применения высоких доз (10-20 мкг/кг/мин), ассоциированных с тяжелыми побочными эффектами и повышением летальности [8]. При неэффективности медикаментозной терапии, в соответствии с современными международными рекомендациями, возможно применение устройств вспомогательного кровообращения. Предпочтение следует отдать короткому курсу механической поддержки кровообращения с помощью обхода ЛЖ или системы ЭКМО (уровень убедительности рекомендаций - IIb, уровень достоверности доказательств - C) [8], использование для этой цели внутриаортальной баллонной контрпульсации не рекомендовано (уровень убедительности рекомендаций - III, уровень достоверности доказательств - B) [8].
Терапия кардиогенного ОЛ. Наиболее распространенным вариантом декомпенсации ХСН является кардиогенный ОЛ, связанный с повышением ДЛП и развитием выраженной венозной легочной гипертензии. У пациентов часто есть дополнительные факторы, предрасполагающие к развитию ОЛ: повышение АД со значимым увеличением постнагрузки ЛЖ, волемическая перегрузка с повышением ДЛП и гипопротеинемия при кровопотере. О росте ДЛП можно судить по величине ДЗЛА и ряду эхокардиографических показателей (форма и размер ЛП, трансмитральный кровоток, допплерографические характеристики потока в легочных венах, увеличение систолического давления в легочной артерии) [23].
Терапия кардиогенного отека легких предполагает на первом этапе коррекцию нарушений газообмена с последующим применением венозных и артериальных вазодилататоров и диуретиков (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8].
Коррекция гипоксемии необходима при снижении SaO2 менее 90% (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8], это может потребовать ингаляции кислорода, в случае неэффективности этой меры - перевода пациента на неинвазивную вентиляцию легких в режиме CPAP или BiPAP (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - B) [8]. Если при использовании этих мер не удается поддержать paO2 более 60 мм рт.ст. и paCO2 менее 50 мм рт.ст., показана интубация трахеи и перевод пациента на ИВЛ (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C) [8]. Необходимо помнить о том, что при ИВЛ назначение ПДКВ не только улучшает газообмен, но и снижает гиперволемию малого круга.
При выборе вазодилататоров предпочтение должно отдаваться препаратам с преимущественным воздействием на венозное русло. С этой целью могут быть назначены нитроглицерин или изосорбида динитрат в дозе 0,3-1,5 мкг/кг/мин. Возможно болюсное введение изосорбида динитрата в дозе 250 мкг под контролем АД.
В случаях, когда кардиогенный ОЛ развивается на фоне нормального или сниженного АД и недостаточной производительности сердца, необходимо назначение инотропных препаратов. В этих клинических ситуациях предпочтение необходимо отдать добутамину, учитывая его воздействие как на β1-, так и на β2-рецепторы.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ПАЦИЕНТОВ С СОПУТСТВУЮЩЕЙ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ НЕКАРДИОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Ключевыми позициями обеспечения раннего послеоперационного периода у пациентов с сопутствующей ХСН являются: продолжение адекватного мониторинга, поддержание стабильной гемодинамики, предупреждение гиперволемии и перегрузки сердца преднагрузкой, коррекция анемии, предупреждение гипоксемии, достижение эффективной аналгезии, предупреждение гипотермии.
У пациентов с сопутствующей ХСН желательно продолжать мониторинг гемодинамики в течение 24 ч после вмешательства. Крайне важно понимать, что интегральными маркерами адекватности гемодинамики служат показатели доставки и потребления кислорода. Об ухудшении состояния свидетельствует снижение Sv O2 менее 65% или менее дооперационных значений. В пользу декомпенсации состояния будет свидетельствовать уровень лактата более 2 ммоль/л и дальнейшее повышение этого показателя. В случае развития декомпенсации ХСН интенсивная терапия синдрома малого СВ и кардиогенного ОЛ должна проводиться в соответствии с принципами, изложенными в соответствующих разделах. В этих ситуациях должна быть выполнена ЭхоКГ для контроля ДЛА, адекватности преднагрузки, сократимости ЛЖ.
Особое внимание следует уделять предупреждению гиперволемии и объемной перегрузки сердца и малого круга. О развитии такой ситуации будут свидетельствовать появление признаков интерстициального застоя в легких на обзорной рентгенограмме, а также данные ЭхоКГ (рост ДЛАсис, увеличение степени регургитации на трехстворчатом и митральном клапанах, увеличение КДО ЛЖ). В послеоперационном периоде необходимо не только стремиться к поддержанию нулевого жидкостного баланса, но и попытаться компенсировать гиперволемию, допущенную на этапе вмешательства. Для решения этой задачи можно использовать постоянную инфузию фуросемида в дозе 1-5 мг/ч.
При решении вопроса об адекватном послеоперационном обезболивании может быть рассмотрена возможность использования ЭА (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - B) [6, 21].
Список литературы
-
Артериальная гипертония у взрослых. Клинические рекомендации Минздрава. Российское медицинское общество по артериальной гипертонии. М., 2016. 84 с.
-
ESC/ESH Clinical Practice Guidelines for the Management of Arterial Hypertension // Eur. Heart J. 2018. Vol. 39. P. 3021-3104.
-
Всероссийское научное общество кардиологов. Прогнозирование и профилактика кардиальных осложнений внесердечных хирургических вмешательств. Национальные рекомендации. М., 2011.
-
Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults. A report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines // J. Am. Soc. Hypertens. 2018. Jan. P. 10-132.
-
Периоперационное ведение больных с сопутствующими заболеваниями / под ред. И.Б. Заболотских. М. : Практическая медицина, 2011. 240 с.
-
Kristensen S.D., Knuuti J., Saraste A. et al. 2014 ESC/ESA guidelines on non-cardiac surgery: cardiovascular assessment and management: the Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA) // Eur. Heart J. 2014. Vol. 35, N 35. P. 2383-2431.
-
Кардиология : национальное руководство. Краткое издание. 2-е изд., перераб. и доп. / под ред. Е.В. Шляхто. М. : ГЭОТАР-Медиа, 2018. 816 с.
-
Рекомендации ESC по диагностике и лечению острой и хронической сердечной недостаточности 2016 // Рос. кардиол. журн. 2017. №1 (141). C. 7-81.
-
Miller R.D., Eriksson L.I., Fleisher L.A. et al. Miller’s Anesthesia. 7th ed. New York, 2010. 3312 p.
-
ESC Guidelines for the diagnosis and management of chronic coronary syndromes // Eur. Heart J. 2020. Vol. 41. P. 407-477.
-
Patel M.R., Calhoon J.H., Dehmer G.J. et al. Appropriate use criteria for coronary revascularization in patients with stable ischemic heart disease // J. Am. College . of Cardiol. 2017. Vol. 69, N 17. P. 2212-2241.
-
Клинические рекомендации ОССН/РКО. Хроническая сердечная недостаточность. URL: http://ossn.ru/news/klinicheskie-rekomendatsii-khronicheskaya-serdechnaya-nedostatochnost/.
-
Valgimigli M., Bueno H., Byrne R.A. et al. 2017 ESC focused update on dual anti-platelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS) // Eur. Heart J. 2018. Vol. 39, N 3. P. 213-260.
-
Roffi M., Patrono C., Collet J.-P. et al. 2015 ESC guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC) // Eur. Heart J. 2016. Vol. 37. P. 267-315.
-
Рекомендации ESC по лечению пациентов с желудочковыми нарушениями ритма и профилактике внезапной сердечной смерти 2015 // Рос. кардиол. журн. 2016. №7 (135). С. 5-86.
-
ВНОА. Клинические рекомендации по проведению ЭФИ, катетерной абляции и применению имплантируемых антиаритмических устройств. М., 2017. 704 с.
-
Brignole M., Auricchio A., Baron-Esquivias G. et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy. The Task Force on cardiac pacing and resyn-chronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA) // Eur. Heart J. 2013. Vol. 34. P. 2281-2329.
-
Vahanian A., Alfieri O., Andreotti F. et al. Guidelines on the management of valvular heart disease (version 2012): the Joint Task Force on the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) // Eur. Heart J. 2012. Vol. 33. P. 2451-2496.
-
Baumgartner H., Falk V., Bax J. et al. 2017 ESC/EACTS guidelines for the management of valvular heart disease: The Task Force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) // Eur. Heart J. 2017. Vol. 38, N 36. P. 2739-2791.
-
Клинические рекомендации по ведению, диагностике и лечению клапанных пороков сердца / под ред. Л.А. Бокерия. М. : Изд-во НЦССХ им. А.Н. Бакулева РАМН, 2009. 356 с.
-
Fleisher L.A., Fleischmann K.E., Auerbach A.D. et al. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines // J. Am. Coll. Cardiol. 2014. Vol. 64, N 22. P. 77-137.
-
Mueller H., Chatterjee K., Davis K. et al. Present use of bedside right heart catheterization in patients with cardiac disease // J. Am. Coll. Cardiol. 1998. Vol. 32, N 3. P. 840-864.
-
Баутин А.Е., Осовских В.В., Басова В.А. Эхокардиографический мониторинг // Кровообращение и анестезия / под ред. К.М. Лебединского СПб. : Человек, 2012. С. 365-398.
-
Практическая кардиоанестезиология. 5-е изд. / Ф.А. Хэнсли-мл., Д.Е. Мартин, Г.П. Грэвли ; под ред. А.А. Бунатяна ; пер. Е.А. Хоменко, А.А. Никитина, С.А. Циклинского, А.Н. Дьячкова. М. : Медицинское информационное агентство, 2017. 1084 с.
-
Заболотских И.Б. и др. Клинические рекомендации Федерации анестезиологов и реаниматологов «Периоперационное ведение больных, получающих длительную антитромботическую терапию». М., 2014.
-
Habib G., Lancellotti P., Antunes M.J. 2015 ESC Guidelines for the management of infective endocarditis. The Task Force for the management of infective endocarditis of the European Society of Cardiology (ESC) Endorsed by: European Association for Cardio-Thoracic Surgery (eActS), the European Association of Nuclear Medicine (EANM) // Eur. Heart J. 2015. Vol. 36. P. 3075-3123.