Гинекология : национальное руководство / под ред. Г. М. Савельевой, Г. Т. Сухих, В. Н. Серова, В. Е. Радзинского, И. Б. Манухина. - 2-е изд. , перераб. и доп. - Москва : ГЭОТАР-Медиа, 2022. - 1008 с. - (Серия "Национальные руководства"). - 1008 с. (Серия "Национальные руководства") - ISBN 978-5-9704-6796-1. |
Аннотация
"Национальные руководства" - серия практических руководств по основным медицинским специальностям, включающих специальную информацию, необходимую врачу для непрерывного последипломного образования. В отличие от большинства других изданий в национальных руководствах достаточное внимание уделено профилактике, диагностике, фармакотерапии и хирургическим методам лечения, подробно представлены клинические рекомендации по всем основным синдромам и заболеваниям. В подготовке настоящего издания в качестве авторов и рецензентов участвовали ведущие специалисты - сотрудники НЦАГиП им. В.И. Кулакова, РНИМУ им. Н.И. Пирогова, Первого МГМУ им. И.М. Сеченова, МГМСУ им. А.И. Евдокимова, РУДН, МОНИИАГ, НИИ АГиР им. Д.О. Отта, РМАПО, РОНЦ им. Н.Н. Блохина и других НИИ и кафедр. Все рекомендации прошли этап независимого рецензирования. Руководство предназначено врачам женских консультаций, поликлиник, гинекологических стационаров, а также студентам старших курсов медицинских вузов, интернам, ординаторам, аспирантам.
Глава 9. Эндокринные расстройства в репродуктивном периоде
9.1. Аномальные маточные кровотечения репродуктивного периода
АМК - кровотечения, чрезмерные по длительности (более 7 дней), объему кровопотери (более 80 мл) и/или частоте (интервал менее 24 дней или более 4 эпизодов за 90 дней).Термин «дисфункциональное маточное кровотечение», ранее используемый в случаях отсутствия органических изменений, в настоящее время не рекомендуется использовать, поскольку женщины, подпадающие под эту категорию, обычно имеют какую-либо причину АМК (нарушение овуляции или структурные изменения эндометрия, их сочетание).
КОД ПО МКБ-10
N92 Обильные, частые и нерегулярные менструации.
N92.1 Обильные и частые менструации при нерегулярном цикле.
N92.2 Обильные менструации в пубертатном периоде.
N92.3 Овуляторные кровотечения.
N92.4 Обильные кровотечения в пременопаузном периоде.
N92.5 Другие уточненные формы нерегулярных менструаций.
N92.6 Нерегулярные менструации неуточненные.
N93 Другие аномальные кровотечения из матки и влагалища.
N93.0 Посткоитальные или контактные кровотечения.
N93.8 Другие уточненные аномальные кровотечения из матки и влагалища.
N93.9 Аномальное маточное и влагалищное кровотечение неуточненное.
ЭПИДЕМИОЛОГИЯ
Частота АМК в репродуктивном возрасте составляет 10-30%, в перименопаузе достигает 50%. Среди женщин репродуктивного возраста 20-30% всех визитов к гинекологу происходит по причине маточных кровотечений, в пери- и постменопаузе этот показатель возрастает до 70%. АМК занимают 2-е место среди причин госпитализации женщин в гинекологические стационары, служат показанием для двух третей производимых гистерэктомий и абляций эндометрия.
КЛАССИФИКАЦИЯ
Классификационная система причин аномальных маточных кровотечений у небеременных женщин репродуктивного возраста - PALM-COEIN (мнемонически: ладонь и монета, англ.)(Международная федерация акушеров-гинекологов, 2011 г.) - позволяет распределить их по характеру и этиологии, подразумевающей следующие понятия:
Данная классификационная система позволяет отразить как одну причину АМК, так и их совокупность, наличие любой категории обозначается цифрой 1, отсутствие - 0.
Первые четыре категории, объединенные в группу PALM, отражают органические или структурные изменения, которые могут быть оценены с помощью методов визуализации и/или гистологически. Другие возможные этиологические факторы включены в группу COEIN. Она состоит из четырех неорганических причин маточных кровотечений, не поддающихся объективизации, редко встречающиеся и пока не классифицированные.
Термин «аномальные маточные кровотечения» включает обильные менструальные кровотечения (heavy menstrual bleeding), ранее называемые меноррагиями, и межменструальные маточные кровотечения (intermenstrual bleeding), ранее называемые метроррагиями/менометроррагиями.
Клинически АМК разделяют на острые и хронические. Острое кровотечение - эпизод обильного кровотечения, требующий срочного вмешательства с целью предотвращения дальнейшей кровопотери. Хроническое кровотечение - это маточное кровотечение, аномальное по объему, регулярности и/или частоте, наблюдающееся в течение 6 мес и более.
КЛИНИЧЕСКАЯ КАРТИНА
АМК могут манифестироваться регулярными, обильными (более 80 мл) и длительными (более 7 дней) менструациями. Этот тип кровотечений до введения новой классификационной системы обозначался как меноррагии, в настоящее время - как обильные менструальные кровотечения (heavy menstrual bleeding). Частые причины этих кровотечений - аденомиоз, субмукозная миома матки, коагулопатии, функциональные нарушения эндометрия. АМК могут быть межменструальными (прежнее название метроррагии) на фоне регулярного цикла, более характерны для полипов эндометрия, ХЭ, очаговой гиперплазии эндометрия. АМК могут проявляться нерегулярными длительными и/или обильными кровянистыми выделениями (менометроррагиями), чаще возникающими после задержек менструаций. Этот тип нарушений более характерен для гиперплазии, предрака эндометрия и РЭ.
Маточные кровотечения - одна из основных причин возникновения железодефицитных анемий, требующих медикаментозной терапии [1].
ДИАГНОСТИКА
Для выбора рациональной тактики ведения необходимо установить причину АМК и отнести его к одной из указанных выше категорий. Обследование пациентки начинают со сбора анамнеза, клинического и гинекологического исследований. Уточняют характер менструального цикла, его становление, наличие гинекологических заболеваний, нарушений свертывающей системы крови, получают сведения о приеме лекарственных препаратов, использовании внутриматочных систем. Оценка величины кровопотери проводится по балльной шкале (пиктограмма менструальной кровопотери). Лабораторная диагностика включает:
-
исключение беременности (определение уровня ХГЧ в сыворотке крови);
-
обследование на наличие анемии (клинический анализ крови, включая тромбоциты);
-
при подозрении на нарушение гемостаза - консультация гематолога и специальное обследование (при болезни Виллебранда - определение фактора VIII, кофактора ристоцетина, АГ фактора Виллебранда);
-
гормональное обследование при нерегулярном ритме менструаций и риске гипотиреоза (определение уровня ТТГ, прогестерона);
-
исследование на хламидийную инфекцию (при высоком инфекционном риске);
Диагностика с использованием методов визуализации:
-
УЗИ органов малого таза [трансвагинальное и/или абдоминальное] рассматривается как диагностическая процедура первой линии для оценки состояния эндо- и миометрия (более высокая информативность в постменопаузе);
-
допплерометрия дает дополнительную информацию о характере кровоснабжения эндометрия и миометрия;
-
соногистерография проводится в неясных случаях, при недостаточной информативности трансвагинального УЗИ и необходимости уточнения очаговых внутриматочных изменений, локализации и размеров поражений. Метод имеет более высокую чувствительность и специфичность по сравнению с трансвагинальной эхографией для диагностики внутриматочных болезней;
-
МРТ не рекомендуется в качестве диагностической процедуры первой линии при АМК. МРТ целесообразно проводить:
-
при наличии множественной миомы матки для уточнения топографии узлов перед планируемой миомэктомией;
-
при плохой визуализации полости матки для оценки состояния эндометрия;
-
диагностическая гистероскопия и биопсия эндометрия - «золотой стандарт» диагностики внутриматочных болезней, проводится в первую очередь для исключения предраковых поражений эндометрия и РЭ.
-
В зависимости от выявленной причины АМК их относят к той или иной категории в соответствии с классификационной системой PALM-COEIN.
ЛЕЧЕНИЕ
Лечение АМК проводится дифференцированно, в зависимости от выявленной причины. При выборе терапии следует учитывать ее эффективность, возможные побочные эффекты, возраст женщины, заинтересованность в беременности или контрацепции.
Терапия маточных кровотечений должна воздействовать на патогенетическое звено:
-
при выявлении субмукозной миомы матки и полипов эндометрия производится гистерорезектоскопия или гистерэктомия;
-
при аденомиозе, гиперплазии или предраковых изменениях эндометрия в репродуктивном возрасте проводится гормонотерапия прогестагенами, агонистами ГнРГ или КОК. У женщин старшей возрастной группы, не заинтересованных в беременности, а также при отсутствии эффекта от гормонотерапии проводится хирургическое лечение (абляция эндометрия);
-
при АМК, не связанных с органическими изменениями, в качестве терапии первой линии рассматривается медикаментозное лечение, позволяющее женщинам сохранить репродуктивную функцию.
Наличие АМК предусматривает использование негормональных и гормональных лекарственных средств.
В качестве негормональных препаратов первой линии применяются антифибринолитики, в частности транексамовая кислота. Механизм действия - уменьшение активности проактиваторов и активаторов плазминогена, ингибирование превращения плазминогена в плазмин, снижение фибринолиза. Снижение кровопотери составляет 40-60%. Эффективность транексамовой кислоты сопоставима с КОК, выше, чем НПВС, циклического приема прогестагенов.
Для негормональной гемостатической терапии используются НПВС (мефенамовая, меклофенамовая кислота, ибупрофен, напроксен и др.). Основанием для клинического применения этой группы препаратов явились данные о взаимосвязи повышенного уровня простагландинов в эндометрии с избыточной менструальной кровопотерей. По сводным данным, кровопотеря уменьшается на 20-40%.
Согласно международным рекомендациям, этамзилат малоэффективен для лечения АМК и не рекомендуется для клинического применения.
Для остановки маточных кровотечений используют КОК, их действие опосредуется подавлением секреции гонадотропинов, функции яичников, ингибированием роста железистого эпителия эндометрия. Монофазные КОК [суточная доза этинилэстрадиола (ЭЭ) 100 мкг] применяются для гормонального гемостаза в случаях острых АМК, а также для последующей противорецидивной терапии по контрацептивной схеме. Эффективность КОК при обильных менструальных кровотечениях составляет 30-50%. Снижение кровопотери при применении 4-фазного КОК, в состав которого входят натуральный эстроген - эстрадиола валерат и гибридный прогестаген - диеногест, достигает 70-80%. Это единственный КОК, зарегистрированный во многих странах мира, включая Россию, как лекарственное средство для лечения обильных менструальных кровотечений.
Из числа гормональных препаратов для лечения АМК применяют прогестагены. Гестагенный гемостаз достигается медленнее, чем при использовании КОК, поэтому применение его целесообразно в случаях противопоказаний к эстрогенам. Терапия гестагенами проводится обычно на втором этапе лечения АМК - для профилактики рецидивов. Из гестагенов применяются дидрогестерон или микронизированный прогестерон во вторую фазу цикла. При этом нормализуется менструальный цикл, уменьшаются продолжительность и интенсивность кровотечения, купируются менструальные боли.
На фоне левоноргестрел - выделяющей внутриматочной системы (ЛНГ-ВМС) кровопотеря снижается на 80-97%, побочные эффекты минимальны. Достоверных различий по величине менструальной кровопотери между ЛНГ-ВМС и абляцией эндометрия как через 12 месяцев, так и через 3 года не выявлено. Применение ЛНГ-ВМС дает возможность сохранить репродуктивную функцию, обеспечивает контрацептивный эффект, экономически вы годно.
Хирургическое лечение
При рецидивирующих АМК, противопоказаниях к гормонотерапии и отсутствии данных о злокачественных новообразованиях половых органов возможна абляция эндометрия 1-й и 2-й генераций. К первой категории относят:
Методы абляции 2-го поколения включают:
Абляция эндометрия приводит к уменьшению кровопотери примерно в 90%, в 20-70% отмечается аменорея, необходимость в гистерэктомии отпадает в 70-80% наблюдений (по данным 4-6-летнего наблюдения), частота повторных абляций - 11-27%.
Показания для гистерэктомии:
Дальнейшее ведение
Пациентки с АМК должны находиться под наблюдением гинеколога, рекомендуется ведение менструальных календарей и пикториальных карт менструальной кровопотери для оценки эффективности проводимой терапии. Гинекологическое обследование и УЗИ органов малого таза проводятся каждые 6 мес, при необходимости - чаще.
ПРОГНОЗ
Большинство пациенток репродуктивного периода благоприятно реагирует на комплексное лечение. При адекватно проводимой терапии в течение последующих месяцев происходит формирование полноценных регулярных менструальных циклов с нормальной кровопотерей. После прекращения гормонотерапии повышается вероятность наступления беременности. Своевременная диагностика причин маточного кровотечения, адекватно проведенная терапия, направленная на регуляцию менструального цикла, служат профилактикой рецидивов АМК, гиперпластических процессов эндометрия и развития онкологических заболеваний.
СПИСОК ЛИТЕРАТУРЫ
-
Акушерство. Гинекология. Бесплодный брак. Клиническая фармакология / под ред. В.Е. Радзинского, Р.Н. Аляутдина. М.: ГЭОТАР-Медиа, 2016. 672 с.
-
Руководство по амбулаторно-поликлинической помощи в акушерстве и гинекологии / под ред. В.Н. Серова, Г.Т. Сухих, В.Н. Прилепской, В.Е. Радзинского, 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2016. 1136 c.
-
Garza-Cavazos A. J. Loret de Mola R. Abnormal uterine bleeding new definitions and contemporary terminology // The Female Patient. 2012 Aug. Vol. 37.
-
Gayle M.S., Tarin A. Dalton S., Weiss P.M., Madsen K.P. Evaluation and management of abnormal uterine bleeding in premenopausal women // Am.Fam. Physician. 2012 Jan. Vol. 85, N 1. P. 35-43.
-
Davies J., Kadir R.A. Endometrial haemostasis and menstruation // Rev. Endocr. Metab. Disord. 2012 Dec.Vol. 13, N 4. Р. 289-299.
-
Diagnosis of Abnormal Uterine Bleeding in Reproductive-Aged Women / ACOG Practice BulletinN 128.Committee on Practice Bulletins - Gynecology // Obstet. Gynecol. 2012 Jul. Vol. 120, N 1. Р. 197-206.
-
Hale G.E., Hughes C.L., Burger H.G. et al. Atypical estradiol secretion and ovulation patterns caused by luteal out-ofphase (LOOP) events underlying irregular ovulatory menstrual cycles in the menopausal transition // Menopause. 2009. Vol. 16. Р. 50-59.
-
Hysteroscopy. Technology Assessment N 7. American College of Obstetricians and Gynecologists // Obstet. Gynecol. 2011. Vol. 117. Р. 1486-1491.
-
Leminen H., Hurskainen R. Tranexamic acid for the treatment of heavy menstrual bleeding: efficacy and safety // Int. J. Womens Health. 2012. Vol. 4. Р. 413-421.
-
Management of acute abnormal uterine bleeding in nonpregnant reproductive-aged women. Committee Opinion N557//Am. Coll. Obstet. Gynecol. 2013 Apr. Vol. 121. P. 891-896.
-
Micks E.A., Jensen J.T. Treatment of heavy menstrual bleeding with the estradiol valerate and dienogest oral contraceptive pill // Adv. Ther. 2013. Vol. 30, N 1. P. 1-13.
-
Munro M.G., Critchley H.O., Broder M.S., Fraser I.S. The FIGO classification system («PALMCOEIN») for causes of abnormal uterine bleeding in non-gravid women in the reproductive years, including guidelines for clinical investigation // Int. J. Gynaecol. Obstet. 2011. Vol. 113. Р. 3-13.
-
Munro M.G., Critchley H.O., Fraser I.S. The FIGO systems for nomenclature and classification of causes of abnormal uterine bleeding in the reproductive years: who needs them? // Am. J. Obstet. Gynecol. 2012 Oct. Vol. 207, N 4. Р. 259-265.
-
Podzolkova N., Tatarchuk T., Doshchanova A., Eshimbetova G., Pexman-Fieth C. Dydrogesterone treatment for menstrual-cycle regularization in routine clinical practice: a multicenter observational study // GynecolEndocrinol. 2016. Mar; 32(3). Р. 246-9.
-
Trivedi N., Chauhan N., Vaidya V. Effectiveness and safety of dydrogesterone in regularization of menstrual cycle: a post-marketing study // Gynecol. Endocrinol. 2016. Aug; 32(8). Р. 667-671.
9.2. Аменорея
Аменорея - отсутствие или прекращение самостоятельных менструаций. Клинические критерии аменореи:
-
1) отсутствие развития вторичных половых признаков и менструаций в возрасте 13-14 лет;
-
2) отсутствие менструаций при условии развития вторичных половых признаков к 15-16 годам жизни;
-
3) отсутствие менструаций в течение 5 лет после развития молочных желез к возрасту 10 лет;
-
4) отсутствие менструаций в течение 6 мес при ранее регулярном менструальном цикле;
КОД ПО МКБ-10
N91 Отсутствие менструаций; скудные и редкие менструации.
N91.0 Первичная аменорея.
N91.1 Вторичная аменорея.
N91.2 Аменорея неуточненная.
ЭПИДЕМИОЛОГИЯ
Частота аменорей составляет приблизительно 3-4% (не включая беременность, лактацию, менопаузу). Первичная аменорея встречается значительно реже, чем вторичная, по некоторым данным их соотношение составляет 1 : 9. Наиболее частыми причинами аменореи являются СПКЯ, гипоталамическая аменорея, гиперпролактинемия, преждевременная недостаточность яичников. Другие причины аменореи достаточно редки в рутинной гинекологической практике. Соотношение встречаемости первичной и вторичной аменореи - 1 : 10. Так, на базе специализированных центров только каждая 10-15-я пациентка обращается с первичной аменореей.
КЛАССИФИКАЦИЯ
По классификации ВОЗ выделяют три категории аменореи:
-
ВОЗ I - недостаточная продукция эстрогенов при нормальных или пониженных уровнях ФСГ, нормальных уровнях пролактина, отсутствии поражений гипоталамо-гипофизарной области;
-
ВОЗ II - нет очевидного снижения продукции эстрогенов, нормальные уровни ФСГ и пролактина;
-
ВОЗ III - повышение уровня ФСГ, указывающее на недостаточность яичников.
В соответствии с уровнем эндогенных гонадотропинов аменореи подразделяются:
Классификация по уровню нарушений репродуктивной системы
В соответствии с генезом выделяют четыре основные группы аменореи: гипоталамическая, гипофизарная, яичниковая, маточная. СПКЯ как мультифакторное заболевание чаще представлен в виде отдельной категории. Дополнительно выделяют аменореи, обусловленные другими функциональными и органическими причинами, в частности нарушениями в работе других эндокринных желез (надпочечников, щитовидной железы).
-
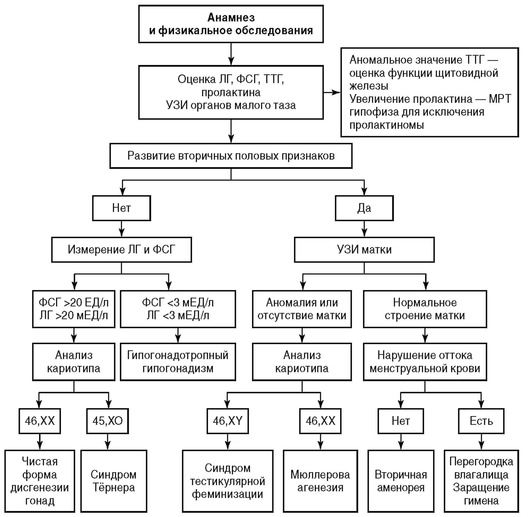
Агенезия мюллеровых протоков (синдром Майера-Рокитанского-Кюстера-Хаузера) - полное или частичное отсутствие матки и влагалища при нормальном развитии вторичных половых признаков. Составляет примерно 10% от наблюдаемой первичной аменореи, встречается с частотой 1 : 4000 живорожденных девочек. Этиология заболевания точно не известна. Возможной причиной является мутация гена АМГ или его рецептора, идентифицирована мутация галактоз-1-фосфат-уридилтранферазы. Чаще спорадические формы, редко семейные. Синдром Майера-Рокитанского-Кюстера-Хаузера в одной трети наблюдений ассоциируется с пороками развития мочевыводящих путей (эктопическая почка, удвоение почки, агенезия и др.). В 10-12% наблюдений возможны аномалии развития скелета. Кариотип женский, антропометрические параметры нормальные, функция яичников не нарушена.
-
Полная резистентность к андрогенам (тестикулярная феминизация) - рассматривается как форма мужского псевдогермафродитизма, наследуется по Х-сцепленному рецессивному типу, кариотип 46ХУ. Частота заболевания 1 : 60000, составляет 5% среди всех форм первичных аменорей. Матка, трубы и верхняя треть влагалища отсутствуют. Уровень тестостерона нормальный или повышен, однако ввиду нечувствительности к андрогенам признаков вирилизации нет. Фенотип женский, рост и развитие нормальные, тенденция к евнухоидной конституции, приблизительно у 50% пациенток наблюдаются паховые грыжи, частота неоплазии гонад достигает 20%. Яички располагаются интраабдоминально или в грыжевом мешке. При неполной форме нечувствительности к андрогенам присутствуют признаки андрогенного влияния.
Этиология
-
Внутриматочные синехии (синдром Ашермана) - повреждение эндометрия в результате послеродового эндометрита или кюретажа, произведенного по поводу неразвивающихся беременностей и беременностей малого срока, реже диагностических выскабливаний. В редких случаях синдром Ашермана развивается в результате туберкулезного эндометрита.
-
-
с измененным кариотипом - синдром Тернера, 45Х (50%), мозаицизм (25%). При синдроме Тернера имеется характерный фенотип - низкий рост, ластовидная шея, бочкообразная грудная клетка, вальгусная девиация суставов. Рекомендовано гормональное обследование для выявления гипергонадотропной аменореи, кариотипирование для исключения мозаицизма, У-хромосомы;
-
нормальным кариотипом - чистая дисгенезия гонад, 46ХХ (25%), синдром Свайера 46ХУ.
-
-
Дефицит ферментных систем - 17-альфа гидроксилазы, 17,20-лиазы, ароматазы.
Определение
Преждевременная недостаточность яичников - клинический синдром, ассоциированный с вторичной гипергонадотропной аменореей в сочетании с низкими уровнями эстрогенов, тестостерона, АМГ, ингибина В у женщин в возрасте до 40 лет. В 2014 г. опубликован Испанский консенсус по ведению женщин с преждевременной недостаточностью яичников, при составлении которого применена система доказательности GRADE, позволяющая в представленных рекомендациях оценить качество и силу приводимых доказательств (А, B, C, D, GPP).
Терминология
-
Наиболее приемлемым считается термин «преждевременная недостаточность яичников», так как он наилучшим образом характеризует не только потерю овариальной функции, но и вариабельность клинической картины, подразумевая возможность спонтанного и крайне редкого восстановления функциональной активности яичников.
КОД ПО МКБ-10
Е 28.3 Первичная яичниковая недостаточность.
Эпидемиология
Этиология
-
Преждевременному истощению овариального резерва могут способствовать генетические, инфекционно-токсические, аутоиммунные и ятрогенные причины. В большинстве наблюдений точно выявить этиологию данного заболевания крайне сложно, в связи с чем идиопатическая форма в структуре преждевременной недостаточности яичников продолжает составлять более 50%. Патогенетической основой развития данного состояния является нефизиологическое по отношению к возрасту женщины уменьшение тотального овариального резерва, нарушение процессов рекрутирования фолликулов или их ускоренный апоптоз.
-
Наиболее распространенными неятрогенными причинами формирования преждевременной недостаточности яичников являются генетические (премутация гена FMR1, мутациигенов FOXL2, NR5A1, BMP15, FSHR и Gs alpha, а также стероидогенных ферментов), инфекционные (вирусные заболевания (ВИЧ, ветряная оспа, краснуха, эпидемический паротит, туберкулез, малярия, шигеллез), аутоиммунные нарушения в рамках полигландулярного синдрома с эндокринными (гипотиреоз, СД 1-го типа, Аддисонова болезнь) и неэндокринными поражениями (тромбоцитопеническая пурпура, витилиго, алопеция, злокачественная или аутоиммунная анемия, ревматоидный артрит, болезнь Крона, синдром Шегрена, первичный биллиарный цирроз и др.).
Клинические симптомы
-
У больных с преждевременной недостаточностью яичников (возраст развития заболевания - 27-33 года) развивается вторичная яичниковая аменорея. До дебюта заболевания для 83% пациенток было характерно своевременное менархе и регулярный ритм менструаций. На фоне аменореи появляются легкие приливы, повышенная утомляемость, раздражительность, снижение работоспособности, что обусловлено выраженным дефицитом половых гормонов.
-
У 63% больных с преждевременной недостаточностью яичников отмечается дефицит андрогенов, не характерный для больных с физиологической менопаузой. Андрогендефицитное состояние характеризуется ухудшением общего самочувствия, дисфорическим настроением (вплоть до депрессии), постоянным необоснованным чувством усталости, сексуальной дисфункцией (снижение либидо), вазомоторными нарушениями и сухостью во влагалище. Другими потенциальными признаками или симптомами андрогенного дефицита является потеря костной массы, снижение мышечной силы, а также познавательной функции и памяти.
-
Бесплодие - наиболее тяжело преодолимый симптом преждевременной недостаточности яичников, в то время как до клинического дебюта заболевания у каждой второй больной наступала беременность, что свидетельствует о сохранении фертильности на начальных этапах заболевания. Репродуктивная функция была реализована только в 39% наблюдений, в остальных беременности заканчиваются их прерыванием по желанию женщин.
-
Дефицит половых гормонов в возрасте до 40 лет не только способствует формированию целой гаммы вазомоторных и эмоционально вегетативных проявлений, но и является фактором риска снижения качества костной ткани и развития остеопороза, а также сердечно-сосудистых заболеваний.
Диагностика
-
Специфических маркеров для ранней диагностики преждевременной недостаточности яичников не существует. Ведущими клиническими признаками являются: возраст младше 40 лет, вторичная олигоменорея или аменорея, продолжительность которой не менее 3-6 мес, уровень ФСГ >25 МЕ/л при двух определениях с интервалом в 4 нед.
-
Алгоритм обследования при преждевременной недостаточности яичников представлен на рис. 9.1.
-
Для акушеров-гинекологов наиболее известна ассоциация преждевременной недостаточности яичников с изменением числа CGG-повторов в гене FMR1, располагающемся на Х-хромосоме, так как одной из его функций является формирование овариального пула и регуляция процесса апоптоза.
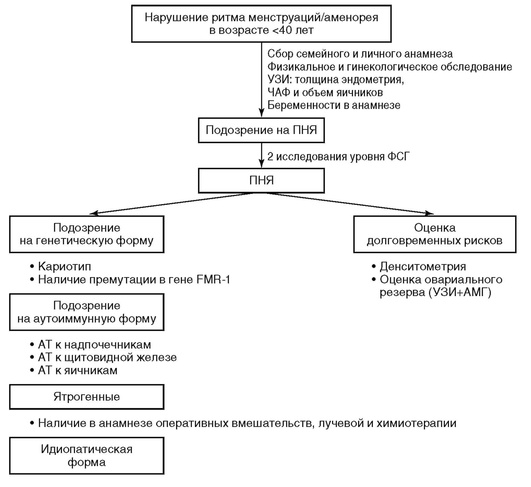
Ранее среди ведущих генетических причин преждевременной недостаточности яичников выделялась премутация гена FMR1 с числом CGG-повторов от 55 до 200, в связи с чем во всех международных рекомендациях в алгоритм обследования входит поиск премутаций гена FMR1 у данной категории больных, частота которых составляет до 16%. Работами Н.Н. Шамиловой в 2013 г. доказано, что число CGG-повторов в гене FMR1 менее 28 и более 36 является ранним прогностическим маркером развития молекулярно-генетической формы преждевременной недостаточности яичников (OR = 2,74), при этом аномальное число CGG-повторов в гене FMR1 в 19-37% сочетается с выявлением неслучайной инактивации Х-хромосомы.
-
Преждевременная недостаточность яичников может быть ярким клиническим проявлением аутоиммунных полигландулярных синдромов 1-го и 2-го типов. Больным необходимо определение антиовариальных антител, ТТГ, свободного Т4, антител к тиреоидной пероксидазе, антител к тиреоглобулину, ядерных и митохондриальных антител. При обнаружении антител к тиреопероксидазе показано ежегодное определение уровня ТТГ. При отсутствии антител к тиреопероксидазе без клинических проявлений повторный скрининг не показан (С). Скрининг на антитела к стероидпродуцирующим клеткам надпочечника (антитела к 21-гидроксилазе) показан для исключения болезни Аддисона. При положительном результате - наблюдение у эндокринолога, при отрицательном - повторный скрининг не показан (С).
-
Ятрогенные формы преждевременной недостаточности яичников развиваются после перенесенных оперативных вмешательств на яичниках, радио- и химиотерапии.
-
Для своевременной диагностики долговременных рисков, ассоциированных с дефицитом половых гормонов, больным с преждевременной недостаточностью яичников показан ежегодный скрининг минеральной плотности кости (МПК) с помощью денситометрии. При преждевременной недостаточности яичников примерно у каждой второй пациентки МПК снижена по отношению к возрастной норме.
-
Определение уровня липидов крови необходимо проводить для оценки риска развития дислипидемии как начального этапа формирования сердечно-сосудистых заболеваний. Известно, что у женщин с преждевременной недостаточностью яичников риск развития ишемической болезни сердца и инсультов после 50 лет повышается в 2,08 и 2,19 раза в сравнении с женщинами в естественной менопаузе.
-
Синдром Каллмана, характеризующийся первичным гипогонадотропным гипогонадизмом и аменореей в сочетании с аносмией. Развитие синдрома связано с нарушением миграции гонадотропин-рилизинг-нейронов в передние отделы гипоталамуса. Заболевание генетически обусловлено, характеризуется дефектом гена KAL1 в Х-хромосоме и наследуется аутосомно-рецессивно.
-
Опухоли гипоталамической области (краниофарингиомы, менингиомы, глиомы, хордомы и др.). Почти никогда не бывают злокачественными, в виду ограниченности пространства могут приводить к сдавлению оптической хиазмы.
-
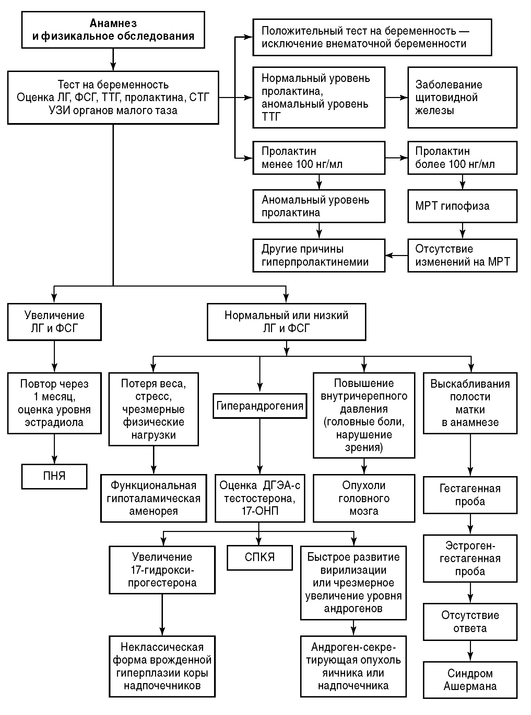
Функциональная гипоталамическая аменорея. Данная форма аменореи составляет примерно 30% от всех форм аменореи и наиболее часто встречается среди подростков и женщин в возрасте 20-25 лет. Функциональная гипоталамическая аменорея независимо от причины развивается стремительно резким прекращением менструации без предварительного периода олигоменореи. Отсутствуют также вегетативно-сосудистые симптомы, характерные для менопаузы. К наиболее значимым причинам развития гипоталамической формы аменореи относят стресс, чрезмерные физические нагрузки, потерю массы тела.
-
Аменорея может развиться вследствие снижения объема жировой ткани менее чем на 22% от общей массы тела. В развитии аменореи важна не только потерянная масса тела, но и время, за которое произошло снижение. Незначительная потеря массы тела (3-10%) в короткий период может привести к развитию заболевания. Основным патогенетическим звеном в развитии данной формы аменореи является гормон жировой ткани - лептин, образующийся в адипоцитах и являющийся одним из главных регуляторов секреции ГнРГ. Диагностика аменореи, связанной с потерей массы тела, строится на тщательном изучении анамнеза с указанием на соблюдение диеты; хронологическое совпадение потери массы тела и аменореи является критерием постановки диагноза. Дополнительным методом диагностики служит денситометрия жировой ткани, определяющая процентное соотношение жира в организме и являющаяся более достоверным показателем, чем стандартное определение ИМТ. При лабораторных обследованиях отмечают снижение лептина, эстрадиола, глобулина, связывающего половые гормоны, низкие уровни ЛГ, ФСГ. При УЗИ органов малого таза отмечают гипоплазию матки. Гестагенная проба малоинформативна ввиду большой частоты ложноположительного и ложноотрицательного результатов.
-
Аменорея может развиться на фоне психоэмоциональных нарушений или вследствие отрицательного энергетического баланса на фоне физических нагрузок.
-
В развитии гипоталамической аменореи первостепенное значение занимают увеличение синтеза АКТГ, активизация коры надпочечников с увеличением сывороточного содержания кортизола. В свою очередь, повышением сывороточного содержания АКТГ и кортизола подавляют синтез и секрецию ГнРГ. Вторым патогенетическим звеном развития данной формы аменореи является повышение активности опиоидергической системы, что приводит к увеличению синтеза эндогенных эндорфинов, которые в свою очередь подавляют функцию гонадотропин-рилизинг-нейронов, а также увеличивают активность лактотрофов. Относительная гиперпролактинемия дополнительно подавляет секрецию ГнРГ. При гормональном обследовании отмечают увеличение сывороточных концентраций стрессорных гормонов, таких как АКТГ, кортизол, а также снижение эстрадиола и гонадотропинов - ЛГ и ФСГ.
-
-
Инфекционные поражения гипоталамуса вследствие туберкулеза, сифилиса, энцефалита или менингита, а также инфильтративное поражение гипоталамуса при саркоидозе, гемохроматозе.
-
Синдром гиперторможения яичников, развивающийся на фоне длительного непрерывного приема КОК, агонистов ГнРГ или пролонгированных гестагенов.
-
Врожденная гиперплазия коры надпочечников - аутосомно-рецессивное заболевание, проявляющееся дефицитом 21-гидроксилазы, приводящее к нарушению синтеза стероидов в надпочечниках и увеличению концентрации 17-ОН прогестерона и андрогенов (дегидроэпиандростерона, дегидроэпиандростерон-сульфата, андростендиона, тестостерона). Характерен гирсутизм, андрогензависимая дермопатия, диагноз подтверждается при выявлении мутации гена CYP-21.
-
Синдром или болезнь Иценко-Кушинга характеризуется увеличением концентрации АКТГ и как следствие повышением уровня кортизола, надпочечниковых андрогенов. Диагноз ставится на основании особенностей фенотипа (лунообразное лицо, стрии, климактерический горб, перераспределение жира с преобладанием на туловище) и лабораторных данных, характеризующихся увеличением АКТГ и кортизола. Для определения источника гиперкортицизма проводится МРТ или КТ надпочечников и гипофиза, сцинтиграфия надпочечников, а также большая и малая дексаметазоновые пробы.
-
Андрогенсекретирующие опухоли надпочечников характеризуются увеличением уровня тестостерона и его метаболитов более чем в 3-4 раза, быстрым развитием вирилизации. Диагноз подтверждается при МРТ или КТ надпочечников.
-
Аменорея, обусловленная мультифакториальными причинами. К данной форме аменореи относится СПКЯ, он характеризуется олигоили ановуляцией, ГА, увеличением объема яичников по данным УЗИ. Характерным симптомом СПКЯ является олигоаменорея с менархе, с возможным переходом в аменорею, гирсутизм (см. главу 9.3).
ДИАГНОСТИКА РАЗЛИЧНЫХ ФОРМ АМЕНОРЕИ
При обследовании пациенток с аменореей используют следующие диагностические мероприятия.
Ниже представлены алгоритмы обследования пациенток с первичной (рис. 9.2) и вторичной аменореей (рис. 9.3), согласно рекомендациям Американского общества клиницистов.
ТЕРАПИЯ РАЗЛИЧНЫХ ФОРМ АМЕНОРЕИ Маточные формы аменореи
-
Синдром Майера-Рокитановского-Кюстера-Хаузера. Лечение хирургическое - кольпоэлонгация или создание искусственного влагалища (кольпопоэз).
-
Синдром тестикулярной феминизации. Лечение - хирургическое (кольпопоэз), после достижения полового развития - удаление гонад, с последующей ЗГТ препаратами натуральных эстрогенов (эстрадиола валерат 2 мг в сочетании с ЛНГ 150 мкг, либо ципротерона ацетат 1 мг, либо медроксипрогестерон 10 мг или эстрадиол 2 мг + дидрогестерон 10 мг).
-
Поперечная перегородка влагалища, неперфорированный гимен, изолированная вагинальная агенезия - пластические операции.
-
Синдром Ашермана. Лечение - гистерорезектоскопия с последующим назначением эстрогенов для поддержания роста эндометрия с 3-й недели в комбинации с 10-14-дневным курсом прогестагенов.
Аменорея, обусловленная нарушениями на уровне яичников
-
Дисгенезия гонад. При низкорослости назначают рекомбинантный гормон роста под патронажем эндокринолога. При наличии в кариотипе Y-хромосомы необходима лапароскопия с удалением придатков в связи с высоким риском малигнизации. Дальнейшее лечение сводится к назначению ЗГТ комбинированными препаратами, содержащими натуральные эстрогены и прогестагены в циклическом режиме. Используют пероральные формы (эстрадиола валерат 2 мг в сочетании с ЛНГ 150 мкг, либо ципротерона ацетат 1 мг, либо медроксипрогестерон 10 мг или эстрадиол 2 мг + дидрогестерон 10 мг). При имеющихся противопоказаниях к назначению пероральных форм (болезни печени, поджелудочной железы, нарушенная всасываемость из ЖКТ, высокий риск тромботических осложнений, артериальная гипертензия, гиперинсулинемия, мигренозная головная боль) предпочтение отдается парентеральным формам введения (гель, содержащий 1-1,5 мг эстрадиола в сочетании с микронизированным прогестероном 200 мг интравагинально). Цель терапии - формирование вторичных половых признаков, профилактика системных нарушений.
-
Основные принципы назначения ЗГТ для женщин с преждевременной недостаточностью яичников: своевременное начало терапии, применение препаратов в адекватной дозе (которые могут быть в 2-3 раза выше доз, рекомендуемых для пациенток со своевременной менопаузой) и, что наи более важно, использование половых стероидов, аналогичных натуральным, продолжительность терапии до возраста естественной менопаузы (в среднем до 51 года).
-
Основной целью лечения является достижение оптимального уровня качества жизни. Известно, что терапия эстрогенами уменьшает тревогу, улучшает настроение, а также общее самочувствие.
-
Для восполнения дефицита половых гормонов при преждевременной недостаточности яичников наиболее рационально применение комбинации эстрогенов и гестагенов в циклическом режиме. Подобное сочетание позволяет добиться надежного контроля за состоянием эндометрия. На фоне дефицита андрогенов оправдано предпочтительное использование натуральных эстрогенов в комбинации с гестагенами с остаточной андрогенной активностью в циклическом режиме (эстрадиола валерат 2 мг + ЛНГ 150 мкг, эстрадиола валерат 2 мг + медроксипрогестерона ацетат 10 мг). В случае нормального уровня андрогенов целесообразно назначать эстрадиол 2 мг + дидрогестерон 10 мг. Об адекватности проводимой терапии можно судить на основании наличия закономерной менструальноподобной ответной реакции, повышения уровня эстрадиола, снижения уровня ФСГ и ЛГ. Несмотря на то что гормонотерапия проводится молодым женщинам, у которых риск развития РЭ и молочной железы минимизирован, следует строго соблюдать принципы ежегодного скрининга: УЗИ гениталий и молочной железы, пап-тест. Учитывая продолжительность проводимой терапии (около 15 лет), в 2004 г. L. Giotto разработал принципы назначения дифференцированного долгосрочного лечения, при котором преимущественно назначаются парентеральные или трансдермальные формы препаратов. Больным с преждевременной недостаточностью яичников в возрасте до 35 лет при отсутствии генетической тромбофилии, венозных тромбозов, ишемической болезни сердца, а также сопутствующей аутоиммунной патологии возможно в течение 7-8 лет назначать препараты per os. Трансдермальные формы назначаются в возрасте после 38 лет и/или при наличии факторов риска тромбофилии. Через 10 лет приема ЗГТ всех больных необходимо переводить на трансдермальные формы. В качестве эстрогенного компонента целесообразно назначение 1,0-1,5 мг эстрадиола в сутки трансдермально в циклическом режиме. В качестве гестагенного компонента используется натуральный микронизированный прогестерон по 200 мг per vaginum или ВМС, содержащая ЛНГ 52 мг. Преимущество парентеральных форм перед таблетированными заключается в том, что они не влияют на метаболизм печени, не активируют свертывающую систему гемостаза, не снижают уровень тестостерона, уменьшают уровень триглицеридов и не влияют на С-реактивный белок.
-
При выявлении дефицита тиреоидных гормонов лечение следует назначать только пациенткам с манифестной формой заболевания в дозе 1,6-1,8 мкг на 1 кг массы тела в непрерывном режиме на протяжении 3 мес и более с обязательным контролем уровня ТТГ. При стойких субклинических формах аутоиммунного тиреоидита вопрос о назначении L-тироксина решается в каждом случае индивидуально эндокринологом.
-
Для женщин, имеющих противопоказания к ЗГТ, например перенесших РМЖ, рекомендуются различные альтернативные лечебные подходы с учетом наиболее значимых проявлений эстрогенного дефицита. При наличии вазомоторных симптомов показано использование селективных ингибиторов обратного захвата серотонина (2B). При вагинальной атрофии - регулярная половая жизнь, применение вагинальных увлажнителей и смазок во время половых актов (2B), использование упражнений для укрепления мышц тазового дня. У женщин с РМЖ и низким риском рецидива и у тех, кто получает лечение тамоксифеном, в случае неэффективности влагалищных смазок/увлажнителей можно рассмотреть возможность применения локальных влагалищных эстрогенов после тщательного анализа пользы и риска, а также после консультации пациентки онкологом (2B). Не рекомендуется применение локальных эстрогенов у женщин, получающих ингибиторы ароматазы (2C). В качестве профилактики снижения МПК показано назначение селективных эстроген-рецепторных модуляторов, так как они обладают дополнительным профилактическим влиянием в отношении РМЖ и сердечно-сосудистых заболеваний и, в отличие от препаратов алендроновой кислоты, не накапливаются в организме. Наличие мигрени, гипертензии, ожирения и тромбозов в анамнезе не является противопоказанием для назначения ЗГТ (GPP). После консультации пациенток с узкими специалистами возможно избрать трансдермальный путь введения эстрогенов. Миома матки не является противопоказанием для назначения ЗГТ (С). У женщин с хирургической менопаузой, как последствие лечения эндометриоза, целесообразно назначение эстроген-гестагенных препаратов или тиболона (С).
Репродукция при преждевременной недостаточности яичников
В 2013 г. N. Panay и соавт. провели метаанализ, в результате которого был сделан вывод о том, что не существует плацебо-контролируемых исследований, позволивших стандартизировать тактику ведения женщин с преждевременной недостаточностью яичников, желающих иметь беременность за счет собственных гамет. Терапией первого выбора с цельюдостижения беременности является донация ооцитов/эмбрионов (В). При донации ооцитов от родных сестер пациенток с преждевременной недостаточностью яичников повышается риск неудачи ЭКО (GPP). ЗГТ или монотерапия эстрадиолом рекомендуетсяженщинам при планировании беременности или перед стимуляцией овуляции, что способствует повышению частоты спонтанного наступления беременности ( C). Беременность после донации ооцитов представляет высокий акушерский риск.
Аменореи, обусловленные нарушениями функций передней доли гипофиза и гипоталамуса
-
При наличии опухоли гипофиза или гипоталамуса показано хирургическое лечение, наблюдение нейрохирургом и эндокринологом. В случае пролактиномы возможна медикаментозная терапия (см. главу 9.8 «Гиперпролактинемия»).
-
Синдром пустого турецкого седла, послеродовый гипопитуитаризм (синдром Шихана), синдром Каллмана. Показана ЗГТ с использованием натуральных эстрогенов в сочетании с гестагенами по ранее предложенным схемам, а также наблюдение у эндокринолога.
-
Воспалительные поражения гипофиза или гипоталамуса. Показана этиотропная и патогенетическая терапия.
Функциональная гипоталамическая аменорея
Первым этапом терапии служит восстановление оптимальной массы тела, восстановление психоэмоционального состояния женщины. При отсутствии самопроизвольного восстановления цикла показана заместительная терапия эстроген-гестагенными препаратами в течение 3-6 мес, что оказывает стимулирующий эффект на гипоталамические структуры. Используют пероральные формы (эстрадиола валерат 2 мг в сочетании с ЛНГ 150 мкг, либо ципротерона ацетат 1 мг, либо медроксипрогестерон 10 мг, или эстрадиол 2 мг + дидрогестерон 10 мг). При имеющихся противопоказаниях к назначению пероральных форм (болезни печени, поджелудочной железы, нарушенная всасываемость из ЖКТ, высокий риск тромботических осложнений, артериальная гипертензия, гиперинсулинемия, мигренозная головная боль) предпочтение отдается парентеральным формам введения (гель, содержащий 1-1,5 мг эстрадиола в сочетании с микронизированным прогестероном 200 мг интравагинально). Также необходима оценка сывороточного содержания витамина D. При снижении уровня витамина D менее 30 нмоль/л показана терапия высокими дозами витамина D 50000 МЕ в неделю в течение 8-12 нед (целевое значение содержания витамина D в сыворотке крови - 30 нмоль/л, или 1000 МЕ/дл). В настоящее время в США и Европе используют препараты рекомбинантного лептина, способные восстановить менструальную функцию у пациенток с гипоталамической формой аменореи на фоне снижения массы тела.
Назначение КОК, направленное на нормализацию менструального цикла пациенток с гипоталамической аменореей, не рекомендуется ввиду их подавляющего эффекта на секрецию гонадотропинов.
Аменореи, обусловленные нарушениями функций других эндокринных желез
-
Врожденная гиперплазия коры надпочечников. Терапия определяется в зависимости от формы врожденной гиперплазии коры надпочечников. Применяется дексаметазон в дозах 0,75-0,5-0,25 мг в сутки в зависимости от выраженности клинической симптоматики. Курс терапии составляет 6 мес, проводится под контролем уровня андрогенов крови и оценки овуляции. В случае заинтересованности в беременности проводится стимуляция овуляции кломифена цитратом по общепринятой схеме с поддержкой лютеиновой фазы. При поздней неклассической форме врожденной гиперплазии коры надпочечников, нерезко выраженных проявлениях ГА и незаинтересованности в беременности гормональная терапия не показана.
-
Синдром или болезнь Иценко-Кушинга. Наблюдение и лечение проводится совместно с эндокринологом.
-
Андрогенсекретирующие опухоли. Лечение хирургическое с применением химиотерапевтических препаратов. Наблюдение осуществляется совместно с онкологами и профильными специалистами.
Синдром поликистозных яичников
Подходы к терапии зависят от выраженности эндокринно-обменных нарушений и заинтересованности женщины в беременности. Подробная схема представлена в главе 9.3.
СПИСОК ЛИТЕРАТУРЫ
-
Руководство по амбулаторно-поликлинической помощи в акушерстве и гинекологии / под ред. В.Н. Серова, Г.Т. Сухих, В.Н. Прилепской, В.Е. Радзинского, 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2016. 1136 c.
-
Акушерство. Гинекология. Бесплодный брак. Клиническая фармакология / под ред. В.Е. Радзинского, Р.Н. Аляутдина. М.: ГЭОТАР-Медиа, 2016. 672 c.
-
Гинекология: учебник / под ред. Г.М. Савельевой, Г.Т. Сухих, И.Б. Манухина. М.: ГЭОТАР-Медиа, 2013. 704 с.
-
Klein D.A., Poth M.A. Amenorrhea: an approach to diagnosis and management // Am. Fam. Physician. 2013. Vol. 87, N 11. P. 781-788.
9.3. Синдром поликистозных яичников
СПКЯ - симптомокомплекс, включающий клинические и биохимические проявления ГА в сочетании с овуляторной дисфункцией и поликистозной морфологией яичников, диагностируется при исключении других причин ГА. СПКЯ составляет 80%, а по некоторым данным - 90% всех форм ГА, является ведущей причиной ановуляторного бесплодия, фактором риска осложнений беременности, ассоциирован с метаболическим синдромом, развитием СД 2-го типа и сердечнососудистых заболеваний.
КОД ПО МКБ-10
Е28.2 Синдром поликистоза яичников.
Склерокистозный овариальный синдром, синдром Штейна-Левенталя
ЭПИДЕМИОЛОГИЯ
СПКЯ относится к числу мультигенных заболеваний с высокой частотой встречаемости и является одной из наиболее частых форм эндокринопатий среди женщин репродуктивного возраста, показатели его распространенности зависят от используемых критериев диагностики. Согласно результатам исследований, которые основывались на критериях Национального института здоровья США (1990), распространенность СПКЯ составляет 5-10%. При применении критериев диагностики СПКЯ, предложенных на Роттердамской конференции, показатели распространенности доходят до 20%, по критериям Общества гиперандрогенных состояний и СПКЯ укладываются в 15%.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этиология и патогенез СПКЯ до настоящего времени полностью не ясны, существует много теорий и научных предположений, которые до конца не объясняют его формирование и многообразие клинических проявлений. С современных позиций СПКЯ рассматривается как мультигенное заболевание. Исследовано более ста генетических полиморфизмов, предположительно ассоциированных с СПКЯ. К числу наиболее значимых генов-кандидатов относятгены, кодирующие ферменты, участвующие в биосинтезе андрогенов (STAR, CYP11A, CYP17, HSD17B6), ген рецептора к инсулину (INSR), субстрата инсулинового рецептора - 1 (IRS1), фибриллина-3 (FBN3), активина А (ACVR2A) и некоторые другие. Исследования генома человека выявили два ассоциированных с СПКЯ локуса (THADA и DENND1A), характерные как для европейской, так и для азиатской популяций.
В формировании СПКЯ играют роль не только генетические, но и эпигенетические нарушения, приводящие к изменениям активности генов, без изменения последовательности ДНК. Одной из наиболее актуальных теорий развития СПКЯ является теория фетального программирования. Предполагают, что неблагоприятное воздействие ряда факторов, таких как пренатальный дефицит питания, материнская андрогенизация, могут менять экспрессию генов, при этом происходит программирование - фиксация изменений метаболизма, которая в последующем может приводить к развитию СПКЯ.
В качестве патофизиологических механизмов развития СПКЯ рассматривают различные гормональные нарушения, к их числу относят нарушения секреции и действия гонадотропинов, андрогенов, инсулина. Для каждой второй пациентки с СПКЯ характерна гипоталамическая дисфункция секреции ГнРГ, способствующая увеличению амплитуды и частоты пульсации ЛГ. Гиперсекреция ЛГ приводит к избыточной стероидогенной активности клеток теки, возникновению яичниковой ГА, характерной для 50-80% больных. Избыток андрогенов индуцирует чрезмерный рост антральных фолликулов, нарушение созревания и развития доминантного фолликула, возникновение стромальной гиперплазии. Стероидогенная дисфункция может быть связана с нарушениями экспрессии генов, участвующих в биосинтезе андрогенов, с изменениями внутриклеточных сигнальных путей, опосредующих действие ЛГ, с избыточной секрецией АМГ, ингибированием действия ФСГ и подавлением активности ароматазы. Важная роль отводится избыточной секреции инсулина, который оказывает стимулирующий эффект на синтез андрогенов клетками теки путем воздействия на 17-α-гидрокилазу/17,20-лиазу. Помимо прямого стимулирующего эффекта на синтез андрогенов, инсулин может оказывать опосредованное воздействие, снижая продукцию секс-стероидсвязывающего глобулина, повышая уровень свободных андрогенов. Примерно у 20% пациенток с СПКЯ выявляется надпочечниковая ГА, ее вклад в клиническую картину СПКЯ менее значимый. До настоящего времени не обнаружено связи надпочечниковой дисфункции со специфическими дефектами стероидогенеза.
Одним из основных компонентов СПКЯ является овуляторная дисфункция, связанная с нарушением фолликулогенеза, ее частота достигает 75-91%.
Патофизиологические механизмы избыточного роста малых фолликулов и остановки их развития на ранних стадиях продолжают изучаться. В качестве патофизиологического механизма обсуждается роль избытка тестостерона, приводящего к инициации фолликулярного роста, ингибированию апоптоза, накоплению антральных фолликулов. Задержка нормального созревания фолликулов может быть связана с недостаточной секрецией ФСГ, которая выявляется у части пациенток с СПКЯ. В последние годы широко обсуждается роль гиперсекреции АМГ, обусловленной большим количеством антральных фолликулов и увеличением продукции гормона. Предполагается, что АМГ ингибирует ФСГ-зависимую активностьароматазы и препятствует дальнейшему синтезу эстрадиола. Тот факт, что в яичниках выявлены различные изоформы рецепторов к инсулину, предполагает возможность непосредственной регуляции ответа на действие гонадотропинов, хотя механизм и сигнальные пути, участвующие в этом процессе, неизвестны. Рассматривается роль нарушений ростовых факторов, секретируемых ооцитом, в регуляции роста и созревании фолликулов на ранних стадиях.
КЛИНИЧЕСКАЯ КАРТИНА
СПКЯ наиболее часто проявляется овуляторной дисфункцией (ановуляции II типа по классификации ВОЗ), проявляющейся олигоменореей (менее 10 менструаций в год) или аменореей, ановуляторным бесплодием.
Для женщин с СПКЯ характерны метаболические нарушения, проявляющиеся ожирением у 40-60% пациенток.
Клиническая картина СПКЯ вариабельна, это затрудняет разработку единых диагностических критериев.
При физикальном обследовании выявляются гирсутизм, акне или андрогенная алопеция. Степень выраженности гирсутизма оценивается по модифицированной шкале Ферримана-Голлвея. Каждая из девяти областей тела в зависимости от степени роста волос оценивается от 0 (нет остевых волос) до 4 баллов (выраженный рост), сумма 8 баллов и более у представителей европеоидной расы указывает на гирсутизм. В отличие от гирсутизма, акне и андрогенетическая алопеция не являются достоверными признаками СПКЯ (табл. 9.1).
| Степень | Оволосение | Балл |
|---|---|---|
I |
Белой линии живота Верхней губы Околососковых полей |
1 2 3 |
II |
I степени + подбородка Бакенбарды Внутренней поверхности бедер |
4 5 6 |
III |
II степени + грудины Спины Ягодиц Плечевой области |
7 8 9 10 |
Клинические проявления СПКЯ условно можно разделить на основные, определяющие диагноз, и дополнительные, к которым относят ожирение, ИР, нарушения толерантности к глюкозе, дислипидемию, жировой гепатоз печени, тревожно-депрессивные расстройства, нарушения сна.
ДИАГНОСТИКА
Критерии диагностики
Диагностика СПКЯ основывается на оценке клинических проявлений заболевания, которые характерны и для других форм ГА, лабораторной диагностике гипер-андрогенемии, выявлении эхографических признаков СПКЯ. В настоящее время известно несколько критериев диагностики СПКЯ у женщин репродуктивного возраста. Критерии диагностики Национального института здоровья США (NIH, 1990) основываются на наличии двух основных признаков:
Обязательным условием является исключение заболеваний со схожей клинической картиной. Эти критерии диагностики не учитывают морфологических изменений в яичниках, что явилось основанием для их пересмотра.
В 2003 г. в Роттердаме Европейским обществом репродукции и эмбриологии человека и Американским обществом репродуктивной медицины были предложены критерии диагностики СПКЯ, которые включали морфологические признаки. Согласно этим критериям, СПКЯ можно диагностировать при наличии как минимум двух из трех нижеперечисленных признаков:
Введение Роттердамских критериев позволило выделить неполные формы синдрома, в том числе овуляторную и неандрогенную.
В 2012 г. Национальный институт здоровья США принял решение использовать диагностические критерии, предложенные на Роттердамской конференции в 2003 г., с определением фенотипа СПКЯ. Рекомендуется выделять четыре клинических фенотипа СПКЯ:
Различные фенотипы СПКЯ могут быть ассоциированы с разной частотой и выраженностью метаболических нарушений и кардиоваскулярных заболеваний.
Диагностика СПКЯ у подростков имеет особенности. Диагноз ставится при сочетании клинической и/или биохимической ГА (после исключения других ее возможных причин) с овуляторной дисфункцией. Наличие ановуляции и УЗИ-признаков СПКЯ недостаточно для постановки диагноза, поскольку эти нарушения могут наблюдаться в норме на определенных стадиях репродуктивного развития.
Лабораторные исследования
Оценка гормонального профиля и биохимической гиперандрогении
ГА может проявляться повышенным содержанием в сыворотке крови общего тестостерона, свободного тестостерона, андростендиона, дегидроэпиандростерона. Для пациенток с СПКЯ характерно снижение продукции секс-стероид-связывающего глобулина в печени, ассоциированное с воздействием избытка инсулина и/или андрогенов. Для диагностики биохимической ГА наиболее информативно определение уровня свободного тестостерона в сыворотке крови. Альтернативным подходом является определение уровня общего тестостерона с последующим расчетом его свободных фракций, исходя из уровня секс-стероид-связывающего глобулина. Расчет индекса свободного тестостерона производится по формуле:
ИСТ = общий тестостерон (нмоль/л) x 100 / секс-стероид-связывающий глобулин (нмоль/л).
В рекомендациях Эндокринологического общества указывается на информативность определения уровня андростендиона и на нецелесообразность рутинного определения уровня дегидроэпиандростерона. Ограничения в диагностике ГА связаны как с отсутствием точных методов определения уровней андрогенов, так и с отсутствием референсных значений, разработанных на основе популяционных исследований. Исследование уровня андрогенов оптимально проводить методом масс-спектрометрии.
Повышение индекса ЛГ/ФСГ не рассматривают в качестве диагностического критерия СПКЯ.
В последние годы в качестве биохимического маркера СПКЯ предлагают рассматривать АМГ, поскольку его концентрация в сыворотке крови повышена пропорционально количеству преантральных и малых антральных фолликулов. Однако пока нет рекомендаций для рутинного определения АМГ с целью диагностики СПКЯ. Для дифференциальной диагностики СПКЯ рекомендуется определять уровень ТТГ, пролактина и 17-прогестерона в первую фазу менструального цикла.
Диагностика овуляторной дисфункции
Для оценки овуляторного статуса у женщин с регулярным менструальным циклом рекомендуется определять уровень прогестерона в сыворотке крови на 20-24-й день менструального цикла, его снижение в двух циклах из трех свидетельствует о наличии ановуляции (рекомендации Эндокринологического общества).
Инструментальные исследования
Эхографическая диагностика
Для диагностики СПКЯ необходима УЗ оценка морфологии яичников, поскольку увеличение их объема и поликистозная трансформация встречаются в 75-90% наблюдений.
В 2013 г. Общество по ГА и СПКЯ (AE-PCOS Society) предложило модифицированные УЗ критерии диагностики СПКЯ:
Физикальное обследование
Диагностика метаболических нарушений
СПКЯ сопровождается метаболическими нарушениями, а именно ожирением, нарушением углеводного и липидного обмена.
Всем пациенткам с СПКЯ необходимо определять ИМТ [кг/м2 ; масса тела (кг)/ рост (м2 )] и окружность талии. При каждом визите следует проводить измерение АД, при систолическом АД выше 130 мм рт.ст. и диастолическом выше 85 мм рт.ст. необходим ежедневный мониторинг АД с ведением дневника.
В связи с высоким риском развития СД 2-го типа пациенткам с СПКЯ рекомендован скрининг на нарушение толерантности к глюкозе и СД 2-го типа путем проведения 2-часового перорального глюкозотолерантного теста с 75 г глюкозы, в случае невозможности проводят определение гликозилированного гемоглобина. По рекомендации Общества по ГА и СПКЯ глюкозотолерантный тест следует проводить 1 раз в 2 года при нормальной толерантности к глюкозе или чаще, если выявляются дополнительные факторы риска развития СД 2-го типа.
Нарушения липидного спектра крови чаще наблюдаются среди пациенток с ожирением, однако нередко выявляются и при его отсутствии. В связи с этим всем пациенткам с СПКЯ необходимо проводить определение липидного профиля, при отсутствии нарушений - 1 раз в 2 года, при отклонениях от нормы - ежегодно.
Дифференциальная диагностика
С целью дифференциальной диагностики необходимо исключить:
ЛЕЧЕНИЕ
Консервативное лечение
Терапия носит симптоматический характер. Выбор тактики ведения определяется жалобами пациентки. Цель терапии при незаинтересованности в беременности - регуляция ритма менструаций для профилактики гипер- и неопластических процессов эндометрия, лечение гирсутизма и других кожных проявлений ГА, коррекция метаболических нарушений для профилактики СД 2-го типа и кардиоваскулярных заболеваний. Цель терапии при планировании беременности - лечение ановуляторного бесплодия.
Модификацию образа жизни следует рассматривать в качестве первой линии терапии у пациенток с избыточной массой тела и ожирением. Накапливается опыт применения бариатрической хирургии пациенток с СПКЯ и морбидным ожирением. При потере массы тела на 5-10% от исходной можно ожидать снижения ГА, гиперинсулинемию, восстановление овуляторных циклов и повышение частоты наступления беременности.
Для коррекции эндокринно-метаболических нарушений при СПКЯ применяются инсулиносенситайзеры, в частности метформин, который не рассматривается в качестве лекарственного средства для лечения ожирения. Он рекомендуется как препарат первой линии при нарушении толерантности к глюкозе, СД 2-го типа, в случаях, когда модификация образа жизни не дает ожидаемого эффекта.
При лечении гирсутизма и овуляторной дисфункции препаратами первой линии являются комбинированные гормональные контрацептивы. Они рекомендуются в качестве монотерапии при умеренном гирсутизме и акне, а также для регуляции менструального цикла, профилактики гиперплазии эндометрия и маточных кровотечений. При противопоказаниях к назначению комбинированных гормональных контрацептивов можно использовать гестагены в циклическом режиме. Обычно это микронизированный прогестерон в дозе 200 мг (в соответствии с протоколами по СПКЯ Европейского общества эндокринологов, 2013).
Снижение уровня андрогенов в сыворотке крови при лечении комбинированными гормональными контрацептивами происходит за счет ингибирования секреции ЛГ и повышения синтеза секс-стероид-связывающего глобулина в печени. Эффективность препаратов, содержащих 20 и 35 мкг ЭЭ, считается сопоставимой. В последнее время для лечения СПКЯ применяются комбинированные гормональные контрацептивы, содержащие натуральные эстрогены - эстрадиола валерат и 17-β-эстрадиол. При выборе комбинированного гормонального контрацептива важное значение имеет гестагенный компонент. Для лечения гирсутизма отдают предпочтение низкодозированным комбинированным гормональным контрацептивом, содержащим нейтральные гестагены или гестагены с антиандрогенным действием (ципротерона ацетат, дроспиренон). Они обладают дополнительными антиандрогенными свойствами, так как являются антагонистами андрогенных рецепторов и/или ингибиторами активности 5α-редуктазы. Применение комбинированных гормональных контрацептивов с фолатами дает преимущества в виде снижения риска дефектов нервной трубки плода, удовлетворения повышенной потребности в фолатах во время беременности. Для достижения клинического эффекта при гирсутизме длительность приема комбинированных гормональных контрацептивов должна быть не менее 6 мес. При неэффективности терапии, а также при выраженном гирсутизме возможна комбинация комбинированных гормональных контрацептивов с нестероидными антиандрогенами (спиронолактоном, флутамидом или финастеридом).
При планировании беременности рекомендовано проводить оценку ИМТ, мониторинг АД, глюкозотолерантного теста. Снижение массы тела перед планируемой беременностью рассматривается в качестве первой линии терапии бесплодия у женщин с СПКЯ, страдающих избыточной массой тела и ожирением.
В качестве терапии первой линии для лечения ановуляторного бесплодия при СПКЯ рекомендуется использовать кломифена цитрат. Длительность стимуля ции овуляции кломифена цитратом должна ограничиваться шестью циклами. У 30-40% пациенток отмечается кломифенорезистентность. Комбинация метформина с кломифена цитратом в 3,5 раза увеличивает вероятность овуляции по сравнению с монотерапией кломифена цитратом. В сравнительных исследованиях доказана высокая эффективность ингибиторов ароматазы при лечении ановуляторного бесплодия у женщин с СПКЯ. В связи с этим индукция овуляции летрозолом рекомендуется для восстановления фертильности при СПКЯ.
При неэффективности непрямых индукторов овуляции в качестве терапии второй линии рекомендуется стимуляция гонадотропинами или лапароскопия с дриллингом яичников. Эффективность этих методов считается сопоставимой, частота многоплодных беременностей выше при лечении гонадотропинами. Лапароскопия не должна применяться в качестве симптоматической терапии СПКЯ, если пациентка не страдает бесплодием.
В качестве третьей линии терапии ановуляторного бесплодия применяются методы ВРТ. Эффективность программ ВРТ при СПКЯ сравнима с их применением у женщин с другими формами бесплодия. С целью профилактики синдрома гиперстимуляции яичников (СГЯ) у пациенток с СПКЯ может применяться метформин.
Хирургические методы лечения
Лапароскопия с дриллингом яичников показана при кломифенорезистентности, а также в случае необходимости лапароскопической операции у пациенток с СПКЯ по другим показаниям. Хирургическое лечение проводится минимально инвазивными методами (электрокаутеризация, лазерный дриллинг и множественная биопсия яичников). Частота восстановления овуляции ниже при наличии ожирения.
В качестве неблагоприятных последствий лапароскопии возможно возникновение спаек и снижение овариального резерва. Вероятность этих осложнений после лапароскопического дриллинга низкая, вместе с тем хирургическое лечение не должно рассматривается в качестве основного метода при СПКЯ.
ПРОГНОЗ
Течение СПКЯ в долгосрочной перспективе изучено недостаточно. С возрастом у пациенток с СПКЯ снижается количество антральных фолликулов, уровень АМГ и концентрация андрогенов в сыворотке крови, хотя эти показатели остаются более высокими, чем у здоровых женщин того же возраста. У пациенток с СПКЯ с возрастом отмечается нормализация ритма менструаций, повышается вероятность овуляции и спонтанного наступления беременности. Менопауза у женщин с СПКЯ наступает на несколько лет позднее, чем в общей популяции, вазомоторные проявления дефицита эстрогенов менее выражены. Проявления ГА с возрастом нивелируются, метаболические нарушения усугубляются. Согласно результатам ряда долгосрочных исследований, женщины с СПКЯ в постменопаузе чаще страдают СД 2-го типа и ишемической болезнью сердца. В связи с этим программа ведения пациенток с СПКЯ должна предусматривать оценку риска сердечно-сосудистых заболеваний и своевременную коррекцию метаболических нарушений.
СПИСОК ЛИТЕРАТУРЫ
-
Руководство по амбулаторно-поликлинической помощи в акушерстве и гинекологии / под ред. В.Н. Серова, Г.Т. Сухих, В.Н. Прилепской, В.Е. Радзинского, 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2016. 1136 c.
-
Акушерство. Гинекология. Бесплодный брак. Клиническая фармакология / под ред. В.Е. Радзинского, Р.Н. Аляутдина. М.: ГЭОТАР-Медиа, 2016. 672 c.
-
Гинекология: учебник / под ред. Г.М. Савельевой, Г.Т., Сухих, И.Б. Манухина. М.: ГЭОТАР-Медиа, 2013. 704 с.
-
Abbott D.H., Bacha F. Ontogeny of polycystic ovary syndrome and insulin resistance in utero and early childhood // Fertil. Steril. 2013 Jul. Vol. 100, N 1. P. 2-11.
-
Chen Z.J., Zhao H., He L. et al. Genome-wide association study identifies susceptibility loci for polycystic ovary syndrome on chromosome 2p16.3, 2p21 and 9q33.3 // Nat. Genet. 2011. Vol. 43. P. 55.
-
Consensus on infertility treatment related to polycystic ovary syndrome. Thessaloniki ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group // Hum. Reprod. 2008 Mar. Vol. 23, N 3. P. 462-477.
-
Dewailly D., Lujan M.E., Carmina E., Cedars M.I. et al.Definition and significance of polycystic ovarian morphology: a task force report from the Androgen Excess and Polycystic Ovary Syndrome Society // Hum. Reprod. Update. 2014. Vol. 20, N 3. P. 334-352.
-
Escobar-Morreale H.F., Carmina E., Dewailly D., Gambineri A. et al. Epidemiology, diagnosis and management of hirsutism: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome Society // Hum. Reprod Update. 2012 Mar-Apr.Vol. 18, N 2. P. 146-170.
-
Goodarzi M.O, Jones M.R., Li X., Chua A.K. et al. Replication of association of DENND1A and THADA variants with polycystic ovary syndrome in European cohorts // J. Med. Genet. 2012. Vol. 49. P. 90-95.
-
Kosova G., Urbanek M. Genetics of the polycystic ovary syndrome // Mol.Cell. Endocrinol. 2013 Jul 5. Vol. 373, N 1-2. P. 29-38.
-
Kristensen S.L., Ramlau-Hansen C.H., Andersen C.Y., Ernst E. et al. The association between circulating levels of antimullerian hormone and follicle number, androgens, and menstrual cycle characteristics in young women // Fertil. Steril. 2012. Vol. 97. P. 779-785.
-
Legro R.S., Arslanian S.A., Ehrmann D.A., Hoeger K.M. et al. Diagnosis and treatment of polycystic ovary syndrome: an Endocrine Society clinical practice guideline // J. Clin. Endocrinol. Metab. 2013 Dec. Vol. 98, N 12. P. 4565-4592.
-
Qin J.Z., Pang L.H., Li M.J., Fan X.J. et al. Obstetric complications in women with polycystic ovary syndrome: a systematic review and meta-analysis // Reprod. Biol. Endocrinol. 2013 Jun 26. Vol. 11. P. 56.
-
Qu F., Wang F.F., Yin R., Ding G.L. et al. A molecular mechanism underlying ovarian dysfunction of polycystic ovary syndrome: hyperandrogenism induces epigenetic alterations in the granulosa cells // J. Mol. Med. (Berl.). 2012 Aug. Vol. 90, N 8. P. 911-923.
-
Wild R.A., Carmina E., Diamanti-Kandarakis E. et al. Assessment of cardiovascular risk and prevention of cardiovascular disease in women with the polycystic ovary syndrome: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome (AEPCOS) Society // J. Clin. Endocrinol. Metab. 2010. Vol. 95. P. 2038-2049.
-
Yildiz B.O., Bozdag G., Yapici Z., Esinler I.etal. Prevalence, phenotype and cardio-metabolic risk of polycystic ovary syndrome under different diagnostic criteria // Hum. Reprod. 2012 Oct. Vol. 27, N 10. P. 3067-3073.
-
URL: http://prevention.nih.gov/workshops/2012/pcos/docs/FinalReport.pdf.
9.4. Метаболический синдром
Метаболический синдром - сочетание факторов риска сердечно-сосудистых заболеваний и СД 2-го типа, включающих резистентность к инсулину, абдоминальное ожирение, артериальную гипертензию и атерогенную дислипидемию. Метаболический синдром является осложнением избыточной массы тела и/или ожирения, но может выявляться и у лиц с нормальной массой тела. У пациенток с нарушениями репродуктивной функции чаще определяется избыточная масса тела или ожирение. Учитывая, что в жизни женщины существуют три периода, при которых физиологическая ИР переходит патологическую, именно в эти периоды прибавка веса тела инициирует развитие метаболического синдрома и ассоциированных с ним заболеваний. В период пубертата это СПКЯ, в период менопаузы - преддиабет (нарушенная толерантность к глюкозе и нарушенная гликемия плазмы натощак), а затем СД 2-го типа. В основе перехода физиологической ИР в патологическую, помимо генетической предрасположенности, лежит нарушение здорового образа жизни.
9.4.1. Ожирение
СИНОНИМЫ
Первичное ожирение, экзогенно-конституциональное ожирение, алиментарное ожирение.
ОПРЕДЕЛЕНИЕ
Ожирение представляет собой гетерогенную группу состояний и синдромов, обусловленных или осложнившихся нейрогуморальными и метаболическими нарушениями, общим проявлением которых является избыточное накопление жира в организме.
КОД ПО МКБ-10
Е66 Ожирение.
E66.0 Ожирение, обусловленное избыточным поступлением энергетических ресурсов.
E66.1 Ожирение, вызванное приемом лекарственных средств.
E66.2 Крайняя степень ожирения, сопровождаемая альвеолярной гиповентиляцией.
E66.8 Другие формы ожирения.
E66.9 Ожирение неуточненное.
ЭПИДЕМИОЛОГИЯ
В странах Западной Европы распространенность ожирения у женщин - 25%; у 55% населения ИМТ более 25 кг/м2 . В России заболеваемость ожирением составляет 789,3 на 100 тыс. человек, в среднем 30% лиц трудоспособного возраста имеют ожирение. Среди людей старше 30 лет, проживающих в экономически раз витых странах, распространенность СД 2-го типа составляет 6-8%, АГ - 17-22%, ишемической болезни сердца - 25%; 25% лиц среднего возраста имеют ИР и как следствие метаболический синдром. Прогноз на 2016 г.: более 2,7 млрд человек в мире будут иметь избыточную массу тела и более 700 млн - ожирение, более 30% - метаболический синдром.
КЛАССИФИКАЦИЯ
Этиопатогенетическая классификация ожирения
Принципиальное значение имеет не только факт наличия ожирения, но и степень его выраженности, что определяет риск сопутствующих заболеваний и выбор тактики лечения.
| Степень ожирения | ИМТ | Риск сопутствующих заболеваний |
|---|---|---|
Избыточная масса тела |
25-29,9 |
Повышенный |
Ожирение I степени |
30-34,9 |
Высокий |
Ожирение II степени |
35-39,9 |
Очень высокий |
Ожирение III степени (морбидное) |
≥40 |
Крайне высокий |
Избыточное отложение жира в абдоминальной области преимущественно за счет развития висцерального жира ассоциировано с высоким риском кардиометаболических осложнений. Сочетание абдоминального ожирения (окружность талии 94 см и более у мужчин и 80 см и более у женщин) с нарушениями углеводного обмена, дислипидемией и/или АГ, т.е. совокупность факторов риска развития СД и сердечно-сосудистых заболеваний, принято обозначать термином «метаболический синдром».
ЭТИОЛОГИЯ
Первичное ожирение и метаболический синдром развиваются вследствие энергетического дисбаланса между поступлением и расходом энергии при определенной генетической предрасположенности. Причинами ожирения в первую очередь служат низкий уровень физической активности пациента и его неправильное питание, характеризующееся избыточным потреблением высококалорийных продуктов с преобладанием в рационе жиров и нарушенным суточным ритмом приема пищи. В целом образ жизни и стиль питания больного определяют развитие ожирения.
ПАТОГЕНЕЗ
Патогенез ожирения и метаболического синдрома сложен и до конца не изучен. Центральные механизмы регуляции массы тела осуществляются гипоталамическими и кортиколимбическими структурами. Одни нейромедиаторы и гормоны (нейропептид Y, галанин, опиоды, соматолиберин, грелин, β-эндорфин, соматостатин) увеличивают, а другие (серотонин, норадреналин, кортиколиберин, холецистокинин, меланоцитстимулирующий гормон, лептин, бомбезин и др.) снижают необходимость в потреблении пищи. Нарушение синтеза, метаболизма и секреции нейротрансмиттеров может приводить к эндокринным сдвигам, которые, в свою очередь, имеют значение в механизме развития ожирения и специфичности отложения жира. Периферическими механизмами регуляции энергетического гомеостаза являются гормоны ЖКТ и адипокины, выделяемые жировой тканью. Помимо депонирования энергии, жировая ткань через адипокины (лептин, адипонектин, резистин и др.), взаимодействуя с различными органамии системами, включая ЦНС, участвует в регуляции энергетического гомеостаза, чувствительности к инсулину, метаболизма глюкозы и липидов. Последние годы активно изучается механизм действия белков теплового шока - шаперонов - как предикторов нарушений углеводного и жирового обмена, а также развития нейродегенеративных заболеваний.
КЛИНИЧЕСКАЯ КАРТИНА
Основная жалоба, предъявляемая больными, - избыточная масса тела. Другие жалобы: повышение АД, головные боли, повышенное потоотделение, одышка при физической нагрузке и в покое, храп во сне, нарушение менструального цикла у женщин, снижение либидо и другие - обусловлены ассоциированными с ожирением заболеваниями.
ДИАГНОСТИКА
С классической точки зрения диагностика ожирения проста: достаточно рассчитать ИМТ для определения степени выраженности заболевания. Дальнейшие исследования должны быть направлены на исключение вторичных форм ожирения и выявление ассоциированных с ожирением заболеваний.
Алгоритм обследования включает осмотр, сбор анамнеза, анализ питания и уровня физической активности больного, лабораторные и инструментальные методы диагностики.
Проводят скрининг больных ожирением в общей популяции: измеряют рост и массу тела для расчета ИМТ. ИМТ = масса тела (кг) / рост (м)2 . Ожирение диагностируют при ИМТ 30 кг/м2 и более (табл. 9.2, 9.3). Для скрининга метаболического синдрома пользуются «золотым стандартом» (табл. 9.4).
ИМТ |
Окружность талии |
||
|---|---|---|---|
М <94 см Ж <80 см |
М = 94-102 см Ж = 80-88 см |
М >102 см Ж >88 см |
|
25-29,9 |
Нет риска |
Обычный риск |
Высокий риск |
>30 |
Обычный риск |
Высокий риск |
Очень высокий риск |
| Фактор риска* | Определяющий уровень |
|---|---|
Абдоминальное ожирение**(окружность талии) |
|
|
Более 94 см |
|
Более 80 см |
Триглицериды |
Более 1,7 ммоль/л |
Холестерин липопротеидов высокой плотности |
Менее 1,29 ммоль/л |
АД |
130/85 мм рт.ст. |
Глюкоза натощак |
Более 5,6 |
* Диагноз устанавливается, когда присутствуют три фактора риска и более.
** Абдоминальное ожирение более высоко коррелирует с метаболическими факторами риска.
Анамнез
При сборе анамнеза заболевания необходимо обратить внимание на длительность ожирения, максимальную/минимальную массу тела после 18 лет, предшествующее лечение, наследственность (ожирение, АГ, ишемическая болезнь сердца, СД 2-го типа), наличие сопутствующих заболеваний, пищевые привычки, режим питания, энергетическую ценность суточного рациона, процент жиров в суточном рационе, нарушения пищевого поведения.
Физикальное обследование
Физикальный осмотр больного предусматривает измерение антропометрических параметров: массы тела, роста, окружности талии, оценку распределения жировой ткани. При осмотре кожных покровов следует обратить внимание на наличие стрий, участков гиперпигментации кожи, оволосение.
Сердечно-сосудистая система. При сборе анамнеза необходимо оценить, с какого возраста повышается АД, принимает ли пациент гипотензивные препараты и какие; были ли в анамнезе инфаркт миокард, острые нарушения мозгового кровообращения. При измерении АД размер манжеты должен соответствовать размеру предплечья пациента. Перкуссия и аускультация сердца при выраженном ожирении, как правило, затруднены.
Органы дыхания. Оценка состояния органов дыхания направлена на выявление синдрома обструктивных апноэ во сне. При сборе анамнеза необходимо выяснить наличие лор-патологии, храпа и остановок дыхания во сне, утренних головных болей, частых пробуждений от сна, сухости во рту после пробуждения, дневной сонливости. При наличии клинических проявлений синдрома обструктивных апноэ во сне рекомендуют консультацию сомнолога и проведение полисомнографии.
Органы пищеварения. При сборе анамнеза обращают внимание на наличие желчнокаменной болезни, панкреатита, жировой болезни печени, перенесенного вирусного гепатита. Обязательным является определение размеров печени (по Курлову). Пальпацию живота проводят стандартными методами.
Эндокринная система. При сборе анамнеза необходимо выявить наличие родственников, страдающих СД и другими эндокринными нарушениями. Пальпация щитовидной железы у больных с ожирением, как правило, затруднена за счет избыточного отложения жира в области шеи, поэтому при наличии клинических проявлений нарушения функции щитовидной железы рекомендуют определение ТТГ и проведение УЗИ щитовидной железы. Наличие лактореи, гирсутизма, бордовых стрий, андроидного ожирения, гинекомастии требует дополнительного инструментального и гормонального обследования для исключения эндокринных заболеваний и вторичного ожирения.
Половая система. При сборе анамнеза обращают внимание на регулярность менструального цикла, наличие/отсутствие в анамнезе беременностей.
Лабораторные исследования
Лабораторная диагностика необходима для определения состояния липидного, углеводного обмена, функционального состояния печени и дифференциальной диагностики первичного и вторичного ожирения. Всем больным проводят биохимическое исследование крови с определением общего холестерина, липопротеидов высокой плотности, липопротеидов низкой плотности, триглицеридов, глюкозы, аланинаминотрансферазы, аспартатаминотрансферазы, γ-глутамилтрансферазы, мочевой кислоты.
При повышении глюкозы натощак более 5,6 ммоль/л, отягощенном семейном анамнезе по СД, косвенных признаках ИР (acantosis nigritans, гирсутизм, абдоминальный тип ожирения и т.д.) показан стандартный глюкозотолерантный тест.
Обязательные гормональные исследования, проводимые для исключения эндокринных причин ожирения, включают определение уровня ТТГ, пролактина и исключение синдрома гиперкортицизма.
При морбидном ожирении рекомендовано определение уровня общего и ионизированного кальция, а также уровня 25(OH)D и паратиреоидного гормона крови для диагностики дефицита витамина D и исключения вторичного гиперпаратиреоза.
Инструментальные исследования
Обязательным является УЗИ органов брюшной полости, ЭКГ.
По показаниям: УЗИ щитовидной железы, надпочечников, МРТ/КТ надпочечников, гипофиза. Наличие ассоциированных с ожирением заболеваний требует консультации кардиолога, гастроэнтеролога, гинеколога, сомнолога, окулиста.
| Жалобы | Осмотр | Эндокринопатии | Лабораторная диагностика |
|---|---|---|---|
Общая слабость, вялость, сонливость, зябкость, отеки, одышка при нагрузке, нарушение половой функции, запоры |
Одутловатое лицо, утолщенный язык с отпечатками зубов, брадикардия, глухие тоны сердца |
Первичный гипотиреоз |
ТТГ |
Перераспределение подкожной жировой клетчатки, покраснение лица, бордовые стрии, повышение АД, мышечная слабость, нарушение половой функции, головные боли, подавленное настроение |
Андроидное распределение жира, «матронизм», гиперпигментация естественных складок кожи, бордовые стрии, гнойничковые/грибковые поражения кожи, стойкое повышение АД |
Синдром гиперкортицизма |
Экскреция кортизола с суточной мочой, ночной подавляющий тест с 1 мг дексаметазона; определение уровня кортизола в слюне |
Нарушение менструального цикла, аменорея, выделения из сосков у женщин, снижение потенции, либидо, бесплодие, гинекомастия |
Галакторея |
Синдром гиперпролактинемии |
Пролактин, биологически активный пролактин |
Снижение половой функции, бесплодие, увеличение грудных желез, снижение мышечной массы у мужчин |
Евнухоидный тип телосложения, снижение тургора кожи, дряблость мышц, гинекомастия, недоразвитие наружных половых органов |
Синдром гипогонадизма (первичный/ вторичный) |
Тестостерон, ЛГ, ФСГ, эстрадиол, секс-связывающий глобулин, проба с кломифеном |
Нарушение менструального цикла, аменорея, избыточный рост волос на теле у женщин |
Андроидный тип телосложения, гирсутизм, вирилизация |
Синдром ГА |
ЛГ, ФСГ, секс-стероид-связывающий глобулин, тестостерон, 17-ОР, дегидро-эпиандростерон-сульфат |
ЛЕЧЕНИЕ
В основе современного подхода к терапии ожирения лежит признание хронического характера заболевания, невозможности его полного излечения, и, следовательно, необходимости долгосрочного лечения. В настоящее время оптимальным считают постепенное умеренное снижение массы тела (не более чем на 0,5-1 кг в неделю), направленное не столько на улучшение антропометрических показателей, сколько на компенсацию сопутствующих метаболических и гормональных нарушений. Клинически значимым считают 10% снижение массы тела от исходной, причем успешным можно считать только такое лечение, которое приводит к улучшению здоровья пациента в целом. Целевые значения показателей метаболизма: АД ≤130/85 мм рт.ст., гликемия натощак в плазме 5,6 ммоль/л и менее, триглицериды 1,7 ммоль/л и менее, холестерин липопротеидов высокой плотности более 1,03 ммоль/л у мужчин и более 1,29 ммоль/л у женщин, общий холестерин 5,2 ммоль/л и менее.
Весь период лечения делят на два этапа: снижения (3-6 мес) и стабилизации (6-12 мес) массы тела. Именно такая тактика ведения больных ожирением позволяет избежать рецидива сброшенной массы тела. Существуют определенные алгоритмы ведения больных ожирением в зависимости от ИМТ. Оптимальным признан персонализированный подход к терапии больных ожирением. Определяющим в выборе лечения являются степень выраженности ожирения, наличие у пациентов метаболических нарушений и хронических, ассоциированных с ожирением имеющихся заболеваний.
Показания к госпитализации
Госпитализация показана для подбора или коррекции терапии коморбидных заболеваний, хирургического лечения ожирения.
Немедикаментозное лечение
Немедикаментозное лечение ожирения включает в себя диетотерапию, аэробные физические нагрузки и поведенческую терапию.
Диетотерапия
В настоящее время широкое распространение получила рекомендуемая ВОЗ система питания со сниженной калорийностью и ограничением жира до 25-30% от общей калорийности рациона. Расчет калорийности для каждого пациента проводят индивидуально по специальным формулам с учетом пола, возраста и уровня физической активности. Физиологическая суточная потребность энергии (в ккал) для женщин:
При низком уровне физической активности полученный результат необходимо умножить на коэффициент 1, умеренном - на 1,3, высоком - на 1,5. Для снижения массы тела полученную величину уменьшить на 20%. В случае исходного потребления больным 3000 ккал и более в сутки калорийность рациона питания снижать постепенно на 300-500 ккал в неделю до достижения рассчитанной индивидуальной нормы калорий. Не рекомендовано сокращение калорийности суточного рациона у женщин ниже 1200 ккал в сутки. Упрощенная методика расчета энергоемкости суточного рациона:
Рекомендован дробный прием пищи: обязательны завтраки, промежутки между едой - не более 4 ч, последний прием пищи - за 4 ч до сна. Стандартные рекомендации по распределению макронутриентов и некоторых продуктов представлены в табл. 9.6, 9.7.
| Нутриенты/пища | Рекомендации |
|---|---|
Жиры |
Менее 35% от общей калорийности рациона питания |
Белки |
Не более 15% от общей калорийности |
Насыщенные жиры |
Не более 11% от общей калорийности |
Углеводы |
Не более 50% от общей калорийности питания |
Сахар |
Не более 11% от общей калорийности |
Пищевые волокна |
Увеличить до 18 г в день |
Соль |
Не более 6 г в день |
Фрукты/овощи |
Не менее 5 порций в день (500 г) |
| Направления воздействия | Методы коррекции |
|---|---|
Коррекция углеводного обмена |
|
Регулирование массы тела:
|
Диетотерапия, достаточная физическая активность Немедикаментозная терапия:
Медикаментозная терапия (препараты центрального действия):
|
Коррекция липидного обмена (снижение синтеза холестерина и триацил-глицеридов, связывание желчных кислот) |
|
Менопаузальная гормональная терапия (МГТ) |
Для женщин с сохраненной маткой или перенесших оперативное лечение по поводу наружного генитального эндометриоза в качестве прогестагенового компонента - натуральный микронизированный прогестерон, дидрогестерон, дроспиренон |
Лечение ассоциированных заболеваний и осложнений (СД 2-го типа, атеросклероза, гипертонической болезни) |
С учетом выраженности заболевания, возраста, сочетанной патологии |
При составлении индивидуального рациона питания особое внимание нужно обращать на имеющиеся у пациента метаболические нарушения (дислипидемия, гиперурикемия, повышение гликемии). Все изменения в питании вводят постепенно и четко согласуют с больным. Рекомендации будут выполнены пациентом, если они конкретны, немногочисленны, просты и доступны в выполнении, не содержат строгих запретов и ограничений.
Поведенческая терапия
Эффективность участия больного в лечении зависит от мотивации и навыков самоконтроля, поэтому когнитивно-поведенческая терапия (обучение больных) - неотъемлемая часть лечения ожирения.
Терапевтическое обучение проводят по структурированной программе для больных ожирением индивидуально или в группах. При выраженных расстройствах питания и других психопатологических нарушениях рекомендована индивидуальная консультация психолога/психотерапевта.
Физические нагрузки
Обязательной составляющей терапии служит увеличение физической активности: сочетание аэробных и умеренно силовых нагрузок. Всем пациентам рекомендуют ходьбу в аэробном режиме не менее 300 мин в неделю.
Медикаментозное лечение
Фармакологические препараты для лечения ожирения назначаются пациентам с ИМТ более 27 кг/м2 при наличии ассоциированных с ожирением заболеваний и всем больным с ИМТ больше 30 кг/м2 при низкой эффективности немедикаментозного лечения. Лекарственные средства, снижающие массу тела, не назначают детям, беременным и в период лактации, больным старше 65 лет. Лекарственные средства влияют на стиль питания пациента, сопутствующие заболевания и метаболические нарушения. Прежде чем назначить лекарственные средства, необходимо проанализировать пищевые пристрастия больного. Только в этом случае фармакотерапия в комплексе с немедикаментозным лечением даст реальную возможность существенного улучшения результатов лечения больных ожирением.
В настоящее время для фармакотерапии ожирения в России разрешены орлистат (ингибитор кишечной липазы) и сибутрамин (препарат центрального действия, ингибирующий обратный захват моноаминов) в сочетании с микрокристаллической целлюлозой.
Фармакологическое действие сибутрамина состоит в селективном торможении обратного захвата серотонина и норадреналина из синаптической щели в нейронах головного мозга. Вследствие такого двойного механизма действия препарат оказывает влияние на обе стороны энергетического баланса, т.е., усиливая и пролонгируя чувство насыщения, уменьшает поступление энергии за счет снижения количества потребляемой пищи и увеличивает ее расход вследствие усиления термогенеза. Сибутрамин отличается по механизму действия от других препаратов центрального действия тем, что не влияет на допаминергическую систему и потому не вызывает лекарственной зависимости. Основные побочные эффекты препарата - сухость во рту, запоры, отсутствие аппетита, бессонница, повышение АД, учащение сердцебиения - слабо выражены и носят преходящий характер. Сибутрамин в сочетании с микрокристаллической целлюлозой не назначают при беременности и лактации, при тяжелой почечной и печеночной недостаточности, психических заболеваниях, АГ, ишемической болезни сердца и нарушениях ритма сердца, сердечной недостаточности, феохромоцитоме, глаукоме, а также одновременно с ингибиторами моноаминооксидазы и психотропными препаратами. Начальную дозу сибутрамина (10 мг) применяют однократно утром. Если за 4 нед потеря массы тела составляет менее 2 кг, то при хорошей переносимости препарата доза может быть увеличена до 15 мг. Прием препарата прекращают, если за 3 мес лечения масса тела уменьшилась менее чем на 5%, если на фоне приема препарата АД увеличилось более чем на 10 мм рт.ст., пульс участился на 10 ударов в минуту. Длительность приема препарата - не более 12 мес. Лечение сибутрамином помогает больным в формировании правильных привычек питания.
Орлистат оказывает ингибирующее действие на желудочно-кишечные липазы, которые участвуют в гидролизе триглицеридов и необходимы для всасывания жиров в ЖКТ. В результате приема препарата около 30% триглицеридов не всасываются в тонком кишечнике. При этом орлистат не оказывает негативного влияния на другие ферменты (амилазу, трипсин, химотрипсин и фосфолипазы). После отмены препарата его фармакологическое действие быстро прекращается, а активность липазы восстанавливается. Уменьшая всасывание жиров пищи, орлистат снижает поступление энергии, что соответственно приводит к потере массы тела.
Препарат применяют по 1 капсуле с основными приемами пищи, не более 3 раз в день. Длительность приема - не менее 3 мес. Безопасно принимать орлистат в непрерывном режиме в течение 4 лет. Препарат разрешен для лечения ожирения у детей с 12 лет. Противопоказания к приему орлистата: синдром хронической мальабсорбции, холестаз, повышенная чувствительность к препарату или любым другим компонентам, содержащимся в капсуле. Побочные действия ограничиваются симптомами со стороны ЖКТ: маслянистые выделения из заднего прохода, жирный стул, учащение дефекации, позывы на дефекацию, метеоризм. Обычно эти побочные действия слабо выражены, возникают на ранних этапах лечения и корригируются ограничением жиров в рационе.
Хирургическое лечение
Хирургическое лечение показано больным с морбидным ожирением (ИМТ >40), метаболическим синдромом при неэффективности консервативных методов лечения. Применяют следующие виды хирургических вмешательств: рестриктивные операции, связанные с уменьшением объема желудочного резервуара (регулируемое бандажирование желудка, рукавная гастропластика), и шунтирующие операции (желудочное шунтирование, билиопанкреатическое шунтирование). Выбор оперативного вмешательства зависит от выраженности ожирения, сопутствующих заболеваний и пищевого поведения. В течение первого года после хирургического вмешательства избыточная масса тела уменьшается на 50-70% от исходной, причем наиболее интенсивно в первые 6 мес. В дальнейшем наступает стабилизация массы тела. Корригирующие операции - абдоминопластика, липосакция - возможны лишь после стабилизации массы тела.
Реабилитация
Динамическое наблюдение после проведенного курса терапии проводят на протяжении всей жизни пациента. Рекомендуют не менее двух визитов пациента в год при постоянном самоконтроле.
Для коррекции дефицита микро- и макронутриентов пациентам после бариатрических операций необходим постоянный прием витаминов и минералов под контролем клинических и биохимических показателей. Объем и частота мониторинга клинических и биохимических показателей после хирургического лечения ожирения/метаболического синдрома определяются видом бариатрического вмешательства.
СПИСОК ЛИТЕРАТУРЫ
-
Диагностика и лечение ожирения у взрослых. Рекомендации Российской ассоциации эндокринологов / под ред. И.И. Дедова. М., 2010.
-
Лечение морбидного ожирения у взрослых : национальные клинические рекомен дации // Ожирение и метаболизм. 2011. № 3 (28). С. 75-83.
-
Ожирение и избыточный вес // Информационный бюллетень ВОЗ. 2014 май. № 311.
-
Морбидное ожирение / под ред. И.И. Дедова. М.: Медицинское информационное агентство, 2014.
-
Guidelines (2013) for the management of overweight and obesity in adults. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and The Obesity Society Published by The Obesity Society and American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Based on a systematic review from the Obesity Expert Panel, 2013 // Obesity. 2014. Vol. 22, N S2. P. S5-S39.
9.5. Предменструальный синдром
Предменструальный синдром (ПМС) (синдром предменструального напряжения, предменструальная болезнь, циклическая болезнь) - патологический симптомокомплекс, характеризующийся разнообразными психоэмоциональными, соматовегетативными и обменно-эндокринными проявлениями, возникающими за 2-14 дней до менструации и исчезающими сразу после начала менструации или в первые ее дни.
Ключевая характеристика ПМС-симптомы возникают четко в лютеиновую фазу цикла и подвергаются регрессу в течение менструации.
КОД ПО МКБ-10
N94.3 Синдром предменструального напряжения.
ЭПИДЕМИОЛОГИЯ
Частота ПМС вариабельна и зависит от возраста женщины. В возрасте до 30 лет частота ПМС составляет 20%, после 30 лет ПМС встречается примерно у каждой второй женщины. Обычно ПМС страдают женщины детородного возраста, однако нередко его проявления отмечаются сразу с наступлением менархе и иногда усугубляются в период перехода к менопаузе. ПМС чаще наблюдается у эмоционально лабильных женщин астенического телосложения с дефицитом массы тела и у женщин интеллектуального труда.
В общей популяции до 8% женщин страдают от крайне тяжелых симптомов ПМС. В случае резкого нарушения привычного образа жизни, негативного влияния на работоспособность, общее благополучие и социальную активность эти проявления принято определять как «предменструальное дисфорическое расстройство».
ЭТИОЛОГИЯ
К факторам, способствующим возникновению ПМС, относят стрессовые ситуации, нейроинфекции, осложненные роды и аборты, различные травмы и оперативные вмешательства, частую смену климатических зон. Определенную роль играет преморбидный фон, отягощенный различными гинекологическими и экстрагенитальными заболеваниями.
ПАТОГЕНЕЗ
Имеется множество теорий развития ПМС, каждая из которых объясняет патогенез возникновения отдельных симптомов: гормональная, теория «водной интоксикации», психосоматических нарушений, аллергическая и др.
Решающее значение в их генезе имеют гормональные колебания в течение менструального цикла и повышенная чувствительность к прогестерону, а не уровни половых гормонов, которые не отличаются от таковых у здоровых женщин, что, в свою очередь, связано с нарушением функции важнейших нейротрансмиттеров, особенно γ-аминомасляной кислоты и серотонина. Изменение настроения, о котором сообщают некоторые женщины в пери- и в ранней постменопаузе, МГТ в циклическом режиме позволяют предположить, что именно прогестерон, а не эстроген ответственен за стимулирование дисфории.
Уровни серотонина и экспрессия его рецепторов в головном мозге меняются в динамике менструального цикла под модулирующим воздействием половых гормонов. Купирование многих симптомов ПМС/предменструального дисфорического расстройства с помощью селективных ингибиторов обратного захвата серотонина свидетельствует в поддержку участия серотонинергической системы головного мозга в генезе этих нарушений. Активность нейронов ЦНС контролирует γ-аминомасляная кислота за счет своего ингибиторного эффекта, при этом метаболит прогестерона аллопрегнанолон действует как агонист А-рецепторов γ-аминомасляной кислоты, и обычно его уровни у пациенток с ПМС снижаются. Доказано тесное взаимодействие между серотонинергическими и системами γ-аминомасляной кислоты, что служит аргументом в поддержку их сочетанного участия в патогенезе предменструальных расстройств, при этом изменение уровня половых стероидов играет лишь роль триггерного механизма их развития.
В нейровизуализационных исследованиях головного мозга с использованием функциональной МРТ у женщин с предменструальным дисфорическим расстройством обнаружено снижение реактивности миндалины в предменструальный период, что приводит к удлинению времени обработки отрицательных эмоций и укорочению времени обработки положительных эмоций, а также снижению контроля со стороны лимбической системы за выраженностью эмоций.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальная диагностика проводится с предменструальным обострением психиатрического заболевания или соматической патологией, ухудшающей свое течение во вторую фазу менструального цикла.
КЛИНИЧЕСКАЯ КАРТИНА
В зависимости от превалирования тех или иных симптомов в клинической картине выделяют четыре формы ПМС:
Нейропсихическая форма ПМС характеризуется следующими симптомами: эмоциональная лабильность, раздражительность, плаксивость, бессонница, агрессивность, апатия к окружающему, депрессивное состояние, слабость, быстрая утомляемость, обонятельные и слуховые галлюцинации, ослабление памяти, чувство страха, тоска, беспричинный смех или плач, сексуальные нарушения, суицидальные мысли. Помимо нейропсихических реакций, которые выступают на первый план, в клинической картине могут быть другие симптомы: головные боли, головокружения, нарушение аппетита, болезненность молочных желез, вздутие живота.
Отечная форма ПМС отличается превалированием в клинической картине следующих симптомов: отеки лица, голеней, пальцев рук, нагрубание и болезненность молочных желез (мастодиния), кожный зуд, потливость, жажда, прибавка массы тела, нарушение функции ЖКТ (запоры, метеоризм, поносы), боли в суставах, головные боли, раздражительность. У подавляющего большинства больных с отечной формой ПМС во второй фазе цикла отмечается отрицательный диурез с задержкой до 500-700 мл жидкости.
Цефалгическая форма ПМС характеризуется превалированием в клинической картине вегетативно-сосудистой и неврологической симптоматики: головные боли по типу мигрени с тошнотой, рвотой и поносами (типичные проявления гиперпростагландинемии), головокружение, сердцебиение, боли в сердце, бессонница, раздражительность, повышенная чувствительность к запахам, агрессивность. Головная боль имеет специфический характер (дергающая, пульсирующая в области виска с отеком века) и сопровождается тошнотой, рвотой. В анамнезе у этих женщин часто отмечаются нейроинфекции, черепно-мозговые травмы, психические стрессы. Семейный анамнез больных с цефалгической формой ПМС часто отягощен сердечно-сосудистыми заболеваниями, гипертонической болезнью и патологией ЖКТ.
При кризовой форме ПМС в клинической картине преобладают симпатоадреналовые кризы (панические атаки), сопровождающиеся повышением АД, тахикардией, болями в сердце, чувством страха без изменений на ЭКГ. Приступы нередко заканчиваются обильным мочеотделением.
Атипичные формы ПМС: вегетативно-дизовариальная миокардиопатия, гипертермическая, офтальмоплегическая форма мигрени, гиперсомническая форма, «циклические» аллергические реакции (язвенный гингивит, стоматит, бронхиальная астма, иридоциклит).
В зависимости от количества симптомов ПМС, их длительности и выраженности выделяют легкую и тяжелую форму ПМС:
Нарушение трудоспособности независимо от количества и длительности симптомов свидетельствует о тяжелом течении ПМС и часто сочетается с нейропсихической формой.
ДИАГНОСТИКА
Диагностика представляет определенные трудности, так как больные часто обращаются к терапевту, неврологу или другим специалистам в зависимости от формы ПМС. Для диагностики ПМС важен сбор анамнеза, при котором выявляется циклический характер описанных симптомов.
Клинико-диагностические критерии предменструального синдрома
Диагноз устанавливается при наличии не менее пяти из следующих симптомов при обязательном проявлении одного из первых четырех.
Рекомендовано ведение дневника в течение не менее двух-трех менструальных циклов, в котором пациентка отмечает все симптомы и время их появления. Ежедневная выраженность симптомов в дневниках отмечается в баллах: рекомендуется использовать шкалу тяжести проявлений симптомов от 0 до 10 или эквивалент такой шкалы, где 0 - отсутствие симптомов, 1-3 - незначительные проявления, 4-6 - умеренные проявления, 7-10 - тяжелые симптомы, вызывающие обеспокоенность ими и/или их влиянием на повседневную жизнь.
Лабораторные и инструментальные исследования
Гормональная характеристика больных ПМС зависит от его формы. При отечной форме отмечено достоверное уменьшение уровня прогестерона во второй фазе цикла. При нейропсихической, цефалгической и кризовой форме - повышение уровня пролактина в крови во второй фазе цикла в сравнении с первой.
Дополнительные методы обследования назначают также в зависимости от формы ПМС.
При выраженных церебральных симптомах (головные боли, головокружение, шум в ушах, нарушение зрения) для исключения объемных образований показана КТ или МРТ.
Электроэнцефалография женщин с нейропсихической формой ПМС регистрирует функциональные нарушения преимущественно в диэнцефально-лимбических структурах мозга. При отечной форме ПМС данные электроэнцефалографии свидетельствуют об усилении активирующих влияний на кору больших полушарий неспецифических структур ствола мозга, более выраженных во второй фазе цикла. При цефалгической форме на электроэнцефалограмме выявляют диффузные изменения электрической активности мозга по типу десинхронизации корковой ритмики, которая усиливается при кризовом течении ПМС.
При отечной форме ПМС показано измерение диуреза, исследование выделительной функции почек.
При болезненности и отечности молочных желез проводится УЗИ молочных желез и маммография в первую фазу цикла для исключения патологии молочных желез.
К обследованию больных с ПМС привлекаются смежные специалисты: невролог, психиатр, терапевт, эндокринолог.
ЛЕЧЕНИЕ
Нефармакологическая (поведенческая) терапия
Образ жизни
Диета - сокращение потребления углеводов с высоким гликемическим индексом, соли, кофеина и алкоголя, хотя доказательные данные на этот счет пока отсутствуют. Очень важно, чтобы питание было полноценным, сбалансированным и включало все необходимые витамины и нутриенты. Значимую роль в функционировании нервной системы играют фолаты, участвующие в важных механизмах трансметилирования в ЦНС (в цикле однокарбоновых кислот), а значит, в метаболизме важнейших нейротрансмиттеров (серотонина, дофамина и норадреналина). Кроме того, они принимают участие в обмене жирных кислот в мембранах нейронов и клеток нейроглии.
Методы снятия напряжения и релаксации - аэробные физические упражнения по 20-30 мин не менее 3 раз в неделю, занятия йогой и другое могут снижать проявления ПМС, как полагают, за счет повышения уровня эндорфинов, уменьшающегося в лютеиновую фазу цикла.
Медикаментозное лечение
ПМС включает психотропные и гормональные средства.
При легких формах ПМС назначают растительные препараты: экстракт Vitex agnus castus является единственным растительным лекарственным средством, которое продемонстрировало положительное влияние на такие симптомы, как раздражительность и лабильность настроения в плацебо-контролируемых исследованиях.
При умеренных и тяжелых формах ПМС следует использовать более эффективные методы фармакологического воздействия. Два основных метода лечения умеренного/тяжелого ПМС включают воздействие:
Антидепрессанты
Патогенетические методы лечения ПМС и особенно предменструального дисфорического расстройства включают применение современных антидепрессантов, к которым относятся препараты класса селективных ингибиторов обратного захвата серотонина, обладающих тимоаналептическим эффектом (снятие тревоги, напряжения, улучшение настроения и общего психического самочувствия). Рекомендуется применять селективные ингибиторы обратного захвата серотонина в непрерывном режиме, так как их терапевтическое действие начинается только с 3-й недели терапии.
Гормональное лечение
Цель гормональной терапии при ПМС/предменструальном дисфорическом расстройстве состоит не в коррекции гормональных нарушений, а в прерывании нормальной циклической активности гипоталамо-гипофизарно-яичниковой системы, являющейся триггером этих симптомов. Наиболее широкое распространение для лечения предменструальных расстройств различного характера получили КОК.
Преимуществом в лечении обладают КОК, содержащие прогестаген четвертого поколения дроспиренон. У пациенток с ПМС к 6-му месяцу лечения ЭЭ 20 мкг + дроспиреноном 3 мг отмечается значимое улучшение таких симптомов, как лабильное настроение, задержка жидкости и изменение аппетита.
Преимущества непрерывного режима приема КОК перед циклическим режимом. Получены убедительные данные о положительных эффектах дроспиренонсодержащих КОК на возникающие в циклическом режиме отеки, масталгию, эмоциональные и поведенческие расстройства, ухудшение состояния кожи. Применение дроспиренонсодержащих КОК в пролонгированном режиме не приводит к существенному изменению фармакокинетики его компонентов или ухудшению переносимости препарата. Использование КОК в пролонгированном режиме значимо улучшает настроение, снимает головную боль или боли в животе и при этом бывает связано с надежным контрацептивным эффектом и меньшим числом дней кровотечения/мажущих выделений по сравнению с традиционным режимом приема.
ПРОГНОЗ
Благоприятный в случае правильной коррекции симптомов ПМС.
СПИСОК ЛИТЕРАТУРЫ
-
Руководство по амбулаторно-поликлинической помощи в акушерстве и гинекологии / под ред. В.Н. Серова, Г.Т. Сухих, В.Н. Прилепской, В.Е. Радзинского, 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2016. 1136 c.
-
Акушерство. Гинекология. Бесплодный брак. Клиническая фармакология / под ред. В.Е. Радзинского, Р.Н. Аляутдина. М.: ГЭОТАР-Медиа, 2016. 672 c.
-
Гинекология: учебник / под ред. В.Е. Радзинского, А.М. Фукса. М.: ГЭОТАР-Медиа, 2016. 1000 c.
-
Кузнецова И.В., Ипастова И.И. Контрацепция в старшем репродуктивном возрасте. Клинические выгоды комбинированной гормональной контрацепции у женщин старше 35 лет / под ред. В.Е. Радзинского // Информационный бюллетень, 2016. - М.: Status Praesens. 24 с.
-
Lazarou C., Kapsou M. The role of folic acid in prevention and treatment of depression: An overview of existing evidence and implications for practice // Complement. Ther. Clin. Pract. 2010. Vol. 16. P. 161-166.
-
Brown J., et al. Selective serotonin reuptake inhibitors for premenstrual syndrome (Review) // Cochrane Database Syst. Rev. 2009. Vol. 2. CD001396.
9.6. Синдром после тотальной овариоэктомии
Синдром после тотальной овариоэктомии развивается у пациенток после тотальной овариоэктомии, проявляются нейровегетативными, психоэмоциональными и обменно-эндокринными нарушениями.
Синонимы: посткастрационный синдром, синдром хирургической (индуцированной) менопаузы.
КОД ПО МКБ-10
N95.3 Состояния, связанные с искусственно вызванной постменопаузой.
ЭПИДЕМИОЛОГИЯ
Гистерэктомию с удалением придатков матки выполняют достаточно часто. Среди полостных операций ее доля равна в Великобритании 25%, в США - 35%. Частота развития синдрома после тотальной овариэктомии составляет 70-80% и варьирует от 55 до 100% в зависимости от возраста пациентки к моменту операции. У одной четверти женщин отмечается длительное и тяжелое течение синдрома. Овариоэктомия, произведенная в период естественной возрастной инволюции, усугубляет биологическую трансформацию организма и может приводить к срыву защитно-приспособительных механизмов и тяжелому течению заболевания, развивается у женщин, оперированных в период менопаузального перехода, имеющих СД, нарушения функции щитовидной железы. Удаление яичников снижает риск РЯ (на 80-90%) и РМЖ (на 50-60%). Получены доказательства разнообразных неблагоприятных долгосрочных последствий такого вмешательства: повышение риска общей смертности (28%), рака легких (45%), ишемической болезни сердца (33%), инсульта (62%), когнитивных нарушений (60%), паркинсонизма (80%), психиатрических проявлений (50-130%), остеопороза и связанных с ним переломов (50%), сексуальной дисфункции (40-110%).
КЛАССИФИКАЦИЯ
В зависимости от степени выраженности клинических проявлений выделяют легкую, среднюю и тяжелую степень течения симптомокомплекса после тотальной овариэктомии.
ЭТИОЛОГИЯ
При синдроме после тотальной овариэктомии пусковым этиологическим фактором является остро возникающий дефицит половых гормонов - эстрогенов, прогестерона и андрогенов в результате удаления функционирующих яичников. Гипоэстрогения, прекращение секреции ингибина приводят к прогрессирующему увеличению секреции ФСГ и ЛГ гипофизом, нарушению работы органов-мишеней половых гормонов, имеющих эстрогеновые рецепторы, и развитию атрофических изменений в эстрогензависимых тканях.
ПАТОГЕНЕЗ
Яичники секретируют половые стероиды как в пременопаузе (эстрогены, прогестерон и тестостерон), так и в постменопаузе (тестостерон, андростендион и дегидроэпиандростерон), преобразующиеся в эстрогены в жировой ткани. Существует три вида эстрогенных гормонов: 17b-эстрадиол, эстрон и эстриол.
Хирургическое выключение яичников в детородном возрасте сопровождается, помимо необратимой утраты репродуктивной функции, сложными реакциями нейроэндокринной системы, характеризующими процесс адаптации женского организма к новым условиям.
Удаление яичников ведет к резкому снижению уровня наиболее биологически активного эстрогена 17b-эстрадиола, и уже в первые недели после операции он может снижаться до следовых значений. В ответ на выключение обратной связи между гонадотропинамии эстрадиолом закономерно повышается (в 10-15 раз) уровень гонадотропинов, и прежде всего ФСГ. Основным эстрогеном, циркулирующим в крови оперированных женщин, становится эстрон. Эстрон накапливается за счет периферической конверсии (происходящей в печени, жировой ткани, коже) андростендиона, образующегося в коре надпочечников. В жировой ткани эти процессы могут усиливаться за счет увеличения активности ароматазы жировых клеток повышенным уровнем ФСГ. Овариэктомия приводит к снижению уровня циркулирующего тестостерона через 24-48 ч после операции у большинства женщин за счет исключения яичниковой фракции тестостерона и его предшественника андростендиона.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ СИНДРОМА ПОСТОВАРИОЭКТОМИИ
Синдром, развивающийся после овариоэктомии, характеризуется вегетативно-сосудистыми, эмоционально-психическими и обменно-эндокринными нарушениями.
Время появления и выраженность симптомов могут быть подвержены значительным индивидуальным колебаниям, но в то же время существует определенная хронологическая последовательность их проявления. У 60-85% пациенток возникают вегетативно-сосудистые симптомы, такие как приливы жара к голове и верхней части туловища, усиление потоотделения, особенно по ночам, приступы сердцебиения в покое, головокружение, спазм периферических сосудов (головные боли, онемение конечностей), в первые недели после операции. Тяжесть состояния пациенток определяется количеством и интенсивностью приливов. Для оценки степени тяжести этих симптомов используется менопаузальный индекс Купермана, а также шкала Грина.
Эмоционально-психические нарушения проявляются в виде эмоциональной лабильности, раздражительности и утомляемости, плаксивости, депрессии, нарушений сна, снижения или полной утраты либидо, ослабления памяти, рассеянности и ослабления познавательной функции у двух третей женщин. Хирургическая менопауза является серьезным психотравмирующим фактором для большинства пациенток, усугубляющим течение депрессии. Прекращение самостоятельных менструаций, необратимая утрата репродуктивной функции означает для многих женщин, помимо потери женской привлекательности и преждевременного увядания, крах всей жизни, потерю ее смысла. Частота депрессивных нарушений у женщин с синдромом постовариэктомии (синдромом после тотальной овариэктомии) составляет 30-40%.
Важную роль в патогенезе депрессии играют возникающие на фоне гипоэстрогении нарушения обмена моноаминов - снижается активность моноаминооксидазы и катехол-0-метилтрансферазы; нарушается (снижается) обмен серотонина и допамина. Снижется активность ацетилхолинсинтетазы, что является важным фактором функции памяти. У 30-50% оперированных женщин выявляются нарушения памяти, способности концентрировать внимание, существенно снижается познавательная функция. Продолжительность синдрома после тотальной овариэктомии может колебаться в значительных пределах. У 19,5% пациенток вегетососудистые симптомы имели тенденцию к обратному развитию в течение первого года после операции. У большинства женщин эти симптомы сохранялись в течение 3-5 лет и более, с весенне-осенними обострениями течения заболевания. Тяжелое течение заболевания отмечается почти у 60% пациенток, у каждой четвертой женщины (26%) его проявления носят умеренный характер и лишь у 14% имеет место легкое течение синдрома постовариэктомии. Безусловно, на тяжесть проявлений синдрома постовариэктомии влияет объем произведенного вмешательства, а также наличие сопутствующих психосоматических заболеваний. Стойкое нарушение трудоспособности, как последствие операции, возникает у 25% женщин.
Дефицит эстрогенов является причиной атрофических изменений в мочеполовой системе, которые развиваются через несколько лет после операции у 40-60% пациенток. Появляется сухость во влагалище, часто сопровождающаяся зудом и жжением. Диспареуния в сочетании со снижением или утратой либидо ведут к сексуальной дисгармонии, а у некоторых к невозможности половой жизни.
Атрофический вагинит, рецидивирующие цистоуретриты, недержание мочи, учащение мочеиспускания, никтурия крайне отрицательно сказываются на качестве жизни пациенток.
Гипоэстрогения ведет к снижению синтеза коллагена в соединительной ткани, дефицит тестостерона угнетает пролиферацию фибробластов. Кожа становится более тонкой, сухой, снижается ее тургор, появляются морщины, может усиливаться сухость и ломкость волос, ногтей.
К неспецифическим симптомам, возникающим после овариэктомии, относятся боли в суставах и мышцах, атрофические конъюнктивиты, фарингиты, ксеростомия (возможно связанная с изменением состава слюны), раннее развитие глаукомы.
Снижение эстрогенных влияний приводит к развитию атерогенных изменений в липидном спектре крови - повышению уровня липопротеинов низкой плотности и особенно липопротеина, триглицеридов, снижению уровня липопротеидов высокой плотности.
В условиях выраженного дефицита эстрогенов нарушается благоприятный эффект последних на биохимические процессы в эндотелии кровеносных сосудов, что способствует снижению секреции простациклина, оксида азота и увеличению синтеза эндотелина-1 и тромбоксана. В результате возрастает резистентность стенок артериальных сосудов кровотоку и появляется склонность к развитию микроциркуляторных изменений.
На фоне дефицита эстрогенов после овариэктомии может изменяться толерантность к глюкозе и развиваться ИР.
Нарушения в системе гемостаза проявляются в повышении уровня фибриногена и снижении фибринолитической активности крови.
За первые 5 лет после операции женщина может потерять до 20-25% костной массы. Установлено, что риск переломов удваивается при снижении костной массы на каждые 10%.
Овариэктомия является существенным фактором риска развития остеопороза, особенно если операция производится в молодом возрасте, когда еще не успела сформироваться пиковая масса кости.
ДИАГНОСТИКА
Жалобы и анамнез
В анамнезе пациенток имеется оперативное вмешательство на придатках матки. Диагностика ранних проявлений постовариэктомии основана на выявлении вегетативно-сосудистых и нейропсихических нарушений, появляющихся в течение первых недель/месяцев после оперативного вмешательства и отсутствовавших до операции. Пациентки предъявляют жалобы на приливы жара, которые могут сопровождаться потливостью, чаще ночью, приступы сердцебиения в покое, парестезии и ознобы, головные боли. Женщины часто жалуются на эмоциональную лабильность, нарушение сна и концентрации внимания, чувство тревоги, депрессивное настроение, снижение/утрату либидо, быструю утомляемость. Выраженность степени тяжести нейровегетативных и психоэмоциональных симптомов оценивают по менопаузальному индексу Купермана или по шкале Грина. Выделяют легкую, среднюю и тяжелую степень течения синдрома постовариэктомии.
| 1. Обязательные исследования | 2. Общее обследование |
|---|---|
Уточнение личного и семейного анамнеза:
|
|
Условные исследования (при соответствующих данных анамнеза):
ЛЕЧЕНИЕ
Заместительная гормонотерапия
Заместительная терапия препаратами половых гормонов является наиболее патогенетически обоснованной. Заместительная терапия эстрогенами (ЗГТ) [этот термин более, чем менопаузальная гормонотерапия (МГТ), подходит для молодых женщин] снижает риск развития отсеопороза и переломов, хотя не может полностью защитить женщину от повышения риска паркинсонизма, глаукомы, расстройств настроения и сексуальной дисфункции.
Назначение ЗГТ сразу после операции способствует более плавной адаптации организма женщины к условиям остро возникающего дефицита половых стероидов и предупреждает развитие синдрома постовариэктомии. Решение вопроса о пользе и риске ЗГТ в каждом конкретном случае должно приниматься с учетом не только уже появившихся симптомов, но и факторов риска возникновения других системных нарушений и противопоказаний.
Дискуссионным остается вопрос об оптимальной длительности проводимой терапии. Считается, что после овариэктомии минимальный срок назначения ЗГТ составляет 5-7 лет. Выбор режима и длительности терапии зависит от возраста женщины на момент оперативного вмешательства, срока, прошедшего после операции, наличия клинических проявлений, обусловленных дефицитом половых гормонов, факторов риска, данных осмотра и инструментальных методов исследования. При необходимости проводят цитологическое исследование влагалищного эпителия, функциональные исследования сердечно-сосудистой системы.
Принципы ЗГТ после овариэктомии аналогичны таковым в менопаузе: применение только препаратов натуральных эстрогенов с использованием наиболее низкого, но обязательно адекватного дозового режима, обеспечивающего отсутствие пролиферативного влияния эстрогенов на эндометрий и молочные железы.
Сочетание эстрогенов с прогестагенами или андрогенами позволяет исключить гиперпластические процессы в эндометрии.
Путь введения препарата подбирается индивидуально. Существуют пероральный и парентеральный (трансдермальный, подкожный) пути введения эстрогенов.
Трансдермальный путь введения эстрогенов применяется с целью минимизации побочных эффектов. Гормональные препараты назначаются в виде пластыря или геля.
Доза вводимого эстрогена зависит от возраста и индивидуальной чувствительности.
Монотерапия эстрогенами рекомендуется женщинам, у которых объем оперативного вмешательства, помимо удаления яичников, включал также и гистерэктомию. Как правило, ЗГТ эстрогенами назначается непрерывно либо прерывистыми курсами по 3-4 нед с 5-7-дневными перерывами.
При урогенитальных расстройствах используется эстрогенный препарат эстриол (овестин), выпускающийся в таблетках, свечах и мазях, а также комбинация эстриола, микродозы прогестерона и лактобактерий штамма Ler 35 (триожиналь).
В репродуктивном возрасте и перименопаузе предпочтителен выбор препаратов для ЗГТ с последовательным включением прогестагенов (в течение 10-14 дней) в циклическом режиме для поддержания регулярных циклов.
С целью профилактики сердечно-сосудистых заболеваний у пациенток с исходно нормальным содержанием тестостерона в сыворотке крови предпочтительно использовать двухфазные препараты, содержащие в качестве прогестагена производные прогестерона - ципротерона ацетат (климен), медроксипрогенстерона ацетат (дивина), дидрогестерон (фемостон), комбинацию микронизированного прогестерона (утрожестан) и трансдермального эстрадиола.
Для профилактики и терапии остеопороза при исходно низком уровне тестостерона применяются препараты, содержащие в своем составе прогестагены - производные 19-нортестостерона: норгестрел (циклопрогинова), ЛНГ (климонорм).
При оперативном вмешательстве по поводу распространенных форм эндометриоза, даже при отсутствии матки, назначаются препараты, содержащие эстрогены и гестагены, так как невозможно полностью быть уверенным в отсутствии очагов эндометриоза.
С удалением яичников исчезает важный источник синтеза андрогенов. Андрогены играют важную роль в сохранении и поддержании сексуальной функции, психического и физического здоровья, оказывают анаболический эффект на костную ткань. На фоне ЗГТ андрогенами отмечено восстановление либидо, устранение депрессии, улучшение памяти, настроения, повышение мышечного тонуса, работоспособности, увеличение МПК. Благоприятный эффект на МПК при добавлении андрогена к ЗГТ более выражен за счет анаболического действия тестостерона на костную ткань.
Особенности гормональной терапии у носительниц мутаций BRCA. Некоторые носительницы генных мутаций BRCA откладывают снижающую риски двустороннюю сальпингоовариэктомию или вообще отказываются от нее из-за сомнений в отношении безопасности системной гормональной терапии, которая может потребоваться после такого вмешательства. Доступны данные наблюдательных исследований, свидетельствующие о безопасности такого лечения для носительниц мутации BRCA после двусторонней овариоэктомии.
Женщины - носительницы генных мутаций с неблагоприятным семейным анамнезом, не имеющие онкологического заболевания на данный момент времени, с наличием вазомоторных симптомов после двусторонней овариоэктомии или двусторонней сальпингоовариоэктомии, опасающиеся использовать гормональную терапию и в связи с отсутствием четких рекомендаций на этот счет, могут применять негормональные методы лечения.
Клинические рекомендации для женщин с генными мутациями BRCA в постменопаузе. Существующие, хотя ограниченные данные указывают на то, что риски РМЖ не повышаются при использовании системной гормональной терапии в постменопаузе у женщин, являющихся носительницами мутации BRCA с интактными молочными железами. Молодые женщины с интактными молочными железами или после операции на молочной железе не должны откладывать или избегать снижающей риск двусторонней сальпингоовариоэктомии из-за опасений, что последующее использование системной гормональной терапии увеличит риск РМЖ. В таких случаях можно применять негормональные методы лечения.
ПРОГНОЗ
Благоприятный при условии возможности длительного использования ЗГТ. ЗГТ также снижает риск развития остеопороза и переломов, хотя не может полностью защитить женщину от повышения риска паркинсонизма, глаукомы, расстройств настроения и сексуальной дисфункции.
ПРОФИЛАКТИКА
СПИСОК ЛИТЕРАТУРЫ
-
Смирнова Т.В., Бриль Ю.А. Фитоэстрогены и онкопрофилактика. Протективное действие изофлавонов на молочную железу / под ред. В.Е. Радзинского // Информационный бюллетень, 2016. М.: Status Praesens. 16 с.
-
Руководство по амбулаторно-поликлинической помощи в акушерстве и гинекологии / под ред. В.Н. Серова, Г.Т. Сухих, В.Н. Прилепской, В.Е. Радзинского, 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2016. 1136 c.
-
Акушерство. Гинекология. Бесплодный брак. Клиническая фармакология / под ред. В.Е. Радзинского, Р.Н. Аляутдина. М.: ГЭОТАР-Медиа, 2016. 672 c.
-
Гинекология: учебник / под ред. Г.М. Савельевой, Г.Т., Сухих, И.Б. Манухина. М.: ГЭОТАР-Медиа, 2013. 704 с.
-
Клинические рекомендации (протокол лечения) «Менопаузальная гормонотерапия и сохранение здоровья женщин зрелого возраста»/ под ред. В.П. Сметник. М., 2015.
-
ACOG Committee Opinion. N 620, Jan2015. Salpingectomy for ovarian cancer preven tion // Obstet. Gynecol. 2015. Vol. 125, N 1. P. 279-281.
-
Duan L., Xu X., Koebnick C., Lacey J.V. et al. Bilateral oophorectomy is not associated with increased mortality: the California Teachers Study // Fertil. Steril. 2012 Jan. Vol. 97, N 1. P. 111-117.
-
Karp N.E., Fenner D.E., Burgunder-Zdravkovski L., Morgan D.M. Removal of normal ovaries in women under age 51 at the time of hysterectomy // Am. J. Obstet. Gynecol. 2015. Vol. 213, N 5. P. 716.e1-e6.
-
Llaneza P., Perez-Lopez F.R. Rethinking elective bilateral oophorectomy at the time of hysterectomy for benign disease // Maturitas. 2013. Vol. 76. P. 109-110.
-
Harmanli O. Save the ovaries in reproductive years… and maybe the uterus, too?// Menopause. 2014. Vol. 21. P. 561-562.
-
Harmanli O., Shinnick J., Jones K., St Marie P. Obstetrician-gynecologists' opinions on elective bilateral oophorectomy at the time of hysterectomy in the United States: a nationwide survey // Menopause. 2014. Vol. 21. P. 355-360.
-
Moen M.H., Rees M., Marc Brincat М., Marco Gambacciani М. et al. EMAS position statement: Managing the menopause in women with a past history of endometriosis // Maturitas. 2010. Vol. 67, N 1. P. 94-97.
-
Stuenkel C.A., Davis S.R., Gompel A. et al. Treatment of symptoms of the menopause: An Endocrine Society Clinical Practice Guideline // J. Clin. Endocrinol. Metab. 2015. Vol. 100. P. 3975-4011.
-
The ESHRE Guideline Group on POI, Webber L., Davies M., Anderson R. et al. ESHRE Guideline: management of women with premature ovarian insufficiency // Hum. Reprod. 2016. Vol. 31, N 5. P. 926-937.
-
Practice Bulletin ACOG N 141: Management of Menopausal Symptoms // Obstet. Gynecol. 2014. Vol. 123. P. 202-216.
-
Wright J., Herzog T., Tsui J. et al. Nationwide trends in the performance of inpatient hysterectomy in the United States // Obstet. Gynecol. 2013. Vol. 122. P. 233-241.
-
de Villiers T.J., Hall J.E., Pinkerton J.V. et al. Revised global consensus statement on menopausal hormone therapy // Climacteric. 2016. Vol. 19, N 4. P. 313-315.
-
URL: https://www.nice.org.uk/guidance/ng23/resources/menopause-diagnosis-and-management-1837330217413.
9.7. Постгистерэктомический синдром
Постгистерэктомический синдром (ПГС) - клинический симптомокомплекс, развивающийся после удаления матки с сохранением яичника/яичников или эндометрэктомии.
КОД ПО МКБ-10
N95.3 Состояния, связанные с искусственно вызванной постменопаузой.
Выделяют синдром после искусственной менопаузы, обусловленный:
16.20.009 эндометрэктомией (абляция эндометрия);
16.20.010 субтотальной брюшной гистерэктомией;
16.20.011 тотальной брюшной гистерэктомией;
16.20.012 влагалищной гистерэктомией;
16.20.013 радикальной (с придатками) брюшной гистерэктомией;
16.20.014 радикальной влагалищной гистерэктомией.
ЭПИДЕМИОЛОГИЯ
В России частота ГЭ варьирует от 32,5 до 38,2%. Средний возраст, при котором выполняются подобные оперативные вмешательства, - 42-43 года.
Частота развития ПГС составляет 20-40% и зависит от возраста, в котором выполнена операция, объема оперативного лечения, преморбидного фона, характера сопутствующей патологии и особенностей кровоснабжения яичников. В случае радикальной гистерэктомии синдром развивается у 60-80% оперированных, при сохранении яичников - у 30 -50% женщин.
При транзиторном течении ПГС симптомы купируются в течение 1 года после операции. У части больных симптомы сохраняются и отмечается преждевременная недостаточность функции яичников.
КЛАССИФИКАЦИЯ
Выделяют ранние и поздние проявления ПГС. В случае радикальной гистерэктомии ранние проявления диагностируются в первые дни после операции. При субтотальной и тотальной гистерэктомии, а также в случае эндометрэктомии симптомы развиваются в течение первого года. По длительности проявлений различают транзиторный и стойкий ПГС. Транзиторную форму характеризуют восстановление овариальной функции в сроки от 1 мес до 1 года. Стойкий ПГС длится более года с момента операции. По степени выраженности клинических проявлений определяют легкую, среднюю и тяжелую степень ПГС.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Кровоснабжение яичников в основном осуществляется из ветвей маточных артерий. После гистерэктомии из-за перевязки обеих маточных артерий приток артериальной крови к яичникам уменьшается приблизительно на 50%. Редукция кровотока обусловливает снижение овариальной перфузии, ишемию и дегенеративно-дистрофические процессы в яичниках с нарушением их гормональной активности. На фоне гипоэстрогении изменяется выработка нейротрансмиттеров, что приводит к патологической перестройке регуляции всех систем, и в первую очередь сердечно-сосудистой. Известно также о собственной эндокринной активности матки, которая оказывает влияние на содержание различных биологически активных веществ (простагландины, кинины), воздействующих как на центральные регуляторные механизмы, так и непосредственно на яичники.
КЛИНИЧЕСКАЯ КАРТИНА
ПГС характеризуется нейровегетативными, психоэмоциональными и обменно-эндокринными проявлениями. ПГС манифестирует с нейровегетативными (сердцебиение, кардиалгии, повышенная потливость, приливы, головная боль) и психоэмоциональными нарушениями (повышенная утомляемость, снижение толерантности к физическим нагрузкам, ухудшение памяти и сна, эмоциональная неустойчивость, шум в ушах, депрессия).
Отмечено появление синдрома вегетативной дистонии, что проявляется кризовыми подъемами АД, тахи- и брадикардией, приступами удушья, метеолабильностью.
У пациенток, перенесших гистерэктомию, сексуальная активность может сохраняться в силу неутраченной способности к продукции андрогенов надпочечниками в интракринных тканях из предшественников тестостерона, а также благодаря «сексуальной памяти», которая является важной доминантой в либидо у женщин. В целом гистерэктомия не ухудшает показатели сексуальной функции пациенток.
Среди отдаленных последствий гистерэктомии наиболее значимы полисимптомные обменно-эндокринные расстройства, которые проявляются патологической прибавкой массы тела, болями в костях и суставах, сухостью кожных покровов, нарушением коагуляционного и агрегационного гомеостаза, изменением функции щитовидной железы, атрофией половых органов, остеопорозом. ГЭ, даже с сохранением яичников, произведенная до возраста естественной менопаузы, ассоциируется с трехкратным увеличением коронарной болезни сердца. Недостаточность эстрогенов, возникающая у большого числа женщин после ГЭ, приводит к ИР и нарушению толерантности к глюкозе.
ДИАГНОСТИКА
С целью выявления нейровегетативных, психоэмоциональных и обменно-эндокринных расстройств проводится анкетирование для оценки менопаузального индекса Купермана. На основании подсчета индекса выделяют легкую, среднюю и тяжелую степень течения ПГС. При физикальном обследовании определяют ИМТ, соотношение окружности талии/окружности бедер, уровень АД.
В случае ранее выполненной эндометрэктомии, субтотальной гистерэктомии с целью исключения патологии шейки матки проводят цитологическое исследование мазков с поверхности шейки матки (по программе цитологического скрининга). УЗИ органов малого таза необходимо для динамического контроля состояния яичников (ежегодно).
Для оценки показателей углеводного обмена определяют концентрацию глюкозы, инсулина, С-пептида. Оптимально проведение глюкозотолерантного теста. Уровни мочевой кислоты, липидный спектр и показатели углеводного обмена помогают в диагностике метаболического синдрома.
Установить выраженность функциональных изменений яичников возможно при определении уровня эстрадиола, ФСГ, В-ингибина и АМГ. Выраженное снижение показателей АМГ и эстрадиола, повышение значений ФСГ, соответствующих менопаузальным, свидетельствуют о стойком снижении овариальной функции.
ЛЕЧЕНИЕ
-
Физиотерапия (при отсутствии противопоказаний): гальванизация шейно-лицевой области, электрофорез новокаина на область верхних шейных симпатических ганглиев, массаж воротниковой зоны, крайне высокочастотная терапия, бальнеотерапия (доказательная база отсутствует или слабая). Оптимально проведение лечения в первые 1,5 года после операции.
-
Фитотерапия и гомеопатическая терапия (доказательная база отсутствует или слабая). За счет способности связываться с рецепторами эстрогенов гипоталамических нейронов хороший эффект оказывают препараты растительного происхождения, обладающие эстрогеноподобным действием, такие как климадинон (30 капель x 2 раза в сутки), климактоплан (1 таблетка x 2 раза в сутки).
-
Патогенетически обоснованным методом коррекции нарушений синдрома после искусственной менопаузы является МГТ, которая представляет собой основной метод коррекции ПГС у женщин позднего репродуктивного возраста (уровень доказательности 1, категория А). Следует оценивать состояние эндокринной системы женщины спустя как минимум 3 мес с момента операции, так как хирургическое вмешательство на органах малого таза может способствовать транзиторному повышению уровня ФСГ. Однократная оценка уровня ФСГ или эстрадиола может оказаться неоднозначной или сопряженной с ложными результатами. Подтверждение наличия дефицита эстрогенов на основании определения уровня ФСГ, эстрадиола, АМГ и В-ингибина является показанием к назначению эстрогензамещающей терапии.
-
До среднего возраста наступления менопаузы (51 год). После тотальной гистерэктомии показано применение монотерапии эстрогенами с использованием трансдермальных систем в виде гелей или пластыря. При трансдермальном способе применения эстрадиола уменьшается выраженность колебаний концентрации эстрадиола в плазме крови, а метаболизм и выведение его при этом соответствует биотрансформации и выведению естественных эстрогенов, что практически исключает активацию синтеза факторов прокоагуляции и изменение тромбогенного потенциала крови. В случае субтотальной гистерэктомии, ввиду возможного сохранения участков эндометрия в оставшейся культе и для профилактики развития РЭ, а также при некоторых состояниях женщинам с тотальной гистерэктомией предпочтительней комбинированный режим МГТ, например при аденокарциноме I стадии в анамнезе, распространенном эндометриозе с целью предупреждения активации возможно сохранившихся эндометриоидных гетеротопий или их малигнизации. Комбинированные препараты МГТ рекомендуют в случае выраженного остеопороза, поскольку гестагены, в частности норэтистерон, оказывают влияние на процессы формации костной ткани. Комбинированные препараты, содержащие гестагены с андрогенной активностью (медроксипрогестерона ацетат, норэтистерон), могут использоваться для восполнения андрогенного дефицита, приводящего к снижению сексуального влечения, резко выраженным психоэмоциональным расстройствам. Оценку эффективности проводимой терапии проводят через 1-3 мес, далее через 1 год. При повторном осмотре отмечают изменения жалоб, данных физикального и гинекологического осмотра, особенностей ММИ, изменение ИМТ, АД, показателей липидного и углеводного обмена. По показаниям проводят денситометрию. Женщинам, получающим препараты МГТ, ежегодно проводят стандартное обследование.
ПРОФИЛАКТИКА
После операции для профилактики развития ПГС рекомендуют проведение утренней гимнастики, лечебный массаж, бальнеотерапию (ванны хвойные, шалфейные, жемчужные, кислородные, радоновые), санаторно-курортное лечение. В рационе питания должны преобладать фрукты и овощи, жиры растительного происхождения, необходимо ограничение углеводов. С целью профилактики развития синдрома возможно проведение метаболитной и витаминной терапии.
СПИСОК ЛИТЕРАТУРЫ
-
Руководство по амбулаторно-поликлинической помощи в акушерстве и гинекологии / под ред. В.Н. Серова, Г.Т. Сухих, В.Н. Прилепской, В.Е. Радзинского, 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2016. 1136 c.
-
Генитоуринарный менопаузальный синдром. Новые возможности патогенетически оправданной местной терапии. Материалы заседания Экспертного совета российских акушеров-гинекологов в рамках XI Конгресса Европейского общества гинекологов (Прага, 21-24 октября 2015 года) // Информационное письмо. М.: Status Praesens, 2015. 4 с.
-
Акушерство. Гинекология. Бесплодный брак. Клиническая фармакология / под ред. В.Е. Радзинского, Р.Н. Аляутдина. М.: ГЭОТАР-Медиа, 2016. 672 c.
-
Никитина Т.И. Хирургическая менопауза: патогенез, кардиологические риски, стандарты ведения : дис. …д-ра мед. наук.М., 2015. 257 с.
-
Подзолкова Н.М., Подзолков В.И., Никитина Т.И., Брагина А.Е. и др.Роль биогенных аминов в развитии полиметаболических нарушений после гистерэктомии // Пробл. репродукции.2013. Т. 19, № 2. С. 43-49.
-
Подзолкова Н.М., Подзолков В.И., Никитина Т.И., Брагина А.Е. Синдром после искусственной менопаузы. Дискуссионные вопросы терминологии. Особенности патогенеза // Пробл. репродукции.2014. Т. 20, № 3. С. 95-108.
-
Matthews K.A., Crawford S.L., Chae C.U. et al. Are changes in cardiovascular disease risk factors in midlife women due to chronological aging or to the menopausal transition? // J. Am. Coll. Cardiol. 2009. Vol. 54. P. 2366-2373.
-
De Villiers T. et al. Updated 2013 International Menopause Society recommendations on menopausal hormone therapy and preventive strategies for midlife health // Climacteric. 2013. Vol. 16. P. 316-337.
-
Baber R.J., Panay N., Fenton A.; the IMS Writing Group. 2016 IMS Recommendations on women’s midlife health and menopause hormone therapy // Climacteric. 2016. Vol. 19. P. 109-150.
9.8. Гиперпролактинемия
Гиперпролактинемия - стойкое избыточное содержание пролактина в сыворотке крови.
Синдром гиперпролактинемии - симптомокомплекс, возникающий на фоне гиперпролактинемии, наиболее характерным проявлением которого являются нарушения функции репродуктивной системы.
КОД ПО МКБ-10
Е22.1 Гиперпролактинемия.
ЭПИДЕМИОЛОГИЯ
Гиперпролактинемия - одна из наиболее частых (до 25%) причин нарушений менструальной функции и ановуляторного бесплодия. Пролактинома составляет до 40% опухолей гипофиза, из них у 90% больных это микроаденомы. Распространенность лекарственной гиперпролактинемии различается в зависимости от препарата.
КЛАССИФИКАЦИЯ
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этиология
Патологические состояния, способствующие гиперпролактинемии.
Патогенез
В основе патогенеза лежит нарушение ингибирующего влияния дофамина на синтез и выделение пролактина в аденогипофизе. В результате постоянной стимуляции секреции пролактина происходит сначала гиперплазия лактотрофов гипофиза, а затем, возможно, формирование микро- и макроаденомы гипофиза.
Механизм нарушения репродуктивной функции на фоне гиперпролактинемии (гиперпролактинемический гипогонадизм):
-
Подавление пульсирующей секреции гонадолиберина (снижение амплитуды и частоты импульсов секреции ЛГ).
-
Конкурентное связывание с рецепторами ЛГ и ФСГ в яичниках (снижение синтеза половых стероидов).
-
Подавление активности ароматаз и 5-α-редуктазы (снижение синтеза половых стероидов).
-
Нарушение механизмов обратной связи между яичниками и гипофизом.
КЛИНИЧЕСКАЯ КАРТИНА
Нарушение функции репродуктивной системы (менструальной, генеративной и половой).
Патологические выделения из сосков молочных желез, напоминающие молоко или молозиво (лакторея).
Вазомоторные нарушения (транзиторная АГ, кардиалгия, головокружение).
Обменно-эндокринные нарушения (ожирение, сухость кожи, ломкость ногтей).
Эмоционально-психические нарушения (канцерофобия, раздражительность, склонность к депрессивным реакциям, снижение памяти).
Нарушение функции органа зрения (сужение полей зрения).
Болевой симптом (головная боль, масталгия).
ДИАГНОСТИКА
Основной диагностический критерий гиперпролактинемии - определение уровня пролактина в сыворотке крови. В гинекологической практике определение уровня пролактина в сыворотке крови показано при следующих состояниях:
При подозрении на развитие фармакологической гиперпролактинемии рекомендуется повторное определение уровня пролактина через 72 ч после отмены препарата, если таковая не несет риск для пациента (уровень доказательности 3, класс рекомендаций С).
Однократное выявление повышенного уровня сывороточного пролактина достаточно для постановки диагноза при условии, что проба была получена у пациента, не испытывающего чрезмерного стресса при венепункции. Большинство российских экспертов придерживаются мнения о необходимости как минимум двукратного проведения лабораторного анализа (уровень доказательности 1, класс рекомендаций А). Верхняя граница нормопролактинемии у женщин составляет 25 нг/мл (500 мЕд/л).
При наличии несоответствия между большими размерами аденомы гипофиза и умеренно повышенным уровнем пролактина рекомендуется последовательное разведение сыворотки крови для исключения ложных результатов (уровень доказательности 1, класс рекомендаций А). Данная методика позволяет избежать «HOOK»-эффекта(«HOOK»-эффект - это артефакт в методике определения уровня пролактина и некоторых других пептидных гормонов, при котором определяемый уровень гормона может быть незначительно повышенным или даже нормальным при очень высоких истинных значениях) и провести дифференциальную диагностику между пролактиномой и неактивной аденомой гипофиза.
Как правило, микроаденомы гипофиза ассоциированы с уровнем пролактина в сыворотке крови более 5000 мЕд/л (250 мг/л), макроаденомы - более 10000 мЕд/л (500 мг/л), про этом уровень пролактина менее 2000 мЕд/л (100 мг/л) более характерен для гиперпролактинемии неопухолевого генеза. Однако, учитывая существенные вариации в уровне пролактина, судить о размерах опухоли или ее наличии только на основании степени повышения уровня пролактина неправомочно.
При высоких показателях уровня пролактина обследование необходимо дополнить МРТ области турецкого седла (с контрастом) (уровень доказательности 1а), КТ (2а), офтальмологическим исследованием (определение боковых полей зрения). Учитывая, что на ранних этапах развития заболевания гиперпролактинемия клинически напоминает гипотиреоз, необходимо одновременно с определением уровня пролактина исследовать показатели ТТГ и свободного Т4. Остальные параметры гормонального и биохимического тестирования - по показаниям, при невозможности на основании клинических данных исключить соматические, гинекологические и эндокринные заболевания, сопровождающиеся лактореей или синдромом гиперпролактинемии.
В ряде случаев при обследовании пациенток диагностируется повышенный уровень пролактина при отсутствии каких-либо клинических проявлений, что может быть связано с макропролактинемией. При макропролактинемии в крови преобладают не мономерные фракции пролактина, а полимерные димеры или комплексы молекулы пролактина с иммуноглобулином класса G, обладающие большим молекулярным весом и отсутствием биологических эффектов. В настоящее время эффективным способом выявления макропролактина является реакция преципитации с этиленгликолем.
Таким образом, у пациентов с асимптоматической гиперпролактинемией рекомендуется исключение феномена макропролактинемии (уровень доказательности 2, класс рекомендаций В).
Скрининга нет.
ЛЕЧЕНИЕ
Цели лечения:
При всех формах гиперпролактинемии основным методом лечения является медикаментозный - фармакотерапия агонистами дофаминовых рецепторов (каберголин, бромокриптин, хинаголид).
Каберголин - эрголиновый селективный агонист D2 - дофаминовых рецепторов. Начальная доза - 0,25-0,5 мг в неделю с последующим наращиванием дозыдо нормализации уровня пролактина. Средняя доза - 1 мг в неделю, в случаях резистентных пролактином может составлять 3-4,5 мг в неделю.
Бромокриптин - эрголиновый агонист дофаминовых рецепторов. Начальная доза - 0,62-1,25 мг в сутки, терапевтический диапазон в пределах 2,5-7,5 мг в сутки.
Хинаголид - неэрголиновый селективный агонист дофаминовых рецепторов. Начальная доза составляет 25 мкг в сутки с постепенным увеличением каждые 3-5 дней на 25 мкг. Среднесуточная доза - около 75 мкг, максимальная - 300 мкг.
Побочные явления, как правило, возникают при инициации лечения, вследствие чего начальная доза должна быть низкой, особую значимость также приобретают рекомендации по приему препарата.
Наиболее распространенные побочные явления при терапии агонистами дофамина:
Среди агонистов дофамина каберголин является препаратом первой линии как наиболее эффективный в отношении нормализации уровня пролактина и повышения вероятности уменьшения размеров опухоли (уровень доказательности 1, класс рекомендаций А).
Критериями эффективности лечения служат нормализация уровня пролактина и значимое уменьшение размеров опухоли.
Продолжительность терапии агонистами дофамина - не менее года до зачатия (на этот период времени - барьерная контрацепция).
Отмену агонистов дофамина осуществляют с момента подтверждения беременности, но у пациенток с макропролактиномами, забеременевших на фоне приема агонистов дофамина, возможно дальнейшее применение медикаментозной терапии, особенно при близком расположении опухоли к хиазме или кавернозным синусам (уровень доказательности 3, класс рекомендаций С).
Проводят мониторинг полей зрения, неврологического статуса (не реже 1 раза в триместр).
Необходимо МРТ головного мозга в послеродовом периоде. Возобновляют терапию агонистами дофамина при отрицательной динамике размеров аденомы.
Рутинное МРТ турецкого седла беременным пациенткам с микроаденомами или макроаденомами без клинических данных, свидетельствующих о росте опухоли, нецелесообразно (уровень доказательности 2, класс рекомендаций А).
При подозрении на рост объемного образования рекомендовано МРТ головного мозга без контрастирования (уровень доказательности 2, класс рекомендаций А).
Транссфеноидальная операция целесообразна в II триместре в случаях отсутствия ответа на медикаментозное лечение и прогрессивного снижения зрения (уровень доказательности 2, класс рекомендаций А).
В литературе отсутствуют данные, указывающие на прогрессирование аденом во время грудного вскармливания. Комплексное клинико-рентгенологическое обследование пациенток с гиперпролактинемией после родов и после окончания кормления не выявило отрицательной динамики заболевания. Целесообразно ограничивать период кормления до 6 мес, а в некоторых случаях отказаться от него (уровень доказательности 3, класс рекомендаций В). После беременности может наблюдаться спонтанная ремиссия заболевания, в возобновлении лечения такие пациентки не нуждаются, однако дальнейшее наблюдение следует проводить в течение как минимум 5 лет.
Обобщенные критерии для отмены терапии:
Важным аспектом отмены терапии является постепенное снижение дозы препарата, что позволяет длительно удерживать нормальный уровень пролактина (уровень доказательности 2, класс рекомендаций В).
Ведение пациенток с макропролактиномами в постменопаузе не отличается от такового в остальных возрастных группах. Учитывая ремиссию заболевания с наступлением менопаузы, у части пациенток с микропролактиномами возможна отмена терапии с дальнейшим динамическим контролем в течение 5 лет (уровень доказательности 3, класс рекомендаций С).
Ряд пациенток с микроаденомами и бессимптомным течением заболевания могут не нуждаться в назначении медикаментозной терапии ввиду малой вероятности роста опухоли (уровень доказательности 3, класс рекомендаций С). Такой подход актуален для пациенток позднего репродуктивного возраста и периода менопаузального перехода при условии сохранения менструального цикла и полном отсутствии или I степени галактореи, а также женщин в пери- и постменапаузе, когда повышенный уровень пролактина не способствует развитию гипогонадизма.
Хирургическое вмешательство и лучевая терапия в настоящее время применяются по показаниям, связанным с рефрактерностью или непереносимостью лечения агонистами дофамина, прогрессией роста опухоли. Основными побочными эффектами хирургического и лучевого лечения пролактинсинтезирующих опухолей гипофиза являются развитие пангипопитуитаризма и высокий процент (до 80%) риска рецидива опухоли.
С целью полного использования резервов медикаментозной терапии у пациенток с резистентными или частично резистентными пролактиномами перед рассмотрением вопроса о хирургическом вмешательстве рекомендуется увеличение доз препаратов до максимально переносимых (уровень доказательности 1, класс рекомендаций А).
ПРОГНОЗ
Благоприятный.
ПРОФИЛАКТИКА
В настоящее время не разработана.
СПИСОК ЛИТЕРАТУРЫ
-
Руководство по амбулаторно-поликлинической помощи в акушерстве и гинекологии / под ред. В.Н. Серова, Г.Т. Сухих, В.Н. Прилепской, В.Е. Радзинского, 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2016. 1136 c.
-
Акушерство. Гинекология. Бесплодный брак. Клиническая фармакология / под ред. В.Е. Радзинского, Р.Н. Аляутдина. М.: ГЭОТАР-Медиа, 2016. 672 c.
-
Гинекология: учебник / под ред. Г.М. Савельевой, Г.Т., Сухих, И.Б. Манухина. М.: ГЭОТАР-Медиа, 2013. 704 с.
-
Калинченко С.Ю. Мифы и правда о гиперпролактинемии. Избранные лекции. М.: Практическая медицина, 2013. 108 с.
-
Клиническая нейроэдокринология / под ред. И.И. Дедова. М., 2011. С. 113-118.
-
Молочные железы и гинекологические болезни / под ред. В.Е. Радзинского. М., 2010. 304 с.
-
Подзолкова Н.М., Глазкова О.Л. Симптом. Синдром. Диагноз. Дифференциальная диагностика в гинекологии. 3-е изд., испр. и доп. М.: ГЭОТАР-Медиа, 2014. 736 с.
-
Тумилович Л.Г., Геворкян М.А. Справочник гинеколога-эндокринолога. 2-е изд., доп. и перераб. М.: Практическая медицина, 2010. 208 с.
-
Федеральные клинические рекомендации по гиперпролактинемии: клиника, диагностика, дифференциальная диагностика и методы лечения // II Всероссийский конгресс с участием стран СНГ «Инновационные технологии в эндокринологии». М., 2014. С. 19.
-
Berinder K., Akre O., Granath F., Hulting A.-L. Cancer risk in hyperprolactinemia patients: a population-based cohort study // Eur. J. Endocrinol. 2011. Vol. 165. P. 209215.
-
Bernichtein S., Touraine P., Goffin V. New concepts in prolactin biology // J. Endocrinol. 2010. Vol. 206. P. 1-11.
-
Das D., Talukdar U., Chisty S.J.S., Das M.K., Das S. Serum prolactin level in patients taking olanzapine // Open J. Psychiatry Allied Sci. 2015. Vol. 6, N 1. P. 50-58.
-
Expert Opin. Ther. Targets. 2015 Sep. Vol. 19, N 9. P. 1229-1244.