Неврология : национальное руководство : в 2-х т. / под ред. Е. И. Гусева, А. Н. Коновалова, В. И. Скворцовой. - 2-е изд., перераб. и доп. - Москва : ГЭОТАР-Медиа, 2022. - Т. 1. - 880 с. - (Серия "Национальные руководства"). - ISBN 978-5-9704-6672-8. |
Аннотация
Во втором издании национального руководства значительное внимание уделено современным методам профилактики, диагностики, фармакотерапии заболеваний нервной системы, а также немедикаментозным методам их лечения. Отдельные разделы посвящены клиническим рекомендациям по основным синдромам и заболеваниям.
В подготовке настоящего издания принимали участие ведущие специалисты-неврологи.
Руководство предназначено неврологам, нейрохирургам, кардиологам, терапевтам, врачам общей практики и представителям других медицинских дисциплин, а также студентам старших курсов медицинских высших учебных заведений, интернам, ординаторам, аспирантам.
2.1.4. Новые направления в нейрорентгенологии
Развитие визуализирующих технологий в нейрорентгенологии идет по пути «от анатомии к изучению функций мозга». Анатомические срезы стандартных КТ и МРТ демонстрируют разные типы тканей: кровь, жировую ткань, белое и серое вещество мозга, мышцы и пр. Современные методы КТ и МРТ позволяют оценить скорость и ориентацию диффузионного движения молекул воды, «увидеть» ткани, отличающиеся по обменному взаимодействию протонов, транспорту ионов и молекул (К+, Nа+), рН среды, активности фагоцитоза. По притоку обогащенной кислородом крови МРТ позволяет выявить области мозга с повышенной нейрональной и метаболической активностью, обнаружить участки нарушения гематоэнцефалического барьера (ГЭБ), количественно оценить микроваскулярную проницаемость ткани, состояние рецепторов на поверхности клеток, гормональную активность, наличие в ткани определенного антигена, белковых структур и пр. [5–12, 23]. Таким образом, с помощью КТ и МРТ стали осуществлять диагностику не только на клеточном, но и на молекулярном уровне. По этой причине диффузионную, перфузионную, функциональную МРТ и МР-спектроскопию относят к так называемым методам молекулярной визуализации.
2.1.4.1. Диффузионно-взвешенная и диффузионно-тензорная магнитно-резонансная томография
Диффузия — основной физический процесс, происходящий в ходе метаболических реакций клетки. Первое диффузионно-взвешенное МР-изображение было построено в 1985 г. [5, 20]. В клиническую практику диффузионная МРТ пришла вместе с МРТ-сканерами III поколения. Для получения диффузионно-взвешенных томограмм используют эхо-планарные импульсные последовательности «спиновое эхо» EPI с двумя диффузионными градиентами одинаковой амплитуды и длительности. Для количественной оценки диффузионных свойств воды в ткани строят параметрические диффузионные карты, на них цвет каждого пиксела соответствует измеряемому коэффициенту диффузии. На диффузионной карте ткани с высокой скоростью диффузии воды окрашены в красно-белые тона, ткани с низкой скоростью диффузии — в сине-черные.
Зависимость диффузионной способности молекул от направления называют анизотропией диффузии . В белом веществе мозга молекулы воды легко диффундируют вдоль нервных волокон, но поперек волокон их движение ограничено непроницаемой миелиновой оболочкой.
Для визуализации анизотропии диффузии воды в ткани применяют диффузионно-тензорную МРТ.
В диффузионно-тензорной МРТ по ориентации эллипсоидов диффузии в вокселах определяют ход нервных волокон, образующих нервные тракты, соединяя друг с другом собственные векторы диффузионного тензора. Алгоритмы соединения довольно сложны, поэтому применяют различные методы расчета, позволяющие «нарисовать» ход множества нервных волокон, образующих нервный тракт. Вследствие этого тензорную МРТ часто называют трактографией — методом визуализации хода нервных трактов [2, 5, 10, 12, 20]. В простейшей форме частичная анизотропия диффузии кодируется цветом, а визуализация направлений диффузионного движения молекул воды в тканях осуществляется окрашиванием определенным цветом пикселов в зависимости от ориентации их собственного вектора (красным — по оси X, зеленым — по оси Y, синим — по оси Z).
Диффузионно-тензорная МРТ позволяет обнаружить структурные связи между отделами мозга, что особенно важно при объемных процессах и заболеваниях, искажающих анатомическую структуру или разрушающих белое вещество [опухоли, черепно-мозговые травмы (ЧМТ), демиелинизирующие заболевания и др.].
Клиническое применение диффузионно-взвешенной и диффузионно-тензорной магнитно-резонансной томографии
Снижение скорости измеряемого коэффициента диффузии в тканях мозга — чувствительный индикатор ишемических нарушений и степени тяжести ишемии [2, 5, 12, 20, 23]. На сегодняшний день применение диффузионно-взвешенных изображений — один из наиболее быстрых и высокоспецифичных методов диагностики ишемического инфаркта мозга в ранних стадиях его развития (до 4,5 ч), когда существует «терапевтическое окно» для использования внутривенного тромболизиса и частичного или полного восстановления кровотока в пораженных тканях мозга. В острой фазе мозгового инсульта на диффузионно-взвешенных изображениях зона поражения мозга имеет типично высокий МР-сигнал, тогда как нормальные ткани мозга выглядят темными. На картах измеряемого коэффициента диффузии — обратная картина (рис. 2.12, см. цв. вклейку). Карты измеряемого коэффициента диффузии стали средством диагностики ишемии и динамического наблюдения за развитием острого нарушения мозгового кровообращения и последующей хронической дегенерации тканей, вызванной ишемией. Неинвазивность и быстрота применения диффузионно-взвешенных изображений предопределяют главенствующее значение метода в первичной диагностике ишемического поражения мозга [2, 3, 5–7, 9–12, 20, 23].
Все диффузионные исследования проводят без введения контрастного вещества, что важно для тяжелых больных и при специализированных исследованиях развития мозга у детей, начиная с внутриутробного периода. В последнем случае диффузионная МРТ позволяет получить дополнительные качественные (визуализационные) и количественные тканевые характеристики, открывает новые возможности исследования микроструктуры тканей мозга в процессе его развития (Коновалов А.Н. и др., 2001). В последних версиях программного обеспечения МР-сканеров появились специальные модификации ИП ДВИ, такие как DWI TETRA, ориентированные на получение ДВИ без построения измеряемого коэффициента диффузии карт, но с хорошим пространственным разрешением и отсутствием искажений, что особенно важно для диагностики спинальной патологии. Полезным оказался режим FOCUS DWI для визуализации областей головного и спинного мозга небольшого размера без артефактов наложения с построением диффузионных карт (рис. 2.13, см. цв. вклейку). FOCUS DTI используют для построения проводящих путей белого вещества (трактографии) и получения количественных показателей степени их повреждения (коэффициенты диффузии и анизотропии).
Диффузионно-взвешенные изображения и диффузионные карты дают дополнительную диагностическую информацию для дифференцировки новообразований головного мозга со сходными проявлениями на Т1- и Т2-МРТ (глиомы, опухоли с кольцевидным накоплением контрастного вещества), оценки перитуморального отека (вазогенный или цитотоксический), предоставляют данные о наличии или отсутствии внутриопухолевых кист и пр. [3, 5, 12].
Неоценимую информацию за столь короткое время сканирования диффузионно-взвешенные изображения дают в диагностике воспалительных поражений головного мозга и позвоночника (например, абсцессы мозга, эмпиема). Гнойное содержимое абсцесса характеризуется высоким МР-сигналом и легко визуализируется на любом этапе лечения, включая послеоперационный. Особенности структурной организации некоторых новообразований головного мозга, в частности менингиом и неврином, дают возможность при применении диффузионно-взвешенных изображений с высокой достоверностью прогнозировать гистологический тип опухоли еще перед операцией. На основе данных этого метода точно дифференцируются эпидермоидные и арахноидальные кисты.
Трактография — новая и многообещающая методика, позволяющая неинвазивно «увидеть» проводящие пути головного мозга (рис. 2.14, см. цв. вклейку). Несмотря на еще существующие технические сложности, первые результаты в приложении к задачам нейрохирургии кажутся многообещающими [3, 20]. Стало возможным с помощью диффузионно-тензорной МРТ, зная расположение проводящих путей и учитывая их заинтересованность в патологическом процессе (смещение/деформация или инвазия и повреждение), планировать операционный доступ и объем оперативного удаления внутримозговых опухолей [5–7, 9–12, 23], оценивать и прогнозировать изменение состояния больных с ЧМТ [2].
В последнее время разработана новая методика визуализации тканевой микроструктуры, учитывающая негауссовый характер диффузионного движения в местах пересечения и разветвления проводящих путей и в патологических тканях из-за обменных процессов с участием молекул воды [17, 18] — метод диффузионно-куртозисной МРТ. Диффузионно-куртозисная МРТ позволяет дополнительно к измеряемому коэффициенту диффузии и показателям анизотропии получить ряд количественных параметров куртозиса (коэффициенты радиального, аксиального, среднего куртозиса), которые по-новому характеризуют структурную организацию мозгового вещества в норме и при патологиях, дополняя диффузионно-тензорную МРТ. Диффузионно-куртозисная МРТ требует выполнения ИП диффузионно-взвешенной ЭПИ при нескольких значениях фактора диффузии, например при b=0, 1000 и 2500 с/мм2 и множества направлений диффузионных градиентов (от 15 и более). Продолжительность диффузионно-куртозисной МРТ составляет 25–30 мин [17]. Диффузионно-куртозисная МРТ находит применение для оценки структурных характеристик опухолевого вещества и выявления изменений, связанных с наличием инфильтративного роста клеток внутримозговых глиальных опухолей в области перитуморозного отека, в белом веществе контралатеральной опухоли полушария, в демиелинизированном белом веществе при рассеянном склерозе и при черепно-мозговой травме.
Метод визуализации магнитных свойств ткани или SWI открывает новые возможности в оценке состояния венозной макро-, но главным образом микросистемы головного мозга в норме и при различной патологии, например в изучении венозных аномалий развития синусов черепа, в визуализации венозных ангиом, а также в визуализации мельчайших изменений в строении венозной микросистемы мозга в различных его отделах, включая также область ствола.
SWAN (Susceptibility Weighted Angiography или Т2 Star Weighted ANgiography) является вариантом 3D Т2* GRE высокого разрешения с возможностью получения изотропного воксела с полной компенсацией влияния потоков. Неоднородность магнитной восприимчивости тканей внутри отдельного воксела создает дефазировку прецессии протонов, которая на амплитудном изображении SWAN проявляется в виде снижения МР-сигнала, что позволяет четко верифицировать анатомические, и прежде всего, венозные структуры [1, 13, 21]. Новая версия SWAN (Т2*) позволяет наряду с амплитудными получать и фазовые изображения, которые в дальнейшем могут быть использованы для построения карт магнитной восприимчивости, то есть для количественной МРТ (QSM). ИП SWAN более точно визуализирует очаги микрогеморрагий размерами до 5 мм, чем ИП 2D T2*GRE [1, 21]. Патологические изменения, обусловленные отложением железосодержащих субстанций, — микроскопические геморрагии, которые могут наблюдаться при целом ряде патологических состояний, например при хронической системной гипертензии, при амилоидной ангиопатии, при синдроме CADASIL и различных васкулитах, обусловлены чаще всего микротромбозами с пропитыванием крови через измененную сосудистую стенку, хорошо визуализируются при ИП SWAN как участки гипоинтенсивного сигнала (рис. 2.15). ИП SWAN в клинической предоперационной диагностике показала большой потенциал и высокую чувствительность в демонстрации аномальной капиллярной сети и микрокровоизлияний, как в первичных, так и во вторичных злокачественных опухолях мозга, и дала новые возможности в изучении ангиогенеза новообразований [5, 13, 21]. Наличие микрокровоизлияний и измененных сосудов (в виде артериовенозных шунтов) в глиобластоме, которые ранее можно было выявить только после морфологического исследования, нашло свое подтверждение при МРТ в режиме SWAN [1, 12].
С помощью методов исследования перфузии рассматривают и количественно оценивают движение крови по капиллярной системе паренхиматозного органа, в нашем случае это вещество головного мозга [2, 6, 10, 12, 19–21].
К современным количественным методам исследования мозговой гемодинамики относят МРТ, спиральную КТ с контрастным усилением, КТ с ксеноном, однофотонную эмиссионную КТ и позитронно-эмиссионную томографию (ПЭТ). Преимущества КТ- и МРТ-методов — минимальная инвазивность, высокая чувствительность в оценке тканевой микроциркуляции, высокая разрешающая способность, короткое время исследования в рамках стандартных протоколов и, наконец, воспроизводимость результатов с течением времени — очевидны.
Наибольшее распространение в нейрорентгенологии получили перфузионные исследования на основе внутривенного введения болюса контрастного препарата (КТ и МРТ). Для количественной оценки используют основные гемодинамические тканевые характеристики: мозговой кровоток, CBV, среднее время транзита крови.
2.1.4.2. Перфузионные исследования
Перфузионная компьютерная томография
При перфузионной КТ анализируют повышение КТ-плотности при прохождении контрастного вещества по сосудистому руслу головного мозга. Болюс рентгеноконтрастного вещества (препарат йода с концентрацией 350–370 мг/мл, скорость введения 4 мл/с) вводят внутривенно. Спиральные режимы сканирования позволяют получать серию срезов с интервалом 1 с в течение 50–60 с после внутривенной инъекции.
Этот метод, обладая высоким разрешением при отсутствии артефактов от костных структур, дает количественные оценки тканевой перфузии и признан одним из самых перспективных в настоящее время [6].
Перфузионная магнитно-резонансная томография
В МРТ существуют методы исследования гемодинамических перфузионных процессов с помощью экзогенных (с использованием контрастных веществ) и эндогенных маркеров (получение изображений, зависящих от уровня оксигенации крови, и др.) [5, 19–20].
Перфузионной МРТ в настоящее время называют методы оценки перфузии при прохождении болюса контрастного вещества. Эти методы исследования мозговой перфузии наиболее широко применяют в МР-диагностике, особенно в сочетании с диффузионными исследованиями, МР-ангиографией и МР-спектроскопией. По мере прохождения болюса контрастного вещества по сосудистой системе многократно регистрируют изображение одного и того же среза (обычно это 15–20 разных уровней или срезов). Само сканирование занимает 1–2 мин. График снижения интенсивности МР-сигнала при прохождении болюса контрастного вещества дает зависимость «интенсивность сигнала — время» в каждом пикселе среза. Форма этой кривой в артерии и вене определяет артериальную и венозную функции, с помощью которых рассчитывают гемодинамические тканевые параметры [2, 6].
Особое место и значение для клинических исследований гемодинамики головного мозга в последнее время стал занимать метод маркирования артериальной крови — ИП ASL (Arterial Spin Labeling), с помощью которого можно исследовать мозговую перфузию (CBF) без применения контрастного вещества [14, 19, 20, 24].
Клиническое применение перфузионных компьютерной и магнитно-резонансной томографий в нейрохирургии и неврологии
В настоящее время в нейрохирургической практике перфузионные исследования проводятся, чтобы оценить гемодинамику опухолей головного мозга, провести дифференциальную диагностику поражений мозга, проводить мониторинг состояния опухоли после лучевой терапии и химиотерапии, диагностировать рецидив опухоли и/или лучевой некроз, ЧМТ, оценить изменения церебрального кровотока при других заболеваниях и повреждениях ЦНС, например таких как ишемия/гипоксия, окклюзирующие заболевания магистральных артерий головы, заболевания крови, васкулиты, болезнь мойа-мойа и др. К перспективным направлениям относят использование перфузионных методов при эпилепсии, мигрени, вазоспазме, различных психических заболеваниях.
КТ- и МР-перфузионные карты позволяют количественно характеризовать зоны гипер- и гипоперфузии, что особенно важно для диагностики опухолевых и цереброваскулярных заболеваний (ЦВЗ).
На первом месте по частоте использования перфузионных методов стоят ишемические поражения мозга. В настоящее время перфузионно-взвешенные изображения — неотъемлемая часть диагностического протокола у больного с подозрением на церебральную ишемию. Впервые клинически метод применили у человека именно для диагностики инсульта. На современном этапе перфузионная КТ/МРТ — пожалуй, единственный метод ранней верификации ишемии мозга, способный уловить снижение кровотока в зоне поражения уже в первые минуты после появления неврологических симптомов.
В нейрохирургии перфузионно-взвешенные изображения в основном используют для того, чтобы провести первичную дифференциальную диагностику степени злокачественности глиом. Следует помнить, что перфузионная МРТ и КТ не позволяют дифференцировать опухоли по их гистологической принадлежности, а тем более оценивать распространенность опухоли в мозговом веществе. Наличие очагов гиперперфузии в структуре астроцитомы предполагает повышение степени злокачественности поражения. Это основано на том, что при новообразованиях тканевая перфузия характеризует развитие аномальной сосудистой сети (неоангиогенез) в опухоли и ее жизнеспособность. Наличие аномальной сосудистой сети в опухоли может свидетельствовать об агрессивности последней, и наоборот — снижение перфузии в опухолевой ткани под действием радио- или химиотерапии может указывать на то, что достигнут лечебный эффект. Использование перфузионно-взвешенных изображений для выбора цели при стереотаксической пункции оказало большую помощь, особенно в группе глиом, характеризующихся слабым контрастированием или полным отсутствием контрастного усиления при стандартных КТ и МРТ (рис. 2.16, см. цв. вклейку).
При оценке гистологического типа новообразования и распространенности внемозговых объемных поражений в полости черепа возможности перфузионно-взвешенных изображений выше, чем при внутримозговых опухолях. С помощью перфузионно-взвешенных изображений успешно дифференцируют менингиомы и невриномы мостомозжечкового угла по характерно высоким показателям гемодинамики у первого типа. Существует четкая корреляция между локальным кровотоком и данными прямой церебральной ангиографии в группе больных с менингиомами. Опухоли, характеризующиеся наличием плотной рентгеноконтрастной тени в ранней капиллярной фазе ангиографии, имеют исключительно высокие показатели перфузии и отличаются высоким риском интраоперационного кровотечения в момент удаления. Весьма специфичны полученные при КТ перфузионно-взвешенные изображения в демонстрации кровоснабжения гемангиобластом задней черепной ямки — раннее и выраженное контрастирование в сочетании с высокой перфузией (рис. 2.17, см. цв. вклейку).Особый интерес представляет МР-исследование мозговой гемодинамики без внутривенного использования контрастного препарата — метод мечения артериальных спинов. ИП ASL, которая в качестве болюса использует артериальную кровь с измененной намагниченностью, дает возможность исследовать мозговую перфузию (CBF) без применения контрастного вещества. Построение карт скорости мозгового кровотока с получением количественных оценок открывает новые возможности в изучении мозговой микроциркуляции. Такое исследование можно проводить при нейрохирургической патологии у большой категории больных: у детей, пожилых, диабетиков, пациентов с плохим состоянием сосудов и с заболеванием почек, а также и в норме, для оценки возрастных особенностей нормальной гемодинамики (рис. 2.18, см. цв. вклейку).
2.1.4.3. Функциональная магнитно-резонансная томография
Функциональная МРТ основана на усилении кровотока в мозге в ответ на увеличение нейрональной активности коры при действии соответствующего раздражителя. Картирование активности мозга позволяет выявить области нейрональной активации, возникающие в ответ на стимуляцию (моторные, сенсорные и другие раздражители).
Использование импульсной эхо-планарной последовательности на основе градиентного эха позволяет зарегистрировать МР-сигнал высокой интенсивности от активных участков коры мозга, причем время регистрации одного МР-изображения составляет около 100 мс. При функциональной МРТ сопоставляют интенсивность сигналов, зарегистрированных при физиологической нагрузке (активация) и в ее отсутствие (контроль). Участки статистически значимого повышения МР-сигнала, выявленные при последующей математической обработке изображений, соответствуют зонам нейрональной активности мозга. Их выделяют цветом, строят карты нейрональной активности и накладывают их на Т1-МРТ или на трехмерную модель поверхности мозга.
Клиническое применение функциональной магнитно-резонансной томографии
Картирование зон нейрональной активности мозга позволяет спланировать хирургический подход и исследовать патофизиологические процессы головного мозга. Метод применяют в нейропсихологии при изучении когнитивных функций головного мозга. Он перспективен для выявления очагов эпилепсии.
Использование функциональной МРТ стало в настоящее время неотъемлемой частью МРТ-протокола у больных с опухолями головного мозга, расположенными около функционально значимых зон коры головного мозга (рис. 2.19, см. цв. вклейку). В большинстве случаев полученные результаты адекватно отображают расположение сенсомоторной, речевой и слуховой зоны коры мозга. Перспективны в рамках одного МР-исследования у больных с опухолью мозга сочетания функциональной МРТ и трактографии с построением карт функционально значимой зоны коры и любого проводящего пути (например, пирамидного или зрительного тракта и др.) с наложением их на трехмерное изображение мозга. На основе совмещения полученных данных нейрохирурги планируют операционный подход и объем резекции новообразования, а радиологи рассчитывают области распределения дозы облучения опухоли.
2.1.4.4. Магнитно-резонансная спектроскопия
МР-спектроскопия позволяет неинвазивно получить информацию о метаболизме мозга. Протонная 1Н-МР-спектроскопия основана на «химическом сдвиге» — изменении резонансной частоты протонов, входящих в состав различных химических соединений. Этот термин ввел N. Rаmsey в 1951 г., чтобы обозначить различия между частотами отдельных спектральных пиков. Единица измерения «химического сдвига» — миллионная доля (ppm). Приводим основные метаболиты и соответствующие им значения химического сдвига, пики которых определяются in vivo в протонном МР-спектре:
В настоящее время в протонной МР-спектроскопии используют два основных метода — одновоксельную и мультивоксельную (Chеmical shift imaging) МР-спектроскопию. В последнем случае можно единовременно определять спектры от нескольких участков головного мозга.
При одновоксельной 1Н-МР-спектроскопии для анализа выбирают только один участок (воксел) мозга. Анализируя состав частот в регистрируемом от этого воксела сигнале, получают распределение пиков метаболитов по шкале химического сдвига (ppm). Соотношение между пиками метаболитов в спектре, уменьшение или увеличение высоты отдельных пиков спектра позволяют неинвазивно оценивать биохимические процессы, происходящие в тканях.
При мультивоксельной МР-спектроскопии получают МР-спектры для нескольких вокселов сразу, и можно сравнить спектры отдельных участков в зоне исследования. Обработка данных мультивоксельной МР-спектроскопии дает возможность построить параметрическую карту среза, на которой концентрация определенного метаболита отмечена цветом, и визуализировать распределение метаболитов в срезе, то есть получить изображение, взвешенное по химическому сдвигу.
Клиническое применение магнитно-резонансной спектроскопии
МР-спектроскопию в настоящее время довольно широко используют для оценки различных объемных образований головного мозга. Данные МР-спектроскопии не позволяют с уверенностью предсказать гистологический тип новообразования, тем не менее большинство исследователей сходятся во мнении, что опухолевые процессы в целом характеризуются низким соотношением NAA/Cr, увеличением соотношения Cho/Cr и в некоторых случаях появлением пика лактата (рис. 2.20, см. цв. вклейку). В большинстве МР-исследований протонную спектроскопию применяли в дифференциальной диагностике астроцитом, эпендимом и примитивных нейроэпителиальных опухолей, предположительно определяя тип опухолевой ткани.
В клинической практике важно использовать МР-спектроскопию в послеоперационном периоде для диагностики продолженного роста новообразования, рецидива опухоли либо лучевого некроза. В сложных случаях 1Н-МР-спектроскопия становится полезным дополнительным методом в дифференциальной диагностике наряду с получением перфузионно-взвешенных изображений. В спектре лучевого некроза характерный признак — наличие так называемого мертвого пика, широкого лактат-липидного комплекса в диапазоне 0,5–1,8 ppm на фоне полной редукции пиков остальных метаболитов.
Следующий аспект использования МР-спектроскопии — разграничение впервые выявленных первичных и вторичных поражений, дифференцировка их с инфекционными и демиелинизующими процессами. Наиболее показательны результаты диагностики абсцессов головного мозга. В спектре абсцесса на фоне отсутствия пиков основных метаболитов отмечено появление пика липид-лактатного комплекса и пиков, специфичных для содержимого абсцесса, таких как ацетат и сукцинат (продукты анаэробного гликолиза бактерий), аминокислоты валин и лейцин (результат протеолиза).
В литературе также очень широко исследуют информативность МР-спектроскопии при эпилепсии, при оценке метаболических нарушений и дегенеративных поражений белого вещества головного мозга у детей, при ЧМТ, ишемии мозга и других заболеваниях.
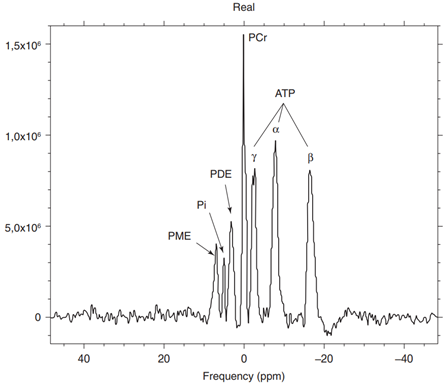
В практику сейчас стала также входить мультиядерная МР-спектроскопия на основе МР-сигнала ядер фосфора (рис. 2.21), углерода и некоторых других соединений [5, 15, 20]. В клинической практике в настоящее время применяется МР-спектроскопия по фосфору, позволяющая оценить энергетический метаболизм мозговой и патологической ткани и неинвазивно измерить рН ткани.
Список литературы
-
Долгушин М.Б., Пронин И.Н., Туркин А.М. и соавт. 3DSWAN в оценке особенностей структуры глиобластом и метастазов в головной мозг на 3 Тл МР томографе // Медицинская визуализация. 2012. №1. С. 26–35.
-
Захарова Н.Е., Корниенко В.Н., Потапов А.А., Пронин И.Н. Нейровизуализация структурных и гемодинамических нарушений при травме мозга. М.: ИП «Т.А. Алексеева», 2013. 156 с.
-
Коновалов А.Н., Корниенко В.Н., Пронин И.Н. Магнитно-резонансная томография в нейрохирургии. М.: Видар, 1997. 427 с.
-
Коновалов А.Н., Корниенко В.Н. Компьютерная томография в нейрохирургической клинике. М.: Медицина, 1985. 230 с.
-
Корниенко В.Н., Пронин И.Н. Диагностическая нейрорадиология. Т. I. М.: ИП «Т.М. Андреева», 2008. 455 с.
-
Корниенко В.Н., Пронин И.Н. Диагностическая нейрорадиология. Т. II. Опухоли головного мозга. М.: «Т.М. Андреева», 2009. 462 с.
-
Корниенко В.Н., Пронин И.Н. Диагностическая нейрорадиология. Т. III. Опухоли головного мозга. М.: «Т.М. Андреева», 2009. 463 с.
-
Корниенко В.Н., Пронин И.Н. Контрастирование в нейрорадиологии. М.: ИП «Т.А. Алексеева», 2010. 256 с.
-
Корниенко В.Н., Пронин И.Н. Диагностическая нейрорадиология. Т. IV. Опухоли головного мозга. М., 2012. 502 с.
-
Корниенко В.Н., Пронин И.Н., Арутюнов Н.В. и др. Нейрорадиология. Современное состояние и перспективы развития // Современные технологии и клинические исследования в нейрохирургии. Т. 1 / под ред. А.Н. Коновалова. М.: ИП «Т.А. Алексеева», 2012. С. 113–158.
-
Корниенко В.Н., Пронин И.Н. Диагностическая нейрорадиология. Т. V. Патология спинного мозга и позвоночника. М., 2014. 685 с.
-
Нейровизуализация: избранные статьи (2000–2007) / под ред. В.Н. Корниенко, И.Н. Пронина. М.: ИП «Т.М. Андреева», 2008. 256 с.
-
Пронин И.Н., Туркин А.М., Долгушин М.Б. и др. Тканевая контрастность, обусловленная магнитной восприимчивостью: применение в нейрорентгенологии // Мед. виз. 2011. №3. С. 75–84.
-
Пронин И.Н., Фадеева Л.М., Подопригора А.Е., Захарова Н.Е. и др. Спиновое маркирование артериальной крови (ASL): метод визуализации и оценки мозгового кровотока // Лучевая диагностика и терапия. 2012. №3. С. 64–78.
-
Ринк П.А. Магнитный резонанс в медицине. Основной учебник Европейского форума по магнитному резонансу / пер. с англ. Д.В. Устюжанина; под ред. В.Е. Синицына. М.: ГЭОТАР-МЕД, 2003. 256 с.
-
Тиссен Т.П. Эндоваскулярное лечение артериовенозных мальфораций спинного мозга. М., 2006. 357 с.
-
Тоноян А.С., Пронин И.Н., Пицхелаури Д.И. и др. Диффузионно-куртозисная магнитно-резонансная томография: новый метод оценки негауссовской диффузии в нейрорадиологии // Медицинская физика. 2014. Т. 4; №949. С. 57–67.
-
Тоноян А.С., Пронин И.Н., Пицхелаури Д.И. и др. Диффузионно-куртозисная МРТ в диагностике злокачественности глиом головного мозга // Медицинская визуализация. 2015. №17–18.
-
Alsop D.C., Detre J.A., Golay X. и др. Recommended Implementation of Arterial Spin-Labeled Perfusion MRI for Clinical Applications: A Consensus of the ISMRM Perfusion Study Group and the European Consortium for ASL in Dementia // MRM. 2015. Vol. 73. P. 102–116.
-
Edelman R., Zlatkin M.B., Hesselink J. Clinical Magnetic resonance Imaging. 2nd ed. W.B. Saunders Comp., 1996.
-
Haacke E.M., Mittal S., Wu Z. et al. Susceptibility Weighted Imaging: Technical Aspects and Clinical Applications. Part 1 // Am. J. Neuroradiol. 2009. Vol. 30. P. 19–30.
-
Kalander W. Computed tomography. Publics. MCD Verlag., 2000.
-
Osborn A. et al. Diagnostic Imaging. Brain. Amyrsys. 2010. 1200 p.
-
Shiroishi M.S., Castellazzi G., Boxerman J.L. et al. Principles of T2*-Weighted Dynamic Susceptibility Contrast MRI Technique in Brain Tumor Imaging // JMRI. 2015. Vol. 41. P. 296–313.