Водно-электролитный обмен и его нарушения : руководство для врачей / В. Г. Антонов, С. Н. Жерегеля, А. И. Карпищенко, Л. В. Минаева ; под ред. А. И. Карпищенко. - Москва : ГЭОТАР-Медиа, 2022. - 208 с. : ил. - 208 с. - ISBN 978-5-9704-6586-8. |
Аннотация
В руководстве рассмотрены вопросы обмена воды и электролитов в организме человека и их нарушения. Дан краткий обзор гомеостаза воды и электролитов в норме. Описаны варианты нарушений водно-электролитного обмена, механизмы возникновения различных нарушений, методы диагностики. Приведены значения показателей водно-электролитного обмена в норме и при патологических процессах.
Издание предназначено врачам широкого профиля, анестезиологам, реаниматологам, специалистам клинической лабораторной диагностики, студентам медицинских вузов. Книга может использоваться в системе последипломного образования врачей.
Осмос, тоничность, осмолярность
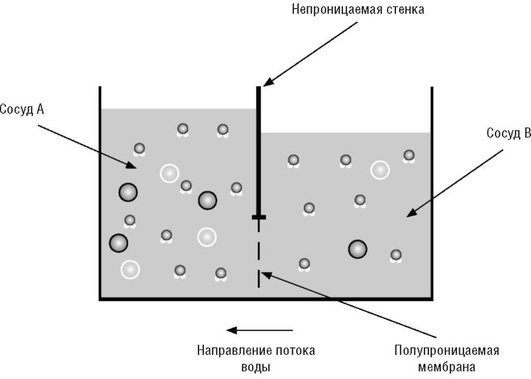
Осмосом, как отмечено выше, называется процесс самопроизвольного перехода растворителя (воды) через полупроницаемую мембрану в раствор или из раствора с меньшей концентрацией растворенного вещества в более концентрированный раствор (рис. 8).
Полупроницаемыми мембранами по отношению к водным растворам могут быть как структуры растительного и животного происхождения (стенки кишечника, мочевого пузыря, кровеносных сосудов), так и искусственно полученные материалы (пленка коллодия, целлофан, пергамент). Такие мембраны обладают свойством свободно пропускать молекулы только одного компонента раствора - растворителя и задерживать молекулы растворенного вещества. Способность раствора вызывать движение воды в клетку или из нее называют тоничностью.
Осмолярность является количественной мерой осмотических свойств раствора. Осмолярность показывает суммарную концентрацию осмотически активных частиц в 1 л раствора. Если осмотические свойства раствора количественно выражают через осмоляльность, то это означает, что концентрация осмотически активных частиц дана на 1 кг растворителя.
При осмосе скорость диффузии молекул растворителя через мембрану в прямом и обратном направлениях зависит от следующих причин:
-
неодинаковых концентраций растворителя в различных частях системы;
-
различий свободных поверхностей мембран со стороны чистого растворителя и раствора, где часть поверхности мембраны занята частицами растворенного вещества;
-
различий в подвижности молекул растворителя в чистом растворителе и в растворе, где есть межмолекулярное взаимодействие между веществом и растворителем.
Со временем вследствие уменьшения разности концентраций растворителя в разделенных частях системы и появления избыточного гидростатического давления со стороны раствора скорость диффузии растворителя будет изменяться. Это приведет к наступлению в системе состояния динамического равновесия, характеризующегося равенством скоростей диффузии молекул растворителя через мембрану в обоих направлениях. Стремление к выравниванию концентраций приводит к тому, что начинается «всасывание» растворителя раствором. Всасывающая сила (на единицу площади) называется осмотическим давлением (Pосм). Осмотическое давление раствора равно тому внешнему давлению, которое необходимо приложить к раствору, чтобы предотвратить осмос. Поскольку значения осмотического давления, выраженные в мм рт.ст., неудобны для клинической практики, их выражают в единицах осмоляльности - концентрации растворенных частиц в единице массы растворителя.
В общем случае осмотическое давление вычисляют по формуле Я. Вант-Гоффа:
Росм= C× R× T,
где Pосм - осмотическое давление, атм. или кПа; C - концентрация, моль/кг растворителя; R - универсальная газовая постоянная; T - температура, K.
Однако это уравнение справедливо только для идеальных растворов, в которых отсутствуют взаимодействия частиц. В реальных же растворах имеют место взаимодействия между молекулами вещества и растворителя, которые могут приводить или к диссоциации молекул растворенного вещества на ионы, или к ассоциации молекул вещества с образованием ассоциатов.
Для учета межмолекулярных взаимодействий в реальных растворах Я. Вант-Гофф предложил изотонический коэффициент i, отражающий отношение числа частиц, образовавшихся в растворе, к числу исходных частиц вещества. Для водных растворов электролитов вследствие диссоциации i >1, причем максимальное значение для данного электролита равно числу ионов в его молекуле. Для растворов неэлектролитов, молекулы которых мало склонны к ассоциации, i = 1. Для растворов, в которых вещество находится в виде ассоциатов, i <1. С учетом изотонического коэффициента формула Я. Вант-Гоффа принимает следующий вид:
Росм = i × C × R × T.
Если осмотическое давление у растворов одинаковое, то они называются изоосмотическими (изотоническими), и между ними происходит равновесный обмен растворителем. В случае контакта растворов с различным осмотическим давлением гиперосмолярным (гипертоническим) будет раствор, у которого осмотическое давление больше, а гипоосмолярным (гипотоническим) - раствор с меньшим осмотическим давлением. Гиперосмолярный раствор всегда будет всасывать растворитель из гипоосмолярного вследствие стремления к выравниванию концентрации вещества за счет перераспределения растворителя между контактирующими растворами.
При приготовлении физиологических растворов необходимо учитывать осмотическую активность, и поэтому их концентрацию выражают через осмолярную или осмоляльную концентрацию. Осмолярность плазмы и клетки составляет 285-295 мосмоль/л. На клеточное осмотическое давление влияет интенсивность обмена веществ. При распаде больших молекул осмолярность повышается, при синтезе - снижается.
Осмотические взаимоотношения ответственны за распределение воды в различных жидкостных биосредах организма. Так, гипотонический раствор натрия хлорида вызывает набухание эритроцитов, гипертонический, наоборот, приводит к их сморщиванию (рис. 9).
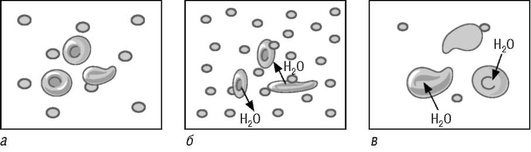
Изменение объема клеток обусловлено разнонаправленным движением воды через клеточные мембраны в гипертоническом и гипотоническом растворах. Ключевую роль как в осмолярности, так и в тоничности плазмы крови играет натрий. В этой связи его называют осмотически эффективным веществом. Напротив, мочевина, присутствующая в плазме в относительно высоких концентрациях, является осмотически неэффективным веществом. Она влияет на осмолярность плазмы крови, но практически не сказывается на ее тоничности, так как легко преодолевает клеточные мембраны по градиенту концентрации благодаря присутствию транспортера. По этой причине мочевина слабо влияет на движение воды из внеклеточного пространства во внутриклеточное.
Доля осмотического давления крови, обусловленная белками, называется онкотическим давлением и составляет 0,03-0,04 атм (или 2,94- 3,92 кПа). Оно играет важную роль в процессах всасывания жидкостей из тканей в кровеносные сосуды.
Коллоидно-осмотическое давление
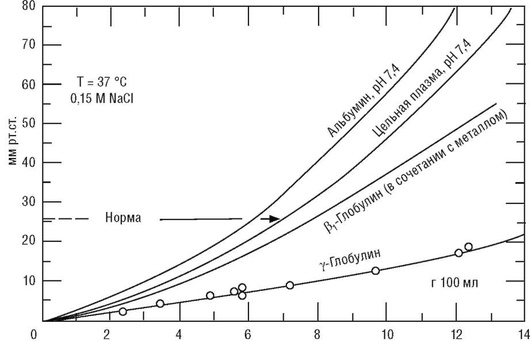
Коллоидно-осмотическое, или онкотическое, давление отражает участие белков в осмолярности. Поскольку белковые молекулы имеют большие размеры, то число их частиц на единицу массы мало. Коллоидно-осмотическое давление белков плазмы крови равно 1,6 мосмоль/л, что составляет 0,55% общей осмолярности плазмы. Наибольший вклад в онкотическое давление белков плазмы крови вносит альбумин (рис. 10).
Поскольку размер молекул альбуминов меньше размера молекул глобулинов, любое определенное количество альбумина содержит больше молекул, обусловливая большее онкотическое давление, чем глобулины с аналогичной относительной молекулярной массой.
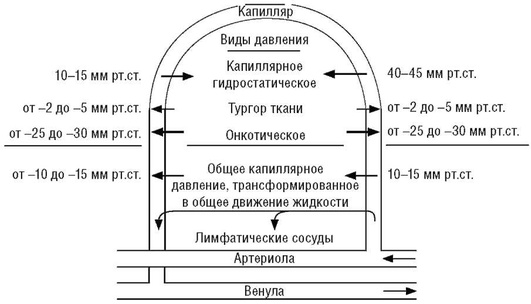
Онкотическое давление имеет большое значение, регулируя на уровне капилляров распределение внеклеточной жидкости между интерстициальным и васкулярным пространствами (рис. 11).
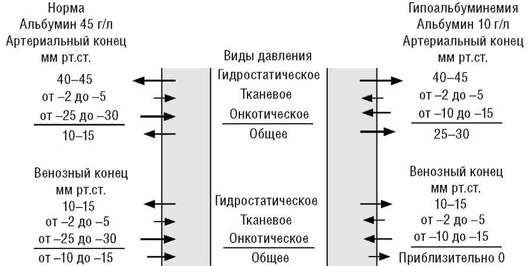
Падение содержания альбумина в плазме приводит к выравниванию онкотического и гидростатического давлений в венулярной части капилляра (рис. 12), что способствует формированию гипопротеинемических так называемых голодных отеков.
Для количественного описания осмотических свойств растворов в лабораторной практике используют показатели измеренной осмоляльности, расчетной осмоляльности, осмотического промежутка, корригированной осмоляльности (изложено в разделе «Расчетный метод определения осмоляльности»).