Инфекционные болезни. Национальное руководство. Краткое издание / под ред. Н. Д. Ющука, Ю. Я. Венгерова. - Москва : ГЭОТАР-Медиа, 2022. - 848 с. : ил. - ISBN 978-5-9704-6519-6. |
Аннотация
Краткое издание национального руководства "Инфекционные болезни" содержит современную информацию об организации службы инфекционной помощи в России, о методах диагностики и лечения инфекционных болезней. В издании впервые приведены рекомендации по основным клиническим синдромам, изложены свойства возбудителя, эпидемиология, профилактика, патогенез, клиническая картина, диагностика, лечение инфекционных и паразитарных болезней, включая новые нозоформы, ставшие актуальными в XXI в.
В подготовке настоящего издания в качестве авторов-составителей и рецензентов принимали участие ведущие специалисты. Все рекомендации прошли этап независимого рецензирования.
Предназначено инфекционистам, семейным врачам, врачам общей практики, студентам старших курсов медицинских вузов, интернам, ординаторам, аспирантам.
ПРЕДИСЛОВИЕ
Со времени 1-го издания национального руководства по инфекционным болезням в 2009 г. в структуре заболеваемости инфекционными болезнями произошли существенные изменения. Так, увеличилась заболеваемость вирусными диареями, геморрагическими лихорадками, произошла крупнейшая эпидемия лихорадки Эбола, распространилась на новые регионы РФ лихорадка Западного Нила (ЛЗН), продолжается пандемия ВИЧ-инфекции, в то же время благодаря улучшению санитарно-бытовых условий, проведению вакцинации снизилась заболеваемость вирусным гепатитом В (ВГB), брюшным тифом. Не регистрируются на территории РФ случаи сыпного тифа, снижается заболеваемость пневмококковой, гемофильной и менингококковой инфекциями.
Значительно усовершенствовались методы специфической диагностики, в частности ПЦР-диагностики, используются автоматические диагностические системы [полимеразная цепная реакция (ПЦР) + масс-спектрография + газожидкостная хроматография]. Значительное развитие получили биохимические методы диагностики и прогнозирования исхода болезни. Шире применяются инструментальные методы диагностики [магнитно-резонансная томография (МРТ), ультразвуковое исследование (УЗИ) и другие]. Произошли существенные сдвиги в чувствительности возбудителей инфекционных болезней (бактерий, простейших, вирусов) к этиотропным препаратам, все более реальной становится проблема широкого распространения полирезистентных штаммов возбудителей, что требует более рационального подхода к назначению антимикробных препаратов, более широкого применения бактериофагов. Дальнейшее распространение и совершенствование получили методы интенсивной терапии и реанимации. Разрабатываются и внедряются в практику стандарты диагностики и лечения ряда инфекционных болезней, в частности вирусного гепатита (ВГ).
Все эти изменения, а также новые данные о патогенезе и иммуногенезе ряда инфекционных болезней свидетельствуют о целесообразности и своевременности 2-го издания национального руководства по инфекционным болезням.
Н.Д. Ющук,
Ю.Я. Венгеров
Участники издания
Главные редакторы
Ющук Николай Дмитриевич - д-р мед. наук, проф., акад. РАН, зав. кафедрой инфекционных болезней и эпидемиологии, президент ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Венгеров Юрий Яковлевич - д-р мед. наук, проф. кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, акад. РАЕН, заслуженный работник высшей школы РФ
Научный редактор
Венгеров Юрий Яковлевич - д-р мед. наук, проф. кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, акад. РАЕН, заслуженный работник выс шей школы РФ
Авторский коллектив
Авдеева Марина Геннадьевна - д-р мед. наук, проф., зав. кафедрой инфекционных болезней и фтизиопульмонологии ФГБОУ ВО «Кубанский государственный медицинский университет» Минздрава России
Аликеева Гайний Каппасовна - канд. мед. наук, ассистент кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Антонова Мария Владимировна - ассистент кафедры инфекционных болезней с курсом детских инфекцией ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России
Архипов Георгий Сергеевич - д-р мед. наук, проф., зав. кафедрой микробиологии, иммунологии и инфекционных болезней Института медицинского образования ФГБОУ ВО «Новгородский государственный университет им. Ярослава Мудрого» Минобрнауки России, заслуженный работник высшей школы РФ
Ахмедов Джалалутдин Расулович - д-р мед. наук, проф., акад. РАЕН, зав. кафедрой инфекционных болезней им. акад. Г.П. Руднева ФГБОУ ВО «Дагестанский государственный медицинский университет» Минздрава России, заслуженный врач Республики Дагестан и РФ, заслуженный деятель науки Республики Дагестан
Балмасова Ирина Петровна - д-р мед. наук, проф., зав. лабораторией патогенеза и методов лечения инфекционных заболеваний НИМСИ ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Белова Елена Геннадьевна - канд. мед. наук, старший преподаватель кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Бессараб Тимур Петрович - канд. мед. наук, зав. отделением профилактики ВИЧ-инфекции Московского городского центра профилактики и борьбы со СПИДом ДЗ г. Москвы
Брико Николай Иванович - д-р мед. наук, проф., акад. РАН, зав. кафедрой эпидемиологии и доказательной медицины ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет), главный внештатный специалист эпидемиолог Минздрава России, заслуженный деятель науки РФ
Валишин Дамир Асхатович - д-р мед. наук, проф., зав. кафедрой инфекционных болезней с курсом Института дополнительного профессионального образования ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России
Венгеров Юрий Яковлевич - д-р мед. наук, проф. кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, акад. РАЕН, заслуженный работник высшей школы РФ
Гаджикулиева Мадина Маратовна - д-р мед. наук, проф. кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Галимзянов Халил Мингалиевич - д-р мед. наук, проф., акад. РАЕН, зав. кафедрой инфекционных болезней и эпидемиологии ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России, ректор ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России, заслуженный врач РФ, заслуженный врач Республики Ингушетия
Дарбеева Ольга Сергеевна - канд. мед. наук, главный эксперт ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России
Добронравова Ольга Валерьевна - старший лаборант кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Дроздова Татьяна Георгиевна - канд. мед. наук, доцент кафедры инфекционных болезней с курсом детских инфекций ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России, заслуженный врач РФ
Дудина Кристина Рубеновна - д-р мед. наук, доцент кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Дуйко Виктор Васильевич - д-р мед. наук, директор ФГБУ «Научно-исследовательский институт по изучению лепры» Минздрава России, заслуженный врач РФ
Еремушкина Янетта Маратовна - канд. мед. наук, доцент кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Ермак Татьяна Никифоровна - д-р мед. наук, ведущий научный сотрудник ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
Еровиченков Александр Анатольевич - д-р мед. наук, проф., профессор кафедры инфекционных болезней ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования»
Зайцева Ирина Александровна - д-р мед. наук, проф., профессор кафедры инфекционных болезней у детей и поликлинической педиатрии им. Н.Р. Иванова ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России, чл.-кор. РАЕН, заслуженный деятель науки РФ, заслуженный врач РФ
Знойко Ольга Олеговна - д-р мед. наук, доцент, проф. кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Караулов Александр Викторович - д-р мед. наук, проф., акад. РАН, зав. кафедрой клинической аллергологии и иммунологии ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет), заслуженный деятель науки РФ
Кареткина Галина Николаевна - канд. мед. наук, доцент кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, заслуженный врач РФ
Кашуба Эдуард Алексеевич - д-р мед. наук, проф., зав. кафедрой инфекционных болезней с курсом детских инфекций, советник ректора ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России, заслуженный деятель науки РФ
Климова Елена Анатольевна - д-р мед. наук, проф. кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Кулагина Маргарита Георгиевна - канд. мед. наук, доцент кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Кускова Татьяна Константиновна - канд. мед. наук, доцент кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Левин Дмитрий Юрьевич - канд. мед. наук, доцент кафедры инфекционных болезней у детей и поликлинической педиатрии им. Н.Р. Иванова ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России
Любимцева Оксана Анатольевна - канд. мед. наук, доцент кафедры инфекционных болезней с курсом детских инфекций ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России
Ляпина Елена Павловна - д-р мед. наук, доцент, проф. кафедры инфекционных болезней ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России
Мазус Алексей Израилевич - д-р мед. наук, руководитель Московского городского центра профилактики и борьбы со СПИДом ДЗ г. Москвы, проф. кафедры инфектологии и вирусологии медико-профилактического факультета ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Максимов Семен Леонидович - д-р мед. наук, проф. кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Малов Игорь Владимирович - д-р мед. наук, проф., зав. кафедрой инфекционных болезней, ректор ФГБОУ ВО «Иркутский государственный медицинский университет» Минздрава России
Мигманов Тимур Эмильевич - канд. мед. наук, доцент кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Михайлова Елена Владимировна - д-р мед. наук, проф., зав. кафедрой инфекционных болезней у детей и поликлинической педиатрии им. Н.Р. Иванова ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России
Нагибина Маргарита Васильевна - д-р мед. наук, доцент кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Никифоров Владимир Владимирович - д-р мед. наук, проф., зав. кафедрой инфекционных болезней и эпидемиологии ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России
Огиенко Ольга Леонидовна - канд. мед. наук, доцент кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Огошкова Наталья Владимировна - канд. мед. наук, доцент кафедры инфекционных болезней с курсом детских инфекций ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России
Рамазанова Кристина Христофоровна - канд. мед. наук, доцент кафедры инфекционных болезней ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России, главный внештатный специалист по инфекционным болезням Минздрава Саратовской области
Розенблюм Александр Юрьевич - канд. мед. наук, старший лаборант кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Сундуков Александр Вадимович - д-р мед. наук, проф. кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Тимченко Ольга Леонидовна - д-р мед. наук, проф. кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Токин Иван Иванович - канд. мед. наук, ведущий научный сотрудник отдела экспериментально-клинических исследований ФГБУ «Научно-исследовательский институт гриппа» Минздрава России, доцент кафедры инфекционных болезней ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России
Токмалаев Анатолий Карпович - д-р мед. наук, проф., профессор кафедры инфекционных болезней с курсами эпидемиологии и фтизиатрии ФГАОУ ВО «Российский университет дружбы народов» Минобрнауки России, заслуженный врач РФ
Филиппов Павел Геннадьевич - д-р мед. наук, проф. кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Ханипова Людмила Вячеславовна - канд. мед. наук, доцент, доцент кафедры инфекционных болезней с курсом детских инфекций ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России
Цветков Валерий Владимирович - канд. мед. наук, старший научный сотрудник отдела экспериментально-клинических исследований ФГБУ «Научно-исследовательский институт гриппа» Минздрава России
Цемба Вячеслав Петрович - канд. мед. наук, заместитель директора по медицинской части ФГБУ «Научно-исследовательский институт по изучению лепры» Минздрава России
Чехова Юлия Сергеевна - ассистент кафедры инфекционных болезней с курсом детских инфекций ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России
Шахгильдян Василий Иосифович - канд. мед. наук, старший научный сотрудник ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
Шахмарданов Мурад Зияудинович - д-р мед. наук, проф., профессор кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России
Шерышева Юлия Владимировна - канд. мед. наук, доцент кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России
Шестакова Ирина Викторовна - д-р мед. наук, проф. кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
Шульдяков Андрей Анатольевич - д-р мед. наук, проф., зав. кафедрой инфекционных болезней ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России
Ющук Николай Дмитриевич - д-р мед. наук, проф., акад. РАН, зав. кафедрой инфекционных болезней и эпидемиологии, президент ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
СПИСОК СОКРАЩЕНИЙ
♠ - торговое название лекарственного средства
ρ - лекарственное средство не зарегистрировано в Российской Федерации
¤ - лекарственное средство в Российской Федерации аннулировано, или срок его регистрации истек
АБП - антибактериальные препараты
АГ - аминогликозиды
АД - артериальное давление
АКДС - адсорбированная коклюшно-дифтерийно-столбнячная вакцина
АЛТ - аланинаминотрансфераза
АРВП - антиретровирусные препараты
АРВТ - антиретровирусная терапия
АРЛ - астраханская риккетсиозная лихорадка
АСТ - аспартатаминотрансфераза
БВВЗ - болезнь, вызванная вирусом Зика
БВВЭ - болезнь, вызванная вирусом Эбола
БВРС - ближневосточный респираторный синдром
БВРС-КоВ - коронавирус ближневосточного респираторного синдрома
БГМ - бактериальные гнойные менингиты
БИН - бактериоскопический индекс
БКЯ - болезнь Крейтцфельда-Якоба
БОПВ - бивалентная оральная полиовакцина
БЦЖ - вакцина Кальметта-Герена (от англ. bacillus Calmette- Guerin)
ВААРТ - высокоактивная антиретровирусная терапия
ВДП - верхние дыхательные пути
ВГ - вирусный гепатит
ВГA - вирусный гепатит A
ВГB - вирусный гепатит B
ВГC - вирусный гепатит C
ВГD - вирусный гепатит D
ВГE - вирусный гепатит E
ВИЧ - вирус иммунодефицита человека
ВОЗ - Всемирная организация здравоохранения
ВПГ - вирус простого герпеса
ГA - гепатит А
ГB - гепатит В
ГC - гепатит C
ГГТ - γ-глутамилтранспептидаза
ГЗТ - гиперчувствительность замедленного типа
ГИ - герпетическая инфекция
ГЛ - геморрагическая лихорадка
ГЛБ - гематоликворный барьер
ГЛД - геморрагическая лихорадка денге
ГЛПC - геморрагическая лихорадка с почечным синдромом
ГHT - гиперчувствительность немедленного типа
ГЦК - гепатоцеллюлярная карцинома
ГЭБ - гематоэнцефалический барьер
ГЭК - губчатая энцефалопатия коров
ДВC - диссеминированное внутрисосудистое свертывание
ддАTФ - дидезоксиаденозин-5?-трифосфат
ДH - дыхательная недостаточность
ДHК - дезоксирибонуклеиновая кислота
ЖВП - желчевыводящие пути
ЖКT - желудочно-кишечный тракт
ИБ - иммунный блоттинг
ИБС - ишемическая болезнь сердца
ИВЛ - искусственная вентиляция легких
ИИ - ингибиторы интегразы
ИЛ - интерлейкин
ИМ - инфекционный мононуклеоз
ИП - ингибиторы протеазы
иРHК - информационная рибонуклеиновая кислота
ИTШ - инфекционно-токсический шок
ИФА - иммуноферментный анализ
ИФH - интерферон
КГЛ - крымская геморрагическая лихорадка
КИЗ - кабинет инфекционных заболеваний
КРC - катарально-респиративный синдром
КT - компьютерная томография
КФК - креатининфосфокиназа
ЛАП - лимфаденопатия
ЛД - люмбальное давление
ЛДГ - лактатдегидрогеназа
ЛЗH - лихорадка Западного Hила
ЛИС - лихорадочно-интоксикационный синдром
ЛОР - имеющий отношение к зеву/гортани, уху и носу (от larynx, otos, rhinos)
ЛОC - липоолигосахарид
ЛПC - липополисахарид
ЛПУ - лечебно-профилактическое учреждение
ЛC - лекарственное средство
ЛУ - лимфатические узлы
ЛФК - лечебная физкультура
МВП - мочевыводящие пути
МКБ-10 - Международная классификация болезней 10-го пересмотра
МHH - международное непатентованное наименование
МРT - магнитно-резонансная томография
HАГ-вибрионы - неагглютинирующиеся вибрионы
нвБКЯ - новый вариант болезни Крейтцфельдта-Якоба
НВИ - норовирусная инфекция
НДП - нижние дыхательные пути
НИОТ - нуклеозидные/нуклеотидные ингибиторы обратной транс-криптазы
ННИОТ - ненуклеозидные ингибиторы обратной транскриптазы
НПВС - нестероидные противовоспалительные средства
ОГB - острый гепатит B
ОГC - острый гепатит С
ОГE - острый гепатит Е
ОГЛ - омская геморрагическая лихорадка
ОДН - острая дыхательная недостаточность
ОКИ - острые кишечные инфекции
ОНГМ - отек-набухание головного мозга
ОПН - острая почечная недостаточность
ОПЭ - острая печеночная энцефалопатия
ОРВИ - острая респираторная вирусная инфекция
ОРЗ - острое респираторное заболевание
ОРИТ - отделение реанимации и интенсивной терапии
ОТ-ПЦР - метод полимеразной цепной реакции с обратной транскрипцией
ПБС - противоботулиническая сыворотка
ПВП - противовирусные препараты
ПГН - постгерпетическая невралгия
ПДС - противодифтерийная сыворотка
ПИ - пневмококковые инфекции
ПЛСГ - пятнистая лихорадка Скалистых гор
ПМЛ - прогрессирующая мультифокальная лейкоэнцефалопатия
ПНС - периферическая нервная система
ПРЛ - пятнистые риккетсиозные лихорадки
ПСБ - пенициллинсвязывающие белки
ПСПЭ - подострый склерозирующий панэнцефалит
ПСС - противостолбнячная сыворотка
ПСЧИ - противостолбнячный человеческий иммуноглобулин
ПТИ - пищевая токсикоинфекция
ПЦР - полимеразная цепная реакция
ПЭГ - пэгилированный
РА - реакция агглютинации
РВО - ранний вирусологический ответ
РДС - респираторный дистресс-синдром
РИФ - реакция иммунофлюоресценции
РЛА - реакция латекс-агглютинации
РМА - реакция микроагглютинации
РНГА - реакция непрямой гемагглютинации
РНИФ - реакция непрямой иммунофлюоресценции
РНК - рибонуклеиновая кислота
РПГА - реакция пассивной гемагглютинации
рРНК - рибосомальная рибонуклеиновая кислота
РСК - реакция связывания комплемента
РТГА - реакция торможения гемагглютинации
СВК - синдром врожденной краснухи
СГА - стрептококк группы А
СКГ - смешанная криоглобулинемия
СКФ - cкорость клубочковой фильтрации
СМЖ - спинномозговая жидкость
СОЭ - скорость оседания эритроцитов
СПИД - синдром приобретенного иммунодефицита
СТШ - синдром токсического шока
ТГС - тромбогеморрагический синдром
ТИН - тубулоинтерстициальный нефрит
тОПВ - трехвалентная оральная полиовакцина
ТОРС - тяжелый острый респираторный синдром
тРНК - транспортная рибонуклеиновая кислота
УВО - устойчивый вирусологический ответ
УЗИ - ультразвуковое исследование
ФНО - фактор некроза опухоли
ХВГ - хронический вирусный гепатит
ХГB - хронический гепатит B
ХГC - хронический гепатит C
цАМФ - циклический аденозинмонофосфат
ЦИК - циркулирующий иммунный комплекс
ЦМВ - цитомегаловирус
ЦМВИ - цитомегаловирусная инфекция
ЦНС - центральная нервная система
ЦС - цефалоспорин
ЩФ - щелочная фосфатаза
ЭАКП - энтероадгезивная кишечная палочка
ЭБВ ИМ - инфекционный мононуклеоз, вызванный вирусом Эпштейна- Барр
ЭБВ - вирус Эпштейна-Барр
ЭГДС - эзофагогастродуоденоскопия
ЭГКП - энтерогеморрагическая кишечная палочка
ЭИКП - энтероинвазивная кишечная палочка
ЭКГ - электрокардиография
ЭНМГ - электронейромиография
ЭПКП - энтеропатогенная кишечная палочка
ЭТКП - энтеротоксигенная кишечная палочка
ЭЭГ - электроэнцефалография
ADE - феномен антителозависимого усиления инфекции (от англ. Antibody-dependend enhancement)
ECHO - кишечные цитопатогенные вирусы-сиротки человека (от англ. enteric cytopathogenic human orphan)
FDA - Американская администрация по контролю за лекарствами и пищевыми продуктами (от англ. Food and Drug Administration)
HAV - вирус гепатита A (от англ. Hepatitis A Virus)
HBV - вирус гепатита B (от англ. Hepatitis В Virus)
HCV - вирус гепатита C (от англ. Hepatitis С Virus)
HDAg - дельта-антиген
HDV - вирус гепатита D (от англ. Hepatitis Delta Virus)
HEV - вирус гепатита Е (от англ. Hepatitis E Virus)
HGV - вирус гепатита G (от англ. Hepatitis G Virus)
HHV) - вирус герпеса человека (от англ. Human Herpes Virus
Ig - иммуноглобулин
MRSA - метициллинорезистентный Staphylococcus aureus
NK - естественный киллер (от англ. Natural Killer)
TSST - токсин синдрома токсического шока (от англ. Toxic Shock Syndrome Toxin)
TTV - вирус, передающийся при переливании (от англ. Transfusion Transmitted Virus)
Глава 1. Вакцинопрофилактика инфекционных болезней. Календарь прививок
Вакцина - медицинский препарат, полученный из микроорганизмов или продуктов их жизнедеятельности (токсинов), который вызывает формирование в организме активного специфического иммунитета.
Вакцинопрофилактика (вакцинация) населения - наиболее эффективный метод профилактики инфекционных болезней, который позволяет резко снизить заболеваемость антропонозными инфекционными болезнями с высокого эпидемического уровня до низкого спорадического, а в отдельных случаях (натуральная оспа) ликвидировать болезнь. Вакцинация против зоонозных инфекций также позволяет резко снизить заболеваемость в природных очагах (например, клещевым энцефалитом).
В случае заболевания вакцинированного соответствующая инфекция, как правило, протекает в легкой форме без осложнений.
Наиболее эффективны живые вакцины, приготовленные из штаммов возбудителя, ослабленных различными методами, которые формируют иммунитет, близкий по продолжительности и напряженности к постинфекционному [БЦЖ (вакцина Кальметта-Γерена), чумная, туляремийная, сибиреязвенная, бруцеллезная, против сыпного тифа и Ку-лихорадки, полиомиелита, коревая, краснушная, паротитная, ротавирусная, папилломавирусная]. Регистрируются единичные случаи развития инфекционного процесса, вызванного вакцинным штаммом, у лиц, страдающих иммунодефицитами различной этиологии (ВИЧ-инфекция, онкогематологические заболевания, прием цитостатиков, кортикостероидов и др.), поэтому наличие иммунодефицита является противопоказанием для их применения. В ряде стран (США) отказались от применения вакцины БЦЖ.
Убитые вакцины (лептоспирозная, брюшнотифозная, холерная, против клещевого энцефалита, бешенства, ΓA и др.) содержат полный набор антигенов возбудителя, но менее эффективны, чем живые. Наименее реактогенны химические вакцины (например, менингококковая), которые содержат в концентрированном виде основные антигены возбудителя, ответственные за формирование иммунитета. К ним также относят анатоксины, т.е. токсины, обработанные формалином и лишенные токсичности, но сохранившие антигенные свойства (столбнячный, дифтерийный). В последние годы все более широкое применение находят рекомбинантные вакцины, полученные методами генной инженерии. Например, вакцина Регевак В против гепатита В (ГB), полученная путем переноса гена, ответственного за синтез HBsAg, в дрожжевую клетку с его последующим клонированием, выделением антигена, его очисткой и концентрацией. На практике часто используют комбинированные вакцины, например АКДС, содержащую коклюшную вакцину, дифтерийный и столбнячный анатоксины.
Для получения максимального иммунизирующего эффекта и минимизации частоты поствакцинальных осложнений необходимо:
После введения ряда вакцин наблюдаются реакции - закономерно возникающие, прогнозируемые, не представляющие непосредственной угрозы и отдельных неблагоприятных последствий проявления вакцинального процесса: кратковременная умеренная лихорадка, недомогание, гиперемия и болезненность в месте введения вакцины и др. Поствакцинальные осложнения - иногда более тяжелые, иногда стойкие нарушения здоровья.
Важно подчеркнуть, что их частота в сотни-тысячи раз меньше, чем при перенесении соответствующей инфекционной болезни.
Согласно рекомендациям ВОЗ, учитывается следующее.
-
Побочные реакции, затрагивающие ЦНС.
-
Острый вялый паралич, включая вакциноассоциированный с полиомиелитом, синдром Гийена-Барре.
-
Энцефалопатия - судороги с нарушением сознания в течение 6 и более часов и/или с выраженными изменениями поведения в течение 1 сут и более.
-
Энцефалит, возникающий в течение 1-4 нед после вакцинации, - те же симптомы, что при энцефалопатии, а также плеоцитоз спинномозговой жидкости (СМЖ) и/или обнаружение вируса (ПЦР, вирусологически).
-
В РФ сформулирован перечень патологии, при которой обязательна информация органов Госсанэпиднадзора, регистрация и расследование (табл. 1-1).
Диагноз |
Срок после вакцинации |
|
|---|---|---|
инактивированные вакцины и МИБП* |
живые вакцины |
|
Абсцесс в месте введения |
До 7 сут |
|
Анафилактический шок, анафилактическая реакция, коллапс |
Первые 12 ч |
|
Генерализованная сыпь, полиморфная экссудативная эритема, отек Квинке, синдром Лайелла, другие тяжелые аллергические реакции |
До 3 сут |
|
Синдром сывороточной болезни |
До 15 сут |
|
Энцефалит, энцефаломиелит, миелит, энцефалопатия, неврит, полирадикулоневрит, синдром Гийена-Барре |
До 10 сут |
5-30 сут |
Серозный менингит |
10-30 сут |
|
Афебрильные судороги |
До 7 сут |
До 15 сут |
Острый миокардит, острый нефрит, тромбоцитопеническая пурпура, агранулоцитоз, гипопластическая анемия, системные заболевания соединительной ткани, артрит |
До 30 сут |
|
Вакциноассоциированный полиомиелит:
|
- |
- |
Осложнения после вакцинации БЦЖ: лимфаденит, келоидный рубец, остеит и другие генерализованные формы заболевания |
- |
- |
* МИБП - медицинские иммунобиологические препараты. При массовом охвате вакцинацией формируется не только индивидуальный, но и коллективный (популяционный) иммунитет, так как прерываются пути передачи возбудителя и эпидемический процесс. При этом резко снижается вероятность заболевания не вакцинированных в связи с наличием противопоказаний или рефрактерных лиц, у которых после вакцинации не формируется защитный уровень иммунитета.
Снижение приверженности к вакцинации приводит к тяжким последствиям. Так, снижение уровня вакцинации против дифтерии привело к росту заболеваемости с 2,6 на 100 тыс. населения в 1992 г. до 26,8 в 1994 г. После того, как уровень вакцинации с 1999 г. превысил 95%, заболеваемость стала с 2009 г. ниже - 0,01 на 100 тыс. населения.
С 2001 г. начата массовая вакцинация против краснухи, заболеваемость, которая была на уровне 300-400 на 100 тыс. населения, снизилась в последующие годы - менее 1 на 100 тыс. населения. Заболеваемость ГB в 2000 г. в РФ составила 42,5 на 100 тыс. населения, в последние годы - менее 2 на 100 тыс. населения.
Снижение приверженности к профилактическим прививкам в значительной степени связано с широкой антивакцинальной агитацией. В связи с этим важно подчеркнуть, что частота поствакцинальных осложнений несопоставима с риском заболевания и тяжелых осложнений при соответствующих инфекционных болезнях.
Современные вакцины содержат ртуть, алюминий, формальдегид, фенол в концентрациях, не представляющих угрозы здоровью, что подтверждено огромным количеством контролируемых исследований.
Важное значение для повышения эффективности вакцинации, приверженности к вакцинации имеет объективная информированность населения, особенно родителей, знание врачами всех аспектов вакцинопрофилактики.
| Категории и возраст граждан, подлежащих профилактическим прививкам | Наименование прививки | Порядок проведения профилактических прививок |
|---|---|---|
Новорожденные в первые 24 ч жизни |
Первая вакцинация против ВГB |
Проводится в соответствии с инструкциями по применению вакцин новорожденным, в том числе из групп риска: родившимся от матерей - носителей HBsAg; больных ВГB или перенесших ВГB в III триместре беременности; не имеющих результатов обследования на маркеры ГB; наркозависимых; в семьях, в которых есть носитель HBsAg или больной острым ВГB и ХВГ (далее - группы риска) |
Новорожденные на 3-7-й день жизни |
Вакцинация против туберкулеза |
Проводится новорожденным вакцинами для профилактики туберкулеза (для щадящей первичной иммунизации) в соответствии с инструкциями по их применению. В субъектах Российской Федерации с показателями заболеваемости, превышающими 80 на 100 тыс. населения, а также при наличии в окружении новорожденного больных туберкулезом - вакциной для профилактики туберкулеза |
Дети в 1 мес |
Вторая вакцинация против ВГB |
Проводится в соответствии с инструкциями по применению вакцин детям данной возрастной группы, в том числе из групп риска |
Дети в 2 мес |
Третья вакцинация против ВГB |
Проводится в соответствии с инструкциями по применению вакцин детям из групп риска |
Дети в 3 мес |
Первая вакцинация против дифтерии, коклюша, столбняка |
Проводится в соответствии с инструкциями по применению вакцин детям данной возрастной группы |
Дети от 3 до 6 мес |
Первая вакцинация против гемофильной инфекции |
Проводится в соответствии с инструкциями по применению вакцин детям, относящимся к группам риска: с иммунодефицитными состояниями или анатомическими дефектами, приводящими к резко повышенной опасности заболевания Hib-инфекцией; с онко гематоло гическими заболеваниями и/или длительно получающим иммуносупрессивную терапию; ВИЧ-инфицированным или рожденным от ВИЧ-инфицированных матерей; находящимся в закрытых детских дошкольных учреждениях (дома ребенка, детские дома, специализированные интернаты для детей с психонев рологи ческими заболе ва-ниями и др., противотуберкулезные санитарно-оздоровительные учреждения). Примечание. Курс вакцинации против гемофильной инфекции для детей в возрасте от 3 до 6 мес состоит из 3 инъекций по 0,5 мл с интервалом 1-1,5 мес. Для детей, не получивших первую вакцинацию в 3 мес, иммунизация проводится по следующей схеме: для детей в возрасте от 6 до 12 мес - из 2 инъекций по 0,5 мл с интервалом в 1-1,5 мес, для детей от 1 года до 5 лет - однократная инъекция 0,5 мл |
Дети в 4,5 мес |
Первая вакцинация против полиомиелита |
Проводится вакцинами для профилактики полиомиелита (инактивированными) в соответствии с инструкциями по их применению |
Вторая вакцинация против дифтерии, коклюша, столбняка |
Проводится в соответствии с инструкциями по применению вакцин детям данной возрастной группы, получившим первую вакцинацию в 3 мес |
|
Вторая вакцинация против гемофильной инфекции |
Проводится в соответствии с инструкциями по применению вакцин детям данной возрастной группы, получившим первую вакцинацию в 3 мес |
|
Вторая вакцинация против полиомиелита |
Проводится вакцинами для профилактики полиомиелита (инактивированными) в соответствии с инструкциями по их применению |
|
Дети в 6 мес |
Третья вакцинация против дифтерии, коклюша, столбняка |
Проводится в соответствии с инструкциями по применению вакцин детям данной возрастной группы, получившим первую и вторую вакцинацию в 3 и 4,5 мес соответственно |
Третья вакцинация против ВГB |
Проводится в соответствии с инструкциями по применению вакцин детям данной возрастной группы, не относящимся к группам риска, получившим первую и вторую вакцинацию в 0 и 1 мес соответственно |
|
Третья вакцинация против гемофильной инфекции |
Проводится в соответствии с инструкциями по применению вакцин детям, получившим первую и вторую вакцинацию в 3 и 4,5 мес соответственно |
|
Третья вакцинация против полиомиелита |
Проводится детям данной возрастной группы вакцинами для профилактики полиомиелита (живыми) в соответствии с инструкциями по их применению. Дети, находящиеся в закрытых детских дошкольных учреждениях (дома ребенка, детские дома, специализированные интернаты для детей с психоневрологическими заболеваниями и др., противотуберкулезные санитарно-оздоровительные учреждения), по показаниям вакцинируются трехкратно вакцинами для профилактики полиомиелита (инактивированными) |
|
Дети в 12 мес |
Вакцинация против кори, краснухи, эпидемического паротита |
Проводится в соответствии с инструкциями по применению вакцин детям данной возрастной группы |
Четвертая вакцинация против ВГB |
Проводится в соответствии с инструкциями по применению вакцин детям из групп риска |
|
Дети в 18 мес |
Первая ревакцинация против дифтерии, коклюша, столбняка |
Проводится в соответствии с инструкциями по применению вакцин детям данной возрастной группы |
Первая ревакцинация против полиомиелита |
Проводится детям данной возрастной группы вакцинами для профилактики полиомиелита (живыми) в соответствии с инструкциями по их применению |
|
Ревакцинация против гемофильной инфекции |
Ревакцинации проводят однократно детям, привитым на первом году жизни, в соответствии с инструкциями по применению вакцин |
|
Дети в 20 мес |
Вторая ревакцинация против полиомиелита |
Проводится детям данной возрастной группы вакцинами для профилактики полиомиелита (живыми) в соответствии с инструкциями по их применению |
Дети в 6 лет |
Ревакцинация против кори, краснухи, эпидемического паротита |
Проводится в соответствии с инструкциями по применению вакцин детям данной возрастной группы, получившим вакцинацию против кори, краснухи, эпидемического паротита |
Дети в 6-7 лет |
Вторая ревакцинация против дифтерии, столбняка |
Проводится в соответствии с инструкциями по применению анатоксинов с уменьшенным содержанием антигенов детям данной возрастной группы |
Дети в 7 лет |
Ревакцинация против туберкулеза |
Проводится не инфицированным микобактериями туберкулеза туберкулино-отрицательным детям данной возрастной группы вакцинами для профилактики туберкулеза в соответствии с инструкциями по их применению |
Дети в 14 лет |
Третья ревакцинация против дифтерии, столбняка |
Проводится в соответствии с инструкциями по применению анатоксинов с уменьшенным содержанием антигенов детям данной возрастной группы |
Третья ревакцинация против полиомиелита |
Проводится детям данной возрастной группы вакцинами для профилактики полиомиелита (живыми) в соответствии с инструкциями по их применению |
|
Взрослые от 18 лет |
Ревакцинация против туберкулеза |
Проводится не инфицированным микобактериями туберкулеза туберкулино-отрицательным детям данной возрастной группы вакцинами для профилактики туберкулеза в соответствии с инструкциями по их применению. В субъектах Российской Федерации с показателями заболеваемости туберкулезом, не превышающими 40 на 100 тыс. населения, ревакцинация против туберкулеза в 14 лет проводится туберкулино-отрицательным детям, не получившим прививку в 7 лет |
Ревакцинация против дифтерии, столбняка |
Проводится в соответствии с инструкциями по применению анатоксинов с уменьшенным содержанием антигенов взрослым от 18 лет каждые 10 лет с момента последней ревакцинации |
|
Дети от 1 года до 18 лет, взрослые от 18 до 55 лет, не привитые ранее |
Вакцинация против ВГB |
Проводится в соответствии с инструкциями по применению вакцин детям и взрослым данных возрастных групп по схеме 0-1-6 (1-я доза - в момент начала вакцинации, 2-я доза - через месяц после 1-й прививки, 3-я доза - через 6 мес от начала иммунизации) |
Дети от 1 года до 18 лет, девушки от 18 до 25 лет |
Иммунизация против краснухи |
Проводится в соответствии с инструкциями по применению вакцин детям от 1 года до 18 лет, не болевшим, не привитым, привитым однократно против краснухи, и девушкам от 18 до 25 лет, не болевшим, не привитым ранее |
Дети с 6 мес, учащиеся 1-11-х классов; студенты высших профессиональных и средних профессиональных учебных заведений; взрослые, работающие по отдельным профессиям и должностям (работники медицинских и образовательных учреждений, транспорта, коммунальной сферы и др.); взрослые старше 60 лет, беременные, лица, подлежащие призыву на военную службу, лица с хроническими заболеваниями |
Вакцинация против гриппа |
Проводится в соответствии с инструкциями по применению вакцин ежегодно данным категориям граждан |
Дети в возрасте 15-17 лет включительно и взрослые в возрасте до 35 лет |
Иммунизация против кори |
Иммунизация против кори детям в возрасте 15-17 лет включительно и взрослым в возрасте до 35 лет, не привитым ранее, не имеющим сведений о прививках против кори и не болевшим корью ранее, проводится в соответствии с инструкциями по применению вакцин двукратно с интервалом не менее 3 мес между прививками. Лица, привитые ранее однократно, подлежат проведению однократной иммунизации с интервалом не менее 3 мес между прививками |
Вакцинация против пневмококковой инфекции
Кроме вышеуказанных прививок, с 1 января 2015 г. в российский календарь детских профилактических прививок добавлена прививка от пневмококковой инфекции. Вакцинации подлежат все дети с 2 мес до 5 лет. В Российской Федерации для этой цели используется вакцина Превенар.
Схемы вакцинации вакциной Превенар.
-
Первый раз прививка проводится ребенку в 2 мес, затем через 2 мес. Ревакцинация выполняется в 12-15 мес, то есть через 4-5 мес после конца двукратной вакцинации.
-
При первой вакцинации после года ребенка вакцину вводят двукратно с интервалом в 2 мес. Ревакцинация в таком случае не проводится.
-
Если прививку не делали до 2-летнего возраста, то ее проводят однократно, и ревакцинация не требуется.
Препарат вводится внутримышечно в бедро, он совместим со всеми другими прививками, то есть можно делать в один день с другими вакцинами.
Иммунизация в рамках национального календаря профилактических прививок проводится медицинскими иммунобиологическими препаратами, зарегистрированными в соответствии с законодательством Российской Федерации, согласно инструкциям по применению.
При нарушении сроков иммунизации ее проводят по предусмотренным национальным календарем профилактических прививок схемам и в соответствии с инструкциями по применению препаратов. Допускается введение вакцин (кроме вакцин для профилактики туберкулеза), применяемых в рамках национального календаря профилактических прививок, в один день разными шприцами в разные участки тела.
Национальный календарь профилактических прививок по эпидемическим показаниям по состоянию на 2018 г. с таблицей
Календарь прививок по эпидемическим показаниям начинает свое действие в условиях угрозы развития эпидемии того или иного заболевания. В приведенной ниже табл. 1-3 национальный календарь прививок сопровождается специальными указаниями на этот счет. Национальный календарь прививок в таблице учитывает основную массу контактных инфекций, передающихся в том числе и от кровососущих насекомых.
| Наименование прививки | Категории граждан, подлежащих профилактическим прививкам по эпидемическим показаниям, и порядок их проведения | Сроки проведения профилактических прививок по эпидемическим показаниям |
|---|---|---|
Против туляремии |
Население, проживающее на энзоотичных по туляремии территориях, а также прибывшие на эти территории лица, выполняющие следующие работы: сельскохозяйственные, гидромелиоративные, строительные, другие работы по выемке и перемещению грунта, заготовительные, промысловые, геологи чес кие, изыскательские, экспедиционные, дератизационные и дезинсекционные; по лесозаготовке, расчистке и благоустройству леса, зон оздоровления и отдыха населения. Лица, работающие с живыми культурами возбудителя туляремии |
В соответствии с инструкциями по применению вакцин |
Против чумы |
Население, проживающее на энзоотичных по чуме территориях. Лица, работающие с живыми культурами возбудителя чумы |
В соответствии с инструкциями по применению вакцин |
Против бруцеллеза |
В очагах козье-овечьего типа лица, выполняющие следующие работы: по заготовке, хранению, обработке сырья и продуктов животноводства, полученных из хозяйств, где регистрируются заболевания скота бруцеллезом; по убою скота, больного бруцеллезом, заготовке и переработке полученных от него мяса и мясопродуктов. Животноводы, ветеринарные работники, зоотехники в хозяйствах, энзоотичных по бруцеллезу. Лица, работающие с живыми культурами возбудителя бруцеллеза |
В соответствии с инструкциями по применению вакцин |
Против сибирской язвы |
Лица, выполняющие следующие работы: зооветработники и другие лица, профессионально занятые предубойным содержанием скота, а также убоем, снятием шкур и разделкой туш; сбор, хранение, транспортировка и первичная переработка сырья животного происхождения; сельскохозяйственные, гидромелиоративные, строительные, по выемке и перемещению грунта, заготовительные, промысловые, геологические, изыскательские, экспедиционные на энзоотичных по сибирской язве территориях. Работники лабораторий, работающие с материалом, подозрительным на инфицирование возбудителем сибирской язвы |
В соответствии с инструкциями по применению вакцин |
Против бешенства |
С профилактической целью иммунизируют лиц, имеющих высокий риск заражения бешенством: работники лабораторий, работающие с уличным вирусом бешенства; ветеринарные работники; егеря, охотники, лесники; лица, выполняющие работы по отлову и содержанию животных |
В соответствии с инструкциями по применению вакцин |
Против лептоспироза |
Лица, выполняющие следующие работы: по заготовке, хранению, обработке сырья и продуктов животноводства, полученных из хозяйств, расположенных на энзоотичных по лептоспирозу территориях; по убою скота, больного лептоспирозом, заготовке и переработке мяса и мясопродуктов, полученных от больных лептоспирозом животных; по отлову и содержанию безнадзорных животных. Лица, работающие с живыми культурами возбудителя лептоспироза |
В соответствии с инструкциями по применению вакцин |
Против клещевого вирусного энцефалита |
Население, проживающее на энзоотичных по клещевому вирусному энцефалиту территориях, а также прибывшие на эти территории лица, выполняющие следующие работы: сельскохозяйственные, гидромелиоративные, строительные, по выемке и перемещению грунта, заготовительные, промысловые, геологические, изыскательские, экспедиционные, дератизационные и дезинсекционные; по лесозаготовке, расчистке и благоустройству леса, зон оздоровления и отдыха населения. Лица, работающие с живыми культурами возбудителя клещевого энцефалита. Лица, посещающие энзоотичные по клещевому энцефалиту территории с целью отдыха, туризма, работы на дачных и садовых участках |
В соответствии с инструкциями по применению вакцин |
Против лихорадки Ку |
Лица, выполняющие работы по заготовке, хранению, обработке сырья и продуктов животноводства, полученных из хозяйств, где регистрируются заболевания лихорадкой Ку скота. Лица, выполняющие работы по заготовке, хранению и переработке сельскохозяйственной продукции на энзоотичных территориях по лихорадке Ку. Лица, работающие с живыми культурами возбудителей лихорадки Ку |
В соответствии с инструкциями по применению вакцин |
Против желтой лихорадки |
Лица, выезжающие за рубеж в энзоотичные по желтой лихорадке районы. Лица, работающие с живыми культурами возбудителя желтой лихорадки |
В соответствии с инструкциями по применению вакцин |
Против холеры |
Лица, выезжающие в неблагополучные по холере страны. Граждане Российской Федерации в случае осложнения санитарно-эпидемиологической обстановки по холере в сопредельных странах, а также на территории Российской Федерации |
В соответствии с инструкциями по применению вакцин |
Против брюшного тифа |
Лица, занятые в сфере коммунального благоустройства (работники, обслуживающие канализационные сети, сооружения и оборудование, а также предприятий по санитарной очистке населенных мест - сбору, транспортировке и утилизации бытовых отходов). Лица, работающие с живыми культурами возбудителей брюшного тифа. Население, проживающее на территориях с хроническими водными эпидемиями брюшного тифа. Лица, выезжающие в гиперэндемичные по брюшному тифу регионы и страны. Контактные лица в очагах брюшного тифа по эпидпоказаниям. По эпидемическим показаниям прививки проводят при угрозе возникновения эпидемии или вспышки (стихийные бедствия, крупные аварии на водопроводной и канализационной сети), а также в период эпидемии, при этом в угрожаемом районе проводят массовую иммунизацию населения |
В соответствии с инструкциями по применению вакцин |
Против ВГA |
Лица, подверженные профессиональному риску заражения (врачи, персонал по уходу за больными, работники сферы обслуживания населения, занятые на предприятиях пищевой промышленности, в организациях общественного питания, а также обслуживающие водопроводные и канализационные сооружения, оборудование и сети). Лица, выезжающие в неблагополучные регионы и страны, где регистрируется вспышечная заболеваемость. Контактные в очагах гепатита А |
В соответствии с инструкциями по применению вакцин |
Против шигеллезов |
Работники инфекционных стационаров и бактериологических лабораторий. Лица, занятые в сфере общественного питания и коммунального благоустройства. Дети, посещающие детские учреждения и отъезжающие в оздоровительные лагеря (по показаниям). По эпидемическим показаниям прививки проводят при угрозе возникновения эпидемии или вспышки (стихийные бедствия, крупные аварии на водопроводной и канализационной сети), а также в период эпидемии, при этом в угрожаемом районе проводят массовую иммунизацию населения. Профилакические прививки предпочтительно проводить перед сезонным подъемом заболеваемости шигеллезами |
В соответствии с инструкциями по применению вакцин |
Против менингококковой инфекции |
Дети, подростки, взрослые в очагах менингококковой инфекции, вызванной менингококками серогрупп А или С. Вакцинация проводится в эндемичных регионах, а также в случае эпидемии, вызванной менингококками серогрупп А или С |
В соответствии с инструкциями по применению вакцин |
Против кори |
Контактные лица из очагов заболевания, не болевшие, не привитые и не имеющие сведений о профилактических прививках против кори, однократно привитые без ограничения возраста |
В соответствии с инструкциями по применению вакцин |
Против ГB |
Контактные лица из очагов заболевания, не болевшие, не привитые и не имеющие сведений о профилактических прививках против ГB |
В соответствии с инструкциями по применению вакцин |
Против дифтерии |
Контактные лица из очагов заболевания, не болевшие, не привитые и не имеющие сведений о профилактических прививках против дифтерии |
В соответствии с инструкциями по применению вакцин |
Против эпидемического паротита |
Контактные лица из очагов заболевания, не болевшие, не привитые и не имеющие сведений о профилактических прививках против эпидемического паротита |
В соответствии с инструкциями по применению вакцин |
Против полиомиелита |
Прививкам подлежат контактные лица в очагах полиомиелита, в том числе вызванного диким полиовирусом (или при подозрении на заболевание): |
|
дети с 3 мес до 18 лет |
Однократно |
|
медработники |
Однократно |
|
Дети, прибывшие из эндемичных (неблагополучных) по полиомиелиту стран (территорий) с 3 мес до 15 лет |
Однократно (при наличии достоверных данных о предшествующих прививках) или троекратно (при их отсутствии) |
|
Лица без определенного места жительства (при их выявлении) с 3 мес до 15 лет |
Однократно (при наличии достоверных данных о предшествующих прививках) или троекратно (при их отсутствии) |
|
Лица, контактировавшие с прибывшими из эндемичных (неблагополучных) по полиомиелиту стран (территорий), с 3 мес жизни без ограничения возраста |
Однократно |
|
Лица, работающие с живым полиовирусом, с материалами, инфицированными (потенциально инфицированными) диким вирусом полиомиелита без ограничения возраста. Иммунизация против полиомиелита по эпидемическим показаниям проводится оральной полиомиелитной вакциной. Показаниями для проведения иммунизации детей оральной полиомиелитной вакциной по эпидемическим показаниям являются регистрация случая полиомиелита, вызванного диким полиовирусом, выделение дикого полиовируса в биопробных материалах от людей или из объектов окружающей среды. |
Однократно при приеме на работу |
|
В этих случаях иммунизация проводится в соответствии с постановлением главного государственного санитарного врача субъекта Российской Федерации, которым определяется возраст детей, подлежащих иммунизации, сроки, порядок и кратность ее проведения |
Допускается введение инактивированных вакцин, применяемых в рамках календаря профилактических прививок по эпидемическим показаниям и национального календаря профилактических прививок, в один день разными шприцами в разные участки тела.
Раздел I. МЕТОДЫ ДИАГНОСТИКИ
Глава 2. Лабораторные методы
Клинический анализ крови
Цель
Выявление изменений показателей периферической крови, имеющих диагностическое и прогностическое значение
Противопоказания
Отсутствуют
Подготовка к исследованию
Плановое исследование проводят утром и желательно натощак, по экстренным показаниям и при поступлении - в любое время суток. Повторное плановое исследование проводят каждые 7-10 сут. Особенной подготовки не требуется
Методика исследования
Кровь берут из концевой фаланги IV пальца (мочки уха или пятки у новорожденных и детей раннего возраста), предварительно обработав место прокола стерильным ватным тампоном, смоченным 70% спиртом. Прокол кожи производят одноразовым скарификатором. Первую каплю крови удаляют сухим стерильным ватным тампоном. Можно использовать кровь из вены, взятую в пробирку с ЭДТА.
Общий анализ крови включает определение количества гемоглобина, эритроцитов, тромбоцитов, ретикулоцитов, лейкоцитов (с подсчетом лейкоцитарной формулы), скорости оседания эритроцитов (СОЭ) и вычисление цветового показателя. Традиционные рутинные определения количества эритроцитов, лейкоцитов, гемоглобина, лейкограммы в современных лабораториях проводят на автоматических анализаторах; для определения СОЭ используют капилляр Панченкова. Исследование мазка крови проводят под световым микроскопом
Интерпретация результатов
Нормальные показатели
Для ряда инфекционных болезней характерна анемия различного генеза. Так, гипохромная анемия со снижением числа эритроцитов, уровня гемоглобина и цветового показателя типична для геморрагических лихорадок (ГЛ), тяжелых глистных инвазий; гемолитическая анемия свойственна малярии, лептоспирозу; гиперхромия - дифиллоботриозу. Анемия может иметь сочетанный генез. Так, при сепсисе возникает гемолиз и угнетение эритропоэза. Развитие анемии может быть результатом кровопотери, например, при кишечном кровотечении у больных брюшном тифом.
Важное прогностическое значение имеет тромбоцитопения, которая характерна для сепсиса, ГЛ, лептоспироза. Снижение тромбоцитов до уровня менее 30 000 в 1 мкл, как правило, сопровождается повышенной кровоточивостью.
Для инфекционных болезней, вызванных бактериальной кокковой флорой (стрепто-, стафило-, менинго-, пневмококки), некоторыми грамотрицательными палочковидными бактериями, характерен нейтрофильный лейкоцитоз со сдвигом влево. Отсутствие лейкоцитоза или лейкопения (сепсис, менингококкемия) прогностически неблагоприятно, исключение - коклюш, при котором наблюдается лимфоцитарный лейкоцитоз.
При большинстве инфекций, вызванных грамотрицательной палочковидной флорой, риккетсиями, лейкоцитоз менее выражен, возможна лейкопения, однако сохраняется нейтрофильный сдвиг влево.
Для большинства вирусных инфекций (грипп, корь, краснуха, вирусные гепатиты, ГЛ и др.) характерна лейкопения и лимфоцитоз, СОЭ не увеличивается или увеличивается незначительно, однако при некоторых вирусных инфекциях, например при энтеровирусных, флавивирусных возможен невысокий нейтрофильный лейкоцитоз без сдвига влево.
При некоторых вирусных инфекциях происходит смена лейкопении на лейкоцитоз, например при ГЛ, в других случаях (грипп, корь) появление лейкоцитоза может указывать на развитие бактериальных осложнений.
В остром периоде большинства инфекций наблюдают анэозинофилию или эозинопению, а при инфекциях, которым свойственна аллергизация организма, - эозинофилию (иерсиниозы). Особенно она характерна для глистных инвазий с миграцией возбудителя в организме, причем степень эозинофилии (до 60-70%) соответствует интенсивности инвазии. Отсутствие эозинофилии при массивной инвазии (трихинеллез) прогностически неблагоприятно.
В некоторых случаях картина крови имеет решающее значение для постановки диагноза. Например, для Эпштейна-Барр вирусного инфекционного мононуклеоза характерен лейкоцитоз, лимфоцитоз и появление в крови атипичных мононуклеаров (широкоплазменных лимфоцитов).
Факторы, влияющие на результат
Обезвоживание, гиперволемия, забор крови после еды.
Осложнения
Осложнения крайне редки. При коагулопатиях может развиться капиллярное кровотечение.
Список литературы
-
Клиническая лабораторная диагностика: национальное руководство в 2 томах (Серия "Национальные руководства") / Под ред. А.А. Кишкуна. - М.: ГЭОТАР-Медиа, 2016.
-
Лифшиц В.М., Сидельникова В.И. Медицинские лабораторные анализы: Справочник. - М.: Триада-Х, 2011. - 184 с.
-
Назаренко Г.И., Кишкун А.А. Клиническая оценка результатов лабораторных исследований. - М.: Медицина, 2006. - 540 с.
-
Практика лабораторных исследований при инфекционных заболеваниях / Под ред. Ю.В. Лобзина. - СПб.: Элби-СПб., 2005. - 274 с.
-
Ющук Н.Д., Венгеров Ю.Я. Лекции по инфекционным болезням. - М.: ГЭОТАР-Медиа, 2016 г. изд. 4 в 2 т.
Клинический анализ мочи
Клинический анализ мочи (общий анализ мочи) - лабораторное исследование, позволяющее оценить физико-химические характеристики мочи и микроскопию осадка.
Цель
Оценить характер, активность поражения почек, мочевых путей и эффективность проводимого лечения.
Показания
Всем пациентам инфекционного стационара проводят исследование мочи при поступлении, в динамике наблюдения - каждые 10 сут, в любые сроки - по экстренным показаниям.
Клинический анализ мочи у больных инфекционными болезнями производят:
Подготовка к исследованию
Накануне перед сдачей анализа мочи не рекомендуется употреблять овощи и фрукты, которые могут изменить цвет мочи (свекла, черника); принимать салицилаты, мочегонные препараты. Перед сбором мочи следует произвести гигиенический туалет наружных половых органов без применения антисептиков.
Методика исследования
Для клинического анализа мочи исследуют среднюю порцию утренней мочи, сбор которой производят в стерильную сухую емкость. При невозможности выполнения правил сбора мочи в условиях стационара, рекомендуют проведение катетеризации мочевого пузыря.
Микроскопию мочевого осадка следует производить не позднее 2 ч после сбора мочи, при низкой относительной плотности мочи (менее 1,010) - непосредственно после сбора мочи. Для сохранения целостности клеточных элементов необходимо подкисление (до значения рН менее 5,0) щелочной мочи.
Клиническое исследование мочи включают оценку следующих параметров:
-
физические свойства мочи (количество, цвет, прозрачность, относительная плотность);
-
химическое исследование (определение реакции рН, белка, глюкозы, кетоновых тел, билирубина, уробилиногена, гемоглобина и миоглобина при соответствующем изменении цвета мочи);
-
микроскопия мочевого осадка (организованный осадок - клетки эпителия, лейкоциты, эритроциты, цилиндры; атипичные клетки, бактерии, дрожжевые грибы, паразиты; неорганизованный осадок - соли в виде кристаллов или аморфных масс).
Интерпретация результатов
| Показатель | Референсное значение |
|---|---|
Физические свойства |
|
Количество |
600-1600 мл/сут |
Цвет |
Соломенно-желтый |
Прозрачность |
Прозрачная |
Относительная плотность |
1,001-1,030 |
Химическое исследование |
|
Реакция (рН) |
4,5-8,5 |
Белок |
Отсутствует или следы (не более 50 мг/сут) |
Глюкоза |
Отсутствует |
Кетоновые тела |
Отсутствуют |
Билирубин |
Отсутствует |
Уробилиноген |
Отсутствует |
Гемоглобин |
Отсутствует |
Микроскопическое исследование |
|
Плоский, переходной эпителий |
Незначительное количество |
Почечный эпителий |
Отсутствует |
Лейкоциты |
0-3 (муж), 0-6 (жен) в поле зрения |
Эритроциты |
0-2 в препарате |
Цилиндры |
0-2 в препарате |
Бактерии |
Отсутствуют / в количестве менее 5×104 КОЕ/мл |
Грибы, паразиты |
Отсутствуют |
Соли |
В незначительном количестве |
Патологически измененный цвет мочи наблюдается при гематурии (вид "мясных помоев"), лейкоцитурии (молочно-белый цвет), билирубинемии (цвет пива), гемоглобинурии или миоглобинурии (красно-коричневая окраска, черный цвет). Мутность мочи обусловлена наличием в ней высокого содержания солей, клеточных элементов, слизи, бактерий, жира. Реакция мочи (рН) зависит от многих факторов: возраста, диеты, температуры тела, физической нагрузки, состояния почек и др.
Резкощелочная реакция мочи отмечается при рвоте, диарее, хронической инфекции мочевых путей. Кислая реакция мочи увеличивается при лихорадочных состояниях, туберкулезе почек или мочевого пузыря, сахарном диабете, почечной недостаточности.
Способность почек к концентрированию и разведению мочи определяют в пробе Зимницкого (определение относительной плотности в 8 порциях мочи, собранных пациентом с интервалом в 3 ч в течение суток). В норме дневной диурез составляет 65-80% от количества выделенной за сутки мочи, колебания относительной плотности мочи в течение суток - 1005-1025. Различают гипостенурию (колебания удельного веса мочи менее 1,010 г/мл), изостенурию (появление монотонного характера удельного веса мочи соответствующее таковому первичной мочи 1,010 г/мл), гиперстенурию (высокие значения удельного веса).
Выделение с мочой белка (протеинурия), превышающее 300 мг/сут, является одним из ключевых признаков поражения почек. Для инфекционных болезней, протекающих с лихорадочно-интоксикационным синдромом, присуща умеренная протеинурия в пределах 0,3 г/л.
Появление в моче измененных (лишенные гемоглобина, выщелоченные) эритроцитов указывает на их почечное происхождение. Встречаются при гломерулонефритах, туберкулезе и других заболеваниях почек; неизмененные эритроциты характерны для поражения мочевыводящих путей. Лейкоцитурия в сочетании с бактериурией и наличием клинических симптомов свидетельствует о воспалении инфекционной природы в почках или мочевыводящих путях.
Для количественного исследования клеточных элементов в осадке мочи используют методы Нечипоренко (в норме лейкоцитов - до 2000, эритроцитов - до 1000; цилиндров - 20 в 1 мл мочи), Каковского-Аддиса (в норме эритроцитов - до 1×106, лейкоцитов - 2×106, цилиндров - 2×104 в сутки).
Патологические изменения в клиническом анализе мочи при инфекционных болезнях представлены в табл. 6-2.
| Нозологическая форма | Вариант поражения почек | Изменения в общем анализе мочи |
|---|---|---|
Скарлатина, рожа, ангина, сепсис, ГЛ, лептоспироз, ВИЧ-инфекция, другие вирусные инфекции |
Острый гломерулонефрит |
Протеинурия, лейкоцитурия гематурия |
ХГB, ХГC, ВИЧ-инфекция |
Хронический гломерулонефрит |
Протеинурия, лейкоцитурия, микрогематурия, цилиндрурия |
Пиелонефрит |
Сепсис, вызванный грамотрицательной флорой (протей, кишечная палочка, энтерококки, клебсиелла), реже стафилококком |
Щелочная реакция мочи, снижение относительной плотности, никтурия, резко выраженная лейкоцитурия, количество бактерий ‹1×105 КОЕ/мл |
ВГВ, ВГС, лептоспироз, ГЛ, иерсиниозы, дифтерия, генерализованные инфекции |
Тубулоинтерстициальный нефрит |
Снижение относительной плотности мочи, полиурия, умеренная протеинурия, микрогематурия, лейкоцитурия |
Острые диарейные инфекции с обезвоживанием III-IV степени, ИТШ Лептоспироз, ГЛ, сепсис, ВИЧ-инфекция |
Острое повреждение почек: преренальное ренальное |
Относительная плотность выше 1018, единичные гиалиновые цилиндры Относительная плотность ниже 1012, незначительная протеинурия, гематурия, зернистые и клеточные цилиндры |
Клиническое значение имеет посев мочи с количественной оценкой степени бактериурии, выделением чистой культуры возбудителя и определением его чувствительности к антибиотикам. Многие виды микроорганизмов могут вызвать развитие инфекционного процесса в мочевых путях. Самыми распространенными возбудителями инфекции мочевой системы являются грамотрицательные бактерии. Кишечная палочка вызывает приблизительно 80% острых инфекционных заболеваний мочевых путей у больных без урологических нарушений. На долю других грамотрицательных бактерий, как Proteus, Klebsiella, Enlerobacter, Serratia и Pseudomonas, приходится меньшая доля неосложненных инфекционных заболеваний, но все большее число рецидивов, а также инфекций, связанных с проведением урологических манипуляций. Они играют основную роль в развитии внутрибольничных инфекций, связанных с использованием катетеров. Грамположительные кокки играют меньшую роль в развитии инфекционных заболеваний мочевых путей. Однако Staphylococcus saprophyticus, представляющие собой коагулазоотрицательные стафилококки, служат причиной развития 10-15% острых инфекций мочевых путей у молодых женщин.
В осадке мочи могут быть обнаружены яйца возбудителя мочеполового шистосомоза (Schistosoma hematobium), элементы эхинококкового пузыря (крючья, сколексы, выводковые капсулы, обрывки оболочки пузыря), мигрирующие личинки кишечной угрицы (Strongloides stercoralis), яйца острицы (Enterobius vermiсularis) и патогенные простейшие - трихомонады (Trichomonas urogenitalis), амебы (вегетативные формы Entamoeba histolitika).
Факторы, влияющие на результат
Перед сдачей мочи не рекомендуется прием в пищу красящих пищевых продуктов. Несоблюдение требований, предъявляемых к технике сбора и исследованию мочи, приводит к искажению результатов вследствие разрушения клеточных элементов (лейкоцитов, эритроцитов, цилиндров):
Список литературы
-
Данилова Л.А. Анализы крови, мочи и других биологических жидкостей человека в различные возрастные периоды. - СПб.: СпецЛит, 2014. - 115 с.
-
Инфекционные болезни: национальное руководство / Под ред. Н.Д. Ющука, Ю.Я. Венгерова. - М.: ГЭОТАР-Медиа, 2009. - 1056 с.
-
Камышников В.С. Методы клинических лабораторных исследований. - МЕДпресс-информ, 2015. - 736 с.
-
Кишкун А. А. Руководство по лабораторным методам диагностики. - М.: ГЭОТАР-Медиа, 2013. - 756 с.
-
Лабораторная диагностика инфекционных болезней / Под ред. В.И. Покровского, М.Г. Твороговой, Г.А. Шипулина. М.: БИНОМ, 2013. - 648 с.
-
Уоллах Ж. Лабораторная диагностика: Пер. с англ. - ЭКСМО, 2013. - 1360 с.
-
Хиггинс К. Расшифровка клинических лабораторных анализов: Пер. с англ. / Под ред. В.Л. Эмануэля. - М.: БИНОМ. Лаборатория знаний, 2014. - 456 с.
-
Щербак С.Г. Клиническая интерпретация лабораторных исследований для практикующего врача. - Корона-Век, 2015. - 464 с.
-
Kidney Disease: Improving Global Outcomes (KDIGO) Chronic Kidney Disease Work Group. KDIGO 2012 Сlinical practice guideline for the evaluation and management of chronic kidney disease // Kidney Int Suppl. - 2013; 3:1-150.
Биохимический анализ крови
Цель
Выявление метаболических нарушений, характера и тяжести органопатологии, сопутствующих заболеваний
Показания
Генерализованная инфекция, особенно с признаками поражения печени и почек
Противопоказания
Отсутствуют
Подготовка к исследованию
Взятие крови для биохимического исследования производят из вены утром натощак, в экстренной ситуации - в любое время. Альтернативный метод - взятие крови из пальца или мочки уха микропипеткой (при срочном исследовании на активность аминотрансфераз)
Методика исследования
Современные приборы для биохимических исследований автоматически определяют до 20-30 показателей одновременно, используя несколько микролитров крови. Актуальными становятся методы "сухой химии", позволяющие с помощью специальных тест-полосок определять многие биохимические показатели в течение нескольких минут
Интерпретация результатов
Нормальные показатели
При тяжелом течении генерализованных инфекций повышение катаболизма, нарушение белково-синтетической функции печени, дефицит белка сопровождаются гипопротеинемией и диспротеинемией со снижением уровня альбумина, относительным и абсолютным (вследствие повышенного синтеза иммуноглобулинов) увеличением глобулиновой (γ-глобулины) фракции. Нарушения пигментного обмена свойственно инфекциям, протекающим с развитием паренхиматозного гепатита (вирусные гепатиты, генерализованные формы иерсиниоза, инфекционный мононуклеоз), протекающим с гемолизом (малярия). Возможны и сочетанные поражения (сепсис, лептоспироз). Реже наблюдается подпеченочная желтуха (эхинококкоз, аскаридоз). Повышение активности аминотрансфераз в сочетании с нарушением пигментного обмена свойственно желтушным формам вирусных гепатитов, в сочетании же с повышением активности других сывороточных ферментов является проявлением генерализованного цитолитического синдрома и свидетельствует о тяжелом течении инфекции. Повышение уровня мочевины отражает интенсивность метаболических процессов при тяжелых инфекциях, а в сочетании с гиперкреатининемией и гиперкалиемией свойственно острой почечной недостаточности.
Повышение уровня амилазы указывает на развитие панкреатита (эпидемический паротит, реактивный панкреатит при тяжелых абдоминальных инфекциях и глистных инвазиях).
Выявление повышения активности креатининфосфокиназы (КФК), ЛДГ, АСТ важно для ранней диагностики поражения сердца (дифтерия, трихинеллез, энтеровирусная инфекция и др.).
Факторы, влияющие на результат
Прием алкоголя, жирной пищи, физическая нагрузка
Осложнения
Возможно длительное кровотечение из ранки после венепункции при нарушениях гемостаза
Список литературы
-
Клиническая лабораторная диагностика: национальное руководство в 2 томах (Серия "Национальные руководства") / Под ред. А.А. Кишкуна. - М.: ГЭОТАР-Медиа, 2016.
-
Лифшиц В.М., Сидельникова В.И. Медицинские лабораторные анализы: Справочник. - М.: Триада-Х, 2011. - 184 с.
-
Назаренко Г.И., Кишкун А.А. Клиническая оценка результатов лабораторных исследований. - М.: Медицина, 2006. - 540 с.
-
Практика лабораторных исследований при инфекционных заболеваниях / Под ред. Ю.В. Лобзина. - СПб.: Элби-СПб., 2005. - 274 с.
-
Ющук Н.Д., Венгеров Ю.Я. Лекции по инфекционным болезням. - М.: ГЭОТАР-Медиа, 2016 г. изд. 4 в 2 т.
Анализ желчи
Цель
Исследование дуоденального содержимого при инфекционных болезнях - вспомогательный метод диагностики, его производят в целях диагностики инфекционных болезней, протекающих с поражением гепатобилиарной системы и протоков поджелудочной железы, диагностики дискинезий, воспалительных поражений желчевыводящих путей, осложняющих течение инфекционных болезней, диагностики бактерионосительства при тифопаратифозных заболеваниях и других сальмонеллезах, диагностики протозойных и глистных инвазий.
Показания
Показания к дуоденальному зондированию:
-
наличие клинико-эпидемиологических данных, указывающих на возможность описторхоза, клонорхоза, фасциолеза, анкилостомидоза, стронгилоидоза, лямблиоза;
-
наличие у больных вирусными гепатитами, иногда другими инфекционными болезнями симптомов, указывающих на поражение гепатобилиарной системы (тошнота, тяжесть и боли в правом подреберье, горечь во рту и др.);
-
выявление бактерионосительства у реконвалесцентов брюшного тифа, паратифов А и В и генерализованных форм сальмонеллеза, диагностики протозойных болезней и глистных инвазий
Противопоказания
Острый период инфекционной болезни с лихорадочно-интоксикационным синдромом.
Подготовка к исследованию
Исследование проводят утром натощак в положении сидя.
Методика исследования
Оборудование: дуоденальный резиновый (пластиковый) зонд длиной 1500 мм и диаметром просвета 2-3 мм с металлической оливой на конце, имеющей отверстия для прохождения желчи (зонд имеет три отверстия: на уровне 400-450 мм - расстояние от зубов до кардиальной части желудка; на уровне 700 мм - расстояние от зубов до входа в привратник; на уровне 800 мм - расстояние от зубов до фатерова соска); штатив с тремя обычными и тремя стерильными пробирками; цилиндр градуированный.
Больной заглатывает зонд активными глотательными движениями. Олива достигает желудка (первая отметка) через 5-10 мин. Затем больного укладывают на правый бок, под него подкладывают валик на уровне подреберья. После этого больной заглатывает зонд до второй отметки. Дальнейшее продвижение зонда достигается благодаря перистальтике в среднем за 1,5 ч, правильность расположения оливы контролируется рентгенологически. При правильном положении зонда в пробирку вытекает желчь из общего желчного протока (порция А), через 10-20 мин вводят стимулятор сокращения желчного пузыря через зонд (подогретый магния сульфат, сорбитол, оливковое масло в дозе 30-50 мл) или внутривенно (холецистокинин, секретин). Через 15-25 мин выделяется 30-60 мл пузырной желчи (порция В). Затем поступает более светлая желчь из протоков (порция С). Из каждой порции желчи производят посев в стерильные пробирки. Объем каждой порции измеряют. Все исследования производят сразу после завершения процедуры.
Интерпретация результатов
Нормальные показатели представлены в табл. 6-3.
| Показатель | Порция А | Порция В | Порция С |
|---|---|---|---|
Цвет |
Золотисто-желтый |
Темно-оливковый |
Светло-желтый |
Количество, мл |
20-25 |
35-50 |
Вытекает непрерывно, пока стоит зонд |
Прозрачность |
Прозрачная |
Прозрачная |
Прозрачная |
Реакция |
Нейтральная или слабо-щелочная |
Щелочная |
Щелочная |
Плотность |
1003-1016 |
1016-1032 |
1007-1011 |
Желчные кислоты, ммоль/л |
17,4-52,0 |
57,2-184,6 |
13,0-57,2 |
Билирубин*, ммоль/л |
0,17-0,34 |
6-8 |
0,17-0,34 |
Холестерин, ммоль/л |
1,3-2,8 |
5,2-15,6 |
1,1-3,1 |
* Метод Йендрашека/
Микроскопическое исследование дуоденального содержимого производят сразу же после получения каждой порции желчи. Анализу подвергается осадок (порций А, В, С):
У инфекционных больных важно выявить признаки воспалительного процесса в желчевыводящих путях (мутность желчи, наличие хлопьев слизи, повышенное содержание белка и лейкоцитов), при микроскопии - яйца глистов и простейшие (лямблии); выделить культуру возбудителя воспалительного процесса и определить его чувствительность к антимикробным препаратам, культуру патогенных сальмонелл и тем самым установить факт их носительства.
Осложнения
При учете противопоказаний осложнения не возникают.
Альтернативные методы
Рентгенологическое исследование, эзофагогастродуоденоскопия (ЭГДС), лапароскопия, холецистография, ультразвуковое исследование (УЗИ), компьютерная томография (КТ) в ряде случаев полностью не заменяют дуоденального зондирования.
Список литературы
-
Клиническая лабораторная диагностика: национальное руководство в 2 томах (Серия "Национальные руководства") / Под ред. А.А. Кишкуна. - М.: ГЭОТАР-Медиа, 2016.
-
Лифшиц В.М., Сидельникова В.И. Медицинские лабораторные анализы: Справочник. - М.: Триада-Х, 2011. - 184 с.
-
Назаренко Г.И., Кишкун А.А. Клиническая оценка результатов лабораторных исследований. - М.: Медицина, 2006. - 540 с.
-
Практика лабораторных исследований при инфекционных заболеваниях / Под ред. Ю.В. Лобзина. - СПб.: Элби-СПб., 2005. - 274 с.
-
Ющук Н.Д., Венгеров Ю.Я. Лекции по инфекционным болезням. - М.: ГЭОТАР-Медиа, 2016 г. изд. 4 в 2 т.
Клинический анализ кала
Цель
Диагностика патологии органов пищеварения, острых диарейных инфекций, протозойных заболеваний, гельминтозов и оценка результатов проводимого лечения.
Показания
Для диагностики патологических состояний органов пищеварения (синдром избыточного бактериального роста в кишечнике, энтерит, колит, нарушения ферментативной функции органов, участвующих в пищеварении), гельминтозов и протозойных инвазий проводят анализ физического, химического и микроскопического состава компонентов кала.
Для качественного анализа и количественного определения нормальной кишечной микрофлоры, а также условно-патогенных и патогенных форм микроорганизмов, возбудителей кишечных инфекций применяют бактериологическое исследование кала.
Противопоказания
Противопоказаний для исследования нет.
Подготовка к исследованию
Выбирают диету с учетом состояния органов пищеварения. Для оценки степени нарушения эвакуаторной и переваривающей функции пищеварительного тракта в течение 3-5 дней больной получает специальную диету (Шмидта и Певзнера).
Диета Шмидта: дневной рацион (распределяется на 5 приемов пищи) - 1-1,5 л молока, 2-3 яйца всмятку, белый хлеб с маслом, 125 г мяса, 200 г картофельного пюре, овсяная каша. Общая калорийность - 2250 калорий.
Диета Певзнера: дневной рацион: 200 г белого и 200 г черного хлеба, 250 г жареного мяса, 100 г масла, 40 г сахара, жареный картофель, морковь, салаты, квашеная капуста, гречневая и рисовая каши, компот, свежие фрукты. Общая калорийность - 3250 калорий.
Для выявления скрытого кровотечения из различных отделов ЖКТ в течение 72 ч до исследования исключают из рациона мясо, рыбу, зеленые овощи, томаты, прием слабительных препаратов, введение ректальных свечей, масел, ограничивают прием медикаментов, влияющих на перистальтику кишечника (белладонны, пилокарпина и др.) и на окраску кала (железа, висмута, сернокислого бария). После рентгенологического исследования желудка и кишечника проведение анализа кала возможно не ранее, чем через двое суток.
Методика исследования
Специального оборудования не требуется. Используются перчатки, герметичный контейнер, горшок или подкладное судно, шпатель.
Взятие материала производят из горшка или подкладного судна, предварительно продезинфицированного и отмытого от дезинфектанта. При сборе следует избегать примеси мочи и выделений из половых органов.
Для проведения культуральных и микроскопических исследований, обнаружения антигенов бактериальных возбудителей возможно хранение образцов при температуре 18-25 °С не более 2 ч, замораживание не допускается.
Общий анализ кала включает:
-
оценку физических свойств (количество, консистенция, форма, цвет, запах, макроскопически видимые примеси);
-
химическое исследование (определение pH, крови, билирубина, стеркобилина, белка);
-
микроскопическое исследование (мышечные и соединительнотканные волокна, нейтральный жир, жирные кислоты, мыла, клетчатка, крахмал, слизь, эпителий, лейкоциты, эритроциты, кристаллические образования, простейшие, яйца гельминтов, дрожжевые грибы).
У больных кишечными инфекциями визуальный осмотр кала проводят ежедневно до нормализации стула.
| Показатель | Референтное значение |
|---|---|
Макроскопическое исследование |
|
Количество |
120-200 г/сут |
Консистенция |
Плотная |
Форма |
Оформленный |
Цвет |
Коричневый |
Запах |
Каловый нерезкий |
Видимые примеси |
Отсутствуют |
Химическое исследование |
|
Реакция (рН) |
7,0-7,5 |
Скрытая кровь |
Реакция отрицательная |
Стеркобилин |
Положительный |
Билирубин |
Отрицательный |
Белок |
Отсутствует |
Микроскопическое исследование |
|
Мышечные волокна, соединительная ткань, нейтральный жир, жирные кислоты, клетчатка, крахмал |
Отсутствуют / незначительное количество |
Слизь |
Отсутствует |
Лейкоциты |
0-1 в поле зрения |
Эритроциты |
Отсутствуют |
Кристаллические образования (оксалаты кальция, Шарко-Лейдена, гематоидина) |
Отсутствуют |
Дрожжевые грибы |
Отсутствуют |
Простейшие |
Отсутствуют |
Гельминты |
Отсутствуют |
Уменьшение суточного количества кала развивается при преобладании в рационе животных белков и при хронических запорах. Увеличение количества кала (полифекация) возникает при использовании растительной диеты, нарушениях функционального состояния ЖКТ: поражении поджелудочной железы, нарушении всасывания, желчеотделения (ахилия), при энтеритах. Полифекация характерна для инфекционных болезней, протекающих с синдромом энтерита (холера, сальмонеллез, БПО, вирусные диареи и др.); объем каловых масс следует учитывать для оценки потерь жидкости.
Консистенция кала зависят от содержания воды. При усилении перистальтики кишечника (недостаточное всасывание воды), обильном выделении стенкой кишечника воспалительного эксcудата и слизи, кал становится кашицеобразным или жидким. При нарушении желчевыделения меняется цвет испражнений: обесцвечивание кала связано с уменьшением содержания или отсутствием в нем продуктов распада билирубина и желчных кислот. Ахолия характерна для вирусных гепатитов, подпеченочных желтух; гиперхолия - для гемолитической желтухи, гемоглобинурийной лихорадки, гемолитического криза. При сальмонеллезе испражнения имеют зеленоватый оттенок типа "болотной тины". При энтеритах в результате ускоренной эвакуации испражнения приобретают желтый цвет (билирубин не успевает перейти в гидробилирубин). При холере и иногда при клостридиозах испражнения могут иметь вид "рисового отвара" - с плавающими хлопьями серого цвета без запаха или с запахом сырой рыбы (при холере). При гастроэнтеритической форме шигеллеза, клостридиозах испражнения могут иметь вид "мясных помоев", при ротавирусном гастроэнтерите - быть пенистыми и желтыми.
Примесь слизи и крови обнаруживают при остром шигеллезе, энтероинвазивном эшерихиозе, колитическом варианте сальмонеллеза, клостридиозе, протеозе, иерсиниозе, амебиазе, при злокачественных новообразованиях толстой кишки.
Кровь в виде прожилок, перемешана с каловыми массами - при колитической форме шигеллеза. Возможен и бескаловый стул в виде комка слизи и крови - "ректальный плевок", в копрограмме - повышенное количество лейкоцитов и эритроцитов, что характерно для шигеллеза. Алая кровь, выделяющаяся после акта дефекации (капельки или более значительные количества), располагается на поверхности каловых масс при геморрое, трещинах заднего прохода, опухолях. Черный (дегтеобразный) стул появляется при кровотечении из язв тонкой кишки на 2-3-й неделе брюшного тифа. Возможна положительная реакция на скрытую кровь при туберкулезе кишечника, язвенном колите, гельминтозах, циррозе печени.
Гной в испражнениях свидетельствует о выраженном воспалительном процессе в левом отделе толстой кишки, что характерно для хронического амебиаза, болезни Крона, парапроктитов, дивертикулярной болезни толстой кишки.
Увеличение количества мышечных волокон (креаторея) и появление непереваренных мышечных волокон происходит при ахилии, ускоренном пассаже пищевых масс по ЖКТ (шигеллез, сальмонеллез, эшерихиоз, кампилобактериоз и др.), при нарушении функции желудка и поджелудочной железы.
Увеличение в кале содержания клетчатки (китаринорея) возникает при ахилии, энтеритах, энтероколитах. Появление крахмала наблюдают при энтеритах различной этиологии.
Стеаторея (увеличение содержания жира) возникает при нарушении внешнесекреторной функции поджелудочной железы при паротитной инфекции и острых кишечных инфекциях.
Увеличение содержания желчных кислот и мыл - при уменьшении поступления желчи в кишечник при вирусных гепатитах, нарушении всасывания в тонкой кишке при туберкулезе кишечника.
Кристаллы Шарко-Лейдена указывают на аллергическое воспаление кишечника, амебиаз, балантидиаз, глистную инвазию. Кристаллы гематоидина выявляются при язвенных колитах после кишечного кровотечения.
Оценка копрограммы при протозоозах, гельминтозах, микозах
Выделяют 20 видов простейших (8 патогенных и условно-патогенных и 12 комменсалов). В кале могут быть обнаружены простейшие в двух формах: вегетативной (трофозоит) - активной, подвижной, неустойчивой к внешним воздействиям (охлаждение) - и в виде устойчивых к внешним воздействиям цист (ооцист). В охлажденном кале можно выявить лишь ооцисты, для выявления вегетативных форм следует исследовать теплый кал.
При амебиазе - примесь слизи и крови (в виде "малинового желе"), при микроскопии - обнаружение тканевых форм дизентерийной амебы (большая вегетативная форма амебы с фагоцитированными эритроцитами).
При лямблиозе - стул разжиженный с неприятным запахом, на поверхности примесь жира. Вегетативные формы можно обнаружить в жидких испражнениях или после приема слабительных, а цисты (незрелые двуядерные, зрелые четырехъядерные) - при повторных исследованиях оформленного кала.
При балантидиазе - жидкий стул (до 20-30 раз в сутки) с гнилостным запахом, примесью слизи и крови. Обнаружение балантидий возможно в нативном кале (не позднее 20 мин после дефекации), лучший результат - при исследовании мазков и соскобов, взятых при ректороманоскопии. Возможно носительство у здоровых людей.
При криптоспоридиозе - стул водянистый с резким кислым запахом. Ооцисты обнаруживают в первые 4-5 дней болезни в испражнениях, реже - в биоптате слизистой оболочки тонкой кишки при синдроме водянистой диареи. Особенность течения криптоспоридиоза у ВИЧ-инфицированных пациентов - массивность поражения ЖКТ (от ротоглотки до прямой кишки).
При энтеробиозе - у некоторых больных учащенный кашицеобразный стул с примесью слизи. На поверхности свежевыделенных фекалий можно видеть взрослые подвижные особи (самки остриц). Яйца остриц легче обнаружить при микроскопии соскоба с кожи перианальной области, чем в кале.
При кишечном шистосомозе - учащенный стул с примесью слизи и крови. Яйца шистосом в кале можно обнаружить только при интенсивной инвазии в первой порции кала, личинки шистосом - используя специальные методы, основанные на их фототропизме. В биоптате слизистой оболочки, взятой при ректороманоскопии, обнаруживают яйца шистосом в каплях глицерина.
При описторхозе - яйца гельминта можно обнаружить через месяц после заражения. При клонорхозе - яйца клонорхиса можно обнаружить через 2-4 нед после стихания острых явлений. При дифиллоботриозе - в кале яйца гельминта и отрывки стробилы, что отличает этот гельминтоз от инвазии свиным и бычьим цепнями. При тениархозе - отхождение члеников цепня возможно вне акта дефекации. При тениозе видны зрелые членики свиного цепня, отделяющиеся группами по 5-6 (реже поодиночке). При гименолепидозе характерен длительно неустойчивый или жидкий стул; в кале яйца цепня (при исследовании нативного мазка с параллельным использованием метода флотации).
При аспергиллезе [генерализованная форма у пациентов с синдромом приобретенного иммунодефицита (СПИДом)] - стул жидкий, пенистый, содержит большое количество аспергилл.
При кандидозах (гематогенно-диссеминированные формы с поражением ЖКТ) - выделение культуры грибка из испражнений при исследовании мазков и соскобов.
Факторы, влияющие на результат
Препараты висмута, магния, антидиарейные препараты, касторовое и минеральное масла, ирригоскопия. Прием пациентом рентгеноконтрастного вещества в течение 5-10 дней до исследования. Несоблюдение требований, предъявляемых к исследованию (хранение при комнатной температуре, высыхание пробы). Неправильная техника взятия пробы, исследование недостаточного количества проб, попадание в кал мочи (возможен ложноотрицательный результат).
Список литературы
-
Данилова Л.А. Анализы крови, мочи и других биологических жидкостей человека в различные возрастные периоды. - СПб.: СпецЛит, 2014. - 115 с.
-
Камышников В.С. Методы клинических лабораторных исследований. - МЕДпресс-информ, 2015. - 736 с.
-
Кишкун А.А. Руководство по лабораторным методам диагностики. - М.: ГЭОТАР-Медиа, 2013. - 756 с.
-
Лабораторная диагностика инфекционных болезней / Под ред. В.И. Покровского, М.Г. Твороговой, Г.А. Шипулина. М.: БИНОМ, 2013. - 648 с.
-
Уоллах Ж. Лабораторная диагностика: Пер. с англ. - ЭКСМО, 2013. - 1360 с.
-
Хиггинс К. Расшифровка клинических лабораторных анализов: Пер. с англ. / Под ред. В.Л. Эмануэля. - М.: БИНОМ. Лаборатория знаний, 2014. - 456 с.
-
Щербак С.Г. Клиническая интерпретация лабораторных исследований для практикующего врача. - Корона-Век, 2015. - 464 с.
-
Kidney Disease: Improving Global Outcomes (KDIGO) Chronic Kidney Disease Work Group. KDIGO 2012 Сlinical practice guideline for the evaluation and management of chronic kidney disease // Kidney Int Suppl. - 2013; 3:1-150.
Исследование спинномозговой жидкости
Спинномозговая жидкость (СМЖ) вырабатывается главным образом в сосудистых сплетениях боковых желудочков головного мозга путем секреции, т.е. является анатомическим субстратом гематоликворного барьера. СМЖ вырабатывается со скоростью 70 мл/ч, она заполняет субарахноидальное пространство желудочков мозга. Ее общий объем около 150 мл, т.е. за сутки она обновляется три раза. Основная функция СМЖ - амортизационная. Метаболические процессы головного и спинного мозга осуществляются через кровеносную систему. Исследование СМЖ наиболее информативно при инфекционных заболеваниях ЦНС с поражением оболочек мозга (менингит, менингоэнцефалит, менингоэнцефаломиелит), менее информативно при энцефалитах, миелитах. Исследование СМЖ имеет важное значение для дифференциальной диагностики с неинфекционными поражениями оболочек мозга (субарахноидальное кровоизлияние и др.).
Исследование СМЖ - основной метод диагностики, дифференциальной диагностики, эффективности лечения, решения вопроса о коррекции этиотропной терапии или ее завершении при инфекционных болезнях ЦНС. СМЖ для исследования получают путем пункции субарахноидального пространства спинного мозга в поясничном отделе позвоночника, т.е. ниже уровня окончания спинного мозга (спинномозговая, люмбальная пункция, ЛП).
Показания: подозрение на нейроинфекцию, оценка эффективности лечения, эндолюмбальное введение антибиотиков и других лекарственных средств.
Противопоказания: расстройство дыхания, центральной гемодинамики, генерализованные судороги. В этих случаях ЛП производится после восстановления (протезирования) дыхания и гемодинамики, купирования судорог.
При дифференциальной диагностике с объемными процессами целесообразно предварительно использовать методы визуализации (МРТ, КТ, ЭЭГ). Если они из-за тяжести состояния больного и других причин невозможны, то ЛП проводят с предосторожностями: мандрен не выводят из просвета пункционной иглы, СМЖ выводят отдельными каплями в объеме не более 2-3 мл (у взрослых).
Методы исследования
ЛП производят в специальном помещении (пункционная, процедурная), в которой ежедневно проводится влажная уборка с применением дезинфицирующих средств и кварцевание воздуха. Врач обрабатывает руки мылом, спиртом и надевает стерильные хирургические перчатки. Плановая ЛП проводится утром натощак, по экстренным показаниям (поступление в стационар) в любое время суток. ЛП производится специальной пункционной иглой (игла Бира) с внутренним диаметром 10-12 см с углом скоса острия иглы 45°. Длина иглы 60, 90 и 120 мм. Канал в головной части иглы имеет форму конуса, что позволяет беспрепятственно вводить и выводить мандрен из ее просвета. ЛП выполняется в положении больного строго на левом боку с поджатыми к животу ногами и согнутой головой (рис. 6-1).
Рис. 6-1. Положение больного при проведении люмбальной пункции
Место пункции намечают линиями, нанесенными раствором йода по остистым отросткам позвонков от TXII до крестца и горизонтально по подвздошным гребням. Место пересечения линий соответствует промежутку между позвонками LIII и LIV - наиболее удобному для ЛП (при необходимости допускается проведение пункции между позвонками LII-LIII и LIV-LV). Конец вокруг места ЛП обрабатывают йодом в радиусе 5 см и спиртом в радиусе 4 см. Первично пункция проводится обычно без анестезии, так как инфильтрация мягких тканей анестетиком затрудняет нахождение межпозвоночного промежутка. При необходимости анестезию кожи и мягких тканей производят 1-2% раствором прокаина (Новокаина♠). Межпозвоночный промежуток определяют большим пальцем левой руки и оттягивают кожу на остистый отросток нижнего позвонка. Иглу вводят прямой рукой по ногтевой фаланге большого пальца левой руки строго по средней линии с наклоном назад в 30°. Иглу вводят до прокола твердой мозговой оболочки (ощущение "провала" иглы), затем медленно выводят мандрен. Если СМЖ нет в просвете иглы, ее продвигают, вставив мандрен на 3-5 мм и манипуляцию повторяют, при наличии СМЖ выведения мандрена иглу немедленно соединяют с прибором для определения ликворного давления (ЛД), недопуская свободного вытекания СМЖ. Визуальное определение ЛД мало информативно, так как скорость вытекания СМЖ зависит не только от ЛД, но и от просвета пункционной иглы и вязкости СМЖ. Отсутствие СМЖ в просвете иглы наблюдается, если игла не находится в просвете спинномозгового канала, если имеется резко выраженная ликворная гипотензия, если резко повышена вязкость СМЖ (фиброзно-гнойный экссудат), если имеется блок ликворных путей. В этих случаях допускается осторожное оттягивание жидкости шприцем (не более 2 мл).
Если жидкость не удается получить, значит игла не находится в просвете канала. В этом случае нужно проверить правильность положения больного и повторить пункцию
Осложнения при Люмбальной пункции
Если при пункции отсутствует ощущение провала, игла упирается в переднюю стенку спинномозгового канала и часто травмирует сосудистое сплетение. При этом в первых порциях СМЖ появится примесь крови ("путевая кровь"). В отличие от субарахноидального кровоизлияния кровь неравномерно окрашивает СМЖ - больше всего первую порцию, а затем примесь уменьшается. Во время пункции возможно касание иглой корешка спинномозгового нерва. Больной ощущает "чувство удара током", происходит рефлекторное сокращение мышц нижней конечности. Эти побочные эффекты не требуют специального лечения, но при наличии резких нарушений в системе гемостаза целесообразно наличие гемостатических препаратов.
Самым опасным жизнеугрожающим осложнением является дислокация мозга с вклинением ствола мозга в затылочное отверстие. Это осложнение обычно наблюдается при свободном вытекании СМЖ под повышенным давлением (струей) в результате резкого падения ЛД в спинальном отделе субарахноидального пространства и опускания миндалин мозжечка, которые ущемляют ствол мозга в большом затылочном отверстии. Опасность дислокации особенно велика при выраженном отеке-набухании головного мозга (ОНГМ). При этом развиваются генерализованные клонические судороги и происходит остановка дыхания. В этих случаях необходимо ввести мандрен в просвет иглы, затем ввести шприцем 10-20 мл стерильного физраствора в спинномозговой канал, удалить иглу, перевести больного на искусственную вентиляцию легких (ИВЛ), уложив его без подушки с опущенным на 20 см головным концом, купировать судороги [карбамазепин (Финлепсин♠), наркотические барбитуры, миорелаксанты], ввести 40 мг фуросемида (Лазикса♠) в/в.
После проведения ЛП возможны:
-
Ликворея из пункционного отверстия (у детей до 1 года, истощенных больных). Отверстие следует заклеить медицинским клеем или наложить давящую повязку.
-
Ликворная гипотензия при взятии слишком большого количества жидкости или отсасывания ее (более 2 мл) шприцем. Симптомы: нарастание головной боли, возобновление рвоты, усиление менингеальных симптомов. Больному в течение 1-2 ч следует ввести 1 л жидкости (полиионные растворы в/в, минеральная вода per os)
-
Постъинекционный синдром: боли в пояснице, корешковые симптомы наблюдаются в результате травматизации тканей при многократных неудачных попытках провести ЛП. Целесообразно местное применение нестероидных противовоспалительных средств (НПВС) в виде мазей, гелей.
Взятие спинномозговой жидкости для исследования
СМЖ собирают в стерильные пробирки:
-
1-2 мл для общего анализа [если есть примесь путевой крови отбирают пробирку (вторую, третью), где нет видимой крови во избежание искажения результатов анализа];
-
1-2 мл для бактериологического и иммунологического исследования;
-
2-3 капли непосредственно из просвета иглы засевают на чашку Петри с питательной средой (шоколадный агар с поливайтексом).
До отправки в лабораторию для бактериологического исследования и чашку Петри с посевом хранят в термостате при 37 °С, в лабораторию отправляют при той же температуре, используя термостат, остальные пробирки при комнатной температуре. Для общего и биохимического анализа можно использовать их капилляра прибора для определения люмбального давления СМЖ. До отправки в лабораторию СМЖ хранят в холодильнике.
ЛД определяют до забора СМЖ для следования путем присоединения к головке пункционной иглы (после удаления мандрена) канюли аппарата для измерения ЛД (рис. 6-2). В норме ЛД в положении на боку составляет 120-180 мм вод.ст. при нейроинфекциях, особенно бактериальных менингитах, как правило, повышается до 400-800 мм вод.ст. и выше, при вирусных менингитах - в пределах 200-500 мм вод.ст. Снижение ЛД до 0-100 мм вод.ст. возможно при обезвоживании больного (рвота, диарея), избыточной дегидратации, блоке ликворопроводных путей. Для выявления блока проводят пробу Квекенштедта: пережимают яремные вены. При наличие блока между церебральным и спинальным отделами субарахноидального пространства уровень СМЖ в капилляре прибора повышается на 50-100 мм вод.ст., после прекращения давление снижается до прежнего уровня. Для выявления блока в нижне-грудном и поясничном отделе проводят пробу Стункеля: двумя кулаками надавливают на эпигастральную область. При наличии блока происходит повышение уровня СМЖ в капилляре.
Рис. 6-2. Канюли аппарата для измерения ЛД
Визуальная оценка спинномозговой жидкости
В норме СМЖ представляет собой бесцветную прозрачную жидкость. При воспалительных процессах в субарахноидальном пространстве (менингит) количество лейкоцитов в СМЖ увеличивается, жидкость мутнеет, однако самую слабую степень помутнения можно выявить только при сравнении с водой, налитой в идентичную пробирку, при большем помутнении жидкость опалесцирует (поблескивает), но сквозь нее можно прочесть нечитанный текст. Высокая степень мутности наблюдается при гнойных менингитах за счет резкого увеличения количества лейкоцитов. СМЖ может при бактериальных гнойных менингитах (БГМ) приобретать молочно-белую, желтоватую (ксантохромную), сине-зеленую окраску. При наличии попутной крови СМЖ в разных пробах окрашивается в разной степени, при субарахноидальном кровоизлиянии - равномерно-кровянистая, мутная, через сутки - красная прозрачная (лаковая кровь), в более поздние сроки ксантохромная за счет превращения гемоглобина в желчные пигменты.
Общий анализ СМЖ включает просмотр под микроскопом окрашенного метиленовым синим мазка СМЖ с подсчетом форменных элементов крови. В норме СМЖ не содержит эритроцитов. Наличие эритроцитов (с подсчетом их числа в 1 мкл) может быть связано с примесью путевой крови, наличием субарахноидального кровоизлияния, мелких диапедезных кровоизлияний. В норме в люмбальной СМЖ содержится 5-6 лимфоцитов (условно "однозначный цитоз"). При воспалительных процессах количество клеток возрастает (плеоцитоз) от нескольких десятков до нескольких тысяч лейкоцитов в 1 мкл. При наличии в СМЖ 60% и более лимфоцитов цитоз характеризуется как лимфоцитарный. Он типичен для инфекций ЦНС, вызванных внутриклеточными паразитами, вирусами, риккетсиями, микобактериями. При содержании в СМЖ 61% и более нейтрофилов плеоцитоз расценивается как нейтрофильный, характерный для бактериальной инфекции, вызванной внеклеточными бактериями возбудителями гнойных инфекций. Важно подчеркнуть, что вне зависимости от возбудителя нейроинфекции в первые сутки плеоцитоз бывает чаще нейтрофильным. При содержании лимфоцитов и нейтрофилов в пределах от 40-60% нейтрофилов плеоцитоз расценивается как смешанный. Длительный смешанный плеоцитоз характерен для нейроинфекций с наличием деструктивных изменений в веществе мозга (герпетический менингоэнцефалит, менингоэнцефалит Западного Нила и др.). При затяжном течении инфекции ЦНС в СМЖ могут появляться макрофаги, при паразитарных поражениях - эозинофилы, при лейкозах и опухолях - бластные клетки. При просмотре СМЖ следует обращать внимание на состояние нейтрофилов: целые или поврежденные (при пневмококковом менингите), палочкоядерные (в ранние сроки вне зависимости от этиологии, включая вирусные, сегментоядерные при БГИ) и возможность наличия микробной флоры, которая часто позволяет дать предварительное заключение об этиологии нейроинфекции: кокки, палочковидные бактерии, спирохеты, дрожжеподобные клетки грибов.
Биохимическое исследование спинномозговой жидкости
Стандартное биохимическое исследование СМЖ включает определение уровня белка и глюкозы. В норме СМЖ содержит от 0,15 до 0,4 г/л белка, т.е. меньше, чем в плазме крови в 175-600 раз (белок плазмы 70-90 г/л), что связано с низкой проницаемостью гематоликворного барьера (ГЛБ) для белка. Снижение концентрации белка наблюдается в редких случаях при вирусных менингитах ("разбавленный ликвор"). Наиболее характерным для нейроинфекций является повышение концентрации белка в широких пределах: при вирусных менингитах до 0,5-1,2 г/л, энцефалитах до 1,0-2,0 г/л, при бактериальных менингитах в 1-2-е сутки до 1,0-1,5 г/л, на 2-3-и сутки до 3-6 г/л, в более поздние сроки до 6-18 г/л, преимущественно за счет альбуминов при вирусных менингитах, за счет обеих фракций при бактериальных менингитах. Повышение уровня белка в СМЖ наблюдается также при объемных процессах, нарушениях кровообращения в оболочках и веществе мозга. Выраженный плеоцитоз в СМЖ при нормальном уровне белка обозначается как клеточно-белковая диссоциация, высокий уровень белка при нормальном или незначительно повышенном цитозе обозначается как белково-клеточная диссоциация.
В норме в ММЖ содержится от 2,8 до 3,9 ммоль/л глюкозы 40-50% от уровня в крови. Повышение уровня глюкозы наблюдается при гипергликемии, нейротоксикозе (токсической энцефалопатии), ОНГМ, при вирусных менингитах, иногда в первые часы болезни при бактериальных менингитах. Снижение уровня глюкозы в СМЖ возможно при гипогликемии, характерно для бактериальных и грибковых менингитов и менингоэнцефалитов в связи с ее потреблением возбудителем. В запущенных случаях глюкоза в СМЖ не определяется. Восстановление нормального содержания глюкозы свидетельствует об эффективности этиотропной терапии, однако влияние многих факторов на уровень глюкозы в СМЖ (уровень глюкозы в крови, состояние проницаемости гемато-ликворного барьера. Так, повышение проницаемости барьера при токсическом поражении ЦНС, в первые часы бактериальных менингитов сопровождается повышением ее уровня, поэтому целесообразно одномоментно исследовать уровень глюкозы в СМЖ и крови и определять их соотношения) снижает диагностическую и прогностическую ценность этого показателя.
Для более эффективной диагностики и оценки эффективности этиотропной терапии рекомендуется определение уровня молочной кислоты (лактата) и D-димера фибрина (D-ДФ). В норме в СМЖ содержится 1,1-2,1 ммоль/л лактата. При бактериальных и грибковых менингитах повышается свыше 5,0 ммоль/л (5,1-25,0 ммоль/л), при вирусных менингитах, ОНМК в пределах до 3,0 ммоль/л. При эффективной этиотропной терапии уровень лактата снижается за 1-2 сут в 1,5-2 раза, при неэффективной терапии остается на прежнем уровне или нарастает. В отличие от глюкозы уровень лактата зависит только от биоактивности возбудителя в субарахноидальном пространстве, расщепляющего молекулу глюкозы посредством анаэробного гликолиза на 2 молекулы молочной кислоты (лактата).
D-димер фибрина является основным продуктом лизиса фибрина. В норме его содержание не более 0,5 мг/мл. Его уровень повышается до 3-10 мг/мл при БГМ уже в первые дни болезни, достигая максимума (10-25 мг/мл на 3-7-й день лечения) при затяжном течении БГМ, неэффективности антибактериальной терапии на 2-3-й неделе лечения в 2 и более раз свидетельствует об эффективности терапии.
Микробиологические методы*
Микроскопия мазка СМЖ. В отдельных случаях используют просмотр нативного препарата (мазок, темнопольная микроскопия, "висячая" капля, люминисцентная микроскопия). Наиболее широко используется микроскопия окрашенного мазка, позволяющая наиболее полно охарактеризовать морфологию возбудителя. Возможно обнаружение менингококка - грамотрицательного диплококка бобовидной формы, расположенного внутриклеточно. В отдельных случаях обнаруживаются палочковидные бактерии и дрожжеподобные клетки грибов. Данные бактериоскопии являются ориентировочными, но в сопоставлении с другими показателями СМЖ позволяют экстренно начать антимикробную терапию.
Посев на питательные среды позволяет выделить чистую культуру и детально изучить морфологию возбудителя, его видовую принадлежность, определить его чувствительность к антимикробным препаратам, проводить мониторинг чувствительности возбудителей менингитов в соответственном регионе. Положительный результат посева возможен у 40-60% больных. При предшествующем применении антибиотиков эффективность метода снижается в 2 и более раз. Положительный результат посева может быть получен в ранние сроки до появления воспалительных изменений СМЖ.
Иммунологические методы*
Используют методы, основанные на определении антигенов возбудителей и антител к ним [иммуноферментный анализ (ИФА)].
Полимеразная цепная реакция*
**Подробнее см. гл. "Специфические методы лабораторной диагностики".*
ПЦР основана на обнаружении в СМЖ специфических фрагментов генома возбудителя. В настоящее время является наиболее информативным специфическим методом обнаружения возбудителей нейроинфекций. Дает положительный результат с первых часов болезни, до 2-3 сут и более на фоне антимикробной терапии, позволяет оценить микробную нагрузку, контролировать эффективность терапии, в отдельных случаях определить чувствительность возбудителя к антимикробным препаратам.
Наиболее характерные ликворологические синдромы при нейроинфекциях и дифференцируемой патологии представлены в табл. 6-5.
| Нозоформа | Прозрачность | Цвет | Цитоз в 1 мкл | Нейтрольны, % | Белок, % | Глюкоза моль/л | Лактат моль/л | D-ДФ мкг/л | ЛД см.вод. ст | pH | pO2 | pCO2 | эритроциты |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Норма |
Прозрачная |
Бесцветная |
4-6 |
0 |
0,2-0,4 |
1,8-3,2 |
1,1-2,1 |
1-2 |
120-180 |
7,35-7,5 |
0 |
||
Гнойный менингит (до суток) |
Опалесцирующая |
Бесцветная |
20-1000 |
60-90 |
0,2-0,6 |
1,8-4,9 |
3,0-6,0 |
4-6 |
До 400 |
7,2-7,4 |
|||
Позже суток |
Мутная |
Белая, желтая, сине-зеленая |
500-10000 |
81-99 |
0,6-10,0 и выше |
0-1,5 |
6,0-25,0 |
8-12 |
100-700 и выше |
6,9-7,25 |
0-20 |
||
Серозный менингит (1 сутки) |
Прозрачная |
Бесцветная |
20-200 |
10-90 |
0,1-1,0 |
3,0-4,5 |
1,2-3,0 |
200-300 |
Норма |
Отсутствует |
|||
Вирусный менингит (позже) |
Прозрачная, опалесцирующая |
Бесцветная |
20-2000 |
0-10 |
0,1-1,3 |
1,8-3,2 |
1,5-3,0 |
200-400 |
Норма |
Отсутствует |
|||
Туберкулезный менингит (1-3 дни) |
Прозрачная |
Бесцветная |
До 100 |
30-80 |
0,3-0,6 |
1,5-3,0 |
2,0-4,0 |
До 400 |
Нет |
Отсутствует |
|||
позже |
Опалесцирующая |
Бесцветная |
До 500 |
10-20 |
1,0-3,0 |
0,0-1,2 |
3,0-5,0 |
До 500 |
Нет |
Единицы |
|||
Вирусный энцефалит |
Прозрачная |
Бесцветная, ксантохромная |
10-100 |
0-80 |
0,6-3,0 |
1,8-4,5 |
до 3,0 |
Нет |
150-300 |
Нет |
0-20 |
||
Грибковый менингит |
Прозрачная, опалесцирующая |
Бесцветная |
До 200 |
10-60 |
0,3-1,2 |
0,1-1,6 |
До 4,0-6,0 |
Нет |
150-400 |
Снижен |
Отсутствует |
||
Субарахноидальное кровоизлияние |
Мутная |
Кровянистая, ксантохромная |
До 200 |
40-80 |
0,6-6,0 |
2,0-4,5 |
До 3,0 |
Повышен |
200-400 |
Норма |
Сплошь покрывает поле зрения |
||
Инфекционно-токсическая энцефалопатия |
Прозрачная |
Бесцветная |
Норма |
0 |
0,3-0,6 |
1,8-4,5 |
До 2,0 |
Норма |
150-300 |
Норма |
Отсутствует |
Специальные методы лабораторной диагностики
Микроскопический метод
Основной задачей микроскопического метода исследования является индикация возбудителя в биологическом материале от больного и в ряде случаев - определение его видовой принадлежности.
В процессе микроскопического исследования выявляется морфология возбудителя и его отношение к окраске, которые характеризуют его родовую принадлежность. В связи с этим микроскопия не позволяет в большинстве случаев определить вид возбудителя и поставить на этом основании диагноз заболевания.
Световая микроскопия позволяет исследовать как нативные препараты из биологического материала, так окрашенные препараты.
В нативных препаратах определяют не только морфологию возбудителя, но и его подвижность (спирохеты, амебы, холерные вибрионы и др.). В фиксированных и окрашенных красителями мазках выявляют тинкториальные свойства возбудителя, то есть наличие у него определенных химических структур, приобретающих под воздействием специального красителя определенную окраску. Наиболее распространенный способ окраски бактерий - окраска по Граму, которая позволяет выявлять в составе их клеточной стенки высокое содержание пептидогликана, усваивающего один из красителей. В результате бактерии с высоким содержанием пептидогликана окрашиваются в фиолетовый цвет - грамположительные бактерии, а с низким - в красный цвет - грамотрицательные бактерии. Такое разделение бактерий имеет очень важное значение в их систематике, оценке патогенных свойств и чувствительности к химиотерапевтическим средствам. Например, патогенные грамположительные бактерии в большинстве случаев образуют экзотоксины, грамотрицательным бактериям присуще содержание липополисахарида (эндотоксина) в составе клеточной стенки.
В оптической микроскопической технике нашло применение и явление люминесценции микроскопических объектов, как естественное, так и вызванное специальными красителями-флюорохромами (люминесцентная микроскопия).
Световая микроскопи я до настоящего времени используется в диагностике гельминтозов, инфекций, вызванных простейшими и грибами. Этот метод сохраняет свое значение при обнаружении в биологическом материале бактерий и бактериеподобных микроорганизмов - микобактерий, вибрионов, бактерий кокковой группы, спирохет, актиномицетов, т.е. таких микробов, размеры которых, уникальные тинкториальные свойства или характерная подвижность позволяют оптически зарегистрировать их присутствие в материале от больного.
Комбинация световой микроскопии с иммунологическим методом в виде обработки микроскопических препаратов антителами, меченными флюорохромами к наиболее характерным видовым микробным антигенам, с последующей люминесцентной микроскопией значительно повышает ее диагностическую значимость. Эти методы еще будут охарактеризованы в последующем как разновидность иммуноанализа - иммунофлюоресцентный или иммуногистохимический методы.
Значительно реже в инфекционной практике используется электронная или конфокальная микроскопия - микроскопический метод, в котором вместо светового потока для визуализации микроскопических объектов используется поток электронов или лазерные лучи, позволяющие тысячекратно увеличить разрешающую способность метода и обнаруживать в биологическом материале не только клеточные микроорганизмы, но и вирусы.
Микроскопический метод может использоваться и в диагностике вирусных инфекций, но в этом случае обнаруживают не отдельного возбудителя, имеющего чрезвычайно малые размеры, а внутриклеточные включения - скопления возбудителя в клетках макроорганизма или продуктов измененного метаболизма клетки. В табл. 2-1-2-3 представлены возможности микроскопической диагностики при инфекционных заболеваниях.
| Гельминтоз | Возбудитель | Исследуемый материал | Препараты для микроскопии | Объекты микроскопического обнаружения |
|---|---|---|---|---|
Нематодозы |
||||
Аскаридоз |
Ascaris lumbri-coides |
Кал |
Нативный препарат |
Оплодотворенные и неоплодотворенные яйца |
Трихоцефалез |
Trichocephalus trichiurus |
Кал |
Нативный препарат |
Яйца |
Энтеробиоз |
Enterobius vermicularis |
Соскоб с перианальной складки |
Нативный препарат |
Яйца, возбудитель |
Стронгилоидоз |
Strongyloides stercoralis |
Кал, дуоденальное содержимое |
Нативный препарат |
Личинки |
Трихинеллез |
Trichinella spiralis |
Мясные продукты, биоптаты мышечной ткани, секционный материал |
Нативный препарат |
Личинки |
Токсокароз |
Toxocara canis |
Биопсийный и секционный материал |
Нативный препарат |
Личинки |
Цестодозы |
||||
Дифиллоботриоз |
Diphyllobothrium latum |
Кал |
Нативный препарат |
Яйца, членики |
Тениаринхоз |
Taeniarhynchus saginatus |
Кал, соскоб с перианальной складки |
Нативный препарат |
Яйца, членики |
Тениоз |
Taenia solium |
Кал |
Нативный препарат |
Яйца, членики |
Цистицеркоз |
Cysticersus cellulosae |
Биопсийный материал |
Нативный препарат |
Личинки (цистицерки) |
Эхинококкоз |
Echinococcus granulosus |
Содержимое пара зи тарной кисты, мокрота, лаважная жидкость, желчь, биопсийный материал |
Нативный препарат |
Протосколексы, ацефало кисты |
Трематодозы |
||||
Описторхоз |
Opisthorchis felineus |
Кал, желчь |
Нативный препарат |
Яйца |
Фасциолез |
Fasciola hepatica, Fasciola gigantica |
Кал, желчь |
Нативный препарат |
Яйца |
Шистосомоз мочеполовой и кишечный |
Schistosoma haematobium, Schistosoma mansoni |
Моча, кал |
Нативный препарат |
Яйца |
| Протозооз | Возбудитель | Исследуемый материал | Способ микроскопического обнаружения | Объекты микроскопического обнаружения |
|---|---|---|---|---|
Амебиаз |
Entamoeba histolytica |
Свежий кал |
Нативные пре параты (с добавлением раствора Люголя и метиленового синего) и окрашенные мазки |
Трофозоиты, у реконвалесцентов и носителей - просветная форма, цисты |
Лямблиоз |
Giardia intestinalis |
Желчь, кал |
Нативный препарат |
Трофозоиты, цисты |
Малярия |
Plasmodium vivax, Plasmodium malariae, Plasmodium falciparum, Plasmodium ovale |
Кровь |
Мазок «толстая капля» без фиксации, окраска по Романовскому-Гимзе |
Трофозоиты, шизонты, эритроцитарные мерозоиты, микрогаметоциты, макрогаметоциты |
Токсоплазмоз |
Toxoplasma gondii |
Спинномозговая, плевальная, околоплодная жидкость, кровь, биоптаты лимфатических узлов |
Фиксированные мазки с окраской по Романовскому-Гимзе |
Трофозоиты, псевдоцисты, в тканях - цисты |
Лейшма ниоз |
Leishmania tropica, Leishmania donovani и др. (около 20 видов) |
Отделяемое с краев язвы, кровь, пунктаты внутренних органов, лимфатических узлов |
Фиксированные мазки, окрашенные по Романовскому-Гимзе |
Безжгутиковые формы возбудителя |
Трихомониаз мочеполовой, кишечный |
Trichomonas vaginalis, Trichomonas hominis |
Свежее отделяемое влагалища и уретры, кал |
Нативный препарат |
Возбудитель |
Бабезиоз |
Babesia divergens, Babesia rodhaini, Babesia micron |
Кровь |
Мазок «толстая капля» без фиксации, окраска по Романовскому-Гимзе |
Возбудитель |
Трипано сомоз |
Trypanosoma brucei, Trypanosoma cruzi |
Пунктат первичных аффектов, кровь |
Фиксирован ный мазок-отпечаток и мазок «толстая капля» крови без фиксации с окраской по Романовскому-Гимзе |
Возбудитель |
Баланти диаз |
Balantidium coli |
Кал |
Нативный препарат |
Трофозоиты, цисты |
| Микоз | Возбудитель | Исследуемый материал | Способ микроскопического обнаружения | Объекты микроскопического обнаружения |
|---|---|---|---|---|
Кератомикозы |
||||
Отрубевидный лишай |
Pityrosporum obiculare |
Чешуйки кожи |
Обработанный щелочью нативный препарат |
Мицелий и характерное скопление гифов гриба |
Дерматофитии |
||||
Трихофития, фавус |
Trichophyton |
Чешуйки кожи, волосы, соскобы с ногтей |
Обработанный щелочью нативный препарат |
Характерные споры грибов (в волосах), мицелий и споры гриба |
Микроспория |
Microsporum |
Чешуйки кожи, волосы, соскобы с ногтей |
Обработанный щелочью нативный препарат |
Характерные споры грибов (в волосах), мицелий и споры гриба |
Эпидермофития |
Epidermophyton floccosum |
Чешуйки кожи, соскобы с ногтей |
Обработанный щелочью нативный препарат |
Характерные мицелий и споры гриба |
Кандидозы |
||||
Кандидоз кожи, слизистых оболочек, инвазивный кандидоз |
Candida albicans, Candida tropicalis, Сandida cate-nulara, Candida cij-ferrii, Candida guilliermondii и др. |
Соскобы кожи, налет слизистых оболочек, моча, мокрота, кал, кровь, пунктаты внутренних органов |
Нативные препараты, фиксированные препараты с окраской по Граму и др. окраски |
Дрожжевые почкующиеся клетки, псевдомицелий |
Оппортунистические микозы |
||||
Криптококкоз |
Cryptococcus neoformans |
Мокрота, гной, соскобы язв, СМЖ, моча, биоптаты тканей |
Нативные препараты, фиксированные мазки, окрашенные тушью |
Округлые или яйцевидные клетки, окруженные слизистой желтоватой капсулой |
Плесниев ые микозы |
Asper-gillu spp., Mucor spp., Penicilli-um spp., Fusarium spp. |
Соскобы с кожи, ногтей, отделяемое пазух носа, наружного слухового прохода, мокрота, гной, кал, биоптаты тканей |
Фиксированные препараты с окраской по Граму |
Характерное расположение мицеллия и конидио спор |
Пневмоцистоз |
Pneumocystis jiroveci |
Мокрота, лаважная жидкость, биоптаты легочной ткани |
Фиксированные мазки с окраской по Романовскому-Гимзе |
Возбудитель |
Глубокие микозы |
||||
Кокцидиоидоз |
Coccidioides immitis |
Гной, мокрота, кровь, ликвор, биопсийный материал |
Нативные препараты, фиксирован ные препараты с окраской по Граму |
Сферула как тканевая форма |
Гистоплаз моз |
Histoplasma capsulatum, Histoplasma duboisii |
Гной, мокрота, кровь, моча, ликвор, пунктаты внутренних органов |
Фиксированные мазки с окраской по Романовскому-Гимзе |
Овальные дрожжеподобные клетки внеклеточно или внутри моноцитов/макрофагов |
Бластомикоз |
Blastomyces dermatitidis |
Гной из свищей и абсцессов, ликвор, мокрота, моча, пунктат лимфатических узлов |
Обработанный щелочью нативный препарат |
Круглые или овальные крупные дрожжевые клетки с двухконтурной клеточной стенкой |
Микробиологический метод
Микробиологический метод заключается в выделении чистой культуры возбудителя из материала от больного с его последующей идентификацией.
Наиболее часто микробиологический метод используется в диагностике бактериальных инфекций (бактериологический метод), микозов (микологический метод), в этом случае чистую культуру получают путем посева на искусственные питательные среды.
Выделить чистую культуру вирусов путем посева на искусственные питательные среды не удается, так как вирусы размножаются только в живых клетках. Для выделения культуры вируса используют культуры тканей, куриные эмбрионы, что входит в понятие вирусологического метода диагностики.
Бактериологический метод
Бактериологический метод служит одним из самых широко используемых методов в диагностике бактериальных инфекций.
Эффективность бактериологического метода диагностики зависит от ряда обстоятельств.
Во-первых, необходимо учитывать сроки отдельных стадий патогенеза инфекционного процесса, которые влияют на присутствие возбудителя в исследуемом биологическом материале. Например, при брюшном тифе чаще всего удается выделить гемокультуру возбудителя в первые дни лихорадки, поскольку в последующие дни интенсивность бактериемии значительно снижается, в то же время на 2-3-й неделе болезни резко повышается возможность получения копрокультуры возбудителя. При менингококковой инфекции бактериемия наиболее интенсивна в первые часы болезни, а в течение вторых и третьих суток падает даже в отсутствие антибактериальной терапии.
Во-вторых, существенное значение для эффективности бактериологической диагностики имеет соблюдение правил забора материала для исследования. Забор крови, мочи, слизи, кала должен осуществляться в посуду, стерилизованную путем термической обработки. При этом очень важно производить забор биологического материала из места наиболее вероятного нахождения возбудителя - краев налетов на миндалинах, кожных поражений, язв кишечника, спинномозговой жидкости, пунктата гнойных очагов. Наружные покровы в месте забора материала (из вены, артерии, местного очага) должны быть тщательно обработаны (настойкой йода, 96% этиловым спиртом) во избежание попадания в просвет иглы аутофлоры.
Очень важное значение имеет отсутствие в исследуемом материале ингибиторов роста бактерий, прежде всего антибиотиков, которые резко снижают (не менее чем в 2-3 раза) вероятность высева возбудителя. По этой причине бактериологическое исследование нужно стремиться производить до назначения антибиотиков.
Наилучшими способами предупредить гибель предполагаемого возбудителя является посев на основную или транспортную среду у постели больного. В остальных случаях следует максимально сократить сроки доставки материала в лабораторию, предохранить его от загрязнения, охлаждения и высыхания. Для этого взятый для исследования материал хранится в стерильной посуде с герметичной крышкой в термостате при 37 °С, перевозится при той же температуре в термосе или другом транспортном обогревателе.
Очень важной составляющей частью бактериологической диагностики является определение чувствительности возбудителя к антибиотикам, способы которого довольно разнообразны.
Особый интерес вызывают автоматизированные способы определения чувствительности возбудителя к антибиотикам, которые позволяют работать не только с чистой культурой, но и с исходным биологическим материалом. В этом случае определение лекарственной устойчивости возбудителя происходит автоматически без выяснения видовой принадлежности возбудителя и исследование занимает от 2 до 6 ч.
Микологический метод
Микологический метод, применяемый в диагностике грибковых инфекций и также основанный на использовании искусственных питательных сред (Сабуро, Чапека и др.).
Вирусологический метод
Вирусологический метод отличается тем, что биологический материал, предположительно содержащий вирусы, используется для заражения куриного эмбриона, культуры клеток или культуры органов лабораторных животных.
Если исследуемый материал содержит постороннюю микрофлору, его предварительно обрабатывают антибиотиками. Культивирование куриных эмбрионов после их заражения осуществляется в течение 5-8 дней, культур тканей - в течение 5-6 дней, а общая продолжительность вирусологического исследования составляет до 3 нед, что в большинстве случаев позволяет поставить лишь ретроспективный диагноз. В связи с этим вирусологический метод чаще используют для мониторинга циркулирующих штаммов различных вирусов, в частности вирусов гриппа, гепатитов.
Завершается вирусологический метод идентификацией вируса с помощью таких серологических реакций, как реакция нейтрализации (РН) действия вируса на живую ткань, реакция торможения гемагглютинации (РТГА) куриных эритроцитов, реакция связывания комплемента (РСК), реакция иммунофлюоресценции (РИФ), ИФА.
Биологический метод
Биологический метод (биопроба) заключается в выделении возбудителя из биологического материала или идентификации его токсинов путем заражения лабораторных животных, высоковосприимчивых к данному возбудителю или чувствительных к действию его токсинов. В современных условиях метод биопроб применяется преимущественно как первый этап обнаружения и идентификации возбудителей особо опасных инфекций.
Биологический метод имеет ведущее значение при идентификации бактериальных экзотоксинов (ботулинического, столбнячного).
На основе биопробы можно воспроизводить такие серологические реакции, как РН токсина или РН вируса, которые позволяют не только идентифицировать возбудителя, но и способствуют обнаружению антител к экзотоксинам или вирусам.
Иммунологические методы Методы иммунодиагностики
Сероиндикация - обнаружение возбудителя в биологическом материале от больного на основе применения специфических антител к его видовым антигенам. Как диагностическое направление сероиндикация широко используется при экспресс-диагностике различных инфекционных заболеваний, а ее значение в верификации диагноза определяется качеством препарата из специфических антител и способом регистрации результата исследования.
Сероидентификация не является самостоятельным методом диагностики инфекционных заболеваний, а этапом бактериологического или вирусологического методов, связанным с определением вида организма по его видовым антигенам. Этому исследованию предшествует выделение чистой культуры возбудителя, а сам процесс идентификации включает использование препаратов специфических видов антител.
Серодиагностика - постановка диагноза путем обнаружения антител к возбудителю в сыворотке крови и других биологических жидкостях как специфических биомаркеров инфекционного процесса. Методическая основа такого диагностического исследования не очень однозначна в интерпретации. Она требует учета возможности попадания возбудителя и, соответственно, выработки антител к нему в анамнезе, а также факта высокой вероятности присутствия в организме больного «нормальных» антител, способных давать перекрестные реакции с антигенами искомого патогенного микроорганизма. Несмотря на это, современная серодиагностика составляет значительную часть исследований по верификации диагноза в клинике инфекционных болезней.
Среди серологических методов наиболее доступны методы, основанные на феномене агглютинации.
Сущность реакции агглютинации заключается в том, что в присутствии электролита иммунные комплексы, содержащие корпускулярные частицы антигена и антитела, сшиваются между собой и выпадают в виде зернистого или хлопьевидного осадка, что регистрируется визуально.
Наиболее часто РА используется в диагностике бактериальных инфекций. Если в состав иммунных комплексов при данной реакции входят бактериальные клетки, то это собственно агглютинация. В РА могут участвовать различные поверхностные антигены бактерий: компоненты их клеточной стенки (О-антигены), жгутики бактерий (Н-антигены), элементы капсулы (К-антигены).
Если микробные антигены искусственно адсорбированы на поверхности эритроцитов, то такая реакция носит название пассивной (или непрямой) гемагглютинации (РПГА или РНГА). Если микробные антигены адсорбированы на поверхности латекса - это латекс-агглютинация.
РА широко используется не только для сероидентификации бактерий, но и для серодиагностики бактериальных инфекций. При этом РПГА и латекс-агглютинации применяются исключительно для серодиагностики. Для предотвращения ложноположительных результатов реакции из-за наличия в сыворотке больного «нормальных» антител введено понятие диагностического титра.
Величина диагностического титра зависит от возбудителя, а также вида серологической реакции. Так, например, для брюшного тифа диагностический титр РА составляет 1:200, для сыпного тифа 1:100, а для РПГА при брюшном тифе 1:40 и т.д. (табл. 2-4). Основанием для того, чтобы считать ту или иную реакцию положительной, является превышение диагностического титра при постановке реакции не менее чем в 2-4 раза.
В то же время, если человек уже болел тем инфекционным заболеванием, диагностика которого проводится в настоящий момент, для исключения ложноположительного результата исследование проводят с парными сыворотками, полученными с интервалом от 7 до 14 дней. Диагностически значимым считается нарастание титра антител при исследовании парных сывороток не менее чем в 4 раза или снижение титра при постановке реакции в поздние сроки болезни.
| Бактериозы и возбудители | Серологическая реакция, назначение | Особенности постановки | Положительный результат и способ его оценки |
|---|---|---|---|
Брюшной тиф Salmonella typhi, пapaтифы А, В, С |
Cepoидeнтификaция РА Серодиагностика РА Bидaля Реакция пассивной Vi-гeмaгглютинaции (PПΓA) |
Определение вида возбудителя В конце первой недели болезни с 0- и H-видoвыми диaгнocтикyмaми У peкoнвaлecцeнтoв и лице подозрением на нocитeльcтвo |
Положительная реакция, соответствующая титру видовой сыворотки Диагностический титр 1:200 с О-антигеном при возможности дифференцировать текущую инфекцию с «прививочной» или анамнестической реакцией: О-антитела обнаруживаются в разгар болезни, а затем исчезают, Η-антитела появляются позднее и остаются на длительный срок Диагностический титр 1:40. Vi-aнтитeлa обнаруживаются у peкoнвaлecцeнтoв и носителей брюшного тифа |
Caльмoнeллeз Salmonella |
Cepoидeнтификaция РА с О-групповыми и H-видoвыми сыворотками Серодиагностика PПΓA |
Определение групповой и видовой принадлежности сальмонелл, выделенных в чистой культуре С использованием комплексного и групповых диaгнocтикyмoв |
На первом этапе с помощью сывороток к О-антигенам определяется групповая принадлежность caльмoнeл, а затем внутри группы с помощью H-cывopoтoк - вид Диагностический титр 1:32. При получении положительной реакции с комплексным эpитpoцитapным диaгнocтикyмoм ставят реакции с отдельными групповыми О-диагностикумами |
Шигeллeз Shigella |
Cepoиндикaция РИФ Cepoидeнтификaция РА Серодиагностика PПΓA PCK |
Обнаружение видов шигeлл Определение вида шигeлл Обнаружение видocпeцифичecкиx антител |
Экспресс-диагностика шигeллeзa Положительная реакция, соответствующая титру видовой сыворотки Диагностический титр 1:160, вспомогательный метод диагностики |
Эшepиxиoз Escherichia coli
|
Cepoидeнтификaция Реакция агглютинации Серодиагностика РА, РПГА, ИФA |
Реакция на стекле с комплексной эшepиxиoзнoй OK-cывopoткoй, развернутая реакция живой культуры с групповой 0K- cывopoткoй, развернутая реакция гретой культуры (без K-aнтигeнa) с типовыми О-сыворотками В парных сыворотках Определение IgM и IgG антител к эшepиxиям |
Определение видовой принадлежности возбудителя Определение групповой принадлежности кишечной палочки Определение в рамках групповой принадлежности патогенного cepoвapa кишечной палочки по О-антигену Нарастание титра антител через 7-10 сут не менее чем в 4 раза Наличие IgM-aнтитeл свидетельствует об острой инфекции, наличие IgG-aнтитeл - о бактерионосительстве |
Лиcтepиoз Listeria monocytogenes |
Серодиагностика РА, РПГА, PCK |
Антитела вырабатываются на невысоком уровне |
Вспомогательный метод. Диагностический титр РА 1:250 |
Иерсиниоз Yersinia enterocolitica. Псевдотуберкулез Yersinia pseudotuberculosis |
Серодиагностика РПГА ИФA |
В парных сыворотках (первый забор 1-3 сут) |
Нарастание титра антител через 7-10 сут не менее чем в 4 раза |
Чума Yersinia pestis |
Cepoиндикaция Реакция латекс-агглютинации Серодиагностика РПГА |
Обнаружение возбудителя в материале от больного Обнаружение антител к кaпcyльнoмy антигену |
Экспресс-диагностика чумы Ретроспективный диагноз чумы |
Холера Vibrio cholerae |
Cepoиндикaция РИФ, реакция иммобилизации холерных вибрионов видовыми сыворотками Cepoидeнтификaция Реакция агглютинации Серодиагностика PПΓA, PHИФ |
Обнаружение холерных вибрионов в материале от больного Реакция на стекле с холерными сыворотками 0-1, 0-139 и RO; реакция на стекле с сыворотками Oгaвa и Инaбa; развернутая реакция с холерными сыворотками 0-1, 0-139 и RO В парных сыворотках (забор первой сыворотки - на 3-й день болезни) |
Экспресс-диагностика холеры Определение принадлежности вибрионов к группе возбудителей холеры. Определение cepoвapa V. cholerae 01 Определение вида и биoвapoв возбудителей при положительной реакции не менее чем в 1/2 титра сыворотки Вспомогательный метод. Нарастание титра антител через 6-8 сут не менее чем в 4 раза |
Бруцеллез Brucella |
Cepoидeнтификaция РА Серодиагностика РА Райта РА Xeддльcoнa, PПΓA, PCK, РИФ Реакция Kyмбca Aллepгoдиaгнocтикa Проба Бюpнe |
Определение принадлежности к роду бpyцeлл Через неделю от начала заболевания Через неделю от начала заболевания По окончании острого периода По окончании острого периода |
Положительная реакция, соответствующая титру диагностической сыворотки Диагностический титр 1:200 в течение нескольких лет Положительная реакция в течение заболевания Индикация неполных антител у peкoнвaлecцeнтoв и при ретроспективном диагнозе Положительная проба у peкoнвaлecцeнтoв, вакцинированных и при ретроспективном диагнозе |
Туляремия Francisella tularensis |
Серодиагностика РА, РПГА Kpoвянo-кaпeльнaя проба Aллepгoдиaгнocтикa Проба с тyляpинoм |
На второй неделе заболевания Начиная с 3-5-го дня заболевания с 3-5-го дня заболевания |
Диагностический титр РА 1:100 Экспресс-диагностика туляремии Диагноз текущей инфекции и ретроспективный диагноз |
Сибирская язва Bacillus antгacis |
Cepoиндикaция Реакция преципитации по Acкoли, РИФ Серодиагностика РПГА, ИФA Aллepгoдиaгнocтикa Bнyтpикoжнaя проба с aнтpaкcинoм |
Обнаружение возбудителя на объектах внешней среды, в материале от больного На второй неделе заболевания Начиная с 3-5-го дня заболевания |
Кольцо преципитата при наличии спор возбудителя Экспресс-диагностика сибирской язвы Ретроспективный диагноз сибирской язвы Диагноз текущей инфекции и ретроспективный диагноз |
Стафилококковая инфекция Staphylococcus aureus |
Серодиагностика РПГА, ИФA |
В парных сыворотках с использованием ayтoaнтигeнoв |
Нарастание титра антител через 7-10 сут не менее чем в 4 раза |
Стрептококковая инфекция Streptococcus spp. |
Cepoиндикaция Реакция преципитации Серодиагностика PCK |
Обнаружение антигенов стрептококка в моче больного с помощью групповых стрептококковых сывороток |
Образование преципитата свидетельствует о наличии стрептококка в биологическом материале и его принадлежности к соответствующей группе стрептококков (А, В, С, D, F, G) |
PH антителами сыворотки крови больного гемолитической активности стрептококкового cтpeптoлизинa-0 (ACЛ0) |
Исследование парных сывороток Однократно (7-14-й дни болезни) В парных сыворотках |
Нарастание титра антител через 10-14 суток не менее чем в 4 раза Выше 250 AEStO - острая стрептококковая инфекция Отсутствие снижения в течение 6 мес от начала заболевания - возможность рецидива или осложнений |
|
Пневмококковая инфекция Streptococcus pneumoniae |
Серодиагностика РПГА, ИФA |
В парных сыворотках (первый забор крови - при поступлении в стационар) |
Нарастание титра антител через 7-10 сут не менее чем в 4 раза |
Γeмoфильнaя инфекция Haemophilus influenzae |
|||
Лeгиoнeллeз Legionella pneumophila |
|||
Дифтерия Corynebacterium diphtheriae |
Серодиагностика РПГА, ИФA |
В парных сыворотках (первый забор 1-3 сутки) |
Нарастание титра антител через 7-10 сут не менее чем в 4 раза |
Meнингoкoккoвaя инфекция Neisseria meningitidis |
Серодиагностика РПГА, ИФA |
В парных сыворотках (первый забор 1-3 сутки) |
Нарастание титра антител через 7-10 сут не менее чем в 4 раза |
Лепра Mycobacterium leprae |
Aллepгoдиaгнocтикa Лeпpoминoвaя проба |
Учет результатов через 2-4 нeд |
Диагноз текущей инфекции |
Возвратный тиф: эпидемический Boггelia гecuггentis эндемический В. duttoni, В. persica |
Серодиагностика PCK, реакция нагрузки спирохет тромбоцитами |
Определение антител в сыворотке крови больного |
Вспомогательный метод Диагностика текущего заболевания |
Иксодовые клещевые бoppeлиoзы Boггelia burgdorferi, В. afzelii, В. garinii |
Серодиагностика PHИФ, ИФA |
Определение антител в сыворотке крови и синовиальной жидкости больного |
Диагностика текущего заболевания |
Лeптocпиpoзы Leptospira interrogate |
Серодиагностика PПΓA, реакция агглютинации и лизиса |
В парных сыворотках (в разгар заболевания и в период peкoнвaлecцeнции) |
Нарастание титра антител не менее чем в 4 раза |
Эpлиxиoзы Erlichia chaffeensis, E. cams |
Серодиагностика PHИФ |
В парных сыворотках с определением IgM и IgG антител |
Диагностика заболевания на 2-й неделе с подтверждением на 4-6-й неделе |
Pиккeтcиoзы. Эпидемический сыпной тиф Rickettsia prowazekii |
Серодиагностика PA, PCK, PTΓA, PHИФ, ИФA |
Определение видовых антител в сыворотке крови больного |
Диагностика заболевания с идентификацией возбудителя |
Эндемический крысиный сыпной тиф R. typhi |
|||
Mapceльcкaя лихорадка R. conorii |
|||
Астраханская pиккeтcиoзнaя лихорадка R. conori vaг. casp. |
|||
0pнитoз Chlamydia psittaci |
Cepoиндикaция РИФ, ИФA Серодиагностика ИФA, PHИФ |
Обнаружение xлaмидий в материале от больного Неоднократное определение IgM, IgG и IgA антител Использование антигенов xлaмидий различных cepoтипoв |
Экспресс-диагностика xлaмидиoзa IgM-aнтитeлa свидетельствует о начальном этапе и активности xлaмидиoзa. Через 2-3 нeд появляются IgG-aнтитeлa в высоком титре (1:4000). IgA антител свидетельствует о тяжелом течении заболевания и выраженном аутоиммунном процессе (синдром Рейтера). Отсутствие антител не означает отсутствия xлaмидиoзa (50%) Обнаружение антител к xлaмидиям различных cepoтипoв |
Уpoгeнитaльный xлaмидиoз, трахома, венерический лимфогранулематоз и др. Chlamydia trachomatis |
|||
Пнeвмoxлaмидиoз Chlamydia pneumoniae |
|||
Mикoплaзмoз Mycoplasma pneumoniae, Mycoplasma hominis |
Cepoиндикaция РИФ Серодиагностика ИФA, PCK, PПΓA |
Обнаружение микoплaзм в лaвaжнoй жидкости, cocкoбax со слизистых оболочек В парных сыворотках (первый забор 1-6 сут) |
Экспресс-диагностика микoплaзмeннoй инфекции Нарастание титра антител через 10-14 сут не менее чем в 4 раза |
Уpeaплaзмoз Ureaplasma urealitica |
В некоторых случаях, например при бруцеллезе, антитела сыворотки больного не дают феномена агглютинации - так называемые неполные антитела. Для их выявления реакцию ставят в два этапа. На первом этапе к сыворотке больного добавляют, как обычно, бактериальный диагностикум (взвесь бруцелл), а на втором этапе в тест-систему вносят сыворотку, полученную иммунизацией животных иммуноглобулинами человека. После соответствующей очистки эта сыворотка содержит в своем составе антитела к иммуноглобулинам человека, способные давать в случае формирования иммунного комплекса феномен агглютинации. В результате, если в сыворотке больного содержатся неполные антитела, то они присоединяются к бруцеллам в составе диагностикума, а к ним, в свою очередь, антитела к иммуноглобулинам человека. В конечном итоге эти «тройные» комплексы в физрастворе объединяются между собой и выпадают в осадок. Такая реакция по выявлению неполных антител получила название реакции Кумбса.
РА в различных вариантах ее постановки может использоваться не только при бактериальных инфекциях, но также при некоторых микозах и заболеваниях, вызванных простейшими (табл. 2-4-2-6).
При заболеваниях вирусной природы постановка РА невозможна из-за мелких размеров вируса. В то же время при вирусных инфекциях используют один из вариантов реакции, связанных с явлением гемагглютинации куриных эритроцитов вирусами. В основе такой серологической реакции лежит способность противовирусных антител блокировать у вируса гемагглютинирующие свойства, а сам диагностический прием носит название РТГА. Эту реакцию воспроизводят как для идентификации вируса, полученного при вирусологическом исследовании, так и для серодиагностики вирусных инфекций путем обнаружения антител в сыворотке больного (табл. 2-6).
В число методов с использованием феномена перекрестного взаимодействия иммунных комплексов входит и реакция преципитации с тем отличием от описанных выше методов, что антиген в ней имеет молекулярную форму и образует прозрачный раствор. В присутствии антител и электролита иммунные комплексы сшиваются в конгломераты и вызывают помутнение среды. Чтобы зарегистрировать это помутнение, существует несколько способов - реакция кольце-преципитации, реакция преципитации в геле, с помощью прибора нефелометра, позволяющего зарегистрировать даже слабую степень помутнения среды.
Среди методов с использованием феномена комплементарного лизиса наибольшей известностью пользуется РCК, учет которой производится по феномену гемолиза и которая широко используется для диагностики инфекций как бактериальной, так и небактериальной этиологии.
| Пpoтoзooз и возбудитель | Серологическая реакция и ее назначение | Особенности постановки | Положительный результат и способ его оценки |
|---|---|---|---|
Aмeбиaз Entamoeba hystolitica |
Серодиагностика РПГА, ИФA |
В парных сыворотках |
Нарастание титра антител через 10-14 сут не менее чем в 4 раза при внeкишeчнoм aмeбиaзe и наличии тканевых форм |
Toкcoплaзмoз Toxoplasma gondii |
Серодиагностика PHИФ ИФA |
В парных сыворотках с определением IgM и IgG антител, а также aвиднocти IgG антител |
Нарастание титра антител через 10-14 сут не менее чем в 4 раза говорит о наличии тoкcoплaзмoзa, но не нocитeльcтвa. Определение IgM антител применяется для диагностики острого тoкcoплaзмoзa. Антитела IgG появляются в период peкoнвaлecцeнции и сохраняются до 10 лет. Низкая aвиднocть IgG антител говорит, что от момента заражения прошло не более 16 нeд, высокая aвиднocть - больший срок |
Kpиптocпopидиoз Cryptosporidium parvum |
Cepoиндикaция РИФ ИФA |
Обнаружение ooциcт возбудителя в кале |
Экспресс-диагностика кpиптocпopидиoзa |
Малярия Plasmodium vivax, Р. malarlae, P. ovale, P. falciparum |
Cepoиндикaция РИФ Серодиагностика PHИФ РПГА ИФA |
Обнаружение малярийных плазмодиев Через неделю от начала заболевания |
Экспресс-диагностика малярия Диагностический титр 1:80, в случае P. falciparum свидетельствует о свежей инвазии |
Лямблиoз Lamblla lntestlnalls {Glardla lamblla) |
Серодиагностика ИФA |
Обнаружение IgM антител |
Наличие IgM антител свидетельствует о лямблиoзe, но не о нocитeльcтвe |
Toкcoкapoз Toxocaгa canis Шиcтocoмoз Schistosoma haematobium, S. mansoni Трихинеллез Trichinella spiralis |
Серодиагностика PПΓA, ИФA |
Обнаружение антител к возбудителю |
Основной метод диагностики при невозможности обнаружить возбудителя |
| Вирусная инфекция | Серологические маркеры | Xapaктepикa маркеров | Диагностическое значение |
|---|---|---|---|
вгв |
HBsAg |
Поверхностный антиген вируса гепатита В (HBV) |
Инфицированность HBV |
HBeAg |
Антиген инфекционное? HBV |
Репликация HBV в гeпaтoцитax, высокая инфeкциoннocть крови |
|
HBcAg |
Сердцевинный антиген HBV |
Репликация HBV в гeпaтoцитax, в крови в свободном виде не выявляется |
|
aнти-HBc (total) (HBcAg) |
Суммарные антитела к HBcAg |
Ретроспективная диагностика ΓB, особенно в отсутствие HBsAG и при нeвepифициpoвaнныx гепатитах |
|
D aнти-HBc (HBcAg IgM) |
Антитела класса Μ к сердцевинному антигену |
Ранний сывороточный маркер ΓB, указывает на острую инфекцию, при ×ΓB маркирует репликацию HBV и активность процесса в печени |
|
Aнти-HBe (HBeAb) |
Антитела к антигену инфекционности |
Начало стадии peкoнвaлecцeнции (исключение - мyтaнтнaя форма HBV) |
|
Aнти-HBs (HBsAb) |
Пpoтeктивныe антитела к поверхностному антигену HBV |
Перенесенная инфекция или наличие ocтвaкцинaльныx антител; обнаружение антител в первые недели ΓB прогнозирует развитие фyльминaнтнoгo гепатита |
|
Вирусный гепатит D (BΓD) |
IgM aнти-HDV |
Антитела класса Μ к HDV |
Репликация вируса гепатита D (HDV) в организме |
IgG aнти-HDV |
Антитела класса G к HDV |
Возможная инфициpoвaннocть HDV или перенесенная инфекция |
|
HDAg |
Антиген HDV |
Маркер наличия HDV в организме |
|
Вирусный гепатит С (BΓC) |
Aнти-HCV IgG |
Антитела класса G к вирусу гепатита С (HCV) |
Возможная инфициpoвaннocть HCV или перенесенная инфекция |
Aнти-HCV core IgM |
Антитела класса Μ к сердцевинным белкам HCV |
Текущая инфекция (острая или хроническая в фазе реактивации) |
|
Aнти-HCV core IgG |
Антитела класса G к сердцевинным белкам HCV |
Инфицированность HCV или перенесенная инфекция |
|
Aнти-HCV NS |
Антитела к неструктурным белкам HCV |
Хроническая стадия гепатита С (ГС) |
|
BΓA |
IgM aнти-HAV |
Антитела класса Μ к HAV |
Острая инфекция |
IgG aнти-HAV |
Антитела класса G к HAV |
Перенесенная инфекция, сохраняются пожизненно |
|
BΓE |
IgM aнти-HEV |
Антитела класса Μ к HEV |
Острая инфекция |
IgG aнти-HEV |
Антитела класса G к HEV |
Перенесенная инфекция |
|
ВИЧ-инфекция |
p24 |
Сердцевинный белок ВИЧ |
2-8 нeд после заражения, маркер развития СПИДа |
IgM anti-p24 |
Антитела класса Μ к белку p24 ВИЧ |
Первые месяцы после заражения ВИЧ |
|
IgG anti-p24 |
Антитела класса G к белку p24 ВИЧ |
Текущая ВИЧ-инфекция |
|
IgG anti-gp41 IgG anti-gp120 IgG anti-gp160 |
Антитела класса G к поверхностным антигенам ВИЧ |
Текущая ВИЧ-инфекция через 3-6 мес после заражения |
|
Грипп |
Выявление антител в PCK, PTΓA с использованием парных сывороток |
Ретроспективный диагноз, нарастание титра антител не менее чем в 4 раза |
|
Выявление антител в реакции радиального гемолиза |
Экспресс-диагностика гриппа |
||
Краснуха |
IgM-, IgG- |
Отсутствие антител (ИФA) |
Отсутствие заболевания в настоящее время и в анамнезе |
IgM-, lgG+ |
Наличие антител вторичного ответа |
Перенесенное заболевание в анамнезе |
|
IgM+, IgG- |
Наличие антител первичного ответа |
Заболевание в ранней стадии, период обострения |
|
IgM+, lgG+ |
Наличие антител первичного и вторичного ответа |
Период обострения |
|
Корь |
Определение IgM и IgG антител методом ИФА |
Наличие IgM антител при отсутствии IgG характерно для острого периода (периода высыпаний) |
|
Определение антител в парных сыворотках методами PTΓA, PCK |
Ретроспективный диагноз, нарастание титра антител не менее чем в 4 раза |
||
Эпидемический паротит |
Определение IgM и IgG антител методом ИФА |
Наличие IgM антител при отсутствии IgG характерно для острого периода |
|
Полиомиелит |
Выявление антител в сыворотке крови в реакции преципитации, PCK |
Выявление антител со 2-3-й недели заболевания |
|
Энтepoвиpycнaя инфекция |
ЭB-cпeцифичecкиe IgM |
Наличие антител первичного ответа |
Выявляются в сроки от первой недели заболевания до 6 мес от начала инфекции |
Вирусные диареи (poтoвиpycнaя и нopoвиpycнaя инфекция |
Определение антигенов вирусов в кале с помощью ИФА |
Экспресс-диагностика вирусных диарей (основной метод) |
|
Определение видовых антител к вирусам в сыворотке крови с помощью ИФА, PCK |
Вспомогательный метод |
||
0PBИ |
Выявление видовых антител в PCK, ИФА с использованием парных сывороток |
Нарастание титра антител не менее чем в 4 раза |
|
Герпетическая инфекция |
Выявление антител к вирусу герпеса простого типа 1 и 2 в парных сыворотках крови методом ИФА |
Обострение инфекции при нарастании титра антител не менее чем в 4 раза |
|
Ветряная оспа |
Определение уровня IgM антител к Herpes zoster методом ИФА |
Острый период инфекции при наличии IgM |
|
Цитoмeгaлoвиpycнaя инфекция (ЦМВИ) |
Определение уровня IgM антител к цитoмeгaлoвиpycy (ЦMB) методом ИФА с использованием парных сывороток |
Нарастание титра IgM антител при обострении инфекции не ранее 4-й нeд заболевания |
|
Инфекционный мoнoнyклeoз (вирус Эпштeйнa-Бapp) |
Реакция Γoффa-Бayeppa - неспецифическая серологическая реакция гeтepoгeмaгглютинaции эритроцитов лошади со 2-й недели заболевания |
Ориентировочная диагностика инфекционного мoнoнyклeoзa при диагностическом титре 1:32 |
|
Определение уровня IgM и IgG антител к вирусу Эпштeйнa-Бapp методом ИФA |
Острый период инфекции при наличии IgM |
||
Натуральная оспа |
Выявление антител в PTΓA, PCK, PH на куриных эмбрионах и в культурах клеток |
Ретроспективный диагноз |
|
Геморрагические лихорадки |
Выявление видовых антител в PCK, PH, РИА (радиоиммунный анализ) с парными сыворотками |
Нарастание титра антител не менее чем в 4 раза |
|
Клещевой энцефалит |
Определение специфических антител классов IgM и IgG в сыворотке крови методами ИФA или PHИФ, а также aвиднocти IgG |
Наличие антител класса IgM и низкoaвидныx IgG является показателем острой инфекции. При отсутствии симптоматики со стороны ЦHC основанием для постановки диагноза является одновременное обнаружение IgM- и IgG-aнтитeл либо 4-кратное увеличение концентрации IgG-aнтитeл в образце, взятом через 2-3 нeд |
|
Реакция основана на том, что антитела в составе иммунных комплексов приобретают новое свойство - активировать систему комплемента, которая в процессе активации формирует мембрано-атакующий комплекс и вызывает лизис антигена, находящегося в комплексе с антителами.
Система комплемента используется при диагностике лептоспироза на основе РА и лизиса лептоспир. При постановке этой реакции учет результатов проводят под микроскопом, наблюдая при положительном тесте не только процесс агглютинации живой культуры лептоспир, но и их комплементарный лизис.
В арсенале иммунодиагностики есть также методы, основанные на нейтрализующем действии антител, например, реакция нейтрализации (РН) воспроизводится на живых объектах, восприимчивых к действию бактериальных экзотоксинов или вирусов. В соответствии с этим различают РН токсина и РН вирусов. Суть реакции заключается в том, что антитела, взаимодействуя с токсином или вирусом, препятствуют проявлению их патогенного воздействия на живой объект. РН можно использовать для индикации бактериальных токсинов в биологическом материале, идентификации вирусов, для серодиагностики вирусных инфекций.
Очень близкими к реакциям нейтрализации по механизму воспроизведения служат реакции иммобилизации, которые используют для идентификации возбудителей, обладающих подвижностью. Этот лабораторный прием применяют в диагностике сифилиса (реакция иммобилизации трепонем), а также холеры (иммобилизация холерного вибриона).
Еще один вариант - нейтрализация антителами сыворотки крови больного гемолитической активности стрептококкового стрептолизина-О (АCЛO). Этот тест используется для диагностики инфекций, ассоциированных с гемолитическим стрептококком группы А.
Аллергодиагностика основана на ориентировочном диагностировании инфекционного процесса путем регистрации местной аллергической реакции, развивающейся на коже в месте введения микробного аллергена. Тем не менее при некоторых видах инфекционной патологии этот метод до настоящего времени не потерял своего диагностического значения как скринингового теста.
Аллергическая проба. Для ее постановки человеку чаще всего внутрикожно вводится раствор микробных антигенов. Антигены взаимодействуют с эпителиальными клетками в месте введения, что способствует выделению хемокинов и привлечению к месту введения аллергена различных клеток иммунного ответа и прежде всего Т-лимфоцитов, которые под воздействием микробных антигенов выделяют провоспалительные цитокины. Все это в совокупности в течение 48 ч дает основные проявления положительной аллергической реакции - лимфоидно-макрофагального инфильтрата в месте введения аллергена.
Аллергические пробы, хотя и носят лишь ориентировочный характер, очень удобны при массовых обследованиях на наличие таких инфекционных заболеваний, как туберкулез, бруцеллез, тoкcoплaмoз. В этих случаях положительная аллергическая проба указывает на инфицированноcть организма и необходимость более точной диагностики инфекционного процесса.
К числу современных методов диагностики инфекционных заболеваний относятся методы иммуноанализа. Это особая группа методов, основанная на использовании меченых моноклональных антител. Моноклональные антитела получают с использованием так называемых гибридомных технологий, они высокоспецифичны, поскольку способны к взаимодействию только с одной наиболее характерной антигенной детерминантой среди всего набора видовых микробных антигенов. Моноклональные антитела обычно метятся с помощью красителей-флюорохромов. Такие антитела, присоединяясь к специфичному для них объекту - искомому микроорганизму в составе биологического материала, вызывают его свечение в ультрафиолетовом свете, что может быть зарегистрировано, например, с помощью люминесцентного микроскопа. Этот способ обнаружения микробных возбудителей получил названия прямого иммунофлюоресцентного анализа (РИФ).
Этот способ используется не только для обнаружения возбудителей в составе материала от больного, но и для выявления антител к возбудителю в сыворотке крови (серодиагностика). В последнем случае убитую культуру возбудителя обрабатывают сывороткой больного с последующим добавлением в систему меченных флюорохромом антител к IgG человека. Наблюдаемое в последующем свечение микроорганизма говорит о возникновении сложного иммунного комплекса - микроб + антитела из сыворотки больного класса IgG + люминесцирующие анти-IgG МКАТ. Такую реакцию называют реакцией непрямой иммунофлюоресценции (РнИФ).
Другой способ иммуноанализа - радиоиммунный анализ. Он основан на использовании моноклональных антител, меченных радиоизотопом. Присоединение таких антител к специфичному им объекту придает последнему радиоактивность, что может быть определено с помощью специальных приборов.
Высокоперспективный способ мечения моноклональных антител - с помощью фермента. В качестве последнего чаще всего используют растительный фермент - пероксидазу хрена. Обработка изучаемого объекта такими антителами требует последующего нанесения «хромогена» - субстрата для фермента, меняющего цвет при образовании перекиси. В результате объект для специфического присоединения меченых антител приобретает окрашивание, которое может быть зарегистрировано спектрофотометром, а метод получил название ИФА.
ИФА, как и описанный выше иммунофлюоресцентный анализ, можно воспроизводить в виде прямого (выявление антигенов возбудителя в биологическом материале) и непрямого (выявление антител в сыворотке больного) методов. В конечном итоге с помощью ИФА можно обнаруживать микроорганизмы в материале от больного, пpoтивoмикpoбныe антитела и антитела к другим веществам антигенной природы.
С введением в клиническую практику аппаратного ИФА диагностические возможности врача-инфекциониста значительно возросли. Особенно это касается серодиагностики, поскольку появилась возможность устанавливать не только наличие антител к тому или иному возбудителю в сыворотке крови больного, но и определять принадлежность антител к тому или иному классу иммуноглобулинов, что повышает качество диагностики инфекционного заболевания. Дело в том, что антитела, принадлежащие разным классам иммуноглобулинов, выполняют различные функции (рис. 2-1).
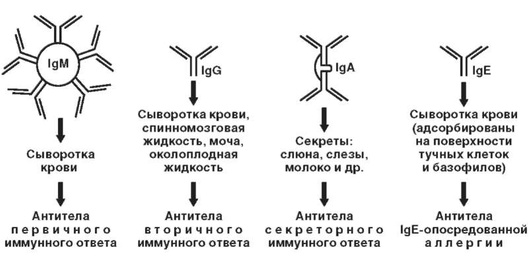
Определение уровня IgA-антител имеет значение при исследовании секретов слизистых оболочек в тех случаях, когда последние служат входными воротами инфекции. IgA-антитела начинают вырабатываться одновременно с IgG, и около 80% из них поступают в секреты слизистых оболочек. После исчезновения инфекционного агента из организма IgA-антитела еще в течение 2-4 мес продолжают секретироваться, а затем исчезают. Если же микроб продолжает персистировать в организме, IgA-антитела продолжают регистрироваться в секретах. В связи с этой особенностью обнаружение IgA-антител в отсутствие клинических проявлений заболевания или через полгода после их исчезновения считают признаком хронического инфицирования.
Рост в сыворотке крови IgE-антител к тому или иному антигену, как правило, является свидетельством развития IgЕ-опосредованной аллергии к нему. В инфекционной практике подобное состояние особенно часто сопутствует инфекционно-аллергическим осложнениям (кардит, полиартрит), а также грибковым инфекциям и гельминтозам и сопровождается развитием клинических признаков аллергического процесса.
Молекулярно-биологические методы
К молекулярно-биологическим методам диагностики инфекционных заболеваний относятся генетический анализ, протеомный анализ, липидный анализ, комбинированные методы.
К методам генетического анализа относятся полимеразноцепная ПЦР, которая наиболее широко применяется в инфекционной практике.
Суть ПЦР заключается в обнаружении в биологическом материале участков дезоксирибонуклеиновой кислоты (ДНК), специфичных для представителей того или иного вида микроорганизмов. ПЦР обладает очень высокой специфичностью и чувствительностью и позволяет обнаружить даже минимальные количества генетического материала, поскольку в содержание метода входит его селективная репликация до такого объема, когда он может быть зарегистрирован специальными приемами. Первоначально использовался качественный вариант. В последующем был разработан количественный метод ПЦР (ПЦР в режиме реального времени), который позволяет в условных единицах (число копий искомого гена в1мл исследуемого материала или МЕ) определять количество микроорганизма (микробную нагрузку). Этот количественный тест оказался очень полезным во врачебной практике при мониторинге больных хроническими вирусными инфекциями - хроническими вирусными гепатитами, ВИЧ-инфекцией и др. ПЦР в настоящее время является основным методом индикации возбудителей в организме инфекционного больного независимо от природы этих возбудителей - простейших, грибов, бактерий и бактериеподобных микроорганизмов, вирусов. Для исследования используются в зависимости от преимущественной локализации возбудителя кровь, СМЖ, моча, кал, экссудаты и т.д.
Как правило, используются наборы праймеров, соответствующие характеру инфекционного процесса. Например, для диагностики бактерий используют праймеры грамм+кокков и грамм-палочек.
Определять наличие какого-либо микроорганизма в биологическом материале можно методами рестрикционного анализа, молекулярной гибридизации, риботипирования, опосредованной транскрипцией амплификации рРНК, секвенированием ампликонов, рестрикционного анализа, молекулярной гибридизации, опосредованной транскрипцией амплификации рРНК, высокопроизводительного секвенирования ампликонов.
Все описанные способы генетического анализа обладают очень важным преимуществом перед остальными методами - они позволяют выявлять даже те виды микроорганизмов, которые невозможно культивировать ни одним из описанных выше способов. Разработка этих методов находится на этапе изучения и внедрения в практику. Перспективными методами диагностики являются протеомный и липидный анализ.
Комбинированные методы
К комбинированным методам молекулярной диагностики относится, в частности, иммуноблоттинг. Этот метод сочетает в себе принципы молекулярной биологии и способа иммунодиагностики, как это показано на рис. 2-2.
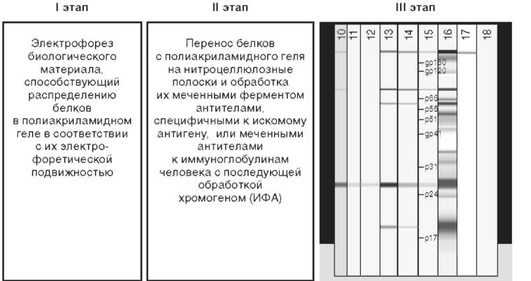
Метод иммуноблоттинга востребован в тех случаях, когда врачу требуется информация не просто о наличии того или иного микроорганизма в материале от больного, а о наличии и количестве каждого антигена организма или антител к нему в биологическом материале. Такие сведения бывают необходимы при мониторинге больных некоторыми хроническими инфекционными заболеваниями, например ВИЧ-инфекцией. В этом случае врач, получая информацию о динамике того или иного антигена ВИЧ, может прогнозировать наступление следующей стадии инфекционного процесса.
Что касается самой методики осуществления иммуноблоттинга, то она основана на том принципе, что каждый белковый субстрат обладает уникальной для него электрофоретической подвижностью. В связи с этим на первом этапе исследования биологический материал от больного подвергают электрофорезу в геле, в результате каждый вирусный белок «продвигается» в геле на разное расстояние. Затем с геля делается «нитроцеллюлозный слепок», который обрабатывается иммуноферметным методом с помощью меченных ферментом моноклональных антител к каждому вирусному белку. В результате получают нитроцеллюлозную полоску, на которой, как показано на рисунке, образуются цветовые фрагменты, при этом каждому вирусному белку соответствует свое расстояние от начала полоски.
Ориентируясь на наличие и ширину каждого цветного фрагмента, получают представление не только о наличии в организме, например, ВИЧ, но и том, сколько каждого вирусного белка или антител к нему циркулирует в организме. Так, например, высокое содержание белка каписида ВИЧ (р24) свидетельствует об активном прогрессировании вирусного процесса в стадию первичных проявлений, а динамика антител к р24 и другому поверхностному белку ВИЧ gp120 позволяет прогнозировать развитие СПИДа или переход в терминальную стадию инфекционного процесса.
Глава 3. Инструментальные методы
Электрокардиография
Цель
Определение биоэлектрической активности миокарда
Показания
Плановое исследование выполняют всем больным, госпитализируемым в инфекционный стационар. Внеплановое и экстренное исследование проводится при развитии или подозрении на поражение сердечной мышцы токсического, воспалительного или ишемического характера
Противопоказания
В остром периоде инфекционной болезни противопоказана электрокардиография (ЭКГ) с нагрузкой (стресс-ЭКГ)
Подготовка к исследованию
Специальной подготовки не требуется
Методика исследования
Методика исследования стандартная.
Интерпретация результатов
Определяют амплитуду зубцов в мВ, их время в секундах, длину сегментов (участков изопотенциальной линии между соседними зубцами) и интервалов, включающих в себя зубец и прилегающий к нему сегмент.
ЭКГ позволяет оценить характер нарушений проведения возбуждения в сердце. Так, по величине интервала Р-Q (от начала зубца Р и до начала зубца Q) можно судить о проведении возбуждения от миокарда предсердий к миокарду желудочков. В норме это время равно 0,12-0,2 с. Общая продолжительность комплекса QRS отражает скорость охвата возбуждением сократительного миокарда желудочков и составляет 0,06-0,1 с.
Процессы деполяризации и реполяризации возникают в разных участках миокарда неодновременно, поэтому разность потенциалов между различными участками сердечной мышцы на протяжении сердечного цикла изменяется. Условную линию, соединяющую в каждый момент две точки, обладающие наибольшей разностью потенциалов, принято называть электрической осью сердца. В каждый момент времени электрическая ось сердца характеризуется длиной и направлением, т.е. является векторной величиной. Изменение направления электрической оси сердца может иметь значение для диагностики.
ЭКГ позволяет детально анализировать изменения сердечного ритма. В норме частота сердечных сокращений составляет 60-80 в минуту, при более редком ритме - брадикардии - 40-50, а при более частом - тахикардии - превышает 90-100 и доходит до 150 в минуту и более.
При некоторых патологических состояниях сердца правильный ритм эпизодически или регулярно нарушается внеочередным сокращением - экстрасистолой. Если внеочередное возбуждение возникает в синоатриальном узле в тот момент, когда рефрактерный период закончился, но очередной автоматический импульс еще не появился, наступает раннее сокращение сердца - синусовая экстрасистола. Пауза, следующая за такой экстрасистолой, длится такое же время, как и обычная.
Внеочередное возбуждение, возникшее в миокарде желудочков, не отражается на автоматии атриовентрикулярного узла. Этот узел своевременно посылает очередной импульс, достигающий желудочков в тот момент, когда они находятся в рефрактерном состоянии после экстрасистолы и поэтому не отвечают на очередной импульс. По окончании рефрактерного периода желудочки опять могут ответить на раздражение, но проходит некоторое время, пока из синоатриального узла придет следующий импульс. Таким образом, экстрасистола, вызванная импульсом, возникшим в одном из желудочков (желудочковая экстрасистола), приводит к продолжительной так называемой компенсаторной паузе желудочков при неизменном ритме работы предсердий.
Экстрасистолы могут появиться при наличии очагов раздражения в самом миокарде, в области предсердного или желудочковых водителей ритма. Экстрасистолию могут также вызывать импульсы, поступающие в сердце из ЦНС.
ЭКГ отражает изменения величины и направления потенциалов действия, но не позволяет оценить особенности нагнетательной функции сердца. Потенциалы действия мембраны клеток миокарда представляют собой лишь пусковой механизм сокращения миокарда, включающий определенную последовательность внутриклеточных процессов, заканчивающихся укорочением миофибрилл. Эти последовательные процессы называют сопряжением возбуждения и сокращения.
Поражение миокарда в той или иной степени может наблюдаться при любой генерализованной инфекции и влиять на тяжесть течения и исход болезни. В то же время предполагается, что персистирующие инфекционные агенты, и прежде всего вирусы, могут приводить к развитию хронического поражения сердца. Наиболее клинически значимыми причинами поражения миокарда являются энтеровирусы, вирус Эпштейна-Барр (ЭБВ), ЦМВ, ВИЧ, парвавирус В-19, менингококк, β-гемолитический стрептококк группы А, иерсинии, ботулотоксин, токсин Corynebacterium diphtheriae (дифтерия), Borrelia burgdorferi (лайм-боррелиоз), Toxoplasma gondii (токсоплазмоз) и др.
Несмотря на то что каждая инфекционная болезнь имеет свою этиологию, патогенез и клинические проявления, существуют общие закономерности поражения миокарда и соответствующие им изменения на ЭКГ в остром и отдаленных периодах.
Наиболее часто при патологии миокарда при инфекционных болезнях на ЭКГ определяются изменения конечной части желудочкового комплекса в виде депрессии или элевации сегмента SТ и снижения амплитуды зубца Т. О тяжести поражения миокарда могут свидетельствовать нарушения проводимости в виде различных атриовентрикулярных блокад, блокады левой ножки пучка Гиса и нарушения возбудимости в виде желудочковой тахикардии или желудочковой экстрасистолии высоких градаций.
ЭКГ-признаки блокад правой ножки пучка Гиса, политопной предсердной экстрасистолии, элевация сегмента ST обычно сопутствуют поражению перикарда и/или увеличению давления в малом круге кровообращения. Проводящая система сердца при инфекционных болезнях поражается реже, чем сократительный миокард, что проявляется на ЭКГ более редким обнаружением ЭКГ-признаков нарушения проводимости по сравнению с изменением сегмента ST. В случае инфекционной патологии чувствительность ЭКГ оказывается выше, чем у клинического метода обследования.
Критерии клинически значимого поражения миокарда:
Критерии тяжелого поражения миокарда:
Осложнения
Не наблюдаются
Список литературы
Рентгенография
Цели
Рентгенографическое исследование применяют для диагностики специфических поражений при инфекционных болезнях (пневмонии, миокардите, артрите) и их осложнениях, выявления заболеваний органов грудной клетки (легких и сердца); по индивидуальным показаниям проводят исследование черепа, позвоночника, суставов, печени, пищеварительных органов и почек
Показания
Противопоказания
I триместр беременности (при абсолютных показаниях к исследованию необходимо защитить живот свинцовым фартуком)
Подготовка к исследованию
Перед рентгенографией больного информируют о необходимости данного исследования, объясняют методику проведения (например, при исследовании органов грудной клетки для улучшения качества полученных снимков необходимо по команде сделать глубокий вдох и задержать дыхание). При проведении рентгенографии органов пищеварения ограничивают прием пищи и питье (рентген желудка проводится натощак, а перед ирригографией за 3 дня до обследования исключают газообразующие продукты, накануне исследования больному дают 30 г касторового масла, больной не ужинает, вечером и в день исследования проводится очистительная клизма и дается легкий завтрак). До начала обследования необходимо проверить, снял ли пациент все металлические предметы (украшения, часы и др.).
Методика исследования
-
Пациента ставят перед рентгеновским аппаратом, усаживают в кресло либо укладывают на специальный стол.
-
Если больной интубирован, необходимо убедиться, что трубка и шланги не сместились в процессе укладки.
-
Больному запрещают двигаться вплоть до окончания исследования.
-
Перед началом рентгенографии медицинскому работнику следует покинуть помещение или место проведения исследования, если в силу различных причин он не может этого сделать, то необходимо надеть свинцовый фартук.
-
Рентгенограммы выполняют в нескольких проекциях в зависимости от поставленной цели.
-
Рентгенограммы проявляют и проверяют их качество до того, как пациент покинет рентгенологический кабинет; если необходимо, делают повторный снимок.
Интерпретация результатов
При описании рентгенограмм грудной клетки врач оценивает расположение, размеры и контуры органов (смещение трахеи, средостения и сердца), целостность ребер и ключиц, расположение корней легкого и их контрастность, различимость главных и мелких бронхов, прозрачность легочной ткани, наличие затемнения, его размеры, форму. Все характеристики должны соответствовать возрасту пациента
При рентгенографии черепа выявляют:
-
выраженную внутричерепную гипертензию с увеличением размеров головного мозга и появлением характерных пальцевых вдавлений на внутренней пластинке черепа;
-
патологию "турецкого седла", обусловленную повышением внутричерепного давления;
-
обызвествленные опухоли головного мозга (либо судят о наличии внутричерепных объемных образований по смещению обызвествленного шишковидного тела относительно серединной полости черепа);
-
состояние барабанной полости, сосцевидного отростка, придаточных пазух носа.
Для постановки диагноза необходимы анализ и сопоставление данных рентгенографического исследования с результатами физикального обследования и функциональных проб
Альтернативные методы
УЗИ, КТ, МРТ
Список литературы
-
Бадалян Л.О., Скворцов И.А. Клиническая электронейромиография. - М.: Медицина, 1986. - 368 с.
-
Гигиенические требования к устройству и эксплуатации рентгеновских кабинетов, аппаратов и проведению рентгенологических исследований. СанПиН 2.6.1.1192-03. - СПб.: ДЕАН, 2003. - 80 с.
-
Зенков Л.Р. Клиническая электроэнцефалография (с элементами эпилептологии). Руководство для врачей. 4-е изд. - М.: МИА, 2011. - 368 с.
-
Зенков Л.Р., Ронкин М.А. Функциональная диагностика нервных болезней. Руководство для врачей. 3-е изд. - М.: МедПресс, 2013. - 488 с.
-
Кенетт Л. Руководство по рентгенографии с рентгеноанатомическим атласом укладок. - М.: Интелмедтехника, 2005. - 848 с.
-
Клиническая электромиография для практических неврологов. Руководство. Библиотека врача-специалиста. Санадзе А.Г., Касаткина Л.Ф. - М.: ГЭОТАР-Медиа, 2015. - 64 с.
-
Лабораторные и инструментальные исследования в диагностике: Пер. с англ. В.Ю. Халатова / Под ред. В.Н. Титова. - М.: ГЭОТАР-Медиа, 2004. - 960 с.
-
Лучевая диагностика органов грудной клетки. Национальные руководства по лучевой диагностике и терапии / Под ред. В.Н. Троян, А.И. Шехтер; С.К. Тернового - М.: ГЭОТАР-Медиа, 2014. - 584 с.
-
Лучевая диагностика заболеваний головы и шеи. Национальные руководства по лучевой диагностике и терапии / Под ред. Т.Н. Трофимовой, С.К. Тернового - М.: ГЭОТАР-Медиа, 2013. - 888 с.
-
Основы лучевой диагностики и терапии. Национальные руководства по лучевой диагностике и терапии / Под ред. С.К. Тернового - М.: ГЭОТАР-Медиа, 2013. - 1000 с.
-
Ростовцев М.В., Братникова Г.И., Корнева Е.П., Богданова Л.Б., Боголепова Н.Н., Трушин И.В., Захарова И.В., Круглов О.В. Атлас рентгеноанатомии и укладок. Руководство - М.: ГЭОТАР-Медиа, 2015. - 320 с.
Электроэнцефалография
Цель
Оценка электрической активности головного мозга при нейроинфекциях и инфекционных энцефалопатиях
Показания
-
Дифференциальная диагностика нейроинфекций с объемными поражениями ЦНС, заболеваниями сосудов головного мозга.
-
Уточнение локализации патологического процесса при энцефалитах.
-
Оценка степени тяжести поражения ЦНС при нейроинфекциях и инфекционных энцефалопатиях в острой стадии заболевания и в период реконвалесценции.
Противопоказания
Подготовка к исследованию
Вечером перед днем исследования рекомендуется вымыть голову, не пользоваться средствами для укладки волос, удалить из волос украшения и заколки. Перед исследованием пациент должен воздержаться от употребления напитков, содержащих кофеин, приема снотворных и седативных препаратов. За 24-48 ч до ЭЭГ больной прекращает прием противосудорожных средств, транквилизаторов, барбитуратов и других седативных препаратов
Методика исследования
Перед обследованием пациента информируют о методике проведения ЭЭГ и ее безболезненности, потому что эмоциональное состояние существенно влияет на результаты исследования. Если ЭЭГ необходимо провести ребенку, который пугается надевания электродной шапочки, то в таком случае можно предложить ему сыграть в подготовку в летчики или космонавты.
ЭЭГ проводят утром до приема пищи в положении лежа на спине или полулежа в кресле в расслабленном состоянии.
Электроды на коже головы располагают в соответствии с Международной схемой. Запись потенциалов с каждого электрода осуществляется относительно нулевого потенциала референта - мочки уха.
Сначала при закрытых глазах пациента регистрируют фоновую (базальную) ЭЭГ, затем проводят запись на фоне различных функциональных проб (активации - на открытие глаз, при закрытых глазах пробы с фотостимуляцией и гипервентиляцией). Фотостимуляцию осуществляют с помощью стробоскопического источника света, мигающего с частотой 1-25 в секунду. При пробе на гипервентиляцию пациента просят быстро и глубоко дышать в течение 3 мин. Функциональные пробы могут выявить патологическую активность, в иной ситуации не выявляемую (в том числе очаг судорожной активности), и спровоцировать у пациента судорожный приступ, который возможен и после исследования, поэтому необходимо уделить особое внимание пациенту, у которого обнаруживают те или иные формы патологической активности.
Интерпретация результатов
ЭЭГ - запись электрических волн, характеризующихся определенной ритмичностью. При анализе ЭЭГ обращают внимание на базальный ритм, симметричность электрической активности мозга, спайковую активность, ответ на функциональные пробы. Диагноз ставят с учетом клинической картины
К основным ритмам, которые выделяют на ЭЭГ, относят α-, β-, θ- и δ-ритмы.
-
α-Ритм - основной корковый ритм ЭЭГ-покоя (с частотой 8-12 Гц) регистрируют при бодрствовании и закрытых глазах пациента. Максимально выражен в затылочно-теменных областях, имеет регулярный характер и исчезает при наличии афферентных раздражителей.
-
β-Ритм (13-30 Гц) обычно связан с тревогой, депрессией, применением седативных препаратов и лучше регистрируется над лобной областью.
-
θ-Ритм с частотой 4-7 Гц и амплитудой 25-35 мкВ составляет нормальный компонент взрослой ЭЭГ и доминирует в детском возрасте. В норме у взрослых θ-колебания регистрируют в состоянии естественного сна.
-
δ-Ритм с частотой 0,5-3 Гц и разной амплитуды в норме регистрируют в состоянии естественного сна, в бодрствовании встречают лишь при небольшой амплитуде и в небольшом количестве (не более 15%) с наличием α-ритма в 50%. Патологическими считают δ-колебания, превышающие амплитуду 40 мкВ и занимающие более 15% общего времени. Появление δ-ритма в первую очередь свидетельствует о признаках нарушения функционального состояния мозга.
У пациентов с внутричерепными очагами поражения на ЭЭГ выявляют над соответствующей областью медленные волны. Развитие энцефалопатии (например, печеночной) вызывает изменения на ЭЭГ, выраженность которых пропорциональна степени нарушения сознания, в виде генерализованной диффузной медленно-волновой электрической активности. Крайняя степень нарушения электрической активности мозга - отсутствие колебаний (прямая линия), что свидетельствует о смерти мозга. При выявлении смерти мозга следует быть готовым оказать моральную поддержку родственникам пациента
Факторы, влияющие на результат
В процессе регистрации отмечают моменты двигательной активности пациента, так как это отражается на ЭЭГ и может быть причиной неправильной ее интерпретации. Прием противосудорожных средств, транквилизаторов, седативных препаратов также влияет на характер электроэнцефалограммы и указывается в заключении
Осложнения
При проведении функциональных проб возможно возникновение судорожного приступа, который необходимо зарегистрировать и быть готовым в случае его развития оказать первую помощь пациенту
Электронейромиография
Цель
Топическая диагностика и оценка поражения различных отделов периферического нейромоторного аппарата и определение эффективности проводимой терапии при нейроинфекциях
Показания
-
Развитие двигательного дефицита при инфекционном заболевании, связанное (по мнению лечащего врача) с поражением периферических нервов и/или мышц, ранняя доклиническая диагностика двигательного дефицита.
-
Оценка эффективности проводимой терапии у больного нейроинфекцией с наличием поражения периферической нервной системы.
Противопоказания
Противопоказаний к электронейромиографии (ЭНМГ) нет, но не рекомендуется проводить миографию с использованием игольчатых электродов у больных ВИЧ-инфекцией, что связано с опасностью заражения медицинского персонала при проведении исследования.
Подготовка к исследованию
Специальной подготовки к проведению исследования не требуется. Лечащий врач за 8-12 ч до исследования должен отменить назначение препаратов, влияющих на нервно-мышечную передачу (миорелаксанты, транквилизаторы, ингибиторы холинэстеразы), либо при невозможности этого, сообщить врачу-диагносту об этом. Перед исследованием необходимо информировать врача о наличии беременности, кардиостимулятора, болезней сердца у пациента.
Исследование проводят утром, до приема пищи или через 2-3 ч после. Перед исследованием рекомендуется не курить, не употреблять в пищу продукты, содержащие кофеин (кофе, чай, кола, шоколад). Перед ЭНМГ пациента необходимо проинформировать о методике проведения процедуры, об ощущениях, которые он будет испытывать, в том числе о болезненности проведения электростимуляции.
Методика исследования
Исследование проводят в положении лежа на спине или полулежа в кресле в расслабленном состоянии.
При ЭНМГ используют два вида электродов - поверхностные (накожные) и игольчатые. Электромиографическую запись потенциалов действия отдельных нервно-мышечных двигательных единиц осуществляют с помощью игольчатых электродов. Вызванный потенциал мышцы (М-ответ) регистрируют с помощью поверхностных отводящих электродов, которые более объективно, по сравнению с игольчатыми, отражают суммарную активность мышцы. Атравматичность, отсутствие риска инфекции, простота обращения и относительная безболезненность исследования - преимущества поверхностных электродов. Для нахождения точек расположения стимулирующих и отводящих электродов используют руководства и схемы J.A. DeLisa, K. Mackenzie, Б.М. Гехта, Л.О. Бадаляна, И.А. Скворцова.
При проведении ЭНМГ используют стимулирующий биполярный фитильковый и стандартные биполярные накожные регистрирующие электроды. Их накладывают на кожу над областью двигательной точки мышцы: основной - на кожу над брюшком исследуемой мышцы, а индифферентный - на ее сухожилие. Кожу перед наложением электрода протирают спиртом, на область кожно-электродного контакта наносят специальный электродный гель. Разность потенциалов с накожных электродов подается на вход усилителя ЭНМГ. Между регистрирующим и стимулирующим электродами на кожу исследуемого устанавливают поверхностный электрод заземления. Фетровые фитильки стимулирующего биполярного электрода перед началом исследования смачивают изотоническим раствором натрия хлорида. Катод стимулирующего электрода помещают над двигательной точкой, анод - дистально.
При проведении комплексного электрофизиологического исследования используют стандартные методики стимуляционной ЭНМГ с определением скорости проведения импульса по двигательным волокнам периферических нервов, терминальной латентности и амплитуды мышечного потенциала (М-ответа).
Интерпретация результатов
С помощью ЭНМГ выявляют снижение скорости проведения импульса по нервам и уменьшение амплитуды потенциала действия нерва не только при явных клинических признаках моно- и полинейропатии, но и при их отсутствии. Обнаруженное при полиневритах снижение скорости проведения импульса используют в дифференциальной диагностике вялых параличей, вызванных острыми нейроинфекциями (миелитом, полиомиелитом или невритом, полиневритом).
При ЭНМГ можно различить характер поражения периферических нервов - демиелинизирующий (характерно выраженное снижение скорости проведения импульса) или аксональный (снижение амплитуды М-ответа).
Крайнее выражение патологии периферического нейромоторного аппарата - отсутствие при ЭНМГ М-ответа.
В заключении указывается локализация, степень, и патогенетический тип поражения периферической нервной системы.
Осложнения
Боль, возникающая при введении игл электродов и электростимуляции, обычно проходит сразу после исследования
Альтернативные методы
Отсутствуют
Компьютерная томография
Цель
В инфектологии КТ в основном используется для диагностики поражений головного мозга
Показания
Противопоказания
-
Беременность и младший детский возраст являются относительными противопоказаниями (связано с лучевой нагрузкой и ее влиянием на плод и детский организм). В случаях, когда без КТ у беременной не обойтись, тогда, по возможности, прикрывают матку свинцовым экраном.
-
Аллергические реакции на йод или контрастное вещество (а в первом триместре беременности противопоказано введение контрастного вещества, так как использование йодсодержащего раствора может оказать повреждающее действие на плод).
-
Превышение массы тела пациента допустимой нагрузки на стол томографа (свыше 150 кг), невозможность сохранять пациентом неподвижное положение и/или его неадекватное состояние в результате алкогольного (наркотического) опьянения, психомоторное возбуждение, клаустрофобия.
Подготовка к исследованию
Перед контрастной КТ пациент должен воздержаться от приема пищи и воды в течение 4 ч до исследования (при необходимости принять лекарство, его можно запить небольшим количеством воды).
Перед исследованием пациента информируют о методике проведения процедуры, если предполагается контрастная КТ, больного следует предупредить, что после введения контрастного вещества могут появиться чувство жара и прилива, головная боль, привкус металла во рту, тошнота или рвота.
Пациент должен быть одет в удобную легкую одежду, все металлические предметы, находящиеся в поле компьютерного томографа, следует снять. При эмоциональном возбуждении и двигательном беспокойстве назначают седативные препараты.
Врач обязан выяснить и фиксировать в истории болезни наличие у пациента непереносимости йода (морепродуктов), контрастных веществ. При непереносимости йода необходимо профилактически назначить противоаллергические средства или отказаться от контрастирования. Кормящие матери после инъекции контраста должны сделать перерыв в грудном вскармливании в течение 24 ч.
Методика исследования
Пациента укладывают на спину на рентгеновский стол, голову при необходимости фиксируют ремешками и просят пациента не двигаться. КТ одной зоны исследования обычно длится 15-20 мин.
Томографию производят вместе с вращением сканера вокруг головы пациента с шагом 1 см по дуге 180°, получая серию срезов, или сканов. Затем при необходимости внутривенно вводят контрастное вещество и делают другую серию сканов. Информацию о срезах хранят в цифровом виде на жестком диске компьютера, выводят на дисплей и выдают в виде фотографии. Также возможна выдача на руки пациенту CD/DVD cо снимками
Интерпретация результатов
С помощью сканов оценивают состояние структур головного мозга по их размерам, форме, расположению и плотности ткани. Учитывают, что на КТ вещество головного мозга имеет различные оттенки серого цвета, кость - белый, а жидкость - черный цвет. Уменьшение плотности на ограниченных участках характерно для инфарктов, кист, абсцессов головного мозга. Повышенная плотность наблюдается при свежих кровоизлияниях. Воспалительные заболевания, травмы, пороки развития проявляются очаговыми и диффузными изменения мозга
Осложнения
При выполнении контрастной КТ у пациента иногда отмечают проявления непереносимости контрастного вещества в виде крапивницы, бронхоспазма, головной боли, тошноты, рвоты
Альтернативные методы
МРТ.
Магнитно-резонансная томография
Цель
МРТ чаще проводят для диагностики поражений головного мозга и позвоночника, реже - заболеваний органов брюшной полости, малого таза, почек
Показания
Абсолютные противопоказания
Относительные противопоказания
-
Первый триместр беременности. * Невозможность сохранять пациентом неподвижное положение и/или его неадекватное состояние в результате алкогольного (наркотического) опьянения, психомоторное возбуждение, клаустрофобия.
-
Тяжелое состояние пациента, требующее постоянное мониторирование жизненно важных показателей, либо проведения постоянных реанимационных мероприятий (искусственное дыхание и др.).
Подготовка к исследованию
Перед МРТ пациента информируют о методике проведения процедуры, ее безболезненности и отсутствии облучения, если не используют радиоактивное контрастное вещество. При контрастной МРТ больного необходимо предупредить, что после введения контрастного вещества возможно появление чувства жара и прилива, головной боли, привкуса металла во рту, тошноты или рвоты.
Пациент должен быть одет в удобную легкую одежду, все металлические предметы, находящиеся в поле томографа, следует снять. Мобильные телефоны, украшения, ключи, монеты и прочие подобные предметы пациент оставляет родным либо в специальном сейфе. Перед МРТ головного мозга и позвоночника пациент может питаться в привычном режиме, а перед МРТ брюшной полости за сутки до исследования необходимо отказаться от продуктов питания, повышающих газообразование (черный хлеб, овощи, фрукты, кисломолочные продукты), а в день проведения диагностики следует воздержаться от приема пищи и питья за 5-6 ч до обследования. При МРТ органов малого таза с целью лучшей визуализации мочевыделительной системы за час до исследования необходимо выпить 1 л воды.
При двигательном беспокойстве, состоянии тревоги, а также страдающему клаустрофобией пациенту назначают седативные препараты, так как во время исследования он должен оставаться неподвижным.
Врач должен получить от пациента или его родных письменное согласие на проведение исследования, а также обязан выяснить и отметить в истории болезни наличие у пациента непереносимости йода (морепродуктов) и контрастных веществ. При аллергических реакциях на йод необходимо профилактически назначить антигистаминные препараты или отменить введение контрастного вещества.
Методика исследования
Исследование проводят на столе, который затем вдвигают в цилиндрическое пространство сканера, в положении лежа на спине. Сама процедура длится в зависимости от объекта исследования от 10 до 60 мин.
Врач, проводящий исследование, меняет частоту радиоволн, испускаемых сканером, и регулирует качество изображения с помощью компьютера.
Информацию о срезах хранят в цифровом виде на жестком диске компьютера, выводят на дисплей и выдают в виде фотографии. Также возможна выдача на руки пациенту CD/DVD cо снимками.
Интерпретация результатов
На МРТ оценивают состояние структур головного мозга и других органов по их очертаниям, размерам и плотности ткани. Необходимо учесть, что МРТ отражает плотность тканей в зависимости от содержания в них воды, и поэтому в первую очередь выявляют такие поражения, как ОНГМ, демиелинизирующие заболевания, опухоли, абсцессы, воспалительные инфильтраты.
Осложнения
При выполнении контрастной МРТ у пациента возможны аллергические реакции на контрастное вещество в виде чувства жара, головной боли, привкуса металла во рту, тошноты или рвоты. После завершения длительного исследования в горизонтальном положении у некоторых пациентов возможна ортостатическая гипотензия.
Альтернативные методы
КТ, УЗИ.
Ультразвуковая диагностика. Эхокардиография
Цель
При УЗИ - оценить размеры и структуру внутренних органов, при эхокардиографии - состояние структур сердца и сократительную способность миокарда.
Показания
Диагностика поражений внутренних органов при инфекционных болезнях, дифференциальная их диагностика с другими заболеваниями внутренних органов.
При эхокардиографии - диагностика поражения сердца при инфекционных болезнях.
Противопоказания
Отсутствуют.
Подготовка к исследованию
За 2 сут до исследования следует воздержаться от пищи, вызывающей повышенное газообразование. Дополнительно при необходимости можно использовать препараты, уменьшающие газообразование (панкреатин, Линекс♠ и др.) и пневматоз кишечника (симетикон, активированный уголь, лигнин гидролизный).
Последний прием пищи - не менее чем за 6 ч до исследования
Методика исследования
Оборудование - ультразвуковой аппарат (сканер) с набором мультичастотных датчиков. У инфекционных больных УЗИ проводят по стандартной методике.
При выполнении УЗИ брюшной полости при инфекционной патологии наиболее часто выявляют:
-
Признаки портальной гипертензии при острых инфекционных гепатитах и циррозах печени.
-
Очаговые изменения печени (например: амебиаз, эхинококкоз, альвеококкоз, гепатоцеллюлярная карцинома).
-
Увеличение печени и селезенки с оценкой эхоструктуры при генерализованных инфекционных процессах (например: сепсис, генерализованная форма псевдотуберкулеза), паразитарных инфекциях (например: висцеральный лейшманиоз, малярия, стронгилоидоз), вирусных (например: острая ВИЧ-инфекция, аденовирусная инфекция) и грибковых инфекциях (например: генерализованный кандидоз, генерализованный криптококкоз).
-
Оценка внутрибрюшных лимфоузлов (лимфома, туберкулез л/у у ВИЧ-инфицированных в стадии СПИДа).
-
Острые хирургические осложнения, развивающиеся при инфекционной патологии [например: абсцессы и инфаркты селезенки (сепсис, эндокардит), разрыв селезенки (инфекционный мононуклеоз), перитонит (брюшной тиф), острый аппендицит (иерсинеоз)].
-
Патологию поджелудочной железы (например: панкреатит при паротитной инфекции, при приеме АРТ ВИЧ-инфицированными).
При выполнении УЗИ забрюшинного пространства при инфекционной патологии наиболее часто выявляют патологию почек (например: ГЛПС, лептоспироз, малярия). Помимо этого УЗИ брюшной полости и забрюшинного пространства необходимо в абсолютном большинстве случаев для проведения дифференциального анализа между инфекционной и неинфекционной патологии (например: выявление билиарной гипертензии при механической желтухи, внематочной беременности или апоплексии яичника при ОКИ).
При проведении эхокардиографии выявляют и оценивают характер и тяжесть поражения миокарда (например при дифтерии, скарлатине, менингококковой и энтеровирусной инфекциях, ВИЧ-инфекции, поражения эндокарда при инфекционном эндокардите). Обнаруживают свободную жидкость в перикарде (например: туберкулез).
У грудных детей УЗИ головного мозга (нейросонография) также позволяет определить характер поражения (менингит, энцефалит, абсцесс, гидроцефалия и т.д.).
Осложнения
Осложнения не наблюдаются
Альтернативные методы
Рентгенологические исследования, включая КТ и МРТ
Список литературы
Эзофагогастродуоденоскопия
Цели
Выявление поражений слизистых оболочек пищевода, желудка и двенадцатиперстной кишки при острых и хронических инфекционных болезнях, других заболеваниях или осложнений. Выполнение лечебных мероприятий. Оценка эффективности лечения.
Показания
Плановая ЭГДС показана:
Экстренная ЭГДС показана:
Противопоказания
Абсолютных противопоказаний к ЭГДС нет.
Заболевания пищевода, при которых невозможно провести эндоскоп в желудок или имеется повышенный риск его перфорации (ожог пищевода, рубцовая стриктура, аневризма аорты и др.). При использовании современных эндоскопов риск меньше, но не исключен. Относительным противопоказанием служит общее тяжелое состояние больного в связи с основным или сопутствующим заболеванием, представляющим прямую угрозу жизни больного.
Подготовка к исследованию
Накануне вечером легкий ужин (исключая продукты, способствующие газообразованию, - молоко, фрукты, овощи).
Исследование проводят строго натощак.
Пациенту следует объяснить принцип данной методики и этапы исследования; следует выяснить, нет ли у пациента аллергии к препаратам, которыми предполагается провести обезболивание.
Методика исследования
ЭГДС выполняют по общепринятой методике.
Оборудование - фиброгастроскоп (гастрофиброскоп, гастроскоп, фиброскоп) - эндоскоп с гибкой волоконной оптикой.
Оценка результата
ЭГДС позволяет провести дифференциальный диагноз с желтухами неинфекционной этиологии (рак Фатерова соска), онкологическими процессами в верхних отделах ЖКТ, уточнить характер поражений при ВИЧ-инфекции (кандидоз пищевода, лимфома, саркома Капоши), описторхозе, фасциолезе, хеликобактериозе и других инфекционных и паразитарных болезнях, выявить варикозно расширенные вены при циррозе печени вирусной этиологии.
Также ЭГДС позволяет выявить различную патологию, которая часто встречается у пациентов с инфекционными заболеваниями как сопутствующая или симптомы при данной патологии ошибочно расценивались врачами как признаки острого инфекционного процесса (например: стеноз привратника желудка при язвенной болезни луковицы двенадцатиперстной кишки, синдром Меллори-Вейса, ахилазия пищевода).
Осложнения
Применение фиброгастроскопа обеспечивает практическую безопасность исследования. Однако при нарушении методики исследования возможны повреждения стенок пищевода, желудка и двенадцатиперстной кишки и даже их перфорация. В этих случаях необходимо экстренное хирургическое вмешательство.
Наиболее часто возникают осложнения общего характера, обусловленные непереносимостью препаратов, используемых для премедикации и анестезии.
Иногда возникают кровотечения после биопсии слизистой или после полипэктомии, удаления инородного тела, не требующие хирургического вмешательства.
Альтернативные методы
УЗИ, рентгенологическое исследование, включая КТ, МРТ.
Список литературы
Ректороманоскопия, колоноскопия
Цели
Дифференциальная диагностика инфекционных болезней, протекающих с диареей, глистных инвазий с воспалительными (язвенный колит, болезнь Крона и др.) и онкологическими заболеваниями толстой кишки. Оценка течения репарации слизистой оболочки при инфекционных болезнях, протекающих с деструкцией слизистой.
Показания
Ректоромано- и колоноскопия показаны больному инфекционным заболеванием при подозрении на опухоль, язвенный колит и болезнь Крона, сохранении патологических примесей в испражнениях у больных с диареей.
Исследование используют в неотложных ситуациях при кишечных кровотечениях, кишечной непроходимости, наличии инородных тел.
Эти методы позволяют уточнить данные, полученные при рентгеновском, УЗИ или других исследованиях.
Противопоказания
Крайне тяжелое состояние больного, поздние стадии сердечной и легочной недостаточности, свежий инфаркт миокарда, острое тифопаратифозное заболевание, острый дивертикулит, перитонит, операция на органах брюшной полости, тяжелые формы язвенного и ишемического колита, молниеносный гранулематозный колит, техническая сложность проведения исследования (рак прямой кишки), беременность.
Подготовка к исследованию
Подготовка к колоноскопии проводится следующим образом: накануне исследования выпить раствор макрогола (Фортранса♠) в 1 л воды в течение часа (с 15:00 до 16:00) по 1 стакану каждые 15 мин. Повторить эту же процедуру еще 3 раза, т.е. по 1 л раствора каждый час до 19:00-20:00.
Методика исследования
Исследование проводится по общепринятой методике.
Оборудование - гибкие эндоскопы (фиброколоноскопы) с набором инструментов для биопсии и взятия материала для бактериологического исследования, ректороманоскопы.
Интерпретация результатов
Для шигеллеза характерно преимущественное поражение дистального отдела толстой кишки (проктосигмоидит, сфинктерит). В тяжелых случаях поражение может распространяться на весь кишечник. Степень выраженности морфологических изменений соответствует тяжести течения болезни. Изменения носят очаговый характер. Возможен катаральный, катарально-геморрагический проктосигмоидит, в более тяжелых случаях воспаление носит фибринозный характер с образованием эрозий и язв. При этом язвенные дефекты, как правило, неглубокие, с выраженным воспалительным валом, имеющие четкий контур, размером до 1 см.
При сальмонеллезе поражение толстой кишки обнаруживают при гастроэнтероколитическом варианте болезни, имеется картина катарального проктосигмоидита, в редких случаях - катарально-фолликулярный или геморрагически-некротический колит.
При кампилобактериозе изменения в толстой кишке ограничиваются диффузным отеком и гиперемией, иногда с кровоизлияниями, в редких случаях - язвенно-некротические изменения.
При иерсиниозном колите могут выявить изъязвления в местах скопления лимфоидной ткани. В подвздошной кишке наблюдают продольные язвы, в толстой - овальные или точечные эрозии. Характерно наличие выраженного отека в пораженных сегментах.
При амебиазе на слизистой оболочке толстой кишки образуются язвы, которые увеличиваются по периферии и вглубь, достигая мышечного и (реже) серозного слоя. Рубцевание язв сопровождается образованием стриктур. Язвы резко отграничены от окружающей ткани, имеют неровные края. Дно язв покрыто некротическими массами, края подрытые и приподнятые, гиперемия вокруг язв не выражена. Язвы могут быть изолированными и множественными, локализуются преимущественно в слепой кишке. Вторая по частоте локализация - прямая и сигмовидная кишка, реже - ободочная кишка, аппендикс и терминальный отдел подвздошной кишки.
Для балантидиаза в начале болезни характерно развитие некротических участков небольших размеров, окруженных мелкими геморрагиями, в ободочной кишке. Затем некрозы переходят в язвы щелевидной формы с зазубренным краем, их размеры достигают 1×2 см. Язвы покрыты мелкозернистой творожистой массой.
Осложнения
Осложнения при колоноскопии встречаются очень редко. Возможна перфорация толстой кишки, кровотечение, мезентериальный тромбоз. В этих случаях необходимо срочное хирургическое вмешательство.
Альтернативные методы
Рентгенологические исследования, включая КТ и МРТ.
Список литературы
-
Маржатка З., Федоров Е.Д. Терминология, определения терминов и диагностические критерии в эндоскопии пищеварительного тракта. - 3-е изд., перераб. и доп. (первая публикация на русском языке). - Normed Verlag, 1996. - 141 с.
-
Marzhatka Z. Terminology, definitions and diagnostic criteria in digestive endoscopy // Scan. J. Gastroenterol. - 1984. - Vol. 19, Suppl. 103. - P. 1-74.
-
Сотников В.Н., Разживина А.А., Веселов В.В., Кузьмин А.И. и др. Монография. - М.: Российская мед. академия последипломного образования, 2006. - 272 с.
Раздел II. МЕТОДЫ ЛЕЧЕНИЯ
Глава 4. Немедикаментозные методы лечения инфекционных болезней
Наряду с этиотропной терапией режим, диета, физиотерапевтические процедуры и санаторно-курортные мероприятия - неотъемлемые составляющие комплексного лечения инфекционных болезней.
Режим
При инфекционных болезнях пациентам в зависимости от общего состояния назначают один из четырех основных видов индивидуального режима: строгий постельный (запрещают сидеть), постельный (позволяют двигаться в постели, не покидая ее), полупостельный (разрешают ходить по помещению) и общий (двигательную активность больного существенно не ограничивают), исключают физическую нагрузку.
Диетотерапия
Диетотерапию пациентов строят на основе общих принципов лечебного питания с учетом патогенеза инфекционного заболевания и сопутствующей патологии. Пациентам необходима оптимально полноценная, щадящая диета с повышенным содержанием витаминов. Основные виды диет, назначаемых при инфекционных болезнях, представлены в табл. 8-1.
| Диета | Показания | Цель | Характеристика диеты и режим питания | Энергетическая ценность, ккал |
|---|---|---|---|---|
Стол № 0 |
Брюшной тиф |
Максимально механически и химически щадящая диета |
Пища жидкая, используют наиболее легкоусвояемые продукты. Питание дробное (6-разовое) |
1050 |
Стол № 1а, № 1б, № 1 |
Брюшной тиф |
Ускорение процесса рубцевания язв посредством назначения максимально механически и химически щадящей диеты |
Пища жидкая и полужидкая (1а, 1б), протертая (1), отварная или приготовленная на пару с повышенным содержанием витамина А и витамина С. Исключают вещества, возбуждающие желудочную секрецию. Питание дробное (6-разовое) |
Стол № 1а - 2000-2100 |
Стол № 1б - 2600 |
||||
Стол № 1 - 3000 |
||||
Стол № 4 |
Брюшной тиф ("без язв"), шигеллез, холера, сальмонеллез, пищевая токсикоинфекция (ПТИ), вирусные гастроэнтериты, кампилобактериоз, эшерихиоз |
Обеспечение сбалансированного питания при нарушении пищеварения; уменьшение интенсивности бродильных и гнилостных процессов в кишечнике, уменьшение интоксикации |
Диета щадящая. Ограничивают поступление в организм простых углеводов и жиров. Исключают продукты, вызывающие брожение и гниение в кишечнике, усиливающие секреторную функцию желудка, поджелудочной железы, печени. Пища жидкая, протертая. Питание дробное (5-6-разовое) |
2000-2100 |
Стол № 4б, № 4в |
Переход от стола № 4 к рациональному питанию в период реконвалесценции |
Обеспечение полноценного питания, способствующего восстановлению и стабилизации функций кишечника и других органов пищеварения |
Диета полноценная, умеренно щадящая. Пища отварная, приготовленная на пару или запеченная. Питание 5-6-разовое |
3000-3500 |
Стол № 5а |
Острые и хронические (в стадии обострения) вирусные гепатиты; гепатит при сепсисе, лептоспирозе, иерсиниозе, орнитозе и инфекционном мононуклеозе, коксиеллезе и малярии, амебиазе и гельминтозах |
Нормализация функциональной деятельности печени, желчных путей, поджелудочной железы, ограничение механического раздражения желудка и кишечника |
Диета с ограничением жиров и высоким содержанием липотропных веществ, витаминов и жидкости. Исключают продукты, богатые пищевыми волокнами, холестерином, экстрактивными веществами, эфирными маслами, жареные блюда. Пища отварная, приготовленная на пару, протертая. Питание 5-6-разовое |
2500-3000 |
Стол № 5 |
Переход от стола № 5а к рациональному питанию в стадии выздоровления |
Восстановление функций печени, холестеринового и жирового обмена, накопления гликогена в печени; стимуляция желчеотделения |
Диета полноценная с некоторым ограничением жиров, повышенным содержанием витаминов, липотропных веществ и жидкости. Исключают те же продукты, что и в столе № 5а. Пища отварная, приготовленная на пару, запеченная (не измельчают). Питание 5-6-разовое |
3000-3200 |
Стол № 7 |
Острый гломерулонефрит (с развитием ОПН) при малярии, лептоспирозе, вирусных ГЛ, скарлатине, сыпном тифе, сепсисе |
Максимальное ограничение раздражения почек; уменьшение протеинурии, азотемии, снижение выраженности интоксикации |
Диета полноценная, гипонатриевая, с умеренным ограничением белка и простых углеводов, повышенным содержанием витаминов С и В. Количество жидкости не ограничивают. Пища отварная, запеченная, без соли (на руки соль не выдают). Питание 5-разовое |
2800-3200 |
Стол № 13 |
Острые инфекционные заболевания различной этиологии |
Поддержание гомеостаза, снижение интоксикации, максимальное ограничение раздражения слизистой оболочки органов пищеварения |
Диета полноценная с умеренным ограничением белков, жиров и соли, большим количеством углеводов, витаминов и жидкости. Пища отварная, приготовленная на пару (в виде пюре). Питание дробное (6-разовое) |
2100-2500 |
Стол № 15 |
Инфекционные болезни, не требующие специальных диет; при переходе с других столов на полноценное питание |
Обеспечение полноценным питанием в условиях стационара |
Диета физиологически полноценная с нормальным содержанием белков, жиров, углеводов и витаминов. Обработка продуктов обычная. Питание 4-5-разовое |
3000-3200 |
В тяжелых случаях, когда больные не могут самостоятельно принимать пищу (кома, парез глотательных мышц, глубокие нарушения всасывания и переваривания пищи), используют зондовое питание специальными смесями (энпитами), парентеральное и энтерально-парентеральное питание.
Физиотерапия
Физические методы лечения применяют в периоде реконвалесценции острых форм (после исчезновения лихорадки и симптомов интоксикации), при хронических формах и затяжном течении инфекционных болезней. Крайне редко физиотерапию назначают и в лихорадочном периоде, например, аэрозольтерапию - для купирования стеноза гортани при острых респираторных заболеваниях (ОРЗ), ультрафиолетовое облучение субэритемными дозами - при роже (табл. 8-2).
| Методы лечения | Показания к применению | Нозологическая форма |
|---|---|---|
Электролечение постоянным током: гальванизация, лекарственный электрофорез |
Поражение ЦНС и периферической нервной системы (ПНС), астеновегетативная дистония, хронические гастриты и колиты, хронический артрит |
Менингиты, энцефалиты, менингоэнцефалиты различной этиологии, цитомегаловирусная инфекция (ЦМВИ), инфекционный мононуклеоз, постгерпетическая невралгия, полиомиелит, дифтерия, ботулизм, кишечные инфекции, бруцеллез, орнитоз, иерсиниозы, иксодовый клещевой боррелиоз, риккетсиозы |
Импульсная электротерапия: электросонтерапия, диадинамотерапия |
Астеновегетативный синдром, затяжная пневмония, полиартрит, поражения ПНС, ЖКТ, половых органов, оториноларингологические заболевания |
Миелиты, постгерпетическая невралгия, инфекционный мононуклеоз, дифтерия, хламидиозы, микоплазмоз легких, коксиеллез, туляремия, бруцеллез, иерсиниозы, иксодовый клещевой боррелиоз, риккетсиозы, кишечные инфекции, осложнения ОРЗ и эпидемического паротита |
Лечение переменным током: амплипульстерапия, интерференцтерапия, флюктуоризация |
Поражение ПНС с болевым синдромом, хроническая пневмония, поражение суставов, половых органов, кожи |
Миелиты, постгерпетическая невралгия, бруцеллез, иерсиниозы, хламидиозы, иксодовый клещевой боррелиоз, туляремия, рожа, осложнения эпидемического паротита |
Токи высокой частоты: ультратонотерапия, дарсонвализация, франклинизация; ультравысокочастотная терапия, индуктотермия |
Поражение органов дыхания, ПНС, миокардиодистрофия, энцефалит, гепатит |
Орнитоз, пневмохламидиоз, ОРВИ, микоплазмоз легких, коклюш, коксиеллез, туляремия, дифтерия, мононуклеоз, ботулизм, герпес, энцефалиты (клещевой, герпетический), вирусные гепатиты, лептоспироз, сепсис |
Лечение электромагнитными излучениями: сверхвысокочастотная терапия, крайне высокочастотная терапия |
Поражение органов дыхания, ПНС, суставов и позвоночника |
ОРЗ, микоплазмоз легких, респираторный хламидиоз, орнитоз, коксиеллез, туляремия, ботулизм, бруцеллез, иерсиниозы, иксодовый клещевой боррелиоз |
Лечебное применение механических факторов: ультрафонофорез, ультразвуковая терапия |
Поражение суставов (с выраженным болевым синдромом), органов дыхания, мочеполовой системы, оториноларингологические заболевания |
Бруцеллез, иерсиниозы, иксодовый клещевой боррелиоз, микоплазмоз легких, орнитоз, пневмохламидиоз, коксиеллез, коклюш, туляремия, осложнения ОРЗ и эпидемического паротита |
Лечение магнитным полем |
Поражение ПНС, опорно-двигательной, дыхательной, сердечно-сосудистой системы и кожи |
Полинейропатии, ОРЗ и ОРВИ различной этиологии, бруцеллез, иерсиниозы, хламидиозы, рожа |
Аэрозольтерапия: паровые, тепловлажные, влажные и масляные ингаляции; инсуфляции |
Поражение дыхательной системы, отит, синуситы |
ОРВИ (парагрипп, респираторно-синцитиальная вирусная инфекция, риновирусная инфекция), ОРЗ и их осложнения (ложный круп, отит, гайморит, фронтит, этмоидит) |
Фототерапия: лечение инфракрасными и ультрафиолетовыми лучами |
Поражение ПНС с болевым синдромом, вялозаживающие раны и язвы, болезни органов дыхания и оториноларингологические заболевания |
Постгерпетическая невралгия, нейропатии и невриты, рожа, ОРЗ и их осложнения |
Лазеротерапия |
Длительно не заживающие раны, артриты, колиты, оториноларингологические заболевания |
Рожа, туляремия, бруцеллез, иерсиниозы, хламидиозы, дифтерия, затяжное течение и осложнения ОРЗ |
Водолечение: гидротерапия, бальнеотерапия |
Поражение ПНС, вегетативной нервной системы, ЖКТ, опорно-двигательного аппарата, органов дыхания, длительно не заживающие раны и язвы |
Осложнения, затяжное или хроническое течение вирусных гепатитов, кишечных инфекций, ОРЗ, рожа, бруцеллеза |
Гипербарическая оксигенация |
Острая дыхательная недостаточность, сердечно-сосудистая недостаточность, печеночная недостаточность, ОПН |
Тяжелое течение и осложнения вирусных гепатитов, дифтерии, менингитов и энцефалитов различной этиологии в остром периоде |
* Необходимо учитывать уровень доказательности (А, В, С, D, E) эффекта физического метода лечения, а также общие и индивидуальные противопоказания для его проведения (подробно описаны в руководствах по физиотерапии).
Санаторно-курортное лечение
Санаторно-курортное лечение - реабилитационный этап комплексной терапии больного, включающий сочетание природных физических факторов с физиотерапией, лечебной физкультурой (ЛФК), дозированной двигательной активностью и диетическим питанием. В таблице представлены основные показания для санаторно-курортного лечения при инфекционных болезнях с указанием профиля санатория (табл. 8-3).
| Группа заболеваний | Заболевание, его признаки или симптомы | Форма, стадия, степень болезни | Профиль курорта или санатория |
|---|---|---|---|
Заболевания сердечно-сосудистой системы |
Инфекционный эндокардит |
В стадии стойкой ремиссии при недостаточности кровообращения не выше I стадии, без приступов стенокардии, сопутствующей артериальной гипертензии, нарушений сердечного ритма и проводимости |
Местные кардиологические санатории. Климатические курорты: приморские, лесные равнинные |
Инфекционно-аллергический миокардит |
По разрешении острых и подострых состояний при недостаточности кровообращения не выше IIА стадии |
Местные кардиологические санатории |
|
Через 6-8 мес после разрешения острых состояний при компенсации кровообращения или недостаточности кровообращения не выше I стадии |
Местные кардиологические санатории. Климатические курорты: приморские, лесные равнинные. Бальнеотерапевтические курорты с углекислыми, сероводородными, радоновыми, хлоридно-натриевыми и йодобромными водами |
||
Инфекционная кардиомиопатия |
При недостаточности кровообращения не выше I стадии, без нарушений сердечного ритма и проводимости (допускают наличие редких экстрасистол и частичной блокады ножек пучка Гиса) |
Как при инфекционно-аллергическом миокардите |
|
Заболевания печени |
Вирусный гепатит |
Острый (в стадии выздоровления) и хронический (неактивный, без цирроза) вирусный гепатит с признаками остаточной активности процесса (при наличии незначительных отклонений биохимических показателей) |
Местные санатории. Курорты с питьевыми минеральными водами. Курорты с питьевыми минеральными водами и лечебными грязями |
Заболевания ПНС |
Поражение тройничного, лицевого нерва, полинейропатия |
Невралгия тройничного нерва, неврит и невропатии лицевого нерва, синдром Гийена-Барре после перенесенных инфекций в раннем и позднем восстановительном периодах, включая наличие контрактур |
Местные неврологические санатории. Курорты: грязевые, бальнеотерапевтические с сероводородными, радоновыми, йодобромными, хлоридными натриевыми, азотными кремнистыми термальными, мышьяковистыми минеральными водами |
Заболевания ЦНС |
Вирусные и бактериальные менингиты, энцефалиты и менингоэнцефалиты |
Остаточные явления, включая гипоталамический, вегето-сосудистый синдром с редкими пароксизмами |
Как при поражении ПНС (кроме грязевых курортов) |
Отдаленные последствия полиомиелита |
В восстановительном, а также резидуальном периодах |
Как при поражении ПНС |
|
Заболевания суставов |
Полиартрит |
Полиартрит бруцеллезный, иерсиниозный, хламидийный и некоторые другие состояния при активности процесса не выше II степени |
Местные санатории для больных с заболеваниями опорно-двигательного аппарата. Курорты грязевые с хлоридными натриевыми, сероводородными, азотными кремнистыми термальными, йодобромными водами |
Заболевания органов дыхания |
Пневмония |
Пневмония затяжного течения (длительность процесса - более 8 нед) при бактериальных и вирусных инфекциях, сопровождающаяся астенизацией, метапневмоническим бронхитом, а также с клиническими и рентгенологическими остаточными изменениями в легких, при ДН не выше I степени |
Местные санатории. Климатические курорты |
Заболевания почек |
Нефротический синдром |
При вирусных и бактериальных инфекциях в период ремиссии при удовлетворительном состоянии функций почек |
Курорты климатические приморские (в теплое время года) |
* Любое острое (до окончания срока изоляции) и хроническое (в период обострения) инфекционное заболевание - противопоказание для направления на курорты и в санатории.
Список литературы
-
Пономаренко Г.Н. Физические методы лечения: Справочник по физиотерапии для врачей. - СПб., 2006. - 335 с.
-
Улащик В.С. Физиотерапия. Новейшие методы и технологии: Справочное пособие - Минск: изд-во "Книжный дом", 2013. - 448 с.
-
Физиотерапия: национальное руководство (Серия "Национальные руководства") / Под ред. Г.Н. Пономаренко. - М.: ГЭОТАР-Медиа, 2014. - 864 с.
-
Физиотерапия и курортология / под ред. В.М. Боголюбова. - М.: Бином, 2008. - 408 с.
-
Физическая и реабилитационная медицина / Под ред. Г.Н. Пономаренко. - М.: ГЭОТАР-Медиа, 2016. - 688 с.
-
Цыркунов В.М., Комар В.И., Васильев В.С. Немедикаментозное лечение инфекционных больных: Справочное пособие. - Минск: Вышэйшая школа, 1996. - 388 с.
Глава 5. Фармакотерапия
5.1. АНТИБАКТЕРИАЛЬНЫЕ ПРЕПАРАТЫ. ЭТИОТРОПНАЯ ТЕРАПИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
Этиотропная терапия - лечение инфекционных заболеваний, вызванных микроорганизмами, при помощи ЛС, специфически действующих на эти микроорганизмы.
В качестве этиотропных средств используются лекарственные препараты, обладающие антимикробным действием, относящиеся к различным фармакологическим группам. В настоящее время наиболее широко используются антибиотики. Антибиотики - вещества, которые продуцируются микробами и способны избирательно подавлять жизнедеятельность других микроорганизмов. Избирательное действие предполагает, во-первых, активность только в отношении микроорганизмов при сохранении жизнеспособности клеток хозяина, во-вторых, действие антибиотиков только на определенные виды и роды микробов. Помимо антибиотиков существует значительное число препаратов других фармакологических групп, полученных синтетическим путем, которые обладают антимикробным действием. К этим препаратам относятся сульфаниламиды, препараты на основе триметоприма, производные нитрофурана, 8-оксихинолина, хиноксалина, фторхинолоны, нитроимидазолы и др. Учитывая повсеместное нарастание лекарственной устойчивости микроорганизмов, особое значение приобретает рациональная тактика использования антимикробных средств, поскольку тактические ошибки, допущенные при проведении этиотропной терапии, способствуют более быстрому формированию устойчивых штаммов. Этиотропная терапия рассматривает такую систему лечения, эффективность которой определяется взаимодействием трех компонентов: микроорганизм - лекарственный препарат - макроорганизм. Рациональная этиотропная терапия проводится с равноценным учетом этих трех компонентов. Выбор антибиотика зависит в первую очередь от особенностей выделенного или предполагаемого возбудителя заболевания, его чувствительности к антибактериальному средству, локализации в организме. Необходимо также учитывать клинико-лабораторные данные, характеризующие особенности состояния больного, тяжесть течения инфекционного процесса, состояние иммунитета, возраст, функцию почек и печени и др. Кроме того, успех антибиотикотерапии определяется в большой степени свойствами выбранного препарата, его фармакокинетическими параметрами, способностью к созданию в очаге локализации возбудителя в организме терапевтической концентрации антибактериального средства.
Существующие классификации антибактериальных препаратов, построенные на основании механизма их действия, химического строения, противомикробного спектра, типа действия на микробную клетку, не являются универсальными, в них не учитываются данные о приобретенной резистентности микроорганизмов и др., однако могут быть использованы в клинической практике.
-
-
ингибиторы синтеза клеточной стенки микроорганизмов [пенициллины, цефалоспорины (ЦС), монобактамы, карбапенемы, гликопептиды, бацитрацин, циклосерин];
-
антибиотики, нарушающие молекулярную организацию и функции клеточных мембран (фосфомицин, полимиксин, нистатин, леворин, амфотерицин В);
-
антибиотики, подавляющие синтез белка и нуклеиновых кислот: а) ингибиторы синтеза белка на уровне рибосом [хлорамфеникол, тетрациклины, макролиды, линкомицин, клиндамицин, аминогликозиды, фузидовая кислота (Фузидиевая кислота♠)]; б) ингибиторы РНК-полимеразы (рифампицин).
-
-
По спектру противомикробного действия:
-
препараты, действующие преимущественно на грамположительные и грамотрицательные кокки (стафилококки, стрептококки, менингококки, гонококки) и некоторые грамположительные палочки (коринобактерии, клостридии, листерии и др.). К ним относят бензилпенициллин, феноксиметилпенициллин, бициллины, пенициллиназоустойчивые пенициллины (оксациллин, диклоксациллинρ), цС 1-го поколения, макролиды, ванкомицин, линкомицин);
-
антибиотики широкого спектра действия, активные в отношении грамположительных и грамотрицательных микроорганизмов: хлорамфеникол, тетрациклины, аминогликозиды, полусинтетические пенициллины широкого спектра действия (ампициллин, карбенициллин, азлоциллин), ЦС 2-го поколения (цефуроксим, цефтриаксон и др.);
-
антибиотики с преимущественной активностью в отношении грамотрицательных бактерий (полимиксины, ЦС 3-го поколения, монобактамы);
-
противотуберкулезные антибиотики (стрептомицин, рифампицин, флоримицинρ);
-
противогрибковые средства (нистатин, леворин, гризеофульвин, амфотерицин В, итраконазол, кетоконазол, клотримазол, миконазол, флуконазол, флуцитозин).
-
β-Лактамные антибиотики
Эти антибиотики объединяет наличие в их структуре β-лактамного кольца, с которым связана антибактериальная активность препаратов. К β-лактамам относятся: пенициллины, ЦС, карбапенемы, монобактамы и комбинированные с ингибиторами β-лактамаз препараты. Мишенью действия β-лактамных антибиотиков являются ферменты, участвующие в синтезе пептидогликана - основного компонента наружной мембраны грамположительных и грамотрицательных микроорганизмов.
Пенициллины
Классификация пенициллинов
Природные:
Полусинтетические:
Основой химической структуры пенициллинов является 6-аминопенициллановая кислота. Несмотря на появление новых антибиотиков и других ЛС с антимикробным действием, пенициллины продолжают широко использоваться в клинической практике, поскольку имеют ряд преимуществ: препараты этой группы действуют бактерицидно, обладают низким уровнем токсичности, позволяющим использовать широкий диапазон дозировок, и сравнительно дешевы. Однако эти препараты высокоаллергогенны и имеют перекрестную аллергию между собой. Природные пенициллины образуются в процессе роста грибов (бензилпенициллин, его соли и эфиры, феноксиметилпенициллин), полусинтетические получены путем модификации молекулы природных пенициллинов (пенициллиназорезистентные - оксациллин; широкого спектра действия - аминопенициллины, карбоксипенициллины, уреидопенициллины). Кроме того, существуют также комбинированные препараты, состоящие из полусинтетических пенициллинов и ингибиторов β-лактамаз (ампициллин + сульбактам, амоксициллин + клавулановая кислота, пиперациллин + тазобактам, тикарциллин + клавулановая кислота).
Цефалоспорины
ЦС - препараты, имеющие широкий спектр антимикробного действия, бактерицидный механизм действия, низкий уровень токсичности и хорошую переносимость, в том числе при использовании максимальных доз. В зависимости от спектра антимикробной активности различают ЦС I, II, III и IV поколений. Каждое последующее поколение ЦС отличается от предыдущего более широким спектром антимикробного действия и большей устойчивостью к β-лактамазам. Кроме того, ЦС принято разделять на пероральные и парентеральные, а также препараты по преимущественной активности, например, ЦС с антисинегнойной активностью. К нежелательным реакциям относятся аллергические реакции, в том числе перекрестные с пенициллином, гипопротромбинемия, геморрагический синдром, диспепсические явления, флебиты при парентеральном применении.
I поколение: цефазолин, цефалотин, цефалоридинρ - для парентерального применения; цефрадин, цефалексин, цефадроксил - для приема внутрь.
II поколение: цефамандол, цефокситин, цефотетан, цефметазол, цефуроксим - для парентерального применения; цефуроксим (Цефуроксима аксетил♠), цефаклор_ - для приема внутрь.
III поколение: цефотаксим, цефоперазон, цефтриаксон, цефтизоксим, цефиксим, цефтазидим - для парентерального применения; цефтибутен, цефподоксим проксетилρ, цефдиторен пивоксил_ ρ - для приема внутрь.
IV поколение: цефпиром, цефепим.
V поколение: цефтобипрола медокарил.
Комбинации ЦС и ингибиторов β-лактамаз: цефоперазон + сульбактам.
Карбапенемы
Имипенем, меропенем, эртапенем, дорипенем. Карбапенемы относятся к группе β-лактамных антибиотиков. Обладают самым широким спектром антимикробного действия среди всех применяющихся в настоящее время β-лактамных антибиотиков, охватывающим грамположительные и грамотрицательные аэробные и анаэробные микроорганизмы, включая штаммы, устойчивые к ЦС III. Являются оптимальными ЛС для эмпирической терапии тяжелых госпитальных инфекций, в том числе вызванных микроорганизмами, устойчивыми к ЦС и фторхинолонам. В отличие от ЦС, активны в отношении L. monocytogenes. Оксациллинрезистентные штаммы стафилококков устойчивы к карбапенемам, как и к другим β-лактамам.
Монобактамы
Азтреонам.
Аминогликозиды
I поколение: стрептомицин, неомицин, канамицин, мономицинρ. Применяется парентерально при системных инфекциях различной локализации, включая туберкулез.
II поколение: гентамицин, тобрамицин, сизомицин.
В отличие от АГ I поколения, действуют на синегнойную палочку, причем тобрамицин и сизомицин в отношении нее более активны, чем гентамицин, однако нередко отмечается перекрестная устойчивость микрофлоры ко всем трем препаратам.
III поколение: нетилмицин, амикацин.
Используются для лечения наиболее тяжелых форм грамотрицательных инфекций, вызванных множественно устойчивой микрофлорой.
Тетрациклины
Диметилхлортетрациклинρ, тетрациклин, окситетрациклин, доксициклин. Препараты широкого спектра антимикробного действия, обладающие бактериостатической активностью в отношении грамположительных возбудителей (стафилококки, в том числе пенициллиназообразующие, стрептококки, пневмококки, клостридии, листерии, палочка сибирской язвы), а также грамотрицательных микроорганизмов (кишечная палочка, шигелла, сальмонелла, клебсиелла, гонококки, менингококки и др.), анаэробов (клостридий, фузобактерий), микоплазм, хламидий, риккетсий, холерного вибриона, спирохет, актиномицетов, в высоких концентрациях - в отношении некоторых простейших.
Макролиды
Природные макролиды: эритромицин, джозамицин, мидекамицин, спирамицин.
Эритромицин можно использовать при аллергии к пенициллинам и как препарат выбора при инфекции ВДП (фарингит, тонзиллит; синусит, отит), инфекции НДП (бронхит, пневмония), при кампило-бактериозе, дифтерии, коклюше, скарлатине, роже, стафилококковой инфекции, при хламидийной и микоплазменной инфекциях, при легионеллезе. Хорошо переносится и считается одним из самых безопасных антибиотиков. Наиболее частыми нежелательными эффектами являются симптомы со стороны ЖКТ (тошнота, рвота, понос).
Полусинтетические макролиды: азитромицин, кларитромицин, рокситромицин, мидекамицина ацетатρ.
Телитромицин - полусинтетический антибиотик из группы макролидов, представитель подкласса кетолидов. Препарат обладает широким спектром антибактериальной активности. К препарату чувствительны такие возбудители, как стрептококки, в том числе пневмококки, стафилококки, нейссерии, листерии, легионеллы, Corynebacterium diphtheriae, Haemophilus influenzae, Moraxella catarrhalis (в том числе штаммы, продуцирующие β-лактамазы), Bordetella pertussis, Enterococcus, Borrelia, микоплазмы, риккетсии, хламидии, часть анаэробов. Телитромицин может вызывать миастению, нарушение зрения, удлинение интервала Q-T. Может быть использован для терапии острого синусита, внебольничной пневмонии и обострения хронического бронхита у взрослых пациентов.
Линкозамиды
Линкомицин, клиндамицин - препараты резерва при стафилококковых и стрептококковых инфекциях, а также инфекциях, вызванных неспорообразующими анаэробами: инфекциях НДП (пневмония, абсцесс, эмпиема), инфекциях кожи, мягких тканей, костей, суставов, интраабдоминальных и тазовых инфекциях, сепсис. При тяжелых интраабдоминальных и тазовых инфекциях необходимо сочетать эти препараты с АГ или другими антибиотиками, действующими на грамотрицательные бактерии.
Гликопептиды
Ванкомицин, тейкопланин - применяются для лечения тяжелых инфекций, часто угрожающих жизни больного, вызванных резистентными стафилококками или энтерококками (пневмония, сепсис, абсцесс мозга и легких, перитонит, менингит, остеомиелит, эндокардит). Препараты показаны лицам с нарушенным иммунитетом и при нейтропении. Внутрь назначают при псевдомембранозном энтероколите.
Полусинтетические липогликопептиды
Телаванцин. Препарат одобрен для терапии нозокомиальной пневмонии и осложненных инфекций кожи и мягких тканей, вызванных клинически значимыми грамположительными микроорганизмами, включая метициллинрезистентные стафилококки, стафилококки со сниженной чувствительностью к ванкомицину, устойчивые к даптомицину и линезолиду стафилококки и энтерококки (кроме ванкомицинрезистентных энтерококков), пенициллинрезистентные пневмококки.
Циклические липопептиды
Даптомицин характеризуется быстро проявляющимся бактерицидным действием в отношении широкого спектра грамположительных возбудителей, включая MRSA, S. aureus с промежуточной чувствительностью к ванкомицину, ванкомицинрезистентный S. aureus и ванкомицинрезистентные энтерококки.
Оксазолидиноны
Линезолид (Зивокс♠). Активен в отношении грамположительных возбудителей (стафилококков, энтерококков, в том числе устойчивых к ванкомицину, пневмококков, различных стрептококков А, В, С, а также viridans), анаэробных кокков, клостридий. Грамотрицательные аэробные микробы природно устойчивы к линезолиду, за исключением M. catarrhalis, H. influenzae, B. pertussis, N. gonorrhoeae, Legionella spp., в отношении которых у линезолида отмечается умеренная чувствительность. Применяется внутрь и парентерально при стафилококковой инфекции любой локализации, в том числе при стафилококковом менингите, эндокардите, при энтерококковых инфекциях.
Глицилциклины
Тигециклин - первый и единственный глицилциклин, активный в отношении многих грамположительных и грамотрицательных микроорганизмов, включая штаммы, обладающие резистентностью к другим классам антибиотиков. Препарат разрешен для применения при осложненных инфекциях кожи и мягких тканей, интраабдоминальной инфекции и внебольничной пневмонии.
Полимиксины
Полимиксин В, полимиксин М.
Препараты с узким спектром антимикробного действия, высокоактивны в отношении большинства грамотрицательных бактерий: кишечной палочки, сальмонеллы, шигеллы, гемофильной и синегнойной палочки, бруцеллы, иерсинии, клебсиеллы, энтеробактера. В связи с высокой токсичностью применение полимиксина В в настоящее время ограничено случаями синегнойной инфекции, вызванной P. aeruginosa, устойчивой ко всем остальным антибактериальным средствам (уреидо-пенициллинам, ЦС, аминогликозидам, фторхинолонам), или тяжелой грамотрицательной инфекции (кроме протейной), вызванной множественно устойчивыми госпитальными штаммами. Полимиксин М не всасывается в ЖКТ, может применяться при кишечных инфекциях.
Фениколы
Хлорамфеникол, тиамфеникола глицинат ацетилцистеинат. Хлорамфеникол - природный антибиотик, тиамфеникол - его синтетический аналог. Учитывая высокий уровень токсичности, показания к назначению хлорамфеникола ограничены несколькими нозологиями: брюшной тиф и паратифы, генерализованный сальмонеллез, заболевания, вызванные гемофильной палочкой, гнойные менингиты, анаэробная неспорообразующая инфекция (абсцессы мозга, интраабдоминальные и тазовые инфекции), иерсиниоз.
Рифамицины
Рифампицин. Препарат широкого спектра антимикробного действия, активен в отношении грамположительных микроорганизмов, преимущественно стрептококков (кроме энтерококков) и стафилококков, а также клостридий, сибиреязвенной палочки. Применяется преимущественно во фтизиатрии, при стафилококковой инфекции, часто в сочетании с АГ, линкозамидами, при бруцеллезе, сибирской язве, хламидиозе, легионеллезе, иерсиниозе.
Рифаксимин не абсорбируется в кишечнике. Показания к применению: желудочно-кишечные инфекции, вызываемые бактериями, чувствительными к рифаксимину, диарея путешественников, синдром избыточного роста микроорганизмов в кишечнике, печеночная энцефалопатия, неосложненная дивертикулярная болезнь толстой кишки.
Фузидины
Фузидовая кислота (Фузидиевая кислота♠). Показанием к применению является стафилококковая инфекция (сепсис, эндокардит, остеомиелит, пневмония, инфекции кожи и мягких тканей), особенно при аллергии к β-лактамам и при выделении устойчивого к ним возбудителя. Фузидовая кислота (Фузидиевая кислота♠) показана также при развитии псевдомембранозного колита на фоне лечения антибиотиками.
Сульфаниламиды
Препараты короткого действия - сульфадимидин (Сульфадимезин♠), сульфаниламид (Стрептоцид♠), среднего действия - сульфадиазин, сульфаметоксазол, длительного действия - сульфадиметоксин, сульфамонометоксин, сульфаметоксипиридазин, сверхдлительного действия - сульфален, сульфадоксин. Не всасываются из просвета ЖКТ фталилсульфатиазол (Фталазол♠) и сульфагуанидин (Сульгин♠). В настоящее время сульфаниламиды используются лишь при лечении токсоплазмоза, нокардиоза, малярии, а также при лечении пневмонии хламидийной этиологии при неэффективности других препаратов. Сульфацетамид (Сульфацил-натрий♠, альбуцидρ) применяется в виде 10-30% раствора в качестве глазных капель, для местного применения используют сульфадиазин серебра (Дермазин♠). Соединения сульфаниламидов с 5-аминосалициловой кислотой (сульфасалазин, салазопиридазинρ, салазодиметоксин ρ) применяют при язвенных колитах.
Комбинированные препараты, содержащие сульфаниламид в сочетании с триметопримом
Ко-тримоксазол [сульфаметоксазол + триметоприм] (Бактрим♠) активен в отношении многих грамположительных (стафилококка, пневмококка, некоторых штаммов стрептококка и др.) и грамотрицательных (менингококка, моракселлы, кишечной и гемофильной палочек, клебсиеллы, цитробактера, энтеробактера, сальмонеллы, шигеллы и др.) аэробных возбудителей, нокардий и пневмоцист, действует на них бактерицидно. Сульфамонометоксин + триметоприм (Сульфатонρ) используется при инфекциях верхних и нижних дыхательных путей, мочевыделительной и желчевыделительной систем, кишечных и стафилококковых инфекциях, при нокардиозе и токсо-плазмозе, бруцеллезе, пневмоцистной пневмонии и заболеваниях, передающихся половым путем.
Хинолоны и фторхинолоны
Хинолоны. Налидиксовая кислота. Этот препарат оказывает противомикробную активность только в отношении грамотрицательных возбудителей (кроме синегнойной палочки) и используется при заболеваниях МВП, однако в настоящее время, так же как и другие препараты этой группы (оксолиновая кислотаρ, пипемидиевая кислота ρ), имеет ограниченное клиническое применение в связи с узким спектром антимикробного действия и появлением большого количества резистентных штаммов.
Фторхинолоны. Норфлоксацин, пефлоксацин, ципрофлоксацин, офлоксацин, ломефлоксацин, спарфлоксацин, моксифлоксацин, левофлоксацин, гемифлоксацин, гатифлоксацин высоко эффективны при лечении отитов и синуситов, в том числе вызванных полирезистентными штаммами, нозокомиальной пневмонии, легионеллеза, кишечных инфекций (брюшного тифа, иерсиниоза, холеры, инфекций МВП, менингитов, вызванных грамотрицательной флорой, сепсиса, при инфекциях у больных с нейтропенией, при туберкулезе в качестве препаратов 2-го ряда. Гатифлоксацин и гемифлоксацин показаны при обострении хронического бронхита и внебольничной пневмонии, вызванных чувствительными грамположительными и грамотрицательными микроорганизмами. Гатифлоксацин также применяется при лечении острых синуситов, инфекций кожи и мягких тканей, инфекций МВП, пиелонефрита и гонореи.
Нитрофураны
Нитрофураны [нитрофурантоин, фуразидин (Фурагин♠)] применяются для лечения инфекций МВП - при цистите, хроническом пиелонефрите. Фуразолидон плохо всасывается в ЖКТ и назначается поэтому при кишечных инфекциях (дизентерия, лямблиоз).
Производные 8-оксихинолина
Нитроксолин обладает широким спектром бактериостатическо-го действия. Применяется при инфекциях МВП. Энтероседив ρ - комбинированный препарат, в состав которого входит производное 8-оксихинолина - используется при кишечных инфекциях. Другие препараты этой группы (энтеросептолρ, интестопанρ, мексаформρ) в настоящее время не применяются в связи с нежелательными реакциями (полиневриты, атрофия зрительного нерва).
Нитроимидазолы
Метронидазол, тинидазол, орнидазол, секнидазол. Оказывают бактерицидный эффект в отношении простейших (трихомонад, лямблий, лейшманий, амеб, балантидий) и неспорообразующих анаэробов (бактероидов, включая B. fragilis, пептококков, пепто-стрептококков, фузобактерий), а также против кампилобактеров, вклю чая Helicobacter pylori, и клостридий. В настоящее время метронидазол считается препаратом выбора при лечении анаэробных или смешанных аэробно-анаэробных инфекций любой локализации - заболевания полости рта, аспирационная пневмония, абсцесс легкого, инфекции, локализованные в брюшной полости, в том числе в малом тазу. Показанием для назначения являются также протозойные инфекции, псевдомембранозный колит, неспецифический вагинит, острый язвенный гингивит. Метронидазол входит в состав комбинированной терапии, применяемой для лечения язвенной болезни желудка и двенадцатиперстной кишки с целью эрадикации Helicobacter pylori.
Производные хиноксалина
Гидроксиметилхиноксалиндиоксид (Диоксидин♠). Синтетический антимикробный препарат широкого спектра действия, применяется только по жизненным показаниям (в связи с высокой токсичностью) для лечения тяжелых форм аэробной или аэробно-анаэробной инфекции, вызванной полирезистентными штаммами в случае неэффективности других антибиотиков (гнойный плеврит, эмпиема или абсцесс легкого, интраабдоминальные инфекции, инфекции кожи, мягких тканей и суставов).
Принципы рациональной этиотропной терапии
Применение антимикробных препаратов при развитии почечной или печеночной патологии, так же как и в крайних возрастных группах (у лиц пожилого возраста или у новорожденных), требует либо уменьшения суточной дозы, либо увеличения интервала между введением препарата, либо отказа от использования некоторых препаратов (табл. 5-1, 5-2).
| Безопасное применение | Применение возможно после корректировки дозы | Применение нежелательно |
|---|---|---|
Аминогликозиды |
Азлоциллин |
Азитромицин |
Амоксициллин |
Азтреонам |
Амфотерицин В |
Ампициллин |
Ванкомицин |
Гризеофульвин |
Бензилпенициллин |
Мезлоциллин♠ |
Доксициклин |
Имипенем |
Моксифлоксацин |
Изониазид |
Левофлоксацин |
Оксациллин |
Итраконазол |
Меропенем |
Пиперациллин |
Кетоконазол |
Норфлоксацин |
Тетрациклин |
Кларитромицин |
Офлоксацин |
Флуклоксациллин |
Клиндамицин |
Цефалексин |
Флуконазол |
Ко-тримоксазол [сульфа-метоксазол + тримето-прим] (Ко-тримоксазол♠) |
Цефокситин |
Фузидовая кислота (Фузидиевая кислота♠) |
Метронидазол |
Цефуроксим |
Ципрофлоксацин |
Миконазол |
Цефтриаксон |
Нитрофурантоин |
|
Цефотаксим |
Пефлоксацин |
|
Цефтазидим |
Пиразинамид |
|
Протионамид |
||
Рифампицин |
||
Рокситромицин |
||
Спирамицин |
||
Сульфаниламиды |
||
Хлорамфеникол |
||
Цефоперазон |
||
Эритромицин |
| Преимущественно почками | Преимущественно с желчью или метаболизируются в печени |
|---|---|
Азтреонам |
Доксициклин |
Аминогликозиды |
Итраконазол |
Ванкомицин |
Клиндамицин |
Имипенем |
Линкомицин |
Кетоконазол |
Макролиды |
Линезолид |
Метронидазол |
Меропенем |
Миконазол |
Нитрофураны |
Пефлоксацин |
Пенициллины |
Рифампицин |
Полимиксин |
Сульфаниламиды |
Спектиномицин |
Фузидовая кислота (Фузидиевая кислота♠) |
Тетрациклин (кроме доксициклина) |
Хлорамфеникол |
Триметоприм |
Цефоперазон |
Тейкопланин |
|
Флуконазол |
|
Фосфомицин |
|
Фторхинолоны (кроме |
|
пефлоксацина) |
|
ЦС (кроме цефоперазона) |
Основной задачей этиотропной терапии является создание терапевтической концентрации антимикробного средства в зоне локализации возбудителя в организме больного. Поэтому очень важное значение имеют правильно выбранная доза ЛС, ритм и пути его введения. Антибактериальные средства могут вводиться внутрь (если нет рвоты или пареза кишечника), внутримышечно и внутривенно. Необходимо помнить, что при выраженных расстройствах микроциркуляции всасывание препарата из места введения существенно затруднено, например, при ИТШ; в этом случае препараты должны вводиться только внутривенно, струйно или капельно. Для быстрого создания необходимой концентрации в месте локализации патологического очага целесообразно максимально приблизить место введения антимикробного препарата к очагу поражения; для этого ЛС вводят в полость сустава, внутрь плевры, в спинномозговой канал, в желудочки мозга и т.д. Антибактериальные средства должны вводиться в течение суток с равными промежутками времени, чтобы достигнутая концентрация препарата поддерживалась на определенном уровне. Возможно проведение ступенчатой терапии, например, при лечении пневмонии, при которой антибактериальные препараты используются в два этапа: вначале препарат вводится внутривенно, а при наступлении клинического и лабораторного улучшения (при уменьшении кашля и других респираторных симптомов, нормализации температуры тела, количества лейкоцитов в периферической крови и др.) переходят на прием лекарства per os. В последние годы предложена прогрессивная схема использования некоторых антимикробных средств, например, рекомендовано однократное введение всей суточной дозы аминогликозидов, что позволяет уменьшить риск токсических эффектов при сохранении аналогичной клинической эффективности.
Длительность курса антибактериальной терапии различна и зависит от особенностей течения патологического процесса, его тяжести и др. Так, применение этиотропной терапии при инфекционном эндокардите, бруцеллезе, туберкулезе может продолжаться в течение нескольких месяцев. При некоторых инфекционных заболеваниях разработаны определенные схемы антибиотикотерапии (например, при менингококковой инфекции антибиотики отменяют только после санации СМЖ). В большинстве случаев длительность лечения определяется индивидуально. При этом необходимо помнить, что длительный прием антибактериальных препаратов может способствовать селекции устойчивых штаммов микроорганизмов и развитию токсических эффектов ЛС; при коротком курсе повышается комплаенс пациентов, реже возникают нежелательные лекарственные явления, снижаются риск формирования и распространения резистентных штаммов микроорганизмов и экономическое бремя, однако неоправданно короткий курс может способствовать риску развития рецидива заболевания.
5.2. ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИЕ БАКТЕРИОФАГИ КАК СРЕДСТВО АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ
Бактериофаги являются вирусами бактерий, естественными регуляторами их популяции. Они широко представлены во всех ареалах обитания бактерий - в почве, воде, в организме животных и растений.
Их общая численность в биосфере составляет до 1030-32 частиц [2]. Они разделяются на умеренные и вирулентные (литические). Умеренные фаги интегрируются в геном бактерии в виде профага, и при размножении бактерии они воспроизводятся, не вызывая ее лизиса. Вирулентные фаги, проникая внутрь бактериальной клетки, переключают ее метаболизм на воспроизведение новых фагов, которое завершается лизисом бактерии. Именно вирулентные бактериофаги обладают терапевтическим потенциалом, поскольку только они способны к уничтожению клеток бактерий-хозяев.
На этом принципе основано использование фагов при лечении и профилактике инфекций бактериальной природы. Благодаря специфичности действия, вирулентные бактериофаги, входящие в состав лечебно-профилактических препаратов, вызывают гибель только определенного вида бактерий. Разрушая целевой патоген, они не подавляют нормальную микрофлору, не взаимодействуют с макроорганизмами и не вызывают побочных реакций, в то же время могут стимулировать различные механизмы иммунитета. На литическую активность бактериофагов не влияет устойчивость бактерий к антибиотикам. Бактериофаги используют не только в виде монотерапии. В случае тяжелых проявлений заболеваний возможно их сочетанное применение с антибиотиками. Так же, как и антибиотики, фаги назначают при наличии чувствительности возбудителя к фаговому препарату.
Преодоление первичной фагоустойчивости бактерий возможно путем подбора фаговых «рас», активных в отношении целевого бактериального возбудителя, в частности в отношении полирезистентных возбудителей инфекций.
Бактериофаг, введенный любым способом (внутривенным, пероральным, подкожным, внутрибрюшинным), поступает в кровь, затем адсорбируется различными тканями, оседая в первую очередь в лимфатических узлах, в печени и селезенке. Выводится он из организма через кишечник и почки. Наличие инфекции, вызванной соответствующим видом бактерии, увеличивает длительность пребывания бактериофага в организме и его количество, что выражается в повышении титра бактериофага. В норме гематоликворный барьер (ГЛБ) для фагов непроницаем. Повышение его проницаемости при воспалительном процессе ведет к поступлению бактериофага из кровяного русла в СМЖ. После перорального однократного приема препарата бактериофага фаговые частицы обнаруживаются через 1 ч в крови, через 1-1,5 ч - на поверхности ожоговых ран и в бронхиальном содержимом, через 2 ч - в СМЖ и моче. Длительность пребывания фага в организме зависит от присутствия фагочувствительного возбудителя инфекции. При наличии инфекционного процесса, обусловленного чувствительным к препарату бактериальным штаммом, фаги в моче выявляли в течение 5-6 сут после однократного приема препарата. При этом высокая концентрация фаговых частиц в образцах мочи свидетельствовала о происходящем процессе их размножения в очаге инфекции. У здоровых лиц, как и у больных с фагорезистентным возбудителем, фаг в незначительном количестве выделялся с мочой в пределах 2 сут.
Благодаря возможности адаптации к актуальным возбудителям, лечебно-профилактические бактериофаги являются наиболее перспективными антимикробными препаратами для решения проблемы госпитальных инфекций (инфекций, связанных с оказанием медицинской помощи), когда при производстве фагового препарата могут использоваться выделенные в конкретном стационаре эпидемиологически значимые внутрибольничные бактериальные штаммы. Таким образом, преодолевая их первичную фагоустойчивость путем подбора и введения в состав препарата высокоактивных фаговых штаммов, возможно создание промышленных серий препарата целевой направленности для конкретного стационара.
В 2014 г. под эгидой Национальной ассоциации специалистов по контролю инфекций, связанных с оказанием медицинской помощи, и Минздрава России изданы методические рекомендации «Принципы использования бактериофагов для борьбы с инфекциями, связанными с оказанием медицинской помощи».
Современные лечебно-профилактические бактериофаги представляют собой стерильные очищенные фильтраты фаголизатов бактерий, освобожденные от продуктов жизнедеятельности бактерий, эндо- и экзотоксинов, продуктов фаголизиса бактериальной клетки, среды выращивания. Фаговые штаммы, входящие в состав препаратов, подобраны против наиболее часто встречающихся возбудителей бактериальных инфекций.
Специфическая направленность бактериофагов отражена в их названии, по своему составу они подразделяются на:
Лечебно-профилактические бактериофаги выпускают в виде растворов (флаконы или аэрозоли), таблеток, суппозиториев, линиментов и мазей.
В табл. 5-3 приведены препараты, производящиеся в РФ.
| Наименование препарата бактериофага | Специфическая антибактериальная направленность |
|---|---|
Монокомпонентные |
|
Бактериофаг стафилококковый |
Staphylococcus (S. aureus) |
Бактериофаг стрептококковый |
Streptococcus (в том числе Enterococcus) |
Бактериофаг псевдомонас аэругиноза (синегнойный)♠ |
Pseudomonas aeruginosa |
Бактериофаг коли |
Escherichia coli |
Бактериофаг протейный |
Proteus mirabilis и P. vulgaris |
Бактериофаг дизентерийный (Бактериофаг дизентерийный поливалентный♠) |
Shigella flexneri 1, 2, 3, 4, 6 сероваров, S. sonnei |
Бактериофаг брюшнотифозный¤ |
Salmonella typhi |
Бактериофаг сальмонеллезный (Бактериофаг сальмонеллезный групп A, B, C, D, E♠) |
Salmonella typhimurium, S. paratyphi A, S. paratyphi B, S. heidelberg, S. newport, S. choleraesuis, S. oranienburg, S. infantis, S. dublin, S. enteritidis, S. anatum, S. newlands |
Бактериофаг клебсиелл пневмонии |
Klebsiella pneumoniae |
Комбинированные |
|
Бактериофаг колипротейный (Бактериофаг колипротейный♠) |
Escherichia coli, Proteus mirabilis и P. vulgaris |
Бактериофаг клебсиелл (Бактериофаг клебсиелл поливалентный очищенный♠) |
Klebsiella pneumoniae, K. ozaenae, K. rhinoscleromatis |
Пиобактериофаг (Пиобактериофаг поливалентный очищенный♠) |
Staphylococcus, Streptococcus, Proteus mirabilis, P. vulgaris, E. coli, Pseudomonas aeruginosa, K. pneumoniae |
Пиобактериофаг (Секстафаг Пиобактериофаг поливалентный♠) |
Staphylococcus, Streptococcus, Proteus vulgaris, P. mirabilis, P. aeruginosa, Klebsiella pneumoniae, E. coli |
Интести-бактериофаг |
Shigella flexneri 1, 2, 3, 4, 6 сероваров, S. sonnei, Salmonella typhimurium, S. paratyphi A, S. paratyphi B, S. heidelberg, S. newport, S. choleraesuis, S. oranienburg, S. infantis, S. dublin, S. enteritidis, S. anatum, S. newlands, Proteus mirabilis и P. vulgaris, E. coli, Enterococcus, Staphylococcus, Pseudomonas aeruginosa |
5.3. ПРОТИВОГРИБКОВЫЕ ПРЕПАРАТЫ
Противогрибковые препараты (антимикотики) - препараты, обладающие специфической активностью в отношении микроскопических грибов (микромицетов). Антимикотики относятся к разным химическим соединениям, различаются по спектру активности, фармакокинетическим параметрам. Различают системные антимикотики и антимикотики для местного применения. В зависимости от химической структуры их разделяют на несколько групп.
Классификация противогрибковых препаратов.
-
Полиены: нистатин; леворин; натамицин; амфотерицин В; липосомальный амфотерицин В; липидный комплекс амфотерицина В; микогептинρ.
-
Азолы. Для системного применения: кетоконазол (может применяться и местно); флуконазол; итраконазол; вориконазол; позаконазол. Для местного применения: клотримазол; миконазол; бифоназол; изоконазол; амиказолρ; эконазол; тиоконазол; бутоконазол; фентиконазол; оксиконазол; омоконазол; терконазолρ.
-
Аллиламины. Для системного применения: тербинафин (может применяться и местно). Для местного применения: нафтифин; бутенафинρ.
Для системного применения: гризеофульвин; калия йодид. Для местного применения: аморолфин; циклопирокс; хлорнитрофенол; Микоферон♠ (интерферон альфа-2b + тербинафин + метронидазол).
Полиены
Полиены имеют природное происхождение, широкий спектр противогрибковой активности, используются для лечения тяжелых инвазивных микозов (амфотерицин В, липосомальный амфотерицин В и липидный комплекс амфотерицина В, применяемые внутривенно) и поверхностных грибковых поражений (нистатин, леворин, натамицин, микогептинρ, применяемые местно и внутрь). Технология получения липосомального амфотерицина В и его липидного комплекса обеспечивает высвобождение активного вещества только при соприкосновении с клетками гриба и существенно меньшее воздействие на нормальные ткани.
Показания
-
Нистатин, леворин: кандидоз кожи, полости рта и глотки, кишечника; кандидозный вульвовагинит.
-
Натамицин: кандидоз кожи, полости рта и глотки, кишечника; кандидозный вульвовагинит, баланопостит; трихомонадный вульвовагинит; микоз наружного слухового прохода.
-
Амфотерицин В: инвазивные микозы (кандидоз, аспергиллез, криптококкоз, бластомикоз, кокцидиоидоз, паракокцидиоидоз, гистоплазмоз, трихоспороноз, фузариоз, споротрихоз, зигомикоз, феогифомикозы); кандидоз пищевода при неэффективности азольных антимикотиков; эмпирическая противогрибковая терапия; кандидоз кожи и слизистых оболочек (местно); лейшманиоз, амебный менингоэнцефалит, вызванный N. fowleri.
Азолы
Азолы - наиболее многочисленная группа синтетических антимикотиков (для системного применения - итраконазол, флуконазол, вориконазол, кетоконазол, для местного применения - клотримазол, миконазол, изоконазол, бифоназол, амиказолρ, эконазол, тиоконазол, бутоконазол, фентиконазол, оксиконазол, омоконазол, терконазолρ; кетоконазол может применяться как при системных, так и при местных поражениях).
Показания
-
Кетоконазол: кандидоз кожи, пищевода, кандидозная паронихия, вульвовагинит (системно и местно); отрубевидный лишай (системно и местно); дерматомикозы (местно); себорейная экзема (местно); паракокцидиоидоз.
-
Флуконазол: инвазивный кандидоз; кандидозный вульвовагинит, кандидоз слизистых оболочек полости рта, пищевода, МВП, кандидоз кожи, ногтей; системные поражения, вызванные грибами Cryptococcus, включая менингит, инфекции легких и кожи, в том числе и у пациентов с различными формами иммунодефицита; микозы кожи, стоп, тела, ногтей, волосистой части головы, обусловленные дерматомицетами; отрубевидный лишай; трихоспороз; некоторые эндемичные микозы (бластомикоз, кокцидиоидоз, паракокцидиоидоз).
Эхинокандиды
Группа эхинокандидов представлена каспофунгином, микафунгином, анидулафунгином.
Показания
Инвазивный кандидоз, кандидоз пищевода. Инвазивный аспергиллез при рефрактерности к другим антимикотикам или их плохой переносимости. Эмпирическая терапия у больных с фебрильной нейтропенией.
Флюоропиримидины
Единственный представитель этой группы - флуцитозин (или 5-фтор цитозин).
Показания
Криптококковый менингит.
Инвазивный кандидоз, рефрактерный к антимикотической терапии.
Применяют только в комбинации с амфотерицином В или флуконазолом.
Аллинамины
Синтетические антимикотики для системного (тербинафин) и местного применения (нафтифин, бутенафинρ).
Механизм действия
Фунгицидное действие обусловлено нарушением синтеза эргостерола, входящего в состав мембраны грибов.
Спектр действия
Широкий спектр антимикотического действия, однако клиническое значение имеет активность только против дерматомицетов (Trichophyton, Microsporium spp. и Epidermophyton spp.).
Фармакокинетика
Хорошо всасываются при приеме внутрь. Создают высокие концентрации в роговом слое эпидермиса, в ногтевых пластинках, волосах. Метаболизируются в печени, выводятся почками. При местном применении создают в различных слоях кожи высокие концентрации, превышающие минимальную подавляющую концентрацию (МПК) для большинства возбудителей дерматомикозов.
Показания
Микозы кожи, вызванные дерматомицетами (при ограниченном поражении - местно, при распространенном - внутрь); микроспория, трихофития волосистой части головы (внутрь); онихомикоз (внутрь); хромомикоз (внутрь); споротрихоз кожный, кожно-лимфатический; кандидоз кожи (местно); отрубевидный лишай (местно).
Противогрибковые лекарственные препараты разных групп
Для системного применения - гризеофульвин, калия йодид. Для местного применения - аморолфин, циклопирокс.
Показания
Калия йодид: споротрихоз.
Механизм действия
Нарушение структуры цитоплазматической мембраны клетки гриба.
Спектр действия
Спектр действия широкий. Чувствительны дерматомицеты (Trichophyton, Microsporium spp. и Epidermophyton spp.), Candida spp., Malas-sezia spp., Cryptococcus spp. и др.
Фармакокинетика
При местном применении хорошо проникает в ногтевую пластинку и ногтевое ложе.
5.4. ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ
В основе действия противовирусных препаратов (ПВП) лежит способность избирательно оказывать прямое угнетающее действие на различные стадии жизненного цикла вируса, блокируя отдельные этапы вирусной репликации. ПВП также угнетают действие вирусных ферментов (ДНК-полимераза, обратная транскриптаза и др.), которые образуются после проникновения вируса в клетки макроорганизма.
Классификация противовирусных препаратов в зависимости от механизма действия.
-
Блокирование этапа адсорбции и проникновения вируса в клетку, а также высвобождения вирусного генома внутрь клетки макроорганизма:
-
Блокирование синтеза вирусной ДНК или РНК, синтеза вирусных белков:
-
-
ингибиторы ДНК-полимеразы и синтеза ДНК/РНК вирусов из различных групп: ацикловир, валацикловир, валганцикловир, ганцикловир, ламивудин, пенцикловир, телбивудин, тенофовир, фамцикловир, энтекавир;
-
нуклеозидные ингибиторы обратной транскриптазы ВИЧ ( абакавир, диданозин, зидовудин, ламивудин, ставудин, тенофовир, фосфазид, эмтрицитабин);
-
ингибиторы синтеза ДНК и РНК вирусов из различных групп: рибавирин, инозин пранобекс, метилтионитрооксодигидротриазолотриазинид натрия;
-
-
-
ненуклеотидные ингибиторы обратной транскриптазы ВИЧ: невирапин, рилпивирин, этравирин, эфавиренз;
-
ингибиторы протеазы (ИП) ВИЧ: атазанавир, дарунавир, индинавир, нелфинавир, ритонавир, саквинавир, типранавир, фосампренавир, лопинавир;
-
ингибиторы NS3 HCV: боцепревир, телапревир, симепревир, асунапревир, нарлапревир, паритапревир;
-
ингибиторы синтеза белков вирусов из различных групп: бромнафтохинон, диоксотетрагидрокситетрагидронафталин.
-
-
-
Блокирование формирования новых вирусных частиц в цитоплазме клетки и их выход из клетки:
Противовирусные препараты для лечения гриппа и других острых респираторных вирусных инфекций
Противовирусные препараты с доказанной клинической эффективностью, применяемые для лечения и профилактики гриппа, разделяют на следующие группы:
Противовирусные препараты для лечения гриппа рекомендуется принимать в первые 48 ч с момента появления первых клинических проявлений вирусной инфекции. При тяжелом и осложненном течении гриппа целесообразно ПВП назначать и в более поздние сроки болезни.
| Параметр | Aмaнтaдин | Pимaнтaдин | Oceльтaмивиp | Зaнaмивиp | Умифeнoвиp |
|---|---|---|---|---|---|
Спектр активности |
Вирус гриппа А |
Вирус гриппа А |
Вирусы гриппа А, В |
Вирусы гриппа А, В |
Вирусы гриппа А, В, парагриппа, PC- виpycы, аденовирусы, кopoнaвиpycы |
Способ введения |
Внутрь |
Внутрь |
Внутрь |
Ингаляционно |
Внутрь |
Биодоступность, % |
~100, не зависит от приема пищи |
~100, не зависит от приема пищи |
75, не зависит от приема пищи |
4-20 |
Нет данных |
Проникновение в молоко |
Да |
Нет данных |
Нет данных |
Нет данных |
Нет данных |
Дозировка |
0,1 г× 1-2 p/cyт после еды, №5-10; дети: 5 мг/кг в сутки (но не более 0,15 г) |
0,1 г × 2-3 p/cyт после еды №5 |
0,075-0,15r×2p/cyт до приема пищи №5-10; дети от 1 года до 12 лет - в зависимости от массы тела |
2 ингаляции (2 × 5 мг) 2 p/cyт № 5 |
старше 12 лет: 0,2 г, 6-12 лет: 0,1 г, 3-6 лет: 0,05 г - 4 p/cyт до приема пищи №5 |
Возрастные ограничения |
До 1 года |
До 1 года |
До 1 года |
До 5 лет |
До 3 лет |
Беременность |
FDA-C |
FDA-C |
FDA-C |
FDA-C |
FDA-C |
Форма выпуска |
Таблетки, 100 мг, раствор для инфyзий (200мг―500 мл) |
Таблетки, 50 и 100 мг |
Капсулы, 75 мг |
Порошок для ингаляций дозированный, 5 мг |
Таблетки и капсулы, 50 мг, 100 мг |
Производные адамантана. Противовирусная активность производных адамантана (амантадин и римантадин) обусловлена подавлением функции белка М2 вируса гриппа.
В настоящее время производные амантадина редко рекомендуют для лечения гриппа в связи с их более низкой эффективностью при лечении гриппа по сравнению с ингибиторами нейраминидазы.
Производное индолилалкиламинов. Умифеновир взаимодействует с гемагглютинином вируса и препятствует слиянию с мембранными рецепторами клеток человека, а также угнетает трансляцию вирусспецифических белков в инфицированных клетках.
Ингибиторы нейроаминидазы. Пероральный ингибитор нейраминидазы осельтамивир (Тамифлю♠) является наиболее эффективным препаратом для лечения гриппа.
Занамивир (Реленза♠)- ингаляционный высокоселективный ингибитор нейраминидазы. Из-за высокой токсичности и низкой биодоступности при приеме внутрь препарат используется только ингаляционно. Развития резистентности к занамивиру не зарегистрировано.
Противовирусные препараты для лечения герпесвирусных инфекций
Большинство современных высокоэффективных средств с доказанной противовирусной эффективностью, рекомендуемых для лечения герпетических инфекций, относятся к аналогам нуклеозидов. Противовирусная терапия не приводит к эрадикации вируса и не всегда влияет на частоту, тяжесть и риск развития рецидивов в последующем. Противовирусные препараты данной группы на вирусы в латентном состоянии не действуют.
Аналоги нуклеозидов. В основе механизма действия аналогов нуклеозидов лежит принцип конкурентного антагонизма. Они имеют сходную структуру со структурой природных нуклеозидов, что позволяет им включаться в репликативный процесс. В инфицированных вирусом клетках они превращаются в нуклеотиды, конкурируя с природными нуклеотидами, встраиваются в геном вируса, блокируя процесс элонгации в цепи ДНК.
Преимуществами аналогов нуклеозидов являются высокая противовирусная активность, хорошая переносимость, возможность применения на любой стадии заболевания. Однако существенными недостатками данных препаратов являются необходимость приема в течение неопределенно долгого времени, риск развития резистентных штаммов вирусов, а также - не все обладают избирательностью действия (функционируют и в инфицированных, и в здоровых клетках).
Противовирусное действие препаратов, применяемых для лечения герпесвирусных инфекций, заключается в блокировании репликации генома и ингибировании ДНК полимеразы вирусов. Угнетение ДНК-полимеразы вирионов блокирует репликацию дочерних вирусных частиц. Препараты преимущественно действуют избирательно, только на синтез вирусных ДНК и РНК, не оказывая влияния на репликацию ДНК клетки человека. В эту группу входят: ацикловир, ганцикловир и пенцикловир - ациклические аналоги гуанозина. С целью увеличения биодоступности препаратов были синтезированы эфиры ацикловира (валацикловир), ганцикловира (валганцикловир) и пенцикловира (фамцикловир) - неактивные соединения, которые в организме человека превращаются в активные метаболиты. Фамцикловир является пероральной формой пенцикловира, который рассчитан только для наружной терапии. В целом все препараты хорошо переносятся, их эффективность при приеме внутрь сопоставимая, нежелательные явления при приеме возникают нечасто (в основном при длительном их применении).
Ацикловир (Зовиракс♠) является основным препаратом для лечения HSV-инфекции, аналог пуринового нуклеозида дезоксигуанидина (нормального компонента ДНК), обладающий широким спектром противогерпетической активности.
Валацикловир является пролекарством, в организме человека превращается в ацикловир, который после фосфорилирования приобретает специфическую активность. Валацикловир по своим основным характеристикам близок к ацикловиру, но отличается от него более высокой биодоступностью при энтеральном приеме.
Пенцикловир. Противовирусное действие оказывает его метаболит пенцикловира трифосфат. Выпускается только для наружного применения в виде крема. Пероральной формой пенцикловира является фамцикловир.
Фамцикловир хорошо всасывается и проникает во все органы и ткани. Это пролекарство, которое в печени превращается в активный метаболит - пенцикловира трифосфат.
Пенцикловир, как и ацикловир, действует главным образом на HSV и VVZ. Достоинством пенцикловира является его активность в отношении штаммов HSV, устойчивых к ацикловиру. Пенцикловир, в отличие от ацикловира, эффективен на стадии везикул (высокие концентрации препарата в содержимом пузырьков).
Основным препаратом для лечения манифестных форм ЦМВИ является ганцикловир, который на HSV и VVZ действует примерно в такой же концентрации, как ацикловир, а на ЦМВ - в концентрации в 10-100 раз ниже по сравнению с ацикловиром. Валганцикловир - пролекарство, которое после приема внутрь под действием ферментов в кишечнике и печени превращается в ганцикловир, близкий по химическому строению к ацикловиру и имеющий аналогичный механизм действия.
| Параметр | Aциклoвиp | Baлaциклoвиp | Пeнциклoвиp | Фамцикловир | Гaнциклoвиp | Baлгaнциклoвиp |
|---|---|---|---|---|---|---|
Спектр активности |
HSV-1, HSV-2, VVZ, ЭБB, ЦMB |
HSV-1, HSV-2, VVZ, ЭБB, ЦMB, вирус герпеса человека типа 6 (HHV-6) |
HSV1, HSV2, VVZ, ЭБB, ЦMB |
HSV1, HSV2, WZ, вирус гепатита В (HBV) |
ЦMB, HSV-1, HSV-2, VVZ, ЭБB, HHV-6, HHV-7, HHV-8, HBV |
ЦMB, HSV-1, HSV-2, VVZ, EBV, HHV-6, HHV-7, HHV-8, HBV |
Способ введения |
Внутрь, в/в, мecтнo |
Внутрь |
Mecтнo |
Внутрь |
В/в, мecтнo |
Внутрь |
Биодоступность |
15-30%, не зависит от приема пищи, зависит от лекарственной формы, снижается с увеличением дозы |
45-63% (~54%), не зависит от приема пищи |
При приеме внутрь - 5% |
70-80%, прием пищи не оказывает влияния, только замедляет всасывание |
При приеме внутрь - 10% |
61%, зависит от приема пищи |
Проникновение в молоко кормящих |
Да |
Да |
Нет данных |
Да |
Да |
Да |
Дозировка |
Внутрь: 0,2-0,8 г × 5 p/cyт (исключая ночь) № 5-10. В/в кaпeльнo: 5-10 мг/ кг × 3 p/cyт № 5-10 (max дозы - 30 м г/кг). Наружно: 5 p/cyт № 5-10. Глазная мазь: полоску мази длиной 10 мм - в нижний кoнъюнктивaльный мешок 5 p/д № 7-10 |
500-2000 мг × 2 p/cyт № 5-10 |
Каждые 2 ч в дневное время, №4 |
125-500 мг × 2-3 p/cyт № 5-10 |
В/в 5 мг/кг на 100 мл 0,9% NaCI или 5% декстрозы (Глюкозы♠), в течение часа 2 p/cyт, № 14-21, затем - 6 мг/кг × 5 днeй/нeд или 5 мг/кг ежедневно. Mecтнo 5 p/дeнь № 11-15 |
900 мг ×1-2 p/cyт во время еды, № 21 |
Возрастные ограничения |
До 3 лет |
Дети до 12 лет |
До 12 лет |
До 18 лет |
Дети до 12 лет |
Дети до 16 лет |
Беременность |
FDA-B |
FDA-B |
FDA-B |
FDA-B |
FDA-C |
FDA-C |
Форма выпуска |
Таблетки, 200 мг, 400 мг, мазь и крем 5%; мазь глазная 3%; лиoфилизaт для инфyзий - 1 флакон - 250 мг |
Таблетки, 250, 500 и 1000 мг |
Крем, 1% |
Таблетки, 125, 250, 500 мг |
Лиoфилизaт для инфyзий, 1 флакон - 500 мг; гель для глаз, 0,15% |
Таблетки, 450 мг |
Примечание. FDA (от англ. Food and Drug Administration) - Американская администрация по контролю за лекарствами и пищевыми продуктами.
Далее описаны препараты с противовирусной активностью по отношению к герпесвирусам, однако их эффективность не доказана в рамках рандомизированных клинических исследований.
Тромантадин - производное амантадина, препятствует проникновению вирусов внутрь клетки. Спектр активности - HSV, VVZ.
Докозанол - длинноцепочечный насыщенный спирт. Спектр активности - HSV. Докозанол препятствует слиянию мембран вируса и клетки-хозяина, и вирус лишается возможности проникнуть в клетку.
Тетрагидроксиглюкопиранозилксантен - препарат растительного происхождения, обладающий противовирусной активностью и умеренным бактериостатическим действием. Спектр активности - HSV, VVZ, ЦМВ. Он препятствует проникновению вирусов в клетку, индуцирует выработку ИФН-γ.
Противовирусные препараты для лечения вирусных гепатитов
Для лечения вирусных гепатитов используют аналоги нуклеозидов и ингибиторы синтеза неструктурных белков HCV. Кроме препаратов с прямым противовирусным действием, для лечения вирусных гепатитов и ряда других вирусных инфекций используют препараты ИФН, оказывающие опосредованный противовирусный эффект путем активации иммунологических реакций на всех этапах репликации, а также обладающие противоопухолевым и иммуномодулирующим действием. В качестве противовирусных средств в основном используются препараты ИФН-α. Они широко используются для лечения и профилактики гриппа, в комплексной терапии герпесвирусных инфекций, вирусных гепатитов и ВИЧ-инфекции, однако только при вирусных гепатитах в виде моноинфекции или ко-инфекции с ВИЧ подтверждена их эффективность в рамках рандомизированных клинических исследований.
Противовирусные препараты для лечения хронического гепатита B
Применение препаратов ИФН-α (ИФН-α2а, ИФН-α2b, ПЭГ-ИФН-α2а, ПЭГ-ИФН-α2b) ограничено для лечения вирусного гепатита Ввиду его недостаточной эффективности (эффективность лишь у 30-40%). Кроме низкой эффективности, недостатками препаратов ИФН являются инъекционный способ введения, наличие широкого спектра нежелательных явлений и противопоказаний к лечению. Единственное преимущество препаратов данной группы - отсутствие резистентности к ним штаммов HBV.
Клиническими исследованиями доказано, что аналоги нуклеозидов эффективно подавляют репликацию HBV, однако для эффективного контроля вирусной репликации необходима длительная терапия. В свою очередь, длительность применения способствует возникновению мутаций в вирусном геноме, что приводит к потере эффективности препаратов. Существенным недостатком аналогов нуклеозидов, применяющихся для лечения хронического гепатита В, является возникновение лекарственной устойчивости и «вирусологический прорыв» при прекращении длительной терапии в отсутствие сероконверсии HBsAg--анти-HBs+. Препараты нового поколения обладают высокой противовирусной эффективностью и одновременно низким риском формирования резистентности при длительном применении (более 5 лет).
В настоящее время для лечения вирусного гепатита В в соответствии с российскими рекомендациями следует использовать аналоги нуклеозидов, зарегистрированных в РФ: ламивудин - синтетический аналог нуклеозида цитидина, телбивудин - синтетический аналог нуклеозида тимидина, энтекавир - синтетический аналог нуклеозида гуанозина, тенофовир - синтетический аналог нуклеотида аденозина монофосфата. Они применяются внутрь один раз в сутки.
Ламивудин - первый безопасный и эффективный ПВП для лечения ХГВ, в том числе у детей, пациентов с декомпенсированным циррозом печени, а также для профилактики реинфекции после трансплантации печени. Ингибирует ДНК-полимеразу HBV. Ламивудин не является препаратом первой линии терапии в связи с формированием резистентности вируса к данному препарату.
Телбивудин - селективный ингибитор ДНК-полимеразы HBV. Не метаболизируется. Выводится почками в неизмененном виде.
Возможно формирование резистентности к телбивудину в процессе лечения (через 2 года терапии).
Энтекавир - селективный ингибитор ДНК-полимеразы HBV, фосфорилируется с образованием энтекавира трифосфата. Сохраняет активность в отношении штаммов HBV, устойчивых к ламивудину, меньше риск возникновения резистентности. Выделяется главным образом почками (в неизмененном виде - 62-73%). Рекомендуется для лечения компенсированного поражения печени при ХГB.
Тенофовир - пролекарство, в организме в процессе фосфорилирования превращается в тенофовира дифосфат, ингибирующий ДНК-полимеразу HBV и обратную транскриптазу ВИЧ (описание препарата см. в разделе «Противовирусные препараты для лечения ВИЧ-инфекции»). Развитие резистентности к препарату не описано.
Краткая характеристика ПВП, используемых для лечения ВГB с доказанной клинической эффективностью, представлена в табл. 5-6.
Особенностями нуклеозидных аналогов последнего поколения (телбивудина и энтекавира) являются быстрое подавление репликации HBV, как при HBе-позитивном (60-67%), так и при HBe-негативном ХГВ (74-78%), а также возможность их применения у больных декомпенсированным циррозом печени. Недостатки ПВП: неопределенная длительность лечения HBe-негативного ХГВ, формирование лекарственной резистентности, что требует смены противовирусной терапии.
| Параметр | Ламивудин | Тенофовир | Телбивудин | Энтекавир |
|---|---|---|---|---|
Спектр активности |
HBV, ВИЧ |
HBV, ВИЧ-1 |
HBV |
HBV |
Способ введения |
Внутрь |
Внутрь |
Внутрь |
Внутрь |
Биодоступность |
80-85% |
25%, усиливается при приеме во время еды |
40%, не зависит от приема пищи |
100%, зависит от приема пищи |
Проникновение в молоко |
Да |
Да |
Нет данных |
Нет данных |
Дозировка |
100 мг × 1 р/ сут |
300 мг × 1 р/сут |
600 мг × 1 р/ сут |
0,5-1 мг × 1 р/ сут |
Длительность |
Неопределенно долго |
Неопределенно долго |
Неопределенно долго |
Неопределенно долго |
Возрастные ограничения |
До 3 лет |
- |
До 18 лет |
До 18 лет |
Беременность |
FDA-C |
FDA-B |
FDA-С |
FDA-C |
Форма выпуска |
Таблетки, 150 мг |
Таблетки, 300 мг |
Таблетки, 600 мг |
Таблетки, 0,5 и 1 мг |
Противовирусные препараты для лечения хронического гепатита С
Длительное время для лечения хронического гепатита С использовалась комбинация препаратов интерферонов (ИФН-α2а, ИФН-α2b, ПЭГ-ИФН-α2а, ПЭГ-ИФН-α2b) с рибавирином (см. описание препарата в разделе «Противовирусные препараты с широким спектром действия»), эффективность которой колеблется при лечении больных, инфицированных различными генотипами HCV. В настоящее время в клинической практике для лечения ХГС стали доступны противовирусные препараты с высокой эффективностью: большая часть из них ингибирует репликацию генотипа 1 HCV; другие - пангенотипного действия (т.е. высокоэффективны в отношении всех генотипов HCV).
Первыми ПВП данной группы, разрешенными к применению на территории РФ, были ингибиторы протеазы (NS3/NS4А) HCV (ферментного комплекса белков, ответственного за процессинг полипротеина HCV для синтеза зрелых вирусных белков, требуемых для репликации вируса) - боцепревир и телапревир, которые ранее применялись в комплексной терапии взрослых пациентов (≥18) с ПЭГ-ИФН-α и рибавирином при инфицировании генотипом 1 (включая компенсированный ЦП). В последующем появились новые ингибиторы вирусных белков HCV, особенностью которых является использование их, в том числе, и в безинтерфероновых режимах противовирусной терапии ХГС.
Асунапревир - наиболее активен в отношении изоформ протеазных комплексов NS3/4A, представляющих генотип 1 HCV. Препарат не применяется в виде монотерапии. Асунапревир продемонстрировал аддитивное взаимодействие с ПЭГ-ИФН-α с рибавирином, даклатасвиром, ингибиторами, взаимодействующими с активным центром NS5B HCV. Лечение ХГC у пациентов с компенсированным заболеванием печени (включая цирроз печени) назначается в комбинациях асунапревира с даклатасвиром (генотип 1b) в сочетании или без комбинации с ПЭГ-ИФН-α и рибавирином.
Мутации, связанные с лекарственной устойчивостью при лечении асунапревиром и даклатасвиром: NS5A-L31, NS5A-Y93H и NS3-D168. При неэффективности терапии комбинацией асунапревира, даклатас-вира, ПЭГ-ИФН-α и рибавирина - мутации NS5A-Q30 и NS3-R155 у пациентов, инфицированных генотипом 1а, тогда как NS5A-L31I/M-Y93M и NS3-D168V - при инфицировании генотипом 1b HCV.
Элиминация с калом - 84%, преимущественно в окисленной форме.
Нежелательные явления. Препарат применяется только в составе схем комбинированной терапии, поэтому необходимо учитывать нежелательные явления лекарственных препаратов, входящих в схему лечения. При комбинации асунапревира с даклатасвиром: часто - головная боль, диарея, тошнота, утомляемость, повышение АЛТ, повышение АСТ, редко - другие многочисленные побочные эффекты.
Противопоказания: декомпенсированное заболевание печени, класс В и С по Чайлд-Пью, грудное вскармливание.
Межлекарственные взаимодействия. Не рекомендуется одновременный прием с флекаинидом, пропафеноном, тиоридазином, фенитоином, карбамазепином, фенобарбиталом, рифампицином, рифабутином, рифапентином, нафциллиномρ, бозентаном, дексаметазоном, препаратами зверобоя продырявленного, эфавирензом, этравирином, модафиниломρ, невирапином, кетоконазолом, итраконазолом, вориконазолом, флуконазолом, фосфлуконазолом, миконазолом, кларитромицином, эритромицином, дилтиаземом, верапамилом, атазанавиром, индинавиром, лопинавиром, нелфинавиром, ритонавиром, саквинавиром, дарунавиром, фосампренавиром; которые снижают эффективность асунапревира.
Симепревир - ингибитор комплекса NS3/4А HCV. Метаболизируется в печени, является субстратом Р-гликопротеина. Выводится с желчью. Препарат применяется только в комбинации c ПЭГ-ИФН-α и рибавирином у взрослых пациентов с компенсированным поражением печени (включая цирроз печени).
Нежелательные явления: запор, сыпь, зуд, реакция фоточувствительности, одышка, повышение уровня билирубина, ЩФ в крови.
Противопоказания: грудное вскармливание, дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция.
Межлекарственные взаимодействия. Не рекомендуется одновременный прием с карбамазепином, фенобарбиталом, астемизолом, терфенадином, эритромицином, кларитромицином, итраконазолом, флуконазолом, вориконазолом, рифампицином, рифабутином, рифапентином, дексаметазоном, эфавирензом, этравирином, невирапином, дарунавиром/ритонавиром, ритонавиром, атазанавиром, фосампренавиром, ампренавиром, лопинавиром, индинавиром, нелфинавиром, саквинавиром, типранавиром, циклоспорином.
Нарлапревир - оказывает ингибирующее действие на протеазу HCV. Используется только в комбинации с ритонавиром, ПЭГ-ИФН-α и рибавирином у пациентов, инфицированных генотипом 1 HCV. Ритонавир не обладает противовирусной активностью в отношении HCV, выступает как фармакокинетический усилитель, который увеличивает пиковую концентрацию нарлапревира в плазме крови и общую экспозицию препарата.
Нарлапревир метаболизируется главным образом с помощью изофермента 3А4 цитохрома Р450 (субстрат изофермента CYP3A4). Также нарлапревир проявляет слабые ингибирующие свойства в отношении изофермента CYP3A4. При совместном применении нарлапревира с мощным ингибитором изофермента CYP3A4 ритонавиром наблюдается увеличение концентрации нарлапревира за счет оптимизации минимальных концентраций, что позволяет применять один раз в день. Преимущественно экскретируется через кишечник (81%).
Нежелательные явления: часто - анемия, лейкопения, нейтропения, лимфопения, тромбоцитопения, снижение аппетита, гиперурикемия, головная боль, кашель, тошнота, диарея, гипербилирубинемия, миалгия, артралгия; редко - другие многочисленные побочные эффекты.
Противопоказания: грудное вскармливание, тяжелая нейтропения (<500 кл/мкл); печеночная недостаточность; предшествующее лечение ХГC ИП HCV; дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция.
Межлекарственные взаимодействия. При применении с лекарственными препаратами, являющимися субстратами, ингибиторами и/или индукторами изофермента CYP3A4, возможно изменение их концентрации.
Вирус гепатита С для своей репликации использует РНК-зависимую РНК-полимеразу NS5, которая служит идеальной мишенью для новых эффективных противовирусных препаратов. Одна из схем лечения больных ХГС (в том числе с компенсированным циррозом печени), инфицированных генотипами 1 HCV, включает прием трех противовирусных препаратов с различными механизмами действия и с непересекающимися профилями резистентности, что позволяет бороться с HCV на разных этапах его жизненного цикла: паритапревир, усиленный ритонавиром, с омбитасвиром в одной таблетке в комбинации с дасабувиром (в сочетании с рибавирином или без него).
Дасабувир - ненуклеозидный ингибитор РНК-зависимой РНК-полимеразы HCV, кодируемой геном NS5B, которая необходима для репликации вирусного генома.
Омбитасвир - ингибитор белка NS5A HCV, необходимого для репликации вируса.
Паритапревир - ингибитор протеазы NS3/4A HCV, которая необходима для протеолитического расщепления полипротеина HCV.
Комбинированный препарат имеет различные механизмы действия и непересекающиеся профили резистентности, что позволяет эффективно подавлять репликацию вируса, вне зависимости от наличия у вируса исходных замен, ассоциированных с резистентностью. Омбитасвир/паритапревир/ритонавир и дасабувир метаболизируются печенью, их кинетика не зависит от функции почек.
Даклатасвир - ингибитор неструктурного белка 5A(NS5A), многофункционального протеина, необходимого для репликации HCV, подавляет два этапа жизненного цикла вируса - репликацию вирусной РНК и сборку вирионов. Препарат является мощным пангенотипическим ингибитором комплекса репликации HCV генотипов 1a, 1b, 2а, 3а, 4а, 5а и 6а. Рекомендован в комбинациях с асунапревиром; асунапревиром, ПЭГ-ИФН-α и рибавирином; софосбувиром.
Софосбувир - пангенотипический ингибитор РНК-зависимой РНК-полимеразы, с помощью которой HCV копирует собственную РНК. Нуклеотидное пролекарство подвергается внутриклеточному метаболизму с образованием активного аналога уридин трифосфата, встраивающегося в строящуюся цепочку РНК HCV и обрывающего ее. Рекомендуется в комбинациях с ПЭГ-ИФН-α и рибавирином, с рибавирином, с даклатасвиром. Софосбувир полностью сохраняет свою активность в отношении мутаций, связанных с резистентностью к другим ПВП.
Метаболизируется в печени. Элиминируется преимущественно почками (80%, в неизмененном виде 3,5%), частично с калом (14%) и выдыхаемым воздухом (2,5%).
Краткая характеристика ПВП, используемых для лечения ХГC с доказанной клинической эффективностью, представлена в табл. 5-7. Внедрение в клиническую практику ингибиторов неструктурных белков HCV позволило значительно сократить длительность лечения, частоту развития побочных эффектов и повысить эффективность терапии до 100%. Благодаря совершенствованию противовирусной терапии ХГС стала возможной эрадикация HCV в группе пациентов, у которых применение препаратов ИФН сопряжено с высокой вероятностью развития тяжелых осложнений (декомпенсированный цирроз печени, аутоиммунные заболевания, пациенты с пересаженной печенью или после трансплантации других органов). Таким образом, в отличие от всех существующих ПВП, только препараты данной группы не подавляют вирусную активность, а могут обеспечить эрадикацию HCV.
| Параметр | Cимeпpeвиp | Acyнaпpeвиp | Hapлaпpeвиp | Oмбитacвиp/ пapитaпpeвиp/ pитoнaвиp | Дacaбyвиp | Дaклaтacвиp | Coфocбyвиp |
|---|---|---|---|---|---|---|---|
Спектр активности |
нcv |
нcv |
нcv |
нcv |
нcv |
нcv |
HCV |
Способ введения |
Внутрь |
Внутрь |
Внутрь |
Внутрь |
Внутрь |
Внутрь |
Внутрь |
Биодоступность |
62% |
9,3% |
Не установлена |
Не установлена |
Не установлена |
67% |
Не установлена |
Проникновение в молоко |
Нет данных |
Нет данных |
Нет данных |
Нет данных |
Нет данных |
Нет данных |
Нет данных |
Дозировка |
1 капе. × 1 p/ сут во время еды |
1 капе. × 2 p/cyт вне зависимости от приема пищи |
2 табл. × 1 p/cyт во время еды (только в комбинации с pитoнaвиpoм + ПЭГ- ИФH-α + PИБ) |
2 табл. × 1 p/cyт (утро) во время еды |
1 табл.× 2 p/ сут во время еды |
1 табл. (60 мг) × 1 p/сут (утро) независимо от приема пищи |
1 табл.× 1 p/cyт (утро) |
Длительность |
12 нeд |
24 нeд |
12 нeд (далее 12 нeд― ПEГ-ИHФ+ pибaвиpин) |
8-24 нeд |
8-24 нeд |
12/24 нeд |
12 нeд |
Возрастные ограничения |
До 18 лет |
До 18 лет |
До 18 лет |
До 18 лет |
До 18 лет |
До 18 лет |
До 18 лет |
Беременность |
FDA-C |
FDA-C |
FDA-C |
FDA-B |
FDA-B |
FDA-C |
FDA-C |
Форма выпуска |
Капсулы, 150 мг |
Капсулы, 100 мг |
Таблетки, 100 мг |
Таблетки, 12,5 мг oмбитacвиpa, 75 мг пapитaпpeвиpa и 50 мг pитoнaвиpa |
Таблетки, 250 мг |
Таблетки, 30 или 60 мг |
Таблетки, 400 мг |
Противовирусные препараты для лечения ВИЧ-инфекции
Для лечения ВИЧ-инфекции используется высокоактивная антиретровирусная терапия (вАаРТ), которая прекращает прогрессирование болезни, развитие ВИЧ-ассоциированных заболеваний, подавляет репликацию ВИЧ, но не позволяет элиминировать вирус из организма. ВААРТ подразумевает ежедневный прием трех и/или более препаратов для подавления активности вируса на разных стадиях заболевания. Подавление вирусной репликации более продолжительно при комбинированной терапии тремя антиретровирусными препаратами по сравнению с комбинированной терапией двумя ЛС. Созданы комбинированные препараты для повышения приверженности ВААРТ, в состав которых входят 2 или 3 антиретровирусных вещества в терапевтической дозировке.
Антиретровирусные препараты, зарегистрированные в РФ, в зависимости от механизма их действия можно разделить на несколько групп:
НИОТ. Механизм действия ПВП данного класса основан на конкурентном подавлении обратной транскриптазы (РНК-зависимая ДНК-полимераза, ревертаза) - фермента, входящего в состав вирусной частицы и катализирующего синтез ДНК на матрице РНК ВИЧ. Попадая в инфицированную клетку, нуклеозидные производные фосфорилируются с образованием активных метаболитов, которые по принципу конкурентного антагонизма угнетают обратную транскриптазу вирионов. В результате нарушается синтез вирусных белков.
Абакавир - ингибирует обратную транскриптазу ВИЧ-1 и ВИЧ-2. Биодоступность препарата - 83%. Метаболизируется в печени. Метаболиты выводятся в 82% случаев почками. Проникновение в СМЖ - низкое. Перед началом лечения необходимо типирование на HLA-B*5701 (назначать при отсутствии данного аллеля).
Диданозин - ингибирует обратную транскриптазу ВИЧ-1, превращаясь после проникновения в клетку в активный метаболит - дидезоксиаденозин-5'-трифосфат, встраивание которого в структуру вирусной ДНК блокирует дальнейшую репликацию нуклеиновых кислот.
Биодоступность вариабельна и зависит от возраста: у взрослых - 33-37%, у грудных детей (от 7 мес), подростков и юношей (до 19 лет) - 2-89%. Прием пищи снижает сывороточные уровни препарата. Метаболизм препарата не изучен. Проникновение в СМЖ - среднее. Применяют в комбинации с другими антиретровирусными препаратами, у длительно принимавших зидовудин или в случае неэффективности последнего.
Коррекция дозировки в зависимости от веса пациента (вес ≥60 кг, вес <60 кг). Комбинации с тенофовиром лучше избегать, в случае ее применения рекомендовано снижение дозы диданозина с 400 до 250 мг 1 р/сут (при весе <60 кг - с 250 до 200 мг/сут).
Зидовудин - избирательно ингибирует репликацию вирусной ДНК за счет конкурентной блокады обратной транскриптазы ВИЧ. Биодоступность - 60-70%. Хорошо проникает в большинство тканей и жидкостей организма, включая СМЖ, где его концентрация достигает около 60% от содержания в сыворотке. Препарат метаболизируется в печени путем конъюгации с глюкуроновой кислотой. Выделяется почками в неизмененном виде (15-20%) и в виде глюкуронидов (75%).
Ламивудин - высокоэффективный селективный ингибитор репликации ВИЧ-1 и ВИЧ-2 (в том числе штаммов ВИЧ, устойчивых к зидовудину). Спектр активности - HBV, ВИЧ. При проникновении в инфицированные клетки образуется активный метаболит - ламивудин 5'-трифосфат, подавляющий в незначительной степени обратную транскриптазу. Основной механизм действия - блокирование синтеза растущей цепи ДНК в процессе обратной транскрипции ВИЧ. Ламивудин не нарушает нормальный клеточный метаболизм ДНК и не оказывает существенного влияния на содержание ядерной и митохондриальной ДНК в клетках человека. Оказывает слабое цитотоксическое действие на стволовые клетки костного мозга, в связи с чем обладает высоким терапевтическим потенциалом. Может применяться при беременности. Ламивудин используется как компонент комбинированной антиретровирусной терапии в сочетании с другими нуклеозидными и ненуклеозидными ингибиторами обратной транскриптазы, ингибиторами протеазы.
Биодоступность - 80-85%. Проникновение в СМЖ - среднее. Выводится почками, в основном в неизмененном виде (более 70%), в незначительной степени (5-10%) метаболизируется в печени. Обычно переносится хорошо. Комбинация ламивудина с зидовудином не показана при скорости клубочковой фильтрации (СКФ) <50 мл/мин или нарушениях функции печени.
Дозировка отличается от таковой при вирусном гепатите В. После отмены существует риск обострении ХГВ.
Комбинация абакавир + ламивудин недостаточно эффективна при концентрации РНК ВИЧ-1 ≥100 000 копий/мл. Комбинации абакавир + ламивудин и абакавир + ламивудин + зидовудин не рекомендуются при весе <40 кг, при СКФ <50 мл/мин или при нарушениях функции печени.
Ставудин - под действием клеточных ферментов превращается в активный метаболит ставудина трифосфат, который подавляет активность обратной транскриптазы ВИЧ, снижает синтез митохондриальной ДНК. Снижение чувствительности к ставудину выявляется после длительного курса лечения. Назначение ставудина не рекомендуется при наличии мутаций M41L и T215Y в гене обратной транскриптазы HIV-1 на фоне лечения аналогами нуклеозидов.
Биодоступность - 80-90%. Метаболизм препарата не изучен. Выведение неизмененного препарата почками - 40%. Проникновение в СМЖ - среднее. Дозировка рассчитывается в зависимости от массы тела (вес ≥60 кг, вес >60 кг).
Применяется для лечения больных ВИЧ-инфекцией после продолжительного использования зидовудина. Не рекомендуется назначать в схемы начальной АРВТ из-за побочных эффектов.
Эмтрицитабин - ингибитор обратной транскриптазы ВИЧ-1. Спектр активности - ВИЧ, HBV. Ингибирует активность обратной транскриптазы ВИЧ-1 и включается в образующуюся цепь вирусной ДНК, что приводит к ее обрыву.
Выводится почками (86%), 14% метаболизируется, выводится с калом. Хорошо переносится. По химической структуре схож с ламивудином, возможны обострения ХГB после отмены данного препарата. Проникновение в СМЖ - среднее. В комбинации с тенофовиром является препаратом выбора при сопутствующем ХГB.
При комбинации эмтрицитабина с нуклеозидными ингибиторами обратной транскриптазы (абакавир, зидовудин, ламивудин, ставудин), ненуклеозидными ингибиторами обратной транскриптазы (эфавиренз, невирапин) и ИП (нелфинавир, ритонавир, саквинавир) наблюдается дополнительный синергический эффект.
Абсолютная биодоступность при приеме натощак - 93%.
Эмтрицитабин не ингибирует изоферменты системы CYP 450. Биотрансформация включает окисление тиоловой группы с образованием 3-сульфоксид диастереомеров (примерно 9% дозы) и конъюгацию с глюкуроновой кислотой с образованием 2-О-глюкуронида (примерно 4% дозы). Другие метаболиты не были идентифицированы. Выведение преимущественно с мочой (86%), частично с калом (14%). Коррекция дозы при клиренсе креатинина <50 мл/мин.
В комбинации с тенофовиром и эфавирензом препарат выбора при сопутствующем ХГB, избегать приема во время беременности (риск для плода, FDA-D), не назначать при СКФ <50 мл/мин, лицам моложе 18 лет. В комбинации с тенофовиром и рилпивирином предпочтительнее назначать при концентрации РНК ВИЧ <100 000 копий/мл. Не следует назначать одновременно с ингибиторами Н+, К+-АТФазы.
Тенофовир (Тенофовира дизопроксил фумарат♠) - пролекарство, превращается в тенофовира дифосфат, облигатный терминатор цепи ДНК, ингибирует обратную транскриптазу ВИЧ, что приводит к прерыванию синтеза ДНК. Спектр активности - ВИЧ-1, ВИЧ-2, HBV.
Биодоступность натощак - 25%, во время еды - до 40% (жирная пища улучшает всасывание). Клинически значимого влияния на эффективность тенофовира прием пищи не оказывает. Метаболизируется в печени, выводится почками. Проникновение в СМЖ - низкое. До начала терапии необходимо оценить функцию почек: при СКФ <50 мл/мин коррекция дозы. Более часто развивается нарушение функции почек при сочетании с ИП (в основном лопинавир/ритонавир), чем при сочетании с ННИОТ.
Фосфазид - оригинальный российский антиретровирусный препарат. Спектр активности - ВИЧ и HBV. Включается в вирусную ДНК, нарушает элонгацию цепочки ДНК, ингибирует обратную транскрипцию в процессе репликации ВИЧ.
Биодоступность - 84%. Проникает через ГЭБ, концентрация в СМЖ - 15-64% исходной дозы. Метаболизируется в печени, выводится почками.
ННИОТ. Как и НИОТ, ННИОТ ВИЧ в клетках макроорганизма воздействует на обратную транскриптазу ВИЧ. Они оказывают прямое неконкурентное ингибирующее действие на обратную транскриптазу. ВИЧ-2 устойчив к действию ННИОТ (за исключением этравирина). ННИОТ не уступают ИП по способности снижать вирусную нагрузку у пациентов, ранее не получавших ВААРТ.
Существенным недостатком ННИОТ является высокий риск формирования резистентности, при этом возникает перекрестная резистентность ко всем препаратам класса, кроме этравирина.
Типичным побочным эффектом этого класса препаратов является сыпь, чаще возникающая при приеме невирапина.
Невирапин - нарушает синтез вирусной ДНК. При монотерапии невирапином быстро возникают устойчивые штаммы вируса.
Биодоступность - 91-93%. Метаболизируется в печени. Выводится почками (до 90%), с калом (10%).
Рилпивирин - ингибирует обратную транскриптазу ВИЧ-1. Рилпивирин обладает аддитивной противовирусной активностью в комбинации с нуклеозидными ингибиторами обратной транскриптазы (абакавиром, диданозином, эмтрицитабином, ставудином и тенофовиром), с ИП (атазанавиром, дарунавиром, индинавиром, лопинавиром, нелфинавиром, ритонавиром, типранавиром и саквинавиром), с ННИОТ (эфавирензом, этравирином и невирапином), а также в комбинации с энфувиртидом и маравироком. Рилпивирин дает синергичный или аддитивный противовирусный эффект в комбинации с ламивудином, зидовудином, ралтегравиром.
Абсолютная биодоступность препарата неизвестна. Метаболизируется в печени, в основном изоферментом IIIA4 цитохрома Р450. Выводится с калом (85%) и мочой (6%).
Этравирин - непосредственно связывается с обратной транскриптазой ВИЧ-1 и блокирует ее активность. Развитие резистентности к этравирину требует множества мутаций в гене обратной транскриптазы: L100I, Е138К, E138G, V179I, У181С и М2301.
Абсолютная биодоступность препарата неизвестна. Метаболизируется изоферментами IIIA4, IIС9 и IIС19 цитохрома Р450 в печени. Выводится с калом (более 90%) преимущественно в неизмененном виде (81-86%). Применяют при устойчивости к ННИОТ и другим пре паратам.
Эфaвupeнз - селективный неконкурентный ингибитор обратной тpaнcкpиптaзы ВИЧ-1. Сохраняет активность в отношении штаммов вируса с заменами аминокислот в гене обратной транскриптазы в позициях 48, 108, 179, 181 или 236, а также с заменами аминокислот в гене протеазы.
Биодоступность - 50%. Метаболизируется в печени, выводится почками в виде конъюгатов с глюкуроновой кислотой (14-34%), с калом (16-61%).
При прекращении ВААРТ эфавиренз отменяют на 1-2 нед раньше остальных препаратов. В противном случае может развиться устойчивость к нему, так как через 1-2 сут в крови и других тканях остается только этот препарат (Т1/2 очень велик).
Прием пищи увеличивает сывороточную концентрацию и риск развития нежелательных явлений.
ИП. Ингибиторы вирусных протеаз обладают сродством к активному центру протеазы ВИЧ, которая должна расщеплять полипротеин вируса на отдельные функциональные белки. Связываясь с активным центром вирусной протеазы, блокируют его функцию. Это приводит к формированию неактивных вирусных частиц, не способных инфицировать новые клетки.
ИП вступают в многочисленные лекарственные взаимодействия, подавляя активность изофермента IIIA4 системы цитохрома P450 (CYPIIIA4). Самым сильным ингибитором CYP3A4 является ритонавир. Такая особенность ритонавира используется для усиления действия других ИП, так как происходит значимое повышение их уровня в крови. Это позволяет уменьшить частоту приема ИП, количество таблеток и иногда отменяет зависимость от приема пищи. Единственный ИП, для которого не отмечен подобный эффект, - нелфинавир.
У ингибиторов протеазы высокая степень перекрестной резистентности, однако ИП второго поколения (дарунавир и типранавир) сохраняют свою эффективность даже при наличии у вируса нескольких мутаций резистентности к ИП. Для развития устойчивости обычно требуется несколько мутаций, уменьшающих сродство ингибитора к протеазе.
При лечении ВИЧ-инфекции наиболее эффективно сочетанное применение ингибиторов протеаз ВИЧ с другими препаратами.
Атазанавир - конкурентно ингибирует протеазу вИч. Активен в отношении ВИЧ-1 и BиЧ-2. Формирует неактивные вирусные частицы, не способные к инфицированию других клеток.
Биодоступность - 86%. Метаболизируется в печени; 20% выводится с мочой (13% в неизмененном виде), 79% с калом (20% в неизмененном виде). Проникновение в СМЖ - среднее. Хорошо всасывается. Пища усиливает всасывание препарата и уменьшает индивидуальные различия в фармакокинетике.
Усиленный ритонавиром атазанавир также применяют в комбинации либо с эфавирензом 600 мг 1 р/сут, либо с тенофовиром 300 мг 1 р/сут.
Дарунавир - активен в отношении протеазы ВИЧ-1 и ВИЧ-2. Биодоступность - 37%. Метаболизируется в печени. Элиминируется с калом - 79,5% (41,2% - в неизмененном виде), почками - 13,9% (7,7% - в неизмененном виде). Проникновение в СМЖ - среднее. В комбинации с низкой дозой ритонавира и другими антиретровирусными препаратами применяется только в начальных схемах ВААРТ.
Индинавир - связывается с активными участками ВИЧ-протеазы, селективно ингибируя расщепление синтезированного в клетке полипептида на вирусные интегразы и протеазы. Биодоступность - 60-65%. Метаболизируется в печени, проникновение в СМЖ - высокое, элиминируется почками. Необходимо обильное питье. Инактивируется продуктами питания с кислой реакцией, в том числе апельсиновым и яблочным соками.
Лопинавир/ритонавир - не относится к комбинированным препаратам, ритонавир усиливает лопинавир и не является действующим веществом.
Абсолютная биодоступность не установлена. Метаболизируется в печени. Проникновение в СМЖ - среднее, выводится преимущественно с калом.
Нелфинавир - метаболизируется в печени. Проникновение в СМЖ - низкое. Пища усиливает всасывание и уменьшает индивидуальные различия в фармакокинетике. Не рекомендуется включать в начальную схему ВААРТ из-за невысокой эффективности. Инактивируется под действием пищевых продуктов с кислой реакцией.
Биодоступность - >78%. Элиминация с калом - 87%.
Ритонавир - активен в отношении ВИЧ-1 и ВИЧ-2, обладает селективным сродством к протеазе.
Биодоступность - 66-75%, метаболизируется в печени. Проникновение в СМЖ - низкое. Пища усиливает всасывание. Самостоятельно не назначается, применяется в низких дозах для улучшения фармакокинетики (усиления) других ИП. Элиминируется с фекалиями (86%, из них 34% в неизмененном виде) и почками (11%, из них в неизмененном в виде - 3,5-4%).
Саквинавир - высокоактивный и избирательный ингибитор протеаз ВИЧ-1 и ВИЧ-2. Несмотря на низкую биодоступность препарата, удается достигать концентраций в плазме, которые подавляют размножение ретровирусов. Возможно развитие устойчивости ВИЧ к саквинавиру.
Метаболизируется изоферментами цитохрома Р450 (ингибитор IIIA4). Элиминируется с калом (более 95%). Проникновение в СМЖ - низкое.
Типранавир - непептидный ингибитор протеазы ВИЧ-1. Назначают тем, кто уже получал несколько схем ВААРТ, или при устойчивости вируса к нескольким ИП.
Биодоступность не установлена. Метаболизируется изоферментом IIIA4 цитохрома Р450, при сочетании с ритонавиром, выводится в основном с калом (82%).
Фосампренавир - подвергается гидролизу до ампренавира. Метаболизируется изоферментами цитохрома Р450 (субстрат и ингибитор IIIA4). Выводится с калом (75%), почками (14%) в виде метаболитов.
Ингибиторы интегразы (ИИ). Препараты данной группы блокируют интегразу ВИЧ, участвующую во встраивании провирусной ДНК в геном клетки-мишени. После переноса из цитоплазмы в клеточное ядро прединтеграционного комплекса (провирусная ДНК в связи с интегразой) интеграза присоединяется к ДНК клетки, что приводит к необратимому связыванию провирусной ДНК и ДНК инфицированной клетки. Не включенные в ДНК человека геномы ВИЧ не способны индуцировать продукцию новых вирусных частиц, вследствие этого происходит подавление процесса интеграции и предотвращение дальнейшего распространения вирусной инфекции в организме.
Ралтегравир - ингибирует каталитическую активность ВИЧ-интегразы, предотвращая связывание генома ВИЧ с геном клетки хозяина на ранних стадиях развития инфекции.
Абсолютная биодоступность не установлена. В организме человека происходит конъюгация с глюкуроновой кислотой, выводится с мочой (32%) и калом (51%). Не проникает через ГЭБ. Одобрен для начальной АРВТ и при полирезистентности ВИЧ.
Долутегравир - ингибирует интегразу ВИЧ, связываясь с активным участком интегразы и блокируя этап переноса цепей во время интеграции вирусной ДНК, который необходим для цикла репликации ВИЧ. Абсолютная биодоступность не установлена. Проникает в СМЖ. Метаболизируется в печени, выводится преимущественно в неизмененном виде через кишечник.
Ингибиторы фузии (слияния). Ингибиторы слияния блокируют последний этап проникновения вируса в клетку-мишень. При слиянии ВИЧ с клеткой происходит связывание с рецептором CD4 и корецептором, вызывая конформационные изменения в молекуле gp41 (трансмембранной субъединице белка наружной оболочки). Ингибиторы слияния, специфически связываясь с гликопротеидом gp41 ВИЧ-1 вне клетки, ингибируют его структурную перестройку, тем самым блокируют проникновение вируса внутрь клетки. Не требует внутриклеточной активации.
Энфувиртид - применяют только в комбинации с другими противоретровирусными средствами. Абсолютная биодоступность - 84%. Недостатком является подкожный способ введения, что обусловливает частые местные побочные эффекты (инфильтраты и пр.). В организме распадается на отдельные аминокислоты, которые утилизируются организмом. Пути выведения неизвестны.
Мутации резистентности к энфувиртиду в гене, кодирующем gp41, появляются относительно быстро, но они значительно снижают жизнеспособность ВИЧ, что позволяет продолжить его использование в большинстве случаев.
Блокаторы корeцeпторов. Основное действие блокаторов корецепторов направлено на препятствование проникновению ВИЧ в клетку-мишень. Два наиболее важных известных корецептора - CXCR4 и CCR5. По сродству к корецептору штаммы ВИЧ делятся на R5-тропные (использующие в качестве корецептора CCR5) и X4-тропные (использующие в качестве корецептора CXCR4). Вирусы с двойным тропизмом способны использовать оба корецептора.
В настоящее время единственным препаратом этого класса, доступным для лечения, является маравирок, вызывающий изменения конформации CCR5, что приводит к невозможности присоединения gp120 к активному центру CCR5. Этот препарат эффективен у пациентов с преобладанием R5-тропных штаммов ВИЧ. CCR5 - это белок адгезии, необходимый корецептор для проникновения ВИЧ в клетку макроорганизма. При мутациях в гене CCR5 регистрируется невосприимчивость к ВИЧ. Препарат селективно связывается с рецептором CCR5 и препятствует присоединению ВИЧ-1 к корецептору CCR5 на CD4-лимфоцитах.
Абсолютная биодоступность - 33%. Метаболизируется в печени. Выводится преимущественно с калом (76%).
Переносимость маравирока хорошая. Одобрен для начальной ВААРТ, а также при полирезистентности ВИЧ. Перед началом терапии нужно убедиться, что штаммы ВИЧ-1 тропны к CCR5.
В табл. 9-8 представлены противовирусные препараты с доказанной клинической эффективностью при ВИЧ-инфекции.
ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ С ШИРОКИМ СПЕКТРОМ ДЕЙСТВИЯ
Из группы аналогов нуклеозидов для лечения гриппа и других ОРВИ можно использовать ряд препаратов с широким спектром действия, эффективность которых не оценивалась в рамках рандомизированных клинических исследований.
Инозин пранобeкс (Изопринозин♠, Гроприносин♠) - производное пурина, обладающее иммуностимулирующей активностью и противовирусным действием. Спектр активности - HSV, ЦМВ, ЭБВ, Measles virus, HPV, HTLV, вирусы гриппа А и В, Poliovirus, ЕСНО-virus. Механизм действия связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации некоторых вирусов, усиливает подавленный вирусами синтез мРНК лимфоцитов, что сопровождается подавлением биосинтеза вирусной РНК и трансляции вирусных белков. После приема внутрь препарат хорошо всасывается из ЖКТ. Быстро подвергается метаболизму, аналогично эндогенным пуриновым нуклеотидам с образованием мочевой кислоты, и выводится почками. Рекомендуется прием данного препарата при многих вирусных инфекциях, в том числе и при гриппе.
| Класс | Непатентованное наименование | Дозировка | Возрастные ограничения, беременность | Форма выпуска |
|---|---|---|---|---|
НИОТ |
Aбaкaвиp |
Внутрь, можно с пищей, 300 мг (15 мл) 2 p/cyт или 600 мг 1 p/cyт |
До 12 лет |
Таблетки, 300 мг, раствор для приема внутрь, 20 мг/мл |
Дидaнoзин |
Внутрь, за 30 мин до или 2 ч после еды, 125 или 200 мг 2 p/cyт, 250-400 мг 1 p/cyт |
До 6 лет |
Капсулы 125, 200, 250, 400 мг; порошок для приема внутрь, 100, 167, 250 мг |
|
Зидoвyдин |
Внутрь, можно с пищей, 300 мг внутрь 2 p/cyт |
До 3 лет |
Капсулы, 300 мг, сироп, 10 мг/мл, раствор для приема внутрь, 10 мг/мл |
|
Лaмивyдин |
Внутрь, можно с пищей, 150 мг 2 p/cyт или 300 мг 1 p/cyт |
До 3 лет |
Таблетки, 150/300 мг, раствор для приема внутрь, 10 мг/мл |
|
Cтaвyдин |
Внутрь, можно с пищей, 30-40 мг 2 p/cyт |
До 3 лет |
Капсулы, 15, 20, 30, 40 мг, раствор для приема внутрь, 1 мг/мл |
|
Teнoфoвиp |
Внутрь, можно с пищей, 300 мг 1 p/cyт при CKФ ≥50 мл/мин |
До 18 лет |
Таблетки, 300 мг |
|
Фocфaзид (не одобрен FDA) |
Внутрь, перед приемом пищи, взрослым - 0,6-1,2 г/cyт в 2 приема |
- |
Таблетки, 200 мг |
|
Эмтpицитaбин |
Внутрь, не зависит от приема пищи, 200 мг 1 p/cyт |
До 3 лет |
Капсулы, 200 мг, раствор для приема внутрь, 10 мг/мл |
|
Aбaкaвиp, лaмивyдин |
Внутрь, 1 таблетка 1 p/cyт |
До 12 лет |
Таблетки, 600/300 мг |
|
Aбaкaвиp, лaмивyдин, зидoвyдин |
Внутрь, 1 таблетка 2 p/cyт |
До 12 лет |
Таблетки, 300/150/300 мг |
|
Лaмивyдин, зидoвyдин |
Внутрь, можно с пищей, 1 таблетка × 2 p/cyт при CKФ ≥50 мл/мин |
До 12 лет |
Таблетки, 150/300 мг |
|
Эмтpицитaбин, тeнoфoвиp |
Внутрь, можно с пищей, 1 таблетка × 1 p/cyт при CKФ ≥50 мл/мин |
До 18 лет |
Таблетки, 200/300 мг |
|
HHИOT |
Heвиpaпин |
Внутрь, можно с пищей, 200 мг 1 p/cyт × 14 сут, затем 200 мг 2 p/cyт или 400 мг 1 p/cyт |
Таблетки, 200, 400 мг, суспензия для приема внутрь, 50 мг/5 мл |
|
Pилпивиpин |
Внутрь, с пищей, 25 мг 1 p/cyт |
До 18 лет |
Таблетки, 25 мг |
|
Этpaвиpин |
Внутрь, после приема пищи, 200 мг 2 p/cyт |
До 18 лет |
Таблетки, 100 и 200 мг |
|
Эфaвиpeнз |
Внутрь, на ночь, натощак, 600 мг 1 p/cyт |
- |
Капсулы, 50, 100, 200 мг, таблетки 200, 600 мг |
|
HHИOT + НИОТ |
Эмтpицитaбин, тeнoфoвиp, pилпивиpин |
Внутрь, во время еды, 1 тaбл × 1 p/cyт |
До 18 лет |
Таблетки, 200/300/25 мг |
Эмтpицитaбин, тeнoфoвиp, эфaвиpeнз |
Внутрь, натощак, на ночь, 1 таблетка × 1 p/cyт при CKФ ≥50 мл/мин |
До 18 лет |
Таблетки, 200/300/600 мг |
|
Зидовудин, ламивудин, нeвиpaпин (не одобрен FDA) |
Внутрь, независимо от приема пищи, 1 таблетка × 2 p/cyт |
До 18 лет |
Таблетки, 300/150/200 мг |
|
ИП |
Aтaзaнaвиp |
Внутрь, во время еды, 400 мг 1 p/cyт; ранее получавшие APBT 300 мг + pитoнaвиp 100 мг 1 p/cyт |
До 18 лет |
Капсулы, 100, 150, 200, 300 мг |
Дapyнaвиp |
Внутрь, во время еды, 600 мг + pитoнaвиp 100 мг2 p/cyт; у ранее не получавших APBT 800 мг + pитoнaвиp 100 мг 1 p/cyт |
До 18 лет |
Таблетки, 75, 150, 300, 400, 600, 800 мг |
|
Индинавир |
Внутрь, натощак или легкая закуска, 800 мг 3 p/cyт; 400 мг + pитoнaвиp 100 мг 2 p/cyт, независимо от приема пищи |
До 4 лет |
Капсулы, 200, 400 мг |
|
Heлфинaвиp |
Внутрь, во время еды, 750 мг 3 p/cyт или 1250 мг 2 p/cyт |
- |
Таблетки, 250 мг, порошок для приема внутрь, 50 мг/г |
|
Pитoнaвиp |
Внутрь, во время еды, 300-600 мг 2 p/cyт |
- |
Капсулы, 100 мг (хранить в холодильнике); раствор для приема внутрь, 600 мг/75 мл (хранить при комнатной температуре) |
|
Caквинaвиp (только с pитoнaвиpoм) |
Внутрь, с жирной пищей, 1000 мг + pитoнaвиp 100 мг 2 p/cyт |
До 16 лет |
Таблетки, 500 мг |
|
Tипpaнaвиp |
Внутрь, во время еды, 500 мг + pитoнaвиp, 200 мг 2 p/cyт |
До 12 лет |
Капсулы, 250 мг, раствор для приема внутрь, 100 мг/мл (хранить в холодильнике) |
|
Фocaмпpeнaвиp |
Внутрь, независимо от приема пищи, 1400 мг 2 p/cyт; 1400 мг + pитoнaвиp 200 мг 1 p/cyт, 1400 мг + pитoнaвиp 100 мг 1 p/cyт, 700 мг + pитoнaвиp 100 мг 2 p/cyт |
- |
Таблетки, 700 мг, суспензия для приема внутрь, 50 мг/мл |
|
- |
||||
Лoпинaвиp, pитoнoвиp |
Внутрь, вне зависимости от приема пищи,400/100 мг 2 p/cyт; Более высокие дозы у ранее получавших APBT в сочетании с эфaвиpeнзoм, нeвиpaпинoм, фocaмпpeнaвиpoм, не усиленным pитoнaвиpoм, - 800/200 мг 1 p/cyт |
До 6 мес |
Таблетки, 200/50 мг, 100/25 мг (хранение при комнатной температуре); раствор для приема внутрь, 80/20 мг (хранение в холодильнике) |
|
ИИ |
Дoлyтeгpaвиp |
Внутрь, независимо от приема пищи, 50 мг 1-2 p/cyт |
До 6 мес |
Таблетки, 200/50 мг, 100/25 мг (хранение при комнатной температуре); раствор для приема внутрь, 80/20 мг (хранение в холодильнике) |
Paлтeгpaвиp |
Внутрь, независимо от приема пищи 400 мг 2 p/cyт |
До 16 лет |
Таблетки, 25, 100 и 400 мг |
|
иc |
Энфyвиpтид |
П/к 90 мг (1 мл) 2 p/cyт |
До 6 лет |
Флаконы с порошком, 90 мг/мл |
ИР |
Mapaвиpoк |
Внутрь, независимо от приема пищи, 150 мг 2 p/cyт - одновременное ингибиторами изoфepмeнтoв IIIA4 CYP450; 300 мг 2 p/cyт - если одновременно не назначают средства, дающие значительные лекарственные взаимодействия; 600 мг 2 p/cyт - одновременно с индукторами изoфepмeнтa IIIA цитoxpoмa P450, включая эфaвиpeнз |
До 18 лет |
Таблетки, 150 и 300 мг |
Примечание. HHИOT - нeнyклeoзидныe ингибиторы обратной транскриптазы; НИОТ - нyклeoзидныe ингибиторы обратной транскриптазы; ИП - ингибиторы пpoтeaз; ИИ - ингибиторы интeгpaзы; ИC - ингибиторы слияния; ИР - ингибиторы рецепторов.
Назначается внутрь, после еды, запивая небольшим количеством воды: масса тела от 15-20 кг - 50 мг/кг в сутки, разделенная на 3-4 приема.
Взрослым - по 6-8 таблеток/сут, детям - по 1/2 таблетки/5 кг массы тела в сутки № 5-14 (иногда № 14-28).
Нежелательные явления: тошнота, рвота, боль в эпигастрии, временное повышение активности АЛТ/АСТ, ЩФ в крови, мочевины, зуд, головная боль, головокружение, слабость, боль в суставах, обострение подагры; редко - диарея, запор, сонливость, бессонница, полиурия.
Противопоказания: подагра, мочекаменная болезнь, аритмии, хроническая почечная недостаточность, детский возраст до 3 лет (масса тела до 15-20 кг), грудное вскармливание.
Межлекарственные взаимодействия. При комбинированном назначении усиливает действие ИФН-α, ацикловира и зидовудина. Иммунодепрессанты ослабляют эффективность препарата.
Выпускается в виде таблеток по 500 мг.
Рибавирин (Виразол♠) - аналог гуанозина, обладающий активностью против различных ДНК- и РНК-содержащих вирусов. Спектр активности - HCV, РС-вирусы, вирусы гриппа А, В, парагриппа, хантавирусы, вирус Pneumophila parotiditis, HSV, VVZ, Measles virus, Reoviruses, онкогенные РНК-геномные ретровирусы и др. Основное показание для применения рибавирина в пероральной форме - ХГC в комбинации с ПЭГИФН-α, эффективность которого доказана в рамках рандомизированных клинических исследований. Парентеральное введение препарата назначается при ГЛПС. При ингаляционном введении препарат создает высокие концентрации в секретах дыхательных путей: применяется при стационарном лечении грудных детей и детей раннего детского возраста, страдающих тяжелыми инфекциями нижних дыхательных путей, вызванными респираторно-синцитиальным вирусом.
Рибавирин легко проникает в пораженные вирусом клетки и быстро фосфорилируется внутриклеточной аденозинкиназой в рибавирин моно-, ди- и трифосфат.
Рибавирина трифосфат является конкурентным ингибитором инозинмонофосфата дегидрогеназы, приводит к выраженному снижению уровня внутриклеточного гуанозин трифосфата, что сопровождается подавлением синтеза вирусной РНК и вирусспецифических белков.
При приеме внутрь быстро и почти полностью всасывается из ЖКТ (при ингаляциях системная абсорбция незначительна), абсолютная биодоступность - 44-64%. Рибавирин хорошо проникает в плазму, секреты дыхательных путей, эритроциты, при длительном применении - в СМЖ. Элиминация в основном почками.
Бромнафтохинон - подавляет синтез цитоплазматических белков, включающихся в состав капсидов, и нарушает транспорт компонентов вирусного капсида в клеточное ядро, где осуществляется их «сборка». Спектр активности - HSV, VVZ и некоторые штаммы аденовирусов. При приеме внутрь хорошо всасывается из ЖКТ, в первые часы после введения обнаруживается в крови, моче и относительно равномерно распределяется в тканях внутренних органов (селезенке, печени, почках и легких). Плохо проникает через плацентарный и гематоэнцефалический барьеры, выводится в основном почками и через ЖКТ. Применяют при герпетическом кератите, стоматите и гингивите, поражении кожи и слизистых при HSV-инфекции, поражении глаз при аденовирусной инфекции. Назначают взрослым и детям внутрь (через час после еды 25-100 мг 3-4 р/сут в зависимости от возраста) № 7-12 или местно (закладывание за веки глазной мази, аппликации на кожу и слизистые оболочки - 3-4 р/сут) № 12-20.
Нежелательные явления. При приеме внутрь - диарея, головная боль; местно - раздражение в месте аппликации.
Межлекарственные взаимодействия. Не выявлены.
Выпускается в таблетках по 25 мг и 100 мг; в виде 0,05% глазной мази, 0,25%, 0,5%, 1% мази.
Только для местного применения используют диоксотeтрагидро-кситeтрагидро-нафталин, действующий как на внеклеточно, так и на внутриклеточно расположенные вирусы. Спектр активности - HSV, VVZ, Adenovirus, HPV, MCV (вирус контагиозного моллюска). Механизм действия обусловлен его непосредственным воздействием на интенсивность вирусной репродукции - угнетение синтеза РНК в инфицированных клетках, что препятствует размножению вирусов. При локальном применении всасывается незначительно и не оказывает выраженного системного действия на организм.
Применяется для лечения аденовирусного кератита, HSV- и VVZ-инфекций в фазе везикул, контагиозного моллюска, риновирусной инфекции, для профилактики гриппа. Для лечения и профилактики вирусных инфекций применяют местно в виде мази (0,25%, 0,5%, 1%, 2%, 3%) на пораженные участки кожи, конъюнктивально 2-3 раза в сутки до полного выздоровления. Для индивидуальной профилактики гриппа - ежедневное смазывание слизистой оболочки носа 2 раза в день (утром и вечером) в период эпидемической вспышки гриппа (на протяжении 25 дней) или при контакте с больным гриппом. Для лечения вирусного ринита - 2-3 р/сут № 3-4.
Выпускается в виде мази 0,25% (назально) и 3%.
Нежелательные явления: жжение кожи и слизистой оболочки полости носа, ринорея, дерматит, легко смываемое синее окрашивание кожи.
Противопоказания: грудное вскармливание, возраст до 2 лет.
Межлекарственные взаимодействия. Не выявлены.
Несмотря на достаточно широкий арсенал противовирусных препаратов, вирусные заболевания остаются плохо контролируемыми инфекциями. За исключением хронической HCV-инфекции, в настоящее время отсутствуют радикальные схемы противовирусной терапии, позволяющие элиминировать патоген при хронических вирусных инфекциях. Основными проблемами, препятствующими достижению данной цели, являются: селективность действия, профиль безопасности лекарственных средств, их переносимость, риск формирования резистентных штаммов вируса и приемлемая стоимость лечения.
5.5. ПРОТИВОПАРАЗИТАРНЫЕ ПРЕПАРАТЫ
По своему действию противопаразитарные препараты подразделяют на противопротозойные (согласно общепринятой международной систематизации противопротозойных ЛС в отдельную группу выделены противомалярийные препараты), противогельминтные, противопедикулезные и средства для лечения чесотки (противоакаридозные).
Класс противопротозойных препаратов включает различные по химической структуре соединения, которые применяют при инфекциях, вызванных одноклеточными простейшими. Среди протозойных инфекций наибольшая медико-социальная значимость принадлежит малярии, амебиазу и другим кишечным протозоозам, а также лейшманиозу и трипаносомозу. В последние годы значительно возросло число регистрируемых случаев токсоплазмоза и криптоспоридиоза. Одна из причин роста заболеваемости протозоозами - распространение резистентных к химиопрепаратам штаммов возбудителей. Полирезистентность способны приобретать плазмодии малярии, особенно Plasmodium falciparum, в меньшей степени такие свойства присущи возбудителям висцерального лейшманиоза, трипаносомозов, амебиаза. Основные противогельминтные препараты систематизируют по их химической структуре.
Некоторые из препаратов, приведенных в данном разделе, в настоящее время не входят в Государственный реестр ЛС РФ, однако, учитывая специфичность проблемы, соответствующая информация может быть полезной для врачей, выезжающих на работу за рубеж по контракту или в составе гуманитарных миссий.
Противопротозойные препараты Противомалярийные препараты
В классификации противомалярийных препаратов по объекту воздействия можно выделить следующие группы (табл. 5-9):
-
гемошизонтоцидные - воздействуют на бесполые эритроцитарные стадии паразитов в крови, эффективны для лечения трехдневной и ovale-малярии, радикального излечения тропической и четырехдневной малярии;
-
гистошизонтоцидные - воздействуют на преэритроцитарные стадии возбудителя в печени, обеспечивают радикальную химио-профилактику тропической, частично - трехдневной малярии;
-
гаметоцидные - воздействуют на половые эритроцитарные стадии P. falciparum в крови, позволяют обезвредить источник инфекции;
-
гипнозоитоцидные - воздействуют на гипнозоиты в печени, обеспечивают радикальное излечение трехдневной и ovale-малярии, радикальную химиопрофилактику трехдневной малярии с длительной инкубацией.
Противомалярийные препараты, применяемые в настоящее время, относят к следующим группам химических соединений (табл. 5-10): 4-аминохинолины (хлорохин), хинолинметанолы (хинин, мефлохин), фенантренметанолы (галофантринρ, халфанρ), производные артемизининаρ (артесунатρ, артеметерρ, артеэтерρ), антиметаболиты (прогуанил), 8-аминохинолины (примахин, тафенохинρ). Кроме того, применяют комбинированные противомалярийные препараты: пириметамин + сульфадоксин (Фансидар♠), хлорохин + прогуанил (саваринρ), атовахон + прогуанил (маларонρ), артеметер + люмефантрин (коартемρ или риаметρ). В России противомалярийные лекарственные препараты не производят (за исключением примахина), а ряд эффективных ЛС, широко применяемых за рубежом, не зарегистрирован в РФ.
| Механизм действия | ЛС | Результаты применения |
|---|---|---|
Гемошизонтоцидные |
Мефлохин; производные артемизининаρ, хинин, хлорохин |
Воздействуют на эритроцитарные шизонты, купируют приступы трехдневной малярии и малярии, вызванной P. ovale, обеспечивают радикальное излечение тропической и четырехдневной малярии |
Гистошизонтоцидные |
Пириметамин, примахин, прогуанил, тетрациклин |
Воздействуют на мерозоиты (в печени), обеспечивают радикальную химиопрофилактику тропической, частично - трехдневной малярии |
Гаметоцидный и гипнозоитоцидный |
Примахин |
Воздействует на половые эритроцитарные стадии P. falciparum, позволяет обезвредить источник инфекции. Воздействует на гипнозоиты (в печени), обеспечивает радикальное излечение трехдневной малярии и малярии, вызванной P. ovale, радикальную химиопрофилактику трехдневной малярии с длительным периодом инкубации |
| Лекарственная группа (код АТХ) | Противомалярийные препараты |
|---|---|
Аминохинолины (РО1ВА) |
Хлорохин (P01BA01) Гидроксихлорохин (P01BA02) Примахин (РО1ВА03) |
Хинолинметанолы (РО1ВС) |
Хинина гидрохлоридρ (РО1ВС01) Мефлохин (P01BC02) |
Производные артемизинина (PO1BE) |
Артемизинин ρ, артесунаρ, артеметерρ, артеэтерρ |
Бигуаниды (P01BB) |
Прогуанил (P01BB01) |
Комбинированные препараты (РО1ВХ - другие противомалярийные ЛС) |
Саварин ρ (хлорохин + прогуанил), Маларонρ (атовахон + прогуанил), Коартемρ (артеметер + люмефантрин) |
Пириметамин + другие противомалярийные ЛС (РО1ВD) |
Пириметамин + сульфадоксин (Фансидарρ) |
Тетрациклины (J01AA) |
Тетрациклин (J01AA07) Доксициклин (J01AA02) |
Хинолины
Хлорохин. Международное непатентованное наименование (МНН) - хлорохин, в РФ - Делагил♠.
Показания: малярия, вызванная P. vivax, P. ovale, P. malariae, а также чувствительными к хлорохину P. falciparum (лечение и профилактика).
Хинин. МНН - хинин, в РФ - хинина гидрохлоридρ, хинина дигидрохлоридρ, хинина сульфатρ.
Оказывает гематошизонтоцидный эффект в отношении всех видов малярийного плазмодия, включая P. falciparum, резистентных к хлорохину.
Показания: лечение тропической малярии. Препарат первой линии при лечении полирезистентной тропической малярии, препарат выбора для лечения завозной тропической малярии, так как в большинстве тропических стран P. falciparum устойчив к хлорохину.
Мефлохин. МНН - мефлохин, в РФ - мефлохин (Лариам♠).
Механизм действия и фармакологические эффекты.
Оказывает гематошизонтоцидное действие в отношении всех видов малярийного плазмодия, включая P. falciparum, лекарственноустойчивые штаммы.
Показания: лечение тропической малярии, вызванной устойчивыми к хлорохину штаммами P. falciparum, химиопрофилактика малярии при выезде в регионы с риском инфицирования устойчивыми к хлорохину штаммами P. falciparum.
Примахин. МНН - примахин. Спектр активности - тканевые формы P. vivax и P. ovale (гистошизонтоцидный эффект); оказывает выраженное гаметотропное действие в отношении гаметоцитов всех видов плазмодия.
Показания: радикальное излечивание малярии, вызванной P. vivax и P. ovale (после завершения курса лечения хлорохином), профилактика рецидивов малярии, вызванной P. vivax и P. ovale, у лиц, вернувшихся из эндемичных зон.
Противомалярийные препараты других групп
Пириметамин. Синтетический препарат, производное диаминопиримидина. МНН - пириметамин.
Механизм действия и фармакологические эффекты.
Влияет на бесполые эритроцитарные, тканевые преэритроцитарные и повреждает гамонты всех видов плазмодия, блокирует спорогонию в организме комара. Оказывает медленный гематошизонтоцидный эффект в отношении всех видов плазмодия, включая штаммы P. falciparum, резистентные к хлорохину. Устойчивость к пириметамину развивается быстро. К препарату также чувствительны токсоплазмы.
Показания: лечение тропической малярии, вызванной резистентными к хлорохину плазмодиями (в сочетании с сульфадоксином и хинином), токсоплазмоз (в том числе токсоплазменный энцефалит при СПИДе, врожденный токсоплазмоз) - в сочетании с сульфадимидином или сульфадиазином.
Пириметамин + сульфадоксин. МНН - пириметамин + сульфадоксин. В РФ - Фансидар♠ .
Механизм действия и фармакологические эффекты.
Усиленный противомалярийный эффект комбинации обусловлен взаимным потенцированием действия каждого из компонентов. Основное клиническое значение имеет медленный гематошизонтоцидный эффект в отношении всех видов плазмодия, включая штаммы P. falciparum, резистентные к хлорохину. Чувствительны также тканевые формы P. falciparum, в несколько меньшей степени - P. vivax.
Показания: токсоплазмоз, профилактика пневмоцистной инфекции, лечение тропической малярии, вызванной резистентными к хлорохину плазмодиями (в сочетании с хинином, что связано с быстрым эффектом препарата).
Устойчивые к препарату пириметамин + сульфадоксин (Фансидар♠) штаммы P. falciparum обнаружены в странах Юго-Восточной Азии, Южной Америки, Океании и Экваториальной Африки.
Галофантринρ. Производное фенантренметанола. МНН - галофантрин дигидрохлоридρ. В РФ не зарегистрирован. Спектр активности - эритроцитарные формы P. falciparum (включая ряд штаммов, устойчивых к хлорохину и пириметамину + сульфадоксину) и P. vivax.
Показания: лечение тропической малярии при резистентности P. falciparum к хлорохину и другим препаратам, резистентные формы тропической малярии (препарат резерва).
Артемизининρ и его производные
Артемизининρ представляет собой экстракт травы Artemisia annua. Оказывает выраженное гематошизонтоцидное действие на все виды плазмодия, в том числе на полирезистентные штаммы P. falciparum. Артемизинин и его производные (артеметерρ , артесунатρ и артеэтерρ) воздействуют как на шизонты, так и на гаметоциты.
Показания: лечение малярии, включая церебральные формы, при резистентности к другим препаратам (иногда в сочетании с мефлохином, хинином, галофантриномρ, пириметамин + сульфадоксином или доксициклином).
Артеметер + люмефантрин - комбинированный препарат (коартем ρ).
Выпускается в таблетках для приема внутрь. Каждая таблетка содержит 20 мг артеметера и 120 мг люмефантрина.
Показания: лечение неосложненной тропической малярии, вызванной полирезистентными штаммами P. falciparum, у взрослых и детей (массой тела более 5 кг).
Прогуанил. Синтетический бигуанид, дериват пиримидина. МНН - прогуанил. В РФ - прогуанил гидрохлоридρ.
Показания: химиопрофилактика малярии (в сочетании с хлорохином).
Атовахонρ. Синтетическое соединение из группы гидроксинафтохинонов, имеющее широкий спектр противопротозойной активности.
Спектр активности: эритроцитарные формы малярийных плазмодиев, токсоплазмы, пневмоцисты, бабезии, микроспоридии.
Показания: в комбинации с прогуанилом для лечения полирезистентной тропической малярии, токсоплазмоз, пневмоцистоз, бабезиоз, микроспоридиоз.
Атовахон + прогуанил - комбинированный препарат (маларонρ), содержащий в одной таблетке 250 мг атовахона и 100 мг прогуанила гидрохлорида. Активны в отношении эритроцитарных и экзоэритроцитарных фаз Plasmodium spp., комбинированный препарат высокоактивен против кровяных стадий P. falciparum, устойчивых к хлорохину, галофантрину и мефлохину.
Показания: полирезистентная falciparum-малярия; профилактика малярии.
Противопротозойные препараты, применяемые при других заболеваниях, вызываемых простейшими
Метронидазол. Производное 5-нитроимидазола. МНН - метронидазол, Флагил♠. Активен в отношении Entamoeba histolytica, Lamblia intestinalis, Trichomonas vaginalis, а также облигатных анаэробов.
Показания: амебиаз, лямблиоз, трихомонадный вагинит и уретрит у женщин, анаэробные инфекции, вызванные чувствительными к препарату микроорганизмами, язвенная болезнь желудка и/или двенадцатиперстной кишки в фазе обострения, ассоциированная с Helicobacter pylori.
Тинидазол. Производное 5-нитроимидазола. МНН - тинидазол. Активен в отношении Entamoeba histolytica, Lamblia intestinalis, Trichomonas vaginalis, возбудителей анаэробных инфекций.
Показания: амебиаз, лямблиоз, трихомониаз, инфекции различной локализации, вызванные анаэробными бактериями, эрадикация Helicobacter pylori (в комбинации с препаратами висмута и антибиотиками).
Дилоксанида фуроатρ. Синтетический препарат, производное дихлорацетамида. В РФ не зарегистрирован.
Показания: бессимптомный кишечный амебиаз (носительство цист), клинически манифестирующий амебиаз (в сочетании с метронидазолом или другими амебицидами).
Паромомицин. МНН - паромомицин. Природный антибиотик - аминогликозид. Спектр активности: E. histolytica, Cryptosporidium, Leishmania.
Показания: неинвазивный амебиаз (бессимптомное носительство), криптоспоридиоз (в том числе при СПИДе), кожный лейшманиоз (местно).
Эметинρ и дегидроэметин ρ. Эметинρ - алкалоид растения Ipecacuanha, дегидроэметинρ - его полусинтетический аналог. МНН - эметинρ. Эметинρ и дегидроэметинρ - тканевые амебициды, действующие на паразита, локализующегося в стенке кишечника и в печени.
Показания: тяжелые формы кишечного и внекишечного амебиаза, включая абсцесс печени (при неэффективности или невозможности применения нитроимидазолов). Используют также в сочетании с хлорохином.
Меглумина антимонатρ. Органическое соединение пятивалентной сурьмы. МНН - меглумина антимонатρ. В РФ - глюкантимρ. Спектр активности - Leishmania.
Показания: лейшманиоз (висцеральный, кожно-слизистый, кожный).
Противогельминтные препараты
Большинство современных противогельминтных препаратов эффективно против гельминтов разных классов. В настоящее время их систематизируют по структурным особенностям: производные бензимидазола (албендазол, мебендазол, триклабендазолρ), имидазолтиазола (левамизол) и препараты других химических групп - пиримидины (пирантел), пиперазины (диэтилкарбамазин), салициланилиды (никлозамид), пиразинизохинолины (празиквантел), макролиды (ивермектин). При выборе средства для специфической терапии учитывают особенности спектра антигельминтной активности препаратов, что особенно важно при полиинвазиях.
Производные бензимидазола
Для бензимидазолов характерна сравнительно высокая терапевтическая эффективность, широкий спектр антигельминтного действия и низкая токсичность. Обладают ларвицидным действием.
Албендазол. МНН - албендазол. В РФ - Немозол♠. Обладает широким спектром противонематодной активности. Действует также на некоторые цестоды.
Показания: аскаридоз, анкилостомидоз, стронгилоидоз, трихинеллез, трихоцефалез, токсокароз, энтеробиоз, эхинококкоз, нейроцистицеркоз, полиинвазии, лямблиоз.
Мебендазол. МНН - мебендазол. В РФ - Вермокс♠.
Показания: аскаридоз, анкилостомидозы, энтеробиоз, трихоцефалез, трихинеллез, эхинококкозы, полиинвазии.
Триклабендазол ρ. МНН - триклабендазолρ. Торговое наименование - фазинексρ. Спектр действия: половозрелые и неполовозрелые паразиты рода Fasciola.
Показания: фасциолез, парагонимоз, дикроцелиоз.
Карбендацимρ. МНН - карбендацимρ. Активен в отношении кишечных не матод.
Показания: анкилостомидозы, аскаридоз, трихоцефалез, энтеробиоз.
Левамизол. МНН - левамизол. В РФ - Декарис♠.
Показания: аскаридоз, энтеробиоз.
Пирантел. Производное пиримидина. МНН - пирантел.
Показания: аскаридоз, энтеробиоз, анкилостомидозы.
Диэтилкарбамазин. Производное пиперазина. МНН - диэтил-карбамазин. В РФ - дитразина цитратρ. Действует на личиночные стадии филярий (микрофилярии) и взрослые формы Brugia malaya, Wuchereria bancrofti, Loa loa, Onchocerca volvulus и др.
Показания: филяриозы (бругиоз, вухерериоз, лоаоз, онхоцеркоз).
Никлозамид. Производное салициланилида. МНН - никлозамид. В РФ - фенасалρ.
Показания: тениаринхоз, дифиллоботриоз, гименолепидоз.
Никлозамид нельзя применять при тениозе, так как существует риск развития в последующем цистицеркоза.
Празиквантел. Производное пиразинизохинолина. МНН - празиквантел. В РФ - Бильтрицид♠.
Показания: трематодозы (описторхоз, клонорхоз, парагонимоз, метагонимоз, фасциолопсидоз, шистосомозы). Из трематод к празиквантелу устойчива Fasciola hepatica; кишечные цестодозы (гименолепидоз, дифиллоботриоз, тениаринхоз, тениоз, нейроцистицеркоз).
Противопедикулезные препараты Перметрин
Показания: головной и лобковый педикулез.
Противопоказания: повышенная чувствительность к препарату, возраст до одного года.
Лекарственные препараты на основе перметрина
Медифокс♠ (Россия) - концентрат эмульсии, содержащий 5% перметрина.
Выпускают 5% концентрат эмульсии: ампулы по 2 мл; флаконы от 10 до 250 мл.
Ниттифор♠¤. Раствор для наружного применения: 60 мл (300 мг перметрина) во флаконе по 1 шт. в упаковке.
Малатион + перметрин + пиперонил бутоксид (Пара плюс♠) (Франция). Синтетический комбинированный препарат.
Форма выпуска: аэрозоль во флаконах по 116 г.
Малатион. МНН - малатион. Торговое наименование - педилинρ.
Показания: педикулез, чесотка.
Противопоказания: гиперчувствительность.
Форма выпуска: эмульсия и шампунь во флаконах.
Спрей пакс ρ. Препарат для лечения лобкового педикулеза.
Форма выпуска: аэрозоль для наружного применения во флаконах по 12 г. В 100 г препарата содержится 1,333 г экстракта пиретрума и 2,667 г пиперонила бутоксида.
Фенотрин. Синоним: итакеρ.
Показания к применению: педикулез волосистой части головы у взрослых и детей.
Форма выпуска: пенящийся лосьон для наружного применения во флаконах по 100 мл (фенотрин - 0,3 г, анионные и неионные поверхностно-активные вещества). Аэрозоль для наружного применения во флаконах по 100 г (фенотрин - 0,483 г, неопинамин - 0,965 г, пиперонил бутоксид - 1,93 г).
Препараты для лечения чесотки
Бензилбензоат (Бензилбензоат♠).
Показания: чесотка, педикулез.
Противопоказания: острые воспалительные заболевания кожи.
Лекарственные формы: мазь 10% и 20% в банках и тубах по 25, 30, 50 г.
Пиперонил бутоксид + эсбиол (Спрегаль♠) - препарат для лече ния чесотки.
Противопоказание: индивидуальная непереносимость одного из компонентов препарата.
Лекарственная форма: аэрозоль в баллоне 152 г.
Кротамитон - средство для лечения чесотки. Показания к применению: лечение чесотки и кожного зуда. Форма выпуска: крем (1 г - 0,1 г кротамитона) в тубах по 60 г; лосьон (1 г - 0,1 г кротамитона) во флаконах по 60 г.
5.6. ЛЕКАРСТВЕННЫЕ ВЗАИМОДЕЙСТВИЯ
Под лекарственным взаимодействием понимают усиление (синергизм) или ослабление (антагонизм) терапевтического эффекта при одновременном или последовательном введении двух или нескольких лекарственных препаратов (табл. 5-11).
| ЛС или группа ЛС, вступающих во взаимодействие | Результаты взаимодействия |
|---|---|
Пенициллины |
|
Антикоагулянты прямого и непрямого действия, тромболитические средства, НПВС, салицилаты |
Повышение риска кровотечения (особенно с высокими дозами карбенициллина, уреидопенициллинов) |
Ингибиторы АПФ, калийсберегающие диуретики, препараты калия и калийсодержащие препараты |
Гиперкалиемия (при введении бензилпенициллина калиевой солиρ) |
Аминогликозиды |
Взаимная инактивация при смешивании |
Эстрогенсодержащие пероральные контрацептивы |
Снижение эффективности контрацепции (особенно с амоксициллином, ампициллином, феноксиметилпенициллином) |
Антигиперлипидемические средства (холестираминρ, колестипол) |
Уменьшение всасывания пенициллинов |
Метотрексат |
Усиление токсичного действия метотрексата |
Сульфаниламиды, хлорамфеникол |
Ослабление бактерицидного эффекта пенициллинов |
Неомицин |
Уменьшение всасывания феноксиметилпенициллина |
ЦС |
|
Спиртсодержащие препараты, алкоголь |
Развитие дисульфирамоподобной реакции (цефоперазон) |
Антикоагулянты прямого и непрямого действия, тромболитические средства, НПВС, салицилаты |
Повышение риска кровотечения (цефоперазон) |
Аминогликозиды, гликопептиды, петлевые диуретики и другие препараты, оказывающие нефротоксичное действие |
Повышение риска нефротоксического действия |
Аминогликозиды |
|
Аминогликозиды, при одновременном или последовательном применении двух препаратов и более |
Повышение риска ототоксичности, нефротоксичности, нервно-мышечной блокады |
Гликопептиды |
Повышение риска ототоксичности и нефротоксичности |
Капреомицин |
Повышение риска ототоксичности, нефротоксичности, нервно-мышечной блокады |
Полимиксин В |
Повышение риска нефротоксичности и нервно-мышечной блокады |
Петлевые диуретики, цисплатин |
Повышение риска ототоксичности |
Средства для наркоза, наркотические анальгетики, недеполяризующие миорелаксанты |
Усиление нервно-мышечной блокады, повышение риска угнетения и остановки дыхания |
Антимиастенические средства |
Ослабление действия антимиастенических средств |
Хинолоны/фторхинолоны |
|
Антикоагулянты непрямого действия |
Усиление антикоагулянтного эффекта (особенно с налидиксовой кислотой) |
Алюминий-, кальций- и магнийсодержащие антациды, магнийсодержащие слабительные, препараты цинка, висмута и железа |
Ослабление эффекта фторхинолонов при приеме внутрь |
Ксантины (теофиллин, аминофиллин, кофеин) |
Повышение риска токсичности ксантинов (особенно с ципрофлоксацином) |
Диданозин |
Уменьшение всасывания фторхинолонов |
Циклоспорин |
Повышение концентрации циклоспорина в сыворотке крови |
Пероральные противодиабетические средства, инсулин |
Гипогликемия или гипергликемия |
НПВС |
Повышение риска возбуждения ЦНС и развития судорог |
Фенитоин |
Уменьшение концентрации фенитоина в сыворотке крови |
Макролиды |
|
Бензодиазепины (мидазолам, триазолам), сердечные гликозиды (дигоксин), антиаритмические средства (дизопирамид) |
Усиление действия данных препаратов |
Алкалоиды спорыньи (эрготамин, дигидроэрготамин) |
Ишемия конечностей, эрготизм с периферическим некрозом (особенно с эритромицином и кларитромицином) |
Противосудорожные средства (карбамазепин, фенитоин, вальпроевая кислота), ксантины (аминофиллин, кофеин, теофиллин) |
Увеличение концентрации данных препаратов в сыворотке крови и повышение риска их токсичности |
Блокаторы Н1-рецепторов (астемизол, терфенадин), сердечные гликозиды (дигоксин), цизаприд |
Повышение риска кардиотоксического действия (увеличение интервала Q-Т, аритмия) |
Циклоспорин |
Увеличение концентрации данного препарата в сыворотке крови и повышение риска его нефротоксичности |
Рифампицин, рифабутин |
Уменьшение концентрации кларитромицина в сыворотке крови |
Зидовудин |
Уменьшение концентрации зидовудина в сыворотке крови (особенно с кларитромицином) |
Тетрациклины |
|
Антациды, магнийсодержащие слабительные, препараты кальция и железа, антигиперлипидемические средства (холестираминρ, колестипол) |
Ослабление всасывания тетрациклинов при приеме внутрь |
Барбитураты, противосудорожные средства (карбамазепин, фенитоин) |
Снижение концентрации доксициклина в сыворотке крови |
Эстрогенсодержащие пероральные контрацептивы |
Снижение эффективности контрацепции |
Антикоагулянты непрямого действия |
Повышение риска кровотечения |
Сердечные гликозиды (дигоксин) |
Усиление действия дигоксина при приеме тетрациклина внутрь |
Ретинол [Ретинола ацетат (витамин A)♠] |
Повышение внутричерепного давления |
Метоксифлуран |
Повышение риска нефротоксичности |
Линкосамиды |
|
Средства для наркоза, наркотические анальгетики, недеполяризующие миорелаксанты |
Усиление нервно-мышечной блокады, повышение риска угнетения и остановки дыхания |
Адсорбирующие противодиарейные средства |
Уменьшение всасывания линкосамидов |
Антимиастенические средства |
Ослабление эффекта действия антимиастенических средств |
Макролиды, хлорамфеникол |
Ослабление действия линкосамидов |
Гликопептиды |
|
Аминогликозиды, капреомицин, полимиксины, амфотерицин В, противоопухолевые средства (кармустин, цисплатин, стрептозоцин), петлевые диуретики, салицилаты, циклоспорин |
Повышение риска ототоксичности и нефротоксичности |
Средства для наркоза, недеполяризующие миорелаксанты |
Усиление гипотензии и нервно-мышечной блокады |
Блокаторы Н1-рецепторов, фенотиазины, тиоксантены |
Маскируется ототоксическое действие ванкомицина (шум в ушах, головокружение) |
Дексаметазон |
Уменьшение проникновения ванкомицина в СМЖ |
Полимиксины |
|
Гликопептиды |
Повышение риска ототоксичности и нефротоксичности |
Капреомицин |
Повышение риска ототоксичности, нефротоксичности и нервно-мышечной блокады |
Аминогликозиды |
Повышение риска ототоксичности, нефротоксичности и нервно-мышечной блокады |
Петлевые диуретики, цисплатин |
Повышение риска ототоксичности |
Недеполяризующие миорелаксанты |
Усиление эффекта миорелаксантов |
Сульфаниламиды и ко-тримоксазол [сульфаметоксазол + триметоприм] (Ко-тримоксазол♠) |
|
Антикоагулянты непрямого действия, пероральные противодиабетические средства, метотрексат |
Усиление эффектов и токсического действия этих препаратов |
Средства, вызывающие угнетение функции костного мозга |
Усиление лейкопенического и тромбоцитопенического эффектов |
Эстрогенсодержащие пероральные контрацептивы |
Снижение эффективности контрацепции |
Фенилбутазон |
Увеличение концентрации сульфаниламидов в сыворотке крови |
Циклоспорин |
Уменьшение концентрации данного препарата в сыворотке крови, повышение риска нефротоксического действия |
Пенициллины |
Ослабление бактерицидного эффекта пенициллинов |
Прокаинамид, фенитоин |
Усиление действия данных препаратов |
Рифампицин, рифабутин |
Усиление выведения триметоприма |
Хлорамфеникол |
|
Средства, вызывающие угнетение функции костного мозга |
Усиление угнетения функции костного мозга |
Пероральные противодиабетические средства (особенно толбутамид и хлорпропамид) |
Усиление гипогликемического эффекта |
Эритромицин, линкосамиды |
Ослабление эффекта данных препаратов |
Пенициллины |
Ослабление бактерицидного эффекта пенициллинов (кроме ампициллина) |
Эстрогенсодержащие пероральные контрацептивы |
Снижение эффективности контрацепции |
Противосудорожные средства (фенитоин) |
Увеличение концентрации фенитоина в сыворотке крови и повышение риска его токсичности |
Барбитураты (фенобарбитал), рифампицин, рифабутин |
Уменьшение концентрации хлорамфеникола в сыворотке крови и снижение его эффективности |
Цианокобаламин |
Снижение эффективности препарата |
Фосфомицин |
|
Метоклопрамид и другие прокинетики |
Усиление моторики ЖКТ, уменьшение концентрации фосфомицина в сыворотке крови и выведения его с мочой |
Фузидовая кислота (Фузидиевая кислота♠) |
|
Гидрокортизон |
Снижение эффективности фузидовой кислоты (Фузидиевой кислоты♠) |
Пенициллины, ЦС |
Ослабление бактерицидного действия этих групп антибиотиков |
Нитроимидазолы |
|
Антикоагулянты непрямого действия |
Усиление эффектов этих препаратов |
Противосудорожные средства (фенитоин) |
Увеличение концентрации фенитоина в сыворотке крови |
Барбитураты (фенобарбитал) |
Снижение эффективности метронидазола |
Спиртсодержащие препараты, алкоголь |
Развитие дисульфирамоподобной реакции |
Блокаторы Н2-рецепторов (циметидин) |
Повышение концентрации метронидазола в крови |
Нитрофураны |
|
Антациды |
Ослабление всасывания нитрофуранов при приеме внутрь |
Противосудорожные средства (фенитоин) |
Снижение концентрации фенитоина в сыворотке крови |
Эстрогенсодержащие пероральные контрацептивы |
Снижение эффективности контрацепции |
Трициклические антидепрессанты, ингибиторы моноаминоксидазы, симпатомиметики (эфедрин, фенилэфрин) |
Резкое повышение АД (с фуразолидоном) |
Спиртосодержащие препараты, алкоголь |
Развитие дисульфирамоподобной реакции (с фуразолидоном) |
Налидиксовая кислота |
Ослабление эффекта налидиксовой кислоты |
Противотуберкулезные средства |
|
Производные гидразида изоникотиновой кислоты (ГИНК) |
|
Стрептомицин |
Замедление выведения с мочой |
Рифампицин, рифабутин, этионамид |
Повышение риска гепатотоксичности |
Пиразинамид |
Усиление противотуберкулезного действия, повышение риска гепатотоксичности |
Этамбутол |
Замедление развития устойчивости микобактерий туберкулеза |
Циклосерин |
Повышение риска нейротоксичности |
Аминосалициловая кислота (ПАСК♠) |
Повышение концентрации изониазида в крови |
Пиридоксин |
Ослабление действия пиридоксина |
Антациды |
Уменьшение всасывания производных ГИНК |
Дисульфирам, спиртсодержащие препараты и алкоголь |
Повышение риска токсичного действия на ЦНС |
Кетоконазол |
Снижение концентрации кетоконазола в сыворотке крови |
Рифамицины |
|
Изониазид, этионамид |
Повышение риска гепатотоксичности |
Пиразинамид |
Усиление противотуберкулезного действия, повышение риска гепатотоксичности |
Аминосалициловая кислота (ПАСК♠) |
Нарушение всасывания рифампицина |
Аминофиллин, теофиллин |
Усиление метаболизма и клиренса этих препаратов |
Средства для наркоза (производные углеводородов) |
Повышение риска токсичного эффекта этих препаратов |
Антикоагулянты непрямого действия, пероральные противодиабетические средства, β-адреноблокаторы, антиаритмические средства, кортикостероиды, циклоспорин, дигоксин, дигитоксинρ, эстрогенсодержащие пероральные контрацептивы, хлорамфеникол |
Снижение эффектов этих препаратов |
Антациды |
Уменьшение всасывания рифамицинов |
ИП ВИЧ (индинавир, нелфинавир, саквинавир) |
Снижение эффектов этих препаратов, повышение риска токсичности рифамицинов |
Флуконазол, кларитромицин |
Повышение концентрации рифабутина в крови |
Этамбутол |
|
Изониазид, фтивазид, метазид |
Замедление развития устойчивости микобактерий туберкулеза |
Этионамид |
Антагонизм |
ЛС, оказывающие нейротоксическое действие |
Повышение риска нейротоксичности (периферический и нейробульбарный невриты) |
Этионамид, протионамид |
|
Изониазид |
Повышение риска гепатотоксичности и нейротоксичности |
Рифампицин |
Повышение риска гепатотоксичности |
Этамбутол |
Антагонизм (с этионамидом) |
Циклосерин, спиртсодержащие препараты, алкоголь, ЛС с нейротоксическим действием |
Повышение риска нейротоксичности |
Пиразинамид |
|
Офлоксацин, ломефлоксацин |
Усиление противотуберкулезного действия |
Изониазид, рифампицин |
Усиление противотуберкулезного действия, повышение риска гепатотоксичности |
Циклоспорин |
Ослабление действия циклоспорина |
Противоподагрические средства |
Ослабление действия данных препаратов |
Циклосерин |
|
Изониазид, фтивазид, этионамид, протионамид, алкоголь, кофеин, дисульфирам, ЛС с нейротоксическим действием |
Повышение риска нейротоксичности |
Аминосалициловая кислота (ПАСК♠) |
|
Изониазид |
Повышение концентрации изониазида в крови |
Рифампицин, эритромицин, линкомицин |
Нарушение всасывания этих препаратов |
Цианокобаламин (Витамин B12♠) |
Нарушение усвоения витамина В12 (риск анемии) |
Капреомицин |
|
Аминогликозиды и другие препараты, оказывающие ототоксическое и нефротоксическое действие |
Повышение риска ототоксичности, нефротоксичности и нервно-мышечной блокады, повышение риска угнетения и остановки дыхания |
Полимиксины |
Повышение риска нефротоксичности и нервно-мышечной блокады, повышение риска угнетения и остановки дыхания |
Синергидное действие используется при выборе комбинаций антибактериальных средств с целью усиления терапевтического эффекта. В частности, облегчение захвата аминогликозидов микроорганизмами в присутствии ингибиторов синтеза бактериальной стенки является основой для их совместного применения с β-лактамными антибиотиками и гликопептидами. С другой стороны, оно может являться причиной нежелательных реакций у пациентов, получающих сопутствующую фармакотерапию (например, повышение риска нефротоксичности и ототоксичности при одновременном применении аминогликозидов или гликопептидов с петлевыми диуретиками; повышение риска геморрагических осложнений при применении β-лактамных антибиотиков с непрямыми антикоагулянтами). Вследствие лекарственного взаимодействия возможно снижение биодоступности пероральных антибиотиков (например, тетрациклинов и фторхинолонов под влиянием антацидов). Большое число лекарственных взаимодействий макролидов (прежде всего эритромицина и кларитромицина) и рифампицина обусловлено их способностью влиять на цитохром Р-450 в печени и изменять метаболизм других ЛС.
Нежелательные последствия лекарственных взаимодействий развиваются в 3-5% случаев при одновременном приеме 2-5 препаратов. Их риск значительно повышается при увеличении числа препаратов более 5, у больных старше 65 лет и у пациентов с почечной недостаточностью. Поэтому одним из наиболее действенных методов уменьшения вероятности лекарственных взаимодействий является предупреждение полипрагмазии.
Данные о лекарственном взаимодействии антимикробных препаратов с препаратами, оказывающими прямое противовирусное действие на HCV, можно получить на сайте http://www.hep-druginteractions.org.
Применение антибактериальных препаратов при беременности и грудном вскармливании
Рациональное и эффективное применение антибиотиков во время беременности предполагает выполнение следующих условий.
-
Необходимо использовать ЛС только с установленной безопасностью применения при беременности, с известными путями метаболизма (критерии FDА).
-
При назначении препаратов следует учитывать срок беременности: ранний или поздний. Поскольку срок окончательного завершения эмбриогенеза установить невозможно, то необходимо особенно тщательно подходить к назначению антибиотиков до 5 мес беременности.
-
В процессе лечения необходим тщательный контроль за состоянием матери и плода.
Если нет объективной информации, подтверждающей безопасность применения ЛС, включая антибиотики, при беременности или грудном вскармливании, назначать их данным категориям пациентов не следует.
Во всем мире широко пользуются следующими категориями риска применения лекарств при беременности, разработанными FDA.
А - в результате адекватных строго контролируемых исследований не выявлено риска неблагоприятного действия на плод в I триместре беременности (и нет данных, свидетельствующих о подобном риске в последующих триместрах).
В - изучение репродукции на животных не выявило риска неблагоприятного действия на плод, а адекватных и строго контролируемых исследований у беременных женщин не проведено.
С - изучение репродукции на животных выявило неблагоприятное действие на плод, а адекватных и строго контролируемых исследований у беременных женщин не проведено, однако потенциальная польза, связанная с применением ЛС у беременных, может оправдывать его использование, несмотря на возможный риск.
D - имеются доказательства риска неблагоприятного действия ЛС на плод человека, полученные при проведении исследований или на практике, однако потенциальная польза, связанная с применением ЛС у беременных, может оправдывать его использование, несмотря на возможный риск.
X - испытания на животных или клинические испытания выявили нарушения развития плода и/или имеются доказательства риска неблагоприятного действия ЛС на плод человека, полученные при проведении исследований или на практике; риск, связанный с применением ЛС у беременных, превышает потенциальную пользу.
5.7. БИОДОСТУПНОСТЬ ВОЗБУДИТЕЛЯ
Биодоступность возбудителя - это возможность достижения в очаге размножения возбудителя терапевтических (микробицидных, микробистатических) концентраций антимикробного препарата при введении его в организм в дозах, регламентированных фармакопеей. Биодоступность возбудителя зависит от многих факторов: во-первых, от чувствительности возбудителя к терапевтическим дозам препаратов, так как широкое распространение получила резистентность к антибактериальным, антипротозойным и противовирусным препаратам; во-вторых, даже при наличии чувствительности возбудителя большое значение имеют особенности фармакокинетики препарата: пути распространения и выведения препарата должны совпадать с локализацией инфекционного процесса; в-третьих, при локализации в различных органах и тканях препарат должен в достаточных количествах проникать в очаг инфекции через гистогемоцитарные барьеры, воспалительные инфильтраты и т.д. Особенно мощными являются ГЭБ и ГЛБ. Эти барьеры непроницаемы для макролидов и аминогликозидов, поэтому последние могут применяться для лечения бактериальных нейроинфекций только в качестве вспомогательных средств или вводиться эндолюмбально (если они разрешены для эндолюмбального введения). Очень низкой способностью проникать через ГЭБ и ГЛБ обладают β-лактамные антибиотики, но при повышении проницаемости ГЭБ и ГЛБ при воспалительном процессе в ЦНС при введении максимальных доз, преимущественно внутривенно, они создают терапевтические концентрации в субарахноидальном пространстве и широко используются для лечения бактериальных нейроинфекций. Наибольшей биодоступностью обладают возбудители, циркулирующие в крови (микробемия). В этих случаях антимикробные препараты желательно вводить внутривенно, с малыми интервалами между введениями, чтобы обеспечить постоянное поддержание в крови эффективной концентрации препарата. При наличии тканевых очагов, ограниченных зоной воспаления, особенно гнойного, биодоступность возбудителя резко снижается, поэтому разовые дозы должны быть максимально повышены для создания пиковых концентраций препарата в крови и пассажа его в это время в очаг инфекции. Пассаж антимикробных препаратов резко снижается при уменьшении кровоснабжения пораженного органа вследствие артериальной гипотензии, кровопотери, при отеке и набухании головного мозга (ОНГМ). В этих случаях препараты следует вводить в регионарные артерии, в частности при нейроинфекциях - в a. carotis. Попытки введения интратекально (эндолюмбально) неэффективны, так как при ОНГМ с дислокацией ствола введенный препарат остается в спинальном отделе субарахноидального пространства, а в церебральный отдел не проникает. В то же время высокие концентрации препарата в спинальном отделе часто сопровождаются тяжелыми побочными реакциями. Если размножение возбудителя происходит в гнойном экссудате, некротизированных тканях, гематомах, то в связи с отсутствием кровотока в этих субстратах не создается терапевтической концентрации антимикробных препаратов, в частности при анаэробной раневой инфекции (газовой гангрене) антибиотикотерапия неэффективна, так как возбудитель размножается в некротических очагах. Важную роль в развитии бионедоступности возбудителей бактериальных гнойных инфекций играет их способность образовывать биопленку, которая защищает колонии микробов от проникновения антибиотиков. В связи с этим в последние 20 лет при тяжелых бактериальных инфекциях рекомендуют сочетать антибиотикотерапию с системной энзимотерапией (вобэнзим и другие, обладающие системным действием, способствующим повышению концентрации антибиотика в очаге инфекции на 8-25%) и разрушать ферментативным путем защитную биопленку колоний бактерий.
При проведении системной антимикробной терапии также следует применять препараты, улучшающие кровоток, стабилизирующие АД, обеспечивать постоянное поддержание нормоволемии.
5.8. ПОБОЧНОЕ ДЕЙСТВИЕ АНТИМИКРОБНЫХ ПРЕПАРАТОВ
В результате применения антимикробных препаратов возникают следующие виды побочных реакций:
Аллергические реакции
Особенности, отличающие аллергические реакции от других нежелательных воздействий ЛС:
В зависимости от сроков развития клинических симптомов с момента поступления лекарственного препарата в организм различают следующие виды аллергических реакций:
Аллергеном может быть любое ЛС (в том числе иммунопрепараты), за исключением химического вещества, являющегося естественной составной частью биологических жидкостей [декстроза (Глюкоза♠), изотонический раствор натрия хлорида и др.].
Большинство ЛС - простые химические вещества с молекулярной массой менее 1000 D. Их относят к неполным антигенам (гаптенам). Для оказания сенсибилизирующего действия гаптены должны соединиться с белком организма и образовать полные антигены, в которых ЛС определяет специфичность, а белок - способность взаимодействовать с антителами.
Выделяют следующие этапы развития лекарственной аллергии:
-
образование гаптена - превращение лекарственного препарата в неполный антиген, который может вступать во взаимодействие с белками организма;
-
конъюгация гаптена с белком или другой молекулой-носителем с образованием полного антигена;
-
развитие иммунной реакции организма на образовавшийся полный антиген (комплекс «гаптен-носитель»), ставший для организма чужеродным.
В реакции на поступление ЛС в организм участвуют и гуморальное (прежде всего IgE), и клеточное (T-лимфоциты) звенья иммунитета, поэтому в развитии лекарственной аллергии могут принимать участие все типы аллергических реакций.
Факторы развития лекарственной аллергии
-
Фармакологические свойства и схема назначения лекарственного препарата: высокие аллергенные свойства препарата и его метаболитов, возможность ЛС активировать или модулировать эффекторные системы, способ введения, доза, продолжительность курса терапии.
-
Предшествующее попадание ЛС с пищей, например мяса птицы, в корм которой добавляли антибиотики (тетрациклин).
-
Сопутствующие заболевания: атопическая бронхиальная астма, атопический дерматит (у детей - экссудативный диатез), нарушения функции печени, хронические инфекционные болезни, требующие длительного и/или частого применения медикаментов, грибковые поражения кожи, слизистых оболочек и др.
-
Лечение сопутствующих заболеваний (применение препаратов, активирующих или подавляющих эффекторные системы).
-
Генетические факторы (аллергия на ЛС у родственников пациента).
Истинные аллергические реакции чаще всего развиваются на бензил-пенициллин (в 70% случаев), ампициллин (в 50% случаев), ампициллин + оксациллин (в 40% случаев), аминогликозиды и сульфаниламиды (в 40 и 60% случаев соответственно), нормальные и специфические иммуноглобулины и сыворотки (20-30%), особенно гетерогенные.
Псевдоаллергические реакции
Часто после поступления химиотерапевтических препаратов в организм развивается не истинная, а псевдоаллергическая реакция - процесс, подобный истинной аллергической реакции, но не проходящий в своем развитии иммунологическую стадию.
Механизмы псевдоаллергических реакций
Факторы развития псевдоаллергических реакций
-
Полипрагмазия - одновременное (часто необоснованное) назначение большого количества ЛС или лечебных процедур.
-
Обменные нарушения, сопутствующие заболевания желудка, кишечника, печени, нейроэндокринной системы.
-
Прием внутрь химиотерапевтических препаратов больными с язвенным, эрозивным или геморрагическим поражением желудка и кишечника.
-
Доза препарата, не соответствующая массе тела и возрасту больного.
Клинические формы аллергических реакций
Анафилактический шок - наиболее тяжелая форма аллергической реакции немедленного типа, чаще всего развивающаяся в срок от нескольких минут до 1 ч после начала внутривенного или ингаляционного введения лекарственного препарата. Первые симптомы: чувство страха, беспокойство, головная боль, головокружение, потливость, кожный зуд. Позже появляется уртикарная сыпь, одышка, кашель, бронхоспазм, боль в животе, тошнота, рвота, диарея, мидриаз, судороги, непроизвольное мочеиспускание и дефекация. При осмотре обнаруживают бледность кожных покровов, цианоз носогубного треугольника, кратковременное резкое повышение АД с последующей резкой гипотензией. Смерть может наступить вследствие асфиксии или коллапса в течение 5-30 мин. В более поздние сроки смерть возможна от отека мозга, ОПН, внутренних кровотечений.
Ангионевротический отек (отек Квинке) может возникать самостоятельно или в сочетании с анафилактическим шоком, крапивницей и другими аллергическими реакциями. Внезапно появляются локальный кожный зуд и отек губ, век, лица, половых органов. Угроза жизни возникает при распространении отека на слизистую оболочку ротоглотки, гортани, трахеи, легких.
Крапивница - локальная или генерализованная уртикарная сыпь, сопровождающаяся сильным зудом. Элементы сыпи часто имеют неправильную или кольцевидную форму.
Лекарственная экзантема - полиморфная сыпь (пятнистая, папулезная, пятнисто-папулезная, везикулезная), которая может сопровождаться повышением температуры тела и поражением внутренних органов. После устранения аллергена экзантема быстро исчезает, но если его поступление в организм не прекращается, то развивается более тяжелая клиническая картина.
Фиксированный дерматит - ограниченная эритема, оставляющая после себя стойкую пигментацию. При повторном применении медикаментов развивается на одних и тех же участках. Возникновение фиксированного дерматита обычно связано с применением сульфаниламидов и антибиотиков.
Лекарственный васкулит - возникновение различных элементов (от единичных петехий до геморрагической пурпуры) на коже и слизистых оболочках внутренних органов. Пигментация кожи на месте высыпания сохраняется долго. Локализация элементов на слизистых оболочках сопровождается соответствующей клинической картиной.
Эритродермия возникает после применения пиразолонов, сульфаниламидов, тетрациклина. Кожа, особенно в складках, гиперемирована, инфильтрирована, отечна, возможно увеличение лимфатических узлов (ЛУ), повышение температуры тела до 39-40 °С, появление экссудативных элементов, гидраденита, присоединение пиодермии. После угасания кожных проявлений остается пластинчатое шелушение («луковая шелуха»).
В некоторых случаях прием антибиотиков ведет к развитию многоморфной экссудативной эритемы, синдромов Стивенса-Джонсона и Лайелла.
Многоморфная (полиморфная) экссудативная эритема - симметричные кожные высыпания в виде пятен, папул, располагающихся на шее, лице, голенях, предплечьях и тыльной поверхности кистей, часто поражаются слизистые оболочки. Возникновению сыпи предшествует повышение температуры тела, признаки общей интоксикации, боли в суставах. Сыпь может быть генерализованной, геморрагической, с последующим образованием пузырей, эритематозных пятен.
Синдром Стивенса-Джонсона - полиморфные высыпания в виде эритематозных пятен и пузырей, часто с геморрагическим содержимым, локализующихся на коже, слизистых оболочках полости рта, мочеиспускательного канала и на конъюнктиве; сопровождается симптомами интоксикации.
Синдром Лайелла (эпидермальный токсический некроз) - токсико-аллергическое поражение кожи, характеризующееся внезапным некрозом поверхностных участков кожи и слизистых оболочек с образованием пузырей на фоне эритемы, которые отслаиваются при малейшем прикосновении, обнажая обширные участки подлежащих слоев кожи (симптом Никольского). На слизистой оболочке глаз, пищеварительного тракта, половых органах отмечаются обширные буллезные элементы, эрозии. Общее состояние больного тяжелое, быстро присоединяется вторичная инфекция, септическое поражение органов. Обязательна срочная госпитализация в реанимационное или ожоговое отделение со строгим соблюдением асептики.
В ответ на введение антимикробных и иммунопрепаратов возможно развитие синдрома, напоминающего сывороточную болезнь. Основные симптомы: крапивница, отек Квинке, лихорадка, артралгия, спленомегалия, полиаденопатия, эозинофилия.
Кроме вышеперечисленных форм аллергических реакций, возможно также развитие ринита, трахеита, бронхиальной астмы, стоматита, гастроэнтерита, поражений внутренних органов.
Диагностика
Важная роль в диагностике принадлежит подробно собранному аллергическому анамнезу, что позволяет определить аллерген с достаточной достоверностью и делает излишним применение тестов с лекарственными препаратами.
Обычно даже в сомнительных случаях все лекарственные препараты отменяют. Предварительный диагноз подтверждается быстрым исчезновением симптомов, но следует уточнить, какой именно из препаратов вызвал реакцию. При аллергических пробах принимают во внимание возможность перекрестных реакций и поступление лекарственных веществ в составе комбинированных препаратов, в продуктах питания и вкусовых добавках. Следует учитывать, что отрицательный результат элиминационной пробы не исключает лекарственной аллергии, а также возможности развития ее в последующем, а положительный - не всегда свидетельствует об аллергической реакции. В последнем случае рекомендуют избегать применения данного медикамента.
Лечение лекарственной аллергии
-
Отмена всех лекарственных препаратов, кроме необходимых по жизненным показаниям.
-
Лечебное голодание или гипоаллергенная диета. Обильное питье (кипяченая вода), очистительная клизма, назначение энтеросорбентов.
-
Назначение глюкокортикоидов (преднизолон). При отсутствии эффекта - увеличение дозы преднизолона или замена его дексаметазоном. Обязательно назначение этих препаратов при угрожающем жизни ангионевротическом отеке (отек гортани).
-
В тяжелых случаях, при развитии анафилактического шока, - внутривенное введение 0,5 мл 0,1% раствора эпинефрина (Адреналина♠) в 20 мл 40% раствора декстрозы (Глюкозы♠), 90 мг преднизолона, 2 мл 2% раствора хлоропирамина. При развитии бронхоспазма внутривенно вводят 10 мл 2,4% раствора аминофиллина. После оказания первичной помощи больного переводят в отделение реанимации и интенсивной терапии (ОРИТ). Для механического удаления иммунных комплексов показаны плазмаферез и гемосорбция.
-
Для устранения кожных проявлений, сопровождающихся повышением температуры тела, ознобом, проводят инфузионную терапию.
-
Обязательная запись в истории болезни о наличии лекарственной аллергии.
Токсические реакции
Развитие их зависит от дозы препарата (в отличие от аллергических реакций) и может быть обусловлено самим препаратом, продуктами его разрушения и примесями, содержащимися в препарате. Выраженность токсических реакций зависит от величины разовой и суточной дозы, продолжительности лечения, метода введения, особенностей взаимодействия с другими препаратами, наличия поражений печени и почек, возраста больного, генетических факторов.
Чаще всего наблюдается нейро-, нефро- и гепатотоксическое действие, влияние препаратов на пищеварительную систему, систему крови. У беременных женщин возможно также токсическое влияние на плод.
Нейротоксическое действие выражается в поражении ядер VIII пары черепных нервов (снижение слуха, вестибулярные нарушения), зрительного нерва, развитии токсического полиневрита, парестезий, атаксии, при эндолюмбальном введении возникают судороги, мышечный гипертонус, галлюцинации.
Нефротоксическое действие (токсический, интерстициальный нефроз, обструктивная уропатия) - нарушение фильтрационной и реабсорбционной функции почек вплоть до развития ОПН.
Гепатотоксическое действие (жировая дистрофия, токсический гепатит) сопровождается гепатомегалией, кожным зудом, желтухой, повышением уровня конъюгированного билирубина и активности трансфераз.
Токсическое действие на пищеварительную систему (диарея, тошнота, рвота, анорексия, боли в животе) обусловлено нарушением секреции и моторики кишечника.
Поражение системы крови проявляется апластической и гемолитической анемией, лейкопенией, агранулоцитозом, тромбоцитопенией.
Эмбриотоксическое действие антимикробных препаратов наблюдают редко. Описаны поражения органа слуха, почек, нарушения формирования костей плода.
Во всех случаях токсического действия антимикробных препаратов необходима их отмена или замена препаратом другой фармакологической группы, детоксикация с использованием метода форсированного диуреза или, по показаниям, экстренных методов (плазмаферез, гемосорбция), а также лечение соответствующих органных поражений.
Суперинфекция - гибель микроорганизмов, входящих в состав нормальной микрофлоры кожи и слизистых оболочек, и размножение условно-патогенных и патогенных микроорганизмов, устойчивых к примененному антимикробному препарату.
Дисбиоз (дисбактериоз) - количественные и качественные изменения состава микрофлоры кожного покрова и слизистых оболочек.
Чаще встречается кишечный дисбиоз.
Нормальная микрофлора кишечника подразделяется на три основные группы:
-
облигатная, или постоянная, микрофлора (90% всей микрофлоры кишечника): бифидобактерии, бактероиды, лактобактерии, кишечные палочки, энтерококки;
-
факультативная, или непостоянная, микрофлора (10% всей микрофлоры кишечника): стрептококки, стафилококки, кампилобактерии, клостридии, протей, дрожжеподобные грибы и др.;
-
транзиторная (случайная) микрофлора: синегнойная палочка, патогенные энтеробактерии, грибы рода Candida и др.
Роль нормальной микрофлоры кишечника в поддержании гомеостаза организма
-
Участие в пищеварении: переваривание полисахаридов (пектин, микрополисахариды, гликопротеиды), участие в расщеплении непереваренных азотсодержащих соединений, мочевины, синтез некоторых незаменимых аминокислот; деконъюгация желчных кислот, детоксикация ксенобиотиков (лекарственные вещества, токсические вещества, консерванты).
-
Синтез витаминов: микрофлора - основной источник витамина К, витаминов группы В (цианокобаламин, фолиевая кислота, биотин, рибофлавин, пантотеновая кислота).
-
-
колонизационная резистентность: связывание с рецепторами и заселение слизистого слоя кишечника;
-
синтез бактерицидных веществ: летучих жирных кислот, перекиси водорода, сероводорода;
-
конкуренция с транзиторной микрофлорой за питательные вещества и факторы роста;
-
стимуляция местного иммунитета: выработка Ig и неспецифических факторов защиты (лизоцим, ИФН и т.д.);
-
-
Расширение наследственной программы: обмен регуляторными молекулами, фрагментами структурных генов с эпителиоцитами; обмен плазмидами и фрагментами структурных генов с другими представителями микробиоценоза.
-
Обеспечение трофического гомеостаза: нормальная микрофлора кишечника является клеточным, метаболическим, иммунологическим и генетическим компонентом жизнедеятельности человека.
Причины кишечного дисбиоза многообразны.
-
Острые и хронические инфекционные болезни, которые сопровождаются нарушениями процессов пристеночного пищеварения и всасывания питательных веществ, воды, двигательной функции пищеварительного канала. Это приводит к изменению химического состава и физических свойств кишечного содержимого, подавлению роста компонентов нормальной микрофлоры (бифидо-, лактобактерий, кишечной палочки) и увеличению численности условно-патогенной микрофлоры (протей, клебсиелла, стафилококк, кишечная палочка с измененными свойствами, грибы рода Candida и др.). При этом происходит контаминация верхних отделов тонкой кишки патогенной микрофлорой и развитие генерализованной суперинфекции (генерализованный кандидоз, пневмония, менингит, сепсис).
-
Диарейные инфекции, при которых дисбиоз кишечника - обязательное звено патогенеза.
-
Прием антибиотиков (длительные и повторные курсы), особенно препаратов широкого спектра действия, которые плохо всасываются при приеме внутрь или выводятся из организма через пищеварительный тракт. Риск развития дисбиоза наиболее высок при приеме ЦС, клиндамицина, ампициллина, амоксициллина, линкомицина; умеренный - при приеме хинолов, тетрациклинов, сульфаниламидов, макролидов, хлорамфеникола и триметоприма.
Микробиологически дисбиоз выражается в снижении количества облигатной флоры (бифидо- и лактобактерий, кишечной палочки). Контаминация тонкой кишки негативно отражается на ее функциях: нарушается полостное пищеварение, усиливаются процессы бактериального гниения и брожения, снижается рН кишечного содержимого, что нарушает активность липазы. Усиливается стеаторея, образуются нерастворимые мылá жирных кислот, нарушается абсорбция жирорастворимых витаминов. Это приводит к развитию эндогенного полигиповитаминоза.
Дисбиоз может стать причиной воспаления слизистой оболочки кишечника, способствуя углублению и более тяжелому течению различных патологических процессов.
Нарушения процессов пищеварения и всасывания в тонкой кишке, усиление газообразования и моторики кишечника, возникающие при дисбиозе, приводят к упорным диспепсическим расстройствам. Избыточная продукция органических кислот в результате микробного гидролиза пищевых компонентов ведет к повышению осмолярности кишечного содержимого и возникновению осмотической диареи. Она сопровождается метеоризмом, приступообразными и распирающими болями в животе.
Повышение проницаемости кишечного барьера при дисбиозе может способствовать сенсибилизации и развитию аллергических реакций.
Диагностика дисбиоза кишечника
Практическое значение для постановки диагноза имеют данные копрограммы и анализа кала на дисбиоз.
Микробиологические критерии кишечного дисбиоза:
-
увеличение количества кишечной палочки с измененными биологическими свойствами (со сниженной ферментативной активностью, лактозонегативных, неподвижных, безиндольных и др.);
-
появление гемолитической кишечной палочки и стафилококков, отсутствующих в норме;
-
изменение соотношения между аэробной и анаэробной микрофлорой;
-
изменение соотношения между облигатными и факультативными микроорганизмами;
-
миграция микрофлоры за границы привычной зоны обитания (синдром избыточной колонизации тонкой кишки).
Существуют методы оценки кишечного микробиоценоза, основанные на определении различных микробных метаболитов (фенола, водорода, метана, углекислого газа, аммиака, ненасыщенных жирных кислот, деконъюгированных желчных кислот) в кале, моче, выдыхаемом воздухе. Определение этих показателей дает представление о метаболической активности кишечной микрофлоры.
На основании клинических и микробиологических данных различают четыре степени дисбиоза кишечника (табл. 5-13).
Коррекция дисбиоза кишечника
Коррекцию дисбиоза проводят одновременно с лечением основного заболевания. При любой степени тяжести дисбиоза индивидуально подобранное лечебное питание - необходимая часть терапии. В рационе должны быть продукты, богатые пищевыми волокнами, пектином.
Коррекцию дисбиоза проводят в два этапа:
I - микробная деконтаминация;
II - восстановление микробиоценоза кишечника.
I этап проводят при:
Коррекцию проводят с учетом характера высеваемой микрофлоры. Предпочтение отдается препаратам, действующим местно, не оказывающим влияния на облигатную микрофлору: бактериофагам, нитрофурановым производным (нифуроксазид, нитрофурантоин, фуразолидон, нитроксолин), гидроксихинолинам (Интетрикс♠), Энтеролу♠ (содержит Saccharomyces boulardii - антагонист аэробной флоры и грибов).
| Степень дисбиоза | Данные микробиологического исследования содержимого толстой кишк | Данные клинического обследования |
|---|---|---|
I |
Снижение общего количества основных представителей микрофлоры (бактероиды, бифидо- и лактобактерии) до 107-108 КОЕ/г, уменьшение количества кишечной палочки с нормальной ферментативной активностью до 106 КОЕ/г, увеличение количества условно-патогенных энтеробактерий, золотистых стафилококков, грибов рода Candida до 103 КОЕ/г |
Измененный аппетит, метеоризм, неустойчивость стула, неравномерная окраска каловых масс |
II |
Снижение основных представителей кишечной микрофлоры до 105 КОЕ/г, увеличение количества лактозонегативной кишечной палочки до 104-105 КОЕ/г на фоне уменьшения количества их нормальных форм, повышение количества условно-патогенных энтеробактерий, золотистых стафилококков, грибов рода Candida до 104 КОЕ/г |
Метеоризм, умеренно выраженные диарея и запоры, чувство распи рания после приема пищи, мигрирующие, неопределенные боли в животе, симптомы гиповитаминоза, отрыжка, изжога, кожные аллергические реакции |
III |
Снижение до 103-104 КОЕ/г; отсутствие эшерихий с нормальной ферментативной активностью на фоне повышения числа их неполноценных штаммов, повышение уровня условно-патогенных энтеробактерий, золотистых стафилококков, грибов рода Candida до 104 КОЕ/г |
Усиление симптомов желудочно-кишечной диспепсии, появление трофических расстройств |
IV |
Отсутствие основных представителей анаэробной микрофлоры, отсутствие эшерихий с нормальной ферментативной активностью, подавляющее превосходство условно-патогенных энтеробактерий, золотистых стафилококков, грибов рода Candida и их ассоциаций (более 108 КОЕ/г) |
Симптомы общей интоксикации, патологические примеси в кале, наруения общего статуса организма, генерализация процесса при крайнем ослаблении организма |
В случае усиленного размножения грибов рода Candida и в целях профилактики кандидоза на фоне массивной антибактериальной терапии назначают фунгицидные препараты (натамицин).
При лечении больных с внешнесекреторной недостаточностью поджелудочной железы в схему лечения добавляют полиферментные препараты (панкреатин).
II этап - использование энтеросорбентов и пробиотиков. Все основные биопрепараты подразделяют на про- и пребиотики.
Пробиотики - препараты, содержащие живые культуры микроорганизмов, способные стимулировать развитие нормальной микрофлоры кишечника. Существует пять поколений пробиотиков.
I поколение - монокомпонентные препараты [бифидобактерии (Бифидобактерин♠), лактобактерии (Лактобактерин♠), кишечные палочки (Колибактерин♠), лактобактерии ацидофильные (Лактобактерин♠) и т.д.]. Они состоят из одного штамма микроорганизма, являющегося типичным обитателем кишечника.
II поколение - препараты конкурентного действия, вытесняющие условно-патогенные и патогенные микроорганизмы и в дальнейшем не колонизирующие кишечник. К ним относят нетипичных обитателей кишечника: бактерии рода Bacillus subtilis (Бактисубтил♠, Биоспорин♠ и т.д.) и дрожжи Saccharomyces boulardii (Энтерол♠).
III поколение - поликомпонентные препараты (симбиотики). Они состоят из нескольких штаммов бактерий (лактобактерии ацидофильные и др.) или из нескольких видов бактерий (Линекс♠, бифидо-бактерии бифидум + кишечные палочки и др.).
IV поколение - комбинированные препараты (синбиотики). Они состоят из бактерий и специальных ингредиентов, способствующих их росту, размножению и метаболической активности (бифидобактерии бифидум + лизоцим, лактобактерии ацидофильные + грибки кефирные, кипацид и др.).
V поколение - поликомпонентные комбинированные препараты [бифидобактерии лонгум + энтерококкус фэциум (Бифиформ♠), бифидобактерии бифидум + лактобактерии плантарум (Флорин форте♠)]. В состав Бифиформа♠ входят два вида бактерий (бифидобактерии, энтерококки) и специальные ингредиенты, способствующие их росту, размножению и метаболической активности. Бифиформ♠ и Флорин форте♠ - одновременно и симбиотики, и синбиотики. В состав Флорина форте♠ входят два вида бактерий (бифидобактерии, сорбированные в виде микроколоний на активированном угле, и лактобактерии), а также специальный ингредиент, способствующий их жизнедеятельности и метаболической активности. Клинические исследования показали эффективность Бифиформа♠ и Флорина форте♠ как в комплексном лечении, так и в виде монотерапии для восстановления нормального состава кишечной флоры.
Пребиотики - соединения немикробного происхождения, способные стимулировать симбионтную микрофлору кишечника. К пребиотикам относят:
Пребиотики назначают на фоне приема пробиотиков. Использование некоторых из них ограничено при галактоземии, фруктоземии и сахарном диабете (лактулоза, Хилак форте♠), острой кишечной непроходимости и острых воспалительных заболеваниях кишечника (лактулоза), целиакии (эубикор).
Различают также симбиотики - препараты, состоящие из комбинации нескольких видов живых микроорганизмов, и синбиотики - препараты, состоящие из комбинации живых микроорганизмов и пребиотиков.
Термин «эубиотик» характеризует способность ЛС влиять на патогенную и условно-патогенную микрофлору, не угнетая при этом бифидо- и лактофлору кишечника.
Реакции, связанные с массивной гибелью микроорганизмов под действием антимикробных средств
Возникновение таких реакций связано с парентеральным введением максимальных доз бактерицидных препаратов при инфекционных болезнях, вызванных грамотрицательной микрофлорой (сальмонеллами, нейссериями, спирохетами и др.). Они возникают в начале лечения и выражаются в резком усилении симптомов соответствующей инфекции, возникновении лихорадочно-инфекционного синдрома (вплоть до развития ИТШ) и полиорганной недостаточности. При этом необходимо уменьшить дозировку препарата, усилить дезинтоксикационную терапию. В тяжелых случаях проводят противошоковую терапию в условиях реанимационного отделения.
Сводные данные о побочном действии различных антимикробных и иммунопрепаратов представлены в табл. 5-13.
| Вид побочного действия | Препарат | |
|---|---|---|
Реакции, обусловленные особой чувствительностью |
Анафилактический шок и анафилактоидные реакции |
Пенициллины, ЦС, сульфаниламиды; стрептомицин, ванкомицин, амфотерицин В, абакавир, нормальные и специфические иммуноглобулины и сыворотки |
Кожные реакции (сыпь, ангионевротический отек) |
Пенициллины, ЦС, сульфаниламиды, амино-гликозиды, макролиды, ванкомицин, хлорамфеникол, олеандомицин, налидиксовая кислота, амфотерицин В, абакавир, невирапин и эфавиренз, нормальные и специфические иммуноглобулины и сыворотки |
|
Синдром, похожий на сывороточную болезнь |
Пенициллины, ЦС, сульфаниламиды, нормальные и специфические иммуноглобулины и сыворотки |
|
Токсические |
Нейротоксичность |
Аминогликозиды, сульфаниламиды; хлорамфеникол, ристомицин, ванкомицин, налидиксовая кислота, диданозин, ставудин и залцитабин, эфавиренз |
Гепатотоксичность |
Сульфаниламиды, туберкулостатики; тетрациклин, невирапин, зидовудин, все ИП и ННИОТ |
|
Нефротоксичность |
Аминогликозиды, ЦС, тенофовир |
|
Гематотоксичность |
Сульфаниламиды, нитрофураны; тетрациклин, хлорамфеникол, стрептомицин, амфотерицин В, рифампицин, зидовудин |
|
Дисбактериоз и суперинфекция |
Полусинтетические пенициллины, ЦС, ульфаниламиды, макролиды; хлорамфеникол, тетрациклин, линкомицин, все ИП, зидовудин и диданозин |
|
Реакции, связанные с массивным бактериолизом (эндотоксиновые) |
Препараты различных групп, применяемые при лечении инфекций, вызванных грамотрицательной микрофлорой (энтеробактерии, спирохеты, нейссерии и др.) |
|
5.9. ИММУНОТЕРАПИЯ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ
Иммунотерапия - метод лечения инфекционных болезней, основанный на оптимизации иммунного ответа на возбудителя инфекции.
Классификация, принципы разработки и применения средств иммунотерапии инфекционных болезней
Методы регуляции иммунных реакций можно разделить на специфические и неспецифические. Специфические методы направлены на регуляцию иммунного ответа в отношении определенного антигена и группы антигенов, а также на нейтрализацию отдельных экзогенных и эндогенных веществ, участвующих в патогенезе заболеваний. К этим методам относятся вакцинотерапия, лечение специфическими иммуноглобулинами и сыворотками, специфическая адаптивная клеточная иммунотерапия. Неспецифические методы иммунотерапии связаны с применением иммуномодуляторов.
Иммуномодуляторы - лекарственные препараты, в терапевтических дозах восстанавливающие функции иммунной системы. Эффективность иммуномодуляторов определяется исходным состоянием иммунной системы пациента: они нормализуют как повышенные, так и пониженные иммунные показатели.
Главной областью применения иммуномодулирующих препаратов являются вторичные иммунодефициты, которые проявляются частыми рецидивирующими, трудно поддающимися лечению инфекционно-воспалительными заболеваниями.
Классификация иммуномодуляторов по происхождению
-
Эндогенные вещества и их синтетические аналоги.
-
-
-
-
-
-
Интерферон альфа-2а: интерферон альфа-2а (Роферон-А♠); пэгинтерферон альфа-2a (40 кДа) (Пегасис♠).
-
-
Для инъекций: цепэгинтерферон альфа-2b (Альгерон♠); интерферон альфа-2b (Альтевир♠); интерферон альфа-2b (Альфарона♠); интерферон альфа-2 (Интераль-П♠); интерферон альфа-2b (Интерфераль♠) (зарегистрирован, но не выпускается); интерферон альфа-2b (Интрон-А♠); интерферон альфа-2b (Лайфферон♠); пэгинтерферон альфа-2b (ПегИнтрон♠); интерферон альфа-2b (Реальдирон♠); интерферон альфа-2b (Реаферон-ЕС♠).
-
Суппозитории: интерферон альфа-2b (Виферон♠); интерферон альфа-2b человеческий рекомбинантный + метрони-дазол + флуконазол (Вагиферон♠); бензокаин + интерферон альфа-2b + таурин (Генферон♠); интерферон альфа-2b + таурин (Генферон лайт♠); интерферон альфа-2b (Гиаферон♠); Кипферон♠.
-
Для приема внутрь: интерферон альфа-2 (Реаферон-ЕС-Липинт♠); интерферон альфа-2b (Реаферон-ЛИПИНТ♠) капсулы.
-
Для наружного и местного применения: интерферон альфа-2b человеческий рекомбинантный (Гриппферон♠), назальные капли и спрей; интерферон альфа-2b человеческий рекомбинантный + лоратадин (Гриппферон♠ с лоратадином), мазь назальная; интерферон альфа-2b человеческий рекомбинантный + дифенгидрамин (Офтальмоферон♠), глазные капли; интерферон альфа-2b человеческий рекомбинантный + ацикловир + лидокаин (Герпферон♠), мазь; интерферон альфа-2b человеческий рекомбинантный + лоратадин (Аллергоферон♠), гель; интерферон альфа-2b человеческий рекомбинантный + тер-бинафин + метронидазол (Микоферон♠), гель; интерферон альфа-2b (Альфарона♠), капли; интерферон альфа-2b (Виферон♠), гель и мазь; интерферон альфа-2b + таурин (Генферон лайт♠), назальный спрей; интерферон альфа-2b (Интерфераль♠), назальный аэрозоль (зарегистрирован, но не выпускается); интерферон альфа-2 (Инфагель♠), гель.
-
-
-
Интерферон -γ: интерферон гамма человеческий рекомбинантный (Ингарон♠) для инъекций и для интраназального введения.
-
-
-
-
1.3.1. Иммуноглобулины человека.
-
Иммуноглобулины для внутримышечного введения.
-
Специфические: иммуноглобулин человека против гепатита В (Анти геп♠); иммуноглобулин антирабический (Иммуноглобулин антирабический из сыворотки крови человека♠); иммуноглобулин человека противостолбнячный (Иммуноглобулин противостолбнячный из сыворотки крови человека♠); иммуноглобулин человека противостафилококковый (Иммуноглобулин человека антистафилококковый♠); иммуноглобулин против клещевого энцефалита (Иммуноглобулин человека против клещевого энцефалита♠); иммуноглобулин человека противоаллергический (Иммуноглобулин человека противоаллергический♠); иммуноглобулин человека противостолбнячный♠; иммуноглобулин антирабический (Ребинолин♠).
-
Антирезусные иммуноглобулины: иммуноглобулин человека антирезус Rho(D) (ГиперРОУ С/Д♠); иммуноглобулин человека антирезус Rho(D) [Иммуноглобулин человека антирезус RhO (D)♠]; иммуноглобулин человека антирезус Rho(D) (Иммуноро Кедрион♠); иммуноглобулин человека антирезус Rho(D) (КамРОУ♠); иммуноглобулин человека антирезус Rho(D) (Партобулин СДФ♠); иммуноглобулин человека антирезус Rho(D) (Резонатив♠).
-
-
Иммуноглобулины для внутривенного введения.
-
Неспецифические: иммуноглобулин человека нормальный [Габри-глобин (иммуноглобулин человека нормальный)♠]; иммуноглобулин человека нормальный (Габриглобин-IgG♠); иммуноглобулин человека нормальный (Гамунекс♠); иммуноглобулин человека нормальный (И.Г. Вена Н.И.В.♠); иммуноглобулин человека нормальный (Имбиоглобулин♠); иммуноглобулин человека нормальный (Иммуновенин♠); иммуноглобулин человека нормальный (раствор); иммуноглобулин человека нормальный (Интраглобин♠) (зарегистрирован, но не поставляется); иммуноглобулин человека нормальный (Интратект♠); иммуноглобулин человека нормальный (Октагам♠), раствор 10% и раствор 5%; иммуноглобулин человека нормальный [IgG + IgM + IgA] (Пента глобин♠).
-
Специфические: гепатектρ; иммуноглобулин человека против гепатита В (Неогепатект♠); иммуноглобулин человека антицито-мегаловирусный (НеоЦитотект♠).
-
-
-
1.3.3. Гетерологичные (лошадиные) сыворотки:
-
антитоксин дифтерийный (Сыворотка противодифтерийная лошадиная очищенная концентрированная♠);
-
антитоксин яда гадюки обыкновенной (Сыворотка против яда гадюки обыкновенной лошадиная очищенная концентрированная жидкая♠);
-
антитоксин гангренозный (Сыворотка противогангренозная поливалентная лошадиная очищенная концентрированная♠);
-
антитоксин столбнячный [Сыворотка противостолбнячная лошадиная очищенная концентрированная (Сыворотка противостолбнячная)♠].
-
-
-
-
Экзогенные вещества и их синтетические аналоги.
-
2.1. Бактериального происхождения.
-
2.1.1. Фрагменты пептидогликана клеточной стенки (мурамилпептиды):
-
2.1.4. Лизаты и антигенные экстракты бактерий:
-
анатоксин стафилококковый (Анатоксин стафилококковый очищенный адсорбированный жидкий♠);
-
анатоксин стафилококковый (Анатоксин стафилококковый очищенный жидкий♠);
-
вакцина для лечения стафилококковых инфекций [Вакцина стафилококковая лечебная жидкая (антифагин стафилококковый)♠];
-
вакцина из антигенов условно-патогенных микроорганизмов поликомпонентная (Иммуновак-ВП-4♠) (зарегистрирован, но не выпускается);
-
лизаты микроорганизмов [Candida albicans + Corynebacterium pseudodiphtheriticum + Enterococcusfaecalis + Enterococcusfaecium + Fusobacterium nucleatum subsp (Имудон♠)];
-
лизатов бактерий смесь [Streptococcus pneumoniae, type I + Streptococcus pneumoniae, type II + Streptococcus pneumoniae, type III + Streptococcus pneumoniae, type V + Streptococcus pneumoniae, type (ИРС 19♠)];
-
экстракт из культуры термофильного штамма золотистого стафилококка (Рузам♠);
-
2.1.5. Живые и инактивированные бактерии:
-
вакцина для иммунотерапии рака мочевого пузыря [Имурон-вак Вакцина БЦЖ для иммунотерапии рака мочевого пузыря♠)];
-
лактобактерии [L. rhamnosus, L.vaginalis, L. salivarius, L. fermentum] (СолкоТриховак♠) (зарегистрирован, но не поставляется);
-
вакцина БЦЖ для терапии рака мочевого пузыря (Уро-БЦЖ медак♠).
-
-
2.2. Растительного происхождения:
-
аскорбиновая кислота + эхинацеи пурпурной трава (Иммунал плюс С♠);
-
эхинацеи пурпурной травы сок (Иммунорм♠) (зарегистрирован, но не поставляется);
-
полисахариды побегов Solanum tuberosum (Панавир♠) раствор, суппозитории ректальные и вагинальные;
-
эхинацеи пурпурной трава (Эхинацеи настойка♠) (несколько производителей);
-
эхинацеи пурпурной травы экстракт (Эхинацеи пурпурной экстракт жидкий♠);
-
-
Синтетические (химически чистые) вещества.
-
-
гистидил-глицил-валил-серил-глицил-гистидил-глицил-глута-минил-гистидил-глицил-валил-гистидил-глицин (Аллокин-альфа♠);
-
треонил-глутамил-лизил-лизил-аргинил-аргинил-глутамил-трео-нил-валил-глутамил-аргинил-глутамил-лизил-глутамат (Гепон♠);
-
глутамил-цистеинил-глицин динатрия (Глутоксим♠) и инозина глицилцистеинил-глутамат динатрия (Моликсан♠);
-
аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин (Имуно-фан♠), раствор, суппозитории, спрей;
-
альфа-глутамил-триптофан + аскорбиновая кислота + бендазол (Цитовир-3♠), капсулы, сироп.
-
-
Цели и задачи применения иммуномодуляторов
Иммуномодуляторы могут влиять на возникновение и ход инфекционного процесса, вызванного различными патогенами далеких друг от друга таксономических групп. Наиболее обоснованным вариантом было и остается применение иммуномодуляторов в комплексе с другими медикаментами, непосредственно воздействующими на микроорганизм, такими как антибиотики, противовирусные или антимикотические препараты.
Применение иммуномодуляторов показано как при гиперергическом иммунном ответе, ведущем к избыточной воспалительной реакции, так и при недостаточности защитных реакций.
Оптимальным считается применение методов и препаратов, обладающих одной направленностью, но имеющих различные механизмы действия. Иммуномодуляторы могут назначаться в комплексной терапии инфекций одновременно с антибиотиками, противогрибковыми, противопротозойными или противовирусными средствами. Применение иммуномодуляторов целесообразно проводить на фоне иммунологического мониторинга.
Общим принципом иммунокоррекции является ее проведение на фоне полноценного питания, приема витаминных препаратов, микро- и макроэлементов. Некоторые из них обладают иммуномодулирующим действием, что необходимо соотносить с характером иммунных нарушений у пациентов. Важным компонентом иммунотропного лечения является использование энтеросорбентов, выводящих из организма соли тяжелых металлов, антигены, радионуклиды, нитраты и нитриты.
Основные направления модуляции иммунитета: модуляция приобретенного иммунитета, коррекция количественного и качественного состава кишечной микробиоты, модуляция врожденного иммунитета.
Иммуноглобулины (γ-глобулины) (табл. 9-12).
Наиболее известны две группы препаратов: иммуноглобулины для внутримышечного и внутривенного применения. Однако эти препараты можно также применять перорально, ректально, интраперитонеально и местно. Существуют готовые лекарственные формы препаратов, предназначенные для перорального, ректального или вагинального применения.
На практике применяют нормальный человеческий иммуноглобулин для внутривенного введения и специфические иммуноглобулины: противогриппозный, антистафилококковый, противостолбнячный; антиротавирусный, противоменингококковый, против клещевого энцефалита, противодифтерийный, антирабический, против краснухи, антиаллергический.
По составу различают Ig, содержащие IgG (нормальный или специфический Ig): Ig, обогащенный IgM: «иммуноглобулин человека нормальный (IgG + IgM + IgA) (Пентаглобин♠)», Ig, обогащенный IgA и IgM: КИП, GAM-глобулин, IG с ИФН-α: Кипферон♠.
Механизм профилактического и лечебного действия иммуноглобулина (Ig) определяется прямым связыванием антигенов и антител, количеством специфических антител и длительностью их персистирования в организме.
Лечебные вакцины направлены на стимуляцию иммунной системы, усиление специфических и неспецифических факторов иммунитета, способных подавлять размножение микроорганизмов, нейтрализовать и элиминировать токсические продукты. Лечебные вакцины применяются при длительном торпидном течении инфекции, при бактерио- и вирусоносительстве в случаях безуспешной антибиотикотерапии. В медицинской практике используется большой набор лечебных вакцин.
Вакцина бруцеллезная (Вакцина бруцеллезная инактивированная лечебная♠). 1 мл вакцины содержит 1 млрд убитых нагреванием бруцелл B. abortus и B. militensis в соотношении 2:1. Вакцина применяется для лечения острого, подострого и хронического бруцеллеза в стадии декомпенсации и субкомпенсации. Вакцина герпетическая культуральная инактивированная сухая. Представляет собой инактивированные формалином вирусы простого герпеса I и II типов, выращенные на культуре клеток ткани фибробластов куриных эмбрионов. Вакцина стимулирует клеточные механизмы резистентности организма человека к вирусу герпеса и применяется для лечения больных с герпетическими поражениями кожи и слизистой в стадию ремиссии. Гонококковая вакцина представляет собой взвесь инактивированной культуры гонококков. Вакцина усиливает специфическую резистентность организма к гонококку. Применяется как вспомогательное средство лечения больных после безуспешной антибиотикотерапии при вялотекущих рецидивах, при свежих торпидных и хронических формах заболевания, у мужчин - с осложненной, у женщин - с восходящей гонореей. Вакцина БЦЖ иногда применяется в комплексном лечении туберкулеза. Она показана при торпидном лечении инфильтративного, очагового, диссеминированного и кавернозного туберкулеза легких. Терапия с помощью БЦЖ противопоказана при всех формах туберкулезного процесса, сопровождающихся обширными деструктивными изменениями. Лечебные препараты из условно-патогенных микроорганизмов применяются для лечения хронических гнойно-воспалительных заболеваний. Вакцины из условно-патогенных микробов рассчитаны на стимуляцию специфического иммунитета и неспецифической резистентности. Лечебные вакцины могут повышать устойчивость одновременно к нескольким видам инфекций. Вакцина стафилококковая сухая для иммунотерапии представляет собой антигенный комплекс, полученный методом водной экстракции из микробной массы золотистого стафилококка. Вакцина предназначена для иммунотерапии, вызывает образование антител к стафилококку и неспецифически стимулирует резистентность организма. Иммунотерапию больных кожными заболеваниями, вызванными стафилококком и его ассоциациями с другими микроорганизмами, проводят через 7-10 дней после традиционного лечения (антибиотики, ангиопротекторы, витамины). Минимальный курс лечения состоит из 5 инъекций с интервалом 3-4 дня. Стафилококковая вакцина корпускулярная представляет собой взвесь инактивированных штаммов стафилококков, содержит в 1 мл 20 млрд микробных клеток. Вакцина используется для тех же целей, что и химическая вакцина. Стафилококковый анатоксин жидкий. Из двух препаратов анатоксина стафилококкового (жидкий и адсорбированный на гидроксиде алюминия) лишь жидкий применяется для иммунотерапии. Препарат содержит 12±2 ЕС анатоксина стафилококкового. Курс лечения: 7 подкожных инъекций через каждые 2 дня. Постепенно повышая первоначальную дозу 0,1 до 1,5 мл, лечение проводится на фоне базисной терапии; за исключением использования иммунных сывороток и плазмы. Стафилококковый антифагин представляет собой комплекс растворимых термостабильных антигенов стафилококков и вызывает формирование специфического антимикробного иммунитета. Используется для лечения заболеваний кожи стафилококковой этиологии.
N-ацетилглюкозаминил-МДП [глюкозаминилмурамилдипептид (Ликопид ♠)] с успехом применяется в комплексном лечении и профилактике целого ряда инфекционных болезней, сопровождающихся вторичной иммунной недостаточностью, у взрослых и детей.
Азоксимера бромид (Полиоксидоний♠).
Обладает выраженной иммуномодулирующей активностью, обладает способностью активировать продукцию цитокинов лейкоцитами крови. Под его влиянием происходит усиление продукции ИЛ-1, ИЛ-6, ФНО- и ИФН-α, он усиливает цитотоксичность естественных киллеров (NK-клеток), активирует макрофаги, усиливает синтез всех цитокинов, вырабатываемых этими клетками, обладает детоксицирующим действием, высокоэффективен в комплексном лечении острых и хронических рецидивирующих вялотекущих инфекционно-воспалительных процессов (кожи и мягких тканей, бронхолегочного аппарата, ЖКТ и урогенитального тракта), протекающих на фоне первичных и вторичных иммунных нарушений. Препарат применяется и в остром периоде, и при хроническом рецидивирующем течении, и у пациентов с аллергией. Разнообразие форм выпуска позволяет использовать разные способы введения Полиоксидония♠ в зависимости от тяжести и локализации инфекционного процесса (парентерально - внутривенно и внутримышечно - при сепсисе и других тяжелых состояниях; в виде ректальных или вагинальных суппозиториев; а также в виде таблеток для сублингвального рассасывания и раствора для интраназального закапывания).
Имунофан - иммуномодулятор многонаправленного действия. Эффективен при хронических и рецидивирующих инфекционных процессах, сепсисе. Повышает уровень специфического иммунитета при применении лечебных вакцин и профилактической вакцинации. Применяется в/м, п/к, в виде спрея и суппозиториев.
Препараты ИФН.
Существующие медицинские препараты ИФН делятся по типу активного компонента на -α, -β, -γ, а по способу создания и времени применения - на природные человеческие лейкоцитарные ИФН (I поколение) и рекомбинантные ИФН (II поколение), полученные с помощью методов генной инженерии. Рекомбинантные ИФН полностью безопасны с точки зрения контаминации вирусами, что очень важно в век широкого распространения гепатитов В, С, D, ВИЧ, ЦМВ и других передающихся через кровь инфекций.
Наиболее широко ИФН используются при вирусных инфекциях. В первую очередь это различные герпетические поражения (кератиты и кератоконъюнктивиты, герпес гениталий, опоясывающий лишай), острые и хронические ВГ, а также грипп и другие ОРВИ.
Индукторы ИФН.
Пидотимод.
Пидотимод (Имунорикс♠ ) - 3-L-пироглютамат-L-тиазолидин-4-карбоксильная кислота - это синтезированный иммуномодулирующий препарат, оказывающий выраженное протективное действие в отношении бактериальных и вирусных респираторных инфекций.
Раздел III. Клинические синдромы
Глава 6. Лихорадочно-интоксикационный синдром
Лихорадочно-интоксикационный синдром (ЛИС) - это клиническое проявление системной воспалительной реакции в ответ на микробную агрессию. Проникновение микроорганизмов и их токсинов во внутреннюю среду организма распознается особыми паттернраспознающими рецепторами, которые передают информацию на клеточные и гуморальные факторы защиты, вызывая активацию фагоцитирующих, иммунокомпетентных клеток, синтез провоспалительных цитокинов, ИФН и других факторов защиты. Эти процессы сопровождаются активацией метаболических процессов, повышением теплопродукции, что приводит к повышению температуры, т.е. лихорадке. Энергоснабжение осуществляется преимущественно за счет эндогенных жиров, а не углеводов, поступающих с пищей. Снижается секреция пищеварительных ферментов, соответственно, утрачивается аппетит, уменьшаются затраты на мышечную работу - появляется слабость, миастения, заставляющая больного ограничить физическую активность и использовать освободившуюся энергию на защитные реакции. Стимулируется работа сердца, появляется тахикардия, стимуляция газообмена сопровождается увеличением минутного объема дыхания, т.е. его учащением или увеличением глубины дыхания. Активация простагландинов вызывает алгический синдром, головную боль, боль в мышцах, костях, суставах, «ломоту во всем теле», что заставляет больного занять горизонтальное положение, т.е. также способствует энергосбережению.
ЛИС может быть адекватным, что характерно для неосложненного циклического течения инфекционного процесса, а также недостаточным для полноценной реализации защитных механизмов, что ведет к прогрессированию патологического процесса и тяжелым специфическим поражениям, вызванным возбудителем, вторичными осложнениями. В ряде случаев защитные механизмы могут быть избыточными и сопровождаться гипертермией, нарушением состояния ЦНС и сердечно-сосудистой системы, поражением сосудистой системы, нарушениями гемостаза и другой патологией, часто - развитием ИТШ.
В то же время и роль возбудителя является не меньшей и зависит от его факторов патогенности, определяющих специфичность клинической картины, от вирулентности штамма возбудителя, инфицирующей дозы, часто от пути инфицирования.
Все эти факторы в совокупности и определяют индивидуальные особенности ЛИС.
Следует подчеркнуть, что тяжесть течения инфекционной болезни определяется не только выраженностью ЛИС, но и в равной степени характерной для каждой инфекции органопатологией (поражением ЦНС, сердечно-сосудистой системы, органов дыхания, печени, почек, пищеварительного тракта и т.д.). Кроме того, факторы патогенности ряда возбудителей (ботулотоксин, столбнячный токсин, холероген, факторы патогенности грибов) не вызывают реакции ТОЛ-рецепторов и не инициируют лихорадочно-интоксикационного синдрома. В то же время тяжесть проявления ЛИС при большинстве инфекций коррелирует с тяжестью течения болезни и должна быть максимально объективно оценена, а в ряде случаев нуждается в коррекции (табл. 6-1). Суммарная оценка тяжести дается по наиболее выраженным нарушениям. При наличии органной патологии соответствующие симптомы не могут быть включены в характеристику ЛИС, и тяжесть состояния определяется степенью выраженности органопатологии. Например, тяжелая миастения при ботулизме при нормальной температуре тела; потрясающий озноб при неосложненной малярии, интенсивная головная боль с тошнотой и рвотой при умеренной лихорадке при вирусном менингите, тахиаритмия при инфекционном миокардите и т.д.
Основным проявлением ЛИС является лихорадка. Ее оценивают по следующим параметрам: уровню повышения температуры тела, продолжительности, характеру суточных колебаний, темпам нарастания и снижения температуры тела.
Основные симптомы |
Степень выраженности |
|||
|---|---|---|---|---|
легкая |
средней степени |
тяжелая |
очень тяжелая |
|
Лихорадка |
До 38 °С |
38,1-39,0 °С |
39,1-40,0 °С |
Выше 40 °С |
Миастения (слабость) |
Утомляемость |
Ограничение подвижности |
Лежачее положение |
Лежачее положение, затруднение активных движений |
Алгии (боли в мышцах, суставах, костях) |
Слабые, отсутствуют |
Умеренные |
Сильные |
Сильные* |
Озноб |
- |
Зябкость, познабливание |
Выражен |
Потрясающий |
Головная боль |
Слабая |
Умеренная |
Сильная |
Сильная* |
Тошнота |
- |
Возможна |
Часто |
Часто* |
Рвота |
- |
- |
Возможна |
Часто |
Менингеальные симптомы |
- |
- |
Возможны |
Часто |
Нарушения сознания |
- |
- |
Ступор, сопор |
Сопор, кома |
Судороги |
- |
- |
Возможны |
Возможны |
Бред, делирий |
- |
- |
Возможны |
Часто |
Частота сердечных сокращений |
Соответствует уровню температуры |
Соответствует уровню температуры |
Тахикардия |
Тахикардия, тахиаритмия, редко брадикардия |
АД |
Норма |
Нижняя граница нормы |
Артериальная гипотензия до 50% нормы |
Артериальная гипотензия ниже 50% нормы |
Снижение аппетита |
Возможно |
Постоянно |
Анорексия |
Анорексия* |
Нарушение сна (бессонница, сонливость) |
Возможно |
Часто |
Постоянно |
Постоянно* |
* При нарушении сознания симптом не может быть оценен.
Температура тела до 38 °С расценивается как субфебрильная (до 37,5 °С - низкий субфебрилитет, 37,6-38,0 °С - высокий субфебрилитет), 38,1-40,0 °С - фебрильная (до 39,0 °С - умеренная, 39,140 °С - высокая), 40,1 °С и выше - гиперпиретическая. Длительность лихорадки в пределах 1-5 сут - кратковременная, 6-15 сут - длительная, свыше 15 сут - затяжная. Если суточные колебания не превышают 1 °С, а уровень выше 38 °С - лихорадка постоянного типа, если суточные колебания до 3 °С - ремиттирующая (послабляющая), свыше 3 °С - гектическая, часто при таких колебаниях температуры ее повышение сопровождается ознобом, снижение - обильным потоотделением; лихорадка с максимумом уровня в утренние часы или ночью, т.е. с нарушением циркадного ритма температуры тела, обозначается как неправильная, извращенная. К неправильному типу относится и лихорадка с повторными колебаниями в течение суток, выявленными при термометрии через 3-4 ч. Выделяют также волнообразную лихорадку, когда высокий уровень температуры тела сменяется субфебрильным, а затем вновь повышается; интермиттирующую, когда дни с высокой температурой чередуются с днями нормальной температуры, и возвратную лихорадку, при которой лихорадочные волны разделены несколькими днями нормальной температуры. Острым развитие лихорадки считается при достижении максимального уровня в течение 1-2 сут, подострым - в течение 3-5 сут, постепенным - более 5 сут. Если падение температуры до нормы происходит в течение суток (иногда нескольких часов), оно обозначается как критическое, в течение 2-3 сут - как ускоренный лизис, более медленное - лизис.
Следует подчеркнуть, что широкое применение НПВС, антибиотиков в ранние сроки, часто до установления диагноза, в большинстве случаев не позволяет дать развернутую характеристику лихорадочной реакции.
Этиология
ЛИС характерен для всех бактериальных, вирусных, протозойных инфекций. Регистрируется при глистных инвазиях (в стадии миграции), не характерен для грибковых инфекций, так как патогенные грибы не содержат компонентов, инициирующих лихорадку и интоксикацию. Лихорадка при генерализованных микозах за редким исключением инициируется сопутствующей бактериальной инфекцией (кандидозно-стафилококковый сепсис). Среди бактериальных инфекций лихорадка не характерна для ботулизма, начальной стадии столбняка (в дальнейшем высокая лихорадка обусловлена повышенной теплопродукцией за счет судорожного сокращения мышц), холеры, неосложненного амебиаза и лямблиоза, кожного лейшманиоза. При ботулизме лихорадка и диспепсический синдром в первые часы связаны с наличием в пищевом продукте дополнительной флоры.
В большинстве случаев ЛИС сопровождается другими, характерными для определенной нозоформы синдромами [сыпь, катарально-респираторный, диспепсический, менингеальные синдромы, лимфаденопатия (ЛАП), гепатолиенальный синдром и др.]. При отсутствии каких-либо характерных признаков какой-либо инфекционной болезни больные подлежат госпитализации в диагностическое отделение инфекционной больницы, где проводится исследование крови, мочи, бактериология, иммунологические исследования, ПЦР-диагностика, для установления диагноза и исключения заболеваний неинфекционной этиологии (аутоиммунные болезни, онкологические заболевания, в частности лейкозы, лимфомы и др.).
Лечение
Лихорадка - защитная реакция организма, сопровождающая активацию защитных механизмов, поэтому подлежит коррекции при высокой температуре (39-39,5 °С и выше), при плохой субъективной переносимости. В этих случаях применяют антипиретики.
Дезинтоксикация зависит от степени выраженности ЛИС. При легкой степени интоксикации показан домашний режим, обильное питье (чай, минеральная вода, соки, морсы, компоты) - до 3 л в сутки, диета с исключением острых приправ, жареных блюд, копченостей, тугоплавких жиров. При средней тяжести ЛИС показан постельный режим, госпитализация по индивидуальным показаниям (длительность лихорадки более 5 сут, отягощенный преморбидный фон), диета, включение потогонных средств: мед, малина, брусника и др.
При тяжелой интоксикации показана госпитализация, при очень тяжелой - экстренные физические методы охлаждения, антипиретики, детоксикация путем внутривенной инфузии растворов: 5-10% раствора декстрозы (Глюкозы♠), декстрана [ср. мол. масса 35 000-45 000] (Реополиглюкина♠), альбумина человека (Альбумина♠), плазмы до 0,5-1,5 л в сутки под контролем диуреза. По показаниям больных переводят в ОРИТ.
Антимикробные препараты на дому не показаны, в стационаре - после установления диагноза. По витальным показаниям после забора материала (кровь, моча) на микробиологические исследования используют антибиотики широкого спектра действия внутривенно, в отдельных случаях - кортикостероиды внутривенно, до 5 мг/кг преднизолона.
Глава 7. Катарально-респираторный синдром
Катарально-респираторный синдром (КРС) характеризуется воспалением слизистой оболочки дыхательных путей с гиперпродукцией секрета и активацией местных защитных реакций.
Клиническая характеристика
При воспалении слизистой оболочки выше голосовых связок возникают симптомы ринита, фарингита, тонзиллита; ниже голосовых связок - ларингита, трахеита, эпиглоттита, бронхита, пневмонии.
Этиологический фактор
Заболевания, сопровождающиеся КРС, относят к группе острых респираторных заболеваний (ОРЗ). Наиболее часто их возбудителями являются вирусы (ОРВИ), реже - бактерии. Причиной КРС может быть действие аллергизирующих (при вазомоторном рините, сенной лихорадке) и раздражающих веществ (например, хлора), простудного фактора. Часто выражено сочетанное действие различных факторов (например, простудный фактор и вирусы, вирусы и бактерии). Основные возбудители ОРЗ - вирусы, имеющие высокую тропность к определенным отделам дыхательных путей. Общее число вирусов (в том числе их серотипов), вызывающих ОРВИ, составляет более 200. Они служат причиной более 90% случаев острых поражений органов дыхания. К группе респираторных относят вирусы гриппа и парагриппа, аденовирусы, риновирусы, коронавирусы, энтеровирусы. Практически все они вызывают заболевания со сходной клинической картиной - КРС на фоне симптомов интоксикации. Клинические проявления этих заболеваний обусловлены как свойствами вируса, так и иммунореактивностью организма.
Клинически наиболее значимые ОРВИ: грипп, парагрипп, заболевания, вызываемые респираторно-синцитиальными, адено- и риновирусами, а также коронавирусами.
Схожесть клинической картины определяют единые патогенетические механизмы при развитии ОРВИ: внедрение возбудителя в клетки эпителия дыхательных путей и его репродукция; вирусемия с развитием токсикоза и токсико-аллергических реакций; развитие воспалительного процесса в дыхательной системе; активизация бактериальной флоры; обратное развитие инфекционного процесса, формирование иммунитета.
Клинические формы КРС.
-
Острый ринит - воспаление слизистой оболочки носовой полости. Характерные симптомы: чиханье, отделение слизи из носа, нарушение носового дыхания. Отток слизи по задней стенке глотки вызывает кашель.
-
Фарингит - воспаление слизистой оболочки глотки. Для него характерны внезапно возникающие ощущения першения и сухости в горле, а также болезненность при глотании, гиперемия задней стенки глотки.
-
Тонзиллит - воспаление нёбных миндалин бактериальной (чаще стрептококковой) и вирусной этиологии. Характерны интоксикация, гиперемия и отечность миндалин, нёбных дужек, язычка, задней стенки глотки, рыхлые наложения в лакунах, на всей поверхности миндалин.
-
Ларингит - воспаление гортани с вовлечением голосовых связок и подсвязочного пространства. Первые симптомы - сухой лающий кашель, осиплость голоса.
-
Эпиглоттит - воспаление надгортанника с характерным выраженным нарушением дыхания.
-
Трахеит - воспалительный процесс слизистой оболочки трахеи. Симптомы: саднение за грудиной, сухой кашель.
-
Бронхит - поражение бронхов любого калибра. Основной симптом - кашель (в начале заболевания непродуктивный, через несколько дней влажный с увеличивающимся количеством мокроты). Мокрота чаще имеет слизистый характер, но на 2-й неделе может приобретать зеленоватый оттенок за счет примеси фибрина. Кашель сохраняется в течение 2 нед и дольше (до 1 мес при заболеваниях аденовирусной, респираторно-синцитиально-вирусной, микоплазменной и хламидийной природы).
В табл. 7-1 представлены клинические синдромы поражения дыхательных путей вирусной этиологии.
Клинические синдромы поражения дыхательных путей бактериальной этиологии представлены в табл. 7-2.
ОРЗ могут быть вызваны грамотрицательными бактериями: Klebsiella pneumoniae, Enterococcus spp., Pseudomonas aeruginosa.
КРС выявляют при коксиеллезе и других риккетсиозах, брюшном тифе. Пневмоцисты (Pneumocystis carinii) вызывают бронхит, пневмонию. Редко возникает грибковое поражение дыхательных путей, наблюдаемое у пациентов с клеточным иммунодефицитом (как первичным, так и вызванным лекарственной иммуносупрессией).
| Возбудители | Основные синдромы поражения дыхательных путей |
|---|---|
Вирусы гриппа |
Трахеит, ринофарингит, бронхит, круп с лихорадкой у детей |
Вирусы парагриппа |
Ларингит, ринофарингит, ложный круп |
Респираторно-синцитиальный вирус |
Бронхит, бронхиолит |
Аденовирусы |
Фарингит, тонзиллит, ринит |
Риновирусы |
Ринит, ринофарингит |
Вирусы ЕСНО |
Ринофарингит |
Вирус Коксаки А |
Фарингит, герпангина |
Вирус Коксаки В |
Фарингит |
Коронавирусы человека |
Ринофарингит, бронхит |
Коронавирус тяжелый острый респираторный синдром |
Бронхит, бронхиолит, респираторный дистресс-синдром |
Вирус простого герпеса |
Фарингит |
| Возбудитель | Основные синдромы поражения дыхательных путей |
|---|---|
Streptococcus pneumoniae |
Ринит, отит, синусит, пневмония |
Streptococcus pyogenes |
Тонзиллит |
Haemophilus influenzae (инкапсульная форма) |
Эпиглоттит, ринит, синусит, пневмония, бронхит |
Haemophilus influenzae (капсульная форма) |
Синусит, отит |
Moraxella catarrhalis |
Отит, синусит (в основном у пациентов, принимавших раньше антибиотики), бронхит |
Staphylococcus aureus |
Отит, синусит, тонзиллит, пневмония |
Mycoplasma pneumoniae |
Ринофарингит, бронхит |
Chlamidia trachomatis |
Бронхит, пневмония |
Chlamidia pneumoniae |
Фарингит, тонзиллит, бронхит |
Chlamidia psittaci |
Пневмония, бронхит |
Legionella pneumophila |
Бронхит, бронхиолит, пневмония |
Neisseria meningitidis |
Назофарингит |
Необходимые дополнительные исследования
Решающую роль в подтверждении диагноза заболеваний с КРС играют методы лабораторной диагностики, среди которых выделяют:
Методы этиологической диагностики заболеваний, протекающих с катарально-респираторным синдромом, представлены в табл. 7-3.
Метод иммунофлюоресценции наиболее предпочтителен, поскольку позволяет проводить точный морфологический анализ с высокой специфичностью. Он прост в воспроизводстве и дает возможность получить результат в течение нескольких часов.
ИФА широко применяют для выявления специфических антител в сыворотке крови больных вирусными или бактериальными заболеваниями.
Принципы лечения
Диагноз ОРЗ устанавливают при отсутствии четкого преобладания определенной нозологической формы. Он подразумевает как бактериальную, так и вирусную природу заболевания. Термин «ОРВИ» предполагает вирусную этиологию заболевания с наличием КРС.
Стратегию лечения КРС определяют в соответствии с механизмами патогенеза, этиологией и общностью клинических проявлений заболевания.
Для этиотропного лечения ОРВИ применяют ЛС группы адамантанового ряда (римантадин), препараты группы индолов (Арбидол♠) и ингибиторы нейроаминидазы (осельтамивир) при гриппе и при других ОРВИ - Арбидол♠.
| Диагноз | Микробиологический | Иммyнoфлюopecцeнция | ΡΗΓΑ РПГА PTГA | PCK | PЛA | ИФА | Посев на культуру клеток эмбриона человека, почек обезьяны | ПЦP |
|---|---|---|---|---|---|---|---|---|
Грипп |
- |
+ |
+++ |
+ |
- |
+ |
+ |
- |
Парагрипп |
- |
+ |
PTГA |
+ |
- |
- |
+ |
- |
Аденовирусная инфекция |
- |
+ |
PTГA |
+ |
- |
- |
- |
- |
Pecпиpaтopнo-cинцитиaльнaя инфекция |
- |
+ |
РПГА |
+ |
- |
- |
+ |
- |
Peoвиpycнaя инфекция |
- |
+ |
РПГА |
- |
- |
- |
+ |
- |
Pинoвиpycнaя инфекция |
- |
+ |
- |
- |
- |
- |
+ |
- |
Энтepoвиpycнaя инфекция |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
Тяжелый острый респираторный синдром |
- |
- |
- |
- |
- |
+ |
- |
+ |
Mикoплaзмeннaя инфекция |
+ |
+ |
- |
+ |
- |
+ |
- |
+ |
Xлaмидийнaя инфекция |
+ |
- |
- |
- |
- |
+ |
- |
+ |
Инфекция, вызванная Haemophilus influenzae aegyptius |
+ |
- |
РПГА |
- |
+ |
+ |
- |
+ |
Пневмококковая инфекция |
+ |
- |
РПГА |
- |
+ |
+ |
- |
+ |
Стафилококковая инфекция |
+ |
- |
РПГА |
- |
+ |
+ |
- |
- |
Другие условно-патогенные инфекции |
+ |
- |
РПГА |
- |
- |
+ |
- |
- |
Эффективно применение ИФН и их индукторов, обладающих антивирусными свойствами, регулирующих процессы перекисного окисления липидов на клеточных мембранах, способствующие восстановлению нарушенного гомеостаза, оказывающие иммуномодулирующее действие, усиливающие активность естественных киллеров и ускоряющие выработку специфических антител. ИФН лейкоцитарный человеческий применяют интраназально, в виде аэрозолей и аппликаций на слизистую оболочку, инстилляций в конъюнктивальный мешок; лейкинфероны - в аэрозолях; рекомбинантные интерфероны (ИФН-α2) - в виде капель в нос или ректальных свечей.
Индукторы ИФН (тилорон, натрия рибонуклеат, Кагоцел♠, меглумина акридонацетат, оксодигидроакридинилацетат натрия) стимулируют образование эндогенного ИФН-α.
Важную роль в развитии и тяжести течения инфекционного процесса играет нарушение равновесия между активностью протеолиза, необходимого для разрушения патогенов, с образованием свободных радикалов для сохранения аминопротеазной и антиоксидантной защиты. Поэтому целесообразно назначать препараты, способные инактивировать протеолитические процессы (апротинин, аминобензойная кислота, аминокапроновая кислота, рибонуклеаза, Дезоксирибонуклеаза♠).
Системное антибактериальное лечение проводят только при ОРЗ бактериальной этиологии.
При легком течении заболевания с КРС предпочтение отдают симптоматическому и патогенетическому лечению. Симптоматическое лечение ринита включает промывание носа изотоническим раствором натрия хлорида, использование сосудосуживающих капель и спреев. При среднетяжелом течении заболевания возможно назначение местных бактериостатических антибиотиков, фузафунгина.
При фарингите показан щадящий режим питания, полоскание горла щелочными растворами, растворами антисептиков, отварами лекарственных трав (шалфея, ромашки лекарственной, календулы). Применяют обезболивающие или местноанестезирующие препараты (Стрепсилс плюс♠).
При тонзиллите системное антибактериальное лечение проводят только при бактериальной этиологии заболевания. Препараты выбора для лечения острого стрептококкового тонзиллита: феноксиметилпенициллин, амоксициллин, макролиды. При развитии ко-резистентности оральной флоры используют Аугментин♠ (амоксициллин + клавулановая кислота). Для симптоматического лечения применяют местные антисептические ЛС.
Лечение ларингита без стеноза проводят смягчающими и местными антибактериальными ЛС. При навязчивом кашле назначают противокашлевые средства (бутамират, кодеин). Применяют ингаляции теплого пара или дозированных аэрозолей (сальбутамол, фенотерол).
При эпиглоттите показано парентеральное введение антибиотиков, активных в отношении гемофильной палочки (фторхинолоны, цефотаксим, цефтриаксон), возможно их сочетание с аминогликозидами.
В случае острого бронхита при микоплазменной и хламидийной инфекции назначают системное антибактериальное лечение (макролиды, тетрациклины). Также применяют противокашлевые ЛС центрального и периферического действия, муколитические препараты (бромгексин, амброксол). Одновременное назначение противокашлевых и муколитических препаратов недопустимо из-за опасности «заболачивания» дыхательных путей при угнетении кашлевого рефлекса.
Глава 8. Экзантемы, энантемы, первичный аффект
Определение
Экзантема (сыпь) - дискретное патологическое образование кожи в ответ на воздействие токсинов и метаболитов возбудителя. Реакция кожи проявляется полнокровием сосудов микроциркуляторного русла, повышением сосудистой проницаемости с развитием отека и геморрагий, некрозом эпидермиса и более глубоких слоев кожи, дистрофическими изменениями клеток, серозным, гнойным, серозно-геморрагическим воспалением. Наличие сыпи важно для диагностики, а в ряде случаев и оценки тяжести течения болезни и ее прогноза.
Сыпь характеризуют по следующим параметрам:
-
вид элементов сыпи: розеола, макула, эритема, папула, бугорок, узел, уртикария, везикула, пустула, булла, петехия, экхимоз;
-
размеры: мелкая - до 2, средняя - до 5, крупная - свыше 5 мм в диаметре;
-
однородность элементов сыпи: мономорфная (все элементы относятся к одному виду и имеют одинаковые размеры); полиморфная (элементы сыпи резко различаются по форме, размерам, или имеются элементы различного вида);
-
локализация элементов: симметричная и асимметричная, преимущественно в той или иной области кожного покрова;
-
обилие сыпи: единичная (до 10 элементов), необильная (элементы можно сосчитать) и обильная (множественная);
-
метаморфоз сыпи: появление элемента, его развитие, часто с переходом элемента одного вида в другой, и угасание сыпи;
-
сроки появления: ранние - 1-2-й, средние - 3-4-й и поздние - после 5-го дня болезни.
При характеристике сыпи указывают фон кожи (бледная, гиперемированная).
Клиническая характеристика
Виды элементов сыпи
-
Розеола - круглое пятнышко розового, красного или пурпурного цвета размером до 5 мм, исчезающее при надавливании или растяжении кожи. Мелкая обильная розеолезная сыпь обозначается как мелкоточечная. В основе возникновения розеолы - локальное полнокровие сосудов микроциркуляторного русла.
-
Макула (пятно) отличается от розеолы большим размером, часто неправильной формой.
-
Эритема - обширный участок гиперемии кожи - образуется в результате слияния отдельных элементов пятен или как самостоятельная форма поражения кожи.
-
Папула (узелок) образуется в результате продуктивного воспаления, инфильтрации клеточными элементами поверхностных слоев дермы и ее полнокровия. Размер элементов от 1 до 20 мм, они возвышаются над поверхностью кожи, розового или красного цвета, могут возникать первично или происходить из розеолы или макулы. После рассасывания элемента можно наблюдать участок бурой пигментации кожи, иногда отрубевидное шелушение.
-
Бугорок похож на папулу, но более плотный по консистенции. Возникает как результат формирования специфических воспалительных гранулем, характерных для хронических инфекций. Бугорки могут некротизироваться и изъязвляться с последующим образованием рубцов.
-
Узел - крупное (2 см и более) образование в толще дермы или подкожной клетчатки. Элемент обнаруживают при пальпации либо визуально, поскольку он может выступать над поверхностью кожи. В основе узла - специфическое гранулематозное воспаление.
-
Уртикария (волдырь) - результат острого очагового отека сосочкового слоя кожи без признаков воспаления. Имеет розовую или бледную (при сосудистом спазме) окраску, диаметр до 2 см и более, круглой или овальной формы, часто сопровождается зудом, характерен для аллергических реакций, сывороточной болезни, пищевой аллергии. Исчезает бесследно через несколько часов.
-
Везикула - куполообразный пузырек диаметром до 5-10 мм, жемчужно-серого цвета, заполненный серозным или серозно-геморрагическим экссудатом. Элемент локализован в эпидермисе или субэпидермально, образуется в результате баллонирующей дистрофии клеток шиповатого слоя эпидермиса, которые увеличиваются в размерах, принимают шаровидную форму, а затем перегородка между ними разрывается с образованием общей полости (однокамерная везикула) или нескольких полостей с внутренними перегородками (многокамерная везикула). Элементы могут вскрываться, образуя поверхностную эрозию, или подсыхать, покрываясь корочкой, после отпадения которой остается участок нестойкой депигментации. Везикулы могут быть окружены венчиком гиперемии или эритемой, в центре иногда образуется пупковидное вдавление. При нагноении экссудата они трансформируются в пустулу.
-
Булла - пузырь диаметром более 1 см, заполненный серозным, серозно-геморрагическим или гнойным содержимым. Образуется первично или в результате слияния везикул.
-
Пустула - пузырек, заполненный гнойным или гнойно-геморрагическим экссудатом. Образуется в результате нагноения содержимого везикул или при сепсисе (первично). Пустулы окружены венчиком гиперемии, могут быть болезненны при пальпации, впоследствии вскрываются или покрываются коркой, после отпадения которой остается рубец.
-
Фликтена - плоский болезненный пузырь с серозно-гнойным содержимым, окруженный венчиком гиперемии.
-
Петехия - точечное, 1-2 мм в диаметре, кровоизлияние, возникает в результате диапедеза при резком повышении сосудистой проницаемости и нарушениях в системе сосудисто-тромбоцитарного звена гемостаза. При регрессе петехий в течение нескольких дней сохраняется бурая пигментация кожи. Элементы могут быть первичными.
-
Экхимозы - крупные кровоизлияния диаметром до 3-5 см неправильной узорчатой формы. Характеризуют тяжелое течение сепсиса, менингококковой инфекции. Могут образовываться вторично в очагах геморрагического некроза кожи. В этих случаях они плотноваты и чувствительны на ощупь, поверхность их эрозируется с образованием язв, покрытых коркой, после отпадения которой остается стойкий рубец.
Основные характеристики сыпи при различных инфекциях представлены в табл. 8-1.
Первичный аффект
Первичный аффект - специфическое поражение кожи в месте внедрения возбудителя, зачастую с сопутствующим регионарным лимфаденитом. Возникает при инфекционных болезнях с трансмиссивным или (реже) контактным механизмом передачи возбудителя. Появление первичного аффекта, как правило, предшествует другим симптомам болезни и служит важным диагностическим симптомом (табл. 8-2).
Энантема - локальное дискретное поражение слизистой оболочки, аналогичное кожной сыпи. Имеет важное клиническое и диагностическое значение. Характеристика энантем представлена в табл. 8-3.
| Нозологическая форма | Частота встречаемости сыпи | Срок появления | Морфология | Обилие | Преимущественная локализация | Этaпнocть высыпания | Метаморфоз | Мономорфизм | Субъективные ощущения |
|---|---|---|---|---|---|---|---|---|---|
Брюшной тиф |
60-80% |
8-10 дней |
Розеола, розеола-папула |
Единичная, необильная |
Живот |
- |
- |
Мономорфная |
- |
Пapaтифы, генерализованный caльмoнeллeз |
50-70% |
3-8 дней |
Розеола, папула, вторичная пeтexия |
Необильная |
Живот, ГРУДЬ, конечности |
- |
Пигментация возможна |
Мономорфная |
- |
Псевдотуберкулез (генерализованная форма) |
80% |
1-7 дней |
Мелкоточечная |
Обильная |
Лицо, туловище, конечности, кожные складки |
- |
Шелушение |
Мономорфная, полиморфная |
Возможен зуд |
Пятнисто-папулезная ypтикapнaя, эpитeмoнoдoзнaя |
Обильная |
Крупные суставы |
- |
Пигментация, шелушение |
Полиморфная |
- |
|||
Иерсиниоз |
Часто |
1-7 дней |
Мелкоточечная, пятнисто-папулезная, ypтикapнaя, эритема |
Необильная, обильная |
Кисти рук, грудь, бедра |
- |
Пигментация, шелушение |
Полиморфная, мономорфная |
Возможен зуд |
Кожная форма чумы |
Постоянно |
Со 2-го дня |
Пустула |
Единичная, необильная |
- |
- |
Язва, рубец |
Полиморфная по размеру |
Резко болезненная |
Септическая форма чумы |
Постоянно |
С 1-го дня |
Экхимозы |
Обильная |
- |
- |
Некроз |
Полиморфная по размеру |
То же |
Стафилококковая инфекция (CTШ) |
Постоянно |
С 1-го дня |
Пятнистая, пятнисто-папулезная, пeтexиaльнaя |
Обильная, особенно в кожных складках |
Туловище, конечности |
- |
Шелушение |
Полиморфная |
- |
Скарлатина |
Постоянно |
С 1-го дня |
Мелкоточечная на гипepeмиpoвaннoм фоне |
Обильная, особенно в кожных складках |
Туловище, конечности |
Одномоментно |
Шелушение |
Moнoмopфнaя |
Легкий зуд |
Meнингoкoккoвaя инфекция (мeнингoкoккeмия) |
100% |
4-48 ч |
Пeтexии, экхимозы, некрозы |
Необильная, обильная |
Дистальные отделы конечностей, бедра, в тяжелых случаях - грудь, живот, лицо, шея |
- |
Пигментация, некроз, изъязвление, рубцевание |
Полиморфная |
- |
Системный клещевой бoppeлиoз |
60-70% |
Через 3-32 дня после присасывания клеща |
Эритема кольцевидная |
Единичная |
Туловище |
- |
Первичный аффект, эритема распространяется цeнтpoбeжнo |
Мономорфная, полиморфная |
- |
Лeптocпиpoз |
30-50% |
2-5 дней |
Пятнистая, пятнисто-папулезная, пeтexиaльнaя |
Необильная, обильная |
Туловище, конечности |
- |
Бесследно исчезает в течение суток, пeтexии пигментируются |
Полиморфная |
- |
Лeгиoнeллeз (лихорадка форта Бpaгг) |
100% |
1-2 дня |
Пятнистая, пятнисто-папулезная |
Необильная |
Туловище, конечности |
- |
Бесследно исчезает |
Полиморфная |
- |
Энтepoвиpycнaя Коксаки ECHО-инфeкция (энтepoвиpycнaя экзантема) |
100% |
2-3 дня |
Мелкопятнистая, пятнисто-папулезная, мелкоточечная, пeтexиaльнaя |
Обильная |
Туловище, конечности |
- |
Бесследно исчезает |
Полиморфная |
- |
ВИЧ (стадия первичных проявлений) |
Часто |
Различные |
Пятнистая, пятнисто-папулезная |
Обильная |
Туловище, конечности, лицо |
- |
Бесследно исчезает |
Полиморфная |
- |
Герпетическая инфекция (герпес-вирусы l-ll типа) |
Около 100% |
1-2 дня |
Beзикyлeзнaя |
Локальная, обильная |
Лицо, гениталии |
- |
Розеола, папула, везикула, корочка |
Moнoмopфнaя |
Чувствительная |
Инфекционный мoнoнyклeoз |
10% (обычно после приема ампициллина) |
Различные |
Пятнистая, пятнисто-папулезная |
Обильная |
Туловище, конечности |
- |
Бесследно исчезает |
Полиморфная |
- |
Ветряная оспа |
100% |
1 день |
Везикула однокамерная |
Необильная, обильная |
Туловище, конечности, лицо, волосистая часть головы |
Волнообразно |
Пятнышко, папула, везикула, корочка |
Moнoмopфнaя |
Возможен зуд |
Опоясывающий лишай |
100% |
1-7 дней |
Везикула однокамерная |
Локализована в пределах 1-2 дерматомов |
Лицо, верхняя часть туловища |
Одномоментно |
Эритема, сгруппированные везикулы, корочка, возможен рубец |
Moнoмopф-нaя |
Возможна болезненность |
Корь |
100% |
3-5 дней (иногда до 8) |
Пятниcтo-пaпyлeзнo-эpитeмaтoзнaя |
Обильная |
Лицо, шея, туловище, проксимальные отделы конечностей |
1-й день - за ушами, на лице, 2-й день - грудь, туловище, бедра, плечи, 3-й день - предплечье, голени |
Мелкие папулы группируются в крупные сливные пятнисто-папулезные элементы, местами эритему, пигментируются |
Мономорфная |
- |
Краснуха |
100% |
1-3 дня |
Пятнистая |
Обильная |
Спина, ягодицы, paзгибaтeльнaя поверхность конечностей |
Появляется за ушами, на лице, на волосистой части головы, распространяется в течение 12-36 ч |
- |
Мономорфная |
Легкий зуд |
Натуральная оспа |
100% (редко у вакцинированных встречается оспа без сыпи) |
4-5 дней |
Пустула многокамерная на инфильтративнoм основании |
Обильная |
Лицо, туловище, конечности |
Лицо, туловище, конечности |
Розеола, папула, везикула, пустула, корочка, рубец (рябина) |
Регионарный мономорфизм |
Зуд |
Оспа обезьян |
100% |
3-4 дня |
Пустула многокамерная |
Необильная, обильная |
Голова, конечности, туловище |
Голова, лицо, кисти рук, туловище и ноги |
Розеола, папула, везикула, пустула, корки |
Регионарный мономорфизм |
Зуд |
Оспа коровья (вакцина) |
100% |
1-2 дня |
Пустула многокамерная на инфильтрированном основании |
Единичная |
Кисти рук |
- |
Папула, везикула, пустула, корка |
Moнoмopфнaя |
Слабый зуд |
ГЛД |
Часто |
2-4 дня |
Пeтexии, экхимозы |
Необильная |
Распространенная |
- |
Возможна пигментация |
Полиморфная по размеру |
- |
Лихорадка дeнгe классическая |
Часто |
2-3 дня |
Мелкоточечная на фоне эритемы |
Обильная |
Распространенная |
- |
Розеола, мaкyлoпaпyлa |
Moнoмopфнaя |
Зуд |
Геморрагическая |
Часто |
2-4 дня |
Пeтexии, экxимoзы |
Необильная |
Распространенная |
- |
Возможна пигментация |
Полиморфная по размеру |
- |
ГЛПC |
В тяжелых случаях |
2-4 дня |
Пeтexии |
Необильная |
Подмышечные области |
- |
- |
Полиморфная |
- |
KГЛ |
Часто |
3-6 дней |
Пeтexии |
Необильная |
Живот, боковая поверхность клетки |
- |
Полиморфная по размеру |
- |
|
Лихорадка Лacca |
Часто |
2 нeд |
Пятнисто-папулезная, пeтexии, экxимoзы |
Необильная |
- |
- |
Пигментация |
Полиморфная (по размеру) |
- |
Лихорадка Эбoлa |
50% |
4-6 дней |
Пятнисто-папулезная |
Необильная, обильная |
- |
- |
Шелушение |
Полиморфная |
- |
Сыпной тиф (болезнь Бpиллa) |
80% |
4-6 дней |
Poзeoлeзнaя, poзeoлeзнo-пeтexиaльнaя |
Обильная, необильная |
Боковые поверхности туловища, cгибaтeльныe поверхности конечностей |
- |
Пигментация |
Полиморфная |
- |
Сыпной тиф эндемический |
Около 100% |
4-7 дней |
Poзeoлeзнo-пaпyлeзнaя, пятнисто-папулезная |
Обильная |
Туловище, верхние конечности, ладони |
- |
- |
Полиморфная |
- |
Лихорадка цyцyгaмyши |
Около 100% |
4-7 дней |
Пятниcтo-пaпyлeзнo-гeмoppaгичecкaя |
Обильная |
Все тело, кроме ладоней и стоп |
- |
Шелушение, пигментация |
Полиморфная |
- |
Mapceльcкaя лихорадка и APЛ |
Около 100% |
2-4 дня |
Пятнисто-папулезная, пятниcтo-пaпyлeзнo-гeмoppaгичecкaя |
Обильная |
Конечности, включая ладони и стопы, туловище, лицо |
Грудь, живот, в течение 2 сут распространяется на другие части тела |
Стойкая пигментация |
Полиморфная |
- |
| Нозологическая форма | Механизм передачи, переносчик | Срок появления | Преимущественная локализация | Этапы развития, размеры | Болезненность | Регионарный лимфаденит |
|---|---|---|---|---|---|---|
Чума: кожная, кoжнo-бyбoннaя форма |
Трансмиссивный, блоха |
Первые часы болезни |
Нижние конечности |
Пятно, папула, везикула, пустула с геморрагическим содержимым, язва до 5-10 см в диаметре, рубец |
Резкая |
2-3-й дни болезни с нагноением (при кoжнo-бyбoннoй форме) |
Туляремия: кoжнo-бyбoннaя форма |
Трансмиссивный, комары, слепни, клещи, мухи-жигалки |
Инкубационный период |
Конечности |
Пятно, папула, везикула, пустула, язвочка до 1 см правильной «штампованной» формы, aтpoфичecкий рубец |
Отсутствует |
2-3-й дни болезни, часто с нагноением |
Эндемический возвратный тиф |
Apгacoвый клещ рода Alectoгobius |
В течение суток после присасывания клеща |
Закрытые части тела |
Мелкая папула с геморрагическим венчиком, сохраняется до 2-4 нeд |
Отсутствует, зуд |
- |
Системный клещевой бoppeлиoз (лaймcкaя болезнь) |
Иксодовые клещи |
Инкубационный период |
Закрытые части тела |
Пятно, папула, иногда везикула с некрозом, вокруг формируется кольцевидная мигрирующая эритема |
Имеется зуд |
Чувствительность, невралгия, нагноения нет |
Coдoкy |
Контактный |
1-й день болезни |
Диcтaльный отдел конечностей |
Инфильтрат, некроз, нагноение, язва, рубец |
Имеется |
Болезненность, лимфангит |
Доброкачественный лимфopeтикyлeз |
Контактный |
1-й день болезни |
Кисть, предплечье, шея |
В месте царапины образуется мелкая папула с некрозом и изъязвлением, сухая корочка |
Отсутствует |
Через 2-3 нeд, слабая болезненность, часто с нагноением |
Лихорадка цyцyгaмyши |
Трансмиссивный, личинка кpacнoтeлкoвыx клещей (нaдceмeйcтвo Tгombea) |
Через 1-2 дня после присасывания клеща |
Закрытые части тела |
Инфильтрат с венчиком гиперемии, некроз, плоская язвочка до 0,5 см в диаметре, корочка, рубчик |
Чувствительность |
Через 3 дня и позже, плотный, безболезненный |
Mapceльcкaя лихорадка |
Трансмиссивный, собачий клещ Rhipicephalus sanguineus |
1-й день болезни |
Закрытые части тела |
Инфильтрат диаметром до 1 см, корка, плоские язвочки, рубец |
Отсутствует |
В части случаев болезненность без нагноения |
Клещевой сыпной тиф Северной Азии |
Трансмиссивный, икcoдoвыe клещи |
Инкубационный период |
Закрытые части тела |
Инфильтрат, некроз с зоной гиперемии, язвочка, корка до 1 см, рубец, пигментация, шелушение |
Отсутствует |
Безболезненный без нагноения |
Африканский трипаносомоз |
Трансмиссивный, муха рода Glos-sina (муха цe-цe) |
Через 2-7 дней после укуса |
Открытые части тела |
Инфильтрат, язва (шанкр), рубец |
Отсутствует |
Болезненность отсутствует, без нагноения |
| Нозологическая форма | Частота появления | Срок появления | Локализация | Вид энантемы |
|---|---|---|---|---|
Meнингoкoккeмия |
Часто |
1-й день болезни |
Конъюнктивы, мягкое нёбо |
Кровоизлияние |
Коклюш |
Часто |
Спазматический период |
Склеры |
Кровоизлияние |
Чума |
Возможна |
3-й день болезни |
Конъюнктивы |
Кровоизлияние |
Лeптocпиpoз |
Возможна |
Разгар болезни |
Склеры, конъюнктивы |
Кровоизлияние |
Сыпной тиф |
Часто |
3-й день болезни |
Конъюнктивы, мягкое нёбо |
Кровоизлияние(пятна Kиapи- Aвцынa), пeтexии (симптом Poзeнбepгa) |
Энтepoвиpycнaя инфекция (герпангина) |
Диагностический симптом |
1-2-й дни болезни |
Передние дужки, язычок, нёбо |
Папула → везикула → эрозия → эпитeлизaция |
Простой герпес (стоматит) |
Диагностический симптом |
1-й день болезни |
Слизистая губ, щек, десен, нёбо, дужки миндалин |
Сгруппированные везикулы → болезненные эрозии → эпитeлизaция |
Ветряная оспа |
Часто |
1-2-й дни болезни |
Ротоглотка, гортань, половые органы |
Везикулы, эрозии, эпитeлизaция |
Корь |
Часто |
2-3-й дни болезни, за 1-2 дня до высыпания |
Нёбо, переходная складка слизистой щек, слизистая десен, губ |
Красные пятна, мелкие белесые точки, окруженные венчиком гиперемии (пятна Филaтoвa-Koпликa) |
Краснуха |
Часто |
1-2-й дни болезни |
Мягкое нёбо |
Красные пятна (пятна Фopxтгeймepa) |
Ящур |
Диагностический симптом |
2-3-й дни болезни |
Слизистая десен, губ, языка, щеки, гортани, иногда носа, конъюнктив, влагалища |
Везикулы → резко болезненные афты → эпитeлизaция |
Натуральная оспа |
Постоянно |
4-5-й дни болезни |
Слизистая ротоглотки, носа, дыхательных путей, уретры, конъюнктивы |
Везикулы → эрозии → эпитeлизaция |
Оспа обезьян |
Часто |
3-4-й дни болезни |
Слизистая ротоглотки, носа, дыхательных путей, уретры, конъюнктивы |
Везикулы → эрозии → эпитeлизaция |
ГЛД |
Часто |
Первые дни болезни |
Мягкое нёбо |
Мелкие везикулы |
ГЛПC |
В тяжелых случаях |
Со 2-3-го дня болезни |
Конъюнктивы, склеры, мягкое нёбо |
Пeтexии, кровоизлияние |
KГЛ |
В тяжелых случаях |
3-4-й дни болезни |
Конъюнктивы, склеры |
Геморрагии |
Лихорадка Лacca |
Постоянно |
3-й день болезни |
Мягкое нёбо, передние дужки |
Беловатые бляшки → некроз → сливающиеся язвы, покрытые фибринозным налетом → эпитeлизaция |
Лихорадка Mapбypг |
Постоянно |
Первые дни болезни |
Твердое и мягкое нёбо, язык |
Везикулы → поверхностные эрозии → эпитeлизaция |
Лихорадка Эбoлa |
Часто |
4-й день болезни |
Конъюнктивы |
Кровоизлияние |
Глава 9. Лимфaдeнoпaтия
Лимфаденопатия (ЛАП) - обобщающий термин, обозначающий увеличение размеров ЛУ независимо от причины и характера патологического процесса. ЛАП является одним из симптомов целого ряда заболеваний, различных по этиологии, клиническим проявлениям, методам диагностики и лечения.
Коды по Международной классификации болезней 10-го пересмотра (МКБ-10).
ЛУ содержат лимфоциты и макрофаги; корковый синус ЛУ заполнен фагоцитами, обеспечивающими первый этап иммунного ответа при инфекциях. Антигенное раздражение сопровождается пролиферацией Т- и В-лимфоцитов в ЛУ, трансформацией В-лимфоцитов в плазматические клетки, секретирующие Ig (антитела). Каждый ЛУ контролирует определенный участок лимфатической системы. При попадании в организм микробов ближайший (регионарный) к этому месту ЛУ уже через несколько часов начинает увеличиваться в размерах, лимфоидные клетки его интенсивно делятся и образуют огромное количество малых лимфоцитов. Функция малых лимфоцитов - организация специфической иммунной защиты от чужеродных агентов - антигенов. Совместное расположение большого числа макрофагов, дендритных клеток, клеток Лангерганса и лимфоцитов позволяет ЛУ выполнять основную функцию специализированной структуры, объединяющей все эти типы клеток для создания эффективной клеточной и гуморальной иммунной реакции организма. В лимфатических узлах происходят антигензависимая пролиферация (клонирование) и дифференцировка Т- и В-лимфоцитов в эффекторные клетки, а также образование Т- и В-клеток памяти.
Кроме того, ЛУ - биологический фильтр, препятствующий поступлению в лимфу и кровь различных инородных агентов, включая микроорганизмы, продукты их метаболизма и токсины. Поэтому при многих инфекционных болезнях закономерно возникает в той или иной мере выраженная ЛАП, которая обычно сочетается с другими характерными для инфекций симптомами: лихорадкой, интоксикацией, гепатоспленомегалией, сыпью и т.д.
Увеличение размеров лимфоузлов (ЛАП) может быть обусловлено:
ЛАП наблюдают при следующих заболеваниях:
Увеличение ЛУ одной группы называют локальной (регионарной) ЛАП, увеличение ЛУ двух и более групп - полиаденопатией, или генерализованной ЛАП.
Различают острую (до 3 мес), затяжную (до 6 мес) и хроническую (персистирующую) ЛАП (свыше 6 мес).
При инфекционных болезнях нередко развивается лимфаденит - воспаление ЛУ, ближайших к месту проникновения возбудителя. Лимфаденит может сочетаться с первичным аффектом или с полиаденопатией.
Острые и (реже) хронические лимфадениты могут сопровождаться нагноением и некрозом пораженных ЛУ. Исходом может быть полное рассасывание ЛУ или его склерозирование.
Нередко воспалительный процесс в ЛУ носит специфический характер. При этом гистологическое исследование биоптата или постмортальное исследование позволяют обнаружить специфические гранулемы (бруцеллез, доброкачественный лимфоретикулез, псевдотуберкулез, листериоз, туляремия, туберкулез, сифилис и др.).
Перечень нозологических форм, протекающих с ЛАП, представлен в табл. 9-1.
Нозологическая форма |
Локальная ЛАП |
Полиаденопатия |
||||
|---|---|---|---|---|---|---|
частота |
нагноение |
длительность |
первичный аффект |
частота |
длительность |
|
Бактериозы |
||||||
Туляремия |
+ |
в |
з, х |
ч |
в |
о, з |
Чума |
+ |
ч |
о |
р |
в |
о |
Доброкачественный лимфо-ретикулез |
+ |
в |
з |
ч |
в |
з, х |
Содоку |
+ |
ч |
о |
+ |
- |
- |
Стрептобациллез |
р |
р |
о |
р |
- |
- |
Иксодовый клещевой боррелиоз |
ч |
- |
о |
ч |
- |
- |
Рожа |
ч |
р |
о |
- |
- |
- |
Стрепто кокковая, стафилококковая инфекции |
ч |
ч |
о |
Очаг гнойной инфекции |
- |
- |
Сибирская язва |
ч |
- |
о |
+ |
- |
- |
Туберкулез |
в |
в |
х |
- |
в |
х |
Сифилис первичный |
+ |
- |
о, з |
+ |
- |
- |
Сифилис вторичный |
- |
- |
- |
- |
ч |
х |
Дифтерия |
+ |
- |
о |
- |
- |
- |
Хламидиоз урогенитальный |
ч |
в |
з |
- |
- |
- |
Псевдотуберкулез |
в |
- |
о |
- |
в |
о |
Бруцеллез |
- |
- |
- |
- |
ч |
х |
Листериоз |
в |
- |
о |
- |
в |
о |
Лихорадка цуцугамуши |
+ |
- |
о |
+ |
в |
о |
Марсельская лихорадка |
в |
- |
о |
+ |
- |
- |
Астраханская клещевая лихорадка |
в |
- |
о |
+ |
- |
- |
Клещевой сыпной тиф североазиатский |
в |
- |
о |
+ |
- |
- |
Вирусные инфекции |
||||||
ИМ |
- |
- |
- |
- |
+ |
о, з, х |
Аденовирусная инфекция |
в |
- |
о |
- |
в |
о |
Краснуха |
- |
- |
- |
- |
+ |
о |
Корь |
- |
- |
- |
- |
+ |
о |
ЦМВИ |
- |
- |
- |
- |
в |
з |
Простой герпес |
ч |
- |
о |
- |
- |
- |
Опоясывающий лишай |
ч |
- |
о |
- |
- |
- |
Ящур |
+ |
- |
о |
- |
- |
- |
ВИЧ-инфекция |
- |
- |
- |
- |
+ |
з, х |
Лихорадка денге |
- |
- |
о |
- |
ч |
о |
Протозоозы |
||||||
Токсоплазмоз |
+ |
- |
х |
- |
в |
х |
Трипаносомоз африканский |
ч |
- |
о |
+ |
ч |
о |
Трипаносомоз американский |
ч |
- |
з |
ч |
+ |
о, з |
Висцеральный лейшманиоз |
- |
- |
- |
- |
ч |
х |
Глистные инвазии |
||||||
Филяриатозы |
+ |
- |
х |
- |
- |
- |
Обозначения: «+» - наличие признака; «-» - отсутствие признака; в - признак возможен; ч - встречается часто; р - встречается редко; ЛАП по продолжительности: о - острая; з - затяжная; х - хроническая.
Глава 10. Синдром желтухи
Введение
Синдром желтухи - часто встречающаяся патология в практике врача многих специальностей. Желтуха указывает на нарушение метаболизма желчных пигментов, связанное как с поражением печени, желчевыводящих путей, так и с нарушением обмена гемоглобина, неполной конъюгацией (связыванием печеночного билирубина, образующегося в результате метаболизма гемоглобина).
Поэтому желтухи подразделяют на надпеченочные, печеночные и подпеченочные.
Желтуха
Желтуха (греч. - icterus) - это окрашивание в желтый цвет (иктеричность) кожного покрова и слизистых оболочек в результате накопления пигмента билирубина в сыворотке крови и последующего его отложения в тканях из-за нарушения динамического равновесия между скоростью его образования и выделения.
Нормальное количество общего билирубина сыворотки крови (по методу Иендрашика) находится в пределах от 3,4 до 20,5 мкмоль/л, большая часть которого представлена непрямым (неконъюгированным, свободным, не связанным с глюкуроновой кислотой) билирубином - до 16,5 мкмоль/л, меньше - прямым (конъюгированным, связанным) билирубином от 0 до 5,1 мкмоль/л.
Обычно при осмотре больного желтуха обнаруживается при уровне билирубина в сыворотке крови, равном 40-60 мкмоль/л (2-3 нормы).
Патогенетические механизмы обмена билирубина и развития синдрома желтухи
Основная часть билирубина образуется из гема, небелковой части гемоглобина, который распадается до железа и промежуточного продукта биливердина при разрушении эритроцитов в клетках ретикулоэндотелиальной системы. Далее биливердин превращается в билирубин с помощью фермента биливердинредуктазы. Этот нерастворимый в воде билирубин называют неконъюгированным (непрямым, свободным) билирубином, он транспортируется в плазме в виде соединения с альбумином и не может проходить через мембрану почечных клубочков. Поглощение билирубина осуществляется печенью, где он соединяется с глюкуроновой кислотой с образованием диглюкуронида билирубина, или конъюгированного (прямого, связанного) билирубина. Эта реакция, катализируемая ферментом уридинфосфат-глюкуронилтрансферазой, переводит пигмент в водорастворимое состояние.
Конъюгированный в гепатоцитах билирубин секретируется в желчные канальцы наряду с другими составными частями желчи и далее поступает в кишечник. В кишечнике под действием бактериальной флоры происходит деконъюгация пигмента и восстановление его до различных соединений, называемых стеркобилиногенами. Большая их часть выделяется с фекалиями, придавая стулу коричневый цвет; определенное количество (около 20%) билирубина абсорбируется в кишечнике и повторно экскретируется в желчь, а небольшая часть выделяется с мочой в виде уробилиногена. Почки могут также экскретировать диглюкуронид билирубина, но неконъюгированный билирубин, как было сказано выше, через почечный фильтр не проходит. Этим объясняется темный цвет мочи, типичный для печеночной (паренхиматозной) или подпеченочной (механической) желтухи, тогда как при надпеченочной (гемолитической) желтухе билирубин в моче отсутствует и темно-красный цвет мочи связан с наличием в ней гемоглобина.
При нарушении билирубинового обмена на этапах образования и его транспорта развивается надпеченочная желтуха. В сыворотке крови больных выявляется преимущественно неконъюгированный (непрямой) билирубин. Другое название надпеченочной желтухи - гемолитическая. Она связана с самой частой, но не единственной причиной ее развития - гемолизом эритроцитов при наследственных или приобретенных гемолитических анемиях.
Уровень билирубина в сыворотке крови при надпеченочной желтухе редко превышает 3-5 норм (60-100 мкмоль/л). Более высокие концентрации непрямого билирубина встречаются при остром гемолизе либо сочетании гемолиза и болезни печени: в этих случаях гипербилирубинемия является смешанной (общий билирубин представлен примерно поровну обеими фракциями), так как нарушается конъюгация билирубина в гепатоцитах и секреция желчи в желчные канальцы.
Печеночной называют желтуху, возникающую при нарушении обмена билирубина на этапе поглощения, конъюгации в гепатоцитах и экскреции билирубина в желчные канальцы. Прежнее название этого типа желтухи - паренхиматозная, связано в первую очередь с поражением гепатоцитов (паренхимы печени) и желчных капилляров при острых или хронических воспалительных заболеваниях печени. Печеночная желтуха обусловлена повышением в сыворотке крови преимущественно прямой фракции билирубина. Она характерна также для синдромов Дабина-Джонсона и Ротора, имеющих наследственный характер.
При возникновении внутренних и внешних препятствий к желчеотделению и выведению желчи в двенадцатиперстную кишку на одном из этапов - от желчных протоков и до фатерова соска - развивается подпеченочная, или механическая (обтурационная), желтуха.
Перечень основных нозологических форм болезней, течение которых сопровождается развитием синдрома желтухи: синдром желтухи наблюдается при вирусных гепатитах, герпетических инфекциях, желтой лихорадке, сепсисе, сальмонеллезе, листериозе, иерсиниозах, лептоспирозах, возвратных тифах, боррелиозах, лейшманиозе (висцеральном), эхинококкозе, альвеококкозе, фасциолезе, клонорхозе, токсокарозе, шистосомозах.
Печеночная желтуха в сочетании с асцитом, другими симптомами портальной гипертензии, кожными и эндокринными нарушениями обычно свидетельствует о хроническом процессе в печени. Среди хронических заболеваний печени, сопровождающихся синдромом желтухи, цирроз печени (класс В или С по Чайлд-Пью) является одним из наиболее распространенных.
Печеночный тип желтухи встречается при большом количестве неинфекционной природы заболеваний, в частности, при токсическом (алкогольном, лекарственном, при отравлении ядовитыми грибами), аутоиммунном гепатитах, первичном билиарном циррозе печени, склерозирующем холангите, болезни Вильсона-Коновалова, гемосидерозе и других. Кахексия и значительно увеличенная в размерах, болезненная, необычно твердая или бугристая печень чаще связаны с метастазами, первичным раком печени, альвеолярным эхинококкозом, а не с циррозом печени. Генерализованная ЛАП у больного с остро развившейся желтухой может свидетельствовать о лимфоме или лейкозе. Гепатоспленомегалия без других признаков хронической болезни может быть обусловлена инфильтративным поражением печени при лимфоме, амилоидозе, саркоидозе, хотя желтуха при таких состояниях обычно минимальна или отсутствует вовсе. Редким заболеванием неясной этиологии, развивающимся накануне родов, является жировой гепатоз беременных. Он характеризуется диспепсическими расстройствами, желтухой с быстро развивающейся печеночной недостаточностью; уровни трансаминаз, как правило, низкие.
Клинический (кожный зуд) и биохимический (увеличение ЩФ, ГГТП, общего холестерина при отсутствии значительного повышения АЛТ, АСТ) синдром, развивающийся в результате нарушения поступления желчи в двенадцатиперстную кишку из-за патологического процесса на каком-либо участке от гепатоцита до фатерова соска, называется холестазом. При подозрении на холестатический характер желтухи важно отличать внутри- и внепеченочный холестаз.
Внепеченочный холестаз (обтурационная желтуха) чаще всего обусловлен камнем общего желчного протока или раком головки поджелудочной железы, реже альвекоккозом и амебным абсцессом печени. Реже причиной болезни являются доброкачественный стеноз общего протока (обычно связанный с предварительным оперативным вмешательством), рак протока, панкреатит или псевдокистозная форма хронического панкреатита. При склерозирующем холангите печеночная по происхождению желтуха превращается в обтурационную (холестатическую) в далеко зашедшей стадии болезни. О развитии внепеченочного холестаза будут свидетельствовать боль в животе постоянного характера, ригидность мышц брюшной стенки, пальпируемый желчный пузырь, появление желтухи после болевого синдрома, нередко с повышением температуры тела. При обтурационной желтухе общий билирубин представлен в сыворотке крови преимущественно прямой фракцией билирубина с повышением показателей ЩФ, ГГТП.
Алгоритм дифференциальной диагностики синдрома желтухи
В клинической практике чаще всего встречается печеночный или подпеченочный характер желтухи. Примерный алгоритм проведения дифференциальной диагностики у пациента с печеночным характером желтухи представлен на рис. 14-1.
Необходимо собрать сведения - жалобы, анамнез жизни, болезни, эпидемиологический анамнез, провести исследования - клинический анализ крови и мочи, биохимический анализ крови, ИФА крови на HBsAg, анти-HВcor IgM, анти-HCV, анти-HAV IgM, анти-HEV IgM, анти-HDV IgM. Острое начало болезни, наличие симптомов пред-желтушного периода, печеночный характер желтухи, активность АЛТ, АСТ выше 10-20 норм, обнаружение маркеров острой фазы вирусов гепатитов А-Е позволяет диагностировать острый ВГ у большинства пациентов с синдромом желтухи. Следует иметь в виду возможное развитие суперинфекции не только вирусом D больных ХГB, но и вирусом A больных ХГB и ХГC.
Если у пациента с печеночным характером желтухи активность АЛТ, АСТ ниже 10-20 норм, желтуха в сочетании с асцитом, другими симптомами портальной гипертензии, кожными и эндокринными нарушениями, обычно это свидетельствует о хроническом процессе в печени. Обнаружение сывороточных маркеров вирусов В, С и D докажет вирусную этиологию хронической болезни, однако для уточнения стадии болезни потребуется проведение дополнительных методов обследования - УЗИ органов брюшной полости, эзофагогастродуоденоскопии (ЭГДС), эластометрии или пункционной биопсии печени. Определение качественных и количественных характеристик ДНК, РНК вирусов В, С, D необходимо при решении вопроса о начале противовирусной терапии.
При отрицательных результатах исследования на маркеры вирусного поражения у больных с печеночным характером желтухи необходимо исключить гемохроматоз, болезнь Вильсона-Коновалова, первичный билиарный цирроз, первичный склерозирующий холангит, аутоиммунный, алкогольный или лекарственный гепатиты, пигментные гепатозы. Обычно у больных этой патологией активность АЛТ, АСТ ниже 10-20 норм, АСТ часто превышает активность АЛТ. Облегчает постановку диагноза анамнез болезни, жизни (прием гепатотоксических лекарственных препаратов до начала болезни), нередко выявляются одновременное повышение активности ЩФ и ГГТП, различные аутоантитела, маркеры нарушения обмена меди, железа.
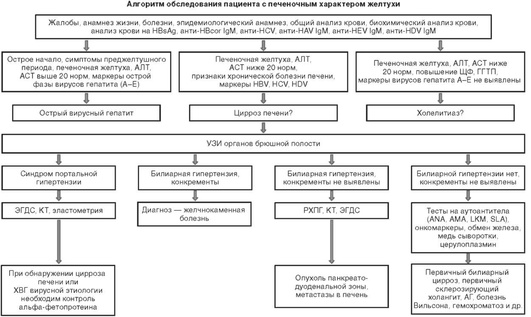
Острое начало болезни с тошноты и рвоты, боли в животе или ригидности мышц брюшной стенки, особенно у лиц зрелого или пожилого возраста, появление желтухи через короткое время после начала болезни могут указывать на подпеченочный, по механизму развития, характер желтухи (обтурация общего желчного протока камнем). В биохимическом анализе крови общий билирубин будет также представлен преимущественно прямой фракцией и будут увеличены параметры ЩФ и ГГТП, но не АЛТ, АСТ. Уточнению диагноза помогут результаты общего анализа крови, отрицательные результаты исследования крови на маркеры вирусов гепатита А-Е и данные инструментальных методов, в первую очередь УЗИ органов брюшной полости.
Надпеченочный характер желтухи (гемолитическая желтуха) может встречаться при сепсисе, лучевой болезни, дефиците глюкозо-6-фосфатдегидрогеназы в эритроцитах, талассемии, переливании несовместимых групп крови, отравлении сульфаниламидами. Желтуха с преимущественным повышением концентрации неконъюгированного билирубина может развиться при длительном голодании, правожелудочковой сердечной недостаточности. Частая разновидность надпеченочной желтухи - «физиологическая желтуха» новорожденных, появляющаяся в первые дни жизни ребенка. Причиной повышения концентрации непрямого билирубина в крови служит не только ускоренный гемолиз, но и недостаточность функции белков и ферментов в печени, ответственных за поглощение, конъюгацию и экскрецию прямого билирубина. Учитывая этот компонент патогенеза желтухи новорожденных, она может быть отнесена и к печеночной желтухе.
Небольшое увеличение неконъюгированного билирубина (превышающее 2-3 нормы) характерно для синдрома Жильбера, наиболее распространенной причины доброкачественных хронических гипербилирубинемий. На основании этого признака часто выставляется ошибочный диагноз хронического гепатита. Механизм развития синдрома до конца неясен. По-видимому, это состояние представляет собой сложное нарушение процесса поглощения печенью билирубина, уровень которого увеличивается при голодании, тяжелой физической нагрузке и других стрессовых ситуациях. Активность глюкуронилтрансферазы при этом синдроме несколько снижена. У многих больных, кроме того, снижена продолжительность жизни эритроцитов. Еще одно врожденное патологическое состояние, при котором повышен уровень неконъюгированного билирубина, называется синдромом Криглера-Найяра. Синдром Криглера-Найяра - редкое наследственное заболевание, обусловлено недостаточностью глюкуронилтрансферазы.
В заключение в данном разделе представлена информация о наиболее часто встречающихся в клинической практике болезнях, сопровождающихся развитием синдрома желтухи.
Глава 11. Синдром поражения желудочно-кишечного тракта при инфекционных болезнях
Симптомы поражения ЖКТ (диспепсия, тошнота, рвота, диарея, боли в животе различной локализации) характерны для многих инфекционных болезней, при острых диарейных (острых кишечных) инфекциях они имеют основное значение для диагностики и оценки тяжести течения болезни.
Диспепсия
В соответствии с современными рекомендациями синдром диспепсии определяют как ощущение боли или дискомфорта (тяжесть, переполнение, раннее насыщение), локализованное в эпигастральной области (табл. 11-1).
Диспепсический синдром характерен для ПТИ, сальмонеллеза, эшерихиоза, гастроинтестинальной формы иерсиниоза, ротавирусного гастроэнтерита и других вирусных диарей, начального периода ботулизма, возможен в преджелтушном периоде ВГ.
Синдром диспепсии при различных органических поражениях и функциональных расстройствах ЖКТ (язвенная болезнь, гастроэзофагеальная рефлюксная болезнь, злокачественные опухоли, желчнокаменная болезнь и хронический панкреатит) обозначается как синдром органической диспепсии. Если при тщательном обследовании больного указанные заболевания не выявлены, правомерно ставить диагноз функциональной (неязвенной) диспепсии (рис. 11-1).
| Симптом | Определение |
|---|---|
Боли, локализованные в эпигастральной области |
Боли субъективно воспринимаются как неприятные ощущения, ощущение повреждения тканей. При расспросе пациента необходимо отличать боль от чувства дискомфорта |
Дискомфорт, локализованный в эпигастральной области |
Неприятное ощущение, которое не интерпретируется пациентом как боль и при более детальной оценке может включать в себя симптомы, указанные ниже |
Раннее насыщение |
Чувство переполнения желудка сразу после начала приема пищи независимо от ее объема, в результате чего прием пищи не может быть завершен |
Переполнение |
Неприятное ощущение задержки пищи в желудке, оно может быть связано или не связано с приемом пищи |
Вздутие в эпигастральной области |
Чувство распирания, его необходимо отличать от видимого вздутия живота |
Тошнота |
Ощущение дурноты и приближающейся рвоты |
Боли в животе - один из основных симптомов острых диарейных инфекций. Локализация и характер их зависят от распространенности воспалительного процесса в кишечнике. Для острого энтерита характерны схваткообразные боли по всему животу. При остром колите боли схваткообразные, локализуются в подвздошных областях. При дистальном колите (проктосигмоидите) пациентов беспокоят боли в левой подвздошной области. При дифференциальной диагностике болевого синдрома наибольшее значение имеют острые хирургические и гинекологические заболевания.
Боли в эпигастральной области возможны при инфаркте миокарда, чаще всего при его локализации в области задней стенки левого желудочка, при пневмонии, особенно нижнедолевой. В отличие от болей в животе другой этиологии при острых диарейных инфекциях боли схваткообразные, отсутствует четкая локальная болезненность.
Рвота может быть однократной, повторной или многократной; скудной или обильной; съеденной пищей, желчью, кровью. Рвота при острых диарейных инфекциях возникает в результате воспалительных изменений слизистой оболочки, увеличения проницаемости мембран клеток из-за действия эндотоксина-ЛПС возбудителя и значительного выделения жидкости в просвет верхних отделов ЖКТ вследствие обратной перистальтики. Большую роль в возникновении рвоты играет синдром интоксикации, характерный для большинства острых диарейных инфекций. Рвоту в связи с интоксикацией часто отмечают в начальном периоде инфекций, не относящихся к группе диарейных (рожа, менингококковая инфекция, тропическая малярия). Рвота может быть симптомом острых хирургических и гинекологических заболеваний, раннего токсикоза беременности, декомпенсации сахарного диабета, абстинентного синдрома у больных алкоголизмом и наркоманией, отравления солями тяжелых металлов, ядовитыми грибами, фосфорорганическими соединениями и суррогатами алкоголя. Учет предшествующей тошноты и непосредственного облегчения после рвоты позволяет отличить гастритический ее генез от церебрального, когда эти два признака отсутствуют. Церебральная рвота характерна для гипертонического криза, менингита, субарахноидального кровоизлияния, острого нарушения мозгового кровообращения.
Диарея
Диарею наблюдают у большинства больных острыми диарейными инфекциями. Чаще всего она становится первой причиной обращения к врачу.
Различают четыре типа диареи, обусловленных различными патогенетическими механизмами: секреторную, гиперэкссудативную, гиперосмолярную, гипер- и гипокинетическую.
Секреторная диарея. Обусловлена усилением секреции натрия и воды в просвет кишки, реже - снижением всасывательной способности кишечника. Секреторная диарея характерна для холеры. Экзотоксин (холероген) проникает через рецепторные зоны в энтероциты и активирует аденилатциклазу, которая способствует усилению синтеза циклического аденозинмонофосфата (цАМФ). Это приводит к повышению секреции энтероцитами электролитов и воды в просвет кишки. Определенную роль отводят простагландинам, стимулирующим синтез цАМФ. Помимо холеры, секреторную диарею наблюдают при сальмонеллезе, эшерихиозе, клебсиеллезе. Она может возникать и при заболеваниях неинфекционной природы: терминальном илеите, постхолецистэктомическом синдроме, поражении поджелудочной железы (так называемая панкреатическая холера), ворсинчатой аденоме прямой кишки. При секреторной диарее осмотическое давление каловых масс ниже осмотического давления плазмы крови. Фекалии у больных водянистые, обильные, иногда зеленого цвета.
Гиперэкссудативная диарея обусловлена выделением слизи и пропотеванием плазмы крови и сывороточных белков в просвет кишки. Этот вид диареи характерен для воспалительных процессов в кишечнике, в том числе для шигеллеза, кампилобактериоза, сальмонеллеза. Гиперэкссудативная диарея возможна и при неинфекционных заболеваниях, в частности при язвенном колите, болезни Крона, лимфоме и карциноме кишечника. Осмотическое давление каловых масс выше такового плазмы крови. Фекалии у больных жидкие, с примесью слизи, крови и гноя.
Гиперосмолярная диарея возможна при некоторых острых диарейных инфекциях из-за нарушения всасывания в тонкой кишке.
Гиперосмолярную диарею наблюдают при синдроме мальабсорбции, нарушении всасывания в тонкой кишке одного или нескольких питательных веществ и нарушении обменных процессов. Основой развития синдрома мальабсорбции считают не только морфологические изменения слизистой оболочки, но и функциональные нарушения ферментных систем, моторики и транспортных механизмов, а также развивающийся дисбиоз. Мальабсорбция - патогенетическая основа развития диареи при ротавирусном гастроэнтерите. Гиперосмолярная диарея возможна при злоупотреблении солевыми слабительными. Осмотическое давление каловых масс выше такового плазмы крови. Фекалии у больных обильные, жидкие, с примесью полупереваренной пищи.
Гипер- и гипокинетическая диарея возникает при нарушениях транзита кишечного содержимого, обусловленных усилением или ослаблением моторики кишки. Ее часто наблюдают у больных с синдромом раздраженного кишечника, при неврозах и злоупотреблении слабительными и антацидами. Осмотическое давление каловых масс соответствует таковому плазмы крови. Фекалии у больных жидкие или кашицеобразные, необильные.
Обезвоживание (дегидратация) - важнейший синдром, развивающийся вследствие поражения ЖКТ при острых диарейных инфекциях, обусловленный потерей организмом жидкости и солей при рвоте и диарее. Обезвоживание различной степени возникает при большинстве ОКИ. У взрослых развивается изотонический тип обезвоживания. Происходит транссудация бедной белком изотонической жидкости, которая не может реабсорбироваться в толстой кишке. Нарастает гемоконцентрация. Происходит потеря не только воды, но и электролитов Na+, К+, Cl-. Синдром обезвоживания при острых диарейных инфекциях часто приводит к метаболическому ацидозу. При преобладании рвоты возможен метаболический алкалоз в связи с потерей кислого содержимого желудка.
Согласно классификации В.И. Покровского, различают четыре степени обезвоживания: при I степени потеря массы тела не превышает 3%, при II степени - 4-6%, при III степени - 7-9%, при IV степени - 10% и более (табл. 11-2). При выраженном обезвоживании развивается гиповолемический шок. II степень обезвоживания соответствует I фазе шока (компенсированный), III степень - II фазе шока (субкомпенсированный), IV степень - III фазе шока (декомпенсированный).
Показатели |
Степень дегидратации |
|||
|---|---|---|---|---|
I |
II |
III |
IV |
|
Потери жидкости относительно массы тела |
До 3% |
4-6% |
7-9% |
10% и более |
Рвота |
До 5 раз |
До 10 раз |
До 20 раз |
Многократная, без счета |
Жидкий стул |
До 10 раз |
До 20 раз |
Многократно |
Без счета |
Жажда, сухость слизистой оболочки полости рта |
Умеренно выражены |
Значительно выражены |
Значительно выражены |
Резко выражены |
Цианоз |
Отсутствует |
Бледность кожи, цианоз носогубного треугольника |
Акроцианоз |
Диффузный цианоз |
Эластичность кожи и тургор подкожной клетчатки |
Не изменены |
Снижены у пожилых |
Резко снижены |
Резко снижены |
Изменение голоса |
Отсутствует |
Ослаблен |
Осиплость голоса |
Афония |
Судороги |
Отсутствуют |
Икроножных мышц, кратковременные |
Продолжительные и болезненные |
Генерализованные клонические; выше 120» |
Пульс |
Не изменен |
До 100 в минуту |
До 120 в минуту |
Нитевидный или не определяется |
Систолическое АД |
Не изменено |
До 100 мм рт.ст. |
До 80 мм рт.ст. |
Менее 80 мм рт.ст., в части случаев не определяется |
Индекс гематокрита |
0,40-0,46 |
0,46-0,50 |
0,50-0,55 |
Более 0,55 |
pH крови |
7,36-7,40 |
7,36-7,40 |
7,30-7,36 |
Менее 7,30 |
Дефицит оснований в крови |
Отсутствует |
2-5 ммоль/л |
5-10 ммоль/л |
Более 10 ммоль/л |
Состояние гемостаза |
Не изменено |
Не изменено |
Легкая гипокоагуляция |
Усиление I и II фазы свертывания и повышение фибринолиза, тромбоцитопения |
Нарушение обмена электролитов |
Отсутствует |
Гипокалиемия |
Гипокалиемия и гипонатриемия |
Гипонатриемия и гипокалиемия |
Диурез |
Не изменен |
Олигурия |
Олигоанурия |
Анурия |
Лечение поражений желудочно-кишечного тракта при диарейных инфекциях
Основу лечения острых инфекций, сопровождающихся обезвоживанием, составляет регидратационная терапия. Ее проводят в целях восстановления водно-электролитного и кислотно-основного состояния организма.
Регидратацию осуществляют полиионными кристаллоидными растворами [квартасольρ, калия хлорид + натрия гидрокарбонат + натрия хлорид (Трисоль♠), калия хлорид + натрия ацетат + натрия хлорид (Хлосоль♠), калия хлорид + натрия ацетат + натрия хлорид (Ацесоль♠)]. Коллоидные растворы [калия хлорид + кальция хлорид + магния хлорид + натрия гидрокарбонат + натрия хлорид + повидон-12,6 тыс. (Гемодез♠), декстран [ср. мол. масса 35 000-45 000] (Реополиглюкин♠)] можно использовать в целях дезинтоксикации лишь при отсутствии обезвоживания. У большинства больных с I-II степенями обезвоживания используют растворы оральных регидратационных солей: декстроза + калия хлорид + натрия хлорид + натрия цитрат (Цитраглюкосолан♠¤), глюкосоланρ, декстроза + калия хлорид + натрия хлорид + натрия цитрат (Регидрон♠).
Регидратационная терапия - основа лечения острых инфекций, сопровождающихся синдромом обезвоживания.
Регидратационную терапию (внутривенную и пероральную) осуществляют в два этапа.
Помимо регидратации, применяют следующие группы препаратов для коррекции желудочно-кишечных нарушений при инфекционных болезнях.
-
Сорбенты - в целях уменьшения интоксикации [лигнин гидролизный (Полифепан♠) по 1 ст. ложке 3-4 раза в день, кремния диоксид коллоидный (Полисорб МП♠), карболонгρ и др.], полиметилсилоксана полигидрат (Энтеросгель♠ сорболонгρ) 30-40 г 3 раза в день.
-
Эубиотики [Линекс♠ по 2 капсулы 3 раза в день, бифидобактерии бифидум (Пробифор♠) 3 капсулы 2 р/сут, бифидобактерии бифидум (Бифидумбактерин форте♠), лактобактерии ацидофильные + грибки кефирные (Аципол♠), Биоспорин♠ и др.].
-
Ферментные препараты - оразаρ, сычужные ферменты (Або-мин♠), панкреатин и др. - по 1 таблетке (драже) 3 раза в день во время еды.
-
Метоклопрамид - блокатор дофаминовых рецепторов - в целях уменьшения рвоты и диспепсических нарушений применяют по 10 мг 1-3 раза в день внутримышечно 1-2 дня.
-
Спазмолитики при болевом синдроме: дротаверин по 0,04 г 3 р/сут внутрь или 1 мл 2% раствора внутримышечно 1-2 р/сут; папаверин; препараты красавки [белладонны листьев экстракт + бензокаин (Белластезин♠), белладонны листьев экстракт + фенилсалицилат (Бесалол♠)].
-
Индометацин - ингибитор биосинтеза простагландинов, способствующий купированию секреторной диареи. Назначают по 50 мг 3 раза с интервалом в 3 ч в течение 1 или 2 сут.
-
Октреотид - ингибитор синтеза активных секреторных агентов, способствующий снижению секреции и моторной активности. Выпускается в ампулах по 0,05, 0,1 и 0,5 мг. Вводят подкожно 1-2 р/сут.
-
Препараты кальция, активирующие фосфодиэстеразу, которая препятствует образованию цАМФ. Рекомендуют применение 0,5 г кальция глюконата per os 2 раза с интервалом в l2 ч.
-
Кишечные антисептики, эффективные в отношении широкого спектра грамположительных и грамотрицательных бактерий, дизентерийных амеб и грибов рода Candida:
-
Антибиотики используют для лечения холеры, шигеллезов, иерсиниозов и кампилобактериозов.
Глава 12. Гепатолиенальный синдром
Гепатолиенальный синдром - сочетанное увеличение селезенки и печени, обусловленное как защитной реакций на микробную агрессию, так и специфическим совместным поражением этих органов. Сочетанная реакция печени и селезенки обусловлена их анатомо-физиологической общностью, в частности участием в системной воспалительной реакции, неспецифических защитных реакциях, формировании специфического иммунитета.
Клиническая характеристика
При легкой степени выраженности гепатолиенального синдрома печень выступает из-под края реберной дуги на 1-2 см, селезенка пальпируется в подреберье или ее увеличение определяют перкуторно. При умеренной степени гепатолиенального синдрома печень выступает из-под края реберной дуги на 2-4 см, селезенка пальпируется у реберного края или выступает из-под него на 1-2 см. Резко выраженный гепатолиенальный синдром характеризуется увеличением печени более чем на 4 см, селезенки - более 2 см ниже реберного края. Мягкая консистенция органов характерна для острых инфекций, плотноватая - для острых и подострых инфекций, обычно протекающих с выраженной лихорадкой или органными поражениями (ВГ, малярия). Плотная консистенция печени и селезенки свойственна хроническим инфекциям (гепатитам, рецидивирующей или нелеченой малярии, бруцеллезу). Каменистая плотность органов, особенно печени, характерна для паразитарных (эхинококкоз) или опухолевых поражений [гепатоцеллюлярная карцинома (ГЦК)]. Чаще печень и селезенка безболезненны или чувствительны при пальпации, более выраженная болезненность наблюдается при значительном и быстром увеличении органов, например при гемолизе. Резкая болезненность может указывать на местный нагноительный процесс (абсцесс печени при амебиазе, абсцесс селезенки при сепсисе). При инфекционных болезнях, сопровождающихся значительной спленомегалией (ИМ), следует соблюдать осторожность при осмотре и транспортировке больного в связи с опасностью разрыва селезенки.
Гепатолиенальный синдром при многих распространенных инфекционных болезнях (табл. 12-1) имеет важное диагностическое значение (малярия, ИМ, бруцеллез, брюшной тиф и паратифы А и В, сыпной тиф и другие риккетсиозы, сепсис). Гепатолиенальный синдром позволяет полностью исключить грипп и другие ОРВИ, кроме аденовирусной инфекции, холеру, дизентерию и ряд других заболеваний.
| Регистрация гепатолиенального синдрома | Нозологические формы |
|---|---|
Постоянно встречается |
Висцеральный лейшманиоз, ИМ, клещевой возвратный боррелиоз, малярия, эпидемический возвратный тиф |
Часто встречается, характерен |
Бруцеллез, брюшной тиф, ВИЧ-инфекция, мононуклеозоподобный синдром, ВГB, ВГB с дельта-антигеном, острый вирусный гепатит С (ОВГC), хронические ВГ, лептоспироз, листериоз (септическая форма), описторхоз (острая фаза), паратифы А, В, риккетсиозы, сепсис, сыпной тиф, трипаносомозы; фасциолез (острая фаза), ЦМВИ врожденная; чума (септическая форма) |
Возможен |
Аденовирусная инфекция, ВГA и ВГЕ, гистоплазмоз хронический диссеминированный; доброкачественный лимфоретикулез, иерсиниоз генерализованный, корь, краснуха, Ку-лихорадка; лихорадка Марбург, орнитоз, псевдотуберкулез генерализованный, сальмонеллез генерализованный, токсоплазмоз острый приобретенный, трихинеллез, ЦМВИ приобретенная, шистостомозы (острый период) |
Редко, не характерен |
Ветряная оспа, ГЛПС, ВГC острый, герпес простой генерализованный, желтая лихорадка, КГЛ, геморрагическая лихорадка денге (ГЛД), лихорадка Ласса, лихорадка паппатачи, лихорадка Эбола, микоплазмоз легочный, натуральная оспа, омская геморрагическая лихорадка (ОГЛ), опоясывающий лишай, ПТИ, стронгилоидоз, энтеровирусная инфекция |
Не встречается |
Амебиаз, анкилостомидоз, аскаридоз, балантидиаз, бешенство, ботулизм, грипп, дизентерия, иксодовый клещевой боррелиоз, кампилобактериоз, кандидоз, клещевой энцефалит, кожный лейшманиоз, кокцидиоидоз, коронавирусная инфекция, лимфоцитарный хориоменингит, ЛЗН, парагрипп, эпидемический паротит, полиомиелит, прионные болезни, реовирусная инфекция, респираторно-синцитиальная инфекция, ротавирусная инфекция, столбняк, токсокароз, трихоцефалез, филяриатозы, холера, цестодозы, эшерихиоз, японский энцефалит |
Помимо метода перкуссии и пальпации, увеличение печени и селезенки диагностируют с помощью УЗИ, КТ, МРТ. При метеоризме селезенка оттесняется в подреберье и может быть недоступна пальпации. При сепсисе, сыпном тифе селезенка мягкая, плохо определяется пальпаторно и слабоэхогенна. При наличии свободного газа в брюшной полости (перфорация полого органа) затруднительно определение границ печени. КТ используют для детального исследования структуры органов в плане дифференциальной диагностики.
Глава 13. Поражение почек при инфекционных болезнях
Патогенез
В основе патогенеза поражения почек при инфекционных болезнях лежит интоксикация и, как следствие ее, снижение или резкое падение АД (коллапс, шок), нарушения микроциркуляции, а также водно-электролитные и метаболические нарушения. В результате действия бактериальных токсинов происходит активизация лимфоцитов, моноцитов, освобождение цитокинов, способствующие повышенному образованию тромбоксана, лейкотриенов, что приводит к ишемии коркового слоя и эпителия канальцев почек. Патогенетической основой патологии почек при вирусных инфекциях является прямое действие возбудителя болезни с непосредственным повреждением клубочковых и канальцевых структур и опосредованное формированием иммунных комплексов в результате развития иммунопатологических реакций.
Этиологический фактор
Развитие инфекционного процесса в почечной ткани с вовлечением различных структур почек могут вызвать многие виды микроорганизмов (табл. 13-1, 13-2).
| Инфекционные агенты | Возбудители инфекционных болезней |
|---|---|
Вирусы |
Возбудители ГЛ (ГЛПС, КГЛ, ОГЛ, БКЛ, желтой лихорадки, лихорадки денге, Эбола, Марбург, Ласса), вирус ЛЗН, ВПГ, ЭБВ, цитомегаловирус, вирус кори, краснухи, HBV, HCV, ВИЧ |
Бактерии |
Стрептококк, пневмококк, коринебактерия дифтерии, бруцелла, лептоспира, иерсиния, микобактерия туберкулеза, токсоплазма, трепонема |
Другие |
Шистосомы |
Примечание. ГЛ - геморрагические лихорадки; ГЛПС - геморрагическая лихорадка с почечным синдромом; КГЛ - крымская геморрагическая лихорадка; ОГЛ - омская геморрагическая лихорадка; БКЛ - болезнь Кьясанурского леса; ВИЧ - вирус иммунодефицита человека.
| Название болезни | Варианты гломерулопатий (морфологические формы) |
|---|---|
Стрептококковая ангина. |
Диффузный пролиферативный |
Скарлатина. |
гломерулонефрит. |
Острый и подострый инфекционный |
Мезангиопролиферативный |
эндокардит. |
гломерулонефрит |
Брюшной тиф. |
|
Проказа. |
|
Токсоплазмоз. Тропическая малярия. |
|
Ветряная оспа. Эпидемический паротит. |
|
Корь. Энтеровирусная инфекция, |
|
вызванная вирусами Коксаки и ЕСНО. |
|
ИМ. |
|
ВИЧ-инфекция. |
|
Гепатиты В и С. |
|
Сифилис |
|
Подострый инфекционный эндокардит. |
Мезангиокапиллярный |
Гепатиты В и С. |
(мембранопролиферативный) |
Тропическая малярия. |
гломерулонефрит |
Шистосомоз |
|
Гепатиты В и С. |
Мембранозная нефропатия |
Тропическая малярия. |
|
Филяриоз. Эхинококкоз. Шистосомоз. |
|
Проказа. |
|
Сифилис. |
|
Энтерококковый эндокардит |
|
ВИЧ-инфекция. |
Фокально-сегментарный |
Шистосомоз |
гломерулосклероз |
При анализе характера поражения почек при инфекции важно понимать, является ли патология почек проявлением основного заболевания; его осложнением, возможным, но не обязательным для основной патологии; обострением нефроурологической патологии, спровоцированным непочечным заболеванием. Так, поражение почек при инфекционных болезнях может быть представлено как основной и ведущий синдром болезни (ГЛПС, лептоспироз), как возможное проявление (дифтерия, бруцеллез, малярия, генерализованная форма иерсиниозной инфекции, ВГ) и как редкое вовлечение в патологический процесс (ОРВИ, ветряная оспа, корь и др.).
При инфекционных болезнях выделяют функциональные нарушения почек интоксикационного генеза, наблюдаемые в острой стадии ряда инфекционных болезней; первичное поражение почек вирусной и бактериальной природы (ГЛПС, ВИЧ-инфекция, скарлатина, лептоспироз); вторичное поражение почек при основном патологическом процессе в печени (ВГ и вирусные циррозы печени); ОПН при ИТШ (менингококковая инфекция, сальмонеллез, сепсис, желтая лихорадка) и при гиповолемическом шоке (холера).
Диагностика
Диагностика поражений почек при инфекционных болезнях базируется на клинических симптомах (боль в пояснице, отеки, олигоанурия, полиурия, дизурические явления), на изменениях в клиническом анализе мочи (протеинурия, эритроцитурия, лейкоцитурия, цилиндрурия и др.) и биохимическом анализе крови (гиперкреатининемия, гиперазотемия, гиперкалиемия). При изменении этих показателей используют методы Нечипоренко, Каковского-Аддиса, пробу Зимницкого. Оценка результатов исследований учитывается в комплексе с имеющимися клинико-эпидемиологическими данными. Критериями отличия ряда хронических неинфекционных болезней (сахарный и несахарный диабет, синдром Шегрена, миеломная болезнь и др.), протекающих с поражением почек, от инфекционных является длительность течения, отсутствие лихорадки и общей интоксикации. Неинфекционные заболевания (дерматомиозит, системная красная волчанка), протекающие с лихорадкой, отличаются от инфекционных длительностью течения. Клинический анализ мочи имеет существенное значение для дифференциальной диагностики ряда инфекционных болезней. При ГЛ, лептоспирозе наблюдаются изменения в анализе мочи, характерные для ТИН (полиурия, снижение относительной плотности, протеинурия, микрогематурия, лейкоцитурия), при сепсисе - изменения, характерные для пиелонефрита (щелочная реакция мочи, лейкоцитурия, бактериурия). Микробиологическое исследование мочи позволяет выделить возбудителей инфекционных болезней (брюшной тиф, иерсиниозы, лептоспироз и др.). Существенную помощь в дифференциальной диагностике оказывают УЗИ почек, КТ, радиоизотопное и ангиографическое исследования.
Лечение
Проведение этиотропной (антибактериальной, антивирусной) терапии инфекционного заболевания уменьшает риск развития и прогрессирования повреждения почек. При почечной патологии лечение инфекционного заболевания сочетают с патогенетической терапией проявлений поражения почек (острого повреждения почек, отеков, нефротического синдрома, мочевого синдрома, артериальной гипертензии), в тяжелых случаях ОПН при ГЛПС, лептоспирозе, дегидратационном и ИТШ используют методы экстракорпоральной детоксикации с учетом возможной нестабильной гемодинамики, нарушений в системе гемостаза, повышенной травматичности форменных элементов крови.
Глава 14. Поражение центральной нервной системы при инфекционных болезнях
Поражение ЦНС при инфекционных болезнях имеет большое значение, часто определяет тяжесть течения и исход болезни. Поражение ЦНС при нейроинфекциях обусловлено непосредственным поражением возбудителем различных отделов ЦНС (бактериальные менингиты и менингоэнцефалиты, вирусные менингиты, менингоэнцефалиты, энцефалиты и миелиты, прионные болезни ЦНС). При ряде инфекционных болезней имеются полиорганные поражения, вследствие этого они не относятся к нейроинфекциям, но поражение ЦНС, обусловленное возбудителем, играет важную роль в их патогенезе и клинической картине (сыпной тиф и другие риккетсиозы, лептоспироз и другие спирохетозы, генерализованные формы чумы и сибирской язвы). При столбняке поражение ЦНС обусловлено специфическим действием основного токсина возбудителя - тетаноспазмина. При многих инфекционных болезнях причиной поражения ЦНС являются тяжелые органные поражения: поражения легких, сердца, приводящие к гипоксии мозга, поражения печени и почек, при которых в организме накапливаются нейротоксические продукты метаболизма. Развитие токсической энцефалопатии характерно для многих бактериальных, вирусных и протозойных инфекций. В основе токсической энцефалопатии лежит поражение сосудов оболочек и вещества головного мозга, проявляющееся расстройством микроциркуляции, диапедезными кровоизлияниями, повышением проницаемости ГЭБ, приводящим к развитию ОНГМ и ГЛБ с развитием ликворной гипертензии. Основные инфекционные болезни, которые сопровождаются менингеальным синдромом, и их дифференциальная диагностика представлены в табл. 14-1, 14-2.
Однако, несмотря на все многообразие поражений ЦНС при инфекционных болезнях, следует подчеркнуть, что клиническая картина поражения ЦНС в первую очередь определяется не характером патологии (воспаление, нарушение кровообращения, объемные образования), а его локализацией. Именно поэтому выделяют основные синдромы поражения ЦНС (менингеальный, общемозговой, очаговые синдромы и симптомы). Для установления характера поражения ЦНС используется комплекс лабораторных и инструментальных методов (СМЖ, МРТ, КТ, ЭЭГ) исследования.
| Нозоформа | Частоты менингеального синдрома | Выраженность менингеального синдрома | Примечание |
|---|---|---|---|
Бактериальные гнойные менингиты (БГМ) (менингококковый, пневмококковый, гемофильный) |
Постоянно |
Резко |
Развивается остро |
Серозные бактериальные менингиты |
Постоянно |
Умеренно, резко |
Развивается подостро, реже остро |
Вторичные септические менингиты |
Часто |
Умеренно, слабо |
Доминирует очаговая симптоматика |
Серозные вирусные менингиты, менингоэнцефалиты |
Непостоянно |
Слабо, умеренно |
Могут исчезать и рецидивировать |
Грибковые менинго-энцефалиты |
Непостоянно |
Слабо, умеренно |
Плеоцитоз в СМЖ может отсутствовать. Развиваются на фоне иммуно дефицитов |
Инфекции с нейротоксикозом |
Редко |
Слабо, умеренно |
Менингизм, так как в СМЖ воспалительные изменения отсутствуют |
Невоспалительные поражения ЦНС (инфаркт мозга, отравление психотропными препаратами, комы - печеночная, диабетическая) |
Редко |
Слабо |
Воспалительные изменения в СМЖ отсутствуют |
Субарахноидальные кровоизлияния |
Постоянно |
Резко, умеренно |
В СМЖ - кровь, эритроциты. Возможен плеоцитоз |
| Нозо-форма | Распространение | Сезонность | Возраст | Симптомы, предшествующие менингеальным | Выраженность менингеального синдрома |
|---|---|---|---|---|---|
Менинго-кокковый менингит |
Убикватное, спорадическое, эпидемическое |
Зимне-весенняя |
70% дети |
Назофарингит, лихорадка, геморрагическая сыпь |
Резко |
Пневмококковый менингит |
Убикватное, спорадическое, при вакцинации резко снижается |
Зимне-весенняя |
Дети и лица старше 60 лет |
Ринит, отит, синусит, пневмония, эндокардит, септицемия |
Резко |
Гемофильный менингит (HIb) |
Убикватное, спорадическое, при вакцинации резко снижается |
Осенне-весенняя |
Дети до 5 лет |
Ринофарингит |
Резко или умеренно |
Стафилококко вый менингит |
Убикватное |
- |
Любой |
Эндокардит, сеп сис, другие гнойные процессы |
Умеренно, слабо |
Другие бактериальные менингиты |
Убикватное, спорадическое |
- |
Любой |
Гнойно-септические процессы |
Умеренно |
Туберкулезный менингит |
Убикватное, спорадическое |
- |
Любой |
Активные формы туберкулеза: могут отсутствовать |
Умеренно, резко |
Вирусные нейроинфекции |
При трансмиссивной передаче вумеренном и жарком климате, спорадическое, эпидемическое |
В умеренном климате в теплое время года |
Зависит от нозоформы |
Лихорадка; катаральный, диспепсический синдромы, первичный аффект |
Умеренно, слабо, при части нозоформ - общемозговой синдром, очаговая симптоматика |
Менингизм |
Убикватное |
- |
Любой |
Высокая лихорадка, выраженная интоксикация, возможен катарально-респираторный синдром |
Умеренно, слабо |
Характеристики СМЖ |
|||||||
внешний вид |
плеоцитоз |
клеточный состав |
белок |
глюкоза |
лактат |
специальные лабораторные тесты |
люмбальное давление (ЛД) |
Мутная, белая |
2-3-значный → 4-5-значный |
Нейтрофильный |
Повышен или норма |
В первые часы - N → повышение → прогрессирую щее снижение |
Резко повы шен с первых часов |
Бактериоскопия, посев, реакция латекс-агглютинации (РЛА), ПЦР |
Резко повы шено |
Мутная, желтая |
2-4-значный |
Нейтрофильный |
Повышен или резко повышен |
Снижена |
Резко повышен |
Бактериоскопия, посев, РЛА, ПЦР |
Повышено |
Мутная |
3-4-значный |
Нейтрофильный |
Повышен или норма |
Снижена |
Резко повышен |
Бактериоскопия, посев, РЛА, ПЦР |
Повышено |
Опалесцирующая, мутная |
2-4-значный |
Нейтрофильный, смешанный |
Умеренно повышен |
Умеренно снижена |
Умеренно повы шен |
Бактериоскопия, посев, ПЦР |
Слабо повы шено |
Мутная, опалесцирующая |
3-4-значный |
Нейтрофильный, смешанный |
Повышен |
Снижена |
Повышен |
Бактериоскопия, посев, ПЦР |
Повышено |
Опалесцирующая |
2-3-значный |
Нейтрофильный → лимфоцитарный |
Повышен |
Прогрессивно снижается |
Повышен |
Бактериологические, ИФА, ПЦР |
Резко повышено |
Прозрачная, опалесцирующая |
2-3-значный, может отсутствовать |
Нейтрофильный → лимфоцитарный |
Повышен или норма |
Норма или повышена |
Норма |
Вирусологические, ПЦР, ИФА, другие иммунологические тесты |
Умеренно, слабо повышено |
Прозрачная |
Отсутствует |
Лимфоцитарный |
Норма |
Норма или повышена |
Норма |
Все бактериологические, вирусологические, иммунологические, ПЦР методы - отрицательны |
Умеренно, слабо повышено |
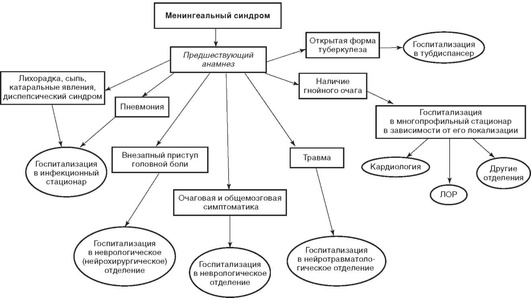
Менингеальный синдром - симптомокомплекс, характеризующий поражение оболочек головного и спинного мозга. Включает в себя головную боль интенсивную, диффузную, распирающего или пульсирующего характера, как правило, сопровождающуюся тошнотой, часто рвотой, возникающей внезапно «фонтаном», не приносящей облегчения больному. Многократная рвота (чаще у детей) может приводить к обезвоживанию, что нужно учитывать при лечении больных; гиперпатия - повышение всех видов чувствительности. Звуковые, зрительные раздражители, перемена положения тела вызывают усиление головной боли, иногда рвоту. Особенно характерна гиперестезия кожи, в частности в области передней брюшной стенки, которая может имитировать картину «острого живота».
Наиболее важными диагностическими менингеальными симптомами являются нижеприведенные.
-
Менингеальная поза - на боку с запрокинутой головой, прижатыми к туловищу ногами и руками («поза легавой собаки»), характерна для относительно поздних сроков развития менингита (3-5-й дни болезни) - воспаления оболочек головного мозга. Другие менингеальные симптомы выявляются в положении больного на спине на ровной поверхности.
-
Ригидность мышц затылка - невозможность при сгибании головы достать подбородком (при закрытом рте) до грудины. Выраженность ригидности мышц затылка может быть слабой (подбородок не достает до грудины на 1-4 см), умеренной (подбородок не достает до грудины более чем на 4 см), выраженной (голова не сгибается вперед от вертикальной линии), резко выраженной (голова запрокинута назад). Проверка ригидности затылочных мышц не сопровождается болевыми ощущениями. Появление боли свидетельствует о вовлечении в процесс затылочных (симптом Нери) и верхнешейных корешков. Пальпация корешковых точек резко болезненна.
-
При проверке ригидности затылочных мышц следует обращать внимание на рефлекторное сгибание ног в коленных и тазобедренных суставах - верхний симптом Брудзинского.
-
Средний симптом Брудзинского выявляется путем надавливания ребром ладони на надлобковую область. При положительном симптоме ноги сгибаются в коленных и тазобедренных суставах.
-
Симптом Кернига проверяется путем сгибания ноги в коленном и тазобедренном суставах под прямым углом и затем разгибания ноги в коленном суставе. При положительном симптоме ногу полностью разогнуть не удается. При появлении болей по задней поверхности бедра проверяют корешковый симптом Ласега - прямую ногу сгибают в тазобедренном суставе. При этом появляется резкая боль по задней поверхности ноги, точка корешка седалищного нерва резко болезненна.
-
У детей наиболее демонстративен симптом посадки (треножника, «горшка»). Если ребенка посадить на горизонтальную поверхность, он откидывается назад и опирается на руки или сгибает ноги в коленных суставах. При посадке на горшок откидывается назад и падает с горшка. У детей до 1 года главными менингеальными симптомами являются: выбухание и прекращение пульсации большого родничка и симптом подвешивания (Лесажа): ребенок, поднятый за подмышки, прижимает ноги к животу, и выпрямить их не удается. Существует более десяти второстепенных менингеальных симптомов, которые, как правило, бывают положительными только при наличии основных перечисленных симптомов. В основе патогенеза менингеального синдрома лежат различные патологические процессы: быстрое повышение давления СМЖ в результате ее гиперпродукции при менингитах, увеличение давления СМЖ при кровоизлияниях в оболочки мозга различного генеза, расстройства микроциркуляции в оболочках мозга. Поражение оболочек мозга приводит к повышению тонуса мышц затылка, спины, сгибателей бедра. Если выявленные менингеальные симптомы обусловлены воспалительным процессом, они обозначаются термином «менингеальный синдром», при отсутствии воспаления употребляется термин менингизм. При наличии всех менингеальных симптомов используется термин «полный менингеальный синдром». При отсутствии части симптомов - «неполный менингеальный синдром».
Общемозговой синдром обусловлен поражением вещества головного мозга различного генеза:
-
энцефалит, менингоэнцефалит, сопровождающиеся ОНГМ, бактериальной, вирусной и другой этиологии;
-
тяжелая гипоксия мозга при шоке (ИТШ, геморрагический, дегидратационный, анафилактический шок); при ДН: круп, РДС, пневмония, полинейропатия, миелит;
-
токсическая энцефалопатия (бактериальные токсины, аутотоксины, отравления нейротропными ядами).
Клиническая характеристика:
Очаговые синдромы. Для нейроинфекций характерны рефлекторно-двигательные нарушения, развивающиеся на фоне ЛИС, редко - нарушение кожной и глубокой чувствительности.
Наблюдаются: парезы и параличи черепных нервов, реже - мышц конечностей, тазовые расстройства, пирамидные знаки, нарушения сухожильных рефлексов (повышение, снижение, анизорефлексия), нарушение слуха (нейросенсорная тугоухость, атаксия).
Очаговая симптоматика зависит от локализации поражения, например при герпетическом энцефалите - лобно-теменные доли, при клещевом энцефалите - двигательные центры головного мозга, при полиомиелите - передние рога спинного мозга и т.д.
Глава 15. Поражение периферической нервной системы при инфекционных болезнях*
* Материалы доступны в электронном виде по ссылке, указанной на 2-м форзаце
Раздел IV. Клинические рекомендации по заболеваниям
Глава 16. Бактериальные инфекции
Сальмонеллезы
Сальмонеллезы - группа инфекционных болезней человека и животных, возбудители которых - бактерии семейства Enterobacteriaceae, рода Salmonella, представленного двумя видами - S. enterica и S. bongori, среди которых выделяют семь подвидов.
Сальмонеллы имеют три основных антигена:
Кроме того, у некоторых серотипов сальмонелл описаны и другие антигены:
Сальмонеллы - грамотрицательные палочки 2-4 × 0,5 мкм; они подвижны, хорошо растут на простых питательных средах при температуре от 6 до 46 °С (оптимум роста 37 °С). Большинство сальмонелл патогенны как для человека, так и для животных и птиц, но в эпидемиологическом отношении наиболее значимы для человека лишь несколько серотипов, которые вызывают 85-91% сальмонеллезов человека на всех континентах мира: S. typhimurium, S. enteritidis, S. раnаmа, S. infantis, S. newport, S. agona, S. derby, S. london.
В настоящее время сальмонеллезы принадлежат к числу наиболее распространенных зоонозов в развитых странах с повсеместной тенденцией к росту заболеваемости. Особенно это касается крупных городов с централизованной системой продовольственного снабжения.
Вспышки сальмонеллеза, обусловленные антибиотикоустойчивыми штаммами сальмонелл и характеризующиеся высокой летальностью, регулярно регистрируют в лечебных учреждениях, особенно в родильных, педиатрических, психиатрических и гериатрических отделениях. Этот вид сальмонеллеза приобрел черты госпитальной инфекции с контактно-бытовым путем передачи возбудителя.
Основные факторы патогенности сальмонелл - холероподобный энтеротоксин и ЛПС-эндотоксин. Некоторые штаммы обладают способностью к инвазии в эпителий толстой кишки (S. enteritidis).
Клинические проявления болезни, вызванной различными серотипами сальмонелл, существенно не отличаются друг от друга, поэтому в настоящее время в диагнозе указывают лишь клиническую форму болезни и серотип выделенной сальмонеллы, что имеет эпидемиологическое значение.
Брюшной тиф и паратифы A, B и C рассматривают отдельно от других сальмонеллезов ввиду наличия клинических особенностей течения.
Брюшной тиф
Брюшной тиф - острая антропонозная инфекционная болезнь с фекально-оральным механизмом передачи, характеризующаяся циклическим течением, интоксикацией, бактериемией и язвенным поражением лимфатического аппарата тонкой кишки.
Код по МКБ-10
Этиология
Возбудитель - Salmonella typhi, принадлежит к роду Salmonella, серологической группе D, семейству кишечных бактерий Enterobacteriaceae.
S. typhi имеет форму палочки с закругленными концами, спор и капсул не образует, подвижна, грамотрицательна, лучше растет на питательных средах, содержащих желчь. При ее разрушении происходит освобождение эндотоксина. Антигенная структура S. typhi представлена О-, Н- и Vi-антигенами, определяющими выработку соответствующих агглютининов.
S. typhi относительно хорошо сохраняется при низких температурах, чувствительна к нагреванию: при 56 °С погибает в течение 45-60 мин, при 60 °С - через 30 мин, при кипячении - за несколько секунд (при 100 °С почти мгновенно). Благоприятная среда для бактерий - пищевые продукты (молоко, сметана, творог, мясной фарш, студень), в которых способны к размножению.
Эпидемиология
Источник инфекции - только человек - больной или бактериовыделитель, из организма которого возбудители брюшного тифа выделяются во внешнюю среду, в основном с испражнениями, реже - с мочой. С испражнениями возбудитель выделяется с первых дней болезни, но массивное выделение начинается после 7-го дня, достигает максимума в разгар болезни и уменьшается в период реконвалесценции. Бактериовыделение в большинстве случаев продолжается не более 3 мес (острое бактериовыделение), но у 3-5% формируется хроническое кишечное или реже - мочевое бактериовыделение. Наиболее опасны в эпидемиологическом отношении мочевые носители в связи с массивностью бактериовыделения.
Фекально-оральный механизм передачи возбудителя осуществляется водным, пищевым и контактно-бытовым путями. Водные эпидемии нарастают бурно, но быстро завершаются, когда прекращают пользоваться зараженным источником воды. Если эпидемии связаны с употреблением воды из загрязненного колодца, заболевания носят обычно очаговый характер. Спорадические заболевания в настоящее время нередко обусловлены употреблением воды из открытых водоемов и технической воды, используемой на различных промышленных предприятиях. Возможны вспышки, связанные с употреблением пищевых продуктов, в которых брюшнотифозные бактерии могут длительно сохраняться и размножаться (молоко). Заражение может происходить также контактно-бытовым путем, при котором факторами передачи становятся окружающие предметы. Восприимчивость к брюшному тифу значительная. Индекс контагиозности составляет 0,4. Наиболее часто заболевают люди в возрасте от 15 до 40 лет.
После перенесенного заболевания вырабатывается стойкий, обычно пожизненный иммунитет, однако в последние годы в связи с антибиотикотерапией увеличилась частота повторных заболеваний брюшным тифом.
Для брюшного тифа при эпидемическом распространении характерна летне-осенняя сезонность.
Меры профилактики
Специфические
По эпидемиологическим показаниям (заболеваемость выше 25 на 100 тыс. населения, выезд в страны с высокой заболеваемостью, постоянный контакт с бактерионосителем в условиях, способствующих заражению) проводят вакцинацию Вакциной брюшнотифозной спиртовой♠ (Тифивак♠). Вакцину применяют в возрасте 15-55 лет. Вводят подкожно в дозе 0,5 мл, вторая прививка - через 1 мес в дозе 1 мл, ревакцинация - через 2 года в дозе 1 мл. С 3-летнего возраста применяют вакцину брюшнотифозную Vi-полисахаридную жидкую♠ (Вианвак♠) в дозе 0,5 мл подкожно однократно. Ревакцинация в той же дозе через 3 года.
Неспецифические
Неспецифическая профилактика включает контроль за водоснабжением, обеззараживание питьевой воды, дезинфекцию сточных вод, соблюдение правил приготовления, хранения и реализации продуктов питания, соблюдение личной гигиены, санитарно-просветительную работу с населением, благоустройство жилых мест. Работников пищевых предприятий, детских учреждений обследуют при поступлении на работу, чтобы своевременно выявить носительство (бактериологическое исследование кала, РПГА с O- и Vi-диагностикумами).
В очаге брюшного тифа проводят эпидемиологическое обследование с целью выявить источник возбудителя и факторы передачи. По каждому случаю болезни направляют экстренное извещение в органы Санэпиднадзора. Больных госпитализируют. В очаге проводят заключительную дезинфекцию. За контактными лицами устанавливают наблюдение на 21 день, их обследуют на бактерионосительство. Работников пищевых и детских учреждений, а также детей, посещающих их, не допускают в них, пока не получены результаты обследования (бактериологическое исследование кала, РПГА с Vi-антигеном).
Патогенез
Заражение происходит через рот, и первичным местом локализации возбудителей является пищеварительный тракт. Преодолев желудочный барьер, возбудитель попадает в тонкую кишку, где происходят его размножение, фиксация солитарными и групповыми лимфоидными фолликулами с дальнейшим накоплением возбудителя, который по лимфатическим сосудам проникает в мезентериальные ЛУ. Эти процессы сопровождаются воспалением лимфоидных элементов тонкой, а нередко и проксимального отдела толстой кишки, лимфангитом и мезаденитом. Они развиваются в течение инкубационного периода, в конце которого возбудитель проникает в кровяное русло и развивается бактериемия. Под влиянием бактерицидных систем крови возбудитель лизируется, высвобождаются ЛПС и развивается интоксикационный синдром, который проявляется лихорадкой, поражением ЦНС в виде адинамии, заторможенности, нарушений сна, поражением вегетативной нервной системы, характеризующимся бледностью кожного покрова, брадикардией, парезом кишечника и задержкой стула. Этот период примерно соответствует первым 5-7 дням болезни. Воспаление лимфоидных элементов кишки достигает максимума и характеризуется как мозговидное набухание.
Бактериемию сопровождает обсеменение внутренних органов, прежде всего печени, селезенки, почек, костного мозга, в них формируются специфические воспалительные гранулемы. Этот процесс сопровождается нарастанием интоксикации, гепатоспленомегалией, усилением нейротоксикоза, характерными изменениями картины крови. Одновременно происходят стимуляция фагоцитоза, синтез бактерицидных антител, специфическая сенсибилизация организма, резко возрастает выделение возбудителя в окружающую среду через желчь и мочевыделительную систему. Сенсибилизация проявляется появлением сыпи, элементы которой - очаг гиперергического воспаления в месте скопления возбудителя в сосудах кожи. Повторное проникновение возбудителя в кишечник вызывает местную анафилактическую реакцию в виде некроза лимфоидных образований.
На третьей неделе отмечают тенденцию к снижению интенсивности бактериемии. Органные поражения сохраняются. В кишечнике происходит отторжение некротических масс и формируются язвы, с наличием которых связаны типичные осложнения брюшного тифа - перфорация язв с развитием перитонита и кишечное кровотечение. В развитии кровотечений существенную роль играют нарушения в системе гемостаза.
На 4-й неделе резко снижается интенсивность бактериемии, активируется фагоцитоз, регрессируют гранулемы в органах, уменьшается интоксикация, снижается температура тела. Происходит очищение язв в кишечнике и начинается их рубцевание, острая фаза болезни завершается. При недостаточном уровне иммунитета - обострения и рецидивы болезни, что приводит к хроническому носительству, которое при брюшном тифе рассматривают как форму инфекционного процесса.
Клиническая картина
Инкубационный период составляет от 3 до 21, чаще 9-14 дней. Классификация
-
По характеру течения: типичный; атипичный (стертый, абортивный, амбулаторный; редко встречающиеся формы: пневмотиф, менинготиф, нефротиф, колотиф, тифозный гастроэнтерит).
-
По наличию осложнений: неосложненный; осложненный: специфические осложнения (кишечное кровотечение, перфорация кишечника); неспецифические (пневмония, паротит, холецистит, тромбофлебит, отиты и др.).
Основные симптомы и динамика их развития
Брюшной тиф характеризуется постепенным или острым развитием интоксикационного синдрома. При современном течении почти одинаково часто встречают оба варианта.
При постепенном нарастании симптомов в первые дни больные отмечают повышенную утомляемость, нарастающую слабость, познабливание, усиливающуюся головную боль, ухудшение или отсутствие аппетита.
Температура тела ступенеобразно повышается и к 5-7-му дню болезни достигает 39-40 °С. При остром начале уже в первые 2-3 дня все симптомы интоксикации достигают полного развития.
В начальном периоде болезни характерны заторможенность и адинамия. Лицо бледное.
Характерны относительная брадикардия, артериальная гипотензия. У части больных отмечают кашель или заложенность носа. Над легкими нередко выслушивают жесткое дыхание и рассеянные сухие хрипы, что свидетельствует о развитии диффузного бронхита.
Язык утолщен, с отпечатками зубов на боковых поверхностях. Спинка языка покрыта массивным серовато-белым налетом, края и кончик свободны от налета, имеют насыщенно-розовый или красный цвет. Живот умеренно вздут. В правой подвздошной области определяют грубое, крупнокалиберное урчание. Определяют укорочение перкуторного звука в илеоцекальной области (симптом Падалки), что обусловлено наличием мезаденита. Стул с наклонностью к запору. К концу 1-й недели болезни увеличиваются и становятся доступными пальпации печень и селезенка.
Гемограмма в первые 2-3 дня характеризуется умеренным лейкоцитозом, а с 4-5-го дня болезни определяют лейкопению со сдвигом влево; их степень зависит от тяжести заболевания. Наблюдают анэозинофилию, относительный лимфоцитоз и тромбоцитопениию. СОЭ умеренно увеличена. Отмечают снижение диуреза, протеинурию, микрогематурию, цилиндрурию.
Все симптомы заболевания достигают максимального развития к концу первой - началу второй недели, когда наступает период разгара болезни. Этот период продолжается от нескольких дней до 2-3 нед и является самым тяжелым. При современном лечении этот период болезни значительно короче и легче. Больные находятся в состоянии ступора. Эти изменения нервно-психического состояния характеризуют тифозный статус, который при современном течении встречают редко.
У отдельных больных на 2-й неделе заболевания возникают небольшие изъязвления на передних нёбных дужках - ангина Дюге. Температура тела в этот период повышена до 39-40 °С и в дальнейшем может иметь постоянный или волнообразный характер.
У 55-70% заболевших брюшным тифом на 8-10-й день болезни на коже возникает характерная экзантема - розовато-красные розеолы диаметром 2-3 мм, расположенные преимущественно на животе и нижней части груди, а в случаях обильного высыпания - охватывающие и конечности. Сыпь мономорфная; как правило, скудная; число элементов редко превышает 6-8. Розеолы нередко слегка возвышаются над уровнем кожи (roseola elevata) и хорошо заметны на ее бледном фоне. При тяжелых формах сыпь может приобретать петехиальный характер. Длительность существования розеол от 1 до 5 дней, чаще 3-4 дня. После исчезновения сыпи остается едва заметная пигментация кожи. Характерен феномен подсыпания. Розеолы могут появиться и в первые дни периода реконвалесценции при нормальной температуре.
В разгар болезни сохраняется относительная брадикардия, возникает дикротия пульса, еще более снижается артериальное и венозное давление.
Внезапная тахикардия может свидетельствовать об осложнениях: кишечном кровотечении, прободении кишечника, коллапсе - и имеет плохое прогностическое значение.
В этом периоде возможна пневмония, обусловленная как самим возбудителем, так и сопутствующей микрофлорой.
Изменения со стороны органов пищеварения достигают максимальной выраженности. Губы сухие, нередко покрыты корочками, с трещинами. Язык утолщен, густо обложен серо-коричневатым налетом, края и кончик его ярко-красного цвета с отпечатками зубов («тифозный», «поджаренный» язык). Живот вздут. Отмечают задержку стула. В некоторых случаях возможна диарея. Стул жидкий, зеленоватого цвета. Отчетливыми становятся урчание и болезненность при пальпации илеоцекального отдела кишечника, положительный симптом Падалки. Печень и селезенка увеличены. Иногда развивается холецистит.
В разгар болезни уменьшается количество мочи. Определяют протеинурию, микрогематурию, цилиндрурию. Возникает бактериурия, которая иногда приводит к пиелиту и циститу. В отдельных случаях могут развиваться мастит, орхит, эпидидимит, дисменорея, у беременных - преждевременные роды или аборт.
В разгаре болезни могут возникать такие опасные осложнения, как перфорация брюшнотифозных язв и кишечное кровотечение.
Период разрешения болезни не превышает одной недели и характеризуется снижением температуры, которая нередко перед нормализацией приобретает амфиболический характер, т.е. суточные колебания достигают 2,0-3,0 °С.
При современном течении брюшного тифа температура чаще снижается коротким лизисом без амфиболической стадии. Однако нормальную температуру не следует воспринимать как гарантию выздоровления. Длительно сохраняются слабость, повышенная раздражительность, лабильность психики, снижение массы тела, возможен субфебрилитет.
Среди перенесших брюшной тиф 3-5% становятся хроническими бактерионосителями.
Обострения и рецидивы. На спаде болезни до нормализации температуры возможны обострения, характеризующиеся нарастанием лихорадки и интоксикации, появлением свежих розеол, увеличивается селезенка. Обострения чаще бывают однократными, в условиях антибиотикотерапии наблюдают редко.
Рецидивы наступают уже при нормальной температуре. Предшественники рецидива - субфебрилитет, сохранение гепатоспленомегалии, анэозинофилии, низкий уровень антител. Клиническую картину рецидива отличают более легкое течение, более быстрый подъем температуры, раннее появление сыпи, менее выраженные симптомы общей интоксикации. Их продолжительность - от одного дня до нескольких недель; возможны два, три рецидива и более.
Осложнения
Кишечное кровотечение чаще возникает в конце второй и на третьей неделе болезни.
Прямой признак кровотечения - мелена (дегтеобразный стул). Иногда в испражнениях отмечают наличие алой крови. Общие симптомы внутреннего кровотечения - бледность кожного покрова, падение АД, учащение пульса, снижение температуры тела, что сопровождается прояснением сознания, активизацией больного и создает иллюзию улучшения. При массивных кровотечениях может развиться геморрагический шок. Вследствие уменьшения объема циркулирующей крови больные чувствительны к кровопотере, и общие симптомы кровотечения могут появиться при кровопотерях, значительно меньших, чем у здоровых. Кровотечения могут из-за нарушений свертываемости крови длиться до 1-2 дней.
Перфорация кишки чаще возникает в терминальном отделе подвздошной кишки. Обычно одно (реже два или три и более) перфоративное отверстие размерами до 1,5 см. Изредка прободение возникает в толстой кишке, желчном пузыре, червеобразном отростке, лимфатический аппарат которого активно вовлекается в воспалительный процесс.
Клинические проявления перфорации - острая боль в мезагастральной области несколько правее от срединной линии, мышечное напряжение брюшного пресса, положительный симптом Щеткина-Блюмберга. Пульс частый, слабого наполнения, лицо бледное, кожа покрыта потом, дыхание учащено, в ряде случаев отмечают коллапс. Наиболее важные клинические признаки прободения кишки - боль, мышечная защита, метеоризм, исчезновение перистальтики. Боль, особенно «кинжальная», не всегда выражена, особенно при наличии тифозного статуса, из-за чего совершаются ошибки при постановке диагноза.
Важные симптомы - метеоризм в сочетании с икотой, рвотой, дизурией и отсутствие печеночной тупости. Независимо от интенсивности боли у больных определяют ригидность мышц в правой подвздошной области, но по мере прогрессирования процесса напряжение мышц живота становится более распространенным и выраженным.
Перфорации кишки способствуют метеоризм, повышенная перистальтика, травмы живота. Развитие перитонита возможно и при глубокой пенетрации брюшнотифозных язв, при некрозе мезентериальных ЛУ.
Картина перфорации и перитонита на фоне антибиотикотерапии часто бывает стертой, поэтому даже нерезкие боли в животе должны привлечь внимание врача, а нарастание лихорадки, интоксикации, метеоризма, тахикардия, лейкоцитоз крови даже при отсутствии локальных симптомов указывают на развитие перитонита.
У 0,5-0,7% больных в периоде разгара болезни развивается ИТШ.
Летальность и причины смерти
При лечении антибиотиками летальность менее 1%, основные причины смерти - перитонит, другие осложнения.
Диагностика
Клиническая диагностика. Из эпидемиологических данных существенны контакт с лихорадящими больными, употребление необеззараженной воды, немытых овощей и фруктов, некипяченого молока и молочных продуктов, приготовленных из него и приобретенных у частных лиц, питание в предприятиях общественного питания с признаками санитарного неблагополучия, высокая заболеваемость кишечными инфекциями в месте пребывания больного. Из клинических данных наиболее важны высокая лихорадка, розеолезная сыпь, адинамия, характерный вид языка, метеоризм, увеличение печени и селезенки, задержка стула, заторможенность, нарушение сна, головная боль, анорексия. Все больные с лихорадкой неясного генеза должны быть обследованы амбулаторно на брюшной тиф.
Специфическая и неспецифическая лабораторная диагностика. Наиболее информативный метод - выделение гемокультуры возбудителя. Положительный результат может быть получен на протяжении всего лихорадочного периода, но чаще в начале болезни. Посев крови следует производить в течение 2-3 дней ежедневно, первый раз - желательно до назначения антимикробных препаратов. Со второй недели болезни вплоть до выздоровления возможно выделение копро-, урино- и билиокультуры, однако при положительном результате исследования нужно исключить возможность хронического носительства. Исследование желчи проводят на 10-й день после нормализации температуры тела. Посевы этих субстратов, а также скарификата розеол, мокроты, СМЖ производят на селективные среды (висмутсульфатный агар, среды Плоскирева, агары Эндо и Левина). Предварительный результат бактериологического исследования может быть получен через двое суток, окончательный, включая определение чувствительности к антибиотикам и фаготипирование, - через 4-5 сут.
Для подтверждения диагноза используют также РНГА с H-, O- и Vi-антигеном. Исследование проводят при поступлении и через 7-10 сут. Диагностическое значение имеет нарастание титра О-антител в четыре раза или титр 1:40 и выше. Положительная реакция с Н-антигеном свидетельствует о перенесенном ранее заболевании или вакцинации, с Vi-антигеном - о хроническом брюшнотифозном носительстве. В последние годы для диагностики брюшного тифа применяют также ИФА.
Дифференциальная диагностика
Дифференциальную диагностику проводят со многими болезнями, протекающими с лихорадкой; чаще с гриппом, пневмонией, аденовирусной инфекцией, а также с малярией, бруцеллезом, лептоспирозом, орнитозом, риккетсиозом, трихинеллезом, генерализованной формой иерсиниозов, сепсисом, милиарным туберкулезом.
Лечение
Современное лечение больных брюшным тифом строят на комплексном применении этиотропной и патогенетической терапии. Диетотерапия. Весь лихорадочный период - стол 4А, затем 4, 2 и 13.
Антибактериальная терапия: ципрофлоксацин по 0,5-0,75 г 2 раза в день после еды; офлоксацин по 0,2-0,4 г 2 раза в день внутрь или в/в; пефлоксацин по 0,4 г 2 раза в день внутрь или в/в. Высокоэффективен цефтриаксон (альтернативный препарат) по 1,0-2,0 г внутривенно один раз в сутки. Антибиотикотерапию проводят до 10-го дня после нормализации температуры тела.
Дезинтоксикационная терапия - по показаниям.
До 6-7-го дня нормальной температуры больному необходимо соблюдать постельный режим, с 7-8-го дня разрешают сидеть, а с 10-11-го дня нормальной температуры при отсутствии противопоказаний разрешают ходить.
Выписку переболевших из стационара производят после клинического выздоровления, но не ранее 21-23-го дня с момента нормализации температуры и после получения двукратного отрицательного бактериологического исследования кала и мочи и однократного - дуоденального содержимого.
Прогноз. В доантибиотический период летальность при брюшном тифе составляла 3-20%, при современной терапии - 0,1-0,3%.
Диспансеризация. Переболевшие брюшным тифом после выписки из больницы подлежат диспансерному наблюдению в КИЗ на протяжении 3 мес. Для своевременного выявления рецидива за реконвалесцентами устанавливают медицинское наблюдение с термометрией 1 раз в неделю в первые 2 мес и 1 раз в 2 нед в течение 3-го месяца.
У всех переболевших брюшным тифом (кроме работников пищевых предприятий и лиц, приравненных к ним) в течение 3-месячного диспансерного наблюдения ежемесячно производят бактериологическое исследование кала и мочи, а к концу 3-го месяца дополнительно - посев желчи и реакцию Vi-гемагглютинации. Далее эти лица состоят на учете органов санитарно-эпидемического надзора на протяжении 2 лет. За этот период у них 2 раза в год производят бактериологическое исследование кала и мочи, а в конце срока наблюдения - посев желчи. При отрицательных результатах бактериологических исследований переболевших снимают с учета.
Реконвалесцентов брюшного тифа из числа работников пищевых предприятий и лиц, приравненных к ним, не допускают к работе по специальности в течение месяца после выписки из больницы. В это время, помимо медицинского наблюдения, необходимо проводить пятикратное бактериологическое исследование кала и мочи с интервалом 1-2 дня, однократный посев желчи и реакцию Vi-гемагглютинации. Лиц с положительной реакцией Vi-гемагглютинации не допускают к работе. У них проводят дополнительное бактериологическое исследование выделений не менее пяти раз и желчи - один раз.
При получении отрицательных результатов реконвалесцентов допускают к работе в пищевые и приравненные к ним учреждения с обязательным ежемесячным бактериологическим исследованием кала и мочи в течение года и к концу третьего месяца - с посевом желчи и постановкой реакции Vi-гемагглютинации. В последующем эти лица состоят на учете в КИЗ в течение 5 лет с ежеквартальным бактериологическим исследованием кала и мочи, а затем на протяжении всей трудовой деятельности у них ежегодно двукратно производят бактериологическое исследование кала и мочи.
Хронические бактерионосители пожизненно пребывают на учете органов санитарно-эпидемического надзора и в КИЗ и два раза в год подвергаются бактериологическому исследованию и клиническому обследованию.
На таком же учете состоят и подлежат аналогичному обследованию реконвалесценты брюшного тифа, у которых во время пребывания в стационаре были выделены брюшнотифозные микробы из желчи. Хронических бактерионосителей, а также проживающих вместе с ними лиц отстраняют от работы на предприятиях пищевой промышленности, общественного питания и торговли, в медицинских, санаторно-курортных учреждениях, аптеках и др.
Паратифы А, В и С
Паратифы - острые инфекционные болезни, сходные по этиологии, эпидемиологии, патогенезу, морфологии и клинической картине с брюшным тифом. Выделяют паратифы А, В и С.
Код по МКБ-10
Этиология
Паратифозные бактерии - самостоятельный вид микробов рода Salmonella, возбудитель:
Возбудители паратифов хорошо сохраняются во внешней среде, в том числе в воде, молоке, масле, сыре, хлебе, относительно устойчивы к действию физических и химических факторов, длительно сохраняются при низких температурах (во льду в течение нескольких месяцев). При кипячении погибают мгновенно.
Эпидемиология
На долю паратифов приходится около 10-12% всех тифо-паратифозных заболеваний.
Паратифы А и В - типичные кишечные инфекции, антропонозы, встречающиеся повсеместно. Паратиф С как самостоятельное заболевание регистрируют редко.
Основной источник и резервуар инфекции - больной или бактерионоситель, выделяющий возбудителей с испражнениями и мочой. Больной начинает выделять возбудителя с испражнениями и мочой с первых дней заболевания, но наибольшей интенсивности бактериовыделение достигает на 2-3-й неделе заболевания. После перенесенного паратифа может сформироваться острое (до 3 мес) или хроническое (свыше 6 мес) бактерионосительство. Хроническими носителями становятся 5-7% лиц, перенесших паратиф. По мере снижения заболеваемости паратифом роль бактерионосителей как источников инфекции по сравнению с больными возрастает.
Механизм передачи паратифов фекально-оральный. Факторы передачи инфекции - пищевые продукты, вода, предметы обихода, зараженные больными или бактерионосителями, а также мухи. Встречают как спорадические случаи, так и эпидемические вспышки.
При нарушении санитарного содержания колодцев или других открытых водоемов они легко загрязняются, в том числе и сточными водами. Водные эпидемии паратифа могут возникать и в случае неисправности водопровода при подключении технического водоснабжения, чаще встречаются при паратифе А.
Пищевой путь распространения паратифов, особенно паратифа В, связан в первую очередь с употреблением инфицированных молочных продуктов, а также продуктов, не подвергшихся термической обработке после приготовления: салатов, студня, мороженого, кремов. Пищевые вспышки паратифа А встречают реже, чем паратифа В.
Заражение контактно-бытовым путем возможно от хронических бактерионосителей, реже - от больных при нарушении санитарного режима.
Патогенез
Патогенез паратифов А, В и брюшного тифа принципиальных различий не имеет.
При паратифах чаще, чем при брюшном тифе, поражается толстая кишка и в меньшей степени выражены деструктивные процессы в лимфатическом аппарате кишечника.
Клиническая картина
Для паратифа А обычно характерны тифоидная (50-60% больных) или катаральная (20-25%) формы. В отличие от брюшного тифа, паратиф А протекает чаще в среднетяжелой форме и в начальном периоде проявляется гиперемией лица, инъекцией склер, кашлем, насморком. Эти симптомы делают начальный период паратифа А сходным с ОРЗ. Сыпь появляется на 4-7-й день болезни у 50-60% больных. Наряду с типичной розеолезной сыпью можно обнаружить макулопапулезные элементы. У некоторых больных возможны петехии. Сыпь более обильна, чем при брюшном тифе. Редко возникают рецидивы и осложнения.
При паратифе В чаще встречают гастроинтестинальную форму (60-65% больных), реже - тифоидную (10-12%) и катаральную (10-12%). Отличительный признак паратифа В - симптомы гастроэнтерита с первых дней болезни. В дальнейшем присоединяются лихорадка розеолезная; экзантема более обильная, чем при брюшном тифе. Температура нередко носит волнообразный характер, с большой суточной амплитудой. Тяжесть течения паратифа В может быть различной, но в целом он протекает легче, чем паратиф А и брюшной тиф. После перенесенного паратифа В формируется стойкий иммунитет, рецидивы возникают у 1-2% больных. Изредка возникают прободение кишки (0,2%) и кишечное кровотечение (0,4-2% больных).
Диагностика
Основные методы диагностики - бактериологическое исследование испражнений, крови, мочи, рвотных масс и промывных вод желудка, а также выявление антител к сальмонеллам в РНГА, реакции Vi-агглютинации с типовыми сыворотками. В качестве антигенов используют монодиагностикумы к конкретным возбудителям. Исследования рекомендуют начинать с 7-х суток (время нарастания титра антител).
Прогноз
При своевременном и адекватном лечении благоприятный. Лечение, меры профилактики, диспансеризация, рекомендации при выписке - см. «Брюшной тиф».
Сальмонеллез
Сальмонеллез - острая зоонозная инфекционная болезнь с фекально-оральным механизмом передачи возбудителя, характеризующаяся преимущественным поражением ЖКТ, развитием интоксикации и обезвоживания.
Коды по МКБ-10
Этиология
Возбудители сальмонеллеза обладают общими для всех патогенных для человека сальмонелл вида enterica свойствами и факторами вирулентности. Важное эпидемиологическое значение имеет способность сальмонелл длительно сохраняться в окружающей среде (в воде - до 5 мес, в почве - до 18 мес, в мясе - до 6 мес, в тушках птиц - больше года, на яичной скорлупе - до 24 дней) и особенность размножаться в мясных и молочных продуктах, яйцах кур при температуре 20-40 °С, так как для развития болезни необходимо накопление в продуктах токсинов инфицирующей дозы. Более 90% случаев сальмонеллеза вызывается S. typhimurium, S. enteritidis, S. раnаmа, S. infantis, S. newport, S. agona, S. derby, S. london. В настоящее время учащается выявление антибиотикорезистентных штаммов сальмонелл и плазмидоваров с повышенной вирулентностью.
Эпидемиология
Резервуар и источник возбудителя инфекции - больные животные: крупный и мелкий рогатый скот, свиньи, лошади, домашние птицы. У них болезнь протекает остро или в виде бактерионосительства. Человек (больной или бактерионоситель) может быть также источником S. typhimurium. Механизм передачи - фекально-оральный. Основной путь передачи - пищевой, через продукты животного происхождения. Инфицирование мяса происходит эндогенно при жизни животного, а также экзогенно в процессе транспортировки, переработки, хранения. В последние годы отмечен значительный рост заболеваемости (S. enteritidis), связанный с распространением возбудителя через мясо птицы и яйца, а также молочные продукты, причем продукты, инфицированные сальмонеллами, не изменяют внешнего вида и органолептических свойств. Водный путь передачи в основном играет роль в заражении животных. Контактно-бытовым путем (через руки и инструментарий), как правило, происходит передача возбудителя в лечебных учреждениях. Наибольший риск заражения сальмонеллезом - у детей первого года жизни и лиц с иммунодефицитом. В конце ХХ и начале ХХI вв. имеется мировая тенденция к росту заболеваемости сальмонеллезом, особенно в крупных городах. Регистрируются вспышки сальмонеллеза в лечебных учреждениях (роддомах, детских, психиатрических, гериартрических отделениях), вызванные резистентными к антибиотикам штаммами сальмонелл. Случаи болезни регистрируют чаще в летние месяцы в связи с худшими условиями хранения продуктов.
Наблюдают спорадическую и групповую заболеваемость. Восприимчивость людей к возбудителю высока. Постинфекционный иммунитет сохраняется менее года.
Меры профилактики
Специфические. Специфическая профилактика не разработана.
Неспецифические. Ветеринарно-санитарный надзор за убоем скота и птицы, технологией обработки туш, приготовлением и хранением мясных блюд. Соблюдение санитарно-гигиенических и противоэпидемических норм на предприятиях торговли и общественного питания, соблюдение санэпидрежима в лечебных учреждениях.
Патогенез
В просвете тонкой кишки сальмонеллы прикрепляются к мембранам энтероцитов, достигают собственной пластинки слизистой оболочки. Это приводит к дегенеративным изменениям энтероцитов и развитию энтерита. В собственной пластинке слизистой макрофаги поглощают сальмонеллы, однако фагоцитоз является незавершенным, и возможна генерализация инфекции. При разрушении бактерий высвобождается эндотоксин, который играет основную роль в развитии синдрома интоксикации. Кроме того, он активирует синтез простаноидов (тромбоксанов, простагландинов), запускающих агрегацию тромбоцитов в мелких капиллярах. Простагландины стимулируют секрецию электролитов и жидкости в просвет кишечника, вызывают сокращение гладкой мускулатуры и усиливают перистальтику. Основную роль в развитии диареи и обезвоживания играет энтеротоксин, активирующий синтез цАМФ аденилатциклазой энтероцитов, благодаря чему усиливается секреция ионов Na+, Cl- и воды в просвет кишки. Важную роль играет воздействие токсинов на нервно-мышечный аппарат кишечника, нарушающий перистальтику, вызывающий спастические боли. Следствием дегидратации и интоксикации является нарушение деятельности сердечно-сосудистой системы. Нарушение секреции пищеварительных ферментов, а также прием антибиотиков приводит к дисбиозу.
Клиническая картина
Инкубационный период от 6 ч до 3 сут (чаще 12-24 ч); при внутри-больничных вспышках удлиняется до 3-8 дней.
Согласно классификации выделяются следующие формы.
Основные симптомы и динамика их развития
Для гастритического варианта характерны острое начало, повторная рвота и боль в эпигастрии. Синдром интоксикации выражен слабо. Длительность болезни от нескольких часов до 2 сут.
Гастроэнтеритический вариант наиболее распространен. Болезнь начинается остро, с повышения температуры тела, головной боли, озноба, ломоты в мышцах, схваткообразной боли в животе. Присоединяются тошнота, рвота, диарея. Испражнения вначале носят каловый характер, но быстро становятся водянистыми, пенистыми, зловонными, иногда с зеленоватым оттенком и имеют вид «болотной тины». Отмечают бледность кожного покрова, в более тяжелых случаях - цианоз. Язык сухой, обложен налетом. Живот вздут, при пальпации болезнен, больше в эпи- и мезогастрии, перистальтика усилена. Тоны сердца приглушены, тахикардия, АД снижено. Уменьшено выделение мочи. Возможны судороги.
При гастроэнтероколитическом варианте клиническая картина та же, но уже на 2-3-й день болезни уменьшается объем испражнений. В них появляется примесь слизи, иногда крови. При пальпации живота отмечают инфильтрацию и болезненность сигмовидной кишки. В отдельных случаях возможен колитический вариант болезни, трудно отличимый от шигеллеза.
Генерализованной форме болезни, как правило, предшествуют гастроинтестинальные расстройства. При тифоподобном варианте температурная кривая приобретает постоянный или волнообразный характер. Усиливаются головная боль, слабость, бессонница. Кожа бледная, к 6-7-му дню болезни на коже живота появляется розеолезная сыпь. Наблюдают относительную брадикардию. Живот вздут. К концу первой недели болезни отмечают увеличение печени и селезенки. Длительность лихорадки составляет 1-3 нед. Рецидивы возникают редко. В первые дни болезни клинические проявления септического и тифоподобного вариантов схожи. В дальнейшем при септическом варианте болезни состояние больных ухудшается. Колебания температуры тела становятся неправильными, с большими суточными перепадами, повторным ознобом и обильным потоотделением, тахикардией, миалгией. Отмечают формирование гнойных очагов в легких, сердце, почках, печени, оболочках мозга и других органах. Прогноз без лечения неблагоприятный. После перенесенного заболевания часть больных становятся бактерионосителями. При остром бактериовыделении выделение сальмонелл заканчивается в течение 3 мес; если оно продолжается более 3 мес, его расценивают как хроническое. При транзиторном бактериовыделении однократный или двукратный высев сальмонелл из испражнений не сопровождается клиническими проявлениями и образованием антител.
В отдельных случаях сальмонеллы могут вызывать локальные гнойно-воспалительные процессы (панкреатит, остеомиелит, пиелонефрит, парапроктит, абсцессы мягких тканей и пр.).
Осложнения
Дегидратационный и ИТШ, нарушение кровообращения в коронарных, мезентериальных и мозговых сосудах, ОПН, септические осложнения.
Летальность и причины смерти
Летальность составляет 0,2-0,6%. Причиной смерти может быть одно из приведенных выше осложнений.
Диагностика
Клиническая: острое начало с повышением температуры тела, тошнотой, рвотой, диареей, болью в животе, характерный вид испражнений.
Эпидемиологическая: прием пищи, приготовленной и хранившейся с нарушением санитарных норм, употребление сырых яиц, групповые вспышки.
Специфическая и неспецифическая лабораторная диагностика: бактериологическое исследование кала, рвотных масс, крови, мочи, желчи, промывных вод желудка, остатков подозрительных продуктов.
Антигены сальмонелл могут быть обнаружены в крови и моче при помощи ИФА и РНГА. Для ретроспективной диагностики используют определение специфических антител (РНГА и ИФА). Исследуют парные сыворотки, взятые с интервалом 5-7 сут. Диагностическое значение имеет нарастание титров в четыре раза и более. При генерализованных формах важное значение имеет бактериологическое исследование крови и обнаружение фрагментов генома возбудителя методом ПЦР.
Дифференциальная диагностика
Проводят с инфекционными (шигеллез, холера, эшерихиоз) и неинфекционными болезнями (острый аппендицит, мезентериальный тромбоз).
ЛЕЧЕНИЕ
Показания к госпитализации
Тяжелое течение болезни, обезвоживание III-IV степени, генерализация процесса, эпидемиологические показания.
Постельный режим назначают при выраженной интоксикации и потере жидкости. Палатный - при среднетяжелом и легком течении. Промывание желудка при поступлении беззондовым методом.
Диета - механически-химически щадящая до нормализации стула.
Медикаментозная терапия
Этиотропная терапия. Проводится при сохранении лихорадки в течение 3 и более дней, при генерализованной форме - рифаксимин 0,2-0,4 г в таблетках 2-3 раза в день, ципрофлоксацин по 500 мг 2 раза в день; цефтриаксон 2 г 1 раз в день внутримышечно или внутривенно 7-14 дней. При всех формах бактерионосительства и декретированной категории лиц - бактериофаг сальмонеллезный по 2 таблетки 3 р/сут или по 50 мл 2 р/сут за 30 мин до еды в течение 5-7 дней.
Патогенетические средства составляют основу лечения. Лечение начинают с промывания желудка.
Регидратационная терапия. Пероральная (при дегидратации I-II степени и отсутствии рвоты): глюкосоланρ, декстроза + калия хлорид + натрия хлорид + натрия цитрат (Цитраглюкосолан♠¤), декстроза + калия хлорид + натрия хлорид + натрия цитрат (Регидрон♠). Регидратацию проводят в два этапа, длительность 1-го этапа - до 2 ч, 2-го - до 3 сут. Объем 30-70 мл/кг, скорость 0,5-1,5 л/ч, температура 37-40 °С. Парентеральная: калия хлорид + натрия ацетат + натрия хлорид (Хлосоль♠), калия хлорид + натрия гидрокарбонат + натрия хлорид (Трисоль♠), калия хлорид + натрия ацетат + натрия хлорид (Ацесоль♠). Регидратацию проводят в два этапа, длительность 1-го этапа - до 3 ч, 2-го - по показаниям (возможен переход на пероральное введение жидкости). Объем 55-120 мл/кг, средняя скорость 60-120 мл/мин. При сохранении ацидоза вводят 4% раствор натрия гидрокарбоната (Натрия бикарбоната♠).
Дезинтоксикационная терапия. После ликвидации обезвоживания. Декстроза (Глюкоза♠), декстран [ср. мол. масса 35 000-45 000] (Реополиглюкин♠) 200-400 мл внутривенно капельно.
Сорбенты: лигнин гидролизный (Полифепан♠) по одной столовой ложке 3-4 раза в день 5-7 дней; активированный уголь (карболонгρ) по 5-10 г три раза в день 3-15 дней; смектит диоктаэдрический (Неосмектин♠) по одному порошку 3 раза в день на протяжении 5-7 дней.
Ферментотерапия: панкреатин по одному порошку 3 раза в день 2-3 мес; панкреатин (Мезим форте♠) по одному драже 3 раза в день 1 мес; оразаρ по одной чайной ложке 3 раза в день 2-4 нед во время еды.
Антидиарейные препараты: кальция глюконат по 1-3 г 2-3 раза в день, индометацин по 50 мг 3 раза в день через 3 ч в течение 1-2 дней 3 раза в день.
Спазмолитики: дротаверин (Но-шпа♠) по 0,04 г 3 раза в день, папаверин по 0,04 г 3 раза в день.
Выписку осуществляют после клинического выздоровления и отрицательного результата бактериологического исследования кала, которое проводят через 2 дня после окончания лечения. Больных декретированной группы выписывают после двух контрольных исследований кала (первое - не ранее 3-го дня после окончания лечения, второе - через 1-2 дня). Пациентов, не выделяющих возбудителя, допускают к работе.
Работники пищевой промышленности и предприятий общественного питания подлежат диспансеризации в течение 3 мес с ежемесячным однократным исследованием кала. Лиц, выделяющих сальмонеллы, не допускают к основной работе в течение 15 дней и устраивают на другую работу. В этот период им проводят 5-кратное исследование кала и однократное - желчи. Если бактериовыделение продолжается более 3 мес, их переводят на другую работу на срок не менее 1 года и обследуют один раз в 6 мес. По истечении этого срока проводят 5-кратное исследование кала и однократное - желчи с интервалом 1-2 дня. При отрицательных результатах таких больных снимают с учета и допускают к основной работе; при положительных - отстраняют от работы.
Шигеллез
Шигеллез (бактериальная дизентерия, Shigellosis dysenterya) - острая инфекционная болезнь, вызываемая бактериями рода Shigella с фекально-оральным механизмом передачи возбудителя, характеризующаяся картиной дистального колита и интоксикацией.
Коды по МКБ-10
A03.0 Шигеллез, вызванный Shigella dysenteriae.
A03.1 Шигеллез, вызванный Shigella flexneri.
A03.2 Шигеллез, вызванный Shigella boydii.
A03.3 Шигеллез, вызванный Shigella sonnei.
Этиология
Шигеллез вызывается бактериями рода Shigella семейства Enterobacteriaceae. По современной классификации род Shigella подразделяют на четыре вида:
Шигеллы - грамотрицательные неподвижные палочки, факультативные аэробы. Палочка Григорьева-Шиги образует шигитоксин (экзотоксин), остальные виды содержат эндотоксин - ЛПС. Шигеллы устойчивы в окружающей среде: на посуде и влажном белье они могут сохраняться в течение месяцев, в почве - до 3 мес, на продуктах питания - несколько суток, в воде - до 3 мес. При нагревании до 60 °С они гибнут через 10 мин, при кипячении - немедленно, в дезинфицирующих растворах - в течение нескольких минут. Из антибактериальных препаратов наибольшая чувствительность in vitro к фторхинолонам (100%).
Эпидемиология
Единственный источник возбудителя - больной человек, а также бактериовыделитель. Наибольшую опасность представляют больные, которые связаны с приготовлением пищи, хранением, транспортировкой и продажей пищевых продуктов. Шигеллез распространяется с помощью фекально-орального механизма передачи возбудителя. Этот механизм включает передачу возбудителя контактно-бытовым, водным, пищевым путем. Болезнь распространена повсеместно, но заболеваемость преобладает в развивающихся странах среди контингента населения с неудовлетворительным социально-экономическим и санитарно-гигиеническим статусом. Для стран с умеренным климатом характерна летне-осенняя сезонность.
Восприимчивость населения к шигеллезу высока во всех возрастных группах, наиболее часто болеют дети. После перенесенного заболевания формируется непродолжительный типоспецифический иммунитет.
Профилактика
Специфическая профилактика: разработана для шигеллеза S. sonnei. В РФ зарегистрирована вакцина Шигеллвак. Она представляет из себя очищенный ЛПС культуры S. sonnei. Вакцинирование Шигеллваком обеспечивает защиту от инфекции в течение одного года. Вакцинации подлежат: работники инфекционных стационаров и бактериологических лабораторий, лица, занятые в сфере общественного питания и коммунального благоустройства, дети, посещающие детские учреждения и отъезжающие в оздоровительные лагеря (по показаниям). По эпидемическим показаниям прививки проводят при угрозе возникновения эпидемии или вспышки (стихийные бедствия, крупные аварии на водопроводной и канализационной сети), а также в период эпидемии, при этом в угрожаемом районе проводят массовую иммунизацию населения. Профилактические прививки предпочтительно проводить перед сезонным подъемом заболеваемости шигеллезами.
Меры неспецифической профилактики состоят в повышении санитарной культуры населения, обеззараживании питьевой воды (хлорирование, кипячение и др.), а также в соблюдении правил приготовления, хранения и реализации пищевых продуктов. Работники пищевых предприятий и лица, к ним приравненные, допускаются к работе только после отрицательного бактериологического анализа на шигеллез, а после перенесенного заболевания шигеллезом - после двух отрицательных результатов анализов, взятых не ранее чем на 3-й день после лечения при отсутствии клинических проявлений. В случае пребывания больного в домашних условиях в квартире проводят текущую дезинфекцию. За лицами, находившимися в контакте с больными, устанавливают медицинское наблюдение в течение 7 дней.
Патогенез
В течение суток (иногда и дольше) шигеллы могут находиться в желудке, выделяя эндотоксин. Затем бактерии попадают в тонкую кишку, где могут задерживаться до нескольких суток и даже размножаться. Далее шигеллы продвигаются в толстую кишку, где интенсивно размножаются. Определяющий момент в развитии инфекционного процесса - способность шигелл к внутриклеточной инвазии. Первостепенное значение среди защитных механизмов имеет состояние естественных факторов резистентности, особенно местных (лизоцим и β-лизины слизистой оболочки дистального отдела толстой кишки). Вместе с гуморальными факторами (бактерицидная активность, комплемент крови) они реагируют на развитие инфекционного процесса на протяжении всего заболевания.
Степень неспецифической резистентности в известной мере определена генетически, но в то же время она зависит от ряда факторов: возраста больного, полноценности питания, сопутствующих заболеваний.
Клиническая картина
Инкубационный период при шигеллезе в большинстве случаев - 2-5 сут. Продолжительность заболевания составляет от нескольких дней до 3 мес, шигеллез длительностью свыше 3 мес расценивается как хронический.
Классификация шигеллеза, принятая в настоящее время, учитывает выраженность основных синдромов, характер течения болезни, вид возбудителя (табл. 16-1).
| Форма | Клинический вариант | Тяжесть течения | Особенности течения | Этиология |
|---|---|---|---|---|
Острый шигеллез |
Колитический |
Легкое, среднетяжелое, тяжелое. |
Стертое, затяжное |
Шигеллы любого из перечисленных видов: Зонне, Флекснера, Бойда, Григорьева-Шиги, Ларджа-Сакса, Штутцера-Шмитца |
Гастроэнтеро-колитический |
Легкое, средне-тяжелое с обезвоживанием I-II степени, тяжелое с обезвоживанием III-IV степени. |
|||
Гастроэнтеритический |
Легкое, среднетяжелое с обезвоживанием I-II степени, тяжелое с обезвоживанием III-IV степени |
|||
Хронический шигеллез |
- |
- |
Рецидивирующее, непрерывное |
- |
Шигеллезное бактерио-носительство |
- |
- |
Субклиническое, носительство реконвалесцентное |
- |
Клиническая картина колитического варианта острого шигеллеза
Заболевание начинается остро, у некоторых больных удается установить кратковременный продромальный период, проявляющийся непродолжительным чувством дискомфорта в животе, легким ознобом, головной болью, слабостью. После продромального периода (а чаще на фоне полного здоровья) появляются схваткообразные боли в нижней части живота, преимущественно в левой подвздошной области. Особенность болевого синдрома - его уменьшение или кратковременное исчезновение после дефекации. Позывы к дефекации появляются одновременно с болью или несколько позже. Стул первоначально каловый, постепенно объем каловых масс уменьшается, появляется примесь слизи и крови, частота дефекаций нарастает. В разгаре болезни испражнения могут терять каловый характер и имеют вид «ректального плевка», т.е. состоят лишь из скудного количества слизи и крови. Дефекация может сопровождаться тенезмами (тянущими судорожными болями в заднем проходе), часто возникают ложные позывы. Примесь крови чаще всего незначительна. При пальпации живота отмечают спазм, через несколько дней инфильтрацию, болезненность сигмовидной кишки. Живот чаще втянут, реже - вздут. С первого дня появляются признаки интоксикации: лихорадка, недомогание, головная боль, головокружение. Возможны сердечно-сосудистые расстройства.
Длительность клинической симптоматики при неосложненном течении острого шигеллеза - 5-10 дней. У большинства больных сначала нормализуется температура и исчезают другие признаки интоксикации, а затем нормализуется стул. Более длительно сохраняются боли в животе.
Гастроэнтероколитический вариант острого шигеллеза.
Начало болезни напоминает ПТИ, а в разгар заболевания появляются и выходят на первый план симптомы колита. Гастроэнтеритический вариант острого шигеллеза по течению соответствует начальному периоду гастроэнтероколитического варианта. Отличие состоит в том, что в более поздние сроки симптомы энтероколита не доминируют, и клинически этот вариант течения более сходен с ПТИ. При ректороманоскопии обычно наблюдают менее выраженные изменения.
Стертое течение острого шигеллеза. Характеризуется кратковременными и невыраженнными клиническими симптомами (1-2-кратное расстройство стула, кратковременные боли в животе), отсутствием симптомов интоксикации. Подобные случаи заболевания диагностируют при определении ректороманоскопических изменений (как правило, катаральных) и выделении шигелл из испражнений. О затяжном течении острого шигеллеза говорят, когда основные клинические симптомы не исчезают или возобновляются после кратковременной ремиссии в течение 3 нед - 3 мес.
Бактерионосительство. К этой форме инфекционного процесса относят случаи, когда отсутствуют клинические симптомы на момент обследования и в предшествовавшие 3 мес, при ректороманоскопии не выявляют изменений слизистой оболочки толстой кишки. Бактерионосительство может быть реконвалесцентным (сразу после перенесенного острого шигеллеза) и субклиническим, если шигеллы выделяют у лиц, не имеющих клинических проявлений и изменений в слизистой оболочке дистального отдела толстой кишки.
Хронический шигеллез. Хроническое заболевание регистрируют в тех случаях, когда патологический процесс продолжается более 3 мес. Хронический шигеллез по клиническому течению подразделяют на две формы - рецидивирующую и непрерывную. При рецидивирующей форме периоды обострений сменяются ремиссией. Обострения характеризуются клинической симптоматикой, характерной для колитического или гастроэнтероколитического варианта острого шигеллеза, но слабой выраженностью интоксикации. При непрерывном течении колитический синдром не стихает, отмечают гепатомегалию. При хроническом шигеллезе на ректороманоскопии обнаруживают также умеренные воспалительные и атрофические изменения слизистой оболочки сигмовидной и прямой кишки.
Особенности шигеллеза Григорьева-Шиги. Протекает в основном тяжело, характеризуется острым началом, интенсивными схваткообразными болями в животе, ознобом, повышением температуры тела до 40 °С. Стул в первые сутки по внешнему виду напоминает мясные помои, затем объем испражнений уменьшается, появляется примесь крови и гноя. Отмечают тенезмы. В ряде случаев наблюдают ИТШ, сепсис с высевом возбудителя из крови, может развиться гемолитико-уремический синдром. Гиповолемический шок встречается при обильном стуле и раннем присоединении рвоты.
Осложнения: ИТШ, серозный (пропотевание кишечной стенки) или гнойный (при циркулярных некрозах или глубоких язвенных дефектах) перитонит, острый панкреатит, инвагинация кишечника.
Летальность
Летальность в России в 70-80-х гг. прошлого века не превышала 0,2%, в 90-е гг. за счет преобладания высокопатогенного возбудителя шигеллы Флекснера 2А летальность возросла в пять раз, а во время отдельных вспышек (Санкт-Петербург, 1992-1994) достигала 6%. С конца 90-х гг. отмечают снижение летальности.
Диагностика
Клинически диагноз шигеллеза можно установить только в случаях типичного колитического варианта течения болезни. Для уточнения диагноза в не подтвержденных лабораторно случаях проводят ректороманоскопию, которая во всех случаях шигеллеза выявляет картину колита (катарального, геморрагического или эрозивно-язвенного) с преимущественным поражением слизистой оболочки дистального отдела толстой кишки, часто сфинктерит. Гастроэнтеритический и гастроэнтероколитический варианты диагностируют только в случае лабораторного подтверждения. Наиболее достоверный метод лабораторной диагностики шигеллеза - выделение копрокультуры шигелл. Для исследования проводят забор частиц испражнений, содержащих слизь и гной (но не кровь), возможен забор материала из прямой кишки ректальной трубкой и при ректороманоскопии. Результаты бактериологического исследования можно получить не ранее чем через 3-4 дня после посева. Выделение гемокультуры имеет значение при шигеллезе Григорьева-Шиги. Диагноз может быть подтвержден также РПГА. Диагностическим считают нарастание антител в парных сыворотках, взятых в конце первой недели болезни и через 7-10 сут, и увеличение титра в четыре раза. Используют также ИФА, реакцию коагглютинации (РКА), возможно применение реакции агрегатгемаг-глютинации и РСК. Все большее значение приобретает ПЦР. Метод позволяет выявить ДНК шигелл в крови, кале и моче больного. Вспомогательный метод диагностики - копрологическое исследование, при котором обнаруживают повышенное содержание нейтрофилов, их скопления, наличие эритроцитов и слизи в мазке.
Дифференциальная диагностика
Чаще всего проводят с другими диарейными инфекциями, острой хирургической патологией органов живота, язвенным колитом, опухолями дистального отдела толстой кишки.
Лечение
Показания к госпитализации
При тяжелом и среднетяжелом течении показан постельный режим, при легком - палатный режим. В остром периоде при значительных кишечных расстройствах назначают стол № 4 по Певзнеру. При улучшении состояния, уменьшении дисфункции кишечника и появлении аппетита больных переводят на стол № 2 или № 13, а за 2-3 дня до выписки из стационара - на общий стол № 15.
Медикаментозная терапия
Этиотропная терапия
-
Назначать больному антибактериальный препарат необходимо с учетом данных регионарного мониторинга лекарственной устойчивости штаммов шигелл, выделяемых от больных в данной местности.
-
Продолжительность курса этиотропной терапии при среднетяжелой форме 3-4 дня, при тяжелой - 5-7 дней.
-
Комбинации из двух и более антибиотиков (химиопрепаратов) должны быть строго ограничены тяжелыми случаями заболевания.
-
При гастроэнтеритическом варианте шигеллеза этиотропное лечение не показано.
Больным с легкой формой шигеллеза в разгаре заболевания назначают фуразолидон в дозе 0,1 г 4 р/сут. При среднетяжелом течении шигеллеза у взрослых назначают препараты группы фторхинолонов: офлоксацин в дозе 0,2-0,4 г 2 р/сут или ципрофлоксацин в дозе по 0,25-0,5 г 2 р/сут; при тяжелом течении - офлоксацин в дозе по 0,4 г 2 р/сут или ципрофлоксацин по 0,5 г 2 р/сут; фторхинолоны в комбинации с ЦС II поколения (цефуроксим в дозе 1 г 3 р/сут) или III поколения (цефтазидим или цефоперазон по 1 г 3 р/сут). В первые 2-3 дня лечения препараты вводят парентерально, затем переходят на прием внутрь. Рифаксимин взрослым и детям старше 12 лет 200 мг 3 раза или 400 мг 2-3 р/сут до 7 сут.
Для лечения шигеллеза Григорьева-Шиги рекомендуют ампициллин и налидиксовую кислоту. Ампициллин вводят внутримышечно в суточной дозе 100-150 мг/кг каждые 4-6 ч в течение 5-7 дней. Налидиксовую кислоту назначают в дозе 1 г 4 р/сут в течение 5-7 дней.
При шигеллезе Флекснера и Зонне эффективен бактериофаг дизентерийный (Бактериофаг дизентерийный поливалентный♠). Препарат выпускают в жидком виде и в таблетках с кислотоустойчивым покрытием. Принимают за 1 ч до еды внутрь в дозе 30-40 мл 3 р/сут или по 2-3 таблетки 3 р/сут. Возможно ректальное введение жидкого бактериофага.
Патогенетические средства
-
Для связывания и выведения токсинов из кишечника назначают энтеросорбенты: лигнин гидролизный (Полифепан♠) по одной столовой ложке 3 р/сут, активированный уголь в дозе 15-20 г 3 р/сут, повидон (Энтеродез♠) по 5 г 3 р/сут, кремния диоксид коллоидный (Полисорб МП♠) по 3 г 3 р/сут, смектит диоктаэдрический (Смекта♠) по одному пакетику 3 р/сут.
-
Кишечные антисептики: оксихинолин (по одной таблетке 3 р/сут), Энтерол♠ - противодиарейный препарат биологического происхождения (из дрожжей Saccharomyces boulardii) назначают по 1-2 капсулы 2 р/сут.
-
Для коррекции и компенсации пищеварительной недостаточности применяют ферментные препараты: бетаин + пепсин (Ацидин-пепсин♠), панкреатин, Панзинорм 10 000♠ в сочетании с препаратами кальция (в дозе 0,5 г 2 р/сут).
-
В остром периоде для купирования спазма толстой кишки назначают дротаверин (Но-шпа♠) по 0,04 г 3 р/сут, препараты красавки [белладонны листьев экстракт + бензокаин (Белластезин♠), белладонны листьев экстракт + фенилсалицилат (Бесалол♠)].
Примерные сроки нетрудоспособности. При легкой форме - 7-10 дней, при среднетяжелой - до 16-18 дней, при тяжелой форме и осложнениях - до месяца и более. Пациентов из декретированной группы допускают к работе после получения двух отрицательных результатов бактериологического исследования испражнений.
Диспансерное наблюдение. Диспансерному наблюдению подлежат больные хронической дизентерией, работники пищевых предприятий и лица, к ним приравненные (в течение 3 мес, а при хронической дизентерии - в течение 6 мес).
Эшерихиозы
Эшерихиозы (Escherichioses, коли-инфекция, коли-энтерит, диарея путешественников) - группа бактериальных инфекционных болезней, вызываемых патогенными (диареегенными) штаммами кишечной палочки, протекающих с симптомами общей интоксикации и поражением ЖКТ с развитием гастроэнтерита или энтероколита, в редких случаях - как генерализованная форма болезни с внекишечными проявлениями.
Коды по МКБ-10
Этиология
Эшерихии - подвижные грамотрицательные палочки, аэробы, относятся к виду Escherichia coli, роду Escherichia, семейству Entero-bacteriaceae. Растут на простых питательных средах, выделяют бактерицидные вещества - колицины. Морфологически серовары не отличаются друг от друга. Диареегенные кишечные палочки подразделяются на 5 типов:
Эшерихии устойчивы в окружающей среде, могут месяцами сохраняться в почве, испражнениях. Сохраняют жизнеспособность в водопроводной воде от 2 до 262 дней, в речной - от 21 до 183 дней, в молоке - до 34 дней, в детских питательных смесях - до 92 дней, на игрушках - до 3-5 мес. Хорошо переносят высушивание. Обладают способностью размножаться в пищевых продуктах, особенно в молоке. Быстро погибают при воздействии дезинфицирующих средств, мгновенно - при кипячении, при 60 °С - через 10 мин. У многих штаммов Е. соli отмечается полирезистентность к антибиотикам.
Эпидемиология
Эшерихиоз - повсеместно распространенное заболевание, чаще диагностируется у детей до года, а у взрослых часто регистрируется как «диарея путешественников». В России ежегодно регистрируется от 17 до 20 тыс. случаев ОКИ, вызванных эшерихиями.
Основной источник эшерихиозов - больные стертыми формами заболевания, меньшую роль играют реконвалесценты и носители. Значимость последних возрастает, если они работают на предприятиях по приготовлению и реализации пищевых продуктов. По некоторым данным, источником возбудителя при энтерогеморрагических эшерихиозах (О157) может быть крупный рогатый скот и другие жвачные животные (овцы, козы, олени), а также другие млекопитающие (свиньи, лошади, кролики, собаки, кошки) и птицы (куры, индейки). Инфицирование людей происходит при употреблении продуктов, недостаточно термически обработанных.
Из пищевых продуктов эшерихии чаще передаются через молочные изделия, готовые мясные продукты, напитки (квас, компоты и др.). Все большее число вспышек эшерихиоза связано с употреблением в пищу фруктов и овощей (ростков шпината, латука, капусты, салата), инфицирование которых возможно в результате контакта с фекалиями домашних или диких животных на какой-либо стадии их обработки или выращивания. В детских коллективах и среди лиц, пренебрегающих правилами гигиены, возможно распространение кишечной палочки контактно-бытовым путем через загрязненные руки, предметы, игрушки. Реже регистрируется водный путь передачи эшерихиозов. Наиболее опасно загрязнение открытых водоемов, которое происходит в результате сброса необезвреженных хозяйственно-бытовых и сточных вод, особенно из детских учреждений и инфекционных больниц.
Восприимчивость к эшерихиозам высокая, особенно среди новорожденных и ослабленных детей. У взрослых восприимчивость повышается в связи с переездом в другую климатическую зону, изменением характера питания и т.д. («диарея путешественников»).
Эпидемический процесс, вызванный разными возбудителями Е. соli, может различаться. Заболевания, вызванные эшерихиями ЭТКП, чаще регистрируются в развивающихся странах тропических и субтропических регионов в виде спорадических случаев, а групповые случаи - среди детей 1-3 лет. Эшерихиозы, вызванные ЭТКП, выявляются больше в развивающихся странах тропического пояса. Чаще заболевания носят групповой характер среди детей 1-2 лет в летне-осенний период. ЭПКП вызывает спорадическую заболеваемость во всех климатических зонах, чаще среди детей до года, которые находились на искусственном вскармливании. Эшерихиозы, вызванные ЭГКП и ЭАКП, выявлены в странах Северной Америки и Европы среди взрослых и детей старше 1 года, характерна их летне-осенняя сезонность. Вспышки среди взрослых чаще отмечались в домах для престарелых
Меры профилактики
Основу профилактики составляют меры по пресечению путей передачи возбудителя. Особенно важно соблюдать санитарно-гигиенические требования на всех стадиях производственной цепи - от производства сельскохозяйственной продукции на фермах до переработки, обработки и приготовления пищевых продуктов как на коммерческих предприятиях, так и в домашних условиях, соблюдать условия и сроки хранения. Способом уничтожения бактерий в пищевых продуктах являются тепловая обработка, кипячение или пастеризация. Овощи и фрукты необходимо тщательно мыть, особенно если они употребляются в сыром виде. По возможности овощи и фрукты следует чистить. Предупреждать контактно-бытовой путь заражения в детских учреждениях, родильных домах, стационарах (использование индивидуальных стерильных пеленок, обработка рук дезинфицирующими растворами после работы с каждым ребенком, дезинфекция посуды, пастеризация, кипячение молока, молочных смесей).
Мероприятия в очаге эшерихиозов определены санитарно-эпидемиологическими правилами «Профилактика острых кишечных инфекций» СП3.1.1.1117-02. Госпитализация больного проводится по клиническим и эпидемиологическим показаниям. В очаге заболевания проводят текущую и заключительную дезинфекцию. Контактных лиц наблюдают в очаге заболевания в течение 7 дней (осмотр, опрос, наблюдение за характером стула, термометрия). Среди контактных лиц однократному бактериологическому обследованию подлежат работники декретированных профессий, дети, посещающие детские дошкольные учреждения, школы-интернаты, летние оздоровительные учреждения, а также дети в возрасте до 2 лет. При подозрении на эшерихиоз необходимо обследовать беременных до родов, рожениц, родильниц и новорожденных. Дети, контактирующие с больным эшерихиозом по месту жительства, допускаются в детские учреждения после разобщения с больным и получения троекратных отрицательных результатов бактериологического исследования кала.
При выявлении больных эшерихиозом в детских учреждениях и родильных домах прекращается прием поступающих детей и рожениц. Персонал, матери, дети, бывшие в контакте с больным, а также дети, выписанные домой незадолго до заболевания, обследуются троекратно (бактериологическое исследование кала). Лиц с положительными результатами обследования изолируют. Специфическая профилактика эшерихиозов не разработана.
Патогенез и патоморфология
Патогенетические звенья эшерихиозов представлены проникновением бактерий в организм с дальнейшим развитием патологического процесса в ЖКТ. Клиническая картина и морфологические изменения ЖКТ во многом зависят от штамма возбудителя. Энтеротоксигенные штаммы способны вырабатывать энтеротоксины, факторы адгезии и колонизации.
Энтеротоксины усиливают активность аденилатциклазы и гуанилатциклазы. При их участии и под действием стимулирующего действия простагландинов увеличивается образование цАМФ. В результате в просвет кишки секретируется большое количество воды и электролитов, которые не успевают реабсорбироваться в толстой кишке, развивается водянистая диарея с последующими нарушениями водно-электролитного баланса и развитием обезвоживания. Инфицирующая доза ЭТКП - 108-1010 микробных клеток.
ЭИКП цитотоксичны, способны к внутриклеточному паразитированию в клетках эпителия толстой кишки. Проникновение ЭИКП в слизистую оболочку приводит к развитию воспалительной реакции и образованию эрозий кишечной стенки. У больных в испражнениях появляются слизь, кровь и полиморфноядерные лейкоциты.
Инфицирующая доза ЭИКП - 5 × 105 микробных тел.
Механизм патогенности ЭПКП изучен недостаточно. У штаммов (055, 086, 0111 и др.) выявлен фактор адгезии, за счет которого обеспечивается колонизация тонкого кишечника. У других штаммов этот фактор не обнаружен. Инфицирующая доза ЭПКП - 108-1010 микробных тел.
ЭГКП продуцируют цитотоксин SLT (Shiga-like toxin), который вызывает разрушение клеток эндотелия мелких кровеносных сосудов кишечной стенки проксимальных отделов толстой кишки. Сгустки крови и фибрин приводят к нарушению кровоснабжения кишки, появлению в кале крови. Развивается ишемия кишечной стенки, вплоть до некроза. У некоторых больных наблюдается развитие ДВС-синдрома, ИТШ и ОПН. Наиболее тяжело протекает заболевание, вызванное штаммом 0157, при котором возможно развитие гемолитико-уремического синдрома (синдрома Гассера).
ЭАКП способны к колонизации эпителия тонкой кишки. Вызванные ими заболевания взрослых и детей протекают длительно, но легко. Это связано с тем, что бактерии прочно закрепляются на поверхности эпителиальных клеток.
Клиническая картина
Клиническая классификация эшерихиозов:
-
по этиологическим признакам: энтеропатогенньие эшерихиозы; энтеротоксигенные эшерихиозы; энтероинвазивные эшерихиозы; энтерогеморрагические эшерихиозы; энтероадгезивные эшерихиозы;
-
по форме заболевания: гастроэнтеритическая; энтероколитическая; гастроэнтероколитическая; генерализованная (коли-сепсис, менингиты, пиелонефриты, холециститы);
При эшерихиозе, вызванном энтеротоксигенными штаммами, инкубационный период - от 12 ч до 2-3 дней.
Заболевание начинается остро, больных беспокоят слабость, головокружение температура нормальная или субфебрильная. Появляются тошнота, повторная рвота, боли в животе схваткообразного характера, разлитые; стул частый, жидкий, обильный, водянистый, до 10-15 р/сут. Живот - вздут, при пальпации определяются урчание, небольшая болезненность.
Тяжесть течения определяется степенью дегидратации. Возможно обезвоживание I-II степени, в редких случаях - III степени в основном за счет упорной и обильной рвоты. Возможно (у детей) развитие молниеносной формы заболевания с быстрым развитием эксикоза. Интоксикация, лихорадка не характерны, длительность болезни 5-10 дней.
Энтероинвазивные эшерихии вызывают дизентериеподобное заболевание, которое протекает с симптомами общей интоксикации и преимущественным поражением толстой кишки. Инкубационный период - от 6 ч до 2-3 дней. Начало острое, характерны симптомы интоксикации - слабость, озноб, головная боль, мышечные боли, снижение аппетита, возможно повышение температуры до 38-39 °С, но у большей части больных температура нормальная или субфебрильная. Через несколько часов присоединяются симптомы поражения ЖКТ (боли в животе схваткообразного характера, преимущественно в нижней части живота, ложные позывы, тенезмы, жидкий стул до 10 раз и больше с примесью слизи и крови). При более тяжелом течении болезни стул в виде «ректального плевка». Сигма спазмирована, уплотнена и болезненна. При ректороманоскопии - катарально-геморрагический, эрозивный, иногда язвенный прокто-сигмоидит. Течение болезни доброкачественное. Лихорадка длится 1-2 дня, реже 3-4 дня. Длительность болезни 5-7 дней. Через 1-2 дня стул нормализуется, спазм и болезненность толстой кишки сохраняются 5-7 дней болезни. Восстановление слизистой оболочки толстой кишки наступает к 7-10-му дню болезни.
У детей энтеропатогенный эшерихиоз, вызываемый Е. coli I класса, протекает в форме различной тяжести энтеритов, энтероколитов, а у новорожденных и недоношенных детей - в септической форме. Для детей характерно острое начало болезни, температура 38-39 °С, слабость, рвота, водянистая диарея, стул желтого или оранжевого цвета, быстрое развитие токсикоза и эксикоза, снижение массы тела. Септическая форма заболевания протекает с выраженными симптомами интоксикации (повышение температуры, анорексия, срыгивание, рвота). Возникают множественные гнойные очаги.
Энтеропатогенный эшерихиоз, вызываемый Е. сoli II класса, регистрируется у взрослых и детей. Инкубационный период - 1-5 дней. Характерно острое начало заболевания (температура - 38-38,5 °С, озноб, нечастая рвота, боли в животе, стул без патологических примесей, жидкий, до 5-8 р/сут), течение доброкачественное. У некоторых больных отмечаются гипотония, тахикардия.
При эшерихиозе, вызванном энтерогеморрагическими штаммами, заболевание характеризуется синдромами общей интоксикации и поражением проксимального отдела толстой кишки. Инкубационный период - 1-7 дней, чаще от 2 до 4 сут. Заболевание начинается остро, с болей в животе, тошноты, рвоты, жидкого стула. Температура субфебрильная или нормальная, стул жидкий, до 4-5 раз в день, без примеси крови. Состояние больных ухудшается на 2-4-й день болезни - стул частый с примесью крови, утрачивает каловый характер, появляются тенезмы. При эндоскопическом исследовании выявляется катарально-геморрагический или фибринозно-язвенный колит. Более выражены изменения в области слепой кишки. Наиболее тяжело протекает заболевание, вызванное штаммом 0157:Н7. Инкубационный период от 1 до 4 сут, иногда удлиняется до 12 дней. Заболевание начинается остро, с болей схваткообразного характера в животе, которые локализуются больше в правой подвздошной области. Больных беспокоят тошнота, многократная рвота; повышение температуры тела не характерно. В первые дни болезни стул жидкий, без патологических примесей, до 15 р/сут, на 2-3-е сутки появляется примесь крови, боли в животе усиливаются. Длительность болезни 7-8 дней. У 35% больных через 6-8 дней от начала заболевания развивается гемолитико-уремический синдром.
Диагностика
Клиническая диагностика эшерихиозов затруднена в связи с большим сходством с другими кишечными инфекциями (шигеллезом, сальмонеллезом, холерой, иерсиниозом и др.), а при генерализованных формах болезни, поражении желчевыводящих и МВП не имеет каких-либо особенностей, поэтому основу подтверждения диагноза составляют анамнез, данные эпиданамнеза и лабораторные методы исследования.
Для оценки состояния больного важно выявить признаки сгущения крови, исследовать водно-электролитный обмен и кислотно-основное состояние крови больного. Для подтверждения диагноза проводят бактериологическое исследование рвотных масс, испражнений, мочи, ликвора, желчи, промывных вод желудка в первые дни болезни до назначения больным этиотропной терапии. Посевы производят на среды Эндо, Плоскирева, Левина, а также на среду обогащения Мюллера. Используются иммунологические методы исследования: РА, РНГА в парных сыворотках. Перспективным методом диагностики является ПЦР.
При серологическом исследовании возможны ложноположительные результаты из-за антигенного сходства с другими энтеробактериями и шигеллезными и сальмонеллезными антигенами, поэтому эти методы исследования не убедительны.
Инструментальные методы исследования (ректороманоскопия, колоноскопия) малоинформативны.
Дифференциальная диагностика
Дифференциальную диагностику эшерихиозов проводят с другими острыми диарейными инфекциями: холерой, шигеллезом, сальмонеллезом, кампилобактериозом, пищевыми токсикоинфекциями стафилококковой этиологии и вирусными диареями: ротавирусной, энтеровирусной, норавирусной инфекцией, хирургическими заболеваниями.
Лечение
Больные при среднетяжелом и тяжелом течении заболевания госпитализируются в инфекционные больницы. В легких случаях могут лечиться амбулаторно при наличии благоприятных бытовых, санитарно-гигиенических условий.
По эпидемиологическим показаниям госпитализации подлежат лица из декретированных групп, больные из организованных коллективов, а также пациенты, проживающие в коммунальной квартире, общежитии.
Госпитализируются больные, если в семье есть лица, относящиеся к декретированным группам.
В остром периоде болезни больным рекомендуется щадящая терапия (стол № 4, при нормализации стула - № 2, в период реконвалесценции - № 13).
В легких случаях заболевания при лечении на дому достаточно назначения оральной регидратационной терапии [глюкосоланρ, декстроза + калия хлорид + натрия хлорид + натрия цитрат (Цитра-глюкосолан♠¤), декстроза + калия хлорид + натрия хлорид + натрия цитрат (Регидрон♠) и др.], количество растворов должно в 1,5 раза превышать потери воды с испражнениями. Лицам, которые находятся в дороге, лучше использовать О.Р.С.
Показаны ферменты (панкреатин, креон).
Энтеросорбенты (Энтеросгель♠, Энтеродез♠, Полифепан♠, кремния диоксид коллоидный Полисорб МП♠) - в течение 1-3 дней. При легком течении болезни целесообразно использование кишечных антисептиков (энтеро-седивρ, Интетрикс♠, Неоинтестопан♠¤, Энтерол♠) в течение 5-7 дней. Легкие и стертые формы эшерихиозов не требуют назначения этиотропных препаратов.
При лечении больных в условиях стационара показан постельный режим в первые 2-3 дня. Назначается этиотропная терапия: ко-тримоксазол [сульфаметоксазол + триметоприм] по 2 таблетки 2 раза в день или препараты фторхинолонового ряда: ципрофлоксацин по 0,75 г 2 раза в сутки перорально, пефлоксацин по 0,4 г 2 раза в сутки, офлоксацин по 0,2 г 2 раза в сутки, длительность терапии - 5-7 дней, рифаксимин по 0,2-0,4 г 3 раза в сутки.
В тяжелых генерализованных случаях фторхинолоны применяются вместе с ЦС: цефтриаксон 1 × 1 раз внутривенно, цефтазидим 2 × 2 раза внутримышечно или внутривенно. Длительность лечения - 7 дней.
При дегидратации II-IV степени назначают регидратационную терапию внутривенно кристаллоидными растворами (Хлосоль♠, Ацесоль♠, Лактосол¤, Квартасольρ). Режим регидратации и оценки эффективности проводится по общим правилам.
Особенности лечения гемолитико-уремического синдрома: переливание отмытых одногруппных эритроцитов для коррекции тяжелой анемии (гемоглобин менее 50 г/л); при развитии ОПН используют гемодиализ, плазмаферез.
Сроки госпитализации. Реконвалесцентов выписывают после полного клинического выздоровления при отрицательных результатах бактериологического исследования кала. Для больных из декретированных групп необходимо наличие троекратного отрицательного бактериологического исследования кала, проведенного через 2 дня после окончания этиотропной терапии.
Диспансерное наблюдение
После выписки из стационара больные находятся на диспансерном наблюдении в КИЗ поликлиник в течение 1 мес. В конце срока наблюдения проводят двукратное бактериологическое исследование кала с интервалом 2-3 дня (лицам, относящимся к декретированным группам).
Дети, которые общались с больным эшерихиозом по месту жительства, допускаются в детские учреждения после разобщения с больным и получения отрицательных результатов троекратного бактериологического исследования кала.
Пищевые токсикоинфекции
Пищевые токсикоинфекции (ПТИ) (пищевые бактериальные отравления) - полиэтиологическая группа ОКИ, возникающих после употребления в пищу продуктов, контаминированных условно-патогенными бактериями, в которых произошло накопление микробной массы возбудителей и их токсинов.
Коды по МКБ-10
А05 Другие бактериальные пищевые отравления.
А05.0 Стафилококковое пищевое отравление.
А05.2 Пищевое отравление, вызванное Clostridium perfringens (Clostridium welchii).
А05.3 Пищевое отравление, вызванное Vibrio parahaemolyticus.
А05.4 Пищевое отравление, вызванное Bacillus cereus.
А05.8 Другие уточненные бактериальные пищевые отравления.
А05.9 Бактериальное пищевое отравление неуточненное.
Этиология
ПТИ объединяют большое количество этиологически различных, но патогенетически и клинически сходных болезней. Объединение ПТИ в отдельную нозологическую форму вызвано необходимостью унифицировать меры по борьбе с их распространением и эффективностью синдромального подхода к лечению. Наиболее часто регистрируют ПТИ, вызываемые следующими условно-патогенными микроорганизмами:
-
семейство Enterobacteriaceae род Сitrobacter, Klebsiella, Enterobacter, Hafnia, Serratia, Proteus, Edwardsiella, Erwinia;
-
семейство Bacillaceae род Clostridium, род Bacillus (в том числе вид B. сereus);
-
семейство Pseudomonaceae род Pseudomonas (в том числе вид Aeruginosa);
-
семейство Vibrionaceae род Vibrio, вид НАГ-вибрионы (неагглютинирующие вибрионы), V. parahaemoliticus.
Большинство вышеперечисленных бактерий обитают в кишечнике практически здоровых людей и многих представителей животного мира. Они устойчивы к действию физических и химических факторов окружающей среды; способны к размножению как в условиях живого организма, так и вне его, например в пищевых продуктах (в широком диапазоне температур).
Эпидемиология
Источниками возбудителей могут быть люди и животные (больные, носители), а также объекты окружающей среды (почва, вода). По эколого-эпидемиологической классификации ПТИ, вызванные условно-патогенной микрофлорой, относят к группе антропонозов (стафилококкоз, энтерококкоз) и сапронозов - водных (аэромоноз, плезиомоноз, НАГ-инфекция, парагемолитическая и альбинолитическая инфекции, эдвардсиеллез) и почвенных (цереус-инфекция, клостридиозы, псевдомоноз, клебсиеллез, протеоз, морганеллез, энтеробактериоз, эрвиниоз, гафния- и провиденция-инфекции).
Механизм передачи возбудителя - фекально-оральный; путь передачи - пищевой. Факторы передачи разнообразны. Обычно болезнь возникает после употребления пищи, контаминированной микроорганизмами, занесенными грязными руками в процессе приготовления; необеззараженной воды; готовой продукции (при нарушении правил хранения и реализации в условиях, способствующих размножению возбудителей и накоплению их токсинов). Протей и клостридии способны к активному размножению в белковых продуктах (холодце, заливных блюдах), B. сereus - в овощных супах, мясных и рыбных изделиях. В молоке, картофельном пюре, котлетах происходит быстрое накопление энтерококков. Галофильные и парагемолитические вибрионы, выживающие в морском осадке, инфицируют многих морских рыб и моллюсков. Стафилококк попадает в кондитерские изделия, молочные продукты, мясные, овощные и рыбные блюда от лиц, больных пиодермией, ангиной, хроническим тонзиллитом, заболеваниями дыхательных путей, пародонтозом и работающих на предприятиях общественного питания. Зоонозный источник стафилококка - животные, больные маститом.
Вспышки ПТИ имеют групповой, взрывной характер, когда в течение короткого времени заболевают большинство людей (до 90-100%), употреблявших инфицированный продукт. Часты семейные вспышки, групповые заболевания пассажиров морских судов, туристов, членов детских и взрослых организованных коллективов. Заболевания чаще всего регистрируют в теплое время года.
Естественная восприимчивость людей высокая. Более восприимчивы новорожденные, пациенты после хирургических вмешательств, длительно получающие антибиотики, больные, страдающие нарушениями желудочной секреции. Иммунитет после перенесенных заболеваний кратковременный и видоспецифичный.
Профилактика
Основное профилактическое и противоэпидемическое мероприятие - санитарно-гигиенический мониторинг за эпидемиологически значимыми объектами: источниками водоснабжения, водопроводной и канализационной сетями, очистными сооружениями; предприятиями, связанными с приготовлением, хранением, транспортировкой и реализацией пищевых продуктов. Необходимо внедрение современных методов обработки и хранения продуктов; усиление санитарного контроля над соблюдением технологии приготовления (от переработки до реализации), сроков и условий хранения скоропортящихся продуктов, медицинского контроля за состоянием здоровья работников общественного питания. Особое внимание следует уделять санитарно-ветеринарному контролю на предприятиях мясомолочной промышленности.
В очаге ПТИ для выявления источника инфекции обязательно нужно проводить бактериологические и серологические исследования у лиц декретируемых профессий.
Патогенез
Основное значение имеет интоксикация бактериальными экзо- и эндотоксинами возбудителей, содержащимися в продукте.
Комплексное воздействие микроорганизмов и их токсинов, продуктов распада возбудителя, медиаторов воспаления приводит к возникновению местных (гастрит, гастроэнтерит) и общих (лихорадка, миалгия и др.) симптомов болезни. Имеет значение возбуждение хеморецепторной зоны рвотного центра. При продолжительной рвоте возможно развитие гипохлоремического алкалоза.
Энтерит вызывают энтеротоксины, выделяемые следующими бактериями: Proteus, B. cereus, Klebsiella, Enterobacter, Aeromonas, Edwardsiella, Vibrio. Вследствие нарушения синтеза и равновесия биологически активных веществ в энтероцитах, повышения активности аденилатциклазы происходит усиление синтеза цАМФ. Энергия, высвобождаемая при этом, стимулирует секреторную функцию энтероцитов, в результате усиливается выход изотонической жидкости, в просвет тонкой кишки. Возникает диарея, ведущая в сочетании с рвотой к нарушениям водно-электролитного баланса, изотонической дегидратации. В тяжелых случаях возможно развитие дегидратационного (гиповолемического) шока. Колитический синдром появляется обычно при микст-инфекциях с участием патогенной флоры. В патогенезе стафилококковых пищевых отравлений имеет значение действие энтеротоксинов A, B, C1, C2, D и E.
Сходство патогенетических механизмов при ПТИ различной этиологии обусловливает общность клинических симптомов и определяет схему терапевтических мероприятий.
Клиническая картина
Инкубационный период - от 2 ч (при ПТИ стафилококковой этиологии - от 30 мин) до 1 сут. Острый период болезни - от 12 ч до 5 сут, после чего наступает период реконвалесценции. В клинической картине на первый план выступают общая интоксикация, обезвоживание и гастроинтестинальный синдром.
Классификация ПТИ
Первые симптомы ПТИ - озноб, повышение температуры тела, боль в животе, тошнота, рвота, жидкий стул. О развитии острого гастрита свидетельствуют обложенный белым налетом язык, рвота съеденной пищей, затем - слизью с примесью желчи, тяжесть и боль в эпигастральной области.
У 4-5% больных обнаруживают только признаки острого гастрита. Боль в животе носит схваткообразный характер. О развитии энтерита свидетельствует диарея, возникающая у 95% больных. Испражнения обильные, водянистые, зловонные, светло-желтого или коричневого цвета; имеют вид болотной тины. Живот при пальпации мягкий, болезненный в эпигастральной области и в средней части. Частота актов дефекации отражает тяжесть течения болезни. Признаки колита: схваткообразная боль в нижних отделах живота (чаще слева), примесь слизи, редко - крови в испражнениях.
Лихорадка наблюдается у 60-70% больных, чаще субфебрильная; у части больных достигает 38-39 °С, редко - 40 °С. Продолжительность лихорадки - от нескольких часов до 2-4 дней. Клинические признаки интоксикации - бледность кожного покрова, одышка, мышечная слабость, озноб, головная боль, боли в суставах и костях, тахикардия, артериальная гипотензия.
Стафилококковое пищевое отравление вызывают энтеротоксигенные штаммы стафилококков. Они устойчивы к воздействию факторов окружающей среды, переносят высокие концентрации соли и сахара. Энтеротоксины стафилококка выдерживают прогревание до 100 °С в течение 1-2 ч. По внешнему виду, вкусу и запаху продукты, контаминированные стафилококком, неотличимы от доброкачественных. Энтеротоксин устойчив к действию пищеварительных ферментов, что делает возможным его всасывание в желудке. Он способствует значительному снижению АД, активирует моторику желудка и кишечника. Начало заболевания острое, бурное. Инкубационный период - от 30 мин до 4-6 ч. Интоксикация резко выражена, температура тела обычно повышена до 38-39 °С, но может быть нормальной или пониженной. Характерна интенсивная боль в эпигастральной области. Отмечают также слабость, головокружение, тошноту. У 50% больных наблюдают многократную рвоту (в течение 1-2 сут), диарею (на протяжении 1-3 сут). При тяжелом течении возникает острейший гастроэнтерит (острый гастроэнтероколит). Характерны тахикардия, глухость тонов сердца, артериальная гипотензия, олигурия. Возможна кратковременная потеря сознания. Длительность заболевания от нескольких часов до 2-3 сут.
У подавляющего большинства больных заболевание заканчивается выздоровлением, но у ослабленных пациентов и лиц старческого возраста возможно развитие псевдомембранозного колита и стафилококкового сепсиса. Наиболее тяжелое осложнение - ИТШ.
Пищевое отравление токсином клостридий возникает после употребления продуктов, обсемененных клостридиями и содержащих их токсины. Клостридии обнаруживают в почве, испражнениях людей и животных. Отравления обусловлены употреблением загрязненных мясных продуктов домашнего приготовления, мясных и рыбных консервов. В консервах, инфицированных клостридиями (Cl. perfringens), происходит накопление газа - «бомбаж», они приобретают запах и привкус прогорклого масла. Заболеванию свойственно тяжелое течение. Токсины повреждают слизистую оболочку кишечника, нарушают всасывание. При попадании в кровь происходит связывание токсинов с митохондриями клеток печени, почек, селезенки, легких, повреждается сосудистая стенка и развиваются геморрагии.
Клостридиоз протекает в виде острого гастроэнтероколита с признаками интоксикации и обезвоживания. Инкубационный период 2-24 ч. Заболевание начинается с интенсивных, колющих болей в животе. При легком и среднетяжелом течении отмечают повышение температуры тела, многократную рвоту, жидкий стул (до 10-15 раз) с примесью слизи и крови, болезненность живота при пальпации. Продолжительность заболевания 2-5 сут.
Возможны следующие варианты тяжелого течения.
-
Острейший гастроэнтероколит: выраженные признаки интоксикации, желтушность кожного покрова, рвота, диарея (более 20 р/сут), примесь слизи и крови в испражнениях, резкая болезненность живота при пальпации, увеличение печени и селезенки, уменьшение количества эритроцитов и содержания гемоглобина, увеличение концентрации свободного билирубина. При прогрессировании заболевания - тахикардия, артериальная гипотензия, анаэробный сепсис, ИТШ.
-
Холероподобное течение - острейший гастроэнтероколит в сочетании с обезвоживанием I-III степени.
-
Развитие некротических процессов в тонкой кишке, перитонита на фоне острого гастроэнтероколита с характерным стулом типа мясных помоев.
Осложнения
Летальность низкая. Основные причины летальных исходов - инфаркт миокарда и острая коронарная недостаточность, тромбоз мезентериальных артерий, ишемический инфаркт мозга, пневмония, де гидратационный шок, ИТШ.
Диагностика
Основана на клинической картине болезни, групповом характере заболевания, связи с употреблением определенного продукта при нарушении правил его приготовления, хранения или реализации.
Для подтверждения диагноза ПТИ необходимо выделить один и тот же микроорганизм из испражнений больного и продуктов, являющихся предполагаемым источником инфекции. При этом учитывают массивность роста, фаговую и антигенную однотипность, антитела к выделенному штамму микроорганизмов, обнаруженные у реконвалесцентов. Диагностическую ценность имеет постановка РА с аутоштаммом в парных сыворотках и 4-кратным нарастанием титра (при протеозе, цереозе, энтерококкозе), однако эти исследования имеют ретроспективное значение.
При подозрении на стафилококкоз и клостридиоз проводят идентификацию токсинов в рвотных массах, испражнениях и подозрительных продуктах. Энтеротоксические свойства выделенной культуры стафилококка определяют при помощи биопробы.
Бактериологическое подтверждение требует 2-3 сут. Серологическую диагностику проводят в парных сыворотках для определения этиологии ПТИ ретроспективно (с 7-8-го дня). Общий анализ крови, мочи, инструментальная диагностика (ректо- и колоноскопия) малоинформативны.
Дифференциальная диагностика
Диагностику проводят с другими острыми диарейными инфекциями, отравлениями химическими веществами, ядами и грибами, острыми хирургическими заболеваниями органов брюшной полости, терапевтическими заболеваниями, у пожилых людей - с инфарктом миокарда.
Лечение
Больным с тяжелым и среднетяжелым течением, социально неустроенным лицам при течении ПТИ любой степени тяжести показана госпитализация в инфекционный стационар.
Рекомендована щадящая диета (стол № 2, 4) с исключением из рациона молока, консервированных продуктов, копченостей, острых и пряных блюд, сырых овощей и фруктов.
Лечение начинают с промывания желудка теплым 2% раствором натрия гидрокарбоната (Натрия бикарбонат♠) или водой. Процедуру проводят до отхождения чистых промывных вод. Промывание желудка противопоказано при высоком АД, лицам, страдающим ИБС, язвенной болезнью желудка, при наличии симптомов шока, подозрении на ИМ.
Основа лечения больных ПТИ - регидратационная терапия, которая проводится по общим правилам.
Медикаментозная терапия: энтеросорбенты (полифелон, энтеродоз, полисорб); индометацин, кальция глюконат, панкреатин, интестопан.
Прогноз в большинстве случаев благоприятный при своевременном оказании медицинской помощи. Причины редких летальных исходов - шок и ОПН.
Осложнения. Мезентериальный тромбоз, ИМ, острое нарушение мозгового кровообращении, дегидратационный и ИТШ, ОПН.
Холера
Холера (cholera) - острая антропонозная инфекционная болезнь с фекально-оральным механизмом передачи возбудителя, для которой типична обильная диарея с быстрым развитием обезвоживания. В связи с возможностью массового распространения относится к карантинным, опасным инфекциям.
Коды по МКБ-10
А00.0 Холера, вызванная холерным вибрионом 01, биовар cholerae.
А00.1 Холера, вызванная холерным вибрионом 01, биовар eltor.
А00.9 Холера неуточненная.
Этиология
Возбудитель холеры Vibrio cholerae относится к роду Vibrio семейства Vibrionaceae.
Холерный вибрион представлен двумя биоварами, сходными по морфологическим и тинкториальным свойствам (биовар собственно холеры и биовар Эль-Тор). Возбудители холеры представляют собой короткие изогнутые грамотрицательные палочки (1,5-3 мкм длиной и 0,2-0,6 мкм диаметром), высокоподвижные благодаря наличию полярно расположенного жгутика. Спор и капсул не образуют. Холерные вибрионы Эль-Тор, в отличие от классических биологических вариантов, способны гемолизировать эритроциты барана.
Холерные вибрионы хорошо выживают при низкой температуре; во льду сохраняются до 1 мес, в морской воде - до 47 сут, в речной воде - от 3-5 дней до нескольких недель, в почве - от 8 дней до 3 мес, в испражнениях - до 3 сут, на сырых овощах - 2-4 дня, на фруктах - 1-2 дня. Холерные вибрионы при 80 °С погибают через 5 мин, при 100 °С - моментально; высокочувствительны к кислотам, высушиванию и действию прямых солнечных лучей, под действием хлорамина и других дезинфектантов погибают через 5-15 мин, долго сохраняются и даже размножаются в открытых водоемах и сточных водах, богатых органическими веществами.
Эпидемиология
Источник возбудителя инфекции - человек (больной и вибриононоситель). Особенно опасны сохраняющие социальную активность больные со стертой и легкой формами болезни.
Механизм передачи инфекции - фекально-оральный. Пути передачи - водный, алиментарный, контактно-бытовой. Водный путь имеет решающее значение для быстрого эпидемического и пандемического распространения холеры. При этом не только питье воды, но также использование ее для хозяйственных нужд, купание в зараженном водоеме, а также употребление рыбы, раков, креветок, устриц, выловленных там и не прошедших термической обработки, могут приводить к заражению холерой. Восприимчивость к холере всеобщая. Наиболее подвержены заболеванию люди со сниженной кислотностью желудочного сока. После перенесенной болезни вырабатывается кратковременный антимикробный и антитоксический иммунитет продолжительностью 1-3 года.
Эпидемический процесс характеризуется острыми взрывными вспышками, групповыми заболеваниями и отдельными завозными случаями. Благодаря широким транспортным связям систематически происходит занос холеры на территорию свободных от нее стран. Описано шесть пандемий холеры. В настоящее время продолжается седьмая пандемия, вызванная вибрионом Эль-Тор.
Классическая холера распространена в Индии, Бангладеше, Пакистане, холера Эль-Тор - в Индонезии, Таиланде и других странах Юго-Восточной Азии, V. parahaemolyticus - в Европе, Азии, Америке, Африке, Австралии и Новой Зеландии, V. vulnificus широко распространена в прибрежных морских водах. V. choleraenon O1/О139 широко распространены в природе, являются естественными обитателями пресных и умеренно соленых водоемов, их обнаруживают в различных климатических регионах, но наиболее часто в Южном, Юго-Восточном и Юго-Западном регионах с жарким, тропическим и умеренным климатом, Vibriocholerae O1 Ogawa.
На территории России регистрируются завозные случаи. За последние 20 лет отмечено более 100 случаев завоза в семь регионов страны. Главная причина - туризм (85%). Отмечены случаи холеры среди иностранных граждан. Наиболее тяжелой была эпидемия холеры в Дагестане в 1994 г., где было зарегистрировано 2359 случаев. Инфекцию занесли паломники, совершавшие хадж в Саудовскую Аравию.
Общее количество случаев заболевания холерой в мире за последние 15 лет варьирует от 20 до 690 тыс. человек, число умерших от 2000 до 8000.
Как и для всех кишечных инфекций, для холеры в странах с умеренным климатом свойственна летне-осенняя сезонность.
Меры профилактики
Неспецифическая профилактика
Направлена на обеспечение населения доброкачественной питьевой водой, обеззараживание сточных вод, санитарную очистку и благоустройство населенных мест, информирование населения. Сотрудники системы эпидемиологического надзора проводят работу по предупреждению заноса возбудителя и распространения его на территории страны в соответствии с правилами санитарной охраны территории, а также плановое исследование воды открытых водоемов на наличие холерного вибриона в зонах санитарной охраны водозаборов, местах массового купания, акваториях портов и т.д.
Проводятся анализ данных о заболеваемости холерой, осмотр и бактериологическое обследование (по показаниям) граждан, прибывших из-за рубежа.
Согласно международным эпидемиологическим правилам, за лицами, прибывающими из неблагополучных по холере стран, устанавливается пятидневное наблюдение с однократным бактериологическим обследованием.
В очаге проводятся комплексные противоэпидемические мероприятия, включающие госпитализацию заболевших и вибриононосителей, изоляцию контактировавших и медицинское наблюдение за ними в течение 5 дней с 3-кратным бактериологическим обследованием. Проводят текущую и заключительную дезинфекцию.
Экстренная профилактика включает применение антибактериальных препаратов (доксициклин, фторхинолоны, хлорамфеникол, бисептол, фурозолидон + канамицин).
Специфическая профилактика
Для специфической профилактики применяют вакцину холерную бивалентную химическую (Россия) в таблетированной форме. Вакцинацию проводят по эпидемическим показаниям. Международное свидетельство о вакцинации против холеры действительно в течение 6 мес после вакцинации или ревакцинации.
Патогенез
Входными воротами возбудителя является пищеварительный тракт. Заболевание развивается лишь тогда, когда возбудители преодолевают желудочный барьер (обычно это наблюдается в периоде базальной секреции, когда pH желудочного содержимого близок к 7), достигают тонкой кишки, где начинают интенсивно размножаться и выделять экзотоксин - энтеротоксин (холероген), который связывается со специфическим рецептором энтероцитов - ганглиозидом. Под действием нейраминидазы из ганглиозида образуется специфический рецептор. Холерогенспецифический рецептор активирует аденилатциклазу, которая инициирует синтез цАМФ, который регулирует посредством ионного насоса секрецию воды и электролитов из клетки в просвет кишечника. В результате слизистая оболочка тонкой кишки начинает секретировать огромное количество изотонической жидкости, которая не успевает всасываться в толстой кишке, - развивается изотоническая диарея. Присоединение рвоты увеличивает объем потерь жидкости.
Сокращается объем циркулирующей крови, происходит ее сгущение. Жидкость перераспределяется из интерстициального во внутри-сосудистое пространство. Возникают гемодинамические расстройства, нарушения микроциркуляции, следствием которых становятся дегидратационный шок и ОПН. Развивается метаболический ацидоз, который сопровождается судорогами. Гипокалиемия вызывает аритмию, гипотензию, изменения в миокарде и атонию кишечника.
Клиническая картина
Инкубационный период от нескольких часов до 5 сут, чаще 2-3 дня.
Классификация
По выраженности клинических проявлений различают стертую, легкую, средней тяжести, тяжелую и очень тяжелую формы, определяющиеся степенью обезвоживания, которая оценивается по классификации В.И. Покровского (см. табл. 11-2).
Основные симптомы и динамика их развития
Заболевание начинается остро, без лихорадки и продромальных явлений, с внезапного позыва на дефекацию и отхождения кашицеобразных или с самого начала водянистых испражнений.
В последующем эти императивные позывы повторяются. Испражнения теряют каловый характер, полупрозрачные, мутновато-белой окраски, иногда с плавающими хлопьями серого цвета, без запаха или с рыбным запахом. Больной отмечает урчание и неприятные ощущения в пупочной области.
У больных легкой формой холеры дефекация повторяется не чаще 3-5 р/сут, общее самочувствие остается удовлетворительным, незначительны ощущения слабости, жажды, сухости во рту. Длительность болезни ограничивается 1-2 днями.
При средней тяжести (обезвоживание II степени) болезнь прогрессирует, к диарее присоединяется рвота, нарастающая по частоте. Рвотные массы имеют такой же вид, как и испражнения. Характерно, что рвота не сопровождается каким-либо напряжением и тошнотой. С присоединением рвоты эксикоз быстро прогрессирует. Жажда становится мучительной, язык сухим, с «меловым налетом», кожа, слизистые оболочки глаз и ротоглотки бледнеют, тургор кожи снижается. Стул до 10 р/сут, обильный, в объеме не уменьшается, а увеличивается. Возникают единичные судороги икроножных мышц, кистей, стоп, жевательных мышц, нестойкий цианоз губ и пальцев рук, охриплость голоса. Развиваются умеренная тахикардия, гипотензия, олигурия, гипокалиемия. Заболевание в этой форме длится 4-5 дней.
Тяжелая форма холеры (III степень обезвоживания) характеризуется резко выраженными признаками эксикоза вследствие обильного (до 1-1,5 л за одну дефекацию) стула, который становится таким уже с первых часов болезни, и такой же обильной и многократной рвоты. Больных беспокоят болезненные судороги мышц конечностей и живота, которые по мере развития болезни переходят от редких клонических в частые и даже сменяются тоническими судорогами. Голос хриплый, тихий. Тургор кожи снижается, собранная в складку кожа долго не расправляется. Кожа кистей и стоп становится морщинистой («рука прачки»). Лицо принимает характерный вид: заострившиеся черты, запавшие глаза, цианоз губ, ушных раковин, мочек ушей, носа.
При пальпации живота определяют шум плеска жидкости. Пальпация безболезненна. Появляется тахипноэ, нарастает тахикардия до 110-120 в минуту. Пульс слабого наполнения («нитевидный»), тоны сердца глухие, АД прогрессивно падает ниже 90 мм рт.ст., сначала систолическое, затем диастолическое и пульсовое. Температура тела нормальная, мочеотделение уменьшается и вскоре прекращается. Сгущение крови выражено умеренно. Показатели относительной плотности плазмы, индекса гематокрита и вязкости крови на верхней границе нормы или умеренно увеличены. Выражены гипокалиемия плазмы и эритроцитов, гипохлоремия, умеренная компенсаторная гипернатриемия плазмы и эритроцитов.
Очень тяжелая форма холеры (ранее называвшаяся алгидной) отличается бурным внезапным развитием болезни, начинающейся с массивных беспрерывных дефекаций и обильной рвоты. Через 3-12 ч у больного развивается тяжелое состояние алгида, которое характеризуется снижением температуры тела до 34-35,5 °С, крайним обезвоживанием (больные теряют до 12% массы тела - дегидратация IV степени), одышкой, анурией и нарушениями гемодинамики по типу гиповолемического шока. К моменту поступления больных в стационар у них развивается парез мышц желудка и кишечника, вследствие чего прекращаются рвота (сменяется судорожной икотой), появляется зияние ануса, свободное истечение кишечного содержимого из ануса при легком надавливании на переднюю брюшную стенку. Понос и рвота возникают вновь на фоне или после окончания регидратации. Больные находятся в состоянии прострации. Дыхание частое, поверхностное. Окраска кожи приобретает пепельный оттенок (тотальный цианоз), появляются «темные очки вокруг глаз», глаза запавшие, афония. Кожа холодная и липкая на ощупь, легко собирается в складку и длительное время (иногда в течение часа) не расправляется («холерная складка»).
Тяжелые формы чаще отмечаются в начале и в разгаре эпидемии. В конце вспышки и в межэпидемическое время преобладают легкие и стертые формы, малоотличимые от форм диареи другой этиологии. Клиническая картина холеры у детей имеет некоторые особенности: часто повышается температура тела, более выражены апатия, адинамия, склонность к эпилептиформным припадкам вследствие быстрого развития гипокалиемии. Длительность заболевания колеблется от 3 до 10 дней, последующие проявления его зависят от адекватности заместительного лечения электролитами.
Осложнения
Вследствие нарушений гемостаза и микроциркуляции у больных старших возрастных групп наблюдают инфаркт миокарда, мезентериальный тромбоз, острую недостаточность мозгового кровообращения. Возможны флебиты (при катетеризации вен), у тяжелых больных нередко возникает пневмония.
Диагностика
Клинический диагноз при наличии эпидемиологических данных и характерной клинической картины (начало болезни с диареи с последующим присоединением рвоты, отсутствие болевого синдрома и лихорадки, характер рвотных масс) не сложен, однако легкие, стертые формы болезни, особенно единичные случаи, часто просматриваются. В этих ситуациях решающее значение имеет лабораторная диагностика.
Основным методом лабораторной диагностики холеры является бактериологическое исследование. В качестве материала используют испражнения и рвотные массы, на вибриононосительство исследуют испражнения; у лиц, погибших от холеры, берут лигированный отрезок тонкой кишки и желчного пузыря.
При проведении бактериологического исследования материал должен быть доставлен в лабораторию в течение первых 3 ч; если это невозможно, используют среды-консерванты (щелочная пептонная вода и др.). Материал собирают в индивидуальные отмытые от дезинфицирующих растворов судна, на дно которых помещают меньший по размерам, обеззараженный кипячением сосуд или листы пергаментной бумаги. В лаборатории материал засевают на жидкие и плотные питательные среды для выделения и идентификации чистой культуры. Результаты экспресс-анализа получают через 2-6 ч (ориентировочный ответ), ускоренного анализа - через 8-22 ч (предварительный ответ), полного анализа - через 36 ч (заключительный ответ).
Серологические методы имеют вспомогательное значение и могут применяться в основном для ретроспективной диагностики. С этой целью может быть использована микроагглютинация в фазовом контрасте, РНГА, но лучше - определение титра вибриоцидных антител или антитоксинов (антитела к холерогену определяют ИФА или иммунофлюоресцентным методом).
Дифференциальная диагностика
Дифференциальную диагностику проводят с другими инфекциями, сопровождающимися диареей (ПТИ, шигеллез, эшерихиоз, вирусные диареи).
Лечение
Обязательной госпитализации подлежат все больные холерой или с подозрением на нее. Специальной диеты для больных холерой не требуется.
Медикаментозная терапия
Основные принципы терапии:
Лечение необходимо начинать в первые часы от начала болезни.
Патогенетические средства
Терапия включает первичную регидратацию (возмещение потерь воды и солей до начала лечения) и корригирующую компенсаторную регидратацию (коррекция продолжающихся потерь воды и электролитов). Регидратация рассматривается как реанимационное мероприятие. В приемном покое в течение первых 5 мин у больного необходимо измерить частоту пульса, АД, массу тела, взять кровь для определения гематокрита или относительной плотности плазмы крови, содержания электролитов, кислотно-основного состояния, коагулограммы, а затем начать струйное введение солевых растворов.
Объем растворов, вводимых взрослым, рассчитывают по следующим формулам.
Формула Коэна:
V = 4(или 5) × P × (Htб - Htн),
где V - определяемый дефицит жидкости (мл); P - масса тела больного (кг); Htб - гематокрит больного; Htн - гематокрит в норме; 4 - коэффициент при разнице гематокрита до 15, а 5 - при разнице более чем 15.
Формула Филлипса:
V = 4(8) × 1000 × P × (X - 1,024),
где V - определяемый дефицит жидкости (мл); P - масса тела больного (кг); Х - относительная плотность плазмы больного; 4 - коэффициент при плотности плазмы больного до 1,040, а 8 - при плотности выше 1,041.
Полиионные растворы, предварительно подогретые до 38-40 °С, вводят внутривенно со скоростью 80-120 мл/мин при III-IV степени обезвоживания. При наличии сопутствующей сердечной патологии жидкость вводят с меньшей скоростью. Для лечения используют различные полиионные растворы. Наиболее физиологичны Трисоль♠ (5 г натрия хлорида, 4 г натрия гидрокарбоната и 1 г калия хлорида); Ацесоль♠ (5 г натрия хлорида, 2 г натрия ацетата, 1 г калия хлорида на 1 л апирогенной воды); Хлосоль♠ (4,75 г натрия хлорида, 3,6 г натрия ацетата и 1,5 г калия хлорида на 1 л апирогенной воды) и раствор Лактасол♠ (6,1 г натрия хлорида, 3,4 г натрия лактата, 0,3 г натрия гидрокарбоната, 0,3 г калия хлорида, 0,16 г кальция хлорида и 0,1 г магния хлорида на 1 л апирогенной воды).
Струйную первичную регидратацию осуществляют с помощью катетеризации центральных или периферических вен. После восполнения потерь, повышения АД до физиологической нормы, восстановления диуреза, прекращения судорог скорость инфузии уменьшают до необходимой, чтобы компенсировать продолжающиеся потери. Введение растворов - решающее в терапии тяжелобольных. Через 4-6 ч состояние больного значительно улучшается, он начинает самостоятельно пить. Каждые 2 ч необходимо проводить контроль гематокpитa крови больного (или относительной плотности плазмы крови), а также содержания электролитов крови для коррекции инфузионной терапии.
Не следует вводить большие количества 5% раствора декстрозы (Глюкозы♠), так как уменьшается концентрация электролитов, особенно калия, в плазме. Не показано также переливание крови и кровезаменителей. Использовать коллоидные растворы для регидратационной терапии недопустимо, так как они способствуют развитию внутриклеточной дегидратации, ОПН и синдрома шокового легкого.
Пероральная регидратация необходима больным холерой, у которых нет рвоты. Комитет экспертов ВОЗ рекомендует следующий состав: 3,5 г натрия хлорида, 2,5 г натрия гидрокарбоната, 1,5 г калия хлорида, 20 г декстрозы (Глюкозы♠), 1 л кипяченой воды (раствор оралитρ). Добавление декстрозы (Глюкозы♠) способствует всасыванию натрия и воды в кишечнике. Экспертами ВОЗ предложен и другой регидратационный раствор, в котором гидрокарбонат заменен более стойким цитратом натрия [декстроза + калия хлорид + натрия хлорид + натрия цитрат (Регидрон♠)].
В России разработан препарат глюкосоланρ, который идентичен глюкозо-солевому раствору ВОЗ.
Водно-солевую терапию прекращают после появления испражнений калового характера при отсутствии рвоты и преобладания количества мочи над количеством испражнений в последние 6-12 ч.
Этиотропная терапия
Антибиотики - дополнительное средство терапии, они не влияют на выживаемость больных, но сокращают продолжительность клинических проявлений холеры и ускоряют эрадикацию возбудителя. Рекомендуемые препараты и схемы их применения представлены в табл. 16-2, 16-3. Применяют один из перечисленных препаратов.
| Препарат | Разовая доза, г | Кратность применения в сутки | Средняя суточная доза, г | Курсовая доза, г |
|---|---|---|---|---|
Ломефлоксацин |
0,4 |
1 |
0,4 |
2 |
Норфлоксацин |
0,4 |
2 |
0,8 |
4 |
Офлоксацин |
0,2 |
2 |
0,4 |
2 |
Пефлоксацин |
0,4 |
2 |
0,8 |
4 |
Рифампицин + триметоприм |
0,3 |
2 |
0,6 |
3 |
0,8 |
0,16 |
0,8 |
||
Ципрофлоксацин |
0,25 |
2 |
0,5 |
2,5 |
Тетрациклин |
0,3 |
4 |
1,2 |
6,0 |
Доксициклин |
0,2 |
1 |
0,2 |
1 |
Хлорамфеникол (Левомицетин♠) |
0,5 |
4 |
2 |
10 |
Триметоприм + сульфаметоксазол |
0,16 |
2 |
0,32 |
1,6 |
0,8 |
1,6 |
8 |
| Препарат | Разовая доза, г | Кратность применения в сутки | Средняя суточная доза, г | Курсовая доза, г |
|---|---|---|---|---|
Амикацин |
0,5 |
2 |
1,0 |
5 |
Гентамицин |
0,08 |
2 |
0,16 |
0,8 |
Доксициклин |
0,2 |
1 |
0,2 |
1 |
Канамицин |
0,5 |
2 |
1 |
5 |
Хлорамфеникол (Левомицетин♠) |
1 |
2 |
2 |
10 |
Офлоксацин |
0,4 |
1 |
0,4 |
2 |
Ципрофлоксацин |
0,2 |
2 |
0,4 |
2 |
Сизомицин |
0,1 |
2 |
0,2 |
1 |
Тобрамицин |
0,1 |
2 |
0,2 |
1 |
Триметоприм + сульфаметоксазол |
0,16 0,8 |
2 |
0,32 1,6 |
1,6 8 |
Диспансеризация
Выписку больных холерой (вибриононосителей) производят после клинического выздоровления, завершения регидратационной и этиотропной терапии и получения трех отрицательных результатов бактериологического исследования кала.
Перенесших холеру или вибриононосительство после выписки из стационаров допускают к работе (учебе), независимо от профессии ставят на учет в территориальных отделах эпидемиологического надзора и КИЗ поликлиник по месту жительства. Диспансерное наблюдение осуществляется в течение 3 мес. Перенесшие холеру подлежат бактериологическому обследованию на холеру: в первый месяц проводят бактериологическое исследование испражнений один раз в 10 дней, в дальнейшем - один раз в месяц.
При выявлении вибриононосительства у реконвалесцентов их госпитализируют для лечения в инфекционную больницу, после чего диспансерное наблюдение за ними возобновляют.
Перенесших холеру или вибриононосительство снимают с диспансерного учета, если холерные вибрионы не выделяются на протяжении диспансерного наблюдения.
Заболевания, вызываемые НАГ-вибрионами*
Иерсиниозы
Иерсиниозы - группа сапрозоонозных бактериальных инфекционных болезней, преимущественно с фекально-оральным механизмом передачи возбудителя, вызываемых микроорганизмами рода Yersinia. Характеризуются полиморфизмом клинических проявлений, интоксикацией, экзантемой, поражением ЖКТ и суставов, склонностью к рецидивирующему, затяжному и хроническому течению с формированием иммунопатологических синдромов.
Род Yersinia относится к семейству Enterobacteriaceae и включает 11 видов. Наиболее значимы в этиологии заболеваний человека Y. pestis, Y. enterocolitica и Y. pseudotuberculosis. Иерсинии - грамотрицательные подвижные овоидной формы бактерии, имеющие перетрихиально расположенные жгутики, факультативные анаэробы. Растут на простых питательных средах, оптимум роста - +22-29 °С, могут размножаться при +4-6 °С, т.е. в условиях бытовых холодильников, овощехранилищ.
Иерсиниоз
Иерсиниоз (кишечный иерсиниоз, англ. yersiniosis) - сапрозооноз с фекально-оральным механизмом передачи возбудителя. Характеризуется развитием интоксикационного синдрома, преимущественным поражением ЖКТ, при генерализованной форме - полиорганными поражениями. Возможность обострения, рецидивы и хроническое течение болезни.
Код по МКБ-10
А04.6 Энтерит, вызванный Y. enterocolitica.
Этиология
Возбудитель - Yersinia enterocolitica. Представляет собой гетеротрофный факультативно-анаэробный микроорганизм. Растет на простых питательных средах. Сохраняет жизнеспособность в широком температурном диапазоне: от 40 до -30 °С. Оптимальная температура роста: 22-28 °С. Активно размножается в условиях бытового холодильника и овощехранилищ (от +4 до +6 °С).
В развитии заболевания ведущую роль отводят факторам патогенности Y. enterocolitica: адгезии, колонизации на поверхности кишечного эпителия, энтеротоксигенности, инвазивности и цитотоксичности. Большинство штаммов неинвазивны. Не все инвазивные штаммы способны к внутриклеточному размножению. Этим объясняют разнообразие форм и вариантов болезни.
Возбудитель погибает при высыхании, кипячении, воздействии солнечного света и различных химических веществ (хлорамин, сулема, пероксид водорода, спирт). Пастеризация и кратковременное воздействие температуры до 80 °С не всегда приводят к гибели Y. enterocolitica. Чувствительны к фторхинолонам, доксициклину, хлорамфениколу.
Эпидемиология
Естественный резервуар иерсиний - почва. Животным и птицам отводят роль вторичного резервуара и источника инфекции. Основные из них - грызуны, сельскохозяйственные животные (свиньи, рогатый скот, кролики), птицы и домашние животные (кошки, собаки).
Основной механизм передачи заболевания - фекально-оральный. Человек инфицируется при употреблении воды и продуктов, контаминированных иерсиниями (овощи, молоко, молочные продукты). На территориях с жарким климатом около 80% всех вспышек связано с питьем зараженной воды.
Восприимчивость высокая. К группам риска относят лиц, работающих в животноводстве, птицеводстве и на пищеблоках. Истинная иммунная прослойка среди населения в разных регионах составляет 10-20%. Постинфекционный иммунитет внутривидовой, типоспецифический.
Иерсиниоз регистрируют повсеместно. Наиболее часто - в странах Западной и Северной Европы, в Великобритании, США, Канаде, Японии и России, реже - в Африке, Азии, Южной Америке и Восточной Европе. Фактическая заболеваемость в России значительно выше, чем официально регистрируемая. Подъем начинается в марте и продолжается 4-5 мес, резко снижаясь к августу и повторно возрастая в конце года.
Меры профилактики
Специфическая профилактика не разработана.
Неспецифическую профилактику проводят в нескольких направлениях:
-
осуществление широкой санитарно-просветительной работы среди населения;
-
соблюдение санитарно-гигиенических правил на продовольственно-пищевых объектах, источниках водоснабжения, водопроводных и канализационных системах и территориях населенных пунктов;
-
проведение дератизации на полях, складах, животноводческих фермах, в овощехранилищах, магазинах, столовых не менее двух раз в год;
-
соблюдение противоэпидемических мер при уходе за больными иерсиниозом и гигиенических правил при уходе за животными.
Патогенез
Основная масса бактерий преодолевает защитный барьер желудка. Развивается катарально-эрозивный, реже катарально-язвенный гастродуоденит. Затем развитие патологического процесса может пойти в двух направлениях: либо возникнут воспалительные изменения только в кишечнике, либо разовьется генерализованный процесс с лимфо- и гематогенной диссеминацией возбудителя.
Проникновение иерсиний в мезентериальные узлы вызывает развитие абдоминальной формы с мезентериальным лимфаденитом, терминальным илеитом или острым аппендицитом. Гастроинтестинальная и абдоминальная формы заболевания могут быть или самостоятельными, или одной из фаз генерализованного процесса.
При адекватном иммунном ответе заболевание заканчивается выздоровлением. Механизмы формирования затяжного течения и вторично-очаговых форм иерсиниоза недостаточно изучены. Ведущую роль отводят формирующимся уже в остром периоде болезни иммунопатологическим реакциям, длительной персистенции Y. enterocolitica и наследственным факторам. В течение 5 лет после острого иерсиниоза у части больных формируются системные заболевания (аутоиммунный тиреоидит, болезнь Крона, синдром Рейтера, ревматоидный артрит и др.).
Клиническая картина
Инкубационный период длится от 15 ч до 6 сут, чаще 2-3 дня.
Классификация
Из-за полиморфизма клинических проявлений до сих пор нет общепринятой классификации иерсиниоза. Используется клиническая классификация Н.Д. Ющука и соавт., в основу которой положен синдромальный принцип (табл. 16-4).
| Форма заболевания | Клинический вариант | Степень тяжести | Характер течения |
|---|---|---|---|
Гастроинтестинальная |
Гастроэнтерит, энтероколит, гастроэнтероколит |
Легкая, средняя |
Острое |
Абдоминальная |
Мезентериальный лимфаденит, терминальный илеит, острый аппендицит |
Средняя, тяжелая |
Острое, затяжное |
Генерализованная |
Смешанный, септический |
Средняя, тяжелая |
Затяжное, хроническое |
Вторично-очаговая |
Артрит(ы), узловая эритема, синдром Рейтера и др. |
Основные симптомы и динамика их развития
В большинстве случаев болезнь начинается с симптомов острого гастроэнтерита, а затем протекает либо как острая кишечная, либо как генерализованная инфекция. Для всех форм иерсиниоза характерны острое начало, лихорадка, симптомы интоксикации, боли в животе, диарея, экзантема, миалгия, артралгия, лимфоаденопатия и склонность к волнообразному течению. Кроме манифестных форм, встречаются стертые. Течение болезни может быть острым (до 3 мес), затяжным (3-6 мес) и хроническим (свыше 6 мес).
Гастроинтестинальная форма (гастроэнтерит, энтероколит, гастроэнтероколит) встречается наиболее часто. Заболевание начинается остро, больных беспокоят боли в животе различной интенсивности, постоянного или схваткообразного характера, локализующиеся в эпигастрии, вокруг пупка, реже в правой подвздошной области. Стул учащен, иногда с примесью слизи и крови. У части больных наблюдают КРС, дизурические симптомы, экзантему. Возможны симптомы «перчаток» и «носков». На 2-6-е сутки болезни преимущественно на кистях, ладонях, стопах, груди и бедрах появляется точечная, пятнисто-папулезная или уртикарная сыпь, после которой остается шелушение. Отмечают гиперемию или бледность кожи лица, склерит, гиперемию конъюнктив и слизистой оболочки полости рта, полиаденопатию. Язык на 5-6-й день становится «малиновым». При пальпации живота - болезненность в правой подвздошной области, увеличение печени, реже - селезенки. Температура нормализуется на 4-5-й день. Типичных изменений гемограммы нет.
Болезнь чаще протекает в среднетяжелой форме. Иногда единственный клинический симптом болезни - диарея. Выздоровление наступает в большинстве случаев через 1-2 нед. Возможны волнообразное течение, рецидивы и обострения.
Абдоминальная форма развивается у 3,5-10% больных (мезентериальный лимфаденит, терминальный илеит, острый аппендицит).
Наиболее частый вариант - острый аппендицит. Начало болезни сходно с гастроинтестинальной формой. Через 1-3 дня появляются (или усиливаются) боли в правой подвздошной области или вокруг пупка. Заболевание может начинаться с интенсивных болей в животе. Аппендикулярная симптоматика сопровождается лихорадкой, лейкоцитозом, иногда симптомами раздражения брюшины. Формы аппендицита: катаральный, флегмонозный или гангренозный.
Мезентериальный лимфаденит может развиться при любой форме иерсиниоза, однако его симптомы преобладают при абдоминальной форме. Больных беспокоят нерезкие боли в правой подвздошной области, возникающие на 2-4-й день на фоне лихорадки и диареи и сохраняющиеся до 2 мес.
Для терминального илеита характерны лихорадка, постоянная ноющая боль в правой подвздошной области и явления энтероколита. При лапароскопии в правом нижнем квадранте живота обнаруживают воспаленный и отечный дистальный отдел подвздошной кишки с брыжеечным аденитом. Обычно явления терминального илеита исчезают через 2-6 нед. Прогноз благоприятный.
У больных с абдоминальной формой возможны экзантема, артралгия и миалгия, шелушение кожи ладоней, пальцев рук и стоп, полиаденопатия, гепато- и гепатоспленомегалия.
Абдоминальная форма может осложниться перитонитом, стенозом терминального отдела подвздошной кишки и спаечной болезнью. Возможно длительное течение (несколько месяцев и даже лет) с рецидивами и обострениями.
Генерализованная форма может протекать по смешанному или септическому варианту. При смешанном варианте чаще всего заболевание начинается остро. Развиваются лихорадка и симптомы интоксикации в сочетании с катаральными явлениями. Затем появляются тупые боли в эпигастрии и вокруг пупка, тошнота. Стул становится кашицеобразным или жидким, без патологических примесей; возможна рвота. Лихорадочный период обычно длится не более 2 нед. Полиморфная сыпь появляется на 2-3-й день болезни и сохраняется в течение 3-6 дней, возможны подсыпания и зуд. Со 2-й недели появляется шелушение. Артралгия возникает обычно на первой неделе, боли различные по интенсивности и продолжительности, носят волнообразный характер. Поражаются крупные (коленные, плечевые, голеностопные) и мелкие (лучезапястные, фаланговые) суставы. У части больных процесс сопровождается воспалением подошвенного и/или подпяточного апоневроза. Артрит развивается редко. На рентгенограмме изменений в суставах, как правило, нет. Характерны симптомы «капюшона», «перчаток» и «носков», тонзиллит, конъюнктивит и склерит. Возможна неинтенсивная желтуха. В легких могут выслушиваться сухие хрипы. При пальпации живота часто определяется болезненность в правом подреберье, правой подвздошной области и книзу от пупка. Часто наблюдают полиаденопатию, гепатомегалию, реже - спленомегалию.
При длительном течении генерализованной формы возможны боли в области сердца, тахикардия (даже при нормальной температуре). Пульс и АД лабильные. На ЭКГ и эхокардиографии - признаки инфекционной кардиопатии или миокардита. Возможно развитие специфической мелкоочаговой пневмонии, увеита, иридоциклита и усиление симптомов поражения ЦНС (головокружение, нарушение сна, вялость, адинамия, негативизм). В редких случаях обнаруживают менингеальный синдром. Некоторые больные жалуются на рези при мочеиспускании.
Течение болезни в большинстве случаев благоприятное. Наблюдают рецидивы и обострения, протекающие легче, чем первая волна болезни, с преобладанием симптомов локальных поражений: артралгии (артрит) и боли в животе.
Период реконвалесценции обычно длительный. В начале наблюдают астеновегетативные расстройства. При генерализованной форме возможны развитие иерсиниозного миокардита, гепатита, пиелонефрита, менингита (менингоэнцефалита).
Септический вариант генерализованной формы встречается редко и, как правило, у лиц с тяжелыми сопутствующими заболеваниями и иммунодефицитными состояниями. Течение не отличается от течения сепсиса другой этиологии. Летальность, достигающая 60%, обусловлена ИТШ, диффузным илеитом с перфорацией кишечника, перитонитом, полиорганной недостаточностью. Период реконвалесценции длительный.
Вторично-очаговая форма может развиться после любой формы иерсиниоза. Предшествующее ей заболевание либо протекает субклинически, либо первые проявления и возникшие затем очаговые поражения отделены друг от друга длительным периодом (до нескольких лет), в течение которого самочувствие пациента остается удовлетворительным. В этих случаях первым клиническим признаком иерсиниоза будет поражение какого-либо одного органа (сердце, печень и др.).
Проявлениями вторично-очаговой формы иерсиниоза могут быть артрит, синдром Рейтера, узловатая эритема, затяжной или хронический энтероколит, шейный лимфаденит, офтальмит, конъюнктивит и остеит. Наиболее частый вариант - артритический, отличающийся от смешанного варианта генерализованной формы более интенсивными и продолжительными артралгиями (артритами), которым в большинстве случаев предшествуют диспепсические явления и симптомы интоксикации. У большинства больных развивается полиартрит. Чаще поражаются межфаланговые, лучезапястные, межпозвоночные, лопаточно-ключичные и тазобедренные, при моноартрите - коленный, голеностопный или локтевой суставы. Характерно асимметричное поражение суставов нижних конечностей и односторонний сакроилеит. В гемограмме - эозинофилия и увеличение СОЭ. Иерсиниозный артрит часто сочетается с кардитом.
Диагностика
В гемограмме при генерализованной форме обнаруживают лейкоцитоз, палочкоядерный сдвиг, эозинофилию (до 7%), лимфопению и увеличение СОЭ. Специфическая лабораторная диагностика включает бактериологические, иммунологические и серологические методы. Основной метод - бактериологический. Материал от больного высевают на среды накопления, затем на плотные питательные среды (желательно на две одновременно): на среду Эндо и буферно-казеиново-дрожжевую среду - с последующей идентификацией культуры. Одновременно исследуют не менее четырех субстратов (например, фекалии, мочу, кровь, смыв с задней стенки глотки).
Иммунологические методы позволяют обнаружить антигены Y. enterocolitica в клиническом материале до 10-го дня от начала болезни [ИФА, реакция коагглютинации, РИФ, РНИФ, реакция агглютинации и лизиса (РАЛ), иммуноблоттинг], эффективна ПЦР.
Серологические методы используют со второй недели болезни в парных сыворотках с интервалом 10-14 дней одновременно 2-3 методами.
Дифференциальная диагностика. В зависимости от клинических особенностей иерсиниоза дифференциальный диагноз проводится с ПТИ, шигеллезом, ВГ, ревматизмом.
Лечение
Показания к госпитализации
Клинические (тяжесть болезни, развитие осложнений, наличие тяжелых преморбидных заболеваний) и эпидемиологические (вспышка и пациенты, относящиеся к группе риска).
При тяжелом течении режим постельный, назначают столы № 4, 2 и 13.
Медикаментозная терапия (табл. 20-19)
Антибактериальную терапию назначают всем больным, независимо от формы болезни, в максимально ранние сроки. Выбор препарата зависит от чувствительности штаммов иерсиний, циркулирующих на данной территории.
При развитии симптомов острого живота при абдоминальной форме проводят аппендэктомию.
Примерные сроки нетрудоспособности от 14-21 дня до 4-6 мес.
Продолжительность диспансерного наблюдения реконвалесцентов должна составлять не менее одного года через 1, 3, 6 и 12 мес после острого периода.
Псевдотуберкулез
Псевдотуберкулез (англ. pseudotuberculosis) - сапрозооноз с фекально-оральным механизмом передачи возбудителя. Характеризуется полиморфизмом клинических проявлений, интоксикацией, лихорадкой, поражением ЖКТ, печени, кожи и суставов.
Клиническая форма |
Клинический вариант |
Этиoтpoпнoe лечение |
Патогенетическое лечение |
||
|---|---|---|---|---|---|
препарат |
схема |
препарат |
схема |
||
Гacтpoинтecтинaльнaя |
Гастроэнтерит, энтероколит, гacтpoэнтepoкoлит |
Ципpoфлoкcaцин |
1-1,5 г/cyт; по 0,5-0,75 г 2 раза в день п/o |
Полиионные растворы (квapтacoль ρ, Xлocoль♠, Aцecoль♠ и др.) |
Объем peгидpaтaции и способ введения определяются степенью обезвоживания и массой тела больного |
Коллоидные растворы (Γeмoдeз♠, Peoпoлиглюкин♠ и др.) |
400-1000 мл/cyт в/в кaпeльнo |
||||
5 (10)% раствор декстрозы (Глюкозы♠) |
400-1000 мл/cyт в/в кaпeльнo |
||||
Абдоминальная |
Терминальный илeит, мeзaдeнит, острый аппендицит |
Ципpoфлoкcaцин |
1-1,5 г/cyт; по 0,5-0,75 г 2 раза в день в/м |
Aнтигиcтaминныe препараты: лopaтaдин 0,01 г/cyт однократно; клeмacтин 0,002-0,004 г/cyт; по 0,001 г 2 раза (утром и вечером перед едой) или по 2 мл 0,1 % раствора 2 раза в день; xлopoпиpaмин 0,05-0,075 г/cyт; по 0,025 г 2-3 раза в день во время еды. Курс лечения зависит от эффективности, в среднем 10-20 дней |
|
Доксициклин |
0,1-0,2 г/cyт; в 1-й день - 0,2 г однократно, затем 0,1 г/cyт в течение 10-14 дней |
||||
Тетрациклин |
1,2 г/cyт; по 0,3 г 4 раза в день пepopaльнo, 10-14 дней |
||||
Гeнтaмицин |
120-180 мг/cyт; по 40-60 мг 3 раза в день в/м, 10 дней |
||||
Цeфaзoлин |
2-4 г/cyт; по 0,5-1 г 3-4 раза в день в/м, 10 дней |
||||
Генерализованная |
Смешанный, средней степени тяжести |
Ципpoфлoкcaцин |
1 г/cyт, по 0,5 г 2 раза в день, в/м |
Коллоидные растворы, растворы декстрозы (Глюкоза♠) и aнтигиcтaминныe препараты. Дозы и схемы как при гacтpoинтecтинaльнoй и абдоминальной форме. HПBC:
Препараты, стимулирующие метаболические процессы:
Курс лечения зависит от эффективности и переносимости, в среднем 20-40 дней |
|
ЦC III поколения (цeфoпepaзoн, цeфтaзидим, цeфтpиaкcoн и др.) |
2 г/cyт, по 1,0 г 2 раза в день в/м или в/в |
||||
Дoкcициклин, тетрациклин, цeфaзoлин |
Дозы и схемы см. выше |
||||
Xлopaмфeникoл |
70-100 мг/кг в сутки в четыре приема в/м |
||||
Пeфлoкcaцин |
800 мг/cyт; по 400 мг два раза в день пepopaльнo |
||||
Смешанный, тяжелое течение |
ЦC (цeфoпepaзoн, цeфтaзидим, цeфтpиaкcoн и др.) |
6-8 г/cyт, по 3-4,0 г 2 раза в день в/в 10-14 дней |
|||
Ципpoфлoкcaцин |
400-800 мг/cyт в/в, 10-14 дней |
||||
Гeнтaмицин |
2,4-3,2 мг/кг в/м в 2-3 приема в течение 2-3 дней, затем 0,8-1,2 мг/кг в сутки в 2-3 приема в течение 10 дней |
||||
Септический |
Одновременно 2-3 антибактериальных препарата |
ЦC, фтopxинoлoны, aминoгликoзиды, в/в введение 10-14 дней |
|||
Вторично-очаговая |
Назначают по показаниям |
Дозы и схемы приема антибактериальных препаратов см. выше |
HПBC; препараты, стимулирующие метаболические процессы (см. выше). Иммунокорректоры: мeглyминa aкpидoнaцeтaт по 2 мл 12,5% (250 мг) 1 раз в день, в/м, по схеме: 1, 2, 4, 6, 8, 11, 14, 17, 20, 23, 26 и 29-е сутки; apгинил-aльфa-acпapтил-лизил-вaлил-тиpoзил-apгинин (Имyнoфaн♠) по 1,0 мл один раз в день с интервалом 3 дня, 8-10 инъекций; aзoкcимep 6 мг/cyт, первые 2 дня ежедневно, затем через 3 дня в/м, №10. Ректальные свечи - из расчета 0,1-0,2 мг/ (ĸr×cyт), первые 3 дня ежедневно, затем через 3-4 дня перед сном после опорожнения кишечника, № 10; aминoдигидpoфтaлaзиндиoн натрия: в первые сутки вводят 200 мг однократно, затем по 100 мг/cyт через 3-4 дня в/м, № 10 При длительном суставном синдроме и признаках системности: хлорохин 0,25-0,5 г/cyт; первые 10 дней по 0,25 г 2 раза в день (после обеда и ужина), затем однократно после ужина, длительно, не менее 6 мес; гидpoкcиxлopoxин 0,8 г/cyт, по 0,4 г 2 раза в день после еды, длительно, не менее 6 мес; cyльфacaлaзин 2 г/cyт по схеме: 1 -я неделя - по 0,5 г 1 раз вечером; 2-я неделя - 1 г/cyт (по 0,5 г 2 раза в день, утром и вечером), 3-я неделя - 1,5 г/cyт (0,5 г утром и 1 г вечером), с 4-й недели - 2 г/cyт (по 1 г утром и вечером) строго после еды. Курс 6-12 мес |
||
Коды по МКБ-10
А28.2 Псевдотуберкулез.
А04.8 Энтероколит псевдотуберкулезный.
Этиология
Y. pseudotuberculosis имеет жгутиковый (Н) антиген, два соматических (О) антигена (S и R) и антигены вирулентности - V и W.
Ведущую роль в развитии псевдотуберкулеза отводят факторам патогенности, способности к адгезии, колонизации на поверхности кишечного эпителия, инвазивности, способности к внутриклеточному размножению в эпителиальных клетках и макрофагах и цитотоксичности.
Эпидемиология
Для псевдотуберкулеза характерно многообразие источников и резервуаров инфекции. Первичный резервуар - почва. Существование почвенных и водных паразитарных систем связано со способностью иерсиний переходить в «некультивируемые» формы. Вторичным резервуаром и основными источниками инфекции для человека являются грызуны, у которых заболевание протекает в острой и хронической формах с поражением ЖКТ. У домовых мышей чаще развиваются генерализованные формы, вызывающие гибель животных. Люди при контакте с грызунами заражаются крайне редко.
Главный механизм передачи - фекально-оральный. Пути - пищевой и водный. Основные факторы передачи Y. pseudotuberculosis - овощи и зелень, употребляемые без термической обработки, соления (квашеная капуста, соленые огурцы, помидоры), реже - фрукты, молочные продукты и вода. Возможно заражение воздушно-пылевым путем через пыль, контаминированную возбудителем.
Восприимчивость высокая, постинфекционный иммунитет стойкий, типоспецифический.
Псевдотуберкулез относят к широко распространенным инфекциям, встречающимся повсеместно. РФ относится к эндемичным территориям. Чаще вспышки регистрируют в Центральной части и на северо-западе РФ, Крайнем Севере, Дальнем Востоке и Субарктике Евразии. Подъемы заболеваемости регистрируют в весенне-летний (III-V месяцы), осенне-зимний (X-XII месяцы) и летний (V-VII месяцы) периоды.
Меры профилактики
Профилактика псевдотуберкулеза аналогична таковой иерсиниоза.
Патогенез
Внедрение Y. pseudotuberculosis начинается в слизистой оболочке миндалин, что клинически проявляется острым тонзиллитом. Значительная часть возбудителя, преодолев желудочный барьер, колонизирует эпителий преимущественно лимфоидных образований подвздошной и слепой кишки. Затем возбудитель проникает в эпителий слизистой оболочки кишки и преодолевает эндотелий кровеносных сосудов - развиваются первичная бактериемия и гематогенная диссеминация. Далее происходит генерализация инфекции, характеризующаяся диссеминацией возбудителя в органы и ткани, размножение в них и развитие системных нарушений. Размножение Y. pseudotuberculosis в эпителиоцитах и макрофагах приводит к разрушению этих клеток, развитию язв и внеклеточному размножению иерсиний в центре формирующихся милиарных абсцессов во внутренних органах.
Максимальные клинико-морфологические изменения развиваются во вторичных очагах: в печени, легких, селезенке, илеоцекальном углу кишечника и регионарных ЛУ. В связи с этим любая клиническая форма заболевания начинается как генерализованная инфекция.
В период реконвалесценции происходит освобождение от возбудителя и восстанавливаются нарушенные функции органов и систем. Y. pseudotuberculosis элиминируется поэтапно: сначала из кровеносного русла, затем из легких, печени и других органов. Длительно иерсинии сохраняются в ЛУ и селезенке. Цитопатическое действие бактерий и их длительная персистенция в ЛУ и селезенке могут привести к повторной бактериемии, клинически проявляющейся обострениями и рецидивами.
У 9-25% больных, перенесших псевдотуберкулез, формируются синдром Рейтера, болезнь Крона, Шегрена, хронические заболевания соединительной ткани, аутоиммунные гепатиты, эндо-, мио-, пери- и панкардиты, тромбоцитопении и др.
Клиническая картина
Классификация
| Клиническая форма | Вариант | Степень тяжести | Течение |
|---|---|---|---|
Абдоминальная |
Мезентериальный лимфаденит Терминальный илеит Острый аппендицит |
Легкая, средняя |
Острое (до 3 мес) |
Смешанная |
Скарлатиноподобный Септический |
Средняя, тяжелая |
Острое, затяжное (до 6 мес) |
Вторично-очаговая |
Артрит(ы) Узловатая эритема Синдром Рейтера и др. |
Средняя, тяжелая |
Затяжное, хроническое (свыше 6 мес) |
Основные симптомы и динамика их развития
Инкубационный период продолжается от 1 до 19 дней (в среднем 5-10 дней).
Начальный период длится от 6-8 ч до 2-5 дней. У большинства больных болезнь начинается остро, иногда бурно. Общее самочувствие резко ухудшается. Температура тела быстро повышается до 38-40 °С, часто с ознобом. Беспокоят сильная головная боль, головокружение, резкая слабость, бессонница, артралгии, миалгии, боли в пояснице, потливость. Больные адинамичны. Нередко появляются признаки острого респираторного синдрома. При осмотре обнаруживают симптомы «капюшона», «перчаток», «носков»; инъекцию сосудов склер. Слизистая оболочка ротоглотки гиперемирована, у некоторых больных - «пылающий» зев, энантема на мягком небе, катаральный тонзиллит. Язык с 3-5-х суток болезни становится «малиновым». У некоторых больных - боли в животе, тошнота, рвота и жидкий стул.
Период разгара составляет 3-10 дней (максимально - месяц) и характеризуется выраженностью симптомов конкретной клинической формы и интоксикации.
Смешанная форма характеризуется сыпью, появляющейся у большинства больных на 2-7-й дни болезни. Чаще сыпь скарлатиноподобная, но может быть полиморфной, петехиальной, мелко- и крупнопятнистой, уртикарной, эритематозной, везикулярной и в виде узловатой эритемы, иногда зудит. Скарлатиноподобная сыпь обильная, расположена на груди, спине, животе, конечностях и лице, на бледном фоне сгущается в естественных складках. Пятнисто-папулезная и уртикарная сыпь нередко группируется вокруг коленных, локтевых, голеностопных суставов. Сыпь может появиться в первые сутки болезни, а все остальные симптомы - присоединяться позже. В этих случаях слегка зудящая, пятнисто-папулезная экзантема обычно локализуется на подошвах, кистях, стопах. Как правило, она сохраняется в течение 3-6 дней, узловатая эритема - несколько недель. Возможны подсыпания. Со второй недели болезни начинается крупно- или мелкопластинчатое шелушение кожи. Артралгии и миалгии часто усиливаются. Чаще поражаются коленные, голеностопные, локтевые, межфаланговые и лучезапястные, реже - плечевые, тазобедренные, межпозвоночные и челюстно-височные суставы. Продолжительность артралгии - от 4-5 дней до 2-3 нед. Болевой синдром и гиперестезия кожи вообще характерны для псевдотуберкулеза. Диспепсические и катаральные явления сохраняются или усиливаются в периоде разгара.
Со 2-4-го дня болезни лицо бледное, особенно в области носогубного треугольника, часто бывают субиктеричность кожи и склер и полиаденопатия.
В период разгара сохраняются или впервые появляются боли в животе. При пальпации у большинства больных определяют болезненность в правой подвздошной области, в правом подреберье и над лобком. Почти у всех больных увеличена печень, иногда - селезенка. Диарея бывает редко. Стул чаще нормальный или задержан. Изменения со стороны ЦНС, сердечно-сосудистой и мочевыводящей системы при смешанном варианте псевдотуберкулеза не отличаются от изменений при иерсиниозе. В периоде разгара температура достигает максимума; постоянная, волнообразная или неправильного типа. Продолжительность лихорадочного периода от 2-4 дней до нескольких недель.
О начале реконвалесценции свидетельствуют улучшение самочувствия, постепенная нормализация температуры, восстановление аппетита, исчезновение сыпи, болей в животе и суставах. Нередко сохраняется субфебрильная температура.
При всех клинических формах заболевания обострения и рецидивы чаще возникают у больных, не получавших антибактериальной терапии.
Септический вариант смешанной формы псевдотуберкулеза встречается редко. Течение не отличается от сепсиса при иерсиниозе. Летальность достигает 30-40%.
Скарлатиноподобный вариант наиболее распространен. Характеризуется выраженной интоксикацией, лихорадкой и обильной точечной сыпью, которая локализуется на груди, животе, боковых поверхностях тела, руках и нижних конечностях, нередко с геморрагиями, сгущающаяся в кожных складках и вокруг крупных суставов. Сыпь в большинстве случаев не зудит, появляется на l-4-й (реже на 5-6-й) дни болезни. Экзантема чаще точечная на нормальном фоне кожи. Симптом «жгута» положительный. У большинства больных наблюдают также симптомы «перчаток», «носков» и «капюшона». Характерны бледный носогубный треугольник, «малиновый» язык, яркая гиперемия лица, миндалин, дужек и стойкий белый дермографизм. Боли в суставах, животе и диспепсические явления не типичны.
Абдоминальная форма чаще встречается у детей. Основные клинические проявления - сильные, постоянные или приступообразные боли в правой подвздошной области или вокруг пупка, им может предшествовать эпизод острого энтероколита с лихорадкой. У некоторых больных заболевание сразу начинается с резких болей в илеоцекальной области, в результате чего их госпитализируют в хирургическое отделение с подозрением на острый аппендицит.
Мезентериальный лимфаденит характеризуется острым началом с высокой температурой, ознобом и усиливающимися болями в животе. Пациенты жалуются на тошноту, рвоту, стул жидкий без патологических примесей. У некоторых обнаруживают гиперемию лица, шеи и груди, точечную сыпь на коже груди, живота, конечностей и паховых складок. При тяжелом течении появляются напряжение мышц в правой подвздошной области и перитонеальные симптомы. При лапароскопии видны увеличенные ЛУ брыжейки диаметром до 3 см, гиперемия подвздошной кишки с фибринозным налетом на серозной оболочке. Характерен ложноаппендикулярный синдром, требующий дифференцировать мезентериальный лимфаденит с острым аппендицитом.
Острый аппендицит может проявляться симптомами, которые могут быть первыми клиническими проявлениями псевдотуберкулеза или появляющимися через несколько дней (недель) после начала болезни. Боль локализуется преимущественно в правой подвздошной области, постоянная. Пациентов беспокоят тошнота и рвота. Лихорадка неправильного типа. Выражена локальная болезненность, аппендикулярные симптомы, симптомы раздражения брюшины.
Терминальный илеит бывает первым проявлением заболевания, но чаще развивается в период рецидивов или ремиссии. Характерны боль в животе, напряжение мышц правой подвздошной области, симптомы раздражения брюшины, тошнота, повторная рвота, жидкий стул 2-3 р/сут. Иногда умеренное увеличение печени. Может сформироваться хронический илеит, клинически проявляющийся во время рецидивов и обострений. Рецидивы при абдоминальной форме встречаются чаще, чем при других формах псевдотуберкулеза.
Клинико-лабораторные признаки псевдотуберкулезного гепатита аналогичны таковым при иерсиниозе. У некоторых больных развивается панкреатит, проявляющийся нарушением внешнесекреторной функции поджелудочной железы.
Миокардит практически не отличается по течению и исходу от миокардита при иерсиниозе. Однако описаны случаи тяжелого инфекционно-токсического миокардита и поражение проводящей системы сердца. Возможны эндо-, пери- и панваскулиты. У большинства больных развивается пиелонефрит, реже - гломерулонефрит, ТИН. Изменения в мочевыделительной системе преходящие. Пневмония наблюдается чаще, чем при иерсиниозе, обнаруживается почти у всех больных с летальным исходом. Течение и исход менингита при псевдотуберкулезе не отличаются от менингита при иерсиниозе. Характерны симптомы поражения периферической (полиневриты и менингорадикулоневриты) и вегетативной нервной системы (раздражительность, нарушение сна, бледность или гиперемия кожи, потливость, диссоциация АД, парестезии и т.д.).
Вторично-очаговая форма псевдотуберкулеза наиболее часто проявляется узловатой эритемой, синдромом Рейтера и хроническим энтероколитом.
Осложнения: ИТШ, спаечная и паралитическая непроходимость, инвагинация, некроз и перфорация кишки с развитием перитонита, менингоэнцефалит, ОПН, синдром Кавасаки - развиваются редко и могут стать причиной летальных исходов.
Диагностика
Клиническая диагностика возможна при вспышечной заболеваемости. Основывается на эпидемиологических данных, клинической симптоматике и лабораторных методах.
Неспецифическая и специфическая лабораторная диагностика
В гемограмме обнаруживают нейтрофильный лейкоцитоз, моноцитоз, эозинофилию, относительную лимфопению и увеличение СОЭ. В биохимическом анализе крови повышение активности цитоплазматических ферментов, реже - гипербилирубинемия. Специфическая лабораторная диагностика псевдотуберкулеза такая же, как и при иерсиниозе. Перспективным методом специфической диагностики является РНГА на основе белков клеточной стенки Y. pseudotuberculosis.
Дифференциальная диагностика при псевдотуберкулезе проводится с острым аппендицитом, скарлатиной, менингококкемией, трихинеллезом, медикаментозным дерматитом.
Показания к госпитализации преимущественно клинические.
Лечение не отличается от лечения иерсиниоза. Для активации макрофагально-фагоцитарной системы, деблокады эффекторной системы иммунитета иммунными комплексами, ослабления аллергических реакций ГНТ и ГЗТ рекомендуют повторное внутривенное или внутримышечное введение иммуноглобулина человека нормального с промежутком 2-3 дня, курс 5-6 введений. Если развиваются симптомы острого живота при абдоминальной форме, проводят аппендэктомию.
Примерные сроки нетрудоспособности в среднем составляют 18-25 дней; при вторично-очаговых формах и волнообразном течении - до 6 мес.
Диспансеризация не отличается от описанной при иерсиниозе.
Чума
Чума (pestis) - острая зоонозная природно-очаговая инфекционная болезнь с преимущественно трансмиссивным механизмом передачи возбудителя, которая характеризуется интоксикацией, поражением ЛУ, кожи и легких. Относится к особо опасным, конвенционным болезням.
Коды по МКБ-10
А20.0 Бубонная чума.
А20.l Целлюлярно-кожная чума.
А20.2 Легочная чума.
Этиология
Возбудитель - грамотрицательная мелкая полиморфная неподвижная палочка Yersinia pestis семейства Enterobacteriaceae рода Yersinia. Имеет слизистую капсулу, спор не образует. Факультативный анаэроб. Окрашивается биполярно анилиновыми красителями (более интенсивно по краям). В окружающей среде устойчив: в почве сохраняется до 7 мес; в трупах, погребенных в земле, до года; в гное бубона - до 20-40 дней; на предметах бытовой обстановки, в воде - до 30-90 дней; хорошо переносит замораживание. При нагревании до 60 °С погибает через 30 с, при l00 °С - мгновенно. При высушивании, действии прямого солнечного света и дезинфицирующих средств (спирт, хлорамин и др.) возбудитель быстро разрушается. Относится к l-й группе патогенности.
Эпидемиология
Ежегодно в мире число заболевших чумой составляет около 2,5 тыс. человек, без тенденции к снижению. Природные очаги инфекции существуют на всех континентах, за исключением Австралии. Самые высокие показатели заболеваемости чумой в мире - 97,6% от общего числа больных чумой и 96,4% летальных исходов в Африке (Мадагаскар, Танзания, Заир). Активные природные очаги в Южной Америке (Бразилия, Боливия, Эквадор, Перу), в Азии (Казахстан, Китай, Вьетнам, Монголия). Последние вспышки заболевания зарегистрированы в 2009-2014 гг. В России известно 16 природных очагов: на Северном Кавказе, Алтае, в Забайкалье, Тыве, Калмыкии, Сибири и Астраханской области. При этом случаи заболевания чумой не регистрировались 30 лет. Заболеваемости людей предшествуют эпизоотии среди грызунов. Сезонность заболевания зависит от климатической зоны и в странах с умеренным климатом регистрируется с мая по сентябрь.
Возбудитель инфекции циркулирует в популяциях более 200 видов грызунов и зайцеобразных, основные из них - сурки (тарбаганы), суслики, полевки, песчанки, а также зайцеобразные (зайцы, пищухи), в антропургических очагах - серая и черная крысы, реже - домовые мыши, верблюды, собаки и кошки. Особую опасность представляет человек, больной легочной формой чумы. Среди животных основные переносчики возбудителя чумы - более 120 видов блох (Xenopsylla cheopis), которые могут передавать возбудителя через 3-5 дней после заражения и сохраняют заразность до года. Механизмы передачи инфекции разнообразны:
-
контактный - через поврежденную кожу и слизистые оболочки при снятии шкурок с больных животных; убое и разделке туш верблюда, зайца, а также крыс, тарбаганов, которых в некоторых странах употребляют в пищу; при соприкосновении с выделениями больного человека или с зараженными им предметами;
-
фекально-оральный - при употреблении в пищу недостаточно термически обработанного мяса инфицированных животных;
-
аспирационный - от человека, больного легочными формами чумы.
Восприимчивость человека абсолютна во всех возрастных группах и при любом механизме заражения. Больной бубонной формой чумы до вскрытия бубона не представляет опасности для окружающих, но при переходе ее в септическую или легочную форму становится высокозаразным, выделяя возбудитель с мокротой, секретом бубона, мочой, испражнениями. Иммунитет нестойкий, описаны повторные случаи заболевания.
Прогнозирование эпизоотической активности природных очагов чумы и эпидемиологическое прогнозирование осуществляют ФГУЗ «Противочумный центр» Роспотребнадзора на основе информационных сообщений 5 научно-исследовательских противочумных институтов (ФГУЗ «Микроб», Иркутск, Ставрополь, Ростов-на-Дону, Волгоград) и 11 противочумных станций (приложение № 3 к санитарно-эпидемиологическим правилам «Профилактика чумы» СП 3.1.7.2492-09). О каждом случае заболевания человека необходимо сообщать в территориальный центр Роспотребнадзора в виде экстренного извещения с последующим объявлением карантина. Международными правилами определен карантин длительностью 6 сут, обсервация контактных с чумой лиц составляет 9 дней. В настоящее время чума включена в перечень заболеваний, возбудитель которого может быть использован как средство бактериологического оружия (биотерроризма). В лабораториях получены высоковирулентные штаммы, устойчивые к распространенным антибиотикам.
Меры профилактики
Неспецифические: эпидемиологический надзор за природными очагами чумы; сокращение численности грызунов, проведение дератизации и дезинсекции; постоянное наблюдение за населением, находящимся в зоне риска заражения; подготовка медицинских учреждений и медицинского персонала к работе с больными чумой, проведение информационно-разъяснительной работы среди населения; меры предупреждения завоза возбудителя из других стран изложены в «Международных медико-санитарных правилах» и «Правилах по санитарной охране территории».
Специфическая профилактика заключается в ежегодной иммунизации живой противочумной вакциной лиц, проживающих в эпизоотических очагах или выезжающих туда. Вакцинацию проводят однократно подкожным, накожным, внутрикожным или ингаляционным способами. Ревакцинацию осуществляют накожным способом через год, при неблагоприятной эпидемической обстановке - через 6 мес. Людям, соприкасающимся с больными чумой, их вещами, трупами животных, проводят экстренную химиопрофилактику (табл. 16-7).
| Препарат | Кратность применения в сутки | Продолжительность курса, сут |
|---|---|---|
Ципрофлоксацин |
2 |
5 |
Офлоксацин |
2 |
5 |
Пефлоксацин |
2 |
5 |
Доксициклин |
1 |
7 |
Рифампицин |
2 |
7 |
Рифампицин + ампициллин |
1 + 2 |
7 |
Рифампицин + ципрофлоксацин |
1 |
5 |
Рифампицин + офлоксацин |
1 |
5 |
Рифампицин + пефлоксацин |
1 |
5 |
Гентамицин |
3 |
5 |
Амикацин |
2 |
5 |
Стрептомицин |
2 |
5 |
Цефтриаксон |
1 |
5 |
Цефотаксим |
2 |
7 |
Цефтазидим |
2 |
7 |
Патогенез
Возбудитель чумы проникает в организм человека чаще через кожу, реже - через слизистые оболочки дыхательных путей, пищеварительного тракта. Изменения на коже в месте внедрения возбудителя (первичный очаг - фликтена) развиваются редко. Лимфогенно из места внедрения возбудитель проникает в регионарный ЛУ, где происходит его размножение, которое сопровождается развитием серозно-геморрагического воспаления, распространяющегося на окружающие ткани, некрозом и нагноением с формированием чумного бубона. При прорыве лимфатического барьера происходит гематогенная диссеминация возбудителя. Попадание возбудителя аэрогенным путем способствует развитию воспалительного процесса в легких с расплавлением стенок альвеол и сопутствующим медиастинальным лимфаденитом. Интоксикационный синдром свойствен всем формам болезни, обусловлен комплексным действием токсинов возбудителя и характеризуется нейротоксикозом, развитием тромбогеморрагического синдрома (ТГС) и ИТШ.
Клиническая картина
Инкубационный период длится от нескольких часов до 9 дней и более (в среднем 2-4 дня), сокращаясь при первичной легочной форме и удлиняясь у привитых или получавших профилактические препараты.
Классификация
Различают локализованные: кожную, бубонную, кожно-бубонную и генерализованные формы чумы: первично-септическую, первично-легочную, вторично-септическую, вторично-легочную и кишечную.
Основные симптомы и динамика их развития
Независимо от формы болезни чума обычно начинается внезапно. Клиническая картина с первых дней болезни характеризуется выраженным ЛИС: ознобом, высокой лихорадкой (≥39 °С), резкой слабостью, головной болью, ломотой в теле, жаждой, тошнотой, иногда рвотой. Кожа горячая, сухая, лицо красное одутловатое, склеры инъецированы, конъюнктивы и слизистые оболочки ротоглотки гиперемированы, нередко с точечными кровоизлияниями, язык сухой, утолщенный, покрыт толстым белым налетом («меловой»). В дальнейшем в тяжелых случаях лицо становится осунувшимся, с цианотичным оттенком, темными кругами под глазами. Черты лица заостряются, появляется выражение страдания и ужаса («маска чумы»). По мере развития болезни нарушается сознание, могут развиться галлюцинации, бред, возбуждение. Речь становится невнятной, нарушается координация движений («пьяная походка»). Характерны артериальная гипотензия, тахикардия, одышка, цианоз. При тяжелом течении болезни возможны кровотечения, рвота с примесью крови. Печень и селезенка увеличены. Отмечают олигурию. Температура остается постоянно высокой в течение 3-10 дней.
В периферической крови - нейтрофильный лейкоцитоз со сдвигом влево.
Кожная форма встречается редко (3-5%). В месте входных ворот инфекции появляется пятно, затем папула, везикула (фликтена), заполненная серозно-геморрагическим содержимым, окруженная инфильтрированной зоной с гиперемией и отеком. Фликтена отличается резкой болезненностью. После ее вскрытия образуется язва с темным струпом на дне. Чумная язва отличается длительным течением, заживает медленно, образуя рубец. Если эта форма осложняется септицемией, возникают вторичные пустулы и язвы. Возможно развитие регионарного бубона (кожно-бубонная форма).
Бубонная форма встречается чаще всего (около 80%) и отличается относительной доброкачественностью течения. С первых дней болезни в области регионарных ЛУ появляется резкая болезненность. Первичный бубон, как правило, бывает одиночным, реже наблюдаются множественные бубоны. В большинстве случаев поражаются паховые и бедренные, несколько реже подмышечные и шейные ЛУ. Pазмеры бубона варьируют от грецкого ореха до яблока средних размеров. Чумной бубон характеризуется резкой болезненностью, плотной консистенцией, спаян с окружающими тканями. Контуры его сглажены из-за развития периаденита. Бубон начинает формироваться на второй день болезни. По мере его развития появляется гиперемия кожи над ним, часто с цианотическим оттенком. Бубон в первые дни плотный, затем происходит его размягчение, появляется флюктуация, контуры становятся нечеткими. На 10-12-й день болезни он вскрывается - образуется свищ, изъязвление. При доброкачественном течении болезни и современной антибиотикотерапии происходит его рассасывание или склерозирование. В результате гематогенного заноса возбудителя могут формироваться вторичные бубоны, которые появляются позже и отличаются незначительными размерами, меньшей болезненностью и, как правило, не нагнаиваются. Грозным осложнением этой формы может быть развитие вторичной легочной или вторичной септической формы, что резко ухудшает прогноз болезни.
Первично-легочная форма встречается редко, в периоды эпидемий в 5-10% случаев, и представляет собой наиболее опасную в эпидемиологическом отношении и тяжелую клинически форму болезни. Начинается остро, бурно. На фоне резко выраженной интоксикации и лихорадки с первых дней появляются сухой кашель, сильная одышка, режущие боли при дыхании. Кашель через 1-2 дня становится продуктивным, с выделением жидкой мокроты, количество которой может варьировать от нескольких плевков до огромных количеств. Мокрота, вначале пенистая, стекловидная, прозрачная, затем приобретает кровянистый вид, позже становится геморрагической, содержит огромное количество чумных бактерий. Физикальные данные скудные: небольшое укорочение перкуторного звука над пораженной долей, при аускультации необильные мелкопузырчатые хрипы, что явно не соответствует общему тяжелому состоянию больного. Терминальный период характеризуется нарастанием одышки, цианоза, развитием сопора, отека легких и ИТШ. АД падает, пульс учащается и становится нитевидным, тоны сердца - глухими, гипертермия сменяется гипотермией. Без лечения заболевание в течение 2-6 сут заканчивается летально. При раннем применении антибиотиков течение болезни доброкачественное, мало отличается от пневмонии другой этиологии, вследствие чего возможны позднее распознавание легочной формы чумы и случаи заболевания в окружении больного.
Первично-септическая форма наблюдается редко - при попадании в организм массивной дозы возбудителя, чаще воздушно-капельным путем. Начинается внезапно, с выраженных явлений интоксикации и гипертермии быстрого появления: множественных кровоизлияний на коже и слизистых оболочках, кровотечений из внутренних органов («черная чума», «черная смерть»), психических нарушений. Прогрессируют признаки сердечно-сосудистой недостаточности. Смерть больного наступает через несколько часов от ИТШ. Изменения в месте внедрения возбудителя и в регионарных лимфатических узлах отсутствуют.
Вторично-септическая форма осложняет другие клинические формы инфекции, обычно бубонную. Генерализация процесса значительно ухудшает общее состояние больного и увеличивает его эпидемиологическую опасность для окружающих. Симптомы аналогичны вышеописанной клинической картине, но отличаются наличием вторичных бубонов и более длительным течением. При этой форме болезни нередко развивается вторичный чумной менингит.
Вторично-легочная форма как осложнение встречается при локализованных формах чумы в 5-10% случаев и резко ухудшает общую картину заболевания, сопровождается нарастанием симптомов интоксикации, появлением болей в груди, кашля с кровавой пенистой мокротой. Течение болезни при лечении может быть доброкачественным, с медленным выздоровлением. Присоединение пневмонии к малозаразным формам чумы делает больных наиболее опасными в эпидемиологическом отношении, поэтому каждый такой пациент должен быть выявлен и изолирован.
Некоторые авторы выделяют отдельно кишечную форму, но большинство клиницистов склонны рассматривать кишечную симптоматику (резкие боли в животе, обильный слизисто-кровянистый стул, кровавую рвоту) как проявления первично- или вторично-септической формы.
При повторных случаях заболевания, а также при чуме у привитых или получивших химиопрофилактику людей все симптомы появляются и развиваются постепенно, течение болезни доброкачественное. В практике такие состояния получили названия «малой», или «амбулаторной», чумы.
Осложнения
Выделяют специфические осложнения, обусловленные возбудителем: ИТШ, сердечно-легочную недостаточность, менингит, тромбо-геморрагический синдром, которые и приводят к смерти больных, и неспецифические, вызванные вторичной флорой (флегмона, рожа, фарингит и др.), что нередко наблюдают на фоне улучшения состояния.
Летальность и причины смерти
При первично-легочной и первично-септической форме без лечения летальность достигает 100%. При бубонной форме чумы летальность без лечения составляет 20-40%, что обусловлено развитием вторично-легочной или вторично-септической формы болезни. При своевременной диагностике и современной терапии летальность составляет 7%.
Диагностика
Клиническая диагностика. Заподозрить чуму позволяют клинико-эпидемиологические данные: выраженная интоксикация, наличие язвы, бубона, тяжелой пневмонии, геморрагической септицемии у лиц, находящихся в природно-очаговой зоне по чуме, проживающих в местах, где наблюдались эпизоотии (падеж) среди грызунов или есть указание на регистрируемые случаи болезни. Каждый подозрительный больной должен быть обследован.
Неспецифическая и специфическая лабораторная диагностика. Картина крови характеризуется значительным нейтрофильным лейкоцитозом со сдвигом влево и увеличением СОЭ. При рентгенологическом исследовании органов грудной клетки, кроме увеличения медиастинальных ЛУ, можно увидеть очаговую, лобарную, реже псевдолобарную пневмонию, признаки РДС. При наличии менингеальных симптомов необходима спинномозговая пункция. В СМЖ чаще выявляют трехзначный нейтрофильный плеоцитоз, умеренное увеличение содержания белка и снижение уровня глюкозы. Для специфической диагностики исследуют пунктат бубона, отделяемое язвы, карбункула, мокроту, мазок из носоглотки, кровь, мочу, испражнения, СМЖ, секционный материал. Правила забора материала и его транспортировки строго регламентированы «Международными медико-санитарными правилами». Предварительное заключение дают на основании микроскопии мазков, окрашенных по Граму, метиленовым синим или обработанных специфической люминесцентной сывороткой. Обнаружение овоидных биполярных палочек с интенсивным окрашиванием по полюсам («биполяр») позволяет поставить предварительный диагноз чумы в течение часа. Для окончательного подтверждения диагноза, выделения и идентификации культуры производят посев материала на агар или на мясной бульон. Окончательную идентификацию культуры производят на 3-5-е сутки. В последние годы применяют ПЦР, которая особенно информативна на фоне антибиотикотерапии.
Диагноз можно подтвердить серологическими исследованиями парных сывороток в РПГА, однако этот метод имеет ретроспективное значение. Изучают патологоанатомические изменения у зараженных внутрибрюшинно мышей, морских свинок через 3-7 дней, с посевом биологического материала. Аналогичные методы лабораторного выделения и идентификации возбудителя применяют для выявления эпизоотий чумы. Для исследования берут материал от грызунов и их трупов, а также блох.
Дифференциальная диагностика
Перечень нозоформ, с которыми необходимо проводить дифференциальную диагностику, зависит от клинической формы чумы. Кожную форму дифференцируют с кожной формой сибирской язвы, туляремии, бубонную - с бубонной формой туляремии, острым гнойным лимфаденитом, содоку, доброкачественным лимфоретикулезом, венерической гранулемой; легочную форму - с крупозной пневмонией, легочной формой сибирской язвы. Септическую форму чумы дифференцируют с менингококкемией и другими геморрагическими септицемиями. Особенно трудна диагностика первых случаев заболевания. Большое значение имеют эпидемиологические данные: пребывание в очагах инфекции, контакт с грызунами, больными пневмонией. При этом следует иметь в виду, что раннее применение антибиотиков видоизменяет течение болезни. Даже легочная форма чумы в этих случаях может протекать доброкачественно, однако больные остаются заразными. Учитывая эти особенности, при наличии эпидемических данных во всех случаях заболеваний, протекающих с высокой лихорадкой, интоксикацией, поражениями кожи, ЛУ и легких, следует исключать чуму. В таких ситуациях необходимо проводить лабораторные тесты и привлекать специалистов противочумной службы.
Лечение
Все больные с подозрением на чуму подлежат экстренной госпитализации на специальном транспорте в инфекционный стационар, в отдельный бокс с соблюдением всех противоэпидемических мер. Персонал, ухаживающий за больными чумой, должен носить защитный противочумный костюм. Предметы быта в палате, выделения больного подлежат дезинфекции.
Режим постельный в течение лихорадочного периода. Специальная диета не предусмотрена. Целесообразно щадящее питание (стол А).
Медикаментозная терапия
Этиотропную терапию необходимо начинать при подозрении на чуму, не дожидаясь бактериологического подтверждения диагноза. При изучении природных штаммов чумной бактерии на территории Pоссии не обнаружено штаммов возбудителя, резистентных к распространенным антимикробным препаратам. Этиотропное лечение проводят по утвержденным схемам (табл. 16-8-16-10).
| Препарат | Способ применения | Разовая доза, г | Кратность применения в сутки | Продолжительность курса, сут |
|---|---|---|---|---|
Доксициклин |
Внутрь |
0,2 |
2 |
10 |
Ципрофлоксацин |
Внутрь |
0,5 |
2 |
7-10 |
Пефлоксацин |
Внутрь |
0,4 |
2 |
7-10 |
Офлоксацин |
Внутрь |
0,4 |
2 |
7-10 |
Гентамицин |
В/м |
0,16 |
3 |
7 |
Амикацин |
В/м |
0,5 |
2 |
7 |
Стрептомицин |
В/м |
0,5 |
2 |
7 |
Тобрамицин |
В/м |
0,1 |
2 |
7 |
Цефтриаксон |
В/м |
2,0 |
1 |
7 |
Цефотаксим |
В/м |
2,0 |
3-4 |
7-10 |
Цефтазидим |
В/м |
2,0 |
2 |
7-10 |
Ампициллин/ сульбактам |
В/м |
2/1 |
3 |
7-10 |
Азтреонам |
В/м |
2,0 |
3 |
7-10 |
| Препарат | Способ применения | Разовая доза, г | Кратность применения в сутки | Продолжительность курса, сут |
|---|---|---|---|---|
Доксициклин* |
Внутрь |
0,2 на 1-й прием, затем по 0,1 |
2 |
10-14 |
Ципрофлоксацин* |
Внутрь |
0,75 |
2 |
10-14 |
Пефлоксацин* |
Внутрь |
0,8 |
2 |
10-14 |
Офлоксацин* |
Внутрь |
0,4 |
2 |
10-14 |
Гентамицин |
В/м |
0,16 |
3 |
10 |
Амикацин |
В/м |
0,5 |
3 |
10 |
Стрептомицин |
В/м |
0,5 |
3 |
10 |
Тобрамицин |
В/в |
0,2 |
2 |
7 |
Цефтриаксон |
В/м, в/в |
2 |
2 |
7-10 |
Цефотаксим |
В/м, в/в |
3 |
3 |
10 |
Цефтазидим |
В/м, в/в |
2 |
3 |
10 |
Хлорамфеникол (Левомицетина натрия сукцинат♠¤**) |
В/м, в/в |
25-35 мг/кг |
3 |
7 |
* Существуют формы препарата для парентерального введения. ** Применяется для лечения чумы с поражением ЦНС.
| Препарат | Способ применения | Разовая доза, г | Кратность применения в сутки | Продолжительность курса, сут |
|---|---|---|---|---|
Цефтриаксон + стрептомицин (или амикацин) |
В/м, в/в |
1 + 0,5 |
2 |
10 |
Цефтриаксон + гентамицин |
В/м, в/в |
1 + 0,08 |
2 |
10 |
Цефтриаксон + рифампицин |
В/в, внутрь |
1 + 0,3 |
2 |
10 |
Ципрофлоксацин* + рифампицин |
Внутрь, внутрь |
0,5 + 0,3 |
2 |
10 |
Ципрофлоксацин + стрептомицин (или ами кацин) |
Внутрь, в/в, в/м |
0,5 + 0,5 |
2 |
10 |
Ципрофлоксацин + гентамицин |
Внутрь, в/в, в/м |
0,5 + 0,08 |
2 |
10 |
Ципрофлоксацин* + цефтриаксон |
В/в, в/в, в/м |
0,1-0,2 + 1 |
2 |
10 |
Рифампицин + гентамицин |
Внутрь, в/в, в/м |
0,3 + 0,08 |
2 |
10 |
Рифампицин + стрептомицин (или амикацин) |
Внутрь, в/в, в/м |
0,3 + 0,5 |
2 |
10 |
* Существуют формы препарата для парентерального введения.
В тяжелых случаях рекомендуют применение в течение первых четырех дней болезни совместимых комбинаций антибактериальных средств в дозах, указанных в схемах. В последующие дни лечение продолжают одним препаратом. Первые 2-3 дня лекарства вводят парентерально, в последующем переходят на пероральный прием.
Наряду со специфическим проводят патогенетическое лечение, направленное на борьбу с ацидозом, сердечно-сосудистой и ДН, нарушениями микроциркуляции, отеком мозга, геморрагическим синдромом. Дезинтоксикационная терапия заключается во внутривенных инфузиях коллоидных [декстран [ср. мол. масса 35 000-45 000] (Реополиглюкин♠), плазма] и кристаллоидных растворов [декстроза (Глюкоза♠) 5-10%, полиионные растворы] до 40-50 мл/кг в сутки. Больных выписывают после полного выздоровления (при бубонной форме не ранее 4 нед, при легочной - не ранее 6 нед со дня клинического выздоровления) и троекратного отрицательного результата бактериологического исследования пунктата бубона, мокроты или крови, который проводят на 2, 4, 6-й дни после отмены антибиотиков. После выписки осуществляют медицинское наблюдение в течение 3 мес.
Кампилобактериоз
Определение болезни
Кампилобактериоз - острая зооантропонозная инфекционная болезнь, вызываемая бактериями рода Campylobacter, характеризующаяся симптомами интоксикации, преимущественным поражением ЖКТ; у маленьких детей и ослабленных людей нередко протекающая в генерализованной форме.
Код по МКБ-10
A04.5 Энтерит, вызванный Campylobacter.
Этиология
Возбудители - бактерии рода Campilobacter, мелкие подвижные неспорообразующие грамотрицательные палочки с одним или двумя полярно расположенными жгутиками. Имеют спиралевидную или изогнутую форму, длиной 1,5-2 мкм, диаметром 0,3-0,5 мкм. В настоящее время известно 17 видов и 6 подвидов рода Campylobacter, из которых к заболеваниям людей наиболее часто приводят C. jejuni (подвид jejuni) и C. coli.
Растут на агаровых средах с добавлением эритроцитов и антибиотиков (ванкомицин, амфотерицин В), образуют мелкие колонии. Оптимальная температура роста - +42 °С, рН 7. Патогенные для человека кампилобактеры растут при концентрации кислорода не более 5-10%, погибают при нагревании до 60 °С в течение 1-15 мин; при пастеризации (+71-77 °С) и кипячении - в течение нескольких секунд. При комнатной температуре сохраняются до 2 нед, в сене, воде, навозе - до 3 нед, а в замороженных тушах животных - до нескольких месяцев. Они чувствительны к эритромицину, хлорамфениколу, стрептомицину, канамицину, тетрациклинам, гентамицину, малочувствительны к пенициллину. Чувствительны к высушиванию, ультрафиолетовым лучам, действию прямого солнечного света. Хлорирование воды обеспечивает быструю гибель Campilobacter. Дезинфицирующие средства активны в отношении Campilobacter в режимах, рекомендуемых для обеззараживания объектов при инфекциях, обусловленных грамотрицательными бактериями.
Эпидемиология
Кампилобактериоз широко распространен во всех странах. Кампилобактеры обусловливают до 10% острых диарейных болезней. Резервуар и источник возбудителя инфекции - многие виды животных, преимущественно домашние, реже - больные люди и носители.
Возбудители кампилобактериоза широко распространены в природе. Как комменсалы ЖКТ они могут присутствовать в кишечнике практически всех известных теплокровных животных и птиц, которые являются природным резервуаром кампилобактерий, а также в воде открытых водоемов, контаминированных фекалиями животных и птиц.
Эпидемический процесс может протекать в виде спорадических случаев и вспышек, иногда с вовлечением нескольких тысяч человек. При вспышках, связанных с употреблением сырого молока, заболеваемость может достигать 60% от общего количества людей, употреблявших данный продукт.
Основной путь передачи возбудителя - пищевой. Чаще всего заражение происходит при употреблении в пищу инфицированного мяса: говядины, свинины, мяса птицы. Существенную роль как фактор передачи возбудителей играет молоко. Контактно-бытовой путь заражения имеет незначительное эпидемиологическое значение. У беременных отмечают трансплацентарную передачу инфекции. Это приводит к самопроизвольным абортам и внутриутробному заражению эмбриона.
Водный путь передачи возможен при употреблении сырой воды из случайных источников водоснабжения, из открытых водоемов, контаминированных кампилобактерами; из аварийных водопроводных сетей, загрязненных канализационными выбросами, сточными водами мясокомбинатов, птицеводческих и животноводческих хозяйств.
Бытовой путь передачи реализуется при прямом контакте с животными (птица, особенно куры), у которых часто наблюдается бессимптомное носительство возбудителей.
У здоровых людей отмечают бактерионосительство (около 1%).
В России кампилобактериоз распространен во многих городах и регионах, составляя 6,5-12,2% от общего числа острых кишечных заболеваний. Отмечают летне-осеннюю сезонность кампилобактериоза.
Меры профилактики
Меры профилактики направлены: на предупреждение контаминации кампилобактериями продовольственного сырья и пищевых продуктов как в процессе их производства, переработки, транспортировки, хранения, так и на всех этапах реализации; предотвращение попадания возбудителя в готовые пищевые продукты и воду; обеспечение качества воды в водоисточниках и распределительных сетях; соблюдение требований по содержанию открытых водоемов, по очистке сточных вод от птицеводческих и животноводческих хозяйств, по обеспечению условий труда в животноводческих и птицеводческих хозяйствах; обеспечение содержания, эксплуатации, соблюдения противоэпидемического режима лечебно-профилактических, в первую очередь акушерских, стационаров, детских дошкольных и других организаций.
Противоэпидемические мероприятия при выявлении случаев кампилобактериоза среди людей
Комплекс санитарно-противоэпидемических (профилактических) мероприятий при кампилобактериозе людей включает:
-
установление лиц (поименно или круга лиц), подвергшихся риску заражения;
-
медицинское наблюдение за лицами, находящимися в одинаковых с больным условиях по риску заражения (7 дней);
-
взятие материала от больных и подозрительных на заболевание, а также проб из объектов окружающей среды для лабораторных исследований;
-
введение запрета на использование продуктов животноводства, которые могут рассматриваться в качестве факторов передачи инфекции;
-
приостановку деятельности предприятия (хозяйства), где сформировался очаг кампилобактериоза;
-
организацию дезинфекционных, дезинсекционных мероприятий в очаге;
-
введение усиленного надзора за системой водоснабжения, благоустройством территории и соблюдением противоэпидемического режима в организациях и учреждениях, вовлеченных в эпидемический процесс.
Специфическая профилактика не разработана.
Патоморфология и патогенез
Возбудитель попадает в организм через ЖКТ. Выделяют следующие этапы проникновения бактерий в организм: адгезия (прикрепление к поверхности энтероцитов); инвазия (при помощи жгутика повреждается клеточная мембрана энтероцита, и возбудитель проникает в клетку); бактериемия (проникновение бактерий в кровь); токсинообразование (при попадании микробов в кровь высвобождаются токсины, обусловливающие развитие общей интоксикации); гематогенное обсеменение органов и тканей.
При гистологическом исследовании биоптатов, взятых во время колоно- или ректороманоскопии, обнаруживают острый экссудативный воспалительный процесс, часто с геморрагическим компонентом. Обильная рвота и понос могут стать причиной дегидратации, гиповолемического шока. У лиц с хорошо функционирующей иммунной системой заражение не сопровождается клинически выраженными проявлениями (субклиническая форма, здоровое бактерионосительство).
Клиническая картина
Инкубационный период длится от 6 ч до 11 (чаще 1-2) дней. Приблизительно у 30-50% больных развитию характерных клинических проявлений болезни может предшествовать лихорадочный продромальный период длительностью до 3 сут. Наблюдаются: общая слабость, артралгия, головная боль, озноб. Температура тела чаще всего находится в пределах 38-40 °С. Болезнь может начинаться остро, с одновременного развития всех симптомов. Больные жалуются на тошноту, боли в эпигастральной области, нередко рвоту. Стул обильный, жидкий, пенистый, у 20% больных с примесью слизи и крови. Могут появиться признаки обезвоживания.
Чаще всего кампилобактериоз - острое диарейное заболевание, которое протекает в виде острого гастрита, гастроэнтерита, гастро-энтероколита, энтероколита и колита. Генерализованную (септическую) форму чаще наблюдают у детей первых месяцев жизни и у лиц с иммунодефицитами. Заболевание характеризуется бактериемией, высокой лихорадкой с большими суточными колебаниями температуры тела, множественными органными поражениями. Часто отмечают рвоту, понос, обезвоживание, увеличение печени. На этом фоне могут развиваться пневмония, эндокардит, перитонит, абсцессы печени, головного мозга, менингит, менингоэнцефалит. Возможно развитие ИТШ и тромбогеморрагического синдрома. Субклиническую (инаппарантную, бессимптомную) форму кампилобактериоза в очаге обычно диагностируют при обследовании контактных лиц. Наблюдают выделение возбудителя из испражнений и нарастание титра специфических антител в сыворотке крови. Хроническая форма кампилобактериоза встречается редко. Отмечают длительный субфебрилитет, слабость, раздражительность, плохой аппетит, нарушение сна, похудание. Иногда появляются тошнота, рвота, кратковременное послабление стула, чередующееся с запором. Возможны конъюнктивит, кератит, иногда фарингит (реже артрит, тромбофлебит, эндокардит, перикардит, эмпиема плевры). У женщин отмечают вагинит, вульвовагинит, эндоцервицит.
Осложнения: острый аппендицит, перитонит, синдромы Гийена-Барре и Рейтера, реактивный артрит, узловатая эритема, кишечное кровотечение, ИТШ и дегидратационный шок, ТГС.
Диагностика
Диагноз устанавливается на основании клинических признаков болезни, результатов лабораторного исследования и эпидемиологического анамнеза.
Подозрительный случай кампилобактериоза:
Вероятный случай кампилобактериоза - случай ОКИ у работников неблагополучных по кампилобактериозу животноводческих и птицеводческих хозяйств, птицеперерабатывающего предприятия (особенно при контакте с абортировавшим животным, павшими животными или птицами, работе в племенном хозяйстве).
Подтвержденный случай кампилобактериоза - случай ОКИ, лабораторно подтвержденный выделением из клинического материала культуры Campylobacter (бактериологическим методом) и/или обнаружением специфических фрагментов ДНК бактерий рода Campylobacter (ПЦР).
Лабораторная диагностика кампилобактериоза
Материалом для исследований служат: испражнения, ректальные смывы, промывные воды желудка, рвотные массы, кровь, СМЖ, трупный материал.
Дифференциальная диагностика кампилобактериоза проводится с клостридиозом, амебиазом, криптоспоридиозом, лямблиозом.
Лечение
При лечении больных кампилобактериозом, протекающим в форме энтерита и гастроэнтерита, обычно ограничиваются неспецифической патогенетической терапией. Применение антибиотиков целесообразно при среднетяжелом и тяжелом течении кампилобактериоза, при лечении больных с отягощенным преморбидным фоном и при угрозе развития и развитии осложнений. Госпитализируют больных по клиническим показаниям. Пациентам рекомендуют режим 1-2, диету № 4.
При среднетяжелом течении болезни используют: метронидазол 0,25-0,5 г 3 раза в день или макролиды: эритромицин 0,25-0,5 г 4 р/сут, азитромицин 0,5-1,0 г 1 р/сут; спирамицин 1,5-3,0 млн МЕ 3 р/сут, мидекамицин 0,4 г 3-4 р/сут перорально. Эффективны также фторхинолоны (ципрофлоксацин, офлоксацин) в средних дозах перорально.
В тяжелых случаях (генерализованная форма) внутривенно применяют: спирамицин 1,5 млн МЕ 3 р/сут на 5% растворе декстрозы (Глюкоза♠), гентамицин 80 мг капельно 2-3 р/сут на 5% растворе декстрозы (Глюкоза♠), амикацин 0,3-0,5 г 2 р/сут на физ. растворе струйно, метронидазол 0,5 г 3 р/сут капельно, ципрофлоксацин капельно по 0,4 г 2 р/сут. Продолжительность лечения при среднетяжелом течении болезни до 14 сут, при тяжелом - не менее 14 сут.
При обезвоживании проводят регидратацию. При хронических формах кампилобактериоза назначают повторные курсы лечения антибиотиками разных групп с интервалом 7-10 дней между ними в сочетании с общеукрепляющей терапией.
Правила выписки переболевших
Выписка больных осуществляется после полного клинического выздоровления и нормализации всех показателей функционального состояния организма переболевших. Необходимость лабораторного обследования перед выпиской определяется врачом-инфекционистом.
Прогноз обычно благоприятный.
Срок нетрудоспособности зависит от тяжести течения заболевания, составляя приблизительно 2-3 нед.
Диспансеризация
За реконвалесцентами устанавливается диспансерное наблюдение в течение одного месяца после выписки, которое включает в себя проведение 3 клинических осмотров (на 10, 20 и 30-й день) с оценкой общего состояния, жалоб, характера стула и проведением термометрии.
Листериоз
Листериоз - бактериальная инфекционная болезнь из группы сапронозов. Характеризуется многообразием источников возбудителя, механизмов передачи; полиморфизмом клинических проявлений, высокой летальностью (особенно у новорожденных и лиц с иммунодефицитами).
Коды по МКБ-10
А32 Листериоз (листериозная пищевая инфекция).
А32.0 Кожный листериоз.
А32.1 Листериозный менингит и менингоэнцефалит.
А32.7 Листериозная септицемия.
Этиология
Возбудитель листериоза человека - Listeria monocytogenes рода Listeria, грамположительная палочка правильной формы, спор и капсулы не образует, кислотонеустойчива, хорошо растет на обычных питательных средах. Факультативный анаэроб.
Антигенная структура листерий сложна. Различают 16 сероваров L. monocytogenes в зависимости от комбинации соматических и жгутиковых антигенов. Листерии ферментируют глюкозу, каталазоположительны, оксидазоотрицательны, образуют цитохромы, подвижны при 20-25 °С. Могут превращаться в L-формы и паразитировать внутриклеточно, что обусловливает недостаточную эффективность в ряде случаев антибактериальной терапии, объясняет склонность листериоза к затяжному и хроническому течению, возможность латентной формы и бактерионосительства.
Факторами патогенности L. monocytogenes являются листериолизин-О, обладающий гемолитической активностью, фосфатидилинозитол, интерналины А и В, белок АctA и др.
Листерии высокоустойчивы в окружающей среде, растут в широком интервале температур (от 1 до 45 °С) и рH (от 4 до 10), хорошо переносят низкие температуры и способны размножаться при температуре 4-6 °С в почве, воде, на растениях, в трупах. В различных пищевых продуктах (молоко, масло, сыр, мясо и др.) размножаются при температуре бытового холодильника. При 70 °С погибают через 20-30 мин, при 100 °С - через 3-5 мин; инактивируются растворами формалина (0,5-1%), хлорамина (3-5%) и другими дезинфицирующими средствами. Листерии чувствительны к пенициллинам, тетрациклинам, макролидам, аминогликозидам, фторхинолонам, карбапенемам, гликопептидам, оксазолидинам; устойчивы к ЦС.
Эпидемиология
Листериоз регистрируется в большинстве стран практически на всех континентах. Заболеваемость носит преимущественно спорадический, реже групповой характер, а летальность достигает 15-17%. В последние 20 лет во всем мире и РФ имеется тенденция к росту заболеваемости.
Основным источником и резервуаром возбудителя являются объекты окружающей среды, прежде всего почва. Листерии выделяют также из растений, силоса, пыли, водоемов и сточных вод. Источником листерии могут быть и различные животные (кролики, свиньи, коровы, собаки, кошки, мыши, крысы, птицы и др.).
Основной путь заражения человека - пищевой, осуществляется при употреблении мясных, молочных, морепродуктов, корнеплодов без предварительной термической обработки, особенно если до этого они длительно хранились в холодильнике. Повышенную опасность представляют мягкие сыры, колбасные и мясные изделия в вакуумной упаковке, а также продукты быстрого приготовления («фастфуд») - сосиски «хот-дог», гамбургеры и др.
Возможны также контактный путь заражения (от больных с поражениями кожи, инфицированных животных и грызунов), аэрогенный (в помещениях при обработке шкур, шерсти, а также в больницах), трансмиссивный (при укусах насекомыми, в частности клещами), половой.
Особое значение имеет способность листерий передаваться от беременной женщины плоду - либо во время беременности (трансплацентарно), либо при контакте новорожденного с родовыми путями родильницы (интранатально). Листерии могут быть причиной внутрибольничной инфекции. Источником возбудителя инфекции являются либо роженицы с нераспознанным листериозом, либо новорожденные с врожденным листериозом. В человеческой популяции бессимптомное носительство листерий составляет 2-20%.
Восприимчивость человека к листериозу низкая. Наиболее восприимчивы лица со сниженным иммунитетом, прежде всего беременные женщины и новорожденные. Учитывая возможность заражения от животных, в группу риска входят также работники животноводческих ферм, мясокомбинатов, птицефабрик и т.д.
Иммунитет после перенесенного листериоза продолжительный.
Меры профилактики
Специфическая профилактика не разработана; неспецифическая включает контроль за продуктами питания, предусмотренный соответствующими нормативными документами, и санитарно-просветительную работу среди населения, особенно групп риска.
Следует исключить из рациона беременных пищевые продукты, не прошедшие достаточной термообработки, а также брынзу, мягкие сыры и сырое молоко.
Для профилактики листериоза новорожденных необходимо обследовать на него женщин с отягощенным акушерско-гинекологическим анамнезом, а также имеющих постоянный контакт с животными. Женщины с выявленным листериозом, клинически манифестным или бессимптомным, подлежат специфической терапии.
Патогенез и патоморфология
Листерии вызывают клинически манифестное заболевание у человека лишь при ослаблении иммунной защиты, поэтому наибольшему риску заболевания подвергаются лица с различными иммунодефицитами (беременные, новорожденные, лица пожилого и старческого возраста, ВИЧ-инфицированные, онкологические больные, больные сахарным диабетом, почечной или сердечной недостаточностью, хронической алкогольной интоксикацией, наркотической зависимостью, лица, получающие иммуносупрессивную терапию).
Листерии проникают в организм человека через слизистые оболочки пищеварительного тракта, органов дыхания, глаз, половых путей, поврежденную кожу, через плаценту беременной женщины к плоду. В месте входных ворот возможен воспалительный процесс, при этом часто вовлекаются регионарные ЛУ. Резидентные макрофаги или моноциты поглощают бактерии в процессе неспецифического фагоцитоза. Часть листерий при этом погибают, оставшиеся размножаются внутриклеточно. При адекватной иммунной реакции дальнейшего продвижения листерий не происходит. При неэффективности местных факторов защиты листерии могут распространяться гематогенно и лимфогенно, проникают в ретикуло-эндотелиальную систему (печень, селезенку, ЛУ), в ЦНС, почки и т.д., где происходит дальнейшее размножение листерий с образованием гранулем. Прогрессирование процесса вызывает некроз в центре гранулем. В дальнейшем происходит организация некротических очагов, рассасывание некротизированных клеточных элементов с возможным рубцеванием. Специфические гранулемы чаще всего обнаруживаются в печени.
Листерии способны преодолевать ГЛБ и ГЭБ, поражать оболочки и вещество головного мозга, где развивается гнойная воспалительная реакция и нередко формируются субкортикальные абсцессы, проникать через плаценту и поражать плод. При врожденном листериозе гранулематозный процесс носит генерализованный характер и трактуется как гранулематозный сепсис. На вскрытии умерших от листериоза все органы с поверхности или на разрезе покрыты гранулемами. Микроскопически в коже наблюдаются продуктивные васкулиты, очажки некроза в дерме с образованием гранулем, гиперемия. В печени выявляются множественные субмилиарные очаги некроза гепатоцитов с выраженной гиперплазией и пролиферацией звездчатых эндотелиоцитов, на месте которых формируются описанные выше гранулемы.
Клиническая картина
Инкубационный период от 1-2 дней до 2-4 нед, изредка до 1,5-2 мес.
Единой клинической классификации листериоза не существует.
Основными формами листериоза являются: железистая; гастроинтестинальная; нервная; септическая; бактерионосительство.
Отдельно выделяют листериоз беременных и новорожденных.
В зависимости от продолжительности заболевания различают острый (1-3 мес), подострый (3-6 мес) и хронический (более 6 мес) листериоз.
Железистая форма протекает в двух вариантах: ангинозно-железистом и глазо-железистом. Первый из них характеризуется повышением температуры тела, интоксикацией, ангиной (язвенно-некротической или пленчатой), увеличением и болезненностью поднижнечелюстных, реже шейных и подмышечных ЛУ. Возможно также увеличение печени и селезенки. Лихорадочный период составляет 5-7 дней. В гемограмме отмечается моноцитоз («моноцитарная ангина»). Заболевание напоминает ИМ, отдельно выделяется ангинозно-септическая форма листериоза, при которой сочетаются тонзиллит, гепатоспленомегалия, длительная лихорадка гектического типа, выраженная интоксикация, генерализованная ЛАП, сыпь на коже.
Для глазо-железистого варианта типичен односторонний гнойный конъюнктивит; возникает выраженный отек век, сужение глазной щели. На переходной складке конъюнктивы выявляются узелковые высыпания. Снижается острота зрения; увеличиваются и становятся болезненными околоушный и поднижнечелюстной ЛУ с соответствующей стороны.
Гастроинтестинальная форма характеризуется острейшим началом, быстрым повышением температуры тела до высоких цифр, выраженной интоксикацией (озноб, головная боль, артралгия и миалгия). Через несколько часов присоединяются тошнота, повторная необильная рвота, схваткообразные боли в животе, учащенный жидкий стул, иногда с примесью слизи и/или крови. Характерны вздутие живота, болезненность при его пальпации, особенно в правой подвздошной области. Продолжительность лихорадки 5-7 и более дней. Эта форма листериоза клинически сходна со многими ОКИ и не может быть идентифицирована без лабораторного подтверждения. Свойственная этой форме высокая летальность (20% и выше) обусловлена либо развитием ИТШ, либо переходом в более тяжелые - нервную, септическую формы.
Нервная форма является одной из наиболее распространенных, встречается чаще всего у детей до трех лет и у взрослых старше 45-50 лет, проявляется обычно в виде менингита или менингоэнцефалита, абсцесса мозга. Частота листериозного менингита - около 1% всех бактериальных менингитов, но среди некоторых категорий, в частности больных с онкологическими заболеваниями, это наиболее частая форма менингита.
По клиническим признакам листериозный менингит существенно отличается от бактериальных менингитов другой этиологии.
Характерно распространение воспалительного процесса на вещество головного мозга, что подтверждается методами визуализации (КТ, МРТ). Нередки расстройства сознания, разнообразная очаговая симптоматика, в частности парезы черепных нервов.
Даже на фоне антибактериальной терапии часто развивается ОНГМ с дислокаций ствола, летальность высокая - 25-30%.
Листериозный менингит (менингоэнцефалит), ангина, конъюнктивит, гастроэнтерит могут быть как самостоятельными формами листериоза, так и одними из проявлений септической формы или предшествовать ей.
Септическая форма характеризуется повторяющимися ознобами, лихорадкой с большими размахами температуры тела, интоксикацией (головная боль, слабость, снижение аппетита, нарушение сна, ломота в мышцах и т.д.), увеличением печени и селезенки. Возможно появление крупнопятнистой сыпи на коже, преимущественно вокруг крупных суставов; на лице сыпь может быть в виде «бабочки». Часто возникает гепатит с желтухой, возможны полисерозит, пневмония. В гемограмме выявляются анемия, тромбоцитопения.
Листериозный гепатит возможен при септической форме, в ряде случаев он сопровождается желтухой. Исключительно редко именно гепатит с выраженной гиперферментемией, признаками печеночно-клеточной недостаточности, симптомами ОПЭ доминирует в клинике листериоза.
Тяжелая септическая форма листериоза чаще встречается у новорожденных, лиц с выраженным иммунодефицитом, пациентов с циррозом печени, хроническим алкоголизмом; летальность достигает 60%. Причиной смерти могут быть ИТШ, массивные кровотечения вследствие развития ДВС, различные виды органной недостаточности.
Кроме перечисленных, описаны редкие формы листериоза: эндокардит, дерматит, артрит, остеомиелит, абсцессы разных органов, паротит, уретрит, простатит и др.
При всех вышеописанных формах листериоза в крови отмечается выраженный нейтрофильный лейкоцитоз со сдвигом влево, иногда моноцитоз. При тяжелом течении может быть протеинурия, лейкоцитурия, микрогематурия.
Листериоз беременных. Беременные в 10-20 раз более восприимчивы к листериозу по сравнению с другими женщинами. Листериоз может развиться в любом сроке беременности, хотя большая часть случаев приходится на ее вторую половину. Острый листериоз у беременных протекает либо вообще бессимптомно, либо легко, со стертой полиморфной симптоматикой, поэтому диагноз устанавливается нередко ретроспективно после гибели плода или новорожденного. У беременной женщины возможны лихорадка, мышечные боли, катаральные явления со стороны верхних дыхательных путей, конъюнктивит; в этих случаях предполагают грипп или другую ОРВИ. У части больных выявляются симптомы гастроэнтерита, у других - воспаления МВП. Поражение нервной системы у беременных встречается крайне редко. Листериоз матери может приводить к трансплацентарному заражению плода, причем развитие внутриутробной инфекции бывает достаточно интенсивным, в связи с чем заболевшие мать и плод как бы обмениваются возбудителем: сначала мать инфицирует свой плод, затем плод вторично заражает мать, вызывая у нее вторичную волну заболевания. Характерной клинической особенностью листериоза беременных является критическое снижение температуры тела после прерывания беременности; в последующем лихорадка обычно не возобновляется.
Практически у всех женщин, заболевших листериозом, был отягощенный акушерско-гинекологический анамнез: эрозия шейки матки, аднексит, искусственные и самопроизвольные аборты, а также пиелонефрит.
Листериоз новорожденных протекает в форме сепсиса с высокой летальностью (до 50%). Удельный вес листериоза в перинатальной смертности достигает 25%. Сроки возникновения и клинические проявления листериоза новорожденных зависят от времени и механизма инфицирования (антенатальное или интранатальное, трансплацентарное или аспирационное заражение).
В случае трансплацентарного заражения плода происходит его внутриутробная гибель или ребенок рождается обычно со сниженной массой тела. Через несколько часов, иногда через 1-2 дня, состояние его резко ухудшается, повышается температура тела, появляется характерная папулезная, иногда геморрагическая экзантема, возникают беспокойство, одышка, цианоз, судороги и в большинстве случаев наступает смерть, причиной которой может быть некупируемый РДС, пневмония, гнойный плеврит, гепатит, менингоэнцефалит, поражение других органов. При интранатальном заражении, которое происходит во время прохождения плода через инфицированные родовые пути матери, ребенок после рождения выглядит здоровым, клинические признаки листериоза в форме сепсиса появляются после 7-го дня жизни ребенка. Аспирация плодом инфицированной амниотической жидкости может привести к тяжелому поражению легких; летальность при этом достигает 50%.
При постнатальном заражении листериоз развивается через 10-12 дней после рождения и обычно протекает в форме менингоэнцефалита с летальностью до 25%. Эта форма наиболее характерна для внутрибольничных вспышек листериоза в родильных домах.
Диагностика
Решающее значение имеет лабораторная диагностика. Предварительное заключение может быть дано на основании результатов бактериоскопического исследования окрашенных по Граму мазков осадка СМЖ и амниотической жидкости.
Окончательное установление диагноза возможно только с использованием бактериологического метода. Листерии могут быть выделены из различных биологических субстратов: крови, ЦСЖ мазков с миндалин, пунктатов ЛУ, мазков из влагалища и цервикального канала, фекалий, гнойного отделяемого из глаз, синовиальной жидкости и т.д. У женщин, родивших мертвого или с признаками листериоза ребенка, исследуют околоплодную жидкость, плаценту, отделяемое родовых путей.
В качестве методов экспресс-диагностики рекомендуют иммунохимические (РИФ, ИФА), а также ПЦР.
Дифференциальная диагностика проводится с различными заболеваниями в зависимости от клинической формы листериоза.
В частности, железистую форму необходимо дифференцировать прежде всего с ЭБВ ИМ. В ряде случаев следует исключить также аденовирусное заболевание, ЦМВИ, токсоплазмоз.
Гастроэнтеритическая форма листериоза отличается от ОКИ иной этиологии более тяжелым течением, преобладанием симптомов интоксикации над признаками поражения ЖКТ, одновременным, как правило, заболеванием большого количества лиц, употреблявших тот же продукт.
Нервную форму дифференцируют с гнойными (реже серозными) бактериальными менингитами другой этиологии.
Септическая форма листериоза неотличима по клиническим данным от сепсиса, вызванного другими микробами, иногда напоминает тифопаратифозные заболевания, иерсиниозы и др.
Листериоз беременных дифференцируют с «банальными» инфекциями МВП, а листериоз новорожденных - с врожденной ЦМВИ, токсоплазмозом, стрептококковым сепсисом, сифилисом. Основанием для предположения о наличии листериоза у беременной женщины являются: «привычные» выкидыши в анамнезе, немотивированная лихорадка, критическое снижение температуры тела после прерывания беременности (выкидыш, роды), смерть ребенка вскоре после рождения.
Лечение
Больные листериозом госпитализируются в инфекционный стационар. Необходимо как можно более раннее назначение антибактериальной терапии. При локализованной (железистой, гастроэнтеритической) форме используется один из следующих препаратов: ампициллин (амоксициллин), ко-тримоксазол [сульфаметоксазол + триметоприм] (Ко-тримоксазол♠), эритромицин, тетрациклин (доксициклин в средних терапевтических дозах).
При генерализации инфекции (нервная, септическая формы), листериозе новорожденных рекомендуется сочетание ванкомицина с Бисептолом♠, рифампицином, в течение всего лихорадочного периода и еще 5-7 дней, а в тяжелых случаях - до 2-3 нед с момента нормализации температуры.
При листериозном менингите применяют ванкомицин, меропенем (Меронем♠), линезолид, рифампицин.
Диспансерное наблюдение
Женщины детородного возраста, у которых диагностирован листериоз, до полного выздоровления и отрицательных результатов лабораторных исследований.
Бруцеллез
Бруцеллез (brucellesis, лихорадка ундулирующая, болезнь Банга, болезнь Брюса) - зоонозная инфекционная болезнь с многообразными механизмами передачи возбудителя, характеризующаяся бактериемией, специфической гиперчувствительностью, лихорадкой, поражением опорно-двигательного аппарата, нервной системы, половых органов и склонностью к хронизации.
Коды по МКБ-10
A23 Бруцеллез.
A23.0 Бруцеллез, вызванный Brucella melitensi.
A23.1 Бруцеллез, вызванный Brucella abortus.
A23.2 Бруцеллез, вызванный Brucella suis.
A23.3 Бруцеллез, вызванный Brucella canis.
Этиология
Возбудители - представители рода Brucella семейства Brucellaceae. Бруцеллез человека может быть обусловлен B. melitensis, В. abortus, В. suis, в редких случаях - B. canis. Наиболее частая причина болезни - B. melitensis, которая подразделяется на 3 биовара. Основные хозяева - овцы и козы. Реже встречаются B. abortus, представленная 7 биоварами; основной хозяин - крупный рогатый скот. У третьего вида бруцелл, B. suis, выделяют 5 биоваров. Основные хозяева - свиньи (типы 1-3), зайцы (тип 2) и северный олень (биовар 4). Основным хозяином B. canis являются собаки.
Бруцеллы отличаются выраженным полиморфизмом, они могут быть шаровидной, овальной и палочковидной формы. Размер их равен 0,3-0,6 мкм для кокковых и 0,6-2,5 мкм для палочковидных форм. Они неподвижны, спор не образуют, жгутиков не имеют, грамотрицательны, факультативные анаэробы, растут медленно на сложных питательных средах. Бруцеллы - внутриклеточные паразиты. Устойчивы в окружающей среде. В воде сохраняются свыше 2 мес, в молоке - 40 дней, в брынзе - 2 мес, в сыром мясе - 3 мес, в засоленном мясе - до 30 дней, в шерсти - до 4 мес. При кипячении погибают мгновенно, чувствительны к дезинфицирующим средствам, ко многим антибиотикам. Имеют 2 антигена - А и М. Основной фактор патогенности - ЛПС.
Эпидемиология
Бруцеллез - облигатный зооноз. Резервуар и источник возбудителя - домашние животные (овцы, козы, коровы, свиньи, реже собаки). Хотя к бруцеллезу чувствительны дикие животные (зайцы, северные олени), природных очагов инфекции нет. Бруцеллез распространен во многих странах мира (до 500 тыс. случаев в год), особенно в регионах с животноводческой ориентацией сельского хозяйства. В России бруцеллез регистрируют в Республике Дагестан, Краснодарском и Ставропольском краях, на Южном Урале, Алтае, в Республике Тыва.
Человек заражается от больных животных контактным, алиментарным, редко - аэрогенным путем. Заражение контактным путем носит профессиональный характер. Часто заражаются ветеринарные работники, телятницы, чабаны и др. Заражение может наступить и при контакте с мясом инфицированных животных. Алиментарное заражение часто происходит при употреблении непастеризованного молока или приготовленных из него продуктов (брынза, сыр, масло). Аэрогенное заражение наблюдается редко при попадании в дыхательные пути пыли, содержащей бруцеллы (в местах выпаса и в загонах для содержания скота, при стрижке овец), а также в лабораториях при нарушении техники безопасности. Чаще заболевают лица трудоспособного возраста (18-50 лет). Восприимчивость высокая. Инфицирующая доза составляет всего от 10 до 100 микробных тел. Постинфекционный иммунитет ненапряженный, через 5-6 лет возможна реинфекция.
Профилактика
Основное направление - предупреждение заноса в благополучные хозяйства, систематические обследования и выбраковка больных животных в неблагополучных хозяйствах, вакцинация животных, гигиеническое содержание и дезинфекция помещений, в которых находятся животные. Лица, ухаживающие за ними, должны носить спецодежду, систематически обследоваться на бруцеллез. Обязательны пастеризация молока, выдерживание брынзы не менее 2 мес, а твердых сыров - 3 мес. Работникам животноводства (а по показаниям - населению неблагополучных районов) вводят бруцеллезную сухую живую вакцину (накожно в объеме 2 капель или подкожно - 5 мл). Ревакцинацию проводят в половинной дозе через 10-12 мес.
Патогенез
Входные ворота инфекции - неповрежденная кожа, микротравмы кожи, неповрежденные слизистые оболочки органов пищеварения и респираторного тракта. В месте внедрения возбудителя изменений не наблюдают. По лимфатическим путям бруцеллы достигают регионарных ЛУ, но и здесь выраженные изменения отсутствуют. Размножение и накопление бруцелл происходит преимущественно в ЛУ, из которых они периодически поступают в кровь, а гибель сопровождается освобождением эндотоксина, вызывающего лихорадку, поражение вегетативной нервной системы. С кровотоком возбудитель разносится по всему организму, концентрируясь в органах и тканях, богатых макрофагами (печень, селезенка, мышцы, фасции, суставные сумки, сухожилия), где вследствие незавершенного фагоцитоза длительно сохраняется, вызывает воспалительную реакцию с образованием специфических гранулем.
Для бруцеллеза характерна выраженная аллергическая перестройка организма, резко выражена ГЗТ, сохраняющаяся длительное время даже после освобождения организма от возбудителя. Аллергия играет большую роль в формировании вторичных очагов инфекции. Бруцеллез отличается склонностью к хроническому течению, что связано с длительным персистированием бруцелл в организме.
Клиническая картина
Инкубационный период при остром начале бруцеллеза продолжается около 3 нед, однако если бруцеллез начинается как первично-латентный, который затем переходит в клинически выраженную форму, то инкубация может длиться несколько месяцев.
Наиболее обоснована классификация клинических форм бруцеллеза, предложенная Н.И. Рагозой (1952), который выделил четыре фазы инфекции:
С этими фазами тесно связаны и выделены пять клинических форм бруцеллеза:
В качестве отдельного варианта выделена септико-метастатическая форма, к которой относят те случаи, когда на фоне остросептической формы обнаруживают отдельные очаговые изменения (метастазы). В классификации показана динамика дальнейшего развития каждой выделенной формы.
Первично-латентная форма бруцеллеза характеризуется состоянием практического здоровья. При ослаблении защитных сил организма она может перейти или в остросептическую, или в первично-хроническую метастатическую форму. При тщательном обследовании лиц с этой формой бруцеллезной инфекции иногда можно обнаружить микросимптомы в виде небольшого увеличения периферических ЛУ, субфебрилитета, повышенной потливости при физическом напряжении. Однако эти лица считают себя здоровыми и полностью сохраняют работоспособность.
Остросептическая форма характеризуется высокой лихорадкой (39-40 °С и выше), температурная кривая имеет в ряде случаев тенденцию к волнообразному течению, нередко неправильного типа с большой суточной амплитудой, повторными приступами озноба и пота. Несмотря на высокую и очень высокую температуру тела, самочувствие больного остается удовлетворительным. Отсутствуют и выраженные признаки общей интоксикации.
Характерно умеренное увеличение всех групп ЛУ, некоторые из них чувствительны при пальпации. К концу 1-й недели болезни часто увеличиваются печень и селезенка. При исследовании периферической крови отмечается лейкопения, СОЭ не повышена. Главное отличие этой формы - отсутствие очаговых изменений (метастазов). Без антибиотикотерапии лихорадка может длиться 3-4 нед и более. Эта форма не угрожает жизни больного и даже без этиотропного лечения заканчивается выздоровлением. В связи с этим остросептическую форму бруцеллеза нельзя считать сепсисом, а нужно рассматривать как один из вариантов бруцеллеза.
Хронические формы бруцеллеза в одних случаях развиваются сразу, минуя острую фазу, в других случаях признаки хронического бруцеллеза появляются спустя какое-то время после остросептической формы бруцеллеза. По клиническим проявлениям первично- и вторично-хронические метастатические формы бруцеллеза не различаются.
Клинически хронические формы характеризуются синдромом общей интоксикации, на фоне которой наблюдают ряд органных поражений. Отмечают длительный субфебрилитет, слабость, повышенную раздражительность, плохой сон, нарушение аппетита, снижение работоспособности. Почти у всех больных наблюдают генерализованную ЛАП, причем наряду с относительно недавно появившимися увеличенными узлами (мягкими, чувствительными или болезненными при пальпации) отмечают мелкие, очень плотные безболезненные склерозированные ЛУ (0,5-0,7 см в диаметре). Часто обнаруживают увеличение печени и селезенки. На этом фоне выявляют органные поражения.
Наиболее типично поражение опорно-двигательного аппарата. Больные жалуются на боли в мышцах и суставах, преимущественно крупных. Для бруцеллеза характерен полиартрит, при каждом обострении в процесс вовлекаются новые суставы. Чаще поражаются коленный, локтевой, плечевой, тазобедренный суставы, редко - мелкие суставы кисти и стоп. Характерны периартрит, параартрит, бурсит. Суставы отекают, подвижность в них ограничена, кожа над ними, как правило, нормальной окраски. Нарушение подвижности и деформация суставов обусловлены разрастанием костной ткани. Поражается позвоночник, чаще в поясничном отделе.
Для бруцеллеза типичен сакроилеит, диагностическая значимость его крайне велика, так как другие этиологические агенты вызывают его очень редко. Для выявления сакроилеита существует ряд диагностических приемов. Информативен симптом Эриксена: больного укладывают на перевязочный стол и производят давление на гребень подвздошной кости при положении на боку или сдавливают обеими руками передние верхние гребни подвздошных костей в положении на спине. При одностороннем сакроилеите возникают боли на пораженной стороне, при двустороннем - отмечают боли в крестце с двух сторон.
При хронических формах бруцеллеза часто поражаются мышцы. Миозиты проявляются тупыми, продолжительными болями в пораженных мышцах, интенсивность их нередко связана с изменениями погоды. При пальпации, чаще в мышцах конечностей и поясницы, определяют более болезненные участки, а в толще мышц прощупывают болезненные уплотнения различных размеров и формы. Чаще они пальпируются в виде тяжей, валиков, реже имеют округлую или овальную форму. Со временем в одном участке изменения мышц проходят, но появляются воспалительные очаги в других мышечных группах. После введения специфического антигена (например, при постановке пробы Бюрне) болевые ощущения в области пораженных мышц заметно усиливаются, а иногда можно определить и увеличение размеров воспалительного инфильтрата.
Помимо миозитов, у больных бруцеллезом часто (до 50-60%) выявляют фиброзит (целлюлит), который может локализоваться в подкожной клетчатке на голенях, предплечьях и особенно часто на спине и пояснице. Размеры фиброзитов (целлюлитов) колеблются от 5-10 мм до 3-4 см. Вначале их прощупывают в виде мягких овальных образований, болезненных при пальпации (иногда больные сами обращают внимание на их появление). В дальнейшем они уменьшаются в размерах, могут полностью рассосаться или склерозируются и остаются на длительное время в виде небольших плотных образований, безболезненных при пальпации. При обострениях возможно появление новых фиброзитов.
Поражение нервной системы при хроническом бруцеллезе проявляется чаще всего невритом, полиневритом, радикулитом. Поражение ЦНС (миелит, менингит, энцефалит, менингоэнцефалит) наблюдают редко, но эти осложнения протекают длительно и довольно тяжело.
Изменения половой системы у мужчин выражены орхитом, эпидидимитом; снижена половая функция. У женщин наблюдают сальпингит, метрит, эндометрит. Возникает аменорея, может развиться бесплодие. У беременных часты аборты, мертворождения, преждевременные роды. Описан врожденный бруцеллез у детей.
Иногда наблюдают поражения глаз (ирит, хориоретинит, увеит, кератиты, атрофия зрительного нерва и др.).
При аэрогенном заражении часто развиваются вялотекущие бруцеллезные пневмонии, которые безуспешно лечатся антибиотиками.
Возможны миокардит, эндокардит, аортит и другие поражения сердечно-сосудистой системы.
Вторично-хроническая форма протекает так же, как и первично-хроническая. И та, и другая заканчиваются переходом во вторично-латентную форму, могут неоднократно рецидивировать.
Вторично-латентная форма отличается от первично-латентной тем, что она значительно чаще переходит в манифестные формы (рецидивирует); кроме того, на фоне вторичной латенции возможно развитие различных резидуальных явлений после хронических форм (ограничение подвижности суставов, бесплодие, нарушение зрения и т.д.).
Течение бруцеллеза зависит от вида возбудителя. При овечьем бруцеллезе (Brucella melitensis) болезнь чаще начинается остро и протекает тяжелее, чем при заражении от коров (Brucella abortus). Однако нужно учитывать, что при совместном содержании скота отмечают инфицирование коров от овец, и тогда человек заражается от коров Brucella melitensis.
Осложнения, вызванные вторичной флорой, редки.
Диагностика
При диагностике бруцеллеза учитывают эпидемиологические предпосылки. Необходимо уточнить пребывание в местах, где бруцеллез еще встречают. Однако иногда заражение происходит через продукты, инфицированные бруцеллами (брынза домашнего изготовления, молоко и др.).
Лабораторное подтверждение бруцеллеза ограничено, поскольку бруцеллы относятся к опасным возбудителям, поэтому выделение гемокультуры, пробы на морских свинках проводят только в специальных лабораториях. При серологических и аллергологических исследованиях необходимо учитывать, что у привитых против бруцеллеза довольно долго могут быть положительными результаты и серологических реакций, и особенно кожной аллергической пробы Бюрне.
Из серологических реакций используется РА (реакция Райта). Положительным считается титр 1:100 и выше. РА на стекле (реакция Хеддлсона) для диагностики не используют. Она применяется при массовых обследованиях по эпидемиологическим показаниям. Реакция Хеддлсона часто дает ложноположительные результаты.
При острой форме бруцеллеза антитела в диагностическом титре можно определить со 2-й недели болезни, в дальнейшем титр их нарастает. Аллергическая проба становится положительной в конце первой и на 2-й неделе. При хронических формах нарастания титра антител часто не обнаруживают. Следует учитывать, что постановка аллергической пробы может вызвать появление антител или нарастание их титра, поэтому ее постановку следует проводить после взятия крови на серологические исследования.
В последние годы широко применяется ПЦР-диагностика, которая позволяет выявить специфические фрагменты генома возбудителя с первых дней болезни (до применения антибиотиков) при низкой микробной нагрузке (100-1000 микробных тел в мкл). ПЦР позволяет получить результат в течение 4-6 ч, обладает 100% специфичностью.
Применяют также ИФА как для выявления антигенов возбудителя, так и антител, реакцию Кумбса и РНГА.
Дифференциальная диагностика
Существенно различается в зависимости от формы бруцеллеза. Остросептическую форму следует дифференцировать от многих заболеваний, сопровождающихся высокой лихорадкой. Основное отличие бруцеллеза - удовлетворительное самочувствие больных при температуре 39-40 °С, хотя при некоторых болезнях (лимфогранулематоз, туберкулез) самочувствие также может оставаться удовлетворительным при высокой температуре.
При острой форме бруцеллеза нет очаговых органных поражений, бывают лишь увеличены печень и селезенка, отсутствуют изменения крови (рис. 20-3).
Труднее дифференцировать хронические формы бруцеллеза. Их особенность - поражение суставов, в связи с чем их следует дифференцировать от многих болезней, характеризующихся артритом.
Более тяжелое гнойное поражение суставов наблюдают при сепсисе и генерализованных формах ряда болезней (сап, мелиоидоз, листериоз). Моноартриты крупных суставов бывают следствием гонореи или хламидиоза (в сочетании с уретритом и другими проявлениями этих болезней).
Бруцеллез необходимо дифференцировать от полиартритов другой этиологии: ревматоидного артрита, системной красной волчанки, системной склеродермии, псориатического артрита, саркоидоза.
Лечение
Принципы и методы терапии бруцеллеза зависят от его клинической формы.
В соответствии с «Федеральными стандартами объема медицинской помощи, оказываемой больным бруцеллезом» длительность госпитализации составляет 26 дней для больных острым бруцеллезом и 30 дней - хроническим. Комплекс терапии включает антибактериальную терапию, НПВС, глюкокортикоиды, десенсибилизирующую, дезинтоксикационную, иммуно-, физиотерапию и санаторно-курортное лечение.
Антибактериальную терапию проводят при наличии лихорадочной реакции. Продолжительность лечения составляет до 1,5 мес. Рекомендуют одну из схем:
-
доксициклин внутрь по 100 мг 2 р/сут + стрептомицин в/м по 1 г/сут (первые 15 дней);
-
доксициклин внутрь по 100 мг 2 р/сут + рифампицин внутрь по 600-900 мг/сут в 1-2 приема;
-
ко-тримоксазол [сульфаметоксазол + триметоприм] (Ко-тримоксазол♠) внутрь по 960 мг 2 р/сут + рифампицин внутрь по 600 мг 1-2 р/сут или стрептомицин в/м по 1 г 1 р/сут.
Эффективны также комбинации доксициклина с гентамицином и рифампицина с офлоксацином, пефлоксацином.
В связи с высокой эффективностью антибиотиков и сенсибилизирующим эффектом вакцинотерапию в настоящее время не рекомендуют.
Следует учитывать, что даже при полном исчезновении всех клинических проявлений у 20-30% больных бруцеллезом в дальнейшем может наступить обострение.
С целью десенсибилизации при всех формах бруцеллеза применяют антигистаминные препараты (хлоропирамин, мебгидролин, прометазин). При поражении опорно-двигательного аппарата (артрит, полиартрит) показаны НПВС: диклофенак, ибупрофен, индометацин, мелоксикам, нимесулид и др. При неэффективности НПВС их сочетают с глюкокортикоидами (преднизолон, дексаметазон, триамцинолон) в средних терапевтических дозах (30-40 мг преднизолона перорально) со снижением дозы через 3-4 дня. Продолжительность курса лечения 2-3 нед. Глюкокортикоиды показаны также при поражении нервной системы, орхитах.
При хронической форме болезни, протекающей с обострениями и наличием иммуносупрессии, назначают иммуномодуляторы.
При поражениях опорно-двигательного аппарата и ПНС рекомендуют физиотерапию [индуктотерапия, электрофорез прокаина (Новокаина♠), гиалуронидазы (Лидазы♠), диметилсульфоксида (Димексида♠); ультравысокочастотная терапия, ионогальванотерапия, применение озокерита, парафиновых аппликаций, массаж, лечебная гимнастика и др.].
После того как признаки активности процесса исчезают, назначают бальнеотерапию. Преимущество отдают местным курортам. При нейровегетативных нарушениях показаны гидрокарбонатные, гидросульфатно-сероводородные, радоновые воды. При поражениях опорно-двигательного аппарата и ПНС эффективна грязетерапия.
Прогноз для жизни благоприятный. При адекватном лечении обычно наступает полное выздоровление. При остром неосложненном бруцеллезе клинические симптомы исчезают через 2-3 нед, однако лечение следует продолжать в течение 6 нед и более. Рецидивы заболевания возникают в 5% случаев. Летальные исходы редки. Возможна инвалидизация в результате тяжелых поражений опорно-двигательного аппарата и ЦНС.
Диспансеризация. Переболевшие острым и подострым бруцеллезом находятся под наблюдением на протяжении 2 лет с момента заболевания, если отсутствуют клинико-иммунологические признаки хронизации процесса. Переболевших обследует врач КИЗ в первый год через 1-3, 6, 9, 12 мес, а в течение второго года - ежеквартально.
Чабаны, доярки, ветеринарные работники, работники мясокомбинатов и другие профессиональные группы подлежат постоянному диспансерному наблюдению в течение всего периода работы.
Лица, взятые на учет как подозрительные на заболевание бруцеллезом (с положительными серологическими реакциями или аллергической пробой Бюрне) без явных клинических проявлений, должны обследоваться не реже одного раза в квартал. Если титр серологических реакций нарастает, больных повторно обследуют не реже одного раза в 2 мес, при необходимости назначают лечение.
Туляремия
Туляремия (лат. tularemia) - острая зоонозная бактериальная природно-очаговая инфекционная болезнь с разнообразными механизмами передачи возбудителя. Характеризуется лихорадкой, интоксикацией, воспалительными изменениями в области входных ворот инфекции, поражением лимфоузлов.
Коды по МКБ-10
А21.0 Ульцерогландулярная туляремия.
А21.1 Окулогландулярная туляремия.
А21.2 Легочная туляремия.
А21.3 Желудочно-кишечная туляремия.
Этиология
Возбудитель - Francisella tularensis, род Francisella, семейство Brucella ceae. Грамотрицательная полиморфная (преимущественно кокковидная) неподвижная палочка, не образующая спор. Факультативный анаэроб. Культивируется на специальных питательных средах.
Микроорганизм содержит соматический (О) и поверхностный (Vi) антигены, с которыми связаны вирулентность и иммуногенные свойства возбудителя. Основной фактор патогенности - эндотоксин. В настоящее время род Francisella включает два вида: Francisella tularensis и Francisella philomiragia, в пределах которых выделяют четыре подвида: неарктический, американский (или тип А), среднеазиатский и голарктический (или тип В). На территории РФ распространен голарктический подвид.
F. tularensis устойчива в окружающей среде, особенно при низких температурах и высокой влажности (выживает при -30 °С, сохраняется во льду до 10 мес, в замороженном мясе - до 3 мес). Возбудитель менее устойчив к высыханию (в шкурках павших от туляремии грызунов сохраняется до 1,5 мес, при температуре 30 °С - до 1 нед); сохраняет жизнеспособность в речной воде при температуре 10 °С до 9 мес, в почве - до 2,5 мес, в молоке - до 8 сут, на зерне и соломе при -5 °С - до 192 сут, при температуре 20-30 °С - до 3 нед. В то же время F. tularensis весьма чувствительна к инсоляции, ультрафиолетовому облучению, ионизирующей радиации, высокой температуре и дезинфицирующим средствам (под действием растворов лизола, хлорамина, хлорной извести, сулемы погибают за 3-5 мин).
Для полного обеззараживания трупы инфицированных животных выдерживают в дезинфицирующем растворе не менее суток, после чего сжигают.
Возбудитель чувствителен к хлорамфениколу, рифампицину, стрептомицину и другим аминогликозидам, антибиотикам тетрациклиновой группы, фторхинолонам, устойчив к пенициллинам.
Эпидемиология
Туляремия - природно-очаговая болезнь, облигатный зооноз. Источником возбудителя инфекции служат около 150 видов животных. На территории России основной резервуар и источник инфекции - грызуны (мышевидные, кролики, зайцы, водяные крысы, ондатры, хомяки и др.). Выделения и трупы павших животных содержат большое количество возбудителей, которые обсеменяют объекты окружающей среды, в том числе и воду, и длительно в них сохраняются. Между грызунами передача инфекции осуществляется алиментарным и трансмиссивным путем. Среди домашних животных резервуаром инфекции могут быть овцы, свиньи, крупный рогатый скот, лошади, но заражение людей чаще всего происходит в природных очагах при прямом и косвенном контакте с грызунами.
Переносчики инфекции, поддерживающие существование возбудителя в природных очагах, - кровососущие членистоногие (иксодовые и гамазовые клещи, комары, слепни), клещи передают возбудителя трансфазово и трансовариально.
Различают четыре механизма передачи возбудителя:
-
контактный - при контакте с инфицированными грызунами (разделка туш, снятие шкурок) и водой (купание, умывание, полоскание белья);
-
алиментарный - при употреблении инфицированных, термически необработанных продуктов и воды;
-
аэрозольный - при вдыхании инфицированной пыли через рот и нос во время веяния и обмолота зерна, скирдования сена и соломы;
-
трансмиссивный (основной) - при укусе инфицированных кровососущих членистоногих или их раздавливании.
Легочная форма туляремии развивается при аэрозольном заражении, ангинозно-бубонная и абдоминальная - при алиментарном, язвенно-бубонная и глазо-бубонная - при трансмиссивном и контактном заражении.
Восприимчивость людей к туляремии высокая (достигает 100%). Отмечают летне-осеннюю сезонность. Заражение человека происходит преимущественно в сельской местности, но в последние годы среди заболевших преобладают жители городов (до 70%).
Лица, перенесшие заболевание, приобретают стойкий, продолжительный, но не абсолютный иммунитет.
Меры профилактики
Специфическая профилактика
Основа специфической профилактики - вакцинация. Необходимость в вакцинации определяют территориальные центры Госсанэпиднадзора на основании анамнеза эпидемиологической обстановки на подведомственной территории.
В России лицензирована и используется живая лиофилизированная вакцина из штамма 15 линии НИИЭГ. Различают плановую и внеплановую (по эпидемическим показаниям) вакцинацию.
Плановая вакцинация проводится населению, проживающему в энзоотичных по туляремии местностях, начиная с 7 лет (в очагах полевого типа - с 14 лет), однократно.
Прививки показаны лицам, выполняющим следующие работы:
В районах, благополучных в отношении туляремии, прививки проводят по эпидемическим показаниям (нарастание численности грызунов, выявление туляремийной эпизоотии, заболевания среди людей).
Неспецифическая профилактика
Предусматривает контроль за природными очагами туляремии, своевременное выявление эпизоотий среди диких животных, проведение дератизационных и дезинсекционных мероприятий.
При водной вспышке запрещают употреблять некипяченую воду и купаться, а при заражении колодезной воды принимают меры к очистке колодца от трупов грызунов и проводят дезинфекцию воды.
При угрозе трансмиссивного заражения рекомендуется применять репелленты, защитную одежду, ограничивается въезд непривитого населения на неблагополучные территории.
Для профилактики промысловых заражений целесообразно использовать перчатки при снятии шкурок с убитых грызунов и дезинфицировать руки. Проводят мероприятия по дезинсекции и дезинфекции на складах хранения шкурок. Необходима тщательная термическая обработка мяса (например, заячьего) перед употреблением в пищу.
При скирдовании сена и обмолоте хлеба употребляют очки-консервы и защитные маски.
Среди населения районов, неблагополучных по туляремии, необходимо проводить систематическую разъяснительную и санитарно-просветительную работу.
За лицами, находившимися в одинаковых с больными условиях по риску заражения, проводят медицинское наблюдение в течение 21 дня. В жилье больного осуществляют дезинфекцию.
Патогенез
F. tularensis проникает в организм человека через кожу (даже внешне не поврежденную) и слизистые оболочки глаз, дыхательных путей, миндалин и ЖКТ. При инфицировании через кожу или аэрогенным путем для развития болезни достаточно 50 жизнеспособных микроорганизмов, а при алиментарном заражении - более 100 микробных клеток.
В месте входных ворот инфекции происходит размножение возбудителя с развитием первичного аффекта (кожная язва, проходящая стадии папулы, везикулы и пустулы; на миндалинах - некротическая ангина, в легких - очаговая некротическая пневмония, на конъюнктиве - конъюнктивит). Затем возбудитель проникает в регионарные ЛУ, вызывая развитие специфического лимфаденита - первичного бубона. Здесь происходит частичная гибель бактерий, сопровождаемая выделением эндотоксина (ЛПС-комплекс), усиливающего местный воспалительный процесс и вызывающего развитие интоксикации при поступлении в кровь.
В ряде случаев возбудитель преодолевает лимфатический барьер и распространяется гематогенно (генерализация процесса), вызывая поражение других групп ЛУ, не связанных с местом внедрения микроорганизма (вторичные бубоны) и внутренних органов (печень, селезенка, легкие). Гибель возбудителя, циркулирующего в крови, и высвобождение эндотоксина усугубляют интоксикацию.
Возможны рецидивы, связанные с длительной внутриклеточной персистенцией возбудителя в макрофагах.
Для туляремии характерен гранулематозный тип воспаления как следствие незавершенного фагоцитоза. Гранулемы образуются в ЛУ и внутренних органах (обычно в печени и селезенке) из эпителиальных клеток, полиморфноядерных лейкоцитов и лимфоцитов. По внешнему виду и клеточному составу туляремийные гранулемы напоминают туберкулезные. Они подвержены некрозу и нагноению с последующим замещением соединительной тканью. В местах скопления гранулем возможно образование абсцессов. При острых формах туляремии преобладают некротические изменения, при подострых - признаки реактивного воспаления.
Наиболее ярко гранулематозный процесс выражен в регионарных ЛУ, где развивается первичный лимфаденит (бубон). При его нагноении и вскрытии образуется длительно не заживающая язва. Во вторичных бубонах нагноения обычно не происходит.
При аэрозольном заражении наиболее выраженные изменения в виде фокусов альвеолярного некроза, инфильтрации и формирования гранулем наблюдают в трахеобронхиальных ЛУ и легочной паренхиме. В сердце и почках отмечают дистрофические изменения, в кишечнике - поражение пейеровых бляшек и мезентериальных ЛУ.
Клиническая картина
Инкубационный период составляет от нескольких часов до 3 нед (в среднем 3-7 дней).
В зависимости от механизма заражения различают несколько форм заболевания (табл. 16-11).
| Клиническая форма | Механизм заражения |
|---|---|
Бубонная (гландулярная)* |
Контактный |
Язвенно-бубонная (ульцерогландулярная) |
Трансмиссивный |
Глазобубонная (окулогландулярная) |
Аэрозольный |
Ангинозно-бубонная (ангинозногландулярная) |
Фекально-оральный |
Абдоминальная (желудочно-кишечная) |
Фекально-оральный |
Легочная с бронхитическим и пневмоническим вариантами (торакальная) |
Аэрозольный |
Генерализованная или первично-септическая |
- |
* В скобках даны названия, соответствующие МКБ-10.
По длительности течения выделяют острую (до 3 мес), затяжную (до 6 мес), рецидивирующую формы туляремии и, кроме того, инаппарантную (бессимптомную, латентную) туляремию, которую обнаруживают преимущественно во время эпидемических вспышек при лабораторном обследовании.
Симптомы начального периода одинаковы при всех клинических формах. Типично острое начало: с озноба, лихорадки и симптомов интоксикации. Температура в течение нескольких часов поднимается до 38-40 °С и выше. Одновременно возникают головная боль, головокружение, слабость, разбитость, мышечные боли (особенно в поясничной области и икроножных мышцах), ухудшение аппетита, нарушения сна, повышенная потливость. Возможны брадикардия, гипотония, гепатоспленомегалия.
Характерен внешний вид больного: лицо одутловато и гиперемировано, в тяжелых случаях - синюшно-багрового цвета (особенно вокруг глаз, губ, мочек ушей). Нередко вокруг подбородка отмечают бледный треугольник, обнаруживают признаки конъюнктивита, инъекцию сосудов склер, точечные кровоизлияния на слизистой оболочке полости рта. Возможны носовые кровотечения.
На коже с 3-го дня болезни в отдельных случаях появляется сыпь эритематозного, папулезного или петехиального характера, которая разрешается пластинчатым и/или отрубевидным шелушением, пигментацией.
Наиболее характерным признаком является лимфаденит различной локализации, отмечающийся при всех формах заболевания.
Бубон обычно локализуется в области паховых, бедренных, локтевых и подмышечных ЛУ. Лимфаденит обнаруживают через 2-3 дня после начала болезни. Постепенно увеличиваясь, ЛУ достигают максимального размера к 5-8-му дню болезни. При вовлечении в процесс группы регионарных ЛУ возможно образование конгломерата с признаками периаденита. Размеры бубона могут варьировать от величины лесного ореха до 10 см. Окраска кожи над бубоном сначала не изменена; подвижность ограничена, болезненность выражена слабо. Эволюция бубона различна. Чаще всего происходит полное рассасывание (с конца 2-й недели) или склерозирование. Реже отмечают нагноение (с конца второй - начала третьей недели). При этом кожа над ЛУ краснеет, узел спаивается с кожей и становится более болезненным, появляется флюктуация. В дальнейшем образуется свищ, через который выделяется густой сливкообразный гной. В этом случае заживление или рассасывание бубона происходит очень медленно, волнообразно, часто с рубцеванием и склерозированием ЛУ. В связи с этим при нагноении узел иссекают.
Вторичные (при гематогенном распространении возбудителя) бубоны не связаны с входными воротами, они меньше первичных, не нагнаиваются и полностью рассасываются.
Исход и продолжительность бубонной формы туляремии зависят от своевременности специфической терапии. Без полноценного лечения длительность заболевания (до рубцевания нагноившегося ЛУ) может составлять 3-4 мес и более.
При язвенно-бубонной форме туляремии в месте внедрения возбудителя образуется первичный аффект. Он развивается при трансмиссивном заражении. Местный процесс последовательно проходит стадии пятна, папулы, везикулы и пустулы, которая, вскрываясь, преобразуется в безболезненную небольшую (5-7 мм) правильной круглой формы язву. Края ее приподняты, отделяемое серозно-гнойное, скудное. Часто язва остается незамеченной. Обычная локализация первичного аффекта - открытые части тела (шея, предплечья, голени).
Первичный аффект сопровождается формированием регионарного бубона. Язва заживает под коркой в течение 2-3 нед и дольше. После отторжения корочки остается депигментированный атрофический рубец.
Ангинозно-бубонная форма возникает при заражении алиментарным путем. При этом первичный аффект расположен на миндалинах (чаще - на одной из них) или на слизистой оболочке задней стенки глотки. Специфический тонзиллит характеризуется гиперемией с синюшным оттенком и отечностью миндалины, серовато-белым островчатым или пленчатым налетом. Налеты снимаются с трудом и напоминают дифтерийные, но они не распространяются за пределы миндалин. Под налетом через несколько дней формируется одна или несколько медленно заживающих язв. В ряде случаев патологический процесс на слизистой оболочке глотки ограничивается симптомами катарального тонзиллита. Одновременно наблюдают поднижнечелюстной бубон. Иногда бубон формируется позднее тонзиллита. Заболевание протекает с высокой температурой и интоксикацией. Продолжительность туляремийной ангины составляет от 8 до 24 дней. В тяжелых случаях специфические антитела обнаруживают поздно, что затрудняет диагностику заболевания.
Абдоминальная форма, так же как ангинозно-бубонная, развивается при алиментарном заражении. Для нее характерны высокая температура и выраженная интоксикация. Появляются интенсивные ноющие или схваткообразные, разлитые или локализованные в определенной области боли в животе, нередко имитирующие картину острого живота. Язык обложен серо-белым налетом, суховат. Возможны тошнота, рвота, метеоризм, увеличение печени и селезенки. С самого начала болезни наблюдают задержку стула или жидкий стул без патологических примесей. Описаны случаи язвенного поражения слизистой оболочки подвздошной и тонкой кишки, пилорической части желудка и двенадцатиперстной кишки.
Глазобубонная форма возникает при заражении через конъюнктиву, когда возбудитель проникает в глаз через загрязненные руки, воздушно-пылевым путем, при умывании водой из инфицированных источников или при купании. Офтальмическая форма туляремии протекает довольно тяжело, но ее наблюдают сравнительно редко (1-2% случаев).
Характерно развитие острого, чаще одностороннего конъюнктивита с сильным слезотечением и отеком век, выраженным набуханием переходной складки конъюнктивы, слизисто-гнойным отделяемым. На слизистой оболочке нижнего века отмечают желтовато-белые узелки размером с просяное зерно, язвочки. Зрение не страдает. Процесс сопровождается увеличением и незначительной болезненностью околоушных, переднешейных и поднижнечелюстных ЛУ. Длительность заболевания от 3 нед до 3 мес и дольше. Возможно развитие таких осложнений, как дакриоцистит, флегмона, кератит, перфорация роговицы.
Легочную форму с первичным воспалительным процессом в легких регистрируют в 11-30% случаев туляремии. Заражение происходит воздушно-пылевым путем.
Выделяют два варианта легочной формы - бронхитический и пневмонический.
Бронхитический вариант, при котором поражаются ЛУ корня легкого, протекает относительно легко, с субфебрильной температурой, сухим кашлем, болью за грудиной (при развитии трахеита). Выслушивают жесткое дыхание, рассеянные сухие хрипы. При рентгенологическом исследовании обнаруживают увеличение трахеобронхиальных ЛУ. Клиническое выздоровление наступает через 10-14 дней.
Пневмонический вариант протекает тяжелее и длительнее (до 2 мес и более), со склонностью к рецидивированию и абсцедированию. Обнаруживают клиническую картину пневмонии (очаговой, сегментарной, долевой или диссеминированной), которая не имеет каких-либо патогномоничных признаков. Физикальные данные скудные (притупление перкуторного звука, разнокалиберные сухие и влажные хрипы) и возникают поздно. Возможно вовлечение в патологический процесс плевры. Часто обнаруживают гепато- и спленомегалию.
Рентгенологически определяют усиление легочного рисунка (периваскулярные и перибронхиальные инфильтраты), увеличение прикорневых, паратрахеальных и медиастинальных ЛУ, плевральный выпот. Все эти признаки можно обнаружить не ранее 7-го дня болезни. В результате некротизации пораженных участков легкого могут образоваться туляремийные каверны.
Легочная форма туляремии при своевременном и правильном лечении заканчивается выздоровлением; летальность не превышает десятых долей процента (в прошлом - до 5%), но характеризуется длительным (до 2 мес) течением, развитием абсцессов, бронхоэктазов.
Генерализованная форма туляремии развивается преимущественно у ослабленных лиц, при лабораторном заражении, массивном инфицировании высоковирулентными штаммами. Заболевание характеризуется выраженной интоксикацией, нередко спутанным сознанием, бредом, лабильностью пульса и АД, гепатоспленомегалией на фоне высокой ремиттирующей, длительной (до нескольких недель) лихорадки. При этом у больных в месте внедрения возбудителя отсутствуют какие-либо изменения и регионарный лимфаденит.
В периоде разгара болезни у многих больных появляется розеолезная сыпь. Сыпь держится 8-12 дней с последующим отрубевидным или крупнопластинчатым шелушением и пигментацией. Возможно сочетание ее с поражением суставов преимущественно кистей и стоп.
Рецидивы, так же как и затяжное течение, чаще наблюдают при поздно начатой или неполноценной антибактериальной терапии. Выделяют ранние (через 3-5 нед) и поздние (через несколько месяцев и даже лет) рецидивы. Чаще рецидивирует бубонная туляремия.
Осложнения чаще отмечаются при генерализованной форме туляремии. Возможно развитие менингита, менингоэнцефалита, перикардита, миокардиодистрофии, полиартрита, перитонита (вследствие нагноения и самопроизвольного вскрытия мезентериальных ЛУ при абдоминальной форме), перфорации роговицы, бронхоэктазий, абсцесса и гангрены легких (при пневмонической форме). Течение любой формы может осложниться туляремийной пневмонией.
Диагностика
При распознавании туляремии необходимо учитывать эпидемиологические предпосылки - пребывание в природных очагах, контакты с грызунами, сезон, профессию больного и др.
При анализе клинической симптоматики особое диагностическое значение имеют данные о формировании бубона, наличии первичного аффекта, выраженности и динамики интоксикации, интенсивности болевого синдрома в области местного процесса, наличии периаденита и лимфангита и др.
Картина крови не имеет диагностического значения.
Для специфической диагностики туляремии применяют серологические и аллергические тесты, бактериологическое исследование и биологическую пробу. Основные серологические методы - РА и РПГА с диагностическим титром 1:100 и выше (стандарт диагностики). Диагностическая ценность РПГА выше, так как антитела в титре 1:100 обнаруживают рано, уже к концу 1-й недели (в РА - с 10-15-го дня). Нарастание титра антител в 4 раза в РА и РПГА подтверждает диагноз туляремии. Отсутствие роста указывает на анамнестический характер реакции. ИФА на твердофазном носителе положителен с 6-10-х суток заболевания (диагностический титр 1:400); по чувствительности он в 10-20 раз превышает другие методы серодиагностики.
В диагностике туляремии может быть использована кожная аллергическая проба, отличающаяся строгой специфичностью. Она становится положительной уже с 3-5-го дня болезни. Тулярин вводят внутрикожно или накожно в среднюю треть ладонной поверхности предплечья. Результат учитывают через 24, 48 и 72 ч. Пробу считают положительной при диаметре инфильтрата и гиперемии не менее 0,5 см. Одну лишь гиперемию, исчезающую через 24 ч, расценивают как отрицательный результат. Проба с тулярином не позволяет отличать свежие случаи заболевания от анамнестических и прививочных реакций. Бактериологические методы и биологическая проба возможны только в специально оснащенных лабораториях, имеющих разрешение на работу с возбудителями I-II групп патогенности.
ПЦР, с помощью которой можно обнаружить специфическую ДНК в различных биологических субстратах (кровь, отделяемое конъюнктив, язвочки, отделяемое нагноившегося бубона), является высокочувствительным и специфическим методом ранней диагностики.
Дифференциальная диагностика
При проведении дифференциальной диагностики в начальном периоде заболевания необходимо исключить брюшной тиф, риккетсиозы, боррелиозы, пневмонию, а в последующем - чуму, сибирскую язву, язвенно-некротическую ангину, дифтерию, неспецифический лимфаденит, туберкулез, сепсис, малярию, бруцеллез, паротит, доброкачественный лимфоретикулез, содоку, ИМ.
Для доброкачественного лимфоретикулеза (фелиноза), так же как и для туляремии, характерно наличие первичного аффекта в области ворот инфекции и бубона (чаще в области подмышечных и локтевых лУ).
Наиболее важно указание на контакт с кошкой (90-95% больных) в виде царапины или укуса. Течение болезни доброкачественное, интоксикация и лихорадка не выражены.
Лечение
Больных госпитализируют по клиническим показаниям. Окна в палатах должны быть закрыты сеткой, чтобы не допустить трансмиссивного пути распространения инфекции.
В остром периоде больным необходимы постельный режим и полноценное питание.
Основные этиотропные препараты - аминогликозиды и тетрациклины (стандарт лечения).
Стрептомицин назначают по 0,5 г 2 р/сут внутримышечно, а при легочной или генерализованной форме - по 1 г 2 р/сут. Гентамицин применяют парентерально по 3-5 мг/кг/сут в 1-2 приема; амикацин - по 10-15 мг/кг/сут в 2-3 приема.
При своевременно начатом лечении бубонной и язвенно-бубонной форм туляремии средней тяжести возможен прием внутрь доксици-клина в суточной дозе 0,2 г или тетрациклина по 0,5 г 4 р/сут.
Второй ряд антибиотиков включает ЦС III поколения, рифампицин, хлорамфеникол, фторхинолоны, применяемые в возрастных дозах. В настоящее время при лечении туляремии ципрофлоксацин рассматривают в качестве препарата, альтернативного аминогликозидам.
Длительность курса антибиотикотерапии составляет 10-14 дней (до 5-7-го дня нормальной температуры).
При наличии кожных язв и бубонов (до возникновения нагноения) рекомендуются местные компрессы, мазевые повязки, тепловые процедуры, прогревания соллюксом, синим светом, кварцем, лазерное облучение, диатермия.
При нагноении бубона, возникновении флюктуации необходимо хирургическое вмешательство: иссечение нагноившегося узла с капсулой.
При поражении глаз (глазобубонная форма) их необходимо 2-3 раза в день промывать и закапывать 20-30% раствором сульфацила натрия; при ангине назначают полоскание нитрофураном, слабым раствором калия перманганата.
Больного можно выписать из стационара при нормальной температуре в течение 2 нед и удовлетворительном состоянии, рубцевании кожных язв. Склерозирование бубона не считают противопоказанием к выписке. Больных, перенесших абдоминальную форму, выписывают при стабильно нормальной температуре в течение недели и более, нормальной функции ЖКТ. Выписку пациентов, переболевших окулогландулярной формой, осуществляют после консультации офтальмолога. Выписывая больного после легочной формы туляремии, необходимо провести контрольное рентгенологическое исследование.
Прогноз благоприятный, при легочной и генерализованной формах - серьезный. Летальность не превышает 0,5-1% (по данным американских авторов, 5-10%).
У ряда больных трудоспособность восстанавливается медленно, что требует проведения лечебно-трудовой экспертизы. Реконвалесцентам, перенесшим легкую и среднетяжелую форму, выдают лист нетрудоспособности на 10 дней, тяжелую - на 20 дней.
Сибирская язва
Сибирская язва (злокачественный карбункул, Anthrax, Pustula maligna, болезнь тряпичников, болезнь сортировщиков шерсти) - острая сапрозоонозная инфекционная болезнь с преимущественно контактным механизмом передачи возбудителя. Чаще всего протекает в доброкачественной кожной форме, реже - в генерализованной.
Относится к опасным инфекциям. Возбудитель сибирской язвы может быть использован в качестве биологического оружия массового поражения и биотерроризма.
Коды по МКБ-10
А22.0 Кожная форма сибирской язвы.
А22.1 Легочная форма сибирской язвы.
А22.2 Желудочно-кишечная форма сибирской язвы.
Этиология
Возбудитель - Bacillus anthracis, крупная грамположительная неподвижная палочка рода Bacillus семейства Bacillaceae, аэроб или факультативный анаэроб. Растет на простых питательных средах, при доступе кислорода образует споры. Вырабатывает экзотоксин. Патогенность B. anthracis зависит от наличия капсулы и токсинообразования. Капсула препятствует фагоцитозу возбудителя. Вегетативные формы малоустойчивы, при кипячении гибнут мгновенно, дезинфицирующие растворы убивают их в течение нескольких минут. В невскрытых трупах возбудитель сохраняется в течение 7 сут. Споры образуются после гибели хозяина, они чрезвычайно устойчивы, выдерживают кипячение до 30 мин, сохраняются при быстром высушивании, замораживании. В почве они способны сохраняться на протяжении нескольких десятилетий (до 100 лет) и прорастать как при попадании в живой организм, так и в почве при наличии анаэробных условий.
Эпидемиология
Потенциальная опасность возникновения случаев заболевания сибирской язвой животных и людей на территории РФ сохраняется постоянно. Неблагополучными по сибирской язве являются животноводческие регионы: Дагестан, Ставропольский край, Волгоградская, Курская, Белгородская, Тамбовская, Оренбургская области, Республика Башкортостан и 5 субъектов Сибирского федерального округа. На фоне общей тенденции к снижению заболеваемости сибирской язвой среди людей за последние 20 лет (до 3-5 случаев в год), тем не менее наблюдаются групповые вспышки. Последняя вспышка сибирской язвы произошла в 2016 г. в Ямало-Ненецком автономном округе, где зафиксирован массовый падеж оленей и заболели 23 человека, один из которых умер. Неблагополучная по сибирской язве обстановка сохраняется в Казахстане, Таджикистане, Узбекистане, Туркмении, Азербайджане, Грузии, Кыргызстане, Украине. Эпизоотии сибирской язвы среди сельскохозяйственных и диких животных ежегодно регистрируются в странах Азии, Африки и Южной Америки (до 149 случаев). Резервуар возбудителя инфекции - почва, в которой вследствие повторения биологических циклов (спора-вегетативная клетка) возбудитель длительно сохраняется и накапливается. Такая особенность B. anthracis способствует созданию долговременно активных почвенных очагов («проклятые» поля) и потенциально опасных территорий, в РФ известно более 600 мест захоронения животных, павших от сибиреязвенной инфекции в различные годы. Вакцинация животных от сибирской язвы в последние годы недостаточна, особенно в частном секторе. Все это приводит к периодическим эпизоотиям и случаям сибирской язвы у людей. Источники B. anthracis для человека - крупный и мелкий рогатый скот, лошади, верблюды, а также (в редких случаях) дикие животные. Больные животные выделяют возбудителя с мочой, калом и др. Механизмы передачи возбудителя человеку - контактный (при нарушении правил личной гигиены при уходе за больными животными, забое и разделке туш, снятии шкур, контакте с шерстью, шкурой и другими продуктами животноводства, контаминированными B. anthracis), аспирационный (воздушно-пылевым путем при вдыхании инфицированной пыли, костной муки), фекально-оральный (пищевой путь при употреблении мяса зараженного животного) и трансмиссивный (через укусы слепней, мух-жигалок, комаров).
Факторы передачи - почва, вода, воздух, пища, предметы быта, животные и продукты их жизнедеятельности, эктопаразиты. Различают три типа заболеваемости сибирской язвой: профессионально-сельскохозяйственный, профессионально-индустриальный и бытовой. При контактном механизме передачи заражение возможно только при нарушении целостности кожных покровов и слизистых оболочек. При воздушно-пылевом и алиментарном путях заражения восприимчивость составляет практически 100%. Больные люди не представляют опасности для окружающих. Иммунитет у переболевших нестойкий.
Меры профилактики
Ветеринарная служба осуществляет выявление, своевременную диагностику, забой больных животных, эпизоотологическое обследование очага, обеззараживание трупов, уничтожение мяса, шкур, шерсти павших животных (сжигание), текущую и заключительную дезинфекцию в очаге, разрабатывает мероприятия, направленные на оздоровление скотомогильников, пастбищ, неблагополучных по сибирской язве территорий, а также плановую иммунизацию живой сибиреязвенной вакциной сельскохозяйственных животных в неблагополучных пунктах. Комплекс медико-санитарных мероприятий включает:
-
контроль за соблюдением общесанитарных норм при заготовке, хранении, транспортировке и переработке сырья животного происхождения;
-
вакцинопрофилактику живой споровой сухой бескапсульной вакциной - двукратно планово (на неблагополучных по сибирской язве территориях) и внеплановую (по эпидемическим показаниям с последующей ревакцинацией ежегодно);
-
своевременную диагностику, госпитализацию и лечение больных;
-
эпидемиологические обследования очага, текущую и заключительную дезинфекцию (4% хлорамином);
-
запрещено проводить посмертное вскрытие больных из-за возможности заражения спорами.
Лицам, соприкасающимся с больными людьми или животными, в целях профилактики вводят иммуноглобулин противосибиреязвенный и антибактериальные препараты в течение 5 дней (табл. 16-12, 16-13). Наблюдение за контактными ведется в течение 14 дней.
Большое значение имеет санитарно-просветительная работа среди населения.
| Препарат | Способ применения | Разовая доза, г | Кратность применения в сутки | Продолжительность курса, сут |
|---|---|---|---|---|
Доксициклин |
Внутрь |
0,2 |
1 |
7 |
Рифампицин |
Внутрь |
0,3 |
2 |
5 |
Ампициллин |
Внутрь |
1 |
3 |
5 |
Феноксиметил-пенициллин |
Внутрь |
1 |
3 |
5 |
Ципрофлоксацин |
Внутрь |
0,25 |
2 |
5 |
Пефлоксацин |
Внутрь |
0,4 |
2 |
5 |
Офлоксацин |
Внутрь |
0,2 |
2 |
5 |
| Группа больных | Способ применения | Разовая доза | Кратность применения в сутки | Продолжительность курса, сут |
|---|---|---|---|---|
Доксициклин* |
||||
Взрослые |
Внутрь |
0,1 г |
3 |
6 |
Дети: |
||||
старше 8 лет, масса тела больше 45 кг |
Внутрь |
0,1 г |
2 |
6 |
старше 8 лет, масса тела меньше 45 кг |
Внутрь |
2,2 мг/кг |
2 |
6 |
младше 8 лет |
Внутрь |
2,2 мг/кг |
2 |
6 |
Беременные без симптоматики** |
Внутрь |
0,1 г |
2 |
6 |
Ципрофлоксацин |
||||
Взрослые |
Внутрь |
0,5 г |
2 |
6 |
Дети*** |
Внутрь |
10-15 мг/кг |
2 |
6 |
Беременные без симптоматики |
Внутрь |
0,5 г |
2 |
6 |
Амоксициллин**** |
||||
Дети |
Внутрь |
0,5 г |
3 |
6 |
Беременные без симптоматики |
Внутрь |
0,5 г |
3 |
6 |
* Как альтернативный препарат возможно применение тетрациклина 0,5 г × 3 р/день.
** Беременные должны принимать доксициклин с осторожностью и только в тех случаях, когда есть противопоказания для других рекомендованных противомикробных препаратов.
*** Суточная доза ципрофлоксацина для детей не должна превышать 1 г.
**** Амоксициллин - препарат выбора для экстренной профилактики у беременных и детей, если возбудитель чувствителен к пенициллинам.
Патогенез
Заражение происходит при попадании как спор, так и вегетативной формы возбудителя в организм человека, где они благодаря капсуле защищены от фагоцитоза и продуцируют экзотоксин, вызывающий повреждение эндотелия сосудов. Микроциркуляторные нарушения и повышение проницаемости сосудов - важное звено патогенеза сибирской язвы. В результате этих изменений в местах размножения возбудителя (кожа, ЛУ, легкие, кишечная стенка) развиваются серозно-геморрагическое воспаление, периваскулярные кровоизлияния, геморрагические инфильтраты, резкий отек. При заражении аэрозольным и алиментарным путями возбудитель легко преодолевает лимфатический барьер, распространяется гематогенно. Инфекция принимает генерализованный характер с массивным обсеменением органов (септицемия), сопровождаясь развитием ИТШ, тромбогеморрагического синдрома и полиорганной недостаточности. При перкутанном заражении генерализацию инфекции наблюдают редко.
Воспаление ограничивается кожей, носит локальный характер, однако токсины вызывают повышенную проницаемость сосудов с развитием обширного отека и местной анестезией.
Клиническая картина
Выделяют кожную (наружную, локализованную) и генерализованную (внутреннюю, висцеральную, септическую) формы сибирской язвы. Генерализованные формы могут быть первичными (карбункул отсутствует) и вторичными (при наличии карбункула). Кожная форма подразделяется на карбункулезный, эдематозный, буллезный, рожистоподобный и глазной варианты, а генерализованная форма - на легочный, кишечный и септический варианты.
Наиболее часто встречается кожная форма. Инкубационный период составляет от 2 до 14 сут. Чаще наблюдается карбункулезный вариант.
В месте внедрения возбудителя (обычно на руках или лице) появляется красноватое или синеватое пятнышко, похожее на укус насекомого. Через несколько часов оно трансформируется в папулу медно-красного цвета, затем в течение суток в везикулу, заполненную серозно-геморрагическим экссудатом. Больных беспокоят жжение и зуд. При расчесывании или спонтанно пузырек вскрывается с образованием язвочки, покрытой темно-коричневым струпом, формируется сибиреязвенный карбункул. Он расположен на плотном инфильтрированном основании, окружен венчиком яркой гиперемии. Образующиеся вокруг дочерние пузырьки также вскрываются, поэтому размеры струпа увеличиваются до 0,5-3,0 см в диаметре и более. Вокруг карбункула развивается резкий распространенный отек мягких тканей, имеющий желеобразную консистенцию. Болевая чувствительность в области карбункула и отека резко снижена или полностью отсутствует. Кожа в зоне отека бледная. Регионарные ЛУ плотные, подвижные, умеренно увеличены, чувствительны при пальпации. При локализации карбункула в области кисти или предплечья возможен лимфангит. После уменьшения отека (8-10-й день болезни) струп возвышается над поверхностью кожи, под ним идут процессы рубцевания и эпителизации язвы. Через 10-30 дней струп отторгается, язва полностью рубцуется. Карбункулы могут быть единичными и множественными (до десяти и более).
При локализации карбункула на лице или на шее иногда развивается тяжело протекающий эдематозный вариант кожной формы болезни. Обширный отек распространяется на клетчатку грудной клетки и даже живота. При распространении отека на мягкие ткани глотки возможна асфиксия. В зоне отека образуются пузырьки, после вскрытия которых формируются обширные участки некроза. Возможен также буллезный вариант (вместо типичного карбункула образуются пузыри, заполненные серозно-геморрагическим экссудатом) и рожистоподобный вариант с наличием гиперемии кожи в области отека. При кожной форме болезни общее состояние больного в первый день болезни остается удовлетворительным, на 2-3-й день появляются озноб, слабость, головная боль, температура тела поднимается до 38-40 °С, отмечают тахикардию, артериальную гипотензию. Температура тела остается повышенной в течение 3-7 дней, затем критически падает до нормы, общее состояние больного быстро улучшается, уменьшается отек в области карбункула, а потом струп отторгается и наступает полное выздоровление. Значительно реже после кратковременного улучшения внезапно появляется озноб, резко ухудшается общее состояние и развивается генерализованная инфекция. Летальность при кожной форме болезни не превышает 2-3% при лечении, без антибиотикотерапии достигает 20%.
Первичная генерализованная форма сибирской язвы развивается при аэрогенном или алиментарном пути заражения и крайне редко - при внедрении возбудителя через кожу или слизистую оболочку (например, губ). При этом в месте внедрения возбудителя карбункул не формируется. Генерализованная форма характеризуется бурным началом, потрясающим ознобом, гипертермией, резко выраженными симптомами интоксикации, головной болью, рвотой, тахикардией, прогрессирующей гипотензией, глухостью тонов сердца. Часто увеличиваются печень и селезенка, появляется геморрагическая сыпь, цианоз, симптомы поражения ЦНС. При легочном варианте в первый день болезни возможны катаральные явления, поэтому часто диагностируют ОРЗ или грипп, но уже через несколько часов развивается интоксикационный синдром, температура достигает 39-41 °С, и на первый план выступают боли в грудной клетке при дыхании, одышка, кашель с пенистой кровянистой мокротой, которая быстро сворачивается в виде желе. Кожа становится бледной, появляется тахикардия, глухость тонов сердца, быстро прогрессирует падение АД. Стремительно нарастают симптомы ОДН. При перкуссии грудной клетки выявляют укорочение перкуторного звука и ослабление дыхания в нижних отделах легких в связи с развитием плеврита. Выслушиваются разнокалиберные влажные хрипы. Смерть наступает на 2-3-й день болезни от ИТШ и ОДН. Летальность составляет 80-100%. Положительный прогноз возможен при начале интенсивной терапии до развития картины шока.
Для кишечного варианта болезни, помимо общих симптомов, с первого дня болезни характерны режущие боли, преимущественно в нижней части живота, кровавая рвота, частый жидкий стул с примесью крови, быстро развивающиеся парез кишечника и перитонит. Исход также неблагоприятный. При всех вариантах болезни возможны осложнения: ИТШ, сепсис, менингит, ОДН.
Диагностика
Диагноз кожной формы болезни устанавливают на основании характерных местных изменений: наличия черного струпа с венчиком гиперемии («черный уголек на красном фоне»), студенистого безболезненного отека и регионарного лимфаденита, появления общих симптомов после формирования карбункула. Особое значение для диагностики имеют эпидемиологические данные (профессия, уход за скотом, забой, разделка туш, работа с кожами, шкурами и т.д., ношение изделий из кожи и меха нефабричной выделки, употребление мяса, не прошедшего ветеринарно-санитарного контроля, особенно при вынужденном забое больных животных). При генерализованной форме болезни установить диагноз без эпидемиологических и лабораторных данных сложно.
Основу лабораторной диагностики составляет микробиологическое исследование.
При подозрении на кожную форму для бактериологического исследования берут содержимое пузырьков или карбункулов, отделяемое язвы, отторгнутый струп и кровь.
Если предполагают генерализованную форму, для лабораторного исследования берут кровь из локтевой вены, мочу, рвотные массы, испражнения, СМЖ (при наличии симптомов менингита), мокроту.
Из серологических методов для подтверждения диагноза используют РИФ, РНГА (РПГА), ИФА.
Разработаны тест-системы для определения генетического материала возбудителя сибирской язвы методом ПЦР. Применяют кожно-аллергическую пробу с антраксином, которая с 3-го дня болезни становится положительной в 82% случаев.
При генерализованном варианте необходимо рентгенологическое исследование легких. При подозрении на кишечный вариант показано УЗИ органов брюшной полости, при клинических признаках менингита - ЛП. В крови обнаруживают умеренно выраженные воспалительные изменения, тромбоцитопению, при исследовании мочи - признаки токсического нефроза.
Дифференциальная диагностика
При кожной форме болезни дифференциальную диагностику проводят с фурункулом, карбункулом, флегмоной, кожным лейшманиозом, рожей, укусом насекомых, доброкачественным лимфоретикулезом, иногда с кожной формой туляремии и чумы. Генерализованные формы болезни дифференцируют с сепсисом другой этиологии, менингококкемией, легочной формой чумы, пневмонией, гнойным менингитом, ОКИ, перитонитом, непроходимостью кишечника. Без соответствующих эпидемиологических и лабораторных данных дифференциальная диагностика представляет трудности, часто диагноз устанавливают постмортально.
Лечение
| Препарат | Способ применения | Разовая доза | Кратность применения в сутки | Продолжительность курса, сут |
|---|---|---|---|---|
Ампициллин |
Внутрь |
0,5 г |
4 |
7 |
Доксициклин |
Внутрь |
0,2 г |
2 |
7 |
Рифампицин |
Внутрь |
0,45 г |
2 |
7 |
Пефлоксацин |
Внутрь |
0,4 г |
2 |
7 |
Офлоксацин |
Внутрь |
0,2 г |
3 |
7 |
Ципрофлоксацин |
Внутрь |
0,25-0,75 г |
2 |
7 |
Бензилпенициллин |
В/м |
1 млн ЕД |
4 |
7 |
Гентамицин |
В/м |
0,08 г |
3 |
7 |
Амикацин |
В/м |
0,5 г |
2 |
7 |
Хлорамфеникол (Левомицетина сукцинат натрия♠¤) |
В/в |
70-100 мг/ кг |
1 |
7 |
| Препарат | Способ применения | Разовая доза | Кратность применения в сутки | Продолжительность курса, сут |
|---|---|---|---|---|
Бензилпенициллин |
В/м, в/в |
1 млн ЕД |
6 |
14-21 |
Ампициллин |
В/м |
2-3 г |
4 |
14 |
Рифампицин |
В/м, в/в |
0,3 г |
2 |
14-21 |
Доксициклин |
В/в |
0,2 г |
2 |
10-14 |
Гентамицин |
В/м, в/в |
0,16 г |
2-3 |
10 |
Амикацин |
В/м, в/в |
0,5 г |
2 |
10 |
Ципрофлоксацин |
В/в |
0,2 г |
2 |
10 |
Пефлоксацин |
В/в |
0,4 г |
2 |
10 |
Рифампицин |
В/м, в/в |
0,45 г |
1 |
14 |
В/м |
+ |
4 |
14 |
|
ампициллин |
2 г |
|||
Рифампицин |
В/м, в/в |
0,45 г |
1 |
14 |
+ |
В/в |
+ |
1 |
14 |
доксициклин |
0,2 г |
| Категории пострадавших | Начальная терапия (внутривенное введение) | Продолжительность курса, сут |
|---|---|---|
Взрослые |
Ципрофлоксацин по 500 мг каждые 12 ч или доксициклин 100 мг каждые 12 ч и один или два дополнительных антимикробных препарата |
Начинают с внутривенного введения, далее прием внутрь, в зависимости от клинического течения: ципрофлоксацин по 500 мг 2 р/сут или доксициклин по 100 мг 2 р/сут. Продолжительность 6 сут |
Дети: в возрасте старше 8 лет при массе тела более 45 кг; в возрасте старше 8 лет при массе тела 45 кг и менее; в возрасте 8 лет и младше; |
Каждые 12 ч ципрофлоксацин в дозе 10-15 мг/кг массы тела или доксициклин: по 100 мг по 2,2 мг/кг по 2,2 мг/кг +1-2 дополнительных антимикробных препарата |
Начинают с внутривенного введения, далее прием внутрь каждые 12 ч, в зависимости от клинического течения: ципрофлоксацин в дозе 10-15 мг/кг массы тела или доксициклин: по 100 мг по 2,2 мг/кг по 2,2 мг/кг Продолжительность 6 сут |
Беременные |
Такая же, как для остальных взрослых. Высокая смертность превышает риск осложнений aнтибиoтикoтepaпии |
Начинают с внутривенного введения, далее прием внутрь, в зависимости от клинического течения; схемы такие же, как и для остальных взрослых |
Лица с иммyнoдeфицитными состояниями |
Такая же, как для взрослых и детей без иммунодефицита |
Такая же, как для взрослых и детей без иммунодефицита |
| Категории пострадавших | Начальная терапия (прием внутрь) | Продолжительность курса, сут |
|---|---|---|
Взрослые |
Ципрофлоксацин по 500 мг 2 р/сут |
6 |
или доксициклин по 100 мг 3 р/сут |
||
Дети: |
Ципрофлоксацин 10-15 мг/кг |
6 |
массы тела каждые 12 ч или |
||
доксициклин каждые 12 ч: |
||
в возрасте старше 8 лет |
по 100 мг |
6 |
при массе тела более 45 кг; |
||
в возрасте старше 8 лет |
по 2,2 мг/кг |
6 |
при массе тела 45 кг |
||
и менее; |
||
в возрасте 8 лет и младше |
по 2,2 мг/кг |
6 |
Беременные |
Ципрофлоксацин по 500 мг 2 р/сут |
6 |
или доксициклин по 100 мг 2 р/сут |
Одновременно с этиотропной терапией однократно вводят специфический иммуноглобулин противосибиреязвенный в дозе 20-100 мл внутримышечно. Пораженные участки кожи обрабатывают растворами антисептиков. Повязки не накладывают. При развитии ИТШ, распространенных отеков лица и шеи рекомендуется преднизолон в дозе 90-240 мг. При генерализованной форме болезни антибиотико-терапию сочетают с интенсивной дезинтоксикацией, мероприятиями, направленными на борьбу с гемодинамическими нарушениями. Применяют внутривенные перфузии полиионных растворов с добавлением 100 мл декстрана [ср. мол. масса 35 000-45 000] (Реополиглюкин♠) или Гемодеза♠. Используют оксигенотерапию, гипербарическую оксигенацию, методы экстракорпоральной детоксикации.
Выписку выздоравливающих при кожной форме сибирской язвы осуществляют после отторжения струпа, эпителизации и формирования рубца. Пациентов, перенесших генерализованные формы болезни, выписывают после полного клинического выздоровления и двукратного отрицательного результата бактериологических исследований мокроты, крови, мочи, кала, проводимых с интервалом 5 дней.
Стрептококковые инфекции*
* Материалы доступны в электронном виде по ссылке, указанной на последней странице книги.
Скарлатина
Скарлатина (лат. scarlatina) - острая антропонозная инфекционная болезнь с аэрозольным механизмом передачи возбудителя, для которой характерны острое начало, лихорадка, интоксикация, тонзиллит и мелкоточечная сыпь.
Код по МКБ-10
А38 Скарлатина.
Этиология
Возбудитель - β-гемолитический СГА (S.pyogenes), рода Streptococcus, семейства Streptococcaceae, грамположительный кокк, образует цепочки различной длины, на кровяном агаре растет, вызывая вокруг колонии широкую полосу гемолиза. Помимо скарлатины вызывает около 40 форм стрептококковой инфекции. К факторам патогенности относятся пирогенные экзотоксины, стимулирующие Т-клетки и выброс прововоспалительных цитокинов, которые инициируют ЛИС; ферменты и токсины: стрептолизины, гиалуронидазу, стрептокиназу и др. Клеточная стенка содержит ряд белков, в частности М-белок, подавляющий фигоцитоз.
Эпидемиология
Резервуар и источник инфекции - больной ангиной, скарлатиной и другими клиническими формами респираторной стрептококковой инфекции, а также здоровые носители стрептококков группы А. Больной наиболее опасен для окружающих в первые дни болезни. Носительство СГА широко распространено в популяции (15-20% здорового населения); многие из носителей выделяют возбудитель на протяжении длительного времени.
Механизмы передачи - аэрозольный (воздушно-капельный путь) и контактный (пищевой и контактно-бытовой). Заражение происходит при тесном длительном общении с больным или носителем.
Естественная восприимчивость людей высокая. Скарлатина возникает у лиц, не имеющих антитоксического иммунитета, при их инфицировании токсигенными штаммами стрептококка, продуцирующими эритрогенные токсины типов А, В и С. Постинфекционный иммунитет типоспецифический; при инфицировании СГА другого серовара возможно повторное заболевание.
Заболевание распространено повсеместно, но чаще его встречают в регионах с умеренным и холодным климатом. Основное число заболевших составляют дети (более 90%). Распространенность скарлатины среди населения городов значительно выше, чем среди сельских жителей. Дети, посещающие детские учреждения, заболевают в 3-4 раза чаще детей, воспитываемых дома. Наиболее резко эта разница выражена в группе детей первых двух лет жизни (в 6-15 раз). Среди этих же групп отмечают наибольшие показатели здорового бактерионосительства. Удельный вес очагов скарлатины с одним случаем заболевания в детских дошкольных учреждениях составляет более 80%.
Минимальную заболеваемость отмечают с июля по август; максимальную - в ноябре-декабре и в марте-апреле. На сроки сезонного повышения заболеваемости решающее влияние оказывают формирование или обновление организованного коллектива и его численность. В дошкольных детских учреждениях подъем заболеваемости, как правило, регистрируют через 4-5 нед с момента формирования группы.
К особенностям эпидемиологии скарлатины относят наличие периодических подъемов и спадов заболеваемости. Наряду с 2-4-летними интервалами отмечают более крупные временные промежутки (40- 45 лет) с последующим существенным увеличением числа заболевших. За последние годы достигнут минимальный уровень заболеваемости, характерный для межэпидемического периода (40-50 на 100 тыс. населения). В 2014 г. в РФ заболеваемость составила 33,4 на 100 тыс. населения.
Меры профилактики
Мероприятия в эпидемическом очаге. При скарлатине обязательной госпитализации подлежат больные: с тяжелыми и средне-тяжелыми формами инфекции; из детских учреждений с круглосуточным пребыванием детей (дома ребенка, детские дома, школы-интернаты, санатории и др.); из семей, где есть дети в возрасте до 10 лет, не болевшие скарлатиной; из семей, где есть лица, работающие в детских дошкольных учреждениях, хирургических и родильных отделениях, детских больницах и поликлиниках, молочных кухнях, при невозможности их изоляции от заболевшего; при невозможности надлежащего ухода на дому.
Выписку больного скарлатиной из стационара осуществляют после клинического выздоровления, но не ранее чем через 10 дней после начала заболевания.
Порядок допуска лиц, переболевших скарлатиной и ангиной, в детские учреждения. Реконвалесцентов из числа детей, посещающих детские дошкольные учреждения и первые 2 класса школ, допускают в них через 12 дней после клинического выздоровления. Реконвалесцентов из группы декретированных профессий с момента клинического выздоровления на 12 дней переводят на другую работу, где они будут эпидемически не опасны. Больных ангиной из очага скарлатины, выявленных на протяжении семи дней с момента регистрации последнего случая скарлатины, не допускают в перечисленные выше учреждения в течение 22 дней со дня их заболевания (также как и больных скарлатиной).
Мероприятия в отношении контактных лиц. При регистрации заболевания скарлатиной в детском дошкольном учреждении на группу, где выявлен больной, накладывается карантин сроком на 7 дней с момента изоляции последнего больного; в течение карантина прекращается допуск новых и временно отсутствовавших детей, ранее не болевших скарлатиной. Не допускается общение с детьми из других групп детского учреждения; в карантинной группе у детей и персонала в обязательном порядке проводится осмотр зева и кожных покровов с термометрией не менее 2 раз в день.
Патогенез
Возбудитель проникает в организм человека через слизистую оболочку зева и носоглотки; в редких случаях через слизистую оболочку половых органов или поврежденную кожу (экстрабуккальная скарлатина). В месте адгезии бактерий формируется воспалительно-некротический очаг. Развитие инфекционно-токсического синдрома обусловлено поступлением в кровоток эритрогенного токсина (токсина Дика), а также действием пептидогликана клеточной стенки стрептококка. Вследствие токсинемии происходит генерализованное расширение мелких сосудов во всех органах, в том числе в кожных покровах и слизистых оболочках, и возникает характерная сыпь. В результате выработки, накопления антитоксических антител при развитии инфекционного процесса и связывания ими токсинов ослабевают симптомы интоксикации и постепенно исчезает сыпь. Одновременно возникают умеренные признаки периваскулярной инфильтрации и отека дермы. Эпидермис пропитывается экссудатом, и клетки эпидермиса ороговевают, что приводит к шелушению кожи после угасания скарлатинозной сыпи.
Компоненты клеточной стенки стрептококка и внеклеточные продукты обусловливают развитие реакций ГЗТ, аутоиммунных реакций, формирование и фиксацию иммунных комплексов, нарушения системы гемостаза. Они являются причиной развития миокардита, гломерулонефрита, артериитов и других осложнений иммунопатологического характера. Из лимфатических образований слизистой оболочки ротоглотки возбудители по лимфатическим сосудам попадают в регионарные ЛУ, где происходит их накопление, сопровождающееся воспалительной реакцией с очагами некроза и лейкоцитарной инфильтрации. Последующая бактериемия может вызвать попадание микроорганизмов в различные органы и формирование гнойно-некротических процессов (гнойный лимфаденит, эндокардит, отит, поражения костной ткани височной области, твердой мозговой оболочки, височных синусов и др.).
Клиническая картина
Инкубационный период 1-10 сут (чаще 2-4). Скарлатину классифицируют по типу и тяжести течения. Типичной считают скарлатину, протекающую с ЛИС, ангиной и сыпью. К атипичной относят стертые, экстрабуккальные (ожоговая, раневая, послеродовая), а также самые тяжелые формы - геморрагическую и гипертоксическую. По тяжести выделяют легкую, среднетяжелую и тяжелую формы. Типично острое начало. В некоторых случаях уже в первые часы болезни температура повышается до высоких цифр, возникают озноб, слабость, недомогание, головная боль, тахикардия, иногда - боли в животе и рвота. При высокой лихорадке в первые дни заболевания больные эйфоричны или, наоборот, вялы, апатичны, сонливы.
При современном течении скарлатины температура тела в пределах 38-38,5 °С.
С самого начала больные предъявляют жалобы на боль в горле при глотании. При осмотре - яркая разлитая гиперемия миндалин, дужек, язычка, мягкого нёба и задней стенки глотки («пылающий зев»). Гиперемия выражена сильнее, чем при обычной катаральной ангине, и резко ограничена в месте перехода слизистой оболочки на твердое нёбо. Возможно развитие фолликулярной или лакунарной ангины: на увеличенных, резко гиперемированных и разрыхленных миндалинах появляются слизисто-гнойные, фибринозные или некротические налеты в виде отдельных мелких или, реже, глубоких и распространенных очагов. Одновременно развивается регионарный лимфаденит: поднижнечелюстные и переднешейные ЛУ при пальпации плотные и болезненные. Язык обложен серовато-белым налетом, а к 4-5-м суткам болезни очищается, приобретает ярко-красную окраску с малиновым оттенком («малиновый» язык); сосочки языка гиперплазированы. К этому времени симптомы ангины начинают регрессировать, но некротические налеты исчезают медленнее, в течение 7-10 сут. Характерна тахикардия на фоне умеренного понижения АД.
Скарлатинозная экзантема на фоне гиперемии кожного покрова возникает в 1-2-е сутки болезни. Вначале мелкоточечные элементы появляются на коже лица, шеи и верхней части туловища, затем сыпь быстро переходит на сгибательные поверхности конечностей, боковые стороны груди и живота, внутренние поверхности бедер. Отчетливо выражен белый дермографизм. Важный признак скарлатины - сгущение сыпи в виде темно-красных полос в местах естественных сгибов, например в локтевых, паховых (симптом Пастиа), подмышечных областях. Иногда обнаруживают обильные сливные мелкоточечные элементы, что создает картину сплошной эритемы. На лице сыпь расположена на ярких гиперемированных щеках, в меньшей степени - на лбу и висках, в то время как носогубный треугольник свободен от элементов сыпи и бледен (симптом Филатова). При надавливании на кожу ладонью сыпь в этом месте временно исчезает (симптом ладони). В связи с повышенной ломкостью сосудов можно обнаружить мелкие петехии в области суставных сгибов, а также в местах, где кожа подвергается трению или сдавлена одеждой. Помимо точечных, возникают отдельные милиарные элементы в виде мелких, с булавочную головку пузырьков, заполненных прозрачной или мутноватой жидкостью. Эндотелиальные симптомы (жгута, Румпеля-Лееде, «резинки», Кончаловского) положительные.
Наряду с типичной скарлатинозной сыпью можно отметить мелкие везикулы и макулопапулезные элементы. Сыпь может появляться поздно, лишь на 3-4-й день болезни, или отсутствовать. К 3-5-м суткам самочувствие больного улучшается, температура начинает постепенно снижаться, сыпь бледнеет, постепенно исчезает и к концу 1-2-й недели сменяется мелкочешуйчатым (на ладонях и подошвах - крупнопластинчатым) шелушением кожи.
Интенсивность экзантемы и сроки ее исчезновения различны. Иногда при легком течении скарлатины скудная сыпь исчезает через несколько часов после возникновения. Выраженность и длительность шелушения кожи прямо пропорциональны обилию предшествующей сыпи.
Токсико-септическую форму относят к типичным формам скарлатины. У взрослых ее обнаруживают редко. Характерны бурное начало с гипертермией, быстрое развитие сосудистой недостаточности (глухие тоны сердца, падение АД, нитевидный пульс, холодные конечности), геморрагии на коже. В последующие дни возникают осложнения инфекционно-аллергического (поражения сердца, суставов, почек) или септического (лимфадениты, некротическая ангина, отиты и др.) типа.
Экстрафарингеальная (экстрабуккальная) скарлатина. Ворота инфекции - места поражения кожи (ожоги, ранения, родовые пути, очаги стрептодермии и др.). Сыпь имеет тенденцию к распростанению от места внедрения возбудителя. При этой редкой форме заболевания воспалительные изменения со стороны ротоглотки и шейных ЛУ отсутствуют. Лимфаденит возникает вблизи входных ворот инфекции.
Стертые формы скарлатины. Часто обнаруживают у взрослых. Характерны слабая интоксикация, катаральное воспаление в ротоглотке, скудная, бледная, быстро исчезающая сыпь. У взрослых возможно тяжелое течение заболевания - токсико-септическая форма.
Осложнения
К наиболее частым осложнениям относят гнойный и некротический лимфаденит, гнойный отит, синусит, гнойный артрит, а также осложнения инфекционно-аллергического генеза, чаще встречающиеся у взрослых, - диффузный гломерулонефрит, миокардит, синовит.
Диагностика
Клинические данные: острое начало заболевания, лихорадка, интоксикация; острый катаральный, катарально-гнойный или некротический тонзиллит; обильная точечная сыпь, сгущающаяся в естественных складках кожи.
Лабораторные данные: нейтрофильный лейкоцитоз со сдвигом влево, повышение СОЭ; обильный рост β-гемолитических стрептококков при посеве материала из очага инфекции на кровяной агар; нарастание титров антител к стрептококковым антигенам: М-протеину, А-полисахариду, стрептолизину О и др.
Для экспресс-диагностики применяют реакцию коагглютинации, определяющую антиген стрептококка.
Дифференциальная диагностика
Скарлатину следует отличать от кори, краснухи, псевдотуберкулеза, медикаментозного дерматита.
Лечение
Лечение проводят на дому, исключая тяжелые, осложненные случаи и эпидемические показания (дети из закрытых коллективов). Больному необходимо соблюдать постельный режим в течение 7 сут. Препарат выбора - бензилпенициллин в дозе 15-20 тыс. ЕД/кг в сутки (5-7 сут). Альтернативные препараты - макролиды (эритромицин по 250 мг 4 р/сут или по 500 мг 2 р/сут) и ЦС I поколения (цефазолин по 50 мг/кг в сутки). Курс лечения 5-7 сут. При наличии противопоказаний к этим препаратам применяют полусинтетические пенициллины, линкозамиды. В домашних условиях следует отдавать предпочтение таблетированным препаратам (феноксиметилпенициллин, эритромицин). Назначают полоскания горла раствором нитрофурала (Фурацилина♠) 1:5000, настоями ромашки, календулы, эвкалипта. Показаны витамины и антигистаминные средства в обычных терапевтических дозах. Симптоматические средства применяют по показаниям.
Профилактику суперинфекции и реинфекции обеспечивают, соблюдая соответствующий противоэпидемический режим в отделении: больных госпитализируют в небольшие палаты или боксы, изолируют при возникновении осложнений; желательно одновременное заполнение палат.
Прогноз
При своевременном лечении обычно благоприятный.
Диспансеризация
Диспансерное наблюдение за переболевшими проводят в течение месяца после выписки из стационара. Через 7-10 дней проводят клиническое обследование и контрольные анализы мочи и крови, по показаниям - ЭКГ. После чего при отсутствии патологии пациента снимают с диспансерного учета. При обнаружении патологии переболевшего передают под наблюдение ревматолога или нефролога.
Рожа
Определение
Рожа (англ. еrysipelas) - антропонозная инфекционная болезнь, вызываемая стрептококком группы А, характеризующаяся выраженным ЛИС, очаговым серозным или серозно-геморрагическим воспалением кожи и наклонностью к рецидивирующему течению.
Код по МКБ-10
Этиология
Возбудителем рожи является СГА или Streptococcus pyogenes.
При использовании бактериологического и молекулярно-биологического исследований СГА чаще выявляется в буллах (эритематозно-буллезная и буллезно-геморрагическая форма рожи), в пунктатах местного воспалительного очага, реже - при исследовании крови (2-5%) и поверхности воспалительного очага. В 20-50% случаев выявляются миксты СГА и Staphylococcus aureus. S. aureus является основным этиологическим фактором нагноительных процессов при роже.
Эпидемиология
Рожа - широко распространенная спорадическая инфекционная болезнь с низкой контагиозностью. Среди контактных по палате больных, а также в семьях больных повторные случаи рожи регистрируют редко. Примерно в 10-15% случаев отмечена наследственная предрасположенность к заболеванию. Раневую рожу в настоящее время встречают крайне редко. Практически отсутствует рожа новорожденных.
Источник возбудителя обнаруживают редко, так как рожа обычно является эндогенной инфекцией. Источником возбудителя инфекции при экзогенном пути заражения могут быть больные любыми стрептококковыми инфекциями и здоровые носители стрептококка.
Наряду с основным, контактным механизмом передачи инфекции возможен аэрозольный механизм передачи (воздушно-капельный путь) с первичным инфицированием носоглотки и последующим заносом возбудителя на кожу руками, а также лимфогенным и гематогенным путем.
При первичной роже СГА проникает в кожу или слизистые оболочки через трещины, опрелости, различные микротравмы (экзогенный путь). При роже лица - через трещины в ноздрях или повреждения наружного слухового прохода, при роже нижних конечностей - через трещины в межпальцевых промежутках, на пятках или повреждения в нижней трети голени. К повреждениям относят незначительные трещины, царапины, точечные уколы и микротравмы.
При первичной и повторной роже экзогенный путь заражения является ведущим. При рецидивирующей роже СГА распространяется лимфогенно или гематогенно из очагов стрептококковой инфекции в самом организме: фарингит, синусит, отит и др. (эндогенный путь). При частых рецидивах рожи в коже и регионарных ЛУ формируется очаг хронической инфекции (L-формы СГА). Под влиянием различных провоцирующих факторов - переохлаждения, перегревания, травм, эмоциональных стрессов - происходит реверсия L-форм в бактериальные формы СГА, которые вызывают рецидивы заболевания. При ранних и поздних рецидивах рожи возможна реинфекция и суперинфекция новыми штаммами (М-типы) СГА.
Предрасположенность к роже имеет, вероятно, врожденный характер и представляет собой один из вариантов генетически детерминированной реакции (гиперчувствительность IV типа) организма на СГА, чаще рожей болеют люди с III (В) группой крови.
Основными предрасполагающими факторами при развитии рожи являются фоновые заболевания: микозы стоп (при роже нижних конечностей до 100% случаев), сахарный диабет II типа (не менее 12-15% всех больных), ожирение (15-20% всех больных), хроническая венозная недостаточность (варикозная болезнь), хроническая (приобретенная или врожденная) недостаточность лимфатических сосудов, экзема; наличие очагов хронической (стрептококковой) инфекции: тонзиллит, отит, синусит, кариес, пародонтоз (чаще при роже лица); остеомиелит, тромбофлебит, язвы (трофические) (чаще при роже нижних конечностей); профессиональные вредности, связанные с повышенной травматизацией, загрязнением кожных покровов.
Заболеваемость рожей в европейской части России составляет от 5-6 до 20 случаев на 10 тыс. населения. Госпитализируется 20-30% больных в основном с геморрагическими формами заболевания (буллезно-геморрагическая и эритематозно-геморрагическая). В последние годы отмечен подъем заболеваемости рожей в США и ряде стран Европы. В странах Азии, Африки, Южной Америки заболевание регистрируется редко.
Подъем заболеваемости отмечают в летне-осенний период.
Меры профилактики
Специфическая профилактика рожи не разработана. Неспецифические меры связаны с соблюдением правил асептики и антисептики в лечебных учреждениях, личной гигиены, лечением и профилактикой микозов стоп, санацией очагов стрептококковой инфекции (хронический тонзиллит), профилактикой травматизации кожи (отказ от ношения шерстяных носков, пользование жесткой мочалкой, обработка кожи дезинфицирующими жидкостями после бритья).
Постинфекционный иммунитет после перенесенной рожи нестойкий. Более чем у трети больных, перенесших первичную (острую) форму рожи, возникает повторное заболевание или рецидивирующая (хроническая) форма болезни, обусловленные аутоинфекцией, реинфекцией или суперинфекцией штаммами СГА, которые содержат другие варианты М-протеина.
Патоморфология и патогенез
Морфологическим изменениям свойственна картина микрокапиллярного артериита, флебита и лимфангита.
При эритематозно-буллезной и буллезно-геморрагической формах воспаления происходит отслойка эпидермиса с образованием пузырей. При геморрагических формах рожи в местном очаге отмечают тромбоз мелких кровеносных сосудов, диапедез эритроцитов в межклеточное пространство, обильное отложение фибрина. Воспалительный процесс при роже распространяется в глубокие слои дермы и, возможно, подкожной клетчатки за пределы визуально определяемого местного воспалительного очага. При рецидивирующем течении рожи в дерме постепенно происходит разрастание соединительной ткани - в результате нарушается лимфоотток и развивается стойкий лимфостаз.
Патогенез рожи можно представить в виде следующих стадий.
-
Внедрение СГА в кожу. Размножение и накопление СГА в лимфатических капиллярах дермы, что соответствует инкубационному периоду заболевания.
-
Развитие бактериемии, токсинемии, что приводит к возникновению симптомов интоксикации.
-
Развитие местного очага инфекционно-аллергического воспаления кожи.
-
Нарушение капиллярного лимфообращения в коже и микроциркуляции с формированием лимфостаза, возможным образованием геморрагий и пузырей с серозным и геморрагическим содержимым.
-
Формирование очагов хронической стрептококковой инфекции в коже и регионарных ЛУ с наличием бактериальных и L-форм СГА, что приводит у части больных к развитию рецидивов заболевания (хроническому течению рожи).
-
Элиминация бактериальных форм СГА с помощью фагоцитоза других иммунных механизмов и выздоровление пациента.
Клиническая картина
Инкубационный период при экзогенном заражении - от нескольких часов до 3-5 дней. У подавляющего большинства больных отмечают острое начало заболевания.
Симптомы интоксикации появляются раньше местных проявлений на несколько часов - 1-2 сут, что особенно характерно для рожи нижних конечностей. Возникает головная боль, общая слабость, озноб, миалгия, тошнота и рвота (25-30% больных). Уже в первые часы болезни пациенты отмечают повышение температуры до 38-40 °С. На участках кожи, где впоследствии возникнут локальные поражения, возможно чувство распирания или жжения, болезненность регионарных ЛУ.
Разгар заболевания наступает через несколько часов до 1-2 сут. Общетоксические проявления и лихорадка достигают максимума; появляются характерные местные проявления рожи. Чаще всего процесс локализуется на нижних конечностях (70-80%), лице (15-20%) и верхних конечностях (4-7% больных), редко - лишь на туловище, в области молочной железы, промежности, наружных половых органов. При своевременно начатом лечении и неосложненном течении заболевания продолжительность лихорадки составляет не более 5 сут. У 10-15% больных ее длительность превышает 7 сут, что свидетельствует о генерализации процесса и неэффективности этиотропной терапии. Самый длительный лихорадочный период наблюдают при буллезно-геморрагической роже.
Период реконвалесценции. Температура нормализуется и интоксикация исчезает раньше, чем происходит регресс местных симптомов. Локальные признаки заболевания наблюдают до 5-8-го дня, при геморрагических формах - до 12-18-го дня и более.
К остаточным явлениям рожи, сохраняющимся на протяжении нескольких недель или месяцев, относят и пигментацию кожи, застойную гиперемию на месте угасшей эритемы, плотные сухие корки на месте булл, отечность.
О неблагоприятном прогнозе и вероятности раннего рецидива свидетельствуют длительное увеличение и болезненность ЛУ; инфильтративные изменения кожи в области угасшего очага воспаления; продолжительный субфебрилитет; длительное сохранение лимфостаза. Гиперпигментация кожи нижних конечностей у больных, перенесших буллезно-геморрагическую рожу, может сохраняться всю жизнь.
Клиническая классификация рожи.
-
По характеру местных проявлений: эритематозная; эритематозно-буллезная; эритематозно-геморрагическая; буллезно-геморрагическая.
-
По степени тяжести: легкая (I); среднетяжелая (II); тяжелая (III).
-
По кратности течения: первичная; повторная (при повторении заболевания через два года; иной локализации процесса); рецидивирующая (при наличии не менее трех рецидивов рожи в год целесообразно определение «часто рецидивирующая рожа»).
-
По распространенности местных проявлений: локализованная; распространенная (мигрирующая); метастатическая с возникновением отдаленных друг от друга очагов воспаления.
Эритематозная рожа является как самостоятельной клинической формой рожи, так и начальной стадией развития других форм рожи. На коже появляется небольшое красное или розовое пятно, которое на протяжении нескольких часов превращается в характерную рожистую эритему. Эритема представляет собой четко отграниченный участок гиперемии кожи с неровными границами в виде зубцов, языков. Кожа в области эритемы инфильтрирована, напряжена, горяча на ощупь, умеренно болезненна при пальпации (больше по периферии эритемы). В ряде случаев можно обнаружить «периферический валик» в виде инфильтрированных и возвышающихся краев эритемы. Наряду с гиперемией и инфильтрацией кожи развивается ее отек, распространяющийся за пределы эритемы.
Эритематозно-буллезная рожа развивается в сроки от нескольких часов до 2-5 сут на фоне рожистой эритемы. Развитие пузырей связано с повышенной экссудацией в очаге воспаления и отслойкой эпидермиса от дермы, скопившейся жидкостью. При повреждении поверхностей пузырей или их самопроизвольном разрыве из них выделяется серозный экссудат, на месте пузырей образуются эрозии. При сохранении целостности пузырей они постепенно ссыхаются с образованием желтых или коричневых корок.
Эритематозно-геморрагическая рожа развивается на фоне эритематозной рожи в 1-3-и сутки от начала заболевания, иногда позднее. Появляются кровоизлияния различных размеров - от небольших петехий до обширных сливных геморрагий, иногда на протяжении всей эритемы.
Буллезно-геморрагическая рожа трансформируется из эритематозно-буллезной или эритематозно-геморрагической формы в результате глубокого повреждения капилляров и кровеносных сосудов сетчатого и сосочкового слоев дермы. Буллезные элементы заполняются геморрагическим и фибринозно-геморрагическим экссудатом, возникают обширные кровоизлияния в кожу в области эритемы. У больных с активной репарацией в очаге поражения на месте пузырей быстро образуются бурые корки. В других случаях покрышки пузырей разрываются и отторгаются вместе со сгустками фибринозно-геморрагического содержимого, обнажая эрозированную поверхность. У большинства больных происходит ее постепенная эпителизация. При значительных кровоизлияниях в дно пузыря и толщу кожи возможно развитие некроза, иногда с присоединением вторичной флоры, образованием язв.
Рожа нижних конечностей - самая распространенная. Характерны геморрагические формы с развитием обширных геморрагий, больших пузырей с последующим образованием эрозий, других дефектов кожи.
Рожа лица обычно наблюдается при первичной и повторной формах болезни. При ней относительно редко наблюдают часто рецидивирующее течение болезни. Нередко ей предшествуют ангины, ОРЗ, обострения хронических синуситов, отитов, кариес.
Рожа верхних конечностей (4-7%), как правило, возникает на фоне послеоперационного лимфостаза у женщин, оперированных по поводу опухоли молочной железы. Рожа этой локализации имеет склонность к рецидивирующему течению.
Различают рецидивы (после перенесенной первичной рожи наблюдаются примерно у 30% больных) поздние (возникающие спустя год и более после предыдущего заболевания рожей с той же локализацией), сезонные (возникают ежегодно на протяжении многих лет, чаще всего в летне-осенний период). Поздние и сезонные рецидивы (строго в определенное время года, чаще летом) болезни по клиническому течению не отличаются от типичной первичной рожи, хотя и протекают обычно на фоне стойкого лимфостаза, других последствий предыдущих эпизодов болезни.
Ранние и частые (3 и более рецидивов за год) рецидивы являются обострениями хронически протекающего заболевания. Более чем у 90% больных часто рецидивирующая рожа протекает на фоне сопутствующей патологии, сопровождающейся нарушениями трофики кожи, снижением ее барьерных функций, местным иммунодефицитом.
Осложнения рожи, преимущественно местного характера, наблюдаются у 5-10% больных. К местным осложнениям рожи относят абсцессы, флегмоны, некрозы кожи, пустулизацию булл, флебиты, тромбофлебиты, лимфангииты, периадениты. Наиболее часто осложнения возникают у больных буллезно-геморрагической рожей. При тромбофлебитах чаще поражаются подкожные и реже глубокие вены голени. Лечение данных осложнений необходимо проводить в гнойных хирургических отделениях.
К общим осложнениям, развивающимся у больных рожей достаточно редко (0,1-0,5%), относятся: сепсис, ИТШ, острая сердечнососудистая недостаточность, тромбоэмболия легочных артерий.
Летальность при роже, леченной антибиотиками, не более 0,1- 0,5%.
К последствиям рожи относятся стойкий лимфостаз (лимфедема) и собственно вторичная слоновость (фибредема), являющиеся двумя стадиями одного процесса.
Успешное противорецидивное лечение рожи (включая повторные курсы физиотерапии) может привести к существенному уменьшению лимфатического отека.
Диагностика
Диагноз рожи основан на клинической картине болезни: острое начало болезни с выраженными симптомами интоксикации, развитие типичных местных проявлений с характерной эритемой, возможным местным геморрагическим синдромом, развитие регионарного лимфаденита, отсутствие выраженных болей в очаге воспаления в покое.
Изменения со стороны периферической крови у больных рожей характеризуются умеренно выраженным нейтрофильным лейкоцитозом со сдвигом влево, повышением СОЭ. У отдельных больных с тяжелым течением рожи могут наблюдаться гиперлейкоцитоз, токсическая зернистость нейтрофилов.
Определенное диагностическое значение имеют повышенные титры антистрептолизина-О и других противострептококковых антител (полисахарида А, М-протеина и других), выявление бактериальных и L-форм СГА в крови, слюне, отделяемом из буллезных элементов у больных (латекс-агглютинация, коагглютинация, ИФА), что особенно важно для прогнозирования рецидивов у реконвалесцентов.
Дифференциальная диагностика проводится более чем с 50 заболеваниями, относящимися к клинике хирургических, кожных, инфекционных и внутренних болезней. В первую очередь необходимо исключить местный гнойно-воспалительный процесс (абсцесс, флегмону, нагноившуюся гематому, тромбофлебит, флебит, дерматит, экзему, опоясывающий лишай, эризипелоид, сибирскую язву, узловатую эритему).
Лечение
Показаниями для госпитализации в инфекционные больницы (отделения) являются: тяжелое течение рожи с резко выраженной интоксикацией или распространенным поражением кожи, частые рецидивы рожи, наличие тяжелых общих сопутствующих заболеваний, старческий или детский возраст больных.
В настоящее время большинство больных с легким течением рожи и многие со среднетяжелой формой заболевания лечатся амбулаторно.
Режим зависит от тяжести течения заболевания.
Диета: общий стол, обильное питье.
Антибактериальная терапия
Курс антибактериальной терапии при роже составляет, в зависимости от тяжести и формы заболевания, от 7 до 14 дней и обычно длится до 3-5 дней нормальной температуры.
При неосложненном течении рожи достоверных отличий в клинической эффективности терапии при парентеральном (внутривенном или внутримышечном) введении препаратов от перорального не установлено.
При лечении больных в амбулаторных условиях целесообразно назначение одного из антибиотиков перорально: спирамицин 3 млн МЕ × 2 р/сут (10 дней), азитромицин - в 1-й день 0,5 г, затем в течение 4 дней по 0,25 г 1 раз в день (или по 0,5 г - 5 дней), рокситро-мицин 0,15 2 раза в день - 7-10 дней, левофлоксацин - 0,5 (0,25) × 2 раза в день - 10 дней, моксифлоксацин 400 мг - 1 раз в день - 10 дней, цефаклор 0,5 × 3 раза в день - 7-10 дней.
При лечении в условиях стационара препаратом выбора (при переносимости) является бензилпенициллин в суточной дозе 6-12 млн ЕД или пенициллин Gρ (1,2 млн ЕД) внутримышечно, курс 10 дней.
Препаратами резерва являются: цефазолин в суточной дозе 3,0-6,0 г внутримышечно, 10 дней), клиндамицин (в суточной дозе 1,2-2,4 г и более, внутримышечно), цефтриаксон (в суточной дозе 2,0 г внутривенно), ванкомицин (2 г в сутки) в комбинации с меропенемом (3-6 г в сутки) внутривенно или самостоятельно, кларитромицин (0,5 г внутривенно в сутки), даптомицин (4 мг/кг в сутки), имипенем + [циластатин] (в суточной дозе 1-2 г, внутривенно), назначаются при тяжелом, осложненном течении рожи.
При тяжелом течении заболевания, развитии осложнений (абсцесс, флегмона и др.) возможно сочетанное введение антибактериальных препаратов.
Назначение комбинированной антибактериальной терапии (без использования β-лактамов) целесообразно при буллезно-геморрагической роже с обильным выпотом фибрина.
Патогенетическая терапия
При выраженной инфильтрации кожи в очаге воспаления показаны НПВС (курсом 10-15 дней). При тяжелом течении рожи проводится парентеральная дезинтоксикационная терапия [декстран [ср. мол. масса 35 000-45 000] (Реополиглюкин♠), 5% раствор декстрозы (Глюкоза♠), полиионные растворы] с добавлением 5-10 мл 5% раствора аскорбиновой кислоты, 60-90 мг преднизолона. Назначаются сердечно-сосудистые, мочегонные, жаропонижающие средства.
Лечение больных рецидивирующей рожей должно проводиться в условиях стационара. Обязательно назначение резервных антибиотиков, не применявшихся при лечении предыдущих рецидивов. Назначается цефазолин внутримышечно по 0,5-1,0 г 3-4 р/сут или другой препарат из группы резерва. Курс антибактериальной терапии 10 дней. При часто рецидивирующей роже целесообразно двухкурсовое лечение. Последовательно назначают антибиотики, оптимально действующие на бактериальные и L-формы стрептококка, соответственно, первый курс антибиотикотерапии осуществляется ЦС или другими препаратами (10 дней), после 2-3-дневного перерыва проводится второй курс лечения линкомицином - 0,6-3 раза в день внутримышечно или по 0,5-3 раза в день перорально (7 дней).
Местная терапия
Лечение местных проявлений болезни проводится лишь при ее буллезных формах с локализацией процесса на конечностях. В остром периоде рожи при наличии неповрежденных пузырей их осторожно надрезают у одного из краев и после выхода экссудата на очаг воспаления накладывают повязки с 0,1% раствором риванолаρ, или 0,02% раствора нитрофурала (Фурацилин♠), или 5% раствора калия перманганата, меняя их несколько раз в течение дня. Тугое бинтование недопустимо. При наличии обширных мокнущих эрозий на месте вскрывшихся пузырей местное лечение начинается с марганцевых ванн для конечностей с последующим наложением перечисленных выше повязок.
Для очищения раневой поверхности от гнойных наложений применяют: 10% раствор хлористого натрия, гидроксиметилхиноксалиндиоксид (Диоксидин♠). В периоде эпителизации: гидросорб-гель, диоксометилтетрагидропиримидин + хлорамфеникол (Левомеколь♠), поливинокс (Винилин♠), диметилсульфоксид (Димексид♠), трипсин, химотрипсин. Всем больным с замедленной репарацией целесообразно назначение Актовегина♠, комплекса витаминов группы В.
Физиотерапия
В остром периоде рожи назначается ультрафиолетовое облучение на область очага воспаления и УВЧ на область регионарных ЛУ (5-10 процедур). При сохранении в периоде реконвалесценции инфильтрации кожи, отечного синдрома, регионарного лимфаденита назначаются аппликации озокерита или повязки с подогретой нафталановой мазью (на нижние конечности), аппликации парафина (на лицо), электрофорез гиалуронидазы (Лидазы♠) (особенно в начальных стадиях формирования слоновости), кальция хлорида, радоновые ванны, магнитотерапия.
В последние годы установлена высокая эффективность низкоинтенсивной лазеротерапии в лечении местного воспалительного синдрома при различных клинических формах рожи. Используется лазерное излучение как в красном, так и инфракрасном диапазоне.
Бициллинопрофилактика рецидивов рожи
Бициллинопрофилактика является составной частью комплексного лечения больных, страдающих рецидивирующей формой заболевания. Профилактическое внутримышечное введение бициллина-5 [Benzathine benzylpenicillin + Benzylpenicilline procaine (производитель ОАО «Синтез» Россия) - 1,5 млн ЕД], или Benzathine benzylpenicillin [бензатина бензилпенициллин (Бициллин-1♠) в России, или препараты производства зарубежных фирм] - 2,4 млн ЕД предупреждает рецидивы болезни, связанные с реинфекцией стрептококком.
При частых рецидивах (не менее трех за последний год) рожи целесообразен метод непрерывной (круглогодичной) бициллино-профилактики на протяжении 1 года и более, с интервалом введения препарата в 3 нед (в первые месяцы интервал может быть сокращен до 2 нед). При сезонных рецидивах препарат начинают вводить за месяц до начала сезона заболеваемости у данного больного с интервалом в 3 нед на протяжении 3-4 мес ежегодно. При наличии значительных остаточных явлений после перенесенной рожи препарат вводится с интервалом в 3 нед на протяжении 4-6 мес.
Прогноз при рациональной терапии обычно благоприятный. Летальные исходы, как правило, связаны с сопутствующей патологией.
Продолжительность стационарного и амбулаторного лечения составляет: от 10-12 дней при первичной, неосложненной роже до 16-20 дней - при тяжелой, рецидивирующей роже.
Диспансеризация больных рожей проводится врачами КИЗ поликлиник.
Диспансеризации подлежат лица, болеющие частыми, не менее трех за последний год, рецидивами рожи (1-я группа); лица, имеющие выраженный сезонный характер рецидивов (2-я группа); лица, имеющие прогностически неблагоприятные остаточные явления при выписке из отделения (3-я группа).
Критериями эффективности диспансерного наблюдения и лечения лиц, перенесших рожу, является предупреждение рецидивов болезни или заметное уменьшение их количества, ликвидация или уменьшение отечного синдрома, стойкого лимфостаза, других остаточных явлений и последствий болезни.
Для профилактики рецидивов болезни необходимы (амбулаторно или в специализированных отделениях): своевременная и полноценная этиотропная и патогенетическая терапия первичного заболевания и рецидивов; лечение выраженных остаточных явлений (эрозии, сохраняющейся отечности в области местного очага), последствий рожи (стойкий лимфостаз, слоновость); лечение длительно и упорно протекающих хронических заболеваний кожи, приводящих к нарушению ее трофики и появлению входных ворот инфекции; лечение очагов хронической стрептококковой инфекции (хронические тонзиллиты, синуситы, отиты и др.); лечение нарушений лимфообращения и кровообращения в коже в результате первичных и вторичных лимфостазов и слоновости; хронических заболеваний периферических сосудов; лечение ожирения, сахарного диабета (частая декомпенсация которого наблюдается при роже).
Пневмококковые инфекции
Пневмококковые инфекции (ПИ) - группа инфекционных болезней человека с аэрозольным механизмом передачи возбудителя, характеризующихся ЛИС, септицемией, преимущественным поражением органов дыхания, среднего уха, придаточных пазух носа, ЦНС и развитием в очагах поражения фибринозно-гнойного воспаления.
Код по МКБ-10
А40.3 Септицемия, вызванная Streptococcus pneumoniae. [Остальные формы ПИ кодируются не по этиологическому принципу, а по принципу органопатологии (пневмония, отит и т.д.)].
Этиология
Пневмококк (Streptococcus pneumoniae) относится к роду Streptococcus семейства Streptococcaceae. В культуре располагаются парами, несоприкасающиеся концы которых слегка заострены (ланцетовидный диплококк) или короткими цепочками. Каждая пара окружена толстой капсулой, состоящей из пептидогликана, тейхоевых кислот, холинсвязывающих белков и полисахаридов. Пневмококк имеет пили, грамположителен. В окружающей среде малоустойчив, при кипячении гибнет моментально, чувствителен к обычным дезинфектантам. Основными факторами патогенности пневмококка являются: тейхоевая и липотейхоевая кислоты и связанные с ними белки (PspA и PspC); капсула, защищающая от фагоцитоза и облегчающая проникновение в кровь и легочную ткань; ферменты: мурамидаза и IgA-протеаза, являющиеся факторами колонизации; нейраминидаза - фактор колонизации и инвазии, гиалуронида-за - фактор инвазии, обеспечивающий проникновение пневмококка через ГЛБ; р-гемолизин (пневмолизин), повреждающий клеточные мембраны, способствующий проникновению пневмококка через ГЛБ, подавляет движение ресничек (цилиостаз) эпителия дыхательных путей, подавляет фагоцитоз, нарушает хемотаксис лейкоцитов, активизирует комплемент по альтернативному типу и вызывает его быстрое потребление.
Эпидемиология
ПИ являются одной из основных причин смертности населения, особенно детей. По данным ВОЗ, от ПИ ежегодно умирают более 1,5 млн человек, т.е. больше, чем от других инфекций.
Источником возбудителя является человек (здоровые носители, больные пневмококковым ринитом, пневмонией). Основной путь передачи - воздушно-капельный, не исключается и контактный. Восприимчивость к пневмококку высокая, однако в большинстве случаев развивается носительство. Клинические формы ПИ чаще наблюдаются среди групп риска: дети до 1-2 лет, лица старше 60 лет, больные с нарушениями в системе иммунитета (ВИЧ-инфицированные, страдающие алкоголизмом и наркоманией, спленэктомированные), страдающие хроническими заболеваниями легких.
Иммунитет типо- и видоспецифический (пневмония, менингит и др.), возможны повторные заболевания и хронизация патологического процесса (отиты, синуситы). Основная защитная роль принадлежит фагоцитозу, специфическим антителам-опсонинам и комплементу.
Профилактика
Неспецифическая профилактика включает: закаливание, здоровый образ жизни, проветривание помещений и т.д. Специфическая вакцинация проводится вакциной для профилактики пневмококковых инфекций [Пневмо 23 (вакциной пневмококковой поливалентной полисахаридной)♠] (Франция) и конъюгированной 7-валентной вакциной для профилактики пневмококковых инфекций «Превенар♠» (фирма Wyeht). Доказана эпидемиологическая эффективность вакцинации.
Патогенез
Пневмококк колонизирует слизистую оболочку дыхательных путей. Дальнейшее его распространение происходит по контакту в легкие, придаточные пазухи носа, лимфогенно - в среднее ухо. Пневмококк часто, особенно у детей, проникает в кровь, вызывая бактериемию, сопровождающуюся ЛИС, которая может спонтанно завершиться выздоровлением или приводит к развитию септицемии, протекающей с поражением сосудов и появлением геморрагической сыпи (пневмококкемия, развитие первичного менингита, эндокардита), пневмонии (бактериемия выявляется у 20% больных пневмококковой пневмонией), артритов и других органных очагов. Примерно у половины больных развивается пневмококковый менингит. При этом возбудитель проникает в субарахноидальное пространство гематогенно или по контакту (из среднего уха, ячеек основной и решетчатой кости). Непосредственно из окружающей среды в субарахноидальное пространство пневмококк проникает у лиц, страдающих назальной или отоликвореей, у которых в результате перелома костей основания черепа, пирамиды височной кости или операций на гипофизе, лобной пазухе образуется свищевой ход, соединяющий субарахноидальное пространство со сводом глотки или слуховым проходом. У детей с врожденным дефектом - spina bifida возможно образование свищевых ходов, открывающихся в прямую кишку или на кожу в области крестца и межъягодичного пространства.
Более тяжелое течение пневмококкового менингита по сравнению с бактериальными гнойными менингитами (БГМ) другой этиологии связано со следующими особенностями патогенеза ПМ: благодаря подавлению фагоцитоза пневмококк образует фиброзно-гнойный экссудат непосредственно на поверхности мозга, быстро по сосудам проникает в вещество мозга и формирует фиброзно-гнойные энцефалитические очаги. Ферменты возбудителя вызывают резкое повышение проницаемости ГЭБ и развитие ОНГМ, часто приводящее к его дислокации с нарушением дыхания и других витальных функций. Снижение мозгового кровотока приводит к уменьшению пассажа антибиотиков в вещество мозга. Кроме того, колонии возбудителя благодаря наличию биопленки и фибринозно-гнойного экссудата биологически малодоступны их действию. Эти факторы резко снижают эффективность антибактериальной терапии. Таким образом, высокая (до 20-30%) летальность при ПМ обусловлена низким пассажем антибиотиков и бионедоступностью возбудителя.
Клиническая картина
Инкубационный период неизвестен, так как ПИ чаще развивается в результате активации аутоштаммов возбудителя. Генерализованным инвазивным формам ПИ часто за 1-3 дня предшествует ринит. Выделяют следующие формы ПИ:
Пневмококкемия обычно встречается у детей до 3-5 лет в качестве самостоятельного заболевания или предшествует пневмонии и менингиту. Проявляется высокой лихорадкой, интоксикацией, длящимися 3-5 дней и более. Сыпь мелкая, геморрагическая, локализуется чаще на боковых поверхностях грудной клетки. Диагностика возможна только при плановом бактериологическом исследовании крови лихорадящих детей. Более быстрый специфический результат дает ПЦР крови. Пневмококковая септицемия может протекать тяжело с гипертермией, обильной геморрагической сыпью и развитием инфекционно-токсического шока, от менингококкемии достоверно дифференцируется только бактериологическим исследованием и ПЦР крови.
Пневмококковый менингит (менингоэнцефалит) клинически трудно отличим от других БГМ, в то же время имеет ряд важных особенностей: раннее вовлечение в патологический процесс вещества мозга сопровождается тяжелой общемозговой симптоматикой; в то же время менингеальный синдром выражен менее резко, чем при менингококковом и других менингитах; нейтрофильный плеоцитоз ниже, чем при менингококковом менингите (МM); санация СМЖ происходит медленно, что связано с рядом факторов: подавлением фагоцитоза, слабой местной иммунной реакцией, слабой противовоспалительной реакцией с относительно низким уровнем провоспалительных цитокинов и белков ранней фазы воспаления; низкой биодоступностью возбудителя; медленной санацией СМЖ и энцефалитических очагов, что проявляется, в частности, длительным сохранением общемозгового и менингеального синдрома, лихорадки, высоким уровнем лактата и D-димера фибрина (D-ДФ) в СМЖ; высокой вследствие указанных причин летальностью.
Диагностика
ПИ в большинстве случаев ограничивается установлением на основании клинических и инструментальных данных органопатологии: внебольничная пневмония, острый гнойный отит, острый синусит, хотя наиболее частым этиологическим фактором этих заболеваний является пневмококк. Выделение культуры пневмококка с определением его чувствительности к антибактериальным препаратам существенно повышает эффективность этиотропной терапии. Бактериологическое исследование в настоящее время при широком применении антибиотиков снизило свою информативность и должно сочетаться с использованием ПЦР.
При гнойном менингите указанные методы (ПЦР, бактериологический, РЛА) имеют только диагностическое значение и не позволяют при отрицательных результатах оценить эффективность лечения и решить вопрос о тактике дальнейшей антибиотикотерапии.
Дифференциальная диагностика зависит от клинической формы ПИ. При ПМ важно выявить наличие первичных очагов (пневмония, отит, синусит, эндокардит), наличие ликвореи в анамнезе, тяжелых травм черепа, оперативных вмешательств на костях черепа (отит, синусит, опухоль гипофиза), у детей - наличие spina bifida. При отсутствии этиологического подтверждения дифференциальную диагностику проводят между БГМ, СВМ, невоспалительными заболеваниями ЦНС.
Лечение
Показания к госпитализации
Клинические: при подозрении на менингит больные госпитализируются в специализированное отделение (отделение нейроинфекций) или ОРИТ инфекционного стационара. Больные вторичными оториногенными менингитами, нуждающиеся в экстренном хирургическом вмешательстве, госпитализируются в ЛОР-отделение.
Режим определяется клинической формой и состоянием больного. Больные ПМ нуждаются в строгом постельном режиме, при наличии возбуждения - в фиксации. При расстройствах сознания, нарушении питания, ИВЛ больные нуждаются в сбалансированном парентеральном питании.
Медикаментозная терапия
Выбор антибиотика, схемы, пути введения определяются стандартами лечения соответствующей нозоформы (пневмония, отит, синусит) с учетом данных мониторинга чувствительности пневмококка в соответствующем регионе. Больные менингитом лечатся по схемам эмпирической теории БГМ, при установлении пневмококковой этиологии менингита по схеме этиотропной терапии пневмококкового менингита (табл. 16-18).
| Штамм пневмококка | Препарат | Суточная доза | Кратность введения | Путь введения |
|---|---|---|---|---|
Пенициллин-чувствительный |
Бензилпенициллин |
300-400 тыс. Ед/кг 400-500 тыс. Ед/кг |
6 8 |
в/м в/в |
Цефтриаксон* |
100 мг/кг (макс. доза 4 г) |
1 |
в/в |
|
Цефотаксим |
200 мг/кг |
4 |
в/в |
|
Устойчивый или с промежуточной чувствительностью к пенициллину |
Цефтриаксон* |
100 мг/кг (макс. доза 4,0 г) |
1 |
в/в |
Цефотаксим |
200 мг/кг |
4 |
в/в |
|
Меропенем |
3 г детям 40 мг/кг |
3 |
в/в |
|
Линезолид |
1,2 г |
2 |
в/в |
|
Ципрофлоксацин** |
1,5 г детям до 50 мг/кг |
2 2 |
в/в в/в |
|
Ванкомицин*** |
3,0 г детям 20 мг/кг + 5-20 мг |
3 3 1 |
в/в в/в эндолюмбально |
* Цефтриаксон по витальным показаниям комиссионно до 130 мг/кг.
** Ципрофлоксацин детям по витальным показаниям комиссионно.
*** При наличии ОНГМ с признаками дислокации мозга (кома, нарушение дыхания, судороги) эндолюмбальное введение противопоказано, так как при разобщении церебрального и спинального отделов субарахноидального пространства препарат задерживается в спинальном отделе, что снижает его эффективность и повышает частоту побочных эффектов.
Из-за особенностей патологического процесса длительность антибиотикотерапии при ПМ составляет в среднем 15 сут без снижения дозы. Препарат отменяется при неосложненном течении болезни: при полном регрессе менингеальных симптомов, ясном сознании, снижении плеоцитоза СМЖ ниже 100 кл./мкл, при содержании лимфоцитов более 70%, уровне глюкозы выше 2,0 ммоль/л, уровне лактата ниже 4,0 ммоль/л.
Сохранение высокого нейтрофильного плеоцитоза, повышенного содержания белка, уровня глюкозы менее 1,5 ммоль/л, лактата более 8 ммоль/л в течение 2-3 сут требует замены антибиотика препаратом альтернативной группы.
Антибиотикотерапия сочетается с дегидратацией преимущественно петлевыми диуретиками с поддержанием нормоволемии и нормального электролитного состава плазмы, а также 20-25% раствором альбумина человека (Альбумин♠), дезинтоксикационной терапией, дексаметазоном (4,0 мг 3-4 р/сут в/в), средствами, улучшающими мозговой кровоток, антиоксидантами и антигипоксантами, противосудорожными средствами.
Прогноз. Летальность до 20-30%, при лечении в специализированных стационарах - 8-15%. Нередко сохраняются остаточные явления поражения ЦНС, тугоухость.
Сроки нетрудоспособности при ПИ зависят от клинической формы болезни, при ПМ - в среднем 3 мес.
Диспансеризация проводится неврологом не менее 1 года, при повторных заболеваниях ПМ больные нуждаются в обследовании в нейрохирургическом отделении, при выявлении ликвореи - в оперативном лечении.
После перенесенного ПМ противопоказаниями являются инсоляция, переохлаждение, употребление продуктов с повышенным содержанием соли, работа на производстве с повышенной вредностью.
Стафилококковые инфекции*
* Материалы доступны в электронном виде по ссылке, указанной на последней странице книги.
Менингококковая инфекция
Менингококковая инфекция - острая антропонозная инфекционная болезнь с аэрозольным механизмом передачи возбудителя, которая характеризуется лихорадкой, интоксикацией, геморрагической сыпью и гнойным воспалением оболочек мозга.
Коды по МКБ-10
А39 Менингококковая инфекция.
Этиология
Возбудитель - менингококк Neisseria meningitidis рода Neisseria семейства Neisseriaceae. Это бобовидный кокк, располагающийся попарно (диплококк).
В мазках СМЖ у больных менингококковым менингитом он локализуется преимущественно внутриклеточно в цитоплазме полиморфноядерных нейтрофилов. Аналогично он расположен и в мазках крови, но при фульминантных формах менингококкемии - преимущественно внеклеточно. Менингококк грамотрицателен, имеет полисахаридную капсулу и выросты - пили. Для культивирования используют специальные среды.
В соответствии с антигенной структурой полисахаридов капсулы менингококки подразделяют на серогруппы А, В, С, H, I, K, L, X, Y, Z, 29E, W-135.
Менингококк малоустойчив в окружающей среде. При 55 °С погибает через 5 мин, при 100 °С - через 30 c. Плохо переносит низкие температуры, до 5 сут сохраняет жизнеспособность при температуре 5-6 °С. При температуре 18-20 °С менингококк сохраняется в распыленном состоянии не более 10 мин, однако при влажности 70-80% отмечали 5-дневную выживаемость.
Под действием дезинфектантов (0,01% раствор хлорамина, 1% фенола, 0,1% раствор водорода пероксида) менингококк погибает через 2-3 мин.
В патологии человека наибольшую роль играют менингококки серогрупп А, В и С. В последние годы широкое распространение, включая территорию РФ, получил менингококк W-135, обладающий повышенной вирулентностью. К факторам патогенности относят капсулу, пили, ЛОС (липоолигосахариды), IgA-протеазы, нейраминидазу и гиалуронидазу.
Эпидемиология
Существуют три группы источников инфекции, различных по своей значимости: носители менингококка, больные менингококковым назофарингитом и больные генерализованными формами менингококковой инфекции.
Носительство менингококка широко распространено, чаще бывает острым и длится не более месяца. Носители ведут активный образ жизни, однако в связи с отсутствием катаральных явлений их значимость в качестве источника инфекции невелика.
Больные менингококковым назофарингитом - наиболее важный источник инфекции и двигатель эпидемического процесса, поскольку легкое течение болезни и активный образ жизни позволяют им иметь множество контактов. Наличие катаральных симптомов активизирует механизм передачи возбудителя.
Больные генерализованной формой менингококковой инфекции - наиболее интенсивный источник высоковирулентных штаммов менингококка, однако они обездвижены, мало контактируют и число их по сравнению с больными назофарингитом в сотни раз меньше.
Механизм передачи возбудителя - аэрозольный, путь передачи - воздушно-капельный. Важное значение для передачи возбудителя имеют длительность, близость, а также условия контакта. Особенно опасны длительные тесные контакты в замкнутом теплом помещении при высокой влажности воздуха.
Восприимчивость к менингококку всеобщая, однако в подавляющем большинстве случаев инфекционный процесс протекает в форме носительства или назофарингита.
Восприимчивость индивидуума зависит от наличия предшествующего специфического иммунитета, который приобретается путем повторных контактов с носителями менингококка или больными назофарингитом. В развитых странах с низким уровнем рождаемости и заболеваемости до 40% заболевших - взрослые. Напротив, в странах с высокой рождаемостью, скученностью населения взрослые составляют не более 10% больных.
Распространение инфекции носит убиквитарный характер. Регистрируют спорадическую, групповую и эпидемическую заболеваемость, в основном обусловленную менингококками серогрупп А, В и С, в последние годы - W-135.
В 2017 г. менингококк W-135 вызывал более 30% случаев генерализованной формы менингококковой инфекции (ГФМИ) в РФ.
В странах с умеренным климатом рост заболеваемости начинается осенью и достигает пика в феврале-марте, а во время эпидемий - в апреле-мае, т.е. позже, чем при других воздушно-капельных инфекциях. В мегаполисах отмечают осенний подъем, связанный с усилением контактов между детьми в дошкольных учреждениях, школах, интернатах и др. В воинских частях возможны вспышки, связанные с поступлением призывников.
Профилактика
Больных генерализованной формой менингококковой инфекции госпитализируют. Выявленных в окружении больного носителей изолируют и санируют. По эпидемиологическим показаниям вводят вакцины для профилактики менингококковых инфекций:
-
вакцину для профилактики менингококковых инфекций (Вакцину менингококковую группы А полисахаридную сухую♠) в дозе 0,25 мл - детям от 1 до 8 лет и 0,5 мл - детям 9 лет, подросткам и взрослым (подкожно однократно);
-
вакцину для профилактики менингококковых инфекций (Полисахаридную менингококковую вакцину А+С♠) в дозе 0,5 мл - детям от 18 мес (по показаниям - от 3 мес) и взрослым подкожно (или внутримышечно) однократно;
-
вакцину для профилактики менингококковых инфекций (Менце-вакс ACWY♠) в дозе 0,5 мл - детям от 2 лет и взрослым подкожно однократно. Роль этой вакцины возрастает в связи с ростом заболеваемости, вызванной менингококком W-135.
Патогенез
Менингококк имеет двойственную природу: с одной стороны, это гноеродный кокк, вызывающий гнойный менингит, артрит; с другой - он содержит (как и другие грамотрицательные микроорганизмы) эндотоксин (ЛОС), вызывающий развитие интоксикационного синдрома, активацию провоспалительных цитокинов, системы комплемента.
Защитные механизмы при менингококковой инфекции связаны с барьерными функциями эпителия носоглотки, действием секреторных IgA, системой комплемента, фагоцитарной активностью полиморфноядерных нейтрофилов, специфическими бактерицидными антителами.
При бактерионосительстве паразитирование менингококка на слизистой оболочке носоглотки не сопровождается субъективными нарушениями здоровья, но при осмотре в большинстве случаев обнаруживают картину острого фолликулярного фарингита (местная воспалительная реакция).
При назофарингите аналогичные местные изменения сопровождаются катаральными явлениями, в части случаев - лихорадочной реакцией. Генерализации инфекции способствует высокая IgA-протеазная активность эпидемического штамма, высокая инфицирующая доза при тесном контакте. Важное значение имеет состояние слизистой оболочки носоглотки. Предшествующая респираторная инфекция, особенно грипп, способствует генерализации менингококковой инфекции. При врожденном дефиците терминальных компонентов системы комплемента (С7-С9) частота встречаемости генерализованных форм болезни возрастает в 100 раз.
Важнейшее звено патогенеза генерализованной формы менингококковой инфекции - бактериемия. В оптимальных случаях (легкие формы менингококкемии) гибель менингококка сопровождается высвобождением небольших количеств ЛОС, обладающего мощным активизирующим действием на все защитные системы организма, благодаря чему организм быстро освобождается от возбудителя. Однако чаще, в связи с интенсивной бактериемией, фагоцитоз становится незавершенным. Нейтрофилы, содержащие жизнеспособные менингококки, преодолевают гистогематические барьеры и заносят возбудитель в субарахноидальное пространство и полость суставов, где развивается гнойное воспаление.
При более высоких уровнях бактериемии и токсинемии усиливается потребление комплемента, подавляется фагоцитоз, снижается бактерицидная активность крови, происходит размножение возбудителя и накопление высоких доз ЛОС. Нерегулируемый выброс биологически активных веществ (кинины, катехоламины, ИЛ, белки ранней фазы), инициирующих генерализованную воспалительную реакцию, клинически выражается в картине ИТШ. ИТШ развивается при микробной нагрузке свыше 1 × 106 /мкл.
Проникновение возбудителя в субарахноидальное пространство приводит к развитию гнойного менингита. Раньше всего выявляют признаки повышенной проницаемости ГЛБ и продукции СМЖ, что сопровождается повышением ЛД и увеличением содержания лактата в СМЖ до 5-6 ммоль/л и более. Затем в течение нескольких часов развивается картина разлитого гнойного менингита. Тяжесть течения и исход менингита в ранние сроки определяются степенью выраженности острого ОНГМ, а в поздние сроки при отсутствии адекватной терапии - прогрессированием гнойно-воспалительного процесса, вовлечением в него вещества и желудочков мозга, нарушением ликвородинамики и развитием водянки головного мозга.
В целом более 90% летальных исходов при менингококковой инфекции обусловлено ИТШ, острым ОНГМ или их сочетанием. Около 10% летальных исходов связано с прогрессирующим менинго-энцефалитом.
Клиническая картина
Инкубационный период при генерализованных формах длится от 1 до 10, чаще 2-4 сут. Клиническая картина многообразна. Разработана отечественная классификация, приближенная к международной.
Менингококковая инфекция
Менингококковое носительство протекает бессимптомно, но при осмотре можно обнаружить картину острого фолликулярного фарингита.
Менингококковый назофарингит - наиболее частое проявление менингококковой инфекции. Он может предшествовать генерализованной форме менингококковой инфекции, но в большинстве случаев это самостоятельная форма болезни. Характерно затруднение носового дыхания, скудные выделения из носа, небольшой кашель, боли в горле, головная боль. Лихорадку (чаще субфебрильную) продолжительностью до 4 сут отмечает половина больных. В более тяжелых случаях температура достигает 38,5-39,5 °С, сопровождается ознобом, болями в мышцах и суставах. Слизистая оболочка задней стенки глотки гиперемирована, отечна, часто видны наложения слизи. На 2-3-й день появляется гиперплазия лимфоидных фолликулов.
Особенно выражены воспалительные изменения в носоглотке, они распространяются на заднюю часть носовых ходов и хоан, приводя к нарушению носового дыхания. Через несколько дней воспалительные изменения стихают, но гиперплазия фолликулов сохраняется до 2 нед.
У детей в возрасте до 3 лет выражены насморк, кашель, воспалительные изменения распространяются на миндалины, нёбные дужки и мягкое нёбо.
Менингококкемия характеризуется сочетанием лихорадочно-интоксикационного синдрома с поражением кожных покровов и широким диапазоном тяжести течения. В типичных случаях начало внезапное или на фоне назофарингита. Появляются озноб, боли в пояснице, суставах, мышцах, головная боль, иногда рвота, резкая слабость, температура повышается в течение нескольких часов до 39 °С и выше. Через 6-24 ч после начала озноба появляется кардинальный симптом менингококкемии - полиморфная геморрагическая сыпь. Элементы сыпи имеют неправильную, часто звездчатую форму, размеры варьируют от петехий до крупных экхимозов диаметром 2-3 см и более. Крупные элементы плотноваты на ощупь, чувствительны при пальпации, возвышаются над поверхностью кожи. Сыпь локализуется преимущественно в дистальных отделах конечностей, на латеральной поверхности бедер и ягодиц. В течение суток она может стать обильнее; в дальнейшем новые элементы не появляются. Мелкие элементы пигментируются и через несколько дней исчезают; крупные подвергаются некрозу, покрываются коркой, после отпадения которой остаются эрозивно-язвенные дефекты с последующим формированием рубцов. Чем раньше появляется сыпь и чем крупнее элементы, тем тяжелее протекает болезнь. До появления геморрагических элементов возможно возникновение необильных папулезных или розеолезных высыпаний, которые быстро исчезают или трансформируются в геморрагии. Возможны также геморрагии на конъюнктивах и слизистой оболочке ротоглотки, носовые кровотечения.
Легкие формы менингококкемии часто не диагностируются или диагностируются уже при развитии осложнений (артрит, иридоциклит). Для них характерны кратковременная лихорадка, длящаяся несколько часов или сутки, типичная, но мелкая и необильная сыпь или только розеолезные и папулезные элементы.
Совершенно иначе протекает фульминантная менингококкемия. Начало бурное, с потрясающего озноба. Характерен резко выраженный токсикоз с первых часов болезни, проявляющийся интенсивной головной болью и рвотой, головокружением, болями в пояснице, конечностях, суставах, тахикардией, одышкой; возможны боли в животе, диарея. Температура в течение нескольких часов достигает 40 °С и более. Сыпь появляется, как правило, в течение первых 12 ч после начала озноба. Элементы крупные, быстро некротизируются и приобретают багрово-синюшную окраску, локализуются преимущественно на лице, шее, животе, передней поверхности грудной клетки. Возможны геморрагические некрозы кончика носа, мочек ушей, гангрена ногтевых фаланг и даже кистей и стоп. Появлению сыпи предшествуют обильные кровоизлияния в конъюнктивы и склеры глаз, слизистые оболочки ротоглотки.
На этом фоне развивается картина ИТШ. В наиболее тяжелых случаях развитие шока предшествует появлению сыпи.
На фоне лечения у части больных в течение шока доминируют проявления тромбогеморрагического синдрома, у других - шокового легкого или ОПН. У лиц пожилого возраста причиной летального исхода в поздние сроки становятся прогрессирующая сердечная недостаточность (снижение сократительной способности миокарда, по данным УЗИ), отек мозга с дислокацией, а также вторичные бактериальные пневмонии.
Картина крови у больных менингококкемией характеризуется резко выраженным нейтрофильным лейкоцитозом до 30-40 тыс. клеток в 1 мкл, сдвигом лейкоцитарной формулы влево, появлением в крови миелоцитов и промиелоцитов, нередко отмечают умеренную тромбоцитопению. При тяжелых формах менингококкемии, осложненных шоком, характерны лейкопения и нейтропения, а также тромбоцитопения ниже 40-50 тыс. Лейкопения и тромбоцитопения - неблагоприятные прогностические признаки.
В тяжелых случаях отмечают протеинурию, гематурию, снижение плотности. Изменения в системе гемостаза зависят от тяжести течения болезни. В тяжелых случаях развивается коагулопатия потребления с резким снижением уровня фибриногена, активности тромбоцитарных и плазменных факторов свертывания и появлением в крови продуктов деградации не только фибрина, но и фибриногена.
Изменения кислотно-основного состояния сводятся в тяжелых случаях к метаболическому ацидозу (при развитии шока - декомпенсированному), гипоксемии.
При микроскопии мазка крови часто обнаруживают характерные диплококки, расположенные чаще внеклеточно, иногда скоплениями.
Менингит, так же как и менингококкемия, начинается остро, но не столь бурно. Появляются познабливание, головная боль, температура в течение первых суток достигает 38,5-39,5 °С. Головная боль быстро усиливается и к концу суток становится труднопереносимой, приобретает распирающий характер. Головная боль усиливается при резких движениях, под воздействием яркого света и громких звуков. Несколько позже присоединяется тошнота, а затем рвота. Одновременно появляется гиперестезия кожи. Во второй половине суток или на второй день болезни при осмотре четко определяются менингеальные симптомы. Степень выраженности менингеального синдрома по мере развития менингита прогрессирует. С 3-4-го дня болезни больные (особенно дети) занимают вынужденную менингеальную позу: на боку с запрокинутой головой и поджатыми к туловищу ногами (поза «легавой собаки»). У детей раннего возраста первыми симптомами менингококкового менингита могут быть монотонный крик, отказ от еды, срыгивание, выбухание и прекращение пульсации родничка, симптом Лесажа (подвешивания), симптом «треножника». Со 2-х суток нарастает общемозговой синдром: заторможенность, сопор, психомоторное возбуждение. На 2-3-й дни также возможно появление очаговых симптомов: парезы черепных нервов (чаще лицевого и глазодвигательных), пирамидные знаки, иногда парезы конечностей, тазовые расстройства. Особенно серьезно развитие гнойного лабиринтита или кохлеарного неврита VIII пары черепных нервов. При этом появляется шум в ухе (ушах), затем сразу развивается нейросенсорная тугоухость.
Картина крови аналогична таковой при менингококкемии, но лейкоцитоз менее выражен, в пределах 15-25 тыс. в 1 мкл. При исследовании кислотно-основного состояния отмечают тенденцию к респираторному алкалозу. Наиболее информативны изменения в СМЖ. При спинномозговой пункции жидкость уже с первых часов болезни вытекает под повышенным давлением, однако при частой рвоте возможна и ликворная гипотензия. Раньше всего отмечают повышение уровня глюкозы до 3,5-4,5 ммоль/л. В дальнейшем этот уровень падает, а на 3-4-й день глюкоза может не определяться. Далее в СМЖ при нормальном цитозе появляются нейтрофилы. В это время, фактически до развития воспаления, возбудитель можно обнаружить в субарахноидальном пространстве всеми доступными методами, появляется лактат-ацидоз СМЖ. Затем в течение нескольких часов СМЖ приобретает гнойный характер, становится мутной, содержит до 3-10 тыс. в 1 мкл нейтрофилов, количество белка повышается до 1,5- 6,0 г/л и более. Содержание лактата увеличивается до 10-25 ммоль/л. Становятся резко положительными осадочные пробы, pH СМЖ снижается до 7-7,1.
Наиболее частое осложнение менингококкового менингита - ОНГМ той или иной степени. Тяжелый, жизнеугрожающий ОНГМ с синдромом дислокации и ущемлением ствола мозга наблюдается у 10-20% больных генерализованной формой менингококковой инфекции. ОНГМ может развиться с первых часов болезни (молниеносная форма менингита), когда еще не сформировался гнойный экссудат в оболочках мозга, а у больных старше 70 лет с исходно сниженным мозговым кровотоком - до 3-5-го дня лечения.
Симптомы тяжелого прогрессирующего ОНГМ - спутанное сознание, психомоторное возбуждение с быстрым развитием комы, генерализованные клоникотонические судороги. Решающее диагностическое значение имеют нарушения дыхания: тахипноэ, аритмия, появление шумного паралитического дыхания с участием вспомогательных мышц при малой экскурсии диафрагмы. У части больных регистрируют дыхание типа Чейна-Стокса, затем наступает апноэ (сердечная деятельность, как правило, сохраняется еще несколько минут). Довольно показательны изменения со стороны сердечно-сосудистой системы. Брадикардию наблюдают редко, чаще тахиаритмию с быстрым изменением частоты сердечных сокращений в пределах 120-160 в минуту (в два раза чаще возрастной нормы). АД повышено за счет систолического до 140-180 мм рт.ст., нестабильно. У части больных, особенно у детей, наоборот, наблюдают выраженную гипотензию. Характерны вегетативные нарушения: багрово-синюшная (при гипотензии - пепельно-серая) окраска лица, усиленное пото- и салоотделение. При исследовании крови - гипергликемия, тенденция к гипонатриемии, гипоксемия, гипокапния со снижением раСО2 до 25 мм и ниже, декомпенсированный респираторный алкалоз.
Чаще всего встречается сочетанная форма менингококковой инфекции. При этом всегда менингококкемия предшествует возникновению менингита, который может развиться после кратковременной (несколько часов) ремиссии после появления сыпи. Вновь повышается температура, нарастает головная боль и появляются менингеальные симптомы. Сочетанной форме, так же как и менингококкемии, часто предшествует менингококковый назофарингит.
Менингококковую пневмонию, как правило, клинически не дифференцируют от пневмококковой, поэтому достоверных данных о ее частоте нет. Для МИ, вызванной менингококком W-135, характерно раннее развитие пневмонии, предшествующее появлению сыпи и менингеального синдрома. Менингококковый артрит и иридоциклит обычно являются следствием недиагностированной менингококкемии.
Хроническая менингококкемия протекает с периодическими подъемами температуры, сопровождающимися высыпаниями на коже, артритом или полиартритом. После нескольких приступов появляется систолический шум в области сердца, свидетельствующий о развитии эндокардита. Больные попадают в поле зрения врача обычно в результате развития менингита.
Наиболее частое осложнение генерализованной формы менинго-кокковой инфекции - полиартрит. Полиартрит может развиваться в первые дни болезни. В этих случаях поражаются преимущественно мелкие суставы кисти. На 2-3-й неделе чаще наблюдаются артриты и полиартриты с поражением крупных и средних суставов (коленного, голеностопного, плечевого, локтевых). При поздних артритах в полости сустава накапливается серозный или гнойный экссудат. Возможно также развитие миокардита или миоперикардита, протекающего по типу инфекционно-аллергического. При тяжелых формах болезни, осложненных шоком или отеком мозга, часто развиваются пневмонии, вызванные стафилококком, синегнойной палочкой, клебсиеллой. Они могут носить деструктивный характер и существенно отягощают прогноз. После перенесенного шока, особенно при применении массивных доз глюкокортикоидов, возможно развитие сепсиса.
Диагностика
Клинический диагноз единичных случаев менингококкового назофарингита всегда требует бактериологического подтверждения, т.е. получения из носоглоточной слизи и типирования культуры менингококка.
Клиническая диагностика менингококкемии и сочетанной формы менингококковой инфекции в типичных случаях не представляет трудностей, однако возможно большое сходство с целым рядом болезней, протекающих с геморрагическими высыпаниями и поражением ЦНС. Менингококковый менингит клинически трудноотличим от других гнойных первичных менингитов, поэтому важно лабораторно подтвердить диагноз генерализованной менингококковой инфекции. Особое значение для дифференциальной диагностики с вирусными инфекциями имеют островоспалительные изменения в крови. Для диагностики менингококкового менингита решающее значение имеет исследование СМЖ.
Из лабораторных способов диагностики наиболее значимы микробиологические методы, РЛА и ПЦР. Бактериоскопически менингококк можно обнаружить в крови и СМЖ, однако данные бактериоскопии ориентировочны. Выделение культуры менингококка - наиболее достоверный метод, но его эффективность в связи с применением антибиотиков до исследования снизилась до 20-40%.
РЛА, применяемая для выявления антигена менингококка в СМЖ, увеличивает частоту положительных результатов до 45-70%, однако иногда дает ложноположительные результаты; наконец, ПЦР позволяет подтвердить диагноз более чем у 90% больных, прием антибиотиков в течение 1-2 сут не влияет на частоту положительных результатов. Перспективно применение ПЦР как метода экспресс-диагностики.
Иммунологическая диагностика (РПГА) имеет вспомогательное значение, так как антитела выявляются не ранее 3-5-го дня болезни. Достоверное значение имеет исследование парных сывороток крови, причем 4-кратное нарастание титров выявляется у 40-60% больных, а у детей в возрасте до 3 лет - не более чем у 20-30%.
Дифференциальная диагностика
Дифференциальную диагностику проводят, основываясь на клинической форме болезни. Менингококковый назофарингит дифференцируют от ОРЗ, ангины. Менингококкемию в ряде случаев приходится дифференцировать от других инфекционных болезней, для которых характерны ЛИС и геморрагическая сыпь (риккетсиозы, ГЛ, лептоспироз), сепсиса, токсико-аллергических (медикаментозных) дерматитов, геморрагического васкулита, тромбоцитопенической пурпуры, острого лейкоза. Сочетанную форму болезни также дифференцируют от сепсиса, лептоспироза, риккетсиозов.
Дифференциальную диагностику менингококкового менингита проводят с другими первичными и вторичными гнойными менингитами, серозными вирусными менингитами, туберкулезным менингитом; менингизмом при острых лихорадочных заболеваниях, экзогенных и эндогенных интоксикациях, нарушениях мозгового кровообращения, особенно с субарахноидальным кровоизлиянием, объемных процессах в ЦНС.
Большие трудности представляет дифференциальная диагностика сочетанной формы менингококковой инфекции с острым сепсисом, чаще всего стафилококковым, протекающим с эндокардитом и тромбоэмболиями мозга. В этих случаях сыпь может появиться на 2-3-й день болезни, но часто наряду с геморрагиями имеются пустулезные и пустулезно-геморрагические элементы. Особенно характерны геморрагические высыпания в области ладоней, стоп, на пальцах. Часто выслушиваются шумы на сердце.
Важно подчеркнуть, что, помимо менингококкового, первичными (без наличия гнойно-воспалительного очага) могут быть пневмококковый и гемофильный менингиты. При этом клинические различия носят количественный характер и не позволяют провести дифференциальную диагностику без лабораторного подтверждения.
Дифференциальная диагностика с серозным вирусным менингитом часто возможна на догоспитальном этапе на основании:
Определенные трудности возникают при исследовании СМЖ на ранних этапах развития болезни. В этих случаях часто выражен нейтрофильный плеоцитоз (до 90% нейтрофилов). При этом, как правило, СМЖ прозрачная, количество клеток не превышает 200 в 1 мкл, содержание глюкозы соответствует верхней границе нормы или повышено, уровень лактата не более 3,0 ммоль/л. В сомнительных случаях следует сделать повторную пункцию через 24-48 ч.
При многих лихорадочных заболеваниях (грипп, пневмония, сальмонеллез, рожа и др.) может развиваться менингеальный синдром. В этих случаях больных следует экстренно госпитализировать в инфекционный стационар. Окончательный диагноз устанавливают на основании исследования СМЖ.
Лечение
Показания к госпитализации: клинические - подозрение на генерализованную форму менингококковой инфекции; эпидемиологические: менингококковый назофарингит (подтвержденный бактериологически или обнаруженный в очаге инфекции).
Режим и диета
При генерализованной форме менингококковой инфекции режим вначале строгий постельный, в дальнейшем - постельный и палатный. Специальной диеты не требуется. При коме, проведении ИВЛ - зондовое и/или парентеральное питание.
Медикаментозная терапия
Лечение менингококковой инфекции зависит от клинической формы болезни. При назофарингите терапия симптоматическая. Если диагноз подтвержден бактериологически, применяют бензилпенициллин, ампициллин, ЦС I-II поколения, хлорамфеникол, пефлоксацин в средних терапевтических дозах в течение 3 сут.
Препаратом выбора для лечения генерализованных форм менингококковой инфекции остается бензилпенициллин, к которому чувствительны почти все штаммы менингококка, встречающиеся на территории РФ. Пенициллин назначают в суточной дозе 200-300 тыс. ЕД/кг, разовые дозы вводят с интервалом 4 ч. При внутривенном введении суточную дозу повышают до 300-400 тыс. ЕД/кг. При позднем поступлении, менингоэнцефалите целесообразно повысить дозу до 400-500 тыс. ЕД/кг. Недостатком пенициллина является 6-8-кратное введение.
Высокоэффективен цефтриаксон. Взрослым его назначают в дозе 4 г однократно, детям - 100 мг/кг, но не более 4 г/сут. Эффективен также цефотаксим в дозе 200 мг/кг (не более 12 г/сут). По индивидуальным показаниям применяют хлорамфеникол в дозе 80-100 мг/кг в сутки в 2-3 приема, фторхинолоны III поколения в максимальных терапевтических дозах.
Длительность антимикробной терапии зависит от сроков санации СМЖ и составляет от 5 до 10 сут. Важным показателем эффективности терапии является снижение уровня лактата в СМЖ до 3,0 ммоль/л.
Дезинтоксикационную терапию неосложненных генерализованных форм болезни проводят по общим правилам. В патогенетической терапии важное место занимают анальгетики и седативные препараты.
При менингококковом менингите главное направление патогенетической терапии - дегидратация, цель которой - уменьшить отек мозга и внутричерепную гипертензию путем мобилизации жидкости из субарахноидального пространства и вещества мозга. Наиболее эффективен фуросемид в суточной дозе 20-40 мг, максимально - 80 мг, детям - до 6 мг/кг. Интенсивную дегидратацию в режиме нормоволемии проводят в первые 5-7 сут, затем используют более слабые диуретики, в частности ацетазоламид. Потери жидкости восполняют введением полиионных растворов.
При развитии ИТШ на ранних этапах основные направления медикаментозной терапии следующие.
-
Дезинтоксикация (режим форсированного диуреза - до6 л жидкости в сутки, детям - до 100 мл/кг). Применяют криоплазму, 5-10% раствор альбумина человека (Альбумин♠), декстран, полиионные растворы, глюкозо-калиевую смесь. Одновременно вводят фуросемид под контролем уровня гематокрита и ЦВД. Оптимален режим умеренной гемодилюции (гематокрит приблизительно составляет 35%); проводят ультрафильтрацию плазмы с использованием сорбента, фиксирующего ЛПС.
-
Стабилизация гемодинамики, борьба с микроциркуляторными нарушениями [допамин, норэпинефрин (Норадреналин♠), преднизолон - 3-5 мг/кг, гидрокортизон 200 мг/сут внутривенно].
-
Борьба с гипоксией путем ингаляций кислорода через маску или назальные катетеры - до 6 л/мин или ИВЛ.
-
Коррекция метаболического ацидоза и электролитных нарушений (по индивидуальным показаниям).
Прогноз
Летальность при генерализованной форме менингококковой инфекции составляет 3-5% (до 20% в непрофильных стационарах). Максимальная летальность (до 20-30%) у детей в возрасте до года и лиц старше 60 лет. Наиболее высокая летальность в последние годы наблюдается при менингококковой инфекции, вызванной менингококком серогруппы W-135. При ИТШ - 20-30%, при ОНГМ с дислокацией мозга - 15-20%. При своевременной диагностике и лечении неблагоприятные последствия (инвалидизация) редки. Самые частые причины инвалидизации - снижение слуха, гидроцефально-гипертензивный синдром.
Диспансеризация
Диспансеризацию осуществляют участковый терапевт (педиатр) и невролог в течение 1 года с явкой через 1, 3, 6 и 12 мес после выписки из стационара.
Сепсис
Сепсис - полиэтиологическая бактериальная инфекционная болезнь, развивающаяся на фоне нарушения защитных механизмов и характеризующаяся неконтролируемой бактериемией, приводящей к развитию инфекционно-токсического шока и полиорганным поражениям, ациклическим прогрессирующим течением болезни с неблагоприятным исходом при отсутствии адекватной терапии.
Коды по МКБ-10
А40 Стрептококковая септицемия.
А41 Другая септицемия.
R65.20 Тяжелый сепсис без септического шока.
R65.21 Тяжелый сепсис с септическим шоком.
Этиология
Наиболее распространенными возбудителями сепсиса являются грамположительные (золотистый стафилококк, пиогенный стрептококк, пневмококк, листерии) и грамотрицательные (менингококк, кишечная палочка, клебсиелла, протей, синегнойная и гемофильная палочки, энтерококки) и другие условно-патогенные бактерии, постоянно или часто входящие в состав флоры наружных покровов (кожи и слизистых оболочек). Реже сепсис вызывается высокопатогенными микроорганизмами: возбудителями чумы и другими иерсиниями, сибирской язвы, легионеллами и др., а при тяжелых предшествующих поражениях (высокие дозы радиации, обширные ожоги, тяжелые травмы, полиорганная недостаточность) - сапрофитной флорой: коагулазоотрицательный стафилококк, негемолитический стрептококк, бактероиды. Анализ свойств возбудителей сепсиса показывает, что при всем их морфологическом и биологическом многообразии они обладают рядом общих свойств:
-
выделяют экзотоксины или содержат эндотоксины, к которым имеются рецепторы у клеток, инициирующих генерализованное и местное воспаление, участвующих в активации фагоцитоза, формировании клеточного и гуморального иммунитета;
-
их циркуляция и размножение в крови при сепсисе не контролируется факторами защиты;
Внутриклеточные паразиты (риккетсии, вирусы, малярийные плазмодии и др.) не могут вызывать сепсис, так как обладают выраженным тропизмом к определенным тканям и органам и не вызывают гнойного воспаления.
Эпидемиология
В большинстве случаев сепсис вызывается аутофлорой, однако возможно и экзогенное заражение, например при инвазивных манипуляциях (катетеризация сосудов, мочеиспускательного канала, эндоскопические исследования, инъекции и др.), при нарушении правил асептики и антисептики. В условиях стационара, особенно в котором сосредоточены пациенты из групп риска по сепсису (роддомы, онкогематологические отделения, отделения трансплантологии, ОРИТ, гнойной хирургии и др., где широко применяются иммуносупрессоры - кортикостероиды, цитостатики), возможны обмен флорой, в частности мультирезистентной к антибиотикам, и возникновение групповых заболеваний сепсисом.
Профилактика
Сводится к строгому соблюдению санитарно-гигиенического режима в стационарах, систематической влажной уборке с использованием хлорсодержащих дезинфектантов, кварцеванию помещений, использованию одноразового инструментария, систем для инфузий и т.д., тщательной стерилизации инструментария многоразового использования. Важно ограничение применения антибиотиков широкого спектра действия, не основанного на определении чувствительности выделенной от пациента флоры.
Патогенез
Сепсис вызывается чаще аутофлорой, поэтому входные ворота инфекции - повреждение наружных покровов, инвазивное вмешательство - часто отсутствуют. Первичный очаг, т.е. местный гнойно-воспалительный процесс (фурункул, панариций, флегмона, аппендицит, пневмония, пиелонефрит, холецистит, тромбофлебит, эндокардит и др.), выявляются значительно чаще. При нормальной функции защитных механизмов этот очаг сопровождается преходящей бактериемией (например, при пневмококковой пневмонии бактериемия выявляется у 20% больных), адекватной генерализованной воспалительной реакцией, направленной на локализацию очага инфекции (выпадение фибрина), его санацию (фагоцитоз, выработка специфических антител и др.), которые инициируются комплексом провоспалительных цитокинов, белков ранней фазы, простаноидов, кининов и других биологически активных веществ. При сепсисе по разным причинам (врожденные дефекты в системах защиты, приобретенные иммунодефициты) местный очаг прогрессирует (перфорация аппендикса, желчного пузыря с развитием перитонита, абсцедирование пневмонии и др.) или же происходит генерализация инфекционного процесса, резко возрастает интенсивность бактериемии, она, в отличие от циклически протекающих генерализованных бактериальных инфекций (брюшной тиф, лептоспироз и др.), факторами защиты не контролируется, поэтому интенсивность ее резко возрастает, что сопровождается резкой активацией системной воспалительной реакции. Избыточное количество бактериальных токсинов, цитокинов и других биологически активных веществ приводит к развитию шока, полиорганной недостаточности, фатальному исходу болезни до формирования органных септических очагов. Интенсивность бактериемии (микробная нагрузка), по данным ПЦР, при этом достигает 1×106-8 в/мкл, например при фульминантной менингококкемии, молниеносном стафилококковом сепсисе. При наличии предшествующего иммунодефицита, снижении интенсивности системной воспалительной реакции (СВР), например у больных ВИЧ-инфекцией, уровень неконтролируемой бактериемии значительно ниже, например при стафилококковом сепсисе - 1×103-1×105 в/мкл, поэтому шок, как правило, не развивается. В то же время формируются множественные органные септические очаги (пневмония, эндокардит, менингит, пиелонефрит, абсцессы, флегмоны), приводящие к развитию органной и полиорганной недостаточности и смертельному исходу. Такая динамика септического процесса характерна для острого, затяжного и хронического сепсиса. Эти различия определяют многообразие клинических вариантов течения сепсиса. Важное значение в развитии сепсиса имеют системы гемостаза и фибринолиза. На самом раннем этапе развития сепсиса наблюдается гиперкоагуляция с резким повышением уровня фибриногена, которая сопровождается подавлением фибринолиза. Длительное сохранение гиперкоагуляции при пролонгированном течении сепсиса приводит к локальному внутрисосудистому тромбообразованию и тромбоэмболическим осложнениям, при острейшем и остром течении болезни, особенно при развитии шока, развивается ДВС-синдром, приводящий к коагулопатии потребления, развитию геморрагического синдрома и утрате защитной функции системы гемостаза, направленной на локализацию инфекционного процесса.
При формировании септических очагов выявляются особенности местного воспалительного процесса: доминирование деструктивных процессов (стафилококковая деструкция легких), быстрое образование гнойного экссудата, слабая клеточно-пролиферативная реакция (инфильтрация).
При длительном течении сепсиса, как правило, нарушается гемопоэз, развиваются гипохромная анемия, гипопротеинемия, особенно снижается уровень альбумина вплоть до развития отечно-асцитического синдрома, повышается проницаемость клеточных мембран (синдром генерализованного цитолиза), сопровождающийся выраженным повышением активности в крови цитоплазматических ферментов.
Следует подчеркнуть, что сепсис без бактериемии невозможен, хотя при ряде инфекционных болезней возможно развитие шока, органной недостаточности, летальных исходов. Так, развитие шока возможно при многих бактериальных (брюшной тиф, генерализованный сальмонеллез, рожа, пневмония, дифтерия, лептоспироз, риккетсиозы и др.) инфекциях.
Клиническая картина
Инкубационный период неизвестен. В большинстве случаев сепсис развивается как аутоинфекция. При экзогенном инфицировании инкубационный период длится от нескольких часов до 2-3 сут. Единой классификации сепсиса не существует. Существуют классификации по этиологии, локализации первичного очага, особенностям течения болезни, особенностям контингента больных. Классификация по этиологии имеет важное значение для выбора антибиотика для эмпирической терапии. По локализации первичного очага (миндалины, легкие, печень, почки и т.д.) можно предположить вид возбудителя. Сепсис у разных контингентов (сепсис новорожденных, хирургический, посттравматический, катетерассоциированный, терминальный у реанимационных больных, сепсис у больных ВИЧ-инфекцией и др.) имеет клиническое значение для определения вероятных возбудителей, характеристики особенностей клинического течения, определения тактики комплексной терапии.
По особенностям течения выделяют молниеносный (острейший сепсис) длительностью от нескольких часов до 3 сут, характеризующийся гипертермией, часто геморрагической сыпью, быстрым развитием шока, геморрагического синдрома и полиорганной недостаточности, отсутствием септических очагов.
Острый сепсис (4 сут - 2 нед) характеризуется ЛИС, высыпаниями на коже, развитием у большей части больных шока на 3-5-е сутки, спленомегалией, появлением септических очагов, органной и полиорганной недостаточностью.
Подострый (затяжной) сепсис длится от 3 нед до 3 мес. Характеризуется ЛИС, гепатоспленомегалией, септическими очагами, редко осложняется шоком. Причиной летальных исходов чаще являются органная недостаточность, тромбогеморрагические осложнения, анемия, тяжелые метаболические нарушения.
Хрониосепсис (длительностью более 3 мес) связан с наличием органного очага (эндокардит, пиелонефрит, хроническая пневмония, хронический абсцесс легкого и т.д.).
В целом для сепсиса характерно сочетание септического синдрома: высокой, с большими суточными колебаниями, часто нарушением циркадного ритма температуры тела (пик лихорадки может приходиться на ночные и утренние часы), причем повышение температуры сопровождается выраженным ознобом, а снижение - обильным потоотделением. Характерны резкая слабость (миастения), даже при снижении уровня температуры, анорексия, нарушение сна, заторможенность, сопор, возможны бред и галлюцинации. Как правило, наблюдается выраженная артериальная гипотензия, тахикардия.
Септический синдром сочетается с органопатологией. Наиболее характерны нижеследующие.
-
Сыпь (чаще пустулезная, геморрагическая, пустулезно-геморрагическая).
-
Поражение опорно-двигательного аппарата. Чаще всего наблюдаются гнойные поли- и моноартриты. Наблюдаются также периартриты инфекционно-аллергического генеза с выраженным отеком, гиперемией в области сустава, выраженным болевым синдромом. Возможны остеомиелит, периостит.
-
Лимфатическая система. Лимфоузлы, как правило, не увеличены, за исключением случаев с первичным очагом в виде фурункула, панариция, нагноившейся раны на конечностях, локального тромбофлебита. В этих случаях возможен регионарный лимфаденит, часто с нагноением.
-
Сердечно-сосудистая система. Поражаются сердце, артерии и вены. Чаще всего наблюдается эндокардит митрального и аортального клапана, возможны трех- и четырехклапанные поражения. При остром течении сепсиса часто множественные тромбоэмболии сосудов конечностей (характерные геморрагические некрозы в области ладоней и стоп), гангрена фаланг пальца, мочки уха, носа, тромбоэмболия сосудов сетчатки глаза с нарушением зрения, сосудов головного мозга с появлением очаговой неврологической симптоматики, формированием абсцессов мозга, характерно развитие гнойного менингита. Наблюдаются тромбоэмболии артерий конечностей, тромбоэмболия легочной артерии и др.; перфорация клапанов, отрыв створок с острой сердечной недостаточностью, возможны абсцессы миокарда, особенно у основания клапанов, флегмона. Как правило, токсический миокардит со снижением сократительной функции. Реже - гнойный или фибринозно-гнойный перикардит.
-
Органы дыхания. Частым и характерным поражением является двусторонняя полисегментарная пневмония, которая носит деструктивный характер, инфильтрация легочной ткани выражена слабо, поэтому физикальные данные скудны, нередко пневмония рентгенологически визуализируется поздно при появлении очагов деструкции. Наиболее характерными клиническими признаками являются одышка, цианоз, снижение рО2 артериальной крови. Для ранней диагностики показаны КТ и МРТ грудной клетки. Возможен также гнойный бронхит, эмпиема плевры.
-
Органы пищеварения. Поражаются главным образом при локализации очага в органах брюшной полости (гнойный аппендицит, холецистит, панкреатит, перфорация язвы желудка, кишечника и т.д.). В остальных случаях наблюдается анорексия, обусловленная резким снижением секреции пищеварительных ферментов. Поскольку лечение сепсиса требует массивной антибиотикотерапии, часто наблюдается дисбиоз, сопровождающийся диареей, иногда поражением кишечной стенки с формированием эрозий, язв, кишечными кровотечениями. Как правило, развивается токсический гепатит, сопровождающийся гепатомегалией и нарушением прежде всего белково-синтетической функции печени со снижением уровня альбумина, белков протромбинового комплекса, нарастанием уровня мочевины.
-
Селезенка. Реагирует, как правило, уже в ранние сроки в связи с ее активным участием в септическом процессе, однако сплено-мегалия не всегда выявляется, так как селезенка в первые дни мягкая, плохо выявляется при пальпации. УЗИ также не всегда эффективно, так как селезенка в этот период слабоэхогенна. Нередки инфаркты и абсцессы селезенки.
-
Мочевыводящая система. Почки постоянно участвуют в септическом процессе. Помимо поражения при септическом шоке, поражение почек обусловлено выведением ими возбудителей сепсиса (бактериурия), бактериальных токсинов и аутотоксинов, формированием в почках и мочевыводящих путях септических очагов. Поражаются все отделы нефрона. Результатом этих поражений может быть развитие ОПН, являющееся одной из частых причин летального исхода.
-
Поражение ЦНС проявляется нейротоксикозом, вазогенными поражениями, возможностью при развитии ТГС внутричерепных гематом. Возможно развитие тромбоэмболических поражений, разлитого гнойного менингита.
Лабораторные исследования
В крови характерен нейтрофильный лейкоцитоз со сдвигом влево («септическая кровь»), однако при тяжелом сепсисе, осложненном шоком, нередко - лейкопения, которая сопровождается резкой тромбоцитопенией (менее 20 тыс./мкл). При затяжном течении болезни наблюдается прогрессирующая гипохромная анемия, возможен гемолиз. У большинства больных в крови повышается активность цитоплазматических ферментов (АЛТ, АСТ, ЛДГ, КФК, ЩФ), обусловленная генерализованным цитолизом и непосредственным поражением печени и других органов. Содержание белка в плазме прогрессивно снижается, особенно альбумина, растет уровень мочевины, при поражении почек - креатинина. Изменения в системе гемостаза зависят от особенностей течения болезни. В раннем периоде возможна гиперкоагуляция, подавление фибринолиза. При развитии шока - ДВС-синдром с развитием коагулопатии потребления, резким снижением концентрации фибриногена и прокоагулянтов I фазы и протромбинового комплекса. При развитии тромбоэмболического синдрома резко (в 10-100 раз) повышается концентрация D-ДФ. Следует отметить снижение раО2, метаболический ацидоз. При исследовании мочи отмечается бактериурия, протеинурия. В зависимости от характера поражения почек могут преобладать микрогематурия или лейкоцитурия, увеличивается количество цилиндров.
Диагностика
Подозрение на сепсис возникает при наличии у больного высокой лихорадки, сопровождающейся ознобами и потами, выраженной интоксикацией. Важно, но не обязательно наличие первичного очага или входных ворот возбудителя. Наличие двух или более признаков СВР не является надежным диагностическим критерием сепсиса, так как признаки СВР наблюдаются при многих других болезнях бактериальной этиологии. В то же время явный очаг инфекции нередко отсутствует при сепсисе (пневмококковая, гемофильная септицемия).
Для лабораторного подтверждения используют определение уровня прокальцитонина, который при сепсисе превышает 1,1 нг/мл, однако этот тест отражает тяжесть течения инфекционного процесса и бывает положительным при многих тяжелых инфекциях. В то же время он является надежным маркером эффективности антибактериальной терапии и снижается в этих случаях до нормы в течение 1-3 сут.
Основу лабораторной диагностики сепсиса составляют специфические методы, позволяющие установить наличие возбудителя в крови и других субстратах и идентифицировать его. Бактериологическое исследование крови, мочи, СМЖ, содержимого септического очага позволяет получить культуру возбудителя, определить его чувствительность к антибактериальным средствам, проводить мониторинг динамики чувствительности возбудителей сепсиса к антибактериальным препаратам.
ПЦР-диагностика в настоящее время выходит на первое место, так как обладает 100% специфичностью, позволяет идентифицировать возбудителя на фоне антибактериальной терапии, в ранние сроки определить ее эффективность по снижению микробной нагрузки в крови. Результаты исследования могут быть получены через несколько часов при использовании индивидуальных тест-систем. Недостатком метода является невозможность определения чувствительности (кроме метициллинчувствительности стафилококка) возбудителя к антимикробным средствам.
Дифференциальная диагностика проводится со всеми острыми лихорадочными заболеваниями, сопровождающимися ознобами, потами, выраженной интоксикацией, спленогепатомегалией, особенно при наличии локальных гнойно-воспалительных очагов.
Лечение
При подозрении на сепсис показана экстренная госпитализация в зависимости от локализации первичного очага, доминирования определенной органопатологии в соответствующее отделение многопрофильной больницы, при наличии шока - в ОРИТ, при отсутствии явного первичного очага и входных ворот, доминировании септического синдрома - в инфекционное отделение (стационар). В остром периоде - строгий постельный режим. Специальной диеты не требуется. В тяжелых случаях показана сбалансированная парентеральная нутритивная поддержка [растворы декстрозы (Глюкоза♠), аминокислот, жировые эмульсии].
Основу лечения сепсиса составляет антибактериальная терапия, которая при отсутствии сведений о чувствительности возбудителя проводится с учетом наличия или отсутствия первичного очага, его локализации, условий заражения (внебольничный, внутрибольничный сепсис). Используются препараты широкого спектра действия: защищенные пенициллины, ЦС III-IV поколения, фторхинолоны II-IV поколения, меропенем, имипенем, дорипенем, линезолид, тигециклин, ванкомицин. Антибиотики вводятся внутривенно в максимальных суточных дозах с минимальными интервалами капельно до появления признаков купирования бактериемии: прекращения ознобов и потов, снижения уровня или нормализации температуры, отсутствия новых очагов инфекции, уменьшения интоксикации. Для санации очагов целесообразно максимально (для данного препарата) увеличить разовую дозу и интервалы между их введением. Продолжительность лечения составляет не менее 3 нед. Отмена возможна при санации септических очагов, стойкой (7-10 сут) нормализации температуры тела.
Замена препаратов на альтернативные целесообразна при отсутствии клинического эффекта в течение 3-5 сут, в более ранние сроки - при прогрессировании заболевания (нарастание лихорадки, интоксикации, появление признаков шока, новых септических очагов). С первых дней целесообразно назначение пробиотиков, антимикотических препаратов. Важным аспектом является применение препаратов человеческого иммуноглобулина, содержащих или обогащенных IgМ [иммуноглобулин человека нормальный [IgG + IgM + IgA] (Пентаглобин♠), иммуноглобулин человека нормальный (Иммуноглобулин человека нормальный♠)]. В ряде случаев эффективно применение полибактериофагов (полифаг, пиофаг), а при установлении возбудителя - монофагов. Преимущество бактериофагов состоит в том, что они не взаимодействуют с макроорганизмом и не вызывают побочных эффектов. При наличии доступных гнойных очагов необходимо хирургическое вмешательство. Различные аспекты патогенетической терапии решаются индивидуально.
Прогноз
Прогноз при сепсисе серьезный. Даже при своевременной адекватной терапии летальность составляет от 20% и выше, нелеченый (недиагностированный) сепсис всегда заканчивается летальным исходом.
Дифтерия
Дифтерия (diphtheria, удушающая болезнь) - острая антропонозная инфекционная болезнь с аэрозольным механизмом передачи возбудителя, характеризующаяся преимущественным поражением ротоглотки и дыхательных путей с развитием местного фибринозного воспаления и токсическим поражением сердечно-сосудистой системы, нервной системы и почек.
Коды по МКБ-10
А36 Дифтерия.
А36.0 Дифтерия глотки.
А36.1 Дифтерия носоглотки.
А36.2 Дифтерия гортани.
А36.3 Дифтерия кожи.
Этиология
Corynebacterium diphtheriae (род Corynebacterium, семейство Corynebacteriaceae) - не образующая спор грамположительная палочка булавовидной формы.
Corynebacterium diphtheriae растет только на специальных питательных средах (наиболее распространена теллуритовая среда). По своим биологическим свойствам коринебактерии дифтерии разделяются на три биовара: mitis, gravis и близкий к нему intermedius. Основной фактор патогенности возбудителя - экзотоксин. Нетоксигенные штаммы заболевания не вызывают. Дифтерийный экзотоксин обладает термолабильностью, высокой токсичностью, иммуногенностью, нейтрализуется антитоксической сывороткой.
Дифтерийная палочка устойчива в окружающей среде: в дифтерийных пленках, на предметах домашнего обихода, в трупах сохраняется около 2 нед; в воде, молоке - до 3 нед. Под воздействием дезинфицирующих средств в обычных концентрациях гибнет в течение 1-2 мин, при кипячении - мгновенно.
Эпидемиология
Актуальность проблемы заключается в постоянной циркуляции токсигенных штаммов в человеческой популяции.
Источник возбудителя - больные любой клинической формой дифтерии, а также бактерионосители токсигенных штаммов. Основной путь передачи возбудителя - воздушно-капельный, возможен контактно-бытовой (при дифтерии кожи, половых органов, глаз), в редких случаях - алиментарный (молоко). Восприимчивость к дифтерии всеобщая, но у части людей инфекционный процесс протекает в форме бессимптомного носительства.
Иммунитет при дифтерии антитоксический и антибактериальный. Возможны повторные заболевания и заболевания у вакцинированных антидифтерийным анатоксином, протекающие чаще в легкой форме.
Наиболее интенсивный источник возбудителя - больные люди. Носители опасны в связи с их большей по сравнению с больными численностью, отсутствием клинических симптомов, активным образом жизни. Особенно опасны носители, страдающие респираторными инфекциями, при которых активизируется механизм передачи возбудителя. Средняя продолжительность носительства около 50 дней (иногда больше). Число носителей токсигенных коринебактерий в сотни раз превышает количество больных дифтерией. В очагах дифтерии носителями могут быть до 10% и более внешне здоровых лиц. Дифтерию относят к управляемым инфекциям, т.е. заболеваемость высока в том случае, если не проводилась массовая вакцинация населения.
Меры профилактики
Специфические. Иммунопрофилактика - основной метод борьбы с дифтерией. Плановую вакцинацию и ревакцинацию населения, согласно национальному календарю прививок, проводят вакцинами, содержащими адсорбированный дифтерийный анатоксин (АКДС, АКДС-М, АДС-М, АД-М).
Неспецифические: раннее выявление и изоляция больных и носителей токсигенных коринебактерий, выписка их после двукратного отрицательного результата бактериологического исследования отделяемого ротоглотки. В коллективе после изоляции больного в течение 7 сут проводят термометрию и ежедневный врачебный осмотр. Контактных с больными и носителями однократно обследуют бактериологически. В очаге инфекции после изоляции больного или носителя проводят заключительную дезинфекцию.
Патогенез
Дифтерийный экзотоксин - первичный поражающий фактор при дифтерии. Тяжелые формы дифтерии у отдельного индивидуума развиваются только при отсутствии или низком титре антитоксических антител. Проникший в кровь токсин взаимодействует с клеткой посредством связывания с цитоплазматическими рецепторами. Дифтерийный токсин поражает клетки-мишени: кардиомиоциты, олигодендроглиоциты, лейкоциты. Экзотоксин блокирует карнитин-челночный механизм, который имеет универсальное значение в системе метаболизма. Вследствие блокады карнитин-челночного механизма токсином нарушаются магистральные пути обмена белков (аминокислот), жиров и углеводов, что может привести к гибели клетки. Внутриклеточный ацидоз и высокое содержание жирных кислот вызывают активацию перекисного окисления липидов.
Многофакторность поражения различных органов и систем в клинической практике проявляется развитием ряда синдромов.
Основные причины смерти при дифтерии - поражение сердца, паралич дыхательной мускулатуры, асфиксия при дифтерии дыхательных путей, ДВС-синдром с развитием ОПН и/или РДС взрослых и вторичная бактериальная инфекция (пневмония, сепсис).
Клиническая картина
Инкубационный период 2-12 (чаще 5-7) сут.
Классификация
Дифтерию классифицируют по локализации процесса и тяжести течения болезни. Самые частые формы - дифтерия ротоглотки (зева) и дыхательных путей. Возможна также дифтерия носа, глаз, уха, половых органов, кожи и ран.
Основные симптомы и динамика их развития
Дифтерия ротоглотки характеризуется наличием на миндалинах пленчатых налетов, которые могут распространяться за пределы миндалин на нёбную занавеску, язычок, мягкое и твердое нёбо, десны. Налеты имеют равномерную белую или серую окраску, расположены на поверхности миндалин («плюс ткань»), с усилием снимаются шпателем, при этом обнажается эрозированная кровоточащая поверхность. Налеты не растираются, не тонут и не растворяются в воде.
Катаральная форма дифтерии ротоглотки диагностируется очень редко на основании эпидемиологических, клинических и бактериологических данных, когда налеты отсутствуют, есть лишь легкая гиперемия и отечность миндалин.
Дифтерию ротоглотки в зависимости от характера налетов разделяют на следующие формы:
Возможно формирование налетов на слизистой оболочке щек после химического ожога, на ранке после экстракции зуба и прикуса языка. По тяжести течения эти формы относят к легкой дифтерии, для которой характерны острое начало с повышения температуры тела до 37,5-38,5 °С, общего недомогания, боли в горле (незначительной или умеренной). Налеты появляются через сутки, на 2-й день приобретают характерный вид. При осмотре отмечают бледность лица, умеренную гиперемию миндалин с синюшным оттенком. Поднижнечелюстные ЛУ, как правило, не увеличены, безболезненны при пальпации. Лихорадка длится до 3 сут. Без лечения налеты сохраняются до 6-7 дней. При легких формах дифтерии ротоглотки (локализованная и распространенная) возможен отек только миндалин.
Токсические формы дифтерии. Наличие отека ротоглотки дает основание диагностировать токсическую форму дифтерии, которая протекает в среднетяжелой и тяжелой форме. Тяжесть течения обусловлена степенью выраженности основных синдромов, прежде всего степенью функциональных изменений различных органов и систем во все периоды болезни. Выраженность отека слизистой ротоглотки и шейной клетчатки - один из признаков, характеризующих тяжесть течения дифтерии.
Субтоксическая и токсическая дифтерия ротоглотки I степени чаще имеет среднетяжелое течение. Эти формы отличаются более выраженной общей интоксикацией, более высокой (до 39 °С) и длительной лихорадкой, выраженной астенией, тахикардией, более сильными болями в горле. Налеты на миндалинах распространенные. Миндалины отечны, ярко гиперемированы. Отек шейной клетчатки локализуется при субтоксическом варианте в подчелюстной области, а при токсической дифтерии I степени - распространяется до середины шеи.
Токсическая дифтерия II, III степени и гипертоксическая дифтерия характеризуются быстрым развитием общей интоксикации, ознобом, повышением температуры тела до 40 °С и выше, резкой мышечной слабостью, головной болью, сильными болями в горле. При осмотре выявляют бледность кожи, выраженный отек шейной клетчатки, распространяющийся при токсической дифтерии II степени до ключиц, при III степени - ниже ключиц на грудную клетку. Отек тестоватой консистенции, безболезненный. Поднижнечелюстные ЛУ умеренно болезненны, значительно увеличены, контуры их из-за отека и периаденита нечеткие. При осмотре слизистой ротоглотки обнаруживают диффузную гиперемию и резкую отечность миндалин, которые могут смыкаться по средней линии, что затрудняет дыхание, глотание, придает голосу носовой оттенок. Налеты в первые сутки могут иметь вид белесоватой паутинки, на 2-3-й день болезни приобретают характерный вид, причем у этой категории больных пленки плотные, распространенные, выходят за переделы миндалин, образуют складки.
При гипертоксической дифтерии на 2-3-й день болезни развиваются ИТШ и полиорганная недостаточность. Для геморрагического варианта характерно пропитывание налетов кровью, из-за чего они приобретают багровую окраску. Наблюдают также кровоизлияния в зоне отека, носовые кровотечения и другие проявления геморрагического синдрома.
При тяжелом течении болезни лихорадка и интоксикация сохраняются до 7-10 сут, налеты отторгаются в еще более поздние сроки, оставляя после себя эрозированную поверхность.
Дифтерия дыхательных путей (дифтерийный круп) - частая форма болезни. Дифтерийный круп может быть локализованным (дифтерия гортани), распространенным (дифтерия гортани и трахеи) и нисходящим, когда процесс распространяется на бронхи и бронхиолы. Тяжесть течения этой формы болезни определяется степенью стеноза.
Болезнь начинается с небольшого повышения температуры тела, появления сухого, «лающего» кашля, охриплости голоса, переходящей в афонию. В течение 1-3 сут процесс прогрессирует, появляются признаки стеноза гортани: шумный вдох, сопровождающийся втяжением эпигастральной области, межреберий, над- и подключичных ямок, яремной ямки. Через несколько часов - 2-3 сут присоединяются признаки ДН: двигательное беспокойство, бессонница, цианоз, бледность кожи, тахикардия, повышение АД, сменяющиеся заторможенностью, судорогами, артериальной гипотензией. При исследовании крови выявляют нарастающую гипоксемию, гиперкапнию, респираторный ацидоз. У взрослых из-за широкого просвета гортани такие симптомы, как афония и стенотическое дыхание, могут отсутствовать, процесс развивается медленно. Признаки ДН проявляются на 5-6-й день болезни. Локализованный и распространенный круп часто выявляют только при ларингоскопии - обнаруживают дифтерийные пленки на голосовых связках. Пленки легко снимаются и могут быть удалены электроотсосом.
Дифтерия носа - третья по частоте форма болезни. Начинается постепенно. Температура тела нормальная или субфебрильная. Отмечают сукровичные или слизисто-гнойные выделения, чаще односторонние, появляется мацерация кожи у входа в нос, при риноскопии выявляют эрозии, корки, фибринозные пленки в носовых ходах, которые могут распространяться на кожу, слизистую оболочку гайморовых пазух. В редких случаях возникает отек лица.
Дифтерия глаз. Процесс обычно односторонний. Характерен отек век, сужение глазной щели, гнойно-сукровичное отделяемое. На переходной складке конъюнктивы появляется фибринозная пленка, которая может распространяться на глазное яблоко. Возможен отек мягких тканей в области глазницы.
Дифтерия половых органов встречается у девочек. Характерны отечность вульвы, выделения. Фибринозные пленки локализуются в области малых губ и входа во влагалище.
Дифтерия кожи и ран встречается преимущественно в тропиках, характеризуется наличием поверхностной малоболезненной язвы, покрытой фибринозной пленкой. Общее состояние нарушается мало; течение вялое, до 1 мес. При токсической форме вокруг раны выражена отечность кожи и мягких тканей. Характерны общие проявления токсикоза и токсическое поражение сердца, почек, НС.
Комбинированная дифтерия. Чаще всего наблюдается сочетание дифтерии ротоглотки с дифтерией дыхательных путей и носа, реже глаза и половых органов.
Для тяжелых токсических форм дифтерии характерно поражение различных органов и систем. В клинической практике целесообразно выделять несколько клинических синдромов.
Синдром местных проявлений (отек подкожной клетчатки, распространенные фибринозные налеты и др.) описан выше.
Интоксикационный синдром наблюдают у всех больных токсическими формами дифтерии.
Синдром токсико-метаболического шока. При особо тяжелом течении дифтерии (фульминантная форма) и выраженной интоксикации у 3-7% больных развивается токсико-метаболический шок. Он характеризуется тяжелым ДВС-синдромом (проявляющимся не только лабораторными изменениями, но и клиническими симптомами), выраженной гиповолемией, ОДН и ОПН, нарушением сократимости и проводимости миокарда и поражением черепных нервов.
Синдром ДН при тяжелой дифтерии может быть обусловлен следующими основными причинами: ИТШ, стенозом гортани, частичной непроходимостью верхних дыхательных путей (отек надгортанника, выраженный отек ротоглотки с дисфункцией мягкого нёба, западение корня языка, преимущественно у алкоголиков, аспирация пленки в трахею), нисходящим крупом, быстрым внутривенным введением больших доз противодифтерийной сыворотки (ПДС) с развитием РДС, обструктивным бронхитом и тяжелой пневмонией, полинейропатией с поражением диафрагмы и вспомогательных дыхательных мышц.
Стеноз гортани и нисходящий круп - наиболее частые причины летального исхода при дифтерии (особенно в первые 10 дней болезни).
ДВС-синдром наблюдают при токсической дифтерии. Клинические признаки ДВС-синдрома при тяжелых формах регистрируют примерно в 15% случаев. Развитие сывороточной болезни усугубляет течение ДВС-синдрома.
Синдром поражения миокарда. Сердце страдает в результате непосредственного действия экзотоксина.
Клинические проявления синдрома складываются из кардиальных жалоб, синдрома сердечной недостаточности и физикальных данных. Кардиальные жалобы непостоянны и не отражают тяжести поражения сердца. При обследовании наибольшее значение имеет выявление аритмии и дефицита пульса, бледности или цианоза. Для более точной и ранней оценки миокарда необходимы данные ЭКГ, УЗИ, исследование активности кардиоспецифических ферментов.
Критерии, определяющие тяжелое поражение миокарда с неблагоприятным прогнозом: прогрессирующая сердечная недостаточность преимущественно по правожелудочковому типу (по клиническим данным); выраженные нарушения проводимости; уменьшение фракции выброса левого желудочка менее 40% (по данным УЗИ); выраженное повышение или, наоборот, относительно низкие показатели активности кардиоспецифических ферментов; развитие в поздние сроки болезни частых приступов тахиаритмии и фибрилляции желудочков.
Синдром поражения миокарда при тяжелой дифтерии выявляют постоянно, в сочетании с другими синдромами это наиболее частая причина летального исхода при тяжелых формах дифтерии ротоглотки.
Синдром поражения ПНС проявляется в виде пареза и полинейропатии.
Парез (паралич) черепных нервов при токсических формах дифтерии выявляют примерно в 30% наблюдений. Возникают гнусавость голоса и поперхивание при приеме жидкой пищи. Эти изменения регистрируют как в начальном периоде (3-16-е сутки), так и в более поздние сроки (после 30-х суток) болезни. Поражение других пар черепных нервов (III, VII, X, XII) встречается реже, возникает парез (паралич) мышц глотки, языка, мимической мускулатуры, нарушается кожная чувствительность.
Полинейропатия развивается примерно в 18% случаев, проявляется парезом или параличом конечностей, диафрагмы, межреберных нервов. Полинейропатия возникает, как правило, после 35-40-го дня болезни. Выявляют периферический парез (паралич). Больные предъявляют жалобы на мышечную слабость, нарушение чувствительности, онемение пальцев, нарушение походки или невозможность ходьбы, чувство нехватки воздуха, одышку. Поражение конечностей всегда появляется раньше дыхательных расстройств, а восстанавливается раньше функция дыхательной мускулатуры.
Синдром поражения почек («токсический нефроз»). При тяжелом течении заболевания поражение почек проявляется микрогематурией, лейкоцитурией, цилиндрурией, протеинурией.
При развитии ОПН у больных наблюдают олигоанурию, повышение уровня мочевины, в меньшей степени креатинина и калия в плазме крови. Большее повышение уровня мочевины по сравнению с уровнем креатинина связано с высокой активностью катаболических процессов.
Осложнения. Чаще всего регистрируют пневмонию, бронхит, инфекцию МВП; абсцесс миндалин, перитонзиллярный абсцесс.
Летальность и причины смерти
При тяжелых формах дифтерии летальность составляет 10-70%. Основные причины смерти - поражение сердца, паралич дыхательной мускулатуры, асфиксия при дифтерии дыхательных путей, ИТШ, а также вторичные бактериальные осложнения.
Диагностика
Диагноз дифтерии, независимо от локализации процесса, устанавливают на основании наличия на слизистых оболочках или коже фибринозной пленки, обладающей характерными свойствами. При распространенной и токсических формах большое диагностическое значение имеет распространение налетов за пределы миндалин, отек миндалин, а при токсических формах - отек мягких тканей.
Для подтверждения диагноза важны данные микробиологического исследования мазков с пораженной поверхности (слизистая оболочка миндалин, носа и др.). После выделения культуры возбудителя определяют ее токсигенные и биологические свойства.
Дифференциальная диагностика
Локализованную дифтерию ротоглотки дифференцируют от всех болезней, протекающих с синдромом острого тонзиллита.
В практике наиболее трудна дифференциальная диагностика между лакунарной ангиной и локализованной дифтерией ротоглотки.
При токсической дифтерии дифференциальную диагностику проводят с паратонзиллярным абсцессом, эпидемическим паротитом, флегмоной дна полости рта (флегмона Людвига), химическими ожогами.
Дифтерию дыхательных путей дифференцируют от крупа при ОРВИ: характерны катаральные явления, отсутствие афонии. У взрослых часто ошибочно диагностируют бронхит, пневмонию, астматическое состояние, инородное тело в гортани. Важна своевременная ларингоскопия.
Лечение
Все больные с подозрением на дифтерию подлежат госпитализации и изоляции.
Режим и диета. В остром периоде болезни и в более поздние сроки при наличии признаков поражения сердца и нервной системы показан постельный режим. В зависимости от состояния больного используют стол № 10, зондовое или парентеральное питание.
Медикаментозная терапия
Основное средство лечения - ПДС, которая нейтрализует дифтерийный токсин, циркулирующий в крови (поэтому она эффективна только в первые 2 сут). После 3-х суток болезни введение ПДС малоэффективно. При легком течении заболевания (локализованная, распространенная форма) сыворотку вводят только при отрицательных результатах кожной пробы. При среднетяжелой и тяжелой форме дифтерии ротоглотки, а также при дифтерии дыхательных путей сыворотку вводят обязательно. При положительной кожной пробе сыворотку вводят в отделении реанимации после предварительного введения 60-90 мг преднизолона и антигистаминных препаратов. Доза сыворотки и путь введения зависят от тяжести течения болезни (табл. 16-19). Сыворотку вводят однократно внутримышечно и внутривенно. При комбинированных формах дозу увеличивают на 20-30 тыс. ME.
| Форма дифтерии | Доза сыворотки, тыс. ME |
|---|---|
Локализованная дифтерия ротоглотки, носа, глаза, кожи, половых органов |
10-20 |
Распространенная дифтерия ротоглотки |
20-30 |
Субтоксическая дифтерия ротоглотки |
30-40 |
Токсическая дифтерия I степени |
30-50 |
Токсическая дифтерия II степени |
50-60 |
Токсическая дифтерия III степени, гипертоксическая дифтерия |
60-80 |
Локализованная дифтерия органов дыхания |
10-20 |
Распространенная нисходящая дифтерия органов дыхания |
20-30 |
Повторное введение сыворотки и повышение дозы не показаны, так как антитела длительно циркулируют в крови, и концентрация их выше необходимой для нейтрализации токсина, приводит к учащению и утяжелению поражения сердца и нервной системы, а также к сывороточной болезни. Чрезвычайно отрицательно сказывается на состоянии больных введение массивных доз сыворотки (1 млн МЕ и более), так как при этом в организм попадает огромное количество чужеродного белка, который блокирует почки, провоцирует развитие РДС и ИТШ, ДВС-синдрома.
При средней тяжести и тяжелых формах, а также при дифтерии дыхательных путей для скорейшего подавления возбудителя назначают антибиотики: пенициллины, ЦС, препараты тетрациклинового ряда, макролиды, комбинированные препараты [ампициллин + оксациллин (Ампиокс♠)] - в средних терапевтических дозах в течение 5-8 сут. Проводят дезинтоксикационную терапию. В тяжелых случаях показан плазмаферез. Кратковременное применение глюкокортикоидов целесообразно только по экстренным показаниям (ИТШ, стеноз гортани).
При дифтерии дыхательных путей показаны тепловые и отвлекающие процедуры, ингаляция, антигистаминные препараты, глюкокортикоиды, оксигенотерапия. При прогрессировании стеноза - интубация трахеи или трахеостомия. При нисходящем крупе оперативное лечение малоэффективно, его необходимо дополнять санационной бронхоскопией для удаления пленок.
При миокардите необходим полный покой. Применяют карнитин. При полинейропатии назначают постельный режим, полноценное питание, нейротропные препараты, повторные сеансы плазмафереза, при дыхательных расстройствах - ИВЛ, профилактику вторичной инфекции.
Прогноз
Прогноз при раннем введении ПДС благоприятный. Летальный исход чаще возникает при поздней госпитализации и у лиц с отягощенным преморбидным фоном (алкоголизм, иммунопатии).
Гемофильная инфекция
Гемофильная инфекция - острая антропонозная инфекционная болезнь с аэрозольным механизмом передачи возбудителя, которая характеризуется преимущественным поражением респираторного тракта и оболочек мозга.
Коды по МКБ-10
А41.3 Септицемия, вызванная Haemophilus influenzae (палочка Афанасьева-Пфейффера).
J14 Пневмония, вызванная Haemophilus influenzae.
Этиология
Возбудитель - бактерия Haemophilus influenzae (H. influenzae, син. - палочка Пфейффера). Гемофильная палочка рода Haemophilus (семейства Pasteurellaceae) - мелкая коккобацилла, может иметь полисахаридную капсулу. В окружающей среде неустойчива. Имеет К- и О-антигены. По капсульному антигену выделяют шесть сероваров (а, b, c, d, e, f), из которых для человека наиболее патогенен H. influenzae типа b (Hib). Основные факторы патогенности - капсула и пили. Дополнительные факторы патогенности - IgA-протеазы, расщепляющие секреторные Ig. Возбудитель также содержит липополисахаридный и гликопротеиновый комплекс. H. influenzae малоустойчива в окружающей среде. Гибнет в течение 30 мин при температуре 55 °С, под воздействием солнечных лучей и при высыхании. Дезинфицирующие растворы в обычно применяемых на практике концентрациях убивают Н. influenzae через несколько минут.
Эпидемиология
Источник инфекции - больные любой клинической формой Hib-инфекции, а также здоровые носители. Частота носоглоточного носительства гемофилов может достигать 90%, но капсульные штаммы Hib, с которыми связаны почти все случаи болезни, обнаруживают только у 3-5% обследованных. Основной путь передачи возбудителя - воздушно-капельный; возможен также контактный путь. Восприимчивость человека изучена плохо. Вероятность заражения у детей от 3 мес до 5 лет в 6000 раз выше, чем в других возрастных группах. Основная регистрируемая форма гемофильной инфекции - Hib-менингит. Заболеваемость неинвазивными формами гемофильной инфекции, по оценкам, в 5-10 раз выше.
Профилактика специфическая. Применяют вакцины согласно национальному календарю профилактических прививок.
Патогенез
Входные ворота инфекции - слизистая оболочка верхних дыхательных путей, где возбудитель может длительно бессимптомно персистировать. С этой локализацией возбудителя связаны ОРЗ, эпиглоттит, отит, синусит. При нарушении или неполноценности механизмов защиты капсульные штаммы возбудителя преодолевают барьер слизистой оболочки и попадают в кровь. Бактериемия приводит к развитию септицемии (может осложняться ИТШ), артрита, остеомиелита и менингита в результате проникновения возбудителя через ГЛБ. При этом защитные ресурсы организма ограничиваются фагоцитозом, что и объясняет высокую летальность (свыше 50%) в отсутствие адекватной терапии. Гемофильный менингит (Hib-менингит) - наиболее типичная и частая форма Hib-инфекции. В развитии болезни выявляют три фазы: фазу респираторной инфекции; бактериемию (частота выделения гемокультуры свыше 60%); фазу менингита.
Клиническая картина
Инкубационный период - от 2 до 4 дней. Единой классификации Hib-инфекции нет. Целесообразно выделять бессимптомное носительство, локализованные [ОРЗ (ринофарингит), ОРЗ, осложненное синуситом, отитом, флегмона, целлюлит] и генерализованные (инвазивные) формы болезни (эпиглоттит, пневмония, септицемия, менингит, остеомиелит, артрит).
ОРЗ, вызванные Haemophilus influenzae, существенно не отличаются от ОРЗ другой этиологии, но часто осложняются отитом и синуситом.
Эпиглоттит - воспаление надгортанника, тяжелая форма Hib-инфекции. Чаще наблюдают у детей 2-7 лет. Начало острое: озноб, высокая лихорадка, слюнотечение. В течение нескольких часов нарастают симптомы ДН (инспираторная одышка, тахикардия, стридор, цианоз, втяжение податливых участков грудной клетки). Больные занимают вынужденное положение. Возможно развитие септицемии, менингита.
Флегмона. Наблюдают у детей до 1 года, наиболее частая локализация - голова и шея. Клинической картиной может напоминать рожу. Возможны бактериемия и менингит.
Целлюлит также наблюдают у детей до 1 года; чаще локализуется на лице и шее. Часто развивается на фоне ринофарингита. В области щеки или вокруг глазницы, на шее появляются гиперемия с синюшным оттенком и отечность кожи. Общая интоксикация не выражена, но могут присоединиться отит, менингит и пневмония.
Пневмония. Клиническая картина не отличается от пневмококковой пневмонии. Может осложняться менингитом, плевритом, септицемией.
Септицемия. Чаще наблюдают у детей до 1 года. Характеризуется гипертермией, часто геморрагической сыпью, развитием ИТШ.
Остеомиелит, артрит обычно развиваются на фоне септицемии.
Менингит, вызванный гемофильной палочкой типа b (Hib-менингит), занимает 3-е место по частоте встречаемости в этиологической структуре бактериальных менингитов, составляя от 5 до 25%.
Имея много общих черт с другими видами бактериального менингита, Hib-менингит отличается рядом существенных клинико-патогенетических особенностей, которые необходимо учитывать при ранней диагностике и выборе оптимальной тактики этиотропной и патогенетической терапии.
Hib-менингит поражает преимущественно детей в возрасте до 5 лет (85-90%). Часто (10-30%) болеют и дети до 1 года, включая первый месяц жизни. На долю детей старше 5 лет и взрослых приходится 5-10% заболевших. У большинства больных Hib-менингит развивается на отягощенном преморбидном фоне (органические поражения ЦНС, отягощенное течение второй половины беременности и родов, частые респираторные инфекции в анамнезе, нарушения в иммунной системе). У детей старше 5 лет и взрослых существенное значение имеют врожденные и приобретенные анатомические дефекты (spina bifida), назальная ликворея.
Болезнь чаще начинается подостро: с кашля, насморка, повышения температуры тела до 38-39 °С. У некоторых больных в начальном периоде могут доминировать диспепсические расстройства. Этот период длится от нескольких часов до 2-4 сут, затем состояние ребенка ухудшается: усиливаются симптомы интоксикации, температура достигает 39-41 °С, усиливается головная боль, присоединяются рвота, менингеальные симптомы, расстройства сознания, судороги, а через 1-2 дня - очаговые симптомы. При остром начале болезни катаральные явления могут отсутствовать. Болезнь в этих случаях начинается с быстрого повышения температуры тела до 39-40 °С, головной боли, рвоты. Отчетливые менингеальные симптомы появляются на 1-2-й день болезни.
Лихорадка чаще ремиттирующая или неправильная, регистрируется даже на фоне антибактериальной терапии, длительностью от 3-5 до 20 сут (в среднем 10-14) и более. Уровень лихорадки выше, чем при бактериальных менингитах другой этиологии. Сыпь возможна в отдельных случаях. Катаральные явления в форме фарингита обнаруживают более чем у 80% больных, ринита - более чем у 50% больных. Реже отмечают бронхит, у отдельных больных - пневмонию. Часто увеличены селезенка и печень, что свидетельствует о бактериемии. Заторможенность, адинамия, быстрая истощаемость характерны для большинства больных. Реже развивается сопор, в отдельных случаях - кома. На фоне дегидратационной и адекватной антибактериальной терапии сознание полностью восстанавливается в сроки от 4-6 ч до 2-3 сут. Выраженную картину отека мозга наблюдают примерно у 25% больных, но признаки дислокации мозга (кома, генерализованные судороги, расстройства дыхания) обнаруживают редко. Очаговую неврологическую симптоматику выявляют не менее чем у 50% больных. Чаще отмечают парезы черепных нервов, ухудшение слуха, фокальные судороги, атаксию, нарушения мышечного тонуса по экстрапирамидному типу, реже - парезы конечностей.
Менингеальный синдром (в частности, выбухание родничка, симптом подвешивания) выражены умеренно. Ригидность мышц затылка, как правило, характерна для детей старше 1 года, а симптомы Брудзинского и Кернига у части больных слабо выражены или отсутствуют. Картина СМЖ характеризуется умеренным нейтрофильным или смешанным плеоцитозом, небольшим повышением уровня белка. Содержание глюкозы в первые 1-2 дня варьирует от резкого снижения до повышения уровня, после 3-го дня - менее 1 ммоль/л или глюкоза не определяется, до 10-20 ммоль/л повышается уровень лактата.
Картина крови отличается слабо или умеренно выраженным лейкоцитозом. У большинства больных - абсолютная лимфопения (до 300-500 клеток в 1 мкл), а также тенденция к уменьшению количества эритроцитов и гемоглобина.
Диагностика
Клиническая диагностика любых форм Hib-инфекции, кроме эпиглоттита, ориентировочная, так как Hib - наиболее частый его возбудитель. Диагноз Hib-инфекции устанавливают на основании выделения гемокультуры возбудителя и культуры из патологических секретов (СМЖ, гной, плевральный выпот, мокрота, мазки из носоглотки). В последнем случае диагностическое значение имеет только выделение капсульных штаммов. Для диагностики менингита применяют также бактериоскопию, РЛА СМЖ, посев и ПЦР, а также посев и ПЦР крови.
Дифференциальная диагностика
Эпиглоттит дифференцируют от дифтерии верхних дыхательных путей, крупа при ОРВИ и инородного тела в гортани. Другие формы Hib-инфекции отличают на основании результатов лабораторных исследований.
Hib-менингит дифференцируют от других видов бактериального, вирусного менингита, менингизма при острых лихорадочных заболеваниях.
ЛЕЧЕНИЕ
Показания к госпитализации
Клинические: наличие менингеального синдрома, ДН, стеноза гортани, местных гнойно-воспалительных процессов (флегмона, целлюлит, артрит, остеомиелит).
Режим - постельный.
Диета
Стол № 13. При эпиглоттите - стол № 1А, парентеральное или зондовое питание.
Медикаментозная терапия
Этиотропная терапия генерализованных форм болезни представлена в табл. 16-20.
| Препарат | Суточная доза, мг/кг | Кратность введения, раз | Путь введения |
|---|---|---|---|
Препараты первого ряда |
|||
Хлорамфеникол |
25-50, при менингите - 80-100 |
3-4 |
Внутривенно, внутримышечно |
Амоксициллин + клавулановая кислота |
30 |
3-4 |
Перорально, внутривенно |
Цефотаксим |
50-100, при менингите - 200 |
4 |
Внутривенно, внутримышечно |
Цефтриаксон |
20-80, при менингите - 100 |
1-2 |
Внутривенно, внутримышечно |
Препараты второго ряда |
|||
Меропенем |
30, при менингите - 120 |
3 |
Внутривенно |
Ципрофлоксацин** |
20, при менингите - 30 |
2 |
Перорально, внутривенно |
* Ампициллин в настоящее время не рекомендуется, так как более 30% штаммов Hib к нему резистентны.
** Детям назначается комиссионно по витальным показаниям.
Пример формулировки диагноза
А41.3 Септицемия, вызванная Hib, гнойный менингит, ОНГМ.
Длительность лечения не менее 7-10 сут.
Для лечения локализованных форм также применяют:
Патогенетическую терапию назначают, основываясь на клинических показаниях, и проводят по общим правилам. При менингите показана дегидратационная терапия (фуросемид, ацетазоламид в средних терапевтических дозах; дексаметазон в дозе 0,25-0,5 мг/к в сутки внутривенно или внутримышечно).
При ОНГМ применяют ИВЛ, оксигенотерапию, противосудорожные средства.
При остром эпиглоттите показаны интубация трахеи, петлевые диуретики, глюкокортикоиды, антигистаминные препараты.
При местных нагноительных процессах (флегмона, остеомиелит) используют хирургические методы лечения.
Прогноз
При менингите, септицемии, эпиглоттите - серьезный, при остальных формах Hib-инфекции - благоприятный. После менингита возможны стойкая тугоухость, гидроцефально-гипертензивный синдром.
Сроки нетрудоспособности при менингите составляют 1-2 мес после выписки из стационара.
Диспансерное наблюдение при Hib-менингите осуществляет невролог, продолжительность не менее 1 года.
Легионеллезы
Легионеллезы (питтсбургская пневмония, лихорадка Понтиак, лихорадка форта Брегг) - группа сапронозных заболеваний, вызываемых бактериями рода легионелла, с аэрозольным механизмом передачи возбудителя, характеризующихся лихорадкой, интоксикацией, преимущественным поражением органов дыхания, а также почек и ЦНС.
Коды по МКБ-10
A48.1 Болезнь легионеров.
A48.2 Болезнь легионеров без пневмонии (лихорадка Понтиак).
Этиология
Возбудители рода Legionella семейства Legionellaceae насчитывают 50 видов. Легионеллы - грамотрицательные, подвижные коккобациллярные бактерии, имеющие жгутики и фимбрии. Спор не образуют. Легионеллы - факультативные внутриклеточные паразиты. Факторы патогенности - термостабильный липополисахаридный эндотоксин и цитолизин. Легионеллы устойчивы к действию физических и химических факторов, чувствительны к ультрафиолетовому облучению, антибиотикам (макролидам, рифампицину, фторхинолонам, хлорамфениколу).
Эпидемиология
Легионеллез распространен повсеместно, вызывает спорадические случаи и крупные эпидемические вспышки с высокой летальностью в различных странах мира.
Легионеллы можно обнаружить в воздухе и в естественных водоемах, где они существуют в симбиозе с сине-зелеными водорослями. Однако популяционная плотность легионелл в природных водных экосистемах крайне низка и не превышает 103 КОЕ/л воды. До опасной для человека концентрации легионеллы размножаются в определенных типах искусственных водных систем, к которым относятся централизованные системы кондиционирования. Вторым типом потенциально опасной водной системs может быть водопроводная вода в системе горячего водоснабжения общественных зданий, где при определенных условиях легионеллы способны к колонизации на поверхности труб и другого водопроводного оборудования. К третьему типу потенциально опасных систем относятся различные типы вихревых ванн, бассейнов, джакузи. Система постоянного разбрызгивания водного аэрозоля при температуре 32-42 °С создает благоприятные условия для размножения легионелл и распространения водного аэрозоля. В нехлорированной питьевой воде легионеллы сохраняются более 1 года.
Основной путь передачи возбудителя инфекции - аэрозольный. К группам риска относятся больные стационаров, где применяется интенсивная иммуносупрессорная терапия, больные диабетом, сердечно-сосудистыми заболеваниями, хроническими легочными болезнями и больные, находящиеся на ИВЛ. Факторы передачи инфекции - вода и почва в эндемичных районах, вода в системах кондиционирования воздуха рециркуляторного типа, а также в системах водоснабжения.
Легионеллезы характеризуются четко выраженной сезонностью (лето-осень). Мужчины болеют в 2 раза чаще, чем женщины. Чаще это заболевание встречают у лиц среднего возраста и пожилых людей. Факторы риска, предрасполагающие к возникновению заболевания, - иммунодефицитные состояния, курение, злоупотребление алкоголем, проживание вблизи мест земляных работ.
Эпидемиологической особенностью легионеллеза является наличие трех групп заболеваний, различающихся по характеру заражения: внебольничная пневмония легионеллезной этиологии, нозокомиальный легионеллез и легионеллез, связанный с путешествиями. В настоящее время создана единая Международная система эпидемиологического контроля за случаями легионеллеза, связанного с туристическими и деловыми поездками.
Меры профилактики
Специфическая профилактика не разработана. Особенно важно своевременно обнаружить водный резервуар возбудителя, механизмы образования водного аэрозоля и провести дезинфекцию (обеззараживание ванных комнат, душевых сеток формалином и хлорсодержащими препаратами, обеззараживание и замена кондиционеров и т.д.). На промышленных предприятиях, электростанциях, в больницах и гостиницах замкнутые водные системы необходимо чистить и дезинфицировать не менее двух раз в год. На смену хлорированию и термообработке приходит широкое применение дезинфектантов, не содержащих хлора (приборы для ультрафиолетового облучения, приспособления, обогащающие воду ионами серебра и меди).
Патогенез
Входные ворота возбудителя инфекции - слизистая оболочка дыхательных путей, в том числе ткань легких.
Наиболее тяжелое течение легионеллеза в форме острого альвеолита наблюдают в случаях, когда инфицирующая доза высока, а диаметр частиц аэрозоля не превышает 2-2,5 мкм, что позволяет им достигать альвеол. Однако в большинстве случаев наблюдают мобилизацию защитного клеточного вала вокруг внедрившихся легионелл. В этом случае легионеллы фагоцитируются альвеолярными макрофагами, моноцитами и полиморфноядерными нейтрофилами.
Легионеллезные поражения легких сопровождаются вовлечением в процесс сосудов, что вызывает нарушения микроциркуляции вплоть до развития РДС. При легионеллезе, протекающем в форме КРС, острого трахеита или бронхита, основное количество микроорганизмов не проходит барьер цилиарной системы и длительно задерживается в слизистой оболочке трахеи и бронхов. Это активирует защитные механизмы. Патология легких начинается с бронхита и бронхиолита с быстрым образованием лобулярных, часто сливающихся очагов воспаления. Это приводит к долевым, нередко двусторонним поражениям легких в виде плевропневмоний. Поражение легких при тяжелом течении заболевания часто заканчивается абсцедированием. Через региональные ЛУ микроорганизмы поступают в кровь, в результате чего развивается бактериемия, приводящая у части больных к поражению печени, почек и других органов.
Эндотоксин обусловливает синдром интоксикации, поражение ЦНС и сердечно-сосудистой системы вплоть до развития ИТШ.
Клиническая картина
Классификация
Различают острый респираторный легионеллез (лихорадку Понтиак), пневмонию (болезнь легионеров, острый альвеолит), лихорадку с экзантемой (лихорадку форта Брегг).
Острый респираторный легионеллез
Инкубационный период - от 6 ч до 3 сут. С первых дней болезни температура тела повышается от 37,9 до 40 °С. Лихорадка сопровождается ознобом, головной болью, мышечными болями. Часто отмечают головокружение, светобоязнь, бессонницу, нарушение сознания и координации.
Респираторный синдром характеризуется сухим кашлем, болью в грудной клетке при дыхании. В некоторых случаях отмечается боль в горле и сухость в ротоглотке. Симптомы интоксикации, респираторный синдром нередко сочетаются с болями в животе, рвотой. В крови наблюдают умеренный лейкоцитоз. Заболевание длится без лечения 2-5 дней. В период реконвалесценции длительно сохраняется астения.
Пневмония
Инкубационный период длится от 2 до 10 дней. Болезнь начинается подостро. Больные жалуются на повышенную утомляемость, снижение аппетита, умеренную головную боль. Довольно часто в продромальном периоде наблюдается диарея. Период разгара характеризуется повышением температуры до 39-40 °С. Лихорадка может продолжаться до 2 нед. Она носит ремиттирующий или неправильный характер, заканчивается лизисом. Для периода разгара характерны выраженная потливость, астения, интенсивные боли в грудной клетке при дыхании. У трети больных локализация и интенсивность болей точно соответствуют развивающемуся парапневмоническому фибринозному плевриту, усугубляющему ДН. Со 2-го или 3-го дня болезни появляется сухой кашель, который в последующие дни становится продуктивным. Мокрота скудная, вязкая, слизисто-гнойная. У трети больных отмечают кровохарканье. Над пораженным участком легкого определяют укорочение перкуторного звука, при аускультации - влажные мелкопузырчатые хрипы. У половины больных выслушивают сухие хрипы. Легионеллезную пневмонию характеризует разнообразие локализации и значительная частота тотальных и субтотальных поражений легкого. Рентгенологически чаще определяют одностороннюю плевропневмонию, для которой характерны длительное сохранение инфильтрации, плевральных изменений и их медленная инволюция. У больных с иммунодефицитом различного генеза определяют деструкцию легочной ткани. У больных легионеллезом быстро развиваются симптомы легочной недостаточности. Типичны выраженная одышка, многих больных уже в ранние сроки приходится переводить на ИВЛ. У большинства больных в остром периоде болезни отмечают артериальную гипотензию, относительную брадикардию, сменяющуюся тахикардией. Более чем у трети больных на 4-5-й день болезни появляется жидкий водянистый стул. Диарея продолжается в среднем 7 дней и сопровождается болями в животе различной локализации и метеоризмом. У 30% больных поражение печени проявляется повышением активности аминотрансфераз, возможна желтуха. Функция печени восстанавливается в течение первых 2 нед заболевания. Часто нарушается функция почек, главным образом вследствие очагового нефрита. Возможно развитие почечной недостаточности, которая может сохраняться до 9 мес после острого периода болезни.
Поражения ЦНС характерны для большинства больных. Они проявляются головной болью, энцефалопатией. Наиболее часто поражаются структуры мозжечка и ствола мозга, что проявляется дизартрией, атаксией, нистагмом, параличом глазодвигательных мышц. Характерны депрессия, эмоциональная лабильность. Возможен серозный менингит, менингоэнцефалит. В период реконвалесценции многие больные жалуются на ухудшение памяти.
В периферической крови отмечают лейкоцитоз до 10-15 × 109 /л, часто со сдвигом формулы влево, в тяжелых случаях возможны тромбоцитопения и лимфопения. СОЭ может повышаться до 80 мм/ч.
При благоприятном течении болезни со 2-й недели состояние больных улучшается. В периоде реконвалесценции длительно сохраняются слабость, головокружение, раздражительность. Рентгенологические изменения в легких могут сохраняться в течение 10 нед. В единичных случаях заболевание осложняется абсцессом легких и эмпиемой плевры.
Острый альвеолит
Характерно острое начало с повышением температуры тела до 39-40 °С. Больные жалуются на головную, мышечные боли. С первых дней болезни появляется сухой кашель. В дальнейшем нарастает одышка, появляется кашель с отделением скудной (слизистой или слизисто-гнойной) мокроты. При аускультации легких определяют распространенную двустороннюю обильную длительно сохраняющуюся крепитацию. При затяжном прогрессирующем течении развивается фиброзирующий альвеолит.
Острое лихорадочное заболевание
Инкубационный период составляет от нескольких часов до 10 сут. Основные симптомы: лихорадка до 38 °С, озноб, головная боль, полиморфная сыпь. Длительность болезни - 3-7 сут. Течение благоприятное.
Осложнения
Самые грозные осложнения - ОДН, ОПН, ИТШ. Могут развиться кровотечения (носовые, желудочно-кишечные и маточные) и тромбоэмболия. Редко регистрируют острую печеночную недостаточность и нагноительные процессы в легких (абсцесс легкого, эмпиема плевры).
Летальность при пневмонической форме достигает 15-20%, чаще у лиц с хроническими заболеваниями легких, иммунодефицитом. Причины смерти - развитие ИТШ, легочно-сердечной недостаточности или суперинфекции.
Диагностика
В качестве диагностических критериев легионеллезной пневмонии действуют международные, а с 2010 г. - национальные стандарты, в соответствии с которыми диагноз легионеллеза в случае острой инфекции НДП считается установленным:
-
при обнаружении легионелл в отделяемом респираторного тракта или легочной ткани методом ПЦР или с помощью прямой иммунофлюоресценции;
-
при нарастании титра специфических антител к Legionella pneumophila в РНИФ;
-
при определении растворимого антигена к Legionella pneumophila в моче иммуноферментным или иммунохроматографическим методом.
При невозможности исследования сыворотки крови в динамике выявление высокого уровня антител к Legionella pneumophila (1:128 и выше) позволяет считать диагноз легионеллеза установленным.
Базовым методом диагностики легионеллеза является иммунохроматографический метод. По данным ВОЗ, 90% случаев легионеллеза в мире устанавливается по определению легионелл в моче. В случае острой тяжелой пневмонии легионеллез иммунохроматографическим методом можно диагностировать в течение 30-40 мин.
Дифференциальная диагностика
Пневмонию легионеллезной этиологии дифференцируют с пневмониями другой этиологии, в первую очередь с атипичной пневмонией (орнитоз, коксиеллез, респираторный микоплазмоз). В связи с клиническим сходством пневмоний различной этиологии решающее значение имеют результаты микробиологических, генетических и иммунологических исследований.
Лечение
Этиотропная терапия
В качестве этиотропного средства используют эритромицин в суточной дозе 2-4 г ежедневно в течение 2-3 нед или другие препараты из группы макролидов (кларитромицин, азитромицин, спирамицин). В тяжелых случаях эритромицин вводят в виде фосфата или аскорбината внутривенно капельно по 0,6-1 г/сут (максимально 2-3 г) или сочетают парентеральное и пероральное введение эритромицина в дозе 500 мг 4 р/сут, особенно при развитии легионеллеза на фоне иммунодефицита, легочно-сердечной недостаточности. Возможно сочетание макролидов с рифампицином. Рифампицин назначают в дозе 0,15-0,3 г 3 р/сут. Высокоэффективны фторхинолоны (левофлоксацин, ципрофлоксацин, моксифлоксацин). Длительность курса лечения антибиотиками - 2-3 нед.
Патогенетическая терапия
Оксигенотерапия. Почти каждому четвертому больному необходима ИВЛ. Целесообразно включение в комплексную терапию ИФН-α (Лейкинферона¤). Препарат вводят внутримышечно по 10 000 МЕ 1-3 раза в день в течение 5-7 дней. Рекомендованы противокашлевые, бронхолитические и отхаркивающие средства.
Противошоковые мероприятия, борьбу с кровотечениями и интоксикацией проводят общепринятыми методами. Вопрос о применении глюкокортикоидов в терапии легионеллеза остается дискуссионным. Если легионеллез осложнен ОПН, проводят гемодиализ.
Возвратные тифы
Возвратные тифы - группа острых антропонозных инфекционных трансмиссивных болезней, вызываемых боррелиями. Характеризуются приступами лихорадки, чередующимися с периодами апирексии. Передаются вшами или клещами.
Эпидемический возвратный тиф вшиный
Эпидемический возвратный тиф вшиный - антропоноз, передается вшами, характеризуется приступами лихорадки, интоксикацией, увеличением печени и селезенки, чередующимися с периодами апирексии.
Код по МКБ-10
А68.0 Вшиная возвратная лихорадка.
Этиология
Возбудитель - спирохета Borrelia recurrentis Obermeieri (спирохета Обермейера), относящаяся к семейству Spirochaetaceae, роду Borrelia, по форме напоминающая нитевидную спираль с 6-8 завитками; обладает активной подвижностью; анаэроб. Размножается поперечным делением, грамотрицательна, растет на специальных питательных средах. Количество белковых антигенов боррелии достигает нескольких десятков. Во время заболевания появляется генерация боррелий с новым антигенным составом. Спирохета Обермейера содержит токсические вещества типа эндотоксина. Пирогенами боррелий являются липопротеины наружной мембраны. В окружающей среде В. recurrentis малоустойчива, быстро погибает при высушивании и нагревании до 50 °С. Чувствительна к пенициллину, тетрациклинам, хлорамфенико-лу, макролидам.
Эпидемиология
В прошлом вшиный возвратный тиф был широко распространен во многих странах мира, заболеваемость резко возрастала во время войн, голода и других социально-экономических бедствий. В России вшиный возвратный тиф полностью ликвидирован в середине прошлого века. Начиная с июля 2015 г. в странах Европы описано несколько случаев возвратного тифа среди беженцев из Восточной Африки.
Единственным источником возбудителя является больной человек, заразность которого особенно велика во время лихорадочных приступов. Переносчиком боррелий служит вошь (преимущественно платяная, реже - головная), которая способна передавать инфекцию спустя 6-28 дней после того, как напитается кровью больного человека. Спирохеты размножаются и накапливаются в гемолимфе вши. Заражение человека происходит при раздавливании вши и попадании ее гемолимфы на поврежденную при расчесах, трении одеждой кожу. Восприимчивость абсолютная. Иммунитет нестойкий, возможны повторные заболевания. Сезонность в странах с умеренным и холодным климатом зимне-весенняя.
Меры профилактики
Специфическая профилактика не разработана, неспецифическая заключается в борьбе с педикулезом, раннем выявлении и изоляции больных, срочной камерной дезинфекции их вещей и постельных принадлежностей. Вещи контактных лиц подвергаются санитарной обработке, за лицами устанавливается медицинское наблюдение с ежедневной термометрией в течение 25 дней после госпитализации больного и осмотра на педикулез.
Патогенез и патоморфология
Проникшие через кожу боррелии захватываются клетками гистио-фагоцитарной системы и размножаются в них - эта фаза соответствует инкубационному периоду. Затем возбудитель поступает в кровь - развивается боррелиемия. Через несколько дней вырабатываются антитела, инактивирующие боррелии. Боррелиемия и токсинемия клинически проявляются первым лихорадочным приступом, по окончании которого часть спирохет сохраняется в ЦНС, костном мозге и селезенке. В этих органах микробы размножаются и через несколько дней после нормализации температуры снова поступают в кровь, вызывая второй лихорадочный приступ. Новая генерация боррелий по антигенной структуре отличается от предыдущей, поэтому возбудитель не нейтрализуется образовавшимися во время первого приступа антителами, но разрушается под действием фагоцитов и антител, вырабатывающихся во время второго приступа. Процесс повторяется до тех пор, пока не появятся антитела ко всем генерациям боррелий, и наступает выздоровление.
Патологоанатомические изменения обнаруживаются в селезенке, печени, головном мозге, почках. Селезенка может быть увеличена в 5-8 раз, капсула ее напряжена, легко разрывается; в паренхиме выявляются кровоизлияния, инфаркты, очаги некроза; в сосудах - тромбозы, скопление боррелий. В печени находят очаги некроза. В головном мозге выявляют расширение сосудов, кровоизлияния, периваскулярные инфильтраты. Иногда выявляется геморрагический отек легких, при этом в альвеолах находят боррелии.
Клиническая картина
Клиническая классификация предусматривает выделение стертой, легкой, средней тяжести и тяжелой форм. Критериями тяжести считают высоту и длительность лихорадки, выраженность интоксикации, интенсивность гемодинамических расстройств.
Инкубационный период - от 3 до 14 дней (в среднем 7-8).
Основные симптомы и их динамика
Характерно бурное, внезапное начало с потрясающим ознобом, который через несколько часов сменяется жаром и быстрым повышением температуры тела до 39-40 °С и выше. Изредка болезнь начинается с продромального периода, во время которого наблюдаются общая слабость, разбитость, головные и суставные боли.
Уже в первый день появляются сильнейшая головная боль, ломота в мышцах (особенно икроножных), пояснице, суставах, светобоязнь, бессонница. Пропадает аппетит, могут возникать тошнота, рвота.
Больные становятся вялыми, апатичными, у некоторых выявляют менингеальные симптомы. Наблюдаются инъекция склер, гиперемия конъюнктив. Кожа лица в первые дни болезни ярко гиперемирована. Возможны носовые кровотечения, петехиальная сыпь, кровохарканье. Со второго дня болезни увеличивается селезенка, что вызывает ощущение тяжести, давления или тупые боли в левом подреберье.
С 3-4-го дня присоединяется иктеричность кожи и склер, увеличивается печень. Типичны одышка, тахикардия до 140-150 в минуту, снижение АД. Язык сухой, густо обложен белым налетом, приобретает «молочный», «фарфоровый» вид. Диурез снижен, моча темная.
Гипертермия сохраняется 5-7 дней, после чего температура тела критически снижается до субнормальной, что сопровождается проливным потоотделением и падением АД вплоть до коллапса. Продолжительность первого приступа от 3 до 13 сут. Во время «кризиса» выделяется до 3-4,5 л светлой мочи. После нормализации температуры самочувствие больных улучшается, пульс урежается, однако сохраняется выраженная слабость.
Заболевание может ограничиться одним лихорадочным приступом (особенно при рано начатом антибактериальном лечении). При симптоматической терапии у большинства больных после 7-10 дней апирексии вновь внезапно повышается температура тела и наступает второй лихорадочный приступ, подобный первому, но менее продолжительный (3-4 дня), хотя нередко и более тяжелый. Более чем в половине случаев болезнь заканчивается после второго приступа. Иногда через 9-12, крайне редко - через 20 дней после очередного периода апирексии наступает третий приступ, еще более короткий и легкий. Всего возможно 4-5 лихорадочных приступов.
В типичных случаях температурная кривая настолько характерна, что именно она позволяет заподозрить возвратный тиф.
Период реконвалесценции длительный, самочувствие больных восстанавливается медленно, в течение нескольких недель после окончательной нормализации температуры сохраняются общая слабость, быстрая утомляемость, головокружение, бессонница.
Осложнения
Специфические осложнения, как и при других спирохетозах, - менингит, энцефалит, ирит, иридоциклит. У беременных возможны выкидыши. Самое тяжелое, но редкое осложнение - разрыв селезенки. Возможны также носовые и маточные кровотечения, кровоизлияние в мозг и другие органы. Критическое снижение температуры тела на 4-5 °С может осложниться коллапсом.
Диагностика
Диагностика основывается в значительной степени на данных эпидемиологического анамнеза - пребывание в местности, где встречается вшиный возвратный тиф, или среди мигрантов из эндемичных стран. В период первого приступа учитывают главные симптомы: острейшее начало болезни, гипертермию с первых же часов, выраженный болевой синдром (головная, мышечная боль), раннее увеличение и болезненность селезенки и печени, субиктеричность кожи и склер. При последующих приступах диагностике помогает типичный вид температурной кривой.
Наиболее информативный метод специфической лабораторной диагностики - обнаружение боррелий Обермейера в периферической крови во время лихорадки (редко в период апирексии). Исследуют мазок и толстую каплю крови, окрашенные по Романовскому-Гимзе. В последние годы используют ПЦР - ДНК боррелий выявляют в крови больных.
Дифференциальная диагностика
Дифференциальную диагностику проводят с малярией, клещевым возвратным тифом, лептоспирозом, гриппом, сыпным тифом, менингитом, пневмонией.
Лечение
Больных возвратным тифом госпитализируют. Обязателен строгий постельный режим вплоть до стойкой нормализации температуры тела. Специальная диета не предусмотрена.
Специфическая этиотропная терапия
Проводится в течение 7-10 дней одним из антибиотиков, действующих на боррелии. Препаратом выбора считают доксициклин по 100 мг 2 р/сут. К альтернативным антибактериальным препаратам относятся цефтриаксон 1 г/сут и бензилпенициллин по 2-3 млн ЕД/ сут внутримышечно, эритромицин в суточной дозе 1 г.
Одновременно назначают инфузионную дезинтоксикационную терапию.
Следует иметь в виду, что после начала лечения антибиотиками (особенно пенициллином) возможна реакция обострения Яриша-Герксгеймера, связанная с гибелью большого количества спирохет и высвобождением значительного количества эндотоксина. Состояние больных при этом резко ухудшается через 30-40 мин после инъекции пенициллина или введения другого антибиотика, развивается ИТШ. При разрыве селезенки необходимо срочное оперативное вмешательство.
Реконвалесцентов выписывают из стационара не ранее чем через 3 нед после нормализации температуры тела.
Возвратный тиф клещевой (эндемический)
Возвратный клещевой тиф (эндемический) - острый природно-очаговый зооноз, передается человеку клещами, характеризуется множественными приступами лихорадки, периодами апирексии.
Код по МКБ-10
A68.1 Эндемический возвратный тиф.
Этиология
Возбудители - спирохеты рода Borrelia (более 20 видов), морфологически идентичные спирохете Обермейера, отличающиеся от нее антигенной структурой и патогенностью. Чаще всего заболевание вызывают африканская В. duttoni, азиатская B. persica, а также B. hermsii и B. nereensis.
В окружающей среде боррелии малоустойчивы. Чувствительны к пенициллину и другим бета-лактамным антибиотикам, а также к тетрациклинам, макролидам, фторхинолонам.
Эпидемиология
Возвратный тиф клещевой - природно-очаговое заболевание. Оно широко распространено во многих странах Азии, Африки и Латинской Америки; в Европе регистрируется в Испании, Португалии, на юге Украины, Северном Кавказе и в Закавказье. Природные очаги возвратного клещевого тифа в России существуют в Краснодарском и Ставропольском краях, Дагестане.
Источник возбудителя инфекции - животные, в том числе грызуны, хищники, насекомоядные, рептилии и др. Основным резервуаром и переносчиком возбудителя служат аргасовые клещи рода Alectorobius. Заражение человека происходит во время присасывания инфицированного клеща. У людей, постоянно живущих в эндемических очагах, как правило, вырабатывается иммунитет. Болеют преимущественно приезжие из других регионов (туристы, останавливающиеся на отдых в развалинах, брошенных жилищах, пещерах, военнослужащие). Заболеваемость увеличивается в весенне-летнее время, что связано с наибольшей активностью клещей-переносчиков. Восприимчивость человека высокая. Иммунитет непродолжителен и строго специфичен для каждой разновидности спирохет, поэтому возможны повторные заболевания.
Меры профилактики
Специфической профилактики не разработано.
Неспецифическая профилактика заключается в уничтожении орнитодовых клещей и грызунов в очагах, ношении защитной одежды в местах обитания клещей, применении репеллентов.
Патоморфология и патогенез идентичны таковым при вшином возвратном тифе, но морфологические изменения в органах выражены слабее.
Клиническая картина
По клинической классификации выделяют легкую, средней тяжести и тяжелую формы в зависимости от степени и продолжительности интоксикации, нарушения функций внутренних органов.
В месте укуса клеща через несколько минут наблюдается местная реакция кожи - появляется розовое пятно, затем узелок (папула) диаметром около 5 мм с геморрагическим ободком. Это первичный аффект, который может сохраняться до 2-3 нед.
Продолжительность инкубационного периода от 4 до 20, чаще 11-12 дней.
Первый лихорадочный приступ возникает обычно внезапно, реже - после продромы и характеризуется высокой температурой тела, ознобом, сильной головной болью и другими симптомами интоксикации, как при вшином возвратном тифе; характерны возбуждение, бред, галлюцинации. Приступ длится 2-4 дня (реже - несколько часов), затем температура тела резко снижается, больные обильно потеют, после чего самочувствие нормализуется. Продолжительность периода апирексии от 4 до 20 дней. Количество приступов может достигать 10-12 и более. Каждый последующий приступ короче, а период апирексии - длиннее предыдущего. Общая продолжительность заболевания составляет несколько месяцев, но при раннем назначении антибактериальной терапии клиническая картина стертая, наблюдается одна волна лихорадки.
Во время приступов отмечают гиперемию лица, субиктеричность склер. Тоны сердца приглушены, характерны снижение АД, относительная брадикардия. Возможны боли в животе, жидкий стул; с 3-го дня умеренно увеличиваются печень и селезенка.
Осложнения встречаются реже, чем при вшином возвратном тифе. Возможны острый психоз, энцефалит, увеит, иридоциклит, кератит. Летальные случаи редки.
В клиническом анализе крови наблюдаются незначительный лейкоцитоз, лимфоцитоз, моноцитоз, эозинопения, повышение СОЭ; через несколько приступов появляется умеренная гипохромная анемия.
Диагностика
Существенную роль играет эпидемиологический анамнез (пребывание в местах обитания клещей-переносчиков), обнаружение первичного аффекта, чередование лихорадочных приступов с периодами апирексии.
Окончательно диагноз устанавливается при выявлении боррелий в крови больного (исследуется толстая капля, окрашенная по Романовскому-Гимзе). Специфические антитела в сыворотке крови начинают тестировать с 5-7-го дня болезни методом НРИФ. В настоящее время для диагностики успешно используется ПЦР.
Дифференциальная диагностика
Дифференциальную диагностику проводят с вшиным возвратным тифом, малярией, лептоспирозом, сепсисом, гриппом и другими заболеваниями, сопровождающимися высокой лихорадкой.
Лечение
Лечение проводят в стационаре теми же антибиотиками и в тех же дозах, что и при вшином возвратном тифе, до 5-7-го дня стойко нормальной температуры. При необходимости назначают дезинтоксикационную терапию.
Лептоспироз
Лептоспироз (болезнь Васильева-Вейля, иктерогеморрагическая лихорадка) - зоонозная природно-очаговая инфекционная болезнь с преимущественно водным путем передачи возбудителя. Характеризуется лихорадкой с выраженной интоксикацией, поражением почек, печени, цНс, развитием геморрагического синдрома и высокой летальностью.
Коды по МКБ-10
А27 Лептоспироз.
А27.0 Лептоспироз желтушно-геморрагический. Лептоспироз, вызванный Leptospira interrogans, серовар icterohae-morrhagiae.
Этиология
Возбудитель лептоспироза - лептоспиры рода Leptospira семейства Leptospiraceae порядка Spirochaetales. В этиологической структуре лептоспироза человека преобладают серогруппы Grippotyphosa, Icterohaemorrhagiae, Canicola, Pomona и Sejroe.
Лептоспиры - тонкие, спиралевидные, подвижные микроорганизмы длиной 6-15 мкм, диаметром 0,1-0,25 мкм, грамотрицательные, спор и капсул не образуют. Оба конца лептоспир, как правило, загнуты в виде крючьев. Высокую подвижность лептоспир обусловливают периплазматические жгутики, расположенные между многослойной наружной оболочкой и протоплазматическим цилиндром, т.е. внутри клетки.
Патогенные лептоспиры относятся к тканевым паразитам, обладающим адгезивностью и инвазивностью. Лептоспиры продуцируют экзотоксиноподобные вещества (экстрацеллюлярный растворимый гемолизин) с цитотоксическими и гемолитическими свойствами, ферменты (фибринолизин, плазмокоагулазу, липазу, фосфолипазу А2, гиалуронидазу и др.) и содержат эндотоксин, оказывающий пирогенное, кожно-некротическое и летальное действие.
Лептоспиры - строгие аэробы; их выращивают на специальных сывороточных и синтетических средах. При высушивании быстро погибают. Они чувствительны к солнечным лучам, высокой температуре, обычным дезинфицирующим растворам. Лептоспиры погибают при нагревании до 55 °С через 25-30 мин, а при температуре 76-96 °С - практически мгновенно. К действию низких температур они более устойчивы. Этим объясняют их способность зимовать в открытых водоемах и влажной почве, полностью сохраняя вирулентность. Лептоспиры чувствительны к препаратам пенициллина, ЦС, хлорамфениколу, тетрациклинам.
Эпидемиология
Источником возбудителя инфекции служат более ста видов диких, сельскохозяйственных и домашних животных. Основными хозяевами (резервуарами) среди диких млекопитающих являются грызуны (серые полевки, мыши, крысы) и насекомоядные (ежи, землеройки). В хозяйственных (антропургических) очагах эту роль играют домашние животные - собаки, свиньи, крупный рогатый скот, овцы, реже козы и лошади, а также пушные звери клеточного содержания - лисицы, песцы, нутрии. Больной человек является «тупиком» инфекции и не имеет практического значения как ее источник.
У грызунов и насекомоядных лептоспирозная инфекция протекает бессимптомно, сопровождаясь выделением лептоспир с мочой. У взрослых домашних животных возможны как бессимптомные, так и клинически манифестные формы. Независимо от клинической формы инфекции и вида животного у отдельных особей развивается бессимптомное носительство длительностью от нескольких недель до 2 и более лет.
Наибольшее число видов-лептоспироносителей зарегистрировано среди крыс рода Rattus. В пределах внетропической Евразии серая крыса является основным резервуаром и источником лептоспир серо-группы Icterohaemorrhagiae.
Лептоспироз передается человеку контактным, водным и пищевым путями. Животные-носители выделяют лептоспир в окружающую среду с мочой, инфицируя воду, пищевые продукты, корма, почву и другие объекты. Человек чаще заражается при проникновении лептоспир через наружные покровы и слизистые - перкутанный механизм заражения, который чаще реализуется при наличии микротравм. Заражение человека лептоспирозом происходит при купании в открытых пресноводных водоемах, рыбной ловле, охоте, различных сельскохозяйственных работах, работе на угольных шахтах, при питье воды из открытых водоемов и колодцев, употреблении инфицированных продуктов, прямом контакте с больными животными. Факторами передачи, помимо воды, бывают также влажная почва, трава пастбищ, загрязненные выделениями больных животных. Заражение может происходить при забое скота, разделке туш, а также при употреблении в пищу молока и термически не обработанного мяса. Возможен профессиональный характер заражения, при этом выделяют сельскохозяйственный, промысловый, производственный и лабораторный типы заболеваемости. В группу риска входят ветеринары, дератизаторы и сельскохозяйственные работники.
Восприимчивость к лептоспирозу у людей высокая. После перенесенного заболевания остается стойкий сероварспецифический иммунитет, возможны повторные заболевания, вызванные другими сероварами возбудителя. Среди заболевших преобладают мужчины молодого и среднего возраста.
Лептоспирозу свойственна летне-осенняя сезонность с пиком в августе.
В Российской Федерации лептоспироз относится к числу наиболее распространенных природно-очаговых инфекций, ежегодно регистрируется от 250-1500 случаев заболеваний (0,18-1,5 на 100 тыс. населения). Наиболее высокий уровень заболеваемости отмечается в СевероЗападном, Южном и Центральном федеральных округах.
Меры профилактики
Неспецифические
Профилактика лептоспироза осуществляется совместно органами Роспотребнадзора и ветеринарной службы и основывается на охране открытых водоемов от загрязнений выделениями животных, запрещении купания в непроточных водоемах, обеззараживании воды из открытых источников, защите пищевых продуктов и сельскохозяйственных объектов от грызунов, мерах личной профилактики среди лиц, профессионально связанных с животными, информировании и образованию потребителей.
Специфические
Плановой вакцинации подлежат лица из группы риска заражения: ветеринарные работники, животноводы, сотрудники зоопарков, зоомагазинов, собачьих питомников, звероводческих хозяйств, предприятий по переработке животноводческого сырья, сотрудники лабораторий, работающие с культурами лептоспир. Профилактическая вакцинация населения против лептоспироза проводится по эпидемическим показаниям, определяемым местными органами здравоохранения.
Профилактика лептоспироза проводится с 7-летнего возраста. В России применяется вакцина лептоспирозная концентрированная инактивированная жидкая. Вакцинацию проводят однократно в дозе 0,5 мл (подкожно в область нижнего угла лопатки). Ревакцинацию проводят через 1 год однократно дозой 0,5 мл.
Экстренная профилактика проводится лицам, подвергшимся риску заражения лептоспирозом. Назначают доксициклин по 0,1 г раз в день в течение 5 дней.
Патогенез
Первая фаза - внедрения и размножения лептоспир. Входными воротами для лептоспир, как правило, служат микроповреждения кожных покровов и слизистых оболочек. С током крови (первичная бессимптомная лептоспиремия) происходит диссеминация лептоспир в печень, почки, легкие, селезенку, а также проникновение через ГЛБ. Вслед за адгезией лептоспир к поверхности клеток происходит их размножение и накопление в межклеточном пространстве, причем наиболее значительно - в тканях печени и почек. Эта фаза патогенеза соответствует инкубационному периоду заболевания и продолжается 6-14 дней.
Вторая фаза характеризуется повторной лептоспиремией. Из крови лептоспиры вновь проникают в ткани, проявляя тропизм к паренхиматозным органам: почкам, печени, а также легким, надпочечникам и оболочкам мозга. Длительность второй фазы - 3-7 дней, клинически она соответствует начальному периоду заболевания и определяет острое начало с фебрильной лихорадки и выраженной интоксикации. В этот период возможна манифестация лептоспирозного менингита, который может быть основным клиническим проявлением заболевания при безжелтушной форме инфекции. Типично проникновение лептоспир в поперечно-полосатую скелетную мускулатуру (особенно икроножные мышцы), что уже в начальном периоде заболевания приводит к специфическому миозиту. В результате некроза мышц в крови повышается уровень миоглобина и КФК. Эндотоксин лептоспир повреждает эндотелий капилляров, развивается генерализованный капилляротоксикоз, проявляющийся носовыми кровотечениями и кровоизлияниями в склеры.
Третья фаза характеризуется нарастанием токсемии и развитием тяжелого поражения внутренних органов. В этом периоде лептоспиры могут проникать непосредственно в клетки, вызывая различные структурно-функциональные изменения - от дистрофии до некроза. Через поврежденные стенки сосудов лептоспиры мигрируют в легочную ткань, миокард, СМЖ и вещество мозга. Клинически 3-я фаза патогенеза соответствует периоду разгара, начинающемуся с конца 1-й недели заболевания и продолжающемуся на 2-3-й неделях.
Генерализованный капилляротоксикоз сопровождается геморрагическим синдромом с кровоизлияниями в органы, внутренними и внешними кровотечениями, глубокими нарушениями микроциркуляции. Продуцируемый лептоспирами гемолизин ведет к гемолизу. Поражение почек многофакторно и проявляется интерстициальным нефритом, с некрозом эпителиальных клеток и основной мембраны клубочков, с последующим вовлечением в процесс извитых канальцев и развитием ОПН с олигоанурией.
Желтуха может наблюдаться у больных независимо от серогруппы лептоспир, вызвавших заболевание, но чаще при лептоспирозе, вызванном L. icterohaemorrhagiae и L. canicola, - 40-85%. Причиной появления желтухи являются дегенеративные изменения гепатоцитов с нарушением желчеобразующей и выделительной функции, внутри-печеночный холестаз, а также эритрофагия клетками ретикулоэндотелиальной системы.
При лептоспирозе легкие являются одним из шоковых органов. Для летальных исходов на ранних стадиях болезни характерно развитие отека легочной ткани, на 2-й неделе болезни в легких уже выявляются инфильтративные изменения.
Полиорганную недостаточность нередко усугубляет специфический интерстициальный лептоспирозный миокардит.
Поражение нервной системы при лептоспирозе имеет широкий диапазон - от функциональных расстройств, вызванных специфической интоксикацией, до органического поражения как периферической, так и ЦНС. В периоде разгара появляются признаки лептоспирозного менингита,
В тяжелых случаях развивается сочетанная острая почечно-печеночная недостаточность, являющаяся наряду с ИТШ и геморрагическим синдромом основной причиной смерти при лептоспирозе. Неблагоприятные исходы могут быть обусловлены развитием РДС, пневмонии, менингита.
В четвертой фазе формируется нестерильный иммунитет (соответствует периоду угасания клинических проявлений - 3-4-я недели болезни, и периоду ранней реконвалесценции). Количество специфических антител в крови нарастает, но лептоспиры еще сохраняются в органах.
Пятая фаза патогенеза - формирование стерильного иммунитета, продолжается от 5-8 нед до 6 мес от начала болезни, соответствует периоду поздней реконвалесценции.
На аутопсии макроскопически отмечается выраженная желтуха, многочисленны кровоизлияния в кожу, слизистые и серозные оболочки, кровоизлияния в слизистую желудка, эпикард и перикард, надпочечники, головной мозг. Определяется геморрагический транссудат в брюшной, плевральной полостях и перикарде. Характерны полнокровие и отек внутренних органов, увеличение массы печени и почек. Гистологически выявляют резкое нарушение кровообращения с поражением сосудов микроциркуляторного русла, полнокровие, дистрофические изменения паренхимы внутренних органов с очагами некроза, особенно выраженными в почках, печени, надпочечниках, миокарде, поджелудочной железе.
Классификация (табл. 16-21).
| Степень тяжести | Форма течения | Исходы |
|---|---|---|
|
|
|
Клиническая картина
Инкубационный период длится от 2 до 30 дней, чаще 7-14 дней. Динамика развития основных симптомов
Лептоспироз начинается остро, без продромы, с резкого подъема температуры до 39-40 °С. Лихорадка сопровождается ознобом, упорной головной болью, общей слабостью. На 2-й день болезни появляются мышечные боли, особенно в икроножных мышцах, реже беспокоят суставные боли. Лицо и шея гиперемированы, инъецированы сосуды склер и конъюнктив, лицо несколько одутловато, на губах и крыльях носа часто появляются герпетические высыпания, в тяжелых случаях - геморрагические, возможна гиперемия зева. К 3-5-му дню болезни присоединяются тошнота, рвота, может появиться кашель, хрипы в легких, отмечаются тахикардия и гипотензия.
Лихорадка, как правило, максимальна в первые 1-3 дня заболевания, носит постоянный или ремиттирующий характер, типичен волнообразный тип температурной кривой с появлением от 2 до 4 лихорадочных волн. Продолжительность первой волны от 3 до 12 сут. Температура снижается критически или ускоренным лизисом. Нормализация температуры тела при лептоспирозе не всегда является благоприятным симптомом, особенно в начальном периоде, и часто происходит при развитии ИТШ и органной патологии.
Важным симптомом для ранней диагностики лептоспироза служат мышечные боли. Миалгии возникают в покое, усиливаются при движении, пальпация мышц болезненна. Интенсивность и распространенность миалгий соответствуют тяжести заболевания.
С 3-4-го дня болезни присоединяется геморрагический синдром в виде кровоизлияний в склеры, носовых кровотечений, на 4-5-й день появляется петехиальная сыпь, кровоизлияния в местах инъекций, в тяжелых случаях - кровохарканье.
В конце начального периода - на 4-5-й день - возникают первые симптомы поражения почек. Суточное количество мочи составляет менее 600-500 мл. Удельный вес мочи падает, появляется протеинурия, цилиндрурия, микрогематурия, клетки почечного эпителия. При нетяжелом течении заболевания эти изменения умеренно выражены и быстро регрессируют. В случаях тяжелого течения лептоспироза олигурия может появляться уже на 2-3-й день болезни, к 5-му дню переходя в стадию анурии.
В период разгара клиническую картину определяют симптомы поражения печени, почек, легких, сердечно-сосудистой системы, ЦНС, признаки генерализованного капилляротоксикоза.
Вслед за первыми признаками патологии почек или одновременно с ними появляется желтуха. Яркая иктеричность кожи с шафранно-красным оттенком появляется на 4-6-й день болезни и сохраняется от нескольких дней до одного месяца, в зависимости от тяжести заболевания. Моча становится темной, гипохолия кала имеется у большинства больных. Интенсивность желтухи в большинстве случаев соответствует тяжести болезни. Возможен незначительный зуд кожи. Характерна гепатомегалия, край печени пальпируется на 2-3 см ниже реберной дуги, умеренно болезненный, реже отмечается увеличение селезенки.
Поражение почек достигает максимума с 7-10-го дня болезни, наблюдается в 50-100% случаев и часто определяет тяжесть течения заболевания. Тяжелый уремический синдром клинически проявляется упорной икотой, рвотой, нарастающей энцефалопатией. При отсутствии адекватной терапии ОПН определяет летальный исход заболевания. При благоприятном течении лептоспироза олигоанурия сменяется полиурией с изогипостенурией и постепенным в течение 2-4 нед восстановлением концентрационной функции почек.
Как правило, поражение почек сочетается с нарушением функции печени. При тяжелой форме лептоспироза в разгаре заболевания ведущим клиническим синдромом становится острая почечно-печеночная недостаточность.
Клиническую картину периода разгара лептоспироза дополняет прогрессирующий геморрагический синдром, достигающий максимума на 2-й неделе болезни. Чаще он наблюдается при желтушной форме. Становится более обильной петехиальная сыпь на туловище, появляются обширные кровоизлияния в местах инъекций, макрогематурия, легочное и желудочно-кишечное кровотечения.
Изменения сердечно-сосудистой системы характеризуются значительной приглушенностью сердечных тонов, тахикардией, снижением АД. Инфекционно-токсический миокардит регистрируется в основном при тяжелой форме заболевания.
С 3-го по 12-й день болезни в 10-60% случаев заболевание осложняется ИТШ, развивающимся чаще при желтушной форме лептоспироза, летальность в этом случае достигает 10-35%.
Поражение легких при лептоспирозе в разгар заболевания чаще проявляется острым бронхитом и очаговой пневмонией, могут развиться и быть причиной смерти геморрагическая пневмония или геморрагический отек легких. Тяжело протекающая ОДН, как правило, развивается на фоне ИТШ.
Поражение ЦНС при лептоспирозе в виде токсической энцефалопатии разной степени выявляется уже в начальный период заболевания, усиливается в период разгара. В конце 1-й - начале 2-й недели болезни у 2-40% больных появляется менингеальный синдром, обусловленный развитием менингита. При исследовании СМЖ плеоцитоз варьирует от 50 до 5000 лейкоцитов в 1 мкл, чаще лимфоцитарного, реже - смешанного или, при высоком плеоцитозе, - нейтрофильного характера. Прогноз при лептоспирозных менингитах, как правило, благоприятный. При тяжелой форме лептоспироза заболевание может осложнять ОНГМ.
Период ранней реконвалесценции начинается при благоприятном течении с 3-й, а при тяжелом течении - с 4-й недели заболевания и продолжается до 6-8 нед.
На 3-5-й неделях болезни могут появляться признаки поражения ПНС в виде моно- и полиневропатий, вегетососудистая дистония, в единичных случаях - увеит, конъюнктивит, кератит. При тяжелом течении этот период характеризуется присоединением вторичных осложнений - флебиты, тромбозы, пневмония, сепсис.
Сроки выздоровления значительно увеличиваются при развитии рецидивов болезни. Частота рецидивов при лептоспирозе составляет 20-60%.
В периоде поздней реконвалесценции сохраняются изменения со стороны печени, почек, сердца, нервной системы с постепенным восстановлением нарушенных функций. В то же время возможны новые осложнения и усугубляется имеющаяся патология.
Осложнения и исходы лептоспироза
К ранним осложнениям относятся ИТШ, ОПН, острая почечно-печеночная недостаточность, ДВС-синдром с массивными внутренними и внешними кровотечениями, РДС, ОНГМ, миокардит, острая сердечно-сосудистая недостаточность (ОССН), а также неспецифические бактериальные осложнения (пневмония, сепсис, гингивит, отит, паротит и др.). К поздним относят осложнения периода реконвалесценции со стороны органов зрения: увеит, конъюнктивит, кератит, иридоциклит, кератоиридоциклит, хориоидит; и нервной системы: неврит, полирадикулонейропатия. Летальность при лептоспирозе составляет 1-3%.
Диагностика
Подозрительны на заболевание лептоспирозом больные с острым лихорадочным заболеванием, жалобами на головную боль, общую слабость, боли в икроножных мышцах, носовое кровотечение, тошноту, рвоту, появление желтухи, уменьшение количества мочи. При объективном исследовании выявляется желтуха, увеличение размеров печени, петехиальная сыпь, инъекция сосудов склер и кровоизлияния в склеры, олигоанурия. Подозрение на лептоспироз может возникнуть также при остром развитии серозного менингита, особенно в эпидемический сезон (лето, осень).
В эпидемиологическом анамнезе важны контакт с малопроточной водой открытых водоемов, влажной почвой (рыбалка, купание, водные виды спорта, охота, туризм и др.) или контакт с животными (наличие в доме собак, крыс, мышей, риск профессионального заражения и др.), наличие риска профессионального заражения лептоспирозом.
Неспецифическая лабораторная диагностика
Со стороны периферической крови наблюдается нейтрофильный лейкоцитоз (10-20 × 109 /л) со сдвигом лейкоцитарной формулы влево, анэозинофилия, лимфопения, увеличение СОЭ до 50-60 мм/ч. При тяжелой форме лептоспироза развивается прогрессирующая анемия, тромбоцитопения 95-40 × 109 /л. В анализе мочи - гипоизостенурия, протеинурия, в осадке: лейкоциты, эритроциты, гиалиновые и зернистые цилиндры, почечный эпителий. Содержание мочевины в крови повышается до 50-90 ммоль/л, уровень креатинина - до 1400-1900 мкмоль/л. Гипербилирубинемия связана с повышением как связанного, так и свободного билирубина. Повышение общего билирубина крови выше 200 мкмоль/л является неблагоприятным прогностическим признаком. Уровень аминотрансфераз (АЛТ, АСТ) повышается не более чем в 2-3 раза. Определенное дифференциально-диагностическое значение имеет повышение КФК крови как показателя повреждения мышечной ткани.
Специфическая диагностика
Метод прямой микроскопии проводят с живыми возбудителями в темном поле зрения микроскопа. Для выявления лептоспир методом микроскопии готовят препарат «раздавленная капля». Отрицательный результат микроскопии цитратной крови не позволяет исключить лептоспироз.
Бактериологический метод имеет значение только для ретроспективного подтверждения диагноза.
Основным методом лабораторной диагностики лептоспироза является реакция микроагглютинации (РМА) лептоспир, а также реакция слайд-агглютинации, ИФА.
ПЦР при лептоспирозе характеризуется высокой специфичностью и чувствительностью (от 10 до 1000 клеток в пробе), а также высокой диагностической эффективностью на 1-й неделе заболевания (начиная с 1-х суток), даже на фоне антибиотикотерапии. Поэтому его можно рекомендовать как метод ранней экспресс-диагностики лептоспирозов. В качестве исследуемого клинического материала используют кровь, СМЖ, мочу. Диагностическая чувствительность лабораторного анализа при лептоспирозе значительно повышается при одновременном применении РМА и ПЦР вне зависимости от фазы заболевания.
Дифференциальная диагностика лептоспироза проводится с гриппом и ОРЗ, геморрагическими лихорадками, тифопаратифозными заболеваниями, вирусными и токсическими гепатитами, иерсиниозом, сепсисом и менингитами различной этиологии, а также другими болезнями, протекающими остро с лихорадкой и выраженным синдромом интоксикации.
С появлением желтухи у больных лептоспирозом наиболее частым ошибочным диагнозом является ВГ. Следует также проводить дифференциальный диагноз с токсическими гепатитами и малярией.
Лечение, режим, диета
-
Больные лептоспирозом подлежат обязательной госпитализации в инфекционные отделения многопрофильных больниц и инфекционные больницы. Медицинская помощь больным с неотложными состояниями оказывается в ОРИТ инфекционной или многопрофильной больницы.
-
Комплексная терапия лептоспироза включает постельный режим в течение всего лихорадочного периода. Больным лептоспирозом во время пребывания в стационаре назначается щадящий вариант диеты, рекомендуемый при заболеваниях почек и печени.
Медикаментозная терапия
Этиотропная терапия. Бензилпенициллин назначается внутримышечно в дозе от 4 до 6, в тяжелых случаях до 12 млн ЕД/сут в течение 5-10 дней, до 3-5-го дня нормальной температуры. В случаях лептоспирозного менингита дозу пенициллина увеличивают до 18 млн ЕД/сут. Эффективны также ЦС III поколения (цефотаксим, цефтриаксон), фторхинолоны II-IV поколений (ципрофлоксацин, левофлоксацин, моксифлоксацин).
Патогенетическая терапия определяется ведущим симптомо-комплексом и отличается в зависимости от периода и тяжести течения болезни. При легкой и среднетяжелой форме лептоспироза назначаются НПВС, антигистаминные препараты.
При тяжелой форме болезни особое значение приобретают методы интенсивной терапии, включающие дезинтоксикацию, коррекцию нарушений гомеостаза и функций жизненно важных органов. Инфузионную терапию проводят изотоническими растворами кристаллоидов.
Особого внимания требует правильная стартовая терапия ИТШ. Оптимизация гемодинамики достигается инфузией вазопрессоров - допамина (Дофамина♠), в резистентных случаях - в сочетании с норэпинефрином (Норадреналином♠).
При поражении легких необходима респираторная поддержка путем ингаляции увлажненного О2. При отсутствии эффекта - перевод на ИВЛ. Глюкокортикостероидная терапия проводится сочетанием преднизолона и дексаметазона в дозе из расчета по преднизолону 3-5 мг/кг/сут, для терапии ИТШ рекомендуется применять гидрокортизон.
Лечение ДВС-синдрома ведется с учетом его варианта и стадии. При коагуляционном варианте ДВС-синдрома основным компонентом терапии является применение антикоагулянтов (низкомолекулярные гепарины). При повышенной агрегационной активности тромбоцитов назначаются антиагреганты (пентоксифиллин по 100 мг внутривенно 2 р/сут). При наличии дефицита антитромбина II - инфузия СЗП в дозе 3-3,5 мл/кг/сут. При фибринолитическом варианте ДВС основным компонентом терапии являются ингибиторы протеаз - апротинин (Трасилол 50000♠). При коагулопатии потребления основным компонентом лечения является плазмаферез с инфузией больших доз СЗП (до 30 мл/кг/сут). Назначаются ингибиторы протеаз и гепарин натрия (Гепарин♠). При острой кровопотере с появлением одышки, сердцебиения, снижения АД применяется переливание эритромассы.
Лечение ОПН проводится по общим принципам: консервативными методами и эфферентными методами.
Для профилактики развития затяжного течения инфекционного процесса у больных лептоспирозом применяется иммунокоррекция (Галавит♠, Имунофан♠).
Стационарное лечение при легком течении лептоспироза продолжается в среднем 7-10 дней, при среднетяжелом - 14-21 день, при тяжелом - 28-35 дней.
Диспансерное наблюдение и реабилитация реконвалесцентов
Лица, переболевшие лептоспирозом, подлежат диспансерному наблюдению в течение 6 мес с обязательным клиническим осмотром офтальмологом, неврологом и терапевтом в первый месяц после выписки из стационара. При наличии стойких остаточных явлений переболевшие передаются под наблюдение специалистам по профилю клинических проявлений (офтальмологам, неврологам, кардиологам) не менее чем на 2 года.
Иксодовые клещевые боррелиозы
Иксодовые клещевые боррелиозы (болезнь Лайма, системный клещевой боррелиоз, лайм-боррелиоз) - группа природно-очаговых инфекционных болезней, вызываемых боррелиями, с трансмиссивным механизмом передачи, характеризующаяся преимущественным поражением кожи, нервной системы, сердца, суставов и склонностью к хроническому течению.
Коды по МКБ-10
А69.2 Болезнь Лайма. Хроническая мигрирующая эритема, вызванная Borrelia burgdorferi.
Этиология
Боррелии относятся к отделу Spirochaetes, классу Spirochaetales, семейству Spirochaetaceae, роду Borrelia. Возбудители иксодовых клещевых боррелиозов - грамотрицательные бактерии комплекса Borre-lia burgdorferi sensulato, к которому относят 14 видов боррелий. Основными из них являются B. burgdorferi sensustricto (болезнь Лайма в Северной Америке и Европе), B. garinii, B. afzelii (в Евразии) и некоторые другие виды (B. lusitaniae, B. valaisiana, B. spielmanii).
В 1995 г. японскими учеными был идентифицирован новый вид боррелий, передаваемых клещами, - B. miyamotoi. Проявления заболевания, вызванного B. miyamotoi, близки к картине возвратного клещевого боррелиоза.
Длина боррелий - 10-30 мкм, диаметр - около 0,2-0,25 мкм. Они способны активно передвигаться с помощью жгутиков. Боррелии выращивают на специальной жидкой питательной среде.
Разделение возбудителя на геномные группы имеет клиническое значение. Так, В. Burgdorferi sensustriсto ассоциируется с преимущественным поражением суставов, B. garinii - c развитием менингорадикулита, В. afzelii - с кожными поражениями.
Боррелии малоустойчивы в окружающей среде: гибнут при высыхании, хорошо сохраняются при низких температурах, при температуре 50 °С гибнут в течение 10 мин, погибают под действием ультрафиолетового облучения.
Эпидемиология
Иксодовые клещевые боррелиозы - облигатно-трансмиссивные природно-очаговые инфекции, распространенные преимущественно в умеренном климатическом поясе северного полушария, лесной ландшафтной зоне и связанные с клещами рода Ixodes. Источник возбудителя - иксодовые клещи: I. ricinus, I. persulcatus - в Европе и Азии; I. scapularis, I. pacificus - в Северной Америке. Резервуар возбудителя - мышевидные грызуны, дикие и домашние животные; птицы, распространяющие инфицированных клещей при миграционных перелетах. Клещи могут нападать на человека во всех стадиях жизненного цикла: личинка → нимфа → имаго. Установлена возможность транс-овариальной и трансфазовой передачи возбудителя у клещей.
Очаги иксодовых клещевых боррелиозов часто сопряжены с очагами клещевого энцефалита, поскольку имеют одних и тех же переносчиков - клещей I. persulcatus (таежный клещ) и I. ricinus (европейский лесной клещ). Весенне-летняя сезонность болезни обусловлена периодом активности клещей (май-сентябрь). Естественная восприимчивость людей близка к абсолютной. Случаи заболевания регистрируются среди всех возрастных групп. Чаще болеет взрослое трудоспособное население.
Постинфекционный иммунитет нестерильный; возможно повторное заражение.
В Российской Федерации официальная регистрация клещевых боррелиозов ведется с 1992 г. В настоящее время число заболеваний в отдельные годы достигает 10 000 случаев и превышает заболеваемость другими природно-очаговыми инфекциями.
Меры профилактики
Специфическая профилактика не разработана.
Мероприятия по предупреждению заражения: акарицидная обработка лесопарковых зон в природных очагах, использование репеллентов, защитной одежды и специальных противоклещевых костюмов, само- и взаимоосмотры в очагах, снятие клещей и их обследование на наличие боррелий. При положительных результатах исследования снятых переносчиков эффективна антибиотикопрофилактика доксициклином, бициллином-3♠, амоксициллином, амоксициллином-клавуланатом.
Патоморфология и патогенез
Из места присасывания со слюной клеща боррелии проникают в кожу. После размножения возбудителя в области входных ворот происходит лимфогенная и гематогенная диссеминация в ЛУ, внутренние органы, суставы, ЦНС. При этом наблюдается частичная гибель боррелий с высвобождением эндотоксина, обусловливающего интоксикацию.
Генерализация инфекции клинически проявляется системным поражением ЛУ, печени, мышц, сердечно-сосудистой и нервной системы, кожи. В это время возбудитель способен проникнуть в ЦНС, преодолев ГЭБ, в другие органы и ткани с преимущественным поражением ретикуло-эндотелиальной системы. Способность боррелий к длительной персистенции в организме приводит к хроническому течению инфекционного процесса.
В. burgdorferi стимулируют выработку различных медиаторов воспаления (ИЛ-1, ИЛ-6, ФНО-α), участвующих в развитии артритов. В патогенезе нейроборрелиоза предполагается участие аутоиммунных реакций.
Существенное значение имеют процессы, связанные с накоплением специфических иммунных комплексов, содержащих антигены боррелий, в синовиальной оболочке суставов, дерме, почках, миокарде.
Иммунный ответ у больных относительно слабый. В ранние сроки заболевания начинают вырабатываться IgM-антитела. IgG обнаруживаются позднее; их концентрация увеличивается через 1,5-3 мес после начала болезни.
Патоморфология иксодовых клещевых боррелиозов изучена в основном на основании гистологического исследования биоптатов кожи, лимфоузлов на аутопсии - исследования селезенки, вещества мозга и других органов. В области мигрирующей эритемы выявляют дистрофические изменения эпителия, расстройства микроциркуляции. Во внутренних органах в очагах имеется слабая или умеренная лимфоцитарно-макрофагальная периваскулярная инфильтрация, инфильтрация пораженных тканей.
Клиническая картина
Клиническая классификация. Единой классификации иксодовых клещевых боррелиозов нет. Обычно используют классификацию А.С. Steer (табл. 16-22).
| Течение | Стадия | Степень тяжести |
|---|---|---|
Субклиническое |
- |
- |
Острое |
Ранняя локализованная инфекция. Ранняя диссеминированная инфекция |
Легкая. Средней тяжести. Тяжелая |
Хроническое |
Ремиссия Обострение |
- |
Инкубационный период от 5 до 30 дней, чаще 10-14 дней.
Наиболее частый вариант - субклиническое течение инфекции. Факт заражения подтверждают нарастанием титра специфических антител в парных сыворотках. Острое течение (от нескольких недель до 6 мес) включает в себя две последовательные стадии - раннюю локализованную инфекцию и раннюю диссеминированную инфекцию. Хроническая форма болезни может длиться пожизненно.
Стадия ранней локализованной инфекции
Начало заболевания острое или подострое. Первые симптомы болезни неспецифичны: утомляемость, озноб, жар, повышение температуры, головная боль, головокружение, слабость, ломота в мышцах, боли в костях и суставах. Нередки катаральные явления (першение в горле, сухой кашель и др.), являющиеся причиной диагностических ошибок.
Основное проявление ранней локализованной стадии иксодовых клещевых боррелиозов - мигрирующая эритема в месте присасывания клеща. В течение нескольких дней участок гиперемии расширяется (мигрирует) во все стороны, в центре кожа бледнеет.
Возможна уртикарная сыпь, небольшие преходящие красные точечные и кольцевидные высыпания и конъюнктивит. У трети больных отмечают увеличение регионарных ЛУ.
Острый период может протекать без эритемы. В этом случае в клинической картине превалирует общеинфекционный синдром, рецидивирующая лихорадка, симптомы поражения оболочек мозга.
Исходом I стадии может быть полное выздоровление или даже при нормализации температуры и исчезновении эритемы болезнь переходит в стадию диссеминированной инфекции.
Стадия ранней диссеминированной инфекции
Развивается через несколько недель или месяцев после окончания стадии ранней локализованной инфекции. Гематогенное распространение возбудителя чаще всего сопровождается изменениями со стороны нервной и сердечно-сосудистой системы, кожных покровов. Поражение нервной системы обычно развивается на 4-10-й неделе болезни и выражается в развитии невритов черепных нервов, менингита, радикулоневрита, лимфоцитарного менингорадикулоневрита (синдром Баннварта).
Синдром Баннварта - вариант нейроборрелиоза, распространенный в Западной Европе. Ему свойственны вялое течение, выраженные радикулярные (преимущественно ночные) боли, лимфоцитарный плеоцитоз в СМЖ.
Поражения сердца при лайм-боррелиозе довольно разнообразны: нарушения проводимости (атриовентрикулярная блокада - от I степени до полной поперечной блокады), ритма, миокардит, перикардит.
В этот период у больных возникают преходящие множественные эритематозные высыпания на коже. Реже обнаруживают паротит, конъюнктивит, ирит, хориоидит, ретинит, панофтальмит, органов дыхания (фарингит, трахеобронхит), мочеполовой системы (орхит и др.).
Стадия хронической инфекции
Хроническому течению свойственно преимущественное поражение суставов, кожи и нервной системы. Обычно у больных наблюдают прогрессирующие артралгии, сменяющиеся хроническим полиартритом. У большинства пациентов рецидивы артрита отмечают на протяжении ряда лет.
В некоторых случаях хроническая инфекция протекает в виде доброкачественной лимфоцитомы кожи и хронического атрофического акродерматита. Доброкачественная лимфоцитома кожи характеризуется узелковыми элементами, опухолями или нечетко отграниченными инфильтратами.
Хроническому атрофическому акродерматиту свойственна атрофия кожи, которая развивается после предшествующей воспалительно-инфильтративной стадии.
Хроническое течение болезни характеризуется чередованием периодов ремиссий и обострений, после которых в инфекционный процесс вовлекаются другие органы и системы.
Диагностика
Клиническая диагностика боррелиоза может быть достоверна при наличии таких типичных специфических признаков, как кольцевая мигрирующая эритема, хронический атрофический акродерматит, синдром Баннварта, двусторонний неврит лицевого нерва, при наличии соответствующего эпидемиологического анамнеза. Мигрирующая эритема - патогномоничный симптом, обнаружения которого достаточно для постановки окончательного диагноза даже без лабораторного подтверждения. В остром периоде болезни характерен лейкоцитоз, повышение СОЭ.
Специфическая диагностика
Боррелии выявляют в иксодовых клещах, снятых с человека, с помощью световой микроскопии (окраска по Романовскому-Гимзе), темнопольной и люминесцентной микроскопии.
Боррелии можно выделить с использованием среды BSK2 у больных из очагов кожных поражений, из крови, СМЖ.
Посредством ПЦР выявляют ДНК боррелий в биоптатах кожи с мест присасывания клещей, СМЖ, крови, моче).
Наибольшее распространение в клинической практике получила серологическая диагностика (ИФА, РНИФ). Для исключения ложно-положительных реакций используют иммуноблоттинг. Исследования на наличие антител к боррелиям желательно проводить в динамике в парных сыворотках, взятых с интервалом в 2-4 нед.
Дифференциальная диагностика
Дифференциальную диагностику проводят с другими трансмиссивными заболеваниями со сходным ареалом распространения (см. табл. в разделе «Клещевой энцефалит»). Изолированное поражение суставов необходимо дифференцировать от инфекционного артрита, реактивного полиартрита, а в сочетании с патологией кожи - от системных заболеваний соединительной ткани, при неврологических нарушениях - от других воспалительных заболеваний периферической и ЦНС. При развитии миокардита, АВ-блокады нужно исключить инфекционный миокардит другой этиологии.
Лечение
Госпитализации подлежат следующие категории больных: со среднетяжелым и тяжелым течением болезни, при подозрении на микст-инфекцию с вирусом клещевого энцефалита, при отсутствии эритемы (для проведения дифференциальной диагностики). Специальной диеты для больных не требуется (стол № 15). Режим активности больного определяется тяжестью течения заболевания.
Основу лечения составляют антибактериальные препараты, дозы и длительность приема которых определяются стадией и формой болезни (табл. 16-23).
При менингите, менингоэнцефалите - цефтриаксон 4,0 г внутривенно однократно 10-14 дней.
В случаях микст-инфекции (лайм-боррелиоз и клещевой энцефалит) наряду с антибиотиками применяют иммуноглобулин против клещевого энцефалита. Дезинтоксикационную терапию проводят по общим принципам. По индивидуальным показаниям применяют сосудистые средства, антиоксиданты. В период реабилитации проводят гипербарическую оксигенацию, лечебную физкультуру, массаж. Санаторно-курортное лечение показано пациентам в стадии ремиссии при хроническом течении с поражением костно-суставной и нервной системы.
Прогноз для жизни благоприятный. При поздно начатой или неадекватной терапии заболевание прогрессирует, приобретает хроническое течение и часто приводит к инвалидизации.
Диспансерное наблюдение в условиях поликлиники осуществляет врач общей практики или врач-инфекционист в течение 2 лет. В случае перенесенной микст-инфекции с клещевым энцефалитом срок диспансерного наблюдения увеличивают до 3 лет.
Санаторно-курортное лечение показано в стадии ремиссии при хроническом течении с поражением костно-суставной и нервной систем.
| Характер течения | Форма | Препарат | Разовая доза | Способ введения | Кратность приема в сутки | Длительность, сут |
|---|---|---|---|---|---|---|
Острое |
Стадия ранней локализованной инфекции |
Основной препарат - доксициклин |
0,1 г |
Внутрь |
2 |
10 |
Препараты выбора |
||||||
Амоксициллин |
0,5 г |
Внутрь |
3 |
10 |
||
Цeфикcим |
0,4 г |
Внутрь |
1 |
10 |
||
Aзитpoмицин |
0,5 г |
Внутрь |
1 |
10 |
||
Амоксициллин |
0,375 г |
Внутрь |
||||
клaвyлaнoвaя кислота (Aмoкcиклaв♠) |
3 |
10 |
||||
Стадия ранней диcceминиpoвaннoй инфекции |
Основной препарат - цефтриаксон |
2г |
В/м |
1 |
14 |
|
Альтернативные препараты |
||||||
Цефотаксим |
2г |
В/м |
3 |
14 |
||
Пенициллин |
0,5-2 млн ЕД |
В/м |
8 |
14 |
||
Доксициклин |
0,2 г |
Внутрь |
1 |
14 |
||
Амоксициллин |
0,5 г |
Внутрь |
3 |
14 |
||
Хроническое |
Основной препарат - цефтриаксон |
2г |
В/м |
1 |
21 |
|
Препараты выбора |
||||||
Цефотаксим |
2г |
В/м |
3 |
21 |
||
Пенициллин |
2-3 млн ЕД |
В/м, в/в |
6-8 |
21 |
||
Столбняк
Столбняк - острая инфекционная болезнь из группы сапрозоонозов с контактным механизмом передачи возбудителя, характеризующаяся мышечным гипертонусом и приступами генерализованных судорог, обусловленных действием токсина возбудителя.
Коды по МКБ-10
A33 Столбняк новорожденного.
A34 Акушерский столбняк.
A35 Другие формы столбняка.
Этиология
Возбудитель столбняка Clostridium tetani относится к семейству Васillасеае, роду Clostridium, имеет форму палочки длиной 4-8 мкм, диаметром 0,4-0,6 мкм, с закругленными концами; она подвижна, при доступе кислорода образует круглую спору, расположенную терминально, что придает ей вид барабанной палочки, грамположительна. Возбудитель столбняка - строгий анаэроб, хорошо растет на простых питательных средах. Cl. tetani имеет жгутиковый Н-антиген, специфический, термолабильный и групповой соматический О-антиген. Основным фактором патогенности является фрагмент экзотоксина - тетаноспазмин, который поражает клетки нервной системы, вызывает тоническое сокращение поперечнополосатых мышц.
Вегетативные формы чувствительны к воздействию физических и химических агентов, при температуре 60-70 °С погибают в течение 30 мин. Споры обладают устойчивостью к действию физических и химических факторов, при кипячении погибают через 30-50 мин; 5% раствор сулемы вызывает их гибель через 8-10 ч.
Эпидемиология
Столбнячные палочки являются постоянным обитателем кишечника преимущественно жвачных животных, попадают с фекалиями в почву и сохраняются в ней в виде спор десятилетиями. При наличии анаэробных условий споры прорастают и происходит накопление возбудителя, например в скотомогильниках. Таким образом, почва служит естественным резервуаром возбудителя. Чаще болеют новорожденные и люди, работающие в сельском хозяйстве. Механизм передачи возбудителя столбняка контактный. Заболевание связано с травматизмом, когда в рану из почвы попадают споры. Заражение возможно во время внебольничных родов. Заболевание может возникнуть в случае даже незначительных повреждений кожи и слизистых оболочек (уколы острыми предметами, занозы), при ожогах, отморожениях. В настоящее время столбняк встречается обычно в виде спорадических случаев. В Российской Федерации в 2015-2016 гг. заболеваемость столбняком не зарегистрирована. Значительное количество заболеваний может наблюдаться во время войн. Высокая заболеваемость, преимущественно новорожденных, сохраняется в ряде развивающихся стран.
Иммунитет после перенесенного заболевания непродолжительный и слабонапряженный; возможно повторное заболевание. От матери, вакцинированной против столбняка, новорожденным передается непродолжительный пассивный антитоксический иммунитет.
Профилактические мероприятия при столбняке
С целью предупреждения возникновения заболеваний столбняком проводят неспецифическую и специфическую профилактику.
Неспецифическая профилактика направлена на предупреждение травматизма в быту и на производстве, исключение возможности заражения операционных, пупочных и других ран, раннюю и тщательную хирургическую обработку ран.
Специфическую профилактику (иммунопрофилактику) проводят в виде плановой активной иммунизации детей и взрослых и экстренной иммунопрофилактики для предупреждения возникновения столбняка в случае травм.
Плановая специфическая профилактика столбняка
Наиболее эффективным методом предупреждения столбняка является иммунизация анатоксином столбнячным [Анатоксин столбнячный очищенный адсорбированный жидкий (АС-анатоксин)♠]. Защита от столбняка у детей создается путем иммунизации вакциной для профилактики дифтерии, коклюша и столбняка [Вакцина коклюшно-дифтерийно-столбнячная адсорбированная жидкая (АКДС-вакцина)♠] или анатоксином дифтерийно-столбнячным [Анатоксин дифтерийно-столбнячный очищенный адсорбированный жидкий (АДС-анатоксин)♠], у подростков и взрослых - анатоксином дифтерийно-столбнячным [Анатоксин дифтерийно-столбнячный очищенный адсорбированный с уменьшенным содержанием антигенов жидкий (АДС-М-анатоксин)♠] или АС-анатоксином.
Экстренная иммунопрофилактика столбняка
Экстренная иммунопрофилактика осуществляется дифференцированно в зависимости от предшествующей иммунизации пациента против столбняка путем введения АС-анатоксина или АДС-М-анатоксина (экстренная ревакцинация) либо с помощью активно-пассивной иммунизации путем одновременного введения АС-анатоксина и противостолбнячной сыворотки (ПСС) или противостолбнячного человеческого иммуноглобулина (ПСЧИ). Одна профилактическая доза ПСС составляет 3000 МЕ; одна профилактическая доза ПСЧИ составляет 250 МЕ. Экстренную профилактику столбняка проводят при: травмах с нарушением целостности кожных покровов и слизистых оболочек; обморожениях и ожогах (термических, химических, радиационных) II, III и IV степени; проникающих повреждениях ЖКТ, прободениях (при хирургических операциях на ЖКТ в стационарах экстренная профилактика не проводится); внебольничных абортах; родах вне медицинских учреждений; гангрене или некрозе тканей любого типа, длительно текущих абсцессах, карбункулах, остеомиелитах; укусах животными.
Патоморфология и патогенез
Столбняк - нейроинфекция с поражением соответствующих структур ЦНС (спинной и продолговатый мозг). Входными воротами возбудителя инфекции является поврежденная кожа, реже - слизистые оболочки. Особенно опасны раны, в которых создаются анаэробные условия, - колотые, с некротизированными тканями, гематомами, инородными телами. Столбняк с невыясненными воротами инфекции относят к криптогенному. В условиях анаэробиоза из спор прорастают вегетативные формы, которые размножаются и выделяют экзотоксин. Токсин достигает спинного и продолговатого мозга, где вызывает паралич вставочных нейронов эфферентных полисинаптических рефлекторных дуг, снимая их тормозящее влияние на мотонейроны. Вследствие паралича вставочных нейронов импульсы с мотонейронов дискоординированно поступают на периферию к скелетным мышцам, вызывая их постоянное тоническое напряжение. Периодические судороги связаны с усиленной афферентной и соответственно эфферентной импульсацией, что обусловлено раздражителями - звуковыми, световыми, тактильными, вкусовыми, обонятельными, термо- и бароимпульсными. Поражаются дыхательный центр, ядра блуждающего нерва. Блокада нейронов ретикулярной формации ствола мозга способствует торможению парасимпатической нервной системы, что приводит к активации симпатической нервной системы, артериальной гипертензии, тахикардии, аритмии, усилению потоотделения, гиперсаливации и обезвоживанию, что усиливает ацидоз и потенцирует судорожный синдром. Судорожный синдром приводит к развитию метаболического ацидоза, гипертермии, нарушению функции дыхания (асфиксии) и кровообращения.
Патоморфологические изменения в организме возникают вследствие повышенной функциональной нагрузки при судорогах. В скелетных мышцах обнаруживают коагуляционный некроз, который нередко приводит к разрыву мышц с образованием гематом. Иногда наблюдают компрессионные переломы грудных позвонков. Прямое действие токсина на сосудодвигательный и дыхательный центры приводит к асфиксии и остановке сердца, что является причиной смерти. Гистологические изменения в ЦНС незначительны.
Клинические проявления
По распространенности процесса заболевание разделяют на общий (генерализованный) и местный столбняк. Последний наблюдают редко.
По тяжести течения различают легкую, среднетяжелую, тяжелую форму и очень тяжелую форму болезни.
Инкубационный период варьирует от нескольких дней до 1 мес, в среднем 1-2 нед. Имеется четкая обратная зависимость тяжести течения болезни от длительности инкубационного периода. Заболевание начинается остро, лишь иногда отмечают продромальные явления в виде напряжения и подергивания мышц в месте ранения, недомогания, головной боли, потливости, раздражительности. Различают три периода болезни: начальный, судорожный (разгара), выздоровления.
В начальном периоде столбняка в части случаев может проявиться его наиболее ранний признак - тупые тянущие боли в области входных ворот инфекции, даже в уже полностью заживших ранах, фибриллярные подергивания прилегающих мышц, потливость, повышенная раздражительность. Основные специфические симптомы, возникающие в этот период, - тризм, «сардоническая улыбка», дисфагия и ригидность затылочных мышц. Эти признаки появляются рано и почти одновременно.
Тризм - тоническое напряжение жевательных мышц - приводит к затрудненному открыванию рта. Повышается тонус мимической мускулатуры, появляется застывшая маска - «сардоническая улыбка» (risus sardonicus), придающая лицу больного своеобразное выражение: морщинистый лоб, суженные глазные щели, растянутые губы, опущенные (или приподнятые) уголки рта. Дисфагия (затрудненное болезненное глотание) обусловлена судорожным спазмом мышц глотки. Сочетание тризма, «сардонической улыбки» и дисфагии характерно только для столбняка. Наблюдается ригидность затылочных мышц, обусловленная тоническим напряжением мышц шеи.
В разгар заболевания гипертонус распространяется на мышцы туловища и конечностей (не захватывая кисти и стопы). Тоническое напряжение мышц постоянно, расслабления мышц не происходит даже во сне. С 3-4-го дня болезни мышцы брюшной стенки становятся твердыми, ноги чаще вытянуты, движения в них ограничены. Одновременно в процесс вовлекаются межреберные мышцы и диафрагма, дыхание становится поверхностным и учащенным. Тоническое напряжение мышц промежности приводит к затруднению дефекации и мочеиспускания. В результате выраженного напряжения мышц спины развивается опистотонус: при положении больного на спине голова его запрокинута назад, поясничная часть тела приподнята над кроватью таким образом, что между спиной и постелью можно просунуть руку. Если преобладает тоническое сокращение мышц брюшного пресса, возникает вынужденное положение тела с согнутым вперед туловищем - эмпростотонус. К постоянным симптомам болезни относятся интенсивная боль в мышцах вследствие их постоянного тонического напряжения и чрезмерного функционирования и тетанические судороги, приступы генерализованных судорог, после которых, в отличие от клонических судорог, сохраняется мышечный гипертонус. Их продолжительность колеблется от нескольких секунд до минуты. Чаще всего их провоцируют слуховые, зрительные болевые и тактильные раздражители. В легких случаях заболевания наблюдают 1-2 приступа судорог в день, при тяжелом течении столбняка они могут повторяться десятки раз в течение часа, становятся более длительными и распространенными. Приступы судорог возникают внезапно. Повышается температура тела, кожа (особенно лица) покрывается крупными каплями пота, отмечают гиперсаливацию, тахикардию, одышку. Тоны сердца громкие, АД склонно к повышению. Судорожный синдром развивается и усиливается при сохранении ясного сознания больного, спутанное сознание и бред появляются лишь незадолго до смерти. Тяжелые приступы судорог дыхательных мышц, гортани и диафрагмы резко нарушают акт дыхания и могут привести к асфиксии и смерти. Нарушения дыхания, кровообращения обусловливает возникновение аспирационной пневмонии. Спазм глотки нарушает акт глотания, что вместе с тризмом, усиленным потоотделением и гиперсаливацией приводит к голоданию и обезвоживанию. Постоянный общий гипертонус, частые приступы судорог приводят к резкому усилению теплопродукции и гипертермии (до 41-42 °С). Изменения со стороны органов кровообращения характеризуются со 2-3-го дня болезни тахикардией.
В случаях благоприятного исхода период реконвалесценции длительный; постепенно ослабевающие клинические проявления заболевания сохраняются 2-4 нед, выздоровление затягивается до 1,5-2 мес. Сначала прекращаются приступы судорог, затем исчезает мышечный гипертонус.
Тяжесть течения столбняка определяется совокупностью нескольких показателей.
При легком течении заболевания инкубационный период чаще превышает 20 дней. Тризм, «сардоническая улыбка» и опистотонус умеренные, гипертонус других групп мышц слабо выражен. Температура тела нормальная или субфебрильная. Симптомы болезни нарастают в течение 3-5 дней. В случаях среднетяжелого течения инкубационный период составляет 15-20 дней. Основные клинические признаки заболевания нарастают за 3-4 дня. Судороги возникают несколько раз в сутки, тахикардия и потливость умеренные, температура тела субфебрильная или (реже) высокая. Тяжелая форма столбняка отличается укороченным до 7-14 дней инкубационным периодом, быстрым (за 1-2 дня) нарастанием симптомов, типичной клинической картиной с частыми и интенсивными тетаническими судорогами (несколько раз в течение часа), выраженными потливостью и тахикардией, высокой лихорадкой. Очень тяжелое течение отличают укороченный (менее недели) инкубационный период и молниеносное развитие заболевания. Общие судороги возникают несколько раз в течение часа. Их сопровождают гиперпирексия, выраженная тахикардия и тахипноэ, цианоз, угрожающая асфиксия.
Одна из тяжелейших форм генерализованного нисходящего столбняка - головной («бульбарный») столбняк Бруннера. Он протекает с преимущественным поражением мышц лица, шеи и глотки, со спазмами глотательных и межреберных мышц, мышц голосовой щели и диафрагмы. Обычно происходит поражение дыхательного, сосудо-двигательного центров и ядер блуждающего нерва. Тяжестью течения и неблагоприятным прогнозом отличаются также гинекологический столбняк и столбняк новорожденных, являющийся одной из важных причин детской смертности в развивающихся странах. Он связан с неудовлетворительными условиями оказания акушерской помощи и отсутствием программ иммунизации женщин.
Местный столбняк встречают редко. Одним из его типичных проявлений, развивающихся после ранений лица и головы, бывает лицевой паралитический столбняк Розе. Возникают тризм, ригидность затылочных мышц, «сардоническая улыбка», к которым присоединяются парезы черепных нервов. Поражение обычно двустороннее, более выражено на стороне ранения.
При определении прогноза столбняка большое внимание уделяют периоду между появлением первых признаков болезни (тризма и других) и возникновением судорог. Если этот период составляет менее 48 ч, прогноз заболевания неблагоприятный.
Осложнения
Одно из опасных осложнений столбняка - асфиксия. К осложнениям также относят пневмонию, разрывы мышц, переломы костей, компрессионные деформации позвоночника. Нарастающая при судорогах гипоксия может способствовать развитию спазма коронарных сосудов и инфаркту миокарда, остановке сердечной деятельности. В период выздоровления возможны мышечные контрактуры и параличи III, VI и VII пар черепных нервов. Столбняк новорожденных может осложняться сепсисом.
Диагностика
Диагноз столбняка ставят на основании клинических данных. Специфические симптомы столбняка: тризм, «сардоническая улыбка», дисфагия и ригидность затылочных мышц, сочетание которых характерно только для столбняка. В разгаре заболевания присоединяется болезненное тоническое напряжение мышц туловища и конечностей, а на их фоне - периодические, внезапно возникающие судороги тетанического характера, частота и продолжительность которых во многом определяет тяжесть заболевания.
Дифференциальная диагностика проводится с менингитом, энцефалитом, бешенством, эпилепсией, спазмофилией, отравлением стрихнином, истерией, у новорожденных - с внутричерепной травмой.
Лабораторная диагностика. При типичной клинической картине выделение возбудителя и его идентификация могут не потребоваться. Наиболее рационально исследование различного материала, взятого в месте ранения.
Параллельно бактериологическому анализу проводят выявление столбнячного экзотоксина в биологической пробе на мышах.
Лечение
Лечение столбняка проводят в ОРИТ с участием анестезиолога. Необходимо обеспечить охранительный режим, исключающий слуховые, зрительные и тактильные раздражители. Кормление больных осуществляют через зонд или парентерально (при парезе ЖКТ). Проводят профилактику пролежней: частое поворачивание больного в постели, разглаживание смятого постельного и нательного белья, его чистку и периодическую смену. Инфицированную рану, даже зажившую, обкалывают ПСС (в дозе 1000-3000 ME), затем проводят тщательную ревизию и хирургическую обработку раны с широкими лампасными разрезами (для создания аэробных условий), удалением инородных тел, загрязненных и некротизированных тканей. Для предупреждения судорог эти манипуляции проводят под наркозом.
Для нейтрализации столбнячного экзотоксина, циркулирующего в кровотоке, однократно вводят внутримышечно 50 000 ME ПСС или 1500-10 000 ЕД (средняя доза 3000 ЕД) специфического человеческого иммуноглобулина с предварительной проверкой индивидуальной чувствительности к ним. Эти препараты следует вводить в максимально ранние сроки, поскольку столбнячный токсин свободно циркулирует в крови не более 2-3 сут, а связанный токсин не инактивируется.
Борьбу с судорожным синдромом проводят применением противосудорожных седативных, наркотических, нейроплегических средств и миорелаксантов. Используют диазепам по 5-10 мг внутрь каждые 2-4 ч; в тяжелых случаях его вводят внутривенно по 10-20 мг каждые 3 ч. Детям препарат назначают внутривенно или внутримышечно по 0,1-0,3 мг/кг каждые 6 ч (максимально до 10-15 мг/кг в сутки). Применяют инъекции смеси 2,5% раствора хлорпромазина (Аминазин♠), 1% раствора тримеперидина (Промедол♠) и 1% раствора дифенгидрамина (Димедрол♠) (по 2 мл каждого препарата) с добавлением 0,5 мл 0,05% раствора скополамина гидобромидаρ. Назначают также диазепам (Седуксен♠), барбитураты, натрия оксибутират, в тяжелых случаях - дроперидол, фентанил, курареподобные миорелаксанты (пипекурония бромид, d-тубокурарина хлорид). При лабильности симпатической нервной системы иногда применяют α- и β-блокаторы. При расстройствах дыхания проводят интубацию или трахеотомию, миорелаксацию сочетают с ИВЛ, очищением дыхательных путей аспиратором; больным дают увлажненный кислород. Эффективна гипербарическая оксигенация.
Для лечения бактериальных осложнений применяют β-лактамные антибиотики - ампициллин до 4,0 г/сут, цефтриаксон до 4,0 г/сут, левофлоксацин до 0,4 г/сут. Применение антибиотиков не исключает возможности развития пневмоний и других вторичных инфекций.
Борьбу с ацидозом и обезвоживанием проводят внутривенными вливаниями 4% раствора натрия гидрокарбоната (Натрия бикарбонат♠), полиионных растворов.
Прогноз серьезный. При относительно малой заболеваемости летальность достаточно высока (до 30-50% и более), особенно у новорожденных (до 80-100%).
Диспансерное наблюдение за переболевшими осуществляют в течение 2 лет.
Ботулизм
Определение
Ботулизм - острая инфекционная болезнь из группы сапрозоонозов, вызываемая блокадой передачи нервных импульсов токсиномов возбудителя и характеризующаяся парезами и параличами поперечнополосатых и гладких мышц.
Выделяют пищевой ботулизм, ботулизм новорожденных и раневой ботулизм. Пищевой ботулизм, составляющий более 98% всех случаев, вызывается токсином, содержащимся в употребляемых пищевых продуктах. При раневом ботулизме токсин продуцируется микроорганизмом в инфицированных тканях, а при ботулизме новорожденных - в ЖКТ.
Код по МКБ-10
А05.1 Ботулизм.
Этиология
Сl. воtuliпит - анаэробная, грамположительная палочка семейства Bacillaceae рода Clostridium, образующая термостабильные споры, достаточно широко распространенные в природе. В пробах почвы споры Сl. воtuliпит обнаруживаются с частотой до 10%. В благоприятных условиях для прорастания спор и размножения Сl. bоtuliпит (низкое парциальное давление кислорода, наличие питательных веществ и пр.) начинается выработка самого сильного из известных токсинов. Летальная доза для человека составляет не более 0,0000003 г. Оптимальная температура роста и токсинообразования - +28-35 °С, т.е. ниже температуры тела теплокровных животных, однако продукция токсина может продолжаться и при +3 °С, т.е. при температуре домашнего холодильника, причем очень строгих анаэробных условий для образования токсина (особенно типа Е) не требуется.
По антигенной структуре различают 7 типов токсина, которые продуцируются 7 типами возбудителя: А, В, С, D, Е, F, G. Однако патологию человека в основном определяют 4 из них: А, В, Е и F.
Токсин ботулизма отличается высокой устойчивостью: под воздействием прямых солнечных лучей и кислорода атмосферы он сохраняет свою активность до 118 ч, в водных растворах с рН среды ниже 7 - в течение многих суток; высокие концентрации поваренной соли (до 18%) не оказывают на него инактивирующего воздействия. В то же время токсин в течение 10 мин полностью разрушается при нагреве до 100 °С, инактивируется щелочными растворами (рН ≥8), и, частично, этанолом. Вегетативные формы гибнут при 80 °С в течение 30 мин. Споры высокоустойчивы к физическим факторам, при кипячении гибнут через 5 ч, при автоклавировании - через 10 мин.
Эпидемиология
Важным источником спор ботулизма являются жвачные животные, в многокамерных желудках которых имеются анаэробные условия для размножения возбудителя, вегетативные формы которых, выделяясь с испражнениями, превращаются в споры. В почве, в придонном иле водоемов периодически создаются анаэробные условия, способствующие образованию вегетативных форм возбудителя и его размножению. Летом в непроточных водоемах происходит интенсивное размножение одноклеточных водорослей, которые потребляют кислород, создавая условия для размножения клостридий. Анаэробные условия создаются аэробной флорой при процессах брожения (например, в силосных башнях), в пищевых продуктах, даже не герметизированных, при которых происходит накопление клостридий и спорообразование. Широкое распространение в природе спор Сl. botulinum приводит к попаданию их в организм различных животных, рыб. Они могут заноситься с пылью на пестики цветов медоносных растений, а затем вместе с нектаром, собираемым пчелами, в мед, в детские питательные смеси, содержащие мед.
Таким образом, при пищевом ботулизме инфекционный процесс как таковой имеет второстепенное значение, так как клинические проявления ботулизма обусловливаются экзогенно выработанным токсином.
Источником ботулотоксина для человека чаще всего являются консервы домашнего приготовления, в которых в результате герметизации или размножения аэробной флоры создаются анаэробные условия. При этом содержащие токсин консервы не изменяют ни своего внешнего вида, ни органолептических свойств. Вопреки широко распространенному заблуждению бомбажа консервных банок также не наблюдается, так как жизнедеятельность Cl. botulinum не сопровождается газообразованием. Указанные изменения обычно связаны с размножением в консервах других клостридий, обычно Cl. perfringens. Не требуется и абсолютной герметичности - описаны случаи ботулизма после употребления в пищу соленых грибов, приготовленных в таре большого объема «под гнетом».
Недавно стали регистрироваться случаи ботулизма, связанные с употреблением в пищу соленой (вяленой) рыбы, в вакуумной упаковке.
Заболеваемость ботулизмом по РФ за последнее десятилетие составляет 300-400 случаев в год с летальностью 7-9%.
Профилактика. Активная иммунизация осуществляется только лицам, имеющим контакт с возбудителями ботулизма и их токсинами. В профилактике ботулизма существенное значение имеет строгое соблюдение ГОСТов (ТУ) на производстве консервов и санитарное просвещение населения в отношении правил консервирования продуктов питания, которые могут стать причиной ботулизма. В частности, важно тщательное мытье грибов, овощей, удаление кишечника при засоле рыбы. Перед употреблением домашних консервов их целесообразно прокипятить на водяной бане в течение 15 мин.
Патогенез
Начальным звеном патогенеза пищевого ботулизма является всасывание токсина из верхних отделов ЖКТ. Токсин гематогенным путем попадает в нервно-мышечные синапсы. Ботулинический токсин через ГЭБ не проникает. Токсин не проходит через плаценту и специфического поражения плода не вызывает. Ботулотоксин блокирует передачу нервных импульсов на холинергических нервно-мышечных синапсах, где медиатором является ацетилхолин (поперечно-полосатая мускулатура, гладкая мускулатура, иннервируемая парасимпатической нервной системой.
Исключить роль самого возбудителя при пищевом ботулизме нельзя: возможность удлинения инкубации до 5 сут, обострения в процессе болезни, случаи с невыясненным продуктом - источником заражения, в частности у потребителей наркотиков, наличие антимикробных антител у 30% переболевших.
Клиническая картина
Инкубационный период ботулизма - от 2-4 ч до 2-3 и даже 5 сут.
Почти у половины больных первыми клиническими проявлениями ботулизма являются симптомы поражения ЖКТ: тошнота, рвота до 3-5 раз, 2-4-кратный жидкий стул, а также кратковременное повышение температуры тела. Появление неврологической симптоматики на фоне или вслед за желудочно-кишечными проявлениями знаменует собой дальнейшее прогрессирование процесса. Симптомы поражения ЖКТ в начальном периоде связаны с наличием в продуктах энтеропатогенной флоры (Cl. perfringens, стафилококка).
При отсутствии диспепсических проявлений, как правило, первой жалобой большинства больных ботулизмом являются резкая слабость и нарушение зрения - появление «тумана» и/или «пелены» перед глазами, расплывчатость контуров предметов, диплопия, усиливающаяся при взгляде в сторону. При осмотре определяется более или менее выраженное ограничение движений глазных яблок во все стороны, мидриаз, анизокория и вялость или отсутствие зрачковых реакций (на свет, на конвергенцию, аккомодацию, косоглазие, двусторонний птоз). Иногда в крайних отведениях выявляется нистагм, как правило горизонтальный; корнеальный и конъюнктивальный рефлексы угнетаются. В тяжелых случаях болезни возможна офтальмоплегия - неподвижность глазных яблок с отсутствием зрачковых реакций. Косоглазие, анизокория, диплопия обусловлены неполным совпадением выраженности парезов глазодвигателей и орбикулярной мышцы зрачка справа и слева. Нарушение глотания и сухость во рту - почти столь же ранние симптомы, как и расстройства зрения. В наиболее легких случаях возможны лишь жалобы на чувство «комка» в горле или незначительное затруднение при глотании твердой, сухой пищи. По мере прогрессирования болезни нарушается глотание пищи мягкой и жидкой консистенции. Возможность питья жидкости ограничивается в самую последнюю очередь. Парез надгортанника и мягкого нёба приводит к тому, что проглатываемая жидкость частично попадает в трахею, вызывая поперхивание, а частично выливается через нос.
Атропиноподобное действие ботулотоксина на вегетативную нервную систему приводит к выраженной гипосаливации и ощущению сухости во рту и жажды. При исследовании полости рта обращают на себя внимание сухость слизистых ротовой полости, свисание (неподвижность) или ограничение подвижности мягкого нёба, снижение или отсутствие глоточного и нёбного рефлексов.
Меняется и голос больных - появляются охриплость, носовой оттенок речи - «гнусавость», ее смазанность и невнятность. Объясняется это парезами мышц мягкого нёба, языка и голосовых связок, зиянием голосовой щели. Крайняя степень этих нарушений выражается в афонии и анартрии. Парез языка, мягкого нёба, надгортанника и голосовых связок способствует аспирации пищи, жидкости, слюны и слизи из ротоглотки. Важным клиническим признаком является парез лицевого нерва по периферическому типу. Характерна общая миастения, больные не могут идти, сидеть и даже стоять, голову поддерживают в положении сидя руками.
Однако важнейшим и наиболее грозным проявлением ботулизма является поражение диафрагмы и межреберных мышц с развитием ОДН. Объективные признаки ОДН - снижение МОД, рО2 артериальной крови - часто появляются до клинических симптомов ДН, так как больные из-за миастении снижают свою дыхательную активность. Часто первым симптомом является разорванность речи. Больные после произнесения 3-5 слов должны сделать вдох. Появляется одышка, чувство нехватки воздуха, тахипноэ. ДН может прогрессировать различными темпами от внезапной остановки дыхания («смерть на полуслове») до 2-3 сут.
АД в случаях легкого и среднетяжелого течения ботулизма имеет некоторую тенденцию к повышению, в то время как для тяжелых форм болезни характерна артериальная гипотензия. Живот в большинстве случаев вздут, газы отходят плохо. Перистальтика не выслушивается. Стул задержан. В подавляющем большинстве случаев имеет место субфебрилитет. Высокая лихорадка свидетельствует о присоединении вторичных бактериальных осложнений.
Существует несколько классификаций ботулизма, однако в лечебной практике наиболее приемлемо деление на легкую, среднетяжелую и тяжелую форму болезни.
Легкая форма ботулизма характеризуется малой выраженностью всей симптоматики.
К среднетяжелой форме относятся случаи заболевания, протекающие с выраженными неврологическими проявлениями, но без признаков декомпенсированной ОДН и при сохраненной способности к глотанию жидкости.
Тяжелая форма ботулизма характеризуется максимальной выраженностью всех симптомов болезни и в первую очередь признаками ОДН.
Ботулизм грудных детей. Ботулизм грудных детей в возрасте до 6 мес, развивающийся в результате внутрикишечной продукции токсина вегетативными Cl. botulinum, был распознан как самостоятельная форма заболевания в 1976 г. в США. В целом симптомы болезни идентичны таковым при пищевом ботулизме у взрослых с учетом специфики детского возраста. Так, больной ребенок перестает держать голову, плач становится редким и хриплым, отмечается вялость сосания и пр.
Никаких признаков токсина в пище, которую получали дети до заболевания, обнаружено не было. Предполагают, что Cl. botulinum попадают в кишечник детей непосредственно из окружающей среды или вместе с питательными смесями при искусственном вскармливании. В пользу теории о внутрикишечной продукции токсина у грудных детей говорит и факт выделения его из кала.
Раневой ботулизм. Раневой ботулизм развивается в результате выработки токсина вегетативными формами возбудителя в области травмированных тканей при наличии анаэробных условий.
В последние два десятилетия появились сообщения о случаях ботулизма у героиновых наркоманов.
Диагностика ботулизма
Диагностика ботулизма, как правило, основывается на эпидемиологических и клинических данных. Лабораторное подтверждение - процесс длительный и трудоемкий. Не менее чем в 50% случаев диагноз ботулизма ставится при отрицательных анализах на наличие в крови токсина, а также при отсутствии Cl. botulinum в подозрительной пище и материале, полученном от больного (выделение бактериальной культуры и/или ПЦР-исследование на токсинпродуцирующие клостридии).
Наиболее широко в настоящее время для обнаружения и идентификации токсина как в сыворотке больных, так и в подозрительных продуктах используются биологическая проба и реакция нейтрализации на мышах.
Дифференциальная диагностика проводится с нейроинфекциями, нарушениями мозгового кровообращения, отравлением атропином.
Для ботулизма, в отличие от других поражений ЦНС, характерны: ясность сознания, симметричность поражений (возможна различная степень выраженности справа и слева) отсутствие судорог, отсутствие нарушений чувствительности, воспалительных изменений СМЖ, выраженной лихорадки.
Лечение
Специфическая терапия
ПБС имеет ограниченные терапевтические возможности, так как способна нейтрализовать лишь свободно циркулирующий в крови токсин, выраженность паралитического синдрома может нарастать даже после введения ПБС, роль которой сводится к нейтрализации токсина и профилактике дальнейшего нарастания паралитического синдрома. ПБС способна вызвать аллергические реакции, вплоть до анафилактического шока.
Для лечения заболеваний, вызванных неизвестным типом токсина (возбудителя) ботулизма, используют смесь моновалентных сывороток (типа А и Е 10 тыс. МЕ, типа В 5 тыс. МЕ). При известном типе токсина (возбудителя), что на практике бывает чрезвычайно редко, используют моновалентную сыворотку соответствующего типа.
Сыворотку вводят однократно, внутривенно на 200 мл изотонического раствора натрия хлорида, в условиях ОРИТ.
Для снижения риска анафилактического шока целесообразно предварительное введение 60 мг преднизолона внутривенно.
Обязательным, учитывая возможность продукции токсина in vivo, является назначение антибиотиков широкого спектра действия. При этом исключаются антибиотики, обладающие нейротоксическим действием (аминогликозиды, спектиномицин).
Патогенетическая терапия и уход
Инфузионно-трансфузионная терапия, имеет целью неспецифическую детоксикацию организма и коррекцию белкового и водно-электролитного баланса, а также обеспечение необходимого суточного калоража (не менее 1600-1800 ккал/сут) при невозможности энтерального питания даже через зонд, т.е. при наличии застоя в желудке.
Эффективность терапевтических мероприятий при ботулизме тем выше, чем меньше времени прошло от момента начала заболевания, причем начинать лечение можно и нужно на догоспитальном этапе. Это относится в первую очередь к промыванию желудка 5% раствором NаНСО3 и высокому промыванию кишечника аналогичным раствором с целью удаления и инактивации еще не всосавшейся части токсина.
Ввиду пареза кишечника очистительные клизмы - ежедневно с использованием в течение первых 3-4 дней пребывания больного в стационаре 5% раствора NaHCO3 до полного восстановления моторики кишечника и самостоятельного стула.
В комплекс терапевтических мероприятий при ботулизме по возможности должна входить гипербарическая оксигенация. В среднем на курс лечения больным требуется 7-10 сеансов, проводимых по общепринятой методике.
Обеспечение проходимости дыхательных путей и респираторная поддержка. Целесообразна плановая назотрахеальная интубация всем пациентам с афагией. ИВЛ при ботулизме осуществляется традиционными методами с индивидуальным подбором параметров вентиляции.
Осложнения и причины летальных исходов
К неспецифическим осложнениям относятся бактериальные вторичные осложнения, среди которых чаще наблюдается пневмония.
Единственным более или менее специфическим осложнением ботулизма можно считать поражения сердца в виде миокардиодистрофии («ботулинический миокардит»). Миокардиодистрофия возникает, как правило, на 7-15-й день болезни. На ЭКГ проявляет себя замедлением внутрижелудочковой проводимости и сопровождается резким снижением фракции выброса, по данным УЗИ.
Четких сроков выписки больных из стационара не существует, так как они сугубо индивидуальны и зависят только от скорости обратного развития симптоматики как основного процесса, так и осложнений последнего.
Сроки нетрудоспособности варьируют в зависимости от тяжести основного процесса и наличия осложнений и определяются индивидуально.
Диспансеризация не регламентирована. Целесообразно наблюдение не менее 6 мес с участием инфекциониста, терапевта (кардиолога) и невролога.
Лепра*
* Материалы доступны в электронном виде по ссылке, указанной на последней странице книги.
Риккетсиозы
Риккетсиозы - группа острых трансмиссивных инфекционных болезней, вызываемых риккетсиями и характеризующихся развитием генерализованного васкулита, интоксикации, поражением ЦНС, специфическими высыпаниями на коже. В эту группу не включены коксиеллез (Ку-лихорадка), бартонеллезы (доброкачественный лимфоретикулез, болезнь Карриона, бациллярный ангиоматоз, бациллярный пурпурный гепатит) и эрлихиозы (лихорадка сеннетсу, моноцитарный и гранулоцитарный эрлихиозы).
Сыпной тиф
Острый антропонозный риккетсиоз с трансмиссивным механизмом передачи возбудителя, способный к массовому распространению, характеризующийся тяжелым циклическим течением, развитием генерализованного васкулита, розеолезно-петехиальной сыпью и преимущественным поражением нервной и сердечно-сосудистой систем. Различают и отдельно регистрируют две формы сыпного тифа:
Эпидемический сыпной тиф
Лат. typhus exanthematicus.
Код по МКБ-10
А75.0 Эпидемический сыпной тиф.
Этиология
Возбудитель сыпного тифа - риккетсия Провачека (R. prowazekii) - полиморфный грамотрицательный микроорганизм размером от 0,5 до 1 мкм, облигатный внутриклеточный паразит.
Риккетсии Провачека культивируют на куриных эмбрионах, в культуре тканей и в легких мышей. Риккетсии быстро погибают во влажной среде, но в высушенном состоянии долго сохраняют жизнеспособность (в фекалиях вшей - более 3 мес), хорошо переносят низкие температуры, чувствительны к дезинфицирующим средствам (формалину, хлорамину, фенолу, кислотам, щелочам) в концентрациях, обычно применяемых для дезинфекции. Возбудитель эпидемического сыпного тифа содержит термолабильный токсин белковой природы.
Риккетсии Провачека чувствительны к тетрациклинам, хлорамфениколу, рифампицину и фторхинолонам.
Эпидемиология
Сыпной тиф - антропоноз. Источник и резервуар инфекции - человек, больной эпидемическим или рецидивным сыпным тифом (болезнь Брилла). Период заразности соответствует продолжительности риккетсиемии и составляет примерно 20-21 день: последние 2-3 дня инкубационного периода, весь лихорадочный период (16-17 дней) и еще 2-8 дней после нормализации температуры при отсутствии антибиотикотерапии.
Механизм заражения трансмиссивный. Переносчики риккетсий - вши, преимущественно платяные (Pediculis humanus corporis), значительно реже головные (Pediculis humanus capitis). При отсутствии педикулеза больной не опасен для окружающих. Вошь становится заразной через 5-6 дней после кровососания и сохраняет заразность до гибели от риккетсиоза (около 2 нед). При каждом кровососании у вши происходит акт дефекации, на кожу попадают испражнения вши, содержащие риккетсии. При укусе вошь впрыскивает в кожу вещества, вызывающие зуд. Человек инфицируется в результате проникновения риккетсий через повреждения кожи (ссадины, расчесы) вследствие втирания фекалий вшей и раздавленных зараженных паразитов. Вши чувствительны к температурному режиму и быстро покидают тело умерших и заболевших с высокой температурой тела, переползая на здоровых людей.
Возможно заражение воздушно-пылевым путем при вдыхании высохших фекалий вшей или при их попадании на конъюнктиву глаз.
После перенесенного заболевания формируется длительный иммунитет, который может быть нестерильным, в связи с чем у некоторых переболевших (до 10%) через 20-40 лет при снижении иммунитета может возникнуть повторный (рецидивный) сыпной тиф - болезнь Брилла. Риккетсии, циркулирующие в Северной Америке (R. Canada), передаются клещами. Пик заболеваемости в зимне-весенний период.
В развитых странах регистрируются завозные случаи сыпного тифа, редко локальные вспышки (Россия, 1997 г.). Очаги распространения сыпного тифа сохраняются в странах с высоким уровнем педикулеза (Руанда, Бурунди, Уганда, Эфиопия, Лесото, Намибия, Нигерия, некоторые регионы Индии, Пакистана, Китая, Гватемалы, Мексики, Новой Гвинеи, Эквадора, Перу, Боливии).
Меры профилактики
Профилактика сыпного тифа направлена на борьбу с педикулезом (приложение № 4 к приказу Минздрава России от 26 ноября 1998 г. № 342). Лиц с повышенным риском заражения вакцинируют вакциной Е (сыпнотифозной комбинированной живой сухой) в дозе 0,25 мл подкожно однократно с ревакцинацией через 1 год или вакциной сыпнотифозной химической сухой в дозе 0,5 мл подкожно однократно с ревакцинацией через 4 мес.
Патогенез и патоморфология
Воротами инфекции служат мелкие повреждения кожи (чаще расчесы). Уже через 5-15 мин риккетсии попадают в кровь, где некоторая часть их гибнет под действием бактерицидных факторов. Основная масса возбудителя при помощи белка адгезина фиксируется на поверхности клеток эндотелия сосудов, а затем путем фагоцитоза проникает в эндотелий сосудов. В цитоплазме этих клеток происходит активное размножение риккетсий, что вызывает набухание, деструкцию и десквамацию эндотелия с развитием вторичной риккетсиемии. В крови часть риккетсий погибает, другая часть внедряется в еще не поврежденные клетки эндотелия мелких сосудов разных органов. Данный цикл без видимых клинических проявлений повторяется до тех пор, пока в организме не накопится достаточное количество риккетсий и их токсинов, что приведет к соответствующим функциональным и органическим изменениям в сосудах, органах и тканях. Этот процесс соответствует инкубационному периоду и первым 2 дням лихорадочного периода.
Циркулирующий в крови риккетсиозный эндотоксин (ЛПС-комплекс) оказывает вазодилатационный эффект в сосудах микро-циркуляторного русла.
При размножении риккетсий и гибели клеток эндотелия формируются специфические сыпнотифозные гранулемы.
Патоморфологическая основа сыпного тифа - генерализованный деструктивно-пролиферативный эндоваскулит, включающий три компонента: тромбообразование, деструкцию сосудов стенки, клеточную пролиферацию.
Вокруг пораженных сосудов во всех органах и тканях, кроме печени, костного мозга и ЛУ, возникает очаговая клеточная пролиферация, скопление полиморфных клеточных элементов и макрофагов с формированием специфических сыпнотифозных гранулем (узелка Попова-Давыдовского). Больше всего их в коже, надпочечниках, миокарде и особенно в сосудах оболочек и вещества головного мозга. Изменения в органах можно охарактеризовать как сыпнотифозный менингоэнцефалит, интерстициальный миокардит, гранулематозный гепатит, интерстициальный нефрит.
Регресс морфологических изменений начинается с 18-20-го дня от начала болезни и завершается к концу 4-5-й недели, а иногда и в более поздние сроки, т.е. после нормализации температуры тела.
У погибших отмечают миокардит, кровоизлияния в надпочечники, увеличение селезенки, ОНГМ, кровоизлияния в оболочках и веществе мозга.
Клиническая картина
Инкубационный период длится от 5 до 25, чаще 10-14 дней.
Болезнь начинается остро - с прогрессивно нарастающих симптомов интоксикации (головная боль, слабость, мышечные боли, сухость во рту, жажда, потеря аппетита, головокружение). Через 2-4 дня постоянная диффузная головная боль становится нестерпимой, усиливаясь при перемене положения тела, разговоре, малейшем движении. Возможна повторная рвота.
Температура тела достигает максимума (38,5-40,5 °С и выше) ко 2-3-му дню болезни. Повышение температуры имеет постоянный, реже ремиттирующий характер (с кратковременными «врезами» на 4, 8 и 12-й день болезни). Больные страдают от своеобразной бессонницы: сначала засыпают, но часто просыпаются от устрашающих, неприятных сновидений. В этот период регистрируют мышечные и суставные боли, раздражительность, беспокойство, эйфорию, возбуждение или заторможенность. Характерен внешний вид больных: лицо гиперемированное, одутловатое, глаза красные («кроличьи») вследствие инъекции сосудов склер.
Язык суховат, обложен белым налетом. С 3-го дня болезни можно наблюдать появление точечных кровоизлияний в переходные складки конъюнктивы (симптом Киари-Авцына), энантему на мягком нёбе (симптом Розенберга), положительные симптомы щипка и жгута, которые предшествуют появлению экзантемы. Характерны умеренная тахикардия и приглушенность тонов сердца, гипотония, умеренная одышка. С 3-4-го дня отмечают увеличение печени и селезенки.
На 4-6-й день болезни наблюдают появление обильной полиморфной розеолезно-петехиальной сыпи. Первые элементы обнаруживают за ушами, на боковых поверхностях шеи с последующим распространением на кожу боковых поверхностей туловища, груди, живота, сгибательных поверхностей рук и внутреннюю поверхность бедер. Размеры элементов не превышают 3-5 мм. Характерен полиморфизм сыпи. Различают розеолы, розеолы со вторичными петехиями, реже первичные петехии. Подсыпаний не бывает. Появление новых петехий - плохой прогностический признак. Розеолы исчезают бесследно через 2-4 дня, а петехии - через 7-8 дней, оставляя бурую пигментацию («нечистота кожи»).
У подавляющего большинства больных тахикардия, пульс слабого наполнения и напряжения. Границы сердца расширены, тоны глухие. Часто выслушивают систолический шум на верхушке. АД, особенно диастолическое, падает.
Часто возникает одышка. На высоте болезни выявляют трахеобронхит и очаговую пневмонию. Язык сухой, обложен густым серо-грязным налетом, может принимать бурую окраску, нередко образуются глубокие трещины. У большинства больных отмечают значительное ухудшение аппетита, жажду, задержку стула и метеоризм. Диурез уменьшен. У некоторых больных отмечают парадоксальную ишурию, когда при переполненном мочевом пузыре мочеиспускание происходит каплями.
Поражение нервной системы проявляется, кроме головной боли и бессонницы, изменением поведения больного. Характерны двигательное беспокойство, сменяемое адинамией, быстрая истощаемость, эйфория, суетливость, говорливость, раздражительность, иногда плаксивость. Возможен бред, сопровождающийся галлюцинациями устрашающего характера. Психические расстройства характеризуют тяжелое течение болезни. С поражением ЦНС связаны и другие типичные для сыпного тифа симптомы: амимия или гипомимия, одно- или двусторонняя сглаженность носогубной складки, мышечный тремор, симптом Говорова-Годелье, дизартрия, дисфагия, нистагм, снижение слуха, гиперестезия кожи, менингеальные симптомы. В тяжелых случаях на фоне высокой температуры тела у некоторых больных нарушается сознание, речь становится бессвязной, поведение немотивированным (status typhosus).
Исследование СМЖ в ряде случаев свидетельствует о серозном менингите (незначительное повышение содержания белка, умеренный лимфоцитарный плеоцитоз). Характерных изменений гемограммы нет.
Первый признак выздоровления - нормализация температуры. При этом уменьшается выраженность тифозного статуса (просветление сознания) и признаков делирия. На 3-5-й день после снижения температуры восстанавливается частота пульса и дыхания, нормализуются АД, размеры печени и селезенки. На 12-й день апирексии при отсутствии осложнений пациента можно выписывать. Полное выздоровление наступает примерно через месяц после нормализации температуры. Слабость сохраняется до 2-3 мес.
Осложнения
Выделяют осложнения, связанные с характерным для сыпного тифа поражением сосудов и вызванные вторичной бактериальной инфекцией.
К 1-й группе относят коллапс, тромбоз, тромбоэмболию, тромбофлебит, эндартериит, геморрагический инфаркт головного мозга, полирадикулоневрит, миокардит, инфаркт, психозы периода рекон-валесценции. Вследствие сосудистых повреждений возникают пролежни и гангрена дистальных отделов конечностей. Ко 2-й группе относят вторичную пневмонию, отит, паротит, абсцессы, фурункулез, пиелит, пиелоцистит, стоматит, флегмоны подкожной клетчатки.
Диагностика
Существенное значение имеют наличие педикулеза, характерный вид больного, интенсивная головная боль в сочетании с бессонницей, появление сыпи на 5-й день болезни, поражение ЦНС, гепатолиенальный синдром. Основной метод диагностики серологический: РСК, РНГА, РА, РНИФ, ИФА. При проведении РСК диагностически достоверным считают титр 1:160. Положительный результат в РНГА можно получить с 3-5-го дня болезни, диагностический титр этого метода составляет 1:1000. РА по сравнению с РНГА менее чувствительна и имеет диагностический титр 1:160. В РНИФ и ИФА определяют специфические IgМ и IgG. Для достоверности диагностики необходимо использовать параллельно несколько серологических тестов, обычно РСК и РНГА. Ранним чувствительным и высокоспецифичным методом диагностики является ПЦР.
Дифференциальная диагностика
В начальном периоде сыпной тиф следует дифференцировать от гриппа, менингококковой инфекции, пневмонии, ГЛ, клещевого энцефалита и других состояний с проявлениями лихорадки; в период разгара дифференцируют от брюшного тифа, кори, псевдотуберкулеза, сепсиса и других лихорадочных заболеваний, сопровождающихся высыпаниями.
Лечение
Больные с подозрением на сыпной тиф госпитализируются в инфекционную больницу. Им назначают строгий постельный режим до 5-6-го дня нормальной температуры.
Специальная диета не требуется.
Большое значение имеют туалет ротовой полости (профилактика гнойного паротита и стоматита) и гигиена кожи (профилактика пролежней).
Медикаментозная терапия
В соответствии со стандартом лечения больным назначают антибиотики группы тетрациклинов (тетрациклин, доксициклин), в обычных дозах: доксициклин внутрь по 0,1 г 2 р/сут, со 2-го дня - 1 р/сут; тетрациклин внутрь в суточной дозе 2 г в 4 приема (детям 20-30 мг/кг). При непереносимости тетрациклинов можно назначать хлорамфеникол по 0,5 г 4 р/сут. Обычно длительность курса составляет 4-5 сут (до 2 дней нормальной температуры). Проводится дезинтоксикационная терапия.
Для борьбы с сердечно-сосудистой недостаточностью назначают сердечные гликозиды, вазопрессоры, а также оксигенотерапию. При возбуждении, делирии проводят седативную терапию.
Для предупреждения тромбоэмболических осложнений, особенно у пожилых больных, применяют антикоагулянты [в раннем периоде - надропарин кальция (Фраксипарин♠), позднее - ацетилсалициловая кислота + магния гидроксид (Кардиомагнил♠) и др.] под контролем коагулограммы. При менингеальном синдроме проводят дегидратацию салуретиками (фуросемид) при поддержании нормоволемии.
Выписывают больных не ранее 12-14-го дня после нормализации температуры тела при отсутствии осложнений. Сроки нетрудоспособности определяются индивидуально, но не ранее чем через 2 нед после выписки.
Прогноз
В прошлом летальность составляла около 10%. При использовании антибиотиков летальные исходы редки (менее 1%).
Рецидивный сыпной тиф (болезнь Брилла)
Болезнь Брилла (Брилла-Цинссера) - острая циклическая инфекционная болезнь, которая представляет собой эндогенный рецидив сыпного тифа, проявляющийся через многие годы у лиц, переболевших эпидемическим сыпным тифом. Характеризуется спорадичностью, отсутствием педикулеза, типичной клинической симптоматикой, более легким течением болезни, чем при эпидемическом сыпном тифе.
Синонимы: повторный сыпной тиф, лат. Brilli morbus.
Код по МКБ-10
А75.1 Рецидивный сыпной тиф (Болезнь Брилла).
Этиология
Возбудитель болезни Брилла - риккетсия Провачека (R. prowazekii).
Эпидемиология
Резервуаром и источником инфекции служит человек, переболевший в прошлом (2-40 лет назад) сыпным тифом. Болеют преимущественно лица пожилого возраста. Больные педикулезом могут быть источником первичного сыпного тифа. Для болезни Брилла характерно отсутствие источника инфекции, сезонности и очаговости. В нашей стране регистрация болезни ведется с 1958 г.
Патогенез и патологическая анатомия
При болезни Брилла патогенез и патологическая анатомия практически совпадают с эпидемическим сыпным тифом. Однако поражение сосудов менее выражено, что обусловлено специфическим иммунитетом. С этим же связана и меньшая продолжительность риккетсиемии (8-10 сут).
Клиническая картина
Клиническая картина сходна с эпидемическим сыпным тифом. Болезнь протекает преимущественно в среднетяжелой или легкой форме. Сыпь на коже появляется в те же сроки и сохраняется 5-7 дней, имеет такую же локализацию, но преобладают розеолезные, крупные (0,5-1,0 см) розеолезно-папулезные элементы; петехии отсутствуют либо их немного. У ряда больных (до 10%) высыпаний нет. Серьезные психические нарушения наблюдаются редко, но возможны эйфория, возбуждение или заторможенность, умеренный делириозный синдром, нарушения сна, иногда деперсонализация. Размеры печени и селезенки обычно нормализуются к 3-4-му дню после снижения температуры. Изменения сердечно-сосудистой системы исчезают к 5-7-му дню, а функции ЦНС восстанавливаются к 15-17-му дню после нормализации температуры.
Осложнения встречаются редко.
Диагностика
Клиническая диагностика
Высокая лихорадка, головная боль, инъекция сосудов склер и конъюнктив, в анамнезе - перенесенный сыпной тиф.
Специфическая и неспецифическая лабораторная диагностика
При лабораторной диагностике болезни Брилла используют преимущественно серологические методы. При этом IgG выявляют в более ранние сроки, а IgM могут отсутствовать.
Лечение
Лечение такое же, как при эпидемическом сыпном тифе. Госпитализировать больных с подозрением на болезнь Брилла обязательно.
Эндемический (крысиный) сыпной тиф
Эндемический сыпной тиф - спорадический острый доброкачественный зоонозный риккетсиоз с трансмиссивным механизмом передачи возбудителя. Характеризуется лихорадкой, умеренной интоксикацией и распространенной розеолезно-папулезной сыпью.
Коды по МКБ-10
A79 Другие риккетсиозы.
A79.8 Другие уточненные риккетсиозы.
Этиология
Возбудитель - риккетсия Музера (Rickettsia typhi), размножающаяся в цитоплазме пораженных клеток. По своим морфологическим, биологическим и антигенным свойствам они очень близки к риккетсиям Провачека, но обладают меньшим плеоморфизмом. Они имеют общий термостабильный антиген и дают перекрестные реакции с сыворотками больных сыпным тифом. Серологическая дифференцировка основана на выявлении видоспецифического термолабильного антигена. К возбудителю чувствительны крысы, мыши, морские свинки. В окружающей среде при низких температурах риккетсии Музера в высушенном состоянии в испражнениях блох и выделениях грызунов могут сохранять жизнеспособность длительное время. Чувствительны к тетрациклину, хлорамфениколу (Левомицетину♠), из макролидов - к джозамицину и кларитромицину, к фторхинолонам.
Эпидемиология
Источник и естественный резервуар возбудителей инфекции - грызуны (крысы и мыши), их эктопаразиты (блохи и гамазовые клещи).
Человек от инфицированных грызунов заражается следующими путями: контактным - при втирании в кожу фекалий инфицированных блох или при попадании инфицированных испражнений на конъюнктиву (достаточно 0,01 мг); аэрогенным - при попадании высохших испражнений блох в дыхательные пути; алиментарным - при поедании пищи, загрязненной мочой инфицированных животных; трансмиссивным - при присасывании клещей, паразитирующих на грызунах и способных к трансфазовой и трансовариальной передаче возбудителя. От человека к человеку болезнь не передается. Максимум заболеваемости отмечают в осенне-зимнее время, когда грызуны перемещаются в жилища людей. Заболевание регистрируют преимущественно среди лиц, живущих в домах, где есть грызуны, а также среди работников складов, продовольственных магазинов и т.п.
Восприимчивость человека высокая.
Блошиный сыпной тиф встречается в портовых городах Северной и Южной Америки, Индии, Австралии, бассейна Средиземного моря и других регионах, где обитает большое количество грызунов (крыс, мышей). Спорадические случаи регистрируют на побережьях Черного, Каспийского и Японского морей. В России эндемичны некоторые районы Ставропольского края и Новороссийск.
Профилактика и мероприятия в очаге в первую очередь направлены на борьбу с грызунами (дератизация). Проводят также дезинсекцию. Специфической профилактики нет.
Патогенез и патологическая анатомия
В эксперименте на животных показано, что основа патогенеза и морфологический субстрат заболевания, так же как при сыпном тифе, - деструктивно-пролиферативный тромбоваскулит сосудов микроциркуляторного русла с образованием гранулем в месте паразитирования риккетсий. Однако все процессы менее выражены и продолжительны. Аллергический компонент - один из существенных факторов в патогенезе эндемического сыпного тифа, что выражается в преимущественно папулезном характере сыпи. После перенесенного крысиного риккетсиоза развивается стойкий гомологичный иммунитет.
Клиническая картина
Инкубационный период 5-15 дней (в среднем 8) дней. Начало чаще постепенное, но может быть острым, с ознобом, головной болью, повышением температуры, мышечными и суставными болями. Лихорадка достигает максимума (38-40 °С) к 4-5-му дню болезни, без применения антибиотиков сохраняется до 2 нед и снижается ускоренным лизисом. Преобладает температурная кривая постоянного типа, реже ремиттирующая или неправильная.
На 4-7-й день болезни у 75% больных появляется полиморфная розеолезная или розеолезно-папулезная сыпь, наиболее обильная на туловище. В отличие от эпидемического сыпного тифа, элементы могут локализоваться на лице, ладонях и подошвах. Большинство розеолезных элементов через 2-3 дня трансформируется в папулы. Петехиальные элементы возможны только при тяжелом течении болезни. Подсыпаний не бывает.
Изменения со стороны сердечно-сосудистой системы минимальны, могут наблюдаться брадикардия и умеренная артериальная гипотензия. Поражения нервной системы у большинства больных незначительны - в виде головокружения и общей слабости. Увеличение печени и селезенки возможно у 30-50% больных.
Течение обычно благоприятное, без рецидивов. Осложнения очень редки.
Диагностика
Клиническая диагностика
Провести клиническую и дифференциальную диагностику с эпидемическим сыпным тифом и другими риккетсиозами очень трудно. Следует учитывать эпидемиологическую обстановку и наличие розеолезной и папулезной сыпи не только на коже туловища и конечностей, но и на лице, ладонях и стопах.
Специфическая и неспецифическая лабораторная диагностика
В гемограмме вначале выявляют лейкопению, затем лейкоцитоз с лимфоцитозом; возможно увеличение СОЭ. Основные методы специфической диагностики (стандарт диагностики) - РСК, ИФА, РНГА. Учитывая антигенное сходство риккетсий Музера и риккетсий Провачека, реакции ставят параллельно. Отчетливое преобладание титра антител в реакции с антигеном R. Mooseri, в 4-8 раз, по сравнению с антигеном R. Prowazekii, подтверждает диагноз эндемического сыпного тифа. Разрабатывается ПЦР-диагностика заболевания.
Дифференциальная диагностика эндемического (крысиного) сыпного тифа проводится с эпидемическим сыпным тифом.
Лечение
Лечение проводят по общим принципам ведения больных риккетсиозами. Госпитализация по клиническим и эпидемиологическим показателям. До нормализации температуры режим постельный. Назначают доксициклин (в первый день по 0,2 г 2 р/сут, затем 1 р/сут) или тетрациклин (по 0,3 г 4 р/сут), а при его непереносимости - хлорамфеникол (по 0,5 г 4 р/сут) до второго дня нормализации температуры включительно (обычно 4-5 сут). Возможно применение фторхинолонов. При своевременном применении антибиотиков патогенетическое и симптоматическое лечение проводят в минимальном объеме.
Реконвалесцентов выписывают после полного клинического выздоровления.
Диспансеризацию не проводят.
Марсельская лихорадка
Марсельская лихорадка (Marseilles febris, ixodorickettsiosis, марсельский риккетсиоз, папулезная лихорадка, болезнь Кардуччи-Ольмера, лихорадка клещевая, средиземноморская и др.) - острый зоонозный риккетсиоз с трансмиссивным механизмом передачи возбудителя, характеризующийся доброкачественным течением, наличием первичного аффекта и распространенной макулопапулезной сыпью.
Код по МКБ-10
A77.1 Пятнистая лихорадка, вызываемая Rickettsia conorii.
Этиология
Возбудитель - Rickettsia conorii. Размножается в культуре тканей (в желточном мешке куриного эмбриона) и при заражении лабораторных животных (в клетках мезотелия). Патогенен для морских свинок, обезьян, кроликов, сусликов, белых мышей и белых крыс. По антигенным свойствам близок к другим возбудителям группы клещевых пятнистых лихорадок. Паразитирует в цитоплазме и ядрах клеток хозяина. У больных возбудитель выявляют в крови в первые дни лихорадочного периода, в первичном аффекте и в розеолах кожи. В окружающей среде неустойчив.
Эпидемиология
Источник возбудителя - многие виды домашних и диких животных (собаки, шакалы, ежи, грызуны). Основной переносчик - собачий клещ Rhipicephalus sanguineus, в организме которого они сохраняются до 1,5 года; характерна трансовариальная передача возбудителя. Переносчиками могут быть и другие клещи (Rhipicephalus simus, Rh. everbsi, Rh. appendiculatus). Сезонность - май-октябрь - обусловлена особенностью биологии собачьего клеща (в этот период значительно увеличивается их количество и повышается активность). Человеку возбудитель передается при присасывании клеща, однако возможно заражение при раздавливании и втирании в кожу гемолимфы инфицированных клещей. Собачий клещ относительно редко нападает на человека, поэтому заболеваемость носит спорадический характер. Заболевание диагностируют в основном среди владельцев собак. Случаи марсельской лихорадки регистрируют в странах Средиземноморья, на побережьях Черного и Азовского морей, в Индии. Случаев передачи возбудителя от человека к человеку не выявлено. Постинфекционный иммунитет устойчивый.
Меры профилактики
Специфическая профилактика не разработана.
В эпидемических очагах проводят обработку возможных мест обитания клещей инсектицидами (например, собак, собачьих будок), отлов бродячих собак.
Патогенез
Начало заболевания обусловлено развитием риккетсиемии и токсинемии. Возбудитель проникает через кожу или слизистые оболочки носа и конъюнктивы. На месте внедрения формируется первичный аффект («черное пятно»), выявляемый вскоре после укуса клещом (за 5-7 сут до возникновения симптомов заболевания). По лимфатическим сосудам риккетсии попадают в регионарные ЛУ (вызывают лимфаденит), а затем в кровь (поражают эндотелий капилляров и венул). При этом возникают изменения, схожие с выявляемыми при эпидемическом сыпном тифе, однако количество гранулем (узелков) меньше и некротические изменения выражены слабее. Повторных заболеваний не наблюдается.
Клиническая картина
Инкубационный период относительно короткий (3-7 сут).
Основные симптомы и динамика их развития
Особенность марсельской лихорадки - наличие первичного аффекта, выявляемого до начала заболевания у большинства пациентов. Первичный аффект сначала представляет собой очаг воспаления кожи с покрытым темной корочкой участком некроза диаметром 2-3 мм в центре. К началу лихорадочного периода размеры первичного аффекта постепенно увеличиваются до 5-10 мм. Корочка отпадает на 5-7-е сутки после нормализации температуры. Язвочка после отпадения корки эпителизируется в течение 8-12 сут, после чего остается пигментированное пятно. Локализация первичного аффекта обычно на участках кожи, закрытых одеждой; могут быть 2-3 элемента. Примерно у трети возникает регионарный лимфаденит.
Начало заболевания острое, с быстрым повышением температуры до 38-40 °С. Лихорадка постоянного типа (реже ремиттирующая) сохраняется в течение 3-10 сут и сопровождается ознобом, сильной головной болью, общей слабостью, выраженной миалгией, а также артралгией и бессонницей. Возможна рвота. При осмотре выявляют гиперемию и одутловатость лица, инъекцию сосудов склер и слизистых оболочек зева.
На 2-4-е сутки лихорадки у всех больных появляется сыпь. Она появляется сначала на груди и животе, затем распространяется на шею, лицо, конечности; почти у всех больных ее обнаруживают на ладонях и подошвах. Высыпания состоят из пятен и папул, часть элементов подвергается геморрагическому превращению. У многих больных папулы трансформируются в везикулы. На ногах сыпь наиболее обильна; ее элементы ярче и крупнее, чем на других участках кожи. Высыпания исчезают через 8-10 сут, оставляя после себя пигментацию кожи, сохраняющуюся иногда до 2-3 мес.
Выявляют брадикардию, небольшое снижение АД. У 50% больных в лихорадочном периоде выявляют задержку стула и очень редко жидкий стул. У части пациентов выражено увеличение печени и, реже, селезенки. Снижается суточный диурез, обнаруживается протеинурия (особенно в 1-ю неделю). Картина крови малохарактерная.
Осложнения развиваются редко. Возможны пневмония, тромбофлебит (как правило, у лиц пожилого возраста).
Диагностика
Клиническая диагностика
При диагностике учитывают эпидемиологические данные: пребывание в эндемичной местности, сезон, контакт с собаками, присасывание клеща. В клинической картине наибольшее значение имеет триада симптомов: первичный аффект («черное пятно»), регионарный лимфаденит, раннее появление обильной полиморфной сыпи по всему телу, включая ладони и подошвы.
Лабораторная диагностика
Лабораторное подтверждение диагноза основано на серологических реакциях: РСК (параллельно проводят реакцию и с другими риккетсиозными антигенами), РНГА, ИФА. Предпочтение отдают рекомендованной ВОЗ РНИФ (минимальный диагностический титр - 1:40-1:64). Появление специфических антител в РНИФ выявляют на 4-9-е сутки заболевания и на диагностическом уровне - не раньше 45 сут. Для ранней диагностики широко используют ПЦР-диагностику.
Дифференциальная диагностика
Марсельскую лихорадку дифференцируют с близкими по клиническим проявлениям инфекционными заболеваниями: крысиным, сыпным, брюшным тифами, вторичным сифилисом, токсико-аллергическим медикаментозным дерматитом, а также с другими экзантемными инфекциями.
Лечение
Показания к госпитализации клинические. Режим постельный. Специальная диета не требуется.
Медикаментозная терапия
Как и при других риккетсиозах, наиболее эффективны тетрациклин (назначают внутрь по 0,3-0,4 г 4 р/сут) и доксициклин (по 0,2 г в 1-е сутки и по 0,1 г в последующие - до 2 суток после нормализации температуры). При непереносимости антибиотиков тетрациклиновой группы назначают хлорамфеникол (по 0,5-0,75 г 4 р/сут). Можно также использовать фторхинолоны (ципрофлоксацин по 0,5 г 2 р/сут) или макролиды (эритромицин по 0,5 г 4 р/сут), азитромицин 0,5 г 1 р/сут. Патогенетическое лечение направлено на устранение интоксикации и геморрагических проявлений.
Выписку больных проводят через 8-12 сут после нормализации температуры.
Прогноз благоприятный. Летальные исходы редки.
Астраханская риккетсиозная лихорадка
АРЛ (астраханская пятнистая лихорадка, астраханская лихорадка, астраханская клещевая пятнистая лихорадка) - риккетсиоз из группы пятнистых лихорадок, передающийся клещом Rhipicephalus pumilio и характеризующийся доброкачественным течением, наличием первичного аффекта, лихорадкой с симптомами интоксикации, ЛАП, пятнисто-папулезной сыпью, гепатоспленомегалией.
Код по МКБ-10
A77.8 Другие пятнистые лихорадки.
Этиология
Возбудитель АРЛ - Rickettsia conori, subsp. caspiensis, по морфологическим и тинкториальным свойствам не отличающийся от других представителей группы возбудителей пятнистых лихорадок. Риккетсии паразитируют в цитоплазме.
Эпидемиология
Основной эпидемиологически значимый фактор в очагах АРЛ - постоянная и довольно обширная пораженность собак клещом Rhipicephalus pumilio, который является основным резервуаром и переносчиком риккетсий. Клещом поражены не только бродячие собаки, но и животные, содержащиеся на привязи, и сторожевые собаки, не покидающие дворов. Значительная пораженность клещами R. pumilio выявлена у диких животных (ежей, зайцев). Клещи могут переползать на человека.
Клещи сохраняют риккетсии пожизненно и передают их трансовариально. Человек заражается при присасывании клеща. Возможно заражение контактным путем при втирании гемолимфы раздавленного клеща в поврежденную кожу, слизистые оболочки глаз, носа или через аэрозольную взвесь. Естественная восприимчивость к АРЛ всевозрастная, чаще болеют жители сельских районов Астраханской области: взрослые трудоспособного и пожилого возраста, дети дошкольного и младшего школьного возраста. Заболевание сезонное: апрель-октябрь с пиком заболеваемости в июле-сентябре, что связано с нарастанием в это время численности клеща, в основном его ювенальных форм (нимфы, личинки). Численность пациентов за сезон с данным заболеванием на протяжении последних восьми лет непрерывно растет, оставаясь достаточно высокой. Заболеваемость АРЛ выявлена в Казахстане. Случаи АРЛ отмечены среди отдыхавших в Астраханской области после их выезда.
Профилактика
Специфической профилактики АРЛ не разработано. Имеют значение дезинсекция собак, кошек, отлов бродячих собак и кошек.
В эндемических очагах во время пребывания на природе в сезон АРЛ необходимо проводить само- и взаимоосмотры, чтобы своевременно обнаружить клещей.
Для защиты от них используют инсектициды (претексис).
Чтобы уменьшить риск переползания клещей с домашнего скота и других животных на человека, в весенне-летний период необходимо систематически осматривать животных, резиновыми перчатками снимать присосавшихся клещей, избегать их раздавливания. Клещей, собранных с животных, следует сжигать.
Присосавшегося к человеку клеща необходимо удалить пинцетом вместе с головкой; место укуса обработать дезинфицирующим раствором; клеща отправить в лабораторию для установления его зараженности риккетсиями.
Патогенез
В месте присасывания клеща возбудитель начинает размножаться, и образуется первичный аффект. Затем риккетсии проникают в регионарные ЛУ, где также идет их репродукция, сопровождающаяся воспалительной реакцией. Следующий этап - риккетсиемия и токсинемия, составляющие основу патогенеза АРЛ. Морфологически в первичном аффекте наблюдается некроз эпидермиса, микроабсцессы сосочкового слоя кожи. Развивается острый васкулит сосудов микроциркуляторного русла с выраженным набуханием эндотелия, местами с фибриноидным некрозом, деструкцией эластического каркаса, набуханием коллагеновых волокон дермы. Просвет сосудов расширен, часть сосудов содержит тромбы. Васкулит сначала носит локальный характер, в пределах первичного аффекта, а при развитии риккетсиемии принимает генерализованный характер (диссеминированный тромбоваскулит).
Риккетсии диссеминируют в различные паренхиматозные органы, что клинически проявляется увеличением печени, селезенки, изменениями в легких.
Клиническая картина
Инкубационный период колеблется от 2 дней до 1 мес, в среднем 1-2 нед.
Первый признак заболевания - первичный аффект в месте присасывания клеща, наблюдается не всегда.
У части больных лихорадке предшествует появление первичного аффекта. В большинстве случаев он локализуется на нижних конечностях, реже - на туловище и в единичных случаях - на шее, голове, кистях. Первичный аффект преимущественно одиночный, изредка наблюдают два элемента. Первичный аффект выглядит как розовое пятно, иногда на приподнятом основании, от 2 до 15 мм в диаметре. В центральной части пятна появляется точечная эрозия, довольно быстро покрывающаяся геморрагической корочкой темно-коричневого цвета, которая отторгается на 8-23-й день болезни, оставляя точечную поверхностную атрофию кожи. В основании первичного аффекта, в отличие от других клещевых риккетсиозов, не наблюдается инфильтрации, дефект кожи носит исключительно поверхностный характер без глубоких некротических изменений в дерме. Появление первичного аффекта в ряде случаев сопровождается регионарным лимфаденитом.
Начальный (доэкзантемальный) период АРЛ длится 2-6 дней. Он начинается с повышения температуры тела, к концу суток достигающей 39-40 °С, появления чувства жара, повторного озноба, головной боли, суставных и мышечных болей, ухудшения аппетита. Быстро усиливается головная боль. Иногда возникают головокружение, тошнота и рвота. У пожилых лиц лихорадке могут предшествовать продромальные явления в виде нарастающей слабости, разбитости, подавленности настроения. Лихорадка сопровождается умеренной тахикардией. Отмечают увеличение печени. Часто отмечают склерит и конъюнктивит, гиперемию слизистой оболочки задней стенки глотки, миндалин, дужек и язычка мягкого нёба в сочетании с жалобами на першение в горле и заложенность носа, иногда с кашлем.
На 3-7-й день лихорадки появляется сыпь, и болезнь переходит в период разгара, что сопровождается усилением симптомов интоксикации. Сыпь имеет распространенный характер с локализацией на коже туловища (преимущественно переднебоковых отделов), верхних (в основном на сгибательных поверхностях) и нижних конечностей, включая ладони и подошвы. На лице сыпь встречается редко, в случаях с более выраженной интоксикацией. Сыпь часто сочетается с энантемой. На фоне разлитой гиперемии зева отчетливо видны единичные мелкоточечные петехии фиолетово-красного цвета.
Экзантема обычно носит полиморфный пятнисто-розеолезно-папулезно-геморрагический характер, в более легких случаях может быть мономорфной. После исчезновения сыпи сохраняется пигментация. Сыпь на ладонях и подошвах носит папулезный характер. Розеолезные элементы обычно обильные, изредка единичные; розового или красного цвета, диаметром от 0,5 до 3 мм. При более тяжелом течении наблюдается слияние розеол. Розеолы нередко трансформируются в геморрагические пятна, чаще всего на нижних конечностях.
У большинства больных выявляют приглушенность сердечных тонов и тахикардию, реже наблюдают различные нарушения ритма (пароксизмальную тахикардию, экстрасистолию, мерцательную аритмию), изредка - артериальную гипотензию.
Язык обложен сероватым налетом. Аппетит снижен. Наблюдаются явления хейлита. В первые дни болезни возможна преходящая диарея. У каждого второго больного наблюдают гепатомегалию, в среднем до 10-12-го дня болезни. Увеличения селезенки не наблюдается.
Температура тела выше 39 °С сохраняется в течение 6-7 дней, лихорадку выше 40 °С наблюдают редко. В среднем до 7-го дня многих больных беспокоит озноб. Температурная кривая ремиттирующая, реже - постоянная или неправильного типа. Лихорадочный период длится в среднем 10-12 дней, завершаясь в большинстве случаев укороченным лизисом.
С нормализации температуры начинается период реконвалесценции.
АРЛ может осложняться пневмонией, бронхитом, ОДН, гломерулонефритом, флебитом, ДВС-синдромом (метро- и риноррагиями, редко - желудочно-кишечными кровотечениями), острым нарушением мозгового кровообращения. При исследовании СМЖ изменений воспалительного характера не обнаруживают.
Картина крови малохарактерна. При тяжелом течении возможны лейкоцитоз, тромбоцитопения, признаки гипокоагуляции, повышения уровня креатинина, мочевины. Возможны протеинурия и лейкоцитурия.
Диагностика
Диагностические критерии АРЛ:
-
эпидемические данные: сезонность заболевания (апрель-октябрь), пребывание в природном (антропургическом) очаге, кон такт с клещами;
-
клиническая картина: высокая лихорадка, выраженная интоксикация без развития тифозного статуса, артралгия и миалгия, обильная полиморфная несливающаяся и незудящая сыпь на 2-4-й день болезни, первичный аффект, склерит, конъюнктивит, катаральные изменения в зеве, увеличение печени.
Для специфической диагностики АРЛ используют реакцию РНИФ. Также можно использовать ИФА, РСК, РНГА. В настоящее время чаще используют ПЦР, которая позволяет поставить диагноз уже с первого дня лихорадки.
Дифференциальная диагностика
АРЛ следует дифференцировать от сыпного тифа, кори, краснухи, псевдотуберкулеза, менингококкемии, КГЛ, лептоспироза, энтеровирусной инфекции (энтеровирусная экзантема), вторичного сифилиса.
Лечение
Показания к госпитализации клинические.
Этиотропную терапию проводят тетрациклином внутрь в дозе 0,3-0,5 г 4 р/сут или доксициклином в первый день 0,1 г 2 р/сут, в последующие дни 0,1 г однократно. Эффективны также рифампицин по 0,15 г дважды в день; эритромицин по 0,5 г 4 р/сут, ципрофлоксацин по 0,5-0,75 мг через 12 ч. Терапию антибиотиками проводят до 2-го дня нормальной температуры тела включительно.
Патогенетическая терапия направлена на устранение интоксикации и геморрагических проявлений.
При выраженном геморрагическом синдроме (обильная геморрагическая сыпь, кровоточивость десен, носовые кровотечения) и тромбоцитопении назначают Аскорутин♠, кальция глюконат, менадиона натрия бисульфит, кальция хлорид, желатин, аминокапроновую кислоту, этамзилат (Дицинон♠).
Прогноз
Прогноз благоприятный.
Больных выписывают спустя 8-12 сут после нормализации температуры тела.
Другие пятнистые риккетсиозные лихорадки
Пятнистые риккетсиозные лихорадки (ПРЛ) - группа природно-очаговых риккетсиозов с трансмиссивным механизмом передачи возбудителя.
Клещевой сыпной тиф Северной Азии
Клещевой сыпной тиф Северной Азии - острый природно-очаговый риккетсиоз с трансмиссивным механизмом передачи возбудителя инфекции, характеризуется лихорадкой, наличием первичного аффекта, лимфаденита, полиморфной экзантемы и доброкачественным течением.
Код по МКБ-10
А 77.2 Сибирский клещевой тиф, североазиатская клещевая лихорадка.
Этиология
Возбудитель - Rickettsia sibirica, по своей антигенной структуре, цитоморфологическим особенностям, иммунологической и молекулярной характеристике близок к R. rickettsii и R. conorii. Размножается в цитоплазме и ядре пораженных клеток. Как и другие риккетсии, хорошо сохраняется в окружающей среде при низких температурах - -30 °С и ниже (до 3 лет). Длительное время сохраняется в высушенном состоянии, что используется в практике для консервации риккетсий. Быстро инактивируется при нагревании и действии обычных дезинфектантов.
Эпидемиология
В России основная часть заболеваний регистрируется в Республике Алтай, Красноярском крае, Хакасии. Кроме того, заболевания регистрируются в Тюменской, Курганской, Новосибирской, Кемеровской, Иркутской, Читинской, Амурской областях, Республиках Тыве, Бурятии, Хабаровском и Приморском краях, Еврейской автономной области, а также на сопредельных территориях Казахстана, Монголии, Китая, Туркмении, Армении. Это наиболее распространенный в России риккетсиоз.
Источник возбудителя - грызуны (суслики, полевки), переносчик и резервуар - иксодовые клещи. Человек инфицируется во время нахождения в местах естественного обитания клещей (степи, поля, луга, кустарники и т.д.). Группами риска являются геологи, строители, туристы, дачники. Нападение клещей на человека происходит при контакте в местах нахождения переносчика на поверхности почвы, в травянистой растительности, кустарнике, лесу. Заражение происходит во время присасывания инфицированных клещей, в слюне которых содержатся риккетсии. Сезонность весенне-летняя, что связано с наибольшей активностью клещей в это время. Осенью возможен второй подъем заболеваемости, обусловленный второй генерацией клещей. Восприимчивость человека к Rickettsia sibirica относительно невелика, в эндемичных очагах заболевают преимущественно впервые прибывшие. Иммунитет после перенесенного заболевания стойкий.
Профилактика: специфическая отсутствует, неспецифическая направлена на защиту от нападения иксодовых клещей и их уничтожение. Наиболее радикальным мероприятием является противоклещевая обработка территорий.
Патоморфология и патогенез
Патоморфология и патогенез сходны с таковыми при сыпном тифе, а также при других клещевых риккетсиозах. В отличие от сыпного тифа, в месте проникновения возбудителя возникает воспалительная реакция кожи и регионарный лимфаденит - первичный аффект. Риккетсии внедряются в клетки эндотелия мелких сосудов, вызывая развитие эндопериваскулита, при этом пролиферативные процессы превалируют над деструктивными, чем и объясняется более легкое течение заболевания по сравнению с эпидемическим сыпным тифом. Риккетсиемия и токсинемия клинически проявляются синдромом интоксикации. Летальные исходы очень редки.
Клиническая картина
Инкубационный период чаще составляет 3-7 сут, редко до 10-14 сут. Начало острое. Повышение температуры тела сопровождается ознобом и нарастающей интоксикацией. В течение 2-3 дней температура тела достигает 39-40 °С и приобретает постоянный или ремиттирующий характер, лихорадка длится от нескольких дней до 2 нед. Характерны гиперемия и одутловатость лица, инъекция склер и конъюнктив. На месте укуса клеща, на открытом участке кожи обнаруживается первичный аффект в виде малоболезненного инфильтрата 1-2 см в диаметре, покрытого некротической корочкой темно-коричневого цвета с венчиком гиперемии. Во многих случаях выявляется регионарный лимфаденит. Первичный аффект появляется до повышения температуры тела и симптомов интоксикации, но обычно не замечается больными, так как не сопровождается болевыми ощущениями. С первого дня появляется и сохраняется в течение всей болезни головная боль (иногда мучительная), миалгия и ломота в пояснице.
Характерна обильная полиморфная розеолезно-папулезная сыпь, несливная, незудящая, которая чаще появляется на 3-4-й день от дебюта болезни. Сыпь покрывает все туловище и конечности, на ладонях и стопах наблюдается редко. Более тяжелое течение заболевания сопровождается геморрагической экзантемой. К концу лихорадочного периода сыпь пигментируется.
Отмечают артериальную гипотензию, брадикардию, у части больных увеличение печени и селезенки.
Возможные осложнения: серозный менингит, пневмония, миокардит.
Течение болезни доброкачественное и прогноз благоприятный. Изменения в гемограмме малоинформативны. Чаще регистрируются нормоцитоз или лейкопения с лимфоцитозом, СОЭ увеличена.
Диагностика
Диагностика основана на данных эпиданамнеза (пребывание в природном очаге в сезон активности клещей) и триады клинических признаков: первичный аффект на месте присасывания клеща, характерная экзантема, лихорадка.
Подтверждением диагноза служит выявление антител к специфическим групповым антигенам в РСК, РНГА, РНИФ, ИФА а также ПЦР.
Дифференциальная диагностика необходима с другими риккетсиозами, брюшным тифом, лептоспирозом.
Лечение
Больные госпитализируются, лечение проводят в стационаре антибиотиками тетрациклинового ряда (доксициклин по 200 мг/сут) до 2-го дня нормальной температуры тела. Беременным женщинам назначают джозамицин. Трудоспособность реконвалесцентов обычно восстанавливается через месяц после нормализации температуры тела.
Пятнистая лихорадка
Скалистых гор
ПЛСГ - острая антропонозная инфекционная болезнь с трансмиссивным механизмом передачи возбудителя. Характеризуется интоксикацией, лихорадкой, пятнисто-папулезной сыпью.
Код по МКБ-10 А77.0.
Этиология
Возбудитель - Rickettsia rickettsii (риккетсия Риккетса) рода Rickettsia семейства Rickettsiaceae. Окрашивается по Романовскому-Гимзе. Имеет клеточную стенку, мембрану, цитоплазматические гранулы, ядерную вакуоль. Является облигатным внутриклеточным паразитом, размножается в цитоплазме и ядрах чувствительных клеток. Обладает гемолитическими и токсическими свойствами. Культивируется в культурах клеток, в клещах, морских свинках и других лабораторных животных. Имеет общие антигены с другими риккетсиями группы клещевой пятнистой лихорадки. В окружающей среде малоустойчива, погибает через несколько минут при +50 °С, инактивируется обычными дезинфектантами. В инфицированных клещах сохраняется несколько месяцев.
Эпидемиология
ПЛСГ встречается исключительно в Западном полушарии, в странах Северной, Центральной и Южной Америки (США, Канада, Мексика, Бразилия и др.).
Резервуаром и источником возбудителя являются различные виды клещей, в том числе лесной и собачий. Заражение людей происходит при присасывании инфицированных клещей во время посещения леса или контакта с собаками (в том числе домашними). В США более половины заболевших ПЛСГ составляют дети и подростки до 19 лет. В Северной Америке сезон заболеваемости приходится на апрель-сентябрь, в Южной - октябрь-март, что связано с периодом активности клещей.
После перенесенного заболевания формируется стойкий иммунитет.
Профилактика
Профилактика специфическая возможна, но широко не применяется, хотя существует живая вакцина. Неспецифическая включает акарицидные меры, ограничение пребывания в эндемичных регионах, ношение соответствующей одежды, запрет на снятие клещей руками с собак. Химиопрофилактика однократным приемом 0,2 г доксициклина рекомендуется при высоком риске заражения.
Патоморфология и патогенез
Патоморфология и патогенез сводятся к характерным изменениям в сосудах (панваскулит). Возможны кровоизлияния в различные органы, вещество мозга, в ткани мошонки. Типичными считаются выявляемые при аутопсии поражение семенников и придатков, значительное увеличение селезенки. Нередко выявляются интерстициальный миокардит, пневмония. Патогенез ПЛСГ сходен с таковым при других риккетсиозах. После укуса инфицированным клещом возбудитель проникает в регионарные ЛУ и далее в кровь. В отличие от других клещевых пятнистых лихорадок, при ПЛСГ первичный аффект обычно не развивается. Риккетсии размножаются в эндотелии сосудов, вызывая панваскулит. Больше других поражаются сосуды микроциркуляторного русла кожи, миокарда, вещества мозга, легких, селезенки и надпочечников. В отличие от других риккетсиозов, возбудитель болезни паразитирует не только в эндотелии, но и в мышечных волокнах мезотелия сосудов, чем усугубляется глубина патологии. В тяжелых случаях отмечается поражение более крупных сосудов с формированием обширных ишемических очагов в органах и тканях, в том числе в головном мозге, миокарде и почках. Течение болезни чаще средней тяжести и тяжелое.
Клиническая картина
Инкубационный период от 2 до 12 дней, в тяжелых случаях не более 4 дней.
Характерно внезапное начало болезни с озноба, сильной головной боли, миалгии и артралгии, выраженной слабости, повышения температуры тела. Возможна рвота типа кофейной гущи, кровотечения (носовые, маточные). Температура тела в первые же дни достигает 39-41 °С, лихорадка без лечения продолжается до 2 нед. Первичный аффект отсутствует, но возможен регионарный лимфаденит.
Через 2-4 дня (реже 5-6) от начала болезни появляется экзантема - обильная пятнисто-папулезная, сначала на коже рук и ног, затем на других участках тела, на лице, ладонях и подошвах. Спустя 4-6 дней сыпь начинает угасать. В тяжело протекающих случаях сыпь геморрагическая или некротическая. Типична и энантема - на мягком нёбе, переходной складке конъюнктивы. Для легкой формы характерна относительная брадикардия, для тяжелой - тахикардия. Селезенка и печень обычно увеличены. Изменения со стороны ЦНС сходны с таковыми при сыпном тифе: сильная головная боль, бессонница, раздражительность, возбуждение; возможны бред, галлюцинации, гиперестезия, снижение зрения и слуха, менингеальные симптомы.
Длительность острого периода болезни составляет 2-3 нед. Реконвалесценция наступает медленно, иногда продолжается в течение нескольких месяцев.
Осложнения обусловлены развивающимся тромбогеморрагическим синдромом, острой сосудистой недостаточностью и проявляются в виде кровотечений, ИТШ, коллапса, флебитов, миокардита.
Возможны также ирит, невриты. К неспецифическим осложнениям относят пневмонию.
ПЛСГ - один из наиболее тяжело протекающих риккетсиозов, потенциально смертельное заболевание. Летальность до применения антибиотиков достигала 20%, с началом их применения снизилась до 4-7%.
Диагностика
Диагностика основана на учете эпидемиологического анамнеза (проживание или пребывание в эндемичной местности, посещение там леса, указание на присасывание клеща; наличие в доме собаки, прогулки с ней на природе) и типичных клинических проявлениях (экзантема, захватывающая в том числе ладони и подошвы, высокая лихорадка).
В гемограмме обычно регистрируется нейтрофильный лейкоцитоз.
Наиболее достоверным лабораторным тестом является обнаружение антител к риккетсиям Риккетса в РСК и РНИФ. Однако в «диагностических» титрах антитела появляются только со 2-й недели, поэтому необходимо внедрение ПЦР.
Лечение
Этиотропная терапия проводится препаратами тетрациклинового ряда: доксициклином по 0,1 г 2 р/сут, тетрациклином по 0,5 г 4 р/сут в течение 5-7 дней. При тяжелом течении тетрациклин рекомендуют вводить парентерально. С учетом частоты развития тромбогеморрагического синдрома целесообразно применение низкомолекулярных препаратов гепарина.
Лихорадка цуцугамуши*
Австралийский клещевой риккетсиоз*
Везикулезный риккетсиоз*
Ку-лихорадка
* Материалы доступны в электронном виде по ссылке, указанной на последней странице книги.
Ку-лихорадка (лат. Q-febris, rickettsiosis Q; коксиеллез) - острая природно-очаговая зоонозная инфекционная болезнь с разнообразными механизмами передачи возбудителя, характеризующаяся развитием распространенного ретикулоэндотелиоза, лихорадкой, интоксикацией, поражением органов дыхания.
Код по МКБ-10
А78 Ку-лихорадка.
Этиология
Возбудитель - Coxiella burnetii. До 90-х гг. прошлого века относилась к риккетсиям. В настоящее время определяется как представитель класса Jamma Proteobacteria, семейства Coxiellacea, порядка Legionelolatus (II группа патогенности), в который входят и легионеллы.
Это полиморфный грамотрицательный неподвижный микроорганизм размером 200-500 нм, способный к образованию L-форм. Антигенная структура C. burnetii нестабильная. C. burnetii - облигатный внутриклеточный паразит, размножающийся в цитоплазме и вакуолях пораженных клеток, способный к образованию спор, устойчивых в окружающей среде. Коксиеллы выращивают на культуре клеток, куриных эмбрионах и путем заражения лабораторных животных.
C. burnetii устойчивы в окружающей среде и к различным физическим и химическим воздействиям. Выдерживают нагревание до 90 °С в течение часа (не погибают при пастеризации молока); сохраняют жизнеспособность в сухих фекалиях инфицированных клещей до полутора лет, в сухих фекалиях и моче зараженных животных - до нескольких недель; в шерсти животных - до 9-12 мес, в стерильном молоке - до 273 дней, в стерильной воде - до 160 дней, в масле (в условиях рефрижератора) - до 41 дня, в мясе - до 30 дней. Выдерживают кипячение в течение 12 мин и более. Устойчивы к ультрафиолетовому облучению, воздействию формалина, фенола, хлор-содержащих и других дезинфектантов, чувствительны к антибиотикам тетрациклинового ряда, хлорамфениколу и фторхинолонам.
Коксиеллы обладают высокой инвазивностью, проникают через неповрежденные слизистые оболочки и микротравмы кожи. Они высоко вирулентны для человека, инфицирующая доза может составлять менее 10 клеток.
Эпидемиология
Ку-лихорадка - природно-очаговая зоонозная инфекция. Различают два типа очагов болезни: первичные природные и вторичные сельскохозяйственные (антропургические). В природных очагах возбудитель циркулирует между переносчиками (клещами) и их теплокровными прокормителями.
Резервуар возбудителя в природных очагах - иксодовые, частично гамазовые и аргасовые клещи (более семидесяти видов), у которых наблюдают трансфазовую и трансовариальную передачу коксиелл, а также дикие птицы (47 видов) и дикие млекопитающие носители возбудителя (более 80 видов). Существование стойкого природного очага инфекции способствует заражению различных видов домашних животных (крупного и мелкого рогатого скота, лошадей, верблюдов, собак, ослов, мулов, домашних птиц и др.). Они длительно (до двух лет) выделяют коксиелл в окружающую среду с экскрементами, мокротой, молоком, околоплодными водами и могут играть роль самостоятельного резервуара возбудителя в антропургических очагах болезни.
Заражение человека Ку-лихорадкой в антропургических очагах происходит различными путями: алиментарным - при употреблении инфицированного молока или молочных продуктов; водным - при питье зараженной воды; воздушно-пылевым - при вдыхании пыли, содержащей сухие фекалии и мочу зараженных животных или фекалии инфицированных клещей; контактным - через слизистые оболочки или поврежденную кожу при уходе за больными животными, обработке сырья животного происхождения.
Возможен трансмиссивный путь инфицирования (при нападении зараженных клещей), не имеющий существенного эпидемиологического значения.
Больной человек может выделять C. burnetii с мокротой, но источником инфекции бывает очень редко (грудные дети, получавшие молоко больной матери; акушеры, патологоанатомы). Чаще болеют мужчины, занятые сельскохозяйственными работами, животноводством, убоем скота, обработкой шкур и шерсти животных, птичьего пуха и др. В последние десятилетия чаще заболевают жители крупных населенных пунктов и городов. Заболеваемость, наблюдаемая преимущественно весной, летом и осенью, имеет спорадический характер; изредка возникают групповые вспышки; часто обнаруживают бессимптомные формы инфекции. Повторные заболевания отмечаются редко; постинфекционный иммунитет стойкий. Спорадические случаи и локальные вспышки Ку-лихорадки регистрируют на всех континентах. В России заболевание встречается в Красноярском и Алтайском краях, на Сахалине, в Читинской области, в ряде регионов Западной и Центральной Сибири и почти на всей территории европейской части (преимущественно в южных регионах). Обязательная регистрация заболеваний Ку-лихорадкой в Российской Федерации введена с 1957 г. В настоящее время ежегодно регистрируют около 100-200 случаев болезни.
Меры профилактики
Больных Ку-лихорадкой или лиц с подозрением на это заболевание госпитализируют в палаты-боксы инфекционного отделения. В очаге осуществляют текущую и заключительную дезинфекцию. Лицам из очага инфекции проводят экстренную антибиотикопрофилактику: доксициклин по 0,2 г 1 р/сут или рифампицин по 0,3 г 2 р/сут в течение 10 дней.
Проводят комплекс ветеринарных, противоэпидемических и санитарно-гигиенических мероприятий: противоклещевую обработку пастбищ, охрану животноводческих хозяйств от заноса в них возбудителей и др. Молоко из неблагополучных хозяйств можно употреблять только в кипяченом виде (пастеризации недостаточно). К уходу за больными животными допускают лиц, переболевших коксиеллезом, вакцинированных против этой инфекции или имеющих положительную РСК в разведении 1:10 и более и/или положительную РНИФ в титре 1:40. Используют защитную одежду. В эндемичных очагах проводят активную санитарно-просветительную работу.
Лицам 14-60 лет из группы риска (животноводы, рабочие мясокомбинатов, ветеринары, зоотехники, рабочие по обработке животноводческого сырья, лица, работающие с животными культурами) проводят вакцинацию вакциной Ку-лихорадки М-44 живой, аттенуированной, сухой, накожной. Ее вводят методом скарификации в дозе 0,05 мл однократно. Ревакцинация проводится через один год лицам, в сыворотке которых отсутствуют специфические антитела.
Патогенез
Ку-лихорадка - циклический доброкачественный ретикулоэндотелиоз. В отличие от риккетсий, коксиеллы размножаются преимущественно в гистиоцитах и макрофагах.
В патогенезе Ку-лихорадки выделяют следующие фазы: внедрение коксиелл без реакции в месте входных ворот; лимфогенная и гематогенная диссеминация коксиелл (первичная или «малая») с внедрением их в макрофаги и гистиоциты; размножение коксиелл в макрофагах и гистиоцитах, выход большого количества возбудителей в кровь (повторная или «большая» коксиеллемия); токсемия с формированием вторичных очагов инфекции во внутренних органах; аллергическая перестройка и формирование напряженного (с элиминацией возбудителя и выздоровлением) или ненапряженного (с повторной генерализацией и развитием затяжных и хронических форм процесса) иммунитета.
Вероятность затяжного, рецидивирующего и хронического течения болезни с развитием эндокардита, интерстициальной пневмонии и длительной персистенцией возбудителя - важная особенность патогенеза Ку-лихорадки. Риск развития хронического коксиеллеза наиболее велик у иммунокомпрометированных лиц с тяжелой хронической патологией, ВИЧ-инфицированных, принимающих иммунодепрессанты.
Патоморфология
Коксиеллы вызывают пролиферацию клеток ретикулоэндотелиальной и лимфатической системы, гиперплазию фолликулов селезенки, а также дегенеративные изменения в печени, почках, миокарде, ЦНС, матке, молочных железах, семенниках и других органах; образование микронекротических фокусов, замещающихся в последующем соединительной тканью. В отдельных случаях образуются абсцессы в паренхиме молочной железы и регионарных ЛУ. Максимально возбудитель накапливается в органах ретикулоэндотелиальной системы.
Клиническая картина
Ку-лихорадка характеризуется выраженным полиморфизмом симптомов, что зависит от механизма передачи возбудителя, инфицирующей дозы коксиелл и состояния макроорганизма. Наиболее тяжелые формы болезни возникают при аэрогенном заражении. В течении болезни различают следующие периоды: инкубационный, начальный (3-5 дней), разгара (4-8 дней) и реконвалесценции.
Выделяют следующие формы болезни: острую (длительность заболевания 2-4 нед) - у 75-80% больных; подострую или затяжную (1-3 мес) - у 15-20% больных; хроническую (от нескольких месяцев до одного года и более) - у 2-3% больных; стертую; бессимптомную инфекцию.
Острые, подострые и хронические формы подразделяют на легкие, среднетяжелые, тяжелые и очень тяжелые. Критерии степени тяжести - уровень лихорадки, выраженность интоксикации и органной патологии.
Инкубационный период - 3-30 сут (в среднем 12-19 сут), наиболее короткий - при аспирационном механизме заражения.
В 95% случаев начало болезни острое: озноб, быстрое повышение температуры до 39-40 °С и общетоксический синдром. Возникает сильная, упорная, не снимающаяся анальгетиками диффузная, реже локализованная (лоб, затылок) головная боль. Возможны головокружение, слабость, потливость, разбитость, артралгия, миалгия, болезненность при пальпации мышц. С первых дней болезни у большей части больных наблюдают гиперемию лица и шеи, инъекцию сосудов склер, гиперемию зева. Характерна резкая боль в глазницах и глазных яблоках, усиливающаяся при их движении. У некоторых больных возникают сухой кашель, тошнота, рвота, носовые кровотечения, ухудшается аппетит.
При тяжелом течении возможны возбуждение, делирий. Редко на 3-16-е сутки болезни появляется розеолезная или пятнисто-папулезная экзантема без постоянной локализации.
Основной и наиболее постоянный симптом - лихорадка, продолжительность которой варьирует от нескольких дней до месяца и более (в среднем 7-10 дней). Обычно температура достигает 38,5-39,5 °С. Лихорадка может быть постоянной, ремиттирующей, неправильной. Характерны ее значительные колебания, обнаруживаемые при трехчасовой термометрии (особенно при тяжелом и среднетяжелом течении болезни). Нередки более выражены утренние подъемы температуры. Лихорадка сопровождается ознобом (познабливание), потливостью на протяжении всего заболевания. Температура снижается литически в течение 2-4 дней или по типу ускоренного лизиса. У некоторых больных сохраняется субфебрилитет, что может быть предвестником рецидива.
Поражение сердечно-сосудистой системы при Ку-лихорадке непостоянно и малоспецифично. У отдельных больных при хронизации инфекции может развиться специфический коксиеллезный эндокардит, чаще на фоне предшествующего ревматического или врожденного порока сердца. Коксиеллезный эндокардит - хронический процесс продолжительностью от 5 мес до 5 лет. В большинстве случаев он заканчивается летально.
Для Ку-лихорадки характерно поражение органов дыхания. Возможны трахеиты, бронхиты, пневмонии. Частота пневмоний варьирует от 5 до 70% и зависит от путей инфицирования. Они развиваются преимущественно при аэрогенном заражении; единичные случаи пневмонии могут быть обусловлены вторичной бактериальной инфекцией. Больные жалуются на кашель (сухой, затем - продуктивный, с вязкой серозно-гнойной мокротой), чувство дискомфорта и саднения за грудиной; иногда возникает одышка. Физикальные данные скудные. Можно обнаружить участки укорочения перкуторного звука, жесткое дыхание, сухие, а затем и влажные хрипы. На рентгенограмме определяют мелкоочаговые конусовидные инфильтраты, локализующиеся преимущественно в нижних отделах легких и прикорневой зоне. Эти изменения свойственны интерстициальной пневмонии. Обычно пневмонические очаги определяют как нежное облаковидное затемнение. Даже при образовании массивных затемнений полости не образуются, острый процесс не переходит в хронический. При увеличении бронхиальных и паратрахеальных ЛУ корни легких расширяются, уплотняются и деформируются. Очень редко обнаруживают плевропневмонию с сухим плевритом, вследствие чего болезнь может принимать затяжное или рецидивирующее течение. Течение пневмоний торпидное, рассасывание воспалительных очагов происходит медленно (в пределах 6 нед).
Со стороны органов пищеварения отмечают ухудшение аппетита, при выраженной интоксикации - тошноту и рвоту; возможен запор. Некоторые больные предъявляют жалобы на метеоризм и боли в животе, иногда сильные, различной локализации. Язык увеличен, обложен грязно-серым налетом (края и кончик чистые), с отпечатками зубов по краям (схожие изменения отмечают при брюшном тифе). Очень характерна умеренная гепато- и спленомегалия. Иногда развивается реактивный гепатит со всеми присущими ему клиническими и биохимическими признаками; исход обычно благоприятный. Длительно сохраняющуюся гепатоспленомегалию (после нормализации температуры) можно наблюдать при затяжном, хроническом или рецидивирующем течении болезни.
В разгар заболевания нередко усиливаются симптомы поражения ЦНС, обусловленные интоксикацией. Возможны менингизм, серозный менингит, менингоэнцефалит, невриты, полиневрит, инфекционный психоз с бредом и галлюцинациями. В периоде реконвалесценции обычно сохраняется выраженный психастенический синдром.
К необычным симптомам острого течения Ку-лихорадки относят неврит зрительного нерва, экстрапирамидные расстройства, синдром Гийена-Барре, синдром гиперсекреции антидиуретического гормона, эпидидимит, орхит, гемолитическую анемию, увеличение ЛУ средостения (картина напоминает лимфому или лимфогранулематоз), панкреатит, узловатую эритему.
При исследовании крови отмечают нормоили лейкопению, нейтро- и эозинопению, относительный лимфоцитоз и моноцитоз, небольшое увеличение СОЭ. У 25% больных обнаруживают тромбоцитопению, а при выздоровлении часто наблюдают тромбоцитоз. Этим можно объяснить тромбоз глубоких вен, нередко осложняющий Ку-лихорадку. Иногда определяют протеинурию, гематурию, цилиндрурию.
Период реконвалесценции начинается с нормализации температуры. У 3-7% больных регистрируют рецидивы болезни через 4-15 дней после основной волны.
Стертым формам свойственна скудная и нетипичная симптоматика. Их обнаруживают при плановых серологических исследованиях, проводимых в очагах инфекции.
Возможно бессимптомное течение инфекции в эндемичных очагах и при эпидемических вспышках болезни.
Обычно болезнь начинается остро, а затем в силу каких-либо причин приобретает торпидное течение. При хроническом течении преобладают поражения легких или сердца (миокардит, эндокардит). Такие формы инфекции возникают преимущественно у больных с пороками сердца, иммунодефицитом, хронической почечной недостаточностью. Высокой лихорадки обычно нет, возможен субфебрилитет. При сочетании приобретенных пороков сердца с геморрагической сыпью неуточненной этиологии или почечной недостаточностью следует в первую очередь заподозрить Ку-лихорадку. Эндокардит, по-видимому, имеет аутоиммунный и иммунокомплексный генез. Иммунные комплексы осаждаются на створках клапанов сердца, пораженных инфекцией, или на разрастаниях эндотелия (особенно на стыке тканей больного и протезов клапанов).
Осложнения. В нераспознанных случаях или при поздно начатом лечении (особенно при хроническом течении) возможно развитие осложнений: коллапса, миокардита, эндокардита, перикардита, тромбофлебита глубоких вен конечностей; поражений органов дыхания - плеврита, инфаркта легких, абсцесса (при суперинфекции). У некоторых больных обнаруживают гепатит, панкреатит, орхит, эпидидимит, неврит, невралгию и др.
Диагностика
Основу лабораторной диагностики составляют серологические методы: РА, РСК, РНИФ, результаты которых анализируют с учетом фазовых вариаций коксиелл, что позволяет дифференцировать больных и переболевших (стандарт диагностики).
Наиболее простой и чувствительный тест - РА - используют в макро- и микромодификации. Агглютинины к 8-10-му дню болезни обнаруживают в диагностических титрах 1:8-1:16. Максимальные титры (1:32-1:512) отмечают к 30-35-му дню болезни. Затем, постепенно снижаясь, они сохраняются в организме переболевшего от нескольких месяцев до нескольких лет. В клинической практике наиболее широко используют РСК.
В последние годы все шире применяют РНИФ, так как антитела в этой реакции обнаруживают раньше, чем в РА, а также ПЦР.
Дифференциальная диагностика
В связи с полиморфизмом симптомов клиническая диагностика Ку-лихорадки чрезвычайно затруднительна и возможна только в эндемичных очагах при наличии эпидемической заболеваемости.
Дифференциальную диагностику проводят с гриппом, сыпным и брюшным тифом, бруцеллезом, орнитозом, пневмониями различной этиологии, безжелтушным лептоспирозом, сепсисом.
При поражении легких необходимо дифференцировать заболевание от туберкулеза (особенно если очаги расположены в верхних отделах легких).
Лечение
Для этиотропного лечения применяют антибиотики тетрациклиновой группы и левомицетин (стандарт лечения). Тетрациклин в первые дни болезни (до нормализации температуры) назначают по 0,4-0,5 г 4 р/сут, затем - по 0,3-0,4 г 4 р/сут в течение еще 5-7 дней, доксициклин - по 200 мг/сут, хлорамфеникол - по 0,5 г 4 р/сут. При непереносимости тетрациклинов возможно применение рифампицина и макролидов (азитромицин), а также фторхинолонов (ципрофлоксацин, офлоксацин). Длительность курса антибиотико-терапии при Ку-лихорадке составляет не менее 8-10 дней. Введение антибиотиков не предупреждает рецидивов, а также малоэффективно при осложнениях (эндокардит, гепатит). При тяжелой форме Ку-лихорадки оптимально парентеральное применение антибиотиков.
Длительно сохраняющиеся рентгенологические изменения в легких не считают показанием к пролонгированию этиотропной терапии. При хронических формах Ку-лихорадки с развитием эндокардита проводят длительный курс лечения (не менее 2 мес) тетрациклином (по 0,25 мг 4 р/сут) в сочетании с Ко-тримоксазолом♠ (по 960 мг в день).
При тяжелом течении затяжных и хронических форм возможно применение антибактериальных препаратов в сочетании с глюкокортикоидами (преднизолон по 30-60 мг/сут) в течение 5-8 дней. Патогенетическая терапия включает дезинтоксикацию, назначение НПВС, дегидратацию при поражении ЦНС.
Реконвалесцентов выписывают из стационара после полного клинического выздоровления.
Прогноз
Прогноз при своевременном полноценном лечении благоприятный, хотя восстановительный период у некоторых больных длительный и сопровождается астеновегетативным синдромом и вестибулярными нарушениями.
Летальные исходы редки и обычно обусловлены развитием эндокардита - основного синдрома хронической формы Ку-лихорадки.
Примерные сроки нетрудоспособности, диспансеризация
Примерно 50% лиц, перенесших болезнь в различной форме, в течение одного месяца остаются нетрудоспособными, а больные с тяжелой формой неспособны к труду в течение 2-3 мес после установления нормальной температуры, что обусловливает необходимость врачебной экспертизы для определения трудоспособности, особенно в случаях, когда Ку-лихорадка - профессиональное заболевание.
В соответствии с санитарными правилами и нормами лица, переболевшие коксиеллезом, подлежат диспансерному наблюдению врача-инфекциониста 2 раза в год в течение 2 лет.
Обязателен динамический контроль за электрокардиограммой и состоянием сердечно-сосудистой системы.
Эрлихиозы
Эрлихиозы (ehrlichiosis) - группа острых зоонозных, главным образом трансмиссивных, инфекционных болезней, характеризующихся полиморфизмом клинических проявлений.
Код по МКБ-10
А79.8 Другие уточненные риккетсиозы.
Этиология
Эрлихии - неподвижные грамотрицательные, риккетсиоподобные организмы, облигатные внутриклеточные паразиты, размножающиеся бинарным делением, не образующие спор. По современной классификации триба Ehrlichia входит в семейство Rickettsiaceae порядка Rickettsiales трибы α-протеобактерий.
Возбудителями заболевания у человека могут быть по меньшей мере четыре вида этих бактерий. Этиологическими агентами моноцитарного эрлихиоза являются два вида эрлихий - E. chaffeensis и E. muris. Anaplasma phagocytophilum - возбудитель человеческого гранулоцитарного эрлихиоза (гранулоцитарный анаплазмоз) также относят к трибе Ehrlichia (род Anaplasma). E. sennetsu - возбудитель лихорадки сеннетсу, высокоэндемичный для юга Японии.
Морфологически все виды эрлихий представляют собой небольшие плеоморфные кокковидные или овоидные микроорганизмы, имеющие при окраске по Романовскому-Гимзе темно-голубой или пурпурный оттенок. Их обнаруживают в вакуолях - фагосомах цитоплазмы пораженных эукариотических клеток (в основном лейкоцитарного ряда) в виде компактных скоплений отдельных частиц возбудителя, из-за внешнего вида называемых морулами. Цито-плазматические вакуоли содержат обычно 1-5 эрлихий, а количество таких вакуолей может достигать 400 и более в одной клетке. При электронной микроскопии эрлихий выявлены сходная с риккетсиями ультраструктура и одинаковый способ размножения - простое бинарное деление.
По антигенному составу эрлихии не имеют общих свойств с риккетсиями клещевой и сыпнотифозной группы, так же как и с боррелиями. Внутри самой группы у эрлихий есть перекрестные антигены.
Эрлихии не растут на искусственных питательных средах. Единственный доступный субстрат для накопления эрлихий с целью изучить их и приготовить специфические антигены - макрофагоподобные или эпителиоподобные перевиваемые клетки эукариотов. Для размножения E. sennetsu, кроме того, могут быть использованы белые мыши.
Эпидемиология
Поддержание и распространение в природе возбудителей моноцитарного и гранулоцитарного эрлихиозов связаны с иксодовыми клещами, а возбудителя эрлихиоза сеннетсу - предположительно с моллюсками, являющимися прокормителями рыб.
В США возбудитель моноцитарного эрлихиоза передают клещи A. americanum, D. variabilis, I. pacificus, в значительной части Евразии - I. persulcatus. Основной переносчик гранулоцитарного анаплазмоза в США - клещ I. scapularis, в Европе - I. ricinus, в Западно-Сибирском регионе - I. persulcatus. Кроме того, в организме одного клеща могут сосуществовать несколько различных микроорганизмов (например, эрлихии, боррелии и вирус клещевого энцефалита) и возможно заражение человека этими возбудителями одновременно.
Основными хозяевами E. canis являются собаки, хозяевами E. chaffeensis - олени. Резервуаром E. chaffeensis могут быть также собаки и лошади. Антитела к E. phagocytophila обнаружены у нескольких видов диких грызунов. В России основной хозяин Anaplasma phagocytophilum - рыжая полевка.
Эрлихии попадают в организм человека со слюной присосавшегося зараженного клеща. При лихорадке сеннетсу заражение связывают с употреблением в пищу сырой рыбы.
Заболеванию подвержены люди любого возраста; среди заболевших преобладают мужчины. Чаще заболевают охотники, жители сельской местности, лица, часто посещающие лес, тайгу. Возможны групповые заболевания.
Эрлихиозы в настоящее время регистрируют во многих странах.
Моноцитарный и гранулоцитарный эрлихиозы обнаружены и в России. При исследовании методом ПЦР клещей, собранных в Пермском крае, установлена зараженность I. persulcatus моноцитарными эрлихиями, которые относят к E. muris. Начиная с 1999-2002 гг., антитела к E. muris и E. phagocytophila, а также к A. phago-cytophilum обнаруживают у больных, к которым присасывался клещ, в Хабаровском, Алтайском, Красноярском и Пермском краях, Новосибирской, Томской и Ульяновской областях. В Пермском крае доля гранулоцитарного анаплазмоза в структуре «клещевых» инфекций составляет 23% и находится на втором месте после клещевого боррелиоза; более чем в 84% случаев эти заболевания протекают в виде микст-инфекции. Пораженность иксодовых клещей E. muris и E. phagocytophila и A. phagocytophilum в 2012-2015 гг. была выявлена практически во всех областях России, в том числе и Московской области.
Активация клещей в более теплое время года обусловливает сезонность моноцитарного эрлихиоза: апрель-сентябрь с пиком в мае-июле. Для гранулоцитарного анаплазмоза характерна двухпиковая заболеваемость: наиболее значительный пик в мае-июне связан с активностью нимфальной стадии переносчика, а второй пик в октябре (до декабря) - с преобладанием в это время взрослых особей клеща.
Экстренную профилактику следует проводить в эндемичных районах при обнаружении укуса клеща (однократный прием 0,1 г доксициклина). Неспецифическая профилактика состоит в проведении противоклещевых мероприятий перед выходом в местность, эндемичную по иксодовым клещам (специальная закрытая одежда, обработка секарицидами). После посещения эндемичной местности необходимы взаимо- и самоосмотр для выявления присосавшихся клещей.
Патогенез и патоморфология
В начальной стадии моноцитарного и гранулоцитарного эрлихиоза возбудитель внедряется через кожу. Следов в месте присасывания клеща не остается. Возбудитель попадает в подлежащие ткани и гематогенно распространяется по организму. Происходят внедрение возбудителя в клетки, размножение в цитоплазматической вакуоли и последующий выход из нее. Преимущественно поражаются макрофаги селезенки, печени, ЛУ, костного мозга. Возможно развитие очаговых некрозов и периваскулярных лимфогистиоцитарных инфильтратов во многих органах и коже. В селезенке, печени, ЛУ и костном мозге развиваются мегакариоцитоз и гемофагоцитоз. Полиорганная периваскулярная инфильтрация лимфогистиоцитами, гемофагоцитоз в органах и костном мозге, нарушение проницаемости сосудов и развитие геморрагий во внутренних органах и коже особенно выражены при тяжелом течении болезни. При фатальном исходе моноцитарного эрлихиоза происходит тотальное поражение жизненно важных органов с необратимым нарушением их функций. E. chaffeensis способны проникать в СМЖ и вызывать менингит. Изменения со стороны клеточного состава крови описаны как «синдром гемофагоцитоза». Механизм подавления иммунной защиты при эрлихиозах пока неизвестен, но летальный исход развивается чаще у больных с клиническими признаками вторичных поражений грибковой или вирусной природы.
При лихорадке сеннетсу входные ворота располагаются в области слизистой полости рта или глотки. Затем возбудитель распространяется по лимфатическим и кровеносным сосудам, сопровождается генерализованной ЛАП, поражением костного мозга и лейкоцитопенией. В инфекционный процесс иногда вовлекается эндотелий капилляров, о чем свидетельствует появление петехиальной или эритематозной сыпи.
Клиническая картина
Инкубационный период продолжается 1-21 день, а клинически выраженное заболевание - 2-3 нед, но иногда может затягиваться до 6 нед. Спектр клинических проявлений широк - от бессимптомной до выраженной клинической картины с тяжелым, угрожающим жизни течением. Общими для всех эрлихиозов считают внезапность развития лихорадки, появление озноба, чувства усталости, головной боли, миалгии, анорексии, тошноты и рвоты. При эрлихиозе сеннетсу летальные исходы не описаны, редко наблюдается и сыпь, в то время как при моноцитарном и гранулоцитарном эрлихиозе летальность достигает 3-10%, а эритематозную или петехиальную сыпь регистрируют в 2-36% случаев. Основные симптомы при лихорадке сеннетсу - подъем температуры тела до 38-39 °С, генерализованная ЛАП и повышенное содержание моноцитов в периферической крови.
Продолжительность лихорадочного периода при лихорадке сеннетсу не превышает 2 нед, при моноцитарном эрлихиозе - 23 дней, при гранулоцитарном анаплазмозе - 3-11 нед. Поскольку эрлихиозы не имеют клинических патогномоничных признаков, у больных чаще всего подозревают различные типы риккетсиоза, сепсис, грипп, инфекции ВДП, ИМ и т.д.
У больных гранулоцитарным анаплазмозом, наблюдавшихся в Хабаровском крае, заболевание начиналось остро, с подъема температуры, озноба в течение первых же суток до 39-40 °С. Одновременно появлялись сильная головная боль, ломящие боли в мышцах и крупных суставах. По мере развития заболевания больные жаловались на упорную бессонницу, тревожный сон, сонливость днем. Отмечали тахикардию, гипотонию, глухость тонов сердца; у половины больных были тошнота и рвота в первые два дня болезни.
Сыпь зарегистрирована у 87% больных; она появлялась на 1-8-й, чаще - на 3-й день болезни. Сыпь была преимущественно пятнистой, бледно-розового цвета, элементы не сливались, размеры не превышали 10 мм. Феномен подсыпания не отмечался. Обратное развитие сыпи происходило без остаточных явлений, обычно на 8-9-й день. У некоторых больных в месте присасывания клеща отмечали наличие плотноватого инфильтрата до 20 мм, покрытого в центре темно-коричневой корочкой (эта местная реакция была только у больных с длительным, более суток, присасыванием клеща). Ни у одного больного не было ЛАП. На фоне высокой температуры отмечали сухость во рту, анорексию, задержку стула в течение нескольких дней. У 20% больных выявлены потемнение мочи, иктеричность склер; у 33% больных - увеличение печени. Наиболее постоянным лабораторным признаком у большинства больных моноцитарным и гранулоцитарным эрлихиозом было повышение активности печеночных трансфераз в сыворотке крови (АЛТ - в 3-4 раза, АСТ - в 1,5-2,5 раза). В гемограмме отмечали лейкопению, нейтропению (не более 2,0 × 109 /л), выраженный сдвиг нейтрофильной формулы влево. У 71% больных зарегистрирована умеренная тромбоцитопения. СОЭ чаще была незначительно увеличена (в среднем до 23 мм/ч). У 40% больных наблюдали микропротеинурию (0,033-0,33 г/л) и умеренную лейкоцитурию.
У больных моноцитарным эрлихиозом из Пермского края (1999-2000 гг.) отмечали практически такую же симптоматику, за исключением катаральных явлений у 1/4 больных, увеличенных до 1,5 см подчелюстных ЛУ и развития у ряда больных серозного менингита. У некоторых из них выявляли парез лицевого нерва по центральному типу. В отличие от больных гранулоцитарным анаплазмозом, у больных моноцитарным эрлихиозом не было сыпи. У 42% отмечали инъекцию сосудов склер и конъюнктив. Наблюдались гепатомегалия, субиктеричность склер и потемнение мочи с повышением уровня связанного билирубина и активности аминотрансфераз. У части пациентов констатировали двухволновое течение болезни: вторая волна имела более тяжелое течение, что проявлялось высокой и длительной лихорадкой, выраженной интоксикацией; у некоторых больных в это время развился серозный менингит. Отмечено также повышение уровня креатинина, но клинических проявлений почечной недостаточности не было. У половины больных зарегистрированы тромбоцитопения, повышение СОЭ (16-46 мм/ч); лейкоцитопения (2,9-4,0 × 109 /л). Клинические симптомы исчезают на 3-5-й день после начала антибиотикотерапии. У реконвалесцентов сохраняется астения в течение 4-6 нед после выписки. При тяжелом течении моноцитарного и гранулоцитарного эрлихиоза и отсутствии этиотропной терапии наиболее часто отмечали нарушение функции почек, вплоть до почечной недостаточности (9%), развитие ДВС-синдрома с желудочно-кишечным, легочным или множественными кровотечениями. У 10% больных гранулоцитарным анаплазмозом наблюдали развитие легочных инфильтратов. У некоторых пациентов в начале болезни возникали судороги, развивалось коматозное состояние.
Диагностика
Основные признаки, позволяющие поставить диагноз, - клинико-лабораторные данные в сочетании с эпидемиологическим анамнезом: пребывание больного в местности, эндемичной по эрлихиозу, присасывание клеща.
Исследование мазков крови, окрашенных по Романовскому-Гимзе, дает положительные находки (вакуоли в цитоплазме нейтрофилов или моноцитов, содержащие скопления эрлихий) редко, и только в острой фазе болезни.
В настоящее время серологическую диагностику эрлихиозов проводят при помощи РНИФ, ИФА, реже иммуноблоттинга. Сероконверсия происходит в течение первой недели заболевания, а антитела, определяемые у переболевших, могут сохраняться на протяжении 2 лет. Минимальный диагностический титр составляет 1:64-1:80 при исследовании одного образца сыворотки, взятой в лихорадочный период или в период ранней реконвалесценции, а также в срок, не превышающий одного года после начала болезни. Максимальные титры антител при моноцитарном эрлихиозе на 3-10-й неделе болезни составляли 1:640-1:1280. Разрабатываются тест-системы ПЦР-диагностики.
Дифференциальная диагностика
Поскольку отсутствуют патогномоничные симптомы и возможно течение заболевания в виде микст-инфекции, дифференциальная диагностика затруднена. Информация о нападении клеща за 1-3 нед до болезни дает основание заподозрить системный клещевой боррелиоз (лайм-боррелиоз, боррелиоз, вызванный bor. miyamatoi), а в эндемичных районах - другие клещевые лихорадки. Дифференциальную диагностику проводят также с ИМ, сыпным и брюшным тифом, лептоспирозом. Часто возникающая микст-инфекция (эрлихиозы с классической формой клещевого боррелиоза и клещевым энцефалитом) накладывает отпечаток на картину болезни и зачастую не имеет четких дифференциальных признаков, необходимых для клинической диагностики, однако при гранулоцитарном анаплазмозе опорными симптомами могут служить острый безжелтушный гепатит, а также выраженная лейкопения, лимфопения и увеличение числа палочко-ядерных элементов в начале болезни.
Лечение
Показаниями к госпитализации считают тяжелое течение болезни, развитие осложнений. В госпитализации нуждаются 50-60%, причем около 7% больных необходима интенсивная терапия.
Медикаментозная терапия
Наиболее эффективны тетрациклин (0,3-0,4 г 4 р/сут в течение 5-10 дней) или доксициклин (по 0,1 г 2 раза в 1-е сутки, затем однократно). Можно использовать хлорамфеникол (Левомицетин♠). Лечение необходимо сочетать с патогенетическими и симптоматическими средствами (дезинтоксикация, борьба с осложнениями и пр.).
Прогноз
Прогноз при развитии тяжелых осложнений в отсутствие своевременной комплексной терапии серьезный.
Доброкачественный лимфоретикулез
Доброкачественный лимфоретикулез (фелиноз, болезнь кошачьих царапин, cat scratch disease) - острая зоонозная инфекционная болезнь с контактным и трансмиссивным механизмом передачи возбудителя, характеризующаяся первичным аффектом, лимфаденитом, в части случаев - конъюнктивитом, при иммунодефиците - ангиоматозом и поражением печени.
Код по МКБ-10
А28.1 Лихорадка от кошачьих царапин.
Этиология
Возбудитель - Bartonella henselae, рода Bartonella семейства Barto-nellaceae - подвижная мелкая грамотрицательная палочка округлой формы, размером 0,2-0,5 × 1,0 × 3,0 мкм, имеет пили и один жгутик, способна к внутриклеточному паразитированию. Окрашиваются по Романовскому-Гимзе, а в биоптатах из тканей - красителями с применением серебра (по Warthmg-Starry). В иммунохимических исследованиях используют краситель акридиновый оранжевый. Бактерии имеют четко структурированную трехслойную оболочку, содержащую до 12 протеинов с молекулярной массой 28-174 кД. Размножение происходит простым поперечным делением. В воде выживают до 7 сут, чувствительны к обычным дезинфектантам, аминогликозидам, макролидам, тетрациклинам, рифампицину, В-лактамам. B. henselae можно культивировать в кошачьих блохах, а также на полужидких или твердых питательных средах, обогащенных 5-10% крови человека или животных. Жгутиковый белок - флигелин участвует в адгезии и инвазии бартонелл в клетки организма человека. Патогенность бартонелл связана также с белком tpA - карбокситерминальной протеазой.
Эпидемиология
Источник возбудителя для человека - кошки, чаще котята. Особенно опасны бродячие кошки. Кошки легко заражаются B. henselae посредством укусов блохами Cfenocephalidesfelis. В организме кошки B. henselae сохраняется более года, входит в состав микрофлоры слизистой оболочки рта. У кошек возможна бессимптомная бактериемия длительностью до 17 мес (срок наблюдения), которая прекращается после курса антибиотикотерапии. Заражение человека происходит во время тесного контакта с кошкой (укус, царапание, лизание) при повреждении кожи или конъюнктивы глаза. Блохи могут нападать и на человека, осуществляя трансмиссивную передачу болезни. Приблизительно у 90% заболевших в анамнезе есть указания на контакт с кошками, но описаны случаи заболевания после контактов с другими животными. Восприимчивость низкая.
Обычно заболевают дети и лица моложе 20 лет, чаще осенью и зимой. Иногда возникают семейные вспышки. Больные не заразны. После перенесенного заболевания развивается стойкий иммунитет, но описаны рецидивы болезни у взрослых.
Меры профилактики
Специфическая профилактика не разработана. При уходе за кошками необходимо соблюдать правила личной гигиены. Домашних кошек не следует выпускать на улицу. Показана дезинсекция кошек. Ранку от укуса, царапины обрабатывают настойкой йода или бриллиантового зеленого.
Патогенез
Распространение возбудителя от места входных ворот происходит лимфогенно и гематогенно. B. henselae с помощью жгутика сначала прикрепляются к поверхности, а затем внедряются в эритроциты и эндотелиальные клетки сосудов и эндокарда и в дальнейшем стимулируют пролиферацию клеток эндотелия и рост мелких сосудов (капилляров), что может приводить к развитию ангиоматоза.
В местах прикрепления возбудителя к чувствительным клеткам формируются скопления микроорганизмов с развитием воспаления и разрастанием клеток эндотелия и прилегающих тканей. Часть эндотелиальных клеток некротизируется. В результате развивается лимфаденит, ангиоматоз или их сочетание с одновременным поражением костномозговых клеток и эритроцитов. Вокруг участков с «набухшими» («эпителиоидными») клетками группируются нейтрофилы и эозинофилы. Бактерии обнаруживают в эритроцитах, клетках эндотелия сосудов, селезенки, ЛУ, печени, костного мозга, кожи. В клапанах сердца у больных с выраженным эндокардитом появляются многочисленные вегетации, состоящие из фибрина и тромбоцитов. У лиц с иммунной недостаточностью часть популяции B. henselae в воспалительных инфильтратах локализуется внутриклеточно. При бациллярном ангиоматозе морфологической основой болезни служит локальная пролиферация разбухших эндотелиальных клеток, выступающих в просвет сосудов и приводящих к формированию гемангиом.
Клиническая картина
Инкубационный период от 3 до 20 (обычно 7-14) сут. Различают типичную, глазную формы болезни и бациллярный ангиоматоз. Типичные формы характеризуются развитием первичного аффекта и регионарным лимфаденитом. На месте уже зажившей ранки после укуса или царапины появляется небольшая чувствительная папула от 2 до 5 мм в диаметре с ободком гиперемии кожи, затем она превращается в везикулу или пустулу, а в дальнейшем - в небольшую язвочку (не всегда), покрытую сухой коркой. К моменту обращения к врачу воспалительная реакция исчезает и обнаруживается корочка по ходу рубчика от царапины. Корочка может отпасть, царапина зажить, поэтому первичный аффект часто не обнаруживают. Первичный аффект локализуется чаще на кисти или предплечье, реже - на лице, шее, в области ключиц, на голени. Общее состояние не нарушается. Через 15-30 сут после заражения развивается регионарный лимфаденит - постоянный и иногда единственный симптом болезни. Чаще поражаются подмышечные, локтевые, реже - околоушные и паховые ЛУ. Они достигают диаметра 3-5 см и более, бывают обычно плотными, малоболезненными, подвижными; не спаяны между собой, с кожей и окружающими тканями. Увеличение ЛУ сохраняется от 2-4 мес до года. В процесс вовлекается от одного до нескольких (10-20% случаев) ЛУ одной группы. Двустороннюю ЛАП обнаруживают редко. У половины больных через 1 мес и более происходит нагноение ЛУ, они спаиваются с кожей; появляются застойная гиперемия, флюктуация; формируется свищ, из которого в течение 2-3 мес выделяется гной, затем происходит заживление с образованием рубца. Симптомы интоксикации (лихорадка, озноб, слабость, головная боль и др.) наблюдают у 30-40% больных. Температура тела может повышаться до 38-41 °С, быть приступообразной, сохраняться от 1 до 3 нед. Характерны слабость, повышенная утомляемость, головная боль. Часто увеличиваются печень и селезенка, даже при отсутствии лихорадочной реакции. Течение болезни может быть волнообразным. Поражение нервной системы в виде менингита регистрируют у 5-6% больных. Оно развивается при тяжелом течении болезни через 1-6 нед после появления ЛАП, сопровождается выраженной лихорадкой, интоксикацией, умеренно выраженным менингеальным синдромом, смешанным плеоцитозом СМЖ, радикулитом, полиневритом, миелитом. Другие осложнения - тромбоцитопеническая пурпура, пневмония, эндокардит, абсцесс селезенки.
Если входными воротами служит конъюнктива, развивается глазная форма болезни (3-7% больных). Как правило, поражается один глаз. На фоне лихорадки и интоксикации появляется выраженный отек век, конъюнктивы, развивается хемоз. На конъюнктиве век (или только верхнего века) и переходной складке появляются серо-желтые узелки, которые часто изъязвляются. Отделяемое из глазной щели - слизисто-гнойное. Роговица обычно не поражается. ЛУ, находящийся перед мочкой ушной раковины, значительно увеличивается и часто нагнаивается с образованием свища, после которого остается рубец. Иногда увеличиваются и поднижнечелюстные ЛУ. Воспалительные изменения сохраняются 1-2 нед; общая длительность болезни колеблется от 1 до 28 нед.
В некоторых случаях возможны разнообразная сыпь, тромбоцитопеническая пурпура, поражение костей, суставов, печени, селезенки, развитие висцеральной ЛАП. Такое течение в основном характерно для лиц с выраженным иммунодефицитом. Эту форму доброкачественного лимфоретикулеза выделяют как «бациллярный ангиоматоз», который можно трактовать как генерализованную форму доброкачественного лимфоретикулеза. При этом развивается ангиоматоз кожи в виде одиночных или множественных безболезненных папул красного или пурпурного цвета, от точечных до более крупных, беспорядочно расположенных на различных участках тела, конечностях, голове и лице. В дальнейшем папулы увеличиваются до размеров ЛУ или небольших опухолей, напоминая гемангиомы, и могут возвышаться, подобно грибам, над кожей. Некоторые из них нагнаиваются и напоминают пиогенные гранулемы. Иногда развиваются поражения в виде бляшек с центром гиперкератоза или некроза. Многие сосудистые разрастания кровоточат. При более глубоком подкожном расположении сосудистых разрастаний появляются узловатые образования, размеры которых могут достигать нескольких сантиметров. Они также располагаются на любом участке тела, часто диффузно по всему телу или голове. Возможно сочетание поверхностных и более глубоко расположенных подкожных сосудистых разрастаний, а также поражение сосудов внутренних органов и костей, вплоть до выраженного остеолиза. Бациллярный ангиоматоз протекает с лихорадкой, выраженной интоксикацией. Характерны значительное повышение СОЭ, лейкоцитоз.
В самостоятельную форму заболевания некоторые авторы выделяют бациллярный пурпурный гепатит (bacillary peliosis hepatitis), однако более правильно эту форму расценивать как вариант течения бациллярного ангиоматоза, при котором преобладают признаки поражения паренхимы печени. Вследствие поражения мелких сосудов в них формируются кистозные образования, переполненные кровью, которые сдавливают клетки печени. В результате развивается застой крови и нарушаются функции печени. Среди жалоб фигурируют тошнота, диарея, вздутие живота на фоне лихорадки с ознобом. При обследовании обнаруживают гепатоспленомегалию, анемию, тромбоцитопению, повышение активности печеночных ферментов в сыворотке крови, а гистологически - множественные расширенные капилляры и переполненные кровью кавернозные пространства в паренхиме печени.
Диагностика
При диагностике доброкачественного лимфоретикулеза принимают во внимание первичный аффект в анамнезе, возникший после контакта с кошкой за несколько дней или недель до начала заболевания, увеличение регионального ЛУ.
Диагноз можно подтвердить результатами бактериологического анализа крови, а также гистологически: исследуют ткани папулы или ЛУ, окрашивая их с применением серебра по Warthing-Starry с целью определить скопление бактерий. При бациллярном ангиоматозе гнездные скопления возбудителя обнаруживают в массивных периваскулярных эозинофильных инфильтратах. При электронной микроскопии отчетливо видны плеоморфные палочки с трехслойной грамотрицательной оболочкой. Используют серодиагностику: она дает возможность обнаружить антитела в крови (и нарастание их титра) к специфическому антигену микроорганизма (РИФ и ИФА). Разработаны молекулярно-генетические методы с использованием ПЦР.
Дифференциальная диагностика. Проводят с туберкулезом ЛУ, туляремией, бактериальным лимфаденитом. Во всех случаях необходимо учитывать характерный анамнез. При бациллярном ангиоматозе или тяжелых системных поражениях дифференциальную диагностику следует проводить также с саркомой Капоши (обязательно гистологическое исследование).
Лечение
Режим домашний.
В специальной диете нет необходимости.
Медикаментозная терапия. В типичных случаях проводят симптоматическую терапию, при нагноении ЛУ производят его экстирпацию. Вскрывать ЛУ не рекомендуется, так как возможно формирование свищей, которые не заживают до года и более. Этиотропная терапия проводится фторхинолонами, азитромицином, рифампицином. Менее эффективен доксициклин. Больным ВИЧ-инфекцией, кроме антибиотиков, назначают АРВТ.
Орнитоз
Орнитоз (ornithosis; син. пситтакоз - psittacosis) - зоонозная природно-антропургическая инфекционная болезнь с аэрозольным механизмом передачи возбудителя, характеризующаяся лихорадкой, интоксикацией, преимущественным поражением органов дыхания.
Код по МКБ-10
А70 Орнитоз.
Этиология
Возбудитель орнитоза - грамотрицательные бактерии Chlamydophila psittaci, рода Chlamidia семейства Chlamidiaceae, облигатный внутриклеточный паразит. Размножается путем бинарного деления в цитоплазме пораженных клеток. Имеет двухфазный цикл развития с чередованием двух форм - элементарных и ретикулярных телец. Хламидии способны образовывать L-формы. Имеют термолабильные антигены. Факторы патогенности - поверхностные экзотоксины и ЛПС (эндотоксин). Культивируются в культурах ткани и на куриных эмбрионах. Высокоустойчивы в окружающей среде. Чувствительны к средствам дезинфекции.
Эпидемиология
Резервуар и источник возбудителя - различные виды диких синантропных, декоративных и домашних птиц. Механизм передачи возбудителя аэрозольный, путь передачи - воздушно-пылевой. Возможен фекально-оральный механизм с пищевым путем передачи инфекции (до 10% случаев). Орнитоз - повсеместно распространенная болезнь, регистрируется в виде спорадических случаев и групповых производственных или семейных вспышек. Установлено, что 10-20% внебольничных пневмоний имеют орнитозную этиологию. Наибольшее эпидемиологическое значение имеют домашние птицы, птицы семейства голубиных, декоративные птицы. Зараженность городских голубей колеблется в пределах 30-80%. Значительная зараженность отмечается среди ворон. Орнитоз у птиц проявляется ринитом, диареей, адинамией, отказом от еды, слипанием перьев. Больные птицы, особенно декоративные, часто погибают. Зараженные птицы выделяют возбудитель с фекалиями и носовым секретом. Возможна трансовариальная передача возбудителя в двух и более поколениях. Заражение человека происходит вследствие контакта с птицами, инфицированными предметами ухода за ними и продуктами птицеводства.
Восприимчивость человека к орнитозу высокая. Болеют в основном люди среднего и старшего возраста, дети - редко. Иммунитет нестойкий, известны случаи повторного заболевания. В ряде случаев у переболевших формируется длительное носительство. Как носители, так и больные орнитозом люди, как правило, опасности для окружающих не представляют. Однако описаны достоверные случаи заражения медицинских сестер, обслуживающих больных орнитозом.
Патогенез
Возбудитель проникает через слизистые оболочки верхних дыхательных путей и фиксируется в эпителии бронхов, бронхиол и альвеол, где проходит его репродукция, вызывающая гибель клеток, высвобождение возбудителя и его токсинов. Развиваются бактериемия и токсинемия и, как следствие, лихорадка и интоксикация. Существенное значение имеет присоединение вторичной бактериальной флоры. C. psittaci могут поражать легкие, бронхи, печень, селезенку, мышцу сердца, ЦНС. Подавляя защитные механизмы, возбудитель способен длительно персистировать в макрофагах, ретикулоэндотелиальных клетках и эпителии дыхательных путей, что объясняет возможность затяжного, рецидивирующего и хронического течения болезни. При пероральном инфицировании возбудитель не вызывает каких-либо изменений в органах пищеварительного тракта, отсутствуют и симптомы поражения респираторного тракта, т.е. развивается тифоподобная (лихорадочная) форма болезни.
Клиническая картина
Общепринятой классификации орнитоза нет. Наиболее рациональна следующая классификация.
По тяжести выделяют легкую, среднетяжелую и тяжелую формы болезни. Острая форма длится до 1,5-2,0 мес, подострая - от 2 до 6 мес, хроническая - от 2 до 8 лет.
На гриппоподобную и пневмоническую формы приходится до 85% всех случаев болезни.
Инкубационный период от 5 до 30, чаще 8-12 дней. При пневмонической форме болезнь начинается остро: с озноба, повышения температуры тела до 38-40 °С, выраженной слабости, головной боли, боли в мышцах и суставах. Температура достигает максимума на 2-4-й день болезни. Лихорадка носит ремиттирующий характер, и без лечения на 2-4-й неделе болезни температура литически снижается. При тяжелом течении возможна лихорадка постоянного типа. Со 2-3-го дня болезни появляется сухой, иногда приступообразный кашель. На 3-4-й день кашель становится продуктивным. Мокрота слизисто-гнойная, иногда с прожилками крови. Возможны боли при дыхании, одышка. Основные признаки в этот период - ларинго-трахеит и трахеобронхит. На 5-7-й день определяют физикальные признаки поражения легких: укорочение перкуторного звука, ослабленное или жесткое дыхание, необильную крепитацию или мелкопузырчатые хрипы в нижних отделах легких. У некоторых больных к концу первой недели болезни выслушивается шум трения плевры. При рентгенологическом исследовании определяют одностороннюю, чаще справа, нижнедолевую, реже двустороннюю пневмонию. Выделяют четыре типа пневмоний при орнитозе: интерстициальный (у половины больных), мелкоочаговый, крупноочаговый и лобарный. Для всех типов пневмоний характерны расширение корней легких, усиление бронхососудистого рисунка и увеличение бифуркационных ЛУ. К концу лихорадочного периода пневмония разрешается. У части больных в течение многих лет может сохраняться усиление легочного рисунка. Со стороны сердечно-сосудистой системы - тенденция к брадикардии, умеренной гипотензии и лабильности пульса. При тяжелом течении болезни выявляют приглушение тонов сердца, систолический шум и ЭКГ-признаки диффузного поражения миокарда. Аппетит снижен, могут быть тошнота, рвота, чаще отмечается задержка стула. Язык обложен. У половины больных с 3-4-го дня болезни увеличивается печень, определяются признаки нарушения ее функции, возможен гепатит. У трети больных в этот же период увеличивается селезенка. У всех больных признаки нейротоксикоза: головная боль, бессонница, вялость, адинамия. При тяжелом течении - депрессивное состояние, бред, спутанное сознание с психомоторным возбуждением, эйфория. Могут определяться признаки менингизма, в редких случаях - серозный менингит. Обычно пневмонический вариант орнитоза характеризуется среднетяжелым и тяжелым течением.
Гриппоподобная форма орнитоза диагностируется только во время вспышек и характеризуется острым началом, кратковременной (от 2 до 8 дней) лихорадкой от 37,5 до 39 °С, признаками интоксикации, сухим кашлем, першением в горле, иногда - осиплостью голоса. Течение болезни легкое или среднетяжелое.
Тифоподобная форма развивается при алиментарном заражении и характеризуется выраженной лихорадкой постоянного или ремиттирующего типа, относительной брадикардией, гепатоспленомегалией, выраженным нейротоксикозом и отсутствием поражения органов дыхания.
Орнитозный менингит наблюдают у 1-2% больных. Болезнь начинается остро, с повышения температуры тела до 39-40 °С и симптомов интоксикации. В течение 2-4 сут (реже 6-8 дней) появляются менингеальные симптомы. СМЖ вытекает под повышенным давлением, в ней отмечают лимфоцитарный цитоз до 300-500 клеток в 1 мкл, увеличение белка до 0,6-1,2 г/л. Болезнь протекает длительно. Лихорадка имеет волнообразное течение и сохраняется 3-4 нед. Санация СМЖ наступает через 5-6 нед и позже. Стойких резидуальных явлений со стороны ЦНС не наблюдается.
У всех больных, независимо от формы орнитоза, в периоде реконвалесценции до 2-3 мес и более сохраняется астенизация с резким снижением трудоспособности, быстрой утомляемостью, гипотензией, вегетососудистыми изменениями (акроцианоз, зябкость конечностей, гипергидроз ладоней, тремор век и пальцев рук).
Хронизация процесса наблюдается у 5-10% больных и обусловлена развитием хронической пневмонии, реже - эндокардитом (у лиц, страдающих пороками сердца). В большинстве случаев хроническая пневмония обусловлена не только хламидофилой, но и кокковой флорой, что необходимо учитывать при лечении.
Для всех форм острого орнитоза характерна тенденция к лейкопении и лимфоцитозу, значительное, до 40-60 мм/ч, увеличение СОЭ даже в легких случаях.
Осложнения орнитоза - менингит, тромбофлебит, гепатит, миокардит, иридоциклит, тиреоидит, панкреатит. Их возникновение возможно и в период ранней реконвалесценции. При современных формах орнитоза осложнения встречаются редко, более часты рецидивы (особенно при нерациональном лечении). Рецидивы возникают через 1-2 нед после нормализации температуры тела и длятся 5-7 дней.
Диагностика
Предварительный диагноз пневмонической формы орнитоза устанавливают на основании клинико-эпидемиологических данных: картины атипичной пневмонии (клинически, рентгенологически), отсутствия острой воспалительной реакции крови, высокой СОЭ, контакта с птицей. Диагноз подтверждают следующими способами: методом бактериоскопии мазков мокроты, окрашенных по Романовскому-Гимзе; антигены хламидий определяют при помощи ИФА, РИФ или РНИФ с использованием антител, меченных флюорохромом; биологическим методом - путем заражения куриных эмбрионов или индикаторных клеток исследуемым материалом; ПЦР - наиболее чувствительный, специфический ранний метод диагностики; серологическим методом - посредством РСК (диагностический титр 1:16-1:32 и выше) или в парных сыворотках, взятых с интервалом в 10-14 сут при нарастании титра антител в 4 раза и более. Реже используют РНГА, диагностический титр 1:512 или нарастание титра антител в парных сыворотках в 4 раза и более.
Диагноз гриппоподобной и тифоподобной формы орнитоза устанавливают при лабораторном обследовании лихорадящих больных, имевших контакт с птицей.
Дифференциальная диагностика
Дифференциальную диагностику проводят с широким кругом острых лихорадочных заболеваний, протекающих с катарально-респираторным синдромом и поражением легких; наиболее часто с пневмококковой пневмонией, Ку-лихорадкой, легионеллезом.
Лечение
Госпитализация по клиническим показаниям (высокая лихорадка свыше 5 сут, пневмония, не поддающаяся стандартной терапии). Режим постельный или полупостельный. Специфической диеты не требуется, стол № 13.
Этиотропная терапия: доксициклин 0,1 г 2 р/сут до третьего дня нормальной температуры, но не менее 10 сут. При замедленном регрессе процесса в легких - до 10-го дня нормальной температуры (до 3 нед). Альтернативные препараты - эритромицин в дозе 0,5 г 3-4 р/сут по аналогичной схеме и азитромицин - 0,5 г/сут однократно, до 10-12 сут.
Патогенетическая терапия: бронхолитики, отхаркивающие средства, в периоде реконвалесценции - физиотерапия.
При затяжном, рецидивирующем и хроническом течении вне обострений показано лечение в санаториях пульмонологического профиля в климатической зоне по месту проживания.
Прогноз
Летальность менее 1%, частота хронизации - до 10%.
Примерные сроки нетрудоспособности
Сроки нетрудоспособности - 7-10 сут при гриппоподобной форме, 20-40 сут при остром течении пневмонической формы. При затяжном и хроническом течении сроки нетрудоспособности, ограничение трудоспособности (инвалидность) устанавливаются комиссией.
Диспансеризация проводится не менее 1 года.
Респираторный микоплазмоз
Микоплазмоз респираторный (микоплазма-пневмонии инфекция) - антропонозная инфекционная болезнь, вызываемая Mycoplasma pneumoniae, с аэрозольным механизмом передачи возбудителя, протекающая преимущественно с поражением различных отделов респираторного тракта.
Коды по МКБ-10
J15.7 Пневмония, вызванная Mycoplasma pneumoniae.
J20.0 Острый бронхит, вызванный Mycoplasma pneumoniae.
Этиология
Возбудитель респираторного микоплазмоза - микоплазма вида Pneumoniae рода Mycoplasma семейства Mycoplasmataceae, единственная патогенная из 14 выделенных от человека представителей рода Mycoplasma (Mycoplasma spp.). Отсутствие клеточной стенки обусловливает ряд свойств, в том числе выраженный полиморфизм и устойчивость к β-лактамным антибиотикам. Микоплазмы размножаются бинарным делением или вследствие десинхронизации деления клеток и репликации ДНК удлиняются с образованием нитевидных, мицелло-подобных форм, содержащих многократно реплицированный геном и впоследствии разделяющихся на кокковидные (элементарные) тела.
Микоплазмы малоустойчивы в окружающей среде: в составе аэрозоля в условиях помещения сохраняют жизнеспособность до 30 мин, гибнут под действием ультрафиолетовых лучей, дезинфицирующих средств, чувствительны к изменению осмотического давления и другим факторам.
Эпидемиология
Источник возбудителя - человек с манифестной или бессимптомной формой инфекции M. pneumoniae (она может выделяться из глоточной слизи в течение 8 нед и более от начала заболевания даже на фоне эффективной антимикробной терапии). Возможно транзиторное носительство M. pneumoniae. Механизм передачи - аспирационный, осуществляется преимущественно воздушно-капельным путем. Восприимчивость наиболее высока у детей старше 5 лет, подростков и лиц молодого возраста. M. pneumoniae -инфекция распространена повсеместно, но наибольшее число случаев отмечается в городах. На фоне спорадической заболеваемости периодически наблюдаются вспышки респираторного микоплазмоза, длящиеся до 3-5 мес и более. Для передачи возбудителя требуется довольно тесный и длительный контакт, поэтому респираторный микоплазмоз особенно распространен в закрытых коллективах (воинских, студенческих и др.); во вновь сформированных воинских коллективах до 20-40% пневмоний вызвано M. pneumoniae. Типичны вторичные случаи M. pneumoniae -инфекции в семейных очагах (первично заболевает ребенок школьного возраста). Спорадическая заболеваемость M. pneumoniae-инфекцией наблюдается в течение всего года, вспышки респираторного микоплазмоза чаще возникают осенью. Для M. pneumoniae-инфекции характерно периодическое повышение заболеваемости с интервалом в 3-5 лет.
После перенесенной микоплазменной пневмонии формируется выраженный клеточный и гуморальный иммунитет длительностью 5-10 лет.
Специфическая профилактика микоплазмозов не разработана. Неспецифическая профилактика сходна с профилактикой других ОРЗ (разобщение, влажная уборка, проветривание помещений).
Патогенез
Возбудитель попадает на поверхность слизистых оболочек дыхательных путей, проникает через мукоцилиарный барьер и прочно прикрепляется к мембране эпителиальных клеток с помощью терминальных структур. Происходит встраивание участков мембраны возбудителя в мембрану клеток; тесный межмембранный контакт не исключает проникновения содержимого микоплазм в клетку. Использование микоплазмами клеточных метаболитов и стеролов мембраны клетки, а также, в свою очередь, действие метаболитов микоплазм - перекиси водорода и супероксидных радикалов - приводит к повреждению и/или гибели клеток, возникает дисфункция ресничек мерцательного эпителия. Обычно процесс ограничивается слизистой оболочкой верхних дыхательных путей и бронхов. В случае распространения процесса на терминальные отделы респираторного тракта развивается пневмония, нередко интерстициальная. У детей раннего возраста возможно развитие гиалиновых мембран. Происходит увеличение перибронхиальных ЛУ. В случае тяжелого течения респираторного микоплазмоза возможно развитие фиброза легких. В патогенезе микоплазмоза большое значение придают иммунопатологическим реакциям, обусловливающим многие внелегочные проявления микоплазмоза.
Клиническая картина
Инкубационный период 1-4 нед, в среднем 3 нед. Респираторный микоплазмоз протекает в двух клинических формах: ОРЗ, пневмония.
M. pneumoniae-инфекция может быть бессимптомной.
При остром респираторном заболевании начало болезни обычно постепенное, реже острое. Температура тела повышается до 37,138 °С, иногда выше. Повышение температуры может сопровождаться умеренным ознобом, чувством «ломоты» в теле, недомоганием, головной болью. Иногда отмечается повышенная потливость. Лихорадка сохраняется в течение 1-8 дней, субфебрилитет - до 1,5-2 нед.
Больных беспокоят сухость, першение в горле. С первого дня болезни появляется приступообразный непродуктивный кашель, который постепенно усиливается и в ряде случаев становится продуктивным с отделением небольшого количества вязкой, слизистой мокроты. Кашель сохраняется 5-15 дней, но может беспокоить и дольше. Примерно у половины больных фарингит сочетается с ринитом (заложенность носа и умеренная ринорея).
При легком течении процесс обычно ограничивается поражением ВДП (фарингит, ринит), при среднетяжелом и тяжелом течении присоединяется поражение нижних отделов респираторного тракта (ринобронхит, фарингобронхит, ринофарингобронхит).
При осмотре выявляют умеренную гиперемию слизистой оболочки задней стенки глотки, увеличение лимфатических фолликулов, иногда гиперемию слизистой оболочки мягкого нёба и язычка. Нередко увеличиваются поднижнечелюстные ЛУ. Для бронхита при M. pneumoniae-инфекции характерно несоответствие между выраженностью приступообразного кашля и неяркими и непостоянными физикальными изменениями в легких.
В отдельных случаях отмечается диарея, возможна боль в животе, иногда в течение нескольких дней.
Пневмония, вызванная M. pneumoniae
Пневмония, вызванная M. pneumoniae, относится к группе атипичных пневмоний. У детей старших возрастных групп и лиц молодого возраста до 40% пневмоний обусловлено M. pneumoniae.
Начало болезни чаще постепенное, реже - острое. При остром начале симптомы интоксикации появляются в 1-й день болезни и достигают максимума к 3-му. При постепенном начале болезни имеется продромальный период длительностью до 6-10 дней: появляется сухой кашель, возможны симптомы фарингита, ларингита, нечасто - ринита; недомогание, познабливание, умеренная головная боль. Температура тела нормальная или субфебрильная, затем повышается до 38-40 °С, усиливается интоксикация, достигая максимума на 7-12-й день от начала болезни (умеренная головная боль, миалгии, повышенная потливость, наблюдающаяся и после нормализации температуры).
Кашель (частый, приступообразный) может приводить к рвоте, болям за грудиной и в эпигастральной области) - ранний, постоянный и продолжительный симптом микоплазменной пневмонии. Вначале сухой, к концу 2-й недели болезни он обычно становится продуктивным, с выделением небольшого количества вязкой слизистой или слизисто-гнойной мокроты. Кашель сохраняется 1,5-3 нед и более. Нередко с 5-7-го дня от начала болезни отмечается боль в грудной клетке при дыхании на стороне пораженного легкого.
Лихорадка сохраняется на высоком уровне в течение 1-5 дней, затем снижается, и в течение разного времени (в отдельных случаях до месяца) может сохраняться субфебрилитет. Слабость может беспокоить больного в течение нескольких месяцев. При микоплазменной пневмонии возможно затяжное и рецидивирующее течение.
Физикальные изменения в легких часто выражены слабо, могут отсутствовать. У части больных выявляют укорочение перкуторного звука, может выслушиваться ослабленное или жесткое дыхание, сухие и влажные хрипы. При плеврите - шум трения плевры.
Нередко наблюдают внелегочные проявления. Одни из наиболее частых - гастроинтестинальные симптомы (тошнота, рвота, диарея), описаны гепатит и панкреатит.
Возможна экзантема - пятнисто-папулезная, уртикарная, узловатая эритема, многоформная экссудативная эритема и др. Нередкое проявление M. pneumoniae-инфекции - артралгии, артриты. Возможно поражение миокарда, перикарда. Характерен геморрагический буллезный мирингит.
Гемолитическая анемия возникает на 2-3-й неделе болезни, что совпадает с максимальным титром холодовых антител, часто развивается желтуха, возможна гемоглобинурия. Процесс продолжается несколько недель.
Возможны поражения НС: серозный менингит, менингоэнцефалит, энцефалит, полирадикулопатия (включая синдром Гийена-Барре); реже - поражение черепных нервов, острый психоз, мозжечковая атаксия, поперечный миелит. В СМЖ в ряде случаев выявляется ДНК M. pneumoniae методом ПЦР. Поражение нервной системы может быть причиной летального исхода.
Осложнения: абсцесс легкого, плеврит, ОРДС. В исходе заболевания возможно развитие диффузного интерстициального фиброза. Риск осложнений наиболее высок у пациентов с иммунодефицитом, курильщиков, злоупотребляющих алкоголем и детей с серповидно-клеточной анемией и другими гемоглобинопатиями. Бактериальная суперинфекция развивается редко.
Летальность составляет 1%. В некоторых случаях причиной смерти являются ДВС-синдром крови или осложнения со стороны ЦНС.
Диагностика
Этиологическая диагностика возможна при использовании специфических лабораторных методов.
Ориентировочные клинические признаки пневмонии микоплазменной этиологии: подострое начало респираторного синдрома (трахеобронхит, назофарингит, ларингит); субфебрильная температура тела; малопродуктивный, мучительный кашель; негнойный характер мокроты; скудные аускультативные данные; внелегочные проявления.
Рентгенологическое исследование органов грудной клетки. При M. pneumoniae-пневмонии возможны как типичные пневмонические инфильтраты, так и интерстициальные изменения. Рентгенологическая картина вариабельна. Нередко наблюдается двустороннее поражение легких с усилением легочного рисунка и перибронхиальной инфильтрацией. Характерны расширение теней крупных сосудистых стволов и обогащение легочного рисунка мелкими линейными и петлистыми деталями. Усиление легочного рисунка может быть ограниченным или распространенным. Инфильтративные изменения разнообразны: пятнистые, неоднородные и негомогенные, без четких границ. Локализуются обычно в одной из нижних долей, вовлекая в процесс один или более сегментов; возможна очагово-сливная инфильтрация в проекции нескольких сегментов или доли легкого. Возможны двустороннее поражение, инфильтрация в верхней доле, ателектазы, вовлечение в процесс плевры как в виде сухого плеврита, так и с появлением небольшого выпота, интерлобит.
В мазке мокроты больных пневмонией обнаруживают большое количество мононуклеарных клеток и некоторое количество гранулоцитов. У некоторых пациентов наблюдается гнойная мокрота с большим количеством полиморфноядерных лейкоцитов. Микоплазмы не выявляются при микроскопии мазка мокроты, окрашенного по Граму.
Специфическая лабораторная диагностика. Антигены микоплазмы можно выявить с помощью РИФ в мазках из носоглотки, мокроты и другом клиническом материале. Также антиген M. pneumoniae можно обнаружить в сыворотке крови методом ИФА и в реакции агрегатгемагглютинации. Определение специфических антител проводится с использованием РСК, РНИФ, ИФА, РНГА. Наиболее часто используют ИФА и/или РНИФ для обнаружения IgM-, IgA-, IgG-антител. Диагностическое значение имеет нарастание титров IgA- и IgМ-антител в 4 раза и более при исследовании в парных сыворотках.
Определение генетического материала возбудителя методом ПЦР в настоящее время относится к наиболее распространенным ранним и специфическим методам диагностики микоплазменной инфекции.
Одна из рекомендуемых схем диагностики M. pneumoniae-инфекции - определение ДНК возбудителя методом ПЦР в материале из носоглотки в комбинации с определением антител методом ИФА.
Данные общего анализа крови неинформативны.
Дифференциальная диагностика
Пневмонию, ассоциированную с M. pneumoniae, необходимо дифференцировать не только с другими наиболее часто встречающимися внебольничными пневмониями (вызванными S. pneumoniae, C. pneumoniae, H. influenzae), но и с легионеллезом, орнитозом, Ку-лихорадкой, туляремией, коклюшем, аденовирусной инфекцией, гриппом, парагриппом, респираторно-синцитиальной вирусной инфекцией, коронавирусной инфекцией и др.
Лечение
Показания к госпитализации: клинические (тяжелое течение заболевания, отягощенный преморбидный фон, неэффективность стартовой антибактериальной терапии); социальные (например, невозможность адекватного ухода и выполнения врачебных назначений в домашних условиях); эпидемиологические (например, пациенты, проживающие в коллективах).
В остром периоде болезни режим полупостельный, специальной диеты не требуется.
Медикаментозная терапия
ОРЗ, вызванное M. pneumoniae, не требует этиотропной терапии.
Препараты выбора у амбулаторных больных при подозрении на микоплазма-пневмонию - макролиды (азитромицин, кларитромицин, рокситромицин, джозамицин).
Альтернативные препараты - респираторные фторхинолоны (левофлоксацин, моксифлоксацин); возможно применение доксициклина.
Продолжительность терапии составляет 7-14 дней. Препараты принимают внутрь.
Дозы препаратов: азитромицин 0,25 г 1 р/сут (в 1-е сутки 0,5 г) или 2 г однократно (при применении лекарственной формы азитромицина пролонгированного действия); кларитромицин 0,5 г 2 р/сут; рокси-тромицин 0,15 г 2 р/сут; спирамицин 3 млн МЕ 2 р/сут; джозамицин 1 г 2 р/сут или 0,5 г 3 р/сут; левофлоксацин 0,5 г 1 р/сут; моксифлок-сацин 0,4 г 1 р/сут; доксициклин 0,1 г 1-2 р/сут (в первые сутки 0,2 г).
Патогенетическую терапию острого респираторного заболевания и пневмонии, вызванных M. pneumoniae, проводят по принципам патогенетической терапии ОРЗ и пневмоний иной этиологии.
В период реконвалесценции показаны физиотерапия и ЛФК (дыхательная гимнастика).
Реконвалесцентам пневмонии, обусловленной M. pneumoniae, показано санаторно-курортное лечение.
Прогноз в большинстве случаев благоприятный. Летальный исход наблюдается редко.
Глава 17. Вирусные инфекции
Вирусные гепатиты
Гепатит А
Гепатит А (ГА) - острая вирусная антропонозная инфекционная болезнь с фекально-оральным механизмом передачи возбудителя. Характеризуется развитием паренхиматозного гепатита с циклическим, преимущественно доброкачественным, течением.
Коды по МКБ-10
В15 Острый гепатит А.
В15.0 Гепатит А с печеночной комой.
В15.9 Гепатит А без печеночной комы.
Этиология
Возбудитель ГA - вирус (hepatitis A virus, HAV), относится к роду Hepatovirus семейства Picornaviridae. Морфологически HAV представляет собой безоболочечную сферическую частицу размером 27-30 нм. Геном представлен одноцепочечной молекулой РНК, окруженной белковым капсидом. Известен только один антиген HAV - НААg, против которого макроорганизм вырабатывает антитела. HAV - гепатотропный вирус, обладает слабым цитопатогенным действием на печеночные клетки. HAV относят к числу наиболее устойчивых к факторам окружающей среды вирусов человека. При комнатной температуре сохраняется в течение нескольких недель, при +4 °С - месяцами, при -20 °С остается жизнеспособным несколько лет. Выдерживает нагревание до 60 °С в течение 4-12 ч; устойчив к действию кислот и жирорастворителей, способен к длительному сохранению в воде, пищевых продуктах, сточных водах, на различных объектах окружающей среды. При кипячении разрушается в течение 5 мин, при обработке хлорамином - через 15 мин. Вирус чувствителен к формалину, ультрафиолетовому облучению.
Инактивируется при автоклавировании, перманганатом калия, йодистыми соединениями, 70% этанолом, дезинфектантами на основе четвертичных аммониевых соединений.
Эпидемиология
Подъем заболеваемости ГА отмечается каждые 5-6-10 лет. Уровень регистрируемой заболеваемости ГA в России до 1995 г. превышал 100 на 100 тыс. населения. В 2015 г. зафиксирован самый низкий уровень заболеваемости - 4,41 на 100 тыс. населения. При оценке широты распространенности ВГA следует учитывать, что на один случай заболевания, протекающего с желтухой, приходится 5 и более случаев без желтухи, которые обычно не выявляют и, соответственно, не регистрируют.
Единственный источник возбудителя инфекции - человек. Вирус выделяют больные с различными формами заболевания, безжелтушной и стертой, которые обычно не диагностируют. У больных желтушной формой вирус выделяется с фекалиями наиболее интенсивно в конце инкубационного и в течение преджелтушного периодов. С появлением желтухи заразность больных значительно уменьшается. С помощью ПЦР у части пациентов установлено наличие РНК HAV в крови и выделение его с фекалиями и после исчезновения желтухи. HAV обладает высокой инфекционностью, для заражения человека достаточно всего нескольких вирусных частиц.
Пути передачи ГA: водный, пищевой и бытовой. Факторы передачи - различные пищевые продукты, не подвергшиеся термической обработке, а также вода и грязные руки. В детских коллективах большое значение имеет контактно-бытовой путь передачи через грязные руки и различные предметы обихода. Очень редко может происходить передача HAV половым путем у гомосексуалов.
Циркуляция HAV в крови может продолжаться несколько месяцев после инфицирования, что дало основание предполагать возможность парентерального механизма заражения HAV, в частности реципиентов крови, а также лиц, вводящих психоактивные препараты внутривенно.
HAV не проходит через плаценту, и его нет в грудном молоке.
Восприимчивость людей к HAV всеобщая. Дети первого года жизни относительно редко заболевают ГA, в связи с наличием пассивного иммунитета.
Иммунитет после перенесенного ГA практически пожизненный.
Меры профилактики
Специфические
Специфическую профилактику осуществляют инактивированными вакцинами. В России зарегистрированы несколько как отечественных, так и зарубежных вакцин. Применяют двукратное введение вакцины, что обеспечивает длительную (до 25 лет) защиту от ГA. В национальный календарь профилактических прививок вакцинация против ГA включена по эпидемическим показаниям.
Неспецифические
Неспецифическая профилактика ГA, как и других кишечных инфекций, включает санитарно-гигиенические мероприятия, обеспечение населения доброкачественной питьевой водой и продуктами питания. Ранняя диагностика ГA и изоляция заболевших еще до появления у них желтухи может предотвратить заражение окружающих. Лица, контактировавшие с больными ГA, должны находиться под наблюдением в течение 35 дней с момента последнего контакта (термометрия, опрос, определение размеров печени и селезенки, осмотр кожи и слизистых оболочек, мочи). При наличии у них лихорадки, диспепсических явлений, потемнения мочи проводят исследования билирубина и активности трансфераз. По решению врача-эпидемиолога в зависимости от конкретной ситуации в очаге ГA может быть назначено также обследование контактных лиц с целью выявления безжелтушного и стертого вариантов ГA, а также инаппаратной инфекции.
Патогенез
Внедрение HAV в организм происходит через рот и далее в желудок. Будучи кислотоустойчивым, вирус преодолевает желудочный барьер, поступает в тонкую кишку, всасывается в кровь и по системе воротной вены достигает печени, в клетках которой происходит его репликация. На мембране гепатоцитов есть соответствующие вирусу рецепторы, к которым HAV прикрепляется и проникает внутрь печеночной клеткия. Часть вновь образованных вирусных частиц поступает с желчью в фекалии и выделяется из организма, другая - инфицирует соседние гепатоциты.
Установлено, что репликация HAV в культуре клеток не сопровождается цитолизом гепатоцитов. Поэтому считается, что поражение гепатоцитов обусловлено иммуно-клеточными реакциями. Освобождение от вируса происходит в значительной степени благодаря иммунологически опосредствованному разрушению печеночных клеток. Благодаря быстрому и интенсивному иммунному ответу возникает блокада репликации вируса, а его дальнейшее внедрение в неинфицированные гепатоциты прекращается. Как правило, уже через несколько недель организм освобождается от HAV, поэтому при ГA нет ни длительного вирусоносительства, ни хронических форм. Адекватностью защитной иммунной реакции при ГA объясняют сравнительно легкое его течение, полное выздоровление в подавляющем большинстве случаев. При ГA печень - единственный орган-мишень, поэтому внепеченочные проявления ГA не свойственны.
Патоморфология
К характерным признакам ГA относится острое воспаление всей паренхимы печени, которое обнаруживают еще до развития желтухи. Основная масса гепатоцитов сохраняется неповрежденной, некроз затрагивает лишь отдельные клетки печени.
Легкому течению ГA соответствует точечный или пятнистый некроз, среднетяжелому - зональный, при котором деструктивные процессы происходят в участках (зонах) печеночной ткани, при ГA зональный некроз наблюдается преимущественно по периферии, а не в центре печеночных долек. Некроз гепатоцитов сопровождается лейкоцитарной и гистоцитарной инфильтрацией.
Клиническая картина
Классификация
По выраженности клинических проявлений:
По длительности и цикличности течения: острое (до 3 мес), затяжное (более 3 мес), с рецидивами, обострениями (клиническими, ферментативными).
По тяжести: легкая, среднетяжелая, тяжелая, фульминантная (молниеносная).
Осложнения: печеночная кома, функциональные и воспалительные заболевания желчевыводящих путей.
Исходы: выздоровление, затянувшаяся реконвалесценция.
Продолжительность инкубационного периода от 7 до 50 дней, составляет в среднем около месяца.
Желтушный вариант ГA. Начало болезни с преджелтушного периода, обычно острое, с повышением температуры тела до 38-39 °С, симптомами интоксикации (головная боль, головокружение, слабость, разбитость, ломота в мышцах, костях, суставах и др.) и диспепсическим синдромом (снижение аппетита, тошнота, горечь во рту, отрыжка, рвота, тяжесть в эпигастральной области и правом подреберье, задержка стула, реже диарея). Одновременно, а иногда раньше диспепсических, могут возникнуть незначительно выраженные катаральные явления со стороны ВДП, что нередко приводит к ошибочной диагностике ОРЗ. У детей возможны интенсивные боли в животе, имитирующие острый аппендицит, желчную колику. В конце преджелтушного периода, продолжительность которого чаще всего составляет от 3 до 7 дней (от 2 до 14 дней), моча становится темно-желтой, а кал - гипохоличным. В отдельных случаях возможен зуд кожи. У детей уже в преджелтушном периоде может быть выявлено увеличение печени. В сыворотке крови заболевших ГA в преджелтушном периоде значительно (в 10 и более раз) повышена активность аминотрансфераз, а в моче увеличено содержание уробилина. Через 3-5 дней температура тела обычно нормализуется, но появляется иктеричность - вначале склер, затем кожи, что знаменует начало желтушного периода. У 2-5% больных симптомы преджелтушного периода отсутствуют,
С появлением желтухи самочувствие больных начинает улучшаться, нормализуется температура тела, через несколько дней исчезают все симптомы преджелтушного периода. Дольше сохраняются слабость и снижение аппетита. Нередко у больных ГA на фоне желтухи продолжается лихорадка и нарастают симптомы интоксикации, чаще у пациентов с хронической алкогольной интоксикацией или наркотической зависимостью.
Желтуха при ГA нарастает быстро, достигая максимума за 3-5 дней, в последующие 5-10 дней держится на одном уровне, а затем интенсивность ее уменьшается. В среднем продолжительность желтушного периода около 2 нед. При осмотре больного обнаруживают увеличение и уплотнение печени. Увеличение селезенки отмечают у 10-20% больных, чаще у детей. На высоте желтухи характерна брадикардия. По мере уменьшения интенсивности желтухи нормализуется окраска кала и мочи, уменьшается до нормальных размеров печень. В желтушном периоде сохраняется выраженная гиперферментемия (активность аминотрансфераз в 10-100 раз выше нормы) с преимущественным повышением активности АЛТ по сравнению с АСТ (коэффициент де Ритиса менее 1). Гипербилирубинемия обычно умеренная и непродолжительная, в основном за счет связанной фракции билирубина («прямой» билирубин). В гемограмме отмечается нормоцитоз или лейкопения, относительный лимфоцитоз; СОЭ в норме. В моче обнаруживаются желчные пигменты (билирубин).
Период реконвалесценции характеризуется быстрым исчезновением клинических и биохимических признаков болезни, в частности гипербилирубинемии. Позднее нормализуется активность АЛТ и АСТ; повышение тимоловой пробы может сохраняться в течение нескольких месяцев. Самочувствие переболевших ВГA, как правило, бывает удовлетворительным, возможны утомляемость после физической нагрузки, неприятные ощущения, тяжесть в животе после еды, иногда сохраняется незначительное увеличение печени. Продолжительность этого периода в большинстве случаев не превышает 3 мес.
В некоторых случаях период реконвалесценции может затягиваться до 6-8 и более месяцев, возможны обострения (ферментативные или клинические), а также рецидивы, которые развиваются обычно у лиц 20-40 лет и протекают, как правило, легче, чем первая волна заболевания.
Желтушный вариант ГA чаще всего протекает в легкой или средне-тяжелой формах. Тяжелую форму ГA встречают не более чем у 1% больных, преимущественно у лиц старше 40 лет, у пациентов с хронической алкогольной интоксикацией или наркотической зависимостью, при сочетании ВГA с острым или хроническим ВГ другой этиологии. У детей тяжелую форму ВГA регистрируют в пубертатном периоде, а также на фоне ожирения и отягощенного аллергологического анамнеза. Как и при других острых ВГ, основной критерий тяжести ГA - проявления интоксикации: общая слабость, адинамия, головокружение, диспепсические расстройства, вегетососудистые нарушения, а в отдельных случаях - нарушения сознания.
Легкую форму гепатита характеризуют слабовыраженные явления интоксикации или их отсутствие. Интенсивность и продолжительность желтухи при легкой форме меньше, чем при среднетяжелой форме. При отчетливом повышении уровня АЛТ и АСТ в крови показатели протеинограммы, а также коагулограммы при легкой форме вирусного гепатита существенно не отклоняются от нормы.
Среднетяжелую форму гепатита характеризует количественное нарастание и усиление всех перечисленных выше клинических признаков болезни без проявления качественно новых клинических симптомов. Общая слабость умеренно выражена. Головная боль непостоянна, больше выражены тяжесть в голове и умеренная адинамия с повышенной утомляемостью. Аппетит плохой, тошнота выраженная. Желтуха яркая и стойкая, уровень билирубина и АЛТ существенно не отличимы от таковых при легкой форме. Наиболее информативны некоторые показатели коагулограммы, в частности снижение протромбинового индекса.
Тяжелую форму гепатита характеризуют, помимо нарастания признаков интоксикации: головокружение, мелькание мушек перед глазами и адинамия, к которым могут присоединиться геморрагический синдром, тахикардия, болезненность в области печени, склонность к задержке жидкости, лихорадка с нейтрофильным лейкоцитозом. Более четкими оказываются биохимические признаки: билирубинемия, протромбиновый индекс, более высокий показатель АСТ по сравнению с АЛТ, появление при нарастании тяжести билирубино-ферментной диссоциации - снижение уровня активности аминотрансфераз с одновременным повышением уровня билирубина крови.
ОПЭ сопровождается, помимо нарастания интоксикации, появлением сонливости, эмоциональными нарушениями, «хлопающим тремором», стереотипностью в ответах, сокращением размеров печени с появлением боли в правом подреберье на фоне усиления желтухи (I степень ОПЭ - начальный период прекомы). Степень II ОПЭ - характеризуется спутанностью сознания в виде дезориентации в пространстве и времени, психомоторное возбуждение. Степень III ОПЭ - начальный период комы, который отличает от предыдущей невозможность словесного контакта при сохранении адекватной реакции на боль. IV степень ОПЭ - глубокая кома с отсутствием болевой реакции, арефлексией. Фульминантная (молниеносная) форма ВГA с развитием ОПН наблюдается у 0,1-0,8% больных.
Иногда ГA сопровождает выраженный холестатический компонент (холестатический вариант ГA), желтушный период удлиняется до нескольких месяцев, желтуха интенсивная, сопровождается зудом, в крови значительно повышена активность ЩФ. Синдром холестаза характерен и для ГA с аутоиммунным компонентом, сочетаясь в этом случае с другими системными иммунными нарушениями: васкулит, нефрит, полиартралгия, пурпура, острая гемолитическая анемия, лихорадка. В сыворотке крови появляются криоглобулины и ревматоидный фактор, повышено количество циркулирующих иммунных комплексов (ЦИК), γ-глобулинов, могут выявляться аутоантитела (в частности, к гладкой мускулатуре).
Безжелтушный вариант характеризуют те же клинические и лабораторные признаки, что и желтушный, однако отсутствие желтухи и гипербилирубинемии затрудняет диагностику. Клиническая симптоматика безжелтушного варианта соответствует проявлениям начального периода желтушного варианта. Возможны кратковременное повышение температуры тела, диспепсические явления, слабость, катаральный синдром и др. в течение 3-5 дней. Увеличивается и становится слегка болезненной при пальпации печень, возможно потемнение мочи, уробилинурия. Выявляют гиперферментемию, показатели АЛТ и АСТ повышены почти так же существенно, как и при желтушном варианте, увеличен показатель тимолового теста.
Стертый вариант проявляется минимальными и быстро проходящими клиническими симптомами (в том числе желтухой) в сочетании с гиперферментемией.
При субклиническом (инаппарантном) варианте самочувствие заболевших не нарушено, печень не увеличена, желтуха отсутствует, но активность АЛТ и АСТ повышена, в сыворотке крови определяют специфические маркеры ГA.
ГA на фоне хронической инфекции HBV характеризует пролонгированное течение, стойкие остаточные явления. У ВИЧ-инфицированных острый период ГA не имеет каких-либо особенностей.
ГA и хроническая алкогольная интоксикация оказывают эффект взаимного отягощения.
Осложнения для ГA не характерны, самое тяжелое из них - печеночная кома. Возможны функциональные и воспалительные заболевания желчевыводящих путей.
Диагностика
Диагноз ГA устанавливают с учетом клинических, эпидемиологических и лабораторных данных. Основанием для предположения о ГA являются: острое начало болезни с высокой температурой тела, диспепсическими и астеновегетативными явлениями, короткий преджелтушный период, увеличение печени, улучшение самочувствия, нормализация температуры тела при появлении желтухи, гиперферментемия (АЛТ, АСТ) с коэффициентом де Ритиса менее 1, гипербилирубинемия (преимущественно за счет связанной фракции), указание на контакт с больным(и) желтухой за 7-50 дней до заболевания или употребление сырой воды из случайных источников, немытых овощей и фруктов и т.д.; случаи ГA в коллективе, нахождение в местности с высокой заболеваемостью ГA в соответствующие инкубационному периоду сроки.
Специфическая диагностика
Специфический маркер ГA - IgM-антитела к HAV, выявляемые методом ИФА в сыворотке крови с первых дней болезни и далее в течение 3-6 мес. Анти-HAV IgG появляются со 2-3-й нед болезни, титр их нарастает медленно и достигает максимума через 4-6 мес, затем снижается, но они обнаруживаются в течение нескольких десятилетий (возможно, пожизненно). Анти-HAV IgG обнаруживают у значительной части взрослых людей, что является доказательством перенесенного ранее ГA. Анти-HAV IgG вырабатываются также у вакцинированных против ГA. РНК HAV в сыворотке крови может быть выявлена за несколько дней до повышения активности АЛТ, т.е. ПЦР - высокоспецифический ранний метод диагностики ГA, позволяет количественно оценить интенсивность вирусемии (ПЦР в режиме реального времени).
Дифференциальная диагностика
Дифференциальную диагностику проводят в преджелтушном периоде - с гриппом, ОРЗ, ПТИ, гастроэнтеритами различной этиологии.
В желтушном периоде проводят дифференциальную диагностику с другими гепатитами, в том числе вирусными (В, С, D, Е). Принимают во внимание результаты определения соответствующих специфических маркеров в динамике заболевания.
В ряде случаев возникает необходимость отграничения ГA от других инфекционных заболеваний, протекающих с гепатитом (лептоспироз, иерсиниозы, ИМ, малярия и др.), а также от пигментных гепатозов (в частности, синдрома Жильбера).
Токсические гепатиты (в том числе лекарственный, острый алкогольный и др.) могут иметь сходство с ГA. Тщательный сбор анамнеза, включая сведения о применении конкретных медикаментов, употреблении алкоголя, грибов, контакте с гепатотропными ядами, имеют важное значение для установления соответствующего диагноза.
Лечение
Больные ГA в легкой форме могут лечиться на дому. Госпитализация по эпидемическим и клиническим показаниям. Этиотропная терапия не разработана, противовирусные препараты не используются.
При легкой форме ограничиваются базисной терапией, которая включает диету и щадящий режим. Рекомендуется обильное питье (до 2-3 л/сут) некрепко заваренного чая с молоком, медом, вареньем, а также отвара шиповника, свежеприготовленных фруктовых и ягодных соков, компотов, щелочных минеральных вод.
Больным среднетяжелой формой ГA назначают энтеросорбенты [повидон (Энтеродез♠), полиметилсилоксана полигидрат (Энтеросгель♠) и др.], а при тошноте, отказе от питья внутривенно капельно 5% раствор декстрозы (Глюкозы♠) и др.; при тяжелой форме проводится интенсивная патогенетическая терапия, включая плазмаферез. В случаях с выраженным холестатическим синдромом рекомендуются жирорастворимые витамины А и Е, энтеросорбенты, препараты урсодезоксихолиевой кислоты.
Пациентам ГA с хронической алкогольной интоксикацией показан адеметионин в первые 2 нед внутривенно по 800-1600 мг ежедневно, затем по 2-4 таблетки в день.
Потребность в витаминах должна обеспечиваться за счет пищевых продуктов, дополнительно назначаются поливитаминные препараты.
Необходимо следить за ежедневным опорожнением кишечника. При запорах следует использовать лактулозу, дозу которой подбирают индивидуально (30-60 мл/сут) таким образом, чтобы стул был ежедневным.
Выписка из стационара производится при хорошем самочувствии, отсутствии желтухи, уменьшении размеров печени, улучшении биохимических показателей (допускается повышенный уровень активности аминотрансфераз до 3-5 N). После выписки из стационара реконвалесценты нуждаются в освобождении от работы не менее чем на 2 нед. При затянувшейся реконвалесценции сроки нетрудоспособности продляются.
Диспансерное наблюдение
Реконвалесценты ГA находятся на диспансерном наблюдении в КИЗ в течение 3-6 мес в зависимости от их самочувствия, быстроты нормализации размеров печени и динамики биохимических исследований.
При возобновлении у реконвалесцента ГA желтухи и гиперферментемии (АЛТ, АСТ) необходима повторная госпитализация. Реконвалесцентам со стойким умеренным повышением активности АЛТ и АСТ целесообразно назначение одного из гепатопротекторов: глицирризиновая кислота + фосфолипиды (Фосфоглив♠) по 1 капсуле 3 р/сут, силибинин, фосфолипиды (Эссенциале Н♠) по 1-2 капсулы 3 р/сут, адеметионин по 2-4 таблетки в сутки, урсодезоксихолевая кислота по 15 мг/кг/сут.
В периоде выздоровления от ГA реконвалесценты могут быть направлены а местные санатории, курорты с питьевыми минеральными водами.
Гепатит Е
ВГE - вирусная инфекционная болезнь с фекально-оральным механизмом передачи возбудителя, характеризующаяся преимущественно водным путем передачи, острым циклическим течением и частым развитием острой печеночной энцефалопатии у беременных во II-III триместре беременности и у рожениц.
Код болезни по МКБ-10
В17.2.
Этиология
HEV имеет сферическую форму, диаметр около 32 нм, геном представлен однонитевой РНК, по своим свойствам близок к калицивирусам (семейство Caliciviridae). Вирус быстро разрушается под воздействием хлорсодержащих дезинфицирующих средств, менее устойчив в окружающей среде, чем HAV.
Эпидемиология
Источником возбудителя являются больные острыми формами болезни. Вирус начинает выявляться в крови больного через 2 нед после заражения, а в фекалиях - за неделю до начала болезни и всю первую неделю болезни. Вирусемия продолжается около 2 нед.
Основной путь передачи инфекции - водный. Гепатит Е встречается повсеместно, но большая часть случаев регистрируется в развивающихся странах Азии и Африки с тропическим и субтропическим климатом. В последние годы в мире ежегодно регистрируется примерно 20 млн случаев гепатита Е и более 56 тыс. смертей, ассоциированных с гепатитом Е.
HEV может передаваться от беременной женщины плоду в III триместре беременности. Вирус также выделяется от животных и птиц - они могут быть резервуаром HEV-инфекции для человека, особенно свиньи. Поэтому некоторые авторы считают эту болезнь зоонозом. Имеются данные о передаче HEV при переливании крови от донора с бессимптомной вирусемией. В странах Западной Европы, в России и Северной Америке заболеваемость гепатитом Е носит спорадический характер и преимущественно регистрируется у больных, вернувшихся из поездок в эндемичные по ВГE регионы.
Меры профилактики
Специфические: в октябре 2012 г. в Китае начато промышленное производство вакцины против гепатита Е, однако эта вакцина не зарегистрирована на территории других стран.
Неспецифические: соблюдение правил личной и общественной гигиены, высоких стандартов для обеспечения населения чистой водопроводной водой может привести к снижению числа случаев гепатита Е в эндемичных странах. Путешественникам рекомендуют не пить воду из случайных источников, не есть пищу, не прошедшую термической обработки, и т.д.
Патогенез
Патогенез изучен недостаточно. По-видимому, вирус Е обладает прямым цитопатическим действием. Важной особенностью ВГE является тяжелое течение болезни у беременных в III триместре, однако причины этого феномена не выяснены. В основе тяжелого течения болезни лежит массивный некроз гепатоцитов, развитие тромбогеморрагического синдрома вследствие резкого дефицита плазменных факторов гемостаза, а также гемолиз, приводящий к ОПН. Непосредственной причиной смерти является отек мозга и ДВС-синдром.
Клиническая картина
Инкубационный период 3-8 нед, в среднем около 40 дней. Болезнь протекает в желтушной и безжелтушной форме (примерное соотношение 1:9). Желтушная форма развивается в основном у лиц молодого и зрелого возраста (15-40 лет). Для желтушных форм характерно острое циклическое, преимущественно легкое течение болезни. Преджелтушный период чаще короткий - 2-5 дней, преобладают проявления диспепсического синдрома. Кратковременная лихорадка (чаще субфебрильная) наблюдается у 10-20% больных. Примерно у 20% больных преджелтушный период отсутствует. Продолжительность желтушного периода от нескольких дней до 1 мес (в среднем 2 нед), возможно развитие холестатической формы болезни с длительной желтухой, кожным зудом. Примерно у 1% больных желтушными формами ВГE развивается фульминантный гепатит. Особенностью гепатита Е является тяжелое течение болезни у беременных, особенно в III триместре, а также у рожениц в течение первой недели после родов. Предвестниками такого течения болезни могут быть выраженность симптомов интоксикации, лихорадка, диспепсический синдром, боль в правом подреберье уже в преджелтушном периоде болезни. После появления желтухи быстро нарастают симптомы печеночной энцефалопатии вплоть до развития комы. Характерными особенностями являются гемолиз, гемоглобинурия, олигоанурия, а также геморрагический синдром, обусловленный снижением активности (до 2-7% нормы) факторов протромбинового комплекса (II, VII, X). Геморрагический синдром проявляется в виде желудочно-кишечных, маточных и других кровотечений, которые нередко являются непосредственной причиной смерти. Беременность в большинстве случаев заканчивается внутриутробной смертью плода, выкидышем, преждевременными родами. Из родившихся живыми половина детей погибают в течение месяца. В эндемичных по ВГE регионах мира фульминантный гепатит Е у беременных развивается в 70% случаев. Летальность в III триместре беременности превышает 50%.
У детей гепатит Е протекает чаще всего в безжелтушной форме и не диагностируется.
Диагноз
На ВГE могут указывать предположение о водном пути заражения гепатитом, посещение эндемичной по гепатиту Е страны, клинические проявления болезни, подобные ВГА, выявление тяжелых форм с симптомами печеночной энцефалопатии, у беременных во второй половине беременности, раннем послеродовом периоде или у кормящих матерей. Обязательно следует обследовать на гепатит Е пациентов с клинико-лабораторными признаками острого гепатита при отрицательных результатах обследования сыворотки крови больного на наличие маркеров острой фазы вирусных гепатитов А-D. Диагноз ВГE может подтвердить выявление анти-HEV IgM в сыворотке крови, которые появляются в крови через 3-4 нед после инфицирования и исчезают через несколько месяцев. Стандартизированных тест-систем для выявления анти-HEV нет, используются коммерческие тест-системы. Обнаружение РНК вируса Е в крови или стуле пациента может быть использовано в качестве дополнительного теста.
Дифференциальная диагностика проводится между ВГE и другими ВГ, лекарственным и токсическим гепатитами, а у беременных - острым жировым гепатозом, HELLP-синдромом.
Лечение
Обязательная госпитализация в стационар требуется для беременных, родильниц в раннем послеродовом периоде, больных с признаками тяжелого течения гепатита. При ВГE применяется такой же комплекс лечебных мероприятий, как при других острых вирусных гепатитах легкой и средней степени тяжести. Официальные рекомендации по этиотропной терапии отсутствуют. Имеются сообщения об эффективности рибавирина при остром ВГE, пэгилированного ИФН-α2.
В случае развития тяжелого течения гепатита лечение проводится в отделениях (палатах) интенсивной терапии с использованием всех средств и методов, направленных на профилактику и лечение печеночной энцефалопатии, тромбо-геморрагического синдрома. При развитии гепатита Е у беременных искусственное прерывание беременности не рекомендуется. В родах следует стремиться к их укорочению и обезболиванию. Выписка из стационара производится после нормализации клинических и биохимических показателей с последующим диспансерным наблюдением через 1, 3 мес после выписки.
Гепатит B
ВГB, или ГB, - вирусная антропонозная инфекционная болезнь с контактным и вертикальным механизмами передачи возбудителя. Характеризуется развитием циклически протекающего паренхиматозного гепатита с наличием или отсутствием желтухи, заканчивающегося в большинстве случаев (до 90-95%) выздоровлением, а также возможностью развития ХГB.
Коды по МКБ-10
B16 Острый гепатит В.
B16.2 Острый гепатит В без дельта-агента с печеночной комой.
B16.9 Острый гепатит В без дельта-агента без печеночной комы.
B16.0 Острый гепатит В с дельта-агентом (коинфекция) и печеночной комой.
B16.1 Острый гепатит В с дельта-агентом (коинфекция) без печеночной комы.
В17.0 Острая дельта (супер-инфекция) вирусоносителя гепатита В.
ХГB регистрируют под кодами:
B18.1 Хронический гепатит В без дельта-агента;
B18.0 Хронический гепатит В с дельта-агентом.
Этиология
HBV относится к семейству гепаднавирусов - ДНК-содержащих вирусов, поражающих печень, роду Orthohepadnavirus. HBV (частица Дейна) имеет сферическую форму, диаметр 40-48 нм. Оболочка состоит из фосфолипидного бислоя толщиной 7 нм, в который погружены субъединицы поверхностного антигена (HBsAg). Внутри HBV находится нуклеокапсид, или ядро (core), имеющее форму икосаэдра диаметром 28 нм и содержащее геном HBV, концевой белок и фермент ДНК-полимеразу.
HBsAg синтезируется в цитоплазме гепатоцита со значительным избытком и, таким образом, в результате репродукции компонентов HBV в сыворотке крови больного преобладают частицы HBsAg, а не полноценные вирионы. HBsAg представляет комплекс белковых молекул, содержащий несколько антигенных детерминант, которые определяет субтип этого белка. Существует 8 основных субтипов HBsAg: ауw1, ayw2, ayw3, ayw4, ayr, adr, adw2, adw4. В России регистрируют в основном субтипы ayw и adw. Изоляты вируса, выделенные в различных регионах мира, объединены в 10 основных генотипов, которые обозначены буквами латинского алфавита: A, B, C, D, E, F, G, H, I, J. Для каждого генотипа HBV характерны особенности распространенности как на отдельных территориях в мире, так и в определенных этнических группах. В РФ наиболее распространены генотипы D и А, которые выявляются приблизительно в 90% и 10% случаев соответственно. Вероятность развития ОПН выше у больных, инфицированных генотипом D HBV. Генотипу В более свойственна сероконверсия HBe/анти-HBe в молодом возрасте, по сравнению с генотипом С. ХГB, вызванный HBV генотипов С и D, несколько чаще имеет прогрессирующий характер, нежели вызванный генотипом А. Частота ремиссии после сероконверсии по HBeAg, а также спонтанной элиминации HBsAg выше у инфицированных генотипом А HBV.
S-ген HBV отвечает за синтез HBsAg, который вызывает продукцию нейтрализующих антител, поэтому S-ген используют для производства генно-инженерных вакцин. Ген C (core-ген) кодирует белок нуклеокапсида (HBcAg). Ген P кодирует белок, обладающий ферментативной активностью, - ДНК-полимеразу HBV. Ген X кодирует белок, который играет важную роль в развитии первичного рака печени у вирусоносителей HBV.
Против каждого антигена HBV в организме человека вырабатываются специфические антитела. В клинической практике выявление антигенов и антител используют для диагностики ВГB, определения стадии процесса, прогноза, оценки эффективности терапии, определения показаний к вакцинации и ревакцинации.
HBV высокоустойчив к физическим и химическим факторам, сохраняет жизнеспособность в сыворотке крови при комнатной температуре в течение 3 мес, в высушенной плазме - до 25 лет, не погибает при действии многих дезинфицирующих средств и консервантов крови. Инактивируется при автоклавировании (45 мин) и стерилизации сухим жаром (+160 °С), чувствителен к эфиру и неионным детергентам. Для дезинфекции используют в основном альдегиды и соединения хлора.
Эпидемиология
Распространенность HBV-инфекции (заболеваемость острыми формами и частота вирусоносительства) в различных регионах мира существенно различается. Критерием оценки распространенности считают частоту выявления HBsAg среди здорового населения. Низким уровнем распространенности принято считать регионы с частотой носительства менее 2%, средним или умеренным - 2-7%, более 7% - высоким. В европейской части России процент носителей относительно невелик (2%), а на востоке РФ (в частности, в Тыве и Якутии) достигает 8-10%.
В России в 1992 г. заболеваемость составляла 18 на 100 тыс. населения, однако в связи с увеличением доли лиц, использующих внутривенное введение наркотиков, происходил систематический рост заболеваемости, и в 1999-2000 гг. она достигла пика (42,5-43,8 на 100 тыс.). С 2001 г. уровень заболеваемости начал снижаться и в 2015 г. составлял 1,13 на 100 тыс. населения.
Снижение заболеваемости ОГB связано с введением в национальный календарь профилактических прививок вакцинации против ВГB. В то же время такой показатель, как «носительство возбудителя ВГB», продолжает превышать показатели заболеваемости ХГB.
Приблизительно 650 тыс. смертей ежегодно в мире обусловлено патологией, ассоциированной с HBV.
Основным резервуаром и источником HBV служат больные ОГB, больные хронической HBV-инфекцией (вирусоносители и больные ХГB), число которых на земном шаре превышает 300 млн человек, а в РФ, по расчетам, их более 5 млн.
У больных HBV-инфекцией HBsAg и ДНК HBV обнаруживают в крови, моче, слюне, желчи, слезной жидкости, фекалиях, грудном молоке, вагинальном секрете, сперме, крови пуповины. Однако только кровь, сперма и, возможно, слюна представляют реальную эпидемиологическую опасность, так как в других жидкостях концентрация вируса очень мала. Основной фактор передачи - кровь. Инфицирующая доза вируса может содержаться в 0,0005 мл крови. ВГB характеризуется множественностью путей передачи (естественных и искусственных): возможен контактный, вертикальный и артифициальный (парентеральные манипуляции, трансплантация органов) пути передачи. Чрезвычайно эффективен половой путь передачи HBV. Среди инфицированных HBV высок удельный вес внутривенных наркоманов, а также гомо- и гетеросексуалов с большим числом половых партнеров, которые поддерживает высокий эпидемический потенциал HBV-инфекции. Заражение HBV возможно и при бытовом общении с больным или вирусоносителем при нарушении целостности слизистых оболочек и кожного покрова. В этих случаях HBV внедряется через микротравмы, при прямом контакте с источником инфекции либо при совместном пользовании различными предметами обихода и личной гигиены. Особое значение имеет передача HBV вертикальным путем от беременной плоду иди новорожденному. При этом возможна трансплацентарная передача вируса (около 8% случаев инфицированных детей) или, чаще, заражение в процессе родов при контакте новорожденного с инфицированными околоплодными водами, влагалищным секретом. В регионах с высоким уровнем распространенности HBV-инфекции перинатальный путь заражения является основным.
В настоящее время риск заражения при переливании крови резко снизился, так как всю донорскую кровь проверяют на наличие HBsAg и анти-НВс IgG. Заражение возможно при нарушении правил стерилизации во время различных парентеральных вмешательств, сопровождающихся нарушением целостности кожного покрова или слизистых оболочек (инъекции, стоматологические, эндоскопические, гинекологические обследования, косметические процедуры, пирсинг, татуаж и т.д.). В группу риска заражения ГB также входят пациенты отделений гемодиализа, ожоговых центров, гематологических, туберкулезных стационаров, центров сердечно-сосудистой хирургии, медицинские работники, имеющие контакт с кровью: процедурные и операционные сестры, анестезиологи-реаниматологи, акушеры-гинекологи, хирурги, стоматологи. Восприимчивость к HBV высокая. Риск развития хронической HBV-инфекции колеблется от 90% у новорожденных, родившихся от HBeAg-позитивных матерей, до 25-30% у грудных детей и детей в возрасте до 5 лет и составляет менее 10% у взрослых. Иммунитет после перенесенного ОГB, закончившегося выздоровлением, длительный. Повторные случаи ОГB наблюдают исключительно редко.
Профилактика
С целью профилактики ВГB проводят тщательный отбор доноров с обязательным исследованием крови на наличие HBsAg и активности АЛТ, максимально ограничивают показания к переливанию крови. Необходимо соблюдение правил обработки медицинских инструментов, соблюдение правил работы медицинскими сотрудниками (использование перчаток, масок, защитных очков), информирование населения о риске полового заражения, риске заражения при внутривенном употреблении наркотиков, обследование беременных на наличие HBsAg.
Больных ВГB госпитализируют в профильные отделения инфекционной больницы, с предположительным диагнозом - в диагностическое отделение или боксы. При угрозе заражения (контакт с больным, с инфицированной кровью) проводят экстренную специфическую профилактику.
Специфическую профилактику осуществляют с помощью генно-инженерных вакцин против ВГB, содержащих в качестве иммуногена рекомбинантный HBsAg согласно национальному календарю профилактических прививок.
Патогенез
HBV попадает в кровь и затем в гепатоциты, где преимущественно происходит его репликация. Репликация возможна также в клетках костного мозга, поджелудочной железы, почек, лимфоцитах, но с меньшей интенсивностью. После адсорбции вируса на поверхности гепатоцита происходит разрушение его наружной оболочки, и нуклеокапсид проникает в цитоплазму клетки, а затем в ее ядро. Механизм репликации способствует длительной персистенции вируса в организме и обусловливает сложность иммуноопосредованной элиминации вируса из организма, что и приводит в 5-10% случаев к развитию хронической инфекции у взрослых.
Взаимодействие HBV с клеткой также может приводить к интеграции фрагментов ДНК HBV в геном гепатоцита, что, в свою очередь, может играть роль в развитии гепатоцеллюлярной карциномы. Клеточная ДНК с интегрированной в нее вирусной ДНК может существовать пожизненно, при этом с интегрированной ДНК может считываться информация о HBsAg и он может изолированно синтезироваться в гепатоците. В гепатоците возможно присутствие ДНК HBV как в интегрированной, так и, чаще, в свободной форме. Антигены вируса экспрессируются на клеточной оболочке, связываются с HLA I и II классов и распознаются цитотоксическими Т-клетками иммунной системы. Гуморальный ответ организма заключается в продукции специфических антител к антигенам HBV, их связывании с антигенами, образованием иммунных комплексов и дальнейшей элиминацией из организма. При острой HBV-инфекции элиминация вируса достигается цитолитическим (некроз гепатоцитов) и нецитолитическим (без гибели гепатоцитов) механизмами.
В результате проникновения HBV в гепатоциты развивается паренхиматозное воспаление органа с появлением у больного определенных клинических и лабораторных признаков (желтуха, увеличение печени, гипербилирубинемия, повышение активности АСТ и АЛТ, ферментов холестаза). Цитолиз на фоне некроза гепатоцитов и апоптотической гибели части вирусинфицированных гепатоцитов приводит к нарушению синтетической и дезинтоксикационной функции печени. Поступающие через воротную вену из кишечника в печень продукты расщепления белков, жиров и углеводов и их метаболиты не подвергаются в полной мере реакциям обменного синтеза вследствие частичного функционального блока органа. Вследствие нарушения нормальных обменных процессов и нарастающего количества продуктов аутолиза клеток печени развивается системная интоксикация организма и гипоксия тканей. Степень тяжести ОГB соответствует степени повреждения гепатоцитов.
В патогенезе ВГB имеют значение и аутоиммунные механизмы. Инфицированный HBV гепатоцит приобретает антигенные свойства, что приводит к образованию антител к собственным гепатоцитам. Иммунные комплексы с HBV обнаруживаются при ОГB и ХГB не только в печени, но и в эндотелии сосудов различных органов, что приводит к патологическим изменениям в них с развитием гломерулонефрита, узелкового периартериита и другим внепеченочным проявлениям.
Морфологически для ОГB характерны диффузные, различной выраженности дистрофические и некробиотические изменения гепатоцитов. Воспалительные и некротические изменения часто захватывают всю дольку или несколько долек. Наблюдают как фокальный некроз, затрагивающий единичные гепатоциты, так и массивный и субмассивный некроз паренхимы печени. Обычно имеется соответствие между обширностью некроза и тяжестью гепатита. Фульминантная форма характеризуется массивным некрозом и отсутствием регенерации печеночной ткани.
Клиническая картина
Острый гепатит В
Для ОГB характерно циклическое течение. Инкубационный период длится от 45 до 180 дней (обычно 2-4 мес).
Клиническая классификация острого гепатита B
-
Клинические формы: желтушный, безжелтушный, субклинический (инаппарантный) варианты.
-
По длительности и цикличности течения: острый (до 3 мес); затяжной (более 3 мес); с рецидивами, обострениями (клиническими, ферментативными).
-
Формы по тяжести: легкая, среднетяжелая, тяжелая, фульминантная (молниеносная).
-
Осложнения: острая и подострая дистрофия печени с развитием печеночной энцефалопатии и печеночной комы.
Преджелтушный период длится 1-5 нед. Характерны астено-вегетативный (слабость, утомляемость, разбитость) и диспепсический (ухудшение аппетита, снижение вкусовых ощущений, тошнота, иногда рвота, горечь во рту, тяжесть и тупые боли в правом подреберье) синдромы. Часты головная боль, нарушения сна. Примерно у 20-30% больных наблюдают боли в крупных суставах, уртикарную сыпь, повышение температуры тела, реже кожный зуд. Еще до появления желтухи увеличивается печень (иногда и селезенка), моча становится темной, в сыворотке крови повышается в 20-30 раз активность АЛТ и АСТ; в крови обнаруживают специфические маркеры HBV-инфекции (HBsAg, HВe-антиген, анти-НВс IgM). Преджелтушный период может отсутствовать, тогда потемнение мочи и желтушность склер служат первыми симптомами болезни.
С появлением желтухи самочувствие больных ухудшается: нарастает слабость, аппетит снижается вплоть до анорексии, отмечают постоянную тошноту, сухость и горечь во рту, нередко головную боль и головокружение и т.д., однако прекращается артралгия и нормализуется температура тела. В этот период печень обычно еще более увеличивается. Желтуха достигает своего максимума на 2-3-й неделе, интенсивность ее может быть значительной. Моча становится темной, кал на высоте желтухи - ахоличным. Продолжительность желтушного периода варьирует от нескольких дней до нескольких месяцев, чаще составляет 2-6 нед.
Гиперферментемию (с преимущественным повышением активности АЛТ в 30-50 раз) регистрируют в течение всего желтушного периода, затем происходит постепенное снижение ее уровня. Белково-синтетическая функция печени нарушается при тяжелом течении болезни, что проявляется снижением содержания альбумина, белков протромбинового комплекса, количества липопротеидов.
В периферической крови каких-либо существенных отклонений от нормы не выявляется, количество лейкоцитов нормальное или понижено.
Период реконвалесценции может продолжаться до полугода. Клинико-биохимические изменения исчезают медленно. Относительно быстро нормализуется содержание билирубина в крови (в течение 2-4 нед), а повышенная активность ферментов сохраняется от 1 до 3 мес. У ряда больных можно наблюдать волнообразный характер гиперферментемии в период реконвалесценции. Необходимо учитывать, что рецидив заболевания с ферментативным обострением и гипербилирубинемией требует исключения инфекции, вызываемой вирусом гепатита D (HDV).
По данным эпидемиологических исследований, безжелтушный вариант встречают в 20-40 раз чаще желтушного.
Одна из особенностей желтушного варианта ОГB - выраженность в ряде случаев холестатического синдрома. При этом интоксикация незначительная, основная жалоба пациентов - зуд кожи; желтуха интенсивная, с зеленоватым или серо-зеленым оттенком кожи, сохраняется длительно. Печень значительно увеличена, плотная. Кал ахоличный, моча темная в течение длительного времени. В сыворотке крови - высокая билирубинемия, повышенное содержание холестерина и активности ЩФ, а уровень АЛТ относительно невысок (5-10 норм). Желтушный период может затягиваться до 2-4 мес, полная нормализация биохимических сдвигов происходит еще позже.
ВГB может протекать в легкой, среднетяжелой или тяжелой форме.
Наиболее информативным для оценки тяжести является синдром печеночной интоксикации, который проявляется слабостью, адинамией, снижением аппетита, вегетососудистыми нарушениями, а в отдельных случаях - и нарушением сознания. Именно выраженность интоксикации (в сочетании с результатами лабораторного исследования, прежде всего протромбиновой активностью) характеризует тяжесть гепатита.
При легкой форме ВГB интоксикацию не наблюдают или она незначительно выражена, интенсивность желтухи невелика, биохимические пробы выявляют лишь повышение билирубина в крови и гиперферментемию (при этом коэффициент де Ритиса менее 1). При среднетяжелой форме ВГB интоксикация проявляется умеренной слабостью, непостоянной головной болью, снижением аппетита, тошнотой; желтуха яркая и стойкая. Биохимически, кроме изменений, присущих легкой форме, может выявляться незначительное снижение протромбиновой активности.
Тяжелая форма ВГB характеризуется нарастанием выраженности признаков интоксикации (слабость, аппетит отсутствует, постоянная тошнота, частая рвота). Появляются адинамия, головокружение, мелькание мушек перед глазами, тахикардия, болезненность в области печени, сокращение размеров печени, геморрагический синдром (кровотечения из носа, кровоподтеки в местах инъекций и т.д.), лихорадка, желтуха обычно нарастает. Одновременно отмечают значительное снижение протромбиновой активности и показателя сулемовой пробы, возможно снижение активности трансфераз при нарастающей гипербилирубинемии.
Наиболее неблагоприятным осложнением тяжелой формы ВГB служит ОПЭ как проявление острой или подострой дистрофии печени, которая, как и молниеносное (фульминантное) течение ВГB, встречается редко (1-2% случаев). В случае развития указанных осложнений у 80-90% больных наступает летальный исход.
Начальным проявлением ОПЭ становятся жалобы на головные боли. По мере нарастания тяжести заболевания могут появиться симптомы ОПЭ - инверсия сна, вялость и сонливость, заторможенность или возбуждение, негативизм, апатия или агрессия (I степень), «хлопающий» тремор, мелькание мушек перед глазами, чувство «провалов» (I-II степень), эхолалия, отсутствие продуктивного контакта с больным, сопор (III степень), кома, арефлексия (IV степень).
Диагностика и дифференциальная диагностика
ОГВ диагностируют на основании: длительности течения инфекции (менее 6 мес), данных эпидемиологического анамнеза: наличии парентеральных манипуляций медицинского и немедицинского характера, сопровождающихся нарушением целостности кожного покрова и слизистых оболочек, включая внутривенное введение психоактивных препаратов, переливание крови или ее компонентов; случайные половые контакты или частую смену половых партнеров, тесный контакт с носителями HBs-антигена; клинической картины [постепенное начало болезни, наличие преджелтушного периода продолжительностью от 1 до 4-5 нед, сопровождающегося астеновегетативным синдромом, слабостью, повышенной утомляемостью, снижением работоспособности, диспепсическим синдромом, артралгиями, экзантемой типа крапивницы, кратковременным повышением температуры тела, ухудшение самочувствия на фоне появившейся желтухи, увеличение размеров печени; лабораторные данные: повышение АЛТ и АСТ более чем в 10 раз, общего билирубина за счет связанной фракции при желтушном варианте заболевания, обнаружение маркеров острой ВГB-инфекции (HBsAg, анти-НВсore IgM) в сыворотке крови].
Для дифференциальной диагностики ОГB с другими ВГ необходима его верификация путем выявления специфических маркеров как острой HBV-инфекции, так и острой дельта-инфекции, диагностическая возможность исключения хронической HBV-инфекции или реактивации хронической HBV-инфекции с желтушным синдромом и способность отличать маркеры пост-инфекции от маркеров острой инфекции.
Это возможно с помощью иммунохимических методов (ИФА, иммунохемилюминесцентный анализ и др.), что позволяет не только выявлять, но и в ряде случаев определять концентрацию некоторых антигенов HBV (HBsAg, HBeAg) и антител к антигенам HBV и HDV (анти-HBs, анти-HBe, анти-HBc IgG, анти-HBc IgM, анти-HDV IgG, анти-HDV IgM) в сыворотке или плазме крови.
Молекулярно-биологические методы (ПЦР, ПЦР в режиме реального времени) наиболее актуальны для диагностики хронической HBV-инфекции, поскольку позволяют выявлять ДНК HBV и РНК HDV (в плазме крови или в ткани печени), определять концентрацию ДНК HBV и РНК HDV в плазме крови (вирусную нагрузку) и генотип HBV, обнаруживать мутации в геноме HBV, связанные с устойчивостью вируса к противовирусным препаратам.
HBsAg - поверхностный антиген HBV, основной маркер, используемый для выявления лиц, инфицированных HBV, и для обследования больных острыми ВГ. Обнаруживается в сыворотке крови через 4-6 нед от момента инфицирования. Длительное выявление HBsAg (более 6 мес) после перенесенного ОГB свидетельствует о формировании хронической инфекции.
Анти-HBs - антитела к поверхностному антигену HBV. Как правило, выявляются у больных, перенесших инфекцию, и у вакцинированных против ГB.
Анти-HBc - антитела к белку нуклеокапсида HBV. Анти-HBc класса IgM являются надежным маркером ОГB и используются в качестве критерия диагноза ОГB, однако могут выявляться и при реактивации хронической HBV-инфекции. Анти-HBс IgG, сохраняются пожизненно и, кроме того, в ряде случаев могут являться единственным серологическим маркером латентной (скрытой) формы инфекции.
HBeAg - указывает на активную репликацию вируса. Является одним из ключевых маркеров при обследовании больных ХГB и ОГB затяжного характера, необходим для определения фазы течения хронической инфекции (HBeAg-позитивный или HBeAg-негативный ХГB) и используется для контроля эффективности противовирусного лечения хронического HBeAg-позитивного ГВ.
Анти-HBe - антитела к HBeAg, обнаруживаются в сыворотке крови после исчезновения HBeAg и сохраняются многие годы. Сероконверсия по HBeAg является признаком благоприятного течения заболевания при ОГB и ХГB и свидетельствует о снижении активности вирусной репликации.
Анти-HDV - антитела к дельта-антигену HDV. Анти-HDV класса IgM являются маркером острой HDV-инфекции. При коинфекции HBV/HDV обнаруживаются отсроченно (через 2-4 нед после появления клинических признаков острого гепатита) и циркулируют в крови в течение 3-4 мес. При суперинфекции HDV вирусоносителя HBV выявляются уже к началу острого периода заболевания и могут циркулировать длительное время. Анти-HDV IgG - маркер как перенесенной, так и хронической HDV-инфекции.
ДНК HBV обнаруживается в крови в среднем через месяц после инфицирования и является самым ранним диагностическим маркером ОГB, опережая появление HBsAg на 10-20 дней.
В табл. 17-1 представлена динамика появления серологических маркеров HBV-инфекции и трактовка лабораторных показателей при ОГB и в периоде реконвалесценции.
| HBsAg/ анти-HBs | Анти-НВс IgM/ анти-НВс IgG | HBeAg/ анти-НВе | ДНК HBV | Трактовка результатов обследования |
|---|---|---|---|---|
+/- |
+/- |
+/- |
+ |
Инкубационный или острый период |
+/- |
+/+ |
-/+ |
+ |
Острый период и начало реконвалесценции |
-/- |
+/+ |
-/+ |
- |
Ранняя реконвалесценция (2-3 мес от начала желтушного периода) |
-/+ |
+/- |
-/+ |
- |
Поздняя реконвалесценция и формирование протективного иммунитета (6 мес и более от начала желтушного периода) |
Дифференциальную диагностику в преджелтушном периоде ВГB проводят с такими заболеваниями, как ревматизм, полиартрит, глистные инвазии желчевыводящих путей. В каждом конкретном случае учитывают эпидемиологический анамнез, не свойственное другим заболеваниям сочетание диспепсического синдрома с артралгиями, увеличением печени, гиперферментемией, появлением HBsAg в сыворотке крови. В желтушном периоде дифференциальную диагностику необходимо проводить с ВГA, ВГC, вГd, ВГE, дебютом аутоиммунного гепатита, в ряде случаев с токсическими (в том числе алкогольным), лекарственными гепатитами, подпеченочной желтухой (желчнокаменная болезнь, опухоли желчевыводящих путей и дуоденопанкреатической зоны).
Кроме тщательного клинического и лабораторного обследования, используют дополнительные методы исследования (УЗИ и МРТ органов брюшной полости).
Лечение ОГB проводится в условиях инфекционного стационара, госпитализация больного обязательна.
Назначается диета № 5а.
При легкой форме гепатита ограничиваются базисной терапией (диета № 5, дробное питье, щадящий двигательный режим). Больным среднетяжелой формой по показаниям проводят дезинтоксикационную терапию: внутривенно вводят 5% раствор декстрозы (Глюкоза♠), полиионные растворы, до 500-1000 мл/сут. При тяжелой форме болезни назначают строгий постельный режим, диету № 5а. Проводят инфузионную терапию с использованием тех же растворов, что и при среднетяжелой форме до 1,5 л/сут. В случае нарастания интоксикации, появления признаков ОПЭ больных переводят в палату (отделение) интенсивной терапии.
Необходимость специфического противовирусного лечения у преобладающего большинства больных отсутствует. При тяжелой форме ОГB с развитием печеночной комы назначается противовирусная терапия аналогами нуклеозидов. Лечение проводится одним из указанных препаратов: ламивудин (100 мг 1 р/сут внутрь ежедневно), энтекавир (0,5 мг 1 р/сут внутрь ежедневно), телбивудин (600 мг 1 р/сут внутрь ежедневно), тенофовир (300 мг 1 р/сут внутрь ежедневно). Длительность курса не менее 3 мес после сероконверсии к анти-HBs или по крайней мере 12 мес после HBe-сероконверсии при отсутствии потери HBsAg.
При выраженном диспепсическом синдроме, нарастании симптомов интоксикации, развитии холестатического синдрома проводится инфузионная терапия с использованием растворов декстрозы (Глюкоза♠) и солевых растворов, объем и кратность введения которых и длительность их применения определяются тяжестью состояния больного. С целью деконтаминации кишечника и для профилактики развития бактериальных осложнений назначают антибиотики широкого спектра действия.
При развитии холестатического синдрома для уменьшения зуда кожи назначают урсодезоксихолевую кислоту (8-10 мг на 1 кг массы тела в сутки), адеметионин (400-800 мг/сут в/в или в/м; для поддерживающей терапии - внутрь 800-1600 мг/сут), проводится витаминотерапия - витамин А (ретинол) и витамин Е (Аевит♠ по 1 капсуле 2 раза в день).
При тяжелом течении ОГB с развитием печеночной комы должен рассматриваться вопрос о выполнении неотложной ортотопической трансплантации печени, поскольку проведение этой операции позволяет увеличить выживаемость больных с 15% до 60-80%. Больной должен находиться в ОРИТ, показан постельный режим, если возможно, предпочтительно энтеральное питание. На ранних стадиях печеночной энцефалопатии назначается лактулоза по 30 мл 3-4 раза в день. Вводится витамин К [(3,0 мл 1% раствора менадиона натрия бисульфита (Викасол♠) внутримышечно 1 р/сут]. Для профилактики генерализации бактериальной или грибковой инфекции, сепсиса назначают антибиотики широкого спектра действия (ампициллин по 1,0 г 4 раза в день в/м, ЦС III-IV поколения, фторхинолоны, карбапенемы и др.), противогрибковые препараты. При появлении симптомов отека мозга необходимо произвести интубацию трахеи для перевода больного в режим ИВЛ. Медикаментозная терапия проводится по общим принципам лечения ОНГМ.
При наличии глубоких изменений в коагулограмме, развитии выраженного геморрагического синдрома, кровотечений различной локализации показана трансфузия свежезамороженной плазмы, введение этамзилата натрия (2,0 мл 3 р/сут в/в), для угнетения фибринолиза назначают ингибиторы протеаз [апротинин (Гордокс♠, Трасилол 500 000♠, Контрикал♠)].
Фульминантное течение ВГ может приводить к развитию полиорганной недостаточности, часто - почечной недостаточности, что делает необходимым использование гемодиализа, плазмафереза.
Исходы острого гепатита B и диспансеризация реконвалесцентов
Реконвалесценты ВГB могут приступить к учебе, работе не ранее чем через 3-4 нед после выписки из больницы при условии нормализации самочувствия и активности печеночных ферментов (допустимо значение, превышающее 2 нормы, у лиц, не занятых физическим трудом). На 3-6 мес реконвалесцентов освобождают от занятий спортом и физкультурой и тяжелой физической нагрузки. В течение полугода противопоказаны плановые профилактические прививки.
Срок диспансеризации реконвалесцентов составляет 12 мес; снятие с учета производят только после стойкой нормализации показателей клинико-биохимических исследований и двукратных отрицательных результатов на наличие HBsAg. Реконвалесценты с сохраняющейся HBs-антигенемией представляют группу риска по возможности присоединения дельта-вирусной инфекции, и в связи с этим пациентам рекомендуется избегать парентеральных вмешательств, которые можно отложить (протезирование зубов, плановые операции и т.д.) до момента исчезновения HBsAg из крови.
Хронический гепатит В
ХГB - ГB, длящийся более 6 мес.
ХГB - исход ОГB, обусловленный персистенцией в организме HBV. В ходе естественного течения хронической HBV-инфекции выделяют несколько фаз. Фазы заболевания характеризуются присутствием или отсутствием в крови больного HBeAg (HBeAg-позитивный и HBeAg-негативный варианты ХГB), степенью активности АЛТ и уровнем виремии, а также гистологической картиной поражения печени, при этом выделяют ХГB, фаза иммунной толерантности; ХГB, иммуноактивная фаза; неактивное носительство HBV; ХГB, фаза реактивации. Лабораторные показатели и морфологическая характеристика хронической HBV-инфекции в зависимости от фазы течения заболевания и HBe-статуса пациента отражены в табл. 21-5.
Принято разделять ХГB на 2 основных варианта по принципу инфицированности «диким» (НВе-позитивный ХГB) или мутантным вариантом HBV (НВе-негативный/анти-НВе-позитивный ХГB - pre-core/core-promoter мутантные варианты).
При естественном течении ХГB кумулятивная частота развития цирроза печени в течение ближайших 5 лет составляет от 8 до 20%, декомпенсации цирроза печени в последующие 5 лет - 20%. При этом вероятность выживаемости больного компенсированным циррозом печени в течение 5 лет составляет около 80-86%.
У пациентов с декомпенсированным циррозом печени прогноз выживаемости в течение 5 лет составляет 14-35%. Ежегодная заболеваемость ГЦК у больных с установленным диагнозом цирроза печени в исходе ХГB составляет 2-5%.
В течении ХГB возможно как спонтанное, так и обусловленное лечением прекращение продукции НВeAg и вслед за этим появление в крови антител к нему (анти-HBe), (сероконверсия по HBeAg), что обычно сопровождается снижением уровня ДНК HBV до минимальных значений вплоть до неопределяемого уровня, нормализацией активности АЛТ и АСТ.
Критериями неактивного носительства HBV являются отсутствие НВеAg и наличие анти-НВе, нормальный уровень активности АЛТ и АСТ, а также уровень ДНК HBV в крови, как правило, менее 2 × 103 МЕ/мл. Необходимо учитывать, что «неактивное носительство HBsAg» с точки зрения морфологии печени можно определить как персистирующую HBV-инфекцию без выраженного воспалительно-некротического процесса в печени и фиброза. У 0,5% «неактивных носителей HBsAg» ежегодно происходит спонтанная элиминация HBsAg, и у большинства этих пациентов в последующем регистрируют в крови анти-HBs. Несмотря на благоприятный в целом прогноз, статус «неактивного носителя HBsAg» нельзя считать неизменным состоянием, так как возможна реактивация хронической HBV-инфекции и повторное развитие выраженного воспалительно-некротического процесса в печени. У данной категории лиц также не исключено развитие гепатоцеллюлярной карциномы, что обосновывает необходимость пожизненного динамического наблюдения за ними.
| Фаза хронической HBV-инфекции | Активность АЛТ | Гистология печени. Индекс активности -А и стадия фиброза -F по METAVIR | Уровень ДНК HBV (МЕ/мл) | HBeAg | HBsAg |
|---|---|---|---|---|---|
Иммунотолерантная фаза |
Норма |
Минимальная активность, минимальный фиброз (АО-1, F0-1) |
Очень высокий (>>107) |
+ |
+ |
HBeAg-позитивный ХГB |
Повышена |
Степень активности гепатита выше минимальной с различной степенью выраженности фиброза (A2 и/или F1-3) |
Высокий (>104) |
+ |
+ |
HBeAg-нeгaтивный ХГB |
Повышена постоянно или волнообразного характера |
Степень активности гепатита выше минимальной с различной степенью выраженности фиброза (A2 и/или F1-3) |
Oт 104 до >107 |
- |
+ |
Реактивация хронической HBV-инфекции |
Повышена |
Степень активности гепатита выше минимальной с различной степенью выраженности фиброза (A2 и/или F1-3) |
Oт 104 до >107 |
- Иногда в сочетании с aнти-HBcore IgM |
+ |
Неактивное носительство HBsAg |
Норма |
Минимальная активность гепатита или ее отсутствие, минимальный фиброз (F0-1) |
Низкий (≤103) или неопределяемый |
- |
+ |
Критериями HBeAg-негативного ХГB являются отсутствие НВеAg и наличие анти-НВе, повышенный уровень активности АЛТ и АСТ и уровень ДНК HBV более 2000 ME/мл, умеренная или высокая активность гепатита, по данным гистологического исследования ткани печени.
Хронический HBe-позитивный гепатит В
Характеризуется постоянно повышенной активностью трансфераз и высоким уровнем виремии. В ряде случаев уже в детском возрасте развивается хронический HBeAg-позитивный ГB. У детей, инфицированных внутриутробно или перинатально, до 18-20-летнего возраста, наблюдают фазу иммунной толерантности - нормальный уровень АЛТ, отсутствие клинических признаков болезни, минимальные гистологические изменения в печени, но наличие высокого уровня репликации ДНК HBV и циркуляцию HBeAg в крови. По достижении совершеннолетия у части этих больных происходит спонтанный клиренс HBeAg. Иммунный клиренс HBeAg может протекать бессимптомно или сопровождаться клиническими признаками ОГB. В дальнейшем может наступить ремиссия и переход в фазу хронической HBV-инфекции с неопределяемым уровнем ДНК HBV на фоне стойкой циркуляции HBsAg в крови. Однако у значительной части лиц, инфицированных внутриутробно или перинатально, в дальнейшем развивается HBeAg-позитивный ХГB. Частота спонтанной элиминации HBeAg из организма составляет от 8% до 12% в год. Частота спонтанного клиренса HBsAg составляет 0,5-2% в год. В целом из числа больных хронической HBV-инфекцией 70-80% становятся с течением времени бессимптомными носителями, а у 20-30% больных развивается прогрессирующее заболевание печени (ХГB) и в течение 10-30 лет может сформироваться цирроз печени и ГЦК.
Хронический HBеAg-негативный гепатит В
Хронический гепатит, вызванный мутантным вариантом HBV, характеризуется наличием в крови анти-НВе, отсутствием HBeAg и более низкой концентраций HBV по сравнению с HBeAg-позитивным ХГB. Течение HBeAg-негативного ХГB характеризуется или стойко повышенной активностью АСТ и АЛТ (трех- или четырехкратное превышение нормы), что наблюдают у 3-40% пациентов, или флюктуирующей активностью АСТ и АЛТ (45-65%) и редко встречающимися длительными спонтанными ремиссиями (6-15%) случаев. Переход HBeAg-негативного ХГB в неактивную фазу вирусоносительства или самопроизвольное выздоровление почти не встречается.
Латентный вирусный гепатит B
Существует вариант хронической HBV-инфекции, при которой HBsAg не обнаруживается, однако в крови и/или ткани печени выявляют ДНК HBV. Такую HBV-инфекцию называют латентной. Часто при латентной инфекции в крови могут выявляться анти-HBcore IgG, а уровень виремии (если вирус обнаруживается в крови), как правило, низкий (менее 200 МЕ/мл), данный вариант инфекции может протекать даже при наличии в крови анти-HBs. Клиническое значение латентной HBV-инфекции пока окончательно не определено.
Лечение хронического гепатита В
Показания к противовирусной терапии больных хроническим гепатитом В
Лечение рекомендуется при уровне виремии >2 × 103 МЕ/мл и индексе гистологической активности или фиброза печени >1 балла по шкале METAVIR. У больных циррозом печени противовирусная терапия необходима при любом определяемом уровне виремии независимо от активности АЛТ. У больных с уровнем виремии <2 × 103 МЕ/мл и активностью печеночного процесса необходимо исключать другую возможную причину поражения печени. Пациенты с декомпенсированным циррозом и определяемым уровнем ДНК HBV требуют незамедлительного начала лечения аналогами нуклеозидов.
Пациентам с активным течением ХГB: НВеAg-позитивные и НВеAg-негативные пациенты с АЛТ выше нормы в 2 раза и уровнем ДНК HBV выше 2 × 104 МЕ/мл - противовирусное лечение назначается без биопсии печени.
Для лечения ХГB применяются препараты ИФН и аналоги нуклеозидов.
Интерферон-альфа (ИФН-α). Стандартный ИФН-α применяют в дозе 5 млн ЕД ежедневно или 10 млн ЕД 3 р/нед п/к.
Рекомендованная продолжительность лечения при HBeAg-позитивном ХГB составляет 16-24 нед, при HBeAg-негативном ХГB - не менее 48 нед.
Пэгинтерферон-альфа-2a (ПЭГ-ИФН-α) применяется в дозе 180 мкг, ПЭГ-ИФН-α-2b дозируется по весу пациента - 1,5 мг/кг, инъекции выполняются 1 р/нед в течение 48 нед. Основные предикторы ответа на терапию ИФН-α - исходно высокая активность АЛТ, низкий уровень виремии, генотип вируса А или В, отсутствие цирроза.
Ламивудин (аналог цитидина) применяется в дозе 100 мг/сут.
Энтекавир (аналог гуанозина) применяют в дозах 0,5 мг/сут натощак (для первичных больных) и 1 мг/сут (для больных с резистентностью к ламивудину и больных с декомпенсированным циррозом печени).
Телбивудин (аналог тимидина) применяют дозе 600 мг/сут.
Тенофовир (аналог аденина) применяют в дозе 300 мг/сут.
Критерии эффективности противовирусного лечения больных хроническим гепатитом В
Эффективность противовирусной терапии больных ХГB оценивают по наличию биохимического, серологического, вирусологического и гистологического ответов.
Эта форма терапии также может быть назначена HBeAg-негативным пациентам с факторами прогноза успешного лечения и достижения УВО (см. выше).
Комбинация ПЭГ-ИФН с ламивудином и другими аналогами нуклеозидов не рекомендуется.
Гепатит D
ВГD (гепатит дельта, ГB с дельта-агентом) - ВГ с контактным механизмом передачи возбудителя, вызываемый дефектным вирусом, репликация которого возможна только при наличии в организме HBsAg. Заболевание характеризуется тяжелым течением и неблагоприятным прогнозом.
Коды по МКБ-10
В16.0 Острый гепатит B с дельта-агентом (коинфекция) и печеночной комой.
B16.1 Острый гепатит B с дельта-агентом (коинфекция) без печеночной комы.
B17.0 Острая дельта(супер)-инфекция вирусоносителя гепатита B. Хронический гепатит дельта регистрируется под кодом: В18.0 Хронический гепатит В с дельта-агентом.
Этиология
Возбудитель ВГD hepatitis delta virus - HDV. Большинство исследователей относят его к единственному представителю нового рода вирусов - Deltavirus. В геноме дельта-вируса отсутствуют участки, кодирующие оболочечные белки вируса. Эта особенность HDV, наряду с невозможностью вызывать инфекцию без инфицирования другим вирусом (HBV), позволяет также относить его к группе вироидов или вирусоидов.
HDV - сферическая частица диаметром около 36 нм, это наименьший из известных вирусов животных. Он состоит из нуклео-капсида, содержащего дельта-антиген (HDAg) и РНК HDV. Внешняя оболочка образована поверхностным антигеном HBV - HBsAg. Геном HDV представлен однонитевой циклической молекулой РНК. Вирус обладает способностью использовать РНК-зависимые РНК-полимеразы человека для транскрипции собственной РНК без образования промежуточных форм ДНК.
Существует две разновидности HDAg с молекулярной массой 24 кДа (HDAg-S) и 27 кДа (HDAg-L) с выраженными функциональными различиями в жизнедеятельности вируса. Малая форма - HDAg-S - необходима для репликации HDV и увеличивает скорость репликации РНК HDV, а большая (HDAg-L) участвует в сборке вирусной частицы и уменьшает скорость репликации HDV. Кроме того, HDAg-L участвует во внутриклеточном перемещении вирусных белков.
Известно 8 генотипов и ряд субтипов HDV. Генотип I распространен во всех регионах мира, в частности в России.
HDV устойчив к высоким температурам, действию кислоты и ультрафиолетового облучения, инактивируется щелочами и протеазами. Многократное замораживание и оттаивание не влияют на его активность.
Эпидемиология
ГB в сочетании с дельта-агентом (гепатит D), который наиболее быстрыми темпами прогрессирует до цирроза и рака печени, по данным субъектов Российской Федерации, выявляется в 0,2-0,3% случаев от общего количества острых и хронических форм ГB.
Основной источник возбудителя HDV-инфекции - лица с хроническими формами HBV-инфекции, зараженные HDV.
Передача дельта-вируса осуществляется парентеральным путем. Риск заражения дельта-инфекцией особенно велик для постоянных реципиентов донорской крови или ее препаратов (больных гемофилией); для лиц, подвергающихся частым парентеральным вмешательствам, а также для наркоманов, вводящих наркотики внутривенно; для лиц, имеющих контакт с кровью. Заражение часто происходит в хирургических отделениях, центрах гемодиализа.
Возможна трансплацентарная передача HDV от беременной плоду, в основном у HBe-позитивных матерей, инфицированных HDV. Перинатальный путь передачи также довольно редок, но развитие ко-HBV-HDV-инфекции у новорожденных возможно.
К дельта-инфекции восприимчивы больные острой или хронической формой ВГB, особенно носители HBs-антигена. Перенесенная HDV-инфекция оставляет стойкий иммунитет.
Для репликации HDV необходим HBsAg, поэтому дельта-инфекция развивается только на фоне HBV-инфекции.
Обязательная регистрация HDV-инфекции в России не предусмотрена.
Меры профилактики
При HDV-инфекции профилактические мероприятия те же, что и при HBV-инфекции. Вакцинация против ВГB обеспечивает защиту и от дельта-вирусной инфекции.
Патогенез
В организме носителя ВГD дельта-вирус окружает себя оболочкой из HBs-антигена и затем проникает в гепатоциты благодаря наличию на их поверхности полимеризованного альбумина, имеющего сродство к HBsAg, образующему внешнюю оболочку. Внепеченочная репродукция ВГD не установлена.
Дельта-вирус оказывает как прямое цитопатическое действие, так и иммуноопосредованное по аналогии с ВГB. Цитопатическое действие HDV характеризуется преобладанием некротических изменений в ткани печени над воспалительными. В то же время при выраженных нарушениях иммунитета отсутствует цитопатическое действие ВГD, что позволяет предполагать иммунологически опосредованный механизм повреждения гепатоцитов, что доказано для первого генотипа HDV.
При инфицировании дельта-вирусом возможны два варианта дельта-инфекции: коинфекция и суперинфекция. Первая возникает в том случае, если HDV попадает в организм здорового человека одновременно с HBV. Суперинфекция развивается у ранее инфицированных вирусом B (у больных ХГB или носителей HBsAg) при дополнительном заражении их дельта-вирусом.
Гепатит, который возникает в результате коинфекции, принято называть острым гепатитом смешанной этиологии ВГB/ВГD или ОГB с дельта-агентом, подчеркивая этим участие обоих вирусов в патогенезе болезни. Продукция HDV происходит одновременно с HBV, но репликация дельта-вируса следует после наработки структурных компонентов HBV (HBsAg), и продолжительность ее лимитируется продолжительностью HBs-антигенемии.
Гепатит смешанной этиологии заканчивается после элиминации из организма обоих вирусов. При суперинфекции развивается острый вирусный гепатит дельта, который принято называть острой дельта(супер)-инфекцией вирусоносителя HBV.
В этом случае участие HBV в развитии повреждения печени минимально, а все возникающие патологические изменения и клинические проявления обусловлены HDV. В отличие от коинфекции, имеющей обычно острое самолимитирующееся течение, суперинфекцию характеризует тяжелое прогрессирующее течение вплоть до развития массивного некроза печени или быстро прогрессирующего цирроза. Для хронического ВГD характерны значительные воспалительные и некротические изменения в дольках с выраженным перипортальным гепатитом, высокая активность процесса в печени, быстрое нарушение архитектоники печени и появление морфологических признаков цирроза печени на ранних сроках заболевания (от 2 до 5 лет).
Клиническая картина
Острый гепатит B с дельта-агентом (коинфекция) с печеночной комой и без нее
Клиническая картина гепатита, развивающегося в результате коинфекции, чрезвычайно сходна с таковой при ОГB. Инкубационный период составляет от 6 до 10 нед, характерно циклическое течение.
Преджелтушный период начинается более остро, чем при ОГB, с ухудшения самочувствия, недомогания, слабости, утомляемости, головной боли. Одновременно отмечают диспепсические явления: снижение аппетита вплоть до анорексии, тошноту, рвоту. Чаще, чем при ВГB, возникают мигрирующие боли в крупных суставах. Почти у половины больных появляются боли в правом подреберье. Другое отличие от ОГB - лихорадка, причем у 30% больных температура тела выше 38 °С. Продолжительность преджелтушного периода короче, чем при ОГB, и составляет в среднем около 5 дней.
Желтушный период. С появлением желтухи симптомы интоксикации нарастают. На фоне желтухи сохраняются артралгии (у 30%) и субфебрилитет. Усиливаются слабость, утомляемость; чаще выявляют кожный зуд; сохраняются боли в правом подреберье, не связанные с приемом пищи. Нередко - уртикарные высыпания на коже. Наиболее продолжительны симптомы желтушного периода: слабость, снижение аппетита, боли в правом подреберье. У всех больных печень выступает из подреберья на 1-3 см, чувствительна при пальпации, край ее эластичный, гладкий. Чаще, чем при ОГB, увеличивается селезенка. В крови повышено содержание билирубина за счет связанной фракции, активность трансфераз намного выше, чем при ОГB. Значительно повышается показатель тимоловой пробы. Сулемовая проба остается нормальной. Гипербилирубинемия длится в среднем до 1,5 мес, гиперферментемия - до 2-3 мес. Заболевание нередко имеет двухволновое течение с клинико-ферментативным обострением. У 60% больных на 18-32-й день от начала желтухи на фоне начинающегося улучшения нарастают слабость, головокружение, боли в области печени; вновь увеличивается печень, повышается показатель тимоловой пробы и активность трансфераз. Часто активность АСТ выше активности АЛТ, коэффициент де Ритиса более 1. Возможно снижение протромбиновой активности. У некоторых больных наблюдают только ферментативное обострение без клинических проявлений. Заболевание чаще протекает в среднетяжелой и тяжелой форме; в 5-25% случаев развивается фульминантная (молниеносная) форма, заканчивающаяся летально. У взрослых 60-80% фульминантных форм HBsAg-позитивного гепатита обусловлены HDV-инфекцией. Болезнь заканчивается выздоровлением (примерно в 75% случаев) либо смертью - при фульминантной форме болезни. Развитие хронического гепатита наблюдают редко (1-5%). Исчезновение HBsAg свидетельствует и о выздоровлении от дельта-инфекции.
Острая дельта(супер)-инфекция вирусоносителя гепатита B
Может протекать как манифестно, так и латентно, но у 60-70% больных регистрируют или эпизод желтухи, или классическую картину желтушного варианта острого гепатита. Инкубационный период длится 3-4 нед. Преджелтушный период характеризует острое, иногда бурное начало. Продолжительность его не превышает 3-4 дней. Более чем у половины больных температура тела выше 38 °С, появляются артралгии и боли в правом подреберье, у отдельных больных - уртикарная сыпь. Через 2-3 дня моча становится темной, кал обесцвечивается, увеличиваются печень и селезенка, появляется желтуха.
В желтушном периоде самочувствие больных ухудшается, нарастают симптомы интоксикации, температура тела остается повышенной еще 3-4 дня, не прекращаются боли в суставах, боли в правом подреберье учащаются, принимают постоянный характер.
При осмотре выявляют значительное увеличение и плотность печени и селезенки. Более чем у 40% больных появляется отечно-асцитический синдром. В сыворотке крови - гипербилирубинемия (сохраняется обычно более 2 мес), гиперферментемия (нередко с извращением коэффициента де Ритиса). Активность АЛТ и АСТ остается высокой дольше, чем при ОГB и гепатите смешанной этиологии, причем практически ни у одного пациента уровень активности ферментов не достигает нормы.
В отличие от других ВГ, при остром гепатите дельта у носителей HBsAg существенно нарушается белково-синтетическая функция печени. Снижается количество альбуминов, повышается количество γ-глобулинов. Развитие отечно-асцитического синдрома связано как с понижением уровня альбуминов, так и с качественным их изменением. У преобладающего большинства больных заболевание протекает волнообразно с повторными клинико-ферментативными обострениями, сопровождающимися нарастанием желтухи, симптомами интоксикации, развитием отечно-асцитического синдрома, кратковременными (1-2-дневными) волнами лихорадки с познабливанием, появлением эфемерной сыпи на коже. Выраженность клинических симптомов у отдельных больных уменьшается при каждой новой волне, а у других заболевание принимает прогредиентный характер: развиваются подострая дистрофия печени, печеночная энцефалопатия, и наступает летальный исход.
Выздоровление наступает крайне редко, исходы почти всегда неблагоприятны: либо летальный исход (при фульминантной форме или при тяжелой форме с развитием подострой дистрофии печени), либо формирование хронического ВГD (примерно у 80%) с высокой активностью процесса и быстрым развитием цирроза печени.
Еще один возможный вариант суперинфекции - заражение дельта-вирусом больных ХГB. Клинически это проявляется обострением до того благоприятно протекающего гепатита, появлением интоксикации, желтухи, гиперферментемии, а также прогрессированием в цирроз печени.
Диагностика
ВГ смешанной этиологии можно предположить при соответствующем эпидемиологическом анамнезе (переливание крови, внутривенное введение наркотиков, многократные парентеральные вмешательства), более остром, чем при ОГB, начале заболевания, лихорадке, непродолжительном преджелтушном периоде с болями в правом подреберье и суставах, двухволновом и более тяжелом течении гепатита, выраженной гиперферментемии. Специфическая диагностика основана на выявлении маркеров активной репликации обоих вирусов: HBV, HDV. С первых дней появления желтухи в сыворотке крови обнаруживают HBsAg, анти-HBV IgM в высоком титре, HBe-антиген, HDAg и/или анти-дельта антител (анти-дельта IgM). Анти-дельта IgM вырабатываются уже в остром периоде и служат основным маркером дельта-инфекции. Их можно определить в течение 1-3 нед в высоком титре, затем они перестают выявляться, анти-дельта IgG выявляют уже через 1-3 нед от начала желтушного периода болезни. Однако у части больных не удается выявить анти-дельта IgM, а выявление анти-HD IgG может задерживаться на 30-60 дней, и в этом случае дельта-инфекция не будет диагностирована, если не проверять наличие анти-HD IgG в сыворотке крови повторно. Основным маркером, указывающим на активную репликацию HDV в организме человека, считают обнаружение РНК HDV в сыворотке крови методом ПЦР, желательно количественным.
В сыворотке крови пациентов с суперинфекцией в продромальном периоде и с первых дней желтушного периода выявляют HBsAg, HBcAg или анти-HBe, но анти-НВс IgM отсутствуют. Выявляют также анти-дельта IgM и немного позднее (через 1-2 нед) - анти-дельта IgG. РНК HDV обнаруживают в крови больных как в продромальном периоде, так и с первого дня желтушного периода. При тяжелом течении гепатита дельта нередко из крови исчезает HBsAg и ДНК HBV, но определяется РНК HDV.
Предположение об остром гепатите дельта должно возникнуть при очень коротком преджелтушном периоде, сочетании выраженной гепатоспленомегалии с болями в правом подреберье, отечно-асцитическим синдромом, лихорадкой, гипербилирубинемией, гиперферментемией, повышением уровня γ-глобулиновой фракции в сыворотке крови. Острый гепатит дельта следует предположить также при появлении желтухи у «неактивных» носителей HBsAg или при обострении ХГB.
Таким образом, при острой дельта-вирусной инфекции необходимо проводить дифференциальную диагностику прежде всего с ОГB и обострением ХГB.
Лечение
Все больные острой дельта-вирусной инфекцией подлежат госпитализации. Патогенетическую терапию проводят, как и при ОГB, с учетом тяжести клинических проявлений. Вследствие прямого цитопатического действия HDV глюкокортикоиды противопоказаны.
Диспансеризация реконвалесцентов
Пациенты, перенесшие ОГB с дельта-агентом (коинфекция), подлежат диспансерному наблюдению в течение 12 мес после выписки из стационара.
Хронический вирусный гепатит B с дельта-агентом
ХГB с дельта-агентом протекает в большинстве случаев тяжелее, чем неосложненный ХГB. В отличие от ХГB и ХГC, при которых как минимум 70-50% больных проживают свою жизнь без формирования цирроза печени, у 100% больных хроническим ВГD в течение 15-30 лет от момента инфицирования при отсутствии лечения неизбежно развивается цирроз печени.
Лечение больных хроническим гепатитом В с дельта-агентом
В связи с неуклонным прогрессирующим течением и возможностью быстрого формирования цирроза печени большинству пациентов показана противовирусная терапия. Единственным методом лечения с доказанной эффективностью является интерферонотерапия. Целесообразность назначения ИФН имеется только при наличии репликации как HDV, так и HBV, установленной методом ПЦР.
Оценка эффективности лечения проводится не ранее чем через 24-48 нед лечения и оценивается по наличию или отсутствию РНК HDV. Лечение требуется проводить не менее 1 года. У 25-40% пациентов удается достичь УВО (неопределяемый уровень РНК HDV) в сочетании с улучшением гистологических критериев.
Гепатит С
Гепатит С (вирусный гепатит ни А,ниВс парентеральным путем передачи, Hepatitis С).
Гепатит С (ГC) - вирусная болезнь человека, характеризующаяся гепатитом, высокой частотой безжелтушных форм в острой фазе инфекции, частым формированием хронического гепатита с возможным развитием цирроза печени и ГЦК.
Коды по МКБ-10
В17.1 Острый гепатит С.
В18.2 Хронический гепатит С.
Этиология
Возбудитель - вирус гепатита C (ВГС) относится к семейству флавивирусов, имеет липидную оболочку, сферическую форму, средний диаметр 50 нм, нуклеокапсид содержит РНК. Геном вируса представлен однонитевой линейной РНК, содержит около 9600 нуклеотидов.
ВГС циркулируют в виде смеси мутантных штаммов, генетически отличающихся друг от друга и получивших название «квазивидов». Особенностью строения генома ВГC является его высокая мутационная изменчивость, способствующая постоянным изменениям антигенной структуры, что позволяет вирусу длительно персистировать в организме человека. Согласно наиболее широко распространенной классификации, выделяют 6 генотипов и свыше 100 субтипов ВГC. На различных территориях земного шара преобладает циркуляция различных генотипов.
Эпидемиология
ГС - антропоноз, источником возбудителя является больной острым или хроническим гепатитом. Заболевание относится к крово-контактным инфекциям. Механизмы заражения - естественный (вертикально - при передаче вируса от матери к ребенку, контактно - при использовании предметов быта и при половых контактах) и искусственный (артифициальный). Искусственный механизм заражения может реализовываться посредством гемотрансфузий инфицированной крови или ее препаратов, любых парентеральных манипуляций (медицинского и немедицинского характера), сопровождающихся нарушением целостности кожного покрова и слизистых, если манипуляции проводились инструментами, контаминированными кровью, содержащей ВГC, при трансплантации органов, если донор заражен ВГC.
Естественные пути заражения ВГC реализуются реже, чем при ГB, что связано, вероятно, с более низкой концентрацией ВГC в биологических субстратах. Инфицированным матерям не противопоказано грудное вскармливание, однако при наличии трещин сосков от кормления следует воздержаться. Не ограничивается посещение ребенком школы и его общение с другими детьми, включая занятия контактными видами спорта. Нет необходимости ограничивать и бытовые контакты, за исключением тех, которые могут повлечь за собой контакт с инфицированной кровью (пользование общей зубной щеткой или бритвой, маникюрные принадлежности и др.).
Постоянные половые партнеры носителей ВГC заражаются половым путем редко. При большом числе половых партнеров вероятность заражения возрастает.
У большинства вновь регистрируемых больных ОГC есть указания на внутривенное введение наркотических средств. Группой риска также являются пациенты гемодиализа, онкогематологические и другие больные, страдающие различными хроническими заболеваниями и получающие многократные гемотрансфузии, а также медицинские работники, имеющие контакт с кровью, и доноры крови и органов. Однако использование даже высокочувствительного метода ИФА для тестирования донорской крови не позволяет полностью исключить вероятность передачи ВГC, поэтому в трансфузиологическую службу в последние годы внедрен метод карантинизации препаратов крови. Инфекция может передаваться не только при проведении парентеральных медицинских манипуляций (инъекции, стоматологические и гинекологические манипуляции, гастро-, колоноскопия и др.), но и при нанесении татуировок, проведении пирсинга, маникюра, педикюра и др. в случае использования загрязненных инфицированной кровью инструментов.
Выявляемые в организме инфицированного человека антитела не обладают протективными свойствами, и их обнаружение не свидетельствует о формировании иммунитета (показана возможность повторного инфицирования ВГС как иным, так и гомологичным штаммом).
Около 80% лиц, перенесших острую форму болезни, формируют хроническую инфекцию, которая является одной из основных причин смерти больных циррозом печени, гепатоцеллюлярной карциномы и наиболее частым показанием для ортотопической трансплантации печени.
В результате проведения комплекса многоплановых профилактических мероприятий в РФ заболеваемость ОГC с 2001 г. снижается.
В РФ распространены по убывающей частоте генотипы 1, 3, 2. Среди подтипов чаще встречается 1b, а также За. Эффективность интерфероновых режимов ПВТ у больных, инфицированных генотипом 1, была существенно ниже, чем при генотипах 2 или 3. В настоящее время на фоне применения ПППД, «трудными» стали пациенты, у которых заболевание вызвано генотипом 3, ассоциирующегося с более быстрым прогрессированием фиброза и с развитием стеатоза, поскольку именно среди этих пациентов реже удается достичь устойчивого вирусологического ответа на фоне проведения ПВТ. Кроме того, исследования последних лет показали, что на территории России циркулирует рекомбинантный вариант ВГС (RF2k/1b), геном которого содержит часть генов, присущих генотипу 2 вируса и часть генов, которые входят в состав субтипа 1b вируса. Выявление этого вирусного варианта возможно лишь при проведении полного секвенирования генома, которое необходимо обязательно выполнять в случае обнаружения генотипа 2 при рутинном генотипировании, поскольку рекомбинантный вариант требует особой тактики ПВТ (использования пангенотипных ПППД).
Специфическая профилактика ГС отсутствует. Неспецифическая профилактика ГC, как и других парентеральных гепатитов, включает совершенствование комплекса мероприятий, направленных на предупреждение парентеральных ВГ в медицинских учреждениях и учреждениях немедицинского профиля, усиление борьбы с наркоманией, улучшение информированности населения о путях передачи возбудителя ГC и мерах профилактики заражения этим вирусом.
Патогенез
После инфицирования ВГC вирус с током крови попадает в гепатоциты, где преимущественно происходит его репликация. Поражение клеток печени при инфекции ВГС обусловлено не только прямым цитопатическим действием вируса, но и иммунологически опосредованным (в том числе аутоиммунным) повреждением. Течение и исход инфекции ВГС (элиминация вируса или его персистенция) определяются прежде всего эффективностью иммунного ответа. В острой фазе инфекции уровень РНК ВГC достигает высоких концентраций в сыворотке крови в течение 1-й недели после инфицирования. При ОГC специфический клеточный иммунный ответ запаздывает как минимум на 1 месяц, гуморальный - на 2 мес, вирус «опережает» адаптивный иммунный ответ. Развитие желтухи редко наблюдается при ОГC. Примерно через 8-12 нед после инфицирования, когда наблюдается максимальное увеличение уровня АЛТ в крови, титры РНК ВГC снижаются. Специфические антитела к ВГC могут определяться несколько позже или могут отсутствовать, но их появление не означает окончания инфекции. У большинства больных развивается ХГC с относительно стабильной вирусной нагрузкой, которая на 2-3 порядка ниже, чем в острой фазе инфекции. Только около 20% больных выздоравливают. Элиминация вируса из печени происходит позднее, чем из крови, повторная виремия была обнаружена у некоторых пациентов даже через 4-5 мес после того, как РНК ВГC перестала определяться в крови. Учитывая, что титры анти-ВГC могут снижаться, а в ряде случаев через 20-30 лет после выздоровления - исчезать, можно предположить возможность полной элиминации вируса. Почти все спонтанно вылечившиеся от ОГC пациенты демонстрировали сильный и полиспецифичный ответ Т-клеток. Напротив, клеточный иммунный ответ у пациентов с хронической инфекцией, вызванной ВГС, обычно слабый. Известен феномен ускользания из-под контроля иммунного ответа хозяина, который обусловлен высокой мутационной изменчивостью генома ВГС.
При ВГС-инфекции возможно появление разнообразных внепеченочных поражений, обусловленных иммунопатологическими реакциями в ответ на воздействие вируса, которые реализуются либо иммуноклеточными (грануломатоз, лимфомакрофагальные инфильтраты), либо иммунокомплексными реакциями (васкулиты различной локализации).
Патологическая анатомия. Морфологические изменения в печени при ГC неспецифичны, наблюдается преимущественно лимфоидная инфильтрация портальных трактов с образованием лимфоидных фолликулов, лимфоидная инфильтрация долек, ступенчатые некрозы гепатоцитов, стеатоз, повреждение мелких желчных протоков, фиброз печени.
Клиническая картина
Инфицирование ВГC приводит к развитию ОГC, в 80% случаев протекающего бессимптомно, в результате чего острая фаза заболевания диагностируется редко. Инкубационный период при ОГC колеблется от 2 до 26 нед (в среднем 6-8 нед).
Клиническая классификация гепатита С
Симптомы ОГC принципиально не отличаются от других парентеральных гепатитов. Преджелтушный период от нескольких дней до 2 нед, у 20% больных отсутствует. ОГC развивается постепенно, в преджелтушном периоде чаще преобладает астеновегетативный синдром. Часто возникают диспепсические расстройства в виде снижения аппетита, дискомфорта в правом подреберье, тошноты и рвоты. Существенно реже бывает артралгический синдром, может появляться кожный зуд. Желтушный период протекает значительно легче, чем при других парентеральных гепатитах. У всех больных увеличена печень, у 20% больных - селезенка. Для ОГC характерны такие же изменения биохимических показателей, как при других вирусных гепатитах: повышение уровня билирубина, значительное повышение активности АЛТ. В большинстве случаев уровень билирубина нормализуется к 30-му дню после появления желтухи. Другие биохимические показатели (осадочные пробы, уровень общего белка и белковых фракций, протромбина, холестерина, щелочной фосфатазы) обычно остаются в пределах нормы. Иногда регистрируется увеличение содержания ГГТ. В гемограмме при желтушной форме ОГC возможна тенденция к лейкопении, в моче обнаруживаются желчные пигменты.
ОГC протекает преимущественно в среднетяжелой форме, у 30% больных - легко. Возможно тяжелое течение болезни (редко), но фульминантный ОГC, встречается очень редко. При естественном течении инфекции 20-25% больных ОГC выздоравливают, у остальных 75-80% развивается ХГC. О спонтанном выздоровлении можно говорить, если у пациента, не получавшего специфическую противовирусную терапию, на фоне хорошего самочувствия в сыворотке крови не выявляется РНК ВГC не менее 2 лет после ОГC.
Формирование ХГC может сопровождаться нормализацией клинико-биохимических показателей вслед за острым периодом, однако в последующем вновь появляется гиперферментемия и РНК ВГC в сыворотке крови. Большинство больных с биохимическими признаками ХГC (70%) имеют благоприятное течение (слабовыраженную или умеренную воспалительную активность в ткани печени и минимально выраженный фиброз). 30% больных ХГC имеют прогрессирующее течение заболевания, у части из них формируется цирроз печени, декомпенсация которого может привести к летальному исходу. Декомпенсированный цирроз печени является показанием к трансплантации печени. У 70% больных причиной смерти является ГЦК, печеночно-клеточная недостаточность и кровотечения. Для больных ХГC риск развития ГЦК через 20 лет после инфицирования составляет 1-5%.
Особенностью ХГC является латентное или малосимптомное течение, длительное время заболевание остается нераспознанным. Повышение активности АЛТ и АСТ, выявление анти-ВГC и РНК ВГC в сыворотке крови в течение не менее 6 мес являются основными признаками ХГC. Чаще всего эта категория больных выявляется случайно, при обследовании перед оперативным вмешательством, при прохождении диспансеризации и т.д.
Внепеченочные проявления при инфекции, вызванной ВГС, встречаются у 30-75% больных, могут выступать на первый план в течение болезни и определять прогноз. Течение ХГC может сопровождаться такими иммуноопосредованными внепеченочными проявлениями, как смешанная криоглобулинемия, красный плоский лишай, гломерулонефрит, поздняя кожная порфирия, ревматоидные симптомы. Показана роль ВГC в развитии В-клеточной лимфомы, различных злокачественных опухолей, идиопатической тромбоцитопении, поражения эндокринных и экзокринных желез (прежде всего, вовлечение в патологический процесс слюнных и слезных желез, в том числе в рамках синдрома Шегрена), органа зрения, кожи, мышц, суставов, нервной системы и др.
Диагноз
Клинические симптомы при ОГC у значительной части больных слабо выражены и не специфичны, поэтому диагностировать ОГC возможно на только основании комплексной оценки полученных при динамическом наблюдении результатов, при наличии сочетания эпидемиологического анамнеза, желтухи, увеличения показателей билирубина, повышения уровня АЛТ более чем в 10 раз и обязательном наличии маркеров ГC (анти-ВГC, РНК ВГC). Диагноз ОГC устанавливают в тех случаях, когда при первичном исследовании сыворотки крови обнаруживают РНК ВГC при отсутствии антител к ВГC, которые появляются спустя 4-6 и более недель от начала болезни. Использование тест-систем III поколения, значительно более чувствительных и специфичных, позволяет выявить анти-ВГC в сыворотке крови уже через 7-10 дней от начала желтухи. Анти-ВГC могут выявляться как при ОГC, так и при ХГC, причем анти-ВГC IgM одинаково часто выявляются у больных как острым, так и ХГC. Таким образом, обнаружение анти-ВГC IgM не может быть использовано как маркер острой фазы ВГC.
Дифференциальную диагностику проводят с другими ВГ, а также калькулезным холециститом и раком головки поджелудочной железы.
Лечение
Режим полупостельный при легком и среднетяжелом ОГC. При тяжелом течении ОГC необходим строгий постельный режим.
Диета: стол № 5.
Принципы проведения патогенетической и симптоматической терапии при ОГC такие же, как и при других вирусных гепатитах.
Противовирусная терапия может быть отложена на 8-12 нед от дебюта заболевания в связи с возможностью спонтанного выздоровления, но, если выздоровления не наступило, начинать терапию необходимо не позднее 12 нед. Если концентрация РНК ВГC высокая и не снижается при мониторинге ее уровня каждые 4 нед, лечение начинают раньше.
Существенно увеличить количество выздоровевших (до 90% и более) при ОГC удается при использовании следующих схем лечения.
-
Монотерапия стандартным ИФН-ИФН-α2 обладает высокой эффективностью: по 5 млн МЕ в/м ежедневно в течение 4 нед, затем по 5 млн МЕ в/м 3 раза в неделю в течение 20 нед; или по 3 млн МЕ в/м через день в течение 24 нед. Применение ПЭГ-ИФН позволяет уменьшить кратность введения.
-
ПЭГ-ИФН-α (ПЭГ-ИФН-α2а, 180 мкг в неделю или ПЭГ-ИФН-α2b, 1,5 мкг/кг в неделю п/к) в течение 12 нед.
-
Согласно европейским рекомендациям (EASL, 2018), у пациентов с ОГС могут применяться препараты с прямым противовирусным действием (ПППД), высокоэффективные при ХГС: софосбувир и даклатасвир, глекапревир и пибрентасвир (для всех генотипов ВГС), при генотипе 1 - комбинация паритапревира, бустированного ритонавиром, омбитасвира и дасабувира, комбинация гразопревира и элбасвира. Длительность курса терапии составляет 8 нед. Данные комбинации назначаются off-label, решением консилиума. Возможно, что при получении новых данных схемы использования безинтерфероновых режимов будут уточнены.
Базисная терапия включает стол № 5, курсовое применение средств, нормализующих деятельность ЖКТ, влияющих на функциональную активность гепатоцитов (панкреатические энзимы, гепатопротекторы, желчегонные, средства для восстановления микрофлоры кишечника и др.).
Принципиально важным является установление показаний для этиотропной терапии ХГC и выбор адекватной программы ее проведения.
Всем пациентам с заболеванием печени, обусловленным ВГС, ранее получавшим или не получавшим терапию, желающим лечиться и не имеющим противопоказаний, показано проведение ПВТ. Лечение должно назначаться безотлагательно у пациентов со значительно выраженным фиброзом (F2 или F3 по шкале METAVIR) или циррозом печени (F4 по шкале METAVIR), включая декомпенсированный цирроз печени; у пациентов с клинически значимыми внепеченочными проявлениями; у пациентов с рецидивом ВГС после трансплантации печени; у пациентов с риском быстрого прогрессирования заболевания печени из-за сопутствующих заболеваний (реципиенты солидных органов, коинфекция вирусом гепатита В, сахарный диабет и др.); у лиц с высоким риском передачи (пациенты, практикующие внутривенное введение наркотиков, мужчины, имеющие половые контакты с мужчинами, женщины детородного возраста, планирующие беременность, пациенты, находящиеся на гемодиализе, заключенные тюрем).
В современных российских условиях лечение пациентов с ХГС проводится с использованием интерферонсодержащих режимов и безинтерфероновых схем.
Достижение УВО24 или УВО12 (отсутствие РНК ВГС в крови через 24 или 12 недель после окончания ПВТ) является надежным критерием элиминации вируса из организма и показателем излечения.
В настоящее время в России используется пегилированные интерфероны в сочетании с рибавирином. Инъекции пегилированного интерферона альфа проводятся 1 раз в неделю подкожно, рибавирин назначается ежедневно внутрь. При составлении прогноза эффективности лечения ХГС интерферонсодержащими режимами традиционно в качестве опорных учитываются факторы хозяина, факторы вируса и адекватность лекарственной терапии. Больные в возрасте менее 40 лет, пациенты с небольшой продолжительностью болезни, при отсутствии стеатоза печени и ожирения, инсулинорезистентности и сахарного диабета, коинфекции ВГВ/ВИЧ и др. чаще отвечают на терапию интерфероном. При генотипе 1 чаще эффективная терапия регистрируется у пациентов, имеющих генотип СС по аллели rs12979860 гена IL-28B. Важную роль в достижении УВО играет правильный режим приема лекарственных препаратов - приверженность больного к лечению.
Эффективность ПВТ с использованием препаратов интерферонового ряда может быть значительно повышена за счёт включения в стандартную схему терапии одного из препаратов с прямым противовирусным действием (тройная терапия), а также путём тщательного отбора групп пациентов, имеющих предикторы благоприятного ответа на интерферонотерапию. Учет данных о вирусной кинетике в процессе этиотропного лечения позволяет оптимизировать схему ПВТ, изменяя её длительность или своевременно прекращая курс лечения. Пациентам с генотипом 1 со слабо или умеренно выраженным фиброзом и предикторами благоприятного ответа на противовирусную терапию могут быть назначены схемы, включающие ПЭГ-ИФН альфа, рибавирин и один из препаратов прямого противовирусного действия (симепревир, софосбувир или нарлапревир).
В реальной клинической практике, согласно опубликованным данным, эффективность комбинации отечественного пегилированного интерферона цепэгинтерферона альфа-2b с рибавирином и симепревиром у описанной когорты пациентов достигала 95% (35/37), а эффективность комбинации цепэгинтерферона альфа-2b, рибавирина и нарлапревира у ранее не леченных пациентов с фиброзом F0-F2 составила 100% (29/29).
У пациентов с генотипами 2 и 3 ВГС, обладающих указанными предикторами благоприятного ответа на противовирусную терапию, может применяться комбинация пегилированного интерферона и рибавирина. По данным литературы, эффективность комбинации цепэгинтерферона альфа-2b и рибавирина у ранее не леченных пациентов без выраженного фиброза достигала 93%. Однако лечение этими препаратами должно сопровождаться тщательным мониторированием возможных нежелательных явлений, характерных для интерферона и рибавирина.
В настоящее время широкое применение для лечения ХГС получили новые ПППД, которые могу применяться как в составе интерфероновых схем, так и в комбинации друг с другом. Безинтерфероновые схемы терапии позволяют достичь эрадикации вируса почти у 100% больных, имеют короткий курс лечения, обладают высокой степенью безопасности и удобны в применении, что значительно повышает комплаентность пациентов с ХГС. Кроме того, практически невилирована значимость предикторов благоприятного ответа при прогнозировании эффективности ПВТ с применением ПППД, играющих исключительно важную роль при использовании интерферонсодержащих режимов лечения.
-
Викейра Пак♠ - комбинированное противовирусное ЛС, предназначенное для лечения ХГC 1 генотипа, включающее три ПППД с различными механизмами действия и непересекающимися профилями резистентности, что позволяет воздействовать на ВГС на разных этапах его жизненного цикла: ингибитор протеазы NS3/4А паритапревир, бустированный ритонавиром, ингибитор комплекса NS5A омбитасвир и ненуклеозидный ингибитор полимеразы NS5B дасабувир. В медицинской литературе эта комбинация нередко обозначается как 3D. Эффективность лечения этим препаратом составляет около 100%, включая больных с компенсированным циррозом печени.
-
Даклатасвир (Даклинза♠) - ингибитор неструктурного белка 5А (NS5A), пангенотипического действия. Комбинация даклатосвира и софосбувира с рибавирином или без него с высокой эффективностью используется для лечения ХГC, вызванного любым генотипом вируса, в том числе и у больных с декомпенсированным циррозом печени.
-
Асунапревир (Сунвепра♠) - ингибитор комплекса сериновой протеазы белков NS3/4A ВГC. Ферментный комплекс белков NS3/4A является ответственным за процессинг полипротеина ВГC для получения зрелых вирусных белков, требуемых для репликации вируса. Асунапревир наиболее активен в отношении протеазных комплексов NS3/4A, представляющих генотип 1. Даклатасвир и асунапревир показаны для лечения ХГC у пациентов с компенсированным поражением печени (включая цирроз). Даклатасвир применяется в комбинации с асунапревиром (для генотипа 1b) или с асунапревиром, ПЭГ-ИФН-α и рибавирином (для генотипа 1). Эти препараты не применяются в виде монотерапии.
-
В 2016 г. в России получил одобрение нарлапревир (Арланса♠), который является ингибитором NS3-сериновой протеазы HCV, подавляющим вирусную репликацию в инфицированных клетках хозяина. Нарлапревир следует применять с ритонавиром, ПЭГ-ИФН-α и рибавирином у пациентов с ХГС, вызванным генотипом 1, как ранее не получавшим ПВТ, так и тем, у кого двойная терапия ПЭГ-ИФН-α и рибавирином была неэффективной. В составе комбинированной терапии нарлапревир показал высокую эффективность у пациентов ХГC с генотипом 1 в группе прежде не леченных больных с отсутствием или слабо выраженным фиброзом (F0-F1) - 93%.
-
Софосбувир (Совальди♠) - противовирусный препарат прямого действия для лечения ХГC в комбинации с другими противовирусными средствам. Софосбувир представляет собой первый пангенотипический ингибитор РНК-зависимой РНК-полимеразы NS5B ВГС, необходимой для репликации вируса. У пациентов с ХГC (генотип 1), ранее не получавших лечения, УВО12 при применении софосбувира + ПЭГ-ИФН + рибавирин в течение 12 нед наблюдался у 83-90% пациентов, при наличии цирроза печени - у 80%. Эффективность и безопасность симепревира (150 мг/сут) в комбинации с софосбувиром продемонстрировала частота достижения УВО12 90-94%. Комбинация даклатасвира и софосбувира может быть использована для лечения ХГС, вызванного любым генотипом. В настоящее время это комбинация препаратов является единственной, разрешенной для применения при декомпенсированном ЦП. При терапии комбинацией даклатасвира, софосбувира и рибавирина в течение 12 нед пациенты с ЦП (класса А, В и С по Чайлд-Пью) достигали УВО в 100% случаев при генотипе 1b, 76% - при генотипе 1а.
-
Глекапревир/пибрентасвир (Г/П, Мавирет♠) - пангенотипный комбинированный противовирусный препарат нового поколения, зарегистрированный в РФ в 2018 г. Препарат включает ингибитор протеазы NS3/4A и ингибитор NS5A вируса гепатита С. Оба компонента обладают высокой активностью в отношении вируса, включая варианты, резистентные к ряду препаратов предыдущих поколений. Г/П эффективен в отношении всех основных генотипов ВГВ, включая генотипы 1, 2 и 3, наиболее распространенные на территории Российской Федерации. 8-недельный курс лечения Г/П показан всем не леченным прежде пациентам без цирроза печени, составляющим большинство в российской популяции. Для пациентов, не ответивших на предыдущую терапию, продолжительность лечения см. в инструкции. Эффективность препарата составляет в среднем 97,5% у пациентов со всеми генотипами вируса, включая больных с циррозом печени и пациентов, ранее не ответивших на терапию пегинтерферон + рибавирин ± софосбувир и софосбувир + рибавирин. Препарат показал высокую эффективность в лечении пациентов с коинфекцией ВИЧ/ВГС, ХБП 4-5 стадий, а также у больных после трансплантации печени и почки. Частота прекращения терапии Г/П по данным программы клинических исследований составляет 0,1% на выборке более чем 2300 пациентов.
-
Элбасвир 50 мг/Гразопревир 100 мг (Э/Г, Зепатир♠) - противовирусный препарат прямого действия, который включает в себя ингибитор белка NS5A, необходимый для репликации вируса и сборки вириона (элбасвир), и ингибитор протеазы NS3/4A, необходимый для расщепления кодируемого протеина на зрелые формы белков и репликации вируса. Оба компонента препарата объединены в одну таблетку, покрытую пленочной оболочкой, которая принимается один раз в день независимо от приема пищи. Э/Г зарегистрирован в 2018 г. для лечения хронического гепатита С генотипов 1а, 1b, 3 и 4 у пациентов 18 лет и старше. Продолжительность терапии составляет от 8 до 16 нед в зависимости от предшествующей терапии, вирусной нагрузки, генотипа, полиморфизма NS5A, наличия значительных признаков фиброза или цирроза печени, с рибавирином или без (при генотипе 3 применяется в комбинации с софосбувиром в течение 12 нед). По данным регистрационных рандомизированных исследований, частота достижения устойчивого вирусного ответа составляет 91-100%. Высокая эффективность была показана в исследованиях у пациентов с циррозом печени или без, хроническими заболеваниями почек, коинфекцией ВИЧ, а также была подтверждена в рамках наблюдательных программ в условиях реальной клинической практики. Коррекция дозы не требуется в зависимости от функции почек, расы, пола, массы тела, возраста, приема ингибиторов протонной помпы.
При применении ПППД следует помнить о возможности развития межлекарственных реакций взаимодействия с лекарственными препаратами других фармакологических групп и тщательно оценивать возможность их совместного применения для предотвращения тяжелых, иногда жизнеугрожающих, состояний.
Перед проведением ПВТ с использованием ПППД больные ХГС должны быть тестированы на маркеры инфекции вирусом гепатита В (HBsAg, анти-HBcIgG, ДНК ВГВ, анти-HBs). При коинфекции ВГС/ВГВ на фоне лечения ХГС с использованием препаратов ПППД возможна реактивация вирусного гепатита В, поэтому в процессе лечения и после него необходим контроль биохимических показателей (АЛТ, АСТ, билирубин), при необходимости - ДНК ВГВ для выявления признаков реактивации и назначения специфической терапии ХГВ аналогами нуклеоти(зи)дов.
Диспансеризация. Диспансерное наблюдение за больными ХГC и лицами, у которых при скрининге выявлены антитела к ВГС (при отсутствии РНК ВГС), осуществляется не реже 1 раза в 6 мес с проведением комплексного клинико-лабораторного исследования с обязательным исследованием крови на наличие РНК ВГС методом ПЦР. Лица с наличием анти-ВГС, у которых в течение 2 лет отсутствует РНК ВГС при исследовании с периодичностью не реже 1 раза в 6 мес, считаются реконвалесцентами и подлежат снятию с диспансерного наблюдения. Пациенты с выраженным фиброзом и ЦП, достигшие эрадикации вируса в результате ПВТ, должны находиться под постоянным наблюдением для своевременного выявления ГЦК, угроза развития которой сохраняется у части больных даже в условиях авиремии (для этого необходимо проведение УЗИ органов брюшной полости и исследование уровня АФП 1 раз в 6 мес).
Гепатиты ни А ни G
ВГ ни А ни G - группа острых инфекционных болезней человека, протекающих с клинико-лабораторными признаками острого вирусного гепатита, но при отсутствии в сыворотке крови маркеров известных возбудителей ВГ (А, В, С, D, E, G). В настоящее время вероятными возбудителями ВГ ни А ни G считают недавно открытые вирусы TTV (1997 г.) и SEN (1999 г.).
TTV-инфекция
Этиология
TTV «Transfusion transmitted virus» - вирус, передающийся при переливании (TTV), относится к семейству Circoviridae. Вирион - частица без оболочки размером 30-50 нм, состоящая из одноцепочечной ДНК кольцевидной структуры, содержащей 3852 нуклеотида, имеет 16 и несколько субтипов. Наиболее часто выделяют генотипы G1a и G1b. У одного пациента могут выявляться сразу несколько генотипов TTV.
Эпидемиология
TTV распространен повсеместно, но неравномерно.
Помимо парентерального механизма TTV может передаваться с помощью фекально-орального механизма. Было доказано наличие вируса в желчи, фекалиях, в том числе и одновременно с его нахождением в сыворотке крови. TTV обнаружен в крови некоторых сельскохозяйственных (быков, свиней, кур, овец) и домашних животных (собак, кошек).
Меры профилактики
Профилактические мероприятия - такие же, как при других вирусных гепатитах.
Патогенез
Документально подтверждены случаи появления у больных ДНК TTV, ее персистенции и дальнейшего исчезновения. У больных с посттрансфузионным гепатитом ни А, ни G рост и падение вирусной нагрузки ТТV были связаны с увеличением и уменьшением активности АЛТ и АСТ. При нормализации активности аминотрансфераз ТТV не обнаруживался. В ткани печени концентрация TTV выше в 10-100 раз. В то же время выявлено персистирование ДНК TTV за 22 года без биохимических и морфологических изменений функций и строения печени.
Клиническая картина
Этиологическая роль ТТV в развитии острого или хронического гепатита, цирроза и первичной гепатомы нуждается в дальнейшем изучении. TTV-инфекция диагностируется методом ПЦР.
SEN-инфекция
SEN-вирус, кандидат для включения в число возбудителей ВГ, был открыт в 1999 г. в сыворотке крови больного ВИЧ-инфекцией с повышенной активностью АЛТ и АСТ и отрицательными результатами исследования сыворотки крови на маркеры HAV, HGV и TTV. Он был обозначен по инициалам этого пациента.
Исследования, проведенные в различных странах и регионах мира, показали высокий уровень распространения вируса среди различных групп населения. Чаще всего он выявляется у пациентов, перенесших операции на сердце, получавших гемотрансфузии и заболевших далее острым гепатитом ни А ни Е (83,3%); больных хроническими гепатитами ни А ни Е (68%). В группе лиц, имеющих повышенный риск инфицирования вирусами гепатитов с парентеральным механизмом передачи возбудителя, частота обнаружения ДНК SEN-вируса в 2-3 раза выше частоты выявления его у первичных доноров.
ВИЧ-инфекция
ВИЧ-инфекция - хроническая инфекционная болезнь, вызванная ВИЧ (human immunodeficiency virus infection - HIV-infection). ВИЧ-инфекция - медленно прогрессирующее антропонозное заболевание с контактным механизмом передачи возбудителя, характеризующееся поражением иммунной системы с развитием СПИДа. Клинические проявления СПИДа, приводящие к гибели инфицированного человека, - оппортунистические (вторичные) инфекции, злокачественные новообразования и аутоиммунные процессы.
Коды по МКБ-10
В20 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде инфекционных и паразитарных болезней.
В21 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде злокачественных новообразований.
В22 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде других уточненных болезней.
В23 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), проявляющаяся в виде других состояний.
В24 Болезнь, вызванная вирусом иммунодефицита человека (ВИЧ), неуточненная.
Z21 Бессимптомный инфекционный статус, вызванный вирусом иммунодефицита человека (ВИЧ).
Этиология
Возбудитель - вирус иммунодефицита человека (ВИЧ).
Имеет два типа - ВИЧ-1 и ВИЧ-2, различающиеся по структурным и антигенным характеристикам. На территории Российской Федерации эпидемиологическое значение имеет ВИЧ-1 (основной возбудитель заболевания). ВИЧ относится к семейству Retroviridae, роду Lentiviridae, имеет округлую форму и сложную структуру. Диаметр вириона составляет 100-120 нм. Специфические белки вируса представлены в таблице (табл. 17-3).
| Группы белков | ВИЧ-1 | ВИЧ-2 |
|---|---|---|
Белки оболочки вируса (env) |
gp160, gp120, gp41 |
gp140, gp105, gp36 |
Белки сердцевины (gag) |
p17, p24, p55 |
p16, p25, p56 |
Ферменты вируса (pol) |
p31, p51, p66 |
p68 |
* Молекулярный вес белков измеряют в килодальтонах (кДа); gp - гликопротеины; р - протеины.
В центре вириона располагается геном вируса, представленный двумя нитями РНК, внутренними протеинами p7 и p9, а также ферментами - обратной транскриптазой (ревертазой), протеазой, РНКазой и интегразой (эндонуклеазой). Геном окружает внутренняя белковая оболочка. В состав внутренней оболочки ВИЧ-1 входят протеины p17, p24 и p55. Протеины p16, p25 и p56 образуют внутреннюю оболочку ВИЧ-2. Наружная липидная оболочка ВИЧ-1 пронизана гликопротеином gp160, состоящим из трансмембранного (gp41) и высокоиммуногенного (gp120) фрагмента. Оболочечные белки gр41 и gр120 соединены нековалентной связью и формируют на поверхности вириона отростки, обеспечивающие присоединение ВИЧ к рецепторам клеток-мишеней человека. Геном вируса содержит 9 генов - три структурных и шесть регуляторных. Геном является изменчивой структурой за счет антигенного дрейфа. Существует ряд вариантов вируса [основная группа М, состоящая из нескольких подтипов (клад): А, В, С, D, Е, F, G, Н, I, J, K; группы O, N, P].
В естественных условиях ВИЧ (в высушенном состоянии) сохраняет активность в течение нескольких часов; в жидкостях, содержащих большое количество вирусных частиц, таких как кровь и эякулят, - в течение нескольких дней.
В замороженной сыворотке крови активность вируса определяют на протяжении нескольких лет.
Нагревание до 56 °C в течение 30 мин приводит к снижению инфекционного титра вируса в 100 раз. При более высокой температуре (70-80 °C) вирус погибает через 10 мин. Вирус чувствителен к 70% раствору этанола (Этиловый спирт♠), 0,5% раствору гипохлорита натрия, 1% раствору глутаральдегида, 6% раствору водорода пероксида, 5% раствору лизола, эфира или ацетона.
ВИЧ относительно мало чувствителен к ультрафиолетовому облучению и ионизирующей радиации.
Эпидемиология
Источник ВИЧ-инфекции - ВИЧ-инфицированные люди, находящиеся на любой стадии заболевания, независимо от наличия или отсутствия клинических проявлений болезни, в том числе в периоде инкубации.
Основной механизм передачи инфекции - контактный. Существуют естественные и искусственные пути передачи. К естественным путям передачи относят половой (при половых контактах) и вертикальный (от инфицированной матери ребенку в период беременности, родов или при грудном вскармливании).
Искусственный (артифициальный) путь передачи - парентеральный - реализуется при проникновении вируса в кровь при различных манипуляциях, связанных с нарушением целостности слизистых оболочек и кожных покровов.
К числу факторов, влияющих на вероятность инфицирования полового партнера ВИЧ, относят титр вируса у источника инфекции; наличие у реципиента различных заболеваний половых органов; интенсивность контакта.
Современная эпидемиология ВИЧ-инфекции исключает существование аэрозольного, фекально-орального и трансмиссивного механизмов передачи вируса.
Восприимчивость человека к ВИЧ практически стопроцентная. Фактором невосприимчивости к заражению ВИЧ может быть отсутствие определенных специфических рецепторов. В настоящее время выделяют гены, контролирующие синтез молекул, участвующих в проникновении ВИЧ в клетки хозяина. Таким образом, люди, имеющие гомозиготный генотип по этим генам, устойчивы к заражению ВИЧ половым путем; лица с гетерозиготным генотипом - менее устойчивы. Было установлено, что длительно контактирующие с ВИЧ-инфицированными и при этом не заразившиеся люди имеют генетический вариант CCR5-32, представляющий собой мутацию в гене, отвечающем за экспрессию корецептора CCR5 на поверхности лимфоцитов. Однако этот признак не ассоциируют с невосприимчивостью к ВИЧ при переливании крови или при внутривенном введении психоактивных веществ.
ВИЧ-инфекция распространена повсеместно. Наибольшее количество ВИЧ-инфицированных проживают в Центральной Африке и на Карибских островах. Важным показателем является прирост числа новых случаев. В начале 80-х гг. ХХ в. максимальное количество случаев ВИЧ-инфекции регистрировали в Центральной Африке и в США, а к концу 2000 г. в эпидемию были вовлечены уже все континенты. В России ВИЧ-инфекцию регистрируют с 1985 г., первоначально среди иностранцев, преимущественно выходцев из Африки, а с 1987 г. - среди граждан СССР. С 2006 г. ВИЧ-инфекцию обнаруживают и регистрируют во всех субъектах РФ.
До середины 90-х гг. ХХ в. в РФ основным путем передачи ВИЧ считали половой. Со второй половины 1996 г. первое место заняло «инъекционное» заражение, как правило, среди наркоманов, практикующих парентеральное введение психоактивных веществ. В последние годы увеличивается значимость гетеросексуального пути передачи ВИЧ-инфекции. Об этом свидетельствует не только увеличение количества инфицированных (основной фактор риска для которых - гетеросексуальные контакты), но и рост доли инфицированных женщин. Вследствие этого повышается вероятность передачи ВИЧ-инфекции от матери к ребенку.
Меры профилактики
Специфическая профилактика не разработана.
Неспецифическая профилактика заключается в предотвращении половой и перинатальной передачи ВИЧ; в контроле безопасности переливаемых компонентов крови и ее препаратов, а также в предупреждении передачи инфекции при проведении медицинских манипуляций. Большое значение имеет также оказание специфической специализированной медицинской помощи.
Патогенез
Дифференцировочный антиген CD4+ (СD - аббревиатура от Cell Differention antigen) и неспецифические (независящие от наличия CD4+) компоненты - рецепторы для ВИЧ. CD4+ - гликопротеид с молекулярной массой 55 000 кД, по своему строению схожий с определенными участками Ig. Аналогичное строение имеет и белок вируса gp120; это и определяет способность проникновения вирионов в клетку.
Рецептор CD4+, расположенный на мембране иммунокомпетентных клеток, выполняет функцию распознавания антигенов (вместе с белками HLA - главного комплекса гистосовместимости II класса).
В организме человека существует целый ряд иммунокомпетентных, соматических и других клеток, несущих рецепторы для ВИЧ (табл. 17-4).
| Тип клеток | Ткани и органы |
|---|---|
Т-лимфоциты, макрофаги |
Кровь |
Клетки Лангерганса |
Кожа |
Фолликулярные дендритные клетки |
ЛУ |
Альвеолярные макрофаги |
Легкие |
Эпителиальные клетки |
Толстый кишечник, почки |
Клетки шейки матки |
Шейка матки |
Клетки олигодендроглии |
Головной мозг |
Оболочка ВИЧ содержит белки человеческого комплекса гистосовместимости I и II классов, поэтому проникновение вируса в организм не вызывает реакции отторжения. Фиксация вирионов на поверхности клетки-мишени происходит при участии гликопротеина gp120. Гликопротеин gp41 обеспечивает слияние вирусной оболочки с мембраной клетки-мишени. Двухцепочечная РНК вируса проникает в клетку, где происходит синтез одноцепочечной провирусной ДНК. Затем происходит формирование двухцепочечной ДНК, встраивающейся в ДНК клетки с помощью интегразы. Вирусная ДНК выполняет функцию матрицы для синтеза РНК, собирающей новую вирусную частицу.
Нередко при репликации ВИЧ возникают генетические ошибки. Таким образом происходит образование разных подтипов вируса.
После проникновения ВИЧ в CD4+-клетки начинается его репликация: чем активнее CD4+-клетки, тем интенсивнее репродукция вируса. Поэтому регуляторы, активирующие CD4+-клетки, обеспечивают увеличение репликации вируса.
ИФН и трансформирующий фактор роста - регуляторы, тормозящие репликацию вируса. ФНО-α активирует транскрипцию про-вирусной ДНК ВИЧ-1 в хронически инфицированных Т-клетках и макрофагах. Моноциты, синтезирующие ФНО-α, не только индуцируют экспрессию ВИЧ-инфицированными клетками, но и стимулируют активацию латентного провируса. Регистрируют одновременную активность ФНО-α, ИЛ-6 и фактора, стимулирующего колонии гранулоцитов и макрофагов.
Иммунопатогенетические признаки ВИЧ-инфекции - дефицит Т-звена и В-звена иммунной системы; недостаток компонентов комплемента и фагоцитов; снижение функций неспецифических факторов защиты. Поликлональная активация В-лимфоцитов приводит, с одной стороны, к гипергаммаглобулинемии, а с другой - к ослаблению способности клеток продуцировать вируснейтрализующие антитела. Происходит увеличение количества ЦИК и образование антител к лимфоцитам; это вызывает еще большее уменьшение числа CD4+-Т-лимфоцитов. Отмечают развитие аутоиммунных процессов. Поражение иммунной системы при ВИЧ-инфекции носит системный характер.
Наряду с дефицитом CD4+-лимфоцитов в течение болезни нарастает функциональная недостаточность СD8+-лимфоцитов, NK-клеток (естественных киллеров) и нейтрофилов. При ухудшении иммунного статуса развиваются различные инфекционные, аллергические, аутоиммунные и лимфопролиферативные заболевания, а также синдром, свойственный болезни иммунных комплексов (эти факторы определяют клиническую картину ВИЧ-инфекции).
На начальных стадиях заболевания в организме вырабатываются вируснейтрализующие антитела, подавляющие активность свободно циркулирующих вирусов. Однако такие антитела не действуют на вирусы, находящиеся в клетках (провирусы). С течением времени (обычно после 5-6 лет) происходит истощение защитных возможностей иммунной системы и накопление вируса в крови.
Клиническая картина
Продолжительность инкубационного периода ВИЧ-инфекции составляет от 2 нед до 6 мес и более.
Классификация
Согласно принятой в Российской Федерации классификации (приказ Минздравсоцразвития РФ от 17 марта 2006 г. № 166), выделяют следующие стадии ВИЧ-инфекции.
-
-
Потеря массы тела менее 10%; грибковые, вирусные, бактериальные поражения кожи и слизистых оболочек; повторные фарингиты и синуситы; опоясывающий лишай. Фазы:
-
Потеря массы тела более 10%; необъяснимая диарея или лихорадка более 1 мес; волосатая лейкоплакия; туберкулез легких; стойкие повторные вирусные, бактериальные, грибковые, протозойные поражения внутренних органов; локализованная саркома Капоши; повторный или диссеминированный опоясывающий лишай. Фазы:
-
Кахексия; генерализованные вирусные, бактериальные, мико-бактериальные, грибковые, протозойные, паразитарные заболевания, в том числе кандидоз пищевода, бронхов, трахеи, легких; пневмоцистная пневмония; внелегочный туберкулез; диссеминированная саркома Капоши; атипичные микобактериозы; злокачественные опухоли; поражения ЦНС различной этиологии. Фазы:
-
Основные симптомы ВИЧ-инфекции и динамика их развития
Стадия первичных клинических проявлений начинается с периода сероконверсии [иногда в самом начале диагностируют острую (лихорадочную) стадию]. Стадия 2 наблюдается у 50-70% пациентов и нередко предшествует наступлению сероконверсии. Клинические признаки острой стадии (часто имеют неспецифический характер) - выраженная интоксикация, слабость, лихорадка, лимфаденопатия, эритематозно-макулезная сыпь, боли в мышцах и суставах, катаральные явления (иногда в сочетании с сыпью на коже), увеличение печени и селезенки: тонзиллит, полиаденит. Возможны преходящие нарушения деятельности ЦНС (от головных болей до острой обратимой энцефалопатии с потерей ориентации, памяти и нарушениями сознания, серозного менингита или менингоэнцефалита). В сыворотке крови обнаруживают антитела к ВИЧ (не постоянно). Нередко антитела к ВИЧ выявляют в конце острой стадии. Острая стадия развивается не у всех пациентов, а вследствие трудности ее диагностики число таких случаев оценить сложно. Манифестное течение периода острой сероконверсии при ВИЧ-инфекции - неблагоприятный признак быстрого прогрессирования заболевания. Продолжительность лихорадочного состояния - от 1-2 нед до 1 мес. Подтвердить диагноз можно путем обнаружения методом ПЦР РНК ВИЧ, иногда определяется антиген ВИЧ - протеин р24.
Субклиническая стадия 3 наступает либо сразу после острой стадии, либо начинает стадию первичных проявлений. Этот период характеризуют положительные серологические реакции на ВИЧ при проведении ИФА и иммунного блоттинга (ИБ) при отсутствии клинических признаков заболевания. Длительность субклинической стадии варьирует от 2-3 мес до нескольких лет.
В бессимптомную стадию возможно развитие персистирующей генерализованной ЛАП (в среднем продолжительность инфекционного процесса составляет от 6 мес до 5 лет). В данный период единственный клинический симптом заболевания - генерализованная ЛАП - увеличение ЛУ (не менее 1 см в диаметре) в двух или более несоприкасающихся внепаховых локусах, сохраняющее свой объем в течение по меньшей мере 3 мес при отсутствии какого-либо текущего заболевания. Помимо генерализованной ЛАП, наблюдают увеличение печени, селезенки; астенический синдром. Наблюдается постепенное снижение уровня CD4+-лимфоцитов. Общая продолжительность инкубационного и бессимптомного периодов от 2 до 10-15 лет и более.
Стадию вторичных заболеваний характеризуют развивающиеся на фоне иммунодефицита бактериальные, вирусные, грибковые, протозойные инфекции или опухолевые процессы. Стадию 4А рассматривают как переходный период от персистирующей генерализованной ЛАП к СПИД-ассоциированному комплексу. При этом длительность инфекционного процесса составляет 3-7 лет и более. Отмечают более выраженный астенический синдром, снижение умственной и физической работоспособности, ночную потливость, периодические подъемы температуры до субфебрильных цифр, неустойчивый стул, потерю массы тела менее 10%. Эта стадия заболевания протекает без выраженных оппортунистических инфекций и инвазий, а также без развития саркомы Капоши и других злокачественных опухолей. Возможны различные заболевания кожи (иногда это обострившиеся прежние, но чаще - приобретенные), грибковой, вирусной, бактериальной или другой этиологии: себорейный или аллергический дерматит, псориаз, папулезная сыпь. Грибковое поражение кожи приводит к развитию онихомикоза, дерматомикоза стоп (кистей, голеней и других участков тела). Вирусные поражения - простой герпес, опоясывающий лишай, остроконечные кондиломы, контагиозный моллюск, бородавки. Бактериальные поражения - стафилококковые и стрептококковые фолликулиты, импетиго и эктима. На слизистых оболочках обнаруживают афты; развивается ангулярный хейлит, гингивит. Нередко развиваются рецидивирующие инфекции верхних дыхательных путей, включая бактериальные синуситы.
Признаки прогрессирования заболевания (стадия 4Б) - общие симптомы без генерализации оппортунистических инфекций или опухолей, появляющиеся в более поздние стадии заболевания. Характерны необъяснимые длительная лихорадка перемежающегося или постоянного типа и хроническая диарея (длительность симптомов - больше месяца), потеря более 10% массы тела. Могут иметь место поражения кожи и слизистых оболочек грибковой (орофарингеальный кандидоз, реже - генитальной и перианальной областей), вирусной (волосатая лейкоплакия, повторный или рецидивирующий Herpes Zoster), телеангиэктазии, геморрагические высыпания, лейкопластический васкулит, гиперальгезивный псевдотромбофлебитический синдром и локализованная форма саркомы Капоши. При бактериальных поражениях кожи и слизистых оболочек возможно развитие вегетирующей, шанкриформной и диффузной форм хронической пиодермии, целлюлита, пиомиозита, пиогенных гранулем, фурункулов и абсцессов. Выявляют бактериальные (в том числе легочный туберкулез), вирусные, грибковые и протозойные поражения внутренних органов (без диссеминации).
Наблюдается тенденция к анемии, тромбоцитопении и лейкопении, обусловленной главным образом лимфопенией. Нарастают признаки иммунодефицита. Определяют уменьшение количества CD4+-лимфоцитов до 200-300 мкл-1, CD8+ -лимфоцитов - до 1300 мкл-1; при этом соотношение количества CD4+/CD8+-лимфоцитов снижается до 0,5.
Стадия 4В соответствует развернутому СПИДу. Как правило, симптомы данной стадии обнаруживают при длительно текущем инфекционном процессе (более 5 лет). Нарастающий иммунодефицит приводит к развитию двух основных клинических проявлений СПИДа: оппортунистические инфекции, вызванные условно-патогенной флорой, и новообразования. Любые патогенные микроорганизмы вызывают необычно тяжелое течение соответствующей инфекции. Клинические состояния, возникающие на стадии 4В Основные протозойные инфекции - токсоплазмоз головного мозга, протекающий в форме энцефалита, и криптоспоридиоз, характеризующийся длительной (более месяца) диареей. Наблюдаются случаи изоспоридиоза, микроспоридиоза, висцерального лейшманиоза, лямблиоза и амебиаза.
Группу грибковых инфекций составляют кандидоз пищевода и трахеи, бронхов и легких, пневмония, вызванная P. jirovecii; экстрапульмональный криптококкоз (протекает, как правило, в форме менинго-энцефалита. Нередко развиваются диссеминированные эндемичные микозы - гистоплазмоз, кокцидиоидоз и аспергиллез.
Основные вирусные заболевания - инфекции, вызванные ВПГ. ВПГ приводит к развитию длительно (более месяца) сохраняющихся признаков поражения кожи и слизистых оболочек; а также обусловливает возникновение генерализованной формы инфекции (любой продолжительности) с вовлечением в патологический процесс бронхов, легких, пищевода и нервной системы. Диагностируют ЦМВИ не только печени, селезенки и ЛУ, но и других органов (как правило, развивается генерализованная форма заболевания, с поражением сетчатой оболочки глаз, ЦНС, легких, пищевода и толстой кишки). Реже обнаруживают диссеминированный опоясывающий лишай, прогрессирующую мультифокальную лейкоэнцефалопатию (паповавирус), инфекцию, вызванную ЭБВ.
Наиболее часто развивающиеся бактериальные инфекции - атипичный диссеминированный микобактериоз с поражением легких, кожи, периферических ЛУ, ЖКТ, ЦНС и других органов; внелегочный туберкулез; сальмонеллезная септицемия. Реже диагностируют стафилококковый и стрептококковый сепсис, а также легионеллез.
Индикаторные опухолевые процессы СПИДа - диссеминированная саркома Капоши (при этом отмечают не только дерматологические признаки, но и поражения внутренних органов) и первичные неходжкинские лимфомы головного мозга (реже - другой локализации).
Этиологию вторичных заболеваний, осложняющих IV стадию ВИЧ-инфекции, во многом определяют бытовые, климатические и природные условия проживания больного ВИЧ-инфекцией.
Диагноз стадии IVВ может быть поставлен на основании выраженных признаков энцефалопатии или кахексии - результата непосредственного действия вируса на ЦНС и органы пищеварительной системы. К таким признакам относят потерю массы тела (более 10% от первоначальной), наличие хронической диареи и лихорадки (интермиттирующей или постоянной) на протяжении месяца и более, а также хроническую слабость. При этом оппортунистические инфекции или новообразования нередко отсутствуют.
В этот период развивается тромбоцитопения и глубокая иммуносупрессия. Количество Т-лимфоцитов составляет <700-800 мкл-1, CD4+-лимфоцитов - <200 мкл-1, происходит резкое уменьшение числа CD8+-лимфоцитов до 400-500 мкл-1. Отношение количества CD4+/CD8+-лимфоцитов не превышает 0,3. При уменьшении количества CD4+-лимфоцитов до 50 мкл-1 возрастает вероятность летального исхода. Развивается несостоятельность системы гуморального иммунитета. Болезнь прогрессирует, наступает терминальная, V стадия, заканчивающаяся фатально.
Осложнения
Осложнениями ВИЧ-инфекции считают вторичные заболевания, развивающиеся на фоне иммунодефицита. Механизм их возникновения связан либо с угнетением клеточного и гуморального иммунитета (инфекционные болезни и опухоли), либо с прямым воздействием ВИЧ (например, поражения ЦНС).
Микобактериозы
Примерно у 65% больных ВИЧ-инфекцией диагностируют туберкулез как впервые возникшее заболевание, у остальных пациентов обнаруживают реактивацию процесса. Особенность туберкулеза легких у больных ВИЧ-инфекцией - тяжелое течение заболевания с поражением бронхов и образованием свищей плевры, перикарда и ЛУ. Как правило, в 75-100% случаев развивается легочная форма туберкулеза, однако по мере нарастания иммунодефицита у 25-70% пациентов отмечают диссеминацию и развитие внелегочных форм заболевания. Туберкулез - одна из основных причин смерти пациентов в России на стадии IVВ (СПИД). При этом отмечают снижение количества случаев, сопровождающихся распадом легочной ткани, а следовательно, и числа больных, в мокроте которых при микроскопии и посеве обнаруживают микобактерии туберкулеза. Весьма характерным считают частое развитие микобактериемии у больных СПИДом, как правило, осложненной септическим шоком и нарушением функций различных органов. Нередко наблюдают поражение ЛУ (особенно шейных), костей, ЦНС, мозговых оболочек и органов пищеварительной системы; описаны абсцессы простаты и печени.
Группу возбудителей «нетуберкулезных» микобактериозов составляют представители различных видов микобактерий. Заболевания у человека вызывают 18 разновидностей микобактерий, 4 вида микроорганизмов обладают сравнительно высокой патогенностью для людей, а 14 видов относят к условно-патогенным. Атипичный микобактериоз, вызванный M. avium (входят в состав комплекса M. avium complex - МАС), - суперинфекция, составляющая группу СПИД-ассоциированных оппортунистических инфекций. До пандемии ВИЧ-инфекции атипичный микобактериоз диагностировали крайне редко, как правило, у лиц с выраженной иммуносупрессией (например, при трансплантации органов и тканей, после длительной кортикостероидной терапии, у онкологических больных). У пациентов, страдающих ВИЧ-инфекцией, иногда развивается диссеминированная форма МАС-инфекции. В терминальной стадии регистрируют локализованную или генерализованную формы заболевания. При локализованной МАС-инфекции обнаруживают абсцессы кожи и поражения ЛУ, а при генерализованной - общеинтоксикационный и желудочно-кишечный синдромы, а также синдром экстрабилиарной обструкции. Признаки общеинтоксикационного синдрома - лихорадка, астенизация, снижение массы тела, тяжелая анемия, лейкопения, повышение активности аланиновой трансферазы в сыворотке крови. При желудочно-кишечном синдроме возникает хроническая диарея, боли в животе; отмечают гепатоспленомегалию, мезаденит и синдром мальабсорбции. Экстрабилиарная обструкция обусловлена перипортальным и перипанкреатическим лимфаденитом, приводящим к билиарному блоку. Основой диагностики атипичных микобактериозов считают выделение гемокультуры микобактерий.
Пневмоцистная пневмония
Возбудитель - P. jirovecii. Инфицирование происходит воздушно-капельным, аэрогенным, ингаляционным и трансплацентарным путем (редко). Пневмоцисты обладают высокой тропностью к легочной ткани, поэтому даже в фатальных случаях патологический процесс редко выходит за пределы легких. Клинические формы пневмоцистоза - интерстициальная пневмония и реактивный альвеолит. Симптомы неспецифичны. Продолжительность инкубационного периода пневмоцистной пневмонии от 8-10 дней до 5 нед. Начало заболевания трудно отличить от других инфекций респираторного тракта. Характерно раннее появление одышки (частота дыхательных движений до 30-50 в минуту), которая сопровождается сухим или влажным кашлем со скудной, вязкой (иногда пенистой) мокротой, цианозом, повышением температуры тела. Плевральные боли и кровохарканье возникают редко. При аускультации выслушивают жесткое или ослабленное дыхание (локально или над всей поверхностью легких), сухие хрипы. По мере прогрессирования пневмонии могут нарастать симптомы дыхательной и сердечно-сосудистой недостаточности. Рентгенологическая картина вначале неспецифическая, затем обнаруживают прикорневое снижение пневматизации легочной ткани и усиление интерстициального рисунка. Более чем в половине случаев визуализируют билатеральные облаковидные инфильтраты (симптом «бабочки»), а в разгаре заболевания - обильные очаговые тени («ватное» легкое). В дальнейшем на рентгенограммах определяют преимущественно паренхиматозную пневмонию. В 10-30% случаев отмечают асимметричные, как правило, верхнедолевые инфильтраты. При проведении КТ обнаруживают периферические инфильтраты (иногда с очагами распада), снижение прозрачности («матовое стекло») и эмфизематозные участки. Пневмоторакс - наиболее частое осложнение.
При исследовании крови определяют гипохромную анемию, лейкоцитоз (до 50 × 109 /л) и эозинофилию. В крови обнаруживают повышение активности лДг до 700-800 МЕ/л, артериальную гипоксемию. Диагноз подтверждают обнаружением пневмоцист в мокроте, лаваже бронхов с помощью различных методов (иммунофлюоресценция, окрашивание образцов по Романовскому-Гимзе и Граму), а также проводят ПЦР-диагностику.
Прогноз значительно ухудшается, если лечение начинают на фоне ОДН, тяжелой гипоксии или при лейкопении. Летальность составляет от 52,5 до 100%, а при осуществлении ИВЛ - 58-100%.
Цитомегаловирусная инфекция
ЦМВИ, как правило, протекает латентно. Однако иногда диагностируют клинически выраженные формы заболевания, обусловленные первичным инфицированием ЦМВ, а также реинфекцией или реактивацией вируса в зараженном организме. Генерализованная ЦМВИ регистрируется у 20-40% больных СПИДом, не принимающих антиретровирусные препараты. ЦМВИ - непосредственная причина смерти 10-20% ВИЧ-инфицированных. Вероятность возникновения и тяжесть течения ЦМВИ связана со степенью иммуносупрессии. Если количество CD4+-лимфоцитов в крови составляет 100-200 мкл-1, то манифестную ЦМВИ диагностируют у 1,5% ВИЧ-инфицированных. При уменьшении числа CD4+-лимфоцитов до 50-100 мкл-1 вероятность развития ЦМВИ увеличивается почти в 4 раза. При тотальном снижении CD4+-лимфоцитов (<50 мкл-1) заболевание регистрируют практически у половины пациентов. ЦМВИ, как правило, развивается постепенно. У взрослых отмечают длительную волнообразную лихорадку неправильного типа с подъемами температуры тела выше 38,5 °С, слабость, быструю утомляемость, потерю аппетита, существенное снижение веса; реже - потливость (преимущественно по ночам), артралгии или миалгии. При поражении легких появляется постепенно усиливающийся сухой или со скудной мокротой кашель. На аутопсии обнаруживают фиброателектаз легких с кистами и инкапсулированными абсцессами. Наиболее тяжелый признак ЦМВИ - ретинит (диагностируют у 25-30% пациентов). Больные жалуются на плавающие пятна перед глазами, затем происходит снижение остроты зрения. Потеря зрения необратима в результате воспаления и некроза сетчатки. При ЦМВ-эзофагите у больного при глотании возникает боль за грудиной. При эндоскопии в типичном случае визуализируют обширную поверхностную язву слизистой оболочки пищевода или желудка. Гистологические методы позволяют обнаружить клетки цитомегалии (гигантские многоядерные клетки с внутриядерными включениями) в биоптате; с помощью метода ПЦР можно определить ДНК вируса. ЦМВ может поражать различные органы пищеварительной системы, но чаще развивается колит. Появляются боли в животе, жидкий стул, похудание и потеря аппетита. Перфорация кишки - наиболее грозное осложнение. Как возможные клинические симптомы ЦМВИ диагностируют также восходящий миелит и полиневропатию (подострого течения); энцефалит, характеризующийся деменцией; ЦМВ-гепатит с одновременным поражением желчных путей и развитием склерозирующего холангита; адреналит, проявляющийся резкой слабостью и снижением АД. Иногда развиваются эпидидимит, цервицит, панкреатит.
Наличие в крови больного антител класса IgM (или высоких титров антител класса IgG), а также присутствие ДНК вируса в слюне, моче, сперме и вагинальном секрете недостаточно для подтверждения диагноза манифестной ЦМВИ. Обнаружение вируса (его антигенов или ДНК) в крови имеет диагностическое значение. Определение высокой концентрации ДНК вируса в лейкоцитах крови и плазме требует безотлагательного начала этиотропной терапии.
Токсоплазмоз
Токсоплазмоз - чаще всего развивается при уровне CD4+-лимфоцитов <100 мкл-1. Попадание токсоплазм в организм человека приводит к формированию объемных образований в ЦНС (в 50-60% случаев) и появлению первичных эпилептических припадков (в 28% случаев). Развитие токсоплазмоза - реактивация латентной инфекции, поскольку при наличии в сыворотке крови антител к токсоплазме вероятность возникновения токсоплазмоза увеличивается в 10 раз. Однако примерно у 5% ВИЧ-инфицированных на момент постановки диагноза токсоплазмоза антитела к T. gondii отсутствуют. Заражение обычно происходит в детском возрасте. Цисты токсоплазм сохраняются до 10-15 лет, преимущественно в тканях головного мозга и органа зрения, а также во внутренних органах. У ВИЧ-инфицированных регистрируют церебральную форму заболевания. Отмечают лихорадку, головные боли, в 90% случаев разнообразную очаговую неврологическую симптоматику (гемипарез, афазия, психические и некоторые другие нарушения). При отсутствии адекватного лечения развиваются спутанность сознания, оглушенность, сопор и кома в результате отека головного мозга. При выполнении МРТ или КТ с контрастированием обнаруживают множественные очаги с кольцевидным усилением и перифокальным отеком, реже - единичный очаг. Дифференциальную диагностику проводят с лимфомой головного мозга, опухолями другой этиологии, СПИД-дементным синдромом, мультифокальной лейкоэнцефалопатией и туберкулемами. Иногда токсоплазмоз протекает без формирования объемных образований в головном мозге. Внемозговые локализации токсоплазмоза (например, интерстициальная пневмония, миокардит, хориоретинит и поражение органов пищеварительной системы) у ВИЧ-инфицированных с выраженным иммунодефицитом регистрируют редко. Диагноз токсоплазмоза устанавливают на основании клинической картины, данных МРТ или КТ, а также при наличии антител к токсоплазме в сыворотке крови и ДНК токсоплазмы в биоматериале.
Саркома Капоши
Саркома Капоши - многоочаговая сосудистая опухоль, поражающая кожу, слизистые оболочки и внутренние органы. Развитие саркомы Капоши связывают с HHV-8, который впервые обнаружили в коже больного этой опухолью. В отличие от эндемического и классического вариантов заболевания, эпидемическую форму саркомы регистрируют только у ВИЧ-инфицированных (преимущественно у гомосексуалов).
Саркома у ВИЧ-инфицированных протекает неодинаково. У одних больных диагностируют легкую форму заболевания, у других - более тяжелую. Клинические признаки саркомы Капоши разнообразны. Чаще всего развиваются поражения кожи, ЛУ, органов пищеварительной системы и легких. Разрастание опухоли может приводить к лимфатическому отеку окружающих тканей. В 80% случаев поражение внутренних органов сочетается с вовлечением в патологический процесс кожи. На начальных стадиях заболевания на коже или слизистой оболочке формируются небольшие возвышающиеся красно-лиловые узлы, нередко возникающие на месте травмы. Вокруг узловых элементов иногда обнаруживают мелкие темные пятна или желтоватый ободок (напоминают синяки). Диагноз саркомы Капоши ставят с учетом гистологических данных. При биопсии пораженных участков отмечают пролиферацию веретенообразных клеток, диапедез эритроцитов; обнаруживают содержащие гемосидерин макрофаги, а также воспалительные инфильтраты. Одышка - первый признак поражения легких при саркоме Капоши, иногда наблюдают кровохарканье. На рентгенограммах грудной клетки определяют двусторонние затемнения в нижних долях легких, сливающиеся с границами средостения и контуром диафрагмы; нередко обнаруживают увеличение прикорневых ЛУ. Саркому Капоши следует дифференцировать с лимфомами и микобактериальной инфекцией, протекающей с поражением кожи. У 50% больных диагностируют поражение органов пищеварительной системы, а в тяжелых случаях возникает кишечная непроходимость или кровотечение. Вовлечение в патологический процесс желчных путей приводит к развитию подпеченочной желтухи.
Летальность и причины смерти
Смерть больных ВИЧ-инфекцией наступает либо от прогрессирования вторичных заболеваний, либо от любых других сопутствующих заболеваний, не связанных с ВИЧ. Генерализованный туберкулез - основная причина гибели больных СПИДом. Кроме того, причиной смерти считают легочную патологию (с последующим развитием ДН) и манифестную ЦМВИ. В последнее время регистрируют увеличение летальности вследствие цирроза печени, обусловленного наличием ХГC на фоне хронической алкогольной интоксикации. Прогрессирование хронического гепатита в цирроз у таких пациентов происходит в течение 2-3 лет.
Диагностика
Клиническая диагностика
Для диагностики ВИЧ-инфекции необходимо лабораторное подтверждение. Проводят клиническую диагностику вторичных или сопутствующих заболеваний на фоне ВИЧ-инфекции; это позволяет определить тяжесть состояния больного, показания к госпитализации и тактику лечения.
Специфическая и неспецифическая лабораторная диагностика
Для подтверждения диагноза ВИЧ-инфекции используют вирусологический, молекулярно-генетический (ПЦР) и серологические методы (ИФА) и ИБ.
Антитела к ВИЧ определяют через 2 нед с момента заражения. При регистрации первого положительного результата ИФА повторяют. После получения второго положительного ответа данную сыворотку крови направляют на исследование в территориальный центр профилактики и борьбы со СПИДом, где проводят ИБ, результаты которого оценивают как положительные, сомнительные или отрицательные.
При обнаружении в сыворотке крови пациента антител к любым двум или трем гликопротеинам оболочки ВИЧ (gp41, gp120 и gp160) одновременно пробы считают положительными. При отсутствии в сыворотке крови антител ко всем антигенам пробы оценивают как отрицательные. Если в крови обнаруживают антитела к одному гликопротеину ВИЧ или каким-либо другим его протеинам, пробы считают сомнительными, требующими проведения повторного исследования.
Выделение и идентификация культуры ВИЧ (вирусологический метод) используют в научных целях и в исключительно трудных для диагностики случаях.
Количественный анализ в ПЦР позволяет определить «вирусную нагрузку». В стадии первичных проявлений «вирусная нагрузка» составляет обычно несколько тысяч копий в 1 мл крови. В стадии вторичных заболеваний концентрация ВИЧ достигает сотен тысяч копий в 1 мл сыворотки крови и миллиона копий вируса в стадии IVВ.
Стойкая высокая концентрация ВИЧ на ранней стадии болезни - неблагоприятный прогностический признак, свидетельствующий о высокой вирулентности штамма.
Лечение
Госпитализацию больных ВИЧ-инфекцией осуществляют с учетом тяжести состояния и клинических данных, в зависимости от наличия вторичных или сопутствующих заболеваний.
Режим и диета
Режим и диету больным назначают соответственно установленным нозологическим формам.
Медикаментозная терапия
Этиотропная терапия
Современный арсенал лекарственных препаратов позволяет подавить репликацию ВИЧ у большей части больных, как правило, на довольно длительный срок и замедлить прогрессирование заболевания в стадию СПИД (табл. 9-8).
Факторы, учитываемые при решении вопроса о назначении антиретровирусных препаратов: степень иммунодефицита (оценивают на основании количества CD4+-лимфоцитов); риск прогрессирования болезни (определяют по уровню РНК ВИЧ в крови); готовность и желание пациента начать лечение; возраст пациента; наличие ко-инфекции ВИЧ/ХГB и/или ВИЧ/ХГC; наличие вторичных и сопутствующих заболеваний, нефропатии; эпидемиологические особенности (дискордантная пара, подготовка пациента к применению вспомогательных репродуктивных технологий), осведомленность пациента о возможных побочных эффектах препаратов и об изменении качества жизни; выбор стартовой терапии для достижения стойкого вирусологического ответа и сохранение максимального выбора комбинаций препаратов для последующего использования; фармакоэкономическая целесообразность выбора различных схем антивирусной терапии (АРВТ).
Перед началом АРВТ всех пациентов с ВИЧ-инфекцией осматривает терапевт, невролог, оториноларинголог и офтальмолог для определения противопоказаний к назначению тех или иных препаратов. Кроме того, больных, употреблявших ранее или применяющих постоянно психоактивные вещества, направляют на консультацию к наркологу. Всех пациентов с легочной патологией, особенно при неэффективности антибактериальной терапии, осматривает фтизиатр. Консультации других специалистов осуществляют по показаниям, в зависимости от выявленной патологии (вторичных или сопутствующих заболеваний), для определения объема дополнительных обследований или решения вопроса о переводе больного в узкоспециализированное отделение или стационар.
Для начала АРВТ существуют определенные показания. Разработаны различные схемы применения препаратов (схемы 1, 2 и 3-го ряда), составленные с учетом проведенных клинических исследований эффективности антиретровирусных препаратов (АРВП) (табл. 17-5, 17-6).
Возникновение мутантных штаммов вируса - одна из основных причин неэффективности АРВТ.
Принципы изменения режима АРВТ при неэффективности схемы первого ряда
Наиболее важными принципами выбора препаратов для новой схемы АРВТ при вирусологической неэффективности текущей схемы АРВТ являются следующие: проводить смену АРВТ по результатам теста на резистентность (AII); при наличии возможностей осуществлять замену препаратов внутри фармакологических групп (АII); включать в схему по крайней мере 2, а лучше 3 АРВП (принадлежащих к 2 фармакологическим группам), которые обладают активностью против данной популяции вируса по результатам проведенных тестов на резистентность; при оценке резистентных свойств вируса следует учитывать результаты всех тестов на резистентность и сведения обо всех принимавшихся ранее АРВП; устранить факторы, препятствовавшие адекватному ответу на прежнюю или текущую схему терапии; менять схему терапии по причине вирусологической неэффективности следует как можно быстрее во избежание накопления дополнительных мутаций резистентности, сужающих спектр активных АРВП для применения в будущем. Исключения составляют ламивудин и эмтрицитабин; не прерывать АРВТ, за исключением случаев тяжелых побочных эффектов; если АРВТ прервана, тест на резистентность назначается не позднее 2 нед перерыва; не ограничиваться добавлением еще одного АРВП к неэффективной схеме АРВТ.
| Клиническая картина | Количество СD4+-лимфоцитов (мкл-1) | Концентрация РНК ВИЧ в сыворотке (копий/мл) | Рекомендации |
|---|---|---|---|
Наличие вторичных и, особенно, СПИД-индикаторных заболеваний |
Любое значение |
Любое значение |
Начинают или продолжают лечение (AI) |
Активная форма туберкулеза |
Любое значение |
Любое значение |
Начинают или продолжают лечение (AIII) |
ХГB, если показано лечение |
Любое значение |
Любое значение |
Начать лечение (AII) |
ХГC |
≥500 |
Любое значение |
Начать АРТ (CIII), после повышения иммунного статуса присоединяют терапию ХГC |
≥500 |
Любое значение |
АРТ может быть отложена до завершения курса лечения ХГC |
|
Острая ВИЧ-инфекция |
Любое значение |
Любое значение |
Начать лечение (BIII), пожизненно |
ВИЧ-ассоциированная нефропатия |
Любое значение |
Любое значение |
Начать лечение (AII) |
Заболевания,требующие длительного приема терапии, угнетающей иммунитет |
Любое значение |
Любое значение |
Начать лечение (AIII) |
Беременность |
Любое значение |
Любое значение |
Начать (AII) или продолжить лечение |
Пациенты старше 60 лет с ВИЧ-ассоциированными нейрокогнитив ными расстройствами |
Любое значение |
Любое значение |
Начать лечение (BII) |
ВИЧ-инфицированному партнеру в дискордантной паре |
Любое значение |
Любое значение |
Начать лечение (AI) |
Подготовка ВИЧ-инфицированного пациента к применению вспомогательных репродуктивных технологий |
Любое значение |
Любое значение |
Начать лечение (AIII) |
Бессимптомное течение |
>500 мкл-1 |
≤100 000 |
Необходимость назначения АРТ обсуждают коллегиально. Можно начать АРТ при готовности пациента принимать терапию пожизненно. Назначают АРТ при быстром снижении СD4+ -лимфоцитов (>100 мкл-1/год) (АIII) |
≥100 000 |
Начать АРТ (BII). Назначают АРТ при быстром снижении СD4+-лимфоцитов (>100 мкл-1/год) (АIII). Необходимость назначения АРТ обсуждают коллегиально |
||
350-500 |
<100 000 |
Начать лечение (АII) |
|
≥100 000 |
Начать лечение (BII) |
||
≤350 |
Любое значение |
Начать лечение (AI) |
По одному препарату или комбинации из граф А и В (применяют предпочтительную категорию) |
||
Схемы выбора |
Графа А |
Графа В |
ННИОТ: эфавиренз, рилпивирин |
тенофовир и ламивудин, тенофовир и эмтрицитабин, абакавир и ламивудин (перед началом лечения необходимо провести скрининг HLA-B*5701) |
|
ИП: атазанавир/ритонавир, дарунавир/ритонавир, фосампренавир/ритонавир, лопинавир/ритонавир |
||
ИИ: ралтегравир |
||
Альтернативные схемы |
ННИОТ: невирапин |
зидовудин и ламивудин |
Другие препараты, используемые иногда в терапии 1-го ряда в качестве альтернативной схемы |
зидовудин/ламивудин/абакавир (перед началом лечения необходимо провести скрининг HLA-B*5701) |
|
Схемы лечения пациентов с множественной резистентностью к АРВП
Множественная резистентность к АРВП - это наличие резистентности к препаратам различных фармакологических групп. Лечение пациентов с таким видом резистентности представляет наиболее сложную задачу, требует повышенного внимания врача, даже при правильно интерпретированных результатах исследования резистентности вируса.
Рекомендуется индивидуальный режим наблюдения, более частый клинический и лабораторный мониторинг (BIII); назначение препаратов в соответствии с исследованием профиля резистентности вируса методом секвенирования генома; для лечения больных с множественной резистентностью к АРВП возможно назначение в одной схеме ИП и ННИОТ; ИП, ННИОТ и ИИ; двух ИП с соответствующей коррекцией доз; с учетом наименьшего риска мутаций в схемах лечения таких больных - дарунавир/ритонавир в дозировке 600/100 мг 2 р/сут (BII); в схемах лечения используются ингибиторы интегразы, ингибиторы слияния, АР; в целях быстрого подавления вирусной нагрузки рекомендуется введение в схему энфувиртида в качестве 3-го или 4-го компонента. По достижении вирусологической и иммунологической эффективности проводится переключение с энфувиртида на ралтегравир; симплификация схем лечения больным, у которых была зафиксирована резистентность к антивирусным препаратам, не допускается.
Принцип подхода к лечению пациентов с ВИЧ-инфекцией - пожизненное применение антиретровирусных препаратов.
При лечении больных ВИЧ-инфекцией немаловажную роль играет терапия вторичных и сопутствующих заболеваний. В большинстве случаев лечение таких болезней имеет приоритет перед началом АРВТ, поскольку тяжесть состояния пациента определяет наличие той или иной нозологии.
Лечение манифестной ЦМВИ: проводят 3-недельную терапию ганцикловиром в дозе 5 мг/кг 2 р/сут в/в медленно в течение часа или в дозе 900 мг 2 р/сут внутрь в течение 3 нед.
Лечение и вторичная профилактика активной ЦМВИ: валганцикловир внутрь по 900 мг 1 р/сут в течение 30 дней, по 5 мг/кг 1 р/сут в/в капельно в течение часа (менее предпочтительно).
Опоясывающий лишай: лечение проводят не менее 10 дней. Ацикловир по 800 мг 5 р/сут (внутрь) или по 750-1000 мг 3 р/сут (в/в), валацикловир по 1 г 3 р/сут (внутрь), фамцикловир по 500 мг 3 р/сут в течение 7-10 дней (внутрь).
Пневмоцистная пневмония: триметоприм/сульфаметоксазол, 5/25 мг/кг внутрь или в/в капельно каждые 6чв течение 28 сут. Альтернативная схема: клиндамицин в дозе 600-900 мг в/в каждые 6-8 ч. Первичная и вторичная профилактика пневмоцистной пневмонии (при уровне CD4+-лимфоцитов <200 мкл-1): триметоприм/сульфаметоксазол, 80/400 мг 2 р/сут через день до повышения количества CD4+-лимфоцитов ≥200 мкл-1. При непереносимости триметоприма/ сульфаметоксазола используют дапсон, 100 мг внутрь 1 р/сут. При рО2 <70 мм рт.ст. или альвеолярно-артериолярном градиенте по кислороду >35 мм рт.ст. назначается преднизолон 1 мг/кг с последующим уменьшением дозы, а также оксигенотерапия до повышения количества CD4+-лимфоцитов ≥200 мкл-1.
Токсоплазмоз (чаще диагностируют церебральную форму): пириметамин/сульфадоксин (25/500 мг), 200 мг (8 таблеток) из расчета по пириметамину в 1-й день, далее 50 мг (при массе тела <60 кг) или 75 мг (при массе тела >60 кг) в сутки в сочетании с фолинатом кальция (по 25 мг) в/м не менее 6 нед (до элиминации не менее 75% очагов на МРТ головного мозга). Альтернативная схема: триметоприм/сульфаметоксазол, 5/25 мг/кг внутрь или в/в капельно 2 р/сут не менее 6 нед (до элиминации не менее 75% очагов на МРТ головного мозга). Вторичная профилактика токсоплазмоза - половинные дозы лечебного курса в течение 6 мес после достижения уровня CD4+-лимфоцитов >200 мкл-1.
Саркома Капоши: АРТ - основной метод, позволяющий предотвратить прогрессирование заболевания и добиться клинического улучшения. При тяжелой форме саркомы Капоши, протекающей с вовлечением в патологический процесс внутренних органов, назначают проспидия хлорид в дозе 100 мг в/м в течение 30 сут; или доксорубицин липосомальный в дозе 20 мг/м2, повторяют через 2-3 нед; или даунорубицин липосомальный в дозе 40 мг/м2, повторяют через 2-3 нед.
Кандидозный стоматит: флуконазол 100 мг внутрь 1 р/сут до достижения клинического эффекта. Альтернативные схемы: нистатин в дозе 500 000 ЕД 5 р/сут, кетоконазол 200 мг внутрь 1 р/сут.
Кандидозный эзофагит: флуконазол в дозе 400 мг в 1-е сутки, далее 200 мг/сут внутрь в течение 2-3 нед. Альтернативные схемы: итраконазол 100-200 мг 2 р/сут в течение 2-3 нед, амфотерицин В 0,3-0,7 мг/кг/сут в/в капельно в течение 5-7 сут, вориконазол, с учетом рекомендуемой насыщающей дозы.
Криптококковая инфекция с поражением центральной нервной системы
Схема выбора.
Амфотерицин B [липидный комплекс] (Амфолип♠), амфотерицин B [холестерилсульфатный комплекс] (Амфоцил♠) 0,7 мг/кг в сутки в/в капельно в сочетании с 5-флуцитзиномρ внутрь по 100 мг/кг в сутки в течение 4-6 нед (индукционная схема). Затем назначают флуконазол в дозе 400 мг/сут в течение 2 мес или до санации ликвора. Заключительный этап - поддерживающая терапия флуконазолом (200 мг/сут) до повышения количества CD4+-лимфоцитов ≥200 мкл-1. Альтернативные схемы: амфотерицин В в дозе 0,7-1,0 мг/кг в сутки в/в в течение 2 нед в сочетании с флуконазолом внутрь по 400 мг/сут в течение 8-10 нед, итраконазол по 200 мг 2 раза в день в течение до 8 нед, флуконазол внутрь по 400-800 мг/сут в комбинации с 5-флуцитзиномρ внутрь по 100 мг/кг в сутки в течение 6-10 нед, используют амфотерицин В липосомальный по 4 мг /кг в сутки в/в капельно в течение 2 нед. Затем флуконазол по 400 мг/сут в течение 8-10 нед, вориконазол, с учетом рекомендуемой насыщающей дозы.
Микобактериальная инфекция
При лечении микобактериозов, обнаруженных у ВИЧ-инфицированных, назначают стандартные препараты и используют обычные схемы дозирования.
Особенности терапии микобактериальной инфекции у ВИЧ-инфицированных пациентов: при уменьшении количества CD4+-лимфоцитов (<100 мкл-1) пациентам назначают рифампицин или рифабутин не реже 3 раз в неделю, поскольку более редкий прием препаратов приводит к формированию резистентности возбудителя. Длительность лечения определяют индивидуально; при сильном снижении количества CD4+-лимфоцитов (<50 мкл-1) используют не менее 4 препаратов в течение 2 мес; затем оставляют 2 препарата (их применяют в течение 4,5 мес). Если при анализе мокроты после 2 мес лечения получают положительные результаты, то терапию проводят в течение последующих 7 мес; при обнаружении внелегочных форм туберкулеза назначают стандартные схемы лечения туберкулеза легких. Исключение составляют милиарный туберкулез, туберкулез костей и суставов, туберкулезный менингит (лечение проводят в течение 12 мес); нельзя одновременно начинать лечение туберкулеза и ВИЧ-инфекции вследствие наложения побочных эффектов используемых препаратов, неблагоприятных лекарственных взаимодействий, требований к соблюдению режима приема препаратов и вероятности парадоксальных реакций, связанных с восстановлением иммунной системы. АРВТ и противотуберкулезное лечение можно начинать одновременно при резком уменьшении CD4+-лимфоцитов до 50 мкл-1 (если пациент хорошо переносит противотуберкулезную терапию); не рекомендуют при проведении противотуберкулезной терапии использовать ИП и ННИОТ, за исключением эфавиренза, ритонавира и комбинации ритонавира и саквинавира.
Гепатит
Принципы лечения ХГC у больных ВИЧ-инфекцией соответствуют таковым у пациентов без ВИЧ-инфекции. Лечение ГC показано всем ВИЧ-инфицированным с ВИЧ/ХГC (при наличии РНК ВГC в крови).
Начальный этап противовирусной терапии ХГC у больных ВИЧ-инфекцией представлен в таблице (табл. 17-7).
Назначение иммуноглобулинов больным ВИЧ-инфекцией можно рассматривать как патогенетическую терапию. Показания к применению иммуноглобулинов: иммунодефицит (с заместительной целью), идиопатические тромбоцитопении с аутоиммунным механизмом развития (по 20 г белка в сутки), тяжелые бактериальные и вирусные вторичные и сопутствующие заболевания.
| Количество CD4+-лимфоцитов (мкл-1) | Принципы лечения ХГC и ВИЧ-инфекции |
|---|---|
<500 |
АРТ целесообразно провести до начала лечения ХГC, учитывая высокий риск возникновения оппортунистических инфекций, а также возможность снижения числа CD4+-лимфоцитов на фоне интерферонотерапии. Только после стабилизации ВИЧ-инфекции (то есть в отсутствие вторичных заболеваний, лечение которых является приоритетным), а также повышения уровня CD4+-лимфоцитов ≥200 мкл-1 и подавления РНК ВИЧ можно начать терапию ХГC |
≥500 |
Риск прогрессии инфекции невысок, и АРТ можно отсрочить. Наиболее предпочтительно начать лечение ХГC |
Дозы препаратов и курс лечения зависят от степени иммунодефицита, тяжести состояния пациента, а также препарата группы иммуноглобулинов.
Медико-социальная экспертиза
При проведении медико-социальной экспертизы ВИЧ-инфицированных учитывают выраженность клинических признаков заболевания (стадию ВИЧ-инфекции). Социальные причины - невозможность дальнейшего выполнения работы (например, хирург, стоматолог, акушер-гинеколог, реаниматолог, медицинский персонал, производящий парентеральные манипуляции, работники станции переливания крови и заводов биомедицинских препаратов, в профессиональные обязанности которых входит приготовление препаратов для парентерального введения) - основание для определения стойкой утраты трудоспособности.
В случае невозможности профессиональной переориентации указанных лиц может быть оформлена III группа инвалидности.
Вопросы временной нетрудоспособности решают, руководствуясь «Инструкцией о правилах экспертизы временной нетрудоспособности для застрахованных лиц», с последующими дополнениями и исправлениями.
Для определения степени стойкой утраты трудоспособности больных ВИЧ-инфекцией используют индекс Карновского.
Если индекс Карновского составляет 100-90%, то активность пациента полностью сохранена; способность пациента к напряженной физической работе ограничена (может выполнять легкую работу) при значении индекса 80-70%; если величина индекса Карновского не превышает 60-30%, то пациент способен передвигаться и ухаживать за собой, но не может работать (лежит или сидит менее 50% периода бодрствования); ограничение способности ухаживать за собой, пациент лежит или сидит более 50% времени бодрствования - значение индекса составляет 40-30%; индекс Карновского не превышает 20-10%; при этом больной полностью обездвижен и не может ухаживать за собой.
В течение стадии первичных клинических проявлений ВИЧ-инфекции (стадии II и III) трудоспособность пациентов полностью сохранена (индекс Карновского - 90-100%).
На стадии вторичных заболеваний (стадия IVА) трудоспособность больных также сохранена полностью (индекс Карновского - 90-100%). Вместе с тем у некоторых пациентов отмечают развитие стойких астенических расстройств и формирование психоорганического синдрома; это приводит к снижению способности к трудовой деятельности в полном объеме (индекс Карновского - 70-80%). В таком случае, учитывая характер профессиональной деятельности, рекомендуют оформить больному III группу инвалидности.
На более поздних стадиях ВИЧ-инфекции (стадия IVБ) отмечают учащение рецидивов вторичных заболеваний и возникает необходимость в госпитализации (неоднократно) большинства больных, что приводит к стойкой утрате трудоспособности (индекс Карновского - 50-80%). В таком случае пациента переводят на II или III группу инвалидности. Исключение составляют стойкие поражения ПНС с выраженными нарушениями двигательных функций (индекс Карновского составляет 10-40%). Пациенту оформляют I группу инвалидности.
На стадии вторичных заболеваний (стадия IVВ) у всех больных обнаруживают стойкое нарушение трудоспособности (индекс Карновского - 10-50%). В зависимости от характера и тяжести поражений рекомендуют устанавливать I или II группу инвалидности.
Диспансеризация
В Российской Федерации Федеральным законом от 30 марта 1995 г. № 38-ФЗ «О предупреждении распространения в Российской Федерации заболевания, вызываемого вирусом иммунодефицита человека (ВИЧ-инфекции)» закреплены принципы: бесплатного лекарственного обеспечения больных ВИЧ-инфекцией в амбулаторных условиях; запрета дискриминации при оказании медицинской помощи в специализированных и неспециализированных медицинских организациях в равной степени частной и государственной систем здравоохранения (ст. 14 Федерального закона № 38-ФЗ).
С принятием Федерального закона от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» медицинская помощь и лекарственное обеспечение осуществляются в соответствии с порядками и стандартами оказания медицинской помощи по профилю соответствующего заболевания.
С целью организации медицинской помощи больным ВИЧ-инфекцией и для увеличения продолжительности и улучшения качества их жизни, а также для проведения противоэпидемических мероприятий необходимо обеспечить максимальный охват диспансерным наблюдением ВИЧ-инфицированных пациентов.
Все обследования ВИЧ-инфицированного пациента выполняют только после получения добровольного информированного согласия. Рекомендуют активно приглашать ВИЧ-инфицированных пациентов на периодические обследования, но при этом нельзя нарушать права людей на отказ от обследования и лечения. Пациент также имеет право на выбор медицинского учреждения.
При постановке ВИЧ-инфицированного пациента на диспансерный учет необходимо ознакомить его с алгоритмом и целью диспансерного наблюдения, графиком посещения лечащего врача и узких специалистов, возможностью выполнения лабораторных и инструментальных исследований. При этом необходимо согласие пациента на проведение диспансерного наблюдения (или отказ от медицинской помощи) в письменном виде.
Мероприятия, проводимые при первичном обследовании: осмотр лечащего врача (консультирование, сбор анамнеза, полное физикальное обследование); регистрация вторичных заболеваний, их динамики и течения; регистрация сопутствующих заболеваний; оценка качества жизни пациента (по шкале Карновского); рентгенография органов грудной клетки (если исследование не выполняли в течение последних 6 мес); УЗИ органов брюшной полости (печень, желчный пузырь, поджелудочная железа) и почек; ЭКГ; консультация офтальмолога (исследуют глазное дно); консультация оториноларинголога (исследуют остроту слуха и состояние вестибулярной функции); консультация невропатолога; консультация стоматолога; консультация гинеколога (для женщин); консультация терапевта; исследование сыворотки или плазмы крови на антитела к ВИЧ с помощью стандартных лабораторных технологий; общий анализ крови; биохимический анализ крови (креатинин и мочевина, активность АЛТ, АСТ, ЩФ, ЛДГ, КФК, амилазы или липазы, билирубин и его фракции, глюкоза, общий белок и фракции, общий холестерин и его фракции); общий анализ мочи; определения маркеров ВГB, ВГC; серологический анализ - для обнаружения маркеров сифилиса, антител к ЦМВ, токсоплазме, ВПГ, Р. jirovecii; исследование кала на яйца глистов и на простейших; посев для диагностики сальмонеллеза; проба с туберкулином или диаскин-тест с консультацией врача-фтизиатра; определение показателей иммунного статуса; ПЦР для определения концентрации РНК ВИЧ в сыворотке крови.
Повторные плановые обследования проводят для своевременного выявления показаний к назначению АРТ (или для ее коррекции). Объем планового повторного обследования зависит от стадии болезни и уровня CD4+-лимфоцитов.
Сроки проведения первичных и повторных осмотров осуществляются согласно «Стандарту специализированной медицинской помощи при болезни, вызванной вирусом иммунодефицита человека (ВИЧ-инфекции)», утвержденному приказом Минздрава России от 9 ноября 2012 г. № 758н и «Стандарту первичной медико-санитарной помощи при болезни, вызванной вирусом иммунодефицита человека (ВИЧ-инфекцией)», утвержденному приказом Минздрава России от 24 декабря 2012 г. № 1511н.
Консультации врача-инфекциониста больных ВИЧ-инфекцией, не получающих АРТ, осуществляются 2 раза в год, при проведении АРТ - 4 раза в год; узких специалистов (гинеколог, невролог, оториноларинголог, офтальмолог, терапевт) - при постановке на учет; далее эти специалисты, а также другие узкие специалисты консультируют больных при наличии показаний.
Рентгенографию (или флюорографию) органов грудной клетки и диаскин-тест необходимо выполнять 2 раза в год, УЗИ органов брюшной полости и почек - 1 раз в год или чаще при наличии показаний. Исследование головного мозга с помощью метода КТ или МРТ рекомендуют выполнять по показаниям при резком снижении количества CD4+-лимфоцитов (<200 мкл-1).
Внеплановые обследования необходимо проводить при обнаружении любых признаков прогрессирования ВИЧ-инфекции или при развитии сопутствующих заболеваний. По решению лечащего врача выполняют дополнительные исследования.
Прогноз
Прогноз заболевания, вызванного ВИЧ, в целом неблагоприятный, поскольку препараты, приводящие к полной элиминации вируса, отсутствуют. Внедрение АРТ позволило резко уменьшить число летальных исходов и значительно увеличить продолжительность и качество жизни ВИЧ-инфицированных.
Тактика проведения диагностических и лечебных мероприятий по оказанию медицинской помощи при ВИЧ у взрослого населения, представлена в табл. 17-8-17-10.
| Консультация специалиста или диагностическое исследование | Кратность выполнения процедуры | Цель консультации или исследования | Мероприятия | Примечания |
|---|---|---|---|---|
Консультация инфекциониста |
Четыре раза в год или чаще при наличии показаний |
Сбор анамнеза и жалоб |
При отсутствии негативных клинических и параклинических изменений рекомендуют диспансерное наблюдение не менее 2 раз в год. При наличии клинических показаний (длительная лихорадка, выраженная интоксикация, недостаточность функций основных органов и систем организма, наличие активной фазы установленного заболевания и пр.) показана госпитализация в стационар, в том числе специализированный, по профилю установленного заболевания |
При наличии показаний (по рекомендации нарколога) пациента направляют на лечение в территориальный наркологический диспансер или наркологический стационар. Диспансеризацию больных проводят в территориальном центре профилактики и борьбы со СПИДом и/или в KИЗ территориальной поликлиники, а также врачами-специалистами по профилю выявленных вторичных и сопутствующих заболеваний |
Проведение общего осмотра |
||||
Консультация гинеколога (для женщин) |
Один раз в год или чаще при наличии показаний |
Получение влагалищного и цepвикaльнoгo мазков |
||
Консультация нарколога. Консультация психиатра |
По показаниям и/или при наличии в анамнезе данных об употреблении психоактивных веществ или алкоголя |
Сбор наркологического анамнеза, выявление жалоб. Определение тактики лечения алкоголизма/ наркомании |
||
ИФА ИБ |
Согласно Стандарту первичной медико-санитарной помощи при болезни, вызванной ВИЧ |
Обнаружение антител к ВИЧ/белковых антигенов ВИЧ в сыворотке крови |
||
Общий анализ крови |
При первичном обращении, перед началом или изменением APBT, через 2 и 4 нед после начала или изменения APBT, далее - по мере необходимости, но не реже 2 раз в год до начала APBT и не реже 3 раз в год на фоне проводимой APBT |
Рутинное исследование |
||
Общий анализ мочи |
При первичном обращении, перед началом или изменением APBT, через 4 нед после начала или изменения APBT, далее - по мере необходимости, но не реже 3 раз в год на фоне проводимой APBT |
Рутинное исследование |
||
Биохимический общетерапевтический анализ крови (натощак) |
При первичном обращении, перед началом или изменением APBT, через 2 и 4 нед после начала или изменения APBT, далее - по мере необходимости, но не реже 2 раз в год до начала APBT и не реже 3 раз в год на фоне проводимой APBT |
Рутинное исследование |
||
Иммунный статус |
При постановке на учет |
Оценка клеточного и гуморального иммунитета |
||
До начала или изменения APBT |
||||
Каждые 3-6 мес до APBT |
||||
Каждые 3-4 мес на фоне проводимой APBT |
||||
При отсутствии эффекта APBT |
||||
Клинические показания |
||||
РНК ВИЧ |
При постановке на диспансерный учет |
Определение концентрации РНК ВИЧ |
||
До начала или изменения APBT |
||||
Каждые 3-12 мес до APBT |
||||
Через 2 и 4 нед после начала или изменения APBT |
||||
Каждые 3-4 мес на фоне проводимой APBT |
||||
Отсутствие эффекта APBT |
||||
Клинические показания |
||||
Серологические исследования на гепатиты HBsAg, Aнти-HBcor IgG, aнти-HCV IgG |
При постановке на учет |
Определение поверхностного антигена ГB |
||
Диcпaнcepнo 1 раз в год, исследование не повторяют, если имеется предыдущий положительный результат |
Определение антител к антигенам HCV |
|||
По клиническим показаниям |
||||
Серологическое исследование на тoкcoплaзмoз |
При постановке на учет и при подозрении на тoкcoплaзмoз |
Определение антител к Т. gondii |
APT показана, но приоритетным является лечение тoкcoплaзмoзa |
|
Moлeкyляpнo-биoлoгичecкoe исследование, ЦMB |
По клиническим показаниям |
|||
Серологическое исследование на сифилис |
При постановке на учет |
Определение антител к Т. pallidum |
||
Диcпaнcepнo 1 раз в год |
||||
По показаниям |
||||
Диacкин-тecт |
Диcпaнcepнo 2 раза в год |
Выявление инфицированных туберкулезом в группах высокого риска |
APBT показана на основании общих критериев, однако лечение туберкулеза является приоритетным |
Проводят в территориальном противотуберкулезном диспансере или во фтизиатрических кабинетах территориальных центров профилактики и борьбы со СПИДом |
При подозрении на туберкулез |
||||
УЗИ органов брюшной полости и почек |
Диcпaнcepнo 1 раз в год |
Диагностика вторичных и сопутствующих заболеваний |
Перед началом APT необходимо провести дополнительное обследование |
|
По показаниям |
||||
Рентгенография или флюорография органов грудной клетки |
При постановке на учет |
|||
Диcпaнcepнo 2 раз в год |
||||
По показаниям |
||||
ЭКГ |
Диcпaнcepнo 1 раза в год |
|||
По показаниям |
||||
| Методы лечения и группы используемых ЛC | Цель лечения | Диспансеризация | Примечание |
|---|---|---|---|
Средства для лечения и профилактики инфекций (антибактериальные, фyнгицидныe, противовирусные, aнтипpoтoзoйныe, aнтигeльминтныe и противотуберкулезные препараты) |
Увеличение продолжительности жизни. Улучшение качества жизни. Максимально возможное снижение вирусной нагрузки в течение длительного времени; в течение месяца ожидают адекватный вирусологический ответ (цель - добиться снижения уровня вирусной нагрузки до неопределяемого уровня в зависимости от чувствительности методики). Восстановление иммунной системы - ожидают увеличения количества CD4+ - лимфoцитoв на ≥50 мкг1 за 24 нeд (6 мec) после начала или изменения APT. Возможно дополнительное ежегодное увеличение количества CD4+-лимфoцитoв. Сохранение возможности использования широкого спектра aнтиpeтpoвиpycныx препаратов. Максимальное снижение риска развития побочных эффектов и токсического действия препаратов и облегчение режима лечения. Сохранение трудоспособности пациента на максимально длительный срок |
После выписки из стационара больных направляют в Центр профилактики и борьбы со СПИДом (по месту регистрации или в KИЗ территориальных поликлиник) |
При госпитализации пациента приоритетной задачей считают лечение вторичных и сопутствующих заболеваний (даже при наличии показаний к APBT). APBT следует начинать в стационаре только при наличии показаний и хорошей переносимости препаратов для лечения сопутствующих заболеваний, а также при отсутствии противопоказаний к началу лечения (продолжительность госпитализации пациента составляет месяц и более). При одновременном лечении сопутствующих или вторичных заболеваний и ВИЧ-инфекции следует учитывать лекарственные взаимодействия препаратов и корректировать дозы при развитии той или иной органной недостаточности. Aмбyлaтopнo-пoликлиничecкyю помощь осуществляют после выписки из стационара. Эпизодическое повышение уровня вирусной нагрузки от 50 до 200 копий/мл не означает вирусологической неудачи; это не основание для изменения терапии (если значение вирусной нагрузки возвращается к неопределяемому уровню). В 20% случаев отмечают paзнoнaпpaвлeннocть ожидаемых изменений между количеством CD4+ - лимфoцитoв и уровнем вирусной нагрузки |
APBT (по показаниям) |
|||
Средства для лечения неопластических процессов |
|||
Симптоматические средства |
|||
Дополнительное специфическое медикаментозное лечение - иммyнoкoppeктopы (иммуноглобулин человеческий нормальный) и стимуляторы кроветворения |
| Дополнительные медицинские манипуляции | Кратность выполнения и причина | |
|---|---|---|
Лабораторная диагностика |
Коагулограмма |
По клиническим показаниям |
Определение маркеров прочих ВГ |
||
Посев крови на стерильность |
||
Посев мокроты на флору |
||
Посевы биологических сред на флору и определение чувствительности к антибиотикам |
||
Микроскопия мокроты (с окраской по Граму и Цилю-Нильсену) |
||
Определение ДНК ЦМВ методом ПЦР |
||
Инструментальная диагностика |
УЗИ органов малого таза, ЛУ, крупных сосудов, сердца |
По клиническим показаниям |
КТ, МРТ, ПЭТ КТ |
||
ЭГДС |
||
Биопсия ЛУ, печени и других органов |
||
Фибробронхоскопия |
||
Спинномозговая пункция |
||
Процедуры, выполняемые перед назначением АРВТ |
Консультации невролога, офтальмолога, оториноларинголога, нарколога, терапевта, при необходимости эндокринолога, нефролога и гематолога |
При первичном обращении пациента, затем по клиническим показаниям |
Определение уровня лактата в сыворотке крови |
Только при наличии симптомов лактатацидоза |
|
Определение натощак общего уровня холестерина, липопротеинов высокой и низкой плотности, триглицеридов, содержания глюкозы крови (натощак) |
При первичном обращении пациента, затем каждые 3-6 мес на фоне АРВТ и по клиническим показаниям |
|
Резистентность к препаратам (генотипирование) |
До начала или изменения АРВТ и по показаниям |
|
Грипп
Грипп (Grippus, Influenza) - острая инфекционная болезнь с аэрозольным механизмом передачи возбудителя, характеризующаяся массовым распространением, кратковременной лихорадкой, интоксикацией и поражением респираторного тракта.
Коды по МКБ-10
J10 Грипп, вызванный идентифицированным вирусом гриппа.
J11 Грипп, вирус не идентифицирован.
Этиология
Возбудители гриппа - РНК-содержащие вирусы семейства Ortho-myxoviridae (включает род Influenzavirus), содержащего вирусы 3 серо-типов: А, В и С. Диаметр вирусной частицы 80-120 нм. Вирион сферической формы (реже нитевидный). В центре вириона расположен нуклеокапсид. Геном представлен однонитевой молекулой РНК, имеющей у серотипов А и В по 8 сегментов и 7 сегментов у серотипа С. Капсид состоит из нуклеопротеина (NP) и белков полимеразного комплекса (P), окружен слоем матриксных и мембранных белков (М). Снаружи от этих структур расположена наружная липопротеиновая оболочка, несущая на своей поверхности сложные белки (гликопротеины): гемагглютинин (Н) и нейраминидазу (N). Поверхностные антигены - гемагглютинин и нейраминидаза - определяют подтип вируса и индуцируют продукцию специфических защитных антител.
Для вирусов серотипа А характерна постоянная изменчивость поверхностных антигенов, причем изменения Н- и N-антигенов происходят независимо друг от друга. Известно 15 подтипов гемагглютинина и 9 - нейраминидазы. Вирусы серотипа В более стабильны (выделяют 5 подтипов). Антигенная структура вирусов серотипа С не подвержена изменениям, нейраминидаза у них отсутствует. Необычайная изменчивость вирусов серотипа А обусловлена двумя процессами: антигенным дрейфом (точечные мутации в сайтах генома, не выходящие за пределы штамма) и антигенным шифтом (полное изменение структуры антигена с образованием нового штамма). Причина антигенного шифта - замена целого сегмента РНК в результате обмена генетическим материалом между вирусами гриппа человека и животных. Согласно современной классификации вирусов гриппа, предложенной ВОЗ в 1980 г., принято описывать серотип вируса, его происхождение, год выделения и подтип поверхностных антигенов. Например, вирус гриппа А, Москва/10/99/Н3 N2. Вирусы серотипа А обладают наиболее высокой вирулентностью и имеют наибольшее эпидемиологическое значение. Их выделяют от человека, животных и птиц. Вирусы серотипа В выделяют только от людей; по вирулентности и эпидемиологической значимости они уступают вирусам серотипа А. Вирусам гриппа С присуща низкая репродуктивная активность. В окружающей среде устойчивость вирусов средняя. Они чувствительны к высоким температурам (более 60 °С), действию ультрафиолетового излучения и жирорастворителей, однако некоторое время сохраняют вирулентные свойства при низких температурах (в течение недели не погибают при температуре 40 °С). Чувствительны к табельным дезинфектантам.
Эпидемиология
Основной источник вируса - больной гриппом человек с клинически выраженным или стертым течением болезни. Эпидемиологическая значимость больного человека определяется количеством вируса в отделяемом ВДП и выраженностью катарального синдрома. В инкубационном периоде заболевания рассеивание вирусов неинтенсивное. Отсутствие катаральных симптомов ограничивает распространение вирусов в окружающей среде (поэтому эпидемиологическая опасность больного незначительна). Больные дети с тяжелым течением болезни - наиболее интенсивный источник вируса. Однако они представляют меньшую эпидемиологическую опасность, чем взрослые с легким течением болезни, которые сохраняют активность и имеют множественные контакты дома, в транспорте и на работе. После 7 сут болезни выделить вирус от больного в большинстве случаев не удается. Длительное выделение вируса возможно у больных с тяжелым и осложненным течением заболевания. При определенных условиях вирусы серотипов Н1N1, Н2N2 и Н3N2 могут выделяться от больных в течение 3-4 нед, а вирусы гриппа В - до 30 сут. Остаточные катаральные явления в дыхательных путях способствуют передаче возбудителя окружающим, поэтому реконвалесценты могут служить источником вируса в здоровых коллективах. Источником вируса могут быть также лица с инаппаратным течением инфекционного процесса и транзиторные вирусоносители.
50-80% взрослых людей, инфицированных вирусами гриппа, не обращаются за медицинской помощью.
Механизм передачи вируса - аэрозольный. Путь передачи - воздушно-капельный. Возможно заражение через предметы, загрязненные выделениями больного (игрушки, посуду, полотенца и др.). Вирус сохраняет свою вирулентность в жилых помещениях в течение 2-9 ч. С уменьшением относительной влажности воздуха срок выживания вируса при повышении температуры воздуха до +32 °С уменьшается до 1 ч.
Восприимчивость людей к гриппу высокая. В связи с широким распространением гриппа, у новорожденных выявляют специфичные к вирусу гриппа антитела, полученные от матери через плаценту и молоко, обусловливающие временную резистентность. Титры противовирусных антител в крови ребенка и матери практически одинаковы. Материнские антитела к вирусу гриппа выявляют у детей, получающих грудное молоко, до 9-10 мес жизни (однако титр их постепенно снижается), а при искусственном вскармливании - только до 2-3 мес. Пассивный иммунитет, полученный от матери, - неполноценный, поэтому при вспышках заболевания в родильных домах заболеваемость у новорожденных выше, чем среди их матерей. Постинфекционный иммунитет типоспецифичен: при гриппе А сохраняется не менее трех лет, при гриппе В - 3-6 лет.
Для гриппа характерно эпидемическое, а нередко и пандемическое распространение в относительно короткие сроки.
Меры профилактики
Специфические. Для специфической профилактики гриппа используют инактивированные гриппозные вакцины, которые состоят из цельных (цельновирионные вакцины) или расщепленных вирионов (сплит-вакцины), а также из смеси поверхностных вирусных белков - гемагглютинина и нейраминидазы (субъединичные вакцины). Антигенный состав вакцин ежегодно корригируется на основании рекомендаций ВОЗ, под эгидой которой производится постоянный мониторинг антигенного состава циркулирующих штаммов вируса гриппа. Вакцинацию проводят в осенне-зимний период. Защитный эффект сохраняется не менее года. Вакцинация снижает уровень заболеваемости и способствует более легкому неосложненному течению болезни. Рекомендуются следующие вакцины: вакцина для профилактики гриппа [инактивированная] + азоксимера бромид (Гриппол♠, Гриппол плюс♠), вакцина для профилактики гриппа [инактивированная] (Ваксигрип♠, Инфлювак♠, Флюарикс♠, Флюваксин♠, Бегривак♠, Агриппал S1♠), вакцина гриппозная субъединичная инактивированная виросомальная (Инфлексал V♠).
Неспецифические: изоляция пациентов, оказание врачебной помощи на дому при появлении эпидемических вспышек. На время эпидемии в стационарах отменяют визиты к больным, ограничивают посещение детьми зрелищных мероприятий. Лица, находящиеся в постоянном контакте с больным, должны носить 4-слойные марлевые повязки (маски) как в больницах, так и в домашних условиях.
Для неспецифической профилактики применяют препараты ИФН (Гриппферон♠, Гриппферон♠ с лоратадином), индукторы ИФН и химиопрепараты [римантадин, осельтамивир, умифеновир (Арбидол♠)].
Применяют методы и средства, предупреждающие заражение (адаптогены, витамины, закаливание).
Необходимо проветривать помещение, где находятся больные. Рекомендовано ультрафиолетовое облучение и влажная обработка помещений 0,2-0,3% раствором хлорамина Б или другими дезинфицирующими средствами. Белье, полотенца и носовые платки больных необходимо кипятить, а полы и мебель следует обрабатывать дезинфицирующими растворами.
Патогенез
Попадая в организм, вирус гриппа репродуцируется в цитоплазме клеток цилиндрического эпителия слизистой оболочки дыхательных путей. Репликация вируса происходит в течение 4-6 ч, чем объясняется короткий инкубационный период. Пораженные вирусом гриппа клетки дегенерируют, некротизируются и отторгаются. Инфицированные клетки начинают вырабатывать и выделять ИФН, препятствующий дальнейшему распространению вируса. Защите организма от вирусов способствуют неспецифические термолабильные В-ингибиторы и секреторные антитела класса IgA. Метаплазия цилиндрического эпителия снижает его защитную функцию. Патологический процесс охватывает ткани, выстилающие слизистые оболочки и сосудистую сеть. Эпителиотропность вируса гриппа клинически выражена в виде трахеита, но поражение может затрагивать крупные бронхи, иногда гортань или глотку. Уже в инкубационном периоде выражена вирусемия, продолжающаяся около 2 сут. Клинические проявления вирусемии - токсические и токсико-аллергические реакции. Такое действие оказывают как вирусные частицы, так и продукты распада эпителиальных клеток. Интоксикация при гриппе обусловлена в первую очередь накоплением эндогенных биологически активных веществ (простагландина Е2, серотонина, гистамина). Установлена роль свободных радикалов кислорода, поддерживающих воспалительный процесс, лизосомальных ферментов, а также протеолитической активности вирусов в реализации их патогенного действия.
Важное звено патогенеза - поражение кровеносной системы. Изменениям в большей степени подвержены сосуды микроциркуляторного русла. Вследствие токсического действия вируса гриппа и его компонентов на сосудистую стенку повышается ее проницаемость, что обусловливает появление у больных геморрагического синдрома. Повышение сосудистой проницаемости и повышенная «ломкость» сосудов приводят к отеку слизистой оболочки дыхательных путей и легочной ткани, множественным кровоизлияниям в альвеолы и интерстиций легких, а также практически во все внутренние органы.
Нарушение циркуляции крови, вызванное поражением сосудов, играет важную роль в поражении ЦНС и вегетативной нервной системы. Влияние вируса на рецепторы сосудистого сплетения желудочков мозга способствует гиперсекреции СМЖ, внутричерепной гипертензии, повышению проницаемости ГЭБ, ОНГМ. Высокая васкуляризация в области гипоталамуса и гипофиза, осуществляющих нейровегетативную, нейроэндокринную и нейрогуморальную регуляцию, обусловливает возникновение комплекса функциональных расстройств нервной системы.
В остром периоде заболевания развивается симпатикотония, приводящая к гипертермии, сухости и бледности кожного покрова, учащению пульса. При снижении токсикоза отмечают признаки возбуждения парасимпатического отдела вегетативной нервной системы: заторможенность, сонливость, снижение температуры тела, урежение пульса, падение АД, мышечную слабость, адинамию (астеновегетативный синдром).
Значительная роль в патогенезе гриппа и его осложнений, а также в развитии воспалительных изменений дыхательных путей принадлежит бактериальной микрофлоре, активация которой способствует повреждению эпителия и развитию иммуносупрессии. Пролонгирование катарально-респираторного синдрома может быть связано с коинфекцией другими респираторными вирусами и бактериальной флорой.
Клиническая картина
Инкубационный период от 10-12 ч до 9 сут.
Классификация
Выделяют неосложненный грипп; осложненный грипп.
По тяжести течения: легкое; средней тяжести; тяжелое.
Иногда выделяют молниеносное течение заболевания. Тяжесть неосложненного гриппа определяется выраженностью и продолжительностью интоксикации.
Основные симптомы и динамика их развития
Болезнь начинается остро. Появляются чувство разбитости, ломота в мышцах и суставах, познабливание. Температура может повышаться в диапазоне от субфебрильной до гипертермического уровня в течение нескольких часов, достигая максимума к концу 1-х суток заболевания. Уровень лихорадки отражает выраженность интоксикации, но полностью отождествлять эти понятия нельзя. Иногда при высокой температуре признаки интоксикации выражены слабо. Длительность лихорадочного периода - 2-5 сут, редко до 6-7 сут, затем температура литически снижается.
Головная боль - основной признак интоксикации и один из первых симптомов заболевания. Она обычно локализована в лобной части, особенно в области надбровных дуг, иногда носит ретроорбитальный характер. У пожилых людей головная боль часто диффузная. Выраженность ее варьирует, но в большинстве случаев умеренная. Сильная головная боль в сочетании с бессонницей, галлюцинациями, многократной рвотой возникает у больных с тяжелым течением заболевания, нередко сопровождаясь менингеальным синдромом. У взрослых, в отличие от детей, судорожный синдром развивается редко. Во время мучительного сухого кашля, сочетающегося с рвотой, появляются сильные боли в верхних отделах прямых мышц живота и межреберных мышцах на линии прикрепления диафрагмы к грудной клетке.
Катаральный синдром - второй ведущий синдром при гриппе (у большинства больных представлен трахеитом), но часто отступает на второй план. В ряде случаев этот синдром выражен слабо или отсутствует, особенно при заболевании в теплое время года. Длительность проявления катарального синдрома - 7-10 сут, дольше всего сохраняется кашель. Слизистая оболочка носоглотки сухая, гиперемированная, отечная. Набухание носовых раковин затрудняет дыхание. Ринорея в первые дни скудная или отсутствует, позднее появляются серозные, слизистые или сукровичные выделения из носа. С первого дня болезни появляются першение и сухость за грудиной. Слизистая задней стенки глотки гиперемированная и сухая.
Тоны сердца приглушены, иногда выслушивается систолический шум на верхушке. У трети больных имеется относительная брадикардия, у 60% пациентов пульс соответствует температуре тела. Иногда выявляют тахикардию. Стойкая тахикардия в разгар болезни прогностически неблагоприятна, особенно у лиц старших возрастных групп. У больных гриппом выявляют снижение АД. У пациентов с гипертонической болезнью в периоде реконвалесценции возможно развитие гипертонического криза. После эпидемии гриппа возрастает смертность от острого нарушения мозгового кровообращения и инфаркта сердца среди пациентов группы риска (атеросклероз, ИБС, гипертоническая болезнь).
Язык густо обложен белым налетом, не утолщен. Аппетит снижен. Диспепсический синдром на фоне лихорадки и интоксикации обычно обусловлен наличием другой кишечной инфекции вирусной (ротавирусы, норавирусы) или бактериальной этиологии. Сыпи при гриппе не бывает, печень и селезенка не увеличены. Нарушения мочеотделения при неосложненной форме гриппа не возникают.
При неосложненном гриппе характерны лейкопения с нейтропенией, а также относительный лимфоцитоз и моноцитоз. СОЭ у большинства больных нормальная. При рентгенологическом исследовании легких в остром периоде заболевания выявляют усиление сосудистого рисунка.
Осложнения
Пневмония - одно из частых осложнений гриппа, относится к первичным вирусно-бактериальным (чаще всего стрептококковой и стафилококковой этиологии), чаще развивается у пациентов группы «высокого риска»: с хроническими заболеваниями легких и сердца, лиц пожилого возраста. Постгриппозные пневмонии развиваются в конце 1-й - начале 2-й недели болезни. Антибактериальное лечение дает хорошие результаты. Пневмонии могут иметь как интерстициальный, так и очаговый характер. Постгриппозные пневмонии опасны для лиц старших возрастных групп.
Молниеносная форма болезни может закончиться смертью на 2-3-и сутки (развивается острый геморрагический отек легких на фоне резкой интоксикации). С первых часов возникает высокая лихорадка, быстро нарастают одышка и цианоз. Появляется кровянистая, иногда пенистая мокрота. На рентгенограммах выявляют очаги затемнения округлой или неправильной формы. Приглушение перкуторного звука отсутствует или выражено незначительно. В последующие дни на фоне высокой температуры и резкой одышки нарастает ДН, развиваются гипоксическая кома и коллапс.
Тяжелое осложнение гриппа - ОНГМ. Для него характерны: сильная головная боль, рвота, судороги, оглушенность, потеря сознания, повышение АД, одышка, тахикардия, менингеальный синдром, застойные явления на глазном дне.
Частые осложнения гриппа - синуситы и отиты; реже - пиелонефрит и пиелоцистит. Возможны диэнцефальный синдром, менингоэнцефалит и астеновегетативный синдром. На тяжесть течения и исход болезни оказывает влияние сопутствующая хроническая патология.
Летальность и причины смерти
В период крупных эпидемий летальность не превышает 1-2%. Причиной смерти при тяжелой форме гриппа могут быть: отек мозга, геморрагический отек легких, острая сосудистая недостаточность, пневмония.
Диагностика основана на выявлении типичных проявлений заболевания (интоксикации, катарального синдрома преимущественно в виде трахеита).
Для быстрой диагностики гриппа применяют метод иммунофлюоресценции (выявляют антигены вируса в мазках и отпечатках из носа). Для постановки окончательного диагноза необходимо выделить возбудитель из полученного от больного клинического материала путем заражения культур клеток или куриных эмбрионов и провести идентификацию выделенного вируса. Ретроспективно диагноз устанавливают по увеличению титра антител в парных сыворотках крови больных.
Дифференциальная диагностика
Дифференциальную диагностику при гриппе проводят с двумя группами инфекционных заболеваний: протекающими с катарально-респираторным синдромом и характеризующимися ранним развитием лихорадочно-интоксикационного синдрома.
В 1-ю группу входят другие ОРВИ, при которых (в отличие от гриппа) кашель, насморк, боль и першение в горле предшествуют повышению температуры и не сопровождаются общими симптомами интоксикации (отсутствуют или возникают на 2-3-и сутки течения заболевания, выражены умеренно, однако могут длиться дольше, чем при гриппе). Сочетание лихорадки, интоксикации и ЛАП с катаральными явлениями позволяет исключить грипп и предположить наличие кори, иерсиниоза или ИМ. Поскольку при гриппе органы пищеварения в патологический процесс не вовлекаются, это позволяет исключить данное заболевание при сочетании лихорадки и катаральных явлений с диспепсическим синдромом. В этом случае возможно наличие вирусных диарей (ротовирусных, норавирусных), а также иерсиниоза или кори у взрослых.
Для многих острых форм инфекционных болезней в первые 1-2 сут характерна гриппоподобная клиническая картина. При этом следует учитывать отличительные особенности гриппа: сильный озноб выявляют редко, пик интоксикации на 1-2-е сутки течения заболевания, ЛАП, увеличения селезенки и печени никогда не наблюдается; со 2-3-х суток выражен трахеит, длительность лихорадки (при неосложненной форме) - 3-4 сут (не более 5-6 сут), характерна относительная брадикардия или соответствие частоты сердечных сокращений уровню температуры тела.
На практике грипп ошибочно диагностируют при стрептококковых заболеваниях (скарлатине, ангине, роже), внебольничной пневмонии (до появления характерных симптомов), менингококковой инфекции, малярии, пиелите, риккетсиозах, брюшном тифе и сальмонеллезе (до появления диспепсического синдрома), лептоспирозе (в теплое время года), ВГA, ГЛ, трихинеллезе.
В сложных для диагностики случаях врач должен оценить тяжесть состояния больного, необходимость и сроки повторного осмотра или экстренной госпитализации. При этом следует избегать назначения антибиотиков и жаропонижающих ЛС, поскольку они могут существенно затруднить дальнейшую диагностику и создать иллюзию улучшения состояния больного.
Лечение
Госпитализации подлежат пациенты с тяжелым или осложненным течением гриппа, а также с рядом сопутствующих заболеваний: тяжелыми формами сахарного диабета, хронической ИБС, хронической обструктивной болезнью легких, болезнями крови, заболеваниями ЦНС.
К синдромальным показаниям для госпитализации относят: высокую лихорадку (выше 40 °С), нарушения сознания, многократную рвоту, менингеальный синдром, геморрагический синдром, судорожный синдром, ДН, сердечно-сосудистую недостаточность.
Госпитализацию и изоляцию больных проводят также по эпидемиологическим показаниям (общежития, интернаты, детские дома, гостиницы, транспорт, воинские коллективы, учреждения пенитенциарной системы).
Режим. Диета: рекомендован постельный режим в течение всего лихорадочного периода. Назначают полноценное питание, включая молочнокислые продукты, фруктовые и овощные соки. Для дезинтоксикации применяют обильное теплое питье до 1,5-2 л/сут (чай, соки, отвар шиповника, отвар липового цвета, минеральные щелочные воды, молоко).
Медикаментозное лечение
Противовирусные препараты показаны при среднетяжелом и тяжелом течении болезни, а также больным с сопутствующей патологией. Этиотропное лечение включает назначение ЛС адамантанового ряда (например, римантадина). Римантадин (Ремантадин♠) обладает противовирусной активностью в отношении штаммов вируса гриппа А. Эффективен при назначении в первые 2 сут течения заболевания. Принимают внутрь после еды (запивая водой) по схеме: в 1-е сутки - 300 мг в три приема; на 2-е и 3-и сутки - 200 мг в два приема; на 4-е сутки - 100 мг одномоментно. Римантадин (Альгирем♠¤ ) - 0,2% раствор римантадина в сиропе (для лечения гриппа А у детей). Курс лечения: 4 сут в соответствии с возрастным режимом дозирования. При лечении гриппа, вызванного вирусами серотипов А и В, эффективны ингибиторы нейраминидазы (осельтамивир - Тамифлю♠, назначаемый по 150 мг в два приема в течение 5-7 сут). Препарат выбора - умифеновир (Арбидол♠) (группа индолов) - противовирусное ЛС с интерферониндуцирующими, иммуномодулирующими и антиоксидантными свойствами. Эффективен в отношении вирусов А и В. Назначают по 600 мг/сут в 3 приема в течение 5-7 сут. Занамивир (Реленза♠) - вводится ингаляционно 2 раза в сутки 5 сут.
Альтернативные ЛС - ИФН и индукторы ИФН. Наиболее распространенные препараты ИФН: интерферон лейкоцитарный человеческий и рекомбинантные соединения (ИФН-α2, например, Гриппферон♠, Гриппферон♠ с лоратадином). Применяют также индукторы ИФН: тилорон, меглюмина акридонацетат (Циклоферон♠), Кагоцел♠, рибонуклеат натрия (Ридостин♠).
Проводят дезинтоксикацию: 5% раствором декстрозы (Глюкозы♠) или декстраном [ср. мол. масса 35 000-45 000] (Реополиглюкин♠). Назначают вазо- и кардиопротекторные препараты. Для предупреждения или лечения начинающегося отека мозга (или легких) назначают фуросемид по 40-80 мг/сут. С этой же целью вводят дексазон по 12-20 мг/сут. При гипертермии показаны препараты ацетилсалициловой кислоты и парацетамола с тщательным учетом противопоказаний. Для улучшения мозгового кровообращения назначают пентоксифиллин. Больным с тяжелой формой заболевания необходима оксигенотерапия (ингаляции кислородно-воздушной смесью).
Следует постоянно следить за проходимостью верхних дыхательных путей, проводить аспирацию мокроты и слизи при помощи электроотсоса. Необходима коррекция нарушений кислотно-щелочного состояния крови. При появлении сердечной недостаточности применяют сердечные гликозиды (ландыша травы ликозидρ, уабаин), 10% раствор Сульфокамфокаина♠.
При наличии бактериальных осложнений (пневмония, отит, синусит и др.) применяют антибиотики.
Примерные сроки нетрудоспособности
При неосложненном течении - 5-7 сут и до 14-21 сут при присоединении пневмонии.
Грипп птиц у человека
Грипп птиц - острая зоонозная инфекционная болезнь с преимущественно фекально-оральным механизмом передачи возбудителя. Характеризуется выраженным ЛИС, поражением легких с развитием РДС и высокой летальностью.
Код по МКБ-10
J10 Грипп, вызванный идентифицированным вирусом.
Этиология
По данным сероархеологических исследований, пандемия «испанка» 1918-1919 гг. была вызвана подтипом Н1N1, содержащим дополнительный белок, полученный от вируса гриппа птиц. Эпизоотии гриппа птиц последних лет связаны с подтипами Н5N1, Н5N2, Н5N8, Н5N9, Н7N1, Н7N3, Н7N4, Н7N7. В популяциях диких птиц циркулируют подтипы Н1, Н2, Н3, N2, N4, т.е. аналогичные вирусу гриппа А человека. Наиболее вирулентен подтип Н5N1, который в последние годы приобрел ряд необычных свойств: высокую патогенность для людей, способность непосредственно инфицировать людей, вызывать гиперпродукцию провоспалительных цитокинов, сопровождающуюся развитием ОРДС, способность вызывать мультиорганные нарушения, включая поражение мозга, печени, почек и других органов, резистентность к противовирусному препарату римантадину; устойчивость к воздействию ИФН.
Вирус гриппа птиц, в отличие от вирусов гриппа человека, более устойчив в окружающей среде. При температуре 36 °С он погибает за 3 ч, 60 °С - за 30 мин, при термической обработке пищевых продуктов (кипячение, жарка) - мгновенно. Хорошо переносит замораживание. В птичьем помете выживает до 3 мес, в воде при температуре 22 °С - 4 сут, а при 0 °С - более месяца. В тушках птиц сохраняет активность до года. Инактивируется обычными дезинфицирующими средствами.
Эпидемиология
Основной резервуар вируса в природе - перелетные водоплавающие птицы. Наибольшее значение имеют дикие утки. Вирусы гриппа в Евразии и Америке эволюционируют независимо, поэтому миграция между континентами не играет роли в распространении вируса, решающее значение имеют перелеты по долготе. Для России важными в этом отношении являются центральноазиатский-индийский и восточноазиатский-австралийский пути миграции. Они включают маршруты, идущие в Сибирь через Малайзию, Гонконг и Китай, т.е. регионы, где идет интенсивное формирование новых вариантов вируса. Менее значимы восточно-африканско-европейский и западно-тихоокеанский пути.
У диких водоплавающих птиц вирус редко вызывает клинически выраженное заболевание. Репликация вируса у пернатых происходит преимущественно в кишечнике, и выделяется он в окружающую среду с фекалиями, в меньшей степени - со слюной и респираторным материалом.
Основной механизм передачи вируса у птиц - фекально-оральный. Водоплавающие птицы (утки) способны передавать вирус транс-овариально и, таким образом, служат его естественным природным резервуаром и распространяют по путям своей миграции. Они выступают главным источником инфекции для домашних птиц, которые, напротив, болеют тяжелыми формами гриппа, сопровождающимися их массовой гибелью (до 90%). Заражение происходит в условиях свободного содержания и возможности контакта с дикими птицами. Особенно это характерно для стран Юго-Восточной Азии.
Вирус гриппа птиц способен поражать млекопитающих: котиков, китов, норок, лошадей и, что особенно важно, свиней. Эти животные также могут быть поражены вирусом гриппа человека. В настоящее время восприимчивость людей к подобным вирусам птиц низкая. Все случаи заражения зафиксированы у тех, кто длительно и тесно контактировал с больной птицей.
Официально зафиксировано 2 случая заражения от больного человека. Таким образом, можно заключить, что межвидовой барьер в настоящее время является достаточно прочным. Однако имеются факты, позволяющие считать, что грипп птиц может потенциально представлять серьезную угрозу: единичные случаи заражения людей от птиц и от больных свидетельствуют о том, что непреодолимость межвидового барьера не абсолютна; фактическое количество случаев заражения от домашней птицы, а возможно, и от больных людей, учитывая реальную обстановку в очагах эпизоотии, может быть во много раз больше, у лиц, контактировавших с больными, обнаружены высокие титры антител, что тоже указывает на возможность передачи вируса от человека к человеку, но с утратой вирулентности, мутагенный потенциал вируса гриппа птиц, особенно подтипа H5N1, весьма велик, свиньи восприимчивы к вирусам гриппа птиц и гриппа человека, поэтому возможна встреча вирусов в организме животного, их гибридизация и возникновение вирусов-ассортантов, обладающих высокой вирулентностью, свойственной вирусу гриппа птиц, и в то же время способных передаваться от человека к человеку, генетическими методами доказано, что пандемия испанки 1918-1919 гг. имела «птичье» происхождение, в современных условиях благодаря процессам глобализации, наличию быстрых видов транспорта возможность распространения вируса-ассортанта резко возрастает.
Меры профилактики
Специфические
Глобальный мониторинг под эгидой ВОЗ позволяет быстро обнаружить опасный вирус и начать массовое производство вакцины через 9 мес после идентификации. В настоящее время важно качественно проводить противоэпидемические мероприятия, нацеленные на снижение распространенности человеческого гриппа. В частности, необходимо увеличить количество вакцинированных, что снизит уровень заболеваемости, а возможно, и восприимчивость к новому варианту вируса.
Неспецифические
Основной метод борьбы с гриппом птиц - полное истребление поголовья пернатых на зараженных фермах, причем лица, контактирующие с ними и осуществляющие их уничтожение, должны работать в респираторах и спецодежде. Большое значение придают дезинфекции с использованием нетоксичных для человека четвертичных аммониевых соединений (ацепур). Проводят карантинные мероприятия, запрещают вывоз птицы и яиц из пораженных регионов. В окружающих хозяйствах и птицефермах осуществляют вакцинацию, но наличие у вакцинированных птиц антител затрудняет мониторинг, так как не позволяет дифференцировать с заражением. Также есть сведения о том, что вакцинация способствует мутации вируса.
В Россию занос инфекции возможен с перелетными птицами. Однако условия ведения сельского хозяйства в России (преимущественно закрытое содержание птицы, малая вероятность контакта со свиньями, менее тесный контакт людей и животных, чем в Юго-Восточной Азии) позволяют практически исключить возможность возникновения вируса-ассортанта. В связи с этим основные мероприятия следует направить на предупреждение заноса вируса из стран, где он может появиться. Для этого следует ужесточить санитарный контроль на границе, рекомендовать ношение респираторных масок, их профилактическая эффективность достигает 98%.
Патогенез
Место репликации вируса - эпителиальные клетки дыхательных путей и энтероциты.
Изменения биологических свойств высокопатогенного штамма вируса А (Н5N1), появление у него способности преодолевать межвидовой барьер могут привести к поражению различных типов клеток у человека с развитием более тяжелых форм болезни. В клинической картине такой патологии наряду с катаральным синдромом развивается поражение ЖКТ.
Клиническая картина
Инкубационный период при гриппе А (Н5N1) составляет 2-3 дня с колебаниями от 1 до 7 дней. Начало болезни острое. Выражены симптомы интоксикации. Температура тела с первых часов болезни повышается до 38 °С, часто достигая гиперпиретических значений. Лихорадочный период удлиняется до 10-12 дней, а при тяжелом течении с летальным исходом - до последних часов жизни больного. Характерны озноб, мышечные и суставные боли. В разгар болезни (2-3-й день) присоединяется катаральный синдром, проявляющийся развитием бронхита, бронхиолита, ларингита; могут быть признаки ринита. Характерны боль в горле и орофарингит. В этот период у большинства больных развивается первичная вирусная пневмония. При этом появляются одышка, продуктивный кашель, возможно с примесью крови. Над легкими выслушиваются жесткое дыхание, влажные разнокалиберные хрипы, крепитация. На рентгенограмме грудной клетки в ранние сроки определяют неспецифические изменения в виде диффузных, мультифокальных или отдельных инфильтратов, имеющих тенденцию к быстрому распространению и слиянию. Характерно прогрессирующее течение, нарастание одышки и развитие ОРДС. Наряду с интоксикацией и катаральным синдромом развивается поражение ЖКТ, проявляющееся повторной рвотой, секреторной диареей и болями в животе. Возможно увеличение печени, сопровождающееся повышением активности трансфераз сыворотки крови. У трети больных развиваются ОПН, креатининемия. У большинства больных наблюдают признаки поражения нервной системы, возможны нарушения сознания, развитие энцефалита. В гемограмме регистрируют лейкопению, лимфопению, тромбоцитопению. Могут быть варианты течения болезни с лихорадкой, диареей и отсутствием признаков поражения органов дыхания.
Осложнения. Инфекция опасна развитием вирусной пневмонии, поражением почек, печени, кроветворных органов. Именно эти последствия часто приводят к смерти больных. Факторы риска развития тяжелых форм гриппа А (Н5N1) у людей: возраст пациента (у детей пяти лет и младше симптомы заболевания выражены неярко), длительность проявления болезни до госпитализации (отсрочка от госпитализации), анатомический уровень поражения респираторного тракта, степень лейкопении периферической крови, наличие полиорганной дисфункции.
Летальность составляет 50-80%. Чаще всего больные умирают от осложнений на 2-й неделе болезни.
Диагностика
Предварительный диагноз гриппа А (Н5N1) может быть поставлен на основании следующих данных: сообщения о вспышках гриппа А (Н5N1) среди популяции птиц и животных или о случаях смерти домашней птицы в регионе проживания больного; контакт с больным человеком, у которого подтверждено инфицирование вирусом гриппа (Н5N1), за 7 дней до появления первых клинических признаков; контакт с больным ОРЗ неясной этиологии, в том числе закончившимся летально, за 7 дней до появления первых клинических признаков; указание на выезд в страну или на территорию, где есть сообщения о неблагополучной эпидемиологической и/или эпизоотической обстановке по гриппу А (Н5N1); наличие профессионального риска инфицирования; высокая лихорадка в сочетании с затрудненным дыханием, кашлем; диарея (при отсутствии примеси крови в фекалиях).
Окончательный диагноз может быть поставлен только после лабораторного подтверждения. Лабораторная диагностика основана на методах вирусологического исследования, серологических реакциях, ИФА и ПЦР.
Дифференциальную диагностику необходимо проводить с другими ОРВИ: гриппом человека (А, В), ТОРС, парагриппом, респираторно-синцитиальной, аденовирусной и энтеровирусной инфекциями, а также легионеллезом и орнитозом.
Показания к госпитализации
Клиническая картина респираторной инфекции у пациента, имевшего контакт с больной птицей.
Лечение
При подтверждении диагноза гриппа А (Н5N1) лечение проводят в боксированном отделении стационара. В течение всего острого периода болезни необходимо соблюдать постельный режим. Рекомендована полноценная диета, богатая витаминами и содержащая достаточное количество жидкости.
Из этиотропных препаратов наиболее эффективен осельтамивир (Тамифлю♠). Его назначают в дозе 75 мг внутрь 2 р/сут в течение 7 дней. Возможно увеличение дозы до 300 мг. Можно также применять римантадин (Ремантадин♠, Альгирем♠¤).
Патогенетические средства
В патогенетической терапии ведущая роль принадлежит дезинтоксикации. По клиническим показаниям используют внутривенное введение кристаллоидных растворов для коррекции кислотно-основного равновесия и электролитного баланса.
При тяжелых клинических формах заболевания показаны глюкокортикоиды, апротинины. При развитии ОРДС лечение проводят в условиях реанимационного отделения с обязательной респираторной поддержкой, вводят сурфактант.
Симптоматическую терапию осуществляют по показаниям.
Из стационара реконвалесцентов выписывают не ранее чем через 7 дней после восстановления нормальной температуры тела.
Всем контактирующим с больными гриппом А (Н5N1) показано медицинское наблюдение в течение 7 дней, с измерением температуры тела 2 раза в день. При ее повышении, появлении кашля и затрудненного дыхания следует немедленно обратиться за медицинской помощью.
При первых признаках заболевания и/или после контакта с заболевшим рекомендуется использование топических препаратов рекомбинантного интерферона (Гриппферон♠, Гриппферон♠ с лоратадином).
Аденовирусная инфекция
Аденовирусная инфекция - острая вирусная антропонозная болезнь с различными механизмами передачи возбудителя, характеризующаяся преимущественным поражением слизистых оболочек респираторного тракта, глаз, кишечника и лимфоидной ткани.
Коды по МКБ-10
В34.0 Аденовирусная инфекция неуточненная
В30.0 Кератоконъюнктивит, вызванный аденовирусами
Этиология
Возбудители ДНК-вирусы рода Mastadenovirus (вирусы млекопитающих) семейства Adenoviridae. Известно 80 видов (сероваров) аденовируса.
Аденовирусы имеют голый капсид, средний диаметр вириона 60-90 нм. Зрелый вирус состоит из 252 капсомеров, включая 240 гексонов, которые образуют грани и 12 пентонов, образующих вертикали. Геном представлен линейной молекулой двунитевой ДНК.
Антигенные свойства положены в основу классификации аденовирусов. Все аденовирусы обладают единым комплементсвязывающим антигеном, что позволяет выявлять их в РСК с помощью группоспецифической сыворотки.
Аденовирусы устойчивы в окружающей среде: сохраняются в замороженном состоянии, адаптируются к температуре от 4 до 50 °С, в воде при +4 °С сохраняют жизнедеятельность 2 года, на стекле, одежде вирус выживает от 10 до 45 дней. Резистентны к эфиру и другим растворителям липидов. Погибают от воздействия ультрафиолетового излучения, хлора, при температуре 56 °С погибают через 30 мин.
Для человека патогенны 49 сероваров аденовирусов, наибольшее значение имеют 1, 3, 4, 5, 6, 7, 8, 12, 14, 21-й серовары, причем типы 1, 2, 5, 6 чаще вызывают заболевания у детей до 7 лет; типы 3, 4, 7, 14, 21 - у взрослых.
Эпидемиология и профилактика
Источником возбудителя инфекции являются больной человек и вирусоноситель. Максимальные сроки вирусовыделения составляют 40-50 дней. Аденовирусные конъюнктивиты могут быть нозокомиальной инфекцией.
Аденовирусы в окружающую среду выделяются из верхних дыхательных путей, с фекалиями, слезами.
Механизм передачи - аэрогенный, фекально-оральный.
Пути передачи - воздушно-капельный, пищевой, контактно-бытовой. Возможно внутриутробное инфицирование плода.
Восприимчивость. Болеют преимущественно дети и лица молодого возраста. В холодное время года заболеваемость возрастает, за исключением фаринго-конъюнктивальной лихорадки, которая встречается преимущественно летом. Эпидемии, вызванные аденовирусами типов 1, 2, 5, наблюдаются редко, вызванные типами 3, 7, - постоянно. После перенесенной болезни формируется видоспецифический иммунитет.
В профилактике аденовирусных заболеваний основная роль принадлежит методам повышения неспецифической резистентности организма (закаливание, рациональное питание). Во время эпидемических вспышек контактным лицам назначают человеческий лейкоцитарный интерферон, препараты рекомбинантного интерферона, индукторы ИФН. В очаге проводят текущую дезинфекцию. Разобщение детей во время вспышек аденовирусных инфекций должно быть не менее 10 дней после выявления последнего больного.
Патогенез
В патологический процесс вовлекаются различные органы и ткани: респираторный тракт, лимфоидная ткань, конъюнктива глаза, кишечник, мочевой пузырь, головной мозг. Наиболее часто входными воротами являются верхние отделы респираторного тракта или слизистая конъюнктив. Из верхнего отдела респираторного тракта вирусы могут бронхогенным путем достигать альвеол, иногда вызывая пневмонию, преимущественно у детей младших возрастных групп.
Первичная репродукция вируса происходит в эпителиальных клетках слизистой оболочки дыхательных путей и кишечника, в конъюнктиве глаза и лимфоидной ткани (миндалины, мезентериальные ЛУ). Аденовирусы, циркулируя в крови, поражают эндотелий сосудов. В пораженных эпителиальных клетках образуются внутриядерные включения овальной или округлой формы, содержащие ДНК вируса. Клетки увеличиваются в размерах, подвергаются деструкции, при этом под эпителием накапливается серозная жидкость. Это приводит к экссудативному воспалению слизистых оболочек, к образованию фибринозных пленок и некрозу. Наблюдается лимфоидная инфильтрация в глубоких слоях стенок трахеи и бронхов. В просвете бронхов содержится серозный экссудат с примесью макрофагов и единичных лейкоцитов.
Помимо местных изменений, аденовирусы оказывают общее токсическое воздействие на организм с клиническими проявлениями интоксикации.
Характерно поражение печени, кишечника, лимфоидной системы, почек, надпочечников с развитием в них гигантоклеточного метаморфоза.
Аденовирусы могут проникать через плаценту, вызывая поражение плода, аномалии развития, пневмонии новорожденных.
Аденовирусы 3, 4, 8, 19-го серотипов ответственны за развитие конъюнктивита, а серовары 40, 41 обусловливают развитие гастроэнтерита.
Клиническая картина
Инкубационный период от 5 до 14 дней.
Аденовирусная инфекция отличается полиморфизмом клинических проявлений. В клинической картине могут преобладать симптомы, свидетельствующие о поражении респираторного тракта, глаз, кишечника, мочевого пузыря, а также лимфоидной ткани, возможно развитие менингоэнцефалита.
В большинстве случаев симптомы интоксикации выражены умеренно. Температура повышается с первых дней болезни, ее продолжительность варьирует от 5-7 дней до 2 нед. Иногда субфебрилитет сохраняется до 4-6 нед, может быть двухволновая лихорадка, редко наблюдаются три волны. С первых дней болезни появляется затрудненное носовое дыхание, одутловатость лица, обильный серозно-слизистый ринит (особенно у младших детей). Характерный признак болезни - фарингит с выраженным экссудативным компонентом, который характеризуется умеренной болью в горле или першением вследствие гиперплазии лимфоидных образований на фоне отечной и гиперемированной слизистой оболочки задней стенки глотки. Миндалины увеличены, у некоторых больных видны белые, нежные, легко снимающиеся шпателем наложения. В большинстве случаев умеренно увеличиваются шейные, поднижнечелюстные, медиастинальные и мезентериальные ЛУ.
Кашель умеренный, непродолжительный, чаще у детей, клинические признаки бронхита у взрослых встречаются достаточно редко. В то же время почти у каждого 5-го заболевшего ребенка развивается острый стенозирующий ларинготрахеит, который протекает тяжело, с выраженным экссудативным компонентом. У некоторых детей отмечается обструктивный синдром, имеющий отечную или смешанную формы, который может сохраняться до 3 нед. При этом кашель влажный, навязчивый, выдох затруднен, одышка смешанного типа. Аускультативно определяется большое количество влажных разнокалиберных и единичных сухих хрипов. У маленьких детей возможно развитие бронхита, бронхиолита.
У части больных имеется гепатолиенальный синдром, иногда повышается уровень трансфераз (АЛТ, АСТ).
Мезаденит проявляется остро возникающими приступообразными болями в животе, преимущественно в нижней части, нередко в правой подвздошной области, иногда в околопупочной. Возможны тошнота, рвота, диарея.
У подавляющего числа заболевших имеется конъюнктивит, вначале он односторонний. Различают катаральный, фолликулярный и пленчатый конъюнктивит. Последняя форма особенна типична. Конъюнктива век гиперемирована, зерниста, несколько набухшая; может быть небольшое выделение секрета. Через 1-3 дня на конъюнктиве появляются белые или серовато-белые пленчатые налеты. Частый симптом - отек век.
У взрослых при аденовирусной инфекции могут быть клинические признаки геморрагического цистита.
Возможен острый энцефалит.
В самостоятельную форму выделена фаринго-конъюнктивальная лихорадка, имеющая довольно четкую клиническую картину с высокой 4-7-дневной температурой, общетоксическим синдромом, рино-фарингитом, пленчатым конъюнктивитом.
Осложнения: отит, синусит и пневмония, обусловленные присоединением вторичной инфекции.
Диагностика
Гемограмма - у большинства заболевших нормоцитоз, но возможны как лейкоцитоз, так и лейкопения. Для ретроспективной расшифровки ОРВИ наиболее широко используют РТГА и РСК.
Методами экспресс-диагностики являются реакции непрямой гемадсорбции, метод ИФА и иммунофлюоресцентный метод. Иммунофлюоресцентный метод позволяет в течение 3-4 ч с момента взятия материала обнаружить антигены аденовирусов в клетках эпителия носовой полости больных, взятых в первые дни болезни. Обнаружение антигенов аденовирусов в ядрах эпителиальных клеток свидетельствует о латентном течении инфекционного процесса, наличие антигенов в цитоплазме позволяет диагностировать острое заболевание.
Дифференциальная диагностика
Дифференциальная диагностика проводится с другими ОРВИ. Нередко приходится ее проводить с дифтерией ротоглотки, дифтерией глаза, ангиной. Аденовирусное заболевание имеет ряд сходных симптомов с ИМ, иерсиниозом.
Лечение
Лечение большинства больных проводится в домашних условиях. Госпитализации подлежат больные с тяжелой формой болезни, при наличии осложнений, сопутствующих заболеваний, а также по эпидемическим показаниям. В лихорадочном периоде необходим постельный режим. Питание должно быть полноценным и богатым витаминами, содержать достаточное количество жидкости.
Большинство больных при неосложненной форме аденовирусного заболевания в этиотропной терапии не нуждаются. При тяжелом течении болезни показан умифеновир (Арбидол♠), препараты ИФН и их индукторы: ИФН-α (Интерферон человеческий лейкоцитарный♠) (вводится аэрозольно), интерлок (для лечения конъюнктивита), ИФН-α (Лейкинферон♠¤) (вводят в/м, ингаляционно) 100 тыс. МЕ, ИФН-α2 рекомбинантный в составе капель и спрея Гриппферон♠, мази назальной Гриппферон♠ с лоратадином.
Прогноз благоприятный. Выписка реконвалесцентов проводится после полного клинического выздоровления.
Риновирусная инфекция
Риновирусная инфекция - острая респираторная вирусная инфекция с поражением слизистой оболочки носа, носоглотки и маловыраженными симптомами интоксикации.
Код по МКБ-10
J20.6.
Этиология
Риновирусы [HRV-(A-C)] - human rhinoviruses, принадлежат к роду Enterovirus семейства Picornoviridae.
Существует более 110 серотипов риновирусов человека. Размеры вируса 15-30 нм. Геном представлен нефрагментированной однонитевой РНК. Репликация РНК происходит в цитоплазме.
Риновирусы малоустойчивы в окружающей среде, однако могут сохранять заразительность на предметах обихода и руках, быстро инактивируются при низких значениях pH, в течение 10 мин погибают при температуре +56 °С, при +4 °С сохраняются длительно. При высушивании погибают через несколько минут.
Эпидемиология
Риновирусы распространены повсеместно.
Источниками возбудителя инфекции являются больной человек и вирусоноситель. Длительность заразного периода в среднем 5-7 дней (с колебаниями от 1 до 28 дней). Больной становится заразным с последних дней инкубационного периода и особенно заразен в период максимального проявления катаральных симптомов, особенно быстро заболевание распространяется среди детей в организованных и закрытых коллективах. В отличие от других респираторных вирусов риновирусы обладают более низкой заразительностью. Вирус в окружающую среду выделяется при кашле и чихании.
Механизм передачи - аспирационной.
Пути передачи: воздушно-капельный, контактный (через предметы личного пользования). Восприимчивость высокая.
Встречается во всех возрастных группах, что объясняется чрезвычайно высоким разнообразием типов риновируса и кратковременностью иммунитета.
Нередко риновирусы являются причиной внутрибольничной инфекции. Среди острых респираторных вирусных заболеваний у взрослых риновирусная инфекция составляет от 10-15% до 28%.
Специфическая профилактика не разработана. Неспецифические меры профилактики не отличаются от таковых при других ОРВИ.
Патоморфология и патогенез
Входными воротами инфекции является слизистая оболочка носа. Патологический процесс ограничивается ВДП. В отличие от других ОРВИ, при риновирусной инфекции в первую очередь страдает плоский эпителий, покрывающий носовые ходы. Характерны значительный отек и набухание слизистой носовых ходов. Отмечаются гиперсекреция и десквамация эпителия. Секреторные клетки эпителия продуцируют слизь, и они же обладают адсорбционной функцией. В состав слизи входят факторы неспецифической защиты: муцин, лизоцим, лактоферрин и опсонины. Макрофаги, содержащиеся в назальном секрете, выделяют противовоспалительные цитокины. Развитие местного иммунитета связано с продукцией секреторного IgА. IgА связывается с вирусами и блокирует их адгезию к клеткам эпителия. Патогены, нейтрализованные секреторными IgА, удаляются за счет мукоцилиарного клиренса. Регенерация слизистой оболочки заканчиваются к концу 2-й недели заболевания.
Клиническая картина
Инкубационный период от 1 до 3 сут (реже - до 6). Заболевание начинается остро с недомогания и легкого познабливания, температура тела нормальная или субфебрильная. С первых часов болезни появляются заложенность носа, многократное чихание и обильное серозное отделяемое, нарушаются обоняние и вкус, снижается слух. Возможны головная боль, чувство «тяжести в голове» и ломота во всем теле. Общее состояние страдает мало. Через 2-3 дня ринит достигает максимальных проявлений. Также возможен небольшой сухой кашель (у одной трети больных признаки бронхита).
При осмотре в области крыльев и преддверия носа определяется мацерация кожи, гиперемия слизистой оболочки ротоглотки, преимущественно в области задней стенки глотки, инъекция сосудов склер и конъюнктив. Могут увеличиться поднижнечелюстные ЛУ. Продолжительность заболевания редко превышает 7 сут, у части больных до 14 дней. При затяжном рините (более 2 нед) в результате присоединения бактериальной флоры выделения из носа приобретают слизисто-гнойный характер, что может свидетельствовать о начинающемся синусите. Наиболее характерными осложнениями являются евстахеит, отит, пневмония, обусловленные присоединением бактериальной флоры.
Диагностика риновирусной инфекции основывается на преобладании ринита. Учитываются данные эпидемиологического анамнеза. Для клинической диагностики наиболее эффективным является метод иммунофлюоресценции.
Лечение
При неосложненной риновирусной инфекции госпитализация не требуется. Больным в большинстве случаев достаточно симптоматической терапии. Срок изоляции больного - 5-6 дней. При средне-тяжелом и тяжелом течении болезни показана дезинтоксикационная терапия. Целесообразно ингаляционное введение ИФН.
Патогенетическая терапия включает применение сосудосуживающих средств, в частности адреномиметиков, относящихся к группе имидазолов. Прогноз благоприятный. Диспансерное наблюдение не предусмотрено.
Коронавирусная инфекция
Коронавирусная инфекция - острое антропозоонозное вирусное заболевание с аэрозольным и фекально-оральным механизмом передачи возбудителя. Клинически характеризуется поражением респираторного тракта с возможным развитием пневмонии и ТОРС. Возможны клинические варианты с поражением ЖКТ.
ТОРС (атипичная пневмония) - тяжело протекающая форма коронавирусной инфекции, характеризующаяся циклическим течением, выраженной интоксикацией, преимущественным поражением альвеолярного эпителия и развитием ОДН.
Коронавирус ближневосточного респираторного синдрома (БВРС-КоВ) характеризуется выраженным синдромом интоксикации, поражением респираторного тракта с развитием тяжелой пневмонии.
Код по МКБ-10
U04.9 Тяжелый острый респираторный синдром неуточненный.
Этиология
Коронавирусы относятся к семейству Coronaviridae.
Коронавирусы - крупные РНК-содержащие вирусы сферической формы диаметром 120-160 нм. Вирион имеет сложное строение, в центре расположена спиралевидная однонитевая молекула РНК, нуклеокапсид окружен белково-липидной оболочкой с отчетливо различимыми на электронномикроскопических снимках булавовидными пепломерами. Репликация вируса происходит в цитоплазме пораженных клеток.
Коронавирусы обладают сложной антигенной структурой, их подразделяют на антигенные группы, которые имеют разные антигенные перекресты.
Этиологическими агентами коронавирусного заболевания ВДП являются HCoV NL63, HCoV 229E, BetaCoV 1, HCoV HKU1 и HToV.
Вирусы родов Alphacoronavirus (HCoV NL63, HCoV 229E) и Torovirus (HToV) чаще клинически проявляются поражением ЖКТ.
Основными клетками-мишенями коронавирусов являются эпителиальные клетки и макрофаги, имеющие на своей поверхности рецепторы, с которыми взаимодействует поверхностный S-белок вируса.
Коронавирусы неустойчивы в окружающей среде, мгновенно погибают при нагревании до 56 °C, под воздействием дезинфицирующих средств. Имеются данные о более высокой устойчивости вируса ТОРС. Предполагают, что вирус ТОРС стал результатом мутаций известных ранее видов коронавируса.
Происхождение вируса БВРС-КоВ (описан в 2012 г.) в настоящее время до конца неизвестно, однако считается, что возник он среди летучих мышей.
Эпидемиология
Источник возбудителя - больной и носитель коронавирусов. Путь передачи воздушно-капельный, восприимчивость к вирусу высокая. Болеют преимущественно дети, после перенесенной болезни формируется гуморальный иммунитет. У 80% взрослых есть антитела к коронавирусам. Коронавирусная инфекция, вызывающая заболевание ВДП, распространена повсеместно и регистрируется в течение всего года с пиками заболеваемости зимой и ранней весной, когда эпидемическая значимость ее в структуре ОРВИ колеблется от 6,8% до 28,6%. Коронавирусы, как правило, лидируют среди прочих респираторных вирусов в этиологии нозокомиальных инфекций.
Первый случай ТОРС, этиологически связанный с SARS-CoV, был зарегистрирован в ноябре 2002 г., последний - 20 июня 2003 г. За этот период зарегистрированы 8422 случая болезни в 30 странах, умерли 916 (10,9%) больных. До 60% от всех летальных исходов приходится на медицинских работников. Природным резервуаром SARS-CoV являются летучие мыши (Chiroptera: Microchiroptera). От летучих мышей в природе заражаются виверровые (Viverridae - мангусты), которых жители Юго-Восточной Азии держат в качестве домашних животных и часто употребляют в пищу.
Источником вируса ТОРС служат больные, основной путь передачи - также воздушно-капельный. Допустима контаминация вирусом предметов в окружении больного. Несмотря на высокую вирулентность, восприимчивость к вирусу ТОРС невысокая, что связано с наличием у большинства людей антител к коронавирусам.
По данным ВОЗ, в 2015 г. в мире зарегистрировано 1280 случаев заражения вирусом БВРС-КоВ/MERS (англ. Middle East respiratory syndrome MERS), скончались 455 человек. Обитающие в России летучие мыши, подобно птицами осуществляют сезонные миграции, зимуя в эндемичной по БВРС территории, и могут, таким образом, заносить вирус в Россию.
Меры профилактики
Профилактика ТОРС и БВРС-КоВ/MERS предполагает изоляцию больных, проведение карантинных мероприятий на границах, дезинфекцию транспортных средств. Индивидуальная профилактика предусматривает ношение марлевых масок и респираторов. Для химиопрофилактики рекомендуют назначение рибавирина, а также препаратов ИФН и его индукторов.
Патоморфология и патогенез
Коронавирусы поражают эпителий ВДП и ЖКТ. Основными клетками-мишенями для вирусов ТОРС и БВРС-КоВ/MERS являются клетки альвеолярного эпителия, в цитоплазме которых происходит репликация вируса. После сборки вирионов они переходят в цитоплазматические вакуоли, которые мигрируют к мембране клетки и путем экзоцитоза выходят во внеклеточное пространство, причем до этого не происходит экспрессии антигенов вируса на поверхность клетки, поэтому антителообразование и синтез ИФН стимулируются относительно поздно. Сорбируясь на поверхности клеток, вирус способствует их слиянию и образованию синцития. Тем самым осуществляется быстрое распространение вируса в ткани. Действие вируса вызывает повышение проницаемости клеточных мембран и усиленный транспорт жидкости, богатой альбумином, в интерстициальную ткань легкого и просвет альвеол. При этом разрушается сурфактант, что приводит к коллапсу альвеол, в результате чего резко нарушается газообмен. В тяжелых случаях развивается острый РДС, сопровождающийся тяжелой ДН. Вызванные вирусом повреждения «открывают дорогу» бактериальной и грибковой флоре, развивается вирусно-бактериальная пневмония. У ряда пациентов вскоре после выписки наступает ухудшение состояния, связанное с быстрым развитием фиброзных изменений в легочной ткани, что позволило предположить инициацию вирусом апоптоза.
Клиническая картина
Инкубационный период коронавирусной инфекции, протекающей, как ОРВИ, составляет 2-3 сут. Заболевание начинается остро, протекает с умеренно выраженными явлениями интоксикации и симптомами поражения верхних отделов респираторного тракта. Температура тела, как правило, нормальная. Катаральный синдром в большинстве случаев проявляется ринитом с обильным серозным отделяемым. Иногда на фоне слабовыраженных явлений интоксикации больные отмечают першение в горле, сухой кашель. При осмотре отмечается гиперемия слизистой оболочки задней стенки глотки, гиперемия и отек слизистой оболочки носа. Продолжительность болезни от 5-7 сут. У детей раннего возраста коронавирусная инфекция может протекать тяжело с поражением НДП и развитием пневмонии.
Описаны нозокомиальные вспышки коронавирусной инфекции, проявляющиеся синдромом острого гастроэнтерита.
При ТОРС инкубационный период от 2 до 7 сут, в ряде случаев до 10 дней. Начало болезни острое, первые симптомы - озноб, головная боль, боли в мышцах, общая слабость, головокружение, повышение температуры тела до 38 °C и выше. У части больных наблюдают кашель, насморк, боли в горле, при этом имеется гиперемия слизистой оболочки нёба и задней стенки глотки. Возможны также тошнота, одно- или двукратная рвота, боли в животе, жидкий стул. Через 3-7 сут, а иногда и раньше болезнь переходит в респираторную фазу, которая характеризуется повторным повышением температуры тела, появлением упорного непродуктивного кашля, одышки, затрудненного дыхания. Наблюдаются бледность кожи, цианоз губ и ногтевых пластинок, тахикардия, приглушение тонов сердца, тенденция к артериальной гипотензии. При перкуссии грудной клетки определяют участки притупления перкуторного звука, выслушивают мелкопузырчатые хрипы. У 80-90% заболевших в течение недели состояние улучшается, симптомы ДН регрессируют и наступает выздоровление. У 10-20% больных состояние прогрессивно ухудшается и развивается картина, сходная с РДС.
У некоторых больных наблюдаются признаки поражения ЖКТ: тошнота, повторная рвота, диарея.
Клиническая картина БВРС характеризуется лихорадкой, кашлем, одышкой, затрудненным дыханием и в большинстве клинически подтвержденных случаев быстро переходит в тяжелую первичную вирусную пневмонию. У пациентов, страдающих хроническими заболеваниями органов дыхания и сердечно-сосудистой системы, метаболическим синдромом и иммунодефицитными состояниями различного генеза, на первом плане могут быть симптомы поражения ЖКТ. ВОЗ рекомендует рассматривать в качестве возможного БВРС, требующего соответствующего лабораторного подтверждения, санитарно-гигиенических мероприятий и госпитализации, все случаи острых респираторных вирусных заболеваний, осложненные ОРДС, при наличии эпидемиологических данных - пребывания на Ближнем Востоке в течение 14 сут до начала заболевания.
Диагностика
Клинически коронавирусная инфекция с поражением ВДП не отличается от риновирусного заболевания. Диагностика ТОРС также представляет большие трудности, так как отсутствуют патогномоничные симптомы. Большое значение имеет эпидемиологический анамнез. В типичных тяжелых и среднетяжелых случаях имеется характерная динамика заболевания.
К подозрительным на ТОРС относят респираторные заболевания неустановленной этиологии, протекающие с повышением температуры тела свыше 38 °C; с наличием одного или нескольких признаков респираторного заболевания (кашель, учащенное или затрудненное дыхание, гипоксемия); у лиц, выезжавших в течение 10 сут до заболевания в регионы мира, пораженные ТОРС, или общавшихся в эти сроки с больными, подозрительными на ТОРС. Важны отсутствие сыпи, полиаденопатии, гепатолиенального синдрома, острого тонзиллита, поражения нервной системы, наличие лимфопении и лейкопении.
Картина периферической крови при ТОРС характеризуется умеренной тромбоцитопенией, лейко- и лимфопенией, анемией; часто наблюдают гипоальбуминемию, что связано с выходом белка во внесосудистое пространство вследствие повышенной сосудистой проницаемости. Возможно повышение активности АЛТ, АСТ и КФК, что указывает на вероятность органных поражений (печень, сердце) или развитие генерализованного цитолитического синдрома.
Диагностика. Иммунологические методы позволяют достоверно выявлять антитела к вирусу ТОРС и БВРС после 21 сут от начала болезни, ИФА через 10 сут от начала болезни, таким образом, они пригодны для ретроспективной диагностики или для популяционных исследований.
Вирусологические методы используются в научных целях. Наиболее эффективный метод ранней диагностики - ПЦР, которая позволяет обнаружить специфические фрагменты РНК вируса в биологических жидкостях (кровь, кал, моча) и секретах (смывах из носоглотки, бронхов, в мокроте) на самых ранних стадиях болезни. Установлено не менее 7 праймеров - нуклеотидных фрагментов, специфичных для вирусов ТОРС и БВРС. Учитывая наличие у вирионов коронавирусов характерных морфологических черт, существенное значение в диагностике коронавирусных заболеваний может иметь электронная микроскопия.
Рентгенологически выявляют интерстициальные инфильтраты, двустороннюю сливную пневмонию.
Дифференциальная диагностика
Дифференциальную диагностику ТОРС, БВРС-ДТ на 1-м этапе болезни следует проводить с гриппом, другими респираторными инфекциями и энтеровирусными инфекциями группы Коксаки-ЕСНО. В респираторной фазе прежде всего следует исключить орнитоз, микоплазмоз, респираторный хламидиоз и легионеллез. Дифференциальная диагностика коронавирусной инфекции (ОРВИ) проводится с гриппом, респираторно-синцитиальной вирусной инфекцией, риновирусной инфекцией и энтеровирусными заболеваниями.
Лечение
Больных коронавирусной инфекцией лечат симптоматическими средствами амбулаторно, пациенты с подозрением на ТОРС, БВРС подлежат госпитализации и изоляции в специально оборудованные стационары. Режим в остром периоде заболевания постельный, специфической диеты не требуется.
Методов специфической терапии, эффективность которых подтверждена методами доказательной медицины, не существует.
Во время эпидемии применяли рибавирин в дозе 8-12 мг/кг каждые 8 ч в течение 7-10 сут, препарат назначали с учетом противопоказаний, также использовали ИФН-α2b, ИФН-α и его индукторы. Целесообразна оксигенотерапия путем ингаляций кислородно-воздушной смеси или ИВЛ в режиме вспомогательного дыхания, проведение дезинтоксикации по общим правилам. Необходимо, с учетом активизации аутофлоры, применение антибиотиков широкого спектра действия, таких как левофлоксацин, цефтриаксон и др. Перспективно применение ингаляций препаратами, содержащими сурфактант [порактант альфа (Куросурф♠), Сурфактант-БЛ♠], а также оксид азота. Выписку больных осуществляют после полного регресса воспалительных изменений в легких, восстановления их функции и стойкой нормализации температуры тела в течение 7 сут.
Прогноз
Летальные исходы при коронавирусной инфекции (ОРВИ) крайне редки. При легком и среднетяжелом течении ТОРС (80-90% больных) прогноз благоприятный, в тяжелых случаях, требующих применения ИВЛ, летальность высокая. У пациентов, перенесших болезнь, возможен фиброз легких.
Энтеровирусные инфекции
Энтеровирусные инфекции (Enterovirosis) - группа антропонозных инфекционных болезней с фекально-оральным механизмом передачи возбудителя, вызываемых энтеровирусами группы Коксаки и ECHO, которые характеризуются полиморфизмом клинической картины с поражением ЦНС, мышц, слизистых оболочек глаз, ВДП, пищеварительного тракта и кожи.
Коды по МКБ-10
А85.0 (G05.1*) Энтеровирусный энцефалит, энтеровирусный энцефаломиелит.
А87.0 (G02.0*) Энтеровирусный менингит; менингит, вызванный вирусом Коксаки/менингит, вызванный ЕСНО-вирусом.
А88.0 Энтеровирусная экзантематозная лихорадка (бостонская экзантема).
В08.4 Энтеровирусный везикулярный стоматит с экзантемой, вирусная пузырчатка полости рта и конечностей.
В08.5 Энтеровирусный везикулярный фарингит, герпетическая ангина.
В08.8 Другие уточненные инфекции, характеризующиеся поражением кожи и слизистых оболочек; энтеровирусный лимфонодулярный фарингит.
Этиология
Возбудители энтеровирусных инфекций - кишечные вирусы рода Enterovirus семейства Picornaviridae. Род энтеровирусов объединяет полиовирусы (3 серовара), которые являются возбудителями полиомиелита, вирусы Коксаки А (24 серовара), Коксаки В (6 сероваров) и ECHO (34 серовара), а также 5 энтеровирусов человека (неклассифицированные вирусы 68-72 типов). Энтеровирус 70 вызывает острый геморрагический конъюнктивит, а энтеровирус 72 - ВГA. Энтеровирусы генетически неоднородны. Они имеют маленькие размеры вириона - 15-35 нм, РНК расположена в центре вириона и окружена белковыми молекулами - капсомерами.
Кишечные вирусы устойчивы в окружающей среде, резистентны к низким температурам, устойчивы к замораживанию и оттаиванию (в фекалиях при низкой температуре сохраняют жизнеспособность более полугода). Устойчивы к 70% раствору этанола, 5% раствору лизола. В сточных водах, мелких водоемах в зависимости от температуры могут сохраняться до 1,5-2 мес. Кишечные вирусы чувствительны к высушиванию, при комнатной температуре сохраняются до 15 сут. При температуре 33-35 °С погибают в течение 3 ч, при температуре 50-55 °С - в течение нескольких минут, при кипячении и автоклавировании - мгновенно. Быстро погибают под воздействием формальдегида, сулемы, метиленового синего, калия перманганата, перекиси водорода♠, а также ультрафиолетового облучения. Свободный остаточный хлор (0,3-0,5 мг/л) быстро инактивирует энтеровирусы в водных суспензиях, однако присутствие органических веществ, связывающих хлор, может снизить эффект инактивации.
Эпидемиология
Источник энтеровирусов - больной или вирусоноситель. В распространении заболевания большую роль играют реконвалесценты и лица, находившиеся в контакте с больными и реконвалесцентами.
Основной механизм передачи возбудителя - фекально-оральный, главные пути передачи - водный и алиментарный. Наиболее интенсивно вирус выделяется в первые дни болезни, однако в ряде случаев энтеровирусы могут выделяться в течение нескольких месяцев. Чаще всего факторами передачи становятся вода, овощи, реже молоко и другие пищевые продукты. Возможно заражение при купании в водоемах, контаминированных энтеровирусами. Вирус может передаваться через грязные руки, игрушки. Не исключен и воздушно-капельный путь передачи. Возможна трансплацентарная передача энтеровирусов от больной матери плоду.
Восприимчивость высокая. Часто наблюдаются групповые заболевания в детских учреждениях, возможны семейные вспышки. Бессимптомное вирусоносительство встречается в 17-46% случаев (чаще у детей младшего возраста). После перенесенной энтеровирусной инфекции вырабатывается стойкий типоспецифический иммунитет. Возможно развитие перекрестного иммунитета к некоторым типам энтеровирусов.
Энтеровирусные инфекции распространены повсеместно. Спорадические случаи болезни, вспышки и эпидемии энтеровирусных инфекций описаны во всех странах мира. Для стран с умеренным климатом характерна летне-осенняя сезонность заболеваемости.
Энтеровирусные болезни регистрируют на территории РФ с 1956 г. Вспышки связаны в основном с употреблением необеззараженной воды и купанием в открытых водоемах.
Меры профилактики
Специфическая профилактика не разработана.
В качестве неспецифической профилактики детям до 3 лет, контактировавшим с больными, вводят человеческий иммуноглобулин из расчета 0,3-0,5 мл/кг, а также в течение 7 дней закапывают в нос лейкоцитарный ИФН по 5 капель 3 р/сут. В эпидемическом очаге проводят профилактические и противоэпидемические мероприятия. Больных изолируют на 14 дней; проводят влажную уборку помещений с использованием дезинфицирующих средств (0,1% раствор хлористоводородной кислоты, 0,3% раствор формальдегида).
В детских учреждениях устанавливают карантин на 14 дней. Работников родильных домов и детских учреждений, контактировавших с больными, переводят на другую работу на 14 дней.
Патогенез и патоморфология
Энтеровирусы проникают в организм через слизистую оболочку верхних отделов дыхательных путей и пищеварительного тракта, где и происходит их первичная репликация. Затем он попадает в регионарные ЛУ и лимфатические образования кишечника, где продолжается его репликация. На 3-й день от начала болезни в результате первичной виремии поражаются другие органы. Многообразие клинических форм энтеровирусной инфекции объясняют как мутацией капсидных антигенов, гетерогенностью вирусной популяции, так и тропностью различных генотипов возбудителя к отдельным тканям (эпителиальным клеткам, нервной ткани и мышцам).
Проникнув в ЦНС, вирус воздействует на сосудистые сплетения желудочков головного мозга, вследствие чего вырабатывается избыточное количество СМЖ с развитием гипертензивно-гидроцефального синдрома, раздражением ядер блуждающего нерва и рвотного центра. В зависимости от уровня поражения ЦНС развиваются серозный менингит, менингоэнцефалит или полиомиелитподобное заболевание.
Энтеровирусная инфекция может протекать бессимптомно с персистенцией вирусов в кишечнике, мышцах, паренхиматозных органах, ЦНС. Возможно и хроническое течение инфекции.
При патоморфологическом исследовании органов больных, умерших от Коксаки-вирусной инфекции (чаще всего детей раннего возраста), обнаруживают миокардит.
При менингоэнцефалите в мягких мозговых оболочках головного и спинного мозга отмечают отек, гиперемию и периваскулярную лимфоцитарно-моноцитарную инфильтрацию. Выявляют диапедезные кровоизлияния в вещество мозга, периваскулярную инфильтрацию и очаговую пролиферацию глиальных клеток, очаговый некроз и полиморфноядерные инфильтраты в сосудистых сплетениях желудочков мозга. При эпидемической миалгии обнаруживают признаки острого или хронического миозита.
Клиническая картина
Инкубационный период составляет от 2 до 10 сут, в среднем 3-4 сут.
Классификация
По классификации энтеровирусных болезней различают:
-
типичные формы: герпангина; эпидемическая миалгия; асептический серозный менингит; экзантема;
-
атипичные формы: инаппарантная форма; малая болезнь («летний грипп»); катаральная (респираторная) форма; энцефалитическая форма; энцефаломиокардит новорожденных; полиомиелит-подобная (спинальная) форма; эпидемический геморрагический конъюнктивит; увеит; нефрит; панкреатит.
Нередко встречаются сочетанные признаки различных клинических форм - смешанные формы энтеровирусных заболеваний.
Герпангину вызывают вирусы Коксаки А (серотипы 2, 3, 4, 6, 7 и 10) и Коксаки В (серотип 3). Начало острое, с быстрого повышения температуры тела до 39,0-40,5 °С, при этом общее состояние больных может оставаться относительно удовлетворительным. Лихорадка длится от 1 до 5 дней (обычно 2-3 дня). При осмотре ротоглотки выявляется гиперемия слизистой оболочки мягкого нёба, нёбных дужек, язычка, задней стенки глотки. В течение 24-48 ч на передней поверхности миндалин, нёбных дужек появляется от 5-6 до 20-30 мелких папул серовато-белого цвета диаметром 1-2 мм, которые могут встречаться группами или отдельно. Вскоре они превращаются в пузырьки, наполненные прозрачным содержимым. Через 12-24 ч (реже на 3-4-й день болезни), после их вскрытия, образуются эрозии диаметром до 2-3 мм, покрытые сероватым налетом, которые могут сливаться. Вокруг эрозий образуется венчик гиперемии. Боли в горле умеренные или отсутствуют, но могут усиливаться при образовании эрозий. Эрозии заживают в течение 4-6 дней без дефектов слизистой оболочки. Заболевание нередко рецидивирует. Иногда герпангина развивается на фоне серозного менингита.
Эпидемическую миалгию (плевродиния, болезнь Борнхольма) вызывают вирусы Коксаки В (типы 1-5), Коксаки А (серотип 9) и ECHO (серотипы 1, 6, 9).
Типично острое, внезапное начало с озноба и подъема температуры тела до 39-40 °С, появления общей слабости, тошноты, нередко рвоты, а также сильной головной боли, боли в грудных мышцах, эпигастральной и пупочной областях, спине, конечностях. Появление миалгии связано с развитием миозита. Боли усиливаются при движении, кашле, часто становятся мучительными и сопровождаются обильным потоотделением. Продолжительность болевых приступов составляет от 5-10 мин до нескольких часов (чаще 15-20 мин). В ряде случаев приступы сопровождаются рвотой и повторяются через 0,5-1 ч. Напряжение мышц брюшной стенки часто имитирует синдром острого живота, в связи с чем больных нередко направляют в хирургическое отделение. При болях в области грудной клетки в ряде случаев ошибочно диагностируют плеврит, пневмонию или приступ стенокардии. В промежутках между приступами больные подавлены, апатичны. Лихорадка сохраняется 2-3 дня. Во время болевых приступов часто возникает тахикардия. Зев гиперемирован, на слизистой оболочке нёба нередко выявляют зернистость, характерен шейный лимфаденит.
У некоторых больных отмечают гепатоспленомегалию. Мышечные боли к 3-му дню болезни становятся менее интенсивными или исчезают, хотя иногда сохраняются и после нормализации температуры. Средняя продолжительность болезни составляет 3-7 дней. При волнообразном течении заболевания (2-3 обострения с интервалом в 2- 4 дня) продолжительность болезни увеличивается до 1,5-2 нед.
Серозный менингит - одна из наиболее распространенных и тяжелых форм энтеровирусной инфекции. Вызывается нейротропными генотипами энтеровирусов: Коксаки А (серотипы 2, 4, 7, 9), Коксаки В (серотипы 1-5), ECHO (серотипы 4, 6, 9, 11, 16, 30). Регистрируется как в виде эпидемических вспышек, так и спорадических случаев. Редко наблюдается продромальный период длительностью 1-2 дня, при котором возникают слабость, раздражительность, сонливость. Характерно острое начало болезни с общей интоксикацией и повышением температуры тела до 38,0-39,0 °С. Симптомы менингита возникают в первые дни болезни, иногда на 3- 5-й день, сопровождаются повторным повышением температуры тела. Характерна общая гиперестезия (гиперакузия, фотофобия, гиперестезия кожи), интенсивная головная боль распирающего характера, рвота «фонтаном» без предшествующей тошноты, не приносящая облегчения. В более тяжелых случаях наблюдается психомоторное возбуждение и судороги. Глубокое расстройство сознания встречается крайне редко. Характерно наличие менингеальных симптомов, в ряде случаев неполный менингеальный синдром. Лихорадка и менингеальные симптомы сохраняются в течение 3-7 дней. В остром периоде чаще отмечается относительная брадикардия, реже - тахикардия и абсолютная брадикардия. Нередко возникает метеоризм, при пальпации живота обнаруживается урчание. Возможны катаральные явления. В периферической крови отмечают умеренный лейкоцитоз, нейтрофилез без сдвига влево, который впоследствии сменяется лимфоцитозом. СМЖ бесцветная, прозрачная, при пункции вытекает с повышенным давлением. Отмечается лимфоцитарный плеоцитоз (несколько десятков и сотен в 1 мм3). В первые 1-2 дня болезни в СМЖ преобладают нейтрофилы (до 90%). В ряде случаев отмечается смешанный характер цитоза. Содержание белка в пределах нормы. Уровень глюкозы в пределах нормы или повышен. Уровень лактата в норме. Возможно рецидивирующее течение менингита. При этом нарастание менингеальных симптомов сопровождается подъемом температуры тела.
В отдельных случаях, при наличии характерных менингеальных симптомов, СМЖ остается интактной, и наоборот, при отсутствии менингеальных симптомов в СМЖ выявляются воспалительные изменения. В обоих случаях диагноз ставится на основании обнаружения генетического материала энтеровирусов в СМЖ методом ПЦР.
Малую болезнь (Коксаки- и ЕСНО-лихорадку, трехдневную, или неопределенную, лихорадку; «летний грипп») могут вызывать все типы маловирулентных штаммов энтеровирусов. Клинически малая болезнь характеризуется лихорадкой не более 3 дней, слабостью, разбитостью, умеренной головной болью, рвотой, миалгией, болью в животе. Катаральные явления со стороны ВДП возникают менее чем у двух третей больных. Возможно двухволновое течение болезни.
Энтеровирусную экзантему (эпидемическую, или бостонскую, экзантему, а также кореподобную и краснухоподобную экзантемы) вызывают вирусы ECHO (типы 4, 5, 9, 12, 16, 18), реже - вирусы Коксаки (типы А-9, А-16, В-3). Относится к числу легких форм энтеровирусной инфекции. Регистрируют чаще в виде небольших вспышек, но описаны и крупные эпидемии. Болезнь развивается остро с подъемом температуры тела до 38-39 °С. Характерны общая слабость, выраженные головная и мышечные боли, боли в горле, шейный лимфаденит, экзантема на лице, туловище и конечностях. Сыпь краснухоподобная, реже макуло-папулезная, буллезная, петехиальная, сохраняется 2-4 дня. Отмечается пятнистая энантема на слизистой оболочке ротоглотки. В остром периоде нередко развивается фарингит, конъюнктивит. В ряде случаев болезнь сопровождается явлениями менингизма или сочетается с серозным менингитом. Лихорадка длится 1-8 дней.
В ряде случаев энтеровирусная экзантема протекает только с поражением кистей, стоп, полости рта. Заболевание вызывают вирусы Коксаки А (серотипы 5, 10, 16). При этой форме на фоне умеренной интоксикации и небольшого повышения температуры тела на пальцах кистей и стоп появляется везикулезная сыпь с элементами диаметром 2-3 мм, окруженными воспалительным венчиком. Одновременно на языке и слизистой оболочке щек, нёба обнаруживают единичные небольшие афты.
Катаральная (респираторная) форма - распространенная, малодифференцируемая форма энтеровирусной инфекции, которая вызывается многими типами энтеровирусов. Болеют как дети, так и взрослые. Развивается остро, в форме гриппоподобного заболевания с повышения температуры тела и симптомов интоксикации. Характерен ринит с серозно-слизистыми выделениями, сухой кашель, гиперемия и зернистость слизистой оболочки зева. Возможны проявления болезни в виде фарингита с регионарным лимфаденитом и кратковременной субфебрильной лихорадкой. У детей иногда развивается ложный круп, а течение заболевания в ряде случаев осложняется пневмонией и миокардитом. В неосложненных случаях лихорадка сохраняется около 3 дней, катаральные явления - около недели.
Энтеровирусную диарею (вирусный гастроэнтерит, «рвотную болезнь») чаще вызывают вирусы ECHO. В основном болеют дети до 2 лет, реже - взрослые. Возможен короткий продромальный период, который проявляется общим недомоганием, слабостью, головной болью, отсутствием аппетита. Болезнь развивается остро с подъема температуры тела до 38-39 °С, реже до субфебрильных цифр. Лихорадочный период продолжается в среднем около недели. Одновременно с повышением температуры тела отмечают жидкий стул без патологических примесей до 2-10 р/сут. Характерно вздутие живота, возможна болезненность при пальпации (более выраженная в илеоцекальной области). Аппетит отсутствует, язык обложен. В первые дни нередко отмечается многократная рвота, однако обезвоживания не наступает. Иногда отмечается гепатоспленомегалия. Часто наблюдаются признаки катарального воспаления ВДП.
Энцефаломиокардит новорожденных - наиболее тяжелый вариант энтеровирусной инфекции, вызываемый вирусами Коксаки В (типы 2-5) и возникающий в виде вспышек в родильных домах. Источником возбудителя инфекции могут быть роженицы (заражение реализуется через плаценту или в процессе родов) или медицинский персонал. На фоне подъема температуры отмечают нарушение аппетита, сонливость, рвоту, понос. Лихорадка имеет двухволновой характер (иногда отсутствует). Характерны цианоз или серый цвет кожи, тахикардия, одышка, расширение границ сердца, глухость тонов, нарушение сердечного ритма, появление шумов на сердце, увеличение размеров печени и селезенки, отеки, в редких случаях желтуха и геморрагическая сыпь. При поражении ЦНС возникают судороги, возможно развитие комы. При исследовании СМЖ выявляют лимфоцитарный плеоцитоз.
Паралитическую (спинальную, полиомиелитподобную) форму вызывают вирусы Коксаки А (типы 4, 7, 10, 14) и В (типы 1-6), а также вирусы ECHO (типы 2, 4, 6, 1, 9, 11, 16). Заболевание чаще регистрируют в теплое время года в виде спорадических случаев у детей 1-5 лет. Протекает преимущественно в виде легких паралитических форм. Тяжелые формы возникают редко. У трети больных отмечают препаралитический период, для которого характерны симптомы, свойственные другим формам энтеровирусной инфекции (малой болезни, респираторной, герпангине). Чаще парезы возникают остро, на фоне полного здоровья, при этом температура тела повышается незначительно или остается нормальной. Обычно поражаются нижние конечности и развивается так называемая утренняя хромота. Возникает нарушение походки в виде прихрамывания, при этом подгибается колено, свисает стопа, наблюдается ротация ноги кнаружи и снижение мышечного тонуса. Поверхностные и глубокие рефлексы не нарушаются; реже отмечают гипо- или гиперрефлексию. При наличии лихорадки в СМЖ обнаруживают небольшое повышение содержания белка, умеренный лимфоцитарный плеоцитоз. Парезы проходят относительно быстро, обычно с полным восстановлением двигательных функций, но в редких случаях в течение нескольких месяцев сохраняются гипотония и гипотрофия пораженных мышц. При тяжелом течении бульбарных, бульбоспинальных форм возможен летальный исход.
К редким формам энтеровирусных инфекций относят энцефалит, менингоэнцефалит, миокардит, перикардит, эпидемический геморрагический конъюнктивит, увеит, нефрит, панкреатит, гепатит.
Осложнения. При эпидемической миалгии, серозном менингите, энцефалите и менингоэнцефалите в ряде случаев развивается ОНГМ. При бульбарных нарушениях возможны тяжелые аспирационные пневмонии. В ряде случаев респираторная форма осложняется вторичной бактериальной пневмонией, крупом. В 8-10% случаев эпидемический геморрагический кератоконъюнктивит и увеит приводят к развитию катаракты и двусторонней слепоты.
Диагноз энтеровирусной инфекции при возникновении эпидемической вспышки и типичных клинических проявлений обычно не вызывает затруднений, но требует лабораторного подтверждения. Сложна диагностика атипичных и легких форм болезни.
Окончательно устанавливают диагноз при помощи серологических исследований и выделения вируса из носоглоточной слизи, цереброспинальной жидкости, фекалий, крови. Высокой эффективностью отличается метод ПЦР. Для серологического исследования в РН, РСК, РТГА и реакции преципитации в геле используют парные сыворотки, полученные с интервалом в 10-12 дней (первая - на 4-5-й день болезни, вторая - после 14-го дня болезни). Диагностический критерий - нарастание титра антител в 4 раза и более. Обнаружение вируса в испражнениях при отсутствии нарастания титра антител в динамике болезни не служит основанием для постановки диагноза энтеровирусной инфекции, так как часто наблюдают бессимптомное носительство.
Дифференциальная диагностика
Дифференциальную диагностику необходимо проводить с большим количеством болезней ввиду многочисленности клинических форм энтеровирусных инфекций.
Серозный менингит и менингоэнцефалитическую форму энтеровирусной инфекции дифференцируют с серозными менингитами и менингоэнцефалитами другой этиологии.
В ряде случаев при эпидемической миалгии необходимо проводить дифференциальную диагностику с острыми хирургическими заболеваниями: острым аппендицитом, холециститом, кишечной непроходимостью, а также исключать развитие плеврита или приступа стенокардии.
Для полиомиелита (в отличие от полиомиелитподобной формы энтеровирусной инфекции) характерно острое начало с быстрым подъемом температуры, выраженными катаральными (ринит, тонзиллит, трахеит, бронхит) и диспепсическими явлениями, а также отсутствие полного регресса парезов и параличей.
Наличие экзантемы при энтеровирусной инфекции требует дифференциальной диагностики с такими заболеваниями, как скарлатина, корь, краснуха, парвовирусная инфекция. При этом надо обращать внимание на характерные для этих заболеваний продромальный период, этапность высыпаний, характер и локализацию экзантемы и другие клинические признаки, а также данные эпидемиологического анамнеза. Необходимо также исключить у пациента аллергическую сыпь.
Герпангину дифференцируют с афтозным стоматитом.
При энтеровирусной диарее дифференциальную диагностику проводят с другими острыми диарейными инфекциями, в частности с рота-, норо- и аденовирусной инфекциями. Во всех случаях необходима лабораторная верификация соответствующей инфекции.
Лечение
Госпитализация проводится по клиническим показаниям. Этиотропные средства отсутствуют. Проводят дезинтоксикационную терапию. При менингитах и менингоэнцефалитах назначают дегидратационную терапию с использованием петлевых диуретиков (фуросемид, ацетазоламид), при тяжелом течении используют дексаметазон по 0,25 мг/кг в сутки в течение 2-4 сут.
С целью улучшения реологических свойств крови и сосудистого тонуса используют пентоксифиллин, Солкосерил♠, винпоцетин. При эпидемической миалгии для купирования болевого синдрома применяют НПВС. Лечение больных с полиомиелитподобными формами проводят так же, как больных полиомиелитом, а больным энтеровирусным миокардитом назначают кардиопротекторы.
Прогноз
У подавляющего большинства больных заболевание заканчивается полным выздоровлением. Тяжелое течение с летальным исходом возможно при энцефаломиокардите новорожденных, энцефалитах и менингоэнцефалитах, паралитической форме энтеровирусной инфекции. После перенесенного энцефалита в ряде случаев сохраняются геми- или монопарезы; после полиомиелитной формы болезни - снижение мышечного тонуса и гипотрофия конечности; при поражениях органа зрения - катаракта и двусторонняя слепота.
Диспансерное наблюдение за лицами, перенесшими энтеровирусную инфекцию, не регламентировано.
Полиомиелит
Полиомиелит (эпидемический детский паралич, болезнь Гейне-Медина) - острая вирусная антропонозная инфекционная болезнь с фекально-оральным механизмом передачи возбудителя, характеризующаяся преимущественным поражением двигательных нейронов спинного и головного мозга с развитием параличей.
Коды по МКБ-10
А80 Острый полиомиелит.
Этиология
Возбудитель - РНК-содержащий полиовирус семейства Picornaviridae рода Enterovirus размером 15-30 нм. Известно 3 серотипа вируса: I, II и III. Все типы близки по своему строению и отличаются последовательностью нуклеотидов. Выделено два типоспецифических антигена полиовирусов: N (нативный), который находится в интактных вирионах, содержащих РНК, и H (гретый), который выделяется из капсидов, не содержащих РНК. Н-антиген инициирует у человека первичную реакцию антителообразования, сменяющуюся в дальнейшем реакцией на N-антиген. Репродукция вируса происходит в цитоплазме пораженных клеток.
Вирус устойчив в окружающей среде. Длительно сохраняется при низкой температуре (в замороженном состоянии - до нескольких лет); несколько месяцев - в фекалиях, сточных водах, молоке и на овощах. Устойчив к колебаниям рН, малочувствителен к спирту, хорошо сохраняется в 50% глицерине. Вирус полиомиелита быстро инактивируется хлорсодержащими веществами (3-5% хлорамином), 15% серной и 4% хлористоводородной кислотами, растворами йода, калия перманганата, медным купоросом, сулемой и под действием ультрафиолетовых лучей. При кипячении погибает мгновенно.
Эпидемиология
Источник и резервуар возбудителя - человек (больной или вирусоноситель). Вирус выделяется с носоглоточной слизью в течение инкубационного периода и до 5-го дня после начала болезни, с фекалиями - от нескольких недель до 3-4 мес. Больной наиболее заразен в остром периоде болезни.
Основной механизм передачи вируса - фекально-оральный, который реализуется водным, пищевым и контактно-бытовым путями. Воздушно-капельный путь заражения возможен в первые дни болезни и начальном периоде вирусоносительства. В странах с умеренным климатом отмечается летне-осенняя сезонность. Наиболее подвержены заражению дети до 3 лет, но могут заболеть и взрослые. При инфицировании чаще всего развивается бессимптомная инфекция или абортивная форма болезни, и лишь в одном из 200 случаев - типичные паралитические формы полиомиелита, при этом от 5 до 10% погибают от ОДН вследствие паралича дыхательной мускулатуры.
После перенесенной инфекции вырабатывается стойкий типоспецифический иммунитет. Пассивный иммунитет, полученный от матери, сохраняется в течение первого полугодия жизни.
До начала вакцинации, в начале 50-х гг. ХХ в., полиомиелит регистрировался более чем в ста странах мира. Благодаря глобальной кампании по эрадикации полиомиелита с помощью массовой вакцинации инактивированной вакциной Солка и живой вакциной Сэбина, которая проводится ВОЗ с 1988 г., число случаев полиомиелита снизилось с 350 тыс. до нескольких сотен в год. В 2002 г. ВОЗ объявила Россию территорией, свободной от полиомиелита.
Меры профилактики
Специфическую профилактику проводят поливалентной (приготовленной из трех типов аттенуированного вируса) оральной живой вакциной (живой вакциной Сэбина) согласно календарю прививок с 3-месячного возраста троекратно с интервалом 45 дней. Ревакцинация - в 18, 20 мес и 14 лет.
Обязательна ранняя изоляция больных полиомиелитом на 40 дней от начала заболевания. В очаге проводят заключительную дезинфекцию и расширенное эпидемиологическое обследование. За контактными лицами наблюдают 21 день.
В детских учреждениях на тот же срок вводится карантин. Обязательна немедленная вакцинация детей младше 7 лет, привитых с нарушением графика, и всех выявленных непривитых независимо от возраста.
Патогенез и патоморфология
Полиовирусы попадают в организм человека через слизистую оболочку ЖКТ и носоглотки, в которых происходит первичная репликация вируса. При отсутствии диссеминации возбудителя инфекционный процесс протекает по типу носительства. Если происходит гематогенное и лимфогенное распространение возбудителя, но вирус не проникает в ЦНС, развиваются абортивные формы болезни. При преодолении вирусом ГЭБ развивается менингеальная или паралитическая форма болезни. Полиовирусы обладают высокой тропностью к серому веществу головного и спинного мозга. Наиболее часто поражаются крупные двигательные нейроны передних рогов спинного мозга, реже - двигательные ядра черепных нервов, ствола мозга и др. Поражения сопровождаются воспалительной реакцией и дистрофическими изменениями, приводящими к гибели нейронов и развитию парезов и параличей по периферическому типу. Сохранение части нейронов и восстановление функции поврежденных нейронов определяет возможность последующего частичного или полного восстановления функций мышц. Смерть больных наступает в результате паралича дыхательных мышц или дыхательного центра головного мозга, бульбарных нарушений, а также присоединения аспирационной пневмонии.
Клиническая картина
Инаппарантная форма, развивающаяся почти в 90% случаев, представляет собой здоровое вирусоносительство, при котором вирус не выходит за пределы лимфоглоточного кольца и кишечника. О перенесенной инфекции судят по результатам вирусологического и серологического исследований.
Различают следующие клинические формы полиомиелита: абортивную (без поражения ЦНС), менингеальную и паралитическую (наиболее типичную).
В зависимости от локализации процесса выделяют: спинальный, бульбарный, энцефалитический и смешанный (сочетанный) варианты паралитической формы.
Инкубационный период продолжается от 3 до 35 дней, чаще - 7-12 дней.
Для абортивной (катаральной) формы болезни (так называемая малая болезнь) характерно острое начало: кратковременное повышение температуры тела, умеренная интоксикация, головная боль, легкое катаральное воспаление ВДП, боли в животе, иногда сопровождающиеся рвотой и жидким стулом без патологических примесей. Протекает доброкачественно и завершается выздоровлением через 3-7 дней. Диагноз ставят на основании эпидемиологических и лабораторных данных.
При менингеальной форме болезнь начинается остро с подъема температуры тела до 39-40 °С с выраженной головной боли, рвоты, боли в спине, шее, конечностях. Менингеальные симптомы выражены умеренно, но могут и отсутствовать, несмотря на воспалительные изменения СМЖ. Типичны наличие симптомов натяжения нервных стволов (Нери, Ласега, Вассермана) и болезненность при пальпации по ходу нервных стволов. Часто выявляется горизонтальный нистагм. Возможно двухволновое течение болезни. Первая волна протекает как абортивная форма болезни, а затем после ремиссии, длящейся от одного до пяти дней, развивается картина серозного менингита. При люмбальной пункции прозрачная СМЖ вытекает под повышенным давлением. Иногда воспалительные изменения в СМЖ могут появляться на 2-3 дня позже возникновения менингеального синдрома. Течение болезни доброкачественное: к началу 2-й недели болезни нормализуется температура, регрессирует менингеальный синдром, а к 3-й неделе происходит нормализация состава СМЖ.
Спинальная (паралитическая) форма болезни наблюдается менее чем у одного на 1000 инфицированных. Выделяют четыре периода: препаралитический, паралитический, восстановительный, резидуальный период.
Препаралитический период длится 3-6 дней. Болезнь начинается остро, с общей интоксикации, лихорадки (иногда - двухволновой). В первые дни болезни отмечаются катаральные симптомы: ринит, трахеит, тонзиллит, бронхит. Возможна диарея, чаще у детей младшего возраста. На 2-3-й день присоединяются симптомы поражения ЦНС. При двухволновой температурной кривой неврологические симптомы появляются на второй волне после 1-2-дневной апирексии. Появляется головная боль, боли в конечностях и спине по ходу нервных стволов, рвота центрального генеза, гиперестезия, менингеальные симптомы, а также симптомы натяжения нервных стволов и корешков спинномозговых нервов. Больные вялы, сонливы, капризны. Изменения вегетативной нервной системы проявляются выраженной потливостью. Возможны фибрилляции мышц, задержка мочеиспускания. К концу первого периода общее состояние улучшается, уменьшается интоксикация, снижается температура, но усиливается болевой синдром, и болезнь переходит в паралитический период. Параличи появляются на 2-6-й день болезни, реже (при отсутствии препаралитического периода) - в первый день («утренний паралич»). Типично бурное развитие вялых асимметричных парезов и параличей мышц туловища и конечностей, нарушение функции тазовых органов в течение короткого времени - от нескольких часов до 1-3 дней. Характерны мышечный гипотонус, гипо- или арефлексия, проксимальная локализация поражений и их мозаичность. Клинические проявления зависят от локализации поражения нервной системы. Чаще поражается поясничный отдел спинного мозга с развитием парезов и параличей мышц тазового пояса и нижних конечностей. При грудной локализации процесса параличи, распространяясь на межреберные мышцы и диафрагму, вызывают дыхательные расстройства. Поражение шейного и грудного отделов спинного мозга проявляется параличами и парезами мышц шеи и рук. В зависимости от количества пораженных сегментов спинного мозга спинальная форма может быть ограниченной (монопарез) или распространенной. Изолированное поражение отдельных мышц при сохранении функций других приводит к нарушению взаимодействия между ними, развитию контрактур, деформаций суставов. Паралитический период длится от нескольких дней до 2 нед, после чего начинается восстановительный период. Наиболее заметное восстановление нарушенных функций происходит в первые 3-6 мес. В дальнейшем темп замедляется, но восстановление продолжается до года, иногда до двух лет. При отсутствии положительной динамики в течение полугода оставшиеся параличи и парезы рассматриваются как резидуальные. Резидуальный период характеризуется атрофией мышц, развитием контрактур суставов, остеопорозом, деформацией костей, у детей - отставанием пораженных конечностей в росте, при поражении длинных мышц спины - искривлением позвоночника, при поражении мышц брюшного пресса - деформацией живота. Чаще остаточные явления наблюдаются в нижних конечностях.
Для бульбарной формы характерна высокая лихорадка, выраженная интоксикация, рвота, тяжелое состояние больных. Препаралитический период короткий или отсутствует. Эта форма болезни сопровождается вовлечением в процесс жизненно важных центров, контролирующих дыхание, кровообращение, терморегуляцию. Поражение ядер IX и X пар черепных нервов приводит к гиперсекреции слизи, расстройствам глотания, фонации и, как следствие, - к обструкции дыхательных путей, нарушению вентиляции легких, гипоксии, развитию аспирационной пневмонии. При поражении дыхательного и сосудодвигательного центров нарушается нормальный ритм дыхания (паузы и патологические ритмы), отмечается нарастающий цианоз, нарушение ритма сердечной деятельности (тахи- или брадиаритмия), а также повышение и последующее падение АД. Наблюдается психомоторное возбуждение, спутанность сознания, а затем - сопор и кома. При стволовых формах с поражением ядер III, VI и VII пар черепных нервов выявляются глазодвигательные нарушения и асимметрия лица вследствие пареза мимических мышц. Нередко бульбарная форма заканчивается летальным исходом. Если смерть не наступает, то в ближайшие 2-3 дня происходит стабилизация процесса, а со 2-3-й недели болезни состояние больных улучшается и наступает полное восстановление утраченных функций.
При изолированном поражении ядра лицевого нерва, находящегося в области варолиева моста мозга, развивается менее тяжелая понтинная форма. Препаралитический период, лихорадка, общая интоксикация, менингеальные симптомы часто могут отсутствовать. При осмотре больного выявляют парез или паралич мимической мускулатуры половины лица, несмыкание глазной щели (лагофтальм), опущение угла рта. Течение доброкачественное, но возможно стойкое сохранение пареза лицевого нерва.
Осложнения. При тяжелом течении болезни с поражением диафрагмы, вспомогательных дыхательных мышц, дыхательного центра, iX, X, XII пар черепных нервов наблюдаются пневмонии, ателектазы и деструктивные поражения легких, часто приводящие к летальному исходу.
Диагностика
Предварительный диагноз устанавливается на основании характерной клинической картины (острое начало болезни с лихорадкой, развитием менингорадикулярного синдрома, периферических парезов, параличей с гипотонией, гипо- или арефлексией, гипо- или атрофией без нарушения чувствительности) и эпидемиологических данных: контакт с больными или недавно привитыми. Учитывается также связь с прививкой, отсутствие или неполная вакцинация. Подтверждают диагноз нарастанием титра вируснейтрализующих антител в 4 раза и более в РСК или РН в парных сыворотках, взятых с интервалом 14-21 день. Используют также вирусологические исследования. Вирус можно выделить из испражнений, реже - из носоглоточной слизи, СМЖ.
При исследовании СМЖ обнаруживается 2-3-значный лимфоцитарный плеоцитоз (в первые дни болезни он может быть нейтрофильным). В острой стадии заболевания концентрации белка и глюкозы обычно находятся в пределах нормы. Для паралитической формы полиомиелита характерна смена клеточно-белковой диссоциации в начале болезни на белково-клеточную (снижение плеоцитоза, нарастание концентрации белка) через 1-2 нед.
Дифференциальная диагностика
Дифференциальная диагностика полиомиелита определяется его клинической формой.
Абортивная форма болезни клинически неотличима от многих ОРВИ или диарей, вызываемых энтеровирусами группы Коксаки-ЕСНО, ротавирусами и другими вирусными агентами.
При менингеальной форме проводят дифференциальную диагностику с другими серозными менингитами (энтеровирусным, паротитным, туберкулезным), а в ранние сроки болезни при нейтрофильном плеоцитозе в СМЖ необходимо исключать и БГМ.
Спинальная форма паралитического полиомиелита дифференцируется с болезнями опорно-двигательного аппарата, с миелитом, полиомиелитической формой клещевого энцефалита, дифтерийной полинейропатией, полирадикулоневритом, спинальной амиотрофией Верднига-Гоффманна.
При понтинной форме болезни дифференциальную диагностику проводят с невритом лицевого нерва, для которого не характерна общая инфекционная симптоматика и наблюдается хотя бы один из следующих симптомов: слезотечение на стороне поражения, снижение вкусовой чувствительности на сладкое и соленое на передних 2/3 языка с больной стороны, болезненность тригеминальных точек при пальпации, спонтанные боли и нарушение чувствительности на лице.
Бульбарную форму дифференцируют со стволовыми энцефалитами, при которых доминируют глубокие расстройства сознания и судорожный синдром.
В отличие от полиомиелита, поражение двигательных черепных нервов при полирадикулоневрите обычно носит двусторонний симметричный характер: диплегия лицевых мышц, двустороннее поражение глазодвигательного нерва.
Поражения нервной системы, клинически неотличимые от полиомиелита, могут вызывать энтеровирусы группы Коксаки-ЕСНО, реже другие вирусные агенты.
В этих случаях необходимо использовать весь комплекс вирусологических, серологических методов диагностики, а также ПЦР.
Лечение
Больные полиомиелитом и с подозрением на него подлежат экстренной изоляции в специализированные отделения или боксы. Специфических противовирусных средств нет. В препаралитическом и паралитическом периодах обязателен абсолютный покой. Вводят ИФН-α2, нормальный человеческий иммуноглобулин, рибонуклеазу. Проводится дезинтоксикационная и дегидратационная терапия. Назначаются витамины группы В и болеутоляющие средства, метамизол натрия. При параличах применяют горячие укутывания, припарки. В течение 30 дней назначают бендазол (Дибазол♠) из расчета 1 мг/кг и аскорбиновую кислоту по 0,5-1,0 г/кг. При дыхательных расстройствах проводят ИВЛ, санацию ротоглотки и дыхательных путей. При расстройствах глотания - зондовое кормление. В обязательном порядке проводится ортопедическая коррекция: необходим ортопедический режим, обеспечивающий физиологическое положение конечности (вплоть до использования гипсовых лонгет). Применяют антихолинэстеразные препараты [неостигмина метил-сульфат (Прозерин♠), оксазиρ, галантамин] курсами по 10-20 дней, при необходимости чередуя курсы. В восстановительном периоде назначают анаболические гормоны [нандролон (Ретаболил♠), метандиенон (Метандростенолон♠)], витамины группы В (B1, В6 и В12), никотиновую кислоту, кокарбоксилазу, ноотропные средства.
Для улучшения функции мышц используют препараты фосфора, калия и физиотерапевтические методы (ультравысокочастотная терапия, электрофорез кальция хлорида, калия йодида, брома, аппликации парафина, диатермия). Физиотерапевтическое лечение проводится курсами продолжительностью 1-1,5 мес. Назначение массажа и ЛФК возможно после нормализации температуры тела и исчезновения симптомов общей интоксикации и болей.
В резидуальном периоде для лечения остаточных явлений проводится ортопедическая и хирургическая коррекция.
Прогноз
Прогноз благоприятный при инаппарантной и абортивной формах полиомиелита. Тяжелое течение с летальными исходами при менингеальной форме чрезвычайно редко.
Исход паралитической формы полиомиелита зависит от тяжести и уровня поражения ЦНС. При своевременном и правильном лечении восстановление функций без последствий происходит в трети случаев. При тяжелом бульбарном параличе летальность достигает 60%.
Диспансерное наблюдение за переболевшими не регламентировано. Сроки наблюдения за больными определяются индивидуально, но при менингеальной и паралитических формах составляют не менее года.
Диареи вирусной этиологии Ротавирусная инфекция
Ротавирусная инфекция (ротавирусный гастроэнтерит) - острая антропонозная инфекционная болезнь с фекально-оральным механизмом передачи возбудителя, характеризующаяся развитием гастроэнтерита с обезвоживанием.
Код по МКБ-10
A08.0 Ротавирусный энтерит.
Этиология
Возбудитель - РНК-содержащий вирус семейства Reoviridae рода Rotavirus.
Под электронным микроскопом вирусные частицы выглядят как колеса с широкой ступицей, короткими спицами и четко очерченным тонким ободом. Геном ротавируса состоит из 11 сегментов двухцепочечной РНК, каждый из которых кодирует структурные протеины вириона (VP) и неструктурные белки.
Ротавирусы устойчивы к воздействию факторов окружающей среды: в питьевой воде, открытых водоемах и сточных водах они сохраняются до нескольких месяцев; на овощах - 25-30 дней; на хлопке и шерсти - до 15-45 дней; на поверхности мебели и на полу - до 7-15 дней. Ротавирусы не разрушаются при многократном замораживании. Погибают при кипячении, обработке фенольными соединениями, крезолом, формалином, растворами с рН более 9 либо менее 3. Эффективен для инактивации ротавирусов 95% этанол. Оптимальные условия сохранения вирусов: температура 4 °С и высокая (>90%) или низкая (<14%) влажность. Инфекционная активность возрастает при добавлении протеолитических ферментов (трипсина, панкреатина).
Ротавирусы классифицируются на серогруппы и серотипы. Известно не менее 7 серогрупп (A, B, C, D, E, F, G), выделение которых основывается на антигенных свойствах структурного белка внутреннего капсида VP6. Патогенными для человека являются серогруппы А, В и С. Серогруппа А наиболее часто обусловливает ротавирусный гастроэнтерит у человека, вызывая эндемические вспышки тяжелой диареи у детей младшего возраста как в развитых, так и в развивающихся странах.
Репликация ротавирусов в организме человека происходит в эпителиальных клетках тонкой кишки.
Эпидемиология
Ротавирусная инфекция встречается повсеместно и выявляется во всех возрастных группах. В структуре ОКИ доля ротавирусного гастроэнтерита колеблется от 9 до 73%, в зависимости от возраста, региона, уровня жизни, сезона и охвата детского населения вакцинацией от ротавирусов. Официальная регистрация ротавирусной инфекции в России проводится с 1990 г. Особенно часто болеют дети первых лет жизни (преимущественно от 6 мес до 2 лет). Ротавирусы - одна из причин диареи, сопровождающейся тяжелой дегидратацией у детей в возрасте до 3 лет, этой инфекцией обусловлено до 30-50% и более всех случаев диареи, требующих госпитализации или проведения интенсивной регидратации. По данным ВОЗ, от этого заболевания в мире ежегодно умирают от 1 до 3 млн детей. Ротавирусная инфекция является этиологическим фактором 25% случаев диареи путешественников.
В России частота ротавирусного гастроэнтерита в структуре других ОКИ колеблется от 7 до 35%, а среди детей до 3 лет - превышает 60%.
Основной источник и резервуар ротавирусной инфекции - больной человек, выделяющий с фекалиями значительное количество вирусных частиц в конце инкубационного периода и в первые дни болезни (до 1010 в 1 г). После 4-5-го дня болезни количество вируса в испражнениях значительно снижается, однако общая продолжительность выделения возбудителя составляет до 2-3 нед. Длительно выделяют вирусные частицы больные с нарушенной иммунологической реактивностью, при хронической сопутствующей патологии ЖКТ, лактазной недостаточности. Источником возбудителя инфекции могут быть также здоровые вирусоносители, в фекалиях которых ротавирус можно определять на протяжении нескольких месяцев.
Механизм передачи возбудителя - фекально-оральный. Пути передачи: контактно-бытовой (через грязные руки и предметы обихода), водный (при употреблении инфицированной вирусами воды, в том числе бутилированной), алиментарный (чаще всего при употреблении молока, молочных продуктов).
Не исключена возможность воздушно-капельного пути передачи ротавирусной инфекции, при этом для заражения человека достаточно всего 10 вирусных частиц.
Ротавирусная инфекция высококонтагиозна, о чем свидетельствует быстрое распространение заболевания в окружении больных. Во время вспышек заболевает до 70% неиммунного населения. При сероэпидемиологическом исследовании в крови 90% детей старших возрастных групп обнаруживают антитела к различным ротавирусам.
Ротавирусы - одна из наиболее частых причин внутрибольничной инфекции, особенно среди недоношенных новорожденных и детей раннего возраста.
На территориях с умеренным климатом ротавирусная инфекция носит сезонный характер, преобладая в холодные зимние месяцы, что связывают с лучшей выживаемостью вируса в окружающей среде при низких температурах и благоприятными условиями передачи в закрытых помещениях. В России около 60-70% случаев ротавирусного гастроэнтерита приходится на зимне-весенний период, около 20-30% регистрируются осенью и 10% - летом.
После перенесенной инфекции в большинстве случаев формируется непродолжительный типоспецифический иммунитет. Возможны повторные заболевания, особенно в старших возрастных группах.
Меры профилактики
Мероприятия в эпидемическом очаге направлены на выявление больных, подозрительных на наличие ротавирусного гастроэнтерита. Больные изолируются из детских коллективов. Дети, посещающие детские учреждения, выписанные из больницы или закончившие лечение на дому, с отрицательными результатами лабораторного обследования допускаются в детские коллективы. Медицинское наблюдение за детьми, общавшимися с больными, осуществляется в течение 7 дней со дня изоляции последнего заболевшего. В образовательных учреждениях проводят ограничительные мероприятия в течение 7 дней с момента изоляции последнего больного.
С целью своевременного и полного выявления детей с ротавирусной инфекцией или подозрением на нее в детских дошкольных учреждениях необходимо проведение «утреннего фильтра» во всех группах. Дети с подозрением на ротавирусный гастроэнтерит не допускаются в учреждение.
Лабораторное обследование на ротавирусы детей и взрослых, общавшихся с больными в организованных коллективах, проводится по указанию эпидемиолога и инфекциониста, при возникновении в семье или в детском коллективе повторных заболеваний с аналогичной клинической картиной, грубых нарушениях санитарно-гигиенического режима, наличии в очаге работников пищевых предприятий и лиц, к ним приравненных. Больные с положительными результатами вирусологического и молекулярно-генетического исследования (ПЦР) на ротавирусы подлежат клиническому осмотру инфекционистом.
Для профилактики ротавирусной инфекции зарегистрированы и используются две вакцины: RotaRix (GSK Biologicals, Бельгия) и RotaTeq (Merck&Co., США).
Курс вакцинации состоит из 2 прививок с интервалом между прививками не менее 4 нед. Первая доза вводится детям, начиная с 6-недельного возраста. Вакцинация должна быть завершена к 24-й неделе жизни ребенка. Для создания полноценного иммунитета необходимо получить 2 прививки.
Живая оральная пятивалентная реассортантная ротавирусная вакцина (RV5), RotaTeq (РотаТек♠) (Merck&Co., США) в России зарегистрирована в 2012 г. Она содержит 5 реассортантных (G1, G2, G3, G4, P1A[8]) вирусов. Курс вакцинации состоит из 3 доз препарата с интервалом между введениями от 4 до 10 нед. Первую дозу препарата РотаТек♠ вводят детям в возрасте от 6 до 12 нед. Все 3 дозы рекомендуется ввести до достижения ребенком возраста 32 нед.
Патогенез
Большое значение в развитии ротавирусного гастроэнтерита придают структурным (VP3, VP4, VP6, VP7) и неструктурным (NSP1, NSP2, NSP3, NSP4, NSP5) белкам вируса. В частности, NSP4-пептид - энтеротоксин, вызывающий секреторную диарею, подобно бактериальным токсинам; NSP3 влияет на репликацию вируса, а NSP1 подавляет выработку ИФН-регулирующего фактора 3. Уже через 30 мин после попадания в организм вирус внедряется в апикальные клетки ворсинок тонкой кишки, где происходит его репликация. Ротавирусы вызывают гибель зрелых эпителиоцитов тонкой кишки и отторжение их от ворсинок. Клетки, замещающие ворсинчатый эпителий, функционально неполноценны и не способны адекватно абсорбировать углеводы и простые сахара. Возникновение дисахаридазной (главным образом лактазной) недостаточности ведет к накоплению в кишечнике нерасщепленных дисахаридов с высокой осмотической активностью, что вызывает развитие водянистой диареи, нередко приводящей к дегидратации.
Кроме этого, ротавирусы способны оказывать также стимулирующее действие на вегетативную нервную систему тонкого кишечника, с усилением секреции жидкости, электролитов в просвет кишки и интестинальной моторики, что может усугубить водянистую диарею, укорачивая время эвакуации кишечного содержимого из кишечника.
Факторами саногенеза являются: замещение энтероцитов молодыми клетками, не имеющими рецепторов к РВ, появление в конце первой недели болезни IgM-антител и IgG-антител на 3-4-й неделе.
Клиническая картина
Инкубационный период от 14-16 ч до 7 дней (чаще - 1-4 дня).
Различают типичную (легкую, средней тяжести, тяжелую) и атипичную ротавирусную инфекцию. К атипичным относят стертую (клинические проявления выражены слабо и кратковременны) и бессимптомную формы, лабораторно обнаруживают ротавирус и специфический иммунный ответ). Диагноз вирусоносительства устанавливают при обнаружении ротавируса у здорового человека, не имевшего при обследовании изменений специфического иммунитета в динамике.
Заболевание чаще начинается остро, с повышения температуры тела, появления симптомов интоксикации, диареи и повторной рвоты. Указанные симптомы возникают почти одновременно в 1-й день болезни, достигая максимальной выраженности в течение 12-24 ч. В 10% случаев рвота и диарея появляются на 2-3-й день болезни. Возможно также постепенное начало заболевания, с медленным нарастанием тяжести процесса и развитием обезвоживания, что нередко обусловливает позднюю госпитализацию. Рвота - нередко ведущий признак ротавирусной инфекции. Обычно она предшествует диарее или появляется одновременно с ней, может быть повторной (2-6 раз) или многократной (до 10-12 р/сут и более), продолжается в течение 1-3 дней. Кишечная дисфункция протекает преимущественно по типу гастроэнтерита или энтерита, характеризуясь жидким, водянистым, пенистым стулом желтого или желто-зеленого цвета без патологических примесей с резким кислым запахом. Кратность дефекаций соответствует тяжести болезни. При обильном жидком стуле может развиться обезвоживание, обычно I-II степени. Лишь в отдельных случаях наблюдают дегидратацию III степени с развитием дегидратационного шока. С самого начала заболевания могут наблюдаться боли в животе. Чаще они умеренные, постоянные, локализованы в эпигастрии; в отдельных случаях - схваткообразные, сильные. При пальпации живота отмечают болезненность в эпигастральной и пупочной областях, урчание в правой подвздошной области. Печень и селезенка не увеличены. Признаки поражения органов пищеварения сохраняются в течение 3-6 дней. Повышение температуры тела от субфебрильных до фебрильных значений. Длительность лихорадки в пределах 2-4 дней, нередко лихорадка сопровождается симптомами интоксикации (вялость, слабость, снижение аппетита). У части больных, преимущественно у детей младшего возраста, наблюдают катаральные явления: покашливание, насморк или заложенность носа, редко - конъюнктивит, катаральный отит. При осмотре обращают на себя внимание гиперемия и зернистость мягкого нёба, нёбных дужек, язычка.
У отдельных пациентов наблюдаются незначительные протеинурия, лейкоцитурия, эритроцитурия, а также повышение содержания креатинина и мочевины в сыворотке крови. В начале болезни может быть лейкоцитоз с нейтрофилезом без сдвига влево, сменяющийся лейкопенией с лимфоцитозом; СОЭ не изменена. Для копроцитограммы характерно отсутствие признаков выраженного воспалительного процесса, в то же время обнаруживаются зерна крахмала, непереваренная клетчатка, нейтральный жир. У большинства больных ротавирусной инфекцией отмечают нарушение состава микрофлоры фекалий, в первую очередь, снижение содержания бифидобактерий, а также рост числа условно-патогенных микробных ассоциаций. Выявляют признаки лактазной недостаточности, в том числе кислые значения pH кала.
Осложнения ротавирусной инфекции: дегидратационный шок, острая сердечно-сосудистая недостаточность, острая экстраренальная почечная недостаточность, вторичная дисахаридазная недостаточность, дисбиоз кишечника (синдром избыточного бактериального роста).
Возможна вторичная бактериальная инфекция, что приводит к изменениям клинической картины болезни и требует коррекции терапевтического подхода.
Летальные исходы чаще встречаются у детей раннего возраста, имеющих выраженный иммунологический дефицит и гипотрофию, а также среди пожилых пациентов с тяжелой сопутствующей патологией.
Диагностика
Основные клинико-диагностические признаки ротавирусной инфекции: характерный эпидемиологический анамнез - групповой характер заболевания в зимнее время года, острое начало болезни, повышение температуры тела и синдром интоксикации, рвота как ведущий симптом, водянистая диарея, умеренно выраженные боли в животе, метеоризм.
Для лабораторного подтверждения ротавирусной инфекции используют РЛА, ИФА, ПЦР, для ретроспективной дигностики - РТГА и РНГА.
Дифференциальный диагноз проводят с другими вирусными диареями, пищевыми токсикоинфекциями, шигеллезом, сальмонеллезом, холерой, эшерихиозом, кампилобактериозом.
Лечение
Госпитализации подлежат больные со среднетяжелой и тяжелой формами ротавирусной инфекции, а также пациенты из закрытых коллективов, декретированные контингенты. Комплексное лечение ротавирусной инфекции включает лечебное питание, патогенетическую и симптоматическую терапию. Из диеты исключают молоко и молочные продукты, ограничивают употребление углеводов (овощи, фрукты и соки, бобовые). Пища должна быть физиологически полноценной, механически и химически щадящей.
Патогенетическое лечение, направленное на борьбу с дегидратацией и интоксикацией, осуществляют путем введения полиионных кристаллоидных растворов, внутривенно или внутрь, с учетом степени обезвоживания и массы тела больного. Оральную регидратацию проводят Цитраглюкосоланом¤, Регидроном♠, оралитомρ. Для инфузионной терапии используют раствор, рекомендованный ВОЗ [3-5 г NaCl, 1,5 г KCl, 20 г декстрозы (Глюкозы♠) на 1 л воды]; Трисоль♠; квартасолρ; Ацесоль♠. Противорвотные препараты назначают с учетом возраста и выраженности симптома. Эффективны энтеросорбенты: Полифепан♠, Энтеросгель♠ и др. Показано применение ферментов (панкреатин и др.).
Прогноз
Прогноз серьезный. При отсутствии своевременной регидратации возможен летальный исход. Переболевших выписывают при полном клиническом выздоровлении, наступающем в большинстве случаев к 5-7-му дню от начала болезни.
После перенесенного заболевания пациенту рекомендуют в течение 2-3 нед соблюдать диету с ограничением молока и молочных продуктов, углеводов.
Норовирусная инфекция
Норовирусная инфекция - острая антропонозная инфекционная болезнь с преимущественно фекально-оральным механизмом передачи возбудителя, характеризующаяся умеренной интоксикацией и картиной острого гастроэнтерита с доброкачественным течением.
Код по МКБ-10
A08.1 Острая гастроэнтеропатия, вызванная возбудителем Норволк.
Этиология
Возбудитель - однонитевые (ssRNA) РНК-содержащих вирусы семейства Caliciviridae. Имеют белковую структуру, округлую форму и размеры около 27-32 нм. Отличаются генетическим разнообразием.
Nv сохраняют жизнеспособность в окружающей среде длительное время (до месяца), в том числе в хлорированной питьевой воде; устойчивы к нагреванию и замораживанию, ультрафиолетовому излучению и действию ряда дезинфицирующих средств (этанол, эфир, жирорастворители). Инактивируются в кислой среде (рН 3,0-5,0), при воздействии температуры выше 60 °C и 0,1-0,5% раствора хлорамина.
Эпидемиология
Источник возбудителя инфекции - больной человек, выделяющий вирус в течение 3-7 нед после заражения. У иммунокомпрометированных пациентов длительная персистенция Nv. Количество вируса в кале больного колеблется от 103 до 106 при инфицирующей дозе 10 вирусных частиц, что, наряду с высокой устойчивостью возбудителя, лежит в основе быстрого распространения Nv-инфекции и развития вспышек.
Основной механизм передачи возбудителя - фекально-оральный, реализующийся контактно-бытовым (88% случаев), пищевым (10% случаев) и водным (2% случаев) путем. Определенное значение имеет и воздушно-капельный путь передачи Nv, содержащегося в аэрозолях, образующихся при рвоте и диарее, что также способствует быстрому вовлечению в эпидемический процесс большого количества людей в местах их скопления (больницы, детские сады, детдома, школы, санатории для пожилых людей, места общественного питания, гостиницы, круизные суда, войсковые части и др.).
Заболеваемость при Nv-инфекции может иметь спорадический, групповой и вспышечный характер. Для вспышек Nv-гастроэнтерита характерно затяжное и волнообразное течение с поражением в основном детей школьного возраста, молодых и пожилых людей. Спорадические случаи чаще наблюдаются у детей и пожилых.
В России подъем спорадической заболеваемости регистрируется в январе-феврале. Появление нового эпидемического штамма может быть причиной роста заболеваемости весной и летом.
Заболевание широко распространено. У 50-70% взрослых, проживающих как в развитых, так и в развивающихся странах, определяются антитела к Nv, появляющиеся еще в детском возрасте. С середины 90-х годов прошлого века отмечен рост циркуляции Nv. В 2006 г. ВОЗ сообщила о пандемии Nv-инфекции.
Официальная регистрация норовирусной инфекции в РФ введена с 2009 г. До 80% от всех случаев норовирусной инфекции в РФ приходится на детей.
Профилактика
Противоэпидемические мероприятия такие же, как и при других кишечных инфекциях. Однако высокая устойчивость во внешней среде, низкая чувствительность к хлорированию и замораживанию, очень малая заражающая доза дают основание предполагать рост удельного веса Nv-инфекции в структуре ОКИ.
Специфическая профилактика не разработана. Активно ведутся исследования, направленные на создание профилактической вакцины, результаты которых свидетельствуют о перспективности данного направления.
Патогенез
Основной патологический процесс локализуется в тонкой кишке, где вирус нарушает структуру клеток, при этом укорачиваются ворсинки клеток, развивается гиперплазия крипт, собственная пластинка слизистой оболочки кишечника инфильтрируется полиморфно-ядерными и моноядерными клетками. Все это обусловливает стеаторею, нарушение всасывания углеводов и снижение активности некоторых ферментов, располагающихся в пограничном клеточном слое. Аденилатциклазная активность клеток не изменяется. В слизистой оболочке толстой кишки значительных изменений обычно не наблюдается.
Реакция организма на внедрение Nv включает активацию факторов неспецифической резистентности с последующим клоноспецифическим распознаванием антигенов, активацией и клональной экспансией эффекторных клеток (Т- и В-лимфоцитов).
После перенесенного заболевания стойкий иммунитет не формируется, что связано с выраженной изменчивостью Nv. Повторное заражение возможно спустя 27-42 мес.
Клиническая картина
Инкубационный период - от 10 ч до 2-3 сут. Начало заболевания острое, у некоторых больных - короткий субфебрилитет, сильная слабость, адинамия. Самые частые симптомы: тошнота и нечастая кратковременная рвота; боли в эпигастрии и средней части живота (несильные, ноющие или схваткообразные); жидкий стул без патологических примесей не более 5-7 р/сут в течение 1-2 сут.
У большинства пациентов наблюдается головная боль, миалгии. При осмотре живот немного вздут, при пальпации ощущается громкое урчание. Печень и селезенка не увеличиваются. В гемограмме чаще встречается нормоцитоз в сочетании с лимфопенией, изредка обнаруживают лейкоцитоз с относительной лимфопенией.
Почти у трети пациентов выявляется катаральный синдром (насморк, кашель, гиперемия зева). У больных пожилого возраста возможно развитие выраженного обезвоживания, при этом продолжительность желудочно-кишечной дисфункции в среднем составляет 5 дней. У детей на фоне Nv-инфекции в 30% случаев регистрируются судороги, нередко отмечаются и бронхиолиты.
Диагностика
Диагноз ставят на основании клинических и эпидемиологических данных, подтверждают лабораторно, методами ИФА, ПЦР и электронной микроскопии. Для экспресс-диагностики Nv-инфекции применяют иммунохимические тесты, выявляющие антигены вируса. Чувствительность составляет 75-90%, специфичность близка к 100%. Время проведения анализа не превышает 15 мин.
Дифференциальная диагностика
См. «Ротавирусная инфекция».
Лечение
Госпитализацию осуществляют по эпидемиологическим и клиническим показаниям.
Назначают полноценную диету, включающую механически и химически щадящую пищу. Применяют оральную регидратацию, энтеросорбенты, ферменты, биопрепараты. Специфические противовирусные препараты отсутствуют.
Прогноз благоприятный.
Герпесвирусные инфекции*
* Материалы доступны в электронном виде по ссылке, указанной на последней странице книги.
Герпетическая инфекция
ГИ (простой герпес, herpes simplex) - широко распространенная антропонозная вирусная болезнь c преимущественно контактным механизмом передачи возбудителя, характеризующаяся поражением кожи, слизистых оболочек глаз, нервной системы и хроническим рецидивирующим течением.
Коды по МКБ-10
B00.0 Герпетическая экзема.
B00.1 Герпетический везикулярный дерматит.
B00.2 Герпетический вирусный гингивостоматит и фарингостоматит.
B00.3 Герпетический вирусный менингит (G02.0*).
B00.4 Герпетический вирусный энцефалит (G05.1*).
Этиология
Возбудитель - ВПГ типа 1 и 2 (вирус герпеса человека типа 1 и 2), семейства Herpesviridae, подсемейства Alphaherpesviruses, рода Simplexvirus. Размер вируса 120-150 нм. Геном ВПГ представлен двуспиральной линейной ДНК, молекулярная масса около 100 Да. Репликация вируса и сборка нуклеокапсидов происходят в ядре инфицированной клетки. Вирус обладает выраженным цитопатическим действием, вызывая гибель пораженных клеток, однако проникновение ВПГ в нейроны не сопровождается репликацией вируса и гибелью клетки. Клетка оказывает на вирусный геном угнетающее влияние, приводя его в латентное состояние. Через какое-то время может произойти активация вирусного генома с последующей репликацией вируса, в некоторых случаях вновь могут появляться герпетические высыпания, что свидетельствует о реактивации и переходе латентной формы инфекции в манифестную. Геномы ВПГ-1 и ВПГ-2 на 50% гомологичны. Оба вируса могут вызывать поражения кожи, внутренних органов, нервной системы, гениталий. Однако ВПГ-2 вызывает поражения гениталий значительно чаще. ВПГ устойчив к высушиванию, замораживанию, при температуре 50-52 °С инактивируется в течение 30 мин. Липопротеидная оболочка вируса растворяется под действием спиртов и кислот. Обычные дезинфицирующие средства существенного влияния на ВПГ не оказывают. Ультрафиолетовое облучение быстро инактивирует вирус.
Эпидемиология
ГИ распространена повсеместно. Антитела к ВПГ обнаруживают более чем у 90% населения в возрасте старше 40 лет. Эпидемиология ГИ, вызванной вирусами ВПГ-1 и ВПГ-2, различна. Первичное инфицирование ВПГ-1 происходит в первые годы жизни (от 6 мес до 3 лет), чаще всего проявляется везикулезным стоматитом.
Антитела к ВПГ-2 обнаруживают, как правило, у лиц, достигших половой зрелости. Наличие антител и их титр коррелируют с половой активностью. У 30% лиц, имеющих антитела к ВПГ-2, в анамнезе есть указания на перенесенную или текущую инфекцию половых органов, сопровождаемую высыпаниями.
По данным ВОЗ, в мире вирусом ВПГ-1 инфицированы около 3,7 млрд человек в возрасте до 50 лет (67% населения), вирусом ВПГ-2 - около 417 млн человек в возрасте от 15 до 49 лет (11%). Заражение ВПГ-2 увеличивает риск заражения и передачи ВИЧ.
Заболеваемость ГИ в России с 2001 по 2011 г. увеличилась практически в 2 раза. В России 18-20 млн больных ГИ. Рецидивирующими формами герпеса страдают от 10 до 20% населения. Тяжелый генитальный герпес у 5% больных обусловлен ВПГ-1. Инфицирование ВПГ-1 на поздних стадиях беременности более опасно, чем ВПГ-2. Оставаясь на 6-м месте в общей структуре инфекций, передаваемых половым путем, доля генитального сепсиса увеличилась с 2001 г. до 2011 г., т.е. в 3,72 раза.
Источник ВПГ-1 - человек в период реактивации ГИ с выделением вируса в окружающую среду. Возможно бессимптомное выделение со слюной ВПГ-1. Источник ВПГ-2 - больные генитальным герпесом и здоровые лица, в секрете слизистой оболочки половых органов которых содержится ВПГ-2.
Различны и механизмы передачи ВПГ-1 и ВПГ-2. Инфицирование ВПГ-1 происходит в детском возрасте. Основные субстраты вируса - слюна, секрет слизистой оболочки ротоглотки, содержимое герпетических пузырьков, то есть передача вируса происходит путем прямого или непрямого (игрушки, посуда, другие ослюненные предметы) контакта. Основной механизм передачи ВПГ-2 - также контактный, но реализуется преимущественно половым путем. Поскольку и передача ВПГ-1 также возможна половым путем (орально-генитальные контакты), ГИ относят к заболеваниям, передаваемым половым путем. ВПГ можно обнаружить в слюне и половых путях у клинически здоровых лиц. При наличии активных проявлений инфекции частота выделения вируса возрастает в несколько раз, а титр вируса в пораженных тканях - в 10-1000 раз и более. Возможна трансплацентарная передача вируса при наличии у беременной рецидива ГИ, сопровождаемого вирусемией. Однако чаще инфицирование плода происходит при прохождении через родовые пути.
Передача вируса возможна при гемотрансфузии и трансплантации органов. Восприимчивость высокая. В результате перенесенной ГИ формируется нестерильный иммунитет, который может нарушаться.
Профилактика
Лицам с симптомами орального герпеса следует избегать орального контакта с другими людьми и совместного пользования предметами, которые были в контакте со слюной, воздерживаться от оральных половых сношений. Лицам с симптомами генитального герпеса следует воздерживаться от половых сношений.
Лица, инфицированные ВПГ-1, не могут заразиться повторно, однако могут заразиться ВПГ-2. Систематическое и правильное пользование презервативами предупреждает распространение генитального герпеса. Однако презервативы обеспечивают лишь частичную защиту.
Предотвращение первичного инфицирования вирусом генитального герпеса особенно важно в поздние сроки беременности, поскольку именно в этот период существует максимальный риск развития неонатального герпеса.
Специфическая профилактика направлена на предупреждение рецидивов ГИ путем комплексного применения противовирусных препаратов, противогерпетической вакцины и иммуномодуляторов (см. раздел «Лечение»).
Патоморфология
Вследствие экссудативного воспаления в эпидермисе образуются пузырьки - баллонирующая дегенерация эпителия. Первоначально возникают очаговые изменения в клетках шиповидного слоя, образуются многоядерные клетки, накапливается серозный экссудат. Формируется полость пузырька, лежащего на инфильтрированном и отечном слое дермы. При генерализованных формах образуются мелкие очаги коагуляционного некроза во многих органах и системах. В ЦНС изменения встречаются преимущественно в сером, редко белом веществе и подкорковых центрах. Типичны диффузный васкулит, пролиферация глии, некроз нервных клеток.
Патогенез
Вирус проникает в организм человека через слизистые оболочки, поврежденную кожу. Размножение вируса в эпителиальных клетках приводит к их гибели с образованием очагов некроза и везикул. Из первичного очага ВПГ путем ретроградного аксонального транспорта мигрирует в сенсорные ганглии: ВПГ-1 преимущественно в ганглий тройничного нерва, ВПГ-2 - в поясничные ганглии. В клетках сенсорных ганглиев репликация вируса подавляется, и он персистирует в них пожизненно. Первичная инфекция сопровождается формированием гуморального иммунитета, напряженность которого поддерживается периодической активацией вируса и проникновением его в слизистые оболочки ротоглотки (ВПГ-1) и половых органов (ВПГ-2). В некоторых случаях реактивация вируса сопровождается клиническими проявлениями в виде пузырьковых высыпаний (рецидив ГИ).
Возможно и гематогенное распространение вируса с генерализованными высыпаниями, поражением ЦНС и внутренних органов, а также обнаружение вируса в крови методом ПЦР. Рецидивы ГИ связывают со снижением уровня специфического иммунитета под воздействием неспецифических факторов (избыточная инсоляция, переохлаждение, инфекционные болезни, стрессы). Иммунный статус во многом определяет вероятность развития заболевания, тяжесть течения, риск развития латентной инфекции и персистенции вируса, частоту последующих рецидивов. Заболевание у лиц с нарушениями клеточного иммунитета протекает значительно тяжелее. У людей с иммунодефицитными состояниями инфекция может приобрести генерализованный характер с органными поражениями. Иммунная система при ГИ реагирует только на свободные вирусные частицы.
Клиническая картина
Основные симптомы и динамика их развития
Первичная инфекция часто сопровождается системными признаками. При этом поражаются как слизистые оболочки, так и другие ткани. При первичном инфицировании продолжительность клинических проявлений и период выделения вируса больше, чем при рецидивах. Вирусы обоих подтипов могут вызывать поражение половых путей, слизистой ротовой полости, кожи, нервной системы. Клинически инфекция, вызванная ВПГ-1 или ВПГ-2, неразличима.
Врожденную ГИ наблюдают при наличии у беременных активных клинических проявлений болезни, сопровождаемых вирусемией. В зависимости от сроков инфицирования возможно формирование различных пороков развития плода (микроцефалия, микрофтальмия, хориоретинит, внутриутробная смерть) или гибель новорожденного при клинических проявлениях генерализованной ГИ.
Инкубационный период при первичной ГИ составляет от 1 до 30 дней.
Вирусный фарингит и стоматит наблюдают чаще у детей и лиц молодого возраста. Заболевание сопровождается лихорадкой, ознобом, недомоганием, раздражительностью, миалгией, затруднением при приеме пищи, гиперсаливацией. Увеличиваются и становятся болезненными поднижнечелюстные и шейные ЛУ. На слизистой оболочке щек, десен, внутренней поверхности губ, реже языка, мягкого и твердого нёба, нёбных дужек и миндалин появляются сгруппированные везикулы, после вскрытия которых образуются болезненные эрозии. Длительность заболевания - от нескольких дней до двух недель.
Герпетическое поражение глотки обычно приводит к экссудативному или язвенному изменению ее задней стенки и/или миндалин. В 30% случаев одновременно могут поражаться язык, слизистая оболочка щек и десен. Продолжительность лихорадки и шейной ЛАП составляет от 2 до 7 дней. У лиц с недостаточностью иммунитета вирус может распространиться вглубь слизистой оболочки, приводя к некрозу, кровоточивости, образованию язв, что сопровождается сильными болями, особенно при жевании.
При герпетическом поражении кожи возникают локальное жжение, зуд кожи, затем появляются отечность и гиперемия, на фоне которых образуются округлые сгруппированные папулы, которые в течение суток трансформируются в пузырьки с прозрачным содержимым, которое затем мутнеет. Пузырьки могут вскрываться с образованием эрозий, покрывающихся коркой, после отпадения которой обнаруживают эпителизированную поверхность. Длительность болезни 7-14 дней. Излюбленная локализация - губы, нос, щеки. Возможны диссеминированные формы с локализацией высыпаний на отдаленных участках кожи.
ВПГ может вызвать заболевания, напоминающие ОРВИ, - так называемую герпетическую лихорадку, для которой характерны острое начало, выраженная температурная реакция, озноб и другие симптомы интоксикации. Катаральные явления в носоглотке выражены слабо. Возможно покашливание из-за сухости слизистых, умеренная гиперемия дужек и мягкого нёба. Такая симптоматика сохраняется в течение нескольких дней. Типичные для ГИ высыпания не всегда наблюдаются в первые дни болезни, а могут присоединиться на 3-5-й день от начала лихорадочного периода или отсутствовать.
Герпетическое поражение глаз может быть первичным и рецидивирующим. Чаще развивается у мужчин в возрасте до 40 лет. Это одна из наиболее частых причин роговичной слепоты. Клинически различают поверхностные и глубокие поражения. К поверхностным относятся герпетический кератоконъюнктивит, древовидный кератит, герпетическая краевая язва роговицы; к глубоким - дисковидный кератит, глубокий кератоирит, паренхиматозный увеит, паренхиматозный кератит.
Поражение нервной системы. Болеют преимущественно лица в возрасте 5-30 лет и старше 50 лет.
Герпетический менингоэнцефалит в 95% случаев вызван ВПГ-1. Патогенез герпетического энцефалита различен. У детей и лиц молодого возраста первичное инфицирование может манифестировать энцефаломиелитом. У большей части взрослых сначала появляются клинические признаки генерализованной инфекции, а затем поражение ЦНС, т.е. в ЦНС вирус может проникать гематогенно. Начало болезни всегда острое, с повышением температуры тела до высоких цифр. Больные жалуются на недомогание, упорную головную боль, возможен умеренно выраженный респираторно-катаральный синдром. Герпетическая экзантема, стоматит возникают редко. Через 2-3 дня, иногда в более поздние сроки состояние больных резко и прогрессивно ухудшается за счет развития неврологических симптомов. Угнетается сознание, развивается менингеальный синдром, появляются генерализованные или фокальные тонико-клонические судороги, многократно повторяющиеся в течение дня. Общемозговая симптоматика сочетается с очаговыми симптомами (нарушение корковых функций, поражение черепных нервов, гемипарезы, параличи). Дальнейшее течение болезни неблагоприятное, через несколько дней развивается кома. В течение всего заболевания температура тела остается высокой, лихорадка носит неправильный характер. При отсутствии противовирусной терапии летальность достигает 50-80%.
Характерная черта герпетического энцефалита - поражение височной доли с одной или с обеих сторон, что проявляется изменениями личности со снижением интеллектуальных функций и психическими расстройствами. Исследование СМЖ выявляет лимфоцитарный или смешанный плеоцитоз, повышение уровня белка, ксантохромию и появление примеси эритроцитов. Возможны изменения на ЭЭГ. При МРТ головного мозга через 5-7 дней обнаруживают очаги поражения с преобладанием изменений в передних отделах височных долей с преимущественным вовлечением коры. Возможны атипичные проявления герпетического энцефалита с поражением ствола мозга и подкорковых структур, абортивное течение болезни, хроническое, рецидивирующее прогредиентное течение герпетического энцефалита по типу медленной инфекции ЦНС.
Серозный менингит. Серозный менингит чаще всего вызывает ВПГ-2, обычно заболевание развивается у лиц, страдающих генитальным герпесом. Клинически менингит характеризуется острым началом, головной болью, повышением температуры тела, светобоязнью, наличием менингеальных симптомов. При исследовании СМЖ наблюдают плеоцитоз от 10 до 1000 клеток в мкл (в среднем 300-400) лимфоцитарного или смешанного характера. Клинические симптомы сохраняются около недели, затем самостоятельно исчезают без неврологических осложнений. Возможны рецидивы.
Другая частая форма поражения нервной системы ВПГ-2 - синдром радикуломиелопатии. Клинически он проявляется онемением, парестезиями, болями в области ягодиц, промежности или нижних конечностей, тазовыми нарушениями. Возможно появление плеоцитоза, повышения концентрации белка в СМЖ. Есть данные о выделении ВПГ-1 из СМЖ больных шейным и поясничным радикулитом. Подтвердилось предположение о связи ВПГ-1 с поражением лицевого нерва (паралич Белла).
Герпетические поражения внутренних органов - результат вирусемии. В процесс вовлекается несколько органов, реже развивается изолированное поражение печени, легких, пищевода. Герпетический эзофагит может быть результатом непосредственного распространения инфекции из ротоглотки в пищевод или возникает вследствие реактивации вируса. Доминирующие симптомы эзофагита: дисфагия, загрудинные боли и снижение массы тела. При эзофагоскопии обнаруживают множественные овальные язвы на эритематозном основании. Чаще поражается дистальный отдел, но по мере распространения процесса происходит диффузное разрыхление слизистой оболочки всего пищевода.
У лиц, перенесших пересадку костного мозга, возможно развитие интерстициальной пневмонии. Летальность от герпетической пневмонии у больных с иммуносупрессией составляет до 80%.
Герпетический гепатит чаще развивается у лиц с иммунодефицитом, при этом повышается температура тела, появляется желтуха, увеличивается концентрация билирубина и активность аминотрансфераз в сыворотке крови. Иногда признаки гепатита сочетаются с проявлениями тромбогеморрагического синдрома.
Генитальный герпес чаще вызван ВПГ-2. Может быть первичным или рецидивирующим. Типичные высыпания локализованы у мужчин на коже и слизистой оболочке полового члена, у женщин - в уретре, на клиторе, во влагалище. Возможны высыпания на коже промежности, внутренней поверхности бедер. Образуются везикулы, эрозии, язвы. Отмечается гиперемия, отечность мягких тканей, локальная болезненность, дизурия. Могут беспокоить боли в пояснице, в области крестца, внизу живота, в промежности. Часто, особенно при первичной ГИ, наблюдается паховый или бедренный лимфаденит. Существует связь между частотой генитального герпеса и раком шейки матки у женщин, раком предстательной железы у мужчин. У женщин рецидивы часто возникают перед началом менструации.
Генерализованная ГИ развивается у новорожденных и у лиц с выраженной иммунной недостаточностью (при гематологических заболеваниях, длительном применении глюкокортикоидов, цитостатиков, иммунодепрессантов, при ВИЧ-инфекции). Болезнь начинается остро, протекает тяжело с поражением многих органов и систем. Характерны высокая лихорадка, распространенные поражения кожи и слизистых оболочек, диарейный синдром, поражение ЦНС, гепатит, пневмония. Без применения современных противовирусных препаратов болезнь в большинстве случаев заканчивается летально.
ГИ у ВИЧ-инфицированных развивается обычно в результате активации латентной инфекции, при этом заболевание быстро приобретает генерализованный характер. Признаки генерализации - распространение вируса со слизистой оболочки полости рта на слизистую оболочку пищевода, появление язв. Часто герпетические поражения сочетаются с кандидозными. Поражения кожи у ВИЧ-инфицированных более обширные и глубокие с образованием не только эрозий, но и язв. Характерно медленное заживление язв и эрозий. Значительно возрастает число рецидивов.
Осложнения обычно обусловлены присоединением вторичной микрофлоры.
Диагностика
Диагноз при поражении кожи и слизистых оболочек устанавливают на основании клинических данных (характерная герпетическая сыпь). При поражении ЦНС, висцеральных и генерализованных формах необходима лабораторная диагностика. Используют иммунологические методы, молекулярно-биологические и серологические методы.
Серологические методы диагностики по своей информативности уступают иммунологическим методам диагностики (РИФ и ИФА).
Поражение ЦНС диагностируют с помощью ПЦР, СМЖ. Для обнаружения специфического антигена в СМЖ применяют РИФ. Важное значение имеет обнаружение при МРТ характерных энцефалитических очагов.
Дифференциальную диагностику проводят, в зависимости от локализации процесса и формы болезни, с герпангиной, опоясывающим герпесом, ветряной оспой, пиодермией.
Лечение
Локализованные формы простого герпеса лечатся амбулаторно. Госпитализируются в инфекционный стационар лица с осложненными и генерализованными формами ГИ. Режим и питание определяются тяжестью течения болезни.
Этиотропное лечение ГИ предусматривает назначение противовирусных препаратов. Наиболее эффективен ацикловир (Зовиракс♠, Виролекс♠), назначается по 200 мг 5 раз в день, перорально, местно на пораженные участки кожи и слизистых накладывается 5% крем ацикловира 5 раз в день. В связи с появлением штаммов ВПГ, резистентных к ацикловиру, используются также валацикловир (Валтрекс♠) 500 мг 2 р/сут и фамцикловир (фамвир) 250 мг 3 раза в день. Продолжительность лечения составляет 5-7 дней. Перспективен новый противовирусный препарат - лобукавирρ. При генерализованных формах ГИ и герпетическом менингоэнцефалите назначается ацикловир внутривенно в дозе 10 мг/кг массы тела каждые 8 ч в течение 10-14 дней. При герпетических кератитах применяется 3% глазная мазь ацикловира. Кроме того, могут быть использованы препараты с другим механизмом противовирусного действия. Аллокин-альфа♠ назначают в дозе 10,0, 1,0 и 0,1 мг в виде 3 п/к инъекций с интервалом через день. Местно на пораженные участки кожи и слизистых мазь тетрагидроксиглюкопиранозилксантен (Алпизарин♠) - 2% для кожи, 5% для слизистых; госсипоρ - 2% мазь, мегосиновая мазь - 5%, смазывать слизистую рта 3-4 раза в день после еды. Десмодиума канадского травы экстракт (Хелепин-Д♠) при поражении слизистых оболочек - 1% мазь, при поражении кожи - 5% мазь, в тяжелых случаях внутрь 0,2 г 3 раза в день в течение 10-15 дней. Флореналевая 0,5% мазь применяется при кератитах и кератоконъюнктивитах до 2 раз в день, продолжительность лечения при поверхностных поражениях - 10-14 дней, при глубоких - до 1-1,5 мес.
Патогенетическая терапия включает в себя применение НПВС, особенно у больных с выраженными отеками, антигистаминные препараты, препараты, стимулирующие регенеративные и репаративные процессы (Солкосерил♠, шиповника семян масло, облепихи масло).
Интенсивную терапию проводят больным с висцеральными и осложненными формами. Кроме этиотропной противовирусной, назначают антибактериальную терапию. В случаях развития ОНГМ назначают антигипоксическую, противосудорожную, дегидратационную и противовоспалительную терапию.
Специфические иммуноглобулины применяются при тяжелых и генерализованных формах ГИ. Они назначаются внутривенно по 1,5-3 мл (0,05 мл/кг) через день или каждый день в течение 5-10 сут. Интерферон альфа-2а внутримышечно 1 млн МЕ 2 раза в день в течение 10 дней. Интерферон альфа-2b (Виферон♠) 1 млн МЕ по 2 свечи ежедневно с 12-часовым интервалом в течение 10 дней. При лечении генитального герпеса применяются индукторы ИФН [оксодигидроакридинилацетат натрия (Неовир♠), меглюмина акридонацетат (Циклоферон♠)].
Профилактику рецидивов ГИ проводят с учетом локализации процесса (лабиальный, генитальный герпес), частоты рецидивов, иммунного и интерферонового статуса организма, которые исследуют в межрецидивный период. Показаны природные адаптогены (элеутерококк, эхинацея). На фоне неспецифической профилактики вводят вакцину для профилактики герпетических инфекций (Витагерпавак♠): 0,2 мл внутрикожно 1 р/нед, 5 инъекций.
Ветряная оспа
Ветряная оспа (Varicella) - острая вирусная антропонозная инфекционная болезнь с аэрозольным механизмом передачи возбудителя, характеризуется лихорадкой, полиморфной макуло-папулезно-везикулезной сыпью, возможностью пожизненной персистенции возбудителя в организме.
Коды по МКБ-10
В01 Ветряная оспа.
Этиология
Возбудитель - вирус ветряной оспы Varicella-zoster virus семейства Herpesviridae (герпес-вирус 3-го типа). Размер вируса от 150 до 200 нм, он находится в ветряночных пузырьках в первые 3-4 дня болезни. Геном имеет двуспиральную линейную молекулу ДНК, липидную оболочку. Репродуцируется только в ядре инфицированных клеток человека. Установлена идентичность вируса, вызывающего опоясывающий герпес, и вируса ветряной оспы. В окружающей среде вирус неустойчив. В капельках слизи, слюны вирус сохраняется не более 10-15 мин. Нагревание, солнечные лучи, ультрафиолетовое излучение быстро инактивируют его.
Эпидемиология
Источник вируса - больной ветряной оспой и опоясывающим герпесом от последнего дня инкубационного периода до 5-го дня после появления последних высыпаний. Основной путь передачи - воздушно-капельный. Вирус способен распространяться на расстояния до 20 м. Возможен вертикальный механизм передачи вируса через плаценту. Восприимчивость к ветряной оспе очень высокая (более 90%), за исключением детей первых 3 мес жизни, у которых сохраняется пассивный иммунитет. Заболеваемость характеризуется выраженной сезонностью, достигая максимума в осенне-зимние месяцы. Болеют преимущественно дети. Постинфекционный иммунитет напряженный, поддерживается персистенцией вируса в организме. При снижении его напряженности возникает опоясывающий герпес.
Показатели заболеваемости этой инфекцией в России составляют от 320 до 780 на 100 тыс. населения (1980-2015 гг.). Наиболее высокая заболеваемость среди детей в возрасте 3-6 лет.
Современный эпидемический процесс ветряной оспы характеризуется тенденцией к «повзрослению» инфекции. Увеличивается вероятность заболевания беременных и, следовательно, риск внутриутробного заражения новорожденных.
Меры профилактики
Больных изолируют дома до 5-го дня со времени появления последнего свежего элемента сыпи, обычно не госпитализируют. Дети до 3 лет, ранее не болевшие, подлежат разобщению и наблюдению с 11 до 21-го дня с момента контакта. Контактным детям с отягощенным фоном рекомендовано введение иммуноглобулина человеческого нормального. Дезинфекцию не проводят.
В настоящее время в категорию инфекций, управляемых вакцино-профилактикой, переходят заболевания, вызванные вирусом Varicella-zoster, - ветряная оспа и опоясывающий лишай. В Национальный календарь прививок с 2014 г. включена вакцинация детей против ветряной оспы, зарегистрированы и разрешены к использованию в России две живые аттенуированные вакцины зарубежного производства.
Патогенез
Входные ворота вируса - слизистые оболочки ВДП, где происходит репликация вируса, далее по лимфатическим путям возбудитель проникает в кровь. В конце инкубационного периода развивается виремия. Вирус фиксируется в клетках эктодермального происхождения, преимущественно в эпителиальных клетках кожи и слизистых оболочек дыхательных путей, ротоглотки. Возможно поражение межпозвоночных ганглиев, коры мозжечка и больших полушарий, подкорковых ганглиев. В редких случаях при генерализованной форме поражаются печень, легкие, ЖКТ. В коже вирус вызывает формирование пузырьков, заполненных серозным содержимым, в котором вирус находится в высокой концентрации. При тяжелых генерализованных формах болезни везикулы и поверхностные эрозии обнаруживают на слизистых оболочках ЖКТ, трахеи, мочевого пузыря и почечных лоханок, уретры, конъюнктивы глаз. В печени, почках, легких и ЦНС выявляют мелкие очаги некроза с кровоизлияниями по периферии.
В патогенезе значительную роль отводят клеточному иммунитету, в основном системе Т-лимфоцитов, при угнетении которой наблюдают более тяжелое течение болезни. После стихания острых проявлений первичной инфекции вирус пожизненно персистирует в спинальных нервных ганглиях.
Клиническая картина
Инкубационный период длится от 10 до 21 дня, при введении иммуноглобулина человека нормального может удлиняться до 28 дней.
Продромальные явления чаще отсутствуют, редко отмечают кратковременный субфебрилитет на фоне ухудшения общего самочувствия. Везикулы появляются обычно одновременно с повышением температуры или на несколько часов позднее. При обильной экзантеме температура может повышаться до 39 °С и выше. Высыпания появляются волнами на протяжении 2-4 дней и сопровождаются подъемом температуры. Сыпь локализована на лице, волосистой части головы, туловище и конечностях. На ладонях и подошвах она встречается только при обильных высыпаниях. Элементы сыпи вначале имеют вид мелких макуло-папул, которые в течение нескольких часов превращаются в везикулы круглой или овальной формы размером 2-5 мм. Они располагаются поверхностно, на неинфильтрированном основании, стенка их напряжена, блестящая, содержимое прозрачное, но в некоторых везикулах мутнеет. Везикулы однокамерные, при прокалывании иглой они полностью спадаются. Большинство везикул окружено узкой каймой гиперемии. Везикулы подсыхают через 2-3 дня, на их месте образуются корочки, которые отпадают через 2-3 нед. После отпадения корочек рубцы остаются только при расчесывании элементов сыпи. Высыпания наблюдаются и на конъюнктиве глаз, слизистых оболочках ротоглотки, иногда гортани, половых органов. Пузырьки на слизистых быстро превращаются в эрозии, которые через несколько дней эпителизируются. Высыпания на слизистой оболочке гортани и трахеи, сопровождаемые отеком слизистой оболочки, могут вызывать грубый кашель, охриплость голоса, в редких случаях - явления крупа. Высыпания на слизистой оболочке половых губ представляют угрозу развития вульвовагинита. Высыпания часто сопровождаются увеличением ЛУ.
К концу 1-й недели болезни одновременно с подсыханием везикул нормализуется температура, улучшается самочувствие больного. В это время многих больных беспокоит кожный зуд.
В гемограмме в период высыпания наблюдают небольшую лейкопению и относительный лимфоцитоз.
Принято выделять типичную и атипичную ветряную оспу. К типичной относят случаи с характерной сыпью. Чаще всего типичная ветряная оспа протекает в легкой и среднетяжелой форме. Тяжелая форма болезни возникает редко, чаще у ослабленных детей и взрослых, для нее характерна ремиттирующая лихорадка до 6-8 сут. Отмечают головную боль, возможна рвота, менингеальный синдром, нарушение сознания, артериальная гипотензия, судороги. Сыпь обильная, крупная, метаморфоз ее замедлен, возможны элементы с пупковидным вдавлением в центре, напоминающие элементы сыпи при натуральной оспе.
К атипичным формам относят рудиментарную, буллезную, геморрагическую, гангренозную и генерализованную ветряные оспы.
Рудиментарную форму чаще наблюдают у детей, получавших иммуноглобулины, плазму в период инкубации. Сыпь необильная, розеолезно-папулезная с единичными очень мелкими везикулами. Общее состояние не нарушается.
Геморрагическая форма ветряной оспы встречается очень редко у резко ослабленных детей, страдающих гемобластозом или геморрагическими диатезами, на фоне приема глюкокортикоидов и цитостатиков. На 2-3-й день высыпания содержимое пузырьков приобретает геморрагический характер. Появляются кровоизлияния в кожу и слизистые оболочки, носовые кровотечения и другие проявления геморрагического синдрома. Возможен летальный исход.
Очень редко встречается гангренозная форма ветряной оспы у истощенных больных, при плохом уходе, создающем возможность присоединения вторичной инфекции. Вначале отдельные пузырьки принимают геморрагический характер, затем в их окружении возникает значительная воспалительная реакция. В последующем образуется геморрагический струп, после отпадения которого обнажаются глубокие язвы с грязным дном и крутыми или подрытыми краями. Язвы, вследствие прогрессирующего гангренозного распада ткани, увеличиваются, сливаются, принимая значительные размеры. Нередко возникают осложнения гнойно-септического характера. Общее состояние больного тяжелое, течение болезни длительное.
Генерализованная (висцеральная) форма. Встречается главным образом у новорожденных, иногда у взрослых с иммунодефицитом. Характерна гипертермия, интоксикация, поражение внутренних органов. Летальность высокая.
Ветряная оспа представляет опасность для плода и новорожденного. Если заболевание у женщины возникло в конце беременности, возможны преждевременные роды и мертворождения. При заболевании ветряной оспой в ранние сроки беременности может произойти внутриутробное заражение плода с развитием у него различных пороков развития. Вероятность заболевания новорожденных составляет 17%, их гибели - 30%. Врожденная ветряная оспа протекает тяжело, сопровождаясь тяжелыми висцеральными поражениями.
Среди осложнений наиболее часты различные гнойные поражения кожи - абсцессы, фурункулы, флегмоны. В основе гнойных осложнений кожи лежит суперинфекция стафилококками или стрептококками. Одной из частых причин инфицирования является расчесывание больным зудящих элементов сыпи. В большинстве случаев входными воротами гнойной инфекции становится поврежденный ветряночный пузырек. Менее распространенные осложнения: поражение ЦНС, миокардит, пневмония, кератит, нефрит, артрит, гепатит.
Клинически выраженная картина ветряночной пневмонии - одна из особенностей ветряной оспы взрослых. При этом непосредственно перед высыпанием, чаще одновременно с массовым высыпанием и повышением температуры, у больного появляются одышка, цианоз, кашель с кровянистой мокротой, боли в груди. На рентгенограмме видны обильные мелкие очажки на всем протяжении легких. Клинические проявления пневмонии наблюдаются в течение 7-10 дней, рентгенологические изменения - до 1-2 мес.
Поражение ЦНС чаще наблюдается у подростков и взрослых с 5-10-го до 21-го дня болезни и имеет различную локализацию. Для ветряночных энцефалитов характерны независимость от обилия высыпания и тяжести течения болезни. Одновременно с кратковременными подъемами температуры у больных появляются вялость, головная боль, рвота, а через несколько дней расстройства сознания, нарушения психики, судороги, атаксия, при миелитах и энцефаломиелитах - вялые параличи. Возможно изолированное поражение периферических нервов. Описаны поздние ветряночные энцефалиты с парезом конечностей и полной временной потерей зрения. Для ветряночного энцефалита и других неврологических осложнений ветряной оспы характерна обратимость процесса, обычно благоприятный исход. К исключительно редким последствиям ветряночных менингоэнцефалитов относится нарушение психики с последующим снижением интеллекта. При исследовании СМЖ обнаруживают повышенное содержание белка, 2-3-значный лимфоцитарный или смешанный плеоцитоз, нормальное или повышенное содержание глюкозы.
Поражение почек - редкое осложнение. Нефрит при ветряной оспе чаще появляется на 2-й неделе к концу высыпания. Он начинается остро: с подъема температуры до высоких показателей, рвоты, головной боли и болей в животе. Изменения в моче выражаются в высокой протеинурии, микрогематурии, единичных цилиндрах. Это осложнение протекает легко и к 12-15-му дню болезни регрессирует.
Диагностика
Диагностика ветряной оспы в типичных случаях не представляет затруднений. Диагноз устанавливают главным образом на основании клинических данных, при этом учитывают эпидемиологический анамнез.
В РФ лабораторная диагностика инфекций, вызванных вирусом Varicella-zoster, недостаточно широко применяется.
Общеприняты РИФ и ПЦР.
Дифференцировать ветряную оспу необходимо от герпетической сыпи при простом герпесе, опоясывающего герпеса, везикулезного риккетсиоза, импетиго и натуральной оспы. Необходимо исключать герпетическую экзему Капоши, а также инфекции, вызванные вирусами Коксаки и ЕСНО.
Лечение
Госпитализируют больных при тяжелом, осложненном течении болезни и по эпидемиологическим показаниям.
У больных с нормальным иммунитетом ветряная оспа требует только профилактики осложнений. Тщательный уход за кожей помогает избежать бактериальной суперинфекции. В качестве этиотропной терапии с первых суток заболевания назначают ацикловир (800 мг внутрь 5 р/сут в течение 5-7 дней) - подросткам и взрослым, у детей младше 12 лет - 20 мг/кг внутрь 4 р/сут. Больным с ослабленным иммунитетом при ветряной оспе ацикловир вводят внутривенно в дозе 10-12,5 мг/кг каждые 8 ч в течение 7 дней.
При развитии ветряночной пневмонии показаны ингаляции ИФН лейкоцитарного человеческого [ИФН-α (Лейкинферон¤)].
Местно используют 5-10% раствор калия перманганата или 1% спиртовой раствор бриллиантового зеленого с целью предотвращения присоединения вторичной инфекции и более быстрого подсыхания пузырьков. Для уменьшения зуда кожу обрабатывают глицеролом или обтирают водой с уксусом или спиртом.
Опоясывающий лишай
Опоясывающий лишай (Herpes zoster, shingles, zona) - острая, циклически протекающая инфекционная болезнь, возникающая в результате реактивации латентного вируса Varicella-zoster virus (вирус ветряной оспы), характеризующаяся лихорадкой, интоксикацией, появлением болей и везикулезных высыпаний в зоне иннервации отдельных чувствительных нервов, поражением ПНС и ЦНС.
Коды по МКБ-10
В.02 Опоясывающий лишай.
Этиология
Возбудитель - вирус семейства Herpesviridae, вызывающий опоясывающий лишай и ветряную оспу (см. раздел «Ветряная оспа»).
Эпидемиология
Болеют лица, ранее перенесшие ветряную оспу. Опоясывающий лишай - вторичная эндогенная инфекция.
Заболевание наблюдают у лиц всех возрастных групп, ранее перенесших ветряную оспу. 75% случаев приходится на людей старше 45 лет, в то время как на долю детей и подростков - менее 10%. Заболеваемость составляет 12-15 на 100 тыс. населения. Больные опоясывающим лишаем являются источниками инфекции для лиц, не болевших ветряной оспой. Индекс контагиозности - не выше 10%, так как, в отличие от ветряной оспы, вирус на поверхности слизистой оболочки дыхательных путей обнаруживают непостоянно.
Случаи опоясывающего лишая регистрируют в течение всего года, выраженной сезонности болезнь не имеет.
Меры профилактики такие же, как при ветряной оспе.
Патогенез
Опоясывающий лишай развивается как вторичная эндогенная инфекция у лиц, перенесших ветряную оспу в клинически выраженной, стертой или латентной форме, вследствие реактивации вируса ветряной оспы, интегрированного в геном клеток черепных и спинномозговых сенсорных ганглиев. Интервал между первичным инфицированием и клиническими проявлениями опоясывающего лишая исчисляется десятками лет, но может быть коротким и составлять несколько месяцев. К факторам риска относят пожилой и старческий возраст, заболевания, сопровождающиеся иммуносупрессией или иммунодефицитом, прежде всего онкологические, гематологические, ВИЧ-инфекцию, наркоманию; применение глюкокортикоидов, цитостатиков, лучевую терапию. В группу риска входят реципиенты трансплантируемых органов. Реактивация вируса может быть спровоцирована стрессовыми состояниями, физическими травмами, переохлаждением, инфекционными заболеваниями, алкоголизмом.
В результате активизации вируса ветряной оспы (Varicella-zoster virus) развивается ганглионеврит с поражением межпозвоночных ганглиев, ганглиев черепных нервов и задних корешков спинного мозга. В процесс могут вовлекаться вегетативные ганглии, вещество и оболочки головного и спинного мозга. Могут быть поражены внутренние органы. Распространяясь центробежно по нервным стволам, вирус попадает в клетки эпидермиса и вызывает в них воспалительно-дегенеративные изменения, что проявляется высыпаниями в пределах зоны иннервации соответствующего нерва, т.е. дерматома. Возможно и гематогенное распространение вируса, о чем свидетельствует генерализованная форма болезни, полиорганность поражений.
Патологоанатомическая картина обусловлена воспалительными изменениями в спинальных ганглиях и связанных с ними участках кожного покрова, а также в задних и передних рогах серого вещества, задних и передних корешках спинного мозга и мягких мозговых оболочках. Морфология везикул идентична таковым при ветряной оспе.
Клиническая картина
У взрослых наиболее ранний признак болезни - появление корешковых болей. Боль может быть интенсивной, носит приступообразный характер, часто ее сопровождает местная гиперестезия кожи. У детей болевой синдром менее выражен и встречается в 2-3 раза реже. Появлению высыпаний предшествуют слабость, недомогание, повышение температуры тела, познабливание, боль в мышцах и суставах, головная боль. В области пораженного дерматома возможно чувство онемения, покалывания или жжения. Продолжительность продромального периода варьирует от 1 до 7 сут.
Период клинических проявлений характеризуется поражением кожи и/или слизистых оболочек, проявлениями интоксикации и неврологическими симптомами.
Сначала экзантема имеет вид розово-красного пятна, которое быстро превращается в тесно сгруппированные везикулы («гроздья винограда») с прозрачным серозным содержимым, располагающиеся на гиперемированном и отечном основании. Размер их не превышает нескольких миллиметров. Содержимое пузырьков быстро мутнеет, затем состояние больных улучшается, нормализуется температура, везикулы подсыхают и покрываются корочкой, после которой не остается рубца. Полное заживление происходит в течение 2-4 нед. При опоясывающем лишае сыпь имеет сегментарный, односторонний характер, захватывая обычно 2-3 дерматома. Преимущественная локализация поражений кожи при опоясывающем лишае отмечена в зоне иннервации ветвей тройничного нерва, далее в убывающей последовательности - в области грудных, шейных, пояснично-крестцовых, шейно-грудных сегментов.
У 10% больных наблюдают распространение экзантемы за границы пораженных дерматомов. Диссеминацию может сопровождать появление множественных или единичных элементов сыпи, с более коротким периодом обратного развития. У ослабленных больных экзантема может трансформироваться в буллезную форму, приобретать геморрагический характер и сопровождаться некрозом. Некротические высыпания наблюдаются у лиц с иммунодефицитом (ВИЧ-инфекция, онкологические болезни). В этих случаях на месте высыпаний остаются рубцы. В зоне высыпаний определяют распространенную гиперемию кожи, выраженный отек подлежащих тканей. При локализации высыпаний в зоне первой ветви тройничного нерва часто наблюдают выраженный отек. Экзантему сопровождают увеличение и умеренная болезненность регионарных ЛУ. У детей могут быть признаки катарально-респираторного синдрома. Повышенная температура тела держится несколько дней, сопровождается умеренно выраженными симптомами интоксикации. В этом периоде болезни возможны общемозговые и менингеальные симптомы в виде адинамии, сонливости, диффузной головной боли, головокружения, рвоты. Длительность клинических проявлений опоясывающего лишая в среднем 2-3 нед.
Постгерпетическая невралгия (ПГН) развивается непосредственно через 2-3 нед после болезни. Боль, как правило, носит приступообразный характер и усиливается в ночные часы, становясь нестерпимой. Продолжительность ПГН составляет от 2-3 мес до года и более. К предрасполагающим факторам развития ПГН относят возраст более 50 лет, женский пол, наличие продромы, массивные кожные высыпания, локализацию высыпаний в области иннервации тройничного нерва или плечевого сплетения, наличие иммунодефицита. Болевой синдром, как правило, сопровождается нарушениями сна, потерей аппетита и снижением веса, хронической усталостью, депрессией, что приводит к социальной дезадаптации пациентов.
Опоясывающий лишай может протекать только с симптомами радикулярных болей, с одиночными везикулами или вообще без высыпаний. Диагноз в таких случаях устанавливают на основании нарастания титров антител к вирусу ветряной оспы.
Заболевание может протекать в легкой, среднетяжелой и тяжелой форме. Возможно абортивное или затяжное течение. Критериями тяжести считают выраженность интоксикации, признаков поражения ЦНС, характер местных проявлений (вид экзантемы, интенсивность болевого синдрома).
Повторные случаи опоясывающего лишая характерны для больных ВИЧ-инфекцией или онкологическими заболеваниями (лейкоз, рак легкого). При этом локализация высыпаний может соответствовать локализации опухоли, поэтому повторный опоясывающий лишай считают сигналом для углубленного обследования больного. В патологии опоясывающего лишая значительное место занимает поражение глаз (кератит), которое определяет тяжесть болезни и служит причиной снижения остроты зрения.
В структуре клинических проявлений опоясывающего лишая значительное место занимает поражение нервной системы: сенсорные нарушения в зоне высыпаний, корешковые парезы.
Серозный менингит - один из основных синдромов в картине опоясывающего лишая. При исследовании СМЖ в ранние сроки обнаруживают двух- или трехзначный лимфоцитарный или смешанный плеоцитоз, в том числе при отсутствии общемозговых и менингеальных симптомов (клинически «асимптомный» менингит). Энцефалит и менингоэнцефалит наблюдают в остром периоде. Признаки поражения ЦНС возникают на 2-8-й день высыпаний. МРТ позволяет выявить очаги деструкции мозговой ткани уже с 5-го дня энцефалита.
Опоясывающий лишай у детей. Имеются единичные сообщения о заболевании детей ОГ. К факторам риска возникновения ОГ у детей относятся: ветряная оспа у матери во время беременности или первичная инфекция VZV в 1-й год жизни. Риск заболевания ОГ повышен у детей, которые переболели ветряной оспой в возрасте до 1 года. Опоясывающий герпес у детей протекает не так тяжело, как у пожилых пациентов, с меньшей выраженностью болевого синдрома; ПГН также встречаются редко.
Опоясывающий герпес у больных ВИЧ-инфекцией. Риск развития ОГ у больных ВИЧ-инфекцией более высок, течение ОГ более длительное, нередко развиваются гангренозные и диссеминированные формы (25-50%), у 10% больных выявляются тяжелые поражения внутренних органов (легких, печени, головного мозга). При ВИЧ-инфекции отмечаются частые рецидивы ОГ как в пределах одного, так и нескольких смежных дерматомов.
Опоясывающий лишай у беременных. Первичная инфекция проявляется, как правило, ветряной оспой, что, по данным статистики, составляет 7:10 тыс. беременных. Заболевание может осложняться развитием пневмонии, энцефалита. Герпетическое инфицирование в I триместре беременности приводит к первичной плацентарной недостаточности и, как правило, сопровождается прерыванием беременности.
Для лабораторного подтверждения диагноза используют обнаружение антигена вируса при микроскопии или с помощью иммунофлюоресцентного метода, серологические методы. Перспективна ПЦР.
Дифференциальная диагностика
В отдельных случаях необходимо дифференцировать опоясывающий лишай от зостериформного простого герпеса, клинически мало отличимого. Буллезную форму опоясывающего лишая дифференцируют с рожей, поражениями кожи при онкологических, гематологических заболеваниях, сахарном диабете и ВИЧ-инфекции. При невралгии, предшествующей высыпаниям, дифференциальную диагностику проводят с невралгиями другой этиологии и заболеваниями органов, расположенных в зоне предстоящих высыпаний (кератит, глаукома, синусит, пульпит, плеврит, стенокардия и т.д.).
Лечение
Госпитализируют больных при тяжелом течении опоясывающего лишая и выраженном болевом синдроме.
В обязательной госпитализации нуждаются больные с генерализованной формой инфекционного процесса, поражением первой ветви тройничного нерва и ЦНС.
Медикаментозная терапия
Препараты выбора этиотропной терапии: ацикловир - 800 мг 5 р/сут, в течение 7-10 дней. При тяжелых формах ацикловир вводят внутривенно по 10 мг/кг каждые 8 ч, продолжительность лечения 7 дней; пенцикловир - 250 мг 3 р/сут, 7 дней; валацикловир - 1000 мг 3 р/сут, 7 дней.
Целесообразно сочетанное использование противовирусной терапии и глюкокортикоидов.
Патогенетическая терапия предполагает назначение дипиридамола в качестве дезагреганта по 50 мг 3 р/сут, 5-7 дней. Показана дегидратационная терапия (ацетазоламид, фуросемид). Целесообразно назначение иммуномодуляторов [продигиозанρ, аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин (Имунофан♠), азоксимера бромид и др.].
При ПГН используют НПВС (индометацин, диклофенак и др.) в сочетании с анальгетиками, седативными средствами и физиотерапией. Возможна витаминотерапия (В1, В6, В12), ее предпочтительнее проводить липофильной модификацией витаминов - мильгаммой «N», обладающей более высокой биодоступностью.
Местно - 1% раствор бриллиантового зеленого, 5-10% раствор калия перманганата, в фазе корочек - 5% мазь висмута субгаллата; при вялотекущих процессах - мазь диоксометилтетрагидропиримидин (Метилурацил♠), Солкосерил♠. Антибиотики назначают только больным опоясывающим лишаем с признаками активации бактериальной флоры.
Лечение ПГН и офтальмогерпеса проводится соответственно врачами неврологами и офтальмологами.
Вирусный инфекционный мононуклеоз, Эпштейна-Барр вирусный инфекционный мононуклеоз, болезнь Филатова
Антропонозная инфекционная болезнь, вызываемая ЭБВ, преимущественно с аэрозольным механизмом передачи возбудителя. Характеризуется циклическим течением, лихорадкой, острым тонзиллитом, фарингитом, выраженным поражением лимфоидной ткани, гепатоспленомегалией, лимфомоноцитозом, появлением в крови атипичных мононуклеаров.
Код по МКБ-10
B27.0 Мононуклеоз, вызванный гамма-герпетическим вирусом.
Этиология
Возбудитель - ЭБВ, HHV-4. Содержит ДНК, имеющую форму двойной спирали, в которой закодировано более 30 полипептидов. Вирион состоит из капсида диаметром 120-150 нм, окруженного оболочкой, содержащей липиды. ЭБВ обладает тропизмом к В-лимфоцитам из-за наличия на их поверхности рецепторов для этого вируса. Вирус может длительное время персистировать в клетках хозяина в латентной форме. Имеет антигенные компоненты, общие с другими вирусами семейства герпес-вирусов. Антигенно однороден, содержит вирусный капсидный антиген, ядерный антиген, ранний антиген и мембранный антиген. Антигены вируса индуцируют продукцию антител - маркеров ЭБВ-инфекции. Устойчивость в окружающей среде низкая. Вирус быстро погибает при высыхании, под действием высоких температур (кипячение, автоклавирование), при обработке всеми дезинфицирующими средствами.
В отличие от других герпетических вирусов ЭБВ вызывает не гибель, а пролиферацию пораженных клеток, потому его относят к онкогенным вирусам, в частности, он является этиологическим фактором саркомы Беркитта, назофарингеальной карциномы, В-клеточных лимфом, некоторых иммунодефицитов, волосистой лейкоплакии языка при ВИЧ-инфекции.
Эпидемиология
Источник возбудителя инфекции - больной человек, в том числе со стертой формой болезни, и вирусоноситель. Эпидемический процесс в популяции поддерживается за счет вирусоносителей, лиц, инфицированных ЭБВ, которые периодически выделяют вирус в окружающую среду со слюной. В смывах из ротоглотки у серопозитивных здоровых лиц в 15-25% случаев обнаруживают вирус. Частота выделения вируса резко возрастает при нарушениях в иммунной системе. Основной путь передачи - воздушно-капельный. Заражение также возможно путем прямого (при поцелуях, половым путем) и непрямого контакта через предметы обихода, игрушки, контаминированные слюной, содержащей вирус. Латентная инфекция в В-лимфоцитах периферической крови доноров создает опасность заражения при гемотрансфузиях.
Человек высоковосприимчив к ЭБВ. Сроки первичного инфицирования зависят от социально-бытовых условий. В развивающихся странах и социально неблагополучных семьях большинство детей инфицируются в возрасте от 6 мес до 3 лет, причем, как правило, бессимптомно или с клинической картиной ОРЗ. В развитых странах и социально благополучных семьях инфицирование происходит в более старшем возрасте, чаще в подростковом или юношеском. К 35 годам инфицируется основная масса населения. При инфицировании в возрасте старше 3 лет у 45% развивается типичная картина ИМ. Иммунитет у перенесших ИМ пожизненный, нестерильный, повторные заболевания не наблюдаются, но возможны различные проявления ЭБВ-инфекции, обусловленные реактивацией вируса. Чаще болеют лица мужского пола. Очень редко болеют лица старше 40 лет. Однако у ВИЧ-инфицированных реактивация ЭБВ может наступать в любом возрасте.
Патогенез
При попадании ЭБВ со слюной воротами инфекции и местом его репликации служит ротоглотка. Инфекцию поддерживают В-лимфоциты, являющиеся основной мишенью вируса. Репликация вируса происходит также в эпителии слизистой оболочки ротоглотки и носоглотки, протоков слюнных желез. Во время острой фазы болезни специфические вирусные антигены обнаруживают в ядрах более 20% циркулирующих В-лимфоцитов. После стихания инфекционного процесса вирусы можно обнаружить лишь в единичных В-лимфоцитах и эпителиальных клетках носоглотки.
Инфицированные вирусом В-лимфоциты под влиянием мутагенов вируса начинают интенсивно пролиферировать, трансформируясь в плазматические клетки. В результате поликлональной стимуляции В-системы в крови возрастает уровень Ig, в частности, появляются гетерогемагглютинины, способные агглютинировать чужеродные эритроциты (барана, лошади), что используют для диагностики. Пролиферация В-лимфоцитов также приводит к активации Т-супрессоров и естественных киллеров. Т-супрессоры подавляют пролиферацию В-лимфоцитов. В крови появляются их молодые формы, которые морфологически характеризуют как атипичные мононуклеары (клетки с крупным, как у лимфоцита, ядром и широкой базофильной цитоплазмой). Т-киллеры разрушают инфицированные В-лимфоциты путем антителозависимого цитолиза. Активация Т-супрессоров приводит к снижению иммунорегуляторного индекса ниже 1,0, что способствует присоединению бактериальной инфекции. Активация лимфатической системы проявляется увеличением ЛУ, миндалин, других лимфоидных образований глотки, селезенки и печени. Гистологически выявляют пролиферацию лимфоидных и ретикулярных элементов, в печени - перипортальную лимфоидную инфильтрацию. В тяжелых случаях возможны некрозы в лимфоидных органах, появление лимфоидных инфильтратов в легких, почках, ЦНС и других органах.
Клиническая картина
Инкубационный период варьирует от 4 до 50 дней.
Периоды болезни: начальный, разгара и реконвалесценции. Болезнь начинается остро или подостро, с повышения температуры тела, появления болей в горле и увеличения ЛУ. При постепенном начале болезненность и увеличение ЛУ предшествуют повышению температуры на несколько дней, затем появляются боли в горле и лихорадка. В любом случае к концу недели начальный период болезни завершается и выявляют весь симптомокомплекс болезни.
Для периода разгара болезни характерны: лихорадка, полиаденопатия, поражение рото- и носоглотки, гепатолиенальный синдром, гематологический синдром.
Лихорадочная реакция многообразна как по уровню, так и по продолжительности лихорадки. В начале болезни температура чаще субфебрильная, в разгаре может достигать 38,5-40,0 °С в течение нескольких дней, затем снижается до субфебрильного уровня. В некоторых случаях субфебрилитет отмечают на протяжении всей болезни, в редких случаях лихорадка отсутствует. Длительность лихорадки от 3-4 сут до 3-4 нед, иногда больше. При длительной лихорадке выявляют ее волнообразность. Особенность ИМ - относительно слабая выраженность интоксикационного синдрома. Больные обычно сохраняют подвижность, аппетит снижен, доминируют миастения, утомляемость, в тяжелых случаях больные из-за миастении не могут стоять, с трудом сидят. Интоксикация сохраняется несколько дней.
Полиаденопатия - постоянный симптом. Чаще всего увеличиваются латеральные шейные ЛУ, часто они видны на глаз, размеры их варьируют от 1-2 см до 3-4 см яйца. В некоторых случаях появляется отек клетчатки вокруг увеличенных ЛУ, изменяются контуры шеи (симптом «бычьей шеи»). Кожа над ЛУ не изменена, при пальпации они чувствительные, плотноэластической консистенции, не спаяны между собой и с окружающими тканями. Увеличиваются также и другие группы узлов: затылочные, подчелюстные, кубитальные. В некоторых случаях, по-видимому при половом пути заражения, доминирует увеличение ЛУ пахово-бедренной группы. При этом отмечают боли в крестце, пояснице, резкую слабость, изменения в ротоглотке выражены слабо. Полиаденопатия регрессирует медленно и, в зависимости от тяжести течения болезни, сохраняется от 3-4 нед до 2-3 мес или принимает персистирующий характер.
Также постоянным симптомом считают увеличение и отечность нёбных миндалин, которые иногда смыкаются между собой, затрудняя ротовое дыхание. Одновременное увеличение носоглоточной миндалины и отечность слизистой оболочки нижней носовой раковины затрудняют носовое дыхание. При этом появляется пастозность лица, гнусавость голоса. Больной дышит открытым ртом. Возможна асфиксия. Задняя стенка глотки также отечна, гиперемирована, с гиперплазией боковых столбов и лимфоидных фолликулов задней стенки глотки (гранулематозный фарингит). Часто на нёбных и носоглоточных миндалинах появляются грязно-серые или желтовато-белые наложения в виде островков, полосок, иногда они сплошь покрывают всю поверхность миндалин. Наложения рыхлые, легко снимаются шпателем, растворяются в воде. Редко отмечают фибринозные налеты или поверхностный некроз ткани миндалин. Налеты могут появиться с первых дней болезни, но чаще на 3-7-й день. Появление налетов сопровождается болью в горле и значительным повышением температуры тела.
Увеличение печени и селезенки - постоянный симптом, особенно у детей. Печень увеличивается с первых дней болезни, максимально в ее разгаре. Она чувствительна при пальпации. Часто выявляют умеренное повышение активности АЛТ и АСТ, реже - потемнение мочи, легкую желтуху и гипербилирубинемию. В этих случаях отмечают тошноту, снижение аппетита. Длительность желтухи не превышает 3-7 сут, течение гепатита доброкачественное. Селезенка увеличивается на 3-5-е сутки, максимально - ко 2-й неделе и перестает быть доступной для пальпации к концу 3-й недели болезни. Она становится малочувствительной при пальпации. В отдельных случаях спленомегалия резко выражена (край определяется на уровне пупка). В этом случае есть угроза ее разрыва.
Картина крови имеет решающее диагностическое значение. Характерен умеренный лейкоцитоз (12-25 × 109 /л), лимфомоноцитоз до 80-90%, относительная нейтропения со сдвигом влево. Часто обнаруживают плазматические клетки. СОЭ увеличивается до 20-30 мм/ч. Особенно характерно появление атипичных мононуклеаров с первых дней болезни или в ее разгаре. Количество их варьирует от 10 до 50%, как правило, они обнаруживаются в течение 10-20 сут, т.е. могут быть выявлены в двух анализах, взятых с интервалом 5-7 сут.
Из других симптомов болезни следует отметить сыпь, обычно папулезную. Она наблюдается у 10% больных, а при лечении ампициллином - у 80%. Возможна умеренная тахикардия. Описывают стертую форму, при которой отсутствует часть основных симптомов и для подтверждения диагноза необходимы серологические тесты. В редких случаях наблюдают висцеральную форму болезни с тяжелыми полиорганными поражениями и неблагоприятным прогнозом.
Описана хроническая форма болезни, которая развивается после перенесенного острого ИМ. Она характеризуется слабостью, утомляемостью, плохим сном, головными болями, миалгией, субфебрилитетом, фарингитом, полиаденопатией, иногда экзантемой. Постановка диагноза возможна только при использовании лабораторных тестов.
Осложнения возникают редко. К гематологическим осложнениям относят аутоиммунную гемолитическую анемию, тромбоцитопению и гранулоцитопению. Неврологические осложнения: менингоэнцефалит, энцефалит, параличи черепных нервов, в том числе паралич Белла или прозоплегия (паралич мимической мускулатуры, обусловленный поражением лицевого нерва), синдром Гийена-Барре, полиневрит, поперечный миелит, психоз. Возможны кардиологические осложнения (перикардит, миокардит). Со стороны органов дыхания иногда отмечают интерстициальную пневмонию.
В редких случаях на 2-3-й неделе заболевания происходит разрыв селезенки.
Летальность и причины смерти
Причинами смерти при мононуклеозе могут быть энцефалит, обструкция дыхательных путей и разрыв селезенки.
Диагностика
Диагностика основывается на комплексе ведущих клинических симптомов (лихорадка, ЛАП, увеличение печени и селезенки, изменения периферической крови).
Помимо исследования картины крови, диагностика основывается на обнаружении гетерофильных антител и специфических антител к ЭБВ (табл. 17-11).
Форма инфекции |
Антитела |
|||
|---|---|---|---|---|
IgM к капсидному антигену |
IgG к капсидному антигену |
к ядерному антигену, сумма |
к ранним антигенам, сумма |
|
Не инфицирован |
- |
- |
- |
- |
Острая стадия первичной инфекции |
++ |
++++ |
- |
++ |
Инфекция, перенесенная до 6 мес назад |
+ |
+++ |
- |
++ |
Инфекция, перенесенная более 1 года назад |
- |
+++ |
+ |
± |
Хроническая инфекция, реактивация |
± |
++++ |
± |
+++ |
Злокачественные новообразования, связанные в ЭБВ |
- |
++++ |
± |
+++ |
Гетерогенные антитела. Используют реакцию гетерогемагглютинации Гоффа-Бауэра - агглютинация сывороткой крови больного формалинизированных лошадиных эритроцитов. Титры гетерофильных антител достигают максимума на 4-5-й неделе от начала болезни, затем снижаются и могут сохраняться 6-12 мес. Однако эта реакция может давать ложноположительные и ложноотрицательные результаты.
Наиболее специфичны и чувствительны методы, основанные на определении антительных маркеров антигенов ЭБВ (РНИФ, ИФА), которые позволяют определить форму инфекции.
Антитела (IgM) к капсидному антигену при инфекционном мононуклеозе обнаруживаются с конца инкубационного периода, они определяются не более 2-3 мес. IgG к капсидному антигену появляются в остром периоде инфекции и сохраняются пожизненно. Антитела к ранним антигенам (IgM) появляются в разгаре болезни у 70-80% больных и быстро исчезают, а антитела к IgG сохраняются длительно. Повышение титра антител к ранним антигенам характерно для реактивации ЭБВ-инфекции и для опухолей, обусловленных этим вирусом. Антитела против ядерного антигена появляются через 6 мес после инфицирования и сохраняются в невысоких титрах пожизненно.
В настоящее время широко используется ПЦР для выявления в крови с первых дней болезни специфических фрагментов генома ЭБВ в крови, при поражении ЦНС - в СМЖ.
Ее применение эффективно для обнаружения ЭБВ-инфекции у новорожденных, когда определение серологических маркеров малоэффективно.
Дифференциальная диагностика
Необходимо дифференцировать с лихорадочными заболеваниями, протекающими с ЛАП и гепатолиенальным синдромом, с синдромом острого тонзиллита и с наличием атипичных мононуклеаров в крови.
Осложнение: сыпь после приема ампициллина.
Показания к госпитализации
Больных госпитализируют по клиническим показаниям: длительная высокая лихорадка, желтуха, осложнения, диагностические трудности.
Лечение
Режим. Диета
Режим полупостельный. Стол № 5. Лечение ИМ чаще всего проводят в амбулаторных условиях. Рекомендуют обильное питье, полоскание ротоглотки растворами антисептиков, НПВС, симптоматическую терапию.
Медикаментозная терапия
In vitro ацикловир и ИФН-α подавляют репликацию ЭБВ, однако их клиническая эффективность не доказана. При выраженных некротических изменениях на миндалинах назначают антибактериальные препараты (фторхинолоны, макролиды). Ампициллин противопоказан из-за возникновения у 80% больных сыпи.
Глюкокортикоиды могут существенно сократить длительность лихорадки и воспалительных изменений в ротоглотке, однако их назначают лишь при тяжелых формах, при обтурации дыхательных путей, при гемолитической анемии и неврологических осложнениях.
При разрыве селезенки необходимо немедленное хирургическое вмешательство. При значительном увеличении селезенки ограничивают двигательный режим, заниматься спортом можно не ранее 6-8 мес после выписки из стационара. При выявлении гепатита - соблюдение диеты № 5 в течение 6 мес после перенесенного ЭБВ-ИМ. Ограничение физической нагрузки на 3 мес.
Прогноз
Благоприятный. Летальные исходы казуистически редки (разрыв селезенки, обструкция дыхательных путей, энцефалит).
Цитомегаловирусная инфекция
ЦМВИ цитомегалия - хроническая антропонозная болезнь вирусной этиологии, характеризующаяся многообразием форм патологического процесса от латентной инфекции до клинически выраженного генерализованного заболевания.
Коды по МКБ-10
В25 (Цитомегаловирусная болезнь).
Этиология
Возбудитель - цитомегаловирус вида Cytomegalovirus hominis семейства Herpesviridae подсемейства Betaherpesvirinae рода Cytomegalovirus. ЦМВ - крупный ДНК-содержащий вирус с невысокой цитопатогенностью в культуре клеток, медленной репликацией, низкой вирулентностью. Инактивируется при температуре 56 °С, длительно сохраняется при комнатной температуре, быстро теряет инфекционность при замораживании до -20 °С. ЦМВ обладает относительной нечувствительностью к действию ИФН, менее чувствителен по сравнению с ВПГ и вирусом Varicella-zoster к противогерпетическим препаратам.
Эпидемиология
Цитомегалия - широко распространенная инфекция. Серопозитивные лица среди взрослого населения нашей страны составляют 73-98%.
Источником ЦМВ является человек. ЦМВИ характеризуется состоянием длительного латентного носительства вируса с его периодическим выделением в окружающую среду. Возбудитель может находиться в любой биологической жидкости, а также в органах и тканях, используемых для трансплантации. Наличие в крови специфических антител в абсолютном большинстве случаев означает присутствие в организме самого вируса. У 20-30% здоровых беременных ЦМВ присутствует в слюне, 3-10% - в моче, 2-20% - в цервикальном канале или вагинальном секрете. Вирус обнаруживают в грудном молоке 20-60% серопозитивных матерей. Установлена значительная частота выявления (до 35%) и длительность присутствия (в среднем до 22 мес) ЦМВ в сперме. Кровь около 1% доноров содержит ЦМВ. Заражение возможно половым, парентеральным, вертикальным путями, а также контактно-бытовым путем, через слюну при близких контактах.
ЦМВИ - классическая врожденная инфекция, частота ее составляет 0,2-2,5% среди новорожденных.
Наибольший риск для плода представляет первичная инфекция на ранних сроках беременности. При реинфекции (повторном заражении ЦМВ) или реактивации вируса частота его передачи плоду существенно меньше.
Наличие ЦМВ в генитальном тракте у беременных женщин - причина заражения ребенка во время родов. С увеличением срока беременности вероятность обнаружения ЦМВ в вагинальном содержимом возрастает, у ВИЧ-инфицированных беременных ДНК ЦМВ в соскобах из цервикального канала была выявлена в 33,3% случаев. Риск интранатального инфицирования ребенка при наличии вируса в генитальном тракте матери составляет 50-57%.
Основной путь заражения в возрасте до года - передача вируса через грудное молоко. ДНК ЦМВ обнаруживают в молоке до 60% серопозитивных матерей.
Контактно-бытовой путь передачи вируса у детей младшего возраста играет существенную роль. Заражение взрослого человека наиболее вероятно половым путем в связи с присутствием вируса в сперме, реже - в вагинальном секрете. Гемотрансфузии и парентеральные манипуляции также могут приводить к заражению ЦМВ. Клинически выраженная ЦМВИ - одно из самых значимых инфекционных осложнений при трансплантации органов.
Проблема клинически выраженной ЦМВИ актуальна и для лиц, имеющих иммуносупрессию. Описана тяжело протекающая манифестная ЦМВИ у онкогематологических больных, больных лучевой болезнью, длительно принимающих глюкокортикоиды, цитостатическую терапию, перенесших ожоговую травму. Цитомегаловирус может быть причиной посттрансфузионных гепатитов, разнообразной гинекологической патологии.
Клинически выраженная генерализованная ЦМВИ занимает одно из первых мест в структуре оппортунистических заболеваний у ВИЧ-инфицированных. Активная репликация ЦМВ у ВИЧ-инфицированных детей ассоциируется с более быстрой прогрессией ВИЧ-инфекции и более высокой вероятностью летального исхода.
Меры профилактики
Необходимы консультирование и информирование серонегативных по ЦМВ женщин, планирующих беременность, и беременных об источниках и путях инфицирования (половые контакты с серопозитивным партнером, физический контакт при ежедневном уходе за ребенком дома или профессиональный контакт с детьми младшего возраста в стационарах, домах ребенка, детских дошкольных учреждениях). Для снижения риска первичного заражения ЦМВ беременным, не имеющим специфических антител IgG, рекомендуется использование барьерных контрацептивов при половых контактах, соблюдение правил личной гигиены после смены пеленок или после контакта с игрушками, испачканными слюной или мочой детей, избегание пользования одной посудой с ребенком, поцелуев в губы детей грудного возраста. Рекомендован временный перевод серонегативных беременных - сотрудников домов ребенка, детских стационарных отделений, учреждений ясельного типа - на работу, не связанную с опасностью их заражения вирусом. Подобные меры профилактики актуальны и для серопозитивных беременных для предотвращения повторного заражения ЦМВ.
В случае активной ЦМВИ у серопозитивной лактирующей женщины, если ребенок недоношен, с низкой массой тела при рождении и/или имеет врожденную ЦМВИ и концентрация ДНК вируса в грудном молоке высокая, рекомендованы пастеризация или замораживание молока на 24 ч.
Важно осуществление проверки крови и ее компонентов на наличие ДНК ЦМВ при гемотрансфузии недоношенному ребенку или взрослому человеку с ослабленной иммунной системой.
Учитывая частоту развития манифестной ЦМВИ при пересадке серонегативному реципиенту органа от серопозитивного донора, важной мерой профилактики ЦМВ-заболевания в трансплантологии является подбор серонегативного донора, если серонегативен реципиент.
Патогенез
Решающим условием для развития антенатальной ЦМВИ является виремия у матери вследствие инфцирования вирусом или его реактивации. Наличие вируса в крови ведет к инфицированию плаценты, ее поражению и заражению плода с возможными последствиями в виде пороков и задержки внутриутробного развития, патологического процесса с поражением внутренних органов, в первую очередь ЦНС. При наличии вируса в канале шейки матки беременной женщины возможен восходящий (трансцервикальный) путь заражения плода без выхода возбудителя в кровь. Реактивация ЦМВ в эндометрии является одним из факторов ранних абортов.
При постнатальной ЦМВИ входными воротами возбудителя служат слизистые оболочки ротоглотки, дыхательной системы, пищеварительного и генитального трактов. После преодоления вирусом входных ворот и его локального размножения наступает кратковременная виремия. При острой ЦМВИ вирус поражает преимущественно эпителиальные клетки легких, печени, кишечника, почек, мочевого пузыря, молочных и слюнных желез, генитального тракта. Поражение эпителиальных клеток облегчает вирусную трансмиссию подлежащим тканям и инфицирование фибробластов. ЦМВ может инфицировать нервные клетки, клетки гладкой мускулатуры, клетки стромы костного мозга. Несмотря на иммунный ответ, ЦМВ индуцирует хроническую латентную инфекцию. Резервуаром вирусных частиц служат моноциты, лимфоциты, эндотелиальные и эпителиальные клетки. Зараженные эндотелиальные клетки крупных сосудов являются резервуарами ЦМВ и способствуют развитию виремии, передавая вирус циркулирующим моноцитам. Вирусная инфекция в микрососудах приводит к разрушению зараженных эндотелиальных клеток, их слущиванию, образованию микротромбов. ЦМВИ в микрососудах вызывает постепенное продуктивное поражение всех слоев сосудистой стенки, приводящее к склеротическим изменениям, стенозу и облитерации сосудов.
При незначительной иммуносупрессии возможны периоды локальной активизации ЦМВ с выделением вируса из носоглотки или урогенитального тракта. В случае выраженных иммунологических нарушений происходит возобновление репликации вируса, развивается виремия с клинически выраженной картиной заболевания. Активность вирусной репликации, риск манифестации ЦМВИ, тяжесть ее течения во многом определяются степенью снижения количества СD4-лимфоцитов.
С ЦМВи связан широкий спектр органных поражений: легких, пищеварительного тракта, надпочечников, почек, головного и спинного мозга, сетчатки глаза. У умерших от ЦМВИ выявляют фиброателектаз легких, эрозивно-язвенное с выраженным фиброзом подслизистого слоя поражение пищевода, толстой кишки, реже желудка и тонкой кишки; массивный, часто двусторонний некроз надпочечников; энцефаловентрикулит, некротическое поражение спинного мозга, сетчатки глаза. Специфичность поражений подтверждает наличие крупных цитомегалоклеток, лимфогистиоцитарных инфильтратов, а также продуктивно-инфильтративных панваскулитов с цитомегалическим превращением клеток всех оболочек мелких артерий и вен с исходом в склерозирование. Подобное поражение сосудов служит основой для тромбообразования, приводит к хронической ишемии, на фоне которой развиваются деструктивные изменения, сегментарные некрозы и язвы, выраженный фиброз. Распространенный фиброз - характерная особенность ЦМВ-поражения органа. У большинства больных патологический процесс, связанный с ЦМВ, носит генерализованный характер.
Клиническая картина
Продолжительность инкубационного периода составляет 2-12 нед. Клиническая картина ЦМВИ зависит от сроков и механизмов заражения (врожденная и приобретенная инфекция, антенатальная, интранатальная и постнатальная ЦМВИ), формы инфекции (первичное заражение, реинфекция, реактивация латентного вируса), путей и механизмов заражения (аспирация слюны, гемотрансфузия, половой путь, трансплантация органа), состояния иммунной системы.
Клиническая классификация цитомегаловирусной инфекции
Основные симптомы и динамика их развития
При врожденной ЦМВИ характер поражения плода зависит от срока заражения. Особенно опасно инфицирование ЦМВ матери в первые 20 нед беременности, которое может привести к самопроизвольному выкидышу, внутриутробной гибели плода, мертворождению, грубым врожденным порокам развития (анэнцефалия, микроцефалия, гидроцефалия, порэнцефалия, микрофтальмия, дефект строения внутренней глазной камеры, гипопластическая дисплазия тимуса, гипоплазия легких, нарушение строения бронхиального дерева и легочных сосудов, гипоплазия внутрипеченочных желчных протоков, атрезия пищевода, аномалии строения почек, рубцовые стенозы МВП, дефекты межпредсердной и межжелудочковой перегородок, фиброэластоз миокарда, стеноз аорты). Врожденные пороки развития в большинстве случаев несовместимы с жизнью. При заражении ЦМВ в поздние сроки беременности прогноз для жизни и развития ребенка более благоприятен.
При антенатальном инфицировании возникает клинически выраженная патология в период от момента рождения до нескольких недель жизни ребенка. Манифестная форма болезни развивается у 5-30% инфицированных новорожденных. Новорожденные, инфицированные внутриутробно, часто рождаются недоношенными, с синдромом задержки роста плода (низкая и экстремально низкая масса тела), гестационным возрастом менее 32 нед, признаками внутриутробной гипоксии, низкой оценкой состояния по шкале Апгар. Характерна обильная петехиальная или более крупная геморрагическая сыпь, обусловленная выраженной тромбоцитопенией и повреждением сосудов кожи. При лабораторных исследованиях отмечают повышение активности АЛТ (>80 ед/л), выраженную тромбоцитопению (<100 кл/мкл) или тромбоцитоз, повышение концентрации связанного билирубина в крови, повышенный гемолиз эритроцитов, возможны лейкопения, нейтропения. В 70-80% случаев врожденной ЦМВИ дети имеют более одного из трех симптомов: низкая масса тела при рождении, желтуха, тромбоцитопения.
Для антенатального инфицирования ЦМВ характерно поражение ЦНС в виде микроцефалии, реже - гидроцефалии; сонливость или мышечная гипотония, слабый сосательный рефлекс, судорожный синдром. При микроцефалии частота инвалидности составляет более 50%. Исследование СМЖ выявляет повышение содержания белка. Неблагоприятными прогностическими факторами развития ребенка являются наличие патологии, по данным МРТ головного мозга плода, и микроцефалия. ЦМВИ - основная причина сенсоневральной потери слуха. Нарушения зрения и страбизм являются частыми клиническими проявлениями ЦМВИ. Нарушения зрения возникают вследствие развития хориоретинита, пигментного ретинита, рубцов сетчатки глаза, атрофии зрительного нерва, потери центрального зрения, врожденной катаракты. Прогноз врожденной ЦМВИ с поражением ЦНС неблагоприятный.
Интерстициальную пневмонию относят к редким прогностически неблагоприятным проявлениям врожденной ЦМВИ. У ребенка с врожденной ЦМВИ возможен некротический энтероколит, фиброз и поликистоз поджелудочной железы, очаговый интерстициальный нефрит, хронический сиалоаденит. Возможно развитие сахарного диабета, диффузного тиреотоксического зоба. Инфицирование ЦМВ в период внутриутробного развития может быть причиной гепато- и спленомегалии, лимфопении, нейтропении, тромбоцитопении, повышения активности аминотрансфераз. Летальность при клинически выраженной врожденной ЦМВИ - около 20-30%.
У 40-90% выживших новорожденных с манифестной ЦМВИ наблюдаются задержка психомоторного развития, сенсоневральная тугоухость, нарушения восприятия речи при сохранении слуха, один или более из следующих признаков (микроцефалия, судороги, парезы/параличи, хориоретинит). В части случаев в более старшем возрасте наблюдаются: когнитивные нарушения, низкая обучаемость в школе, неспособность к чтению, гиперактивность в сочетании с невозможностью сосредоточиться, поведенческие проблемы.
Инфицирование ЦМВ плода во второй половине беременности может быть причиной развития заболевания в первые недели и месяцы жизни ребенка. Наличие виремии в период от момента рождения до 3 мес жизни является фактором риска развития неврологической патологии (прогрессирующей тугоухости, хориоретинита, очаговых двигательных нарушений, гипотонии, судорожного синдрома). Бессимптомная антенатальная ЦМВИ также приводит к значительному ухудшению слуха, снижению зрения, судорожному синдрому, задержке физического и умственного развития, нейросенсорным нарушениям, сложностям при обучении.
При интранатальном или раннем постнатальном инфицировании клинические признаки болезни чаще возникают через 1-3 мес после родов. Наиболее часто ЦМВИ проявляется поражением легких, протекающим благоприятно. У недоношенных ослабленных детей с низким весом при рождении, зараженных ЦМВ во время родов или в первые дни жизни путем гемотрансфузий, уже к 3-5-й неделе жизни может развиться тяжелое генерализованное заболевание, проявлениями которого служат пневмония, гепатит с затяжной желтухой и холестазом, гепатоспленомегалия, нефропатия, поражение пищеварительного тракта, анемия, тромбоцитопения. Заболевание может носить длительный рецидивирующий характер.
Максимальная летальность при ЦМВИ приходится на возраст 2-4 мес.
Острая цитомегаловирусная инфекция. Мононуклеозоподобный синдром
Первичное инфицирование ЦМВ иммунокомпетентных лиц обычно протекает бессимптомно или с нерезко выраженным мононуклеозоподобным синдромом. Лишь у 5% взрослых острая ЦМВИ проявляется яркой клинической симптоматикой. Около 15% больных с диагнозом ИМ имеют лабораторные маркеры острой ЦМВИ. Характерны высокая лихорадка неправильного типа длительностью более 2 нед, слабость, выраженная утомляемость, потеря аппетита, ЛАП. Возможны головная боль, миалгии, артралгии, гепатоспленомегалия, характерно повышение активности аминотрансфераз и щелочной фосфатазы. Ангину и увеличение заднешейных и затылочных ЛУ наблюдают редко. Описаны гепатит, холангит, эзофагит и пневмония. Ряд заболевших отмечают выраженную сухость во рту, нарушение выработки слюны. Выявляют лейкопению, относительный лимфоцитоз, причем более 10% лимфоцитов - атипичные (с широкой базофильной цитоплазмой). Прогноз благоприятный.
Острая ЦМВИ у беременных протекает с умеренно выраженным фарингитом, субфебрилитетом, наличием слабости, артралгий или миалгий, повышением активности печеночных ферментов, лимфоцитозом. У трети пациенток инфекция протекает бессимптомно.
Заражение вирусом при гемотрансфузии или трансплантации органа серонегативному реципиенту может привести к развитию острого заболевания, возникающего через 2-8 нед после переливания инфицированной крови или через 8-12 нед после пересадки зараженного органа и характеризующегося высокой лихорадкой, выраженной астенией, болями в горле, ЛАП, миалгией и артралгией. В крови выявляют нейтропению и тромбоцитопению. Возможны пневмония, плеврит, гепатит, нефрит, миокардит, артрит. Заражение ЦМВ серонегативного реципиента органа в 70-80% случаев вызывает развитие манифестной ЦМВИ, которая при отсутствии лечения может закончиться летальным исходом.
Отсутствие иммунологических нарушений обусловливает переход острой ЦМВИ в латентную, при которой клинических проявлений инфекции не наблюдается.
Развитие иммуносупрессии ведет к возобновлению репликации ЦМВ, вирусемии и возможной манифестации заболевания. Повторное попадание вируса в организм человека на фоне иммунодефицитного состояния также может быть причиной клинически выраженной ЦМВИ.
Для ЦМВИ у иммуносупрессивных лиц характерно постепенное, в течение нескольких недель, развитие заболевания, появление быстрой утомляемости, слабости, потери аппетита, значительного снижения веса, длительной волнообразной лихорадки неправильного типа с подъемами температуры тела выше 38,5 °С, реже - потливости по ночам, артралгии, миалгии. Данный комплекс симптомов носит название «ЦМВ-ассоциированный синдром». Через 1-3 мес при сохранении иммуносупрессии развивается тяжелая органная патология с тенденцией к генерализации процесса. С ЦМВИ связан широкий спектр органных поражений, легких, сетчатки, надпочечников, ЖКТ, пищевода, печени, головного мозга, спинного мозга, корешков спинных нервов. Летальность стационарных больных ВИЧ-инфекцией, страдающих ЦМВИ, составляет 25-27%.
ЦМВ - основной этиологический фактор язвенных дефектов пищеварительного тракта у больных ВИЧ-инфекцией. Типичными признаками ЦМВ-эзофагита служат лихорадка, затруднение при глотании, загрудинная боль при прохождении пищевого комка, отсутствие эффекта противогрибковой терапии, наличие неглубоких округлых язв и/или эрозий в дистальном отделе пищевода. Поражение желудка ЦМВ-этиологии характеризуется сочетанием симптомов интоксикации и наличием острых или подострых язв в центре полиповидных образований в различных отделах желудка. Клиническая картина ЦМВ-колита или энтероколита характеризуется значительным снижением массы тела, лихорадкой, диареей, постоянными болями в животе, болезненностью толстой кишки при пальпации. Колоноскопия выявляет эрозии и изъязвления слизистой оболочки толстой кишки.
Гепатит - одно из основных клинических проявлений ЦМВИ при трансплацентарном заражении ребенка. Клинической особенностью ЦМВ-гепатита является частое сочетание с патологией желчевыводящих путей (склерозирующий холангит, папиллярный стеноз, стриктура общего желчного потока и некалькулезный холецистит). ЦМВ-гепатит характеризуется мягким клиническим течением. Может развиться надпеченочная желтуха.
Патология поджелудочной железы обычно протекает бессимптомно или со стертой клинической картиной и проявляется повышением активности панкреатических ферментов в крови и в моче.
Высокой чувствительностью к ЦМВ обладают клетки эпителия мелких протоков слюнных желез, преимущественно околоушных. Специфические изменения в слюнных железах при ЦМВИ у детей встречаются в подавляющем большинстве случаев. У взрослых больных ЦМВИ сиалоаденит возможен при первичном заражении.
Цитомегаловирусный интерстициальный нефрит, как правило, протекает без клинических проявлений. Отмечают микропротеинурию, микрогематурию, лейкоцитурию, редко - нефротический синдром и почечную недостаточность.
ЦМВ - одна из причин патологии надпочечников (часто у больных ВИЧ-инфекцией) с развитием надпочечниковой недостаточности, проявляющейся стойкой артериальной гипотензией, слабостью, похуданием, анорексией, нарушением работы кишечника, рядом психических отклонений, реже - гиперпигментацией кожи и слизистых.
Манифестная ЦМВИ у новорожденных, детей первых месяцев и лет жизни, ВИЧ-инфицированных лиц нередко протекает с поражением нервной системы в виде энцефаловентрикулита, миелита, полирадикулопатии, полинейропатии нижних конечностей.
У больных ВИЧ-инфекцией самой частой причиной потери зрения является ЦМВ-ретинит, который описан также у реципиентов органов, детей с врожденной ЦМВИ, в единичных случаях - у беременных женщин. Больные предъявляют жалобы на плавающие точки, пятна, пелену перед глазами, снижение остроты зрения. Вначале процесс односторонний, через 2-4 мес поражается второй глаз, и без этиотропной терапии приводит в большинстве случаев к потере зрения.
Сенсоневральная глухота отмечается у 60% детей с клинически выраженной врожденной ЦМВИ. Снижение слуха возможно и у взрослых ВИЧ-инфицированных больных с манифестной ЦМВИ. В основе связанных с ЦМВ дефектов слуха лежит воспалительное и ишемическое повреждение улитки и слухового нерва.
ЦМВ может быть причиной «идиопатических» миокардитов и миоперикардитов у пациентов без иммуносупрессии. При иммунодефицитных состояниях у больных манифестной ЦМВИ нередко наблюдают развитие дилатационной кардиопатии.
Возможно ЦМВ-поражение селезенки, ЛУ, костного мозга с развитием панцитопении. Частыми проявлениями ЦМВ-болезни являются тромбоцитопения со снижением способности клеток к агрегации и экзоцитозу, а также умеренные анемия, лейкопения, лимфопения и моноцитоз.
Диагностика
Клинический диагноз ЦМВ-заболевания требует обязательного лабораторного подтверждения.
Определение серологических маркеров методом ИФА, в частности твердофазным иммунолюминисцентным ИФА, имунным блоттингом. Решающее значение имеет обнаружение ДНК вируса методом РЦР в качественном и количественном вариантах.
Наиболее важное диагностическое значение имеет обнаружение ДНК в крови, свидетельствующее о высокоактивной репликации вируса и его роли в имеющейся патологии. Наличие ДНК ЦМВ в лейкоцитах крови беременной женщины является достоверным признаком активной репликации ЦМВ и служит важным маркером высокого риска антенатального и интранатального заражения вирусом ребенка. Прямым доказательством заражения плода является обнаружение ДНК ЦМВ в амниотической жидкости и пуповинной крови. Доказательством наличия врожденной ЦМВИ является обнаружение ДНК ЦМВ в любой биологической жидкости (крови, моче, соскобе с ротовой полости) в первые 14 дней жизни ребенка.
У иммуносупрессивных лиц (больных ВИЧ-инфекцией, реципиентов органов) для подтверждения диагноза манифестной ЦМВИ необходимо устанавливать количество ДНК вируса в крови. Диагностическое значение имеет вирусная нагрузка 105 и выше в лейкоцитах и 104 в плазме крови. Высокая вирусная нагрузка является даже при отсутствии клинических проявлений поводом для превентивной антицито-мегаловирусной терапии.
Важным подтверждением ЦМВ-природы имеющихся у больного клинических проявлений заболевания и патологических изменений в органах является обнаружение при гистологических исследованиях биопсийных материалов цитомегалоклеток.
Дифференциальная диагностика
Врожденную ЦМВИ следует дифференцировать с краснухой, токсоплазмозом, неонатальным герпесом, сифилисом, бактериальными инфекциями, гемолитической болезнью новорожденных, родовой травмой, наследственными синдромами. Решающее значение имеет специфическая лабораторная диагностика заболевания в первые недели жизни ребенка, гистологическое исследование плаценты с привлечением молекулярных методов. При мононуклеозоподобном заболевании исключают инфекции, вызываемые ЭБВ, герпесвирусами 6-го и 7-го типов, острую ВИЧ-инфекцию, а также стрептококковый тонзиллит и дебют острого лейкоза. В случае развития ЦМВ-заболевания органов дыхания у детей раннего возраста дифференциальную диагностику следует проводить с коклюшем, бактериальным трахеитом или трахеобронхитом, РС-вирусной инфекцией, герпетическим трахеобронхитом. У больных с иммунодефицитом ЦМВ-пневмонию следует дифференцировать с пневмоцистной пневмонией, туберкулезом, микоплазменной пневмонией, грибковым поражением легких, бактериальным сепсисом; ЦМВ-энцефаловентрикулит - с ВИЧ-энцефалитом, прогрессирующей многоочаговой лейкоэнцефалопатией, нейросифилисом. Полинейропатия и полирадикулопатия ЦМВ-этиологии требуют дифференцировки с полирадикулопатией, вызванной герпесвирусами 2-го и 6-го типов, синдромом Гийена-Барре, токсической полинейропатией, связанной с приемом ЛС, алкоголя, психотропных препаратов.
Лечение
При развитии клинически выраженной ЦМВ-болезни показана госпитализация. Особого режима и диеты не требуется. Они устанавливаются, исходя из состояния больного и локализации поражения. Грудное вскармливание при наличии ЦМВИ у матери не противопоказано. Если ребенок недоношенный, с низкой массой тела при рождении, имеет врожденную ЦМВИ и концентрация ДНК ЦМВ в грудном молоке высокая, рекомендована пастеризация или замораживание молока на 24 ч.
Медикаментозная терапия
Ганцикловир 5 мг/кг в/в 2 р/сут с 12-часовым интервалом или валганцикловир 900 мг 2 р/сут (ретинит).
Длительность терапии: 21 день у больных ретинитом, 4 нед - при поражении легких или пищеварительного тракта, 6 нед и более - при патологии ЦНС.
Лечение проводят до исчезновения симптомов заболевания и ДНК ЦМВ из крови.
Поддерживающая терапия: валганцикловир 900 мг/сут.
Длительность терапии: не менее одного месяца.
При рецидиве заболевания - повторный лечебный курс.
Превентивная терапия активной ЦМВИ у иммуносупрессивных больных: валганцикловир 900 мг/сут в течение не менее 1 мес.
Критерии прекращения терапии: отсутствие ДНК ЦМВ в крови.
Превентивная терапия при острой или активной ЦМВИ во время беременности: иммуноглобулин человека антицитомегаловирусный (НеоЦитотект♠) 1 мл/кг в сутки в/в 3 введения с интервалом в 2 нед.
Превентивная терапия активной ЦМВИ у новорожденных, детей младшего возраста: иммуноглобулин человека антицитомегаловирусный (НеоЦитотект♠) 2 мл/кг в сутки в/в 6 введений с интервалом 48 ч.
Лечебный курс при манифестной врожденной ЦМВИ: ганцикловир 6 мг/кг каждые 12 ч не менее 42 дней в дальнейшем с переходом на пероральную форму валганцикловира в форме суспензии в дозе 16-20 мг/кг каждые 12 ч в течение 6 мес.
Прогноз
При ранней постановке диагноза ЦМВ-пневмонии, эзофагита, колита, ретинита, полинейропатии и своевременном начале этиотропной терапии прогноз для жизни и сохранения трудоспособности благоприятный. Поздняя диагностика поражения сетчатки ведет к стойкому снижению зрения или к его полной потере. ЦМВ-поражение легких, кишечника, надпочечников, головного и спинного мозга могут стать причиной инвалидности или привести к летальному исходу.
Диспансеризация
Женщины во время беременности проходят лабораторное обследование для исключения активной ЦМВИ. Дети младшего возраста, инфицированные ЦМВИ антенатально, наблюдаются неврологом, отоларингологом, окулистом. Дети, перенесшие клинически выраженную врожденную ЦМВИ, находятся на диспансерном учете у невролога. Больные после пересадки костного мозга, других органов в первый год после трансплантации должны не реже одного раза в месяц проходить обследование на наличие ДНК ЦМВ в крови. Больные ВИЧ-инфекцией, имеющие количество СD4-лимфоцитов <100 кл./мкл, должны осматриваться офтальмологом и проходить обследование на количественное содержание ДНК ЦМВ в клетках крови не реже одного раза в 3 мес. Выполнение подобных рекомендаций, использование современных методов диагностики, применение эффективных терапевтических средств позволяют предотвратить развитие манифестной ЦМВИ или свести к минимуму ее последствия.
Инфекция, вызванная вирусом герпеса человека 6-го типа
Герпесвирус 6-го типа (HHV-6) считают наиболее вероятным этиологическим агентом рассеянного склероза, лихорадки новорожденных с судорожным синдромом и ИМ, негативных по ЭБВ и ЦМВ, а также ассоциированного с HHV-6 энцефалита. HHV-6 является кофактором СПИДа, некоторых форм карцином шейки матки и назофарингеальных карцином.
Этиология
HHV-6 сходен с остальными герпесвирусами, но отличается от них по биологическим, иммунологическим свойствам, спектру чувствительных клеток, антигенной структуре, составу генома, количеству и молекулярной массе структурных вирусных белков. HHV-6 относят к подсемейству Betaherpesvirinae роду Roseolovirus.
Диаметр вириона 160-200 нм, тип симметрии икосаэдрический, вирус содержит 162 капсомера, обладает суперкапсидной липидсодержащей оболочкой. Геном представлен двунитевой ДНК.
ННV-6А вызывает лимфогранулематоз, лимфоретикулез, гемоцитобластоз, рассеянный склероз, ННV-6В - внезапную экзантему новорожденных (Exanthema subitum). ННV-6 вызывает мононуклеоз, негативный по ЭБВ и ЦМВ, с длительной ЛАП. ННV-6 индуцирует у детей лимфопролиферативное заболевание с моноклональной пролиферацией В-клеток (дети от 3 мес до 3 лет). Считается, что ННV-6 может быть индуктором фульминантного гепатита.
Вирус HHV-6 селективно тропен к CD4+-Т-клеткам, но также способен поражать Т-клетки с детерминантами CD3+, CD5+, CD7+, CD8+. Вирус реплицируется во многих клеточных первичных и перевиваемых культурах различного происхождения.
Эпидемиология
HHV-6, подобно другим герпесвирусам, распространен повсеместно. При рождении большинство детей серопозитивны за счет материнских антител, титр которых снижается к 5 мес. От 1 года до 7 лет наблюдается уменьшение количества серопозитивных детей, в возрастной группе от 3 до 7 лет оно составляет 55%. От 7 до 15 лет отмечается стабилизация частоты инфицированности. Начиная с 15 лет, отмечается резкое увеличение количества инфицированных HHV-6, эта тенденция сохраняется, включая лиц 60 лет и старше.
Исследования в различных регионах мира свидетельствуют о широком распространении HHV-6 (85%) в человеческой популяции.
В естественных условиях основной путь передачи вируса - воздушно-капельный. Возможны также половой путь и перинатальная инфекция. Однако в большинстве случаев инфицирование происходит постнатально, что подтверждает контактный путь передачи в раннем периоде жизни.
Возможно заражение при гемотрансфузиях, трансплантации органов, использовании медицинских инструментов, контаминированных вирусом.
Клиническая картина
Спектр заболеваний, связанных с HHV-6, довольно широк (табл. 17-12). HHV-6 связывают с различными лимфопролиферативными и иммуносупрессивными заболеваниями, с внезапной экзантемой новорожденных, злокачественными новообразованиями, аутоиммунной патологией, некоторыми заболеваниями ЦНС и др.
| Заболевания, ассоциированные с первичной острой HHV-6-инфекцией | Заболевания, ассоциированные с персистентной HHV-6-инфекцией |
|---|---|
Синдром хронической усталости (миалгический энцефаломиелит). Внезапная экзантема у новорожденных и детей (roseola Infantum exanthema subitum). ИМ у подростков и взрослых, не связанный с заражением ЭБВ. Гистиоцитарный некротический лимфаденит (KIKuchis lymphadenitis) |
Лимфопролиферативные заболевания (иммунодефицит, ЛАП, поликлональная лимфопролиферация). Злокачественные лимфомы (неходжкинская лимфома, периферическая Т-клеточная лейкемия, В-клеточная лимфома, дерматопатическая ЛАП, лимфогранулематоз, синусоидальная В-клеточная лимфома, плеоморфная Т-клеточная лимфома) |
Доказана этиологическая роль HHV-6 в развитии внезапной экзантемы (синонимы: розовая сыпь новорожденных, exanthema subitum, roseola infantum, «шестая болезнь», МКБ-10: В08.2) - широко распространенного заболевания детей в возрасте от 3 мес до 3 лет. Инкубационный период заболевания 5-15 дней. Exanthema subitum характеризуется острым началом, высокой лихорадкой (38,5-40 °С) и умеренно выраженной интоксикацией. На 4-й день болезни температура снижается, и одновременно или через несколько часов появляется макулезная сыпь. Обычно высыпания локализуются на спине, животе, груди, разгибательных поверхностях конечностей. На лице сыпь встречается редко. Через 2-3 дня сыпь исчезает, не оставляя следов. Обычно заболевание заканчивается без осложнений, но описаны клинические случаи манифестной инфекции с различными симптомами: лихорадка выше 40 °С, острый тимпонит, респираторные и гастро-интестинальные симптомы, неврологические осложнения.
Неврологическим осложнением HHV-6, кроме фебрильных судорог, является энцефалит, который протекает более доброкачественно, чем вызванный ВПГ-1, -2 с формированием воспалительных инфильтратов в различных отделах мозга. В редких случаях возможны менингит, развитие эпилепсии. Причинами фебрильных судорог может быть как прямое повреждающее действие на ЦНС, так и опосредованное за счет активации ИЛ-8 в СМЖ. В редких случаях первичная HHV-6-инфекция протекает с гепатоспленомегалией, фатальным фульминантным гепатитом.
Доказана роль HHV-6 в развитии ИМ у детей как моноинфекции и в ряде случаев в виде микст-инфекции в сочетании с вирусами ЭБВ и ЦМВ.
Критериями диагностики моноинфекции ИМ, вызванного HHV-6, являются обнаружение ДНК вируса в лейкоцитах крови, наличие специфических антител класса IgМ в сыворотке крови и/или повышение уровня антител класса IgG к HHV-6 в сыворотке крови в 2-4 раза выше диагностических значений; отрицательная реакция на наличие гетерофильных антител при отсутствии маркеров активной репликации ЭБВ и ЦМВ.
Клинико-лабораторными проявлениями HHV-6 мононуклеоза у детей являются: острое начало с развитием основных симптомов уже на 1-й неделе заболевания (лихорадка, ЛАП, гепатомегалия с повышением активности трансфераз, ангина, спленомегалия); в гемограмме отмечаются умеренный лейкоцитоз, лимфоцитоз, тромбоцитоз, значительное (более 20 мм/ч) повышение СОЭ, атипичные мононуклеары (до 55%). Проба на гетерофильные антитела всегда отрицательная. При HHV-6-мононуклеозе менее выражены такие симптомы, как ангина, ЛАП (более 2 см), спленомегалия.
Первичную инфекцию среди взрослых выявляют довольно редко, она проявляется в форме длительной ЛАП, мононуклеозоподобного синдрома, гепатита и др.
В крови наблюдают лейкопению, нейтропению, относительный лимфоцитоз и моноцитоз.
Роль HHV-6 как кофактора СПИДа обеспечивается его способностью инфицировать, реплицироваться и разрушать CD4+-клетки. Отмечают усиление цитопатического эффекта при двойном инфицировании по сравнению с моноинфекцией ВИЧ-1, при этом HHV-6 может как ингибировать, так и стимулировать репликацию ВИЧ-1. HHV-6 активирует онкопротеины Е6 и Е7 вируса папилломы человека при цервикальной карциноме.
ДНК HHV-6 была идентифицирована в тканях и клетках биопсийных образцов ходжкинских, смешанных В- и Т-клеточных неходжкинских лимфом, при ангиоиммунобластоидной ЛАП, африканской лимфоме Беркитта, Т-клеточной острой лимфобластной лейкемии и ряде других лимфопролиферативных заболеваний.
Роль HHV-6 в развитии синдрома хронической усталости обсуждается.
Диагностика
Для диагностики HHV-6-инфекции используют иммунологические методы (РНИФ, ИБ, ИФА), метод электронной микроскопии и ПЦР.
Лечение
Перечень лекарственных препаратов для медицинского применения: нуклеозиды и нуклеотиды, кроме ингибиторов обратной транскриптазы (ацикловир, валацикловир), прочие противовирусные препараты (инозин пранобекс), иммуностимуляторы (глюкозаминилмурамилдипептид), ИФН-α, ИЛ (интерлейкин-2), другие иммуностимуляторы (меглюмина акридонацетат, пидотимод, тилорон), симпатомиметики в комбинации с другими средствами, кроме глюкокортикоидов (ацетилцистеин + туаминогептан), антисептики (лизоцим + пиридоксин, Гексализ♠), муколитические препараты (амброксол), производные пиперазина (цетиризин). Средняя продолжительность 14 дней.
Инфекция, вызванная вирусом герпеса человека 7-го типа
Этиология
HHV-7 относится к роду Roseolovirus подсемейству Betaherpesvirus. При электронно-микроскопическом исследовании выявлены типичные для герпесвирусов вирионы диаметром до 170 нм. HHV-7 является лимфотропным вирусом, осуществляющим репликацию в Т-лимфоцитах и моноцитах. Рецептором для попадания в клетку HHV-7 являются CD4+, но также HHV-7 способен инфицировать клетки и с другими рецепторами.
Эпидемиология
HHV-7 широко распространен среди населения. У серопозитивных взрослых вирус можно обнаружить в периферических мононуклеарах крови, слюне. Частота выделения HHV-7 у детей старше 36 мес - 100%. Основной путь передачи HHV-7 - через слюну. Характерна внутрисемейная передача вируса. Кроме того, вирус обнаруживается в грудном молоке. В отличие от HHV-6, HHV-7 не вызывает внутриутробной инфекции.
Патогенез
Как и все герпесвирусы человека, HHV-7 персистирует в организме после перенесенной первичной инфекции в течение всей жизни, но может реактивироваться при выраженной иммуносупрессии. Такая ситуация наиболее характерна для реципиентов после трансплантации костного мозга и органов. Реактивация HHV-7 на фоне иммунодефицита может сопровождаться лихорадкой, пневмонией, развитием энцефалита, реакцией «трансплантат против хозяина» и отторжением пересаженного органа. HHV-7 может выступать кофактором в развитии манифестной ЦМВИ у пациентов после пересадки почек.
Клиническая картина
Основным клиническим проявлением первичной HHV-7-инфекции у детей является внезапная экзантема. Считается, что в основном это заболевание вызывается HHV-6 и только в 10% - HHV-7. Проявляется болезнь высокой лихорадкой в течение 3 дней с последующим появлением пятнисто-папулезной сыпи на голове и туловище, самостоятельно исчезающей в течение 2 дней. При осмотре выявляются также гиперемия ротоглотки и увеличение затылочных ЛУ. Частым неврологическим осложнением первичной HHV-7-инфекции являются фебрильные судороги, которые встречаются чаще, чем при HHV-6-инфекции. Среди других проявлений HHV-7-инфекции выделяют мононуклеозоподобный синдром. Описаны случаи гепатита, менингоэнцефалита.
Диагностика
Для диагностики HHV-7-инфекции используют иммунологические методы (РНИФ, ИФА), электронную микроскопию, ПЦР.
Инфекция, вызванная вирусом герпеса человека 8-го типа
Этиология
HHV-8 - герпесвирус, ассоциированный с саркомой Капоши, идентифицирован молекулярным клонированием с использованием тканей саркомы Капоши. HHV-8 инфицирует в первую очередь лимфоциты. С HHV-8 связано развитие некоторых В-клеточных лимфом, ангиоиммунобластоидной ЛАП, болезни Кастлемана, первичной выпотной лимфомы и ряда других лимфопролиферативных заболеваний. HHV-8 по морфологии, структуре и функциям относят к подсемейству γ-герпесвирусов рода радиновирусов. Установлено, что HHV-8 связан со всеми типами саркомы Капоши, включая эндемическую - у африканцев, классическую - у пожилых людей, эпидемическую и иммуносупрессивную. Выделяют 5 субтипов генотипа А, В, С, D, E. В России получены изоляты субтипов А и С.
Эпидемиология
Вирус широко распространен в популяции; более 25% взрослого населения и 90% ВИЧ-инфицированных имеют антитела к HHV-8. Выявлены высокие уровни заболеваемости классической саркомой Капоши в странах Африки, особенно Центральной; низкие - в США, Японии и в некоторых северных европейских странах, средние - в большинстве средиземноморских стран. Установлено, что за 3-10 лет развитию саркомы Капоши предшествует инфекция, вызванная HHV-8. Вирус передается половым путем. Кроме того, вирус может передаваться вертикально от матери к плоду. Чаще всего HHV-8 передается во время родов или после родов. Наибольшую концентрацию вируса отмечают в слюне.
Патогенез и патоморфология
Происхождение веретенообразных клеток - важного компонента бляшек и опухолей при саркоме Капоши - подтверждено результатами ультраструктурных и иммуногистохимических исследований с маркерами CD31 и С34, в которых выяснено, что они являются трансформированными эндотелиальными клетками.
Гистологическая структура опухоли характеризуется множеством хаотично расположенных тонкостенных новообразованных сосудов и пучков веретенообразных клеток. Характерна инфильтрация опухоли лимфоцитами и макрофагами. Сосудистый характер опухоли резко увеличивает риск кровотечений.
Клиническая картина
Первичная инфекция HHV-8 протекает бессимптомно. Манифестация саркомы Капоши на фоне иммуносупрессии проявляется характерными узелками багрово-синюшного, иногда бурого цвета, которые могут появиться на коже или на слизистой оболочке рта. Болезнь поражает легкие, желчевыводящую систему, другие органы.
Классическая форма характеризуется появлением локализованных узлов преимущественно на коже нижних конечностей. Встречается у лиц пожилого возраста, чаще у мужчин, в Центральной Европе и странах Средиземноморья, а также и в России. Заболевание протекает медленно, внутренние органы вовлекаются в процесс редко.
Эндемическая форма распространена в Центральной Африке. Болеют преимущественно дети. В процесс вовлекаются кожа, кости, внутренние органы, ЛУ, подкожная клетчатка, часто развивается лимфедема. Прогноз неблагоприятный, летальный исход наступает через 2-3 мес.
Иммуносупрессивная саркома Капоши возникает у лиц, длительно получающих иммуносупрессивную терапию, после трансплантации органов, при системных заболеваниях. Отличается более агрессивным течением. Начинается внезапно, характерно появление множественных элементов, которые быстро трансформируются в опухолевые узлы. Часто поражаются внутренние органы. Однако после прекращения иммуносупрессивной терапии саркома Капоши может спонтанно регрессировать.
Эпидемическая (СПИД-ассоциированная) саркома Капоши отличается агрессивным течением, распространением элементов сверху вниз, разнообразием морфологических элементов, с преобладанием бляшечных. Типичной локализации для данной формы саркомы Капоши нет. Элементы саркомы Капоши могут появляться на лице, часто на кончике носа, ушах, в слуховом проходе, на слизистых оболочках глаз и около глазницы, во рту, на половых органах, нижних конечностях. Часто в процесс вовлекаются внутренние органы.
Первичная лимфома серозных оболочек встречается у ВИЧ-инфицированных. Это редкий тип лимфом. Выявляется серозный экссудат, без объемных образований. В серозном экссудате обнаруживают большое количество лимфоцитов с признаками высокой степени злокачественности и герпесвирус человека 8-го типа. Не распространяется за пределы серозных полостей. Прогноз неблагоприятный. Продолжительность жизни после установления диагноза от 2-6 мес.
Многоочаговая болезнь Кастлемана - злокачественное лимфо-пролиферативное заболевание у ВИЧ-инфицированных. Больных беспокоят сильная слабость и недомогание. Отмечается значительное увеличение ЛУ. Наблюдается выраженная лихорадка, ночные поты, потеря веса. Выявляется выраженная спленомегалия, часто гепато-мегалия, катаральные явления, отеки с гипоальбуминемией. Прогноз неблагоприятный. Средняя продолжительность жизни после постановки диагноза составляет 14 мес. Отмечается частая трансформация в высокозлокачественную лимфому.
Диагностика
Для диагностики HHV-8 преимущественно используют серологические исследования (ИФА, иммуноблоттинг) и ПЦР.
Дифференциальная диагностика
Саркому Капоши дифференцируют в первую очередь с гетерогенной группой сосудистых пролифераций [псевдоангиосаркома Массона, псевдосаркома Капоши типа Мали (акроангиодерматит), мишенеподобная гемосидеротическая гемангиома и др.].
Лечение
Местная терапия: инъекции винбластина по 0,1 мл/см2 в ткань опухоли с интервалом 3-4 нед. При поверхностной и бляшечной форме - облучение мягкими Rö-лучами 4-5 гр/день 3 р/нед. Лучевая терапия при обширном распространении опухоли 400 рад/нед в течение 6 нед. Хирургическое лечение с осторожностью. Химиотерапия: проспидия хлорид (Проспидин♠) 100 мг в/м ежедневно на курс 3-6 г; липосомальные антрациклины: доксорубицин (Келикс♠) 20 мг/м2 в/в каждые 2-3 нед, курс 6-8 введений; даунорубицин (дауноксρ) 40 мг/м2 в/в каждые 2 нед. Интерферонотерапия: рекомбинантный ИФН-α2b 3-6 млн МЕ/м2 п/к в день 3-5 р/нед. ПЭГ-ИФН 50 мкг/нед п/к.
Корь
Корь - острая высококонтагиозная антропонозная вирусная болезнь с аэрозольным механизмом передачи возбудителя, характеризующаяся циклическим течением, общей интоксикацией, макулопапулезной сыпью, патогномоничными высыпаниями на слизистой оболочке рта, катарально-респираторным синдромом и конъюнктивитом.
Коды по МКБ-10
В05 Корь.
Этиология
Возбудитель кори - РНК-содержащий вирус, семейства парамиксовирусов, рода коревых вирусов. Вирусная частица плейоморфна имеет округлую форму, мембранную оболочку и спиральный нуклеокапсид, образованный тремя белками вируса и РНК. Имеется липопротеидная мембрана, обеспечивающая адгезию, проникновение и размножение вируса в чувствительных клетках хозяина, и гликопротеидная мембрана, представленная гемагглютинином (белок Н) и гемолизином (F), которые индуцируют образование специфических антител. При размножении вирус кори вызывает образование многоядерных гигантских клеток-симпластов и эозинофильных включений. Формирование дочернего вируса кори происходит путем «почкования» на поверхности зараженных клеток. Вирус кори высококонтагиозен, но неустойчив в окружающей среде, он быстро погибает под воздействием солнечного света, ультрафиолетового излучения, при высыхании. В высушенном состоянии при температуре -20 °С вирус не теряет активности в течение года. При температуре 37 °С инактивация 50% популяции вируса наступает через 2 ч, при 56 °С вирус гибнет через 30 мин, при 60 °С - мгновенно. Он инактивируется 0,00025% раствором формалина, чувствителен к эфиру, кислой среде (рН <4,5).
Эпидемиология и профилактика
Источник возбудителя - больной человек. Индекс контагиозности составляет 95-96%. Больные заразны в течение 1-2 сут до появления симптомов и до конца 4-х суток с момента появления сыпи. При развитии пневмонии сроки выделения вируса увеличиваются. Путь передачи - воздушно-капельный, заражение возможно даже при кратковременном контакте. От источника вирус потоками воздуха по вентиляционным ходам может распространяться в другие помещения. Лица, не болевшие корью и не привитые против нее, остаются высоковосприимчивыми к возбудителю в течение всей жизни.
Корь распространена повсеместно. До введения вакцинации подъемы заболеваемости корью регистрировались каждые 2 года. После введения массовой вакцинации и ревакцинации периоды эпидемиологического благополучия стали более продолжительными (8-9 лет). Для кори характерна зимне-весенняя сезонность заболеваемости, меньше всего болеют корью осенью.
После перенесенной естественной коревой инфекции остается стойкий иммунитет.
Повторные заболевания корью встречаются редко. Иммунитет после прививок более кратковременный.
Основной метод профилактики - специфическая профилактика противокоревой вакциной. Современные вакцины обладают профилактической эффективностью 95-98%. За период с 2000 по 2014 г. противокоревая вакцинация привела к снижению глобальной смертности от кори на 79%. По данным ВОЗ, в 2000-2014 гг. вакцинация от кори предотвратила 17,1 млн случаев смерти, сделав вакцину от кори одним из наиболее эффективных достижений общественного здравоохранения.
Современные вакцины национального календаря прививок:
Метод неспецифической профилактики - ранняя изоляция больного. Больные подлежат изоляции в течение 7 дней, при развитии осложнений - 17 дней от начала заболевания.
Детей, не привитых и не болевших, контактировавших с больными корью, не допускают в детские учреждения в течение 17 дней с момента контакта. Первые 7 дней от начала контакта дети разобщению не подлежат.
Противоэпидемические мероприятия в очаге
Если очаг инфекции зарегистрирован в детском дошкольном учреждении или школе, то на срок с момента выявления первого больного до 21 дня с момента выявления последнего больного в коллектив не принимаются дети, не болевшие корью и не привитые против нее. Больных корью госпитализируют при наличии показаний на срок до исчезновения клинических симптомов, но не менее 5 дней с момента появления сыпи с обязательным лабораторным обследованием. Реконвалесцентов допускают в коллектив после клинического выздоровления даже при наличии вторичных случаев инфекции в очаге. Контактные лица в очагах кори ежедневно осматриваются врачом или медсестрой. При наличии среди контактных лиц не привитых (или привитых однократно) и не болевших корью за ними устанавливается медицинское наблюдение в течение 21 дня с момента выявления первого случая заболевания в очаге, проводится их лабораторное обследование в те же сроки, что и больным.
С целью предупреждения распространения инфекции в очагах не позднее 72 ч с момента выявления первого больного проводится вакцинация (ревакцинация) против кори следующим категориям контактных лиц в возрасте до 35 лет: не болевшим и не привитым ранее; не болевшим и привитым однократно, если с момента прививки прошло не менее 6 мес; при неизвестном инфекционном и прививочном анамнезе; серонегативным или имеющим титр антител ниже защитного уровня. При наличии противопоказаний к вакцинации, а также детям, не достигшим прививочного возраста, вводится иммуноглобулин человека нормальный, не позднее 5-го дня с момента первого контакта с больным корью. Неиммунные дети, контактные по кори, подлежат разобщению с 9-го по 17-й день. На вакцинированных против кори детей карантин не накладывается, если контакт произошел не ранее 21 дня после иммунизации.
Патогенез
Вирус кори обладает эпителиотропными, лимфотропными и нейротропными свойствами. Входными воротами вируса является слизистая оболочка дыхательных путей и, возможно, конъюнктива глаз, где осуществляется адгезия вируса и откуда он попадает в регионарные ЛУ, в которых начинается его репликация. С 3-4-го дня инкубационного периода вирус проникает в кровь (первичная вирусемия, во время которой его можно частично нейтрализовать парентеральным введением иммуноглобулина) и оседает в ЛУ, печени, селезенке. Начинается новый этап интенсивного размножения вируса в этих органах, в результате которого образуются гигантские многоядерные клетки, несущие коревой антиген. Размножившийся вирус снова проникает в кровь (вторичная вирусемия), что соответствует началу заболевания. В капиллярах слизистых оболочек и кожи происходит контакт сенсибилизированных Т-клеток и клеток, несущих коревой антиген, и реакция ГЗТ, клинически проявляющаяся характерной сыпью на коже и пятнами Филатова-Бельского-Коплика на слизистой оболочке полости рта. С последних дней инкубации в течение 1-2 дней после появления сыпи вирус можно выделить из крови.
Эпителиотропные свойства вируса реализуются клинически воспалительной реакцией в дыхательных путях (коревой бронхит, пневмония) и пищеварительном тракте (абдоминальный синдром, диарея). Нейротропные свойства коревого вируса клинически ассоциируются с развитием инфекционного токсикоза с возможным возникновением энцефалической реакции у детей младшего возраста или коревого менингоэнцефалита у детей старшего возраста и взрослых.
Лимфотропные свойства вируса проявляются увеличением ЛУ (преимущественно шейных), печени, селезенки и особенно повреждением иммунокомпетентных клеток с развитием иммуносупрессии, предрасполагающим к возникновению бактериальных осложнений. Во многих лейкоцитах выявляют разрушенные хромосомы.
С 3-го дня высыпания вирусемия резко снижается, а с 4-го дня вирус в крови обычно не обнаруживается, с этого времени в крови появляются вируснейтрализующие антитела. При кори развивается специфическая аллергическая перестройка организма, сохраняющаяся длительное время. У привитых со временем резко снижаются титры антител к вирусу кори, тогда как аллергизация сохраняется длительно, что обусловливает атипичное течение болезни спустя 5-7 лет после прививки.
Самые значительные изменения происходят в органах дыхания. С первого дня болезни наблюдается воспаление слизистой оболочки носа, гортани, трахеи, бронхов, бронхиол и альвеол. Воспалительный процесс углубляется, захватывает не только слизистую бронха, но и мышечную, перибронхиальную ткань, вызывая панбронхит. Иногда интерстициальный коревой пневмонит переходит в характерную для этой болезни гигантоклеточную пневмонию, при которой в альвеолах обнаруживают типичные для кори гигантские клетки.
Со стороны органов ЖКТ отмечается катаральный или язвенный стоматит, катаральный колит с наличием в лимфоидных фолликулах и групповых лимфатических фолликулах (пейеровых бляшках) специфических клеток (ретикулоэндотелиоцитов). Поздние поражения пищеварительного канала являются, как правило, следствием присоединения вторичной инфекции.
Клиническая картина
Инкубационный период - 9-17 дней, при введении иммуноглобулина может удлиниться до 21 дня, реже - больше.
Классификация
По тяжести: легкая, среднетяжелая, тяжелая.
По течению: типичная, атипичная, с вариантами течения: абортивное, митигированное, стертое, бессимптомная инфекция.
В продромальном периоде (продолжительность 2-4 сут у детей и до 5-8 сут у взрослых) характерны кашель, насморк с обильными выделениями из носа, конъюнктивит со слезотечением, лихорадка (до 40 °С), связанная со второй волной вирусемии. Незадолго до сыпи появляются пятна Филатова-Бельского-Коплика (голубовато-белые, диаметром 1-2 мм, с ярко-красной каймой), иногда обильные, сливающиеся между собой, располагающиеся на слизистой оболочке щек напротив вторых моляров. С появлением сыпи пятна вскоре исчезают. Слизистая щек и поверхности губ отечна, гиперемирована, губы иногда краснеют. У части больных на лице, туловище и конечностях на 2-3-й день появляется продромальная мелкопятнистая зудящая сыпь.
Период высыпания характеризуется усилением интоксикации, катаральных явлений, нарастанием лихорадки, на 4-8-й день появляется сыпь на голове вдоль линии роста волос и за ушами, распространяется на лицо, туловище и конечности, в том числе на ладони и стопы, часто становясь сливной: в 1-е сутки элементы сыпи появляются на лице, шее; на 2-е сутки - на туловище, руках и бедрах; на 3-и сутки сыпь захватывает голени и стопы, а на лице начинает бледнеть. Наиболее густо элементы сыпи расположены на лице, шее и верхней части туловища. Элементами сыпи являются мелкие папулы (около 2 мм), сливающиеся между собой и окруженные неправильной формы пятном диаметром более 10 мм. Даже при самой обильной сыпи можно обнаружить участки кожи нормальной окраски. В некоторых случаях на фоне коревой экзантемы можно заметить кровоизлияния (петехии).
В период высыпания состояние больных наиболее тяжелое. На 4-е сутки сыпь начинает бледнеть в том же порядке, в каком она появилась. Пигментация сохраняется 1-2 нед, отрубевидное шелушение на лице и туловище - 5-7 дней. Температура нормализуется на 4-5-е сутки от начала высыпания. Более длительная лихорадка указывает на развитие осложнений.
Стертая форма кори характеризуется тем, что все основные симптомы заболевания выражены слабо, а иногда отсутствуют.
Митигированная корь развивается после введения в инкубационном периоде иммуноглобулина или других препаратов, содержащих антитела, а также у грудных детей, не утративших полностью врожденного иммунитета. Заболевание протекает при слабо выраженных симптомах интоксикации; укорачивается и нарушается этапность высыпаний.
Корь может иметь неосложненное и осложненное течение. По срокам развития различают ранние осложнения, обусловленные вирусом кори, возникающие в остром катаральном периоде и периоде высыпаний, и поздние, вызванные вторичной инфекцией в периоды пигментации и реконвалесценции.
В настоящее время наиболее частыми осложнениями кори являются коревой круп, ларинготрахеит, отит, бронхит, пневмония, синусит, стоматит, колит и энтероколит, импетиго, фурункулез.
К осложнениям со стороны ЦНС относятся серозный менингит, энцефалит, менингоэнцефалит, встречающиеся с частотой 1:1000 случаев кори и отличающиеся тяжелым течением с возможным летальным исходом. При коревом энцефалите различают наиболее типичные синдромы: коматозный, судорожный, гемиплегический, акинетикоригидный, психоорганический. Острый коревой энцефалит развивается чаще у детей старшего возраста и взрослых как при тяжелой, так и при легкой форме кори на 3-5-й день после появления сыпи. На фоне повышения температуры тела до высоких цифр появляются головная боль, сонливость, переходящая в сопор или кому. На фоне нарушения сознания возникают судороги генерализованные или фокальные, параличи и парезы, гемипарезы, реже монопарезы. Возможны гиперкинезы разного характера, мозжечковая атаксия, нистагм, диэнцефальные нарушения, парезы черепных нервов, чаще всего лицевого, носящие обратимый характер. Поражение спинного мозга в виде миелита и полирадикулоневрита проявляется нарушением функции тазовых органов, развитием нижней параплегии, проводниковыми расстройствами чувствительности, трофическими расстройствами. Серозный менингит характеризуется появлением на фоне кори головной боли, менингеальных симптомов, рвоты, общетоксического синдрома. В СМЖ - умеренный плеоцитоз лимфоцитарного или смешанного характера, содержание белка может быть повышено.
Подострый склерозирующий панэнцефалит - медленная коревая нейроинфекция с длительным инкубационным периодом (до 8-10 лет после перенесенной кори). Заболевание развивается латентно, проявляется хроническим нейроастеническим синдромом, головной болью, вялостью, слабостью, быстрой утомляемостью. Наблюдаются изменения в психоэмоциональной сфере: нарушение памяти, реже снижение способности к обучению, расторможенность. Постепенно присоединяются пирамидные и экстрапирамидные симптомы, появляются эпилептические припадки, гиперкинезы. Характерно снижение интеллекта, панагнозия.
Особенности течения кори у детей 1-го года жизни: в периоде продромы катаральные явления слабо выражены, заболевание может начинаться с появления сыпи, сохраняются этапность высыпания и пятнисто-папулезный характер сыпи с последующей пигментацией. Симптом Филатова-Коплика может отсутствовать. Для детей раннего возраста характерно появление дисфункции кишечника (частый жидкий стул). Течение кори у детей первого года жизни более тяжелое, отличается более частым развитием ранних и поздних осложнений.
Диагностика
Диагностика кори носит комплексный характер и предусматривает оценку эпидемической ситуации в окружении больного, клиническое наблюдение в динамике и серологическое обследование. Типичную корь с пятнами Филатова-Бельского-Коплика, кашлем, ринитом, конъюнктивитом и сыпью легко диагностировать на основе клинической картины.
Выявление в сыворотке крови больного (лиц с подозрением на заболевание) специфических антител, относящихся к IgМ, методом ИФА является основанием для установления (подтверждения) диагноза.
ПЦР позволяет диагностировать корь в ранние сроки при наличии вирусемии вне зависимости от клинической картины. В более поздние сроки исследуют мочу, носоглоточные смывы, СМЖ.
Дифференциальная диагностика при кори проводится с краснухой, скарлатиной, ИМ, аллергическими сыпями, энтеровирусной инфекцией, инфекционной эритемой, внезапной экзантемой.
Лечение
Госпитализируют детей из приютов, детских домов, общежитий, социально-неблагополучных семей, а также больных с тяжелыми и осложненными формами заболевания.
Режим постельный на все время лихорадочного периода. Кровать пациента должна находиться головным концом к окну, чтобы свет не раздражал глаза, искусственное освещение в комнате или палате должно быть приглушенным.
В рацион больного необходимо включить фруктовые соки, морсы, пища должна быть полноценной, богатой витаминами, легко усваиваться.
Медикаментозная терапия
Симптоматическая терапия включает жаропонижающие средства при лихорадке 38,5 °С и выше (парацетамол), адреномиметики (ксило-метазолин), муколитические препараты (ацетилцистеин). Обосновано применение ИФН-α в катаральном периоде и периоде высыпания. При коревом крупе показана ингаляционная терапия, глюкокортикоиды, при тяжелом крупе - при неэффективности ингаляционного введения - внутривенно или внутримышечно. Антибактериальная терапия назначается при тяжелых формах кори (независимо от возраста заболевших), при среднетяжелых формах у детей до первого года жизни и при бактериальных осложнениях. Рекомендуются защищенные пенициллины, макролиды и ЦС II-III поколения парентерально в возрастных дозах. При коревом энцефалите рекомендуется применение рекомбинантных ИФН, глюкокортикоидов, нейропротекторов, препаратов, улучшающих микроциркуляцию и тканевый метаболизм, дегидратации петлевыми диуретиками.
Прогноз. При неосложненном течении заболевания прогноз благоприятный. При развитии пневмонии, энцефалита, неадекватном несвоевременном лечении возможен летальный исход.
Диспансеризация. Дети, перенесшие коревой энцефалит, подлежат наблюдению неврологом, офтальмологом, инфекционистом в течение 2 лет с проведением курсов восстановительного лечения.
Краснуха
Краснуха (Rubeola) - острая антропонозная инфекционная болезнь, передающаяся воздушно-капельным путем, проявляющаяся лихорадкой, мелкопятнистой сыпью, полиаденопатией и высоким риском поражения плода при развитии заболевания у беременных.
Коды по МКБ-10
В06 Краснуха [немецкая корь].
В06.0 Краснуха с неврологическими осложнениями.
В06.8 Краснуха с другими осложнениями.
В06.9 Краснуха без осложнений.
Этиология
Возбудитель краснухи - Rubella virus - относится к семейству Togaviridae, роду Rubivirus. Вирион краснухи сферической формы, 40-80 нм в диаметре, состоит из наружной оболочки с характерными выступами, представленными гемагглютинином, и нуклеокапсида. Геном образован несегментированной одноцепочечной молекулой +РНК. Вирус чувствителен к действию химических агентов. Инактивируется под действием эфира, хлороформа, формалина. При температуре 56 °С погибает через 30 мин, при 100 °С - через 2 мин, при воздействии ультрафиолетового облучения - через 30 с.
При наличии в среде белка устойчивость вируса повышается. Вирус хорошо сохраняет биологическую активность при низких температурах. Вирионы формируются в цитоплазме чувствительной клетки. Вирус оказывает слабое цитопатогенное действие, имеет способность к длительной персистенции.
Эпидемиология
В 2014 г. в РФ зарегистрировано 54 случая заболевания краснухой.
Источник возбудителя инфекции - больные, в том числе со стертым и атипичным течением болезни, лица с бессимптомной инфекцией и вирусоносители. Вирус выделяется из слизи ВДП за 1-2 нед до появления сыпи и в течение 3 нед после высыпания. У детей с врожденной краснухой возбудитель может выделяться с мочой, мокротой, калом до 2 лет после рождения. Основной путь передачи возбудителя - воздушно-капельный. Вирусемия, развивающаяся при краснухе, обусловливает внутриутробный путь передачи возбудителя от матери плоду, а также вероятность парентеральной передачи. Восприимчивость к краснухе высокая. Невосприимчивы к инфекции дети первого полугодия жизни, если у матери есть иммунитет к этой инфекции. Наиболее восприимчивы дети в возрасте от 1 до 9 лет. Постинфекционный иммунитет в большинстве случаев пожизненный, повторные случаи заболевания крайне редки. Для крупных городов характерна постоянная заболеваемость с сезонными зимне-весенними подъемами. Возможны эпидемические вспышки, возникающие обычно с интервалом 7 лет. Заболеваемость краснухой характеризуется выраженной очаговостью в детских коллективах. Болезнь распространяется там, где люди находятся в длительном и тесном контакте (семья, школа, детский сад, больница).
Меры профилактики
Больных изолируют на дому в течение 5 сут с момента высыпания. Дезинфекцию и разобщение контактных детей не проводят. Основу профилактики составляет вакцинация. Вакцинацию проводят в возрасте 12 мес и 6 лет. Вакцинации подлежат также девочки 13 лет, не болевшие краснухой, при отсутствии данных о вакцинации. Рекомендуют вакцинировать и женщин фертильного возраста, не вакцинированных в детстве, не болевших краснухой и имеющих концентрации антител против краснухи ниже защитного уровня. Прививка противопоказана беременным, после вакцинации женщинам необходимо предохраняться от беременности в течение 3 мес.
Патоморфология и патогенез
Вирус проникает в организм через слизистые оболочки ВДП. Наиболее вероятными местами первичной репликации вируса являются носоглотка и регионарные ЛУ. Через 5-7 дней после инфицирования развивается вирусемия, и вирус выделяется в окружающую среду с выдыхаемым воздухом, мочой и испражнениями. В дальнейшем вирус размножается в ЛУ (этот процесс сопровождается полиаденопатией), а также в эпителии кожи, приводя к появлению сыпи. Вирус проникает через ГЭБ и плаценту. В результате активации продукции ИФН, формирования клеточного и гуморального иммунитета циркуляция вируса прекращается, и наступает выздоровление. Однако у беременных и детей с врожденной краснухой вирус может персистировать в организме длительное время. При врожденной краснухе вирус попадает в плод через плаценту, инфицирует эпителий ворсинок хориона и эндотелий кровеносных сосудов плаценты, затем попадает в кровоток плода. При этом поражаются органы и ткани, находящиеся в процессе формирования (для мозга это 3-11-я неделя беременности, для глаз и сердца - 4-7-я, для органа слуха -712-я). Психомоторные нарушения плода развиваются при заболевании матери краснухой на 3-4-м месяце беременности. Сформировавшийся плод относительно устойчив к действию вируса. Частота поражения плода зависит от срока беременности. Заражение краснухой на 1-4-й неделе беременности приводит к поражению плода в 60% случаев, на 9-12-й неделе - в 15% случаев, на 13-16-й неделе - в 7% случаев. Чем раньше произошло инфицирование плода, тем тяжелее и многообразнее его поражения. В основе развития пороков и аномалий плода лежит способность вируса подавлять митотическую активность клеток и, в меньшей степени, его прямое цитопатическое действие.
Клиническая картина
Общепринятой классификации краснухи нет. Принято выделять приобретенную и врожденную краснуху. Приобретенную краснуху подразделяют на типичную, атипичную (без сыпи) и субклиническую (инаппарантную). Врожденную краснуху классифицируют в зависимости от преобладающего поражения (ЦНС, сердечно-сосудистая система, орган слуха, орган зрения). Типичные формы краснухи характеризуются цикличностью течения инфекции со сменой периодов: инкубационного, продромального, высыпания (экзантема) и реконвалесценции.
Инкубационный период продолжается от 10 до 25 дней, в среднем - 16-20 дней. Продромальный (или катаральный) период - 1-3 дня. Период высыпания - 2-4 дня. Период реконвалесценции протекает, как правило, без осложнений. У детей болезнь протекает в большинстве случаев легко, с симптомами, включающими сыпь, умеренную лихорадку (<39 °С), ЛАП и легкий конъюнктивит. Чаще всего увеличиваются затылочные, заднешейные и заушные ЛУ. Они слегка болезненны, могут оставаться увеличенными несколько недель. Часто увеличивается селезенка. Сыпь появляется сначала на лице, затем в течение суток распространяется на шею, туловище, руки и ноги. Сыпь мелко-пятнистая, более обильная на спине, разгибательных поверхностях конечностей. Элементы сыпи расположены на неизмененной коже, иногда сопровождаются зудом, исчезают через 1-3 сут, не оставляя пигментации и шелушения. У подростков и взрослых также могут наблюдаться тонзиллит, ринит, конъюнктивит.
Осложнения наблюдают редко. Возможен доброкачественно протекающий полиартрит с поражением мелких и средних суставов, который длится до 2 нед, тромбоцитопеническая пурпура. Наиболее тяжелое осложнение - энцефалит (менингоэнцефалит, энцефаломиелит), чаще развивающийся у подростков и взрослых. Энцефалит может сочетаться с тромбоцитопенической пурпурой. Симптомы энцефалита появляются через 2-4 сут после появления сыпи. Внезапно повышается температура тела, появляются генерализованные судороги, расстройства сознания вплоть до развития комы. Возможны менингеальные симптомы, делириозный синдром, парезы черепных нервов, конечностей, гиперкинезы, мозжечковая, диэнцефальная и бульбарная симптоматика, расстройства функций тазовых органов. В СМЖ обнаруживают повышение уровня белка и глюкозы при нормальном содержании лактата, у части больных - двузначный смешанный или лимфоцитарный плеоцитоз. Редкими осложнениями краснухи являются первичная вирусная или вторичная бактериальная пневмония. В большинстве случаев краснуха протекает доброкачественно. Причиной летального исхода может стать энцефалит, в редких случаях при тромбоцитопенической пурпуре - кровоизлияние в мозг.
Врожденная краснуха
Наиболее часто встречающиеся аномалии плода - катаракта, пороки сердца и глухота - были объединены под названием «классический СВК». В случае если инфицирование женщины вирусом краснухи происходит в начале беременности, вероятность того, что она передаст вирус плоду, составляет 60%. Это может приводить к выкидышу, мертворождению или тяжелым врожденным порокам развития, известным как СВК. Дети с СВК могут выделять вирус в течение года или более после рождения. Частота врожденных аномалий, связанных с заболеванием беременных женщин краснухой, варьирует от 8,1 до 38%. К СВК относят:
-
пороки сердца: незаращение артериального протока, стеноз легочного ствола, дефекты межжелудочковой и межпредсердной перегородки;
-
поражения глаз: жемчужную ядерную катаракту, микрофтальмию, врожденную глаукому, ретинопатию;
-
поражения ЦНС: микроцефалию, задержку умственного развития, умственную отсталость, параплегию, аутизм, глухоту.
Дети часто рождаются с низкой массой тела, геморрагической сыпью, гепатоспленомегалией, гемолитической анемией, менингитом, поражением костей, однако все эти поражения обратимы. На втором десятилетии жизни возможно развитие медленной инфекции ЦНС - прогрессирующего краснушного панэнцефалита, проявляющегося снижением интеллекта, миоклонией, атаксией, эпилептическим синдромом и приводящего к смерти. Врожденная краснуха повышает риск развития инсулинозависимого сахарного диабета. При фетальном синдроме краснухи летальность составляет около 10%.
Диагностика
Диагноз устанавливают на основании клинико-эпидемиологических данных и картины крови. Для специфической диагностики используют РСК, РТГА, ИФА и РИФ в парных сыворотках. Определение специфических антител, относящихся к классу IgM, проводят не позднее 12-го дня после контакта с источником инфекции. В последние годы широко применяют ПЦР, особенно для диагностики врожденной краснухи.
Дифференциальная диагностика
Дифференциальную диагностику при подозрении на краснуху в первую очередь необходимо проводить с такими заболеваниями, как корь, псевдотуберкулез, ИМ, энтеровирусная экзантема, внезапная экзантема и токсикоаллергический дерматит.
Лечение
Лечение типичной краснухи не требует назначения ЛС. При полиартрите показаны НПВС. При энцефалите рекомендуют лечение в ОРИТ. Дексаметазон в дозе 1,0 мг/кг, противосудорожные средства [диазепам, натрия оксибутират (Натрия оксибат♠), тиопентал натрия], ноотропы, петлевые диуретики, оксигенотерапия, коррекция гомеостаза.
Паротитная инфекция
Синонимы - эпидемический паротит, parotitis epidemica, «свинка», «заушница» - острая антропонозная воздушно-капельная инфекционная болезнь, характеризующаяся преимущественным поражением слюнных желез и других железистых органов (поджелудочной железы, половых желез и др.), а также ЦНС.
Коды по МКБ-10
В26 Эпидемический паротит.
Этиология
Возбудитель - вирус Pneumophila parotiditis семейства Paramyxovi-ridae рода Paramyxovirus, патогенный для человека и обезья. Геном представлен одноцепочечной спиралевидной РНК, окруженной нуклеокапсидом. Вирус обладает гемолитической, нейраминидазной и гемагглютинирующей активностью, связанной с гликопротеинами HN и F, культивируется на куриных эмбрионах, культурах ткани, малоустойчив в окружающей среде, инактивируется при воздействии высокой температуры, при ультрафиолетовом облучении, высушивании, быстро разрушается в дезинфицирующих растворах [50% этанола (Этиловый спирт♠), 0,1% раствора формалина и др.]. При низкой температуре (-20 °С) он может сохраняться до нескольких недель. Антигенная структура вируса стабильна. Известен только один серотип вируса, имеющий два антигена: V (вирусный) и S (растворимый).
Эпидемиология
Наиболее высока заболеваемость с 2 до 25 лет, резко снижается после 40 лет. В последние годы эпидемический паротит у взрослых встречается чаще в связи с проведением массовой вакцинации детей. У большей части вакцинированных уже через 5-7 лет концентрация защитных антител значительно снижается. Это способствует увеличению восприимчивости к заболеванию подростков и взрослых. В настоящее время регистрируются единичные спорадические случаи.
Источник возбудителя - больной паротитной инфекцией человек, который начинает выделять вирус за 1-2 дня до появления первых клинических симптомов и до 9-го дня болезни. При этом наиболее активное выделение вируса в окружающую среду происходит в первые 3-5 дней заболевания. Вирус выделяется со слюной и мочой. Вирус можно обнаружить в крови, грудном молоке, СМЖ и в пораженной железистой ткани. Вирус передается воздушно-капельным путем. Интенсивность выделения вируса в окружающую среду небольшая из-за отсутствия катаральных явлений. Один из факторов, ускоряющих распространение вируса эпидемического паротита, - наличие сопутствующих ОРЗ, при которых в связи с кашлем и чиханием повышается выделение возбудителя в окружающую среду. Не исключена возможность заражения через предметы обихода, инфицированные слюной больного. Описан вертикальный путь передачи эпидемического паротита от больной беременной плоду. Восприимчивость к инфекции высокая (до 100%). «Вялый» механизм передачи возбудителя, длительная инкубация, большое количество больных стертыми формами болезни, затрудняющее их выявление и изоляцию, приводит к тому, что вспышки эпидемического паротита в детских и подростковых коллективах протекают длительно, волнообразно на протяжении нескольких месяцев. Лица мужского пола болеют в 1,5 раза чаще, чем женского. Максимум заболеваемости приходится на март-апрель, минимум - на август-сентябрь. Среди взрослого населения эпидемические вспышки регистрируют чаще в закрытых и полузакрытых коллективах - казармах, общежитиях, корабельных командах. Подъемы заболеваемости отмечают с периодичностью 7-8 лет. Паротитная инфекция относится к управляемым. После введения в практику иммунизации заболеваемость значительно снизилась. Из-за постоянной циркуляции вируса у 80-90% люди старше 15 лет имеют противопаротитные антитела. По оценкам, в 25% случаев паротитная инфекция протекает инаппарантно. После перенесенного заболевания формируется стойкий пожизненный иммунитет, повторные заболевания встречаются крайне редко.
Профилактика
Больных паротитной инфекцией не допускают в детские коллективы на 9 дней. Контактные лица (дети до 10 лет, не болевшие паротитной инфекцией и невакцинированные) подлежат разобщению сроком на 21 день, а в случаях точного установления даты контакта - с 11-го по 21-й день. Проводят влажную уборку с использованием дезинфицирующих средств и проветривание помещения. За детьми, имевшими контакт с больным, на период изоляции устанавливают врачебное наблюдение. Основу профилактики составляет вакцино-профилактика в рамках национального календаря профилактических прививок России. Для экстренной профилактики невакцинированным и неболевшим вакцину вводят не позже 72 ч после контакта с больным. Сертифицированы также паротитно-коревая культуральная живая сухая вакцина (Россия) и вакцина против кори, эпидемического паротита и краснухи живая аттенуированная лиофилизированная (Индия).
Патогенез
Вирус эпидемического паротита попадает в организм через слизистую оболочку ВДП, рта, конъюнктиву глаз. Репликация вируса начинается в клетках эпителия респираторного тракта, затем вирус проникает в кровь. Развивается первичная вирусемия, и вирус заносится в слюнные железы и другие железистые органы. Период первичной вирусемии соответствует концу инкубационного периода и длится до 3-5-го дня болезни. Из всех органов, пораженных вирусом, наиболее интенсивно его репликация происходит в слюнных железах, особенно околоушной, сопровождаясь ответной воспалительной реакцией и развитием более интенсивной вторичной вирусемии, во время которой вирус поражает ЦНС, а также оболочки глаза, печень, почки, сердце, мышцы, суставы, слуховой аппарат. Из железистых органов чаще всего поражаются поджелудочная, половые железы, реже - вилочковая, щитовидная и грудные железы. Поражение ЦНС и железистых органов возможно не только после, но и одновременно, раньше, в редких случаях без клинически выраженного поражения слюнных желез. Преобладает поражение соединительной ткани. При этом для острого периода типично развитие отека и лимфоцитарной инфильтрации интерстициального пространства железистой ткани, однако вирус одновременно поражает и железистую ткань. При орхите, помимо отека, поражается и паренхима яичек. Это обусловливает уменьшение выработки андрогенов, нарушение сперматогенеза и вторичное бесплодие или снижение репродуктивной функции. Значительно реже наблюдается поражение яичников. Сходный характер поражения описан и для поражения поджелудочной железы, результатом чего может быть атрофия островкового аппарата. После 10-15-го дня болезни органные поражения развиваются редко. Со 2-й недели болезни начинается активное формирование иммунитета и освобождение организма от вируса.
Клиническая картина
Инкубационный период от 11 до 23 дней (чаще 15-19).
Классификация
По тяжести: легкая форма, среднетяжелая форма, тяжелая форма.
Критерии тяжести: выраженность лихорадки, интоксикации, выраженность органных поражений.
Исходы болезни: полное выздоровление, выздоровление с резидуальной патологией (сахарный диабет, бесплодие, поражение ЦНС).
У некоторых больных (чаще у взрослых) за 1-2 дня до развития типичной картины наблюдают продромальные явления в виде разбитости, недомогания, гиперемии ротоглотки, боли в мышцах, головной боли, нарушения сна и аппетита. Типично острое начало, озноб и повышение температуры до 39-40 °С. Один из ранних признаков заболевания - болезненность за мочкой уха (симптом Филатова). Односторонняя припухлость околоушной железы чаще появляется к концу суток или на второй день болезни, а через 1-2 дня у 80-90% больных поражается вторая железа. При этом обычно отмечают шум в ушах, боли в области уха, усиливающиеся при жевании и разговоре, возможен тризм. Железа заполняет ямку между сосцевидным отростком и нижней челюстью. При значительном увеличении околоушной железы ушная раковина оттопыривается и мочка уха поднимается кверху (отсюда народное название «свинка»). Отек распространяется в трех направлениях: кпереди - на щеку, вниз и кзади - на шею и вверх - на область сосцевидного отростка. Отечность особенно заметна при осмотре больного со стороны затылка. Кожа над пораженной железой напряжена, обычной окраски, при пальпации железа имеет тестовую консистенцию, умеренно болезненна. Максимальной степени отечность достигает на 3-5-й день заболевания, затем постепенно уменьшается и исчезает, как правило, на 6-9-й день (у взрослых на 10-16-й день). В этот период саливация снижена, слизистая оболочка полости рта сухая, больные жалуются на жажду. Устье Стенонова протока видно на слизистой оболочке щеки в виде гиперемированного отечного колечка (симптом Мурсу). Реже в процесс вовлекаются поднижнечелюстные слюнные железы, которые определяют в виде слабоболезненных веретенообразных припухлостей тестовой консистенции, при поражении подъязычной железы припухлость отмечают в подбородочной области и под языком. В ряде случаев у больных отмечают тахикардию, шум на верхушке и приглушение тонов сердца, гипотонию. Поражение ЦНС проявляется головной болью, бессонницей, адинамией. Общая продолжительность лихорадочного периода составляет чаще 3-4 дня, в тяжелых случаях - до 6-9 дней.
Частое проявление паротитной инфекции у подростков и взрослых - поражение яичек (орхит). Возможен орхит без поражения слюнных желез. Признаки орхита отмечают на 5-8-й день болезни на фоне снижения и нормализации температуры. При этом состояние больных вновь ухудшается: температура тела повышается до 38-39 °С, появляется озноб, головная боль, возможны тошнота и рвота. Отмечают сильные боли в области мошонки и яичка, иногда иррадиирующие в нижние отделы живота. Яичко увеличивается в 2-3 раза, становится болезненным и плотным, кожа мошонки гиперемирована, часто - с синюшным оттенком. Чаще поражается одно яичко. Выраженные клинические проявления орхита сохраняются 5-7 дней. Затем боли исчезают, яичко постепенно уменьшается в размерах. В дальнейшем можно отметить признаки его атрофии. Почти у 20% больных орхит сочетается с эпидидимитом. Придаток яичка пальпируется как продолговатая болезненная припухлость. Это осложнение приводит к нарушению сперматогенеза. Стертая форма орхита также может быть причиной мужского бесплодия. У женщин может развиться оофорит, бартолинит, мастит. Оофорит в редких случаях приводит к бесплодию.
Частое проявление эпидемического паротита - острый панкреатит, часто протекающий бессимптомно и диагностируемый только на основании резкого повышения активности панкреатических ферментов в крови и моче. Чаще он развивается у детей и подростков. Панкреатит развивается обычно на 4-7-й день болезни. Наблюдают тошноту, многократную рвоту, диарею, боли опоясывающего характера в средней части живота. При выраженном болевом синдроме возможно напряжение мышц живота и симптомы раздражения брюшины. Повышение активности ферментов поджелудочной железы сохраняется до месяца, тогда как другие симптомы заболевания исчезают уже через 5-10 дней. Поражение поджелудочной железы может приводить к атрофии островкового аппарата и развитию диабета.
В редких случаях возможно поражение и других железистых органов. Описаны тиреоидит, паратиреоидит, дакриоадениты, тимоидит.
Поражение нервной системы - одно из частых и существенных проявлений паротитной инфекции. Чаще всего наблюдают серозный менингит. Возможны также менингоэнцефалит, невриты черепных нервов, полирадикулоневрит. Клиническая картина паротитного менингита полиморфна, поэтому критерием диагностики может быть только выявление воспалительных изменений СМЖ. Возможны случаи эпидемического паротита, протекающие с синдромом менингизма, при интактности СМЖ. Напротив, часто без наличия менингеальных симптомов отмечают воспалительные изменения СМЖ. Между тем своевременная диагностика и лечение менингита и других поражений ЦНС существенно влияют на отдаленные последствия болезни.
Менингит в большинстве случаев развивается на 4-9-й день болезни, т.е. в разгаре поражения слюнных желез или на фоне стихания болезни. Однако возможно и появление симптомов менингита одновременно с поражением слюнных желез и даже раньше. Возможны случаи менингита без поражения слюнных желез, в редких случаях - в сочетании с панкреатитом. Менингит характеризуется быстрым повышением температуры тела до 38-39,5 °С, интенсивной головной болью диффузного характера, тошнотой и часто рвотой, гиперестезией кожи. Дети становятся вялыми, адинамичными. Уже в первые сутки заболевания отмечают менингеальные симптомы, которые выражены умеренно, часто не в полном объеме, например, только симптом посадки («треножника»). У детей младшего возраста возможны судороги, потеря сознания, у старших детей - психомоторное возбуждение, бред, галлюцинации. Общемозговая симптоматика обычно регрессирует в течение 1-2 сут. В то же время развитие ОНГМ с дислокацией ствола не описано. Эвакуация СМЖ во время люмбальной пункции до нормального уровня ЛД (200 мм вод.ст.) сопровождается выраженным улучшением состояния больного.
СМЖ при паротитном менингите прозрачная или опалесцирующая, плеоцитоз составляет 200-400 в 1 мкл. Содержание белка повышено до 0,3-0,6/л, иногда до 1,0-1,5/л, редко наблюдают сниженный или нормальный уровень белка. Цитоз, как правило, лимфоцитарный (90% и выше), в 1-2-й дни болезни может быть смешанным или нейтрофильным. Концентрация глюкозы в СМЖ - в пределах нормальных значений или повышена. Санация ликвора происходит позже регресса менингеального синдрома, к 3-й нед болезни, но может затягиваться, особенно у детей старшего возраста, до 1-1,5 мес.
При менингоэнцефалите через 2-4 дня после развития картины менингита на фоне ослабления менингеальных симптомов нарастает общемозговая симптоматика, появляются очаговые симптомы. У детей младшего возраста возможны мозжечковые расстройства. Паротитный менингит и менингоэнцефалит протекают доброкачественно. Как правило, наступает полное восстановление функций ЦНС, однако после менингоэнцефалита может сохраняться внутричерепная гипертензия, астенизация, снижение памяти, внимания, слуха, задержка развития. Возможно развитие невритов черепных нервов, чаще всего VIII пары. Процесс обычно односторонний, но часто полного восстановления слуха не происходит.
Полирадикулоневрит развивается на фоне менингита или менингоэнцефалита, ему всегда предшествует поражение слюнных желез. При этом характерно появление корешковых болей и симметричных парезов, преимущественно дистальных отделов конечностей, процесс обычно обратим, возможно и поражение дыхательной мускулатуры.
Иногда, обычно на 10-14-й день заболевания, чаще у мужчин, развивается серозный полиартрит. В основном поражаются крупные суставы (плечевые, коленные). Процесс, как правило, обратим, заканчивается полным выздоровлением в течение 1-2 нед.
Осложнения встречаются крайне редко. Изменения крови при эпидемическом паротите незначительны и характеризуются лейкопенией, относительным лимфоцитозом, моноцитозом, увеличением СОЭ, у взрослых иногда отмечают лейкоцитоз.
Диагностика
Диагностика основана, главным образом, на характерной клинической картине и эпидемиологическом анамнезе, и в типичных случаях трудностей не вызывает.
В последние годы применяют серологические методы диагностики, наиболее часто используют ИФА, РСК и РТГА. Высокий титр IgM и низкий - IgG в острый период инфекции может служить признаком паротитной инфекции. Окончательно подтвердить диагноз можно через 3-4 нед при повторном исследовании титра антител, при этом увеличение титра IgG в 4 раза и более имеет диагностическое значение. При использовании РСК и РТГА возможны перекрестные реакции с вирусом парагриппа. В последние годы применяется ПЦР, эффективная при наличии вирусемии. Для диагностики часто определяют активность амилазы и липазы в крови и моче, содержание которых повышается у большинства больных. Это особенно важно не только для диагностики панкреатита, но и косвенного подтверждения паротитной этиологии серозных менингитов.
Дифференциальная диагностика
Дифференциальную диагностику эпидемического паротита в первую очередь следует проводить с бактериальными паротитами, слюнно-каменной болезнью. Увеличение слюнных желез также отмечается при саркоидозе и новообразованиях. Паротитный менингит дифференцируют с серозными менингитами энтеровирусной этиологии, лимфоцитарным хориоменингитом, иногда туберкулезным менингитом. При этом особое значение имеет повышение активности панкреатических ферментов в крови и моче при паротитном менингите. Острый панкреатит следует дифференцировать с острыми хирургическими заболеваниями брюшной полости (бактериальным панкреатитом, аппендицитом, острым холециститом).
Паротитный орхит дифференцируют с туберкулезным, гонорейным, травматическим и бруцеллезным орхитом.
Лечение
Госпитализируют больных по эпидемиологическим показаниям из закрытых детских коллективов (детские дома, интернаты, воинские части). Госпитализация показана при тяжелом течении болезни (гипертермия свыше 39,5 °С, признаки поражения ЦНС, панкреатита, орхита). В течение лихорадочного периода рекомендуется постельный режим. В остром периоде заболевания больные должны получать только жидкую и полужидкую пищу. Учитывая нарушения саливации, большое внимание следует уделять уходу за слизистой оболочкой полости рта, а в период реконвалесценции проводить стимуляцию секреции слюны, используя лимонный сок. Показано обильное питье (морсы, соки, чай, минеральная вода). На область слюнных желез назначают светотеплолечение (лампа-соллюкс). При орхите применяют преднизолон в течение 3-4 дней в дозе 2-3 мг/ кг в сутки с последующим уменьшением дозы на 5 мг ежедневно. Обязательно ношение суспензория в течение 2-3 нед. При остром панкреатите назначают щадящую диету (в первые сутки - голодную диету). Показан холод на живот. Для уменьшения болевого синдрома вводят анальгетики, применяют апротинин. При подозрении на менингит показана люмбальная пункция. Назначают анальгетики, дегидратационную терапию с использованием фуросемида (Лазикса♠) в дозе 1 мг/кг в сутки. При выраженном общемозговом синдроме назначают дексаметазон по 0,25-0,5 мг/кг в сутки в течение 3-4 дней.
Прогноз благоприятный, летальные исходы редки (1 на 100 тыс. заболевших эпидемическим паротитом). У некоторых больных возможно развитие эпилепсии, глухоты, сахарного диабета, снижение потенции, атрофии яичек, бесплодие.
Натуральная оспа*
* Материалы доступны в электронном виде по ссылке, указанной на последней странице книги.
Оспа животных
Оспа животных - группа острых зоонозных инфекционных болезней с преимущественно контактным механизмом передачи возбудителя, характеризующихся лихорадкой и папулезно-пустулезной сыпью.
Возбудители оспы животных и человека - большая группа оспенных вирусов семейства Poxviridae (более 100 вирусов).
Человек восприимчив к вирусам оспы обезьян, коров, вакцины и его подвиду - вирусу оспы буйволов, а также псевдокоровьей оспы (паравакцина) и оспы Таны. Возбудителя псевдокоровьей оспы относят к роду Parapoxvirus, оспы Таны - к роду Yatapoxvirus, остальных - к роду Orthopoxvirus.
Возбудители оспы различных видов животных морфологически сходны. Это ДНК-содержащие вирусы, характеризующиеся относительно большими размерами (170-350 нм), эпителиотропностью и способностью образовывать в клетках элементарные округлые включения (тельца Пашена, Гварниери, Боллингера), видимые в световом микроскопе при окраске по Морозову. Вирусы натуральной оспы коров и осповакцины имеют широкий спектр патогенности, включая крупный рогатый скот, буйволов, лошадей, ослов, мулов, верблюдов, кроликов, обезьян и человека.
Близкие иммунологические связи сохранились только между двумя видами вирусов - осповакцины и коровьей оспы, тогда как остальные возбудители различны в антигенном и иммуногенном отношении.
Устойчивость оспенных вирусов в окружающей среде сравнительно высокая. Они могут сохранять жизнеспособность в сухих корочках оспин до 1-2 лет. Замораживание консервирует вирусы. В овчарнях вирус оспы овец сохраняется более 6 мес, на пастбищах и в шерсти переболевших животных - свыше 2 мес. Вирусы оспы быстро погибают при гниении субстрата. Они чувствительны к высокой температуре, солнечным лучам и кислотам; кипячение убивает их моментально, 70 °С - за 5 мин, кислая среда (рН 3,0-3,6) - в течение часа. Растворы серной, соляной и карболовой кислот (2-5%), формальдегида и хлорамина (1%), едкого натра (3%) инактивируют возбудителя в течение 1 ч. Биотермическое обеззараживание инфицированного помета наступает через 28 дней.
Аналогично патологический процесс протекает и у людей.
Оспа обезьян
Оспа обезьян (англ. monkeypox, лат. variola vimus) - острая зоонозная природно-очаговая вирусная инфекционная болезнь, характеризующаяся интоксикацией, лихорадкой и везикулезно-пустулезной сыпью.
Коды по МКБ-10
В04 Инфекции, вызванные вирусом обезьяньей оспы.
Этиология
Возбудитель - вирус рода Orthopoxvirus семейства Poxviridae. По морфологическим и антигенным свойствам близок к вирусу натуральной оспы, но отличается от него по биологическим свойствам.
Устойчивость к воздействию факторов окружающей среды - такая же, как у возбудителя натуральной оспы.
Эпидемиология
Единичные случаи и групповые заболевания регистрируются в зоне саванны и тропического леса Центральной и Западной Африки. Источник и резервуар возбудителя - больные приматы 12 видов, тропические белки и гамбийские крысы. Длительность периода выделения вируса неизвестна. Человек заражается от больных животных контактным (через конъюнктиву и поврежденную кожу) путем, а также в результате прямых контактов с кровью, жидкостями организма или сыпью инфицированных животных. Возможен воздушно-капельный или воздушно-пылевой путь (аэрозольный механизм заражения).
Естественная восприимчивость людей неизвестна. Вторичная передача происходит от человека человеку в результате тесного контакта с выделениями из дыхательных путей, повреждениями кожи инфицированного человека или с недавно зараженными предметами.
Возможно трансплацентарное заражение плода при заболевании беременной.
Наиболее поражаемый контингент - дети в возрасте 4-10 лет. Сезонность летняя.
Меры профилактики: специфические, неспецифические. Мероприятия в очаге
-
При выявлении больных оспой обезьян или подозрительных на это заболевание проводят такие же противоэпидемические и профилактические мероприятия, как при натуральной оспе, включая вакцинацию противооспенной вакциной. В тропических районах Центральной и Западной Африки, эндемичных по оспе обезьян, рекомендована плановая вакцинация населения.
-
Предотвращение дальнейшего распространения оспы обезьян в результате торговли животными. Ограничение или запрещение перемещения небольших африканских млекопитающих животных или обезьян может быть эффективным в замедлении распространения вируса за пределы Африки.
-
Содержащихся в неволе животных не следует прививать против натуральной оспы. Однако инфицированных животных необходимо изолировать от других животных и немедленно помещать в карантин на 30 дней.
-
Снижение риска инфекции у людей. Во время вспышек оспы обезьян тесный контакт с другими пациентами является самым значительным фактором риска инфицирования вирусом оспы обезьян. Единственным способом уменьшения числа заболеваний среди людей является информация населения в отношении факторов риска и в отношении мер по ограничению возможного контакта с вирусом.
-
Снижение риска передачи возбудителя от человека человеку. Необходимо избегать тесных физических контактов с людьми, инфицированными оспой обезьян. При уходе за больными необходимо надевать перчатки и использовать средства защиты.
-
Снижение риска передачи инфекции от животного человеку. Усилия по предотвращению передачи инфекции в эндемичных районах должны быть направлены на тщательную тепловую обработку всех употребляемых в пищу продуктов животного происхождения. При обращении с больными животными или их инфицированными тканями, а также во время забоя животных необходимо надевать перчатки и другую защитную одежду.
-
В медицинских учреждениях
Медицинские работники, осуществляющие уход за пациентами с предполагаемой или подтвержденной инфекцией вирусом оспы обезьян или обращающиеся с образцами, взятыми у таких пациентов, должны принимать стандартные меры предосторожности в области инфекционного контроля, им необходимо проведение иммунизации против натуральной оспы. Иммунологически компрометированным лицам с ослабленной иммунной системой вакцинация противопоказана.
Работа с образцами, взятыми у людей и животных с предполагаемой инфекцией вирусом оспы обезьян, должна осуществляться специально подготовленными сотрудниками в надлежащем образом оборудованных лабораториях.
Патогенез
Фазы патогенеза - такие же, как при натуральной оспе, в то же время вирус имеет тропизм к ЛУ, вызывая в них выраженные воспалительные изменения.
Клиническая картина
Инкубационный период длится от 6 до 16 дней.
Основной особенностью, отличающей оспу обезьян от натуральной оспы, является развитие лимфаденита у 86% больных, одновременно с ознобом, повышением температуры до 38,0-39,5 °С и проявлениями интоксикации (головной болью, миалгией и артралгией). Лимфаденит может быть двусторонним или односторонним и, в зависимости от входных ворот инфекции, развивается в подчелюстных, шейных, подмышечных или паховых ЛУ. При аэрозольном механизме заражения больные отмечают боль в горле и кашель. Периоды высыпания, нагноения и реконвалесценции по клиническим проявлениям практически не отличаются от натуральной оспы, но протекают обычно легче и быстрее (за 2-4 нед). По классификации Rao оспа обезьян у людей проходит по дискретному варианту в 58% случаев заболевания, по полусливному и сливному - в 32% и 10% случаев соответственно. Возможно развитие оспенной пурпуры, вариолоида, оспы без сыпи, оспы без температуры и инаппарантной инфекции.
Течение болезни можно разделить на два периода:
1 - период инвазии (0-5 дней), для которого характерны лихорадочное состояние, сильная головная боль, ЛАП, боль в спине, миалгия и выраженная астения;
2 - период высыпаний, когда элементы сыпи появляются на лице (в 95% случаев), на ладонях и ступнях (75%) и на теле почти одновременно, поэтому характерен мономорфизм сыпи, т.е. все элементы находятся в одной стадии развития: розеола-папула-везикула-пустула. Нагноение (пустулизация) сыпи сопровождается лихорадкой и развитием бактериальных осложнений: бронхопневмонии, кератитов, диареи, флегмон, абсцессов и др.
Летальность при оспе обезьян в среднем составляет 3,3-9,8% (в зависимости от возраста заболевших). Большинство случаев смерти происходит среди детей раннего возраста. Дети более чувствительны к вирусу оспы обезьян из-за прекращения регулярной вакцинации против натуральной оспы, последовавшей за всемирной ликвидацией этой болезни в 1980 г.
В возрастной группе старше 10 лет летальные исходы не зарегистрированы.
Диагностика
Основные диагностические мероприятия соответствуют таковым при натуральной оспе.
Дифференциальную диагностику обычно проводят с натуральной оспой, ветряной оспой, корью, пиодермией, медикаментозной аллергией.
Окончательный диагноз устанавливается с помощью иммуноферментного анализа, ПЦР, изоляции вируса в культурах клетках.
Лечение
Больные изолируются в боксы. Специфических методов лечения нет. Режим постельный (до нормализации температуры). Диета - механически и химически щадящая (стол № 4). Принципы лечения такие же, как при натуральной оспе.
Прогноз
У детей раннего возраста - серьезный. Зависит от клинической формы болезни и осложнений.
Коровья оспа
Коровья оспа (Cowpox) - зоонозная инфекционная болезнь с контактным механизмом передачи возбудителя, протекающая в части случаев с развитием лихорадочно-интоксикационного синдрома, единичными пустулезными высыпаниями на коже.
Коды по МКБ-10
В08.0 Другие инфекции, вызванные ортопоксвирусом. Коровья оспа. Болезнь, вызванная вирусом Орф.
Этиология
Возбудитель - Cowpox virus, относится к роду Othopoxvirus, семейству Poxviridae. Геном вируса представлен односпиральной ДНК, известны генетические варианты вируса. Вирус хорошо культивируется на хорион-аллантоисной оболочке куриных эмбрионов и ряде клеточных культур, с развитием в них цитопластического эффекта.
Эпидемиология
Коровья оспа - природно-очаговая инфекция. Основным резервуаром возбудителя являются лесные мыши и мыши-полевки, которые инфицируют домашних кошек и крупный рогатый скот, которые и служат основным источником возбудителей для человека. Человек является случайным хозяином вируса, передача возбудителя от человека не установлена.
Заражение людей от инфицированных кошек и других животных происходит контактным путем через поврежденную кожу при ручном доении коров.
Чаще болеют дети и подростки, имевшие контакт с зараженными кошками; среди взрослых - лица, ухаживающие за скотом, доярки. Заражению способствуют мелкие травмы (царапины, ссадины) кожи.
Заболевание регистрируется повсеместно в Европе в виде спорадических случаев и локальных вспышек преимущественно летом и осенью (июль-октябрь).
Меры профилактики: специфические, неспецифические. Мероприятия в очаге
Меры профилактики заключаются в строгом выполнении ветеринарно-санитарных мероприятий, тщательном соблюдении санитарных мер при уходе за больными животными, обеспечении работы предприятий в режиме закрытого типа.
Патогенез
В месте инокуляции вируса возникает очаговая воспалительная реакция с пролиферацией клеток базального слоя эпидермиса и массивной лейкоцитарной инфильтрацией, формируется крупная везикула. В пораженных клетках при световой микроскопии обнаруживаются характерные внутриклеточные включения типа А, представленные скоплениями зрелых вирионов. Патологический процесс в коже заканчивается рубцеванием. Возможно развитие транзиторной вирусемии.
Клиническая картина
Продолжительность инкубационного периода не установлена.
В большинстве случаев заболевания на руках и лице пациента появляется один или несколько элементов сыпи, сходных с элементами сыпи при натуральной оспе, и проходят те же фазы развития (папула-везикула-пустула-корка). Везикулы имеют в центре пупковидное вдавление, расположены на инфильтрированном основании, многокамерные. После отпадения корки (6-12 нед) остается рубец. Возможны, в результате инокуляции, вторичные элементы на различных участках кожи. Часто лимфаденит.
У пациентов, не вакцинированных против натуральной оспы, возможна лихорадка и интоксикация, длящиеся до 5-7 дней.
Диагностика
Постановка диагноза достигается путем обнаружения Cowpox virus при электронной микроскопии содержимого везикул, или изоляции вируса при заражении патологическим материалом хорион-аллантоисной оболочки куриного эмбриона, на которой образуются геморрагические оспины, или выделения клеточной культуры, в которой возникает цитопатический эффект. Вирус может быть обнаружен в виде внутриклеточных включений типа А при гистологическом исследовании материала из очага поражения.
Дифференциальную диагностику проводят с сибирской язвой, паравакциной, герпетическими высыпаниями при простом герпесе.
Лечение
Противовирусная терапия не разработана. Больным проводят патогенетическое лечение, местно применяются антисептики, для профилактики вторичной инфекции назначают антибиотики. Противопоказано использование глюкокортикоидов.
Прогноз
Болезнь протекает доброкачественно, у иммунокомпрометированных пациентов описаны генерализованные заболевания с летальным исходом.
Геморрагические лихорадки
Геморрагические лихорадки (ГЛ) - полиэтиологичная группа острых вирусных зоонозных инфекций, объединенных по признаку регулярного развития геморрагического синдрома на фоне острого лихорадочного состояния и характеризующихся интоксикацией и генерализованным поражением сосудов микроциркуляторного русла с развитием тромбогеморрагического синдрома.
ГЛ - опасные или особо опасные болезни с высокой летальностью. В эту группу входят как минимум 15 самостоятельных нозологических форм (табл. 17-13). Венесуэльская и бразильская ГЛ - варианты аргентинской ГЛ.
Этиология
Возбудители ГЛ отнесены к четырем семействам вирусов: Arenaviridae, Bunyaviridae, Filoviridae, Flaviviridae. Их геном представлен одно-нитевой РНК.
Репликация генома этих вирусов происходит с низкой точностью, что обусловливает высокую частоту мутаций РНК и возникновение новых вариантов вируса с измененной антигенной структурой и вирулентностью.
Большинство ГЛ - природно-очаговые инфекции.
Резервуар возбудителей - различные виды животных. В некоторых случаях источником вируса становится больной человек и инфекция принимает антропонозный характер.
Заражение человека арбовирусными ГЛ происходит трансмиссивным путем через укус инфицированных кровососущих членистоногих (клещи, комары).
| Hoзoфopмa (русское название) | Международное название | Код no MKБ-10 | Toкcoнoмия возбудителя | Резервуар возбудителя в природе | Переносчик | Основные синдромы | Летальность, % |
|---|---|---|---|---|---|---|---|
Болезнь, вызванная вирусом Эбoлa |
Ebola virus disease |
A98.4 |
Род Filoviгus, сем. Filoviridae |
Рукокрылые |
Неизвестен |
ЛИС, геморрагический, ИТШ |
25-90 |
Лихорадка Mapбypг |
Disease |
A98.3 |
Род Filoviгus, сем. Filoviгidae |
Обезьяны |
Неизвестен |
ЛИС, диapeйный, геморрагический, ИТШ |
25-50 |
Лихорадка Лacca |
Lassa fever |
A96.2 |
Род Arenavirus, сем. Arenaviridae |
Многососковые крысы |
Отсутствует |
ЛИС, стоматит, энцефалопатия, геморрагический, ИТШ |
1-20 |
Боливийская ГЛ |
Machupo haemorrhagic fever, Bolivien haemorrhagic fever |
A96.1 |
Вирус Machupo, род Arenavirus, сем. Arenaviridae |
Грызуны рода Calomis |
Отсутствует |
ЛИС, геморрагический |
5-30 |
Аргентинская ГЛ |
Junin haemorrhagic fever, Argentinain haemorrhagic fever |
A96.0 |
Вирус Junin, род Arenavirus, сем. Arenaviridae |
Грызуны рода Calomis |
Отсутствует |
ЛИС, геморрагический |
1-15 |
Желтая лихорадка |
Yellow fever |
A95 |
Род Flavivirus, сем. Flaviviridae |
Обезьяны |
Комары родов Aedes и Haemogogus |
ЛИС, желтуха, геморрагический |
5-25 |
глд |
Dengue haemorrhagic fever |
A91 |
Род Flaviviгus, сем. Flaviviridae |
Обезьяны, лемуры, белки, летучие мыши |
Комары рода Aedes |
лис, геморрагический, ИТШ |
10-25 |
oгл |
OMSK haemorrhagic fever |
A98.1 |
Род Flaviviгus, сем. Flaviviгidae |
Иксодовые клещи, ондатра |
Иксодовые клещи |
лис, геморрагический, поражение ЦНС, легких |
Дo 1 |
Kьяcaнypcкaя лесная болезнь |
Kyassanur Forest disease |
A98.2 |
Род Flaviviгus, сем. Flaviviгidae |
Обезьяны, клещи |
Иксодовые клещи |
лис, геморрагический |
10-15 |
KГЛ |
Crimian Congo haemorrhagic fever |
A98.0 |
Род Naiгoviгus, сем. Bunyaviridae |
Млекопитающие, иксодовые клещи рода Hyalomma |
Иксодовые клещи рода Haemogogus |
ЛИС, почечный, геморрагический |
5-50 |
ГЛПC |
Haemorrhagic fever with renal syndrom |
A98.5 |
Род Hantavirus, сем. Bunyaviridae |
Грызуны, гaмaзoвыe клещи |
Отсутствует |
ЛИС, почечный, геморрагический |
0,2-15 |
Лихорадка Pифт-Baлли |
Rift Vally fever |
A92.4 |
Род Phlebovirus, сем. Bunyaviridae |
Парнокопытные |
Комары |
лис, геморрагический, желтуха |
До 0,5 |
Лихорадка Чикyнгyнья |
Chikungunya virus disease (haemorrhagic) fever |
A92.0 |
Род Alphavirus, сем. Togaviridae |
Обезьяны, летучие мыши |
Комары рода Aedes |
лис, геморрагический |
Дo З |
ГЛ, вызываемые арена-, филовирусами и некоторыми буньявирусами, распространяются контактно-бытовым, аэрогенным, парентеральным путями.
Восприимчивость человека к ГЛ варьирует в широких пределах и зависит от изменчивости вируса.
Общая характеристика
Репликация вирусов - возбудителей ГЛ происходит преимущественно в клетках эндотелия сосудов микроциркуляторного русла, что сопровождается расстройствами микроциркуляции и развитием геморрагического синдрома и ИТШ. Именно эти особенности позволяют рассматривать ГЛ в одной группе болезней. Клинически общность ГЛ определяется наличием лихорадочно-интоксикационного и геморрагического синдромов. Диагностику ГЛ осуществляют вирусологическими и иммунологическими методами. Основу лечения составляет патогенетическая терапия, методы специфической профилактики не разработаны. В связи с тяжестью течения, высокой летальностью, эпидемиологической неуправляемостью ГЛ относят к особо опасным и опасным инфекционным болезням.
Геморрагическая лихорадка с почечным синдромом
ГЛПС (геморрагический нефрозонефрит) - острая вирусная зоонозная природно-очаговая болезнь с многообразными механизмами передачи возбудителя, характеризующаяся системным поражением мелких кровеносных сосудов, геморрагическим диатезом, гемодинамическими расстройствами и поражением почек с развитием ОПН.
Код по МКБ-10
А98.5 Геморрагическая лихорадка с почечным синдромом.
Этиология
Возбудитель - арбовирус семейства Bunyaviridae, рода Hantavirus, включающий около 30 серотипов, 4 из которых (Hantaan, Puumala, Seul и Dobrava/Belgrad) вызывают ГЛПС. Вирус ГЛПС имеет сферическую форму диаметром 85-120 нм, содержит четыре полипептида: нуклеокапсид (N), РНК-полимеразу и гликопротеины мембраны - G1 и G2. Геном вируса включает три сегмента (L-, M-, S-) одноцепочечной «минус»-РНК; реплицируется в цитоплазме инфицированных клеток (моноцитах, клетках легких, почек, печени, слюнных желез). Возбудитель ГЛПС способен размножаться в куриных эмбрионах, пассируется на лабораторных животных. Вирус чувствителен к хлороформу, ацетону, эфиру, бензолу, ультрафиолетовому облучению; инактивируется при 50 °С в течение 30 мин, кислотолабилен (полностью инактивируется при pH ниже 5,0). Относительно устойчив в окружающей среде при 4-20 °С, хорошо сохраняется при температуре ниже -20 °С. В сыворотке крови, взятой у больных, сохраняется до 4 сут при 4 °С.
Эпидемиология
Основной источник и резервуар возбудителя ГЛПС - мышевидные грызуны (рыжая полевка, лесная мышь, красно-серая полевка, азиатская лесная мышь, домовые мыши и крысы), которые переносят бессимптомную инфекцию и выделяют вирус с мочой и фекалиями. Заражение людей происходит преимущественно воздушно-пылевым путем (при аспирации вируса из высохших испражнений инфицированных грызунов), а также контактным (через поврежденные кожные и слизистые покровы, при соприкосновении с грызунами или инфицированными объектами окружающей среды - сено, солома, хворост), а также алиментарным (при употреблении продуктов, загрязненных выделениями инфицированных грызунов и не прошедших термическую обработку). Больной человек не заразен. Естественная восприимчивость людей высокая, болезни подвержены все возрастные группы. Чаще заболевают мужчины (70-90% больных) от 16 до 50 лет, преимущественно работники сельского хозяйства, трактористы, водители. Реже ГЛПС регистрируют у детей, женщин и лиц пожилого возраста. Перенесенная инфекция оставляет стойкий пожизненный типоспецифический иммунитет. Природные очаги ГЛПС распространены по всему миру. В России ГЛПС регистрируют во всех регионах. Наиболее активные очаги существуют между Волгой и Уралом (Республики Башкортостан, Татарстан, Марий Эл, Самарская и Ульяновская области) и на Дальнем Востоке. Четко выражена сезонность заболеваемости: с мая по декабрь. В последние годы наблюдается смещение сезонного пика из летне-осеннего в осенне-зимний период. Наиболее высокая заболеваемость в Республике Башкортостан.
Меры профилактики
Специфическая не проводится. Корейская вакцина, изготовленная на основе штамма Hantaan, в России не сертифицирована.
Неспецифическая профилактика включает уничтожение грызунов в очагах, использование респираторов при работе в запыленных помещениях, хранение продуктов на складах, защищенных от грызунов.
Патогенез
Вирус внедряется через слизистые дыхательных, пищеварительных путей, поврежденный кожный покров и репродуцируется в ЛУ и мононуклеарно-фагоцитарной системе. Происходит диссеминация вируса и его инфекционно-токсическое воздействие на рецепторы сосудов и нервной системы, что клинически соответствует инкубационному периоду болезни. Циркулирующий в крови вирус захватывают клетки мононуклеарно-фагоцитарной системы и при нормальной иммунореактивности удаляют из организма. Однако при нарушении регуляторных механизмов комплексы «антиген-антитело» повреждают стенки артериол, в результате чего повышается проницаемость сосудов и развивается геморрагический диатез с плазмореей в ткани. Ведущее место в патогенезе также принадлежит клеточным факторам иммунитета: цитотоксическим лимфоцитам, NK-клеткам и провоспалительным цитокинам (ИЛ-1, ФНО-α, ИЛ-6), которые оказывают повреждающее действие на инфицированные вирусом клетки.
Результатом развившихся под действием вируса нарушений становятся геморрагические, дистрофические и некробиотические изменения в гипофизе, надпочечниках, почках и других паренхиматозных органах (манифестация ДВС-синдрома). Наибольшие изменения отмечают в почках - снижение клубочковой фильтрации и нарушение канальцевой реабсорбции, что приводит к олигурии, азотемии, протеинурии, кислотно-основному и водно-электролитному дисбалансу, в результате чего развивается ОПН.
Клиническая картина
Инкубационный период - от 4 до 49 (в среднем 14-21) дней. Для заболевания характерна цикличность течения и многообразие клинических вариантов, от абортивных лихорадочных форм до тяжелых, с массивным геморрагическим синдромом и стойкой почечной недостаточностью. Выделяют следующие периоды: начальный (лихорадочный), олигурический, полиурический, реконвалесцентный (ранний - до 2 мес и поздний - до 2-3 лет). Продромальные явления в виде недомогания, познабливания, утомляемости, субфебрилитета, длящиеся 1-3 дня, наблюдают не более чем у 10% больных.
Начальный период (1-3-й дни болезни) характеризуется острым началом, повышением температуры тела до 38-40 °С и более, сильной головной болью, сухостью во рту, тошнотой, снижением аппетита, слабостью, миалгиями. Отмечают запоры, хотя возможна и диарея до 3-5 р/сут. Характерны жалобы на снижение остроты зрения («мушки» перед глазами), боли в глазных яблоках, которые исчезают в течение 1-5 дней. Отмечают гиперемию лица, шеи, верхней части груди, инъекцию склер и конъюнктивы, гиперемию зева, геморрагическую энантему на слизистой оболочке мягкого нёба, умеренную брадикардию. Возможны кровянистые выделения из носа, рвота, боли в пояснице, животе; с 3-5-го дня появляется петехиальная сыпь в области ключиц, подмышечных впадин, груди. При тяжелых формах отмечают симптомы менингизма. На 4-6-й день болезни возрастает риск развития ИТШ, особенно при нарушении лечебно-охранительного режима (физический труд, посещение бани, употребление алкоголя). Олигурический период (с 3-6-го по 8-14-й день болезни) - при нормализации температуры тела состояние больного чаще ухудшается; усугубляются симптомы интоксикации, суточный диурез снижается, степень выраженности олигурии коррелирует с тяжестью заболевания. Характерна выраженная адинамия, боли в поясничной области различной интенсивности, геморрагический синдром ышение уровня белка и глюкозы при нормальном содержании лактата, у части больных - двузначный смешанный или лимфоцитарный плеоцитоз. Редкими осложнениями краснухи являются первичная вирусная или вторичная бактериальная пневмония. В большинстве случаев краснуха протекает доброкачественно. Причиной летального исхода может стать энцефалит, в редких случаях при тромбоцитопенической пурпуре - кровоизлияние в мозг. Врожденная краснуха (кровоизлияния в склеры, в местах инъекций; носовые, желудочно-кишечные, маточные кровотечения). Кровоизлияния в жизненно важные органы (ЦНС, надпочечники, гипофиз) могут стать причиной летального исхода. У больных отмечают бледность и одутловатость лица, пастозность век, брадикардию, гипотензию, сменяемую к концу периода гипертензией. При пальпации живота определяется болезненность в проекции почек, гепатомегалия, положительный симптом поколачивания по поясничной области. При выявлении последнего симптома следует проявлять особую осторожность из-за возможности разрыва капсулы почки.
Полиуригеский период (с 9-13-го дня болезни) отличается развитием полиурии (до 5 л/сут и более), никтурии с гипоизостенурией, прекращением рвоты, исчезновением болей в пояснице, восстановлением сна и аппетита. В то же время сохраняются слабость, сухость во рту, усиливается жажда. Иногда в первые дни полиурии нарастает азотемия, возможно развитие дегидратации, гипонатриемии, гипокалиемии.
В период реконвалесценции восстанавливается суточный диурез, приходят к норме показатели мочевины и креатинина, улучшается общее состояние больного. Длительность выздоровления зависит от скорости восстановления почечных функций и продолжается от 3 нед до 2-3 лет. Оценка тяжести заболевания соответствует степени выраженности основных клинических синдромов, прежде всего ОПН, и развитию осложнений.
Осложнения специфические: ИТШ, ДВС-синдром, азотемическая уремия, отек легких и головного мозга, кровоизлияния в гипофиз, надпочечники, миокард, головной мозг, эклампсия, острая сердечнососудистая недостаточность, профузные кровотечения, надрыв или разрыв капсулы почки, инфекционный миокардит, геморрагический менингоэнцефалит, парез кишечника, вирусная пневмония и др.
Неспецифические: пиелонефрит, гнойный отит, абсцессы, флегмоны, пневмонии, паротит, сепсис и др.
Летальность и причины смерти. Летальность составляет 0,73,5% и наступает от развития ИТШ, ОПН, кровоизлияний в жизненно важные органы, разрыва почек.
Диагностика
Клиническая
Характерно сочетание острого начала болезни с появлением лихорадки и симптомов интоксикации, поражения почек с развитием ОПН и геморрагическим синдромом; пребывание в эндемичном очаге, характер профессиональной деятельности; сезонность (май-декабрь). Цикличность течения с закономерной сменой инфекционно-токсических симптомов начального периода (лихорадка, головная боль, слабость, гиперемия лица, шеи, верхней трети груди, слизистых оболочек, инъекция сосудов склер), признаками нарастающей почечной недостаточности олигурического периода (боли в пояснице, животе, рвота, не связанная с приемом пищи, снижение остроты зрения на фоне сильной головной боли, сухости во рту, жажды, выраженный геморрагический синдром, снижение диуреза менее 500 мл/сут).
Неспецифическая лабораторная диагностика
Анализ крови: в начальном периоде - лейкопения, увеличение числа эритроцитов, гемоглобина, снижение СОЭ, тромбоцитопения; в разгар болезни - лейкоцитоз со сдвигом формулы влево, увеличение СОЭ до 40 мм/ч.
Анализ мочи: протеинурия (от 0,3 до 30,0 г/л и выше), микро- и макрогематурия, цилиндрурия, клетки Дунаевского.
Проба Зимницкого: гипоизостенурия.
Биохимический анализ крови: повышение концентрации мочевины, креатинина, гиперкалиемия, гипонатриемия, гипохлоремия.
Коагулограмма: в зависимости от периода заболевания признаки гиперкоагуляции (укорочение тромбинового времени до 10-15 с, времени свертывания крови, повышение концентрации фибриногена до 4,5-8 г/л, протромбинового индекса до 100-120%) либо гипокоагуляции (удлинение тромбинового времени до 25-50 с, удлинение времени свертывания, снижение концентрации фибриногена до 1-2 г/л, протромбинового индекса до 30-60%).
Специфическая лабораторная диагностика
РНИФ: исследования проводят в парных сыворотках, взятых с интервалом 5-7 сут. Диагностически значимым считают нарастание титра антител в 4 раза и более. Метод высокоэффективен, подтверждаемость диагноза достигает 96-98%. Для повышения эффективности серодиагностики ГЛПС рекомендуют проводить забор первой сыворотки до 4-7-го дня болезни, а второй - не позже 15-го дня заболевания. Используют также твердофазный ИФА, который позволяет определить концентрацию IgM-антител. С целью ранней диагностики применяют ПЦР.
Дифференциальная диагностика
ГЛПС следует дифференцировать с другими ГЛ, однако ареал их распространения не совпадает с ареалом распространения ГЛПС, кроме ОГЛ. В начальном периоде проводят дифференциальную диагностику с гриппом, риккетсиозами, клещевым энцефалитом, в дальнейшем с болезнями, характеризующимися триадой симптомов: лихорадка, поражение почек, геморрагический синдром. Актуальна дифференциальная диагностика с острыми хирургическими заболеваниями брюшной полости.
Лечение
Больные ГЛПС подлежат обязательной ранней госпитализации в инфекционные или терапевтические стационары, независимо от тяжести и периода заболевания. Транспортировка пациента должна быть максимально щадящей, с исключением толчков и тряски.
Строгий постельный режим до конца периода полиурии. Учет водного баланса. Щадящая диета без ограничения соли. В период олигоанурии исключаются продукты, богатые белком (мясо, рыба, бобовые) и калием (овощи, фрукты). В стадии полиурии эти продукты необходимы. Контроль гемодинамики, общего анализа крови, общего анализа мочи, коагулограммы, азотистых шлаков.
-
Этиотропная терапия (обязательно назначение этих препаратов в первые 3-5 дней заболевания): рекомбинантный ИФН-α2а и ИФН-α2b [Реаферон-ЕС-Липинт♠, Реаферон-Липинт♠, Реаферон-ЕС♠, интерферон альфа-2b (Реальдирон♠)]; рекомбинантный ИФН-α2b в свечах [интерферон альфа-2b (Виферон♠)]; человеческий лейкоцитарный интерферон в свечах. Противовирусные химиопрепараты: рибавирин (Виразол♠, Рибамидил♠) перорально по 200 мг 5 р/сут 5 дней; индукторы эндогенного ИФН [тилорон (Амиксин♠) по 125 мг 2 р/сут, 2 дня подряд и 125 мг однократно на 3-й день внутрь; 1-фенил-2,3-диметил-4 йодпиразолон (Йодантипирин♠) перорально по 200 мг (2 таблетки) 3 раза в день в первые 4 дня, затем по 100 мг 3 раза в сутки в последующие 5 дней]. При невозможности приема капсулированного рибавирина (неукротимая рвота, кома) с учетом противопоказаний рекомендуют в/в введение рибавирина с начальной нагрузочной дозой 33 мг/кг; через 6 ч - по 16 мг/кг через каждые 6 ч в течение 4 дней (всего 16 доз); через 8 ч после введения последней из этих доз - по 8 мг/кг каждые 8 ч в течение 3 дней (9 доз). Лечение рибавирином в данной дозе может быть продолжено в зависимости от состояния больного и мнения лечащего врача, но не должно превышать 7 дней. При возможности перорального приема рибавирина необходимо прекратить внутривенное введение рибавирина и перейти на капсулированные формы в соответствии со схемой лечения, приведенной выше.
В начальном периоде
-
Дезинтоксикационная терапия: 5-10% раствор декстрозы (Глюкозы♠) с аскорбиновой кислотой, кокарбоксилазой по 400-600 мл, 0,9% раствор натрия хлорида с аминофиллином (Эуфиллином♠); антиоксиданты (аскорбиновая кислота, альфа-токоферола ацетат♠).
-
Лечение ДВС-синдрома (фазы гиперкоагуляции). Дезагреганты: пентоксифиллин (Трентал♠, Пентилин♠, Агапурин♠), аминофиллин (Эуфиллин♠), растворы гидроксиэтил крахмала (ГЭК); антикоагулянты: гепарин натрия (Гепарин♠) 5-10 тыс. ед. в сутки - кратковременно, под контролем активированного частичного тромбопластинового времени (АЧТВ), времени свертывания крови (ВСК); ангиопротекторы: рутинρ, пармидинρ (продектинρ), этамзилат (Дицинон♠); ингибиторы протеаз: апротинин (Контрикал♠, Гордокс♠, Трасилол 500 000♠); свежезамороженная плазма.
-
Лечение инфекционно-токсического шока: допамин; декстран [ср. мол. масса 50 000-70 000] (Полиглюкин♠); объем инфузий - до 40-50 мл/кг массы в сутки под контролем диуреза), восстановление объема циркулирующей крови (ОЦК) - кристаллоиды [полиионные солевые растворы, 10% раствор декстрозы (Глюкозы♠)] и коллоиды [растворы ГЭК, СЗП, альбумин человека (Альбумин♠)] в изоволюмическом режиме - 3:1; глюкокортикоиды в разовой дозе от 2-3 до 6 мг/кг массы, при отсутствии эффекта или при шоке III ст. - допамин (0,5% или 4% по 5 мл); коррекция КЩС (буферные солевые растворы, 4% раствор натрия гидрокарбоната, кокарбоксилаза); купирование ДВС-синдрома; кислородотерапия, ИВЛ; мочегонные препараты - только(!) после нормализации гемодинамики, петлевые диуретики - фуросемид (Лазикс♠) (0,5-1 мг/кг), противопоказано введение маннитола; больным старше 50 лет необходимо назначение сердечных гликозидов (Строфантин К♠, Коргликон♠ в/в).
В олигоанурическом периоде
-
Коррекция уремической интоксикации (в период олигурии не вводятся коллоидные растворы декстрана [декстран [ср. мол. масса 35 000-45 000] (Реополиглюкин♠), декстран [ср. мол. масса 50 00070 000] (Полиглюкин♠), декстран [ср. мол. масса 30 000-50 000] + маннитол + натрия хлорид (Реоглюман♠)], с осторожностью растворы ГЭК (при выраженной тромбоцитопении), глюкокортикоиды (кроме случаев коллапса, отека мозга и легких): промывание желудка и кишечника 2% содовым раствором (осторожно); внутривенные инфузии 10-20% декстрозы (Глюкозы♠) с инсулином, 0,9% раствора натрия хлорида с аминофиллином (Эуфиллином♠), аскорбиновой кислотой, кокарбоксилазой; при тяжелых формах - 10-20% раствора альбумина человека (Альбумина♠); прием энтеросорбентов [энтеросорбρ, лигнин гидролизный (Полифепан♠), полиметилсилоксана полигидрат (Энтеросгель♠)]; для снижения белкового катаболизма - ингибиторы протеаз, парентеральное питание [Интралипид♠, аминокислоты для парентерального питания (Нефрамин♠¤)].
-
Борьба с гипергидратацией, ацидозом и электролитными нарушениями. Лечение олигурии (мочи менее 900-600 мл/сут) и олигоанурии (менее 350 мл/сут) должно исходить из главного принципа: «лучше недолить, чем перелить». Для этого необходимо: расчет вводимой жидкости, не превышающей 500-700 мл объема потерь (с мочой, рвотой и диареей); стимуляция диуреза фуросемидом (Лазиксом♠) в режиме ударных доз (200-300 мг одномоментно, в вену, струйно) после ощелачивания (4% натрия гидрокарбонат 100-200 мл) и введения белковых препаратов [альбумин человека (Альбумин♠), СЗП]. Если при введении первой дозы получено не менее 100-200 мл мочи, через 6-12 ч возможно повторное введение фуросемида (Лазикса♠) в той же дозе. Общая доза препарата не должна превышать 800-1000 мг. В период анурии (мочи менее 50 мл/сут) использование фуросемида нежелательно; коррекция ацидоза проводится назначением 4% натрия гидрокарбоната, объем введения (в мл) которого рассчитывается по формуле: 0,6 × масса тела больного (кг) × ВЕ (ммоль/л). При невозможности определения рН и ВЕ крови больным с олигоанурией допускается введение до 200-300 мл 4% натрия гидрокарбоната в сутки; коррекция гиперкалиемии - глюкозо-инсулиновая смесь, кальция глюконат 10% до 30-40 мл/сут, бескалиевая диета; избегать введения препаратов, содержащих ионы калия и магния.
-
Симптоматическая терапия: анальгетики; десенсибилизирующие средства; купирование упорной рвоты, икоты; антигипертензивные средства; противосудорожные средства.
При анурии (менее 50 мл мочи в сутки) использование фуросемида противопоказано.
При неэффективности консервативных мероприятий показано проведение экстракорпоральной детоксикации (гемодиализа), необходимость в которой может возникнуть на 8-12-й день болезни.
В полиурическом периоде
Прогноз. Летальность от 1 до 10% и выше. Функция почек восстанавливается медленно, но ХПН не развивается.
Примерные сроки нетрудоспособности
Зависят от клинической формы и составляют от 3 нед до 2-3 мес.
Диспансеризация
Диспансерному наблюдению подлежат все реконвалесценты ГЛПС. Срок наблюдения для переболевших легкой формой ГЛПС - 3 мес, среднетяжелой и тяжелой - 12 мес. Наблюдение проводит врач-инфекционист, при его отсутствии - участковый терапевт.
Омская геморрагическая лихорадка
ОГЛ - острая вирусная зоонозная природно-очаговая болезнь с преимущественно трансмиссивным механизмом передачи возбудителя, характеризующаяся волнообразной лихорадкой, общей интоксикацией, развитием геморрагического синдрома, поражением ЦНС, легких, почек и относительно доброкачественным течением.
Код по МКБ-10
А98.1 Омская геморрагическая лихорадка.
Этиология
Возбудитель - арбовирус семейства Flaviviridae рода Flavivirus. Геном представлен однонитевой РНК; по антигенной структуре близок к геному вируса клещевого энцефалита. Размеры вириона составляют до 40 нм; он имеет сферическую форму, кубическую симметрию; покрыт двухслойной оболочкой, содержащей липиды и белки, имеющие антигенные свойства и определяющие группо- и видоспецифические детерминанты. Размножается вирус ОГЛ в цитоплазме на мембранах комплекса Гольджи. Высокопатогенен для белых мышей, ондатр, полевок, представляет опасность внутрилабораторного заражения сотрудников, работающих с инфицированными животными. Вирус инактивируется дезинфицирующими растворами (3% раствором карболовой кислоты, 3% раствором лизола, 1% раствором хлорамина); при температуре 70-80 °С погибает через 10 мин, при кипячении - мгновенно; при 4 °С инактивируется через 29 сут; в 50% глицерине сохраняется до 7 мес; в высушенном состоянии - до 4 лет.
Эпидемиология
После 2002 г. эпизоотическая и эпидемическая активность природных очагов ОГЛ перестала регистрироваться, однако вирус ОГЛ на эндемичных территориях периодически выявляется. В 1989-2002 гг. регулярная эпидемическая активность имела место только на территории четырех административных районов Новосибирской области. В абсолютном большинстве случаев доминировали нетрансмиссивные пути инфицирования людей, как правило, при непосредственном контакте с инфицированными ондатрами.
Основной источник и резервуар вируса - иксодовые клещи Dermacentor pictus и Dermacentor marginatus (вирус передается транс-овариально и трансфазово). В природных очагах обнаруживают грызунов, инфицированных вирусом ОГЛ. Заражение людей происходит в основном через присасывание клещей, а также воздушно-пылевым путем от грызунов, контактным - при разделке туши животных и алиментарным - при употреблении сырой озерной воды. Естественная восприимчивость людей высокая; вирус поражает все возрастные группы населения, но преимущественно заболевают промысловые рабочие и люди, занятые на полевых работах в лесостепных районах.
Нозоареал ОГЛ ограничен 9 районами Омской области, 8 районами Новосибирской и 5 районами Тюменской и Курганской областей.
Четко выражена сезонность заболеваемости: первый подъем наблюдают в весенне-летние месяцы (май-июнь) - период активности клещей (трансмиссивный путь передачи); второй - в осенние месяцы (сентябрь-октябрь) в период отлова ондатры (нетрансмиссивные пути передачи).
После перенесенной инфекции развивается стойкий иммунитет, при котором определяются в крови вируснейтрализующие и комплементсвязывающие антитела.
Меры профилактики
Специфические. В очагах используют вакцину против клещевого энцефалита (вследствие схожести антигенных характеристик возбудителей развивается стойкий иммунитет против обоих заболеваний).
Неспецифические. Уничтожение клещей, борьба с грызунами; соблюдение индивидуальных мер безопасности (использование защитной одежды, инсектицидов, при работе в запыленных помещениях - респираторов).
Патогенез
Внедряясь в организм человека через поврежденную кожу, слизистые оболочки дыхательных путей и органов пищеварения, вирус с током крови распространяется по всему организму и поражает преимущественно эндотелий сосудов микроциркуляторного русла, надпочечники, вегетативную нервную систему и селезенку. Поражение мелких кровеносных сосудов в различных органах и тканях обусловливает развитие геморрагического синдрома.
Клиническая картина
Инкубационный период составляет 2-10 сут (в среднем 5-7 сут).
В зависимости от наличия и выраженности основных симптомов выделяют: типичные формы заболевания (геморрагические); атипичные формы заболевания (без геморрагических проявлений).
По степени тяжести заболевания выделяют: легкое течение, средне-тяжелое течение, тяжелое течение.
По характеру клинических проявлений выделяют: острое течение (без рецидива), острое рецидивирующее течение (с повторной температурной волной).
Основные симптомы и динамика их развития
Начало заболевания острое, внезапное, с высокой лихорадкой, ознобом, резкой головной болью, головокружением, выраженной слабостью, мышечными болями в конечностях и спине, тошнотой и носовыми кровотечениями. Температура тела с 1-х суток заболевания достигает 39-40 °С, держится в течение 3-4 сут, а затем на 7-15-е сутки заболевания литически снижается. Почти у 50% больных в период реконвалесценции (на 2-3-й неделе заболевания) выявляют повторную волну лихорадки. Вторая волна заболевания продолжается 4-14 сут, но протекает легче. На фоне лихорадки больные заторможены. Возникает одутловатость и гиперемия лица, шеи; инъекция сосудов склер и конъюнктив; яркая гиперемия мягкого и твердого нёба, десен с развитием в них мелких и крупных кровоизлияний. С 3-4-х суток течения заболевания развиваются геморрагические симптомы, наиболее ранний из которых - геморрагическая сыпь на передней и боковых поверхностях груди, разгибательных поверхностях рук и ног; положительные симптомы жгута и щипка. Возможны носовые, легочные, желудочно-кишечные и маточные кровотечения, чаще необильные, но повторяющиеся на протяжении заболевания несколько раз. В период обострения иногда выявляют общемозговые и менингеальные симптомы, преходящие очаговые симптомы. Часто выявляют бронхит и мелкоочаговую пневмонию, что представляет характерную особенность клинической картины ОГЛ (в отличие от других ГЛ). Диурез снижен, но развития почечной недостаточности не выявляют. Вовлечение органов пищеварительной системы выражается тошнотой, рвотой, горечью и сухостью во рту, гепатомегалией, болями в эпигастрии. Характерны брадикардия, расширение границ сердца влево, глухость сердечных тонов и артериальная гипотензия.
Осложнения возникают редко. К ним относят отит или паротит (нередко гнойного характера), пиелит, поздние очаговые пневмонии. У большинства больных ОГЛ заканчивается полным выздоровлением. В неосложненных случаях прогноз благоприятный.
Летальность и причины смерти. При тяжелом течении смерть может наступить в ранние сроки в результате интоксикации или кровотечения и на 30-45-е сутки течения заболевания от септических осложнений. Летальность не превышает 1%.
Диагностика
Клиническая диагностика: жалобы: высокая лихорадка, озноб, резкая головная боль, головокружение, выраженная слабость, мышечные боли в конечностях и спине, тошнота, носовые кровотечения; пребывание в эндемичных для ОГЛ районах, присасывание клеща, особенности профессиональной деятельности, сезонность - май-июнь, сентябрь-октябрь; клинические признаки; часто возникают бронхит и пневмония; развитие геморрагического (петехиальная сыпь, кровоизлияния в склеру, кровохарканье; носовые, желудочно-кишечные, легочные и маточные кровотечения) и менингеального синдромов при отсутствии выраженных проявлений почечной недостаточности.
Лабораторная диагностика
Неспецифическая лабораторная диагностика. В крови: повышение содержания гемоглобина и числа эритроцитов, лимфопения, умеренный нейтрофилез со сдвигом влево, тромбоцитопения, уменьшение СОЭ до 3-7 мм/ч.
В анализе мочи: протеинурия, микрогематурия, цилиндрурия, наличие в осадке мочи уже со 2-х суток течения заболевания клеток почечного эпителия и эпителия МВП (до 20-30 в поле зрения).
Специфическая лабораторная диагностика: метод флюоресцирующих антител (в парных сыворотках), РСК, РН, РПГА, ПЦР.
Дифференциальная диагностика
ОГЛ дифференцируют от других ГЛ, клещевого энцефалита, лептоспироза.
Лечение
Больные ОГЛ подлежат обязательной госпитализации в инфекционный стационар. Необходимо соблюдение постельного режима. Рекомендовано щадящее питание - дробное, в теплом виде, с переходом на общий стол (№ 15) в период реконвалесценции.
Этиотропное лечение. Не разработано.
Патогенетическое лечение
Дезинтоксикационная терапия - внутривенное введение 5-10% растворов декстрозы (Глюкоза♠), изотонического раствора натрия хлорида с аскорбиновой кислотой и кокарбоксилазой, энтеросорбенты (лигнин гидролизный, повидон). Профилактика ДВС-синдрома: дезагреганты - пентоксифиллин, ксантинола никотинат, дипиридамол, ангиопротекторы - кальция глюконат, этамзилат, рутозид, свежезамороженная плазма, ингибиторы протеаз - апротинин; антиоксиданты (витамин Е, Убихинон композитум♠).
Прогноз благоприятный.
Желтая лихорадка
Желтая лихорадка (англ. Yellow fever, лат. Febris flava, нем. Yelbfiberа - амарильная лихорадка) - острая природно-очаговая трансмиссивная вирусная болезнь, характеризующаяся поражением сосудов, печени, почек, геморрагическим синдромом, тяжелым циклическим течением.
Желтую лихорадку относят к группе карантинных заболеваний (особо опасные инфекции), подлежащих международной регистрации.
Коды по МКБ-10
A95 Желтая лихорадка.
Этиология
Возбудитель - РНК-содержащий вирус Visceronhilus tropicus рода Flavivirus семейства Flaviviridae, относящийся к группе арбовирусов. Капсид имеет сферическую форму; размеры около 40 нм. В окружающей среде малоустойчив: быстро инактивируется при низких значениях рН, воздействии высокой температуры и обычных дезинфицирующих средств. Длительно сохраняется при низких температурах (в жидком азоте до 12 лет) и при высушивании. Установлено антигенное родство с возбудителями лихорадки денге и японского энцефалита. Вирус желтой лихорадки отнесен к 1-й группе патогенности.
Эпидемиология
Различают два эпидемиологических типа желтой лихорадки:
На американском континенте переносчиками возбудителя являются комары рода Haemagogus и Aedes, а в Африке - ряд видов рода Aedes, среди которых основную роль играют A. africanus и A. simpsoni. Главный источник и резервуар инфекции при джунглевой форме желтой лихорадки - дикие животные (обезьяны, опоссумы, сумчатые, грызуны и другие), а при городской форме - человек. Заразный период у животных определить невозможно, у человека он начинается за 1-2 дня до появления клинических признаков заболевания, длится в течение 3-4 дней. A. africanus во время сухого сезона сохраняет активность в кронах деревьев и тем самым постоянно обеспечивает циркуляцию вируса. Обычно заражаются люди, часто посещающие леса. Человек, в свою очередь, представляет источник вируса для комара A. aegypti, обитающего рядом с жилищем человека. Для размножения комары используют декоративные водоемы, бочки с водой и другие временные вместилища воды; часто нападают на человека. В организме комара возбудитель сохраняется в течение жизни насекомого. При температуре окружающей среды 25 °С комар становится способным передать возбудителя человеку через 10-12 сут после заражения, а при 37 °С - 4 сут. В организме комара вирус сначала размножается в тканях средней кишки, затем через гемолимфу попадает практически во все органы насекомого, в том числе слюнные железы; при этом количество вируса возрастает в тысячи раз по сравнению с исходным уровнем.
Если циркуляция вируса происходит по цепочке «человек-комар-человек», то желтая лихорадка становится типичным антропонозом. Вирусемия у больного развивается в конце инкубационного периода и в первые 3 сут течения заболевания. Вирус, передаваемый комарами, поражает людей любого возраста и пола. В эндемических очагах взрослые болеют реже детей.
Природные очаги желтой лихорадки располагаются в тропических зонах Южной Америки и Африки. По данным ВОЗ, эндемичными в настоящий момент являются 45 стран Африки и 13 стран Южной и Центральной Америки. Больной в отсутствие переносчика эпидемиологически не опасен. Комар A. aegypti обитает в субтропических районах России, но случаев желтой лихорадки в нашей стране не выявлено. У переболевших развивается пожизненный иммунитет. Восприимчивость людей к вирусу очень высокая, при этом в эндемичных районах часто происходит латентная иммунизация местного населения малыми дозами вируса.
Меры профилактики
Специфические. Иммунизация населения, используют две живые вакцины: вакцина на основе штамма 17Д и, реже, вакцина на основе штамма Дакар.
Для предупреждения распространения желтой лихорадки по Международным санитарным правилам учитываются все случаи заболевания.
Лицам, направляющимся в зону, эндемичную для данного заболевания, необходимо сделать прививку.
Для предупреждения распространения комаров самолеты и корабли, посещающие эндемичные для желтой лихорадки местности или места распространения A. aegypti, подвергают обязательной дезинсекции. Большое значение имеет выявление первого случая заболевания. По рекомендации ВОЗ его следует предполагать при выявлении случаев острой лихорадки с развитием желтухи в течение 2 нед после начала заболевания, сопровождающейся кровотечениями или смертью в течение 3 нед.
Неспецифические. Борьба с комарами: для достижения быстрого эффекта уничтожения взрослых особей насекомых используют химические инсектициды. Наибольшее распространение получили фосфорорганические соединения, в частности малатион и различные препараты группы пиретроидов. В последние годы получили распространение препараты, приготовленные на основе культур Вас. thuringiensis, применяемые для уничтожения комаров на личиночной стадии развития. Существуют специальные методы защиты человека от укусов комарами - сетки, закрывающие обнаженные участки тела (особенно голову и шею) или кровать. Сетки, одежду и отдельные участки тела обрабатывают репеллентами. Для предупреждения распространения возбудителя необходимо принимать меры по предотвращению контакта больного человека с переносчиками.
Патогенез
Заражение происходит при укусе инфицированным комаром. Вирус по лимфатическим сосудам проникает в регионарные ЛУ, в которых происходит его репликация во время инкубационного периода. По прошествии нескольких дней он поступает в кровь и распространяется по всему организму. Длительность вирусемии 3-6 сут. В это время вирус попадает главным образом в эндотелий сосудов, печень, почки, селезенку, костный и головной мозг. В результате повышается проницаемость сосудов и микроциркуляторного русла. Развиваются дистрофия и некроз гепатоцитов, поражение клубочковой и канальцевой систем почек. Развитие тромбогеморрагического синдрома обусловлено как поражением сосудов и микроциркуляторного русла, так и нарушением синтеза в печени плазменных факторов гемостаза.
Кожные покровы умерших окрашены в желтый цвет, часто багровые из-за венозной гиперемии. Печень и почки значительно увеличены, с мелкоточечными кровоизлияниями, жировой дистрофией, очагами некроза (в тяжелых случаях субтотального). В печени обнаруживают тельца Каунсильмена, в ядрах клеток печени - ацидофильные включения (тельца Торреса). Они образуются вследствие размножения вируса в клетках и изменений в их ядрах. Несмотря на существенные изменения в печени и в почках, после выздоровления наблюдают полное восстановление их функций без исхода в фиброз.
В ряде случаев причина смерти - поражение почек, характеризующееся набуханием и жировой дистрофией почечных канальцев вплоть до некроза. Изменения в клубочках почек часто незначительны. Селезенка переполнена кровью, ретикулярные клетки фолликулов гиперплазированы. Дегенеративные изменения происходят в мышце сердца; в перикарде выявляют кровоизлияния. Характерны множественные кровоизлияния в желудке, кишечнике, легких, плевре, а также периваскулярные инфильтраты в головном мозге.
Клиническая картина
Инкубационный период обычно составляет 3-6, редко до 10 сут.
Классификация
По тяжести течения выделяют легкую, среднетяжелую, тяжелую, молниеносную формы болезни.
Основные симптомы и динамика их развития
В типичных случаях заболевание имеет двухволновое течение с тремя периодами: начальный лихорадочный (период гиперемии); период ремиссии со снижением температуры тела; период венозного стаза (реактивный).
Заболевание начинается, как правило, остро, без продромы. Высокая лихорадка развивается в течение 1-х суток. Подъем температуры сопровождается ознобом, болями в мышцах спины и конечностей и сильной головной болью. Часто тошнота, рвота. Обычно температура тела снижается до нормальных значений к исходу 3-х суток, но при тяжелом течении лихорадка может длиться 8-10 сут. Затем температура вновь повышается, обычно не достигая первоначальных высоких значений. В начале заболевания появляются гиперемия лица, шеи и верхней части туловища, выраженная инъекция сосудов склер, отечность век, припухлость губ, одутловатость лица («амарильная маска»). Характерны светобоязнь и слезотечение. Слизистая оболочка рта и язык ярко-красного цвета. Больные страдают бессонницей. Появляются тошнота, рвота с примесью желчи. Пульс достигает 100-130 ударов в минуту, в дальнейшем развивается брадикардия. АД в норме. Увеличены печень и селезенка, возможна их болезненность при пальпации. В общем анализе крови выявляют лейкопению и лимфопению, СОЭ не увеличена. Характерна протеинурия.
С началом желтушного окрашивания склер, конъюнктив и мягкого нёба снижается АД и появляется цианоз. Состояние больных значительно ухудшается. Возможны носовые кровотечения, кровоточивость десен, в рвотных массах выявляют кровь. При менее тяжелом течении наступает стадия ремиссии, при этом температура тела снижается до нормы, общее состояние улучшается, прекращаются тошнота и рвота, лицо бледнеет, исчезает одутловатость. Однако уже через несколько часов вновь происходит резкое ухудшение состояния, температура тела быстро повышается. Эти признаки свидетельствуют о переходе заболевания в период венозного стаза, наблюдаемый примерно у 15% больных и характеризующийся развитием желтухи, геморрагического диатеза и ОПН. Появляется кровоточивость десен, а также носовые, маточные и кишечные кровотечения. На фоне полиморфной сыпи на коже возникают геморрагии. Нередко появляется рвота цвета кофейной гущи. АД падает; тоны сердца приглушены; пульс слабого наполнения до 40 в минуту. Состояние больного часто отягощается поражением почек с развитием олигурии. Количество белка в моче возрастает до 10 г/л и больше, появляются зернистые и гиалиновые цилиндры. В крови нарастает уровень мочевины и креатинина. Печень увеличена, болезненная. Возрастает количество связанного и свободного билирубина, повышается активность альдолазы и аминотрансфераз. Лейкопения достигает 1,5-2,5×109 на литр. Замедляется свертывание крови, возрастает СОЭ. Указанные изменения наиболее выражены на 6-7-е сутки заболевания - критический период для больного. Летальный исход наступает в 50% случаев, чаще от ОПН с развитием комы (отек головного мозга, потеря сознания) и токсического энцефалита, реже от печеночной комы или сердечно-сосудистой недостаточности (миокардита). При благоприятном течении заболевания с 8-9-х суток общее состояние больных постепенно улучшается. Происходит нормализация клинических и лабораторных показателей. Астения сохраняется в течение недели. Возможны также субклинические формы заболевания. Диагноз устанавливают ретроспективно с использованием серологических методов исследования.
Осложнениями желтой лихорадки являются: ИТШ, пневмония, абсцесс почек, энцефалит, миокардит, гангрена мягких тканей, пневмония, паротит, сепсис.
Летальность. Молниеносная форма приводит к смерти на 3-4-е сутки течения заболевания, при тяжелой форме - летальные исходы на 6-7-е сутки.
Диагностика
Клиническая диагностика. Предварительный диагноз устанавливается на основании прибытия или нахождения в эндемичном регионе (страны Африки и Южной Америки); симптомов болезни («двухволновая» температурная кривая, геморрагический синдром, желтуха, поражение почек, печени и селезенки).
Лабораторная диагностика
Неспецифическая: увеличение билирубина, АЛТ, АСТ, мочевины, креатинина, лейко- и лимфопения, увеличение СОЭ, в моче - белок, цилиндры, эритроциты.
Специфическая: диагноз подтверждается биологическим методом: внутримозговое заражение новорожденных или молодых лабораторных мышей; выделение возбудителя из крови; ИФА для индикации антигена возбудителя (результат через 3 ч); РН, РСК, РТГА, РНГА ставят с парными сыворотками, взятыми к концу первой недели болезни и спустя 2-3 дня; при летальном исходе гистологически исследуют печень, где выявляют очаги субмассивного и массивного некроза печеночных долек и ацидофильные тельца Каунсильмена.
Дифференциальная диагностика
Желтую лихорадку дифференцируют с тропической малярией, желтушной формой лептоспироза, ВГ, менингококкемией, а также с ГЛ Ласса, Марбург и Эбола и ГЛПС.
Лечение
Необходима госпитализация всех больных в стационар и строгий постельный режим! Диета молочно-растительная с комплексом витаминов (С, В).
Медикаментозное лечение
Этиотропного (противовирусного) лечения нет. Некоторые авторы рекомендуют назначать рибавирин в дозе 800-1200 мг и вводить сыворотку переболевших людей.
Патогенетическое и симптоматическое лечение: дезинтоксикация (глюкозо-солевые растворы, растворы альбумина); профилактика и лечение геморрагического синдрома (преднизолон, аминокапроновая кислота, коллоидные растворы, по показаниям - переливание крови); при почечной недостаточности - стимуляция диуреза, по показаниям гемодиализ; при поражении печени - детоксикация организма - Гепасол-Нео♠, гепатопротекторы, декстроза (Глюкоза♠) и др.; при вторичных бактериальных инфекций - антибиотики.
Рекомендации по применению гепарина натрия (Гепарина♠) и глюкокортикоидов основывают только на теоретических данных; контролируемых исследований не проводили.
Прогноз благоприятный при легкой и среднетяжелой формах заболевания. При тяжелых формах летальность достигает 25%. Даже при тяжелых формах после 12-го дня заболевания наступает выздоровление.
Лихорадка денге
Лихорадка денге - острая зооантропонозная вирусная инфекционная болезнь с трансмиссивным механизмом передачи возбудителя, распространенная в странах тропического и субтропического пояса. Различают две клинические формы болезни: классическую и геморрагическую (шоковый синдром денге).
Классическая лихорадка денге (синонимы - денге, костоломная лихорадка) характеризуется двухволновой лихорадкой, артралгией, миалгией, экзантемой, полиаденитом, лейкопенией и доброкачественным течением болезни.
ГЛД (ferbis hemorragica dengue, шоковый синдром денге) характеризуется развитием тромбогеморрагического синдрома, шока и высокой летальностью.
Коды по МКБ-10
А90 Классическая лихорадка денге.
А91 Геморрагическая лихорадка денге.
Этиология
Возбудитель лихорадки денге относится к арбовирусам, роду Fla-vivirus, семейству Flaviviridae. Геном представлен однонитевой РНК. Размеры вириона 40-45 нм. Имеет дополнительную суперкапсидную оболочку, с которой связаны антигенные и гемагглютинирующие свойства. Вирус хорошо сохраняется при низких температурах (-70 °С) и в высушенном состоянии; чувствителен к формалину и эфиру, инактивируется при обработке протеолитическими ферментами и при нагревании до 60 °С. Известны четыре антигенных серотипа вируса денге: DEN I, DEN II, DEN III, DEN IV. Серотип денге-1 вызывает более высокую и продолжительную вирусемию в крови больных, чем серотипы 2 и 3. Выраженной зависимости клинической картины от серотипа вируса не установлено. Вирус обладает слабой цитопатической активностью. Его репликация происходит в цитоплазме пораженных клеток.
Эпидемиология
Источник возбудителя инфекции - больной человек и обезьяны, у которых инфекция может протекать латентно.
В эндемичных регионах существуют природные очаги болезни, в которых циркуляция вируса происходит между обезьянами, лемурами, белками, летучими мышами и, возможно, другими млекопитающими. Переносчики - комары рода Aedes (A. aegypti, A. albopictus, A. cutellaris, A. polinesiensis), возможно, определенная роль принадлежит комарам родов Anopheles и Culex.
Комары после кровососания становятся заразными через 8-12 дней в зависимости от температурных условий. Их способность к заражению сохраняется в течение жизни, т.е. 1-3 мес, однако при температуре воздуха ниже 22 °С размножения вируса в организме комара не происходит, поэтому ареал денге меньше ареала комаров-переносчиков и ограничивается 42° северной и 40° южной долготы. В странах с умеренным и холодным климатом регистрируются завозные спорадические случаи классической лихорадки денге, очень редко - геморрагической.
Заражение человека в эндемичных регионах привело к формированию стойких антропургических очагов инфекции. В этих очагах источник возбудителя - больной человек, который становится заразным почти за сутки до начала болезни и остается заразным в течение первых 3-5 дней болезни. Основной переносчик возбудителя в человеческой популяции - комар A. aegypti, обитающий в жилище человека. Самка комара кусает человека днем. Комар наиболее активен при температуре 25-28 °С, при этой же температуре его численность достигает максимума. Комар является пожизненным перносчиком вируса (от 1 до 5 мес). Человек высоковосприимчив к лихорадке денге, заражение происходит даже при однократном укусе комара. У человека каждый из четырех типов вируса способен вызывать классическую форму лихорадки денге и ГЛД. Иммунитет после перенесенной болезни кратковременный, типоспецифический, поэтому после перенесенной болезни человек остается восприимчивым к другим серотипам вируса. Крупные эпидемии всегда связаны с заносом типа вируса, не свойственного данному региону, или в регионы (страны), где отсутствует эндемическая заболеваемость. Эпидемиология классической лихорадки денге и ГЛД существенно различается. Классическую денге наблюдают среди местных жителей, преимущественно детей и приезжих любого возраста, а ГЛД заболевают главным образом дети. Пики заболеваемости приходятся на две возрастные группы: дети до 1 года, имеющие пассивный иммунитет против вируса другого типа, и дети 3-летнего возраста, переболевшие классической денге. В первой группе формируется иммунный ответ по типу первичного, во второй - по типу вторичного. Тяжелая форма ГЛД - шоковый синдром денге чаще всего развивается при заражении вторым типом вируса при инфицировании детей, перенесших денге, вызванную вирусами I, III или IV типа.
Меры профилактики
Профилактические мероприятия включают уничтожение комаров и обезвреживание мест их выплода. В случаях экстренной профилактики применяют специфический иммуноглобулин или иммуноглобулин из плазмы доноров, проживающих в эндемичных районах.
Патогенез
Заражение происходит при укусе инфицированным комаром. Первичная репликация вируса происходит в регионарных ЛУ и клетках эндотелия сосудов. В конце инкубационного периода развивается вирусемия, сопровождающаяся лихорадкой и интоксикацией. В результате вирусемии поражаются различные органы и ткани. Именно с органными поражениями связывают повторную волну лихорадки. Выздоровление связано с накоплением в крови комплементсвязывающих и вируснейтрализующих антител, которые сохраняются в течение нескольких лет.
При ГЛД, помимо клеток эндотелия, поражаются клетки макро-фагально-моноцитарной системы [моноциты, гистиоциты, звездчатые ретикулоэндотелиоциты (купферовские клетки)]. Это связано с феноменом иммунологического усиления, сущность которого состоит в том, что у лиц, имеющих антитела против вируса денге (чаще I, III или IV типов), в результате пассивного (дети до 1 года) или активного иммунитета (инфицированные другим типом вируса, чаще II) образуются циркулирующие иммунные комплексы «антиденге иммуноглобулин-вирус денге», которые связываются с Fc-рецепторами моноцитов. Вследствие этого происходит резкая активация его репликации, уровень вирусемии, по экспериментальным данным, возрастает более чем в 50 раз. Развивается генерализованная воспалительная реакция, сопровождающаяся активацией комплемента, резким повышением проницаемости сосудов микроциркуляторного русла, приводящим к плазморее со снижением объема циркулирующей крови, поступлением в кровоток тканевых факторов гемостаза, активацией системы гемостаза, развитием ДВС-синдрома с потреблением факторов гемостаза, приводящим к коагулопатии потребления, расстройствам микроциркуляции. Клинически эти процессы манифестируют геморрагическим синдромом и развитием шока.
Клиническая картина
Инфицирование вирусом денге может быть бессимптомным, а также протекать как недифференцируемая лихорадка, лихорадка денге или ГЛД.
Инкубационный период длится от 3 до 15 дней, чаще 5-8 дней. Различают классическую, атипичную ГЛД (без шокового синдрома денге и сопровождающуюся им).
ВОЗ предлагает следующую классификацию ГЛД (табл. 17-14).
| Степень | Клинические признаки | ||
|---|---|---|---|
ГЛД |
- |
I |
Лихорадка, сопровождающаяся неспецифическими симптомами. Единственное проявление геморрагии - положительный результат теста со жгутом (турникетная проба) |
II |
Симптомы I степени + спонтанные кровотечения (внутрикожные, из десен, желудочно-кишечные) |
||
Шоковый синдром денге |
III |
Симптомы II степени + циркуляторная недостаточность, выраженная частым и слабым пульсом, уменьшением пульсового давления или гипотензией, холодной и влажной кожей и возбуждением |
|
IV |
Симптомы III степени + глубокий шок, при котором невозможно определить АД (АД - 0) |
||
Классическая лихорадка денге начинается с кратковременного продромального периода. Во время него отмечают недомогание, конъюнктивит и ринит. Однако чаще продромальный период отсутствует, и болезнь начинается с озноба, быстрого повышения температуры до 38-41 °С, сохраняющегося в течение 3-4 дней (начальный период болезни). Больные жалуются на сильную головную боль, боли в глазных яблоках, мышцах, крупных суставах, позвоночнике, нижних конечностях. Это приводит к затруднению при любом движении, обездвиживает больного (название болезни происходит от английского «dandy» - медицинские носилки).
При тяжелом течении болезни наряду с сильной головной болью возможны рвота, бред, потеря сознания. Нарушается сон, ухудшается аппетит, во рту появляется горечь, резко выражена слабость и общее недомогание.
Уже с первого дня болезни изменяется внешний вид больного: лицо ярко гиперемировано, выражена инъекция сосудов склер, гиперемия конъюнктив. Часто на мягком нёбе появляется энантема. Язык обложен. Глаза прикрыты из-за светобоязни. Отмечается увеличение печени, периферических ЛУ. К концу 3-х суток или на 4-е сутки температура критически снижается до нормы. Период апирексии длится обычно 1-3 дня, затем температура повышается вновь до высоких цифр. У некоторых больных периода апирексии в разгар болезни не наблюдают. Характерный симптом - экзантема. Сыпь появляется обычно на 5-6-й день болезни, иногда раньше, сначала на грудной клетке, внутренней поверхности плеч, затем распространяется на туловище и конечности. Характерна пятнисто-папулезная сыпь, которая часто сопровождается зудом, оставляет после себя шелушение.
Общая продолжительность лихорадки - 5-9 дней. В гемограмме в начальном периоде - умеренный лейкоцитоз и нейтрофилез без сдвига формулы влево, позже - лейкопения, лимфоцитоз. Возможна протеинурия.
При атипичной лихорадке денге наблюдают лихорадку, анорексию, головную боль, миалгию, эфемерную сыпь, полиаденопатия отсутствует. Длительность болезни не превышает 3 сут.
Клиническая картина геморрагической лихорадки денге
Типичные случаи ГЛД характеризуются четырьмя главными клиническими признаками: высокой температурой, геморрагиями, гепатомегалией и недостаточностью кровообращения.
Болезнь начинается с внезапного сильного озноба, повышения температуры тела до 39-40 °С, головной боли, кашля, явлений фарингита. В отличие от классической денге миалгию и артралгию наблюдают редко. В тяжелых случаях быстро развивается прострация. Характерна выраженная гиперемия и одутловатость лица, блеск глаз, гиперемия видимых слизистых оболочек. Нередко отмечают скарлатиноподобную сыпь, в основном на разгибательных поверхностях локтевых и коленных суставов. В последующие 3-5 дней болезни появляется кореподобная пятнисто-папулезная или скарлатиноподобная сыпь на туловище, а затем - на конечностях и лице. Отмечают боли в эпигастральной области или по всему животу, сопровождающиеся многократной рвотой. Печень болезненна, увеличена. Через 2-7 дней температура тела часто снижается до нормального или гипотермического уровня, проявления болезни могут регрессировать, наступает выздоровление. При тяжелом течении состояние пациента ухудшается. Самый частый геморрагический признак - положительный тест со жгутом. У большинства больных возникают гематомы в местах инъекций. На коже появляются петехии, подкожные кровоизлияния, возможны кровотечения. Значительно снижается количество тромбоцитов, показатель гематокрита повышается на 20% и более. Характерно развитие гиповолемического шока.
В тяжелых случаях после нескольких дней высокой температуры состояние больного внезапно ухудшается. Во время падения температуры (между 3 и 7-м днем болезни) появляются признаки нарушения кровообращения: кожа становится холодной, покрывается цианотичными пятнами, часто встречается цианоз кожи вокруг рта и тахикардия. Больные беспокойны, жалуются на боль в животе. Некоторые больные заторможены, однако затем у них развивается возбуждение, после чего наступает декомпенсированная стадия шока. Состояние прогрессивно ухудшается. На лбу и в дистальных отделах конечностей появляется петехиальная сыпь, АД резко снижается, уменьшается его амплитуда, пульс нитевидный, усиливаются тахикардия и одышка. Кожа холодная, влажная, нарастает цианоз. На 5-6-й день возникает кровавая рвота, мелена, судороги. Продолжительность шока невелика. Больной может умереть в течение 12-24 ч или быстро выздоравливает после соответствующих противошоковых мероприятий. Выздоровление при ГЛД с шоком или без шока наступает быстро и протекает без осложнений. Благоприятный прогностический признак - восстановление аппетита.
У некоторых больных лихорадкой денге и ГЛД наблюдают признаки поражения ЦНС, такие как судороги, гиперкинезы и длительное нарушение сознания.
При исследовании крови выявляют тромбоцитопению, высокий показатель гематокрита, удлинение протромбинового (у одной трети пациентов) и тромбопластинового времени (у половины больных), гипофибриногенемию, появление в крови продуктов деградации фибрина, метаболический ацидоз. Почти всегда отмечают гемоконцентрацию (свидетельствует о потере плазмы), даже у больных без шока. Число лейкоцитов варьирует от лейкопении до небольшого лейкоцитоза. Часто выявляются атипичные лимфоциты.
К осложнениям относят шок, пневмонию, энцефалит, менингит, психоз, полиневрит.
Диагностика
Диагноз геморрагической формы денге по критериям ВОЗ устанавливают при наличии следующих симптомов: быстрое повышение температуры до 39-40 °С, сохраняющееся в течение 2-7 дней; появление признаков тромбогеморрагического синдрома (петехии, пурпура, кровоизлияния, кровотечения); увеличение печени; тромбоцитопения (менее 100×109 /л), повышение гематокрита на 20% и более; развитие шока.
Первые два клинических критерия в сочетании с тромбоцитопенией и гемоконцентрацией или повышенным уровнем гематокрита достаточны для постановки диагноза ГЛД. Необходимо также учитывать эпидемиологический анамнез (пребывание в эндемичной местности, укусы комарами).
Классическую форму денге диагностируют при наличии характерных симптомов: боль в суставах и мышцах, двухволновая лихорадка, сыпь, ЛАП, околоорбитальная и головная боль. При классической лихорадке денге могут возникать слабовыраженные проявления геморрагического диатеза, не отвечающие критериям ВОЗ. В этих случаях диагностируют лихорадку денге с геморрагическим синдромом, но не ГЛД.
Лабораторная диагностика: выделение вируса и обнаружение повышения титра антител к вирусу денге (в парных сыворотках крови в РСК, РТГА, РН-вирусов). Вирус в крови, плазме или клетках тканей может быть обнаружен в продромальный или лихорадочный период заболевания в течение первых 4-5 дней. Для выделения вирусов предпочтительно использование клеточных линий комаров - С6/36. В эти же сроки целесообразно использовать ПЦР. Серологические тесты значительно проще, и на их постановку уходит меньше времени. Однако возможны перекрестные реакции с другими флавивирусами. Это может быть причиной ложноположительных результатов. Диагноз лихорадки денге считается подтвержденным в случае обнаружения вируса денге в культуре, вирусной РНК ПЦР, сероконверсии IgM в парных сыворотках крови, или 4-кратного прироста титра IgG в парных сыворотках.
Дифференциальная диагностика
Классическую форму денге дифференцируют от гриппа, кори, флеботомной лихорадки.
Геморрагическую форму денге дифференцируют от менингококкемии, сепсиса, тропической малярии, лихорадки Чикунгунья и других ГЛ.
Лечение
Этиотропных средств лечения лихорадки денге нет. Все больные в зависимости от тяжести симптоматики делятся на 3 категории (А, В, С). В неосложненных случаях (категория А) проводится симптоматическая терапия в домашних условиях, включающая жаропонижающие препараты, борьбу с дегидратацией и наблюдение врача. В случаях появления «симптомов тревоги», болезни беременных, детей (категория В) лечение проводят в условиях стационара. Лечение тяжелых случаев лихорадки денге, связанных с развитием шока, геморрагиями и нарушением функции органов (категория С), проводится в ОРИТ. Высокая температура и рвота вызывают жажду и обезвоживание организма, поэтому больные должны пить как можно больше жидкости. При ГЛД без шока проводят регидратационную терапию, преимущественно пероральную. За больными необходимо тщательно наблюдать для выявления ранних признаков шока.
Больных немедленно следует госпитализировать при наличии симптомов шока.
Повышение гематокрита, развитие ацидоза - показания к парентеральному введению щелочных и полиионных растворов. При шоке показано введение свежезамороженной плазмы или плазмозаменителей. В большинстве случаев необходимо вводить не более 20-30 мл плазмы на 1 кг массы тела. Введение жидкости следует продолжать с постоянной скоростью (10-20 мл/кг в час) до явного улучшения дыхания, пульса и температуры. В качестве заменителя плазмы эффективен декстран (Декстран 40♠). Показана оксигенотерапия. Заместительную терапию прекращают при снижении гематокрита до 40%. Антибиотики назначают в случае присоединения бактериальных осложнений. При благоприятных условиях наступает полное выздоровление.
Прогноз при классической лихорадке денге обычно благоприятный, летальность при ГЛД - до 40%, при адекватной терапии - 5-10%. Наиболее высокая летальность у детей до 1 года.
Болезнь, вызванная вирусом Эбола
Болезнь, вызванная вирусом Эбола (БВВЭ, Ebola virus disease - EVD, ГЛ Эбола), - вирусная ГЛ человека и других приматов, вызванная представителями рода ebolaviruses, характеризующаяся высокой контагиозностью, тяжелым течением, развивающимся геморрагическим синдромом с показателями летальности, достигающими 90%.
Код по МКБ-10
А98.4.
Этиология
Вирус Эбола принадлежит к виду Ebolavirus рода Ebola семейства Filoviridae. Вирион имеет вид длинной нити. Наружный диаметр вирионов 70-100 нм, средняя длина 665 нм. Геном представлен одной молекулой одноцепочечной РНК, содержащей 7 генов, с молекулярной массой 4,0-4,2 МДа. В центре вириона располагается тяж диаметром 20 нм, который составляет основу цилиндрического спирального рибонуклеопротеида. Вирион имеет наружную липопротеиновую мембрану толщиной 20-30 нм, на поверхности которой располагаются шипы длиной 7-10 нм. Вирус содержит гликопротеин, который может оказывать прямое разрушающее действие на клетки сосудов, что является одной из причин геморрагического синдрома.
Для человека патогенны 4 из 5 известных вирусов Эбола: Бундибуджио вирус (BDBV), Судан вирус (SUDV), Тай форест вирус (TAFV), Эбола вирус (EBOV, бывший Заир Эбола). Последний (Заир) считается самым опасным по причине максимальной летальности и наиболее частой встречаемости. Пятый вирус, вирус Рестон (RESTV), не вызывает заболевания у людей. Все пять вирусов тесно связаны с семейством marburgviruses, но существующие антигенные отличия между ними обусловливают отсутствие перекрестных антигенных реакций.
Вирус Эбола имеет среднюю степень устойчивости в окружающей среде. Вирус способен выживать на абиотических предметах в течение нескольких часов в высушенном состоянии, а в биологических жидкостях организма вне человека - в течение нескольких дней. Гибнут при термической обработке в течение 30-60 мин при температуре 60 °С и в течение 5 мин - при кипячении. Для дезинфекции поверхностей используют жирорастворители, такие как некоторые спиртосодержащие продукты, моющие средства, гипохлорит натрия (отбеливатель) или гипохлорит кальция.
Эпидемиология
Вирус был выделен в районе реки Эбола в Заире. Вспышки БВВЭ происходят периодически в тропических регионах Африки к югу от Сахары. В марте 2014 г. в Западной Африке началась эпидемия БВВЭ, продолжавшаяся до 1916 г., распространившаяся на Либерию, Сьерра-Леоне, Гвинею. Зарегистрировано 28 575 случаев заболевания (летальность 39,6%).
Естественным резервуаром вируса Эбола являются некоторые виды плотоядных рукокрылых, которых часто ошибочно именуют «летучими мышами». К наиболее вероятным кандидатам в природные резервуары БВВЭ относят три вида плотоядных рукокрылых: Hypsignathus monstrosus, Epomops franqueti и Myonycteris torquata.
Помимо рукокрылых, источником возбудителя инфекции могут быть другие дикие животные, инфицированные вирусом Эбола.
Вирус Эбола передается при непосредственном контакте с биологическими жидкостями зараженного человека или животного. Передача вируса возможна также при прямом контакте с предметами, загрязненными биологическими жидкостями больных. Вирус могут содержать слюна, слизь, рвотные массы, кал, пот, слезы, грудное молоко, моча и сперма. Однако наибольшее значение в передаче вируса имеют кровь, фекалии и рвотные массы. Входными воротами вируса являются слизистые рта, носа, глаз, открытые раны, порезы и ссадины. Способствует передаче вируса контакт с поверхностями или объектами, зараженными вирусом, особенно инъекционным медицинским инструментарием (иглами и шприцами). После выздоровления у людей вирус может сохраняться в течение более чем 3 мес в сперме, что может привести к инфицированию половым путем. В периоде реконвалесценции отмечается также возможность присутствия вируса в грудном молоке кормящих матерей и слезной жидкости.
Особую опасность представляют трупы умерших от БВВЭ. 69% случаев заражения вирусом Эбола в Гвинее в 2014 г. произошло в результате контакта с инфицированными трупами во время похоронных ритуалов. Работники здравоохранения, осуществляющие уход за больными с БВВЭ, подвергаются наибольшему риску заражения. Была отмечена передача вируса при повторном использовании медицинского инъекционного инструментария.
Восприимчивость людей к вирусу Эбола высокая. После выздоровления формируется стойкий иммунитет. Частота повторных случаев заболевания не превышает 5%.
Меры профилактики
Люди, осуществляющие уход за больными БВВЭ, должны носить защитную одежду, включая маски, перчатки, халаты и очки. Эти же меры безопасности распространяются на лиц, участвующих в погребальных обрядах, бальзамировании тел умерших от БВВЭ и имеющих отношение к секционному материалу. Все оборудование, медицинские отходы, выделения пациента должны быть продезинфицированы. Отказ от прямого контакта с инфицированными людьми и регулярное мытье рук с помощью мыла и воды значительно снижают риск инфицирования. Приготовление пищи из мяса диких животных должно происходить с соблюдением тех же мер безопасности, что и при работе с больными БВВЭ. Мясопродукты должны быть подвергнуты достаточной для уничтожения вируса термической обработке.
В медицинских лабораториях, где проводятся диагностические тестирования, требуется соблюдение 4-го уровня биологической безопасности.
Для специфической профилактики БВВЭ российскими учеными в конце 2015 г. предложена генно-инженерная гетерологичная вакцина на основе двух векторов аденовируса шимпанзе и вируса везикулярного стоматита - «Гам-Эвак Комби». Клинические испытания указанной вакцины проведены в 2016-2017 гг. на территории Республики Гвинея.
Патогенез
Входными воротами вируса Эбола являются слизистые оболочки и поврежденные участки кожи. Клетками-мишенями являются клетки эндотелия сосудов, макрофаги, моноциты, дендритные клетки, гепатоциты. Дальнейшая репродукция вируса происходит в ЛУ. Оттуда вирус проникает в кровоток и разносится по всему организму. Вирус Эбола эффективно реплицируются во многих клетках: моноцитах, макрофагах, дендритных клетках, гепатоцитах, фибробластах и клетках надпочечников. Вирусная репликация инициирует высвобождение провоспалительных цитокинов и приводит к развитию системной воспалительной реакции.
Макрофаги являются первыми клетками, зараженными вирусом, и это заражение приводит к их апоптозу. Лимфоциты также подвергаются запрограммированной гибели, что приводит к аномально низкой их концентрации в крови. В этой связи у больных БВВЭ наступает вторичный иммунодефицит.
Эндотелиальные клетки могут быть инфицированы и повреждены в течение 3 дней после воздействия вируса. Массивные кровотечения при тяжелом течении болезни являются результатом ДВС и развитием коагулопатии потребления.
Полиорганные поражения развиваются вследствие вторичного иммунодефицита, обусловленного генерализованным разрушением клеток системы мононуклеарных фагоцитов (СМФ) и повреждением эндотелия капилляров, что приводит к нарушению метаболических процессов, гипоксии и ацидозу органов и тканей. Посмертно обнаруживают некротические изменения во всех органах и тканях, особенно выраженные в ЛУ, печени, селезенке.
Выздоровление сопровождается выработкой специфических антител к возбудителю, которые циркулируют минимум 10 лет, однако выполняют ли они протективную роль - неизвестно.
Клиническая картина
Инкубационный период составляет от 2 до 21 дней, чаще 4-10 дней.
Болезнь начинается остро. Появляется резкая слабость, лихорадка, снижение аппетита, миалгии, артралгии, головная боль и боль в горле. Лихорадка, как правило, выше, чем 38,3 °С, часто сопровождается рвотой, диареей и болью в животе. Характерны одышка, боль в груди, развитие энцефалопатии. На 5-7-й дни болезни у половины больных появляется макуло-папулезная сыпь. В эти же сроки возможно появление геморрагического синдрома, который характеризуется появлением подкожных геморрагий, петехий, гематом (особенно в местах инъекций), кровоизлияниями в склеры, кровохарканьем, рвотой «кофейной гущей», кишечными кровотечениями в виде мелены и/или свежей крови в стуле (при толстокишечных кровотечениях). Массивные желудочно-кишечные кровотечения служат неблагоприятным прогностическим признаком. В этом случае больные в последние дни жизни часто находятся в коме.
Госпитальная летальность в среднем около 50%.
Причиной летального исхода в большинстве случаев является ИТШ и/или гиповолемический дегидратационный шок, который наступает, как правило, через 6-16 дней от начала заболевания. В случаях выздоровления длительно сохраняются миалгии и артралгии, слабость, гепатомегалия, снижение зрения и слуха.
Диагностика
При диагностике учитывают эпидемиологические сведения: пребывание в местностях с природными очагами БВВЭ, контакт и уход за больными БВВЭ, отлов, обработка, приготовление и употребление в пищу животных из природных очагов. При сочетании этих данных с лихорадкой, головной болью, рвотой, слабостью, диареей, миалгиями и присоединением геморрагического синдрома, осложнений и признаков полиорганного поражения следует исключать БВВЭ.
Лабораторная диагностика. Неспецифическими изменениями при БВВЭ являются тромбоцитопения, первоначальная лейкопения с последующим лейкоцитозом, повышение активности трансфераз (АЛТ, АСТ) ДВС-синдром.
Специфическая диагностика. Изоляция вируса на культуре клеток, обнаружение вирусной РНК методом ПЦР и вирусных антигенов с помощью ИФА используются на ранних стадиях заболевания, а также для обнаружения вируса в трупном материале. Обнаружение антител против вируса является наиболее надежным в поздних стадиях заболевания и у реконвалесцентов. Антитела класса IgM могут быть обнаружены через 2 дня после появления симптомов, а IgG-антитела могут быть обнаружены от 6 до 18 дней после появления первых симптомов. В 2014 г. был предложен для использования экспресс-тест, который дает результат в течение 15 мин с достоверностью 92%.
Дифференциальная диагностика
Ранние симптомы БВВЭ могут быть схожи с другими заболеваниями, распространенными в Африке, в том числе с малярией и лихорадкой денге. Сходную клиническую симптоматику имеет ГЛ Марбурга. Полная дифференциальная диагностика требует учета множества других инфекционных заболеваний, таких как брюшной тиф, дизентерия, риккетсиозы, холера, сепсис, боррелиоз, лептоспироз, сыпной тиф, чума, трипаносомоз. Неинфекционные заболевания, требующие проведения дифференциальной диагностики с БВВЭ, включают острый лейкоз, гемолитико-уремический синдром, тромботическую тромбоцитопеническую пурпуру, наследственную геморрагическую телеангиэктазию, болезнь Кавасаки.
Лечение
Лечение проводят в условиях инфекционного стационара и режима строгой изоляции.
Специфического этиотропного лечения БВВЭ не существует.
Патогенетическая терапия направлена на борьбу с интоксикацией, дегидратацией, коррекцией нарушений в системе гемостаза, поддержкой функций жизненно важных органов и систем. Наряду с гемодилюцией и форсированием диуреза требуется коррекция кислотно-основного состояния крови и контроль объема циркулирующей крови. Регидратационная терапия предполагает инфузионное введение полиионных растворов. В целях коррекции нарушений в системе гемостаза и профилактики ДВС-синдрома используются тромбоцитарная масса, свежезамороженная плазма, низкомолекулярные препараты гепарина, варфарин. При развитии ОПН показана ультрафильтрация плазмы.
В качестве средств симптоматической терапии применяют болеутоляющие, противорвотные средства, транквилизаторы. Не рекомендуется применение аспирина или НПВС.
Случаи выздоровления у части больных осложняются развитием орхита, выпадением волос, шелушением кожи, снижением остроты зрения, слезотечением, фотофобией, артралгией, миалгией. В связи с этим продолжительность нетрудоспособности может достигать 3 мес.
Геморрагическая лихорадка Марбург
ГЛ Марбург - острая зоонозная эндемическая вирусная инфекционная болезнь, проявляющаяся интоксикацией, универсальным васкулитом, поражением ЖКТ, печени, почек. Относится к особо опасным инфекционным болезням.
Код по МКБ-10
A98.3 Болезнь, вызванная вирусом Марбург.
Этиология
Возбудитель - Marburgvirus рода Marburgvirus семейства Filoviridae. Вирусные частицы полиморфные (нитевидной, спиралевидной или округлой формы) длиной в среднем 790 нм и диаметром 80 нм. Содержат негативную однонитевую РНК, липопротеин. В состав вириона входит 7 белков. Белковый состав вируса Марбург близок к родственному ему филовирусу Эбола. Штаммоспецифические антигены сосредоточены в области поверхностного белка гликопротеида (GР), а группоспецифический антиген - в области белка нуклео-протеида (NP). Вирус выделяют и пассируют in vitro в перевиваемых культурах клеток почки зеленой мартышки (Verо) и in vivo на морских свинках. Репликация происходит в цитоплазме пораженных клеток. Вирус обладает средней устойчивостью к факторам внешней среды, при комнатной температуре сохраняет вирулентность длительное время. Инактивировать можно при нагревании до 60 °С в течение 30 мин и с помощью органических растворителей [этанола (Этиловый спирт♠), хлороформа].
Эпидемиология
Ареал распространения вируса - центральная и западная территории Экваториальной Африки, а также юг континента.
По официальным данным ВОЗ, за период с 1967 по 2014 г. выявлено 588 случаев заболевания, из которых 478 закончились летальным исходом. За период с 2005 г. по первую половину 2015 г. отмечено два эпизода заноса болезни в США и Нидерланды туристами, посетившими пещеры в Уганде.
Летучие мыши рода Rousettus (нильский крылан или египетская летучая собака) рассматриваются предположительно как природный резервуар вируса. Источником возбудителя для человека являются обезьяны, в частности африканские зеленые мартышки Cercopithecus aethiops. Механизмы передачи возбудителя: аэрозольный, артифициальный. Пути передачи: воздушно-капельный, контактный, инъекционный. Вирус содержится в крови, носоглоточной слизи, моче и сперме (до 3 мес). Заражение людей происходит при прямом контакте с кровью и органами обезьян, также через поврежденную кожу (при уколах, порезах), при попадании вируса на конъюнктивы. Больной человек контагиозен для окружающих. Описан случай передачи возбудителя половым путем.
Восприимчивость людей к вирусу Марбург высокая. Постинфекционный иммунитет длительный. Сведения о повторных заболеваниях отсутствуют. Сезонность и периодичность вспышек не выявлены.
Меры профилактики. Профилактика состоит в выявлении и изоляции больных в боксах, перевозке больных в транспортных изоляторах, использовании индивидуальных средств личной защиты от заражения при работе с больными, выполнении рекомендаций ВОЗ по завозу обезьян и работе с ними. Для экстренной профилактики применяют специфический иммуноглобулин.
Патогенез
Входные ворота вируса - поврежденная кожа, слизистые оболочки ротовой полости и глаз. Первичная репликация вируса происходит в клетках моноцитарно-макрофагальной системы. Затем развивается вирусемия, сопровождаемая подавлением функций иммунной системы и генерализованными нарушениями микроциркуляции, что приводит к возникновению ДВС-синдрома и полиорганным поражениям. В головном мозге, легких, миокарде, почках, печени, селезенке, надпочечниках, половых и других органах обнаруживают очаги некрозов и кровоизлияний. Самые обширные некрозы отмечаются в печени и лимфатической системе. В легких наблюдают интерстициальный пневмонит, в мелких артериолах - эндартериит. Нейропатологические изменения включают множественные мелкие геморрагические инфаркты с пролиферацией нейроглии.
Клиническая картина. Инкубационный период 3-16 сут.
Начало болезни острое. Характерны: высокая лихорадка в течение 2 нед, выраженная интоксикация, головная боль, миалгии, боли в пояснично-крестцовой области. При осмотре выявляют конъюнктивит, энантему, везикулезно-эрозивные изменения слизистой оболочки ротовой полости, брадикардию. Тонус мышц повышен, пальпация их болезненна. С 3-4-х суток возникают рвота и водянистая диарея, приводящие к быстрому обезвоживанию. На 5-6-е сутки возможно появление макуло-папулезной сыпи с последующим шелушением кожи. С 6-7-х суток выявляют геморрагические проявления в виде кожных геморрагий, носовых, желудочно-кишечных и других кровотечений, а также гепатит, миокардит, поражение почек. Для поражения ЦНС характерны адинамия, заторможенность и менингизм. В конце первой недели возможно развитие ИТШ. Ухудшение состояния больных наступает на 8-10-е сутки и на 15-17-е сутки течения заболевания (иногда заканчивающееся летально).
В периоде реконвалесценции, продолжающемся 3-4 нед, возможна длительная диарея, выраженная астенизация, психические расстройства, выпадение волос.
При исследовании крови отмечают лейкопению с относительным нейтрофилезом, анемию с анизо- и пойкилоцитозом, тромбоцитопению, признаки ДВС-синдрома, гиперкреатининемию, гиперазотемию, декомпенсированный ацидоз, в моче - протеинурию.
Осложнения. Гепатит, миокардит, орхит с атрофией яичка, шок, поперечный миелит, увеит; реже - пневмония и психозы.
Летальность около 25%, но может достигать 50%. Причины смерти: отек легких и мозга, гиповолемический шок, ИТШ, ОПН, ДВС-синдром.
Диагностика
Клиническая диагностика затруднена из-за отсутствия патогномоничных симптомов. Диагностическое значение имеет следующее сочетание: острое начало заболевания, тяжелое течение, наличие везикулезно-эрозивных изменений слизистой оболочки полости рта, геморрагический синдром, экзантема, рвота, диарея, обезвоживание, поражение ЦНС. Основное значение имеют эпидемиологические данные (пребывание в местностях с природными очагами лихорадки Марбург, работа с тканями африканских мартышек, контакт с больными).
Неспецифическая лабораторная диагностика включает общий (выявляют анемию, анизоцитоз, пойкилоцитоз, базофильную зернистость эритроцитов, лейкопению, сдвиг нейтрофильной формулы влево, атипичные лимфоциты, тромбоцитопению), биохимический анализ крови (гипопротеинемия, повышена активность аминотрансфераз, амилазы, азотемия), коагулограмму (выражена гипокоагуляция) и определение кислотно-основного состояния крови (декомпенсированный метаболический ацидоз); общий анализ мочи (протеинурия).
Специфическую лабораторную диагностику осуществляют с использованием ПЦР, РНИФ, ИФА (ELISA), РН, РСК и др. У умерших вирус обнаруживают при электронной микроскопии или с помощью РНИФ. Все исследования проводят в лаборатории с максимальным уровнем защиты.
Лихорадку Марбург дифференцируют других ГЛ, лептоспироза, тифопаратифозных заболеваний, малярии, сепсиса, кори, менингококковой инфекции.
Лечение
Больные с подозрением на лихорадку Марбург подлежат обязательной экстренной госпитализации и строгой изоляции.
Необходим строгий постельный режим и круглосуточное медицинское наблюдение.
Стол № 4 без ограничения количества белков и поваренной соли.
Этиотропное лечение не разработано.
Патогенетическое лечение направлено на борьбу с обезвоживанием, ИТШ, геморрагическим синдромом. Есть данные об эффективности сыворотки реконвалесцентов, плазмафереза и больших доз ИФН.
Летальность - 25%, смерть наступает обычно на 8-17-е сутки заболевания. Период реконвалесценции затяжной, 3-4 нед.
Геморрагическая лихорадка Ласса
ГЛ Ласса - острая зоонозная природно-очаговая вирусная инфекционная болезнь с различными механизмами передачи возбудителя, характеризующаяся развитием геморрагического синдрома, язвенно-некротического фарингита, пневмонии, миокардита, поражением почек и высокой летальностью.
Код по МКБ-10
A96.2 Лихорадка Ласса.
Этиология
Возбудитель - Lassa virus рода Arenavirus семейства Arenaviridae; относят к комплексу аренавирусов Старого Света LChM/Lassa. Вирус имеет капсид сферической формы, с диаметром частиц 50-300 нм, покрытый липидной оболочкой, включающей гликопротеины (G1 и G2). Нуклеокапсид состоит из белка (N) и РНК, два фрагмента которой (L и S) кодируют синтез компонентов вириона в инфицированной клетке. Вирус устойчив к окружающей среде. Инфекционность вируса в сыворотке крови и слизистых секретах без специальной обработки не снижается в течение длительного времени, инактивируется жировыми растворителями (эфир, хлороформ и др.).
Эпидемиология
Лихорадка Ласса распространена в странах Западной и Центральной Африки. География распространения болезни продолжает расширяться за счет вовлечения в эпидемический процесс новых территорий. В странах Западной Африки, по оценочным данным ВОЗ, ежегодно отмечено от 200 тыс. до 500 тыс. случаев лихорадки Ласса, из которых около 5 тыс. заканчивается летальным исходом. Возможен завоз лихорадки Ласса в неэндемичные страны и возникновение там очага заболевания при контактной передаче возбудителя.
Источник и резервуар возбудителя - многососковая крыса (Masto-mysnatalensis), обитающая в большинстве стран Африки вблизи жилья человека. Вирус также выделен и от других африканских грызунов (M. erythroleucus, M. huberti). Животные выделяют вирус в окружающую среду с экскретами и слюной.
Механизмы передачи возбудителя: аэрозольный, фекально-оральный. Пути передачи: воздушно-капельный, пищевой, водный, контактный. Факторы передачи: пищевые продукты, вода, а также предметы, загрязненные мочой грызунов. Заражение людей в природных очагах может происходить при вдыхании аэрозоля, содержащего экскреты грызунов; употреблении воды из инфицированных источников; недостаточно термически обработанного мяса зараженных животных.
Больной человек представляет большую опасность для окружающих. Основной фактор передачи - кровь, однако вирус содержится и в экскретах больного. Заражение при этом происходит воздушно-капельным, контактным и половым путями. Выделение вируса больными может продолжаться до месяца и более. Заражение происходит через микротравмы при попадании на кожу крови или выделений больного. Зарегистрированы случаи заболеваний медицинского персонала при использовании инструментов, контаминированных возбудителем, проведении хирургических операций и вскрытии трупов.
Передача возбудителя от человека человеку аэрогенным путем ведет к появлению вторичных внутрисемейных вспышек, а также к возникновению нозокомиальных вспышек, сопровождающихся высокой летальностью. Восприимчивость высокая. Постинфекционный иммунитет напряженный и длительный, повторные случаи заболевания не описаны. В эндемичных районах антитела выявляют у 10-15% населения, что свидетельствует о возможности бессимптомного или легкого течения заболевания.
Меры профилактики
Специфическая профилактика не разработана.
Неспецифическая профилактика состоит в защите помещений от проникновения грызунов и дератизационных мероприятиях в природных очагах. Медицинский персонал обязан работать в защитной одежде, респираторах или марлевых масках, перчатках, очках. Рекомендована строгая изоляция больных (желательно в специальные пластиковые или стеклянно-металлические кабины с автономным жизнеобеспечением) на срок не менее 30 сут от начала заболевания. Наблюдение за лицами, контактировавшими с больными, продолжают в течение 17 сут. Проводят заключительную дезинфекцию. Для экстренной профилактики применяют рибавирин (внутрь по 0,2 г 4 р/сут в течение 10 сут). Проводят карантинные мероприятия в отношении лихорадящих больных, прибывших из стран Центральной и Западной Африки.
Патогенез
Входные ворота возбудителя - слизистые оболочки органов дыхания и пищеварения, поврежденная кожа. После первичной репликации вируса в лимфоидных элементах в месте внедрения развивается вирусемия с поражением многих органов и систем. Вирус вызывает некротические изменения в клетках печени, селезенки, миокарда, почек, надпочечников, эндотелия мелких сосудов, что и определяет клинические проявлении болезни. В тяжелых случаях вследствие цитопатического эффекта вируса и клеточных иммунных реакций повреждение эндотелиальных клеток в сочетании с нарушением функций тромбоцитов приводит к повышенной проницаемости сосудистой стенки. Возникают глубокие расстройства гемостаза с развитием ДВС-синдрома, коагулопатии потребления.
Наиболее характерным гистологическим изменением при лихорадке Ласса является мультиочаговый некроз гепатоцитов. В почках характерен тубулярный и гломерулярный некроз. Селезенка уплотнена, обнаруживают атрофию белой пульпы, инфильтрацию интимы селезеночных вен лимфоидными клетками. В ЛУ лимфоидное истощение и дегенерация, эритрофагоцитоз. В слизистой оболочке ЖКТ - признаки воспаления и петехии.
Клиническая картина
Инкубационный период длится 3-21 сут, чаще 7-14 сут. Общепринятой классификации не существует. Выделяют: легкое, среднетяжелое и тяжелое течение болезни.
Начало болезни подострое или постепенное. Появляются общее недомогание, умеренные мышечные и головные боли, невысокая лихорадка, конъюнктивит. В этом периоде у большинства больных развивается характерный язвенно-некротический фарингит, а также увеличение шейных ЛУ. К концу первой недели температура тела достигает 39-40 °С; нарастают симптомы интоксикации; присоединяются тошнота, рвота, боли в грудной клетке и животе; развивается диарея, приводящая к дегидратации. Со второй недели возможно появление пятнисто-папулезной сыпи; у большинства больных геморрагические явления (подкожные кровоизлияния, носовые, легочные, маточные и другие кровотечения). Характерны брадикардия, артериальная гипотензия; возможно снижение слуха, появление судорог и очаговых неврологических симптомов. При неблагоприятном течении болезни выявляют отечность лица и шеи, свободную жидкость в плевральной и брюшной полостях, нарастает геморрагический синдром. В тяжелых случаях смерть наступает на 7-14-е сутки. У выживших больных через 2-4 нед температура тела литически снижается. Выздоровление медленное. В течение нескольких недель сохраняется общая слабость, в ряде случаев происходит выпадение волос и развивается глухота; возможны рецидивы заболевания.
Осложнения. Пневмония, миокардит, ОПН, шок, острый психоз.
Летальность составляет 30-50% и выше (особенно высока у беременных в III триместре). Причины смерти: ИТШ и гиповолемический шок, ОПН, геморрагический синдром.
Клиническая диагностика лихорадки Ласса затруднена из-за отсутствия специфических симптомов. Наибольшее диагностическое значение имеют: подострое начало, сочетание лихорадки, язвенного фарингита, гастроэнтерита, геморрагического синдрома и почечной недостаточности, отек лица и шеи (в тяжелых случаях). Большое значение имеют эпидемиологические данные (пребывание в эндемическом очаге, контакт с грызунами, лихорадящими больными). При исследовании крови лейкопения со сменой на лейкоцитоз, сдвиг нейтрофильной формулы влево, тромбоцитопения, повышенная СОЭ; гипопротеинемия; повышение активности аминотрансфераз, азотемия, гипокоагуляция, декомпенсированный метаболический ацидоз. При исследовании мочи протеинурия, гематурия, цилиндрурия.
Специфическая диагностика
В клинической практике используют ПЦР, ИФА (ELISA) и РНИФ. Диагноз подтверждают серологически (при возрастании титров антител к вирусу Ласса в 4 раза и больше). По рекомендации ВОЗ при наличии у лихорадящих больных в эндемичных регионах антител класса IgG в титрах 1:512 и выше с одновременным выявлением антител класса IgM ставят предварительный диагноз «лихорадка Ласса». Постановка РСК имеет ретроспективное значение.
Дифференциальную диагностику проводят с заболеваниями, протекающими с длительной лихорадкой (брюшной и сыпной тиф, сепсис, малярия), диареей (вирусные диареи), геморрагическим синдромом (другие ГЛ), лептоспирозом, герпангиной, стрептококковым фарингитом, дифтерией, пневмонией.
Лечение
Все больные подлежат госпитализации и строгой изоляции в инфекционных специализированных отделениях не менее чем на 30 дней от начала болезни.
Больной нуждается в строгом постельном режиме и круглосуточном медицинском наблюдении. Диета - стол № 4.
Медикаментозное лечение. Противовирусное лечение проводят внутривенным введением рибавирина в течение 10 сут (начальная доза препарата - 2 г, затем по 1 г каждые 6 ч в течение 4 сут и по 0,5 г каждые 8 ч в последующие 6 сут). В ранние сроки заболевания в ряде эндемичных регионов применяют плазму реконвалесцентов.
Патогенетическое лечение направлено на борьбу с шоком, геморрагическим синдромом, сердечной и ДН, а также на проведение дезинтоксикационных мероприятий и инфузионной регидратации солевыми растворами. Антибиотики применяют при бактериальных осложнениях.
При тяжелом течении заболевания летальность до 50% и выше. При легком и среднетяжелом течении прогноз благоприятный. Период реконвалесценции затяжной.
Лихорадка Западного Нила
ЛЗН (энцефалит Западного Нила) - острая вирусная зоонозная природно-очаговая болезнь с трансмиссивным механизмом передачи возбудителя. Характеризуется острым началом, выраженным ЛИС и поражением ЦНС.
Код по МКБ-10
А92.3.
Этиология
Вирус ЛЗН принадлежит роду Flavivirus семейства Flaviviridae и относится к арбовирусам. Геном представлен однонитевой РНК.
Репликация вируса происходит в цитоплазме пораженных клеток. Вирус ЛЗН обладает значительной способностью к изменчивости. Наибольшая изменчивость характерна для генов, кодирующих белки оболочки, ответственные за антигенные свойства вируса и его взаимодействие с мембранами тканевых клеток, с которыми связана вирулентность штамма. Штаммы вируса ЛЗН, выделенные в различных странах и в различные годы, имеют генетические различия и обладают различной вирулентностью. Группа «старых» штаммов ЛЗН, выделявшихся в основном до 1990 г., не связана с тяжелыми поражениями ЦНС. Группа «новых» штаммов, в частности Волгоград-1999, связана с заболеваниями человека, протекающими с поражением ЦНС.
Эпидемиология
Резервуар вируса - птицы водно-околоводного комплекса, переносчик - комары, в первую очередь орнитофильные комары рода Culex. Между ними происходит циркуляция вируса в природе, они определяют возможный ареал распространения ЛЗН - от экваториальной зоны до регионов с умеренным климатом. В настоящее время вирус ЛЗН выделен более чем от 40 видов комаров. Значение конкретных видов комаров в эпидемическом процессе, протекающем на определенной территории, не выяснено. Работами российских ученых установлена зараженность аргасовых и иксодовых клещей в природных очагах ЛЗН.
Дополнительную роль в сохранении и распространении вируса играют синантропные птицы. Роль переносчика в этих случаях играют городские популяции комаров, размножающиеся во влажных подвальных помещениях. Вспышка ЛЗН в 1999 г. в Нью-Йорке сопровождалась массовым падежом ворон и гибелью экзотических птиц в зоопарке; в 2000-2010 гг. эпизоотия распространилась на всю территорию США, часть Канады, Мексики, Аргентину. Вместе с «городскими» орнитофильными и антропофильными комарами домашние и городские птицы могут формировать антропургический очаг ЛЗН.
Описаны заболевания млекопитающих, в частности эпизоотии лошадей (от десятков до тысяч случаев).
В США в 2002-2010 гг. отмечали случаи заражения ЛЗН реципиентов крови и органов. С начала XXI в. ЛЗН стала эндемичной в 20 странах Европы с теплым и умеренным климатом, в 28 регионах РФ - от Калужской области до Алтайского края.
В странах с умеренным климатом болезнь имеет выраженную сезонность. В северном полушарии заболеваемость отмечается с конца июля, достигает максимума в конце августа - начале сентября и прекращается к октябрю-ноябрю.
Восприимчивость человека к ЛЗН высокая, но преобладает субклиническое течение инфекции. Перенесенная болезнь оставляет после себя выраженный иммунитет.
Профилактика
Специфическая профилактика не разработана. Мероприятия по профилактике ЛЗН направлены на снижение численности комаров, что достигается проведением обработок мест выплода комаров в городской черте и на прилегающих территориях, а также на территориях вблизи загородных баз отдыха, профилакториев, детских лагерей. Подлежат дезинсекционной обработке подвалы жилых и общественных зданий в городской и сельской местности.
Меры неспецифической индивидуальной профилактики сводятся к применению в эпидемический период (июнь-октябрь) репеллентов и одежды, защищающей от укусов комаров. В эндемичных регионах особое значение имеет санитарно-просветительская работа среди населения.
Патогенез
Первичная репликация вируса происходит в месте укуса комаров в различных клетках, затем вирус реплицируется в ЛУ и проникает в кровь, вызывая поражение эндотелия сосудов и микроциркуляторные расстройства, в части случаев - развитие тромбогеморрагического синдрома. Вирусемия кратковременна и неинтенсивна. Ведущее в патогенезе болезни - поражение оболочек и вещества мозга, приводящее к развитию менингеального и общемозгового синдромов, очаговой симптоматики. Смерть наступает, как правило, на 7-28-й день болезни вследствие нарушения жизненно важных функций из-за ОНГМ с дислокацией стволовых структур, некрозом нейроцитов, кровоизлияниями в ствол мозга.
На аутопсии обнаруживают отек и полнокровие оболочек мозга, мелкоочаговые периваскулярные кровоизлияния, крупные геморрагии (до 3-4 см в диаметре), расширение желудочков мозга, полнокровие сосудистого сплетения, множественные очаги размягчения в полушариях мозга, мелкоточечные кровоизлияния в дно IV желудочка, дислокацию ствола мозга. При микроскопическом исследовании определяют васкулиты и периваскулиты оболочек мозга, очаговый энцефалит с образованием мононуклеарных инфильтратов. В сосудах головного мозга - картина полнокровия и стаза, фибриноидное набухание и некроз сосудистой стенки. В ганглиозных клетках - выраженные дистрофические изменения вплоть до некроза, выраженный периваскулярный и перицеллюлярный отек. Со стороны сердца обнаруживают дряблость мышцы, стромальный отек, дистрофию миоцитов, участки фрагментации мышечных волокон и миолиза. В почках - дистрофические изменения. У части больных определяют признаки генерализованного тромбогеморрагического синдрома.
Вирус обнаруживают методом ПЦР в СМЖ, тканях головного мозга, почках, сердце, в меньшей степени - в селезенке, ЛУ, печени.
Клиническая картина
Инкубационный период от 2 дней до 3 нед, чаще 3-8 дней. Болезнь начинается остро с повышения температуры тела до 38-40 °С, а иногда и выше в течение нескольких часов. Повышение температуры сопровождается выраженным ознобом, интенсивной головной болью, болью в глазных яблоках, иногда рвотой, болями в мышцах, пояснице, суставах, резкой общей слабостью. Интоксикационный синдром выражен даже в случаях, протекающих с кратковременной лихорадкой, причем после нормализации температуры длительно сохраняется астения. Наиболее характерные симптомы ЛЗН, вызванной «старыми» штаммами вируса, помимо перечисленных, - склерит, конъюнктивит, фарингит, полиаденопатия, сыпь, гепатолиенальный синдром. Нередки диспепсические расстройства (энтерит без болевого синдрома). Поражение ЦНС в виде менингита и энцефалита встречается редко. В целом течение болезни доброкачественное.
Картина болезни, вызванной «новыми» штаммами вируса, существенно отличается от вышеописанной. Ю.Я. Венгеровым и А.Е. Платоновым (2000) на основании наблюдений и серологических исследований предложена клиническая классификация ЛЗН (табл. 17-15). Субклиническую инфекцию диагностируют при скрининговых исследованиях населения по наличию антител класса IgM или нарастанию титра антител класса IgG в 4 и более раз. Гриппоподобная форма не имеет клинической специфики.
| Форма | Степень тяжести | Диагностика | Исход |
|---|---|---|---|
Субклиническая |
Скрининг на наличие антител класса IgM или нарастание титра антител класса IgG |
||
Гриппоподобная |
Легкая |
Эпидемиологическая, серологическая |
Выздоровление |
Гриппоподобная с нейротоксикозом |
Среднетяжелая |
Эпидемиологическая, клиническая, ПЦР, серологическая |
Выздоровление |
Менингеальная |
Среднетяжелая, тяжелая |
Эпидемиологическая, клиническая, ликворологическая, ПЦР, серологическая |
Выздоровление |
Менингоэнцефалическая |
Тяжелая, очень тяжелая |
Эпидемиологическая, клиническая, ликворологическая, ПЦР, серологическая, МРТ |
Летальность до 50% |
При гриппоподобной форме с нейротоксикозом на 3-5-й день болезни происходит резкое ухудшение состояния, что выражается усилением головной боли, появлением тошноты, рвоты, мышечного тремора, атаксии, головокружения и других симптомов поражения ЦНС. Лихорадка в этих случаях высокая, длительностью 5-10 сут. Классическую симптоматику - склерит, конъюнктивит, диарею, сыпь - наблюдают в единичных случаях. Более чем у половины больных определяют менингеальный синдром, в части случаев - повышение АД. При исследовании СМЖ, помимо повышения ЛД, изменений нет.
У пациентов с менингеальной формой болезни менингеальные симптомы нарастают в течение 2-3 дней. Выражена общемозговая симптоматика, отмечают преходящие очаговые симптомы. Наиболее характерны: ступор, мышечный тремор, анизорефлексия, нистагм, пирамидные знаки. СМЖ вытекает под повышенным давлением. Цитоз варьирует в пределах - от 15 до 1000 клеток в 1 мкл (в большинстве случаев 200-300 клеток в 1 мкл) и носит чаще смешанный характер. При исследовании в первые 3-5 дней болезни у части больных цитоз нейтрофильный (до 90% нейтрофилов). Смешанный цитоз сохраняется нередко до 2-3 нед, что, по-видимому, связано с наличием некроза значительной части нейроцитов. Этим объясняется и более медленная санация СМЖ, нередко затягивающаяся до 3-4-й нед болезни. Количество белка в пределах 0,45-1,0 г/л, содержание глюкозы - у верхних границ нормы или повышено. Течение болезни доброкачественное, продолжительность лихорадки 12 сут, менингеальные симптомы регрессируют в течение 3-10 сут. После нормализации температуры сохраняются слабость, повышенная утомляемость.
Менингоэнцефалическая форма болезни протекает наиболее тяжело, летальность близка к 50%. Начало болезни бурное, гипертермия и интоксикация с первых дней болезни. Менингеальные симптомы выражены слабо или умеренно. С 3-4-го дня нарастают общемозговые симптомы: спутанность сознания, возбуждение, бред, сопор, в части случаев переходящий в кому. Часто отмечают судороги, парезы черепных нервов, нистагм, реже - парезы конечностей, в наиболее тяжелых случаях доминируют дыхательные расстройства, центральные нарушения гемодинамики. Летальность до 50%. У выздоровевших нередко сохраняются парезы, мышечный тремор, длительная астения. Плеоцитоз СМЖ от 10 до 300 клеток в 1 мкл, содержание белка достигает 0,6-2,0 г/л.
Картина крови характеризуется преобладанием лейкоцитоза, нейтрофилеза без сдвига влево, отмечается лимфопения, увеличение СОЭ. В моче - протеинурия, цилиндрурия, лейкоцитурия.
Летальность среди госпитализированных больных составляет около 4-5%, что позволяет отнести ЛЗН к тяжелым (опасным) вирусным нейроинфекциям.
Диагностика
Клиническая диагностика спорадических случаев ЛЗН проблематична. В эндемичном для ЛЗН регионе с умеренным климатом всякий случай гриппоподобного заболевания или нейроинфекции в июне-октябре подозрителен на ЛЗН, но может быть диагностирован только с использованием лабораторных тестов. Во время вспышек диагноз может быть поставлен со значительной степенью достоверности на основании клинико-эпидемиологических данных: связи заболевания с укусами комаров, выездами за город, проживанием вблизи открытых водоемов, отсутствия повторных случаев заболеваний в очаге и связи заболевания с употреблением пищевых продуктов, воды из открытых водоемов, наличия в доме проживания подвалов, населенных комарами.
Вирус ЛЗН может быть выделен из проб крови и, реже, СМЖ, взятых у больных в острый период болезни, как правило, до 5-го дня от начала заболевания.
В те же сроки возможно обнаружение РНК вируса с помощью ПЦР.
В настоящее время в практике наибольшее применение получил ИФА, позволяющий обнаружить антитела к вирусу класса IgM и IgG. Ранние антитела класса IgM определяют в первые дни болезни, и их титры достигают очень высокого уровня через 1-2 нед от начала заболевания. Для серологической диагностики необходимо взять две пробы крови: первая проба - в острый период болезни до 7-го дня от начала заболевания; вторая проба - через 2-3 нед после взятия первой.
Дифференциальная диагностика
Дифференциальную диагностику проводят в зависимости от клинической формы ЛЗН с гриппом, менингитами другой этиологии, с герпетическим энцефалитом, риккетсиозами, малярией.
Лечение. Госпитализация производится по клиническим показаниям: гипертермия 40 °С и выше, наличие менингеальной, общемозговой и очаговой неврологической симптоматики.
В остром периоде болезни режим постельный.
Специальной диеты не требуется. При расстройствах сознания, бульбарных нарушениях показано зондовое или зондово-парентеральное питание.
Медикаментозная терапия. Для борьбы с церебральной гипертензией и ОНГМ применяют фуросемид взрослым 20-60 мг в сутки, поддерживают нормальный объем циркулирующей крови. При нарастании симптомов ОНГМ назначают однократно маннитол в дозе 0,5 г/кг массы тела в 10% растворе, вводить быстро в течение 10 мин, с последующим введением 40 мг фуросемида в/в, назначают дексаметазон (Дексазон♠) в дозе 0,25-0,5 мг/кг в сутки в течение 2-4 сут. Дезинтоксикацию и компенсацию потерь жидкости осуществляют путем внутривенных инфузий полиионных растворов, поляризующей смеси и коллоидных растворов [10% раствор альбумина человека (Альбумина♠), криоплазма, декстран [ср. мол. масса 30 000-50 000] + маннитол + натрия хлорид (Реоглюман♠)] в соотношении 2:1. Оптимальный суточный объем вводимой жидкости, включая пероральное и зондовое введение, - 3-4 л для взрослых и 100 мл/кг массы тела для детей.
Для борьбы с гипоксией используют ингаляции кислорода. Больных переводят на ИВЛ по следующим показаниям - одышка (ЧД в два раза и более выше нормы), стойкая гипоксемия (РаО2 менее 70 мм рт.ст.), гипокапния (РаСО2 менее 25 мм рт.ст.) или гиперкап-ния (РаСО2 более 45 мм рт.ст.), кома, генерализованные судороги. Проводят коррекцию электролитных нарушений и осмолярности крови.
По индивидуальным показаниям назначают противосудорожные, седативные препараты, антиоксиданты, средства, улучшающие мозговой кровоток (пентоксифиллин), при наличии вторичных бактериальных осложнений - антибиотики.
Выписку больных осуществляют после стойкой нормализации температуры, регресса неврологических нарушений и санации СМЖ. Минимальная продолжительность стационарного лечения для больных с нейротоксикозом - 10 сут, менингитом - 20 сут, менингоэнцефалитом - 30 сут. После выписки из стационара больные с неврологическими нарушениями нуждаются в диспансерном наблюдении неврологом до полного восстановления трудоспособности и регресса неврологической симптоматики.
Лихорадка Зика
Лихорадка Зика - острая зооантропонозная инфекционная болезнь с трансмиссивным механизмом передачи возбудителя, характеризующаяся лихорадкой, сыпью, способностью возбудителя проникать через плацентарный барьер и вызывать у плода тяжелое поражение ЦНС. Распространена в странах тропического и субтропического пояса.
Код по МКБ-10
A92.8 Другая уточненная комариная вирусная лихорадка.
Этиология
Возбудителем заболевания является вирус Зика (англ. Zika virus, ZIKV), относящийся к арбовирусам семейства Flaviviridae рода Flavavirus. Структура вируса схожа со структурой других флавивирусов, имеет нуклеокапсид сферической формы диаметром около 50 нм с мембраной, являющейся гликопротеиновой оболочкой, поверхностные белки которой располагаются в икосаэдрической симметрии. Внутри нуклеокапсида находится одноцепочечная линейная РНК. Прикрепление вируса к цитоплазматическим клеточным мембранам и его проникновение внутрь клетки обусловлено наличием специального мембранного белка Е.
Репликация вирусной РНК происходит в цитоплазме клеток-мишеней.
Впервые вирус был выделен от макак-резус в лесу Зика (Уганда).
Эпидемиология
По данным ВОЗ, в настоящее время вирус Зика распространен в тропических районах с большими популяциями комаров: в Африке, Южной и Центральной Америке, Южной Азии и Западной части Тихого океана. Завозные случаи зарегистрированы в ряде стран, в частности РФ. Все заболевшие вернулись из регионов, эндемичных по лихорадке Зика.
Источник возбудителя - больные люди, здоровые вирусоносители, обезьяны, зараженные вирусом. От человека к человеку и от животных вирус передается посредством укуса комарами рода Aedes (A. Aegipti и А. albopictus). Наибольшую эпидемическую опасность представляет комар A. Aegipti, который распространен в тропических и субтропических районах. Комары инфицируются вирусом от зараженных людей и животных.
Основной механизм передачи возбудителя - трансмиссивный. Описаны случаи заражения половым путем, как при гетеро-, так и при гомосексуальных контактах, при переливании крови.
Естественный резервуар вируса неизвестен.
Профилактика заключается в сокращении численности комаров путем уничтожения мест их выплода, использовании репеллентов, москитных сеток на дверях и окнах, противомоскитного полога для сна. Для размножения комарам рода Aedes требуется очень малое количество воды, поэтому нужно опорожнять сельскохозяйственные резервуары с водой (ведра, бочки, горшки для растений и т.д.). Большую роль играет санитарно-просветительская работа с населением. Особую осторожность следует соблюдать при поездках в эндемичные по заболеванию районы.
Пациентов, зараженных вирусом Зика, и их половых партнеров (особенно беременных) необходимо информировать о риске половой передачи вируса Зика и безопасном половом поведении.
В климатических условиях Российской Федерации риска распространения лихорадки Зика нет.
Патогенез
Вирус поражает дермальные фибробласты, кератиноциты эпидермиса, незрелые дендритные клетки в месте внедрения, затем достигает ЛУ с последующим гематогенным распространением. За адгезию и проникновение вируса внутрь клеток-мишеней отвечает фосфатидилсериновый рецептор AXL, находящийся на поверхности иммунных клеток кожи. В этих клетках были обнаружены пораженные ядра в месте предполагаемого внедрения вируса. Повышение репликации вируса вызывает в клетках продукцию интерферона I типа и аутофагосом. Доказана высокая чувствительность вируса к ИФН I и II типа. На протяжении болезни отмечается стойкое повышение активности Т-клеток (в основном Th1, Th2, Th9 и Th17), выражающееся увеличением уровня соответствующих цитокинов с четким возрастанием к периоду реконвалесценции.
Манифестация заболевания, по данным ВОЗ, происходит в 1 из 5 случаев заражения.
Клиническая картина
Инкубационный период неизвестен.
Длительность болезни составляет от 2 до 7 сут. Чаще заболевание начинается с появления лихорадки, хотя в некоторых случаях может протекать на фоне нормотермии. Характерны головная боль, боли в мышцах и суставах, конъюнктивит. Обычно на 2-3-й день болезни на коже туловища, шеи, верхних и нижних конечностей (иногда включая ладони и стопы) появляется пятнистая или пятнисто-папулезная сыпь. Для элементов сыпи характерны нисходящая последовательность распространения, зуд. Сыпь может сохраняться от 2 до 14 дней. Часто отмечается конъюнктивит. В редких случаях заболевание может сопровождаться головокружением, ретроорбитальными болями, рвотой, диареей, болями в животе, отеками (чаще у беременных). В целом заболевание протекает доброкачественно. Известны случаи проявления заболевания изолированным конъюнктивитом. Особую опасность болезнь представляет для беременных в I триместре беременности, что обусловлено проникновением вируса через гематоплацентарный барьер с последующим развитием внутриутробной инфекции, приводящей к серьезной патологии развития плода (микроцефалия). Существуют данные о связи лихорадки Зика с развитием синдрома Гийена-Барре, а также различными аутоиммунными реакциями. РНК вируса Зика была обнаружена в эмбрионах после выкидышей, произошедших у инфицированных женщин. Имеется связь между вирусной инфекцией Зика и другими серьезными аномалиями головного мозга плода.
Диагностика
В связи с клиническим сходством с другими тропическими лихорадками клиническая диагностика малоинформативна.
Для лабораторной диагностики лихорадки Зика методом выбора является ПЦР и выделение вируса из образцов крови (до 10-го дня с начала болезни), мочи и слюны (до 29-го дня с момента заражения), а также семенной жидкости на поздних сроках (более 30 дней после заражения). Серологическая диагностика малоинформативна в силу перекрестных реакций с другими флавивирусами, такими как вирус Денге, Западного Нила и желтой лихорадки.
Лечение
Этиотропная терапия не разработана. Рекомендовано симптоматическое лечение, соблюдение постельного режима, применение НПВС, обильное питье. При выраженном кожном зуде применяют антигистаминные препараты.
Бешенство
Бешенство (гидрофобия Hydrophobia, Rabies, Lyssa) - вирусная зоонозная природно-очаговая и антропургическая инфекционная болезнь с контактным механизмом передачи возбудителя (через слюну зараженного животного), характеризующаяся развитием энцефалита с нарушением витальных функций.
Код по МКБ-10
А.82.
Этиология
Возбудитель бешенства - РНК-содержащий вирус, относящийся к семейству Rabdoviridae рода Lyssavirus. Существует 7 генотипов вируса бешенства. Классические штаммы вируса бешенства (1 генотип) высокопатогенны для млекопитающих. Вирион имеет форму пули, размер - 60-80 нм в диаметре; состоит из сердцевины (РНК, связанная с белком); окружен липопротеиновой оболочкой с гликопротеиновыми шипами. Гликопротеин G отвечает за адсорбцию и внедрение вируса в клетку, обладает антигенным (типоспецифический антиген) и иммуногенным свойствами. Антитела к нему нейтрализуют вирус и определяются в реакции нейтрализации. Различают дикий (уличный) и фиксированный штаммы вируса бешенства. Дикий штамм вируса циркулирует среди животных и патогенен для человека. Фиксированный штамм получен Пастером путем многократного пассирования дикого вируса через мозг кроликов, в результате чего вирус приобрел новые свойства - утратил патогенность для человека, перестал выделяться со слюной, инкубационный период сократился с 15-20 дней до 7 дней и в последующем не изменялся. Полученный вирус Пастер использовал в качестве антирабической вакцины. Оба вируса идентичны по антигенам. Вирус бешенства быстро погибает под действием солнечных и ультрафиолетовых лучей, при нагревании до 60 °С. Чувствителен к дезинфицирующим веществам, жирорастворителям, щелочам и др., сохраняется при низких температурах (-20-70 °С). Вирус культивируют путем внутримозгового заражения лабораторных животных и в культурах клеток. Вирус патогенен для человека и практически для всех видов теплокровных животных, включая грызунов и птиц.
Эпидемиология
Основным резервуаром бешенства в природе являются дикие млекопитающие, различные в разных регионах мира. Выделяют две эпидемиологические формы заболевания - городское бешенство (антропургические очаги), основной резервуар которого - домашние собаки и кошки, и лесное бешенство, резервуаром которого служат различные дикие животные. По данным ВОЗ, более чем в 99% случаев заболевания людей вирус бешенства передается домашними собаками. Вакцинация собак признана ВОЗ самым эффективным способом для уменьшения риска этой болезни.
В России в природных очагах основными распространителями болезни являются лисица, енотовидная собака, волк, корсак, в тундровой зоне - песец. В последние годы зарегистрированы случаи бешенства у барсуков, хорьков, куниц, бобров, лосей, рысей, диких кошек, серых крыс, домовых мышей, белок, хомяков, ондатр, нутрий, медведей. Домашнее животное обычно заражается от диких животных. Человек может встретиться с источником инфекции как в городе, так и на природе, заражение происходит при укусе больным животным, а также при ослюнении кожи (если есть микротравмы) и слизистых.
Заболевание может передаваться также при укусе летучими мышами-вампирами в Мексике, Аргентине и Центральной Америке, а также в США, Европе, Австралии, Африке, Индии), единичные - в России (Белгородская область), на Украине. Доказана возможность аэрогенного пути заражения (заражение спелеологов, побывавших в пещерах, заселенных летучими мышами; случай лабораторного заражения). Описаны случаи передачи бешенства от донора к реципиенту через инфицированный трансплантат роговицы. В 2004 г. впервые сообщено о возможности передачи бешенства при пересадке солидных органов. От человека человеку бешенство не передается, однако при работе с больными людьми или животными необходимо соблюдать меры предосторожности: использовать защитную одежду (халат, шапочку, перчатки, очки и др.) и проводить дезинфекцию инструментария, оборудования, помещения и др.
Восприимчивость к бешенству не является всеобщей. Только 12-30% людей, укушенных животными с доказанным бешенством и не привитых антирабической вакциной, заболевают бешенством. Почти 50% собак с доказанным бешенством не выделяют вирус со слюной.
Бешенство встречается более чем в 150 странах, на всех континентах. Бешенство по наносимому экономическому ущербу занимает 5-е место среди инфекционных болезней. В последние годы в мире наблюдается активизация природных очагов этой инфекции как во всем мире, так и в различных регионах Российской Федерации, что неизбежно ведет к увеличению числа заболевших людей. В России ежегодно регистрируется около 20 случаев этого заболевания.
Меры профилактики
Иммунизация против бешенства - профилактическая и лечебно-профилактическая. С профилактической целью иммунизируют лиц, работа которых связана с риском заражения (ветеринары, лесники, охотники, собаколовы, работники бойни, таксидермисты, сотрудники лабораторий, работающих с уличным вирусом бешенства).
Лечебно-профилактическая иммунизация проводится при контакте и укусах людей бешеными, подозрительными на бешенство или неизвестными животными, противопоказаний в этом случае не существует. Вакцинированному запрещается употребление спиртных напитков в течение курса прививок и 6 мес после его окончания. Следует также избегать переутомления, переохлаждения, перегревания.
Постэкспозиционная профилактика бешенства включает обработку раны и введение антирабической вакцины в сочетании с иммуноглобулином антирабическим. Одновременно проводится профилактика столбняка в соответствии с существующими схемами.
В РФ для проведения вакцинно-сывороточной профилактики бешенства используются антирабические вакцины и иммуноглобулин антирабический. Наиболее широко используется вакцина антирабическая культуральная концентрированная очищенная инактивированная сухая (КОКАВ). Культуральные вакцины лишь в единичных случаях вызывают реакции местного и общего характера. При тяжелых множественных укусах опасной локализации наряду с вакциной вводится иммуноглобулин антирабический - гетерологичный (лошадиный) или гомологичный (человеческий), нейтрализующий вирус бешенства. Иммуноглобулин антирабический должен вводиться как можно раньше, в первые часы после укуса (не позднее 3 сут). Доза иммуноглобулина антирабического определяется из расчета 40 МЕ на 1 кг массы при введении гетерологичного иммуноглобулина и 20 МЕ на 1 кг массы - при введении гомологичного. Рассчитанная доза иммуноглобулина инфильтрируется вокруг ран и в глубину раны, если анатомическое расположение раны не позволяет вводить всю дозу вокруг раны, то остаток иммуноглобулина вводят внутримышечно в другие места, чем вакцина. Иммуноглобулин антирабический не применяется после введения антирабической вакцины. Применение КОКАВ позволяет значительно сократить дозы и кратность введения вакцины - вакцина вводится 6 раз в дозе 1,0 мл в дельтовидную мышцу (детям - в мышцы бедра) на 0, 3, 7, 14, 30 и 90-й дни. КОКАВ обладает более высокой степенью очистки и безвредности и более высокой иммуногенной активностью, чем культурная антирабическая вакцина (КАВ).
Умерщвлению подлежат все дикие животные, укусившие человека, а из домашних животных - больные, невакцинированные, бродячие, совершившие неспровоцированное нападение на человека, ведущие себя необычно или имеющие другие признаки бешенства. Голову животного немедленно направляют на исследование в специализированную лабораторию. При отрицательном результате профилактика не требуется. Если человек был укушен диким животным, поймать которое не удалось, одновременно проводят активную и пассивную иммунизацию. В местности, где бешенство среди домашних животных не распространено, внешне здоровых собак и кошек изолируют и наблюдают за ними 10 сут. При появлении симптомов заболевания или при изменении в поведении животное умерщвляют, а его голову направляют в специализированную лабораторию для иммунофлюоресцентного окрашивания головного мозга на антигены вируса бешенства. Если животное в течение 10 сут не заболело, в момент укуса его слюна не могла содержать вирус бешенства. В этом случае начатую иммунизацию прекращают. В местности, где бешенство распространено среди собак, оправдано немедленное исследование головного мозга животного, особенно в случаях тяжелых укусов. Схема лечебно-профилактических прививок КОКАВ и иммуноглобулина антирабического приведена в инструкции к этим препаратам.
Патогенез
Вирус бешенства проникает в организм человека через поврежденный эпидермис или слизистые оболочки, включая неповрежденные, внедряется в поперечнополосатые мышцы; в нервную систему вирус попадает через нервно-мышечные синапсы и сухожильные рецепторы Гольджи (в этих структурах имеются уязвимые для вируса безмиелиновые нервные окончания). Далее вирус со скоростью около 3 мм/ч продвигается по нервным волокнам в ЦНС. Достигнув ЦНС, вирус инфицирует нейроны, репликация происходит почти исключительно в сером веществе. После репликации в нейронах мозга вирус распространяется в обратном направлении по вегетативным нервным волокнам - в слюнные железы, в слезные железы, в роговицу, почки, легкие, печень, кишечник, поджелудочную железу, скелетные мышцы, кожу, сердце, сосочки языка, надпочечники и волосяные фолликулы и др. Наличие вируса в волосяных фолликулах и роговице используется для прижизненной диагностики заболевания (наличие вирусного антигена исследуется в биоптате кожи, взятом в заушной области, и в мазке-отпечатке с роговицы). Смерть наступает вследствие поражения жизненно важных центров - дыхательного и сосудодвигательного.
Патоморфологическое исследование мозга умерших выявляет умеренные воспалительные изменения с относительно негрубой деструкцией нервных клеток, сопровождающиеся ОНГМ. Гистологическая картина напоминает таковую при других вирусных инфекциях ЦНС. Обращает внимание несоответствие между тяжелыми неврологическими проявлениями болезни и скудными патоморфологическими изменениями, обнаруживаемыми в тканях мозга. В клетках мозга вирус бешенства образует оксифильные цитоплазматические включения (тельца Бабеша-Негри), однако их отсутствие не исключает диагноза бешенства.
Клиническая картина
Длительность инкубационного периода - от 7 дней до года и более, чаще - от 30 до 90 дней. Она зависит от локализации укусов (чем больше расстояние до головного мозга, тем продолжительность его длиннее), их глубины и обширности. Наиболее короткий инкубационный период отмечается при укусах дикими плотоядными животными в область лица, головы, шеи, промежности, гениталий, наиболее длительный - при одиночных укусах в туловище и в нижние конечности. Болезнь начинается с продромального периода: появляются неприятные ощущения и боли в месте укуса, этому может предшествовать появление лихорадки. Одновременно отмечаются бессонница, подавленное настроение, раздражительность, чувство страха, тоски, повышенная чувствительность к слуховым и зрительным раздражителям, гиперестезия кожи, чувство нехватки воздуха. Чаще всего наблюдается повышенная эмоциональная лабильность с продолжительностью от нескольких часов до нескольких дней. Затем выявляются симптомы острого энцефалита, первыми признаками которого служат приступы психомоторного возбуждения. Вскоре присоединяются изменение сознания, галлюцинации, агрессивность, бред, мышечные спазмы, судороги. Больной пытается убежать, укусить, нападает с кулаками. Затем этот период сменяется периодом успокоения. На этом фоне возникает приступ болезни («пароксизм бешенства»), сопровождающийся судорогами мышц глотки, гортани, диафрагмы, возможно нарушение дыхания и глотания. Наблюдается психомоторное возбуждение, гиперсаливация, рвота. Приступы длятся несколько секунд или минут, в дальнейшем частота приступов нарастает, они провоцируются попыткой пить (гидрофобия), дуновением воздуха (аэрофобия), ярким светом (фотофобия) или громким звуком (акустикофобия). На высоте развития приступа возможна остановка дыхания. Между приступами сознание, как правило, проясняется. К симптомам энцефалита скоро присоединяются признаки нарушения стволовых функций. Поражение черепных нервов ведет к диплопии, парезу лицевых нервов, нарушению зрения и глотания. Слюнотечение в сочетании с дисфагией приводит к появлению пены во рту. Следующая стадия болезни - паралитическая, когда прекращаются судороги и возбуждение, проясняется сознание. Однако на фоне мнимого улучшения состояния наступает смерть от паралича дыхательного или сосудодвигательного центров. Возможны различные варианты течения болезни - отсутствие продромального периода или развитие «тихого» бешенства, часто развивающегося после укусов летучих мышей, для которого характерно развитие восходящих параличей, напоминающих синдром Гийена-Барре.
Исходом заболевания является смерть больного. Через 4 сут после появления первых симптомов умирает половина больных, через 20 сут - все. Если проводится ИВЛ, возможно развитие поздних осложнений: синдром гиперсекреции антидиуретического гормона, несахарный диабет, нестабильность гемодинамики, аритмии, РДСВ, желудочно-кишечные кровотечения, тромбоцитопения и др.
В 2005 г. был описан экспериментальный курс лечения бешенства у 15-летней девочки, приведший к выздоровлению. Лечение включало в себя создание искусственной (кетаминовой) комы и применение противовирусных препаратов (рибавирина и амантадина). Впоследствии в разных странах мира было произведено более 40 попыток спасения жизни людей, заболевших бешенством, с помощью предложенной схемы лечения, положительного эффекта удалось добиться примерно в 16% случаев.
Диагностика
Прижизненный диагноз бешенства может быть подтвержден определением вирусного антигена в первые дни болезни (метод флюоресцирующих антител - МФА - в отпечатках роговицы или в биоптатах кожи затылка), а также определением нейтрализующих антител после 7-10-го дня болезни реакцией нейтрализации. У невакцинированных больных диагноз бешенства подтверждает четырехкратное нарастание титра нейтрализующих антител при исследовании парных сывороток. У вакцинированных больных при постановке диагноза опираются на абсолютный уровень нейтрализующих антител в сыворотке, а также на присутствие этих антител в СМЖ.
Посмертный диагноз бешенства основан на обнаружении телец Бабеша-Негри в мазках-отпечатках головного мозга. Биологический метод основан на заражении исследуемым материалом лабораторных животных, после гибели животных, обнаружении телец Бабеша-Негри в мозговой ткани ответ может быть получен на 25-30-й день исследования. Используются также иммунологический (флюоресцирующих антител - МФА или ИФА) и вирусологический методы, основанные на выделении и идентификации вируса бешенства.
В качестве материала для лабораторного исследования у животных чаще всего направляется голова животного, а если животное мелкое - то труп целиком.
Дифференциальная диагностика бешенства проводится с заболеваниями, сопровождающимися развитием сходной клинической симптоматики (отравление атропином, столбняк, лиссофобия).
Лечение
Больные гидрофобией госпитализируются в отделение реанимации и/или интенсивной терапии инфекционной больницы.
Развитие гидрофобии сопровождается нарушением глотания, что требует установки назогастрального зонда и проведения зондового питания.
Проводят инфузионную, противосудорожную и седативную терапию, при необходимости назначают мышечные релаксанты, ИВЛ, наркотические средства и средства для наркоза.
Прогноз неблагоприятный. Бешенство относится к абсолютно смертельным заболеваниям.
Клещевой энцефалит
Клещевой энцефалит (весенне-летний энцефалит, таежный энцефалит, русский энцефалит, дальневосточный энцефалит, клещевой энцефаломиелит) - природно-очаговая вирусная болезнь с трансмиссивным механизмом передачи возбудителя, характеризующаяся лихорадкой и преимущественным поражением ЦНС.
Коды по МКБ-10
А84.0 Дальневосточный клещевой энцефалит (русский весенне-летний энцефалит).
А84.1 Центрально-европейский клещевой энцефалит.
Этиология
Вирус клещевого энцефалита принадлежит к семейству Flaviviridae роду Flavivirus и включает три подтипа - европейский, дальневосточный и сибирский. Вирион вируса клещевого энцефалита имеет сферическую форму, кубический тип симметрии и покрыт липопротеиновой суперкапсидной оболочкой. Размер вириона - 40-45 нм. Геном представлен линейной одноцепочечной РНК положительной полярности. В составе генома 10 генов, три из которых кодируют структурные вирусные белки Е, М и С, входящие в состав вириона, a остальные 7 - неструктурные белки NS1, NS2a, NS2b, NS3, NS4a, NS4b, NS5, необходимые для осуществления процесса его репликации в зараженной клетке. Нуклеокапсид содержит РНК и протеин С (core). Оболочка состоит из двух гликопротеидов (мембранного М, оболочечного Е) и липидов. Вирус культивируют в куриных эмбрионах и культурах тканей различного происхождения. Репликация вируса происходит в цитоплазме клетки.
С генетическим разнообразием возбудителя связаны различия в клинической картине клещевого энцефалита в Европе, Сибири и на Дальнем Востоке.
Вирус стабилен при рН 8,0, чувствителен к органическим растворителям и детергентам, инактивируется при температуре 40 °С, при кипячении погибает в течение 2-3 мин, легко разрушается при пастеризации, обработке растворителями и дезинфектантами, но способен длительно сохранять жизнеспособность при низких температурах, в высушенном состоянии. Вирус долго сохраняется в таких продуктах питания, как молоко или масло, которые могут быть источниками инфицирования, устойчив к низким концентрациям соляной кислоты, поэтому возможен пищевой путь заражения.
Эпидемиология
Клещевой энцефалит - природно-очаговое заболевание. Основной резервуар и переносчик вируса в природе - иксодовые клещи Ixodes persulcatus, Ixodes ricinus с трансфазовой и трансовариальной передачей возбудителя. Дополнительные резервуары вируса - дикие и домашние животные, птицы. Благодаря широкому кругу хозяев происходит непрерывная циркуляция вируса в природе.
Клещ заражается вирусом при питании на животных с надпороговыми уровнями вирусемии. Личиночные и нимфальные стадии клещей передают или воспринимают вирус преимущественно при питании на мелких лесных животных, прежде всего мышевидных грызунах. Прокормителями половозрелых клещей являются в основном средние и крупные животные: зайцы, косули, олени. Птицы также могут быть прокормителями клещей и участвуют в циркуляции вируса. В антропургических очагах прокормителями клещей являются домашние животные, прежде всего - крупный и мелкий рогатый скот. Козы могут быть не только прокормителями клеща, но и являться источником заражения человека, так как молоко этих животных может содержать вирус в высоких дозах. Возможен половой путь передачи вируса клещевого энцефалита от самцов клещей к самкам во время спаривания. Передача вируса от зараженных самок через яйца личинкам менее эффективна - не более 1% потомства.
Основной путь инфицирования человека - трансмиссивный, через присасывание клещей. Риск инфицирования людей тесно связан с активностью клещей. Клещи I. persulcatus проявляют максимум активности с апреля по середину июля, а для клещей I. ricinus характерен второй небольшой пик активности в начале осени. Чаще болеют лица в возрасте 20-60 лет. В структуре заболевших в настоящее время преобладают городские жители. Возможна также передача вируса алиментарным путем (при употреблении в пищу сырого молока коз и коров), в результате раздавливания клеща при его удалении с тела человека и аэрозольным путем при нарушении условий работы в лабораториях.
Вирус клещевого энцефалита распространен в 25 странах Европы и Азии, главным образом в умеренной климатической зоне. Ареал вируса в основном совпадает с ареалом клеща Ixodes persulcatus в Азии, клеща Ixodes ricinus - на территории Европы. На протяжении периода от начала официальной регистрации клещевого энцефалита (1944 г.) до настоящего времени в России было зарегистрировано две больших волны подъема заболеваемости. Первая волна достигла своего пика в середине 1950-х гг., когда было выявлено более 5000 случаев. Затем отмечался длительный постепенный спад заболеваемости до середины 1970-х гг. Следующая волна достигла максимума в 1996 г. Заболеваемость достигла 7,0 на 100 тыс. населения, или более 10 тыс. случаев в абсолютном выражении.
Восприимчивость к клещевому энцефалиту высокая, независимо от пола и возраста, особенно среди лиц, впервые посещающих природный очаг. У коренных жителей преобладают субклинические формы инфекции (один клинический случай на 60 инаппарантных). Иммунитет после перенесенного клещевого энцефалита пожизненный. В крови переболевших в течение всей жизни сохраняются вирус-нейтрализующие антитела.
Больной как источник инфекции для окружающих не опасен.
Меры профилактики
Специфическая профилактика включает активную и пассивную иммунизацию населения. Вакцинацию осуществляют тканевой культуральной вакциной (троекратные прививки) с последующей ревакцинацией через 4, 6 и 12 мес. В России используются две отечественные культуральные инактивированные высокоочищенные вакцины, приготовленные из дальневосточных штаммов вируса клещевого энцефалита Софьин и 205. Зарегистрированы и разрешены к применению также вакцины фирмы «Бакстер» (США, производство в Австрии) и «Новартис» (Германия). Тяжелые формы среди непривитых в 4 раза чаще, чем у привитых.
Специфическую пассивную профилактику проводят гомологичным донорским иммуноглобулином как предэкспозиционно (до предполагаемого присасывания клеща, при выходе в зону риска), так и постэкспозиционно (после присасывания клеща). Иммуноглобулин вводят в/м из расчета 0,1 мл/кг однократно за несколько часов до выхода в лесную зону или в течение первых суток после укуса клеща. В последующие 2-3 дня эффективность постэкспозиционной иммунопрофилактики снижается.
Неспецифическая профилактика и мероприятия в очаге
Профилактика направлена на уничтожение или сокращение численности клещей. Методика обработок предусматривает использование акарицидных препаратов с коротким остаточным действием («Таран 10% в.к.э.», «Байтекс 40% с.п.», «Цифокс», «Акаритокс»). Меры личной профилактики предусматривают использование при посещении леса специальной одежды, применение репеллентов, взаимоосмотры после посещения лесов и парков в черте города.
Патогенез и патоморфология
После внедрения вирус размножается в клетках кожи. На месте присасывания клеща в тканях развиваются дегенеративно-воспалительные изменения. При алиментарном пути заражения фиксация вируса происходит в эпителиальных клетках ЖКТ. Вирусемия при клещевом энцефалите имеет двухволновой характер. Первая волна вирусемии (транзиторная) обусловлена проникновением вируса в кровь из мест первичной локализации. В конце инкубационного периода возникает вторая волна вирусемии, совпадающая по времени с началом размножения вируса во внутренних органах. Заключительная фаза - внедрение и репликация вируса в клетках ЦНС и периферической нервной системы.
Морфологически клещевой энцефалит характеризуется диффузным воспалительным поражением головного и спинного мозга (полиэнцефаломиелит). Поражается преимущественно серое вещество. Наиболее распространенные и интенсивные изменения отмечаются в ядрах продолговатого мозга и нервных клетках аммонова рога. На первый план выступают повреждения сосудов микроциркуляторного русла и двигательных нейронов. Наблюдаемые поражения неспецифичны и включают воспаление, гиперплазию, глиальную пролиферацию и некроз нейронов. Прогредиентные формы клещевого энцефалита связывают с длительным сохранением вируса в активной форме в клетках ЦНС. В развитии персистирующей инфекции значительную роль отводят мутантным формам вируса.
Клиническая картина
Клиническая классификация клещевого энцефалита основана на определении формы, тяжести и характера течения заболевания (табл. 17-16).
| Клиническая форма | Тяжесть течения | Характеристика течения |
|---|---|---|
Инаппарантная (субклиническая) |
- |
- |
Лихорадочная |
легкое |
двухволновое |
Менингеальная |
средней тяжести |
хроническое (прогредиентное) |
Менингоэнцефалитическая |
тяжелое |
|
Полиомиелитическая |
тяжелое |
|
Полирадикулоневритическая |
тяжелое |
Инкубационный период при трансмиссивном пути заражении составляет 5-25 (в среднем 7-14) дней, а при пищевом - 2-3 дня.
Лихорадочную форму клещевого энцефалита регистрируют в 40-50% случаев. У большинства больных заболевание начинается остро. Лихорадочный период длится от нескольких часов до 5-6 дней. В острый период болезни температура тела повышается до 38-40 °С и выше. Иногда наблюдают двухволновую и даже трехволновую лихорадку.
Больных беспокоят различной интенсивности головная боль, общая слабость, недомогание, озноб, чувство жара, потливость, головокружение, боль в глазных яблоках и светобоязнь, снижение аппетита, боли в мышцах, в костях, в позвоночнике, в конечностях, в пояснице, в области шеи и в суставах. Характерна тошнота, возможна повторная рвота в течение одного или нескольких дней. Отмечают инъекцию сосудов склер и конъюнктив, гиперемию лица, шеи и верхней половины туловища, выраженную гиперемию слизистых оболочек, ротоглотки, в ряде случаев бледность кожного покрова. Возможен менингизм.
В большинстве случаев заболевание заканчивается полным клиническим выздоровлением. Однако у ряда пациентов после выписки из стационара сохраняется астеновегетативный синдром.
Менингеальная форма - наиболее распространенная форма клещевого энцефалита. В структуре заболеваемости она составляет 50-60%. Клиническая картина характеризуется выраженным общеинфекционным и менингеальным симптомами.
В большинстве случаев начало болезни острое. Температура тела повышается до 39-39,5 °С. Лихорадка сопровождается ознобом, чувством жара и потливостью. Характерна головная боль различной интенсивности и локализации. Отмечают анорексию, тошноту и часто рвоту. В некоторых случаях выражены миастения, боли в глазных яблоках, светобоязнь, шаткая походка и тремор рук. При осмотре выявляют гиперемию лица, шеи и верхней части туловища, инъекцию сосудов склер и конъюнктив.
Менингеальный синдром при поступлении обнаруживают у половины больных. У остальных он развивается на 1-5-й день пребывания в стационаре. Выявляют преходящую очаговую симптоматику, асимметрию лица, анизокорию, недоведение глазных яблок кнаружи, нистагм, оживление или угнетение сухожильных рефлексов, анизорефлексию. Давление СМЖ, как правило, повышено (250-300 мм вод ст.). Плеоцитоз СМЖ составляет от нескольких десятков до нескольких сотен клеток в 1 мкл. Преобладают лимфоциты, в ранние сроки могут преобладать нейтрофилы. Содержание глюкозы в СМЖ нормальное или повышенное. Изменения в СМЖ сохраняются от 2-3 нед до нескольких месяцев.
Астеновегетативный синдром сохраняется дольше, чем при лихорадочной форме. Характерны раздражительность, плаксивость. Доброкачественное течение менингеальной формы клещевого энцефалита не исключает возможности развития в дальнейшем клинической картины хронической формы заболевания.
Менингоэнцефалитическая форма отличается тяжелым течением и высокой летальностью. Частота этой формы в отдельных географических регионах составляет от 5 до 10%, на Дальнем Востоке - до 15%. Для острого периода болезни характерны высокая температура, более выраженная интоксикация, выраженные менингеальные и общемозговые симптомы, а также признаки очагового поражения головного мозга.
Характерны глубокие нарушения сознания вплоть до развития комы. У больных, поступавших в бессознательном и сопорозном состоянии, наблюдают двигательное возбуждение, судорожный синдром, мышечную дистонию, фибриллярные и фасцикулярные подергивания в отдельных мышечных группах. Часто oбнаруживают нистагм, появление подкорковых гиперкинезов, гемипарезов, а также поражения черепных нервов: III, IV, V, VI пар, несколько чаще VII, IX, Х, XI, XII пар. При стволовых поражениях появляются бульбарный, бульбопонтинный синдромы, реже - симптомы поражения среднего мозга. Отмечают нарушение глотания, поперхивание, гнусавый оттенок голоса или афонию, паралич мышц языка, при распространении процесса на мост - симптомы поражения ядер VII-VI черепных нервов. Нередко выявляют пирамидные знаки, повышение рефлексов, клонусы, патологические рефлексы. Поражения ствола мозга чрезвычайно опасны из-за возможного развития нарушений дыхания и сердечной деятельности. Бульбарные расстройства - одна из основных причин высокой летальности при менингоэнцефалитической форме клещевого энцефалита. При исследовании СМЖ обнаруживают лимфоцитарный плеоцитоз, концентрация белка повышена до 0,6-1,6 г/л.
Полиомиелитическая форма - самая тяжелая форма инфекции. В настоящее время наблюдается у 1-2% больных.
Неврологический статус характеризуется значительным полиморфизмом. У больных с полиомиелитической формой заболевания возможно внезапное развитие слабости в какой-либо конечности или появление онемения в ней. В дальнейшем в этих конечностях развиваются двигательные нарушения. На фоне лихорадки и общемозговых симптомов развиваются вялые парезы шейно-плечевой мускулатуры и верхних конечностей. Нередко парезы симметричны и охватывают всю мускулатуру шеи. В конце второй недели развивается атрофия пораженных мышц. Парезы и параличи нижних конечностей встречаются редко.
Улучшение общего состояния наступает медленно. Лишь у половины больных умеренно восстанавливаются утраченные функции. В СМЖ выявляют плеоцитоз от нескольких сотен до тысячи клеток в 1 мкл.
Остаточные явления при полиомиелитической форме характерны для всех больных. Отмечаются слабость мышц шеи и верхних конечностей, симптом «свисающей» головы, гипотрофия мышц шеи, плечевого пояса, предплечий, межреберных мышц. При этой форме высока инвалидизация больных.
Полирадикулоневритиzескую форму диагностируют у 1-3% больных. Ведущие симптомы - мононевриты (лицевого и седалищного нервов), шейно-плечевой радикулоневрит, а также полирадикулоневрит с восходящим течением или без него. В клинической картине преобладают невралгии, корешковые симптомы, болезненность мышц и нервов, периферические параличи или парезы. У больных появляются боли по ходу нервных стволов, парестезии.
Двухволновая лихорадка встречается при всех формах заболевания, но чаще при менингеальной форме. Этот тип лихорадки более характерен для заболеваний, вызванных центрально-европейским и восточно-сибирским генотипами вируса. Для первой лихорадочной волны обязательно наличие выраженного инфекционно-токсического синдрома. Наблюдается острое начало, внезапное повышение температуры до 38-39 °С, сопровождающееся головной болью и общей слабостью. Спустя 5-7 дней состояние больных улучшается, температура тела нормализуется, но через несколько дней повторно повышается. Нередко на фоне второй волны у больных появляется менингеальный синдром.
Хроническое прогредиентное течение наблюдают у 1-3% больных. Хронические формы возникают спустя несколько месяцев, а иногда и лет после острого периода болезни, преимущественно при менингоэнцефалитической, реже - менингеальной формах болезни.
Основная клиническая форма хронического периода - кожевниковская эпилепсия, которая выражается в постоянных миоклонических гиперкинезах, захватывающих прежде всего мышцы лица, шеи, плечевого пояса. Периодически, особенно при эмоциональном напряжении, происходит приступообразное усиление и генерализация миоклоний или переход их в большой тонико-клонический приступ с потерей сознания. Наблюдается также синдром хронического подострого полиомиелита, обусловленного медленно прогрессирующей дегенерацией периферических мотонейронов передних рогов спинного мозга, который клинически характеризуется нарастающими атрофическими парезами конечностей, в основном верхних, с постоянным снижением мышечного тонуса и сухожильных рефлексов.
Гиперкинетический синдром характеризуется появлением спонтанных ритмичных мышечных сокращений в отдельных мышечных группах паретических конечностей уже в остром периоде болезни. Нередко прогредиентные формы сопровождаются нарушениями психики вплоть до деменции. Часто клинические симптомы носят смешанный характер, когда прогрессирование гиперкинезов сочетается с нарастающей амиотрофией и, иногда, психическими нарушениями. По мере нарастания тяжести симптомов больные инвалидизируются.
В последние годы относительно редко наблюдаются тяжелые клинические формы острого периода, что не исключает развития в дальнейшем хронической прогредиентной формы болезни.
Диагностика
Диагноз основан на анамнестических, клинико-эпидемиологических и лабораторных данных. Большое значение в эндемичных регионах придают посещению леса, парка, дачи в весенне-летний период, факту присасывания клеща, а также употреблению в пищу некипяченого козьего или коровьего молока.
Клиническая диагностика
Ранние клинические диагностические признаки заболевания - повышение температуры тела до 39-40 °С, ознобы, головная боль, головокружение, тошнота, рвота, общая слабость, боли в мышцах, суставах, пояснице.
При осмотре обращают внимание на наличие гиперемии лица, шеи и верхней части туловища, инъекцию сосудов склер, конъюнктивит и гиперемию ротоглотки. Больные вялые, адинамичные. Необходимо тщательно осмотреть кожные покровы, так как на месте присасывания клещей могут оставаться точки или различных размеров гиперемированные пятна.
Лабораторная диагностика
В крови обнаруживают умеренный лимфоцитарный лейкоцитоз, иногда сдвиг влево, повышение СОЭ. При двухволновом течении заболевания на первой волне у большинства больных наблюдается лейкопения с относительным лимфоцитозом, во время второй волны - лейкоцитоз с нейтрофильным сдвигом влево и повышение СОЭ. При менингеальных и очаговых формах заболевания в СМЖ обнаруживают лимфоцитарный плеоцитоз, от нескольких десятков до нескольких сотен клеток в 1 мкл.
Специфическая диагностика
Стандарт диагностики - ИФА, который позволяет отдельно определять общий пул антител к вирусу, IgG и IgM. Определение IgM важно для диагностики не только острых случаев заболевания, но и обострений хронического течения. IgG - следствие перенесенного заболевания или вакцинации. Эффективным экспресс-методом является ПЦР.
Дифференциальная диагностика
Дифференциальную диагностику клещевого энцефалита проводят с тремя основными группами заболеваний: другими трансмиссивными инфекциями, переносимыми иксодовыми клещами; инфекционными болезнями с острым началом и выраженными общеинфекционными проявлениями; другими нейроинфекциями.
При дифференциальной диагностике клещевого энцефалита с гриппом необходимо учитывать сезонность заболевания, факт посещения леса, наличие контакта с клещами или факт переохлаждения, а также результаты лабораторных исследований.
ГЛПС от клещевого энцефалита отличают боли в поясничной области, выраженные изменения в клиническом анализе крови (с 3-5-го дня болезни нейтрофильный лейкоцитоз, сдвиг лейкоцитарной формулы влево, появление плазмоцитов, повышение СОЭ до 40-60 мм/ч) и развитие почечной недостаточности.
При проведении дифференциальной диагностики менингеальных форм клещевого энцефалита с менингитами, вызванными другими вирусами (энтеровирусами, эпидемического паротита, герпесвирусами), прежде всего, необходимо обращать внимание на сезонность заболевания и указание в анамнезе на посещение леса, укусы и нападение клещей. Наряду с клинической симптоматикой заболевания, большое значение имеет ПЦР-диагностика.
Лечение
Все больные с подозрением на клещевой энцефалит подлежат госпитализации в специализированное отделение инфекционной больницы с наличием ОРИТ.
Показан строгий постельный режим в течение всего лихорадочного периода и 7 дней после нормализации температуры. Специальная диета не требуется. В течение лихорадочного периода рекомендуют обильное питье: морсы, соки, гидрокарбонатные минеральные воды.
Лечение противоэнцефалитным иммуноглобулином назначают всем больным клещевым энцефалитом, независимо от ранее проведенной вакцинации или применения иммуноглобулина с профилактической целью.
В зависимости от формы заболевания иммуноглобулин против клещевого энцефалита вводят внутримышечно в следующих дозах: больным лихорадочной формой: ежедневно в дозе 0,1 мл/кг, на протяжении 3-5 дней до улучшения общего состояния, исчезновения лихорадки. Курсовая доза для взрослых составляет не менее 21 мл препарата; больным с менингеальной формой: ежедневно в разовой дозе 0,1 мл/кг 2 р/сут с интервалом 10-12 ч не менее 5 дней до улучшения общего состояния пациента. Курсовая средняя доза - 70-130 мл; больным с очаговыми формами: ежедневно в разовой дозе 0,1 мл/кг 2-3 р/сут с интервалами 8-12 ч не менее 5-6 дней до снижения температуры и стабилизации неврологических симптомов. Курсовая средняя доза для взрослого составляет не менее 80-150 мл иммуноглобулина; при крайне тяжелом течении заболевания разовая доза препарата может быть увеличена до 0,15 мл/кг.
Для лечения клещевого энцефалита используется также рибонуклеаза (РНК-аза), которая задерживает репликацию вируса в клетках нервной системы, проникая через ГЭБ. Рибонуклеазу вводят в/м в изотоническом растворе натрия хлорида (препарат разводят непосредственно перед выполнением инъекции) в разовой дозе 30 мг через 4 ч. Суточная доза вводимого в организм составляет 180 мг. Лечение продолжают в течение 4-5 дней, что обычно соответствует моменту нормализации температуры тела.
Неспецифические лечебные мероприятия направлены на борьбу с общей интоксикацией, отеком мозга, внутричерепной гипертензией, бульбарными расстройствами. Применяют петлевые диуретики, маннитол, полиионные растворы; при дыхательных нарушениях - ИВЛ, ингаляция кислорода; для снижения ацидоза - 4% раствор натрия гидрокарбоната. При менингоэнцефалитической, полиомиелитической и полирадикулоневритической формах болезни назначают преднизолон в таблетках из расчета 1,5-2 мг/кг в сутки равными дозами в 4-6 приемов в течение 5-6 дней, затем дозу постепенно снижают на 5 мг каждые 3 дня (курс лечения 10-14 дней). При бульбарных нарушениях и расстройствах сознания преднизолон вводят парентерально. При судорожном синдроме назначают клоназепам, фенобарбитал, примидон, бензобарбитал, вальпроевую кислоту, диазепам. Применяют ингибиторы протеаз (апротинин). Хроническая форма клещевого энцефалита с трудом поддается терапии, эффективность специфических средств значительно ниже, чем в остром периоде. Рекомендуют общеукрепляющую терапию, глюкокортикоиды короткими курсами (до 2 нед) из расчета преднизолона по 1,5 мг/кг. Из противосудорожных препаратов при кожевниковской эпилепсии применяют бензобарбитал, фенобарбитал, примидон.
В большинстве случаев клещевой энцефалит заканчивается выздоровлением. Прогноз при менингеальной и лихорадочной форме благоприятный. При менингоэнцефалитической, полиомиелитической и полирадикулоневритической - существенно хуже. В реконвалесцентном периоде в 20-50% случаях развивается астеническое состояние различной продолжительности - от нескольких недель до нескольких месяцев. Летальность при клещевом энцефалите зависит от генотипа циркулирующего вируса и варьирует от единичных случаев в Европе и европейской части России до 10% на Дальнем Востоке. При очаговых формах больные в большинстве случаях инвалидизируются.
Больных с лихорадочными и менингеальными формами выписывают из стационара на 14-21-й день нормальной температуры при отсутствии менингеальных симптомов, больных с очаговыми формами - в более поздние сроки, после клинического выздоровления.
Примерные сроки нетрудоспособности с учетом амбулаторного лечения и реабилитации составляют при лихорадочной форме 2-3 нед, менингеальной форме - 4-5 нед, менингоэнцефалитической, полирадикулоневритической - 1-2 мес, полиомиелитической - 1,5-3 мес.
Все перенесшие клещевой энцефалит, независимо от клинической формы, подлежат диспансерному наблюдению в течение 1-3 лет. Диспансеризацию больных (за исключением больных лихорадочной формой) проводят совместно с неврологом.
Медленные инфекции центральной нервной системы*
* Материалы доступны в электронном виде по ссылке, указанной на последней странице книги.
Глава 18. Протозоозы
Амебиаз
Амебиаз (англ. amebiasis) - антропонозная протозойная болезнь, вызываемая Entamoeba histolytica, с фекально-оральным механизмом передачи. Характеризуется язвенным поражением толстой кишки, тенденцией к хроническому рецидивирующему течению, внекишечными осложнениями в виде абсцессов печени и других органов.
Коды по МКБ-10
A06 Амебиаз.
Этиология
Entamoeba histolytica относится к типу Sarcomastigophora классу Sarcodina роду Entamoeba. Жизненный цикл E. histolytica включает две стадии - вегетативную (трофозоит) и стадию покоя (циста). Мелкая вегетативная форма (просветная форма, или forma minuta) имеет размеры от 7 до 25 мкм. Эта непатогенная, комменсальная форма обитает в просвете толстой кишки человека, подвижна, размножается вегетативно. Тканевая форма (20-25 мкм) встречается в пораженных тканях и органах хозяина. Она очень подвижна, образует широкие тупые псевдоподии. Крупная вегетативная форма (forma magna) образуется из тканевой формы. Тело серое, округлое, до 60 мкм и более при движении, пищеварительные вакуоли содержат фагоцитированные эритроциты. Именно из-за этого она также получила название «эритрофаг». По мере продвижения по толстой кишке амебы превращаются в предцистные стадии, а затем - в цисты. Незрелые цисты содержат одно или два ядра, зрелые - четыре ядра с кариосомами.
Цисты устойчивы к воздействию факторов окружающей среды: при температуре 20 °С остаются жизнеспособными в почве несколько дней, в зимних условиях (-20 °С) - до 3 мес. Из-за устойчивости к дезинфицирующим средствам (хлор, озон) в концентрациях, применяемых на водоочистных станциях, жизнеспособные цисты могут оказаться в питьевой воде. Высокие температуры для них губительны, при высушивании и нагревании цисты быстро погибают. Вегетативные формы в окружающей среде неустойчивы.
При заражении цисты амеб с водой или с пищевыми продуктами попадают в рот, а затем в кишечник. В дистальных отделах тонкой кишки под действием кишечных ферментов оболочка цисты растворяется. Из зрелой цисты выходят четыре метацистные одноядерные амебы, которые, в свою очередь, каждые 2 ч делятся надвое. В результате последующих делений они превращаются в вегетативные просветные стадии (см. выше).
Эпидемиология
Высокая пораженность населения амебиазом имеется в Юго-Восточной Азии, Южной и Центральной Америке, Южной и Западной Африке. Болезнь встречается в ряде стран СНГ, преимущественно Закавказья и Средней Азии. В России спорадические случаи, в основном завозные, выявляют во всех регионах.
Источником возбудителя служит человек (в основном бессимптомный носитель просветных форм), выделяющий с фекалиями цисты амеб. Механизм передачи - фекально-оральный. Пути передачи - водный, алиментарный, контактно-бытовой. Факторами передачи являются вода, пищевые продукты (преимущественно овощи и фрукты, не подвергавшиеся термической обработке), предметы обихода. Цисты могут распространяться механическими переносчиками: мухами и тараканами.
Восприимчивость невысокая, при заражении чаще развивается здоровое носительство. Сезонности не отмечают. Иммунитет при амебиазе нестойкий и нестерильный, не защищает от рецидивов и реинфекции.
Меры профилактики: защита водоемов от фекального загрязнения и качественное водоснабжение, предотвращение загрязнения цистами амеб пищевых продуктов, раннее выявление и лечение больных и бессимптомных носителей, систематическое санитарное просвещение. Кипячение воды является более эффективным методом обеззараживания, чем применение химических средств дезинфекции.
Патогенез и патоморфология
В развитии инвазивных форм амебиаза имеют значение такие факторы, как интенсивность инвазии, изменение физико-химической среды кишечного содержимого, иммунодефицит, в частности при лечении глюкокортикоидами, ВИЧ-инфекции; голодание, стресс, преклонный возраст, алкоголизм и др. Отмечают относительно частое развитие инвазивных форм у женщин во время беременности и в период лактации. Амебы переходят к тканевому паразитизму с приобретением характерных для других патогенных микроорганизмов свойств, таких как адгезивность, инвазивность, способность подавлять защитные механизмы хозяина и др. Трофозоиты прикрепляются к энтероцитам благодаря специфическому лектину - галактозо-N-ацетилгалактозамину. У E. histolytica обнаружены гемолизины, про-теазы, у некоторых штаммов - гиалуронидаза, которые могут играть существенную роль в разрушении амебами эпителиального барьера. Трофозоиты паразита способны вызывать контактный лизис нейтрофильных лейкоцитов с выделением монооксидантов, усиливающих процесс расплавления тканей. Амебы оказывают ингибирующее воздействие на моноциты и макрофаги, что способствует их выживанию. Они способны специфически блокировать выработку клетками кишечника ИЛ (ИЛ-1β, ИЛ-8), расщеплять комплемент (С3), IgA, IgG, влияя, таким образом, на процессы воспаления в месте внедрения паразита. Под воздействием цитолизинов и протеолитических ферментов амеб повреждаются слизистая оболочка и прилегающие слои кишечной стенки.
Первичным проявлением амебиаза является образование небольших участков некроза в слизистой оболочке толстой кишки, которые трансформируются в язвы. Язвы увеличиваются по периферии и вглубь, достигая мышечной и даже серозной оболочки толстой кишки. Типичные амебные язвы резко отграничены от окружающих тканей, имеют неровные края. На дне язвы - некротические массы, содержащие трофозоиты амеб. Воспалительная реакция слабо выражена. Язвенный процесс может осложниться перфорацией и перитонитом, возникновением спаек брюшины.
Амебные язвы чаще локализуются в области слепой кишки. Далее в порядке убывания частоты поражения следуют: прямая и сигмовидная кишка, аппендикс и терминальный участок подвздошной кишки.
Поражение кишечника носит сегментарный характер, воспалительная реакция и интоксикационный синдром выражены слабо. Язвы заживают с образованием фиброзного рубца, поэтому могут возникнуть стриктуры и стеноз кишечника.
При хроническом амебиазе в стенке кишки иногда формируется амебома - опухолевидное образование, расположенное преимущественно в восходящей, слепой или прямой кишке. Амебома состоит из фибробластов, коллагена и клеточных элементов и содержит относительно небольшое число амеб.
В результате проникновения амеб в кровеносные сосуды они с током крови заносятся в другие органы, где возникают очаги поражения в виде абсцессов. Наиболее часто абсцессы формируются в печени, реже - в легких, головном мозге, почках, поджелудочной железе. Их содержимое студенистое, желтоватого цвета, в крупных абсцессах гной имеет красно-коричневую окраску. Хронический абсцесс обычно имеет толстую капсулу, содержимое желтоватого цвета с гнилостным запахом. Вследствие прорыва абсцесса печени под диафрагму после ее расплавления развивается гнойный плеврит. В легких абсцессы в большинстве случаев локализуются в нижней или средней доле правого легкого.
Клиническая картина
Только у 10% инфицированных развивается инвазивный амебиаз. Различают две основные формы инвазивного амебиаза - кишечную и внекишечную.
Кишечный амебиаз. Инкубационный период от 1-2 недель до нескольких месяцев. При локализации поражений в ректосигмоидальном участке толстой кишки клиническая картина может соответствовать дизентериеподобному синдрому с тенезмами и изредка с примесью слизи, крови и гноя в стуле. При локализации поражений в слепой кишке отмечают запор с болями в правой подвздошной области и симптомы, характерные для клинической картины хронического аппендицита (в ряде случаев действительно развивается аппендицит).
Клинические варианты течения кишечного амебиаза
Острый кишечный амебиаз (острый амебный колит) нередко проявляет себя только в виде диареи. Реже отмечают острое начало, схваткообразные боли в животе, тенезмы, жидкий стул с кровью и слизью. Высокая лихорадка и другие проявления интоксикационного синдрома редки. Однако у детей младшего возраста обычно возникают лихорадка, рвота, дегидратация.
Тяжело протекающая некротизирующая форма острого кишечного амебиаза - фульминантный колит. Для этой формы характерны токсический синдром, тотальные и глубокие повреждения слизистой оболочки кишечника, кровотечения, перфорации, перитонит. Чаще его выявляют у беременных и женщин в послеродовом периоде, после назначения ГК. Острое течение кишечного амебиаза в эндемичных районах нередко обусловлено сочетанием с шигеллезом, малярией, брюшным тифом, которые оказывают взаимоотягощающее влияние на течение инфекционного процесса.
Затяжной кишечный (первично-хронический) амебиаз. Характерны нарушение моторной функции кишечника, послабленный стул, запор (50% случаев) или неустойчивый стул, боли в нижней половине живота, тошнота, слабость, плохой аппетит. Со временем появляются признаки гипохромной анемии, развиваются трофические нарушения, гиповитаминоз, дисбиоз кишечника. Без противопаразитарного лечения болезнь прогрессирует, развиваются осложнения, кахексия.
Внекишечный амебиаз
Абсцесс печени. У больных с амебным абсцессом печени указания на перенесенный ранее кишечный амебиаз или эпизод диареи выявляют только в 30-40% случаев, а амебы в фекалиях обнаруживают не более чем у 20% больных. Амебный абсцесс печени у взрослых развивается чаще у лиц мужского пола. Единичные или множественные абсцессы образуются преимущественно в правой доле печени в непосредственной близости от диафрагмы или в нижних отделах органа.
Характерна лихорадка с ознобами и обильным потоотделением в ночное время; увеличение и боль в области печени, умеренный лейкоцитоз. При крупных абсцессах возможно развитие желтухи, что считают плохим прогностическим признаком. Выявляют высокое стояние правого купола диафрагмы, ограничение ее подвижности; возможно развитие ателектазов в нижнем отделе легкого. Возможно длительное скрытое или нетипичное течение абсцесса (например, только лихорадка, псевдохолецистит, желтуха) с возможным последующим прорывом его и развитием перитонита или эмпиемы плевры.
Плевролегочный амебиаз часто возникает вследствие прорыва абсцесса печени через диафрагму в легкие, реже гематогенным путем. Проявляется в виде эмпиемы плевры, абсцессов легких, печеночно-бронхиальной фистулы. Характерны боль в грудной клетке, кашель, одышка, гной и кровь в мокроте, озноб, лихорадка, нейтрофильный лейкоцитоз со сдвигом влево, повышенная СОЭ.
Вследствие прорыва абсцесса печени из левой доли через диафрагму в перикард возможно развитие амебного перикардита, что может вести к тампонаде сердца и летальному исходу.
Абсцесс мозга наблюдается редко. Возможны единичные или множественные абсцессы. Характерны острое начало и молниеносное течение, заканчивающееся летальным исходом.
Амебное поражение кожи развивается чаще у ослабленных и истощенных больных. Язвы обычно локализуются в перианальной области, на месте прорыва абсцессов в области фистулы, у гомосексуалов - в области половых органов.
Осложнения
Основные осложнения кишечного амебиаза - перфорация кишечника, амебный аппендицит, амебные стриктуры кишечника (обычно единичные, расположенные в области слепой или сигмовидной кишки), кишечное кровотечение; формирование амебомы. Наиболее серьезное осложнение при внекишечном амебиазе - прорыв абсцесса в окружающие органы.
Диагностика
Опорными симптомами клинической диагностики кишечного амебиаза являются постепенное развитие заболевания, прогрессирующее нарастание кишечных расстройств - учащенный жидкий стул с примесью обильной слизи, равномерно окрашенной кровью, тупые боли в животе, преимущественно в правой подвздошной области, при длительном течении - гипохромная анемия. Учитываются данные эпидемиологического анамнеза: пребывание больного в эндемичной местности, употребление в пищу недостаточно обезвреженных продуктов, особенно овощей и огородной зелени, питье некипяченой воды, купание в открытых водоемах.
Лабораторная диагностика
Основной метод диагностики кишечного амебиаза - микроскопическое исследование фекалий для выявления вегетативных форм (трофозоитов) и цист. Трофозоиты лучше выявлять у больных при диарее, а цисты - в оформленном стуле. Исследуют нативные препараты из свежих проб фекалий с изотоническим раствором натрия хлорида. Выявление амеб более эффективно при немедленном исследовании фекалий после назначения слабительного. В практике используют также методы обогащения, в частности эфирформалиновое осаждение. В последние годы применяют ПЦР, позволяющую быстро идентифицировать в фекалиях E. histolytica.
При клинических данных, указывающих на возможное поражение кишечника, рекомендуют проводить ректо- или колоноскопию с получением биопсийного материала. Диагностику внекишечного амебиаза, в частности абсцесса печени, проводят с помощью УЗИ, КТ, МРТ.
Специфические противоамебные антитела определяют c помощью ИФА, РНИФ, РП.
Дифференциальную диагностику проводят с шигеллезом, бластоцистозом, балантидиазом, кампилобактериозом, неспецифическим язвенным колитом, в тропических странах - с некоторыми гельминтозами, протекающими с проявлениями гемоколита (кишечный шистосомоз, трихоцефалез и др.).
Лечение
Режим во время обострений полупостельный, столы № 2, 4.
Медикаментозная терапия
Все препараты, используемые для лечения амебиаза, можно разделить на две группы - контактные (просветные), воздействующие на кишечные просветные формы, и системные тканевые амебоциды.
Для противопаразитарного лечения больных инвазивным кишечным амебиазом применяют следующие препараты: метронидазол - 30 мг/кг в сутки в 3 приема в течение 8-10 дней; тинидазол - 30 мг/кг 1 р/сут в течение 3 дней; орнидазол - 30 мг/кг 1 р/сут в течение 5 дней.
Для лечения больных с амебными абсцессами печени и других органов применяют те же препараты из группы 5-нитроимидазолов более длительными курсами: метронидазол, в течение 10 дней; тинидазол, орнидазол, в течение 10 дней.
В качестве альтернативной схемы лечения амебного абсцесса печени могут быть использованы: эметинρ (дегидроэметин дигидрохлорид) - 1 мг/кг в сутки однократно в/м (не более 60 мг/сут) в течение 4-6 дней; хлорохина основания - 600 мг в день в течение 2 дней, затем по 300 мг в течение 2-3 нед - одновременно или сразу же после завершения курса эметинаρ.
После завершения курса лечения системными тканевыми амебоцидными ЛС с целью элиминации оставшихся амеб в кишечнике применяют следующие просветные амебоциды: дилоксанида фуроатρ по 500 мг 3 р/сут 10 дней (детям 20 мг/кг в сутки); этофамид - 20 мг/кг в день в 2 приема в течение 5-7 дней; паромомицин - 1000 мг в день в 2 приема в течение 5-10 дней.
Эти же препараты применяют для санации паразитоносителей.
Тяжелым больным с амебной дизентерией из-за возможной перфорации кишечника и развития перитонита рекомендуют дополнительно назначать препараты группы тетрациклина (доксициклин 0,1 г 1 р/сут).
После успешной химиотерапии абсцесса печени остаточные полости обычно исчезают в течение 2-4 мес, иногда - позднее.
Аспирацию (или чрескожное дренирование) абсцесса рекомендуют при больших размерах (более 6 см в диаметре), локализации абсцесса в левой доле или высоко в правой доле печени, сильных болях в животе и напряжении брюшной стенки, при которых вероятна угроза разрыва абсцесса, а также в случаях, когда химиотерапия неэффективна в течение 48 ч после ее начала.
Прогноз. Амебиаз - полностью излечимое заболевание при ранней диагностике и адекватной терапии. Основной причиной летальных исходов служат развивающиеся осложнения кишечного амебиаза и абсцесса печени.
Диспансерное наблюдение за переболевшими продолжают в течение года. В этот период каждые 3 мес, а также при появлении дисфункции кишечника проводят медицинские осмотры и лабораторные исследования. Работники объектов водоснабжения и питания к работе допускаются после полной санации и троекратных отрицательных результатов анализов фекалий.
Лямблиоз
Лямблиоз (жиардиаз; англ. - giardiasis) - протозойная инвазия, протекающая чаще как бессимптомное носительство, иногда с функциональными расстройствами кишечника.
Код по МКБ-10
A07.1 Жиардиаз (лямблиоз).
Этиология
Возбудитель - Lamblia intestinalis (Giardia lamblia) - относят к роду Lamblia подтипа Mastigophora подцарства Protozoa.
В цикле развития простейшего выделяют две стадии - вегетативной формы и цисты. Вегетативная форма - трофозоит размером 8-18×5-10 мкм, грушевидной формы. Задний конец сужен и вытянут, передний - расширен и закруглен; брюшная сторона плоская, спинная - выпуклая. Трофозоит имеет четыре пары жгутиков, два ядра с кариосомами и так называемый присасывательный диск - углубление, при помощи которого он прикрепляется к поверхности эпителиальной клетки кишечника хозяина. Максимальное количество паразитов находится в проксимальном отделе тонкой кишки (начальные 2,5 м), где наиболее высока интенсивность пристеночного пищеварения. Лямблии не паразитируют в желчевыводящих путях. Размножение происходит путем продольного деления трофо-зоита.
Эпидемиология
Источник заражения - человек, выделяющий с фекалиями зрелые цисты лямблий. Механизм заражения фекально-оральный. Основной путь передачи водный.
Лямблиоз встречается повсеместно, но наибольшую пораженность населения отмечают в странах с тропическим и субтропическим климатом. В РФ в 2015 г. было зарегистрировано 51 560 случаев лямблиоза; большую часть инфицированных (70%) составляют дети дошкольного и младшего школьного возраста. На территории центральной части РФ наиболее выражена весенне-летняя сезонность, наименьшее число случаев регистрируют в ноябре-декабре.
Меры профилактики такие же, как при амебиазе и других инфекциях с фекально-оральным механизмом передачи возбудителя.
Патогенез
Развитие клинических проявлений зависит от инфицирующей дозы, функционального состояния ЖКТ и иммунного статуса организма. Увеличению количества лямблий способствуют пища, богатая углеводами, резекция желудка в анамнезе и снижение кислотности желудочного сока. Препятствует размножению лямблий белковая диета. Трофозоиты обитают в двенадцатиперстной кишке, прикрепляясь с помощью присасывательных дисков к эпителиальным клеткам ворсинок и крипт. Присасывательные диски образуют углубления на микроворсинчатой поверхности эпителиальных клеток. Паразиты питаются продуктами пристеночного пищеварения и могут размножаться в кишечнике в огромных количествах. В местах паразитирования лямблий усиливаются митотические процессы, и зрелые, функционально полноценные клетки замещаются молодыми, незрелыми (частая смена эпителия); в результате нарушается всасывание компонентов пищи. Эти изменения обратимы, после излечения процесс всасывания нормализуется. Лямблиозу часто сопутствует дисбиоз кишечника, особенно возрастает численность аэробной микрофлоры. Морфологические изменения при лямблиозе характеризуются укорочением сосочков слизистой оболочки двенадцатиперстной и тощей кишки, уменьшением глубины крипт. Продукты метаболизма лямблий и вещества, образуемые после их гибели, всасываются и вызывают сенсибилизацию организма.
Массивная инвазия лямблиями возникает при иммунодефиците, особенно у детей с первичным B-клеточным иммунодефицитом, селективным дефицитом IgA. Лямблии способны вырабатывать IgA-протеазы, разрушающие Ig этого класса, что имеет значение в формировании рецидивирующего течения лямблиоза, резистентного к про тиво паразитарным ЛС.
Клиническая картина
Различают лямблиоз латентный (без клинических проявлений) и манифестный. Подавляющее большинство инфицированных становятся бессимптомными носителями лямблий. Инкубационный период от 7 до 28 дней. Во время эпидемических вспышек симптомы заболевания появляются через 5-10 дней после заражения. Клинически манифестные формы развиваются сравнительно редко. Острый период длится обычно несколько дней, после чего лямблиоз чаще переходит в подострую или хроническую стадию с кратковременными обострениями в виде жидкого стула и вздутия кишечника, похудания, повышенной утомляемости.
Наиболее частые проявления первичной инфекции - тошнота, анорексия, вздутие кишечника и урчание в животе. Стул учащенный, зловонный, маслянистый, пенистый; возможны рвота, схваткообразные боли в эпигастральной области. Эта форма лямблиоза в гигиенических условиях купируется в течение нескольких дней, хорошо поддается химиотерапии, но без специфического лечения может приобретать затяжное течение. У некоторых людей есть предрасположенность к повторному инфицированию и персистирующему лямблиозу. В этих случаях болезнь протекает месяцами и годами с периодическими обострениями в форме гастродуоденита, еюнита, дискинезии желчного пузыря. Возможны клинические формы с аллергическими проявлениями в виде крапивницы, приступов бронхиальной астмы с умеренной эозинофилией в крови. У детей нередки: слабость, быстрая утомляемость, раздражительность, плаксивость, головные боли. В тропических и субтропических странах у больных лямблиозом регистрируют синдром мальабсорбции.
Лабораторная диагностика лямблиоза проводится путем исследования фекалий или дуоденального содержимого. В фекалиях обычно выявляются цисты лямблий. Однако при диарее или после назначения слабительного в фекалиях можно выявить и вегетативные формы L. intestinalis. Для обнаружения трофозоитов исследуют дуоденальное содержимое. В диагностических целях проводят также исследование мазков-отпечатков слизистой оболочки тонкой кишки, биопсийного материала, полученного при эндоскопии. Используется метод ИФА, тестовые наборы (метод иммунохроматографии) для экспресс-определения антигенов лямблий и криптоспоридий в кале человека.
Дифференциальную диагностику проводят с гельминтозами и другими диарейными инфекциями.
Лечение
Специфическое лечение проводят при обнаружении лямблий и наличии у больного клинических проявлений. Для этих целей используют метронидазол. Внутрь взрослым назначают по 400 мг 3 р/сут 5 дней или по 250 мг 3 р/сут 7-10 дней; детям 1-3 лет - по 0,5 г/сут 3 дня, 3-7 лет - по 0,6-0,8 г/сут 3 дня, 7-10 лет - по 1-1,2 г/сут 5 дней; тинидазол назначают внутрь однократно, взрослым по 2 г (при необходимости можно повторить), детям - по 50-75 мг/кг; орнидазол применяют внутрь по 1,5 г 1 раз в день (вечером) в течение 5-10 дней; детям с массой тела до 35 кг препарат назначают по 40 мг/кг в 1 прием; ниморазол назначают внутрь по 500 мг 2 р/сут в течение 6 дней; нифурател принимают внутрь: взрослые по 400 мг 2-3 р/сут в течение 7 дней, дети - по 15 мг/кг 2 р/сут 7 дней; албендазол внутрь взрослым по 400 мг 2 р/сут 7 дней; детям - 10 мг/кг в сутки, но не более 400 мг в течение 7 дней. После курса специфического лечения проводят контрольное исследование фекалий.
Прогноз благоприятный.
Диспансерное наблюдение проводят по клиническим и эпидемиологическим показаниям при длительном упорном течении лямблиоза.
Малярия
Малярия (англ. malaria, франц. paludisme) - антропонозная трансмиссивная протозойная болезнь, характеризующаяся циклическим течением, возможностью рецидивов, проявляющаяся лихорадочными приступами, гепатоспленомегалией, анемией.
Коды по МКБ-10
B50 Малярия, вызванная Plasmodium falciparum.
B51 Малярия, вызванная Plasmodium vivax.
B52 Малярия, вызванная Plasmodium malariae.
B53.0 Малярия, вызванная Plasmodium ovale.
B54 Малярия неуточненная.
Этиология
Возбудители малярии относятся к типу Sporozoa семейству Plasmo-diidae. У человека паразитируют четыре вида возбудителя: Plasmodium vivax - вызывает трехдневную малярию, Р. malariae - четырехдневную, P. falciparum - тропическую, P. ovale - трехдневную овале-малярию.
Малярийные паразиты в процессе своей жизнедеятельности проходят следующие циклы развития со сменой хозяев: бесполое развитие (шизогония) протекает в организме промежуточного хозяина - человека; половое развитие (спорогония) проходит в организме окончательного хозяина - самки комара рода Anopheles.
В организм человека спорозоиты попадают при укусе зараженным малярийным комаром. После проникновения в кровь спорозоиты через 15-45 мин внедряются в гепатоциты и начинают экзоэритроцитарный цикл (тканевая шизогония).
Паразиты увеличиваются, многократно делятся и образуют множество мелких одноядерных мерозоитов. Минимальная продолжительность экзоэритроцитарного цикла составляет 5-7 сут у P. falciparum, 6-8 сут у Р. vivax, 9 сут у Р. ovale и 14-16 сут у Р. malariae. Затем мерозоиты выходят из гепатоцитов в кровь и внедряются в эритроциты, где происходит эритроцитарная шизогония. Для трехдневной и овале-малярии характерен особый тип экзоэритроцитарного развития: все паразиты или их часть способны длительное время (7-14 мес и более) находиться в гепатоцитах в «дремлющем» состоянии (гипнозоиты), и только после окончания этого периода они начинают превращаться в мерозоиты, способные заражать эритроциты. Таким образом, это обусловливает возможность длительной инкубации и возникновение отдаленных рецидивов (до 3 лет).
Эритроцитарную шизогонию сопровождают циклическое развитие и множественное деление паразитов. После завершения процесса шизогонии эритроцит разрушается. Свободные мерозоиты активно проникают в новые эритроциты, но бóльшая их часть погибает от воздействия защитных иммунных механизмов хозяина. Продолжительность эритроцитарной шизогонии составляет у Р. vivax, P. ovale, P. falciparum 48 ч, а у Р. malariae - 72 ч. Во время эритроцитарного цикла часть мерозоитов превращается в половые формы - женские (макрогаметоциты) или мужские (микрогаметоциты). Гаметоциты попадают в организм комара-переносчика, когда он питается кровью больного малярией или паразитоносителя, содержащей зрелые гаметоциты. В желудке комара через 9-12 мин мужской гаметоцит выбрасывает восемь подвижных микрогамет, которые проникают в женскую клетку (макрогамету); после слияния ядер образуется зигота - круглая оплодотворенная клетка. Далее последовательно развиваются оокинеты, ооцисты со спорозоитами, их дозревание проходит в слюнных железах комара. При оптимальной температуре воздуха окружающей среды (25 °С) спорогония продолжается 10 дней у Р. vivax, 12 дней у P. falciparum, 16 дней у Р. malariae и Р. ovale; при температуре воздуха ниже 15 °С спорозоиты не развиваются.
Эпидемиология
Малярия остается наиболее широко распространенной в мире тропической болезнью и является серьезнейшей проблемой здравоохранения для 106 стран Азии, Африки, Южной Америки. По данным ВОЗ (2014), в настоящее время 82 страны мира являются высокоэндемичными, остальные находятся в предэлиминационном периоде или достигли элиминации малярии на своих территориях. В России регистрируются только завозные случаи малярии.
Источником возбудителя инфекции является человек, переносчиком - комары рода Anopheles. Малярия - природно-очаговая инфекция. Ее распространение в эндемичных регионах носит зонально-очаговый характер, определяемый сочетанием природных и социально-экономических факторов. P. vivax - возбудитель трехдневной малярии, широко распространен в странах Азии, Океании, Южной и Центральной Америки; на африканском континенте P. vivax постоянно обнаруживается в странах Восточной Африки. Ареал P. ovale невелик, занимает тропическую Африку от Гамбии - на севере до Конго - на юге континента. Вторая часть ареала - это страны западной части Тихого океана и Юго-Восточной Азии. Географический ареал тропической малярии простирается от 40° с.ш. до 20° ю.ш. P.falciparum и обусловливает до 50% заболеваемости малярией в мире. Четырехдневная малярия в настоящее время встречается в Африке, некоторых районах Центральной и Южной Америки, в странах Карибского бассейна, Юго-Восточной Азии.
Возможны три пути передачи малярии: 1) через комара; 2) от матери плоду или новорожденному (вертикальная передача); 3) трансфузионно через кровь или при медицинских манипуляциях при нарушении асептики при инъекциях (шизонтная малярия). Первый путь является основным.
Источником инфекции является больной малярией человек или здоровый паразитоноситель, в крови которого имеются зрелые гаметоциты. Эпидемиологическая опасность источника инфекции определяется численностью гаметоцитов в крови, длительностью периода гаметоносительства и доступностью его комарам. При заражении P. falciparum человек становится источником инфекции спустя 10-12 дней после начала паразитемии и может оставаться им в течение 2 мес и более. При заражении другими видами малярии человек является источником инфекции от момента появления половых форм (14-21-й день болезни) до их исчезновения. Гаметоциты погибают спустя несколько часов после созревания.
При вертикальной передаче малярии плод может заражаться через плаценту, что наблюдается редко. Чаще заражение происходит в родах, при попадании материнской крови в кровоток плода при отслойке плаценты. Вертикальная передача инфекции происходит у неиммунных к малярии матерей. У коренных жителей эндемичных очагов рождается иммунный ребенок, остающийся устойчивым к малярии в течение нескольких месяцев.
Восприимчивость к малярии всеобщая. Исключение составляют коренные жители Западной Африки, обладающие врожденной невосприимчивостью к Р. vivax.
Легко протекает тропическая малярия у носителей аномального гемоглобина S (серповидноклеточная анемия) и лиц с некоторыми другими генетически обусловленными аномалиями гемоглобина и ферментов эритроцитов (дефицит Г-6-ФДГ). Малярия - сезонная инфекция. Передача ее приходится на сезон активности комаров, т.е. на теплое время года. В районах с умеренным и субтропическим климатом сезон передачи ограничивается летне-осенними месяцами с устойчивой среднесуточной температурой выше 16 °С. Длительность его колеблется от 1,5 до 6-7 мес. В тропической зоне продолжительность сезона передачи инфекции является круглогодичной.
Очагом малярии считают населенный пункт с прилегающими к нему анофелогенными водоемами. О пораженности населения малярией судят по ряду маляриометрических индексов: паразитарный (процент лиц с паразитемией среди обследованной группы); селезеночный (процент лиц с увеличенной селезенкой в группе обследованных лиц).
Случаи малярии классифицируют как завозные, вторичные от завозного, местные, прививные.
Рецидивом называют случай малярии с повторными проявлениями болезни через несколько месяцев после первого заболевания. Первичные проявления трехдневной малярии вне сезона передачи (например, весной следующего года) - это первичные проявления после длительной инкубации.
Меры профилактики
ВОЗ осуществляет борьбу с малярией в мире в рамках программы «Обратить малярию вспять», принятой в 1998 г. В настоящее время для европейского региона ВОЗ поставлена цель: ликвидировать трехдневную малярию, вызванную P. vivax, и тропическую к 2015 г. Наиболее важным звеном в комплексе мероприятий является своевременное выявление и лечение источников инфекции. Борьба с переносчиками предусматривает энтомологические наблюдения в потенциальных очагах, гидротехнические мероприятия, обработку мест выплода комаров ларвицидами, помещений - имагицидами. Во время пребывания в местах, где распространена малярия, следует принимать меры предосторожности по защите от укусов комаров. Необходимо проводить консультации граждан, выезжающих в эндемичные регионы, информировать их о правильном проведении индивидуальной химиопрофилактики малярии. Химиопрофилактику малярии следует проводить людям, выезжающим в очаги средней и высокой эндемичности. Неиммунным беременным женщинам посещать такие районы не рекомендуется.
Индивидуальную химиопрофилактику малярии в эндемичных очагах, где распространена тропическая малярия, проводят мефлохином, который рекомендуется принимать 1 раз в неделю по 250 мг в течение всего периода пребывания в очаге, но не более 6 мес. В настоящее время часто используют маларонρ - таблетки для взрослых - 250 мг атовахонаρ + 100 мг прогуанила гидрохлорида, 1 таблетка за день до въезда в зону риска заражения, ежедневно 1 таблетка в эндемичном очаге и 7 дней после выезда. Хлорохин применяют в очагах четырехдневной, трехдневной и овале-малярии при отсутствии тропической малярии. Препараты следует начинать принимать до выезда в очаг, весь период пребывания в очаге в сезон, когда существует риск заражения, и в течение 4 нед после выезда из очага. Прибывшим из высокоэндемичного региона для профилактики поздних рецидивов трехдневной и овале-малярии дополнительно назначают примахин в дозе 0,25 мг/кг (основания) в течение 14 дней.
Патогенез и патоморфология
Все клинические проявления малярии обусловлены эритроцитарной шизогонией.
Малярийный приступ связан с завершением эритроцитарной шизогонии, массовым распадом эритроцитов и выходом в кровяное русло большого числа мерозоитов, продуктов метаболизма паразитов и гемолиза, обладающих пирогенными и токсическими свойствами, что приводит к развитию лихорадочной реакции. Приступ может возникнуть лишь тогда, когда число паразитов достигает так называемого пирогенного порога. При трехдневной, овале- и четырехдневной малярии для наступления приступа должно быть около 100 паразитов в 1 мкл крови, при тропической - до 600. При рецидивах приступы наступают при значительно более высокой паразитемии, чем при первичной малярии. Ввиду цикличности эритроцитарной шизогонии лихорадочные приступы повторяются каждые 48 ч при трехдневной, овале- и тропической малярии и каждые 72 ч - при четырехдневной.
При заражении малярией в организм человека попадает гетерогенная популяция паразитов, и шизогония в начальном периоде происходит асинхронно, в связи с чем тип лихорадки может быть неправильным. По мере формирования иммунных реакций способность к паразитированию в эритроцитах получает одна ведущая генерация плазмодия, обусловливающая свойственный данному виду ритм лихорадки. Только при тропической малярии может быть несколько ведущих генераций плазмодиев, поэтому лихорадка чаще носит неправильный характер. Активированные под влиянием паразитарных антигенов лимфоциты и макрофагальные клетки выделяют большое количество цитокинов, свободных окислительных радикалов, происходит активация системы комплемента. Это приводит к повреждению стенок сосудов микроциркуляторного русла. Основным механизмом развития осложнений при тропической малярии является скопление инвазированных эритроцитов в сосудах внутренних органов, преимущественно головного мозга, а также почек, печени, кишечника, костного мозга, плаценты и др. Это обусловлено изменениями свойств эритроцитов, проявляющихся цитоадгезией - приклеиванием пораженных эритроцитов к эндотелиальным клеткам, приводит к секвестрации в капиллярах и посткапиллярных венулах. В результате закупорки сосудов развивается ишемия пораженных органов. Некоторые штаммы Р. falciparum имеют свойство вызывать прилипание здоровых эритроцитов к инфицированным, что приводит к образованию «розеток». Эритроциты становятся ригидными, что ухудшает реологические свойства крови и усугубляет нарушение микроциркуляции.
Важным повреждающим фактором является гипоксия, особенно ткани мозга, вызванная недостаточной кислородно-транспортной функцией зараженных эритроцитов, что играет важную роль в генезе церебральной малярии.
Значительные нарушения возникают в системе гемостаза: при тяжелой тропической малярии наблюдаются признаки ДВС. Нарушение микроциркуляции, отек легких, нарушение функции почек и системы гемостаза являются ведущими патогенетическими факторами развития злокачественной малярии.
Причиной анемии является разрушение эритроцитов находящимися в них паразитами. Дополнительными факторами гемолиза могут служить аутоиммунные механизмы или фиксация циркулирующих иммунных комплексов к неинфицированным эритроцитам, что также приводит к их лизису. Развивающаяся при малярии гиперплазия ретикулоэндотелиальных элементов селезенки угнетает гемопоэз, что усиливает анемию и тромбоцитопению.
Активация анаэробного гликолиза приводит к накоплению лактата в крови, СМЖ и развитию ацидоза, что является одной из причин летального исхода при тяжелой тропической малярии.
Патоморфологическая картина характеризуется наличием анемии и изменением со стороны органов, богатых ретикулоэндотелиальной тканью. Вследствие отложения буро-черного пигмента гемомеланина внутренние органы приобретают аспидно-серо-дымчатую окраску. Отмечается значительное увеличение печени и селезенки. Селезенка полнокровна, микроскопически определяются гиперплазия фолликулов, пролиферация ретикулярных клеток, нередко инфаркты и кровоизлияния под капсулу. В печени наблюдают гиперемию, пролиферацию купферовских клеток, сосудистого эндотелия. При длительном течении болезни развиваются фиброзные изменения. В костном мозге выявляется выраженная эритробластическая реакция. В сердечной мышце обнаруживают дегенеративные изменения, кровоизлияния под эндокардом. Сосуды легких переполнены инфицированными эритроцитами. В осложненных случаях наблюдают пневмонию, отек легких. Поражение почек при тропической малярии характеризуется увеличением и полнокровием органов, признаками интерстициального нефрита и острого тубулярного некроза. При длительном течении четырехдневной малярии развивается нефротический синдром, сопровождающийся отложением в клубочках активных иммунных комплексов. При злокачественном течении тропической малярии наблюдаются дегенеративно-деструктивные изменения коры надпочечников. При исследовании ЖКТ выявляют некротические и язвенные изменения слизистой оболочки, петехиальные кровоизлияния. Наиболее характерные изменения при тяжелой тропической малярии возникают в головном мозге, где наблюдаются отек и набухание вещества мозга, периваскулярные и периганглионарные разрастания невроглии. Капилляры блокированы инвазированными эритроцитами и паразитами, имеются обширные гемостазы. Развивается периваскулярный отек с геморрагиями и очаговыми некрозами.
Клиническая картина
Выделяют 4 формы малярии: трехдневную малярию (vivax - малярия, malaria tertiana); трехдневную овале-малярию (ovale-malaria); четырехдневную малярию (malaria quartana); тропическую малярию (falciparum-малярия, malaria tropica).
В соответствии с рекомендациями ВОЗ различают малярию: неосложненную, тяжелую и осложненную. Тяжелые и осложненные формы малярии характерны в основном для инфекции P. falciparum. Болезнь, вызванная P. vivax, P. ovale и P. malariae, как правило, имеет доброкачественное течение.
В течении малярийной инфекции различают первичную малярию и рецидивы - ранние и поздние.
Первичная малярия охватывает начальный период заболевания, период разгара и реконвалесценции. Без лечения или неполноценной этиотропной терапии болезнь переходит в период рецидивного течения. Различают экзоэритроцитарные и эритроцитарные рецидивы, а по времени их развития, соответственно, - ранние и поздние.
Эритроцитарные рецидивы наблюдаются при заражении всеми видами плазмодиев. Ранние возникают в период до 2 мес после первичных приступов, развивающиеся в более поздние сроки относят к поздним рецидивам. При нелеченой или неадекватно леченной трехдневной и овале-малярии наступает «затишье» длительностью 6-11 мес с исчезновением паразитов из крови и клиническим «выздоровлением». Затем наступают поздние рецидивы, которые без лечения снова сменяются латентным периодом, после чего заболевание опять рецидивирует. Продолжительность существования в организме человека (без лечения) для P.falciparum составляет до 1,5 лет, для Р. vivax и P. ovale - до 3 лет, для P. malariae - многие годы, иногда пожизненно.
Трехдневная малярия
Инкубационный период - от 10-21 дня или 6-14 мес. Продромальные явления наблюдаются редко, но часто предшествуют рецидивам. Продолжительность продромального периода в среднем - 1-5 дней. Вначале температурная кривая носит неправильный характер (инициальная лихорадка). В последующем начинаются типичные малярийные пароксизмы с интермиттирующей лихорадкой. В малярийном приступе клинически отчетливо выражены три фазы: стадия озноба, жара и потливости. Приступ начинается с озноба, интенсивность которого может быть от легкого познабливания до потрясающего озноба. Кожа становится сухой, на ощупь шероховатой или «гусиной», холодной, конечности и видимые слизистые - цианотичными. Отмечаются сильная головная боль, иногда рвота, боли в суставах и поясничной области. Стадия озноба продолжается от нескольких минут до 1-2 ч и сменяется стадией жара. Температура тела достигает 40-41 °С, кожа становится сухой и горячей, лицо краснеет. Головная боль, боли в поясничной области и суставах усиливаются. Стадия жара продолжается от одного до нескольких часов и сменяется периодом потоотделения. Температура тела критически падает, потоотделение нередко профузное. Продолжительность приступа составляет 6-10 ч. Характерным считается наступление приступов болезни в утренние и дневные часы. После приступа наступает период апирексии, который длится около 40 ч. Интервал между приступами 48 ч. После 2-3 приступов выявляется увеличение печени и селезенки. Изменения в крови характеризуются гипохромной анемией, развивающейся со 2-й недели болезни, выявляются лейкопения, нейтропения с палочкоядерным сдвигом, относительный лифоцитоз, анэозинофилия и повышенная СОЭ. При естественном течении болезни после 12-14 приступов интенсивность лихорадки уменьшается, приступы постепенно угасают, размеры печени и селезенки сокращаются. Однако спустя 2 нед - 2 мес вновь возникают ранние рецидивы, характеризующиеся синхронной температурной кривой, увеличением печени и селезенки, анемией. В последующем, с нарастанием иммунитета, паразиты исчезают из крови и наступает латентный период. Через 6-8 мес, а иногда спустя 1-3 года происходит активация «дремлющих» в гепатоцитах тканевых форм паразитов и разовьются отдаленные рецидивы. Отдаленные рецидивы характеризуются острым началом, более легким течением, ранним увеличением селезенки, числом приступов до 7-8, меньшей интенсивностью и длительностью паразитемии, наличием гаметоцитов в крови.
Овале-малярия
Овале-малярия по многим клинико-патогенетическим признакам сходна с трехдневной vivax -малярией. Инкубационный период - 11-16 дней. При овале-малярии наблюдается первичная латенция: длительность инкубационного периода может растянуться от 2 мес до 2 и более лет. В клинической картине с первых дней болезни преобладает интермиттирующая трехдневная лихорадка, реже - ежедневная. Лихорадочные приступы с большим постоянством, в отличие от других видов малярии, наблюдаются в вечерние часы. Овале-малярия характеризуется преимущественно легким течением с небольшим числом приступов, что объясняют быстрым развитием высокого уровня иммунитета. Приступы протекают без выраженных ознобов и с меньшим уровнем температуры тела. При отсутствии лечения гистошизотропными препаратами возможны от 1 до 3 рецидивов с интервалом от 17 дней до 7 мес.
Четырехдневная малярия
Инкубационный период от 3 до 6 нед. Продромальные симптомы наблюдаются редко. Начало болезни острое. С первого приступа устанавливается интермиттирующая лихорадка с периодичностью приступов через 2 сут. Приступ обычно начинается в полдень, средняя его продолжительность около 13 ч. Период озноба длительный и резко выражен. Период жара продолжается до 6 ч, сопровождается головной болью, миалгиями, артралгиями, иногда тошнотой, рвотой. Могут наблюдаться беспокойство больных и бред. В межприступный период состояние больных удовлетворительное. Анемия, гепатоспленомегалия развиваются медленно - не ранее чем через 2 нед от начала болезни. Проявления четырехдневной малярии купируются без лечения после 8-14 приступов, но процесс эритроцитарной шизогонии на низком уровне длится многие годы. Чаще всего болезнь протекает без активизации эритроцитарной шизогонии в виде паразитоносительства, что делает таких лиц потенциально опасными донорами. Заболевание протекает обычно доброкачественно, однако в эндемичных очагах четырехдневная малярия ответственна за развитие нефротического синдрома с неблагоприятным прогнозом у детей.
Тропическая малярия
Наиболее тяжелая форма малярийной инфекции. Инкубационный период - 8-16 дней. В конце его у части неиммунных лиц отмечаются продромальные явления продолжительностью от нескольких часов до 1-2 дней. У большинства больных болезнь начинается остро, без продромы, с подъема температуры тела до 38-39 °С. Характерно отсутствие цикличности приступов лихорадки. Приступ начинается с озноба, продолжительность которого составляет от 30 мин до 1 ч. В этот период больной бледен, кожа холодная, нередко с шероховатостью по типу «гусиной кожи». Озноб сопровождается подъемом температуры тела до 38-39 °С. С прекращением озноба наступает вторая фаза приступа - жар. У больных появляется чувство тепла, иногда они испытывают сильный жар. Кожа горячая, сухая, лицо - гиперемировано. Продолжительность этой фазы - около 12 ч, она сменяется слабовыраженной потливостью. Температура тела падает до нормальных и субнормальных цифр и через 1-2 ч повышается снова. В некоторых случаях начало тропической малярии сопровождается тошнотой, рвотой, диареей. Наблюдаются: кашель, насморк, боли в горле. Позднее появляются герпетические высыпания на губах и крыльях носа. В острой стадии у больных отмечается инъекция конъюнктив, при тяжелом течении возможны петехиальные или более крупные субконъюнктивальные кровоизлияния. В периоде разгара озноб менее выражен, чем в первые дни болезни, его продолжительность составляет всего 15-30 мин. Лихорадка продолжается сутками, периоды апирексии регистрируются редко. При легком течении болезни высота температуры тела у больных достигает 38,5 °С, продолжительность лихорадки - 3-4 дня; при средней степени тяжести соответственно - 39-39,5 °С и 6-7 дней. Тяжелое течение болезни характеризуется повышением температуры тела до 40 °С и выше, продолжительность лихорадочного периода составляет 8 и более дней. Длительность отдельных приступов (а по существу наслоение нескольких) при тропической малярии достигает 30-40 ч. Преобладает неправильный тип температурной кривой, реже наблюдается ремиттирующий, изредка - интермиттирующий и постоянный типы. Увеличение печени и селезенки обычно появляется на 3-й день болезни. При УЗИ увеличение размеров печени и селезенки определяется уже на 2-3-й день от начала болезни. Нарушения пигментного обмена наблюдаются у больных с тяжелым и, реже, среднетяжелым течением тропической малярии. Более чем троекратное повышение активности аминотрансфераз в сыворотке крови прогностически неблагоприятно. К метаболическим нарушениям относят изменения в системе гемостаза и гипогликемию. Нарушения со стороны сердечно-сосудистой системы проявляются тахикардией, приглушенностью сердечных тонов, гипотензией. При тяжелой форме болезни появляются изменения на ЭКГ в виде уплощения и отрицательного зубца Т, снижения сегмента SГ, снижение вольтажа зубца R в стандартных отведениях. При тропической малярии часто наблюдают нарушения со стороны ЦНС, связанные с высокой лихорадкой и интоксикацией: головные боли, рвота, менингизм, судороги, сонливость, иногда делириоподобные состояния, но, в отличие от церебральной формы, сознание больного сохранено. Характерными являются гемолитическая анемия и лейкопения, а в лейкоцитарной формуле - эозино- и нейтропения, относительный лимфоцитоз. При тяжелых формах болезни нередко отмечается нейтрофильный лейкоцитоз; СОЭ постоянно и значительно повышена. Тромбоцитопения - признак, типичный для всех видов малярии.
Рецидивирующее течение тропической малярии обусловлено либо неполноценным этиотропным лечением, либо наличием резистентности P. falciparum к используемым химиопрепаратам. Естественное течение тропической малярии с благоприятным исходом продолжается не более 2 нед. При отсутствии этиотропной терапии через 7-10 дней наступают рецидивы. Беременность является фактором риска при тропической малярии. Это связано с более высокой заболеваемостью беременных женщин, склонностью к тяжелым клиническим формам, риском для здоровья и жизни ребенка, с ограничением терапевтического арсенала.
Малярия у детей
У детей, как и у взрослых, трехдневная и ovale-малярии протекают сходно, но чаще встречаются ежедневные приступы различной продолжительности, возникающие в разное время суток. У детей старшего возраста в начале болезни нередко наблюдается лихорадка постоянного типа, сменяющаяся типичными приступами. Во время приступа появляются бледность кожи, цианоз, иногда рвота, понос, общее беспокойство, судороги. В некоторых случаях отмечают боли в животе, аппендикулярный синдром, требующий срочной консультации хирурга. Печень и селезенка увеличиваются рано и почти одновременно. При прогрессировании болезни селезенка может достигать больших размеров. Быстро развивается анемия. При трехдневной и ovale-малярии случаи со смертельными исходами - явление редкое, у детей с резко выраженной анемией и дистрофией. У детей и подростков, получавших неадекватную терапию или не получавших лечение вовсе, описана злокачественная молниеносная форма трехдневной малярии. Злокачественные проявления малярии возникали при рецидивах или в начале болезни, чаще во время второго приступа. Внезапно во время пароксизма лихорадки появлялись сильные головные боли, рвота, судороги, сонливость, переходящая в бессознательное состояние. Через несколько часов наступала смерть. При патологоанатомическом исследовании обнаруживалось острое набухание и усиленное кровенаполнение вещества головного мозга. В отличие от малярийной комы при falciparum-малярии, в капиллярах мозга выявлялись лишь единичные плазмодии. Четырехдневная малярия у детей очень напоминает трехдневную, за исключением периодичности приступов. Четырехдневная малярия у детей может осложняться нефротическим синдромом. Чаще всего нефротический синдром развивается у детей в возрасте 5-8 лет.
В тропических странах с высоким уровнем эндемии (голо- и гиперэндемичные очаги) falciparum-малярия остается одной из главных причин заболеваемости и смертности детей. Наиболее часто и тяжело болеют дети от 6 мес до 4-5 лет, поэтому тропическую малярию у них обоснованно считают потенциально смертельной болезнью. Тропическая малярия у детей старшего возраста протекает обычно так же, как и у взрослых. У детей до 3-4 лет, особенно у детей грудного возраста, falciparum-малярия отличается отсутствием малярийных приступов. В то же время наблюдаются судороги, рвота, понос, боли в животе, с быстро прогрессирующим ухудшением состояния ребенка. В периоде апирексии температура не снижается до нормы, поэтому наблюдается ремиттирующая лихорадка. У детей грудного возраста первые приступы тропической малярии бывают очень тяжелыми, болезнь быстро приобретает злокачественное течение и может закончиться смертью. Часто появляются боли в животе и жидкий стул, иногда с примесью слизи и крови, иногда стул водянистый. Упорная диарея может вызвать тяжелую дегидратацию. Живот обычно увеличен в объеме. Селезенка увеличена, при частых повторных заражениях селезенка может достигать больших размеров и занимать почти всю брюшную полость. Увеличение селезенки у детей грудного возраста при малярии наблюдается непостоянно. Увеличение и уплотнение печени менее выражены, чем селезенки. Чем меньше возраст ребенка, тем быстрее развивается и нарастает анемия. Паразитемия у детей младшего возраста обычно высокая: P. falciparum может поражать до 20% эритроцитов. Если лечение не проводилось, то состояние ребенка быстро ухудшается и наступает летальный исход. Усугубляет прогноз присоединение интеркуррентных заболеваний: пневмонии, сальмонеллеза и других кишечных инфекций.
Осложнения. Наблюдаются преимущественно при тропической малярии и возможны на всех стадиях болезни. Прогностически неблагоприятные клинические признаки, указывающие на возможность развития злокачественной малярии, - ежедневная лихорадка, отсутствие апирексии между приступами, сильная головная боль, генерализованные судороги, повторяющиеся чаще 2 раз за 24 ч, децеребрационная ригидность, гемодинамический шок (систолическое давление ниже 70 мм рт.ст. у взрослого и менее 50 мм рт.ст. у ребенка), высокая паразитемия (более 100 тыс. Р. falciparum в 1 мкл крови), обнаружение различных возрастных стадий паразита в периферической крови, наличие гаметоцитов, нарастающий лейкоцитоз (более 12×109 /л). Показателями плохого прогноза являются также снижение глюкозы крови менее 2,2 ммоль/л, декомпенсированный метаболический ацидоз, более чем троекратное повышение активности аминотрансфераз в сыворотке крови, а также низкий уровень глюкозы в цереброспинальной жидкости и высокий уровень молочной кислоты (более 6 мкмоль/л), выраженная гипоальбуминемия.
Церебральная (мозговая) малярия, основным исходом которой является развитие коматозного состояния.
В клинической картине церебральной малярии выделяют три периода: сомноленции, сопора и комы. Стадия сомноленции характеризуется психической и физической вялостью больного, быстрым истощением. Стадия сопора проявляется глубокой прострацией больного с редкими проблесками сознания. Возможны атаксия, амнезия, судороги, иногда эпилептиформного характера. Роговичные рефлексы сохранены, зрачки нормальные. Сухожильные рефлексы повышены, появляются патологические рефлексы. При коме больной на внешние раздражители не реагирует. Наблюдаются нарушение конвергенции, расходящееся косоглазие, плавающие движения глазных яблок при открытых веках, горизонтальный и вертикальный нистагм, паралич VI пары черепных нервов; сухожильные и брюшные рефлексы отсутствуют, резко нарушены вегетативные функции. Выражены менингеальные симптомы и патологические рефлексы Бабинского, Россолимо и др. У детей старше 4 лет и взрослых для оценки степени нарушения сознания, как и при других поражениях ЦНС, используют шкалу комы Глазго. При спинномозговой пункции выявляется повышение внутричерепного давления. При церебральной малярии возможно развитие психоза. Возможны эпилептические приступы. Для постмалярийного психоза характерны депрессия, истерия, шизофреноподобные синдромы, у детей возможна временная задержка психического развития.
Гипохромная анемия относится к частым осложнениям всех форм малярийной инфекции. Тяжелая анемия диагностируется в случаях, когда гематокрит падает ниже 20%, а уровень гемоглобина - менее 50 г/л. Серьезными проявлениями малярии являются нарушения гемостаза: кровоточивость десен, кровоизлияние в сетчатку глаз, спонтанные носовые и желудочно-кишечные кровотечения, ДВС-синдром.
ОПН диагностируется при уменьшении выделения мочи менее 400 мл/сут у взрослого и менее 12 мл/кг у детей (и нет эффекта применения фуросемида), креатинин сыворотки крови превышает 265 ммоль/л, мочевина - более 21,4 ммоль/л, возникает гиперкалиемия.
Гемоглобинурийная лихорадка является следствием массивного внутрисосудистого гемолиза, что может быть обусловлено интенсивной инвазией или применением некоторых противомалярийных препаратов (хинин, примахин, сульфаниламиды) у лиц с дефицитом фермента глюкозо-6-фосфатдегидрогеназы (Г-6-ФД). При тяжелой ее форме развиваются интенсивная желтуха, выраженный геморрагический синдром, анемия и анурия, сопровождающиеся ознобом, высокой лихорадкой (40 °С), болями в поясничной области, повторной рвотой желчью, миалгиями, артралгиями. Моча приобретает темно-коричневый цвет, что обусловлено наличием оксигемоглобина. Число эритроцитов в тяжелых случаях снижается до 1×1012 /л, а уровень гемоглобина - до 20-30 г/л. Паразитов в крови при малярийной гемоглобинурии очень мало или они вовсе не обнаруживаются. При быстрой отмене противомалярийного препарата, вызвавшего гемолиз эритроцитов, состояние больного улучшается без серьезных последствий.
Малярийный алгид характеризуется клиническими проявлениями, свойственными ИТШ: нарушениями гемодинамики, микроциркуляции, нарушениями в системе гемостаза, полиорганной недостаточностью и гипотермией. Сознание сохранено, хотя в дальнейшем возможно развитие комы. Алгид может развиваться на фоне отека легких, метаболического ацидоза и резкого обезвоживания. Обычно отмечается высокий уровень паразитемии. Прогноз во многом зависит от своевременного и адекватного лечения.
Острый отек легких у больных тропической малярией часто приводит к летальному исходу.
Разрыв селезенки является редким, но грозным осложнением при любой клинической форме малярии. Разрыв органа может быть вызван перекрутом ее ножки с острым застоем крови и развитием субкапсулярной гематомы.
Нефротический синдром является осложнением четырехдневной малярии. Отличается медленным, неуклонно прогрессирующим течением с нарастанием протеинурии, гипопротеинемии, распространенными отеками, артериальной гипертонией и почечной недостаточностью.
Поражения глаза возможны при тропической малярии: кератит, реже встречаются ирит, иридоциклит, помутнение стекловидного тела, хориоретинит и кровоизлияния в сетчатку.
Диагностика
Диагностика малярии основывается на анализе клинической картины болезни, эпидемиологического анамнеза с обязательным подтверждением диагноза обнаружением малярийных паразитов в периферической крови.
Основным методом лабораторной диагностики малярии является микроскопическое исследование препаратов крови («толстой капли» и «тонкого мазка»), окрашенных по Романовскому-Гимзе. Обследованию на малярию подлежат: лихорадящие больные с неустановленным диагнозом в течение 3 дней в эпидемический сезон и 5 дней в остальное время года; больные с периодическими подъемами температуры, несмотря на проводимое лечение в соответствии с установленным диагнозом; реципиенты при повышении температуры тела в течение 3 мес после переливания крови; лица, проживающие в активном очаге, при любой лихорадке.
Забор крови для исследования рекомендуется производить как во время лихорадки, так и в период апирексии. Исследования препаратов крови проводят в течение 2-3 сут до 3-4 раз в день. Исследование «толстой капли» предназначено для обнаружения паразитов, так как объем крови в ней в 30-40 раз больше, чем в «тонком мазке». Особенности морфологии и тинкториальных свойств (окрашиваемости) разных возрастных стадий бесполых форм в эритроцитах хорошо различимы в «тонком мазке».
Для быстрого получения предварительного ответа используются экспресс-тесты (иммунохроматографические методы), основанные на обнаружении специфических антигенов плазмодиев. Тест-системы для экспресс-диагностики малярии, разработанные разными производителями, предназначены для детекции P. falciparum, P. falciparum + P. vivax или Plasmodium species. Использование экспресс-тестов позволяет получить результат уже через 10 мин.
Применение ПЦР позволяет выявлять носительство при низкой паразитемии и смешанную инфекцию разными видами плазмодиев, а также дифференцировать рецидив лекарственно-устойчивой falciparum -малярии с реинфекцией P. falciparum.
Дифференциальная диагностика
Дифференциальную диагностику малярии проводят с рядом инфекционных и неинфекционных заболеваний, сопровождающихся лихорадкой, анемией и гепатоспленомегалией. В зависимости от остроты течения болезни и ее длительности, малярию необходимо дифференцировать от гриппа, тифо-паратифозных заболеваний, лихорадки денге, паппатачи, тропических геморрагических лихорадок, висцерального лейшманиоза, вирусного гепатита, сепсиса, лептоспироза, острого бруцеллеза, спирохетозов, ПТИ, милиарного туберкулеза, холангита, лимфогранулематоза, гемолитической анемии, бабезиоза (затруднения здесь возникают даже при лабораторной диагностике, так как бабезии в форме «кольца» в препаратах крови очень напоминают P. falciparum в соответствующей стадии). Малярийную кому дифференцируют от комы мозговой, уремической, печеночной, диабетической, гипогликемической.
Лечение. Больные малярией подлежат госпитализации; лечение больных тяжелыми и осложненными формами проводят в условиях ОРИТ.
Этиотропное лечение больных малярией следует назначать немедленно после установления клинико-эпидемиологического диагноза и взятия крови для паразитологического исследования.
На выбор тактики лечения оказывают влияние следующие факторы: вид возбудителя, регион, где произошло заражение (для суждения об устойчивости плазмодиев к противомалярийным препаратам), период болезни, тяжесть заболевания, наличие и характер осложнений.
Противомалярийные препараты, применяемые в настоящее время, относят к следующим группам химических соединений: 4-аминохинолины (хлорохин), хинолинметанолы (хинин, мефлохин), фенантрен-метанолы (галофантринρ, халфанρ), производные артемизининаρ (артесунатρ, артеметерρ, артеэтерρ), антиметаболиты (прогуанил), 8-аминохинолины (примахин, тафенохинρ). Кроме того, применяют комбинированные противомалярийные препараты: пириметамин + сульфадоксин (Фансидар♠), хлорохин + прогуанил (саваринρ), ато-вахон + прогуанил (маларонρ), артеметер + люмефантрин (коартемρ или риаметρ).
При обнаружении у пациента P. vivax, P. ovale или P. malariae применяют препараты из группы 4-аминохинолинов, чаще всего хлорохин (Делагил♠). Схема лечения: первые 2 дня препарат применяют в суточной дозе 10 мг/кг основания (4 таблетки Делагила♠ за 1 прием), на 3-й день - 5 мг/кг (2 таблетки Делагила♠) однократно. В случаях резистентности к хлорохину лечение следует проводить мефлохином или хинином по схеме лечения неосложненной малярии. Приступы прекращаются через 24-48 ч, а паразиты исчезают из крови через 48-72 ч после начала приема хлорохина.
Для радикального излечения (предупреждения отдаленных рецидивов) при малярии, вызванной P. vivax или P. ovale, по окончании курса хлорохина применяют тканевой шизонтоцид - примахин, который назначают в течение 14 дней в дозе 0,25 мг/кг (основания) в сутки.
При обнаружении в крови неиммунных лиц P. falciparum в случаях нетяжелого и неосложненного течения, в соответствии с рекомендациями ВОЗ, применяют схемы лечения артемизинин-комбинированными противомалярийными препаратами. Используются 2 или более противомалярийных препарата с разным механизмом действия:
-
внутрь 3 сут: артесунатρ 4 мг/кг 1 р/сут + 1-е сутки сульфадоксин 25 мг/кг + пириметамин 1,25 мг/кг 1 р/сут;
-
внутрь 7 сут: артесунатρ 2 мг/кг 1 р/сут + доксициклин 3,5 мг/кг 1 р/сут;
-
внутрь 3 сут: артесунатρ 4 мг/кг 1 р/сут + 2 сут: мефлохин 1 р/сут (1-е сутки - 15 мг/кг, 2-е сутки - 10 мг/кг);
-
внутрь 2 сут: артеметерρ 80 мг 1 раз, затем по 80 мг через 8, 24 и 48 ч с момента первой дозы + 2 сут: люмефантринρ 480 мг, затем по 480 мг через 8, 24 и 48 ч с момента первой дозы.
Для лечения детей на начальном этапе можно применять свечи с артесунатомρ.
Если у больного не установлен вид возбудителя, то лечение рекомендуется проводить по схемам лечения тропической малярии. В случае появления у пациента рвоты менее чем через 30 мин после приема внутрь назначенного противомалярийного препарата следует повторно принять ту же дозу, если рвота отмечалась через 30-60 мин после приема таблеток, то дополнительно назначают половину дозы этого же препарата.
При выявлении гаметоцитоносительства P. falciparum назначают внутрь примахин (основание) 0,25 мг/кг в сутки в течение 2-3 сут.
При тяжелой и осложненной тропической малярии средством выбора для лечения, по рекомендации ВОЗ, является артесунатρ в/в капельно 7 сут: 1-я доза - 4 мг/кг, далее 2-7-е сутки 2 мг/кг в сутки. Хинин является альтернативным ЛС для лечения тяжелой falciparum-малярии и применяется в случае отсутствия артесунатаρ. Хинин применяется в/в капельно [в 5% растворе декстрозы (Глюкоза♠) или изотоническом растворе медленно]: 10 мг/кг 4 ч, далее - 20 мг/кг в сутки в 2-3 введения с интервалом 8-12 ч (суточная доза для взрослого не должна превышать 2,0 г) с последующим переводом на пероральную форму препарата. Монотерапия хинином не обеспечивает радикального излечения (так как он быстро выводится из организма, а его длительное применение часто приводит к развитию побочных реакций). Поэтому после улучшения состояния больного проводят курс лечения мефлохином, Фансидаром♠ или тетрациклином.
Больным с тяжелыми и осложненными формами малярии проводят интенсивную патогенетическую терапию в условиях ОРИТ. Если при анемии гематокрит снижается до 15-20%, то следует переливать эритроцитарную массу или цельную кровь. Переливание свежей цельной крови или концентратов факторов свертывания и тромбоцитов применяют при развитии ДВС. Основу терапии при отеке мозга составляют дезинтоксикация, дегидратация, оксигенотерапия, борьба с гипоксией мозга и дыхательными расстройствами. По показаниям вводят противосудорожные средства. Опыт лечения церебральной малярии доказал неэффективность и даже опасность применения некоторых ЛС: осмотических диуретиков, декстранов с низким молекулярным весом, эпинефрина (Адреналина♠), простациклина, пентоксифиллина (Трентала♠), циклоспорина, гипериммунных сывороток. Не рекомендуется также проведение гипербарической оксигенации. В случаях развития острой почечной или печеночно-почечной недостаточности суточную дозу хинина уменьшают до 10 мг/кг из-за возможной кумуляции препарата и вводят растворы медленно - 20 капель в минуту. В начальный период ОПН назначают форсированный диурез, а при отсутствии эффекта и нарастании азотемии проводят гемодиализ. Значительно эффективнее применение для этих целей продленной вено-венозной гемодиафильтрации. При развитии гемоглобинурийной лихорадки отменяют препарат, вызвавший гемолиз, при необходимости заменяют другим противомалярийным ЛС, одновременно назначают глюкокортикоиды (преднизолон 1-2 мг/кг), дезинтоксикационную терапию. При разрыве селезенки показано экстренное хирургическое вмешательство.
Для лечения рецидивов тропической малярии подбирают ранее не применявшийся препарат либо используют прежний, но в комбинации с другими противомалярийными ЛС. Лечение гаметоносительства проводят примахином в течение 1-3 дней в обычных терапевтических дозах.
Для лечения больных малярией, вызванной P. knowlesi, применяются описанные выше схемы лечения falciparum-малярии.
В процессе лечения проводят определение уровня паразитемии в динамике в периферической крови. Через сутки после начала этиотропного лечения уровень паразитемии должен снизиться на 25% и более, на 3-й день - не должен превышать 25% исходного. Наличие паразитов в препарате крови на 4-й день после начала лечения при соблюдении всех условий успешной терапии служит признаком резистентности возбудителя к применяемому препарату.
Прогноз
В подавляющем большинстве случаев летальность обусловлена церебральной формой тропической малярии. Летальные исходы от других видов малярии очень редки.
Диспансеризация
За больными, перенесшими тропическую малярию, устанавливают диспансерное наблюдение в течение 1-1,5 мес и с интервалом 1-2 нед проводят паразитологическое исследование крови. Диспансеризация больных, перенесших малярию, вызванную P. vivax, P. ovale, P. malariae, должна проводиться в течение 2 лет. Любое повышение температуры тела у этих лиц требует лабораторного исследования крови с целью обнаружения малярийных плазмодиев.
Токсоплазмоз
Токсоплазмоз ( англ. toxoplasmosis) - инвазия, вызываемая Toxoplasma gondii, характеризующаяся разнообразием вариантов течения и полиморфизмом клинических проявлений.
Коды по МКБ-10
B58 Токсоплазмоз.
Включено: инфекция, вызванная Toxoplasma gondii. Исключено: врожденный токсоплазмоз (P37.1).
Этиология
Возбудитель - Toxoplasma gondii рода Toxoplasma относится к типу Sporozoa классу Coccidеа подсемейству Toxoplasmatinae. В организме человека и животных T. gondii существует в следующих формах: трофозоит (тахизоит), циста (брадизоит) и ооциста. Трофозоиты размером 4-8×2-3 мкм напоминают по форме полумесяц. Цисты, покрытые плотной оболочкой, достигают размеров до 100 мкм. Ооцисты - овальной формы, диаметром 9-11 и 11-14 мкм. По данным генотипирования, в настоящее время различают 3 группы штаммов токсоплазм.
У человека встречаются штаммы 2-й и 3-й групп токсоплазм, причем представители последней группы чаще обнаруживаются у больных ВИЧ-инфекцией. Установлено, что трофозоиты и цисты имеют как общие антигены, так и характерные только для каждой из них. Т. gondii является облигатным внутриклеточным паразитом, который внедряется в эпителиальные клетки кишечника, где делится посредством эндодиогении. Затем по мере накопления трофозоиты (тахизоиты) гематогенно и лимфогенно разносятся в другие органы и ткани (ЛУ, печень, легкие и др.), где также активно проникают в клетки. В пораженных клетках появляются скопления трофозоитов одной генерации, окруженные мембраной паразитофорной вакуоли, так называемые псевдоцисты. В результате ответной иммунной реакции хозяина паразиты исчезают из крови, а в инфицированных клетках-мишенях формируются покрытые плотной оболочкой цисты. При хроническом течении болезни T. gondii в виде цист, расположенных внутриклеточно, сохраняют жизнеспособность неопределенно долго. Цисты локализуются преимущественно в головном мозге, сердечной и скелетных мышцах, матке, глазе.
Окончательные хозяева - кошки и другие представители семейства кошачьих - также могут заражаться токсоплазмами в различных стадиях развития. В их организме из кишечника токсоплазмы способны перемещаться в различные органы. Размножение паразита посредством мерогонии происходит в эпителиальных клетках кишечника, в результате образуются мерозоиты. Часть мерозоитов дает начало мужским и женским половым клеткам - гамонтам. После выхода из энтероцитов мужские гамонты многократно делятся - образуются микрогаметы, имеющие сходство со сперматозоидами; из женских гамонтов формируются макрогаметы, напоминающие яйцеклетки. После оплодотворения образуется незрелая ооциста, которая с фекалиями выходит в окружающую среду. При благоприятных условиях созревание ооцист - спорогония продолжается от 2 дней до 3 нед. Зрелые цисты устойчивы к действию неблагоприятных факторов и могут сохранять жизнеспособность до 1 года и более.
Эпидемиология
Окончательными хозяевами T. gondii являются домашняя кошка и другие представители семейства кошачьих (рысь, пума, ягуар и др.). Промежуточными хозяевами служат сотни видов животных: различные виды грызунов, зайцеобразных, хищных сумчатых, насекомоядных, непарно- и парнокопытных, приматов, птиц. Ведущее значение в распространении болезни имеют синантропные животные, прежде всего кошки, которые, в свою очередь, заражаются при поедании грызунов, птиц, мяса домашних животных, а также при попадании в их кишечник ооцист из окружающей среды. У животных наблюдается также трансплацентарный путь передачи инфекции. Человек заражается пероральным путем при употреблении инфицированного мяса, содержащего тканевые цисты (сырое или термически недостаточно обработанное мясо), при попадании ооцист с продуктами и водой, а также при проглатывании ооцист с объектов, загрязненных кошками. Возможно заражение через поврежденную кожу и слизистые оболочки при тесном контакте с инфицированным животным сырьем (у работников мясокомбинатов, скотобоен и т.п.). Описаны случаи инфицирования при пересадке органов. У людей, больных острым токсоплазмозом, возбудителя обнаруживают в слюне, мокроте, моче, менструальной крови, фекалиях. Однако роль человека как источника Т. gondii определяется в основном трансплацентарной передачей плоду беременной с острым токсоплазмозом. Передача инфекции начинается с 3-го месяца беременности и достигает максимума в III триместре. У женщин, родивших однажды инфицированного ребенка, при последующих беременностях передачи токсоплазмоза плоду не происходит.
Иммунитет при токсоплазмозе нестерильный, однако напряженность его такова, что реинвазия не наблюдается. В большинстве случаев у людей без нарушений иммунной системы результатом заражения T. gondii является формирование здорового носительства.
Возбудитель распространен повсеместно. Уровень инфицированности населения в разных странах колеблется в широких пределах и во многом зависит от санитарно-гигиенических условий, а также особенностей питания населения. В развивающихся странах высока пораженность токсоплазмозом детского населения, в развитых странах инфицированность нарастает с возрастом.
Меры профилактики
Специфические. Основное мероприятие по предупреждению врожденного токсоплазмоза - своевременное обследование женщин детородного возраста и беременных в женских консультациях. У ВИЧ-инфицированных проводят первичную и вторичную профилактику токсоплазмоза. Цель первичной профилактики - предупредить заражение T. gondii или развитие токсоплазменного энцефалита у лиц с латентно протекающей формой заболевания. У ВИЧ-инфицированных с положительной серологической реакцией на токсоплазмоз проводят химиопрофилактику этиотропными препаратами. Цель вторичной профилактики или поддерживающего лечения - предупредить рецидивы токсоплазменного энцефалита у больных СПИДом.
Неспецифические: тщательная термическая обработка мясных продуктов и молока, соблюдение правил личной гигиены, особенно в группах риска (ветеринары, работники мясокомбинатов, охотники и др.), предотвращение загрязнения детских песочниц экскрементами кошек.
Патогенез
Из места внедрения (чаще всего - пищеварительный тракт) токсоплазмы попадают в регионарные ЛУ, где размножаются и вызывают развитие лимфаденита. Затем паразиты поступают в кровь и разносятся по всему организму, вследствие чего возникают очаги поражения в нервной системе, печени, селезенке, ЛУ, скелетных мышцах, миокарде, глазах. Вследствие размножения трофозоитов разрушаются зараженные клетки. Вокруг очагов некроза и скоплений токсоплазм формируются специфические гранулемы. При нормальном иммунном ответе трофозоиты исчезают из тканей, и начинается процесс формирования цист. Инвазия переходит из острой фазы в хроническую, а еще чаще - в хроническое носительство с сохранением цист в тканях органов. В неблагоприятных для организма условиях оболочка цист разрушаются; высвободившиеся паразиты, размножаясь, поступают в кровоток, что клинически проявляется обострением хронического токсоплазмоза. Воспалительные инфильтраты и некрозы обнаруживают в скелетных мышцах, миокарде, легких и других органах. В головном мозге появляются воспалительные очаги с последующим некрозом, что приводит к образованию петрификатов. В сетчатке и сосудистой оболочке глаза возникает продуктивно-некротическое воспаление. Злокачественное течение токсоплазмоз приобретает на фоне развернутой картины СПИДа, при этом развивается генерализованная форма заболевания, в ряде случаев являющаяся причиной гибели больных. В ответ на воздействие антигенов токсоплазм вырабатываются специфические антитела и происходит аллергическая перестройка по типу ГЗТ.
Врожденный токсоплазмоз является следствием заражения плода от матери, инфицированной во время беременности. В результате паразитемии возбудитель заносится в плаценту, в которой формируется первичный очаг, а из него гематогенным путем токсоплазмы попадают в плод. Заражение плода происходит вне зависимости от наличия клинических проявлений у беременной, но исход различен при инфицировании в разные сроки беременности. Инвазия в ранние сроки эмбриогенеза заканчивается спонтанным выкидышем, мертворождением, а также приводит к тяжелым аномалиям развития (анэнцефалии, анофтальмии и др.), часто несовместимым с жизнью, или развиваются признаки генерализованного токсоплазмоза. При заражении в III триместре беременности преобладают асимптомные формы, поздние клинические признаки которых проявляются через месяцы и годы.
Клиническая картина
Приобретенный токсоплазмоз
У лиц с нормальным иммунным ответом в большинстве случаев токсоплазмоз протекает в латентной форме. Манифестный токсоплазмоз протекает в острой (до 0,01% инфицированных) и хронической (1-5%) форме, имея склонность к рецидивам и обострениям.
Острая форма. У лиц с нормальным иммунным статусом заболевание часто клинически не проявляется. О заражении свидетельствует наличие в крови специфических IgМ-антител с повышением их уровня в динамике и последующей сменой на IgG. При развитии манифестной формы острого приобретенного токсоплазмоза инкубационный период длится около 2 недель. Заболевание проявляется лихорадкой, интоксикацией, ЛАП; возникают высыпания на коже, диарея. Поражение скелетных мышц проявляется миалгией, часто наблюдается артралгия. Выражены гепатолиенальный синдром и признаки поражения ЦНС. Возможны катаральные проявления, пневмония, миокардит.
Хроническая форма приобретенного токсоплазмоза может развиться первично или вследствие перенесенной острой формы заболевания. В манифестных случаях хронический токсоплазмоз характеризуется полиморфизмом клинических проявлений. Начало постепенное, с головной боли, общей слабости, повышенной утомляемости, снижения памяти, неврозоподобных изменений, нарушения сна, длительного субфебрилитета. У большинства больных выявляют ЛАП, миозиты, артралгии. При поражении миокарда больные предъявляют жалобы на одышку, сердцебиение, боли в области сердца, указывающие на развитие миокардита или миокардиодистрофии. Возможны интерстициальные пневмонии, хронический гастрит, энтероколит, поражения желчевыводящих путей и женской половой системы (нарушения менструального цикла, сальпингоофорит, эндометрит, бесплодие).
Важную роль при приобретенном хроническом токсоплазмозе играет поражение нервной системы: менингоэнцефалит, энцефалит, церебральный арахноидит, диэнцефальные и психические расстройства, судорожный синдром.
При поражении глаз возможны патологические изменения во всех оболочках, поражения зрительного нерва, наружных мышц глазного яблока. В сочетании с хориоретинитом и другими изменениями иногда отмечают кератосклерит или кератоувеит.
У лиц с иммунодефицитным состоянием (СПИД, злокачественные лимфомы, применение иммунодепрессантов) латентное течение токсоплазмоза или новое заражение, как и при других оппортунистических инфекциях, переходит в генерализованный процесс с поражением головного мозга, миокарда, легких и других тканей и органов[1].
Врожденный токсоплазмоз
Развивается только при инфицировании женщины во время беременности. У женщин с ВИЧ-инфекцией латентная, возникшая до беременности инвазия может реактивироваться. Врожденный токсоплазмоз в 25-30% случаев протекает с клиническими проявлениями, в остальных случаях - латентно. В зависимости от сроков инфицирования матери во время беременности врожденный токсоплазмоз у ребенка может выражаться в различных формах.
Острая форма развивается при инфицировании в поздние сроки беременности. Она протекает как тяжелое генерализованное заболевание с выраженной интоксикацией, лихорадкой, высыпаниями на коже, изъязвлениями на слизистой оболочке носоглотки, желтухой, отеками, гепатоспленомегалией. Позже возникает токсоплазмозный энцефалит. Выявляют поражение глаз и других органов. Если ребенок переносит острую форму внутриутробно, он может родиться с признаками хронического врожденного токсоплазмоза: с последствиями энцефалита в виде гидроцефалии, олигофрении, судорожного синдрома, с поражением глаз (вплоть до микро- и анофтальмии). Постепенно процесс переходит во вторично-хроническую форму с резидуальными явлениями.
При хроническом врожденном токсоплазмозе (резидуальные явления у детей и подростков) выявляют остаточные явления со стороны ЦНС и органов зрения: отставание в умственном и физическом развитии, гидроцефалию, микроцефалию, парезы и параличи, микрофтальм, микрокорнеа, хориоретинит, атрофию зрительного нерва, катаракту, косоглазие, нистагм, эпилептиформные судороги.
Диагностика
Клиническая диагностика
Диагноз ставят, выявляя эпидемиологические факторы риска инфицирования и учитывая данные клинической картины и результатов лабораторной диагностики.
Специфическая лабораторная диагностика
Специфические антитела классов IgM и IgG к антигенам токсоплазм выявляют в повторных серологических исследованиях: ИФА, РНГА и РИФ (но они недостаточно информативны у больных СПИДом); при церебральном токсоплазмозе в сыворотке крови и СМЖ определяют титры IgG-антител (реже IgM), выявляют ДНК возбудителя методом ПЦР. В диагностике токсоплазмоза используют внутрикожную пробу с токсоплазмином, но она не дает информации о характере течения заболевания. Беременным с положительными серологическими реакциями проводят УЗИ плода в динамике. При диагностике церебрального токсоплазмоза (особенно у больных СПИДом) проводят КТ, МРТ головного мозга.
Токсоплазмоз дифференцируют со многими заболеваниями инфекционной и неинфекционной природы: лимфогранулематозом, лимфолейкозом и другой патологией системы крови, туберкулезом, листериозом, иерсиниозом, ИМ, заболеваниями нервной системы и органов зрения. У детей, с учетом возраста, токсоплазмоз необходимо дифференцировать с ЦМВИ, герпетическими инфекциями и различными ОРВИ, краснухой, ВГ. При повторных выкидышах, рождении детей с аномалиями развития у серопозитивных женщин необходимо исключать акушерскую и гинекологическую патологию.
Лечение
Специфическая терапия наиболее эффективна в острой фазе заболевания; больные с латентной формой хронического приобретенного токсоплазмоза в лечении не нуждаются. Эффективность этиотропных ЛС при хроническом токсоплазмозе низкая, поскольку химиопрепараты и антибиотики практически не воздействуют на эндозоиты, находящиеся в тканевых цистах. При хроническом токсоплазмозе лечение показано только при обострении процесса и при невынашивании беременности (лечение проводят вне периода беременности). Применяют пириметамин в сочетании с сульфаниламидами или антибиотиками. Длительность цикла лечения 7 сут. Обычно проводят 2-3 цикла с перерывами между ними в 10 сут. Суточные дозы пириметамина и сульфадиазина приведены в табл. 22-4; антибиотики назначают в обычных дозах. Возможно применение Ко-тримоксазола♠ по 1 таблетке 2 р/сут в течение 10 сут. Проводят два цикла с интервалом 10 сут. Одновременно назначают кальция фолинат по 2-10 мг в сутки или дрожжи пивные по 5-10 таблеток в сутки. Необходимы контроль гемограммы (возможно угнетение костномозгового кроветворения) и общий анализ мочи в динамике.
Препараты |
Суточные дозы препаратов |
|||
|---|---|---|---|---|
1-3-й дни курса |
4-7-й дни курса |
|||
взрослые |
дети |
взрослые |
дети |
|
Пириметамин (1 раз в день) |
75 мг |
2 мг/кг |
25 мг |
1 мг/кг |
Сульфадиазин (в 4 приема) |
2000 мг |
100 мг/кг |
2000 мг |
25 мг/кг |
Лейковорин |
- |
1 мг |
2-10 мг |
1 мг |
Эффективен противомалярийный препарат пириметамин + сульфадоксин (Фансидар♠).
В качестве альтернативной схемы применяют доксициклин по 100 мг каждые 12 ч в сочетании с метронидазолом - по 250 мг каждые 8 ч внутрь; длительность курса - 10 дней. Беременных лечат спирамицином (накапливается в плаценте и не проникает в плод). Его назначают по 3 млн ЕД 3 р/сут в течение 2-3 нед.
Лечение детей с врожденным токсоплазмозом проводят теми же препаратами, что и лечение взрослых: пириметамин по 1 мг/кг в сутки в 2 приема в комбинации с сульфаниламидами короткого действия по 0,1 г/кг в сутки в 3-4 приема. Лечение проводят циклами: 5 сут принимают пириметамин, а сульфаниламидный препарат на 2 сут дольше - 7 сут. Проводят 3 цикла с перерывами между ними в 7-14 сут. Дополнительно назначают кальция фолинат по 1-5 мг 1 раз в 3 сут в течение всего курса лечения для устранения побочного действия антифолатов (пириметамина, сульфаниламидов). Такой же курс лечения по показаниям (например, хроническая форма заболевания, иммунодефицитное состояние, обострение хориоретинита) повторяют через 1-2 мес.
Прогноз при приобретенном токсоплазмозе благоприятный. Генерализованные формы, наблюдающиеся у больных СПИДом и у пациентов с иммунодефицитным состоянием другой этиологии, протекают тяжело и могут закончиться летальным исходом.
В диспансерном наблюдении нуждаются больные острой формой приобретенного и с рецидивирующим течением хронического токсоплазмоза, а также серопозитивные к антигенам токсоплазмы ВИЧ-инфицированные пациенты. Объем и сроки диспансерного наблюдения зависят от клинической формы токсоплазмоза и характера течения заболевания. При врожденном токсоплазмозе у детей в зависимости от резидуальных явлений вопрос о диспансеризации решают совместно с неврологами, офтальмологами и другими специалистами. Некоторые пациенты нуждаются в пожизненном диспансерном наблюдении (с поражением глаз при неэффективности этиотропного лечения, серопозитивные к антигенам токсоплазмы ВИЧ-инфицированные пациенты).
Криптоспоридиоз
Криптоспоридиоз (Cryptosporidiosis) - зоонозная протозойная инфекция, характеризующаяся преимущественным поражением тонкого кишечника, диареей с развитием обезвоживания. Относится к СПИД-индикаторным заболеваниям.
Код по МКБ-10
А07.2 Криптоспоридиоз.
Этиология
Криптоспоридии - простейшие рода Cryptosporidium. У человека паразитируют чаще 2 вида криптоспоридий - C. parvum, передающиеся к человеку от животных (молодняка жвачных, мышей, крыс, собак, кошек, волков и др.), и C. hominis, паразитирующие только у человека. Однако до 30% криптоспоридий, выделенных от больных ВИЧ-инфекцией, относятся к редким видам (C. baileyi и C. muris), которые паразитируют соответственно у птиц и грызунов, а также C. canis, паразитирующие у собак, и C. meleagridis, паразитирующие у индюков.
Криптоспоридии - облигатные паразиты, инфицирующие микроворсинки слизистых оболочек ЖКТ и дыхательных путей. Жизненный цикл криптоспоридий проходит в организме одного хозяина, включает стадии шизогонии, мерогонии, гаметогонии и спорогонии. Локализуются криптоспоридии в паразитоформной вакуоли, образованной микроворсинками кишечника, поэтому паразит располагается внутриклеточно, но экстраплазматически. Мерозоиты первой генерации способны пролиферировать в шизонты первой или в шизонты второй генерации, поэтому численность паразитов увеличивается. В организме хозяина образуются два типа ооцист: толстостенные - покидающие организм хозяина с фекалиями, и тонкостенные - высвобождающие спорозоиты в кишечнике, вследствие чего возможна аутоинфекция.
Ооцисты криптоспоридий, сохраняясь в окружающей среде, способны к инвазии в течение 18 мес при температуре 4 °С и 1 нед при -10 °С. При нагревании до 72 °С они погибают в течение 1 мин. Ооцисты резистентны к действию дезинфектантов, особенно содержащих хлор. В связи с этим, а также с их малыми размерами (4-7 мкм), позволяющими проходить через многие фильтры, очистка воды от криптоспоридий с помощью современных технологий невозможна, поэтому инфекция распространяется преимущественно водным путем. В настоящее время не существует ни одного достаточно эффективного препарата, к которому криптоспоридии были бы чувствительны.
Эпидемиология
Источник инвазии для человека - различные млекопитающие, в основном домашний скот (телята, ягнята), а также животные, обитающие в местах проживания людей (грызуны и т.д.).
Криптоспоридиоз может передаваться от человека к человеку. Об этом свидетельствуют случаи заражения детей в детских учреждениях, внутрибольничные вспышки и заражения лабораторного персонала. Известны случаи внутрисемейного заражения, когда взрослые заражались от детей.
Механизм передачи в основном фекально-оральный (через пищевые продукты, воду, молоко, контактно-бытовым путем); существует вероятность передачи криптоспоридий половым путем у гомосексуалов.
С эпидемиологической точки зрения важен тот факт, что ооцисты в инвазивных стадиях могут выживать в фекалиях больных на протяжении 2 нед после прекращения диареи. Криптоспоридии - один из этиологических факторов диареи путешественников.
Более чем в 80% случаев заболевание носит спорадический характер, остальные 20% включают групповые заболевания, в том числе водные вспышки. В настоящее время считают, что водный путь - основной путь передачи инфекции.
Заражение людей может происходить при купании в реках, озерах, плавательных бассейнах. Описаны случаи заражения при употреблении сырого молока и приготовленного из него мороженого, а также сырых овощей, соков. В то же время имеются данные о защитном действии большого количества сырых овощей и фруктов - особенно при употреблении томатов, моркови, сельдерея.
Естественная восприимчивость людей низкая. Заболеванию больше подвержены дети до 2 лет, а также лица с иммунодефицитными состояниями и особенно больные ВИЧ-инфекцией в поздних стадиях болезни. К группе риска относят ветеринаров, животноводов, работников предприятий по убою скота. Криптоспоридиоз имеет убикватное распространение.
Антитела к криптоспоридиям обнаружены в 25-35% лиц в популяциях индустриально развитых стран и около 65% - в развивающихся.
Профилактика
Эффективной специфической профилактики криптоспоридиоза не разработано. Необходимо максимально ограничивать контакты больных, страдающих иммунодефицитными состояниями, с крупным рогатым скотом, избегать купания в естественных и искусственных водоемах и употребления сырой воды. Лицам с нормальной иммунной системой каких-либо специальных мер профилактики не требуется.
В связи с водным путем распространения криптоспоридий во многих странах ужесточаются требования к очистке водопроводной воды, в основном за счет усовершенствования технологии фильтрации.
Патогенез
Патогенез изучен недостаточно. Преобладание холероподобной профузной водянистой диареи в клинической картине болезни предполагает продукцию энтеротоксина, но токсин у криптоспоридий не обнаружен. Наиболее типичная локализация процесса - дистальный отдел тонкой кишки. После попадания ооцист в кишечник начинается усиленное размножение паразита; образующиеся мерозоиты поражают большое число энтероцитов, вызывая у них атрофию ворсинок. Это сопровождается гипертрофией крипт, моно- и полиморфноядерной инфильтрацией базальной мембраны и приводит к появлению кратерообразных углублений на поверхности эпителия. При тяжелых формах болезни происходит тотальное поражение микроворсинок.
В результате массивного поражения микроворсинок нарушается всасывание воды и электролитов, повышается их секреция, что проявляется водянистой диареей. Нарушается ферментативная деятельность кишечника, возникают вторичные мальабсорбция и стеаторея. У больных с выраженным иммунодефицитом возможно поражение не только ЖКТ, но и гепатобилиарной системы и дыхательных путей. Доказана роль гуморального иммунитета, но главное значение имеет нарушение функции Т-клеток.
Клиническая картина
Инкубационный период 2-14 дней. На протяжении 7-10 (от 2 до 26) дней у больных без иммунодефицита отмечается обильный водянистый (холероподобный) стул с неприятным запахом до 20 р/сут. Больной теряет при этом от 1 до 15-17 л жидкости в день. Профузный понос сопровождается умеренными спастическими болями в животе, тошнотой и рвотой (50%), небольшим повышением температуры тела (не выше 38 °С у 30-60% больных во время эпидемических вспышек), отсутствием аппетита, головной болью. Обычно наступает выздоровление, но у ослабленных детей болезнь может продолжаться более 3 нед и закончиться летальным исходом. Очень редко заболевание приобретает характер колита с появлением крови и слизи в кале.
У людей с различными нарушениями иммунитета, особенно у больных на поздних стадиях ВИЧ-инфекции, болезнь принимает хронический характер (до 6-11 мес, если больной не умирает раньше) и сопровождается резким похуданием (слим-синдром).
Для 15% больных характерны боли в животе с локализацией в правом верхнем квадранте, тошнота, рвота; возможна желтуха, в связи с развитием холецистита. При УЗИ выявляют увеличение и растяжение желчного пузыря, утолщение его стенок, изменения в желчных протоках. При гепатите и склерозирующем холангите развиваются лихорадка, тошнота, рвота, боли в правом подреберье. Диарея при этом может отсутствовать. Повышаются уровень билирубина, активность ЩФ и трансфераз. Поджелудочная железа поражается редко.
При поражении легких, чаще всего сочетающемся с поражением кишечника, появляется кашель, затруднение дыхания, одышка, возможна охриплость голоса. При проведении биопсии легкого или аутопсии на поверхности эпителия склерозированных бронхиол обнаруживают скопления криптоспоридий.
Возможен реактивный полиартрит с поражением коленных, локтевых, лучезапястных и голеностопных суставов.
Лабораторная диагностика
Тяжелое течение болезни развивается при выраженном иммунодефиците (число СD4-лимфоцитов ниже 0,1×109 /л), поэтому в анализах регистрируются изменения, свойственные его проявлениям (например, лейкопения и эритроцитопения).
Для выявления ооцист криптоспоридий в испражнениях применяют методы окраски по Цилю-Нильсену, сафранином по Кестеру и азур-эозином по Романовскому-Гимзе, а также методы негативного окрашивания. Применяют методы флотации или седиментации (если в материале содержится небольшое количество ооцист), при использовании соответствующих консервантов ооцисты могут быть обнаружены в нативном материале, хранящемся в холодильнике в течение 1 года.
В последнее время используют моноклональные антитела с флюоресцентной меткой, что позволяет визуализировать возбудителя с высокой специфичностью и чувствительностью. Реакцию флюоресцирующих антител, ИФА и ИБ используют в эпидемиологических исследованиях. Возможно применение ПЦР.
Поражение органов брюшной полости при криптоспоридиозе можно обнаружить при УЗИ. При исследовании желудка видны деформация стенок и утолщение складок слизистой оболочки. При поражении двенадцатиперстной и тонкой кишки видны спастические сокращения кишечной стенки, резко выраженное расширение просвета, атрофия ворсинок слизистой оболочки, гиперсекреция и утолщение складок.
Дифференциальную диагностику проводят с заболеваниями, сопровождающимися диареей и обезвоживанием, в частности с холерой (особенно при вспышках болезни), амебиазом, сальмонеллезом, шигеллезом, кампилобактериозом, а у больных ВИЧ-инфекцией - с ЦМВ-колитом, микроспоридиозом, изоспорозом, заболеваниями желчевыводящей системы.
Лечение
Режим. Диета
Для лечения больных с легким или среднетяжелым течением болезни при отсутствии нарушений в иммунной системе достаточно полноценной диеты (стол № 4) и приема адекватного количества жидкости (солевые растворы для оральной регидратации). При тяжелом течении проводят внутривенную регидратацию в соответствии со степенью обезвоживания.
Медикаментозная терапия
Эффективных средств этиотропной терапии нет.
В связи с длительным, хроническим и тяжелым течением у больных СПИДом необходимо с первых дней болезни проводить комплексную терапию: АРВТ (постепенно улучшает показатели иммунитета, тем самым способствует купированию диареи); пероральную или внутривенную регидратацию; ферментные препараты, пробиотики, содержащие E. coli и бифидобактерии; симптоматические средства.
Прогноз у больных ВИЧ-инфекцией в поздних стадиях неблагоприятный.
Пневмоцистоз
Пневмоцистоз (pneumocystosis, пневмоцистная пневмония) - оппортунистическая инфекционная болезнь, вызываемая Pneumocystis jiroveci (старое название - Pneumocystis carinii), характеризующаяся развитием интерстициальной пневмонии с выраженной ДН, возможным поражением других органов.
Коды по МКБ-10
В59 Пневмоцистоз (Y17.3).
Этиология
Пневмоцисты - одноклеточные эукариоты, имеющие ядерную оболочку и внутриклеточные органеллы. Они проходят стадии развития, свойственные простейшим. Первая фаза: трофозоиты - овальная или амебовидная клетка размером 1-5 мкм, от ее поверхности отходят выросты, с помощью которых трофозоиты плотно прилегают к эпителию легкого. Вторая фаза: прециста - овальная клетка размером 2-5 мкм, не имеющая выростов, стенка прецисты состоит из трех слоев, в цитоплазме имеется несколько глыбок (делящиеся ядра); третья фаза: циста - клетка размером 3,5-6 мкм, стенки ее также состоят из трех слоев, в цитоплазме обнаруживается до 8 внутрицистных телец диаметром 1-2 мкм, имеющих двуслойную оболочку. Внутрицистные тельца выходят при разрушении цист и становятся внеклеточными трофозоитами, начиная новый жизненный цикл возбудителя.
Существует около 50 разновидностей Р. jiroveci, и от одного больного можно выделить одновременно несколько разных штаммов возбудителя.
Пневмоцисты филогенетически ближе к царству грибов. Однако они имеют и нетипичные для грибов свойства: морфология, невозможность культивирования на средах для грибов, устойчивость к противогрибковым средствам и, наоборот, чувствительность к противопротозойным препаратам, а также наличие небольшого числа копий генов рибосомальной РНК, в то время как у грибов имеются сотни их копий. Тем не менее пневмоциста в настоящее время классифицирована как гриб, но благодаря морфологическим и биологическим свойствам она остается включенной в атлас медицинской паразитологии. Данные о продукции токсинов пневмоцистами отсутствуют. Пневмоцисты не культивируются на питательных средах.
Продолжительность сохранения пневмоцист на объектах окружающей среды не изучена, однако в воздухе помещений, где находятся больные, присутствует ДНК возбудителя. Пневмоцисты чувствительны к сульфаниламидам (сульфаметоксазол) в сочетании с пиримидинами (триметоприм), сульфонам (дапсон), некоторым противопротозойным средствам (пентамидин, метронидазол), нитрофуранам.
Эпидемиология
Резервуар пневмоцист в природе неизвестен. Пневмоцисты широко распространены во всех регионах мира и обнаруживаются практически у всех животных. Уровень носительства у отдельных категорий детей до 78%, а уровень инфицированности взрослых в Москве составляет 75%.
Заражение происходит аэрогенным путем от человека (больного или носителя). При внутрибольничных вспышках пневмоцистоза доказана доминирующая роль медицинского персонала в качестве источника инфекции. В отделении для больных ВИЧ-инфекцией выявлено широкое носительство пневмоцист среди больных (92,9%) и персонала (80%).
Механизм клинически выраженного заболевания в основном связан с активацией латентной инфекции. Люди заражаются в раннем детстве - еще до 7-месячного возраста, а в 2-4 года заражены уже 60-70% детей. С другой стороны, известны групповые заболевания пневмоцистозом и вспышки внутрибольничной инфекции не только у детей, но и у взрослых (в отделениях для недоношенных, детей раннего возраста с патологией ЦНС, в отделениях для больных гемобластозами, в туберкулезном стационаре). Описаны случаи семейного инфицирования (источниками инфекции были родители, а заболевали их ослабленные дети). Развитие рецидивов пневмоцистной пневмонии у больных ВИЧ-инфекцией, скорее всего, связано не с активацией латентной инфекции, а с реинфекцией.
Нарушение иммунитета предрасполагает к развитию заболевания, основное значение имеет Т-клеточный иммунодефицит: уменьшение количества CD4+-клеток и увеличение содержания цитотоксических клеток приводит к манифестации болезни.
Группы риска для развития клинически выраженной болезни - больные ВИЧ-инфекцией, недоношенные, ослабленные новорожденные и дети раннего возраста с агаммаглобулинемией или гипогаммаглобулинемией, рахитом, гипотрофией; больные лейкозом, другими онкологическими заболеваниями, реципиенты органов, получающие иммунодепрессанты, пожилые люди из домов престарелых, больные туберкулезом.
Пневмоцистоз диагностируется на протяжении всего года, но наибольшее число заболеваний приходится на зимне-весенний период с максимумом в феврале-апреле.
Меры профилактики
Неспецифические: периодические проверки медицинского персонала, работающего в центрах трансплантации органов, онкологических и гематологических отделениях, реабилитационных отделениях больниц, детских закрытых учреждениях на наличие маркеров пневмоцистоза, чтобы ограничить внутрибольничное заражение: больных пневмоцистной пневмонией изолируют в бокс или отдельную палату; проведение текущей и заключительной дезинфекции в отделениях (влажная уборка, обработка предметов 0,5% раствором хлорамина, проветривание, ультрафиолетовое облучение); медперсонал должен использовать маски или респираторы.
Специфические: химиопрофилактику пневмоцистной пневмонии проводят у больных ВИЧ-инфекцией с количеством CD4+-лимфоцитов ниже 0,2×109/л или менее 14% (превентивная терапия) и у больных, перенесших пневмоцистную пневмонию (профилактика рецидивов); назначают ко-тримоксазол (триметоприм/сульфаметоксазол) в дозе 160/800 мг 1 р/сут или 80/400 мг 1 р/сут ежедневно или 160/800 мг 1 р/сут 3 раза в неделю. Альтернативная схема: дапсон 100 мг 1 р/сут внутрь ежедневно.
Химиопрофилактику пневмоцистной пневмонии прекращают при повышении количества CD4+-лимфоцитов на фоне АРТ >200 кл./мкл в течение 3 мес или при количестве CD4+ -лимфоцитов 100-200 кл./мкл и неопределяемом уровне РНК ВИЧ в течение 3 мес.
Патогенез пневмоцистной пневмонии связан с механическим повреждением стенок интерстиция легких. Р. jiroveci имеет преимущественный тропизм к легочной ткани и поражает пневмоцисты 1-го и 2-го порядка. Весь жизненный цикл пневмоцист проходит в альвеоле, к стенке которой они очень плотно прикрепляются. Постепенно размножаясь, они заполняют все альвеолярное пространство, захватывая все большие участки легочной ткани. При тесном контакте трофозоитов со стенками альвеол происходит повреждение легочной ткани, постепенно снижается растяжимость легких, в 5-20 раз увеличивается толщина межальвеолярных перегородок. Вследствие этого развивается альвеолярно-капиллярный блок, что приводит к тяжелой гипоксии. Образование участков ателектаза усугубляет нарушение вентиляции и газообмена. У больных с иммунодефицитными состояниями выраженное уменьшение числа CD4+-лимфоцитов (менее 0,2×109/л) является критическим для манифестации болезни.
Патоморфология. При пневмоцистной пневмонии выделяют три стадии патологического процесса в легких: отечную (длится 7-10 дней), ателектатическую (1-4 нед), эмфизематозную (продолжительность различна). На аутопсии легкие увеличены, плотные, тяжелые, бледно-фиолетового цвета; ткань легких легко разрывается, на разрезе имеет мраморный вид с серовато-синюшным оттенком, отделяемое вязкое. При гистологическом исследовании в отечной стадии в просвете альвеол и бронхиол обнаруживают пенисто-ячеистые массы, содержащие скопления пневмоцист, вокруг которых скапливаются нейтрофилы, макрофаги и плазматические клетки. Это патогномоничный признак пневмоцистоза. В ателектатической стадии обнаруживают полнокровие, клеточную инфильтрацию межальвеолярных перегородок с последующей их деструкцией, которая наиболее выражена при рецидивирующем течении болезни при ВИЧ-инфекции. Если выздоровление наступает в последней стадии, происходит постепенное обратное развитие процесса. При рецидивах у больных СПИДом могут возникать фиброзно-кистозные изменения в легких.
Клиническая картина
Инкубационный период при экзогенном заражении от 7 до 30 дней, но может превышать 6 нед.
У детей раннего возраста болезнь протекает как классическая интерстициальная пневмония с четким соответствием стадиям патологического процесса. Заболевание начинается постепенно: у ребенка ухудшается аппетит, прекращается нарастание массы тела, появляются бледность и цианоз носогубного треугольника (особенно при еде и крике), легкое покашливание. Температура тела субфебрильная, в дальнейшем достигает высоких цифр. Вначале при перкуссии над легкими определяется тимпанический звук, особенно в межлопаточном пространстве. Появляется одышка при физической нагрузке. Во II стадии заболевания (ателектатическая стадия) постепенно нарастают одышка (в покое частота дыхания достигает 50-80 в минуту), цианоз и навязчивый коклюшеподобный кашель, нередко с пенистой мокротой. В легких выслушивают жесткое, местами ослабленное дыхание, непостоянные мелко- и среднепузырчатые хрипы; наблюдают расширение грудной клетки, увеличение межреберных промежутков.
В передневерхних отделах нарастает тимпанит, а в межлопаточном пространстве выявляют участки укороченного звука. Прогрессирует респираторный ацидоз, который при тяжелом поражении сменяется алкалозом. Развивается легочно-сердечная недостаточность. В этой фазе может возникнуть серповидный пневмоторакс. При сочетании пневмоторакса с пневмомедиастинитом, а также при отеке легких возможна гибель больного. В III стадии (эмфизематозная стадия) состояние улучшается, уменьшаются одышка и вздутие грудной клетки, но длительно сохраняется коробочный оттенок при перкуссии.
У взрослых болезнь начинается продромальными симптомами: слабостью, повышенной утомляемостью, похуданием, ухудшением аппетита, потливостью, субфебрилитетом. Особенно часто это наблюдается в поздних стадиях ВИЧ-инфекции (СПИД). Больные обращаются за медицинской помощью обычно в поздние сроки болезни потому, что явные характерные признаки заболевания развиваются постепенно, а в ряде случаев пневмоцистоз у них может протекать без явных симптомов поражения легких. В этих случаях болезнь обнаруживают при рентгенологическом обследовании или на аутопсии.
Наиболее характерные симптомы пневмоцистной пневмонии у больных СПИДом - одышка, лихорадка, кашель. Они развиваются практически у всех заболевших. Одышка - самый ранний симптом. Вначале она появляется при умеренной физической нагрузке. Этот период может длиться несколько недель и даже месяцев. Постепенно одышка нарастает и беспокоит больных уже в покое. У больных СПИДом при пневмоцистной пневмонии температура повышается постепенно, достигая максимальных цифр (38-40 °С) в разгаре болезни. Повышение температуры тела иногда сопровождается ознобом, повышенной потливостью. Температурная кривая отличается постепенным нарастанием, постоянным, ремиттирующим или неправильным характером. Если этиотропная терапия эффективна, температура держится у неинфицированных ВИЧ больных 3-7 дней, а у ВИЧ-инфицированных - 7-15 дней. Кашель, как правило, непродуктивный. Появление мокроты возможно у больных с сопутствующим бронхитом или у курильщиков. Для начала болезни характерно навязчивое покашливание из-за постоянного ощущения раздражения за грудиной или в гортани. В дальнейшем кашель почти постоянный, коклюшеподобный. Боли в грудной клетке наблюдаются редко. Они могут быть признаком остро развивающегося пневмоторакса или пневмомедиастинума.
В ранней стадии болезни больной бледен, отмечаются цианоз губ и носогубного треугольника, одышка при физической нагрузке. Частота дыхания 20-24 в минуту. При прогрессировании болезни цианоз нарастает, кожа приобретает серовато-цианотичный оттенок, дыхание становится поверхностным и учащенным (40-60 в минуту).
При осмотре в легких часто не удается выявить характерных изменений. Возможно укорочение перкуторного звука, аускультативно - жесткое дыхание, усиленное в передневерхних отделах, иногда рассеянные сухие хрипы. В начале болезни нередко выявляют двустороннюю крепитацию, преимущественно в базальных отделах, уменьшение экскурсии диафрагмы. Обычно увеличиваются размеры печени, реже - селезенки. При глубоком иммунодефиците возможно развитие внелегочного пневмоцистоза с поражением ЛУ, селезенки, печени, костного мозга, слизистой оболочки ЖКТ, брюшины, глаз, щитовидной железы, сердца, головного и спинного мозга, тимуса и т.д. Самым характерным биохимическим неспецифическим показателем является повышение активности ЛДГ как отражение ДН. Общее содержание белка в сыворотке крови уменьшено, особенно уровень альбуминов, содержание Ig повышено.
При рентгенографии и КТ легких уже в ранних стадиях в прикорневых отделах определяют облаковидное понижение прозрачности, усиление интерстициального рисунка, затем - мелкоочаговые тени, располагающиеся в обоих легочных полях симметрично в виде крыльев бабочки. Такие изменения получили название «облаковидных», «пушистых» инфильтратов, «хлопьев снега», создающих вид «завуалированного» или «ватного» легкого. Такая же картина интерстициальной пневмонии может наблюдаться при атипичных пневмониях. У 20-30% больных рентгенологические изменения могут отсутствовать, а в ряде случаев встречаются атипичные признаки (асимметричные лобарные или сегментарные инфильтраты, поражение верхних отделов легких, как при туберкулезе, единичные инфильтраты в виде узлов; у 7% больных встречаются тонкостенные кистоподобные полости, не заполненные фибрином или жидкостью).
При исследовании функции внешнего дыхания выявляют уменьшение жизненной емкости, общего объема и диффузной способности легких. Гипоксемия соответствует тяжести заболевания, pO2 составляет 40-70 мм рт.ст., альвеолярно-артериальная разница по кислороду - 40 мм рт.ст. У взрослых, как правило, болезнь носит более тяжелый характер, имеет затяжное, рецидивирующее течение с высокой летальностью. Неблагоприятные прогностические признаки - активность ЛДГ более 500 МЕ/л, продолжительное течение болезни, наличие рецидивов, выраженная ДН и/или сопутствующая цитомегаловирусная пневмония, а также низкое содержание в крови гемоглобина (менее 100 г/л), альбумина и γ-глобулинов.
У больных ВИЧ-инфекцией болезнь без адекватного лечения заканчивается летальным исходом чаще на фоне прогрессирующей дыхательной и легочно-сердечной недостаточности или в результате развития тяжелых осложнений.
Среди осложнений нередко отмечается пневмоторакс. Возможно развитие серповидного пневмоторакса (часто двустороннего) в результате разрывов ткани легкого в передневерхних отделах. У детей возможно его сочетание с пневмомедиастинумом.
Иногда (особенно при длительном, рецидивирующем течении) легочные инфильтраты некротизируются; и при рентгенографическом исследовании становятся видны полости, напоминающие кисты и каверны, как при туберкулезе или раке легкого. У детей возможно развитие «шокового» легкого с исходом в необратимую ДН и легочно-сердечную недостаточность.
Из внелегочных поражений у больных СПИДом возможен пневмоцистный ретинит (в виде «ватных пятен»). При пневмоцистном тиреоидите, в отличие от воспалительного процесса щитовидной железы другой этиологии, не бывает симптомов интоксикации, появляется опухолевидное образование на шее, дисфагия, иногда похудание. Возможно поражение пневмоцистами всех органов.
| Место поражения | Признак |
|---|---|
Печень |
Гепатомегалия, повышение активности печеночных ферментов в сыворотке, гипоальбуминемия, коагулопатия |
Селезенка |
Боль, спленомегалия |
ЛУ |
ЛАП |
Глаза |
Снижение остроты зрения, «ватные» пятна на сетчатке или желтоватые пятна на радужке |
ЖКТ |
Тошнота, рвота, боль в животе, симптомы острого живота, диарея |
Уши |
Боль, ухудшение слуха, средний отит, мастоидит |
Щитовидная железа |
«Зоб», гипотиреоидизм, дисфагия |
Костный мозг |
Панцистопения |
Кожа |
Участки изъязвления |
Клиническая диагностика. Наиболее существенное значение имеет длительно нарастающая выраженная одышка при минимальных физикальных изменениях. Часто доказательством правильного диагноза пневмоцистной пневмонии является эффективность терапии, назначаемой exjuvantibus.
Лабораторная диагностика. Повышение активности ЛДГ и снижение рО2 крови, что свидетельствует о ДН. Кроме этого, при пневмоцистозе всегда значительно повышается СОЭ. Эти признаки хотя и неспецифичны, но характерны для пневмоцистной пневмонии.
Для обнаружения возбудителя исследуется мокрота, бронхиальный секрет, промывные воды бронхов или бронхоальвеолярный лаваж, а также кусочки легочной ткани, взятые при трансбронхиальной, чрескожной или открытой биопсии. Исследование мокроты является наиболее доступным методом диагностики. Для получения достаточного количества мокроты назначают ингаляции растворов, стимулирующих секрецию и/или кашлевые толчки. При использовании солевой ингаляции пневмоцисты можно обнаружить в 40-50% проб мокроты. Отрицательный результат исследования мокроты не позволяет исключить пневмоцистоз. При положительном результате нельзя исключить носительство пневмоцист или возможность того, что болезнь вызвана другим возбудителем.
Для более точной диагностики используют иммунофлюоресцентные методы с моно- и поликлональными антителами, определение антигена в мокроте или промывных водах бронхоальвеолярного лаважа с помощью РНИФ.
Дифференциальная диагностика особенно трудна у больных СПИДом при развитии других вторичных поражений, протекающих со сходной легочной симптоматикой - клинической и рентгенологической (туберкулез, ЦМВИ, токсоплазмоз), тем более что они часто могут протекать в виде микст-инфекции с пневмоцистной пневмонией. Нужно учитывать наиболее важные клинические и лабораторные признаки (постепенно нарастающая ДН, скудность физикальных данных, высокая активность ЛДГ и СОЭ), а также эффект от терапии, часто назначаемой exjuvantibus.
Лечение. Госпитализация больных обязательна в связи с угрозой осложнений.
Режим в период разгара болезни постельный.
Этиотропная терапия
Для лечения детей без иммунодефицитных состояний используют преимущественно триметоприм/сульфаметоксазол (по 120 мг 4 р/сут), чаще в сочетании с фуразолидоном (по 1 таблетке 4 раза в день) или трихополом (по 4 таблетки в день) в течение 1-2 нед.
Альтернативные схемы: 1) дапсон 100 мг 1 р/сут внутрь + триме-топрим 5 мг/кг 3 р/сут перорально в течение 21 дня; 2) клиндамицин 600-900 мг каждые 6-8 ч в/в капельно или 300-450 мг каждые 6 ч внутрь + примахин 15-30 мг 1 р/сут внутрь в течение 21 дня.
Патогенетическая терапия направлена в основном на улучшение дыхательной и сердечно-сосудистой деятельности, она должна быть интенсивной при развитии ДН, отека легких, острой легочно-сердечной недостаточности. При наличии у больного ДН (рО2 <70 мм рт ст.) показано назначение глюкокортикоидов: преднизолон по 80 мг в сутки (по 40 мг 2 р/сут) в течение 5 дней, затем по 40 мг 1 р/сут в течение 5 дней, затем по 20 мг в сутки до конца курса лечения.
Прогноз. В среднем количество выживших больных после перенесенной пневмоцистной пневмонии составляет 75-90%. При рецидивах выживают около 60% больных. Однако с введением в широкую клиническую практику АРВТ эти показатели снижаются.
Глава 19. Гельминтозы
Трематодозы
Описторхоз
Описторхоз (лат. opisthorchosis, англ. оpisthorchiasis, франц. оpisthor-chiase) - природно-очаговый биогельминтоз с фекально-оральным механизмом передачи возбудителя, характеризующийся длительным течением и преимущественным поражением гепатобилиарной системы и поджелудочной железы.
Код по МКБ-10
В66.0 Описторхоз.
Этиология
Возбудитель - Opisthorchis felineus (кошачья двуустка) принадлежит к типу плоских червей (трематоды), классу сосальщиков. Имеет плоское удлиненное тело длиной 8-14 мм и диаметром 1-3,5 мм; снабжен двумя присосками - ротовой и брюшной. Описторхи - гермафродиты. Размеры яиц - 23-24×11-19 мкм.
Возбудитель обладает сложным циклом развития. Помимо окончательных, он имеет двух промежуточных и дополнительного хозяев. У основных хозяев гельминт паразитирует в половозрелой стадии своего развития. Из желчных ходов, желчного пузыря и протоков поджелудочной железы человека и плотоядных млекопитающих (кошка, собака, лисица, песец, соболь, росомаха, свинья домашняя и др.) яйца паразитов вместе с желчью проникают в кишечник и затем попадают в окружающую среду. Дальнейшее развитие проходит в водоемах, где описторхи сохраняют жизнеспособность до 6 мес и заглатываются первым промежуточным хозяином - пресноводным моллюском рода Codiellα, в теле которого происходит ряд превращений: из яйца выходит мирацидий, образующий спороцисту, в которой формируются редии, рождающие большое количество личинок следующей стадии (церкариев). Последние выходят из моллюска и проникают в мышцы второго промежуточного хозяина - рыб семейства карповых, где церкарии превращаются в метацеркариев, которые через 6 нед становятся инвазионными. Рыба, пораженная метацеркариями описторхов, - источник заражения человека и многих плотоядных животных.
В желудке и двенадцатиперстной кишке окончательного хозяина происходит эксцистирование метацеркариев. Обладая положительным хемотаксисом к желчи, паразиты отыскивают отверстия желчного протока и через общий желчный проток проникают в желчные ходы и желчный пузырь, а иногда и в поджелудочную железу. Спустя 3-4 нед после заражения гельминты достигают половозрелого состояния и после оплодотворения начинают выделять яйца. Продолжительность жизни описторхов достигает 15-25 лет.
Яйца O. felineus устойчивы в окружающей среде: в пресной воде сохраняют жизнеспособность около года. Личинки описторха погибают при варке рыбы цельным куском через 20 мин, в рыбном фарше - через 10 мин после начала кипячения. При засолке рыбы личинки погибают через 4-7 сут. Горячее копчение гибельно для возбудителя, а холодное не повреждает его.
Эпидемиология
Описторхоз широко распространен на Евроазиатском континенте. В России наиболее обширные очаги инфекции на территории Западной Сибири, Северного Казахстана (бассейн Оби и Иртыша), Пермской и Кировской областей и бассейнов рек Камы, Вятки, Днепра, Десны, Сейма, Северного Донца, Южного Буга. Самую напряженную ситуацию отмечают в Западной Сибири, где расположен крупнейший Обьско-Иртышский очаг инвазии.
Восприимчивость населения к инвазии высокая. Пораженность описторхозом коренного населения севера РФ достигает 80-100% и связана с особенностями питания: употреблением термически не обработанной рыбы и высокой степенью инвазированности последней. Пораженность местного русского населения несколько ниже. Основной источник описторхоза в населенных пунктах - человек, домашние животные (кошки, свиньи) или синантропные грызуны. Механизм передачи - фекально-оральный, путь передачи - пищевой. Через 3-4 нед после заражения в течение многих лет (до 10-20) источник инвазии выделяет с фекалиями в окружающую среду яйца описторхов. Источник заражения для человека - рыбы семейства карповых, инвазированные метацеркариями и употребляемые в пищу в сыром или полусыром виде. Более других заражены язь, елец, плотва. Метацеркарии устойчивы к низким температурам (в замороженной рыбе они могут сохранять жизнеспособность при -40 °С до 7 ч, при -35 °С - до 14 ч, при -28 °С - 32 ч), но чувствительны к высоким: после выделения из рыбы они погибают при 55 °С в течение 5 мин.
Описторхозу свойственна летне-осенняя сезонность. Несколько чаще болеют мужчины. После излечения иммунитет не вырабатывается; часто наблюдают реинфекцию.
Меры профилактики
Комплекс мер борьбы с описторхозом включает: обнаружение очагов и лечение больных описторхозом; проведение широкой санитарно-просветительной работы среди населения в очагах; дегельминтизация домашних плотоядных животных; охрана окружающей среды от фекального загрязнения; качественная термическая обработка рыбы карповых пород перед употреблением ее в пищу; борьба с промежуточными хозяевами описторхов и свободноплавающими стадиями паразита.
В домашних условиях рыбу рекомендуют прожаривать небольшими кусками не менее 20 мин; кипятить 20 мин; выпекать рыбные пироги 40-60 мин; применять крепкий посол (20% соли к массе рыбы) с 10-дневной выдержкой; вялить мелкие карповые породы (плотва, елец) в течение 3 нед с 2-3-дневным предварительным посолом; холодное копчение рыбы проводить после крепкого посола или промораживания в течение 3-4 нед.
Патогенез
После употребления в пищу инвазированной рыбы метацеркарии попадают в желудок и двенадцатиперстную кишку, а через 3-5 ч достигают внутрипеченочных желчных ходов - места своего основного обитания в организме окончательного хозяина. У 20-40% зараженных лиц описторхов обнаруживают в протоках поджелудочной железы и желчном пузыре. При дальнейшем развитии они выделяют ферменты и продукты метаболизма, оказывающие сенсибилизирующее и прямое токсическое действие на организм. В динамике инвазионного процесса при описторхозе выделяют две фазы - раннюю (острую) и позднюю (хроническую).
В основе патогенеза ранней стадии лежат токсико-аллергические реакции организма на метаболиты, выделяемые личинками в процессе их миграции и созревания и их антигены. В этой стадии наблюдают повышенную проницаемость сосудов печени и поджелудочной железы, продуктивный васкулит, эозинофильную инфильтрацию стромы органов, их отечность, пролиферацию и десквамацию эпителия желчных ходов. В двенадцатиперстной кишке, печени, легких и других органах формируются эозинофильные инфильтраты.
В хронической стадии токсико-аллергические реакции сохраняются, но основные патологические изменения обусловлены жизнедеятельностью описторхов, которые своими присосками и шипиками оказывают раздражающее и повреждающее действие на стенку желчных и панкреатических протоков, желчного пузыря, вызывая развитие холангита и перихолангита, приводящих к фиброзу органов.
Гиперпластические и воспалительные процессы приводят к развитию стриктур в терминальной части общего желчного и пузырного протока, способствуют присоединению бактериальной инфекции и образованию конкрементов в желчевыводящих протоках и протоке поджелудочной железы. Часто ее сопровождает гастродуоденит.
Пролиферативные процессы при описторхозе могут приводить к развитию холангиокарциномы. В Западной Сибири, где высок уровень пораженности населения описторхозом, заболеваемость холангиокарциномой в 10-15 раз выше, чем в других регионах.
Ранний иммунный ответ сопровождается увеличением уровня общих IgМ с максимумом на 2-3-й неделе и снижением их концентрации через 6-8 нед, когда отмечают увеличение содержания IgG. Иммуносупрессия, сопровождающая инвазию, способствует тяжелому течению шигеллеза и других кишечных инфекций, часто провоцирует хроническое бактерионосительство у переболевших брюшным тифом, отягощает течение ВГ выраженным холестазом, частыми обострениями и рецидивами.
Клиническая картина
Инкубационный период 2-6 нед. Заболевание характеризуется полиморфизмом клинической картины.
Единой классификации описторхоза не существует. Выделяют острую фазу инвазии, которая может протекать бессимптомно или стерто у коренных жителей эндемичных регионов при реинвазии или суперинфекции. Клинически выраженную форму острой фазы наблюдают у лиц, прибывших в эндемичный регион. Хроническую фазу болезни при отсутствии симптомов острой фазы расценивают как первично-хроническую; если же ей предшествует острая фаза - как вторично-хроническую. Органные поражения (желчевыводящих путей, поджелудочной железы, желудка и двенадцатиперстной кишки) могут сохраняться и после освобождения организма от описторхов, поэтому выделяют резидуальную фазу болезни.
Острую фазу при бессимптомной инвазии диагностируют по обнаружению яиц паразита в дуоденальном содержимом и фекалиях, по незначительной эозинофилии и повышенному содержанию специфических IgM. Стертую форму, помимо этих критериев, характеризует кратковременный субфебрилитет.
Клинически выраженная форма манифестирует внезапно возникшей лихорадкой, болями в правом подреберье, миалгией, артралгией, высыпаниями на коже, увеличением селезенки и печени, лейкоцитозом и гиперэозинофилией крови. При легкой форме лихорадка (около 38 °С) продолжается до 2 нед, возможны боли в животе неопределенной локализации, диарея, умеренный лейкоцитоз и эозинофилия. Среднетяжелая форма характеризуется лихорадкой (38-39,5 °С) ремиттирующего, постоянного или неправильного типа длительностью до 3 нед, уртикарными высыпаниями на коже, миалгией и артралгией, болями в правом подреберье, в части случаев - умеренной диареей и рвотой. Печень и селезенка увеличены; возможен астматический бронхит.
Тяжелому течению болезни свойственны высокая лихорадка, выраженная интоксикация (головная боль, бессонница, заторможенность или возбуждение, тахикардия), полиморфные кожные высыпания. Выражена картина гепатита: боли в правом подреберье, увеличение печени, желтуха, повышение уровня билирубина, увеличение активности аминотрансфераз и ЩФ. У части больных развивается эрозивно-язвенный гастродуоденит с сильными болями в эпигастральной области, тошнотой, рвотой, метеоризмом, диареей. Возможны боли в грудной клетке, одышка, кашель, летучие инфильтраты в легких, миокардит. Характерен гиперлейкоцитоз (20-60×109 /л), эозинофилия в пределах от 10 до 80-90%, увеличение СОЭ.
Острая фаза длится от 2-3 нед до 2 мес, после чего клинические симптомы стихают и болезнь переходит в хроническую фазу, признаки которой проявляются через несколько месяцев и даже лет и характеризуются значительным полиморфизмом. Чаще всего наблюдают поражение гепатобилиарной системы. Больные отмечают тяжесть в правом подреберье и эпигастральной области, ухудшение аппетита, тошноту, рвоту, диарею. Печень немного увеличена, чувствительна, плотноватая при пальпации. Функциональные показатели обычно не изменены. Желчный пузырь увеличен, точка желчного пузыря болезненна; возможны приступы коликообразных болей. При дуоденальном зондировании количество желчи увеличено, содержание лейкоцитов в ней повышено. При поражении поджелудочной железы отмечают боли опоясывающего характера. Возможны развитие хронического гастрита, гастродуоденита, язвенное поражение слизистой оболочки желудка и двенадцатиперстной кишки. Больные часто страдают головной болью, головокружением, бессонницей; возможна депрессия. Течение инвазии длительное (до 20 лет и более), но доброкачественное. Летальные исходы редки и связаны с осложнениями.
Осложнения. В хронической фазе болезни часто развивается гнойный холангит и холецистит, острый и хронический панкреатит, язвенная болезнь желудка и двенадцатиперстной кишки, перитонит, холангиокарцинома.
Диагноз устанавливают на основании клинико-эпидемиологи-ческих и лабораторных данных: употребление термически не обработанной, слабосоленой рыбы в эндемичных регионах; лихорадка, токсико-аллергический синдром; лейкоцитоз и эозинофилия в крови; в хронической фазе - симптомы холецистопанкреатита, гастродуоденита.
Для клинической диагностики применяют ЭГДС, холецистографию, дуоденальное зондирование, УЗИ органов брюшной полости, определяют кислотность желудочного сока.
Паразитологическая диагностика острого описторхоза невозможна, так как гельминты начинают выделять яйца только через 6 нед после начала инвазии. Для определения специфических антител используют ИФА. Применяют следующие тест-системы: для определения IgM - «Описторхис-IgM-стрип»; для определения IgG - «Тиатоп-стрип»; для определения специфических ЦИК - «Описторх-ЦИК-стрип».
Паразитологическое исследование желчи - наиболее достоверный метод диагностики описторхоза. Проводят микроскопическое исследование осадка трех порций желчи. Наиболее распространена копроовоскопия, основанная на изучении морфологических особенностей яиц описторхов.
Дифференциальная диагностика
Острую фазу описторхоза дифференцируют с брюшным тифом, гриппом, воспалительными заболеваниями органов брюшной полости (холецистит, холангит, панкреатит), глистными инвазиями (трихинеллез, фасциолез, парагонимоз), пневмонией, ОКИ, ВГ.
Хроническую фазу описторхоза дифференцируют с фасциолезом, хроническим холециститом, панкреатитом, гастродуоденитом, язвенной болезнью желудка и двенадцатиперстной кишки, хроническим гепатитом другой этиологии.
Лечение
Госпитализацию больных осуществляют по клиническим показаниям. Назначают щадящий режим, диету № 5 в течение 6 мес.
Препарат выбора - празиквантел или его отечественный аналог Азинокс♠¤. Лечение, как правило, амбулаторное (кроме больных с выраженными симптомами острой фазы, тяжелыми органными поражениями, токсико-аллергическими проявлениями). В острой фазе терапию начинают после купирования лихорадки, устранения интоксикации и аллергических симптомов. Препарат назначают в суточной дозе 75 мг/кг массы тела после еды в 3 приема с интервалом 4-6 ч. Максимальная разовая доза - 2 г, суточная - 6 г. Препарат не рекомендуют детям до 2 лет и беременным в I триместре. Кормящие женщины в день приема и на следующий день не должны кормить ребенка грудным молоком. Противопоказано употребление алкоголя.
В острой фазе проводят дезинтоксикационную и десенсибилизирующую терапию с использованием антигистаминных препаратов. В тяжелых случаях назначают преднизолон по 40-60 мг в сутки в течение 5-7 дней, в хронической стадии - желчегонные препараты, спазмолитики, ферментные препараты, тюбаж с сернокислой магнезией, боржоми. При присоединении бактериальных осложнений применяют противомикробные препараты.
При отсутствии бактериальных осложнений прогноз обычно благоприятный; серьезный - при развитии гнойных процессов в желчевыводящих путях, при желчном перитоните и остром панкреатите; неблагоприятный при развитии холангиокарциномы или гепатокар-циномы.
Диспансеризацию проводят в течение 1-2 лет. Кратность осмотров гастроэнтеролога и объем реабилитационных мероприятий определяют индивидуально. При аллергических проявлениях контрольное обследование на яйцевыделение осуществляют через 3, 6, 12 мес после окончания антигельминтной химиотерапии. Проводят троекратное исследование фекалий и дуоденальное зондирование.
Фасциолез
Фасциолез (лат. fasciolosis, англ. fascioliasis) - хронический зоонозный биогельминтоз, вызываемый паразитированием трематод семейства Fasciolidae; характеризуется преимущественным поражением желчевыделительной системы.
Код по МКБ-10
B66.3 Фасциолез.
Этиология
Возбудители фасциолеза - два вида трематод. Fasciola hepatica (двуустка печеночная) имеет плоское листовидное тело длиной 20-30 мм, диаметром 8-12 мм от коричневого до серого цвета с зеленоватым оттенком, на кутикуле имеются мелкие шипики. Ротовая и брюшная присоски развиты слабо, они сближены между собой и расположены в передней части тела. Fasciola gigantica (двуустка гигантская), длиной 33-76 мм, диаметром 5-12 мм. Фасциoлы относятся к типу Plathelminthes классу Trematoda семейству Fasciolidae.
Они имеют крупные овальные яйца размером 0,125-0,150×0,062- 0,081 мм, хорошо выраженную оболочку и крышечку, во внешнюю среду они выделяются незрелыми. Окончательные хозяева - жвачные животные (мелкий и крупный рогатый скот, свиньи, лошади и др.), иногда крысы, а также человек. Гельминты паразитируют в желчевы-водящей системе в течение 3-5 лет и более. В окружающую среду яйца выделяются с фекалиями, дальнейшее их развитие возможно только в пресной воде. Выделившиеся из яиц личинки (мирацидии) проникают в тело промежуточного хозяина - брюхоногих моллюсков, из которых спустя 30-70 дней выходят хвостатые церкарии. Они сбрасывают хвост, инцистируются и превращаются в шаровидной формы адоле-скарии, которые прикрепляются к стеблям подводных растений или к поверхностной пленке воды. В организм окончательного хозяина личинки попадают с водой или растениями.
Эпидемиология
Основной источник заражения окружающей среды - овцы и крупный рогатый скот. Человек заражается при употреблении в пищу зараженных адолескариями растений (щавель, дикий лук, кресс-салат, огородная зелень), а также сырой воды из непроточных водоемов. Заражение возможно также при мытье салатных трав прудовой водой.
При употреблении фасциолезной печени животных в кишечник попадают яйца, которые не могут вызвать заболевание, однако могут обнаружиться при исследовании кала. Фасциолез, вызванный Fasciola hepatica, распространен во всех регионах мира, но более широко в странах Азии, Африки и Южной Америки. В некоторых регионах России регистрируют спорадические случаи.
Яйца фасциол в водоемах и на пастбищах сохраняются жизнеспособными до 2 лет. Личинки в теле моллюска могут перезимовывать и весной завершать свое развитие.
Профилактика фасциолеза предусматривает профилактическую дегельминтизацию скота, смена пастбищ и др. Борьбу с моллюсками - промежуточными хозяевами фасциол - проводят путем мелиорации заболоченных пастбищ. Вода из стоячих и медленно текущих водных источников при использовании для питья и хозяйственных нужд подлежит кипячению. Особое значение придается санитарно-просветительной работе среди населения, проживающего в эндемичной по фасциолезу местности.
Патогенез
Миграция личинок фасциол из кишечника в печень происходит двумя путями - гематогенным и посредством активного внедрения через перитонеальную полость, фиброзную оболочку (глиссонову капсулу) печени. Основные патологические изменения возникают во время миграции личинок через паренхиму печени, длящейся 4-6 нед и более. От момента попадания адолескариев в организм дефинитивного хозяина до развития половозрелых особей паразита проходит 3-4 мес. Взрослые фасциолы локализуются в желчных протоках. Иногда личинки могут мигрировать и созревать в поджелудочной железе, подкожной ткани, головном мозге. В миграционной фазе выражены токсико-аллергические реакции вследствие сенсибилизации организма антигенами личинок, а также повреждения тканей по ходу их продвижения. Гельминты вызывают деструктивные изменения в печени, микроабсцессы, в последующем - фиброзные изменения. Взрослые особи, обитающие в желчевыводящих протоках и желчном пузыре, вызывают пролиферативный холангит с аденоматоз-ными изменениями эпителия, перидуктальным фиброзом и фиброзом стенки желчного пузыря. Возможна обструкция желчных протоков, что создает условия для присоединения вторичной инфекции.
Клиническая картина
Инкубационный период 1-8 нед. Выделяют острую и хроническую стадии фасциолеза. У многих клинические проявления острой стадии отсутствуют, у некоторых больных в течение многих месяцев инвазия протекает бессимптомно. При клинически манифестных формах начало болезни острое: с повышением температуры тела до 38-39 °С, недомоганием, общей слабостью, потливостью, головной болью, потерей аппетита. Лихорадка может быть ремиттирующей, гектической, волнообразной. Наблюдают кашель, приступы бронхоспазма, боли в эпигастральной области, правом подреберье, тошноту, рвоту. Печень увеличена, плотновата, болезненна. Возможны желтуха, спленомега-лия, асцит. На коже иногда высыпания уртикарного или полиморфного характера. В периферической крови лейкоцитоз, гиперэозинофилия (до 80%), иногда анемия в хронической стадии аллергический симптомокомплекс стихает, но субфебрилитет продолжается иногда до нескольких месяцев.
Хронический неосложненный фасциолез протекает с болями в правом подреберье, подложечной области, диспепсическими явлениями. Для фасциолеза, осложненного бактериальной инфекцией желчевыводящих путей, характерны приступообразные боли, сопровождающиеся лихорадкой, лейкоцитозом. При длительном течении гельминтоза развиваются нарушения функции печени, анемия.
Осложнения - гнойный и склерозирующий холангит, гепатит, абсцесс и цирроз печени.
В результате локализации гельминта в головном мозге возникают сильная головная боль, эпилептиформные приступы, при попадании в легкие - кашель, кровохаркание.
Диагностика
В острой стадии диагноз основан на анамнестических, эпидемиологических данных, клинических проявлениях, а также на результатах серологических исследований (РНГА, РИФ, ИФА). Через 3-4 мес после заражения с началом откладывания яиц взрослыми гельминтами диагноз подтверждают овоскопическими исследованиями фекалий и дуоденального содержимого. Следует использовать методы обогащения (эфир-формалиновый или эфир-уксусный методы). Яйца фасциол могут быть обнаружены после употребления печени крупного скота, пораженной гельминтами (транзитные яйца). В таких случаях рекомендуется провести повторное исследование через 3-5 дней после исключения из питания продуктов из печени.
Для суждения о характере и степени изменений в печени и желче-выводящих путях проводят инструментальные исследования - УЗИ, КТ, МРТ печени, холецистохолангиографию.
Дифференциальная диагностика
Дифференциальную диагностику в острой стадии проводят с трихинеллезом, описторхозом, клонорхозом, ВГ, эозинофильным лейкозом; в хронической - с холециститом, холангитом, панкреатитом.
Лечение
В острой стадии назначают диету (стол № 5), антигистаминные средства. После стихания симптомов - антигельминтную терапию. Средство выбора - триклабендазолρ (в РФ не зарегистрирован), который применяют в суточной дозе 10 мг/кг в 1 прием, в тяжелых случаях препарат применяют в дозе 20 мг/кг в сутки, в 2 приема с интервалом в 12 ч [5]. Можно использовать празиквантел в дозах, применяемых при описторхозе, однако при инвазии Fasciola hepatica его эффективность не превышает 40%, но значительно выше в отношении Fasciola gigantica. Эффективность противогельминтного лечения оценивают по исчезновению яиц фасциол в кале и/или дуоденальном содержимом в исследованиях через 3 и 6 мес.
Прогноз для жизни благоприятный. При длительном течении фасциолеза возможно развитие цирроза печени. Редкие летальные исходы обусловлены осложнениями.
Шистосомозы
Шистосомозы, или бильгарциозы (лат. schistosomosis; англ. schistosomiasis, bilharziasi), - тропические гельминтозы, характеризующиеся в острой стадии токсико-аллергическими реакциями, в хронической - преимущественным поражением кишечника или мочеполовой системы, в зависимости от вида возбудителя.
Коды по МКБ-10
B65 Шистосомоз (бильгарциоз).
B65.0 Шистосомоз, вызванный Schistosoma haematobium (мочеполовой шистосомоз).
B65.1 Шистосомоз, вызванный Schistosoma mansoni (кишечный шистосомоз).
B65.2 Шистосомоз, вызванный Schistosoma japonicum.
Этиология
Шистосомы относятся к типу Plathelminthes, классу Trematoda, семейству Schistosomatidae. Пять видов шистосом: Schistosoma mansoni, S. haematobium, S. japonicum, S. intercalatum и S. mekongi - возбудители гельминтоза у человека. Шистосомы в отличие от остальных представителей класса Trematoda раздельнополые и отличаются половым диморфизмом. Тело половозрелых шистосом удлиненное, цилиндрическое, покрыто кутикулой. Имеются расположенные близко друг к другу присоски - ротовая и брюшная. Тело у самки длиннее и тоньше, чем у самца. Вдоль тела самца проходит особый копулятивный желобок (гинекоформный канал), в котором самец удерживает самку. Самец и самка почти постоянно находятся вместе. Наружная поверхность самца покрыта шипиками или бугорками, у самки шипы имеются только на переднем конце тела, остальная поверхность гладкая. Половозрелые самки и самцы спариваются и мигрируют в сосуды постоянной локализации - в систему мезентериальных вен (кишечные разновидности шистосом) или мочевого пузыря и малого таза - S. haematobium, где обитают в мельчайших венозных сосудах окончательного хозяина. Взрослые гельминты питаются компонентами крови через пищеварительную трубку и частично адсорбируют жидкую часть через кутикулу. В матке S. haematobium находится одновременно не более 20-30 яиц. Личинка в яйце шистосомы, отложенном в мелких венах хозяина, созревает в течение 5-12 дней. Миграция яиц из кровеносных сосудов происходит благодаря наличию шипа, протеолитической активности секрета личинок, а также под влиянием сократительных движений мышечного слоя стенок сосудов, кишечника и мочевого пузыря. В окружающую среду яйца попадают с мочой (S. haematobium) или калом (S. mansoni и др.). Дальнейшее развитие происходит в воде, где оболочка яиц разрушается; из них выходят мирацидии. Их промежуточный хозяин - пресноводные моллюски, в теле которых мирацидии в течение 4-6 нед проходят сложный процесс формирования церкариев, способных активно внедряться в организм окончательного хозяина. Продолжительность жизни мирацидия - до 24 ч, церкариев - до 2-3 сут, половозрелых особей шистосом - 5-8 лет [1, 2, 3, 6, 9].
Эпидемиология
Основной источник заражения окружающей среды при всех шистосомозах - больной человек. Некоторые животные (обезьяны, грызуны) также могут заражаться S. mansoni, но в распространении шистосомоза значимой роли не играют. S. japonicum имеет значительно более широкий круг хозяев и, по-видимому, может поражать всех млекопитающих и достигать в них половой зрелости, поэтому животные, особенно домашние (крупный рогатый скот, свиньи, лошади, собаки, кошки и др.), могут быть резервуаром инфекции.
Промежуточные хозяева шистосом - пресноводные моллюски. Ежедневно тело инфицированного моллюска покидают до 1500-4000 и более церкариев, а за период жизни моллюска - до нескольких сот тысяч инвазионных личинок.
Естественная восприимчивость людей к заражению всеми 5 видами шистосом всеобщая. В высокоэндемичных очагах пораженность людей шистосомозом достигает максимума во втором десятилетии жизни, затем снижается вследствие формирующегося иммунитета. Отмечают определенный уровень невосприимчивости к суперинвазии и низкую интенсивность инвазии после реинфекции. Шистосомы наиболее чувствительны к воздействию иммунных механизмов организма хозяина в течение первых дней после заражения, т.е. в стадии мигрирующих личинок.
Человек заражается шистосомозом при купании, стирке белья, при работе в водоемах, на поливных землях, во время религиозных обрядов и других контактов с зараженной водой. Местом заражения служат как естественные, так и искусственные водоемы. Появлению новых очагов способствует строительство ирригационных сооружений, усиление миграции населения, связанное с хозяйственным освоением новых территорий, туризмом, паломничеством. Чаще заражаются сельские жители, рыбаки, садоводы, сельскохозяйственные рабочие, но особенно велик риск заражения детей в возрасте 7-14 лет, так как их игры часто связаны с водой.
Ареал различных форм шистосомоза охватывает 74 страны и территории тропического и субтропического пояса, в которых, по данным ВОЗ, число инфицированных превышает 237 млн человек, из них более 120 млн страдают клинически манифестными формами болезни, а 20 млн имеют серьезные осложнения. В странах Африки отмечают как изолированные очаги мочеполового, кишечного шистосомоза, так и сочетанное их распространение. Изолированные очаги мочеполового шистосомоза имеются в странах Ближнего и Среднего Востока, а сочетание мочеполового и кишечного шистосомоза - в Йемене, Саудовской Аравии. Ареал японского шистосомоза охватывает Китай, Малайзию, Филиппины, Индонезию, Японию; ареал меконгового шистосомоза - Кампучию, Лаос, Таиланд. В странах Центральной и Южной Америки и на островах Карибского бассейна (за исключением Кубы) распространен кишечный шистосомоз (S. mansoni). В РФ регистрируются только завозные случаи шистосомозов.
Меры профилактики
Уничтожение шистосом или прекращение выделения ими яиц достигается своевременным выявлением и специфическим лечением больных. В комплекс мер профилактики входят предупреждение фекального загрязнения водоемов, уничтожение в них моллюсков и церкариев с помощью химических и биологических средств. В настоящее время в программах борьбы с шистосомозами наибольшее значение имеют массовая химиотерапия и применение моллюскоцидов. Большое значение придается активной санитарно-просветительной работе среди населения эндемичных очагов. Лица, выезжающие в эндемичные по шистосомозам регионы и страны, должны получать полноценную информацию о личной профилактике гельминтоза.
Патогенез
Патогенное влияние паразитов начинается с момента проникновения церкариев через кожу. Секреты желез мигрирующих личинок, продукты распада части из них - сильные антигены, вызывающие реакции ГЗТ. Клинически это проявляется преходящей папулезной зудящей сыпью и известно под названием «чесотка пловцов». Личинки (шистосомулы), внедряясь в периферические лимфатические и венозные сосуды, мигрируют в правые отделы сердца, в легкие, затем достигают сосудов печени, где и происходят их развитие и дозревание до взрослых особей. Через 4-6 нед после заражения, в период завершения миграции шистосомул и начала откладывания яиц созревшими самками, резко усиливаются аллергические реакции, которые лежат в основе острой («токсемической») фазы болезни (болезнь Катаямы). По характеру клинических проявлений эта фаза напоминает сывороточную болезнь. Чаще ее наблюдают при инвазии S. japonicum, значительно реже - после заражения другими видами возбудителя.
Из общего числа яиц шистосом, отложенных самками в мелких венозных сосудах, питающих стенки кишечника или мочевого пузыря, в окружающую среду попадает не более 50%; остальные задерживаются в тканях пораженных органов или током крови заносятся в другие органы. Основа патологических изменений в хроническом периоде болезни - воспалительные изменения вокруг яиц шистосом (формирование гранулемы, с последующим фиброзом и кальцификацией). В формировании гранулемы участвуют Т-лимфоциты, макрофаги, эозинофилы. Вначале процесс имеет обратимый характер, но с отложением коллагена и развитием фиброза морфологические изменения в тканях становятся необратимыми. Гранулематозная реакция и фиброз вызывают нарушения кровоснабжения в стенке органа, что становится причиной вторичных дистрофических изменений слизистой оболочки, образования язв. Следствием постоянного и длительного раздражения тканей яйцами паразитов могут быть также гиперплазия и метаплазия эпителия слизистой. В мочевом пузыре в 85% случаев основным местом поражений, связанных с отложением яиц S. haematobium, является подслизистый слой; мышечный слой поражается реже. В мочеточниках глубоко расположенные слои поражаются чаще. Поскольку возбудитель кишечного шистосомоза S. mansoni локализуется в венах геморроидального сплетения и в нижней брыжеечной вене и там же скапливаются откладываемые яйца. Основные патологические изменения развиваются преимущественно в дистальных отделах толстой кишки. S. japonicum, в отличие от других видов, откладывает не одиночные яйца, а группы, и они быстрее подвергаются кальцификации. При всех формах шистосомозов яйца заносятся и в другие органы, прежде всего в печень и легкие. Наиболее тяжелые поражения печени, приводящие к циррозу, развиваются при японском и кишечном шистосомозе. Попадание яиц в легкие ведет к развитию обструктивно-деструктивного артериита, артериовенозных анастомозов, развитию гипертензии малого круга кровообращения, которая становится причиной формирования «легочного сердца». Возможен занос яиц шистосом в спинной и головной мозг.
Тяжесть клинических проявлений болезни зависит от интенсивности инвазии. Зрелые шистосомы устойчивы к воздействию факторов иммунитета. Шистосомозы могут быть факторами канцерогенеза. В очагах этого гельминтоза часто встречаются опухоли мочеполовой системы и толстой кишки.
Клиническая картина
Мочеполовой шистосомоз
Возбудитель - Schistosoma haematobium.
В клиническом течении выделяют три стадии: острую, хроническую и стадию исхода.
Проявления, связанные с внедрением церкариев, в виде аллергического дерматита у неиммунных лиц регистрируют редко. Через 3-12 нед скрытого периода может развиться острый шистосомоз. Появляются головные боли, слабость, распространенная болезненность в спине и конечностях, отсутствие аппетита, повышается температура тела, особенно вечером, нередко с ознобом и сильным потом, наблюдают уртикарную сыпь (непостоянно); характерна гиперэозинофилия (до 50% и выше). Печень и селезенка часто увеличены. Выявляют нарушения со стороны сердечно-сосудистой системы и органов дыхания.
Наиболее ранний симптом хронического мочеполового шистосомоза - гематурия, которая чаще бывает терминальной. Отмечают боли в надлобковой области и промежности. В более поздних стадиях может присоединиться цистит, вызванный вторичной инфекцией. При цистоскопии на слизистой оболочке мочевого пузыря обнаруживают бугорки (гистологически - конгломерат специфических гранулем) - беловато-желтые образования размером с булавочную головку, а также инфильтраты, папилломатозные разрастания, эрозии, язвы, «песчаные пятна» - просвечивающие через истонченную слизистую оболочку скопления обызвествленных яиц шистосом. Стеноз мочеточников и фиброз шейки мочевого пузыря создает условия для застоя мочи, образования конкрементов, впоследствии - гидронефроза и пиелонефрита. Отмечают также поражения половых органов: у мужчин - фиброз семенных канатиков, орхит, простатит, у женщин - папилломы и изъязвления слизистых оболочек влагалища и шейки матки. В позднем периоде возможно образование свищей мочевого пузыря, новообразований мочеполовой системы. Поражение легких и их сосудов ведет к гипертензии в малом круге кровообращения: у больных возникают одышка, ощущение сердцебиения, признаки гипертрофии правого желудочка сердца.
Кишечный шистосомоз
Возбудитель - S. mansoni.
Вскоре после заражения возможно развитие дерматита, вслед за которым могут появиться лихорадка, слабость, головная боль. Продолжительность этих проявлений от 1 до 7-10 дней.
Острый кишечный шистосомоз характеризуется лихорадкой (ремиттирующей, интермиттирующей, неправильной), ухудшением аппетита, тошнотой, рвотой, частым жидким стулом, иногда с обезвоживанием организма; возможны примесь крови в испражнениях, боли в животе, в отдельных случаях напоминающие картину «острого живота», кашель с мокротой, часто тахикардия, артериальная гипотензия. Отмечают слабость, адинамию, реже - возбуждение. В крови - гиперэозинофилия, лейкоцитоз. Возможен гепатит. Клинические проявления острого кишечного шистосомоза наблюдают в течение первых 3 мес после заражения.
В хроническом периоде болезни основные симптомы связаны с поражением толстой кишки, особенно ее дистального отдела. Характерен жидкий стул, чередования диареи и запора или хронический запор. Отмечают боли по ходу толстой кишки. При обострениях развивается дизентериеподобный синдром: стул учащен, слизисто-кровянистый, схваткообразные боли в животе, тенезмы. Обострение сменяется запором, часто образуются трещины заднего прохода, геморрой. При колоноскопии преимущественно в дистальном отделе толстой кишки обнаруживают гиперемию, отечность слизистой оболочки, множественные точечные геморрагии; иногда - полипоз кишечника, инфильтраты в стенке кишки, напоминающие опухоль.
При шистосомозном поражении печени (гепатоспленомегалическая форма) исходом процесса становятся перипортальный фиброз и цирроз печени. Независимо от кишечных симптомов больные отмечают чувство тяжести, дискомфорта.
Печень увеличена, плотная, бугристая. Биохимические показатели не претерпевают существенных изменений. С развитием портальной гипертензии расширяются вены пищевода и желудка, вследствие их разрыва могут возникать кровотечения. Декомпенсация портального кровообращения проявляется асцитом, увеличением селезенки.
При инвазии S. mansoni наблюдают гломерулонефрит, который обусловлен образованием и отложением иммунных комплексов.
Поражение легких не дает заметных клинических проявлений. Если давление в легочной артерии превышает 60 мм рт.ст., то возникают типичные признаки хронического «легочного сердца»: одышка, чувство сердцебиения, повышенная утомляемость, кашель, цианоз губ, надчревная пульсация, акцент и раздвоение II тона над легочной артерией.
Шистосомоз кишечный интеркалатный вызывается паразитированием S. intercalatum в венах кишечника, брыжейки, системы воротной вены. Болезнь патогенетически и клинически аналогична кишечному шистосомозу, вызванному S. mansoni. Течение болезни доброкачественное, случаи портального фиброза не зарегистрированы.
Японский шистосомоз
Возбудитель - S. japonicum.
Острый период (болезнь Катаямы), при японском шистосомозе отмечают значительно чаще, чем при инвазии S. mansoni и S. haematobium. Он может протекать в разных формах - от легких, бессимптомных до молниеносных, с внезапным началом, тяжелым течением и летальным исходом.
При хроническом японском шистосомозе преимущественно поражаются кишечник, печень и брыжейка. Желудочно-кишечные расстройства наблюдают только у 44% больных. Беспокоят боли в животе, метеоризм, диарея, запор или их чередование; в стуле возможны слизь, кровь. Иногда развивается аппендицит. Занос яиц в портальную систему приводит к тому, что через 1-2 года после инвазии формируется перипортальный фиброз, в последующем - цирроз печени. Тяжелое и частое осложнение японского шистосомоза - кровотечение из расширенных вен пищевода. Поражения легких имеют такую же природу, как и при других формах шистосомозов.
Шистосомоз, вызываемый S. mekongi. Патогенез и клиническая характеристика идентичны таковым японского шистосомоза.
Диагностика
В остром периоде шистосомозов при проведении диагностики необходимо учитывать эпидемиологический анамнез, наличие признаков острого дерматита после купания. Паразитологические методы исследования мочи и фекалий зачастую в начале острого периода неэффективны, яйца шистосом появляются несколько позднее клинических проявлений.
Исследование мочи производят после центрифугирования, при этом следует иметь в виду, что максимальное количество яиц гельминтов выделяется с мочой в период с 10 до 14 ч дня после заражения.
В эндемичных очагах для диагностики используют ИФА, чувствительность которого при инвазии S. mansoni - до 96%, S. haemotobium - до 92%. Положительный ответ - не ранее чем через 6 нед от заражения. В случаях поражения ЦНС используют ПЦР-диагностику.
Инструментальные методы
Цистоскопия дает возможность выявить специфичные для мочеполового шистосомоза изменения на слизистой оболочке мочевого пузыря. Ценное дополнение цистоскопии - эндобиопсия.
При контрастной урографии наблюдают изменения структуры мочеточников. Обзорная рентгенография позволяет обнаружить изменения в легких, обызвествление стенок мочевого пузыря. Для выявления органных и функциональных нарушений используют также фиброколоноскопию (с эндобиопсией), УЗИ, МРТ, КТ органов брюшной полости и малого таза и др.
Дифференциальную диагностику в раннем периоде проводят с ОКИ, тифопаратифозными болезнями, висцеральным лейшманиозом, сывороточной болезнью, а при выраженной эозинофилии - с миграционной фазой других гельминтозов (стронгилоидоз, филяриозы и др.). Кишечные формы шистосомоза необходимо дифференцировать с амебиазом, шигеллезом, хроническими колитами, циррозом печени вирусной и другой природы; мочеполовой шистосомоз - с различными заболеваниями мочеполовой системы, включая воспалительные заболевания, туберкулез и рак МВП. Однако диагностика становится нетрудной после появления яиц в моче (S. haematobium) и фекалиях (S. mansoni, S. japonicum, S. mekongi, S. intercalatum).
Лечение
Противопаразитарное лечение проводят в условиях стационара. Режим полупостельный, специальной диеты не требуется. Основное средство лечения больных шистосомозом - празиквантел, высокоэффективный при всех формах гельминтоза. Препарат назначают в дозе от 40 до 75 мг/кг (более высокие дозы применяют при инвазии S. japonicum, S. mekongi) в 2-3 приема после еды с интервалом 4-6 ч в течение 1 сут.
После завершения специфического лечения через 3-4 нед проводят контрольные исследования мочи или кала на наличие яиц шистосом; исследования повторяют троекратно с интервалом 2 нед. При неэффективности проведенного специфического лечения назначают повторно празиквантел.
Наблюдение за переболевшими проводят в течение 6 мес, а при наличии осложнений болезни - до 2-3 лет.
Прогноз в остром периоде наиболее серьезный при японском шистосомозе, в хроническом периоде - в случаях тяжелых поражений печени при всех формах гельминтоза и мочевыделительной системы при мочеполовом шистосомозе.
Церкариальный дерматит
Церкариальный дерматит (шистосоматидный дерматид, церкариоз, зуд купальщиков) - заболевание, вызываемое личинками трематод семейства Schistoso matidae, облигатными хозяевами которых являются водоплавающие птицы. Клинические проявления характеризуются развитием локального дерматита в местах внедрения личинок.
Код по МКБ-10
B65.3 Церкариальный дерматит.
Этиология
Известно около 20 видов гельминтов семейства Schistosomatidae, паразитирующих во взрослом состоянии в кровеносной системе водоплавающих птиц и некоторых млекопитающих, личинки (церкарии) которых способны проникать в кожу человека. У человека чаще регистрируется инвазия личинками трихобильгарций - Trichobiharzia ocellata и T. stagnicolae. Промежуточными хозяевами этих гельминтов служат пресноводные моллюски, в организме которых происходит размножение и развитие личинок до инвазионной стадии - церкария, с последующим выходом их в воду. Человек является случайным неспецифическим хозяином этих видов гельминтов, и личинки, проникшие через кожные покровы человека, в дальнейшем остаются в коже и погибают.
Эпидемиология
Заражение человека происходит при контакте с водой в пресных водоемах, однако и личинки шистосом морских водоплавающих птиц также могут вызывать заболевания людей после купания в море. Церкариозы широко распространены во всем мире, в том числе и в России. Загрязнение и зарастание внутренних городских водоемов создают благоприятные условия для развития моллюсков и увеличения численности городских водоплавающих птиц, в связи с чем случаи церкариозов стали отмечаться не только в сельской местности, но и в городах.
Меры профилактики
Предупреждение контакта с водой, где имеются водоплавающие птицы и биотопы моллюсков. При длительном пребывании в воде (рыбная ловля и т.п.) необходимо использовать защитную одежду (резиновые сапоги и др.). Рекомендуется проводить регулярную очистку городских водоемов и мест для купания от водной растительности.
Патогенез и клиническая картина
Церкарии, активно внедряясь в кожу, вызывают механическое повреждение тканей и токсико-аллергические реакции, которые проявляются в большей степени в случаях повторного заражения. После контакта с водой, зараженной личинками шистосоматид, на коже (чаще на нижних конечностях) через 20-30 мин появляются зудящие эритематозно-папулезные и уртикарные высыпания. При повторном заражении и интенсивной инвазии возможно общее недомогание, повышение температуры тела, появление местных отеков и волдырей. Обычно указанные симптомы отмечаются в течение 1-2 дней, но могут держаться и 7-10 дней. Заболевание, как правило, заканчивается самопроизвольным выздоровлением.
Диагностика основана на характерной клинической картине и данных эпидемиологического анамнеза. Проводится симптоматическая терапия с включением десенсибилизирующих препаратов и средств местной терапии.
Прогноз благоприятный. Заболевание заканчивается спонтанным выздоровлением.
Цестодозы
Дифиллоботриозы
Дифиллоботриозы (лат. diphyllobothriosis; англ. diphyllobothriasis, fish tapeworm infection) - кишечные гельминтозы, вызываемые лентецами. Характеризуются хроническим течением с преимущественным нарушением деятельности ЖКТ и развитием мегалобластной анемии.
Код по МКБ-10
В70.0 Дифиллоботриоз.
Этиология
Возбудители дифиллоботриозов человека - лентец широкий - Diphyllobothrium latum, и ряд так называемых малых лентецов (более 10 видов дифиллоботриид). D. latum относят к типу Plathelminthes классу Cestoda семейству Diphyllobothriidae. Лентец широкий достигает в длину 10 м и более, на сколексе имеет две щелевидные присоски, с помощью которых он прикрепляется к стенке тонкой кишки человека. Тело гельминта состоит из 3-4 тыс. члеников, поперечный размер которых больше продольного. В зрелых гермафродитных члениках формируются яйца овальной формы, покрытые желтовато-коричневой оболочкой с крышечкой на одном конце.
Развитие D. latum происходит со сменой трех хозяев. Окончательные хозяева - человек, реже - животные, питающиеся рыбой (кошка, собака, медведь, лисица и др.). Яйца выделяются с фекалиями и сохраняют жизнеспособность в течение 3-30 дней, но продолжают развитие только при попадании в воду. В воде через 2-3 нед из яйца выходит корацидий, которого заглатывает промежуточный хозяин. В его теле происходит развитие второй личиночной стадии - процеркоида. Рачков, содержащих инвазионные личинки, проглатывает дополнительный хозяин - хищная (щука, окунь, ерш, налим) или проходная лососевая рыба (кета, горбуша), в кишечнике которого рачки перевариваются, а процеркоиды мигрируют в мышцы, икру, печень и другие органы, где превращаются в плероцеркоиды (инвазионная для человека стадия).
Эпидемиология
Основным источником заражения окружающей среды служит человек, определенную роль могут играть домашние и дикие животные, питающиеся рыбой. Механизм заражения человека оральный. Факторы передачи - зараженная сырая, недостаточно просоленная или плохо термически обработанная рыба, а также икра. Заболеваемость дифиллоботриозом имеет очаговый характер. Чаще поражается взрослое население, особенно занятое ловлей и переработкой рыбы. Дифиллоботриозы распространены преимущественно в Северном полушарии: в странах севера Европы, США, Канаде. В России основные очаги гельминтоза расположены в бассейне рек Северо-Западного региона, Волги, Енисея, Лены, на Сахалине.
Меры профилактики
Употреблять в пищу рыбу следует после тщательной термической обработки или длительного посола (последнее относится и к употреблению икры). Необходимо охранять водоемы от загрязнения фекалиями человека и животных, проводить санитарно-просветительную работу среди населения очагов.
Патогенез
Лентецы, прикрепляясь к слизистой оболочке тонкой кишки, ущемляют ее ботриями, изъязвляя, некротизируя и атрофируя травмируемые участки. При множественной инвазии гельминты могут вызывать непроходимость кишечника. Эозинофилия и катаральные явления в слизистой оболочке в раннем периоде болезни обусловлены сенсибилизацией организма к антигенам гельминта. Эндогенный гипо- и авитаминоз В12 и фолиевой кислоты лежит в основе патогенеза дифиллоботриозной мегалобластной анемии. Гельминт выделяет специфический белковый компонент (рилизинг-фактор), нарушающий связь витамина В12 и гастромукопротеина. В результате длительного паразитирования (возможно, до 20 лет) даже одной особи гельминта анемия приобретает черты пернициозной и сопровождается поражением периферических нервов и спинного мозга.
Клиническая картина
Дифиллоботриоз нередко протекает бессимптомно или со слабовыраженными ощущениями дискомфорта в животе. Однако при любом клиническом течении наблюдают отхождение крупных фрагментов гельминта с каловыми массами. При манифестном течении инвазии возникают боли в животе различной локализации, периодически приобретающие схваткообразный характер, тошнота, гиперсаливация. Аппетит иногда повышен, но отмечаются похудание и снижение работоспособности. При развитии анемии более выражены повышенная утомляемость, головокружение, сердцебиение. Раннее проявление анемии - глоссит, сопровождающийся жжением языка, атрофией его сосочков. В дальнейшем могут появиться боли при приеме пищи вследствие распространения воспалительно-дистрофических изменений на десны, слизистую оболочку щек, нёба, глотки и пищевода. В тяжелых случаях наблюдается увеличение печени и селезенки. Неврологические нарушения при дифиллоботриозе: парестезии, нарушение чувства вибрации, онемение, атаксия - возникают чаще, чем при истинной пернициозной анемии, могут не сопровождаться признаками анемии. Позже нарушается проведение по боковым столбам спинного мозга, появляются спастичность, гиперрефлексия, больные становятся раздражительными, может развиться депрессия.
Осложнения. Основным осложнением дифиллоботриоза является гиперхромная (В12-дефицитная) анемия, иногда возможно развитие кишечной непроходимости.
Диагностика
Дифиллоботриоз диагностируют, основываясь на клинико-эпидемиологических данных (употребление рыбы, сочетание диспепсического синдрома с признаками анемии), выявлении яиц гельминтов при копроовоскопическом исследовании или в результате исследования выделенных при дефекации фрагментов стробилы гельминта.
В крови обнаруживают снижение уровня гемоглобина, гиперхомию эритроцитов, анизо- и пойкилоцитоз, базофильную зернистость эритроцитов (в них нередко видны тельца Жолли), ретикулоцитопению, тромбоцитопению, нейтропению. Дифиллоботриозная В12-дефицитная анемия развивается примерно у 2% инвазированных D. latum, примерно у 40% больных понижено содержание витамина в сыворотке крови. Чаще гематологические изменения регистрируют у лиц пожилого возраста.
Дифференциальную диагностику проводят с другими гельминтозами, сопровождающимися анемией (анкилостомидоз, трихоцефалез, шистосомозы), гиперхромными и гемолитическими анемиями.
Лечение. Госпитализация показана при тяжелой анемии. Специфическое лечение проводят празиквантелом или никлозамидом.
Празиквантел назначают однократно в дозе 15-20 мг на 1 кг массы тела без специальной подготовки.
Никлозамид 2,0 г принимают на ночь, тщательно разжевывая и запивая водой. За 15 мин до приема рекомендуется выпить 1-2 г натрия гидрокарбоната (питьевая сода).
Контрольные анализы кала на наличие яиц дифиллоботрий проводят через 1 и 3 мес после антигельминтной терапии. В случаях возобновления отхождения фрагментов лентеца или обнаружения яиц гельминта в фекалиях больному проводят повторный курс противо-паразитарного лечения.
При выраженной анемии и уровне цианокобаламина в сыворотке менее 100 пг/мл до дегельминтизации показано лечение данным препаратом в дозе 200-400 мкг/кг в течение 2-4 нед.
Диспансеризация не регламентирована. Контрольные анализы кала на наличие яиц широкого лентеца проводят через 1 и 3 мес после антигельминтной терапии. Если возобновляется отхождение фрагментов лентеца или в фекалиях обнаруживают яйца гельминта, проводят повторный курс противопаразитарного лечения.
Прогноз при неосложненном течении гельминтоза благоприятный.
Тениаринхоз
Тениаринхоз (лат. taeniarhynchosis) - гельминтоз из группы цестодозов, вызываемый Taeniarhynchus saginatus (бычьим цепнем) и характеризующийся развитием диспепсических явлений.
Код по МКБ-10
В68.1 Инвазия, вызванная Taeniarhynchus saginatus.
Этиология
Возбудитель - Taeniarhynchus saginatus (цепень невооруженный, бычий цепень), относится к типу Plathelminthes классу Cestoda семейству Taeniidae. Тело его плоское, лентовидное и состоит из головки с четырьмя мощными присосками и множества (1000 и более) члеников (проглоттид). Длина зрелого членика 20 мм, диаметр 5 мм. Гельминт достигает в длину 4-12 м. Зрелые гермафродитные проглоттиды содержат более 140 тыс. яиц. Бычий цепень относится к биогельминтам, при развитии сменяет двух хозяев. Человек - окончательный хозяин, промежуточные - крупный рогатый скот, буйвол, як, зебу.
В организме человека взрослые гельминты паразитируют в тонкой кишке до 20 лет. Зрелые членики, отрываясь от стробилы, попадают в окружающую среду с фекалиями, пассивно или активно выползают из анального отверстия. В организме промежуточного хозяина личинки развиваются в мышечной и соединительной ткани, где превращаются в ларвоцисты овальной формы - цистицерки (финны). Личинки, попавшие в кишечник человека, достигают стадии взрослого гельминта через 2,5-3 мес.
Эпидемиология
Источником контаминации окружающей среды онкосферами бычьего цепня служит человек - единственный дефинитивный хозяин. Наибольшую опасность представляют лица, ухаживающие за животными. Заражение животных чаще всего происходит на пастбищах. Яйца гельминта с кормом попадают в кишечник промежуточного хозяина. Через 16 нед после заражения животного его мясо становится заразным для человека. Цистицерки в мышцах животных сохраняют жизнеспособность в течение 1-3 лет. Механизм заражения человека пероральный - при употреблении в пищу сырого или недостаточно проваренного финнозного мяса животных, промежуточных хозяев гельминта. Тениаринхоз регистрируют во многих регионах нашей страны. Эндемичные районы - Дагестан, Республика Саха (Якутия), Бурятия, Алтайский край, Иркутская, Красноярская и Новосибирская области.
Профилактику осуществляют с помощью комплекса медицинских и ветеринарных мероприятий, направленных на выявление источников инвазии при массовом обследовании населения. Проводят мероприятия по защите окружающей среды (пастбищ) от фекального загрязнения. Личная профилактика заключается в исключении из пищевого рациона сырого и недостаточно термически обработанного мяса крупного рогатого скота.
Патогенез. Бычий цепень в кишечнике человека, как правило, паразитирует в единственном числе (старое название - солитер). Паразит, достигающий размером нескольких метров, прикрепляясь присосками к слизистой оболочке тонкой кишки, наносит повреждение, раздражает рецепторы кишечника, оказывая влияние на моторную и секреторную функции кишечника. Дополнительное механическое воздействие могут оказывать отделившиеся проглоттиды, которые провоцируют болевой синдром, особенно при прохождении через илеоцекальный клапан. Описаны случаи проникновения паразитов в червеобразный отросток, общий желчный и панкреатический проток, что приводило к обструкции и воспалительным изменениям. Возможно развитие непроходимости кишечника. Интенсивное потребление паразитом пищевых веществ в процессе роста и развития создает дефицит в пищевом рационе больного. Характерно значительное снижение уровней витаминов С, группы В, А, Е в сыворотке крови. Определенное значение в патогенезе тениаринхоза имеет блокирующее действие веществ, выделяемых гельминтом, на ферментную систему кишечника человека, а также сенсибилизация продуктами метаболизма бычьего цепня.
Клиническая картина
Нередко инвазия протекает бессимптомно и проявляется только выделением члеников с фекалиями и/или вне акта дефекации в результате их активного выползания из ануса. На 2-3-й неделе после заражения появляются изжога, тошнота, чувство тяжести в эпигастрии, на 8-й неделе нарушается стул. При длительной инвазии больные отмечают общую слабость, боли в животе, иногда наблюдаются снижение массы тела, диарея, повышение аппетита, возникают астеноневротические проявления: головокружение, головная боль, нарушение сна, обморочные состояния, эпилептиформные судо ро ги. В отдельных случаях регистрируются эозинофилия в крови и анемия.
Осложнения: механическая кишечная непроходимость, аппендицит, холангит, панкреатит - возникают очень редко.
Прогноз обычно благоприятный.
Диагностика
Клиническая картина малоспецифична. Подозрение на инвазию может вызывать сочетание диспепсического синдрома и потери массы тела с повышением аппетита. Проводят исследование фекалий, чтобы выявить фрагменты стробилы (проглоттид) и яйца гельминтов методами обогащения.
Дифференциальную диагностику проводят с другими кишечными цестодозами - тениозом и дифиллоботриозом, при которых, в отличие от тениаринхоза, не наблюдается самостоятельного активного отхождения члеников гельминта из анального отверстия.
Лечение
Препарат выбора - празиквантел, назначаемый однократно в дозе 25 мг/кг. Для дегельминтизации можно использовать также никлозамид: 2 г принимают на ночь, тщательно разжевывая и запивая водой. За 15 мин до приема рекомендуют выпить 1-2 г натрия гидрокарбоната (питьевой соды). Препарат вызывает гибель сколекса и незрелых члеников. Если выделение члеников возобновляется, проводят повторный курс лечения теми же антигельминтными препаратами. Если отхождение члеников прекращается в течение 2-3 мес после противопаразитарного лечения, это свидетельствует об эффективном лечении. В таких случаях проводят контрольное исследование фекалий на наличие онкосфер гельминта. Диспансеризация не регламентирована.
Тениоз
Тениоз (taeniosis, taeniasis) - биогельминтоз, вызываемый паразитированием в кишечнике человека свиного цепня и проявляющийся нарушением функций ЖКТ.
Код по МКБ-10
B68.0 Инвазия, вызванная Taenia solium.
Этиология
Возбудитель - Taenia solium - цепень вооруженный (свиной цепень), тип Plathelminthes класс Cestoda семейство Taeniidae. Гельминт имеет плоское лентовидное тело. На шаровидном сколексе расположены четыре присоски и хоботок с двумя рядами чередующихся коротких и длинных хитиновых крючьев.
Длина взрослого гельминта достигает 3-4 м, количество члеников - 800-1000, их размеры: длина 12-15 мм, диаметр 6-7 мм. В зрелом членике матка имеет 7-12 пар боковых ответвлений. Членики не обладают активной подвижностью. Каждый из них содержит 30-50 тыс. яиц.
Окончательный хозяин - человек, в кишечнике которого паразитирует половозрелая форма гельминта. В организме промежуточного хозяина - свиньи (факультативными хозяевами могут быть также дикие свиньи, собаки, кошки, иногда человек) зародыш освобождается из яйца, проникает в кишечную стенку и с кровотоком разносится по всему организму. Через 60-70 дней зародыш превращается в цистицерк (Cysticercus cellulosae) - финны, достигающие в диаметре 5-8 мм, а в паренхиматозных органах - 1,5 см. Цистицерки сохраняют жизнеспособность до 5 лет.
Эпидемиология
Источник инвазии - человек, который с фекалиями выделяет в окружающую среду онкосферы. Это приводит к заражению промежуточных хозяев (свиней) финнозом. Люди заражаются при употреблении в пищу сырого или недостаточно термически обработанного финнозного свиного мяса. Тениоз регистрируют в странах, где развито свиноводство, в частности в РФ.
Основные меры профилактики - выявление и лечение больных, санитарное просвещение населения, благоустройство населенных мест, санитарный надзор за содержанием и убоем свиней, ветеринарный контроль мяса.
Патогенез
При неосложненном кишечном тениозе в основе патогенеза лежат те же факторы, что и при тениаринхозе. Однако, когда зрелые членики вследствие антиперистальтических сокращений забрасываются из кишечника в желудок, возможна аутоинвазия онкосферами. В этом случае тениоз может осложниться развитием цистицеркоза мозга, скелетных мышц, глаз.
Клиническая картина
Клиническая картина неосложненного кишечного тениоза близка к таковой при тениаринхозе. При тениозе сравнительно часто регистрируют диспепсические и астеноневротические проявления: нарушение аппетита, тошнота, рвота, боли в животе, расстройство стула, головные боли, головокружение, нарушение сна, кратковременные обморочные состояния.
Осложнения редки. Возможны кишечная непроходимость, перфорация кишки, аппендицит, холангит, панкреатит, цистицеркоз. Течение доброкачественное. Летальные случаи наблюдают крайне редко, связаны с осложнениями.
Диагностика
Предположительный диагноз тениоза устанавливают на основании указания больного на отхождение члеников или небольших фрагментов стробилы гельминта при дефекации. Для подтверждения диагноза и дифференциации тениоза от тениаринхоза необходимо провести микроскопическое исследование выделяемых больным члеников.
Дифференциальную диагностику проводят с другими кишечными гельминтозами, прежде всего с тениаринхозом и дифиллоботриозом.
Лечение
Лечение больных тениозом проводят в стационаре никлозамидом (фенасалρ): 2 г принимают на ночь, тщательно разжевывая и запивая водой. За 15 мин до приема рекомендуется выпить 1-2 г натрия гидрокарбоната (питьевая сода). Препарат высокоэффективен, вызывает гибель сколекса и незрелых члеников. В настоящее время часто применяют празиквантел, который назначают однократно в дозе 25 мг/кг больным всех возрастных групп.
Трудоспособность в неосложненных случаях не нарушается.
Цистицеркоз
Цистицеркоз (лат. cysticercosis) - хронический биогельминтоз, вызываемый личиночной стадией свиного цепня - цистицерка (финны).
Коды по МКБ-10
B69 Цистицеркоз.
Этиология. Возбудитель - Cysticercus cellulosae (личиночная стадия Taenia solium) представляет собой образование в виде пузырька диаметром 5-15 мм, содержащего ввернутый внутрь сколекс.
Эпидемиология. Цистицеркоз у человека развивается после заражения онкосферами фекально-оральным путем или в результате аутоинвазии при наличии кишечного тениоза, когда зрелые членики вследствие антиперистальтических сокращений забрасываются из кишечника в желудок. Цистицеркоз, как и кишечный тениоз, регистрируют в странах, где развито свиноводство.
Профилактика. Предусматривается комплекс мер по недопущению инвазии животных, их санации, предотвращению загрязнения окружающей среды яйцами гельминтов. Личная профилактика цистицеркоза у человека, с учетом возможности его развития, как следствие кишечного тениоза, предусматривает, наряду с неукоснительным соблюдением правил личной гигиены, употребление мяса и мясных продуктов только в достаточно хорошо термически обработанном виде.
Патогенез
Паразитирование Cysticercus cellulosae наблюдается в подкожной клетчатке, головном и спинном мозге, глазах, мышцах, сердце, печени, легких, брюшине и др. Вокруг гельминта во всех органах и тканях (кроме глаза) образуется реактивная соединительнотканная капсула, развиваются воспалительные и дегенеративные изменения. Значение фактора механического сдавливания паразитами окружающих тканей зависит от локализации цистицерков. Наиболее тяжелое течение характерно для поражения головного мозга и глаза. В мозговой ткани вокруг цистицерка развиваются васкулит, выраженная глиальная реакция, возможны энцефалит, менингит, нарушение ликвородинамики. При локализации личинки в оболочках основания мозга развивается рацемозная (ветвистая) форма цистицерка, при этом паразит, достигающий в длину более 20 см, может опускаться по ходу спинного мозга. При поражении глаз в процесс нередко вовлекаются оба глаза. Выраженные токсико-аллергические реакции наблюдаются при отмирании паразита, когда происходит его расплавление; при кальцификации воспалительная реакция отсутствует.
Клиническая картина
Клинические проявления цистицеркоза определяются его локализацией, интенсивностью инвазии и стадией развития паразита.
Цистицеркоз подкожной клетчатки и мышц часто не имеет каких-либо явных признаков, иногда в тканях пальпируются плотные узелки. Цистицеркоз ЦНС протекает в виде церебрального, спинального поражения или сочетанных поражений полушарий большого мозга, желудочковой системы, основания мозга, поэтому и развивающаяся очаговая неврологическая симптоматика весьма разнообразна и зависит от локализации паразита. Характерна приступообразная головная боль, сопровождающаяся тошнотой, рвотой, приступами генерализованных судорог. Возможны нарушения психики в виде делириозных, галлюцинаторных и аментивных состояний. При локализации цистицерков в желудочках мозга выявляют внутричерепную гипертензию, локализация паразита в IV желудочке может привести к внезапной смерти. Цистицеркоз глаза вначале проявляется нарушениями зрения, снижением его остроты, вплоть до слепоты. Внедрение цистицерка в глазницу вызывает экзофтальм. Локализация его в сердце в области предсердно-желудочкового пучка ведет к нарушению сердечного ритма.
Диагностика
Примерно у 50% больных цистицеркозом регистрируют подкожную локализацию паразита. Диагноз в этом случае устанавливают на основании рентгенограммы или по результатам биопсии узлов. Цистицеркоз мозга диагностируют на основании анамнестических (в том числе заболевание тениозом), клинических и эпидемиологических данных, положительных результатов серологических исследований (ИФА, РНИФ, иммуноблот), ПЦР-диагностики.
При поражениях мозга в СМЖ возможны 2-3-значный плеоцитоз с преобладанием эозинофилов и лимфоцитов, повышение концентрации белка при нормальном содержании глюкозы и лактата.
Для идентификации поражений мозга используют КТ, МРТ, ангиографию головного мозга. Обнаружение внутриглазного цистицерка возможно при прямой офтальмоскопии и биомикроскопии, когда видны волнообразные движения живого паразита. При гибели возбудителя диагностика затруднена вследствие дезорганизации внутриглазных структур.
Дифференциальную диагностику проводят с опухолями и воспалительными заболеваниями органов, эхинококкозом, церебральным токсоплазмозом.
Лечение
Больных нейроцистицеркозом и глазным цистицеркозом для лечения госпитализируют в профильные стационары. Лечение нейроцистицеркоза проводят в условиях неврологического стационара. Для противопаразитарного лечения используют празиквантел в суточной дозе 50 мг/кг массы тела в сутки в 3 приема в течение 14 дней и более или албендазол по 15 мг/кг массы тела в сутки в 2-3 приема в течение 28-30 дней. Одновременно с применением антигельминтных препаратов осуществляют противовоспалительную терапию, назначают глюкокортикоиды. Рекомендуют проводить 3 цикла лечения с интервалом 2-3 нед. При глазном цистицеркозе албендазол и празиквантел противопоказаны. Больным с цистицеркозом мышц и подкожной клетчатки назначают симптоматическое лечение.
Хирургическое удаление одиночных цистицерков (при наличии технических возможностей) показано при поражении глаз, головного мозга и спинного мозга [1, 2, 5].
Прогноз зависит от топографии и объема поражения тканей и органов.
При цистицеркозе мозга (особенно при многофокусных поражениях различных его отделов) и глаз прогноз неблагоприятный. Больные с такими поражениями нуждаются в длительном (практически пожизненном) наблюдении и лечении.
Эхинококкозы
Эхинококкозы - хронически протекающие биогельминтозы, вызываемые паразитированием у человека личинок цестод рода Echinococcus.
Коды по МКБ-10
B67 Эхинококкоз.
Гидатидозный эхинококкоз
Гидатидозный эхинококкоз (однокамерный эхинококкоз, эхинококкоз цистный, лат. echinococcosis, англ. echinococcus disease) - хронический зоонозный биогельминтоз с фекально-оральным механизмом передачи возбудителя, характеризующийся образованием паразитарных кист в печени, реже в легких и других органах.
Этиология
Возбудитель гидатидозного эхинококкоза Echinococcus granulosus относится к типу Plathelminthes классу Cestoda семейству Taeniidae. Половозрелый E. granulosus - ленточный гельминт белого цвета длиной 3-8 мм. Состоит из головки с четырьмя присосками и двойной коронкой крючьев, шейки и 2-6 члеников. Последний членик заполнен маткой, содержащей яйца (онкосферы), которые обладают инвазивной способностью и не нуждаются в дозревании в окружающей среде. Половозрелый гельминт паразитирует в тонкой кишке окончательного хозяина - плотоядных животных. Зрелые членики с фекалиями попадают в окружающую среду. Яйца обладают высокой устойчивостью в окружающей среде, зимой сохраняют жизнеспособность до 6 мес.
Эпидемиология
Источником инвазии E. granulosus для человека чаще всего служат домашние собаки, реже - дикие животные (волки, шакалы и др.). Основным фактором передачи являются руки, загрязненные онкосферами эхинококка, которые находятся на шерсти инвазированных собак. Заражение человека может происходить также при сборе ягод и трав, питье воды из загрязненных яйцами гельминта открытых водных источников. Заболевание чаще встречается в определенных профессиональных группах: работники скотобоен, пастухи, кожевники, охотники, члены их семей, особенно дети. Существуют различные штаммы эхинококков, адаптированных к разным промежуточным и окончательным хозяевам. Эхинококкоз гидатидозный встречается на всех континентах. Чаще регистрируется в странах с пастбищным скотоводством, особенно в тех, где для охраны скота используются собаки. В странах ближнего зарубежья эхинококкоз распространен в Закавказье, Казахстане и других странах Центральной Азии, на Украине, в Молдове. Случаи заболевания людей гидатидозным эхинококкозом зарегистрированы в 73 из 89 субъектов Российской Федерации. Наиболее неблагополучными являются Уральский, Дальневосточный и Северо-Кавказский регионы.
Меры профилактики
Состоят в соблюдении личной гигиены. Особая настороженность необходима при содержании собак в доме и уходе за животными. Проводят плановую дегельминтизацию собак. В местах, неблагополучных по эхинококкозу, необходима плановая диспансеризация групп риска.
Патогенез
Из-за гематогенного пути распространения онкосферы эхинококка могут быть занесены в любой орган, но чаще всего эхинококковые кисты локализуются в печени (30-75%) и легких (15-20%), значительно реже в ЦНС (2-3%), селезенке, поджелудочной железе, сердце, в трубчатых костях и почках (до 1%). Превращение онкосферы в ларвоцисту у инвазированного человека длится около 5 мес; за это время она достигает в диаметре 5-20 мм. Патологическое воздействие эхинококка обусловлено механическим и сенсибилизирующим факторами. У большинства пациентов поражается единственный орган одной солитарной кистой, но может развиваться и множественный эхинококкоз. Размеры кист варьируют от 1 до 20 см (и более) в диаметре. Эхинококковая киста растет медленно в течение ряда лет, отодвигая ткани пораженных органов, где постепенно развиваются дистрофические изменения, склероз стромы и атрофия паренхимы. У 5-15% больных отмечают сдавление желчных протоков обызвествленными внутрипеченочными кистами. В легочной ткани вокруг погибшего паразита формируются ателектазы, очаги пневмосклероза, бронхоэктазы. Кисты, поражающие кости, постепенно разрушают структуру костной ткани, что приводит к патологическим переломам. При длительном течении болезни может происходить нагноение и разрыв эхинококковых кист. При вскрытии кисты (самопроизвольно или в результате повреждения ее стенок) развиваются сильные аллергические реакции; высвобождение многочисленных сколексов ведет к диссеминации возбудителя.
Клиническая картина
Различают следующие стадии гидатидозного эхинококкоза: доклиническую, неосложненную и стадию осложнений.
При наиболее частом поражении - эхинококкозе печени - первые признаки болезни появляются через несколько лет и даже десятилетий после заражения. Нередко эхинококкоз диагностируют случайно (при плановой флюорографии, УЗИ) или при целенаправленном обследовании населения в очагах. Гидатидозный эхинококкоз чаще выявляют у лиц среднего возраста. В клинически манифестной стадии в неосложненных случаях у больных эхинококкозом печени отмечают снижение работоспособности, общую слабость, диспепсические расстройства, головные боли, иногда аллергические проявления: кожные высыпания, зуд, эозинофилию в крови. Печень при пальпации увеличенная, плотная (при локализации пузыря в глубине паренхимы) или мягкая, эластичная (при поверхностном расположении кисты), при кальцификации - деревянисто-плотная.
Симптоматика эхинококкоза легких определяется локализацией кисты и темпами ее роста. Киста, расположенная вблизи плевры, рано проявляет себя болевым синдромом, а при локализации у бронхиального ствола - упорным сухим кашлем, кровохарканьем, болями в груди, одышкой. Возможны деформация грудной клетки, сглаженность межреберных промежутков, отставание при дыхании пораженной стороны, укорочение перкуторного звука и ослабление дыхания над кистой. При небольших единичных кистах симптомы могут отсутствовать, но течение болезни может резко измениться при вскрытии кисты. При прорыве в бронх появляются сильный кашель, удушье, цианоз, возможны тяжелые аллергические реакции и аспирационная пневмония. Прорыв в плевральную полость приводит к развитию острого экссудативного плеврита, в тяжелых случаях развивается анафилактический шок, а перфорация в полость перикарда бывает причиной внезапной смерти.
Осложнения
Наиболее частые осложнения гидатидозного эхинококкоза печени - нагноение эхинококковой кисты, прорыв или сдавление кистой желчных путей с возникновением обтурационной желтухи. Кисты больших размеров могут сдавливать крупные сосуды портальной системы, что приводит к развитию портальной гипертензии. Разрыв кисты может быть спровоцирован ударом, поднятием тяжестей, грубой пальпацией. Разрыв кисты сопровождается резкой болью и проявлениями аллергической реакции различной степени выраженности, вплоть до развития анафилактического шока. В результате разрыва жизнеспособной кисты печени происходит диссеминация возбудителя в брюшную полость и развивается вторичный множественный эхинококкоз других органов. Клинические проявления вторичного множественного эхинококкоза, обусловленного диссеминацией возбудителя после разрыва кист, появляются через 1-2 года и больше. При локализации паразита в головном мозге, глазнице, спинномозговом канале или миокарде уже маленькие кисты могут давать выраженную симптоматику, схожую с объемным поражением.
Диагностика
Предполагать диагноз эхинококкоза позволяют клинические проявления (обнаружение опухолевидного образования в печени, легких или других органах) и эпидемиологические данные. Рентгенологические методы обследования, УЗИ, КТ и МРТ позволяют оценить локализацию, размеры кисты, состояние окружающих органов и тканей.
Сероиммунологические методы (ИФА, РНГА, латекс-агглютинации) дают положительные результаты в 90% случаев и более при поражении печени, при эхинококкозе легких эффективность ниже - 60%. При использовании ИФА примерно у 10% исследуемых регистрируются ложноположительные результаты.
Паразитологическая диагностика: исследованию на цистный эхинококкоз подлежат: содержимое паразитарной кисты, ее оболочки, мокрота больного (при эхинококкозе легких), промывные воды при лаваже бронхов (в случаях вскрытия кисты в бронх), желчь (при подозрении на прорыв кисты в желчные протоки), содержимое брюшной и плевральной полостей (при вскрытии кист в полости), содержимое дренажной жидкости в разные сроки после операции, при бронхоскопии, плевральной пункции, дуоденальном зондировании.
Дифференциальную диагностику гидатидозного эхинококкоза проводят с опухолями, паразитарными кистами другой этиологии, гемангиомами печени.
Лечение. Госпитализация показана при осложненном течении болезни.
Основной метод лечения больных эхинококкозом - хирургический.
Химиотерапия проводится в случаях разрыва кист, когда есть опасность обсеменения при нарушении целостности кисты во время операции, а также в случаях множественных поражений кистами небольших размеров (не более 3-5 см) печени, легких и других органов, при которых оперативное вмешательство сопряжено с высоким риском для жизни больного и невозможно технически. Противо-рецидивное лечение рекомендуется после операции, когда нельзя исключить наличие других локализаций паразита небольших размеров.
Противопаразитарное лечение в настоящее время проводят албендазолом. Препарат принимают внутрь после еды 10 мг/кг массы тела (не более 800 мг/сут) в 2 приема, курс - 28 дней, интервалы между курсами - не менее 2 нед. Продолжительность лечения клинически выраженных форм инвазии (наличие кист) - 12-18 мес. Лечение проводится при нормальных лабораторных показателях (клинический и биохимический анализы крови), в процессе лечения каждые 5-7 дней осуществляется контрольное исследование крови. Применение высоких доз албендазола в течение длительного времени само по себе становится причиной развития осложнений, обусловленных токсическим действием препарата: наблюдаются лейкопения, агранулоцитоз, алопеция, лихорадка, токсический гепатит.
Прогноз. После радикального удаления эхинококковых кист прогноз благоприятный; если невозможно оперативное лечение - неблагоприятный.
Диспансеризация. После хирургического лечения 1-2 раза в год проводят обследование, включающее клиническое, биохимическое исследование крови, серологические реакции и инструментальное исследование (УЗИ, КТ, МРТ). Реконвалесцентов снимают с учета не ранее чем через 5 лет при отсутствии признаков рецидива и стойких отрицательных результатах серологических исследований.
Альвеолярный эхинококкоз
Альвеолярный эхинококкоз (альвеококкоз, многокамерный эхинококкоз, лат. alveococcosis, англ. alveococcus disеase) - зоонозный хронический гельминтоз, который характеризуется развитием в печени кистозных образований, способных к инфильтративному росту и метастазированию в другие органы.
Этиология
Возбудитель - Alveococcus multilocularis, развивается со сменой хозяев. Окончательные хозяева альвеококка - плотоядные животные (лисицы, песцы, собаки, кошки и др.), в тонкой кишке которых паразитируют половозрелые формы. Промежуточные хозяева - грызуны.
Половозрелая форма A. multilocularis по строению сходна с ленточной стадией E. granulosus, но имеет меньшие размеры (длина 1,6-4 мм), головка снабжена одним венчиком коротких крючьев, матка шаровидной формы. Основное различие состоит в строении финны, которая у A. multilocularis имеет вид грозди пузырьков и представляет собой конгломерат экзогенно почкующихся мелких пузырьков, заполненных жидкостью или студенистой массой. У человека пузырьки часто не имеют сколексов. Рост финны происходит медленно, в течение нескольких лет.
Эпидемиология
Источник гельминта для человека - его окончательные хозяева. Зрелые яйца и членики, заполненные яйцами, выделяются в окружающую среду с фекалиями животных. Заражение человека происходит при попадании в рот онкосфер из окружающей среды при охоте, обработке шкур убитых диких животных, употреблении в пищу лесных ягод и трав, обсемененных яйцами гельминта. Онкосферы альвеококка очень устойчивы к действию факторов окружающей среды: они переносят температуру от -30 °С до +60 °С, на поверхности почвы при температуре 10-26 °С сохраняют жизнеспособность в течение месяца.
Альвеококкоз - природно-очаговое заболевание. Факторы, определяющие активность очагов, - обилие промежуточных хозяев (грызунов), большие территории (луга, пастбища), которые не вспахиваются, прохладный дождливый климат. Заболевания в основном отмечают среди лиц, посещающих природные очаги по профессиональной или бытовой необходимости (сбор ягод, грибов, охота, пеший туризм и др.), а также среди работников зверосовхозов. Отмечают и семейные случаи заражения. Чаще болеют мужчины в возрасте 20-40 лет, дети болеют редко.
В России заболевание встречается в Поволжье, Западной Сибири, на Камчатке, Чукотке, в Республике Саха (Якутии), Красноярском и Хабаровском краях.
Меры профилактики
Такие же, как при гидатидозном эхинококкозе. Патогенез и патоморфология
У человека личинка А. multilocularis развивается 5-10 лет и более. У лиц, не являющихся коренными жителями эндемических очагов, рост паразита происходит быстрее. Личиночная форма альвеококка представляет собой плотную, мелкобугристую опухоль, которая состоит из конгломерата мелких пузырьков. На разрезе она напоминает мелкопористый сыр. Альвеококковый узел - это очаг продуктивно-некротического воспаления. Вокруг очагов некроза образуется грануляционный вал, содержащий живые пузырьки альвеококка. Особенности альвеококка - инфильтрирующий рост и способность к метастазированию, что сближает данное заболевание со злокачественными опухолями. Первично всегда поражается печень. Чаще всего паразитарный очаг локализуется в правой доле, реже в обеих ее долях. Возможно солитарное и многоузловое поражение печени. Паразитарные узлы округлые, цвета слоновой кости, от 0,5 до 30 см и более в диаметре, деревянистой плотности. Компенсация функции органа возможна за счет гипертрофии непораженных отделов печени. В осложненной стадии болезни в центре альвеококковых узлов практически всегда появляются полости некроза (каверны) различной формы и величины. Стенка каверны местами может истончаться, что создает угрозу ее разрыва. Активно размножающиеся пузырьки паразита в периферической зоне узла внедряются в ткань печени по ходу сосудисто-протоковых структур, в желчный пузырь. Развивается обтурационная желтуха, в поздних стадиях - билиарный цирроз печени. Альвеококковый узел может прорастать в желчные протоки, малый и большой сальники, забрюшинную клетчатку, диафрагму, правое легкое, правые надпочечник и почку, заднее средостение. Возможно метастазирование в ЛУ забрюшинной клетчатки, легкие, головной мозг, кости.
Клиническая картина
Альвеококкоз выявляется преимущественно у лиц молодого и среднего возраста. Нередко заболевание многие годы протекает бессимптомно - доклиническая стадия. В клинически манифестной стадии симптоматика малоспецифична и определяется объемом паразитарного поражения, его локализацией и наличием осложнений. Выделяют раннюю, неосложненную стадию, стадию осложнений и терминальную стадию заболевания. По характеру течения различают: медленно прогрессирующий, активно прогрессирующий и злокачественного течения альвеолярный эхинококкоз.
Первым признаком заболевания является увеличение печени, которое обычно обнаруживают случайно. Больные отмечают дискомфорт и ощущение давления в правом подреберье или в эпигастральной области. Появляется чувство тяжести и тупая ноющая боль. Нередко отмечается увеличение и асимметрия живота. Пальпируется плотная печень с неровной поверхностью. Печень продолжает увеличиваться, становясь деревянистой плотности, бугристой и болезненной при пальпации. Больные отмечают слабость, снижение аппетита, похудание. Как правило, значительно повышена СОЭ, наблюдается непостоянная эозинофилия, лимфопения. Рано появляются гиперпротеинемия с гипергаммаглобулинемией (повышается в основном уровень IgG). При осложненных формах заболевания наблюдается анемия. Показатели биохимических проб длительное время сохраняются в пределах нормы. Билирубинемия, повышение активности АСТ, АЛТ, ЩФ характерны для стадии осложнений. В этой стадии чаще всего развивается подпеченочная желтуха, особенно при центральной локализации кисты, которая начинается без болевого синдрома и нарастает медленно, сопровождается кожным зудом, который часто предшествует появлению желтухи. В случае присоединения бактериальной инфекции развивается клиническая картина абсцесса печени. Портальная, или кавальная гипертензия, встречаются реже, чем желтуха. Симптомы портальной гипертензии возникают в запущенных стадиях альвеококкоза. Наиболее опасным осложнением портальной гипертензии является кровотечение из вен пищевода и желудка. Метастазы чаще всего обнаруживаются в легких, головном мозге, реже - в почках, костях. Более чем у 50% больных наблюдается протеинурия, гематурия, пиурия, цилиндрурия. Поражение почек может быть обусловлено сдавлением органа извне или за счет метастазов, нарушением почечного кровотока и пассажа мочи с развитием инфекции МВП.
Диагностика
Диагностика основана на данных эпидемиологического анамнеза, клинико-лабораторных и инструментальных исследований.
Рентгенологические исследования, УЗИ, КТ и МРТ позволяют оценить степень поражения органов.
Используют серологические методы: РЛА, непрямой гемагглютинации, ИФА, ПЦР, однако отрицательный результат не исключает наличия альвеококкоза.
Дифференциальная диагностика
Альвеококкоз печени необходимо дифференцировать от гидатидозного эхинококкоза, новообразований холедохопанкреатической области, амебного абсцесса, цирроза печени.
Лечение
Режим и диета показаны при осложненном течении болезни.
Химиотерапия проводится в случаях разрыва кист, при нарушении целостности кисты во время операции, а также в случаях множественных поражений кистами небольших размеров (не более 3-5 см). Противорецидивное лечение рекомендуется после операции, когда нельзя исключить наличие других локализаций паразита небольших размеров.
Противопаразитарное лечение проводят албендазолом. Препарат принимают внутрь после еды 10 мг/кг массы тела (не более 800 мг/ сут) в 2 приема, курс - 28 дней, интервалы между курсами - не менее 2 нед. Продолжительность лечения клинически выраженных форм инвазии (наличие кист) - 12-18 мес.
Прогноз
Серьезный, если невозможно оперативное лечение.
Диспансеризация
Диспансерное наблюдение за переболевшим после перенесенной операции длится 8-10 лет с обследованием не реже чем 1 раз в 2 года. Снимают с учета только лиц, показавших отрицательный результат при 3- или 4-кратном серологическом исследовании в течение 3-4 лет. При появлении клинических признаков рецидива или нарастании титров антител при серологических реакциях показано обследование в условиях стационара. Больные с неоперабельными формами заболевания остаются нетрудоспособными, и наблюдение за ними пожизненное.
Нематодозы
Аскаридоз
Аскаридоз (лат. ascaridosis) - антропонозный геогельминтоз - нематодоз, вызываемый человеческой аскаридой - Ascaris lumbricoides. Характеризуется аллергическим синдромом в ранней (миграционной) стадии, нарушением функций ЖКТ и возможными осложнениями - в хронической (кишечной) стадии инвазии.
Коды по МКБ-10
В77.0 Аскаридоз с кишечными осложнениями.
Этиология
Возбудитель Ascaris lumbricoides, относится к типу Nemathelminthes, классу Nematoda, отряду Rhabditida, семейству Oxyuridae. В цикле развития A. lumbricoides различают следующие стадии: половозрелую форму, яйцо, инвазионное яйцо, личинку.
Половозрелые особи имеют длинное тонкое тело беловато-розового цвета. Самка размером 20-40 см × 3-6 мм, самец - 15-25 см × 2-4 мм.
Ротовое отверстие, расположенное на переднем конце тела, окружено тремя кутикулярными губами. Паразитируют половозрелые аскариды в тонкой кишке человека, питаясь содержимым кишечника. Каждая самка в сутки откладывает до 240 тыс. оплодотворенных и неоплодотворенных яиц. При благоприятных условиях внешней среды (наличие кислорода, высокая влажность, температура 20-25 °С) развитие личинки в яйце занимает 2-3 нед. Зрелые личинки способны в течение 20 дней сохраняться при температуре -20-27 °С. При -30 °С личинки быстро погибают, а температура +47 °С вызывает их гибель в течение 1 ч.
Эпидемиология
Аскаридоз относится к геогельминтозам. Источник контаминации окружающей среды - только больной аскаридозом человек. Он заражается при проглатывании инвазивных яиц. Факторами передачи служат загрязненные овощи, ягоды, другие пищевые продукты, вода, а также руки. В зоне умеренного климата сезон заражения длится до 7 мес - с апреля по октябрь, в условиях теплого влажного климата - круглый год. Восприимчивость к аскаридозу высокая. Для жителей эндемичных очагов, подверженных частым повторным заражениям, характерно развитие определенной невосприимчивости: формируется иммунитет к суперинвазии и реинвазии. Иммунные реакции против личинок гельминта защищают хозяина от бесконтрольного увеличения интенсивности инвазии при повторном заражении.
Аскаридоз широко распространен во влажных зонах умеренного, субтропического и тропического поясов, редко регистрируется в сухих степях, отсутствует в зоне вечной мерзлоты, высокогорья и пустынь. По данным ВОЗ, аскаридозом в мире ежегодно поражаются около 900 млн человек, большинство из которых составляют дети дошкольного и школьного возраста. Очаги аскаридоза формируются преимущественно в сельской местности, интенсивность передачи зависит от степени загрязненности почвы инвазионными яйцами, уровня санитарной культуры населения и санитарного благоустройства населенных мест.
Меры профилактики
В профилактике аскаридоза основное значение имеют санитарное благоустройство населенных мест и охрана почвы от фекального загрязнения. В индивидуальной профилактике важно строго соблюдать правила личной гигиены, тщательно промывать употребляемые в пищу сырые овощи, ягоды и фрукты. В очагах аскаридоза с пораженностью менее 10% населения один раз в два года проводят паразитологическое обследование 20% жителей; в очагах, где поражено более 10% жителей, ежегодно обследуют все население. Лечение инвазированных проводят с контролем эффективности через 14 дней после дегельминтизации, всего - троекратно с интервалом 7-10 дней. Обследование жителей микроочага проводят в течение 2 лет ежегодно.
Патогенез
Из инвазионных яиц аскарид в тонкой кишке человека выходят рабдитовидные личинки, которые через 3-4 ч проникают в толщу слизистой оболочки. Далее происходит миграция личинок по системе портальной вены в печень, затем в легкие, где в течение 1-2 нед продолжается их развитие. В печени на 5-6-й день после заражения и в легких (на 10-й день) личинки совершают линьку. В легких, разрывая капиллярную сеть и стенки альвеол, они проникают в просвет бронхов и продвигаются по воздухоносным путям в ротоглотку. С заглатываемой слюной и пищей личинки повторно попадают в тонкую кишку, где превращаются в половозрелых самцов и самок, совершив перед этим еще две линьки. Продолжительность миграции личинок составляет около 2 нед, а созревание самок до начала откладывания яиц длится более 10 нед. В организме человека взрослая особь живет 11-13 мес.
В ранней миграционной стадии в основе патологических изменений лежит сенсибилизация организма продуктами метаболизма, линьки и распада погибших личинок. Аллергены аскарид - самые сильные среди аллергенов паразитарного происхождения. При интенсивной инвазии наблюдается механическое повреждение стенки тонкой кишки, кровеносных сосудов, ткани печени, легких. Отмечают также эозинофильные инфильтраты в легких, капиллярный стаз, геморрагии. Клинические проявления в поздней кишечной стадии связаны с механическим воздействием гельминтов и продуктов их метаболизма на слизистую оболочку кишечника, что ведет к нарушению пищеварения, моторной функции, азотистого баланса, гиповитаминозам. Один из выделяемых аскаридой полипептидов оказывает токсическое влияние на ЦНС. Аскариды могут мигрировать за пределы тонкой кишки: в желчные и панкреатические протоки, аппендикс, дыхательные пути. Иногда скопления аскарид приводят к закупорке, завороту кишки, инвагинации. Кишечная непроходимость чаще возникает при интенсивной инвазии, а инвагинация - при наличии единичных гельминтов или нескольких особей одного и того же пола. Аскариды существенно подавляют иммунологическую реактивность хозяина.
Клиническая картина
Выделяют две клинические стадии болезни - раннюю (миграционную) и позднюю (кишечную). Ранняя стадия часто протекает субклинически или бессимптомно. При клинически выраженной форме на 2-3-й день после заражения появляется недомогание, слабость, субфебрилитет. Наблюдаются уртикарные высыпания на коже, возможно увеличение печени и селезенки. Более характерен симптомокомплекс поражения легких с образованием транзиторных инфильтратов, определяемых рентгенологически, и эозинофилией в периферической крови (синдром Леффлера). В этих случаях появляются сухой кашель, иногда с мокротой с прожилками крови, одышка, боли в груди, удушье. В легких выслушивают сухие и влажные хрипы.
В кишечной стадии аскаридоз у взрослых часто протекает со слабовыраженными симптомами или бессимптомно. Наблюдаемые симптомы малоспецифичны (ухудшение аппетита, тошнота, иногда рвота, схваткообразные боли в животе, диарея или неустойчивый стул). Самочувствие больных ухудшается, снижается работоспособность, появляются головная боль, нарушение сна, головокружение.
У детей в ранней стадии аскаридоза может развиться пневмония, при интенсивной инвазии - тяжелая интоксикация. Снижается масса тела, дети становятся капризными, рассеянными, возможны эпилептиформные приступы, менингизм, синдром Меньера, в анализе крови - нормо- и гипохромная анемия, эозинофилия.
Осложнения
Наиболее частое осложнение, особенно у детей в возрасте от 4 до 8 лет, - непроходимость кишечника. При деструктивных изменениях слизистой оболочки кишечника или после оперативных вмешательств возможны проникновение аскарид в брюшную полость и развитие перитонита. Внедрение гельминтов в желчевыводящие и панкреатические ходы может привести к подпеченочной желтухе, реактивному панкреатиту, в случае присоединения вторичной бактериальной инфекции развиваются гнойный холангит, абсцессы печени, иногда аппендицит. При рвоте, антиперистальтических движениях аскариды могут попасть в пищевод, откуда они проникают в глотку, дыхательные пути, вызывая асфиксию.
Диагностика
При распознавании ранней (миграционной) стадии аскаридоза необходимо ориентироваться на симптомы поражения легких в сочетании с лихорадкой и эозинофилией крови. Редко удается обнаружить личинок аскарид в мокроте. Лабораторная диагностика аскаридоза в кишечной стадии заключается в выявлении яиц гельминтов в фекалиях. При отрицательных результатах, в случае подозрения на гельминтоз, рекомендуют проводить повторные исследования с интервалом 1-2 нед.
Дифференциальную диагностику аскаридоза в миграционной стадии проводят с токсокарозом, ранней фазой других гельминтозов, характеризующихся аллергическими проявлениями, острым бронхитом, пневмонией. В кишечной стадии по клиническим симптомам практически невозможно дифференцировать аскаридоз от хронических болезней ЖКТ.
Лечение
Медикаментозная терапия. Лечение больных проводят амбулаторно или в дневном стационаре. Госпитализации подлежат больные с хирургическими осложнениями аскаридоза.
Все больные аскаридозом подлежат лечению антигельминтными средствами.
Албендазол назначают взрослым однократно в дозе 400 мг внутрь после еды, детям старше 3 лет - по 10 мг/кг в 2 приема в течение 1-3 дней.
Мебендазол показан взрослым и детям старше 2 лет внутрь по 100 мг 2 р/сут в течение 3 дней.
Пирантел назначают по 10 мг/кг однократно внутрь после еды.
При приеме указанных антигельминтных препаратов не требуется специальной диеты и назначения слабительных средств.
При возникновении хирургических осложнений необходимо оперативное или инструментальное вмешательство.
Прогноз при неосложненном течении аскаридоза благоприятный. В отсутствие повторного заражения через 9-12 мес наступает самоизлечение вследствие естественной гибели гельминтов.
Диспансерное наблюдение за переболевшими осуществляют в течение 2-3 мес. Контрольные исследования фекалий на наличие яиц аскарид проводят троекратно: через 14 дней после дегельминтизации и повторно с интервалом 7-10 дней. При неэффективности курс лечения следует повторить.
Трихоцефалез
Трихоцефалез (трихиуриаз, трихуроз, лат. trichocephalosis, англ. trichocephaliasis, trichuriasis) - антропонозный геогельминтоз, характеризующийся хроническим течением с преимущественным нарушением функций ЖКТ.
Код по МКБ-10
B79 Трихуроз.
Этиология
Возбудитель - власоглав, Trichocephalus trichiurus, тип Nemathelminthes, класс Nematoda, отряд Enoplida, семейство Trichocephalidae. Передняя часть тела гельминта тонкая, волосовидная, хвостовой отдел утолщен; отношение нитевидной части к утолщенной у самки составляет 2:1, у самца - 3:2. Длина тела самки 30-35 мм, тела самца - 30-45 мм. У самок задний конец изогнут, у самцов имеет вид спирали.
Яйца власоглава имеют форму бочонка размером 0,02×0,05 мм. Взрослые особи гельминта паразитируют в толстой, чаще в слепой кишке. Здесь самки откладывают до 1500 до 3000 яиц в сутки. Яйца с фекалиями попадают в окружающую среду. Они должны пройти инкубацию в почве в течение 3 нед и более. Когда яйцо проглочено, в тонкой кишке высвобождается личинка, она внедряется в ворсинки, через несколько дней перемещается в толстую кишку, где достигает зрелости через 3 мес. Среди взрослых особей преобладают самки. Продолжительность жизни власоглава около 5 лет.
Эпидемиология
Трихоцефалез относят к геогельминтозам. Источник загрязнения окружающей среды - больной человек. Созревание яиц власоглава в почве длится 20-25 дней. Человек заражается в результате заглатывания зрелых яиц с загрязненными овощами, фруктами, ягодами, водой. Власоглав - убиквитарный паразит. По данным ВОЗ, в мире трихоцефалезом поражены 604 млн человек. В РФ гельминтоз распространен на Северном Кавказе и в центральных черноземных областях. Болеют преимущественно дети в возрасте от 5 до 15 лет.
Профилактика
В профилактике центральное место занимают мероприятия по охране почвы от фекального загрязнения, а также соблюдение правил личной гигиены.
Патогенез
В патогенезе трихоцефалеза главную роль отводят травмирующему действию возбудителя. Власоглавы тонким головным концом повреждают слизистую оболочку, проникая до подслизистого, а иногда и мышечного слоя. При интенсивной инвазии наблюдают геморрагии, образование эрозий и язв в кишечнике. Власоглавы - факультативные гематофаги. Полагают, что инвазированные люди теряют 0,005 мл крови на одного паразита в день, поэтому наличие более 800 гельминтов в кишечнике у детей служит причиной гипохромной анемии. Сенсибилизирующее воздействие на организм метаболитов паразита ограничивается чаще тканями кишки, что способствует развитию диареи. Клинические проявления гельминтоза очевидны при паразитировании большого количества власоглавов. Симптомы болезни наблюдаются у людей, выделяющих более 5000 яиц возбудителя в 1 г фекалий.
Клиническая картина
При умеренной инвазии больные предъявляют жалобы на ухудшение аппетита, тошноту, слюнотечение, диарею, метеоризм. Возможны спастические боли в животе с локализацией в правой подвздошной области. Больные отмечают слабость, раздражительность, головокружение, головную боль. При массивной инвазии развивается гемоколит, проявляющийся болевым синдромом, тенезмами, кровянистым жидким стулом. Дети, больные трихоцефалезом, отстают от сверстников в физическом и умственном развитии. В тропических странах трихоцефалезу приписывают роль фактора, способствующего развитию кишечного амебиаза и его тяжелому течению.
Осложнения трихоцефалеза - выпадение прямой кишки, гипохромная анемия, дисбиоз кишечника, кахексия. Трихоцефалез - фактор риска развития аппендицита.
Лабораторная диагностика трихоцефалеза основана на обнаружении яиц гельминтов в фекалиях методами обогащения (МУК 4.2.3145-13). Взрослых гельминтов в кишечнике обнаруживают при эндоскопии (колоноскопия).
Дифференциальную диагностику проводят с другими кишечными гельминтозами, шигеллезом, амебиазом, язвенными колитами. При подозрении на хирургические осложнения показана консультация хирурга, при подозрении на язвенный колит - консультация проктолога.
Противопаразитарное лечение больных трихоцефалезом проводят амбулаторно. В госпитализации нуждаются больные с тяжелым и осложненным течением инвазии.
Применяют следующие лекарственные препараты.
В случаях упорной инвазии проводят повторный курс лечения спустя 3-4 нед.
Контрольное исследование фекалий необходимо через 3-4 нед после завершения курса лечения антигельминтным препаратом.
Прогноз обычно благоприятный.
Энтеробиоз
Энтеробиоз (лат. enterobiosis, англ. enterobiasis, oxyuriasis) - антропонозный контагиозный гельминтоз человека, характеризующийся перианальным зудом и кишечными расстройствами.
Код по МКБ-10
B80 Энтеробиоз.
Этиология
Возбудитель энтеробиоза - острица (Enterobius vermicularis), относящаяся к типу Nemathelminthes классу Nematoda отряду Rhabditida семейству Oxyuridae. Тело взрослых гельминтов веретенообразное; длина самки 9-12 мм, самца - 3-5 мм.
Зрелая самка паразитирует в слепой кишке. В ночное время, когда сфинктер расслабляется, она выходит через анальное отверстие и в перианальных складках откладывает от 5000 до 15 000 яиц, после чего погибает. Содержащийся в яйце зародыш развивается в инвазионную личинку в течение 4-5 ч. Длительность жизни остриц с момента заражения до выхождения зрелых самок для яйцекладки составляет около 30 сут. Яйца, относительно устойчивые к высыханию, загрязняют нательное и постельное белье, где сохраняют инвазивность до 2-3 нед. Особенность жизненного цикла E. vermicularis - отсутствие фазы миграции и низкая иммуногенность.
Эпидемиология
Источником заражения служит только инвазированный человек. Механизм заражения фекально-оральный. Основной фактор передачи - загрязненные яйцами остриц руки, а также предметы домашнего обихода, игрушки. Яйца остриц находят на полу, коврах, в ночных горшках и др. Расчесы из-за сильного зуда в перианальной области способствуют скоплению яиц под ногтями, где личинки заканчивают развитие до инвазионного состояния. Иногда возможна ретроинвазия, когда яйца остриц созревают в аногенитальной зоне, личинки заползают обратно в кишечник и там созревают. Контагиозность очень высока. Несмотря на небольшую длительность жизни остриц, вследствие возможности частых повторных заражений энтеробиоз может длиться годами. Энтеробиоз распространен повсеместно, преимущественно в странах с умеренным климатом. Энтеробиозом в основном поражаются дети дошкольного и младшего школьного возраста. По оценкам ВОЗ, в мире этим гельминтозом ежегодно поражается около 350 млн человек; в России энтеробиоз - один из наиболее распространенных гельминтозов.
Меры профилактики
В профилактике энтеробиоза значение придают выявлению источника инвазии и устранению путей передачи возбудителя. С этой целью один раз в год (после летнего периода при формировании детского коллектива или по эпидемическим показаниям) проводят плановые профилактические обследования детей и обслуживающего персонала. Детей, больных энтеробиозом, в период лечения и проведения контрольного обследования отстраняют от посещения дошкольных и образовательных учреждений. Если выявлено 20% и более зараженных энтеробиозом при проведении плановых профилактических обследований в организованных коллективах, одновременно всем детям и персоналу проводят противогельминтное лечение (двукратно с интервалом в 2 нед). В очаге энтеробиоза необходимо строго соблюдать чистоту жилища, служебных, школьных помещений. Лица, соприкасающиеся с больными, должны соблюдать чистоту тела, одежды, мыть руки перед едой и после посещения туалета.
Патогенез
Острицы вызывают механическое повреждение при фиксации на слизистой оболочке кишечника, особенно сильно травмируют ее самки своим длинным и острым хвостовым концом. Механическое раздражение и действие продуктов жизнедеятельности гельминтов вызывают зуд кожи в перианальной зоне. Острицы иногда погружаются в толщу слизистой оболочки кишки, при этом вокруг них формируются гранулемы. В результате заноса патогенных микроорганизмов вглубь тканей острицы могут способствовать развитию тифлита, аппендицита, а сами гельминты, проникая в червеобразный отросток, способны вызвать аппендикулярную колику. Эктопическая миграция остриц бывает причиной вагинита, эндометрита и сальпингита у девочек.
Клиническая картина
Клинические проявления энтеробиоза больше выражены у детей, у взрослых гельминтоз может протекать бессимптомно или субклинически. Наиболее частый симптом - зуд в области заднего прохода. При низкой инвазии зуд возникает периодически, по мере созревания очередных поколений самок остриц. Зуд появляется вечером или ночью, когда гельминты выползают из анального отверстия. При интенсивной инвазии зуд и жжение становятся постоянными и изнуряющими, распространяются на область промежности, половые органы. Длительное и сильное расчесывание способствует лихенизации кожи и развитию экзематозного дерматита, пиодермии, сфинктерита, иногда парапроктита. Больные, особенно дети, становятся раздражительными, жалуются на плохой сон, повышенную утомляемость; у детей регистрируются обмороки, эпилептиформные припадки, никтурия. При массивной инвазии возникают боли и урчание в животе, метеоризм, тошнота, рвота, запор или понос, иногда с примесью слизи. При проникновении остриц в червеобразный отросток могут появиться симптомы «острого живота», в таких случаях больных оперируют: в удаленном аппендиксе обнаруживают катаральные изменения, в его просвете и толще слизистой оболочки находят яйца и взрослых гельминтов.
Диагностика
Взрослых гельминтов иногда обнаруживают на поверхности испражнений. Для выявления яиц остриц исследуют соскоб с перианальных складок. Рекомендуют не менее трех повторных исследований, чтобы полностью исключить вероятность инвазии.
Дифференциальную диагностику проводят с геморроем, заболеваниями прямой кишки (язвенные, необластозные поражения), сахарным диабетом, нейродерматитом.
Лечение
Госпитализация больных не требуется.
Препараты выбора - албендазол, мебендазол; в качестве альтернативны - пирантел.
Албендазол назначают внутрь: взрослым по 400 мг однократно, детям от 2 лет - 5 мг/кг однократно; повторный прием в той же дозе через 2 нед.
Мебендазол внутрь по 10 мг/кг однократно; повторный прием в той же дозе через 2 нед.
Пирантел внутрь по 5-10 мг/кг однократно; повторный прием в той же дозе через 2 нед.
Необходимость повторного лечения выбранным антигельминтным препаратом через 2 нед связана с тем, что из-за возможности ре- и суперинвазий один курс может не оказать должного эффекта.
Непременные условия успешной дегельминтизации при энтеробиозе - одновременное лечение всех членов семьи (детского коллектива) и строгое соблюдение гигиенического режима для исключения повторного заражения.
Контроль за эффективностью лечения с помощью указанных выше паразитологических методов проводят через 15 дней после полного завершения курса лечения.
Прогноз благоприятный.
Стронгилоидоз
Стронгилоидоз (лат. strongyloidosis) - гельминтоз из группы кишечных нематодозов, вызываемый Strongyloides stercoralis; протекающий с аллергическими реакциями, а позже - с диспепсическими расстройствами; человек заражается при проникновении личинок через кожу или при проглатывании их с пищей.
Коды по МКБ-10
В78 Стронгилоидоз.
Этиология
Возбудитель стронгилоидоза человека - Strongyloides stercoralis (кишечная угрица) - мелкая раздельнополая нематода, относится к типу Nemathelminthes, классу Nematoda, отряду Rhabditida, семейству Strongy loididae.
Развитие Strongyloides stercoralis происходит без промежуточного хозяина. Половозрелые паразитические самки длиной 2,2 мм и шириной 0,03-0,04 мм имеют бесцветное нитевидное тело, суживающееся к переднему концу, и конический хвост. Самцы, свободноживущие и паразитические, имеют одинаковые размеры (0,07 мм в длину и 0,04-0,05 мм в ширину).
В организме человека половозрелые гельминты паразитируют в верхних отделах тонкой кишки, иногда в желчных и панкреатических протоках, но чаще всего в либеркюновых криптах, где самки ежедневно откладывают до 40 яиц (размером около 0,05×0,03 мм), здесь же из них выходят рабдитовидные личинки, которые с фекалиями попадают в окружающую среду. При неблагоприятных условиях среды рабдитовидные личинки линяют и через 3-4 дня превращаются в филяриевидных личинок (инвазионная стадия). Личинки способны перемещаться в почве. В организм человека личинки проникают активно через кожу или заносятся пассивно через рот с загрязненными овощами, фруктами, водой. При всех видах заражения филяриевидные личинки совершают миграцию по организму хозяина, подобно личинкам аскариды. Самки внедряются в слизистую оболочку кишечника и через 17-28 дней после заражения начинают откладывать яйца.
Эпидемиология
Человек - основной источник заражения окружающей среды. Заражение человека в большинстве случаев происходит в результате активного проникновения личинок через кожу при соприкосновении с зараженной почвой (перкутанный путь). Однако возможны другие пути заражения: алиментарный (при употреблении овощей и фруктов, загрязненных личинками гельминта), водный (при питье воды из загрязненных источников водоснабжения). Описаны случаи профессионального заражения при нарушении правил техники безопасности в лабораториях во время паразитологических исследований фекалий больных. Существует также механизм внутрикишечного самозаражения (аутоинвазии), благодаря которому новые паразитические поколения образуются, минуя свободноживущую фазу; рабдитовидные личинки могут превращаться в инвазивные филяриевидные в кишечнике при долгом нахождении в нем (например, при запорах). В этом случае перелинявшие личинки внедряются в стенку кишечника, и цикл повторяется. Благодаря этому механизму стронгилоидоз может персистировать у человека десятилетиями, даже после выезда из очага. Возможен также половой путь заражения (у гомосексуалов). Некоторые эндемичные очаги поддерживаются сохранением в почве свободноживущих поколений червей. Заражение обычно происходит весной, летом и осенью.
Гельминтоз чаще регистрируют у жителей сельской местности. В группу риска входят также лаборанты паразитологических лабораторий, лица, находящиеся в наркологических отделениях, психиатрических клиниках и интернатах для умственно отсталых. В 70 странах мира, по оценочным данным, число пораженных составляет от 100 до 200 млн человек. Стронгилоидоз распространен во влажных тропиках и субтропиках. Однако регистрируют повсеместно вследствие интенсивного завоза с эндемичных территорий. В умеренном климатическом поясе наблюдают спорадические случаи. Наиболее высокий уровень пораженности населения в РФ регистрируют в Ростовской области, Краснодарском крае, Приамурье.
Профилактические мероприятия предусматривают охрану окружающей среды от фекального загрязнения, активное выявление больных стронгилоидозом среди групп риска по клиническим показаниям: при заболеваниях ЖКТ (язвенная болезнь), аллергозах (линейные формы крапивницы), эозинофилии крови, а также при профилактических осмотрах.
Меры личной профилактики - избегать хождения босиком и других контактов открытых участков тела с почвой на эндемичных территориях, а также тщательное мыть овощи и огородную зелень перед употреблением. Необходимо проводить систематическую санитарно-просветительскую работу среди населения по мерам индивидуальной профилактики.
Патогенез
В ранней стадии патологические изменения в тканях и органах на путях миграции личинок обусловлены сенсибилизацией организма продуктами метаболизма гельминтов и их механическим воздействием. Паразитирование самок и личинок вызывает в ЖКТ воспалительную реакцию. При миграции личинки могут попасть в печень, легкие, почки и другие органы и ткани, где развиваются гранулемы, дистрофические изменения и микроабсцессы. Возможно многолетнее бессимптомное течение кишечной инвазии, способной быстро реактивироваться при подавлении клеточного иммунитета.
У ослабленных и иммунокомпрометированных лиц (имеющих раковые заболевания, СПИД, после трансплантации органов, химиотерапии и лечения глюкокортикоидами) стронгилоидоз может переходить в диссеминированную форму, когда личинки паразитов распространяются по всему организму. Эта форма болезни может протекать тяжело, вызывая паразитемию, менингит, миокардит.
Клиническая картина
Длительность инкубационного периода не установлена.
Различают острую (раннюю миграционную) и хроническую стадии гельминтоза. У большинства инвазированных ранняя миграционная стадия протекает бессимптомно.
В манифестных случаях в этот период преобладает симптомо-комплекс острого инфекционно-аллергического заболевания. При перкутанном заражении в месте внедрения личинок появляются эритематозные и макуло-папулезные высыпания, сопровождающиеся зудом. Больные жалуются на общую слабость, раздражительность, головокружение и головную боль, повышение температуры тела (до 38-39 °С). Наблюдаются бронхит или пневмония: кашель, иногда с примесью крови в мокроте, одышка, бронхоспазм. Рентгенологически обнаруживают «летучие» инфильтраты в легких. Эти явления продолжаются от 2-3 сут до недели и более. Через 2-3 нед после заражения у большинства больных появляются симптомы поражения ЖКТ: тупые или схваткообразные боли в животе, диарея, сменяющаяся запором, нарушение аппетита, саливация, тошнота, рвота. Возможно увеличение печени и селезенки. В периферической крови эозинофилия до 30-60%, лейкоцитоз, увеличение СОЭ. Через 2-3 мес эти симптомы стихают и заболевание переходит в хроническую стадию, для которой характерны нарушения деятельности ЖКТ (в том числе дуодено-желчно-пузырный синдром), функциональные расстройства ЦНС и вегетативной нервной системы и аллергические симптомы.
Для желудочно-кишечной формы свойственно длительное течение с периодическими обострениями симптомов гастрита, энтерита, энтероколита (изжога, боль в животе, метеоризм, похудание, анорексия, тошнота, рвота, понос). При интенсивной инвазии слизистая изъязвляется, возможен парез кишечника. В таких случаях заболевание протекает по типу язвенной болезни двенадцатиперстной кишки, язвенного колита или острого живота, наблюдают признаки дискинезии билиарной системы. Длительная инвазия может приводить к синдрому мальабсорбции.
Нервно-аллергическая форма протекает с астеноневротическим синдромом, уртикарной сыпью (линейная, кольцеобразная) с сильным зудом. При аутосуперинвазии, наблюдающейся чаще у лиц с психическими расстройствами и низкой санитарной культурой, возникает упорный дерматит в области промежности, на ягодицах, внутренних поверхностях бедер.
Примерно у 10% больных возможно поражение органов дыхания с развитием астмоидного бронхита.
При смешанной форме могут быть выражены все проявления заболевания или некоторые из них. При тяжелом течении инвазии наблюдаются истощающая диарея с обезвоживанием, синдром мальабсорбции, анемия, кахексия. Возможны осложнения: язвенные поражения кишечника, нередко заканчивающиеся перфоративным перитонитом, паренхиматозная дистрофия печени, некротический панкреатит.
У ослабленных больных, злоупотребляющих алкоголем, с иммунодефицитом (при СПИДе, лейкозе, лучевой терапии, длительном приеме глюкокортикоидов, цитостатиков), отмечается крайне неблагоприятное течение стронгилоидоза, который переходит в гиперинвазивную и диссеминированную форму. Стронгилоидная гиперинвазия обусловлена высокой численностью паразитов и характеризуется проникновением филяриевидных личинок во многие органы и ткани. Миграция личинок в головной мозг вызывает тромбоз сосудов, отек и быструю гибель больного. При диссеминированном стронгилоидозе нередко отсутствует один из характерных лабораторных признаков - эозинофилия. Стронгилоидоз относят к числу СПИД-ассоциированных паразитарных болезней.
Осложнения
Основное осложнение стронгилоидоза - развитие гиперинвазивного синдрома с поражением печени, почек, сердца, брюшины, ЛУ, поджелудочной и щитовидной железы, простаты, яичников. Известны случаи аппендицита, вызванного инвазией S. stercoralis. Поражения почек иногда проявляются нефротическим синдромом.
Для лабораторной диагностики необходимо обнаружение личинок S. stercoralis в фекалиях или в дуоденальном содержимом с помощью специальных методов (метод Бермана, его модификации и др.). При массивной инвазии личинок можно обнаружить в нативном мазке фекалий. При генерализации процесса обнаружение личинок гельминта в кале нередко затруднено, их чаще находят в дуоденальном содержимом, они могут появляться также в мокроте и в моче.
Методом ИФА возможно обнаружение IgG-антител. Разработана ПЦР-диагностика.
Дифференциальная диагностика на основании клинической картины затруднена, что объясняется полиморфизмом проявлений стронгилоидоза. В миграционной стадии стронгилоидоз дифференцируют от миграционной стадии аскаридоза и других гельминтозов, в хронической - от язвенной болезни желудка и двенадцатиперстной кишки, хронического холецистита, панкреатита.
Лечение
Лечение больных неосложненным стронгилоидозом проводят в амбулаторных условиях; больных генерализованным и гиперинвазивным стронгилоидозом госпитализируют в инфекционный стационар.
Препаратом выбора в настоящее время считают ивермектин (в РФ не зарегистрирован). Он эффективен для лечения острой и хронической формы стронгилоидоза, а также диссеминированной гиперинфекции. Ивермектин назначают в дозе 200 мкг/кг массы тела однократно. Пока препарат плохо изучен у детей.
Албендазол - альтернативный препарат, назначают в суточной дозе 400-800 мг (детям старше 2 лет по 10 мг/кг в сутки) в 1-2 приема в течение 3 дней, при интенсивной инвазии - до 5 дней.
Противопаразитарное лечение проводят на фоне приема антигистаминных препаратов.
Контроль за эффективностью лечения больных стронгилоидозом проводят непосредственно после окончания лечения и через месяц. Для этого троекратно исследуют кал с интервалом 1-2 дня на наличие личинок S. stercoralis. В сомнительных случаях целесообразно исследовать дуоденальное содержимое.
Больным, получающим иммуносупрессивную терапию, больным ВИЧ-инфекцией даже при отрицательных контрольных анализах после эффективного лечения целесообразно проводить ежемесячное профилактическое противопаразитарное лечение указанными выше препаратами в половинной дозе курсами по 2 дня.
Прогноз благоприятный в неосложненных случаях при проведении этиотропной терапии в ранние сроки болезни. При тяжелом течении, особенно протекающем на фоне иммунодефицита, прогноз серьезный, особенно тяжело протекает стронгилоидоз у больных вИч/СПИД, так как сопровождается выраженными деструктивными изменениями в стенке кишки, иногда приводящими к перфорации, генерализации инвазии с поражением многих органов и систем, прежде всего ЦНС, легких.
Трихинеллез
Трихинеллез (лат. trichinellosis, англ. trichinosis) - биогельминтоз, вызываемый нематодами рода Trichinella. Характеризуется острым течением, лихорадкой, болями в мышцах, отеками, гиперэозинофилией и различными аллергическими проявлениями.
Код по МКБ-10
В75 Трихинеллез.
Этиология
Возбудители трихинеллеза - круглые черви семейства Trichinellidae, включающего два вида - Trichinellа spiralis c тремя вариантами (T. s. spiralis, T. s. nativa, T. s. nelsoni) и Trichinella pseudospiralis. В России наибольшее значение имеют T. s. spiralis и T. s. nativa. Trichinella s. spiralis распространена повсеместно, паразитирует у домашних свиней, патогенна для человека. Trichinellа s. nativa встречается в Северном полушарии, паразитирует у диких млекопитающих, чрезвычайно устойчива к холоду, патогенна для человека.
Трихинеллы - мелкие нематоды с цилиндрическим бесцветным телом, покрытым прозрачной кутикулой кольчатой структуры. Длина неоплодотворенной самки 1,5-1,8 мм, оплодотворенной - до 4,4 мм, половозрелого самца - около 1,2-2 мм, диаметр гельминтов менее 0,5 мм. В отличие от других нематод трихинеллы - живородящие гельминты. Их личинки, юные трихинеллы, имеют палочковидную форму, длину до 0,1 мм; через 18-20 дней развития личинка удлиняется до 0,7-1,0 мм.
Один и тот же организм теплокровного животного для трихинелл служит сначала дефинитивным (кишечные трихинеллы), а затем промежуточным (инкапсулированные в мышцах личинки) хозяином. В организм нового хозяина паразит попадает с мясом животных, в котором содержатся живые инкапсулированные личинки. Под действием желудочного сока капсула растворяется, личинки в тонкой кишке через час активно внедряются в слизистую оболочку. На 4-7-е сутки самки начинают производить живых личинок. Каждая самка в течение репродуктивного периода, длящегося 10-30 дней, рождает от 200 до 2000 личинок. Из кишечника личинки током крови разносятся по всему организму. Дальнейшее развитие паразита возможно только в поперечнополосатых мышцах. На 3-й неделе после заражения личинки становятся инвазионными и принимают типичную спиралевидную форму. К началу 2-го месяца после заражения вокруг них в мышцах формируется фиброзная капсула, которая через 6 мес начинает обызвествляться. В капсулах личинки сохраняют жизнеспособность 5-10 лет и более. В мышцах человека капсулы личинок трихинелл размером 0,3-0,6 мм всегда имеют лимоновидную форму.
Эпидемиология
Трихинеллез - природно-очаговый биогельминтоз. Четких границ между природными и синантропными очагами во многих случаях провести не удается, так как возможен обмен возбудителем между дикими и домашними животными. Известно более 100 видов млекопитающих, которые могут быть хозяевами трихинелл. Возбудитель циркулирует между хищными (бурые и белые медведи, псовые, кошачьи, куньи), факультативно-плотоядными парнокопытными животными (кабан, северный олень, лось) и грызунами (крысы, полевки, лемминги и др.). Возможно также заражение ластоногих (морж, тюлень) и китообразных (белуха). Циркуляция трихинелл в природе осуществляется преимущественно через хищничество и поедание падали. Инкапсулированные личинки трихинелл проявляют жизнеспособность и заразность в течение 4 мес после полного разложения трупа инвазированного животного.
Синантропные очаги вторичны. Циркуляция возбудителя в них обычно идет по цепи «домашняя свинья-крыса-домашняя свинья». В циркуляции трихинелл человек не участвует, так как в цикле развития гельминта является биологическим тупиком. Заболеваемость трихинеллезом часто носит групповой характер.
Источником возбудителя инфекции для человека служат пораженные трихинеллами домашние и дикие животные. Путь заражения оральный. Человек заражается при употреблении в пищу инвазированного трихинеллами мяса: чаще свинины, реже мяса диких животных (медведя, кабана, барсука, моржа и др.). Личинки трихинелл, находящиеся в мышцах животных, устойчивы к высоким и низким температурам. Нагревание мяса, содержащего инкапсулированные личинки трихинелл, в микроволновой печи до 81 °С не обеспечивает их инактивации. При варке куска мяса толщиной около 10 см личинки погибают только через 2-2,5 ч. Личинки устойчивы к солению, копчению, замораживанию. Наибольшую опасность представляют термически не обработанные мясные продукты: строганина, сало (шпик) и т.д.
Ареал распространения трихинеллеза среди людей соответствует таковому среди животных. В природе среди млекопитающих трихинеллез регистрируют повсеместно, за исключением Австралии. В России синантропный трихинеллез распространен в умеренно-северных, умеренных и южных зонах, на юге Дальнего Востока, Камчатке. Основные районы трихинеллеза, где заражение связано с употреблением в пищу мяса диких животных, - Магаданская, Камчатская области, Красноярский край, Республика Саха (Якутия) и Хабаровский край. Очаги смешанного типа с циркуляцией возбудителя между синантропными (свинья, кошка, собака) и дикими (кабан, медведь, грызуны) животными встречаются на Северном Кавказе. Заболеваемость трихинеллезом в РФ в 90-е гг. XX в. достигала 0,7 на 100 тыс. населения. Благодаря усилению мер профилактики стала снижаться: в 2015 г. - 0,02 на 100 тыс. населения.
Меры профилактики
Основу профилактики трихинеллеза составляют обеспечение ветеринарно-санитарного надзора и санитарно-просветительная работа. Для предупреждения заболевания людей наибольшее значение имеют обязательная ветеринарная экспертиза используемого в пищу мяса, которое допускается к реализации только после тpихинеллоскопии. Исследованию подлежат также и туши диких животных, добытых на охоте. Большое значение имеет информирование населения о гельминтозе и путях его распространения, а также распространение зоотехнических знаний среди лиц, содержащих свиней в личном хозяйстве. По каждому случаю заболевания трихинеллезом проводят экстренное эпидемиологическое расследование с целью выявить источник инвазии и предотвратить ее распространение. Всем лицам, заведомо употреблявшим в пищу мясные продукты, инвазированные трихинеллами, проводят превентивное лечение.
Патогенез
В основе патогенеза трихинеллеза лежит сенсибилизация организма к антигенам гельминта, проявляющаяся в разной степени в кишечной, миграционной и мышечной стадиях инвазии. К концу первой недели после заражения преимущественно в тонкой кишке обнаруживают самок трихинелл, погруженных в слизистую оболочку, вокруг которых развивается местная катарально-геморрагическая воспалительная реакция. При тяжелой инвазии наблюдаются язвенно-некротические повреждения слизистой оболочки кишечника. Взрослые особи выделяют иммуносупpессивные вещества, подавляющие бурную воспалительную реакцию, что способствует миграции личинок. В тощей кишке активизируется система кининов, других гормонов, вызывающих функциональные расстройства, болевой синдром. Метаболиты мигрирующих личинок, освобождающиеся после их гибели, - это антигены, обладающие сенсибилизирующим, ферментативным и токсическим свойствами. Вследствие этого развиваются выраженные аллергические реакции с поражением кровеносных сосудов, коагуляционными нарушениями, тканевым отеком, повышением секреторной активности слизистых оболочек. На второй неделе личинок обнаруживают не только в скелетных мышцах, но и в миокарде, легких, почках, головном мозге. В паренхиматозных органах личинки погибают. Развивающиеся иммунопатологические реакции ведут к тяжелым поражениям: миокардиту, менингоэнцефалиту, пневмонии. Воспалительные процессы со временем стихают, но через 5-6 нед могут сменяться дистрофическими, последствия которых исчезают только через 6-12 мес. Из скелетных мышц чаще всего поражаются межреберные, жевательные, глазодвигательные мышцы, диафрагма, мышцы шеи, языка, верхних и нижних конечностей. У больных тяжелой формой болезни находят 50-100 личинок трихинелл и более в 1 г мышечной массы. К концу 3-й недели личинки приобретают спиралевидную форму, вокруг них наблюдается интенсивная клеточная инфильтрация, затем формируется фиброзная капсула. Процесс образования капсулы нарушается при чрезмерной антигенной нагрузке (при массивной инвазии), а также под воздействием веществ с иммунодепрессивными свойствами (глюкокортикоиды и др.). В паренхиматозных органах встречаются узелковые инфильтраты. В миокарде появляются множественные воспалительные очаги в интерстициальной ткани, но капсулы в сердечной мышце не формируются. При интенсивной инвазии в миокарде развиваются очагово-диффузная воспалительная реакция и дистрофические изменения; возможны образование гранулем и развитие васкулитов с поражением артериол и капилляров мозга и мозговых оболочек.
Для трихинеллеза характерен стойкий нестерильный иммунитет, который обусловлен наличием инкапсулированных личинок возбудителя в мышцах зараженных людей. Высокое содержание специфических антител в сыворотке крови отмечается с конца 2-й недели и достигает максимума на 4-7-й неделе. Комплекс реакций в энтеpальной стадии предупреждает проникновение в кровоток значительной части личинок, что ограничивает их распространение в организме.
Клиническая картина
Инкубационный период при трихинеллезе составляет от 5-8 дней до 6 нед. При заражении в синантропных очагах (после употребления инфицированного мяса домашних свиней) чем короче инкубационный период, тем тяжелее клиническое течение. При заражении в природных очагах такой закономерности обычно не отмечают.
Различают следующие формы трихинеллеза: бессимптомную, абортивную, легкую, средней степени тяжести и тяжелую.
Первые симптомы в виде тошноты, рвоты, жидкого стула, болей в животе у некоторых больных появляются в ближайшие дни после употребления зараженного мяса и могут длиться от нескольких дней до 6 нед. При бессимптомной форме единственным проявлением может быть эозинофилия крови. Для абортивной формы характерны кратковременные (длительностью 1-2 дня) клинические проявления. Основные симптомы трихинеллеза - лихорадка, боли в мышцах, миастения, отеки, гиперэозинофилия крови. Лихорадка ремиттирующего, постоянного или неправильного типа. В зависимости от степени инвазии повышенная температура тела у больных сохраняется от нескольких дней до 2 нед и дольше. У некоторых больных субфебрилитет сохраняется несколько месяцев.
Отечный синдром появляется и нарастает в течение 1-5 дней. При легкой и среднетяжелой формах болезни отеки сохраняются 1-2 (реже до 3) нед, при тяжелом течении отечный синдром развивается медленнее, но сохраняется дольше и может рецидивировать. Сначала, как правило, появляется периорбитальный отек, сопровождающийся конъюнктивитом и затем распространяющийся на лицо. В тяжелых случаях отеки переходят на шею, туловище, конечности (неблагоприятный прогностический признак).
У больных трихинеллезом наблюдаются макуло-папулезные высыпания на коже, иногда приобретающие геморрагический характер, подконъюнктивальные и подногтевые кровоизлияния.
Мышечный синдром проявляется миалгией, которая при тяжелом течении принимает генерализованный характер, сопровождается миастенией. Боли появляются сначала в мышцах конечностей, затем в других группах мышц, в том числе жевательных, языка и глотки, межреберных, глазодвигательных. В поздней стадии трихинеллеза могут развиться мышечные контрактуры, приводящие к обездвиживанию больного.
При поражении легких, развивающемся в течение первых 2 нед болезни, наблюдаются кашель, иногда с примесью крови в мокроте, признаки бронхита, на рентгеновских снимках определяются «летучие» инфильтраты в легких.
В периферической крови, обычно с 14-го дня, нарастают эозинофилия, лейкоцитоз, характерны гипоальбуминемия, снижение уровня калия, кальция, повышение активности КФК, АСТ и др. в сыворотке крови. Эозинофилия достигает максимальных значений на 2-4-й неделе и может сохраняться на уровне 10-15% в течение 2-3 мес и дольше.
Трихинеллез легкого течения проявляется небольшим повышением температуры тела (до 38 °С), отеком век, слабо выраженными болями в мышцах конечностей и невысокой эозинофилией.
Для трихинеллеза средней степени тяжести характерны инкубационный период 2-3 нед, острое начало с лихорадкой до 39 °С в течение 1-2 нед, отеком лица, умеренными болями в мышцах конечностей, лейкоцитозом 9-14×109 /л и эозинофилией 20-25% и выше.
При трихинеллезе тяжелого течения короткий инкубационный период (менее 2 нед), длительная высокая температура не менее 2 нед, генерализованные отеки, миалгии с мышечными контрактурами и полной обездвиженностью больного. В гемограмме - гиперлейкоцитоз (до 20×109 /л), гиперэозинофилия (до 50% и выше), однако при крайне тяжелом течении эозинофилия может отсутствовать или быть незначительной (плохой прогностический признак). Нередко встречается диспепсический и абдоминально-болевой синдром, более чем у 50% больных обнаруживают гепатомегалию.
Общая продолжительность манифестных форм болезни в зависимости от тяжести течения колеблется от 1-2 до 5-6 нед. Период реконвалесценции при тяжелой форме трихинеллеза может составлять 6 мес и более. Мышечные боли и отечность лица могут периодически рецидивировать, сопровождаясь лихорадкой и другими симптомами. Рецидивы протекают легче первичного заболевания.
Осложнения и причины смерти
Тяжесть течения трихинеллеза и его исход во многом зависят от органных поражений, развивающихся на 3-4-й неделе болезни; одно из серьезнейших среди них - миокардит. С его развитием возникают тахикардия, гипотония, возможны нарушение сердечного ритма, развитие сердечной недостаточности. Границы сердца расширены, на ЭКГ выявляют диффузные поражения миокарда, иногда коронарные нарушения. Миокардит при трихинеллезе - одна из главных причин летального исхода, наступающего в период с 4-й по 8-ю неделю болезни. Следующая после миокардита причина смерти - поражение легких. При среднетяжелом течении клинически и рентгенологически выявляют признаки бронхита и «летучие» инфильтраты в легких. При тяжелой форме легочные поражения могут иметь вид долевой пневмонии с появлением серозного выпота в полости плевры. Возможен отек легких, чему способствует также развитие сердечно-сосудистой недостаточности. Возможно присоединение вторичной бактериальной инфекции. Поражение ЦНС проявляется головной болью, сонливостью, иногда бредом, менингизмом, связанным с отечным синдромом. В поздние сроки регистрируют тяжелые нарушения, такие как полиневриты, острый передний полиомиелит, тяжелая псевдопаралитическая миастения (myasthenia gravis), менингит, энцефалит с развитием психозов, локального пареза или паралича, комы. Летальность при отсутствии адекватного лечения может достигать 50%.
Диагностика
Во время вспышек и групповых заболеваний при наличии типичных симптомов у больных постановка диагноза трихинеллеза не вызывает трудностей. Необходимо установить общий источник заражения и, по возможности, провести исследование остатков пищи (мяса или мясных продуктов) на наличие личинок трихинелл. Трудности возникают при диагностике спорадических случаев. В подобных ситуациях большое значение имеет эпидемиологический анамнез.
При отсутствии данных об источнике заражения иногда прибегают к биопсии мышц (дельтовидной или икроножной у лежачих больных или длинной мышцы спины у ходячих больных): кусочек мышечной ткани массой 1 г исследуют под микроскопом при малом увеличении на наличие личинок трихинелл.
Серологические методы диагностики можно использовать только на 3-й неделе болезни. Используют ИФА с антигеном T. spiralis и РНГА. Для ранней серологической диагностики трихинеллеза желательна одновременная постановка двух серологических реакций: ИФА и РНГА. Чувствительность в этих случаях достигает 90-100% и специфичность - 70-80%. У лиц, употреблявших зараженное трихинеллами мясо, проводят серологическое обследование через 2-3 нед после превентивного лечения. Диагностические показатели серологических реакций - подтверждение того, что эти лица переболели трихинеллезом.
У всех больных трихинеллезом, наряду с клиническими анализами крови и мочи, проводят биохимический анализ крови, ЭКГ, рентгенологическое исследование легких, определяют уровень электролитов в плазме.
Дифференциальную диагностику проводят с ОКИ, брюшным тифом и паратифами, ОРЗ, сыпным тифом, корью, лептоспирозом, иерсиниозом, отеком Квинке. При нарастании эозинофилии в крови дифференцируют от острой фазы других гельминтозов (описторхоз, фасциолез, стронгилоидоз, токсокароз), эозинофильного лейкоза, узелкового периартериита, дерматомиозита.
Лечение
Лечение больных среднетяжелой и тяжелой формой трихинеллеза проводят в условиях инфекционного стационара или ЛПУ общетерапевтического профиля.
Противопаразитарная терапия направлена на уничтожение кишечных трихинелл, мышечных трихинелл, пресечение продукции личинок, нарушение процесса их инкапсуляции. Для этих целей применяют албендазол и мебендазол.
Албендазол назначают внутрь после еды по 400 мг 2 р/сут больным с массой тела 60 кг и более или по 15 мг/кг в сутки в два приема больным с массой тела менее 60 кг. Длительность лечения 14 дней.
Мебендазол назначают внутрь через 20-30 мин после еды в дозе 10 мг/кг в сутки в 3 приема. Длительность курса лечения 14 дней.
При легком течении болезни эти же препараты назначают курсом длительностью до 7 дней.
Превентивное противопаразитарное лечение лиц, употреблявших в пищу инвазированные мясные продукты, проводят албендазолом в тех же дозах в течение 5-7 дней. Наиболее эффективна этиотропная терапия в инкубационном периоде, когда можно предотвратить клинические проявления, или в первые дни болезни, когда трихинеллы еще находятся в кишечнике. Во время мышечной стадии заболевания и инкапсуляции эффективность этиотропной терапии значительно ниже, и ее применение в этот период может даже способствовать обострению болезни.
Больным назначают антигистаминные препараты, ингибиторы простагландинов, НПВС. При тяжелой инвазии с неврологическими расстройствами, миокардитом, ИТШ, легочной недостаточностью используют глюкокортикоиды: обычно преднизолон в суточной дозе 20-60 (по показаниям до 80) мг внутрь в течение 5-7 дней на фоне Албендазола♠ или Мебендизола♠. Опасность представляют также возможные язвенные поражения кишечника в сочетании с нарушениями в системе гемостаза. У таких больных резко возрастает риск ульцерогенного действия глюкокортикоидов, особенно при одновременном назначении НПВС (индометацин, диклофенак и т.п.). В этих случаях необходимо применять ингибиторы протонного насоса (омепразол и др.). Больным трихинеллезом тяжелого течения с генерализованными отеками (вследствие ускоренного катаболизма белка и гипопротеинемии) рекомендуют инфузионную терапию с введением дезинтоксикационных средств и препаратов для парентерального белкового питания.
Прогноз
Прогноз благоприятный при легкой и среднетяжелой форме инвазии. При тяжелой форме с осложнениями прогноз серьезный: при поздней диагностике и запоздалом противопаразитарном лечении возможен летальный исход; при злокачественном течении он может наступить уже в первые дни болезни.
Диспансеризацию переболевших осуществляют вpач-инфекционист или участковый терапевт в течение 6 мес и более, в зависимости от тяжести течения и наличия осложнений. Реконвалесцентов осматривают через 2 нед, 1-2 и 5-6 мес после выписки из стационара, обязательно выполняют клинический и биохимический анализы крови, а также ЭКГ.
Токсокароз
Токсокароз (лат. toxocarosis) - хронический тканевый гельминтоз, вызываемый миграцией личинок гельминта собак Toxocara canis в организме человека. Характеризуется рецидивирующим течением с поражением внутренних органов и глаз.
Код по МКБ-10
В83.0 Висцеральная мигрирующая личинка.
Этиология
Возбудитель токсокароза Toxocara canis (аскарида собачья) относится к типу Nemathelminthes, классу Nematoda, подотряду Ascaridata, роду Тохосаrа. T. canis - раздельнополые нематоды, половозрелые особи которых достигают относительно больших размеров (длина самки 9-18 см, самца - 5-10 см). Яйца токсокары шаровидной формы, размером 65-75 мкм. Т. canis паразитирует у собак и других представителей семейства псовых. В жизненном цикле токсокар выделяют циклы развития - основной и два вспомогательных. Основной цикл соответствует схеме «собака-почва-собака». После заражения собаки алиментарным путем в ее тонкой кишке из яиц выходят личинки, которые затем мигрируют подобно аскаридам в организме человека. После созревания самок токсокар в тонкой кишке собака с фекалиями начинает выделять яйца паразита. Такой тип развития гельминта осуществляется у щенков в возрасте до 2 мес. У взрослых животных личинки гельминта мигрируют в различные органы и ткани, где вокруг них образуются гранулемы. В них личинки длительное время сохраняют жизнеспособность, не развиваются, но периодически могут возобновлять миграцию.
Первый тип вспомогательного цикла характеризуется трансплацентарной передачей личинок токсокар плоду по схеме «окончательный хозяин (собака)-плацента-окончательный хозяин (щенок)». Таким образом, родившийся щенок уже содержит гельминтов. Кроме того, щенки могут получить личинки при лактации.
Второй тип вспомогательного цикла происходит с участием паратенических (резервуарных) хозяев (грызуны, свиньи, овцы, птицы, земляные черви). В их организме мигрирующие личинки не способны превращаться во взрослых особей. При поедании резервуарного хозяина собакой или другим животным семейства псовых личинки, попадая в кишечник облигатного хозяина, развиваются во взрослых гельминтов.
Продолжительность жизни половозрелых особей в кишечнике основных хозяев составляет 4-6 мес. Самка Т. canis откладывает более 200 тыс. яиц в сутки. Срок созревания яиц в почве (от 5 сут до 1 мес) зависит от температуры окружающей среды и влажности. В средней полосе России яйца токсокар могут сохранять жизнеспособность в почве в течение всего года.
Эпидемиология
Токсокароз - зооноз с фекально-оральным механизмом передачи возбудителя. Источник инвазии в синантропном очаге для людей - собаки, загрязняющие почву фекалиями, которые содержат яйца токсокар.
Пораженность собак токсокарами во всех районах - до 40-50% и выше, а в сельской местности может достигать 100%. Наибольшую пораженность отмечают у щенков в возрасте 1-3 мес. Основной путь передачи возбудителя - загрязненность почвы яйцами гельминта и контакт людей с ней. Доказано значение геофагии в пораженности детей токсокарозом. Геофагия - пример прямого заражения возбудителями гельминтозов без участия каких-либо других факторов передачи, причем человек в этих случаях получает массивную инвазию, предопределяющую, как правило, тяжелое течение болезни. Отмечают высокую пораженность токсокарозом владельцев приусадебных, дачных земельных участков, огородов, а также людей, живущих во дворах, где выгуливают собак. Яйца токсокар могут передаваться с овощами и столовой зеленью. Факторами передачи токсокар бывают контаминированная шерсть животных, вода, руки. Установлена роль тараканов в распространении гельминтоза: они поедают значительное количество яиц токсокар и выделяют в окружающую среду до 25% яиц в жизнеспособном состоянии.
Токсокароз распространен повсеместно. В группу риска входят ветеринары, сотрудники собачьих питомников, охотники, находящиеся в тесном контакте с охотничьими собаками, продавцы овощных магазинов и рынков, постоянно контактирующие с немытыми овощами, земля на которых может быть заражена личинками токсокар, работники коммунальных служб. Люди заражаются токсокарозом в течение всего года, однако чаще заражение происходит в летне-осенний период, когда количество яиц в почве и контакт с ней максимальны.
Профилактика включает соблюдение личной гигиены, обучение детей санитарным навыкам. Важны своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4-5 нед, а также беременных самок. Необходимо ограничивать численность безнадзорных собак, оборудовать специальные площадки для выгула. Следует проводить систематическую санитарно-просветительскую работу среди населения, сообщать информацию о возможных источниках инвазии и путях передачи.
Патогенез
T. canis способны в миграционной (ларвальной) стадии паразитировать у человека и вызывать заболевание, получившее название синдрома «Visceral larva migrans». В организме человека из яиц токсокар, попавших в рот, а затем в желудок и тонкую кишку, выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает; их окружает воспалительный инфильтрат, и образуются гранулемы. При интенсивной инвазии гранулематозное поражение тканей наблюдают в легких, поджелудочной железе, миокарде, ЛУ, головном мозге и других органах. Личинка в организме человека может выживать до 10 лет. Личинки гельминта, находящиеся в тканях, периодически возобновляют миграцию, что обусловливает рецидивы заболевания. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Экскреторно-секреторные антигены живых и соматические антигены погибших личинок оказывают сильное сенсибилизирующее действие с развитием реакций ГНТ и ГЗТ, которые проявляются отеками, кожной эритемой, нарушением проходимости дыхательных путей. Определенное значение в патогенезе имеют иммунные комплексы «антиген-антитело». По сравнению с аскаридами и некоторыми другими гельминтами, T. canis обладает наиболее сильным иммуносупрессивным действием. При токсокарозе у детей уменьшается эффективность вакцинации и ревакцинации против кори, дифтерии и столбняка.
Клиническая картина
Выделяют две основные формы токсокароза - висцеральную и глазную.
По степени выраженности клинических проявлений различают токсокароз манифестный и бессимптомный, а по длительности течения - острый и хронический.
Висцеральным токсокарозом болеют как дети, так и взрослые, однако у детей эта форма встречается намного чаще, особенно в возрасте от 1,5 до 6 лет. Основные клинические проявления острого токсокароза - рецидивирующая лихорадка, легочный синдром, увеличение размеров печени, полиаденопатия, кожные проявления, эозинофилия крови, гипергаммаглобулинемия. У детей заболевание нередко развивается внезапно или после короткого продромального периода. Температура тела чаще субфебрильная (в тяжелых случаях - фебрильная), более выражена в период легочных проявлений. Отмечают разнообразные рецидивирующие высыпания на коже (эритематозные, уртикарные), возможно развитие отека Квинке, синдрома Маскла-Веллса (Muscle-Wells syndromе) и др. Кожный синдром может сохраняться длительное время, иногда это основное клиническое проявление болезни. У большинства зараженных, особенно у детей, умеренно увеличены периферические ЛУ.
Поражение дыхательной системы встречается у 50-65% больных висцеральным токсокарозом и может выражаться от катаральных явлений до тяжелых астмоидных состояний. Особенно тяжело поражение протекает у детей раннего возраста. Возможны рецидивирующий бронхит, бронхопневмония. Больных беспокоят сухой кашель, частые приступы ночного кашля, заканчивающиеся иногда рвотой, в некоторых случаях появляется тяжелая экспираторная одышка, сопровождающаяся цианозом. Выслушивают рассеянные сухие и разнокалиберные влажные хрипы. Рентгенологически выявляют усиление легочного рисунка, картину пневмонии; часто определяют облаковидные инфильтраты, что в сочетании с другими клиническими симптомами (лихорадкой, ЛАП, гепатоспленомегалией, кожно-аллергическим синдромом, гиперэозинофильным лейкоцитозом) позволяет поставить диагноз синдрома Леффлера. Одна из наиболее серьезных проблем, связанных с токсокарозом, - его взаимосвязь с бронхиальной астмой. Показано, что у 20% больных атопической формой бронхиальной астмы, протекающей с гиперэозинофилией, выявляют антитела к токсокарозному антигену (Ig классов Gи⁄ или Е).
Гепатомегалию регистрируют у 40-80% больных. Печень уплотненная, гладкая, часто напряженная, примерно у 20% больных увеличена селезенка. Установлена предрасполагающая роль токсокар в развитии пиогенных абсцессов печени, которые бывают как единичными, так и множественными, располагаются в обеих долях печени. Абдоминальный синдром наблюдают в 60% случаев. Характерны боли и вздутие живота, тошнота, иногда рвота, диарея.
В хронической стадии токсокароз протекает с обострениями и ремиссиями. После острого периода инвазия длительное время может протекать бессимптомно или субклинически. В хронической стадии даже в период ремиссии у детей сохраняются субфебрилитет, слабость, ухудшение аппетита, иногда похудание, полиаденопатия, увеличение печени, иногда кожно-аллергический синдром.
В отдельных случаях токсокарозу сопутствует миокардит: описано развитие эндокардита Леффлера (эндокардит фибропластический пристеночный с эозинофилией). Личинки, обнаруженные в биоптатах мышечной ткани, подтверждают, что при токсокарозе поражаются мышцы.
Одно из главных и наиболее постоянных проявлений висцеральной формы токсокароза - длительная эозинофилия крови, вплоть до развития эозинофильно-лейкемоидных реакций. Относительный уровень эозинофилов, как правило, превышает 30%, а в отдельных случаях может достигать 90%. Общее количество лейкоцитов также повышается до 15-20×109 /л, а в некоторых случаях - до 80×109 /л. Эозинофилия может сохраняться месяцами и даже годами. У детей нередко отмечают умеренную анемию. Характерны увеличение СОЭ, гипергаммаглобулинемия. При поражении печени повышены уровни билирубина и активности трансфераз.
При миграции личинок токсокар в головной мозг выявляют признаки поражения ЦНС (судороги типа «petit mal», эпилептиформные припадки). В тяжелых случаях регистрируют менингоэнцефалит, парезы и параличи, нарушения психики.
Описаны случаи диссеминированного токсокароза с одновременным поражением печени, легких и ЦНС у больных с иммунодефицитом (на фоне лучевой терапии, лечения глюкокортикоидами, при ВИЧ-инфекции и др.).
Глазной токсокароз чаще встречается у детей и подростков и редко сочетается с висцеральными поражениями. Наблюдаются два типа поражений - солитарные гранулемы и хронические эндофтальмиты с экссудацией. Характерно одностороннее поражение глаз с развитием хронического эндофтальмита, хориоретинита, иридоциклита, кератита, папиллита, косоглазия. Возможны кровоизлияния в сетчатку, поражение зрительного нерва, эозинофильные абсцессы цилиарного тела, панофтальмит, отслойка сетчатки. Наблюдаются также поражения личинками параорбитальной клетчатки, проявляющиеся периодическими отеками. При резком отеке может развиться экзофтальм. Количество эозинофилов в периферической крови у больных токсокарозом глаз обычно нормальное или повышено незначительно.
Осложнения. Возможно нарушение функций жизненно важных органов (мозга, глаз и др.). В некоторых случаях вероятно развитие бронхиальной астмы. Глазной токсокароз - одна из возможных причин потери зрения.
Летальные исходы при токсокарозе редки, наблюдаются при массивной инвазии и связаны с миграцией личинок в миокард и ЦНС.
Прижизненный паразитологический диагноз токсокароза возможен редко и только при исследовании биопсионного материала, когда в тканях удается обнаружить личинки T. canis. Диагноз устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики. Учитывают наличие стойкой длительной эозинофилии. Указание на содержание в семье собаки или на тесный контакт с собаками, геофагия свидетельствуют о высоком риске заражения токсокарозом.
Исследования методом ИФА обладают высокой чувствительностью и достаточной специфичностью, однако недостаточно информативны при поражениях глаз. Титр антител 1:400 свидетельствует об инвазированности, но не о болезни, о заболевании токсокарозом свидетельствует титр 1:800 и выше. У больных хронической формой болезни с выраженным легочным синдромом закономерно выявляется повышенное антител класса IgE. Для подтверждения результатов ИФА используется иммуноблоттинг. В плане клинического исследования у больных токсокарозом рекомендуется проводить биохимический анализ крови, рентгенологическое исследование легких, по показаниям - бронхоскопию, бронхографию, ЭКГ, УЗИ органов брюшной полости. Надежных методов диагностики глазного токсокароза не существует. Во многих случаях диагноз выясняется только при гистологическом исследовании. В диагностических целях используют УЗИ и КТ глаза.
Дифференциальную диагностику токсокароза следует проводить с ранней стадией гельминтозов (аскаридоз, стронгилоидоз, шистосомозы, описторхоз, фасциолез), бронхиальной астмой, а также с многочисленными заболеваниями, которые сопровождаются эозинофилией в периферической крови (синдром Леффлера, тропическая легочная эозинофилия при лимфатических филяриозах, хронический неспецифический полиартрит у детей, лимфогранулематоз, рак, медикаментозная сенсибилизация, пристеночный фибропластический миокардит и др.). Глазной токсокароз необходимо дифференцировать от ретинобластомы и хориоретинита туберкулезной, цитомегаловирусной и другой этиологии.
Лечение
Лечение больных с тяжелой формой и детей до 3 лет проводят в стационаре. Больные токсокарозом неконтагиозны и в изоляции не нуждаются.
Единой схемы этиотропной терапии токсокароза нет. Многие антигельминтные препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Албендазол назначают внутрь после еды в дозе 10-12 мг/кг в сутки в два приема (утром и вечером) в течение 10-14 дней.
Мебендазол назначают внутрь по 200-300 мг/сут в 2-3 приема в течение 10-15 дней; проводят 2 цикла с интервалом 2 нед.
Диэтилкарбамазин (в РФ не зарегистрирован) назначают внутрь в дозе 3-4 мг/кг в сутки, курс лечения 21 день.
Противопаразитарную терапию при глазном токсокарозе проводят по тем же схемам, что и при висцеральном токсокарозе. Показания к лечению определяют индивидуально, в зависимости от характера поражения глаз и с учетом возможных осложнений в результате лечения.
При бессимптомном течении инвазии с низкими титрами специфических антител этиотропную терапию не проводят.
Прогноз
Прогноз при неосложненном токсокарозе благоприятный; при массивной инвазии и поражениях глаз - серьезный.
Диспансеризация
Диспансерное наблюдение за переболевшими проводят врач-инфекционист или врачи общего профиля (терапевт, педиатр). Больные подлежат врачебному осмотру каждые 2 мес.
Дирофиляриозы
Дирофиляриоз, вызываемый Dirofilaria repens (подкожный дирофиляриоз) - трансмиссивный зоонозный гельминтоз, характеризуется патологическими изменениями в тканях и органах в месте локализации.
Код по МКБ-10
В74.8 Другие виды филяриатоза.
Этиология
Dirofilaria repens - нематода. Самка D. repens имеет длину тела - 120-150 мм, ширину - 0,48-0,55 мм. Самец - длиной 58,0-70,0 мм, максимальная ширина - 0,41 мм. Основной признак нематод рода Dirofilaria - наличие кутикулярной орнаментации в виде продольных гребней на поверхности тела гельминтов. Взрослые паразиты в организме окончательного хозяина (собак, кошек и других животных) находятся в подкожной соединительной ткани. Самка дирофилярии - живородящая, за сутки рождает до 30 тыс. личинок. Микрофилярии D. repens имеют длину 0,22-0,29 мм, по ширине равны диаметру эритроцита. Микрофилярии циркулируют по кровеносным и лимфатическим сосудам, поэтому могут проникать в любые органы и ткани.
Цикл развития гельминта протекает при участии промежуточных хозяев - комаров разных видов. У собак после заражения при укусе комарами дирофилярии в течение 6 мес развиваются до половой зрелости и сохраняются в жизнеспособном состоянии до 2 лет. У человека после заражения примерно через 2 мес личинки превращаются в молодых, неполовозрелых дирофилярий размером 1-2 см, которые в течение 3 мес активно мигрируют по подкожной клетчатке. В последующие 3 мес они превращаются во взрослых особей, оседающих под кожей в любых частях тела и в глазах.
Эпидемиология
Дирофиляриоз, вызываемый Dirofilaria repens, является распространенным гельминтозом животных - собак, кошек, волков, леопардов, виверр, которые являются их окончательными хозяевами. Промежуточными хозяевами и специфическими переносчиками дирофилярий служат комары разных родов. На территории России подкожный дирофиляриоз является единственным трансмиссивным гельминтозом, передающимся практически всеми видами комаров - Culex, Anopheles, Aedes и др. Развитие личинок дирофилярий до инвазивной стадии в переносчике происходит только при температуре воздуха выше +14 °С, оптимальная температура - +24 °С. Развитие паразита в теплокровном животном заканчивается за 193 дня. Из-за неактивности переносчика в холодное время года один оборот инфекции обязательно захватывает два последовательных сезона передачи.
Подкожный дирофиляриоз, вызываемый D. repens, имеет убикватное распространение. С 1960-х гг. северная граница распространения этого гельминтоза переместилась с 40° с.ш. до 58° с.ш. в начале ХХI в. Участились местные случаи инвазии D. repens людей в Московской, Тульской областях. Этому способствуют миграционные процессы людей и животных. К началу 2014 г. на территории 42 субъектов РФ было зарегистрировано более 900 случаев подкожного дирофилярио-за у людей.
Мероприятия по профилактике дирофиляриозов отражены в СанПиН 3.2.3215-14. Профилактика заражения человека и животных дирофиляриями основывается на истреблении комаров, выявлении и дегельминтизации инвазированных домашних собак, предотвращении контакта комаров с домашними животными и человеком.
Клиника и патогенез
Инкубационный период - от2 нед до 6 мес и более. Личинки D. repens у человека вызывают образование узлов под кожей и слизистыми оболочками и могут локализоваться в области грудной клетки, живота, верхних и нижних конечностей, половых органов, а также в области лба, под кожей век, под конъюнктивой и реже - в глазном яблоке. Личинка в период от 1 мес до 2 лет от момента заражения превращается во взрослую особь, которая в организме человека может образовывать паразитарную опухоль, содержащую круглого гельминта диаметром 1-3 мм и длиной до 30-120 мм. Специфические симптомы у некоторых больных обусловлены миграцией на ранней стадии паразитирования гельминта (до образования тонкостенной капсулы) и проявляются перемещением «опухоли» под кожей (до 30 см в сутки). Больные ощущают шевеление внутри уплотнения. Опухолевидные образования могут подвергаться нагноению с развитием абсцессов и регионарного лимфаденита. Почти у половины инвазированных наблюдается поражение органа зрения, обычно в области конъюнктивы век. Отмечаются слезотечение, блефароспазм, гиперемия кожи век, чувство инородного тела в глазу. Снижение остроты зрения бывает только в случаях поражения глазного яблока. Редкая локализация паразита внутри глазного яблока сопровождается отслойкой сетчатки. В случаях локализации гельминта в глазнице возникает воспаление глазничной клетчатки, приводящее к экзофтальму и ограничению подвижности глазного яблока. При локализации дирофилярий в половых органах возникают боли, гиперемия и отек кожи. Описаны единичные случаи дирофиляриоза легких, вызванных D. repens, у жителей южных областей РФ. Иногда наблюдаются общие симптомы инвазии: головная боль, слабость, субфебрильная лихорадка, боли в месте локализации гельминта с иррадиацией по ходу нервных стволов.
Диагностика
Выявление случаев инвазии D. repens обычно происходит случайно. Диагноз устанавливается по клинико-эпидемиологическим данным и подтверждается при извлечении гельминта из узла хирургическим путем. В лабораторию доставляются следующие объекты для исследований: взрослые дирофилярии или их фрагменты, выделенные хирургическим путем или самопроизвольно вышедшие из пораженных тканей, гистологические препараты внутренних органов и тканей, кровь, пунктаты подкожных опухолей, удаленные подкожные опухоли, гранулемы, кисты, цисты и другие патологические образования. Разработаны методы ИФА для выявления соматических антигенов гельминтов, а также ПЦР, позволяющие дифференцировать виды дирофилярий - D. repens и D. immitis, в частности в очагах, где среди животных регистрируется инвазия обоими видами гельминтов.
Дифференциальная диагностика
Дифференциальную диагностику проводят с опухолями: фиброма, атерома, киста и др. При поражении глаз необходимо дифференцировать с токсокарозом, цистицеркозом, конъюнктивитами, иридоциклитами другой этиологии.
Лечение
Лечение хирургическое. Необходимо гельминта (часто обнаруживают одну особь паразита) удалить полностью. Прогноз
Обычно благоприятный.
Глава 20. Болезни, вызываемые членистоногими*
* Материалы доступны в электронном виде по ссылке, указанной на последней странице книги.