Медицинская генетика : национальное руководство / под ред. Е. К. Гинтера, В. П. Пузырева, С. И. Куцева. - Москва : ГЭОТАР-Медиа, 2022. - 896 с. (Серия "Национальные руководства") - ISBN 978-5-9704-6307-9 |
Аннотация
Настоящее издание подготовлено коллективом авторов, абсолютное большинство которых хорошо известны не только отечественному, но и зарубежному читателю.
В книге представлены основные разделы генетики человека и медицинской генетики, такие как генетика развития человека, эпигенетика, генетика соматических клеток, популяционная генетика, фармакогенетика, иммуногенетика и система генов HLA. Также описаны современные представления об основных классах наследственных болезней: моногенных, включая популяционную генетику моногенных заболеваний, наследственных болезнях обмена веществ, митохондриальных заболеваниях, патологиях, обусловленных расширением зоны тандемных тринуклеотидных повторов, хромосомных болезнях, включая те, что обусловлены микрохромосомными перестройками, заболеваниях, связанных с геномным импринтингом, многофакторных болезнях, врожденных пороках развития и тератогенных синдромах.
Отдельная часть руководства посвящена лечению и профилактике наследственных болезней, а также этическим проблемам медицинской генетики. В ней подробно рассмотрена проблема генной терапии, в том числе с использованием методов редактирования генома, которые многими исследователями рассматриваются как наиболее перспективные в генотерапии заболеваний человека.
Книга будет полезна врачам практически всех специальностей с учетом все возрастающего вклада генетики в современную медицину, без которого невозможно ее дальнейшее совершенствование.
Глава 4. Хромосомы человека
Введение
Практически вся история развития биологии проходит под знаком огромного интереса к человеку как биологическому объекту. В результате после разработки новых методов им сразу находили применение в исследованиях, посвященных изучению человека. В этом отношении цитогенетика до 1956 г. представляла редкое исключение. Первые описания хромосом датированы еще 70-ми годами XIX в. Хромосомы были обнаружены в виде окрашиваемых структур, образующихся при клеточном делении. Их первые описания, представленные в литературе, были сделаны Страсбургером и Флемингом. Вскоре после этого было замечено, что при слиянии гамет число хромосом удваивается, а в ходе клеточного деления они расщепляются продольно и расходятся в дочерние клетки. Уже в 1882 г. Флеминг пришел к выводу о постоянстве числа хромосом в клетках одного вида. Годом спустя Ру, наблюдая за их особенностями, высказал предположение об участии этих образований в передаче наследственных признаков.
Дальнейшее развитие этой идеи Вейсманом, опиравшимся на полученные к тому времени данные об организации и поведении хромосом, легло в основу хромосомной теории наследственности. На этом этапе развития биологии изучение морфологии и поведения хромосом явно опережало развитие генетики как науки. Годом рождения последней считают 1866 г., когда Грегор Мендель опубликовал главный труд своей жизни. К сожалению, он не был достойно оценен современниками, и законы наследственности были открыты заново де Фризом, Корренсом и Чермаком только в 1900 г.
Имея такую многолетнюю фору, цитологи оказались хорошо подготовленными к моменту принятия научным сообществом основных законов передачи наследственной информации. Им потребовались лишь один-два года для проведения необходимых исследований и наглядной демонстрации соответствия поведения хромосом ожидаемому от гипотетических частиц наследственности. Учитывая очевидное различие в числе генов и хромосом, Саттон в 1903 г. дал структурно-морфологическое объяснение феномену сцепления генов, ранее открытому Корренсом. Описание непарной хромосомы и ее правильная идентификация как половой хромосомы показали значение последней в определении пола. Это обеспечило материальную базу для объяснения феномена сцепления генов с полом, открытого в 1906 г.
Прогресс в исследованиях и анализе полученных в те годы результатов, острота мысли биологов того времени поражают и сегодня. Уже в 1904 г. в гипотезе Саттона-Бовери достаточно полно и точно была определена связь хромосом с элементами наследственности. Вероятно, именно представление этой гипотезы можно считать той точкой в развитии биологии, начиная с которой изучение хромосом неразрывно связано с генетическими исследованиями, а цитогенетика стала отдельной, самостоятельной областью биологии.
В последующие годы успешное развитие цитогенетики было во многом обусловлено удачным выбором объектов исследования, в число которых человек, к сожалению, не входил. Многочисленные работы проводили на политенных хромосомах плодовой мушки Drosophila melanogaster, которая к тому времени уже стала одним из излюбленных объектов исследований генетиков. Активному изучению подверглись мейотические хромосомы амфибий. Несмотря на большой интерес к хромосомам млекопитающих, исследования в этой области в течение длительного времени были менее интенсивными и успешными, что связано с отсутствием полноценных методов анализа.
Путь, пройденный цитогенетикой млекопитающих к настоящему времени, условно можно разделить на четыре этапа.
Первый этап был посвящен главным образом поиску адекватных подходов к разработке соответствующих методик для исследования морфологии хромосом. Значительный вклад в развитие цитогенетики на этом этапе внесли такие выдающиеся отечественные исследователи, как П.И. Живаго, А.Г. Андрес и М.С. Навашин.
Началом второго этапа заслуженно считают 1956 г. - год опубликования работ, в которых были впервые представлены метафазные хромосомы человека. Это позволило правильно подсчитать их число и дать детальное описание их морфологии. Число хромосом в диплоидной клетке человека оказалась равно 46, а не 48, как полагали ранее. Это исследование было выполнено в Институте генетики г. Лунда (Швеция). Joe-Hin Tjio и Albert Levan провели его на клетках культуры, полученной из эмбриональной печени человека, благодаря усовершенствованию метода приготовления препаратов метафазных хромосом. Следует отметить, что работы в этом направлении со сходными результатами выполняли и ранее. В 1954 г. Eva и Yngve Melander, также работавшие в Институте генетики г. Лунда, определили число хромосом человека как 46. Joe-Hin Tjio и Albert Levan упоминают эти результаты в своей знаменитой статье. Eva и Yngve Melander работали с давлеными препаратами ткани эмбриональной печени. К сожалению, полученные ими результаты были недостаточно убедительными. Фотография метафазной пластинки с 46 хромосомами человека, представленная в качестве решающего аргумента в вопросе о числе хромосом человека, была сделана Joe-Hin Tjio 22 декабря 1955 г. в 2 ч ночи по местному времени. В те годы днем Институт генетики был активно функционирующим учебным институтом. Исследовательскую работу начинали вечером и часто заканчивали поздно ночью. Эту фотографию с пометкой в нижнем левом углу «Human cell with 46 chromosomes observed 1955 on December 22nd at 2.00 am» Joe-Hin Tjio разослал своим друзьям и коллегам по всему миру. Сегодня в память об этом факте у главного входа в институт висит мемориальная доска (рис. 4-1). Статья, подготовленная Joe-Hin Tjio и Альбертом Леваном, была представлена в журнал Hereditas 26 января 1956 г. и опубликована в апрельском номере этого журнала. Высокое качество препаратов и фотографий, анализ 265 метафаз, из которых лишь в четырех число хромосом отличалось от 46, устранили всякие сомнения в том, что более 30 лет число хромосом человека, считавшееся равным 48, было неверным. В том же году Чарльз Е. Форд и Джон Л. Хамертон подтвердили полученный их коллегами результат. Этот этап развития цитогенетики характеризуется интенсивными исследованиями морфологии митотических и мейотических хромосом млекопитающих и началом работ, посвященных изучению структурно-функциональной организации хромосомы. В это же время были проведены первые исследования репликации хромосом и их отдельных районов, разработаны методы введения в ДНК хромосом радиоактивных предшественников, а также методы радиографии хромосомных препаратов. Были описаны первые примеры хромосомных нарушений у человека, показано значение изменений хромосомного баланса, и возник такой раздел науки, как медицинская цитогенетика.

Начало следующего этапа (конец 60-х - начало 70-х годов) было обусловлено созданием методов дифференциального окрашивания хромосом, идентификации как целых хромосом, так и их отдельных районов. Развитие этих методов принципиально изменило ситуацию не только в цитогенетике, но и в генетике человека в целом. Немного раньше разработки методов дифференциального окрашивания хромосом были получены первые гибриды соматических клеток, а затем и клоны гибридных клеток, содержащих наряду с полным набором хромосом мыши отдельные хромосомы человека. Описание хромосомного состава линий гибридных клеток и определение присутствующих в них генов человека положило начало картированию его генома. Локализацию генов определяли сначала с точностью до целой хромосомы, затем, используя перестроенные хромосомы человека, - с точностью до хромосомного района, позже, анализируя соматические гибриды, индуцированные облучением перестроенные хромосомы человека, определяли порядок генов в хромосоме и относительное расстояние между ними.
Развитие лазерной микротехники в 1970-х гг. позволило приступить к изучению принципов организации хромосом человека в интерфазном ядре не на модельных объектах, а в прямых экспериментах. В первых исследованиях для индукции микроповреждений хромосом в интерфазе использовали микролуч лазера. Изучение изменений проводили спустя несколько часов, анализируя метафазные хромосомы. Полученные результаты привели к формированию представлений о существовании внутри интерфазного ядра территорий, занятых материалом отдельных хромосом. В дальнейшем при изучении принципов пространственной организации хромосом в интерфазном ядре успешно использовали гибриды соматических клеток, но настоящий прорыв в этой области стал возможен лишь благодаря огромным успехам в развитии молекулярной биологии и микроскопической техники в конце XX и начале XXI в.
Четвертый этап характеризуется широким внедрением в практику хромосомного анализа молекулярно-цитогенетических методов. Во многом его успешное развитие оказалось обусловлено разнообразным использованием гибридизации нуклеиновых кислот. В настоящее время можно выделить три основных направления в развитии современной цитогенетики.
-
Визуализация и распознавание в составе хромосомы конкретных последовательностей ДНК, РНК и белков. Имеющийся спектр ДНК-проб, используемых для FISH, поразительно широк. Он варьирует от небольших, размером несколько десятков пар оснований, фрагментов ДНК до ДНК-проб, содержащих в своем составе ДНК всего генома человека. В первые годы гибридизацию нуклеиновых кислот in situ использовали главным образом для анализа распределения в хромосомах человека и других видов млекопитающих различных повторенных последовательностей, а затем и для определения локализации конкретных генов и уникальных анонимных последовательностей ДНК. В настоящее время гибридизация нуклеиновых кислот in situ превратилась в мощный инструмент анализа хромосомных аномалий и определения гомологии хромосомных районов у близкородственных и давно дивергировавших видов. Следует отметить, что во многом такой прогресс оказался возможен лишь благодаря созданию систем цифровой регистрации микроизображений и их компьютерной обработки.
-
Пространственная организация хромосомы и клеточного ядра. Быстрое развитие лазерной сканирующей микроскопии и фантастические успехи генной инженерии определили начало нового этапа изучения хромосомы - исследования трехмерной и прижизненной организации хромосомы, анализа архитектоники всего интерфазного ядра, пространственного взаимодействия хромосомных районов и макромолекулярных комплексов. Изыскания, проводимые в этом направлении, варьируют от одновременной визуализации в ядре всех хромосом человека до наблюдения за организацией и локализацией индивидуальных локусов в ядре живой клетки.
-
Развитие технологии биочипов и высокопроизводительных методов массового параллельного секвенирования легло в основу анализа хромосомных аномалий человека с помощью детального анализа геномной ДНК пациента.
Таким образом, обнаружение хромосомных нарушений стало возможным в отсутствие препаратов хромосом пациента. Секвенирование генома человека и стремительное развитие методов молекулярной биологии и биоинформатики поставило вопрос, где находятся границы между цитогенетикой, молекулярной генетикой и молекулярной биологией. Первый проект, непосредственно посвященный изучению генома человека, стартовал в 1990 г. под руководством Джеймса Уотсона под эгидой Национальной организации здравоохранения США. Существовавшая в то время методическая база предполагала, что решение задачи секвенирования генома человека займет десятилетия. Однако уже в 2000 г. был выпущен первый рабочий черновик структуры генома, а сборка почти полного генома была представлена в 2003 г. Правда, следует заметить, что статус почти завершенной сборки генома человека сохранился до настоящего времени. Секвенирование персональных геномов показало их большое разнообразие как по SNP, вариациям по числу копий различных участков, так и по другим вариантам организации. Высокая эффективность современных методов секвенирования позволила решать задачи изучения геномов десятков и сотен тысяч людей, принадлежащих различным группам населения. Целью международного проекта (HapMap), стартовавшего в 2002 г., являлись изучение и систематизация генетических особенностей геномов людей. 2-го сентября 2010 г. была опубликована карта вариаций генома человека третьего поколения, в которой одна SNP в среднем приходилась на 279 пар оснований. Проект 1000 Genomes Project (1KGP) был начат в 2008 г. В 2015 г. в журнале Nature были представлены результаты реконструкции геномов 2504 человек из 26 популяций. Было выявлено более 88 млн различных вариаций (84,7 млн SNP, 3,6 млн инсерций и делеций, 60 000 структурных вариантов). То есть суммарно SNP встречаются каждые 30 п.н. В Великобритании в 2013 г. был запущен проект 100,000 Genomes Project. К 1 октября 2018 г. уже были секвенированы 87 231 персональных геномов. Выявленные различия геномов включают, среди прочих, отличия в присутствии в них участков геномов других видов древних людей. Также стоит упомянуть, что в настоящее время остаются почти не вовлеченными в анализ районы структурного гетерохроматина хромосом человека, что может представлять отдельный и большой интерес в связи с их значительными вариациями по размеру в 1, 9, 16-й и Y-хромосомах. Более того, относительно недавно была выявлена интенсивная транскрипция ДНК некоторых районов структурного гетерохроматина на определенных стадиях онтогенеза и в фазах клеточного цикла. Вариабельность качественного и количественного состава повторенных последовательностей ДНК С-положительных районов хромосом, районов, которые остаются несеквенированными до настоящего времени, требует разработки принципиально новых подходов к их изучению.
Следует отметить, что, помимо анализа SNP, массовое параллельное секвениро-вание и другие современные методы, базирующиеся на анализе последовательностей нуклеотидов, используются для анализа в геноме числа отдельных хромосом и хромосомных районов. Вероятно, такие и все другие исследования, посвященные анализу хромосом и хромосомных районов, имеет смысл отнести к разделу современной цитогенетики, признав, что сегодня значительная часть цитогенетических работ и цитогенетической диагностики проводится без использования препаратов митотических или мейотических хромосом.
Выявление обширного полиморфизма различных участков в геноме человека и принципиальная, а часто и техническая возможность диагностики, обеспечивающей детальную информацию о практически любом хромосомном районе, остро поставило вопрос о разграничении нормы и патологии при проведении такого детального анализа хромосом. Уже показано огромное значение для формирования фенотипа вариабельности по числу копий определенных последовательностей ДНК. Решение этой задачи осложняется различиями проявления различных структурных и количественных вариантов хромосомной организации на различном генетическом бэкграунде. Во многом загадочным остается значение различий по локализации и размерам кластеров дуплицированных последовательностей, широко представленных в хромосомах человека. Несмотря на многочисленные исследования метилирования ДНК и модификации гистонов, мы и в этой области находимся лишь в начале пути. Стремительный рост знаний позволяет детализировать и расширять представления о структурно-функциональной организации хромосом, но с еще большей скоростью он вскрывает новые проблемы, ставит новые вопросы и открывает новые направления.
Сегодня цитогенетика человека является разделом биологии, в котором исследователи как заняты решением фундаментальных проблем структурно-функциональной организации генома человека, так и принимают непосредственное участие в разработке и использовании новых методов анализа в диагностических целях. Цитогенетика служит неотъемлемым элементом современной медицины, без которого уже невозможно представить доимплантационную, пре- и постнатальную диагностику и диагностику онкологических заболеваний.
Номенклатура хромосом человека
Развитие любой области науки всегда связано с формированием и развитием ее специального языка, возникновением новых терминов и правил их использования. Эта проблема особо остро встала перед цитогенетикой в связи с необходимостью описания хромосом человека. К ее решению приступили сразу после разработки методов приготовления препаратов метафазных хромосом человека. Результаты, полученные в 1956 г., вызвали резкое увеличение числа исследований, посвященных хромосомам человека. Уже к 1959 г. были предложены различные классификации хромосом, но их многообразие только осложнило общение исследователей, работающих в этой области. Разработка общей системы описания хромосом стала насущной необходимостью. По предложению Чарльза Форда в г. Денвере (Колорадо, США) собрались 14 исследователей и трое консультантов, представлявших все лаборатории, которые к тому времени опубликовали результаты анализа кариотипа человека и описания хромосом. На этом собрании, более известном как Денверская конференция (1960), была предложена система описания хромосом, озаглавленная A Proposed Standard System of Nomenclature of Human Mitotic Chromosomes. Заложенные принципы описания хромосом, несмотря на многочисленные дополнения, обусловленные интенсивным развитием новых методов хромосомного анализа, до настоящего времени остались неизменными.
Спустя три года, на лондонской встрече (1963), организованной по инициативе С. Пенроуза, было официально введено разделение хромосом человека на семь групп, обозначенных буквами от A до G. Ранее оно было предложено К. Патау еще в 1960 г. Следующее значительное событие произошло в 1966 г. в г. Чикаго на III Международном конгрессе по генетике человека. Анализ результатов исследований хромосом человека, накопившихся к этому времени, позволил сформулировать правила краткого описания набора хромосом человека в норме и при патологических изменениях. Эти правила прошли проверку временем и для хромосом человека при рутинной окраске остались неизменными до настоящего момента.
В 1968 г. произошло событие, определившее развитие цитогенетики на долгие годы. Торнбьерн Касперсон и соавт. показали, что окраска растительных хромосом акридиновым оранжевым дает дифференциальное окрашивание по длине хромосомы. Этот способ немедленно применили для анализа хромосом человека, и уже в 1970 г. был опубликован первый кариотип дифференциально окрашенных хромосом, в котором каждая из них получила свой номер. Вскоре был предложен еще ряд методов дифференциальной окраски хромосом, дающих сходные результаты. Анализ и обобщение результатов дифференциального окрашивания требовали систематической работы, поэтому в 1971 г. в Париже на IV Международном конгрессе по генетике человека пришли к заключению о необходимости создания комитета для разработки номенклатуры хромосом человека. Его первое заседание под председательством Джона Хамертона состоялось в Эдинбурге в январе 1972 г. В результате был принят документ, имеющий огромное значение для дальнейшего развития цитогенетики человека. В нем были сформулированы принципы описания не только целых хромосом человека, но и их отдельных районов. В 1976 г. в Мехико на V Международном конгрессе по генетике человека был избран первый международный постоянно действующий комитет по номенклатуре хромосом человека (International Standing Committee on Human Cytogenetic Nomenclature). Это был первый постоянно действующий орган с широким международным и географическим представительством. Он работал под председательством Яна Линдстена. Результатом его работы стало создание первой официальной номенклатуры хромосом человека - An International System for Human Cytogenetic Nomenclature(ISCN, 1978).
Следующим шагом в развитии номенклатуры хромосом стала ее адаптация к результатам исследований хромосом человека, выполненных на высоком уровне разрешения. Если ISCN (1978) описывала в хромосомах человека около 400 сегментов, то номенклатура, предложенная комитетом под председательством Бернарда Дютрилё, давала возможность описания хромосом с разрешением в 550 и 850 сегментов на гаплоидный набор (1981). Следующая версия ISCN (1985) была подготовлена в 1984 г. комитетом под председательством Дэвида Хардена. В дальнейшем она была усовершенствована для более точного и однозначного описания хромосомных перестроек, обнаруживаемых при онкологических заболеваниях (ISCN, 1991). Следующая номенклатура была принята 9-13 октября 1994 г. на заседании комитета в Мемфисе (ISCN, 1995). В отличие от предыдущих вариантов, в ней были учтены проблемы описания результатов, полученных при использовании FISH. Десять лет она успешно служила цитогенетике, и лишь в декабре 2004 г. на конференции в Ванкувере были уточнены некоторые ее положения. В ISCN (2005) были представлены G- и R-дифференциально окрашенные хромосомы на высоком уровне разрешения, добавлены новые идиограммы на уровне 300 и 700 бэндов, расширен раздел, касающийся гибридизации in situ, включены дополнительные примеры редких вариантов хромосомных перестроек и введена базовая номенклатура хромосом для сравнительной геномной гибридизации со следующими изменениями и дополнениями: введены новые схемы дифференциально окрашенных хромосом на всех уровнях разрешения; пересмотрена номенклатура в случаях неоплазий и введено использование специальной терминологии для обозначения основных и сопутствующих клеточных клонов при описании клональной эволюции; в большинство глав включены новые примеры для описания сложных и уникальных ситуаций; представлена краткая и полная номенклатура для описания результатов микроэррей диагностики, включающая все существующие в то время платформы; представлена номенклатура для описания результатов MLPA-диагностики.
Дальнейшее совершенствование ISCN было связано главным образом с разработкой и введением описания результатов исследований, полученных с использованием методов полногеномного анализа. Они нашли отражение в ISCN (2013) и ISCN (2016). Более того, в 2016 г. An International System for Human Cytogenetic Nomenclature (Международная система цитогенетической номенклатуры) получила новое название - An International System for Human Cytogenomic Nomenclature (Международная система цитогеномной номенклатуры). В последней версии ISCN основные изменения затронули главы «Микроматричный анализ» и «Районоспецифичные анализы», а также была включена новая глава «Технологии, основанные на секвенировании». Идиограммы хромосом представлены для пяти уровней разрешения (300, 400, 550, 700 и 850), как это было введено в ISCN (2013). В сравнении с предыдущей номенклатурой появился ряд новых символов и сокращений, а также исчезли некоторые сокращения. Нововведения в ISCN (2016) недавно были систематизированы и рассмотрены в статье Антоненко и Шиловой (2018).
В настоящее время номенклатура ISCN (2016) обязательна для использования исследователями и сотрудниками медицинских учреждений, работающими в области цитогенетики человека.
Хромосомы человека, несомненно, представляют особый случай, что связано с тем вниманием, которое было уделено созданию их номенклатуры. Разработанные принципы рекомендованы для построения номенклатур других видов млекопитающих. Сегодня ISCN (2016) представляет собой и словарь, и грамматику языка цитогенетика. Изложить ее в настоящей главе даже в кратком варианте не представляется возможным. В ISCN (2016) включены разделы, в которых приведены правила описания кариотипа, хромосом и хромосомных районов, различных хромосомных аномалий и хромосомного полиморфизма. В настоящей главе будет представлена только та минимальная информация, без которой будет очень сложно говорить об организации хромосомы и диагностике хромосомных нарушений.
Идентификация и описание основных ориентиров, районов и бэндов хромосом
В номенклатуре хромосом человека каждой хромосоме присвоен номер, а при описании конкретного места на хромосоме указывается, в состав какого плеча, района, бэнда, суббэнда и субсубэнда оно входит. Таким образом, положение на хромосоме описывается 6 символами. Необходимо отметить, что в номенклатуре все хромосомы человека рассматривают как непрерывные серии бэндов и суббэндов. При этом бэндом, а затем и суббэндом, считают участок хромосомы, отличающийся от соседних по интенсивности окрашивания соответствующими методами. Согласно ISCN (2016), бэнды отражают структурно-функциональную организацию генома, обусловливающую регуляцию репликации ДНК, репарацию, транскрипцию и генетическую рекомбинацию. Бэнды - крупные структуры размером 5-10 млн п.н., которые могут включать сотни генов. Молекулярная основа дифференциального окрашивания хромосом - нуклеотидный и белковый состав, а также функциональная организация участков генома, соответствующих бэндам. G-позитивные бэнды (R-негативные) содержат АТ-богатую (относительно соседних бэндов), поздно реплицирующуюся ДНК, бедную генами, тогда как G-негативные бэнды (R-позитивные) богаты GC, обогащены генами, их ДНК реплицируется в начале S-фазы клеточного цикла.
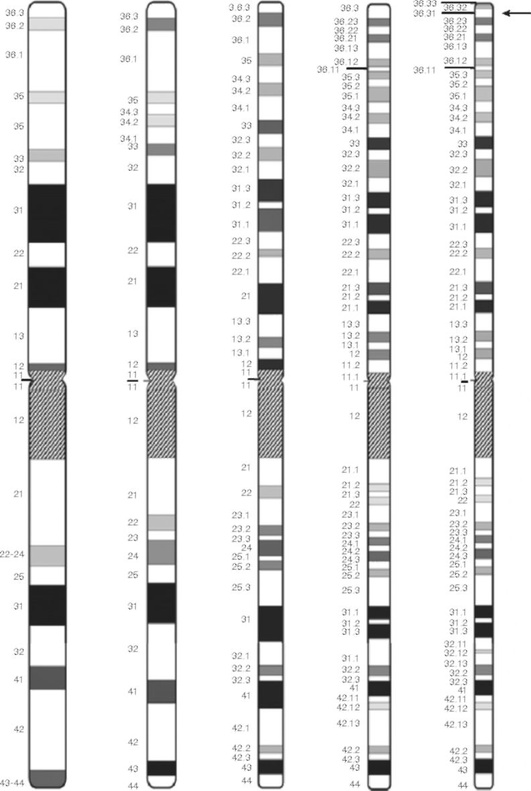
Для описания места на хромосоме используется следующий порядок записи: первым указывается номер хромосомы, затем плеча, район в составе плеча, бэнд в составе района, суббэнд в составе бэнда и на самом высоком уровне разрешения - субсуббэнд в составе суббэнда. Например, 1p36.31 означает участок хромосомы, находящийся в первом субсуббэнде третьего суббэнда шестого бэнда третьего района короткого плеча первой хромосомы человека (рис. 4-2). Стоит обратить внимание, что суббэнды отделены от бэндов точкой, и произносится такая запись следующим образом «первая хромосома, короткое плечо, три, шесть, точка, три, один». Ни число районов в плече хромосомы, ни бэндов в районе, ни суббэндов в бэнде, ни субсуббэндов в суббэнде не может быть двухзначным.
Для обозначения коротких и длинных плеч хромосом, а также районов и бэндов, расположенных в них, используют следующие символы: p - короткое плечо хромосомы (от французского petite - маленький), q - длинное плечо (от английского queue - очередь, хвост). Плечи разделяет центромера, обозначаемая символом «cen», но для обозначения ее части, прилежащей к р-плечу, применяют символ «р10», а прилежащей к q-плечу, - символ «q10». Район хромосомного плеча, ближайший к центромере, обозначают цифрой 1, следующий - цифрой 2 и т.д. Нумерация бэндов внутри района также проводится в направлении от центромеры к теломере. То же правило действует для суббэндов и субсуббэндов. Для описания суббэндов в составе бэнда после номера последнего ставят точку, а затем номер соответствующего суббэнда. Суббэнды в пределах бэнда также нумеруют в направлении от центромеры к теломере. Так, в бэнде 1р31 выделяют три суббэнда: 1р31.1, 1р31.2 и 1р31.3, из которых 1р31.1 - проксимальный, а 1р31.3 - дистальный. Если суббэнды подразделяются на части, то их также нумеруют цифрами, но уже без использования пунктуации. Например, 1р31.11 означает «проксимальный элемент суббэнда 1р31.1».
Важными элементами в номенклатуре хромосом являются четко видимые ориентиры, представленные постоянными и отчетливыми морфологическими особенностями хромосом и делящие их на районы. К таким ориентирам относят концы хромосомных плеч, центромеры и определенные, наиболее четко видимые бэнды. Бэнды, используемые в качестве ориентиров, полностью входят в состав дистального района. Перечень и описание бэндов, используемых в номенклатуре хромосом человека в качестве ориентиров, приведены в ISCN (2016). GTG-дифференциально окрашенные хромосомы человека и идиограмма GTG-дифференциально окрашенных хромосом с обозначением номеров бэндов представлены на рис. 4-3 и 4-4 (см. цв. вклейку).
Общие принципы описания кариотипа
В данном разделе будут рассмотрены общие принципы и правила описания кариотипа. По требованиям к точности их исполнения они напоминают языки машинного программирования. Пропуск символа или пробела может полностью изменить весь смысл приводимого описания.
Первым пунктом в описании кариотипа указывается общее число хромосом, включая половые хромосомы. Данное число отделяется от остальной части записи запятой (,). Следом записываются половые хромосомы. Аутосомы расписываются лишь в случае наличия аномалий и приводятся в порядке возрастания их номеров. Ниже приведены записи нормальных кариотипов:
При наличии численных и/или структурных хромосомных аномалий первыми записываются аномалии половых хромосом, затем аномалии аутосом в порядке возрастания номеров независимо от типа аномалии. Каждая аномалия выделяется запятыми. Знаки плюс (+) или минус (-) перед хромосомой указывают на приобретение дополнительной хромосомы или на потерю хромосомы:
Единственным исключением из этого правила являются конститутивные аномалии половых хромосом, которые описываются без использования знаков (+) или (-). Например:
Наличие в описании численных аномалий половых хромосом знаков (+) и (-) указывает на приобретенный характер аномалий. Например:
-
47,XX,+X - кариотип опухолевой клетки женщины с приобретенной Х-хромосомой;
-
45,X,-X - кариотип опухолевой клетки женщины с потерей Х-хромосомы;
-
45,X,-Y - кариотип опухолевой клетки мужчины с потерей Y-хромосомы. При комбинации приобретенной и конститутивной численной аномалий половых хромосом конститутивная численная аномалия обозначается символом (с):
-
48,XXYc,+X - кариотип опухолевой клетки с приобретенной Х-хромосомой у пациента с синдромом Кляйнфельтера (48,XXY);
-
48,XY,+21c,+21 - кариотип опухолевой клетки с приобретенной хромосомой 21 у пациента с синдромом Дауна;
-
46,XY,+21c,-21 - кариотип опухолевой клетки с потерей хромосомы 21 у пациента с синдромом Дауна.
При замещении в кариотипе нормальной хромосомы перестроенной, нормальная хромосома не указывается как потерянная:
-
46,XX,inv(3) - означает, что одна из хромосом 3 содержит инверсию:
-
46,XY,der(1)t(1;3) - описывает кариотип, в котором одна из хромосом 1 замещена перестроенной хромосомой 1, потерявшей какой-то из ее районов, но содержащей фрагмент хромосомы 3. Таким образом, в данном случае в наличии частичная моносомия по хромосоме 1 и частичная трисомия по хромосоме 3.
Для обозначения множественного числа копий используется знак умножения, но он может быть использован только для обозначения множественных копий перестроенных хромосом. Его использование в случае нормальных хромосом недопустимо. Символ ставится после описания хромосомы:
При наличии, кроме хромосом с делециями, двум нормальных хромосом кариотип должен быть описан следующим образом:
Описание объектов, содержащих разные клоны клеток
При описании объектов, содержащих разные клоны клеток, приводятся кариотипы всех клонов, разделенные косой чертой (/ ). В квадратных скобках после описания кариотипа указывается абсолютное число клеток данного клона, выявленное в проведенном исследовании. Указывается также причина наличия разных клонов. Символы mos (мозаик - различные клеточные линии произошли из одной зиготы) или chi (химера - различные клеточные линии произошли из разных зигот) приводятся перед общим описанием. При перечислении кариотипов нормальный кариотип всегда указывается последним. Если выявлено несколько аномальных клонов, то порядок их перечисления определяется долей их представленности. Первым приводится наиболее часто встречаемый. Затем по нисходящей. Последним указывается нормальный клон. Например:
В случае наличия двух нормальных клонов первым указывается клон, имеющий большее представительство:
Следует заметить, что правила описания гетерогенных клеточных популяций при диагностике онкологических заболеваний отличаются.
ПРОИСХОЖДЕНИЕ ХРОМОСОМ
Материнское или отцовское происхождение аномальной хромосомы обозначается символами mat и pat соответственно. Эти символы располагаются непосредственно после описываемой аномалии. Если хромосомы родителей нормальны, а у ребенка выявлена аномалия, то она рассматривается как возникшая de novo, и для ее описания используется символ (de novo).
При определении присутствия обоих гомологов хромосомы, происходящих от одного родителя (унипарентная дисомия), используется символ (upd):
В ISCN (2016) предусмотрено обозначение варианта, когда перестройка унаследована от родителей, но неизвестно, от отца или матери. В этом случае используется символ inh (inherited).
Описание аномальных хромосом человека
СТРУКТУРНЫЕ АНОМАЛИИ
Буквы и сокращения, используемые при описании хромосомных аномалий [при описании хромосом используются только буквы и сокращения, принятые в ISCN (2016)], означают тип реорганизации хромосомы. Номер хромосомы, задействованной в перестройке, приводится сразу за символом перестройки в круглых скобках, например:
Если в перестройку вовлечены 2 или более хромосом, они разделяются точкой с запятой (;). Порядок их перечисления подчиняется тому же правилу, что и перечисление аномальных хромосом в кариотипе, а именно X и Y, а затем аутосомы по возрастанию номеров, например:
Исключением из этого правила являются перестройки с тремя точками разрывов, когда имеет место инсерция фрагмента одной хромосомы в район другой хромосомы. В этом случае номер хромосомы-реципиента приводится первым. Например, запись ins(5;2) означает инсерцию фрагмента хромосомы 2 в хромосому 5.
В случае сбалансированных транслокаций, затрагивающих три хромосомы с одной точкой разрыва в каждой из них, первой приводится половая хромосома или хромосома с самым маленьким номером. Следующим записывается номер хромосомы, являющейся реципиентом для ее района, а последним приводится номер хромосомы-донора для хромосомы, записанной первой. Этот принцип распространяется и на сбалансированные транслокации, вовлекающие большее число хромосом.
Для описания хромосомных перестроек ISCN предполагает использование краткой или полной системы их описания. При использовании краткой системы указывается только тип хромосомных перестроек и точки разрывов. Иногда она не дает возможности однозначного описания сложных хромосомных перестроек, которые выявляются при анализе неоплазий. В этом случае состав аномальной хромосомы описывается в терминах бэндов, входящих в состав ее районов.
В краткой системе описания структурных хромосомных аномалий указывается тип хромосомной перестройки, а следом за его символом в круглых скобках указывается локализация точек разрывов.
При описании хромосомных перестроек с двумя точками разрывов в одной хромосоме первой указывается точка разрыва в р-плече или, если они локализованы в одном плече, то проксимальная точка разрыва:
Точки разрывов, локализованные в одной хромосоме, не разделяются какими-либо знаками. При локализации точек разрывов на двух хромосомах первой указывается либо половая хромосома, либо хромосома с меньшим номером:
Исключением из правила, определяющего последовательность записи хромосом, являются перестройки хромосом с тремя точками разрывов, когда происходит вставка в хромосому-реципиент фрагмента хромосомы донора. Такой случай уже был рассмотрен выше. Хромосома-донор всегда стоит на последнем месте, даже если это половая хромосома или хромосома с более низким номером:
Если подобная перестройка затрагивает только одну хромосому, то сначала указывается бэнд вставки, затем, в случае прямой инсерции, - более близкая к центромере точка разрыва фрагмента инсерции и, наконец, - дистальная точка разрыва этого фрагмента:
Для транслокаций, в которые вовлечены три хромосомы при одной точке разрыва в каждой из них, существует следующий порядок перечисления хромосом:
Запись 46,XX,t(9;22;17)(q34;q11;q22) означает, что фрагмент хромосомы 9, соответствующий району, дистальному относительно 9q34, перенесен на хромосому 22 с точкой разрыва-соединения в 22q11, фрагмент хромосомы 22, соответствующий району, дистальному относительно 22q11, перенесен на хромосому 17 с точкой разрыва-соединения в 17q22, и, наконец, фрагмент хромосомы 17, соответствующий району, дистальному относительно 17q22, перенесен на хромосому 9 с точкой разрыва-соединения в 9q34. Этот принцип применим для перестроек и с большим числом точек разрывов. В качестве примера ниже приведен кариотип с транслокациями, затрагивающими 4 хромосомы, и кариотип с реципрокными транслокациями 2 интерстициальных фрагментов хромосом:
Следует заметить, что несбалансированные перестройки приводят к появлению как минимум одной производной хромосомы, обозначаемой символом der (derivative chromosome). Обычно такие перестройки не удается однозначно описать с помощью краткой системы записи кариотипа. При использовании полной системы описания структурных хромосомных аномалий описание перестроенной хромосомы начинается с конца р-плеча или ближайшего к нему бэнда и продолжается до конца q-плеча. Бэнды указываются в том порядке, в котором они располагаются в хромосоме. Если перестроенная хромосома содержит материал одной хромосомы, то номер хромосомы при обозначении бэндов не повторяется. Такое описание требует, кроме точного обозначения участка хромосомы, введения символов, обозначающих точку разрыва, соединения участка хромосомы, расположенного между двумя обозначенными участками. Для решения этой задачи были введены следующие обозначения:
При описании точки разрывов указываются район, бэнд или суббэнд ее локализации. Если район, в котором была локализована точка разрыва, включает два соседних бэнда, то они приводится оба, разделенные символом (or), например: 1q23 or q24. Если район локализации точки разрыва включает больше бэндов, то при ее описании указывается район или районы хромосомы, например, 1q2 or q3.
Для упрощения восприятия описанной хромосомной перестройки в ISCN используется указание на ее конкретный тип, для чего введены сокращения типов хромосомных перестроек. Дупликации хромосомных районов обозначаются как dup. Они могут быть прямыми или инвертированными, что отражается в порядке перечисления точек разрыва, либо могут быть подчеркнуты символами dir (прямая дупликация) и inv (инвертированная дупликация), которые раньше приводились перед символом dup. Однако так как обычно для однозначного описания дупликаций использование символа dir не требовалось, он был исключен из ISCN (2016). Примерами записи дупликаций могут служить описания следующих перестроек:
Следует заметить, что только полная система дает возможность однозначного описания инвертированных дупликаций.
При описании трипликаций (trp) только полная система дает возможность однозначного описания ориентации дополнительных районов. Примером могут служить следующие записи:
Различные варианты возможны и при инсерциях хромосомного материала. Район может сохранять исходную ориентацию или менять ее на противоположную. При записи это отражается в порядке перечисления точек разрыва, либо инвертированное положение может быть подчеркнуто символом inv. Стоит напомнить, что прямой инсерцией считается инсерция, в результате которой проксимальный конец района инсерции оказывается в проксимальном положении относительно второго конца, а инвертированная инсерция представляет собой инсерцию, при которой проксимальный конец района инсерции оказывается в дистальном положении. Примеры:
При описании хромосомных аномалий цитогенетики часто встречаются с хромосомами, возникшими в результате перестроек, затрагивающих две или более хромосом, а также являющихся результатом множественных перестроек одной хромосомы. Такие хромосомы называются производными (дериватными) хромосомами. Номер производной хромосомы соответствует номеру хромосомы, чей центромерный район входит в состав производной хромосомы. При описании производной хромосомы, возникшей в результате более чем одной перестройки, аберрации перечисляются в порядке очередности точек разрывов в производной хромосоме.
Примеры описания производных хромосом:
Производные хромосом-дицентриков обозначаются номерами обеих хромосом, например:
В случае если происхождение центромеры производной хромосомы не установлено, для ее обозначения используется знак вопроса. Например:
Для описания хромосом-дицентриков, в формировании которых не было никаких дополнительных перестроек, кроме перестроек, обусловивших дицентричность, используется символ (die).
Описание хромосом-трицентриков проводится по тем же правилам, что и хромосом-дицентриков. Порядок перечисления хромосом определяется следующим образом: первой приводится концевая хромосома с меньшим номером, а остальные - в порядке прикрепления к ней. Для обозначения хромосом-трицентриков используется символ (tre):
Изохромосомы представляют собой хромосомы, состоящие из двух идентичных плеч, т.е. точки разрывов, имевших место при их формировании, локализованы в центромерных бэндах p10 или q10:
В тексте статей и книг возможно краткое обозначение изохромосомы, например: i(17q), что следует понимать, как i(17)(q10). Для изопроизводных (изодериватных) хромосом используется символ ider (изохромосома, плечо которой состоит из производной хромосомы). Примеры таких и изодицентрических хромосом (idie) приведены ниже:
В отличие от обычных хромосом кольцевые хромосомы (r) представляют собой структуры, замкнутые в кольцо, у которых обычно отсутствуют теломерные районы. Они могут состоять из материала одной или нескольких хромосом, например:
или
Особое место в номенклатуре хромосом человека занимают маркерные хромосомы. Они являются аномальными хромосомами, у которых не идентифицирован ни один из их районов. В случае идентификации какого-либо района этой хромосомы она переходит в разряд «производная хромосома» (der). Примеры записи маркерных хромосом приведены ниже:
Если маркерные хромосомы могут быть отличены одна от другой, то им присваиваются номера: mar1, mar2, mar3 и так далее.
Основные принципы описания хромосомных перестроек применимы и для описания транслокаций. Рассмотрим примеры реципрокных транслокаций, начиная с транслокаций с разным числом точек разрывов.
Реципрокные транслокации с 2 точками разрывов:
Реципрокные транслокации с 3 точками разрывов:
Реципрокные транслокации с 4 точками разрывов и более:
Транслокации целых хромосомных плеч могут быть однозначно описаны указанием точек разрывов в центромерных бэндах p10 и q10. При сбалансированных транслокациях для половой хромосомы или хромосомы с более низким номером точка разрыва обозначается р10:
Необходимо обратить внимание на разницу данной записи и записи, приведенной ниже:
В случае несбалансированных транслокаций хромосомных плеч перестроенная хромосома обозначается как производная (der). Из приведенной же ниже записи ясно видно отсутствие двух нормальных хромосом:
В данном кариотипе присутствуют по одной копии нормальных хромосом 1 и 3, а также der(1;3). То есть имеет место моносомия длинного плеча хромосомы 1 и короткого плеча хромосомы 3. В следующем примере производная хромосома тоже состоит из короткого плеча хромосомы 1 и длинного плеча хромосомы 3, однако в кариотипе присутствуют две нормальные хромосомы 1, что приводит к трисомии по короткому плечу хромосомы 1 и моносомии по короткому плечу хромосомы 3:
Запись присутствия в сходном случае двух нормальных хромосом 3, одной хромосомы 1 и одной der(1;3) приведена ниже. Следует обратить внимание на порядок перечисления хромосом. Он соответствует правилам, рассмотренным выше:
Робертсоновские транслокации представляют собой особый тип транслокаций, возникающих в результате центрических слияний длинных плеч акроцентриче-ских хромосом (хромосомы 13-15 и 21, 22), обычно сопровождающихся одновременной потерей коротких плеч этих хромосом. Так как эти транслокации являются несбалансированными, для их описания используется символ (der), точки разрывов указываются в бэндах q10 соответствующих хромосом:
«Jumping» транслокации представляют собой транслокации одного и того же хромосомного района в разные хромосомы в разных клеточных клонах. Для их описания используются стандартные правила. Пример описания «jumping» транслокации приведен ниже:
Для описания разделения хромосомы по центромерному району используется символ fis (fission). Такое разделение приводит к появлению двух производных хромосом, каждая из которых состоит из плеча исходной хромосомы. Кариотип, возникший в результате такой хромосомной перестройки, описывается следующим образом:
Далеко не всегда проведение цитогенетического анализа позволяет идентифицировать все хромосомы или все районы возникших перестроенных хромосом. В ряде случаев, особенно при анализе хромосом раковых клеток, не удается точно определить даже число хромосом. В этом случае ярко проявляется основной принцип, заложенный в ISCN для описания хромосомных аномалий. Он заключается в том, что точно описываются результаты проведенного анализа. В случае если исследователь не смог определить или сомневается в своих заключениях, это находит свое отражение в записи кариотипа, индивидуальной хромосомы или геномного анализа. При проведении цитогенетического анализа не всегда удается получить препараты метафазных хромосом высокого качества. Особенно часто это случается при цитогенетической диагностике при онкологических заболеваниях. В книгах, посвященных хромосомному анализу раковых клеток, можно встретить фразы, утверждающие, что их хромосомы печально известны своим ужасным качеством. Не всегда удается идентифицировать даже целые хромосомы, или остаются сомнения в их целостности. Такие сомнения могут быть обозначены несколькими способами, например, знаком вопроса перед элементом, вызывающим сомнение:
-
45,XY,-?21 - установлена потеря одной хромосомы, потерянная хромосома, вероятно, является хромосомой 21;
-
47,XX,+?8 - установлено присутствие одной дополнительной хромосомы, она, вероятно, является хромосомой 8;
-
46,XX,del(2)(q2?) - при возникновении делеции разрыв произошел в районе 2q2, локализация внутри района не определена;
-
46,XX,del(2)(q2?3) - при возникновении делеции разрыв произошел в районе 2q2, вероятно, в бэнде 2q23;
-
46,XX,del(2)(q?23) - при возникновении делеции разрыв, вероятно, в бэнде 2q23, но неопределенность распространяется и на весь район 2q2. Доказана лишь локализация разрыва в 2q;
-
46,XX,?del(2)(q23) - возможно наличие делеции в бэнде 2q23, однако нет уверенности ни в наличии делеции, ни в ее локализации.
Для описания неопределенности в известных пределах может быть использован символ (~ ). Он применим как к районам, так и к числу хромосом:
-
46,XX,del(2)(q21~24) - делеция имеет место в пределах 2q21→q24;
-
43~47,XX - число хромосом из-за недостаточного качества препаратов мета-фазных хромосом точно не подсчитано, оно находится в пределах от 43 до 47. При отсутствии возможности проведения полного анализа кариотипа (обычно в результате низкого качества доступных препаратов хромосом) описание кариотипа может заканчиваться символом ine (incomplete - неполный, незавершенный).
В случае существования альтернативных интерпретаций полученного результата они разделяются символом or:
Знаки (+) и (-) также могут быть использованы для обозначения увеличения и уменьшения определенных хромосомных районов за счет материала неизвестного происхождения. В этом случае они ставятся непосредственно после символа соответствующего района. Знаки (+) и (-) в случае их нахождения после символа плеча (4p+, 5q-) хромосомы означают увеличение длины этого плеча. Такое использование этих символов возможно в тексте, но не при описании кариотипа. Так, 19р+ в тексте статьи указывает на удлинение р-плеча хромосомы 19 за счет дополнительного материала неизвестного происхождения, но запись кариотипа с такой хромосомой будет выглядеть следующим образом:
Символ add (от латинского additio) используется для указания на дополнительный материал неизвестного происхождения, добавленный к хромосомному району или бэнду. В полной системе записи такой кариотип будет описан следующим образом: 46,XX,add(19)(?::p13→qter). При описании хромосом с дополнительным материалом в p- и q-плечах перед номером хромосомы следует поставить символ der, например, 46,XX,der(5)add(5)(p15)add(5)(q23).
Если дополнительный материал выявлен в интерстициальном районе хромосомы, т.е. имела место инсерция фрагмента хромосомы неизвестного происхождения, то для описания используются символы ins. В случае инсерции неизвестного происхождения в интерстициальном районе запись будет выглядеть следующим образом: 46,XX,ins(5;?)(q13;?) в краткой системе записи и 46,XX,ins(5;?)(pter→q13::?::q13→qter в полной системе. Такие записи означают инсерцию фрагмента хромосомы неизвестного происхождения в бэнд q13 хромосомы 5.
Достаточно часто подобные изменения хромосом записываются как t(19;?) - транслокация хромосомы 19 и материала неизвестной хромосомы. Различия между записями с использованием символов add и + и записью, подобной t(19;?), заключается в том, что символ t, в отличие от символов add и +, предполагает формирование хромосомной перестройки в результате транслокации.
В одной главе невозможно привести все варианты описания хромосомных аномалий. В ней приведены только наиболее часто встречающиеся случаи хромосомных патологий. Для корректного описания хромосомных аномалий цитогенетику необходимо иметь ISCN (2016) на своем столе и уметь ею пользоваться. В завершение рассмотрения описания случаев хромосомных аномалий, выявленных традиционными цитогенетическими методами, мы кратко коснемся описания случаев с double minutes. Double minutes (сокращение dmin) представляют собой специальный тип маленьких ацентрических структур, выявляемых в некоторых клетках. В связи со сложившейся исторически практикой в статьях их часто называют DM-хромосомы. Однако они не попадают под определение «хромосома», так как не содержат центромеры, поэтому при описании кариотипа их число не учитывается при подсчете общего числа хромосом, например:
Заметим, что число dmin в раковых клетках может достигать нескольких десятков. Обычно они содержат ДНК амплифицированных онкогенов.
Отметим, что в настоящей главе полностью отсутствует рассмотрение правил описания как хроматидных, так и хромосомных повреждений, описания хромосомных аномалий при неоплазиях. Мы ограничимся лишь приведением используемых для их описания сокращений.
ХРОМАТИДНЫЕ АБЕРРАЦИИ
Хроматидный пробел (chtg) (chromatid gap) - неокрашиваемый район хрома-тиды, обусловливающий ее минимальное нарушение.
Хроматидный разрыв (chtb) (chromatid break) - разрыв одной хроматиды с явным ее нарушением.
Хроматидный обмен (chte) (chromatid exchange) - реорганизация материала хроматид одной (intrachange) или разных хромосом (interchange), являющаяся следствием двух или более хроматидных повреждений, проявляющихся в виде разрывов и соединений в новых вариантах.
Сестринские хроматидные обмены (sce) (s ister c hromatid e xchange) - обмены гомологичными районами хроматид одной хромосомы, могут быть детектированы только с использованием специальной техники окрашивания. Символ (sce) несколько выпадает из общих принципов обозначения повреждений хромосом, так как он был введен еще до принятия ISCN (1995). Однако он включен в современную номенклатуру хромосом человека.
При более точном определении района аберрации хроматидные повреждения могут быть описаны с указанием конкретного района и типа повреждения. Примеры таких записей:
ХРОМОСОМНЫЕ АБЕРРАЦИИ
При хромосомных аберрациях (ehr) в формирование аномалии вовлекаются обе хроматиды одного и того же хромосомного района. Как и среди хроматид-ных повреждений, среди хромосомных выделяют хромосомные пробелы (ehrg) (chromosome gap), хромосомные разрывы (chrb) (chromosome break), хромосомные обмены (chre) (chromosome exchange).
(chrg) - неокрашиваемые районы хроматид в одном и том же районе хромосомы, обусловливающие ее минимальное нарушение.
(chrb) - разрывы обеих хроматид хромосомы в одном и том же районе, приводящие к появлению ацентрического фрагмента и аномальной моноцентричной хромосомы.
(chre) - результат разрывов хромосомных районов и их соединения в новых вариантах (формирование реципрокных транслокаций, дицентриков и т.д.).
(min) - ацентрические фрагменты, длина которых меньше ширины отдельной хроматиды. Они могут быть одинарными или двойными. В особых случаях присутствия двойных ацентрических фрагментов в клонах злокачественных клеток для их обозначения используется термин double minutes (сокращение - dmin).
(pvz) (pulverization) - хромосомные аномалии, при которых разрывы хроматид и хромосом не поддаются подсчету, но остальные хромосомы сохраняют нормальную морфологию, например: pvz(1) означает распад хромосомы 1 на мелкие фрагменты.
(pcd) (premature centromere division) - преждевременное расхождение центромер в метафазе, pcd может затрагивать одну или несколько хромосом.
МЕЙОТИЧЕСКИЕ ХРОМОСОМЫ ЧЕЛОВЕКА В ISCN
Биваленты поздней профазы/первой метафазы могут быть разделены на группы в соответствии с их размером, а бивалент 9 иногда может быть идентифицирован. При анализе хромосом на этих стадиях информативны методы Q- и С-дифференциального окрашивания. Биваленты аутосом проявляют окрашивание, сходное с бэндингом соматических хромосом. Наиболее эффективно последовательное использование Q- и С-методов.
Для обозначения стадий мейоза используются следующие сокращения:
В описании кариотипа следом за указанием стадии мейоза приводится общее число отдельных хромосомных элементов, отделенное запятой. Половые хромосомы в случае их ассоциации записываются (XX) или (XY). Если половые хромосомы не ассоциированы, они разделяются запятой (X,Y). Любой дополнительный, потерянный или аномальный элемент приводится после половых хромосом в круглых скобках, при этом перед ним римскими цифрами указывается, является ли он унивалентом (I), бивалентом (II), тривалентом (III) или тетравалентом (IV). Отсутствие элемента обозначается знаком минус (- ). Знак плюс (+ ) используется только для описания первой метафазы и только в случаях, когда дополнительная хромосома не вошла в состав мультивалента. Хромосомы, вовлеченные в перестройки, перечисляются в скобках, разделенные точкой с запятой (; ).
Для обозначения хиазм используется сокращение (xma). Общее число хиазм на клетку указывается двузначным числом в скобках совместно с сокращением (xma) и знаком равенства (= ). (xma=52) и (xma=09) означает 52 и 9 хиазм на клетку соответственно. Число хиазм в биваленте (или мультиваленте) указывается однозначным числом, например: (xma=4).
Ниже приведены примеры записи мейотических кариотипов:
-
MI,23,XY - сперматоцит в диакинезе или метафазе I с 23 элементами, включая бивалент XY;
-
MI,24,X,Y - сперматоцит в диакинезе или метафазе I с 24 элементами, включая униваленты X и Y;
-
MI,23,XY,III(21) - сперматоцит в диакинезе или метафазе I с 23 элементами, включая бивалент XY и тривалент хромосомы 21 (трисомия по хромосоме 21);
-
MI,24,XY,+I(21) - сперматоцит в диакинезе или метафазе I с 24 элементами, включая бивалент XY и дополнительный унивалент хромосомы 21 (трисомия по хромосоме 21);
-
MI,22,XY,III(13q14q) - сперматоцит в диакинезе или метафазе I c 22 элементами пациента, гетерозиготного по der(13;14)(q10;q10). Перестроенная хромосома формирует тривалент.
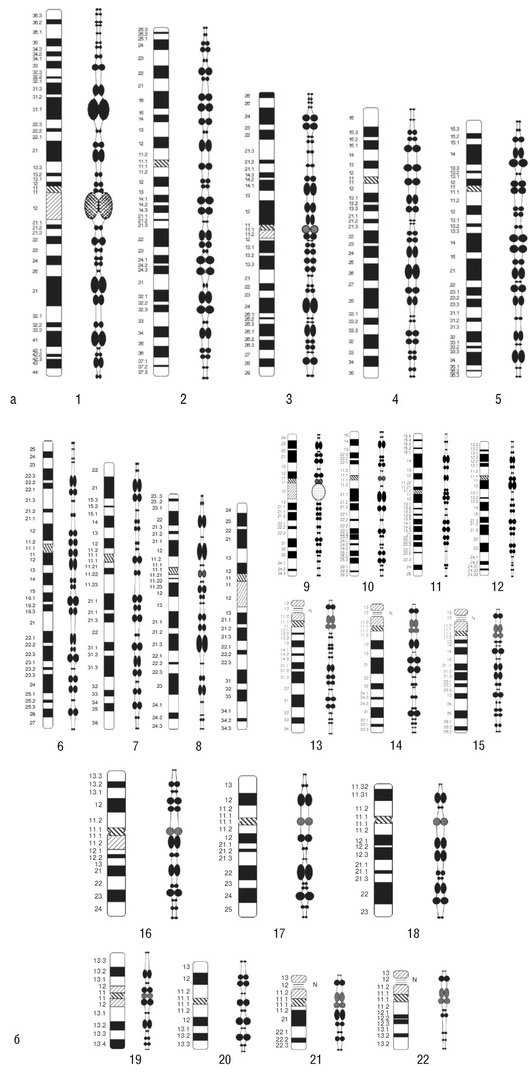
Мейотические хромосомы сперматоцитов на стадии пахитены имеют хромо-мерную структуру. Хромомеры соответствуют G-позитивным бэндам, выявляемым при GTG-дифференциальном окрашивании. Сравнение идиограмм митотических и пахитенных хромосом приведено на рис. 4-5.
ОПИСАНИЕ РЕЗУЛЬТАТОВ ДИАГНОСТИКИ С ИСПОЛЬЗОВАНИЕМ ФЛУОРЕСЦЕНТНОЙ ГИБРИДИЗАЦИИ IN SITU
В случае проведения стандартной цитогенетической диагностики результаты, полученные с помощью FISH, представляются в виде дополнения к обычной записи. Это дополнение должно быть отделено от нее точкой и пробелом, за которым следует символ ish. За ним после пробела записывается результат полученного исследования. В случае если стандартное цитогенетическое исследование не проводилось, то запись содержит только результаты, полученные с помощью FISH. Так как в этом случае отсутствуют данные о числе хромосом, в записи оно не указывается. В записи указываются не только выводы проведенных исследований, но и использованные в исследовании ДНК-пробы. Если невозможно указать название клонированного фрагмента ДНК, использованного в качестве ДНК-пробы, то приводится обозначение локуса в соответствии с геномными браузерами Калифорнийского университета в Санта-Круз (University of California Santa Cruz - UCCSC) или Ensembl (www.genome.ucsc.edu и www.ensembl.org). Порядок записи локусов сохраняется, как и в стандартной цитогенетической номенклатуре, от pter к qter. Если неизвестно и название локуса, то возможно использование названия гена, принятого в номенклатуре HUGO (www.hugo-international.org). При использовании протяженных ДНК-проб, включающих несколько локусов, локу-сы отделяются знаком (/). Следует отметить, что обозначение бэндов хромосом, содержащих эти локусы, должно соответствовать современной версии UCSC браузера. В случае выявленной хромосомной перестройки ее символ записывается за символом ish после пробела. За ним следует номер соответствующей хромосомы в круглых скобках, точки разрывов и названия соответствующих локусов. Знаки наличия (+ ) или отсутствия (-) локуса(ов) приводятся в тех же скобках. При выявлении нормальной хромосомы ее номер после символа ish приводится не в скобках. Также указываются район, бэнд, суббэнд локализации тестированных локусов, а после знака х приводится число зарегистрированных сигналов. Примером таких записей могут служить записи анализа Х-хромосомы, приведенные ниже:
-
46,XX. ish der(X)t(X;Y)(p22.3; p11.3)(SRY+) - присутствует несбалансированная транслокация с точками разрыва в коротких плечах X- и Y-хромосом, определившая присутствие в перестроенной хромосоме гена SRY;
-
46,XX. ish X(DXZ1x2, SRYxO) - с использованием ДНК-пробы DXZ1, специфичной прицентромерному району Х-хромосомы, и ДНК-пробы, выявляющей ген SRY, показано отсутствие гена SRY.
При описании результатов исследований, проведенных методами микроматричного анализа, выявляющих нарушение баланса участков хромосом или их вариации по числу копий, учитываются рекомендации Human Genome Variation Society (HGVS). При записи аномалии дается указание на версию сборки генома, как это показано в приведенном примере: arr[GRCh38] Xp22.31(6467202_8091950)x0 mat, означающем, что микроматричный анализ выявил у пациента потерю суббэнда Xp22.31.
Более детальное знакомство с номенклатурой, использующей методы микроматричного анализа мультиплексной лигазозависимой амплификации (MLPA), цифровой ПЦР, ПЦР в реальном времени, анализ на сферических биочипах, требует внимательного изучения главы «Районоспецифичные анализы» в ISCN (2016). В ISCN (2016) включена новая глава (Глава 16 «Анализы, основанные на секвенировании»). В настоящее время она нередко вызывает вопросы у пользователей и, вероятно, в следующей версии ISCN будет существенно доработана. В настоящее время она достаточно подробно рассмотрена в статье Антоненко и Шиловой (2018), поэтому мы не будем рассматривать ее в данной главе. Отметим только, что при написании этого раздела ISCN (2016) были учтены рекомендации HGVS.
Стремительное развитие молекулярно-генетических методов хромосомного анализа, вероятно, приведет к необходимости подготовки следующей версии ISCN, в которой не только будут улучшены правила описания хромосомных патологий, выявленных методами, вошедшими в ISCN (2016), но и разработаны принципы описания результатов исследований, использующих такие методы, как karyomapping и другие технологии молекулярного анализа, позволяющие проводить детальное кариотипирование индивидуальных клеток.
СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ ХРОМОСОМ ЧЕЛОВЕКА
Рассмотрение вопросов, связанных со структурно-функциональной организацией хромосом человека, требует обсуждения укладки ДНК. На стандартной иллюстрации обычно демонстрируется пространственная организация ДНК, начиная с двойной спирали и заканчивая формированием хроматид метафазной хромосомы (рис. 4-6, см. цв. вклейку).
Эта схема, несомненно, полезна для создания первых представлений о строении материала хромосомы, но крайне упрощена и показывает один из ее элементов в определенный момент клеточного цикла. Это относят даже к классической двойной спирали ДНК и нуклеосомной организации. Известно, что ДНК не всегда располагается в этой форме, и не везде сохраняется нуклеосомная организация хроматина. При завершении секвенирования генома человека, когда определена последовательность нуклеотидов в ДНК большей части генома и частично расшифрован язык, на котором записана генетическая информация, приходится признать, что часто наши представления ограничены понятиями об одномерном геноме - длинной строке, содержащей четыре символа. Кроме того, в лучшем случае учтены сайты метилирования. Информация о пространственной организации генома, ее изменении во времени, при дифференцировке, модификации гистонов и взаимодействии ДНК с различными белками существенно менее полная и более сложна для анализа.
Центромерный район хромосомы
Исходно центромерой считали место первичной перетяжки хромосомы. В настоящее время это положение входит во многие определения, которые можно найти в статьях, словарях и в интернете («место первичной перетяжки в хромосоме»; www.mhhe.com). Кроме того, можно найти множество других определений.
Центромера - специализированный район конденсированного хроматина в каждой из хромосом, в котором во время митоза сохраняется контакт хроматид, создающий Х-образную форму хромосомы. Центромеру сложно секвенировать (www.wordnetweb.princeton).
Центромера - обычно расположенный недалеко от центра хромосомы район ДНК, в котором сестринские хроматиды находятся в контакте. Он вовлечен в клеточное деление и выступает в качестве места прикрепления митотического веретена (www.en.wikipedia.org).
Центромера - район эукариотической хромосомы, где собирается кинетохор.
Центромера - район первичной перетяжки, включающий микротрубочки веретена и ответственный за движение хромосом во время митоза и мейоза (www. biology.usgs).
Центромера - перетяжка в хромосоме, делящая ее на плечи и служащая местом соединения сестринских хроматид и прикрепления нитей веретена (www. biologylessons.sdsu).
Центромера - место на хромосоме, где соприкасаются хроматиды и крепятся микротрубочки (www.knowledgerush.com).
Центромера - район перетяжки, соединяющий две сестринские хроматиды и обусловливающий Х-форму хромосомы; место формирования кинетохора (www. biology-online.org).
Большинство этих определений вызывает улыбку, некоторые - грустную, например, утверждение, что центромера обычно располагается около центра хромосомы. Тем не менее следует признать, что дать полное и точное определение центромеры не так просто. Очень коротко понятие «центромера» сформулировали Шулер и Салливан (2006): «Центромера - локус, состоящий из хроматина, необходимого для правильной сегрегации хромосом». Или более подробное определение: «Центромера - место сборки кинетохора - белковой структуры, присутствующей на всех хромосомах, координирующей их прикрепление и движение вдоль микротрубочек». В 2009 г. Подгорная и соавт. описали центромеру более развернуто: «Центромера - структура, обеспечивающая удержание хромосом, правильность их выстраивания в метафазной пластинке и прикрепление к веретену; участок, ответственный за контроль наступления анафазы». Вероятно, было бы правильнее сказать, что центромера участвует во всех этих процессах. Кроме того, в этом определении сохраняется большая свобода в трактовке того, какие элементы входят в состав этой структуры, а какие - взаимодействуют с центромерой. Наглядно проблемы определения центромеры демонстрирует ее описание, приведенное в словаре на сайте www.academic.ru. В нем центромера определена как «участок хромосомы, характеризующийся специфической последовательностью нуклеотидов и структурой. Центромера играет важную роль в процессе деления клеточного ядра и контроле экспрессии генов». Далее сообщается, что «у большинства эукариот центромера не имеет определенной, соответствующей ей нуклеотидной последовательности».
Вероятно, наиболее просто было бы определить центромеру как участок ДНК, на котором происходит сборка кинетохора. При этом следует отметить, что последовательность нуклеотидов этого участка не является ни достаточным, ни необходимым элементом для проявления функциональной активности центромеры. Во избежание затруднений с терминологией ниже приведены несколько определений, предложенных Шулером и Салливаном, связанных с центромерой или описывающих часть ее элементов.
Кинетохор - белковая структура, собранная на центромерном хроматине и связывающая ДНК центромеры с протеинами, которые управляют движением хромосомы и определяют ее прикрепление к микротрубочкам веретена.
Центромерный район - район, включающий различные домены, которые располагаются рядом с центромерным локусом и имеют соответствующие функции.
α-Сателлит - семейство сателлитной ДНК, основанное на повторении единицы размером 171 п.н., которая представлена в центромере у всех изученных видов приматов.
Мономер - наименьшая по размеру единица повторенной сателлитной ДНК.
Повтор более высокого порядка - единица повторенной сателлитной ДНК, состоящая из набора копий сателлитных мономеров.
Центромерный хроматин - специализированный хроматин в центромерном районе, служащий основой кинетохора.
В результате многочисленных исследований было показано, что центромерный район имеет сложную структурную и функциональную организацию и представлен мультидоменным локусом. Примечательно, что наряду с высоким консерватизмом белков кинетохора последовательности нуклеотидов в центромере эволюционно лабильны. Общая черта ДНК центромер разных видов - присутствие в них тандемных повторов соответствующих семейств. Мономерный α-сателлит был идентифицирован в 21 из 24 хромосом человека. Во всех хромосомах он входил в состав повтора более высокого порядка, который в центромерном локусе мог воспроизводиться сотни и тысячи раз, распространяясь на 0,3-5 млн п.н. Секвенирование генома человека показало различие последовательностей центро-мерных локусов в разных хромосомах. Последовательности мономеров α-сателлитов часто прерываются вставками LINE-ов, SINE-ов и LTR-(long terminal repeat) ретро-транспозонов. Такие разрывы тандемно повторенных α-сателлитов могут сопровождаться изменениями их ориентации. Схема организации центромерной ДНК представлена на рис. 4-7 (см. цв. вклейку). Последовательность α-сателлитной ДНК у человека варьирует от хромосомы к хромосоме. Источником разнообразия, вероятно, служит неравный кроссинговер. В результате неравных обменов возникают 4-6-кратные различия гомологичных участков повторенной ДНК по протяженности.
Центромерный район включает функционально значимые белковые домены, определяющие кинетохорную функцию и формирование гетерохроматина. У эукариот нить ДНК взаимодействует с гистонами Н2А, Н2В, Н3 и Н4, формируя нуклеосомы. В центромерном хроматине гистон Н3 заменен на CENP-A, идентичный гистону Н3 в его центральной части и отличающийся по N- и С-концам. Центромерный хроматин также содержит CENP-В и CENP-С - обязательные компоненты кинетохора. Они формируют прекинетохорный комплекс, служащий предшественником зрелого метафазного кинетохора. Блоки гетерохроматина фланкируют центромерный хроматин с одной или двух сторон. Несмотря на то что центромерный хроматин и гетерохроматин формируются независимо, оба играют важную роль в организации правильной сегрегации хромосом и поддержании хромосомной стабильности.
Центромерный хроматин, содержащий специализированные протеины, отвечает за формирование кинетохора. Следует отметить, что у высших эукариот оно не зависит от последовательности нуклеотидов. В этот процесс вовлечены эпигенетические механизмы, детали которых остаются неизвестными и сегодня. Несмотря на значительную дивергенцию центромерной ДНК, центромерные протеины (CENP-А, CENP-В и CENP-С) или их гомологи представлены у большинства эукариот. Как было сказано выше, для них характерно сходство центральной коровой части и различия по N- и С-концам. Центральным в сборке центромеры считают CENP-А, так как именно он инициирует формирование центромеры в месте своей локализации. Он необходим для вовлечения в структуру организации центромерного района других белков центромеры и кинетохора. Исключением служат белки, специфичные для гетерохроматинового домена, например, HP1 (heterochromatin protein 1). Кроме того, CENP-А, в противоположность гистону Н3, который входит в состав хроматина в S-фазе, во время репликации, наследуется полуконсервативно. Нуклеосомы, содержащие CENP-А, в дальнейшем не удаляются и не замещаются. Вновь синтезированный CENP-А включается в нуклеосомы центромер в G2-фазе, используя механизм, не зависящий от репликации. Одна из гипотез предполагает, что в G2-фазе, когда начинается конденсация хроматид, гистон Н3, находящийся в хроматине центромеры, замещается CENP-А. «Старый» CENP-А используется как маркер для определения позиций, в которые должен встать CENP-А, заменив гистон Н3. Сходный процесс замещения коровых гистонов происходит в местах специализированного активного хроматина по замене гистона Н3 на гистон Н3.3.
Рассмотрению вопроса о составе ДНК центромерного района и формировании белкового комплекса центромеры посвящены многочисленные обзоры. В них описана сборка на нуклеосомах, содержащих CENP-А проксимального протеинового комплекса (NAC). Последний состоит из шести компонентов (CENP-С, CENP-М, CENP-N, CENP-T, CENP-U, CENP-H), которые вместе с CENP-I формируют внутреннюю пластину кинетохора (см. рис. 4-7). Комплекс (CENP^)-(NAC) служит для присоединения следующего протеинового комплекса внутренней части кинетохора, включающего CENP-K, CENP-L, CENP-O, CENP-Q CENP-R, CENP-S (комплекс CAD). Комплекс CAD не связывается непосредственно с CENP-А. Детально взаимодействие этих и других белков кинетохора описано в 2009 г. Валдивиа и соавт. Именно поэтому в этой главе не имеет смысла анализировать данную проблему более подробно. Стоит напомнить, что антитела, специфичные к CENP-А, позволяют легко и надежно детектировать центромеру, а благодаря присутствию в центромерных районах хромосом человека комбинаций различных типов альфоидной ДНК FISH с соответствующими ДНК-пробами позволяет идентифицировать центромеры индивидуальных хромосом человека. В последние годы этот способ практически не используют, так как были получены ДНК-пробы, специфичные последовательностям прицентромерной ДНК индивидуальных хромосом. Они показали свою высокую эффективность при анализе как численных, так и структурных хромосомных аномалий.
На фоне разнообразной информации о сложной организации центромеры, требующей рассмотрения специфических взаимодействий ДНК-белок, белок-белок и целых белковых комплексов, вызывает удивление организация неоцентромер. Неоцентромеры - эктопические центромеры, возникающие вне центромерных районов хромосом. Описаны неоцентромеры различных районов более двух третей хромосом человека. Их число уже превысило сотню. Несмотря на отсутствие центромерной α-сателлитной ДНК, неоцентромеры способны формировать функционально активный кинетохор и первичную перетяжку. Возникновение в хромосомах человека неоцентромер часто связано с задержками и аномалиями развития. Кроме того, их обнаруживают при некоторых формах онкологических заболеваний. Возникновение конституционных неоцентромер обычно ассоциировано с такими хромосомными перестройками, как инвертированные дупликации, интерстициальные делеции и маркерные хромосомы. Предпочтительные места локализации неоцентромер - С-негативные, G-позитивные и AT-богатые районы. В интерфазном ядре они локализованы на поверхности хромосомных территорий. Последовательности нуклеотидов в разных неоцентромерах различаются и сходны с таковыми в ДНК этих районов до формирования неоцентромеры. Митотическая стабильность неоцентромерных хромосом несколько снижена, вероятно, в связи с неоптимальным функционированием кинетохора и отсутствием фланкирующего неоцентромеру гетерохроматина.
Анализ эволюции центромерной ДНК, проведенный путем сравнения ее последовательности у различных видов, дал неожиданные результаты. Несомненно, что без правильного функционирования центромеры невозможно нормальное клеточное деление, но последовательности ДНК в центромере эукариот оказались очень разными. Этот удивительный факт нашел свое отражение в выражении «центромерный парадокс». Пока не удалось дать ему полноценного объяснения.
В заключение стоит отметить, что, согласно номенклатуре хромосом, любой фрагмент ДНК остается фрагментом независимо от его размера, если в нем отсутствует активная центромера. Существует только одно исключение - двойные микрохромосомы (DM-хромосомы - double minute chromosomes) - парные экстрахромосомные элементы, не имеющие центромеры. DM-хромосомы - результат амплификации генетического материала, ответственного за возникновение лекарственной устойчивости, либо хромосомные фрагменты, содержащие онкогены (например, онкоген С-myc). Происхождение названия этих элементов имеет исторические корни и только подтверждает, что не бывает правил без исключений, даже при разработке номенклатуры хромосом.
Теломерный район
Основная функция теломер - сохранение целостности хромосомы и обеспечение ее полной репликации. Стабильность генома во многом зависит от способности клеток поддерживать размер теломерного района в необходимых пределах. Структурно-функциональная организация теломеры позволяет обеспечить защиту конца хромосомы, замаскировав имеющийся двунитевой разрыв. Нарушения организации в теломерных районах приводят к хромосомным перестройкам. Они могут возникать при репликативном старении клеток, клеточной трансформации и апоптозе. Феномен репликативного старения клеток, вызванного концевой недо-репликацией ДНК, был предсказан Алексеем Оловниковым в 1971 г. За биохимическое доказательство и развитие его идеи американские исследователи Элизабет Блэкберн, Кэрол Грейдер и Джек Шостак в 2009 г. получили Нобелевскую премию по физиологии и медицине.
У человека, как и у других видов млекопитающих, теломеры представлены в основном двунитевыми некодирующими повторами (ТТАГГГ)п, заканчивающимися 3'-однонитевым участком. В теломере размер двунитевого участка варьирует от 4 до 12 т.п.н., однонитевого - от 100 до 200 п.н.
Необходимые компоненты теломеры: белки, связанные с теломерной ДНК, - TRF1/TRF2 (ТТАГГГ Repeat binding Factor 1/ТТАГГГ Repeat binding Factor 2) и POT1 и ассоциированные с ними белки RAP1, TPP1 и TIN2 (рис. 4-8, см. цв. вклейку). TRF1 и TRF2 связываются с двунитевой теломерной ДНК, а РОТ1 - с одиночной нитью, которая выступает за пределы двунитевой ДНК. TIN2 связывает TRF1 и TRF2 и через TPP1 вовлекает в формирующийся комплекс POT1. RAP1 включается в белковый комплекс через связь с TRF2. Сформированная таким образом нуклеопротеиновая структура защищает конец хромосомы от его соединения с концами других хромосом или двунитевыми разрывами и воздействия экзонуклаз. Помимо кэпирования конца хромосомы, белки теломеры участвуют в формировании t-петли (см. рис. 4-8, цв. вклейка). Теломерные протеины также участвуют в контроле размера теломеры. Так, TRF1 вовлечен в этот контроль через «счетный механизм». Кроме того, взаимодействие РОT1/TPP1 с TRF1 позволяет устанавливать взаимодействие двунитевой ДНК, теломеразы с 3'-однонитевым участком ДНК теломеры. Фермент теломераза, обеспечивающий репликацию теломерной ДНК, был выделен в 1984 г. Теломераза - РНК-зависимая ДНК-полимераза. Используемая ею в качестве матрицы РНК входит непосредственно в состав ферментативного комплекса. Для осуществления теломеразной активности в клеточном лизате достаточно присутствия каталитического компонента тело-меразы (hTERT) и теломеразной РНК (hTR). Поскольку hTR есть в большинстве соматических клеток, то для демонстрации теломеразной активности в стареющих клетках обычно достаточно введения в них hTERT. Это может приводить к увеличению числа делений до достижения барьера Хэйфлика либо к иммортализации клеток. Резкое уменьшение активности теломеразы и укорочение теломер обычно сопутствуют клеточной дифференцировке. Часто отмечают зависимость размера теломеры от возраста человека.
Кроме регуляции активности теломеразы, существуют и другие, альтернативные способы контроля размера теломер. Исследования, проведенные на трансформированных и опухолевых клеточных линиях человека, показали, что более чем в трети активно пролиферирующих in vitro клеточных линий и в 10-15% опухолей теломеразная активность отсутствует. Теломеры в таких клетках значительно различаются по размеру. Чаще всего они достаточно длинные - от 20 до 80 т.п.н., но в некоторых случаях в одних и тех же клетках описаны как длинные, так и очень короткие теломеры, размер которых не превышает 2 т.п.н., т.е. он меньше, чем длина теломер стареющих клеток. Установлено, что изменение размера теломер в таких линиях происходит одномоментно или, по крайней мере, достаточно быстро. Обнаруженные альтернативные механизмы поддержания размера тело-мер получили название ALT - Alternative Lengthening of Telomeres. Кроме вышеперечисленных, характерными признаками ALT-клеток считают присутствие в них специальных ядерных структур - ALT-ассоциированных промиелоцитных лейкемических телец (APB). Для этих клеток характерны пострепликативные межхроматидные теломерные обмены. Как правило, APB содержат кольцевую теломерную ДНК, PML-белок, теломероассоциированные белки TRF1 и TRF2, а также ряд факторов репарации и рекомбинации ДНК. В некоторых клеточных линиях, кроме изменений в самих теломерах, наблюдают модификации субтеломерных районов. Например, последовательности ДНК субтеломерных районов одной хромосомы могут присутствовать в терминальных районах других хромосом. Несмотря на существующие различия в биологии теломер человека и дрожжей, данные о структуре теломер последних в клонах, выживших в условиях отсутствия теломеразной активности, оказались важными для понимания происхождения ALT-теломер у человека. Альтернативные механизмы поддержания размера теломер наиболее детально были изучены на примере нескольких видов дрожжей: Saccharomyces cerevisiae, Schizosaccharomyces pombe, Kluyveromyces lactis и Candida albicans. У Saccharomyces cerevisiae было показано существование двух возможных путей поддержания размера теломер в отсутствие теломеразы, основанных на гомологичной и негомологичной рекомбинации ДНК. У дрожжей выделяют два типа поддержания размера теломеры. Удлинение теломер по типу I проходит в основном в результате амплификации Y'-субтеломерных элементов, представленных несколькими субтеломерными повторами размером 6,7 т.п.н. В этом случае Y'-элементы оказываются разделенными короткими вставками теломерных повторов размером от 50 до 150 пар оснований. Следует отметить, что для поддержания размера теломерного района по типу I требуется активность факторов Rad54, Rad51, Rad55, Rad57, Rad52 и Exo1. Молекулярный механизм их взаимодействия друг с другом и с ДНК хорошо согласуется с данными, полученными при изучении рекомбинации, индуцированной двунитевыми разрывами на границе теломерных и субтеломерных повторов. Удлинение теломер по типу II приводит к амплификации в основном теломерных повторов. Как и в первом случае, для этого требуется рекомбинация, на что указывает потребность в постоянной активности Rad52. Показано, что консервативный и многофункциональный комплекс протеинов MRX, включающий Mre11, Rad50 и Xrs2, связывается с теломерой, где взаимодействует с одной из трех протеинкиназ: ATM, Tel1 или Mec1. Комплекс MRX действует как нуклеазно-геликазный комплекс, который вместе с 5'-3'-экзонуклеазой Exo1 формирует одиночную 3'-нить, которая может обеспечивать организацию репликации в варианте «катящегося кольца» либо «катящейся петли». Оба гипотетических механизма ALT включают рекомбинацию ДНК, причем она может быть как гомологичной, так и негомологичной, приводить как к увеличению, так и к уменьшению размера теломер, в основном за счет изменения числа копий теломерного повтора. В процессе поддержания размеров теломер как по I, так и по II типу в результате гомологичной рекомбинации может формироваться кольцевая теломерная ДНК.
Заметно сходство между структурой ALT-теломер в клетках человека и клонах дрожжей, дефицитных по активности теломеразы. Хотя точный механизм формирования теломер и субтеломерных последовательностей в ALT-клетках человека пока не выяснен, в настоящее время предполагают, что ALT-теломеры у человека могут образовываться по механизмам, сходным с вышеописанными. Предполагают, что может существовать несколько вариантов реализации ALT, в том числе и те, которые не описаны у дрожжей, а также дополнительные механизмы, связанные с межхромосомными и межхроматидными сестринскими тело-мерными обменами (T-SCE). T-SCE сейчас рассматривают как надежный маркер ALT-клеток.
В ряде исследований было показано, что в условиях отсутствия теломеразной активности у гомозигот по мутации в гене теломеразной РНК соматические и даже стволовые клетки мыши оказались способны после этапа некоторого укорочения теломер решить проблему стабилизации их размера. В процессе формирования новых теломер отмечали признаки хромосомной нестабильности, выражающиеся в слияниях хромосом, амплификации теломерных и нетеломерных последовательностей. В результате были сформированы функционирующие теломеры особой структуры, в которых теломерные повторы перемежались с нетеломерными. Такие теломеры имели признаки теломер хромосом Saccharomyces cerevisiae, сформированных в отсутствие теломеразной активности. В таких хромосомах трудно провести границу между собственно теломерой и субтеломерным районом.
Проблема нестабильности теломер непосредственно связана со слияниями хромосом, присутствием в них интерстициальных теломерных повторов и выяснением роли последних в эволюции хромосом. Предполагают, что районы локализации интерстициальных теломерных повторов могут быть местами эволюционных слияний и разделений. Число и локализация теломерных повторов, вероятно, могут во многом определять направление хромосомной изменчивости и оказывать большое влияние на структурно-функциональную организацию интерфазного ядра клеток человека.
Дисфункцию теломер, связанную в том числе с их укорочением и выражающуюся в нарушении кэппинга, в настоящее время рассматривают как механизм, запускающий теломерные слияния хромосом. Неоднократно было показано, что нарушение кэппинга теломер приводит к распознаванию конца хромосомы как разрыва, который должен быть репарирован. Это ведет к теломера-теломерному слиянию хромосом, образованию дицентрических хромосом или мостов. Разрывы в дицентриках, как правило, приводят к новым хромосомным перестройкам, при этом в сайтах слияния сохраняются блоки теломерной ДНК. Такой цикл обозначают как «разрыв-слияние-мост». Как правило, он сопровождается амплификацией ДНК и крупными терминальными делециями. Образование даже одного конца хромосомы без теломеры либо с предельно укороченной теломерой может послужить причиной длительной геномной нестабильности и генерировать разнообразные типы хромосомных аберраций.
Важный момент стабилизации генома - формирование в районах разрывов полноценных теломер. В настоящее время установлено множество факторов, влияющих на кэппинг теломер. Среди них можно назвать фактор TRF2, а также компоненты, необходимые для гомологичной и негомологичной рекомбинации при репарации двунитевых разрывов ДНК, в том числе комплекс Rad50/Mre11, который, связываясь с TRF2, помогает образованию Т-петли. В ряде случаев механизм влияния факторов репарации и рекомбинации на стабильность хромосом не совсем ясен. Например, показано, что белок Ku86 играет большую роль в функционировании теломер, предотвращая их слияния независимо от длины теломерного повтора и наличия одноцепочечного 3'-конца молекулы ДНК. У Кu86-дефицитных мышей отсутствует укорочение теломер или деградация одноцепочечного 3'-конца, но происходят теломерные слияния с сохранением в сайтах последнего крупных блоков теломерной ДНК.
Изучение распределения теломерных повторов в хромосомах показало, что они могут находиться не только в теломерных районах. Теломерная ДНК была обнаружена в интерстициальных районах хромосом (ITS - interstitial telomeric sites) более чем 100 видов позвоночных разных классов и отрядов. В хромосомах человека было обнаружено более 50 ITS, причем в гомологичных районах хромосом других видов приматов их обычно также обнаруживали. Показано, что локализация значительной части ITS совпадала с районами слияний или разрывов хромосом, случавшихся в эволюции хромосом млекопитающих. Известно, что хромосомы индийского мунтжака образовались в результате тандемных слияний конец в конец предковых хромосом. В районах слияний были обнаружены теломерные и субтеломерные сателлитные повторы.
Клонирование интерстициальных теломерных последовательностей из хромосом человека позволило идентифицировать в них два типа кластеров теломерных повторов. Один из них состоял из прямых теломерных повторов, другой - из повторов, ориентированных голова к голове. Предполагают, что возникновение первого типа кластеров связано с участием теломеразы в репарации двунитевых разрывов в процессе реорганизации хромосом. Сходным способом, по-видимому, возникли ITS, расположенные в районах конститутивного гетерохроматина и в ядрышкообразующих районах. Было показано, что для образования новых кластеров теломерных последовательностей с участием теломеразы в местах разрывов достаточно последовательности из 3-4 нуклеотидов, гомологичных тело-мерному мотиву. Кластеры второго типа, вероятно, связаны с теломерными слияниями хромосом. Они обнаружены у человека в районе 2q13, представляющем собой место слияния двух предковых хромосом. Дополнительное доказательство теломерного слияния в этом районе - данные о локализации в нем последовательностей гомологичных ДНК субтеломерных районов соответствующих хромосом человекообразных обезьян. Такое же происхождение, возможно, имеет ITS в бэнде q41 хромосомы 1 человека.
Детальное исследование состава других ITS и их фланкирующих последовательностей в геноме человека, а также их ортологов в геномах приматов показало, что большинство из них образовалось 5-40 млн лет тому назад в результате репарации двунитевых разрывов вследствие негомологичной рекомбинации, которая, вероятно, происходила с участием теломеразы. Возможно, эти ITS представляют «рубцы», маркирующие места двунитевых разрывов ДНК в ломких сайтах хромосом герминальных клеток. В большинстве ITS теломерная ДНК, вероятно, не несет какой-то определенной функции, но она, как и любые другие микросателлиты, может способствовать увеличению частоты негомологичной рекомбинации в этих районах и, таким образом, способствовать возникновению хромосомных аномалий. К схожему выводу пришли исследователи ITS хромосом китайского хомячка. Они установили, что у него блоки теломерных последовательностей размером 29-126 т.п.н. фланкированы АТ-обогащенными последовательностями. Известно, что последние нестабильны и присутствуют в ломких сайтах хромосом млекопитающих, служащих ГТ спонтанных и радиационных разрывов, а также сайтами с повышенной частотой рекомбинаций. Независимо от того, каким образом сформировались ITS, они могут быть не только ГТ разрывов в эволюции хромосом, но, что важно, и основой для возникновения новых теломер. При разрывах в области ITS или субтеломер интактные и дегенерированные теломерные последовательности могут способствовать теломеризации разорванных концов хромосом. Описан случай образования в клетках культуры индийского мунтжака новых хромосом в результате фрагментации хромосом по районам локализации ITS и последующей амплификации находящихся там теломерных повторов. Эти данные могут иметь значение при изучении хромосомной нестабильности в малигнизированных клетках человека.
Если структуру и функцию теломер в настоящее время исследуют интенсивно, и этой проблеме посвящено множество экспериментальных и теоретических работ, то структура и назначение субтеломерных районов пока остаются в тени.
С очень большим упрощением можно сказать, что классическая организация конца хромосомы включает район теломерных повторов, за которым следуют район субтеломерных повторов и, наконец, эухроматиновый район, в состав которого входят транскрипционно активные участки ДНК.
В действительности концы хромосом организованы намного сложнее. В большинстве случаев не существует четких границ между теломерными, субтеломерными и эухроматиновыми районами хромосом. На границе теломерных и субтеломерных районов обнаруживают чередование теломерных и субтеломерных повторов, а последние присутствуют в эухроматиновых прителомерных районах, для которых характерно присутствие кластеров дуплицированных последовательностей. Следует отметить некоторые особенности эухроматиновых районов, прилежащих к терминальным районам хромосом. Для них характерны повышенное содержание CpG-островков, более высокая концентрация генов и частота рекомбинации. Вполне возможно, что это имеет отношение не к структурно-функциональной организации теломеры как отдельного элемента хромосомы, а к принципам строения и функционирования хромосомы как таковой, или даже связано с оптимизацией пространственной организации всего интерфазного ядра.
У человека и приматов субтеломеры насыщены интактными и дегенерирован-ными теломерными последовательностями, короткими прямыми и инвертированными повторами, получившими название «теломеро-ассоциированные повторы», и AT-богатыми участками. Особенность субтеломерных районов человека - высокая концентрация сегментных дупликаций. Они содержат около 40% всех сегментных дупликаций генома, половина из которых образовалась относительно недавно. Примером сегментных дупликаций, локализованных в субтеломерах, могут служить дупликации, содержащие члены семейства генов обонятельных рецепторов. Блоки, содержащие по три гена из этого семейства, обнаружены в субтеломерах 14 хромосом человека.
Молекулярный анализ сегментных дупликаций показал, что большинство из них образовалось в результате повторных актов негомологичной и гомологичной рекомбинации, а также транслокаций в терминальных районах хромосом. Субтеломерные районы - наиболее быстро эволюционирующие участки генома, для которых характерна высокая скорость нуклеотидных замен и дупликаций небольших районов. Предполагают, что циклы изменения степени полиморфизма в субтеломерах чередуются с крупными геномными перестройками в них. Сравнение результатов секвенирования геномов человека и мыши показало, что 53% сайтов, в которых нарушена синтения, содержат сегментные дупликации, что в 3 раза превышает среднюю частоту нарушения таковой в других районах генома. Такая организация субтеломерных районов хромосом может иметь большое значение в структурно-функциональной организации всей хромосомы.
Неудивительно, что ее изменения могут приводить к различным нарушениям развития. Наиболее интригующий пример - одна из форм аутосомной доминантной мышечной дистрофии (FSHD), ассоциированной с районом 4qter. Этот участок у нормальных индивидуумов содержит кластер полиморфного повтора D4Z4 размером от 11 до 150 т.п.н. У больных он не превышает 11 т.п.н. В датской популяции он был также обнаружен при 10qter-анализе. Для этой популяции была продемонстрирована высокая частота мейотических (20%) и митотических обменов между 4qter и 10qter.
Возможно, причиной высокой частоты мейотических обменов в субтеломерах негомологичных хромосом служит участие терминального хромосомного домена в формировании хромосомного букета на стадии перехода из лептотены в зиготену. Известно, что с теломер начинается конъюгация хромосом в мейозе. Обычно мейотическая рекомбинация происходит позже, после конъюгации гомологов, но незаконная рекомбинация, вероятно, начинается на более ранних этапах - при возникновении пространственного сближения и установлении контактов между хромосомными районами. Это может приводить к расселению субтеломерных последовательностей по негомологичным хромосомам и обмену материала негомологичных плеч хромосом. Косвенный аргумент в пользу такой возможности - вышеприведенные данные о структуре субтеломер у человека. Кроме того, такой взгляд находит подтверждение в модели организации субтеломер хромосом человека, предложенной Флинтом и соавт. Согласно этой модели, субтеломерный район разделяется дегенерированными теломерными повторами на два субдомена. Дистальный субдомен содержит повторенные последовательности, которые взаимодействуют с концами всех хромосом, тогда как проксимальный - только те, которые взаимодействуют с последовательностями гомологичных хромосом. Несмотря на явную упрощенность таких представлений, они отражают тот факт, что чем ближе субтеломерный сайт расположен к теломере, тем чаще в нем могут происходить рекомбинационные события между негомологичными хромосомами.
Ядрышкообразующие районы хромосом
Ядрышкообразующие районы хромосом (ЯО-районы) локализованы в коротких плечах акроцентрических хромосом человека: 13, 14, 15, 21 и 22. На препаратах метафазных хромосом активные ЯО-районы представлены вторичными перетяжками, окрашиваемыми азотнокислым серебром. Наряду с генами 45S рРНК - предшественника 5.8S, 18S, 28S, ЯО-районы содержат межгенные спей-серы и различные микросателлитные последовательности. Транскрипция генов рРНК - необходимое условие поддержания нативности ядрышек, которое может служить маркером здоровья клетки. Ингибирование синтеза рРНК ведет к деградации ядрышка, повышению количества р53 и индукции апоптоза. В ряде работ полуколичественную оценку активности ЯО-районов используют в качестве показателя состояния клетки и прогностического критерия. В среднем на геном человека приходится около 400-500 копий генов рРНК (по 40-50 на один ЯО-район). Их общее число в геноме разных индивидуумов может значительно варьировать (от 200 до 700). Количество копий генов рРНК в ЯО-районах разных хромосом также может значительно меняться. Редкий вариант - акроцентрические хромосомы с двумя ЯО-районами в коротком плече. Неравномерна и транскрипционная активность генов рРНК в разных кластерах. В настоящее время неизвестно, чем определяется функциональный статус каждого конкретного гена. Возможным фактором, влияющим на транскрипционную активность генов рРНК, может быть вариабельность регуляторных участков, входящих как в состав повторяющихся единиц рДНК, так и участков ЯО-районов, примыкающих к кластерам рДНК. Собственно, ЯО-районы фланкированы участкам хромосом, обогащенным повторенными последовательностями.
На примере белков, характерных для ядрышка, была продемонстрирована функция хромосом в качестве перевозчиков ядерных белков во время митоза. При вхождении клетки в метафазу по крайней мере некоторые белки ядрышка переходят на поверхность хромосомы, а после телофазы при формировании ядер участвуют в образовании новых ядрышек. Такое использование хромосом в качестве клеточных извозчиков значительно упрощает решение проблемы сборки новых ядер после клеточного деления, обеспечивая правильную исходную пространственную локализацию ядерных белков.
Кластеры дуплицированных последовательностей
Секвенирование генома человека позволило взглянуть на хромосомы под новым углом зрения. Анализ распределения дуплицированных последовательностей показал, что более чем половина пограничных участков, разделяющих эухроматиновые районы и прицентромерный гетерохроматин, содержит дуплицированные сегменты. Индивидуальные дупликации происходят из различных участков генома и включают фрагменты известных генов, в которых могут присутствовать как экзоны, так и интроны. Многочисленные дуплицированные последовательности в этих и в подобных им районах собираются вместе конец к концу, формируя большие блоки, которые по размерам могут превышать миллион пар оснований. Вероятно, они играют роль буферных зон между участками хромосом, состоящих из плотно упакованных тандемных сателлитных повторов и районов, содержащих транскрипционно активную ДНК. Сравнительный анализ близкородственных видов приматов указывает, что формирование таких кластеров дуплицированных последовательностей проходило в течение последних 30 млн лет. При этом паралогичные сегменты, содержащие дуплицированные последовательности и варьирующие по размеру, оказались распространенными вдоль всех хромосом, от прицентромерных до субтеломерных районов (рис. 4-9, см. цв. вклейку). Например, в хромосоме 21 размер проксимального кластера, локализованного в прицентро-мерном районе, достигает 1 млн п.н., а самого дистального в субтеломерном районе - 130 т.п.н. В хромосоме 22 размеры этих кластеров составляют 1,5 млн п.н. и 50 т.п.н. соответственно.
Следует отметить, что крупные кластеры обычно содержат преимущественно межхромосомные дупликации. Отдельные дуплицированные последовательности, входящие в них, значительно варьируют по размерам (от менее 1 т.п.н. до 85 т.п.н.). Обычно дуплицированные последовательности ДНК представлены в нескольких кластерах. Например, дуплицированные фрагменты гена NF1, локализованного в 17q11.2, также были обнаружены в 14q11, 15q11, 22q11, 2q21, 18q11, 21q11, 12q12, 1q32 и 20q11. Большинство дупликонов в прицентромерных районах не вовлечено в транскрипцию. Они представлены лишь фрагментами исходных транскриптомов, и в этих кластерах отсутствуют необходимые регуляторные последовательности. Тем не менее было обнаружено несколько примеров мРНК и EST-последовательностей, соответствующих копиям дупликонов из прицентро-мерных районов. Правда, в большинстве случаев транскрипция была ограничена стволовыми и трансформированными клетками, а также эмбриональными тканями.
Анализ последовательностей, фланкирующих прицентромерные дупликации, показал, что они представлены несовершенными полипиримидиновыми или полипуриновыми (CAGGG, GGGCAAAAAGCCG, GGAA) последовательностями и HSREP522-элементами. Многие из них имеют сходство с теломерными повторами, субтеломерными последовательностями и последовательностями, определяющими перестройку иммуноглобулиновых генов. Кластеры повторяющихся CAGGG, GGGCAAAAAGCCG и HSREP522 могут способствовать формированию особой конфигурации ДНК, стимулирующей негомологичные обмены, и таким образом приводить к интеграции дупликонов в районы, граничащие с прицентромерным гетерохроматином. Вероятно, такой механизм не единственный при формировании сегментных дупликаций, так как известны примеры дупликаций, не имеющих на своих границах подобных повторенных структур.
Сравнение сегментных дупликаций из разных хромосом (2p11, 10p11, 16p11 и 22q11) обнаружило их сходство, позволившее предложить двушаговую модель формирования сегментных дупликаций (рис. 4-10, см. цв. вклейку). На первом этапе предполагается внедрение дубликатов различных уникальных последовательностей в прицентромерный район. На втором этапе происходят дупликация фрагмента из протяженного комплекта ранее дуплицированных последовательностей и его встройка в новое положение.
Существование сегментных дупликаций в хромосомах человека имеет ряд последствий. Одно из них - возникновение нового фактора геномной нестабильности. Спаривание в мейозе паралогичных сегментов может приводить к неравному кроссинговеру и в результате - к микродупликациям и микроделециям. Действительно, многие из районов, для которых характерна повышенная частота внутрихромосомных перестроек, приводящих к различным заболеваниям или обнаруживаемых при онкологических болезнях, активно участвуют в процессе формирования прицентромерных сегментных дупликаций. Паралогичные сегментные дупликации, находящиеся на одной хромосоме, могут быть причиной или следствием инверсий. Это относится к перицентрической инверсии в хромосоме 9 - одному из наиболее распространенных вариантов хромосомного полиморфизма у человека. Результаты FISH-анализа указывают на высокую степень гомологии в бэндах 9р12 и 9q13, соответствующих точкам разрыва при инверсии. Инверсия в хромосоме 2 имеет границы в 2р11 и 2q13. В этих районах присутствуют протяженные участки сегментных дупликаций со степенью гомологии 98%.
Завершая рассмотрение сегментных дупликаций, следует отметить, что их существование и полиморфизм в районах локализации могут усложнять молекулярно-цитогенетическую диагностику хромосомных нарушений человека вследствие обнаружения гомологичных последовательностей, представленных в различных сегментных дупликациях.
Ломкие сайты хромосом
В 70-х годах XX в. в культуре клеток некоторых индивидуумов был обнаружен феномен повышенной ломкости хромосом. Он существовал либо в клетках обычной культуры, либо возникал только при определенных воздействиях на нее. Для него характерна повышенная частота хромосомных разрывов. Как правило, последняя или пробелы хроматид в конкретных хромосомных участках не связаны с какими-либо заболеваниями, но существование ломких сайтов может сопровождаться развитием различных аномалий. Так, в 1969 г. у больных с синдромом Мартина-Белла, сопровождающимся умственной отсталостью, был обнаружен специфический цитогенетический маркер-ломкий сайт в дистальной части длинного плеча хромосомы Х, позже локализованный в суббэнде Xq27.3 (FRAXA). Основные диагностические признаки заболевания: умственная отсталость, прогнатизм, широкое лицо с чертами акромегалии, большие оттопыренные уши, макроорхидизм в постпубертатном периоде, аутизм, гиперкинезы, плохая концентрация внимания и дефекты речи, более выраженные у детей. Отмечают также аномалии соединительной ткани с повышенной растяжимостью суставов и пролапсом митрального клапана. Относительно полный спектр клинических признаков обнаруживают только у 60% мужчин с ломкой хромосомой Х; 10% больных не имеют лицевых аномалий, у 10% присутствует только умственная отсталость без других признаков, а у 30% пациентов отсутствует макроорхидизм.
Синдром ломкой хромосомы Х имеет высокую частоту встречаемости (один случай на 1500-3000 человек) и необычное наследование. Клинические признаки заболевания обнаруживают только у 80% мужчин-носителей мутантного гена. Остальные 20% пациентов как клинически, так и цитогенетически нормальны, но могут иметь внуков, рожденных от дочерей-носителей мутантного гена, с клиническими симптомами синдрома. Мужчины-носители мутации, не имеющие клинических признаков, служат передатчиками неэкспрессированного мутантного гена (трансмиттерами), который может манифестировать в последующих поколениях. Среди женщин, гетерозиготных по мутантному гену, выделяют два типа:
Молекулярный механизм наследования и передачи мутации был выяснен в 1991 г. Было установлено, что развитие синдрома связано с мутацией в гене FMRl (Fragile site Mental Retardation l - ломкий участок хромосомы, связанный с развитием умственной отсталости первого типа). В первом экзоне гена FMRl отмечают многократное увеличение числа копий простого тринуклеотидного повтора CGG. В норме оно варьирует от 5 до 52. У пациентов с синдромом Мартина-Белла их число составляет 200 и более. Феномен резкого увеличения числа копий CGG-повторов (экспансии числа тринуклеотидных повторов) зависит от пола потомка. Такая экспансия - постзиготическое событие, происходящее на ранних стадиях эмбриогенеза у эмбрионов женского пола.
В настоящее время в дистальном районе длинного плеча хромосомы Х найдено еще несколько ломких участков: FRAXE, FRAXF и RFAXD. FRAXE и FRAXF не связаны с аномалиями развития. RFAXD располагается рядом с FRAXA. Его обнаруживают у нормальных индивидуумов с частотой около 1-2%, что создает затруднения при диагностике синдрома Мартина-Белла. Возможно, ломкие районы хромосом также вовлечены в процесс клеточной трансформации, возникающий при онкологических заболеваниях.
Сестринские хроматидные обмены
Впервые сестринские хроматидные обмены (СХО) были описаны много лет назад. Несмотря на огромные успехи современной цитогенетики и широкое использование СХО в оценке мутагенности и онкогенности различных факторов, их механизм остается неизвестным. Одно из наиболее полных определений СХО включает следующие положения: «Обмен гомологичных сегментов генетического материала между сестринскими хроматидами хромосомы: между сестринскими хроматидами мейотических тетрад или между сестринскими хроматидами дуплицированных соматических хромосом. Частота обменов увеличивается в результате повышенной хромосомной ломкости. Она обусловлена наследственными факторами или влиянием окружающей среды, таким как ультрафиолетовое, ионизирующее облучение и другие мутагенные агенты. Особенно высока частота СХО при синдроме Блюма». Метод обнаружения и подсчета СХО в большинстве хромосомных районов достаточно прост и описан выше. К делящимся клеткам добавляют 5-бромдезоксиуридин. После двух клеточных циклов в одной из хроматид он присутствует в обеих нитях ДНК, а в другой - только в одной. Отличать их позволяют специальные методы окрашивания. Более сложен учет СХО в терминальных районах хромосом. Последние известны как ГТ мейотических рекомбинаций и дву-нитевых разрывов. Проведенные оценки показали, что 17% всех СХО приходится на теломерные и субтеломерные районы, представляющие лишь 0,1% материала всех хромосом. Частота встречаемости СХО в них в пересчете на нуклеотиды (один СХО на 1600 пар оснований) в 160 раз выше, чем где-либо еще в геноме человека. Для оценки частоты в теломерных районах были использованы специальные методы, такие как CO-FISH (chromosome orientation fluorescence in situ hybridization).
Невысокую частоту СХО в клетках человека (от 3 до 8 СХО на метафазу при использовании стандартных методов) считают нормой. Она может значительно увеличиваться при воздействии некоторых мутагенов, что делает определение частоты СХО эффективным тестом на мутагенность. Она также значительно повышена при ряде наследственных заболеваний человека. При синдроме Блюма число СХО на метафазу может достигать 100-160. Частота СХО зависит как минимум от двух факторов - частоты возникновения двунитевых разрывов ДНК и эффективности репарационной системы клетки. В связи с этим связь наследственных нарушений, снижающих эффективность репарационной системы, и мутагенных воздействий с увеличением частоты СХО кажется очевидной. Простая логика говорит, что если часть двунитевых разрывов после репарации приводит к СХО, то воздействие мутагенов, вызывающее образование разрывов ДНК, должно приводить к увеличению числа СХО. С другой стороны, увеличение количества сбоев при репарации разрывов также должно вызывать повышение частоты обменов гомологичными участками сестринских хроматид. Снижение эффективности репарационной системы ограничено традиционными представлениями об увеличении времени репарации разрыва двойной нити ДНК в одной хроматиде и, как следствие, увеличении вероятности разрыва ДНК второй хроматиды с последующим лигированием ДНК разных хроматид. В этом случае приходится допустить рост вероятности возникновения неравных СХО, приводящих к мутациям.
В результате даже такого поверхностного рассмотрения проблемы возникает ряд вопросов. Отличаются ли СХО, возникающие при нормальном клеточном делении, от индуцированных мутагенами или служащих следствием различных наследственных нарушений? Каким образом клетка решает проблему нескольких СХО, в норме возникающих в каждом клеточном цикле? Чтобы попытаться найти ответы на эти вопросы, полезно рассмотреть процесс конденсации хроматина хромосом в митозе. После репликации ДНК сестринские хроматиды, удерживаемые когезиновым комплексом, расположенным интервалом около 10 т.п.н., остаются рядом. При переходе клетки в митоз когезин уходит, а с ДНК связываются кон-денсины, что приводит к компактизации хроматина. На этом этапе начинается разделение материала хроматид. Сложно представить, что две нити ДНК могут без затруднений сформировать две отдельные хроматиды. Считают, что сестринские хроматиды на ранних стадиях митоза удерживаются за счет районов, из которых еще не ушли молекулы когезина, но можно предположить, что наряду с этим хроматиды удерживаются рядом и за счет «перепутывания» ДНК сестринских хроматид в некоторых участках хромосом. В этих местах должно возникать дополнительное напряжение. Похоже, что решение проблемы завершения полного разделения сестринских хроматид невозможно без разрывов (энзиматической рестрикции) ДНК в них и их последующей репарации. Высокой эффективности восстановления целостности ДНК в ее исходном виде можно достичь посредством участия в формировании разрыва рестриктаз, под действием которых образуются липкие концы ДНК. Пространственная близость гомологичных участков ДНК сестринских хроматид позволяет допустить возможность возникновения разрывов в гомологичных сайтах двух хроматид с последующим лигированием нитей ДНК, принадлежащих разным хроматидам. Таким образом обеспечивается успешное расхождение хромосом с небольшим побочным эффектом - возникновением нескольких СХО на геном, при этом абсолютная точность при проведении обменов практически гарантирована. Это только гипотеза. Механизм формирования СХО остается неизвестным.
Тем не менее стоит рассмотреть возможные следствия из приведенных выше предположений. Если увеличение числа СХО обусловлено множеством разрывов двунитевой ДНК, возникших под воздействием мутагенов, естественно предположить, что они будут происходить не точно в гомологичных сайтах сестринских хроматид. В этих случаях возникновение СХО должно сопровождаться формированием мутаций. Таким образом, СХО, возникающие под воздействием мутагенов, могут принципиально отличаться от СХО, вызванных нормальным расхождением хроматид.
Механизмы увеличения числа СХО при различных наследственных нарушениях, вероятно, различаются, при этом могут быть затронуты различные этапы процесса репликации или репарации ДНК. Так, например, при синдроме Блюма мутации возникают в гене, кодирующем геликазу. Известно более десятка мутаций, характерных для анемии Фанкони. Продукты большинства генов, на которые влияют мутации, участвуют в формировании комплекса, осуществляющего лигазную активность. Таким образом, подобные мутации могут значительно увеличивать время лигирования ДНК при репарации двунитевого разрыва. Увеличение времени лигирования повышает вероятность пространственного разобщения концов ДНК, возникших при двунитевом разрыве, и, как следствие, последующего лигирования концов, исходно принадлежащих ДНК разных хроматид или даже различных хромосом. Действительно, у пациентов с анемией Фанкони увеличивается не только частота СХО, но и количество межхромосомных обменов.
Разнообразие механизмов формирования СХО, вероятно, - одна из основных причин того, что они остаются неизвестными до настоящего времени.
ГОРЯЧИЕ ТОЧКИ ХРОМОСОМНЫХ ПЕРЕСТРОЕК
При анализе реорганизации хромосом человека были обнаружены районы, в которых разрывы и воссоединения происходят с более высокой частотой, чем в среднем в геноме. Анализ ДНК в ГТ хромосомных перестроек при врожденных хромосомных аномалиях и канцерогенезе показал присутствие в них различных типов повторенных последовательностей. Особое значение имеют районоспецифичные низкокопийные повторы (Low Copy Repeats - LCRs) и дупликоны, которые часто фланкируют сайты ДНК, вовлеченные в перестройки. Реорганизация хромосом, опосредованная рекомбинацией между разными копиями таких повторов, в зависимости от их ориентации приводит к делециям, дупликациям, инверсиям или U-образным обменам. В проксимальной части q-плеча хромосомы 15 обнаружено четыре ГТ. ГТ1, ГТ2 и ГТ3 задействованы более чем в 95% микроделеций в этом районе. Обычно точками разрывов служат дистальная (ГТ3) и одна из проксимальных ГТ (ГТ1 или ГТ2).
Делеции в проксимальном участке длинного плеча q11-q13 хромосомы 15 представляют классический пример вовлечения в реорганизацию хромосомных районов, подвергнутых импринтингу. В зависимости от того, какой из гомологов хромосомы 15 (матери или отца) несет делецию, у носителя формируется либо СПВ, либо синдром Энжельмена (СЭ). СПВ впервые описали в 1956 г. в Швейцарии. Частота встречаемости составляет 1: 12 000-15 000 живорожденных. При этом синдроме делеция располагается на отцовской хромосоме. Делеция в материнской хромосоме приводит к развитию СЭ. Гены этого района в зависимости от происхождения хромосомы экспрессируются в разных тканях и в разное время: в одних - только отцовские, в других - только материнские. В результате и делеция выражается по-разному. Лишь около 70% случаев СПВ обусловлено делецией в отцовской хромосоме. В остальных случаях его причиной служит материнская дисомия хромосомы 15, при этом, как и при делеции 15q11-q13 в отцовской хромосоме, в клетках индивидуума отсутствуют отцовские гены этого района.
Синдром Энжельмена впервые описали в 1965 г. Гарри Энжельмен представил истории болезни трех пациентов с выраженной умственной отсталостью. Учитывая своеобразие поведения и фенотипа пациентов, он назвал этот синдром «puppet children» - «дети-куклы». Окончательное название он получил в 1982 г.
Помимо делеции 15q11-q13 в материнской хромосоме, к развитию СЭ приводит отцовская дисомия хромосомы 15. Всего в настоящее время описано четыре механизма возникновения заболевания: делеция de novo в локусе 15q11-q13 (70-80% всех случаев), отцовская дисомия (5% случаев), дефект центра импринтинга (ЦИ) (5%) и мутация материнской копии гена, кодирующего убиквитинпротеинлигазу (ген UBE 3A).
Поскольку в структурные перестройки обычно вовлекаются участки ДНК, обогащенные повторенными последовательностями, достаточно типичными считают перестройки с точками разрывов в районах прицентромерного гетерохроматина. Примерами таких перестроек могут быть робертсоновские транслокации акроцентрических хромосом и изохромосомы по плечам хромосом. Формирование двуплечей хромосомы из длинных плеч акроцентриков при сохранении их нормального числа практически не сказывается на фенотипе носителя. Из изохромосом, состоящих из плеч аутосом, совместимой с жизнью считают только изохромосому по короткому плечу хромосомы 18.
Хромосомные аномалии и их анализ
Первые результаты диагностики хромосомных нарушений были получены вскоре после определения числа хромосом человека. Уже в 1958 г. была опубликована статья, содержащая описание нарушения числа хромосом при синдроме Дауна (Lejeune et al., 1958), а на следующий год были описаны изменения при синдроме Кляйнфельтера (Jacobs, Strong, 1959) и Тернера (Ford et al., 1959). Уже в следующем году была обнаружена первая структурная аномалия хромосом: в клетках периферической крови у больных с хронической миелолейкемией описана филадельфийская хромосома. Ситуация принципиально изменилась после внедрения методов дифференциального окрашивания хромосом. Благодаря последним стало возможным описание структурных хромосомных аномалий. В то же время диагностика нарушений, связанных с небольшими хромосомными районами, оставалась проблематичной и ненадежной. Это особенно касалось хромосомного анализа при онкологических заболеваниях. Хромосомы раковых клеток были и остаются печально известными своей отвратительной морфологией. Основные трудности удалось решить введением в практику диагностики методов молекулярной цитогенетики: определение числа хромосом, делеций и транслокаций конкретных районов стало возможно при анализе, проводимом не только на мета-фазных хромосомах, но и на интерфазных ядрах. Мощным инструментом обнаружения хромосомных транслокаций стала 24-цветная FISH. Нарушение баланса хромосомных районов CGH можно определить даже на архивном материале. Получение ДНК-проб из аномальных хромосом с последующим FISH-анализом c нормальными хромосомами и многоцветным бэндингом дает возможность разобраться с самыми сложными случаями комплексных хромосомных перестроек, возникающих при онкологических заболеваниях (рис. 4-11, см. цв. вклейку).
Показательным является прогресс в диагностике малых сверхчисленных маркерных хромосом (достаточно распространенный вариант хромосомных аномалий). Частота их встречаемости варьирует от 0,65 до 1,5 случая на 1000 человек. Она несколько ниже, если учитывать результаты только постнатальной диагностики (0,14-0,72 случая на 1000 человек). Многие из них не влияют на формирование фенотипа. По некоторым оценкам, семейные маркерные хромосомы составляют до 40% всех обнаруженных маркерных хромосом. Отсутствие клинических признаков подобного нарушения кажется вполне логичным, так как такие хромосомы не содержат эухроматиновых сегментов и функционально активных генов. Тем не менее формирование маркерных хромосом может указывать на повышенную хромосомную нестабильность и необходимость проведения более тщательного цитогенетического анализа. Обнаружение множественных маркерных хромосом разного происхождения хорошо согласуется с этим предположением.
Около 80% маркерных хромосом представлено изохромосомами по коротким плечам акроцентриков и некоторых двуплечих хромосом. Наиболее высокой частотой встречаемости (около 40% случаев) среди них характеризуется inv dup(15). На втором месте стоит хромосома inv dup(22). В их образовании участвуют те же ГТ хромосомных перестроек, что и в возникновении делеций. Так, inv dup(15) может быть результатом перестройки по ГТ1, ГТ2, ГТ3, а также ГТ, локализованной дистальнее последней (дистальная ГТ). Предполагают, что она содержит другой тип повторенных последовательностей. Таким образом, конкретная inv dup(15) может представлять один из четырех вариантов изохромосомы. Различие маркерных хромосом по составу входящих в них эухроматиновых районов определяет разнообразие клинических признаков.
Перестройки в районе 22q11, подобно перестройкам в 15q11→q13, обусловлены рекомбинациями, связанными с районоспецифичными низкокопийными повторами. Микроделеции в районе 22q11 обнаруживают с частотой 1 случай на 4000 новорожденных. Хромосомы inv dup(22): 22pter→cen→q11.2::q11.2→cen→ 22pter обнаруживают несколько реже. Низкокопийные повторы хромосомы 22 варьируют по размеру от 40 до 350 т.п.н. с уровнем гомологии 97-98%. Они были обнаружены в районах локализации трех ГТ хромосомных перестроек в 22q11, а также еще в 6 локусах, расположенных в пределах 6,5 млн п.н. от основных ГТ. Микроделеции и дупликации в районе 22q11 связаны с дистальной и проксимальной ГТ. Около 90% делеций имеют размер 3 млн п.н., а 7% - 1,5 млн п.н. Они же задействованы в формировании большинства хромосом inv dup(22). Различие маркерных хромосом по составу входящих в них эухроматиновых районов определяет различные клинические признаки.
Из-за более низкой частоты встречаемости других маркерных хромосом детальное изучение механизма их формирования затруднительно. Тем не менее стоит рассмотреть случаи возникновения множественных маркерных хромосом. В одном из них число последних варьировало от 1 до 6. Все они имели разное происхождение (хромосомы 2, 5, 6, 12, 14 и 22). Одновременное образование нескольких маркерных хромосом указывает на нестабильность хромосом у пациента. Механизм ее формирования неизвестен.
Отдельную проблему представляют маркерные хромосомы с неоцентромерой. Механизм перестроек, приводящих к их образованию, неясен. В связи с относительно небольшим числом исследований маркерных хромосом с неоцентромерами сложно говорить о молекулярной организации районов, входящих в их состав. Следует лишь отметить, что некоторые такие хромосомы включают материал хромосомных сегментов, содержащих низкокопийные повторы, например сегмент 15q26. Возможно, последние участвуют в формировании и этого типа маркерных хромосом.
Большинство маркерных хромосом, ассоциированных с врожденными пороками развития (ВПР), характеризуются существованием эухроматиновых сегментов, независимо от того, представляют ли они бисателлитные, кольцевые или другие варианты хромосом. Таким образом, в этих случаях обнаружение эухроматиновых сегментов и идентификация их состава - основная задача цитогенетической диагностики. Идентификация относительно крупных маркерных хромосом, таких как i(5p), i(9p), i(12p), i(18p), благодаря их значительным размерам не представляет особых затруднений даже для традиционных методов хромосомного анализа. Их присутствие приводит к тетрасомии по большому числу генов и, как следствие, к формированию многочисленных аномалий развития. Из них совместимой с рождением живого ребенка оказалась только i(18p).
Значительно более сложной считают оценку клинического значения маркерных хромосом, содержащих небольшие эухроматиновые сегменты. В случае их формирования из прицентромерных районов и прилежащих к ним эухроматиновых сегментов значение имеют не только определение происхождения маркерной хромосомы, но и идентификация материала сегментов, входящих в ее состав. Задача диагностики сводится к обнаружению локализации точек разрывов, происходящих при образовании маркерной хромосомы. Именно ее решение позволяет дать достаточно обоснованный прогноз. К сожалению, и в этом случае он носит вероятностный характер, что может быть обусловлено присутствием различных аллелей генов, входящих в состав маркерной хромосомы, ее мозаицизмом и однородительской дисомией (ОРД) по хромосоме, из которой возникла маркерная хромосома.
Важный фактор формирования маркерной хромосомы - момент ее возникновения. Если перестройка произошла в клетках эмбриона или взрослого организма, то несущие ее клетки могут составлять лишь небольшую долю всех клеток организма. Формирование маркерной хромосомы на предмейотических стадиях или во время мейоза может привести к присутствию такой хромосомы уже в зиготе. Тем не менее мозаицизм по маркерной хромосоме нельзя рассматривать как доказательство ее постзиготического происхождения. Известны примеры семейных маркерных хромосом, которые и у матери, и у ее потомства были обнаружены лишь в части исследованных клеток. Механизм потери маркерных хромосом в соматических клетках неизвестен.
Формирование маркерной хромосомы в результате U-образного обмена приводит к возникновению и последующей потере ацентрического фрагмента, т.е. один из гомологов хромосомы должен быть замещен маркерной хромосомой. Такие примеры известны только для половых хромосом (46,X,+mar, где mar - дериват хромосомы Х или Y). Моносомия по большей части районов аутосомы невозможна, так как она приводит к гибели плода уже на ранней стадии развития. Все конститутивные маркерные хромосомы, дериваты аутосом, считают сверхчисленными. Было предложено несколько возможных механизмов их возникновения. В случае хромосомных перестроек в ходе гаметогенеза возможно формирование гамет, содержащих маркерные хромосомы либо вместо, либо в дополнение к нормальной хромосоме. Для объяснения коррекции числа нормальных хромосом при формировании маркерной хромосомы были предложены следующие механизмы.
Функциональная коррекция трисомии. В результате ошибки в мейозе одна из гамет несет две копии хромосомы. При образовании зиготы это приводит к трисомии по данной хромосоме. К этому же результату может приводить нарушение митоза на постзиготической стадии. Реорганизация одной из трех копий хромосомы завершается образованием маркерной хромосомы и переходом полной трисомии в частичную.
Постзиготическая редупликация. Возникновение маркерной хромосомы происходит в процессе гаметогенеза или непосредственно в мейозе. Одна из гамет несет маркерную хромосому вместо нормальной. Зигота, полученная при слиянии с такой гаметой, - моносомик по большей части соответствующей хромосомы. Редупликация нормальной хромосомы переводит частичную моносомию в частичную трисомию, ассоциированную с ОРД.
Комплементация гамет. Одна из гамет несет две копии нормальной хромосомы, вторая - маркерную хромосому.
Следует отметить, что функциональная коррекция трисомии может с высокой вероятностью приводить к ОРД, а постзиготическая редупликация - к ОРД в 100% случаев. Действительно, исследования носителей сверхчисленных маркерных хромосом показали, что их возникновение часто сочетается с ОРД. Это обусловливает некоторые дополнительные проблемы, связанные с хромосомным импринтингом, возникновением гомозиготности по аутосомным рецессивным мутациям, а также с их комбинациями. Из 19 случаев ОРД, обнаруженной у пациентов с маркерными хромосомами, описанных к настоящему времени, 4 были эпизодами отцовской ОРД, остальные - материнской ОРД. По одному случаю ОРД было найдено для хромосом 1, 6, 7, 9, 10, 12, 20 и 22. 11 случаев было описано для хромосомы 15. У 8 пациентов с ОРД по хромосоме 15 был обнаружен СПВ, у 3 - СЭ. В одном из случаев ОРД по хромосоме 15 маркерная хромосома возникла из хромосомы Х. Суммарный анализ организации различных маркерных хромосом указывает на существование различных механизмов формирования сверхчисленных маркерных хромосом.
До разработки методов молекулярной цитогенетики из всех малых маркерных хромосом было возможно идентифицировать только i(18p). В остальных случаях просто констатировали факт существования маркерной хромосомы, иногда - с уточнением ее возникновения из одного из акроцентриков. Затем анализ состава альфоидной ДНК центромерного района маркерной хромосомы, FISH-исследование ДНК-проб, специфичных прицентромерным и прителомерным районам хромосом, и PRINS прицентромерных и теломерных последовательностей ДНК позволили определять их происхождение. CISS-гибридизация WCP c мета-фазными хромосомами пациента, включая 24-цветную FISH, и CGH открыли путь к анализу эухроматиновых районов маркерных хромосом. Их чувствительность и точность значительно увеличились в связи с использованием в диагностике метода микродиссекции метафазных хромосом и FISH клонированных фрагментов ДНК. В последних работах использовали высокоразрешающие чипы CGH или гибридизацию ДНК-проб маркерных хромосом с соответствующими микрочипами. При этом определение локализации точек разрыва, возникающих при образовании маркерной хромосомы, проводят с точностью, близкой к таковой методов молекулярной биологии.
Хромосомный анализ при экстракорпоральном оплодотворении
Одной из задач при проведении экстракорпорального оплодотворения (ЭКО) является выбор наиболее перспективных бластоцист, культивируемых in vitro. Еще относительно недавно в связи с жесткими временными рамками кариотипирование проводилось на стадии 8 бластомеров. Для этого выделялся 1 бластомер, из него готовили препарат, распластывая ядро на предметном стекле, и анализировали число копий 13, 18, 21-й, Х- и Y-хромосом. Выбор хромосом для анализа был обусловлен тем, что при анеуплоидии по этим хромосомам возможно рождение живого ребенка. Для оценки числа копий проводили FISH ДНК-проб, дающих в интерфазном ядре одиночные интенсивные сигналы на соответствующих хромосомах, которые могли быть надежно детектированы. В течение длительного времени такой анализ проводился в большинстве лабораторий мира при оценке качества бластоцист для их дальнейшего использования.
Однако уже в 1993 г. был выявлен хромосомный мозаицизм в преимплантационных эмбрионах. Было показано, что не все клетки эмбриона имеют один и тот же хромосомный состав (Delhanty et al., 1993). Многочисленные исследования, посвященные изучению этого вопроса, обнаружили высокую частоту мозаицизма. В разных исследованиях она варьировала от 15% (Harper et al., 1995) до 90% и более (Daphnis et al., 2005). Причем процент мозаиков зависел от числа хромосом, вовлеченных в анализ. Стало очевидно, что для оценки перспективности использования эмбриона необходимо проводить полное кариотипирование как минимум нескольких клеток. То есть анализ должен быть проведен на более поздних стадиях эмбриогенеза, и желательно определение числа копий всех хромосом человека. Соответствующие методы, позволяющие проводить такую диагностику, были разработаны.
В 1990 г. была показана возможность заморозки и последующей разморозки эмбриона, что открывало возможность его использования в последующих циклах реципиента. В 2009 г. была опубликована целая серия статей, в которых проводилось сравнение эффективности витрификации и медленной заморозки эмбриона. Была показана высокая эффективность витрификации и возможности забора клеток и ДНК эмбриона из его различных частей для проведения их кариотипи-рования.
Почти в это же время успешно создавались и совершенствовались технологии молекулярно-цитогенетического анализа, получившие название Сomprehensive Chromosome Screening (CCS). К ним относятся сравнительная геномная гибридизация на метафазных хромосомах и микрочипах, количественная ПЦР, анализ на микрочипах, базирующийся на анализе SNP, а также на анализе гаплотипов SNP (karyomapping). Кроме того, развитие методов массового параллельного секвени-рования позволило использовать эту технологию для проведения кариотипирова-ния индивидуальных клеток.
Более того, оказалось, что karyomapping позволяет не только проводить одновременный анализ всех 24 хромосом человека, но и, выявляя информативные локусы и анализируя гаплотипы родительских и прородительских хромосом в хромосомах «пациента», определять для каждой хромосомы ее состояние (моно-сомия, трисомия, норма) (http://dx.doi.org/10.1136/jmg.2009.069971).
Нужно отметить, что преимплантационная генетическая диагностика (PGD)/ преимплантационный генетический скрининг (PGS), применяемые уже более 25 лет, имели «врожденный» дефект: анализ хромосомных нарушений и диагностика моногенных заболеваний были несовместимы. Однако karyomapping позволяет путем сборки унаследованных хромосомных сегментов одновременно и проводить анализ хромосомных нарушений, и определять унаследованные родительские и прородительские гаплоблоки. Полученные результаты позволяют дать описание гомологичных хромосом, кроссинговера, наличия интересующего участка хромосомы, используя анализ сцепления, а также наряду с анализом хромосомных аномалий осуществить анализ наследования интересующих исследователя мутаций, отслеживая гетерозиготные SNP и определяя интересующие локусы. То есть karyomapping позволяет одновременно анализировать анеуплоидии, мозаицизм и индивидуальные гены, ответственные за развитие патологий; в 2018 г. около 1000 клиник по всему миру использовали эту технологию, опираясь на ~20 диагностических лабораторий. Технология использовалась в ~2500 случаях. Необходимо, однако, упомянуть, что этот подход не позволяет выявлять случаи постзиготической трисомии.
Оценивая эффективность описанной технологии, можно рассмотреть результаты анализа анеуплоидии в эмбрионах от родителей с моногенными заболеваниями и эффективность одновременного детального кариотипирования эмбрионов выявления генов, ответственных за развитие моногенных заболеваний при проведении PGD. В одном из исследований с ноября 2014 по апрель 2017 г. было проведено исследование эмбрионов от 36 пар - носителей генов моногенных заболеваний. Технология «Karyomap gene chip» была использована для анализа бластоцист, полученных от этих пар, и для выбора нормальных эмбрионов для дальнейшего использования. Всего выполнено 43 полных цикла PGD с кариотипированием и анализом индивидуальных генов. Получено 687 ооцитов и протестировано 186 бластоцист. В результате 175 бластоцист были охарактеризованы, 117 из 175 (66,8%) были отнесены к нормальным, или непатогенным (silent carriers), 58 из 175 (33,2%) - к анормальным, или патогенным. Выявлено 40 (22,9%) анеуплоидных эмбрионов. Среди эмбрионов, нормальных по моногенным заболеваниям, анеуплоидным был 31 (26,5%) эмбрион.
Пять лет назад при проведении PGD началось использование CCS на основе технологий секвенирования нового поколения. Уже опубликованы протоколы, основанные на массовом параллельном секвенировании, для скрининга анеуплоидии у преимплантированных эмбрионов человека. Одной из проблем использования этих технологий является то, что большинство реагентов, необходимых для проведения таких исследований, маркировано «for research use only», т.е. не может быть использовано при проведении диагностики. Все процедуры для нового варианта PGD должны быть протестированы на аналитическую чувствительность, специфичность, устойчивость, точность, на лимиты выявления, воспроизводимость, а также пройти необходимые процедуры лицензирования. Кроме того, для интерпретации данных и постановки диагноза требуется разработка новых критериев и определения соответствия аналитических результатов клиническим потребностям.
Хромосомы в интерфазном ядре
Длительное время хромосомы человека были доступны для прямого наблюдения только в митозе и мейозе. В ходе этих исследований сложились представления, что в митозе конденсация хромосом приводит к уменьшению их длины в несколько раз. Они верны, если уточнить, что меняется длина хромосом на цитологическом препарате, а не в клетке. Аккуратное сравнение размеров хромосомы в метафазе и G2 интерфазы показало, что значительных изменений не происходят, и едва ли стоит говорить об изменении длины хромосомы (рис. 4-12, см. цв. вклейку).
Если кратко описать пространственную организацию хромосом человека в интерфазе, то можно сказать, что каждая из них занимает в ядре свою территорию, которая не перекрывается с территориями других хромосом. Это утверждение верно для плеч хромосом и, в определенной степени, для хромосомных районов. Указания на существование отдельных хромосомных территорий возникли несколько десятилетий назад на основании данных по индукции хромосомных аберраций тонким лучом лазера. Затем были разработаны методы, позволяющие обнаруживать материал индивидуальной хромосомы непосредственно в интерфазном ядре. Чаще всего для этого используют 3D-FISH с последующей трехмерной микроскопией. Многочисленные эксперименты в этой области позволили обнаружить некоторые закономерности локализации хромосом в интерфазном ядре. Хромосомы, содержащие больше активно работающих генов, имеют тенденцию располагаться во внутреннем компартменте ядра, в отличие от хромосом, несущих больше транскрипционно неактивного материала. Тем не менее далеко не всегда в ядре просто выделить внутренний компартмент. Например, в плоских ядрах фибробластов большинство хромосомных территорий находится в контакте и с нижней, и с верхней ядерной мембраной. В связи с этим более правильно будет провести анализ локализации в ядре транскрипционно активного и транскрипционно неактивного хроматина.
Изучение локализации рано и поздно реплицирующейся ДНК показало, что в контакте с ядерной пластиной находится поздно реплицирующаяся ДНК, т.е. хроматин, не несущий активно работающих генов. Материал хромосом с активно работающими генами всегда находится на некотором расстоянии от ядерной ламины. Обобщая гипотезы, рассматривающие пространственную организацию хромосом в качестве фактора, участвующего в регуляции транскрипционной активности генов, можно сказать, что транскрипционно активный материал должен располагаться в той части хромосомной территории, где он доступен для ферментов, осуществляющих транскрипцию и сплайсинг. Очевидно, что такие условия существуют на границе хромосомной территории и в ее приграничной части, характеризующейся низкой степенью компактизации хроматина. Результаты определения положения активных и неактивных генов в хромосомных территориях хорошо согласуются с такими представлениями о локализации активно работающих генов у поверхности интерфазной хромосомы. Логичным следствием, вытекающим из этого правила, служит предположение о более высокой концентрации таких генов в терминальных районах хромосом и микрохромосомах. Именно такое увеличение числа генов показано в Т-бэндах хромосом человека. В норме микрохромосомы у человека отсутствуют. Они характерны для кариотипов птиц, и именно там находится ДНК, гомологичная ДНК Т-бэндов хромосом человека. Организация хромосомы в интерфазе имеет еще ряд особенностей, связанных с локализацией транскрипционно активного и транскрипционно неактивного хроматина. ДНК С-позитивных районов хромосом обычно находится в контакте с ядерной оболочкой, G-бэндов - либо в контакте с оболочкой ядра, либо с инвагинациями ядерной ламины, либо располагается на границе ядрышка (рис. 4-13, см. цв. вклейку). ДНК R-бэндов локализована на некотором расстоянии от этих структур.
Сегодня рассмотрение вопросов об организации интерфазного ядра невозможно без использования таких понятий, как хромосомная территория и меж-хроматиновое пространство. Именно поэтому стоит подробнее рассмотреть, что означают эти термины. Простое заключение о том, что, так как материал разных хромосом в ядре не перемешан, пространство, которое занимает хромосома, считают хромосомной территорией, а пространство, свободное от него, - межхроматиновым пространством, оказывается не совсем верным. Существует различие между семантическим определением и тем, что имеют в виду современные биологи, используя эти термины. Термин «хромосомная территория» сегодня относят к той части интерфазного ядра, которая окрашивается 3D-FISH хромосомоспецифичной ДНК-пробой. Рассмотрение этого определения приводит к двум выводам:
Это наглядно продемонстрировали исследования по локализации в интерфазном ядре конкретных фрагментов ДНК из короткого плеча хромосомы 11 человека. Часть ДНК, как и следовало ожидать, оказалась в пределах территории 11р, определенной по результатам 3D-FISH соответствующей ДНК-пробы, но часть располагалась за ее пределами (рис. 4-14, см. цв. вклейку). Объяснить эти результаты очень просто: отдельная петля ДНК в интерфазном ядре не может быть обнаружена, если для 3D-FISH используют хромосомоспецифичную ДНК-пробу, в то время как ДНК-проба, приготовленная на базе клонированного фрагмента ДНК, в интерфазном ядре дает четкий сигнал.
Таким образом, из хромосомных территорий в межхроматиновое пространство выходят отдельные петли ДНК. Показано, что их размер может достигать нескольких миллионов пар оснований. В состав ДНК такой петли входят гены, часть которых активно транскрибируется. Уходя за пределы хромосомной территории в межхроматиновое пространство, они попадают в идеальные условия для взаимодействия с ферментами транскрипции и сплайсинга. Именно здесь находятся макромолекулярные комплексы, обеспечивающие синтез новой иРНК. Есть еще одно большое преимущество такого синтеза в межхроматиновом пространстве - служит не только местом локализации таких фабрик синтеза иРНК, но может функционировать и в качестве магистральных путепроводов, позволяющих генным продуктам быстро добраться до оболочки ядра, а затем через ядерную пору перейти в цитоплазму, где они будут использованы по прямому назначению. Петер Фрезер предложил называть такие макромолекулярные комплексы «фабриками транскрипции». Было показано, что одна такая «фабрика» может одновременно работать с ДНК из разных районов одной хромосомы или разных хромосом (рис. 4-13, см. цв. вклейку), причем расстояние между генами, локализованными в одной хромосоме, может превышать 20 млн п.н.
Районы хромосом, материал которых локализован на периферии хромосомных территорий или в межхроматиновом пространстве, - места локализации функционально активных генов. Подобное их расположение не обеспечивает включение гена, но дает шанс на это. Правдоподобно выглядит гипотеза о том, что при дифференцировке клеток формируется необходимый вариант пространственной организации хромосомных территорий, определяющий спектр генов, которые могут быть допущены к работе. Окончательная настройка и определение того, какие из этих генов будут активными, зависит от других, привычных для молекулярного биолога механизмов. Возможно, для полного описания структурно-функциональной организации хромосомы ее рассмотрения даже в четырехмерном пространстве (трехмерное пространство + время) окажется недостаточно. Значение имеет и отдаленная история хромосомы, выражающаяся в импринтинге соответствующих хромосомных районов. При абсолютно идентичных геномах (с точки зрения нуклеотидных последовательностей) возможно возникновение различных нарушений в развитии их обладателей. Примером может служить небольшая делеция в проксимальном районе длинного плеча хромосомы 15 человека, которая приводит либо к СПВ, либо к СЭ.
Хромосомы в клеточном цикле
Клеточный цикл включает четыре фазы: G1, S, G2 и М. G1-фаза - интервал между митозом и началом репликации ДНК. Для нее характерны высокая метаболическая активность и увеличение размера клетки. В S-фазе происходит основная репликация ДНК. G2 - фаза подготовки к митозу, продолжения синтеза белков и роста клетки. В М-фазе происходят непосредственная подготовка и собственно деление клетки. Митоз включает начальную стадию конденсации хроматина (профаза), ее продолжение, разборку ядерной оболочки, начало формирования клеточного веретена и прикрепления микротрубочек к кинетохорам хромосом (прометафаза), выстраивание хромосом в экваториальной части клетки, завершение прикрепления микротрубочек к кинетохорам хромосом (метафаза), расхождение сестринских хроматид (анафаза), формирование ядерных оболочек и цитокинез, что обеспечивает деление клетки (телофаза). Клетка может выйти из этого цикла и надолго задержаться в G0-фазе. Возвращение в клеточный цикл и последующий переход в в S-фазу требуют прохождения R-точки (restriction point). Это событие зависит в основном от присутствия в окружении клетки специальных индукторов - факторов роста. Например, фибробласты кожи могут выйти из стадии покоя под действием тромбоцитарного фактора роста (PDGF), образующегося в зоне повреждения кожи при свертывании крови.
Регуляцию клеточного цикла в основном осуществляют циклинзависимые киназы (Cdk) и циклины. У человека Cdk1, Cdk2, Cdk4 и Cdk6 непосредственно участвуют в регуляции клеточного цикла, поэтому их называют Cdk-активирующими киназами. Сdk - каталитические субъединицы протеинового комплекса. Для их активации требуется присутствие соответствующих циклинов. Регуляция активности Сdk происходит путем изменения количества в определенные фазы клеточного цикла. В активной форме комплексы циклин-Cdk фосфорилируют регуляторные белки, контролирующие течение этой фазы.
Чтобы обеспечить надежную передачу генетической информации дочерним клеткам, в процессе участвует целый набор контролирующих механизмов, определяющих прохождение клетки через контрольные точки клеточного цикла (checkpoints - сверочные точки). Такая система контроля предотвращает размножение клеток, в которых произошли или могут произойти хромосомные нарушения, вследствие чего клетка не готова к корректному прохождению очередного этапа. В настоящее время описаны четыре контрольные точки во всех фазах клеточного цикла.
Поскольку основное требование к клетке для перехода в S-фазу - целостность ее ДНК, то в контрольной точке в G1 происходит проверка интактности ДНК. Показано, что клетки, подвергшиеся воздействиям, вызывающим разрывы ДНК, останавливаются в G1. Вход в S-фазу для них запрещен, так как до того, как начнется репликация ДНК, должна завершиться репарация всех имеющихся к этому моменту повреждений. Необходимо отметить, что остановку в фазе G1 вызывают не только повреждения ДНК, но и другие нарушения, в дальнейшем приводящие к нарушению числа хромосом и образованию микроядер. Остановка в G1 может быть как временной (до момента решения возникшей проблемы), так и необратимой. В контрольной точке в S-фазе проверяются правильность и полнота репликации ДНК. Клетка может задержаться в S-фазе, например, при снижении эффективности репликации в результате недостатка предшественников синтеза ДНК. В контрольной точке в G2-фазе клеточного цикла также идет проверка ДНК на интактность, но, кроме этого, оценивается и завершенность ее репликации. Клетки, в которых репликация не завершена, не могут войти в митоз. Контрольная точка сборки веретена деления обеспечивает прикрепление всех кинетохоров к микротрубочкам веретена. До завершения этого процесса клетка остается в метафазе. Контроль осуществляется по присутствию в клетках кинетохоров, не прикрепленных к микротрубочкам веретена. В экспериментах, в ходе которых лучом лазера разрушали такие кинетохоры, клетки переходили из метафазы в анафазу, что приводило к отставанию хромосом и формированию микроядер. Основную роль в контроле перехода клетки из метафазы в анафазу играют изменения во взаимодействии белков BUB1, BUBR1, MAD1 и MAD2, ассоциированных с кинетохорами. Задержка клетки в контрольных точках дает ей возможность завершить репарацию ДНК, ее репликацию или обеспечить нормальное прохождение клеточного деления. Если клетке не удается завершить необходимые для прохождения контрольной точки процессы и устранить существующие нарушения, то включается механизм программируемой клеточной гибели - апоптоз.
В случае успешного прохождения всех контрольных точек хромосомы демонстрируют удивительное постоянство своей организации и положения относительно друг друга. Даже миграция в экваториальную часть клетки в метафазе и последующее расхождение в дочерние клетки не приводят к их глобальному перемешиванию в новом ядре, хотя некоторые изменения все-таки происходят. В клеточном цикле также происходит некоторая трансформация пространственной организации индивидуальных хромосом, причем она связана не только с их компактизацией в митозе. Как было упомянуто выше, в интерфазной хромосоме хроматин рано реплицирующихся и транскрипционно активных районов хромосом тяготеет к межхроматиновому пространству и внутреннему компартменту ядра, тогда как хроматин поздно реплицирующихся и транскрипционно неактивных районов локализован преимущественно у ядерной оболочки, инвагинаций ядерной пластины и на границе ядрышка. Таким образом, относительно своей оси хромосома организована несимметрично. Можно сказать, что в сферических ядрах на хромосомной территории материал С- и G-бэндов локализуется у ядерной оболочки, далее располагается материал R-бэндов, а еще дальше в межхрома-тиновое пространство выходит наиболее активно транскрибируемый материал.
Такое распределение материала хромосомы в ядре может нарушаться в S-фазе, когда происходит репликация ДНК С- и G-бэндов. Перемещение материала хромосомного района, связанного с репликацией его ДНК, было наглядно продемонстрировано на клетках китайского хомячка. Ганг Ли и соавт. удалось проследить за положением в ядре 90 млн п.н. гетерохроматинового района на протяжении всего клеточного цикла. Большую часть времени в интерфазе этот район хромосомы находился на периферии ядра рядом с ядерной мембраной. Лишь на время репликации ДНК он перемещался во внутренний компартмент ядра, и в это же время происходила деконденсация его хроматина. После завершения репликации ДНК хроматин этого района опять становился компактно организованным и возвращался на периферию ядра. Происходят ли подобные перемещения материала нормальных С- и G-бэндов, неизвестно, но с уверенностью можно сказать, что во время репликации их ДНК степень компактизации хроматина уменьшается.
Репликация ДНК в хромосомах человека, как и у других высших эукариот, начинается сразу во множестве мест. В них формируется протеиновый комплекс (ORC - origin recognition complex), что приводит к формированию репликатив-ного комплекса. Происходит это следующим образом. Два дополнительных протеина (Cdc6p и Cdt1p) и сложный протеиновый комплекс MCM2-7 связываются с ORC, формируя пререпликативный комплекс (pre-RC). Его созревание происходит после привлечения дополнительных факторов, включая Cdc45 и Sld3. Затем подключаются ДНК-полимеразы, и начинается синтез нитей ДНК, который протекает в двух направлениях. Этот процесс запускается соответствующей комбинацией Cdk и циклина. Кроме инициации репликации, циклинзависимые киназы ингибируют начало повторной репликации участка ДНК, предотвращая формирование нового pre-RC. После репликации ДНК сестринские хроматиды плотно удерживаются друг с другом, вплоть до расхождения в митозе. Этот феномен, называемый когезией сестринских хроматид, осуществляет когезиновый комплекс протеинов.
Когезин содержит основной комплекс гетеродимеров, состоящий из двух протеинов семейства SMC (Structural Maintenance of Chromosomes): Smc1 и Smc3. SMC-протеины оказались очень консервативным семейством. У прокариот был обнаружен только один SMC-протеин, тогда как у эукариот их было найдено 6 (SMC1-SMC6). Вступая во взаимодействия с другими протеинами, они участвуют в самых разных процессах в хромосомах. SMC-протеины состоят из 1000-1500 аминокислот и имеют на N- и С-конце глобулярные домены. N-конец содержит мотив Walker A, С-конец - Walker B. Соединяясь вместе, они формируют сайт с АТФ азнойкаталитической активностью. Взаимодействие Smc1 и Smc3 происходит через петлевой домен. Этот димер через свои глобулярные домены связывается с протеином Scc1, который соединен с четвертой субъединицей когезина Scc3. Сформированный таким образом когезиновый комплекс связан либо с нереплицированной хроматидой (от телофазы до момента репликации ДНК), либо с сестринскими хроматидами (от момента репликации ДНК до разделения ДНК хроматид в митозе, когда протеолиз открывает кольцо, позволяя ДНК сестринских хроматид разойтись).
На рис. 4-15 и 4-16 (см. цв. вклейку) приведены гипотетические модели организации когезина и его связи с ДНК. Когезин принимает участие в работе контрольной точки, определяющей переход клетки в S-фазу. В ней происходит проверка целостности ДНК. Так, ее повреждение при облучении активирует ATM-киназу, которая фосфорилирует SMC1 в когезине, что приводит к формированию нового комплекса, отличающегося от когезина присутствием в нем протеинов NBS1, BLM и BRCA1. Последние связаны с ответом на повреждение ДНК (рис. 4-17, см. цв. вклейку). Фосфорилирование SMC1 в когезине - принципиальный момент для запуска механизма контрольной точки, которая задерживает репликацию ДНК до завершения репарации возникших повреждений.
Другой интригующий момент реорганизации хромосом в клеточном цикле - разделение материала сестринских хроматид и формирование типичных метафазных хромосом. Для этого необходимы освобождение сестринских хроматид от когезина и решение топологических проблем в локализации их ДНК. В профазе основная часть когезина удаляется его фосфорилированием Polo-подобной киназой, которое, вероятно, снижает аффинность когезина к ДНК. На хромосоме его остается около 5% с преимущественной локализацией в прицентромерном районе. Этот когезин участвует как в удержании вместе сестринских хроматид, так и в биполярной ориентации хромосом. После прикрепления всех кинетохор к веретену посредством деградации циклина В запускается переход к анафазе. Освобождение от остатков когезина происходит в результате расщепления сепаразой Scc1. До начала анафазы вследствие связи с секурином она остается неактивной (рис. 4-18, см. цв. вклейку).
Решение топологических проблем связано с компактизацией материала индивидуальных хроматид. Выяснение механизма этого процесса шло одновременно с изучением роли негистоновых протеинов в поддержании структурно-функциональной организации хромосомы. Хромосома приблизительно на треть состоит из нуклеиновых кислот, на треть - из гистонов и на треть - из негистоновых протеинов. Эксперименты по количественному удалению из хромосомы гистонов показали, что именно негистоновые протеины ответственны за структурную организацию митотических хромосом. Она представлена каркасом и отходящими от него петлями ДНК. Выделяют два основных компонента хромосомного каркаса, получивших название ScI- и ScII-протеины. ScI был идентифицирован как топоизомераза II, а ScII оказался членом семейства SMC-протеинов. Белки хромосомного каркаса - SMC2 и SMC4. Проведенные исследования показали, что функционально активен комплекс, включающий, кроме SMC2/SMC4, еще три протеина (CAP-D2, CAP-H, CAP-G), не относящиеся к семейству SMC. Он способен поддерживать конденсированное состояние хроматина и был назван конденсином (конденсином I). Позже у позвоночных был открыт второй комплекс конденсина (конденсин II). В его состав входят те же SMC2/SMC4, а также CAP-D3, CAP-H2 и CAP-G2. Гипотетическая модель организации конденсиновых комплексов приведена на рис. 4-18. Анализ взаимодействия конденсина с ДНК показал, что он вызывает ее суперспирализацию, а в присутствии топоизомеразы II формируются хиральные узелки. В настоящее время предложено несколько моделей взаимодействия конденсина с молекулами ДНК (см. рис. 4-18), суть которых заключается либо в суперспирализации ДНК, либо в формировании ее специфического сворачивания.
Детальный анализ локализации конденсина I и конденсина II показал, что в интерфазе первый локализуется преимущественно в цитоплазме, а второй - в ядре. Взаимодействие конденсина I с хромосомным материалом становится возможным только после разборки ядерной оболочки. Начиная с метафазы, комплексы конденсина I и II располагаются вдоль оси хромосом, вероятно, сменяя один другого. Хромосомным районом, в котором явно преобладает конденсин II, считают район центромеры. Недостаток конденсина приводит к нарушению структурно-функциональной организации кинетохора и, как следствие, к нарушениям расхождения хромосом. До настоящего времени широко распространено представление, что когезин связан с ДНК хромосом с телофазы до метафазы, обеспечивая когезию сестринских хроматид. С начала прометафазы он начинает вытеснять когезин, приводя к компактизации хроматина. Ранее считали, что сохранения связи его небольшого количества с ДНК сестринских хроматид, вплоть до метафазы, достаточно для удержания рядом в основном сформированных хроматид. Лишь после расщепления сепаразой Scc1 хроматиды оказывались полностью свободными и могли быть разведены в дочерние клетки. Открытие конденсина II заставляет частично пересмотреть эти представления. Он присутствует в интерфазном ядре и, возможно, участвует в частичной компактизации неактивного хроматина уже в интерфазе. В профазе количество конденсина II, связанного с хроматином, должно возрастать, что позволяет при фиксации клеток на этой стадии видеть неоднородно окрашенное ядро с многочисленными точечными вкраплениями более ярко окрашенного материала, а профазные хромосомы - с компактно расположенными G-позитивными суббэндами. После разборки ядерной оболочки хроматин становится доступным конденсину I, и в результате его взаимодействия с ДНК начинаются активное вытеснение когезина и компактизация хроматина. Последняя - следствие изменения конформации ДНК в результате суперспирализации и формирования хиральных узелков. Возможно, конденсины имеют большее сродство к АТ-обогащенной ДНК, что определяет порядок компактизации ДНК элементарных структурных элементов хромосомы и последовательное формирование прометафазных, ранних метафазных и поздних метафазных хромосом, отличающихся по степени компактизации их индивидуальных участков. К сожалению, динамика связи конденсинов с различными районами хромосом пока не изучена, и вышеизложенный механизм формирования метафазной хромосомы остается гипотетическим. Результаты некоторых исследований указывают, что конденсины необходимы для поддержания конформации компактного хроматина, но сама компактизация может происходить и без их участия. Насколько это справедливо и существуют ли другие факторы, необходимые для перехода интерфазной хромосомы в метафазную, предстоит выяснить в будущем.
Хромосомы IN VIVO, IN VITRO и IN SILICO
Отдельный интерес представляет сравнение результатов исследований хромосом непосредственно в живой клетке, предварительно фиксированных и хромосом in silico. Характерно, что во всех типах исследований хромосому удается представить в виде набора структурно-функциональных единиц. Теломерные, центромерные и районы ядрышкового организатора уже были рассмотрены выше. В настоящем разделе будут подробнее проанализированы эухроматиновые районы хромосом. Важный момент в формировании представлений о принципах организации хромосом человека - определение ее базовых элементов. При попытках установления размера такого элемента учитывали самые разные параметры: дифференциальное окрашивание хромосомных районов, время их репликации, соотношение АТ- и ГЦ-пар, обогащение различными типами повторов, концентрацию и состав генов, а также организацию хроматина. В результате исследований было показано, что размер такой единицы близок к млн п.н., а хромосому можно представить как их последовательность. В ряде работ по изучению структурно-функциональной организации хромосомы для этого базового элемента используют термин «1 млн п.н. субструктура». Эти элементы имеют общую регуляцию репликации, степень конденсации хроматина и, как следствие, некий общий уровень организации, определяющий возможности транскрипционной активности генов, входящих в их состав.
Секвенирование генома человека открыло возможности контекстного анализа последовательности нуклеотидов в различных районах хромосом. Казалось бы, надо только взять известную последовательность нуклеотидов, определить границы, разделяющие ДНК R- и G-бэндов, и in silico будет получен вариант чередования R- и G-бэндов в анализируемой хромосоме. Исследования были проведены, и полученные данные наглядно показали, что хромосома, построенная in silico, при использовании простых критериев обогащенности ДНК ГЦ-парами имеет очень мало общего с хромосомой in vitro. На рис. 4-19 (см. цв. вклейку) приведены результаты такого анализа, выполненного для хромосом человека 21 и 22.
Несмотря на тенденции обогащения R-бэндов ГЦ-парами и короткими диспергированными повторами, представленные данные едва ли можно считать убедительным подтверждением распространенных представлений об АТ/ГЦ-составе ДНК R- и G-бэндов. Такое несоответствие можно объяснить несколькими причинами. Одна из них заключается в далеко не полном соответствии R- и G-бэндов на схеме хромосомы и данных по секвенированию ДНК. Тем не менее оказалось, что даже этой информации достаточно, чтобы на основании результатов секвенирования построить схему расположения R- и G-бэндов внутри хромосомы. Для этого потребовалось правильно сформулировать критерии для определения ГЦ-богатых участков хромосом. Попытки определить пограничное значение процента ГЦ-пар для всех R- и G-бэндов хромосомы не дали положительного результата.
Схемы R- и G-бэндов, полученные на основании анализа процента ГЦ-пар, совпали с таковыми из номенклатуры хромосом человека, когда обогащенность ГЦ-парами оценивали относительно соседних районов. Процент ГЦ-пар определяли для участка хромосомы размером 2,5 млн п.н. и сравнивали с относительным числом ГЦ-пар в участке размером 9,3 млн п.н., внутри которого он находится. На рис. 4-19 черная линия показывает процент ГЦ-пар в участке 2,5 млн п.н., а красная линия - в участке 9,3 млн п.н. При построении графиков центр этих районов перемещали с шагом 10 т.п.н. Районы, в которых процент ГЦ-пар в участке 2,5 млн п.н. был выше, чем в участках размером 9,3 млн п.н., считали ГЦ-богатыми и относили к R-бэндам. Районы, в которых процент ГЦ-пар для участка 2,5 млн п.н. был ниже, чем для участков размером 9,3 Мb, считали ГЦ-бедными и относили к G-бэндам. В этом случае in silico окраска хромосом совпадала со схемами, основанными на результатах дифференциального окрашивания (см. рис. 4-19). Вероятно, необходимо объяснить выбор исследователями районов размерами 2,5 млн п.н. и 9,3 млн п.н. Он объясняется достаточно просто: сравнение окраски хромосом in silico проводили с идиограммой хромосом человека, содержащей 750 бэндов. Таким образом, средний размер бэнда близок к 4 МЬ. В этом случае анализ участков размером 2,5 млн п.н. должен давать достаточно хорошее представление о среднем значении процента ГЦ-пар в отдельных бэндах, а участок размером 9,3 млн п.н. должен включать, кроме этого бэнда, либо соседний бэнд, либо большие участки двух соседних бэндов. Такой анализ, по мнению авторов, позволяет провести сравнение ГЦ-состава в соседних бэндах. Вывод: важна не просто степень обогащения бэнда ГЦ-парами, а обогащение относительно соседних районов. Авторы полагают, что их данные достаточно хорошо согласуются с очень популярной гипотезой организации метафазной хромосомы, предложенной Saitoh и Laemmli в 1994 г.
В 1994 г. с помощью специфического окрашивания им удалось обнаружить последовательно расположенные матрикс/скэфолд-ассоциированные районы (MAR/SAR) в метафазной хромосоме индийского мунджака. В результате такой обработки было показано, что существует чередование районов, в которых MAR/ SAR формируют спираль и расположены почти параллельно оси хромосомы. На основании этого была предложена модель, в которой G-бэнды представляют районы хромосом с плотно упакованным хроматином, расположением MAR/SAR по спирали и уменьшенным размером петель 30 нм хроматина (рис. 4-20), в то время как в R-бэндах петли хроматина больше по размеру, а MAR/SAR расположены в линию практически параллельно оси хромосомы. Таким образом, плотность материала хромосомы в G-бэндах выше, чем в R-бэндах.
Известно, что MAR/SAR, несмотря на отсутствие конкретного мотива в их последовательностях, обогащены АТ-парами (около 70%), поэтому можно ожидать существования связи между ГЦ/АТ-составом ДНК хромосомных районов и обнаружением G- и R-бэндов в митотической хромосоме. Многие факты, касающиеся организации хромосомы, согласуются с этой гипотезой, рассматриваемой в качестве наиболее правдоподобной в большинстве учебников и монографий. К сожалению, всю сложную картину структурно-функциональной организации хромосомы и формирования ее имиджа на цитологическом препарате едва ли возможно объяснить в рамках таких простых представлений. Даже в самой работе Saitoh и Laemmli (1994) участки хромосомы индийского мунджака, в которых MAR/SAR располагались почти параллельно оси хромосомы и были рассмотрены в качестве R-бэндов, вероятно, соответствовали местам эволюционных слияний предковых хромосом, которые привели к образованию огромных хромосом у индийского мунджака.
Эффективность анализа хромосомных районов in silico во многом зависит от того, насколько точно можно отнести определенные последовательности нуклеотидов к конкретным элементам структурно-функциональной организации хромосомы. Многочисленные данные указывают на то, что размер базового элемента хромосомы близок к 1 млн п.н., в то время как точность локализации конкретного района или события на препаратах митотических хромосом значительно превышает эту величину. Тем не менее результаты некоторых исследований позволяют провести детальное сравнение индивидуальных соседних бэндов и пограничного района. Это можно сделать на примере района хромосомы, прилежащего к гену NF1. На рис. 4-21 представлены результаты исследования Клаудии Шмегнер и соавт., показывающие процент ГЦ-пар на участке хромосомы человека размером 500 т.п.н., в состав которого входит ген NF1. Этот район хромосом человека представляет часть G-бэнда, переходную зону и часть R-бэнда. Часть G-бэнда соответствует ГЦ обедненной ДНК, а часть R-бэнда - ГЦ богатой ДНК, а переходная зона размещается в участке размером 5 т.п.н. Доказательство того, что переход от ГЦ бедной к ГЦ богатой ДНК служит границей между G- и R-бэндами, было получено в тщательно выполненных экспериментах, показавших, что именно в этом месте происходит задержка репликации ДНК. Действительно, можно считать доказанным, что по крайней мере некоторые соседние G- и R-бэнды отличаются по содержанию АТ-и ГЦ-пар. Исследование Клаудии Шмегнер и соавт. наглядно показало, что в настоящее время можно провести корректное сравнение структурно-функциональной организации конкретного выбранного района на всех уровнях - in vivo, in vitro и in silico. К сожалению, такой район составляет менее 1/10 000 гаплоидного генома человека и около 1/100 самой маленькой хромосомы. Именно поэтому еще предстоит пройти большой путь от гипотез, описывающих структурно-функциональную организацию хромосомы, до надежной теории, без которой секвенирование даже 100 000 персональных геномов человека не даст завершенной картины и оставит множество острых вопросов, стоящих перед медицинской генетикой, открытыми.
Список литературы
-
Антоненко В.Г., Шилова Н.В. О новой версии Международной системы цитогене-тической номенклатуры ISCN-2016 // Медицинская генетика. 2018. Т. 17, № 6. С. 11-17.
-
Баранов В.С., Кузнецова Т.В. Цитогенетика эмбрионального развития человека: Научно-практические аспекты. М., 2007. 640 с.
-
Бочков Н.П., Пузырев В.П., Смирнихина С.А. Клиническая генетика. М.: ГЭОТАР-Медиа, 2011. 544 с.
-
Ворсанова С.Г., Юров И.Ю., Соловьев И.В., Юров Ю.Б. Гетерохроматированные районы хромосом человека: клинико-биологические аспекты. М.: Медпрактика, 2008. 300 с.
-
Ворсанова С.Г., Юров Ю.Б., Чернышов В.Н. Медицинская цитогенетика. М.: Медпрактика, 2006. 300 с.
-
Гинтер Е.К. Медицинская генетика. М.: Медицина, 2003. 1997 с.
-
Ридли М. Геном: автобиография вида в 23 главах. М.: Эксмо, 2008. 432 с.
-
Рубцов Н.Б. Методы работы с хромосомами млекопитающих. Федеральное агентство по образованию, Новосибирский государственный университет, Институт цитологии и генетики СО РАН. Новосибирск, 2006. С. 1-147.
-
Рубцов Н.Б. Хромосомы человека: описание хромосомных патологий. Учебное пособие. Федеральное агентство по образованию, Новосибирский государственный университет, 2006.
-
Рубцов Н.Б., Карамышева Т.В., Матвеева В.Г. и др. Обратная in situ гибридизация ДНК-зондов аномальных хромосом в диагностике хромосомных патологий // Генетика. 2001. № 11. С. 1545-1552.
-
Фогель Ф., Мотульски А. Генетика человека: история хромосомы человека, формальная генетика. М.: Мир, 1989.
-
Bain B.J. The role of cytogenetics in the assessment of haematological disorders / Human Cytogenetics. Vol. II. Malignancy and acquired abnormalities. A practical approach. Oxford; New York; Tokyo: Oxford University Press, 1992. P. 121-154.
-
ISCN 2016 - An International System for Human Cytogenomic Nomenclature / Ed. McGovan-Jordan J., Simons A., Schmid M.K. 2016.
-
Fluorescence In Situ Hybridization (FISH) Application Guide. Berlin;Heidelberg: Springer-Verlag, 2009.
-
Graf M.D., Schwartz S. Molecular approaches for delineating marker chromosomes // Methods Mol. Biol. 2002. Vol. 204. P. 211-218.
-
Miller K., Madan K. The new ISCN 2016. // European Cytogeneticsts Association Newletter. 2016. Vol. 38. P. 15-17
-
Shaffer L.G., Slovak M.L., Campbell L.J. ISCN 2009 An International System for Human Cytogenetic Nomenclature (2009). Recommendations of the International Standing Committee on Human Cytogenetic Nomenclature. 2009. Published in collaboration with «Cytogenetic and Genome Research».
-
Shaffer L.G., Lupski J.R. Molecular mechanisms for constitutional chromosomal rearrangements in humans // Annu Rev. Genet. 2000. Vol. 34. P. 297-329.