Неонатология. Клинические рекомендации / под ред. Н. Н. Володина, Д. Н. Дегтярева, Д. С. Крючко. - Москва : ГЭОТАР-Медиа, 2021. - 320 с. - ISBN 978-5-9704-6213-3. |
Аннотация
Книга содержит клинические рекомендации по наиболее распространенным в неонатальной практике заболеваниям новорожденных, подготовленные ведущими специалистами Российского общества неонатологов и Российской ассоциации специалистов перинатальной медицины. В издании рассмотрены эпидемиология, патогенез, клиническая картина, классификация, современные методы диагностики и дифференциальной диагностики, а также подходы к медикаментозному и немедикаментозному лечению гемолитической и геморрагической болезней новорожденных, непрямой гипербилирубинемии, врожденной пневмонии, инвазивного кандидоза, мекониальной аспирации, открытого артериального протока у недоношенных. Подробно изложены также технологии парентерального питания, энтерального вскармливания и терапевтической гипотермии новорожденных. В разделе "В помощь практическому врачу" приведены методические рекомендации по профилактике и контролю госпитальной инфекции и по оказанию базовой помощи и организации грудного вскармливания в перинатальном центре. Соблюдение международной методологии, использование современных литературных источников в подготовке данного издания гарантируют его актуальность, достоверность и обобщение лучшего мирового опыта и знаний.
Клинические рекомендации по неонатологии предназначены практикующим врачам-неонатологам, педиатрам, терапевтам, врачам других специальностей, а также студентам старших курсов медицинских вузов.
Синдром аспирации мекония у новорожденных
Согласовано и утверждено Российским обществом неонатологов и Российской ассоциацией специалистов перинатальной медицины
Авторы: Буров А.А., Дегтярев Д.Н., Иванов Д.О., Карпова А.Л., Ли А.Г., Мерзликина С.С., Межинский С.С., Мостовой А.В. (модератор рабочей группы), Петренко Ю.В., Сапун О.И., Шабалов Н.П.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Синдром аспирации мекония (САМ) - дыхательное расстройство, обусловленное попаданием мекония вместе с околоплодными водами в дыхательные пути ребенка до родов или в момент рождения.
Синдром утечки воздуха - тяжелое состояние новорожденных, характеризующееся повреждением воздухоносных путей и альвеол с последующим выходом из них воздуха, распространением перибронхиально и накоплением в полостях и тканях организма.
ПЛГН - симптомокомплекс, развивающийся при широком круге легочных, внелегочных и кардиальных патологических состояний (при структурно нормальном сердце). При этом высокая сопротивляемость легочных сосудов и нарушенная реактивность легочной артериальной сети вызывают право-левое шунтирование крови через ОАП и/или овальное окно, приводящее к развитию системной гипоксемии.
Переношенный ребенок - ребенок, родившийся в срок беременности 42 полные недели или более (294 дня или более).
КРАТКАЯ ИНФОРМАЦИЯ
Определение
Синдром аспирации мекония (САМ) - дыхательное расстройство, обусловленное попаданием мекония вместе с околоплодными водами в дыхательные пути ребенка до родов или в момент рождения [1].
Синоним - синдром мекониальной аспирации у новорожденных.
Этиология и патогенез
САМ чаще наблюдается у переношенных или доношенных новорожденных. Аспирация содержащих меконий околоплодных вод может возникнуть до родов или в момент рождения. Редко наблюдается выход мекония в околоплодные воды до полных 34 нед [2]. Появление мекония в околоплодных водах - результат стимуляции созревающего кишечника вследствие гипоксического стресса. У почти доношенного плода кишечник достаточно зрелый, и вагусная стимуляция от головного мозга при компрессии пуповины или других состояниях, сопровождающихся гипоксией, может вызвать перистальтику и релаксацию ректального сфинктера, приводя к пассажу мекония. Меконий, попадая в околоплодные воды, уменьшает их антибактериальную активность и впоследствии увеличивает риск перинатальной бактериальной инфекции. Однако самое тяжелое осложнение пассажа мекония, возникшего внутриутробно, - аспирация загрязненных меконием околоплодных вод. Аспирация мекониальными водами может возникнуть, если у плода на фоне прогрессирующей гипоксии развивается дистресс, приводящий к возникновению паттерна гаспинг-дыхания. Аспирация вызывает гипоксию после рождения за счет четырех легочных эффектов: обструкции дыхательных путей, дисфункции сурфактанта, химического пневмонита, легочной гипертензии [3].
-
Обструкция дыхательных путей. Полная обструкция дыхательных путей меконием приводит к ателектазам. Частичная обструкция вызывает задержку газа (воздушные ловушки) и перерастяжение альвеол. Это часто называют клапанным эффектом. Газ воздушных ловушек (перерастягивая легкое) может вызывать повреждение легкого с выходом в плевральную полость (пневмоторакс), средостение (пневмомедиастинум) или перикард (пневмоперикард) [4].
-
Вторичный дефицит сурфактанта. Меконий деактивирует сурфактант и может угнетать синтез сурфактанта [5, 6]. Некоторые компоненты мекония, особенно свободные жирные кислоты (пальмовая, стеариновая, олеиновая), имеют минимальное поверхностное натяжение выше сурфактанта, в результате чего уменьшается альвеолярная поверхность, вызывая диффузные ателектазы [7].
-
Аспирационный пневмонит. Энзимы, желчные соли и свободные жирные кислоты мекония раздражают дыхательные пути и паренхиму, способствуя выбросу цитокинов, которые вызывают диффузный пневмонит. Развитие асептического воспалительного процесса в респираторном отделе легких возможно через несколько часов после аспирации.
Все эти легочные эффекты могут вызвать серьезные нарушения перфузионно-вентиляционных отношений и привести к развитию ПЛГН.
У части детей через 48-72 ч после рождения САМ осложняется развитием аспирационной пневмонии.
Эпидемиология
Околоплодные воды могут быть окрашены меконием в 8-20% всех родов [1, 2, 8, 9], причем после полных 42 нед частота достигает 23-52% [10, 11]. У 2-9% новорожденных, у которых околоплодные воды были окрашены меконием, развивается клиническая картина САМ [2, 12, 13]. Около 1/3 новорожденных с САМ требуют интубации трахеи и механической вентиляции легких [13]. Летальность при САМ в связи с тяжелыми повреждениями паренхимы легких и развитием легочной гипертен-зии может достигать 20%. Другие осложнения, включая синдром утечки воздуха, встречаются у 10-30% детей с САМ.
Код по Международной классификации болезней 10-го пересмотра
Классификация
По степени тяжести САМ подразделяется [2]:
-
на легкое течение - кислородная зависимость сохраняется менее 48 ч, новорожденный нуждается менее чем в 40% кислороде;
-
среднюю степень тяжести - новорожденный нуждается более чем в 40% кислороде в течение более 48 ч, отсутствуют признаки синдрома утечки воздуха;
-
тяжелое течение - необходимость во вспомогательной вентиляции легких в течение более 48 ч. Частым осложнением при тяжелом течении является ПЛГН.
Осложнения САМ [15].
-
-
может развиваться практически на любой стадии, поскольку САМ относится к заболеваниям, которые сопровождаются формированием воздушных ловушек. Эту особенность необходимо постоянно принимать во внимание при проведении реанимационных мероприятий и интенсивной терапии. Наиболее важно помнить об этом в тех ситуациях, когда внезапно происходит ухудшение состояния ребенка либо изначально имеет место тяжелое течение заболевания.
-
-
Аспирационная пневмония и сепсис:
-
за исключением сепсиса, все остальные варианты инфекционных процессов, как правило, не провоцируют отхождение мекония;
-
особенно у недоношенных новорожденных необходимо помнить о возможности развития листериоза;
-
меконий представляет собой благоприятную среду для роста микроорганизмов, поэтому возможно развитие вторичных инфекционных процессов.
-
ДИАГНОСТИКА
Жалобы и анамнез
Необходимо тщательно собрать и оценить анамнез в целях выявления факторов риска развития САМ. Факторы риска:
-
острая гипоксия плода вследствие обвития пуповиной вокруг шеи ребенка, преждевременной отслойки плаценты и др.;
-
хроническая гипоксия плода, обусловленная плацентарной недостаточностью, гемолитической болезнью плода, сахарным диабетом у матери, артериальной гипертензией у матери, преэклампсией и эклампсией;
-
курение, наркотическая зависимость матери (особенно кокаиновая) [2].
Физикальное обследование
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2b).
Комментарии. Клинически развернутый САМ, как правило, развивается в первые 48 ч после рождения. Ребенок, родившийся в мекониальных околоплодных водах, требует интенсивного наблюдения за динамикой состояния в целях мониторинга развития дыхательных нарушений. Первая оценка степени дыхательной недостаточности должна быть проведена не позднее 1 ч после рождения [15]. Клинически развернутый САМ включает наличие мекония в амниотической жидкости, респираторный дистресс в возрасте первых часов жизни (одышка, стон, участие вспомогательной мускулатуры, цианоз), необходимость в респираторной поддержке, исключены другие причины респираторного дистресса [1, 2, 17, 18, 19].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2b).
Комментарии. Вследствие образования воздушных ловушек и чрезмерного растяжения альвеол грудная клетка постепенно принимает бочкообразную форму, поэтому при перкуссии может определяться коробочный звук, чередующийся с участками притупления в связи с образованием ателектазов. При аускультации выслушивается ослабленное или жесткое дыхание, обилие разнокалиберных хрипов.
Лабораторная диагностика
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3).
Комментарии. В зависимости от выраженности мекониальной аспирации может отмечаться развитие респираторного либо метаболического ацидоза вследствие гипоксемии и гиперкарбии. Ацидоз любого генеза, в свою очередь, увеличивает риск развития либо потенцирует формирование пер-систирующей легочной гипертензии [4].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3).
Комментарии. Выбор тактики АБТ у новорожденных с САМ желательно проводить с учетом результатов бактериологического исследования.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3).
Комментарии. Необходимо проводить дифференциальную диагностику с врожденной пневмонией.
Инструментальная диагностика
Комментарии. Мекониальная аспирация приводит к формированию характерных изменений, обнаруживаемых при рентгенографии органов грудной полости, таких как появление диффузных, полиморфных, неоднородных по структуре узелковых инфильтратов, локальных либо генерализованных, расположенных асимметрично либо симметрично; увеличение воздушности неизмененной легочной ткани; признаки утечки воздуха; плевральный выпот; кардиомегалия. Полная окклюзия дыхательных путей приводит к формированию ателектазов. Ателектазы могут быть двусторонними, диффузными/распространенными, неоднородными по структуре и полиморфными по форме и размерам или более четкими в виде отдельных узелков. Наличие ателектазов является наиболее значимым прогностическим признаком в отношении тяжести дыхательной недостаточности и смертности. Вследствие повреждения альвеолярного эндотелия в дыхательных путях накапливается жидкость, развивается альвеолярный отек легких и появляется плевральный выпот. Частичное перекрытие просвета дыхательных путей и альвеол мекониальным детритом приводит к формированию воздушных ловушек, а также сопровождается гипервентиляцией отдельных участков легких, что рентгенологически проявляется более легким/усиленным прохождением через данную зону рентгеновских лучей, а также более низким стоянием диафрагмы на стороне поражения. Чрезмерное растяжение дыхательных путей и альвеол может приводить к разрыву альвеол с последующим выходом воздуха в интерстициальное пространство, расширением интерстициальных лимфатических сосудов и распространением по ним далее вышедшего воздуха, а также выходом его в плевральную полость и средостение. Кардиомегалия может быть следствием перенесенной асфиксии либо отсроченным проявлением ПЛΓН [4].
Дифференциальная диагностика
Дифференциальную диагностику проводят:
При диагностике РДС характерными признаками на рентгенограмме являются диффузное снижение прозрачности легочных полей (симптом матового стекла), контрастирование воздухом бронхов (воздушная бронхограмма). Важно отметить, что при наличии болезни гиалиновых мембран отмечается тенденция к тому, что легкие выглядят пропорционально, диффузно уменьшенными в размерах вследствие дефицита сурфактанта, в то время как при наличии САМ определяется повышенная воздушность задействованных в процессе дыхания участков легочной ткани.
Диагностика транзиторного тахипноэ новорожденных. Заболевание может встречаться у детей любого ГВ, но более характерно для поздних недоношенных и доношенных новорожденных, особенно после родоразрешения путем кесарева сечения. Заболевание характеризуется отрицательными маркерами воспаления и быстрым регрессом дыхательных нарушений и рентгенологической симптоматики. Последняя характеризуется легким или умеренным повышением воздушности легочной ткани, симметричным усилением рисунка в области корней легких, возможно появление плеврального выпота с усилением междолевой плевры. Рентгенологическая картина возвращается к нормальной через 48-72 ч [4].
Диагностика раннего неонатального сепсиса, врожденной пневмонии. Характерны положительные маркеры воспаления, определяемые в динамике в первые 72 ч жизни. Рентгенологические симптомы врожденной пневмонии неспецифичны. В большинстве случаев отмечается двустороннее поражение легочной ткани, как правило, в виде пятнистой картины легких - сочетание участков уплотнения легочной ткани и компенсаторного повышения воздушности. Может обнаруживаться выпот в плевральных полостях [21, 22, 23]. При пневмонии, вызванной стрептококками группы В, на рентгенограммах отмечается усиление рисунка за счет сетчатых/зернистых структур, особенно в случае сочетания с дефицитом сурфактанта [24]. Очаги уплотнения легочной ткани, как правило, затрагивают несколько долей. Выраженное уплотнение, ограниченное одной отдельно взятой долей, сравнительно редко встречается у новорожденных [25].
ЛЕЧЕНИЕ
Консервативное лечение
Помощь новорожденному с синдромом аспирации мекония в родильном зале
Рекомендуется дифференцированный подход к оказанию помощи в родильном зале новорожденным с околоплодными водами, содержащими меконий [26]. Акушеры должны заранее предупредить врачей-неонатологов, если околоплодные воды окрашены меконием и имеются признаки дистресса плода.
-
Не рекомендуется санация ротоглотки после рождения головки плода, так как это не снижает вероятности развития дыхательной недостаточности или клинически выраженного САМ, включая новорожденных, где имело место наличие густого мекония, отмечались признаки дистресса у плода или родоразрешение выполнялось абдоминальным путем [19].
-
Не рекомендуются рутинная интубация и санация трахеи через интубационную трубку, если на момент рождения у новорожденного ЧCC более 100 в минуту, спонтанное дыхание эффективное, хороший мышечный тонус [27, 28].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2b).
Комментарии. При наличии мекония в околоплодных водах у ребенка, имеющего показания к ИВЛ, следует начать ИВЛ маской. Интубация трахеи и санация показаны при подозрении на обструкцию трахеи меконием (отсутствует экскурсия грудной клетки при масочной ИВЛ) [59].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2b).
Комментарии. В случае отсутствия лаважа желудка в родильном зале при наличии мекония в околоплодных водах не зарегистрировано вторичных осложнений, связанных с регургитацией и/или аспирацией мекониального желудочного содержимого [29]. В то же время лаваж желудка рассматривается как потенциально опасная манипуляция, поскольку введение рото- или назогастрального зонда в родильном зале нередко сопровождается развитием апноэ и/или брадикардии [30].
Использование респираторной поддержки в условиях родильного зала
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2a). Комментарии.
-
ИВЛ в родильном зале может проводиться:
-
аппаратом ИВЛ традиционным [26]. В целях безопасности желательно применять саморасправляющиеся мешки объемом не более 240 мл с клапаном положительного давления PEEP и манометром для контроля за пиковым давлением. В настоящее время, как правило, в родильном зале применяются нетриггерные режимы ИВЛ, контролируемые по давлению. Однако в перспективе более безопасными и эффективными могут стать режимы ИВЛ с контролем дыхательного объема. Параметры ИВЛ подбираются в зависимости от степени выраженности дыхательных нарушений и определяются механическими свойствами легких. Основным индикатором эффективности ИВЛ в родильном зале является увеличивающаяся ЧСС, а также видимые экскурсии грудной клетки. Уровень кислорода для доношенных новорожденных устанавливается на старте 21% и в дальнейшем увеличивается пошагово для поддержания целевого уровня сатурации (Методическое письмо от 21 апреля 2010 г. № 15-4/10/2- 3204 «Первичная и реанимационная помощь новорожденным детям»). Скорость потока устанавливается 8-10 л/мин. Уровень положительного PEEP устанавливается в пределах 5-6 см вод.ст. [31]. Давление вдоха (пиковое давление) регулируется в зависимости от видимых глазом экскурсий грудной клетки и оксигенации, определенной с помощью транскутанного пульсоксиметра. Важно помнить, что в случае отсутствия видимых экскурсий грудной клетки необходимо проверить проходимость дыхательных путей, в зависимости от ситуации сменить эндотрахеальную трубку или увеличить давление вдоха. ИВЛ в условиях родильного зала проводится с частотой 35- 40 вдохов в минуту в целях предотвращения гипокапнии [32]. Для поддержания заданной частоты ИВЛ с помощью ручного аппарата вентиляции легких эффективно использование устройства с метрономом [33].
Лечебно-охранительный режим
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1b).
Комментарии. Создание оптимального температурного режима осуществляется с помощью специального медицинского оборудования, позволяющего обеспечивать термонейтральный климат (кувез, открытая реанимационная система, матрасик с подогревом, источник лучистого тепла). Под термонейтральным климатом следует понимать температуру окружающей среды, при которой температура тела ребенка поддерживается в пределах 36,5-37,5 °С.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1b).
Комментарии. Соблюдение лечебно-охранительного режима важно, поскольку беспокойство может увеличивать проявления ПЛГН и право-левое шунтирование крови, приводя к дополнительной гипоксемии и ацидозу. Может возникнуть необходимость в седативной терапии для уменьшения беспокойства ребенка [35]. Санация эндотрахеальной трубки не должна быть рутинной, проводится только по показаниям. Желательно использовать закрытые санационные системы, поскольку они позволяют наиболее оптимально уменьшить эпизоды гипоксемии, связанные с санацией, а также снизить риск инфицирования [28].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1b).
Респираторная терапия у новорожденных с синдромом аспирации мекония
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1b). Комментарии.
-
Необходимо избегать гипоксемии и гиперкапнии, поддерживая сатурацию гемоглобина кислородом (SpO2 ) 91-95%.
-
Потребность в механической ИВЛ возникает приблизительно у 30-40% новорожденных с САМ [1, 38]. Выбор режима ИВЛ представлен в приложении 3, параметров ИВЛ - в приложении 4.
При возрастающей потребности в увеличении параметров традиционной ИВЛ необходимо рассмотреть вопрос о высокочастотной осцилляторной вентиляции (ВЧО ИВЛ) [39, 40-42] или высокочастотной струйной ИВЛ [43]. По данным литературы, около 20-30% всех детей с САМ, находящихся на ИВЛ, нуждаются в ВЧО ИВЛ [12, 36, 41]. Основными показаниями к переводу больного с традиционной ИВЛ на ВЧО ИВЛ является рефрактерная гипоксемия и/или потребность в высоком МАР (8-10 см вод.ст. и более), а также высокий уровень FiO2 (0,6 и более) для поддержания целевого уровня SpO2 91-95% [40, 44]. Подбор параметров ВЧО ИВЛ представлен в приложении 5. -
Следует помнить, что доказательства эффективности применения CPAP у новорожденных с САМ отсутствуют. Кроме того, CPAP при САМ может увеличивать риск развития пневмоторакса [37]. Однако из всех новорожденных с САМ, нуждающихся в респираторной поддержке, примерно 10-20% получают респираторную терапию только в виде назального CPAP. Кроме того, до 1/4 новорожденных с САМ, потребовавших проведения интубации и механической ИВЛ, получают CPAP до и/или после ИВЛ. CPAP обычно эффективен с давлением 5-8 см H2 O, с применением как биназальных, так и мононазальных канюль.
-
За исключением чрезвычайных обстоятельств, интубация новорожденного с САМ должна выполняться с премедикацией. Значительная утечка воздуха при ИВЛ является серьезным барьером для эффективной вентиляции, и в большинстве случаев требуется эндотрахеальная трубка большего внутреннего диаметра, обычно не менее 3,5 мм [44].
-
При подтверждении САМ можно рассмотреть вопрос о сурфактантной терапии [45]. Терапия сурфактантом может быть представлена в виде болюсного эндотрахеального введения и реже - бронхоальвеолярного лаважа. Обе процедуры являются рискованными, требуют дальнейших исследований, поэтому не могут быть рекомендованы для рутинного использования, однако могут быть показаны при тяжелой гипоксемии, не поддающейся коррекции другими методами респираторной терапии [46, 47, 58].
-
В случае развития ПЛГН возможно проведение терапии ингаляцией оксида азота (NO) [48]. Крупные рандомизированные контролируемые исследования демонстрируют улучшение исходов при применении ингаляции оксида азота у новорожденных с ПЛГН, а также уменьшение риска перевода детей на экстракорпоральную мембранную оксигенацию или летального исхода [49]. Однако в РФ оксид азота не зарегистрирован как медицинский газ (применение off-label). При его назначении необходимо проведение врачебного консилиума и взятие согласия на его использование по жизненным показаниям у законных представителей ребенка [50].
-
В тяжелых случаях проявления ПЛГН может потребоваться проведение экстракорпоральной мембранной оксигенации при наличии технической и организационной возможности.
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2a).
Комментарии. Седация при ИВЛ проводится для уменьшения потребления кислорода и исключения работы дыхания у новорожденных по показаниям (особенно при развитии ПЛГН) с учетом индивидуальных особенностей. Показания: одышка более 80 вдохов в минуту, выраженное участие дыхательной мускулатуры в акте дыхания, сопротивление аппарату, при котором происходит снижение оксигенации. Используются опиоидные анальгетики и бензодиазепины [35, 44]. Применение мышечных релаксантов может быть использовано в период стабилизации состояния у пациентов со стойкой рефрактерностью к опиоидным анальгетикам и бензодиазепи-нам и сопутствующей легочной гипертензией. Медикаментозные средства, которые могут быть использованы у новорожденных в целях синхронизации с аппаратом ИВЛ, представлены в приложении 6.
Антибактериальная терапия
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2b).
Комментарии. Антибактериальная терапия при аспирации мекония проводится в связи с высоким риском развития инфекционного процесса, так как меконий способствует росту бактерий. Стартовая АБТ включает комбинацию ампициллина с аминогликозидом. Важно отметить, что отбор крови на бактериологическое исследование необходимо провести перед первым введением антибактериального препарата. Дальнейшая тактика АБТ выбирается согласно результатам бактериологического исследования. При получении отрицательного результата культуры крови и отрицательных повторных маркеров воспаления АБТ можно отменить.
РЕАБИЛИТАЦИЯ
Специфические мероприятия для реабилитации после САМ отсутствуют.
ПРОФИЛАКТИКА
Учитывая факторы риска развития САМ, к мерам профилактики относится профилактика перенашивания и состояний, приводящих к развитию гипоксии плода, как хронической, так и острой. Согласно приложению 5 к «Порядку оказания медицинской помощи по профилю "акушерство и гинекология" (за исключением использования вспомогательных репродуктивных технологий)», утвержденному приказом Министерства здравоохранения РФ от 1 ноября 2012 г. № 572н, в целях своевременного выявления дистресса плода и принятия тактического решения по методу родоразрешения показаны аускультация плода в родах (каждые 30 мин в первом периоде, после каждой потуги во втором периоде), продолжительная или непрерывная кардиотокограмма плода во время родов (индуцированные роды, переношенная беременность, фетоплацентарная недостаточность и т.д.), ведение партограммы в родах. Необходимо непрерывное обучение медицинского персонала родовспомогательного учреждения методам первичной реанимации и интенсивной терапии при САМ.
Диспансерное наблюдение
Форма помощи
Несмотря на планирование диагностических и лечебных мероприятий новорожденным с аспирацией мекония, помощь носит неотложный характер. Отсрочка начала неотложных действий и адекватной терапии приводит к снижению показателей общей выживаемости среди новорожденных и утяжеляет прогноз у конкретного больного.
СПИСОК ЛИТЕРАТУРЫ
-
Wiswell T.E., Tuggle J.M., Turner B.S. Meconium aspiration syndrome: have we made a difference? // Pediatrics. 1990. Vol. 85, N 5. P. 715-721.
-
Cleary G.M., Wiswell T.E. Meconium-stained amniotic fluid and the meconium aspiration syndrome: an update // Pediatr. Clin. North Am. 1998. Vol. 45, N 3. P. 511-529.
-
Singh B.S., Clark R.H., Powers R.J., Spritzer A.R. Meconium aspiration syndrome remains a significant problem in the NICU: outcomes and treatment patterns in term neonates admitted for intensive care during a ten-year period // J. Perinatol. 2009. Vol. 29, N 7. P. 497-503.
-
Radiological Imaging of the Neonatal Chest. 2nd revised ed. / ed. V. Dono-qhue. Springer, 2008. 362 p.
-
Janssen D.J., Carnielli V.P., Cogo P. et al. Surfactant phosphatidylcholine metabolism in neonates with meconium aspiration syndrome // J. Pediatr. 2006. Vol. 149, N 5. P. 634-639.
-
Clark D.A., Nieman G.F., Thompson J.E. Surfactant displacement by meconium free fatty acids: an alternative explanation for atelectasis in meconium aspiration syndrome // J. Pediatr. 1987. Vol. 110, N 5. P. 765-770.
-
Terasaka D., Clark D.A., Singh B.N., Rokahr J. Free fatty acids of human meconium // Biol. Neonate. 1986. Vol. 50, N 1. P. 16-20.
-
Nathan L., Leveno K.J., Carmody III T.J., Kelly M.A. et al. Meconium: a l990’s perspective on an old obstetric hazard // Obstet. Gynecol. 1994. Vol. 83, N 3. P. 329-332.
-
Ross M.G. Meconium aspiration syndrome - more than intrapartum meconium // N. Engl. J. Med. 2005. Vol. 353, N 9. P. 946-948.
-
Ostrea E.M. Jr, Naqvi M. The influence of gestational age on the ability of the fetus to pass meconium in utero: clinical implications // Acta Obstet. Gynecol. Scand. 1982. Vol. 61, N 3. P. 275-277.
-
Usher R.H., Boyd M.E., McLean F.H., Kramer M.S. Assessment of fetal risk in postdate pregnancies // Am. J. Obstet. Gynecol. 1988. Vol. 158, N 2. P. 259-264.
-
Dargaville P.A., Copnell B. The epidemiology of meconium aspiration syndrome: incidence, risk factors, therapies, and outcome // Pediatrics. 2006. Vol. 117, N 5. P. 1712-1721.
-
Velaphi S., Vidyasagar D. Intrapartum and post-delivery management of infants born to mothers with meconiumstained amniotic fluid: evidence-based recommendations // Clin. Perinatol. 2006. Vol. 33, N 1. P. 29-42.
-
Ghidini A., Spong C.Y. Severe meconium aspiration syndrome is not caused by aspiration of meconium // Am. J. Obstet. Gynecol. 2001. Vol. 185, N 4.P. 931-938.
-
National Women’s Health at Auckland City Hospital, Auckland, New Zealand Newborn Services Clinical Guideline «Meconium-stained Liquor and Me-conium Aspiration». Clinical Practice Committee, May, 2016. URL: http://www. adhb.govt.nz/newborn/Guidelines/Admission/MeconiumStainedLiquorAnd-MAS.htm.
-
Downes J.J., Vidyasagar D., Boggs T.R. Jr, Morrow G.M. 3rd. Respiratory distress syndrome of newborn infants. I. New clinical scoring system (RDS score) with acid-base and blood-gas correlations // Clin. Pediatr. (Phila.). 1970 Vol. 9, N 6. P. 325-331.
-
Wiswell T.E., Gannon C.M., Jacob J., Goldsmith L. et al. Delivery room management of the apparently vigorous meconium-stained neonate: results of the multicenter, international collaborative trial // Pediatrics. 2000. Vol. 105, N 1. P. 1-7.
-
Blackwell S.C., Moldenhauer J., Hassan S.S., Redman M.E. et al. Meconium aspiration syndrome in term neonates with normal acid base status at delivery: is it different? // Am. J. Obstet. Gynecol. 2001. Vol. 184, N 7. P. 1422-1425; discussion P. 1425-1426.
-
Vain N.E., Szyld E.G., Prudent L.M., Wiswell T.E. et al. Oropharyngeal and nasopharyngeal suctioning of meconium-stained neonates before delivery of their shoulders: multicentre, randomised controlled trial // Lancet. 2004. Vol. 364, N 9434. P. 597-602.
-
Неонатология: в 2 т. Т. 2 / под ред. Т.Л. Гомеллы, М.Д. Каннингамм, Ф.Г. Эяля ; пер. с англ. под ред. Д.Н. Дегтярева. М.: БИНОМ. Лаборатория знаний, 2015. 864 с.
-
Haney P.J., Bohlman M., Sun C.C. Radiographic findings in neonatal pneumonia // AJR Am. J. Roentgenol. 1984. Vol. 143, N 1. P. 23-26.
-
Leonidas J.C., Hall R.T., Beatty E.C., Fellows R.A. Radiographic findings in early onset neonatal group b streptococcal septicemia // Pediatrics. 1977. Vol. 59, N 6. Pt 2. P. 1006-1011.
-
Payne N.R., Burke B.A., Day D.L., Christenson P.D. et al. Correlation of clinical and pathologic findings in early onset neonatal group B streptococcal infection with disease severity and prediction of outcome // Pediatr. Infect. Dis. J. 1988. Vol. 7, N 12. P. 836-847.
-
Hedlund G.L., Griscom N.T., Cleveland R.H., Kirks D.R. Respiratory system // Practical pediatric imaging: diagnostic radiology of infants and children. 3rd ed. / eds D.R. Kirks, N.T. Griscom. Philadelphia: Lippincott; Raven, 1998. P. 715-717.
-
Swischuk L.E. Respiratory system // Imaging of the Newborn, Infant, and Young Child. 4th ed. Baltimore: Williams and Wilkins, 1997. P. 43-47.
-
Методическое письмо Минздравсоцразвития РФ от 21 апреля 2010 г. № 15-4/10/2-3204 «Первичная и реанимационная помощь новорожденным детям» для использования в работе лечебно-профилактических учреждений, оказывающих медицинскую помощь новорожденным.
-
Wyllie J., Perlman J.M., Kattwinkel J. et al. Part 7: Neonatal resuscitation: 2015 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations // Resuscitation. 2015. Vol. 95. P. e169-e201.
-
Обеспечение эпидемиологической безопасности медицинских технологий в отделениях реанимации и патологии новорожденных и недоношенных детей. Федеральные клинические рекомендации. М., 2015. 58 с.
-
Narchi H., Kulaylat N. Is gastric lavage needed in neonates with meconium-stained amniotic fluid? // Eur. J. Pediatr. 1999. Vol. 158. P. 315-317.
-
Aguilar A.M., Vain N.E. The suctioning in the delivery room debate // Early Hum. Dev. 2011. Vol. 87S. P. S13-S15.
-
Wyllie J., Perlman J.M., Kattwinkel J., Atkins D.L. et al. Neonatal Resuscitation Chapter Collaborators. Part 11: neonatal resuscitation: 2010 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations // Resuscitation.2010. Vol. 81, suppl. 1. P. e260-e287.
-
Wyckoff M.H., Aziz K., Escobedo M.B., Kapadia V.S. et al. Part 13: Neonatal Resuscitation: 2015 American Heart Association Guidelines Update for Car-diopulmonary Resuscitation and Emergency Cardiovascular Care // Circulation. 2015. Vol. 132, N 18. Suppl. 2. P. S543-560.
-
Cocucci C., Madorno M., Aguilar A., Acha L. et al. A metronome for pacing manual ventilation in a neonatal resuscitation simulation // Arch. Dis. Child. Fetal Neonatal Ed. 2015. Vol. 100, N 1. F47-F49.
-
Storme L., Aubry E., Rakza T., Houeijeh A. et al.; French Congenital Diaphragmatic Hernia Study GrouP. Pathophysiology of persistent pulmonary hypertension of the newborn: impact of the perinatal environment // Arch. Cardiovasc. Dis. 2013. Vol. 106, N 3. P. 169-177.
-
Aranda J.V., Carlo W., Hummel P., Thomas R. et al. Analgesia and sedation during mechanical ventilation in neonates // Clin. Ther. 2005. Vol. 27, N 6. P. 877-899.
-
Singh B.S., Clark R.H., Powers R.J., Spritzer A.R. Meconium aspiration syndrome remains a significant problem in the NICU: outcomes and treatment patterns in term neonates admitted for intensive care during a ten-year period // J. Perinatol. 2009. Vol. 29, N 7. P. 497-503.
-
Goldsmith J.P. Continuous positive airway pressure and conventional mechanical ventilation in the treatment of meconium aspiration syndrome // J. Perinatol. 2008. Vol. 28, suppl. 3. P. S49-S55.
-
Wiswell T.E., Gannon C.M., Jacob J., Goldsmith L. et al. Delivery room management of the apparently vigorous meconium-stained neonate: results of the multicenter, international collaborative trial // Pediatrics. 2000. Vol. 105, N 1. P. 1-7.
-
Hachey W.E., Eyal F.G., Curtet-Eyal N.L., Kellum F.E. High-frequency oscillatory ventilation versus conventional ventilation in a piglet model of early meconium aspiration // Crit. Care Med. 1998. Vol. 26, N 3. P. 556-561.
-
Мостовой А.В. Комплексная терапия легочной гипертензии у новорожденных с применением высокочастотной осцилляторной вентиляции легких и ингаляции оксида азота: дис. … канд. мед. наук. СПб., 2003.
-
Tingay D.G., Mills J.F., Morley C.J., Pellicano A. et al. Trends in use and outcome of newborn infants treated with high frequency ventilation in Australia and New Zealand, 1996-2003 // J. Paediatr. Child Health. 2007. Vol. 43, N 3. P. 160-166.
-
Pellicano A., Tingay D.G., Mills J.F., Fasulakis S. et al. Comparison of four methods of lung volume recruitment during high frequency oscillatory ventilation // Intensive Care Med. 2009. Vol. 35, N 11. P. 1990-1998.
-
Kamlin O., Loughnan P., Dargaville P., Mills J., McDougall P. Outcomes from the first seven years of rescue therapy with high frequency jet ventilation in critically ill newborns in a tertiary referral centre // Proceedings of the 19th Annual Conference of High Frequency Ventilation in Infants. Snowbird, Utah, 2002.
-
Dargaville P.A. Respiratory support in meconium aspiration syndrome: a practical guide // Int. J. Pediatr. 2012. Vol. 2012. Article ID 965159.
-
Dargville P.A., Mills J.F. Surfactant therapy for meconium aspiration syndrome: current status // Drugs. 2005. Vol. 65, N 18. P. 2569-2591.
-
Dargaville P.A., Mills J.F., Copnell B., Loughnan P.M. et al. Therapeutic lung lavage in meconium aspiration syndrome: a preliminary report // J. Paediatr. Child Health. 2007. Vol. 43, N 7-8. P. 539-545.
-
Dargville P.A. Innovation in surfactant therapy I: surfactant lavage and surfactant administration by fluid bolus using minimally invasive techniques // Neonatology. 2012. Vol. 101, N 4. P. 328-336.
-
Finer N.N., Barrington K.J. Nitric oxide for respiratory failure in infants born at or near term // Cochrane Database Syst. Rev. 2006. Vol. 4. CD000399.
-
Lakshminrusimha S., Keszler M. Persistent pulmonary hypertension of the newborn // Neoreviews. 2015. Vol. 16, N 12. P. e680-e692.
-
Буров А.А. Терапия оксидом азота в неонатологии // Неонатология: новости, мнения, обучение. 2014. Т. 4, № 6. С. 73-86.
-
Bernstein G., Mannino F.L., Heldt G.P. et al. Randomized multicenter trial comparing synchronized and conventional intermittent mandatory ventilation in neonates // J. Pediatr. 1996. Vol. 128, N 4. P. 453-463.
-
Wu R., G.F. Zheng G.F., Tian Z.F. et al. Treatment of neonates with me-conium aspiration syndrome by proportional assist ventilation and synchronized intermittent mandatory ventilation: a comparision study // Minerva Pediatr. 2016. Vol. 68, N 4. P. 262-268.
-
Fox W.W., Berman L.S., Downes J.J. Jr et al. The therapeutic application of end expiratory pressure in the meconium aspiration syndrome // Pediatrics. 1975. Vol. 56, N 2. P. 214-217.
-
Bernstein G., Knodel E., Heldt G.P. Airway leak size in neonates and auto-cycling of three flow-triggered ventilators // Crit. Care Med. 1995. Vol. 23, N 10. P. 1739-1744.
-
Sharma S., Clark S., Abubakar K., Keszler M. Tidal volume requrements in mechanically ventilated infants with meconium aspiration syndrome // Am. J. Perinatol. 2015. Vol. 32, N 10. P. 916-919.
-
Bouziri A., Clark S., Abubakar K., Keszler M. et al. Management of meconium aspiration syndrome with high frequency oscillatory ventilation // Tunis Med. 2011. Vol. 89, N 7. P. 632-637.
-
Alexander J., Milner A.D. Determination of gas-trapping during high frequency oscillatory ventilation // Acta Pediatr. 1997. Vol. 86, N 3. P. 268-273.
-
Hahn S., Choi H.J., Soll R., Dargaville P.A. Lung lavage for meconium aspiration syndrome in newborn infants // Cochrane Database Syst. Rev. 2013. Vol. 4. CD003486.
-
Wyllie J., Bruinenberg J., Roehr C.C., Rüdiger M., Trevisanuto D. et al. European Resuscitation Council Guidelines for Resuscitation 2015. Section 7. Resuscitation and support of transition of babies at birth // Recuscitation. 2015. Vol. 95. P. 249-363.
ПРИЛОЖЕНИЯ
Приложение 1. Алгоритмы ведения пациента
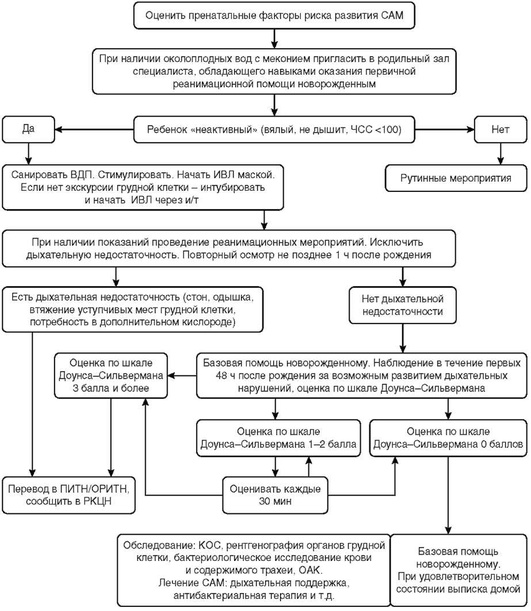
Приложение 2.
Шкала оценки респираторного дистресс-синдрома у новорожденных по Доунсу [16]
| Шкала | 0 | 1 | 2 |
|---|---|---|---|
Частота дыхания, в минуту |
<60 |
60-80 |
>80 |
Цианоз |
Отсутствует при дыхании c FiO2 0,21 |
Присутствует при дыхании с FiO2 0,21-0,4 |
Присутствует или отсутствует при дыхании с FiO2 более 0,4 |
Втяжение уступчивых мест грудной клетки |
Отсутствует |
Умеренное |
Тяжелое |
Стоны |
Отсутствуют |
Слышны с помощью стетоскопа |
Слышны на расстоянии |
Проведение дыхания в легких |
Ясное |
Задержка или ослабленное |
Не слышно или проводится очень плохо |
Примечание. При оценке дыхательной недостаточности по шкале Доунса производится подсчет баллов в зависимости от клинических проявлений:
-
1-3 балла - предполагается наблюдение за пациентом, оценка состояния каждые 30 мин до момента исчезновения признаков дыхательной недостаточности либо до момента перевода больного на респираторную поддержку;
-
4-5 баллов - состояние, при котором допускается применение CPAP-терапии, однако необходимо помнить о возможных последствиях применения CPAP в виде воздушных ловушек или развития синдрома утечек воздуха;
-
6 баллов и более - прямое показание к началу механической ИВЛ через эндотрахеальную трубку.
Приложение 3. Выбор режима искусственной вентиляции легких [39]
При ИВЛ у некоторых пациентов можно использовать пациент-триг-герную вентиляцию в качестве стартовой при условии получения на ИВЛ удовлетворительного газового состава крови (отсутствие гипервентиляции, гипокапнии). Однако целесообразнее, учитывая высокий риск синдрома утечки воздуха у новорожденных с САМ, использовать в качестве стартовой принудительную ИВЛ (IMV) в условиях медикаментозной седации. В случае использования принудительного режима ИВЛ (медикаментозная седация) могут быть рекомендованы режимы ИВЛ с двойным контролем [например, Volume Guarantee, PRVC (Pressure Regulated Volume Control - режим ИВЛ, регулируемый по давлению, контролируемый по объему)] в целях оптимизации минутного объема вентиляции и обеспечения постоянного дыхательного объема в условиях изменяющихся механических свойств легких [55].
При неэффективности традиционной ИВЛ ребенок может быть переведен на ВЧО ИВЛ (см. клинические рекомендации по врожденной пневмонии, с. 170).
Приложение 4. Подбор параметров искусственной вентиляции легких
| Параметры ИВЛ | Значения | Комментарии |
|---|---|---|
Пиковое давление (pip) |
От 12 см вод.ст. и выше |
Учитывая снижение комплаенса (податливости) легких, возникающее при САМ, потребность в пиковом давлении для достижения целевого дыхательного объема 5-6 мл/кг значительно варьирует. Высокие уровни пикового давления могут привести к вторичным, ассоциированным c ИВЛ, повреждениям легких, поэтому при вентиляции с управляемым давлением уровень пикового давления должен быть индивидуальным и подбираться в зависимости от показателей экспираторного дыхательного объема [44, 55] |
PEEP |
4-7 см вод.ст. |
Применение PEEP обязательно у новорожденных с САМ, находящихся на ИВЛ. Уровень PEEP должен обеспечивать функциональную остаточную емкость легких и препятствовать развитию ателектазов, не приводя к избыточному растяжению ткани легких. Более высокие значения PEEP (8-14 см вод.ст.) не приводят к дальнейшему улучшению показателей оксигенации, однако могут оказать отрицательное влияние на центральную гемодинамику, а также быть причиной развития синдромов утечки воздуха [44] |
Частота дыхания (Rate) |
Стартовая частота дыхания - в пределах возрастной нормы (30-40 в минуту) [40] |
Учитывая высокий риск формирования непреднамеренного PEEP (autoPEEP), нецелесообразно на старте вентиляции устанавливать частоту дыхания не более 40 в минуту. Минутный объем вентиляции должен обеспечивать элиминацию углекислого газа (CO2) для достижения значения уровня углекислого газа в крови (pCO2) в пределах 40-6 мм рт.ст. и водородный показатель 7,3-7,4, что позволит сохранить адекватный церебральный и легочный кровоток [44]. В динамике необходимо осуществлять индивидуальный подбор частоты дыхания с учетом клинико-лабораторных, рентгенологических данных и респираторных показателей, характеризующих механические свойства бронхолегочной системы (податливость и сопротивление дыхательных путей) |
Временные интервалы дыхательного цикла (Tin/Tex) |
Соотношение вдоха и выдоха не менее 1:2 |
Для заполнения легких доношенного ребенка требуется более длительное время вдоха, чем у недоношенного, что связано с различной сопротивляемостью дыхательных путей и податливостью легочной ткани [44]. Длительное время вдоха может быть использовано для вовлечения спавшихся альвеол в процесс газообмена, однако необходимо помнить, что последующее за этим укорочение экспираторного времени при сохраненной частоте дыхательных циклов может способствовать формированию воздушных ловушек и повышать риск баро- и волюмотравмы. Подбор инспираторного и экспираторного времени при САМ должен осуществляться с использованием таких показателей респираторной механики, как податливость легочной ткани (комплаенс) и сопротивление дыхательных путей. Графический мониторинг и непосредственно кривая «поток-время» могут быть очень полезны для подбора оптимального времени вдоха и выдоха |
Приложение 5. Подбор параметров высокочастотной осцилляторной искусственной вентиляции легких
| Параметры ИВЛ | Значения | Комментарии |
|---|---|---|
Среднее давление в дыхательных путях (MAP) |
Необходимо использовать оптимальное МАР для поддержания адекватной оксигенации [44]. Традиционно устанавливается на 2-4 см вод.ст. выше, чем при традиционной ИВЛ |
У детей с выраженными ателектазами может потребоваться высокое МАР для вовлечения большего количества альвеол в процесс вентиляции в сравнении с традиционной ИВЛ. Пошаговое исполнение маневра рекруитмента может быть эффективным [44]. Как только оксигенация улучшится, МАР снижают пошагово в сочетании с процентом кислорода [56] |
Частота при ВЧО ИВЛ |
От 8 до 10 Гц [46] |
При увеличении частоты вентиляции до 15 Гц наблюдается ухудшение состояния с формированием воздушных ловушек [44] |
Амплитуда колебаний |
Подбирается по формуле МАР × 2, в дальнейшем регулируется под визуальным контролем и контролем за газовым составом крови |
Амплитуда колебаний определяет степень элиминации углекислого газа. При задержке СО2 в легких возможно увеличение значения амплитуды до МАР × 3. В дальнейшем необходимо снижать частоту вентиляции, так как при увеличении амплитуды выше троекратного МАР резко возрастает риск повреждения легких [44, 56] |
Соотношение вдоха и выдоха |
Практически на всех современных аппаратах имеется возможность установить соотношение вдоха и выдоха как 1:2, или 33% |
При увеличении соотношения вдоха и выдоха до 1:1 на ВЧО ИВЛ увеличивается риск формирования воздушных ловушек и синдрома утечки воздуха [57] |
Приложение 6. Препараты для медикаментозной синхронизации с аппаратом искусственной вентиляции легких
| Препарат | Анатомо-терапевтическо-химическая классификация | Разовая доза | Доза для продленного внутривенного введения | Примечания |
|---|---|---|---|---|
Седативные препараты |
||||
Диазепам** # |
N05BA01 |
0,1-0,3 мг/кг |
Нет |
Постоянная инфузия малоэффективна |
Мидазолам** |
N05CD08 |
0,05-0,1 мг/кг |
<32 нед: 0,03 мг/кг в час (0,5 мкг/кг в минуту); >32 нед: 0,06 мг/кг в час (1 мкг/кг в минуту) |
- |
Гипнотики |
||||
Натрия оксибутират** |
N01AX |
50-100 мг/кг |
20-60 мг/кг в час |
- |
Опиоидные анальгетики |
||||
Фентанил**# |
N01AH01 |
0,25-3,0 мкг/кг |
1-10 мкг/кг в час |
- |
Тримеперидин**# |
N01AH |
0,05-0,2 мг/кг |
0,1-0,2 мг/кг в час |
- |
Морфин** |
N02AA01 |
50-100 мкг/кг |
10-15 мкг/кг в час |
- |
Трамадол** # |
N02AX02 |
1-2 мг/кг |
0,1-0,2 мг/кг в час |
- |
Миорелаксанты |
||||
Пипекурония бромид** # |
M03AC06 |
40 мкг/кг |
10-20 мкг/кг в час |
- |
Атракурия безилат** |
M03AC04 |
0,3-0,6 мг/кг |
0,3-0,6 мг/кг в час |
- |
Рокурония бромид** # |
M03AC09 |
0,6 мг/кг |
0,3-0,6 мг/кг в час |
- |