Терапевтическая стоматология : национальное руководство / под ред. Л. А. Дмитриевой, Ю. М. Максимовского. - 2-е изд., перераб. и доп. - Москва : ГЭОТАР-Медиа, 2021 |
ISBN 978-5-9704-6097-9 |
Аннотация
Второе издание национального руководства по терапевтической стоматологии входит в серию практических руководств по основным медицинским специальностям, включающих всю основную информацию, необходимую врачу для непрерывного дополнительного образования. В настоящем руководстве освещены современные вопросы профилактики, диагностики, фармакотерапии и лечения стоматологических заболеваний в терапевтической стоматологии.
Во второе издание включены гнатологические аспекты комплексного лечения пародонтологических больных, малоинвазивные методы лечения кариеса, новинки в реставрации, методиках коррекции цвета зубов и эндодонтии. Авторами руководства раскрыты актуальные вопросы пародонтологии и болезней периапикальных тканей. В материалы данной книги внесены актуальные для терапевтической стоматологии сведения о зубосохраняющих технологиях, новых аспектах гигиены полости рта.
В подготовке настоящего издания в качестве авторов и рецензентов принимали участие ведущие специалисты-стоматологи страны.
Руководство предназначено врачам-стоматологам, студентам старших курсов медицинских вузов, интернам, ординаторам, аспирантам.
ЦЕЛИ И ЗАДАЧИ ЭПИДЕМИОЛОГИИ
Выявление распространенности, закономерностей возникновения и течения заболеваний пародонта (ЗП) в интересах разработки принципов, методов и средств их профилактики и лечения реализуется в рамках самостоятельного научного направления пародонтологии - эпидемиологии. К основным задачам эпидемиологии ЗП относят:
-
определение медицинской и социально-экономической значимости ЗП, их места в структуре стоматологической заболеваемости населения;
-
выявление факторов риска и изучение распространенности, закономерностей возникновения и течения ЗП во времени (в частности по годам, месяцам), в зависимости от территории и у различных групп населения (например, по возрасту, полу, профессии);
-
разработку прогноза распространенности ЗП. Решение первой задачи предусматривает:
-
определение относительной доли ЗП среди других стоматологических заболеваний и их влияние на уровень здоровья в целом;
-
установление потенциальных социально-экономических потерь населения вследствие этих заболеваний;
-
уточнение места этих заболеваний в зависимости от различных системновлияющих факторов.
По распространенности ЗП занимают второе место в мире после кариеса среди стоматологических заболеваний. Эта патология, особенно воспалительные заболевания пародонта (ВЗП), существенно влияет на уровень здоровья населения в целом. Как очаг хронической одонтогенной инфекции ВЗП могут инициировать соматическую патологию или усугублять её течение. На долю ВЗП приходится около 80% всех ЗП. Финансовые годовые потери населения России вследствие ЗП исчисляют в миллиардах рублей, тогда как в Америке на профилактику и лечение ЗП ежегодно тратится около 5 млрд долларов.
Вторая задача эпидемиологии ЗП включает сбор статистических данных, их анализ и связывание найденных заболеваний с первопричинами. При выявлении закономерностей развития и течения ЗП выделяют группы населения:
Этим группам свойственны как общие, так и специфические закономерности развития, течения, профилактики и лечения ЗП. Среди таких закономерностей:
В пределах третьей задачи различают подзадачи. Это разработка рекомендаций:
-
по организации профилактики и лечения, включая разработку стоматологических программ для мегаполисов, небольших населенных пунктов, отдельных организаций и учреждений (общих рекомендаций);
-
подготовке специалистов-пародонтологов и стоматологических гигиенистов;
-
совершенствованию консервативных и хирургических мероприятий;
-
обеспечению материально-техническими, финансовыми и другими ресурсами. Четвертая задача предполагает разработку методов прогнозирования,
определение исходного пародонтологического статуса населения и параметров развития заболеваний пародонта, получение и анализ прогнозных оценок. Помимо перечисленных задач эпидемиологии ЗП возможно решение и других проблем, с учетом специфик.
АНАТОМИЯ, ГИСТОЛОГИЯ ПАРОДОНТА
Пародонт - комплекс тканей, окружающих зуб, обеспечивающих его фиксацию в челюсти и функционирование. В состав пародонта входят:
Снаружи весь фиксирующий комплекс покрыт десной. Перечисленные структуры пародонта составляют комплекс, единый не только функционально, но и генетически (за исключением десны). Десна - единственная структура пародонта, заметная глазу в норме. Это слизистая оболочка, покрывающая альвеолярные отростки верхней и нижней челюстей (рис. 14-1).
С оральной поверхности десна переходит в слизистую оболочку: на верхней челюсти - твердого нёба, на нижней - дна полости рта. Различают свободную десну (краевую), прилежащую к шейке зуба, и прикрепленную десну (альвеолярную), покрывающую альвеолярный отросток. Краевая десна - наружная стенка десневой бороздки, она окружает шейки зубов. Ширина зоны краевой десны зависит от глубины десневой бороздки. Она неодинакова в области разных групп зубов, но в среднем колеблется от 0,5 мм во фронтальном участке до 1,5 мм в области моляров.
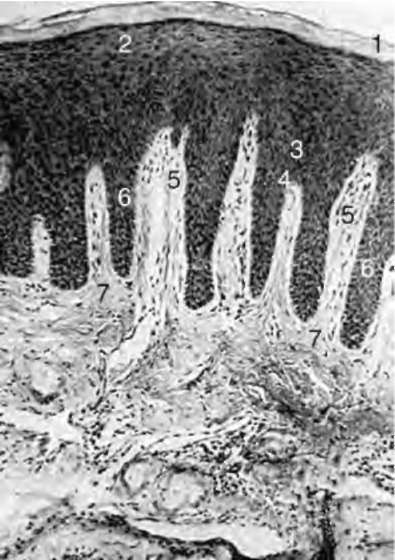
Рис. 14-1. Строение десны человека: 1 - роговой слой эпителия; 2 - зернистый слой; 3 - шиповатый слой; 4 - базальный слой; 5 - соединительнотканные сосочки; 6 - эпителиальные сосочки; 7 - собственная пластинка слизистой оболочки (В.В. Гемонов)
В состав краевой зоны входит и межзубный сосочек. Межзубный десневой сосочек образован соединением вестибулярной и оральной частей десны посредством соединительнотканных волокон, и на поперечном срезе все сосочки имеют вид седла. Форма сосочков в области разных групп зубов различна: во фронтальных участках - треугольная, в боковых - трапециевидная.
Свободная, или краевая, десна граничит с зоной прикрепленной десны. Эта граница на наружной поверхности выглядит как фестончатая, слегка вдавленная линия, которая в основном соответствует дну десневой бороздки. Десна состоит из трех слоев: многослойного плоского эпителия, собственно слизистой оболочки и подслизистого слоя. Зона прикрепленной десны, или альвеолярная десна, лишена подслизистого слоя и срастается с надкостницей. В отличие от кожи, многослойный плоский эпителий десны не имеет блестящего слоя клеток. В нормальных условиях в эпителии десны наблюдаются ороговение и паракератоз, которые обеспечивают защиту от механических, химических и физических воздействий. Этот эпителий называют ротовым (оральным). Кроме того, различают сулькулярный (бороздковый) и соединительный эпителий (эпителиальное прикрепление, рис. 14-2).
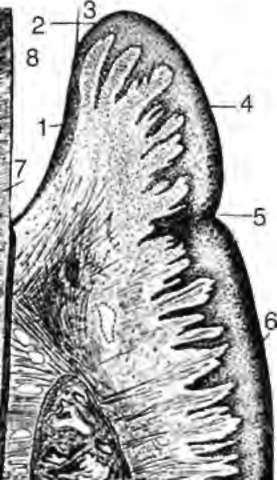
Рис. 14-2. Схема строения десны (В.В. Гемонов): 1 - эпителиальное прикрепление; 2 - дно десневого кармана; 3 - кутикула эмали; 4 - свободная десна; 5 - десневой желобок; 6 - прикрепленная десна; 7 - дентин коронки; 8 - пространство, до декальцинации занятое эмалью
Сулькулярный эпителий выстилает десневую бороздку (сулькус) - щель между поверхностью зуба и прилежащей к ней десной. На дне десневой борозды сулькулярный эпителий переходит в многослойный плоский соединительный эпителий, который прочно сращен с кристаллами гидроксиапатита эмали зуба. По мнению некоторых авторов, природа этой связи химико-физическая: адгезия эпителиальных клеток к поверхности зуба возникает благодаря липким макромолекулам десневой жидкости. Согласно другой точке зрения, поверхностные клетки эпителия прикрепления связаны с кристаллами гидроксиапатита посредством гемидесмосом. В отличие от ротового эпителия, сулькулярный и соединительный эпителии не ороговевают, их клетки способны быстро обновляться. Кроме того, соединительный эпителий обладает высокой проницаемостью, так как представлен несколькими слоями клеток, расположенных вдоль эмали в виде ровной линии, и отличается особым строением кровеносных сосудов подлежащей соединительной ткани: по строению их относят к посткапиллярным венулам.
В клетках эпителия отмечено высокое содержание рибонуклеиновой кислоты (РНК), обеспечивающей высокий уровень обмена белка, митотической активности клеток и регенерации, а также активности ферментов (в частности, сукцинатдегидрогеназы и лактатдегидрогеназы). В итоге митотическая активность соединительного эпителия в 2-4 раза выше таковой эпителия десны. Между клетками эпителия находятся гликозаминогликаны, которые играют роль цементирующего вещества для клеток, обеспечивают нормальный метаболизм и выполняют защитную функцию при воздействии бактерий и их токсинов.
Собственно слизистая оболочка десны представлена рыхлой соединительной тканью непосредственно под эпителием (сосочковый, подэпителиальный слой) и несколько более плотной - в глубоких отделах (сетчатый, надальвеолярный слой). Соединительная ткань собственной оболочки состоит из волокнистых структур, основного вещества и клеточных элементов.
В состав межклеточного (основного) вещества входят белки и полисахариды, образующие комплексы (такие, как протеогликаны и гликопротеины). Значение несульфатированных (например, гиалуроновой кислоты и хондроитина) и сульфатированных протеогликанов (в частности, гепарина и хондроитин-6-сульфата) для соединительной ткани состоит в том, что они обеспечивают трофическую функцию (транспорт воды, солей, аминокислот, липидов и других веществ), придают ткани соответствующие механические свойства (упругость, прочность) и участвуют в репаративных процессах.
Среди волокнистых структур преобладают коллагеновые волокна, состоящие из коллагена I типа. В меньшем количестве присутствуют ретикулярные, незрелые эластические (эластиновые) и аргирофильные волокна (незрелые коллагеновые). Основную часть клеточных элементов составляют фибробласты, несколько меньшую - фиброциты, гистиоциты, плазматические и тучные клетки (лаброциты), а также лимфоциты, моноциты и нейтрофилы. Первостепенная функция фибробластов - образование коллагена и мукопротеидов, содержащих гиалуроновую кислоту и хондроитин-сульфат. Тучные клетки в процессе дегрануляции выделяют гистамин, гепарин и производные арахидоновой кислоты - простагландины, которые имеют большое значение в регуляции функционирования соединительной ткани в норме и при патологии. Гистиоциты (макрофаги), единичные плазматические клетки и лимфоциты - своего рода «дежурные клетки», предназначенные для своевременного уничтожения чужеродных или патогенных веществ, проникающих в ткань десны.
В десне хорошо выражена сеть сосудов микроциркуляторного русла: артериолы, капилляры и венулы, есть артериоловенозные анастомозы. Ведущая роль в поддержании нормального обмена в десне принадлежит капиллярам. Среди нервных элементов присутствуют многочисленные чувствительные окончания в виде петель и клубочков, а также инкапсулированные нервные окончания типа осязательных телец Мейснера или колб Краузе.
Десневая бороздка - важное образование пародонта. Она формируется только после прорезывания зуба. Это не обязательная анатомическая структура, а результат хронического воздействия микроорганизмов на краевой пародонт, с одной стороны, и выхода из подлежащих кровеносных сосудов защитных компонентов плазмы и форменных элементов крови в ответ на такие воздействия - с другой.
Десневая жидкость представляет транссудат, соответствующий по составу сыворотке крови (в частности, ней присутствуют альбумины, глобулины и ферменты), хотя активность некоторых ферментов (например, катепсина В и фосфатазы) в десневой жидкости выше, чем в сыворотке крови. Десневая жидкость содержит антитела IgG, IgA, IgM, а также более 20 сывороточных белков всех девяти компонентов системы комплемента, играющих важную роль в комплексе реакций воспаления (прежде всего, фагоцитозе, хемотаксисе и высвобождении сосудисто-активных веществ). В десневой жидкости обнаружены антимикробные факторы (лизоцим, лактоферрин) и сывороточные белки - альбумины и глобулины. Кислотность (pH) десневой жидкости составляет 6,3-7,9 и зависит от содержания в ней азота и мочевины.
Среди клеточных элементов десневой жидкости преобладают полиморфно-ядерные лейкоциты, есть немного микроорганизмов и слущенных клеток эпителия. При действии раздражителей (жевательного давления или давления щёткой при чистке зубов, но в основном - бактериальных скоплений) объем десневой жидкости увеличивается, и её состав изменяется. Поскольку функциональное значение этих процессов состоит в вымывании либо уничтожении повреждающих агентов, то количество и состав десневой жидкости служат важными диагностическими критериями, отражающими интенсивность агрессии.
Эти особенности свидетельствуют о важности барьерной функции десневой жидкости для пародонта. Самый значимый участок защитного барьера пародонтальных структур от механических, инфекционных и других воздействий - эпителиальное прикрепление, расположенное на границе между эмалево-цементной границей и эпителием дна бороздки.
Периодонт представлен, главным образом, пучками коллагеновых волокон, состоящих из коллагена I типа, которые лежат в периодонтальной щели (между цементом корня и компактной пластинкой альвеолы). Кроме них, присутствует незначительное количество тонких ретикулиновых и незрелых эластических - окситалановых волокон, обычно рыхло расположенных около сосудов. Одним концом коллагеновые волокна прикреплены к цементу корня зуба (рис. 14-3), другим - к костной ткани альвеолы.

Рис. 14-3. Коллагеновые волокна, проникающие в вещество цемента (В.В. Гемонов)
В области шейки зубов и края альвеолярных отростков эти волокна расположены горизонтально, по длине корня - косо, в области верхушек корней - перпендикулярно. Благодаря этому зуб как бы подвешен внутри альвеолы, и давление на него в разных направлениях не передается непосредственно на альвеолярную кость и не повреждает её при сохранности периодонтальных структур. Для периодонта характерно отсутствие эластических волокон, а коллагеновые волокна не способны к растяжению, поэтому их амортизирующий эффект определяется спиралевидными изгибами, что позволяет им при увеличении нагрузки на зуб выпрямляться, а при снижении - снова скручиваться. Именно этим определяется физиологическая подвижность зуба. Между пучками волокон расположена рыхлая соединительная ткань с межклеточным веществом, кровеносными и лимфатическими сосудами и нервными элементами. В этой интерстициальной ткани присутствуют более тонкие коллагеновые волокна, образующие трехмерную сеть. В целом, расположение пучков коллагеновых волокон в боковых отделах периодонтальной щели напоминает гамачную сетку (рис. 14-4).
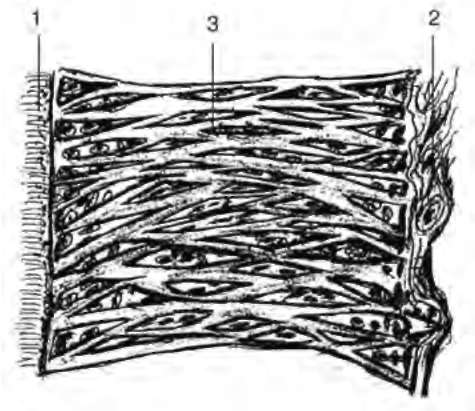
Рис. 14-4. Схема строения коллагеновых волокон периодонта зубов человека (В.В. Гемонов): 1 - цемент корня зуба; 2 - кость альвеолы; 3 - пучки коллагеновых волокон в виде гамачной сетки
Ширина периодонтальной щели неодинакова: наибольшая - в пришеечной и верхушечной области корня зуба (0,24 мм и 0,22 мм), наименьшая - в средней части корня (0,10-0,11 мм). Такая форма, подобная песочным часам, определена адаптацией связочных структур к функциональным нагрузкам.
В средней части периодонта находится зикхеровское сплетение, играющее важную роль в регенерации периодонта при ортодонтических перемещениях зубов. Однако мнение о его происхождении неоднозначно. По мнению некоторых авторов, коллагеновые волокна - не единое образование, напрямую соединяющее корень зуба и кость альвеолы: часть этих волокон начинает формироваться из цемента корня, другая - со стороны альвеолы, обе части доходят до середины периодонтальной щели, где соединяются с помощью менее зрелых коллагеновых волокон. После 25 лет это сплетение исчезает, что важно учитывать при планировании ортодонтического лечения взрослых.
Особенность клеточного состава периодонта - присутствие цементобластов и остеобластов, обеспечивающих построение цемента и костной ткани. В периодонте обнаружены эпителиальные клетки Маляссе, по-видимому, участвующие в образовании кист и опухолей.
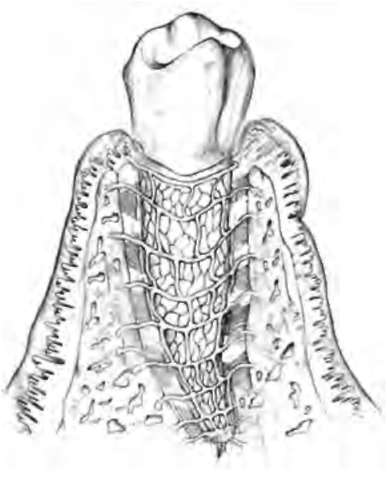
Рис. 14-5. Зуб. Сосудистая сеть (В.В. Гемонов)
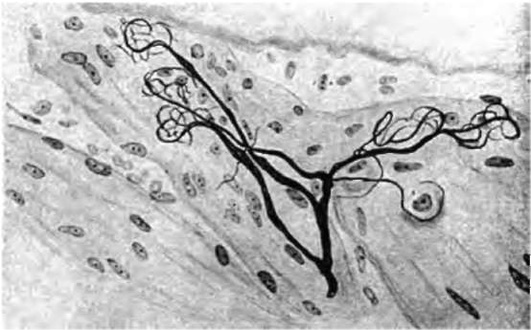
Рис. 14-6. Чувствительное нервное окончание кустикового типа с клубочками на концах терминальных веточек в периодонте латеральной поверхности корня резца. Рисунок. Импрегнация серебром (В.В. Гемонов)
Костная ткань альвеолярного отростка состоит из компактного вещества (система остеонов, костные пластинки), расположенного с оральной и вестибулярной поверхности корней зубов. Между слоями компактного вещества находится губчатое вещество, состоящее из костных трабекул. Костномозговые полости заполнены костным мозгом: красным - в молодом возрасте, и жёлтым жировым - во взрослом. Кроме того, в ткани залегают кровеносные и лимфатические сосуды, а также нервные волокна. Компактное вещество костной ткани альвеолы на всем протяжении корня зуба пронизано системой прободных канальцев, через которые в периодонт проникают кровеносные сосуды и нервы (рис. 14-5, 14-6).
Таким образом, элементы пародонта тесно взаимосвязаны с десной, костной тканью альвеолы и цементом корня зуба посредством соединения коллагеновых волокон периодонта, что обеспечивает многообразие их функций. Нарушение одного из звеньев этого морфофункционального комплекса при патологии ведет к изменениям в нескольких или во всех структурах пародонта.
БИОТИПЫ ПАРОДОНТА
В современной стоматологии большое внимание уделяется методам хирургического лечения косметических дефектов, возникающих вследствие воспалительной деструкции тканей пародонта. Развитие и прогрессирование хронического пародонтита, как правило, проходит бессимптомно и незаметно для больного. Обычно пациенты обращаются к врачу-пародонтологу на поздних стадиях заболевания при явных его признаках: патологическая подвижность, деформация зубных рядов. Однако у многих пациентов хронический пародонтит приводит к формированию косметических дефектов, таких, как множественные рецессии десны. Течение хронического пародонтита, выраженность воспаления, степень и быстрота деструкции напрямую зависят от местных анатомо-физиологических особенностей тканей пародонта. Один из критериев оценки морфофункциональных параметров пародонта - биотип. Все больше среди населения встречается тонкий биотип пародонта, который является неблагоприятным фактором, способствующим более агрессивному течению пародонтита. Как следствие растет число обращаемости данной группы населения за специализированной пародонтологической помощью, направленной на лечение основной жалобы - обнажение поверхности корня, рецессия десны.
Исторически термин «биотип пародонта» был введён Ochsenbein в 1969 г. На основании таких критериев, как: высота и ширина коронок зубов, толщина альвеолярной кости и десны, а также величина зоны прикрепленной десны, - им было предложено выделять два биотипа пародонта, встречающихся у населения: тонкий и толстый. Тонкий биотип имеет высокие и узкие коронки зубов, малую зону прикрепленной десны (рис. 14-8, см. цв. вклейку), множественные дигисценции (щелевидные дефекты альвеолярной кости с обнажением корня) и фенестрации корней (дефекты в виде окна). Толстый биотип, как правило, имеет короткие и широкие коронки зубов, большую зону прикрепленной десны (рис. 14-7, см. цв. вклейку), маргинальный костный контур массивный, десна имеет более выраженный фиброзный слой. По распространенности среди населения, тонкий биотип пародонта встречается у 15% населения, толстый - 85%. По данным Петровой, распространенность дигисценции корней (тонкого биотипа) составляет в среднем 20%.
Формирование биотипа пародонта
Можно выделить несколько факторов, предрасполагающих к формированию того или иного биотипа пародонта.
Учитывая онтогенетическую общность пародонта и твердых тканей зуба, ряд авторов считают, что биотип пародонта формируется в зависимости от анатомии зубов. Иначе говоря, утолщенные корни зубов, широкие и низкие коронки зубов предрасполагают к толстому биотипу, а узкие и высокие коронки зубов и утонченные корни - к тонкому. Oh и соавт., исследуя КТ-срезы фронтального отдела нижней челюсти у 800 пациентов, доказали, что при высоких и узких коронках зубов наблюдается дефицит костной ткани с вестибулярной стороны. Причиной, по которой форма и размер зубов предопределяет костный контур альвеолярной кости, служит то, что в процессе эмбрио- и онтогенеза человека стимулирование развития и роста альвеолярной кости идет за счет механических микроимпульсов, передаваемых от зуба к кости - так называемое явление механотрансдукции. Таким образом, чем больше форма и размер зубов, окклюзионная нагрузка, тем больше будут механическое стимулирование роста кости и склонность к формированию толстого биотипа.
Форму того или иного биологического объекта предопределяет его функция. Изменившийся характер питания человека, с преобладанием мягкой пищи и особенно фастфуда, способствует увеличению распространенности среди населения тонкого биотипа пародонта и относительному недоразвитию зубочелюстной системы в целом.
Причиной системного нарушения кальциево-фосфорного обмена костной ткани, приводящей к задержке развития челюстных костей, могут быть гормональный дисбаланс, недостаточность питания. Так, у мальчиков с 13 до 18 лет наступает период активного роста скелета, который совпадает с периодом минерализации альвеолярной кости. В это время растет потребление белков, микро- и макроэлементов. При недостаточном потреблении этих веществ замедляются или нарушаются процессы минерализации и роста альвеолярной кости. Период активного роста опорного скелета у девочек протекает с 10 до 14 лет, минерализация альвеолярной кости продолжается до 20 лет. Нарушение менструальной функции из-за недостаточной выработки эстрогенов способствует торможению процессов остеосинтеза остеобластами органического матрикса кости и последующей минерализации. Как следствие, у данной группы пациентов формируется тонкий, слабоминерализованный альвеолярный отросток, тонкий биотип, более подверженный воспалительной деструкции в раннем возрасте.
Воспаление и биотип пародонта
Пародонт в зависимости от своего биотипа по-разному реагирует на воспалительное повреждение, оперативное вмешательство, ортодонтическое лечение. Толщина вестибулярной костной пластинки определяет клиническое течение пародонтита. Воспалительная деструкция костной ткани - длительный процесс, развивающийся годами. Накопление таких провоспалительных факторов, как ИЛ-1, ФНОα, способствует образованию остеокластов и усилению резорбции костной ткани. Естественно, скорость этой резорбции, приводящей к клиническим признакам пародонтита, напрямую зависит от объёма костной ткани челюсти. Воспаление в костной ткани при развитии пародонтита в условиях толстого биотипа сопровождается образованием локальных пародонтальных карманов (рис. 14-9, см. цв. вклейку), резорбция альвеолярной кости и потеря клинического прикрепления при тонком биотипе проявляются в виде рецессий десны (рис. 14-10, см. цв. вклейку). Таким образом, при тонком биотипе пародонта, когда имеется дефицит костной ткани, течение пародонтита носит более агрессивный характер вследствие ускоренной альтерации тканей. Прогноз лечения хронического пародонтита в данном случае более неблагоприятным.
Wise и соавт. наблюдали более высокие репаративные способности толстого биотипа пародонта. Любое хирургическое вмешательство на тканях пародонта протекает более благоприятно и предсказуемо при толстом биотипе. Высокие и узкие межзубные перегородки альвеолярного отростка тонкого биотипа более подвержены резорбции после операционной травмы. Из этого следует, что при тонком биотипе сложнее воссоздать эстетические параметры десны: межзубной сосочек, ровную линию маргинальной десны. В прогнозе дентальной имплантологии, альвеолярный отросток тонкого биотипа, после удаления зубов, сильнее подвержен резорбции. Рекомендуется проводить удаление зубов при тонком биотипе как можно атравматичнее, используя периотом, технику разделения корней и слабые вывихивающие движения.
По данным литературы, форсированные нагрузки при ортодонтическом лечении пациента с тонким биотипом - один из основных ятрогенных факторов, приводящих к формированию множественных рецессий. В ответ на механическую нагрузку, создаваемую ортодонтическим аппаратом, формируется асептическое воспаление в костной ткани, что способствует её динамической перестройки, в которой процесс костеобразования находится в равновесии с процессами резорбции. Форсированная нагрузка приводит к нарушению цикла ремоделирования, преобладанию резорбции над костеобразованием. И если при толстом биотипе достаточный объем костной ткани не приводит к каким-либо функциональным нарушения, то при тонком биотипе происходит усиленное прогрессирование и так имеющихся дигисценций и фенестраций корней. В некоторых случаях форсированная бесконтрольная ортодонтическая нагрузка на пародонт приводит к фактически полному выдвижению корней зубов из альвеолярного отростка челюсти.
Концепция патогенеза хронического пародонтита в условиях тонкого биотипа пародонта
Предрасполагающие генетические и онтогенетические факторы приводят к формированию тонкого биотипа пародонта (рис. 14-11).
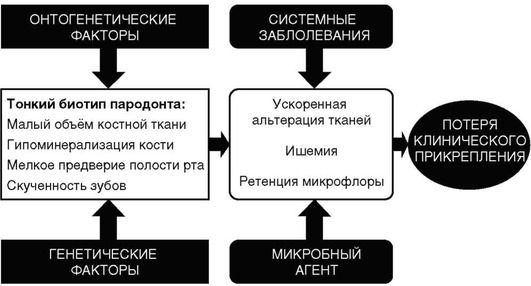
Рис. 14-11. Факторы, влияющие на развитие тонкого биотипа пародонта
Тонкий биотип имеет характерные клинические признаки, способствующие патогенезу воспалительной деструкции тканей пародонта: малый объем костной ткани ее гипоминерализация (остеопения) способствует ускоренной альтерации, мелкое преддверие полости рта формирует локальную ишемию и, так же как и скученность зубов, способствует ретенции и росту микробного агента. Неблагоприятные анатомо-физиологические особенности при тонком биотипе, относительное увеличение количества пародонтопатогенных микроорганизмов в комплексе с возможным отягощением системной патологией приводят к воспалительной деструкции тканей пародонта, потере клинического прикрепления, формированию рецессий десны.
Лечение хронического пародонтита в условиях тонкого биотипа пародонта. Как правило, в придесневой области зубов с рецессиями имеются зубные отложения. Накоплению и ретенции налета способствует микрошероховатость обнаженной поверхности корня. Основным методом лечения рецессий является нормализация гигиенического состояния придесневой области. Рядом авторов доказано, что без адекватной гигиены полости рта невозможно достичь хороших результатов с применением методов закрытия поверхности корня. Из этого следует, что данной группе пациентов рекомендовано регулярное проведение профессиональной гигиены полости рта, планирование каких-либо хирургических вмешательств должно проводиться только после приобретения пациентом эффективных и рутинных для него гигиенических навыков.
Как уже указывалось выше, при тонком биотипе пародонта, как правило, имеется дефицит зоны прикрепленной десны. Биологическая сущность этой зоны состоит в том, что она блокирует механическое воздействие мимической мускулатуры на придесневую область. По данным Грудянова и соавт., мелкое преддверие полости рта (МППР) является одним из основных факторов в патогенезе рецессий десны в области естественных зубов. Также установлено, что MППР приводит к хронической ишемии тканей пародонта, что сопровождается нарушением ее трофики, защитной антимикробной способности, ввиду нарушения транспорта форменных элементов крови и компонентов плазмы.
Потеря клинического прикрепления приводит к локальной утрате зоны прикрепленной десны. При развитии пародонтита в условиях тонкого биотипа прикрепленная десна полностью утрачивается в области нескольких зубов. Комплексное лечение множественных рецессий десны должно включать пластику преддверия полости рта, так как это предопределяет дальнейший прогноз результата лечения. После проведения любого хирургического метода устранения рецессии десны должна быть сформирована адекватная зона прикрепленной десны, которая будет препятствовать моменту натяжения и ишемии придесневой области, ретракции маргинальной десны, облегчать проведение индивидуальной гигиены полости рта.
Основное клиническое проявление ХП в условиях тонкого биотипа - рецессия десны. Как правило, у данной группы пациентов рецессии десны носят генерализованный характер. По степени на ранних стадиях наблюдаются рецессии 1-2-го класса по Миллеру, при прогрессировании потери клинического прикрепления в аппроксимальной области формируются рецессии 3-4-го класса.
Поскольку при ХП в условиях тонкого биотипа имеются генерализованные рецессии и дефицит зоны прикрепленной десны, наиболее приемлемым представляется метод хирургической коррекции мелкого преддверия полости рта (по методу Эдлана-Mейхера в модификации Шмидта) с одномоментным устранением рецессий десны (по конвертному методу Raetzke).
Метод позволяет сформировать адекватную зону прикрепленной десны. Однако все двухслойные методы имеют один существенный недостаток: они не устраняют саму дигисценцию, т.е. костные дефекты вестибулярной поверхности альвеолярного отростка челюстной кости, которые являются первопричиной приводящей к рецессии десны. Величина дефекта альвеолярного отростка полностью коррелирует с классом рецессии десны: чем выше класс, тем больше костный дефект. Таким образом, целью устранения костного дефекта является не только устранение косметического дефекта, но и восстановление анатомо-физиологической целостности тканей пародонта, что во многом предопределяет долгосрочный прогноз лечения.
В целом лечение ХП в условиях тонкого биотипа пародонта должно быть направлено на устранение нескольких патофизиологических факторов: косметических дефектов (множественных рецессий), мелкого преддверия полости рта, костных дефектов альвеолярного отростка. Тонкий биотип не является самостоятельной нозологией, что не требует проведения «профилактических» оперативных вмешательств. Следует отдать предпочтение трехслойной методике при наличии у пациента обширных дефектов вестибулярной пластинки альвеолярного отростка челюсти. Многослойные методики закрытия рецессий десны с одномоментной пластикой преддверия полости рта, позволяющие устранить патофизиологические факторы тонкого биотипа, показали свою клиническую эффективность. Данные методы не являются нововведениями в пародонтологии и представляют собой модификацию общепринятых методов пластики преддверия полости рта и устранения рецессий. Методы не требуют специального оснащения, просты в исполнения, что создает перспективу их использования в клинической практике.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ И АЛГОРИТМ ЛЕЧЕНИЯ БОЛЕЗНЕЙ ПАРОДОНТА
К05 Гингивит и болезни пародонта
Включена: болезнь беззубого альвеолярного края.
Гингивит является самостоятельной нозологической единицей и относится к воспалительным формам заболеваний пародонта. Он характеризуется развитием ограниченного патологического процесса в тканях десны.
К05.0 ОСТРЫЙ ГИНГИВИТ
Исключены: острый перикоронит (К05.22); острый некротизирующий язвенный гингивит (фузоспирохетозный гингивит) (гингивит Венсана) (А69.10); гингивостоматит, вызванный вирусом простого герпеса (В00.2Х)
Воспаление десны при остром гингивите редко носит специфический характер, клинически и морфологически развивается так же, как в других органах и тканях, сопровождается болью, гиперемией, отёчностью, отсутствием пародонтальных карманов и отсутствием резорбции костной ткани на рентгеновском снимке.
Причинные факторы: микробный, механическая, химическая, физическая травма и др. Под влиянием токсинов пародонто-патогенных микроорганизмов и местной травмы развивается первоначальное острое воспаление, или острый гингивит.
К05.00 Острый стрептококковый rинrивостоматит
Стрептококковый гингивит, или гингивостоматит, - воспалительное заболевание десны, которое развивается у пациентов на фоне системной стрептококковой инфекции или может возникнуть в результате прямого заражения. Обычно заболеванию предшествует ангина.
Заболевание протекает остро с повышением температуры тела, общим недомоганием, клинически в полости рта выявляются резкая гиперемия и отёк, болезненность слизистой оболочки десны, миндалин; могут образовываться десневые абсцессы. Определяются обильные зубные отложения - мягкий зубной налет, который может быть вторичным в результате ухудшения индивидуальной гигиены на фоне болезненной десны.
Считается, что данная форма гингивита развивается у детей с хроническим тонзиллитом.
Лечение основано на терапии основного заболевания, а также в создании адекватных условий для проведения индивидуальной гигиены рта с использованием ультрамягкой зубной щетки, проведении профессинальной гигиены рта.
К05.08 Другой уточненный острый гингивит
Эта форма гингивита представляет собой острое воспаление десны, чаще всего возникающее под действием травмы зубочисткой, зубным флоссом, жесткой зубной щеткой, при приеме твердой пищи или аллергическую реакцию на различные медикаменты, пломбировочные материалы, слепочную массу, ожог мономер, зубные пасты, пищевые агенты и побочные причины.
Диагностика заболевания основывается на жалобах и на анамнестических данных пациента с целью выявления аллергена.
Клиническая картина. Жалобы и анамнез позволяют поставить диагноз и установить причину острого воспаления и не допустить трансформацию в хронический процесс. Характерны боль в области нанесения травмы, гиперемия, отек окружающих тканей, усиливающиеся при касании языком, болезненность.
Лечение. В основном сопряжено с устранением этиологического фактора и назначением симптоматических средств и антидота в соответствии с причиной. При этом следует учитывать информацию об общесоматическом состоянии пациента и лечении в этой связи.
К05.09 Острый гингивит неуточненный
Используется для кодирования случаев клинического проявления острого гингивита с неопределенной причиной.
Диагноз ставится на основании признаков, характерных для диагноза К05.08, при невозможности выявления причины.
При курации пациентов требуются проведение общесоматического обследования и назначение соответствующей терапии.
К05.1 ХРОНИЧЕСКИЙ ГИНГИВИТ
По данным многочисленных исследований, биопленка является прямой причиной хронических воспалительных процессов в пародонте, в том числе хронического гингивита. Первичное повреждение тканей десны обусловлено действием пародонтопатогенной флоры. Особую роль при этом играют микробные ферменты (гиалуронидаза, хондроитинсульфатаза и коллагеназа), способные разрушать эпителиальные мембраны и соединительнотканные структуры слизистой оболочки десны.
К05.10 Простой маргинальный (катаральный) гингивит
В отечественной классификации называется катаральный гингивит.
Через 1-2 нед от момента запуска патологии воспаление принимает характер хронического со всеми клинико-морфологическими признаками простого маргинального гингивита (рис. 14-12, см. цв. вклейку).
Гингивит развивается лишь в том случае, когда основной этиологический фактор (микробный) находит соответствующее отражение в организме больного.
Патогенез. При хроническом воспалении в десне обнаруживают многочисленные В-лимфоциты и плазматические клетки. Чем тяжелее течение заболевания, тем выше содержание В-лимфоцитов и плазматических клеток, продуцирующих IgG, IgA, IgM.
Эта стадия воспаления характеризуется преобладанием в клеточном инфильтрате плазматических клеток, которые отражают иммунный ответ на повреждение.
Плазматические клетки составляют до 80% всех клеток экссудата. Это свидетельствует о хронизации воспаления и активном вовлечении иммунных механизмов воспаления. Плазматические клетки - это конечный этап развития В-лимфоцитов, они обеспечивают гуморальный иммунитет путем активной выработки иммуноглобулинов. В очагах поражения пародонта количество плазматических клеток нарастает пропорционально тяжести процесса и степени разрушения тканей.
Клиническая картина, диагностика. Характерные признаки простого маргинального гингивита:
-
заболевание чаще выявляют у детей и подростков или у лиц молодого возраста;
-
десна цианотична, отёчна или в области всех зубов, или нескольких зубов;
-
в зависимости от интенсивности воспаления отмечается разная степень кровоточивости, но зондовая проба на кровоточивость всегда положительная;
-
имеется неминерализованный зубной налёт и/или зубной камень;
-
на рентгенограмме нет признаков деструкции межальвеолярных перегородок;
Жалобы при простом маргинальном гингивите весьма скудны. В большинстве случаев больные долгое время не подозревают о наличии заболевания, так как начало гингивита обычно не сопровождается значительной болью и другими неприятными симптомами. Главным же симптомом является кровоточивость десны, но пациенты обычно с этим справляются сами: они либо вообще перестают чистить зубы, либо начинают пользоваться мягкой щёткой, полоскать полость рта настоями трав и т.д. Поскольку в большинстве случаев кровоточивость либо спонтанно, либо под действием предпринимаемых мер прекращается или значительно уменьшается, то пациенты редко обращаются к врачу самостоятельно. Обычно лечение рекомендует врач-стоматолог. Иногда обратиться к специалисту заставляет появление запаха изо рта.
Клинико-лабораторные методы диагностики. Для объективизации местного статуса при простом маргинальном гингивите используют несколько показателей. Количество микробного налёта определяют по величине его скопления в пришеечной области - по индексу Силнеса-Лоэ (Silness J., Loe H., 1964) или по гигиеническому упрощенному индексу Грина-Вермильона (Green J.C, Vermillion J.R., 1967). Интенсивность воспаления определяют с помощью папиллярно-маргинально-альвеолярного индекса (Shour J., Massler M., 1947, в модификации Parma C., 1960) или индекса кровоточивости Mюлеманна (Muhlemann H.R., 1971, в модификации Cowell J., 1975), с помощью зондовой пробы.
Для практических врачей этих показателей достаточно. В научных целях представляет интерес изучение состояния микроциркуляторного русла десны методом витальной микроскопии, реопародонтографии, лазерной допплеровской флоуметрии; напряжения кислорода (рО2) в десне - методом полярографии; количественного и качественного состава десневой жидкости.
При клиническом анализе в крови не выявлены специфические изменения, характерные для простого маргинального гингивита. Только изучение капиллярной крови десны позволяет выявить определенные изменения уже в начальных стадиях воспаления (увеличение содержания полиморфно-ядерных лейкоцитов, иммуноглобулинов, интерлейкинов, белковых фракций комплемента и др.) по сравнению с показателями периферической крови. Однако для практиков это не представляет интереса.
Рентгенологически изменения костной ткани на ранних стадиях развития гингивита отсутствуют (компактная пластинка межзубных перегородок сохранена). Однако при хронизации процесса или его обострении в верхушках межзубных перегородок определяют мелкие очаги остеопороза, которые обычно исчезают после проведенного лечения или самостоятельно в случае ремиссии.
Простой маргинальный гингивит дифференцируют от гипертрофического (его отечной формой), пародонтита лёгкой степени, проявлений на десне некоторых дерматозов - плоского лишая, пузырчатки и др.
Лечение. Лечение больных простым маргинальным гингивитом должно включать в первую очередь устранение главной причины воспаления - зубных отложений. Затем необходимо устранить местные факторы, которые способствуют усиленному скоплению зубного налёта; восстанавить контактные пункты, запломбировать пришеечные полости, преимущественно с применением светоотверждаемых композитов либо керамических вкладок.
Пациента обучают правилам чистки зубов и проводят контролируемую чистку зубов. С помощью красителей для индикации налёта пациенту демонстрируют микробные скопления до чистки и оставшиеся после чистки плохо очищенные участки. Индивидуально рекомендуют средства гигиены: зубные щётки с мягкой щетиной, флоссы, межзубные ёршики, ирригаторы, а также пасты и полоскания. Контроль выполнения правил гигиены рта проводят неоднократно до получения желаемого результата - отсутствия бактериального налёта. В процессе лечения целесообразно после чистки зубов назначать пациенту полоскания растворами листеринаρ хлоргексидина, асепты♠ в концентрации от 0,05 до 0,3% по 1 мин 2 раза в день в течение не более 7-10 дней.
Профессиональную гигиену рта проводят с использованием ультразвукового оборудования и ручных инструментов-скелеров и кюрет, завершают полированием поверхности зуба специальными пастами, содержащими абразивы с помощью щёточек, пластиковых головок и механического наконечника.
Если же и после профессиональной гигиенической обработки сохраняются гиперемия и отечность десны, следует использовать медикаментозные средства воздействия на конкретные проявления, как правило, это противовоспалительные препараты, нормализующие сосудистую проницаемость и устраняющие отёчность тканей, т.е. воздействовать на патогенетические механизмы воспалительной реакции: ингибиторы простагландинов (3% ацетилсалициловую, индометациновую, бутадионовую мазь♠ и др.) - противовоспалительные средства нестероидного ряда, которые не снижают устойчивости тканей к инфекции; антиоксиданты и антигипоксанты - мексидол-гель♠, троксерутин, гепариновая мазь♠. В целях нормализации процессов коллагенообразования и тканевого метаболизма наряду с перечисленными лечебными повязками и лечебно-профилактическими пастами и полосканиями бывает оправдано назначение внутрь витаминных комплексов. Желательно минимизировать мягкую, богатую сахарами пищу и липкие продукты - во избежание усиленного скопления бактериальных бляшек. Однако следует помнить, что это не имеет значения при условии, если после приема пищи пациент будет тщательно чистить зубы.
Не менее 2 раз в год пациенты должны проходить профилактический осмотр, в процессе которого проводят профессиональную гигиену и контроль чистки зубов.
Своевременная диагностика и адекватное лечение простого маргинального гингивита при условии мотивированного ухода за полостью рта, как правило, обеспечивают излечение без остаточных явлений и предупреждают переход воспалительного процесса в другую форму - пародонтит.
K05.11 ГИПЕРПЛАСТИЧЕСКИЙ (ГИПЕРТРОФИЧЕСКИЙ) ГИНГИВИТ
В отечественной классификации рассматривается как гипертрофический гингивит.
Гиперпластический гингивит представляет собой хронический воспалительный процесс в десне с преобладанием пролиферации и встречается у 3-5% лиц с заболеваниями пародонта. Различают отёчную (которая встречается чаще) и фиброзную формы.
Этиология. Причины возникновения гиперпластического гингивита могут быть как общими, так и местными, но чаще к заболеванию приводит их сочетание. Главное место отводят гормональным нарушениям. Выделение как самостоятельных форм гиперпластического юношеского и гингивита беременных не очень убедительно, так как не сами по себе юность или беременность являются причиной гингивита, а соответствующие местные метаболические изменения под влиянием эндокринных сдвигов в эти периоды при обязательном наличии микробных скоплений. Играет роль наследственная предрасположенность, побочное действие некоторых препаратов, применяемых для лечения эпилепсии (фенитоин - дифенин♠, вальпроевая кислота - депакин♠ и др.), иммуносупрессоров (циклоспорин), а также блокаторов кальциевых каналов - при тяжёлом течении гипертонической болезни или при заболеваниях сердца (нифедипин, дилтиазем) и др.
В качестве местных факторов в развитии гиперпластического гингивита могут выступать аномалии развития зубочелюстной системы (глубокий прикус, глубокое резцовое перекрытие, скученность зубов, ротовое дыхание и др.).
Очаговый гиперпластический гингивит наблюдают при механической травме десны краем разрушенного зуба, при наличии нависающих краев пломбы и искусственных коронок, пришеечных кариозных полостей. В этих случаях пролиферативный процесс развивается как следствие действия раздражителя небольшой силы в течение длительного времени.
Гиперпластическому гингивиту, как и язвенному, как правило, предшествует хронический простой маргинальный гингивит. Под действием перечисленных выше факторов воспаление в десне приобретает хронический характер. В морфологической картине заболевания преобладает процесс пролиферации.
Клиническая картина. Ведущий признак гиперпластического гингивита - необычный вид десны вследствие её разрастания, деформации межзубных десневых сосочков и маргинальной десны. При фиброзной форме такое состояние не сопровождается кровоточивостью десны и неприятными ощущениями, при отечной форме пациенты указывают на кровоточивость при чистке зубов, приеме пищи, реже спонтанную кровоточивость, иногда - незначительные болевые ощущения. Десневые сосочки и десневой край не только гипертрофированы, но и гиперемированы.
При этом целостность зубодесневого соединения не нарушена, определяются лишь ложные карманы. Степень гипертрофии определяется по следующей шкале: до 1/3 коронки - легкая; до 1/2 - средняя, свыше 1/2 высоты коронки - тяжелая.
Разрастание десны в ряде случаев либо частично, либо даже полностью исчезает после устранения этиологических факторов - микробной биопленки, а также по завершении ортодонтического лечения, после замены пломб, нормализация гормонального цикла, отмены или замены препаратов, после родов. При обеих формах особенно важны регулярные курсы профессиональной гигиены в сочетании с качественной индивидуальной гигиеной полости рта пациентов.
Диагностика гиперпластического гингивита основана на необычном виде десны и не вызывает затруднений. Наблюдается скопление зубного камня и мягкого микробного налета. Из методов исследования могут быть использованы индексы: воспаления и гигиены; рентгенография. На рентгенограмме обычно изменений нет, либо на них определяют остеопороз верхушек гребней при хронизации процесса, как и при других видах гингивита.
Дифференциальная диагностика. Дифференциальную диагностику гиперпластического гингивита следует проводить с фиброматозом десен, лейкемией (специфическая гиперплазия десны при хроническом лейкозе), разрастанием десны при пародонтите. Очаговую форму следует дифференцировать от эпулиса.
Лечение. Лечение заключается в выявлении ведущего этиологического фактора и ликвидации или уменьшении его патогенного действия и частичном или полном устранении гипертрофии десны.
Подходы к лечению фиброзной и отечной форм гингивита несколько различны. При отёчной форме гиперпластического гингивита независимо от этиологического фактора обязательны тщательное удаление зубных отложений, устранение ретенционных факторов, обучение гигиене рта и контроль её выполнения, использование местных противовоспалительных препаратов. Среди препаратов отдают предпочтение нестероидным противовоспалительным, противоотечным и нормализующим микроциркуляцию средствам.
При сохранении гипертрофии десны проводят гингивэктомию. При её планировании следует иметь в виду, что юношам и девушкам в пубертатном возрасте, беременным без крайней нужды её проводить не следует, так как реактивные разрастания десны уменьшаются или исчезают полностью после родов, устранения аритмии гормонального цикла и др.
К05.12 ЯЗВЕННЫЙ ГИНГИВИТ
Исключен: некротизирующий язвенный гингивит (А69.10).
Язвенные поражения слизистой оболочки десны встречаются в результате манифестирования различных соматических заболеваний (ВИЧ-инфекции, так же известной, как линеарная эритема, различных заболеваний крови). СПИД-ассоциированный гингивит возникает в связи с наличием ряда оппортунистических инфекций (кандидоз, лимфоаденопатия). Клиническая картина характеризуется заметно выраженной гиперемией маргинальной десны и петехиальным кровоизлиянием и изъязвлением слизистой оболочки. Локализуются поражения преимущественно во фронтальном отделе зубного ряда.
Они могут быть вызваны приемом лекарственных препаратов, а также могут свидетельствовать о злокачественном поражении слизистой оболочки полости рта, включая десну (эпителиальная карцинома).
К05.13 ДЕСКВАМАТИВНЫЙ ГИНГИВИТ
Десквамативный гингивит связан с проявлениями различных дерматозов в полости рта, к которым относятся красный плоский лишай, красная волчанка, пемфигус и др.
Десквамативный гингивит на фоне красного плоского лишая чаще встречается у женщин в постклимактерическом периоде. Элементы поражения, характерные для данного заболевания, локализуются на десне. Слизистая оболочка десны имеет бляшкообразные багровые образования без поверхностного эпителия, плотные при пальпации и легко кровоточащие при зондировании. Пациенты отмечают повышенную чувствительность к солёной и острой пище. Одним из дифференциально-диагностических признаков этого заболевания является отсутствие эффекта или даже ухудшение состояния слизистой оболочки в ответ на традиционную терапию гингивита (например, полоскание хлоргексидином).
Клиническая картина десквамативного поражения слизистой оболочки десны при красной волчанке незначительно отличается от других дерматозов. При заболевании наблюдаются резкая дилатация сосудов, атрофия эпителия, акантоз, гипер- и паракератоз. При заболевании наблюдают резкую гиперемию с участками ороговения и атрофическим центром.
К05.18 ДРУГОЙ УТОЧНЕННЫЙ ХРОНИЧЕСКИЙ ГИНГИВИТ
Другие причины, способствующие развитию хронического гингивита, могут быть вызваны гормональным дисбалансом. Гингивит беременных, например, связан с наличием некоторых бактерий (Prevotella intermedia, Prevotella melanogenica, Bacteroides subspecies) в зубном налёте, а эстроген и прогестерон способствуют повышению проницаемости стенки сосудов, усиливается синтез медиаторов воспаления.
Межменструальный, менструальный и климактерический гингивиты возникают также вследствие колебания уровня или снижения эстрогена, что приводит к уменьшению кератинизации десны и потере ороговевающего слоя слизистой оболочки десны, выполняющего защитную функцию.
Подростковый гингивит также связан с гормональным фоном, но может ассоциироваться с неудовлетворительной гигиеной и ротовым дыханием.
Некоторые исследователи среди причин развития хронического гингивита выделяют так называемый пилюльный гингивит, причиной которого является длительный приём противозачаточных средств (прогестерона). Кроме этого, другие группы лекарственных препаратов вызывают хроническое воспаление десны: антиконвульсанты, средства для лечения сердечно-сосудистых заболеваний, иммунодепрессанты. Медикаментозный гингивит может проявляться как в виде гиперемии десны иногда с геморрагическими высыпаниями, без выраженного отека. При присоединении бактериальной инфекции появляются отёк и дилатация сосудов.
Гингивит при интоксикации ртутью. По краю десны отмечается черная кайма, в некоторых случаях возможно появление изъязвлений. Пациенты отмечают металлический привкус во рту и гиперсаливацию. Наблюдаются также общие симптомы интоксикации.
Гингивит при интоксикации свинцом. По краю десны отмечается серая кайма, воспаление развивается в результате отложения соединений свинца в стенках сосудов. Проявлениям в полости рта могут сопутствовать симптомы интоксикации, как например: анемия, почечная колика, параличи периферических нервов, неврозы.
К05.19 ХРОНИЧЕСКИЙ ГИНГИВИТ НЕУТОЧНЕННЫЙ
Используется для кодирования случаев клинического проявления хронического гингивита в результате другой неясной этиологии.
К05.2 ОСТРЫЙ ПАРОДОНТИТ
Острый пародонтит возникает относительно редко. Чаще всего он является следствием острой травмы челюстно-лицевой области (ушиб, удар, подвывих, вывих зубов, перелом челюстей), приводящей к разрыву периодонтальной связки зуба. Острый травматический пародонтит часто наблюдают у детей раннего, младшего школьного возраста. Зубы подвижны, вертикальная и горизонтальная перкуссия резко болезненна. Визуально определяется ограниченная зона гиперемии, отека десны, нередко с нарушением целостности эпителия и соединительной ткани, наличием кровоизлияний. Присоединение вторичной инфекции может привести к развитию острого язвенно-некротического, реже - гнойного воспаления. В таких случаях нарастает боль, увеличивается отёк тканей. Десневые сосочки, края раны изъязвляются. Подчелюстные лимфатические узлы увеличиваются, пальпация их болезненна. Иногда может сопровождаться образованием пародонтального абсцесса.
К05.20 ПЕРИОДОНТАЛЬНЫЙ АБСЦЕСС (ПАРОДОНТАЛЬНЫЙ АБСЦЕСС) ДЕСНЕВОГО ПРОИСХОЖДЕНИЯ БЕЗ СВИЩА. ПЕРИОДОНТАЛЬНЫЙ АБСЦЕСС ДЕСНЕВОГО ПРОИСХОЖДЕНИЯ, НЕ СВЯЗАННЫЙ СО СВИЩОМ
Исключены: острый апикальный периодонтит пульпарного происхождения (К04.4); острый периапикальный абсцесс пульпарного происхождения (К04.6; К04.7).
К05.21 ПЕРИОДОНТАЛЬНЫЙ АБСЦЕСС (ПАРОДОНТАЛЬНЫЙ АБСЦЕСС) ДЕСНЕВОГО ПРОИСХОЖДЕНИЯ СО СВИЩОМ
Исключены: острый апикальный периодонтит пульпарного происхождения (К04.4); острый периапикальный абсцесс пульпарного происхождения (К04.6; К04.7).
Пародонтальный абсцесс - это очаговое гнойное воспаление в тканях пародонта. В большинстве случаев причиной возникновения пародонтального абсцесса является нарушение оттока экссудата из глубокого пародонтального кармана. Экссудат, скапливаясь в замкнутом пространстве, приобретает гнойный характер, слизистая оболочка десны отекает, краснеет, появляется округлое выбухание. Все это способствует активному лизису окружающих тканей. Пациент жалуется на появление дискомфорта, затем боль в области поражённого участка, иногда может иррадиировать по ходу нервных окончаний. Пародонтальные абсцессы имеют тенденцию самостоятельно дренироваться через свищ либо через маргинальную десну (рис. 14-13, 14-14, см. цв. вклейку).
Лечение. При наличии пародонтального абсцесса без свища после тщательной антисептической обработки полости рта выполняют инфильтрационную или проводниковую анестезию. Затем широкую серповидную гладилку вводят в пародонтальный карман и дренируют абсцесс, продвигая инструмент в медиальном, дистальном, апикальном направлениях. Пародонтальный карман тщательно промывают антисептиком и выполняют кюретаж. При поражении моляров с вовлечением фуркации и образованием глубокого пародонтального кармана абсцесс может локализоваться под надкостницей. В таком случае необходимо сделать разрез для осуществления дренажа. Пациенту назначают нестероидные противовоспалительные средства внутрь, для полоскания и ротовых ванночек рекомендуют хлоргексидин, мирамистин, гексэтидин.
При интоксикации из средств общего воздействия следует отдавать предпочтение сочетанию антибиотиков с метронидазолом: амоксициллин 0,25 г + метронидазол 0,250 г 3 раза в день в течение 7 дней.
После купирования острого воспаления проводят комплексное лечение в плановом порядке.
К05.22 ОСТРЫЙ ПЕРИКОРОНИТ
Перикоронит - воспаление мягких тканей, окружающих коронку прорезывающегося третьего моляра нижней челюсти (зуба мудрости).
Этиология. Перикоронит возникает в результате активизации обычной микрофлоры полости рта. В ней преобладают анаэробные и факультативно-анаэробные виды бактерий, как в монокультуре, так и ассоциации.
Патогенез. Во время прорезывания нижнего зуба мудрости слизистая оболочка над медиальными буграми атрофируется, остальная часть коронки остается покрытой слизистой оболочкой - капюшоном. В перикоронарное пространство (пространство между коронкой зуба и внутренней поверхностью капюшона) попадают остатки пищи, клетки спущенного эпителия, слизь. Оптимальная температура, влажная среда, отсутствие света и кислорода создают благоприятные условия для развития микрофлоры. Хроническая травма слизистой оболочки капюшона во время жевания приводит к образованию на ее поверхности эрозий и декубитальных язв. В результате этого развиваются воспалительные явления в тканях, окружающих коронку не полностью прорезывавшегося зуба мудрости.
Клиническая картина. Острый перикоронит по течению воспалительного процесса бывает серозный и гнойный. Больные жалуются на боль при жевании в области прорезывающегося зуба мудрости. Общее состояние удовлетворительное, температура тела нормальная. Определяются увеличенные и болезненные лимфатические узлы в поднижнечелюстной области. Открывание рта свободное.
Слизистая оболочка, покрывающая зуб мудрости, капюшон, гиперемированная, отечная. При осмотре видны только один или оба медиальных бугра зуба. В некоторых случаях вся коронка зуба находится под капюшоном. Выделений из-под капюшона нет, пальпация его болезненна (рис. 14-15, см. цв. вклейку).
Эта форма перикоронита протекает благоприятно и при своевременном лечении быстро купируется.
Острый гнойный перикоронит характеризуется сильной постоянной болью позади второго моляра, усиливающейся при жевании. Боль иррадиирует в ухо, висок. Появляется боль при глотании (зубная ангина). Общее состояние больного нарушается, температура тела повышается до 37,2-37,5 °С. Открывание рта становится болезненным. Поднижнечелюстные лимфатические узлы увеличены, болезненны при пальпации.
При осмотре слизистая оболочка вокруг зуба мудрости гиперемирована, отечна как в области инфильтрированного капюшона. Гиперемия и отек слизистой оболочки распространяются на нёбно-язычные дужки, щеки, мягкое нёбо. При пальпации капюшона из-под него выделяется гнойное содержимое, возникает резкая боль (рис. 14-16, см. цв. вклейку).
На рентгенограмме нижней челюсти в боковой проекции обращают внимание на положение нижнего зуба мудрости, состояние его периодонта и окружающей кости, отношение его к ветви и каналу нижней челюсти (рис. 14-17).
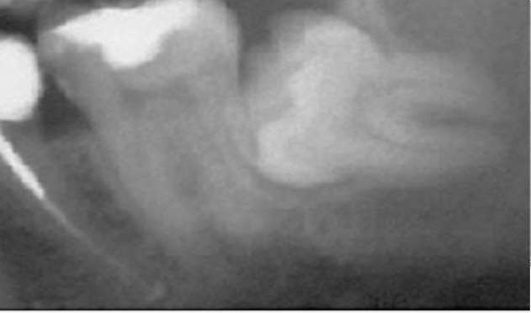
Рис. 14-17. Рентгенологическая картина ретенции зуба мудрости
Длительная травма капюшона и частые рецидивы приводят к хроническому воспалительному процессу, который протекает по типу хронического краевого периодонтита и хронического гингивита. Наблюдаются рост грануляционной ткани в области шейки зуба, рассасывание прилежащих участков кости. Вследствие этого у зуба мудрости образуется патологический костно-десневой карман, над которым формируется отечный и набухший капюшон. Во время еды он подвергается постоянному травмированию, что усиливает воспаление, вызывая еще более выраженный отек и утолщение капюшона. Ухудшается отток экссудата из перикоронарного пространства. В дальнейшем воспалительный процесс распространяется на клетчатку и надкостницу позадимолярной ямки, образуется гнойник. Возникает позадимолярный (ретромалярный) периостит или перикоронит.
Клиническая картина. Острый перикоронит может перейти в хроническую форму, при котором воспалительные явления полностью не стихают, нередко возникают обострения. Во время ремиссии жалоб не бывает.
Определяется увеличенный, слегка болезненный поднижнечелюстной лимфатический узел или узлы.
Открывание рта слегка ограниченно, слизистая оболочка, покрывающая зуб мудрости, гиперемированная, незначительно болезненная при пальпации.
На рентгенограмме боковой проекции нижней челюсти при хроническом процессе характерна резорбция кости чаще в виде широкой щели у шейки зуба и по ходу корня, нередко в виде полулуния (рис. 14-18).
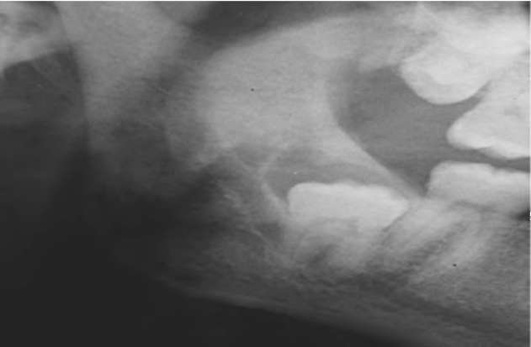
Рис. 14-18. Рентгенологическая картина ретенции зуба мудрости с полулунным очагом деструкции кости в проекции коронки
Лечение острого и хронического перикоронита хирургическое. При серозной форме перикоронита эффективно промывание перикоронарного пространства растворами антисептиков.
При гнойном перикороните проводят операцию перикоронаротомию - рассечение капюшона, прикрывающего коронку зуба или его дистальную часть. Под рассеченный капюшон вводят небольшую тонкую полоску марли, пропитанной йодоформной жидкостьюρ.
Назначают тепловые процедуры в виде ванночек с гипертоническим раствором, ко 2-3-му дню назначают физические методы лечения - УВЧ, микроволновую терапию по 5-7 процедур, излучение гелиево-неонового лазера. При регионарном лимфадените показаны наружные мазевые повязки, повязки с димексидом♠. Назначают антибиотики, нестероидные противовоспалительные средства в течении 5 сут.
После стихания воспалительных явлений необходимо на основании клинических и рентгенологических данных решить вопрос о дальнейшей «судьбе» зуба мудрости. Если зуб расположен правильно и для него в альвеолярной части челюсти достаточно места, то причиной затрудненного прорезывания является плотная слизистая оболочка, покрывающая его коронку. В этих случаях проводят иссечение капюшона до полного обнажения зуба, покрывающего коронку зуба мудрости. Эту операцию осуществляют под проводниковым и инфильтрационным обезболиванием. Слизистую оболочку иссекают скальпелем или изогнутыми ножницами, можно использовать конхотом, лазерный скальпель, применить криодеструкцию.
При неправильном положении зуба, недостатке места в альвеолярной части челюсти, деструкции костной ткани у шейки зуба и по ходу корня, рецидивах воспалительного процесса зуб мудрости удаляют.
К05.28 ДРУГОЙ УТОЧНЕННЫЙ ОСТРЫЙ ПАРОДОНТИТ
К другому уточненному острому пародонтиту можно отнести язвенный пародонтит, развивающийся как осложнение язвенного гингивита при отсутствии адекватного лечения и на фоне резкого снижения резистентности организма. Для клинической картины язвенного пародонтита характерны резко выраженный болевой синдром, галитоз, большое количество мягкого зубного налёта, некроз десневых сосочков, который быстро распространяется на глубже расположенные ткани, нарушается зубодесневое соединение, развивается деструкция костной ткани межзубных перегородок. Однако глубина зондирования может быть незначительной, поскольку потеря прикрепления сопровождается некрозом тканей десны. Язвенный пародонтит редко бывает генерализованным, чаще встречаются локализованные формы.
К05.29 ОСТРЫЙ ПАРОДОНТИТ НЕУТОЧНЁННЫЙ
Диагноз используется для идентификации острого пародонтита неясного происхождения.
К05.3 ХРОНИЧЕСКИЙ ПАРОДОНТИТ
К05.30 ЛОКАЛИЗОВАННЫЙ
К локализованным формам хронического пародонтита относят поражения, охватывающие не более 30% площади пародонта. Причинами развития хронического локализованного пародонтита чаще всего являются местные факторы: аномалии прикрепления уздечек губ, языка и подслизистых соединительнотканных тяжей, мелкое преддверие полости рта, дефекты пломбирования зубов (отсутствие точечного контактного пункта и экватора зуба, нависающие края пломбы и т.д.), дефекты протезирования зубов и челюстей (широкий край коронки, длинная коронка, мостовидный протез большой протяженности, консольный протез, частичный съемный протез с плохой фиксацией и т.д.), дефекты ортодонтического лечения, аномалии положения и скученность зубов, нарушение прикуса и т.д. Эти факторы, воздействуя на пародонт длительный период времени, ведут к возникновению локализованного пародонтита или могут отягощать генерализованные формы пародонтита (рис. 14-19).
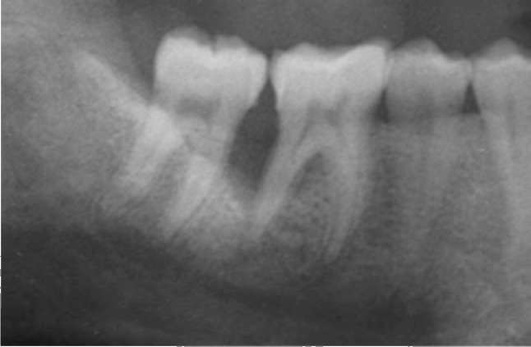
Рис. 14-19. Рентгенологическая картина хронического локализованного пародонтита
К05.31 ГЕНЕРАЛИЗОВАННЫЙ ПАРОДОНТИТ
Хроническим генерализованным пародонтитом страдают пациенты в возрасте старше 35 лет. Генерализованным можно считать хронический воспалительный процесс в пародонте, при котором поражено более 30% площади пародонта.
Определение. Заболевания пародонта (ЗП) представляют собой хронические инфекционные воспалительные заболевания, характеризующиеся разрушением опорных структур зуба и являющиеся наиболее распространенной формой костной патологии у человека и модифицирующим фактором системного здоровья пациентов. Интересно, что наличие пародонтальных патогенов необходимое, но недостаточное условие развития подобного заболевания. Ряд исследований показал, что к разрушению тканей пародонта приводит устойчивая воспалительная иммунная реакция, вызванная этими патогенами. Недавно были выяснены некоторые молекулярные механизмы, лежащие в основе разрушения ткани пародонта, и исследован ряд факторов, являющихся многообещающими терапевтическими целями с точки зрения сдерживания прогрессирования заболевания. В целом, медиаторы воспаления связаны с разрушением ткани, тогда как противовоспалительные медиаторы способны оказывать противодействие и подавлять развитие пародонтита. С открытием нескольких подгрупп Т-клеток с явными иммунорегуляторными свойствами сценарий про- и противовоспалительной активности организма-хозяина заметно усложнился, и исследователи предложили гипотезу о защитной и деструктивной роли поляризованных субпопуляций лимфоцитов (Th1, Th2, Th17 и Treg).
Концепция защитных и деструктивных сил обычно рассматривается в рамках разрушения тканей и прогрессирования заболевания. Тем не менее важно помнить, что пародонтит является инфекционным воспалительным заболеванием, и недавние исследования продемонстрировали, что сходные паттерны иммунологической реакции (т.е. паттерны с участием сходных цитокинов), считающиеся вредными в контексте разрушения ткани, могут играть важную положительную роль в контроле инфекции.
Этиология и патогенез. Важную роль в развитии пародонтита играют усиление повреждающего действия микробных скоплений десенной бороздки по мере как простого увеличения количества микробных масс, так и увеличения в их составе наиболее патогенных форм. Однако для реализации их разрушающего потенциала недостаточно только перечисленных изменений микробного состава. Необходимы снижение резистентности организма, неблагоприятное воздействие на пародонт нервно-соматических заболеваний, нарушения обмена и т.д. (рис. 14-20).
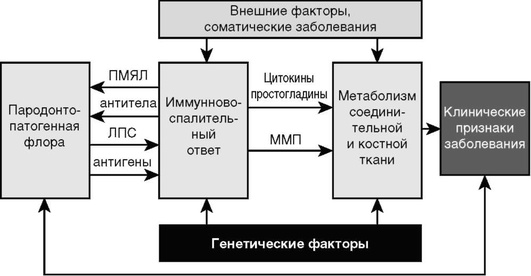
Рис. 14-20. Современная концептуальная модель пародонтита (Kornman K.S., 2008): ПМЯЛ - полиморфно-ядерные лейкоциты; ЛПС - липополисахариды; ММП - матриксные металлопротеиназы
По мере увеличения времени нахождения налёта бляшек в их глубоких отделах идет рост анаэробов, токсины и ферменты которых обладают значительным разрушающим действием на все структуры пародонта. Эти токсины увеличивают проницаемость эпителия. В результате утрачиваются его барьерные свойства, создаются условия для проникновения через эпителий не только токсинов, но и бактерий. Наиболее патогенное влияние оказывает поддесневая биоплёнка.
При том, что эта теория микробного повреждения на сегодня практически общепринята, многочисленные наблюдения и результаты продольных эпидемиологических обследований не позволяют так прямолинейно объяснять связь между присутствием микроорганизмов и степенью повреждения пародонтальных тканей.
Обнаруживаемое существенное различие между количественным присутствием повреждающего микробного фактора и выраженностью тканевого повреждения исследователи объясняют модифицирующим влиянием различных общих воздействий, и в первую очередь иммунного механизма.
Большой интерес в этой связи привлекает наряду с классической иммунологией новая теория - так называемая теория образраспознающих рецепторов, или иммунология toll-рецепторов.
Эти рецепторы имеются практически на всех типах клеток организма человека. Доказана их важнейшая роль в регуляции не только функционирования иммунной системы, но и микробного биоценоза организма человека. Становление данного направления очень важно с практической точки зрения, поскольку позволяет объяснить хронический характер течения неспецифического воспаления и непредсказуемость возникновения периодов обострения. По данной теории, отсутствие тканевого воспалительного ответа на микрофлору со стороны клеток эпителия (что в первую очередь интересует пародонтологов) объясняется врожденной адаптацией к присутствующей микрофлоре. Согласно этому взгляду, toll-рецепторы эпителиальных клеток воспринимают микроорганизмы как собственные структуры и не реагируют на них. Когда же возникает воспалительный ответ? Когда меняется структура этих микробных клеток. В частности, когда под влиянием либо местных, либо общих факторов микроорганизмы с целью противостояния их патогенному воздействию вырабатывают белки «теплового шока». При этом микроорганизмы становятся неузнаваемыми toll-рецепторами, и эти рецепторы активизируются по приведенному выше принципу и запускают воспалительный ответ.
Хотя присутствие патогенов является обязательным, но недостаточным условием начала заболевания, исследования четко показали, что решающую роль в разрушении тканей пародонта играет иммунная реакция организма-хозяина. Изначальная реакция врожденного иммунитета подразумевает распознавание микробных компонентов как «опасных сигналов» и последующую выработку воспалительных медиаторов. Толл-подобные рецепторы (TLR) экспрессируются резидентными клетками и лейкоцитами пародонта и активируют реакцию врожденного иммунитета за счет связывания с различными бактериальными компонентами (т.е. липополисахаридами - LPS, бактериальной ДНК, диацил-липопептидами, пептидогликаном и т.п.). Недавние исследования показали роль TLR-2 и TLR-4 в распознавании таких пародонтальных патогенов, как Actinobacillus actinomycetemcomitans, Porρhyromonas gingivalis и Tannerella forsythensis. После активации TLR стимулируется внутриклеточный сигнальный каскад, что приводит к активации факторов транскрипции и последующей экспрессии воспалительных цитокинов, миграции лейкоцитов и остеокластогенезу. Соответственно, отсутствие TLR2 или TLR4 приводит к усилению утраты альвеолярной кости у мышей после их инфицирования P. gingivalis. Помимо TLR, NOD-рецепторы (домены нуклеотид-связывающей олигомеризации) и инфламмасомы также указывались в качестве потенциальных вспомогательных молекул, участвующих в запуске реакции врожденного иммунитета на пародонтальные патогены. Такие цитокины врожденного иммунитета, как TNF-α, IL-1 и IL-6, оказались первыми из медиаторов, выделяющихся после распознавания микробной угрозы, чью роль в патогенезе ЗП удалось выяснить.
TNF-α участвует в процессе миграции клеток на нескольких уровнях, вызывая повышающую регуляцию молекул адгезии и выработку хемокинов, которые являются хемотаксическими цитокинами, вовлеченными в миграцию клеток к участкам инфицирования или воспаления. Цитокин TNF-α обильно присутствует как в жидкости десневой борозды (GCF), так и в пораженных заболеванием тканях пародонта, где уровень содержания этих клеток имеет положительную корреляцию с экспрессией MMP и RANKL. Подтверждая результаты исследований с привлечением пациентов, анализ данных экспериментов на крысах и приматах четко показывает, что TNF-α играет центральную роль в воспалительной реакции, резорбции альвеолярной кости и утрате соединительнотканного прикрепления. Соответственно, экспериментальный пародонтит у мышей без рецептора TNF-α p55 (TNFp55KO) характеризовался значимым снижением экспрессии MMP и RANKL, которое было связано с существенным уменьшением утраты альвеолярной кости. Помимо прямого участия в патогенезе ЗП, цитокин TNF-α вызывает повышающую регуляцию выработки других классических провоспалительных цитокинов врожденного иммунитета, например IL-1β и IL-6. Интересно, что IL-1β и IL-6 также имеют характерную связь с процессами миграции воспалительных клеток и остеокластогенеза. Хотя функции цитокинов врожденного иммунитета, с одной стороны, могут показаться избыточными, они также могут играть интересные дополнительные по отношению друг к другу роли. Действительно, в то время как отсутствие отдельных цитокинов ослабляет воспалительную утрату костной ткани, их одновременное ингибирование приводит к более эффективной защите, в результате которой обеспечивается почти полное прекращение остеокластической активности.
Помимо прямого влияния на резорбцию кости цитокины врожденного иммунитета также оказывают воздействие на связанный процесс формирования костной ткани. Недавние исследования, по существу, подтвердили выдвинутую ранее гипотезу, что провоспалительные цитокины подавляют остеогенную дифференцировку, а также продемонстрировали, что активация TLR в остеобластах вызывает выработку цитокинов с остеокластогенными свойствами.
Цитокины врождённого иммунитета вырабатываются как резидентными клетками (т.е. эпителиальными клетками и фибробластами), так и фагоцитами (т.е. нейтрофилами и макрофагами) пародонта. Хотя точную роль каждого типа клеток ещё предстоит выяснить, исследования показали, что гиперактивный фенотип фагоцитов связан с усилением выработки провоспалительных цитокинов при агрессивном и хроническом пародонтите.
Полученные недавно результаты также указывают на важную роль резидентных клеток в утрате костной ткани пародонта, поскольку контакт фибробластов периодонтальной связки и клеток-предшественников остеокластов синергически усиливает экспрессию генов, связанных с остеокластогенезом, например RANKL, TNF-α и IL-1. Дополнительной иллюстрацией важной роли десневых фибробластов в патогенезе пародонтита служит их долговременная способность вырабатывать воспалительные цитокины после стимулирования со стороны LPS.
Данная теория на настоящий момент имеет много уязвимых мест, но очень привлекательна для клиницистов и исследователей по целому ряду причин. Во-первых, становится ясным, почему на постоянную по своему составу микрофлору периодически тканевой ответ резко изменяется: ведь белки теплового шока возникают как ответ на медикаментозные препараты, так и на действие стрессорных факторов. Во-вторых, становится понятным, почему микробный состав в одних случаях после лечения меняется очень резко, а в других почти не меняется (Безрукова И.В., Грудянов А.И., 2000).
Согласующиеся между собой данные научной литературы демонстрируют двойственный характер воспалительных иммунных реакций при заболеваниях пародонта; представляется, что контроль пародонтальной инфекции и разрушение тканей пародонта обусловливаются сходными клеточными и молекулярными паттернами. Провоспалительные клетки типа Th1 и Th17 вредны с точки зрения разрушения ткани, однако они играют важную роль в контроле инфекции пародонта, выполняя функцию хемоаттракции и активации фагоцитов. В то время как роль оси Th2/B-клеток в прогрессировании заболевания остается противоречивой, с точки зрения контроля инфекции выработка антител представляется активным средством противодействия инфекции. Наконец, противовоспалительные цитокины IL-10 и Treg связаны с ослаблением разрушения ткани пародонта и, по-видимому, не ухудшают контроль пародонтальных патогенов. Недавно описанные новые липидные медиаторы с важными иммунорегуляторными свойствами необходимо включить в концепцию взаимодействия и противостояния защитных и деструктивных сил. Так или иначе, для выяснения точной природы и степени воспалительной иммунной реакции, необходимой для эффективного контролирования инфекции без повреждения тканей (или с их минимальным повреждением), требуются дальнейшие исследования.
Из местных факторов риска в прогрессировании патологических изменений в пародонте имеют значение аномалии прикуса, положения отдельных зубов, окклюзионная травма, наличие ретенционных пунктов, придесневая деминерализация зубов. В меньшей степени на это влияют структура пищи (мягкая, не способствующая самоочищению зубов и нормальной нагрузке при жевании), вредные привычки (жевание на одной стороне челюстей, т.е. функциональная недогрузка или перегрузка в других участках), экологические, профессиональные вредности. Однако главную роль играет неудовлетворительная гигиена полости рта, состояние иммунной системы и неспецифических факторов защиты.
Клиническая картина. Проявления пародонтита разнообразны и зависят от характера течения заболевания, тяжести, патологического процесса и других причин (рис. 14-21, см. цв. вклейку).
В основе многочисленных клинических симптомов, обусловливающих разнообразие проявлений пародонтита, лежат степень деструкции костной ткани альвеолярного отростка и интенсивность воспалительной тканевой реакции. Именно эти признаки определяют появление других симптомов: формирование и глубину карманов, подвижность и перемещение зубов, гноетечение, абсцедирование и т.д.
Причина развития хронического генерализованного пародонтита - это всегда действие микробного фактора. При этом степень задействованности различных общих (защитных и отягощающих) факторов (специфической и неспецифической защиты, системных заболеваний) бывает разной: от очень значительной до минимальной. Хронический пародонтит всегда развивается на основе предшествующего гингивита.
Именно поэтому при пародонтите легкой степени пациенты если и обращаются за помощью, то не по поводу собственных субъективных ощущений, которые практически не отличаются от таковых при хроническом катаральном гингивите, а по рекомендации терапевтов-стоматологов, либо, что бывает редко, - ортопедов или ортодонтов.
В связи с этим специалисты обычно изначально имеют дело с уже достаточно глубоким процессом, когда разрушение кости достигает не менее 1/2 длины корня, т.е. с пародонтитом средней либо тяжелой степени.
Характерно, что сами пациенты, в преобладающем большинстве уже привыкшие к субъективным ощущениям при начальных воспалительных поражениях пародонта (кровоточивости десен, неприятным ощущениям по утрам в виде липкой, ржавого цвета слюны), связывают начало пародонтита с новыми, более серьёзными ощущениями. Именно поэтому для них начальные признаки - это расхождение верхних резцов, что влечёт за собой существенный косметический дефект, особенно для женщин; подвижность зубов, обычно весьма выраженная на момент обращения (Π-Ш степени), когда возникает ощутимая боль при жевании; боль при чистке зубов или от химических и температурных раздражителей вследствие рецессии десны и обнажения корней зубов. Неприятный запах изо рта - причина обращения к врачу лишь в случаях, когда пациенту говорят об этом окружающие. Наиболее же весомая причина обращения - обострение хронического пародонтита: появление видимых самому пациенту абсцессов, явного гноетечения, особенно изъязвление десневого края и связанные с этим болевые ощущения, уже воспринимаемый самими пациентами резкий гнилостный запах изо рта, а иногда и существенное ухудшение общего состояния.
Для хронического генерализованного пародонтита характерны отложения над- и поддесневого зубного камня и зубного налета, пародонтальные карманы глубиной от 4 до 6 мм и более, подвижность зубов различной степени, которая зависит как от степени убыли кости, так и от фазы воспаления и от предшествующих травматических моментов. Воспалительные изменения десны разной интенсивности и характера: либо гиперплазия, либо изъязвления. Экссудация - серозная или гнойная. В силу подвижности и вторичного перемещения зубов часто определяют нарушения формы зубных рядов и прикуса.
Диагностика. Описанные изменения позволяют специалисту достаточно точно поставить предварительный диагноз на основании осмотра и зондирования пародонтальных карманов с помощью пародонтального зонда. Дополнительные лабораторные и функциональные методы позволяют представить более детальную картину поражения для обоснованного планирования лечебных вмешательств, а в редких случаях - поставить другой, более серьёзный диагноз (например, опухолевое поражение), замаскированный поверхностными воспалительными и деструктивными изменениями, характерными для пародонтита.
Из дополнительных методов обследования при пародонтите наиболее важна рентгенография, позволяющая не только оценивать степень деструкции костной ткани, но и определять вид изменений костной ткани. Обычно используют ортопантомографию, внутриротовую контактную рентгенографию и рентгенографию вприкус.
В ряде случаев незаменима компьютерная томография, позволяющая представить трёхмерное изображение костных структур, но в настоящее время она доступна лишь для незначительного количества лечебных учреждений и пациентов.
Помимо индексов гигиены и ПМА, определяют пародонтальный индекс Рассела, индексы Мюлеманна, Рамфьорда. Для оценки подвижности зубов используют индекс Миллера; состояние фуркаций определяют по методикам Хемпа и Тарноу-Флетчера.
Исследование содержимого пародонтального кармана на практике врачи фактически не проводят. Внимание уделяют только количеству и характеру видимого экссудата, так как это - критерий интенсивности воспаления и эффективности лечения.
Состояние гемодинамики, сосудистого, в том числе микроциркуляторного, русла пародонта оценивают с помощью реопародонтографии, лазерной или ультразвуковой допплеровской флоуметрии; выраженность гипоксии - полярографическим методом по напряжению О2 в десне. Эхоостеометрия и денситометрия позволяют определить плотность костной ткани в процессе лечения. Перечисленные функциональные методы позволяют объективно оценить не только местный статус, но и динамику процесса во времени. Однако их преимущественно используют только в научных целях, поскольку клиницистам обычно бывает достаточно констатации приведенных выше клинических симптомов и данных рентгенологических исследований.
На основании клинических и ряда лабораторных признаков патологии можно характеризовать активность течения хронического пародонтита и степень тяжести. Главный клинический признак тяжести процесса - потеря зубодесневого соединения: лёгкая степень - до 4 мм; средняя - от 4 до 6 мм; тяжелая - свыше 6 мм. Приемлемый в клинике аналог потери зубодесневого прикрепления (соединения) - глубина карманов при отсутствии явлений гиперплазии (разница между уровнем прикрепления и глубиной кармана примерно 1-1,5 мм).
Обострение хронического пародонтита может быть связано как с накоплением повреждающих продуктов скоплений микроорганизмов, так и со снижением активности факторов защиты от них даже при временном ухудшении общего состояния больного вследствие инфекционных (пневмония, грипп и др.), сердечно-сосудистых, сахарного диабета и других заболеваний, а также из-за функциональной перегрузки отдельных групп зубов.
Ремиссия хронического пародонтита возможна только в результате комплексного лечения с использованием консервативных, хирургических, ортопедических и других методов. Клиническая ремиссия наступает раньше, чем её выявляют рентгенологически.
В стадии ремиссии больные, как правило, жалоб не предъявляют. В результате лечения исчезают кровоточивость десен и запах изо рта, десна приобретает нормальный цвет, структуру и конфигурацию, патологическая подвижность зубов уменьшается.
Десна обычно становится бледно-розового цвета, плотно прилежит к поверхности зуба, при зондировании не выявляют кровоточивость десен. Индексы, отражающие интенсивность воспаления: ПМА и Мюлеманна - значительно снижаются. За счет этого уменьшаются и значения пародонтальных индексов Рассела и Рамфьорда. Улучшается жевательная функция, нормализуется психоэмоциональное состояние больных.
На рентгенограммах (по сравнению с исходными) отмечают уплотнение костной ткани, исчезновение или уменьшение очагов остеопороза.
Дифференциальную диагностику пародонтита лёгкой степени в стадии ремиссии следует проводить с пародонтозом, возрастными изменениями костной ткани (инволютивными изменениями). Хронический пародонтит лёгкой степени в стадии активного течения следует отличать от хронического катарального гингивита; тяжёлую форму пародонтита, особенно у лиц молодого возраста, - быстропро-грессирующего пародонтита (БПП) - от поражений пародонта, обусловленных общей соматической патологией, СПИДом; фазу абсцедирования пародонтита - от периостита вследствие обострения хронического верхушечного периодонтита.
Лечение. Выбор методов и средств лечения пародонтита зависит от тяжести клинического течения и общего состояния больного.
Независимо от тяжести пародонтита необходимо провести ряд мероприятий: обучение гигиене рта, контролируемую чистку зубов, удаление над- и поддесневых зубных отложений и сглаживание поверхности корня (scaling, root planning - SRP), устранение факторов, способствующих ретенции микробного налёта: лечение кариозных зубов, устранение нависающих краёв реставраций, ликвидировать супраконтакты.
Контроль гигиены рта проводят многократно до получения желаемого результата - устранения микробного налёта.
Удаление зубных отложений и выравнивание поверхностей корней (SRP) можно расценивать и как самостоятельное лечение, и как подготовительный этап перед хирургическим вмешательством. Одновременно для обработки пародонтальных карманов следует использовать корсодил, 0,06-0,2% раствор хлоргексидина, 1% гель метронидазол + хлоргексидин, Асепту♠ - полоскание и адгезивную пасту. Эти препараты действуют на анаэробную флору кармана. Вместо указанных средств могут быть использованы препараты сангвиритрина♠ - растительного антибиотика широкого спектра действия (1% линимент, 0,2% спиртовой раствор). Учащение случаев аллергических реакций на химиопрепараты, а также их негативное влияние на экосистему полости рта объясняет целесообразность применения препаратов бактерий (лактобактерии ацидофильные, бифидобактерии бифидум), антигомотоксичных средств (траумель С♠ и др.), озона, оксида азота, иммунокорректоров (суперлимф♠, тимуса экстракт и др.), причем для введения непосредственно в карманы.
К05.32 ХРОНИЧЕСКИЙ ПЕРИКОРОНИТ
Частое травмирование капюшона и рецидивы воспаления приводят к хроническому воспалительному процессу в области ретинированных и дистопированных зубов мудрости. При хроническом перикороните наблюдается как бы порочный круг. Отёчный и набухший капюшон во время еды подвергается постоянному травмированию. Травма усиливает воспаление, вызывая еще более выраженный отёк и утолщение капюшона. Ухудшается отток экссудата из перикоронарного пространства. Начинается обострение хронического процесса, клиническая картина которого аналогична острому перикорониту. Возникший впервые острый перикоронит при частых обострениях и без своевременного лечения преобретает хроническое течение. При хронизации процесса воспалительные явления полностью не стихают, нередко возникают гнойные обострения.
К05.33 УТОЛЩЕННЫЙ ФОЛЛИКУЛ (ГИПЕРТРОФИЯ СОСОЧКА)
Увеличение тканей десны (гипертрофия сосочка) может быть связана с преобладанием фазы пролиферации. В результате длительно существующего местного травмирующего фактора происходят разрастание десны и увеличение ее объёма, что приводит к гипертрофии межзубного сосочка.
К05.38 ДРУГОЙ УТОЧНЕННЫЙ ХРОНИЧЕСКИЙ ПАРОДОНТИТ
К этой группе заболеваний пародонта относят хронический пародонтит, ассоциированный с различными системными заболеваниями. Клиническая картина этой патологии значительно не отличается от хронического генерализованного пародонтита у взрослых, однако носит только генерализованный характер. Среди системных заболеваний, наиболее часто манифестирующих патологический процесс в пародонте, выделяют сахарный диабет, патологию гипофизарно-надпочечниковой системы, заболевания ЖКТ (особенно язвенную болезнь желудка и двенадцатиперстной кишки), заболевания почек и печени, различные гипо- и авитаминозы, нарушения липидного обмена и стресс.
К05.39 ХРОНИЧЕСКИЙ ПАРОДОНТИТ НЕУТОЧНЕННЫЙ
В отечественной литературе рассматривается как агрессивная форма пародонтита (АФП).
Эпидемиология агрессивных форм пародонтита. Согласно данным эпидемиологических исследований, в структуре заболеваний пародонта АФП занимают не более 5-10%.
Этиология и патогенез. На сегодня в развитии АФП наиболее обоснована роль микробных и иммунных факторов. Основное значение принадлежит Actinobacillus actinimycetemcomitans (A.a), Prevotella intermedia (P.i), Porphyromonas gingivalis (P.g) и ряду других микроорганизмов, которые отличаются наиболее высокой агрессивностью и способностью проникать в ткани пародонта, и присутствие которых наиболее часто определяют при этих поражениях. Скорее всего, правомерно говорить о своеобразных ассоциациях микроорганизмов, обусловливающих суммарный либо потенцированный, взаимоусиливающий повреждающий эффект.
В пользу правомерности такого предположения говорит отсутствие резких изменений видового состава микрофлоры пародонтальных карманов при лечении больных АФП, относительная ее стабильность даже в период ремиссии. Следовательно, резонно говорить об одновременном угнетении местного клеточного иммунитета и местной неспецифической защиты в ответ на внедрение агрессивной патогенной микрофлоры. При этом недостаточная активность нейтрофилов в отношении А.а. объясняется их дефектом, точнее, отсутствием цитохрома-С, поэтому при взаимодействии хемотаксических рецепторов ПМЯЛ с хемотаксическими молекулами не происходит «кислородного взрыва» и выброса синглентного кислорода, который уничтожает А.а. Агрессивное течение процесса определяет и то, что микрофлора пародонтальных карманов у пациентов с АФП отличается в большинстве случаев сниженной чувствительностью к антибиотикам.
Как правило, АФП характеризуется минимально выраженной воспалительной реакцией при интенсивной деструкции костной ткани, что объясняет нарушение механизмов местного иммунитета и функционального состояния полиморфно-ядерных лейкоцитов, т.е. системный характер патологии, что наблюдают у 75-83% пациентов с АФП.
Данные о роли наследственного фактора в возникновении АФП (повышенная экспрессия HLA-A9 и DR4 в сравнении с типичной формой) интересны, но пока они немногочисленны и весьма противоречивы.
Привлекают внимание данные о нарушениях структуры и функций клеточных мембран, особенностях свободнорадикального окисления, поскольку они могут быть реально использованы специалистами для выбора действенных лекарственных комбинаций.
Заслуживает внимания и более высокая частота нарушений анатомо-топографических соотношений тканей пародонта и анатомического строения зубов по сравнению с типичными формами пародонтита: нарушение строения преддверия полости рта, патология прикуса, супраконтакты и отсутствие истираемости эмалевых бугров отмечают в 2-2,5 раза чаще, а корни зубов, особенно моляров, у пациентов с БПП короткие, незначительно изогнуты либо прямые, конусовидно сходящиеся в области верхушек. Эти особенности могут быть одной из причин ускоренной деструкции тканей пародонта при одинаковой интенсивности повреждающего микробного фактора и в определенной мере определять прогноз течения БПП.
Клиническая картина. Атипичность агрессивных форм пародонтита проявляется не только возрастом, в котором они возникают, но и в клинической картине. В частности, подвижность зубов, рентгенологически и клинически выявляемая резкая убыль кости зачастую не сопровождаются адекватной воспалительной реакцией и происходят при незначительном скоплении мягкого зубного налета. Такое несоответствие имеет свое объяснение для каждой из форм. При препубертатном пародонтите, напротив, как раз воспалительные явления и подвижность зубов молочного прикуса очень выражены. Такое активное начало и течение процесса обусловлены резко сниженной гуморальной и клеточной защитой либо врожденным поражением функциональной активности нейтрофилов вследствие наличия тяжелых соматических заболеваний (хроническая или циклическая нейтропения). Выделяют две клинические формы препубертатного пардонтита: очаговую, или локализованную, и генерализованную. Заболевание наиболее часто встречают у девочек после прорезывания молочных зубов. При локализованной форме деструкция тканей пародонта протекает не так стремительно, и эта форма заболевания обычно хорошо поддаётся лечению.
При локализованном юношеском пародонтите ареактивность можно объяснить специфичностью причинного микробного фактора: Actinobacillus actinimycetemcomitans, обладая мощным повреждающим потенциалом в отношении тканей, в то же время подавляет хемотаксис нейтрофилов вследствие выделения им лейкотоксина. Диагноз локализованного юношеского пародонтита может быть поставлен, если есть пародонтальные карманы глубиной более 4 мм в области не менее двух постоянных резцов или первых моляров у подростков в возрасте от 13 до 17 лет, не страдающих системными заболеваниями. Для генерализованного юношеского пародонтита характерна убыль зубодесневого прикрепления более 5 мм в области как минимум восьми постоянных зубов. При этом генерализацию процесса определяет агрессивное влияние присоединившихся P.g., P.i.
Атипичность БПП проявляется тем, что активное разрушение тканей пародонта начинается в молодом возрасте: с 17-20 лет, практически не поддается лечению с помощью традиционных средств и отличается крайне неблагоприятным прогнозом.
Клиническая картина БПП отличается рядом признаков: деструктивные изменения в тканях пародонта начинаются в постювенильном или молодом возрасте; генерализованное разрушение костного субстрата при неадекватно умеренной в большинстве случаев воспалительной реакции в тканях пародонта; более тяжелое поражение пародонта по сравнению с пациентами аналогичного возраста при сопоставимом скоплении зубного налёта; неэффективность либо незначительный и кратковременный эффект от проводимого ранее лечения. Первый симптом воспалительного заболевания пародонта (кровоточивость дёсен при чистке зубов) появляется у пациентов за 5-6 лет до явлений выраженной деструкции костной ткани. Обычно пациенты обращаются в клинику уже на поздних стадиях заболевания, связывая подвижность и перемещение зубов с началом болезни пародонта, поэтому нельзя с уверенностью утверждать, что предшествует заболеванию: либо банальный гингивит, либо ювенильный пародонтит.
Течение заболевания волнообразное, с периодами частых обострений (чаще 1 раза в 3 мес) и коротких ремиссий.
Диагностика. Диагноз быстропрогрессирующего пародонтита может быть поставлен на основании очень тщательного анамнеза и данных клинического обследования, рентгенологического, а при возможности - микробиологического и иммунологического исследований. Для БПП характерны:
-
отсутствие параллелизма между активностью воспаления и глубиной деструктивных изменений в тканях пародонта;
-
иногда заболевание сопровождается системными проявлениями, такими, как понижение массы тела, депрессия и общее недомогание;
-
при фазово-контрастной микроскопии в составе микрофлоры пародонтальных карманов пациентов с БПП отмечают преобладание подвижных и извитых форм факультативных анаэробов; коэффициент устойчивости микроорганизмов (соотношение неподвижных и подвижных форм микроорганизмов) уменьшается в среднем более чем в 3 раза по сравнению с нормой; у 80% пациентов и более микрофлора пародонтальных карманов устойчива к антибиотикам;
-
при иммунологическом исследовании периферической крови пациентов с БПП выявляют нарушения в иммунном статусе: устойчивое понижение в 1,5-2 раза иммунорегуляторного индекса (соотношение хелперных и супрессорных популяций Т-лимфоцитов), который в отличие от типичных форм пародонтита не претерпевает достоверных изменений в ходе лечения;
-
при рентгенологическом исследовании (ортопантомография) определяют генерализованное поражение костной ткани альвеолярных отростков челюстей, обширные очаги остеопороза с размытыми нечёткими границами, что косвенно свидетельствует об активности воспалительно-деструктивного процесса. Однако следует помнить, что данные клинического состояния тканей пародонта и рентгенологическая картина не совпадают более чем в 50% наблюдений.
БПП дифференцируют от типичного генерализованного пародонтита взрослых. БПП возникает в молодом возрасте, пародонтит взрослых - после 35 лет; при БПП количество местных факторов зубного налёта и камня не соответствует тяжести поражения пародонта.
В отличие от БПП, юношеские и препубертатные пародонтиты проявляются в более раннем возрасте. При юношеских пародонтитах чаще всего поражается пародонт в области резцов и первых моляров, отмечают также нарушение функций полиморфно-ядерных лейкоцитов. Препубертатный пардонтит следует дифференцировать от воспалительных заболеваний пародонта, обусловленных такими системными заболеваниями, как сахарный диабет 1-го и 2-го типа, нарушения функции щитовидной железы, заболевания крови (лейкоз, агранулоцитоз, циклическая нейтропения). Необходимо также дифференцировать БПП от язвенного пародонтита при СПИДе. БПП дифференцируют не только от приобретенных тяжелых патологий, но и от врожденных заболеваний, при которых выявляют нарушения функциональной активности полиморфно-ядерных лейкоцитов: хроническая гранулематозная болезнь, синдром Чедиака-Хигаси, дефицита лейкоцитарной адгезии, недостаточности лейкоцитарных гранул, «ленивого лейкоцита», болезнь Дауна, синдром Лефевра-Папийона и др.
Лечение. При составлении плана лечения необходимо учитывать два ведущих фактора: микробный и травматический.
Основные тактические подходы к лечению АФП не отличаются от таковых в отношении ТФП и включают: мотивацию пациента к проведению оптимальной гигиены полости рта, поэтапное механическое инструментальное удаление над- и поддесневых зубных отложений с последующим сглаживанием поверхности корня (SRP), адекватную антибиотикотерапию; комплекс хирургических вмешательств, поддерживающее лечение.
К особенностям относят большую резистентность процесса к вмешательствам, а соответственно, более длительное лечение при более скромных результатах.
Кроме того, в силу приведенных выше особенностей определение чувствительности микрофлоры к антибиотикам, определение функциональной активности нейтрофилов и консультация у специалистов общего профиля для пациентов с АФП обязательны.
Если при хроническом генерализованном пародонтите функциональное избирательное пришлифовывание показано пациентам старше 25 лет, то при АФП выраженные супраконтакты (особенно в участках усиленной деструкции) имеет смысл устранять в любом возрасте, а полностью методику ФИП в полном объёме целесообразно проводить с 18-20 лет.
Наиболее весомый эффект при АФП обеспечивает проведение хирургических вмешательств, направленных на устранение пародонтальных карманов и на коррекцию местных травматических факторов: мелкого преддверия полости рта, патологии прикрепления уздечек губ, тянущих тяжей слизистой оболочки переходных складок.
Антибиотики следует выбирать на основании антибиотикограмм. При отсутствии такой возможности следует выбирать наиболее эффективные по отношению к А.а, Р.g., Р.i. При препубертатных пародонтитах обоснованы амоксициллин или амоксициллин + клавулановая кислота в дозах согласно возрасту. При локализованном юношеском пародонтите - доксициклин по 100 мг 2 раза в день в течение 2 нед, тетрациклин с нистатином по 250 мг 4 раза в день - 15-28 дней или метронидазол по 250 мг 3 раза в день - 10 дней, комбинированное использование метронидазола по 250 мг и амоксициллина по 375 мг 3 раза в день в течение 7 дней. При генерализованном юношеском пародонтите назначают либо доксициклин в такой же дозировке, либо препараты метронидазола: тинидазол по схеме в сочетании с местным введением в ПК на 30 мин геля метронидазол + хлоргексидин (метрогил-дента♠) на протяжении 10 дней. При БПП - тетрациклин по 0,25 г 4 раза в день с нистатином по 500 000 ЕД или разовом назначении флуконазола на протяжении 14-21 дня (в зависимости от клинической динамики) или тинидазол (при отсутствии противопоказаний со стороны печени) по схеме: после приема пищи по 1 таблетке через каждые 15 мин, всего 4 таблетки - 1 раз (!). У пациентов с локализованным юношеском пародонтите и БПП на стадии обострения рекомендуют использовать АБ из группы макролидов: азитромицин по 500 мг 1 раз в день в течение 3-5 дней; рокситромицин по 150 мг 2 раза в день в течение 10 дней; для профилактики кандидоза - нистатин по 500 000 ЕД 2 раза в день или 1 таблетку флуконазола.
Пациентам с АФП с дисбиотическими нарушениями, как и пациентам с ТФП, а также для профилактики их развития рекомендуют применение таблетированных форм пробиотиков: бифидобактерии бифидум и лактобактерии ацидофильные - по 10 доз в день в течение 14 дней при активной фазе лечения; по 5 доз в день в течение 1 мес во время поддерживающего лечения.
Второй этап лечения - хирургический. Он отличается только более длительной противовоспалительной подготовкой, но именно проведение лоскутных операций наиболее существенно влияет на количество патогенной микрофлоры.
Как и при ТФП, III этап лечения пациентов с АФП предусматривает проведение поддерживающего лечения с целью длительного сохранения стабильного состояния тканей пародонта после активного лечения.
Каждый раз в процессе поддерживающего лечения после оценки гигиены рта проводят инструктаж по гигиене полости рта. Пациенты с АФП должны проходить курс поддерживающего лечения каждые 3 мес, т.е. 4 раза в год.
Систематическое наблюдение за пациентами и своевременное корригирующее лечение позволяют у лиц с АФП добиться достаточно ощутимых результатов.
К05.4 ПАРОДОНТОЗ
Этиология и патогенез. В происхождении пародонтоза, по-видимому, ведущее значение имеют общие (системные) факторы. Именно поэтому изменения в тканях пародонта - местное проявление системной дистрофии. В число системных факторов могут входить заболевания внутренних органов и систем (атеросклероз, гипертоническая болезнь, вегетососудистая дистония и др.), нейрогенные дистрофии, а также проявления системной, в том числе при экстремальных воздействиях (гипоксия, гиподинамия и др.).
Патогенетические механизмы пародонтоза заключаются в нарушении трофики костной ткани, периодонта (задержка обновления тканевых структур, нарушение метаболизма белка, минерального и других видов обмена). В отличие от воспалительных заболеваний при пародонтозе гипоксия первична.
Клиническая картина, диагностика. Пародонтоз относят к заболеваниям первично-дистрофического характера. Он встречается нечасто (5-10%).
Пародонтоз не вызывает болевых и других ощущений, поэтому больные, как правило, не обращаются к врачу. При средней и тяжелой степени заболевание может осложняться воспалением десны и фактически трансформируется в пародонтит, который характеризуется преимущественно горизонтальной, достаточно равномерной атрофией кости, равномерным обнажением шеек зубов, клиновидными дефектами и неглубокими, приблизительно равной глубины пародонтальными карманами.
Наиболее характерны следующие клинико-диагностические признаки пародонтоза:
-
на рентгенограммах не выявляют воспалительной деструкции костной ткани. Отмечают, как правило, равномерное снижение высоты межзубной перегородки (горизонтальная атрофия);
-
нередко сочетание с патологией твердых тканей зуба некариозного происхождения (эрозия эмали, патологическая стертость, клиновидные дефекты);
-
наличие заболеваний сердечно-сосудистой системы (атеросклероз и др.), эндокринных, обменных нарушений. Картина пародонтоза, осложненного воспалением, приведена выше.
Клинические проявления пародонтоза скупы. Некоторые больные отмечают неприятные ощущения в десне, ощущение зуда, но чаще обращаются за помощью к врачу в связи с гиперестезией тканей зуба. Иногда больных беспокоит как бы удлинение зуба за счет ретракции десны и обнажения корня зуба. Такие изменения развиваются исподволь, медленно. При осмотре на зубах обычно не обнаруживают налета микроорганизмов (при окрашивании зубов), отложения зубного камня незначительны. Десна бледно окрашена, плотно прилежит к поверхности зуба, кармана нет. Кровоточивость при зондировании десневой бороздки не наблюдается. Такое состояние десны подтверждают результатами витальной микроскопии (уменьшение количества капилляров в поле зрения, изменение их конфигурации).
На реопародонтограммах отмечают повышение тонического напряжения сосудов и структурные изменения, соответствующие склеротическим. О выраженной гипоксии свидетельствуют данные полярографии (значительное снижение РО2 в десне). Нередко определяют эрозии эмали, клиновидные дефекты, патологическую стираемость твердых тканей зубов, их гиперестезию. Индекс гигиены в большинстве случаев в пределах нормы. Все дополнительные пробы, выявляющие воспаление и положительные при гингивите и пародонтите (индекс ПМА, количество десневой жидкости, проба Кулаженко и др.), при пародонтозе отрицательны.
На рентгенограммах (панорамные, ортопантомограмма) выявляют очаги остеопороза и равномерное снижение высоты межзубных перегородок при сохранении плотности костной ткани, очаги остеопороза и остеосклероза в глубоких отделах альвеолярного отростка (дисгармоничная перестройка костной ткани).
Пародонтоз следует отличать прежде всего от пародонтита в стадии ремиссии и инволютивных изменений костной ткани альвеолярного отростка.
При наслоении воспалительных явлений все приведенные показатели изменяются и становятся сходными с таковыми при пародонтите, однако дистрофический компонент и связанные с ним метаболические изменения выражены более значимо.
Лечение. Лечение пародонтоза целесообразно проводить в два этапа. Первый включает симптоматическое лечение:
-
лечение гиперестезии с помощью методик глубокого фторирования, пленок с натрия хлоридом и калия хлоридом, с кальция гидроксифосфатом (гидроксиапатитом), натрия фторида (фторлакρ), фтористых гелей, компосилаρ, реминерализирующих растворов;
-
пломбирование эрозий эмали, клиновидных дефектов композитами;
Второй этап предполагает активацию микроциркуляции в тканях пародонта и как следствие - устранение гипоксии и нормализация метаболических процессов в тканях. Вопрос о выборе лекарственных средств, продолжительности курсов лечения следует согласовывать с лечащим терапевтом. Целесообразно использовать по согласованию с терапевтом и эндокринологом антисклеротические (ловастатин - мевакор♠, диоскореи ниппонской корневищ с корнями экстракт - полиспонин♠ и др.) и вазотропные (пентоксифиллин - трентал♠, аденозина фосфат - фосфаден♠, пирикарбат - пармидин♠, витамин Е и др.) препараты. Очень перспективным представляется использование озонотерапии как в виде аппликации озоносодержащих растворов, так и их подслизистого введения.
К05.5 ДРУГИЕ БОЛЕЗНИ ПАРОДОНТА
Другие болезни пародонта рассматриваются в следующих разделах «Симптомы и синдромы, проявляющиеся в тканях пародонта», «Поражения пародонта при заболеваниях слизистой оболочки полости рта и системных заболеваниях», «Заболевания пародонта и ВИЧ-инфекция», «Особенности клинической картины, диагностики, лечения заболеваний пародонта при общесоматической патологии».
К06 ДРУГИЕ ИЗМЕНЕНИЯ ДЕСНЫ И БЕЗЗУБОГО АЛЬВЕОЛЯРНОГО КРАЯ
Исключены: атрофия беззубого альвеолярного края (К08.2); гингивит (К05.0; К05.1).
К06.0 РЕЦЕССИЯ ДЕСНЫ
Включены: постинфекционная, послеоперационная.
Рецессия десны - это апикальное смещение края десны без клинически видимых признаков воспаления, сопровождающееся обнажением корней зубов, повышенной чувствительностью обнаженных поверхностей и прогрессирующим эстетическим нарушением.
По распространенности рецессии бывают одиночными или множественными. Иногда рецессии определяются в области всех зубов одной из челюстей либо обеих челюстей.
К06.00 ЛОКАЛЬНАЯ РЕЦЕССИЯ
Локальная рецессия развивается в области одного зуба. Локализованная рецессия (ЛР), как правило, может возникать в местах низкоприкрепленной уздечки или эпителиальных тяжей (складок) преддверия полости рта (рис. 14-22, см. цв. вклейку), при вестибулярном расположении зубов и их скученности (чаще это встречается в области вестибулярно расположенных клыков).
Локализованная рецессия может быть результатом плохо поставленной коронки, когда не соблюдены все правила при формировании маргинальной ее части. Кроме того, в последние годы растет количество людей, увлекающихся пирсингом. А между тем длительное ношение пирсинга может привести не только к образованию локализованной рецессии десны, но и к расшатыванию и даже потере зуба. Иногда при ЛР отмечается образование уплотненного десневого валика (фестон Маккола - McCall?s feston), который чаще всего бывает выражен на вестибулярной поверхности в области клыков и премоляров. Также отмечается нарушение целостности десны, которая напоминает разрез десневого края (щель Стильмана - Stillman?s Clefts). Локальная рецессия может возникать как при локализованном ювенильном пародонтите, где деструктивные процессы в костной ткани отмечаются в области первых моляров и резцов, так и вследствие хронических деструктивных периапикальных процессов, вызванных резорбцией или перфорацией корня. Чаще всего перфорация корня является результатом эндодонтического лечения или ортопедических мероприятий с использованием штифтов и культевых вкладок.
К06.01 ГЕНЕРАЛИЗОВАННАЯ РЕЦЕССИЯ
Генерализированная рецессия развивается в области ряда зубов или на протяжении всего зубного ряда (рис. 14-23, см. цв. вклейку). Генерализованная рецессия может быть проявлением физиологического процесса старения, когда происходит так называемое прорезывание зубов.
Генерализованная рецессия чаще всего является результатом длительно протекающего хронического пародонтита без выраженных симптомов, а также результатом агрессивных форм пародонтита, при котором потеря десны может быть единственной жалобой пациента.
Этиология, патогенез, классификация и лечение рецессии десны подробно рассматриваются в разделе «Хирургические методы лечения болезней пародонта. Устранение рецессии десны».
К06.09 РЕЦЕССИЯ ДЕСНЫ НЕУТОЧНЕННАЯ
Используется для обозначения рецессии с неясной этиологией.
К06.1 ГИПЕРТРОФИЯ ДЕСНЫ
Включена: бугристость.
Клиническая картина гипертрофии десны характеризуется медленным увеличением межзубных сосочков в размере, распространяясь затем и на прикрепленную десну. Сливаясь, гипертрофия покрывает вестибулярную и лингвальную поверхность зубов, ухудшая гигиену полости рта, что приводит к дальнейшей гиперплазии ткани десны.
К06.10 ФИБРОМАТОЗ ДЕСНЫ
Фиброматоз десны проявляется в виде диффузного разрастания десен вместе с десневыми сосочками вплоть до переходной складки верхней и нижней челюсти, а также встречается фиброматоз в области бугров верхней челюсти с обеих сторон. Отмечается преимущественно у мужчин до 30 лет. Фиброматоз бугров верхней челюсти наблюдается в возрасте 50-60 лет и выявляется случайно при протезировании.
Этиология неизвестна. Относится к генетически обусловленным заболеваниям. Может возникать при различных эндокринопатиях.
Клиническая картина. Определяется валикообразное увеличение десны, покрывающее частично или полностью коронки зубов. Преимущественно разрастание десны наблюдается с вестибулярной поверхности, реже и с оральной стороны, гладкой или дольчатой поверхностью, бледно-розового цвета, реже гиперемированная. При пальпации участок фиброматоза плотноэластической консистенции, а в области бугров смещается, безболезненный. Между коронками зубов и патологическим разрастанием десны образуются карманы, где скапливается пища, формируется зубной камень, возникает воспаление, ведущее к глубокому отслаиванию тканей и их травме. При длительном течении патологического процесса отмечаются подвижность и расхождение зубов (рис. 14-24, 14-25, см. цв. вклейку).
Рентгенологическая картина. При длительных и обширных разрастаниях фиброматоза дёсен визуализируется деструкция межзубных перегородок с резорбцией альвеолярной части или отростка челюстей.
Гистологическая картина. Фиброматоз десен представлен плотной фиброзной соединительной тканью, бедной сосудами, иногда встречаются костные или цементоподобные включения.
Лечение хирургическое, заключается в поэтапном иссечении патологически измененных тканей до кости в пределах 6-8 зубов. Раневую поверхность прикрывают йодоформнойρ турундой. После истечения 2-3 нед оперативное вмешательство проводят в других участках.
К06.18 ДРУГАЯ УТОЧНЕННАЯ ГИПЕРТРОФИЯ ДЕСНЫ
Гипертрофия десны может быть следствием различных системных заболеваний, таких, как болезнь Крона, саркоидоз и грануломатоз Вегенера.
К06.19 ГИПЕРТРОФИЯ ДЕСНЫ НЕУТОЧНЕННАЯ
Используется для характеристики гипертрофии десны неясной этиологии.
К06.2 ПОРАЖЕНИЯ ДЕСНЫ И БЕЗЗУБОГО АЛЬВЕОЛЯРНОГО КРАЯ, ОБУСЛОВЛЕННЫЕ ТРАВМОЙ
Данный вид патологии подробно рассматривается в главе «Поражения пародонта при заболеваниях слизистой оболочки полости рта и системных заболеваниях».
К06.20 ОБУСЛОВЛЕННЫЕ ТРАВМАТИЧЕСКОЙ ОККЛЮЗИЕЙ
Перегрузка зубов в результате окклюзионной травмы - частое осложнение при потере зубов. Разрушение тканей пародонта происходит вследствие функциональной перегрузки оставшихся зубов, что приводит к замедлению репаративных процессов и способствует возрастанию костной резорбции. К такому же результату может привести наличие у пациента бруксизма. Наряду с возникновением в пародонте участков функциональной перегрузки, в тех же ситуациях имеются и очаги функциональной недогрузки, что приводит к возникновению гипофункции пародонта и обладает не менее разрушительным действием на пародонт.
К06.21 ОБУСЛОВЛЕННЫЕ ЧИСТКОЙ ЗУБОВ ЩЕТКОЙ
Использование щеток со слишком жесткой щетиной, особенно при неправильной методике чистки зубов, зачастую приводит к травме краевой десны, что проявляется ее воспалением, наличием ссадин, вплоть до изъязвления, а при хроническом воздействии способно привести к развитию рецессий десны.
К06.22 ФРИКЦИОННЫЙ (ФУНКЦИОНАЛЬНЫЙ) КЕРАТОЗ
Возникновение его связывают с наличием хронической не ярко выраженной по силе механической травмы, т.е. трение двух поверхностей друг о друга. Среди причин, приводящих к травме, выделяют: наличие дистопированных зубов, неадекватное протезирование, наличие ортодонтических конструкций, пережевывание пищи на беззубом участке, а также вредные привычки (закладывание леденцов и жевательной резинки между слизистой оболочкой десны и щеки). Также известны случаи развития данного заболевания у стеклодувов. Фрикционный кератоз выявляется в равной степени как у мужчин, так и у женщин; не существует гендерных различий, однако чаще поражает молодых пациентов. Клинически кератоз проявляется наличием тонкой белой ороговевающей полосы в проекции травмы. Поражения на слизистой оболочке десны, как правило, бывают двусторонними и могут сочетаться с аналогичными поражениями по линии смыкания зубов, на передней или боковой поверхности языка. Гистологически кератоз проявляется акантозом и ортокератозом (вариант нормы). В тканях наблюдается интраэпителиальный отек, в некоторых случаях выявляют вакуолизацию. Заболевание дифференцируют от лейкодемы (вариант нормальной слизистой оболочки, которая имеет бело-голубой цвет), невуса, кератоза, возникающего при употреблении бездымного табака, химического кератоза и волосатой лейкоплакии. Лечение не требуется, как правило, озлокачествления не происходит, однако пациент может предъявлять жалобы на боли в пораженной области. Клинические изменения обратимы и исчезают в течение нескольких дней или недель после устранения причины. При упорном течении воспалительного процесса после устранения причины (т.е. более 4 нед) необходимо проявлять онкологическую настороженность.
К06.23 ГИПЕРПЛАЗИЯ ВСЛЕДСТВИЕ РАЗДРАЖЕНИЯ (ГИПЕРПЛАЗИЯ, СВЯЗАННАЯ С НОШЕНИЕМ СЪЕМНОГО ПРОТЕЗА)
Причиной этого является травма краем протеза.
Профилактика заключается в соблюдении принципа законченности лечения: врач после наложения протеза наблюдает больного с целью убедиться в том, что тканям протезного ложа не угрожает травма. Также четкий и полный инструктаж больного о пользовании протезом и диспансерное наблюдении за больным.
Заболевание возникает при несоответствии базиса и кламмеров протеза границам и поверхности протезного ложа.
Клиническая картина зависит от интенсивности действия травмирующего фактора. Катаральное воспаление сменяется появлением пролежневой язвы с отечными краями и кровоточащим дном, вокруг которой в случае сохранения травмирующего фактора возникает гиперплазия эпителия, иногда в виде лепестков, прикрывающих язву.
Дифференциальная диагностика проводится с фибромой, гиперпластическим папилломатозным разрастанием, раковой язвой, милиарно-язвенным туберкулезом, твердым шанкром, трофической язвой.
Лечение сводится к устранению раздражителя - коррекции протеза, либо временному отказу от пользования протезом. После эпителизации повреждения слизистой оболочки возможно иссечение участка гипертрофированной ткани и в дальнейшем изготовление нового протеза.
К06.28 ДРУГИЕ УТОЧНЕННЫЕ ПОРАЖЕНИЯ ДЕСНЫ И БЕЗЗУБОГО АЛЬВЕОЛЯРНОГО КРАЯ, ОБУСЛОВЛЕННЫЕ ТРАВМОЙ
Средства гигиены призваны помочь в профилактике и лечении заболеваний пародонта, контролируя количество патогенной микрофлоры в полости рта. Однако при неправильном использовании средства гигиены сами способны запускать либо осложнять течение патологического процесса в пародонте.
Флоссы при неправильном их использовании также способны приводить к механической травме пародонта. Резкое введение флосса в межзубной промежуток вызывает травму десневого сосочка и развитие папиллита.
Зубочистки. Использование зубочисток вызывают травму краевой десны, а иногда и зубодесневого прикрепления, и как следствие локальное воспаление тканей пародонта.
Применение зубных паст и ополаскивателей для полости рта способно привести к химической травме тканей пародонта.
Зубные пасты, содержащие антисептики (хлоргексидин, триклозан и др.) при длительном, бесконтрольном применении способны вызвать дисбактериоз полости рта и развитие резистентностных форм микроорганизмов. Пасты без контролируемой абразивности могут приводить не только к истиранию твердых тканей зубов, но и оказывать травмирующее воздействие на пародонт.
Ополаскиватели для полости рта, содержащие активные антисептики и спирт, также могут вызывать дисбактериоз полости рта при неправильном применении.
К06.29 НЕУТОЧНЕННЫЕ ПОРАЖЕНИЯ ДЕСНЫ И БЕЗЗУБОГО АЛЬВЕОЛЯРНОГО КРАЯ, ОБУСЛОВЛЕННЫЕ ТРАВМОЙ
Код используется для обозначения травмы пародонта неясной этиологии.
К06.8 ДРУГИЕ УТОЧНЕННЫЕ ИЗМЕНЕНИЯ ДЕСНЫ И БЕЗЗУБОГО АЛЬВЕОЛЯРНОГО КРАЯ*
*К06.80 КИСТА ДЕСНЫ ВЗРОСЛЫХ
Исключена: киста десны новорожденных (К09.82).
Киста, развивающаяся из пролиферирующих остатков зубной пластинки (эктодермальной связки), располагается в мягких тканях, покрывающих зубосодержащие зоны челюсти, имеет вид небольшого узелка, безболезненная. Необходимо наблюдение врача.
К06.81 ГИГАНТОКЛЕТОЧНАЯ ПЕРИФЕРИЧЕСКАЯ ГРАНУЛЕМА (ГИГАНТОКЛЕТОЧНЫЙ ЭПУЛИС)
Гигантоклеточная периферическая гранулема (гигантоклеточный эпулис)
Эпулис (от греч. epi - на, вокруг и ulon - десна) - понимается «новообразование», локализующееся на десне. Согласно Международной гистологической классификации опухолей (ВОЗ, Женева, 1971), образования, исходящие из костной ткани, называются центральной гигантоклеточной гранулемой (остеобластомой). Опухолеподобные поражения, разрастающиеся из тканей десны, именуют гигантоклеточной периферической гранулемой (гигантоклеточный эпулис), локализующейся на альвеолярном отростке. Данное образование чаще встречается у женщин в возрасте 30-40 лет.
Клиническая картина. На альвеолярном отростке челюсти отмечается «грибовидное» образование на широком основании (ножке), схожее с эпулисом, слизистая оболочка над ним синюшно-бурого цвета, бугристой поверхности с участками эрозии и отпечатками зубов-антагонистов, плотноэластической консистенции, безболезненное при пальпации, нередко кровоточит. Зубы, локализующиеся в патологическом очаге, подвижны (рис. 14-26, 14-27, см. цв. вклейку).
На рентгенограмме при данном образовании визуализируется очаг резорбции костной ткани с увеличением расстояния между костными балками.
Гистологическая картина определяет большие скопления многоядерных гигантских клеток типа остеокластов и однотипных, одноядерных овальной формы клеток остеобластов. В ткани эпулиса сочетаются процессы примитивного остеогенеза и резорбции кости, участки разрастания грануляционной рыхлой волокнистой ткани. Для гигантоклеточного эпулиса характерен интерстициальный тип кровообращения, что проявляется наличием межтканевых тяжей, выстланных эндотелием, а также обширные лакуны, переполненные кровью, где отмечается отложение гемосидерина.
Лечение заключается в полном удалении зубов и образования с резекцией альвеолярной части или отростка челюсти. При нерадикальном оперативном вмешательстве возможны не только рецидивы, но и озлокачествление опухоли.
К06.82 ФИБРОЗНЫЙ ЭПУЛИС
Фиброзный эпулис - часто встречающееся образование у лиц зрелого возраста, преимущественно у женщин.
Разрастание на десне, которое по патогистологической картине различают на фиброзный и ангиоматозный. В последние годы считается, что эти виды являются отражением различных стадий хронического воспаления десны, вызванное разными травмирующими факторами с выраженной продуктивной тканевой реакцией с иммунологической перестройкой в патологическом очаге.
Этиология и патогенез. Причиной возникновения разрастания десны является хроническая травма: острым краем кариозной разрушенной полости зуба, исскуственной коронкой, нависающей пломбой, кламерной конструкцией частично съемного протеза, наличие травматической окклюзии при глубоком резцовом перекрытии и т.д. Данные этиологические факторы вызывают хронический воспалительный процесс с разрастанием грануляций, на месте которых по мере созревания образуется зрелая фиброзная ткань.
Клиническая картина. Фиброзный эпулис представляет собой плотное безболезненное разрастание бледно-розового цвета, часто с гиперемированным краем, неправильной формы с четкими границами на широком основании. Чаще всего располагается на вестибулярной поверхности, но может через межзубной промежуток распространяться на язычную или нёбную сторону, в виде седла. Зубы, прилегающие к образованию, имеют плохо припасованную металлокерамическую коронку либо незашлифованную пломбу или острые края коронки, разрушенные кариесом, а также над- или поддесневые зубные отложения (рис. 14-28, см. цв. вклейку).
Ангиоматозный эпулис отличается мягкоэлатической консистенцией и более ярко красного цвета, кровоточащий при зондировании, а при гистологическом исследовании на фоне незрелой фиброзной ткани прослеживается большое количество кровеносных сосудов (рис. 14-29, см. цв. вклейку).
При рентгенологическом исследовании эпулисов патологических изменений костной ткани не отмечается.
Лечение. На первом этапе лечение заключается в устранении травмирующих факторов: это снятие коронки, коррекции пломб, удаление зубных отложений и корней. После чего в течение 2-3 нед отмечается уменьшение или полная регрессия образования. Оперативное лечение заключается в иссечение образования в пределах здоровых тканей. Отступя от края образования 2-3 мм, скальпелем рассекают ткани до кости, распатором отделяют патологически изменённые ткани вместе с надкостницей. Кровоточащие участки ткани электрокоагулируют, в созданный дефект укладывают йодоформнуюρ турунду, под которой рана постепенно гранулирует и эпителизируется. Корни зубов, расположенные в зоне образования, могут оголяться, поэтому в предоперационном периоде их депульпируют (рис. 14-30, см. цв. вклейку).
К06.83 ПИОГЕННАЯ ГРАНУЛЕМА
Исключена: пиогенная гранулема других локализаций (К13.40).
Пиогенная гранулема (син.: телеангиэктатическая гранулема, ботриомикома, гемангиома грануляционнотканного типа) - частое заболевание кожи и слизистых оболочек, представляющее собой не опухоль, а реактивный ответ в виде выраженной пролиферации грануляционной ткани на механическую травму, гормональные нарушения.
Излюбленной локализацией опухолеподобного образования является граница кожи и красной каймы губ, на слизистой оболочки полости рта, языка, твёрдого нёба, дёсен. Одинаково часто встречается как у женщин, так и у мужчин до 30 лет.
Этиология и патогенез. Развивается при недостаточном уходе за полостью рта, наличии местных раздражающих факторов, зубного камня, при гормональном дисбалансе у женщин во время беременности и в климактерическом периоде. Обладает быстрым ростом, в течение 1-2 нед достигает размеров от 2 до 3 см, а затем спонтанно уменьшается с формированием фибромы.
Клиническая картина. В полости рта пиогенная гранулема развивается из межзубного сосочка на вестибулярной или язычной поверхности, на тонкой ножке, бугристая, синевато-багрового цвета, безболезненная, мягкоэластической консистенции, легко кровоточащая. Поверхность её может быть эрозированной и покрыта фибринозным налетом (рис. 14-31, см. цв. вклейку).
Гистологическая картина. Ранние очаги пиогенной гранулемы идентичны гранулематозной ткани, состоящие из множественных капилляров и венул, расположенные радиально к поверхности, строма, как правило, отечна и инфильтрирована. Сформированная пиогенная гранулема имеет полиповидный очаг, разделенный фиброзными перегородками на доли, которая состоит из скопления капилляров и венул с отечными эпителиальными клетками и полностью покрыта эпидермисом. На стадии фиброза отек исчезает, происходит уменьшение долек и постепенное разрастание фиброзной ткани, вследствие чего пиогенная гранулема превращается в фиброму.
Лечение. Иссечение образования двумя сходящимися разрезами в пределах здоровых тканей, отступя от основания 2-3 мм, рана ушивается путем сближения крав. В местах, где отсутствует подслизистый слой (твердое нёбо, десна), в области дефекта подшивается йодоформнаяρ турунда, под которой рана постепенно эпителизирует.
К06.84 АТРОФИЯ ГРЕБНЯ ЧАСТИЧНАЯ
Снижение высоты и толщины (ширины) альвеолярного отростка верхней челюсти или альвеолярной части нижней челюсти в области отсутствия одного или нескольких зубов. Возникает после удаления зуба, при использовании частичного съёмного протеза, несъёмного мостовидного протеза под промывной частью. Альвеолярный гребень истончается и происходит снижение его высоты. Необходимо сохранение или восстановление формы, толщины и высоты альвеолярного гребня: применение зубосохраняющих методик лечения, предупреждающих удаление зубов, костная пластика альвеолярного гребня, использование имплантатов.
К06.88 ДРУГИЕ ИЗМЕНЕНИЯ
Данный вид изменения десны и беззубого альвеолярного края рассматривается в главах «Симптомы и синдромы, проявляющиеся в тканях пародонта», «Поражения пародонта при заболеваниях слизистой оболочки полости рта и системных заболеваниях», «Заболевания пародонта и ВИЧ-инфекция», «Особенности клинической картины, диагностики, лечения заболеваний пародонта при общесоматической патологии».
К06.9 ИЗМЕНЕНИЕ ДЕСНЫ И БЕЗЗУБОГО АЛЬВЕОЛЯРНОГО ГРЕБНЯ НЕУТОЧНЕННОЕ
Данный вид изменения десны и беззубого альвеолярного края рассматривается в главах «Симптомы и синдромы, проявляющиеся в тканях пародонта», «Поражения пародонта при заболеваниях слизистой оболочки полости рта и системных заболеваниях», «Заболевания пародонта и ВИЧ-инфекция», «Особенности клинической картины, диагностики, лечения заболеваний пародонта при общесоматической патологии».
Класс: некоторые инфекционные и паразитарные болезни. Блок: другие болезни, вызванные спирохетами.
А69.10 ОСТРЫЙ НЕКРОТИЧЕСКИЙ ЯЗВЕННЫЙ ГИНГИВИТ (ФУЗОСПИРОХЕТНЫЙ ГИНГИВИТ, ГИНГИВИТ ВЕНСАНА)
Синонимы. Гангренозный стоматит, дифтерийный стоматит, фузоспирохетозный гингивит, фузоспирохетозный стоматит, фузоспирохетоз, стоматит Плаута-Венсана, болезнь Венсана, острый некротический язвенный гингивит, гингивит Венсана.
Чрезвычайно редко встречается как первичное поражение, как правило, представляет фазу обострения простого маргинального гингивита и характеризуется резко выраженными явлениями альтерации.
Этиология. Причиной может быть как резкое увеличение микробных скоплений и, соответственно, усиление их повреждающего потенциала, так и падение механизмов общей и местной защиты, на фоне чего происходит резкая активация микрофлоры, особенно анаэробной и простейших (фузобактерий), веретенообразные палочки (Bacillus fusiformis, Clostridium multiforme) и спирохеты (Borellia Vincenti, Borellia buccalis). Данные микроорганизмы относят к условно-патогенной флоре полости рта, живущим в глубоких слоях зубного налета, пародонтальных карманах, под слизистым капюшоном в области ретинированных третьих моляров, в разрушенных зубах, между нитевидными сосочками обложенного языка, в криптах миндалин.
Причины падения механизмов защиты могут быть различными: понижение иммунитета, переохлаждение, ОРВИ, ангина, грипп, другие инфекционные заболевания, переутомления, нарушение питания (гиповитаминоз С и др.), стрессовые ситуации, курение, приём наркотиков.
Одним из обстоятельств, указывающих на роль снижения резистентности организма в возникновении язвенно-некротического гингивита, является то, что чаще пик заболеваемости приходится преимущественно на зимне-весенний период года. У студентов и военнослужащих - соответственно на период сессии и тренировочных занятий в режиме «по тревоге». Однако главная причина - неудовлетворительное гигиеническое состояние рта. Возникновение язвенного процесса при затрудненном прорезывании третьего моляра также объясняется имеющимся в таких случаях большим скоплением микроорганизмов.
Язвенно-некротическим гингивостоматитом Венсана чаще болеют молодые, практически здоровые мужчины от 17 до 30 лет (как правило, с плохим гигиеническим состоянием рта).
Клиническая картина. Наиболее характерные признаки: резкая самопроизвольная боль, затрудняющая прием пищи, речь, чистку зубов; наличие язв, покрытых некротическим налетом на деснах; резкий, неприятный гнилостный запах изо рта. Местные проявления болезни сопровождаются повышением температуры тела до 37,5-39 °С, слабостью, головной болью, болями в суставах, мышцах. В анамнезе такие больные обычно указывают на кровоточивость дёсен продолжительностью от нескольких недель до нескольких лет.
При внешнем осмотре обычно характерны землистый цвет лица, бледность кожных покровов. Подчелюстные лимфатические узлы увеличенные и болезненные, обильная саливация, большие скопления мягкого налета на зубах.
Десна ярко гиперемирована, легко кровоточит, покрыта серовато-зеленым налетом, после снятия которого, обнажается кровоточащая раневая поверхность. Десневые сосочки приобретают вид «отрезанных», из-за некротизации их вершины (рис. 14-32, см. цв. вклейку). Часто процесс начинается с десны в области третьих моляров нижней челюсти (перикоронит), распространяется на прилежащую слизистую оболочку щеки и ретромолярную область, что приводит к тризму, болезненности при глотании и припухлости щеки за счет отека окружающих тканей.
При отсутствии лечения процесс распространяется по десневому краю, приобретает генерализованный характер и быстро углубляется, вовлекая в процесс костную ткань альвеолярного отростка.
Диагностика. Диагноз не представляет сложности ввиду характерной клинической картины.
Диагноз язвенно-некротического гингивостоматита Венсана ставят на основании результатов бактериоскопического исследования, данных гемограммы и отрицательных показателей на ВИЧ-инфекцию.
При бактериоскопическом исследовании материала с язвенно-некротической поверхности (окраска язур-эозин) определяются элементы неспецифического воспаления (лейкоциты, гистиоциты) и в большом количестве веретенообразные палочки и спирохеты. В остром периоде заболевания эта флора является главенствующей в микроскопических препаратах.
Клинические показатели крови при относительно кратковременном процессе у большинства больных в пределах нормы. При более длительном течении они могут уменьшаться: увеличивается СОЭ и количество лейкоцитов до верхней границы нормы (8,0-9,0×109/л) либо выше. Однако это может быть связано и с фоновым заболеванием.
Дифференциальная диагностика. Ее проводят, прежде всего, с язвенным гингивитом при заболеваниях крови (лейкоз, агранулоцитоз и др.) и пародонтитом легкой степени с некротическими изменениями десны, СПИДом, висмутовым и свинцовым гингивитом (в случае язвенно-некротических изменений при этих заболеваниях).
Лечение. Местные процедуры направлены на устранение очага воспаления, предотвращение распространения патологических изменений на другие отделы слизистой оболочки полости рта. Общие меры направлены на повышение сопротивляемости организма и устранение явлений интоксикации. Сверх общепринятых перечисленных мер необходимо предусмотреть удаление некротических масс, для чего следует, кроме чисто механического способа, использовать протеолитические ферменты: трипсин, химотрипсин, лизоамидазуρ, литинρ, гигролитинρ, нуклеазы и др. Все процедуры нужно проводить под прикрытием тщательной обработки десны антисептическими и антимикробными препаратами широкого спектра действия. К таким препаратам относят лакалют♠, листеринρ, раствор хлоргексидина 0,06%, гель с 25% метронидазолом и хлоргексидином; сангвинарин♠, сангвиритрин линимент 1%♠, раствор 0,2%. Все манипуляции следует проводить только под аппликационной, инфильтрационной или проводниковой анестезией. Удаляют мягкий налёт, по возможности твёрдые зубные отложения. Пациенту дают инструкции по гигиене рта с использованием ультрамягкой зубной щётки, назначают ротовые ванночки растворами антисептиков.
При интоксикации внутрь назначают метронидазол по 0,25 г 3 раза в сутки и доксициклин 0,2 г 1 раз в день - 8 дней, аскорбиновая кислота + рутозид (аскорутин♠) по 1 таблетке 3-4 раза в сутки, эбастин (кестин♠), мебгидролин (диазолин♠) или лоратадин на ночь, при стрессовой ситуации - феназепам♠, микстуру Бехтереваρ и др. После устранения острых воспалительных явлений необходимы санация полости рта, обучение больного правилам гигиены, лечение простого маргинального гингивита.
В зависимости от степени язвенных поражений после лечения остаются различной выраженности дефекты десневого края.
Профилактика. Заключается в своевременном лечении простого маргинального гингивита, кариеса зубов, соблюдении правил гигиены рта, профилактике инфекционных заболеваний, отказе от курения. Особенно важно закаливание организма в целях повышения устойчивости к влиянию различных инфекций.
Прогноз. Полное выздоровление наступает в сроки от 3 до 7 дней. Однако вершины некротизированных десневых сосочков не восстанавливаются. Рецидивы заболевания возможны при плохом гигиеническом состоянии полости рта на фоне пониженного иммунитета.
Симптомы и синдромы, проявляющиеся в тканях пародонта
К05.5. ДРУГИЕ БОЛЕЗНИ ПАРОДОНТА
В отличие от гингивита и пародонтита, причиной которых является обязательное наличие микробного налёта как причинного фактора, данные поражения первично обусловлены наличием различных соматических нарушений и генетическим влиянием, т.е. действием наследственного фактора. Присутствие микробных скоплений необязательно для проявления общих поражений в тканях пародонта в виде специфических изменений. Однако наличие бактериальной флоры изменяет клинические формы общих воздействий в виде обязательного наслоения выраженного воспалительного компонента, который соответствующим образом меняет клиническую картину, как правило, представленнную совокупностью воспалительных, деструктивных, а в ряде случаев и гиперпластических изменений в тканях. Пародонт вовлекается в процесс при целом ряде заболеваний различного характера, специфические проявления которых также весьма многообразны. С целью упрощения изложения этого раздела мы разделили эти общие заболевания на несколько групп (весьма условно):
Повторяем, что такое деление условно, так как большинство общесоматических влияний характеризуется вовлечением одновременно нескольких перечисленных выше факторов.
Характерно, что врач-стоматолог, как правило, может проводить только симптоматическое лечение, устраняя по мере сил приносящие пациенту страдания.
В основном это противовоспалительные и антимикробные меры, удаление гиперпластических разрастаний, устранение болей. Зачастую таким пациентам требуется ортопедическое лечение - врач обязан подготовить пациента к нему.
Учитывая, что в ряде случаев общие заболевания проявляются именно в полости рта и в пародонте, в частности, стоматолог обязан своевременно направить пациента к врачу общего профиля либо конкретно к эндокринологу или гематологу, а в последующем поддерживать постоянный контакт с ним, определяя характер лечебных воздействий.
СИНДРОМ ПАПИЙОНА-ЛЕФЕВРА Q 82.82
Синдром Папийона-Лефевра (ладонно-подошвенный дискератоз) - достаточно редко встречающееся заболевание, которое наследуется по аутосомно-рецессивному типу и характеризуется сочетанием ороговения внутренних поверхностей ладоней и подошв с воспалительно-деструктивными изменениями пародонта. Поражение пародонта вызвано нарушением функций лейкоцитов, а также специфической бактериальной флорой зубного налета (Actinobacillus actinomycetemcomitans). Однако выраженный гиперкератоз едва ли определяется перечисленными причинами. Скорее всего эти клинические проявления имеют метаболическую основу - нарушение триптофанового обмена.
Первые признаки заболевания (воспаление десны, расшатывание и выпадение вначале временных зубов, а по мере прорезывания - и постоянных, развитие той же клинической картины: расшатывание и смещение зубов с последующим выпадением) у ребенка проявляются именно в пародонте: разрыхлённая, легко кровоточащая десна, пародонтальные карманы с серозным или гнойным экссудатом в области даже молочных (а позже и постоянных) зубов (рис. 14-33, см. цв. вклейку). На рентгенограммах явления генерализованного лизиса костной ткани. К 14-15 годам ребенок может потерять зубы постоянного прикуса. На коже ладоней и подошв явления повышенного ороговения и десквамации эпителия. Общее же состояние больных, как правило, не нарушено.
Диагностика не представляет сложностей в связи с характерными кожными проявлениями. Дифференциальный диагноз требуется редко: в случае сочетания этого поражения с другими системными нарушениями. Состояние же пародонта представляет картину, достаточно типичную для большинства других синдромов и симптомов.
Лечение симптоматическое: профессиональная гигиеническая обработка, противовоспалительная терапия, протезирование. Общее лечение назначает и контролирует педиатр.
НАСЛЕДСТВЕННЫЙ ФИБРОМАТОЗ ДЕСЕН
Наследственный фиброматоз десен - редкое наследственное заболевание, которое может быть изолированным заболеванием или составлять часть синдрома. Заболевание представляет собой генетическое нарушение. В случае изолированного заболевания может быть спорадическим или наследоваться по аутосомно-доминантному или изредка - по аутосомно-рецессивному типу. Характерным клиническим симптомом является выраженная гипертрофия десен, которые частично или полностью закрывают зубы. Десны гладкие, плотной консистенции, нормального цвета. Подобные клинические симптомы появляются в детском возрасте и иногда замедляют прорезывание зубов.
Диагностика. Диагноз ставят на основании данных анамнеза и клинического обследования, дополненного биопсией и гистологическим исследованием. Дифференциальный диагноз проводят с синдромами Лейбенда, Кросса, гипертрофией десен под влиянием лекарственных средств (фенитоина, циклоспорина, блокаторов кальциевых каналов), болезнью Крона, амелоидозом, лейкозом.
Лечение симптоматическое: профессиональная гигиена, противовоспалительная терапия, при необходимости хирургическое лечение.
СИНДРОМ ЛОКАЛЬНОГО ГИПЕРКЕРАТОЗА СЛИЗИСТОЙ ОБОЛОЧКИ ПОЛОСТИ РТА, ЛАДОНЕЙ И ПОДОШВ
Синдром локального гиперкератоза слизистой оболочки полости рта, ладоней и подошв (hyperkeratosis palmoplantaris и гиперкератоз прикрепленной десны) - необычное наследственное заболевание: гиперкератоз кожи и слизистой оболочки полости рта. Причиной заболевания является генетическое нарушение, которое наследуется по аутосомно-доминанатного типу. Основная локализация на слизистой оболочке полости рта на участках, подверженных механическому давлению или трению (твердое нёбо, слизистая оболочка ретромолярного участка нижней челюсти, альвеолярная слизистая оболочка, боковая поверхность языка. Также могут быть проявления на коже ладоней и подошв.
Основное клиническое проявление - это выраженный гиперкератоз прикрепленной десны; участки поражения выглядят, как лейкоплакия. Воспаление отсутствует, уровень прикрепления не нарушен. Реже наблюдаются участки гиперкератоза на других участках слизистой оболочки полости рта. Всегда наблюдается гиперкератоз участков ладоней и подошв, связанных с противодействием нагрузке и подверженных давлению. Иногда наблюдаются дистрофия ногтей и повышенная потливость. Гиперкератоз проявляется в раннем детстве, и его выраженность с возрастом нарастает.
Диагностика. Диагноз ставят на основании данных клинического обследования, гистологического исследования. Дифференциальный диагноз проводят с лейкоплакией, белым губчатым невусом, врожденным дискератозом.
Лечение. Некоторый эффект даёт применение кератопластических средств.
СИНДРОМ ЭЛЕРСА-ДАНЛО Q 79.6X
Синдром Элерса-Данло - аутосомно-доминантно-наследуемая группа заболеваний с дефектным синтезом коллагена (10 форм заболеваний). При типах IV и VIII обычно вовлекаются ткани пародонта даже в области молочных зубов.
Заболевание характеризуется гиперэластичной и ранимой кожей с гиперпигментацией, рецидивирующими гематомами, слабым развитием подкожного жирового слоя, чрезмерной подвижностью суставов (в частности, височно-нижне-челюстного). При этом часто встречаются сколиоз, синдактилия, бронхоэктазия, нередко и нарушения интеллекта.
Для данной патологии характерны раннее прорезывание и неправильное расположение зубов в зубном ряду, наличие сверхкомплектных зубов или же, напротив, отсутствие отдельных зубов и их зачатков. Зубы обычно мелкие, с меловидными пятнами на эмали, которая отличается повышенной ломкостью.
Слизистая оболочка щёк и языка гиперэластична. Десна при чистке зубов сильно кровоточит.
Рентгенологически выявляются участки деструкции костной ткани в виде множества интенсивных плотных теней неправильной формы с четкими границами, связанных с корнями зубов, цементная дисплазия челюстей. Корни зубов деформированы, искривлены, периодонтальная щель не определяется в участках, где корень зуба спаян с патологической тканью. Корневые каналы прослеживаются не у всех зубов.
Диагностика основана на клинических проявлениях.
Дифференциальный диагноз проводят с агрессивными формами пародонти-та и проявлениями других синдромов (в частности, с синдромом Марфана). Лечение симптоматическое.
СИНДРОМ ОСЛЕРА I78.0X
Син.: болезнь Ослера, болезнь Ослера-Рандю, болезнь Рандю-Вебера-Ослера, семейная наследственная телеангиэктазия, наследственная геморрагическая телеангиэктазия, геморрагический ангиоматоз - наследственное заболевание, передается по аутосомно-доминантному типу. Характеризуется локальным расширением мелких сосудов (венул и капилляров) вследствие их структурной неполноценности и кровотечением из них. При этом коагуляционный и тромбоцитарный гемостаз не нарушен. Встречается редко.
Для генерализованной формы болезни характерно расположение телеангиэктазий на слизистых и серозных оболочках кожи, во внутренних органах (лёгких, печени, селезёнке, почках), в костях (чаще в позвоночнике).
Клинически характерны частые, профузные, не связанные с внешними причинами носовые кровотечения (у 80% больных). Реже - кровотечения из ЖКТ, лёгких, почек, мочевыводящих путей, кровоизлияния в мозг, в оболочки мозга, сетчатку.
Впервые могут появиться в любом возрасте, но чаще в 40-50 лет. Телеангиоэктазии небольшие (1-3 мм), плоские, пурпурно-фиолетового цвета, не пульсируют, кровоточат даже при незначительном механическом воздействии. Располагаются на слизистой оболочке носа, губ, дёсен, языка, щёк, на коже волосистой части головы, лица (особенно на крыльях носа и ушных мочках), конечностей, туловища, а также на конъюнктиве и под ногтями. Характерна гипохромная, микроцитарная, железодефицитная анемия. Болезнь часто сочетается с сосудистыми аномалиями (аневризмы и ангиомы в легких).
Диагноз устанавливается на основании клинической картины и данных анамнеза.
Дифференциальный диагноз проводят с рядом наследственных коагулопатий, при которых нарушен коагуляционный и тромбоцитарный гемостаз (например, болезнь Виллебранда - ангиогемофилия).
Лечение симптоматическое. Для остановки кровотечений используют различные гемостатические средства (гемостатическая марля или губка, ε-амино-капроновая кислота).
Прогноз в большинстве случаев для жизни благоприятный.
СИНДРОМ ЧЕДИАКА-ХИГАСИ
Синдром Чедиака-Хигаси - очень редкое аутосомно-рецессивное наследственное заболевание. Характеризуется нарушениями функций нейтрофильных гранулоцитов (хемотаксиса, внутриклеточной дистрофией).
Прогноз неблагоприятный.
СИНДРОМ МАРФАНА Q 87.4
Син.: врожденная гипопластическая мезодермальная дистрофия, акрохондро-гиперплазия, дизлинзектопия, долихоморфия). Наследуется по аутосомно-доминантному типу, обусловлен наследственным пороком развития соединительной ткани, характеризуется поражением опорно-двигательного аппарата, глаз и внутренних органов. Встречается редко.
Этиология и патогенез изучены недостаточно. Значительное место в патогенезе принадлежит нарушению обменных процессов. Характерны нарушение метаболизма и накопление в организме больного свободных или слабосвязанных с белком кислых мукополисахаридов - гликозаминогликанов (ГАГ типа гидроксипролина, хондроитинсерной и гиалуроновой кислот). Это проявляется нарушением строения эластических и коллагеновых волокон, основной субстанции соединительной ткани. Нарушается функция коркового слоя надпочечников.
Клинически проявляется весьма характерными и постоянными признаками: резко выраженной астенической конституцией, «птичьим лицом» (череп узкий, подбородок срезанный или выступающий, близко посаженные глаза), ушные раковины тонкие и малоэластичные, кисти и стопы длинные с тонкими «паукообразными» пальцами. Впалая грудь, кифоз и т.д. Умственное развитие больных с синдромом Марфана не страдает.
Гистологически выявляется, что эластические волокна истончены, расположены неравномерно, местами хаотично; имеются расслоения средней оболочки крупных сосудов, разрыхления эндотелиального слоя, образование в эндотелиальном и субэндотелиальном слоях подушкообразных выступов, выходящих в просвет сосудов. Нарушена структура хрящевой ткани за счет образования коллагеновых пучков, расслаивающих межуточное вещество. В костной ткани наблюдается разряженность костных балок и неравномерное отложение извести.
Диагноз ставят на основании клинических лабораторных данных (повышенная экскреция с мочой ГАГ и оксипролина).
Лечение. Радикальных методов нет. Назначают глюкокортикоиды, учитывая снижение функции надпочечников.
Прогноз: как правило, неблагоприятный.
НАСЛЕДСТВЕННАЯ ХРОНИЧЕСКАЯ И ЦИКЛИЧЕСКАЯ НЕЙТРОПЕНИЯ D 70.X1
Эти две формы заболевания характеризуются резким снижением в крови количества нейтрофилов при одновременном увеличении содержания моноцитов и базофилов. При хронической форме это постоянно, при циклической - на протяжении 1 нед в течение месяца.
Клинические проявления обусловлены снижением неспецифической резистентности ребенка, в результате развиваются гнойничковые изменения кожи: фурункулез, блефарит. С начала прорезывания молочных зубов возникает гингивит, который быстро распространяется на периодонт и костную ткань альвеолярного отростка: образуются пародонтальные карманы, зубы становятся подвижными и выпадают. Эти же явления происходят и при формировании постоянного прикуса. При хронической нейтропении к 12-14 годам ребенок зачастую теряет все зубы. При циклической форме прогноз более оптимистичен. Именно пародонтальные нарушения в большинстве случаев служат причиной направления ребенка стоматологом к педиатру, что позволяет своевременно выявить основное заболевание (рис. 14-34, см. цв. вклейку).
Лечение только симптоматическое: регулярная профессиональная гигиеническая обработка, гигиеническая мотивация и контроль, противовоспалительное лечение.
Прогноз: при циклической нейтропении при условии качественной индивидуальной гигиены и регулярном лечении - удовлетворительный.
АГРАНУЛОЦИТОЗ D 70
Агранулоцитоз - острое гематологическое заболевание, для которого характерно резкое снижение количества нейтрофилов или всех гранулоцитов в крови.
Причиной заболевания может служить побочное действие лекарственных средств, идиопатические или инфекционные заболевания в сочетании с неудовлетворительной гигиеной полости рта. Клинически проявляется изъязвлением и некрозом десны, сопровождающимися геморрагиями в слизистой оболочке десны. Иногда происходит генерализованная деструкция костной ткани.
Диагностика. Диагноз ставят на основании клинического обследования и лабораторных исследований (общий анализ крови, биопсия костного мозга). Дифференциальный диагноз проводят с некротическим язвенным гингивитом и стоматитом, острым лейкозом, наследственной циклической нейтропенией.
Лечение только симптоматическое с учётом рекомендаций гематолога.
ГИПОГАММАГЛОБУЛИНЕМИЯ D 80.VX
Причина - недостаток одного или нескольких классов иммуноглобулинов, в связи с чем в разной степени снижена общая резистентность организма.
Клинически проявляется гнойными процессами на коже, частыми инфекционными заболеваниями. Пародонт поражается часто, характерны гипертрофия краевой десны, разрастание десневых сосочков различной степени, иногда на всю высоту коронок. Десна разрыхлена, неплотно прилежит к зубам, быстро образуются пародонтальные карманы, особенно при неудовлетворительной гигиене полости рта.
Рентгенологически определяется воспалительная деструкция костной ткани без каких-либо особенностей (Виноградова Т.Ф., 1987).
Диагноз устанавливают только на основании результатов иммунологического исследования крови. В таких случаях именно стоматолог может быть инициатором направления пациента на углубленное клиническое обследование.
Лечение. Только симптоматическое с учетом рекомендаций иммунолога и гематолога.
ЛЕЙКОЗЫ
Лейкозы - гетерогенная группа тяжелых злокачественных заболеваний, для которых характерны нарушения созревания и пролиферации лейкоцитов.
Поражение десен наблюдают часто: при острых лейкозах примерно в 30% случаев, при хронических - в 10%. Среди основных симптомов, проявляющихся в полости рта, следует назвать некроз (эрозии), кровоточивость и разрастание десен. Иногда может происходить быстрая деструкция альвеолярной кости. Нередко именно поражение дёсен является первым проявлением лейкоза. При наличии у больного двух из трех упомянутых выше симптомов врач-стоматолог обязан немедленно провести общее терапевтическое обследование.
Диагностика. Диагноз ставят на основании результатов клинического и обязательно - лабораторного исследований.
Лечение. Стоматолог проводит симптоматическое лечение.
Х-ГИСТИОЦИТОЗЫ
Гистиоцитозы Х - группа заболеваний неясной этиологии, связанных с патологической пролиферацией гистиоцитов и эозинофилов, вследствие чего возникают очаговые и системные повреждения.
К группе гистиоцитозов относятся: острый системный прогрессирующий гистиоцитоз (болезнь Леттерера-Зиве), хронический системный прогрессирующий гистиоцитоз (болезнь Хенда-Шюллера-Крисчена) и эозинофильная гранулема. Многие исследователи рассматривают все три формы гистиоцитозов как взаимосвязанные варианты (или синдромы) единой нозологической формы, обозначаемой как пролиферативно-обменный ретикулогистиоцитоз. Наиболее частой формой гистиоцитозов является эозинофильная гранулема. В 1953 г. Л. Лихтенстайн предложил обозначать данные три формы гистиоцитозов как гистиоцитозы Х, так как нозологическая принадлежность процесса точно не установлена.
Высказывается мнение о трансформационных вариантах гистиоцитоза Х. Так, эозинофильная гранулема может развиваться на фоне хронического системного гистиоцитоза Х, а острый системный гистиоцитоз Х - проявляться как обострение хронического системного гистиоцитоза Х. Возможно преобразование эозинофильной гранулемы в липидную.
Болезнь Хенда-Шюллера-Крисчена и болезнь Леттерера-Зиве сближаются с некоторыми эндогенными тезаурисмозами, в частности со сфинголипидозами, к которым относятся болезни Гоше и Ниманна-Пика.
Гистологически изменения при всех формах одинаковы: диффузная гистиоцитарная пролифирация, сопровождающаяся геморрагическим отёком, некрозом и лейкоцитарной инфильтрацией. Наличие эозинофилов зависит от формы и стадии заболевания, которые могут переходить одна в другую (рис. 14-35, см. цв. вклейку).
ЭОЗИНОФИЛЬНАЯ ГРАНУЛЕМА КОСТЕЙ (БОЛЕЗНЬ ТАРАТЫНОВА)
Эозинофильная гранулема костей характеризуется наличием в костях инфильтратов, состоящих из гистиоцитарных элементов, эозинофилов, лейкоцитов, а также нейтрофилов, лимфоцитов и плазматических клеток. Впервые была описана казанским патологоанатомом Н.И. Таратыновым (1913) как псевдотуберкулезная гранулема неясной этиологии. В настоящее время рассматривается как один из вариантов Х-гистиоцитозов.
Различают продромальную стадию (1,5-2 мес) и стадию выраженных проявлений. В продромальный период возникают одиночные очаги деструкции в скелете, проявляющиеся незначительной болью, зудом, припухлостью в пораженном участке. Процесс чаще локализуется в плоских костях: поражаются череп, нижняя челюсть (альвеолярная часть и ветвь). Отмечают подвижность 1-2 моляров, кровоточивость дёсен, глубокие пародонтальные карманы без гнойного отделяемого, возможно изъязвление десневого края. Нередко очаги поражений располагаются симметрично.
Стадия выраженных проявлений характеризуется воспалением мягких тканей пародонта и прогрессирующей подвижностью зубов, может быть абсцедирование. После выпадения зубов альвеолы долго не заживают, и процесс резорбции продолжается. В костной ткани наблюдают очаги резорбции овальной или округлой формы различной величины (1-4 см). Они локализуются в области верхушек зубов, угла нижней челюсти или её ветви; иногда процесс затрагивает тело челюсти. Течение длительное.
Этиология неизвестна. На основании обнаружения в клетках вирусоподобных включений высказывают предположение о вирусной этиологии. Некоторые исследователи, учитывая хороший эффект от введения кортикостероидов и антибиотиков, считают, что развитие эозинофильной гранулемы обусловлено аллергическим процессом.
Клиническая картина. Эозинофильная гранулема наблюдается преимущественно в старшем детском и юношеском возрасте в виде одиночного, солитарного или множественного поражения костей. Чаще встречается у детей 5-10 лет, в 70% поражение носит солитарный характер. Чаще всего локализуется в костях черепа, бедренной, плечевой, но может быть и в костях таза, позвонках. Обычно сопровождается болью в зоне поражения.
Диагноз устанавливается по данным рентгенологического и морфологического исследований.
Рентгенологически определяются очаги деструкции округлой или неправильной формы с фокусом в губчатом веществе, но затем процесс переходит на компактное вещество, вызывая его прободение. Иногда в центре определяются костные секвестры. Материал для морфологического исследования получают при биопсии, пункции или кюретаже.
Лечение хирургическое, которое иногда дополняют лучевой терапией.
БОЛЕЗНЬ ЛЕТТЕРЕРА-ЗИВЕ M9722/3,C96.0X (ОСТРЫЙ СИСТЕМНЫЙ ПРОГРЕССИРУЮЩИЙ ГИСТИОЦИТОЗ)
Чаще бывает у детей раннего возраста (до 3 лет).
Этиология неясна. Признается и опухолевая природа заболевания, и вирусная.
Патогенез: в основе заболевания лежит пролиферация гистиоцитов Х.
Клиническая картина. Заболевание начинается остро, сопровождается резким подъёмом температуры тела, пятнисто-папулезными высыпаниями на коже, увеличением печени и селезёнки, прогрессирующей анемией, лимфаденитом.
Ранние симптомы - себорея на основе мокнутия в кожных складках, папулезная сыпь. Характерно поражение слизистых оболочек в виде упорных стоматита и вульвовагинита, рецидивирующего отита. В более отдаленные сроки - поражения костей, чаще поражаются плоские кости (таза, лопатки, череп).
Может быть и экзофтальм, и несахарный диабет.
Рентгенологически выявляются очаги разряжения с четкими границами, прежде всего губчатой кости. Характерно, что надкостница не вовлекается в процессс даже при бурном течение процесса.
Лечение: цитостатики, гормональные препараты курсами. Иногда лучевая терапия.
Прогноз неблагоприятный.
БОЛЕЗНЬ ХЕНДА-ШЮЛЛЕРА-КРИСЧЕНА D76.01
Болезнь Хенда-Шюллера-Крисчена D76.01 - болезнь группы гистиоцитозов Х, характеризующаяся инфильтрацией различных органов и тканей атипичными гистиоцитарными элементами. Впервые описал Хенд в 1893 г. у трехлетнего ребенка, а Шюллер (1916) и Крисчен (1919) выделили триаду симптомов при этой болезни:
Этиология неизвестна. Некоторые исследователи относят к инфекционным болезням, возможно, вирусной этиологии, другие связывают с иммунологической недостаточностью.
Клиническая картина: боли в костях. Деструкция костей челюстей, приводящая к подвижности зубов и выпадению зубов. Стоматит.
Гистологически в костях выявляются дефекты, заполненные опухолевидными гранулематозными разрастаниями желтого цвета. Могут иметь место гипертрофия десен, выпадение зубов, очаговые утолщения и изъязвления слизистой оболочки ЖКТ, папулезные высыпания на коже.
Диагноз устанавливается по данным клинических, рентгенологических и гистологических исследований.
Лечение, как правило, оперативное в сочетании с лучевой терапией.
Прогноз в большинстве случаев благоприятный.
Профилактика не разработана.
СИНДРОМ ГОШЕ-ШЛАГЕНГАУФЕРА (КЕРАТИНОВЫЙ РЕТИКУЛОГИСТИОЦИТОЗ, БОЛЕЗНЬ ГОШЕ, ПЕРВИЧНАЯ ИДИОПАТИЧЕСКАЯ СПЛЕНОМЕГАЛИЯ, ГЛЮКОЦЕРЕБРОЗИДНЫЙ ЛИПИДОЗ)
Различают острую и хроническую формы болезни Гоше. Острая форма бывает у детей 1 года жизни, заболевание быстро прогрессирует и заканчивается летальным исходом. Хроническую форму наблюдают у детей старше 10 лет. Она проявляется малым ростом, спленомегалией, изменениями в костях (рентгенологически определяют остеопороз или остеосклероз), которые сопровождаются болями. Реже наблюдают увеличение печени и лимфатических узлов; характерна желтовато-коричневая окраска кожи.
В полости рта проявления пародонтита тяжелой степени с пролиферативными изменениями десен, подвижностью зубов. Слизистая оболочка рта желтушная, с очагами кровоизлияний. При клиническом анамнезе крови определяются гипохромная анемия, степень которой нарастает по мере длительности болезни, лейкопения, тромбоцитопения. Типичный признак болезни - наличие клеток Гоше в селезенке и костном мозге.
Диагностика. Диагноз ставят на основании клинического обследования, рентенологического исследования, лабораторных методов исследования (иммунологического, гистологического). Дифференциальный диагноз проводят с болезнью Ниманна-Пика, лейкозами.
Лечение симптоматическое.
БОЛЕЗНЬ НИМАННА-ПИКА E 75.22 (СФИНГОМИЕЛИНОВЫЙ ЛИПИДОЗ, РЕТИКУЛЯРНЫЙ И ГИСТИОЦИТАРНЫЙ СФИНГОМИЕЛИНОЗ, ЭССЕНЦИАЛЬНЫЙ ЛИПОИДНЫЙ ГИСТИОЦИТОЗ)
Заболевание начинается в первые месяцы жизни, характеризуется гепатоспленомегалией, лимфаденопатией, ксантомами и пигментациями, особенно выраженными на открытых участках тела, задержкой физического и умственного развития, тяжелыми неврологическими расстройствами (нарушение зрения, слуха, мышечная слабость, спастические явления).
В полости рта могут развиваться пролиферативные процессы в деснах, деструктивные явления в альвеолярном отростке и связочном аппарате зубов.
Гистологически выявляют пенистые клетки Ниманна-Пика, названные так вследствие наличия в них большого числа жировых капель. Наследственный по аутосомно-рецессивному типу липоидоз, обусловленный нарушением обмена сложных липидов: с накоплением сфингомиелина вследствие недостатка сфин-гомиелазы (кислой лизосомной гидролазы) сфингомиелин не расщепляется, а происходит его накопление в клетках ретикулоэндотелиальной системы (печени, селезенке, надпочечниках и центральной нервной системе - ЦНС).
Дифференциальную диагностику проводят с болезнью Гоше, болезнью Хенда-Шюллера-Крисчена.
АКАТАЛАЗИЯ (БОЛЕЗНЬ ТАКАХАРЫ) E 80.3X
Акаталазия - наследственная энзимопатия, связанная с недостаточностью фермента каталазы (в норме его значение - 4500, при болезни - 0). Фермент каталаза продуцирует в тканях кислород путем расщепления перекиси водорода на воду и кислород. Следовательно, у таких больных образующаяся перекись водорода не расщепляется, а способствует окислению гемоглобина в метгемоглобин и развитию местной гипоксии. Перекись водорода может вырабатываться микроорганизмами, входящими в состав зубных бляшек или биопленок, и при отсутствии каталазы кумулироваться в ней, поэтому чем больше микробных скоплений, тем сильнее действие перекиси на пародонт, тем значительнее разрушения тканей пародонта.
Клинические проявления заболевания разнообразны. Чаще болеют молодые, подростки; редко заболевание проявляется в раннем детском возрасте. Больные жалуются на наличие язвенных поражений в ротовой полости, кровоточивость десен, подвижность зубов. Нередко отмечают нагноительные процессы в полости рта, носа, шеи с периодическими обострениями.
Рентенологически выявляют равномерную резорбцию костной ткани альвеолярного отростка.
Течение заболевания хроническое, с периодами обострений. Особенно бурно заболевание протекает в раннем детском возрасте. Традиционное лечение практически неэффективно. Больные быстро теряют молочные зубы, по мере прорезывания постоянных зубов картина повторяется.
Диагностика. Основана на клинических проявлениях, а главное - на результатах данных семейного анамнеза, клинико-лабораторных методов обследования.
Лечение. Отмечают повышение эффективности лечения за счёт включения в комплекс мероприятий аппликаций полупроницаемых микрокапсул, содержащих каталазу.
БОЛЕЗНЬ ДАУНА Q 90.VX
Болезнь Дауна - трисомия по 21-й паре хромосом. Синонимы: трисомное дисморфологическое слабоумие, трисомная идиотия, акромикрия врожденная, дисплазия генерализованная фетальная. Заболеваемость: 1 случай на 600-800 новорожденных. У большинства наблюдают полную трисомию по 21-й паре хромосом. Реже бывает мозаицизм, еще реже - транслокации. Для больных характерны округлой формы голова с уплощенным затылком, скошенный и узкий лоб, плоское лицо, малый рост, умственная отсталость, мышечная гипотония, аномалии скелета.
Частота воспалительных заболеваний пародонта у пациентов с этим синдромом после 30 лет составляет 100%.
Гигиена полости рта неудовлетворительная. Реализации действия микрофлоры способствуют:
Есть данные, что у детей с синдромом Дауна повышено содержание Prevotella melaninogenica в полости рта.
Десна гиперемирована, отечна, кровоточит. Из-за постоянного ротового дыхания, плохой гигиены полости рта и других причин часты явления гипертрофии (гиперплазии) десен, быстро развивается генерализованный пародонтит с агрессивным течением, поражая молочные зубы, а после и постоянные. Характерны макроглоссия, складчатый и географический язык, готическое нёбо, расщелина нёба, задержка прорезывания зубов, гипоплазия эмали.
Кроме того, для синдрома Дауна характерны полидактилия, синдактилия, клинодактилия, разболтанность суставов, нарушения скелета, врожденные пороки сердца, эндокринные нарушения, неспособность к обучению, монголоидный разрез глаз, короткие уши и плоское лицо.
Диагноз ставится по клиническим симптомам и анализу числа хромосом.
Лечение у стоматолога симптоматическое: профессиональная гигиена, лечение зубов, устранение явлений воспаления.
БОЛЕЗНЬ ИЦЕНКО-КУШИНГА
Гипоталамо-гипофизарное заболевание, характеризующееся вторичным гиперкортицизмом - избыточной продукцией гормонов коры надпочечников, главным образом глюкокортикоидов. Сравнительно редкое заболевание. Чаще болеют женщины в возрасте 20-40 лет. Симптомокомплекс, подобный болезни Иценко-Кушинга, может быть при опухолях коры надпочечников, опухолях щитовидной и поджелудочной желёз, раке легких, яичников, придатков - тогда это называют синдромом Иценко-Кушинга.
Этиология. Гипоталамо-гипофизарные нарушения могут возникать в результате воспалительных процессов, новообразований, травмы черепа, при базофильной аденоме гипофиза, иногда - вследствие длительного введения больших доз кортикостероидных препаратов. Часто причина остается неясной.
Патологическая анатомия. В аденогипофизе большинства больных обнаруживается гиперплазия базофильных аденоцитов или базофильные аденомы. В надпочечниках выявляется диффузно-узелковая гиперплазия коры.
Клиническая картина: неравномерное ожирение (лунообразное лицо, отложение жира в области туловища и живота при относительно худых конечностях), повышение артериального давления (ранний и постоянный признак), остеопороз (частый, но более поздний признак), нарушение углеводного обмена.
Развивается сахарный диабет, возникают изменения со стороны психики: раздражительность, ухудшение памяти, снижение интереса к окружающему.
Течение болезни хроническое. Выделяют легкую, среднюю и тяжелую степени. В 82% случаев наблюдается поражение пародонта. Отечность десен и кровоизлияние в них, подвижность и смещение зубов, разрастание межзубных сосочков, пародонтальные карманы с гнойным отделяемым.
Рентгенологически выявляют остеопороз (не только челюстных костей), резорбцию костной ткани альвеолярного отростка, которая идет необязательно с вершин межзубных перегородок.
Диагноз ставится на основе внешнего вида пациента, а тяжесть устанавливается на основе клинических и лабораторных данных.
Лечение. Применяют лучевой, оперативный, химиотерапевтический методы. Выбор метода зависит от тяжести течения заболевания. При тяжелом течении иногда применяют и оперативный метод (удаление надпочечников или гипофиза).
Прогноз при своевременном выявлении болезни, интенсивном лечении и при отсутствии тяжелых осложнений благоприятный.
ГИПОФОСФАТАЗИЯ
Редкое наследственное заболевание, для которого характерно снижение синтеза и активности щелочной фосфатазы в сыворотке крови и тканях. Гипофосфатазия как генетическое нарушение наследуется по аутосомно-рецессивному, изредка - по аутосомно-доминантному типу. Поражения пародонта выявляют часто, особенно при детской форме заболевания. Кроме пародонта поражается скелет, череп, глаза.
Поражения пародонта проявляются выраженной деструкцией альвеолярной кости и преждевременной потерей как молочных, так и постоянных зубов без воспаления. Раннее выпадение молочных зубов, особенно передних, может быть единственным проявлением заболевания.
Иногда наблюдают аномалии скелета, замедление развития, краниосиностоз, повышение внутричерепного давления.
Диагностика. Диагноз ставят на основании клинического обследования, дополненного рентгенологическим исследованием скелета и черепа, измерением активности щелочной фосфатазы в сыворотке крови.
Дифференциальный диагноз проводят с локализованным агрессивным пародонтитом, акаталазией, синдромом Папийона-Лефевра, синдромом Чедиака-Хигаси, гликогенозом.
Лечение у стоматолога симптоматическое.
Неотъемлемой частью современной пародонтологии являются хирургические вмешательства: лоскутные операции, пластика уздечек и тяжей слизистой оболочки полости рта, коррекция размеров преддверия полости рта, закрытие рецессии десны, увеличение объёма кератинизированной десны.
Пластическая пародонтальная хирургия решает достаточно сложные проблемы коррекции анатомии слизистой оболочки рта.
В настоящее время вопрос о совершенствовании методов и средств, применяемых в пластической пародонтальной хирургии, является актуальным.
Проблема хирургического устранения рецессии десны еще далека от своего разрешения.
Из общего числа всех заболеваний пародонта на долю рецессии десны приходится 10%.
Десневая рецессия увеличивается с возрастом: встречается в различных проявлениях от 8% у детей, приближаясь к 100% после 50 лет. Рецессия может быть физиологическим процессом старения, а также результатом прогрессирующих воспалительно-деструктивных процессов в тканях пародонта.
Различная по своей форме и глубине, эта патология пародонта поставила ученых перед необходимостью разработки методов и средств, позволяющих наиболее эстетично устранять различные формы данной патологии пародонта. Помимо косметических недостатков, для рецессии десны характерны гиперчувствительность шеек зубов и кариозные процессы эмали и цемента корня зуба.
Рецессия десны, по мнению К.Н. Rateischak (1986), представляет собой ограниченную атрофию тканей пародонта, проявляющуюся в клиновидном или овальном снижении высоты десны с вестибулярной поверхности и обнажением корня зуба без воспаления. В результате рецессии десны происходит потеря маргинальной ткани и альвеолярной кости на выпуклостях корня в щечной, язычной и нёбной проекциях.
Ряд ученых определяет рецессию как «Гингивопародонтальную атрофию».
Как правило, при рецессии нет воспаления, десна бледно-розового цвета и чаще всего она появляется в тех местах, где компактная пластинка альвеолы имеет фенестрацию.
В этой ситуации может возникнуть прободение (нарушение целостности) десны, трещина или щель Штильмана (Stillman. s Clefts), которая чаще напоминает разрез десневого края и может быть различных размеров. Штильман описал данное явление как результат травмы, хотя иногда может встречаться и при воспалительно-эрозивном процессе маргинальной десны.
Образование уплотненного десневого валика, фестон Маккола (McCall s festoon), есть результат адаптации десны, который чаще всего бывает выражен на вестибулярной поверхности в области клыка и премоляров. Вначале цвет и консистенция десны в области валика нормальная, позже при аккумуляции пищевых остатков на десневом крае возникают вторичные воспалительные изменения.
ХИРУРГИЧЕСКОЕ УСТРАНЕНИЕ РЕЦЕССИИ ДЕСНЫ
Теории, объясняющие возникновение рецессии десны
Существует несколько теорий возникновения рецессии десны, в которых рассматриваются как генетические факторы, так и влияние экзогенных раздражителей. Одной из наиболее популярных теорий является генетическая Dr. Dieter, E. Lange (1999).
Гингивоальвеолярная атрофия возникает первично после прорезывания зубов, так как генетически закладывается неправильное соотношение размеров, формы (признаков искривления) корней по отношению к толщине кости альвеолярного отростка челюсти.
После прорезывания зубов под слизистой оболочкой образуются клинически не выявленные участки костной резорбции, а также свищевые ходы над корнями. В период функционирования зуба и с возрастом у пациента наступает истончение десневой связки и трофические нарушения, которые особенно увеличиваются при растягивании связок и при недостаточном объёме прикрепленной десны.
Одним из неблагоприятных анатомических факторов является анатомия коронки зуба, при которой экваториальная часть не выражена и близка по объему к пришеечной его части. В результате неправильного перераспределения жевательного давления на коронку зуба пришеечная поверхность и связочный аппарат зуба испытывает повышенную нагрузку.
Теория возникновения рецессии под влиянием экзогенных факторов учитывает влияние ортопедических конструкций на пародонт (Maynard and Wilson, 1979), влияние ортодонтических аппаратов (Maynard and Ochenbein, 1975), натяжение слизистых тяжей и уздечки, мелкого преддверия полости рта, скученности зубов.
Длительное воспаление тканей пародонта, сменяющееся периодами ремиссии с горизонтальной резорбцией костной ткани, а также недогрузка зубов, вялое жевание, преобладание феномена прорезывания зуба над его стираемостью могут приводить к десневой рецессии.
Такие вредные привычки, как держание ручки или карандаша во рту, сосание языка и его переднее положение (инфантильный тип глотания), которое нередко сохраняется с раннего возраста, также могут влиять на состояние тканей пародонта. При такой ситуации язык упирается в язычную поверхность десны нижних резцов, что приводит к рецессии и последующему воспалению в этой области.
Быстропрогрессирующие процессы в тканях пародонта, особенно при ювенильных формах, а также хирургическое лечение (кюретаж, лоскутные операции и др.) могут способствовать десневой рецессии.
Глубокое резцовое перекрытие может быть также важным фактором, который приводит к обнажению шеек и корней зубов, так как данное состояние может способствовать механической травме маргинального края, особенно в области нёбной поверхности верхних резцов и вестибулярной поверхности нижних резцов.
По данным морфофункциональных исследований пародонта (реопародонтография и поллярография), в области РД снижается исходный уровень парциального давления кислорода, что способствует течению дистрофических процессов. Для РД также характерно повышение сосудистого тонуса.
Значение общих и местных факторов в этиологии и патогенезе заболеваний пародонта
В этиологии воспалительно-деструктивного поражения пародонта отмечена ведущая роль микробного налёта. В течение дня число бактерий увеличивается, формируя массивные скопления бактериального налета в зоне десневой борозды. Через 3-4 дня отложения бактерий в области десневого края приводят к гингивиту. Микробные ассоциации на зубах часто минерализуются фосфатами кальция, формируя зубной камень, который обеспечивает условия для микробной ретенции на зубах и в пародонтальных карманах.
Однако к факторам риска, создающим условия для развития болезней пародонта, относятся:
Также признано влияние зубочелюстных аномалий на развитие пародонтопатий различного генеза.
По мнению М.Х. Сааг (1984, 1987), предрасполагающим фактором является сочетание нескольких антропометрических показателей: высокий рост, диаметр скуловой дуги, окружность головы, высота лица. Таким образом, чем меньше размер диаметра скуловой дуги и окружность головы при высоком росте и чем больше высота лица, тем выше вероятность развития патологии пародонта.
Все авторы, изучающие причины развития патологии пародонта, считают, что своевременная диагностика и профилактика предрасполагающих факторов позволяют снизить риск развития пародонтопатий.
Взаимосвязь аномалий развития мягких тканей полости рта и аномалий зубочелюстной системы с патологией пародонта воспалительного и деструктивного характера
Причины, приводящие к зубочелюстным аномалиям, могут быть различного генеза: эндогенные и экзогенные. К эндогенным причинам следует отнести наследственные и эндокринные факторы. Установлено, что 25% аномалий обусловлено генетически. Аномалии зубов и челюстей генетического характера влекут за собой нарушения соотношения зубных рядов, которые, как правило, являются также наследственными, а именно дистальная окклюзия зубных рядов (дистальный и прогнатический прикус). При дистальной окклюзии изменяется положение нижней губы: соприкасаясь с нёбной поверхностью верхних резцов, она способствует смещению их вестибулярно. Кроме того, по наследству может передаваться вид нарушения смыкания зубных рядов по вертикали. Установлена зависимость частоты и клинического течения пародонтопатий от вида зубочелюстных деформаций.
К факторам, влияющим на ширину прикрепленной части десны следует отнести: высокое прикрепление уздечек, наличие тяжей слизистой оболочки полости рта, рецессию.
Аномалии развития мягких тканей полости рта: низкое прикрепление уздечки верхней губы, короткая уздечка языка, нижней губы, мелкое преддверие полости рта - могут передаваться по наследству и являться предрасполагающими факторами к развитию аномалий прикуса и пародонтопатий. Установлено, что у пациентов с быстро прогрессирующим пародонтитом (БПП) характерной особенностью служит нарушение «анатомо-топографических» параметров.
Мелкое преддверие полости рта и короткая уздечка нижней губы приводят к обнажению шеек нижних резцов и возникновению пародонтита. При прикреплении уздечки нижней губы у основания зубодесневого сосочка, расположенного между центральными резцами нижней челюсти, отмечаются диастема и ретракция десны с вестибулярно-мезиальной поверхности. Подобная клиническая картина может быть и при прикреплении уздечки языка к межзубному сосочку. Прикрепление уздечки нижней губы ближе к вершине зубодесневого сосочка приводит к хроническому воспалению. При натягивании высоко прикрепленной сильно выраженной уздечки нижней губы наблюдаются смещение межзубного сосочка центральных резцов и механическое отделение поверхности сосочка от поверхности зуба. В аналогичных условиях при откусывании и разжевывании пищи в раскрытую десневую борозду попадают пищевые частицы, которые способствуют травме и патологическим изменениям пародонта. Формируется зубодесневой карман, нарушается круговая связка зуба, появляются отложения зубного камня, ухудшается кровоснабжение, разрушается вершина межальвеолярной перегородки. Изменения особенно прогрессируют при скученности зубов во фронтальном отделе, недостаточной гигиене полости рта, при аномалиях размеров челюстей.
Возрастные особенности изменении ширины прикрепленной десны и глубины преддверия полости рта
Зубочелюстная система на протяжении жизни претерпевает ряд адаптационно-приспособительных изменений, наиболее выраженных в период активного формирования челюстных костей. Со стороны мягких тканей, прикрепляющихся к альвеолярному отростку челюстей, в это время отмечаются увеличение глубины преддверия полости рта и расширение зоны прикрепленной десны.
При прикреплении уздечки нижней губы выше основания десневого сосочка в случаях средней и широкой зоны десны возникала подвижность межзубного сосочка у центральных резцов. При узкой зоне десны отмечались равномерное побледнение десневого края в области центральных и боковых резцов или оттягивание его от шеек зубов с раскрытием десневого желобка.
Сравнение показателей распространенности различных вариантов ширины зоны десны в целом по возрастным группам и среди имеющих заболевания пародонта показывает, что дети с узкой зоной десны в возрасте 6-15 лет встречаются статистически достоверно чаще в группе с заболеваниями пародонта. Это подтверждает роль мелкого преддверия полости рта в развитии патологии пародонта.
Реографическое исследование при аномалии мягких тканей полости рта
Реопародонтография при аномалии мягких тканей полости рта показывает увеличение периферического тонуса сосудов (ПТС) - 18,0±1,4% при норме 13,0±0,36%; снижение реографического индекса 0,05-0,06 Ом. Индекс эластичности (ИЭ) составил 55+1,3%. Визуально дикротическая волна располагается в верхней трети РПГ. Восходящая часть крутая, вершина округлая, сглаженная дикротическая волна в верхней трети нисходящей части. Повышенный тонус сосудов микроциркуляторного русла можно связать с мощным контролем вазоконстрикторных волокон шейного отдела симпатического ствола и индивидуальными особенностями иннервации сосудов, кровоснабжающих эту область. Длительная вазоконстрикция может привести к склерозированию сосудистой стенки и к атрофическим нарушениям в тканях пародонта.
Вазоконстрикция сосудов микроциркуляторного русла регистрируется при недостаточном размере прикрепленной зоны десны. Причина этого явления - повышенная функциональная нагрузка на слизистую оболочку преддверия полости рта в области прикрепления уздечки верхней и нижней губы при разговоре, приеме пищи, что вызывает и усугубляет локальную ишемию пародонта на уровне фронтальных зубов верхней и нижней челюсти. Капиллярное русло реагирует на патогенные факторы до появления клинических симптомов воспаления в пародонте. Данные свидетельствуют о наличии изменений микроциркуляции у пациентов молодого возраста с мелким преддверием полости рта во фронтальном отделе десны в сравнении с боковым. Причиной повышенного тонуса сосудов может быть также «недогрузка» пародонта жевательным давлением. Учитывая, что состояние регионарного кровообращения характеризует степень адекватности тканей функциональной нагрузке, недостаточность последней вызывает вазоконстрикцию.
Изменения РПГ являются характерными для функциональной недогрузки в любом возрасте. Они обусловлены возникновением незначительной по величине и продолжительности функциональной гиперемией на протяжении ряда лет в участках уменьшенной силы механического давления.
Сосуды становятся «малотренированными» к нагрузкам, что ведет к развитию вазоконстрикции, а со временем - к морфологическим изменениям в структуре сосудистых стенок (замена эластических волокон на грубоволокнистую соединительную ткань; уменьшение мышечного слоя, его атрофия).
Устранение аномалий мягких тканей преддверия полости рта приводит к нормализации кровоснабжения в этой области.
Патогенез рецессии десны
Десна представляет собой часть слизистой оболочки полости рта, она покрыта ороговевающим эпителием. В норме десна - единственная ткань периодонта, доступная непосредственному обзору (рис. 14-36, см. цв. вклейку).
Значительная роль в патогенезе воспаления принадлежит системам нейрорегуляции и микроциркуляции. Существование очага хронической инфекции приводит к перераздражению соответствующих нервов. Возникающие на этом фоне нейрофизические и нейротрофические расстройства способствуют снижению резистентности тканей.
Нарушение микроциркуляции в зоне воспаления ослабляет окислительно-восстановительные процессы за счет падения напряжения кислорода, что также снижает резистентность тканей к инфекции. Причинами нарушения микроциркуляции являются: во-первых, непосредственное повреждение эндотелия капилляров комплексами антиген-антитело, которые фиксируются на клеточных мембранах, а затем фагоцитируются нейтрофильными лейкоцитами. При этом в результате повреждения клеточной мембраны освобождаются лизосомальные ферменты, медиаторы воспаления и происходит активация кинин-калликреиновой системы. Конечный продукт этой системы брадикинин влияет на тонус и проницаемость сосудов микроциркуляторного русла, реологические свойства крови, состояние свертывающей и фибринолитической систем. Повышается коагуляционный потенциал в виде гиперкоагуляции, гиперфибриногенемии с депрессией фибринолитической системы и нарастанием толерантности плазмы к гепарину. Повышение коагулянтного потенциала наряду с ухудшением реологических свойств крови и замедлением скорости объёмного кровотока может быть причиной внутрисосудистого свертывания крови с полным либо частичным нарушением микроциркуляции.
Во-вторых, причиной нарушения микроциркуляции могут быть внесосудистые механизмы окклюзии. Сюда относится сдавление сосудов воспалительным инфильтратом, экссудатом. Особенно это относится к воспалительным процессам, локализирующимся в замкнутом пространствах.
В ряде случаев микроциркуляторные расстройства усугубляются повреждением сосудов при хирургических вмешательствах, наложении тугих повязок. В частности, при широкой отслойке надкостницы происходит наиболее значительное нарушение кровообращения по внутрикостным сосудам, и питание тканей осуществляется преимущественно за счет периостальных сосудов. Поэтому их пересечение сопровождается усилением трофических расстройств.
Воспаление пародонта начинается с маргинальной десны, затем распространяется вглубь тканей, окружающих зуб, что означает переход гингивита в пародонтит. Пародонтиты всегда являются результатом гингивитов, но не все гингивиты переходят в пародонтиты. В некоторых случаях (особенно у подростков) они никогда не ведут к пародонтитам, а в других могут прогрессировать очень быстро. Как считают некоторые пародонтологи (Саггапга Р., 1990 и др.), механизмы, ответственные за воспаление на уровне опорно-удерживающего аппарата и за переход гингивита в пародонтит, пока остаются неясными. Однако, с другой стороны, многими фундаментальными исследованиями доказано, что этот переход связан с изменением состава бактериального налёта и содержимого клеточного инфильтрата (рис. 14-37, см. цв. вклейку).
При прогрессирующей стадии периодонтита количество подвижных микроорганизмов и спирохет увеличивается, а количество кокковых форм и видов палочек уменьшается. Кроме того, установлено, что в клеточном инфильтрате увеличивается число В-лимфоцитов и плазматических клеток. Воспалительный процесс из десны распространяется в структурные компоненты опорно-удерживающего аппарата, окружающего зуб, через рыхлые ткани, кровеносные сосуды с вовлечением альвеолярной кости. Распространение его особенно опасно, когда это сопровождается деструкцией кости и прогрессированием болезни пародонта. Поначалу микроорганизмы зубного налета вызывают воспаление в маргинальной десне и межзубном сосочке. В области десневой бороздки воспаляется прикрепленный эпителий десны. Сначала разрушаются волокна десны на коротком расстоянии от места их прикрепления к цементу, затем поражаются глубоколежащие тканевые структуры опорно-удерживающего аппарата и все ткани вокруг зуба. Дальше воспаление распространяется вдоль наружной периостальной поверхности кости, через сосудистые канальцы проникает внутрь пространства костного мозга и достигает наружной кортикальной перегородки на фациальной и язычной поверхностях. После вовлечения в процесс пространства костного мозга воспаление может направляться от кости к пародонтальной связке (реже - напрямую от десны к связке), поражая межзубную перегородку. При распространении воспаления от десны к кости отмечаются уменьшение транссептальных волокон, дезорганизация зернистых компонентов тканей, участвующих в образовании грануляций, окруженных воспалительными клетками и отёком. Продолжающийся воспалительный процесс ведет к реорганизации транссептальных волокон, пронизывающих гребень межзубной перегородки. Распространение воспалительной деструкции костных структур. Благодаря природной склонности транссептальных волокон к восстановлению, они сохраняются даже в случаях, когда наблюдается выраженная потеря массы пародонтальной кости. Вне зависимости от того, распространяется воспаление непосредственно от десны или косвенно через альвеолярную кость, пародонтальная связка является ключевым объектом поражения, определяющим подвижность зубов и болевые ощущения. Результат развития очага поражения в области опорно-удерживающего аппарата - образование воспалительного экссудата. При этом нарушается опорно-удерживающая функция пародонтальной связки зуба, обусловленная дегенерацией и деструкцией ее волокон с последующим разрывом прикреплений между корнем и костью.
Воспаление пародонтальной связки обычно хроническое и асимптоматическое. Однако оно может протекать остро, сопровождается болью и завершается формированием пародонтального абсцесса. Характерный признак различных форм пародонтитов - деструктивные изменения в тканях, окружающих зуб. Для всех пародонтальных тканей скорость их деструктивных изменений имеет большое прогностическое значение. Высота альвеолярной кости считается нормальной, когда сохраняется равновесие между образованием кости и ее резорбцией, вызванной в ответ на локальные и системные воздействия. Если процесс резорбции преобладает над процессом восстановления, высота кости уменьшается. При развитии болезни пародонта нарушение равновесия проявляется в доминировании процессов резорбции над фазой формирования. Убыль кости возможна вследствие увеличенной резорбции при нормальном процессе образования структур при нормальной ее резорбции или сочетания увеличенной резорбции с уменьшенным образованием костной ткани.
В основе воспалительно-деструктивных изменений, характерных для пародонтита, лежат нарушения процессов костного ремоделирования, приводящие к лизису костной ткани.
Изменения в костной ткани челюстных костей могут быть также ранними признаками системного остеопороза. Нарушения микроциркуляции, склеротические изменения сосудов пародонта являются важнейшими в развитии патологии тканей, окружающих зуб.
Десневая рецессия, глубина кармана и потеря кости. Результатом образования пародонтального кармана часто бывают рецессия десны и обнажение поверхности корня зуба. В зависимости от тяжести заболевания рецессия десны проявляется по-разному и не всегда соответствует глубине пародонтального кармана. Как правило, степень рецессии десны зависит от локализации основания и глубины пародонтального кармана. Бывают ситуации, когда пародонтальные карманы одинаковой глубины могут быть связаны с рецессией, имеющей различную степень выраженности, а с другой стороны - пародонтальные карманы различной глубины могут способствовать рецессии с одной и той же степенью проявления.
Обнажение корней вследствие образования пародонтальных карманов зависит от степени выраженности рецессии десны. Учитывая это, необходимо реалистично оценивать существующую рецессию, связанную с пародонтальными карманами, чтобы избежать ошибочных выводов при диагностическом обследовании, так как рецессия десны может быть следствием некоторых лечебных процедур. Как известно, скорость убыли костных структур обычно связана с глубиной пародонтального кармана. Интенсивная убыль кости может наблюдаться при неглубоких пародонтальных карманах, а иногда при глубоких бывает незначительной. Расстояние между основанием пародонтального кармана и цементно-эмалевым соединением остается таким же, несмотря на разную глубину пародонтального кармана.
Классификация рецессии десны
Десневая рецессия может быть локальной и генерализованной. Локальная рецессия чаще всего возникает в местах низкоприкреплённой уздечки или эпителиальных тяжей (складок) преддверия полости рта, вестибулярном расположении зубов, чаще всего клыков.
Генерализованная рецессия прежде всего возникает при аномалии прикуса и мелком преддверии полости рта и конституционных особенностях пациента. Нередко генерализованная рецессия бывает результатом длительно протекающего пародонтита без выраженных пародонтальных карманов, также атипичных форм проявления быстропрогрессирующего пародонтита, при котором потеря десны может быть единственной жалобой пациента.
Данный процесс встречается у пациентов при недостаточном объёме прикреплённой десны, вестибулярном расположении анатомически крупных зубов и выраженном сокращении круговой мышцы губы (чаще всего это встречается у актёров, оперных певцов и среди других специальностей, где необходимы профессиональная дикция и постоянная работа мимической мускулатуры).
Нередко образованию десневой рецессии способствует травматическая ситуация (перегрузка зуба, наличие супраконтактов) в тех участках, где возникают боковые силы.
При несоблюдении правил чистки зубов зубной щёткой рецессия десны появляется как результат хронической травмы десневого края.
В современной классификации по ВОЗ (Женева, 1997) рецессия различается на постинфекционную, послеоперационную, генерализованную, локализованную и неуточненной этиологии (идиопатическую).
Наиболее популярной для клинициста считается классификация рецессии десны, предложенная Р. Миллером в 1985 г. Автор различает 4 класса рецессии, основными критериями которой являются ширина и длина потери десны.
-
Класс I - узкая или широкая рецессия на уровне зубодесневого соединения без его структурных нарушений.
-
Класс II - узкая и широкая рецессия на уровне зубодесневого соединения с нарушением его целостности. Костная ткань в области корня исследуемого зуба не изменена.
-
Класс III - уровень рецессии ниже зубодесневого соединения, имеется резорбция кости в области корня исследуемого зуба.
-
Класс IV - самая тяжёлая форма рецессии десны. Зубодесневое соединение полностью отсутствует, резорбция кости отмечается не только в области корня исследуемого зуба, но захватывает и межальвеолярную область.
Методики ликвидации рецессий
Различные методики ликвидации рецессии, предложенные для устранения косметических дефектов десны, были объединены термином «пародонтальная пластическая хирургия». Этот термин был предложен Миллером в 1969 г. Автор считает, что «пародонтальная пластическая хирургия - это целое направление в пародонтологии, использующее хирургические методы для коррекции анатомических или травматических деформаций десны и альвеолярной кости».
В настоящее время прогноз десневой пластики считается благоприятным в отношении рецессии IиII классов (Harris R.J., 1992). Хирургические операции для закрытия дефектов III и IV классов - малоперспективны; возможности пародонтальной хирургии все более расширяются с появлением усовершенствованных хирургических методик и средств, стимулирующих репаративные процессы мягких тканей.
Современные материалы и средства, используемые для пластических операций на пародонте, претерпели значительные изменения. Можно по праву говорить о микрохирургии пародонта, так как для современных оперативных вмешательств используются микроскопы, микрохирургический инструмент и усовершенствованный шовный материал (Burghardt R., Zurich, 2001).
В настоящее время в пародонтальной хирургии выделилось достаточно перспективное направление - методика направленной регенерации тканей (НТР), с использованием мембран, выполняющих барьерную функцию. НТР позволяет улучшить отдалённые результаты хирургических вмешательств за счет более совершенной трансформации кровяного сгустка под мембраной.
Еще одна группа хирургических методик обособилась относительно недавно - использование матриксных протеинов как факторов роста. К этой группе относится методика с использованием аллодермы и эмдогейна.
Следует отметить, что в ходе пародонтальной регенерации происходит восстановление альвеолярной кости, цемента и пародонтальной связки зуба (Американская академия пародонтологии, 1993).
Одним из важных условий успешного закрытия рецессии десны является создание достаточного объёма кератинизированной ткани.
Прикрепленная десна покрыта многослойным плоским эпителием, состоящим из базальной мембраны, базалиоцитов, базального и шиповидного слоёв, нескольких рядов полигональных клеток и кератинизированного слоя, где находятся кератиноциты. Такое строение способствует тому, что эта часть альвеолярной десны является «буферной зоной» и выполняет амортизирующую и защитную функции для зубов и более глубоких слоёв пародонта.
По данным Lange В., Loe II., 1972, ширина кератинизированной десны должна быть не менее 2 мм.
В 80-х годах прошлого века к основным методикам, используемым для увеличения объёма кератинизированной десны, причисляли вестибулопластику и десневой аутотрансплантат.
В настоящее время для увеличения объема кератинизированной десны используются различные процедуры. N. Sato (2000), резюмируя опыт ряда авторов, перечисляет следующие процедуры, способствующие увеличению объема кератинизированной десны.
P.D. Miller, Н.Е. Grupe, R.G. Cafesse (1982); S. Nyman (1982) пишут, что для выбора метода десневой пластики необходимо учитывать следующие параметры: количество зубов, ограничивающих область рецессии, ширину и глубину рецессии, расположение рецессии в области моляров. N. Sato (1990) дополняет этот перечень несколькими условиями: объем и толщина кератинизированной десны, граничащей с областью рецессии, соотношение между высотой междесневых сосочков, примыкающих к области рецессии, местоположение рецессии к области улыбки, необходимость десневой пластики после реставрации или ортопедического лечения зубов.
J. Lindhe, S. Nyman (1980) отмечают, что для успешного закрытия рецессии десны донорская ткань должна иметь следующие характеристики: необходим достаточный объём кератинизированной ткани, ширина её должна быть не менее 1 мм, поверхность альвеолярной кости на донорском участке должна быть без признаков резорбции. J.L. Wennstrom (1981), дополняя этот перечень, указывает на то, что в случае перемещения вертикальных лоскутов, размер прилегающих десневых сосочков должен быть достаточным для успешной десневой пластики.
В литературе различные авторы ссылаются на разнообразные параметры, подтверждающие успешный результат десневой пластики. Н. Com,Н.М. Goldman, D.W. Сohen (1980) к критериям успешной пластики десны относят следующие клинические показатели: в области рецессии десневой край находится на уровне цементно-эмалевой границы зуба, глубина десневой борозды не превышает 1 мм, нет кровоточивости при зондировании.
Важный показатель успешной пластики РД - увеличение объема кератинизированной (прикрепленной) десны.
К наиболее популярным методам относятся: перемещение вертикальных лоскутов, соединительнотканный трансплантат, коронарно-направленный лоскут.
Средства, используемые для обработки корня зуба
Для формирования нового прикрепления к корню зуба большое значение имеет обработка его поверхности в ходе операции. Помимо очистки поверхности корня существует ряд средств, используемых для ее обработки. Протравливание 20% молочной кислотой, 2-5% лимонной кислотой, ЭДТА 24% улучшает цементогенез, так как удаляется смазанный слой. Этим самым стимулируется активность цементобластов.
Без предварительного очищения корня протравливание не имеет смысла, так как глубокая деминерализация возможна только на идеальной поверхности корня.
Обработка молочной, лимонной, ЭДТА кислотами поверхности корня способствует удалению микрокристаллических обломков на поверхности дентина и способствует расширению дентинных трубочек (Poison A.M., 1984).
Протравливание лимонной кислотой способствует удалению с поверхности корня эндотоксинов и бактерий.
На протравленной поверхности корня быстрее откладывается фибрин и одновременно тормозится миграция эпителия на поверхности корня.
Следующий препарат, используемый для обработки корня, - фибронектин. Это гликопротеин, который требуется фибробластам для прикрепления на поверхность корня.
Увеличение фибронектина на поверхности корня выше его концентрации в плазме дает очевидное улучшение послеоперационных результатов (Caffesse R.G., 1987).
В опытах на собаках использовались одновременно фибронектин, молочная кислота и мембранная техника. Перекрытие десневой рецессии при использовании фибронектина было 100%.
Эффект от фибрин-фибронектиновой связующей системы был изучен в ряде экспериментов. В настоящее время в Европе большой популярностью пользуется препарат фибронектина под названием «Тиссакол» (Pini Prato G., 1994).
Обработка поверхности корня раствором тетрациклина дает хороший результат в комбинации с фибронектином (Alger F.A., 1990 и др.).
Применение различных видов трансплантатов
Методика закрытия рецессий с помощью свободного тканевого аутотранс-плантата
В 1968 г. в литературе впервые появилась классическая трилогия Саливана и Аткинса, описывающая технику пересадки свободных десневых трансплантатов. Впоследствии было опубликовано множество работ, дополнивших и усовершенствовавших данную методику. К её преимуществам можно отнести:
Т. Holbrook (1983) отмечал, что в клинической ситуации, когда глубина и ширина рецессии составляла 3 мм и 3 мм, перекрытие корня с использованием десневого трансплантата составляло 100%.
S. Nelson в 1987 г. писал, что в его клинической практике рецессия глубиной 3 мм была перекрыта на 100%, 4-6 мм - на 92%, 7-10 мм - на 88%. Таким образом, автор отмечает успешное перекрытие корня с помощью десневого аутотрансплантата для рецессии I и II классов.
Обычно в качестве донорской ткани используют соединительную ткань твердого нёба (область премоляров). Толщина трансплантатов варьирует от 0,5 до 2 мм. Тонкие трансплантаты (0,5-0,75 мм) дают наилучший эстетический результат, но для охвата корня они малопригодны, их можно использовать только в области зубодесневого соединения.
Толстый трансплантат (1,5-2 мм) менее эстетичен, но более надежен для охвата корня. Следует отметить, что тонкие трансплантаты имеют минимальное первичное сокращение, но вторичное сокращение составляет 25-45% в результате рубцевания. У толстых трансплантатов, наоборот, первичное сокращение максимально, вторичное - минимально. С учётом этого трансплантат должен быть приблизительно в 1,5 раза больше участка получателя.
L. Langer, В. Langer отмечают следующие возможные ошибки в ходе операции: недостаточный размер трансплантата по отношению к рецессии (маленький трансплантат), горизонтальный разрез на участке получателя располагаются слишком низко от цементно-эмалевой границы.
I.F. Bruno (1994) писал, что частыми причинами некроза трансплантата являются недостаточная его толщина (тонкий трансплантат), плохое кровоснабжение трансплантата из-за неадекватного препарирования участка получателя, плохое прилежание трансплантата к участку рецессии из-за недостаточной фиксации шовным материалом. Он также указывал на то, что достаточно частая ошибка клиницистов - неправильная фиксация трансплантата по отношению к шейке зуба. Для того чтобы не было рецидива рецессии, трансплантат после фиксации швами должен покрывать шейку зуба на 2 мм.
K.S. Kornman,M.G. Newman (1992) указывают, ссылаясь на свой клинический опыт, что основными недостатками этого метода являются: два операционных участка, недостаточная активность гемодинамики в трансплантате, слабый гемостаз, длительный период (6-10 мес) отсутствия косметического эффекта.
Применение техники подэпителиального аутотрансплантата для закрытия рецессий
В. Langer в 1985 г. описал технику подэпителиального трансплантата для закрытия поверхности корня. Достаточно часто эту методику используют в области широкой и мелкой РД, а также в случае неадекватного объёма ткани на соседнем участке для закрытия РД смещенным лоскутом.
В. Langer, L. Langer, J.F. Bruno (1994), используя на практике методику для закрытия рецессии I и II классов, пишут о том, что у нее есть преимущества перед десневым аутотрансплантатом:
-
хорошее кровоснабжение между трансплантатом и лоскутом на участке получателя;
-
незначительная раневая поверхность на нёбе после забора трансплантата;
-
гемостаз происходит достаточно быстро, и процесс заживления протекает легко, в силу этого снижаются дискомфорт и боль в ходе заживления;
-
возможность использования данной техники в области нескольких зубов. Трансплантат забирают с нёба, но в отличие от предыдущей методики лишь небольшой участок покрыт эпителием. Основная площадь донорской ткани выкраивается в подэпителиальной области. L. Langer и В. Langer являются родоначальниками этого метода. Они предложили на участке, куда будет перенесен трансплантат, использовать 1 горизонтальный и 2 боковых разреза. Однако вертикальные разрезы ухудшают кровообращение трансплантата в ходе заживления.
G.F. Bruno (1994) модифицировал технику L. Langer и В. Langer, решив отказаться от вертикальных разрезов на участке получателя. Он использовал в области рецессии один горизонтальный разрез, выполняя его достаточно далеко в мезиодистальном направлении. Это способствовало улучшению кровоснабжения лоскута и трансплантата, снижению послеоперативного дискомфорта и позволило избежать грубого рубцевания ткани.
P. Raetzke в 1985 г. предложил использовать методику «конверта». Через десневую борозду между надкостницей и лоскутом формируется ложе, куда, как в конверт, будет помещен трансплантат. Возможность данной техники ограничена областью одного зуба. A.L. Allen (1994) модифицировал данную методику, включив в область операционного поля несколько зубов с рецессией.
R. Harris (1992) описал технику перемещения подэпителиального трансплантата под двойной сосочковый лоскут.
S. Nelson (1987), A. Borghetti, F. Louise (1994) предложили помещать трансплантат под полностью расщепленный латерально-смещенный лоскут.
К недостаткам данных методик относится сложность данной техники.
Поскольку трансплантат тонкий, ткань в области рецессии может быть недостаточной толщины, и будет необходима повторная пластика для усиления морфологии ткани. P. Raetzke (1985) использовал технику конверта при пересадке подэпителиалъного лоскута, он отмечает следующие результаты. Были прооперированы 10 пациентов, рецессия была перекрыта в области 12 зубов. Наблюдение велось в течение 2-8 мес. Средний размер рецессии составлял 3,29 мм (2-5 мм). Размер послеоперационной рецессии составил 0,67 мм (0,0-2,0 мм). При этом значения перекрытия корня следующие - 5 зубов - 100%, 7 зубов - 60-80%, среднее значение - 80%.
S. Nelson (1987) применил методику подэпителиального лоскута в сочетании с перемещённым лоскутом на ножке. Были прооперированы 14 пациентов, осуществлена пластика в области 29 зубов. Время наблюдения 6-42 мес. Размеры рецессии до операции следующие: 6 зубов - 1-3 мм, 3 зуба - 4-6 мм, 20 зубов - 7-10 мм. Процент перекрытия корня следующий: мелкая рецессия - 100%, средняя - 92%, глубокая - 88%, среднее значение - 91%.
R.A. Levine (1991) использовал технику L. Langer и В. Langer. В течение 3-30 мес наблюдались 10 пациентов, был прооперирован 21 зуб. Средний размер рецессии до операции составил 3,86 мм, среднее перекрытие корня - 97,04%.
R.J. Harris (1992) помещал подэпителиальный лоскут под двойной сосочковый лоскут. В течение 3 мес были обследованы 20 пациентов, пластику рецессии произвели в области 30 зубов. Средний размер рецессии составлял 3,6 мм (2-7 мм). Послеоперационный размер - 0,1 мм. Среднее значение перекрытия корня - 97,4%.
A.L. Allen (1994) использовал технику конверта для пересадки подэпителиального трансплантата. Была прооперирована рецессия в области 23 зубов, наблюдения проводились в течение 6-48 мес. 12 зубов имели размер рецессии 1-3 мм, 10 - 4-6 мм, 1 зуб - 10 мм, перекрытие корня в процентах соответственно - 95, 73, 75%. Среднее значение - 84%.
Методики перемещения вертикальных лоскутов для закрытия рецессии десны
Не менее популярными методиками устранения локальной рецессии десны являются перемещение вертикальных лоскутов (Grup Н.Е., 1966; Pfeifer J.S., Knowles J., Ramfojrd S., 1971). К ним относятся следующие процедуры:
M.P. Ruben, Н.И. Goldman, W.B. Janson (1976) отмечали, что основными преимуществами данных методик являются: одно хирургическое поле, перемещаемый лоскут хорошо кровоснабжается, хороший послеоперационный эстетический результат, возможность перекрытия корня.
К недостаткам этих методик можно отнести:
В 1956 г. H. Grupe и R. Warren впервые описали технику перемещения латерального лоскута для закрытия поверхности корня. Недостатком этой методики является большая вероятность появления рецессии на донорском участке. Н.А. Guinard и R.G. Caffesse (1978) отмечали размер послеоперационной рецессии 1 мм. После этого появилось множество модификаций данной методики. Н. Staffileno (1964) предложил перемещать частично расщеплённый лоскут на область рецессии. H. Girupe (1964) описал технику подкраевых разрезов на донорском участке, что должно было снизить риск возникновения рецессии.
J.S. Рfeifer и R. Heller (1971) предложили использовать для перемещения лоскут различной толщины. На область рецессии будет приходиться полностью расщепленная часть лоскута, на донорском участке лоскут будет частично расщеплен (до надкостницы).
Knowler J. и Ram fjord S. 1971 г. использовали свободный тканевой трансплантат для закрытия донорской области после перемещения лоскута.
S. Knowler, Ram fjords S. (1971) отмечали, что возможность использования данной методики ограничена количеством (ширина, длина и толщина) кератинизированной ткани в прилегающей к рецессии области.
M.P. Ruben, Н.А. Goldman, W. Janson (1976) указывают на основные противопоказания к использованию данной методики:
Особенность техники латерально направленного лоскута заключается в том, что донорский лоскут должен быть в 1,5 раза шире участка получателя и в 3-4 раза длиннее. Он помещается на участок рецессии так, чтобы перекрыть на 1-2 мм эмаль зуба (Knowles J., Ramfjord S., 1971).
Одна из разновидностей данной методики - техника косого наклонного лоскута, предложенная W.H. Dahlberg (1969). Вертикальные разрезы в этом случае выполняются таким образом, что в основании донорского лоскута, граничащего с областью рецессии, создается ось вращения, и донорский лоскут свободно перемещается на область получателя.
О. Bahat (1991), модифицировав технику косого наклонного лоскута, предложил использовать для закрытия рецессии горизонтальный сосочковый лоскут.
Условия для использования данной техники:
Донорский лоскут выкраивается дистальнее области рецессии и переносится медиально, перекрывая рецессию.
D.W. Cohen и S.E. Ross (1968) предложили использовать двойной сосочковый лоскут для устранения локальной рецессии десны.
Показания для этого метода:
Недостатки данного метода:
-
встречные лоскуты фиксируются в области корневого выпячивания и тем самым создается линия слабости, что может спровоцировать расхождение лоскутов или их некроз;
-
эту технику рациональнее применять для увеличения объёма кератинизированной десны, так как процент перекрытия рецессии в данном случае достаточно невысок.
Использование методики коронарно-смещенного лоскута для закрытия рецессии
Методика коронарно-направленного лоскута удобна при мелкой и распространённой рецессии (в области нескольких зубов). В отличие от предыдущих техник выполняются косые продольные разрезы в основании теневых сосочков. Маргинальная десна рассекается скальпелем под углом 30° с вестибулярной поверхности. Лоскут препарируют до кости, надсекают надкостницу, после чего он становится более мобильным, деэпителизируют маргинальную десну и подшивают к основанию десневых сосочков. E. Allen и P. Miller в 1989 г. описали данную методику с использованием частично расщепленного лоскута,
S.P. Ramfjord (1973) - с использованием полностью расщепленного лоскута. Выбор метода в данном случае зависит от глубины рецессии.
D.P. Tarnow (1986) модифицировал данную технику, предложив использовать полулунные разрезы в области шеек зубов. Эти разрезы частично препарируют лоскут до надкостницы, образуя воротник ткани вокруг шеек зубов.
D.P. Tarnow писал, что полулунные разрезы снимают натяженность лоскута, нет необходимости в наложении швов и защитной повязки. Технически процедура достаточно проста и занимает минимум времени. Данную технику можно использовать в области нескольких зубов.
D.P. Tarnow отмечал, что противопоказаниями к использованию данной техники являются:
-
тонкая кератинизированная десна, так как для полного закрытия рецессии в ее апикальной части толщина частично расщепленного лоскута должна быть адекватной;
-
если в области рецессии имеет место костная резорбция, то перемещение полулунного лоскута нужно сочетать с пересадкой десневого трансплантата в апикальной части.
Достаточно часто эту методику применяют в области передних зубов и премоляров верхней челюсти, где десневая рецессия не превышает 2-3 мм.
Данную технику можно использовать вторично после предыдущих методов пластики для улучшения косметического эффекта.
D.P. Tarnow (1986) описывал клинические случаи закрытия рецессии III и IV класса, используя соединительнотканный трансплантат в сочетании с коронарно-направленным лоскутом с полулунными разрезами.
Использование техники направленной регенерации тканей для ликвидации рецессии
Методика направленной регенерации ткани в настоящее время одна из надёжных и прогнозируемых по результатам.
Основная функция мембран - сохранение и нормальная трансформация кровяного сгустка. А.Н. Melcher (1976) предположил, что характер прикреплённой к корню зуба пародонтальной ткани зависит от типа клеток, которые первыми появились в ходе заживления на корневой поверхности. Основываясь на этом предположении, S. Nyman et al. (1980) провели ряд экспериментов, целью которых было восстановление полноценной пародонтальной ткани на поверхности корня.
S. Nyman et al. добились значительных успехов в своих экспериментах, когда поверхность корня и костного дефекта перекрывалась фильтром Millipore. Серия этих исследований положила начало новому направлению - направленной тканевой регенерации. Было дано логическое обоснование этой методики. Функция мембраны заключалась в способности удерживать апикальную миграцию эпителия. Клетки, находящиеся на поверхности корня ограниченной мембраной, начинали селективно размножаться, и происходило формирование новой пародонтальной связки.
Со времени первых опытов техника направленной регенерации ткани шагнула далеко вперед. Сегодня существует большое разнообразие мембран, используемых в пародонтальной пластической хирургии. Мембраны делятся на две сновные группы - резорбируемые и нерезорбируемые. Нерезорбируемые мембраны должны быть удалены через 4-6 нед после оперативного вмешательства.
Нерезорбируемые мембраны созданы из медицинского облегченного политетрафторэтилена. Наиболее популярны e-PTFE мембраны фирмы GORE-TEX. Резорбируемые мембраны по своей природе могут быть: коллагеновыми, мембраны на основе оксидированной целлюлозы - хрящевые (коллагеноподобные), могут состоять из гидролизирующегося полиэфира, полимолочной кислоты, викриловой массы. Самыми популярными из синтетических резорбируемых мембран являются:
Преимущество мембранной техники заключается в следующем (Kortellini P., PiniPrato G., 1995):
N. Sato (2000) использовал мембранную технику для закрытия рецессии глубиной более 5 мм. Так же он осуществлял пластику рецессии в области верхнечелюстных клыков с помощью мембранной техники. M.R. Guillemin, J.T. Melloning, M.A. Brunsvold (1993) использовали технику направленной регенерации в сочетании с местно-пластическими процедурами. Вначале глубокий десневой дефект скрывали с помощью мембраны, а затем использовали десневую пластику для улучшения морфологии десны.
M.S. Tonetti, Pini prato G., P. Cortellini (1995) писали, что мембранная техника является хорошей альтернативой аутотрансплантата в том случае, когда десна в области рецессии тонкая и фестончатая, а тонкая соединительная ткань в области твердого нёба делает невозможным пересадку тканевого трансплантата.
Кровообращение лоскута, покрывающего мембрану, имеет сходство с кровоснабжением свободного десневого аутотрансплантата.
C.R. Anderegg и соавт. (1995) отмечали, что толщина лоскута, покрывающего мембрану, должна быть в среднем равна толщине тканевого трансплантата - 1,5 мм. Автор с сотрудниками наблюдали за двумя контрольными группами пациентов. В первой группе толщина используемого лоскута составляла 5 мм, во второй - 1,5 мм. Средний размер рецессии у пациентов первой группы составил 2,1 мм, во второй - 0,6 мм.
Pini Prato и соавт. (1992) помещали мембрану под полностью расщеплённый лоскут, трапециевидный или коронарно-направленный. С. Tinti и соавт. (1992) использовали те же методы десневой пластики в сочетании с мембранной техникой.
Pini Prato и соавт. (1992) использовал e-PTFE-мембрану для закрытия рецессии в области 25 зубов. Пациенты наблюдались в течение 18 мес. Средний размер рецессии до операции 5,5 мм, после операции - 1,4 мм. Процент перекрытия корня составил 72,7%.
L. Trombelli и соавт. (1994) применили для покрытия корня e-PTFE-мембрану в сочетании с обработкой поверхности корня раствором тетрациклина и фибрин-фибронектином. Количество исследуемых зубов - 15, время наблюдения - 6 мес. Средний размер рецессии до операции - 4,7 мм, после операции - 1,1 мм. Процент перекрытия корня - 77,4%.
С. Tinti и G. Vincenzi (1994) использовали титанум-усиленные e-PTFE-мембраны. Операции проводились в области 12 зубов, наблюдения велись в течение 15 мес. Средний размер рецессии до операции - 5,3 мм, после операции - 1,4 мм. Процент перекрытия корня - 73,5%. М. Roccuzzo и соавт. использовали резорбируемые мембраны и получили следующие результаты. Оперировалась рецессия в области 12 зубов, наблюдения велись в течение 6 мес. Средний размер рецессии до операции - 4,75 мм, после - 0,83 мм. Средний процент перекрытия корня - 82,4%.
М. Roccuzzo и D. Buser (1996) использовал e-PTFE-мембрану с мини-винтами. Перекрывалась рецессия в области 12 зубов, наблюдения велись 9 мес. Средний размер рецессии до операции - 5,2 мм, после операции - 0,8 мм. Средний процент перекрытия корня - 84%.
N. Sato (2000) приводит сравнительную характеристику данных по использованию пересадки тканевого трансплантата и техники направленной регенерации. У 14 пациентов было прооперировано 22 зуба с помощью техники направленной регенерации. Клинические данные оценивались через 12 мес. Размер рецессии до операции - 3,5 мм, после операции - 0,8 мм, глубина десневой борозды до операции - 1,5 мм, после операции - 1,1 мм. Объем кератинизированной десны до операции - 2,8 мм, после операции - 3,6 мм. Костный дефект до операции - 6,5 мм, после операции костный дефект не отмечается. Таким образом, редукция рецессии составила 2,7 мм, глубина десневой борозды уменьшилась на 0,4 мм. Объем кератинизированной десны вырос на 0,8 мм.
У второй группы пациентов рецессия была закрыта с помощью тканевого транспсплантата. Было прооперировано 14 человек, пластика рецессии осуществлялась у 28 зубов. Десневая рецессия до операции составила 2,9 мм, после - 0,4 мм. Глубина десневой борозды до операции - 1,6 мм, после - 0,9 мм. Объем кератинизированной десны до операции - 2 мм, после - 3,4 мм. Костный дефект составил 5,1 мм. Редукции рецессии составила 2,5 мм, глубина десневой борозды уменьшилась на 0,7 мм, а объем кератинизированной десны вырос на 1,4 мм.
Данные лабораторных и клинических наблюдений показали, что через 1-1,5 г. после хирургического устранения рецессии с применением мембран рецессия оказалась на 0,5-1,5 мм меньше, чем без мембран. Основное осложнение при использовании методики направленной регенерации тканей - экспозиция мембраны, ее инфицирование, возможная аллергическая реакция на материал.
Использование матриксных протеинов соединительной ткани как факторов роста для устранения рецессии десны
Одни из самых последних разработок - материалы, способствующие восстановлению пародонтального прикрепления. Эти материалы по своей природе могут быть аллогенными или аутогенными. С 1991 г. проводились клинические испытания аллодермы. Аллодерма - это бесклеточный кожный трансплантат, полученный из тканей трупа. Этот материал хранится в банке тканей. Аллодерма консервируется с помощью сухой заморозки. Она проходит проверку на наличие вируса гепатита С, В, вируса ВИЧ-инфекции.
Аллодерма служит хорошей альтернативой соединительнотканного трансплантата. Ее используют в пластической пародонтальной хирургии для увеличения объема кератинизированной десны и для закрытия рецессии. Благодаря отсутствию клеточных структур аллодерма имеет низкую антигенную активность.
Тем не менее поскольку аллодерма состоит из протеинов, протеогликанов и других компонентов человеческой ткани, то специфическая реакция на неё не исключена.
При приживлении аллодермы происходит миграция фибробластов окружающих тканей в её сторону, одновременно она прорастает коллаггеновыми волокнами.
Для закрытия рецессии аллодерму используют по аналогии с техникой подэпителиального трансплантата. Аллодерму помещают под лоскут, который препарирован одним горизонтальным разрезом (модификация техники L. Langer и В. Langer), либо ее укладывают под коронарно-направленный лоскут.
Следует отметить, что степень сокращения аллодермы после приживления выше, чем у соединительнотканного трансплантата Alireza Haeri (2002).
Одной из самых передовых методик на сегодня является использование Emdogain-техники. Эмдогейн - это дариват матрицы эмали, состоящий преимущественно из амелогенина и производных протеинов (простых белков), их получают из почек (зачатков) зубов свиньи. Эти протеиновые матрицы эмали важны для развития бесклеточного цемента корня зуба, пародонтальной связки и альвеолярной кости. Поскольку протеины эмали во время эволюции остались неизмененными, наблюдается большая однородность между протеинами эмали свиньи и человека.
Клиническая эффективность и надежность эмдогейна проверены и подтверждены на пародонтальных дефектах животных и человека.
В результате клинических опытов было установлено, что эмдогейн давал прирост цементного вещества на 73%, новообразование кости составляло 65%.
Аллодерма и эмдогейн - последние достижения пародонтальной пластической хирургии. Они требуют дальнейших клинических наблюдений. Операции с применением этих техник менее травматичны для пациентов, и отдаленные результаты эффективнее методик, использовавшихся ранее для закрытия рецессии десны. Около 40 лет назад в пародонтологии обособилось новое направление - пародонтальная пластическая хирургия. В течение этого времени ученые-клиницисты шагнули далеко вперед. Появлялись и совершенствовались новые методики десневой пластики. Разрабатывались средства, влияющие на регенерацию пародонта.
Первые данные об использовании техники направленной регенерации тканей появились в 70-х годах прошлого века. Эти исследования были дополнены в 90-х годах изучением регенерации костной ткани аллогенными, аутогенными и ксеногенными материалами.
С усовершенствованием методов и средств пародонтальной хирургии отдаленные результаты операций стали предсказуемыми. Авторы отмечают 97- 100% перекрытия рецессии десны.
Согласно данным литературы, местно-пластические процедуры способны решить проблему мелкой РД. Однако при этом необходимо соблюдать все тонкости описанных методик, не выходить за рамки показаний к ним. В случае более тяжелой рецессии или неудовлетворительных результатов местно-пластических операций необходимо сочетать десневую пластику с методами направленной регенерации ткани. Для получения хорошего косметического эффекта и надежно прогнозируемого результата можно сочетать десневую пластику с эмдогейн-техникой.
Прекрасной альтернативой соединительнотканного трансплантата является аллодерма. Хороший эстетический результат после приживления, одно операционное поле делают эту технику выгодной в применении. Однако для широкого внедрения этой методики необходимы соответствующие клинические и экспериментальные исследования.
Обязательна предоперационная подготовка больного и постоперационный уход за раной.
Фибробласты и процессы репарации
Фибробласты - основная и наиболее распространенная клеточная форма соединительной ткани. В функции этих клеток входит продукция углеводно-белковых комплексов основного вещества (фибронектина, гликозамингликанов, протеогликанов и гликопротеидов), образование коллагеновых, ретикулиновых и эластических волокон. Эти клетки играют ключевую роль в регуляции метаболизма и структурной стабильности, указанных выше веществ и структурных элементов, в том числе их катаболизма.
Фибробласты играют также важную роль в регуляции их микроокружения и формирования эпителиально-мезенхимального взаимодействия.
Термин «фибробласт» обычно применяют к клеткам, активно продуцирующим компоненты межуточного вещества. Дифференцированную малоактивную форму этих клеток называют фиброцитами. Относительно гистогенеза фибробластов известно, что они возникают в ходе эмбрионального развития непосредственно из малодифференцированных мезенхимных клеток, находящихся в тех местах, где позднее обнаруживаются фибробласты.
Однако результаты исследований по регенерации соединительной ткани в постнатальной жизни указывают на то, что митозы, приводящие к образованию новых фибробластов, могут также происходить в менее дифференцированных перицитах, тесно связанных с мелкими кровеносными сосудами. Было установлено, что перициты, окружающие мелкие сосуды, являются полипотентными мезенхимными клетками, трансформирующимися в фибробласты, обладающие многими факторами роста и оказывающие активное влияние на окружающие клетки. Из этого следует, что сосуды служат не только транспортной системой, доставляющей в ткани питательные вещества, но и источником строительного материала для процессов организации и заживления при раневом процессе.
Изучая строение фибробласта, легко убедиться в том, что по своей функции - это, прежде всего, секреторная клетка. Однако существенное отличие фибробласта от секреторной эпителиальной клетки состоит в том, что он выделяет секрет через участки, распределенные по всей плазматической мембране. Фибробласты продуцируют четыре основных вещества: проколлаген, фибронектин, гликозаминогликаны и проэластин. Кроме того, они могут также секретировать и микрофибриллярный белок, который включается в эластические волокна. Проколлаген и проэластин, превращаясь в соответствующие волокна, служат волоконным каркасом для соединительной ткани, а фибронектин и гликозаминогликаны формируют экстрацеллюлярный матрикс.
Фибронектин - белок, влияющий на адгезию клеток. Помимо его растворимой формы, содержащейся в сыворотке крови, имеется нерастворимая форма этого белка, которая синтезируется фибробластами и выделяется ими в окружающую тканевую среду. Данная форма фибронектина образует филаментарные структуры на клеточных поверхностях и во внеклеточном матриксе. С помощью фибронектина происходят прикрепление и последующее распластывание многих клеток. При этом сначала фибронектин связывается с коллагеном, а затем происходит адгезия клеток к клеточным центрам на молекуле фибронектина, образуется комплекс клетки с фибронектином и коллагеном, после чего и следует распластывание клетки.
Фибронектин способствует взаимной контактной ориентировке фибробластов. Его рассматривают как многофункциональную молекулу, которая может связывать коллаген и желатин, фибрин и фибриноген, гепарин, гиалуроновую кислоту, актин, ДНК, поверхности эукариотических клеток. В целом, основная функция этого гликопротеида - прикрепление клеток к молекулам экстрацеллюлярного матрикса. Фибронектин играет важную роль не только как белок прикрепления, но он влияет и на подвижность и дифференцировку клеток.
Известно, что фибронектин - коллагеновый комплекс, имеет, главным образом, внутриклеточное происхождение и формируется внутри фибробластов, не менее 20% секретируемого фибробластами фибронектина выводится из клетки в виде комплекса с проколлагеном, а не в свободном виде.
Наряду с указанными выше веществами фибробласты продуцируют ряд ферментов, в частности коллагеназу, а также ряд белков, играющих чрезвычайно важную роль в регуляции местных гомеостатических процессов и межклеточных взаимодействий. Согласно Л.И. Бобро (1991), фибробласты представляют собой клеточную популяцию, функциональная полипотентность которой находится в зависимости как от местных, так и от общих условий. Способность фибробластов вступать в контакты с различными клетками, проявлять высокую чувствительность к нарушениям местного гомеостаза и оказывать на него самое активное регулирующее воздействие дает основание считать их одними из регуляторов гомеокинеза.
На сегодняшний день существует следующий перечень факторов (факторов роста - ФР), влияющих на регенерацию соединительной ткани и, в частности, пародонтальных структур.
-
Тромбоцитарный ФР (PDGF) - стимулирует синтез ДНК, увеличивает синтез гиалуроновых кислот, протеогликанов, коллагена, а на тканевом уровне интенсифицирует процессы регенерации кости.
-
Трансформирующий ФР (TGF-|31) - стимулирует синтез коллагена I типа, фибронектина и остеонектина, а также формирование костной матрицы.
-
Инсулиноподобный ФР (IGF) - синтезируется остеобластами и активизирует остеогенез, стимулирует синтез коллагена I типа.
-
Цементный ФР (cGf) - синтезируется цементобластами, стимулирует цементогенез, рост фибробластов периодонтальной связки и синтез коллагена I типа.
-
Костные морфогенетические белки (ВMPs) - инициируют остеогенез за счет стимуляции пролиферации, перемещения в костный дефект и дифференциации полипотентных клеток в остеобласты.
-
Паратгормон-зависимый белок (РТНrР) - ФР, влияющий на остеогенез за счет мощного анаболического эффекта на остеобласты.
-
7-й фактор роста фибробластов щелочной (bFGF) - синтезируется фибробластами, и его свойства рассматривались.
Первоначально фактор роста фибробластов (FGF) был идентифицирован как активное вещество, способное стимулировать рост клеток. Его активность обусловливается двумя белками. Один из них имел оптимум действия при рН 5,6 и был назван кислым FGF (aFGF), а другой был активен при рН >9,6 и получил название основной FGF(bFGF).
Факторы роста фибробластов aFGF и bFGF имеют аналогичный аминокислотный состав (совпадающий более чем на 80%), однако по биологическим характеристикам они различны. Так, aFGF и bFGF отличаются по способности связывать гепариноподобный гликозаминогликан (FILGAG) и протеогликаны на поверхности клетки. Показано, что aFGF и bFGF отличаются по степени и виду олигомеризации. Анализ показал, что bFGF и HLGAG образуют кристаллические структуры, a aFGF формирует только димеры. Разработка и внедрение в исследовательскую практику метода гепарин-аффинной хроматографии дали возможность получать достаточное количество bFGF, необходимого для структурного анализа на молекулярном уровне. Было показано, что бычий bFGF является белком, содержащим 146 аминокислот, с молекулярной массой 16,400, тогда как bFGF плаценты человека имеет 157 аминокислот и молекулярную массу 17,500.
Факторы роста фибробластов (ФРФ) включают 15 полипептидов. ФРФ связываются с киназами тирозина, гепарина сульфат - протеогликанами и цистеинсодержащим рецептором. Передача сигналов ФРФ сложна и связана с инсулиноподобным фактором роста, β-трансформирующим фактором роста, костным морфогенетическим белком. ФРФ - главные регуляторы эмбрионального развития: влияют на формирование позвоночника, головного и спинного мозга конечностей и других структур. Действие ФРФ зависит от их местонахождения, клеточных функций, ответа, дифференциации и т.д.
Установлено, что bFGF - мощный митогенный фактор для клеток мезодермального происхождения, значительно сокращающим время их удвоения. Это объясняется сокращением G1-фазы клеточного цикла. Кроме стимулирования пролиферации, bFGF вызывает и другие эффекты относительно клеток мишеней: способствует обратимым изменениям морфологии клетки, стимулирует транспортные системы клетки, образование полирибосом, синтез и стабилизацию РНК, общий синтез белка. bFGF стабилизирует фенотипическую экспрессию культурируемых клеток, что позволяет производить длительное выращивание клеток, сопровождающееся многочисленными клеточными пассажами. При этом присущий клеткам фенотип не изменяется. Этот феномен, возможно, объясняется способностью bFGF контролировать синтез и формирование компонентов внеклеточного матрикса, которые могут воздействовать на экспрессию генов.
В настоящее время предлагается модель, описывающая взаимодействия bFGF с клетками и матриксом:
-
после выделения из клетки bFGF связывается с протеогликанами, содержащими гепарина сульфат;
-
будучи связанным с матриксом, bFGF может быть инициирован либо гепариназой, либо плазмином, при этом он выделяется в межклеточный матрикс в виде комплексов bFGF-гликозаминогликаны или bFGF- протеогликаны, содержащих гепарина сульфат.
Эти комплексы диффундируют через строму к клеткам-мишеням и связываются со специфическими рецепторами клеток.
Выделение bFGF в виде комплексов обеспечивает стабильность фактора роста, предотвращая денатурацию и протеолитическую деградацию. Кроме того, эти комплексы диффундируют через матрикс быстрее, чем свободный bFGF, так как последний способен фиксироваться на межклеточном матриксе. В отличие от других обычных ростковых факторов, таких, как β-трансформирующий фактор роста, тромбоцитарный фактор роста, bFGF не выделяется в растворимой форме.
В ряде экспериментальных исследований in vivo было продемонстрировано выраженное стимулирующее влияние bFGF на ускорение процессов ангиогенеза. В частности, в опытах in vitro и in vivo показано, что в присутствии bFGF значимо усиливается пролиферация эндотелиоцитов капилляров и крупных сосудов, интенсифицируются миграция эндотелиоцитов и прорастание этих клеток в трехмерный коллагеновый матрикс с формированием тубулярных структур, схожих с кровеносными капиллярами. При этом наблюдается усиление секреции эндотелиоцитами, по крайней мере, двух протеаз (коллагеназы и активатора плазминогена), разрушающих межклеточный матрикс. Кроме того, bFGF стимулирует пролиферацию гладкомышечных клеток и перицитов, которые играют важную роль в формировании сосудов.
ФРФ и их рецепторы участвуют в регуляции эмбрионального развития скелетных, кардиальных и гладких мышц. В частности, установлено, что снижение FGF приводит к ослаблению интенсивности процесса миогенеза и усилению дифференциации миоцитов, что в определенной мере свидетельствует о регулирующей роли ФРФ в скелетном миогенезе.
К настоящему времени накоплена значительная по объему и разнообразию информация о влиянии ФРФ на остеогенетические процессы. Так, в опытах, поставленных на 5-недельных мышах-самцах (SAМР6) на модели экспериментально воспроизведенных нарушений костеобразовательного процесса, II. Nagai и соавт. (1999) исследовали эффект систематического применения основного фактора роста фибробластов (bFGF) в дозах 0,1 и 0,3 мг/кг в сутки в течение 7 сут. Изучали с помощью гистоморфометрического метода темпы костеобразовательного процесса. Было установлено, что при введении животным 0,1 мг/кг в сутки bFGF в дистальной эпифизарной части бедренной кости отмечалось уменьшение продольной скорости роста, при этом синтез хряща нормализовался, и отмечалось увеличение роста кости в ширину. В хонтроцитах при введении 0,3 мг/кг в сутки выявлялись признаки дефектного энхондриального окостенения. В дистальной трети бедренной гости в обширных межтрабекулярных пространствах наблюдалось усиление остеогенетического процесса. В этой области отмечалась интенсивная пролиферация эндостальных остеобластов, дифференцирующихся, по всей видимости, из массивов фибробластоподобных мезенхимных клеток. Формирование описанных очагов остеогенеза в пределах слоев указанных мезенхимальных клеток свидетельствует об их высоком остеогенном потенциале. Эти результаты показывают, что систематическое введение bFGF может активизировать остеогенез. В то же время более высокая доза bFGF, 0,3 мг/кг в сутки, замедляет и эндохондриальный, и периостальный остеогенез, что согласуется с данными, полученными Т. Kimoto и соавт. (1998), а также C.R. Dunstan и соавт. (1999).
I. Martin и соавт. (1999) выявили, что зрелым хондроцитам из гиалинового хряща с помощью фактора роста фибробластов (bFGF) можно вернуть их хондрогенный потенциал. Количество хондроцитов увеличилось в 2000 раз в присутствии основного фактора роста фибробласта (bFGF). Добавление в среду bFGF приводило к резкому увеличению массы хондроцитов и к формированию хрящевой ткани, что не наблюдалось в контроле, где bFGF отсутствовал.
N. Nakagawa и соавт. (1999) показали, что bFGF замедляет формирование остеокластоподобных клеток (ОСL) в селезёнке мыши или в соседстве с остеобластами. bFGF непосредственно действовал на клетки стромальных остеобластов, но не на клетки-предшественники остеокластов. bFGF ингибирует выработку индуктора дифференцирования остеокласта (ODF), но не воздействует на остеокластогенез.
А. Suzuki (2000) доказал, что bFGF - важный регулятор остеобластической дифференциации клеток. Доказано, что для кальцификации матрицы кости необходим транспорт неорганического фосфата (Pi). Изучено влияние bFGF на активность транспорта Pi в остеобластоподобные клетки. Обнаружено, что bFGF - мощный стимулятор натрийзависимого канала Pi в этих клетках. Активность транспортировки Pi в ответ на bFGF объясняется встраиванием синтезируемых Na-Pi-каналов в плазматическую мембрану.
G. Zellin и соавт. (2000) in vivo исследовали остеогенетичеекие эффекты bFGF различных культуральных клеток остеобластического происхождения. Была изучена эффективность рекомбинанта человеческого основного фактора роста фибробластов (rhFGF-b), использованного для стимуляции ортотопического остеогенеза в околокостных челюстных дефектах у крыс. Три различные дозы rhFGF-b (10 нг, 100 нг и 1 мкг) были помещены на носитель (коллагеновая губка). Остеогенные клетки были получены из костного мозга. Оценку проводили с помощью микроскопии и автоматизированного визуального анализа на 12-е и 24-е сутки после начала опыта. На 24-е сутки в большинстве наблюдений были выявлены картины ограниченного остеогенеза, исключая дозу 1 мкг, при которой происходило подавление остеогенеза. Впрочем, было показано, что в опытах in vitro rhFGF-b стимулирует быстрое нарастание в культуре числа остеобластических клеток.
F. Blanquaert и соавт. (1999) показали влияние bFGF на гепатоцитарный фактор роста (HGF/SF). HGF/SF - многофункциональный фактор роста, который играет главную роль в морфогенезе тканей и регенерации. Он стимулирует митогенез клеток-предшественников остеобластов. При исследовании было обнаружено, что bFGF увеличивал синтез HGF/SF приблизительно в 2 раза.
A. Palmon и соавт. показали, что фактор роста фибробластов «основной» (bFGF) влияет на хемотаксис и митогенез клеток пародонтальной связки. Было обнаружено влияние bFGF на синтез I типа коллагена и матричной металлопротеиназы-1. Влияние на синтез коллагена III типа отмечено не было.
Y. Tabata и соавт. (1999) представили результаты по использованию биоразлагаемого гидрогеля, содержащего основной фактор роста фибробластов (bFGF), для стимуляции регенерации костной ткани в дефектах черепа обезьян диаметром 6 мм. Гидрогель на основе желатина, включающий 100 мкг bFGF, значительно усиливал регенерацию кости, и дефект черепа полностью закрывался к 21-й неделе после операции. Дефекты в группе наблюдений, где использовали один лишь гидрогель без bFGF, оставались незаполненными костным регенератом.
Carlos Rossa Jr. и соавт. (1998) исследовали регенерацию фуркационных дефектов III класса с использованием основного фактора роста фибробласта (bFGF) и применением направленной регенерации ткани (GTR) в хирургически смоделированных фуркационных дефектах у собак. Формировались 3 группы исследования: группа № 1 (контроль) - механическая обработка корня, хлоргидрат тетрациклина (125 мг/мл) и GTR с коллагеновой мембраной; группа № 2 - то же, что и в № 1 + 0,5 мг bFGF; группа № 3 - то же, что и в № 1 плюс 1,0 мг bFGF. Через 90 дней проведена гистологическая оценка результатов: регенерация выше в группах № 2 и 3 (с bFGF), а по данным гистометрии, проанализированным посредством дисперсионного анализа (ANOVA), выявлено преимущество в группе № 2.
S. Takayama и соавт. (1998) исследовали влияние bFGF на пролиферативную активность клеток пародонтальной связки в зависимости от дозировки. Максимальный митогенный эффект bFGF на клетки пародонтальной связки наблюдался при концентрации 10 нг/мл. Согласно данным исследователей, bFGF замедлял также индукцию активности щелочной фосфатазы и минерализации. Выделение коллагена III типа и фибронектина mRNA не изменилось даже тогда, когда клетки были активизированы bFGF. S. Murakami и соавт. (1999) исследовали эффективность bFGF при лечении 2- и 3-стеночных и фуркационных дефектов II класса. В сроки 6 и 8 нед после операции проводились морфологические и морфогистометрические исследования. Везде, где применяли bFGF, отмечалось формирование пародонтальной связки с образованием нового цемента зуба и активным остеогенезом. Прорастание в пародонт эпителия, развития анкилоза или резорбции корня зуба при введении в ткани фактора bFGF не наблюдалось.
In vitro показано, что bFGF увеличивает пролиферативную активность в клетках пародонтальной связки, но снижает активность щелочной фосфатазы и минерализации сформированного костного матрикса. bFGF не влияет на уровень ламинина в клетках пародонтальной связки.
Все перечисленные выше факты свидетельствуют о целесообразности применения клеточной культуры фибробластов или продуктов их секреции. Опираясь на них, Melcher (1976) предложил гипотезу, которая начала бурно развиваться и преобразовалась в хирургическое направление - «тканевое строительство» (tissue engineering), которое характеризуется применением во время хирургических манипуляций факторов роста или клеточных культур, непосредственно влияющих на пролиферацию и дифференциацию клеток, находящихся в области хирургического вмешательства.
Анализируя накопленную в литературе информацию, нельзя не отметить, что большая часть информации об остеогенетической активности фибробластов и ФРФ была получена в экспериментальных исследованиях. Однако, как известно, экспериментальные модели далеко не всегда могут в полной мере воспроизвести весь спектр изменений, развивающихся при патологических процессах, а также реакций организма человека и его органных и тканевых систем на внешние воздействия в условиях нормы и патологии, возникающих при той или иной клинической ситуации. В связи с этим мы придерживаемся сбалансированной точки зрения, согласно которой окончательные суждения по обсуждаемому вопросу должны формироваться по мере накопления информации, полученной как в клинических, так и в экспериментальных исследованиях.
К сожалению, производство синтетических факторов роста (в том числе и bFGF) не налажено. Таким образом, решение вопроса использования для тканевого строительства (tissue engineering) факторов роста следует сегодня искать на путях применения их продуцентов, в частности фибробластов. Однако систематическое получение аутогенного клеточного материала (с последующим его культивированием) непосредственно от самих пациентов в условиях поликлинического приема на практике нереально. В связи с этим был поставлен вопрос о применении культур многократно пассированных клеток, в частности у нас в стране культуры эмбриональных фибробластов человека, штамм М-22.
Согласно данным литературы, местнопластические процедуры способны решить проблему мелкой РД. Однако при этом необходимо соблюдать все тонкости описанных методик, не выходить за рамки показаний к ним. В случае более тяжелой рецессии или неудовлетворительных результатов местнопластических операций необходимо сочетать десневую пластику с методами направленной регенерации ткани.
ХИРУРГИЧЕСКОЕ УДЛИНЕНИЕ КОРОНКОВОЙ ЧАСТИ ЗУБА
Здоровье пародонта - краеугольный камень любой успешно выполненной реставрации. Долгосрочный благоприятный прогноз реставраций основывается на комбинации принципов реставрационного лечения и деликатного обращения с тканями пародонта.
Удлинение коронковой части зуба представляет собой хирургическое вмешательство, которое выполняют на здоровом пародонте, направленное на высвобождение достаточного количества тканей зуба с целью увеличения высоты клинической коронки. Данная операция проводится для дальнейшего адекватного восстановления коронковой части зуба.
После проведения данной операции становится возможным расположить край будущей реставрации над или на уровне десневого края, что существенно влияет на дальнейшее состояния как тканей пародонта, так и самой реставрации. По данным отечественной и зарубежной литературы, в области реставраций, края которых расположены под десной, отмечается более обильное скопление налета, увеличение индексов кровоточивости и глубины пародонтальных карманов.
Удлинение коронковой части зуба выполняют по пародонтологическим, ортопедическим и эстетическим показаниям.
Ортопедические показания
Современный подход к грамотному проведению реставрации в стоматологии невозможен без учета концепции биологической ширины. Это ключевой момент для сохранения здорового состояния пародонта при наличии любого вида реставраций.
Удлинение коронковой части для последующего восстановления зубов с переломами (травмирование), обширным кариозным процессом, недостаточно проросших зубов, стертых или плохо протезированных зубов должно проводиться с соблюдением определенных биологических принципов и сохранением биологической ширины зуба.
Термин «биологическая ширина» обозначает комплекс тканей пародонта, который располагается над альвеолярной костью. Гистологически он включает в себя соединительную ткань (Шарпеевы волокна) и прикрепленный к зубу эпителий. Некоторые исследователи включают в биологическую ширину и десневую бороздку.
Впервые гистологическое строение и средние размеры «биологической ширины» установил А. Gargiulo et al. (1961) в исследовании на удаленных зубах. Средние размеры биологической ширины: прикрепленная соединительная ткань 1,07 мм + прикрепленный эпителий 0,97 мм = 2,04 мм. Размер десневой бороздки - 0,69 мм (рис. 14-38).
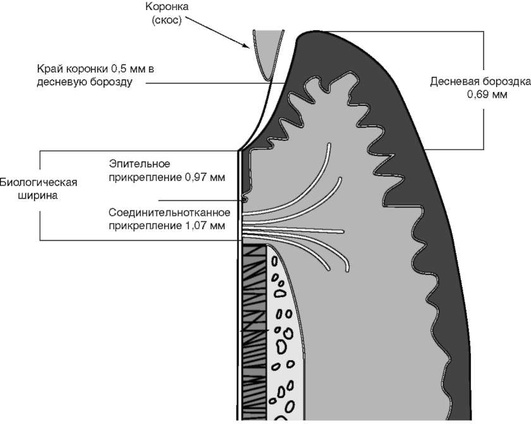
Рис. 14-38. Схема биологической ширины, биологической зоны и всего зубодесневого комплекса. (Из монографии «Fundamentals of Periodontics**, 2nd ed.)
Размеры биологической ширины для каждого пациента индивидуальны. У некоторых людей они могут быть от 0,75 до 4,3 мм, а размер биологической ширины у моляров в среднем на 0,33 мм больше, чем у передних зубов.
В 1992 г. Bragger et al. доказал, что расстояния в 3 мм от альвеолярного гребня до апикальной границы реставрации достаточно для эффективного поддержания пародонта в здоровом состоянии в период до 6 мес.
Вторжение края реставрации в зону билогической ширины приводит к хроническому воспалительному процессу в тканях пародонта, резорбции костной ткани и рецессии десны с восстановлением нормальной биологической ширины.
Maynard и Wilson установили, что если коронка устанавливается апикальнее десневого края, то она должна располагаться в пределах десневой бороздки и как минимум на 0,5 мм от прикрепленного эпителия в сторону коронки (рис. 14-39, см. цв. вклейку).
Эстетические показания
Удлинение коронковой части также проводят с целью коррекции эстетики десневого края при таких клинических ситуациях, как десневая улыбка (см. рис. 14-40, см. цв. вклейку).
Пародонтологические показания
Нередко удлинение коронковой части зуба проводят с помощью форсированного ортодонтического вытягивания зуба (рис. 14-41). Эта методика была разработана Ingber в 1974 г. Она позволяет увеличить длину клинической коронки зуба и одновременно устранить внутрикостный дефект. Традиционная методика принудительной экструзии приводит к корональному перемещению десны. Для придания краю десны физиологичного контура проводят небольшую корригирующую операцию.
Противопоказаниями к хирургическому удлинению коронковой части зуба могут быть заведомая невозможность реставрации зуба, состояния, когда ценность зуба несопоставима с затратами и сложностью выполнения вмешательства, неудовлетворительный эстетический результат после проведения операции. Так же как и любая плановая операция в полости рта, удлинение коронковой части зуба противопоказано пациентам с неудовлетворительной гигиеной полости рта. С осторожностью следует планировать данное вмешательство у курящих пациентов.
Методика поведения операции
Существует несколько видов операций. В каждом случае подход зависит от конкретной клинической ситуации. Среди возможных операций следующие:
Гингивэктомия проводится при неполном прорезывании зуба или при гиперплазии десны.
Остеотомия, частичная или со всех сторон, показана в случаях, когда биологическая ширина не достигает 2-3 мм, необходимых для успешного протезирования; наличия таких эстетических поблем, как асимметрия зубов и высокая линия улыбки.
Протокол лоскутной операции с остеотомией по периметру зуба
-
Под аппликационной и инфильтрационной анестезией проводят фестончатые горизонтальные разрезы с вестибулярной и оральной сторон.
-
С помощью распатора откидывают полные слизисто-надкостничные лоскуты. Необходимо помнить, что фестончатый контур лоскута должен соответствовать окончательному контуру подлежащей кости, фестончатость лоскута должна напоминать архитектуру десны пациента в здоровом состоянии.
-
До начала проведения остеохирургии удаляют всю грануляционную ткань и остатки соединительнотканных волокон. С поверхности корня удаляют остатки соединительного эпителия.
-
Остеопластика и остеотомия: с помощью хирургических боров проводят реконтурирование костного края, сглаживая костные выступы. Во избежание травмы зубов вблизи поверхности корня рекомендуется использовать ручные или ультразвуковые инструменты. Окончательный костный контур должен соответствовать желаемому контуру здоровой десны после операции без попыток его улучшения в последующем.
-
Проводят репозицию лоскутов и наложение швов. Швы могут быть как отдельными, так и непрерывными в зависимости от клинической ситуации.
Послеоперационный период
В первые дни в зоне операции допускается только полоскание растворами антисептиков, затем осторожная механическая чистка. Снятие швов проводят через 7 дней после проведения операции. При проведении вмешательства в области боковых зубов пациента назначают на повторное обследование через 6 нед до перехода к изготовлению окончательных реставраций. При работе в области фронтальных зубов рекомендуется более длительный период заживления.
При составлении плана лечения стоматологического пациента на современном уровне необходим интердисциплинарный подход. Такая пародонтологическая операция, как хирургическое удлинение коронковой части зуба, позволяет достичь оптимальных функциональных и эстетических результатов протезирования.
Клинические примеры
Удлинение коронковой части зуба с целью последующего восстановления.
Клинический случай 1 (рис. 14-39, см. цв. вклейку)
Удлинение коронковой части зуба с целью коррекции эстетики десневого края (рис. 14-40, см. цв. вклейку)
Удлинение коронковой части зуба с помощью форсированного ортодонтического вытягивания зуба (атлас Edward S. Cohen) (рис. 14-41, рис. 14-42-14-44, см. цв. вклейку)
Рис. 14-41. Удлинение коронковой части зуба с помощью форсированного ортодонтического вытягивания зуба: а - форсированное прорастание. Клиническая и рентгенологическая картина до лечения; б - медиальный внутрикостный дефект в области центрального резца; в - вид через 1 год; протезирование завершено; г - на рентгенологическом снимке полное устранение внутрикостного дефекта
ДЕНТАЛЬНАЯ ИМПЛАНТАЦИЯ В ПАРОДОНТОЛОГИЧЕСКОЙ ПРАКТИКЕ
Использование достижений научно-технического прогресса в стоматологии привели к широкому распространению во всем мире дентальной имплантации.
Лечение пациентов с применением имплантатов во многих случаях приняло характер рутинного. Однако имеющиеся лимитирующие факторы предполагают тщательное проведение подготовительного периода имплантологического лечения и последующего диспансерного наблюдения пациентов. Высокая распространенность заболеваний пародонта частично связана с недостаточной эффективностью профилактических и лечебных мероприятий. Изменения в костной ткани, формирование очагов деструкции в пародонте зачастую протекают бессимптомно, что затрудняет своевременную диагностику. Дальнейшее прогрессирование патологических процессов оказывает негативное влияние на свойства прилегающих тканей, приводя к неспособности полноценной регенерации.
В настоящее время нет никаких научно подтвержденных данных, которые позволяют считать, что имплантат лучше естественного зуба. Поэтому возможность сохранения зубов при достаточной мотивации и соблюдении удовлетворительной гигиены позволяет в течение длительного времени предотвратить прогрессирование пародонтита. Необходимо определить разумный баланс между пародонтологическими и имплантологическими методами, чтобы обеспечить длительное поддержание здорового состояния полости рта пациента.
Остеоинтеграция - термин, введенный профессором Бренемарком и его соратниками в 1977 г. Он означает создание прямого контакта между несущим нагрузку дентальным имплантатом и костной тканью.
Очевидны различия во взаимоотношении зуба и имплантата с окружающими тканями (рис. 14-45, см. цв. вклейку).
Строение и функции тканей пародонта изучены достаточно хорошо. Самая важная характеристика пародонта - это специфическое соединение между мягкими и твердыми тканями. Маргинальный пародонт фиксирован к поверхности зуба посредством соединительного эпителия, который защищает более глубокие элементы зубодесневого соединения от механического и микробного воздействия. Под краевым эпителием расположены волокна круговой связки зуба. Они соединяют зуб с десной. В области альвеолярной кости расположены волокна периодонта, которые вплетаются в костную ткань и цемент корня.
При составлении плана лечения необходимо учитывать различный подход к оценке эффективности пародонтологического и имплантологического лечения. Под успехом пародонтологического лечения понимают полное отсутствие потери кости в области сохраненных зубов. Одним из критериев успешного лечения с применением имплантатов является потеря кости в области шейки имплантата в первый год после функционирования не более 1,5 мм и в последующем не превышает 0,2 мм в год, что через 10 лет может составить не более 3,5 мм.
Прогноз имплантологического лечения часто ограничивается данными о коэффициенте выживаемости имплантатов. Этот коэффициент обычно приближается к 95%, но он не позволяет определить состояние окружающих имплантат тканей. Атрофия краевой кости и периимплантит снижают степень остеоинтеграции имплантата. Особенно распространение таких осложнений часто недооценивается из-за отсутствия адекватного рентгенологического контроля или несвоевременного клинического обследования с зондированием зубоимплантатного соединения.
По международному определению, периимплантит - это прогрессирующая резорбция окружающей имплантат костной ткани с воспалительным очагом тканевой деструкции в слизистой оболочке полости рта. Встречаемость этого патологического процесса участилась в связи с увеличением срока функционирования большого количества имплантатов. При отсутствии адекватного лечения периимплантит приводит к полной дезинтеграции имплантата и последующей его утрате.
Пародонтит относительно редко встречается в течение первых 20-30 лет, зато периимплантит представляет собой обычное явление уже через 10 лет функционирования имплантатов без систематической поддерживающей терапии. Безусловно, повышение качества самостоятельной гигиены во многом способствует увеличению продолжительности срока службы имплантатов.
В настоящее время большинство пародонтологов уже имеет достаточную подготовку для профилактики и лечения периимплантита. Придавая большое значение профилактике, ранней диагностике и своевременному лечению пародонтологических заболеваний, аналогичный подход, включая систематическую поддерживащую терапию, должен применяться и при ведении пациентов с имплантатами.
Микробиологические исследования, проведенные у пациентов с различными формами пародонтита, выявили наличие преобладания так называемой пародонтопатогенной флоры. В большинстве случаев это грамнегативные бактерии. К ним относятся в первую очередь следующие виды бактерий - Aggregatibacter actinomycetemcomitans, Fusobacterium nucleatum, Porphyromonas gingivalis, Prevotella intermedia, Treponema denticola и Tannerella forsythia. Во вторую группу относятся микроорганизмы, обладающие менее выраженными вирулентными свойствами. К данным видам относятся - Peptostreptococcus micros, Fusobacterium nucleatum, Campylobacter rectus, Eubacterium nodatum, Eikinella corrodens и Capnocytophaga spp. По данным ряда авторов, в развитии пародонтита могут также играть роль акциномицеты, а также Streptococcus intermedius.
Микрофлора в периимплантационных тканях отличается от микрофлоры пародонтальных карманов пациентов, страдающих хроническим генерализованным пародонтитом, значительно меньшим количеством спирохет и подвижных палочек.
При развитии периимплантита ряд авторов указывает на схожесть микробного пейзажа при пародонтите и при периимплантите. В обоих случаях обнаруживали такие виды, как Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Treponema denticola, Tannerella forsythia и Campylobacter rectus.
Воспалительные заболевания пародонта могут приводить к потере зубов. Скорость развития этого процесса у разных пациентов может значительно отличаться. На основании тестов Мак-Гайра и Нунна (McGuire и Nunn) создана трехступенчатая классификация зубов в соответствии с пародонтологическим прогнозом. В большинстве случаев зубы с исходным благоприятным прогнозом служат от 5 до 8 лет. Для зубов с сомнительным прогнозом уровень выживаемости в период наблюдения значительно ниже. В прогностическом плане для многокорневых и однокорневых зубов самый низкий уровень выживаемости имеют моляры, особенно при вовлечении фуркаций в патологический процесс.
Оценка пародонтологического прогноза
При осложнённом, запущенном пародонтите как альтернативу регенеративной или радикальной операции можно выбрать удаление зуба и замещение его имплантатом. Особенно это касается области фуркации моляров, где при возникновении обширного воспалительного поражения невозможно добиться полноценного удаления зубной бляшки и регенерации костной ткани и периодонтальной связки (рис. 14-46).
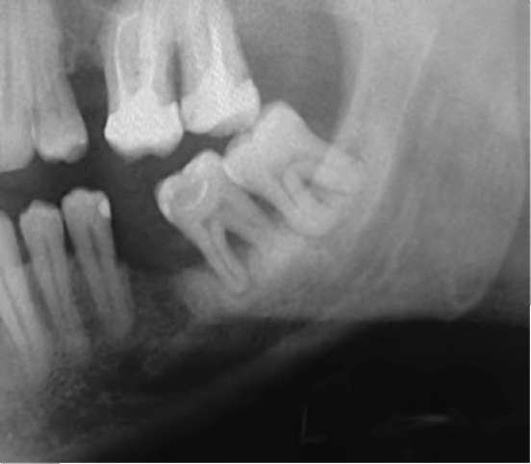
Рис. 14-46. Пациент А. Обширное воспалительное поражение зуба 37 вокруг медиального корня и в области фуркации. С целью дальнейшего прекращения убыли костной ткани возможно замещение зуба имплантатом
Количество костной ткани должно отвечать потребностям имплантологического лечения. Однако даже и при более благоприятных условиях необходимо регулярно проводить пародонтологическую санацию остальных зубов и имплантатов и обеспечить со стороны пациента оптимальный контроль над зубными отложениями.
Каждое контрольное посещение оценивают по следующим параметрам:
Еще одной причиной данной патологии является неправильное изготовление ортопедической конструкции (рис. 14-47, см. цв. вклейку). Это может приводить к раздражению слизистой оболочки полости рта, хронической травме десневой манжетки, а также способствовать задержке остатков пищи в труднодоступных местах. Образование твердых и мягких отложений вызывает гиперемию, отечность и повреждение околоимплантатной десны и её болезненность. В большинстве случаев чувствительные участки пациент не затрагивает чисткой, вследствие чего патологические процессы усугубляются. Образование налета на супраструктуре дентального имплантата приводит к воспалению тканей десневой манжетки, ее гиперплазии и образованию грануляционной ткани на месте рубца, окружающем искусственную опору (рис. 14-48, см. цв. вклейку). Кроме того, на слизистой оболочке полости рта могут возникнуть и другие заболевания (плоский лишай, многоформная эксудативная эритема и др.). Они могут сами вызывать жжение, болезненность либо служить входными воротами для болезнетворных инфекций. Первыми признаками будут отечная десна, кровоточивость, болезненность, изъязвление слизистой оболочки, что ведет к уменьшению объёма мягких тканей вокруг шейки имплантата и его оголению.
При гиперплазии слизистой оболочки следует провести тщательный кюретаж околоимплантатной десневой бороздки специальными пластиковыми кюретами и скалерами, антисептическую и противовоспалительную терапию, а также при необходимости хирургическую коррекцию околоимплантатной десны. Вопросы гигиены должны быть решены на профессиональном уровне.
Основными осложнениями, возникающими как после одноэтапной, так и после двухэтапной методики имплантации, являются периимплантит и отторжение имплантатов.
Спектр высеиваемой микрофлоры из воспалительного очага развившегося пародонтита мало чем отличается от спектра бактерий при периимплантите. Кроме того, не обнаружена зависимость в том, что стало причиной последнего: микробная контаминация окружающих имплантат мягких тканей или перегрузка в процессе функционирования ортопедической конструкции.
Причинами раннего периимплантита у дентальных имплантатов, развившегося в период заживления, могут быть: несоблюдение принципов атравматичного вмешательства, неудовлетворительное состояние гигиены в области установленных имплантатов, травмирование их плохо припассованным временным протезом, образование гематомы над заглушкой дентального имплантата и её нагноение (рис. 14-49, см. цв. вклейку), рубцы и некорректное закрытие операционной раны.
Клинически он проявляется в виде гиперемии и отека слизистой оболочки, ее истончения в зоне размещения погруженной искусственной опоры и образования свищевого хода с небольшим количеством серозного, реже гнойного экссудата, болезненностью при надавливании на имплантат, отсутствием или незначительной его подвижностью.
Рентгенологически при раннем периимплантите определяется горизонтальный очаг резорбции альвеолярного отростка или ограниченная деструкция с образованием костного кармана вокруг дентального имплантата (рис. 14-50).
Рис. 14-50. Пациент Б., рентгенограмма. Образование гематомы над заглушкой дентального имплантата. Рентгенологически определяется ограниченная деструкция вокруг дентального имплантата
Поздний периимплантит встречается в различные сроки в области функционирующих имплантатов. Причинами воспалительного процесса при данном виде патологии могут быть: микробная контаминация поверхности дентального имплантата при неудовлетворительной гигиене полости рта, хроническое травмирование пораженных околоимплантатных мягких тканей вследствие неправильно проведённых протезирования или установки компонентов имплантата.
Клиническими проявлениями позднего периимплантита являются гиперемия и отёчность околоимплантатной десны, дискомфорт и кровоточивость во время приёма пищи и чистки зубов, образование грануляционной ткани и свищей в области проекции установленного имплантата, увеличение глубины зондирования периимплантатного кармана.
В результате трансгингивального расположения в полости рта всех искусственных опор не выявлено существенных различий в частоте возникновения тканевой деструкции у погруженных и непогруженных функционирующих имплантатов.
Чаще всего процесс дезинтеграции в отдаленные сроки протекает бессимптомно. Иногда при накусывании пациенты отмечают незначительную болезненность в области имплантата. Наличие функциональной перегрузки имплантатов ведет к воспалительно-дистрофическому процессу. И основной причиной данной патологии бывают ортопедические конструкции, опирающиеся на зубные имплантаты, в результате неправильного протезирования, частичной расцементировки протеза или их разрушения. Поэтому следует обращать особое внимание на распределение жевательной нагрузки.
Рентгенологически в поздние сроки имеются признаки обширной горизонтальной резорбции альвеолярной кости либо кратерообразная деструкция вокруг шейки имплантата и образование костных карманов.
При лечении периимплантита следует устранить причину, вызвавшую развитие воспалительного процесса, провести тщательную антисептическую обработку и кюретаж вокруг пораженной искусственной опоры специальными пластиковыми кюретами, медикаментозную противовоспалительную и антибактериальную терапию, ревизию периимплантатной деструкции и восстановление дефицита костных структур с помощью методов направленной тканевой регенерации. Одним из наиболее важных аспектов, оказывающих значительное влияние на результат лечения, является качество деконтаминации поверхности имплантата. В настоящее время применяется большое количество средств для обработки и очистки поверхности имплантата, например абразивная взвесь гидрокарбоната натрия, лимонная кислота, хлоргексидин, стерильный физиологический раствор, дельмопинолρ или гидроксипероксидρ. Однако наиболее качественной очистки шероховатой поверхности имплантата удается достичь с помощью лазерного воздействия. Помимо качественной деконтаминации производится стерилизация поверхности имплантатов и благоприятное стимулирующее воздействие на окружающие его ткани (рис. 14-51, см. цв. вклейку).
В отличие от периимплантита отторжение имплантата представляет собой прогрессирующую воспалительную деструкцию и является острым очаговым остеомиелитом в костной ткани, окружающей имплантат (рис. 14-52)
Причиной отторжения имплантата могут быть: несоблюдение принципов атравматического вмешательства во время препарирования костного ложа (термический ожог), стремительная костная деструкция в результате общесоматических осложнений (гормональный дисбаланс, остеопенический синдром, химиотерапия, остеопороз, облучение) или инфицирование околоимплантатных структур.
Воспалительные реакции в виде отёка, гиперемии, образования свищевого хода, значительной подвижности имплантата свидетельствуют о полной дезинтеграции искусственной опоры и служит показанием к его удалению. Попытка регенерационной терапии подвижного имплантата усугубляла клиническую ситуацию, усиливая вокруг него активность процесса костной деструкции.
Рентгенологически определяется неравномерная резорбция кости по всему периметру внутрикостной части имплантата.
Рис. 14-52. Пациент В. Рентгенологическая картина отторжения имплантата через 1 мес после операции (по всему периметру внутрикостной части одного имплантата имеет место неравномерная резорбция костной ткани глубиной 1-2,5 мм)
Лечение заключается в удалении имплантата и щадящей ревизии дефекта кости. Повторную установку дентального имплантата рекомендуется проводить в том же участке не ранее чем через 6-8 мес.
Травматические поражения слизистой оболочки вокруг функционирующих дентальных имплантатов часто возникают в результате неправильной гигиены полости рта при использовании зубочисток, чрезмерного давления зубной нитью или случайного повреждения околоимплантатных тканей при бытовых, уличных и других травмах.
Наиболее распространенным осложнением является неправильное препарирование супраструктур имплантатов, приводящее к их нагреванию, термическому повреждению окружающей кости и отторжению. Необходимо тщательно контролировать орошение зоны препарирования и бора.
Ортопедические конструкции на имплантатах отличаются от естественных зубов: они более уязвимы к механическим повреждениям и давлению.
Пластическим деформациям в первую очередь подвержены фиксирующие протез винты и их резьбовое соединение с головкой имплантата, а также место соединения головки с внутрикостной частью искусственной опоры. При принудительном расшатывании ощущается незначительная подвижность протеза, иногда с щелчками.
Неадекватная механическая нагрузка, возникшая при частичной расцементировки протезов, приводит к перелому дентального имплантата. При этом показано удаление оставшейся в кости его части, с последующим замещением дефекта альвеолярного отростка, используя методы направленной регенерации тканей.
При переломах ортопедических компонентов имплантатов производится починка протеза или его замена. Если возникает ослабление соединений имплантата и протеза, необходимо сильнее затянуть резьбовые соединения, а при возникновении деформации рекомендуется заменить соответствующий компонент имплантата.
В различные сроки функционирования дентальных имплантатов могут возникать общесоматические проблемы, осложняющие процесс заживления и полного восстановления. В послеоперационном периоде или на более поздней стадии функционирования имплантатов организм человека может подвергнуться различного вида патологическим процессам: гормональному дисбалансу, онкологическим заболеваниям, изъязвлению мягких тканей вследствие поражения слизистой оболочки полости рта и др.
Гормональный фон может вызвать срыв репаративной регенерации костной ткани вокруг околоимплантатных структур.
Лечение химиотерапией и облучением ставят под угрозу всю иммунную систему, кроме того, может способствовать раздражению мягких тканей полости рта и развитию язв. Тщательная чистка зубов будет причинять пациентам боль. Аналогичная ситуация с гигиеной полости рта развивается и у людей с заболеваниями слизистой оболочки (плоский лишай, многоформная экссудативная эритема и др.), так как эти болезни снижают барьерную функцию мягких тканей и способствуют их инфицированию.
Дентальные осложнения имплантологического лечения могут проявляться в виде анатомических и функциональных нарушений. Неправильный прикус, пародонтит, заболевания височно-нижнечелюстных суставов, разрушение опорных зубов в протезе, а также бруксизм являются причинами образования травматических узлов окклюзии. Наличие функциональной перегрузки искусственной опоры ведет к воспалительно-дистрофическому процессу, срыву физиологической регенерации кости, очагу тканевой деструкции и последующей полной дезинтеграции имплантата.
Способ оптимизации величины нагрузки на имплантат, при котором зазор с антагонистами должен быть равным 80-100 мкм, уточняется с помощью артикуляционной бумаги.
Адаптационные изменения в тканях клинически здорового пародонта при отсутствии функциональной нагрузки на имплантаты и окружающую их костную ткань характеризуются региональной гипофункцией. Это ведет к снижению высоты костной ткани за счет её прогрессирующей атрофии.
К средствам стимулирования регионального кровообращения можно отнести гнатотренинг жевательной резинкой по 5 мин 3 раза в день после еды, а также само- и гидромассаж десны.
К общим относятся осложнения, вызванные вредными привычками (злоупотребление курением, алкоголем), возрастом (уменьшение интенсивности обменных процессов), стилем жизни (изнуряющие строгие диеты), эмоциональным статусом (эмоциональная лабильность) пациента.
Злоупотребление курением приводит к нарушению метаболизма костной ткани и способствует развитию остеопороза, отрицательно влияет на процессы заживления, особенно постоперационном периоде. Одна выкуренная сигарета снижает приток крови к пальцам руки на 40% в час. Поэтому необходимо рекомендовать воздержаться от курения в течение 2 нед до операции и 8 нед после.
Диагностика периимплантита и других нарушений должна проводиться своевременно, чтобы вовремя принять меры. При правильном уходе имплантаты прослужат много лет.
Без рациональной гигиены полости рта решить проблему заболеваний пародонта, равно как и вокруг околоимплантатных тканей, невозможно. Врачом-стоматологом осуществляется профессиональная гигиена, включающая удаление зубного камня. Контролируемая гигиена (профессиональное обучение и контроль качества очищения зубов) выполняется самим пациентом. Индивидуальные гигиенические мероприятия осуществляются самостоятельно. Даже регулярно ухаживая за зубами, у большинства людей обнаруживаются недостаточные знания о средствах и методах ухода за полостью рта. В связи с этим возрастает необходимость разъяснить значение и важность гигиенических процедур для достижения долгосрочных результатов лечения и обучить их правилам ухода за полостью рта и функционирующими дентальными имплантатами. В противном случае образовавшийся микробный налет, бляшки в области шеек головок имплантатов и на протезе приведут к околоимплантатным воспалительным процессам и ускоренной резорбции костной ткани. Кроме этого на этапе создания протезной конструкции необходимо предусмотреть условия для поддержания гигиены (изготовление грушевидной формы жевательной группы зубов протеза, высокая степень полирования его металлических и пластмассовых частей, наличие промывной зоны в области головок имплантатов и под искусственными зубами).
Индивидуальный уход за протезами на имплантатах включает в себя ежедневную программу процедур из нескольких этапов:
Первый шаг в гигиене полости рта - это удаление налёта с помощью зубной щётки. Чистке подвергаются десна, возвышающиеся над ней абатменты дентальных имплантатов, все оставшиеся естественные зубы и ортопедические конструкции (опорные металлические балки и протезы, включая коронки и внутреннюю часть). Зубы надо чистить нежно, короткими движениями с достаточным давлением. Обычно рекомендуется щётка с мягкими щетинками и закругленными кончиками. Мягкими щетинками меньше риска повредить десну и мягкотканный контакт с дентальным имплантатом. Чистить надо по определенной схеме, разделив челюсти на фрагменты по 2-3 зуба. Переходить к следующему фрагменту, только тщательно очистив предыдущий. Сначала очищать наружную, потом внутреннюю поверхность. Менять щётку не реже 1 раза в 2-3 мес.
Пациентам, страдающим рядом заболеваний (болезнь Паркинсона, артрит и др.), рекомендуется использовать автоматические электрические щетки.
Способ проверки качества очищения зубов осуществляется с помощью безвредных для организма красителей. Применяются в виде раствора или таблеток для разжевывания (обычно имеет красный цвет). Окрашенный зубной налёт удаляется повторной чисткой полости рта.
Дополнительную механическую обработку головок имплантатов и придесневой части протезов осуществляют дентальными ершиками и нитями. Несъемные мостовидные протезы и опорные металлические балки изготовлены обычно как единое целое. Ручка с межзубными ершиками, сделанная под углом, позволяет вычистить труднодоступные места между установленными абатментами, а также между дёснами и нижней частью ортопедической конструкции (рис. 14-53, см. цв. вклейку).
Зубная нить подходит для чистки как естественных, так и искусственных зубов. При этом она может проникать даже в недоступные для зубного ершика участки полости рта. Некоторые нити в специальных комплектах особенно эффективны для чистки мостовидных протезов и соединительных балок (рис. 14-54, 14-55, см. цв. вклейку). Она позволяет удалить остатки пищи с задней, боковых и передней сторон коронок и абатментов дентальных имплантатов.
Полоскание проводится на завершающем этапе процедуры гигиены полости рта. Оно дает возможность удалить микробный налёт и остатки пищи после чистки зубной щёткой и нитью. Полоскать полость рта рекомендуется после каждого приёма пищи. Кроме того, гигиенический уход подразумевает периодические (2-3 дня в неделю) полоскания полости рта антисептическими растворами и использование зубных паст, содержащих хлоргексидин, а также эликсиров и настоев трав, обладающих противовоспалительными свойствами.
Выполнять гигиенические процедуры (чистку зубов, дёсен, использование зубных ёршиков и нити) 1 раз в день, лучше вечером после последнего приёма пищи. По утрам (желательно после еды) рекомендуется просто чистка зубов и дёсен.
Регулярный имплантологический осмотр включает в себя обязательную профессиональную чистку полости рта и проверку ортопедической конструкции на стабильность. Даже при самом тщательном домашнем уходе происходит образование микробных бляшек на оставшихся зубах, протезах и выступающих в полость рта частях имплантатов. Профессиональная гигиена осуществляется не менее 1 раза в год. Для этой цели используют струйную обработку стерильным раствором бикарбоната натрия (соды), а также скелер с пластиковыми кюретами (рис. 14-56).
Рис. 14-56. Карбоновая насадка для обработки имплантатов
Несмотря на то что абатменты имплантатов и опорные балки сделаны из металла, их легко поцарапать или повредить поверхностный слой титана. Очень важно, чтобы гигиена полости рта, в том числе профессиональная, проводилась с использованием инструментов, не повреждающих поверхность имплантата. Поэтому применение металлических скелеров, зондов и другого стоматологического инструментария для этой обработки недопустимо.
Имплакер - инструмент для ухода за имплантатами и абатментами. Традиционные кюреты из нержавеющей стали и пластиковые кюреты, содержащие стеклянный или графитовый наполнители, могут повредить титановую поверхность. Большинство цельных пластиковых скелеров и кюрет слишком гибкие и хрупкие, чтобы эффективно удалить налет и камень. Имплакер имеет твердые рабочие части, что значительно повышает эффективность гигиенических мероприятий. Благодаря тому, что его рабочие части изготовлены из сверхпрочного пластика «Пластил» (PLASTEELТМ), снятие отложений может быть выполнено без повреждения титановых поверхностей имплантатов и абатментов. Кроме того, имплакер очень удобен для обработки традиционных ортопедических конструкций.
Ирригаторы. Ирригатор полости рта - современное средство гигиены, продуцирующее пульсирующий ток жидкости, которая вымывает остатки пищи из межзубных промежутков и ретенционных пунктов. Биопленка при этом не смывается, но замедляется её образование.
Струя жидкости, порционно подается из резервуара через гибкое соединение в наконечник и направляется перпендикулярно десневой линии.
Кроме очищающего эффекта регулируемая интенсивность воздействия обеспечивает гидромассаж десны. Гидромассаж десны с помощью ирригатора оказывает лечебное и профилактическое действие: стимулируется кровоток, улучшается регионарное кровоснабжение в слизистой оболочке десны, подавляется деятельность микрофлоры, улучшается обмен веществ (рис. 14-57, см. цв. вклейку).
Некоторые ирригаторы снабжены терморегуляторами для дополнительного температурного воздействия в заданном интервале. Растворы для ирригаторов содержат аромасоединения и антисептики, направленные на подавление образования биоплёнки и воспаления.
Таким образом, внутриротовой ирригатор значительно уменьшает количество налета и пародонтопатогенной микрофлоры как в области зубов, так и в области имплантатов. А применение специального инструмента для ухода за этими конструкциями значительно повышает эффективность гигиенических мероприятий.
Комплексные мероприятия по индивидуальной гигиене полости рта решают проблему заболеваний пародонта, равно как и вокруг околоимплантатных тканей, и создают благоприятные условия для их нормального функционирования.
СПИСОК ЛИТЕРАТУРЫ
-
Белоусов Н.Н. Причины возникновения тяжелых форм заболеваний пародонта // Материалы IX Международной конференции челюстно-лицевых хирургов и стоматологов. - СПб., 2004. - С. 31-32.
-
Бернадский Ю.И. Затрудненное прорезывание нижних третьих моляров, или так называемых зубов мудрости //Основы хирургической стоматологии. - Киев: Здоровья, 1983. - С. 140-146.
-
Бернадский Ю.И. Одонтогенные опухолеподобные образования // Основы челюстно-лицевой хирургии и хирургической стоматологии. - Витебск: Белмедкнига, 1998. - С. 303-318.
-
Безрукова И.В., Грудянов А.И. Агрессивные формы пародонтита. - М.: МИА. - 126 с.
-
Безруков В.М. Справочник по стоматологии. - М.: Медицина, 1998. - 656 с.
-
Безруков В.М., Робустова Т.Г. Болезни прорезывания зубов // Руководство по хирургической стоматологии и челюстно-лицевой хирургии. - М.: Медицина, 2000. - С. 302-310.
-
Боровский Е.В., Мишкиллейсон А.Л. Заболевания слизистой оболочки полости рта. - М.: Медицина, 1984. - 400 с.
-
Бычков А.И. Профилактика и лечение осложнений, связанных с удалением третьего моляра при затрудненном прорезывании: Автореф. дис. канд. мед. наук. - М., 1993.
-
Воложин А.И., Порядин Г.В. Патологическая физиология. - М., 1998. - 479 с.
-
Вольф Г.Ф., Ратейцхак Э.М., Ратейцхак К. Пародонтология / пер. с нем.; под ред. проф. Г.М. Барера. - М.: МЕДпресс-информ, 2008. - 548 с.: ил.
-
Горбатова Е.А. Влияние топографии отделов десны, преддверия полости рта, прикрепления уздечек губ на формирование патологических изменений в пародонте: Дис*?* канд. мед. наук /МГМСУ. - М., 2004. - 161 с.
-
Гринин В.М., Смирнов А.В. Клинико-патогенетическая взаимосвязь состояния околозубных тканей и соматической патологии // Материалы юбилейной научно-практической конференции, посвященной 70-летию профессора Барера Г.М.: Сб. науч. трудов/ МГМСУ. - М., 2004. - С. 51-53.
-
Григорьян А.С., Грудянов А.И., Рабухина Н.А., Фролова О.А. Болезни пародонта. Патогенез, диагностика, лечение. - М.: МИА, 2004.- 320 с.
-
Грудянов А.И., Григорьян А.С., Фролова О.А. Диагностика в пародонтологии. - М., 2004. - 93 с.
-
Грудянов А.И., Овчинникова В.В., Дмитриева Н.А. Антимикробная и противовоспалительная терапия в пародонтологии. - М., 2004. - 79 с.
-
Грудянов А.И., Москалев К.Е. Инструментальная обработка поверхностей корней зубов. - М., 2005. - 67 с.
-
Грудянов А.И., Овчинникова В.В. Профилактика воспалительных заболеваний пародонта. - М., 2007. - 78 с.
-
Грудянов А.И., Ерохин А.И. Хирургические методы лечения заболеваний пародонта. - М., 2006. - 120 с.
-
Грудянов А.И. Пародонтология. Избранные лекции. - М., 1997. - 32 с.
-
Грудянов А.И. Диагностика в пародонтологии. - М.: Мед. информ. агентство, 2004. - 104 с.
-
Грудянов А.И., Фоменко Е.В. Этиология и патогенез воспалительных заболеваний пародонта // Заболевания пародонта. - М., 2009. - С. 9-45.
-
Губайдулина Е.Я., Цегельник Л.Н. Опухоли, опухолеподобные поражения и кисты лица, органов полости рта, челюстей и шеи // Хирургическая стоматология. - М.: Медицина, 1996. - С. 512-624.
-
Губайдулина Е.Я., Цегельник Л.Н., Лузина В.В., Чергештов Ю.И. Амбулаторные оперативные вмешательства при доброкачественных поражениях лица, органов полости рта и челюстей // Хирургическая стоматология. - М.: Медицина, 2007. - С. 111-136.
-
Дмитриева Л.А. Терапевтическая стоматология. - М., 2003. - 894 с.
-
Дмитриева Л.А., Крайнова А.Г. Современные представления о роли микрофлоры в патогенезе заболеваний пародонта // Пародонтология. - 2004. - № 1. - С. 2-4.
-
Есаян З.В. Болезни пародонта у детей и подростков. - Ереван, 2003. - 185 с.
-
Жуматов У.Ж., Бекметов З.М. Оценка эффективности удаления зубных отложений с помощью ультразвука // Клиническая стоматология. - 2002. - № 4. - С. 44-45.
-
Карапетян И.С., Губайдулина Е.Я., Цегельник Л.Н. Опухоли и опухолеподобные поражения полости рта, челюстей лица и шеи. - М.: МИА, 2004. - 232 с.
-
Колесов А.А., Воробьев Ю.А., Каспарова Н.Н. Новообразования мягких тканей и костей лица у детей и подростков. - М.: Медицина, 1989. - 265 с.
-
Кондратьева Т.Г. Цитологическая диагностика новообразований полости рта: авто-раф. дис. канд. мед. наук. - М., 1977. - 16 с.
-
Коэн Э. Атлас косметической и реконструктивной пародонтологической хирургии. - М.: Азбука, 2004. - 416 с.
-
Лангле Р.П., Миллер К.С. Атлас заболеваний полости рта. - 2008.
-
Ласкарис Дж., Скалли К. Атлас по пародонтологии. - М., 2005. - 346 с.
-
Логинова Н.К., Воложин А.И. Патофизиология пародонта. - М., 1995. - 108 с.
-
Магид Е., Штейнберг В., Житнитцкий Г. Затрудненное прорезывание нижних зубов мудрости и связанные с ним осложнения. - Волгоград, 1970. - 121 с.
-
Максимовский Ю.М., Митронин А.В. Основные направления профилактики и лечения хронического воспаления в области периодонта // Рос. стоматол. журн. - 2004. - № 1. - С. 1-19.
-
Перова М.Д. Ткани пародонта: норма, патология, пути восстановления. - М.: Триада, Лтд, 2005. - 312 с.
-
Ренуар Ф., Бо Рангерт. Факторы риска в стоматологической имплантологии. - М.: Азбука, 2004. - 182 с.
-
Робустова Т.Г. Болезни прорезывания зубов // Хирургическая стоматология / под ред. проф. Л.А. Дмитриева / Пародонтит. - М.: Медпресс-П18 информ, 2007.
-
Орехова Л.Ю. Иммунологические механизмы в патогенезе воспалительных заболеваний пародонта: Дис…. д-ра мед. наук. - СПб., 1997. - 226 с.
-
Плахтий Л.Я., Царев В.Н. Микробиологическое и молекулярно-генетическое обоснование применения антибиотиков в пародонтологии. - Владикавказ, 2007. - 180 с.
-
Софронов Б.Н., Левин М.Я., Орехова Л.Ю. Введение в иммунологию. - СПб., 1995. - 116 с.
-
Уепг В., Магхег М. Процедуры регенерации в имплантологии и пародонтологии // Новое в стоматологии. - 2002. - № 1 - С. 16-18.
-
Улитовский С.Б. Практическая гигиена полости рта // Новое в стоматологии. - 2002. - 328 с.
-
Цепов Л.М. Заболевания пародонта: взгляд на проблему. - М., 2006. - 192 с.
-
Carranza F.A., Saunders C. Clinical Periodontology. - 2002. - 1033 p.
-
Cripps S. Periodontal desease: Recognition, Interseption and Prevention // Quintess. - 1984 - 290 р.
-
Goldman H.M., Cohen D.W. Periodontal Therapy. Mosby Comp. - 1980. - 1217 р.
-
Hamada Sh., Holt S.C. Ghec Mc. Peridontal Desease: Pathogens; Host Immune Response // Quintess. - 1991. - p. 410.
-
Ibsen O., Phelan I. Oral patology for the dental Hygienist. Saunders Company. - 1996. - 483 p.
-
Polson A. Periodontal regeneration. Quintess. - 1994. - Р. 217.
-
МКБ-10, Международная статистическая классификация болезней и проблем, связанных со здоровьем, в 3-х томах - М., 2003. - 2440 с.
-
Adda F. Concentr_s plaquettaires & Platelet rich fibrin: une nouvelle strat_gie en paro-implantologie. D.U. d?implantologie Paris XII 2001.
-
McGuire M.K., Nunn M.E. Prognosis versus actual outcome. Ll. The effectiveness of clinical parameters in accurately predicting tooth survival. J Periodontal 1996; 67: 666-674.
-
McGuire M.K., Nunn M.E. Prognosis versus actual outcome. Ll. The effectiveness of clinical parameters and IL-1 genottype in accurately predicting prognoses and tooth survival. J Periodontal 1999; 70: 49-56.
-
Hamp S.E., Nyman S., Lindhe J. Periodontal treatment of multirooted teeth. Results after 5 years. J Clin periodontal 1975; 2: 126-135.
-
Litonjua L.A., Andreana S., Buch P.J., Cohen R.E. Toothbrushing and gingival recession // Int Dent J. 2003; 53(2):67-72.
-
Sculean A., Chiantella G. et al. Four-Year Resalts Following Treatment of Intrabony Periodontal Defect with an Enamel Matrix Protein Derivative: A Report of 46 Cases // Int. J Periodontics Restorative Dent, 2003, No 23, p. 345-351.
-
Sbordone L., Bortolaia C. Periodontal disease and occlusal trauma: a still debated controversy? // Minerva Stomatol. 2002; 51(3):79-85.
-
Carranza F.A., Saunders C. Clinical Periodontology. - 2002. - 1033 p.
-
Cohen, Edward S. Atlas of cosmetic and reconstructive periodontal surgery / Edward S. Cohen. - 2nd ed., 1994
-
Cargiulo A., Wentz F., Orban B.: Dimensions and relations of the dentogingival junction in humans. J Periodontol 1961; 32: 261-267
-
Chu S.J., Hochman M.N.: A Biometric approach to aesthetic crown lenghthening. Pract Proced Aesthet Dent 2007; 19(10):A-X
-
Cunliffe J., Grey N.: Crown Lengthening Surgery - Indications and Techniques. Dent Update 2008; 35: 29-35
-
Perez J.R., Smukler H., Nunn M.E.: Clinical Evaluation of the Supraosseous Gingivae Before and After Crown Lengthening. Journal of Periodontology 2007; 78; 1023-1030
-
Thomas G. Wilson, Kenneth S. Kornman. Fundamentals of Periodontics (second edition), 2003.