Эндокринология : национальное руководство / под ред. И. И. Дедова, Г. А. Мельниченко. - 2-е изд. , перераб. и доп. - Москва : ГЭОТАР-Медиа, 2021. - 1112 с. : ил. - 1112 с. - ISBN 978-5-9704-6054-2. |
Аннотация
Национальные руководства - серия практических руководств по основным медицинским специальностям, включающих специальную информацию, необходимую врачу для непрерывного последипломного образования. В отличие от других изданий в национальных руководствах равное внимание уделено профилактике, диагностике, фармакотерапии и немедикаментозным методам лечения.
В национальном руководстве "Эндокринология" приведены современные рекомендации по профилактике, диагностике, лечению эндокринных заболеваний и реабилитации эндокринологических больных. Особое внимание уделено ведению больных с наиболее распространенными заболеваниями эндокринной системы, такими как сахарный диабет, ожирение, остеопороз, болезни щитовидной железы. Рекомендации по диагностике, лечению и профилактике эндокринных заболеваний подготовлены ведущими специалистами и отражают объединенную, согласованную позицию отечественной научной школы.
В настоящем, втором издании пересмотрены и обновлены все разделы руководства с учетом последних международных и отечественных рекомендаций.
Руководство предназначено эндокринологам, терапевтам, врачам общей практики, а также студентам старших курсов медицинских вузов, интернам, ординаторам, аспирантам.
Глава 10. Сахарный диабет
ВВЕДЕНИЕ
Майоров А.Ю.
ОПРЕДЕЛЕНИЕ
Группа метаболических (обменных) заболеваний, характеризующихся гипергликемией, возникающей в результате дефекта секреции инсулина, действия инсулина или совместного воздействия факторов.
КОД ПО МКБ-10
Хроническая гипергликемия при диабете сочетается с повреждением, дисфункцией и развитием недостаточности различных органов: глаз, почек, нервов, сердца и кровеносных сосудов. В развитии диабета участвуют несколько патогенетических процессов: от аутоиммунного повреждения β-клеток поджелудочной железы с развитием в последующем абсолютного дефицита инсулина до нарушений, вызывающих развитие резистентности периферических органов-мишеней к действию инсулина. Основой нарушений метаболизма углеводов, жиров и белков при диабете считают недостаточность действия инсулина в тканях-мишенях. Недостаток действия инсулина - результат неадекватной секреции инсулина и/или сниженного тканевого ответа на инсулин. Нарушение секреции инсулина и дефекты его действия часто сосуществуют у одного и того же больного, и неясно, какое нарушение является первичной причиной гипергликемии.
КЛАССИФИКАЦИЯ
Этиологическая классификация сахарного диабета [5] (ВОЗ, 1999-2013)
-
1-й тип (деструкция β-клеток, обычно приводящая к абсолютной инсулиновой недостаточности):
-
2-й тип (с преимущественной инсулинорезистентностью и относительной инсулиновой недостаточностью или с преимущественным нарушением секреции инсулина с инсулинорезистентностью или без нее).
-
ГСД (возникает во время беременности [6] ).
СИМПТОМЫ ХРОНИЧЕСКОЙ ГИПЕРГЛИКЕМИИ
ОСТРЫЕ, УГРОЖАЮЩИЕ ЖИЗНИ ОСЛОЖНЕНИЯ ДИАБЕТА
ДИАГНОСТИКА
В России приняты критерии диагностики СД, предложенные экспертами ВОЗ в 1999 г. и дополненные в 2013 г. (табл. 10.1).
Время определения |
Концентрация глюкозы, ммоль/л* |
|
цельная капиллярная кровь |
венозная плазма |
|
Норма |
||
Натощак и |
<5,6 |
<6,1 |
через 2 ч после ПГТТ |
<7,8 |
<7,8 |
СД |
||
Натощак**, или |
≥6,1 |
≥7,0 |
через 2 ч после ПГТТ**, или |
≥11,1 |
≥11,1 |
случайное определение*** |
≥11,1 |
≥11,1 |
Нарушенная толерантность к глюкозе |
||
Натощак (если определяется) и |
<6,1 |
<7,0 |
через 2 ч после ПГТТ |
≥7,8 <11,1 |
≥7,8 <11,1 |
Нарушенная гликемия натощак |
||
Натощак и |
≥5,6 <6,1 |
≥6,1 <7,0 |
через 2 ч после ПГТТ (если определяется) |
<7,8 |
<7,8 |
Норма у беременных |
||
Натощак, или |
<5,1 |
|
через 1 ч после ПГТТ, или |
<10,0 |
|
через 2 ч после ПГТТ |
<8,5 |
|
гсд |
||
Натощак, или |
≥5,1 <7,0 |
|
через 1 ч после ПГТТ, или |
≥10,0 |
|
через 2 ч после ПГТТ |
≥8,5 <11,1 |
|
* Диагностика проводится на основании лабораторных определений уровня глюкозы.
** Диагноз СД всегда следует подтверждать повторным определением гликемии в последующие дни, за исключением случаев несомненной гипергликемии с острой метаболической декомпенсацией или с очевидными симптомами. Диагноз ГСД может быть поставлен на основании однократного определения гликемии.
*** При наличии классических симптомов гипергликемии.
Перевод глюкозы крови из ммоль/л в мг/дл:
ммоль/л×18,02=мг/дл.
Натощак - уровень глюкозы утром после предварительного голодания в течение не менее 8 ч и не более 14 ч.
Случайное - уровень глюкозы в любое время суток независимо от времени приема пищи.
ПГТТ - в случае сомнительных значений гликемии для уточнения диагноза.
Правила проведения ПГТТ: ПГТТ следует проводить утром на фоне не менее чем 3-дневного неограниченного питания (более 150 г углеводов в сутки) и обычной физической активности. Тесту должно предшествовать ночное голодание в течение 8-14 ч (можно пить воду). Последний вечерний прием пищи должен содержать 30-50 г углеводов. После забора крови натощак испытуемый должен не более чем за 5 мин выпить 75 г безводной глюкозы или 82,5 г декстрозы моногидрата, растворенных в 250-300 мл воды. Для детей нагрузка составляет 1,75 г безводной глюкозы (или 1,925 г декстрозы моногидрата) на 1 кг массы тела, но не более 75 г (82,5 г). В процессе теста не разрешается курение. Через 2 ч осуществляется повторный забор крови.
Для предотвращения гликолиза и ошибочных результатов определение концентрации глюкозы проводится сразу после взятия крови, или кровь должна быть центрифугирована сразу после взятия, или храниться при температуре 0-4 °С, или быть взята в пробирку с консервантом (флуорид натрия).
ПГТТ не проводится на фоне:
В 2011 г. ВОЗ одобрила возможность использования HbA1C для диагностики СД.
В качестве диагностического критерия СД выбран уровень HbA1C ≥6,5% (48 ммоль/моль).
Исследование должно быть выполнено с использованием метода определения HbA1C , сертифицированного в соответствии с National Glycohemoglobin Standardization Program или International Federation of Clinical Chemists и стандартизованного в соответствии с референсными значениями, принятыми в Diabetes Control and Complications Trial.
Нормальным считается уровень HbA1C до 6,0% (42 ммоль/моль).
Перевод HbA1C из процентов в ммоль/моль:
(HbA1C , %×10,93) -23,5=HbA1C ммоль/моль.
Перевод HbA1C из ммоль/моль в проценты:
(0,0 915×HbA1C ммоль/моль) +2,15=HbA1C , %.
ХРОНИЧЕСКИЕ ОСЛОЖНЕНИЯ ДИАБЕТА
-
Периферическая нейропатия с риском образования язв нижних конечностей и ампутации, а также сустава Шарко.
-
Синдром диабетической стопы, приводящий к развитию гангрены и ампутации.
-
Автономная нейропатия, вызывающая гастроинтестинальные, урогенитальные, сердечно-сосудистые симптомы и половую дисфункцию.
Гликирование тканевых белков и других макромолекул и избыток продуктов полиолового пути утилизации глюкозы стоят в ряду механизмов, ведущих к повреждению тканей в результате хронической гипергликемии. Среди больных диабетом высока частота атеросклеротических поражений сосудов сердца, периферических и церебральных сосудов. Часто у больных диагностируют гипертонию, нарушения метаболизма липопротеидов и пародонтоз. Эмоциональное и социальное влияние диабета и потребности лечения могут вызвать существенную психосоциальную дисфункцию у больных и членов их семей. Подавляющее большинство случаев диабета относится к СД 1-го и 2-го типа.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
СД 1-го типа (2-го типа) или СД вследствие (указать причину).
ТЕРАПЕВТИЧЕСКИЕ ЦЕЛИ ПРИ САХАРНОМ ДИАБЕТЕ 1-ГО И 2-ГО ТИПА
Они отражены в алгоритмах специализированной медицинской помощи больным СД (Москва, 2015).
В настоящее время в России приняты индивидуальные цели лечения для показателей контроля углеводного обмена. Выбор индивидуальных целей лечения зависит от возраста пациента, ожидаемой продолжительности жизни, наличия тяжелых осложнений и риска тяжелой гипогликемии (табл. 10.2). В связи с введением индивидуализированных целей терапии понятия компенсации, субкомпенсации и декомпенсации в формулировке диагноза у взрослых пациентов нецелесообразны.
Возраст или ожидаемая продолжительность жизни |
|||
молодой |
средний |
пожилой и/или ожидаемая продолжительность жизни <5 лет |
|
Нет тяжелых макрососудистых осложнений и/или риска тяжелой гипогликемии** |
<6,5% |
<7,0% |
<7,5% |
Есть тяжелые макрососудистые осложнения и/или риск тяжелой гипогликемии |
<7,0% |
<7,5% |
<8,0% |
* Данные целевые значения не относятся к детям, подросткам и беременным женщинам.
** Основными критериями риска тяжелой гипогликемии являются тяжелая гипогликемия в анамнезе, бессимптомная гипогликемия, большая продолжительность СД, ХБП C3 и выше, деменция.
Данным целевым уровням HbA1C будут соответствовать следующие целевые значения глюкозы плазмы (табл. 10.3).
| HbA1C, % | Глюкоза плазмы натощак/перед едой, ммоль/л | Глюкоза плазмы через 2 ч после еды, ммоль/л |
|---|---|---|
<6,5 |
<6,5 |
<8,0 |
<7,0 |
<7,0 |
<9,0 |
<7,5 |
<7,5 |
<10,0 |
<8,0 |
<8,0 |
<11,0 |
* Данные целевые значения не относятся к детям, подросткам и беременным женщинам.
У беременных женщин с СД цели лечения более строгие (табл. 10.4).
| HbA1C, % | Глюкоза плазмы натощак/перед едой/перед сном/3 ч, ммоль/л | Глюкоза плазмы через 1 ч после еды, ммоль/л |
|---|---|---|
<6,0 |
<5,1 |
<7,0 |
У детей цели лечения показаны в табл. 10.5.
Наряду с гликемическим контролем следует уделять внимание терапевтическим целям в отношении уровня липидов крови и АД (табл. 10.6, 10.7).
| Уровень контроля | Идеальный | Оптимальный (компенсация) | Субоптимальный (субкомпенсация) | Высокий риск осложнений (декомпенсация) |
|---|---|---|---|---|
Клиническая оценка |
||||
Повышенная глюкоза плазмы |
Не повышена |
Нет симптомов |
Полиурия, полидипсия, энурез |
Нечеткое зрение, плохой набор массы тела, задержка пубертата, плохая посещаемость школы, кожные и генитальные инфекции, признаки сосудистых осложнений |
Низкая глюкоза плазмы |
Не низкая |
Нет тяжелых гипогликемий |
Эпизоды тяжелой гипогликемии (потеря сознания и/или судороги) |
Эпизоды тяжелой гипогликемии (потеря сознания и/или судороги) |
Биохимическая оценка |
||||
Глюкоза плазмы натощак или до еды, ммоль/л |
3,6-5,6 |
4-8 |
>8 |
>9 |
Глюкоза плазмы через 2 ч после еды, ммоль/л |
4,5-7,0 |
5-10 |
10-14 |
>14 |
Глюкоза плазмы перед сном, ммоль/л |
4,0-5,6 |
6,7-10 |
<4,2 или >9 |
<4,0 или >11 |
Глюкоза плазмы ночью, ммоль/л |
3,6-5,6 |
4,5-9 |
<4,2 или >9 |
<4,0 или >11 HbA1C, % |
Показатели |
Целевые значения, ммоль/л* |
мужчины женщины |
|
Общий холестерин |
<4,5 |
Холестерин ЛПНП. Для лиц с сердечно-сосудистыми заболеваниями и/или ХБП с 3а и более |
<2,5** <1,8** |
Холестерин ЛПВП |
>1,0 >1,3 |
Триглицериды |
<1,7 |
* Перевод из ммоль/л в мг/дл:
Общий холестерин, холестерин ЛПНП, холестерин ЛПВП: ммоль/л × 38,6 = мг/дл. Триглицериды: ммоль/л × 88,5 = мг/дл.
** Или снижение холестерина ЛПНП на 50% и более от исходного уровня при отсутствии достижения целевого уровня.
| Показатели | Целевые значения, мм рт.ст. |
|---|---|
Систолическое АД При наличии ХБП 3а |
>120* и ≤140 >120* и ≤130 |
Диастолическое АД |
>70* и ≤85 |
* На фоне антигипертензивной терапии.
САМОКОНТРОЛЬ ГЛИКЕМИИ
Самоконтроль гликемии в настоящее время рассматривается как важная часть эффективного лечения СД. Это неотъемлемый компонент терапии у больных, получающих инсулинотерапию. Рекомендуемая частота самоконтроля для больных на многократных инъекциях инсулина не менее 4 раз в день. Для других терапевтических категорий частота самоконтроля должна определяться в соответствии с актуальными терапевтическими целями и индивидуальными потребностями больных. В наибольшей мере нуждаются в самоконтроле гликемии пациенты с недавно выявленным диабетом, больные, ведущие неупорядоченный образ жизни или склонные к частым гипогликемиям, а также лица с повышенной мотивацией на достижение жесткого контроля уровня гликемии.
Самоконтроль позволяет больному оценивать изменения гликемии в реальном времени и обеспечивает обратную связь, необходимую для своевременной коррекции факторов образа жизни, а подчас и медикаментозной терапии (например, адаптация дозы инсулина перед едой). Результаты самоконтроля используются врачом для оценки эффективности и безопасности терапии, определения актуальных целей в обучении больных и т.д. Самоконтроль возможен только в тех случаях, когда пациент готов к его систематическому проведению, ведению записей в дневнике, способен понять значение результатов измерений гликемии и соответствующим образом изменять свое поведение.
Анализ глюкозурии не требует больших расходов, но в настоящее время практически не применяется, так как имеет ограниченную ценность. Отсутствие глюкозы в пробах мочи является показателем того, что ее концентрация в крови ниже порога почечной экскреции; обычно это имеет место при уровне гликемии порядка 10 ммоль/л (180 мг%). Положительные результаты определения глюкозы в моче не позволяют провести различие между умеренным и значительным повышением ее концентрации в крови, а отрицательные результаты - дифференцировать нормогликемию и гипогликемию.
ОБУЧЕНИЕ БОЛЬНЫХ
Даже при максимально полном применении арсенала современных медикаментозных и технических средств эффективность лечения СД низка, если отсутствует компонент активного и грамотного участия пациента в терапевтическом процессе. Результаты лечения диабета в большой мере зависят от поведения больного, так как именно он изо дня в день реализует план контрольных и лечебных мероприятий, назначенных врачом. Известно, что 95% всей диабетологической помощи больные оказывают себе самостоятельно. Следование терапевтическому режиму при СД является трудной задачей. Технически сложные контрольные и лечебные мероприятия (инсулинотерапия, самоконтроль гликемии и т.д.) проводятся больным на повседневной основе и существенным образом затрагивают образ жизни (питание, физическая активность). Практика лечения диабета требует от больного многих специальных знаний и навыков, а также умения принимать решения медицинского характера. Например, как спланировать прием пищи, если больной вне дома, сколько инсулина вводить в конкретной ситуации, как купировать гипогликемию и т.д.
Для освоения таких умений необходима специальная подготовка с участием медицинских профессионалов - терапевтическое обучение больных. Принципиальной целью обучения является оказание терапевтического эффекта наряду с другими лечебными мероприятиями (фармакологическими и т.д.).
В 1998 г. был опубликован отчет рабочей группы ВОЗ, посвященный этому новому самостоятельному направлению в медицине. В нем приводится список заболеваний и состояний, при которых обучение составляет существенную часть терапевтического процесса СД; его последствия и коморбидные состояния (ожирение, АГ, ИБС, состояние после ампутации конечностей, почечная недостаточность, диализ) представляют его значительную часть.
Методологической основой обучения являются специально разрабатываемые структурированные программы. Структура программы подразумевает четкую регламентацию объема и определенную последовательность изложения. Для каждого раздела формулируются учебные цели и оговаривается необходимый набор наглядных материалов, а также педагогических приемов, направленных на усвоение, повторение и закрепление знаний и навыков.
В разработке структурированных программ участвуют специалисты-эндокринологи (диабетологи), имеющие подготовку в области терапевтического обучения больных СД. Желательно также участие педагогов и психологов. Программа обучения является универсальной моделью, позволяющей проводить адаптацию к условиям конкретного региона или медицинского учреждения. В процессе такой адаптации не должно возникать противоречий с рекомендациями ВОЗ и отечественными стандартами терапии СД.
Обучающие программы адресованы конкретному контингенту больных. Обучение проводится по структурированным программам отдельно для следующих категорий больных:
Важнейшей особенностью ведения больных СД является смещение акцента с традиционного «курсового» лечения больного в стационаре на длительное амбулаторное наблюдение. Пациент не может постоянно находиться под непосредственным медицинским контролем, он выполняет врачебные рекомендации самостоятельно. В данной ситуации обучение становится тем базисом, без которого эффективный контроль заболевания невозможен, причем рамки обучения расширяются и, помимо традиционной «школы», охватывают всю систему поликлинического ведения больного. Обучение не является изолированной частью медицинской помощи и должно проводиться при каждом контакте больного с обслуживающими его специалистами. Первостепенное значение для планирования обучения больных диабетом имеет оценка их индивидуальных потребностей, тогда как его содержание в целом определяется потребностями обслуживаемой популяции. Практическая реализация указанных рекомендаций возможна лишь силами медицинского персонала, подготовленного в области принципов обучения больных и стратегий изменения образа их жизни.
САХАРНЫЙ ДИАБЕТ 1-ГО ТИПА
Смирнова О.М., Кононенко И.В.
СД 1-го типа обусловлен деструкцией β-клеток поджелудочной железы, приводящей к абсолютному дефициту инсулина.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
По данным ряда эпидемиологических исследований, распространенность СД 1-го типа в общей популяции больных СД составляет 7-10%, а заболеваемость не превышает 40,0 на 100 000 населения соответствующего возраста, в основном среди детей до 15 лет. Распространенность СД 1-го типа в разных странах Европы существенно отличается. В России в 2015 г. зарегистрировано более 340 000 больных СД 1-го типа, что составляет около 8,5% общего количества больных СД (4,1 млн). Распространенность СД 1-го типа у детей выросла за последние 5 лет на 15,79%, у подростков - на 26,1%, у взрослых - на 16,9%. Ежегодный прирост распространенности СД 1-го типа у детей составил 3,14%, у подростков - 5,22% и несколько меньше у взрослых - 3,38%. Как и во всем мире, в России увеличение численности больных СД наблюдается в основном за счет лиц, страдающих СД 2-го типа.
ПРОФИЛАКТИКА
Ни один из известных методов лечения СД 1-го типа не позволяет излечивать больных. Поэтому единственный способ снижения заболеваемости СД 1-го типа - первичная профилактика болезни у лиц с высоким генетическим риском. Ее цель - предупреждение развития или замедление (блокирование) уже начавшейся аутоиммунной реакции против собственных β-клеток. Профилактику следует проводить тем лицам, у которых обнаруживают молекулярно-генетические маркеры (комбинации аллелей HLA-DQA1-DQB1). Выявление лиц в доклиническом периоде СД 1-го типа основано на определении иммунологических (аутоантител к различным структурам β-клетки) и гормонально-метаболических (уровень С-пептида, отсутствие ранней фазы секреции инсулина, определение HbA1C ) маркеров.
Выделяют три уровня профилактики.
-
Первичная проводится в группах высокого генетического риска, когда еще не разился аутоиммунный процесс в β-клетках. Чаще такие программы проводятся в популяциях с высокой частотой заболевания.
-
Вторичная проводится при появлении признаков инсулита, начавшейся аутоиммунной реакции.
-
Третичная: сохранение и восстановление секреции инсулина, а в дальнейшем отсрочка острых и хронических осложнений СД.
Современные подходы к профилактике включают следующее.
-
Исключение влияния экзогенных факторов: предупреждение внутриутробных вирусных инфекций, а также вирусных инфекций у детей и подростков (краснуха, корь, паротит, ветряная оспа и др.), исключение из рациона детей грудного возраста питательных смесей, изготовленных на основе коровьего молока или содержащих глютен; обогащение диеты дополнительными питательными веществами: докозагексаеновая кислота, витамин D.
-
Поддержание нормальной массы тела, увеличение физических нагрузок, что способствует уменьшению нагрузки на β-клетки и снижению инсулинорезистентности.
-
Антиген-специфическая терапия - создание иммунологической толерантности к собственным антигенам путем индуцирования регуляторных Т-клеток.
-
Антиген-неспецифическая терапия - от легкой иммуномодуляции до подавления иммунитета в целом.
-
Изучаются возможности влияния на процессы регенерации β-клеток. Однако многочисленные исследования показали, что эффективных методов профилактики данного заболевания, которые могли бы быть рекомендованы для широкого внедрения в клиническую практику, не существует. В связи с этим Американская диабетическая ассоциация не рекомендует проводить скрининг с целью выявления групп риска развития СД 1-го типа.
КЛАССИФИКАЦИЯ
Выделяют две формы СД 1-го типа: аутоиммунный и идиопатический.
Аутоиммунный сахарный диабет 1-го типа
Эта форма СД (прежние названия - инсулинзависимый диабет, диабет 1-го типа, диабет с ювенильным началом) - результат клеточно-опосредованной аутоиммунной деструкции β-клеток поджелудочной железы. Маркерами аутоиммунной деструкции β-клеток являются аутоантитела к различным антигенам β-клеток: к цитоплазматическим антигенам β-клеток, инсулину, глутаматдекарбоксилазе, тирозинфосфатазе островковых клеток α и β, к транспортерам цинка 8. Данные антитела определяются у 85-90% пациентов с типичным СД 1-го типа. Главными генетическими детерминантами СД 1-го типа являются гены HLA -комплекса [DRB1, DQA1 и DQB (гаплотипы DR3 и DR4)], кодирующие белки, вовлеченные в иммунный ответ. Лиц с высоким риском развития аутоиммунного типа СД выявляют по серологическим признакам аутоиммунного процесса в панкреатических островках, а также по генетическим маркерам. В детском возрасте утрата β-клеток происходит быстро, и уже к концу первого года заболевания остаточная эндокринная функция поджелудочной железы угасает. У детей и подростков манифестация заболевания протекает, как правило, с явлениями кетоацидоза. При развитии заболевания в возрасте старше 25 лет отмечают умеренную гипергликемию натощак, которая нередко при присоединении инфекции или стресса может быстро смениться выраженной гипергликемией или кетоацидозом.
Аутоиммунный диабет обычно начинается в детском и подростковом возрасте, но может развиться в любом возрасте, в том числе в старческом. Часто отмечают сочетание с другими аутоиммунными заболеваниями, такими как болезнь Грейвса, тиреоидит Хасимото, болезнь Аддисона, витилиго и пернициозная анемия.
Медленно прогрессирующий аутоиммунный диабет взрослых. Особый вариант течения СД 1-го типа у взрослых. Основными клиническими особенностями медленно прогрессирующего аутоиммунного СД взрослых являются возраст дебюта заболевания старше 30 лет, в дебюте клиническая картина СД 2-го типа и компенсация углеводного обмена может быть достигнута соблюдением диеты или приемом пероральных сахароснижающих препаратов, однако уже в первые годы заболевания, в среднем через 6 лет, развивается инсулинопотребность.
Основные диагностические критерии медленно прогрессирующего аутоиммунного СД взрослых, которые позволяют рассматривать его как вариант течения СД 1-го типа, следующие: присутствие аутоантител к антигенам β-клеток (чаще к глутаматдекарбоксилазе и/или цитоплазматическим антигенам β-клеток); низкий базальный и стимулированный уровень С-пептида; присутствие HLA-аллелей высокого риска СД 1-го типа.
Важность проблемы своевременной диагностики медленно прогрессирующего аутоиммунного СД взрослых заключается в том, что исходная клиническая картина заболевания, «маскирующегося» под СД 2-го типа, приводит к ошибочной диагностике и назначению пероральных сахароснижающих препаратов, вместе с тем основной патогенетически правильной тактикой лечения медленно прогрессирующего аутоиммунного СД взрослых является инсулинотерапия.
Идиопатический сахарный диабет 1-го типа
Данный тип СД упоминается в литературе под различными названиями: СД типа 1В, идиопатический СД, атипичный диабет, Flatbush-диабет, а позднее - СД 2-го типа, склонный к кетозу. Большинство больных африканского или азиатского происхождения. Заболевание характеризуется острым началом, выраженной гипергликемией в дебюте заболевания, развитием кетоацидоза, инсулинопении, однако затем наступает период ремиссии, и оптимальный уровень гликемии поддерживается при соблюдении диеты или приеме пероральных сахароснижающих препаратов. При этом у пациентов отсутствуют маркеры аутоиммунного поражения β-клеток - антитела к антигенам β-клеток. Данный подтип СД в 2-3 раза чаще встречается у мужчин среднего возраста с избыточной массой тела или ожирением.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Патогенетические механизмы аутоиммунного поражения β-клеток недостаточно ясны. СД 1-го типа - Т-клеточно-опосредованное тканеспецифическое аутоиммунное заболевание, основным патогенетическим звеном которого является возникновение аутоагрессивных Т-клеток. Это приводит к инфильтрации островков Лангерганса иммунокомпетентными клетками (инсулиту) и в итоге вызывает разрушение β-клеток с развитием абсолютной инсулиновой недостаточности.
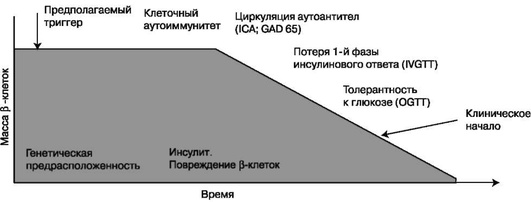
Несмотря на классическое острое начало заболевания, СД 1-го типа имеет длительный скрытый период, который может продолжаться в течение ряда лет. Согласно G.S. Eisenbarth (1989), выделяют шесть стадий этого процесса.
-
I стадия - генетическая предрасположенность, которая реализуется менее чем у половины однояйцовых близнецов и у 2-5% сибсов. Большое значение придают наличию антигенов HLA, особенно II класса (DR3, DR4, DQ). При этом риск развития СД 1-го типа возрастает многократно.
-
II стадия - гипотетический триггерный фактор (вирусная инфекция, стресс, характер питания, химические факторы).
-
III стадия - иммунные нарушения при сохранении нормальной секреции инсулина. Определяют иммунологические маркеры СД 1-го типа: аутоантитела к антигенам β-клеток, инсулину, глутаматдекарбоксилазе, тирозинфосфатазе островковых клеток α и β).
-
IV стадия - выраженные иммунные нарушения. Прогрессирующее снижение секреции инсулина вследствие развивающегося инсулита при нормальном уровне глюкозы в плазме крови.
-
V стадия - клиническая манифестация, которая развивается после гибели 80-90% массы β-клеток. При этом сохраняется остаточная секреция С-пептида.
Стадии развития СД 1-го типа представлены на рис. 10.1.
В настоящее время СД 1-го типа относят к многофакторным, полигенным заболеваниям. Проявление болезни определяется взаимодействием средовых и генетических факторов. Известно более 20 областей генома, связанных с развитием СД 1-го типа. Большинству из найденных областей присвоено название Insulin-Dependent Diabetes Mellitus и порядковый номер. Наибольший вклад вносят гены 2-го класса главного комплекса гистосовместимости - системы HLA (локус IDDM1). Среди остальных наиболее важными являются гены инсулина (INS ), рецептора цитотоксических Т-лимфоцитов (CTLA-4), тирозиновой фосфатазы (PNPN-22), выполняющие ключевую роль в координации иммунного ответа. Гены системы HLA располагаются на небольшом участке хромосомы 6. Примерно половина генетического риска может быть обусловлена продуктами генов комплекса HLA. Наследование предрасположенности к СД 1-го типа - сложный процесс, в передачу предрасположенности (или резистентности) к СД вовлечены несколько генов HLA-системы. Антигены класса II (HLA-DP, DR, DQ ) в норме представлены на поверхности некоторых клеток иммунной системы и играют основную роль в регуляции иммунного ответа. Доказано, что наличие ряда генов (локусы HLA-DQB1 и DRB1) прямо коррелирует с предрасположенностью к диабету (аллели DQB1*0302 и DRB1*0401). Вместе с этим обнаружены HLA-антигены, оказывающие протективное действие (аллель DOB1*0602) (табл. 10.8). При выявлении подобных антигенов развитие СД 1-го типа маловероятно.
Аллели, ассоциированные с риском развития СД 1-го типа |
|||
Высокий риск |
|||
DR3 |
DRB1*0301 |
DQA1*0501 |
DQB1*0201 |
DR4 |
DRB1*0401 |
DQA1*0301 |
DQB1*0302 |
Средний риск |
|||
DR1 |
DRB1*01 |
DQA1*0101 |
DQB1*0501 |
DR8 |
DRB1*0801 |
DQA1*0401 |
DQB1*0402 |
DR9 |
DRB1*0901 |
DQA1*0301 |
DQB1*0303 |
DR10 |
DRB1*1001 |
DQA1*0301 |
DQB1*0501 |
Протективные аллели |
|||
Сильная защита |
|||
DR2 |
DRB1*1501 |
DQA1*0102 |
DQB1*0602 |
DR5 |
DRB1*1101 |
DQA1*0501 |
DQB1*0301 |
Слабая защита |
|||
DR4 |
DRB1*0401 |
DQA1*0301 |
DQB1*0301 |
DR4 |
DRB1*0403 |
DQA1*030 |
DQB1*0302 |
DR7 |
DRB1*0701 |
DQA1*0201 |
DQB1*0201 |
Практически во всех исследованиях была доказана положительная корреляция между СД 1-го типа и генотипами DRB1*0401-DQA1*0301-DQB1*0302 и DRB1*0301-DQA1*0501-DQB1*0201, а также отрицательная корреляция между СД 1-го типа и генотипом DRB1*1501-DQA1*0102-DQB1*0602. Помимо этих, часто встречаемых HLA -гаплотипов, известны и другие, более редкие гаплотипы, ассоциированные с высоким риском развития СД 1-го типа.
Ген инсулина (INS ) (локус IDDM2), расположенный на хромосоме 11, определяет в различных популяциях от 5 до 15% семейного риска развития СД 1-го типа и вместе с локусом IDDM1 - около 40-60% семейного риска развития СД 1-го типа. Локус IDDM2 содержит собственно ген INS и полиморфной мини-сателлит, расположенный в 5'-концевой части этого гена, который называют 5'-VNTR. Результаты многочисленных исследований позволяют предположить, что наличие предрасполагающих аллелей VNTR I класса гена INS вызывают снижение экспрессии изоформ проинсулина в тимусе (но не в β-клетках), что снижает эффективность процесса центральной толерантности против всех возможных эпитопов инсулина, представляемых β-клетками.
Выделен ряд генов, контролирующих продукцию цитокинов (интерлейкина 1, фактора некроза опухолей), включающих механизмы деструкции, защиты и репарации β-клеток (IDDM8, IDDM9, IDDM10). Ген PTPN22 кодирует тирозиновую фосфатазу Т-лимфоцитов и подавляет активационный сигнал Т-клеточного рецептора. Локус IDDM12 содержит ген CTLA-4 (белок, активирующий цитотоксические T-лимфоциты).
II стадию СД 1-го типа характеризует воздействие на организм различных факторов внешней среды (триггеров), приводящих к развитию аутоиммунных процессов и инсулита. По мнению H. Kolb, триггерами могут быть как инфекционные, так и неинфекционные агенты.
Действие различных факторов внешней среды может быть установлено у 60% больных с впервые выявленным СД 1-го типа. Например, в ряде эпидемиологических исследований было показано, что раннее включение белков коровьего молока в питание новорожденных может служить фактором, запускающим аутоиммунный процесс и развитие СД. Наибольшее значение придают бычьему сывороточному альбумину, β-лактоглобулину и β-казеину, поскольку в момент манифестации СД 1-го типа антитела к этим белкам обнаруживают у большинства больных.
III стадию заболевания характеризует развитие иммунных нарушений при нормальной секреции инсулина. В крови могут быть обнаружены специфические аутоантитела к инсулину, белкам цитоплазмы, глутаматдекарбоксилазе, тирозинфосфатазе островковых клеток α и β, к белкам-транспортерам цинка 8. Это указывает на развитие активного аутоиммунного процесса. В III стадии отмечают нарушение функции β-клеток (обусловлено уменьшением их количества), отсутствие 1-й фазы секреции инсулина (диагностируют с помощью внутривенного глюкозотолерантного теста).
IV стадия заболевания - стадия выраженных иммунных нарушений (НТГ при отсутствии клинических признаков СД). При проведении ПГТТ выявляют повышение уровня глюкозы в плазме крови натощак или через 2 ч после нагрузки декстрозой (глюкозой♠ ).
На V стадии наблюдают клинические проявления заболевания, поскольку к этому моменту основная масса β-клеток (более 80%) погибла. Остаточная секреция С-пептида, играющая важную роль в метаболизме, сохраняется в течение последующих лет. Клинические проявления болезни отражают степень инсулиновой недостаточности.
Начало последней, VI стадии характеризует полная утрата функции β-клеток. Не выявляют даже базальный уровень С-пептида. Титры антител могут быть снижены. В этой стадии течение СД обычно становится менее контролируемым.
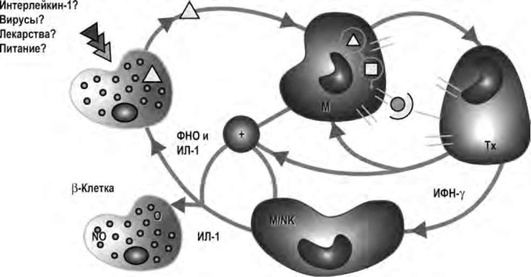
Согласно современным представлениям о патогенезе СД 1-го типа, высказывается предположение, что гибель β-клеток при СД возникает под действием различных патологических процессов. Один из них - деструкция или некроз β-клеток в результате аутоиммунного процесса. Эта модель патогенеза была предложена J. Nerup и получила название «копенгагенская модель». Согласно этой концепции, под действием факторов внешней среды в β-клетках при наследственной предрасположенности организма к СД активируется свободно-радикальное окисление, сопровождающееся высвобождением высокотоксичных свободных радикалов в избыточном количестве. Свободные радикалы кислорода, оксида азота, гидроксильные радикалы вызывают денатурацию белков β-клеток. В результате этого β-клетки погибают, а измененные белки, попадая в кровь, становятся аутоантигенами. В крови они поглощаются макрофагами; затем происходит запуск реакций иммунной системы с активацией Т-лимфоцитов, В-лимфоцитов, естественных киллеров (NK), дополнительным выбросом интерлейкина 1, γ-интерферона, фактора некроза опухолей. Это приводит к повреждению новых β-клеток. При этом J. Nerup отмечает, что для β-клеток характерна уязвимость к действию свободных радикалов и слабость антиоксидантной ферментной защиты (рис. 10.2).
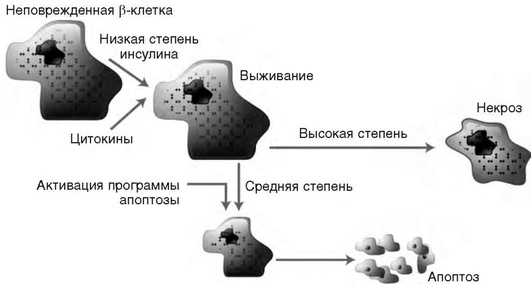
Второй возможный механизм повреждения и разрушения ß-клеток - усиление процессов апоптоза с участием цитокинов (интерлейкин 1, фактор некроза опухолей, интерферон γ), которые секретируются в островках активированными Т-лимфоцитами. Апоптоз - процесс генетически запрограммированной гибели клеток, служащий для поддержания гомеостаза в клеточных системах и обеспечивающий функционирование определенной массы клеток. Гибель клеток путем апоптоза происходит во всех тканях. Если процессы некроза ткани вызываются ишемией или физическими, химическими или другими факторами, то процессы апоптоза регулируются генами. Роль апоптоза в патогенезе СД 1-го типа в настоящее время активно изучают (рис. 10.3). Дальнейшее исследование патогенетических механизмов развития СД 1-го типа необходимо для разработки перспективных направлений лечения и профилактики данного заболевания.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические проявления СД 1-го типа достаточно типичны. Больные жалуются на сухость во рту, жажду, полиурию, повышение аппетита, похудание, слабость, кожный зуд, повышенную подверженность инфекционным заболеваниям, снижение либидо и потенции, изменение остроты зрения. При обследовании выявляют гипергликемию и глюкозурию. Гипергликемия обусловлена снижением утилизации глюкозы периферическими тканями вследствие недостатка инсулина. Гипергликемия, в свою очередь, приводит к глюкозурии. Известно, что глюкоза полностью реабсорбируется в канальцах почек при ее концентрации в плазме крови до 10 ммоль/л. Превышение этого порога приводит к выведению глюкозы с мочой. Полиурия, обычно сопровождающая высокую глюкозурию, - следствие осмотического диуреза. Сухость во рту и жажда связаны с обезвоживанием организма вследствие избыточного выделения жидкости через почки, а также с повышением содержания в крови глюкозы, мочевины, натрия.
Снижение массы тела при декомпенсированном СД обусловлено усилением процессов липолиза и выведением глюкозы с мочой. Потеря веса - признак, патогномоничный для СД 1-го типа (при СД 2-го типа обычно наблюдается избыточная масса тела). Значительная потеря массы тела особенно характерна для детей.
Механизм развития клинических проявлений острой недостаточности инсулина, помимо нарушения углеводного обмена, включает дисбаланс белкового и жирового обменов. Это приводит к гипераминоацидемии, гиперлипидемии и кетоацидозу. Дефицит инсулина стимулирует глюконеогенез и гликогенолиз, а также подавляет гликогеногенез в печени.
Гиперлипидемия проявляется повышением содержания холестерина, неэстерифицированных жирных кислот, триглицеридов, липопротеинов. Повышенное поступление липидов в печень, где они усиленно окисляются, приводит к увеличению продукции кетоновых тел и гиперкетонемии.
Накопление кетоновых тел (ацетона, β-оксимасляной и ацетоуксусной кислот) вызывает ДКА, уменьшение рН и развитие тканевой гипоксии. Прогрессирование метаболических нарушений, обусловленное дефицитом инсулина, усиливает тканевую дегидратацию, гиповолемию, гемоконцентрацию с тенденцией к развитию синдрома диссеминированного внутрисосудистого свертывания, гипоксии и отеку коры головного мозга и в конечном итоге развитию диабетической комы.
Характерны острое начало симптоматики («дебют» заболевания) и быстрое развитие выраженных метаболических нарушений. В 20% случаев заболевание впервые проявляется диабетической комой или тяжелым ацидозом.
Многие больные не ощущают проявлений высокого уровня глюкозы в плазме крови. Однако те из них, у которых отмечают прогрессирующее повышение этого показателя, предъявляют жалобы на слабость, тяжесть в голове, нарушение зрения. Причина снижения остроты зрения - набухание хрусталика и слабость аккомодации, вызванные гипергликемией. Полиурия и жажда, обусловленные высоким содержанием глюкозы в плазме крови, наблюдаются далеко не у каждого больного с декомпенсацией обмена веществ.
По состоянию кожи и слизистых оболочек можно в определенной степени судить о состоянии обменных процессов. При выраженной декомпенсации кожа, губы, язык сухие; тургор поджкожно-жировой клетчатки снижен. При СД 1-го типа из-за паретического расширения капилляров кожи лица наблюдают диабетический рубеоз (гиперемия щек, подбородка, лба). При СД 2-го типа часто наблюдают ксантоматоз как следствие гиперлипидемии. Иногда на передней поверхности голеней развиваются липоидный некробиоз кожи, диабетические пузыри на кистях рук и стопах (к 1987 г. в литературе было описано 60 случаев развития диабетических пузырей).
Нередко отмечают витилиго, пигментацию на голенях (диабетическая дермопатия или «пигментная голень»). Трофические язвы голеней и стоп - следствие тяжелой ангиопатии и нейропатии. Обычно они развиваются при длительном и плохо компенсированном СД. Частый признак СД - наличие различных кожных инфекций. Наиболее характерно развитие фурункулеза, остиофолликулита, панарициев, паронихий. Нередки различные грибковые поражения слизистых оболочек и ногтей. При СД чаще, чем в общей популяции, диагностируют такие кожные заболевания, как эритразма, кандидозы, глубокие микозы, отрубевидный лишай и др.
Преобладание катаболических процессов при СД приводит к нарушению белковой матрицы скелета, вымыванию кальция из костей и развитию остеопороза. Эти процессы редко становятся клинически выраженными. Своеобразная форма костно-суставной патологии - диабетическая остеоартропатия, в основе которой лежат нейрогенные изменения в хрящах и костной ткани.
Среди больных СД отмечают более частое развитие туберкулезного процесса. Два этих заболевания взаимно отягощают друг друга. При наличии туберкулеза больные нуждаются в пожизненном наблюдении у фтизиатра, поскольку на фоне измененного иммунитета возможны частые обострения.
Вследствие снижения иммунитета у этих пациентов чаще развиваются острые респираторные заболевания, пневмонии, нередко отмечают их затяжное течение и хронизацию.
При СД чаще диагностируют ИБС и АГ. Инфаркт миокарда (часто безболевого течения) - причина смерти почти половины больных СД.
Прогрессирующий кариес, пародонтоз, альвеолярная пиорея, гингивиты могут быть первыми признаками диабета. В свою очередь, воспалительные заболевания органов и тканей ротовой полости значительно ухудшают течение диабета. Функция слюноотделения, состояние зубов и микрофлоры полости рта играют важную роль в компенсации СД.
Диабетическая энтеропатия - гастроинтестинальная форма автономной нейропатии, обусловленная поражением вегетативной нервной системы (пре- и паравертебральных ганглиев и мезентериального сплетения). Недостаточная компенсация обменных процессов приводит к развитию жирового гепатоза. Функциональные печеночные пробы при этом меняются незначительно. Этот процесс обратим в случае адекватной компенсации метаболизма. Гипотония и гипокинезия желчного пузыря, запоры - типичные проявления СД.
СД часто сопровождают инфекционные заболевания почек и мочевыводящих путей, атония мочевого пузыря. Предрасположенность к мочевой инфекции - следствие снижения иммунитета и развития автономной нейропатии.
При выраженной длительной декомпенсации СД нередко наблюдают снижение фертильности у молодых женщин и нарушение роста у детей.
Острые осложнения СД - диабетическая кетоацидотическая, гиперосмолярная (некетонемическая) и лактатацидотическая комы.
Изменения венул, артериол и капилляров при длительном течении СД получили название диабетических микроангиопатий. Диабетическая ретинопатия - специфическое поражение сосудов сетчатки, характеризующееся развитием микроаневризм, кровоизлияний и пролиферацией эндотелиальных клеток. В поздней стадии эти изменения приводят к слепоте. ДН - специфическое поражение сосудов почек, развивающееся через 5 и более лет от начала заболевания и характеризующееся протеинурией, гипертонией с развитием в последующем ХПН. Диабетическая нейропатия - специфическое поражение нервной системы: симметричное множественное поражение периферических нервов или поражение одного или нескольких нервных стволов (мононейропатия). Выделяют также автономную нейропатию (кардиоваскулярная, урогенитальная и гастроинтестинальная формы).
В развитии поздних осложнений СД основную роль играют компенсация углеводного обмена и генетическая предрасположенность к развитию заболевания.
После начала лечения инсулином примерно у 80% детей и подростков с СД 1-го типа временно уменьшается потребность в инсулине - ремиссия, или «медовый месяц». В настоящее время ремиссией считается состояние, когда суточная потребность в инсулине составляет менее 0,5 Ед/кг массы тела, а концентрация HbA1C менее 7%. Частичная ремиссия может длиться от нескольких недель до полугода, редко в течение 1 года и более.
ДИАГНОСТИКА
Гипергликемия - главный лабораторный признак СД. В типичных случаях диагностика не вызывает трудностей. Яркая клиническая картина заболевания и повышение уровня глюкозы в плазме крови в любое время суток более 11,1 ммоль/л позволяют безошибочно диагностировать СД 1-го типа. Однако при отсутствии выраженной симптоматики или при обследовании лиц в группе риска необходимы другие подходы. Во всем мире общеприняты критерии диагностики СД, предложенные экспертами ВОЗ в 1999-2006 гг. (см. табл. 10.1).
Глюкозурия. В норме у здорового человека глюкоза в моче не определяется. Глюкозурия возникает при уровне гликемии, превышающем почечный порог (в среднем 8-10 ммоль/л). Выявление глюкозурии у ребенка, даже случайное, всегда должно ориентировать врача на исключение СД и исследование содержания глюкозы в крови. Диагноз СД при обнаружении глюкозурии может считаться достоверным только после выявления гипергликемии. Наличие глюкозурии при нормальном уровне глюкозы в крови возможно при болезни почек, синдроме Фанкони и других состояниях.
Кетоны. Повышение концентрации кетоновых тел в крови и появление кетоновых тел в моче свидетельствуют о тяжелой декомпенсации углеводного обмена, связанной с недостатком инсулина, и, как правило, наблюдаются в дебюте заболевания. При отсутствии нарушений углеводного обмена кетононурия может развиваться при инфекционных заболеваниях, протекающих с высокой температурой, при рвоте, голодании, особенно у детей раннего возраста.
Фруктозамин. Для диагностики СД не используется. Отражает состояние углеводного обмена за последние 3-4 нед. Используется на практике у людей с нарушением времени выживания эритроцитов либо при необходимости быстрой оценки эффективности изменения терапии.
Антитела к антигенам β-клеток (цитоплазматическим антигенам β-клеток, глутаматдекарбоксилазе, инсулину, тирозинфосфатазе островковых клеток, транспортерам Zn8) - иммунологические маркеры аутоиммунного инсулита. Их обнаружение используют для ранней доклинической диагностики СД 1-го типа в группах высокого генетического риска либо для проведения дифференциального диагноза между СД 1-го типа и другими типами. При наличии классических симптомов СД 1-го типа и установленном диагнозе диабета (согласно критериям ВОЗ) определять данные антитела нет необходимости. Отсутствие антител не противоречит диагнозу СД 1-го типа, так как наблюдается у 20% больных при манифестации заболевания.
С-пептид - позволяет оценить функциональное состояние β-клеток у лиц с высоким риском развития СД, при дифференциальной диагностике СД 1-го и 2-го типа. При СД 1-го типа уровень С-пептида снижен или не определяется. После стимуляции декстрозой (глюкозой♠ ) или глюкагоном уровень С-пептида при СД 1-го типа не повышается, а при СД 2-го типа значительно возрастает.
В сложных случаях для установления диагноза определяют содержание иммунологических, генетических маркеров СД 1-го типа и уровень С-пептида.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
До настоящего времени проблема дифференциальной диагностики СД в период его дебюта остается актуальной. Более чем у 80% детей диабет диагностируется в состоянии кетоацидоза. Анализ историй болезни выявил большое разнообразие диагнозов, поставленных детям при первом обращении к врачу (маскировавших дебют СД 1-го типа):
-
хирургическая патология (острый аппендицит, кишечная непроходимость, «острый живот»);
-
инфекционные заболевания (грипп, пневмония, менингит, бронхиальная астма);
-
заболевания ЖКТ (пищевая токсикоинфекция, гастроэнтерит, дискинезия желчевыводящих путей);
-
заболевания нервной системы (вегетососудистая дистония, переутомление);
Острое начало, яркие клинические проявления, абсолютное преобладание заболевания в детском и юношеском возрасте в большинстве случаев позволяют правильно поставить диагноз СД 1-го типа. Однако при постепенном и медленном развитии заболевания, особенно у взрослых, необходимо проводить дифференциальный диагноз между СД 1-го типа, СД 2-го типа и MODY (табл. 10.9) с привлечением генеалогического, генетического анализа и дополнительных методов исследования.
| Признак | СД 1-го типа | СД 2-го типа |
|---|---|---|
Распространенность |
7-10% |
90-93% |
Наследственная предрасположенность |
Не характерна |
Характерна |
Масса тела |
Чаще снижена |
Чаще повышена |
Характер начала заболевания |
Обычно быстрое развитие симптомов |
Обычно незаметное, медленное |
Возраст пациента при манифестации заболевания |
Чаще 15-24 года |
Чаще >40 лет |
Симптоматика |
Резко выражена |
Выражена слабо |
Уровень инсулина/С-пептида в крови |
Низкий/отсутствует |
Вначале повышен |
Количество инсулиновых рецепторов |
В норме |
Снижено |
Ассоциация с HLA-гаплотипами |
Обычно есть |
Обычно нет |
Аутоантитела к антигенам ß-клеток |
Определяются |
Отсутствуют |
Риск кетоацидоза |
Высокий |
Низкий |
Инсулинорезистентность |
Нет |
Есть |
Ответ на терапию пероральными сахароснижающими препаратами |
Отсутствует |
Чаще имеется |
Потребность в инсулине |
Жизненная |
Вначале обычно отсутствует, затем развивается |
ПОКАЗАНИЯ К ГОСПИТАЛИЗАЦИИ
ЛЕЧЕНИЕ
Цели лечения СД - сохранение жизни, устранение симптомов заболевания, профилактика острых и хронических осложнений, снижение смертности.
Заместительная пожизненная инсулинотерапия является единственным методом лечения СД 1-го типа. Питание и физическая активность лишь учитываются для коррекции дозы инсулина. При отсутствии необходимой адекватной инсулинотерапии при СД 1-го типа развивается диабетическая кома. Другая важная цель лечения СД - это не просто устранение симптомов заболевания, а достижение уровня углеводного обмена, максимально близкого к нормальному состоянию углеводного обмена. Именно оптимальный контроль состояния углеводного обмена составляет основу профилактики и лечения диабетических осложнений. Обязательный принцип лечения каждого больного СД 1-го типа - обучение и самоконтроль, т.е. умение пациента самостоятельно определять и регулировать уровень глюкозы крови.
Цели и приоритеты лечения необходимо определять индивидуально с учетом возраста больных, предполагаемой продолжительности жизни, наличия сопутствующих заболеваний и хронических осложнений СД, способности и желания пациента к самоконтролю и обучению (см. табл. 10.2-10.6).
Заместительная инсулинотерапия - единственный метод лечения СД 1-го типа в условиях абсолютного дефицита инсулина. В клинической практике используют разные виды инсулинов. Следует помнить, что в России применяют только генно-инженерные инсулины человека или аналоги инсулина человека. Препараты свиного инсулина и человеческого полусинтетического инсулина в настоящее время запрещены.
Инсулинотерапию всегда назначает врач. Он подбирает вид инсулина и его дозу. При лечении СД 1-го типа используют базис-болюсный принцип инсулинотерапии, включающий множественные инъекции инсулина. Цель такого способа введения инсулина - имитация выделения гормона нормальной поджелудочной железой в течение суток. Режим секреции инсулина у здорового человека хорошо изучен. Доказано, что в разное время суток организму необходимо различное количество инсулина. На практике такой режим осуществляют введением ИСД или ИДД (1-2 инъекции) в сочетании с инъекциями ИКД или ИУКД (перед основными приемами пищи).
Дозу инсулина подбирают ориентировочно, но обязательно под контролем уровня глюкозы в плазме крови натощак и через 2 ч после еды. Обычно перед завтраком и обедом назначают 2/3 суточной дозы инсулина; перед ужином и сном - по 1/3 суточной дозы. Средняя суточная потребность в инсулине может колебаться в достаточно широких пределах (табл. 10.10). Коррекция дозы инсулина должна осуществляться ежедневно с учетом данных самоконтроля гликемии в течение суток и количества углеводов в пище, до достижения индивидуальных целевых показателей углеводного обмена. Не существует ограничений в дозе инсулина.
| Дебют СД | «Медовый месяц» | Длительное течение СД | Декомпенсация (кетоацидоз) | Препубертат | Пубертат |
|---|---|---|---|---|---|
0,5-0,6 |
<0,4 |
0,7-0,8 |
1,0-1,5 |
0,6-1,0 |
1,0-2,0 |
Характеристика препаратов инсулина представлена в главе 4.
Рекомендации по питанию
Общее потребление углеводов при СД 1-го типа не должно отличаться от такового у здорового человека. Необходима оценка усваиваемых углеводов по системе ХЕ для коррекции дозы инсулина перед едой. Ориентировочная потребность в ХЕ в сутки в зависимости от образа жизни и ежедневных физических нагрузок у взрослых представлена в табл. 10.11.
Физические нагрузки
Люди с дефицитом массы тела, выполняющие тяжелый физический труд |
25-30 ХЕ |
Люди, выполняющие среднетяжелую работу с нормальным весом |
20-22 ХЕ |
Люди с сидячей работой |
15-18 ХЕ |
Малоподвижные пациенты с умеренно избыточным весом |
12-14 ХЕ |
Пациенты с избыточным весом |
10 ХЕ |
Пациенты с ожирением |
6-8 ХЕ |
Риск гипогликемий индивидуален и зависит от исходной гликемии, дозы инсулина, вида, продолжительности и интенсивности физической активности, а также степени тренированности пациента. Правила профилактики гипогликемии являются ориентировочными и должны адаптироваться каждым пациентом эмпирически. Во время физической активности нужно иметь при себе углеводы в большем количестве, чем обычно: не менее 4 ХЕ при кратковременной и до 10 ХЕ при длительной физической активности. Больным СД 1-го типа, проводящим самоконтроль и владеющим методами профилактики гипогликемий, можно заниматься любыми видами физической активности, в том числе спортом, с учетом следующих противопоказаний и мер предосторожности.
Временные противопоказания к физической активности:
-
уровень глюкозы плазмы выше 13 ммоль/л в сочетании с кетонурией или выше 16 ммоль/л, даже без кетонурии (в условиях дефицита инсулина физическая активность будет усиливать гипергликемию);
-
гемофтальм, отслойка сетчатки, первые полгода после лазеркоагуляции сетчатки; неконтролируемая АГ; ИБС (по согласованию с кардиологом).
Ведение больных
Разработан алгоритм обследования для больных СД 1-го типа. При отсутствии сосудистых осложнений стандартное обследование проводят по схеме, представленной в табл. 10.12.
| Показатель | Частота обследования |
|---|---|
Самоконтроль гликемии |
Не менее 4 раз ежедневно |
HbA1C |
1 раз в 3 мес |
Непрерывное мониторирование уровня глюкозы крови |
По показаниям |
Общий анализ крови |
1 раз в год |
Общий анализ мочи |
1 раз в год |
Микроальбуминурия |
1 раз в год |
Биохимический анализ крови (белок, общий холестерин, холестерин ЛПВП, холестерин ЛПНП, триглицериды, билирубин, АСТ, АЛТ, мочевина, креатинин, калий, натрий, расчет СКФ) |
1 раз в год (при отсутствии изменений) |
Контроль АД |
При каждом посещении врача. При наличии АГ самоконтроль 2-3 раза в день |
ЭКГ |
1 раз в год |
Осмотр ног и оценка чувствительности |
Не реже 1 раза в год, по показаниям чаще |
Проверка техники и осмотр мест инъекций инсулина |
Не реже 1 раза в 6 мес |
Осмотр офтальмолога (офтальмоскопия с широким зрачком) |
1 раз в год, по показаниям чаще |
Консультация невролога |
По показаниям |
Рентгенография органов грудной клетки |
1 раз в год |
При появлении признаков хронических осложнений СД, присоединении сопутствующих заболеваний, появлении дополнительных факторов риска вопрос о частоте обследований решают индивидуально.
Прогноз
За последние годы (2007-2012) изменилась демографическая ситуация среди больных СД 1-го типа в России: увеличилась средняя продолжительность жизни больных СД 1-го типа: мужчин - до 56,7 лет (±3,8 года), женщин - до 60,8 лет (±4,1 года). Прогноз СД 1-го типа в определенной степени зависит от возраста дебюта заболевания и степени компенсации углеводного обмена. Данные, полученные за последние десятилетия, дают оптимистические предпосылки. Разработаны практически совершенные препараты инсулина и средства их введения, средства для самоконтроля. Доказана возможность поддержания организма больного в состоянии компенсации практически в течение всей его жизни, а это залог успешной борьбы с возникновением сосудистых осложнений.
В частности, убедительные результаты были представлены в американском многоцентровом исследовании по контролю диабета и его осложнениям - Diabetes Control and Complications Trial, законченном в 1993 г. Оно продолжалось 10 лет, в нем участвовал 1441 пациент с СД 1-го типа. Пациенты были разделены на две группы. Одним пациентам назначалась традиционная инсулинотерапия, а другим - интенсивная. Целью традиционной терапии была клиническая компенсация - отсутствие симптомов гипергликемии, кетонурии, частых и тяжелых гипогликемий. Достигалось это за счет одной или двух инъекций инсулина, не очень частого самоконтроля гликемии, обучения принципам диеты. При интенсивной терапии преследовались те же клинические цели, а кроме того, поддержание гликемии, максимально приближенной к уровню здоровых людей. Интенсивная терапия предусматривала режим многократных инъекций инсулина (три и более в день) или использование носимого дозатора инсулина (помпы), частый (четыре и более раз в день) самоконтроль гликемии, обучение больных принципам самостоятельной адаптации доз инсулина. На протяжении всего исследования уровень HbA1C в группе интенсивного лечения поддерживался на уровне, близком к 7%, тогда как в группе с традиционной инсулинотерапией он был около 9%. Было показано, что интенсифицированная инсулинотерапия и близкая к нормальной гликемия позволяют предотвратить или затормозить развитие:
Результаты последующего 30-летнего наблюдения (исследование Epidemiology of Diabetes Interventions and Complications) за исходной когортой больных показали, что пациенты, достигшие в исследовании Diabetes Control and Complications Trial HbA1C менее 7%, даже спустя 18 лет после завершения данного исследования, уже при отсутствии интенсивного контроля гликемии, имели на 46% ниже риск прогрессирования ретинопатии, на 39% ниже риск микроальбуминурии и 61% более низкий риск макроальбуминурии, чем пациенты с традиционной инсулинотерапией в первые годы заболевания. Отмечалось, в частности, снижение риска развития пролиферативной ретинопатии на 47%, на 35% - снижение риска клинически значимого отека макулы, на 39% - риска фокальной лазерной терапии и на 48% - любой глазной хирургии. Данные результаты убедительно указывают на то, что интенсивная терапия в первые годы заболевания может иметь устойчивое, долгосрочное влияние на развитие осложнений СД.
САХАРНЫЙ ДИАБЕТ 2-ГО ТИПА
Майоров А.Ю., Суркова Е.В.
ОПРЕДЕЛЕНИЕ
СД 2-го типа - форма заболевания, обусловленная резистентностью к инсулину и/или его недостаточностью.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
В общей структуре заболевания СД 2-го типа составляет 90-95%. Именно этот тип диабета составляет подавляющее большинство из 382 млн больных диабетом во всем мире. Высокая и постоянно растущая распространенность СД 2-го типа расценивается экспертами ВОЗ как эпидемия неинфекционного заболевания. Усугубляет ситуацию то, что фактическая распространенность в 2-3 раза превышает регистрируемую «по обращаемости». Увеличение распространенности СД 2-го типа обусловлено прежде всего резкими переменами в образе жизни современного человека (переедание, гиподинамия) и лежащими в их основе социально-экономическими процессами. Наиболее бурный рост заболеваемости СД 2-го типа наблюдают среди населения развивающихся стран, а также в популяциях этнических меньшинств с низким уровнем дохода в индустриально развитых странах. Самые высокие показатели зарегистрированы среди индейцев Пима в штате Аризона, США и урбанизированных микронезийцев Науру (до 50% взрослого населения). В европейских популяциях распространенность СД 2-го типа составляет 3-8% (вместе с нарушенной толерантностью к глюкозе - 10-15%). Среди белого населения США сохраняется примерно тот же уровень распространенности, а среди черного он достигает 30%. СД 2-го типа редко встречается в некоторых популяциях Океании, Восточной Африки и Южной Америки, а также среди коренного населения Севера. В России в 2015 г. зарегистрировано более 3,7 млн больных СД 2-го типа.
ПРОФИЛАКТИКА
Профилактика СД 2-го типа наиболее актуальна для лиц с избыточной массой тела и с условно выделяемой категорией - «предиабетом», которая включает нарушенную толерантность к глюкозе и нарушенную гликемию натощак. Согласно рекомендациям ведущих диабетологических ассоциаций, этой группе пациентов показано снижение массы тела и увеличение физической активности. В качестве ЛС, способных предотвратить или отсрочить развитие СД 2-го типа, рассматривают метформин и ингибиторы α-глюкозидаз. Однако сегодня ни один препарат не показан для широкого использования для профилактики данного заболевания.
СКРИНИНГ
Состоит в оценке степени риска заболевания и определении уровня гликемии, последовательно или одновременно. К группам повышенного риска развития СД 2-го типа относятся пациенты с избыточной массой тела и ожирением, привычно низкой физической активностью, сердечно-сосудистыми заболеваниями, отягощенным анамнезом (родители или сибсы с СД 2-го типа), женщины с ГСД или рождением крупного плода в анамнезе, лица с предшествовавшими нарушениями углеводного обмена.
Лица, у которых скрининговое исследование выявляет повышенный уровень гликемии, подлежат дополнительному диагностическому обследованию с повторным определением гликемии натощак и/или проведением ОГТТ.
При выборе стратегии скрининга должны быть учтены имеющиеся в конкретном регионе ресурсы.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этот тип заболевания ранее называли инсулиннезависимым СД, а также СД взрослых. В основе СД 2-го типа лежит резистентность к инсулину и его недостаточность (чаще относительная, чем абсолютная). В большинстве случаев в начале заболевания, а часто и на протяжении жизни больные не нуждаются в инсулинотерапии по жизненным показаниям. Этиология и патогенез СД 2-го типа до конца еще не изучены. Наследственная предрасположенность отмечается при СД 2-го типа намного чаще, чем при СД 1-го типа. Однако генетика этого типа СД сложна и пока четко не определена. В будущем можно ожидать выявления специфических процессов и генетических дефектов, лежащих в основе этого заболевания. Одновременное существование двух фундаментальных патогенетических факторов, характерных для СД 2-го типа: инсулинорезистентности и нарушения инсулин-секретирующей функции β-клеток поджелудочной железы. Большинству больных СД 2-го типа свойственна избыточная масса тела (ожирение), что и является основной причиной развития инсулинорезистентности. Инсулинорезистентность также возможна у лиц с нормальной массой тела, но избыточным абдоминальным отложением жира. При СД 2-го типа аутоиммунной деструкции β-клеток не происходит. Больные СД 2-го типа могут иметь нормальный или даже повышенный уровень инсулина в крови, для них характерен недостаточный инсулиновый ответ на гипергликемию. Секреция инсулина у этих больных неполноценна и не может компенсировать инсулинорезистентность. Резистентность к инсулину может уменьшиться в результате снижения веса и/или лечения гипергликемии, однако она редко восстанавливается до нормы. Инсулинорезистентность увеличивается с возрастом, а также при нарастании массы тела и снижении физической активности. Заболевание чаще развивается у женщин с СД беременных в анамнезе и у лиц с АГ и дислипидемией.
КЛИНИЧЕСКАЯ КАРТИНА
СД 2-го типа характеризуется наличием длительной бессимптомной доклинической стадии развития и часто остается недиагностированным из-за отсутствия каких-либо видимых проявлений. Ко времени установления диагноза более чем у половины пациентов уже имеется одно или более осложнений. Так, например, частота ретинопатии на момент установления диагноза колеблется от 20 до 40%. Поскольку ретинопатия развивается по мере увеличения продолжительности диабета, предполагается, что СД 2-го типа может возникнуть даже за 10-12 лет до установления клинического диагноза.
Клинические симптомы, обусловленные выраженной гипергликемией и дефицитом инсулина, обычно сводятся к тому же комплексу, что и при СД 1-го типа: полиурия (в том числе в ночное время), жажда, полидипсия, снижение массы тела, сухость во рту, а также такие неспецифические симптомы, как слабость, утомляемость. Лабораторные симптомы: гипергликемия, глюкозурия, редко кетоновые тела в моче в небольших концентрациях.
У больных СД 2-го типа наряду с признаками нарушения углеводного обмена часто отмечают ожирение или избыточный вес (в 80-90% случаев), АГ, снижение зрения, неврологические нарушения, ИБС.
Проявления микро- и макроангиопатии, а также кожный зуд, фурункулез, грибковые инфекции, боли в ногах, импотенция могут стать причиной первого обращения больного к врачу.
Нередко СД 2-го типа впервые выявляют у больных с инфарктом миокарда или инсультом.
Иногда первым проявлением СД 2-го типа может оказаться гиперосмолярная кома. Спонтанное развитие ДКА отмечают редко; обычно он является следствием тяжелого интеркуррентного заболевания.
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ
Поскольку диагноз СД ставится по абсолютному уровню гликемии, дифференциальный диагноз может быть только между различными типами СД (см. классификацию).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Для больных без осложнений консультации офтальмолога (прямая офтальмоскопия с расширенным зрачком), кардиолога, невролога показаны ежегодно. При имеющихся осложнениях осмотры перечисленных специалистов более частые (по показаниям).
ЛЕЧЕНИЕ
Основные принципы лечения сахарного диабета 2-го типа
Показания к госпитализации
Модификация образа жизни
Имеются многочисленные данные об эффективности рационального питания и физической активности в качестве средств профилактики и лечения СД 2-го типа.
В Британском проспективном исследовании СД 2-го типа United Kingdom Prospective Diabetes Study раннее обучение пациентов правильному питанию оказалось весьма эффективным способом добиться уменьшения уровня гликемии вскоре после установления диагноза. Некоторым больным удалось поддерживать желаемую концентрацию глюкозы в плазме крови на протяжении длительного периода исключительно посредством модификации диеты.
Важно отметить, что стоимость обучения, имеющего одной из целей побудить больного изменить образ жизни, в целом невелика, в том числе и потому, что, в отличие от медикаментозной терапии, оно проводится не на постоянной основе, а с интервалами. Основная часть этой работы не требует бюджетного финансирования, поскольку переход на более здоровый режим питания, интенсификация физической активности реализуются самими пациентами. Однако необходимо принимать во внимание, что изменение образа жизни больного диабетом и следование ему представляет собой чрезвычайно трудную задачу. Многим больным не удается сохранить эти изменения на протяжении длительного времени. Кроме того, следует иметь в виду, что эффективность перечисленных мер зависит от сопутствующих изменений режима медикаментозной терапии.
Рациональное питание
Рекомендуется в общении с пациентами постепенно переходить от терминов «диета» или «диетотерапия» к другим, отражающим принадлежность питания к важнейшим составляющим образа жизни. Примерами могут являться «рациональное питание», «пищевой план», «питание, ориентированное на терапевтические цели».
Эффективное лечение СД 2-го типа невозможно без правильной организации питания, независимо от того, получает больной дополнительно какие-либо сахароснижающие средства (в том числе инсулин) или нет. Питание больного СД 2-го типа должно быть направлено на оптимизацию массы тела (для 80-90% больных СД 2-го типа, имеющих избыток массы, - ее снижение) и предотвращение постпрандиальной (т.е. после приема пищи) гипергликемии. Многочисленными исследованиями доказано, что у большой части больных умеренное снижение массы тела (на 5-10% от исходной) позволяет достичь устойчивой компенсации углеводного обмена, уменьшить инсулинорезистентность, а также получить положительный эффект в отношении часто сопутствующих АГ и дислипидемии.
Ниже представлены основные принципы питания при СД 2-го типа.
-
Питание должно быть частью терапевтического плана и способствовать достижению метаболических целей при любом варианте медикаментозной сахароснижающей терапии. В то же время, поскольку питание является важной составляющей образа жизни и оказывает сильное влияние на качество жизни, при формировании рекомендаций по питанию должны учитываться персональные предпочтения.
-
В целом речь идет не о жестких диетических ограничениях, которые трудно реализовать на долгосрочной основе, а о постепенном формировании стиля питания, отвечающего актуальным терапевтическим целям.
-
Всем пациентам с избыточной массой тела/ожирением рекомендуется ограничение калорийности рациона с целью умеренного снижения массы тела. Это обеспечивает положительный эффект в отношении гликемического контроля, липидов и АД, особенно в ранний период заболевания.
-
Достижение снижения массы тела наиболее эффективно при одновременном применении физических нагрузок и обучающих программ.
-
Резкие, нефизиологические ограничения в питании и голодание противопоказаны.
-
Идеального процентного соотношения калорий из белков, жиров и углеводов для всех пациентов с СД не существует. Рекомендации формируются на основе анализа актуального образца питания и метаболических целей.
-
Как правило, полезным для снижения массы тела может быть максимальное ограничение жиров (прежде всего животного происхождения) и сахаров; умеренное (в размере половины привычной порции) - продуктов, состоящих преимущественно из сложных углеводов (крахмалов) и белков; неограниченное потребление - продуктов с минимальной калорийностью (в основном богатых водой и клетчаткой овощей).
-
Учет потребления углеводов важен для достижения хорошего гликемического контроля. Если пациент с СД 2-го типа получает ИКД, оптимальным подходом является обучение подсчету углеводов по системе «ХЕ». В других случаях может быть достаточно практически ориентированной оценки.
-
С точки зрения общего здоровья следует рекомендовать потребление углеводов в составе овощей, цельнозерновых, молочных продуктов, в противовес другим источникам углеводов, содержащих дополнительно насыщенные или трансжиры, сахара или натрий. Важно также включать в рацион продукты, богатые моно- и полиненасыщенными жирными кислотами (рыба, растительные масла).
-
Не доказана польза от употребления в виде препаратов витаминов (в отсутствие признаков авитаминоза), антиоксидантов, микроэлементов, а также каких-либо пищевых добавок растительного происхождения при СД.
-
Допустимо умеренное потребление некалорийных сахарозаменителей.
-
Употребление алкогольных напитков возможно в количестве не более 1 условной единицы для женщин и 2 условных единиц для мужчин в сутки (но не ежедневно) при отсутствии панкреатита, выраженной нейропатии, гипертриглицеридемии, алкогольной зависимости. Одна условная единица соответствует 15 г этанола, или примерно 40 г крепких напитков, или 140 г вина, или 300 г пива. Употребление алкоголя увеличивает риск гипогликемии, в том числе отсроченной, у тех пациентов, которые получают секретагоги и инсулин. Необходимо обучение и постоянный контроль знаний о профилактике гипогликемий.
Относительно режима питания рекомендуется придерживаться индивидуальных предпочтений. Дробное питание (5-6 раз в день малыми порциями) позволяет избежать сильного чувства голода при уменьшении привычного объема питания, а также препятствует как постпрандиальной гипергликемии (порция углеводов в каждом приеме пищи должна быть невелика), так и гипогликемиям у больных на медикаментозной сахароснижающей терапии (частый прием небольших количеств углеводов). Для больных, выбирающих трехразовое питание, важно избегать переедания в вечернее время. В целом питание больных СД 2-го типа должно соответствовать современным рекомендациям по здоровому питанию.
Физические нагрузки
Физические упражнения рассматриваются как важный метод в структуре комплексной терапии СД 2-го типа. Кроме ускорения снижения веса, физическая активность улучшает чувствительность к инсулину и, как следствие этого, показатели углеводного обмена, а также нормализует липидемию. Если больной получает сахароснижающие препараты, должна соблюдаться осторожность в связи с возможной гипогликемией. Требуется также оценка состояния больного на предмет возможных противопоказаний для определенных видов упражнений (например, ИБС, неконтролируемая АГ, выраженная автономная и/или периферическая нейропатия, препролиферативная или пролиферативная ретинопатия, макулярный отек). Рекомендуются аэробные физические упражнения умеренной интенсивности продолжительностью 30-60 мин, предпочтительно ежедневно, но не менее 3 раз в неделю. Суммарная продолжительность не менее 150 мин в неделю.
Медикаментозное лечение
Общие принципы начала и интенсификации сахароснижающей терапии
-
Стратификация лечебной тактики в зависимости от исходного уровня HbA1C , выявленного при постановке диагноза СД 2-го типа.
-
Мониторинг эффективности сахароснижающей терапии по уровню HbA1C осуществляется каждые 3 мес. Оценивать темп снижения HbA1C .
-
Изменение (интенсификация) сахароснижающей терапии при ее неэффективности (т.е. при отсутствии достижения индивидуальных целей HbA1C ) выполняется не позднее чем через 6 мес.
-
Группы сахароснижающих препаратов с их характеристиками даны в главе 4.
Стратификация лечебной тактики в зависимости от исходного гликированного гемоглобина
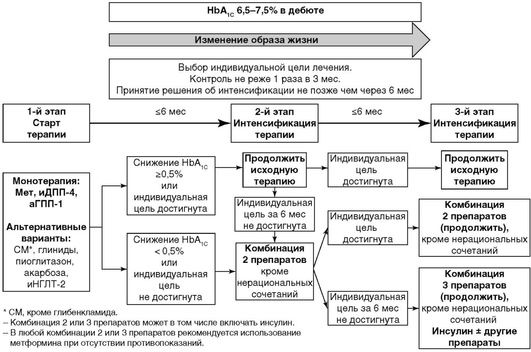
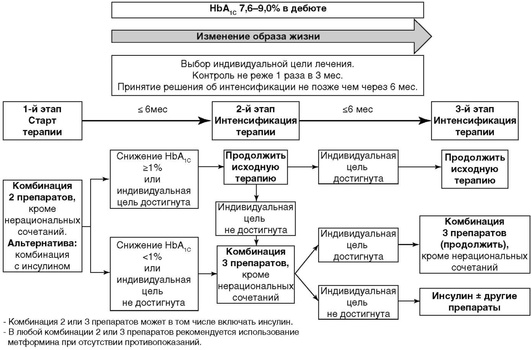
При уровне HbA1C 6,5-7,5% начинать лечение рекомендуется с монотерапии (рис. 10.4). Приоритет должен быть отдан средствам с минимальным риском гипогликемий (метформин, иДПП-4, аГПП-1); при наличии ожирения и АГ предпочтительны аГПП-1 в связи с эффективным снижением массы тела и уровня систолического АД. При непереносимости или противопоказаниях к препаратам первого ряда рекомендуется начало терапии с альтернативных классов сахароснижающих препаратов. Эффективным считается темп снижения HbA1C >0,5% за 6 мес наблюдения.
При уровне HbA1C 7,6-9,0% начинать лечение рекомендуется с комбинации 2 сахароснижающих препаратов, воздействующих на разные механизмы развития болезни (рис. 10.5). К наиболее рациональным комбинациям относятся сочетания метформина (базового препарата, снижающего инсулинорезистентность) и препаратов, стимулирующих секрецию инсулина: иДПП-4, аГПП-1, ПСМ или глинидов. Комбинация метформина и ингибиторов натрий-глюкозного котранспортера 2-го типа оказывает эффект независимо от наличия инсулина в крови. Приоритет должен быть отдан средствам с минимальным риском гипогликемий. Эффективным считается темп снижения HbA1C >1,0% за 6 мес наблюдения.
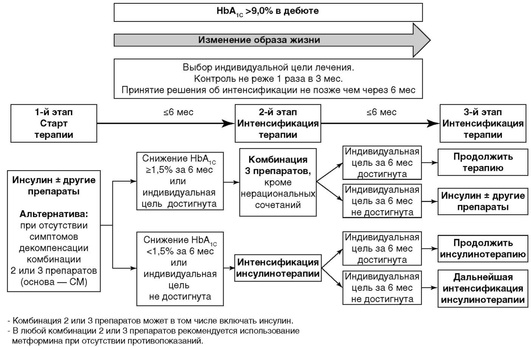
При уровне HbA1C >9,0% ситуация характеризуется наличием выраженной глюкозотоксичности, для снятия которой необходимо начинать инсулинотерапию или комбинацию инсулина с пероральными сахароснижающими препаратами/аГПП-1 (рис. 10.6). Если в «дебюте» заболевания определяется уровень HbA1C более 9%, но при этом отсутствуют выраженные клинические симптомы декомпенсации (прогрессирующая потеря массы тела, жажда, полиурия и др.), можно начать лечение с альтернативного варианта - комбинации 2 или 3 сахароснижающих препаратов, воздействующих на различные механизмы развития гипергликемии. Эффективным считается темп снижения HbA1C ≥1,5% за 6 мес наблюдения.
Рациональные комбинации сахароснижающих препаратов приведены в табл. 10.13.
К нерациональным комбинациям сахароснижающих препаратов относятся:
| Метформин | иДПП-4 | СМ/глиниды | ТЗД | аГПП-1 | Базальный инсульт | иНГЛТ-2 | |
|---|---|---|---|---|---|---|---|
Метформин |
+ |
+ |
+ |
+ |
+ |
+ |
|
иДПП-4 |
+ |
+ |
+ |
Нет |
+ |
+ |
|
СМ/глиниды |
+ |
+ |
+ |
+ |
+ |
+ |
|
ТЗД |
+ |
+ |
+ |
+ |
Нет |
+ |
|
аГПП-1 |
+ |
Нет |
+ |
+ |
+ |
+ |
|
Базальный инсульт |
+ |
+ |
+ |
Нет |
+ |
НИ |
|
иНГЛТ-2 |
+ |
+ |
+ |
+ |
НИ |
+ |
НИ - комбинация не изучена.
Комментарий. В случае назначения комбинации трех сахароснижающих препаратов следует проверить рациональность сочетания каждого препарата с двумя другими. При необходимости интенсификации лечения очередность назначения сахароснижающих средств не регламентируется и должна определяться индивидуально. У лиц, получающих в составе комбинированной терапии базальный инсулин, можно продолжить интенсифицировать лечение посредством присоединения других сахароснижающих препаратов (при условии рационального сочетания всех средств, используемых в комбинации).
Инсулинотерапия
Число больных СД 2-го типа, требующих лечения инсулином, неуклонно возрастает, уже давно превысив количество больных СД 1-го типа. Следует отметить, что перевод на инсулин больных СД 2-го типа часто осуществляется слишком поздно, а нормальный метаболический статус достигается далеко не всегда, особенно при большой длительности заболевания. В ряде случаев инсулин должен назначаться очень рано, если вообще не с самого начала заболевания.
С момента установления диагноза больные СД 2-го типа должны быть осведомлены о возможном назначении инсулина с учетом прогрессирующего течения заболевания.
Показания к инсулинотерапии:
-
у лиц с впервые выявленным СД 2-го типа - при уровне HbA1C >9% и наличии выраженной клинической симптоматики декомпенсации;
-
у лиц с анамнезом СД 2-го типа - при отсутствии достижения индивидуальных целей гликемического контроля на фоне лечения оптимальными дозами других сахароснижающих препаратов или комбинаций;
-
при наличии противопоказаний к назначению или непереносимости других сахароснижающих препаратов;
-
при необходимости оперативного вмешательства, острых интеркуррентных и обострениях хронических заболеваний, сопровождающихся декомпенсацией углеводного обмена (возможен временный перевод на инсулинотерапию).
Индивидуальный подход в выборе режима инсулинотерапии зависит от образа жизни конкретного пациента, особенностей течения заболевания, прежде всего от состояния гликемического контроля (табл. 10.14).
Показания для интенсификации инсулинотерапии при СД 2-го типа:
-
отсутствие достижения индивидуальных целей терапии на предшествующем режиме инсулинотерапии в течение 3-6 мес;
-
дальнейшее титрование дозы в одной инъекции ограничено из-за большой однократной дозы (увеличение риска развития гипогликемии);
-
режим питания предполагает необходимость интенсификации инсулинотерапии.
| Образ жизни | Течение заболевания | Выбор режима инсулинотерапии |
|---|---|---|
Пациент неохотно обсуждает необходимость начала инсулинотерапии / проявляет готовность использовать наиболее простой режим инсулинотерапии. Размеренный образ жизни. |
Неэффективность диеты и оптимальной дозы других сахароснижающих препаратов и их комбинаций. Уровень HbA1C выше целевого на 1,0-1,5%. Гипергликемия натощак |
Аналог ИДД 1-2 раза в день или ИСДД 1 раз в день + пероральные сахароснижающие препараты/аГПП-1. ИСД (НПХ) 1-2 раза в день + пероральные сахароснижающие препараты/аГПП-1 |
Низкая физическая активность. Живет один. Не может справляться с интенсивным режимом инсулинотерапии |
Неэффективность диеты и оптимальной дозы других сахароснижающих препаратов и их комбинаций. Уровень HbA1C выше целевого более чем на 1,5%. Постпрандиальная гипергликемия |
Готовая смесь аналога ИУКД и протаминированного аналога ИУКД 1-2 раза в день ± пероральные сахароснижающие препараты. Готовая смесь ИКД и ИСД (НПХ) 1-2 раза в день ± пероральные сахароснижающие препараты. Готовая комбинация аналога ИСДД и аналога ИУКД 1-2 раза в день ± пероральные сахароснижающие препараты |
Активный образ жизни. Физические нагрузки, занятия спортом. Мотивация к самоконтролю. Способность справляться с требованиями к режиму инсулинотерапии и частоте инъекций |
Неэффективность диеты и оптимальной дозы других сахароснижающих препаратов или их комбинаций. Уровень HbA1C выше целевого более чем на 1,5%. Гипергликемия натощак и после еды |
Аналог инсулина длительного действия 1-2 раза в день или ИСДД 1 раз в день + аналог ИУКД перед завтраком, обедом и ужином. ИСД (НПХ) 2-3 раза в день + ИКД перед завтраком, обедом и ужином |
Варианты интенсификации представлены в табл. 10.15.
| Режим | Схема |
|---|---|
Базис-болюсный режим |
Аналог ИДД 1-2 раза в день или ИСДД 1 раз в день + аналог ИУКД перед завтраком, обедом и ужином. ИСД (НПХ) 2-3 раза в день + ИКД перед завтраком, обедом и ужином |
Режим многократных инъекций готовых смесей инсулина |
Готовая смесь аналога ИУКД и протаминированного аналога ИУКД перед завтраком, обедом и ужином. Готовая смесь ИКД и ИСД (НПХ) перед завтраком, обедом и ужином |
Режим многократных инъекций перед едой |
Аналог ИУКД или инсулин короткого действия перед завтраком, обедом и ужином |
После начала инсулинотерапии пациент должен по-прежнему уделять внимание рекомендованному образу жизни (питание, физические нагрузки) и по мере необходимости вносить в него соответствующие изменения.
Следует разъяснять пациенту с момента обнаружения у него СД, что инсулин является одним из ЛС для лечения данного заболевания и может стать главным и в конце концов незаменимым средством поддержания желаемого уровня гликемии на протяжении длительного времени.
Дозы инсулина индивидуальны, увеличение проводится постепенно, до достижения индивидуальных целевых показателей углеводного обмена. Не существует ограничений в дозе инсулина.
Оценка эффективности лечения
Как и при СД 1-го типа, лечение должно оцениваться в основном по концентрации глюкозы в крови (у пожилых больных - глюкозы в моче), в том числе измеряемой самим больным в домашних условиях. Определение уровня HbA1C может быть достаточно 1 раз в 3 мес. Современные цели лечения СД 2-го типа в отношении контроля гликемии выглядят следующим образом (см. табл. 10.2-10.4).
Впечатляющие результаты исследований United Kingdom Prospective Diabetes Study заставляют уделять больше внимания улучшению гликемического контроля. Было показано, что снижение HbA1C на 1% позволяет уменьшить:
Дальнейшее ведение больных
Разработан алгоритм обследования для больных СД 2-го типа. При отсутствии сосудистых осложнений стандартное обследование проводят по схеме, представленной в табл. 10.16.
| Показатель | Частота обследования |
|---|---|
Самоконтроль гликемии |
В дебюте заболевания и при декомпенсации - ежедневно несколько раз! В дальнейшем в зависимости от вида сахароснижающей терапии: на интенсифицированной инсулинотерапии: не менее 4 раз ежедневно; на пероральной сахароснижающей терапии и/или агонистах рецепторов ГПП-1 и/или базальном инсулине: не менее 1 раза в сутки в разное время + 1 гликемический профиль (не менее 4 раз в сутки) в неделю; на готовых смесях инсулина: не менее 2 раз в сутки в разное время + 1 гликемический профиль (не менее 4 раз в сутки) в неделю; на диетотерапии: 1 раз в неделю в разное время суток |
HbA1c |
1 раз в 3 мес |
Непрерывное мониторирование уровня глюкозы крови |
По показаниям |
Общий анализ крови |
1 раз в год |
Общий анализ мочи |
2 раза в год |
Микроальбуминурия |
2 раза в год |
Биохимический анализ крови (белок, общий холестерин, холестерин ЛПВП, холестерин ЛПНП, триглицериды, билирубин, АСТ, АЛТ, мочевая кислота, мочевина, креатинин, калий, натрий, расчет СКФ) |
Не менее 1 раз в год |
Контроль АД |
При каждом посещении врача. При наличии АГ самоконтроль 2-3 раза в день |
ЭКГ |
1 раз в год |
ЭКГ (с нагрузочными тестами при наличии ≥2 факторов риска) |
1 раз в год |
Консультация кардиолога |
1 раз в год |
Осмотр ног |
При каждом посещении врача |
Оценка чувствительности стоп |
Не реже 1 раза в год, по показаниям чаще |
Проверка техники и осмотр мест инъекций инсулина |
Не реже 1 раза в 6 мес |
Осмотр офтальмолога (офтальмоскопия с широким зрачком) |
1 раз в год, по показаниям чаще |
Консультация невролога |
По показаниям |
Рентгенография грудной клетки |
1 раз в год |
При появлении признаков хронических осложнений СД, присоединении сопутствующих заболеваний, появлении дополнительных факторов риска вопрос о частоте обследований решают индивидуально.
ПРОГНОЗ
При эффективной терапии СД 2-го типа прогноз для жизни больных, как правило, относительно благоприятен. При неадекватном контроле гликемии резко возрастает риск микро- и макрососудистых осложнений СД. Свыше 55% больных СД 2-го типа умирают от инфаркта миокарда.
В проспективном исследовании United Kingdom Prospective Diabetes Study, продолжавшемся около 20 лет и включавшем более 5000 больных, показано, что снижение уровня HbA1C на 1% позволяет уменьшить:
Через 10 лет после окончания исследования United Kingdom Prospective Diabetes Study, были обнаружены достоверные преимущества раннего гликемического контроля (группа интенсивного лечения в первую фазу исследования), которые проявились в снижении риска развития:
СПИСОК ЛИТЕРАТУРЫ
-
Дедов И.И., Балаболкин М.И. и др. Современные аспекты патогенеза, классификации, диагностики и лечения сахарного диабета: Пособие для врачей. - М., 2004. - 172 с.
-
Дедов И.И., Кураева Т.Л., Петеркова В.А. Сахарный диабет у детей и подростков. - М.: ГЭОТАР-Медиа, 2013.
-
Дедов И.И., Суркова Е.В., Майоров А.Ю. и др. Терапевтическое обучение больных сахарным диабетом. - М.: Реафарм, 2004. - 193 с.
-
Дедов И.И., Шестакова М.В., Аметов А.С., Анциферов М.Б., Галстян Г.Р., Майоров А.Ю., Мкртумян А.М., Петунина Н.А., Сухарева О.Ю. Инициация и интенсификация сахароснижающей терапии у больных сахарным диабетом 2-го типа: обновление консенсуса совета экспертов Российской ассоциации эндокринологов (2015 г.) // Сахарный диабет. - 2015. - №1. - С. 4-22.
-
Дедов И.И., Шестакова М.В., Аметов А.С., Анциферов М.Б., Галстян Г.Р., Майоров А.Ю., Мкртумян А.М., Петунина Н.А., Сухарева О.Ю. Консенсус совета экспертов Российской ассоциации эндокринологов по инициации и интенсификации сахароснижающей терапии у больных сахарным диабетом 2-го типа // Сахарный диабет. - 2011. - № 4. - С. 6-17.
-
Дедов И.И., Шестакова М.В. Оптимизация и интенсификация инсулинотерапии при СД 2-го типа (клинически рекомендации) // Сахарный диабет. - 2010. - №5. - С. 9-16.
-
Клинические рекомендации «Алгоритмы специализированной медицинской помощи больным сахарным диабет. - Спецвыпуск №1.
-
Результаты реализации подпрограммы «Сахарный диабет» Федеральной целевой программы «Предупреждение и борьба с социально значимыми заболеваниями на 2007-2012 годы» / Под ред. И.И. Дедова, М.В. Шестаковой // Сахарный диабет. - 2013. - Спецвыпуск №2. - С. 2-48.
-
Сахарный диабет: диагностика, лечение, профилактика / Под ред. И.И. Дедова, М.В. Шестаковой. - М: Медицинское информационное агентство, 2011.
-
Терапевтическое обучение больных. Программы непрерывного обучения для работников здравоохранения в области профилактики хронических заболеваний. Отчет рабочей группы ВОЗ. - М., 1998. - 96 с.
-
Adler A.I., Stratton I.M., Neil H.A. W. et al. On behalf of the UK Prospective Diabetes Study Group. Association of systolic blood pressure with macrovascular and microvascular complications of type 2 diabetes (UKPDS 36): prospective observational study // Br. Med. J. - 2000. - Vol. 321. - P. 412-419.
-
Albers J.W., Herman W.H., Pop-Busui R., Feldman E.L., Martin C.L., Cleary P.A., Waberski B.H., Lachin J.M., Group ftDER. Effect of Prior Intensive Insulin Treatment During the Diabetes Control and Complications Trial (DCCT) on Peripheral Neuropathy in Type 1 Diabetes During the Epidemiology of Diabetes Interventions and Complications (EDIC) Study // Diabetes Care. - 2010. - Vol. 33 (5). - P. 1090-1096. DOI: 10.2337/dc09-1941.
-
American Diabetes Association. Standards of medical care in diabetes - 2015 // Diabetes Care. - 2015. - Vol. 38. - Suppl. 1. - P. s1-s93.
-
Boul N.G., Haddad E., Kenny G.P. et al. Effects of exercise on glycemic control and body mass in type 2 diabetes mellitus. A meta-analysis of controlled clinical trials // JAMA. - 2001. - Vol. 286. - P. 121-827.
-
DCCT Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus // New Engl. J. Med. - 1993. - Vol. 329. - P. 977-986.
-
Diagnostic criteria and classification of hyperglycaemia first detected in pregnancy. - WHO Guideline. 2013.
-
Definition, diagnosis and classification of diabetes mellitus and its complications // Report of WHO Consultation. - 1999. - 59 p.
-
Gerstein H.C., Miller M.E., Byington R.P., Goff Jr D.C., Bigger J.T., Buse J.B. et al. Effects of Intensive Glucose Lowering in Type 2 Diabetes // N. Engl. J. Med. - 2008 Jun. - Vol. 358 (24). - P. 2545-2559.
-
Intensive Diabetes Therapy and Glomerular Filtration Rate in Type 1 Diabetes // New England Journal of Medicine. - 2011. - Vol. 365 (25). - P. 2366-2376. DOI: doi: 10.1056/ NEJMoa1111732.
-
International Diabetes Federation. Diabetes Atlas 6th Edition. - 2013.
-
International Diabetes Federation. Global Guideline for Type 2 diabetes. - 2012.
-
Inzucchi S.E., Bergenstal R.M., Buse J.B., Diamant M., Ferrannini E., Nauck M. et al. Management of Hyperglycemia in Type 2 Diabetes, 2015: A Patient-Centered Approach: Update to a Position Statement of the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. - 2014. - Vol. 38 (1). - P. 140-149.
-
Inzucchi S.E., Bergenstal R.M., Buse J.B., Diamant M., Ferrannini E., Nauck M. et al. Management of Hyperglycemia in Type 2 Diabetes: A Patient-Centered Approach: Position Statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD) // Diabetes Care. - 2012. - Vol. 35 (6). - P. 1364-1379.
-
ISPAD Clinical Practice Consensus Guidelines 2014 Compendium // Pediatric Diabetes. - 2014. - Vol. 15 (Suppl. 20). - P. 1-290.
-
Nathan D.M., Zinman B., Cleary P.A., Backlund J.Y., Genuth S., Miller R., Orchard T.J. Modern-day clinical course of type 1 diabetes mellitus after 30 years' duration: the diabetes control and complications trial/epidemiology of diabetes interventions and complications and Pittsburgh epidemiology of diabetes complications experience (1983-2005) // Arch Intern Med. - 2009. - Vol. 169 (14). - P. 1307-3116. DOI: 10.1001/archinternmed. 2009.193.
-
Rodbard H.W., Jellinger P.S., Davidson J.A., Einhorn D., Garber A.J., Grunberger G. et al. Statement by an American Association of Clinical Endocrinologists/American College of Endocrinology Consensus Panel on Type 2 Diabetes Mellitus: An Algorithm for Glycemic Control // Endocrine Practice. - 2009. - Vol. 15 (6). - P. 540-559.
-
Stratton I.M., Adler A.I., Neil H.A.W. et al. On behalf of the UK Prospective Diabetes Study Group. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study // Br. Med. J. - 2000. - Vol. 321. - P. 405 -412.
-
The Diabetes Prevention Program Research Group. Impact of intensive lifestyle and metformin therapy on cardiovascular disease risk factors in the Diabetes Prevention Program // Diabetes Care. - 2005. - Vol. 28. - P. 888-894.
-
UKPDS Group. Effect of intensive blood-glucose control with metformine on complications in overweight patients with type 2 diabetes (UKPDS 34) // Lancet. - 1998. - Vol. 352. - P. 854-865.
-
UKPDS Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33) // Lancet. - 1998. - Vol. 352. - P. 837-853.
-
White N.H., Sun W., Cleary P.A., Tamborlane W.V., Danis R.P., Hainsworth D.P., Davis M.D., Group ftD-ER Effect of Prior Intensive Therapy in Type 1 Diabetes on 10-Year Progression of Retinopathy in the DCCT/EDIC: Comparison of Adults and Adolescents // Diabetes. - 2010. - Vol. 59 (5). - P. 1244-1253. DOI: 10.2337/db09-1216.
ГЕСТАЦИОННЫЙ САХАРНЫЙ ДИАБЕТ
Григорян О.Р., Андреева Е.Н.
ОПРЕДЕЛЕНИЕ
ГСД - это заболевание, характеризующееся гипергликемией, впервые выявленной во время беременности, но не соответствующей критериям «манифестного» СД (табл. 10.17, 10.18).
ГСД, при первичном обращении в перинатальный центр |
||
ммоль/л |
мг/дл |
|
Натощак |
≥5,1, но <7,0 |
≥92, но <126 |
ГСД, при проведении ПГТТ с 75 г декстрозы (глюкозы♠) |
||
ммоль/л |
мг/дл |
|
Через 1 ч |
≥10,0 |
≥180 |
Через 2 ч |
≥8,5 <11,1 |
≥153 <200 |
Манифестный (впервые выявленный) СД у беременных* |
|
Глюкоза венозной плазмы натощак |
≥7,0 ммоль/л (126 мг/дл) |
Глюкоза венозной плазмы через 2 ч при проведении ПГТТ |
≥11,1 ммоль/л (200 мг/дл) |
HbA1C** |
≥6,5% |
Глюкоза венозной плазмы независимо от времени суток и приема пищи при наличии симптомов гипергликемии |
≥11,1 ммоль/л (200 мг/дл) |
* Если аномальные значения были получены впервые и нет симптомов гипергликемии, то предварительный диагноз манифестного СД во время беременности должен быть подтвержден уровнем глюкозы венозной плазмы натощак или HbA1C с использованием стандартизированных тестов. При наличии симптомов гипергликемии для установления диагноза СД достаточно одного определения в диабетическом диапазоне (гликемии или HbA1C ). В случае выявления манифестного СД он должен быть в ближайшие сроки квалифицирован в какую-либо диагностическую категорию согласно действующей классификации ВОЗ, например СД 1-го типа, СД 2-го типа и др.
** HbA1C с использованием метода определения, сертифицированного в соответствии с National Glycohemoglobin Standartization Programm или International Federation of Clinical Chemists и стандартизированного в соответствии с референсными значениями, принятыми в Diabetes Control and Complications Trial.
Верификация ГСД не зависит от степени повышения уровня глюкозы в крови, от возможной потребности в инсулинотерапии на период беременности, а также от возможной персистенции гипергликемии после родов.
Широкое понятие ГСД имеет большую практическую ценность. Это означает, что ГСД - гетерогенный синдром в отношении выраженности клинических проявлений, патофизиологии и патогенеза.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
ГСД - частое осложнение беременности. Распространенность ГСД напрямую зависит от этнического состава населения и возможностей современных диагностических тестов.
Частота ГСД в общей популяции разных стран варьирует от 1 до 20%, составляя в среднем 7%. Указанные вариации обусловлены различиями в способах его диагностики и напрямую связаны с распространенностью СД 2-го типа в отдельных этнических группах. В Северной Америке распространенность ГСД значительно выше в областях, где население преимущественно латиноамериканское и/или коренное. В Северной Америке, Великобритании и Австралии ГСД намного чаще страдают выходцы из Азии (индийский субконтинент, Китай, Юго-Восточная Азия). Другие популяции с высоким риском ГСД - народность маори Новой Зеландии и население других тихоокеанских островов. Распространенность ГСД в популяциях выходцев из Африки выше таковой у представителей европеоидной расы. В других странах распространенность ГСД несколько ниже, чем в Северной Америке (например, 2% в этнически однородной Корее).
При распространенности 2-7% ГСД является одним из наиболее частых осложнений беременности наряду с АГ (10% и более), преждевременными родами (около 7%) и внутриутробной задержкой развития плода.
ДИАГНОСТИКА
В 2008 г. в г. Пасадене (США) Международной ассоциацией групп изучения диабета и беременности (International Association of Diabetes and Pregnancy Study Groups) были предложены для обсуждения новые критерии диагностики ГСД, основанные на результатах исследования Hyperglycemia and Adverse Pregnancy Outcomes Study, включавшего более 23 тыс. беременных женщин. В течение 2010-2011 гг. ряд развитых стран (США, Япония, Германия, Израиль и др.) самостоятельно приняли эти новые критерии, руководствуясь результатами исследования Hyperglycemia and Adverse Pregnancy Outcomes Study. В 2013 г. их одобрила ВОЗ.
В России, как практически во всех европейских странах, проводят тест с 75 г глюкозы.
Диагностика нарушений углеводного обмена при беременности проводится в 2 фазы (рис. 10.7).
1-я фаза проводится при первом обращении беременной к врачу. При первом обращении беременной к врачу любой специальности (акушеру-гинекологу, эндокринологу, терапевту, врачу общей практики) на сроке до 24 нед всем женщинам в обязательном порядке проводится одно из следующих исследований:
-
глюкоза венозной плазмы натощак (определение глюкозы венозной плазмы проводится после предварительного голодания в течение не менее 8 ч и не более 14 ч);
-
определение уровня HbA1C с использованием метода определения, сертифицированного в соответствии с National Glycohemoglobin Standartization Program или International Federation of Clinical Chemists и стандартизированного в соответствии с референсными значениями, принятыми в Diabetes Control and Complications Trial; исследование проводится в соответствии с Алгоритмами специализированной помощи больным сахарным диабетом, 7-й выпуск;
-
глюкоза венозной плазмы в любое время дня независимо от приема пищи.
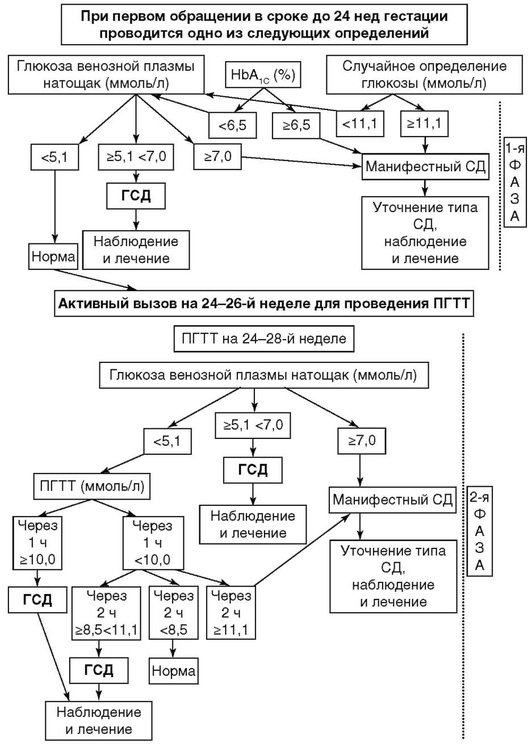
В том случае, если результат исследования соответствует категории манифестного (впервые выявленного) СД (см. табл. 10.18), больная немедленно передается эндокринологу для уточнения типа СД в соответствии с Алгоритмами специализированной медицинской помощи больным сахарным диабетом.
Если уровень HbA1C <6,5% или случайно определенный уровень глюкозы плазмы <11,1, то проводится определение глюкозы венозной плазмы натощак.
При уровне глюкозы венозной плазмы натощак ≥5,1, но <7,0 ммоль/л устанавливается диагноз ГСД (см. табл. 10.17).
2-я фаза проводится на 24-28-й неделе беременности. Всем женщинам, у которых не было выявлено нарушение углеводного обмена на ранних сроках беременности, между 24 и 28 нед проводится ПГТТ с 75 г декстрозы (глюкозы♠ ). В исключительных случаях ПГТТ с 75 г декстрозы (глюкозы♠ ) может быть проведен вплоть до 32-й недели беременности (высокий риск ГСД, размеры плода по данным ультразвуковых таблиц внутриутробного роста ≥75 перцентиля, ультразвуковые признаки диабетической фетопатии).
Показания к проведению ПГТТ:
Противопоказания к проведению ПГТТ:
Временные противопоказания к проведению ПГТТ:
Правила проведения ПГТТ.
ПГТТ с 75 г декстрозы (глюкозы ♠ ) является безопасным нагрузочным диагностическим тестом для выявления нарушения углеводного обмена во время беременности.
Интерпретацию результатов тестирования проводят акушеры-гинекологи, терапевты, врачи общей практики.
Специальной консультации эндокринолога для установки факта нарушения углеводного обмена во время беременности не требуется.
Тест выполняется на фоне обычного питания (не менее 150 г углеводов в день) как минимум в течение 3 дней, предшествующих исследованию. Тест проводится утром натощак после 8-14-часового ночного голодания. Последний прием пищи должен обязательно содержать 30-50 г углеводов. Пить воду не запрещается. В процессе проведения пациентка должна сидеть. Курение до завершения теста запрещается. ЛС, влияющие на уровень глюкозы крови (поливитамины и препараты железа, содержащие углеводы, глюкокортикоиды, β-адреноблокаторы, β-адреномиметики), по возможности следует принимать после окончания теста.
Определение глюкозы венозной плазмы выполняется только в лаборатории на биохимических анализаторах либо на анализаторах глюкозы. Использование портативных средств самоконтроля (глюкометров) для проведения теста запрещено.
Забор крови производится в холодную пробирку (лучше вакуумную), содержащую консерванты: фторид натрия (6 мг на 1 мл цельной крови) как ингибитор енолазы для предотвращения спонтанного гликолиза, а также этилендиаминтетраацетат или цитрат натрия как антикоагулянты. Пробирка помещается в воду со льдом. Затем немедленно (не позднее ближайших 30 мин) кровь центрифугируется для разделения плазмы и форменных элементов. Плазма переносится в другую пластиковую пробирку. В этой биологической жидкости и производится определение уровня глюкозы.
Этапы проведения ПГТТ
-
1-й этап. После забора первой пробы плазмы венозной крови натощак уровень глюкозы измеряется немедленно, так как при получении результатов, указывающих на манифестный (впервые выявленный) СД или ГСД, дальнейшая нагрузка декстрозой (глюкозой♠ ) не проводится и тест прекращается. При невозможности экспресс-определения уровня глюкозы тест продолжается и доводится до конца.
-
2-й этап. При продолжении теста пациентка должна в течение 5 мин выпить раствор декстрозы (глюкозы♠ ), состоящий из 75 г сухой (ангидрида или безводной) декстрозы (глюкозы♠ ), растворенной в 250-300 мл теплой (37-40 °С) питьевой негазированной или дистиллированной) воды. Если используется декстрозы моногидрат, для проведения теста необходимо 82,5 г вещества. Начало приема раствора декстрозы (глюкозы♠ ) считается началом теста.
-
3-этап. Следующие пробы крови для определения уровня глюкозы венозной плазмы берутся через 1 и 2 ч после нагрузки декстрозой (глюкозой♠ ). При получении результатов, указывающих на ГСД после второго забора крови, тест прекращается, и третий забор крови не производится.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Физиологическая беременность характеризуется двумя главными изменениями в гомеостазе глюкозы. Первое - это непрерывная передача глюкозы к оплодотворенной яйцеклетке, т.е. к плоду и плаценте. Tрансплацентарный транспорт глюкозы осуществляют белки-транспортеры глюкозы, главным образом -1 и -3. Из-за утилизации глюкозы плодом и плацентой для матери беременность можно охарактеризовать как состояние «ускоренного голодания». В этот период уровень глюкозы падает быстрее, чем у небеременных женщин, в то время как липолиз и кетогенез активизированы.
Второе - отмечаемое со II триместра беременности снижение чувствительности тканей к инсулину, или инсулинорезистентность. При этом инсулинорезистентность во время беременности отражается на метаболизме и глюкозы, и липидов. Скелетная мускулатура и жировая ткань становятся резистентными к стимулирующему влиянию инсулина на утилизацию глюкозы. В печени, вопреки подавляющему влиянию инсулина, увеличивается продукция эндогенной глюкозы. Вышеуказанные изменения происходят как у беременных женщин с нормальной массой тела, так и у пациенток с ИМТ более 29,9 кг/м2 .
Что касается метаболизма липидов, возникает резистентность тканей к ингибирующему влиянию инсулина на липолиз и окисление жирных кислот. Сама инсулинорезистентность ведет к постепенной компенсаторной стимуляции секреции инсулина β-клетками поджелудочной железы. Поэтому во время беременности повышены и уровень инсулина натощак (базальный), и уровень стимулированного с помощью внутривенного глюкозотолерантного теста инсулина (1-я и 2-я фазы инсулинового ответа). Кроме того, с увеличением срока гестации повышается и клиренс инсулина.
Повышенная инсулинорезистентность отличает беременность при ГСД от нормальной (физиологической) беременности. Инсулинорезистентность при ГСД, помимо углеводного и липидного, влияет предположительно и на белковый обмен. У данной категории женщин в условиях гиперинсулинемии снижена утилизация глюкозы плазмы крови инсулинзависимыми тканями, а продукция эндогенной глюкозы печенью увеличена.
Необходимо отметить, что инсулинорезистентность у пациенток с ГСД в сочетании с АГ (развившейся до 20 нед беременности) имеет более драматичные последствия, чем у женщин только с ГСД. Хотя уровень инсулина натощак у женщин с ГСД в пределах нормы или увеличен, секреция инсулина в ответ на глюкозу или прием пищи неадекватна степени инсулинорезистентности: особенно недостаточна 1-я фаза секреции при проведении ПГТТ или внутривенного глюкозотолерантного теста в сравнении с нормальной беременностью. При этом недостаточность ответного секреторного выброса инсулина отчетливее у женщин с ГСД и нормальной массой тела или ее дефицитом. Ответная секреция инсулина во 2-ю фазу не снижена, а может быть и повышена. Кроме того, ГСД характеризует увеличение концентрации проинсулина. Это говорит об ухудшении функции β-клеток.
С патогенетической точки зрения повышенная инсулинорезистентность в какой-то степени может быть объяснена избыточной массой тела или ожирением (факторы риска ГСД), которые чаще встречаются у женщин с ГСД. Генетические мутации, ответственные за развитие MODY, - это аутосомно-доминантная генетически и клинически неоднородная группа раннего начала диабета 2-го типа у молодых пациентов с дефектом секреции инсулина - также были найдены и у женщин с ГСД, включая мутацию гена глюкокиназы - причину развития MODY 2.
По мнению многих зарубежных исследователей, мутации глюкокиназы составляют 3-6% всех случаев ГСД и влияют на вес новорожденного. У женщин с ГСД также встречаются и другие «пострецепторные» аномалии (т.е. возникающие после связывания инсулина с рецептором). Например, у 50% женщин с ГСД выявили аномальную активность тирозинкиназы в скелетных мышцах и истощение резервов инсулинзависимого транспортера глюкозы-4 в адипоцитах.
С другой стороны, аутоантитела к инсулину, островковым клеткам поджелудочной железы, глутаматдекарбоксилазе-65 и/или тирозинфосфатазе-2 были обнаружены у 10% женщин с ГСД, а антитела к поверхности островковых клеток - у 31% пациенток с ГСД. Именно присутствие аутоантител (особенно множественных) увеличивает риск последующего развития СД 1-го типа у пациенток с ГСД.
В настоящее время существуют предгестационные и гестационные факторы риска ГСД. В американском исследовании Nurses Health Study Cohort, включавшем 14 613 женщин, выявили несколько предгестационных факторов риска, ассоциированных с высокой распространенностью ГСД:
Факторы, которые как минимум в 2 раза увеличивают относительный риск развития ГСД:
Значимость фактора избыточной массы тела в разных этнических группах варьирует: большее значение для развития ГСД у коренных жителей Северной Америки, чем у некоренных. У скандинавской популяции с умеренным ожирением фактор массы тела также показателен.
Избыточная жировая ткань у женщин с ГСД прежде всего локализуется в брюшной полости («андроидный» тип ожирения). Увеличение соотношения «окружность талии/окружность бедер» это подтверждает. Низкорослость - фактор риска развития ГСД примерно у 20% женщин. И, наконец, СПКЯ и АГ, несомненно, связаны с повышенным риском развития ГСД.
По-видимому, вышеуказанные предгестационные факторы риска ГСД непосредственно связаны с инсулинорезистентностью: избыточная масса/ожирение с центральным распределением жировой ткани, низкорослость, этническая принадлежность, АГ. Таким образом, ГСД может быть рассмотрен как клиническое проявление инсулинорезистентности, так как в его патогенезе участвуют многие из метаболических составляющих данного понятия.
Существуют факторы риска развития ГСД, связанные с беременностью. Наиболее важный фактор - многоплодная беременность: беременность двойней повышает риск ГСД в 2 раза, а тройней - в 4-5 раз. Также есть работы, подтверждающие связь между ГСД и гипертензией во время беременности. В проспективном исследовании с участием около 3700 здоровых нерожавших женщин относительный риск развития гипертензии беременных (гестоз и преэклампсия) у пациенток с ГСД составил 1,54 (95%, доверительный интервал 1,28-2,11) по сравнению с женщинами, у которых не был верифицирован ГСД. Лечение преждевременных родов β-адреноблокаторами и/или глюкокортикоидами повышало риск развития ГСД на 15-20%. Женщины, получавшие длительную терапию стероидами, имели еще больший риск развития ГСД.
Таким образом, факторы риска развития ГСД:
КЛИНИЧЕСКАЯ КАРТИНА
ГСД не имеет специфических проявлений, поэтому необходимо проводить лабораторный скрининг даже у лиц с низким риском.
ЛЕЧЕНИЕ
После постановки диагноза ГСД на 1-м этапе назначают диету, соблюдение умеренной физической активности и мониторирование уровня глюкозы в крови. При неэффективности этих мер назначают инсулинотерапию. Таблетированные сахароснижающие препараты при ГСД противопоказаны!
Рациональное питание
Наблюдение акушерами-гинекологами, терапевтами, врачами общей практики!
Принципы диетотерапии:
Основы диетотерапии известны. Режим питания состоит из 3 основных приемов пищи и 3 перекусов. Из них 10-20% составляют белки, менее 10% - насыщенные жиры, а остальное - ненасыщенные жиры и углеводы. В последнее время обнаружено, что низкоуглеводная диета (<42%) обеспечивает лучший контроль гликемии и приводит к лучшему перинатальному исходу (чем диета с содержанием 45-50% углеводов). Необходимый суточный калораж рассчитывают по массе тела до беременности, или по ИМТ до беременности. Снижение суточного калоража до 1600-1800 ккал/сут у женщин с ожирением уменьшает гипергликемию, не вызывая кетонурию. С другой стороны, не следует значительно снижать калорийность (более чем на 50%): калораж 1200 ккал/сут приводит к значительной кетонемии у женщин с ГСД. Контроль уровня кетонурии помогает выявить недостаток калорий и углеводов в диете.
Физические нагрузки
Женщины с ГСД должны быть мотивированы продолжать умеренную физическую нагрузку. Программа физических нагрузок (по 20 мин 3 раза в неделю) в дополнение к диете ведет к лучшим результатам контроля гликемии, чем использование только диетотерапии.
Самоконтроль гликемии
Самоконтроль уровня глюкозы в крови - рутинная процедура для пациенток с ГСД (табл. 10.19).
Интересно отметить тот факт, что по некоторым данным одинаковая еда, которую дают женщинам с ГСД, приводит к более высокому уровню гликемии через 1 ч утром (07:00), чем вечером (21:00). Через 2 ч утренний и вечерний показатели становятся практически одинаковыми, в то время как 3-9-часовые показатели после еды были выше вечером. Данная закономерность, где 1-часовой уровень глюкозы был утром выше, вероятно, связана с физиологическим повышением концентрации кортизола в крови в 6-8 ч утра.
Инсулинотерапия
Самоконтроль выполняется пациенткой, результаты предоставляются врачу (см. табл. 10.19). Самоконтроль включает определение:
| Показатель | Целевой уровень |
|---|---|
Глюкоза |
Результат, калиброванный по плазме |
Натощак |
<5,1 ммоль/л |
Перед едой |
<5,1 ммоль/л |
Перед сном |
<5,1 ммоль/л |
В 03:00 |
<5,1 ммоль/л |
Через 1 ч после еды |
<7,0 ммоль/л |
Гипогликемии |
Нет |
Кетоновые тела в моче |
Нет |
АД |
<130/80 мм рт.ст. |
При появлении кетонурии или кетонемии введение дополнительного приема углеводов (=15г) перед сном или в ночное время.
ГСД сам по себе не является показанием к досрочному родоразрешению и плановому кесареву сечению.
Родоразрешение при ГСД целесообразно проводить не позднее 38-39 нед гестации. Акушер определяет показания к способу родоразрешения. Показания к плановому кесаревому сечению при ГСД являются общепринятыми в акушерстве. При наличии у плода выраженных признаков диабетической фенопатии во избежание родового травматизма (дистоция плечиков) показания для планового кесаревого сечения целесообразно расширить.
Ведение после беременности
Реклассификация состояния углеводного обмена матери на 45-60-й день после родов.
При нормальных цифрах гликемии - повторные обследования 1 раз в год. При выявлении НТГ - повторные обследования 1 раз в 3 мес. Планирование последующей беременности
СПИСОК ЛИТЕРАТУРЫ
-
Дедов И.И., Краснопольский В.И., Сухих Г.Т. и др. Российский национальный консенсус «Гестационный сахарный диабет: диагностика, лечение, послеродовое наблюдение» // Сахарный диабет. - № 4. - 2012. - С. 4-10.
-
Дедов И.И., Шестакова М.В. Алгоритмы специализированной медицинской помощи больным сахарным диабетом (7-й выпуск). - М., 2015 - 120 с.
-
Петрухин В.А., Бурумкулова Ф.Ф., Титова Т.В., Головченко М.А., Котов Ю.Б. Распространенность гестационного сахарного диабета в Московской области: резуль таты скрининга Российский вестник акушера-гинеколога. - 2012. - №4. - С. 81-84.
-
Diagnostic criteria and classification of hyperglycaemia first detected in pregnancy. - WHO Guideline. 2013.
-
Guidelines and recommendations for laboratory analysis in the diagnosis and management of diabetes mellitus. Washington (DC):National Academy of Clinical Biochemistry (NACB) - 2011. - 104 p.
-
International Association of Diabetes and Pregnancy Study Groups. International Association of Diabetes and Pregnancy Study Groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy // Diabetes Care. - 2010. - Vol. 335. - N 3. - P. 676-82.
ПОРАЖЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ ПРИ CАХАРНОМ ДИАБЕТЕ
Бондаренко И.З., Калашников В.Ю.
Сердечно-сосудистые заболевания в 75% случаев являются причиной госпитализаций и лидируют в структуре смертности среди заболевших СД.
Поражение сердца при СД является многокомпонентным и включает атеросклеротическую окклюзию коронарных артерий, микроангиопатию и метаболические нарушения в миокарде, лежащие в основе формирования кардиоваскулярной формы диабетической кардиомиопатии. Формирование атеросклеротической бляшки проходит следующие условные стадии: в интиме и подслизистом слое артерий эндотелий становится проницаемым, начинается адгезия и миграция моноцитов, появляются отдельные пенистые клетки, что приводит к появлению «липидных пятен». Последние начинают сливаться и увеличиваться в размерах, превращаясь в атерому с липидным ядром внутри. Атерома эвалюционирует в фиброатерому, состоящую из фиброзной ткани и большого количества солей кальция. Такая бляшка не стабильна и склонна к разрывам с формированием тромботических масс. Механизмы образования атеросклеротической или тромботической окклюзий схожи у пациентов с СД и без, но в условиях нарушения углеводного обмена они протекают быстрее, агрессивней и часто бессимптомно: в популяции СД инфаркт миокарда может стать дебютом ИБС. Помимо этого, существуют диабет-ассоциированные факторы риска, негативно влияющие на механизмы атеросклероза и атеротромбоза: гипергликемия и гликирование белков крови, гиперинсулинемия и инсулинорезистентность, нарушения в системе гемостаза, изменения в липидном спектре.
Прогноз пациентов с СД и ИБС определяется и сопутствующими заболеваниями: ожирение, АГ, прогрессирующая нефропатия, атеросклеротические изменения в других артериальных бассейнах. В отчете экспертов Национальной образовательной программы по холестерину США пациенты с СД 2-го типа приравнены к больным ИБС по вероятности развития сердечно-сосудистых осложнений.
Помимо традиционных механизмов формирования ишемии в миокарде, связанных с формированием атеросклеротической бляшки, существуют дополнительные сигнальные пути кислородного дефицита, такие как гипоксия-индуцированный фактор. Гипоксия-индуцированный фактор - это белок, состоящий из двух компонентов: 1b и 1a. При нормальном уровне кислорода гипоксия-индуцированный фактор-1a распадается. В условиях гипоксии распад белка прекращается, он накапливается внутри клетки и соединяется с гипоксия-индуцированным фактором-1b, образуя функциональный комплекс, запускающий транскрипцию индуцируемых гипоксией генов, следствием чего является уменьшение ишемии. При СД образование функционального комплекса гипоксия-индуцированного фактора нарушено, что приводит к дополнительному кислородному долгу в миокарде (рис. 10.8).
СД является фактором, стимулирующим развитие и прогрессирование артериальной кальцификации, или медиакальциноза. Этот процесс не является тождественным атеросклерозу: в его основе лежит формирование костной структуры, а не атеромы, он не зависит от уровня липидов и тесно связан с гипергликемией и инсулинорезистентностью. Медиакальциноз способен самостоятельно сужать просвет артерии, усугубляя течение ИБС.
Таким образом, поражение сердечно-сосудистой системы при СД является следствием нескольких составляющих. Принципиально важным является верификация диагноза ИБС, что позволит врачу сделать оптимальный выбор между медикаментозным, рентгенэндоваскулярным или хирургическим методами ее лечения.
Оценка сердечно-сосудистого риска при cахарном диабете
Рекомендательные базы большинства международных, а также российских рекомендаций по сердечно-сосудистым заболеваниям относят СД к группе высокого (в отсутствии ИБС) и очень высокого сердечно-сосудистого риска (при наличии подтвержденной ИБС или ее эквивалентов). Рабочая группа по диабету, предиабету и сердечно-сосудистым заболеваниям Европейского общества кардиологов (European Society of Cardiology - ESC) в сотрудничестве с Европейской ассоциацией по изучению диабета (European Association for the Study of Diabetes - EASD) не рекомендует у пациентов с СД оценивать вероятность наступления сердечно-сосудистого события по шкалам рисков, применяемых в общей популяции (табл. 10.20). В последние несколько лет разработаны модели специально для популяции СД, оценивающие длительность течения СД, возраст, пол, оптимальность контроля АГ, наличие фибрилляции предсердий, ретинопатии, соотношение «альбумин/креатинин» в моче, уровень липидного показателя холестерина ЛПВП, состояние компенсации углеводного обмена по уровню HbA1C .
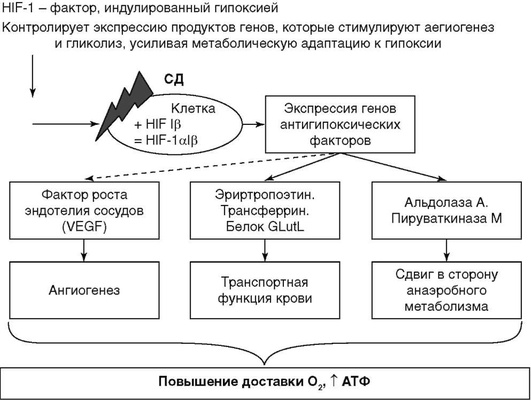
| Рекомендации | Класс рекомендаций | Уровень доказательности |
|---|---|---|
Следует рассматривать пациентов с СД как группу высокого и очень высокого риска сердечно-сосудистых осложнений |
IIa |
C |
Не рекомендуется использовать у больных СД шкалы прогнозирования риска, разработанные для общей популяции |
III |
C |
Рекомендуется оценивать степень микроальбуминурии при стратификации риска у больных СД |
I |
B |
Скрининг в отношении безболевой ишемии миокарда должен проводиться у больных СД очень высокого риска |
IIa |
C |
План обследования больных СД с подозрением на наличие ИБС не отличается от диагностики ИБС у больных без диабета. Нагрузочный тест на тредмиле или велоэргометре позволяет предположить или подтвердить наличие ИБС.
У пациентов с ортопедическими нарушениями и/или сопутствующими осложнениями СД, такими как пролиферативная ретинопатия, синдром диабетической стопы, облитерирующий атеросклероз артерий нижних конечностей, более оправдано проведение cтpecc-эxoкapдиoгpaфии с медикаментозным сопровождением (добyтaмин, реже дипиридамол). В этом случае ишемические изменения на ЭКГ индуцируются не физической нагрузкой, а медикаментозно.
Другой проблемой поражения сердечно-сосудистой системы при СД является высокий процент безболевой ишемии миокарда. Безболевая ишемия миокарда встречается у 20-35% страдающих СД и имеющих хотя бы 1 фактор сердечнососудистого риска: медиакальциноз, субклинический атеросклероз в сонных или периферических артериях, протеинурию, кардиоваскулярную форму автономной нейропатии. От 35 до 70% пациентов с бессимптомной ишемией миокарда по данным коронароангиографии имеют окклюзирующее поражение артерий сердца. В остальных случаях изменения на ЭКГ по ишемическому типу не могут быть объяснены коронарным атеросклерозом и, возможно, являются следствием нарушения функции эндотелия, развития микроангиопатии и кислородного дефицита в миокарде.
Необходимо отметить, что у бессимптомных пациентов рутинный скрининг безболевой ишемии миокарда поддерживается не всеми рекомендациями. Он не рекомендуется Американской диабетологической ассоциацией, так как не влияет на исходы заболевания, как только становятся модифицированными сердечнососудистые факторы риска. При наличии протеинурии, периферического атеросклероза, высокого содержания коронарного кальция или желания пациента выполнять интенсивные физические нагрузки необходимо индивидуальное обследование, после проведения которого решается вопрос о медикаментозном лечении или выполнении коронароангиографии.
Перспективными для оценки ишемических изменений в миокарде при СД являются инновационные технологии неинвазивной визуализации коронарных артерий: МСКТ коронарных артерий, ПЭТ (табл. 10.21). При появлении ишемических изменений на ЭКГ и/или нарушения локальной кинетики левого желудочка по данным нагрузочного теста проводится коронароангиография для решения вопроса о дальнейшей тактике лечения.
Отсутствие симптомов (скрининг) |
Симптомы ИБС |
Прогностическая ценность положительного результата |
Прогностическая ценность отрицательного результата |
|||
Предварительная вероятностьb ИБС |
||||||
низкая |
средняя |
высокая |
||||
Коронароангиография |
IIIA |
IIIA |
IIbA |
IA |
IA |
IA |
МСКТ |
IIIB |
IIbB |
IIaB |
IIIB |
IIbB |
IIaB |
МРТ |
IIIB |
IIIB |
IIIB |
IIIB |
IIIC |
IIIC |
Стресс-эхокардиография |
IIIA |
IIIA |
IA |
IIIAd |
IA |
IA |
Ядерно-магнитный резонанс |
IIIA |
IIIA |
IA |
IIIAd |
IA |
IA |
Стресс МРТ |
IIIB |
IIIC |
IIaB |
IIIBd |
IIaB |
IIaB |
ПЭТ |
IIIB |
IIIC |
IIaB |
IIIBd |
IIaB |
IIaB |
b Предварительная вероятность ИБС основывается на клинической картине.
d У пациентов с обструктивным поражением коронарных артерий, доказанным коронароангиографией (тест может быть полезен для определения стратегии и объема реваскуляризации миокарда).
Медикаментозная терапия стабильной ишемической болезни сердца при сахарном диабете
β-АДРЕНОБЛОКАТОРЫ
Эта группа ЛС доказала свою эффективность в предупреждении внезапной коронарной смерти в общей популяции. В настоящее время β-адреноблокаторы рекомендуются для длительного приема пациентам с перенесенным инфарктом миокарда, стабильной стенокардией, хронической сердечной недостаточностью и систолической дисфункцией левого желудочка. Влияние β-адреноблокаторов на прогноз жизни больных СД было впервые проанализировано в Норвежском многоцентровом исследовании, оценившем влияние неселективного β-адреноблокатора тимолола на выживаемость пациентов после инфаркта миокарда. Прием тимолола пациентами с СД сопровождался снижением летальности на 63% и повторного инфаркта миокарда - на 83%.
β-Блокаторы неоднородны по своему составу, имеют разные фармакологические профили и степень селективности к адренорецепторам. Некоторые из них обладают вазодилатирующими свойствами, опосредованными блокадой α-адренорецепторов (карведилол) или способностью к собственной стимуляции монооксида азота (небиволол).
Высокоселективный метопролол достоверно снижает сердечно-сосудистую смертность в общей популяции. Крупное многоцентровое исследование MERIT-HF (был включен 3991 пациент, из них 25% - пациенты с СД) подтвердило преимущество влияния метопролола на выживаемость у пациентов с хронической сердечной недостаточностью.
Исследование CIBIS-II посвящено изучению эффективности бисопролола в лечении недостаточности кровообращения. Исходно в исследование было включено более 2500 пациентов, имеющих тяжелую стадию сердечной недостаточности III-IV класса по NYHA (фракция выброса левого желудочка составила менее 35%), и оно было прекращено досрочно в связи с неоспоримым преимуществом назначения β-блокаторов в схему лечения пациентов, имеющих хроническую сердечную недостаточность. При отдельном анализе подгруппы больных СД 2-го типа, получавших бисопролол, оказалось, что риск смертности, включая гибель от сердечнососудистой патологии, был почти вдвое ниже, чем у лиц, не получающих лечение β-адреноблокаторами.
Карведилол блокирует β1 -, β2 - и α1 -рецепторы. Результаты крупных клинических исследований с участием карведилола доказали его высокую эффективность у пациентов с хронической сердечной недостаточностью. В исследовании GEMINI оценивалось гипотензивное действие карведилола и метопролола тартратρ у пациентов с СД 2-го типа и АГ (всего 1235 человек) и проанализирована эффективность этих препаратов в предупреждении прогрессирования микроальбуминурии как маркера сердечно-сосудистого риска. Анализ исследования GEMINI показал, что степень снижения АД при одновременном применении блокатора ренинан-гиотензиновой системы с карведилолом или метопрололом одинакова для обоих β-адреноблокаторов, но карведилол сдерживал развитие микроальбуминурии у лиц с СД 2-го типа и АГ в большей степени, чем метопролол тартратρ . Такой эффект карведилола может быть связан с его антиоксидантным действием и снижением сосудистой проницаемости в почечных клубочках. Карведилол оказался более эффективным и в метаболическом контроле: его α1 -блокирующие свойства улучшали чувствительность к собственному инсулину, что отражалось в отсутствии изменений уровня HbA1C при неизменной сахароснижающей терапии, в то время как на фоне приема метопролола этот показатель достоверно увеличился.
Приведенные исследования позволили ESC и EASD в 2006 г. рекомендовать селективные β-адреноблокаторы: метопролол, бисопролол и карведилол использовать как препараты первой линии для лечения сердечной недостаточности у больных СД 2-го типа.
БЛОКАТОРЫ РЕНИН-АНГИОТЕНЗИН-АЛЬДОСТЕРОНОВОЙ СИСТЕМЫ
При СД РААС играет ключевую роль в развитии как АГ и ДН, так и сердечнососудистых осложнений, таких как инфаркт миокарда, хроническая сердечная недостаточность, нарушение мозгового кровообращения. В связи с этим назначение блокаторов РААС является патогенетически обоснованным.
В Рекомендациях по лечению АГ Европейское общество гипертонии (European Society of Hypertension - ESH) и ESC, опубликованных в 2013 г., учтены данные новых рандомизированных клинических исследований, которые показали, что снижение АД ниже 130/80 мм рт.ст. у больных СД, так же как у других пациентов высокого сердечно-сосудистого риска, не обосновано. Блокаторы РААС (ИАПФ или БРА) широко применяются у больных СД в целях профилактики ДН или уменьшения ее выраженности. Но факт положительного воздействия на протеинурию не сопровождается снижением сердечно-сосудистых заболеваний при диабете. Согласно Рекомендациям ESH/ESC, гипотензивную терапию у больных СД следует начинать при уровне систолического АД более 140 мм рт.ст. При этом необходимо добиваться стойкого снижения систолического АД менее 140 мм рт.ст., диастолического АД менее 80-85 мм рт.ст. Поскольку ингибиторы ренинангиотензиновой системы доказали свою эффективность в профилактике протеинурии, целесообразно включать в комбинацию гипотензивной терапии ИАПФ или БРА. Вместе с ними целесообразно назначение тиазидовых диуретиков, что дает дополнительный гипотензивный эффект (табл. 10.22).
Кроме того, блокаторы РААС предотвращают развитие постинфарктного ремоделирования сердца. В основе ремоделирования сердечной мышцы лежит активация нейрогуморальных систем - симпатоадреналовой и РААС, поэтому ингибиторы РААС являются необходимой медикаментозной составляющей у пациентов, перенесших инфаркт миокарда, в том числе в популяции СД.
Согласно рекомендациям ESH/ESC, для лечения АГ могут использоваться все классы антигипертензивных средств, однако выбор лекарства для конкретного пациента должен учитывать имеющиеся осложнения СД. Чаще всего для оптимального контроля АГ назначается комбинированная терапия, включающая дополнительно антагонисты кальция, блокаторы имидазолиновых рецепторов и при необходимости α-блокаторы.
| Рекомендации | Класс рекомендации | Уровень доказательности |
|---|---|---|
В то время как назначение антигипертензивной медикаментозной терапии больным диабетом с систолическим АД ≥160 мм рт.ст. является обязательным, настоятельно рекомендуется начинать фармакотерапию также при систолическом АД ≥140 мм рт.ст. |
I |
A |
У больных СД рекомендуется целевое значение систолического АД <140 мм рт.ст. |
I |
A |
У больных СД рекомендуется целевое значение диастолического АД менее 85 мм рт.ст. |
I |
A |
У больных диабетом рекомендуется и можно использовать все классы антигипертензивных препаратов. Возможно, предпочтительны блокаторы ренинангиотензиновой системы, особенно при наличии протеинурии или микроальбуминурии |
I |
A |
Рекомендуется подбирать препараты индивидуально с учетом сопутствующей патологии |
I |
C |
Одновременное назначение двух блокаторов ренинангиотензиновой системы не рекомендуется, и у больных СД его следует избегать |
III |
B |
СТАТИНЫ
Впервые факторы, влияющие на вероятность развития сердечно-сосудистых событий в популяции СД 2-го типа, изучались в исследовании United Kingdom Prospective Diabetes Study. Как показало это исследование, декомпенсация углеводного обмена, оцениваемая по уровню HbA1C , является не первым и не основным фактором риска ИБС. Повышение концентрации холестерина ЛПНП на 1 ммоль/л увеличивало риск развития кардиоваскулярных заболеваний на 57%, а снижение холестерина ЛПВП на 1 ммоль/л уменьшало вероятности их наступления на 36%.
При СД имеются некоторые особенности дислипидемии, так называемая диабетическая триада, которая характеризуется гипертриглицеридемией, снижением концентрации холестерина ЛПВП, повышением количества мелких плотных частиц атерогенных ЛПНП; наличием гликозилированных ЛПНП и более высоким, чем в общей популяции, содержанием аполипопротеинов В. Кроме того, функционально неполноценны ЛПОНП, а также повышена концентрация мелких и плотных частиц ЛПВП и хиломикрон. Эти аномалии делают липидный профиль пациента с СД более атерогенным, чем у пациентов без СД.
В последние годы особое внимание уделяется холестерину не-ЛПВП, так как он связан с атерогенным аполипопротеином В и является интегральным показателем общего числа атерогенных частиц в плазме - ЛПОНП, липопопротеинов промежуточной плотности + ЛПНП, т.е. лучше отражает степень кардиоваскулярного риска по сравнению с уровнем холестерина ЛПНП, особенно у пациентов с СД [10].
Уровень холестерина не-ЛПВП высчитывается по формуле: общий холестерин - холестерин ЛПВП; совместно с апоВ является дополнительной терапевтической мишенью для гиполипидемической терапии [11]. Желательный уровень холестерина не-ЛПВП составляет <3,3 ммоль/л (менее ~130 мг/дл), уровень апопротеина B <100 мг/дл (табл. 10.23).
В Рекомендациях EASD/ESC [4] стратегия по первичной профилактике похожая, но есть дополнения.
В Рекомендациях Американской диабетической ассоциации (5), напротив, предлагается добиваться повышения концентрации холестерина ЛПВП более 1 ммоль/л для мужчин и более 1,3 ммоль/л для женщин, а также снижать уровень триглицеридов менее 1,7 ммоль/л. Однако класс рекомендации и уровень доказательности невысокий: IIB (желательно, но не обязательно). Данные рекомендации также придерживаются жесткой стратегии в отношении снижения холестерина ЛПНП в популяции СД: менее 1,8 ммоль/л или более 50% при невозможности достичь целевой уровень.
| Рекомендации | Класс рекомендаций | Уровень доказательности |
|---|---|---|
Всем больным СД 1-го типа с наличием микроальбуминурии и ХБП рекомендуется снижение уровня холестерина ЛПНП (минимум на 30%) назначением статинов в качестве средства выбора (в некоторых случаях показана комбинированная терапия) независимо от исходной концентрации холестерина ЛПНП |
I |
C |
У пациентов с СД 2-го типа и сердечно-сосудистыми заболеваниями или ХБП, а также у пациентов в возрасте >40 лет без сердечно-сосудистых заболеваний, но с наличием одного и более других факторов риска или с признаками поражения органов-мишеней рекомендуемый уровень холестерина ЛПНП составляет <1,8 ммоль/л (<70 мг/дл); дополнительными целями терапии являются уровни холестерина не-ЛПВП <2,6 ммоль/л (<100 мг/дл) и апопротеина B <80 мг/дл |
I |
B |
У пациентов с CД 2-го типа основной целью терапии является достижение уровня холестерина ЛПНП <2,5 ммоль/л (менее ~100 мг/дл). Дополнительными целями лечения является достижение уровня холестерина не-ЛПВП <3,3 ммоль/л (130 мг/дл) и уровня апопротеина B <100 мг/дл |
I |
B |
Резюме: в последних рекомендациях ESC/Европейского общества по изучению атеросклероза [11] стратификация риска представлена группами сердечно-сосудистого риска: очень высокий, высокий, умеренный и низкий риск. Медикаментозная профилактика, наряду с коррекцией модифицируемых факторов - ожирение, курение, оптимизация уровня АД и физических нагрузок, - рекомендуется пациентам высокого и очень высокого риска. Пациенты с СД без микрососудистых осложнений относятся к группе высокого риска, при наличии сердечно-сосудистого заболевания - очень высокого риска. В рекомендациях ESC/Европейского общества по изучению атеросклероза предлагается рассматривать медикаментозное снижение холестерина ЛПНП с целью первичной профилактики в случаях, когда общий сердечно-сосудистый риск высокий или очень высокий.
До 2012 г. целевой уровень холестерина ЛПНП для лиц с высоким риском составлял 2,5 ммоль/л, с 2012 г. считается важным снижать этот показатель ниже 1,8 ммоль/л. Такой же низкий уровень холестерина ЛПНП должен быть при проведении терапии у больных с очень высоким риском сердечно-сосудистых заболеваний.
В декабре 2013 г. вышли новые американские Рекомендации по дислипидемии Национальной образовательной программы по холестерину IV, в которых изменена стратегия профилактики сердечно-сосудистых заболеваний.
Выделены 4 группы для лечения статинами:
-
предлагается проводить терапию статинами умеренными и высокими дозами (2 режима приема статинов);
-
другая липидоснижающая терапия, кроме статинов: фибратов, никотиновой кислоты, эзетимиба, ω-3-полиненасыщенных жирных кислот, не рекомендуются, так как не снижает сердечно-сосудистые риски;
-
предложен новый калькулятор сердечно-сосудистого риска (Pooled Cohort Eguations), который, помимо традиционных факторов, учитывает расовую принадлежность и концентрацию холестерина ЛПВП. Последние Рекомендации Национальной образовательной программы по холестерину-IV в качестве первичной и вторичной профилактики сердечнососудистых заболеваний предлагают использовать только конкретные статины: розувастатин, аторвастатин и симвастатин как имеющие большую доказательную базу своего преимущества, в том числе в популяции СД (табл. 10.24).
| Интенсивный (снижение холестерина ЛПНП более 50%) |
|---|
Розувастатин 20 (40) мг |
Аторвастатин 40 (80) мг |
Умеренно интенсивный (снижение холестерина ЛПНП на 30-50%) |
Розувастатин 5 (10) мг |
Аторвастатин 10 (20) мг |
Симвастатин 20 (40) мг |
Согласно последним Рекомендациям Национальной образовательной программы по холестерину-IV, упрощается схема назначения статинов пациентам с СД 1-го и 2-го типа: при возрасте от 40 до 75 лет, отсутствии сердечно-сосудистых заболеваний - умеренная интенсивность терапии статинами, при наличии ИБС или ее эквивалентов - высокая интенсивность терапии статинами. При уровне холестерина ЛПНП более 4,9 ммоль/л высокоинтенсивная терапия статинами применяется в любом возрасте независимо от наличия или отсутствия ИБС. Однако окончательный выбор стратегии признается за клиницистом.
Остается спорным вопрос - исключение американскими экспертами понятия целевого уровня холестерина ЛПНП.
По мнению европейских и российских экспертов, целевые уровни являются важнейшим инструментом в повседневной клинической практике, помогая взаимодействию пациента и врача и улучшая приверженность терапии. Кроме того, подход к снижению риска в целом должен быть индивидуальным для каждого пациента.
При сравнении Европейских и Американских рекомендаций следует отметить, что они отличаются своими стратегиями по снижению липидов, но это не умоляет их общего акцента на важность снижения уровня холестерина ЛПНП в популяции СД (табл. 10.25).
| ESC/Европейская ассоциация по изучению диабета | Американский колледж кардиологии/ Американская ассоциация сердца | |
|---|---|---|
Первичная профилактика при СД |
СД в сочетании с другими факторами риска или поражением органов-мишеней: целевой уровень холестерина ЛПНП <1,8 ммоль/л или, при невозможности его достичь 50% снижение. Неосложненный СД (т.е. отсутствие микрососудистых поражений) - целевой уровень менее 2,5 ммоль/л |
СД с высоким риском: высокая интенсивность терапии статинами. СД с низким риском: умеренная интенсивность терапии статинами |
Российские рекомендации основаны на Европейских рекомендациях 2011 г., т.е. рассматривают пациентов с СД как группу высокого риска, при наличии сопутствующего сердечно-сосудистого поражения - очень высокого риска с соответствующим достижением уровня холестерина ЛПНП менее 1,8 ммоль/л.
ПОКАЗАНИЯ ДЛЯ ПРОВЕДЕНИЯ РЕВАСКУЛЯРИЗАЦИИ МИОКАРДА У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ И ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА
Применение интервенционного вмешательства проводится при сохранении симптомов стенокардии (или ее эквивалентов), несмотря на оптимальную медикаментозную терапию, и/или при наличии доказанных значимых стенозов ствола левой коронарной артерии, проксимальной трети передней межжелудочковой артерии, многососудистом поражении в сочетании с обширной зоной ишемии миокарда (табл. 10.26).
Ангиографические факторы, влияющие на прогноз |
Степень и локализация стеноза в коронарных артериях |
Класс рекомендаций |
Уровень доказательности |
Стеноз ствола левой коронарной артерии >50%b |
I |
A |
|
Стеноз проксимальной трети передней межжелудочковой артерии >50%b |
I |
A |
|
2- или 3-сосудистое поражение при наличии сниженной фракции выброса левого желудочкаb |
I |
B |
|
Стеноз >50% единственного функционирующего сосудаb |
I |
С |
|
Клинические факторы |
Наличие стеноза >50% при сохранении стенокардии или ее эквивалентов, несмотря на оптимальное медикаментозное лечение |
I |
A |
Одышка/симптомы хронической сердечной недостаточности при наличии более 50% стеноза коронарной артерии |
IIa |
B |
|
Отсутствие ограничивающих симптомов на оптимальной медикаментозной терапии |
III |
C |
Реваскуляризация миокарда в популяции СД проводится по тем же принципам, что и у пациентов без СД: выполняются баллонная ангиопластика коронарных артерий с имплантацией стентов с лекарственным покрытием или аортокоронарное шунтирование - аутовенозное и/или одностороннее или билатеральное маммарокоронарное шунтирование. Необходимость проведения реваскуляризации миокарда определяется для каждого пациента индивидуально, с учетом сопутствующих заболеваний, микро- и макрососудистых осложнений СД, а также предпочтений самого пациента.
После имплантции стентов с лекарственным покрытием проводится двойная антитромботическая терапия клопидогрелем в дозе 75 мг и ацетилсалициловой кислотой в дозе 75-100 мг в сутки, т.е. в тех же объемах, что и у пациентов без СД. Если эндоваскулярное лечение проводится экстренно (острый коронарный синдром) и пациент ранее не принимал клопидогрель, то должна быть применена нагрузочная доза 600 мг перед предполагаемым вмешательством:
-
в дальнейшем пациенты с имплантированным стентом должны принимать клопидогрель в дозе 75 мг не менее 12 мес, если нет высокого риска кровотечения; прием ацетилсалициловой кислоты проводится пожизненно;
-
перед имплантацией стента кардиолог должен объяснить пациенту необходимость длительной двойной антитромботической терапии и убедиться в приверженности пациента к лечению;
-
у больных, которым планируется проведение чрескожного коронарного вмешательства, но в силу каких-либо причин прием двойной антитромботической терапии может быть прерван в течение последующих 12 мес, рассматриваются другие варианты лечения ИБС: проведение ангиопластики или аортокоронарного шунтирования.
В специальном разделе Рекомендаций, посвященном больным СД, предложено:
В последних Рекомендациях ESC/EASD при эндоваскулярном лечении острого коронарного синдрома у пациентов с СД предпочтение отдается прасугрелу (не зарегистрирован в России) и тикагрелору (зарегистрирован в России) как альтернатива клопидогрелу.
Сердечно-сосудистая терапия и риск новых случаев возникновения сахарного диабета: соотношение «риск/польза»
Пациенты с СД составляют группу высокого и очень высокого риска сердечно-сосудистых осложнений. В настоящее время все международные и Российские рекомендации придерживаются тактики интенсивного снижения уровня холестерина ЛПНП, оптимизации медикаментозной терапии, направленной на уменьшение ишемии миокарда (β-адреноблокаторы, нитраты), коррекцию АД (блокаторы ренин-ангиотензиновой системы), пожизненный прием ацтилсалициловой кислоты.
В последние годы появились факты, что при всей неоспоримости в предотвращении сердечно-сосудистых событий и смертности у пациентов любой группы риска статины могут вызывать новые случаи СД в общей популяции. Чаще проблема дебюта СД на фоне приема статинов возникает у лиц с высокой вероятностью его развития. Так, в исследовании Jupiter было включено 17,8 тыс. мужчин и женщин без ИБС, с нормальным уровнем холестерина ЛПНП и повышенным уровнем С-реактивного белка. Пациенты были рандомизированы на получение розувастатина в дозе 10 мг или плацебо в течение 2 лет. Исходно целью Jupiter было доказать целесообразность назначения статинов пациентам с формально низким сердечно-сосудистым риском. И действительно, на фоне приема статинов достоверно уменьшилось количество нефатальных инфарктов миокарда, инсультов, реваскуляризирующих вмешательств на коронарных артериях, общей смертности. Более 65% участников исследования имели факторы риска развития СД: НТГ, ожирение. При субанализе данного исследования выявлено достоверное увеличение случаев заболевания СД у пациентов, имеющих хотя бы один фактор риска ее развития (табл. 10.27).
| Розувастатин | Плацебо | Δ | Относительный риск (95% доверительный интервал) | р | |
|---|---|---|---|---|---|
Нет факторов риска |
12 (0,18) |
12 (0,18) |
0 |
0,99 (0,45-2,21) |
0,99 |
1 и более факторов риска |
258 (2,12) |
204 (1,65) |
54 |
1,28 (1,07-1,54) |
0,01 |
Авторы Jupiter сделали вывод, что преимущества терапии статинами в отношении сердечно-сосудистых событий и смертности превышают риск, связанный с развитием СД, который чаще развивается у пожилых пациентов, имеющих факторы риска его дебюта. Относительный риск развития СД на фоне высоких доз статинов увеличивается на 12%, но относительный риск сердечно-сосудистых заболеваний снижается на 16%.
Еще одной группой препаратов, потенциально влияющих на углеводный обмен, являются β-адреноблокаторы. По итогам исследования the Carvedilol Or Metoprolol European Trial показано, что при пятилетнем наблюдении впервые выявленный СД у пациентов с хронической сердечной недостаточностью более часто выявляется при лечении метопрололом, чем при лечении карведилолом (оба препарата рекомендованы к применению в качестве приоритетных у пациентов с СД, имеющих хроническую сердечную недостаточность и систолическую дисфункцию миокарда). Предосторожность в отношении метопролола в популяции СД обозначена и в последних совместных Рекомендация ESH/ESC, опубликованных в 2014 г.: β-адреноблокаторы менее эффективны в отсрочке поражения органов-мишеней, чем ингибиторы ренин-ангиотензиновой системы, а также влияют на чувствительность к инсулину, особенно метопролол.
Пациентам с уже имеющимся СД необходимо проводить первичную и вторичную профилактику сердечно-сосудистых заболеваний, в том числе с применением статинов и β-адреноблокторов, особенно при наличии ИБС. У пациентов с факторами риска развития СД, пожилым пациентам назначение этих ЛС должно проводиться обоснованно, с тщательным мониторированием уровня гликемии и HbA1C .
Сахароснижающая терапия и сердечно-сосудистая безопасность
Согласно последним Рекомендациям EASD/ESC, в вопросах безопасности влияния различных стратегий сахароснижающей терапии на сердечно-сосудистую систему существуют определенные пробелы в знаниях, которые заключаются в том, что долгосрочные исходы сердечно-сосудистых заболеваний для большинства сахароснижающих стратегий пока не изучены. Уровень гликемии (гликемия натощак, 2 ч - глюкоза плазмы, HbA1C ), при котором сердечно-сосудистая система находится в благоприятных условиях, не известен, поскольку не было исследований с данным конкретным вопросом.
В крупных международных плацебо-контролируемых исследованиях Action to Control Cardiovascular Risk in Diabetes, Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation и Outcome Reduction with Initial Glargine Intervention доказано, что строгий контроль гликемии может предотвращать развитие микрососудистых осложнений СД, однако не приносит дополнительных преимуществ в отношении развития сердечно-сосудистых осложнений у больных СД. Более того, исследование Action to Control Cardiovascular Risk in Diabetes закончилось досрочно из-за достоверного увеличения сердечнососудистой смертности.
У пациентов с СД и ИБС, перенесших баллонную ангиопластику и стентирование коронарных артерий, риск развития повторных стенозов зависит от многих факторов: активности неоинтимальной интимы, лекарственного покрытия стента, области его имплантации и т.д., в том числе какая сахароснижающая терапия проводится. Наиболее безопасными являются бигуаниды и тиазолидиндионы, причем последние способны предотвращать формирование неоинтимальной интимы. Производные сульфонилмочевины, напротив, увеличивают вероятность развития рестеноза в коронарных артериях после эндоваскулярного лечения. Пациенты, находящиеся на инсулинотерапии, как правило, имеют более тяжелое поражение коронарных артерий и чаще нуждаются в повторной реваскуляризации миокарда.
Безопасность сахароснижающих препаратов, влияющих на секрецию инкретинов - иДПП-4 и глюкагонподобных пептидов-1, в настоящее время изучается. Опубликованы результаты крупного общенационального ретроспективного Датского регистра с включением 40 028 пациентов с СД, не имеющих сердечнососудистого анамнеза. Пациенты были рандомизированы в 3 группы: на получение стандартных схем терапии - метформин с препаратами сульфонилмочевины и метформин с инсулином, третью группу составили пациенты, получающие метформин с препаратами инкретинового ряда. Наблюдение длилось в течение 5 лет. Количество наступивших серьезных сердечно-сосудистых событий достоверно не различалось во всех трех группах. В Британском исследовании с включением 11 257 пациентов с СД сравнивались 2 стратегии снижения гликемии с применением метформина в сочетании с препаратами сульфонилмочевины и метформина в сочетании с иДПП-4. Исследование длилось в течение 6 лет. У пациентов, принимающих метформин и иДПП-4, общая и сердечно-сосудистая смертность наступали достоверно реже. В то же время есть данные, что препараты, влияющие на секрецию инкретинов, могут усугублять течение хронической сердечной недостаточности.
В целом новые сахароснижающие стратегии с применением инкретинов рассматриваются как безопасные и, возможно, полезные в отношении сердечнососудистой системы, учитывая их плейотропные эффекты: позитивное влияние на липидный профиль, снижение концентрации С-реактивного белка. Этот вопрос требует дальнейшего изучения.
СПИСОК ЛИТЕРАТУРЫ
-
Stratmann B., Tschoehe D. Pathobiology and cell interactions of platelet in diabetes // Diab. Vasc.Dis. Res. - 2005. - Vol. 2. - P. 16-23.
-
Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) // JAMA. - 2001. - Vol. 285. - P. 2486-2589.
-
Metabolism, hypoxia and the diabetic heart. Lisa C. Heather, Kieran Clarke. - January 2011.
-
ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD; the Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD). See comment in PubMed Commons below // Eur. Heart. J. - 2013 Oct. - Vol. 34 (39). - P. 3035-3087.
-
American Diabetes Association. Standards of medical care in diabetes - 2014 // Diabetes Care. - 2014. - Vol. 37 (suppl. 1). - P. S14-S80.
-
Guidelines on myocardial revascularization. The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) Developed with the special contribution of the European Association for Percutaneous Cardiovascular Interventions (EAPCI) Authors/ Task Force Members; Wijns W., Kolh Ph., Danchin N., Di Mario C., Falk V., Folliguet T., Garg S. et al., P. EACTS Clinical Guidelines Committee; Kolh Ph., Alfieri O., Dunning J., Elia S., Kappetein P., Lockowandt U, Sarris G, Vouhe P. // European Heart Journal (2010) doi; 10.1093/eurheartj/ehq277.
-
Norwegian Multicenter Study of Timolol after Myocardial Infarction) (Gundersen T., Kjekshus J. Timolol treatment after myocardial infarction in diabetic patients // Diabetes Care. - 1983. - Vol. 6. - P. 285-290.
-
Smith S.C., Allen J., Blair S.N., Bonow R.O., Brass L.M., Fonarow G.C. et al. National Heart, Lung, and Blood Institute. AHA/ACC guidelines for secondary prevention for patients with coronary and other atherosclerotic vascular disease; 2006 update; endorsed by the National Heart, Lung, and Blood Institute // J. Am. Coll. Cardiol. - 2006. - Vol. 47. - P. 2130-2139.
-
2013 ESH/ESC Guidelines for the management of arterial hypertension; the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // J. Hypertens See comment in PubMed Commons below. - 13 Jul. - Vol. 31 (7). - P. 1281-1357.
-
Robinson J.G., Wang S., Smith B.J., Jacobson T.A. Meta-analysis of the relationship between non-high-density lipoprotein cholesterol reduction and coronary heart disease risk // J. Am. Coll Cardiol. - 2009. - Vol. 53. - P. 316-322.
-
ESC/EAS Guidelines for the management of dyslipidaemias; The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS) // Atherosclerosis. - 217S (2011). - S1-S44.
-
Goff D.C. Jr, Lloyd-Jones D.M., Bennett G., Coady S., D’Agostino R.B. Sr., Gibbons R., Greenland P., Lackland D.T., Levy D., O’Donnell C.J., Robinson J., Schwartz J.S., Smith S.C. Jr, Sorlie P., Shero S.T., Stone N.J., Wilson P.W. 2013 ACC/AHA guideline on the assessment of cardiovascular risk; a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines // Circulation. - 2013. - doi; 10.1161/01.cir. 0000437741.48606.98.
-
Stone N.J., Robinson J., Lichtenstein A.H., Bairey Merz C.N., Blum C.B., Eckel R.H., Goldberg A.C., Gordon D., Levy D., Lloyd-Jones D.M., McBride P., Schwartz J.S., Shero S.T., Smith S.C. Jr, Watson K.,Wilson P.W.F. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults; a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines // Circulation. - 2013. - doi; 10.1161/01.cir. 0000437738.63853.7a.
-
Ridker P.M. et al. Lancet. - 2012. - Vol. 380. - P. 565-571. Метаанализ 5 исследований (Preiss D. et al. JAMA. - 2011. - Vol. 305. - P. 2556-2564).
-
Lexis C.P.H., Rahel B.M., Meeder J.G., Zijlstra F., van der Horst I.C.C. . The role of glucosae lowering agents on restenosis after percutaneous coronary intervention in patients with diabetes mellitus // Cardiovascular Diabetology. - 2009. - Vol. 8(41). doi:10.1186/1475-2840-8-41.
-
Mogensen U.M., Andersson C., Fosbol E.L., Schramm T.K., Vaag A., Scheller N.M., Torp-Pedersen C., Gislason G. & Kober L. Cardiovascular safety of combination therapies with incretin-based drugs and metformin compared with a combination of metformin and sulphonylurea in type 2 diabetes mellitus - a retrospective nationwide study // Diabetes, Obesity and Metabolism. - 2014. - Vol. 16. - P. 1001-1008.
-
Morgan C.L. Diabetes Obes Metab. - 2014 Apr 25. doi; 10.1111/dom. 12306.
ПОРАЖЕНИЕ ГЛАЗ ПРИ САХАРНОМ ДИАБЕТЕ
Липатов Д.В.
Диабетическая офтальмопатия - патологический процесс невоспалительного характера в глазу, обусловленный нарушением углеводного обмена. Наиболее характерное проявление диабетической офтальмопатии - диабетическая ретинопатия. Помимо этого, обнаруживают диабетическую катаракту, заболевания век (хронический блефарит, халазион, ячмени и др.), транзиторное нарушение остроты зрения (при значительных колебаниях гликемии) - все эти проблемы могут существовать у пациентов с СД как отдельно, так и в сочетании с диабетической ретинопатией.
ДИАБЕТИЧЕСКАЯ КАТАРАКТА
Диабетическая катаракта чаще локализуется ближе к задней капсуле хрусталика, нередко бывает двусторонней. Она патогенетически связана с неудовлетворительной компенсацией СД. В настоящее время широкое распространение получила факоэмульсификация помутневшего хрусталика с имплантацией эластичной интраокулярной линзы в сохраненную собственную капсулу хрусталика. Часто диабетическая катаракта характеризуется различной степенью несостоятельности связочно-капсулярного аппарата (подвывих различной степени). Для ее коррекции проводят дополнительную транссклеральную шовную фиксацию имплантируемой интраокулярной линзы. Имплантация в этих случаях переднекамерных интраокулярных линз и ирис-клипс линз с креплением к радужной оболочке нежелательна из-за возможности развития эпителиально-эндотелиальной дистрофии роговицы, передней пролиферации, возникновения рубеоза радужки и вторичной глаукомы.
ДИАБЕТИЧЕСКАЯ РЕТИНОПАТИЯ
Диабетическая ретинопатия - микрососудистое осложнение СД с поражением сосудов сетчатки (развитием микроаневризм, мягких и твердых экссудатов, кровоизлияний), проявляющееся экссудативными изменениями сетчатки, макулопатией и пролиферативным ростом новообразованных сосудов.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
Диабетическую ретинопатию обнаруживают у 85% больных СД 1-го типа с 20-летним стажем заболевания и в среднем диагностируют у 40% всех больных СД 1-го типа. Ретинопатию имеют 20% пациентов с СД 2-го типа уже в момент постановки диагноза СД. Диабетическая ретинопатия - самая частая причина слепоты у больных СД.
СКРИНИНГ
В настоящее время во всем мире придают большое значение скринингу диабетической ретинопатии. Регулярное обследование, контроль лечения и цифровая архивация полученных данных (состояния глазного дна) - «золотой стандарт» при ведении таких пациентов.
КЛАССИФИКАЦИЯ
В настоящее время принята классификация диабетической ретинопатии (рекомендованная ВОЗ), в соответствии с которой различают непролиферативную, препролиферативную, пролиферативную стадии и осложнения.
ПАТОГЕНЕЗ
Патогенез развития диабетической ретинопатии сложен и еще окончательно не ясен. Предполагают, однако, что наряду с нарушением обмена углеводов и других сопряженных с ним видов обмена в патогенезе диабетической ретинопатии принимают участие наследственные факторы. Установлено, что одним из основных факторов возникновения диабетической ретинопатии служит нарушение окислительно-восстановительных процессов в сетчатке. Локальные отеки в сетчатке, сужение капилляров и расширение вен приводит к появлению микроаневризм, точечных кровоизлияний и очагов роста новообразованных сосудов.
Прогрессируя, процесс распространяется на прилежащее стекловидное тело. Новообразованные сосуды сетчатки - источник кровоизлияний в стекловидное тело, что приводит к его задней отслойке. Полная отслойка стекловидного тела, когда задняя гиалоидная мембрана полностью отходит от заднего полюса глаза и подтягивается вперед, случается сравнительно редко. Чаще задняя гиалоидная мембрана отслаивается частично, сохраняя связь с диском зрительного нерва.
Нарушение проницаемости гематоофтальмического барьера приводит к миграции в стекловидное тело сосудистых факторов роста, которые запускают механизм клеточной пролиферации. Особенно активно рост пролиферативной ткани идет по задней гиалоидной мембране.
В случаях, когда полная отслойка стекловидного тела не произошла и задняя гиалоидная мембрана по всей поверхности прилежит к сетчатке, пролиферация может развиваться между сетчаткой и задней гиалоидной мембраной, продвигаясь по ее поверхности. В этих случаях могут возникать как преретинальные кровоизлияния, так и прорыв крови через заднюю гиалоидную мембрану в стекловидное тело с развитием в нем пролиферативных процессов.
Дальнейшее разрастание фиброзной ткани, конденсация и сокращение волокон стекловидного тела ведут к усилению тракций сетчатки и могут быть причиной массивных гемофтальмов, а иногда и отслойки сетчатки.
Пролиферативные процессы в переднем отрезке глаза характеризуются ростом новообразованных сосудов в радужной оболочке (рубеоз) и изменением угла передней камеры, что приводит к развитию вторичной (неоваскулярной или рубеозной) глаукомы.
КЛИНИЧЕСКАЯ КАРТИНА
Непролиферативная стадия диабетической ретинопатии характеризуется расширением вен и капилляров, микроаневризмами, множеством ретинальных кровоизлияний, экссудативных очагов, которые располагаются преимущественно в парамакулярной зоне (рис. 10.9, см. цв. вклейку).
Кровоизлияния имеют вид небольших точек или пятен округлой формы, темного цвета, располагаются в центральной зоне глазного дна или по ходу крупных вен в глубоких слоях сетчатки. Также возникают кровоизлияния штрихообразного вида. Твердые и мягкие экссудаты локализуются в основном в центральной части глазного дна и имеют желтый или белый цвет, четкие или расплывчатые границы. Важный элемент непролиферативной диабетической ретинопатии - отек сетчатки, располагающийся в центральной (макулярной) области или по ходу крупных сосудов (рис. 10.10). Зрение, как правило, не нарушено.
Препролиферативная стадия диабетической ретинопатии сопровождается более выраженными изменениями: множественные ретинальные кровоизлияния, большое количество твердых и мягких «ватообразных» экссудативных очагов в ишемизированных зонах (рис. 10.11, см. цв. вклейку, 10.12).
Картину глазного дна могут дополнять венозные аномалии (четкообразность, извитость, петли, удвоение и/или выраженные колебания калибра сосудов) и интраретинальные микрососудистые аномалии. Изменения на сетчатке захватывают не только парамакулярную, но и макулярную область, что сопровождается снижением остроты зрения.
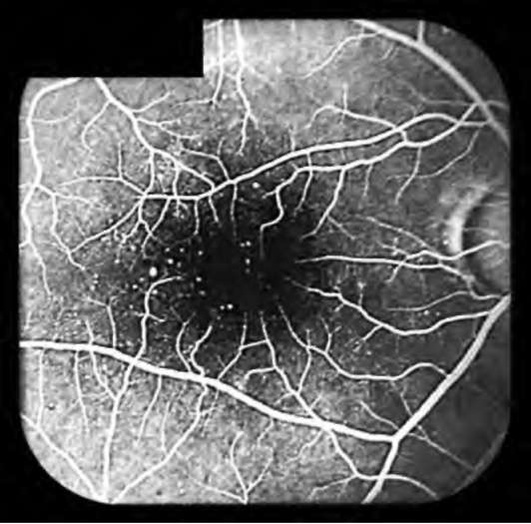
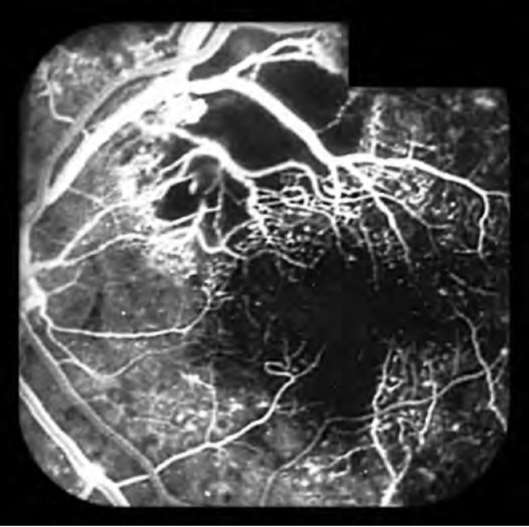
Пролиферативная стадия диабетической ретинопатии характеризуется появлением новообразованных сосудов не только по всему полю сетчатки (рис. 10.13, см. цв. вклейку), но и в области диска зрительного нерва, с их интенсивным проникновением в стекловидное тело (рис. 10.14, см. цв. вклейку).
В области преретинальных кровоизлияний происходит образование фиброзной ткани. Новообразованные сосуды весьма тонкие и хрупкие, поэтому часто возникают новые кровоизлияния. Повторные кровоизлияния в стекловидное тело с пролиферативным ростом новообразованных сосудов приводят к развитию витреоретинальных тяжей и тракционной отслойке сетчатки. При росте сосудов в радужной оболочке глаза возникает угроза развития вторичной рубеозной глаукомы.
Новообразованные сосуды заднего отдела глаза отличаются от нормальных сосудов сетчатки своими особыми свойствами, в том числе экстраретинальным ростом, ростом по поверхности задней гиалоидной мембраны, редукцией после удаления задней гиалоидной мембраны. Поэтому главная задача витреоретинальной хирургии при пролиферативной диабетической ретинопатии - полное удаление задней гиалоидной мембраны как субстрата для роста новообразованных сосудов.
ДИАГНОСТИКА
Диагностика диабетической ретинопатии базируется на основных офтальмологических методах исследования: визометрии, периметрии, тонометрии, биомикроскопии переднего отрезка глаза, прямой или обратной офтальмоскопии глазного дна. К специальным методам исследования относят УЗИ глазного яблока при помутнении хрусталика и стекловидного тела, флуоресцентную ангиографию, оптическую когерентную томографию и фотографирование глазного дна для архивации данных.
Следует отметить, что самым характерным офтальмоскопическим проявлением диабетической ретинопатии служат микроаневризмы - цилиндрические выпячивания и расширения капиллярных стенок, расположенные проксимально в венозных посткапиллярах сетчатки. Наряду с расширением капилляров и микроаневризмами при офтальмоскопии обнаруживают облитерацию капилляров и различной величины кровоизлияния. Микроаневризмы могут возникать и при гипертонической болезни или после тромбоэмболии сосудов сетчатой оболочки, но они, в отличие от микроаневризм при диабетической ретинопатии, располагаются, как правило, на периферии сетчатки, поражают прекапилляры, бывают более массивными и регрессируют.
ЛЕЧЕНИЕ
водного обмена по уровню HbA1C . Лечение диабетической ретинопатии, как и других поздних осложнений СД, базируется на оптимальной компенсации гликемии для данного пациента наряду с нормализацией показателей жирового, белкового и водно-солевого обмена.
В настоящее время доказано, что использование ангиопротекторов [винпоцетин (кавинтон♠ ), пентоксифиллин (трентал♠ ), этамзилат и др.] для лечения диабетической ретинопатии не только малоэффективно, но и опасно в плане возникающих осложнений.
Одним из эффективных методов лечения диабетической ретинопатии была и остается лазерная коагуляция сетчатки. Ее своевременное проведение в адекватном объеме позволяет стабилизировать процесс в 80-90% при непролиферативной и препролиферативной и в 50-60% случаев при пролиферативной стадии заболевания. Если патологический процесс ограничен отдельными участками, проводят фокальную лазерную коагуляцию сетчатки в пределах пораженных участков. При обширных изменениях и выраженной пролиферации применяют панретинальную лазерную коагуляцию сетчатки. Лечение проводят в несколько этапов (сеансов) под контролем флуоресцентной ангиографии. Цель лазерной коагуляции сетчатки - прекращение функционирования неполноценных новообразованных сосудов, которые представляют основную угрозу развития таких тяжелых осложнений, как гемофтальм, отслойка сетчатки, рубеоз радужки и вторичная глаукома. Значительные кровоизлияния, наличие плотных пролифератов в стекловидном теле, помутнение хрусталика затрудняют, а иногда делают невозможным проведение лазерной коагуляции сетчатки.
В последнее время было проведено множество исследований, подтвердивших роль эндотелиального сосудистого фактора роста в патогенезе диабетической ретинопатии. Показано, что использование антисосудистого эндотелиального фактора роста препаратов представляется перспективным в качестве эффективной терапии как в случае диабетического макулярного отека, так и при выраженных пролиферативных изменениях на глазном дне у пациентов с СД. Сейчас на территории Российской Федерации для интравитреального введения используется единственный антисосудистый эндотелиальный фактор роста - препарат ранибезумаб. Ведутся большие исследовательские работы по поиску новых ЛС и апробируются новые пути их введения для достижения большей эффективности.
В настоящее время применяют и другой эффективный метод лечения пролиферативной стадии диабетической ретинопатии - витрэктомию. Она показана при массивных, длительно не рассасывающихся гемофтальмах, отслойке сетчатки. Кровоизлияние на единственно видящем глазу и двусторонний гемофтальм считают также показанием к срочной витрэктомии. При тяжелой васкуляризации радужки, свежих кровоизлияниях в стекловидное тело и при общем тяжелом состоянии пациента от витрэктомии следует воздержаться. Для решения вопроса о тактике лечения, возможности проведения и выборе анестезии необходима согласованная работа офтальмолога, эндокринолога и анестезиолога.
ДИАБЕТИЧЕСКАЯ НЕЙРОПАТИЯ
Талстян Г.Р., Роживанов Р.В.
Диабетическая нейропатия - патогенетически связанное с СД сочетание синдромов поражения нервной системы, классифицируемое в зависимости от преимущественного вовлечения в процесс спинномозговых нервов (дистальная или периферическая диабетическая нейропатия) и (или) вегетативной нервной системы (висцеральная, или автономная, диабетическая нейропатия) при исключении других причин их поражения.
Согласно данному определению, диабетическим можно считать лишь тот тип повреждения периферической нервной системы, при котором исключены другие причины развития полинейропатии, например токсическое (алкогольное) поражение, другие заболевания эндокринной системы (гипотиреоз).
ЭПИДЕМИОЛОГИЯ
Частота развития различных форм нейропатии среди больных СД достигает 65-80%. Диабетическую нейропатию диагностируют в любом возрасте, однако клинические проявления чаще обнаруживают у лиц старше 50 лет. Практически с одинаковой частотой диабетическая нейропатия развивается у больных СД 1-го и 2-го типа. Самая частая форма поражения периферической нервной системы - диабетическая диффузная периферическая полинейропатия (около 80%). Вторая по частоте - автономная диабетическая нейропатия (обнаруживают у 15% больных СД на момент постановки диагноза и у 50% - через 20 лет после начала заболевания). Чаще всего страдает вегетативная иннервация сердечно-сосудистой системы.
КЛАССИФИКАЦИЯ
Диффузная нейропатия:
-
-
ЖКТ: атония желудка, диабетическая энтеропатия (ночная и постпрандиальная диарея);
-
сердечно-сосудистой системы: безболевой инфаркт миокарда, ортостатическая гипотония, нарушение ритма сердца;
-
половой системы: эректильная дисфункция, ретроградная эякуляция;
-
других органов и систем: нарушение зрачкового рефлекса, нарушение потоотделения, отсутствие симптомов гипогликемии.
-
Фокальная нейропатия:
Различают следующие стадии диабетической полинейропатии:
-
стадия I (субклиническая) - есть изменения периферической нервной системы, обнаруживаемые специальными количественными неврологическими тестами, при этом отсутствуют клинические признаки нейропатии;
-
стадия II - стадия клинических проявлений, когда наряду с измененными неврологическими тестами присутствуют симптомы нейропатии;
-
стадия III характеризуется выраженными нарушениями функции нервов, приводящими к тяжелым осложнениям, в том числе к развитию синдрома диабетической стопы.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Патогенез диабетической нейропатии до конца не ясен. Основной патогенетический фактор диабетической нейропатии - хроническая гипергликемия, приводящая в конечном итоге к изменению структуры и функции нервных клеток.
Вероятно, наиболее важную роль играют микроангиопатия (изменения vasa nervorum с нарушением кровоснабжения нервных волокон) и метаболические нарушения, к которым относят:
-
активизацию полиолового шунта (нарушение обмена фруктозы) - альтернативный путь метаболизма глюкозы, в результате чего она превращается в сорбит под действием альдозоредуктазы, затем во фруктозу; накопление сорбита и фруктозы ведет к повышению осмолярности межклеточного пространства и отеку нервной ткани;
-
снижение синтеза компонентов мембран нервных клеток, приводящее к нарушению проведения нервного импульса;
-
неферментативное и ферментативное гликозилирование структурных белков нервного волокна (миелина и тубулина), приводящее к демиелинизации и нарушению проведения нервного импульса; гликозилирование белков базальной мембраны капилляров вызывает ее утолщение и расстройство обменных процессов в нервных волокнах;
-
усиление окислительного стресса и угнетение антиоксидантной системы с последующим накоплением свободных радикалов (прямое цитотоксическое действие);
-
аутоиммунные процессы (по некоторым данным, антитела к инсулину перекрестно связывают фактор роста нервов, что ведет к атрофии нервных волокон).
КЛИНИЧЕСКАЯ КАРТИНА
Субклиническая стадия диабетической нейропатии
Клинические признаки отсутствуют. Нейропатию обнаруживают только с помощью специальных методов исследования. При этом возможно изменение результатов:
-
электродиагностических тестов: уменьшение проводимости нервного импульса в чувствительных и двигательных периферических нервах, снижение амплитуды индуцированных нервно-мышечных потенциалов;
-
тестов на чувствительность: вибрационную, тактильную, температурную;
-
функциональных тестов, характеризующих деятельность вегетативной нервной системы: нарушение функции синусного узла и ритма сердца, нарушение зрачкового рефлекса.
Клиническая стадия диабетической нейропатии
Диффузная нейропатия
-
Для дистальной симметричной нейропатии характерны:
-
боли (обычно умеренные, тупые и тянущие, преимущественно в стопах и голенях, усиливающиеся в покое, особенно в вечернее и ночное время суток и уменьшающиеся при физической нагрузке);
-
онемение, парестезии (в том числе ощущения «ползания мурашек», «поверхностного покалывания»), дизестезии (извращение чувствительности), аллодинии (неприятные или болевые ощущения от любого прикосновения одежды, постельных принадлежностей), гиперестезии, чувство жжения (чаще в подошвах);
-
нарушения чувствительности (вибрационной - самые ранние проявления; тактильной, болевой, температурной, мышечно-суставного чувства или проприоцепции в суставах дистальных фаланг больших пальцев обеих стоп); также может нарушаться генитальная чувствительность с развитием задержки эякуляции;
-
арефлексия (обычно выпадение ахиллова рефлекса с обеих сторон);
-
нарушения мышечно-суставного чувства в дистальных межфаланговых суставах больших пальцев ног;
-
Симптомы автономной диабетической нейропатии определяются локализацией поражения.
-
Для автономной диабетической нейропатии сердечно-сосудистой системы характерно:
-
безболевая ишемия и инфаркт миокарда (обнаруживают только с помощью ЭКГ);
-
сниженная вариабельность сердечного ритма, в том числе отсутствие адекватного прироста ЧСС при нагрузке, отсутствие изменений ЧСС при глубоком дыхании, опыте Вальсальвы, ортостатической пробе;
-
ортостатическая гипотензия (поражение симпатической иннервации).
-
-
При автономной диабетической нейропатии мочеполовой системы отмечают:
-
При автономной диабетической нейропатии других органов и систем возможны:
Фокальные нейропатии. Клинические проявления этих редких видов нейропатий определяются локализацией поражения.
-
Туннельные нейропатии. Связаны в первую очередь не с нарушением кровоснабжения или метаболизма нервов, а с их сдавлением в анатомически образованных «туннелях». Возможны туннельные синдромы со сдавлением срединного, локтевого, лучевого, бедренного, латерального кожного нерва бедра, малоберцового, а также медиального и латерального подошвенных нервов. Наиболее часто при СД обнаруживают синдром запястного канала (сдавление срединного нерва). Для туннельных синдромов характерны:
-
постепенное прогрессирование и отсутствие спонтанного выздоровления (в отличие от типичных мононейропатий);
-
клинические симптомы синдрома запястного канала включают парестезию большого, указательного и среднего пальцев; по мере прогрессирования заболевания обнаруживают снижение болевой чувствительности в этих пальцах, атрофию короткой мышцы, отводящей большой палец.
ДИАГНОСТИКА
Диагноз диабетической нейропатии ставят на основании соответствующих жалоб, наличия в анамнезе СД 1-го или 2-го типа, данных стандартизированного клинического обследования и инструментальных методов исследования, включающих количественные сенсорные, электрофизиологические (электромиография) и автономные функциональные тесты.
Жалобы и стандартизированное клиническое обследование
Для количественной оценки интенсивности болевых ощущений используют специальные шкалы: общую шкалу симптомов, визуальную аналоговую шкалу, шкалу Мак-Гилла, Гамбургский опросник по болевому симптому.
Инструментальные методы исследования
Большое значение инструментальных методов исследования нарушений чувствительности заключается в том, что они позволяют диагностировать диабетическую нейропатию еще до появления клинических признаков. Недостатком всех перечисленных ниже исследований служит их неспецифичность: указанные нарушения возможны при нейропатиях, не связанных с СД.
-
Оценку вибрационной чувствительности проводят градуированным камертоном (Riedel-Seifert с частотой колебаний 128 Гц) на кончиках больших пальцев обеих стоп троекратно с вычислением среднего значения (в норме: >6 условных единиц из 8).
-
Для оценки тактильной чувствительности используют монофиламент Semmes-Weinstein с силой воздействия 1, 2, 5, 10 г. В течение 1,5 с монофи-ламентом прикасаются перпендикулярно к поверхности кожи с давлением, достаточным для того, чтобы монофиламент изогнулся. Отсутствие ощущения прикосновения у больного свидетельствует о нарушении тактильной чувствительности.
-
Оценка болевой чувствительности: наносят легкие уколы притупленной иглой. Пробу считают положительной при наличии у пациента болевых ощущений.
-
Оценку температурной чувствительности проводят с помощью прибора Tip-Therm. Металлическим и пластмассовым концами прибора попеременно прикасаются к коже больного. Пробу считают положительной, если больной чувствует разницу в температуре поверхностей прибора.
Электромиография. Этот метод позволяет оценить состояние двигательных и чувствительных нервов верхних и нижних конечностей. При стимуляционной нейромиографии исследуют такие показатели, как амплитуда М-ответа, скорость распространения возбуждения, резидуальная латентность, позволяющие оценить выраженность нейропатии. Электронейромиографическое исследование, в частности стимуляционная электронейромиография, позволяет судить о нервно-мышечном проведении по крупным миелинизированным волокнам. Основные задачи, решаемые при проведении электронейромиографии: оценка состояния и функционирования мышцы, нервного аппарата, выявление изменений на уровне нервно-мышечной передачи. Метод позволяет получить полноценное представление о типе поврежденного нервного волокна и понять характер повреждений (аксонопатия, димиелинизация), что может также позволить проводить дифференциальную диагностику между различными заболеваниями. Поскольку электрофизиологическое исследование позволяет оценивать состояние крупных нервных волокон, использование данного метода для диагностики начальных изменений малоинформативно.
Пункционная биопсия кожи с количественной оценкой плотности интраэпидермальных нервных волокон, согласно рекомендациям Европейской ассоциации неврологических обществ, на сегодняшний день является «золотым стандартом» в диагностике повреждения тонких немиелинизированных волокон.
Конфокальная микроскопия роговицы - относительно новый неинвазивный метод, позволяющий диагностировать наличие повреждения тонких немиелинизированных нервных волокон и, следовательно, выявить начальные признаки повреждения нерва. Преимущество современных софокусных микроскопов заключается в возможности быстро получать качественные изображения различных слоев роговицы для дальнейшего анализа интересующих исследователей структур и получить количественную характеристику степени повреждения немиелинизированных малых нервных волокон.
-
Функциональные тесты автономной нервной системы. Для диагностики автономной диабетической нейропатии чаще всего используют сердечнососудистые тесты, в частности:
-
количественное определение вариабельности сердечного ритма при глубоком дыхании (в норме разница между ЧСС на вдохе и на выдохе >10 в минуту);
-
ортостатическая проба (измерение АД в положении лежа и после вставания). Пациент спокойно лежит на спине в течение 10 мин, после чего ему измеряют АД. Затем пациент встает, и АД ему измеряют на 2-й, 4-й, 6-й, 8-й и 10-й минутах. Падение систолического давления ≥30 мм рт.ст. считают патологическим, это свидетельствует о вегетативной кардиальной нейропатии с нарушением симпатической иннервации;
-
измерение АД при изотонической мышечной нагрузке. После определения исходного АД пациента просят в течение 5 мин сжимать ручной динамометр до 1/2 максимальной силы руки. Если при этом увеличение диастолического давления ≤10 мм рт.ст., это говорит о вегетативной нейропатии с поражением симпатической иннервации;
-
ЭКГ при опыте Вальсальвы. В норме при повышении внутрилегочного давления (натуживании) ЧСС увеличивается. При нарушении парасимпатической регуляции ЧСС этот феномен исчезает. На ЭКГ определяют наименьший и наибольший интервалы R-R. Отношение величины максимального R-R к минимальному <1,20 свидетельствует об автономной нейропатии.
-
Дополнительными методами диагностики автономной диабетической нейропатии служат суточное мониторирование ЭКГ по Холтеру и суточное мониторирование АД, рентгеноскопия желудка с контрастированием и без него, УЗИ органов брюшной полости, уродинамические исследования (УЗИ мочевого пузыря, урофлоуметрия).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Диабетическую нейропатию необходимо дифференцировать с нейропатиями иного генеза, в том числе алкогольной нейропатией, нейропатией при приеме нейротоксических ЛС (НПВС, нитрофураны, барбитураты, цитостатики и др.) или воздействии химических веществ (некоторые растворители, тяжелые металлы, инсектициды), нейропатией в рамках паранеопластического синдрома или синдрома мальабсорбции, узелковым периартериитом, нарушением секреции тиеоридных гормонов, психогенной болевой симтоматикой. При этом основную роль играет подробный сбор анамнеза, объективизация поражений нервной системы с учетом выявления характерных признаков и симптомов.
В клинической картине на первый план часто выступают признаки диабетической автономной нейропатии. Диагноз дисфункции того или иного органа или системы в результате вегетативной нейропатии считают диагнозом исключения.
У больных СД 2-го типа диабетическую радикулоплексопатию необходимо дифференцировать с заболеваниями сердца и органов брюшной полости.
ЛЕЧЕНИЕ
Основной мерой профилактики и лечения при диабетической нейропатии служит достижение и поддержание целевых значений гликемии (см. «Сахарный диабет»).
Патогенетическая терапия диабетической нейропатии [ингибиторы альдозо-редуктазы, γ-линолевая кислота, тиоктовая (альфа-липоевая♠ ) кислота, фактор роста нерва, аминогуанидин, ингибитор протеинкиназы С] по результатам рандомизированных клинических исследований не показала способности замедления или предотвращения прогрессирования повреждений периферической нервной системы на долгосрочной основе. Не было отмечено также существенного влияния так называемой патогенетической лекарственной терапии на течение клинической симптоматики, в частности облегчения тяжести нейропатических болей.
Лечение диффузных и фокальных нейропатий в основном симптоматическое (табл. 10.28).
При болях, помимо НПВС, используют местные анестетики. В случае неэффективности НПВС обезболивающий эффект могут оказывать антидепрессанты (трициклические и тетрациклические, селективные ингибиторы обратного захвата серотонина) или противосудорожные препараты. Также для купирования нейропатических болей используют нейростимуляционные методы лечения (чрескожную электрическую стимуляцию нерва, стимуляцию спинного мозга).
Для лечения автономной диабетической нейропатии применяют немедикаментозные и медикаментозные методы лечения.
-
При автономной нейропатии ЖКТ рекомендуют прием пищи небольшими порциями, при опасности развития постпрандиальной гипогликемии целесообразно перед едой выпить содержащий сахар напиток. Используют препараты, нормализующие моторику ЖКТ, антибиотики при атонии желудка. При диарее, связанной с диабетической энтеропатией, применяют антибиотики широкого спектра действия.
-
При автономной диабетической нейропатии сердечно-сосудистой системы с ортостатической гипотонией рекомендуют обильное питье, контрастный душ, ношение эластичных чулок, целесообразно несколько увеличить прием пищевой соли. С кровати и стула пациенту необходимо вставать медленно. При безуспешности таких мероприятий назначают минералокортикоиды. При аритмиях лечение проводят совместно с кардиологом.
-
При автономной диабетической нейропатии с нарушением функции мочевого пузыря используют катетеризацию, препараты, нормализующие функцию детрузора, такие как эфедрин, имипрамин (лечение проводят совместно с урологом). При эректильной дисфункции возможно использование алпростадила, препаратов ингибиторов фосфодиэстеразы 5 типа (силденафил, тадалафил, варденафил, уденафил) по стандартным схемам (в отсутствие противопоказаний). В случаях неэффективности фармакотерапии автономной урогенитальной нейропатии возможно проведение хирургического лечения: фаллопротезирования полового члена в случаях эректильной дисфункции и введения коллагеноподобного вещества в шейку мочевого пузыря в случаях ретроградной эякуляции. У больных с туннельными синдромами нередко приходится прибегать к хирургическому лечению с целью декомпрессии нерва.
Показания Группа ЛС Схемы лечения |
||
Лечение болевого синдрома |
||
При болях, вызванных диффузной или очаговой нейропатией |
НПВС и/или малые опиаты |
Парацетамол по 50 мг внутрь 2 раза в сутки |
Ибупрофен по 600 мг внутрь до 4 раз в сутки |
||
Кетопрофен по 50 мг внутрь 3-4 раза в сутки. Трамадол по 50 мг в сутки |
||
Дополнительно можно применять |
||
Раздражающие средства |
Капсаицин мазь/крем 0,075% местно наносить тонким слоем на кожу до 3-4 раз в сутки |
|
Местные анестетики |
Лидокаин гель 5% местно наносить тонким слоем на кожу до 3-4 раз в сутки |
|
Антидепрессанты |
Амитриптилин внутрь по 25-100 мг 1 раз в сутки (на ночь) |
|
Дулоксетин по 60-120 мг в сутки |
||
Флуоксетин внутрь по 20 мг 1-3 раза (начальная доза 20 мг/сут, дозу увеличивать на 20 мг/сут в неделю) |
||
Циталопрам по 20-60 мг 1 раз в сутки |
||
Противосудорожные ЛС |
Габапентин внутрь по 300-3600 мг в сутки. Прегабалин внутрь по 75-600 мг в сутки |
|
Карбамазепин внутрь по 200-600 мг 2-3 раза в сутки (максимальная доза 1200 мг/сут) |
||
Лечение автономной нейропатии |
||
При ортостатической гипотонии |
Минералокортикоиды |
Флудрокортизон внутрь по 0,1-0,4 мг 1 раз в сутки |
При нарушениях ритма (при этом целесообразно ведение пациента совместно с кардиологом) |
Антиаритмические ЛС |
Мексилетин внутрь по 400 мг, далее по 200 мг каждые 8 ч, после достижения эффекта по 200 мг 3-4 раза в сутки |
При атонии желудка |
Прокинетики |
Домперидон внутрь по 10 мг 3 раза в сутки |
Метоклопрамид внутрь по 5-10 мг 3-4 раза в сутки |
||
Дополнительно можно применять |
||
Антибактериальные ЛС |
Эритромицин внутрь по 0,25-1 г 4 раза в сутки |
|
При энтеропатии (диарее) |
Антибактериальные ЛС |
Доксициклин внутрь по 0,1-0,2 г 1 раз в сутки в течение 2-3 дней ежемесячно |
Дополнительно можно применять |
||
Антидиарейные ЛС |
Лоперамид внутрь по 2 мг, далее по 2-12 мг/сут до частоты стула 1-2 раза в сутки, но не более 6 мг на каждые 20 кг массы тела больного в сутки |
|
При урогенитальной нейропатии |
Препараты, нормализующие функцию детрузора и шейки мочевого пузыря |
Эфедрин (эфедрина гидрохлорида раствор для инъекций 5%♠) по 50 мг перорально ежедневно, имипрамин по 5-20 мг перорально ежедневно |
Дополнительно можно применять |
||
Препараты, стимулирующие развитие эрекции |
Алпростадил по 5-20 мкг интракавернозно за 30 мин до полового акта; или силденафил по 25-100 мг, или тадалафил по 5-20 мг, или варденафил по 5-20 мг, или уденафил по 150-200 мг перорально за 1 ч до полового акта. Альтернативно тадалафил 5 мг ежедневно |
|
При назначении НПВС необходимо помнить о возможном нефротоксическом действии, при этом отсутствие обезболивающего эффекта требует не увеличения дозы препаратов, а оценки причин неэффективности НПВС.
Не обосновано назначение так называемых патогенетических средств, включающих водорастворимые витамины группы В, антиоксиданты, препараты магния и цинка, а также другие средства, эффект которых при диабетической нейропатии не доказан клиническими испытаниями.
Об эффективности лечения диабетической нейропатии свидетельствует купирование болевого синдрома, устранение нарушений функций внутренних органов, обусловленных автономной диабетической нейропатией.
ПРОГНОЗ
Диабетическая нейропатия ухудшает прогноз больных СД. Это особенно относится к автономной диабетической нейропатии: поражение вегетативной иннервации сердечно-сосудистой системы в четыре раза повышает риск желудочковых аритмий (в том числе желудочковой тахикардии и фибрилляции желудочков) и соответственно внезапной смерти.
Компенсация СД (интенсифицированная инсулинотерапия, обучение пациентов) снижает риск развития клинических и электрофизиологических проявлений периферической нейропатии примерно на 50-56%. Также показано, что поддержание нормогликемии, контроль содержания холестерина, уровня АД в сочетании с приемом ИАПФ примерно в три раза снижает риск развития автономной диабетической нейропатии.
СПИСОК ЛИТЕРАТУРЫ
-
Дедов И.И., Мельниченко Г.А. Диабетическая нейропатия. Рациональная фармакотерапия заболеваний эндокринной системы и нарушений обмена веществ: Руководство для практикующих врачей. - М.: Литтерра, 2006.
-
Курбатов Д.Г., Галстян Г.Р., Роживанов Р.В., Лепетухин А.Е., Дубский С.А., Шварц Я.Г. Коррекция ретроградной эякуляции у больных сахарным диабетом 1-го типа // Андрология и генитальная хирургия. - 2013. - №3. - С. 44-47.
-
Gordois A. et al. The Health Care Costs of Diabetic Peripheral Neuropathy in the U. S. // Diabetes Care. - 2003. - Vol. 26. - P. 1790-1795.
-
Ziegler D. et al. Prevalence of polyneuropathy in pre-diabetes and diabetes is associated with abdominal obesity and macroangiopathy: the MONICA/KORA Augsburg Surveys S2 and S3. // Diabetes Care. - 2008. - Vol. 31. - P. 464-469.
-
Tesfaye S. et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments // Diabetes Care. - 2010. - Vol. 33. - P. 2285-2293.
-
Dyck P.J. et al. Signs and symptoms versus nerve conduction studies to diagnose diabetic sensorimotor polyneuropathy: Cl vs. NPhys trial // Muscle Nerve. - 2010. - Vol. 42. - P. 157-164.
-
American Diabetes Association. Clinical practice recommendations. 2014 Diabetic neuropathy. Standardized measures in diabetic neuropathy // Diabetes Care. - 2014. - Vol. 18. - P. 53-82.
-
Tavakoli M.I., Kallinikos P.A., Efron N., Boulton A.J.M. R., A. Malik. Corneal sensitivity is reduced and relates to the severity of neuropathy in patients with diabetes // Diabetes Care. - 2007. - Vol. 30, №7. - P. 18-20.
-
Tavakoli M., Quattrini C., Abbott C., Kallinikos P., Marshall A., Finnigan J., Morgan P., Efron N., Boulton A.J. M. R. Corneal confocal microscopy: a novel noninvasive test to diagnose and stratify the severity of human diabetic neuropathy // Diabetes Care. - 2010. -Vol. 33. - N 8. - P. 1792-1797.
-
Boulton A.J., Malik R.A. Diabetic neuropathy // Med. Clin. N. Am. - 1998. - Vol. 82. - N 4. - P. 909-929.
-
Consensus Statement. Report and recommendations of the San Antonio conference on diabetic neuropathy. American Diabetes Association American Academy of Neurology // Gaede P., Vedel P., Parving H.H., Pedersen O. Intensified multifactorial intervention in patients with type 2 diabetes mellitus and microalbuminuria: the Steno type 2 randomised study // Lancet. - 1999. - Vol. 353. - P. 617-622.
-
Greene D.A., Stevens M.J., Obrosova I., Feldman E.L. Glucose-induced oxidative stress and programmed cell death in diabetic neuropathy // Europ. J. Pharmacol. - 1999. - Vol. 375. - P. 217-223.
-
Neuropathies. Pathomechanism, clinical presentation, diagnosis, therapy / Ed. by P. Kempler. - Springer, 2002.
-
Sima A. F., Sugimoto K. Experimental diabetic neuropathy: an update // Diabetologia. - 1999. - Vol. 42. - P. 773-788.
-
Sindrup S.H., Jensen T.S. Efficacy of pharmacological treatments of neuropathic pain: an update and effect related to mechanism of drug action // Pain. - 1999. - Vol. 83. - P. 389- 400.
-
Somers D.L., Somers M.F. Treatment of neuropathic pain in a patient with diabetic neuropathy using transcutaneous electrical nerve stimulation applied to the skin of the lumbar region // Phys. Ther. - 1999. - Vol. 79. - P. 767-775.
-
UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34) // Lancet. - 1998. - Vol. 352. - P. 854-865.
-
UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33) // Lancet. - 1998. - Vol. 352. - P. 837-853.
-
UK Prospective Diabetes Study Group. Tight blood pressure control and risk of mac-rovascular and microvascular complications in type 2 diabetes: UKPDS 38 // Brit. Med. J. - 1998. - Vol. 317. - P. 703-713.
-
Zochodne D.W. Diabetic Neuropathies: Features and Mechanisms // Brain Pathol. - 1999. - Vol. 9. - P. 369-391.
ДИАБЕТИЧЕСКАЯ НЕФРОПАТИЯ
Шамхалова М.Ш., Шестакова М.В.
ДН - специфическое поражение почек при СД, сопровождающееся формированием узелкового или диффузного гломерулосклероза, приводящего к развитию терминальной почечной недостаточности, требующей проведения ЗПТ, таких как диализ или трансплантация почки. Наряду с ДН возможно развитие других вариантов почечной патологии (инфекция мочевых путей, хронический гломеру-лонефрит, лекарственный нефрит, атеросклеротический стеноз почечных артерий, тубулоинтерстициальный фиброз и др.), имеющих различные механизмы развития, динамику прогрессирования, методы лечения. Для унификации подходов к диагностике, лечению и профилактике почечной патологии, особенно в случаях минимальной выраженности и трудно устанавливаемой природы заболевания, был введен термин ХБП. Это наднозологическое понятие, обобщающее повреждения почек или снижение СКФ менее 60 мл/мин/1,73 м2 , персистирующие в течение более трех месяцев, независимо от первичного диагноза.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
Частота развития ДН тесно зависит от длительности заболевания, с максимальным пиком в сроки от 15 до 20 лет течения СД. Это особенно характерно для СД 1-го типа, у которого, как правило, известна точная дата дебюта заболевания. В первые 3-5 лет ДН у таких больных развивается редко, а через 20 лет - почти у 30%. Пик развития осложнения приходится на сроки от 15 до 20 лет с момента постановки диагноза СД, при этом весьма важен возраст начала заболевания. Максимальная частота ДН у лиц с дебютом в возрасте 11-20 лет, что связано с патологическим воздействием на почки возрастной гормональной перестройки организма. Распространенность ДН при СД 2-го типа менее изучена, прежде всего из-за неопределенности времени начала заболевания. СД 2-го типа развивается обычно у лиц старше 40 лет, когда специфическое поражение почек накладывается на исходно имеющиеся почечные заболевания, а также на структурные и функциональные возрастные изменения почек. Согласно данным Государственного регистра СД, распространенность ДН в среднем около 30% при СД 1-го типа и СД 2-го типа. ДН лидирует в структуре терминальной почечной недостаточности. Согласно Объединенной системе данных о донорских почках США (USRDS), в 2011 г. больные СД (преимущественно СД 2-го типа) в структуре терминальной почечной недостаточности в США составили 44,0%, Японии - 44,6%, Австралии - 35,5%, Португалии - 33,5%, Норвегии - 14,3%, Российской Федерации - 17,3%, Мексике - 48%. В России, по данным регистра Российского диализного общества на 2009 г., каждый девятый пациент на гемодиализе страдает СД, тогда как в США это каждый второй-третий. Менее учтенной и исследованной остается когорта больных СД с начальной и умеренной почечной недостаточностью, что затрудняет прогнозирование динамики распространенности терминальной почечной недостаточности и потребности в ЗПТ. Пятилетняя выживаемость больных СД, начавших лечение гемодиализом, наиболее низкая по сравнению с другими нозологическими группами, что свидетельствует о центральной роли гипергликемии в ускоренном формировании системных метаболических сдвигов, характерных для почечной недостаточности. Более высокие показатели выживаемости пациентам с СД обеспечивает трансплантация почки (особенно живой родственной), что позволяет рассматривать этот метод ЗПТ как оптимальный для данной категории больных.
ПРОФИЛАКТИКА
Профилактика ДН возможна только при своевременном определении и коррекции факторов риска развития и прогрессирования осложнения.
СКРИНИНГ
В ходе первого обследования пациентов определяется уровень креатинина сыворотки и рассчитывается СКФ по формуле CKD-EPI. Если СКФ <60 мл/мин/1,73 м2 , повторить исследование через 3 мес или ранее. В случайной порции мочи определяется отношение альбумин/креатинин. Если отношение альбумин/креатинин >30 мг/г (>3 мг/ммоль), повторить исследование через 3 мес или ранее. Если значения СКФ <60 мл/мин/1,73 м2 и/или отношение альбумин/креатинин >30 мг/г (>3 мг/ммоль) сохраняются по крайней мере 3 мес, диагностируется ХБП и проводится лечение. Если оба исследования соответствуют нормальным значениям, то их следует повторять ежегодно.
Группы риска развития ДН, которым необходимо проводить ежегодное мони-торирование альбуминурии и СКФ, представлены в табл. 10.29.
| Категории больных | Начало скринирования |
|---|---|
Больные СД 1-го типа, заболевшие в раннем детском возрасте и постпубертатном возрасте |
Через 5 лет от дебюта диабета, далее ежегодно |
Больные СД 1-го типа, заболевшие в пубертатном возрасте |
Сразу при постановке диагноза, далее ежегодно |
Больные СД 2-го типа |
Сразу при постановке диагноза, далее ежегодно |
Беременные на фоне СД или больные ГСД |
1 раз в триместр |
Стереотипное представление о ДН у больных СД 2-го типа может маскировать у них различные заболевания почек: одноили двусторонний атеросклеротический стеноз почечных артерий, тубулоинтерстициальный фиброз, инфекцию мочевых путей, интерстициальный нефрит, лекарственный нефрит и др. В связи с этим наряду с обязательными методами исследования для диагностики почечной патологии при СД (альбуминурия, осадок мочи, креатинин, калий сыворотки, расчет СКФ) проводятся дополнительные (дуплексное УЗИ почек и почечных сосудов; ангиография почечных сосудов для диагностики стенозирующего процесса, эмболии сосудов и др.) (табл. 10.30).
| Обязательные методы исследования | Дополнительные методы исследования |
|---|---|
Альбуминурия (в утренней порции мочи). Протеинурия в общем клиническом анализе мочи и в моче, собранной за сутки. Осадок мочи. Креатинин, мочевина, калий сыворотки. Расчет СКФ |
Дуплексное УЗИ почек и почечных артерий. Ангиография почечных артерий для диагностики стенозирующего процесса, эмболии сосудов и др. |
В случае затруднений этиологической диагностики почечной патологии и/или ее стремительного прогрессирования необходима консультация нефролога.
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ И КЛАССИФИКАЦИЯ
Согласно концепции ХБП, оценка стадии почечной патологии осуществляется по величине СКФ, признанной как наиболее полно отражающей количество и суммарный объем работы нефронов, в том числе связанной с выполнением неэкскреторных функций (табл. 10.31).
Последние данные позволили разделить сердечно-сосудистые и почечные риски в диапазоне 3 стадии ХБП (3а - СКФ 45-59 мл/мин/1,73 м2 и 3б - СКФ 30-44 мл/ мин/1,73 м2 соответственно), чему способствовали данные о депопуляции больных с почечной дисфункцией именно за счет кардиоваскулярных событий при относительно низкой ренальной смертности благодаря современным технологиям ЗПТ.
| Стадия | Определение | СКФ, мл/мин/1,73 м2 |
|---|---|---|
1 |
Высокая и оптимальная |
>90 |
2 |
Незначительно сниженная |
60-89 |
3а |
Умеренно сниженная |
45-59 |
3б |
Существенно сниженная |
30-44 |
4 |
Резко сниженная |
15-29 |
5 |
Терминальная почечная недостаточность |
<15 |
В 2007 г. соответствующие изменения были внесены в МКБ-10, в которой устаревший термин «ХПН» был заменен на термин «ХБП» (код 18). Коды N18.1-N18.5 следует использовать для обозначения стадий ХБП.
В широкой клинической практике для расчета СКФ могут быть использованы простые способы расчета клиренса креатинина, позволяющие обходиться без суточного сбора мочи (формулы Кокрофта-Голта, MDRD, CKD-EPI). Формула CKD-EPI лучше соотносится с данными, полученными референтными способами, что позволяет рекомендовать ее для амбулаторной практики. Показатель может быть рассчитан автоматически с помощью калькуляторов, представленных в Интернете (http://www.kidney.org/professional/kdoqi/gfr_calculator.cfm, http://nkdep.nih.gov/professional/gfr_calculator/index.htm).. При расчете СКФ по этой формуле учитываются раса, пол, возраст и уровень креатинина сыворотки, что позволяет преодолеть влияние различий в мышечной массе лиц разного возраста и пола, а также ошибку, связанную с активацией канальцевой секреции креатинина на поздних стадиях ХБП. Для расчета СКФ у детей применяются формулы Швартца и Коунахана на основе использования данных креатинина и роста. «Золотым стандартом» измерения СКФ остаются клиренсовые трудоемкие методики с введением экзогенного гломерулотропного тест-агента. Ситуации, когда необходимо воспользоваться стандартным измерением клиренса эндогенного креатинина (проба Реберга-Тареева) или другими клиренсовыми методами:
Уровень экскреции альбумина с мочой, отражающий системную эндотелиальную дисфункцию, состояние проницаемости гломерулярного барьера и реабсорбционную емкость проксимальных канальцев, является другим важным показателем почечной функции. Для количественного определения экскреции альбумина с мочой используются радиоиммунные, иммуноферментные и иммунотурбодимитрические методы. Альтернативным методом количественной оценки альбуминурии, не подверженным влиянию гидратации, служит измерение отношения «альбумин/креатинин» в нефиксированном по времени произвольном образце мочи. Предпочтительна первая утренняя порция мочи, наилучшим образом коррелирующая с 24-часовой экскрецией белка. Выделяют три категории альбуминурии (табл. 10.32).
Категория |
Альбумин/креатиинин мочи |
Скорость экскреции альбумина, мг/24 ч |
Описание |
|
мг/ммоль |
мг/г |
|||
А1 |
<3 |
<30 |
<30 |
Норма или незначительно повышена |
А2 |
3-30 |
30-300 |
30-300 |
Умеренно повышена |
А3 |
>30 |
>300 |
>300 |
Значительно повышена* |
* Включая нефротический синдром [экскреция альбумина >2200 мг/24 ч (альбумин/креатинин >2200 мг/г; >220 мг/моль)].
Традиционные градации альбуминурии: нормо- (<20 мкг/мин в утренней порции мочи), микро- (20-199 мкг/мин), макроальбуминурия (≥200 мкг/мин) - в настоящее время используются реже.
В рекомендациях Американской диабетической ассоциации 2014 г. представлены только две категории экскреции альбумина: нормальная (<30 мг/г) и повышенная (≥30 мг/г). В то же время понятия микро- и макроальбуминурии отнесены к историческим.
Необходимо помнить, что преходящее повышение экскреции альбумина возможно при следующих заболеваниях и состояниях:
Принятие новой классификации ХБП потребовало коррекции формулировки диагноза ДН с указанием стадии ХБП:
СКФ и альбуминурия необходимы для первичной диагностики патологии почек, контроля эффективности и безопасности терапии, скорости прогрессирования патологического процесса и определения прогноза.
Наличие ДН - важный независимый фактор риска развития сердечнососудистой патологии. По данным USRDS 2013, имеются значимые различия в частоте сердечно-сосудистой патологии у пациентов с ХБП и без ХБП независимо от возраста. Результаты исследований ACCOMPLISH, ALTITUDE, SHARP, Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation, ROADMAP, CARRESS-HF и некоторых других позволили признать ХБП независимым фактором риска развития сердечно-сосудистых заболеваний и эквивалентом ИБС по риску осложнений.
Популяционные данные свидетельствуют о высочайшем риске сердечнососудистой смертности у больных на ГД независимо от возраста, приравненном к риску сердечно-сосудистой смертности у больных в возрасте 80 лет и более. До 50% этих пациентов имеют асимптоматическую значимую ишемию миокарда. Факт снижения почечной функции вследствие развития ДН ускоряет развитие сердечно-сосудистой патологии, поскольку обеспечивает действие дополнительных нетрадиционных факторов риска атерогенеза: альбуминурии, системного воспаления, анемии, гиперпаратиреоза, гиперфосфатемии, дефицита витамина D и др.
Очевидна необходимость скрининга кардиоваскулярной патологии у всех больных СД и ДН.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
ДН - результат воздействия метаболических и гемодинамических факторов на почечную микроциркуляцию, модулируемый генетическими факторами.
-
Гипергликемия - основной инициирующий метаболический фактор развития ДН, реализующийся через следующие механизмы:
-
неферментативное гликозилирование белков почечных мембран, нарушающее их структуру и функцию;
-
прямое глюкотоксическое воздействие, связанное с активацией фермента протеинкиназы С, которая регулирует сосудистую проницаемость, контрактильность, процессы пролиферации клеток, активность тканевых факторов роста;
-
активацию образования свободных радикалов, обладающих цитотоксическим действием;
-
нарушенный синтез важнейшего структурного гликозаминогликана мембраны клубочка почки - гепарансульфата. Снижение содержания гепарансульфата приводит к потере базальной мембраной важнейшей функции - зарядоселективности, что сопровождается появлением микроальбуминурии, а в дальнейшем, при прогрессировании процесса, и протеинурии.
-
Гиперлипидемия - другой мощный нефротоксический фактор. Согласно современным представлениям, процесс развития нефросклероза в условиях гиперлипидемии аналогичен механизму формирования атеросклероза сосудов (структурное сходство мезангиальных клеток и гладкомышечных клеток артерий, богатый рецепторный аппарат ЛПНП, окисленных ЛПНП в том и другом случае).
Протеинурия - важнейший негемодинамический фактор прогрессирования ДН. При нарушении структуры почечного фильтра крупномолекулярные белки приходят в соприкосновение с мезангием и клетками почечных канальцев, что приводит к токсическому повреждению мезангиальных клеток, ускоренному склерозированию клубочков, развитию воспалительного процесса в интерстициальной ткани. Нарушение тубулярной реабсорбции - основной компонент прогрессирования альбуминурии.
АГ у больных СД 1-го типа развивается вторично вследствие диабетического поражения почек. У больных СД 2-го типа эссенциальная АГ в 80% случаев предшествует развитию диабета. Однако и в том, и в другом случае она становится наиболее мощным фактором прогрессирования почечной патологии, превосходя по силе своей значимости метаболические факторы. Патофизиологические особенности течения СД - нарушение циркадного ритма АД с ослаблением его физиологического снижения в ночные часы и ортостатическая гипотония.
Внутриклубочковая гипертензия - ведущий гемодинамический фактор развития и прогрессирования ДН, проявлением которой на ее ранних стадиях служит гиперфильтрация. Открытие этого феномена стало «прорывным» моментом в понимании патогенеза ДН. Механизм активируется хронической гипергликемией, вызывая вначале функциональные, а затем структурные изменения в почках, приводящие к появлению альбуминурии. Длительное воздействие мощного гидравлического пресса инициирует механическое раздражение прилежащих структур клубочка, способствующее гиперпродукции коллагена и накоплению его в области мезангиума (начальный склеротический процесс). Другим важным открытием было определение сверхвысокой активности локальной РААС при СД. Локальная почечная концентрация ангиотензина II в 1000 раз превышает его содержание в плазме. Механизмы патогенного действия ангиотензина II при СД обусловлены не только мощным вазоконстрикторным действием, но и пролиферативной, прооксидантной и протромботической активностью. В почках ангиотензин II вызывает внутриклубочковую гипертензию, способствует склерозированию и фиброзированию почечной ткани посредством выброса цитокинов и факторов роста.
Анемия - важный фактор прогрессирования ДН, ведет к почечной гипоксии, усиливающей интерстициальный фиброз, тесно коррелириующий со снижением почечной функции. С другой стороны, выраженная ДН приводит к развитию анемии.
Курение в качестве независимого фактора риска развития и прогрессирования ДН при остром воздействии ведет к активации симпатической нервной системы, влияя на АД и почечную гемодинамику. Хроническое воздействие никотина приводит к дисфункции эндотелия, а также к гиперплазии клеток интимы сосудов.
Риск развития ДН определенно детерминирован генетическими факторами. Только у 30-45% больных СД 1-го типа и СД 2-го типа развивается это осложнение. Генетические факторы могут действовать непосредственно и/или совместно с генами, влияющими на кардиоваскулярные заболевания, определяя степень восприимчивости органа-мишени к воздействию метаболических и гемодинамических факторов. Поиск ведется в направлении определения генетических дефектов, обусловливающих структурные особенности почек в целом, а также изучения генов, кодирующих активность различных ферментов, рецепторов, структурных белков, участвующих в развитии ДН. Генетические исследования (геномный скрининг и поиск генов-кандидатов) диабета и его осложнений сложны даже в гомогенных популяциях.
КЛИНИЧЕСКАЯ КАРТИНА
-
Симптомы ДН у большинства больных СД 1-го типа на ранних стадиях отсутствуют, редко отмечают эпизоды повышения АД. У больных СД 2-го типа ранние стадии ДН не имеет специфических клинических симптомов. Возможна АГ, при осмотре иногда можно обнаружить пастозность голеней и стоп.
-
На стадии ХБП 3 и более - нарастание и постоянно высокое АД у 80-90% больных, отеки стоп, голеней, иногда бедер, лица, слабость, быстрая утомляемость, проявления кардиоваскулярной патологии.
-
На стадии ХБП 5 (додиализная) - стабильно повышенное АД, задержка жидкости, выраженные стойкие отеки, тошнота, иногда рвота без облегчения состояния, зуд и желтушность кожных покровов, изменение ментального статуса на фоне уремической интоксикации, снижение диуреза.
АНАМНЕЗ И ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Подробный сбор анамнеза и тщательное обследование проводят у всех пациентов с СД (табл. 10.33).
ЛАБОРАТОРНЫЕ И ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
| Стадия ДН | Параметры контроля | Частота определений |
|---|---|---|
ХБП 1-3 А2 |
HbA1C |
1 раз в 3 мес |
Альбуминурия |
1 раз в 6 мес |
|
АД |
Ежедневно |
|
Креатинин и мочевина сыворотки |
1 раз в год |
|
СКФ |
1 раз в год |
|
Липиды сыворотки |
1 раз в год при нормальных значениях; 1 раз в 3 мес при лечении статинами |
|
Гемоглобин |
1 раз в год |
|
Железо сыворотки |
||
Ферритин сыворотки |
||
Насыщение трансферрина железом |
||
С-реактивный белок |
||
ЭКГ + нагрузочные тесты, ЭхоКГ |
Рекомендации кардиолога |
|
Глазное дно |
Рекомендации окулиста |
|
Осмотр стоп |
При каждом посещении врача |
|
ХБП 1-3 А3 |
HbA1C |
1 раз в 3 мес |
Протеинурия |
1 раз в 6 мес |
|
АД |
Ежедневно (утро-вечер) |
|
Креатинин и мочевина сыворотки |
1 раз в 6 мес |
|
СКФ |
1 раз в 6 мес |
|
Альбумин сыворотки |
1 раз в 6 мес |
|
Липиды сыворотки |
1 раз в 6 мес при нормальных значениях, 1 раз в 3 мес при лечении статинами |
|
Гемоглобин |
1 раз в 6 мес (чаще в начале лечения средствами, стимулирующими эритропоэз, и препаратами железа) |
|
Железо сыворотки |
||
Ферритин сыворотки |
||
Насыщение трансферрина железом |
||
С-реактивный белок |
||
ЭКГ + нагрузочные тесты, ЭхоКГ |
Рекомендации кардиолога |
|
Глазное дно |
Рекомендации окулиста |
|
Исследование автономной и сенсорной нейропатии |
Рекомендации невролога |
|
Осмотр стоп |
При каждом посещении врача |
|
ХБП 5 |
HbA1C |
1 раз в 3 мес |
Протеинурия |
1 раз в мес |
|
АД |
Ежедневно (утро, вечер) |
|
Креатинин, мочевина и калий сыворотки |
1 раз в 1 мес (чаще в начале лечения ИАПФ или БРА) |
|
СКФ |
1 раз в месяц |
|
Альбумин сыворотки |
1 раз в месяц |
|
Кальций плазмы (общий и ионизированный), фосфор |
1 раз в 3 мес |
|
Липиды сыворотки |
1 раз в 3 мес |
|
Гемоглобин |
1 раз в 3 мес (1 раз в мес при начале лечения средствами, стимулирующими эритропоэз, и препаратами железа) |
|
Железо сыворотки |
||
Ферритин сыворотки |
||
Насыщение трансферрина железом |
||
С-реактивный белок |
||
ПТГ |
1 раз в 3 мес |
|
Денситометрия |
1 раз в год |
|
ЭКГ + нагрузочные тесты, ЭхоКГ |
Рекомендации кардиолога |
|
Глазное дно |
Рекомендации окулиста |
|
Осмотр стоп |
При каждом посещении врача |
|
Консультация невролога |
1 раз в 6 мес |
|
Маркеры вирусных гепатитов |
1 раз в 6 мес |
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
При появлении протеинурии у больного СД с длительным анамнезом заболевания (более 10 лет), с выраженной диабетической ретинопатией и другими признаками микро- и макрососудистых осложнений диагноз ДН не вызывает сомнений. Заподозрить какое-либо альтернативное заболевание почек у больного СД можно в тех случаях, когда течение этого заболевания отличается от типичного течения ДН (табл. 10.34).
| ДН | Другое поражение почек |
|---|---|
Не развивается у детей с СД 1-го типа младше 10 лет |
Может развиться в раннем детском возрасте |
Протеинурия появляется через 8-10 лет от начала СД 1-го типа |
Протеинурия появляется менее чем через 5 лет от начала СД 1-го типа |
Постепенное нарастание протеинурии и постепенное снижение СКФ |
Быстрое нарастание протеинурии, внезапное развитие нефротического синдрома, быстрое снижение СКФ |
Скудный мочевой осадок (отсутствие гематурии и лейкоцитурии) |
Микро-(макро)гематурия, лейкоцитурия, зернистые цилиндры в моче |
Крупные почки (нефромегалия) даже на выраженной стадии |
Сморщенные почки на выраженной стадии |
Симметричное поражение почек (симметрия размера, экскреторной функции) |
Асимметричное поражение почек (кроме гломе-рулонефрита) |
Ретинопатия, невропатия |
Отсутствие других микрососудистых осложнений |
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
ДН, ХБП на стадии 1 (2, 3 или 4), альбуминурия 2.
ЛЕЧЕНИЕ
Показания к госпитализации
Стационарное лечение показано больным СД с ДН при:
Немедикаментозное лечение
Немедикаментозные методы лечения являются немаловажным компонентом нефропротективной терапии. Пациентам с ХБП следует рекомендовать активный образ жизни и физические нагрузки с учетом имеющихся сердечно-сосудистых заболеваний и толерантности (по крайней мере 30 мин физических упражнений 5 раз в неделю), снижение веса до оптимальных величин (ИМТ 20-25 кг/м2 ) и прекращение курения.
Всем больным ХБП рекомендуется консультация диетолога, а также обучение в рамках образовательных программ соответственно тяжести заболевания и необходимости ограничения поваренной соли, фосфатов, калия, продуктов, богатых пуринами, животными жирами и белком, в рационе.
Несмотря на ограниченный нефропротективный потенциал низкобелковой диеты (0,8 г/кг массы тела/сут), она имеет значение в усилении антипротеинурического эффекта ИАПФ и БРА II, снижении гемодинамической нагрузки на почки, уменьшении фильтрационной нагрузки белком с последующим отложением макромолекул в мезангиуме, предотвращении гиперфосфатемии, развитии метаболического ацидоза вследствие повышенного аммониогенеза, нарушения баланса вазоактивных простагландинов. Согласно рекомендациям Kidney Disease Improving Global Outcomes, ограничение животного белка необходимо пациентам с СКФ <30 мл/мин/1,73 м2 при соответствующем обучении. В то же время прием белка в дозе 1,3 г/кг массы тела/сут считается недопустимым у лиц с ХБП и высоким риском прогрессирования патологии. Умеренное ограничение белка в диете, как правило, не приводит к катаболизму собственных белков и развитию отрицательного азотистого баланса. Для обеспечения энергетических потребностей организма допускается расширение углеводного рациона больных при обязательном контроле за гликемией. Низкобелковая диета противопоказана при острых инфекционных заболеваниях, детям, подросткам и беременным.
Ограничение потребления соли и натрийсодержащих продуктов относится к немедикаментозным методам коррекции АД. При нормальных значениях АД следует ограничивать употребление соли до 5-6 г в сутки, при повышении АД (даже умеренном) - до 3 г в сутки. Потребление соли до 3 г/сут необходимо для адекватного контроля АД, повышения эффективности терапии ИАПФ и БРА.
Больным с почечной недостаточностью и уровнем калия более 5 ммоль/л рекомендуется исключить из питания продукты с высоким содержанием калия. Усугублять гиперкалиемию могут инфекция, лихорадка, травма, операция, гемолиз, прием калийсберегающих диуретиков, ацидоз. Гиперфосфатемия требует ограничения продуктов, богатых фосфором (рыбы, твердые сыры, гречка).
Рекомендация по прекращению потребления никотина не должна носить формальный характер. Необходимо достичь понимания важности ее регулярного выполнения больными СД для профилактики развития и прогрессирования почечной патологии.
Медикаментозное лечение
Компенсация углеводного обмена играет ключевую роль в профилактике развития и замедлении прогрессирования ХБП у больных СД. Роль контроля гликемии для профилактики развития и прогрессирования ДН убедительно показана в крупнейших исследованиях: Diabetes Control and Complications Trial, United Kingdom Prospective Diabetes Study, Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation.
Контроль гликемии становится проблематичной на выраженных стадиях ХБП в силу ряда причин. Это, прежде всего, риск гипогликемии вследствие снижения ренального глюконеогенеза и кумуляции инсулина и антигликемических агентов и их метаболитов. Риск гипогликемий может превысить преимущества гликемического контроля (вплоть до развития жизнеугрожающих аритмий).
Кроме того, достоверность HbA1C как показателя компенсации углеводного обмена на поздних стадиях ХБП, часто сопровождающихся анемией, ограничена из-за уменьшения периода полужизни эритроцитов, изменения их свойств под действием метаболических и механических факторов, влияния терапии. Ситуация усложняется тем, что выраженная гипергликемия, изменяя функциональные свойства мембраны эритроцитов и гемоглобина и соответственно приводя к гипоксии, ускоренной деструкции красных кровяных клеток, их повышенной адгезии к эндотелию, сама по себе может способствовать уменьшению периоду полужизни эритроцитов. Тем не менее необходимость контроля гликемии на всех стадиях ХБП очевидна при большой осторожности при его интенсификации с учетом повышенного риска кардиоваскулярной смертности в соответствии с выраженностью почечной дисфункции.
Последние рекомендации Kidney Disease Improving Global Outcomes рассматривают гликемический контроль как часть мультифакторной интервенционной стратегии, направленной на контроль АД и кардиоваскулярного риска. В рекомендациях Национального почечного фонда США определены целевые уровни HbA1C у лиц с СД и ХБП с учетом имеющихся рисков:
Согласно Алгоритмам специализированной медицинской помощи больным СД, для пациентов с выраженными осложнениями, сопутствующей патологией, небольшой ожидаемой продолжительностью жизни, риском гипогликемий целевое значение HbA1C <8,0%.
Инсулинотерапия как наиболее эффективная обеспечивает наибольшее снижение HbA1C . На 4-5 стадиях ХБП потребность в инсулине может снижаться в силу замедления его деградации, снижения уровня катехоламинов, ренального глюконеогенеза, изменения нутритивного статуса с гипопротеинемией, что требует соответствующей редукции дозы. Важно отметить частоту автономной нейропатии у пациентов с ХБП, проявляющуюся в том числе нераспознаванием «гипо». Следует отметить предпочтительность аналогов инсулина для этой группы пациентов с учетом их преимуществ по минимизации риска гипогликемий и необходимость мониторирования гликемии. Меньше внимания уделяется вопросам возможности развития инсулинорезистентности с соответствующим повышением потребности в инсулине на выраженных стадиях ХБП под влиянием уремических токсинов, гиперпаратиреоза, дефицита витамина D, ожирения, содержания глюкозы в диализных растворах.
Совместный Консенсус Американской диабетической ассоциации и EASD по лечению больных СД 2-го типа от 2006 и 2009 г. и новая версия этого документа от апреля 2012 г. предлагают использовать метформин как препарат выбора при лечении СД 2-го типа, поскольку его применение ассоциировано со снижением риска кардиоваскулярной патологии, общей смертности, инсулинорезистентности, низким риском гипогликемий и прибавки массы тела. До недавнего времени применение препарата было ограничено при снижении СКФ менее 60 мл/мин/1,73 м2 в связи с риском лактоацидоза. Однако, как показали последние исследования, риск развития этого осложнения завышен и в основном связан с гипоксическими состояниями. Авторы, проводившие анализ 347 исследований с участием больных СД 2-го типа, не обнаружили свидетельств повышения риска развития лактатацидоза при приеме метформина в сравнении с другими сахароснижающими препаратами. Неоправданная и преждевременная отмена метформина может ухудшить контроль гликемии и привести к необходимости назначения других сахароснижающих агентов, имеющих свои проблемы безопасности. Руководящие принципы для использования метформина в США начали обновляться в 2011 г. и были согласованы с таковыми Национального института здоровья Великобритании, Канадской диабетической ассоциацией и Австралийским обществом диабета. Поэтому современные рекомендации расширили возможности применения метформина, включая лиц с ХБП 3-й стадии с учетом других ограничений (анемия, сердечная, легочная недостаточность, дисфункция печени, дегидратация, контрастные процедуры) и соответствующей редукцией дозы, а также мониторированием функции почек. Важно отметить, что не рекомендуется инициировать терапию метформином на стадии ХБП 3в.
Гипогликемические эффекты препаратов группы сульфонилмочевины усиливаются на фоне снижения СКФ из-за аккумуляции активных метаболитов. Другие факторы могут вносить свой вклад в повышение риска гипогликемий - высокие дозы, пропуск приема углеводов, недостаток питания, сниженный аппетит, чрезмерный прием алкоголя, печеночная дисфункция, сердечная недостаточность, пожилой возраст, взаимодействие с другими препаратами [ацетилсалициловая кислота (аспирин♠ ), сульфаниламиды, гемфиброзил, варфарин и др.], которые способны вытеснять сульфонилмочевинные препараты в плазме из их связи с белками. При развитии почечной патологии (включая ХБП 4-й стадии) возможно применение гликлазида, глимепирида, гликвидона в редуцированной дозе при условии адекватного контроля гликемии.
Представитель группы глинидов, обладающих стимулирующим влиянием на секрецию инсулина (менее выраженную, чем сульфонилмочевинные препараты и соответственно с меньшим риском гипогликемий), - репаглинид, метаболизируется в основном в печени. Применение этого препарата не противопоказано у лиц с ХБП, включая диализных.
Глитазоны обладают не только сахароснижающим эффектом, благодаря повышению чувствительности к инсулину, но и прямым подоцитопротективным влиянием, независимым от гликемии, подтвержденным в экспериментальных и клинических исследованиях при недиабетических почечных повреждениях, что делает их весьма привлекательными для больных с СД и ХБП. Но установленные ассоциации при применении этих препаратов с задержкой жидкости, прибавкой массы тела, ухудшением сердечной недостаточности (часто сочетающейся с почечной патологией в рамках нефрокардиального синдрома), остеопорозом, особенно у менопаузальных женщин, раком мочевого пузыря, сужают показания по их применению. Несмотря на низкий риск гипогликемий и особенности фарма-кокинетики, не требующей альтерации дозы, глитазоны требуют очень большой осторожности при применении у лиц с СКФ менее 60 мл/мин/1,73 м2 .
Ингибиторы α-глюкозидазы имеют ограниченный гипогликемический эффект при побочных явлениях (газообразование, диарея), ограничивающих их применение. Эти препараты не рекомендуются при снижении почечной функции.
Поиск средств контроля углеводного обмена, соответствующих современным требованиям эффективности и безопасности у лиц с ХБП, определяет повышенный интерес к возможностям инновационных препаратов инкретинового ряда. Они дополняют терапевтический арсенал клинициста благодаря улучшению функции β-клеток, усилению глюкозозависимой секреции инсулина с низким риском гипогликемии, подавлению повышенной секреции глюкагона, благоприятным сердечно-сосудистым эффектам, способности контролировать массу тела. Особого внимания при применении аГПП-1 у пациентов с ХБП заслуживают гастроинтерстинальные проблемы (гастропарез, энтеропатия и другие, чаще развивающиеся при применении эксенатида), снижающие качество жизни, осложняющие контроль гликемии, влияющие на нутритивный статус. Применение аГПП-1 может усугубить эти проблемы ввиду потенциальной способности снижать моторику желудка и всасывания не только глюкозы, но и препаратов, требующих точного контроля концентрации (иммуносупрессантов у лиц с трансплантированной почкой). Комбинация ИАПФ и диуретиков - необходимая нефропротективная терапия при ХБП у больных СД 2-го типа - требует особой бдительности при назначении эксенатида ввиду возможного усугубления почечной дисфункции при развитии побочных эффектов. У пациентов со СКФ 30-50 мл/мин/1,73 м2 требуется осторожное назначение препарата под контролем функции почек. Лицам со СКФ менее 30 мл/мин/1,73 м2 эксенатид противопоказан. Другой препарат группы аГПП-1 - лираглутид, обладающий 97% гомологичностью с человеческим ГПП-1, демонстрирует близкие с эксенатидом эффекты при меньшей выраженности побочных эффектов и большим периодом полувыведения, позволяющим вводить препарат 1 раз в день. Применение лираглутида у лиц с ХБП и терминальной почечной недостаточностью (на перитонеальном диализе) не продемонстрировало значимого повышения его экспозиции и риска развития побочных эффектов. Требуют особого внимания пациенты с гипоальбуминемией, поскольку 98% препарата связывается с белками крови. Опыт применения лираглутида у пациентов с умеренной почечной недостаточностью пока ограничен. В настоящее время применение препарата у пациентов с тяжелыми нарушениями функции почек, в том числе с терминальной почечной недостаточностью, противопоказано.
иДПП-4 заняли достойное место в международных и отечественных рекомендациях по лечению больных СД 2-го типа. Определена эффективность и безопасность этих средств для лиц с нормальной функцией почек. В сравнении с другими гипогликемизирующими средствами иДПП-4 демонстрируют при монотерапии меньший риск гипогликемий и возможных побочных гастроинтерстинальных эффектов, что делает их весьма привлекательными для контроля гликемии в условиях развивающейся почечной патологии. Применение этих препаратов при нарушении функции почек зависит от стадии ХБП. Следует особо отметить, что субстратами ДПП-4, помимо инкретинов, является ряд пептидов с известными кардиоваскулярными эффектами - BNP, NPY, PYY, SDF-1альфа, что открывает новые перспективы, помимо влияния на гликемический контроль, связанные с кардио- и нефропротективными свойствами.
Опубликованные результаты исследований свидетельствуют об эффективности и безопасности применяемых сегодня иДПП-4 (ситаглиптин, вилдаглиптин, саксаглиптин, линаглиптин) при монотерапии и присоединении к текущей сахароснижающей терапии у лиц со сниженной СКФ (включая лиц на диализе), сопоставимой с плацебо частотой нежелательных явлений, имеющих потенциальное отношение к самим препаратам, а также к функции почек, сердечно-сосудистой системы и частоте гипогликемий.
В ряду новых препаратов, активно разрабатываемых фармацевтическими компаниями, - селективные ингибиторы канальцевой реабсорбции глюкозы (глифлозины). Применение этих препаратов позиционируется с усилением натрий-уреза с последующим умеренным снижением АД посредством влияния на РААС (вероятно, повышая эффективность блокады этой системы) и снижением массы тела при усилении глюкозурии без повышенного риска гипогликемий. Наряду с этими позитивными эффектам препараты демонстрируют ряд побочных эффектов, осложняющих их применение, прежде всего частота мочевой и генитальной инфекций, крайне нежелательных у лиц с диабетом и поражением почек.
Рекомендации по коррекции доз сахароснижающих препаратов в зависимости от стадии ХБП представлены в табл. 10.35.
| Препараты | Стадии ХБП |
|---|---|
Метформин |
1-3б |
Глибенкламид (в том числе микронизированный) |
1-2 |
Гликлазид (гликлазид МВ♠) |
1-4* |
Глимепирид |
1-4* |
Гликвидон |
1-4 |
Глипизид (глипизид GITSρ) |
1-4 |
Репаглинид |
1-4 |
Пиоглитазон |
1-4 |
Росиглитазон |
1-4 |
Ситаглиптин |
1-5* |
Вилдаглиптин |
1-5* |
Саксаглиптин |
1-5* |
Линаглиптин |
1-5 |
Эксенатид |
1-3а |
Лираглутид |
1-3а |
Акарбоза |
1-3а |
Инсулины |
1-5* |
* Коррекция дозы препарата при ХБП 4 и 5.
АГ играет ключевую роль в развитии и прогрессировании ДН, так же как и в развитии макроваскулярной патологии, что требует оптимизации контроля АД. По мере прогрессирования ДН роль метаболических факторов снижается, и возрастает роль гемодинамических (АГ, внутриклубочковая гипертензия).
В международных рекомендациях ESH/ESC 2013 г. по АГ сформулированы целевые уровни АД у больных с ХБП (табл. 10.36).
Анализ результатов исследований, в которых больные ХБП были рандомизированы для достижения более низкого (<125-130 мм рт.ст.) и более высокого (<140 мм рт.ст.) целевого уровня систолического АД, не выявил различий между группами по риску развития почечной недостаточности или смерти.
С позиций доказательной медицины у пациентов с диабетической и ДН уровень целевого систолического АД составляет <140 мм рт.ст. (IIВ), а при наличии явной протеинурии можно рассматривать достижение целевого уровня АД <130 мм рт.ст. при условии мониторирования динамики СКФ (IIB). Целевой уровень диастолического АД составляет <90 мм рт.ст. для всех пациентов, а для больных с СД следует рассматривать уровни между 80 и 85 мм рт.ст. (IА), которые обычно хорошо переносятся и безопасны.
Согласно Алгоритмам специализированной медицинской помощи больным СД, целевое значение АД при СД, включая больных с ХБП, на фоне антигипертензивной терапии 120-135/70-85 мм рт.ст.
Последние рекомендации Kidney Disease Improving Global Outcomes предлагают индивидуализировать целевой уровень АД в зависимости от возраста, имеющейся сердечно-сосудистой патологии, сопутствующих заболеваний, риска прогрессирования ХБП, наличия или отсутствия ретинопатии (у больных с СД и ХБП) и толерантности проводимой терапии.
| Рекомендации | Класс рекомендаций | Уровень доказательств |
|---|---|---|
Следует рассматривать снижение систолического АД <140 мм рт.ст. |
II |
B |
Целевое диастолическое АД <90 мм рт.ст. для всех больных, <85 мм рт.ст. при СД |
I |
А |
При наличии явной протеинурии можно рассмотреть снижение систолического АД <130 мм рт.ст. при условии мониторирования изменений СКФ |
II |
B |
Блокаторы РААС более эффективны в снижении альбуминурии, чем другие антигипертензивные препараты, и показаны пациентам с АГ при наличии микроальбуминурии или явной протеинурии |
I |
A |
Достижение целевого АД обычно требует комбинированной терапии, рекомендуется комбинировать блокаторы РААС с другими антигипертензивными препаратами |
I |
A |
Комбинация двух блокаторов РААС, хотя потенциально более эффективна в снижении протеинурии, не рекомендуется |
III |
A |
Антагонисты альдостерона не могут быть рекомендованы при СКФ <30 мл/мин/1,73 м2, особенно в комбинации с блокатором РААС, учитывая риск ухудшения функции почек и гиперкалиемии |
III |
C |
При СД 1-го типа генез АГ на 80-90% связан с развитием ДН. Она наблюдается у 35-40% больных СД 1-го типа. АГ при СД 1-го типа носит Na-зависимый и объемозависимый характер. В отличие от больных СД 1-го типа, у больных СД 2-го типа АД уже повышено до развития ДН. У 80% больных СД 2-го типа в момент диагностики заболевания амбулаторный контроль выявляет повышенное АД или нарушенный циркадный профиль АД (<15% снижения в ночные часы). Развившаяся ДН усиливает АГ следующими механизмами:
Эти механизмы определяют выбор антигипертензивных средств - ИАПФ, БРА, петлевые диуретики, блокаторы симпатической системы.
Немаловажной особенностью АГ у больных СД является высокая частота ортостатической гипотонии, определяющая индивидуальные целевые уровни АД - наименьший уровень АД, при котором пациент не испытывает эффекты этого состояния.
АГ при СД, являясь симптомом формирующейся почечной патологии, в то же время представляет собой мощный фактор прогрессирования ДН, определяющий нарастание альбуминурии, темпы снижения СКФ, выраженность склеротических изменений почечной ткани, повышенную смертность пациентов от уремии.
Блокада РААС является наиважнейшей в терапии почечной патологии у больных СД, обеспечивая основной рено- и кардиопротективный эффект. ИАПФ стали первыми препаратами, внедренными в клиническую практику для блокирования активности РААС с целью профилактики развития и прогрессирования ДН и недиабетических хронических заболеваний почек. Комплексное воздействие ИАПФ и БРА включает антигипертензивное, антипротеинурическое действие, отсроченные негемодинамические эффекты, опосредованные снижением почечной экспрессии трансформирующего фактора β и других цитокинов, а также антиатерогенные эффекты путем редукции концентрации циркулирующих молекул адгезии.
Наряду с явными преимуществами терапии ИАПФ, опыт их длительного применения показал ряд недостатков, которые ограничивают их использование. ИАПФ нередко вызывают сухой кашель, ангионевротический отек, обусловленные уменьшением распада брадикинина и подобных ему сосудорасширяющих метаболитов. Длительное (более 25 лет) применение ИАПФ показало, что в реальной клинической практике нефропротективный эффект от применения ИАПФ развивается только у 50% больных с ДН. У части пациентов с ДН, несмотря на использование ИАПФ, продолжает прогрессивно снижаться почечная функция даже при удовлетворительном уровне контроля АД. Причинами недостаточной эффективности ИАПФ (феномен ускользания) могут быть активность альтернативных путей образования ангиотензина II (контролируемые химазой, катепсином G, тонином и др.), злоупотребление солью, а также генетические факторы. Причины, механизмы, время развития феномена, а также его клиническое значение остаются пока предположительными и мало освещенными в литературе.
Более полную и селективную блокаду системы могут обеспечить БРА, которые действуют как антагонисты ангиотензина II в отношении антител 1-рецепторов, опосредующих основные сердечно-сосудистые и почечные эффекты активации РААС при сохранении функции антител 2-рецепторов, обеспечивающих дополнительное органопротективное действие. Заслуживает особого внимания тот факт, что ренопротективный эффект длительной терапии БРА, в отличие от ИАПФ, у больных СД не зависит от полиморфизма гена ангиотензинпревращающего фермента (DD или II). БРА реже вызывают гиперкалиемию за счет уменьшения канальцевой реабсорбции калия.
ИАПФ или БРА (но не в комбинации) необходимо рекомендовать для лечения небеременных пациентов с умеренной (30-299 мг/24 ч) и значительной (>300 мг/24 ч) альбуминурией. В лечении больных СД с нормальным уровнем АД и альбуминурией уровней А2 и А3 также должны применяться ИАПФ или БРА. В этой ситуации снижение степени альбуминурии может считаться целью лечения диабетического поражения почек. Применение этих препаратов требует мониторирования калия и креатинина. Регулярный контроль экскреции альбумина позволит оценить эффективность терапии и прогрессирование патологии.
Почечная недостаточность не является противопоказанием для проведения терапии ИАПФ и БРА. Следует помнить, что их нефропротективные свойства находятся в прямой зависимости от длительности лечения, что снижает их эффективность при назначении на поздних стадиях почечной недостаточности и повышает риск побочных эффектов (нарастание гиперкреатининемии и уровня калия). Целесообразность назначения ИАПФ и БРА на стадии почечной недостаточности должна решаться в индивидуальном порядке. В этой ситуации обязателен контроль калия и креатинина перед назначением этих препаратов, через 10 дней лечения и в последующем ежемесячно. Стойкое повышение уровня креатинина на 30-50% после снижения дозы препарата или его повышение более чем на 50% сразу после назначения препаратов может свидетельствовать о дестабилизации почечной гемодинамики и необходимости немедленной отмены блокаторов РААС.
Комбинация ИАПФ+БРА наиболее дискутабельна. В проведенных клинических исследованиях не удалось подтвердить безопасность и эффективность сочетанного применения ИАПФ и БРА у больных СД.
Достижения антигипертензивной терапии последних двух десятилетий связаны с широким применением ИАПФ и БРА, имеющих особое значение для больных со стенозом почечных артерий. При монолатеральном стенозе прием этих препаратов необходим прежде всего для максимальной нефропротекции контралатеральной почки благодаря предотвращению вторичной клубочковой гипертензии в неишемизированных нефронах и подавлению продукции молекулярных медиаторов фиброгенеза, а также для известных положительных эффектов в отношении сердечно-сосудистой системы. Даже в случае поражения контралатеральной почки без стеноза почечных артерий (гипертонический нефросклероз) начальное снижение СКФ может стабилизироваться. В случае же тотальной ишемии они могут вызвать резкое снижение СКФ за счет критического снижения клубочкового давления. В первых двух случаях терапию целесообразно продолжить с учетом положительных антипролиферативных, противовоспалительных клеточных эффектов блокады РААС, наблюдая за функциональным состоянием почек. После успешной реваскуляризации почек блокаторы РААС необходимы для длительной нефропротекции независимо от АД.
ИАПФ и БРА подавляют альдостерон (конечный продукт системы, подтвердивший свою роль как важного фактора прогрессирования кардиоваскулярных и почечных заболеваний), однако у части больных после начального периода эффективного подавления его уровень вновь может повыситься. Развивается феномен «ускользания ингибиции альдостерона» (по аналогии с ангиотензином II). Этот феномен развивается приблизительно у 20% пациентов с сердечной недостаточностью и приблизительно у 40% с ДН. Его развитие связывают с неполной блокадой РААС, недостаточной комплаентностью, вариантностью употребления натрия и гомеостаза калия, фармакогенетикой, различиями в продукции ангиотензина II в тканях и чувствительностью надпочечников к ангиотензину II. Проблемой блокады альдостерона остается неселективность широко применяемого для этой цели препарата спиронолактона, позволяющая связываться с прогестероновыми и андрогенными рецепторами (гинекомастия у мужчин и менструальные дисфункции у женщин). Эти побочные эффекты преодолеваются применением селективных антагонистов рецепторов альдостерона (эплеренон).
При длительном применении ИАПФ или БРА неизбежно происходит увеличение АРП вследствие снижения активности ангиотензина II и активации отрицательной обратной связи. Для нейтрализации высокой АРП ведутся исследования по применению прямых блокаторов ренина (алискирен). Они показали новые возможности усиления нефропротекции у больных СД, однако отдаленный прогноз при использовании этих препаратов сегодня требует изучения.
Еще одна группа препаратов - блокаторы рецепторов эндотелина (сантаны) продемонстрировала преимущества применения на ранних стадиях ДН, однако при выраженной ХБП они повышают риск сердечной недостаточности и отека легких.
Целевой уровень АД у большинства больных СД с ДН не удается достичь без антигипертензивных препаратов других групп. Как правило, это многокомпонентная терапия с обязательным участием диуретиков.
Лечебные мероприятия, направленные на нормализацию липидного обмена, способствуют улучшению функции почек. Терапия ингибиторами редуктазы 3-гидрокси-3метилглютарового-кофермента А - статинами - для поддержания целевых показателей липидного обмена наиболее эквивалента для профилактики сердечно-сосудистой патологии и прогрессирования ДН. Наряду с эффективной коррекцией липидного обмена эти препараты обладают умеренным антипротеину-рическим действием, подавляют выработку профиброгенных факторов. Согласно рекомендациям Национального почечного фонда США, применение статинов или комбинированной терапии статинами/эзитимибом снижает риск серьезных атеросклеротических событий у пациентов с СД и ХБП, включая лиц с трансплантированной почкой. Указанное руководство не рекомендует инициировать терапию статинами у больных СД, находящихся на лечении ГД, при отсутствии специфических сердечно-сосудистых показаний для их применения, что является крайне редкой клинической ситуацией. Целевой уровень ЛПНП у больных СД на выраженных стадиях ХБП, согласно рекомендациям ESH/ESC, должен быть менее 70 мг/дл (1,8 ммоль/л).
Дополнительно к основным нефропротективным средствам при ведении больных СД с почечной патологией применяют и антиагреганты, прежде всего с целью кардиопротекции. Стандарты мультифакторной терапии включают ацетилсалициловую кислоту (аспирин♠ ) для больных СД с почечной патологией для первичной и вторичной кардиоваскулярной профилактики. Рекомендации ESH/ESC 2013 г. подтвердили их особую значимость для пациентов с СКФ <45 мл/мин/1,73 м2 в профилактике сердечно-сосудистых событий.
Анемия - модифицируемый фактор риска прогрессирования ДН и сердечнососудистых заболеваний. Коррекцию почечной анемии следует проводить эритропоэз-стимулирующими средствами, в сочетании с препаратами железа на додиализном этапе с целью уменьшения сердечно-сосудистой смертности, замедления прогрессирования ДН повышения выживаемости и качества жизни. Для пациентов с ХБП и анемией (независимо от возраста и стадии ХБП) при первичном обследовании включаются клинический анализ крови, включающий концентрацию гемоглобина, индексы эритроцитов, количество и дифференциальный подсчет лейкоцитов, количество тромбоцитов, абсолютное число ретикулоцитов; оценка уровня ферритина сыворотки, насыщения трансферрина сыворотки, уровней витамина В12 и фолатов в сыворотке. Анемия диагностируется у взрослых и детей старше 15 лет с ХБП, если концентрация гемоглобина ниже 130 г/л у мужчин и ниже 120 г/л у женщин. Тяжесть анемии оценивается по гемоглобину, а не по гематокриту, поскольку последний относительно нестабилен, его измерения не стандартизованы и зависят от оборудования. Определение уровня эритропоэтина рутинно не используется для определения его недостаточности как причины анемии у пациентов с ХБП в большинстве клинических ситуаций. Эритропоэтическую активность можно оценить по абсолютному числу ретикулоцитов.
Коррекция дефицита железа пероральными или внутривенными препаратами может снизить выраженность анемии у пациентов с ХБП. Нескорректированный дефицит железа - важная причина пониженной чувствительности к терапии эритропоэз-стимулирующими средствами. Важно выявлять дефицит железа, поскольку его коррекция может быстро компенсировать связанную с ним анемию, а исследование причин дефицита железа, которое должно последовать за его выявлением, может привести к установке диагноза. В отсутствие менструальных кровопотерь истощение запасов железа и его дефицит могут быть связаны с кровопотерями через ЖКТ, вследствие задержки крови в диализаторе и магистралях, при хирургических процедурах (таких как создание сосудистого доступа), частым забором крови, влиянием на абсорбцию железа противоязвенных и фосфатсвязывающих препаратов, сниженной абсорбцией железа вследствие воспаления.
У пациентов с ХБП (додиализные стадии) и анемией, не получающих терапию железом или эритропоэз-стимулирующими средствами, следует провести пробную терапию внутривенными препаратами железа или 1-3-месячный курс пероральных препаратов железа. Желательно добиться увеличения концентрации гемоглобина без начала терапии эритропоэз-стимулирующими средствами, насыщения трансферрина сыворотки ≤30% и ферритина ≤500 нг/мл (мкг/л).
У взрослых пациентов с ХБП без диализа при концентрации гемоглобина <100 г/л рекомендуется индивидуализировано принимать решение о начале терапии эритропоэз-стимулирующими средствами на основании скорости снижения гемоглобина, предшествовавшем ответе на терапию железом, риска потребности в трансфузиях, рисков, связанных с терапией эритропоэз-стимулирующими средствами, и наличия симптомов, относящихся к анемии.
У пациентов с ХБП 5 на диализе рекомендована терапия эритропоэз-стимулирующими средствами для предотвращения падения гемоглобина ниже 90 г/л при концентрации гемоглобина 90 и 100 г/л. У некоторых пациентов обоснована инициация терапии эритропоэз-стимулирующими средствами при гемоглобине выше 100 г/л для улучшения качества жизни.
У взрослых пациентов с ХБП не рекомендуется использовать эритропоэз-стимулирующие средства для поддержания концентрации гемоглобина выше 115 г/л. При дальнейшем его повышении до полной нормализации может увеличиться риск развития острого инфаркта миокарда, инсульта, гипертензии, повыситься частота тромбозов хронической артериовенозной фистулы. В процессе лечения необходим постоянный контроль функции почек (динамика СКФ и креатинина крови), АД, гидратации, кардиодинамики, скорости прироста гемоглобина, гематокрита, содержания железа в организме, электролитных показателей, факторов свертывания крови. У некоторых пациентов возможна индивидуализация терапии для поддержания концентрации гемоглобина выше 115 г/л для улучшения качества жизни. У всех взрослых пациентов, получающих эритропоэз-стимулирующие средства, не рекомендовано намеренное увеличение концентрации гемоглобина выше 130 г/л.
При выборе эритропоэз-стимулирующих средств необходимо основываться на информации по фармакодинамике, безопасности, данных по клиническим исходам, стоимости и доступности. Следует использовать только эритропоэз-стимулирующие средства, одобренные независимыми регуляторными органами. Среди «копийных» образцов эритропоэз-стимулирующих средств следует использовать только истинные биоаналоги.
Не рекомендуется использование в качестве дополнительной терапии анемии андрогенов, витаминов C, D, E, фолиевой кислоты, L-карнитина и пентоксифиллина.
При лечении хронической анемии рекомендуется избегать, где возможно, переливания эритроцитов для минимизации общих рисков, связанных с их использованием. Это особенно важно для пациентов, подходящих для трансплантации, для минимизации риска аллосенсибилизации.
Объектом активной терапии должна оставаться гиперкалиемия. При уровне калия более 5,5 ммоль/л наряду с диетическими ограничениями рекомендуется применение ионообменных смол (полистиролсульфонат натрияρ внутрь 15 г 4 раза в день), петлевых диуретиков. При более значимом повышении уровня калия, угрожающим остановкой сердца (на ЭКГ - удлинение интервала PQ, расширение комплекса QRS, сглаженность волн P), решается вопрос о проведении гемодиализа.
Нарушения фосфорно-кальциевого гомеостаза ответственны за развитие остеодистрофии, кальцификацию сосудов и мягких тканей, повышение кардио-васкулярной заболеваемости и смертности. Существенные достижения в расшифровке механизмов их развития, включая открытие фосфатурических гормонов, подходах в коррекции с использованием принципиально новых фармакологических препаратов [активаторы рецепторов витамина D, не содержащие кальций фосфатбиндеры (севеламер, лантана карбонат), кальциймиметики] сформировали новую концепцию - «минеральные и костные нарушения при ХБП». Снижение массы функционирующей почечной ткани ведет к уменьшению продукции кальцитриола, гипокальциемии, гиперфосфатемии, повышению уровня ПТГ, развитию вторичного гиперпаратиреоза. Коррекция этого состояния требует соблюдения гипофосфатной диеты, применения фосфатсвязывающих препаратов, метаболитов витамина D и их аналогов, кальцимиметиков. При СД 1-го типа ситуация осложняется высокой частотой низкообменной формы ренальной остеодистрофии, проявляющейся остеомаляцией и адинамическим заболеванием скелета, главная роль в развитии которой принадлежит дефициту инсулина.
Согласно рекомендациям Kidney Disease Improving Global Outcomes, измерение уровня кальция, фосфора, ПТГ, ЩФ должно проводиться ежегодно у взрослых при СКФ <45 мл/мин/1,73 м2 (ХБП 3в-5) для определения базовых значений и дальнейшего прогноза.
У лиц со СКФ <45 мл/мин/1,73 м2 (ХБП 3в-5) рекомендовано поддерживать уровень фосфора в пределах нормальных значений по данным локальных лабораторий. При значениях интактного ПТГ выше нормального уровня прежде всего необходимо дать оценку гиперфосфатемии, гипокальциемии и дефициту витамина D.
Не рекомендуется рутинное назначение витамина D или его аналогов в отсутствие документально подтвержденного дефицита для подавления повышенного уровня ПТГ у лиц с ХБП до диализа. Не рекомендуется назначение бифосфонатов лицам со СКФ <30 мл/мин/1,73 м2 (ХБП 4-5) в отсутствие очень серьезных клинических показаний. У лиц со СКФ <45 мл/мин/1,73 м2 не предлагается рутинно выполнять измерение показателей МПК, поскольку они не предсказывают риск переломов (как в общей популяции) и не позволяют определить тип почечной остеодистрофии.
Пациенты с ДН и ИБС, сердечной недостаточностью должны получать лечение по поводу кардиальной патологии в полном объеме в соответствии с национальными и международными рекомендациями, если нет противопоказаний (табл. 10.37).
| Рекомендации | Класс рекомендаций | Уровень доказательств |
|---|---|---|
Пациентов с ХБП следует относить к группе высокого риска сердечно-сосудистых заболеваний |
I |
А |
При лечении ИБС у больных ХБП следует исходить из существующих рекомендаций при отсутствии противопоказаний* |
I |
А |
Антитромботическая терапия может назначаться больным ХБП с высоким риском сердечно-сосудистых осложнений, если не повышен риск кровотечения* |
II |
В |
Лечение сердечной недостаточности при ХБП следует проводить в том же объеме, что и у пациентов без ХБП* |
II |
А |
При болях в грудной клетке больные ХБП должны обследоваться так же, как и пациенты без ХБП |
I |
В |
* Необходима коррекция дозы препаратов с учетом СКФ.
При проведении терапии, особенно сердечной недостаточности, следует строго контролировать состояние больных и мониторировать СКФ и уровень калия сыворотки крови. При СКФ <60 мл/мин/1,73 м2 (СКФ категории 3а-5) сывороточные уровни тропонина и натрийуретических пептидов могут быть повышены и должны оцениваться с учетом функционального состояния почек и клинической картины.
Показания к проведению экстракорпоральных методов лечения терминальной почечной недостаточности при ДН определяются раньше, чем у больных с иной почечной патологией, поскольку при СД задержка жидкости, нарушение азотистого и электролитного баланса развиваются при более высоких значениях СКФ. При снижении СКФ менее 15 мл/мин/1,73 м2 , тяжелой гипергидратации с риском развития отека легких, серозите, выраженном зуде, метаболическом ацидозе, нарастании белково-энергетической недостаточности, электролитных нарушений, неконтролируемом АД, изменении ментального статуса на фоне уремической интоксикации необходимо оценить показания и противопоказания к применению методов заместительной терапии: гемодиализа, перитонеального диализа и трансплантации почки.
Выбор диализной терапии должен быть индивидуальным. При этом следует учитывать как социальные, так и медицинские аспекты предстоящей диализной терапии. При отсутствии противопоказаний необходимо ориентировать пациентов на перспективу пересадки почки, рассматривая гемодиализ или перитонеальный диализ как временный этап при подготовке к трансплантации. Согласно рекомендациям Kidney Disease Improving Global Outcomes, имеются преимущества при трансплантации почки от живого донора лицам со СКФ <20 мл/мин/1,73 м2 при убедительном свидетельстве необратимого прогрессирования ХБП в течение последних 6-12 мес. Этот метод ЗПТ обеспечивает полное излечение от почечной недостаточности на период функционирования трансплантата, лучшую реабилитацию и выживаемость.
Применение лекарственных препаратов при хронической болезни почек
Последние рекомендации Kidney Disease Improving Global Outcomes обращают особое внимание на меры предосторожности при применении различных ЛС у лиц с ХБП, учитывая следующие изменения фармакокинетики препаратов:
-
абсорбции (уремический гастрит, применение фосфатбиндеров, ингибиторов протонной помпы, гастропарез, нарушение всасывания в кишечнике при нефротическом синдроме);
-
распределения (зависимость от внеклеточной жидкости, гипоальбуминемии, воспаления, изменения рН крови, влияния уремических токсинов, нарушения функции печени);
-
метаболизма (увеличение периода полураспада даже для препаратов без почечной экскреции путем модуляции активности цитохрома, гликопротеина Р, анионтранспортирующего полипептида);
-
экскреции (изменение клиренса препарата пропорционально снижению СКФ).
У лиц со СКФ <60 мл/мин/1,73 м2 (ХБП 3а-5) при развитии тяжелых интеркуррентных заболеваний, повышающих риск развития острого почечного повреждения, рекомендована временная отмена потенциально нефротоксичных препаратов и препаратов с почечной элиминацией [блокаторы РААС (ИАПФ, БРА, ингибиторы альдостерона, прямые ингибиторы ренина), диуретики, НПВС, метформин, препараты лития, дигоксин и др.] (табл. 10.38).
Не рекомендуется пользоваться средствами из трав лицам с ХБП. Обязательна предварительная консультация врача при приеме каких-либо препаратов, в том числе и биологических добавок, у лиц с ХБП. Всем пациентам, принимающим потенциально нефротоксичные препараты, такие как литий, ингибиторы кальций-неврина, независимо от уровня СКФ, необходим мониторинг электролитов и концентрации препарата. Пациентам с ХБП не должны отказывать в терапии при развитии других заболеваний, прежде всего онкологических, при условии коррекции доз цитотоксических препаратов соответственно уровню СКФ.
| Препараты | Меры предосторожности |
|---|---|
Антигипертензивные/кардиологические Блокаторы РААС (ИАПФ, БРА, антагонисты альдостерона, прямые ингибиторы ренина) |
Избегать при подозрении на стеноз почечной артерии. Начинать с более низких доз при СКФ <45 мл/мин/1,73 м2. Контроль СКФ и калия сыворотки крови через неделю после начала терапии или увеличения дозы. Временная отмена при интеркуррентных заболеваниях, плановом в/в введении рентгенконтрастных препаратов, подготовке к колоноскопии, перед большими оперативными вмешательствами Не отменять необоснованно при СКФ <30 мл/мин/1,73 м2,если применяются для нефропротекции |
Дигоксин |
Уменьшить дозу с учетом плазменных концентраций |
Обезболивающие НПВС |
Избегать назначения при СКФ <30 мл/мин/1,73 м2. Нежелателен длительный прием при СКФ <60 мл/мин/1,73 м2. Не применять вместе с препаратами лития. Избегать назначения на фоне приема блокаторов РААС |
Опиаты |
Уменьшить дозу при СКФ <60 мл/мин/1,73 м2. Назначать с осторожностью при СКФ <15 мл/мин/1,73 м2 |
Антибиотики Пенициллины |
Риск кристаллурии при СКФ <15 мл/мин/1,73 м2 и назначении высоких доз. Бензилпенициллин нейротоксичен при СКФ <15 мл/мин/1,73 м2 и назначении высоких доз (максимально 6 г/сут) |
Аминогликозиды |
Уменьшить дозу и/или увеличить интервал между приемами при СКФ <60 мл/мин/1 ,73 м2. Контроль сывороточной концентрации. Избегать одновременного приема ототоксичных препаратов (фуросемид) |
Макролиды |
Уменьшить дозу на 50% при СКФ <30 мл/мин/1,73 м2 |
Фторхинолоны |
Уменьшить дозу на 50% при СКФ <15 мл/мин/1,73 м2 |
Тетрациклины |
Уменьшить дозу при СКФ <45 мл/мин/1,73 м2; может усилить уремию |
Противогрибковые |
Избегать назначения амфотерицина при СКФ <60 мл/мин/1,73 м2. Уменьшить поддерживающую дозу флуконазола на 50% при СКФ <45 мл/мин/1,73 м2. Уменьшить дозу флуцитозина при СКФ <60 мл/мин/1,73 м2 |
Гипогликемические Препараты сульфонилмочевины |
Избегать назначения препаратов с почечной элиминацией (глибурид/глибенкламид). Препараты, метаболизирующиеся в печени, можно применять при СКФ <30 мл/мин/1,73 м2 в сниженных дозах (гликлазид, гликвидон) |
Инсулин |
Учитывая частично почечную элиминацию, может возникнуть необходимость в снижении дозы при СКФ <30 мл/мин/1,73 м2 |
Метформин |
Избегать назначения при СКФ <30 мл/мин/1,73 м2, но следует оценить соотношение «риск/польза» при стабильной СКФ (рассмотрено ранее) |
Гиполипидемические. Статины |
Нет признаков токсичности при приеме симвастатина 20 мг/сут или комбинации симвастатина 20 мг/эзетимиба 10 мг/сут при СКФ <30 мл/мин/1,73 м2 и у пациентов на диализе. В других исследованиях со статинами токсичность также отсутствовала у пациентов с СКФ <15 мл/мин/1,73 м2 и на диализе |
Фенофибрат |
Повышает креатинин сыворотки ~ на 0,13 мг/дл (12 мкмоль/л) |
Химиотерапевтические. Цисплатин |
Уменьшить дозу при СКФ <60 мл/мин/1,73 м2. Избегать назначения при СКФ <30 мл/мин/1,73 м2 |
Мелфалан |
Уменьшить дозу при СКФ <60 мл/мин/1,73 м2 |
Метотрексат |
По возможности избегать назначения при СКФ <30 мл/мин/1,73 м2 |
Антикоагулянты. Низкомолекулярные гепарины |
Уменьшить дозу на 50% при СКФ <30 мл/мин/1,73 м2. Попытаться заменить на нефракционированный гепарин или контролировать содержание антифактора Ха в плазме при высоком риске кровотечений |
Варфарин |
Повышенный риск кровотечений при СКФ <30 мл/мин/1,73 м2. Использовать низкие дозы и строго контролировать международное нормализованное отношение при СКФ <30 мл/мин/1,73 м2 |
Другие препараты. Литий |
Нефротоксичен, может вызвать канальцевую дисфункцию при длительном приеме даже в терапевтической дозе. Контроль СКФ, электролитов, концентрации лития каждый месяц или чаще, если изменяется доза или состояние пациента ухудшается. Избегать одновременного приема НПВС. Гидратация при интеркуррентных заболеваниях. Оценка соотношения риск/польза в особых ситуациях |
Проведение визуализирующих исследований с применением рентгенконтрастных препаратов предполагает оценку диагностической и терапевтической ценности ожидаемых результатов, а также риск развития острого почечного повреждения. При проведении исследований с внутривенным введением йодосодержащих рентгенконтрастных препаратов у пациентов со СКФ <60 мл/мин/1,73 м2 (ХБП 3а-5) необходимо руководствоваться рекомендациями Kidney Disease Improving Global Outcomes, включающими следующие положения:
Возможно применение гадолиниевых препаратов на основе макроциклических хелатных комплексов для пациентов со СКФ <30 мл/мин/1,73 м2 (ХБП 4-5). Применение этих препаратов при СКФ <15 мл/мин/1,73 м2 (ХБП 5) не рекомендуется (риск развития нефрогенного системного фиброза) и допустимо только в случаях крайней необходимости при отсутствии альтернативных методов исследования.
Основные принципы лечения ДН в зависимости от стадии осложнения представлены в табл. 10.39.
Хирургическое лечение
Хирургическое лечение - трансплантация почки (осуществляют на стадии терминальной ХПН).
Показания к консультации других специалистов
Консультация и наблюдение нефролога, начиная со стадии ХБП 3а. Консультации и наблюдение кардиолога, офтальмолога, невролога. Консультация трансплантолога на выраженных стадиях ХБП для решения вопроса о целесообразности и возможности проведения трансплантации почки.
| Стадия ДН | Принципы лечения |
|---|---|
ХБП 1-3 А2 |
Достижение индивидуальных целевых значений HbA1C. ИАПФ или БРА как препараты выбора; противопоказаны при беременности. Комбинированная антигипертензивная терапия для достижения целевого уровня АД. Коррекция дислипидемии. Коррекция анемии. Избегать применения нефротоксических средств (аминогликозиды, НПВС). Осторожность при проведении рентгенконтрастных исследований |
ХБП 1-3 А3 |
Достижение индивидуальных целевых значений HbA1C. Ограничение животного белка (0,8 г/кг массы тела в сутки). ИАПФ или БРА как препараты выбора; противопоказаны при беременности. Комбинированная антигипертензивная терапия для достижения целевого уровня АД. Коррекция дислипидемии. Коррекция анемии (средства, стимулирующие эритропоэз, препараты железа). Избегать применения нефротоксических средств (аминогликозиды, НПВС). Осторожность при проведении рентгенконтрастных процедур. Контроль статуса питания |
ХБП 4 |
Достижение индивидуальных целевых значений HbA1C. Ограничение животного белка (0,8 г/кг массы тела в сутки). ИАПФ или БРА как препараты выбора; уменьшение дозы при СКФ <30 мл/мин/1,73 м2. Комбинированная антигипертензивная терапия для достижения целевого уровня АД. Коррекция гиперкалиемии. Коррекция дислипидемии. Коррекция нарушений фосфорно-кальциевого обмена. Коррекция анемии (средства, стимулирующие эритропоэз, препараты железа). Избегать применения нефротоксических средств (аминогликозиды, НПВС). Осторожность при проведении рентгенконтрастных процедур. Контроль статуса питания |
ХБП 5 |
Гемодиализ. Перитонеальный диализ. Трансплантация почки |
Информация для пациента
Пациенту необходимо объяснить важность диетических рекомендаций и постоянной медикаментозной терапии, которая становится пожизненной.
Режим мониторирования включает систематический контроль гликемии, АД, креатинина, СКФ, мочевины, калия, альбумина, кальция, фосфора, ПТГ, липидного спектра, железа сыворотки крови, гемоглобина, гематокрита, альбуминурии, а также наблюдение нефролога и кардиолога.
ПРОГНОЗ
Прогноз в отношении жизни серьезный. Стадии ХБП 1, 2 обратимые при соблюдении в полном объеме лечебных рекомендаций и достижении целевых значений мониторируемых параметров. При более выраженных стадиях ХБП прогноз более сложен и определяется своевременностью начала патогенетической терапии и генетической предрасположенностью. На стадии ХБП 1 трудоспособность, как правило, сохранена. На выраженных стадиях ХБП трудоспособность ограничена.
СПИСОК ЛИТЕРАТУРЫ
-
Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И.И. Дедова, М.В. Шестаковой. - 6-е изд. - М., 2013. - 120 с.
-
Дедов И.И., Шестакова М.В., Аметов А.С., Анциферов М.Б., Галстян Г.Р., Майоров А.Ю., Мкртумян А.М., Петунина Н.А., Сухарева О.Ю. Консенсус совета экспертов: Рекомендации Российской ассоциации эндокринологов по инициации и интенсификации сахароснижающей терапии у больных сахарным диабетом 2-го типа // Сахарный диабет. - 2011. - № 4 (53). - С. 6-17.
-
Шестакова М.В., Мартынов С.А., Кутырина И.М., Ильин А.В., Арбузова М.И., Дедов И.И. Ранний дефицит эритропоэтина при диабетическом поражении почек // Терапевтический архив. - 2012. - № 10. - С. 9-13.
-
Сахарный диабет: острые и хронические осложнения / Под ред. И.И. Дедова, М.В. Шестаковой. - М.: МИА, 2011. - 480 с.
-
Шамхалова М.Ш., Трубицына Н.П., Шестакова М.В. Феномен частичного ускользания блокады ангиотензина II у больных сахарным диабетом 2-го типа и диабетической нефропатией // Терапевтический архив. - 2008. - № 1. - С. 49-52.
-
Шестакова М.В., Ярек-Мартынова И.Р., Иванишина Н.С. Кардиоренальная патология при сахарном диабете 1-го типа: механизмы развития и возможности медикаментозной коррекции // Терапевтический архив. - 2005. - № 6. - С. 40-46.
-
KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease // Kidney Intern. Suppl. - 2013. -N (3).
-
National Kidney Foundation. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 update // Am. J. Kidney Dis. - 2012. - Vol. 60 (5). - P. 850-886.
-
Standards of medical care in diabetes 2014. American Diabetes Association // Diabetes Care. - 2014. - Vol. 37 (Suppl. 1). - P. S14-S80.
-
2013 ESH/ESC Guidelines for the management of arterial hypertension // Eur. Heart J. - 2013. - Vol. 34. - P. 2159-2219. - doi: 10.1093/eurheartj/eht151.
-
Inzucchi S.E., Bergenstahl R.M., Buse J.B. Management of hyperglycemia in type 2 diabetes: a patient-centered approach // Diabetes Care. - Published online ahead of print. April 19, 2012.
-
Tonelli M., Muntner P., Lliod A., Manns B.J., Klarenbach S., Pannu N., James M.T., Hemmelgarn B.R. Risk of coronary events in people with chronic kidney disease compared with those with diabetes: a population-level cohort study // Lancet. - 2012. - Vol. 380. - P. 807814.
-
Lipska K.J., Bailey C.J., Inzucchi S.E. Use of metformin in the setting of mild-to-moderate renal insufficiency // Diabetes Care. - 2011. - Vol. 34. - P. 1431-1437.
-
Salpeter S.R., Greyber E., Pasternak G.A., Salpeter E.E. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus // Cochrane Database Syst. Rev. - 2010 Apr. - Vol. 14 (4). - CD002967.
-
Bakris G.L., Serafidis P.A., Weir M.R. et al. ACCOMPLISH Trial Investigators. Renal outcomes with different fixed-dose combination therapies in patients with hypertension at high risk for cardiovascular events (ACCOMPLISH): a prespecified secondary analysis of randomised controlled trial // Lancet. - 2010. - Vol. 375. - P. 1173-1181.
-
Parving H.H., Brenner B.M., McMurray J.J. V. et al. Cardiorenal endpoints in a trial of aliskiren for type 2 diabetes // N. Engl. J. Med. - 2012. - Vol. 367. - P. 2204-2213.
-
Baigent C., Landray M.J., Reith C. et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial // Lancet. - 2011. - Vol. 377 (9784). - P. 2181-2192.
-
The ADVANCE Collaborative Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes // N. Engl. J. Med. - 2008. - Vol. 358. - P. 2560-2572.
-
Haller H., Ito S., Izzo J.L. Jr. et al. ROADMAP Trial Investigators. Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes // N. Engl. J. Med. - 2011. - Vol. 364. - P. 907-917.
-
Bart B.A., Goldsmith S.R., Lee K.L. et al. Ultrafiltration in decompensated heart failure with cardiorenal syndrome // N. Engl. J. Med. - 2012 Dec 13. - Vol. 367 (24). - P. 2296-2304.
-
Lee M., Saver J.L., Chang K.H., Liao H.W., Chang S.C., Ovbiagele B. Low glomerular filtration rate and risk of stroke: meta-analysis // BMJ. - 2010. - Vol. 341. - P. 4249.
-
Margolis D., Hofstad O., Feldman H.I. Association between renal failure and foot ulcer or lower-extremity amputation in patients with diabetes // Diabetes Care. - 2008. - Vol. 31. - P. 1333-1336.
-
United States Renal Data System, USRDS 2013 Annual Data Report.
-
Peacock T.P., Shihabi Z.K., Bleyer A.J., Dolbare E.L., Byers J.R., Knovich M.A., Calles-Escandon J., Russell G.B., Freedman B.I. Comparison of glycated albumin and hemoglobin A1c levels in diabetic subjects on hemodialysis // Kidney Int. - 2008. - Vol. 73. - P. 162-1068.
-
Shurraw S., Hemmelgarn B., Lin M., Majumdar S.R., Klarenbach S., Manns B., Bello A., James M., Turin T.C., Tonelli M. Association between glycemic control and adverse outcomes in people with diabetes mellitus and chronic kidney disease: a population-based cohort study // Arch. Intern. Med. - 2011. - Vol. 171. - P. 1920-1927.
-
Hocher B., Reichetzeder C., Alter M. Renal and cardiac effects of DPP4 inhibitors // Kidney Blood Press Res. - 2012. - Vol. 36. - P. 65-84.
-
Ritz E. Limitations and future treatment options in type 2 diabetes with renal impairment // Diabetes Care. - 2011. - Vol. 34. - P. S330-S334.
СИНДРОМ ДИАБЕТИЧЕСКОЙ СТОПЫ
Галстян Г.Р., Токмакова А.Ю.
Синдром диабетической стопы объединяет патологические изменения периферической нервной системы, артериального и микроциркуляторного русла, костно-суставного аппарата стопы, представляющие непосредственную угрозу развития/наличия язвенно-некротических процессов и гангрены стопы.
ЭПИДЕМИОЛОГИЯ
Синдром диабетической стопы регистрируется у 15-25% больных СД. Это основная причина ампутаций нижних конечностей у этой категории пациентов, которые производятся в 17-45 раз чаще, чем у лиц без нарушения углеводного обмена. Это приводит к ранней инвалидизации и повышению уровня летальности. Данные литературы по частоте ампутаций и язвенных дефектов стоп у больных СД отличаются достаточно большой вариабельностью. Так, показатели ежегодной частоты больших ампутаций в индустриально развитых странах колеблются от 0,06 до 3,86 на 10 000 больных СД. Согласно данным Государственного регистра больных СД, в России частота ампутаций варьирует от 0,76 до 18,2 случаев на 1000 больных СД, в среднем по стране составляя 6,4 на 1000 больных. Популяционные исследования показали, что большие ампутации составляют от 48,9 до 60%. Согласно когортным исследованиям, этот показатель близок к 25%. Столь существенную разницу полученных данных можно объяснить несколькими причинами. Среди них наиболее значимые - различия обследуемых популяции; многообразие систем оказания медицинской помощи; отсутствие системного подхода в сборе данных.
ПРОФИЛАКТИКА
У большинства больных с трофическими язвами развитие этого осложнения можно было бы предотвратить. Известно, что пусковым моментом формирования нейропатической язвы стопы является травма (механическая, термическая, химическая). При нейроишемической или ишемической форме синдрома диабетической стопы влияние травмы усугубляется имеющейся ишемией мягких тканей, вызванной артериальной недостаточностью. На скорость развития и выраженность формирующихся поражений мягких тканей стопы влияет и состояние контроля углеводного обмена.
Выделяют следующие меры профилактики поражений стоп при СД.
-
Своевременное выявление и адекватное лечение начальных поражений мягких тканей нижних конечностей у больных СД. Для этого стопы пациента должны осматриваться врачом при каждом визите.
-
Организация долгосрочного контроля и профессионального подиатрического ухода пациентов группы высокого риска.
-
Обучение пациентов и их родственников правилам ухода за ногами и выбора обуви.
-
Обеспечение пациентов группы риска развития трофических язв стоп профилактической, а при наличии показаний - сложной ортопедической обувью.
Занятия, посвященные правилам ухода за ногами, являются неотъемлемой частью всех обучающих программ для пациентов СД 1-го и 2-го типа. Учитывая тот факт, что далеко не все больные высокого риска развития синдрома диабетической стопы могут обучаться в группе по стандартной структурированной программе (в «школах диабета»), высока роль эндокринолога и специалиста отделения/кабинета диабетической стопы в проведении индивидуального обучения таких пациентов. Особенно важно осуществлять контроль практического использования больными полученных знаний.
У половины больных осмотр стоп позволяет прогнозировать место развития язвы (зону риска) задолго до ее возникновения. Причины «предъязвенного повреждения кожи» и последующего развития трофических язв - формирование зон избыточного нагрузочного давления на стопе за счет ее деформации (клювовидные и молоткообразные пальцы, Hallux valgus, плоскостопие, ампутации в пределах стопы и т.п.), а также утолщение ногтевых пластинок. Способствует развитию трофических нарушений и ношение тесной обуви.
Каждая деформация приводит к образованию «зоны риска» в типичных местах. Если такая зона испытывает при ходьбе повышенное нагрузочное давление, то возникают предъязвенные изменения кожи (гиперкератоз и/или подкожное кровоизлияние). В отсутствие своевременного вмешательства (удаления участков гиперкератоза, лечение гематомы) образуются трофические язвы. Важнейшее профилактическое средство, позволяющее в 2-3 раза сократить вероятность образования дефекта, - адекватный подиатрический уход, правильный выбор обуви (профилактической или сложной ортопедической). Основные требования к такой обуви:
Профилактика развития трофических язв - основная задача кабинетов диабетической стопы, где средний медицинский персонал, прошедший специальную подготовку, осуществляет профессиональный подиатрический уход. Для этого используются аппараты (скалер с набором насадок) и набор инструментов (скальпели с укороченным лезвием, кусачки, пинцеты). Правильно проведенные подиатрические процедуры позволяют снизить нагрузочное давление в зонах риска формирования трофических язв более чем на 30%.
СКРИНИНГ
Оценку состояния нижних конечностей осуществляет врач, наблюдающий больного СД (эндокринолог, диабетолог, врач общей практики). Оценка состояния стоп.
-
Осмотр стоп - цвет, внешний вид, целостность и состояние кожных покровов, в том числе в межпальцевых промежутках; наличие деформаций стопы, состояние ногтевых пластин.
-
Пальпация стоп - оценка температуры кожных покровов и определение пульса на артериях стопы и голени (тыльной артерии стопы, передней и задней большеберцовых артерий на обеих ногах).
-
Оценка периферической чувствительности - использование 10 г монофиламента, градуированного камертона.
Частота обследования.
КЛАССИФИКАЦИЯ
По этиопатогенетическому признаку выделяют следующие формы синдрома диабетической стопы:
Данная классификация отражает этиологию и патогенез поражений и определяет тактику ведения больных, однако не учитывает тяжесть поражения.
Классификация раневых дефектов по глубине поражения была предложена F.W. Wagner (282). Согласно ей, хронические раневые дефекты можно разделить на 5 категорий:
Данная классификация широко используется как хирургами, так и эндокринологами - специалистами по диабетической стопе, но она имеет существенный недостаток - не учитывает наличие и выраженность возможной ишемии конечности и состояние периферической иннервации.
В связи с этим в последние годы стали пользоваться вариантами комбинированных классификаций. Одна из них предложена Университетской группой Техаса:
-
0 стадия: нет нарушения целостности кожи, однако есть признаки высокого риска развития синдрома диабетической стопы (участки гиперкератоза, трещины, сухость кожи в области стоп, выраженные деформации, ослабление чувствительности, снижение или отсутствие пульсации артерий на стопе);
-
IV стадия: гангрена части стопы, чаще всего сочетается со снижением магистрального кровотока или тромбозом артерий и инфекционным воспалением.
Наиболее полноценной является классификация Perfusion, Extent, Depth, Infection, Sensation, предложенная в 2003 г., которая учитывает, помимо глубины раны и состояния периферического кровотока, также наличие нейропатии и площадь дефекта.
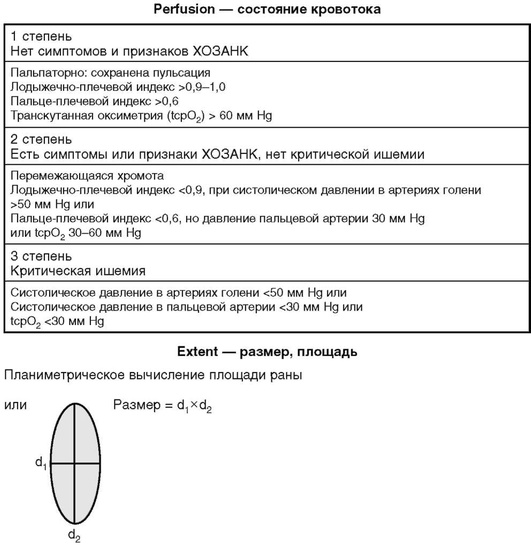
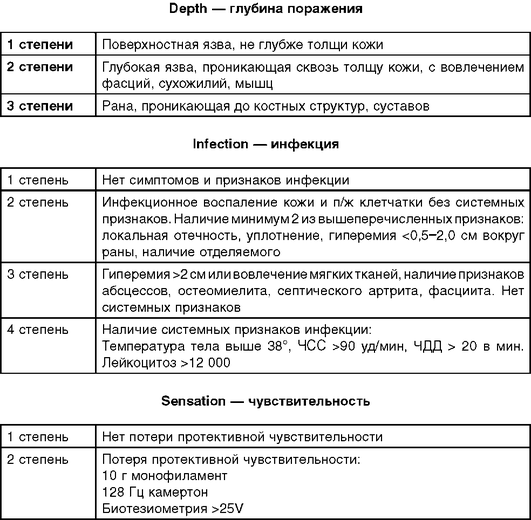
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Среди основополагающих механизмов развития синдрома диабетической стопы наиболее важные - дистальная сенсомоторная и автономная невропатия. Снижение чувствительности вследствие сенсорной невропатии, деформация стопы, обусловленная моторной невропатией, сухость кожи и интенсификация кровообращения в системе артериовенозных шунтов - основные общеизвестные составляющие данной патологии. Важно отметить, что эти нарушения непосредственно не вызывают нарушение целостности кожного покрова. Как правило, образование язвенного дефекта происходит под воздействием внешних повреждающих факторов, среди которых наиболее часто встречается избыточное давление на определенные участки стопы. Повреждение может возникнуть быстро, когда пациент не чувствует внешнего повреждающего воздействия, например механическая травма острым предметом или термический ожог. Однако чаще всего имеет место перманентное воздействие избыточного давления на отдельные участки стопы с образованием зон гиперкератоза, приводящего к аутолизу мягких тканей и последующему развитию язвенного дефекта. В одном из исследований было показано, что наличие гиперкератоза ассоциировано с 77-кратным увеличением риска образования язвенного дефекта.
Окклюзирующие заболевания периферических артерий у больных СД имеют ряд отличительных черт, поскольку в большинстве случаев им сопутствует дистальная полинейропатия. Особенности касаются как локализации процесса, так и клинической картины заболевания, включая болевую симптоматику, и его прогноза. У пациентов с тяжелой сенсорной нейропатией может полностью отсутствовать болевой синдром: даже на фоне критической ишемии лишь половина обследованных предъявляет жалобы на боли в покое. Работами последних лет показано, что у лиц с диабетом по сравнению с больными с аналогичными нарушениями кровоснабжения без СД имеет место дистальный, чаще двусторонний тип поражения, худший прогноз в отношении вероятности высокой ампутации конечности и повышенной летальности. Важно отметить, что и в этом случае непосредственной причиной формирования акральных некрозов (дистальные фаланги пальцев, пяточная область) чаще всего выступает внешнее повреждение (например, сдавление обувью). Пациенты с нарушенным кровотоком и сопутствующей сенсорной невропатией более восприимчивы в отношении воздействия избыточного давления на стопу.
В ряде случаев на фоне артериального стеноза (без критической ишемии) и сопутствующей тяжелой дистальной полинейропатии образуются язвенные дефекты. Причисление этих пациентов к группе с тяжелой ишемией (IV степени по классификации Фонтейна-Покровского) ошибочно, поскольку состояние магистрального кровотока в данном случае может быть достаточным для применения консервативных методов лечения. При истинной критической ишемии, подтвержденной данными транскутанной оксиметрии (ТсРО2 ниже 20 мм рт. ст.) и/или допплерометрии (АД в пальцевой артерии ниже 30 мм рт. ст.), больные нуждаются в реконструктивных сосудистых вмешательствах.
Сопутствующие хронические осложнения СД - существенные факторы риска развития трофических язв стоп. К ним относят диабетическую ретинопатию в стадии нарушения остроты зрения и тяжелую ДН (формирование периферических отеков при нефротическом синдроме, ХПН). Значительная вариабельность объема стоп в течение суток может стать причиной незамеченного пациентом сдавления мягких тканей тесной обувью и формирования участков локальной ишемии. Данные изменения, в свою очередь, ведут к образованию зон некроза. Особенно высокому риску подвержены пациенты с ХПН. Значительное падение систолического давления на фоне сеанса гемодиализа оказывается достаточным для развития относительной критической ишемии мягких тканей и формирования участков дистальных некрозов конечности.
СД - самая частая причина формирования остеоартропатии (нейроостеоартропатии Шарко). Инициирующим моментом для формирования данной патологии считают «малую» механическую травму костно-суставного аппарата стопы на фоне диабетической полинейропатии.
У половины больных это не сопровождается болевой симптоматикой или болевая симптоматика не соответствует тяжести изменений костно-суставного аппарата. Указанные нарушения становятся причиной позднего обращения пациентов, приводят к диагностическим ошибкам и, соответственно, неадекватному лечению. Терапевтическая тактика зависит от стадии нейроостеоартропатии. Наиболее эффективна, с точки зрения предотвращения дальнейшей деструкции костного скелета стопы, ранняя иммобилизация конечности с помощью индивидуальной фиксирующей повязки (Total Contact Cast) в острой стадии процесса. Клинические признаки этой стадии: отечность и гипертермия пораженной стопы. Разница в температуре поверхности кожи стоп в два и более градуса Цельсия может являться диагностическим критерием острой стадии стопы Шарко. Более точным методом диагностики данного осложнения СД является МРТ пораженного сустава, при которой выявляется отек костного мозга. На сегодняшний день единственный подтвержденный данными клинических исследований метод лечения - иммобилизация пораженной конечности. Длительность иммобилизации может варьировать от 3 до 12 мес в зависимости от данных клинического обследования пациента. Назначение препаратов, усиливающих кровоток (пентоксифиллин, спазмолитики и т.д.), - грубейшая ошибка. В острой фазе имеет место значительное усиление кровообращения, особенно в системе артериовенозных шунтов, стимулирующее активность остеокластов и, как следствие, резорбции костной ткани. По данным плацебо-контролируемого исследования, препарат из группы бифосфонатов (памидроновая кислота), обладающий ингибирующим влиянием в отношении остеокластов, способствовал уменьшению температуры пораженной конечности, болевых ощущений, снижению уровня костной изоформы ЩФ, отражающей активность процессов костной резорбции. В обеих группах непременное условие лечения - осуществление разгрузки конечности с применением технологии Total Contact Cast. Именно эта процедура позволила достичь существенного уменьшения отечности пораженной конечности и значительного снижения температуры поверхности кожи стопы в группе плацебо. Исходя из вышесказанного, есть все основания утверждать, что разгрузка конечности - непременное условие эффективного лечения острой фазы стопы Шарко. Лекарственная терапия может рассматриваться лишь как дополнение к иммобилизации конечности.
КЛИНИЧЕСКАЯ КАРТИНА
Сравнительная характеристика нейропатической и ишемической форм приведена в табл. 10.40.
| Признак | Нейропатическая форма | Ишемическая форма |
|---|---|---|
Средний возраст |
Нет зависимости |
Старше 45 лет |
Длительность диабета |
При СД 1-го типа более 10 лет |
При СД 1-го типа более 15 лет |
Другие осложнения СД |
Встречаются часто |
Могут быть не столь выражены |
Сердечно-сосудистые заболевания |
Могут сопутствовать |
АГ; дислипидемия; ИБС; болезни сосудов шеи, головного мозга |
Вредные привычки |
Усугубляет злоупотребление алкоголем |
Чаще курение |
Язвы стоп в анамнезе |
Часто рецидивы |
Редко |
Состояние язв |
Безболезненная, окружена гиперкератозом |
Язва может быть болезненна, кожа вокруг истончена, часто образование сухого некроза в виде струпа |
Локализация язв |
Участки наибольшего давления на стопе (подошва, пальцы) |
В акральных зонах стопы (пятка, дистальные фаланги пальцев) |
Состояние кожи стоп и пульсации периферических артерий |
Кожа розовая, сухая, теплая на ощупь Пульсация на артериях стоп сохранена |
Кожа бледная или цианотичная, холодная на ощупь Пульсация на артериях снижена или отсутствует |
Чувствительность |
Определяется снижение вибрационной, болевой и температурной чувствительности (по типу «носков» и «перчаток»), снижение коленного и ахиллового рефлекса |
Чувствительность может быть сохранена или снижена незначительно |
Костные изменения |
Имеют место деформации пальцев и свода стопы, при остеоартропатии может развиться коллапс свода стопы |
Костные изменения развиваются редко, регистрирующиеся могут быть связаны с сопутствующими заболеваниями (деформирующий остеоартроз, подагра) |
Согласно современным международным рекомендациям, клинически значимая артериальная недостаточность может быть исключена при наличии хорошо пальпируемого пульса на тыльной артерии стопы, передней и задней большеберцовых артериях или лодыжечно-плечевом индексе >0,9. Лодыжечно-плечевой индекс >1,3 свидетельствует о ригидности артериальной стенки. У пожилых пациентов или у лиц с лодыжечно-плечевым индексом >1,2 состояние артериального кровотока должно быть подтверждено уровнем АД в пальцевой артерии (величиной пальце-плечевого индекса) или данными транскутанной оксиметрии (ТсрО2 >40 мм рт. ст.). Ультразвуковое дуплексное сканирование артерий подтверждает артериальную окклюзию, выявляет ее анатомическую локализацию и протяженность.
Основным методом диагностики инфекционного процесса в ране и определения показаний для проведения антибактериальной терапии является бактериологическое исследование. Для анализа необходимо брать образцы тканей из разных участков, так как микрофлора может различаться в разных областях дефекта. У пациентов с нейроишемической и ишемической формой синдрома диабетической стопы необходимо выявлять не только аэробные, но и анаэробные микроорганизмы и определять их чувствительность к современным антибактериальным препаратам. Клинически значимым считается содержание бактериальных тел выше 1×106 на грамм ткани или обнаружение β-гемолитического стафилококка.
Показанием для антибактериальной терапии могут служить также местные и системные признаки раневой инфекции. Системные признаки раневой инфекции:
Местные признаки раневой инфекции:
ДИАГНОСТИКА
Анамнез
При сборе анамнеза необходимо обратить внимание на наличие и длительность существования раневых дефектов, интенсивность возможных болевых ощущений, время обнаружения больным изменений со стороны стоп, вероятную причину, вызвавшую образование язвенного дефекта. Так же важно выявить факт травматизации стопы, оценить результаты предшествующего лечения, наличие сопутствующих осложнений СД и их лечение. Нельзя забывать о сопутствующих заболеваниях (хроническая сердечная недостаточность, ХПН, онкологические заболевания, алиментарные нарушения, прием глюкокортикоидных препаратов и иммуносупрессоров), которые могут в значительной степени повлиять на скорость заживления раневых дефектов.
Лабораторные исследования
Общий анализ крови, биохимический анализ крови, коагулограмма, бактериологическое исследование тканей раны.
Инструментальные исследования
Оценку вибрационной чувствительности проводят градуированным камертоном с частотой колебаний 128 Гц у основания 1 пальцев стоп, на дистальной фаланге 1 пальцев обеих стоп и на медиальной лодыжке троекратно с вычислением среднего значения. При оценке полученных данных необходимо учитывать возможное возрастное снижение показателей.
Оценку тактильной чувствительности осуществляют монофиламентом массой 10 г. Монофиламентом прикасаются перпендикулярно к поверхности кожи в течение 1,5 с с давлением, достаточным для того, чтобы он изогнулся. Отсутствие ощущения прикосновения у больного свидетельствует о нарушении тактильной чувствительности.
Состояние магистрального кровотока оценивают допплеровским анализатором с измерением систолического давления в артериях голени и/или пальцевой артерии. При отсутствии признаков медиакальциноза информативно использование показателей лодыжечно-плечевого индекса, отношение систолического давления в артериях голени к систолическому давлению в плечевой артерии. Нормальные значения лодыжечно-плечевого индекса составляют 0,9-1,2. Его показатели ниже 0,7 свидетельствуют о наличии стенозирующего поражения артерий. У пожилых пациентов или у лиц с лодыжечно-плечевым индексом >1,2 состояние артериального кровотока должно быть подтверждено уровнем АД в пальцевой артерии (величиной пальце-плечевого индекса) или данными транскутанной оксиметрии (ТсрО2 >40 мм рт. ст.).
Дуплексное сканирование артерий нижних конечностей позволяет с большей достоверностью определить локализацию и протяженность стеноза или окклюзии артерий.
Состояние тканевого кровотока оценивают с использованием транскутанной оксиметрии (ТсРО2 ). Нормальные значения ТсРО2 составляют 30 мм рт. ст. и выше. Показатели ТсРО2 ниже 30 мм рт. ст. свидетельствуют об ишемии тканей.
Показания к консультации других специалистов
При наличии признаков ишемии конечности показана консультация сосудистого хирурга. Совместно с ним необходимо решать вопрос о возможности реваскуляризации. На выбор метода вмешательства (транслюминарная баллонная ангиопластика, шунтирование, протезирование артерий) влияют локализация окклюзии, ее протяженность, возможность выполнения того или иного вида операции по сосудистому статусу, общее состояние пациента. Противопоказанием к сосудистой реконструкции может послужить инфаркт миокарда и инсульт давностью менее 6 мес, тяжелое онкологическое заболевание.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
-
СД 2-го типа. Синдром диабетической стопы, нейропатическая форма. Язвенный дефект плантарной поверхности правой стопы.
-
СД 1-го типа. Синдром диабетической стопы, нейропатическая форма. Диабетическая остеоартропатия, острая фаза.
-
СД 2-го типа. Синдром диабетической стопы, нейроишемическая форма. Язвенный дефект левой пяточной области.
-
СД 1-го типа. ДН на ст. ХПН, ХБП 5 ст. Дистальная полинейропатия. Облитерирующий атеросклероз артерий нижних конечностей с окклюзией артерий левой голени. Синдром диабетической стопы, нейроишемическая форма. Трофическая язва 1 пальца левой стопы.
ЛЕЧЕНИЕ Цели лечения
Целью лечения пациентов с любой клинической формой синдрома диабетической стопы является предотвращение высокой ампутации и сохранение опорной функции конечности.
В случае нейропатической формы поражения при своевременно начатой адекватной терапии удается предотвратить ампутацию в более чем 90% случаев. Для достижения этой цели необходимо проводить адекватную разгрузку пораженной конечности, хирургическую обработку раневого дефекта, использовать для местного лечения раны современные перевязочные средства.
Для эффективного лечения нейроишемической и ишемической формы синдрома необходимо восстановление артериального кровотока в объеме, достаточном для заживления раны. Также проводится санация гнойного очага (инфицированной раны) и разгрузка конечности. Решение об использовании антибактериальных препаратов принимается с учетом данных бактериологического исследования тканей раны, результатов клинического обследования, наличия и выраженности других осложнений СД и сопутствующих заболеваний.
При остеоартропатии (нейроостеоартропатия Шарко) в острой фазе - предотвращение дальнейшей деформации стопы. Основные компоненты лечения: функциональная разгрузка конечности (см. выше).
Показания к госпитализации
Медикаментозное лечение
Рациональное использование терапевтических возможностей, направленных на коррекцию гликемии, АГ и дислипидемии, - основа предотвращения тяжелых сосудистых осложнений СД. В связи с этим необходимо руководствоваться не видом лекарственной терапии, а достижением и поддержанием в длительной перспективе целевых значений следующих показателей:
-
гликемии и HbA1C в пределах индивидуальных целевых показателей;
-
АД (систолическое - 130-140 мм рт. ст., диастолическое - менее 90 мм рт. ст.);
-
показателей холестерина ЛПНП плазмы менее 2,0 ммоль/л или динамики показателя ЛПНП не менее чем 50% от исходного, что соответствует целевому уровню у пациентов группы очень высокого сердечно-сосудистого риска.
При наличии инфицированной раны проводят ее первичную хирургическую обработку. Первичная обработка раны направлена на удаление всех некротизированных и нежизнеспособных тканей и подготовку раневого ложа к заживлению. Возможно использование хирургического, ферментного, механического, ультразвукового методов или их комбинации. Метод обработки выбирается индивидуально, исходя из состояния раны, общего состояния больного, возможностей клиники. После проведения обработки рана должна быть закрыта стерильной атравматичной повязкой. В процессе лечения может возникнуть необходимость в повторном проведении обработки раневого дефекта.
Важнейшим аспектом лечения трофических язв у больных с синдромом диабетической стопы служит контроль раневой инфекции. Первым этапом является полное удаление некротизированных и нежизнеспособных тканей хирургическим методом. Могут быть использованы как классический метод хирургической обработки, так и современные технологии (гидрохирургическое оборудование, ультразвуковая кавитация). При наличии критической ишемии конечности проведение хирургической обработки раны опасно, так как может привести к расширению зоны некроза. В случае проведения адекватной обработки раневого дефекта эпителизация должна начаться в течение 2 нед, при условии соблюдения оптимального режима разгрузки пораженной области. Если этого не произошло, показано проведение бактериологического исследования тканей раны. Дальнейшие терапевтические мероприятия будут зависеть от результатов исследования. При выявлении β-гемолитического стафилококка и/или содержания микробных тел более 1×106 на грамм ткани показана повторная хирургическая обработка раневого дефекта и назначение системной антибактериальной терапии. Местное использование антисептиков не имеет определяющего успех лечения характер. При достижении бактериального баланса применение антисептика должно быть прекращено во избежание цитотоксического эффекта и бактериальной резистентности. В качестве антисептика не должны использоваться спиртсодержащие жидкости, растворы кислот и щелочей, красящие вещества.
При активном инфекционном процессе (фебрильная лихорадка, лейкоцитоз, гнойный раневой экссудат, гиперемия и гипертермия мягких тканей пораженной области) показано проведение системной антибактериальной терапии с учетом характера и чувствительности микрофлоры.
Важным условием при выборе антибактериального препарата является предварительная оценка выделительной функции почек (по СКФ). При СКФ <45 мл/мин/1,73 м2 доза антибактериального препарата должна быть редуцирована. Пациентам даже с начальными проявлениями ДН (на стадии микроальбуминурии) абсолютно противопоказаны препараты из группы аминогликозидов, амфотерицин В и некоторые цефалоспорины первого поколения.
При подозрении на наличие остеомиелита должно быть выполнено дополнительное обследование (зондирование раны, рентгенография, МСКТ). При подтверждении диагноза показано хирургическое лечение - удаление пораженной кости с последующей антибактериальной терапией в течение 2-4 нед.
После достижения бактериального баланса раны и заполнения ее объема здоровой грануляционной тканью на 75% и более возможно выполнение пластического закрытия раны местными тканями, или аутодермопластики.
Необходимо регулярно последовательно документировать состояние раны (локализация, размеры, раневое дно, отделяемое, состояние окружающей кожи, выраженность болевого синдрома) и определение скорости заживления и оценки эффективности лечения. В том случае, если раневой дефект за 4 нед не сократился на 40%, тактика лечения должна быть пересмотрена.
При тяжелых формах раневой инфекции, таких как флегмона, глубокие абсцессы, влажная гангрена, сепсис, антибиотикотерапию необходимо проводить только парентерально, в условиях стационара, в сочетании с полноценным хирургическим дренированием гнойных очагов, детоксикацией и коррекцией углеводного обмена. При менее тяжелых состояниях (наличии только локальных признаков раневой инфекции и неглубоких гнойных очагах) антибиотикотерапию можно назначить перорально и проводить в амбулаторных условиях. При нарушенном всасывании в ЖКТ, что может быть проявлением автономной нейропатии, необходимо переходить на парентеральный путь введения препарата. Достаточно часто у больных с синдромом диабетической стопы имеет место нарушение функции почек, вызванное ДН. Применение ЛС в обычных терапевтических дозах по ряду причин может ухудшить общее состояние больного, негативно влиять на эффективность лечения и отрицательно сказываться на состоянии почек. Во-первых, снижение выделительной функции почек повышает вероятность токсического воздействия препарата и его метаболитов на организм. Во-вторых, у пациентов с нарушенной функцией почек отмечают снижение толерантности к побочным эффектам препаратов. В-третьих, некоторые антибактериальные препараты не проявляют в полной мере своих свойств из-за нарушенной выделительной функции почек. С учетом вышесказанного следует вносить коррективы в дозу вводимого лекарственного вещества и выбор антибактериального препарата с учетом СКФ. Наиболее часто используемые схемы антибиотикотерапии представлены в табл. 10.41.
Микроорганизм |
ЛС |
|
внутрь |
внутривенно |
|
Стафилококки (Staphylococcus aureus) |
Клиндамицин 300 мг 3-4 раза в день Рифампицин 300 мг 3 раза в день Флуклоксациллин 500 мг 4 раза в день |
Клиндамицин 150-600 мг 4 раза в день Флуклоксациллин 500 мг 4 раза в день |
Метициллин резистентный Staphylococcus aureus |
Триметоприм 200 мг 2 раза в день Рифампицин 300 мг 3 раза в день Доксициклин 100 мг в сутки Линезолид 600 мг 2 раза в день |
Ванкомицин 1 г 2 раза в день Линезолид 600 мг 2 раза в день Даптомицин 4 мг/кг 1 раз в день |
Стрептококки |
Амоксициллин 500 мг 3 раза в день Клиндамицин 300 мг 3-4 раза в день Флуклоксациллин 500 мг 4 раза в день Эритромицин 500 мг 3 раза в день |
Амоксициллин 500 мг 3 раза в день Клиндамицин 150-600 мг 4 раза в день |
Энтерококки |
Амоксициллин 500 мг 3 раза в день |
Амоксициллин 500 мг 3 раза в день |
Анаэробы |
Метронидазол 250 мг 4 раза в день Клиндамицин 300 мг 3 раза в день |
Метронидазол 500 мг 3 раза в день Клиндамицин 150-600 мг 4 раза в день |
Колиформные (Escherichia coli, Proteus, Klebsiella, Enterobacter) |
Ципрофлоксацин 500 мг 2 раза в день Цефадроксил 1 г 2 раза в день Триметоприм 200 мг 2 раза в день |
Ципрофлоксацин 200 мг 2 раза в день Цефтазидим 1-2 г 3 раза в день Цефтриаксон 1-2 г в сутки Тазобактам 4,5 г 3 раза в день Триметоприм 200 мг 2 раза в день Меропенем 500 мг 1 г 3 раза в день Тикарциллин + клавулановая кислота 3,2 г 3 раза в день |
Род pseudomonas (P. аeruginosa) |
Ципрофлоксацин 500 мг 2 раза в день |
Цефтазидим 1-2 г 3 раза в день Меропенем 500 мг 1 г 3 раза в день Тикарциллин + клавулановая кислота 3,2 г 3 раза в день |
Хирургическое лечение
Пациенты с ишемией конечности нуждаются в проведении реваскуляризирующих вмешательств. Показаниями к ангиохирургическому вмешательству (баллонная ангиопластика, баллонная ангиопластика со стентированием, открытые вмешательства на сосудах нижних конечностей, гибридные операции) являются гемодинамически значимые (>85%) стенозы и/или окклюзии артерий нижних конечностей, ведущие к ишемии мягких тканей стопы (ТсрО2 <30 мм рт. ст.), риску развития гангрены и/или препятствующие заживлению раневых дефектов. В периоперационном периоде эндоваскулярного вмешательства необходимо проводить профилактику контраст-индуцированной нефропатии. Для этого накануне вмешательства и после его проведения пациентам группы риска (ХБП 2 ст. и выше) нужно отменить метформин, петлевые диуретики и ввести 1000 мл физиологического раствора внутривенно капельно. При наличии гнойно-некротического очага его первичная санация должна быть выполнена до ангиохирургического вмешательства.
При невозможности выполнения реваскуляризирующего вмешательства показано назначение препаратов простагландинового ряда.
При выявлении остеомиелита (зондирование дна раны, рентгенография, МСКТ) показана хирургическая санация остеомиелитического очага. В том случае, если хирургическое лечение остеомиелита невозможно (тяжелое общее состояние пациента), может быть использована длительная антибактериальная терапия.
Коррекция сахароснижающей терапии При наличии показаний (превышение индивидуальных целевых показателей углеводного обмена) коррекция терапии должна проводиться параллельно с лечением трофической язвы стопы.
При интенсификации лечения необходимо проводить профилактику тяжелых гипогликемических состояний.
Пациенты с нейроишемической и ишемической формой синдрома диабетической стопы нуждаются в коррекции возможной дислипидемии, а больные после выполненной ангиопластики - в приеме антитромботиков в течение 6 мес.
Местное лечение раны
Выбор повязки зависит от состояния локальной гемодинамики (наличия или отсутствия ишемии) и фазы раневого процесса. Выбранная повязка должна поддерживать влажную среду в ране, контролировать уровень экссудата и препятствовать мацерации краев. Она должна быть хорошо зафиксирована на ране, чтобы не травмировать ее за счет своей подвижности.
В настоящее время в клинической практике используется следующий широкий спектр перевязочных средств. Основные группы повязок представлены в табл. 10.42.
| Повязка | Характеристики |
|---|---|
Влажные марлевые салфетки |
Салфетки, смоченные физиологическим или гипертоническим раствором. Нуждаются в частой (до 4 раз в сутки) смене и при длительном использовании вызывают мацерацию окружающей рану здоровой кожи |
Нетканые абсорбирующие композиционные повязки |
Многослойные раневые покрытия, полностью исключающие или значительно уменьшающие прилипание, содержащие такие впитывающие волокна, как целлюлоза, хлопок или вискоза |
Пленки |
Поддерживают влажную среду, влагостойкие, плотно фиксируются, прозрачные (позволяют контролировать состояние раны без снятия повязки) |
Губчатые повязки |
Изготавливаются на основе пенообразующих растворов полимеров, атравматичные, обладают высокой впитывающей способностью, зависящей от толщины |
Гидроколлоиды |
В состав входят желатин и пектин; абсорбирующая способность низкая; плотно фиксируются на коже, непроницаемы для воды и воздуха |
Гидрогели |
Полимерные соединения, набухающие при взаимодействии с экссудатом раны, обладающие высокой впитывающей способностью |
Аморфные гидрогели |
Вода, полимеры и другие ингредиенты, входящие в состав повязки, способны поддерживать влажность раны |
Альгинаты |
Нетканые повязки, созданные на основе морских водорослей; при контакте с экссудатом превращаются в гель |
Комбинация гидрогелей и гидрополиперов |
Содержат волокна с высокой абсорбирующей способностью, посредством которых экссудат отводится от раны |
Повязки, содержащие антибиотики и антисептики |
Повязки различного состава с добавлением антисептиков (ионы серебра, повидон-йод и др.), способные постепенно отдавать в рану содержащиеся противомикробные препараты |
Комбинированные и импрегнированные повязки |
Марлевые и нетканые повязки, импрегнированные солями цинка или антисептиками |
Коллагенсодержащие повязки |
Повязки на основе свиного, бычьего, человеческого коллагена с добавлением окисленной целлюлозы или альгината |
Все эти современные средства местного лечения ран предназначены для использования на определенной стадии раневого процесса (экссудация, грануляция, эпителизация). Также необходимо помнить о том, что при лечении больных с нейроишемической и ишемической формой синдрома диабетической стопы противопоказано применение окклюзирующих повязок (гидроколлоидные и липидоколлоидные повязки), так как они препятствуют проникновению кислорода к ране, могут вызывать отек окружающих непораженных тканей, что усугубляет уже имеющуюся ишемию.
Дополнительные методы лечения
При отсутствии заживления на фоне стандартной терапии можно использовать дополнительные (адъювантные) методы: препараты на основе факторов роста, отрицательное давление, электростимуляцию. В отечественной клинической практике доступными являются препараты на основе тромбоцитарного и эпидермального ростовых факторов. Они доказали свою эффективность в лечении трофических язв у больных с синдромом диабетической стопы. Использование отрицательного давления (Negative Presuare Wound Therapy) возможно у пациентов с нейропатической и нейроишемической (после восстановления кровотока) формами синдрома. Абсолютно противопоказано использование Negative Presuare Wound Therapy у больных с выраженной ишемией конечности (TcpO2 <30 мм рт. ст.), остеомиелитом, флегмоной и гангреной стопы.
Дальнейшее ведение
Больные с синдромом диабетической стопы требуют активного пожизненного наблюдения в кабинете диабетической стопы и, при необходимости, обеспечения ортопедическим пособием. Частота визитов к специалисту определяется индивидуально и варьирует от 1 раза в 2 нед до 1 раза в 4-6 мес.
Информация для пациента
Информация для пациента касается ряда «разрешающих» и «запрещающих» правил, позволяющих больным осуществлять самостоятельный уход за стопами и тем самым снижать риск развития трофических язв. Рекомендации для больных приведены ниже.
Так нужно ухаживать за ногами при диабете!
-
Ежедневно необходимо внимательно осматривать свои стопы, особенно подошвенную поверхность, область пяток и межпальцевые промежутки. Пожилые люди и пациенты с избыточным весом могут испытывать при этом немалые затруднения. Им можно порекомендовать использовать при осмотре зеркало, установленное на полу, или попросить сделать это родственников. Помощь родственников особенно важна для лиц с нарушением зрения. Ежедневный осмотр позволяет своевременно обнаружить ранки, трещины, потертости.
-
Необходимо ежедневно мыть ноги. После мытья высушить кожу осторожными промокательными движениями, особенно в межпальцевых промежутках. Повышенная влажность в этих областях способствует развитию опрелостей и грибковых заболеваний. По этой же причине, используя увлажняющий крем при избыточной сухости кожи, не следует наносить его между пальцами.
-
Обрабатывать ногти следует регулярно (1 раз в 2 нед) с помощью педикюрной пилки. Это позволит не только избежать травматизации, но и сформировать правильный горизонтальный край ногтя, оставляя нетронутыми его уголки.
-
Наиболее подходящим средством для удаления мозолей и участков избыточного ороговения (утолщения и сухости) кожи является пемза. Лучше купить в аптеке специальную пемзу для ухода за ногами. Пользоваться ею нужно до мытья ног (обрабатывать сухую, нераспаренную кожу) и не стремиться привести в полный порядок все проблемные участки за один прием. Просто нужно это делать регулярно.
-
Если ноги мерзнут, согревать их надо теплыми носками соответствующего размера и без тугих резинок. Необходимо следить, чтобы носки в обуви не сбивались.
-
Нужно принять за правило проверять внутреннюю поверхность обуви рукой перед тем, как ее надеть: не попали ли внутрь какие-либо посторонние предметы, не завернулась ли стелька, не проступают ли острые гвоздики. Еще раз напомним, что это необходимо из-за того, что чувствительность стоп может быть снижена.
-
Ваши ноги надежно защищены, если вы носите правильно подобранную обувь. Советы по выбору необходимой для каждого конкретного пациента обуви можно получить в кабинете «Диабетическая стопа».
Этого при диабете делать нельзя!
-
Нельзя пользоваться при уходе за ногами никакими острыми предметами: ножницами, мозольными ножами, бритвенными лезвиями. Использование таких предметов - одна из самых частых причин возникновения травм, особенно в условиях сниженной чувствительности и плохого зрения! При отсутствии этих «факторов риска» пользование ножницами возможно, но не следует срезать ногти слишком коротко и глубоко выстригать уголки. Это может привести к образованию так называемого вросшего ногтя - причины болезненных ощущений, воспалительных процессов и длительного лечения, вплоть до хирургического вмешательства. Врастанию ногтя способствует ношение узкой обуви.
-
Если ноги мерзнут, нельзя согревать их с помощью грелок (в том числе электрических), батарей парового отопления, электронагревательных приборов. Температурная чувствительность при диабете часто бывает снижена, поэтому можно легко получить и вовремя не заметить ожог.
-
По этой же причине нельзя принимать горячие ножные ванны. Температура воды не должна быть выше 37 °С (ее лучше измерить с помощью водного термометра, как для купания детей). Ножные ванны не должны быть длительными - это делает кожу рыхлой и более травмируемой.
-
Не рекомендуется ходить без обуви (даже дома), так как при этом высока опасность травматизации с одновременным проникновением инфекции в область повреждения. На пляже и при купании нужно надевать купальные тапочки. Также следует оберегать ноги от солнечных ожогов. Недопустимо ношение обуви на босую ногу из-за большой вероятности образования потертостей.
-
Необходимо отказаться от неудобной (узкой, натирающей, давящей) обуви и не носить туфли на высоком (более 5 см) каблуке. Высокий каблук способствует образованию зон повышенного давления на подошвенной поверхности. Нужна осторожность по отношению к новой обуви: надевать ее в первый раз не более чем на час, а также ни в коем случае не применять никаких методов разнашивания, например надевания на мокрый носок. Дополнительный риск создает обувь, которая открывает, а значит, не защищает пальцы и пятку. Сандалии или босоножки с ремешком, проходящим между пальцами, могут травмировать нежную кожу в этой области.
-
Если на ногах есть мозоли, нельзя пытаться избавиться от них с помощью мозольных жидкостей, мазей или пластырей, так как все они содержат вещества, разъедающие кожу. Мозоли, как правило, образуются в результате ношения плохо подобранной или некачественной обуви, давящей на стопу в определенных местах.
-
Следует обращать внимание на резинки носков. Если они слишком тугие и оставляют вдавления на коже голеней, это затрудняет кровообращение.
ПРОГНОЗ
При нейропатической форме синдрома диабетической стопы заживление достижимо более чем у 90% больных.
При нейроишемической и ишемической формах синдрома вероятность ампутации составляет около 50% в зависимости от исходного состояния пациента, наличия тяжести сопутствующей патологии, глубины язвенно-некротических изменений стопы.
СПИСОК ЛИТЕРАТУРЫ
-
Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И.И. Дедова, М.В. Шестаковой. - М., 2013. - 120 с.
-
Сахарный диабет. Острые и хронические осложнения / Под ред. И.И. Дедова, М.В. Шестаковой. - М., 2011. - 477 с.
-
Удовиченко О.В., Бублик Е.В., Максимова Н.В., Пряхина К.Ю., Ермолаева О.С., Спруит П., Галстян Г.Р. Эффективность иммобилизирующих разгрузочных повязок Total Contact Cast: обзор зарубежных рандомизированных клинических исследований и собственные данные // Сахарный диабет. - 2010. - №2. - С. 50-55.
-
Bakker K., Apelqvist J., Schaper N.C. Practical guidelines on the management and prevention of the diabetic foot 2011 // Diab. Metab. Res. Rev. - 2012. - Vol. 28 (Suppl. 1). - P. 225-231.
-
Cavanagh P.R., Bus S.A. Off-loading the diabetic foot for ulcer prevention and healing // Plast Reconstr Surg. - 2011 Jan. - Vol. 127. - Suppl. 1. - P. 248S-256S.
-
Edwards J., Stapley S. Debridement of diabetic foot ulcers // Cochrane Database Syst. Rev. - 2010. - CD003556.
-
Lipsky B.A., Berendt A.R., Cornia P.B., Pile J.C., Peters E.J., Armstrong D.G., Deery H.G., Embil J.M., Joseph W.S., Karchmer A.W., Pinzur M.S., Senneville E. 2012 infectious diseases society of america clinical practice guideline for the diagnosis and treatment of diabetic foot infections // J. Am. Podiatr. Med. Assoc. - 2013 Jan-Feb. - Vol. 103 (1). - P. 2-7.
-
Morbach S., Furchert H., Gröblinghoff U., Hoffmeier H., Kersten K., Klauke G.T., Klemp U., Roden T., Icks A., Haastert B., Rümenapf G., Abbas Z. G., Bharara M., Armstrong D.G. Long-term prognosis of diabetic foot patients and their limbs: amputation and death over the course of a decade. // Diabetes Care. - 2012 Oct. - Vol. 35 (10). - P. 2021-2027. - Epub 2012 Jul.
-
Peters E.J., Lipsky B.A. Diagnosis and management of infection in the diabetic foot // Med. Clin. North Am. - 2013 Sep. - Vol. 97 (5). - P. 911-946.
-
Schaper N.C., Andros G., Apelqvist J., Bakker K., Lammer J., Lepantalo M. et al. Specific guidelines for the diagnosis and treatment of peripheral arterial disease in a patient with diabetes and ulceration of the foot 2011 // Diabetes Metab. Res. Rev. - 2012. - Vol. 28 (Suppl. 1). - P. 236-237.
-
Snyder R.J., Kirsner R.S., Warriner R.A. 3rd, Lavery L.A., Hanft J.R., Sheehan P. Consensus recommendations on advancing the standard of care for treating neuropathic foot ulcers in patients with diabetes // Ostomy Wound Manage. - 2010 Apr. - Vol. 56 (4 Suppl.). - P. S1-24.
-
Wukich D.K., Armstrong D.G., Attinger C.E., Boulton A.J., Burns P.R., Frykberg R.G., Hellman R., Kim P.J., Lipsky B.A., Pile J.C., Pinzur M.S., Siminerio L. Inpatient management of diabetic foot disorders: a clinical guide // Diabetes Care. - 2013 Sep. - Vol. 36 (9). - P. 2862-2871.
-
World Union of Wound Healing Societies (WUWHS) «Principles of best practice: Wound exudate and the role of dressings». A consensus document. - London: MEP Ltd, 2007.
ВЕДЕНИЕ САХАРНОГО ДИАБЕТА И СТРЕССОВОЙ ГИПЕРГЛИКЕМИИ В ПЕРИОД ИНТЕНСИВНОЙ ТЕРАПИИ И В ПЕРИОПЕРАЦИОННОМ ПЕРИОДЕ
Старостина Е.Г.
Стрессовая гипергликемия - уровень глюкозы в венозной плазме натощак выше 6,1 ммоль/л или в случайной точке более 11 ммоль/л, который возникает на фоне тяжелого биологического стресса и исчезает после его прекращения.
Отрицательное влияние на прогноз и различия в тактике ведения больных, находящихся в отделении реанимации и интенсивной терапии (ОРИТ), практически одинаковы при СД и стрессовой гипергликемии (здесь и далее - гипергликемия).
ЭПИДЕМИОЛОГИЯ
Гипергликемию, хотя бы однократно, обнаруживают у 97,5% больных, находящихся в ОРИТ, у 70% больных сепсисом, примерно у 60% больных с инфарктом миокарда и 50% больных с острым нарушением мозгового кровообращения (ОНМК) и 25% стационарных больных в целом. Больным СД чаще, чем лицам без него, требуются хирургические вмешательства, что обусловлено особенностями их сопутствующей патологии и степенью компенсации углеводного обмена. Так, из-за высокой частоты ИБС и тромбозов велик удельный вес таких больных в кардио-, ангио- и флебохирургии, общей и гнойной хирургии, урологии, отоларингологии, торакальной хирургии и др.
Гипергликемия повышает летальность и риск типичных осложнений (сепсиса, тяжелых воспалительных процессов, полинейропатии реанимационных больных и полиорганной недостаточности, раневых инфекций и др.), длительность пребывания в ОРИТ и сроки госпитализации. Увеличение концентрации глюкозы на каждые 1,1 ммоль/л свыше 5,5 ммоль/л увеличивает риск летального исхода в ОРИТ на 30%. Периоперационная гипергликемия более 12 ммоль/л в сравнении с гликемией менее этого значения повышает:
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Любая причина пребывания в ОРИТ (травма, кровотечение, ожоги, гипоксия, инфекции, включая сепсис, шок, операции и т.д.), как у больного СД, так и у лиц, ранее не страдавших им, вызывает резкое повышение концентраций контринсулярных гормонов и цитокинов и активацию симпатической нервной системы. Это ведет к периферической и печеночной инсулинорезистентности, относительной инсулиновой недостаточности, уменьшению утилизации глюкозы периферическими тканями и усилению ее продукции печенью, протеолизу, липолизу с повышением уровня глюкозы, уровней свободных жирных кислот, лактата, нередко кетоновых тел и развитием ацидоза. Контринсулярная реакция на биологический стресс зависит от тяжести состояния, объема и хода оперативного вмешательства и обширности операционной травмы. Периоперационная метаболическая декомпенсация может усиливаться вследствие голодания и дегидратации. Общая анестезия вносит вклад в нарушение метаболизма, усиливая активность симпатической нервной системы, продукцию норадреналина, кортизола и цитокинов.
Последствия гипергликемии
-
Увеличение частоты нозокомиальных и раневых инфекций; ухудшение процессов репарации из-за подавления клеточных и гуморальных звеньев иммунитета, включая фагоцитоз, и усиление системного воспалительного ответа из-за избыточной продукции цитокинов и других медиаторов воспаления.
-
Повышение риска инфаркта миокарда и смертности; частоты постинфарктной сердечной недостаточности; повторных инфарктов из-за нарушения ишемического прекондиционирования; уменьшение коллатерального кровотока; усиление апоптоза кардиомиоцитов; накопление лактата, что ухудшает сократительную функцию ишемизированного и неишемизированного миокарда. Кроме того, гипергликемия способствует повышению уровня катехоламинов, подъему АД, увеличению ЧСС и удлинению интервала Q-T.
-
Усиление действия факторов тромбообразования. Повышается синтез тромбоксана и концентрация фибриногена в плазме крови; усиливается агрегация тромбоцитов, увеличивается активность фактора фон Виллебранда; усиливаются дисфункция эндотелия сосудов и окислительный стресс; нарушается эндотелийзависимая вазодилатация.
-
Повышение риска ОНМК и смертности, расширение зоны инсульта, более длительное пребывание в стационаре и восстановительный период, более выраженная и стойкая инвалидизация независимо от возраста и степени тяжести ОНМК ишемического типа. Гипергликемия увеличивает зону обратимой ишемии и способствует ее трансформации в инфаркт. Летальность при ОНМК геморрагического типа не зависит от гликемии. Гипергликемия способствует нарушению гематоэнцефалического барьера, формированию отека мозга и геморрагической трансформации после тромболизиса. Кроме того, она неблагоприятно влияет на исходы ОНМК посредством тех же механизмов, что и при инфаркте миокарда (повышение концентрации медиаторов воспаления, перекисного окисления липидов, усиление эндотелиальной дисфункции, тромбообразования; подавление образования оксида азота и уменьшение кровотока).
ОБОСНОВАНИЕ НЕОБХОДИМОСТИ БЛИЗКОГО К НОРМАЛЬНОМУ УРОВНЯ ГЛИКЕМИИ В ОТДЕЛЕНИИ РЕАНИМАЦИИ И ИНТЕНСИВНОЙ ТЕРАПИИ И ПЕРИОПЕРАЦИОННОМ ПЕРИОДЕ
Инсулинотерапия, направленная на поддержание гликемии в целевых диапазонах, уменьшает описанные выше следствия гипергликемии в ОРИТ, положительно влияя на:
-
метаболизм и состояние питания (устранение гипергликемии, протеолиза и липолиза; снижение концентрации свободных жирных кислот, лактата и ацидоза; усиление поглощения глюкозы тканями и ее более эффективное энергетическое использование);
-
миокард, эндотелий (уменьшение эндотелиальной дисфункции, вазодилатация);
Возможность улучшения клинических исходов в ОРИТ при снижении гликемии с помощью непрерывной внутривенной инфузии инсулина (НВИИ) показана при следующих клинических ситуациях, сопровождающихся гипергликемией, в ОРИТ:
В сравнении с традиционным контролем гликемии (10-12 ммоль/л), интенсивная ее коррекция (4,4-6,6 ммоль/л) снижает летальность в ОРИТ с 8,0 до 4,6%, среди больных, находящихся в ОРИТ более 5 дней, - с 20,2 до 10,6%, после кардиохирургических операций - с 5,1 до 2,1%, после других операций - с 13,1 до 8,7%. При этом удельный вес сепсиса и полиорганной недостаточности в структуре летальности уменьшается с 33 до 8% (все различия статистически значимы). Кроме того, нормализация гликемии у пациентов, находящихся в ОРИТ, уменьшает суммарную частоту инфекций на 46%, почечной недостаточности - на 41%, «нейропатии реанимационных больных» - на 44%, длительности механической вентиляции более 14 дней - на 37%, длительности пребывания в ОРИТ - на 27%. У постинфарктных больных, имеющих СД, снижение гликемии с помощью НВИИ с первых суток заболевания в сравнении со стандартной сахароснижающей терапией достоверно снижает относительный риск годичной смертности на 28%, абсолютный риск - на 11%. Эти мероприятия дополнительно сохраняют жизнь каждого девятого пациента. Строгий контроль гликемии с помощью НВИИ у больных с черепно-мозговой травмой уменьшает внутричерепное давление, позволяет поддержать церебральную перфузию на восьмикратно меньшей дозе вазопрессоров, снижает частоту развития судорожного синдрома и улучшает отдаленные функциональные результаты.
ЦЕЛЕВОЙ ДИАПАЗОН ГЛИКЕМИИ
Вне зависимости от наличия СД в анамнезе и причины пребывания больного в ОРИТ для улучшения клинических исходов нужно поддерживать концентрацию глюкозы в диапазоне 7,8-10 ммоль/л. Уотдельных пациентов ОРИТ хирургического профиля может быть целесообразным выбор более низкого целевого диапазонау крайне тяжелых, по мнению ряда авторов, - 4,4-6,1 ммоль/л; гипогликемии и гипергликемии выше 10 ммоль/л при этом следует максимально избегать. При ОНМК рекомендован целевой диапазон 7,8-10,2 ммоль/л.
В периоперационном периоде необходимо поддерживать уровень глюкозы от 6 до 10, а по мнению ряда авторов - до 11 ммоль/л. Поддержание более строгого контроля гликемии (4-7 ммоль/л) не снижает смертность и количество осложнений. У больных СД, находящихся в обычных отделениях стационара (не ОРИТ), целевым диапазоном гликемии является < 7,8 ммоль/л перед приемами пищи и не выше 10 ммоль/л в случайной точке. Для больных в стабильном состоянии, ранее очень хорошо компенсированных, целевой диапазон гликемии может быть ниже. У пациентов старческого возраста или страдающих тяжелыми сопутствующими заболеваниями целевой диапазон гликемии может быть несколько выше.
ИНСУЛИНОТЕРАПИЯ В ОТДЕЛЕНИИ РЕАНИМАЦИИ И ИНТЕНСИВНОЙ ТЕРАПИИ И В ПЕРИОПЕРАЦИОННОМ ПЕРИОДЕ
НВИИ - единственное средство хорошего контроля гликемии у больных, находящихся в ОРИТ. Подкожное введение инсулина в условиях нарушения микроциркуляции при артериальной гипотонии, введении вазопрессоров, отеках или тучности не обеспечивает адекватного управления гликемией. Пероральные сахароснижающие препараты имеют свойства, ограничивающие их применение у больных, находящихся в ОРИТ, и не позволяют управлять гликемией на фоне ее резких колебаний.
МЕТОДИКА НЕПРЕРЫВНОЙ ВНУТРИВЕННОЙ ИНФУЗИИ ИНСУЛИНА
Готовят раствор ИКД со стандартной концентрацией 100 единиц в 100 мл 0,9% раствора натрия хлорида (приготовление смеси см. в разделе «Диабетический кетоацидоз»). НВИИ проводят с помощью отдельного инфузомата. Ее начинают у хирургических больных, ранее получавших сахароснижающую терапию, при гликемии более 6,7 ммоль/л; у всех остальных больных с уже известным СД - при гликемии более 3,9 ммоль/л. Если гипергликемия выявлена в ОРИТ впервые, то инсулинотерапию начинают при гликемии не выше 10 ммоль/л.
Средняя начальная скорость НВИИ зависит от:
-
исходной гликемии: около 0,5-1 ЕД/ч у хорошо компенсированных и 2-3 ЕД/ч у плохо компенсированных взрослых больных с СД без избыточной массы тела (у детей соответственно 0,3-0,4 или 0,5-1 ЕД/ч);
-
массы тела: возможная начальная скорость 0,02 ЕД/кг массы тела в час. Более низкая начальная скорость НВИИ (менее 0,5 ЕД/ч) возможна при дефиците массы тела, почечной, печеночной или ХНН.
Более высокую начальную скорость НВИИ (более 2 ЕД/ч) применяют при очень высокой гликемии, высокой потребности в инсулине до поступления в ОРИТ, при наличии состояний, связанных с инсулинорезистентностью (ожирение, инфекции, хроническая терапия стероидами и др.). Максимальный биологический эффект инсулина наблюдают при скорости введения не более 10 ЕД/ч; описаны случаи, когда для достижения нормогликемии у больных ОРИТ требовалась НВИИ со скоростью до 50 ЕД/ч.
В отсутствие инфузомата ИКД вводят внутривенно капельно (способ приготовления раствора см. «Диабетический кетоацидоз»), при этом у больного, находящегося в ОРИТ, гораздо труднее поддерживать гликемию близкой к норме, чем с помощью инфузомата, что связано с невозможностью точной оценки и коррекции скорости введения.
Определение гликемии проводят 1 раз в час до тех пор, пока она не будет удерживаться в целевом диапазоне в течение как минимум 4 ч. Затем исследование выполняют каждые 2 ч в течение 4 ч, если уровень глюкозы стабилен, то его определяют 1 раз каждые 4 ч. У пациентов в критическом состоянии определение концентрации глюкозы проводят 1 раз в час даже при стабильно хорошей гликемии. Ряд факторов у больных, находящихся в ОРИТ, влияет на точность определения глюкозы в капиллярной крови. Более надежно определение ее в артериальной или венозной крови, а также необходимо регулярно сверять результаты, полученные с помощью глюкометра, с лабораторными. Источники аналитических ошибок:
-
низкий и высокий гематокрит (соответственно, ложное завышение и занижение величины гликемии);
-
шок, дегидратация и гипоксия (ложное занижение или завышение, в зависимости от глюкометра);
-
гипербилирубинемия и резко выраженная дислипидемия (ложное завышение);
-
ЛС (аскорбиновая кислота, допамин, маннитол, салицилаты), передозировка парацетамола (ложное занижение или завышение, в зависимости от глюкометра).
Одновременно с НВИИ необходимо проводить медленную инфузию 5-10% раствора декстрозы (глюкозы♠). Средняя скорость ее введения, необходимая для профилактики гипогликемии, предотвращения голодного кетоза и протеолиза, около 5 г в час (например, 100 мл 5% раствора или 50 мл 10% раствора); для парентерального питания - см. далее. Если исходная гликемия у пациента превышает 14-15 ммоль/л, декстрозу (глюкозу♠) не вводят, но все необходимое должно быть наготове. Инсулин и декстрозу (глюкозу♠) вводят раздельно (через разные инфузионные системы), так как для достижения целевых показателей гликемии требуется частая коррекция скорости инфузии двух растворов по отдельности.
Γипогликемия: отсутствие частого контроля гликемии и коррекции дозы инсулина у больных, находящихся в ОРИТ, может быть сопряжено с риском гипогликемии, особенно у пациентов старше 75 лет, у больных СД с печеночной, сердечной и почечной недостаточностью, сепсисом, злокачественными опухолями, недостаточностью питания. Факторы риска гипогликемии в ОРИТ и в периоперационном периоде: снижение распознавания гипогликемии больным, рвота, недостаточное поступление углеводов в организм (как пероральное, так и парентеральное), внезапная отмена или снижение дозы кортикостероидов, выбор слишком низкого целевого диапазона гликемии. Гипогликемия на фоне НВИИ чаще очень кратковременная, что связано с отсутствием депо инсулина в подкожной жировой клетчатке и с коротким периодом полувыведения внутривенно введенного ИКД.
При гипогликемии (менее 3,3 ммоль/л): остановить НВИИ и в/в ввести 30 мл 40% раствора декстрозы (глюкозы♠) (если пациент в сознании) или 60 мл (если пациент без сознания). Определять гликемию каждые 20 мин, при уровне менее чем 3,3 ммоль/л вводить по 30 мл 40% раствора декстрозы (глюкозы♠). Возобновить НВИИ с меньшей скоростью после повышения гликемии до 3,9 ммоль/л и выше (повторить определение дважды).
При НВИИ и глюкозы обязателен тщательный контроль уровня K+ плазмы. При нормальной функции почек и нормальном уровне K+ плазмы вводят по 10-20 мЭкв калия (18-20 мл 4% раствора калия хлорида) на каждый литр 5% раствора декстрозы (глюкозы♠) (при гипокалиемии - больше).
Если вместо раздельной инфузии инсулина и декстрозы (глюкозы♠) используют глюкозо-инсулино-калиевую смесь, то ее готовят так: к 500 мл 10% декстрозы (глюкозы♠) добавляют 15 ЕД ИКД и 0,7-0,8 г калия хлорида (18-20 мл 4%). При гликемии более 11 ммоль/л необходимо заменить инфузионный раствор на другой, с более высокой концентрацией инсулина [20 ЕД ИКД в 500 мл 10% декстрозы (глюкозы♠)]; при гликемии менее 6 ммоль/л готовят новую смесь с содержанием 10 ЕД ИКД в 500 мл 10% декстрозы (глюкозы♠). Приготовление разнородных смесей трудоемко. Введение глюкозо-инсулино-калиевой смеси подходит больным с не очень высокой гликемией. Эта процедура не позволяет раздельно корректировать скорость введения инсулина и скорость введения декстрозы (глюкозы♠), а также эффективно и безопасно управлять гликемией. Поэтому в ОРИТ целесообразно отказаться от применения готовой глюкозо-инсулино-калиевой смеси.
Для повышения эффективности, безопасности и экономичности НВИИ в ОРИТ необходимо определять гликемию у постели больного (частоту см. выше). Безотлагательно корректировать скорость инфузии инсулина и декстрозы (глюкозы♠) строго по протоколу (алгоритму, табл. 10.43), предпочтительно обученной медицинской сестрой. Стандартизация протокола НВИИ и глюкозы в сравнении с введением инсулина «на усмотрение врача» позволяет быстрее достичь целевых цифр гликемии и длительно удерживать их при очень низкой частоте тяжелых гипогликемий (менее 1,4%).
Алгоритм 1 |
Алгоритм 2 |
Алгоритм 3 |
Алгоритм 4 |
||||
гликемия ЕД/ч |
гликемия ЕД/ч |
гликемия ЕД/ч |
гликемия ЕД/ч |
||||
Менее 3,3 (гипогликемия), проводимые мероприятия см. в тексте |
|||||||
Менее 3,9 |
Не вводить |
Менее 3,9 |
Не вводить |
Менее 3,9 |
Не вводить |
Менее 3,9 |
Не вводить |
3,9-6,1 |
0,2 |
3,9-6,1 |
0,5 |
3,9-6,1 |
1 |
3,9-6,1 |
1,5 |
6,2-6,6 |
0,5 |
6,2-6,6 |
1 |
6,2-6,6 |
2 |
6,2-6,6 |
3 |
6,7-8,3 |
1 |
6,7-8,3 |
1,5 |
6,7-8,3 |
3 |
6,7-8,3 |
5 |
8,4-9,9 |
1,5 |
8,4-9,9 |
2 |
>8,4-9,9 |
4 |
8,4-9,9 |
7 |
10-11,6 |
2 |
10-11,6 |
3 |
10-1,6 |
5 |
10-11,6 |
9 |
11,7-13,3 |
2 |
11,7-13,3 |
4 |
11,7-13,3 |
6 |
11,7-13,3 |
12 |
13,4-14,9 |
3 |
13,4-14,9 |
5 |
13,4-14,9 |
8 |
>13,4-14,9 |
16 |
15-16,6 |
3 |
15-16,6 |
6 |
15-16,6 |
10 |
15-16,6 |
20 |
16,7-18,3 |
4 |
16,7-18,3 |
7 |
16,7-18,3 |
12 |
16,7-18,3 |
24 |
18,4-19,9 |
4 |
18,4-19,9 |
8 |
18,4-19,9 |
14 |
Более 18,4 |
28 |
Более 20 |
6 |
Более 20 |
12 |
Более 20 |
16 |
||
-
Алгоритм 2: если на алгоритме 1 не достигнут контроль; при аортокоронарном шунтировании, пересадке солидных органов или β-клеток, на фоне терапии глюкокортикоидами и у больных СД, ранее получавших более 80 ЕД инсулина в сутки.
-
Алгоритм 3: используют в случае безуспешности предыдущего этапа. Не применять этот алгоритм в качестве начального без консультации эндокринолога.
-
Алгоритм 4: применять при неэффективности алгоритма 3. Никогда не использовать в качестве начального этапа.
Переход на более высокий алгоритм производят, если гликемия не попадает в целевой диапазон и не снижается хотя бы на 3,3 ммоль/л в час. Переход на более низкий: если гликемия менее 3,9 ммоль/л 2 раза подряд. Если при использовании вышеуказанных алгоритмов целевые цифры гликемии достигнуты не были, необходима консультация эндокринолога.
ПОЛНОЕ ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ ПРИ ГИПЕРГЛИКЕМИИ
Полное парентеральное питание больного СД и питание через желудочный зонд принципиально не отличаются от питания здорового пациента. Средняя суточная потребность таких больных в углеводах составляет 200 г, в ОРИТ - до 300 г/сут. Их вводят в виде растворов декстрозы (глюкозы♠ ) различной концентрации (растворы фруктозы не показаны) и легко компенсируют увеличением скорости НВИИ. Полное парентеральное питание у больных, находящихся в ОРИТ, ведет к более выраженному повышению гликемии, чем энтеральное питание с применением медленно всасывающихся углеводов. Вероятность гипергликемии на фоне полного парентерального питания увеличивается с возрастом, тяжестью состояния пациента и зависит от скорости инфузии декстрозы (глюкозы♠ ). При нем потребность в инсулине может быть довольно высокой (в среднем, 100 ± 8 ЕД/сут). В связи с этим полное парентеральное питание проводят на фоне НВИИ по описанным выше правилам. Если используют растворы декстрозы (глюкозы♠ ) с концентрацией более 5%, то на каждые 10 г декстрозы (глюкозы♠ ) дополнительно вводят 1 ЕД ИКД. В послеоперационном периоде НВИИ продолжают до начала самостоятельного приема пищи и перевода на подкожную инсулинотерапию. Ее прекращают утром, через 1-2 ч после первой подкожной инъекции инсулина перед завтраком.
ОПЕРАЦИОННЫЙ РИСК И ОСОБЕННОСТИ АНЕСТЕЗИИ
Больные СД входят в группу высокого хирургического и анестезиологического риска, но при соблюдении определенной тактики ведения сам по себе СД не повышает послеоперационную летальность и никогда как таковой не должен служить противопоказанием к операции. Для снижения риска необходимо (до операции) тщательно оценить степень компенсации СД, наличие его осложнений и частых сопутствующих заболеваний, которые повышают риск в анестезиологической и хирургической практике.
Параметры оценки
-
Степень компенсации СД (гликемия, ацетонурия; перед плановыми операциями, по возможности, HbA1C ; глюкозурию определять не нужно).
-
Степень гидратации (АД, диурез, ортостатическая гипотония); кислотно-основное состояние (как минимум, pH и концентрация бикарбоната плазмы) и электролиты (K+ , Na+ ), особенно у декомпенсированных больных СД.
-
Состояние сердечно-сосудистой системы, особенно перед операциями средней тяжести и тяжелыми:
-
оценить риск возникновения инфаркта миокарда как важной причины послеоперационной летальности (при СД нередка безболевая ишемия миокарда, поэтому перед плановыми операциями, при высокой вероятности ИБС, целесообразно проведение нагрузочных тестов и холтеровского мониторирования);
-
диагностировать наличие диабетической кардиомиопатии (увеличивается риск сердечной недостаточности, особенно при перегрузке жидкостью, в том числе у молодых больных с СД, не страдающих ИБС).
-
Вегетативная диабетическая нейропатия (у больных с продолжительностью СД более 10 лет), в частности:
-
диабетический гастропарез и атоническая форма энтеропатии (замедление эвакуации и моторики повышает риск аспирации, послеоперационной тошноты и рвоты, паралитического илеуса);
-
нейропатия сердечно-сосудистой системы (риск периоперационной артериальной гипотонии; необходимо проведение ортостатических проб);
-
нейропатия мочевыводящих путей (риск послеоперационной атонии мочевого пузыря).
-
-
Функция почек (креатинин сыворотки крови, протеинурия, СКФ по формуле Кокрофта-Голта).
-
Глазное дно (вероятность новых кровоизлияний при препролиферативной и пролиферативной диабетической ретинопатии).
-
Риск тромбоэмболических осложнений (возрастает у декомпенсированных больных с СД; у больных с СД старше 60 лет, имеющих ожирение, тяжелую инфекцию и до операции малоподвижных в течение более 3 сут, в частности, с синдромом диабетической стопы).
Выбор метода анестезии. По возможности предпочтительна регионарная (эпидуральная, спинальная) анестезия, поскольку она сопровождается менее выраженными метаболическими и нейровегетативными изменениями. При диабетической вегетативной нейропатии высокая эпидуральная и высокая спинальная анестезия противопоказаны.
ПОДГОТОВКА БОЛЬНОГО С САХАРНЫМ ДИАБЕТОМ К ОПЕРАЦИИ
Экстренные вмешательства: многие больные находятся к этому моменту в стадии декомпенсации, вплоть до кетоацидоза. Операцию следует по возможности отложить, чтобы с помощью НВИИ и жидкости провести максимально возможную предоперационную коррекцию гипергликемии, степени гидратации, уровня калия и pH (по тем же принципам, что и лечение ДКА).
Плановые вмешательства. Предоперационная подготовка зависит от гликемии и объема предстоящей операции.
-
Малые хирургические вмешательства (местное обезболивание, амбулаторные) не требуют специальной подготовки (изменения питания) и каких-либо принципиальных изменений сахароснижающей терапии.
-
Средние и большие хирургические вмешательства (в условиях стационара, требующие изменения питания, регионарной анестезии или наркоза) требуют отмены пероральных сахароснижающих средств (метформина за 48 ч до операции из-за риска лактатацидоза; ПСМ длительного действия за 24 ч до операции, короткого действия и глинидов за 12 ч или утром в день операции; тиазолидиндионы за 48 ч) и достижения оптимальной компенсации обмена веществ до операции, для чего, как правило, назначают инсулин. Обойтись без перевода на инсулин удается лишь у больных с СД 2-го типа, у которых ранее, на фоне только диеты или небольших доз пероральных сахароснижающих средств, гликемия натощак и в течение дня была меньше 7 ммоль/л и HbA1C менее 6,5%. Дополнительные факторы в пользу предоперационного перевода на инсулин:
Если больной в предоперационном периоде был компенсирован, то перед ужином и на ночь накануне операции ему вводят обычную дозу инсулина (или обычную дозу ПСМ, остальные пероральные сахароснижающие средства отменяются). Если ужинать нельзя, то ИКД вечером не делают, оставляя лишь инсулин продленного действия на ночь. Если ранее пациент получал вечером только инсулин продленного действия, его дозу уменьшают на 20-50%; дозу ПСМ уменьшают вдвое. Наконец, если уровень гликемии вечером накануне операции более 7 ммоль/л, то даже при пропуске ужина следует ввести ИКД (возможно, в меньшей дозе), а дозу инсулина продленного действия почти не снижают.
УПРАВЛЕНИЕ ГЛИКЕМИЕЙ В ДЕНЬ ОПЕРАЦИИ
Плановые оперативные вмешательства при СД проводят с утра. Основа оптимального ведения больного - частое экспресс-определение концентрации глюкозы (1 раз в час, при стабильно хороших показателях 1 раз в 2 ч) и соответствующая немедленная коррекция терапии. Способы периоперационного управления гликемией зависят:
В табл. 10.44 приведен ориентировочный алгоритм при плановых вмешательствах у больных с исходно хорошо компенсированным СД.
Утром в день операции вначале проводят экспресс-анализ гликемии. Если она превышает 10 ммоль/л, можно ввести небольшую коррекционную (2-3 ЕД) дозу ИКД. Затем при вмешательствах среднего объема возможны два варианта инсулинотерапии: подкожно и внутривенно (в последнее время все чаще применяют НВИИ); при вмешательствах большого объема - только НВИИ. Правила раздельной НВИИ и глюкозы см. выше.
Периоперационная подкожная инсулинотерапия: только у очень хорошо компенсированных пациентов при малых и средних операциях небольшой продолжительности. Утром в день операции вводят половину обычной дозы инсулина продленного действия. В настоящее время от инъекционной инсулинотерапии во время операции отходят (непредсказуемость всасывания инсулина из подкожной клетчатки в периоперационном периоде). В послеоперационном периоде рекомендуется интенсифицированная инсулинотерапия с применением инсулина (ультра) короткого действия и базального инсулина, но не «дробная» инсулинотерапия (только препаратом короткого действия, без базального).
Выбор раствора декстрозы (глюкозы♠ ) зависит от предполагаемой длительности введения и клинических особенностей больного. При относительно непродолжительных операциях в час вводят по 100-125 мл 5% раствора декстрозы (глюкозы♠ ). При более длительных вмешательствах, во избежание перегрузки жидкостью, используют 50 мл 10% раствора декстрозы (глюкозы♠ ) в час. Если перегрузка жидкостью нежелательна для пациента, используют 20% или 40-50% раствор декстрозы (глюкозы♠ ) в меньших объемах, а для поддержки гемодинамики и возмещения кровопотери используют растворы, не содержащие глюкозу.
| Терапия до операции | Терапия в периоперационном периоде |
|---|---|
Легкие операции (например, имплантация электрокардиостимулятора, инвазивные диагностические процедуры) |
|
Только диета / Частое определение гликемии |
|
Пероральные сахароснижающие средства |
Отмена пероральных сахароснижающих средств перед операцией. Частое определение концентрации глюкозы. Возобновление приема пероральных сахароснижающих средств перед первым приемом пищи |
Инсулин |
Оперировать рано утром. До операции не завтракать, ввести 50% обычной утренней дозы инсулина продленного действия. До и во время операции провести инфузию 5% раствора декстрозы (глюкозы♠), определять концентрацию глюкозы ежечасно. Перед первым после операции приемом пищи измерить гликемию и ввести обычную дозу инсулина (с коррекцией в зависимости от ее уровня и питания) |
Операции средней тяжести (типа протезирования тазобедренного сустава, ампутации небольшого объема) |
|
Только диета |
Внутривенно инфузия 5% раствора декстрозы (глюкозы♠) вплоть до первого приема пищи, частое определение гликемии |
Пероральные сахароснижающие средства |
Отмена пероральных сахароснижающих средств перед операцией. До операции не завтракать. Внутривенно инфузия 5% раствора декстрозы (глюкозы♠), вплоть до первого приема пищи, определять гликемию ежечасно. Инсулин иметь наготове. Возобновить прием пероральных сахароснижающих средств перед первым употреблением пищи |
Инсулин |
Оперировать рано утром. До операции не завтракать. Вариант 1. Перед операцией ввести 50% (при СД 2-го типа) или 80-100% (при СД 1-го типа) обычной утренней дозы инсулина продленного действия. До и во время операции необходимо проводить инфузию 5-10% раствора декстрозы (глюкозы♠); определение гликемии ежечасно. Вариант 2. НВИИ и глюкозы; правила см. в тексте. Перед первым после операции приемом пищи измерить гликемию и ввести обычную дозу инсулина (с коррекцией в зависимости от гликемии и питания) |
Тяжелые операции с последующим парентеральным питанием на протяжении нескольких дней (типа резекции кишки) |
|
Только диета |
Адекватное парентеральное питание. Частое определение гликемии, инсулин иметь наготове |
Пероральные сахароснижающие средства |
Отмена пероральных сахароснижающих средств и перевод на инсулин заранее, до операции*. Оперировать рано утром. До операции не завтракать. Во время операции и после нее, в течение периода парентерального питания применять НВИИ и глюкозы; правила см. в тексте. Перед первым после операции приемом пищи измерить гликемию и ввести обычную дозу инсулина (с коррекцией в зависимости от концентрации глюкозы и питания) |
Инсулин |
Вечером накануне операции 50% (при СД 2-го типа) или 80-100% (при СД 1-го типа) обычной вечерней дозы инсулина продленного действия. Оперировать рано утром. До операции не завтракать. Во время операции и после нее, в течение периода парентерального питания использовать НВИИ и глюкозы; правила см. в тексте. Перед первым после операции приемом пищи измерить гликемию и ввести обычную дозу инсулина (с коррекцией в зависимости от гликемии и питания) |
* Пациенты с уровнем гликированного гемоглобина менее 6,5% или гликемией в течение суток не более 7 ммоль/л.
ОСОБЕННОСТИ ВЕДЕНИЯ БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ ПРИ НЕКОТОРЫХ ВИДАХ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
Операции на «открытом сердце»: очень высокая интраоперационная потребность в инсулине в связи с применением растворов, содержащих глюкозу, и усилением инсулинорезистентности вследствие гипотермии. На каждый грамм глюкозы требуется в среднем втрое большая доза инсулина, чем при обычных операциях.
Кесарево сечение: особо частый контроль гликемии и экстренная коррекция скорости инфузии инсулина. Вначале скорость НВИИ высокая, что связано с выраженной инсулинорезистентностью в конце беременности, применением некоторых токолитиков, иногда кортикостероидов. После отделения плаценты потребность в инсулине резко падает, что требует быстрого снижения скорости НВИИ для предотвращения гипогликемии.
Малоинвазивные (лапароскопические) операции: метаболические нарушения и инсулинорезистентность выражены так же, как при использовании традиционных хирургических методик, поэтому принципы периоперационного ведения больных одинаковые.
Другие мероприятия в периоперационном периоде направлены на уменьшение периоперационного стресса. Они включают:
-
адекватную премедикацию, анестезию и послеоперационное обезболивание;
-
предпочтительное применение эпидуральной анестезии (по возможности);
-
предоперационную инфузию декстрозы (глюкозы♠ ) (с инсулином) вместо традиционного ночного голодания;
-
особо тщательная профилактика тошноты и рвоты. Прокинетики (метоклопрамид) показаны пациентам с высоким риском аспирации (диабетический гастропарез) и при декомпенсации СД;
-
при вегетативной нейропатии мочевого пузыря необходим тщательный контроль за его регулярным опорожнением для профилактики восходящей инфекции;
-
у декомпенсированных больных СД необходимо особое внимание обратить на немедикаментозную и медикаментозную профилактику венозных тромбо-эмболических осложнений;
-
глюкокортикоиды у больных, находящихся в ОРИТ, следует назначать по строгим показаниям и только в небольших, физиологически стрессовых, дозах (не более 200-300 мг гидрокортизона в сутки). Например, лабораторно верифицированная НН или пациенты с тяжелым сепсисом/септическим шоком и артериальной гипотонией, не отвечающие на стандартную инфузионную терапию и вазопрессоры;
-
гипергликемию, возникшую в условиях ОРИТ в ответ на введение стероидов, корректируют с помощью НВИИ;
-
в хирургическом отделении необходимо обеспечить своевременную раздачу питания больным с СД, включая промежуточные приемы пищи и возможность экспресс-анализа гликемии в отделении. Необходимо оперативно корректировать инсулинотерапию в зависимости от изменяющейся потребности;
-
обученным больным с СД, если позволяет общее состояние, в стационаре следует разрешить самостоятельно контролировать гликемию и адаптировать дозу инсулина, записывая все показатели и изменения в дневнике диабета;
-
больных с СД 2-го типа, которые ранее были компенсированы на диете или с помощью пероральных сахароснижающих средств, переводят с инсулинотерапии обратно на них только при наличии уверенности в отсутствии местных и системных гнойно-воспалительных осложнений и в хорошем заживлении раны (оптимально не ранее, чем будут сняты швы). Отмену инсулина и назначение других сахароснижающих средств проводят до выписки из стационара, а при необходимости - с переводом пациента в терапевтическое или эндокринологическое отделение.
СПИСОК ЛИТЕРАТУРЫ
-
Потемкин В.В., Старостина Е, Г. Неотложная эндокринология. Руководство для врачей. - М., Медицинское информационное агентство, 2008. - 400 с.
-
Adams H.P., Del Zoppo G., Alberts M.J. et al. Guidelines for the Early Management of Adults with Ischemic Stroke (Guideline from the American Heart Association / American Stroke Association etc.) // Stroke. - 2007. - Vol. 38. - P. 1655-1692.
-
Berger M., Rave K. Die perioperative Betreuung des Diabetikers // Berger M. Diabetes Mellitus. 2 Aufl. Urban & Fisher, Muenchen-Jena, 2000. - P. 683-687.
-
Buchleitner AM, Martínez-Alonso M, Hernández M, Solà I, Mauricio D. Perioperative glycaemic control for diabetic patients undergoing surgery // Cochrane Database Syst. Rev. - 2012 Sep 12. - Vol. 9:CD007315.
-
Deedwania P, Kosiborod M, Barrett E, Ceriello A, Isley W, Mazzone T, et al. Hyperglycemia and acute coronary syndrome: A scientific statement from the American Heart Association Diabetes Committee of the Council on Nutrition, Physical Activity, and Metabolism // Circulation. - 2008. - Vol. 117. - Р. 1610-1619.
-
Duncan AE. Hyperglycemia and perioperative glucose management // Curr. Pharm. Des. 2012. - Vol. 18 (38). - Р. 6195-6203.
-
Gearhart M.M., Parbhoo S.K. Hyperglycemia in the critically ill patient // AACN Clin Issues. - 2006. - Vol. 17 (1). - Р. 50-55.
-
Gill G.V. Surgery in patients with diabetes mellitus // Textbook of Diabetes, ed. Pickup J.C., Williams G. - Blackwell Science Ltd., 2003. - P. 41.1-41.9.
-
Marik P.E., Zaloga G.P. Early enteral nutrition in acutely ill patients: a systematic review // Crit. Care Med. - 2001. - Vol. 29. - Р. 2264-2270.
-
Moghissi ES1, Korytkowski MT, DiNardo M, Einhorn D, Hellman R, Hirsch IB, Inzucchi SE, Ismail-Beigi F, Kirkman MS, Umpierrez GE;American Association of Clinical Endocrinologists; American Diabetes Association. American Association of Clinical Endocrinologists and American Diabetes Association consensus statement on inpatient glycemic control // Diabetes Care. - 2009. - Vol. 32 (6). - Р. 1119-1131.
-
Raghavan M., Marik P.E. Stress hyperglycemia and adrenal insufficiency in the critically ill // Sem. Resp. Crit. Care Med. - 2006. - Vol. 27 (3). - P. 274-285.
-
Umpierrez G.E., Smiley D., Jacobs S., Peng L., Temponi A., Mulligan P., Umpierrez D., Newton C., Olson D., Rizzo M. Randomized study of basal-bolus insulin therapy in the inpatient management of patients with type 2 diabetes undergoing general surgery (RABBIT 2 surgery) // Diabetes Care. - 2011. - Vol. 34 (2). - Р. 256-261.
-
Van den Berghe G., Wouters P., Weekers F. et al. Intensive insulin therapy in the critically ill patients // N. Engl. J. Med. - 2001. - Vol. 345. - P. 1359-1367.
ГИПОГЛИКЕМИЯ И ГИПОГЛИКЕМИЧЕСКАЯ КОМА
Глинкина И.В.
Гипогликемия (биохимическое определение) - снижение концентрации глюкозы в плазме крови менее 2,8 ммоль/л в сочетании с клиническими проявлениями (см. ниже) или менее 2,2 ммоль/л независимо от симптоматики. Если гипогликемия сопровождается потерей сознания, то такое состояние называют гипогликемической комой.
КОД ПО МКБ-10
ЭТИОЛОГИЯ
Основная причина гипогликемии - избыток инсулина в организме по отношению к поступлению углеводов экзогенно (с пищей) или эндогенно (в результате продукции печенью) и/или при ускорении их утилизации (при повышенной мышечной работе).
Причины развития гипогликемии следующие.
-
Связанные с сахароснижающей терапией:
-
передозировка инсулина, ПСМ, глинидов:
-
ошибка врача (низкий целевой уровень гликемии, высокие дозы препаратов);
-
ошибка пациента (неправильный набор дозы инсулина или дополнительный прием препаратов, самостоятельное увеличение дозы инсулина или препаратов);
-
неисправность шприц-ручки, использование шприца, предназначенного для введения инсулина с более низкой концентрацией;
-
неисправность глюкометра (завышенные цифры при измерении концентрации глюкозы в крови);
-
намеренная передозировка с суицидальными или манипулятивными целями;
-
-
изменение фармакокинетики инсулина, ПСМ, глинидов:
-
замедленное выведение (почечная или печеночная недостаточность, наличие антител к инсулину);
-
неправильная техника введения инсулина (изменение глубины или неправильный выбор места инъекции, массаж места инъекции, воздействие высокой температуры);
-
лекарственные взаимодействия (β-адреноблокаторы, салицилаты, ингибиторы моноаминоксидазы и некоторые другие потенцируют действие пероральных сахароснижающих препаратов);
-
-
-
-
пропуск приема пищи или недостаточное количество углеводов (ХЕ) в рационе;
-
кратковременные незапланированные физические нагрузки без приема углеводов до и после нагрузки;
-
ограничение питания или голодание для снижения массы тела (без уменьшения дозы сахароснижающих препаратов);
-
замедленная эвакуация пищи из желудка (при автономной нейропатии);
-
ПАТОГЕНЕЗ
В физиологических условиях глюкоза - единственный энергетический субстрат для клеток ЦНС. У здорового человека с помощью электрофизиологических методов регистрируют первые признаки реакции головного мозга на снижение гликемии с 4,9 до 3,8 ммоль/л. Поскольку глюкоза - основной субстрат метаболизма для ЦНС, в процессе эволюции выработаны механизмы, направленные на поддержание ее баланса: гликогенолиз и глюконеогенез, торможение утилизации инсулинзависимыми тканями. Эти процессы активируются контринсулярными гормонами (глюкагон, катехоламины, кортизол, гормон роста), секреция которых увеличивается при содержании глюкозы в плазме крови около 3,8 ммоль/л. Стимуляция вегетативной нервной системы в ответ на снижение концентрации глюкозы в плазме крови до 3,3 ммоль/л проявляется так называемыми вегетативными симптомами (см. ниже). При падении уровня гликемии до 2,7 ммоль/л отмечают симптомы дефицита поступления глюкозы в головной мозг (нейрогликопенические симптомы). При резком развитии гипогликемии вегетативные и нейрогликопенические симптомы возникают одновременно.
У пациентов с непродолжительным течением СД система контррегуляции функционирует так же, как у здоровых людей. При длительном течении заболевания возможна ее дисфункция: сначала снижение секреции глюкагона, а затем адреналина. Эти регуляторные сдвиги повышают риск развития тяжелой гипогликемии. Больные СД не должны ожидать самопроизвольного прекращения гипогликемии, а всегда самостоятельно принимать активные меры для ее купирования.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические проявления гипогликемии включают:
-
вегетативные симптомы (связаны с компенсаторной активацией вегетативной нервной системы): адренергические - сердцебиение, тремор, бледность, нервозность и тревожность, ночные кошмары, холинергические - повышенное потоотделение, чувство голода, парестезии;
-
нейрогликопенические симптомы (обусловлены снижением поступления в ЦНС основного энергетического субстрата - глюкозы): слабость, повышенная утомляемость, снижение концентрации внимания, головокружение, зрительные и речевые нарушения, изменение поведения, судороги, нарушение сознания.
Симптомы гипогликемии неспецифичны, и порог их возникновения может сильно варьировать. У пациентов с длительным анамнезом декомпенсированного СД или страхом гипогликемий клиническая симптоматика может развиваться при уровне гликемии 5-7 ммоль/л (ложная гипогликемия, не требующая вмешательства), в то время как пациенты с автономной нейропатией могут не распознавать истинную гипогликемию (снижение уровня глюкозы в крови <2 ммоль/л).
ЭПИДЕМИОЛОГИЯ
В исследовании Diabetes Control and Complications Trial распространенность тяжелой гипогликемии в группе пациентов с СД 1-го типа, получавших интенсифицированную инсулинотерапию, составила 65%. В Британском проспективном исследовании диабета (United Kingdom Prospective Diabetes Study) в течение 6 лет у пациентов с СД 2-го типа и уровнем HbA1C 7,0%, получавших терапию ПСМ, распространенность всех случаев гипогликемии составила 45%, среди них случаев тяжелой гипогликемии - 3,3%, а при инсулинотерапии - 76% и 11,2% соответственно. Гипогликемическая кома - причина смерти 3-4% больных СД.
ПРОФИЛАКТИКА
Профилактика гипогликемии у пациентов с СД при терапии таблетированными сахароснижающими препаратами (ПСМ, глинидами) или инсулином заключается в обучении пациентов самостоятельно изменять дозу инсулина и/или количество потребляемых углеводов при изменении режима физической активности, приеме алкоголя и при других состояниях, провоцирующих снижение уровня глюкозы в плазме крови.
При назначении сахароснижающей терапии желательно, чтобы пациент испытал и самостоятельно купировал первый эпизод легкой гипогликемии в присутствии врачей. Мероприятия по купированию гипогликемии у больных СД, получающих сахароснижающую терапию, следует начинать при уровне глюкозы плазмы <3,9 ммоль/л.
Для профилактики тяжелой гипогликемии пациенту следует постоянно иметь при себе легкоусвояемые углеводы для купирования легкой гипогликемии. Задача врача заключается в обучении пациента распознавать и правильно купировать легкую гипогликемию, чтобы избежать ее перехода в тяжелую. Одним из критериев оценки эффективности обучения является демонстрация пациентами наличия у них легкоусвояемых углеводов в карманах, сумке в ответ на просьбу врача.
КЛАССИФИКАЦИЯ
-
Легкая гипогликемия: пациент способен самостоятельно купировать гипогликемию приемом углеводов независимо от выраженности симптомов; помощь другого лица не требуется.
-
Тяжелая гипогликемия сопровождается различной степенью нарушения сознания вплоть до его потери (гипогликемическая кома); требуется посторонняя помощь.
ДИАГНОСТИКА
Анамнез
Гипогликемия возникает внезапно на фоне удовлетворительного самочувствия у пациентов с СД, принимающих пероральные сахароснижающие препараты или инсулин.
Физикальное обследование
Симптомы гипогликемии описаны выше. При гипогликемической коме (если ей не предшествовала длительная декомпенсация углеводного обмена) кожные покровы влажные, обычной окраски, тургор мягких тканей нормальный, мышечный тонус нормальный или повышенный, дыхание ровное, неучащенное, АД повышено, пульс учащен, реакция зрачков на свет сохранена. При длительной глубокой гипогликемической коме можно отметить симптомы поражения ствола мозга, проявляющиеся в виде нестабильной дыхательной и сердечной деятельности. Отсутствие реакции зрачков на свет - прогностически неблагоприятный признак, свидетельствующий о структурных изменениях ствола мозга.
Лабораторные исследования
Снижение концентрации глюкозы в плазме крови менее 2,8 ммоль/л в сочетании с клинической картиной или менее 2,2 ммоль/л независимо от симптоматики.
Измерение гликемии крайне желательно во всех случаях до начала купирования гипогликемии ввиду сходства клинических симптомов гипогликемии с различными состояниями, в первую очередь тревожными расстройствами (особенно фобиями гипогликемий и паническими атаками). Вместе с тем при невозможности определения уровня гликемии для подтверждения гипогликемии необходимо сразу же начинать мероприятия по купированию гипогликемии.
Инструментальные исследования
Инструментальные методы исследования используют для выяснения других возможных причин нарушения сознания после достижения нормогликемии (ЭКГ для исключения инфаркта миокарда и другой патологии сердца; КТ или МРТ головного мозга для исключения ОНМК, черепно-мозговой травмы и т.д.).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Проводят с:
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Гипогликемическая кома. СД 1-го типа.
ЛЕЧЕНИЕ
Цели лечения
Устранение клинической симптоматики и повышение уровня глюкозы в плазме крови выше 3,9 ммоль/л.
Показание к госпитализации
Отсутствие сознания после внутривенного введения 40-100 мл 40% раствора декстрозы (глюкозы♠ ).
Немедикаментозное лечение
Мероприятия по купированию гипогликемии у больных СД, получающих сахароснижающую терапию, следует начинать при уровне глюкозы плазмы <3,9 ммоль/л. Однако при клинических проявлениях гипогликемии (даже при неизвестной концентрации глюкозы в плазме крови) пациент должен немедленно прекратить физическую активность и принять легкоусвояемые углеводы в количестве 1-2 ХЕ: это могут быть 3-5 кусков по 5 г или 3-5 чайных ложек сахара (предпочтительно растворенного в воде или чае), или 100-200 мл сладкого фруктового сока или сахарсодержащего газированного напитка, или 1-1,5 столовые ложки меда или варенья, или 4-5 больших таблеток декстрозы (глюкозы♠ ) (по 3-4 г), или 1-2 тубы с углеводным сиропом (по 13 г). После купирования гипогликемии, вызванной действием инсулина среднего или длительного действия (особенно в ночное время), пациенту рекомендуется съесть еще 1-2 медленноусвояемых ХЕ (1-2 куска хлеба, 2-4 ложки каши, батончик мюсли и т.д.). В том случае, если гипогликемия развилась на фоне приема акарбозы, единственный способ ее купирования - прием внутрь декстрозы (глюкозы♠ ) в количестве 1-2 ХЕ [4-5 больших таблеток декстрозы (глюкозы♠ ) по 3-4 г].
Через 15 мин после приема легкоусвояемых углеводов необходимо повторно измерить гликемию, чтобы проверить эффективность проводимых мероприятий. В случае если гипогликемия сохраняется, пациенту необходимо повторно принять легкоусвояемые углеводы и вновь измерить уровень гликемии. Желательно избегать приема избыточного количества легкоусвояемых углеводов (более 2 ХЕ), ориентируясь лишь на полное исчезновение клинических симптомов. Такая тактика приводит к выраженной гипергликемии, так как субъективные симптомы гипогликемии исчезают несколько позже, чем происходит восстановление нормального уровня глюкозы в крови.
Не рекомендуется купировать гипогликемию шоколадными конфетами, бутербродами с маслом, сыром, колбасой, поскольку жиры замедляют всасывание углеводов. Для купирования не подходят напитки, содержащие сахарозаменители.
Медикаментозное лечение
Показано при нарушении сознания, в том числе его отсутствии (тяжелая гипогликемия, гипогликемическая кома).
Пациента необходимо уложить на бок и освободить полость рта от остатков пищи. При отсутствии сознания нельзя вливать в рот сладкие растворы из-за риска развития асфиксии.
Внутривенно струйно вводят 40-100 мл 40% раствора декстрозы (глюкозы♠ ) до полного восстановления сознания.
NВ! При отсутствии возможности измерить уровень глюкозы в плазме крови и определить причину потери сознания пациенту с СД необходимо внутривенно ввести 40-100 мл 40% раствора декстрозы (глюкозы♠). Это позволит повысить концентрацию глюкозы в плазме крови до нормальных значений и вывести пациента из гипогликемической комы, если она является причиной потери сознания. В случае если кома вызвана какой-либо другой причиной, введенное количество раствора декстрозы (глюкозы ♠) не ухудшит состояние пациента.
Альтернативой в домашних условиях может быть внутримышечное или подкожное введение глюкагона (для взрослых доза составляет 1 мг, для детей - 0,5 мг) родственниками пациента до приезда медицинской бригады. Если через 10-15 мин после инъекции сознание не восстанавливается, то введение препарата в той же дозе необходимо повторить. После восстановления сознания необходимо принять внутрь быстроусвояемые углеводы для восстановления запасов гликогена в печени. Глюкагон неэффективен при алкогольной гипогликемии и гипогликемии, вызванной передозировкой инсулина, ПСМ или глинидов.
Если через 20 мин после внутривенного струйного введения 40-100 мл 40% раствора декстрозы (глюкозы♠ ) сознание не восстанавливается, начинают внутривенное капельное введение 5-10% раствора декстрозы (глюкозы♠ ) до восстановления сознания и транспортировку пациента в стационар.
Если причиной гипогликемии является передозировка пероральных сахароснижающих препаратов с большой продолжительностью действия, особенно у пациентов пожилого возраста или при сопутствующем нарушении функций почек, внутривенное капельное введение 5-10% раствора декстрозы (глюкозы♠ ) продолжают до достижения нормогликемии и полного выведения препарата из организма.
При затянувшейся гипогликемической коме (более 4 ч) при подозрении на отек мозга вводят дексаметазон (внутривенно струйно 4-8 мг однократно) или преднизолон (внутривенно струйно 30-60 мг однократно).
Примерные сроки нетрудоспособности
При тяжелой гипогликемии зависят от длительности пребывания в коме, развития осложнений, необходимости последующей реабилитации.
Дальнейшее ведение пациента
-
Необходимо выяснить причину гипогликемического состояния и в зависимости от этого провести коррекцию сахароснижающей терапии, целей лечения, диеты, режима физической активности.
-
Пациентов с СД необходимо обучить умению самостоятельно распознавать симптомы гипогликемии и купировать ее (см. выше), а также уменьшать дозу инсулина при запланированной длительной физической нагрузке или дополнительно принимать углеводы при незапланированной или кратковременной физической нагрузке.
-
Алкоголь является одним из факторов, провоцирующих развитие гипогликемии. Употребление алкогольных напитков возможно в количестве не более 1 усл. единицы в сутки для женщин и 2 усл. единиц для мужчин (1 условная единица соответствует 15 г чистого этанола, или примерно 40 г крепких напитков, или 140 г сухого вина, или 300 г пива). Целесообразно сочетать прием алкоголя с медленноусвояемыми углеводами. Если алкогольный напиток содержит сахар, то дополнительное количество инсулина на него не вводится. В случае приема алкоголя (особенно в количестве, превышающем рекомендованное) необходимо измерение гликемии перед сном и в ночное время.
-
Родственники, близкие и коллеги больных СД должны уметь выполнять подкожные и внутримышечные инъекции глюкагона.
-
Для дополнительной безопасности пациент должен носить медицинский браслет/брелок/кулон со своими данными и информацией о заболевании. Можно рекомендовать пациенту носить с собой «Паспорт пациента с сахарным диабетом», где будет написано о заболевании, проводимой терапии, указана просьба срочно вызвать бригаду «Скорой медицинской помощи» в случае неадекватного поведения или отсутствия сознания, телефон врача и других людей, которым нужно сообщить о случившемся.
-
Если пациент водит машину, то необходимо ознакомить его с правилами безопасности, в том числе с необходимостью измерения гипогликемии непосредственно перед вождением и т.д.
ПРОГНОЗ
При своевременном и адекватном купировании легкой гипогликемии - благоприятный. При тяжелой гипогликемии прогноз определяется длительностью пребывания в коме, развитием осложнений и последствий (отек мозга, сердечнососудистые осложнения, черепно-мозговая травма и др.). Смертность вследствие гипогликемической комы среди больных СД составляет 3-4%.
СПИСОК ЛИТЕРАТУРЫ
-
Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И.И. Дедова, М.В. Шестаковой. 6-й выпуск. - М., 2013.
-
Руководство для врачей «Эндокринология. Фармакотерапия без ошибок» / Под ред. И.И. Дедова, Г.А. Мельниченко. - М., 2013.
-
Суркова Е.В., Майоров А.Ю., Мельникова О.Г. Сахарный диабет 2-го типа: Руководство для людей с диабетом. - М., 2008.
-
Дедов И.И., Шестакова М.В. Сахарный диабет: Руководство для врачей. - М.: Универсум Паблишинг, 2003.
-
Дедов И.И., Демидова И.Ю. Острые осложнения сахарного диабета. - М.: ЛЕМ ACT, 1998.
-
http://www.mayodinic.org/diseases-conditions/hypoglycemia/basics/definition/con-20021103.
ГИПЕРОСМОЛЯРНОЕ ГИПЕРГЛИКЕМИЧЕСКОЕ СОСТОЯНИЕ
Старостина Е.Г.
СИНОНИМЫ
Гиперосмолярная некетоацидотическая кома, гипергликемическое некетоацидотическое состояние.
ОПРЕДЕЛЕНИЕ
ГГС - острая декомпенсация СД с резко выраженной гипергликемией (как правило, более 35 ммоль/л), высокой осмолярностью плазмы и резко выраженной дегидратацией при отсутствии кетоза и ацидоза.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
ГГС диагностируют в 6-10 раз реже, чем ДКА: ГГС составляет около одной трети неотложных диабетических состояний и менее 1% всех госпитализаций по поводу СД (зарубежные данные). Эпидемиологических данных по России нет. Большинство больных ГГС - пациенты с СД 2-го типа в возрасте 57-70 лет, хотя ГГС описано и при СД 1-го типа, в том числе у детей.
ПРОФИЛАКТИКА
См. «Диабетический кетоацидоз».
СКРИНИНГ
Измерение концентрации глюкозы, натрия и калия крови и расчет осмолярности плазмы при состояниях с выраженной дегидратацией или с нарушением сознания любой степени.
ЭТИОЛОГИЯ
Основная причина ГГС - относительная инсулиновая недостаточность в сочетании с обезвоживанием.
Факторы риска: пожилой возраст, женский пол, острые инфекции, в 20-33% - впервые диагностированный диабет.
Важнейшие пусковые факторы:
-
состояния, ведущие к обезвоживанию и инсулиновой недостаточности: инфекционный процесс (30-60% случаев), особенно с лихорадкой, рвотой и диареей;
-
другие острые заболевания (10-15%), такие как инфаркт миокарда, тромбоэмболия легочной артерии, острый панкреатит, кишечная непроходимость, мезентериальный тромбоз, инсульт, массивные кровотечения, обширные ожоги, почечная недостаточность;
-
эндокринопатии (акромегалия, тиреотоксикоз, гиперкортицизм);
-
перитонеальный диализ, операции, травмы, тепловой и солнечный удар;
-
прием больших доз β-адреноблокаторов, антагонистов кальция, диуретиков, диазоксида, иммунодепрессантов, фенитоина, аналогов соматостатина, симпатомиметиков и особенно стероидов;
-
примерно в 5-15% случаев - низкая комплаентность больных и неправомерное ограничение потребления жидкости при жажде.
ПАТОГЕНЕЗ
Патогенез до конца не ясен. Существуют гипотезы, объясняющие развитие гипергликемии и гиперосмолярности без кетоза и ацидоза.
-
При относительной инсулиновой недостаточности секреции инсулина хватает, чтобы подавить липолиз в жировой и мышечной ткани и, следовательно, образование кетоновых тел, но ее недостаточно, чтобы блокировать продукцию глюкозы печенью.
-
Гиперосмолярность и дегидратация сами по себе ингибируют липолиз и кетогенез.
-
Эндогенный инсулин в небольшом количестве попадает в печень, а на периферии, в условиях более выраженной инсулиновой недостаточности, усиливается липолиз. Образующиеся в результате свободные жирные кислоты поступают в печень, где при наличии инсулина служат субстратом для глюконеогенеза, но не для кетогенеза.
-
Меньшие концентрации контринсулярных гормонов, в частности СТГ, чем при ДКА.
Гиперосмолярность плазмы обусловлена высоко осмотическими соединениями, самые важные из которых - глюкоза и натрий. Они плохо диффундируют внутрь клеток, создавая осмотический градиент и вызывая перемещение жидкости из клеток вовне, что ведет к внутриклеточной дегидратации. Гиперосмолярность плазмы и дегидратация развиваются вследствие длительного осмотического диуреза и приема недостаточного количества жидкости пациентом в сочетании с вышеуказанными пусковыми факторами. При ГГС дефицит воды в организме составляет 100-200 мл/кг массы тела (8-12 л); соответственно, развивается гиповолемия с резким снижением тканевого кровотока, в первую очередь почечного, и развитием олиго- и анурии после периода массивной полиурии. Из-за дегидратации возможно развитие тромбозов, тромбоэмболий, синдрома диссеминированного внутрисосудистого свертывания.
Гипернатриемия при ГГС обусловлена компенсаторной гиперпродукцией альдостерона в ответ на дегидратацию. Содержание натрия повышается и в ликворе, который находится в осмотическом равновесии с плазмой в условиях гипергликемии. Усиление потока Na+ из клеток мозга в ликвор и обратного потока К+ ведет к нарушению мембранного потенциала нейронов и резкой внутриклеточной дегидратации, что вместе с гипоксией сопровождается психоневрологической симптоматикой. От величины гиперосмолярности плазмы и гипернатриемии ликвора зависит степень нарушения сознания.
Несмотря на гипернатриемию, происходит массивное выведение натрия с мочой и образуется дефицит натрия в организме около 5-13 ммоль/кг массы тела. Потери с мочой ведут и к дефициту других электролитов (в мэкв/кг массы тела): калия - 4-6, хлоридов - 5-15, кальция - 1-2, фосфатов - 3-7, магния - 1-2. В остальном патофизиологические события при ГГС аналогичны таковым при ДКА.
КЛИНИЧЕСКАЯ КАРТИНА
ГГС развивается медленно, в течение нескольких дней или недель, с усилением полиурии, жажды, слабости, вялости, снижением массы тела, головными болями. У пациентов пожилого и старческого возраста жажда может отсутствовать, при этом обезвоживание наступает быстрее. В 25-60% случаев присутствуют тошнота и рвота, вызванные заболеваниями, которые спровоцировали развитие ГГС. Период массивной полиурии сменяется олиго- и анурией. Характерна полиморфная неврологическая симптоматика.
ДИАГНОСТИКА
Анамнез
Следует обратить внимание на состояния, которые могут быть пусковым фактором развития ГГС (включая прием некоторых препаратов) и особенно способствовать обезвоживанию.
Физикальное обследование
-
Признаки выраженной дегидратации: сухость кожи и слизистых оболочек, снижение тургора кожи, мягкость глазных яблок при пальпации; тахикардия, позднее - артериальная гипотензия, затем нарастание недостаточности кровообращения вплоть до коллапса и гиповолемического шока (АД <80/50). При ГГС на фоне сепсиса кожные покровы могут быть теплыми и влажными. Температура тела чаще повышена; нормо- и даже гипотермия не исключают наличия инфекции.
-
Нарушение сознания - почти у всех больных: спутанность, сонливость - 40-50%, сопор - 27-54%, собственно кома - 10%; возможен делирий.
Часто (до 20%) присутствует полиморфная неврологическая симптоматика в виде судорог, дизартрии, двустороннего спонтанного нистагма, гипертонуса мышц, парезов и параличей; гемианопсии, вестибулярных нарушений и др. Она не укладывается в какой-либо определенный синдром, неустойчива, изменчива и исчезает на фоне нормализации осмолярности.
Лабораторные исследования
-
Основные показатели - как при ДКА, включая обязательный расчет скорректированного Na+ , так как от его значения зависит выбор раствора для инфузии.
-
Поскольку гиповолемическая недостаточность кровообращения и тканевая гипоксия могут осложняться лактат-ацидозом, резко ухудшающим прогноз, желательно определить концентрацию лактата.
-
Измеряют протромбиновое время и активированное частичное тромбопластиновое время.
Инструментальные исследования
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику проводят как при ДКА.
Особенности: сопор или кома при отсутствии явного повышения осмолярности (<320 мосмоль/л) указывают на другую причину нарушения сознания. Особое внимание следует уделять дифференциальной диагностике с отеком мозга в силу схожести неврологической симптоматики, но кардинально различных подходов к терапии.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
СД 2-го типа, тяжелого течения, стадия декомпенсации. ГГС. Кома I.
ЛЕЧЕНИЕ
Цели лечения
Цель лечения - регидратация, снижение гиперосмолярности плазмы путем уменьшения гипернатриемии и гипергликемии, устранение гиповолемической недостаточности кровообращения и гипоксии, лечение сопутствующих заболеваний, которые могли быть причиной ГГС.
Показания к госпитализации
Госпитализируют при подозрении на ГГС.
Немедикаментозное лечение
На догоспитальном этапе - обеспечение проходимости дыхательных путей, при необходимости - мероприятия по улучшению функции внешнего дыхания.
Медикаментозное лечение
На догоспитальном этапе: внутривенная инфузия 0,9% раствора натрия хлорида для регидратации.
В ОРИТ лечение проводят почти по тем же принципам, что и ДКА, с некоторыми особенностями.
-
Основа терапии - регидратация. Ввиду более выраженного дефицита жидкости начальный объем регидратации должен быть больше, чем при ДКА: в 1-й час вводят 1-1,5 л жидкости, во 2-й и 3-й час - по 0,5-1 л, в последующие часы - по 300-500 мл. Регидратацию осуществляют под контролем центрального венозного давления, с особой осторожностью ее проводят у больных старческого возраста или имеющих сердечно-сосудистую патологию.
-
При гиповолемическом шоке (АД <80/50 мм рт. ст.) вначале внутривенно очень быстро вводят 1 л 0,9% раствора натрия хлорида или коллоидные растворы. Рекомендовано начинать регидратацию с 1 л изотонического (0,9%) раствора натрия хлорида в первый час, переходя затем на инфузию гипотонического (0,45%) или продолжая введение 0,9% раствора в зависимости от концентрации Na+ в плазме. При концентрации скорректированного Na+ 145-165 ммоль/л регидратацию проводят 0,45% раствором натрия хлорида; при снижении содержания скорректированного Na+ до <145 ммоль/л продолжают инфузию 0,9% раствора натрия хлорида. При концентрации скорректированного Na+ >165 ммоль/л введение солевых растворов противопоказано и регидратацию проводят 2% раствором декстрозы (глюкозы♠ ). Потребность в вазопрессорах при ГГС как таковом, как правило, не возникает.
-
Инсулинотерапия: с учетом того, что при ГГС адекватная регидратация ведет к снижению гликемии, а чувствительность к инсулину относительно высока, в начале инфузионной терапии 0,45% раствором натрия хлорида инсулин совсем не вводят или вводят в очень малых дозах - 0,5-2 ЕД/ч, максимум 3-4 ЕД/ч внутривенно. Если через 4-5 ч от начала инфузии, после частичной регидратации и снижения концентрации Na+ сохраняется высокая гипергликемия, а также если регидратацию с самого начала проводят 0,9% раствором натрия хлорида, то используют режим дозирования инсулина, рекомендованный для ДКА (около 0,1 ЕД/кг в час). Гликемию ни в коем случае не следует снижать быстрее чем на 4 ммоль/л в час, а осмолярность сыворотки - не более чем на 3-5 мосмоль/л в час. Более резкое снижение опасно развитием осмотического дисбаланса между вне- и внутриклеточным пространством и отека мозга.
-
Инфузия 5% раствора декстрозы (глюкозы♠ ): добавляют после снижения гликемии до ≤16 ммоль/л.
-
Остальные мероприятия - как при ДКА. Особенности: обычно необходимо большее количество К+ , чем при ДКА, в силу его более выраженного дефицита. Щелочные растворы не показаны, так как рН, как правило, превышает 7,3. Исключение - редкие случаи ГГС с подтвержденным рН <7,0 (сочетание с ДКА, либо метаболический ацидоз при присоединении гнойно-некротических процессов, либо респираторный - при нарушении дыхания).
-
При развитии острых тромбозов и тромбоэмболий показаны прямые антикоагулянты (нефракционированный или низкомолекулярные гепарины).
Показания к консультации других специалистов
Консультация эндокринолога: для коррекции инсулинотерапии, если в ОРИТ не удается достичь целевых значений гликемии.
Примерные сроки нетрудоспособности
Около 14 дней, в зависимости от сопутствующих заболеваний и времени, необходимого для подбора сахароснижающей терапии.
Дальнейшее ведение
Перевод в эндокринологическое или терапевтическое отделение для подбора сахароснижающей терапии и обучения.
Информация для пациента
ГГС - угрожающая жизни декомпенсация СД с резким обезвоживанием организма, очень высоким содержанием декстрозы (глюкозы♠ ) в крови, но без появления ацетона в моче. Как правило, он возникает при присоединении других заболеваний, сопровождающихся потерей жидкости. Регулярно самостоятельно определяйте концентрацию декстрозы (глюкозы♠ ) в крови. При ее стойком повышении, а также при увеличении объема мочи и усилении жажды немедленно обратитесь к врачу. В качестве меры самопомощи увеличьте объем выпиваемой жидкости до 3-5 л в сутки.
ПРОГНОЗ
При своевременной и адекватной терапии прогноз относительно удовлетворительный (летальность 12-15%), при позднем начале терапии - неблагоприятный (58-60%). Факторы риска летального исхода: старческий возраст, высокая гиперосмолярность, высокая концентрация мочевины, кома, гиповолемический шок, тяжелые сопутствующие заболевания, гипонатриемия.
СПИСОК ЛИТЕРАТУРЫ
-
Потемкин В.В., Старостина Е.Г. Неотложная эндокринология: Руководство для врачей. - М.: Медицинское информационное агентство, 2008. - 400 с.
-
Старостина Е.Г. Острые осложнения сахарного диабета. В кн: Сахарный диабет: острые и хронические осложнения / Под ред. И.И. Дедова, М.В. Шестаковой. - М.: Медицинское информационное агентство, 2011. - С. 25-58.
-
ADA Practice Recommendations / Position statement: Hyperglycemic crises in diabetes // Diabetes Care. - 2004. - Vol. 27, N 1 (suppl. 1). - Р. 94-102.
-
Berger M., Sawicki P.T. Coma diabeticum // Diabetes Mellitus / Ed. by M. Berger. - Muenchen-Jena, 2 Aufl. Urban & Fisher, 2000. - P. 387-393.
-
Booth G. Short-term clinical consequences of diabetes in adults // Evidence-based diabetes care / Ed. by H.C. Gerstein, R.B. Haynes. - BC Decker Inc., 2001. - P. 68-106.
-
English P., Williams G. Hyperglycaemic crises and lactic acidosis in diabetes mellitus // Postgrad. Med. - 2006. - Vol. 80. - P. 253-261.
-
Kitabchi A.E., Umpierrez G.E., Murphy M.B. et al. Management of hyperglycaemic crises in patients with diabetes // Diabetes Care. - 2001. - Vol. 24. - P. 31-53.
-
Krentz A.J., Nattrass M. Acute metabolic complications of diabetes: diabetic ketoacidosis, hyperosmolar non-ketotic hyperglycaemia and lactic acidosis // Textbook of Diabetes / Ed. by J.C. Pickup, G. Williams. - Blackwell Science Ltd., 2003. - P. 32.1-32.24.
ЛАКТАТ-АЦИДОЗ
Старостина Е.Г.
СИНОНИМЫ
Молочнокислый ацидоз.
ОПРЕДЕЛЕНИЕ
Лактат-ацидоз - метаболический ацидоз с большой анионной разницей (≥10) и концентрацией молочной кислоты в крови >4 ммоль/л (по некоторым данным - более 2 ммоль/л).
КОД ПО МКБ10
ЭПИДЕМИОЛОГИЯ
Данных о частоте развития лактат-ацидоза при СД в России нет. За рубежом: максимальная частота возникновения ЛАКТАТ-АЦИДОЗа у больных СД, получавших метформин, - 0,000 063 случаев на больного в год; у больных СД, не получавших метформин, - 0,000 078 случаев на больного в год.
ПРОФИЛАКТИКА
-
Соблюдение противопоказаний к назначению метформина, включая его отмену за 48 ч до операции и возобновление не ранее полной нормализации клинико-лабораторных показателей и отмену при любом предстоящем рентгенологическом обследовании с внутривенным введением контраста у больных с ХПН.
-
Лечение сопутствующих заболеваний, провоцирующих лактат-ацидоз.
СКРИНИНГ
Измерение концентрации лактата в крови при состояниях с нарушением сознания любой степени и при появлении миалгий у больных, принимающих метформин.
КЛАССИФИКАЦИЯ
-
лактат-ацидоз типа А (гипоксический): кардиогенный, эндотоксический, гиповолемический шок; хроническая сердечная недостаточность, асфиксия; отравление СО, синдром сдавления, ожоги, травмы, обширные гнойно-некротические процессы в мягких тканях, мезентериальная ишемия.
-
Лактат-ацидоз типа В (связанный с усиленным образованием и снижением утилизации лактата).
-
Типа В1: почечная или печеночная недостаточность, тяжелая анемия, алкогольный кетоацидоз, онкологические заболевания и гемобластозы, тяжелые инфекции, декомпенсированный СД, судорожные синдромы, тяжелая физическая нагрузка, панкреатит, тепловой удар, феохромоцитома, авитаминоз В1 , синдромы мальабсорбции, передозировка теофиллина, адреналина.
-
Типа В2: бигуаниды, нуклеозидные аналоги, β-адреномиметики, кокаин, эфир диэтиловый, пропофол, изониазид, стрихнин, сульфасалазин, вальпроевая кислота, линезолид; избыточное парентеральное введение фруктозы, ксилита или сорбита; отравление парацетамолом, салицилатами, спиртами, гликолями, цианогенами.
-
Типа В3: гликогенозы 1-го типа, болезнь Гирке; метилмалоновая ацидемия.
-
ЭТИОЛОГИЯ
При СД чаще развивается лактат-ацидоз смешанной этиологии (тип А + тип В). В прошлом самой частой причиной возникновения лактат-ацидоза был фенформин (препарат группы бигуанидов), изъятый из обращения в конце 1970-х годов. Имея структурные и фармакокинетические отличия, метформин не вызывает столь выраженного накопления лактата. В большинстве случаев лактат-ацидоз возникает при наличии противопоказаний к приему метформина, к которым относят состояния, сами способные вызвать лактат-ацидоз.
ПАТОГЕНЕЗ
Лактат - продукт метаболизма углеводов. В норме в состоянии натощак лактат расходуется на синтез глюкозы, после приема пищи метаболизируется с образованием ацетил-кофермента А; оба процесса идут только в присутствии кислорода. Гиперлактатемия возникает в результате:
-
усиленного образования лактата: при выраженной декомпенсации СД, ацидозах различного генеза;
-
тканевой гипоксии, подавления аэробного и активации анаэробного гликолиза: при тяжелых болезнях органов дыхания, анемиях, тяжелых сердечнососудистых заболеваниях (хроническая сердечная недостаточность, ИБС, облитерирующие заболевания периферических артерий);
-
снижения клиренса лактата и/или метформина: поражение паренхимы печени, алкоголизм, ХПН (80-90% случаев лактат-ацидоза), внутривенное введение рентгенконтрастных средств;
-
сочетания указанных звеньев патогенеза: острый тяжелый стресс, в том числе операционный, старческий возраст, тяжелое общее состояние, распространенные стадии злокачественных новообразований, беременность.
Гиперлактатемия и ацидоз снижают реакцию миокарда на катехоламины и его сократимость, уменьшают порог фибрилляции и прессорные эффекты катехоламинов с развитием острой сердечной недостаточности, тяжелых аритмий и периферической вазодилатации, которые ведут к артериальной гипотонии, коллапсу и остановке сердца. Вследствие снижения почечного и печеночного кровотока еще более угнетаются метаболизм и выведение лактата, нарастает ацидоз. В ЦНС кровоток вначале усиливается в сочетании с торможением скорости метаболизма, в дальнейшем перфузия падает.
КЛИНИЧЕСКАЯ КАРТИНА
Симптомы лактат-ацидоза неспецифичны и вначале напоминают декомпенсацию СД или усиление побочных эффектов метформина: анорексия, тошнота, рвота, диарея, боли в животе неопределенного характера, слабость. Единственный относительно специфичный симптом - миалгии, вызванные накоплением лактата, возможные задолго до ухудшения общего состояния. Выраженный ацидоз с жаждой, гипервентиляцией, впоследствии с дыхательной недостаточностью, спутанностью сознания и в конечном итоге комой может развиться в течение нескольких часов.
ДИАГНОСТИКА
Анамнез
Следует обратить внимание на прием метформина и других препаратов, а также наличие сопутствующих заболеваний, способствующих развитию лактат-ацидоза.
Физикальное обследование
Специфических признаков нет. Боли в мышцах, тошнота, рвота, нарушение сознания различной степени выраженности, бледность и сухость кожи, холодные конечности, артериальная гипотония, тахикардия, нарушения сердечного ритма, ацидотический тип дыхания (дыхание Куссмауля). Возможны многочисленные клинические признаки заболеваний, провоцирующих лактат-ацидоз.
Лабораторные исследования
-
Лактат. Диагноз лактат-ацидоза подтвержден при концентрации лактата >5,0 ммоль/л и рН <7,35 и весьма вероятен при концентрации 2,2-5 ммоль/л в сочетании с рН артериальной крови <7,25. Кровь для определения лактата хранят на холоде не более 4 ч.
-
Кислотно-основное состояние: концентрация бикарбоната в сыворотке ≤18 мэкв/л, анионная разница ≥15 мэкв/л (с коррекцией на гипоальбуминемию).
-
Биохимический анализ крови, включая электролиты: возможно повышение концентрации креатинина и мочевины, нередко - гиперкалиемия (из-за снижения почечного кровотока или почечной недостаточности иного генеза).
-
Общий клинический анализ крови и общий анализ мочи: изменения, характерные для сопутствующих заболеваний, которые могли спровоцировать лактат-ацидоз.
Инструментальные исследования
Специфичных для диагноза лактат-ацидоза инструментальных исследований нет. Проводят исследования, необходимые для контроля состояния (ЭКГ, кардио-мониторинг, пульсоксиметрию), а также для обнаружения сопутствующих заболеваний, спровоцировавших лактат-ацидоз.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Исключают другие виды ацидоза, в первую очередь - диабетический и алкогольный кетоацидозы, уремический ацидоз (необходимо провести определение кетоновых тел в крови или моче); нередко обнаруживают сочетания указанных состояний.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
СД 2-го типа. Лактат-ацидоз смешанного типа на фоне декомпенсации СД, приема метформина и хронической сердечной недостаточности III функционального класса. Прекома.
ЛЕЧЕНИЕ
Цели лечения
Цель лечения - выведение из организма лактата и метформина, борьба с шоком, гипоксией, ацидозом, электролитными нарушениями; лечение сопутствующих заболеваний, которые могли быть причиной лактат-ацидоза.
Показания к госпитализации
Госпитализируют при подозрении на лактат-ацидоз.
Немедикаментозное лечение
-
На догоспитальном этапе следует обеспечить проходимость дыхательных путей и, при необходимости, предпринять мероприятия по улучшению функции внешнего дыхания.
-
При лактат-ацидозе на фоне приема метформина единственное эффективное мероприятие по выведению метформина и лактата - гемодиализ с безлак-татным буфером (выживаемость 60%).
-
Искусственная вентиляция легких: в режиме гипервентиляции для устранения избытка СО2 (целевое значение рСО2 25-30 мм рт. ст.); при этом рН в гепатоцитах и кардиомиоцитах может восстановиться, что способствует метаболизму и снижению концентрации лактата.
Медикаментозная терапия
-
На догоспитальном этапе: внутривенная инфузия 0,9% раствора натрия хлорида для восстановления тканевой перфузии.
-
В ОРИТ: борьба с шоком, гипотонией, тканевой гипоксией по общим для интенсивной терапии правилам, в условиях кардиомониторинга из-за высокой опасности тяжелых нарушений сердечного ритма.
-
При лактат-ацидозе после недавней острой передозировки метформина: назначение активированного угля или другого сорбента.
-
Для снижения образования лактата и усиления синтеза гликогена: внутривенная инфузия ИКД (2-5 ЕД/ч) с декстрозой (глюкозой♠ ) (5-12,5 г/ч), однако доказательств улучшения выживаемости при этом нет.
-
Щелочи: инфузия бикарбоната натрия при лактат-ацидозе не имеет преимуществ по сравнению с раствором хлорида натрия по показателям гемодинамики и ответу на вазопрессоры. Введение бикарбоната может привести к парадоксальному усилению ацидоза из-за повышения внутриклеточной концентрации H+, уменьшения сердечного выброса и усиления продукции лактата. Тем не менее некоторые авторы рекомендуют применение бикарбоната натрия, но только при рН <6,9, не более 100 мл 4% раствора однократно путем медленной внутривенной инфузии с последующим увеличением минутной вентиляции легких для выведения избытка СО2 , образующегося при введении бикарбоната. Исследований по применению трисамина (трометамола H♠ ) при лактат-ацидозе недостаточно. При лактат-ацидозе на фоне сепсиса, кардиогенного шока или массивной кровопотери применение дихлорацетатного буфера повышает рН крови, снижает концентрацию лактата, но не влияет на гемодинамику и выживаемость.
Показания к консультации других специалистов
Консультация эндокринолога: для коррекции инсулинотерапии, если не удается достичь целевых показателей гликемии в ОРИТ.
Примерные сроки нетрудоспособности
Как правило, 14-18 дней в зависимости от сопутствующих заболеваний и времени, необходимого для подбора сахароснижающей терапии.
Дальнейшее ведение
Перевод в эндокринологическое или терапевтическое отделение для подбора сахароснижающей терапии и обучения. Дальнейший прием метформина исключен.
Информация для пациента
Лактат-ацидоз - угрожающее жизни неотложное состояние, которое может возникать у больных СД на фоне приема метформина или при наличии других тяжелых заболеваний. Если вы принимаете метформин, необходимо контролировать содержание гемоглобина в крови, функцию печени и почек не реже двух раз в год. Не злоупотребляйте алкоголем. При появлении болей в мышцах, слабости, тошноты или рвоты, болей в животе немедленно обратитесь к врачу.
ПРОГНОЗ
Прогноз сомнительный; в отсутствие возможности определения концентрации лактата в крови и при наличии тяжелых сопутствующих заболеваний - неблагоприятный. Летальность зависит от продолжительности и степени гиперлактатемии: уровни лактата 2,5-3,9 и ≥4 ммоль/л дополнительно повышают летальность на 9,0% и 28,4% соответственно. Если концентрация лактата под влиянием терапии нормализуется (<2 ммоль/л) в первые сутки, то летальность составляет 0%, если в течение первых двух суток - 22%, после первых двух суток - 86%.
СПИСОК ЛИТЕРАТУРЫ
-
Потемкин В.В., Старостина Е.Г. Руководство по неотложной эндокринологии. - М.: Медицинское информационное агентство. - 2008. - 393 с.
-
Старостина Е.Г. Острые осложнения сахарного диабета // Сахарный диабет: острые и хронические осложнения / Под ред. И.И. Дедова, М.В. Шестаковой. - М.: ООО «Издательство «Медицинское информационное агентство», 2011. - С. 25-58.
-
Старостина Е.Г. Диабетический лактат-ацидоз // Фармакотерапия без ошибок. Руководство для врачей / Под ред. И.И. Дедова, Г. А, Мельниченко. - М.: Е-ното, 2013. - С. 402-404.
-
Andersen L.W., Mackenhauer J., Roberts J.C., Berg K.M., Cocchi M.N., Donnino M.W. Etiology and therapeutic approach to elevated lactate levels // Mayo Clin. Proc. - 2013. - Vol. 88 (10). - P. 1127-1140.
-
Cox K., Cocchi M.N., Salciccioli J.D., Carney E., Howell M., Donnino M.W. Prevalence and significance of lactic acidosis in diabetic ketoacidosis // J. Crit. Care. - 2012. - Vol. 27 (2). - H. 132-137.
-
Krentz A.J., Nattrass M. Acute metabolic complications of diabetes: diabetic ketoacidosis, hyperosmolar non-ketotichyperglycaemia and lactic acidosis // Textbook of Diabetes; ed. by J.C. Pickup, G. Williams // Blackwell Science Ltd., 2003. - P. 32.1-32.24.
-
Salpeter S.R., Greyber E., Pasternak G.A., Salpeter E.E. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus // Cochrane Database Systю Rev. 2010. - Vol. (4):CD002967.
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ И КЕТОАЦИДОТИЧЕСКАЯ КОМА
Старостина Е.Г.
СИНОНИМЫ
Диабетическая кетоацидотическая кома.
ОПРЕДЕЛЕНИЕ
ДКА - острая декомпенсация СД, характеризующаяся абсолютной или относительной инсулиновой недостаточностью, гипергликемией (>13,9 ммоль/л) и гиперкетонемией (>5 ммоль/л или ≥+), ацетонурией (≥++) и метаболическим ацидозом (рН <7,3), с различной степенью нарушения сознания или без нарушения, при которой необходима экстренная госпитализация больного.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
Частота первичного ДКА (в дебюте СД) в мире от 12.8% до 80%, в России - около 30%. Суммарная частота вторичного ДКА (на фоне уже установленного диагноза СД) в Европе и США составляет 0,000085-0,008, при СД 1-го типа - 0,01- 0,05 случаев на больного в год. В России частота ДКА при СД 1-го типа - 0,2-0,5, при СД 2-го типа - 0,07 случаев на больного в год. Процент больных СД в России, имеющих хотя бы один тяжелый ДКА (собственно кома) в год, - около 2,5 - 3%. У адекватно обученных больных СД 1 типа частота вторичного ДКА может быть снижена практически до нуля.
ПРОФИЛАКТИКА
-
Обучение больных СД самостоятельному распознаванию нарастающей декомпенсации по симптомам и данным методов самоконтроля гликемии и ацетонурии, а также мерам первой самопомощи. У обученных больных СД частота возникновения ДКА может быть сведена до нуля.
-
Информирование населения о симптомах СД (для своевременного обращения в дебюте СД).
СКРИНИНГ
КЛАССИФИКАЦИЯ
-
ДКА легкой степени: гликемия >13 ммоль/л, рН артериальной крови 7,25- 7,30, бикарбонат 15-18 ммоль/л, ацетонурия +, кетонемия слегка выше нормы, анионная разница >10, нарушения сознания нет.
-
ДКА средней степени тяжести: гликемия >13 ммоль/л, рН артериальной крови 7,0-7,24, бикарбонат 10-15 ммоль/л, ацетонурия ++, кетонемия умеренно выше нормы, анионная разница >12, нарушения сознания нет или может появляться сонливость, оглушенность.
-
ДКА тяжелой степени: гликемия >13 ммоль/л, рН артериальной крови <7,0, бикарбонат <10 ммоль/л, ацетонурия +++, кетонемия резко повышена, анионная разница >14, сопор или кома.
ЭТИОЛОГИЯ
Причина - абсолютная или выраженная относительная инсулиновая недостаточность. Пусковые факторы:
-
интеркуррентные заболевания (инфекционно-воспалительные процессы, особенно дыхательных и мочевыводящих путей; инфаркт миокарда, инсульт, острая абдоминальная патология и др.);
-
пропуск или самовольная отмена инсулина пациентами (около 30% больных СД 1 типа с ДКА и около 80% больных СД 1 типа с многократными ДКА), ошибки в дозировании инсулина и технике инъекций, неисправность инсулиновых шприц-ручек или дозаторов;
-
невыполнение пациентами правил самостоятельного повышения дозы инсулина при интеркуррентных заболеваниях или при дополнительном приеме углеводов;
-
врачебные ошибки: несвоевременное назначение инсулина при СД 2-го типа, неадекватная коррекция дозы инсулина;
-
терапия стероидами, диуретиками в больших дозах, атипичными нейролептиками.
ПАТОГЕНЕЗ
Инсулиновая недостаточность ведет к:
-
гипергликемии вследствие снижения поглощения глюкозы печенью, мышцами и жировой тканью, усилению гликогенолиза и глюконеогенеза в печени, повышению концентрации контринсулярных гормонов;
-
распаду собственных белков организма на аминокислоты, которые включаются в глюконеогенез;
-
распаду триглицеридов в собственных жировых депо с образованием свободных жирных кислот;
-
кетозу - неполному окислению избытка свободных жирных кислот в печени с образованием «кетоновых тел» (ацетона, ацетоуксусной и β-оксимасляной кислот). Жиры пищи в кетогенезе не участвуют. Ацетоуксусная и β-оксимасляная кислоты диссоциируют с образованием H+ - возникает метаболический ацидоз.
Гипергликемия ведет к глюкозурии, осмотическому диурезу и резко выраженной дегидратации; последняя усиливается при рвоте. Суммарный дефицит воды - 5-12 л, или 100 мл/кг. Развивается гиповолемическая недостаточность кровообращения с гипоперфузией и тканевой гипоксией, включая ишемию почек. Ацидоз ухудшает сократимость миокарда, вызывает периферическую вазодилатацию, усиливая артериальную гипотонию, и повышает риск желудочковых аритмий. Нарушение сознания развивается параллельно гипергликемии, дегидратации, гипоксии и тяжелому ацидозу ЦНС.
Концентрация К+ до начала лечения чаще нормальная или повышенная, однако в клетках существует дефицит К+ , вызванный его потерей с мочой, уменьшением активности Nа+ , K+ -зависимой АТФазы и ацидозом. Средний дефицит электролитов (мэкв/кг): К+ 3-5, Na+ 7-10, хлориды 3-5, Са2+ 1-2, фосфаты 5-7, Mg2+ 1-2.
КЛИНИЧЕСКАЯ КАРТИНА
ДКА развивается в течение нескольких дней, реже - в течение суток, с усилением симптомов дегидратации: полиурии, жажды, слабости и снижения работоспособности, анорексией, снижением массы тела. Затем присоединяются симптомы кетоза и ацидоза: тошнота, рвота, боли в животе, головные боли, дыхания Куссмауля; нарушение сознания различной степени.
ДИАГНОСТИКА
Анамнез
Ведут поиск пусковых факторов ДКА, особенно интеркуррентных заболеваний и погрешностей инсулинотерапии.
Физикальное обследование
Признаки обезвоживания и гиповолемии: сухость кожи и слизистых оболочек, снижение тургора кожи и глазных яблок, тонуса мышц, артериальная гипотония, тахикардия. Запах ацетона в выдыхаемом воздухе, при выраженном ацидозе - частое, глубокое и шумное дыхание (дыхание Куссмауля). У 40-75% больных развивается так называемый диабетический псевдоперитонит: боли в животе, напряжение и болезненность брюшной стенки, уменьшение перистальтики; при абдоминальном обследовании возможен шум плеска (острый парез желудка, вызванный гипокалиемией). Симптомы ложного «острого живота» вызваны действием кетоновых тел на ЖКТ и дегидратацией брюшины. Гипокалиемия чаще проявляется после начала лечения (нарушения сердечного ритма, судороги в мышцах, парез перистальтики). Температура тела повышена, нормальна или снижена, что не исключает инфекции. Нарушение сознания развивается постепенно: сонливость, оглушенность, сопор (прекома) и кома со снижением или выпадением сухожильных, периостальных и кожных рефлексов, коллапсом, олигоанурией.
Необходимо провести тщательный поиск симптомов заболеваний, спровоцировавших ДКА (боли в пояснице, озноб, лихорадка, одышка, боли в груди и т.д.).
Лабораторные исследования
На догоспитальном этапе или в приемном отделении: экспресс-анализ гликемии и ацетонурии (по тест-полоскам).
В ОРИТ
Экспресс-анализ гликемии - 1 раз в час до снижения гликемии ≤13 ммоль/л, затем 1 раз в 3 ч, желательно проводить стандартным лабораторным методом, поскольку некоторые глюкометры не определяют гликемию >25 ммоль/л, что затрудняет расчет осмолярности и скорректированного Na+ .
Анализ мочи на ацетон, по возможности - кетоновые тела в сыворотке или бета-гидроксибутират в капиллярной крови - 2 раза в сутки в течение первых двух дней, затем 1 раз в сутки (повышение до 4-12 ммоль/л).
Общий анализ крови и мочи: исходно, затем 1 раз в двое суток.
Электролиты в крови: Na+ , К+ минимум 2 раза в сутки, при необходимости - каждые 2 ч до разрешения ДКА. При сверхвысокой гипергликемии рассчитывают скорректированный Na+ :
измеренный Na+ +1,6× (глюкоза - 5,5)/5,5.
Фосфор - только при состоянии недостаточного питания и у страдающих хроническим алкоголизмом.
Обязателен расчет эффективной осмолярности:
2×Na+ (мэкв/л) +глюкоза (ммоль/л).
-
Остаточный азот, мочевину, креатинин сыворотки, хлориды, бикарбонат, желательно лактат измеряют исходно, затем 1 раз в трое суток, при необходимости - чаще.
-
Анализ газового состава и рН крови (можно венозной): 1-2 раза в сутки до нормализации кислотно-основного состояния. Расчет анионной разницы: (Na+) - (Cl- +HCO3 - ) (мэкв/л). Характерен декомпенсированный метаболический ацидоз. Типы метаболического ацидоза при ДКА: ацидоз с большой анионной разницей (46% больных), смешанный ацидоз с анионной разницей + гиперхлоремический (43%), только гиперхлоремический метаболический ацидоз (11%). Редко: нормальный или повышенный рН при поступлении (зависит от степени дыхательной компенсации и наличия метаболического алкалоза при частой рвоте или применении диуретиков).
Инструментальные исследования
-
Почасовой контроль диуреза, лучше по катетеру; контроль центрального венозного давления, АД, пульса и температуры тела каждые 2 ч; мониторинг ЭКГ; ЭКГ не реже 1 раза в сутки; пульсоксиметрия.
-
Обследования, необходимые для обнаружения пусковых факторов ДКА: рентгенография легких, бактериологическое исследование крови, мочи или других биологических материалов при необходимости.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику проводят с:
-
метаболический ацидоз с большой анионной разницей (лактат-ацидоз, отравление салицилатами, метанолом, этиловым спиртом, паральдегидом);
-
алкогольным кетоацидозом: у больных СД возникает при злоупотреблении алкоголем на фоне недостаточного приема углеводов, гепатоза, рвоты. Характерна гликемия <16 ммоль/л, возможна ложноотрицательная реакция мочи на ацетон; гипокалиемия (с самого начала), гипокальциемия и гипомагниемия.
Если есть кома уже при поступлении, проводят поиск дополнительных причин нарушения сознания (ОНМК, травма головы, лекарственная интоксикация и т.д.).
При оценке лабораторных показателей при ДКА важно учитывать:
-
частое развитие стрессового лейкоцитоза (<15 000), который не всегда указывает на инфекцию. Признак инфекции - число лейкоцитов >15 000. Повышение температуры тела или С-реактивного белка всегда указывает на инфекцию;
-
повышение концентрации креатинина сыворотки крови, протеинурия и эритроцитурия, возможные олиго- и анурия могут быть признаками гиповолемии и гипоперфузии почек и за 2-3 дня нормализуются на фоне регидратации. Если нормализации нет, необходимо проведение дифференциальной диагностики с почечной недостаточностью другого генеза;
-
транзиторное повышение трансаминаз и креатинфосфокиназы как следствие протеолиза и субклинического рабдомиолиза при дефиците инсулина; для исключения инфаркта миокарда следует определить концентрацию тропонина и креатинфосфокиназы (МВ-фракции);
-
умеренное повышение содержания амилазы без панкреатита, что в сочетании с картиной ложного «острого живота» служит вероятным источником диагностической ошибки.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При подозрении на инфекционный очаг той или иной локализации показана консультация соответствующих специалистов (отоларинголога, уролога, гинеколога, хирурга и т.д.).
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
СД 1-го типа. ДКА средней степени тяжести, прекома.
ЛЕЧЕНИЕ
Цели лечения
Цели лечения - устранение дефицита инсулина, снижение гипергликемии, регидратация, коррекция электролитных нарушений и ацидоза, лечение заболеваний, которые могли служить пусковыми факторами ДКА.
Показания к госпитализации
Госпитализируют при подозрении на ДКА.
Немедикаментозное лечение
На догоспитальном этапе - обеспечение проходимости дыхательных путей, при необходимости - мероприятия по улучшению функции внешнего дыхания. В ОРИТ: при рО2 <80 мм рт. ст. - кислород; при нарушении сознания или рвоте - постоянная аспирация через назогастральный зонд.
Медикаментозное лечение
На догоспитальном этапе - инфузия 0,9% раствора натрия хлорида.
Лечение ДКА проводят в ОРИТ; ДКА в начальных стадиях без нарушения сознания и отягощающей патологии - в эндокринологическом или терапевтическом отделении.
Инсулинотерапия - единственный вид этиологического лечения ДКА. Применяют только режим малых доз: преимущество - лучшее управление гликемией и меньший риск осложнений (гипогликемии, гипокалиемии), чем при использовании режима больших доз.
-
-
Вариант 1: начальная доза ИКД - 0,1-0,15 ЕД/кг внутривенно болюсно медленно, затем - непрерывная инфузия через инфузомат по 0,1 ЕД/кг в час. Если непрерывную в/в инфузию инсулина начинают сразу после поступления больного, то болюсная доза необязательна, но начальная скорость инфузии при этом должна составлять 0,1-0,14 единиц/кг массы тела в час. Детям болюсная доза не вводится, внутривенная инфузия проводится со скоростью 0,05-0,1 ЕД/кг. Инфузионная смесь: 50 ЕД ИКД + 2 мл 20% раствора альбумина человека (альбумина♠ ) или 1 мл крови пациента, объем доводят до 50 мл 0,9% раствором натрия хлорида. Белок (альбумин или кровь) добавляют для предотвращения сорбции инсулина в системе.
-
Вариант 2: если инфузомата нет, раствор с концентрацией ИКД 1 ЕД/мл или 1 ЕД/10 мл вводят внутривенно капельно через обычную инфузионную систему. Для предотвращения сорбции инсулина также необходимо добавлять в раствор белок [4 мл 20% альбумина человека (альбумина♠ ) или 2 мл крови пациента на каждые 100 мл] или предварительно «промывать» систему 20-50 мл инсулиновой смеси. Недостатки: при коррекции малых доз ИКД по числу капель или миллилитрам смеси необходимы постоянное присутствие персонала и тщательный подсчет, малые дозы трудно отмерить из-за слишком большой «цены деления» инфузионной емкости; без применения белка сорбция полностью не устраняется.
-
Вариант 3: удобнее всего в отсутствие инфузомата вводить ИКД внутривенно 1 раз в час шприцем в «резинку» инфузионной системы. В инсулиновый шприц набирают ИКД 0,1 ЕД/кг и доводят объем до 1 мл 0,9% раствором натрия хлорида, что позволяет ввести инсулин очень медленно (за 2-3 мин). Способ используют только при отсутствии инфузомата. Длительность фармакологического эффекта ИКД - до 60 мин, что делает возможным болюсное введение 1 раз в час. Преимущества: полностью устраняется проблема сорбции инсулина, возможны точный учет и коррекция введенной дозы, меньшая занятость персонала, чем в варианте 2.
-
-
Внутримышечная инсулинотерапия.
-
Нагрузочная доза - 0,4 ЕД/кг (половина - внутривенно, половина - внутримышечно), затем внутримышечно по 5-10 ЕД/ч. Обязательное условие для внутримышечной инсулинотерапии - адекватная гидратация и отсутствие гиповолемии. Недостатки: проблемы с всасыванием внутримышечно введенного ИКД при нарушении микроциркуляции (коллапс, прекома и кома); малая длина иглы инсулинового шприца затрудняет внутримышечную инъекцию; 24 внутримышечные инъекции в сутки дискомфортны для пациента. Внутримышечное введение проводят: когда внутривенный доступ невозможен; на начальных стадиях ДКА, при отсутствии нарушений гемодинамики, нахождении пациента не в ОРИТ. Если через 2 ч после начала внутримышечной инсулинотерапии гликемия не снижается, необходимо переходить на внутривенное введение. Скорость снижения гликемии должна быть не более 5 ммоль/л в час (опасность обратного осмотического градиента между внутри- и внеклеточным пространством и отека мозга), в первые сутки гликемию следует снижать до концентрации не ниже 13-15 ммоль/л.
-
Коррекция дозы инсулина: если в первые 2-3 ч гликемия не снижается, то следующую дозу ИКД удваивают (0,2 ЕД/кг) и проверяют адекватность гидратации. При скорости снижения гликемии около 5 ммоль/л в час следующую дозу уменьшают вдвое (то же - после снижения гликемии до 15 ммоль/л), при скорости снижения >5 ммоль/л следующую дозу ИКД пропускают, продолжая контролировать гликемию.
Перевод на подкожную инсулинотерапию: после улучшения состояния, при стабильном АД, гликемии ≤11-12 ммоль/л и рН >7,3. ИКД вводят дробно по 10-14 ЕД каждые 4 ч (луше сразу в сочетании с инсулином продленного действия по 10-12 ЕД 2 раза в сутки); внутривенное введение продолжают еще в течение 1-2 ч после первой подкожной инъекции.
Регидратация. Цель регидратации в первые сутки - восполнение не менее половины дефицита жидкости. При концентрации скорректированного Na+ <145 ммоль/л регидратацию проводят 0,9% раствором натрия хлорида, при Na+ ≥150 ммоль/л - 0,45% раствором натрия хлорида (гипотоническим). Скорость регидратации с помощью 0,9% раствора NaCl составляет 1-1,5 л (или 15-20 мл/кг массы тела) в 1-й час, далее по 250-500 мл в час. Скорость регидратации корректируется в зависимости от гидратации, диуреза и центрального венозного давления (ЦВД): при ЦВД< 4 см вод.ст. вводится 1 л жидкости в час, при ЦВД от 5 до 12 см вод.ст. - 0,5 л в час, выше 12 см вод.ст. - 250-300 мл в час. Общий объем инфузии в первые 12 ч терапии - не более 10% массы тела. Суммарная продолжительность регидратации у взрослых составляет около 48 ч. Если регидратацию при ДКА начинают с 0,45% раствора натрия хлорида (в редких случаях истинной гиперна-триемии), скорость инфузии меньше, около 4-14 мл/кг в час.
Инфузия коллоидных растворов показана только при гиповолемическом шоке (систолическое АД стойко <80 мм рт.ст. или центральное венозное давление <4 см вод.ст.).
Скорость регидратации у детей: 10-20 мл/кг, при гиповолемическом шоке - 30 мл/кг, но не более 50 мл/кг в первые 4 ч терапии. Регидратацию следует начинать не менее, чем за 1-2 часа до внутривенного введения инсулина.
При гликемии ≤13 ммоль/л начинают инфузию 5-10% раствора декстрозы (глюкозы♠ ) [+3-4 ЕД ИКД на каждые 20 г декстрозы (глюкозы♠ )] для профилактики гипогликемии и поддержания осмолярности, если больной не может принимать пищу.
Коррекция электролитных нарушений. На фоне инсулинотерапии, регидратации, снижения гликемии и уменьшения ацидоза К+ в больших количествах поступает в клетку и продолжает выводиться с мочой, что связано с риском гипокалиемии, особенно через 3-4 ч от начала терапии (целевое значение - 4-5 ммоль/л). При исходной лабораторно подтвержденной гипокаликемии начинают с введения калия (даже при олиго- и анурии), а инсулин назначают только при К+ >3,3 ммоль/л. При К+ <5,5 ммоль/л (в отсутствие анурии) с самого начала инсулинотерапии (и не позднее инфузии второго литра) внутривенно непрерывно вводят калия хлорид в дозе не более 3 г в первый час, затем по 1,5-2,25 г в час (в 100 мл 4% раствора калия хлорида содержится 4 г калия хлорида). Если концентрация калия неизвестна, введение К+ начинают не позднее, чем через 2 ч от начала инсулинотерапии в дозе около 1,5 г/ч, под контролем диуреза и ЭКГ. Максимальная суточная доза - не более 15-20 г калия. Потребность в калии выше при рН <7,1. Противопоказание к введению - К+ >6 ммоль/л.
Во избежание перегрузки хлоридами треть дозы калия вводят в виде фосфатов или ацетата.
Рутинное возмещение фосфатов не показано (только при концентрации фосфатов <0,35 ммоль/л). Коррекция Mg2+ в стандарт ведения не входит и остается на усмотрение врача (не более 10 мл 20% раствора однократно или 80 мл в сутки); проводят с осторожностью при почечной недостаточности.
Коррекция ацидоза. Этиологическое лечение метаболического ацидоза при СД - инсулинотерапия, которая, подавляя липолиз и кетогенез, устраняет ацидоз. Активная регидратация способствует коррекции рН благодаря нормализации гемодинамики. Возможные отрицательные эффекты щелочей: гипокалиемия; внутриклеточный ацидоз (хотя рН крови может повышаться); гипокальциемия, замедление купирования кетоза; нарушение диссоциации оксигемоглобина и гипоксия; «парадоксальный» ацидоз ликвора и отек мозга. Назначение бикарбоната при рН 6,9-7,14 не уменьшает число осложнений и смертность. По поводу назначения бикарбоната больным с рН ≤6,9 рандомизированные исследования не проводили.
Бикарбонат можно вводить только при рН крови ≤ 6,9 и/или уровне стандартного бикарбоната менее 5 ммоль/л, особенно при угрожающей жизни гиперкалиемии, всегда под контролем кислотно-основного состояния, газового состава крови, содержания К+ , Na+ .
При рН <6,9 вводят 4 г бикарбоната натрия (200 мл 2% раствора внутривенно медленно за 1 ч), при более низком рН вводят 8 г бикарбоната (400 мл 2% раствора за 2 ч). Риск введения щелочей без определения рН превышает потенциальную пользу.
Хорошо спланированные клинические исследования эффективности применения трисамина (трометамола H♠ ) при ДКА не проводили.
Неспецифические мероприятия:
-
при гипертермии или другом подозрении на инфекционный процесс - немедленное назначение антибиотиков широкого спектра действия, не дожидаясь верификации инфекции;
-
гепаринопрофилактика тромбоза целесообразна, если у больного нет заболеваний, повышающих вероятность кровотечения, и крайне желательна у больных высокого риска по тромбозам глубоких вен, больных старческого возраста; при глубокой коме и при осмолярности >380 мосмоль/л.
Критерии разрешения ДКА: гликемия <11 ммоль/л и как минимум два из трех показателей кислотно-основного состояния - бикарбонат ≥18 мэкв/л, венозный рН ≥7,3 и анионная разница ≤12 мэкв/л. Небольшая ацетонурия может некоторое время сохраняться.
Пероральное питание начинают после восстановления сознания, глотания, в отсутствие тошноты и рвоты, с достаточным количеством углеводов и умеренным - белка, с дополнительным подкожным введением ИКД на прием пищи. Через 1-2 сут после начала питания можно переходить на обычную эукалорийную пищу.
Показания к консультации других специалистов
Консультация эндокринолога: для коррекции инсулинотерапии, если в ОРИТ не удается достичь целевых значений гликемии.
Примерные сроки нетрудоспособности
Около 14 дней в зависимости от сопутствующих заболеваний и времени, необходимого для подбора сахароснижающей терапии.
Дальнейшее ведение
Перевод в эндокринологическое или терапевтическое отделение для подбора сахароснижающей терапии и терапевтического обучения.
Информация для пациента
ДКА - угрожающее жизни состояние с высоким содержанием глюкозы в крови и появлением ацетона в моче, обезвоживанием и интоксикацией. Чаще оно возникает при присоединении других заболеваний, а также при неправильно проводимой инсулинотерапии. Регулярно самостоятельно определяйте концентрацию глюкозы в крови, а при ее резком повышении или в любых случаях повышения температуры тела, тошноты или рвоты исследуйте мочу на ацетон. При появлении ацетона в моче, увеличении объема мочи, усилении жажды, тошноте и рвоте немедленно обратитесь к врачу. В качестве меры самопомощи увеличьте объем выпиваемой жидкости до 3-5 л в сутки и, если вы получаете инсулин, увеличьте его суточную дозу как минимум на 25%, преимущественно за счет ИКД.
ПРОГНОЗ
Летальность при ДКА - 2% (США), в России у детей и подростков с СД 1-го типа - от 7 до 9%, отечественных данных по взрослым нет. Факторы риска неблагоприятного исхода: коллапс, нарушение сознания, респираторный дистресс-синдром взрослых, сверхвысокая гликемия, почечная недостаточность, низкие значения содержания бикарбоната и рН, высокая осмолярность, тяжелые заболевания, старческий возраст.
СПИСОК ЛИТЕРАТУРЫ
-
Потемкин В.В., Старостина Е.Г. Руководство по неотложной эндокринологии. - М.: Медицинское информационное агентство, 2008. - 393 с.
-
Старостина Е.Г. Острые осложнения сахарного диабета // Сахарный диабет: острые и хронические осложнения / Под ред. И.И. Дедова, М.В. Шестаковой. - М.: ООО «Издательство «Медицинское информационное агентство», 2011. - С. 25-58.
-
Старостина Е.Г., Анциферов М.Б. и др. Эффективность программы лечения и обучения больных сахарным диабетом 1-го типа // Проблемы эндокринологии. - 1994. - №3. - С. 15-19.
-
Duhon B., Attridge R.L., Franco-Martinez A.C., Maxwell P.R., Hughes D.W. Intravenous sodium bicarbonate therapy in severely acidotic diabetic ketoacidosis // Ann. Pharmacother. - 2013. - Vol. 47 (7-8). - P. 970-975.
-
Kitabchi A.E., Umpierrez G.E., Miles J.M., Fisher J.N. Hyperglycemic crises in adult patients with diabetes. ADA Practice Recommendations // Positionstatement Diabetes Care. - 2009. - Vol. 32 (7). - P. 1335 - 1343.
-
Nyenwe E.A., Kitabchi A.E. Evidence-based management of hyperglycemic emergencies in diabetes mellitus // Diabetes Res. Clin. Pract. - 2011. - Vol. 94. - P. 340.
-
Perel P., Roberts I., Pearson M. Colloids versus crystalloids for fluid resuscitation in critically ill patients // Cochrane Database of Syst. Rev. - 2007 (Issue 4):Art. No.: CD000567.
-
Pollock F., Funk D.C. Acute diabetes management: adult patients with hyperglycemic crises and hypoglycemia // AACN Adv. Crit. Care. - 2013. - Vol. 24 (3). - P. 314-324.
-
Savage M.W., DhatariyaK.K., Kilvert A., Rayman G., Rees J.A., Courtney C.H., Hilton L., Dyer P.H., Hamersley M.S.; Joint British Diabetes Societies. Joint British Diabetes Societies guideline for the management of diabetic ketoacidosis // Diabet. Med. - 2011. - Vol. 28. - P. 508.