Эндокринология : национальное руководство / под ред. И. И. Дедова, Г. А. Мельниченко. - 2-е изд. , перераб. и доп. - Москва : ГЭОТАР-Медиа, 2021. - 1112 с. : ил. - 1112 с. - ISBN 978-5-9704-6054-2. |
Аннотация
Национальные руководства - серия практических руководств по основным медицинским специальностям, включающих специальную информацию, необходимую врачу для непрерывного последипломного образования. В отличие от других изданий в национальных руководствах равное внимание уделено профилактике, диагностике, фармакотерапии и немедикаментозным методам лечения.
В национальном руководстве "Эндокринология" приведены современные рекомендации по профилактике, диагностике, лечению эндокринных заболеваний и реабилитации эндокринологических больных. Особое внимание уделено ведению больных с наиболее распространенными заболеваниями эндокринной системы, такими как сахарный диабет, ожирение, остеопороз, болезни щитовидной железы. Рекомендации по диагностике, лечению и профилактике эндокринных заболеваний подготовлены ведущими специалистами и отражают объединенную, согласованную позицию отечественной научной школы.
В настоящем, втором издании пересмотрены и обновлены все разделы руководства с учетом последних международных и отечественных рекомендаций.
Руководство предназначено эндокринологам, терапевтам, врачам общей практики, а также студентам старших курсов медицинских вузов, интернам, ординаторам, аспирантам.
Глава 13. Болезни щитовидной железы
СИНДРОМ ГИПОТИРЕОЗА
Свириденко Н.Ю., Абрамова Н.А.
ОПРЕДЕЛЕНИЕ
Гипотиреоз - клинический синдром, вызванный стойким дефицитом гормонов щитовидной железы или снижением их биологического эффекта на тканевом уровне.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
Распространенность гипотиреоза зависит от возраста, пола, уровня потребления йода. Частота манифестного гипотиреоза в популяции составляет 0,2-2,0%, субклинического - до 10% у женщин и до 3% у мужчин. Наибольшей частоты гипотиреоз достигает среди женщин старшей возрастной группы, где показатель распространенности увеличивается до 12%. Согласно результатам крупного попу-ляционного исследования National Health and Nutrition Examination Survey III, 2002, распространенность гипотиреоза у 17 353 жителей США старше 12 лет составила 4,6% (0,3% - манифестный, 4,3% - субклинический). В группе лиц старше 70 лет частота гипотиреоза достигала 14%. По данным Фрамингемского исследования, из 2139 обследованных пациентов (892 мужчины и 1256 женщин) старше 60 лет субклинический гипотиреоз наблюдался у 126 пациентов (5,9%), причем среди женщин - почти в два раза чаще. По данным 20-летнего Викгемского исследования (Whickham Survey, Великобритания), частота новых случаев спонтанного гипотиреоза составила у женщин 3,5 случаев на 1000 человек в год, а гипотиреоза в результате радикального лечения тиреотоксикоза - 0,6 случаев на 1000 человек в год. Длительное наблюдение за больными субклиническим гипотиреозом показало, что при наличии тиреоидных антител риск развития явного гипотиреоза составляет 5% в год. При эпидемиологических исследованиях субклинический гипотиреоз встречается чаще, чем манифестный, но в клинической практике реже диагностируется.
КЛАССИФИКАЦИЯ И ЭТИОЛОГИЯ ГИПОТИРЕОЗА
-
-
Центральный (гипоталамо-гипофизарный, вторичный и третичный) гипотиреоз.
-
Разрушение или недостаток клеток, продуцирующих ТТГ и/или тиролиберин:
-
травматическое или лучевое повреждение (хирургические операции, протонотерапия);
-
сосудистые нарушения (ишемические или геморрагические повреждения, аневризма внутренней сонной артерии);
-
инфекционные и инфильтративные процессы (абсцесс, туберкулез, гистиоцитоз);
-
врожденные нарушения (гипоплазия гипофиза, септооптическая дисплазия).
-
-
Тканевой гипотиреоз (транспортный, периферический) - возникает вследствие нарушения транспорта, метаболизма и действия тиреоидных гормонов и включает:
-
генерализованную резистентность к гормонам щитовидной железы;
-
частичную (гипофизарную) резистентность к тиреоидным гормонам;
-
инактивацию циркулирующих Т3 и Т4 или ТТГ. Снижение уровня тиреоидных гормонов в организме вызывает нарушение функционирования различных органов и систем. Выраженность этих изменений будет зависеть от степени тяжести гипотиреоза.
-
Первичный гипотиреоз по степени тяжести классифицируется на субклинический, манифестный и осложненный (табл. 13.1).
ПАТОГЕНЕЗ
При дефиците тиреоидных гормонов, необходимых для нормального функционирования практически каждой клетки, развиваются тяжелые изменения всех без исключения органов и систем. При тяжелом гипотиреозе развивается муцинозный отек (микседема) вследствие избыточного накопления в интерстициальных тканях гиалуроновой кислоты и других гликозаминогликанов, которые из-за гидрофильности задерживают избыток воды. Аккумуляция гликозаминогликанов, наиболее вероятно, обусловлена выпадением ингибирующих эффектов тиреоидных гормонов на синтез фибробластами гиалуроновой кислоты, фибронектина и других структур коллагена.
| Степень тяжести | Лабораторные изменения | Клиническая картина |
|---|---|---|
Субклинический |
ТТГ повышен, св. Т4 в норме |
Бессимптомное течение или только неспецифические симптомы |
Манифестный |
ТТГ повышен, св. Т4 снижен |
Присутствуют характерные симптомы гипотиреоза, возможно и бессимптомное течение |
Осложненный |
ТТГ повышен, св. Т4 снижен |
Развернутая клиническая картина гипотиреоза. Отмечают тяжелые осложнения: полисерозит, сердечную недостаточность, энцефалопатию, микседематозную кому и др. |
Обмен веществ. При гипотиреозе происходит снижение потребления кислорода тканями, снижение расходования энергии и утилизации энергетических субстратов. Уровень основного обмена может снижаться на 35-40%. Все это в сочетании со снижением аппетита может привести к умеренной прибавке веса. При гипотиреозе происходит снижение синтеза и метаболизма белка, при этом у большинства пациентов отмечается положительный азотистый баланс и повышение содержания сывороточного альбумина. Наблюдается также снижение кишечной абсорбции глюкозы, которое обусловливает низкий гликемический пик в ОГТТ. В соответствии с этим отмечается снижение и отсроченность пикового уровня инсулина в ответ на нагрузку декстрозой (глюкозой♠ ). При гипотиреозе развиваются атерогенные изменения липидного обмена, а также гиперлипидемия IIa или IIb по Фридериксону. Для гипотиреоза характерно одновременное снижение как синтеза жирных кислот, так и липолиза. Повышение уровня холестерина связано в большей степени с замедлением метаболизма, чем с его синтезом. Прежде всего увеличивается уровень холестерина ЛПНП, так как подавляется экспрессия Т3 -зависимого рецептора ЛПНП гепатоцитов. Выраженность нарушений липидного обмена обратно пропорциональна уровню Т4 и прямо пропорциональна уровню ТТГ. В настоящее время определенную роль в развитии атеросклероза, артериальных и венозных тромбоэмболий отводят гомоцистеину, содержание которого при гипотиреозе повышено.
Нервная система. У пациентов с длительно существующим тяжелым гипотиреозом были выявлены атрофия нейронов, глиоз, фокусы дегенерации, а также скопление муцинозного материала и круглых гликогеновых телец (нейрональные микседематозные тельца). При гипотиреозе наблюдают нарушение обмена и продукции ряда медиаторов. Депрессию, развивающуюся как при субклиническом, так и при манифестном гипотиреозе, связывают со снижением активности в ЦНС 5-гидрокситриптамина.
Опорно-двигательная система. Изменения характеризуются замедлением костного ремоделирования, наличием гипотиреоидной рабдомиопатии, генерализованной гипертрофии скелетной мускулатуры, сочетающейся с умеренной мышечной слабостью и медлительностью в движениях (синдром Хоффмана).
Сердечно-сосудистая система. Тиреоидные гормоны оказывают положительный инотропный и хронотропный эффекты на сердце и повышают потребление миокардом кислорода. Т3 снижает системное сопротивление за счет расширения резистивных артериол на периферии. При гипотиреозе возникает брадикардия и мягкая АГ. Происходит снижение ударного объема, ЧСС, сократимости миокарда и сердечного выброса. Однако сердечная недостаточность возникает только при тяжелом гипотиреозе, так как одновременно со снижением объема циркулирующей крови снижается и потребность в кислороде. Причинами увеличения сердца при гипотиреозе считают гипертрофию миокарда, уменьшение сократимости миокарда и, как следствие, удлинение мышечных волокон, увеличение объема интерстициальной жидкости, нарушение синтеза миозина. На фоне нагрузочных проб при гипотиреозе можно обнаружить изменения на ЭКГ, характерные для ИБС, что связано с тканевой гипоксией в результате снижения доступности кислорода, а не с изменениями коронарных артерий.
Система дыхания. При гипотиреозе наблюдают снижение максимальной емкости легких и вентиляционного ответа на СО2 . Основной причиной альвеолярной гиповентиляции считается слабость мышц диафрагмы.
ЖКТ. Наблюдается снижение аппетита (иногда анорексия), что связано со снижением потребности в энергетических субстратах на фоне снижения метаболизма. Запоры объясняются замедлением перистальтики кишечника и уменьшением поступающей пищи. При гипотиреозе снижается сократимость и возникает дискинезия желчного пузыря и желчных протоков, что ведет к образованию камней.
Выделительная система и водно-солевой обмен. В связи со снижением сердечного выброса и объема циркулирующей крови объем почечного кровотока и СКФ снижены, что ведет к повышению уровня креатинина. Для гипотиреоза характерна задержка в организме натрия из-за связывания с внеклеточными мукополисахаридами. Уровень сывороточного натрия снижается из-за синдрома неадекватной продукции АДГ, что ведет к гипоосмолярности.
Репродуктивная система. Дефицит тиреоидных гормонов приводит к изменению синтеза, транспорта, метаболизма и периферических эффектов половых гормонов. Характерно снижение уровня общего тестостерона и эстрадиола за счет снижения секс-стероид-связывающего глобулина. Гиперпродукция тиреотропин-рилизинг гормона при первичном гипотиреозе ведет к повышению секреции как ТТГ, так и пролактина. Дефицит Т4 нарушает образование дофамина - вещества, необходимого для нормального пульсового выделения ЛГ. Нередко первичный гипотиреоз сочетается с синдромом галактореи-аменореи и нарушениями в репродуктивной сфере. При обследовании у таких больных выявляется повышенный уровень пролактина и признаки микроили макроаденомы гипофиза. Патогенез развития данного синдрома связан с увеличением синтеза тиролиберина в ответ на гипотироксинемию и его стимулирующим действием на секрецию пролактина. Лакторея как симптом первичного гипотиреоза встречается примерно у 5% больных и у 65% женщин с вторичной аменореей и бесплодием. Сочетание первичного гипотиреоза с лактореей и аменореей выделено в литературе в особую форму, известную под названием синдрома Van Wyk-Hennes-Ross. Послеродовый тиреоидит с гипотиреозом также может сопровождаться лактореей и аменореей. У девочек с некомпенсированным гипотиреозом встречается ювенильный вариант синдрома, описанный Van Wyk и Grumbach, который в отличие от обычного варианта сопровождается макромастией, лактореей, преждевременными менархе и меноррагией, при отсутствии полового оволосения и задержки «костного возраста».
Система крови и гемостаза. Причиной анемии при гипотиреозе может быть снижение костно-мозгового кроветворения в результате дефицита тиреоидных гормонов, а также последствия мено- и метроррагий. Нарушения тромбоцитарного ростка ведут к снижению агрегации тромбоцитов, что в сочетании со снижением в плазме уровня факторов VIII и IX, а также с повышенной ломкостью капилляров усугубляет кровоточивость.
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА
Классические симптомы гипотиреоза: быстрая утомляемость, сонливость, выраженная сухость кожных покровов, выпадение волос, замедленная речь, отечность лица, пальцев рук, нижних конечностей, запоры, снижение памяти, зябкость, охриплость голоса, депрессивное состояние, нарушение менструального цикла, бесплодие и т.д. - достаточно неспецифичны и могут присутствовать при заболеваниях другой этиологии. Нередко больные гипотиреозом годами лечатся у врачей разных специальностей, пока их не направят к эндокринологу. Кроме того, симптомы гипотиреоза часто «маскируются» под другую патологию.
К «маскам» гипотиреоза можно отнести следующие проявления:
-
гастроэнтерологические: запоры, дискинезия желчных путей, желчнокаменная болезнь, хронический гепатит («желтуха» в сочетании с повышением уровня печеночных трансаминаз);
-
кардиологические: диастолическая гипертензия, дислипидемия, гидроперикард;
-
респираторые: синдром апноэ во сне, плевральный выпот «неясного» генеза, «хронический ларингит»;
-
неврологические: туннельные синдромы: синдром карпального канала, синдром канала малоберцового нерва;
-
ревматологические: полиартрит, полисиновит, прогрессирующий остеоартроз (часто соседствуют с неврологическими «масками»);
-
гинекологические: при явном гипотиреозе часто наблюдают различные нарушения менструального цикла, такие как аменорея, полименорея, гиперменорея, меноррагия, дисфункциональные маточные кровотечения (определение уровня ТТГ входит в обязательный алгоритм исследований при женском бесплодии);
-
гематологические: нормохромная нормоцитарная, гипохромная железодефицитная или макроцитарная В12 -дефицитная анемия;
Неспецифичность клинической картины, нарушения функции различных органов и систем, маскирующие основные проявления болезни, пожизненная заместительная терапия формируют, с одной стороны, представление о гипотиреозе как о тяжелом заболевании, с другой стороны, достаточно простая гормональная диагностика и адекватное лечение позволяют предупредить развитие серьезных осложнений, обеспечить профилактику раннего развития атеросклероза и инфаркта миокарда, улучшить репродуктивное здоровье, повысить качество и продолжительность жизни пациента.
ДИАГНОСТИЧЕСКИЙ АЛГОРИТМ
В подавляющем большинстве случаев гипотиреоз является первичным, т.е. обусловленным поражением щитовидной железы. Вторичный гипотиреоз встречается значительно реже, он связан с патологией гипоталамо-гипофизарной области. Достаточно редко встречается тканевой или периферический гипотиреоз, обусловленный резистентностью тканей к тиреоидным гормонам или нарушением транспорта, метаболизма и действия тиреоидных гормонов. Отдельно выделяют врожденные формы гипотиреоза, уровень поражения при которых также может быть первичным, центральным, периферическим. Как правило, гипотиреоз носит перманентный характер, однако при ряде заболеваний щитовидной железы он может быть и транзиторным. В этой связи большое значение в постановке диагноза отдается лабораторной диагностике гипотиреоза.
Диагностика первичного гипотиреоза. Современная лабораторная диагностика гипотиреоза основана на определении уровня ТТГ и св. Т4 . Приоритет тестирования в диагностике гипотиреоза отдается прежде всего определению ТТГ. Определение Т3 для диагностики гипотиреоза не имеет дополнительного значения. По результатам исследования выделяют две формы гипотиреоза: манифестный (ТТГ повышен, св. Т4 снижен) и субклинический (ТТГ повышен, св. Т4 норма).
Диагностика вторичного гипотиреоза. Развитие вторичного гипотиреоза может быть связано с патологией гипофиза вследствие разрушения опухолью, оперативным вмешательством, облучением или нарушением кровообращения, либо с патологией гипоталамо-гипофизарной области. Вторичный гипотиреоз редко бывает изолированным. Как правило, он сопровождается дефицитом других тропных гормонов гипофиза, в частности АКТГ, ФСГ, пролактина и соответствующими клиническими проявлениями. В ряде случаев вторичный гипотиреоз может сопровождаться клиникой несахарного диабета вследствие недостаточности АДГ. Диагностика вторичного гипотиреоза основана на определении пониженного уровня св. Т4 . Уровень ТТГ при вторичном гипотиреозе может быть пониженным, нормальным или даже превышать верхнюю границу нормы, при этом его биологическая активность будет снижена.
Диагностика периферического гипотиреоза. Периферический гипотиреоз встречается достаточно редко. Его развитие обусловлено резистентностью к тиреоидным гормонам. В основе патогенеза резистентности к тиреоидным гормонам лежат дефекты рецепторов к тиреоидным гормонам и нарушение отрицательной обратной связи функции щитовидной железы и гипофиза. Выделяют две формы резистентности к тиреоидным гормонам: генерализованную и изолированную (гипофизарную). Характерным для генерализованной формы резистентности к тиреоидным гормонам является повышенный уровень св. Т3 и св. Т4 в сочетании с нормальным или увеличенным уровнем ТТГ и клиникой эутиреоза или гипотиреоза. Гипофизарная резистентность к тиреоидным гормонам сопровождается повышенным уровнем св. Т3 и св. Т4 в сочетании с нормальным или увеличенным уровнем ТТГ и клиникой тиреотоксикоза. При проведении дифференциальной диагностики между первичным гипотиреозом и резистентностью к тиреоидным гормонам необходимо повторить исследование гормонов для исключения технической погрешности при проведении теста. Если в повторных анализах сохраняется несоответствие ТТГ и св. Т4 , следует провести молекулярно-генетические исследования - THRB (ERBA2), экзоны 9 - 10.
Изолированное снижение содержания св. Т3 на фоне нормальных концентраций ТТГ и св. Т4 наблюдают при синдроме «эутиреоидной патологии», связанном с развитием выраженных системных и органных нарушений (инфаркт миокарда, постинфарктный период, распространенный инфекционный процесс, декомпенсированный СД), при которых нарушается периферическое дейодирование св. Т4 в св. Т3 .
Следует максимально избегать исследований функции щитовидной железы в условиях реанимационных отделений и отделений интенсивной терапии в связи с одновременным назначением большого числа препаратов, которые могут вмешиваться в обмен тиреоидных гормонов и изменять результаты анализов, воздействуя непосредственно на уровне тест-систем (например, гепарин натрия).
В табл. 13.2 приведены ЛС, влияющие на функцию щитовидной железы.
Высокие дозы йодидов подавляют высвобождение тиреоидных гормонов из щитовидной железы, вероятно, за счет подавления протеолиза. Глюкокортикоиды оказывают аналогичный эффект, который в начале сопровождается одновременным подавлением продукции ТТГ. Хроническое введение лития подавляет высвобождение тиреоидных гормонов из щитовидной железы, вероятно, в результате подавления протеолиза тиреоглобулина. Дейодиназа внешнего кольца или 5'-дейодиназа 1-го типа, которая преимущественно находится в печени, почках, щитовидной железе и в сердце, является селенопротеином, катализирующим периферическую конверсию Т4 в Т3 и реверсивный Т3 в 3,3’T2. Различные β-адреноблокаторы отличаются по своим эффектам на 5'-дейодирование тиреоидных гормонов. Пропранолол в высоких дозах уменьшает продукцию Т3 in vitro и in vivo. Такой Т3 -снижающий эффект не характерен для других β-адреноблокаторов, таких как атенолол и метапролол. Ряд йодсодержащих соединений, включая амиодарон и контрастные оральные препараты для холецистографии, подавляют активность 5'-дейодиназы как 1-го, так и 2-го типа, что приводит к уменьшению образования Т3 в гипофизе и, таким образом, к небольшому повышению уровня ТТГ в сыворотке, которое, как правило, не выходит за пределы нормальных значений. Воздействуя на активность дейодиназы 1-го типа, амиодарон обусловливает уменьшение сывороточного уровня Т3 и повышение реверсивного Т3 , что часто сочетается с повышением уровня Т4 и связывается с уменьшением его клиренса. Эндогенные и экзогенно вводимые эстрогены могут влиять на результаты исследования функции щитовидной железы, повышая уровень общего Т4 за счет увеличения уровня Т4 -связывающего глобулина, при этом уровень свободного Т4 остается в пределах нормы. В ответ на повышение уровня связывающих белков вначале имеется тенденция к снижению уровня свободной фракции тиреоидных гормонов, что приводит к транзиторному усилению продукции ТТГ и восстановлению базального уровня свободного Т4 за счет увеличения общей фракции гормона. Однако уровень св. Т4 оказывается ниже исходного. Уровень метаболизма Т4 остается неизменным, но при этом увеличивается его экстрацеллюлярный пул. Связывание Т3 изменяется аналогичным образом. Определение уровней св. Т4 и св. Т3 позволяет избежать возможных проблем, связанных с изменением уровня Т4 -связывающего глобулина. Печеночный метаболизм Т4 и Т3 может усиливаться препаратами, стимулирующими систему цитохрома Р450, опосредованно через рецепторы, относящиеся к надсемейству стероидных и тиреоидных рецепторов гормонов. Помимо уже известных препаратов, которые оказывают этот эффект, таких как рифампицин, фенитоин, карбамазепин и барбитураты, указанными свойствами могут обладать антибиотики, психотропные препараты, ксенобиотики, не использующиеся как лекарства. Результаты лабораторных исследований, изучающих функцию щитовидной железы, в наибольшей степени могут быть изменены при назначении сразу нескольких препаратов. Например, при одновременном назначении фуросемида и допамина может развиться выраженная гипотироксинемия. Фуросемид, вводимый в большой дозе, вытесняет Т4 из связи с Т4 -связывающим глобулином, ускоряя тем самым его клиренс, тогда как назначение допамина приводит к подавлению нормального секреторного ответа ТТГ на гипотироксинемию. После отмены допамина уровень ТТГ может транзиторно повыситься до супранормальных значений, что может быть ошибочно трактовано как первичный гипотиреоз. В дальнейшем наблюдается спонтанная нормализация уровней Т4 и ТТГ. Комбинация рифампицина, который усиливает клиренс Т4 с глю-кокортикоидами, подавляющими секрецию ТТГ, может сопровождаться аналогичными сдвигами. Введение таких цитокинов, как интерферон альфа, интерферон гамма, интерлейкин-1, интерлейкин-2, фактор некроза опухолей и гранулоцитарный колониестимулирующий фактор, может сопровождаться развитием гипотиреоза или тиреотоксикоза. Указанные изменения чаще носят транзиторный характер и исчезают спустя несколько месяцев после прекращения лечения. На фоне лечения хронического гепатита С интерфероном альфа описано развитие как гипотиреоза, так и тиреотоксикоза, при этом гипотиреоз встречается примерно в 6% случаев, тогда как повышенные титры антител к тиропероксидазе определяются в каждом пятом случае. Факторами риска развития гипотиреоза являются женский пол, назначение высоких доз препарата, продолжительное лечение, наличие антител к щитовидной железе до начала лечения и сочетанное назначение интерлейкина-2. Более чем в половине случаев гипотиреоз спонтанно разрешался после прекращения лечения. В регионах с достаточным йодным обеспечением наиболее часто на фоне приема амиодарона развивается гипотиреоз, обычно при наличии исходной аутоиммунной патологии щитовидной железы. Стандартная заместительная терапия с использованием Т4 эффективна, но может понадобиться ее некоторая модификация в связи с имеющимся заболеванием сердца или из-за способности амиодарона снижать клиренс Т4 и повышать сывороточный уровень ТТГ.
Механизм действия |
Препараты |
Эффект |
|
Модификация продукции ТТГ гипофизом |
Допамин, добутамин, глюкокортикоиды, октреотид |
- |
|
Нарушение синтеза и высвобождения тиреоидных гормонов при поступлении избытка йода |
Контрастные средства, амиодарон, препараты местного действия |
± |
|
Влияние на синтез или высвобождение тиреоидных гормонов |
Литий, глюкокортикоиды, аминоглутетимид |
- |
|
Подавление Т4-Т3 5'-дейодирования |
Амиодарон, глюкокортикоиды, β-адреноблокаторы [10], контрастные средства (йопаноевая кислотаρ, йопадатρ) |
- |
|
Модификация иммунного ответа |
Интерлейкин-1, интерферон альфа, γ-интерферон, моноклональные антитела |
± |
|
Изменение связывания Т4 и Т3 с белками плазмы |
Изменение уровня Т4-связывающего глобулина |
Эстрогены, героин, метадон, клофибрат, фторурацил (5-фторурацил♠), перфеназин, тамоксифен |
+ |
Вытеснение Т4 и Т3 из связи с белками |
Фуросемид, салицилаты, фенитоин, карбамазепин, НПВс, гепарин натрия [11] |
- |
|
Вытеснение тканевого пула Т4 |
Алкилирующие агенты, оральные холецистографические препараты |
+ |
|
Модификация действия тиреоидных гормонов |
Амиодарон, фенитоин |
± |
|
Усиление клиренса Т4 и Т3 |
Барбитураты, фенитоин, карбамазепин, рифампицин, сертралин, флуоксетин, дотиепинρ |
+ |
|
Нарушение кишечной абсорбции Т4 |
Алюминия гидрохлоридρ, железа сульфат, холестирамин, колестипол, сукральфат, препараты сои, каексалатρ |
- |
|
(-) - подавление; (+) - стимуляция; (±) - эффект зависит от функции щитовидной железы.
Клинический анализ крови
Нормоили гипохромная анемия, в ряде случаев В12 -дефицитная анемия.
Биохимический анализ крови
Повышение уровня холестерина, ЛПНП, триглицеридов (чаще гиперлипидемия IIа или IIb по Фридериксену), увеличение уровня креатинина, гипонатриемия, гипоосмолярность, снижение клубочковой фильтрации, повышение содержания в крови ферментов (креатининфосфокиназы, аспартат-трансаминазы, лактатдегидрогеназы).
Инструментальные исследования
ЭКГ: Уменьшение числа сердечных сокращений, низкий вольтаж зубцов, сглаженный или отрицательный зубец Г, отклонение электрической оси сердца влево, удлинение интервалов Р-R, Q-T, расширение комплекса QRS.
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ
Йододефицитный гипотиреоз. Первичный гипотиреоз вследствие дефицита йода развивается при крайней степени йодной недостаточности, когда уровень потребления йода не превышает 20 мкг в сутки. В районах легкого и умеренного йодного дефицита развитие йододефицитного гипотиреоза маловероятно, однако во время беременности в связи с активным плацентарным дейодированием Т4 и увеличением почечного клиренса йода возможно развитие относительной гестационной гипотироксинемии. Известно, что при нормальном уровне потребления йода продукция Т4 во время беременности должна увеличиться примерно на 30-50%. Однако в условиях йодного дефицита щитовидная железа беременной не может обеспечить такой функциональный подъем и, соответственно, удовлетворить возросшие потребности организма в тиреоидных гормонах. Относительная гестационная гипотироксинемия неблагоприятно сказывается на становлении функций мозга и в дальнейшем на коэффициенте умственного развития IQ.
Послеоперационный гипотиреоз. При проведении оперативных вмешательств на щитовидной железе гипотиреоз часто является планируемым исходом, а не осложнением лечения и имеет прямую зависимость от объема оперативного вмешательства. Гипотиреоз, развившийся в первые месяцы после резекции щитовидной железы, гемиструмэктомии, может иметь транзиторный характер. О стойком характере гипотиреоза можно судить через 4-6 мес после операции.
Постлучевой гипотиреоз. При проведении терапии радиоактивным йодом гипотиреоз также является планируемым исходом, а не осложнением лечения. Гипотиреоз, развившийся в первые месяцы после лечения 131I, может иметь тран-зиторный характер. О стойком характере гипотиреоза можно судить через 6 мес после облучения.
Лекарственный гипотиреоз. Развивается на фоне приема препаратов, обладающих тиреостатическим действием. К ним относятся производные имидазола [тиамазол (тирозол♠ ), мерказолил♠ ] и тиоурацила [пропилтиоурацил (пропицил♠ )]. В психиатрической практике для лечения маниакально-депрессивных состояний используются препараты лития, которые помимо своего психотропного действия обладают способностью блокировать аденилатциклазную систему щитовидной железы и вызывать снижение ее функции и развитие зоба.
У лиц, имеющих сопутствующую патологию щитовидной железы, прием амиодарона может вызвать функциональные нарушения с развитием симптомов гипотиреоза. Функциональные тесты, оценивающие состояние щитовидной железы у пациентов, получающих амиодарон, имеют другой диапазон нормальных значений, чем у эутиреоидных лиц, не принимающих препарат. Установлено, что у 1/3 пациентов в процессе лечения амиодароном наблюдается повышение уровня общего и св. Т4 , реверсивного Т3 , уменьшение уровня св. Т3 . Это обусловлено подавлением активности 5-дейодиназы I типа, нарушающей конверсию Т4 в Т3 в периферических тканях, особенно в печени. Подавление активности 5-дейодиназы может сохраняться на протяжении нескольких месяцев и после отмены препарата. Кроме того, препарат снижает проникновение тиреоидных гормонов в клетки периферических тканей. Оба механизма способствуют развитию доброкачественной формы эутиреоидной гипертироксинемии, с повышенным уровнем общего и св. Т4 , реверсивного Т3 , нормальным или субнормальным Т3 . Эутиреоидная гипертироксинемия рассматривается как лабораторный феномен, развивающийся на фоне приема амиодарона. Это состояние не требует медикаментозной коррекции. В процессе лечения амиодароном у ряда больных может произойти изменение уровня ТТГ в сыворотке крови без клинических проявлений нарушения функции щитовидной железы. Повышение концентрации ТТГ у клинически эутиреоидных пациентов зависит как от дозы, так и от длительности приема препарата. Так при ежедневном приеме 200-400 мг амиодарона уровень ТТГ обычно находится в пределах нормы. При более высокой дозе препарата увеличение концентрации ТТГ может произойти в первые месяцы приема с последующим возвращением к норме. Распространенность гипотиреоза на фоне приема амиодарона колеблется в пределах от 6% в странах с низким потреблением йода до 13% - с высоким потреблением йода. Наиболее часто гипотиреоз встречается у пожилых и женщин, распространенность тиреоидной патологии среди которых особенно высока. У лиц с сопутствующим АИТ лечение амиодароном, как правило, ускоряет развитие гипотиреоза. Амиодарон-ассоциированный гипотиреоз может быть транзиторным или постоянным, последний почти всегда связан с предшествующими нарушениями в щитовидной железе. Гипотиреоз обычно манифестирует рано, но иногда и после 18 мес лечения. Развитие гипотиреоза не сопровождается потерей антиаритмической эффективности амиодарона и не является показанием к его отмене. У пациентов без органической патологии щитовидной железы и нормальным уровнем антител к тиреоглобулину и тереопероксидазе как причины гипотиреоза рассматриваются: скрытые дефекты органификации йода и синтеза тиреоидных гормонов на фоне приема фармакологических доз йода и развитие деструкции тиреоцитов с уменьшением числа функционирующих клеток.
Цитокининдуцированный гипотиреоз. Цитокины играют важную роль в развитии аутоиммунных заболеваний. Цитокины: α-интерферон и интерлейкин 2 используются для лечения больных с воспалительными заболеваниями, гепатитом В и С, в онкологии. Цитокины могут вызывать развитие деструктивного процесса и функциональных нарушений щитовидной железы, которые носят, как правило, транзиторный характер и проходят после отмены препарата. У пациентов, помимо лабораторных признаков гипотиреоза, может регистрироваться высокий уровень антител к тиреоидным антигенам.
Врожденный гипотиреоз. Частота его встречаемости составляет 1 случай на 3500-4000 новорожденных. Ранняя диагностика врожденного гипотиреоза стала возможной благодаря внедрению государственной системы неонатального скрининга на врожденный гипотиреоз. Скрининг позволяет поставить диагноз в первые недели жизни ребенка и избежать тяжелых и необратимых последствий.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИЯМ СПЕЦИАЛИСТОВ
Рекомендуется консультация кардиолога, особенно в случае развития тяжелого (осложненного) гипотиреоза, по показаниям консультация невролога, гинеколога, психоневролога, гастроэнтеролога, гематолога.
ЛЕЧЕНИЕ
При всех формах гипотиреоза показана заместительная терапия левотироксином натрия. Цель терапии гипотиреоза - клиническая и лабораторная компенсация гипотиреоза. Как правило, доза препарата подбирается индивидуально, в зависимости от тяжести гипотиреоза, возраста пациента и наличия сопутствующей кардиальной патологии. В ряде случаев у пациентов с ожирением левотироксин натрия назначается из расчета 1,6 мкг на 1 кг идеального веса. Исследование уровня ТТГ проводится не ранее, чем через 2 мес после подбора полной заместительной дозы препарата. В том случае, если доза была изменена в процессе лечения, определение уровня ТТГ также должно проводиться не ранее чем через 2 мес. Обычно контроль уровня ТТГ осуществляется один раз в год или при появлении признаков декомпенсации заболевания. У лиц моложе 50 лет, при отсутствии сердечно-сосудистой патологии, первоначальная доза препарата может составлять 50 мкг и более с быстрым повышением до полной заместительной. У лиц более старшего возраста следует проявлять большую осторожность, так как назначение заместительной терапии может вызвать обострение недиагностированного заболевания сердца.
Лечение больных гипотиреозом с кардиальной патологией. Увеличивая частоту и силу сердечных сокращений, тиреоидные гормоны повышают потребность миокарда в кислороде, что может в условиях коронарной недостаточности ухудшить его кровоснабжение. Лечение больных гипотиреозом и сопутствующей кардиальной патологией, особенно ИБС, следует начинать с минимальных доз левотироксина натрия - 12,5-25 мкг, постепенно увеличивая дозу на 12,5-25 мкг каждые 1-2 мес до нормализации уровня ТТГ. Заместительную терапию проводят под контролем ЭКГ или мониторирования ЭКГ по Holter, не допуская при этом декомпенсации кардиальной патологии или развития аритмии. На фоне приема левотироксина натрия у большинства больных отмечается положительная динамика, которая связана с улучшением сократительной функции сердца, уменьшением периферического сопротивления и увеличением сердечного выброса. Однако у ряда больных наблюдается ухудшение течения сердечной патологии, особенно ИБС, что может препятствовать подбору полной заместительной дозы левотироксина натрия. В такой ситуации рекомендуется более медленный и длительный подбор дозы препарата с сохранением уровня ТТГ в пределах, не превышающих значений, характерных для субклинического гипотиреоза (не выше 10 мЕд/л). Если на фоне заместительной терапии произошло ухудшение течения предшествующей кардиальной патологии или усиление симптомов предшествующей стенокардии, рекомендуется снизить дозу левотироксина натрия, исследовать уровень кардиоспецифических ферментов, оптимизировать лечение исходной патологии миокарда.
Лечение гипотиреоза у беременных. Материнский Т4 важен для развития плода. Исследования показали, что значения коэффициента интеллекта IQ у детей, матери которых имели некомпенсированный гипотиреоз во время беременности, были существенно ниже по сравнению с детьми, матери которых принимали адекватную дозу левотироксина натрия. Для своевременной диагностики гипотиреоза необходимо проводить исследование уровня ТТГ у всех беременных при первичном обращении или на этапе планирования беременности. При выявлении у беременной как манифестного, так и субклинического гипотиреоза ей сразу показано назначение полной заместительной дозы левотироксина натрия из расчета 2,3 мкг/кг. Если женщина до беременности принимала левотироксин натрия, доза последнего должна быть увеличена примерно на 50%. Оценка эффективности лечения гипотиреоза во время беременности должна проводиться прежде всего по уровню св. Т4 , так как показатель ТТГ меняется медленно. Рекомендуется поддерживать уровень ТТГ менее 2,0 мЕд/л и уровень св. Т4 ближе к верхней границе нормы в I триместре беременности. Контроль уровня ТТГ и св. Т4 осуществляется каждые 8-10 нед. Во II и III триместрах уровень ТТГ должен быть ниже 3 мЕд/л. После родов доза левотироксина натрия снижается до обычной заместительной (1,6-1,8 мкг/кг).
Женщины с высокими титрами антител к тиреопероксидазе во время беременности, но с нормальным уровнем ТТГ в сыворотке должны длительно наблюдаться после родов в связи с высокой вероятностью развития послеродового тиреоидита и клинического гипотиреоза.
Лечение субклинического гипотиреоза. При субклиническом течении гипотиреоза вопрос о заместительной терапии решается индивидуально. Принимая во внимание высокую частоту дислипидемий, а также повышенный риск развития атеросклероза и инфаркта миокарда считается оправданным назначение препаратов левотироксина натрия. Прежде чем начинать лечение, следует убедиться, что субклинический гипотиреоз не носит транзиторный характер. С этой целью рекомендуется повторить исследование ТТГ и св. Т4 через 3-6 мес. Если субклинический гипотиреоз выявлен во время беременности, терапия левотироксином натрия в полной заместительной дозе назначается немедленно. Показаниями к назначению заместительной терапии левотироксином натрия у лиц пожилого возраста, особенно с кардиальной патологией, являются: стойкий характер субклинического гипотиреоза при уровне ТТГ ≥10 мЕд/л, или при уровне ТТГ между 5 и 10 мЕд/л и наличии сопутствующей дислипидемии.
Лечение гипотиреоза у больных с надпочечниковой недостаточностью. В практике эндокринолога нередко встречаются пациенты с поражением двух и более эндокринных желез с характерными признаками их гипоили гиперфункции. При наличии у больного полиэндокринопатии необходимо учитывать взаимное влияние протекающих патологических процессов, что может существенно изменять типичную клиническую картину заболевания, маскируя или утяжеляя проявления дисфункции отдельных желез. Аутоиммунные эндокринопатии развиваются не одновременно, поэтому следует помнить о возможности полиэндокринного синдрома при аутоиммунном поражении одной эндокринной железы и проводить целенаправленные иммунологические и гормональные исследования для раннего выявления поражения других эндокринных желез. Назначение заместительной терапии гипотиреоза при наличии дефицита глюкокортикоидов может привести к проявлению или ухудшению течения существующей НН или развитию аддисонического криза. В этой связи лечение АПС всегда начинают с назначения препаратов глюкокортикоидного и минералкортикоидного ряда и только после компенсации НН назначают препараты левотироксина натрия.
Лечение вторичного гипотиреоза. Недостаточность ТТГ редко встречается изолированно. Как правило, она сопровождается дефицитом других тропных гормонов гипофиза. Оценка адекватности заместительной терапии вторичного гипотиреоза проводится по уровню св. Т4 , так как уровень ТТГ еще до назначения лечения может быть сниженным или находится в пределах нормы.
Оценка эффективности лечения гипотиреоза. Эффективность лечения гипотиреоза должна оцениваться по клиническим и лабораторным параметрам. В силу неспецифичности симптомов очень часто плохое самочувствие у пациентов сохраняется и после компенсации гипотиреоза. В связи с этим оценка адекватности заместительной терапии проводится по уровню ТТГ. Следует учесть, что прием пищи, препаратов кальция, антацидов может снижать абсорбцию левотироксина натрия в кишечнике и потребовать увеличения его дозы. Коррекция дозы левотироксина натрия может потребоваться и на фоне заместительной терапии эстрогенами или проведении контрацепции. У большинства пациентов контроль уровня ТТГ осуществляется один раз в год. На эффективность лечения может оказывать влияние комплаентность пациента, т.е. готовность выполнять назначения врача. Часто пациенты игнорируют рекомендации врача, сознательно занижают дозу тиреоидных препаратов или принимают препарат нерегулярно и не натощак, при этом не ставя врача в известность. В таких случаях следует путем обучения повысить мотивацию пациента к правильному и аккуратному проведению заместительной терапии. При выявлении низких показателей ТТГ на фоне приема тиреоидных препаратов следует уменьшить дозу левотироксина натрия с последующим контролем уровня ТТГ через 2-3 мес.
СПИСОК ЛИТЕРАТУРЫ
-
Анциферов М.Б., Свириденко Н.Ю. Синдром гипотиреоза: диагностика и лечение: Методические рекомендации. - М.: НПЦ ЭМП, 2005.
-
Дедов И.И., Мельниченко Г.А., Пронин В.С. и др. Клиника и диагностика эндокринных нарушений: Учебно-методическое пособие. - М., 2005.
-
Дедов И.И., Мельниченко Г.А., Свириденко Н.Ю., Платонова Н.М. и др. Диагностика, профилактика и лечение ятрогенных йодиндуцированных заболеваний щитовидной железы // Вестник РАМН. - 2006. - №1. - С. 34-39.
-
Моргунова Т.Б., Фадеев В.В. Заместительная терапия гипотиреоза препаратами тиреоидных гормонов - один гормон или два? // Проблемы эндокринологии. - 2005. - Т. 51. - №1. - С. 53-55.
-
Петунина Н.А. Использование препаратов гормонов щитовидной железы в клинической практике // Интелтек. - 2003.
-
Свириденко Н.Ю., Платонова Н.М., Молашенко Н.В., Голицин С.П., Бакалов С.А., Сердюк С.Е. Эндокринные аспекты применения амиодарона в клинической практике: Алгоритм наблюдения и лечения функциональных расстройств щитовидной железы // Российский кардиологический журнал. - 2012. - №2 (94). - С. 63-71.
-
Синдром гипотиреоза в практике интерниста: Методическое пособие для врачей / Трошина Е.А., Александрова Г.Ф., Абдулхабирова Ф.М., Мазурина Н.В.; Под ред. проф. Г.А. Мельниченко. - М., 2002. - 42 с.
-
Фадеев В.В. Современные концепции диагностики и лечения гипотиреоза у взрослых // Проблемы эндокринологии. - 2004. - Т. 50. - №2. - С. 47-53.
-
American Association of clinical endocrinologists medical guidelines for clinical practice for the evaluation and treatment of hyperthyroidism and hypothyroidism // Endocrine Practice. - 2002. - Vol. 8. - N 6. - P. 458-469.
-
Baskin H., Cobin R.H., Duick D.S. et al. Medical guidelines for clinical practice for the evaluation and treatment of hyperthyroidism and hypothyroidism // Endocrine Practice. - 2002. - Vol. 8. - P. 457-467.
-
Biondi B., Klein I. Cardiovascular abnormalities in subclinical and overt hypothyroidism // The Thyroid and cardiovascular risk. - Stuttgart; New York, 2005. - P. 30-35.
-
Pollock M.A., Sturrock A., Marshall K. et al. Thyroxine treatment in patients with symptoms of hypothyroidism but thyroid functional tests within the reference range: randomized double blind placebo controlled crossover trial // B.M. J. - 2001. - Vol. 323. - P. 891-895.
-
Stockigt J.R. Drug effects on thyroid function // Thyroid International. - 2000. - N 2.
-
Toft A.D. Thyroid hormone treatment, how and when? // Thyroid International. - 2001. - N 4. - P. 16-18.
СИНДРОМ ТИРЕОТОКСИКОЗА
Свириденко Н.Ю., Абрамова Н.А.
Обычно термины «тиреотоксикоз» и «гипертиреоз» используют как синонимы. Однако они не тождественны. Гипертиреоз обозначает повышение функциональной активности щитовидной железы и является самой частой причиной развития тиреотоксикоза. При деструктивных процессах в щитовидной железе тиреотоксикоз может протекать при нормальном или сниженном синтезе тиреоидных гормонов.
ОПРЕДЕЛЕНИЕ
Тиреотоксикоз - клинический синдром, обусловленный избыточным содержанием тиреоидных гормонов в крови и их токсическим действием на различные органы и ткани. Тиреотоксикоз может развиться как при заболеваниях щитовидной железы, протекающих с гипертиреозом или без, так и при заболеваниях других органов или экзогенном введении тиреоидных гормонов. Редко гипертиреоз не сопровождается тиреотоксикозом, например при периферической резистентности к тиреоидным гормонам.
ЭПИДЕМИОЛОГИЯ
Основная причина тиреотоксикоза в йодобеспеченных районах - аутоиммунная болезнь Грейвса, в йододефицитных районах - функциональная автономия щитовидной железы. В 2001 г. распространенность тиреотоксикоза в России составила 18,4 случаев на 100 000 населения. Тиреотоксикоз встречается преимущественно у женщин. Частота ранее не диагностированного тиреотоксикоза среди женщин составляет 0,5%, заболеваемость - 0,08% женщин в год. В исследовании National Health and Nutrition Examination Survey III (1988-1994, США) манифестный тиреотоксикоз был выявлен у 0,5%, а субклинический - у 0,8% от общей популяции в возрасте от 12 до 80 лет. По данным исследования, проведенного в Дании (йододефицитный регион), распространенность многоузлового токсического зоба составила 47,3%, болезни Грейвса - 38,9%. В Исландии распространенность болезни Грейвса составила 84,4% среди всех случаев тиреотоксикоза, узлового/многоузлового зоба - 13%. В США и Англии частота новых случаев болезни Грейвса варьировала от 30 до 200 случаев на 100 тыс. населения в год, женщины болеют болезнью Грейвса в 10-20 раз чаще мужчин.
ПРОФИЛАКТИКА
Известны случаи быстрого развития тиреотоксикоза после тяжелых потрясений, например высока частота этого заболевания среди узников концлагерей и в период ведения войн. У пациентов с узловым/многоузловым зобом развитие тиреотоксикоза может быть вызвано избыточным потреблением йода, введением йодсодержащих ЛС.
КЛАССИФИКАЦИЯ
По происхождению тиреотоксикоза выделяют:
По патогенетическим признакам выделяют следующие формы тиреотоксикоза.
-
Тиреотоксикоз, обусловленный гиперпродукцией тиреоидных гормонов, развивается при болезни Грейвса, многоузловом токсическом зобе и некоторых других заболеваниях.
-
Деструктивный тиреотоксикоз развивается в результате разрушения фолликулов щитовидной железы и выхода тиреоидных гормонов в кровяное русло. Такой патогенетический вариант тиреотоксикоза развивается при подостром (тиреоидит Де Кервена), послеродовом, безболевом («молчащем») и цитокининдуцированных тиреоидитах.
-
Медикаментозный (экзогенный) тиреотоксикоз развивается при передозировке препаратов тиреоидных гормонов.
По особенностям поглощения 131 I выделяют:
-
заболевания, сопровождающиеся снижением поглощения 131 I:
-
амиодарон-индуцированный тиреоидит. По степени выраженности клинических проявлений и гормональных нарушений выделяют манифестный и субклинический тиреотоксикоз (табл. 13.3).
| Степень тяжести | Критерии |
|---|---|
Субклинический тиреотоксикоз |
Устанавливается на основании данных гормонального исследования при стертой клинической картине. Определяется сниженный (подавленный) уровень ТТГ при нормальных уровнях св. Т4 и св. Т3 |
Манифестный тиреотоксикоз |
Имеются развернутая клиническая картина заболевания и характерные гормональные сдвиги - сниженный уровень ТТГ при высоком св. Т4 и/или св. Т3 |
Осложненный тиреотоксикоз |
Имеются тяжелые осложнения: фибрилляция предсердий, сердечная недостаточность, тромбоэмболические осложнения, НН, токсический гепатит, дистрофические изменения паренхиматозных органов, психоз, кахексия и др. |
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА
Клинические проявления синдрома тиреотоксикоза включают поражение различных органов и систем.
Для тиреотоксикоза также характерны глазные симптомы (Кохера, Грефе, Дальримпля, Жоффруа), вызванные нарушением вегетативной иннервации глаза и развитием ретракции век.
ЭТИОЛОГИЯ
Синдром тиреотоксикоза может быть обусловлен повышенной продукцией тиреоидных гормонов щитовидной железой как в случае диффузного или узлового токсического зоба, йодиндуцированного тиреотоксикоза, ТТГ продуцирующей аденомы гипофиза, так и разрушением тиреоидной ткани и выходом тиреоидных гормонов в кровь (подострый, послеродовый, АИТ, амиодарониндуцированный тиреотоксикоз), либо обусловлен продукцией тиреоидных гормонов вне щитовидной железы (struma ovarii, функционально активные метастазы щитовидной железы).
МЕХАНИЗМ РАЗВИТИЯ
Развитие синдрома тиреотоксикоза чаще всего обусловлено болезнью Грейвса и функциональной автономией щитовидной железы. Функциональная автономия щитовидной железы - йододефицитное заболевание - исход длительного, продолжающегося многие десятилетия морфогенеза йододефицитного зоба. По современным представлениям в условиях йодного дефицита щитовидная железа находится под влиянием хронической гиперстимуляции, основной причиной которой является снижение интратиреоидного пула йода. Под действием ТТГ и внутриклеточных ростовых факторов тиреоидные клетки начинают расти и размножаться, что приводит к формированию на первом этапе диффузного зоба. В ткани зоба тиреоциты, обладающие наибольшей пролиферативной активностью, будут в большей степени, чем остальные клетки, отвечать на стимуляцию и более активно размножаться, образуя группы клеток, отличные от окружающей ткани, или узлы. С течением времени в результате соматических мутаций часть узлов приобретает способность функционировать автономно, т.е. независимо от ТТГ. Известно, что в районах с недостаточным потреблением йода частота автономных образований в щитовидной железе значительно выше, чем в тех, где проводится йодная профилактика. Если продукция тиреоидных гормонов автономными образованиями превышает физиологическую потребность, у больного разовьется тиреотоксикоз. Такое событие может произойти в результате естественного течения заболевания или после поступления в организм дополнительных количеств йода с йодными добавками или в составе фармакологических средств. Процесс развития функциональной автономии длится годами. Клиническая манифестация функциональной автономии происходит в основном у лиц старшей возрастной группы (после 45 лет).
Патогенез болезни Грейвса описан в соответствующей главе. Йодиндуцированный тиреотоксикоз составляет 0,2-10% всех случаев тиреотоксикоза. Заболевание развивается на фоне приема препаратов йода как у пациентов с уже имеющимися тиреоидными нарушениями (узловой/многоузловой зоб, латентно протекающая болезнь Грейвса), так и у лиц без тиреоидной патологии. Наиболее часто встречается в йододефицитных регионах. Йодиндуцированный тиреотоксикоз часто возникает в результате приема амиодарона (см. «Амиодарон-индуцированные тиреопатии»).
В некоторых случаях тиреотоксикоз развивается на фоне повышения содержания ХГЧ, имеющего структурное сходство с ТТГ и обладающего сродством к его рецепторам. У 2-3% беременных в I триместре беременности на фоне высоких концентраций ХГЧ развивается так называемый гестационный тиреотоксикоз. При пузырном заносе и хориокарциноме, особенно при повышении концентрации ХГЧ выше 300 000 ЕД/л, возможно развитие трофобластического тиреотоксикоза.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Диагностический алгоритм (табл. 13.4).
| Болезнь Грейвса | Функциональная автономия щитовидной железы |
|---|---|
Аутоиммунное заболевание |
Йододефицитное заболевание |
Чаще диффузное увеличение щитовидной железы, в 10% случаев зоб отсутствует |
Чаще многоузловой зоб |
Молодой возраст (20-40 лет) |
Возрастная группа старше 45-50 лет |
Короткий анамнез |
Длительный анамнез эутиреоидного зоба |
Клинически явная ЭОП в 50% случаев |
Не бывает ЭОП, хотя могут отмечаться глазные симптомы тиреотоксикоза |
Часто манифестная клиника |
Часто субклинический вариант |
В большинстве случаев выявляются антитела к ткани щитовидной железы (наиболее чувствительные и специфичные антитела к рецептору ТТГ) |
Антитела к ткани щитовидной железы, как правило, отсутствуют |
Диффузное усиление захвата 99mТс при сцинтиграфии щитовидной железы |
Зоны повышенного накопления 99mТс («горячие» узлы) |
Стойкая ремиссия после консервативной терапии у 25-30% пациентов |
Тиреостатическая терапия только купирует тиреотоксикоз на время приема препаратов, бесперспективна для достижения стойкой ремиссии |
АНАМНЕЗ
При болезни Грейвса, в отличие от многоузлового токсического зоба, симптомы тиреотоксикоза развиваются и прогрессируют довольно быстро. У пожилых пациентов симптомы тиреотоксикоза выражены слабо. В клинической картине доминируют сердечно-сосудистые и психические расстройства: апатия, депрессия, отсутствие аппетита, слабость, сердцебиения, нарушения сердечного ритма, симптомы недостаточности кровообращения. У 20% больных тиреотоксикоз манифестирует впервые возникшим пароксизмом фибрилляции предсердий. Глазные симптомы, как правило, отсутствуют. Часто эти больные страдают сопутствующими заболеваниями сердечно-сосудистой системы, патологией пищеварительного тракта, неврологическими заболеваниями, что значительно затрудняет диагностику.
Симптомы, характерные для подострого тиреоидита, возникают через 5-6 нед после перенесенной инфекции. Наблюдают отчетливую сезонность заболевания (осень-зима).
Необходимо уточнить, принимал ли пациент препараты йода в любом виде [йодсодержащие витамины, пищевые добавки, йод + [калия йодид + глицерол] (люголя раствор с глицерином♠ ), йодсодержащие антиаритмические препараты, рентгенографические исследования с введением йодсодержащих контрастных веществ и т.д.].
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
При физикальном обследовании отмечают следующие симптомы:
-
иногда при болезни Грейвса на отдельных участках кожи депигментированные очаги (витилиго);
-
постоянная (реже пароксизмальная) синусовая тахикардия, экстрасистолия, пароксизмальная (реже постоянная) мерцательная аритмия, преимущественно систолическая АГ;
-
глазные симптомы тиреотоксикоза (симптомы Кохера, Грефе, Мебиуса, Жоффруа);
Пальпация щитовидной железы: при болезни Грейвса щитовидная железа, как правило (в 80% случаев), диффузно увеличена, умеренной плотности. При наложении на щитовидную железу фонендоскопа может прослушиваться систолический шум, что вызвано значительным усилением кровоснабжения органа. При функциональной автономии щитовидной железы пальпация выявляет узловые образования.
Для подострого тиреоидита характерна плотная, резко болезненная щитовидная железа. В зависимости от степени вовлечения железы в воспалительный процесс болезненность может быть локальной или диффузной.
ЛАБОРАТОРНОЕ ОБСЛЕДОВАНИЕ
Гормональное исследование:
Клинический анализ крови:
Биохимический анализ крови:
Определение концентрации ХГЧ - при подозрении на struma ovarii, трофобластический тиреотоксикоз.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
УЗИ щитовидной железы:
-
при болезни Грейвса примерно в 80% случаев обнаруживают диффузное увеличение щитовидной железы, снижение эхогенности, значительное усиление кровотока в ткани щитовидной железы;
-
при функциональной автономии щитовидной железы - одно или несколько узловых образований;
-
при подостром тиреоидите - увеличение щитовидной железы, «облаковидные» зоны пониженной эхогенности в одной или обеих долях, возможна миграция этих зон.
Сцинтиграфия щитовидной железы с 99m Тс:
-
при болезни Грейвса - диффузное усиление захвата изотопа железой (131 I и 99m Tс);
-
при функциональной автономии щитовидной железы - наличие «горячих» узлов - зон повышенного накопления 99m Тс;
-
при деструктивном тиреотоксикозе - снижение захвата 99m Тс. Пункционная биопсия щитовидной железы: при узловых образованиях более 1 см в диаметре показано проведение ТАБ под контролем УЗИ.
ЭКГ: отмечают учащение сердечных сокращений, наблюдают высокие заостренные зубцы Р и Г, в осложненных случаях - мерцание предсердий, экстрасистолию, депрессию сегмента SΓ, отрицательный зубец Г. У 1 /3 больных выявляют признаки гипертрофии левого желудочка функционального характера, исчезающие после устранения тиреотоксикоза.
Рентгенография загрудинного пространства с контрастированным барием пищеводом или КТ - при наличии у пациента узла больших размеров, вызывающего симптомы компрессии трахеи и пищевода.
УЗИ органов малого таза - при подозрении на struma ovarii, трофобластический тиреотоксикоз.
МРТ гипоталамо-гипофизарной области с контрастированием - при подозрении на ТТГ-секретирующую аденому гипофиза.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИЯМ СПЕЦИАЛИСТОВ
Консультации специалистов рекомендуют в следующих случаях:
ЛЕЧЕНИЕ
Лечение болезни Грейвса подробно рассмотрено в разделе о заболеваниях щитовидной железы.
Лечение функциональной автономии (многоузловой и узловой токсический зоб) подразумевает хирургическое удаление щитовидной железы или ее деструкцию при помощи радиоактивного йода.
Лечение деструктивного тиреотоксикоза (подострый, послеродовый тиреоидит, цитокининдуцированные тиреопатии), как правило, не требует применения тионамидов, так как это состояние не сопровождается гиперпродукцией тиреоидных гормонов. Для устранения симптомов тиреотоксикоза назначают β-адреноблока торы. Лечение подострого тиреоидита см. в главе «Подострый тиреоидит».
При пузырном заносе или хорионкарциноме применяют оперативное лечение пузырного заноса и химиотерапию хорионкарциномы, тиреостатики не используют.
Лучший метод лечения ТТГ-продуцирующих аденом гипофиза - транссфеноидальная операция с последующей лучевой терапией или без нее.
Struma ovarii требует хирургического лечения яичников.
В тяжелых случаях ятрогенного тиреотоксикоза проводят плазмаферез или диализ.
БЕРЕМЕННОСТЬ И СИНДРОМ ТИРЕОТОКСИКОЗА
Как было сказано выше, функциональная активность щитовидной железы во время беременности имеет свои особенности. В норме концентрация ТТГ в плазме крови здоровых небеременных женщин при определении высокочувствительными иммунометрическими методами составляет 0,4-4,0 мЕ/л. В первом триместре беременности из-за стимуляции ХГЧ уровень Т4 увеличивается, а уровень ТТГ уменьшается. У 20% беременных уровень ТТГ находится в диапазоне ниже референсных значений. Поэтому нижнюю границу нормального диапазона ТТГ нельзя использовать у беременных. Определение общих тиреоидных гормонов для оценки функции щитовидной железы во время беременности не информативно, так как их уровень зависит от Т4 -связывающего глобулина, содержание которого в сыворотке крови увеличивается в первом триместре беременности и остается высоким до родов. Поэтому уровни общих Т4 и Т3 во время беременности возрастают. Концентрация св. Т4 также увеличивается к концу первого триместра беременности и может превышать верхнюю границу нормы, определяя снижение уровня ТТГ. Концентрация св. Т3 также повышается, но обычно не превышает нормального уровня. На протяжении второго и третьего триместров уровни св. Т4 , св. Т3 и ТТГ постепенно возвращаются к исходному уровню. На поздних сроках беременности может определяться низко нормальный уровень св. Т4 при нормальном уровне ТТГ.
В первом триместре беременности примерно у 2% женщин уровень св. Т4 превышает верхнюю границу нормы, а уровень ТТГ транзиторно снижается. Это состояние определяется как транзиторный гестационный тиреотоксикоз. Это физиологическое состояние, которое не требует назначения лечения. Очень редко уровень св. Т4 может повышаться до 30-40 пмоль/л. В таких случаях следует проводить дифференциальную диагностику с тиреотоксикозом, обусловленным болезнью Грейвса. Гестационный тиреотоксикоз чаще развивается при многоплодной беременности, клинически сопровождается выраженным токсикозом первой половины беременности (тошнотой, иногда неукротимой рвотой - hyperemesis gravidarum).
СПИСОК ЛИТЕРАТУРЫ
-
Дедов И.И., Мельниченко Г.А., Свириденко Н.Ю., Платонова Н.М. и др. Диагностика, профилактика и лечение ятрогенных йодиндуцированных заболеваний щитовидной железы // Вестник РАМН. - 2006. - №1. - С. 34-39.
-
Мельниченко Г.А. Болезни щитовидной железы и беременность // Болезни органов эндокринной системы (руководство по внутренним болезням) / Под ред. И.И. Дедова. - М.: Медицина, 2002.
-
Рациональная фармакотерапия заболеваний эндокринной системы и нарушений обмена веществ: Руководство для практикующих врачей / Под общ. ред. И.И. Дедова, Г.А. Мельниченко. - М.: Литтерра, 2006.
-
Свириденко Н.Ю. Функциональная автономия при эндемическом зобе// Проблемы эндокринологии. - 2005. - №1. - С. 40-42.
-
American Association of clinical endocrinologists medical guidelines for clinical practice for the evaluation and treatment of hyperthyroidism and hypothyroidism // Endocrine Practice. - 2002. - Vol. 8. - N 6. - P. 458-469.
-
Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and Postpartum // Thyroid. - 2011. - Vol. 11. - N 10. - P. 1-47.
-
Laurber P., Nohr S.B., Pedersen K. M. et al. Thyroid disorders in mild iodine deficiency // Thyroid. - 2000. - Vol. 10. - P. 951-963.
-
Pearce E.N. Diagnosis and management of thyrotoxicosis // B.M. J. - 2006. - Vol. 332. - P. 1369-1373.
-
Issa B.G., Hanna F.W. Clinical approach to thyrotoxicosis // Practitioner. - 2004. - Vol. 248. - P. 358-361.
-
Franklyn J. Thyrotoxicosis // Clin. Med. - 2003. - Vol. 3. - P. 11-15.
УЗЛОВОЙ ЗОБ
Ванушко В.Э.
Узловой зоб - собирательное клиническое понятие, объединяющее различные по морфологии объемные образования щитовидной железы, выявляемые с помощью пальпации и УЗИ. Термин «многоузловой зоб» целесообразно использовать при обнаружении в щитовидной железе двух и более узловых образований.
Распространенность в популяции:
Патологическое значение узлового зоба сомнительно и сводится к следующему:
-
относительно небольшому риску того, что пальпируемое узловое образование является злокачественной опухолью щитовидной железы (около 4%);
-
относительно небольшому риску значительного увеличения щитовидной железы со сдавлением окружающих органов и/или формированием косметического дефекта (0,3-0,5%);
-
относительно небольшому риску развития функциональной автономии щитовидной железы и тиреотоксикоза (0,5%).
Основными направлениями диагностики пациентов с узловым зобом являются:
-
определение риска злокачественности образования щитовидной железы на основании ТАБ;
-
оценка принадлежности пациента к группе риска наличия РЩЖ на основании анамнестических данных;
-
диагностика симптомов, снижающих качество жизни пациентов при доброкачественных образованиях щитовидной железы (функциональная автономия, синдром компрессии трахеи, косметический дефект).
ДИАГНОСТИКА УЗЛОВОГО ЗОБА
Первичная диагностика
Методом первичной диагностики узлового зоба является пальпация щитовидной железы и регионарных лимфоузлов. Также первичная диагностика включает сбор анамнеза для оценки принадлежности больного к группе риска наличия РЩЖ.
Критерии принадлежности к группе риска наличия РЩЖ:
Лабораторная диагностика
При выявлении у пациента узлового образования щитовидной железы показана оценка уровня ТТГ и кальцитонина крови. Оценка уровня кальцитонина крови значительно превосходит ТАБ в диагностике МРЩЖ. Это исследование может повлиять на показания к ТАБ, поэтому должно проводиться на первичном этапе обследования.
При обнаружении сниженного уровня ТТГ дополнительно проводится определение уровня свободного Т4 и свободного Т3 , при обнаружении повышенного ТТГ - уровня свободного Т4 .
Уровень кальцитонина необходимо оценивать с учетом гендерных различий верхней границы референсных значений (до 5 пг/мл у женщин и 8-10 пг/мл у мужчин). При повышенном уровне кальцитонина показано проведение стимуляционного теста.
Методика проведения: после забора крови из вены для определения уровня базального кальцитонина пациенту внутривенно болюсно в течение 30 с вводят глюконат кальция из расчета 2,5 мг (0,27 мл 10% раствора) на 1 кг массы тела. При весе пациента более 70 кг вводят 20 мл раствора. Стимулированный уровень кальцитонина определяется через 2 и 5 мин после введения раствора.
Уровень стимулированного кальцитонина менее 60 пг/мл является нормальным, от 60 до 100 пг/мл требует повторного теста через 6 мес. Уровень стимулированного или базального кальцитонина более 100 пг/мл крайне подозрителен в отношении МРЩЖ.
Определение уровня тиреоглобулина, а также антител к щитовидной железе в диагностическом поиске при узловом зобе не показано.
Ультразвуковое исследование щитовидной железы
УЗИ является самым распространенным методом визуализации щитовидной железы. Несмотря на самую высокую чувствительность в выявлении узловых образований щитовидной железы, УЗИ не является скрининговым методом, так как приводит к выявлению огромного количества непальпируемых инциденталом.
Основной задачей УЗИ при узловом зобе является определение показаний к ТАБ и навигационный контроль за ее проведением.
Показания:
Протокол УЗИ должен включать описание размеров образования щитовидной железы и лимфоузлов, а также их ультразвуковых характеристик. Выделяют следующие подозрительные ультразвуковые признаки (оценивают только в солидных узлах или в солидных участках узлов):
При наличии подозрительных ультразвуковых признаков в задачу УЗИ входит оценка подвижности голосовых складок.
Важнейшим диагностическим этапом УЗИ является исследование регионарных лимфоузлов, при котором оценивают следующие признаки:
Наиболее специфичными признаками, позволяющими заподозрить метастатическое поражение лимфоузла, являются микрокальцинаты, кистозный компонент, периферическая васкуляризация, сходство ткани лимфоузла с тканью щитовидной железы; менее специфичными - увеличение размеров, закругленность контуров, отсутствие ворот.
Радиоизотопное сканирование
Проводится при субклиническом или манифестном тиреотоксикозе для дифференциальной диагностики функциональной автономии и других причин тиреотоксикоза. Оно неинформативно для первичной диагностики узлового зоба (для обнаружения узлов и оценки их размеров), а также неинформативно для первичной диагностики РЩЖ. Не является конкурирующим с ТАБ методом определения риска злокачественности узла щитовидной железы.
Компьютерная томография
КТ применяется для оценки синдрома компрессии трахеи при наличии соответствующих жалоб.
Рентгенография органов шеи с контрастированием пищевода и МРТ являются малоинформативными методами.
Тонкоигольная аспирационная биопсия щитовидной железы
ТАБ является основным методом дифференциальной диагностики доброкачественных и злокачественных поражений щитовидной железы. По данным многочисленных исследований, чувствительность и специфичность ТАБ в выявлении РЩЖ достигает 98-100%. Обязательно проводится под ультразвуковым контролем.
Показания для проведения ТАБ:
-
узловые образования щитовидной железы, равные или превышающие 1 см в диаметре;
-
узловые образования менее 1 см, если пациент относится к группе риска наличия РЩЖ;
-
узловые образования менее 1 см при наличии подозрительных ультразвуковых признаков;
-
при динамическом наблюдении доброкачественных узлов щитовидной железы при изменении ультразвуковой структуры узла или при появлении измененных шейных лимфоузлов.
Увеличение размеров доброкачественного узлового образования не является показанием к повторной ТАБ.
При получении доброкачественного цитологического заключения из узла с подозрительными ультразвуковыми признаками ТАБ необходимо повторить в ближайшее время.
При анэхогенных узлах независимо от размеров ТАБ диагностического значения не имеет, но может быть выполнена с лечебной целью.
При обнаружении при УЗИ измененных регионарных лимфоузлов показана прицельная ТАБ, диагностическая точность которой повышается при исследовании смыва из иглы на тиреоглобулин или кальцитонин в зависимости от предполагаемой морфологической формы РЩЖ.
Цитологическое исследование
Заключение цитологического исследования должно содержать диагноз, который позволит клиницисту определить оптимальную лечебную тактику в отношении каждого конкретного больного. Наиболее эффективно использование шести стандартных категорий заключений современной международной цитологической классификации (Bethesda Thyroid Classification, 2009):
-
I категория - неинформативная пункция (периферическая кровь, густой коллоид, кистозная жидкость);
-
II категория - доброкачественное образование (коллоидные и аденоматозные узлы, хронический АИТ, подострый тиреоидит);
-
III категория - атипия неопределенного значения (малоинформативная пункция с подозрением на опухолевое поражение);
-
V категория - подозрение на злокачественное поражение (подозрение на папиллярный рак, подозрение на медуллярный рак, подозрение на метастатическую карциному, подозрение на лимфому);
-
VI категория - злокачественное поражение (папиллярный рак, низкодифференцированный рак, медуллярный рак, анапластический рак).
Заключения, содержащие только описательную часть, а также заключения без конкретного цитологического диагноза («атипичных клеток не обнаружено», «данных за рак нет» и т.п.) расцениваются как неинформативные.
ЛЕЧЕНИЕ
Хирургическое лечение
На основании заключения цитологического исследования определяется вероятность злокачественности образования щитовидной железы и оптимальная лечебная тактика в отношении каждого конкретного больного:
-
неинформативная пункция - вероятность злокачественности - 1-4%, рекомендуется повторная ТАБ;
-
доброкачественное образование - вероятность злокачественности - 0-4%, рекомендуется динамическое наблюдение. Показания к оперативному лечению при доброкачественном заключении ТАБ:
-
атипия неопределенного значения - вероятность злокачественности - 5-15%, рекомендуется повторная ТАБ;
-
атипия неопределенного значения повторно - вероятность злокачественности - 20-40%, рекомендуется гемитиреоидэктомия с интраоперационным гистологическим исследованием;
-
фолликулярная неоплазия - вероятность злокачественности - 15-30%, рекомендуется гемитиреоидэктомия с интраоперационным гистологическим исследованием;
-
фолликулярная неоплазия более 5 см - вероятность злокачественности более 50%, в связи с низкой чувствительностью интраоперационного гистологического исследования и высокой вероятностью повторной операции возможно обсуждение с пациентом выполнения тиреоидэктомии;
-
подозрение на злокачественное поражение - вероятность злокачественности - 60-75%, рекомендуется тиреоидэктомия;
-
злокачественное поражение - вероятность злокачественности - 97-99%, рекомендуется тиреоидэктомия.
Терапия радиоактивным йодом
Терапия радиоактивным йодом является альтернативой оперативному лечению при доброкачественных образованиях щитовидной железы по данным ТАБ. При функциональной автономии щитовидной железы терапия йодом является методом выбора.
Супрессивная терапия препаратами тиреоидных гормонов
При узловом зобе не показана, так как неэффективна и небезопасна.
Альтернативные методы лечения
Различные виды малоинвазивной деструкции являются предметом дальнейшего изучения. В отдельных случаях могут рассматриваться как альтернатива хирургическому лечению исключительно при доброкачественных образованиях щитовидной железы по данным ТАБ.
НАБЛЮДЕНИЕ
Динамическое наблюдение заключается в периодическом (1 раз в 1-2 года) УЗИ щитовидной железы и определении уровня ТТГ и кальцитонина крови. ТАБ не является методом динамического наблюдения доброкачественных образований щитовидной железы.
АМИОДАРОН-ИНДУЦИРОВАННЫЕ ТИРЕОПАТИИ
Свириденко Н.Ю.
Амиодарон - антиаритмический препарат III класса был синтезирован в начале 60-х годов в лаборатории Labaz (Бельгия) и с тех пор широко используется в кардиологической практике. Препарат обладает фармакологическими свойствами, характерными для всех четырех классов антиаритмических препаратов. Совокупность этих свойств делает его применение эффективным при лечении больных с желудочковыми и наджелудочковыми нарушениями ритма сердца, резистентными к назначению других препаратов. Помимо своего антиаритмического действия у ряда больных препарат оказывает влияние на функцию щитовидной железы.
СИНОНИМЫ
Кордарон♠ -индуцированные тиреопатии.
ОПРЕДЕЛЕНИЕ
Амиодарон-индуцированные тиреопатии - нарушения функции щитовидной железы (гипотиреоз, тиреотоксикоз) на фоне приема амиодарона.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
У большинства больных, принимающих амиодарон, сохраняется эутиреоз. Тем не менее у некоторых пациентов может развиться гипотиреоз или тиреотоксикоз. Частота нарушений функции щитовидной железы колеблется от 2 до 24%, в большинстве случаев - от 14 до 18%. Тиреотоксикоз на фоне приема амиодарона наиболее часто наблюдается среди пациентов, проживающих в районах с недостаточным поступлением йода, в то время как гипотиреоз наиболее распространен в йод-обеспеченных регионах. В исследованиях, проведенных в зонах с умеренно-низким потреблением йода (Западная Таскания, Италия) и нормальным потреблением йода (Массачусетс, США), распространенность амиодарон-индуцированного тиреотоксикоза составила около 10% в Италии и 2% в США, в то время как гипотиреоз встречался в 5 и 22% соответственно. С другой стороны, обследование пациентов в Голландии в областях с достаточным потреблением йода показало, что распространенность тиреотоксикоза, вызванного амодароном, была в два раза выше, чем гипотиреоза. По статистике амиодарон-индуцированный гипотиреоз развивается у 6%, а амиодарон-индуцированный тиреотоксикоз - у 0,003-15% пациентов.
ПРОФИЛАКТИКА
Всем пациентам, которым планируется назначение амиодарона, необходимо проводить обследование функционального состояния щитовидной железы и ее структуры до и во время лечения. Это позволит не только выявить сопутствующие изменения, но и спрогнозировать возможное развитие тиреотоксикоза или гипотиреоза после начала терапии.
СКРИНИНГ
На фоне приема амиодарона необходимо исследовать функцию щитовидной железы не реже 1 раза в 6 мес и всегда при ухудшении течения аритмии.
КЛАССИФИКАЦИЯ
-
Амиодарон-индуцированный тиреотоксикоз 1-го типа развивается в основном у лиц с исходной патологией щитовидной железы, включая узловой зоб, функциональную автономию или субклинический вариант диффузного токсического зоба. Йод, высвобождаемый из препарата, приводит к повышению синтеза тиреоидных гормонов в зонах автономии в железе.
-
Амиодарон-индуцированный тиреотоксикоз 2-го типа развивается у пациентов без предшествующих или сопутствующих заболеваний щитовидной железы и связан с развитием деструктивных процессов в железе вследствие действия самого амиодарона, а не только йода (т.е. форма лекарственного тиреоидита) и выходом ранее синтезированных гормонов в кровоток.
-
Тиреотоксикоз смешанного типа, сочетающий черты амиодарон-индуцированного тиреотоксикоза 1-го и 2-го типов, как правило, диагностируется ретроспективно, в ходе исследования послеоперационного материала ткани щитовидной железы или исходя из клиники заболевания (тяжесть тиреотоксикоза, отсутствие эффекта от приема тиреостатиков или преднизолона).
-
Амиодарон-индуцированный гипотиреоз может быть транзиторным или постоянным, последний почти всегда связан с предшествующими нарушениями в щитовидной железе. Гипотиреоз обычно манифестирует рано, но иногда и после 18 мес лечения.
ЭТИОЛОГИЯ
Амиодарон представляет собой йодированное жирорастворимое производное бензофурана, которое содержит 37% йода (75 мг йода в таблетке по 200 мг). Во время метаболизма из каждых 200 мг препарата высвобождается примерно 6-9 мг неорганического йода в сутки, что во много раз превышает суточную потребность в элементе, составляющую по ВОЗ <150 мкг. Амиодарон метаболизируется в печени, где он превращается главным образом в дезэтиламиодарон. Амиодарон и его метаболит дезэтиламиодарон обладают липофильностью, благодаря которой они в больших количествах накапливаются в печени, легких, коже, жировой ткани, щитовидной железе и других органах. Анализ распределения препарата в тканях показал, что концентрация амиодарона и его метаболита дез-этиламиодарона в щитовидной железе составила 14 мг/кг и 64 мг/кг по сравнению с 316 мг/кг и 76 мг/кг в жировой ткани и 391 мг/кг и 2354 мг/кг в печени. Период полувыведения амиодарона составляет от 30 дней до 5 мес. За это время экскреция йода с мочой возрастает с 0,25 мкмоль/ммоль креатинина до 7 мкмоль/ммоль. Уровень неорганического йода в плазме увеличивается с 0,05 до 2,2 мкмоль/л. Захват йода щитовидной железой увеличивается с 16 до 54 ммоль/ч через 6 нед терапии, через 24 нед он снижается (32 нмоль/ч), но остается выше нормы.
ПАТОГЕНЕЗ
Влияние амиодарона на сердечно-сосудистую систему
Амиодарон способен неконкурентно ингибировать α- и β-адренорецепторы, инактивировать калиевые каналы, быстрые натриевые каналы в мембране кар-диомиоцитов, обладает свойствами антагонистов кальция и периферических вазодилататоров. Электрофизиологические эффекты препарата проявляются удлинением трансмембранного потенциала действия кардиомиоцитов за счет блокады калиевых каналов и, соответственно, увеличением эффективного рефрактерного периода предсердий, желудочков, атриовентрикулярного узла, проводящей системы Гиса-Пуркенье и аномальных проводящих путей. Амиодарон влияет на автоматизм сердца за счет торможения медленной (диастолической) деполяризации синусового узла и других водителей ритма. При длительном приеме амиодарона изменяется максимальная скорость быстрой деполяризации (фаза 0 трансмембранного потенциала действия) за счет селективной блокады натриевых каналов. Антиадренергическое действие амиодарона ограничено только сердцем и не распространяется на другие органы. Электрофизиологические изменения сердечно-сосудистой системы аналогичны таковым при гипотиреозе (брадикардия, замедление реполяризации и т.д.) и обусловлены конкурентным связыванием амиодарона с рецепторами тиреоидных гормонов, что приводит к ослаблению действия Т3 на кардиомиоциты.
Влияние амиодарона на щитовидную железу
Амиодарон влияет на метаболизм тиреоидных гормонов и ТТГ гипофиза. Он подавляет активность 5'-дейодиназы I типа в периферических тканях, особенно в печени, уменьшает конверсию Т4 в Т3 и вызывает уменьшение сывороточного уровня Т3 и повышение реверсивного Т3 , что часто сочетается с повышением уровня общего Т4 и свободного Т4 в связи с уменьшением клиренса последних (эутире-оидная гипертироксинемия). Эутиреоидную гипертироксинемию имеют примерно 1/3 пациентов, получающих амиодарон. Эти изменения не требуют коррекции, а диагноз амиодарон-индуцированного тиреотоксикоза не должен основываться на обнаружении только повышенного уровня Т4 . Применение амиодарона может привести к изменению концентрации ТТГ в сыворотке крови. Он подавляет активность 5'-дейодиназы II типа, что приводит к уменьшению образования Т3 в гипофизе и, таким образом, к небольшому повышению уровня ТТГ в сыворотке.
На клеточном уровне амиодарон действует как антагонист тиреоидных гормонов за счет структурного сходства с Т3 . Наиболее активный метаболит амиодарона - дизэтиламиодарон - действует как конкурентный ингибитор присоединения Т3 к α-1-Т3 -рецептору и как неконкурентный ингибитор β-1-Т3 -рецептора.
Известно, что α-1-Т3 -рецепторы находятся в основном в сердечной и скелетной мускулатуре, тогда как в печени, почках и мозге преобладают β-1-Т3 -рецепторы. Снижение проникновения Т3 в кардиомиоциты оказывает антиаритмический эффект за счет изменения экспрессии генов ионных каналов и других функциональных белков. Длительное введение амиодарона приводит к значительному снижению плотности β-адренергических рецепторов и урежению ЧСС, при этом плотность α-адренергических рецепторов и содержание в сыворотке Т3 не меняются. Амиодарон оказывает прямое действие на ионные каналы независимо от его эффектов на тиреоидные гормоны, он ингибирует Nа-К-АТФ-азу. Препарат блокирует несколько ионных токов на мембране кардиомиоцита: выход ионов К во время фаз реполяризации, а также вход ионов Na и Ca.
Кроме вышеописанных эффектов, амиодарон и его метаболит дизэтиламиодарон оказывают цитотоксическое действие на щитовидную железу. О прямом цитотоксическом влиянии амиодарона или его метаболитов на тироциты свидетельствуют нарушение нормальной архитектоники тиреоидной ткани, некроз и апоптоз, наличие включений, отложение липофусцина и расширение эндоплаз-матической сети. Предполагается, что избыток йода, высвобождаемый из амиодарона, может приводить к индукции или манифестации аутоиммунных изменений в щитовидной железе.
Возникновение гипотиреоза объясняется длительным блоком органификации йода в щитовидной железе вследствие нарушения «ускользания» от эффекта Вольфа-Чайкоффа. По современным представлениям, основной механизм, обеспечивающий «ускользание» от ингибирующего влияния эффекта Вольфа-Чайкоффа, - блокирование поступления йода в щитовидную железу за счет снижения активности Nа/I-симпортера, что приводит к уменьшению интратиреоидного содержания элемента. Этот процесс позволяет восстановить органификацию йода в железе, несмотря на высокое содержание элемента в плазме. Однако во время терапии амиодароном интратиреоидное содержание йода очень высоко, несмотря на блокированный транспорт элемента. Предполагается, что амиодарон благодаря своей липофильности попадает внутрь клеток и внутри тиреоцитов из препарата высвобождается йод. Кроме того, амиодарон оказывает токсическое влияние на щитовидную железу, приводя к уменьшению количества тиреоцитов, что в комбинации с высвобождением большого количества йода снижает функциональную активность железы. Наиболее часто АГ встречается у пациентов с сопутствующим АИТ. У пациентов без органической патологии щитовидной железы и с нормальным уровнем антител к тиреоидным антигенам как причины АГ рассматриваются: скрытые дефекты органификации йода и синтеза тиреоидных гормонов на фоне приема фармакологических доз йода и развитие деструкции тиреоцитов с уменьшением числа функционирующих клеток.
КЛИНИЧЕСКАЯ КАРТИНА
У большинства больных, принимающих амиодарон, сохраняется эутиреоидное состояние. Тем не менее у некоторых пациентов может развиться гипотиреоз или тиреотоксикоз. По результатам обследования российской популяции у лиц старшей возрастной группы (средний возраст 60 лет), проживающей в районе легкого и умеренного йодного дефицита, наиболее часто на фоне приема амиодарона выявлялся субклинический гипотиреоз (18%) и манифестный тиреотоксикоз (15,8%), реже - явный гипотиреоз (1,5%) и субклинический тиреотоксикоз (1,5%). При этом у пациентов с исходной сопутствующей патологией щитовидной железы общая частота тиреотоксикоза и гипотиреоза была значительно выше и составляла 49%, чем у пациентов без патологии щитовидной железы - 25%.
Благодаря антиадренергической активности амиодарона и его блокирующего влияния на конверсию Т4 в Т3 классические симптомы тиреотоксикоза: зоб, потливость, тремор рук, потеря веса - могут быть выражены незначительно или вовсе отсутствовать. В клинической картине, как правило, доминируют сердечно-сосудистые и психические расстройства. Больные предъявляют жалобы на учащенное сердцебиение, одышку при физической нагрузке, утомляемость. При осмотре у больных фиксируются тахикардия, увеличение разницы пульсового давления, систолический шум. Токсическое действие тиреоидных гормонов на ЦНС приводит к развитию тиреотоксической энцефалопатии, которая проявляется нервной возбудимостью, эмоциональной лабильностью, нарушением сна. Однако у больных пожилого возраста, как правило, доминируют противоположные признаки: психическая заторможенность, апатия, отсутствие аппетита, слабость, адинамия, депрессия, что может затруднять диагностику амиодарон-индуцированного тиреотоксикоза.
Серьезную опасность для пациента представляет действие избытка тиреоидных гормонов на сердечно-сосудистую систему: ухудшение течения аритмий, стенокардии у больных ИБС. Повышенная чувствительность кардиомиоцитов к адренергической стимуляции при тиреотоксикозе может увеличивать частоту желудочковых аритмий, особенно у больных с предшествующей сердечной патологией. Тиреоидные гормоны непосредственно влияют на электрофизиологические свойства предсердных миоцитов. Укорачивая их рефрактерный период, они способствуют формированию условий для повторного входа волны возбуждения и возникновению фибрилляции предсердий. При нераспознанном и длительно существующем тиреотоксикозе может развиться синдром дилатационной кардиомиопатии, проявляющийся снижением насосной функции сердца и появлением сердечной недостаточности. Рецидивирование нарушений ритма сердца у пациентов, принимающих амиодарон, является показанием для обследования функционального состояния щитовидной железы с целью исключения тиреотоксикоза, единственным проявлением которого они могут являться.
В клинической картине АГ отмечаются классические признаки: утомляемость, сухость кожи, зябкость, запоры, сонливость, ухудшение внимания, отечный синдром, брадиаритмии и др. Субклинический вариант гипотиреоза может протекать бессимптомно, но возможны признаки легкой тиреоидной недостаточности (изменения в эмоциональной сфере, ухудшение памяти, депрессия) в сочетании с нарушениями липидного обмена (повышение ЛПНП, коэффициентов общий холестерин/ЛПВП, ЛПНП/ЛПВП и снижение ЛПВП). Депрессия при АГ характеризуется чувством паники и более «бедным» ответом на лечение антидепрессантами. Считается, что субклинический гипотиреоз не является причиной развития депрессии, но он может снижать порог развития депрессивных состояний и затруднять коррекцию этих нарушений. Со стороны сердечно-сосудистой системы у лиц с субклиническим гипотиреозом и ИБС может отмечаться обострение коронарной недостаточности, а также тенденция к повышению показателей диастолического АД по сравнению с пациентами в эутиреозе. Среди других признаков, встречающихся у пациентов с гипотиреозом, можно отметить развитие гипохромной анемии, миалгии, снижение ахиллова рефлекса. Развитие у пациентов гипотиреоза редко сопровождается потерей антиаритмической эффективности амиодарона и не является показанием к его отмене.
АНАМНЕЗ
У пациентов с тиреотоксикозом и гипотиреозом следует выяснить, принимали ли они амиодарон. В связи с длительным периодом полувыведения препарата (более 5 мес) амиодарон-индуцированный тиреотоксикоз может развиться и через год после отмены амиодарона. Следует уточнить наличие в анамнезе заболеваний щитовидной железы (узловой/многоузловой эутиреоидный зоб, функциональная автономия щитовидной железы, диффузный токсический зоб).
ДИАГНОСТИКА
Диагностика тиреотоксикоза основывается на определении уровня ТТГ в сыворотке крови с помощью высокочувствительного иммунометрического анализа. Снижение уровня ТТГ ниже нижней границы нормы свидетельствует о развитии тиреотоксикоза. При манифестном тиреотоксикозе снижение уровня ТТГ сопровождается повышением уровня свободного Т4 , нормальным или повышенным уровнем свободного Т3 . При субклиническом варианте уровни свободных Т4 и Т3 остаются в пределах нормы.
Диагностика гипотиреоза основана на определении сниженного уровня свободного Т4 и повышенного уровня ТТГ либо изолированного повышения ТТГ при субклиническом гипотиреозе. Уровень Т3 не является надежным индикатором, так как у эутиреоидных пациентов, принимающих амиодарон, он может быть низким, а при гипотиреозе - в пределах нормы.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Для клинициста важно дифференцировать две формы амиодарон-индуцированного тиреотоксикоза для выбора правильной тактики ведения пациентов. Амиодарон-индуцированный тиреотоксикоз 1-го типа развивается на фоне существующих или предшествующих заболеваний щитовидной железы (табл. 13.5). Помимо повышения уровня свободного Т4 и свободного Т3 , снижения уровня ТТГ и определения повышенного уровня антител к рецептору ТТГ (в случаях манифестации диффузного токсического зоба), амиодарон-индуцированный тиреотоксикоз 1-го типа характеризуется нормальным или повышенным захватом 99m Tc. При УЗИ с допплерографией выявляются признаки сопутствующей патологии: узлового зоба или изменения эхо-структуры щитовидной железы с нормальным или повышенным кровотоком.
| Амиодарон-индуцированный тиреотоксикоз 1-го типа | Амиодарон-индуцированный тиреотоксикоз 2-го типа | |
|---|---|---|
Исходная патология щитовидной железы |
Есть |
Нет |
Пальпация щитовидной железы |
Узловой или диффузный зоб |
Норма или небольшой зоб, чувствительный при пальпации |
Цветовое допплеровское картирование при УЗИ щитовидной железы |
Кровоток выражен умеренно |
Кровоток отсутствует |
Патогенетический механизм |
Йод, высвобождаемый из препарата, приводит к чрезмерному синтезу и секреции тиреоидных гормонов, аналогичен феномену йод-базедов |
Чрезмерное высвобождение тиреоидных гормонов вследствие деструкции ткани щитовидной железы |
Лабораторные показатели |
Выраженное повышение уровней св. Т4 и св. Т3, антитела к рецептору ТТГ при диффузном токсическом зобе |
Преимущественное повышение св. Т4 |
Терапия |
Тиреостатики |
Глюкокортикостероиды как монотерапия или в комбинации с тиреостатиками |
Влияние избытка йода после тиреотоксической фазы |
Вероятен йод-индуцированный тиреотоксикоз |
Вероятен йод-индуцированный гипотиреоз |
Амиодарон-индуцированный тиреотоксикоз 2-го типа развивается при отсутствии заболеваний щитовидной железы. Главная клиническая особенность этой формы - тяжесть тиреотоксикоза. При исследовании с 99m Tc отмечается снижение накопления препарата в железе. При УЗИ с допплерографией часто наблюдается отсутствие или снижение кровотока в щитовидной железе. Уровень антител к рецептору ТТГ не превышает нормальных значений.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
Рекомендуют консультации следующих специалистов:
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Амиодарон-индуцированный тиреотоксикоз I типа средней тяжести в фазе декомпенсации. Узловой токсический зоб.
Амиодарон-индуцированный гипотиреоз в фазе декомпенсации (медикаментозной компенсации).
ЛЕЧЕНИЕ
Эффективность лечения зависит от правильно поставленного диагноза. Лечение амиодарон-индуцированного тиреотоксикоза необходимо проводить совместно эндокринологом и кардиологом с учетом тяжести заболевания и формы тиреотоксикоза.
Цели лечения
Нормализация функции щитовидной железы.
Показания к госпитализации
Амиодарон-индуцированный тиреотоксикоз.
Немедикаментозное лечение
Возможно восстановление эутиреоза в течение нескольких месяцев после отмены препарата. Однако зачастую отмена амиодарона невозможна, поскольку препарат применяют по жизненным показаниям, в частности для лечения тяжелых желудочковых тахиаритмий.
Медикаментозное лечение
Компенсация тиреотоксикоза, развившегося на фоне приема амиодарона, сопряжена со многими трудностями и требует индивидуального подхода в каждом случае. Для лечения тиреотоксикоза применяют тионамиды, глюкокортикоиды, плазмаферез, РИТ, оперативное лечение, за рубежом - блокатор поступления йода в щитовидную железу - калия перхлорат.
Для подавления синтеза тиреоидных гормонов рекомендуется применение больших доз антитиреоидных препаратов [тиамазол (тирозол♠ , мерказолил♠ 40-60 мг или пропилтиоурацил 400-600 мг]. Сроки медикаментозной компенсации удлиняются. Эутиреоз, как правило, восстанавливается через 6-12 нед. Доза тиреостатика должна снижаться после лабораторной компенсации тиреотоксикоза (нормализация уровня свободного Т4 и свободного Т3 ). Длительная терапия высокими дозами тионамидов обычно необходима пациентам, которые продолжают получать амиодарон по жизненным показаниям. Пациентам с амиодарон-индуцированным тиреотоксикозом 2-го типа или смешанного типа назначается преднизолон в дозе 30-40 мг/сут. Курс лечения может продолжаться до 3 мес, так как описаны случаи возобновления симптомов тиреотоксикоза при попытке снизить дозу препарата. При тяжелом течении амиодарон-индуцированного тиреотоксикоза (обычно при сочетании 2 форм) используют комбинацию тионамида и глюкокортикоида.
В случае, когда невозможно дифференцировать две формы тиреотоксикоза, рекомендуется назначить 40 мг тиамазола (тирозола♠ ), 400 мг пропилтиоурацила (пропицила♠ ) и 40 мг преднизолона и через 2 нед исследовать уровень свободного Т3 . Если уровень свободного Т3 снизился на 50% (деструктивный тиреотоксикоз), следует отменить тиамазол (тирозол♠ ) и продолжить прием преднизолона, если Т3 снизился менее чем на 50% (повышенный синтез тиреоидных гормонов) или не изменился - отменить преднизолон, продолжить прием тиамазола (тиро-зола♠ ), пропилтиоурацила (пропицила♠ ).
Как было отмечено выше, амиодарон назначается при тяжелых, жизнеугрожающих аритмиях, часто рефрактерных к другой терапии. Отмена препарата в такой ситуации может быть недопустима по жизненным показаниям. Поэтому в лечебной практике в случае невозможности прекращения приема антиаритми-ка компенсацию тиреотоксикоза проводят на фоне продолжающейся терапии амиодароном. В каждом конкретном случае решение о смене антиаритмического препарата должно приниматься индивидуально совместно кардиологом и эндокринологом.
Развитие гипотиреоза не сопровождается потерей антиаритмической эффективности амиодарона и не является показанием к его отмене. Проведение заместительной терапии левотироксином натрия не приводит к возобновлению нарушений ритма сердца. У лиц с явным гипотиреозом рекомендуется начинать заместительную терапию левотироксином натрия с минимальных доз 12,5-25 мкг в сутки с постепенным повышением с интервалом 4-6 нед до эффективных под контролем уровня ТТГ, ЭКГ или мониторирования ЭКГ по Holter, не допуская при этом декомпенсации кардиальной патологии или развития аритмии. У лиц старшей возрастной группы при субклиническом гипотиреозе рекомендуется проведение заместительной терапии левотироксином натрия, если уровень ТТГ превышает 10 мЕд/л. Если уровень ТТГ не превышает 10 мЕд/л, относительным показанием к назначению левотироксина натрия с использованием минимально эффективных доз и хорошей переносимости препарата является наличие дислипидемии. В остальных случаях проводится динамическое наблюдение с определением ТТГ 1 раз в 6 месяцев и УЗИ щитовидной железы 1 раз в год.
Хирургическое лечение
У некоторых пациентов комбинированная лекарственная терапия может быть неэффективна, что требует хирургического вмешательства. Оперативное лечение обычно проводится в случае невозможности достижения компенсации заболевания после длительного (около 6 мес) курса медикаментозной терапии или при сочетании амиодарон-индуцированного тиреотоксикоза с узловым токсическим зобом. При крайне тяжелом состоянии или с целью подготовки к оперативному лечению используют плазмаферез. В районах с пограничным йодным дефицитом пациентам с диффузным или узловым зобом, имеющим нормальное или повышенное поглощение радиоизотопа, при отсутствии эффекта от консервативной терапии показано лечение радиоактивным йодом.
Примерные сроки нетрудоспособности
21 день.
Дальнейшее ведение
Всем пациентам, которым планируется назначение амиодарона, необходимо провести исследование функционального состояния щитовидной железы и ее структуры. Это позволяет не только выявить наличие тиреоидной патологии, но и прогнозировать возможное развитие тиреотоксикоза или гипотиреоза после начала терапии.
План обследования щитовидной железы до назначения препарата включает:
Повторное определение уровня ТТГ можно повторить через 3 мес от начала терапии, а затем каждые 6 мес. При нормальных показателях мониторинг осуществляется по уровню ТТГ 1-2 раза в год, особенно у пациентов с измененной щитовидной железой. Присутствие антител к тиреопероксидазе увеличивает риск развития амиодарон-индуцированного гипотиреоза, особенно во время первого года лечения. Появление рефрактерности к антиаритмической терапии может быть ранним признаком манифестации амиодарон-индуцированного тиреотоксикоза. При амиодарон-индуцированном тиреотоксикозе I типа после достижения эутиреоза необходимо определить дальнейшую тактику лечения (оперативное лечение или терапия радиоактивным йодом).
Информация для пациента
Пациент должен быть информирован, что амиодарон - высокоэффективный антиаритмический препарат с высоким содержанием йода. Прием амиодарона может привести к развитию различных нарушений функции щитовидной железы. На фоне приема амиодарона необходимо каждые 6 мес исследовать содержание ТТГ. В случае выявления нарушения функции щитовидной железы лечащий врач назначит соответствующее лечение.
ПРОГНОЗ
Амиодарон-индуцированный гипотиреоз не представляет угрозы для жизни пациентов и не требует отмены препарата. Амиодарон-индуцированный тиреотоксикоз - жизненно опасное осложнение лечения амиодароном. Лечение амиодарон-индуцированного тиреотоксикоза требует отмены препарата и назначения препаратов тионамидов или глюкокортикоидов в зависимости от типа тиреотоксикоза.
ЗАКЛЮЧЕНИЕ
Амиодарон на сегодняшний день является наиболее эффективным и широко используемым препаратом для лечения и профилактики жизнеугрожающих желудочковых нарушений сердечного ритма и различных других форм сердечных аритмий. Однако, как и любой фармакологический препарат, он может вызывать нежелательные эффекты со стороны различных органов и тканей, что может осложнять его использование. Одним из самых распространенных эффектов является нарушение функционального состояния щитовидной железы, что обусловлено фармакологическими особенностями препарата - высоким содержанием йода в его молекуле. Для предупреждения и прогнозирования возможных осложнений со стороны щитовидной железы пациенты, которым планируется лечение амиода-роном, должны быть направлены к эндокринологу для уточнения функционального состояния щитовидной железы и наличия сопутствующей тиреоидной патологии. В дальнейшем на фоне приема препарата необходимо исследовать функцию щитовидной железы не реже 1 раза в 6 месяцев и всегда при ухудшении течения аритмии. В тех случаях, когда амиодарон назначается для первичной или вторичной профилактики фатальных желудочковых нарушений ритма сердца, или когда отмена препарата невозможна по иным причинам (любые формы аритмий, протекающих с тяжелой клинической симптоматикой, которые не удается устранить другими средствами антиаритмической терапии), компенсацию тиреотоксикоза проводят на фоне продолжения приема амиодарона. Вопрос об отмене или продолжении лечения амиодароном должен решаться индивидуально для каждого пациента совместно кардиологом и эндокринологом.
СПИСОК ЛИТЕРАТУРЫ
-
Голицын С.П. Принципы фармакотерапии желудочковых нарушений ритма сердца // Клиническая фармакология и терапия. - 1997. - Т. 6, №3. - С. 14-16.
-
Дедов И.И., Мельниченко Г.А., Свириденко Н.Ю., Платонова Н.М. и др. Диагностика, профилактика и лечение ятрогенных йодиндуцированных заболеваний щитовидной железы // Вестник РАМН. - 2006. - №1. - С. 34-39.
-
Свириденко Н.Ю., Молашенко Н.В., Платонова Н.М., Атаманова Т.М., Сердюк С.Е., Бакалов С.А., Голицин С.П. Функциональное состояние щитовидной железы у пациентов, принимающих амиодарон. Методы коррекции тиреоидной дисфункции // Клиническая тиреоидология. - 2004. - Т. 2, №4. - С. 19-26.
-
Сердюк С.Е., Бакалов С.А., Голицин С.П., Молашенко Н.В., Платонова Н.М., Свириденко Н.Ю. Дисфункция щитовидной железы на фоне длительного приема амио-дарона. Связь антиаритмической эффективности амиодарона с действием препарата на функцию щитовидной железы // Кардиология. - 2005. - Т. 45, №1. - С. 22-27.
-
Bogazzi F., Bartalena L., Gasperi M. The various effects of amiodarone on thyroid function // Thyroid. - 2001. - Vol. 11, N 5. - P. 511-519.
-
Erdogan M. Treatment of amiodarone-induced thyrotoxicosis. The thyroid and cardiovascular risk // Merck European thyroid symposium, Berlin. - 2004. - Р. 85-90.
-
Klein I., Ojamaa K. Thyroid hormone and the cardiovascular system // N. Engl. J. Med. - 2001. - Vol. 344, N 7. - P. 501-509.
-
Platonova N., Molashenko N., Sviridenko N. Management of patients with amiodaron-induced thyrotoxicosis and euthyroid hyperthyroxinemia // The Thyroid and cardiovascular risk. - Stuttgart; New York, 2004. - P. 96-97.
-
Roti E. Iodine excess and hyperthyroidism // The thyroid and environment: Merck European thyroid symposium, Budapest. - 2000. - Р. 22-25.
-
Sviridenko N., Molashenko N., Platonova N. Lipid disorders in amiodarone-treated patients with subclinical hypothyroidism // The Thyroid and cardiovascular risk. - Stuttgart; New York, 2004. - P. 99-100.
-
Williams M., Lo Gerfo P. Thyroidectomy using local anaesthesia in critically ill patients with amiodarone-induced thyrotoxicosis: a review and description of the technique // Thyroid. - 2002. - Vol. 12. - P. 523-525.
ХРОНИЧЕСКИЙ АУТОИММУННЫЙ ТИРЕОИДИТ
Свириденко Н.Ю., Абрамова Н.А.
СИНОНИМЫ
АИТ, лимфоцитарный тиреоидит, хронический тиреоидит, лимфоматозный зоб.
ОПРЕДЕЛЕНИЕ
АИТ является органоспецифическим аутоиммунным заболеванием, приводящим к развитию клинического гипотиреоза вследствие разрушения ткани щитовидной железы через активацию Т- и В-клеточного иммунитета с образованием аутоантител к различным компонентам тиреоидной ткани. Антитела могут определяться задолго до появления клинических симптомов заболевания и выявления гормональных изменений существующими тестами. Антитела могут определяться не только к щитовидной железе, но и к другим эндокринным органам, вызывая развитие АПС.
КОД ПО МКБ-10
ИСТОРИЯ
В 1912 г. японский хирург Хашимото описал четырех пациентов с хроническим заболеванием щитовидной железы, которое назвал «struma lymphomatosa». Щитовидные железы этих пациентов характеризовались диффузной лимфоидной инфильтрацией, фиброзом, атрофией паренхиматозных клеток и эозинофильными изменениями в некоторых из ацинарных клетках. Классический тиреоидит Хашимото описывали как диффузное безболезненное увеличение щитовидной железы у молодых и среднего возраста женщин, которое часто ассоциировалось с гипотиреозом. Причина увеличения щитовидной железы была неизвестна, и тиреоидит диагностировался во время операции или после гистологического исследования ткани. В 1953 г. было сообщено о повышенном уровне гамма-глобулинов в сыворотке крови пациентов с этой патологией. В 1956 г. было показано, что иммунизация кроликов экстрактом щитовидной железы приводит к лимфоцитарной инфильтрации как при тиреоидите Хашимото. Были также обнаружены антитела к тиреоглобулину в крови животных. В этом же году наблюдали преципитацию при добавлении экстракта щитовидной железы человека в сыворотку крови пациентов с АИТ. Эти наблюдения привели к формированию совершенно новой концепции патогенеза заболевания.
В настоящее время все теории развития аутоиммунной патологии сводятся к единому общему нарушению в системе иммунологического надзора. Развитие аутоиммунных заболеваний включает поломку механизмов, которые контролируют толерантность к собственным и чужеродным антигенам. Предполагается, что тиреоидит Хашимото, первичная микседема и болезнь Грейвса являются различными выражениями единых иммунологических нарушений и что клинические проявления отражают спектр иммунных ответов у отдельных пациентов. Эти ответы могут включать клеточно-опосредованные цитотоксические реакции, синтез стимулирующих, блокирующих или цитотоксических антител. Тиреоидит Хашимото является преимущественно проявлением клеточно-опосредованной цитотоксичности, приводящей к деструкции тиреоцитов с развитием гипотиреоза и идиопатической микседемы.
ЭПИДЕМИОЛОГИЯ
Данных о распространенности АИТ в мировой литературе фактически нет, так как заболевание выявляется в основном на стадии гипотиреоза, хотя есть достаточно данных о распространенности в популяции носительства антител к ткани щитовидной железы и частоты гипотиреоза. Наиболее детально зависимость между наличием тиреоидных антител и развитием гипотиреоза была изучена в Викгемском исследовании (Whickham Survey), в котором на протяжении с 1972 по 1995 г. у 2779 человек оценивалась функция щитовидной железы. Частота новых случаев гипотиреоза (заболеваемость) составила около 3,5 случаев в год для женщин и 0,6 случаев в год у мужчин на 1000 человек. При многофакторном анализе было показано, что риск развития гипотиреоза у женщины с изолированным повышением уровня антител к щитовидной железе (т.е. без нарушения ее функции) составил всего 2,1% в год. Т.е. из 100 женщин с повышенным уровнем антител к щитовидной железе гипотиреоз за год разовьется только у двух. Антитела к тиреоидным антигенам могут присутствовать у 10-25% практически здоровых лиц без нарушений функции щитовидной железы.
СКРИНИНГ
Скрининговое определение уровня антител к щитовидной железе не рекомендует ни одна эндокринологическая ассоциация мира. АИТ - фактор риска гипотиреоза, поэтому скрининг должен быть направлен на выявление гипотиреоза. Американская тиреоидная ассоциация рекомендует проводить скрининг взрослых на дисфункцию щитовидной железы путем определения концентрации ТТГ, начиная с 35 лет каждые последующие пять лет. Обсуждают необходимость скрининга гипотиреоза у беременных.
КЛАССИФИКАЦИЯ
По морфофункциональным особенностям выделяют:
-
гипертрофический вариант АИТ (тиреоидит Хашимото): увеличение объема щитовидной железы, при гистологическом исследовании в щитовидной железе выявляется массивная лимфоидная инфильтрация с формированием лимфоидных фолликулов, оксифильная трансформация тироцитов, атрофированные, без четких границ тиреоидные фолликулы, гипертрофия соединительной ткани, отсутствие коллоида;
-
атрофический вариант АИТ: уменьшение объема щитовидной железы, в гистологической картине доминируют признаки фиброза, атрофия тиреоидной ткани, отсутствие коллоида.
Иногда в раннюю фазу АИТ могут наблюдаться умеренные симптомы тиреотоксикоза. С течением времени у пациентов может восстановиться эутиреоидное состояние или развиться стойкий гипотиреоз. В действительности, и болезнь Грейвса, и АИТ патогенетически тесно связанные патологии, имеющие общую аутоиммунную основу, гистологическую картину и лабораторные показатели тиреоидных гормонов и ТТГ в раннюю фазу заболевания. Но клиническое течение этих патологий может существенно отличаться в зависимости от спектра аутоиммунных реакций, которые включают образование цитотоксических антител, стимулирующих или блокирующих антител, клеточно-опосредованную цитотоксичность. У пациентов с болезнью Грейвса будут преобладать стимулирующие антитела, а при АИТ - блокирующие или цитотоксичные антитела, которые с активацией клеточно-опосредованного иммунитета приведут к разрушению клеток щитовидной железы.
В 1993 г. T.F. Davies и N. Amino предложили классификацию аутоиммунных заболеваний щитовидной железы в зависимости от функционального состояния и ее размеров. Под термином АИТ они объединяли и тиреоидит Хашимото, и болезнь Грейвса, но с подразделением на типы 1 и 2, которые, в свою очередь, подразделяли на подтипы А, В и С.
-
-
Функциональное состояние: начинается как транзиторный тиреотоксикоз (повышенный уровень тиреоидных гормонов с низким поглощением радиоактивного йода), часто наблюдается переход в гипотиреоз, который может быть транзиторным. Транзиторный гипотиреоз может наблюдаться без предшествующего тиреотоксикоза.
R.Volpe, 1989 г. предложил свою классификацию АИТ:
ЭТИОЛОГИЯ
АИТ - мультифакториальное заболевание, при котором определенная наследственная предрасположенность реализуется на фоне факторов окружающей среды. Так, атрофический вариант АИТ ассоциирован с гаплотипом HLA- DR3 , а гипертрофический вариант - с DR5 HLA -системы. АИТ ассоциируется с полиморфизмом генов HLA I класса (клеточно-опосредованная тканевая деструкция) и полиморфизмом генов HLA II класса (презентация антигена). Хотя гены HLA участвуют в развитии АИТ, генетическая предрасположенность составляет около 10-20%. Полиморфизм генов CTLA-4, контролирующих T-клеточную инактивацию, выявляется как при болезни Грейвса, так и при АИТ, а также при СД 1-го типа, целиа-кии. Полиморфизм гена PTPN22, который кодирует тирозинфосфатазу, и гена IL2RA, который кодирует рецептор активации интерлейкина-2, также ассоциируются с повышенным риском развития аутоиммунных заболеваний. Полиморфизм генов объясняет сочетание АИТ с другими аутоиммунными заболеваниями, в том числе и эндокринными, например синдром Шмидта (АИТ и хроническая недостаточность надпочечников), синдром Карпентера (сочетание первичной НН, АИТ и СД 1-го типа).
ПАТОГЕНЕЗ
При АИТ происходит постепенное разрушение функционирующей ткани щитовидной железы в процессе ее аутоиммунного поражения. Предполагается несколько механизмов развития АИТ. У пациентов с тиреоидитом присутствуют антитела к тиреопероксидазе, тиреоглобулину, рецептору ТТГ. Главным механизмом поражения при АИТ является антитело-зависимая клеточно-опосредованная цитотоксичность. Активация цитотоксичных Т-лимфоцитов (СD8+T cells) в ответ на клеточно-опосредованную иммунную реакцию, инициированную посредством Т-лимфоцитов хелперов (CD4+ T-cells), является центральным механизмом в тиреоидной деструкции. Другим эффектом Т-хелперов-1 является продукция провоспалительных цитокинов в щитовидной железе с активацией макрофагов и их миграцией в щитовидную железу для прямого эффекта. При гистологическом исследовании у пациентов с АИТ выявляется диффузная паренхиматозная инфильтрация лимфоцитами, частично плазматическими В-клетками, образующими лимфоидные фолликулы, содержащие герминальные центры. Тиреоидные фолликулы выстланы клетками Hürthle. Выраженная атрофия тиреоидной ткани сопровождается развитием фиброза. Клинически это проявляется развитием гипотиреоза.
Антитела к тиреопероксидазе фиксируют комплемент и обладают антителозависимой комплемент-опосредованной цитотоксичностью. Однако не все сыворотки, содержащие антитела к тиреопероксидазе, проявляют цитотоксическую активность. Более того, такую активность проявляют и сыворотки, в которых соответствующие антитела отсутствуют. Предполагается, что аномальная экспрессия Fas/FasL и ослабленная регуляция Fas-опосредованного апоптоза могут быть причиной для большинства аутоиммунных заболеваний. Обнаружено, что тиреоциты от пациентов с АИТ, в отличие от пациентов с узловым зобом и нормальных щитовидных желез, гиперэкспрессируют Fas и FasL на их поверхности. Интерлeйкин-1β, цитокин, в избытке продуцированный в щитовидной железе пациентов с АИТ, вызывает взаимодействие Fas/FasL на поверхности соседних тиреоцитов, приводящее к массивному апоптозу и разрушению тиреоидных клеток.
Определенное значение в развитии атрофического варианта АИТ придают антителам, блокирующим рецептор ТТГ.
КЛИНИЧЕСКАЯ КАРТИНА
АИТ не имеет клинических проявлений при эутиреозе. Можно наблюдать лишь увеличение щитовидной железы. При развитии гипотиреоза клиническая картина будет характеризоваться симптомами данного состояния (см. синдром гипотиреоза). Довольно редко АИТ может манифестировать транзиторной тиреотоксической фазой (хаши-токсикоз). В отличие от тиреотоксикоза при болезни Грейвса, хашитоксикоз в подавляющем большинстве случаев не выходит за рамки субклинического (подавленная концентрация ТТГ при нормальном содержании св. Т4 и св. Т3 ) и не имеет развернутой картины тиреотоксикоза.
ДИАГНОСТИКА
В 2002 г. Российской ассоциацией эндокринологов были приняты клинические рекомендации по диагностике АИТ.
-
Диагноз АИТ не может быть установлен только на основании данных пальпации щитовидной железы, а также увеличения или уменьшения ее объема.
-
«Большие» диагностические признаки АИТ: первичный гипотиреоз (манифестный или субклинический), наличие тиреоидных антител, ультразвуковые признаки аутоиммунного поражения щитовидной железы.
-
При отсутствии хотя бы одного из «больших» диагностических признаков диагноз носит вероятностный характер.
-
Пункционная биопсия щитовидной железы для подтверждения диагноза АИТ не показана. Ее преимущественно проводят в рамках диагностического поиска при узловом зобе.
-
После установления диагноза дальнейшее исследование динамики уровня циркулирующих антител к щитовидной железе с целью оценки развития и прогрессирования АИТ не имеет диагностического и прогностического значения.
-
У женщин, планирующих беременность, при выявлении антител к ткани щитовидной железы и/или ультразвуковых признаках АИТ необходимо исследовать функцию щитовидной железы (содержание ТТГ и св. Т4 в сыворотке крови) перед наступлением зачатия, а также в каждом триместре беременности.
Анамнез и физикальное исследование
В семейном анамнезе могут быть аутоиммунные заболевания щитовидной железы или других органов и систем (например, ревматоидный артрит, бронхиальная астма). При физикальном осмотре в большинстве случаев определяются симптомы гипотиреоза (см. «Синдром гипотиреоза»). При пальпации размер щитовидной железы колеблется в различных пределах от минимальных до максимальных величин, консистенция может быть более плотная, чем у здоровых лиц, подвижность обычно не нарушена, болезненность не отмечается. Редко встречается болевая форма АИТ.
Лабораторные исследования
Определение концентрации ТТГ и св. Т4 позволяет выявить клинический или субклинический гипотиреоз или эутиреоидное состояние:
«Классические» антитела - антитела к тиреоглобулину и тиреопероксидазе выявляются у 80-90% больных АИТ. При воспалительных и деструктивных процессах в щитовидной железе неаутоиммунной природы антитела могут присутствовать, но в невысоких титрах. Определение антител к тиреоидной пероксидазе играет доминирующую роль по сравнению с антителами к тиреоглобулину как средство диагностики аутоиммунного процесса в щитовидной железе. 99% положительных сывороток по антителам к тиреоглобулину являются также положительными по антителам к тиреопероксидазе. С другой стороны, около 65% положительных сывороток по антителам к тиреопероксидазе являются отрицательными по антителам к тиреоглобулину.
В течение АИТ выделяют тиреотоксическую фазу. Частота ее развития неизвестна, так как симптомы тиреотоксикоза не достигают той интенсивности, как при болезни Грейвса, и нередко носят субклинический характер, поэтому она часто не диагностируется. Одной из причин тиреотоксикоза при АИТ является разрушение тиреоидной ткани и поступление тиреоидных гормонов в кровь. Обычно тиреотоксикоз развивается в начале АИТ и продолжается не более 4 мес с последующим восстановлением функции щитовидной железы или развитием гипотиреоза.
Инструментальные исследования
УЗИ щитовидной железы: определяется диффузное снижение эхогенности ткани, неоднородность структуры, усиление васкуляризации.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальная диагностика проводится с другими формами тиреоидита. В тиреотоксическую фазу дифференциальная диагностика проводится с болезнью
Грейвса. В пользу тиреотоксической фазы свидетельствует умеренная выраженность клинической симптоматики, непродолжительный период тиреотоксикоза (менее полугода), отсутствие повышения содержания антител к рецептору ТТГ (не обязательно).
Антитела к тиреоглобулину и тиреопероксидазе определяются у 80-95% больных АИТ и не могут служить диагностическим критерием аутоиммунного процесса при болезни Грейвса и АИТ. УЗИ не дает четких и надежных критериев для дифференциальной диагностики. Эхогенность железы при болезни Грейвса и при АИТ снижена, структура может быть неоднородной как в том, так и в другом случае, особенно на фоне тиреостатической терапии. Выраженная лимфоидная инфильтрация у больных с аутоиммунной патологией, к которой относятся болезнь Грейвса и АИТ, не позволяет морфологу верифицировать диагноз на основании цитологического исследования. Более информативным методом при проведении дифференциальной диагностики является радиоизотопное сканирование щитовидной железы. Поглощение радиоактивного изотопа при АИТ может быть нормальным, пониженным или повышенным, распределение изотопа неравномерное, что определяет «пеструю» сканограмму у этих больных с зонами повышенного и пониженного захвата. В том случае, если результаты обследования не позволяют уточнить диагноз, необходимо тщательно наблюдать за течением заболевания и ответом на проводимую терапию. Если симптомы тиреотоксикоза не выражены, следует ограничиться назначением β-блокаторов, седативных препаратов. При более выраженной картине заболевание следует расценивать как болезнь Грейвса и назначить тиреостатическую терапию тионамидами в дозе, не превышающей 15-20 мг. Надо помнить, что тяжелая степень тиреотоксикоза и длительность тиреотоксической фазы более 4 мес не характерны для АИТ. В пользу АИТ будут также свидетельствовать быстрое развитие эутиреоза и гипотиреоза на фоне проводимого лечения и отсутствие рецидива заболевания после отмены тиреостатических препаратов.
Дифференциальный диагноз с подострым тиреоидитом (см. «Подострый тиреоидит»).
Послеродовый тиреоидит развивается в течение первого года после родов. Возникает у 5-9% женщин (частота увеличивается в 3 раза, если женщина страдает СД 1-го типа). Заболевание аутоиммунной природы, имеет фазовое течение как любой деструктивный тиреоидит. Фаза умеренного тиреотоксикоза переходит в фазу транзиторного гипотиреоза и заканчивается спонтанной ремиссией с восстановлением эутиреоидного состояния. Продолжительность послеродового тиреоидита, как правило, не превышает 6-8 мес. Возможность рецидива послеродового тиреоидита при последующих беременностях составляет примерно 70%. Если антитела к тиреоидной пероксидазе присутствуют в I триместре, риск послеродового тиреоидита составляет 50%, если антитела к тиреоидной пероксидазе сохраняются в III триместре, риск послеродового тиреоидита превышает 80%. В большинстве случаев послеродовый тиреоидит не диагностируется из-за стертости клинической картины заболевания и ошибочной трактовки причины плохого самочувствия женщиной. На наличие заболевания указывает связь его с предшествующими родами. Стойкий гипотиреоз развивается у 20-30% женщин.
Быстрый рост зоба с появлением признаков компрессии окружающих органов и тканей, с эхографическими признаками аутоиммунного поражения подозрителен на развитие лимфомы щитовидной железы, гистологическая картина лимфомы щитовидной железы не отличается от таковой при АИТ.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
ЛЕЧЕНИЕ
Цель лечения
Показания к госпитализации
В случае тяжелого течения гипотиреоза (подозрение на микседематозную кому).
Необходимость оперативного лечения в связи со значительным увеличением щитовидной железы и компрессионным синдромом.
Медикаментозное лечение
В настоящее время использование левотироксина натрия при отсутствии нарушений функционального состояния щитовидной железы, а также применение глюкокортикоидных препаратов, иммунодепрессантов, плазмафереза/гемосорбции, лазерной терапии с целью коррекции содержания антитиреоидных антител признано неэффективным и нецелесообразным.
Медикаментозное лечение тиреоидными препаратами назначают больным с гипотиреозом (см. «Синдром гипотиреоза»).
Согласно клиническим рекомендациям Российской ассоциации эндокринологов, физиологические дозы йода (около 200 мкг/сут) не оказывают отрицательного влияния на функцию щитовидной железы при уже существующем гипотиреозе, вызванном АИТ.
Дальнейшее ведение
Исследование динамики содержания циркулирующих антител к щитовидной железе с целью оценки развития и прогрессирования АИТ не проводят, так как это не имеет диагностического и прогностического значения. Уровень ТТГ контролируют 1 раз в год или при появлении симптомов гипотиреоза. Пациентам, получающим левотироксин натрия, рекомендуется исследовать содержание ТТГ в сыворотке крови 1 раз в год и/или при ухудшении состояния.
Информация для пациентов
АИТ - заболевание, при котором вследствие аутоиммунных нарушений разрушается ткань щитовидной железы и снижается ее способность синтезировать тиреоидные гормоны. Единственно клинически значимая проблема, к которой может привести АИТ, - это гипотиреоз (т.е. снижение функции щитовидной железы). При отсутствии нарушения функции щитовидной железы аутоиммунный процесс в щитовидной железе не имеет клинических проявлений. Изолированное умеренное повышение уровня антител к щитовидной железе не позволяет поставить диагноз АИТ. Основываясь только на данных УЗИ щитовидной железы, диагноз АИТ поставить невозможно. При развитии гипотиреоза необходима пожизненная заместительная терапия тиреоидными гормонами. Левотироксин натрия необходимо принимать натощак за 30 мин до приема пищи. Эффективность терапии оценивают по уровню ТТГ.
ПРОГНОЗ
Длительное наблюдение за больными субклиническим гипотиреозом показало, что в течение последующих 4-8 лет явный гипотиреоз развивается у 20-50% из них (табл. 13.6). При наличии тиреоидных антител у лиц старше 65 лет риск развития манифестного гипотиреоза в последующие 4 года составляет 80%. При субклиническом гипотиреозе и наличии тиреоидных антител риск развития явного гипотиреоза в общей популяции составляет 5% в год.
Повышение содержания |
Отношение шансов развития гипотиреоза (с 95% доверительным интервалом) |
|
женщины |
мужчины |
|
Только тиреоидных антител |
8 (5-15) |
25 (10-63) |
Только ТТГ |
8 (3-20) |
44 (19-104) |
ТТГ + тиреоидных антител |
38 (22-65) |
173 (81-370) |
СПИСОК ЛИТЕРАТУРЫ
-
Дедов И.И., Мельниченко Г.А., Герасимов Г.А. и др. Клинические рекомендации Российской ассоциации эндокринологов по диагностике и лечению аутоиммунного тиреоидита у взрослых // Клиническая тиреоидология. - 2003. - Т. 1, №1. - С. 24-25.
-
Фадеев В.В., Мельниченко Г.А. Гипотиреоз: Руководство для врачей. - М.: РКИ Соверо пресс, 2002.
-
Фадеев В.В., Мельниченко Г.А., Герасимов Г.А. Аутоиммунный тиреоидит. Первый шаг к консенсусу // Проблемы эндокринологии. - 2001. - Т. 47, №4. - С. 7-13.
-
Akamizu T., Amino N., DeGroot L.J. Hashimoto’s Thyroiditis // Thyroid Disease Manager. - December 20. - 2013.
-
American Association of clinical endocrinologists medical guidelines for clinical practice for the evaluation and treatment of hyperthyroidism and hypothyroidism // Endocrine Practice. - 2002. - Vol. 8. - N 6. - P. 458-469.
-
Garber J.R., Cobin R.H., Gharib H., Hennessey J.V., Klein I., Mechanick J.I., Pessah-Pollack R., Singer P.A., Woeber K.A. Clinical Practice Guidelines for Hypothyroidism in Adults: Co-sponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association // Endocr. Pract. - 2012. - Vol. 11. - P. 1-207.
-
Jaruratanasirikul S., Leethanaport K., Khuntigij P., Sriplun H. The clinical course of Hashimoto’s thyroiditis in children d adolescents: 6 year longitudinal follow up // J. Pediatr. Endocrinol. Metab. - 2001. - Vol. 14. - P. 177-184.
-
Hashimoto H. Zur Kenntniss der lymphomatosen Veranderung der Schilddruse (struma lymphomatosa) // Arch. Klin. Chir. - 1912. - Vol. 97. - P. 219.
-
Pearce S.H., Brabant G., Duntas L., Monzani F., Peeters R., Razvi S., Wemeau J.-L. 2013 ETA Guideline: Management of Subclinical Hypothyroidism // Eur. Thyroid. J. - 2013. - Vol. 2. - P. 215-228.
-
Vanderpump M.P. et al. The incidence of thyroid disorders in the community: a twenty-year follow-up of the Whickham Survey // Clin. Endocrinol. (Oxf). - 1995. - Jul. - Vol. 43 (1). - P. 55-68.
-
Weetman A. Autoimmune thyroid disease: propagation and progression // Eur. J. Endocrin. - 2003. - Vol. 148. - P. 1-9.
ДИФФУЗНЫЙ ЭУТИРЕОИДНЫЙ ЗОБ
Абдулхабирова Ф.М., Абрамова Н.А.
СИНОНИМЫ
Диффузный нетоксический зоб. Диффузный эндемический зоб.
ОПРЕДЕЛЕНИЕ
Диффузный эутиреоидный (нетоксический) зоб - общее диффузное увеличение щитовидной железы без нарушения ее функции.
Диффузный эндемический зоб - увеличение щитовидной железы, обусловленное дефицитом йода, у части населения, проживающего в определенном регионе.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
По данным ВОЗ, в условиях дефицита йода живут более 2 млрд человек, среди них у 740 млн человек выявлен эндемический зоб. В Российской Федерации не существует территорий, на которых население не подвергалось бы риску развития йододефицитных заболеваний. Распространенность диффузного эндемического зоба в различных регионах России варьирует от 5,2 до 70% и в среднем по стране составляет 31%.
Диффузный эутиреоидный зоб преимущественно встречается у детей, подростков и лиц молодого возраста. Более чем в 50% случаев он развивается до 20-летнего возраста, причем у женщин зоб развивается в 2-3 раза чаще, чем у мужчин. Как правило, риск развития диффузного эутиреоидного зоба многократно возрастает в те периоды, когда повышенная потребность в йоде (детский возраст, пубертатный период, беременность, кормление грудью) не восполняется адекватно.
ПРОФИЛАКТИКА
Нормализация потребления йода. Потребность в йоде составляет 90 мкг в сутки для детей в возрасте 0-59 мес, 120 мкг в сутки для детей в возрасте 6-12 лет, 150 мкг в сутки для подростков и взрослых, 250 мкг в сутки для беременных и кормящих. Обеспечение нормального потребления йода в регионах йодного дефицита возможно путем внедрения методов массовой, групповой и индивидуальной йодной профилактики.
СКРИНИНГ
В регионах должны проводиться специализированные эпидемиологические кластерные исследования с целью объективной оценки тяжести йодной недостаточности и зобной эндемии, а также для оценки эффективности проводимых профилактических программ.
Регион считается эндемичным по зобу, если частота его встречаемости у детей младшего и среднего школьного возраста составляет более 5%.
КЛАССИФИКАЦИЯ
Диффузное увеличение объема щитовидной железы с сохраненной функцией наблюдают как при эндемическом зобе (встречается в йододефицитных регионах), так и при спорадическом зобе (не связан с недостатком йода в среде, а обусловлен врожденными или приобретенными дефектами биосинтеза гормонов щитовидной железы).
Для оценки степени увеличения щитовидной железы методом пальпации ВОЗ (2001) рекомендована следующая классификация.
-
0-я (нулевая) степень - зоба нет (объем каждой доли не превышает объем дистальной фаланги большого пальца руки обследуемого).
-
1-я степень - зоб пальпируется, но не виден при нормальном положении шеи. Сюда же относятся узловые образования, не приводящие к увеличению самой железы.
-
2-я степень - зоб четко виден при нормальном положении шеи (рис. 13.1).
Важно отметить, что не всегда определяемые пальпаторно размеры щитовидной железы совпадают с истинными, например, по причинам анатомических особенностей строения шеи, низкого расположения самой щитовидной железы или загрудинного зоба.
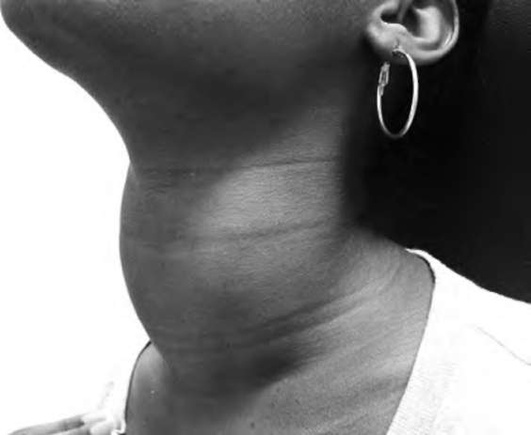
ЭТИОЛОГИЯ
Существует множество этиологических факторов развития увеличения щитовидной железы (зобогенные вещества, дефект синтеза тиреоидных гормонов, АИТ), однако наиболее частой причиной его развития является йодный дефицит. Диффузный эндемический зоб и узловой коллоидный зоб входят в спектр йододефицитных заболеваний.
ПАТОГЕНЕЗ
Основным пусковым механизмом развития зоба в условиях хронического йодного дефицита является снижение концентрации йода в ткани щитовидной железы. Доказано, что йод является не только структурным компонентом тиреоидных гормонов, но и мощным регулятором роста и пролиферации тиреоцитов. Снижение интратиреоидной концентрации йода сопровождается усиленной продукцией аутокринных факторов роста, таких как ИФР-1, эпидермальный ростовой фактор и фактор роста фибробластов. Также при хронической йодной недостаточности возникает снижение образования йодлипидов - веществ, сдерживающих пролиферативные эффекты аутокринных факторов роста. Кроме того, при недостаточном содержании йода происходит повышение чувствительности этих аутокринных факторов роста к ростовым эффектам ТТГ, снижается продукция трансформирующего фактора роста-β, который в норме является ингибитором пролиферации, активируется ангиогенез. Следствием этих процессов является гипертрофия и гиперплазия тиреоцитов, которые имеют компенсаторный характер и направлены на обеспечение организма тиреоидными гормонами. Все это приводит к увеличению щитовидной железы, образованию йододефицитного зоба.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая симптоматика может либо отсутствовать, либо проявляться косметическим дефектом или синдромом сдавления трахеи, пищевода, что зависит от степени увеличения объема щитовидной железы.
ДИАГНОСТИКА
Анамнез
При сборе анамнеза следует узнать регион проживания, количество беременностей, курение.
Как правило, зоб протекает бессимптомно, при значительном увеличении размеров щитовидной железы может проявляться компрессией трахеи и пищевода.
Физикальное обследование
Пальпация щитовидной железы: при пальпации определяют увеличение щитовидной железы. Классификация размеров зоба (ВОЗ, 2001) представлена выше. Если по результатам пальпации сделан вывод об увеличении размеров щитовидной железы или о наличии узловых образований, пациенту показано проведение УЗИ щитовидной железы.
Лабораторные исследования
Основные гормональные маркеры при диагностике заболеваний щитовидной железы - ТТГ и свободный Т4 . Для того чтобы дифференцировать состояние эутиреоза от гипоили гипертиреоза, проводят тест первого уровня - определение ТТГ в крови с помощью чувствительных методов, при изменении его уровня - дополнительное определение св. Т4 .
Инструментальные исследования
УЗИ позволяет охарактеризовать размеры и форму щитовидной железы, ее топографо-анатомическое соотношение с другими органами шеи, эхогенность и эхоструктуру, прицельно исследовать узлообразования и региональные лимфатические узлы. С помощью УЗИ уточняют данные пальпаторного обследования и определяют степень увеличения щитовидной железы. Объем каждой доли подсчитывается путем перемножения длины (а), ширины (b) и толщины (с) с коэффициентом поправки на эллипсоидность - 0,479. Объем щитовидной железы измеряют с помощью следующей формулы:
V=Vлевой доли +V правой доли ;
Vдоли = (а×b×с) ×0,479.
Нормальный объем щитовидной железы для жителей Европы у женщин - до 18 мл, у мужчин - до 25 мл.
У детей объем щитовидной железы сопоставляется с нормативными показателями в зависимости от площади поверхности тела, полученными в регионах без дефицита йода. В настоящее время общепринятые стандарты для объема щитовидной железы у детей отсутствуют, что вызывает определенные разногласия при трактовке результатов УЗИ. Принятые нормативы объема щитовидной железы у детей ВОЗ рекомендует использовать только при проведении эпидемиологических исследований. В клинической практике данные нормативы не применяются, оценка зоба у детей в практическом здравоохранении проводится методом пальпации.
Сцинтиграфию щитовидной железы проводят для диагностики загрудинного зоба.
Рентгенологическое исследование грудной клетки с контрастированием пищевода барием или КТ щитовидной железы рекомендуют при наличии зоба больших размеров, сопровождающегося симптомами компрессии трахеи и пищевода.
Определение уровня классических антитиреоидных антител (к тиреопероксидазе, к тиреоглобулину) с целью дифференциальной диагностики эндемического зоба и аутоиммунного заболевания щитовидной железы.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику диффузного эндемического зоба проводят с гипертрофической формой хронического АИТ.
Алгоритм диагностики диффузного зоба представлен на рис. 13.2.
Показания к консультации других специалистов
При компрессионном синдроме консультация хирурга.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Диффузный эутиреоидный зоб 1-й степени (ВОЗ, 2001).
ЛЕЧЕНИЕ
Цели лечения
Уменьшение и нормализация размеров щитовидной железы.
Показания к госпитализации
Госпитализация показана в крайне редких случаях только при наличии компрессионного синдрома - в хирургический стационар.
Немедикаментозное лечение
Отсутствует.
Медикаментозное лечение
Консервативная терапия: существуют три варианта консервативной терапии диффузного эутиреоидного зоба:
На первом этапе лечения подавляющему большинству детей, подростков и молодых людей показано назначение йода в дозе 100-200 мкг в день, что приводит к достаточно быстрому подавлению гипертрофического компонента зоба (увеличение размеров тироцитов). В контролируемых клинических исследованиях было показано, что на фоне терапии йодом за первые 6 мес объем щитовидной железы уменьшается на 30%. Преимущества терапии йодом: этиотропный характер, безопасность, отсутствие необходимости в подборе дозы и в проведении частых гормональных исследований.
Цель терапии левотироксином натрия при диффузном эутиреоидном зобе - поддержание ТТГ в пределах 0,1-0,4 мМЕ/л, как правило, требует назначения не менее 100 мкг левотироксина натрия. Недостатки супрессивной терапии левотироксином натрия: высокая вероятность рецидива зоба после отмены препарата, риск осложнения медикаметозного тиреотоксикоза, необходимость подбора дозы, что требует частых гормональных исследований. Супрессивную терапию левотироксином натрия не считают лечением выбора при диффузном эутиреоидном зобе.
Хорошо себя зарекомендовала в клинических исследованиях комбинированная терапия препаратами йода и левотироксином натрия (200 мкг йода и 100-150 мкг левотироксина натрия). Основное преимущество комбинированной терапии - быстрое достижение уменьшения объема щитовидной железы за счет левотироксина натрия и отсутствие феномена отмены левотироксина натрия (рецидив зоба) за счет йода, который предотвращает снижение интратиреоидного содержания йода, возникающего при монотерапии левотироксином натрия. Возможно и последовательное назначение вначале левотироксина натрия, а затем добавление йода.
Назначение физиологических доз йода (100-200 мкг в сутки) при гипертрофической форме АИТ не несет для пациента никакой опасности, но не является этиопатогенетическим. В таком случае при динамическом наблюдении не будет уменьшения объема щитовидной железы.
Особенности наблюдения пациентов среднего и пожилого возраста: у лиц старше 40 лет при зобе небольшого размера с узловыми изменениями или без них наиболее оправдано активное наблюдение, подразумевающее УЗИ и определение уровня ТТГ с интервалом в 1-2 года.
Хирургическое лечение
Операция при диффузном эутиреоидном зобе может быть показана лишь при его гигантском размере и/или при явлениях компрессии окружающих органов.
Лечение во время беременности
Всем беременным, проживающим в йододефицитном регионе, наряду с йодированной солью целесообразно назначение ЛС, содержащих калия йодид. Такая же тактика ведения применяется и при диффузном эндемическом зобе, диагностированном впервые во время беременности. Суточная потребность в йоде в период беременности и лактации составляет 250 мкг. При этом следует помнить, что даже при достаточном потреблении йода объем щитовидной железы закономерно несколько увеличивается.
Примерные сроки нетрудоспособности
Трудоспособность ограничена в крайне редких случаях при проведении оперативного лечения при диффузном эутиреоидном зобе с компрессионным синдромом. Сроки нетрудоспособности в указанных случаях при условии адекватной предоперационной амбулаторной подготовки пациента в среднем составят от 7 до 14 дней.
Дальнейшее ведение
Для профилактики рецидива заболевания рекомендуется употребление йодированной соли с пищей.
Информация для пациента
Зобом называют увеличение щитовидной железы более 18 мл у женщин и более 25 мл у мужчин. «Диффузный зоб» означает, что увеличение происходит равномерно во всех отделах щитовидной железы. Наиболее частой причиной служит дефицит йода. Российская Федерация является йододефицитным регионом, частота диффузного эндемического зоба в среднем по стране составляет 31%.
В большинстве случаев зоб протекает бессимптомно. При подозрении на увеличение щитовидной железы по результатам пальпации необходимо определение объема щитовидной железы с помощью УЗИ. Если увеличение щитовидной железы подтверждено, необходимо оценить функцию щитовидной железы. Тест первого уровня - определение ТТГ. Первый этап в лечении диффузного эутиреоидного зоба - назначение препаратов йода. При отсутствии эффекта от терапии йодом показана комбинированная терапия препаратами йода и левотироксином натрия. Нормализация объема щитовидной железы происходит через 1,5-2,0 года лечения. Для профилактики рецидива заболевания рекомендуется постоянное употребление йодированной соли с пищей.
ПРОГНОЗ
При лечении диффузного эндемического зоба 1 ст. нормализация объема щитовидной железы происходит через 6-12 мес лечения.
Для снижения частоты встречаемости диффузного эндемического зоба в целом по стране необходимо принятие законодательных мер по государственной программе профилактики йододефицитных состояний.
СПИСОК ЛИТЕРАТУРЫ
-
Герасимов Г.А., Фадеев В.В., Свириденко Н.Ю. и др. Йододефицитные заболевания в России. Простое решение сложной проблемы. - М.: Адамант, 2002.
-
Дедов И.И., Мельниченко Г.А., Пронин В.С. и др. Клиника и диагностика эндокринных нарушений: Учебно-методическое пособие. - М., 2005.
-
Дедов И.И., Мельниченко Г.А., Трошина Е.А., Платонова Е.А. и др. Дефицит йода - угроза здоровью и развитию детей России. Пути решения проблемы. Национальный доклад. - М., 2006. - 124 с.
-
Рациональная фармакотерапия заболеваний эндокринной системы и нарушений обмена веществ: Руководство для практикующих врачей / Дедов И.И., Мельниченко Г.А., Андреева Е.Н. и др.; Под общ. ред. И.И. Дедова, Г.А. Мельниченко. - М.: Литтерра, 2006.
-
Фадеев В.В. Эутиреоидный зоб: патогенез, диагностика, лечение // Клиническая тиреоидология. - 2003. - Т. 1, №1. - С. 3-13.
-
Klemenz B., Foerster G., Wieler H. et al. Combination therapy of endemic goiter with two different thyroxine/iodine combinations // Nuklearmedizin. - 1998. - Vol. 37. - P. 101-106.
-
Thompson C. Dietary recommendations for iodine around the world // IDD Newsletter. - 2002. -Vol. 18. - N 3. - P. 38-42.
-
World Health Organization, United Nations Children’s Fund, International Council for the Control of Iodine Deficiency Disorders 2007 Assessment of iodine deficiency disorders and monitoring their elimination. 3rd ed. Geneva: WHO.
-
Zimmermann M.B. et al. New reference values for thyroid volume by ultrasound in iodine-sufficient schoolchildren: a World Health Organization/Nutrition for Health and Development Iodine Deficiency Study Group Report // American Journal of Clinical Nutrition. - 2004. - Vol. 79. - P. 231-237.
КОЛЛОИДНЫЙ УЗЛОВОЙ ЗОБ
Абдулхабирова Ф.М., Абрамова Н.А.
СИНОНИМЫ
Коллоидный в разной степени пролиферирующий узловой зоб, узловой коллоидный пролиферирующий зоб.
ОПРЕДЕЛЕНИЕ
Коллоидный узловой зоб - неопухолевое заболевание щитовидной железы, возникающее в результате очаговой пролиферации тиреоцитов и накопления коллоида, патогенетически наиболее часто связанное с хроническим дефицитом йода в организме; постановка данного диагноза возможна лишь на основании данных ТАБ узлового образования.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
Среди здорового населения при пальпации щитовидной железы узловой зоб регистрируют у 3-5% обследуемых, при аутопсии ткани щитовидной железы узловые образования обнаруживают более чем в 50% случаев.
В регионах йодного дефицита РФ распространенность заболевания варьирует от 10 до 40%. На долю узлового коллоидного зоба приходится большинство (75-90%) всех узловых образований щитовидной железы.
ПРОФИЛАКТИКА
Профилактика - нормализация потребления йода путем принятия законодательных актов по государственной профилактике йододефицитных состояний.
СКРИНИНГ
Скрининг может проводиться только в рамках специализированных региональных эпидемиологических кластерных исследований.
КЛАССИФИКАЦИЯ
Классификация зоба, рекомендованная ВОЗ (2001 г.), следующая.
-
-
степень 0 - зоба нет (объем каждой доли не превышает объема дистальной фаланги большого пальца руки обследуемого);
-
степень 1 - зоб пальпируется, но не виден при нормальном положении шеи, сюда же относят узловые образования, не приводящие к увеличению щитовидной железы;
-
степень 2 - зоб четко виден при нормальном положении шеи (рис. 13.3).
-
-
По количеству узловых образований:
-
узловой зоб - единственное инкапсулированное образование в щитовидной железе (солитарный узел);
-
многоузловой зоб - множественные инкапсулированные узловые образования в щитовидной железе, не спаянные между собой;
-
конгломератный узловой зоб - несколько инкапсулированных образований в щитовидной железе, спаянных друг с другом и формирующих конгломерат;
-
диффузно-узловой (смешанный) зоб - узлы (узел) на фоне диффузного увеличения щитовидной железы.
-
ЭТИОЛОГИЯ
Наиболее частая причина развития коллоидного узлового зоба - йодный дефицит, реже - генетические изменения и факторы окружающей среды (зобогенные факторы).
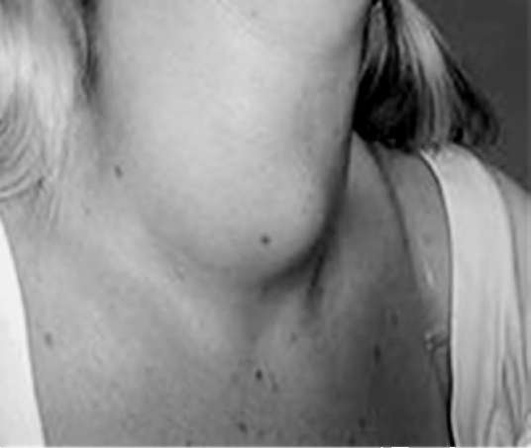
ПАТОГЕНЕЗ
В условиях йодного дефицита щитовидная железа подвержена воздействию комплекса стимулирующих факторов, которые обеспечивают продукцию адекватного количества тиреоидных гормонов в условиях дефицита основного субстрата для их синтеза. В результате происходит увеличение объема щитовидной железы - формируется диффузный эутиреоидный зоб. В зависимости от выраженности йодного дефицита он может формироваться у 10-80% всего населения. Тироциты исходно обладают различной пролиферативной активностью, т.е. обладают микрогетерогенностью. Одни пулы тироцитов более активно захватывают йод, другие быстро пролиферируют, третьи имеют низкую функциональную и пролиферативную активность. В условиях йодного дефицита микрогетерогенность тироцитов приобретает патологический характер: тироциты, обладающие наибольшей способностью к пролиферации, в большей степени отвечают на гиперстимуляцию. Таким образом, формируется узловой и многоузловой эутиреоидный зоб. В результате скопления ряда соматических мутаций в участках узлового/многоузлового зоба с течением времени происходит развитие функциональной автономии щитовидной железы.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая симптоматика зависит от степени увеличения объема щитовидной железы и может либо отсутствовать, либо проявляться синдромом сдавления близлежащих органов (трахея, пищевод) или косметическим дефектом шеи. При формировании функциональной автономии возможна клиника тиреотоксикоза.
ДИАГНОСТИКА
Анамнез
Как правило, выявление узлового зоба является случайной клинической «находкой». При узловых образованиях больших размеров возможны деформация шеи, клинические симптомы компрессии пищевода и трахеи; при длительно существующем зобе (более 10-15 лет) необходимо исключать наличие функциональной автономии щитовидной железы. В анамнезе следует обязательно учитывать регион проживания пациента, семейный анамнез по заболеваниям щитовидной железы, предшествующее облучение головы и шеи.
Физикальное обследование
При осмотре шея пациента может быть не изменена, однако узловое образование в щитовидной железе может быть видно при запрокинутой назад голове. При пальпации может быть обнаружено либо одиночное узловое образование в щитовидной железе, либо несколько узлов. Пальпаторно оценивают болезненность узла, его консистенцию, смещаемость по отношению к окружающим тканям, распространение зоба за грудину (достижимость нижнего полюса при глотании). При узлах больших размеров (более 5 см в диаметре) может возникнуть деформация шеи, набухание шейных вен (бывает редко, только при очень значительных размерах узлов).
Лабораторные исследования
Инструментальные исследования
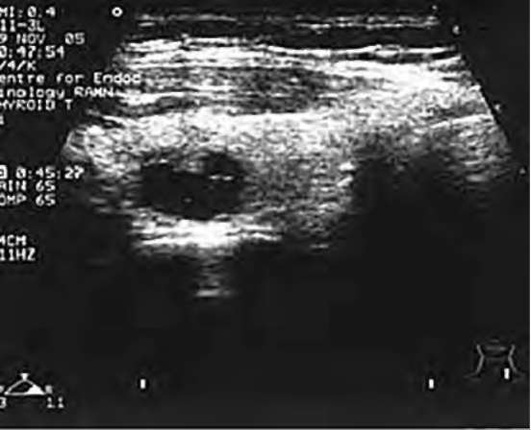
-
Абсолютным показанием для УЗИ является изменение щитовидной железы по данным пальпации и/или функциональные нарушения щитовидной железы по данным гормонального обследования, а также наличие облучения головы и шеи в анамнезе и отягощенный семейный анамнез по МРЩЖ.
-
Сцинтиграфия щитовидной железы с технецием 99m Тс - метод диагностики функциональной автономии щитовидной железы (рис. 13.6, см. цв. вклейку). Для исследования щитовидной железы используют также и три изотопа радиоактивного йода: 131 I, 125 I и 123 I. Из-за относительно большой лучевой нагрузки использование 131 I ограничено обнаружением функционирующих метастазов карциномы щитовидной железы. В связи с длительным периодом полураспада (60 дней)125 I практически не используется. Использование 123 I ограничено коротким периодом полураспада и высокой стоимостью. Основное показание для проведения сцинтиграфии щитовидной железы у пациентов с узловым зобом - дифференциальная диагностика различных видов тиреотоксикоза.
-
Сцинтиграфия щитовидной железы неинформативна для первичной диагностики узлового зоба (для обнаружения узлов и оценки их размеров) и не служит конкурирующим с УЗИ методом исследования для верификации пальпируемых образований щитовидной железы.
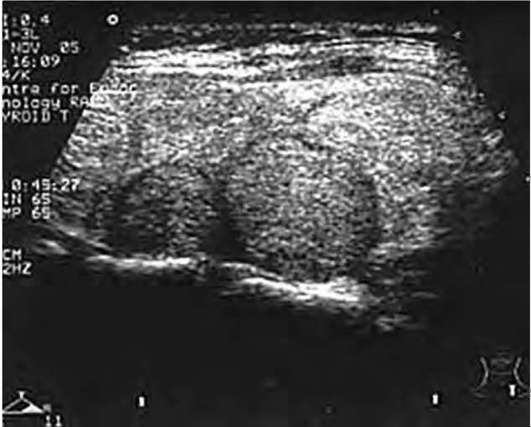
-
ТАБ щитовидной железы - метод прямой морфологической (цитологической) диагностики при узловом зобе, позволяет провести дифференциальную диагностику заболеваний, проявляющихся узловым зобом, и исключить злокачественную патологию щитовидной железы. Показания для проведения ТАБ:
-
узловые образования щитовидной железы, равные или превышающие в диаметре 1 см (обнаруженные при пальпации и/или УЗИ);
-
случайно диагностированные образования меньшего размера при подозрении на злокачественную опухоль щитовидной железы (по данным УЗИ) при условии технической возможности выполнить пункцию под контролем УЗИ (в настоящее время является дискутабельным вопросом).
-
-
При получении достаточного количества клеточного материала цитологическое исследование позволяет диагностировать узловой коллоидный зоб. При наличии большого количества пролиферирующих клеток (тиреоцитов) может устанавливаться диагноз активно пролиферирующего или аденоматозного (паренхиматозного) зоба. Данный тип цитологического заключения относится к категории доброкачественных (неопухолевых) образований - диагностическая категория II по системе Bethesda.
-
Как правило, при наличии верифицированного цитологического диагноза коллоидного или аденоматозного (паренхиматозного) зоба повторная ТАБ этого же узлового образования в динамике не рекомендуется.
-
Рентгенологическое исследование грудной клетки с контрастированием пищевода барием, а также МРТ и КТ щитовидной железы рекомендованы при наличии у пациента узлового/многоузлового коллоидного зоба больших размеров, при частично загрудинном или загрудинном расположении зоба.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику проводят с фолликулярной аденомой, АИТ с формированием ложных узлов, солитарной кистой, РЩЖ, а также с различными нетиреоидными заболеваниями (срединная киста шеи, липома, тимома и т.д.).
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При компрессионном синдроме необходима консультация хирурга. При наличии тиреотоксикоза - консультация радиолога, при наличии противопоказаний к РЙТ - консультация хирурга. При развитии синдрома тиреотоксического сердца и при подготовке к оперативному лечению необходима консультация кардиолога.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Узловой эутиреоидный коллоидный зоб степени 1 (ВОЗ, 2001).
ЛЕЧЕНИЕ
Тактика лечения узлового/многоузлового коллоидного зоба может быть различной (рис. 13.7).
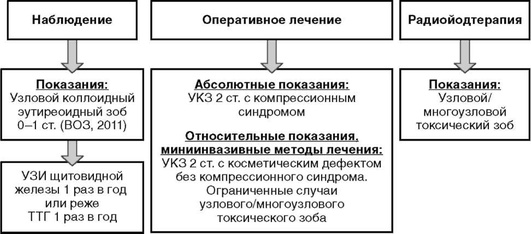
В подавляющем большинстве случаев метод выбора - динамическое наблюдение.
Цели лечения
Цель - устранение компрессионного синдрома, косметической деформации шеи, нормализация функционального состояния щитовидной железы.
Показания к госпитализации
Как правило, госпитализация не показана, кроме случаев узлового коллоидного зоба большого размера с компрессионным синдромом или тиреотоксикоза тяжелого течения.
Немедикаментозное лечение
Немедикаментозное лечение не проводят.
Медикаментозное лечение
Методов консервативного лечения узлового нетоксического зоба не существует.
Наблюдение - предпочтительная тактика при узловом коллоидном зобе небольшого размера, так как в настоящее время отсутствуют данные с высоким уровнем доказательности о том, что медикаментозное вмешательство или хирургическое лечение имеет значительные преимущества по увеличению продолжительности и повышению качества жизни пациентов. Под динамическим наблюдением подразумевают оценку функции щитовидной железы (определение содержания ТТГ) 1 раз в год и размеров узловых образований (УЗИ щитовидной железы) 1 раз в год или реже.
Оперативное лечение
Оперативное лечение показано при узловом (многоузловом) зобе с признаками компрессии окружающих органов и/или косметическим дефектом, обнаруженной декомпенсированной функциональной автономии. При изменениях в обеих долях операция выбора - тиреоидэктомия или предельно субтотальная резекция, так как при органосохраняющих операциях риск рецидива узлового зоба составляет 50-80%.
Мини-инвазивные методы лечения узлового коллоидного зоба
Включают: чрескожное введение склерозантов, криодеструкцию, лазеродеструкцию, диатермкоагуляцию узла.
Показания к мини-инвазивным вмешательствам крайне ограничены. Они могут быть использованы как метод выбора, когда необходимое радикальное лечение связано с высокой степенью риска по сопутствующим заболеваниям, и как альтернатива операции при узловом коллоидном зобе с косметическим дефектом. Цель указанных методов должна заключаться в устранении симптома, вызванного доминирующим узлом.
Любое мини-инвазивное вмешательство наряду с органосохраняющими операциями является симптоматической процедурой. Достижение полной регрессии узла при этом необязательно.
Радиойодтерапия
Является методом выбора при развитии тиреотоксикоза (декомпенсированная функциональная автономия щитовидной железы). Противопоказана при беременности.
Примерные сроки нетрудоспособности
Вопрос о нетрудоспособности ставят только при узловом коллоидном зобе с компрессионным синдромом или с тиреотоксикозом. Сроки нетрудоспособности напрямую зависят от возможных осложнений оперативного вмешательства или от тяжести течения тиреотоксикоза и в среднем составляют 7-14 дней. При проведении РЙТ может потребоваться госпитализация пациента в специализированную закрытую палату на несколько суток.
Дальнейшее ведение
Рекомендовано исследование концентрации ТТГ 1 раз в год и проведение УЗИ щитовидной железы один раз в год или реже. После проведения радикального лечения - соответственно алгоритму ведения гипотиреоза.
Информация для пациента
Узловые образования в щитовидной железе, которые не пальпируются и/или не превышают в диаметре 1 см, не имеют клинического значения и, как правило, не требуют активного диагностического поиска. Пальпируемые и/или превышающие в диаметре 1 см узловые образования делают необходимым проведение пункционной биопсии щитовидной железы. Подавляющее большинство узловых образований щитовидной железы представлены узловым коллоидным пролиферирующим в разной степени зобом небольшого размера, при котором в большинстве случаев показано динамическое наблюдение.
ПРОГНОЗ
При наличии диагноза узлового коллоидного зоба 0-1 ст., подтвержденного цитологически, прогноз для жизни и трудоспособности благоприятный. С течением времени возможно развитие функциональной автономии щитовидной железы, что диктует необходимость радикального лечения (метод выбора - терапия радиоактивным йодом). При развитии компрессионного синдрома прогноз определяется рисками оперативного вмешательства.
СПИСОК ЛИТЕРАТУРЫ
-
Дедов И.И., Мельниченко Г.А., Пронин В.С. и др. Клиника и диагностика эндокринных нарушений: Учебно-методическое пособие. - М., 2005.
-
Дедов И.И., Мельниченко Г.А., Фадеев В.В. и др. Клинические рекомендации Российской ассоциации эндокринологов по диагностике и лечению узлового зоба // Проблемы эндокринологии. - 2005. - №5. - С. 40-42.
-
Дедов И.И., Мельниченко Г.А., Андреева Е.Н. и др. Рациональная фармакотерапия заболеваний эндокринной системы и нарушений обмена веществ: Руководство для практикующих врачей / Под общ. ред. И.И. Дедова, Г.А. Мельниченко. - М.: Литтерра, 2006.
-
Эндокринная хирургия: Руководство для врачей / Под ред. И.И. Дедова, Н.С. Кузнецова, Г.А. Мельниченко. - М.: Литтерра, 2011. - 338 с.
-
AACE Management Guidelines for Patients with Thyroid Nodules and Differentiated Thyroid Cancer // Endocr. Pract. - 2006. - Vol. 12. - P. 63-102.
-
Manders J.M., Corstens F.H. Radioiodine therapy of euthyroid multinodular goiters // Europ. J. Nucl. Med. Mol. Imaging. - 2002. - Vol. 29, N 2. - P. 466-470.
-
Cooper S., Gerard M. Doherty, Bryan R. Haugen et al. Management Guidelines for Patients with Thyroid Nodules and Differentiated Thyroid Cancer // Thyroid. - 2006. - Vol. 16, N 2. - P. 1-33.
ПОДОСТРЫЙ ТИРЕОИДИТ
Свириденко Н.Ю., Абрамова Н.А.
СИНОНИМЫ
Гранулематозный тиреоидит; тиреоидит Де Кервена; вирусный тиреоидит; гигантоклеточный тиреоидит.
ОПРЕДЕЛЕНИЕ
Подострый тиреоидит - воспалительное заболевание щитовидной железы, предположительно, вирусной этиологии. Заболевание впервые описано в 1904 г. французским патологоанатомом Де Кервеном.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
Доля подострого тиреоидита в структуре заболеваний щитовидной железы составляет 1-5%. Чаще страдают люди в возрасте 30-60 лет; женщины болеют в 5 раз чаще мужчин. Обычно заболеванию предшествует вирусная инфекция. Число случаев подострого тиреоидита возрастает после эпидемий гриппа, аденовирусной инфекции, эпидемического паротита.
ПРОФИЛАКТИКА
Первичная профилактика отсутствует.
СКРИНИНГ
Не проводят.
КЛАССИФИКАЦИЯ
В развитии заболевания выделяют 4 стадии:
ЭТИОЛОГИЯ
Причиной подострого тиреоидита считают вирусную инфекцию. В пользу вирусной этиологии свидетельствуют:
Предполагаемые возбудители: вирус Коксаки, аденовирусы, вирус эпидемического паротита, ЕСНО-вирусы, вирусы гриппа и вирус Эпштейна-Барр. Существует генетическая предрасположенность к подострому тиреоидиту, так как заболеваемость выше у лиц с HLA-BW35.
ПАТОГЕНЕЗ
Обычно подострый тиреоидит развивается после перенесенной вирусной инфекции (грипп, корь, свинка и др.). Проникая внутрь клетки, вирус вызывает образование атипичных белков, на которые организм реагирует воспалительной реакцией. Воспалительный процесс в щитовидной железе приводит к деструкции фолликулярных клеток и фолликулов, потере фолликулами коллоида. Отмечается инвазия щитовидной железы полинуклеарными лейкоцитами, лимфоцитами, образуются гранулемы, которые содержат гигантские многоядерные клетки. Наряду с деструктивными изменениями наблюдается пролиферация тиреоидных клеток и образование новых фолликулов. Все содержимое поврежденного фолликула железы попадает в кровеносное русло (тиреотоксикоз без гиперфункции щитовидной железы).
КЛИНИЧЕСКАЯ КАРТИНА
Клинически подострый тиреоидит протекает как типичное воспалительное заболевание. Отмечается увеличение частоты заболеваемости в осенне-зимний период во время эпидемий вирусных заболеваний. Заболеванию обычно предшествует продромальный период, затем в области щитовидной железы появляются боли достаточной интенсивности, иррадиирующие в околоушную область, шею, затылок, иногда отмечается боль при глотании и поворотах головы. Щитовидная железа увеличена, болезненна при пальпации. Отмечается повышение температуры до 38-39 °C, слабость, потливость, раздражительность. В крови выявляется ускоренная СОЭ (до 40-60 мм/ч) при неизменном уровне лейкоцитов и небольшом лимфоцитозе.
При подостром тиреоидите в стадии интенсивных болей на УЗИ выявляется увеличение объема железы, появление в одной или в обеих долях зон пониженной эхогенности неправильной формы, без четких контуров. При динамическом наблюдении возможны миграция этих зон, появление их в других участках щитовидной железы. Изменения эхограммы сохраняются длительное время и после устранения болевого синдрома и нормализации СОЭ.
При исследовании функционального состояния щитовидной железы в острой стадии подострого тиреоидита за счет повышения проницаемости сосудов на фоне воспаления отмечается повышенный выброс ранее синтезированных тиреоидных гормонов и тиреоглобулина. Клинически в этот период заболевания у больных выявляются симптомы тиреотоксикоза, и дифференциальный диагноз проводится с диффузным токсическим зобом, токсической аденомой и болевой формой АИТ. Больных беспокоят слабость, потливость, раздражительность, тахикардия. В этот период отмечается снижение захвата радиоактивного йода или 99m Тс-пертехнетата щитовидной железой - основной дифференциально-диагностический критерий подострого тиреоидита и диффузного токсического зоба, при котором захват изотопа будет повышен.
В дальнейшем, вследствие нарушения синтеза тиреоидных гормонов и истощения их запасов в щитовидной железе, уровни Т3 и Т4 снижаются и происходит повышение выброса ТТГ. При этом захват изотопов увеличивается и появляются симптомы легкого гипотиреоза (вялость, сонливость, сухость кожи). В этой стадии подострый тиреоидит необходимо дифференцировать с АИТ и гипотиреозом. Подострый тиреоидит проходит спонтанно, обычно через несколько месяцев (4-6), иногда он рецидивирует, но стойкий гипотиреоз развивается в редких случаях.
ДИАГНОСТИКА
Физикальное обследование
Тиреотоксическую стадию отличают следующие признаки:
При пальпации щитовидная железа плотная, резко болезненная. В зависимости от степени вовлечения железы в воспалительный процесс болезненность может быть локальной или диффузной. Надо отметить, что встречаются и безболевые формы подострого тиреоидита.
Лабораторные исследования
Инструментальные исследования
При УЗИ обнаруживают увеличение щитовидной железы, «облаковидные» зоны пониженной эхогенности в одной или обеих долях. Описана миграция этих зон.
Данные сцинтиграфии указывают на снижение захвата РФП (табл. 13.7).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику проводят с другими патологиями щитовидной железы и нетиреоидными заболеваниями, которые сопровождаются болями в области шеи, ухе, нижней челюсти и нарушениями функции щитовидной железы:
Для подтверждения диагноза подострого тиреоидита проводят тест Крайля с назначением 20-30 мг/сут преднизолона. При подостром тиреоидите через 24-72 ч после приема преднизолона наблюдают уменьшение болезненности в области шеи и постепенное снижение СОЭ.
Клиническая картина |
Симптомы тиреотоксикоза. Боль в области щитовидной железы. Субфебрилитет. Симптомы острого инфекционно-воспалительного процесса |
Лабораторные исследования |
Тиреотоксикоз (не всегда). Высокая СОЭ. Отсутствие лейкоцитоза, часто лимфоцитоз |
Инструментальные исследования |
Снижение или отсутствие захвата РФП (деструктивный тиреотоксикоз). Нечетко ограниченные гипоэхогенные зоны при УЗИ |
Цитологическое исследование |
На фоне макрофагов, лейкоцитов, лимфоидных элементов, разрушенных фолликулов наличие гигантских многоядерных клеток |
Тест Крайля (терапия ex juvantibus) |
Через 12-48 ч после назначения преднизолона болевой синдром купируется и самочувствие значительно улучшается |
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При подозрении на фарингит или средний отит показана консультация оториноларинголога. Для исключения десневого или пародонтального абсцесса, синдрома височно-нижнечелюстного сустава показана консультация стоматолога.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Подострый тиреоидит, тиреотоксическая фаза.
ЛЕЧЕНИЕ
Цели лечения
Показания к госпитализации
Выраженный болевой синдром, выраженные симптомы тиреотоксикоза.
Медикаментозное лечение
Основным методом лечения подострого тиреоидита является применение глюкокортикоидов. Обычно назначают преднизолон в дозе 20-30 мг в сутки.
Критерием снижения дозы глюкокортикоидов служит уменьшение или исчезновение болей в щитовидной железе, нормализация СОЭ. Отсутствие клинического эффекта от применения глюкокортикоидов в течение 2 нед может быть диагностическим признаком иного характера патологического процесса в щитовидной железе. На фоне лечения глюкокортикоидами отмечается уменьшение объема щитовидной железы, положительная эхографическая динамика. Нормализация эхографической картины щитовидной железы у больных запаздывает по сравнению с нормализацией клинико-лабораторных данных.
Помимо глюкокортикоидов при подостром тиреоидите широко используют препараты НПВС (кроме салицилатов), предпочтительнее препараты пролонгированного действия (напроксен). Применение тиреостатиков в тиреотоксическую фазу нецелесообразно, так как тиреотоксикоз при подостром тиреоидите обусловлен ускоренным поступлением в кровь ранее синтезированных гормонов. Более предпочтительным является использование β-блокаторов. Симптомы гипотиреоза при подостром тиреоидите обычно имеют преходящий характер. При необходимости назначается заместительная терапия тиреоидными гормонами. В случаях положительного результата дозу глюкокортикоидов снижают и добавляют НПВС. При легких формах можно назначить только НПВС. После исчезновения болевого синдрома, снижения температуры тела, нормализации СОЭ дозу постепенно снижают вплоть до отмены.
Антибиотики не назначают - не эффективно.
Дальнейшее ведение
У пациентов с подострым тиреоидитом может быть рецидивирующее течение, которое требует возобновления приема глюкокортикоидов, контроль уровня ТТГ и тиреоидных гормонов, СОЭ, УЗИ щитовидной железы.
Информация для пациента
Подострый тиреоидит - заболевание щитовидной железы вирусной этиологии. Проявления заболевания: тиреотоксикоз, боли в области шеи, симптомы острого инфекционного процесса.
Диагноз подтверждают: тест Крайля с 20 мг преднизолона, высокая СОЭ, снижение уровня ТТГ и повышение уровня св. Т4 и св. Т3 . При лечении эффективны НПВС и глюкокортикоиды (преднизолон). Антибактериальную терапию не применяют. Лечение преднизолоном проводят в течение 2-3 мес. При быстром снижении дозы преднизолона отмечают усиление болевого синдрома. В большинстве случаев подострый тиреоидит заканчивается выздоровлением.
ПРОГНОЗ
Обычно подострый тиреоидит заканчивается полным выздоровлением через 1,5-2 мес. У ряда больных отмечают склонность к рецидивированию. При развитии стойкого гипотиреоза необходима пожизненная терапия тиреоидными гормонами.
СПИСОК ЛИТЕРАТУРЫ
-
Дедов И.И., Мельниченко Г.А., Пронин В.С. и др. Клиника и диагностика эндокринных нарушений: Учебно-методическое пособие. - М., 2005.
-
Дедов И.И., Мельниченко Г.А., Андреева Е.Н. и др. Рациональная фармакотерапия заболеваний эндокринной системы и нарушений обмена веществ: Руководство для практикующих врачей / Под общ. ред. И.И. Дедова, Г.А. Мельниченко. - М.: Литтерра, 2006.
-
Fatourechi V., Aniszewski J.P., Fatourechi G.Z. et al. Clinical features and outcome of subacute thyroiditis in an incidence cohort: Olmstead County, Minnesota, study // J. Clin. Endocrinol. Metab. - 2003. - Vol. 88. - P. 2100 - 2105.
-
Bindra A., Braunstein G.D. Thyroiditis // Am. Fam. Physician. - 2006. - Vol. 73. - P. 1769-1776.
РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Румянцев П. О.
СИНОНИМЫ
Карцинома щитовидной железы.
ОПРЕДЕЛЕНИЕ
РЩЖ - злокачественная эпителиальная опухоль, развивающаяся из фолликулярных или парафолликулярных клеток щитовидной железы. РЩЖ представлен пятью гистологическими типами: папиллярным (около 80-85% случаев), фолликулярным (10-15%), медуллярным (5%), низкодифференцированным (1%) и анапластическим (0,1-0,2%). Первые два относят к высокодифференцированным типам РЩЖ с учетом их биологической природы (из А- или В-клеток), клинического течения, тактики лечения и прогноза. Медуллярный рак происходит из парафолликулярных клеток (С-клеток), его клиническое течение отличается большей агрессивностью, до 30% случаев имеют наследственную этиологию, связанную с точковой онкомутацией в гене RET. Низкодифференцированный рак происходит из А- или В-клеток фолликулярного эпителия, имеет низкую гистологическую дифференцировку и более высокую опухолевую агрессию. Анапластический (недифференцированный) тип РЩЖ может происходить из любых клеток щитовидной железы, часто возникает в результате потери дифференцировки вышеозначенных гистологических типов.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
Удельный вес РЩЖ в структуре заболеваемости злокачественными новообразованиями в мире составляет от 1 до 3% всех впервые выявленных случаев. В 2012 г. заболеваемость РЩЖ в РФ составила 6,86 случаев на 100 тыс. населения в год. За десятилетие с 2002 по 2012 г. заболеваемость РЩЖ в РФ выросла на 19,5%, среднегодовой темп прироста составляет 1,8%. Во многом это связано с улучшением диагностики узлов в щитовидной железе с помощью УЗИ. В наибольшей степени это выражается в выявлении РЩЖ на стадии микрокарциномы (до 1 см), потенциал опухолевой агрессии которой чаще всего низкий. Вместе с тем это предоставило возможность выявлять клинически агрессивные карциномы щитовидной железы на более ранней стадии. С другой стороны, в России до сих пор сказываются медицинские последствия радиационной аварии на Чернобыльской атомной электростанции в 1986 г., в результате которой радиоактивными выбросами были загрязнены обширные территории ряда центральных и западных областей (особенно Брянской, Орловской, Тульской и Калужской). Заболеваемость РЩЖ среди населения, проживающего на данных территориях, и особенно среди лиц, подвергшихся облучению в детском и подростковом возрасте, стала расти через 5 лет после Чернобыльской аварии, достигнув своего пика спустя 10-12 лет, остается аномально высокой по сегодняшний день.
ПРОФИЛАКТИКА
Необходимо избегать ионизирующего лучевого воздействия на область щитовидной железы и нахождения в зоне радиоактивного загрязнения, особенно в детском и подростковом возрасте. Отсутствие йодного дефицита существенно снижает риск радиационно-индуцированного РЩЖ в облученной популяции. В случае радиационной катастрофы в целях блокады щитовидной железы осуществляется экстренная йодная профилактика.
СКРИНИНГ
Скрининг РЩЖ необходимо проводить в рамках специализированной диспансеризации молодого населения, проживающего на радиационно загрязненных территориях. Кроме того, повышенный риск развития РЩЖ имеют лица, ранее получившие лучевую терапию на область шеи (например, при лечении лимфогранулематоза). Семейный генетический скрининг необходимо проводить среди кровных родственников больного наследственной формой медуллярного рака с целью выявления носителей онкомутации в гене RET.
КЛАССИФИКАЦИЯ
Согласно гистологической классификации (ВОЗ, 2004), выделяют пять гистологических типов РЩЖ:
К редким злокачественным новообразованиям щитовидной железы относят плоскоклеточный рак, саркому и др.
Выделяют 15 гистопатологических вариантов папиллярной карциномы, некоторые из которых (диффузный склерозирующий, высококлеточный, столбчатоклеточный) имеют неблагоприятный клинический прогноз. Среди фолликулярных карцином высокой опухолевой агрессивностью отличается широинвазивный и низкодифференцированный варианты.
В настоящее время в клинической практике используется классификация злокачественных опухолей pTNM Международного противоракового союза 7-й редакции 2009 г. пересмотра.
-
-
Tx - первичная опухоль щитовидной железы не может быть оценена;
-
T2 - опухоль >2 см, но ≤4 см, ограниченная щитовидной железой;
-
Т3 - опухоль >4 см, ограниченная тканью или капсулой щитовидной железы, или опухоль любых размеров с минимальным распространением за пределы капсулы щитовидной железы (например, претиреоидные мышцы или мягкие ткани крыловидной ямки);
-
T4a - опухоль любого размера, распространяющаяся за пределы капсулы щитовидной железы в любую из следующих структур: подкожные мягкие ткани, гортань, трахею, пищевод, возвратный гортанный нерв;
-
T4b - опухоль, прорастающая предпозвоночную фасцию шеи, сосуды средостения или окружает внутреннюю сонную артерию.
-
-
Все анапластические карциномы щитовидной железы классифицируют как стадию T4:
-
Дополнительно: индексом m обозначается наличие множественных (более одного) очагов первичной опухоли в щитовидной железе.
-
Метастазы в регионарные лимфатические узлы (лимфатические узлы шеи I-VI уровней и верхнего средостения уровня VII):
-
N1 - наличие регионарных метастазов:
-
N1а - метастазы в центральную (VI) зону лимфооттока [претрахеальные, паратрахеальные и преларингеальные (Дельфиана) лимфатические узлы];
-
N1b - метастазы в боковые шейные лимфоузлы на стороне опухоли, с противоположной стороны или с обеих сторон (уровни I-V) или в лимфоузлы верхнего средостения (уровень VII).
-
-
-
M1 - наличие отдаленных метастазов. Стадирование опухоли осуществляется согласно следующим критериям гистологического типа карциномы, возраста пациента и распространенности опухоли (табл. 13.8).
Карцинома щитовидной железы |
|||
папиллярная, фолликулярная, низкодифференцированная |
медуллярная |
анапластическая |
|
Стадия I |
Больные до 45 лет Любая Т, Любая N, M0 Больные после 45 лет Т1 N0M0 |
Т1N0M0 |
|
Стадия II |
Больные до 45 лет Любая Т, Любая N, M1 Больные после 45 лет Т2N0M0 |
Т2-3N0M0 |
|
Стадия III |
Больные после 45 лет Т3N0M0 T1-3N1aM0 |
T1-3N1aM0 |
|
Стадия IVA |
Больные после 45 лет T1-3N1bM0 T4a Любая N M0 |
T1-3N1bM0 T4a Любая N M0 |
T4a Любая N M0 |
Стадия IVB |
Больные после 45 лет T4b Любая N M0 |
T4b Любая N M0 |
T4b Любая N M0 |
Стадия IVC |
Больные после 45 лет Любая T Любая N M1 |
Любая T Любая N M1 |
Любая T Любая N M1 |
ЭТИОЛОГИЯ
Этиология РЩЖ в большинстве случаев остается неясной, но уже известен ряд причин, вызывающих или значительно увеличивающих риск его возникновения. По предполагаемой этиологии РЩЖ выделяют спорадические, семейные (наследственные) и радиогенные случаи заболевания.
ПАТОГЕНЕЗ
Ионизирующее лучевое воздействие на щитовидную железу повышает риск развития папиллярного РЩЖ спустя несколько лет после облучения. До недавнего времени считали, что внешнее облучение имеет в 4 раза более сильный канцерогенный эффект, чем внутреннее, латентный период развития РЩЖ составляет 8 лет. Однако опыт ликвидации последствий чернобыльской аварии продемонстрировал столь же высокий канцерогенный потенциал внутреннего облучения и укорочение латентного периода до 4-5 лет. Усугубляющим фактором служит детский возраст на момент облучения, особенно уязвимым является возраст до 5 лет.
Семейный характер дифференцированного РЩЖ регистрируют в 3-7% случаев, однако наследственная предрасположенность не доказана. В то же время МРЩЖ в трети случаев имеет наследственную природу, при этом известен этиологический фактор - точковая онкомутация в гене RET. Различают три клинических варианта этого наследственного заболевания: семейный МРЩЖ, синдром МЭН 2А и 2В типов. Вариантов мутаций в гене RET при МРЩЖ описано более 30, наиболее частыми являются мутации в кодонах 634 и 620. Несомненна роль женских половых гормонов в этиопатогенезе РЩЖ, учитывая тот факт, что лица женского пола болеют РЩЖ примерно в 4-6 раз чаще мужчин, причем в репродуктивном возрасте (с 18 до 45 лет) соотношение М: Ж увеличивается до 1:8-1:12.
КЛИНИЧЕСКАЯ КАРТИНА
Наиболее частой причиной самостоятельного обращения к врачу служат такие неспецифические симптомы, как ощущение кома в горле, наличие объемного образования на шее, дискомфорт при глотании. Подозрителен на РЩЖ одиночный, плотный, фиксированный узел щитовидной железы, а также асимметричное безболезненное увеличение лимфатических узлов шеи в отсутствие причин лимфаденопатии воспалительного генеза. Настораживающим симптомом служит внезапно возникшая осиплость и односторонний (на стороне узла щитовидной железы) паралич гортани. В ряде случаев заболевание манифестирует асимметричным увеличением лимфоузлов шеи.
ДИАГНОСТИКА
Анамнез
Повышенный риск развития РЩЖ имеют лица с отягощенным семейным (случаи РЩЖ у кровных родственников) и радиационным (получавшие облучение на область головы и шеи или проживание в зоне радиоактивного загрязнения), особенно в детском и подростковом возрасте, анамнезом. Неблагоприятный анамнестический фактор - работа в условиях контакта с ионизирующим излучением. При подозрении на МРЩЖ во время сбора семейного анамнеза необходимо тщательно опросить кровных родственников на предмет наличия в семье случаев МРЩЖ или других компонентов синдрома МЭН-2: опухолей надпочечников и паращитовидных желез.
Физикальное обследование
При осмотре и пальпаторном обследовании шеи необходимо оценить локализацию, плотность, болезненность и смещаемость опухолевых узлов в проекции щитовидной железы, а также лимфатического коллектора шеи. Злокачественная опухоль в щитовидной железе чаще всего плотная и безболезненная, увеличение лимфатических узлов шеи на одноименной стороне должно настораживать.
Лабораторные исследования
При подозрении на опухоль щитовидной железы необходимо исследовать содержание кальцитонина в крови и при его повышении выполнить УЗИ и КТ надпочечников с целью исключения феохромоцитомы. У всех больных МРЩЖ необходимо проводить молекулярно-биологический анализ гена RET на предмет наличия герминальной (наследуемой) онкомутации. При обнаружении таковой целесообразно провести семейный генетический скрининг среди кровных родственников больного, в первую очередь среди детей.
Инструментальные исследования
УЗИ - основной метод в первичной оценке патологии щитовидной железы и регионарных лимфатических узлов шеи. Исследование шеи проводят линейным датчиком 7,5-10 МГц. Если узел щитовидной железы имеет нечеткие контуры, неправильную форму, кальцинаты, деформирована капсула железы - это должно насторожить врача о возможной злокачественной природе новообразования.
При выполнении УЗИ оценивается состояние зон регионарного лимфооттока для исключения метастатической диссеминации.
-
Центральная (VI) зона (преларингеальная, пре- и паратрахеальная, верхняя медиастинальная клетчатка) является первым лимфатическим барьером.
-
Боковая (II-V) зона (параюгулярные лимфоузлы) считается второй линией лимфатических узлов, поражаемых при РЩЖ.
-
Лимфатические узлы других уровней (I, VII) поражаются редко, как правило, после массивного метастатического поражения лимфатических узлов центральной и боковой зон лимфоттока.
-
При подозрении на асимметричное увеличение и/или изменение эхографических характеристик лимфатических узлов шеи необходимо назначить ТАБ под контролем УЗИ, которую разумно дополнить исследованием опухолевого маркера в смыве пункционной иглы: тиреоглобулина при папиллярном и фолликулярном РЩЖ и кальцитонина при МРЩЖ.
ТАБ с последующим цитологическим исследованием - «золотой» стандарт предоперационной дифференциальной диагностики РЩЖ. Чувствительность ТАБ ограничена неинформативными пунктатами и цитологической картиной «фолликулярной неоплазии (опухоли без возможности дополнительных уточнений)», под которой в 20% случаев скрывается злокачественная природа новообразования щитовидной железы. При заборе в достаточном количестве цитологического клеточного материала ТАБ в 80-96% случаев позволяет диагностировать РЩЖ и его гистологический тип - в 60-70% случаев. Чувствительность метода напрямую зависит от качества пункционного материала и опыта цитолога. В случае неинформативных мазков ТАБ рекомендуют повторить.
ТАБ целесообразно использовать для уточнения морфологической характеристики впервые выявленных и/или увеличивающихся в размерах узлов щитовидной железы, при достижении ими размера 1 см. Технически образование щитовидной железы можно пунктировать начиная с 3-4 мм, однако распространенность таких узлов в популяции довольно высока, а потенциал их злокачественности чаще всего невысокий. Поэтому Европейская тиреоидная ассоциация, как и Российская ассоциация эндокринологов, считает целесообразным выполнение ТАБ при размерах узла от 1 см. Тем не менее при наличии ультразвуковых признаков злокачественности (кальцинаты, нечеткие контуры, признаки выхода за пределы капсулы щитовидной железы), особенно при асимметрично увеличенных на стороне опухоли щитовидной железы регионарных лимфатических узлах, ТАБ следует выполнять независимо от размера образований. Пункцию необходимо выполнять под контролем УЗИ.
Сцинтиграфия шеи с 99m Тс-пертехнетатом или радиоактивным йодом (123 I, 131 I) не дает информации о морфологической природе опухоли, а лишь о ее функциональных свойствах. Исследование следует назначать при подозрении на гипертиреоз, возможно связанный с наличием функциональной автономии («токсическая аденома», многоузловой токсический зоб). Рентгенологические методы исследования, МРТ, сцинтиграфия (технетрил, пирфотех), ПЭТ имеют вспомогательную роль в диагностике РЩЖ, и их используют для оценки распространенности опухоли.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальную диагностику проводят с доброкачественными опухолями (аденома), узловым зобом, узловыми формами тиреоидита, тиреоидитом Риделя.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При нарушении голоса необходима консультация отоларинголога.
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Папиллярный РЩЖ, pT3m N1a M0 (стадия III).
ЛЕЧЕНИЕ
Цели лечения
Радикальное хирургическое удаление местно-распространенных случаев заболевания и комбинированное лечение потенциально диссеминированных форм РЩЖ.
Показания к госпитализации
Подозрение на опухоль щитовидной железы, РЩЖ.
Хирургическое лечение
Хирургическое лечение РЩЖ эффективнее и безопаснее проводить в специализированном медицинском учреждении руками опытных хирургов, выполняющих не менее 50 операций на щитовидной железе в год (международный стандарт).
План лечения высокодифференцированного (папиллярного и фолликулярного) РЩЖ предполагает хирургическое вмешательство, которое часто дополняют терапией радиоактивным йодом. Выбор тактики лечения высокодифференцированного РЩЖ определяется в зависимости от клинической группы риска по развитию рецидива/прогрессирования заболевания (рис. 13.8).
В высокой и умеренной группах риска операцией выбора является тиреоидэктомия, которая может быть дополнена превентивным (при отсутствии на УЗИ увеличенных лимфоузлов) удалением центральной клетчатки шеи (VI уровень). Футлярно-фасциальное иссечение боковой клетчатки шеи (II-V) производится при диагностированном на дооперационном этапе метастатическом поражении лимфатических узлов. Фасциально-футлярное иссечение клетчатки шеи выполняют на стороне опухоли или с обеих сторон при установлении метастатического поражения лимфатических узлов латерального лимфатического коллектора. Подобный подход к выбору объема операции достоверно снижает частоту рецидива опухоли и сопряжен с минимальным риском осложнений в руках опытного хирурга. Кроме того, это делает возможным после хирургического вмешательства аблацию радиоактивным йодом и последующий адекватный мониторинг.
Гемитиреоидэктомия может быть выполнена при солитарной опухоли до 1 см, расположенной внутри щитовидной железы, без признаков интратиреоидной, регионарной и отдаленной диссеминации (стадия T1aN0M0). Гемитиреоидэктомию желательно дополнить превентивным удалением паратрахеальной клетчатки на стороне опухоли. Превентивное удаление прилежащей к доле паратрахеальной клетчатки оправдано ввиду высокой (до 60%) частоты скрытых метастазов в лимфатические узлы. При размере опухоли менее 5 мм превентивное удаление паратрахеальной клетчатки нецелесообразно и его выполняют только в случае выявления при УЗИ увеличенных лимфатических узлов.
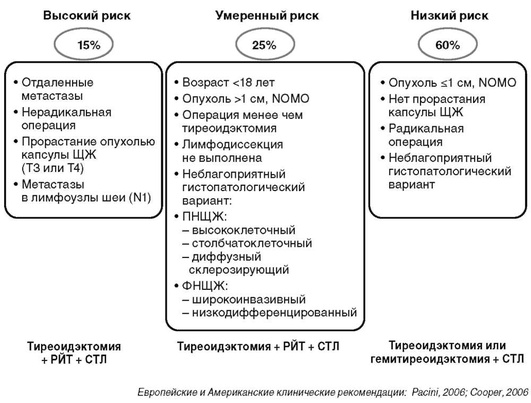
При МРЩЖ только хирургическое вмешательство может обеспечить радикальность лечения, поэтому, учитывая высокий потенциал опухолевой диссеминации (как интратиреоидной, так и регионарной), минимальный объем операции при любых размерах медуллярной карциномы - тиреоидэктомия с центральной лимфодиссекцией (VI уровень). Футлярно-фасциальное иссечение клетчатки шеи на стороне поражения выполняют при подозрении на метастазы в боковые лимфатические узлы шеи, а также при размерах первичной опухоли более 3 см и/или экстратиреоидном распространении опухоли (стадия T4). При наследственных формах МРЩЖ во время операции производят ревизию паращитовидных желез, которые в случае гиперплазии удаляют. До операции необходимо провести обследование, направленное на исключение феохромоцитомы. При диагностике сопутствующей феохромоцитомы на первом этапе выполняют ее удаление, а на втором этапе - хирургическое лечение МРЩЖ.
Анапластический РЩЖ на хирургически резектабельной стадии встречается исключительно редко. В таких случаях тиреоидэктомию с удалением центральной клетчатки и фасциально-футлярным иссечением клетчатки шеи (по показаниям) на стороне опухоли выполняют через 2-3 нед после дистанционной лучевой терапии суммарной очаговой дозой 40 Грей.
В целях повышения безопасности хирургического лечения должны применяться анатомо-хирургические подходы при удалении en block щитовидной железы и зон регионарного лимфооттока. В целях профилактики непреднамеренного повреждения во время операции ветвей двигательных нервов (возвратный и верхний гортанные нервы, добавочный нерв и др.) дополнительно к хирургической технике их визуализации целесообразно пользоваться методом интраоперационного нейромониторинга. Последний позволяет не только обнаружить нерв, но и убедиться в его функциональной сохранности.
Лучевая терапия
РЙТ 131 I - составная часть комбинированной схемы лечения, применяемой при папиллярном, фолликулярном и низкодифференцированном РЩЖ. Цели лучевой радионуклидной терапии:
Последовательность подготовки и проведения
-
Первый курс РЙТ, так называемая радиойодаблация (через 3-6 нед после операции). Если есть сомнения в полноценности тиреоидэктомии, перед радиойодаблацией выполняют так называемый радиойодтест (назначают небольшую диагностическую дозу радиоактивного йода). Если накопление в проекции шеи через 24 ч превышает 20%, рекомендуют повторную операцию на щитовидной железе.
-
Контроль уровня ТТГ, тиреоглобулина и антител к тиреоглобулину через 3 мес.
-
Отмена левотироксина натрия (за месяц) или лиотиронина (за 12 дней).
-
Повторный курс РЙТ или радиойоддиагностики (по показаниям). Необходимо отметить, что РЙТ далеко не всегда эффективна в лечении нерезектабельных очагов рецидива или отдаленных метастазов дифференцированных типов (папиллярного, фолликулярного) РЩЖ и очень редко при низкодифференцированных карциномах. При выявлении радиойодрезистентных (не накапливающих йод) очагов опухоли или прогрессировании опухоли на фоне РЙТ встает вопрос об альтернативной системной терапии. Химиотерапия и дистанционная лучевая терапия не продемонстрировали значимой эффективности, не без учета высокой токсичности первой. В последнее время при радиойодрезистентных метастазах дифференцированных типов РЩЖ в качестве терапии выбора рассматривается применение мультикиназных ингибиторов, первым среди которых доказал свою эффективность и безопасность сорафениб (нексавар♠ ). Алгоритм принятия решений при выявлении радиойодрезистентных метастазов дифференцированных типов РЩЖ приведен на рис. 13.9.
При прорастании опухоли в трахею и/или пищевод, и/или возвратный гортанный нерв во время хирургического вмешательства рекомендуют производить иссечение опухоли таким образом, чтобы сохранить целостность этих органов (структур). В последующем выполняется РЙТ, по показаниям может быть дополнительно назначена дистанционная лучевая терапия на область резидуальной опухоли узким полем с бустированием суммарной очаговой дозой 60 Гр.
При операбельном анапластическом РЩЖ рекомендуется предоперационный курс дистанционной лучевой терапии суммарной очаговой дозой 40 Гр на первичный очаг и зоны регионарного лимфооттока, после чего выполняется операция. В неоперабельных случаях проводят дистанционную лучевую терапию по радикальной программе до суммарной очаговой дозы 60 Гр в режиме гиперфракционирования на фоне введения паклитаксела (или аналога).
Медикаментозное лечение
После хирургического или комбинированного лечения папиллярного, фолликулярного и низкодифференцированного РЩЖ назначают гормональную терапию левотироксином натрия в дозе, вызывающей подавление (супрессию) секреции ТТГ гипофизом до уровня ≤0,1 мЕД/л (международных единиц на литр). Для определения начальной дозы левотироксина натрия учитывают объем операции на щитовидной железе, возраст и массу тела пациента. Коррекцию терапии осуществляют через 2-3 мес после назначения. Дозу считают адекватно подобранной, если при эутиреоидном клиническом состоянии больного концентрация ТТГ в сыворотке крови ниже нижней границы диапазона референсных значений нормы, а содержание Т4 - на верхней границе. Современные принципы супрессивной терапии левотироксином натрия больных дифференцированным РЩЖ представлены в табл. 13.9. В табл. 13.10 представлены критерии отнесения пациентов к группам риска по развитию осложнений супрессивной терапии левотироксином натрия.
Риск рецидива/прогрессирования опухоли |
||||
высокий |
умеренный |
низкий |
||
Риск осложнений супрессивной терапии левотироксином натрия |
Высокий |
<0,1 мЕ/л при наличии рецидива/прогрессирования опухоли 0,1-0,5 при отсутствии рецидива/прогрессирования через 5 лет наблюдения |
0,5-1 мЕ/л при отсутствии рецидива/прогрессирования опухоли в течение 5 лет, далее 1-2 мЕ/л |
1-2 мЕ/л |
Умеренный |
<0,1 мЕ/л при наличии рецидива/прогрессирования опухоли 0,1-0,5 при отсутствии рецидива/прогрессирования через 10 лет наблюдения |
0,1-0,5 мЕ/л при отсутствии рецидива/прогрессирования опухоли в течение 10 лет, далее 1-2 мЕ/л |
1-2 мЕ/л |
|
Низкий |
<0,1 мЕ/л при наличии рецидива/прогрессирования опухоли 0,1-0,5 МЕ/л при отсутствии рецидива/прогрессирования через 10 лет наблюдения |
0,1-0,5 мЕ/л при отсутствии рецидива/прогрессирования опухоли в течение 10 лет, далее 0,3-2 мЕ/л |
0,3-2 мЕ/л |
|
| Группа риска | Критерии |
|---|---|
Низкая |
Молодой или средний возраст Отсутствие симптомов Нет сердечно-сосудистых заболеваний и/или риска их развития Нет нарушений ритма Нет симптомов андрогенной гиперфункции Женщины в пременопаузе Нормальная костная плотность Нет остеопороза и остеопении |
Умеренная |
Пожилой возраст АГ Симптомы или проявления андрогенной гиперфункции Курение Факторы риска сердечно-сосудистых заболеваний СД Менопауза Остеопения Факторы риска остеопороза |
Высокая |
Клиническое проявление ИБС Постменопауза Остеопороз Тяжелые сопутствующие заболевания |
При МРЩЖ и анапластическом РЩЖ назначается заместительная терапия левотироксином натрия.
Примерные сроки нетрудоспособности
От 7 до 14 дней в зависимости от объема операции. Если больному планируют РЙТ, ему предварительно отменяют гормоны щитовидной железы, что приводит к потере трудоспособности за 12 дней до лечения и от 5 до 10 дней после диагностики и лечения с применением радиоактивного йода соответственно.
Дальнейшее ведение
Больные, прооперированные по поводу РЩЖ, подлежат обязательному диспансерному наблюдению онкологом и эндокринологом. Периодичность контрольных обследований не реже одного раза в полгода. Через пять лет - не реже одного раза в год.
Объем диагностических исследований при контрольных обследованиях пациентов дифференцированным РЩЖ включает:
У больных после тиреоидэктомии и успешной радиойодаблации тиреоглобулин в крови не должен определяться. При его появлении в анализе крови пациент должен быть подвергнут углубленному обследованию на фоне отмены в течение месяца левотироксина натрия (состояние глубокого гипотиреоза), либо на фоне введения рекомбинантного человеческого тиреотропина (тирогенρ ) с включением в состав диагностических мероприятий анализа крови на тиреоглобулин и антитела к нему, сцинтиграфии всего тела с радиоактивным 123 I или 131 I (2-10 мКи). При выявлении рецидива заболевания решают вопрос о повторном хирургическом вмешательстве и/или РЙТ.
У больных МРЩЖ в послеоперационном периоде определяют содержание кальцитонина и ракового эмбрионального антигена. Данные показатели являются критериями радикальности проведенного хирургического лечения и маркерами рецидива опухоли. Прогностическое значение имеет скорость нарастания уровня кальцитонина и ракового эмбрионального антигена в крови. Если время удвоения уровня кальцитонина и/или ракового эмбрионального антигена меньше 6 мес, прогноз является неблагоприятным. Удвоение концентраций в течение от 6 мес до 12 мес - прогноз умеренно благоприятный. Более года - прогноз сравнительно благоприятный.
У всех больных МРЩЖ проводят забор крови для определения герминальной мутации в гене RET. При обнаружении герминальной RET-мутации (а также отягощенном семейном анамнезе) диагностируют наследственную форму МРЩЖ (синдром МЭН-2) и далее проводят обследование, направленное на выявление других компонентов синдрома МЭН-2А и МЭН-2В (гиперпаратиреоз и опухоли надпочечников). При выявлении наследственного МРЩЖ необходимо обследовать всех ближайших кровных родственников пациента на носительство герминальной RET -мутации и при ее обнаружении обследовать родственника-носителя мутантного гена на наличие клинических симптомов МЭН-2.
ПРОГНОЗ
Прогноз при папиллярном и фолликулярном РЩЖ чаще всего благоприятный. Применение современных подходов к лечению позволяет достичь показателя 10-летней выживаемости не менее чем у 94% больных. При медуллярном РЩЖ прогноз в значительной степени зависит от наличия регионарных метастазов на момент выявления заболевания. При отсутствии метастазов 10-летняя выживаемость находится на уровне 80-90%, при наличии метастазов не превышает 40%. Выполнение обширных хирургических вмешательств повышает вероятность радикальности излечения. Отдаленные метастазы значительно ухудшают прогноз. Анапластический РЩЖ - прогностически самая неблагоприятная гистологическая форма РЩЖ, и она слабо чувствительна к терапии. В лечении его используют дистанционную лучевую терапию и/или химиотерапию, хирургически резектабельные случаи очень редки. Выживаемость чаще всего не превышает одного года.
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
РЩЖ при условии его адекватного лечения чаще всего имеет благоприятный прогноз, за исключением медуллярных, низкодифференцированных и анапластических карцином. Основной метод лечения - хирургический, который часто дополняют терапией радиоактивным йодом. После хирургического или комбинированного лечения назначают терапию левотироксином натрия с рекомендацией наблюдения у онколога и эндокринолога. Период наблюдения составляет от 10 до 40 лет в зависимости от гистологического типа опухоли. Получать лечение и наблюдаться при РЩЖ эффективнее и безопаснее в специализированных медицинских учреждениях, способных оказывать профилактическую, диагностическую и лечебную помощь в соответствии с международными стандартами.
СПИСОК ЛИТЕРАТУРЫ
-
Микрокарцинома щитовидной железы / Лушников Е.Ф., Втюрин Б.М., Цыб А.Ф. и др. - М.: Медицина, 2003.
-
Рак щитовидной железы: Современные подходы к диагностике и лечению / Румянцев П.О., Ильин А.А., Румянцева У.В., Саенко В.А. - М.: ГЭОТАР-Медиа, 2009. - 448 с.
-
Румянцев П.О., Коренев С.В., Румянцева У.В. Современные принципы терапии левотироксином после операции у больных высокодифференцированным раком щитовидной железы // Опухоли головы и шеи. - 2013. - №2. - С. 5-8.
-
Brandi M.L., Gagel R.F., Angeli A. et al. Consensus: Guidelines for Diagnosis and Therapy of MEN Type 1 and Type 2 // J. Clin. Endocrinol. Metab. - 2001. - Vol. 86. - P. 5658-5671.
-
Cooper D.S., Doherty G.M., Haugen B.R. et al. Management Guidelines for Patients with Thyroid Nodules and Differentiated Thyroid Cancer // Thyroid. - 2006. - Vol. 16. - P. 1-33.
-
Pacini F., Schlumberger M., Dralle H. et al. European consensus for the management of patients with differential thyroid carcinoma of the follicular epithelium // Eur. J. Endocrinol. - 2006. - Vol. 154. - P. 787-803.
-
Werner & Ingbar?s the thyroid: a fundamental and clinical text. - 8th ed. / Ed.L. E. Braverman, R.D. Utiger. - 2000. - P. 875-1006.
ЭНДОКРИННАЯ ОФТАЛЬМОПАТИЯ
Липатов Д.В., Свириденко Н.Ю.
В 1786 г. Галеб Перри из Уэльса, в 1835 г. Роберт Грейвс из Дублина и в 1840 г. Карл фон Базедов описали пациентов с увеличением щитовидной железы, сердцебиениями и протрузией глазных яблок. С этого времени гиперфункцию щитовидной железы стали рассматривать как основную причину экзофтальма. Более детально ЭОП начали изучать в конце 40-х годов ХХ в. Экзофтальм пытались объяснить разными причинами, в том числе продукцией гипофизом фрагментов ТТГ с экзофтальмическим фактором и общими антигенами в тиреоидной и ретро-бульбарной ткани. В настоящее время ЭОП рассматривается как самостоятельное заболевание, которое встречается не только при тиреотоксикозе, но и при АИТ и даже в отсутствие патологии щитовидной железы.
СИНОНИМЫ
Офтальмопатия Грейвса; тиреотоксический, эндокринный экзофтальм; инфильтративная, тиреоидная, эутиреоидная, дистиреоидная и ЭОП, аутоиммунная офтальмопатия.
ОПРЕДЕЛЕНИЕ
ЭОП - аутоиммунное заболевание с вовлечением мягких тканей орбиты (ретробульбарной клетчатки, экстраокулярных мышц) и вспомогательного аппарата глаза (век, роговицы, конъюнктивы, слезной железы), приводящее к развитию экзофтальма и комплексу глазных симптомов.
КОД ПО МКБ-10
ЭПИДЕМИОЛОГИЯ
ЭОП возникает в любом возрасте. Женщины болеют этим заболеванием в 2-5 раз чаще, чем мужчины. Пики развития заболевания приходятся на 40-44, 60-64 года у женщин и на 45-49, 65-69 лет у мужчин. ЭОП обнаруживается примерно у трети пациентов с диффузным токсическим зобом, однако с появлением новых методов исследования диагностика ЭОП значительно улучшилась, и, соответственно, частота выявления заболевания возросла. ЭОП может сочетаться с другой аутоиммунной патологией, как эндокринной, так и не эндокринной. В 95% случаев ЭОП развивается на фоне диффузного токсического зоба, в 5% случаев - на фоне АИТ. Согласно данным G. Bartley (1994), ежегодно ЭОП диагностируется у 16 женщин и у 2,9 мужчин на 100 000 населения.
ПРОФИЛАКТИКА
Профилактику ЭОП условно можно разделить на первичную и вторичную. Первичная направлена на предупреждение развития заболевания путем воздействия на факторы риска (изменение функции щитовидной железы, курение, стрессы), а вторичная - на раннее выявление заболевания, когда оно еще не проявляет себя клинически, особенно в случае, если раннее выявление будет способствовать улучшению результатов лечения.
СКРИНИНГ
Не проводится.
КЛАССИФИКАЦИЯ
Первая систематическая классификация ЭОП была опубликована в 1969 г. Американской тиреоидной ассоциацией под руководством С. Вернера. В 1977 г. была издана переработанная классификация NOSPECS (табл. 13.11). Она определяет степень функциональных и косметических нарушений на любой из стадий/фаз заболевания независимо от активности процесса.
| Класс | Стадия | Клинические проявления |
|---|---|---|
0 (No signs or symptoms) |
Отсутствие патологических изменений и симптомов со стороны глаз |
|
1 (Only signs) |
Единичные симптомы |
|
2 (Soft tissue involvement) |
Изменения мягких тканей орбиты |
|
0 |
отсутствуют |
|
а |
незначительно выражены |
|
b |
умеренно выражены |
|
с |
резко выражены |
|
3 (Proptosis) |
Экзофтальм |
|
0 |
отсутствует |
|
а |
незначительно выражен (3-4 мм больше нормы) |
|
b |
умеренно выражен (5-7 мм больше нормы) |
|
с |
резко выражен (=8 мм) |
|
4 (Extraocular muscle involvement) |
Изменение экстраокулярных мышц |
|
0 |
отсутствует |
|
а |
ограничение движения глазных яблок в крайних отведениях |
|
b |
ограничение движения глазных яблок |
|
с |
фиксированное глазное яблоко (одно или оба) |
|
5 (Сorneal involvement) |
Изменение роговицы |
|
0 |
отсутствует |
|
а |
сухость |
|
b |
изъязвление |
|
с |
помутнение, некроз, перфорация |
|
6 (Sight loss) |
Снижение зрения |
|
0 |
отсутствует |
|
а |
незначительно выражено (острота зрения 0,63-0,5) |
|
b |
умеренно выражено (острота зрения 0,4-0,1) |
|
с |
резко выражено (менее 0,1) |
|
NOSPECS |
||
В отечественной практике офтальмологи используют классификацию А.Ф. Бровкиной и соавт. (1985), в которой выделяются три формы ЭОП:
Другой клинической характеристикой ЭОП является активность. Под активностью понимают воспалительную фазу заболевания, при которой активно манифестируют и прогрессивно нарастают клинические проявления ЭОП. В неактивную фазу ЭОП процесс остается стабильным несмотря на то, что у пациента сохраняются функциональные и косметические дефекты. Оценка активности необходима с клинических позиций, так как определяет выбор и тактику лечения пациента.
Шкала активности ЭОП Clinical activity score (табл. 13.12) была предложена M.P. Mourits с соавторами в 1989 г. Она представляет собой простую систему оценки в баллах, позволяющую разделить пациентов на лиц с активной и неактивной стадией заболевания. Активность оценивается максимально в 7 баллов, по наличию 2 симптомов и 5 признаков воспаления.
1. Болезненное чувство давления за или перед глазами (спонтанная ретробульбарная болезненность) |
2. Боль при попытках посмотреть вверх, в стороны или вниз (боль при движении глаз) |
3. Краснота (эритема) века (век) |
4. Покраснение конъюнктивы |
5. Припухлость (отек) века (век) |
6. Хемоз |
7. Отек слезного мясца или плики (полулунной складки) |
Количество баллов по шкале Clinical activity score |
Верификация активности проводится на основании осмотра и опроса пациента. За наличие одного симптома дается 1 балл. Об активности процесса свидетельствует суммарный балл по данной шкале 3 и более.
ЭТИОЛОГИЯ
Среди пусковых факторов заболевания рассматривают вирусную (ретрови-русы) или бактериальную (Yersinia enterocolitica) инфекции, токсины, курение, радиацию, стрессы.
В основе патологического процесса ЭОП лежит поражение мягких тканей глазницы на фоне нарушенной функции щитовидной железы, характер и степень поражения которой могут быть различными. По данным А.Ф. Бровкиной с соавт. (1993), при длительном наблюдении за больными с ЭОП дисфункция щитовидной железы была обнаружена у 81,5% больных, из них у 73,4% - гиперфункция, у 8,1% - гипофункция; у 18,5% больных на фоне выраженной картины ЭОП - эутиреоидное состояние.
Четкой генетической предрасположенности к ЭОП не выявлено. С предрасположенностью к ЭОП ассоциируется ген CTLA4. Полиморфизм аллели G в экзоне 1 CTLA4 A/G также ассоциируется с ЭОП (отношение шансов: 1.65). Частота аллели G коррелирует с тяжестью ЭОП. С ЭОП ассоциируется аллель T в интроне 1 CTLA4 C/T, но не полиморфизм CTLA4 C/T в промоторе (отношение шансов: 1.70).
ПАТОГЕНЕЗ
Существует несколько теорий патогенеза ЭОП.
-
Первая теория. В качестве возможного механизма рассматривается перекрестное реагирование антител к тканям щитовидной железы с тканями глазницы, наиболее часто встречающееся при диффузном токсическом зобе. На это указывает частое сочетание (в 70% случаев) ЭОП и диффузного токсического зоба, частое одновременное их развитие, уменьшение выраженности глазных симптомов при достижении эутиреоза. Обнаружение экспрессии рецептора ТТГ в орбитальной жировой и соединительной ткани у пациентов с ЭОП позволило предположить, что таким общим антигеном является рецептор ТТГ. В ряде исследований показано, что между активностью ЭОП и уровнем антител к рецептору ТТГ существует прямая зависимость. В настоящее время орбитальные фибробласты рассматриваются как главная мишень аутоиммунного процесса, на которых в процессе дифференцировки из преадипоцитов повышается экспрессия рецептора ТТГ. Под действием стимуляции провоспалительными цитокинами орбитальные фибробласты взаимодействуют с активированными аутореактивными иммунными клетками, присутствующими в орбитальных тканях. В результате они продуцируют избыток гликозаминогликанов, пролиферируют и могут дифференцироваться в адипоциты и секретировать цитокины, хемокины и избыток простаглан-динов E2. С другой стороны, экспрессия рецептора ТТГ в орбитальной ткани выявляется и у больных диффузным токсическим зобом без ЭОП, и не у всех пациентов с высоким уровнем антител к рецептору ТТГ развивается ЭОП.
-
Вторая теория рассматривает ЭОП как самостоятельное аутоиммунное заболевание с преимущественным поражением ретробульбарных тканей. Под действием пусковых механизмов у генетически предрасположенных лиц в мягких тканях глазницы экспрессируются аутоантигены. При ЭОП существует антиген-специфический дефект Т-супрессоров, что делает возможным выживание и размножение клонов Т-хелперов, направленных против аутоантигенов щитовидной железы и мягких тканей глазницы. В ответ на появление аутоантигенов Т-лимфоциты и макрофаги, инфильтрируя мягкие ткани, высвобождают цитокины, которые индуцируют образование молекул major histocompatibility complex класса II, молекул адгезии и белков теплового шока. Цитокины стимулируют пролиферацию фибробластов, выработку коллагена и гликозаминогликанов, которые с белками образуют протеогликаны, способные связывать воду и вызывать отек мягких тканей глазницы. При тиреотоксикозе дефект иммунологического контроля усугубляется: при декомпенсированном диффузном токсическом зобе уменьшается количество Т-супрессоров, снижается активность естественных киллеров, что приводит к синтезу аутоантител В-лимфоцитами и запуску аутоиммунных реакций.
Развитие ЭОП при гипотиреозе можно объяснить следующим образом. В норме Т3 ингибирует синтез гликозаминогликанов. При дефиците Т3 ингибирующий эффект уменьшается. Кроме того, высокий уровень ТТГ приводит к увеличению экспрессии HLA-DR на тиреоцитах, что усиливает патологический процесс.
Увеличение объема глазодвигательных мышц и ретробульбарной клетчатки приводит к повышению ретробульбарного давления в замкнутой костной полости и развитию характерной клинической картины.
КЛИНИЧЕСКАЯ КАРТИНА
Основными начальными проявлениями ЭОП являются: экзофтальм, периорбитальные отеки и глазодвигательные нарушения.
Развитие экзофтальма связано с анатомическими особенностями орбиты. Орбита представляет собой замкнутое пространство, неспособное к растяжению, поскольку она ограничена со всех сторон четырьмя костными стенками. Как правило, больные жалуются на боли или чувство тяжести, сдавления, распирания в орбите и на выпячивание глазного яблока. Нарастание экзофтальма сопровождается линейным натяжением экстраокулярных мышц с ограничением их подвижности и зрительного нерва с последующим развитием оптической нейропатии. Периорбитальные отеки создают картину отечного экзофтальма. На стадии выраженной клинической симптоматики отек век сопровождается гиперемией кожи или даже некоторой синюшностью (из-за венозного стаза). Отечность чаще локализуется в области верхнего века, но может захватывать и нижнее. У пациентов с отечным экзофтальмом в процесс вовлекается слезная железа. Она увеличивается в объеме и может смещаться к наружному краю верхней орбитальной стенки или наоборот кзади, вызывая асимметрию положения век. На стороне, где вовлечена слезная железа, может появиться валикообразный или подушкообразный отек верхнего века и незначительный птоз. При этом в области верхнего века может быть пропальпировано опухолевидное образование. Вовлечение в патологический процесс слезной железы сопровождается усилением слезопродукции и появлением слезотечения. По мере того, как проптоз и ширина глазной щели увеличиваются, компенсаторные возможности слезной железы по выработке секрета истощаются, развивается синдром «сухого» глаза. Отек конъюнктивы (хемоз) проявляется ее утолщением, которая при этом слегка приподнимается над склерой. Хемоз может быть «белым» и «красным». Увеличение ширины глазной щели приводит к увеличению испарения слезы, что вместе с нарушением процесса моргания вызывает развитие точечных поверхностных эрозий и симптомов раздражения поверхности глаза.
Вовлечение в воспалительный процесс экстраокулярных мышц, осуществляющих движения глазного яблока, сопровождается изменением положения глаза в орбите и нарушением его глазодвигательных функций. Клинически это проявится косоглазием, отсутствием слаженной координации движений глазных яблок, недостаточностью конвергенции и ослаблением аккомодации, т.е. развитием глазодвигательных нарушений, что при наличии асимметрии приводит к возникновению диплопии. На фоне сформировавшегося в течение 6-12 мес фиброза экстраокулярных мышц развивается стойкое косоглазие. Подвижность глаза резко ограничивается. Диплопия становится постоянной и мучительной. Попытки приспособиться к диплопии приводят к формированию вынужденного положения головы. Увеличение объема экстраокулярных мышц в области их брюшка и в зоне циннова кольца у вершины орбиты (апикальный синдром) приводит к компрессии зрительного нерва и нарушению кровотока. В нижней и верхней глазничных венах орбиты снижается приток и отток крови, что приводит к повышению внутриглазного давления. На этой стадии заболевания больные чаще всего жалуются на постоянные боли в глазу, затруднения при движении глазами, мучительное двоение, ощущение «песка в глазах», запорошенности, засоренности, эпизодическое или даже постоянное слезотечение, возможно изменение рефракции с сохранением или со снижением зрительных функций, нарушение цветовой чувствительности, периферического и центрального зрения. При проведении компьютерной периметрии выявляются центральные и парацентральные скотомы с последующим выпадением полей зрения.
Вовлечение в процесс роговицы приводит к снижению ее прозрачности, остроты зрения вследствие развития стойких помутнений: от небольших полупрозрачных инфильтратов (облачко) до грубых рубцов - бельмо. Наиболее тяжелая кератопатия развивается при сочетании экзофтальма с ретракцией верхнего века и лагофтальмом (несмыканием глазной щели), что обусловливает длительное обнажение роговицы, хроническую гиперемию конъюнктивы, полулунной складки и слезного мясца. При несвоевременном лечении заболевание переходит в тяжелую клиническую форму. В условиях нарушения чувствительности и трофики роговицы, снижения активности роговичного рефлекса и слезопродукции нарастающий экзофтальм и/или лагофтальм сопровождается развитием эрозий и язв роговицы. При присоединении инфекции возможно гнойное расплавление роговицы с невозвратимой утратой зрительных функций.
Наиболее тяжелым проявлением ЭОП является оптическая нейропатия. Начало оптической нейропатии чаще протекает бессимптомно. Однако при тщательном опросе пациенты предъявляют жалобы на эпизоды затуманивания зрения, фрагментарной потери зрения или снижение цветовой насыщенности и контрастности. Явная клиническая манифестация оптической нейропатии ассоциируется с центральными, парацентральными и/или расположенными в нижне-височной области относительными или абсолютными дефектами в поле зрения в виде скотом.
А.Ф. Бровкина выделяет липогенный вариант отечного экзофтальма, основной характеристикой которого является отсутствие увеличения экстраокулярных мышц при выраженном отеке ретробульбарной клетчатки. Липогенный вариант протекает более доброкачественно. Несмотря на выраженный проптоз и периорбитальные отеки, движения экстраокулярных мышц сохраняются в полном объеме. У больных с липогенным вариантом редко развиваются оптическая нейропатия, изменения глазного дна, ухудшение остроты зрения и цветового зрения, так как отсутствует компрессия зрительного нерва. Наличие липогенного варианта подтверждается различными методами визуализации, которые не выявляют или выявляют очень умеренное утолщение экстраокулярных мышц.
При другом варианте ЭОП - эндокринной миопатии происходит значительное утолщение экстраокулярных мышц, без особого увеличения ретробульбарной клетчатки. У таких больных наблюдается нарушение функции экстраокулярных мышц с развитием диплопии, косоглазия, расстройством бинокулярного зрения, но без выраженного экзофтальма. Фиброз развивается быстро, через 3-4 мес от первых клинических проявлений, что дополнительно ограничивает подвижность экстраокулярных мышц за счет образования спаек и развития контрактуры. У больных с миопатией практически отсутствуют отек периорбитальных тканей и поражение роговицы. Эта форма ЭОП тяжело поддается лечению, а уже развившаяся диплопия и косоглазие не имеют обратного развития.
ДИАГНОСТИКА Анамнез
В большинстве случаев ЭОП развивается одновременно с манифестацией диффузного токсического зоба (56%), но может появиться через несколько лет после его начала (18%) или предшествовать развитию тиреотоксикоза (26%).
Физикальное обследование
Выявляет изменение мягких тканей орбиты, наличие и степень экзофтальма (в миллиметрах по экзофтальмометру Гертля), периорбитальные отеки, наличие внутриглазной гипертензии, нарушение функции глазодвигательных мышц, поражение роговицы, нарушение зрения.
Алгоритм обследования врача-офтальмолога включает проведение:
Лабораторные исследования
Для определения функциональной активности щитовидной железы исследуется уровень ТТГ, свободного Т4 , свободного Т3 в сыворотке крови, антител к рецептору ТТГ. В активной фазе ЭОП повышается содержание глюкозоаминогликанов в моче. Однако ложные положительные результаты можно получить при повышенной деструкции соединительной ткани (остеомаляции, злокачественных новообразованиях, ревматоидном артрите и т.д.).
Инструментальные исследования УЗИ щитовидной железы.
УЗИ орбит. При ультразвуковом сканировании у больных с отечным экзофтальмом выявляется расширение ретробульбарной зоны, определяется плотность и величина 4 прямых мышц глаза, измеряется диаметр акустического канала зрительного нерва. Суммарная толщина прямых мышц глаза у здоровых людей в среднем составляет 16,8 мм, у больных ЭОП она может достигать 22,6 мм. Канал зрительного нерва также увеличивается в среднем на 22% по сравнению с нормой. По мере развития фиброза мягких тканей орбиты ширина ретробульбарной зоны сокращается, толщина экстраокулярных мышц сохраняется, но становится неравномерной. Ультразвуковое сканирование позволяет визуализировать только 2 /3 орбиты, в то время как вершина орбиты остается немой зоной. Более объективно оценить состояние мягких тканей орбит можно при помощи КТ или МРТ. При КТ нормальной орбиты в аксиальной проекции визуализируются глаз, зрительный нерв, глазодвигательные мышцы, слезная железа, ретробульбарная клетчатка, верхняя глазничная вена, костные стенки, верхняя и нижняя глазничные щели, зрительный канал. Ранняя диагностика ЭОП строится на выявлении увеличения размеров нижней прямой мышцы и/или отека ретробульбарной клетчатки. При этом минимальные отклонения от нормы, выявляемые на серии томограмм, выполненных с толщиной срезов более 4 мм, могут быть пропущены или низко информативными. Второй по частоте и последовательности вовлечения в аутоиммунный процесс при ЭОП является медиальная прямая мышца. К ней присоединяются верхняя прямая и косая экстраокулярная мышцы. Двустороннее вовлечение в орбитальный процесс на КТ наблюдалось приблизительно у 50-75% пациентов с предположительным односторонним поражением глаз. По мере прогрессирования ЭОП структура экстраокулярных мышц становится неоднородной, плотность их, по данным КТ, повышается. ЭОП сопровождается повышением плотности ретробульбарной клетчатки в результате ее отека в среднем до -64 HU (при норме -120 HU). О наличии фиброза свидетельствовало повышение плотности экстраокулярных мышц (+50-+98 HU, при норме до +49 HU), ретробульбарной клетчатки (от -30 до +20 HU при норме от -112 до -65 HU), плотности слезной железы и визуализация рубцовых изменений в ретробульбарных тканях.
Одним из основных параметров, получаемых при проведении МРТ, является интенсивность сигнала. Кроме стандартных Т1- и Т2-взвешенных изображений, дополнительную информацию могут предоставить специальные магнитно-резонансные программы: TIRM- и STIR-последовательности. Данные последовательности за счет подавления сигнала от жировой клетчатки могут быть полезными в дифференциации мягких тканей орбиты и обнаружении отека экстраокулярной мышцы. Интенсивность сигнала на STIR-срезе непосредственно связана с увеличением времени релаксации Т2, обусловленным увеличением содержания воды в тканях. Благодаря свойству подавления сигнала от ретробульбарной клетчатки на данной магнитно-резонансной последовательности становится доступна не только качественная, но и количественная оценка отека и инфильтрации экстраокулярной мышцы в активную фазу ЭОП в виде регистрации гиперинтенсивного сигнала от них. Увеличение соотношения интенсивности сигнала экстраокулярной мышцы к интенсивности сигнала височной мышцы соответствующей стороны ассоциируется с нарастанием клинической симптоматики заболевания по шкале Clinical activity score. В активную фазу сигнал височной мышцы достоверно увеличивается в среднем с 2,6 до 3,3. У пациентов с неактивной ЭОП сигнал височной мышцы в среднем не превышает 2,0. По мере нарастания клинических проявлений ЭОП отмечается достоверное увеличение интенсивности сигнала экстраокулярной мышцы. Подавление Т2-сигнала и снижение интенсивности сигнала экстраокулярной мышцы на STIR-срезе ассоциируется с формированием фиброза.
Проводить КТ, МСКТ необходимо для уточнения истинных причин снижения зрения. При декомпенсации заболевания утолщенные экстраокулярные мышцы сдавливают зрительный нерв в задней трети орбиты, диаметр зрительного нерва уменьшается на 1-2 мм в результате резкого растяжения. КТ, МРТ-признаком компрессии зрительного нерва является интракраниальный пролапс жировой ткани. Этот симптом имеет высокую чувствительность (73%) и специфичность (96%) и является важным диагностическим признаком. Кроме того, отмечаются отек периорбитальных тканей (75%), увеличение слезных желез с нечеткостью их контуров (41%), нечеткость контуров зрительного нерва (37%), утолщение верхней глазничной вены (29%).
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Проводится с экзофтальмом опухолевого генеза, кровоизлиянием или воспалительным процессом в орбите, увеличением размеров самого глазного яблока при глаукоме и высокой близорукости, поражением соседних пазух носа.
ПОКАЗАНИЯ К КОНСУЛЬТАЦИИ ДРУГИХ СПЕЦИАЛИСТОВ
При наличии симптомов ЭОП пациент должен быть направлен к эндокринологу для выявления аутоиммунной патологии щитовидной железы: диффузного токсического зоба или АИТ (исследуется уровень ТТГ, свободный Т4 , свободный Т3 антитела к рецептору ТТГ, антитела к тиропероксидазе, УЗИ щитовидной железы).
ПРИМЕР ФОРМУЛИРОВКИ ДИАГНОЗА
Диффузный токсический зоб 2-й степени, средней тяжести, в стадии компенсации. ЭОП, тяжелой степени, активная фаза, оптическая нейропатия, диплопия.
ЛЕЧЕНИЕ
же высокий канцерогенный потенциал внутреннего облучения и укорочение латентного периода до 4-5 лет. Усугубляющим фактором служит детский возраст на момент облучения, особенно уязвимым является возраст до 5 лет. Эффективность лечения зависит от правильно поставленного диагноза, точности определения активности процесса в орбите и тяжести клинических проявлений ЭОП, от субъективной оценки качества жизни, от индивидуальных характеристик пациента. Лечение ЭОП комплексное, и его необходимо проводить совместно офтальмологом и эндокринологом с учетом степени тяжести заболевания и нарушения функции щитовидной железы.
Цели лечения
Основной задачей лечения является уменьшение клинических проявлений ЭОП, предупреждение развития кератопатии, снижение внутриглазного и ретро-бульбарного давления, подавление деструктивных процессов в тканях орбиты, увлажнение конъюнктивы, предупреждение прогрессирования ЭОП и развития слепоты, улучшение качества жизни и восстановление зрения. Непременным условием успешного лечения является достижение эутиреоидного состояния.
Показания к госпитализации
Тяжелое течение ЭОП, наличие прогрессирующего экзофтальма, лагофтальма, поражения роговицы, резкого ограничения подвижности глазных яблок, хемоза,
кератопатии, симптомов оптической нейропатии требуют срочной госпитализации больных.
Немедикаментозное лечение
В активную фазу ЭОП проводится лучевая терапия на область орбит в суммарной дозе 16 или 20 Гр на курс. Эффективность лечения зависит от длительности существования ЭОП. Положительные результаты наблюдаются при анамнезе заболевания не более 12 мес. Наиболее эффективна лучевая терапия орбит в первые 6 мес от манифестации заболевания. Лучевая терапия обычно хорошо переносится, однако может вызывать преходящее обострение симптомов, которое можно предотвратить назначением глюкокортикоидов. Хотя катаракта после проведения лучевой терапии может возникнуть раньше, чем обычно, она легко устраняется хирургической коррекцией. Тяжелая гипертония и диабетическая ретинопатия являются противопоказаниями к проведению лучевой терапии. Диабет без ретинопатии может рассматриваться как относительное противопоказание к облучению. Лучевая терапия эффективна только в активную фазу ЭОП, менее эффективна в стадию перехода, когда начался фиброз, и абсолютно неэффективна в стадию закончившегося фиброза.
Медикаментозное лечение
Длительный некомпенсированный тиреотоксикоз является установленным фактором риска тяжелого течения ЭОП, что определяет необходимость компенсации тиреотоксикоза в максимально возможные сроки. В настоящее время нет убедительных данных о влиянии дозы или режима приема тиреостатиков (монотерапии или блокирования с последующим приемом левотироксина натрия) на течение ЭОП, но в отдельных случаях, когда трудно добиться стойкой компенсации, схема «блокируй и замещай» может иметь преимущество, так как позволяет длительно поддерживать эутиреоидное состояние.
При неэффективности тиреостатической терапии показано радикальное лечение: хирургическое или РЙТ. Методом выбора является тиреоидэктомия, так как у больных после неполного удаления щитовидной железы отмечают стойкое повышение антител к рецептору ТТГ. Предполагается, что длительная персистенция антител к рецептору ТТГ способствует затяжному течению ЭОП с поддержанием активности воспаления, увеличению проптоза, ретракции век и ширины глазной щели, т.е. к увеличению тяжести. Это снижает шансы пациентов на возврат к исходному косметическому статусу со стороны глаз и зрительному комфорту.
В неактивную фазу ЭОП проводится РЙТ. Достижение пострадиационного гипотиреоза имеет существенное значение для клинического течения ЭОП. Факторами риска ухудшения течения ЭОП после радиойодтерапии являются: сохраняющийся тиреотоксикоз в течение 12 мес после РЙТ (RR=5,1; p <0,01), исходный объем щитовидной железы ≥50 мл (RR=6,7; p <0,001), персистенция антител к рецептору ТТГ ≥10 UI/l в течение года (RR=5,4; p <0,01) и курение (RR=3,2; p <0,001). При гипотиреозе проводится заместительная терапия левотироксином натрия под контролем уровня ТТГ.
Ухудшение состояния глаз возникает при резком переходе от одного состояния к другому, поэтому после оперативного лечения диффузного токсического зоба или РЙТ необходимо тщательно следить за уровнем гормонов щитовидной железы в крови и проводить профилактику и адекватное лечение гипотиреоза или тиреотоксикоза (в случае неэффективной РЙТ).
При планировании оперативного лечения или РЙТ необходимо учитывать степень активности ЭОП. Пациентам с неактивной фазой (Clinical activity score <3) предварительная подготовка не требуется, назначается только симптоматическое лечение в зависимости от выявляемой симптоматики (синдром «сухого» глаза, ретракция век, диплопия, лагофтальм, повышение внутриглазного давления). При наличии синдрома «сухого» глаза (ощущение песка в глазах, слезотечение и фотофобия) и лагофтальма назначаются искусственные заменители слезы и глазные гели. При повышении внутриглазного давления назначаются антиглаукомные капли.
При высокоактивном процессе в орбитах (Clinical activity score ≥5) хирургическое лечение или РЙТ следует отложить до уменьшения выраженности воспаления. При низкоактивном процессе в орбитах (Clinical activity score=3-4) назначаются глюкокортикоиды перорально через 1-3 дня после операции или РЙТ (начиная с 0,3-0,5 мг преднизолона на кг массы тела в день с последующим снижением дозы и отменой препарата примерно через 1-3 мес).
Симптоматическое лечение
Всем пациентам с ЭОП и повреждением роговицы рекомендуется применение препаратов искусственной слезы в течение дня и/или мазей на ночь. Применение призматических линз позволяет контролировать преходящее или постоянное двоение в глазах, а сон с возвышенным положением головы позволяет уменьшить отек век по утрам. Спорным является введение ботулинического токсина в леватор верхнего века при ретракции век, которое проводится только в специализированных центрах.
Патогенетическое лечение
Лечение ЭОП легкой степени. Легкая форма ЭОП обычно диагностируется на основании невыраженного отека век, конъюнктивы и гиперемии, умеренного проптоза (<3 мм), легкой ретракции век (<2 мм) и очень слабого, если такое имеется, вовлечения экстраокулярных мышц. У большинства пациентов с легкой степенью ЭОП, особенно с удовлетворительным качеством жизни, методом выбора является выжидательная тактика и наблюдение. В случае если легкая ретракция век, отек мягких тканей или экзофтальм значительно ухудшают качество жизни или имеется тенденция к прогрессированию болезни, будет оправдано лечение, применяемое при ЭОП средней степени тяжести.
Лечение ЭОП средней и тяжелой степени. При выборе метода лечения следует прежде всего учитывать активность ЭОП.
Лечение пациентов с активной фазой ЭОП. Пациенты с активной ЭОП средней или тяжелой степени (Clinical activity score ≥3/7) должны получать иммуносупрес-сивную терапию глюкокортикоидами, лучевую терапию или их комбинацию.
Tлюкокортикоиды. При пероральном приеме глюкокортикоиды оказываются эффективными примерно в 60% случаев, тогда как при ретробульбарном введении - только в 40% случаев. Пероральное введение глюкокортикоидов (начальная доза 60-80-100 мг преднизолона, или ≈1 мг/кг массы тела) требует применения высоких дозировок в течение длительного времени. Глюкокортикоиды эффективно устраняют клинические проявления со стороны мягких тканей, уменьшая отеки, гиперемию, хемоз, увеличивая подвижность экстраокулярных мышц и остроту зрения. В то же время их воздействие на проптоз ограничено. У пациентов с миогенной формой ЭОП раннее лечение глюкокортикоидами (в первые 3-4 мес от манифестации глазных симптомов) позволяет уменьшить риск развития непреходящей диплопии, вызванной фиброзом экстраокулярных мышц. После достижения клинического эффекта доза глюкокортикоидов постепенно снижается, примерно на 5-10 мг в неделю, и зависит от клинической реакции на отмену. Достаточно часто при снижении дозы глюкокортикоидов или в случае их отмены развивается рецидив ЭОП, что потребует увеличения дозы и более длительного лечения.
Длительный прием пероральных глюкокортикоидов может вызвать ряд побочных эффектов: развитие остеопороза, медикаментозного синдрома Кушинга, гипертонии, стероидного диабета, обострение язвенной болезни, сопутствующих инфекций. В таких случаях, а также с профилактической целью возможно применение препаратов кальция, витамина D, калия, бисфосфонатов, средств, снижающих кислотность желудка, соблюдение диеты.
В настоящее время методом выбора для лечения активной ЭОП является внутривенное введение глюкокортикоидов в режиме пульс-терапии. В литературе описано несколько случаев летального исхода от токсического гепатита и тромбоэмболии при превышении кумулятивной дозы метилпреднизолона более 10 г. В этой связи рекомендуется ограничение курсовой суммарной дозы метилпреднизолона до 8 мг во избежание развития острой дистрофии печени с летальной печеночной недостаточностью. Во избежание тяжелых осложнений до назначения лечения необходимо исключить нарушение функции печени, вирусный гепатит в анамнезе, гипертонию, тромбофлебит, обострение язвенной болезни желудка и 12-перстной кишки, декомпенсацию диабета, обострение инфекции мочевыводящих путей и глаукому. Также не рекомендуется резко, с большой дозы, обрывать лечение, так как это может привести к обострению сопутствующих заболеваний, в частности гепатита.
Внутривенная пульс-терапия метилпреднизолоном используется в различных режимах, курсовой дозе, интервалах между курсами и продолжительности лечения, и нет доказательств о преимуществе любой из схем.
Схемы в/в пульс-терапии метилпреднизолоном:
-
1000 мг/нед метилпреднизолона в течение 6 нед (кумулятивная доза 6 г) [Macchia P.E. et al, 2001];
-
500 мг метилпреднизолона через 48 ч (кумулятивная доза 12 г) с приемом преднизолона per os по 40 мг/день между инъекциями [Kauppinen-Makelin R. et al., 2002];
-
1000 мг метилпреднизолона 3 последующих дня/нед, затем 500 мг 2-я, 3-я, 4-я неделя, 250 мг 5-7-я неделя, 125 мг следующие 4-5 нед. Интервал между инъекциями - 10-12 дней (кумулятивная доза - 6 г). В промежутках между иньекциями назначаются поддерживающие дозы преднизолона per os по 25-30 мг/день с постепенным уменьшением дозы на 5 мг каждые 10-14 дней после последней инъекции [Бровкина А.Ф., 2004];
-
500 мг в неделю метилпреднизолона в течение 6 нед, затем 250 мг/нед в течение 6 нед (кумулятивная доза 4,5 мг) [Kahaly G.J. et al., 2005];
-
500 мг метилпреднизолона 3 последующих дня, затем прием преднизолона per os по 0,7 мг/кг/день (кумулятивная доза 1,5 мг) [Ng et al., 2005].
Максимальная концентрация препарата в крови развивается через 1 ч после введения с последующим снижением в течение 6-7 ч. Метилпреднизолон накапливается в различных тканях, причем больше в воспаленных, чем в нормальных. Пульс-терапия позволяет достигнуть быстрого (в течение 24 ч), но нестабильного эффекта. Часто через 4-12 нед после отмены лечения симптомы ЭОП возобновляются.
При тяжелом, угрожающем зрению поражении роговицы показаны частое применение глазных мазей, увлажнителей, тарзоррафия (полное или частичное ушивание век) или другие временные меры для создания условий для заживления роговицы. В случае перфорации роговицы/тяжелого язвенного поражения необходимо применение антибиотиков, проведение кератопластики или пересадки роговицы.
Другие методы лечения включают в себя аналоги соматостатина, циклоспорин, азатиоприн, циамексон и внутривенное введение иммуноглобулинов, но они не являются препаратами выбора из-за меньшей эффективности и высокой токсичности.
В качестве специфического лечения рассматриваются моноклональные антитела, направленные к различным антигенам, экспрессируемым на иммунных клетках и вовлеченным на разных уровнях в аутоиммунные реакции: этанерцепт, анакинра, ритуксимаб. Эти препараты подавляют созревание В-лимфоцитов на ранней стадии. Ритуксимаб представляет собой синтетические (генно-инженерные) химерные моноклональные антитела мыши/человека, обладающие специфичностью к CD20 антигену, находящемуся на поверхности нормальных и измененных В-лимфоцитов. По структуре ритуксимаб относится к иммуноглобулинам класса G1 . В результате терапевтического воздействия на клетки CD20+ исчезают В-лимфоциты во всех промежуточных стадиях В-клеточного созревания и также активированные клетки памяти и короткоживущие плазматические клетки, без воздействия на регенерацию В-клеток из стволовых клеток и продукцию иммуноглобулинов плазматическими клетками. Было показано, что ритуксимаб оказывает значительный эффект на активность и тяжесть ЭОП.
При стероидрезистентных формах ЭОП проводится плазмаферез или гемосорбция.
Хирургическое лечение Декомпрессия орбиты
В том случае, если у пациентов с тяжелой формой ЭОП, осложненной оптической нейропатией, выраженным проптозом, изъязвлением роговицы, подвывихом глазного яблока, формированием выраженного косметического дефекта, через 2 нед ответ на внутривенное введение глюкокортикоидов отсутствует или незначителен, или развиваются серьезные побочные эффекты, проводится срочная декомпрессия орбит для предупреждения развития слепоты. Орбитальная декомпрессия представляет собой увеличение объема для содержимого орбиты либо за счет расширения костной составляющей орбиты, либо за счет удаления жировой клетчатки, либо то и другое вместе. На сегодняшний день хирургическая декомпрессия включает удаление медиальной стенки, основания орбиты, латеральной стенки, в то время как от удаления верхней стенки отказались, так как вклад этой техники в увеличение объема орбит является минимальным и ассоциируется с побочными эффектами и осложнениями. Чаще хирургическое лечение проводится в неактивную (не менее 6 мес) фазу ЭОП и включает реконструктивную декомпрессию орбит при выраженном экзофтальме или ретробульбарной боли.
Операции на глазодвигательных мышцах
Диплопия, развившаяся в начале заболевания, связана с отеком и нарушением функции экстраокулярных мышц. Она может быть устранена иммуносупрессивной или лучевой терапией. Диплопия, развившаяся в неактивную фазу, связана с фиброзом экстраокулярных мышц и ретробульбарной клетчатки и может быть устранена только хирургически.
Изменения со стороны век (ретракция, лагофтальм, птоз, отек) требуют выполнения операции на веках. Наиболее частой проблемой хирургического лечения ретракции верхнего века при ЭОП считают установление после операции неправильного уровня века.
Абсолютному большинству пациентов с ЭОП оперативное лечение не требуется. В том случае, если оно показано, операции на глазодвигательных мышцах и веках, а также декомпрессия глазницы позволяют улучшить зрительные функции и внешний вид пациента.
Показания к консультации других специалистов
Лечение проводится совместно офтальмологом, эндокринологом, офтальмохирургом, нейрохирургом, радиологом, отоларингологом.
Примерные сроки нетрудоспособности
14-21 день.
Дальнейшее ведение
Определение тактики лечения тиреотоксикоза (медикаментозное, оперативное, лечение радиоактивным йодом). Систематический контроль функции щитовидной железы. Офтальмологический контроль через 3-6 мес. Предупреждение прогрессирования ЭОП и развития осложнений: контроль состояния роговицы, внутриглазного давления, диагностика зрительных расстройств. Диспансерное наблюдение 1 раз в год при отсутствии признаков прогрессирования заболевания.
Информация для пациента
Пациент должен быть информирован, что у курильщиков ЭОП развивается чаще и имеет более тяжелое течение, эффективность терапии ЭОП у курильщиков значительно ниже, чем у некурящих. Изменение функционального состояния щитовидной железы как в сторону гипофункции, так и декомпенсации тиреотоксикоза также оказывает негативное влияние на течение ЭОП. Другие факторы риска (стрессы, переохлаждение, перегревание, повышенная инсоляция, истощение) могут утяжелять течение ЭОП. Больного следует предупредить о сложности и длительности лечения.
ПРОГНОЗ
Возможно стойкое сохранение экзофтальма с развитием косоглазия и диплопии. При злокачественном течении ЭОП и отсутствии своевременных медикаментозных и хирургических вмешательств нарушается функция зрительного анализатора вплоть до полной потери зрения.
ЗАКЛЮЧЕНИЕ
Таким образом, ЭОП была и остается одной из актуальнейших проблем на «стыке» офтальмологии и эндокринологии. Дальнейшее изучение патогенеза, совершенствование методов диагностики и лечения этой патологии позволят оказывать квалифицированную и своевременную помощь большому количеству пациентов с этой патологией.
СПИСОК ЛИТЕРАТУРЫ
-
Бровкина А.Ф. Эндокринная офтальмопатия. - М., 2004. - 176 с.
-
Бровкина А.Ф., Аубакирова А.С. Внутренняя декомпрессия орбиты при некомпенсированном отечном экзофтальме // Вестник офтальмологии. - 2006. - №3. - С. 3-6.
-
Бровкина А.Ф., Павлова Т.Л. Эндокринная офтальмопатия с позиций офтальмолога и эндокринолога // Вестник офтальмологии. - 2000. - №1. - С. 11-14.
-
Пантелеева О.Г., Куроедов А.В., Шамшинова А.М. и др. Морфофункциональные характеристики сетчатки и зрительного нерва при эндокринной офтальмопатии // Вестник офтальмологии. - 2006. - №4. - С. 25-28.
-
Родионова Т.И., Фаттахова Е.К. Аутоиммунная офтальмопатия: современные представления об этиологии, патогенезе, диагностике, клиническом течении и лечении // Клиническая тиреоидология. - 2004. - Т. 2, №4. - С. 6-13.
-
Свириденко Н.Ю., Лихванцева В.Г., Беловалова И.М., Шеремета М.С., Табеева К.И. Антитела к рецептору ТТГ как предикторы тяжести и исходов эндокринной офтальмопатии у пациентов с болезнью Грейвса // Пробл. эндокринол. - 2011. - №2. - C. 23-26.
-
Bartalena L. Glucocorticoids for Graves? ophthalmopathy: how and when // J. Clin. Endocrinol. Metab. - 2005. - Vol. 90. - P. 5497-5499.
-
Bonnema S.J., Bartalena L., Toft A.D., Hegedus L. Controversies in radioiodine therapy: relation to ophthalmopathy, the possible radioprotective effect of antithyroid drugs, and use in goiters // Eur. J. Endocrinol. - 2002. - Vol. 147. - P. 1-11.
-
Dickinson A.J., Perros P. Controversies in the clinical evaluation of active thyroid-associated orbitopathy: use of a detailed protocol with comparative photographs for objective assessment // Clin. Endocrinol. - 2001. - Vol. 55. - P. 283-303.
-
Eckstein A.K., Plicht M., Lax H., Neuhauser M. et al. Thyrotropin receptor autoantibodies are independent risk factors for Graves? ophthalmopathy and help to predict severity and outcome of the disease // J. Clin. Endocrinol. Metab. - 2006. - Vol. 91. - P. 3464-3470.
-
Krassas E.K., Wiersinga W.M. Thyroid eye disease: current concepts and the EUGOGO perspective // Thyroid International. - 2005. - N 4. - P. 3-18.
-
Lennerstrand G., Tian S., Isber B., Landau H.I. et al. Magnetic resonance imaginand ultrasound measurements of extraocules in thyroid-associated ophthalmopathy at different stages of the disease // Acta Ophthalmol Scand. - 2007. - Vol. 85. - P. 192-201.
-
Marcocci C., Bartalena L., Rocchi R. Long-term safety of orbital radiotherapy for Graves? ophthalmopathy // J. Clin. Endocrinol. Metab. - 2003. - Vol. 88. - P. 3561- 3566.
-
McKea D., Lane C., Lazarus J.H., Baldeschi L. et al. Clinical features of dysthyroid optic neuropathy: a European group on Graves? orbitopathy (EUGOGO) survey // Br. J. Ophthalmol. - 2007. - Vol. 91. - P. 455-458.
-
Moleti N., Mattina F., Salamone I., Violi M.A. et al. Effects of thyroidectomy alone or followed by radioiodine ablation of thyroid remnants on the outcome of Graves? ophthalmopathy // Thyroid. - 2003. - Vol. 13. - P. 653-658.
-
Mourits M.P., Koorneef L., Wiersinga W.M., Prummel M.F., Berghout A., van der Gaag R. Clinical criteria for the assessment of disease activity in Graves? ophthalmopathy: a novel approach // Br.J. Ophthalmol. - 1989. - Vol. 73. - P. 639-644.
-
Stan M.N., Garrity J.A., Bradley E.A., Woo J.J. Randomized, double-blind, placebo-controlled trial of long-actin-release octreotide for treatment of Graves? ophthalmopathy // J. Clin. Endocrinol. Metab. - 2006. - Vol. 91. - P. 4817.
-
Wiersinga W.M., Perros P., Kahaly G.J., Mourits M.P., Baldeschi L., Boboridis K., Boschi A., Dickinson A.J., Kendall-Taylor P., Krassas G.E., Lane C.M., Lazarus J.H., Marcocci C., Marino M., Nardi M., Neoh C., Orgiazzi J., Pinchera A., Pitz S., Prummel M.F., Sartini M.S., Stahl M., von Arx G. Clinical assessment of patients with Graves? Orbitopathy: The European Group on Graves? Orbitopathy (EUGOGO) recommendations to generalists, specialists and clinical researchers // Eur. J. Endocrinol. - 2006. - Vol. 155. - P. 207- 2011.
ТИРЕОТОКСИЧЕСКИЙ КРИЗ
Петунина Н.А.
Тиреотоксический криз - редкое, но опасное для жизни состояние, проявляющееся резким увеличением выраженности симптомов тиреотоксикоза у больных диффузным или диффузно-узловым токсическим зобом.
ЭПИДЕМИОЛОГИЯ
В настоящее время тиреотоксический криз встречается реже, чем в прошлом, что является следствием хорошей подготовки к тиреоидэктомии и РЙТ. Тиреотоксический криз встречается у 1-2% пациентов, госпитализированных по поводу тиреотоксикоза, наиболее часто у больных диффузным токсическим зобом. У женщин тиреотоксический криз развивается в 3 раза чаще, чем у мужчин, однако гендерные различия отмечают не все исследования. У детей криз развивается гораздо реже, чем у взрослых.
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА
Тиреотоксический криз характеризуется увеличением выраженности всех симптомов тиреотоксикоза (табл. 13.13). Данному осложнению более подвержены пациенты с явным тиреотоксикозом, однако тиреотоксический криз встречается и при субклиническом тиреотоксикозе.
Основные симптомы тиреотоксического криза
-
Гипертермия и профузное потоотделение без признаков инфекции - ключ к диагностике криза и показание для начала интенсивной терапии.
-
Поражение ЦНС. Метаболическая энцефалопатия: возбуждение, эмоциональная лабильность, тревожность, замешательство, вплоть до развития психоза, спутанность сознания и кома.
-
Поражение сердечно-сосудистой системы. Синусовая тахикардия, не соответствующая степени гипертермии, наджелудочковая тахикардия или мерцательная аритмия, также могут возникать признаки сердечной недостаточности или обратимой дилатационной кардиомиопатии, в том числе у относительно молодых людей (как впервые манифестирующая сердечная патология). В начале криза у большинства пациентов наблюдают систолическую АГ с высоким пульсовым давлением. Дегидратация, снижение объема циркулирующей крови вследствие рвоты, диареи, повышенного потоотделения в последующем приводит к развитию постуральной гипотензии с коллапсом. Это одна из причин летального исхода у пациентов с тиреотоксическим кризом.
-
Желудочно-кишечные проявления. Тошнота и рвота, диарея, разлитые боли в животе, гепатомегалия. Поражение печени связано как с застойными явлениями вследствие сердечной недостаточности, так и с некротическими изменениями (острой желтой атрофией). Появление желтухи - плохой прогностический признак, требующий немедленной терапии.
Для тиреотоксического криза характерно острое начало и молниеносное течение, особенно если криз ассоциирован с оперативным вмешательством на щитовидной железе, травмой, инфекцией и т.д. Кризы, обусловленные лечением радиоактивным йодом, и спонтанные кризы протекают медленнее. При лечении радиоактивным йодом тиреотоксический криз возникает чаще в конце первой - начале второй недели после приема изотопа.
У пожилых пациентов тиреотоксический криз может протекать атипично с развитием апатичного криза и преобладанием в клинической картине крайней слабости, депрессии, летаргии.
В течение тиреотоксического криза выделяют начальную (подострую) и острую (коматозную) фазы.
Наиболее частые причины летального исхода - острая сердечная, надпочечни-ковая или печеночная недостаточность.
ЭТИОЛОГИЯ
Строгой зависимости между тяжестью тиреотоксикоза и риском развития тиреотоксического криза нет. Тиреотоксический криз обычно развивается при наличии недиагностированного или некомпенсированного тиреотоксикоза. Нет определенного сывороточного уровня тиреоидных гормонов, при котором неизбежно развивается тиреотоксический криз, возможно, важен не уровень гормонов, а скорость нарастания их концентрации. Криз имеет резкое начало и почти всегда вызывается провоцирующими факторами.
| Критерии | Баллы |
|---|---|
Нарушение терморегуляции |
|
Температура тела (°С) |
|
37,2-37,7 |
5 |
37,8-38,2 |
10 |
38,3-38,8 |
15 |
38,9-39,3 |
20 |
39,4-39,9 |
25 |
>40,0 |
30 |
Сердечно-сосудистая система |
|
Тахикардия (уд. /мин) |
|
100-109 |
5 |
110-119 |
10 |
120-129 |
15 |
130-139 |
20 |
>140 |
25 |
Фибрилляция предсердий |
|
Нет |
0 |
Да |
10 |
Застойная сердечная недостаточность |
|
Нет |
0 |
Легкая (отеки стоп) |
5 |
Умеренная (хрипы в нижних отделах легких) |
10 |
Тяжелая (отек легких) |
20 |
Желудочно-кишечные проявления |
|
Отсутствуют |
0 |
Умеренные (диарея, боли в животе, тошнота/рвота) |
10 |
Тяжелые (желтуха) |
20 |
Поражение ЦНС |
|
Отсутствует |
0 |
Легкое (возбуждение) |
10 |
Умеренное (делирий, психоз, апатия) |
20 |
Тяжелое (судороги, кома) |
30 |
Провоцирующие факторы |
|
Нет |
0 |
Да |
10 |
>45 - тиреотоксический криз 25-44 - надвигающийся криз <25 - криз маловероятен |
|
Тиреотоксический криз могут спровоцировать:
-
внезапное необоснованное прекращение тиреостатической терапии;
-
инфекция, сепсис (наиболее частая причина в настоящее время);
-
оперативное вмешательство по поводу сопутствующего заболевания (в том числе и у пациентов с недиагностированным тиреотоксикозом);
-
массивная нагрузка йодом (например, внутривенное введение контрастных веществ при рентгенологическом исследовании);
-
прием ЛС (цитотоксические препараты, передозировка салицилатов и адреномиметиков);
МЕХАНИЗМ РАЗВИТИЯ
Механизм развития тиреотоксического криза изучен недостаточно. Большинство исследователей выделяют три важнейших звена патогенеза:
Ряд авторов основную роль в развитии тиреотоксического криза отводят изменениям ЦНС (гиперактивности ее высших отделов).
Тиреотоксикоз может быть связан с различными факторами.
Относительная НН
-
На основании полученных данных о взаимовлиянии гормонов надпочечников и щитовидной железы сделано предположение об антагонистических взаимоотношениях между ними и, как следствие, возможности развития НН у больных тиреотоксикозом.
-
Часто наблюдаемая при диффузном токсическом зобе НН может иметь аутоиммунную природу.
-
Функциональные возможности коры надпочечников у больных тиреотоксикозом снижены (даже при отсутствии НН как таковой). Резерв надпочечников может быть превышен при кризе (как и при любом стрессе, в том числе операционном) вследствие несоответствия возросшим потребностям.
-
Кроме того, при тиреотоксическом кризе происходит изменение метаболизма кортизола в сторону увеличения образования менее активных в биологическом отношении кортизона и тетрагидрокортизона.
Γиперактивность симпатоадреналовой системы
-
Активация симпатоадреналовой системы - один из механизмов быстрой мобилизации защитных сил организма, необходимой при всяком стрессе, хирургическом вмешательстве, а также тиреотоксикозе и т.д.
-
Тиреоидные гормоны могут повышать чувствительность тканей к катехоламинам, увеличивая экспрессию адренорецепторов и активность аденилатциклазы.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Тиреотоксический криз дифференцируют со следующими заболеваниями и состояниями:
-
с сердечно-сосудистой недостаточностью и сосудистым кризом у больных тиреотоксикозом;
-
периодическим тиреотоксическим параличом, обусловленным гипокалиемией и потерей мышечных белков;
-
эндогенным психозом, тревожными расстройствами и паническими атаками;
-
острой лекарственной интоксикацией (кокаином, амфетаминами);
АНАМНЕЗ
Характерная симптоматика, выраженность ее нарастает в течение нескольких часов, реже дней. Тиреотоксикоз в анамнезе, наличие зоба и экзофтальма облегчают распознавание криза.
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Характерные проявления тиреотоксического криза:
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Можно выполнять одновременно с проводимой терапией (при малейшем подозрении на тиреотоксический криз терапию необходимо начинать немедленно!).
-
Общий анализ крови. Лейкоцитоз с умеренным сдвигом влево может присутствовать даже без инфекции. Остальные показатели - в пределах нормы.
-
-
Умеренная гипергликемия при отсутствии СД. Причина - повышение гликогенолиза.
-
Значительное снижение протромбинового индекса (до 35-44%) и фибриногена.
-
Умеренная гиперкальциемия в результате гемоконцентрации и повышения костной резорбции под влиянием тиреоидных гормонов (уровни других электролитов сыворотки остаются нормальными).
-
Повышение активности АЛТ и АСТ, уровня билирубина (как следствие печеночной дисфункции).
-
Увеличение активности ЩФ - следствие повышения костной резорбции и (в ответ на нее) функции остеобластов.
-
-
Определение тиреоидных гормонов. Уровни свободных фракций Т3 и Т4 в сыворотке крови повышены.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Характерно повышение показателя 24-часового теста поглощения радиоактивного йода.
НЕОТЛОЖНЫЕ МЕРОПРИЯТИЯ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ
Летальность по различным данным может достигать 75-90%, но ранняя диагностика и адекватная интенсивная терапия может снизить риск до 10-20%.
У 25% пациентов с тиреотоксическим кризом смерть наступает вследствие полиорганной недостаточности, частыми причинами смерти являются сердечная недостаточность, дыхательная недостаточность, аритмия, синдром диссеминированного внутрисосудистого свертывания, острые стресс-язвы ЖКТ и сепсис.
Лечение проводят в условиях реанимационного отделения. Начинать лечение следует немедленно, уже при первых клинических проявлениях, не ожидая результатов лабораторных исследований. Только своевременная активная терапия сохранит жизнь больному.
Терапию проводят по четырем направлениям: снижение уровня циркулирующих тиреоидных гормонов, борьба с гиперактивностью симпато-адреналовой системы, купирование относительной НН, симптоматическая терапия.
-
Снижение уровня циркулирующих тиреоидных гормонов достигают путем подавления:
-
Для блокирования синтеза тиреоидных гормонов назначают тиреостатические препараты - тиамазол или пропилтиоурацил. Механизм их действия связан с инактивацией ключевого фермента - тиреопероксидазы. Парентеральные формы этих препаратов не производятся, поэтому больным в коме их вводят через назогастральный зонд или ректально. При диарее последний путь введения не используют. Пропилтиоурацил назначают в нагрузочной дозе 500-1000 мг однократно и далее по 250 мг каждые 4 ч. Доза тиамазола может достигать 100 мг в сутки (по 20-25 мг каждые 6-8 ч). Пропилтиоурацил, кроме того, обладает способностью блокировать периферическую конверсию Т4 в Т3 , поэтому многие отдают предпочтение этому препарату.
-
Данные тиреостатические препараты не оказывают влияние на уже синтезированные и хранящиеся внутри фолликула йодсодержащие гормоны. Для ингибирования протеолиза коллоида и предотвращения выброса Т4 и Т3 в кровь назначают неорганический йод или лития карбонат. Оптимально применение йода внутрь (в виде йод + [калия йодид + глицерол] (люголя раствор с глицерином♠ ) или насыщенного раствора калия йодида по 5-8 капель каждые 6 ч) или парентерально. Раннее назначение поддерживающей терапии внутривенной инфузии натрия йодида (0,5-1,0 г каждые 12 ч) возможно, если приготовить стерильный раствор ex tempore.
-
Как минимум за час до начала терапии йодом необходимо назначить антитиреоидные препараты! Иначе применение йода бессмысленно, так как отсутствие медикаментозной блокады синтеза тиреоидных гормонов создает условия для накопления гормонов в щитовидной железе и, в случае их высвобождения в кровь, резкого усиления тиреотоксикоза. При назначении йода в сочетании с полной дозой антитиреоидных препаратов происходит быстрое снижение уровня сывороточного Т4 и нормализация его в течение 4-5 дней.
-
В качестве препаратов йода возможно применение йодсодержащих рентгеноконтрастных веществ (натрия йоподата и йопаноевой кислоты). Они снижают захват Т4 печенью и долю свободного Т4 и Т3 в сыворотке. Применение этих препаратов способствует значительному клиническому улучшению. Обусловлено это в основном снижением концентрации Т3 в сыворотке в результате уменьшения периферической конверсии Т4 в Т3 , частично - уменьшением высвобождения тиреоидных гормонов из-за высокого содержания йода в этих препаратах (1,8 г йода на 3 г препарата). После насыщающей дозы (3 г натрия йоподата) препарат назначают внутрь по 1 г в день в сочетании с тиреостатиками. В отечественной практике использование рентгеноконтрастных средств не нашло широкого применения.
-
Амиодарон (антиаритмическое и антиангинальное средство) также богат йодом и потенциально может ингибировать периферическую конверсию Т4 в Т3 , но его применение опасно из-за развития побочных эффектов вследствие продолжительного периода полураспада (выделение йода происходит в течение многих месяцев). В отечественной практике использование амиодарона также не нашло широкого применения.
-
Лития карбонат - альтернативное средство для ингибирования выброса тиреоидных гормонов при аллергии на йод. Его можно применять также у пациентов с серьезными токсическими реакциями на пропилтиоурацил или тиамазол. Малые аллергические реакции на тиамазол и пропилтиоурацил (например, сыпь) не могут быть противопоказанием к их применению при тиреотоксическом кризе, но агранулоцитоз в анамнезе - основание для альтернативной терапии (например, лития карбонатом). Лития карбонат назначают по 300 мг каждые 6 ч с последующей коррекцией дозы для поддержания уровня лития в плазме на уровне 0,8-1,2 мэкв/л (1 ммоль/л).
-
Для снижения уровня гормонов в периферической крови применяют перитонеальный диализ или плазмаферез. Некоторый эффект достигается при назначении колестирамина (холестирамин) и L-карнитина.
-
Для уменьшения гиперактивности симпатоадреналовой системы применяют β-адреноблокаторы. Препаратом выбора является пропранолол. Пропранолол назначают внутрь по 20-40 мг каждые 6 ч. В тяжелых случаях доза может быть увеличена до 80-120 мг каждые 6 ч. Внутривенное введение (начальная доза 0,5-1 мг) необходимо производить с большой осторожностью: медленно, с мониторированием сердечной деятельности. При необходимости через несколько часов могут быть введены последующие дозы: 2-3 мг в течение 10-15 мин каждые 3 ч. Пропранолол уменьшает основные эффекты катехоламинов, снижает периферическую конверсию Т4 в Т3 . β-Адреноблокаторы быстро снижают ЧСС и сердечный выброс, уменьшают нагрузку на сердце. Они эффективны и при рефрактерности к дигоксину и диуретикам.
-
Если применение β-адреноблокаторов противопоказано, возможно назначение резерпина: по 2,5 мг (1 мл 0,25% раствора) внутримышечно каждые 6-8 ч или по 0,25-0,5 мг внутрь каждые 4 ч. Резерпин, однако, оказывает тормозящее влияние на ЦНС и способен вызвать диспепсию.
-
У лиц с тяжелыми сердечно-сосудистыми заболеваниями, у пожилых лиц с выраженным атеросклерозом применение резерпина и β-адреноблокаторов ограничено. Для усиления сократительной способности миокарда целесообразно сочетать их назначение с внутривенным введением сердечных гликозидов.
-
С этой целью назначают глюкокортикоиды, обладающие, кроме того, способностью ингибировать периферическую конверсию Т4 в Т3 . Гидрокортизон вводят внутривенно в начальной дозе 300 мг, с последующим введением 100 мг каждые 8 ч в течение первых 24-36 ч. Возможно применение дексаметазона по 5 мг каждые 12 ч или по 2 мг каждые 6 ч. Длительность терапии глюкокортикоидами обычно составляет несколько дней.
-
Симптоматическая терапия: ликвидация гипоксии, гипертермии, дегидратации. Гипертермию купируют парацетамолом, салицилаты противопоказаны, так как они способствуют высвобождению тиреоидных гормонов из связи с белком, увеличивая их свободную фракцию. Полезно также наружное охлаждение (алкогольные губки, лед, охлаждающие компрессы). Во многих руководствах (в том числе в рекомендациях Ассоциации эндокринологов США) рекомендовано применение миорелаксанта дантролена (стартовая доза - 2,5 мг/кг массы тела), что, однако, связано со значительным риском.
-
Потеря жидкости вследствие гипертермии, потоотделения, рвоты и поноса должна быть немедленно компенсирована для предупреждения сосудистого коллапса. У пожилых пациентов с сердечной недостаточностью возмещение жидкости необходимо проводить с осторожностью. Внутривенное введение 10% раствора декстрозы и растворов электролитов помогает восстановить истощенные запасы гликогена печени и купировать гиперкальциемию, наблюдаемую у некоторых пациентов. В инфузионные растворы рекомендовано добавлять витамины.
-
При лечении застойной сердечной недостаточности применяют стандартные средства, включая дигоксин и диуретики. Дигоксин назначают в дозах, рекомендуемых для больных с тяжелым тиреотоксикозом, т.е. несколько превышающих обычные. При артериальной гипотензии, не купируемой регидратацией, может потребоваться вазопрессорная терапия.
-
Антибиотики широкого действия при подозрении на инфекцию, купирование кетоацидоза или гипогликемии.
-
На фоне интенсивной комплексной терапии улучшение состояния больного наступает через 24-30 ч. После снижения температуры, ликвидации диареи и рвоты постепенно переходят с внутривенного введения препаратов на внутримышечное или подкожное, а также назначение внутрь с постепенным уменьшением доз (в зависимости от регрессии клинических проявлений криза). Лечение продолжают до полного устранения всех симптомов и метаболических расстройств, обычно в течение 7-10 дней.
ПРОФИЛАКТИКА
-
Своевременная диагностика и рациональное лечение тиреотоксикоза.
-
Отказ от плановых оперативных вмешательств по поводу сопутствующих заболеваний у больных с декомпенсированным тиреотоксикозом.
-
Проведение радикального оперативного лечения тиреотоксикоза лишь после максимально возможной медикаментозной компенсации (в идеале на фоне эутиреоидного состояния).
-
Лечение радиоактивным йодом, как и оперативное, следует проводить на фоне компенсации тиреотоксикоза. После введения изотопа рекомендуют продолжать прием тиамазола в течение 3-4 нед для предупреждения обострения заболевания.
СПИСОК ЛИТЕРАТУРЫ
-
Papi G., Corsello S.M., Pontecorvi A. Clinical concepts on thyroid emergencies // Front. Endocrinol. (Lausanne). - 2014 Jul 1. - Vol. 5. - P. 102.
-
Haraldsdottir S., Li Q.., Villalona-Calero M.A., Olencki T.E., Kendra K., Ing S.W. Case of sorafenib-induced thyroid storm // J. Clin. Oncol. - 2013. - Vol. 31. - P. e262-е264.
-
Chong H.W., See K.C., Phua J. Thyroid storm with multiorgan failure // Thyroid. - 2010. - Vol. 20. - P. 333-336.
-
Yılmaz Karaören G., Sahin O.T., Erbesler Z.A., Bakan N. Thyroid storm due to head injury // Ulus. Travma. Acil. Cerrahi Derg. - 2014 Jul. - Vol. 20 (4). - P. 305-307.
-
Fujio S., Ashari, Habu M., Yamahata H., Moinuddin F.M., Bohara M., Arimura H., Nishijima Y., Arita K. Thyroid storm induced by TSH-secreting pituitary adenoma: a case report // Endocr. J. - 2014 Aug 12. - [Epub ahead of print.]
-
Chatterjee K., Sen C., Ghosh G.C. Thyroid storm: An early clinical diagnosis and multidrug approach to therapy // J. Postgrad. Med. - 2013 Oct-Dec. - Vol. 59 (4). - P. 339-340.
-
Carhill A., Gutierrez A., Lakhia R., Nalini R. Surviving the storm: two cases of thyroid storm successfully treated with plasmapheresis // BMJ Case Rep. - 2012 Oct 19.
-
Benvenga S., Lapa D., Cannavò S.,Trimarchi F. Successive thyroid storm treated with L-carnitine and low doses of methimazole // Am. J. Med. - 2003. - Vol. 115. - P. 417- 418.
-
Klubo-Gwiezdzinskа J., Wartofsky L. Thyroid Emergencies // Med. Clin. North Am. - 2012 Mar. - Vol. 96 (2). - P. 385-403.
-
Yılmaz Karaören G., Sahin O.T., Erbesler Z.A., Bakan N. Thyroid storm due to head injury // Ulus. Travma Acil. Cerrahi Derg. - 2014 Jul. - Vol. 20 (4). - P. 305-307.
-
Akamizu T., Satoh T., Isozaki O., Suzuki A., Wakino S., Iburi T., Tsuboi K., Monden T., Kouki T., Otani H., Teramukai S., Uehara R., Nakamura Y., Nagai M., Mori M.; Japan Thyroid Association // Thyroid. - 2012 Jul. - Vol. 22 (7). - P. 661-679.
ГИПОТИРЕОИДНАЯ КОМА
Петунина Н.А.
ОПРЕДЕЛЕНИЕ
Гипотиреоидная кома - ургентное, крайне тяжелое состояние в исходе длительно некомпенсированного гипотиреоза. Гипотиреоидная кома может развиваться при гипотиреозе любого генеза, однако значительно чаще ее диагностируют при первичном гипотиреозе. Летальность высокая, достигает 50-80%, своевременная диагностика и адекватное лечение позволяют снизить летальность до 20-30%.
ЭПИДЕМИОЛОГИЯ
Данные о частоте и распространенности гипотиреоидной комы немногочисленны. Заболеваемость составляет 0,22 на миллион населения в год. В 80% случаев встречается у женщин старше 60 лет. Однако также встречается среди молодых лиц, в том числе описаны несколько десятков случаев у беременных. Наиболее часто заболевание диагностируют в зимнее время года. У подавляющего большинства больных (95%) - первичный гипотиреоз, и лишь у немногих (5%) - вторичный гипотиреоз.
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА
Длительно текущий некомпенсированный гипотиреоз часто не имеет четких клинических проявлений, развивается медленно и протекает под масками других заболеваний, поэтому в большинстве случаев гипотиреоидную кому диагностируют поздно. Поскольку гипотиреоидная кома чаще развивается у пациентов пожилого возраста преимущественно в холодное время года, клинические симптомы заболевания воспринимают как естественные возрастные изменения организма. Кроме того, скудность субъективных данных, нечеткие проявления гипотиреоза и полиморбидность, характерные для заболеваний пожилых людей, также не позволяют своевременно установить правильный диагноз. Крайне затруднителен диагноз гипотиреоидной комы и при отсутствии анамнестических сведений о гипотиреозе.
Развитию гипотиреоидной комы предшествует прекоматозное состояние, резко утяжеляются все симптомы гипотиреоза: выраженная сухость кожи, редкие волосы, осиплость голоса, периорбитальный отек и плотный отек конечностей, макроглоссия, замедление глубоких сухожильных рефлексов, гипотермия. Утяжеление клинических проявлений, как правило, происходит постепенно в течение нескольких недель или месяцев.
Гипотермия присутствует практически у всех пациентов, в нередких случаях может быть глубокой (<26 °С), часто это первый клинический симптом. Температура тела - один из основных критериев прогноза выживания: худший прогноз у пациентов с ректальной температурой менее 33 °С. При присоединении интеркуррентного инфекционного заболевания температура тела может быть субфебрильной.
-
Другие симптомы - нарастающая сонливость, отсутствие словесного контакта, гипорефлексия. Характерно нарастающее угнетение ЦНС от заторможенности и дезориентации до комы.
-
Состояние сердечно-сосудистой системы характеризуется прогрессирующей брадикардией и артериальной гипотонией.
-
Характерный признак - гипотиреоидный полисерозит с накоплением жидкости в плевральной, перикардиальной и брюшной полостях.
-
Часто возникает острая задержка мочи и динамическая или механическая кишечная непроходимость, нередки желудочно-кишечные кровотечения.
-
Течение гипотиреоидной комы может осложняться тяжелой гипогликемией. Без адекватного лечения происходит дальнейшее падение температуры тела и АД, урежение дыхания и уменьшение ЧСС, нарастают гиперкапния и гипоксия, прогрессирует снижение сократительной способности миокарда, может развиться атония мочевого пузыря с острой задержкой мочи. Гипоксия мозга сопровождается нарушением функции жизненно важных центров ЦНС, возможно появление судорог. Непосредственной причиной смерти обычно является прогрессирующая сердечно-сосудистая и дыхательная недостаточность.
Декомпенсация тяжелого гипотиреоза сопровождается нарушениями когнитивных функций (включая внимание, концентрацию, память, ориентацию и восприятие), прогрессирующими в условиях нарастающего дефицита тиреоидных гормонов. В дальнейшем на фоне выраженной сонливости развивается спутанность сознания. Изредка возникают острые психозы, не имеющие специфических черт, имитирующие параноидный или аффективный психоз.
Проблематична также диагностика случаев гипотиреоидной комы нетипичного течения. Описаны следующие варианты нетипичной клинической картины декомпенсированного гипотиреоза:
Часто такие больные вначале наблюдаются у психиатров. Среди пациентов психиатрических клиник частота гипотиреоза достигает 3%.
ЭТИОЛОГИЯ
Резкое ухудшение больного с длительно существующим некомпенсированным гипотиреозом обычно развивается под влиянием провоцирующих факторов. Наиболее частые провоцирующие факторы гипотиреоидной комы:
У пациентов, получающих лечение тиреоидными гормонами, причинами могут быть:
У лиц пожилого возраста нередкой причиной гипотиреоидной комы служат пневмония и сепсис. Пневмония может быть первичной либо развиваться на фоне ОНМК или аспирации. В некоторых случаях, особенно у пожилых больных, развитию пневмонии способствует длительный прием ЛС, угнетающих ЦНС (фенотиазины, транквилизаторы, барбитураты, антигистаминные), а также амиодарона, препаратов лития, диуретиков и β-адреноблокаторов.
МЕХАНИЗМ РАЗВИТИЯ
В основе патогенеза микседематозной комы лежит низкий уровень внутриклеточного Т3 вследствие гипотиреоза, что приводит к развитию гипотермии и снижению инотропной и хронотропной сердечной функции. Снижение чувствительности ЦНС к гипоксии и гиперкапнии приводит к дыхательной недостаточности. Изменения со стороны органов дыхания проявляются урежением дыхания, альвеолярной гиповентиляцией с гиперкапнией, которые вместе с ухудшением мозгового кровотока усугубляют гипоксию мозга. Хотя существует многофакторность в развитии комы у пациентов, принципиальным фактором считают угнетение дыхательного центра, поддерживаемое гиперкапнией. Угнетение дыхательной функции приводит к альвеолярной гиповентиляции и прогрессированию гипоксемии и, как крайнее проявление, к гиперкапническому наркозу и коме. Ухудшение функции дыхательной мускулатуры и ожирение могут еще более усиливать гиповентиляцию. Дыхательная функция может быть нарушена и в результате плеврального выпота или асцита, уменьшения легочного объема, макроглоссии и отека (микседема) носоглотки и глотки, которые снижают эффективность проводимости дыхательных путей. Артериальная гипотония может развиваться в результате снижения объема циркулирующей крови, она может быть рефрактерна к лечению вазопрессорами, если не будут назначены тиреоидные гормоны.
НЕОТЛОЖНЫЕ МЕРОПРИЯТИЯ ПО ДИАГНОСТИКЕ, ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКИЕ МЕРОПРИЯТИЯ
Желательно диагностировать и начать лечение на той стадии заболевания, когда угнетение функций ЦНС еще не достигло предельной степени. Предикторами плохого исхода являются пожилой возраст пациента, наличие сердечно-сосудистых заболеваний и угнетенное сознание.
Гипотиреоидную кому необходимо исключать у всех пациентов в ослабленном, сомнолентном или бессознательном состоянии с гипонатриемией, особенно в сочетании с гипотермией и гиповентиляцией. Диагностические мероприятия включают исследование электролитного баланса (одного из специфических диагностических признаков) и концентрации свободных фракций тиреоидных гормонов в сыворотке крови. Основание для начала терапии - значимое снижение содержания свободных фракций Т4 и Т3 в сыворотке крови. Резкое повышение содержания ТТГ также может указывать на длительно существующий некомпенсированный гипотиреоз, однако в случае вторичного гипотиреоза содержание ТТГ принципиального значения не имеет.
Экспресс-методы определения содержания тиреоидных гормонов в крови позволяют узнать результаты исследования через несколько часов. Однако если клинические симптомы не вызывают сомнений и/или нет возможности столь быстро получить результат, лечение необходимо начать без промедления. Терапию проводят под контролем температуры тела (лучше ректальной), частоты дыхания, пульса, АД, психического статуса, состояния электролитного баланса.
Пациенты с тяжелыми нетиреоидными системными заболеваниями могут иметь сходную симптоматику, имитирующую гипотиреоидный синдром. Результаты гормонального исследования помогут дифференцировать эти состояния.
Изолированное снижение концентрации свободного Т3 , не связанное с тиреоид-ной патологией, можно наблюдать при острых и хронических инфекциях, злокачественных новообразованиях, заболеваниях печени, почек, сердца, коматозных состояниях различной этиологии, однако в этих случаях концентрация ТТГ и свободного Т4 будет в пределах нормы.
Анамнез
Если возможно получить сведения о предыдущем лечении больного, могут быть указания на предшествующее заболевание щитовидной железы, терапию радиоактивным йодом, тиреоидэктомию или терапию гормонами щитовидной железы, которая была необоснованно прервана. У 40% пациентов на момент микседема-тозной комы впервые диагностируется гипотиреоз.
Физикальное обследование
При физикальном обследовании следует обратить внимание на наличие послеоперационного рубца на шее, непальпируемой щитовидной железы или наличие зоба. Также могут быть обнаружены:
-
изменения кожных покровов (выраженная сухость кожи, крайне бледный, восковой или желтушный оттенок кожи, выраженный гиперкератоз локтей и пяток, выпадение волос на голове);
-
изменения дыхательной системы (уменьшение частоты дыхательных движений, сниженная экскурсия легких, застойные хрипы в легких);
-
изменения сердечно-сосудистой системы (синусовая брадикардия, выраженная артериальная гипотензия, увеличение размеров сердца, очень глухие тоны сердца, периорбитальный отек, плотный отек конечностей);
-
общие симптомы (осиплость голоса, увеличение языка, замедление глубоких сухожильных рефлексов, гипотермия).
Лабораторные исследования
-
Биохимический анализ крови: гипонатриемия, гипохлоремия, гипогликемия, повышение концентрации креатинина, липидов, активности креатининфос-фокиназы, трансаминаз.
-
Исследование кислотно-щелочного баланса: гипоксия, гиперкапния, ацидоз.
-
Гормональные исследования: свободные фракции Т3 и Т4 существенно снижены (основание для начала неотложной терапии), содержание ТТГ в большинстве случаев значительно повышено (>15-20 мкМЕ/мл).
Инструментальные исследования
ЛЕЧЕНИЕ
Неотложные лечебные мероприятия при гипотиреоидной коме включают в себя замещение гормонами щитовидной железы, инфузионную терапию, глюкокортикостероидную терапию, коррекцию гипотензии и электролитных нарушений, интенсивную терапию с огсигенацией и вентиляцией легких, коррекцию провоцирующих факторов.
Введение тиреоидных гормонов
Возможны внутривенный и пероральный способы введения тиреоидных гормонов. Внутривенный путь введения сопровождается быстрым повышением концентраций тиреоидных гормонов (в среднем через 3-4 ч) до субнормальных показателей, дальнейшее медленное увеличение содержания гормонов происходит в течение 5-7 дней. Интенсивная внутривенная терапия левотироксином натрия в первые часы (100-500 мкг в течение 1 ч) резко уменьшает смертность. В первые сутки левотироксин натрия вводят внутривенно капельно в дозе 300-1000 мкг/сут, в дальнейшем применяют поддерживающие дозы - 50-100 мкг/сут. При улучшении самочувствия больного, при появлении возможности самостоятельного приема препарата осуществляют переход на прием внутрь. При отсутствии растворов левотироксина натрия для парентерального введения больным в бессознательном состоянии препарат вводят через желудочный зонд.
При приеме левотироксина натрия внутрь, несмотря на медленное повышение концентраций тиреоидных гормонов в крови, клиническое улучшение наблюдают уже через 24-72 ч. Всасывание левотироксина натрия при пероральном введении варьирует, но клиническая реакция развивается быстро даже при микседематозном поражении кишечника.
В связи с некоторой отсроченностью клинических эффектов левотирокси-на натрия на протяжении первых суток возможно введение лиотиронина (Т3 ) в малых дозах (20-40 мкг) внутривенно или через желудочный зонд (100 мкг исходно, затем по 25-50 мкг каждые 12 ч). Лиотиронин дает более быстрые метаболические эффекты и активнее воздействует на ЦНС. Кроме того, существует мнение, что гипотиреоидная кома сопровождается выраженным нарушением периферической конверсии Т4 в метаболически активный Т3 . Однако внутривенное введение препарата опасно из-за значительного риска тяжелых сердечнососудистых осложнений. ИБС - противопоказание для применения лиотиронина, в этом случае назначают малые дозы левотироксина натрия (50-100 мкг/сут).
Необходимо подчеркнуть, что чем тяжелее состояние больного, тем меньшие начальные дозы тиреоидных гормонов следует использовать.
Введение глюкокортикоидов
Введение глюкокортикоидов предшествует или его проводят одновременно с введением тиреоидных гормонов. Вводят 50-100 мг/сут гидрокортизона внутривенно капельно каждые 6 ч. Через 2-4 дня в зависимости от динамики клинической симптоматики дозу глюкокортикоидов постепенно уменьшают.
Противошоковые мероприятия
Вводят плазмозаменители, 5% раствор декстрозы (глюкозы♠ ), солевые растворы. Общий объем не должен превышать 1 л в сутки во избежание перегрузки миокарда и нарастания гипонатриемии. Последняя устраняется по мере увеличения концентрации тиреоидных гормонов. При гипогликемии вводят 20-30 мл 40% раствора декстрозы (глюкозы♠ ) внутривенно болюсно.
Согревание больного
Рекомендуют пассивное согревание (повышение комнатной температуры на один градус в час, обертывание одеялами). Быстрое, активное согревание больного противопоказано в связи с ухудшением гемодинамики в результате быстрой периферической вазодилатации с развитием коллапса и аритмий.
Оксигенотерапия и искусственная вентиляция легких
Оксигенотерапию необходимо проводить всем больным в целях устранения респираторного ацидоза. В аппаратной вентиляции легких нуждаются большинство пациентов независимо от причины гиповентиляции. Оксигенотерапию и/или искусственную вентиляцию легких нужно проводить в течение нескольких дней даже после начала терапии тиреоидными гормонами.
Лечение сопутствующих заболеваний, спровоцировавших развитие гипотиреоидной комы или развившихся на ее фоне
Проводят терапию инфекционных и других сопутствующих заболеваний, вызвавших декомпенсацию гипотиреоза. При сопутствующей инфекции проводят лечение антибиотиками широкого спектра. С другой стороны, развитие гипотиреоидной комы и ее терапия могут осложняться развитием аритмий, инфаркта миокарда и тяжелой сердечной недостаточности.
Следует избегать назначения седативных средств даже при возбуждении больного, которое купируют назначением тиреоидных гормонов.
Терапия только тиреоидными гормонами без коррекции прочих метаболических расстройств неадекватна. Ввиду потенциально высокой смертности (без энергичной комплексной терапии) всех пациентов необходимо помещать в блок интенсивной терапии (реанимационное отделение) с целью мониторирования состояния дыхательной и сердечно-сосудистой систем, центрального венозного давления и давления в легочной артерии.
После вывода из критического состояния пациента необходимо перевести на пероральную терапию тиреоидными гормонами (см. лечение гипотиреоза). Причины возникновения гипотиреоидной комы должны быть тщательно рассмотрены и устранены.
СПИСОК ЛИТЕРАТУРЫ
-
Papi G., Corsello S.M., Pontecorvi A. Clinical concepts on thyroid emergencies // Front. Endocrinol. (Lausanne). - 2014 Jul 1. - Vol. 5. - P. 102.
-
Mathew V., Misgar R.A., Ghosh S., Mukhopadhyay P., Roychowdhury P., Pandit K., Mukhopadhyay S., Chowdhury S. Myxedema Coma: A New Look into an Old Crisis // J. Thyroid. Res. - 2011.
-
Beynon J., Akhtar S., Kearney T. Predictors of outcome in myxoedema coma // Crit. Care. - 2008. - Vol. 12 (1). - P. 111.
-
Rodríguez I., Fluiters E., Pérez-Méndez L.F., Luna R., Páramo C., García-Mayor R.V. Factors associated with mortality of patients with myxoedema coma: prospective study in 11 cases treated in a single institution // J. Endocrinol. - 2004 Feb. - Vol. 180 (2). - P. 347-350.
-
Mir S.A., Wani A.I., Masoodi S.R., Bashir M.I., Ahmad N. Lithium toxicity and myxedema crisis in an elderly patient // Indian J. Endocrinol. Metab. - 2013 Dec. - Vol. 17 (Suppl. 3). - P. S654-S656.
-
Hassan S., Ayoub W., Hassan M., Wisgerhof M. Amiodarone-induced myxoedema coma // BM. J. Case. Rep. - 2014 Apr 12.
-
Kogan A., Kassif Y., Shadel M., Shwarz Y., Lavee J., Or J., Raanani E. Severe hypothermia in myxoedema coma: a rewarming by extracorporeal circulation // Emerg. Med. Australas. - 2011 Dec. - Vol. 23 (6). - P. 773-775.
-
Klubo-Gwiezdzinska J., Wartofsky L. Thyroid emergencies // Med. Clin. North Am. - 2012 Mar. - Vol. 96 (2). - P. 385-403.
-
James R., James J., Vij A.S., Vij K.K. Postoperative myxoedema coma // BMJ Case Rep. - 2014 Feb 13.
-
Chaudhari D., Gangadharan V., Forrest T. Heart failure presenting as myxedema coma: case report and review article // Tenn. Med. - 2013 May. - Vol. 106 (5). - P. 39-40.