Анемия хронических заболеваний
Анемия хронических заболеваний / под общ. ред. Крюкова Е. В. - Москва : ГЭОТАР-Медиа, 2020. - 160 с. - ISBN 978-5-9704-5923-2 |
Аннотация
В руководстве представлены современные сведения, касающиеся этиологии, патогенеза, клинических проявлений и способов лечения анемии хронических заболеваний. Приведенные данные являются результатом глубокого анализа не только ранее опубликованной информации по этой проблеме, но и, в значительной степени, собственных исследований. Предложена оригинальная классификация хронических заболеваний.
Издание адресовано врачам-гематологам и терапевтам, врачам общей практики, а также специалистам в области внутренней медицины (гастроэнтерологам, ревматологам и другим). Может применяться в обучении студентов, аспирантов, ординаторов, слушателей сертификационных курсов и курсов повышения квалификации.
ОБМЕН ЖЕЛЕЗА
Железо (Fe) принадлежит к восьмой группе элементов периодической системы Д.И. Менделеева (атомный номер 26, атомный вес 55,847, плотность 7,86 г/см3 ), один из самых распространенных металлов на Земле. В организме человека содержится около 4-5г этого металла. Железо всасывается в двенадцатиперстной кишке, используется в костном мозге, хранится в печени и селезенке. Находится в растворимой форме в связи с ферритином, а внутри клеток хранится в нерастворимой форме в связи с лактоферрином и гемосидерином. Уникальная способность железа изменять свое состояние окисления и окислительно-восстановительный потенциал (валентность) в ответ на смену состава окружающих лигандов делает этот металл необходимым почти всем живым существам. Железо легко вступает в одноэлектронные окислительно-восстановительные реакции, переходя при этом между Fe2+ - и Fe3+ - состояниями. Железосодержащие белки являются ключевыми компонентами многих биологических процессов, таких как энергетический обмен, транспорт кислорода, репликация и репарация ДНК, нейтрализация активных форм кислорода и многих других, катализируемых ферментами оксигеназами, пероксигеназами и т.п.
Однако те же самые химические свойства железа делают его опасным для организма. Человеческое тело не имеет механизма по утилизации избытка этого элемента. Даже малое количество «свободного» железа может катализировать образование высокотоксичных радикалов. Биологическая ценность железа определяется многогранностью его функций, незаменимостью другими металлами в сложных биохимических процессах, активным участием в клеточном дыхании, обеспечивающем нормальное функционирование тканей и организма человека.
Кроме важного значения в метаболизме, железо также необходимо для роста инфекционных агентов. Одним из механизмов защиты от инфекции считается активация метаболического пути, уменьшающего концентрацию сывороточного железа с транспортировкой его внутрь клеток. Развивающийся дефицит железа вызывает уменьшение синтеза эритроцитов и развитие АХЗ.
Тип железа |
Концентрация (мг Fe/кг) |
|
Женщины |
Мужчины |
|
Функциональное железо |
||
Гемоглобин (Hb) |
31 |
28 |
Миоглобин |
5 |
4 |
Гемовые ферменты |
1 |
1 |
Негемовые ферменты |
1 |
1 |
Транспортное железо |
||
Трансферрин |
<1 (0,2) |
<1 (0,2) |
Железо запаса |
||
Ферритин |
8 |
4 |
Гемосидерин |
4 |
2 |
Общее количество |
50 |
40 |
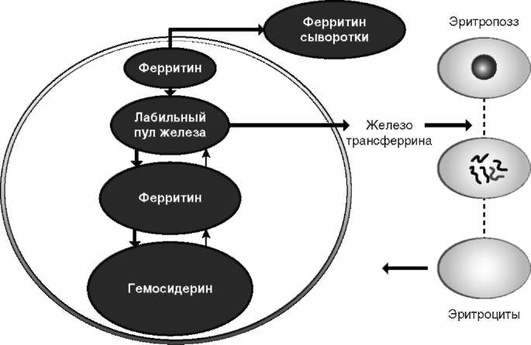
Все железосодержащие и железозависимые белки по характеру их связи с этим биоэлементом, а также с учетом их функции можно разделить на четыре группы, в том числе три составляют стабильный пул железа и одна группа - лабильный пул железа (см. табл. 2-1).
СТАБИЛЬНЫЙ ПУЛ ЖЕЛЕЗА
В организме его содержание можно условно разделить на клеточное, неклеточное и железо запаса. Клеточное железо выявляется в первую очередь в гемопротеинах, основным компонентом которых является гем [1]. Это самая большая группа ферропротеинов, объединяющая гемсодержащие белки, включает приблизительно 2/3 железа организма. К ним относятся гемоглобин, миоглобин, нейроглобин, циклооксигеназа, цитохромы дыхательной цепи (a1, a3, b1, b5, c), цитохром P450, каталаза, перокси-дазы (миелопероксидаза, тиреопероксидаза, лактопе-роксидаза) и др.
Гем является конечным продуктом в цепи превращений порфиринов в результате включения Fe2 в протопорфириновое кольцо при участии фермента феррохелатазы, чувствительного к воздействию свинца. Угнетение активности этого фермента нарушает утилизацию железа, и оно может накапливаться, связываясь с другими белками и лигандами. Все клетки организма имеют гемсодержащие белки, поэтому синтез гема идет во всех клетках, за исключением эритроцитов, не имеющих, как известно, белоксинтезирующей системы.
Гемоглобин, содержащийся в эритроцитах, выполняет важную для организма газотранспортную функцию - переносит экзогенный кислород и эндогенный углекислый газ. Гем является конечным продуктом в цепи превращений порфиринов в результате включения Fe2 в протопорфириновое кольцо при участии фермента феррохелатазы, чувствительного к воздействию свинца. Угнетение активности этого фермента нарушает утилизацию железа, и оно может накапливаться, связываясь с другими белками и лигандами.
Гемоглобин состоит из белка и железосодержащего гема. В каждую цепь глобина встроена молекула гема; содержащийся в ней атом железа связывает кислород. Переносить кислород может только двухвалентное железо. Большая часть гемоглобина у взрослых содержит две цепи а-глобина и две - р-глобина (по 141 и 146 аминокислот соответственно), которые кодируются генами а-глобиновых кластеров и генами р-глобиновых кластеров, находящихся на различных хромосомах. Ген а-глобина человека локализован на 16-й хромосоме в позиции p13.3-pter. Ген р-глобина человека локализуется на 11-й хромосоме в позиции p15.5. Гены, кодирующие у-, б- и е-цепи, локализуются на 11-й хромосоме. Последовательная экспрессия различных генов глобина во время онтогенеза приводит к смене преобладающего типа гемоглобина. Так, на момент рождения преобладает синтез не р-, а у-цепей, которые, соединяясь с а-цепями, образуют фетальный гемоглобин (гемоглобин F).
Гемоглобин - это примерно 95% белков эритроцитов. Молекула гемоглобина представляет собой тетрамер, состоящий из двух гомологичных димеров. Гемоглобин нормального человека содержит три компонента. На долю гемоглобина А1 приходится 90% всего гемоглобина, в то время как гемоглобин А2 составляет 2,5%, гемоглобин А3 - 7,5%. Конфигурация как отдельных цепей, так и молекулы в целом может меняться, приводя к образованию форм гемоглобина с различным сродством к кислороду.
Время жизни эритроцитов составляет около 120 дней. К концу этого периода они стареют и затем разрушаются фагоцитирующими макрофагами печени, селезенки, костного мозга. Гемоглобин расщепляется на гем и глобин. Глобин распадается на составляющие его аминокислоты, которые поступают в общий фонд свободных аминокислот печени и используются в соответствии с потребностями. От гема отщепляется железо, а остающиеся пиррольные кольца образуют зеленый пигмент биливердин, который превращается в билирубин - желтый пигмент, входящий в состав желчи.
Миоглобин - дыхательный белок сердечной и скелетной мускулатуры. Основной функцией миоглобина является транспортировка кислорода через клетку и регуляция его содержания в мышце для осуществления сложных биохимических процессов, лежащих в основе клеточного дыхания. Он содержит 0,34% железа. Миоглобин депонирует кислород во время сокращения мышц, а при их поражении он может попадать в кровь и выделяться с мочой. Темы - комплексные соединения порфиринов с двухвалентным железом, несущие один или два аксиальных лиганда. Следующая форма клеточного железа - железосодержащие ферменты негеминовой группы. Это негемовое железо, включающее железосерные белки и железофлавопротеиды, к которым относятся негемовые ферменты митохондрий, также участвующие в транспорте электронов и имеющие в своем составе больше железа, чем цитохромы. Эта группа включает никотинамидадениндинуклеотиддегидрогеназу, сук-цинатдегидрогеназу, ксантиноксидазу, а также специализированный железосерный белок нуклеинового обмена рибонуклеотид редуктазу, оксигеназы, в том числе липоксигеназу.
НЕКЛЕТОЧНОЕ ЖЕЛЕЗО
Представлено белками трансферрином и лакто-феррином, содержащимися во внеклеточном пространстве, осуществляющими транспортную функцию по отношению к ионам железа. Вне клеток железо также обычно находится в связанном состоянии - в виде железо-белковых комплексов. Концентрация его в плазме широко варьирует у здорового человека, составляет 10,8-28,8 мкмоль/л с достаточно большими суточными колебаниями, достигающими 7,2 мкмоль/л. Уровень железа в плазме крови зависит от ряда факторов: взаимоотношения процессов разрушения и образования эритроцитов, состояния запасного фонда железа в желудочно-кишечном тракте. Однако наиболее важной причиной, определяющей уровень плазменного железа, является взаимодействие процессов синтеза и распада эритроцитов.
Трансферрин - это гликопротеин плазмы, относящийся к бета-1-глобулинам с молекулярной массой от 75 до 80 кДа, представляет собой полипептидную цепочку из 679 аминокислот, имеет два места для связывания трехвалентного железа (один на N-конце и другой на С-конце). Может связывать один или два атома железа, а 1 г трансферрина - около 1,25 мг железа, исходя из чего можно определить общее количество железа, которое может связать сывороточный трансферрин. Оно приближается к величине общей железосвязывающей способности сыворотки крови. Трансферрин, не связанный с железом, называется апотрансферрин. Концентрация в плазме у взрослых в норме колеблется от 1,8 до 3,2 г/л. Хотя основное место синтеза трансферрина - печень (около 16 мг/ кг/сут), он также может синтезироваться в макрофагах, лимфоидных органах и в меньшей степени - в лимфоцитах.
Функции трансферрина в организме представляют значительный интерес. Он не только переносит железо в различные ткани и органы, но и «узнает» синтезирующие гемоглобин ретикулоциты и, возможно, другие нуждающиеся в железе клетки. Трансферрин отдает железо им только в том случае, если клетки имеют специфические рецепторы, связывающие железо. Кроме того, трансферрин обладает защитной функцией: предохраняет ткани организма от токсического действия железа.
Концентрация трансферрина уменьшается при системном воспалении. У пациентов с ЖДА концентрация железа вначале поддерживается в нормальных значениях за счет имеющихся депо. Затем увеличивается концентрация трансферрина, после этого уменьшается концентрация железа и развивается гипохромная анемия. Таким образом, концентрация трансферрина повышается при ЖДА. Также концентрация трансферрина может повышаться при высокой концентрации эстрогена (беременность, заместительная гормональная терапия, оральная контрацепция, хотя лекарства с низкой и ультранизкой дозой имеют меньший эффект), использовании тиазидных диуретиков, а также при тяжелом гипогонадизме у мужчин. Концентрация трансферрина уменьшается у пожилых людей, а также при воспалительных заболеваниях, таких как ревматоидный артрит (РА), злокачественные новообразования, инфекция, нарушениях питания, экзогенном воздействии андрогена. У больных гемохроматозом концентрация трансферрина также может уменьшаться.
Для работы трансферрина необходимы рецепторы, которые находятся как в клеточных мембранах, так и в растворимом виде.
Мембранный рецептор трансферрина представляет собой мембранный гликопротеин весом 190 кДА, состоящий из 760 аминокислот, образующих два мономера, связанных дисульфидными связями. Все клетки в организме человека, кроме зрелых эритроцитов, экспрессируют рецепторы трансферрина на своих мембранах. 80% рецепторов трансферри-на расположены на мембранах предшественников эритробластов. Развивающийся дефицит железа стимулирует быстрый синтез мембранных рецепторов трансферрина.
Растворимый рецептор трансферрина (soluble transferrin receptor) является мономерной формой мембранного рецептора трансферрина. Концентрация растворимого рецептора трансферрина считается маркером эритропоэтической активности и дефицита железа в тканях. Растворимый рецептор трансферрина увеличивается пропорционально дефициту железа. Считается, что системное воспаление не влияет на концентрацию растворимого рецептора трансферрина.
Общая железосвязывающая способность сыворотки крови - расчетный показатель, получающийся путем умножения концентрации трансферрина (г/л) на 25 для учета конверсии микромолей в моли (106 ), молекулярной массы трансферрина и его способности связывать два атома железа. В норме составляет 45-80 мкмоль/л. Массивный гемолиз сопровождается высвобождением в плазму количества железа, превышающего общую железосвязывающую способность.
Коэффициент насыщения трансферрина - показатель, который измеряется в процентах и рассчитывается как отношение концентрации железа (мкмоль/л) к общей железосвязывающей способности (мкмоль/л). В норме значения этого показателя составляют 20-40% у мужчин и 15-35% у женщин. Значение более 45% свидетельствует о перегрузке железом. Коэффициент насыщения трансферрина железом может уменьшаться как при железодефицитной анемии, так и при АХЗ. Концентрация железа может меняться в течение 24-часового цикла, тогда как концентрация трансферрина стабильна.
Лактоферрин - также железосвязывающий белок, обнаружен во многих биологических жидкостях: молоке, слезах, желчи, синовиальной жидкости, панкреатическом соке и секрете тонкого кишечника. Лактоферрин относится к семейству трансферринов, переносит ионы трехвалентного железа. Кроме того, он находится в специфических вторичных гранулах нейтрофильных лейкоцитов, образуясь в клетках миелоидного ряда со стадии промиелоцита. Подобно трансферрину, лактоферрин способен связывать два атома железа. Он состоит из одной полипептидной цепочки, молекулярный вес приблизительно равен 80 000. В физиологических условиях этот железосвязывающий белок насыщен железом до 20%, в ничтожных количествах он содержится в плазме крови, освобождаясь в нее из нейтрофильных лейкоцитов. Несмотря на схожесть лактоферрина и трансферрина, эти железосвязывающие белки отличаются друг от друга по антигенным свойствам, составу аминокислот, белков и углеводов.
ЖЕЛЕЗО ЗАПАСА
К этому пулу относят белковые соединения железа с ферритином и гемосидерином, которые задействуются при недостатке клеточного железа. Наибольшее количество железа (за вычетом крови) содержится в следующих органах: селезенке (336 мкг/г), легких (319 мкг/г), печени (195 мкг/г), мышцах (до 27,9%, в виде миоглобина - 21,9%, ферритина - 6,91%), печени (7,8% - ферритин, гемосидерин). Ферритин и гемосидерин являются основными соединениями, содержащими запасы железа в клетке. Они находятся главным образом в ретикулоэндотелиальной системе печени, селезенки и костного мозга. Приблизительно одна треть резервного железа организма человека, преимущественно в виде ферритина, падает на долю печени. Большая часть железа печени находится в комплексе с белком ферритином или гемосидерином (примерно 80%), 5% ассоциировано с трансферрином, 2% - с гемом, а оставшаяся часть находится в лабильном пуле железа. Запасы железа могут быть при необходимости мобилизованы для нужд организма и предохраняют его от токсичного действия свободно циркулирующего железа.
Ферритин - гидрофильная молекула массой 450 кДа, состоящая из 24 субъединиц, формирующих полую сферу. Состоит из субъединиц Н-типа (heart) и L-типа (liver). Различные комбинации этих субъединиц обусловливают существование большого числа изоформ ферритина. Этот белок может существовать в гликозилированной и негликозилированной формах. Гликозилированная форма имеет более длительный период полураспада и составляет от 60 до 80%. Белок, не содержащий железа, называется апоферритин. Каждая молекула ферритина может связывать до 4500 молекул железа. Синтез ферритина индуцируется при высоком уровне внутриклеточного железа и подавляется при нехватке железа. Эта регуляция опосредуется системой «железоответственный элемент-железорегуляторный белок». Синтез ферритина также регулируется цитокинами, такими как интерферон-γ, интерлейкин (ИЛ)-1 и -6. Деградация ферритина и, следовательно, высвобождение железа помогает мобилизовать железо для нужд клетки. В процесс деградации вовлечены протеосомный и лизосомный аппараты клетки.
Общее количество ферритина у мужчин около 1 г, у женщин около 0,4 г. Нормальная концентрация у мужчин составляет 30-300 г/л, у женщин 20-200 г/л. Внутриклеточный ферритин депонирует около 0,5 г легкодоступного железа. Концентрация плазменного ферритина менее 12-16 нг/л свидетельствует о дефиците железа.
Ферритин - белок, который хранит железо в доступной форме и является ключевой молекулой, ограничивающей токсическое действие железа в норме и при патологии. Железо, связанное с фер-ритином, нетоксично. Имеется также плазменный ферритин, содержащий небольшое количество железа, имеющий короткий период полураспада и быстро утилизирующийся печенью. Эта форма ферритина является источником доступного и быстро метаболи-зируемого железа. Негликозилированный ферритин содержится преимущественно внутри паренхиматозных клеток, а повышение его концентрации в плазме отражает лизис этих клеток.
Гемосидерин - не растворимая в воде молекула, присутствующая в лизосомах. Железо, хранящееся в комплексе с гемосидерином, гораздо менее доступно и менее эффективно в продукции свободных радикалов, чем в комплексе с ферритином.
Существует лабильный пул железа - от 80 до 90 мг: железо, покидающее плазму крови, проходящее в интерстициальное пространство, в межклеточные промежутки, где оно может связываться с клеточной мембраной, а может возвращаться обратно в плазму крови. Его существование было установлено в экспериментах с радиоактивными изотопами железа. Полагают, что данный пул железа сосредоточен в лимфатической системе или депонируется в цитоплазме клеток вне комплекса с ферритином.
МЕТАБОЛИЗМ ЖЕЛЕЗА
Обмен железа в организме можно разделить на пять этапов (фаз).
Фаза 1 - всасывание в желудочно-кишечном тракте. Железо всасывается как в виде гема, так и в негемовой форме с помощью ворсинок верхней части тонкого кишечника. Сбалансированная ежедневная диета содержит около 5-10 мг железа (гемового и негемового), но всасывается лишь 1-2 мг. В желудке происходит ионизация железа путем комплексования с биокомпонентами желудочного сока. Железо поступает в дуоденум и проксимальный отдел тощей кишки, где всасывается не более 1-2 мг железа в сутки (зависит от обеспеченности организма железом).
Для метаболизма железа наиболее важны клетки, находящиеся в эпителиальном слое дуоденального отдела кишечника - энтероциты, которые являются высокоспециализированными клетками, координирующими абсорбцию и транспорт железа ворсинками.
Поддержание баланса железа связано с жизненным циклом энтероцита, начинающегося с родоначальных молодых клеток, находящихся в крипте и преобразующихся в зрелые энтероциты на кончиках ворсинок. В энтероцитах происходит программируемый синтез новых необходимых организму белков, ответственных за абсорбцию, хранение и транспорт пищевого железа.
Всасывание регулируется протеинами энтероцитов:
-
дуоденальный цитохром В обладает феррооксидазной активностью, переводит трехвалентное железо в двухвалентное [транспортер ионов двухвалентных металлов (divalent metal transporter -DMT)-1];
-
ферропортин - ferroportin 1 (гемовая оксида-за) - продвигает двухвалентное железо к базола-теральной мембране, откуда железо переходит во внутренние эпителиальные клетки, из которых попадает в плазму или соединяется с апоферритином, образуя ферритин, который в последующем теряется организмом вместе со спущенными клетками кишечного эпителия;
-
гефестин вместе с ферропортином участвует в переносе железа через мембрану энтероцита, но при этом окисляет железо в трехвалентное, так как трансферрин присоединяет только трехвалентное железо. Гефестин очень сходен с церуло-плазмином, который тоже обладает ферроокси-дазной активностью и регулирует концентрацию экспортируемого железа из клетки в плазму (ответственен за насыщение апотрансферрина железом и превращение его в трансферрин);
-
железоответственный элемент и железорегуляторный белок - при избытке железа железо-регуляторный белок не связывается с железо-ответственным элементом, снижается синтез рецепторов трансферрина, и железо не проникает в кровь и ткани. При дефиците железа железорегуляторный белок взаимодействует с железоответственным элементом, что приводит к усилению экспрессии рецепторов трансфер-рина в дуоденальной крипте, повышению всасывания железа и уменьшению концентрации дуоденального ферритина. При высоком содержании железа железоответственный элемент и транспортер двухвалентных металлов DMT-1 разрушаются;
-
гепцидин (антимикробный пептид) - универсальный гуморальный регулятор метаболизма железа (отрицательный регулятор транспорта железа, состоит из 25 аминокислот). При избытке железа его синтез гепатоцитами повышается. При анемии снижается экспрессия гена гепцидина, в результате чего повышается захват железа из макрофагов (быстро) и из кишечника (медленно);
-
фактор высокого Fe (High Fe), название которого теперь известно только в виде аббревиатуры HFE, - трансмембранный белок семейства белков основного комплекса гистосовместимости класса 1 - связывает рецепторы трансферрина с высокой афинностью, близкой к трансферрину, блокируя возможность соединения трансферрина со своим рецептором, что снижает доставку железа к тканям. Поступление железа в организм происходит через слизистую оболочку кишечника, где оно адсорбируется из пищи энтероцитами. Процесс обновления кишечных энтероцитов происходит постоянно. Энтероциты перемещаются из складок слизистой оболочки к вершине ворсинок примерно за 24-36 ч и затем постепенно отторгаются в просвет кишечника (суммарное время жизнедеятельности - 48-72 ч). При этом на апикальной мембране расположены транспортные, регуляторные и вспомогательные белки, обеспечивающие абсорбцию, трансформацию и транспорт гема и негемового железа в клетку. Базолатеральная мембрана и пограничная область энтероцита являются носителями транспортеров и медиаторов перехода железа в кровь с участием ферропортина, трансферриновых рецепторов и HFE, где железо находится в связанном с трансферрином транспортном комплексе. Не экспортированное в плазму железо удаляется из организма при слущивании энтероцитов.
На рис. 2-2 схематично изображен механизм всасывания железа в двенадцатиперстной кишке.
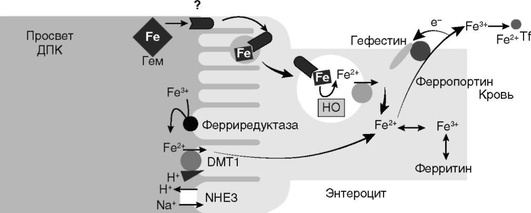
Регуляция абсорбции Fe происходит на апикальной и базолатеральной мембранах. При этом апикальная мембрана специализирована для поглощения гема и Fe2+ из воды и пищи, а базолатеральная мембрана является медиатором перехода Fe во внутренние эпителиальные клетки для дальнейшего его использования организмом. Железо, которое не экспортируется в плазму, теряется при слущивании внутреннего эпителия.
На апикальной поверхности энтероцитов происходит связывание Fe3+ из муцина с дуоденальным цитохромом b. Дуоденальный цитохром b является ферриредуктазой, восстанавливает Fe3+ до Fe2+ , что делает возможным перенос железа с участием DMT-1. Этот транспортер является представителем большого семейства белков, осуществляющих транспорт различных двухвалентных ионов металлов, однако его основной функцией является трансмембранный перенос Fe2+ . У человека он кодируется геном SLC11A2. Уровень экспрессии транспортера DMT-1 в энтероцитах крипт зависит от обеспеченности железом организма в целом. Информация поступает в энтероциты с железотрансферриновым комплексом через базолатеральную мембрану путем рецептор-опосредованного эндоцитоза. Происходит программирование уровня активности энтероцита в части его способности к поглощению железа. Эта программа сохраняется в течение всего периода жизнедеятельности клетки. Возможно, на базолатеральной мембране клетки существуют рецепторы нагруженного железом и свободного от металла трансферрина, которые регулируют вход и выход трансферрина соответственно. Из-за снижения содержания внутриклеточного железа дифференцирующиеся энтероциты, мигрирующие к вершине ворсинок, начинают вырабатывать повышенное количество DMT-1, в результате чего усиливается захват железа. Этот процесс зависит от белка гемохроматоза HFE. Белок гемохроматоза человека кодируется геном HFE. Ген HFE расположен на коротком плече хромосомы 6, локусе 6р21.3. Белок, кодируемый этим геном, является мембранным белком, который связывается с р2 -микроглобулином. Считается, что этот белок выполняет функции по контролю всасывания железа, регулируя взаимодействие рецептора трансферрина с трансферрином. В норме HFE экспрессируется в энтероцитах крипт дуоденума, где он расположен преимущественно интра-целлюлярно и ассоциирован с рецептором транс-феррина (transferrin receptor - TfR). Этот комплекс регулирует уровень поглощения железа в кишечнике.
Таким образом, мутация HFE-гена нарушает трансферрин-опосредованный захват железа энтероцитами двенадцатиперстной кишки, вследствие чего формируется ложный сигнал о наличии низкого содержания железа в организме, что, со своей стороны, приводит к повышенной выработке железосвязывающего белка DMT-1 в ворсинках энтероцитов и, как следствие, к повышенному захвату железа, что приводит к гемохроматозу.
Экспериментальные исследования свидетельствуют о том, что транспорт железа и других двухвалентных ионов металлов посредством DMT-1 является рН-зависимым, но точный механизм регулирующего действия рН неизвестен.
Второй путь транспорта железа в кишечнике касается транслокации только Fe3+ и протекает при посредничестве ключевого белка мобилферрина (mobilferrin). У железодефицитных животных и DMT-1, и мобилферрин сосредоточены на апикальной поверхности микроворсинок. В энтероцитах железо связывается и хранится в виде ферритина, который впоследствии либо используется, либо удаляется в результате слущивания эпителиальных клеток. Квота железа, предназначенная для метаболизма в других тканях, переносится через базолатеральную мембрану энтероцита.
Фаза 2 - транспорт в ткани. Концентрация железа в крови в основном контролируется взаимодействием двух белков - гепцидина и ферропортина, что дало возможность назвать это взаимодействие осью «гепцидин-ферропортин». Это ключевой механизм в регуляции обмена железа. Соотношение этих белков регулирует депонирование и высвобождение железа из клеток. Единственная известная молекулярная мишень воздействия гепцидина - белок ферропор-тин, служащий трансмембранным каналом, посредством которого осуществляется транспорт железа из плазмы в клетку. При увеличении уровня железа в плазме крови увеличивается и концентрация гепцидина, который снижает всасывание железа из двенадцатиперстной кишки и высвобождение железа из депо.
Транспорт и депонирование железа в организме осуществляются группой белков - сидерофилинов (негемовые гликопротеины: трансферрин плазмы и лактоферин молока и большинства секретов, где он представлен белковым компонентом гранул полиморфноядерных лейкоцитов). Их объединяет наличие двух участков связывания трехвалентного железа.
К энтероциту подходит трансферрин (р-глобулин). Таким образом железо попадает в циркулирующую кровь (сывороточное железо), а затем в органы депонирования (печень, селезенку), где связывается с рецепторами к трансферрину на мембране ретикулоцитов (интегральный мембранный гликопротеин), отдает клетке железо, а само возвращается в циркуляцию в виде апотрансферрина (одноцепочечный, 700 аминокислот). В норме трансферрин насыщен железом на 25-40% (на одну треть своей железосвя-зывающей способности).
Фаза 3 - утилизация тканями. Всего в организме человека 3-5 г железа, которое распределяется следующим образом: гемоглобин (хромопротеид) содержит 65% железа организма; депонированные формы железа (ферритин, гемосидерин) - 31 (15-30)%; миогло-бин - 3,5%; тканевые ферменты - 0,5%; сывороточное железо - 0,1%.
Фаза 4 - депонирование. Ферритин - лабильный пул - это растворимая нетоксичная форма в белковой оболочке в цитозоле практически всех клеток организма, период полужизни - около 60 ч. Легкодоступный резерв для синтеза железосодержащих соединений. Основная масса ферритина содержится в костном мозге и ретикулоцитах. Ферритин также является белком острофазного воспаления и повышается в организме при инфекционных и неопластических процессах, в том числе при беременности. Содержание 1 мкг/л ферритина в сыворотке соответствует 10 мкг железа в депо. Этот показатель не информативен при лечении: прием препаратов железа в течение 3 нед или парентеральное введение декстрана железа в течение последних суток вызывает повышение ферритина до нормального и высокого.
В печени и селезенке (в лизосомах, в основном макрофагов) железо соединяется с нерастворимыми субстратами, образуя нерастворимую форму депонированного железа гемосидерин (деградированный ферритин), конечный продукт обмена железа, без белковой оболочки.
Лактоферрин, высвобождаясь в процессе дегрануляции полиморфноядерных лейкоцитов, поглощается макрофагами после связывания с железом, присутствующим в инфицированных участках. Лактоферрин связывает избыточное железо в желудочно-кишечном тракте. В женском молоке содержится ненасыщенный лактоферрин, что обеспечивает подавление роста железозависимых микроорганизмов (сальмонеллы, клостридии, бактероиды, эшерихии, стафилококки, микобактерии).
Фаза 5-экскреция и потеря железа. Осуществляется с потом, мочой, калом, путем слущивания эпителия кишечника, выпадения волос и отрастания ногтей. Общая потеря Fe организмом не зависит от пола и равна 1 мг/сут, у менструирующих женщин - 2-3 мг/сут.
В среднем человеческое тело содержит 4 г железа. В нормальном состоянии 1-2 мг железа ежедневно потребляется из пищи дуоденальными энтероцитами. Железо, абсорбированное энтероцитами, по мере необходимости поступает в плазму крови, где связывается с переносчиком - трансферрином. Если такой необходимости нет, то железо остается в энтероцитах и позже выводится из организма через желудочно-кишечный тракт в составе клеток, отторгнутых по мере износа. Примерно 3 мг железа циркулирует в комплексе с трансферрином. Это железо потребляется многими клетками, в основном посредством TfRl-зависимого рецептор-индуцируемого эндоцитоза. Клетки получают железо из плазмы крови, где в нормальном состоянии большая часть железа находится в комплексе с трансферрином.
Большинство клеток способно получать железо из этого комплекса посредством рецептор-индуцируемого эндоцитоза (рецепторы TfRl и TfR2). Трансферрин - гликопротеид, содержащийся в большом количестве в плазме крови и с высокой аффинностью связывающий две молекулы Fe3+ . При внеклеточном pH~7,4 холотрансферрин (Holotransferrin TF - трансферрин, связанный с двумя молекулами железа) способен быстро связываться с TfRl. Эндоцитоз происходит в окаймленных ямках - специальных структурных образованиях на плазматической мембране. Вследствие инвагинации окаймленной ямки внутрь клетки формируется окаймленный пузырек, который быстро превращается в эндоцитоз-ный пузырек. Кислая среда вызывает изменения как в молекуле TfRl, так и в трансферрине, что приводит к диссоциации трехвалентного железа от комплекса. При этом трансферрин остается связанным c рецептором. Далее редуктаза Steap3 восстанавливает Fe3+ до Fe2+ , которое транспортируется из эндосомы в цитоплазму с помощью белка DMT-1. TfRl в комплексе с апотрансферрином возвращается на плазматическую мембрану, где может вступать в новый цикл эндоцитоза.
Большая часть этого железа предназначена для развивающихся эритроцитов костного мозга, где оно потребляется со скоростью примерно 22 мг в день и используется для синтеза гемоглобина. Значительная часть железа организма (65-70%) находится в циркулирующих эритроцитах. Старые или поврежденные красные кровяные клетки удаляются из циркуляции макрофагами ретикулоэндотелиальной системы, где железо высвобождается из гемоглобина и экспортируется обратно в плазму или запасается в комплексе с ферритином. Частично железо поступает из старых эритроцитов: после их фагоцитоза макрофагами железо попадает в фагосомы, откуда рециркулируется обратно в кровяное русло. Железо входит в цитоплазму макрофагов при участии ферропортина и поддержке феррооксидазной активности церулоплазми-на и гемовой оксидазы (ГО). Кроме того, макрофаги имеют в распоряжении белки-транспортеры - DMT-1, интегрин-мобил-ферриновый протеин (integrin-mobilferrin protein) и белки-регуляторы - HFE, другие Fe-регуляторные белки. Схематически данную картину можно представить следующим образом:
-
Fe в макрофагах освобождается из порфиринового кольца с помощью гемовой оксидазы;
-
Fe входит в фагосомы макрофагов (в этом процессе участвуют ферропортин и церрулоплазмин, обладающий восстановительной способностью);
-
Fe в эндосомах связывается с белками-транспортерами - DMT-1 и интегрин-мобил-ферриновым протеином;
-
Fe передается на апотрансферрин, а затем в эритроцитах феррохелатаза «вставляет» двухвалентное железо в протопорфирин IX для построения гема. Таким образом, железо стареющих эритроцитов через ряд последовательных соединений с соответствующими белками возвращается в кровоток, соединяясь с ТР.
Кроме поступления железа из кишечника и его высвобождения из стареющих эритроцитов, существует альтернативный железо-транспортный путь. Трехвалентное железо связывается с муцином, который передает его на интегрин, и далее, после перехода в энтероцит, связывается с интегрин-мобил-ферриновым протеином. Клетки ретикулоэндотелиальной системы высвобождают в плазму примерно 22 мг железа в день, что компенсирует потребление клетками костного мозга. Другие клетки потребляют железо из плазмы в небольшом количестве для синтеза железосодержащих белков, таких как гем-содержащие цитохромы и содержащие железо-серный кластер белки. Примерно 10-15% железа организма хранится в этих белках. Оставшиеся 20% откладывается в «запасниках», преимущественно в макрофагах и гепатоцитах. Потеря железа организмом происходит за счет слущивания клеток кожи и слизистой, а также при кровопотере.
СИСТЕМНЫЕ РЕГУЛЯТОРЫ ОБМЕНА ЖЕЛЕЗА
Транспорт железа - строго контролируемый процесс, который может регулироваться в соответствии с потребностями организма. Отдельные клетки поддерживают должный внутриклеточный уровень железа, изменяя активность соответствующих белков на различных уровнях. Помимо такой «внутренней» регуляции, клеточный транспорт железа может контролироваться извне системными регуляторами, что наиболее характерно для клеток ретикулоэндотели-альной системы, клеток печени и энтероцитов тонкой кишки. Открытие новых регуляторов метаболизма железа выявило сложность системы поддержания гомеостаза железа, но в то же время помогло улучшить общее понимание работы этой системы.
Гепцидин: ключевым моментом в понимании регуляции системного гомеостаза железа было открытие регуляторного белка гепцидина. Гепцидин - это белок из 25 аминокислот. Имеет особенную волосоподобную структуру и содержит 4 цистиновые мостика, по строению аналогичен противомикробным белкам.
В 2001 г. Park et al. в ходе исследований по изучению антимикробных свойств различных биологических жидкостей человека сообщили о выделении из мочи человека нового пептида, который назвали гепцидином (hepcidin). Название нового пептида было получено путем комбинации двух слов: hepar (лат. - печень - место синтеза пептида) и cidin (лат. - уничтожать - подчеркивает антимикробные свойства белка). Позднее было показано, что синтез гепцидина происходит и в тубулярной системе почек. Krause et al. независимо от Park et al. получили похожий пептид из ультрафильтрата плазмы и назвали его LEAP1 (liver expressed antimicrobial peptide). Показана последовательность зрелого белка из 25 аминокислот в отдельном буквенном шифре.
Взаимосвязь между гепцидином и метаболизмом железа впервые была обнаружена С. Pigeon et al. в ходе исследований по изучению реакций печени на перегрузку железом. Стимуляция образования матричной РНК гепцидина была обнаружена не только при алиментарной или парентеральной перегрузке железом, но и при введении мышам липополисахарида. Это дало основание считать, что образование гепцидина связано и с метаболизмом железа, и с иммунными реакциями. В более поздних исследованиях было показано, что гепцидин играет ключевую роль в регуляции поглощения железа в кишечнике и рециркуляции железа из клеток моноцитарно-макрофагальной системы. Nicolas G. et al. показали, что у мышей, лишенных гена USF2, ответственного за синтез гепцидина, развивается гемохроматоз. Ими было сделано заключение, что гепцидин негативно влияет на процессы поглощения железа в кишечнике и тормозит процессы рециркуляции железа из макрофагов. Fleming и Sly предположили, что избыточная продукция гепцидина, отмечаемая при инфекциях и воспалении, может быть ответственной за развитие анемии хронических болезней. Трансгенные мыши, вырабатывающие сверхдозы гепцидина, умирали вскоре после рождения от тяжелого дефицита железа. Это, по мнению авторов, указывало на то, что геп-цидин является отрицательным регулятором трансплацентарного переноса железа к плоду. Weinstein et al. продемонстрировали двух пациентов с большими аденомами печени и сопутствующей микроцитарной рефрактерной к железу анемией. Полная резекция опухоли привела к быстрому восстановлению уровня гемоглобина у обоих пациентов. Авторы установили, что причиной развития анемии была избыточная продукция гепцидина опухолевой тканью. Этот небольшой пептид синтезируется гепатоцитами и секретиру-ется в плазму крови, где ингибирует экспорт железа из различных типов клеток в кровь. Продукция гепциди-на понижается в ответ на стимулы, усиливающие экспорт железа из клеток (недостаток железа, высокий уровень эритропоэза), и повышается в состоянии, когда необходимо снизить экспорт железа в системное русло (избыток железа в крови, воспаление).
Гепцидин способен непосредственно взаимодействовать с ферропортином на поверхности клеточной мембраны и индуцировать его вхождение в цитоплазму и последующую деградацию, понижая таким образом скорость экспорта железа из клетки. На данный момент известно четыре регуляторных пути, контролирующих продукцию гепцидина:
На рис. 2-3 представлен механизм взаимодействия гепцидина и ферропортина.
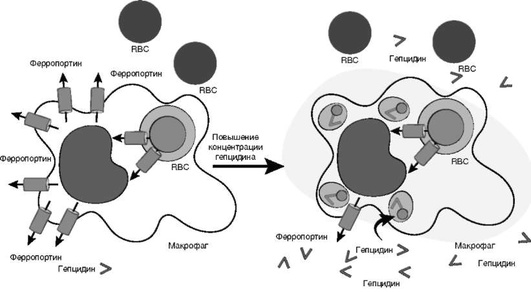
Принято считать, что индикатором общего уровня железа в организме является степень насыщения трансферрина железом в плазме крови. Путь передачи этого сигнала на гепцидин ясен не до конца, хотя недавние работы по изучению взаимодействий трансферрина и HFE c TfR1 и TfR2 привели к гипотетической модели, в которой циркулирующее железо, связанное с трансферрином, влияет на формирование комплекса HFE с TfR2 на поверхности гепатоцитов. Этот комплекс способен увеличивать продукцию гепцидина посредством пока неизвестного внутриклеточного сигнального пути. Рецептор трансферрина второго типа стабилизируется холотрансферрином, что приводит к увеличению количества TfR2 на клеточной мембране при повышении уровня этой формы белка. HFE и трансферрин связываются с рецептором трансферрина первого типа на частично перекрывающихся сайтах и конкурируют за связывание. Увеличение уровня холотрансферрина приводит к вытеснению HFE из комплекса с трансферрином и, как следствие, к перемещению HFE из эндосом, содержащих TfR1, на плазматическую мембрану. Высвобождение TfR1 из комплекса с HFE приводит к усилению транспорта железа в клетку. HFE, вытесненный из комплекса с TfR1, связывается с рецептором трансферрина второго типа, формируя комплекс, предположительно передающий сигнал на гепцидин.
В случае гипоксии или анемии низкое давление кислорода индуцирует стабилизацию фактора гипоксии (hypoxia inducible factor - HIF)-1a, что приводит к продукции эритропоэтина (ЭПО) почкой. Эритропоэтин усиливает интенсивность эритропоэза и, таким образом, потребность железа костным мозгом. Это приводит к мобилизации железа из запасников и усилению абсорбции энтероцитами посредством понижения уровня гепцидина, несмотря на уровень железа в плазме.
На концентрацию гепцидина оказывает существенное влияние системное воспаление. Этот путь индуцируется преимущественно интерлейкином 6, вследствие чего активируется Jak/Stat путь передачи сигнала в ядро и осуществляется регуляция экспрессии гена гепцидина. Недавние исследования показали, что регуляция гепцидина при изменении общего уровня железа и интенсивности эритропоэза зависит от активности дополнительного пути, который контролируется белком гемоювелином. Предположительно гемоювелин поддерживает передачу сигнала посредством костного морфогенетического белка (bone morphogenic protein - BMP)/ Suppressor of Mothers Against Decapentaplegic (Smad) пути сигнальной трансдукции. Мутации гемоювелина приводят к нарушению обоих путей сигнализации. При исследовании промоторной области гена гепцидина были найдены сайты связывания различных транскрипционных факторов, таких как С/EBPa, HNF4a, USF, p53, роль которых в регуляции экспрессии гепцидина не до конца понятна.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВОЗМОЖНЫХ БЕЛКОВ - РЕГУЛЯТОРОВ КОНЦЕНТРАЦИИ ГЕПЦИДИНА
Два белка суперсемейства трансформирующего ростового фактора-бета, фактор дифференциации роста 15 (growth differentiation factor - gdf) и гомолог-1 белка скрученной гаструляции (twisted gastrulation protein homolog 1 - TWSG1) были предложены в качестве патологических супрессоров синтеза гепцидина при неэффективном эритропоэзе. Несмотря на то что оба этих белка синтезируются во многих тканях, в моделях ex vivo показана их экспрессия на поздней (gdf15) и ранней (TWSG1) стадиях дифференциации эритробластов человека. gdf15 через не полностью изученные механизмы играет роль в патогенезе воспаления, онкологических и сердечнососудистых заболеваний, ожирения, в то время как TWSG1 модулирует активность костного морфогенетического белка во время эмбрионального развития и во многих тканях взрослых людей. В условиях in vitro установлено, что высокие концентрации gdf15 или TWSG1 подавляют экспрессию гепцидина в клеточных линиях гепатоцитов. Однако роль gdf15 и TWSG1 в подавлении синтеза гепцидина in vivo менее ясна. У мышей с β-талассемией установлено увеличение экспрессии мессенджерной РНК TWSG1 в селезенке, печени и в гораздо меньшей степени - в костном мозге, но механизм, посредством которого повышенный уровень TWSG1 подавляет синтез гепцидина, неизвестен. Также неизвестно, увеличивается ли уровень TWSG1 у пациентов с неэффективным эритропоэзом. TWSG1, по-видимому, не участвует в подавлении секреции гепцидина у мышей с усиленным эритропоэзом. Так, у Vhl-/- мышей, имеющих высокий уровень эритропоэтина, а также у диких мышей после введения эритропоэтина или тяжелой кровопотери не выявлено изменения уровня матричной РНК TWSG1 в костном мозге и селезенке.
Также существует предположение о том, что gdf15 может быть фактором, подавляющим синтез гепцидина у пациентов с β-талассемией и дизэритропо-этическими анемиями, так как у данной категории больных выявлен повышенный уровень этого белка в крови. Прямые доказательства роли gdf15 до сих пор отсутствуют. Одной из трудностей является видоспецифичная разница в экспрессии и регуляции gdf15. В отличие от человеческих, мышиные эритробласты не синтезируют gdf15 во время дифференцировки в условиях in vitro. Кроме того, у мышей с β-талассемией, в отличие от человека, уровень gdf15 не увеличивается, что свидетельствует о том, что мышиные модели не подходят для изучения gdf15 в регуляции уровня гепцидина. Кроме того, у пациентов с дефицитом железа и с железодефицитными анемиями выявлен нормальный или незначительно повышенный уровень gdf15, что также свидетельствует о том, что данный белок не является физиологическим регулятором уровня гепцидина. Таким образом, непосредственное участие gdf15 или TWSG1 в регулировании уровня гепцидина в организме человека до сих пор до конца не подтверждено.
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ ЗНАЧЕНИЯ ЭРИТРОФЕРРОНА В РЕГУЛЯЦИИ ОБМЕНА ЖЕЛЕЗА
В 2014 г. L. Kautz et al. в эксперименте на мышах изучали экспрессию матричной РНК белков, концентрация которых увеличивалась через 4 ч после кро-вопотери или инъекции эритропоэтина. Результатом исследования стало обнаружение секретируемого созревающими эритробластами белка Fam132b, члена суперсемейства фактора некроза опухоли (ФНО)-α. Группа исследователей назвала этот белок - «эритроферрон» и доказала, что он функционирует в качестве гормона, связывающего эритропоэз и метаболизм железа. При изучении базы данных экспрессии генов установлено, что синтез Fam132b более выражен в костном мозге и печени плода, а исследование in vitro дифференцирующихся человеческих эритробластов подтвердило, что экспрессия Fam132b - наиболее высокая в эритробластах промежуточных генераций. При отсутствии эритроферрона утрачивается механизм подавления гепсидина в ранние сроки после стимуляции гемопоэза, и у Fam132b-дефицитных мышей в сравнении с дикими мышами отмечается более длительный период восстановления гемопоэза после кровотечения. Эти результаты подтверждают тот факт, что эритроферрон является важным биологическим регулятором экспрессии гепцидина и необходим для быстрого компенсационного ответа на кровопотерю. Тем не менее Fam132b-дефицитные мыши восстанавливаются после кровопотери, что доказывает существование других механизмов, повышающих доступность железа для синтеза новых эритроцитов.
Интересно отметить, что у зрелых Fam132b-дефицитных мышей исходно не обнаруживается каких-либо значимых отклонений в параметрах обмена железа, и уровень экспрессии гепцидина схож с дикими мышами. Более того, индукция синтеза матричной РНК Fam132b после кровопотери не модулируется с участием сигнального пути BMP/ Smad или железа. Таким образом, эритроферрон является стрессовым регулятором эритропоэза и не играет ведущую роль при эритропоэзе в нормальных условиях. В соответствии с этим удаление эритроферрона у мышей вызывает только кратковременный дефицит в синтезе гемоглобина, а в период быстрого роста с 3-й по 6-ю неделю эритропоэз усиливается. Сильная зависимость индукции Fam132b эритропоэтином через Stat5 сигнальный путь также согласуется с ролью эритроферрона в эритропоэзе в стрессовых условиях.
У мышей введение рекомбинантного эритроферрона или усиление экспрессии эритроферрона с использованием лентивирусов подтвердило предположение о том, что данный белок является эффективным супрессором гепцидина in vivo. Использование эритроферрона на клеточной культуре гепатоцитов подтверждает тот факт, что эритроферрон действует непосредственно на клетки печени.
Необходима дальнейшая работа для идентификации рецептора или рецепторов эритроферрона и последующего внутриклеточного сигнального пути, контролирующего экспрессию гепсидина.
BMP/Smad сигнальный путь, основной путь железозависимой регуляции уровня гепцидина, не вовлечен в эритроферрон-зависимую регуляцию гепцидина, так как ни гемоювелин, ни рецептор трансферрина-2 не были необходимы для быстрого подавления уровня гепцидина после кровопотери. Таким образом, хотя железо-регулируемый сигнальный путь BMP/ Smad и эритропоэтин-регулируемый эритроферроновый путь влияют на уровень гепцидина, не выявлено никаких существенных доказательств перекреста в их действии. В исследовании на модифицированных мышах с гиперпродукцией эритропоэтина, в котором изучалась регуляция уровня гепцидина железом, установлено существование независимых путей, регулирующих уровень гепсидина в ответ на нагрузку печени железом и активность эритропоэтина. Подавление секреции гепцидина на фоне повышения активности эритропоэза лежит в основе развития перегрузки железом при наследственных анемиях с неэффективным эритропоэзом. Это особенно заметно у пациентов, которым не переливалась кровь и у которых гиперабсорбция пищевого железа - единственный источник перегрузки железом. Исследование таких пациентов необходимо для понимания того, влияет ли подавление эритроферроном секреции гепцидина на перегрузку железом при анемиях с неэффективным эритропоэзом. Ожидается, что продукция эритроферрона увеличена при анемиях с перегрузкой железом, поскольку у таких пациентов отмечается высокий уровень эритропоэтина и существенно расширена популяция эритробластов. Абляция Fam132b у мышей с бета-талассемией интермедиа приводит к обратному развитию дефекта гепцидина, уменьшению печеночной перегрузки железом, сывороточной концентрации железа, среднего объема эритроцитов и среднего содержания гемоглобина в эритроците. Таким образом, эритроферрон является значимым фактором, осуществляющим патологическую супрессию гепцидина при наследственных анемиях с неэффективным эритропоэзом, при которых уровень гепцидина обратно пропорционально коррелировал с концентрацией эритропоэтина и активностью эритропоэза. Хотя изменения, вызванные абляцией эритроферрона, менее значительные и не влияют на концентрацию гемоглобина в крови, в остальном картина похожа на эффект фармакологического увеличения экспрессии уровня гепцидина у мышей с бета-талассемией.