Диффузные паренхиматозные заболевания легких / под ред. Ильковича М. М. - Москва : ГЭОТАР-Медиа, 2021. - 440 с. - ISBN 978-5-9704-5908-9. |
Аннотация
Диффузные паренхиматозные заболевания легких (ДПЗЛ) - одна из наиболее актуальных проблем пульмонологии. Трудности дифференциальной диагностики, нередко тяжелое и прогрессирующее течение наряду с частыми диагностическими ошибками предопределяют актуальность проблемы. Ситуация усугубляется крайне недостаточными познаниями практикующих врачей об этом виде патологии. Книга посвящена наиболее часто встречающимся в практике врача заболеваниям, входящим в группу ДПЗЛ. В ней учтены последние достижения отечественной и зарубежной науки, касающиеся этиологии, патогенеза, современных методов диагностики, лечения и диспансерного наблюдения больных ДПЗЛ. В создании книги участвовали ведущие специалисты НИИ интерстициальных и орфанных заболеваний легких, сотрудники кафедры пульмонологии факультета последипломного образования Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова.
Издание рекомендовано врачам-интернистам - пульмонологам, терапевтам, рентгенологам, врачам общей практики, фтизиатрам, онкологам, торакальным хирургам, клиническим ординаторам и студентам старших курсов медицинских вузов.
2.3. Экзогенные токсические альвеолиты
Г.П. Орлова, Н.С. Яковлева
ЭТА - патологический процесс, возникающий вследствие воздействия на паренхиму легких веществ, обладающих цитотоксическими свойствами.
Впервые интерстициальное заболевание легких (ИЗЛ) у работающих на производстве сплавов карбидов твердых металлов и кобальта было описано в Германии в 1949 г., когда H.L. Hardy и L.R. Taberskaw выявили диссеминированный гранулематозный процесс в легких у работающих с флюоресцентными лампами (контакт с бериллием). Первые случаи медикаментозного ЭТА были описаны I. Morrow в 1953 г. у больных, принимавших гексаметоний, а в 1972 г. появляется первый обзор 19 лекарственных препаратов, обладающих пневмотоксическими свойствами (Becklake M.R. et al., 2000; Machado R.F. et al., 2004).
В 80-х ХХ в. рост заболеваемости пневмофиброзом среди полировщиков алмазов после введения новых высокоскоростных полировочных дисков привел к выделению группы заболеваний от воздействия твердых металлов. В 1986 г. Н.В. Путовым и М.М. Ильковичем было дано понятие «токсический фиброзирующий альвеолит» как патологический процесс в легких, возникающий «вследствие токсического воздействия ряда химических веществ, в первую очередь некоторых групп лекарственных препаратов». Увеличение числа новых лекарственных препаратов и биологически активных добавок, широкая реклама и доступность медикаментов приводят к учащению случаев побочного токсического действия на легочную ткань некоторых лекарственных препаратов. Развитие малого бизнеса, индивидуальной трудовой деятельности, наряду с появлением новых технологий при неадекватной индивидуальной защите, также способствует увеличению риска развития ЭТА на производстве и в быту. Появляются описания новых ИЗЛ от воздействия полиамидоамина акрамина-FWN, нейлонового флока, оксида индияолово и других (Путов Н.В., Илькович М.М., 1986; Romero S. et al., 1998; Flors L. et al., 2010; Cummings K.J. et al., 2016). Так, в 1992 г. впервые было описано развитие ОП у рабочих текстильного производства в Валенсии (Испания), при использовании спрея, содержащего полиамидоамин акрамин-FWN. Название «ардистил синдром» обусловлено названием производств, где отмечались первые 6 смертельных случаев этого заболевания. В 1994 г. Moya C. et al. описал ОБ с ОП - у 22 из 257 работников двух предприятий, на которых в 1991 г. был изменен состав краски с акрамин-FWR на акрамин-FWN (Romero S. et al., 1998, Sole A. et al., 1996). Первые случаи ИЗЛ у работающих в компаниях по производству флока были описаны в 1990-х годах в Канаде, а через 3-4 года - в США (Lougheed M. et al., 1995, Kern D. et al., 1997). Среди больных диссеминированными процессами в легких, госпитализированных в клинику пульмонологии ПСПбГМУ им. акад. И.П. Павлова за период 1991-2016 гг., ЭТА составлял 5,3% (245 пациентов).
Лекарственно-обусловленный ЭТА нередко развивается при лечении амиодароном, нитрофуранами, некоторыми цитотоксическими препаратами и антиметаболитами. По данным разных авторов, медикаментозный ЭТА составляет от 1,8 до 3,5% всех ИЗЛ. Так, блеомицин вызывает ЭТА в 2-40% случаев, особенно если суммарная доза превышает 400 мг, а возраст больных старше 60 лет. При приеме амиодарона ЭТА развивается в 1,2-8,8% случаев. Изменения в легких могут сохраняться или прогрессировать даже после отмены препарата. Митомицин (Митомицин С♠ ) может инициировать развитие ЭТА в 3-12% случаев, нитрофураны - в 3,65% случаев, циклофосфамид - менее чем в 1% случаев, арабинопиранозилметил нитрозомочевина в дозе более 1500 мг/м2 - у 50% больных с летальностью 90%, бусульфан - в 5% случаев, метотрексат - в 0,06-15% случаев (Skeoch S. et al., 2018; Lessnau K.-D. et al., 2019).
Эпидемиология заболеваний легких от воздействия промышленных аэрозолей изучена недостаточно. Литературные данные, как правило, сводятся к описанию отдельных случаев поражения легких при экспозиции аэрозолей определенных металлов (кобальт, никель и др.), органических растворителей (ксилол, стирол, трихлорэтилен и др.) в отдельных группах рабочих. Так, пневмофиброз у зубных техников на Крите встречается в 9,8% случаев. ЭТА выявляется у 3% хлопкоробов, 9,8% зубных техников, у 23 из 108 работающих в контакте с индием (Ризамухамедова М.З., 1995; Froudarakis M.E. et al., 1999; Chonan T. et al., 2006). Заболеваемость бериллиозом среди лиц, контактирующих с бериллием и его соединениями, составляет 0,3-7,5-16%, а в отдельных категориях рабочих - до 20% (Dweik R.A., 2015; Li L. et al., 2016). Отмечены случаи заболевания «непрофессионального» бериллиоза среди населения, проживающего на расстоянии до 10 км от предприятий, использующих бериллий, или от контакта с одеждой работников бериллиевых производств. Возможно развитие заболевания через много лет после прекращения контакта (10-20 лет). Сенсибилизация к бериллию развивается у 2-20% контактирующих рабочих, а бериллиоз при высоком уровне экспозиции может встречаться у 16% работающих, а ежегодная заболеваемость хроническим бериллиозом может достигать 8% (Dweik R.A., 2015; Li L. et al., 2016). В литературе отсутствуют данные, касающиеся распространенности заболеваний легких от воздействия органических растворителей.
Этиология и факторы риска
Впервые этиологические факторы ЭТА были систематизированы Н.В. Путовым и М.М. Ильковичем в 1986 г. Были выделены две группы факторов: лекарственные препараты и токсические вещества производственной сферы. С учетом результатов исследований последних лет в настоящую классификацию включены антибиотики, цитокины, моноклональные антитела, запрещенные препараты и органические растворители (Dajczman E. et al., 1995; Perez-Alvarez R. et al., 2011; Megarbane B. et al., 2013; Skeoch S. et al., 2018; Lessnau K.-D. et al., 2019; Sorger C. et al. 2019).
К лекарственным препаратам, обладающим пневмотропным токсическим действием, относят следующие группы:
-
-
алкилирующие (бусульфан, циклофосфамид, хлорамбуцил, мелфалан);
-
антиметаболиты (метотрексат, 6-меркаптопуринρ , азатиоприн, цитозин-арабинозидρ /цитарабин, гемцитабин, флударабин);
-
препараты растительного происхождения [алкалоиды барвинка розового (винбластин, винкристин), алкалоиды безвременника великолепного (демекольцин, колхицин), алкалоиды тисового дерева (таксаны) (паклитаксел, доцетаксел), подофиллотоксины (этопозид, тенипозид), полусинтетические производные алкалоида камптотецина (иринотекан и топотекан];
-
ингибиторы тирозинкиназы эпидермального фактора роста (EGFR-tyrosine kinase) [эрлотиниб, гефитиниб, иматиниб];
-
препараты других групп [арабинопиранозилметил нитрозо-мочевина (кармустин, ломустин), прокарбазин, аспарагиназа (L-Аспарагиназа♠ )];
-
-
нейроактивные препараты [фенитоин (Дифенин♠ , дифенилгидантоинρ )], карбамазепин, хлорпромазин);
-
сердечно-сосудистые препараты [амиодарон, амиодарон (Кордарон♠ ), бензогексонийρ , гидралазин, β-адреноблокаторы - пропранолол, пропранолол (Анаприлин♠ )];
-
цитокины (гранулоцит-макрофаг-колониестимулирующий фактор, ингибитор TNF-α (этанерцепт), IL-2, IFN-α, IFN-β, IFN-γ);
-
-
к TNF-α [инфликсимаб (Ремикейд♠ ), инфликсимаб, адалимумаб];
-
к рецепторами эпидермального фактора роста (цетуксимаб, трастузумаб, панитумумаб);
-
IgG1-антитела к фактору роста эндотелия сосудов (бевацизумаб);
-
к гликопротеину CD52 на поверхности В- и Т-лимфоцитов (алемтузумаб);
-
к запрограммированным белкам смерти 1 (PD-1) клеток (ниволумаб, пембролизумаб);
-
-
запрещенные препараты (героинρ , кокаин, опиаты, кодеин, пропоксифена гидрохлоридρ , амфетаминρ , метадон гидрохлоридρ , тальк);
-
другие лекарственные вещества (Л-триптофан♠ , сиролимус, эверолимус, темсиролимус);
К токсическим веществам производственной сферы относят:
-
раздражающие газы (сероводород, хлор, аммиак, хлорпикрин и др.);
-
металлы в виде паров, дымов, окислов, солей (кадмий, ртуть, пентоксид ванадия, вольфрам, марганец, бериллий, кобальт, никель, кадмий, цинк, ртуть, цирконий, хлорид сурьмы, титан и др.);
-
органические растворители (алифатические углеводороды - бензин, нефть, минеральный спирт, керосин, ароматические углеводороды - бензол, толуол, ксилол, стирол, галогенизированные углеводороды - тетрахлорэтилен, трихлорэтилен, метиленхлорид, тетрахлорметан, кетоны - ацетон, альдегиды - формальдегиды, глютеральдегиды, гликоли - этиленгликоль, эфиры - этилацетат, другие - этиленоксид);
Пневмотоксический эффект медикаментов чаще возникает при создании высоких (пиковых) концентраций препарата в крови. Предрасполагающими к возникновению ЭТА факторами являются комбинированное назначение химиопрепаратов в сочетании с длительным вдыханием кислорода, лучевой терапией, гемотрансфузиями, а также возраст старше 60 лет и длительность терапии (например, применение амиодарона более двух месяцев). Применение комбинированных схем лечения увеличивает риск развития ЭТА до 40%. При дозе амиодарона более 400 мг/сут смертность на ранних сроках ЭТА достигает 5-10%.
Следует отметить, что минимальные концентрации бериллия могут вызывать ЭТА даже при отсутствии профессионального контакта с этим металлом (проживание вблизи заводов по очистке бериллия, работа одного из членов семьи на производстве бериллия). Так, бериллиоз выявлялся у людей, живущих за 10 км от предприятий, использующих бериллий.
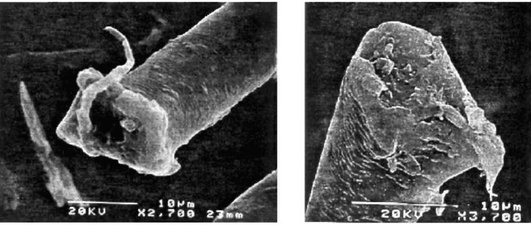
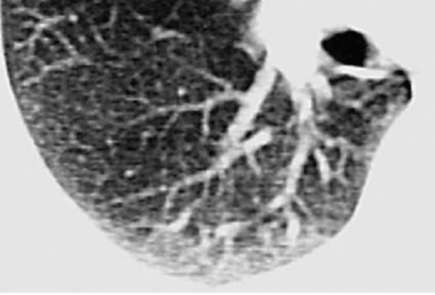
Характер воздействия экзогенных факторов на организм зависит от размера, формы, площади поверхности, заряда, химических свойств, растворимости, степени агломерации вдыхаемых частиц. Чем меньше диаметр частиц, тем больше их общая поверхность. Так, общая поверхность 1 мг вещества при диаметре частиц 10 мкм (1012 частиц) составляет 270 м2 , а при диаметре 10 нм (1021 частиц) - 270 000 м2 , что обусловливает большую поражающую активность наночастиц. Кроме того, высокое соотношение сторон (отношение длины частицы к ее диаметру) у нанотрубок значительно повышает повреждающее действие частиц, приводя к незавершенному фагоцитозу и постоянной активации альвеолярных макрофагов. Повреждающее действие нейлонового флока обусловлено игольчатыми, линейными структурами на концах нейлоновых волокон, образующимися при их разрезании (рис. 2.24).
В развитии ЭТА немаловажную роль играют генетические особенности организма. Экспериментальные исследования по моделированию у мышей блеомицинового фиброза легких выявили зависимость степени выраженности интерстициального пневмофиброза от пород мышей. В патогенезе ЭТА важное значение имеет генетическая недостаточность антиоксидантной активности. Некоторые твердые металлы, например кобальт, могут стимулировать выработку активных форм кислорода, в связи с чем лица с генетически детерминированной слабостью систем детоксикации, например от оксидантной агрессии, представляют собой группу риска развития «кобальтового легкого». В этом случае кислородотерапия при «кобальтовом легком» приводит к молниеносному прогрессированию болезни.
Генетическая предрасположенность к бериллиозу подтверждается преобладанием среди больных хроническим бериллиозом лиц, имеющих аллель HLA-DP-в1-glutamin-69 (97%), в то время как у контактирующих с бериллием здоровых рабочих такая аллель выявляется лишь в 30% случаев. Наличие этого генетического маркера повышает риск развития берил-лиоза в 8-10 раз. Такой генный маркер, как TNF-α-308×2, ассоциируется с гиперчувствительностью к бериллию в реакции пролиферации лимфоцитов и выявляется как у больных бериллиозом, так и у здоровых рабочих. Ген HLA-DR-Arg-74 предотвращает развитие заболевания и ассоциируется с гиперчувствительностью к бериллию у здоровых рабочих, но не у больных. Роль молекул HLA-DP аллелей не ясна, но in vitro подтверждено, что эти молекулы связывают кобальт, а присутствие HLF-DP-Glu-в-69, ассоциирующееся с возникновением заболеваний легких от патогенного действия твердых металлов, определяет высокую степень связывания металлов. Исследования HLA-DPB1 аллели с остатком глютаминовой кислоты в позиции 69 (E69) показали связь возрастания риска развития хронического бериллиоза с уменьшением частоты E69 аллелей (95% CI) (Richeldy L. et al., 1993; Potolicchio I. et al., 1999; Saltini C. et al., 2001; Van Dyke M.V. et al., 2011; Silveira L.J. et al., 2012). C.M. Black и соавт. (1983) не исключают генетически обусловленную чувствительность к некоторым химическим веществам (винилхлорид), способствующую развитию скле-родерматоидного синдрома с рестриктивными нарушениями ФВД.
Патогенез
Патогенетические механизмы развития ЭТА изучены недостаточно. Предполагается, что триггером может быть множественное микроскопическое и непрерывное повреждение эндотелия сосудов легких, что приводит к нарушению микроциркуляции, интерстициальному отеку с некрозом альвеолярных клеток и последующему развитию интерстици-ального фиброза легких. Токсическое действие некоторых лекарственных препаратов на легочную паренхиму многокомпонентно и включает следующие механизмы (Илькович М.М., 1998):
-
поражение капиллярного русла вследствие некроза эндотелия капилляров;
-
нарушение диффузии газов через альвеолярно-капиллярную мембрану вследствие интерстициального отека, а также уплотнения и утолщения межальвеолярных перегородок за счет гиперпродукции ретикулиновых и коллагеновых волокон;
-
нарушение аэрогематического барьера вследствие массивного некроза альвеолоцитов I типа;
-
спадение альвеол вследствие метаплазии альвеолоцитов II типа и потери ими способности вырабатывать сурфактант.
Исследования последних лет показали различные механизмы повреждающего действия на легочную ткань этиологических факторов (табл. 2.10).
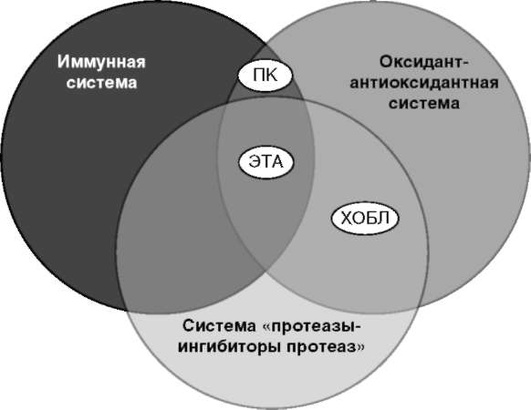
Нами было показано (рис. 2.25), что в развитии патологического процесса при ЭТА участвуют как иммунная система (активация клеточного и гуморального звеньев иммунитета), так и система оксидант-антиоксидантной защиты (повышение уровня продуктов перекисного окисления липидов при снижении антиоксидантной активности) и система «протеазы - ингибиторы протеаз» с резким повышением активности протеолитических ферментов в ЖБАЛ (Орлова Г.П., 2003).
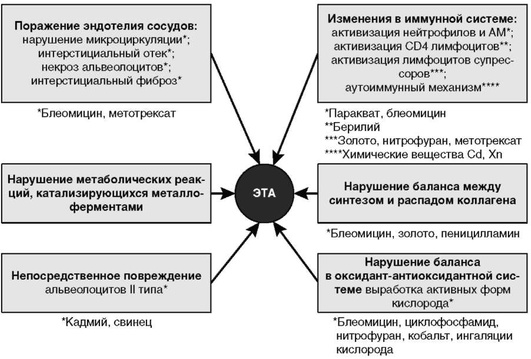
Токсические вещества могут как непосредственно воздействовать на клетки иммунной системы, так и опосредованно нарушать иммунный статус организма, изменяя антигенную структуру белков (рис. 2.26). Так, паракватρ и блеомицин активируют нейтрофилы и альвеолярные макрофаги, а золото, нитрофуран, метотрексат активируют лимфоциты-супрессоры. Бериллий вызывает клеточно-опосредованную гранулематозную реакцию, обусловленную активацией CD4+ Т-клеток I типа, вовлечением ИФН-γ, IL-2, IL-6 и TNF-α. Существенную роль в развития ЭТА от воздействия химических веществ и металлов (кадмий, цинк) играют аутоиммунные процессы. Химические вещества, соединяясь с белками организма, могут изменять структуру белков, делая их антигенно чужеродными, запуская аутоиммунный механизм повреждения легочной ткани. При воздействии металлов могут нарушаться метаболические реакции, катализирующиеся металлоферментами. Кроме того, некоторые металлы (кадмий и свинец) могут непосредственно повреждать альвеолоциты II типа (Glazer C.S. et al., 2009).
| Механизмы патогенеза | Экспозиционный фактор |
|---|---|
Поражение эндотелия сосудов:
|
Гербициды, растворители, хлор, аммиак и др. |
Изменения в иммунной системе:
|
Паракватρ. Бериллий. Золото. Химические вещества, кадмий, цинк |
Нарушение метаболических реакций, катализирующихся металлоферментами |
Металлы (железо, медь, никель молибден и др.) |
Нарушение баланса между синтезом и распадом коллагена |
Золото |
Непосредственное повреждение альвеолоцитов II типа |
Кадмий, свинец, органические растворители |
Нарушение баланса в оксидант-антиоксидантной системе:
|
Кобальт, железо, медь, хром, ингаляции кислорода |
Одним из механизмов действия многих веществ является нарушение баланса в оксидант-антиоксидантной системе (блеомицин, циклофосфамид, нитрофуран), а кобальт даже способен сам вырабатывать активные формы кислорода. Так, у онкологических больных, получающих, помимо химиотерапевтических препаратов, и радиотерапию, активные формы кислорода играют ключевую роль в развитии альвеолита и легочного фиброза. Не менее важным является нарушение баланса между синтезом и распадом коллагена под воздействием таких препаратов, как блеомицин, золото, пеницилламин (Glazer C.S. et al., 2009; Jomova K. et al., 2011).
Органические растворители оказывают прямое токсическое (продукты распада тетрахлорэтилена: фосген, четыреххлористый углерод, соляная кислота) или раздражающее (ароматические углеводороды, этиленгликоль, метилизобутилметан, минеральные спирты, этиленоксид, тетрахлорэтилен, формальдегид) действие.
Патологическая анатомия
Морфологические изменения при ЭТА неспецифичны и могут наблюдаться при «шоковом легком», лучевых поражениях легких, ИЛФ и других ИЗЛ. В легочной ткани выявляются некроз эндотелия легочных капилляров, транссудация жидкой части крови в альвеолы и межальвеолярные перегородки, некроз альвеолоцитов I типа, гиперплазия и метаплазия альвеолоцитов II типа, пролиферация фибробластов с гиперпродукцией ретикулиновых и коллагеновых волокон.
В острых случаях может наблюдаться внутриальвеолярный отек, сменяющийся через 3-6 нед интерстициальным и внутриальвеолярным фиброзом (отравление паракватомρ ). В подострых случаях выявляются гранулемы из гигантских клеток, очаговые скопления лимфоцитов, плазматических клеток, эозинофилов (метотрексат). При хроническом бериллиозе в интерстиции легких, преимущественно вокруг бронхосо-судистых пучков, а также в подслизистом слое бронхов, субплеврально и во внутригрудных лимфатических узлах формируются эпителиоидно-клеточные неказеозные гранулемы. В этом случае морфологические изменения напоминают ЭАА с более выраженной диффузной инфильтрацией мононуклеарными клетками. На поздних стадиях заболевания формируется «сотовое легкое» (Илькович М.М., 1998).
Патогномоничным для заболеваний легких от аэрозолей твердых металлов («кобальтовое легкое») является гигантоклеточная интерстициальная пневмония (гигантские многоядерные клетки с чертами каннибализма - «клетка в клетке»), но могут выявляться изменения, характерные для ДИП (десквамация клеток в альвеолы), лимфоплазмоцитарная инфильтрация и различная степень интерстициального, преимущественно центрилобулярного, фиброза (рис. 2.27, см. цв. вклейку, табл. 2.11). Так, при воздействии вольфрама и некоторых лекарственных препаратов могут выявляться соответственно причудливой формы пенистые альвеолярные макрофаги (Forni A., 1994; Lessnau K.-D. et al., 2019).
Клиническая картина
Начало ЭТА может быть острым или стертым в зависимости от агрессивности токсического агента, его концентрации, времени экспозиции и индивидуальной реакции организма.
Острое течение ЭТА характеризуется появлением симптомов в первые-вторые сутки после контакта с токсическими или раздражающими веществами. Отмечаются симптомы ларингофарингита в виде болей в горле, осиплости, свистящего стридорозного дыхания. Непродуктивный кашель, боли или чувство тяжести в грудной клетке могут свидетельствовать о развитии токсического бронхита. Могут наблюдаться лихорадка (иногда с ознобами), слабость, слезотечение, чихание, носовое кровотечение, кровохарканье, ощущение неполного вдоха, артралгии, похудание.
| Морфологическая картина | Возможный экспозиционный фактор |
|---|---|
ОИП |
Кобальт, алюминий |
ДИП |
Кобальт, алюминий, плутоний |
НСИП |
Реактивные химические вещества |
Организующаяся пневмония |
Акрамин-FWR, окислы азота |
ОсИП (патология = диффузное альвеолярное повреждение) |
Ингаляционные ирританты - окислы азота, окислы серы, кадмий, бериллий, хлор, кислотные туманы и др. |
Гигантоклеточная интерстициальная пневмония |
Кобальт |
В легких выслушиваются сухие и влажные мелкопузырчатые хрипы, крепитация. Через 2-3 дня появляется одышка. В тяжелых случаях заболевание протекает как респираторный дистресс-синдром. При контакте с окислами азота, фосгеном, хлором может развиться токсический отек легких. Острая реакция в легочной ткани при приеме нитрофурантоина может наступить в течение первого месяца приема препарата. При кадмиевом пневмоните ведущей жалобой является прогрессирующая одышка. Также могут наблюдаться слезотечение, чихание, носовое кровотечение, боли в горле, осиплость, кашель, свистящее стридорозное дыхание, боли или чувство тяжести в грудной клетке. В тяжелых случаях развивается отек легких. Острое течение болезни проявляется лихорадкой (90% больных), одышкой (75-95%), непродуктивным кашлем (60-70%), болями в груди (30%), артралгиями (5-15%), слабостью и быстрой утомляемостью (80-100%), похуданием (30-40%). Одна треть больных жалуется на ощущение неполного вдоха. Крепитация выслушивается у половины пациентов. При поражениях легких производными нитрофурана у 10-15% больных острой формой ЭТА описаны плевральные выпоты, токсико-аллергическая сыпь на коже. Острое ингаляционное повреждение может разрешиться полным выздоровлением. Неадекватная лечебная тактика или поздно начатое лечение приводят к развитию фиброза легких, бронхиолита, бронхоэк-тазов, стойкой неспецифической гиперреактивности бронхов - реактивной дисфункции дыхательных путей (Machado R.F. et al., 2004).
К острым формам ЭТА следует относить ингаляционные лихорадки от воздействия металлов, в особенности окиси цинка (металлическая дымная лихорадка), высоких концентраций органических веществ (токсический синдром от органической пыли) или пластмасс (полимерная дымная лихорадка). Заболевание развивается через 4-6 ч после контакта и напоминает респираторную вирусную инфекцию. После экспозиции окислов металлов (сварка гальванизированной стали) в ряде случаев появляется металлический привкус во рту, проходящий самостоятельно. Ингаляционные лихорадки развиваются при воздействии высоких концентраций повреждающих веществ, вызывающих неаллергический выброс цитокинов из альвеолярных макрофагов и эпителиальных клеток, обусловливающий лейкоцитоз периферической крови и приток нейтрофилов в легкие. Развивается цитокин- и простагландининдуцируемая лихорадка. У больных выявляется лейкоцитоз крови, нейтрофилез ЖБАЛ. На рентгенограммах и КТ органов грудной клетки могут выявляться инфильтративные затенения. Функциональные исследования могут оставаться в пределах нормы или изменяться по рестриктивному типу со снижением ДСЛ. Морфологические изменения характерны для альвеолярного повреждения, бронхиолоальвеолита (Ahsan S.A. et al., 2009; Shimizu T. et al., 2012; Greenberg M.I. et al., 2015). Через 12-48 ч наступает спонтанная обратная динамика клинических проявлений. Особенностью ингаляционной лихорадки является развитие толерантности: заболевание развивается только в том случае, когда контакту предшествовало несколько дней без экспозиции, и не развивается в дни после лихорадки, даже если контакт с вредным фактором продолжается. При повторяющихся ингаляционных лихорадках может развиться ЭТА.
Токсический отек легких развивается через 4-8 ч после контакта с высокими концентрациями паров формальдегида, ксилола, стирола, трихлорэтилена, метиленхлорида и тетрахлорэтилена. Клиническая картина характеризуется симптомами прогрессирующей ДН. Над легкими могут выслушиваться как влажные мелкопузырчатые, так и сухие хрипы. Исходом патологии может быть реактивный синдром дисфункции дыхательных путей, ОБ или переход в хроническую форму ЭТА. В легких случаях и при своевременной и адекватной терапии может наступить выздоровление с полной обратной динамикой изменений в легких. В тяжелых случаях через 24-48 ч может наступить смерть больного.
Респираторный дистресс-синдром может развиваться при аспирации растворителей (керосин, алкогольные напитки, разбавленные метанолом, стеклоочистительные жидкости), приеме лекарственных препаратов (противоопухолевые алкилирующие препараты, блеомицин, амиодарон).
Начало заболевания при хроническом течении ЭТА может быть стертым. Первые симптомы могут появиться через несколько лет после начала контакта с вредными веществами. В этих случаях одышка возникает исподволь и имеет тенденцию к прогрессированию. Хроническая форма ЭТА при приеме нитрофурантоина может развиваться в интервале от 2 мес до 5 лет непрерывного лечения нитрофурантоином.
Наиболее характерными симптомами заболевания являются одышка (94%), сухой кашель (73%), затрудненность вдоха (37%), лихорадка (35%), слабость (34%). Реже наблюдаются похудание (16%), боли в грудной клетке (8%), артралгии (8%) и кровохарканье (4%). Почти у половины больных выслушивается крепитация (45%). На поздних стадиях заболевания отмечаются признаки ДН: акроцианоз, изменение ногтевых фаланг по типу «барабанных палочек» и «часовых стекол» («пальцы Гиппократа»). На этой стадии клинические проявления ЭТА и ИЛФ практически не отличаются.
Клиническая картина ЭТА зависит от экспозиционного фактора. Так, при хроническом бериллиозе первые проявления заболевания могут развиться через много лет после экспозиции (10-15 лет). При бериллиозе могут наблюдаться также внелегочные поражения: лимфаденопатия, поражения кожи (но, в отличие от саркоидоза, не бывает узловатой эритемы), слюнных желез, печени, но не бывает поражения глаз и нервной системы. У некоторых пациентов с «кобальтовым легким» отмечается прогрессирование пневмофиброза и развитие «сотового легкого», несмотря на глюкокортикоидную терапию. Воздействие органических растворителей на организм характеризуется полиорганным поражением с преобладанием токсических изменений центральной нервной системы (депрессия и наркотический эффект), ирритационного дерматита, изменениями со стороны крови, поражением печени и почек. Зарубежными авторами выделяется «органический психосиндром от воздействия растворителей» или «энцефалопатия от воздействия растворителей». Для этого симптомокомплекса характерны слабость, головокружение, снижение либидо, нарушение сна, памяти и концентрации внимания, изменение поведения (агрессивность, депрессия), вегетативная симптоматика (тахикардия, потливость). Для пульмонологов представляет интерес тот факт, что у больных токсической энцефалопатией могут наблюдаться различные респираторные симптомы, в том числе и гипервентиляционный синдром (Glazer C.S. et al., 2009).
При воздействии органических растворителей (хлорированных этиленов: трихлорэтилена, трихлорэтана, винилхлорида, ароматических углеводородов) на кожу рестриктивные поражения легких могут сочетаться со склеродермическим синдромом. Заболевание проявляется рубцовыми изменениями кожи, синдромом Рейно, артралгиями, миалгиями, склеродактилией, поражением пищевода.
Классификация
В Международной классификации болезней 10-го пересмотра ЭТА соответствуют следующие рубрики в разделе J68 «Респираторные состояния, вызванные вдыханием химических веществ, газов, дымов и паров».
-
J68.1 Острый легочный отек, вызванный химическими веществами, газами, дымами и парами.
-
J68.4 Хронические респираторные состояния, вызванные химическими веществами, газами, дымами и парами.
-
J68.8 Другие респираторные состояния, вызванные химическими веществами, газами, дымами и парами.
-
J68.9 Неуточненные респираторные состояния, вызванные химическими веществами, газами, дымами и парами.
-
J70.2 Острые интерстициальные легочные нарушения, вызванные лекарственными средствами.
-
J70.3 Хронические интерстициальные легочные нарушения, вызванные лекарственными средствами.
-
J70.4 Легочные интерстициальные нарушения, вызванные лекарственными средствами, неуточненные.
Объединение токсических поражений легких в группу ЭТА позволит изменить тактику ведения больных, не ограничиваться симптоматической терапией, а своевременно назначать адекватное лечение. В частности, при рецидивирующих ингаляционных лихорадках можно предотвратить переход заболевания в хроническую форму. В связи с этим нами была разработана следующая классификация ЭТА.
По клиническому течению:
Острая форма ЭТА может протекать по типу:
Хроническое течение ЭТА. В зависимости от этиологического фактора выделяют:
По рентгенологическим проявлениям:
В Перечне профессиональных заболеваний (Приказ Минздрав-соцразвития России от 27.04.2012 № 417н «Об утверждении перечня профессиональных заболеваний»), благодаря совместной работе пульмонологов и профпатологов, ЭТА впервые был включен как самостоятельная нозологическая форма, но только от воздействия бериллия, олова, меди, фтора и их соединений. Однако такие формы острого ЭТА, как литейная лихорадка и отек легких, выделены как отдельные нозологические формы, что затрудняет диагностику, экспертную оценку, своевременное назначение адекватной терапии и значительно ухудшает прогноз.
В случаях развития заболевания от воздействия едких и раздражающих веществ, нефтепродуктов, хрома, кадмия, никеля, кобальта и газообразных аэрозолей до настоящего времени используются такие термины, как «токсическая пневмония» и «пневмосклероз», что не отражает существа патологического процесса и обусловливает назначение неадекватной терапии: антибиотиков при «токсической пневмонии» и симптоматической терапии при пневмосклерозе. В то же время в пункте 1.53 «Последствия острых отравлений, связанных с воздействием веществ, указанных в пунктах 1.1-1.51» пневмосклероз не включен, хотя он является исходом заболевания.
Осложнения
Основными осложнениями ЭТА при его хроническом течении являются прогрессирующая ДН, развитие ЛГ и хронического легочного сердца. Реже заболевание может осложняться кровохарканьем (11% больных), синдромом реактивной дисфункции дыхательных путей.
Диагностика
Важное значение для постановки диагноза имеет профессиональный анамнез, установление факта возникновения заболевания после контакта с токсическими веществами или после приема лекарственных препаратов. Следует учитывать преобладание в клинической картине одышки, кашля, затрудненного вдоха.
Данные клинического анализа крови не содержат каких-либо характерных для этого патологического процесса признаков. Однако в случаях острого поражения легких увеличение СОЭ и лейкоцитоз определяются у 80% больных. Для ингаляционных лихорадок характерен лейкоцитоз периферической крови. Прием препаратов, способных вызывать токсическое аллергическое повреждение легочной ткани (метотрексат, прокарбазин), может сопровождаться эозинофилией периферической крови, которая более характерна для хронической формы заболевания.
Биохимические показатели (гипоальбуминемия, гипер-а2-и γ-глобулинемия и др.) диагностически не информативны. Их изменения неспецифичны и зависят от остроты патологического процесса. Высокие титры антинуклеарных антител в сыворотке крови более характерны для хронической формы ЭТА (определяются у 90% больных при хроническом течении ЭТА от воздействия нитрофурантоина). Тем не менее специфичность этого показателя невысока.
Специфическая диагностика бериллиоза включает кожную пробу Куртиса (накожная аппликация растворимых солей бериллия: 0,51% раствора хлорида бериллия, 1-2% раствора сульфата или нитрата бериллия). Проба считается положительной в случае появления эритемы. В последние годы все чаще стали применяться реакция пассивной гемагглютинации, реакция специфической агломерации лейкоцитов, реакция торможения миграции лейкоцитов, реакция бласттрансформации лимфоцитов, реакция пролиферации лимфоцитов, измеряемая по включению меченного тритием тимидина в ДНК делящихся клеток. Последние две реакции можно проводить с лимфоцитами ЖБАЛ (Dweik R.A., 2013; Clinical guideline for the diagnosis of Berillium, 2015).
В последнее время определенное значение придается выявлению в крови повышенного уровня сывороточного гликопротеина KL-6 (больше 520 ЕД/мл - верхняя граница нормы), продуцируемого альвеолоцитами II типа и являющегося предположительно маркером интерстициального фиброза легких. Этот тест используется при диагностике «амиодаронового легкого» и других медикаментозных ЭТА (Morell E.B. et al., 2005; Cummings K.J. et al., 2016).
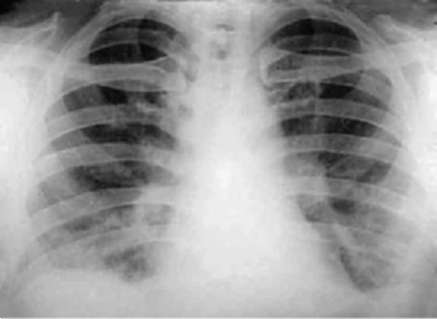
Лучевые методы исследования. Рентгенологическая картина при ЭТА зависит от стадии заболевания. В начальной фазе выявляются признаки отека интерстициальной ткани легких и распространенные мелкоочаговые затенения. При прогрессировании процесса формируются двусторонние изменения легочного рисунка по типу интерстициального фиброза, преимущественно в нижних отделах легких (рис. 2.28). В далеко зашедших случаях определяется мелко- и крупноячеистая деформация легочного рисунка. Описаны случаи, когда единственным рентгенологическим признаком болезни был односторонний плевральный выпот. Отсутствие каких-либо изменений на рентгенограммах отнюдь не исключает ЭТА. Так, при бериллиозе у 23-59% больных может выявляться умеренно выраженная двусторонняя лимфоаденопатия, а в ряде случаев - рентгенотрицательная форма бериллиоза (Dweik R.A., 2015). У 30% из 71 больных ЭТА, наблюдавшихся нами в клинике пульмонологии, в момент обследования изменений на рентгенограммах не было (Орлова Г.П., 2019). Группа больных ЭТА была обозначена условно как рентгенотрицательная группа. Уточнить диагноз помогает КТ легких, выявляющая интерстициальные изменения в легочной ткани по типу «матового стекла», усиление и деформацию легочного и сосудистого рисунка (рис. 2.29), фиброзные изменения тяжистого и звездчатого типов, на поздних стадиях - «сотовое легкое». ВРКТ выявляет «матовое стекло» и другие изменения в легочной паренхиме, которые не видны при обычном рентгенологическом исследовании. Но даже ВРКТ не всегда выявляет изменения в легочной ткани. Так, в 25% случаев гистологически подтвержденного хронического берил-лиоза легких ВРКТ была нормальной (Dweik R.A., 2013; Амосов В.И., Сперанская А.А., 2015; Amanullah S. et al., 2015).
Рентгенологические изменения в легких при ингаляционных лихорадках также могут отсутствовать или проявляться в виде летучих инфильтратов (Ahsan S.A. et al., 2009; Shimizu T. et al., 2012; Greenberg M.I. et al., 2015). При бериллиозе, помимо диффузных инфильтратов и усиления легочного рисунка, за счет интерстициального компонента у 23-59% больных может выявляться лимфаденопатия (Sirajuddin A. et al., 2009).
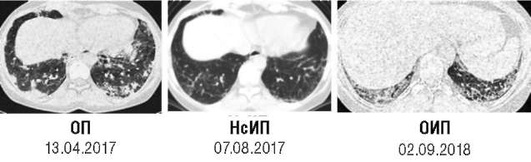
Проведенное нами динамическое исследование КТ-паттернов у 42 больных ЭТА показало трансформацию отдельных типов интерстициальных пневмоний по мере прогрессирования патологического процесса в фиброзную НСИП или ОИП (рис. 2.30), что подтверждает объединительную концепцию интерстициальных пневмоний вне зависимости от этиологического фактора, которые являются не отдельными нозологическими формами, а стадиями течения фиброзирующего процесса в легких (Илькович М.М., Новикова Л.Н., 2018; Орлова Г.П. и др., 2019).
Исследование функциональных показателей внешнего дыхания.
Характер и степень изменения ФВД при ЭТА зависят от рентгенологического варианта заболевания. У половины больных ЭТА выявляется резкое и значительное снижение ОЕЛ с перестройкой ее структуры по рестриктивному типу, достоверно более выраженной у рентгенположительной группы больных по сравнению с рентгенотрицательной группой. Эластическая отдача легких умеренно увеличивается. ДСЛ снижается как в устойчивом состоянии, так и при задержке дыхания. При бериллиозе ее снижение может наблюдаться за несколько лет до появления рентгенологических изменений (Clinical guideline for the diagnosis of Berillium, 2015).
Рестриктивный синдром при рентгенотрицательном варианте ЭТА выражен в меньшей степени, чем при рентгенположительном ЭТА, и ведущим является нарушение ДСЛ. Так, при воздействии органических растворителей (хлорированных этиленов: трихлорэтилена, трих-лорэтана, винилхлорида, ароматических углеводородов) ЭТА может протекать как рентгенотрицательный вариант с рестриктивным синдромом и снижением ДСЛ. Следует отметить, что у больных ЭТА может выявляться обструктивный синдром, обусловленный развитием ОБ (Орлова Г.П., 2019). Рестриктивного синдрома при ингаляционных лихорадках может не быть, или он выражен относительно слабо (Ahsan S.A. et al., 2009; Shimizu T. et al., 2012; Greenberg M.I. et al., 2015). Результаты исследования ФВД и легочного газообмена могут влиять на терапевтическую тактику, но не позволяют дифференцировать ЭТА от других фиброзирующих альвеолитов.
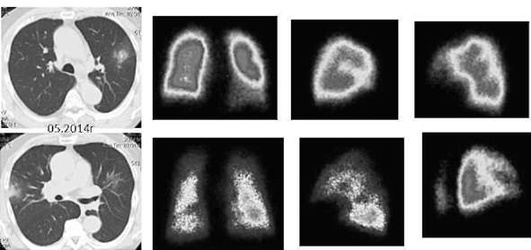
Исследование легочно-сердечной гемодинамики. При эходоплеркардиографии отмечается увеличение систолического давления в легочной артерии за счет повышения общего легочного сопротивления по отношению к нормальным величинам. Наличие нарушений гемодинамики малого круга кровообращения подтверждается данными сцинтиграфии легких с 99m[Tc], указывающими на диффузные нарушения перфузии разной степени выраженности. Перфузионная сцинтиграфия позволяет выявить осложнение альвеолита тромбоэмболией мелких ветвей легочной артерии. Так, при амиодарониндуцированном ЭТА в 31,1% случаев могут выявляться субплевральные участки консолидации легочной ткани, подозрительные на присоединение тромбэмболии мелких ветвей легочной артерии (Яковлева Н.С. и др., 2019). В этих случаях диагностика тромбоэмболии по данным КТ затруднена на фоне текущего альвеолита или распространенных фиброзных изменений. По нашим данным, из 16,7% больных только у 3,3% ТЭЛА была выявлена при ангиоКТ, а у 13,4% больных признаки тромбоэмболии мелких ветвей легочной артерии выявлялись при перфузионной сцинтиграфии с Тс-99-МАА (рис. 2.31).
Бронхологические методы исследования. Фибробронхоскопия выявляет наличие диффузного катарального эндобронхита или атрофические изменения слизистой оболочки бронхов как следствие перенесенного токсического бронхита. Отмечается как нейтрофилез, так и лимфоцитоз ЖБАЛ. При ингаляционных лихорадках в ЖБАЛ увеличивается число нейтрофилов и цитокинов (Ahsan S.A. et al., 2009; Greenberg M.I. et al., 2015). Прогрессирование пневмофиброза сопровождается увеличением числа нейтрофилов в ЖБАЛ. Цитологический состав ЖБАЛ позволяет уточнить характер экспозиционного фактора. Повышение числа лимфоцитов и значительное повышение отношения CD4/CD8 клеток в ЖБАЛ характерно для бериллиоза (Clinical guideline for the diagnosis of Berillium, 2015). При ЭТА от аэрозолей твердых металлов («кобальтовое легкое») в ЖБАЛ повышается число всех видов клеток: альвеолярных макрофагов, лимфоцитов, нейтрофилов, эозинофилов и даже выявляются тучные клетки. При воздействии цинка, магния, кадмия, никеля и ванадия в ЖБАЛ повышается число нейтрофилов. В ряде случаев в ЖБАЛ можно выявить изменения альвеолярных макрофагов, характерные для воздействия определенных веществ: вольфрама (причудливые макрофаги), лекарственных препаратов (пенистые макрофаги), кобальта (причудливые гигантские многоядерные клетки с признаками каннибализма, так называемые клетка в клетке) (Meyer K.C. et al., 2012; Mizutani R.F. et al., 2016). Ядерно-активный анализ ЖБАЛ помогает уточнить тип металла.
Эндоскопические и хирургические методы исследования. В сложных для диагностики ЭТА случаях показано проведение ЧББ, видеоторакоскопической или открытой биопсии легких для гистологической верификации диагноза. Наиболее информативной при небольшой травматичности является видеоторакоскопическая биопсия легких. В случае подозрения на хронический бериллиоз легких при неинформативной ЧББ и наличии лимфоцитоза ЖБАЛ более 20% рекомендуется повторить биопсию легкого (Dweik R.A., 2003).
В последние годы для ЧББ применяют новую эндоскопическую технику - криобиопсию, которая с 1970-х гг. использовалась бронхологами у больных с онкологическими заболеваниями легких. В отличие от традиционной щипцовой ЧББ, криобиопсия позволяет взять больший объем биопсийного материала с меньшими артефактами. ECM исследуемых тканей остается сохранным. Метод дешевый и легкий в использовании. К недостаткам криобиопсии следует отнести возможные отсроченные эффекты (кровотечение по мере прогревания тканей) и необходимость интубации (Yarmus L. et al., 2013; Griff S. et al., 2014).
Диагностические критерии экзогенного токсического альвеолита
Основные критерии:
-
начало заболевания через несколько часов после контакта с токсическими веществами при характерных для ЭТА клинических проявлениях;
-
подтверждение контакта с токсическим веществом: анамнез, санитарно-гигиеническое исследование воздуха рабочей зоны;
-
характерные изменения на рентгенограммах и ВРКТ органов грудной клетки;
-
лимфоцитоз и/или нейтрофилез ЖБАЛ (выявление пенистых альвеолярных макрофагов, содержащих пластинчатые включения, указывает на воздействие амиодарона);
-
появление клинических и функциональных признаков и лабораторных изменений после повторных контактов с предполагаемым фактором (анамнез);
-
высокое содержание токсических веществ (металлов) в биологических средах;
-
положительные пробы на гиперчувствительность к металлам (кожные, серологические, ЖБАЛ);
-
выявление в крови повышенного уровня сывороточного гликопротеина KL-6.
Дополнительные критерии:
Формулировка диагноза
Дифференциальная диагностика
В первую очередь при диагностике экзогенных альвеолитов необходимо уточнить наличие контакта с внешним фактором. Следует отметить, что, в отличие от ЭАА, ЭТА возникает при первом контакте с высокими концентрациями токсических веществ (например, токсический синдром от органической пыли). Поражаются сразу несколько лиц, находившихся в зоне повышенного содержания вредных факторов, в то время как при ЭАА заболевает, как правило, один человек, ранее контактировавший с этим веществом, и концентрация этиологического фактора может быть небольшой. Если ЭАА и ИЛФ болеют преимущественно женщины, то ЭТА чаще развивается у мужчин, что, возможно, связано с характером трудовой деятельности пациентов. Клиническая картина, рентгенологические и функциональные признаки фиброзирующих альвеолитов, особенно на поздних стадиях: ЭТА, ЭАА и ИИП, ИЛФ однотипны, в связи с чем подчас чрезвычайно трудно установить нозологическую форму альвеолита. При дифференциальной диагностике этих заболеваний следует учитывать следующие признаки.
-
Формирование таких признаков хронической гипоксии, как «пальцы Гиппократа», значительно чаще отмечается при ИЛФ (36%), чем при ЭТА (13%) и ЭАА (9%).
-
Наибольшая степень выраженности рестриктивных изменений характерна для ИЛФ, в то время как при ЭАА и ЭТА могут выявляться смешанные нарушения вентиляционной способности легких: при ЭАА за счет присоединения бронхоспастического синдрома, при ЭТА - за счет развития ОБ или реактивной дисфункции дыхательных путей.
-
Инфильтративные изменения на рентгенограммах органов грудной клетки характерны для ЭАА и ЭТА, причем при ЭАА отмечается быстрая динамика этих изменений. Для ИЛФ свойственны интерстициальные изменения с уменьшением объемов нижних долей легких и высокое стояние куполов диафрагмы.
-
Бронхофиброскопия выявляет катаральный эндобронхит при всех рассматриваемых заболеваниях. Атрофические изменения слизистой оболочки бронхов могут выявляться только при ЭТА.
-
В ЖБАЛ характерными являются высокий лимфоцитоз у больных ЭАА (до 30-70%), нейтрофилез при ИЛФ. При ЭТА может увеличиваться как число лимфоцитов, так и число нейтрофилов. Лимфоцитоз ЖБАЛ ассоциируется с выраженностью альвеолита. Обнаружение пенистых клеток, содержащих пластинчатые включения, указывает на воздействие амиодарона, а наличие причудливых альвеолярных макрофагов и гигантских клеток может указывать на контакт с твердыми металлами (вольфрам, кобальт).
-
Положительные иммунологические реакции с определенными аллергенами позволяют достоверно поставить диагноз ЭАА.
-
Спонтанная обратная динамика проявлений заболевания характерна для ЭАА, но также может наблюдаться при ингаляционных лихорадках. Благоприятное течение заболевания на фоне глюкокортикоидной терапии с последующей отменой препаратов может с большой долей вероятности указывать на ЭАА.
Лечение
При подозрении на ЭТА в первую очередь необходимо немедленно устранить предполагаемый этиологический фактор. Лечебная тактика при ЭТА принципиально не отличается от тактики лечения фиброзирующего альвеолита. Базисной терапией ЭТА являются ГК в начальной дозе 0,5-1 мг на 1 кг массы тела в пересчете на преднизолон с последующим снижением дозы в зависимости от быстроты обратной динамики заболевания. В отличие от фиброзирующего альвеолита, больным ЭТА не назначаются азатиоприн и пеницилламин из-за их возможного пневмотоксического действия. Однако при бериллиозе в случаях резистентности к ГК рекомендуется метотрексат в дозе 5-10 мг в неделю (принимать в первые два дня в неделю по половинной дозе) (Dweik R.A., 2003). Широко применяются экстракорпоральные методы лечения: плазмаферез, гемосорбция, плазмацитоферез с инкубацией лимфоцитов с ГК. Повторные курсы лечения рекомендуется проводить через 0,5-1 год. Проведенное рандомизированное клиническое исследование показало подавляющее влияние инфлексимаба на интенсивность иммунного ответа и улучшение ДСЛ у больных хроническим бериллиозом (Maier L.A. et al., 2012). При прогрессировании ДН показана длительная кислородотерапия на дому, легочная реабилитация.
В настоящее время еще не разработаны клинические рекомендации по использованию антифибротических препаратов (нинтеданиба или пирфенидона) при хроническом ЭТА. Безопасность и эффективность этих препаратов должна быть оценена в рандомизированных клинических исследованиях. Возрастает число клинических исследований, уточняющих роль мезенхимальных стволовых клеток как потенциального таргетного агента при фиброзирующих заболеваниях легких (Аверьянов А.В. и др., 2018).
Критерием полной излеченности больных является исчезновение одышки, нормализация ФВД (в первую очередь ДСЛ), газов крови, данных рентгенологического исследования органов грудной клетки. В случае сохранения снижения ДСЛ, даже при нормализации других показателей, состояние расценивается как выздоровление с дефектом. Исходом ЭТА могут быть пневмофиброз, реактивная дисфункция дыхательных путей, ОБ с ОП.
Прогноз
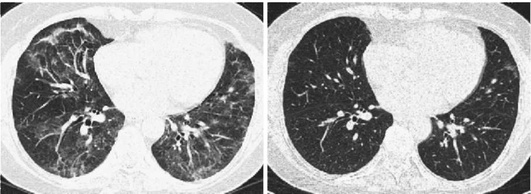
Зависит от сроков установления диагноза и быстроты устранения этиологического фактора. Своевременная и адекватная терапия может привести к полному или частичному (сохраняется снижение ДСЛ) выздоровлению. Лечебные мероприятия на поздних стадиях заболевания малоэффективны, и прогноз, как правило, неблагоприятный. При Ардистил-синдроме в случае развития ОП прогноз благоприятный (улучшение отмечается в течение одного года). При ОБ с ОПфиброзе прогноз серьезный - у 17% больных заболевание прогрессирует даже на фоне терапии системными ГК (Solé A. et al., 1996; Romero S. et al., 1998). Прогноз ЭТА от нейлонового флока более благоприятный (рис. 2.32) - вывод больных из вредных условий труда и системная ГК терапия может существенно улучшить прогноз (Glazer C.S., Maier L. Eur. Respir. Mon., 2009). ЭТА от воздействия оксида индий-олово характеризуется прогрессирующим пневмофиброзом с развитием вторичного ЛАП даже после прекращения контакта с этиологическим фактором (Cummings K.J. et al., 2016). Прогноз лекарственно-индуцированного ЭТА описан в соответствующей главе.
Профилактика
Ведущими методами первичной профилактики ЭТА, возникающего в производственных условиях, являются инженерно-технические мероприятия, направленные на снижение уровня запыленности, нормализацию микроклиматических условий на рабочих местах, внедрение очистных сооружений в рамках общегосударственной программы. Обязательно использование эффективных индивидуальных средств защиты органов дыхания в виде респираторов, противогазов, а при ряде работ необходимо использование масок с принудительной подачей воздуха.
Медицинские мероприятия включают прежде всего качественное проведение предварительных (при поступлении на работу) и периодических медицинских осмотров. Обязательным условием должно стать проведение профессионального отбора во вредные для дыхательной системы производства. Повторные курсы антиоксидантной терапии у лиц, имеющих длительный контакт с вредными факторами, позволят снизить риск развития ЭТА. Рекомендуется ацетилцистеин (N-ацетилцистеин♠ ) по 200 мг/сут, поливитамины+минералы (Триовит♠ по 2 капсулы в сутки, Активит антиоксидант♠ по 1 капсуле в сутки), чередуя по 1 мес каждый препарат в течение 6 мес в году.
При проведении химиотерапии необходимо избегать сочетания двух и более пневмотропных токсических препаратов, особенно на фоне длительной кислородотерапии.
СПИСОК ЛИТЕРАТУРЫ
-
Аверьянов А.В., Коноплянников А.Г., Забозлаев Ф.Г. и др. Сравнительное исследование эффектов мезенхимальных стволовых клеток при различных методах доставки в экспериментальной модели фиброза легких // Клиническая практика. 2018. Т. 9, № 4. С. 4-14. doi: https://doi.org/10.17816/ clinpract 944-14.
-
Амосов В.И., Сперанская А.А. Лучевая диагностика интерстициальных заболеваний легких. СПб.: ЭЛБИ-СПб, 2015. 176 с.
-
Илькович М.М., Новикова Л.Н. Идиопатические интерстициальные пневмонии: объединительная концепция // Доктор.Ру Кардиология Терапия. 2018. Т. 148, № 4. С. 14-17.
-
Илькович М.М. Заболевания органов дыхания. СПб.: Нормед-изд., 1998. C. 185-198.
-
Орлова Г.П. Экзогенный токсический альвеолит // Интерстициальные и орфанные заболевания легких / под ред. проф. М.М. Ильковича. М.: ГЕО-ТАР-Медиа, 2019. Гл. 3.3. С. 140-162.
-
Орлова Г.П. Заболевания легких, вызванные экзогенным воздействием токсико-пылевых факторов (клинико-экспериментальное исследование): автореф. д-ра мед. наук: 14.00.43, 14.00.16 / МЗ РФ. НИИ пульмонологии СПбГМУ им. акад. И.П. Павлова. СПб., 2003. 38 с.
-
Орлова Г.П., Илькович М.М., Яковлева Н.С. Экзогенные токсические альвеолиты как фиброзирующая болезнь легких // Материалы Всероссийской научно-практической конференции с международным участием по программам инноваций в области медицины труда «Трудовое долголетие: инновационная кристаллизация проблем ранней диагностики, лечения и реабилитации сердечно-сосудистых, респираторных и онкологических заболеваний» / под ред. И.В. Бухтиярова, И.О. Маринкина, Л.А. Шпагиной, Л.А. Паначевой. Новосибирск: Издательско-полиграфический центр НГМУ, 2019. С. 209-214.
-
Путов Н.В., Илькович М.М. Фиброзирующие альвеолиты. Л.: Медицина, 1986. 168 с.
-
Ризамухамедова М.З. Экзогенный фиброзирующий альвеолит у жителей села в условиях жаркого климата: автореф. д-ра мед.наук:14.00.43 / МЗ МП РФ. Государственный научный центр пульмонологии. СПб., 1995. 47 с.
-
Яковлева Н.С., Сперанская А.А., Золотницкая В.П., Орлова Г.П. Диагностика и динамический контроль сосудистых нарушений у пациентов с ами-одарон-индуцированной легочной токсичностью (АИЛТ) // Регионарное кровообращение и микроциркуляция. 2019. Т. 18, № 1. С. 66-76. https://doi.org/10.24884/1682-6655-2019-18-1-66-76
-
Ahsan S.A., Lackovic M., Katner A., Christine Palermo. Metal Fume Fever: A Review of the Literature and Cases Reported to the Louisiana Poison Control Center // J. La State Med Soc. 2009. Vol. 161, N. 6. P. 348-351.
-
Amanullah S., Lessnau K.D. Chemical Worker’s Lung // Chief Editor: Byrd Jr. R. P. Updated: Jan 14, 2015. http://emedicine.medscape.com/article/297248-overview
-
Becklake M.R., Cowie R.L. Pneumoconiosis // Textbook of Respiratory Medicine / Murray and Nadel. 3rd ed. P. 1811-1824. 2000 W.B. Saunders Company. MD Consult L.L.C. http://www.mdconsult.com
-
Black C.M., Welsh K.I., Walker A.E. et al. Genetic susceptibility to scleroderma-like syndrome induced byvinyl chloride // Lancet. 1983. Vol. 8314-8315, N. 1. P. 53-55.
-
Chonan T., Taguchi O., Omae K. Interstitial pulmonary disorders in indium-processing workers // Сytochem. 2006. Vol. 54, N. 12. P. 1315-1325.
-
Clinical guideline for the diagnosis of Berillium sensitization and chronic beril-lum disease // Washington state dept. of labor and industries office of the medical director. 2015. 7 p.
-
Cummings K.J., Virji M.A., Park J.Y. et al. Respirable Indium Exposures, Plasma Indium, and Respiratory Health Among Indium-Tin Oxide (ITO) Workers // Am. J. Ind. Med. 2016. Vol. 59, N. 7. P. 522-531. doi:10.1002/ajim.22585.
-
Dajczman E., Srolovitz H., Kreisman H. et.al. Fatal pulmonary toxicity following oral etoposide therapy // Lung Cancer. 1995. Vol. 12, N. 1-2. P. 81-86.
-
Dweik R.A. Berylliosis // Chief Editor: Zab Mosenifar. Updated: Nov 20, 2015. https://emedicine.medscape.com/article/296759-overview#a6
-
Flors L., Domingo M.L., Leiva-Salinas C. et al. Uncommon occupational lung diseases: high-resolution CT findings // AJR, 2010. V. 194. P. 20-26.
-
Forni A. Bronchoalveolar lavage in the diagnosis of hard metal disease // Sci. Total Environ. 1994. Vol. 150. P. 69-76.
-
Froudarakis M.E., Voloudaki A., Borous D. et al. Pneumoconiosis among Cretan dental techniciants // Respiration. 1999. Vol. 66, N. 4. P. 338-342.
-
Glazer C.S., Maier L. Occupational interstitial lung disease // Eur. Respir. Mon., Ch. 15 2009. Vol. 49. P. 265-286.
-
Griff S., Schönfeld N., Ammenwerth W. et al. Diagnostic yield of transbronchial cryobiopsy in non-neoplastic lung disease: a retrospective case series // BMC Pulmonary Medicine 2014, 14:171http://www.biomedcentral.com/1471-2466/14/171
-
Greenberg M.I., Vearrier D. Metal fume fever and polymer fume fever // Clinical Toxicology. 2015. Vol. 53, Iss. 4. P. 195-203.
-
Jomova K., Valko M. Advances in metal-induced oxidative stress and human disease // Toxicology. 2011. Vol. 283, Iss. 2-3, N. 10. P. 65-87.
-
Kern D.G., Durand K.T.H., Crausman R.S. et al. Chronic interstitial lung disease in nylon flocking industry workers. Rhode Island, 1992-1996 // Morbid. Mortal. Weekly Rep. 1997. Vol. 46. P. 897-901.
-
Lessnau K.D., Lazo K.G.G. Chief Editor: Zab Mosenifar, Drug-Induced Pulmonary Toxicity // Updated: Apr 09, 2019. https://emedicine.medscape.com/ article/1343451-overview#showall
-
Li L., Silveira L.J., Hamzeh N. et al. Beryllium-induced lung disease exhibits expression profiles similar to sarcoidosis // Eur. Respir. J. 2016. Vol. 47, N. 6. P. 1797-1808. doi:10.1183/13993003.01469-2015.
-
Lougheed M.D., Roos J.O., Waddell W.R., Munt P.W. Desquamative interstitial pneumonitis and diffuse alveolar damage in textile workers // Chest. 1995. Vol. 108. P. 1196-1200.
-
Machado R.F., Dweik R.A., Demeter S.L., Ahmad M. Drug-induced pulmonary disease // Baum’s Textsdook of Pulmonary Diseases. 7th ed. / Eds J.D. Crapo, J. Glassroth, J.B. Karlinsky, T.E. King. 2004. P. 657-677.
-
Maier L.A., Barkes B.Q., Mroz M. et al. Infliximab therapy modulates an antigen-specific immune response in chronic beryllium disease // Respir. Med. 2012. Vol. 106, N. 12. P. 1810-1813.
-
Megarbane B., Chevillard L. The large spectrum of pulmonary complications following illicit drug use: Features and mechanisms // Chemico-Biological Interactions. 2013. Vol. 206. P. 444-451.
-
Meyer K.C., Raghu G., Baughman R.P. et al. An Official American Thoracic Society Clinical Practice Guideline: The Clinical Utility of Bronchoalveolar Lavage Cellular Analysis in Interstitial Lung Disease // Am. J. Respir. Crit. Care Med. 2012. Vol. 185, Iss. 9. P. 1004-1014.
-
Mizutani R.F., Terra-Filho M., Lima E. et al. Hard metal lung disease: a case series Hard metal lung disease: a case series // J. Bras. Pneumol. 2016. Vol. 42, N. 6. P. 447-452. http://dx.doi.org/10.1590/S1806-37562016000000260
-
Morell E.B., Madrid A.H., Marín I.M. et al. Multiple Pulmonary Nodules and Amiodarone KL-6 as a New Diagnostic Tool // Rev. Esp. Cardiol. 2005. Vol. 58, N. 4. P. 447-449.
-
Moya C., Anto J.M., Taylor A.J. N and Collaborative Group for the Study of Toxicity in Textile Aerographic Factories. Outbreak of organising pneumonia in textile printing sprayers // Lancet. 1994. Vol. 343. P. 498-502.
-
Perez-Alvarez R., Perez-de-Lis M., Diaz-Lagares C. et al. Interstitial Lung Disease Induced or Exacerbated by TNF-Targeted Therapies: Analysis of 122 Cases// Semin Arthritis Rheum, 2011. Vol. 41, N. 2. P. 256-64.
-
Potolicchio I., Festucci A., Hausler P., Sorrentino R. HLA-DP molecules bind cobalt: a posible explanation for the genetic association with hard metal disease // Eur. J. Immunol. 1999. Vol. 29, N. 7. P. 2140-2147.
-
Richeldy L., Sorrentino R., Saltini C. HLA-DPB1 glutamate 69: a genetic marker of beryllium disease // Science. 1993. Vol. 262. P. 242-244.
-
Romero S., Hernandez L., Gil J. et al. Organizing pneumonia in textile printing workers: a clinical description // Eur. Respir. J. 1998. Vol. 11. P. 265-271.
-
Saltini C., Richeldi L., Losi M. et al. Major histocompatibility locus genetic markers of beryllium sensitization and disease // Eur. Respir. J. 2001. Vol. 189, N. 4 P. 677-684.
-
Segal E., Lang E. Toxicity, Chlorine Gas // 2006, Oct. 10. eMedicine Spe-cialties>Emergency Medicine>TOXICOLOGY.
-
Shimizu T., Hamada O., Sasaki A., Ikeda M. Polymer fume fever // BMJ Case Reports. Published online: 10 December 2012. doi:10.1136/bcr-2012-007790 Available at: https://casereports.bmj.com/content/2012/bcr-2012-007790
-
Silveira L.J., McCanlies E.C., Fingerlin T.E. et al. Chronic beryllium disease, HLA-DPB1, and the DP peptide binding groove // J. Immunol. 2012. Vol. 189, N. 8. P. 4014-4023.
-
Sirajuddin A., Kanne J.P. Occupational Lung Disease // J. Thorac. Imaging. 2009. Vol. 24, N. 4. P. 310-320.
-
Skeoch S., Weatherley N., Swift F.J. et al. Drug-Induced Interstitial Lung Disease: A Systematic Review // J. Clin. Med. 2018. Vol. 7, N 10. pii: E356; doi:10.3390/ jcm7100356
-
Sole A., Cordero P.J., Morales P. et al. Epidemic outbreak of interstitial lung disease in aerographics textile workers - the «Ardystil syndrome»: a first year follow up // Thorax. 1996. Vol. 51. P. 94-95.
-
Sorger C., Simon J.C., Treudler R. [Drug-induced interstitial lung disease (DILD) during treatment with ustekinumab] [Article in German] // Hautarzt. 2019 Dec 2. doi: 10.1007/s00105-019-04519-9. [Epub ahead of print]
-
Van Dyke M.V., Martyny J.W., Mroz M.M. et al. Risk of Chronic Beryllium Disease by HLA-DPB1 E69 Genotype and Beryllium Exposure in Nuclear Workers // Am. J. Respir. Crit. Care Med. 2011. Vol. 183, N. 12. P. 1680-1688.
-
Washko R., Burkhart J., Piacitelli C. Microfibres, Inc. // NIOSH HETA. N 96- 0093-2685. Pawtucket, RI, April 1998. 38 p. https://www.cdc.gov/niosh/hhe/reports/pdfs/1996-0093-2685.pdf
-
Yarmus L., Akulian J., Gilbert C. et al. Cryoprobe transbronchial lung biopsy in patients after lung transplantation // Chest. 2013. Vol. 143, N. 3. P. 621-626.
2.3.1. МЕДИКАМЕНТОЗНЫЕ ПОРАЖЕНИЯ ЛЕГКИХ
Г.П. Орлова, Н.С. Яковлева, М.М. Илькович
Одним из побочных действий многих лекарственных препаратов является поражение дыхательной системы - от некардиогенного отека легких, ЭАА и ЭТА до бронхиальной астмы. Своевременная диагностика этих состояний, прекращение приема препарата и при необходимости назначение адекватной терапии позволяют предотвратить дальнейшее повреждение легких и тем самым улучшить прогноз.
В США ежегодно регистрируется более 2 млн случаев лекарственно обусловленных реакций, в том числе 100 000 со смертельным исходом. Токсические реакции на лекарственные препараты развиваются у 10-18% стационарных больных. По данным разных авторов, реакции на лекарственные препараты обусловливают от 2 до 12% смертности и 0,03-3% внутрибольничной летальности. Медикаментозные поражения легких составляют 1,8-3,5% всех ИЗЛ. По данным зарубежных авторов, реакцией пациентов на лекарственные препараты обусловлены 2-5% госпитализаций и 0,3% смертельных случаев среди стационарных больных. Лекарственные поражения легких развиваются у 10-18% госпитализированных больных (Balk R.A. et al., 2002; Lessnau K.-D. et al., 2019). Среди больных, наблюдавшихся в НИИ интерстициальных и орфанных заболеваний легких ПСПбГМУ им. акад. И.П. Павлова, лекарственные поражения легких выявлялись у 37,7% больных ЭАА и 33% больных ЭТА.
Впервые в 1880 г. William Osler при аутопсии описал некардиогенный отек легких (НОЛ) от опиатов (Sternbach G., 1983). В 1901 г. Е.А. Аркин впервые применил термин «лекарственная болезнь» к системной реакции в виде астении, анорексии, лихорадки, диспепсии, сыпи на коже после втирания серно-ртутной мази (Аркин Е.А., 1901). В 1972 г. E.C. Rosenow опубликовал первый обзор 19 лекарственных препаратов, обладающих пневмотоксичностью. Регулярно выявляются новые препараты, вызывающие респираторные проблемы. В настоящее время известно более чем о 1300 лекарственных средствах, процедурах или веществах, которые могут вызывать те или иные поражения легких, причем около 350 - ИЗЛ. По данным зарубежных авторов, заболевания легких развиваются у 1,2-8,8% лиц, получавших амио-дарон, у 2-40% - получавших блеомицин, у 1,1-3,9% - гемцитабин, у 0,06-15% - метотрексат, у 3,65% - нитрофураны, у 20% - IL-2. Ингибиторы АПФ в 20% случаев вызывают кашель. Волчаночный синдром при применении гидралазина в 30% случаев сопровождается поражением легких и менее чем в 5% вызывает изолированное поражение легких (Osler S.G.W., 1883; Fraser, 1999; Ozkan M. et al., 2001; Skeoch S. et al., 2018; Lessnau K.-D. et al., 2019).
В одном из районов Парижа (Сена-Сен-Дени, Франция) ежегодная заболеваемость медикаментозными ИЗЛ в 2012 г. составила 1,2 на 100 000 населения (6,4%, 14/219 всех ИЗЛ и 18%, 14/77 всех ИЗЛ известной природы), а распространенность - 2,6 на 100 000 населения и 12% (31/260) всех ИЗЛ известной природы (Duchemann B. et al., 2017).
Этиология и факторы риска
Наиболее частой причиной развития медикаментозных ИЗЛ являются противоопухолевые препараты, на которые приходится 23-51% случаев. Реже этиологическим фактором являются таргетные противоревматические препараты (6-72%), антибиотики (6-26%), нестероидные противовоспалительные средства (0-23%), психиатрические препараты (0-9%) и антиаритмические препараты (0-9%) (Skeoch S. et al., 2018).
Факторами риска развития лекарственных поражений легких считают следующие:
-
предшествующие реакции респираторной системы на лекарственные препараты;
-
контакт с профессиональными вредными факторами (асбест и др.);
-
индивидуальные особенности механизмов активации и детоксикации лекарств;
-
генетическую предрасположенность к определенным реакциям на прием препаратов;
-
назначение одновременно нескольких пневмотоксических препаратов;
Мультифакторный анализ показал, что при лечении немелкоклеточного рака гефитинибом его пневмотоксический эффект чаще проявляется у лиц мужского пола, курящих, при наличии пневмофиброза и плохого общего состояния. Роль генетической предрасположенности в развитии медикаментозного поражения легких подтверждает тот факт, что применение гефитиниба по поводу рака легкого вызывает развитие ИЗЛ у 1,9-5% жителей Японии по сравнению с 0,3% во всех других странах мира (Cottin V. et al., 2009). Кашель при применении ингибиторов АПФ чаще отмечается у чернокожих. Применение кислородотерапии одновременно с препаратами, нарушающими баланс в оксидант-антиоксидантной системе (блеомицин, амиодарон и др.), может спровоцировать развитие респираторного дистресс-синдрома (Kuo L.C. et al., 2011; Lessnau K.-D. et al., 2019).
Как известно, цитохром P450 (CYP) участвует в метаболизме целого ряда лекарственных препаратов (психотропные препараты, рифампицин, противосудорожные препараты, стероиды, анорексический препарат фенфлурамин). Недостаточная активность одного из аллелей CYP приводит к повышению уровня препарата в крови, что увеличивает риск развития ЭТА (Wijnen P.A.H.M., 2010).
Патогенез
Патогенетические особенности развития различных форм лекарственных поражений легких подробно рассмотрены в соответствующих главах. При ингаляционном воздействии препарат может как аккумулироваться в легочной ткани (например, липоидная пневмония), так и вызывать метаболическое и воспалительное эндотелиальное повреждение (например, поражение легких при воздействии кокаина).
Системное действие лекарственных препаратов обусловлено шестью основными механизмами патогенеза (Balk R.A. et al., 2002; Prasad R. et al., 2014; Lessnau K.-D. et al., 2019).
-
Прямое токсическое действие. Более характерно для химиотерапевтических препаратов. Так, блеомицин повреждает хромосомы, расщепляя спираль ДНК.
-
Оксидативный стресс. Активные формы кислорода, продуцируемые альвеолярными макрофагами, моноцитами, нейтрофилами, участвуют в окислительно-восстановительных реакциях, окисляя жирные кислоты, что ведет к нестабильности мембран и, возможно, аутогенной цитотоксичности. Классический пример - хроническое воздействие нитрофуранов, противоопухолевых препаратов, амиодарона. Эти препараты генерируют активные формы кислорода в клетках легких и подавляют антиоксидантные защитные механизмы, запуская тем самым воспалительные и фибротические процессы.
-
Дисрегуляция альвеолярных макрофагов. Развивается при воздействии амиодарона, амитриптилина. Метаболиты амиодарона способны связывать липиды лизосом альвеолярных макрофагов и вызывать нарушение катаболизма фосфолипидов, которые откладываются в виде пластинчатых телец в альвеолах.
-
Поражение иммунокомпетентной системы. Лекарственные препараты действуют как антигены или гаптены, активируя иммунные механизмы повреждения легких. Менее 15% лекарственно-индуцируемых побочных эффектов обусловлены иммунными реакциями. Препараты таргетной терапии и блокирующие антитела вызывают дисрегуляцию иммунного ответа.
-
Повреждение сосудов легких. Развивается при остром отеке легких, ИЗЛ, веноокклюзионной болезни легких (ВОБЛ), ЛГ и легочном кровоизлиянии. Повреждение эндотелия может вызываться химиотерапевтическими препаратами (платиносодержащие, антрациклины, таксаны, алкилирующие препараты), препаратами молекулярной таргетной терапии (бевацизумаб, леналидомид, талидомид, сорафениб), наркотиками (кокаин, амфетаминρ ). Предполагают следующие механизмы поражения легочных сосудов:
-
Поражение центральной нервной системы. Стимуляция симпатического звена вегетативной нервной системы приводит к повышению внутричерепного давления, что активирует гипоталамус и вазомоторные центры продолговатого мозга, повышается проницаемость эндотелия. Развивается нейрогенный отек легких.
O.Matsuno (2012) выделяет два основных механизма развития лекарственно-индуцированных ИЗЛ:
Вовлечение этих двух механизмов может быть изолированным или комбинированным.
Патологическая анатомия
Морфологические изменения в легких от воздействия лекарственных препаратов неспецифичны и зависят от остроты патологического процесса (см. «Экзогенный токсический альвеолит»). Лекарственные препараты вызывают однотипные морфологические изменения, что предполагает общие механизмы клеточного повреждения (Flieder D.B. et al., 2004; Schwarz M.I. et al., 2004; Meltzer E. et al., 2005; Lessnau K.-D. et al., 2019).
В острых случаях может развиваться альвеолярный отек. При подостром течении заболевания выявляются гранулемы из гигантских клеток, очаговые скопления лимфоцитов, плазматических клеток, эозинофилов (метотрексат), неказеозные саркоидные гранулемы, окруженные лимфоцитами (IFN). Для хронического течения морфологическая картина аналогична изменениям при идиопатическом фиброзирующем альвеолите. Выявляются утолщенные, фиброзированные межальвеолярные перегородки, инфильтрация легочного интерстиция нейтрофилами, лимфоцитами, гистиоцитами, плазматическими клетками, фибробластами; десквамация альвеолярного эпителия в просвет альвеол (амиодарон, блеомицин, эрлотиниб и др.).
При воздействии амиодарона развивается внутриклеточный дислипидоз, что приводит к формированию пенистых альвеолярных макрофагов. Типичной гистологической картиной амиодарон-индуцированного ЭТА является гиперплазия альвеолоцитов II типа, утолщение межальвеолярных перегородок, клеточная инфильтрация интерстиция и фиброз. Патогномоничным признаком является обнаружение пенистых альвеолярных макрофагов, содержащих два типа аномальных вакуолей, выявляемых при электронной микроскопии:
-
пластинчатые включения, представляющие собой крупные фаголизосомы, содержащие фосфолипиды и организованные в пластинчатые структуры (рис. 2.33, см. цв. вклейку).
Кроме макрофагов такие включения, могут содержаться в альвеолоцитах II порядка. Эти же включения могут быть найдены у здоровых людей, длительно принимающих амиодарон, что указывает лишь на прием препарата и не может свидетельствовать о токсичном воздействии амиодарона на легочную ткань. При отмене амиодарона пенистые макрофаги исчезают.
Выделяют следующие гистологические паттерны лекарственно-обусловленных заболеваний легких (Flieder D.B. et al., 2004; Lessnau K.-D. et al., 2019):
Клиническая картина
Клинические проявления различных форм лекарственных поражений легких описаны в соответствующих разделах. Различают острое, подострое и хроническое течение лекарственных поражений легких.
Классификация
В зависимости от вида лекарственного препарата и наличия факторов риска могут развиваться следующие заболевания легких и респираторные синдромы: ЭАА, ЭТА, некардиогенный отек легких, ВОБЛ, легочно-почечный синдром (псевдосиндром Гудпасчера), ОБ, ОБ с ОП, легочный эозинофильный инфильтрат, волчаночный синдром,
АНЦА-положительный ангиит, синдром Черджа-Стросса, ТЭЛА, легочные кровоизлияния, неврологические нарушения (миастениеподобный синдром). Некоторые препараты могут вызывать кашель или бронхоспазм (в ряде случаев с гиперэозинофилией).
Лекарственно-индуцированные заболевания/синдромы можно объединить в следующие группы (Flieder D.B. et al., 2004; Lessnau K.-D. et al., 2019):
Течение заболевания может быть острым, подострым или хроническим. Возможно сочетание одновременно несколько типов поражения. Основные препараты, которые могут инициировать те или иные поражения легких, представлены в табл. 2.12. Лекарственные препараты в одном случае могут быть причиной некардиогенного отека легких, в другом - ЭАА (антибиотики и др.) или ЭТА (нитрофурантоин, амиодарон и др.), ОБ (D-пеницилламинρ , сульфасалазин) или псевдосиндрома Гудпасчера (D-пеницилламинρ ).
Подробное описание клинических, рентгенологических и функциональных проявлений различных нозологических форм и вопросы терапии даны в соответствующих разделах.
| Лекарственный препарат | Наиболее часто встречающиеся поражения легких |
|---|---|
Цитотоксические антибиотики |
|
Блеомицин |
ЭТА, подострое течение |
Митомицин |
ЭТА, подострое течение |
Zinostatin (неокарциностатинρ) |
Веноокклюзионная болезнь |
Алкилирующие препараты |
|
Бусульфан |
ЭТА, хроническое течение |
Циклофосфамид |
ЭТА, хроническое течение |
Ифосфамид |
ЭТА |
Хлорамбуцил |
ЭТА |
Мелфалан |
ЭТА |
Арабинопиранозилметил нитрозомочевина: кармустин, ломустин |
ЭТА |
Алкалоиды барвинка розового |
ЭТА |
Антиметаболиты |
|
Метотрексат |
ЭТА |
Цитозин-арабинозидρ (цитарабин) |
Некардиогенный отек легких |
Азатиоприн |
ЭТА, |
6-меркаптопуринρ |
ЭТА |
Флударабин |
ЭТА |
Аспарагиназа (L-Аспарагиназа♠) |
ТЭЛА |
Фторурацил (5-Фторурацил-Эбеве♠) |
ЭТА |
Колхицин |
Некардиогенный отек легких |
Пеметрексед |
ЭТА |
Другие противоопухолевые препараты |
|
Циклоспорин-Аρ |
ЭТА |
Прокарбазин |
ЭТА |
Этопозид |
ЭТА |
Гефитиниб |
ЭТА |
Иринотекан |
ЭТА |
Сунитиниб |
ЭТА |
Иматиниб |
Плевральный выпот, ЭТА |
Гормональные препараты |
|
Тамоксифен |
ТЭЛА |
Нилутамид |
ЭТА |
Бикалутамид |
ЭАА, легочный эозинофильный инфильтрат |
Цитокины |
|
IL-2 |
Некардиогенный отек легких, бронхоспазм, плевральный выпот |
TNF |
Некардиогенный отек легких, легочное кровоизлияние |
Гранулоцит-макрофаг колониестимулирующий фактор |
ЭТА, некардиогенный отек легких, плевральный выпот, легочный эозинофильный инфильтрат |
IFN |
ЭТА |
Иммуноглобулин и антитела к вилочковой железе |
ЭТА, некардиогенный отек легких |
Третиноин (all-trans-retinoic) |
ЭТА, некардиогенный отек легких |
Моноклональные антитела |
|
Антитела к TNF-альфа [инфликсимаб (Ремикейд♠), инфликсимаб, адалимумаб] |
ЭТА |
Анти-CD20 антитела (РТМ) |
ЭТА |
Антитела к рецепторами эпидермального фактора роста (цетуксимаб, трастузумаб, панитумумаб) |
ЭТА |
Антитела к IL-6 рецепторам (тоцилизумаб) |
Кашель |
IgG1-антитела к фактору роста эндотелия сосудов (бевацизумаб) |
ЭТА |
Антитела к гликопротеину CD52 на поверхности В- и Т-лимфоцитов (алемтузумаб) |
ЭТА |
Антитела к цитотоксическому Т-лимфоцитарному антигену 4 (CTLA-4) (ипилимумаб) |
ЭТА |
Антитела к запрограммированным белкам смерти 1 (PD-1) клеток (ниволумаб, пембролизумаб) |
ЭТА |
Противомикробные препараты |
|
Нитрофурантоин |
ЭТА, ЭАА, волчаночный синдром |
Сульфасалазин |
ЭТА, ЭАА, волчаночный синдром. васкулиты |
Тетрациклин и миноциклин |
ЭАА, легочный эозинофильный инфильтрат, волчаночный синдром |
Сульфонамиды |
ЭАА, легочный эозинофильный инфильтрат, волчаночный синдром |
Пенициллин |
ЭАА, легочный эозинофильный инфильтрат, волчаночный синдром |
Парааминосалициловая кислота ρ |
ЭАА, легочный эозинофильный инфильтрат |
Этамбутол |
ЭАА, легочный эозинофильный инфильтрат |
Ампициллин |
ЭАА, ЭТА |
Малопримρ |
ЭАА, ЭТА |
Пириметамин |
Некардиогенный отек легких |
Триметоприм/сульфаметоксазол |
Некардиогенный отек легких |
Амфотерицин В |
ЭТА |
Антиаритмические препараты |
|
Амиодарон |
ЭТА, некардиогенный отек легких, ОБ с ОП, волчаночный синдром |
Лидокаин |
Некардиогенный отек легких |
Токаинидρ |
ЭТА |
Верапамил |
Некардиогенный отек легких |
Бепридил |
ЭТА |
Прокаинамид |
ЭТА, миастениеподобный синдром, волчаночный синдром |
Бета-блокаторы |
|
Соталол |
ОБ с ОП |
Карведилол |
ЭТА |
Пропранолол |
Волчаночный синдром |
Противосудорожные препараты |
|
Дифенилгидантоинρ |
ЭТА, ЭАА, волчаночный синдром |
Карбамазепин |
ЭТА, ЭАА |
Обезболивающие препараты |
|
Ацетилсалициловая кислота |
ЭАА, некардиогенный отек легких, бронхо-спазм |
Месалазин |
ЭТА |
Нестероидные противовоспалительные препараты |
|
Напроксен, сулиндак, пироксикам, дифлунизалρ, диклофенак |
Волчаночный синдром, бронхоспазм с гиперэозинофилией, некардиогенный отек легких, легочная эозинофилия |
Противоревматические препараты |
|
D-пеницилламинρ |
ОБ с ОП, волчаночный синдром, миастениеподобный синдром, псевдосиндром Гудпасчера |
Золото |
ЭТА, волчаночный синдром |
Симпатомиметики |
|
Токолитики |
Некардиогенный отек легких |
Антидепрессанты, нейроактивные препараты |
|
Амитриптилин |
ЭТА, бронхиолит |
Кломипрамин |
ОБ с ОП |
Флуоксетин |
ЭАА, легочный эозинофильный инфильтрат |
Галоперидол |
Некардиогенный отек легких |
Рентгеноконтрастные препараты |
|
Масленые контрастные вещества для лимфангиографии |
Некардиогенный отек легких |
Водные растворы контрастных веществ |
Некардиогенный отек легких |
Ингибиторы АПФ |
|
Все препараты этой группы |
Постоянный кашель |
Каптоприл |
ЭТА, волчаночный синдром |
Антилипидемические препараты |
|
Симвастатин |
ЭТА, ОБ с ОП, волчаночный синдром |
Клофибратρ |
Волчаночный синдром |
Препараты других групп |
|
Гидрохлортиазид |
Некардиогенный отек легких, ЭТА, волчаночный синдром |
Беклометазон |
Легочный эозинофильный инфильтрат |
Силикон |
ЭТА |
Эрготамин |
ЭТА |
Изониазид |
ЭТА |
Дефероксамин (Десферал♠) |
Некардиогенный отек легких |
Ритодринρ |
Некардиогенный отек легких |
Дилтиазем |
Некардиогенный отек легких |
Тербуталинρ |
Некардиогенный отек легких |
Аминорекс (меноцил)ρ |
ЭТА |
Хлорпропамид |
ЭТА |
Сиролимус |
ЭТА, ОБ с ОП |
Эверолимус |
ЭТА |
Темсиролимус |
ЭТА |
Лефлуномид |
ЭТА |
Запрещенные препараты, наркотики, седативные препараты |
|
Героинρ |
Некардиогенный отек легких |
Метадонρ |
Некардиогенный отек легких |
Бупренорфин |
Некардиогенный отек легких |
Пропоксифенρ |
Некардиогенный отек легких |
Хлордиазепоксид |
Некардиогенный отек легких |
Этхлорвинолρ |
Некардиогенный отек легких |
Паральдегидρ |
Некардиогенный отек легких |
Кодеин |
Некардиогенный отек легких |
Бромокарбамид |
Некардиогенный отек легких |
Фенобарбитал |
Некардиогенный отек легких |
Налоксон |
Некардиогенный отек легких |
Кодеин |
Некардиогенный отек легких |
Налоксон |
Некардиогенный отек легких |
Кокаин |
Некардиогенный отек легких, ОБ с ОП, ЭАА, ЭТА, ЛГ, эмфизема, пневмоторакс, легочное кровотечение |
ЭАА медикаментозной этиологии, как правило, протекает остро или подостро. Острая форма ЭАА развивается через 4-12 ч после попадания аллергена в организм. При прекращении приема препарата симптомы исчезают через 12-48 ч. При подострой форме ЭАА начало заболевания не столь демонстративно.
Повторные курсы лекарственных препаратов приводят к обострению заболевания. Длительный многократный контакт с небольшими дозами лекарственных препаратов ведет к формированию хронической формы ЭАА.
В диагностике медикаментозного ЭАА большое значение придается определению специфических преципитирующих антител класса IgG, но их отсутствие не исключает наличие заболевания. Плохая растворимость многих медикаментов ограничивает применение методов радиальной диффузии в геле и встречного иммуноэлектрофореза для диагностики медикаментозных ЭАА. В этих случаях используются тест аллергического лейкоцитолиза, дополненный параллельной постановкой теста дегрануляции тучных клеток, тест торможения миграции лейкоцитов или макрофагов, реакция бласттрансформации лимфоцитов, тест агрегации лейкоцитов. В случаях ранней диагностики прогноз благоприятный.
Лекарственно-индуцированный экзогенный токсический альвеолит
Полипрагмазия, достигшая широких масштабов с 80-х гг. ХХ в., стала проявляться ростом распространенности медикаментозного ЭТА, который, по данным разных авторов, составляет от 1,8 до 3,5% всех медикаментозных ИЗЛ. Участились случаи развития пневмофиброза у онкологических больных, получавших химиотерапию, а затем и кардиологических больных - «амиодароновое легкое» (Toews G.B., 2000; Poll I.W. et al., 2001; Segura A., 2001; Stamatoullas A. et al., 2015; Duchemann B. et al., 2017).
ЭТА наиболее часто развивается при лечении химиотерапевтическими препаратами, амиодароном (табл. 2.13). При приеме больших доз блеомицина среднее время от начала приема до развития ЭТА составляет 1,5-4,2 мес. Риск возникновения ЭТА при кумулятивной дозе больше 300 000 международных единиц повышается в 3,5 раза. Гемцитабин-индуцированный ЭТА развивается в среднем через 23 дня - 4 года после начала лечения или после прекращения лечения (Osawa M. et al., 2015; Bowyer S. et al., 2016; Skeoch S. et al., 2018; Lessnau K.-D. et al., 2019).
| Препарат | Процент развития ЭТА |
|---|---|
Арабинопиранозилметил нитрозомочевина (кармустин, ломустин) |
20-30 |
при дозе более 1,5 г/м2 |
50 |
при дозе более 525 мг/м2 |
47 |
при дозе более 1500 мг/м2 |
50 |
Амиодарон |
1,2-8,8 |
при дозе более 500 мг |
5-15 |
при дозе менее 200 мг |
0,1-1,6 |
Бепридил |
6,3 |
Бусульфан |
5-46 |
Цитозин-арабинозидρ (цитарабин) |
15-44 |
Блеомицин |
6,8-21-40 |
Метотрексат |
0,06-15 |
Гемцитабин |
1,1-3,9 |
Митомицин |
3-12 |
Симпатомиметики (альбутерол, тербуталинρ) |
0,5-5 |
Нитрофураны |
3,65 |
Циклофосфамид |
Менее 1 |
Опиаты (при передозировке) |
50-70 |
Эрлотиниб |
0,9-5,9 |
Гефетиниб |
1,2-3,5 |
Панитумумаб |
1,3 |
Цетуксимаб |
1,2 |
Эверолимус |
2,8-58 |
Темсиролимус |
29-36 |
Сиролимус |
9,5 |
Ипилимумаб |
5,44-7,5 |
Новолумаб |
11,7 |
Пеметрексед |
1,8 |
Гранулоцит-макрофаг колониестимулирующий фактор |
0,2 |
Моноклональные антитела к TNF-α |
0,5-0,6 |
Лефлуномид |
0-1,2 |
Пембролизумаб |
<1-5 |
Этанерцепт |
0,6 |
Комбинированные схемы лечения |
40 |
Клинический пример
Больная В., 45 лет, поступила в клинику пульмонологии НИИ интерстициальных и орфанных заболеваний легких ПСПбГМУ им. акад. И.П. Павлова в марте 2005 г. с жалобами на одышку при умеренной физической нагрузке.
Заболела в мае 2004 г., когда появились одышка при физической нагрузке, сухой кашель, слабость. Изменения на флюорограммах были расценены как двусторонняя пневмония. Лечилась амбулаторно в течение месяца, затем в стационаре. Антибиотикотерапия и симптоматическое лечение были неэффективны. Одышка прогрессировала. В августе 2004 г. был заподозрен ЭАА, назначен преднизолон в суточной дозе 25 мг с положительной клинико-рентгенологической динамикой. При снижении дозы преднизолона до 15 мг в сутки вновь наросли изменения на рентгенограммах. Доза преднизолона была увеличена до 30 мг в сутки. Для уточнения диагноза больная была госпитализирована в клинику пульмонологии. Контакта с профвредностями не было. Не курила. Аллергических реакций в анамнезе не было. Больная с февраля 2004 г. постоянно принимала биологически активную добавку «Тенториум» (в состав входит 15 наименований).
При поступлении состояние больной было удовлетворительное. Дыхание ослабленное, крепитация в нижних отделах легких. Клинический анализ крови без патологических изменений. На рентгенограммах органов грудной клетки от июня 2004 г. выявлялось усиление легочного рисунка за счет интерстициального компонента в обоих легких, инфильтративное затенение в нижних отделах правого легкого. КТ органов грудной клетки от июня 2004 г. выявила усиление легочного рисунка за счет интерстициального компонента, изменения по типу «матового стекла» (рис. 2.34). При обследовании в клинике на рентгенограммах органов грудной клетки выявлялась положительная динамика изменений в легких: незначительное усиление легочного рисунка за счет интерстициального компонента. На КТ органов грудной клетки отмечалась выраженная положительная динамика (рис. 2.35). При комплексном функциональном исследовании внешнего дыхания выявлялось умеренное снижение ДСЛзд - 67% при нормальных ЖЕЛ (105%) и показателях проходимости дыхательных путей. Эластическая отдача легких была в пределах нормы (0,51 кПа/л). Больной был поставлен диагноз ЭАА, ДН II степени. Назначена терапия глюкокортикоидными препаратами: четыре таблетки триамцинолона через день с постепенным снижением дозы, препараты калия, нандролон, ангиопротекторы. На фоне проводимой терапии одышка исчезла. ДСЛус повысилась, но оставалась умеренно сниженной (78%).
Среди пациентов с медикаментозным ЭТА, наблюдавшихся в НИИ интерстициальных и орфанных заболеваний легких, наиболее частым этиологическим фактором был амиодарон (табл. 2.14).
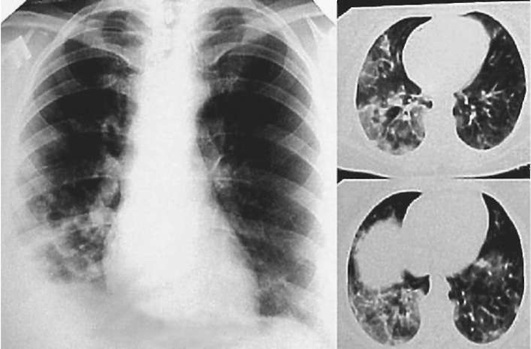
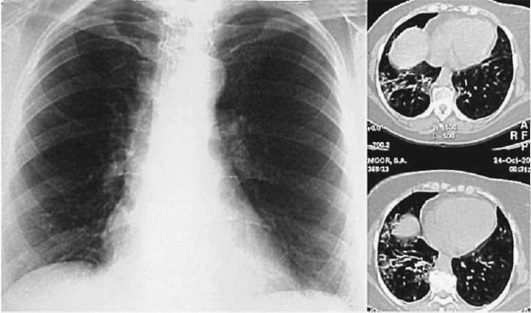
Препарат |
Количество больных |
|
число |
процент |
|
Амиодарон |
42 |
75 |
Антибиотики |
7 |
13 |
Химиотерапевтические препараты |
4 |
7 |
Нейроактивные препараты |
1 |
2 |
Биологически активные добавки |
1 |
2 |
Марихуана |
1 |
2 |
К лекарственным препаратам, обладающим пневмотропным токсическим действием, относят следующие:
-
-
алкилирующие (бусульфан, циклофосфамид, хлорамбуцил, мелфалан);
-
антиметаболиты [метотрексат, 6-6-меркаптопуринρ , азатиоприн, цитозин-арабинозидρ (цитарабин), гемцитабин, флударабин];
-
препараты растительного происхождения [алкалоиды барвинка розового (винбластин, винкристин), алкалоиды безвременника великолепного (демекольцин, колхицин), алкалоиды тисового дерева (таксаны) (паклитаксел, доцетаксел), подофиллотоксины (этопозид, тенипозид), полусинтетические производные алкалоида камптотецина (иринотекан и топотекан), ингибиторы тирозинкиназы эпидермального фактора роста (EGFR-tyrosine kinase) (эрлотиниб, гефитиниб, иматиниб);
-
препараты других групп [арабинопиранозилметил нитрозо-мочевина (кармустин, ломустин), прокарбазин, аспарагиназа (L-Аспарагиназа♠ )];
-
-
нейроактивные препараты [фенитоин (Дифенин♠ , дифенилгидантоинρ )], карбамазепин, хлорпромазин;
-
сердечно-сосудистые препараты [амиодарон (Кордарон♠ ), бензогексонийρ , гидралазин, β-адреноблокаторы -пропранолол (Анаприлин♠ )];
-
цитокины (гранулоцит-макрофаг-колониестимулирующий фактор, ингибитор TNF-α (этанерцепт), IL-2, IFN-α, IFN-β, IFN-γ);
-
-
к TNF-α [инфликсимаб (Ремикейд♠ ), инфликсимаб, адалимумаб];
-
к рецепторами эпидермального фактора роста (цетуксимаб, трастузумаб, панитумумаб);
-
IgG1-антитела к фактору роста эндотелия сосудов (бевацизумаб);
-
к гликопротеину CD52 на поверхности В-и Т-лимфоцитов (алемтузумаб);
-
к запрограммированным белкам смерти 1 (PD-1) клеток (ниволумаб, пембролизумаб);
-
-
запрещенные препараты (героинρ , кокаин, опиаты, кодеин, пропоксифена гидрохлоридρ , амфетаминρ , метадон гидрохлоридρ , тальк);
-
другие лекарственные вещества (Л-триптофан♠ , сиролимус, эверолимус, темсиролимус);
Так же, как и ЭАА, ЭТА может протекать в острой, подострой и хронической формах. Острая реакция в легочной ткани при приеме нитрофурантоина может наступить в течение первого месяца приема препарата. Приблизительно у 15% пациентов, принимающих амиодарон, развивается послеоперационный ОРДС (Lessnau K.-D. et al., 2019). В случаях поражения легких производными нитрофурана у 10-15% больных острой формой ЭТА описаны плевральные выпоты, токсико-аллергическая сыпь на коже. Хроническая форма может развиваться в интервале от 2 мес до 5 лет непрерывного лечения нитрофурантоином. Хронический ЭТА, как правило, развивается при приеме химиопрепаратов (Илькович М.М., Орлова Г.П., 2006; Lessnau K.-D. et al., 2019). Иногда заболевание может протекать бессимптомно и выявляется только при рентгенологическом исследовании (до 39% случаев) (Stamatoullas A. et al., 2015; Skeoch S. et al., 2018).
Наиболее информативным методом диагностики лекарственных поражений легких является ВРКТ. Выделяют следующие КТ-паттерны: диффузное альвеолярное повреждение, все виды известных интерстициальных пневмоний (НСИП, ОИП, ОП, ДИП), ОБ с ОП, отек легких, эозинофильную пневмонию, ЭАА, диффузное альвеолярное кровоизлияние (рис. 2.36) (Piciucchi S. et al., 2010; Matsuno O., 2012; Lessnau K.-D. et al., 2019).
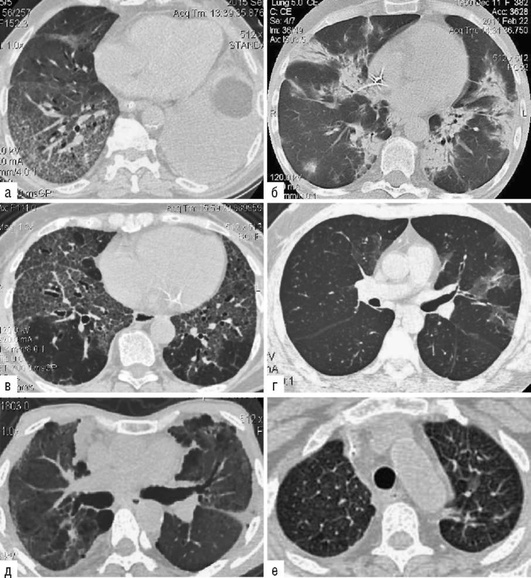
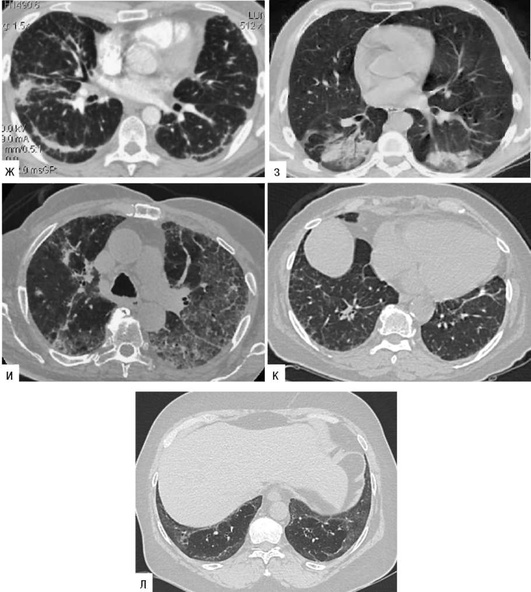
Острая форма амиодарон-индуцированного ЭТА (амиодарон-индуцированной легочной токсичности) клинически может проявляться как респираторный дистресс-синдром с КТ-картиной диффузных изменений в легких по типу диффузного альвеолярного кровоизлияния, диффузного альвеолярного повреждения, ОсИП (рис. 2.37).
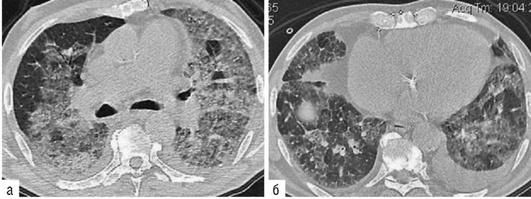
Подострые формы амиодарон-индуцированной легочной токсичности характеризуются КТ-признаками двусторонних инфильтративных изменений в легких альвеолярного (52,4%) или смешанного альвеолярно-интерстициального (42,6%) характера, преимущественным перибронховаскулярным распределением инфильтративных изменений (47,5%) (см. рис. 2.36 б, и). Наряду с инфильтративными изменениями в 21,3% случаев могут наблюдаться изменения по типу ОП, медиастинальная лимфоаденопатия (40,9%) и плевральный выпот (27,8%) (Яковлева Н.С. и др., 2019).
При хронической форме амиодарон-индуцированной легочной токсичности основным и обязательным лучевым симптомом являются фиброзные изменения локального (59,3%) и выраженного диффузного характера (40,6%) (рис. 2.38).
В 26% случаев медикаментозного ЭТА изменения на обычных рентгенограммах органов грудной клетки не определяются, и их можно увидеть только при проведении ВРКТ. По данным D.A. White (1999), проведение скрининговой КТ среди больных, получавших блеомицин, позволило выявить изменения в легких в 38% случаев, в то время как обычное рентгенографическое исследование обнаруживало патологические изменения только в 15% (Lengyel C. et al., 1996; White D.A., 1999).
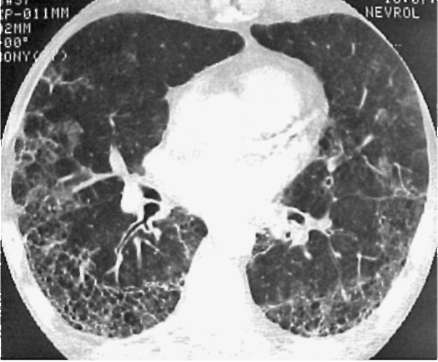
Изменения в клиническом анализе крови и биохимических показателей неспецифичны. В ряде случаев может выявляться гипер-эозинофилия периферической крови, что указывает на присоединение аллергического повреждения легочной ткани (метотрексат, прокарбазин). Характерно раннее формирование ЛГ.
Результаты собственных исследований. В клинике пульмонологии нами обследовано 17 пациентов с диагнозом амиодарон-индуцированного ЭТА (или «амиодароновое легкое») в динамике через год после начала терапии. Все пациенты прекращали прием амиодарона и получали системные глюкокортикоиды (ГК) в дозе 20-30 мг/сут в пересчете на преднизолон с постепенным снижением дозы до 5-10 мг/сут в течение года. Среди обследуемых больных преобладали мужчины (70%), средний возраст на момент начала заболевания 64±6 года, 41% - экс-курильщики. У пациентов имела место значимая сердечно-сосудистая патология: нарушения ритма сердца - 82%, инфаркт миокарда перенесли 29% больных, тромбоэмболию ветвей легочной артерии - 23%. Амиодарон в основном назначался для купирования пароксизмов фибрилляции предсердий, мерцательной аритмии или коррекции постоянной формы мерцательной аритмии. Длительность приема амиодарона (Кордарона♠ ) была различна, медиана составляла 2 года, более половины пациентов принимали амиодарон (Кордарон♠ ) от 1 года до 5 лет. Реже встречался более короткий срок приема амиодарона (Кордарона♠ ) - 3-6 мес (12%) и крайне длительный стаж приема амиодарона (Кордарона♠ ) - более 16 лет (18%). Средняя суточная доза амиодарона (Кордарона♠ ) составляла 276 мг/сут (от 120 до 400 мг/сут).
Заболевание чаще развивалось постепенно (77%), острое начало болезни наблюдалось в 23% случаев. В клинической картине преобладали явления ДН I-III степени (100%). Почти половину пациентов беспокоил сухой кашель (47%); в 18% случаев отмечалась лихорадка на начальном этапе заболевания. Наблюдались также внелегочные проявления токсического действия амиодарона: гиперфункция щитовидной железы (18%), сине-серое окрашивание кожных покровов (6%).
На стадии установления диагноза на рентгенограммах органов грудной клетки определялось усиление интерстициального компонента легочного рисунка (более выраженное субплеврально, в базальных отделах). КТ органов грудной клетки выявляла изменения по типу «матового стекла» (41%), очаговые затенения (41%), инфильтративные и инфильтратоподобные (29%), фиброзные изменения (23%), редко выявлялась лимфаденопатия до 3 см (12%), незначительный односторонний плевральный выпот (12%), тенденция к более выраженным изменениям с одной стороны (слева) (12%).
На фоне лечения положительная динамика в виде уменьшения протяженности и выраженности интерстициальных изменений, уменьшения и исчезновения очаговых и инфильтративных затенений отмечалась в 77% случаев, отрицательная - в 15% случаев, волнообразное течение - в 8% случаев.
По данным комплексного исследования ФВД, у пациентов отмечалось значительное снижение ДСЛзд (53±2,8%) на фоне умеренного снижения ООЛ (79±6,3%), без существенного изменения ЖЕЛ (93±5,3%). На фоне лечения была зарегистрирована достоверная положительная динамика по ДСЛзд (р =0,02) (рис. 2.39). По данным ЭхоКГ наблюдалось расширение правых камер сердца, ЛГ (37±2,7 мм рт.ст.).
Некардиогенный отек легких (НОК) - отек легких, не обусловленный заболеванием сердца. Список лекарственных средств, способных вызвать НОК (чаще всего в случаях их передозировки), расширяется; в настоящее время к препаратам этой группы относят:
-
наркотические средства (героинρ , пропоксифенρ , метадонρ , кокаинρ );
-
противоопухолевые препараты (колхицин, цитарабин, метотрексат, циклофосфамид, гемцитабин, митомицин-С);
-
другие препараты [ацетилсалициловая кислота (Аспирин♠ ), лидокаин, гидрохлортиазид, клопидогрел, тербуталинρ ; ритодринρ , налоксон - опиоидный ненаркотический анальгетик, налмефен - антагонист опиоидных рецепторов].
Развивается НОК у 20% больных, получавших цитотоксическую химиотерапию. Признаки НОК имеют место более чем у одной трети лиц, госпитализированных в связи с превышением дозы наркотических средств (героинρ , пропоксифенρ , метадонρ ). Некардиогенный отек легких также может развиться при передозировке опиоидных наркотических анальгетиков - кодеина, бупренорфина, и налбуфина. Если в 1968-1971 гг. среди пациентов, госпитализированных с передозировкой героинаρ , НОК диагностировался в 48-80% случаев, то в 1992-2000 гг. - только в 0,8-2,4% случаев (Sporer K.A. et al., 2001).
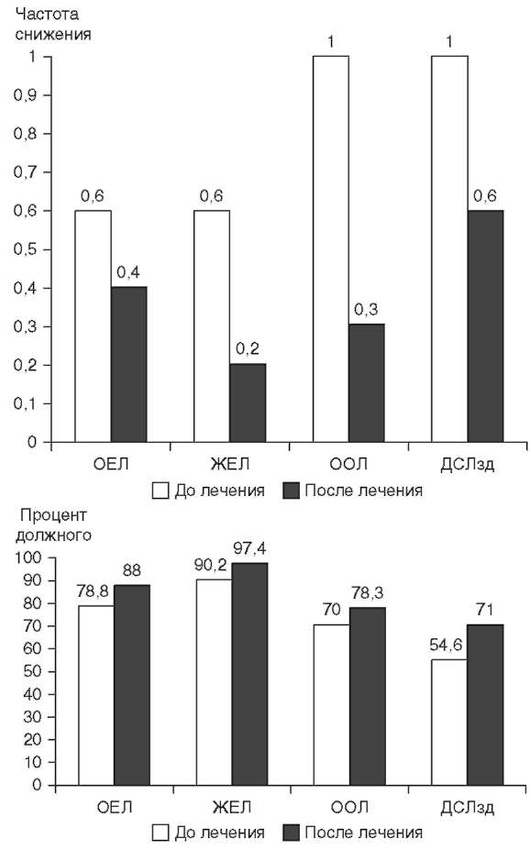
Факторами риска развития заболевания, кроме передозировки препаратов, являются пожилой возраст и непереносимость лекарственного препарата (Snyder L.S. et al., 1988; Erdinler I.C. et al., 2007).
Патогенез НОК изучен недостаточно. Предполагается, что повышение проницаемости легочных капилляров может развиваться за счет селективной ингибиции циклооксигеназного пути метаболизма арахидоновой кислоты, приводящей к избыточному синтезу лейкотриенов [ацетилсалициловая кислота (Аспирин♠ )], воздействия на центральную нервную систему [транквилизаторы, ацетилсалициловая кислота (Аспирин♠ )], дегрануляции тучных клеток с высвобождением медиаторов - лейкотриенов и гистамина (опиаты), повреждения эндотелия капилляров вследствие активации комплемента (героинρ , β-симпатомиметики) (Илькович М.М., 1998).
Изменения в легочной ткани, возникающие при НОК, чаще всего напоминают таковые при токсических поражениях легочной паренхимы: инфильтрация лимфоцитами альвеол и межальвеолярных перегородок, пролиферация альвеолоцитов II типа, интерстициальный фиброз (развивается при длительном воздействии причинного фактора) или ОБ, не отличающийся морфологически от облитерирующих бронхиолитов другого генеза.
Основными клиническими проявлениями НОК являются одышка и непродуктивный кашель. В зависимости от степени выраженности отека легких кашель может сопровождаться выделением пенистой мокроты. Отмечаются цианоз вследствие гиповентиляции, сонливость. Аускультация выявляет крепитацию. Повышение температуры тела не характерно (Илькович М.М., Орлова Г.П., 2006).
Некардиогенный генез отека легких позволяют подтвердить cоответствующие данные анамнеза и исключение сердечно-сосудистых заболеваний после консультации кардиолога.
Так же как и при экзогенных альвеолитах, данные лабораторных исследований неинформативны. В клиническом анализе крови иногда определяется лимфоцитоз. Различная степень гипоксемии и гиперкапнии - наиболее часто регистрируемый признак НОК. Нередко определяется протеинурия.
При рентгенологическом и КТ-исследовании, как правило, выявляются признаки отека легких, ацинарные инфильтраты (рис. 2.40). При прогрессировании заболевания развивается рестриктивный синдром (снижается ЖЕЛ, ДСЛ). Регистрация нарушений бронхиальной проходимости на уровне мелких бронхов может свидетельствовать о формировании ОБ (Juhl J.H. et al., 1998).
Некардиогенный отек легких следует дифференцировать с кардиогенным и нейрогенным отеками легких. При кардиогенном отеке легких у больного выявляется заболевание сердечно-сосудистой системы, подтвержденное данными электрокардиограммы и ЭхоКГ, уровнем мозгового натрийуретического пептида (превышает 700 пг/мл при норме 47 пг/мл), повышением давления в системе малого круга кровообращения. Рентгенография и КТ органов грудной клетки выявляют отек, плевральный выпот, увеличенные размеры сердца. Катетеризация легочной артерии определяет повышение давления заклинивания легочной артерии более 18 мм рт.ст.
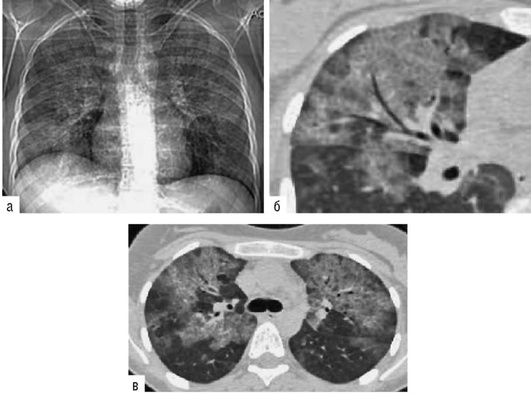
При нейрогенном отеке легких в анамнезе имеется патология центральной нервной системы (черепно-мозговая травма, геморрагический инсульт, эпилепсия). Патогенез нейрогенного отека легких сочетает механизмы кардиогенного и некардиогенного отеков легких (повышение проницаемости легочных капилляров и вазоконстрикция прекапиллярных сосудов легких).
Тактика ведения больного заключается в своевременной адекватной оценке общего состояния пациента и отмене соответствующего препарата, вызвавшего НОК. В большинстве случаев отмена препарата приводит к полному выздоровлению. В зависимости от тяжести состояния больного может возникнуть необходимость в использовании вспомогательной вентиляции легких, во введении антагонистов опиатов (при передозировке опиатов). Патогенетически обосновано назначение мочегонных, кислорода. Положительный эффект применения глюкокортикоидных препаратов при НОК не доказан.
Легочная эозинофилия может проявляться как простая, острая или хроническая эозинофильная пневмония. Развитие заболевания могут индуцировать амиодарон, амфотерицин В, блеомицин, карбамазепин, дифенилгидантоинρ , этамбутол, этопозид, гранулоцит-макрофаг колониестимулирующий фактор, изониазид, метотрексат, миноциклин, митомицин (Митомицин С♠ ), нитрофурантоин, пара-аминосалициловая кислота, прокарбазин, сульфасалазин, сульфаниламиды, тетрациклин, тразодон. Синдром Леффлера проявляется «летучими» инфильтратами в легких (на рентгенограммах или КТ органов грудной клетки) с быстрой обратной динамикой через 6-12 дней (рис. 2.41), гиперэозинофилией до 20-40%. При морфологическом исследовании отмечаются заполнение альвеол эозинофилами, лимфоцитами и плазматическими клетками, содержащими в цитоплазме эозинофильные гранулы, обтурация дистальных бронхиол скоплениями эозинофилов, утолщение стенок бронхов за счет бесклеточного отека, периваскуляр-ная инфильтрация эозинофилами (Flieder D.B. et al., 2004; Prasad R. et al., 2014, Lessnau K.-D. et al., 2019).
Дифференциальная диагностика проводится с ЭАА и пневмонией.
При ЭАА отсутствует эозинофилия и повышение уровня IgЕ в крови. При пневмонии выявляется связь с инфекционным фактором, отмечаются симптомы интоксикации и соответствующие изменения лабораторных показателей. На фоне антибактериальной терапии наблюдается положительная клинико-рентгенологическая динамика.
Липоидная пневмония представляет собой инфильтрацию паренхимы легких с последующим фиброзным уплотнением в результате вдыхания липидосодержащих веществ (животные жиры, минеральные масла) (Юдин А.Л., 2015). В 1925 г. G.F. Laughlen впервые описал данную нозологию, обнаружив в структуре легочной ткани масляные капли при аутопсии троих детей и одного взрослого пациента, в течение жизни принимавших (эндонозально или перорально) препараты, содержащие масла. По данным ретроспективных исследований, распространенность липоидной пневмонии составляет менее одного случая на 10 млн населения (Meltzer E. et al., 2006). Минеральные масла, обладая вязкими, инертными свойствами, при аспирации не раздражают слизистую оболочку верхних дыхательных путей, не провоцируют смыкание надгортанника и кашлевой рефлекс, ослабляют мукоцилиарный механизм транспорта и, как следствие, не эвакуируются из трахеобронхиального дерева, накапливаясь в легочной паренхиме в виде фагоцитированной макрофагами эмульсии.
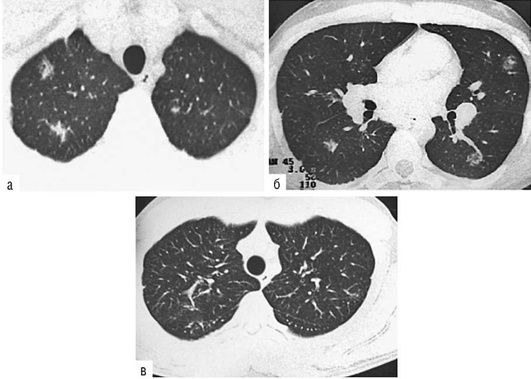
Факторами риска развития липоидной пневмонии являются нарушения глотания (анатомические или функциональные аномалии глотки и пищевода), нервно-мышечные заболевания, влияющие на моторику глотки или кашлевой рефлекс, трахеостома, интраназальное использование масляных капель, курение электронных сигарет, содержащих растительный глицерин (Юдин А.Л. и др., 2015; Modi S. et al., 2015; Sung S. et al., 2018; Viswam D. et al., 2018). Клиническое течение может быть острым (лихорадка, кашель), хроническим, которое часто протекает бессимптомно. Острое течение наблюдается редко, как правило, при массивной аспирации/ингаляции нефтепродуктов.
При морфологическом исследовании в легочной ткани выявляются отек, утолщение межальвеолярных перегородок, гигантоклеточная и лимфоцитарная инфильтрация, пенистые макрофаги с липидными включениями, фиброз (Pernick N., 2019).
Хроническое течение развивается при повторных аспирациях животного жира, минеральных или растительных масел в течение длительного времени (от 1 мес до 10 лет и более) (Юдин А.Л., 2015). При прогрессировании пневмофиброза появляется одышка, сухой кашель. На КТ органов грудной клетки выявляются консолидации, «матовое стекло», «булыжная мостовая», центрилобулярные очаги («дерево в почках») (рис. 2.42) (Hadda V. et al., 2010; Sung S. et al., 2018).
Диагностика основывается на цитологическом исследовании ЖБАЛ, выявляющем пенистые альвеолярные макрофаги с жировыми включениями (рис. 2.43, см. цв. вклейку) и гистологической верификации (рис. 2.44, см. цв. вклейку) (Sung S. et al., 2018).
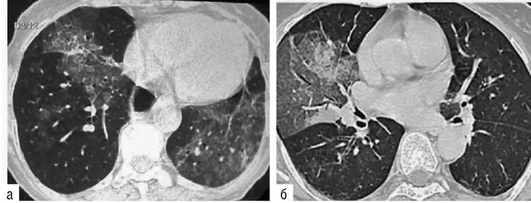
При прекращении контакта, как правило, наблюдается клиническое улучшение, рентгенологические изменения могут сохраняться. При наличии ДН применяются системные ГК, сегментарный или тотальный бронхоальвеолярный лаваж (ТБАЛ) (Hadda V. et al., 2010; Modi S. et al., 2015).
Поражение плевры
Плевральный выпот может развиваться при лечении метотрексатом, нитрофуранами, амиодароном, прокарбазином, кармустином, циклофосфамидом, блеомицином, бусульфаном, митомицином (Митомицином С♠ ), антикоагулянтами, бромокриптином, гранулоцит-макрофаг-колониестимулирующим фактором, ИЛ-2, метисергидом, токолитическими препаратами (например, тербуталиномρ ). Может наблюдаться при лекарственно-индуцированном волчаночном синдроме. Ингибитор протеинкиназ дазатиниб вызывает плевральный выпот в 16-54% случаев (Sundreji R. et al., 2000; Lessnau K.-D. et al., 2019). Утолщение плевры описано при применении эрголиновых препаратов (Flieder D.B. et al., 2004).
Волчаночный синдром могут вызывать более 75 лекарственных препаратов, включая гидралазин, прокаинамид, хинидин, изониазид, дифенилгидантоинρ , нитрофураны, тетрациклин, сульфаниламиды, нестероидные противовоспалительные препараты, золото, тиазиды, бета-адреноблокаторы. Волчаночный синдром характеризуется частыми легочно-плевральными осложнениями при редком вовлечении в процесс почек и нервной системы. Гидроторакс развивается в 50-80% случаев. Иммунологическое исследование выявляет положительные тесты на антинуклеарный фактор и антигистоновые антитела при отрицательном тесте дсДНК и нормальном уровне комплемента, редко повышается уровень ЦИК (Flieder D.B. et al., 2004; Radić M. et al., 2012; Prasad R. et al., 2014). На поздних стадиях медикаментозных поражений легких, индуцированных блеомицином, кармустином и ретиноевой кислотой, может развиваться пневмоторакс (Lessnau K.-D. et al., 2019).
Поражение/дисфункция дыхательных путей
ОБ и ОБ с ОП вызываются более чем 35 лекарственными препаратами, включая противомикробные препараты (миноциклин, нитрофурантоин, цефалоспорин и амфотерицин B), абакавир, противоопухолевые препараты (бусульфан, метотрексат, блеомицин, доксорубицин, талидомидρ , цитозин-арабинозид, цитарабин окфосфат, хлорамбуцил, РТМ, оксалиплатин), сердечно-сосудистые препараты (амиодарон, ацебутолол), противовоспалительные средства (золото, сульфасалазин, месалазин, D-пеницилламинρ , буцилламинρ и инфликсимаб), имму-нодепрессанты (азатиоприн, 6-меркаптопуринρ , такролимус, сиролимус и эверолимус), противосудорожные средства (карбамазепин, фенитоин) и другие препараты (IFN, тиклопидин, L-триптофанρ , вдыхаемый кокаин, внутривенный героинρ , флувастатин, ризедронатρ ). Амиодарон-индуцированные ОБ с ОП встречаются в 1-15% случаях. У 1,8-2,2% больных, подвергшихся лучевой терапии, также может развиться ОБ с ОП (Epler G., 2011; Lessnau K.-D. et al., 2019).
Отмечаются одышка, кашель. Аускультация может не выявлять изменений, в ряде случаев могут выслушиваться «попискивание» или крепитация. Рентгенологически отмечается повышение прозрачности легочной ткани. Функциональная КТ выявляет воздушные ловушки и мозаичность изменений. Морфологически обнаруживается облитерация мелких проводящих путей с концентрическим сужением их просвета за счет массивной лимфоидной инфильтрации. Типичные для немедикаментозного ОБ окклюзионные пробки из грануляционной ткани обычно не выявляются (Camus Ph. et al., 2001; Edgerton C.C. et al., 2004; Lessnau K.-D. et al., 2019).
Бронхоспазм. Бронхоспастический синдром могут вызывать многие лекарственные препараты: ацетилсалициловая кислота (Аспирин♠ ), нестероидные противовоспалительные препараты, бета-адреноблокаторы, кокаин, дипиридамол, IL-2, метилфенидатρ , нитрофурантоин, протамина сульфат (Протамин♠ ), сульфасалазин. Эта реакция часто развивается у лиц, страдающих бронхиальной астмой или ХОБЛ. Осложнение развивается через минуты или часы после приема препаратов, может быть тяжелым и трудно поддаваться лечению. В связи с этим назначение бета-блокаторов больным астмой и другими обструктивными заболеваниями нецелесообразно (White D.A., 1999; Toews G.B., 2000; Camus Ph. et al., 2001; Lee J., 2018; Lessnau K.-D. et al., 2019).
Кашель. Хронический кашель в 5-25% случаев могут вызывать ингибиторы АПФ (каптоприл, хинаприл, лизиноприл, рамиприл, трандолаприл, фозиноприл, эналаприл и др.). Препараты этой группы используются для лечения артериальной гипертонии при неэффективности или непереносимости бета-адреноблокаторов и тиазидных диуретиков. Ингибиторы АПФ применяют как в ранние сроки инфаркта миокарда, так и в постинфарктном периоде. Они являются препаратами выбора при сочетании артериальной гипертонии с инсулинозависимым сахарным диабетом с нефропатией. Сухой кашель возникает через 1 мес лечения и чаще развивается у женщин. Возможны также першение в горле, ринит, синуситы. Возникший упорный сухой кашель на фоне приема ингибиторов АПФ является достаточным основанием для их отмены и перехода на прием блокаторов ангиотензина II (лозартан, валсартан, эпросартан, телмисартан и др.). Препараты этой группы не ингибируют расщепление брадикинина и других кининов, благодаря чему лишены свойства вызывать упорный сухой кашель (White D.A., 1999; Balk R.A. et al., 2002; Lessnau K.-D. et al., 2019).
Легочная кальцификация - кальцификация хрящевых колец - относительно редкое лекарственное поражение легких. Может развиваться при длительном приеме витамина D, антацидов, препаратов кальция, фосфора (Balk R.A. et al., 2002).
Поражение легочных сосудов
ВОБЛ характеризуется окклюзией или сужением легочных вен и венул рыхлой или более плотной и богатой коллагеном волокнистой тканью, что ведет к клиническим проявлениям, которые во многом сходны с легочной артериальной гипертензией и проявляются постепенным нарастанием одышки.
Веноокклюзионная болезнь легких вызывается оральными контрацептивами, блеомицином, митомицином (Митомицином С♠ ), кармустином и другими цитотоксическими препаратами. На рентгенограммах органов грудной клетки могут выявляться линии Керли при отсутствии кардиомегалии, а также рассеянные, пятнистые затенения, плевральный выпот, чаще правосторонний. Однако отсутствие этих рентгенографических изменений не исключает ВОБЛ. ВРКТ выявляет центрилобулярное «матовое стекло», септальные линии, небольшие узелки, участки консолидации, лимфаденопатию и плевральные выпоты. Сочетание плохо очерченных узлов, утолщение перегородки и лимфаденопатия позволяют заподозрить ВОБЛ (рис. 2.45) (Gunther S. et al., 2012; Ali H.A. et al., 2018).
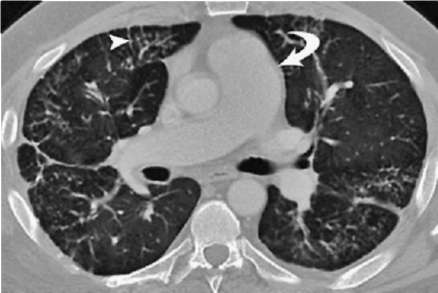
Вентиляционно-перфузионное сканирование выявляет асимметричные, диффузные или очаговые нарушения перфузии без четкой сегментарной или субсегментарной локализации. Тип дефекта может варьировать в зависимости от размера и расположения вовлеченных вен. Катетеризация правых отделов сердца показана для установления диагноза. При этом следует учитывать, что в ответ на легочный вазодилататор у больных ВОБЛ может развиться отек легкого, поэтому при подозрении на ВОБЛ не проводится тестирование вазодилататоров. Уточнить диагноз помогает биопсия легкого, однако при высокой ЛГ риск биопсии легкого перевешивает ценность и полезность полученной информации (Ali H.A. et al., 2018).
ВОБЛ следует дифференцировать с:
-
легочной артериальной гипертензией (идиопатической, семейной, ассоциированной с ДБСТ, лекарственными или токсическими воздействиями, врожденными пороками сердца, обусловливающими шунтирование крови из большого круга кровообращения в малый, вирусом иммунодефицита человека, портальной гипертензией и др.). Следует отметить, что посткапиллярное поражение приводит к увеличению висцерального плеврального и легочного капиллярного давлений с транссудацией жидкости в плевральное пространство, а далее к плевральным выпотам. Это может служить дифференциально-диагностическим признаком ВОБЛ, так как при первичной ЛГ плевральные выпоты встречаются крайне редко (Ali H.A. et al., 2018);
-
хроническими тромботическими и/или эмболическими заболеваниями;
-
другими причинами (гематологическими, системными, метаболическими и другими заболеваниями).
Прогноз неблагоприятный.
Специфическая терапия легочной артериальной гипертензии может вызвать отек легких. Рассматривается вопрос о непрерывном внутривенном введении эпопростенола с относительно медленным повышением дозы. В настоящее время ТЛ является единственным методом лечения, способным значительно продлить и улучшить жизнь пациентов с ВОБЛ (Ali H.A. et al., 2018; Boucly A. et al., 2018).
Васкулиты
АНЦА-положительный ангиит может протекать с развитием легочного капиллярита (или без него) и легочных кровотечений. Развивается при лечении антитиреоидным препаратом - пропилтиоурацилом, а также рядом других лекарственных средств (миноциклин, левамизол, сульфасалазин, аллопуринол). Некоторые лекарственные средства, такие как пропилтиоурацил и гидралазин, вызывают АНЦА-положительный васкулит (White D.A., 1999; Taborda L. et al., 2013).
Эозинофильный ГПА (синдром Черджа-Стросса) развивается при приеме ацетилсалициловой кислоты (Аспирина♠ ), макролидов, сульфаниламидов и других препаратов. Заболевание описано у больных бронхиальной астмой, принимающих антагонисты лейкотриенов (Camus P. et al., 2001; Prasad R. et al., 2014). Однако сравнительные исследования не выявили достоверной связи между развитием синдрома Черджа-Стросса и приемом антагонистов лейкотриенов после контроля использования других противоастматических препаратов (Harrold L.R., 2007). В перекрестном исследовании было высказано предположение, что развитие синдрома Черджа-Стросса может быть связано не с монтелукастом, а с другими препаратами, назначаемыми для длительного контроля тяжелой астмы (Hauser T. et al., 2008). На основании этих данных комиссия из Национального управления по санитарному надзору за качеством пищевых продуктов и медикаментов США пришла к выводу, что ни один класс антагонистов лейкотриенов не был связан с развитием синдрома Черджа-Стросса и что эти препараты являются безопасными (Radić M. et al., 2012).
Эозинофильный ГПА характеризуется триадой синдромов: астматическим синдромом, гиперэозинофилией крови, некротическим васкулитом. Характерен высокий уровень иммуноглобулина Е. При МСКТорганов грудной клетки патологические изменения выявляются более чем у 2/3 пациентов. Чаще всего обнаруживаются преходящие и уменьшающиеся со временем паренхиматозные затемнения (по типу «матового стекла» и консолидации) и реже узелки. Выпоты могут отмечаться в 10% случаев (Анаев Э.Х., 2017).
ЛГ может развиваться при приеме средств, подавляющих аппетит (амфетаминρ , аминорексρ , фенфлурамин). Прием бета-блокаторов, митомицина (Митомицина С♠ ), ингибиторов протеинкиназы также может осложняться легочной гипертензией (Lessnau K.-D. et al., 2019; Cornet L. et al. 2019). Длительная терапия IFN-β через три года приводит к развитию ЛГ у 66% больных (Savale L. et al., 2014).
Легочная тромбоэмболия вызывается оральными контрацептивами, прокаинамидом, фенитоином, ретиноевой кислотой (изотретиноином). Отмечается повышение адгезивной способности тромбоцитов и снижение тонуса вен, что повышает риск тромбоэмболии в 4-7 раз (Lessnau K.-D. et al., 2019).
Легочные кровоизлияния являются осложнением антикоагулянтной терапии, в том числе и абциксимабом, или лекарственно-обусловленной тромбоцитопении. В очень редких случаях могут быть проявлением легочно-почечного синдрома (псевдосиндрома Гудпасчера). Развиваются при приеме пропилтиоурацила, фенитоина, нитрофуранов, цитозин-арабинозидρ (цитарабин), метотрексата, амиодарона, хинидина и оксифенбутазона, высоких доз циклофосфамида, митомицина (Митомицина С♠ ). Пеницилламин, кокаин, гидралазин, нитрофурантоин, карбамазепин и моксалактамтакже признаны провоцирующими агентами. Описывают развитие легочного кровоизлияния от анти-CD52 антитела (алемтузумаб), анти-CD20 антитела (РТМ), сиро-лимуса. Диагноз устанавливается при БАЛ, выявляющем нарастающее окрашивание кровью ЖБАЛ в последующих порциях (Rivera M.H., 1995; Juhl J.H., 1998; Cottin V. et al., 2009, Lessnau K.-D. et al., 2019).
Легочно-почечный синдром (псевдосиндром Гудпасчера) встречается редко и напоминает синдром Гудпасчера. У больных развиваются одышка, гипопластическая анемия, гематурия. Патоморфологически выявляются легочные кровоизлияния, но линейных отложений Ig не обнаруживается. Заболевание развивается при приеме D-пеницилламинаρ (White D.A., 1999).
Поражение средостения
Средостенная лимфаденопатия может развиваться у больных, получающих фенитоин, блеомицин, карбамазепин, амиодарон и др. (рис. 2.46). Кроме того, при лечении IFN-α и IFN-β может развиваться псевдосаркоидный синдром (Cottin V. et al., 2009; Lessnau K.-D. et al., 2019).
Медиастинальный липоматоз представляет собой накопление избытка неинкапсулированного жира в средостении. Развивается при глюкокортикоидной терапии (синдром Иценко-Кушинга). Выявляется при рентгенологическом исследовании: расширение переднего и заднего средостения без деформации трахеи. Жировые отложения в костодиафрагмальном углу также часто увеличены (Lessnau K.-D. et al., 2019).
Поражение дыхательных мышц. Неврологические нарушения. Некоторые лекарственные препараты (прокаинамид, D-пеницил-ламинρ ) ингибируют нервную проводимость, что приводит к периферической нейропатии и блоку нейромышечной функции. Развивается слабость респираторных мышц (White D.A., 1999).
Осложнения
Лекарственные поражения легких могут осложняться пневмофиброзом, ДН, ТЭЛА, ЛГ, пневмотораксом.
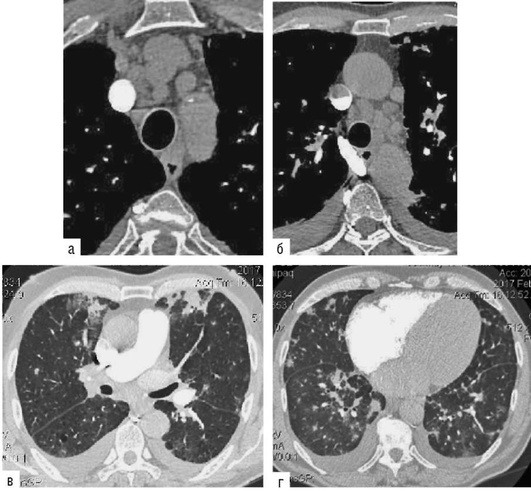
Диагностика
Наличие лекарственного поражения легких, как правило, устанавливается после исключения других возможных причин заболевания. Чаще медикаментозные поражения легких возникают при продолжительном приеме лекарственных препаратов. При отмене этиологически значимого препарата может наступить спонтанное выздоровление, в то время как продолжение терапии может привести к необратимым изменениям в легких. При повторном приеме лекарственных средств наблюдается возобновление симптомов заболевания. Лекарственные поражения легких представлены многообразными нозологическими формами и не имеют общих патогномоничных клинических, лабораторных, функциональных и рентгенологических признаков. При их диагностике следует учитывать также возможное отсроченное начало заболевания при воздействии некоторых лекарственных препаратов через недели (амиодарон) и даже годы после прекращения приема препарата.
Исследование ФВД и легочно-сердечной гемодинамики, лучевые, бронхологические, эндоскопические и хирургические методы исследования подробно описаны в соответствующих разделах. Выявление в ЖБАЛ пенистых клеток, содержащих пластинчатые включения, может свидетельствовать о воздействии амиодарона. Повышение уровней маркеров фиброза КД-6 и альвеоломуцина в крови может указывать на развитие лекарственно-индуцированного ЭТА (Орлова Г.П., 2016; Lessnau K.-D. et al., 2019).
В сложных диагностических случаях показана гистологическая верификация диагноза. Обнаружение в интерстициальной ткани легкого пенистых альвеолярных макрофагов или внутриальвеолярных макрофагов, содержащих внутрицитоплазматические вакуоли, многоядерных клеток позволяет предположить медикаментозное поражение легких: амиодароновое легкое, липоидную пневмонию и др. В ряде случаев при медикаментозно-обусловленных заболеваниях легких могут выявляться смешанные гистологические паттерны интерстициальных пневмоний и признаки различных фаз одного процесса (острые, хронические), что подтверждает объединительную концепцию интерстициальных пневмоний (Илькович М.М., Новикова Л.Н., 2018).
Для оценки тяжести лекарственного поражения легких используется международно согласованная классификация тяжести лекарственно-индуцированных ИЗЛ, разработанная Национальным институтом рака (Cancer Therapy Evaluation Program, 2017) и выделяющая пять степеней тяжести.
Лечение
При подозрении на лекарственно-обусловленные поражения легких необходимо немедленно отменить препарат. Назначаются СК в начальной дозе 0,5-1,0 мг на 1 кг массы тела в сутки в пересчете на преднизолон с последующим снижением дозы в зависимости от быстроты обратной динамики заболевания. Предпочтительные препараты - триамцинолон, метилпреднизолон, таблетированный триамцинолон. Рецидив «амиодаронового легкого» может возникать на фоне снижения дозы глюкокортикоидов даже через несколько недель или месяцев после отмены препарата. В тяжелых случаях и в зависимости от этиологического фактора применяется пульс-терапия ГК. Так, при гефитиниб-индуцированном альвеолите пульс-терапия высокими дозами системных ГК высокоэффективна, в отличие от средних доз препаратов. Показано применение экстракорпоральных методов лечения: плазмаферез, гемосорбция, плазмацитоферез с инкубацией лимфоцитов с глюкокортикоидами (Kuo L.C. et al., 2011).
В случаях ЭТА, обусловленного таргетной иммунотерапией онкологических больных, Национальная комплексная сеть по борьбе с раком рекомендует терапию ГК. При 2-й степени тяжести альвеолита рекомендуется доза 1 мг/кг в сутки в пересчете на преднизолон. При 3-4-й степени тяжести альвеолита доза преднизолона должна составлять 2-4 мг/кг в сутки (Suresh K. et al., 2018). Рекомендуется контролировать реакцию пациента на терапию через 48-72 ч. (National Comprehensive Cancer Network, 2018).
Прогноз
Прогноз поражений легких, вызванных лекарственными средствами, зависит от конкретного лекарственного препарата, нозологической формы заболевания легких и от основного заболевания, по поводу которого назначается терапия. Так, при приеме препаратов по поводу онкологических заболеваний смертность колеблется от 14 до 51,3%, в то время как в других случаях, не связанных с онкологией, смертность колеблется от 0 до 41% (Skeoch S. et al., 2018).
Острые формы лекарственных поражений легких могут разрешаться через 24-48 ч после отмены этиологически значимого препарата. При хронических формах прогноз серьезный и зависит от сроков установления диагноза.
При остром течении летальность при приеме метотрексата достигает 15%. «Амиодароновое легкое» заканчивается летально у 3-50% (Mankikian J. et al., 2014; Skeoch S. et al., 2018), несмотря на глюкокортикоидную терапию. При подостром/хроническом течении амиодароновый ЭТА в 5-20% случаев прогрессирует даже после отмены препарата и в 10-33% случаев заканчивается летально. Так, 90-дневная летальность у госпитализированных пациентов от амиодарон-индуцированного ЭТА составляет 37%. Клинико-рентгенологическое выздоровление с исходом в пневмофиброз у выживших наблюдалось в среднем через 36 мес в 66% случаев (Papiris S.A. et al., 2010; Skeoch S. et al., 2018).
Летальность при остром респираторном дистресс-синдроме от амиодарона достигает 10% (Teerakanok J. et al., 2016).
ЭТА, вызванный арабинопиранозилметил нитрозомочевиной, в 90% случаев приводит к летальному исходу, несмотря на глюкокортикоидную терапию. Поражение легких, развивающееся при приеме циклофосфамида, заканчивается летально в 50% случаев. Бусульфан в 4-5% случаев вызывает развитие ЭТА, который заканчивается летально в 50-80% случаев. У 7% пациентов принимающих метотрексат, развивается хронический ЭТА со смертельным исходом в 8% случаев (Lessnau K.-D. et al., 2019). Летальность от блеомицина, по данным разных авторов, составляет 8,1-48%, а диффузное альвеолярное кровоизлияние при приеме цитотоксических препаратов приводит к смертельному исходу в 50-100% случаев (Johnson P. et al., 2016, Skeoch S. et al., 2018). Эрлотиниб-индуцированный ЭТА заканчивается летально в 31-45% случаев (Skeoch S. et al., 2018). Смертность от НОК, вызванного цитозин-арабинозидомρ , колеблется от 2 до 50% (Lessnau K.-D. et al., 2019). При КТ-паттерне диффузного альвеолярного повреждения от пеметрекседа, панитумумаба и эрлотиниба смертность составляет 40-83,3% (Skeoch S., 2018).
Профилактика
Необходимо избегать полипрагмазии, одновременного назначения нескольких препаратов, обладающих пневмотропным токсическим действием. Так, среднее количество лекарственных препаратов у госпитализированных больных иногда достигает 10. При приеме менее шести препаратов вероятность развития побочных эффектов равна 5%, в то время как она возрастает до 40% при увеличении числа принимаемых пациентом препаратов до 16 (Balk R.A. et al., 2002).
При подозрении на снижение активности цитохрома P450 рекомендуется уменьшение дозы или назначение альтернативного лекарственного средства, метаболизируемого другим ферментом CYP. Для предотвращения токсических побочных эффектов целесообразно изучение профиля CYP пациента перед назначением лекарств.
СПИСОК ЛИТЕРАТУРЫ
-
Анаев Э.Х. Легочные васкулиты: дифференциальная диагностика // Практическая пульмонология. 2017. № 1. С. 51-57.
-
Аркин Е.А. К учению о лекарственных сыпях. Случай разлитого дерматита, вызванного втиранием ртути. (Лекарственная скарлатина Behrend’a) // Врач. 1901. Т. 28. С. 884-887.
-
Илькович М.М. Заболевания органов дыхания. СПб.: Нормед-изд., 1998. C. 185-198.
-
4. Илькович М.М., Орлова Г.П. Лекарственное поражение легких // Чучалин А.Г., Синопальников А.И., Страчунский Л.С. Пневмония. М.: Мед. ин-форм. агентство, 2006. Гл. 17. С. 445-462.
-
Илькович М.М., Новикова Л.Н. Идиопатические интерстициальные пневмонии: объединительная концепция // Доктор.Ру. Кардиология. Терапия. 2018. Т. 148, № 4. С. 14-17.
-
Орлова Г.П., Суркова Е.А., Лапин С.В.. Маркеры активности экзогенных интерстициальных заболеваний легких // Пульмонология. 2016. № 2. С. 180-185.
-
Юдин А.Л., Шаталов К.М., Сологубова Г.Ф. Липоидная пневмония // Медицинская визуализация. 2015. № 6. С. 42-49. https://medvis.vidar.ru/jour/ article/download/162/163
-
Яковлева Н.С., Сперанская А.А., Золотницкая В.П., Орлова Г.П. Диагностика и динамический контроль сосудистых нарушений у пациентов с амиодарон-индуцированной легочной токсичностью (АИЛТ) // Регионарное кровообращение и микроциркуляция. 2019. Т. 18, № 1. С. 66-76. https://doi.org/10.24884/1682-6655-2019-18-1-66-76
-
Alazemi S., Campos M.A. Interferon-Induced Sarcoidosis // Int. J. Clin. Pract. 2006. Vol. 60, N 2. P. 201-211.
-
Ali H.A., Alam S. Pulmonary Veno-Occlusive Disease // Chief Editor: Zab Moseni-far. Updated: Oct 16, 2018 https://emedicine.medscape.com/article/1464015-overview
-
Balk R.A., Ramasubban S. Drug-Induced Pulmonary Disease // Hospital Physician Board Review Manual / Pulmonary Disease. 2002. Vol. 9, Part 3. P. 1-11.
-
Bourke S.J., Dalphin J.C., Boyd G., McSharry C., Baldwin C.I. et al. Hypersen-sitivity pneumonitis: current concepts // Eur. Respir. J. 2001. Vol. 18, Suppl. 32. P. 81-92.
-
Boucly A., Girerd B., Bourlier D. et al. Pulmonary veno-occlusive disease // Rev. Mal. Respir. 2018. Vol. 35, N. 2. P. 160-170.
-
Boyle Y.J., Chatte G., Rivoire M., Fléchon A. Lung toxicity in a patient treated with sunitinib // ERJ. November 1, 2012. Vol. 40, N. 5. P. 1300-1303.
-
Bowyer S., Prithviraj P., Lorigan P. et al. Efficacy and toxicity of treatment with the anti-CTLA-4 antibody ipilimumab in patients with metastatic melanoma after prior anti-PD-1 therapy // British Journal of Cancer. 2016. Vol. 114. P. 1084-1089.
-
Camus P., Fanton A., Bonniaud P., Camus C., Foucher P. Interstitial Lung Disease Induced by Drugs and Radiation // Respiration. 2004. Vol. 71. P. 301-326.
-
Camus Ph., Foucher P., Bonniaud Ph., Ask K. Drug-induced infiltrative lung disease // Eur. Respir. J. 2001. Vol. 18, Suppl. 32. P. 93-100.
-
Cancer Therapy Evaluation Program DoCTaDNCINIoH. Common Terminology Criteria for Adverse Events [Internet]. Version 5.0. 27-11-2017. Available online: http://ctep.cancer.gov (accessed on 13 October 2018).
-
Cleverley J.R., Screaton N.J., Hiorns M.P. et al. Drug-induced lung disease: high-resolution CT and histological findings. // Clin. Radiol. 2002. Vol. 57. P. 292-299.
-
Cornet L., Khouri C., Roustit M. et al. Pulmonary arterial hypertension associated with protein kinase inhibitors: a pharmacovigilance-pharmacodynamic study // Eur. Respir. J. 2019. Vol. 53. 1802472 https://doi.org/10.1183/13993003.02472-2018
-
Cottin V., Bonniaud P. Drug-induced infiltrative lung disease // Eur. Respir. Mon., Ch. 16. 2009. Vol. 46. P. 287-318.
-
Demedts M., Thomeer M. Rare diffuse lung diseases and mimics of diffuse lung diseases // Interstitial Lung Diseases: Eur. ResP. Monograph. 2000. Chap. 16. P. 267-288.
-
Duchemann B., Annesi-Maesano I., de Jacobe N.C. et al. Prevalence and incidence of interstitial lung diseases in a multi-ethnic county of Greater Paris // Eur. Respir. J. 2017. Vol. 50. 1602419 https://doi.org/10.1183/13993003.02419-2016
-
Edgerton C.C., Gilman M., Roth B.J. Topotecan-Induced Bronchiolitis // South Med. J. 2004. Vol. 97, N. 7. P. 699-701.
-
Epler G. Bronchiolitis obliterans organizing pneumonia (BOOP), 25 years: a variety of causes, but what are the treatment options? // Expert Rev. Respir. Med. 2011. N. 5. P. 353-361.
-
Erdinler I.C., Ucer E., Eksik A. et al. Noncardiogenic pulmonary edema associated with clopidogrel: a serious but unexpected side effect of clopidogrel // Can. J. Cardiol. May 1, 2007. Vol. 23, N. 6. P. 478-80.
-
Flieder D.B., Travis W.D. Pathologic characteristics of drug-induced lung disease // Clin. Chest. Med. 2004. Vol. 25. P. 37-45.
-
Fraser. Drugs // Fraser and Pare’s Diagnosis of the Chest / Fraser, 4th ed. by. 1999. Chap. 63. P. 2537-2575. 1999 W.B. Saunders Company. MD Consult L.L.C. http://www.mdconsult.com
-
Gunther S., Jais X., Maitre S. et al. Computed tomography findings of pulmonary veno-occlusive disease in scleroderma patients presenting with precapillary pulmonary hypertension // Arthritis Rheum. 2012. Vol. 64, N. 9. P. 2995-3005.
-
Hadda V., Khilnani G.C. Lipoid pneumonia: an overview // Expert Rev. Resp. Med. 2010. Vol. 4, N. 6. P. 799-807.
-
Harrold L.R., Patterson M.K., Andrade S.E. et al. Asthma drug use and the development of Churg-Strauss syndrome (CSS) // Pharmacoepidemiol Drug Saf. 2007. Vol. 16. P. 620-628.
-
Hatel F.V., Ryu J.H., Reed C.E. Hypersensitivity pneumonitis: Current concepts and future questions // J. Allergy Clin. Immunol. 2001. Vol. 108, N. 5. 2001 Mosby, Inc. MD Consult L.L.C. http://www.mdconsult.com.
-
Hauser T., Mahr A., Metzler C. et al. The leucotriene receptor antagonist montelukast and the risk of Churg-Strauss syndrome: A case-crossover study // Thorax. 2008. Vol. 63. P. 677-682.
-
Johnson P., Federico M., Kirkwood A. et al. Adapted Treatment Guided by Interim PET-CT Scan in Advanced Hodgkin’s Lymphoma // N. Engl. J. Med. 2016. Vol. 374. P. 2419-2429.
-
Juhl J.H., KuhlmanJ.E. Diseases ofOccupational, Chemical, and Physical Origin// Juhl: Paul and Juhl’s Essentials of Radiologic Imaging. 7th ed. 1998. Chap. 27. P. 955-986. 1998 Lippincott Williams & Wilkins. MD Consult L.L.C. http:// www.mdconsult.com
-
Khan A.N., Irion K.L., Nagarajaiah C.P. Lung, Drug-Induced Disease // Article Last Updated: Jun 4. 2008. eMedicine Specialties > Radiology > CHEST.
-
Khan A.N., Irion K.L., Kasthuri R.S. Pulmonary Edema, Noncardiogenic // Article Last Updated: May 7, 2008. eMedicine Specialties > Radiology > CHEST.
-
Kuo L.C., Lin P.C., Wang K.F. et al. Successful treatment of gefitinib-induced acute interstitial pneumonitis with high-dose corticosteroid: a case report and literature review // Med. Oncol. 2011. Vol. 28, N. 1. P. 79-82.
-
Laughlen G.F. Studies on pneumonia following nasopharyngeal injections of oil // Am. J. Pathol. 1925. Vol. 1. P. 407-414.
-
Lee J. Drug-Induced Pulmonary Disease // Last full review/revision May 2018 https://www.msdmanuals.com/professional/pulmonary-disorders/interstitial-lung-diseases/drug-induced-pulmonary-disease.
-
Lengyel C., Boros I.,.Varkonyi T et al. Amiodaron altal eloidezett tudofibrosis // Orvosi Hetilap. 1996. Vol. 137, N. 32. P. 1759-1762.
-
Lessnau K.-D., Lazo K.G.G. Drug-Induced Pulmonary Toxicity // Chief Editor: Zab Mosenifar. Updated: Apr 09, 2019. https://emedicine.medscape.com/ article/1343451-overview#showall.
-
Liu V., White D.A., Zakowski M.F. et al. Pulmonary toxicity associated with erlotinib // Chest. 2007 Sep. Vol. 132, N. 3. P. 1042-1044.
-
Machado R.F., Dweik R.A., Demeter S.L. Drug-Induced Pulmonary Disease // Baum’s textsdook of pulmonary diseases 7th ed. / editors: Crapo J.D., Glassroth J., Karlinsky J.B., King T.E. 2004. P. 657-677.
-
Mankikian J., Favelle O., Guillon A. et al. Initial characteristics and outcome of hospitalized patients with amiodarone pulmonary toxicity // Respir. Med. 2014. Vol. 108. P. 638-646.
-
Matsuno O. Drug-induced interstitial lung disease: mechanisms and best diagnostic approaches // Respiratory Research. 2012. Vol. 13, N. 1. P. 39-48. http://respiratory-research.com/content/13/1/39.
-
Megarbane B., Chevillard L. The large spectrum of pulmonary complications following illicit drug use: Features and mechanisms // Chemico-Biological Interactions. 2013. Vol. 206. P. 444-451.
-
Meltzer E., Guranda L., Perelman M. Lipoid pneumonia: a preventable form of drug-induced lung injury // Eur. J. Intern. Med. Dec. 2005. Vol. 16(8). P. 615-617.
-
Meltzer E., Guranda L., Vassilenko L. et al. Lipoid pneumonia: a preventable complication // Isr. Med. Assoc. J. 2006. Vol. 8, N. 1. P. 33-35.
-
Mercola J. Obesity Drugs Linked To Rise in Lung Disease // Chest. 2000. Vol. 117, N. 3. P. 796-800.
-
Modi S, Sangani R., Alhajhusain A. Acute Lipoid Pneumonia Secondary to E-Cigarettes Use: An Unlikely Replacement for Cigarettes // Chest. 2015. Vol. 148, Issue 4, Supplement. P. 382A. DOI: https://doi.org/10.1378/chest.2274860.
-
National Comprehensive Cancer Network (NCCN), American Society of Clinical Oncology (ASCO). Management of immunotherapy-related toxicities (immune checkpoint inhibitor-related toxicities). [Guideline]. Version I.2018. Available at http://oncolife.com.ua/doc/nccn/immunotherapy.pdf. February 14, 2018; Accessed: January 21, 2019.
-
O’Driscoll B.R., Hasleton P.S., Taylor P.M. et al. Active lung fibrosis up to 17 years after chemotherapy with carmustine (BCNU) in childhood // N. Engl. J. Med. Aug 9, 1990. Vol. 323, N. 6. P. 378-382.
-
Osawa M., Kudoh S., Sakai F. et al. Clinical features and risk factors of pani-tumumab-induced interstitial lung disease: a postmarketing all-case surveillance study // Int. J. Clin. Oncol. 2015. Vol. 20. P. 1063-1071. DOI 10.1007/s10147-015-0834-3.
-
Osler S.G.W. Narcotic-induced pulmonary edema // J. Emerg. Med. 1983. N. 1. P. 165-167.
-
Ozkan M., Dweik R.A. Ahmad M. Drug-induced lung disease // Cleve Clin. J. Med. 2001. Vol. 68. P. 782-785.
-
Papiris S.A., Triantafillidou C., Kolilekas L. et al. Amiodarone Review of Pulmonary Effects and Toxicity // Drug. Saf. 2010. Vol. 33. N. 7. P. 539-558.
-
Pernick N. Lipoid pneumonia. // PathologyOutlines.com website. http://www. pathologyoutlines.com/topic/lungnontumorlipoidpneumonia.html. Accessed August 19th, 2019.
-
Piciucchi S., Romagnoli M., Chilosi M. et al. Prospective evaluation of drug-induced lung toxicity with highresolution CT and transbronchial biopsy Valutazione prospettica della tossicitа polmonare farmaco indotta con TC ad alta risoluzi-one e biopsia transbronchiale // Radiol med., DOI 10.1007/s11547-010-0608-y. Springer-Verlag. 2010. 18 p.
-
Pigakis K., Ferdoutsis M., Meletis G. et al. Pulmonary toxicity from cardiovascular drugs // Pneumon. 2009. Vol. 22. N. 1. P. 75-84.
-
Prasad R., Gupta P., Singh A. Drug induced pulmonary parenchymal disease // Drug Discoveries & Therapeutics. 2014. Vol. 8, N. 6. P. 232-237.
-
Poll I.W., May P., Koch J.A. HRCT findings of amiodarone pulmonary toxicity: clinical and radiologic regression // J. Cardiovase Pharmacol. Ther. 2001. Vol. 6, N. 3. P. 307-311.
-
Radić M., Kaliterna D.M., Radić J. Drug-induced vasculitis: a clinical and pathological review // The Netherlands J. Med. 2012. Vol. 70, N. 1. P. 12-17.
-
Rivera M.H., Kris M.G., Gralla R.J. Syndrome of acute dyspnea related to combined mitomycin plus vinca alkaloid chemotherapy // Am. J. Clin. Oncol. 1995. Vol. 323. P. 378-382.
-
Rosenow E.C. 3rd. The spectrum of drug-induced pulmonary disease // Ann. Intern. Med. 1972. Vol. 77. P. 977-991.
-
Savale L., Sattler C., Gunther S. Pulmonary arterial hypertension in patients treated with interferon // Eur. Respir. J. 2014. Vol. 44. P. 1627-1634. DOI: 10.1183/09031936.00057914.
-
Schwarz M.I., Fontenot A.P. Drug-induced diffuse alveolar hemorrhage syndromes and vasculitis // Clin. Chest. Med. Mar, 2004. Vol. 25(1). P. 133-140.
-
Segura A. Pulmonary fibrosis induced by cyclophosphamide // Ann. Pharmacother. 2001. Vol. 35, N. 7-8. P. 894-897.
-
Skeoch S., Weatherley N., Swift F.J. et al. Drug-Induced Interstitial Lung Disease: A Systematic Review // J. Clin. Med. 2018. Vol. 7, N. 10. pii: E356; doi:10.3390/ jcm7100356.
-
Snyder L.S., Hertz M.I. Cytotoxic drug-induced lung injury // Semin. Respir. Infect. 1988. Vol. 3, N. 3. P. 217-28. [Medline].
-
Sporer K.A., Dorn E. Heroin-Related Noncardiogenic Pulmonary Edema A Case Series // CHEST. 2001. Vol. 120, N. 5. P.1628-1632. Downloaded From:http://journal.publications.chestnet.org/pdfaccess.ashx?url=/data/journals/chest/21969/on06/26/2017.
-
Stamatoullas A., Brice P., Bouabdallah R. et al. Outcome of patients older than 60 years with classical Hodgkin lymphoma treated with front line ABVD chemotherapy: Frequent pulmonary events suggest limiting the use of bleomycin in the elderly // Br. J. Haematol. 2015. Vol. 170, Issue 2. P. 179-184. [https://doi. org/10.1111/bjh.13419]
-
Sternbach G.W. Osler. Narcotic-induced pulmonary edema // J. Emerg. Med. 1983. Vol. 1. P. 165-167.
-
Steigel D., Bubendorf L., Oberholzer M. Ciprofloxacin-induced acute interstitial pneumonitis // Eur. Respir. J. 2004. Vol. 23, N. 1. P. 172-175.
-
Sundreji R., Kanji Z., Gin K. Pulmonary effects of low dose amiodarone: A review ofthe risks and recommendations for surveillance // Can. J. Cardiol. 2000. Vol. 16. S. 1435-1440.
-
Sung S., Tazelaar H.D., Crapanzano J.P. et al. Adult exogenous lipoid pneumonia: A rare and underrecognized entity in cytology A case series // Cytojournal. 2018. Vol. 15. P. 17. Published online 2018 Jul 13. doi: 10.4103/cytojournal. cytojournal_29_17
-
Suresh K, Naidoo J., Lin C.T., Danoff S. Immune checkpoint immunotherapy for non-small cell lung cancer: benefits and pulmonary toxicities // Chest. 2018. Vol. 154, N. 6. P. 1416-1423.
-
Taborda L., Amaral B., Isenberg D. Drug-induced vasculitis // Adverse Drug Reaction Bulletin. 2013 Vol. 279 Issue 1 p. 1075-1078. doi: 10.1097/ FAD.0b013e32836106df
-
Teerakanok J., Tantrachoti P., Chariyawong P. Acute amiodarone pulmonary toxicity after surgical procedures // Am. J. Med. Sci. 2016. Vol. 352, N. 6. P. 646-51.
-
Thomeer M., Demedts M., Vandeurzen K et al. Epidemiological registration of interstitial lung diseases // Am. J. Respir. Crit. Care Med. 1997. Vol. 155. P. 320-323.
-
Toews G.B. Interstitial Lung Disease // Cecil Textbook of Medicine / Goldman, 21st ed. Chap 78. P. 393-401. 2000 W.B. Saunders Company. MD Consult L.L.C. http://www.mdconsult.com
-
Viswam D., Trotter S., Burge P.S. Respiratory failure caused by lipoid pneumonia from vaping e-cigarettes // BMJ Case Reports. 2018. 2018: bcr-2018-224350. Online issue publication July 06, 2018 [http://dx.doi.org/10.1136/bcr-2018-224350
-
White D.A. Drugs and the Lungs // Comprehensive Respiratory Medicine / Albert, 1st ed. 1999. Chap. 77. 1999 Mosby, Inc. MD Consult L.L.C. http://www.mdconsult.com
-
Wijnen P.A.H.M., Bekersa O., Drent M. et al. Relationship between drug-induced interstitial lung diseases and cytochrome P450 polymorphisms // Current Opinion in Pulmonary Medicine. 2010. Vol. 16. P. 496-502.