Клиническая фармакология : учебник / В. Г. Кукес, Д. А. Сычев [и др. ] ; под ред. В. Г. Кукеса, Д. А. Сычева. - 6-е изд. , испр. и доп. - Москва : ГЭОТАР-Медиа, 2021. - 1024 с. : ил. - 1024 с. - ISBN 978-5-9704-58815 |
Аннотация
Шестое издание учебника исправлено и дополнено новыми сведениями с учетом последних достижений клинической фармакологии, а также новых государственных образовательных стандартов. Даны современные представления о фармакокинетических процессах, указаны принципы диагностики, коррекции и профилактики нежелательных лекарственных реакций, раскрыты новые механизмы взаимодействия лекарственных средств (на уровне транспортеров). В главе "Основы рациональной фармакотерапии" отражены основные клинико-фармакологические технологии эффективного и безопасного применения лекарственных средств. Клиническая фармакология отдельных групп лекарственных средств рассмотрена с учетом современных представлений о механизме действия, а также с позиций доказательной и персонализированной медицины. Изложена клиническая фармакология новых групп лекарственных средств. Главы, в которых освещены темы, не входящие в примерную программу, размещены в электронной версии учебника, код доступа к которой указан на первом форзаце книги под защитным слоем.
1.4. Метаболизм лекарственных средств
Метаболизм, или биотрансформация, - это общее понятие, отражающее химические изменения, которым подвергаются ЛС в организме. Чаще всего результатом метаболизма ЛС становится, с одной стороны, снижение растворимости в жирах (липофильности) и повышение растворимости в воде (гидрофильности), а с другой стороны - изменение фармакологической активности ЛС.
Немногие ЛС способны выводиться почками в неизмененном виде. Чаще всего это либо ЛС с небольшими размерами молекул, либо ЛС, способные находиться в ионизированном состоянии при физиологических значениях рН. Большинство ЛС не обладает такими физико-химическими свойствами. Фармакологически активные органические молекулы чаще липофильны и остаются неионизированными при физиологических значениях рН. Эти ЛС обычно связываются с белками крови, плохо фильтруются в почечных клубочках и в то же время легко реабсорбируются в почечных канальцах. Система метаболизма (биотрансформации) направлена на повышение растворимости ЛС (увеличение гидрофильности), что способствует выведению их из организма с мочой. Иными словами, липофильные ЛС превращаются в гидрофильные, легко выводимые соединения.
Изменение фармакологической активности ЛС в результате метаболизма может проходить по следующим направлениям:
-
фармакологически активное вещество превращается в фармакологически неактивное (характерно для большинства ЛС);
-
фармакологически активное вещество на первом этапе превращается в другое фармакологически активное вещество (табл. 1.9), т.е. имеет активные метаболиты;
-
фармакологически неактивные вещества (пролекарства) превращаются в организме в фармакологически активные (табл. 1.10).
Таблица 1.9. Лекарственные средства, метаболиты которых сохраняют фармакологическую активность

* Фенацетин¤ снят с производства из-за выраженных нежелательных лекарственных реакций, в частности нефротоксичности («фенацетиновый нефрит»).
Таблица 1.10. Лекарственные средства, относящиеся к пролекарствам
Продукты метаболизма чаще менее активны, чем «родительские» соединения, однако существует ряд метаболитов с повышенной активностью или токсическими свойствами, в том числе мутагенными, тератогенными и канцерогенными.
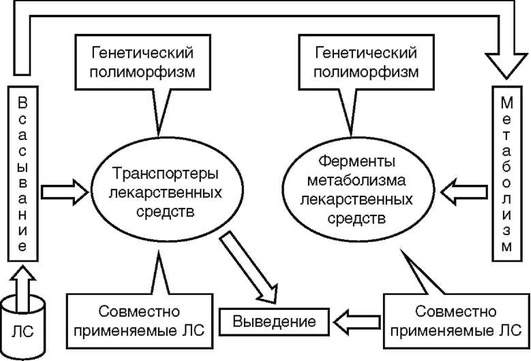
Рис. 1.5. Схема метаболизма
Интересным является тот факт, что в синтезе некоторых эндогенных субстратов (стероидных гормонов, холестерина, желчных кислот) участвуют многие ферменты, связанные с метаболизмом ксенобиотиков. Они также играют важную роль в метаболизме и экскреции конечного метаболита гема-билирубина.
Различают медленный метаболизм лекарственного средства при метаболическом индексе <30% и быстрый метаболизм ЛС с метаболическим индексом >30%. Метаболическим индексом называется отношение концентрации метаболита ЛС в плазме к концентрации ЛС в плазме [3].

В случаях когда активность изоферментов цитохрома Р450 высокая (концентрация лекарственного средства в плазме крови падает), для обеспечения активности фармакотерапии необходимо повышение дозы лекарственного препарата. В том же случае, когда активность изоферментов цитохрома Р450 низкая, наступает кумуляция лекарственного средства, следственно, нужно снизить дозу препарата во избежание появления неблагоприятных лекарственных реакций.
Одна из целей создания пролекарств заключается в улучшении фармакокинетических свойств ЛС, что ускоряет и увеличивает их всасывание. Так, были разработаны сложные эфиры ампициллина - пивампицинρ, талампицинρ и бикампицинρ, которые, в отличие от ампициллина, практически полностью всасываются при приеме внутрь (98-99%). В печени эти ЛС гидролизуются ферментами, в том числе карбоксиэстеразами, до ампициллина, который и обладает антибактериальной активностью. Еще одним примером служат ингибиторы АПФ, содержащие карбоксильную группу (эналаприл, периндоприл, рамиприл, трандолаприл, квинаприл и др.). Так, эналаприл всасывается при приеме внутрь на 60%, а в печени под влиянием карбоксиэстераз гидролизуется до активного эналаприлата. Необходимо отметить, что эналаприлат при введении внутрь всасывается лишь на 10%.
Еще одна цель создания пролекарств - усиление избирательности действия ЛС, что повышает их эффективность и безопасность. Допамин используют для усиления почечного кровотока при острой почечной недостаточности (ОПН), однако он вызывает ряд нежелательных лекарственных реакций (НЛР): тахикардию, аритмии, повышение артериального давления (АД). Присоединение к допамину остатка глутаминовой кислоты привело к созданию ЛС глутамил-дофаρ. Глутамил-дофаρ гидролизуется до допамина только в почках под влиянием глутамилтранспептидазы и декарбоксилазы L-ароматических аминокислот, поэтому практически не оказывает действие на центральную гемодинамику.
Лекарственные средства с высоким и низким печеночным клиренсом
Метаболизирующиеся в печени ЛС (а таких большинство) подразделяются на две группы.
-
Лекарственные средства с высоким печеночным клиренсом. Для них характерна высокая степень извлечения (экстракции) из крови, что обусловлено значительной активностью (емкостью) метаболизирующих их ферментных систем (табл. 1.11). Поскольку эти ЛС быстро и легко метаболизируются в печени, их печеночный клиренс определяется величиной и скоростью кровотока.
-
Лекарственные средства с низким печеночным клиренсом. Их печеночный клиренс зависит не от скорости печеночного кровотока, а от активности ферментов и степени связывания ЛС с белками крови.
Таблица 1.11. Лекарственные средства с высоким печеночным клиренсом

При одинаковой емкости ферментных систем ЛС, в значительной степени связанные с белками (фенитоин, хинидин¤, толбутамид), имеют низкий клиренс, по сравнению с ЛС, слабо связанными с белками (теофиллин, парацетамол). Емкость ферментных систем - величина не постоянная. Например, она может уменьшаться при увеличении дозы ЛС (вследствие насыщения ферментов), что может приводить к увеличению биодоступности.
При приеме внутрь ЛС с высоким печеночным клиренсом всасываются в тонкой кишке и через систему воротной вены поступают в печень, где подвергаются активному метаболизму на 50-80% еще до поступления в системное кровообращение. Это явление называется пресистемной элиминацией, или эффектом «первого прохождения» («first-pass effect»). В результате эти ЛС имеют низкую биодоступность при приеме внутрь, в то время как абсорбция их может составлять почти 100%. Эффект «первого прохождения» характерен для таких ЛС, как хлорпромазин, ацетилсалициловая кислота, верапамил, гидралазин, изопреналин, имипрамин, кортизон, лабетолол, лидокаин, морфин, метопролол, метилтестостерон, метоклопрамид, нортриптилин, окспренолол, органические нитраты, пропранолол, резерпин, салициламид, морацизин и др. Следует отметить, что незначительный метаболизм ЛС может проходить и в других органах (в просвете и стенке кишечника, в легких, плазме крови, почках и др.).
Фазы метаболизма лекарственных средств
В целом, все реакции метаболизма ЛС могут быть отнесены к одной из двух категорий, называемых фазами метаболизма I и II (рис. 1.6).
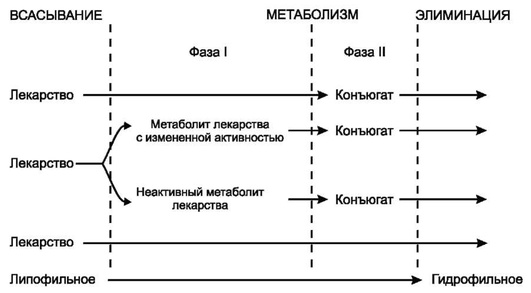
Рис. 1.6. Фазы метаболизма лекарственных средств (Katzung В., 1998)
-
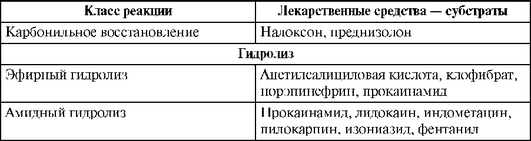
Реакции I фазы (несинтетические реакции). В процессе этих реакций ЛС переходят в более полярные и более водорастворимые (гидрофильные) соединения, чем исходное вещество, за счет присоединения или освобождения активных функциональных групп (например, -ОН, -NH2, -SH). Основными реакциями I фазы являются реакции окисления, из которых наиболее распространена реакция гидроксилирования - присоединение гидроксильного радикала (-ОН). Таким образом, можно считать, что в I фазу метаболизма происходит «взлом» молекул ЛС (табл. 1.12). Катализаторами реакций служат ферменты, называемые оксидазами со смешанной функцией. Субстратная специфичность этих ферментов очень низка, поэтому они окисляют различные ЛС. К другим, менее частым реакциям I фазы относятся процессы восстановления и гидролиза.
Таблица 1.12. Реакции I фазы (Katzung В., 1998, с дополнениями)
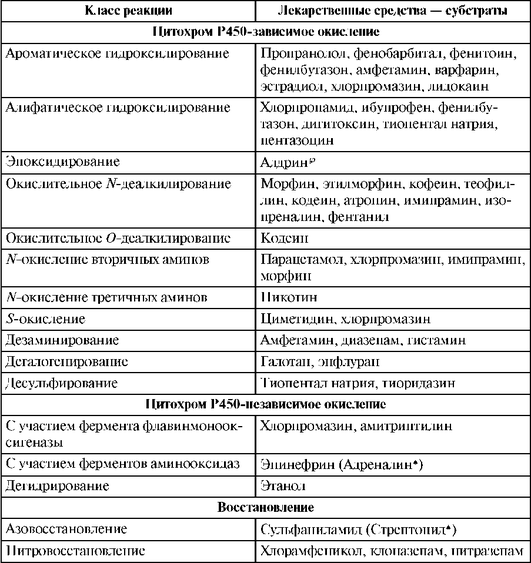
Окончание табл. 1.12
-
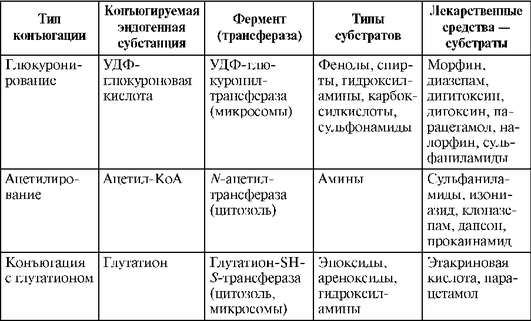
Реакции II фазы (синтетические реакции). Реакции II фазы метаболизма, или синтетические реакции, представляют собой соединение (конъюгацию) ЛС и (или) их метаболитов с эндогенными веществами, в результате чего образуются полярные хорошо растворимые в воде конъюгаты, легко выводимые почками или с желчью. Для вступления в реакцию II фазы молекула должна обладать химически активным радикалом (группировкой), к которому может присоединиться конъюгирующая молекула. Активные радикалы либо существуют в молекулах ЛС изначально, и тогда реакции конъюгации осуществляются минуя стадию I фазы, либо активные радикалы приобретаются молекулой ЛС в реакциях I фазы (табл. 1.13).
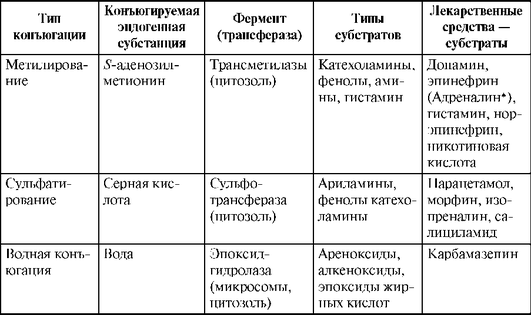
Таблица 1.13. Реакции II фазы (Katzung В., 1998, с дополнениями)
Окончание табл. 1.13
Следует отметить, что помимо последовательного участия реакций I и II фазы в метаболизме ЛС возможны их превращения за счет реакций исключительно I или II фазы. Иногда часть одного лекарственного средства метаболизируется путем реакций I фазы, а часть - путем реакций II фазы.
Микросомальная система оксидаз со смешанной функцией
Многие метаболизирующие ЛС ферменты располагаются на мембранах эндоплазматического ретикулума (ЭПР) печени и других тканей. При изоляции мембран ЭПР путем гомогенизации клеток с последующим фракционированием гомогената они образуют везикулы, называемые микросомами. Микросомы сохраняют большинство морфологических и функциональных характеристик интактных мембран ЭПР, включая свойство шероховатости или гладкости поверхности соответственно у шероховатого (рибосомального) и гладкого (нерибосомального) ЭПР. В то время как шероховатый ЭПР в основном связан с синтезом белка, гладкий ЭПР содержит ферменты, ответственные за окислительный метаболизм ЛС. В частности, он содержит ферменты, называемые оксидазами со смешанной функцией, или монооксигеназами. Для активности этих ферментов необходимо присутствие как восстанавливающего агента (НАДФН), так и молекулярного кислорода.
В типичной реакции на молекулу субстрата расходуется (восстанавливается) одна молекула кислорода, при этом один из атомов кислорода включается в продукт реакции, а другой образует молекулу воды. В таком окислительно-восстановительном процессе ключевую роль играют два микросомальных фермента.
-
Флавопротеин НАДФН-цитохром Р450-редуктаза. Один моль этого фермента содержит по одному молю флавинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД). Поскольку акцептором электрона может служить цитохром C, этот фермент часто называют НАДФ-цитохром С-редуктазой.
-
Гемопротеин, или цитохром Р450. Фермент играет роль конечной оксидазы. В действительности микросомальная мембрана содержит множество форм этого гемопротеина, и множественность возрастает при повторном введении ксенобиотиков. Относительное изобилие цитохрома P450, по сравнению с редуктазой печени, делает процесс восстановления гема цитохрома P450 лимитирующей стадией в процессе окисления ЛС в печени.
Процесс микросомального окисления ЛС требует участия цитохрома P450, цитохрома Р450-редуктазы, НАДФН и молекулярного кислорода. Упрощенная схема окислительного цикла представлена на рис. 1.7. Окисленный цитохром Р450 (Fe3+) соединяется с ЛС с образованием бинарного комплекса. НАДФН служит донором электрона для флавопротеинредуктазы, которая, в свою очередь, восстанавливает окисленный комплекс «цитохром Р450-лекарство». Второй электрон переходит от НАДФН через ту же флавопротеинредуктазу, которая восстанавливает молекулярный кислород и формирует комплекс «"активированный кислород"-цитохром Р450-субстрат». Этот комплекс переносит «активированный кислород» на лекарственный субстрат с образованием окисленного продукта.
Цитохром P450
Цитохром Р450, в литературе часто обозначаемый CYP, представляет собой группу ферментов, осуществляющих не только метаболизм ЛС и других ксенобиотиков, но и участвующих в синтезе стероидных гормонов, холестерина, желчных кислот, простаноидов (тромбоксана А2, простациклина). Филогенетические исследования показали, что цитохромы Р450 появились у живых организмов около 3,5 млрд лет назад. Цитохром P450 является гемопротеином, т.е. содержит гем. Название цитохрома Р450 связано с особыми свойствами этого гемопротеина. В восстановленной форме он связывает монооксид углерода с образованием комплекса, максимально поглощающего свет при длине волны 450 нм. Это свойство объясняется тем, что в геме цитохрома Р450 железо не только связано с атомами азота четырех лигандов, образуя порфириновое кольцо, но и имеет пятый и шестой лиганды сверху и снизу кольца гема, представляющие собой атом азота гистидина и атом серы цистеина, входящих в состав полипептидной цепи белковой части цитохрома Р450.
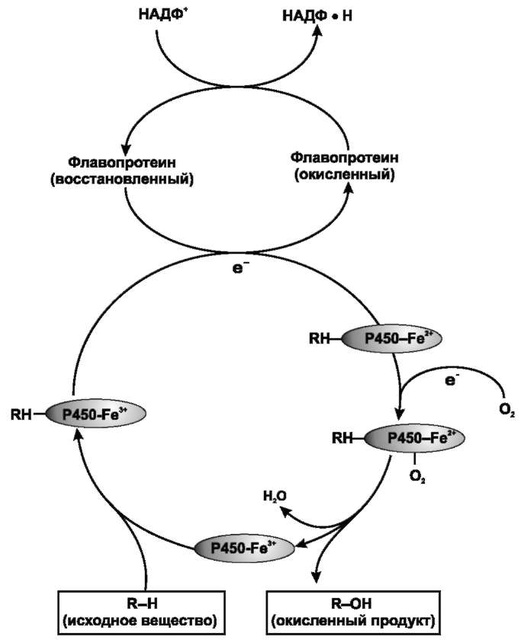
Рис. 1.7. Схема функционирования системы оксидаз со смешанной функцией (по Katzung 1998)
Наибольшее количество цитохрома Р450 находится в гепатоцитах, однако цитохром Р450 обнаруживается и в других органах: кишечнике, почках, легких, надпочечниках, головном мозге, коже, плаценте, миокарде. Важнейшее свойство цитохрома Р450 - способность метаболизировать практически все известные ксенобиотики. Наиболее важной реакцией при этом является гидроксилирование. Как уже указывалось, цитохромы Р450 еще называют монооксигеназами, поскольку они включают один атом кислорода в субстрат, окисляя его, а один - в воду.
Цитохром P450 имеет множество изоформ - изоферментов, которых на данный момент выделено более 1000. Изоферменты цитохрома Р450, по классификации Nebert (1987), принято разделять по близости аминокислотного состава на семейства, а последние, в свою очередь, на подсемейства. Изоферменты цитохрома Р450 с идентичностью аминокислотного состава более 40% объединены в семейства, которых выделено 17. Изоферменты цитохрома Р450 с идентичностью аминокислотного состава более 55% объединены в подсемейства, которых выделено 39. Семейства цитохромов Р450 принято обозначать римскими цифрами, подсемейства - латинской буквой. Отдельные изоферменты маркируются следующим образом: сначала следует арабская цифра, обозначающая семейство, далее латинская буква, обозначающая подсемейство, а в конце указывается арабская цифра, соответствующая изоферменту. Изоферменты цитохрома Р450, относящиеся к различным семействам и подсемействам, отличаются субстратной специфичностью и регуляторами активности (ингибиторы и индукторы). В метаболизме ЛС принимают участия изоферменты семейств I, II и III. Наиболее важны для метаболизма ЛС хорошо изученные изоферменты цитохрома Р450: 1A1, 1А2, 2А6, 2B6, 2D6, 2C9, 2С19, 2E1, 3A4. Содержание различных изоферментов цитохрома Р450 в печени человека, а также их вклад в окисление ЛС не одинаковы (табл. 1.14).
Таблица 1.14. Содержание изоферментов цитохрома Р450 в печени человека и их вклад в окисление лекарственных средств (Lewis et al., 1999)
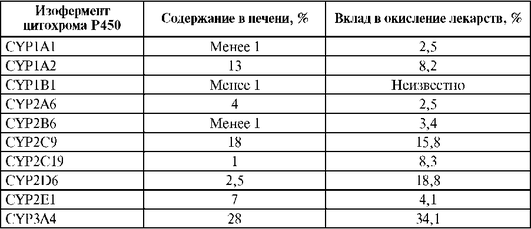
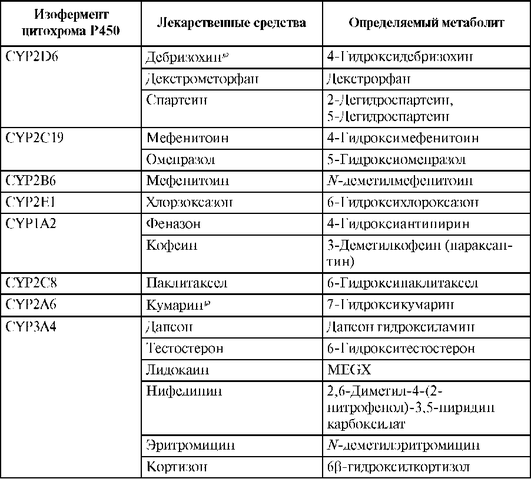
Субстратная специфичность определенных изоферментов цитохрома Р450 позволила разработать методы фенотипирования, позволяющие определять активность того или иного фермента метаболизма по фармакокинетике «маркерного» субстрата. Для этого производятся измерения концентраций неизмененного вещества и его метаболита в сыворотке или плазме крови (табл. 1.15).
Таблица 1.15. Лекарственные средства, использующиеся в качестве «маркерных» субстратов для фенотипирования некоторых изоферментов цитохрома Р450
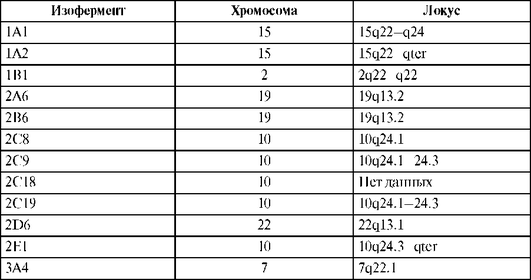
Каждый изофермент цитохрома Р450 кодируется определенным геном, который находится в разных хромосомах и различных их участках. Локализация генов изоферментов цитохрома Р450, участвующих в метаболизме ЛС, представлена в табл. 1.16. К настоящему моменту установлено 53 гена изоферментов цитохрома Р450.
Таблица 1.16. Локализация генов изоферментов цитохрома Р450, участвующих в метаболизме лекарственных средств
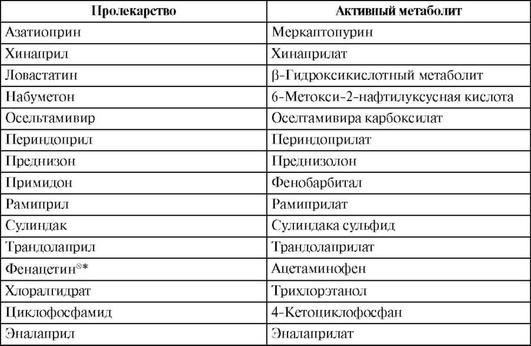
Активность ферментов I и II фаз метаболизма ЛС варьирует в зависимости от генетического полиморфизма (см. гл. 7), а также от способности к индукции и меняется вследствие ингибирования под действием некоторых ЛС (см. гл. 5).
С развитием методик, основанных на полимеразной цепной реакции (ПЦР), появилась возможность определения активности изоферментов цитохрома Р450 путем идентификации полиморфизмов генов соответствующих изоферментов; такой подход называется генотипированием изоферментов цитохрома Р450 (см. гл. 7).
Ниже описаны наиболее важные ферменты I и II фаз метаболизма ЛС.
Семейство цитохрома Р450 CYPI
Изоферменты семейства CYPI метаболизируют ксенобиотики; эндогенные субстраты для них до сих пор не известны. К субстратам CYPI относятся некоторые ЛС и полициклические ароматические углеводороды (ПАУ) - основные компоненты табачного дыма и продукты сжигания органического топлива. Отличительная особенность изоферментов семейства CYPI - их способность индуцироваться под действием ПАУ, в том числе диоксина и 2,3,7,8-тетрахлордибензо-β-диоксина (TCDD), поэтому семейство CYPI в литературе называют цитохромом, индуцибельным ПАУ, диоксининдуцибельным цитохромом, TCDD-индуцибельным цитохромом. В организме человека семейство CYPI представлено двумя подсемействами: IA и IB. В состав подсемейства IA входят изоферменты 1А1 и 1А2, а в состав подсемейства IB - изофермент 1В1.
Изофермент цитохрома Р450 1А1
Изофермент цитохрома Р450 1А1 (CYP1A1) обнаружен в основном в легких, в меньшей степени - в лимфоцитах и плаценте. CYP1A1 не участвует в метаболизме ЛС, однако в легких он активно метаболизирует ПАУ. При этом некоторые ПАУ, например бензопирен, а также нитрозамины, превращаются в канцерогенные соединения, способные вызвать злокачественные новообразования, в первую очередь - рак легких. Такой процесс получил названия биоактивации канцерогенов. Как и другие цитохромы семейства CYPI, CYP1A1 индуцируется ПАУ, механизм этого изучен. ПАУ, проникнув в клетку, соединяются с Ah-рецептором (aromatic hydrocarbonhydroxilase receptor), представляющим собой белок из класса регуляторов транскрипции. Образующийся комплекс «ПАУ-Ah-рецептор» проникает в ядро посредством другого белка, ARNT, где стимулирует экспрессию гена CYP1A1, связываясь со специфическим «диоксинчувствительным» участком (сайтом) гена. Таким образом, у курящих людей индукция CYP1A1 осуществляется наиболее интенсивно, что приводит к биоактивации канцерогенов. Именно этим объясняется высокий риск возникновения рака легких у курильщиков.
Изофермент цитохрома Р450 1А2
Изофермент цитохрома Р450 1А2 (CYP1А2) обнаруживается в основном в печени. В отличие от цитохрома CYP1A1, CYP1А2 метаболизирует не только ПАУ, но и ряд ЛС (см. приложение 1.3). В качестве «маркерных субстратов» для фенотипирования CYP1А2 применяют фенацетин¤, кофеин и феназон (Антипирин*). При этом фенацетинx подвергается О-деметилированию, кофеин - 3-деметилированию, а антипирин - 4-гидроксилированию.
Оценка клиренса кофеина представляет собой важный диагностический тест для определения функционального состояния печени, и, так как главный метаболизирующий фермент кофеина - это CYP1А2, по сути, в тесте определяется активность данного изофермента. Пациент получает внутрь кофеин, меченный радиоактивным изотопом углерода [13C], т.е. [13C]-кофеин, после этого выдыхаемый пациентом воздух собирается в течение 1 ч и анализируется. По соотношению в выдыхаемом воздухе 13СО2 к 12СО2 (измеряют с помощью масс-спектроскопии) определяют клиренс кофеина. Существует и другая модификация этого теста, при которой методом высокоэффективной жидкостной хроматографии (ВЭЖХ) определяют концентрацию кофеина и его метаболитов натощак в плазме крови, моче и слюне. В этом случае определенный вклад в метаболизм кофеина вносят цитохромы CYP3А4 и CYP2D6. Оценка клиренса кофеина - надежный тест для определения функционального состояния печени при ее выраженном поражении (цирроз печени), однако он недостаточно чувствителен при умеренном поражении. На результат теста влияют курение (индукция CYP1А2), возраст, совместное применение ЛС, изменяющих активность изоферментов цитохрома Р450 (ингибиторов или индукторов).
Следует отметить, что CYP1А2 - это главный фермент, метаболизирующий теофиллин (рис. 1.8).
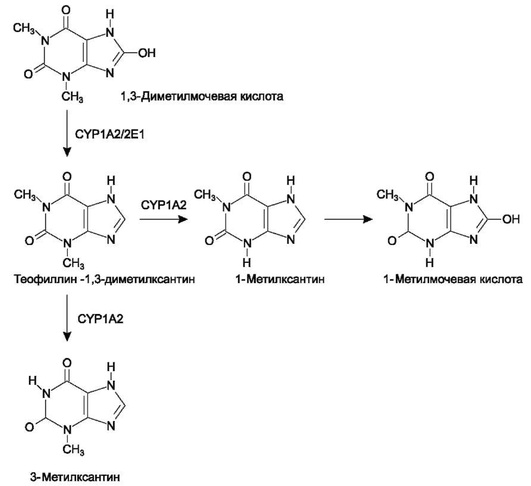
Рис. 1.8. Метаболизм теофиллина
Подсемейство цитохрома Р450 CYPIIA
Из изоферментов подсемейства CYPIIA наиболее важную роль в метаболизме ЛС играет изофермент цитохрома Р450 2А6 (CYP2A6). Общее свойство изоферментов подсемейства CYPIIA - их способность к индукции под действием фенобарбитала, поэтому второе название подсемейства CYPIIA - фенобарбитал-индуцибельный цитохром.
Изофермент цитохрома Р450 2А6
Изофермент цитохрома Р450 2А6 (CYP2A6) выявляется в основном в печени. Он участвует в метаболизме небольшого количества ЛС: осуществляет превращение никотина в кетинин, 7-гидроксилирование кумарина, 7-гидроксилирование циклофосфамида, вносит определенный вклад в метаболизм ритонавира (см. электронное приложение 1.3). CYP2A6 также принимает участие в биоактивации компонентов табачного дыма нитрозоаминов - канцерогенов, вызывающих рак легких. CYP2A6 способствует биоактивации мощных мутагенов: 6-амино(х) ризена и 2-амино-3-метилмидазо[4,5-f]кванолина.
Подсемейство цитохрома Р450 CYPIIC Из всех изоферментов подсемейства цитохрома CYPIIC наиболее важную роль в метаболизме ЛС играют изоферменты цитохрома Р450 2С9 и 2С19. Общее свойство цитохромов подсемейства CYPIIC - 4-гидроксилазная активность по отношению к противосудорожному препарату мефенитоину, который может служить маркерным субстратом изоферментов подсемейства CYPIIC. Именно поэтому второе название изоферментов подсемейства CYPIIC - мефенитоин-4-гидроксилаза.
Изофермент цитохрома Р450 2С9
Изофермент цитохрома Р450 2С9 (CYP2C9) находится в основном в печени. CYP2C9 метаболизирует ряд ЛС, в том числе многие НПВС, фенитоин, S-варфарин.
Изофермент цитохрома Р450 2С19
Изофермент цитохрома Р450 2С19 (CYP2C19) также участвует в метаболизме ЛС (см. электронное приложение 1.3). Активность CYP2С9 и CYP2C19 варьирует в зависимости от генетического полиморфизма (см. гл. 7).
Подсемейство цитохрома Р450 CYPIID
Подсемейство цитохрома Р450 CYPIID включает 1 изофермент - 2D6.
Изофермент цитохрома Р450 2D6
Изофермент цитохрома Р450 2D6 (CYP2D6) локализован в основном в печени. CYP2D6 метаболизирует около 20% всех известных ЛС, в том числе нейролептики, антидепрессанты, транквилизаторы, β-адреноблокаторы (см. электронное приложение 1.3). Маркерными субстратами, используемыми для фенотипирования цитохрома 2D6, являются дебризохинρ, декстрометорфан и спартеин. CYP2D6, в отличие от других изоферментов цитохрома Р450, не имеет индукторов. Активность CYP2D6 варьирует в зависимости от генетического полиморфизма в широких пределах, при этом ген CYP2D6 чрезвычайно полиморфен (см. гл. 7).
Подсемейство цитохрома Р450 CYPIIE
Из изоферментов подсемейства цитохрома IIE наиболее важную роль в метаболизме ЛС играет изофермент цитохрома Р450 2Е1. Общее свойство изоферментов подсемейства CYPIIE заключается в способности к индукции под влиянием этанола, поэтому второе название подсемейства CYPIIE - этанол-индуцибельный цитохром.
Изофермент цитохрома Р450 2Е1
Изофермент цитохрома Р450 2Е1 (CYP2E1) локализован в печени взрослых, он составляет около 7% всех изоферментов цитохрома Р450. К субстратам CYP2E1 относится небольшое количество ЛС (см. электронное приложение 1.3), а также некоторые другие ксенобиотики: этанол, нитрозоамины, «небольшие» ароматические углеводороды типа бензола и анилина, алифатические хлоруглеводороды. CYP2E1 катализирует превращение дапсона в гидроксиламиндапсон, N1- и N7- деметилирование кофеина, дегалогенизацию хлорфторуглеводородов и средств для ингаляционного наркоза (галотан), а также ряд других реакций. CYP2E1 вместе с CYP1A2 катализируют важную реакцию превращения парацетамола в N-ацетилбензохинонимин, обладающий мощным гепатотоксическим действием. Есть данные об участии цитохрома CYP2E1 в атерогенезе. Так, известно, что CYP2E1 является наиболее важным изоферментом цитохрома Р450, окисляющим холестерин липопротеидов низкой плотности (ЛПНП). В процессе окисления ЛПНП также принимают участие как цитохромы и другие изоферменты цитохрома Р450, так и 15-липооксигеназа, НАДФН-оксидазы, при этом продуктами окисления оказываются 7α-гидроксихолестерол, 7β-гидроксихолестерол, 5β-6β-эпоксихолестерол, 5α-6β-эпоксихолестерол, 7-кетохолестерол, 26-гидроксихолестерол. Процесс окисления ЛПНП происходит в эндотелиоцитах, гладкой мускулатуре кровеносных сосудов, макрофагах. Окисленные ЛПНП стимулируют формирование пенистых клеток, что способствует образованию атеросклеротических бляшек.
Подсемейство цитохрома Р450 CYPIIIA
Подсемейство цитохрома Р450 CYPIIIA включает 4 изофермента: 3А3, 3А4, 3А5 и 3А7. Цитохромы подсемейства IIIA составляют 30% всех изоферментов цитохрома Р450 в печени и 70% всех изоферментов стенки ЖКТ. При этом в печени преимущественно локализован изофермент 3А4 (CYP3A4), а в стенке желудка и кишечника - изоферменты 3А3 (CYP3A3) и 3А5 (CYP3A5). Изофермент 3А7 (CYP3A7) определяется только в плодной печени. Из изоферментов подсемейства IIIA наиболее важную роль в метаболизме ЛС играет CYP3A4.
Изофермент цитохрома Р450 3А4
Изофермент цитохрома Р450 3А4 (CYP3A4) метаболизирует около 60% всех известных ЛС (см. электронное приложение 1.3), в том числе блокаторы медленных кальциевых каналов, макролидные антибиотики, некоторые антиаритмики и т.д. CYP3A4 катализирует реакцию β-гидроксилирования эндогенных стероидов, в том числе тестостерона, прогестерона, кортизола. Маркерными субстратами для определения активности CYP3A4 служат дапсон, эритромицин, нифедипин, лидокаин, тестостерон, кортизон.
Метаболизм лидокаина протекает в гепатоцитах, где через окислительное N-деэтилирование CYP3A4 образуется моноэтилглицинксилидид (MEGX). Определение активности CYP3A4 по метаболиту лидокаина MEGX представляет собой наиболее чувствительный и специфичный тест, который характеризует функциональное состояние печени при острых и хронических ее заболеваниях, а также при синдроме системного воспалительного ответа (сепсис). При циррозе печени концентрация MEGX коррелирует с прогнозом заболевания.
Имеются данные о внутривидовой вариабельности метаболизма ЛС посредством CYP3А4, однако причина этого феномена кроется, скорее всего, не в генетическом полиморфизме CYP3А4, а в нарушении экспрессии факторов транскрипции гена CYP3A4.
Ферменты восстановления
Ферменты, ответственные за восстановление ксенобиотиков, нуждаются в НАДФ-Н, как кофакторе. Субстраты для восстановительных реакций включают: азо- и нитросоединения, эпоксиды, гетероциклические соединения, галогенизированные гидрокарбонаты. Азоили нитровосстановление протекают с участием цитохрома Р450, карбонилы (альдегиды или кетоны) восстанавливаются с помощью альдегидредуктаз, альдозоредуктаз, карбонилредуктаз.
Реакции восстановления намного реже катализируются цитохромом Р450. Хотя многие из этих реакций чувствительны к кислороду, давление кислорода в тканях ниже, чем в окружающей жидкости (печень 30-40 μM, сердце 16 μМ), и, таким образом, реакции восстановления будут благоприятнее in vivo, чем in vitro, в присутствии окружающей кислородной концентрации, равной примерно 240 |M.S = Х+НАДФ+Н+ → SH-XH+НАД+.
Было также установлено, что ароматический альдегид, 9-антрацен альдегид, восстанавливается ограниченным количеством цитохромов P450, CYP3A4, CYP2B1 и CYP1A2. α, β-Ненасыщенная связь альдегидов позволяет восстановление альдегидов до спиртов, это похоже на кислородно-нечувствительные азовосстанавливающие реакции. Этот прецедент наводит на мысли, что могут быть другие реакции восстановления для олефиновых соединений, катализируемые цитохромами.
Редуктазы
Альдокеторедуктазы (AKRs) - растворимые, НАДФ-зависимые оксидоредуктазы, которые способны восстанавливать альдегиды и кетоны до спиртов. Известны человеческие AKR-ферменты, способные метаболизировать широкий спектр субстратов, который ведет или к их биоактивации, или детоксикации. Номенклатура AKR включает цифру для идентификации семейства (AKR1), букву для описания подсемейства (AKR1A) и вторую цифру для обозначения уникального протеина (AKR1A1). Альдокеторедуктазы млекопитающих были найдены в семействах AKR1, AKR6 и AKR7 (всего более 15 семейств). Большинство человеческих альдокеторедуктаз принадлежит семейству AKR1, включая человеческих гомологов альдегидредуктазы (AKR1A1), альдозоредуктаз (AKR1B1 и AKR1B10), гидроксистероиддегидрогеназы. Кофактор (НАДФ) и субстрат связываются с разными сайтами фермента и сходятся в активном центре фермента. Перенос гидрид-иона от НАДФ к субстрату стереоспецифичен. Человеческие альдоредуктазы вовлечены в метаболизм синтетических гормонов, химиотерапевтических средств и препаратов, влияющих на ЦНС. Альдокеторедуктазы также участвуют в детоксикации карциногенных производных никотина.
Азоредуктазы и нитроредуктазы
Азоредуктазы и нитроредуктазы восстанавливают азосвязь (N=N) в азокрасителях с получением соответствующих аминов, как продуктов реакции. Большинство изоферментов азоредуктаз могут восстанавливать метиловый красный, но не могут восстанавливать сульфоазокрасители. Было установлено, что при восстановлении азокрасителей в качестве доноров электронов используются и НАД, и НФДФ.
Семейство нитроредуктаз представляют группу флавинмононуклеотидов (ФМН) или ФАД- и НФДФ-зависимых ферментов, которые метаболизируют широкий спектр нитрозамещенных соединений с последующим их превращением в гидроксиламины.
Азоредуктазы и нитроредуктазы являются характерными для бактерий и отсутствуют у большинства эукариотов, за исключением трипаносом. В основном азо- и нитроредуктазы, продуцирующие бактерии, принадлежат к семейству Clostridium и Eubacterium. Активность обоих ферментов возрастает в присутствии ФАД. Бактерии с нитроредуктазной активностью снижают мутагенность нитроароматических соединений (по тесту Эймса), в то время как азоредуктазы превращают некоторые азокрасители в генотоксичные соединения.
Хотя роль нитроредуктаз in vivo не ясна, их участие считается важным в метаболизме пролекарств и противораковых ЛС.
Хинонредуктазы (QRs) - ферменты, которые катализируют восстановление хинонов до гидрохинонов с использованием НАДФ, как донора электронов. Хинонредуктазы функционируют с помощью механизма «пинг-понг», где НАДФ связывается с хинонредуктазой, восстанавливает кофактор ФАД, а затем освобождается, позволяя субстрату хинона связаться с ферментом для восстановления. QR1 катализирует восстановление широкого спектра субстратов, включая хиноны, хинонимины и азосоединения, а также защищает клетку от оксидативного стресса и неоплазии. Функция хинонредуктаз, как антиоксидантов клетки, заключается в сохранении витамина Е и убихинонов (коэнзима Q) в их восстановленной и активной форме.
Ферменты гидролиза
Эпоксидгидролазы (EHs). Эпоксидгидролазы принадлежат к субкатегории широкой группы гидролитических ферментов, которые включают эстеразы, протеазы, дегалогеназы и липазы. Эпоксидгидролазы - это класс белков, которые катализируют гидратацию химически активных эпоксидов до им соответствующих 1,2-диолов. У млекопитающих различают как минимум пять форм эпоксидгидролаз: микросомальная холестерол 5,6-оксидгидролаза, гепоксиллин А-гидролаза, лейкотриен А-гидролаза, растворимая эпоксидгидролаза и микросомальная эпоксидгидролаза. Каждый из этих ферментов различается химически и иммунологически. Наиболее изученными за последние 30 лет стали растворимая эпоксидгидролаза и микросомальная эпоксидгидролаза. Микросомальная эпоксидгидролаза у млекопитающих наиболее выражена в печени и обладает высокой субстратной селективностью. Она способна гидратировать большое количество разных по структуре, высокоактивных эпоксидов, как, например, эпоксидбензопирена и андростана.
Эпоксидгидролазы играют основную роль в детоксикации генотоксичных эпоксидов, а также их важной функцией является регуляция физиологических процессов посредством контроля сигнальных молекул с эпоксидной структурой. Растворимые эпоксидгидролазы участвуют в метаболизме арахидоновой кислоты, которая важна для регуляции сосудистой, ренальной и сердечной функций.
Эстеразы и амидазы катализируют присоединение молекулы воды к эфиру, тиоэфиру или амиду с последующим формированием соответствующего спирта, амина или кислоты. Как и эпоксидгидролазы, эстеразы являются членами семейства α- или β-гидролаз. У них общая структура и каталитический механизм, включающий формирование и гидролиз ковалентных промежуточных соединений. Оба фермента присоединяют воду к субстрату, не требуя присутствия дополнительных кофакторов. В то время как реакции с участием эпоксидгидролаз необратимы, действие эстераз и амидаз обратимо и при определенных условиях эти ферменты могут быть использованы для синтеза эфиров и амидов. Более того, эстеразы и амидазы используют два субстрата (эфир и воду) для формирования двух продуктов реакции (кислоты и спирта или амина). Эстеразы и амидазы играют важную роль в сохранении нормальной физиологии и метаболизма, детоксицируя различные ЛС и ксенобиотики.
Карбоксилэстеразы (CEs) и их изоферменты классифицируются на четыре главные CE-группы (CE1-CE4) и несколько подгрупп в соответствии с гомологичностью аминокислотной последовательности. Два основных человеческих изофермента hCE-1 и hCE-2 принадлежат классам CE1 и CE2. Человеческий hCE-1 очень распространен в печени и гораздо меньше в ЖКТ. С другой стороны, человеческий hCE-22 присутствует в тонкой кишке, почках, печени, сердце, мозге и яичках. hCE-1 преимущественно катализирует реакции гидролиза эфиров и спиртов с короткой цепью, а hCE-2 катализирует реакции гидролиза соединений с короткой ацильной цепью и спиртов с длинной цепью.
Связь реакций I и II фазы метаболизма
Реакции II фазы метаболизма, или синтетические реакции, представляют собой соединение (конъюгацию) ЛС или его метаболитов с эндогенными веществами, в результате чего образуются полярные хорошо растворимые в воде конъюгаты, легко выводимые почками или с желчью. Для вступления в реакцию II фазы молекула должна обладать химически активным радикалом (группировкой), к которому способна присоединиться конъюгирующая молекула. Активные радикалы могут присутствовать в молекуле ЛС изначально, и тогда реакция конъюгации осуществляется минуя реакции I фазы, а могут приобретаться молекулой ЛС в реакциях I фазы. Наиболее распространенные реакции II фазы метаболизма - это реакции глюкуронирования, ацетилирования, метилирования, сульфатирования, водной конъюгации. Тип реакции конъюгации зависит прежде всего от химической структуры субстрата. Например, глюкуронированию подвергаются соединения, содержащие гидроксильные группы, а также карбоксильные, карбомоильные, тиоловые, карбонильные и нитрогруппы. Субстратами ацетилирования являются ЛС и метаболиты, содержащие нитрогруппу. Сульфатирование характерно для соединений с фенольной структурой. В большинстве случаев ксенобиотики в результате реакций II фазы полностью утрачивают биологическую активность, однако ниже приведены примеры образования в реакциях конъюгации активных метаболитов и канцерогенов. Таким образом, реакции I и II фазы представляют собой отдельные этапы единого процесса метаболизма (биотрансформации) ксенобиотиков. Связь и взаимодействие реакций I и II фаз биотрансформации можно показать на примерах метаболизма парацетамола и изониазида.
Парацетамол служит одним из широко используемых ЛС. 80-90% парацетамола подвергается конъюгации с глюкуроновой (глюкуронирование) и серной (сульфатирование) кислотами, в результате чего образуются конъюгированные метаболиты, нетоксичные и легковыводимые почками. 10-17% парацетамола подвергается окислению CYP2E1 и CYP1А2 с образованием N-ацетилбензохинонимина (рис. 1.9).
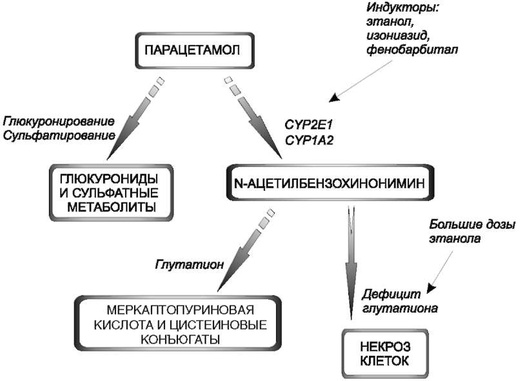
Рис. 1.9. Метаболизм парацетамола (Ацетаминофена*)
N-ацетилбензохинонимин, в свою очередь, соединяясь с глутатионом, превращается в неактивное соединение, которое выводится почками. При увеличении дозы парацетамола возрастает количество N-ацетилбензохинонимина, при этом возникает дефицит глутатиона, и N-ацетилбензохинонимин начинает оказывать гепатотоксическое действие: он соединяется с нуклеофильными группами белков гепатоцитов, что приводит к некрозу ткани печени. Выяснение механизма гепатотоксического действия парацетамола привело к созданию и внедрению эффективного метода лечения интоксикации парацетамолом - применению N-ацетилцистеина, восполняющего запасы глутатиона в печени, в первые 10-12 ч в большинстве случаев дает положительный результат. Гепатотоксическое действие парацетамола усиливается на фоне хронического злоупотребления алкоголем, что объясняется двумя механизмами: с одной стороны, этанол истощает запасы глутатиона в печени, а с другой стороны, вызывает индукцию цитохрома СYP2Е1. Другой пример - метаболизм изониазида, широко используемого противотуберкулезного лекарственного средства, входящего в состав большинства современных схем комбинированной химиотерапии туберкулеза. 60-70% изониазида подвергается окислению (реакция I фазы) CYP2E1, в результате чего образуется нетоксичный и неактивный метаболит - изоникотиновая кислота, легко выводимая почками. 30-40% изониазида ацетилируется (реакция II фазы) с образованием ацетилизониазида, часть которого выводится почками, а часть подвергается амидному гидролизу (реакция I фазы), при этом образуется ацетилгидразин. Ацетилгидразин оказывает мощное гепатотоксическое действие, приводя к нарушению функций печени.
Глюкуронирование
Глюкуронирование - наиболее важная реакция II фазы метаболизма ЛС. Оно представляет собой присоединение (конъюгацию) к субстрату УДФ-глюкуроновой кислоты. Эта реакция катализируется надсемейством ферментов, называемых УДФ-глюкуронилтрансферазами, обозначаемых UGT. Надсемейство УДФ-глюкуронилтрансфераз включает 2 семейства и более 20 изоферментов, локализованных в эндоплазматической системе клеток. Они катализируют глюкуронирование большого количества ксенобиотиков, включая ЛС, их метаболиты, пестициды и канцерогены. К соединениям, подвергающимся глюкуронированию, относятся простые и сложные эфиры, соединения, содержащие карбоксильные, карбомоильные, тиольные, карбонильные и нитрогруппы. Глюкуронирование приводит к увеличению полярности химических соединений, что облегчает их растворимость в воде и элиминацию. УДФ-глюкуронилтрансферазы обнаружены у всех позвоночных животных, от рыб до человека. В организме новорожденных активность УДФ-глюкуронилтрансфераз низкая, однако к 1-3-му месяцу жизни их активность становится сравнимой с таковой у взрослых. УДФ-глюкуронилтрансферазы находятся в печени, кишечнике, легких, головном мозге, обонятельном эпителии, почках, но главным органом, в котором идет глюкуронирование, является печень. Различные изоферменты УДФ-глюкуронилтрансферазы неодинаково экспрессируются в различных органах. Так, изофермент УДФ-глюкуронилтрансферазы, который катализирует реакцию глюкуронирования билирубина (UGT1A1), экспрессируется главным образом в печени, но не в почках. Изоферменты УДФ-глюкуронилтрансферазы, которые ответственны за глюкуронирование фенола (UGT1A6 и UGT1A9), экспрессируются в одинаковой степени как в печени, так и в почках.
Как было указано выше, надсемейство УДФ-глюкуронилтрансфераз по идентичности аминокислотного состава подразделяется на 2 семейства: UGT1 и UGT2. Изоферменты семейства UGT1 сходны по аминокислотному составу на 62-80%, а изоферменты семейства UGT2 - на 57-93%. Изоферменты, входящие в состав семейств УДФ-глюкуронилтрансферазы человека, а также локализация генов и маркерные субстраты изоферментов для фенотипирования представлены в табл. 1.17.
Таблица 1.17. Состав семейств УДФ-глюкуронилтрансферазы человека, локализация генов и маркерные субстраты изоферментов
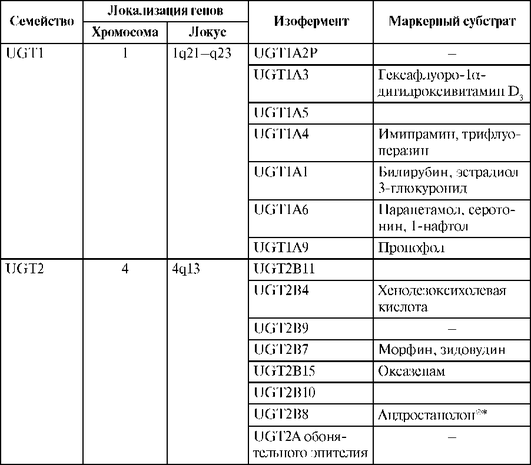
* Андростанолон¤ снят с производства.
Физиологическая функция УДФ-глюкуронилтрансферазы заключается в глюкуронировании эндогенных соединений. Наиболее хорошо изученным эндогенным субстратом УДФ-глюкуронилтрансферазы является билирубин, продукт катаболизма гема. Глюкуронирование билирубина предотвращает накопление токсичного свободного билирубина, при этом билирубин выделяется с желчью в виде моно- и диглюкуронидов. Другой физиологической функцией УДФ-глюкуронилтрансферазы стало участие в метаболизме гормонов. Так, тироксин и трийодтиронин подвергаются глюкуронированию в печени и выводятся в виде глюкуронидов с желчью. УДФ-глюкуронилтрансферазы также метаболизируют стероидные гормоны, желчные кислоты, ретиноиды, однако эти реакции в настоящее время изучены недостаточно.
Глюкуронированию подвергаются ЛС разных классов, многие из которых характеризуются узкой терапевтической широтой (морфин, хлорамфеникол) (табл. 1.18).
Глюкуронированию подвергаются ЛС - представители следующих химических групп:
Таким образом, глюкуронированию подвергаются соединения, содержащие разные функциональные группы, служащие акцепторами для УДФ-глюкуроновой кислоты. Как указывалось выше, в результате глюкуронирования образуются полярные неактивные метаболиты, легко выводящиеся из организма. Однако есть пример, когда в результате глюкуронирования образуется активный метаболит: глюкуронирование морфина приводит к образованию морфин-6-глюкуронида, который обладает значительным анальгетическим эффектом и реже, чем морфин, вызывает тошноту и рвоту. Также глюкуронирование может приводить к биоактивации канцерогенов. К канцерогенным глюкуронидам относятся: N-глюкуронид 4-аминобифенила, N-глюкуронид N-ацетилбензидина, О-глюкуронид 4-[(гидрокисметил) нитрозоамино]-1-(3-пиридил)-1-бутанона.
Ацетилирование
Эволюционно ацетилирование представляет собой один из ранних механизмов адаптации, так как эта реакция необходима для синтеза жирных кислот, стероидов, а также для функционирования цикла Кребса. Важная функция ацетилирования заключается в метаболизме (биотрансформации) ксенобиотиков: ЛС, бытовых и промышленных ядов. Ацетилирование ксенобиотиков, в том числе ЛС, происходит преимущественно в печени и осуществляется ферментом N-ацетилтрансферазой с участием кофермента А. Интенсивность ацетилирования в организме человека контролируется β2-адренорецепторами, метаболическими резервами (пантотеновая кислота, пиридоксин, тиамин, липоевая кислота), а также зависит от генотипа. Кроме того, уровень ацетилирования зависит от функционального состояния печени и других органов, в которых находится N-ацетилтрансфераза.
Таблица 1.18. Лекарственные средства и ксенобиотики, подвергающиеся глюкуронированию различными изоферментами УДФ-глюкуронилтрансферазы другие реакции II фазы, мало изменяются при заболеваниях печени. Выделено 2 изофермента N-ацетилтрансферазы: N-ацетилтрансфераза 1 (NAT1) и N-ацетилтрансфераза 2 (NAT2). NAT1 ацетилирует лишь небольшое количество ариламинов, и основным ферментом ацетилирования является NAT2. Ген NАТ2 расположен в хромосоме 8, локусе 8р23.1-р21.3. NAT2 ацетилирует ряд ЛС, в том числе изониазид и сульфаниламиды (табл. 1.19).
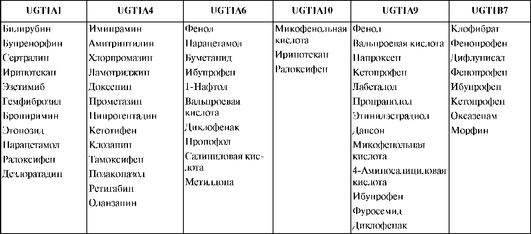
Таблица 1.19. Лекарственные средства, подвергающиеся ацетилированию
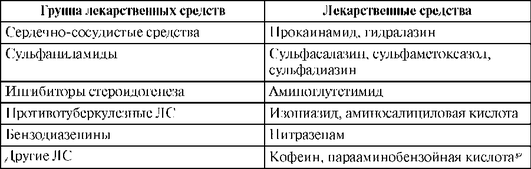
Наиболее важное свойство NAT2 - значительная зависимость активности фермента от генетического полиморфизма (см. гл. 7).
Сульфатирование
Реакции сульфатирования подразумевают присоединение к субстрату остатка серной кислоты с образованием сложных эфиров серной кислоты. Сульфатирование катализируется сульфотрансферазами (SULTs), расположенными главным образом в печени, почках, кишечнике, легких и мозге. Существуют два основных класса сульфотрансфераз:1) связанные с мембранами сульфотрансферазы в аппарате Гольджи важны для таких биологических процессов, как клеточная адгезия, Т-клеточный ответ, пролиферация клетки;2) растворимые сульфотрансферазы цитоплазмы, которые участвуют в сульфатировании различных ЛС.
Сульфатирование происходит при участии кофактора 3'-фосфоаденозин-5'-фосфосульфата (PAPS), который включает перенос сульфоната (SO3-), а не сульфата (SO4-) от PAPS к ксенобиотикам. Эту реакцию катализируют сульфотрансферазы.
К настоящему времени было идентифицировано 11 изоформ сульфотрансфераз, которые были разделены на два подсемейства: фенольные сульфотрансферазы (SULT1) и гидроксистероидные сульфотрансферазы (SULT2). SULT1 состоят как минимум из 8 изоформ и ответственны за конъюгацию «простых» фенольных соединений, эстрогенов, катехоламинов и многих других ЛС. SULT1A1 (термостабильная сульфотрансфераза) катализирует сульфатирование таких ЛС, как морфин, миноксидил, изопреналин, ацетаминофен. SULT1A3 (термолабильная сульфотрансфераза) катализирует реакции сульфатирования фенольных моноаминов: серотонина, норадреналина, дофамина.
Метилирование
Метилтрансферазы катализируют перенос метильных групп от S-аденозилметионина к ксенобиотикам или эндогенным субстратам, содержащим -C, -O, -N или -S-функциональные группы. Их основным отличием от других реакций конъюгаций является тот факт, что метилирование ксенобиотиков приводит к образованию более гидрофобных метаболитов, за исключением N-метилирования пиридинсодержащих ксенобиотиков (таких, как никотин) и S-метилирования тиоэфиров. Метильная группа, связанная с ионом сульфония в S-аденозилметионине, переносится к ксенобиотикам или эндогенному субстрату посредством нуклеофильной атаки от богатого электронами гетероатома. B организме существуют различные формы метилтрансфераз. Большинство из них вовлечены в метилирование ксенобиотиков: никотинамид N-метилтрансферазы (NNMT), тиопуринметилтрансферазы (TPMT), тиолметилтрансферазы (TMT), катехол-О-метилтрансферазы (COMT) и гистамин-N-метилтрансферазы (HNMT). NNMT метилирует соединения, содержащие пиридиновое кольцо (никотинамид) или индольное кольцо (триптофан и серотонин). S-метилирование катализируется двумя ферментами TPMT и TMT. TРMT находится в цитозоле и в основном метилирует ароматические и гетероциклические соединения, как, например, тиопуриновые ЛС. TMT, с другой стороны, является микросомальным ферментом, который метилирует алифатические сульфгидрильные соединения. Генетический полиморфизм TРMT (тиопуринметилтрансферазы) ответствен за токсичность и терапевтическую эффективность тиопуриновых ЛС. К тому же существуют данные, что генотип TPMT может влиять на риск развития вторичных злокачественных опухолей, включая опухоль мозга и острый миелоидный лейкоз. Тиопурины - пролекарства, которые требуют экстенсивного метаболизма для проявления цитотоксичной активности. Азатиоприн неферментативным путем восстанавливается до меркаптопурина. Меркаптопурин и тиогуанин активируются гипоксантин-гуанин фосфорибозилтрансферазой, и на последующих этапах формируются цитотоксичные тиогуаниновые нуклеотиды, которые встраиваются в ДНК и РНК, что приводит к поперечному сшиванию ДНК, однонитевым разрывам. TРMT в основном инактивирует эти ЛС, а его недостаток ведет к увеличению конверсии в цитотоксичные тиогуаниновые нуклеотиды. К тому же меркаптопурин - единственное соединение, которое может быть превращено с помощью TPMT в метил-тиоинозин-5-монофосфат-метаболит, который подавляет denovo синтез пуринов и увеличивает цитотоксический эффект меркаптопурина. Катехол-О-метилтрансферазы (COMT) ответственны за метилирование таких нейромедиаторов, как дофамин, норэпинефрин, эпинефрин и метилдопа.
Присоединение глутатиона
Глутатионтрансфераза (GST) принадлежит к семейству ферментов, которые катализируют конъюгацию восстановленной формы трипептидов (γ-glu-cys-gly). Глутатионтрансферазы играют важную роль не только в детоксикации электрофильных ксенобиотиков, но также и в инактивации эндогенных вторичных метаболитов, образующихся во время оксидативного стресса (α-, β-ненасыщенные альдегиды, хиноны, эпоксиды, гидропероксиды). Конъюгации с глутатионом подвергаются ксенобиотики с различной химической структурой: эпоксиды, ареноксиды, гидроксиламины. Существует три GST-семейства: цитозольные, митохондриальные и микросомальные. Было идентифицировано 13 различных субъединиц (от GSTA1 до GSTA4, GSTM1 до GSTM5, GSTP1, GSTT1 и GSTT2, и GSTZ1), принадлежащих к 7 различным классам: альфа (α), мю (μ), омега (ω), пи (π), сигма (σ), тета (θ) и зета (ζ). Примеры лекарств, которые образуют глутатион-конъюгаты: ацетаминофен, сульфаниламиды, карбамазепины, клозапин, ротонавир, прокаинамид, циклоспорин А, диклофенак, эстрогены. Несмотря на свою детоксикационную активность, есть множество примеров, когда глутатионтрансферазы участвуют в формировании цитотоксичных, мутагенных или карциногенных метаболитов.
Аминокислотная конъюгация
Аминокислотная конъюгация встречается в субстратах, содержащих карбоксильные кислоты или ароматические гидроксиламины. Аминокислотная конъюгация с карбоксильной кислотой включает три этапа:1) активацию карбоксильной кислоты с помощью АТФ, чтобы образовать ациладенилатипирофосфат;2) реакцию ациладенилата с коферментом А, производя реактивный ацилкофермент А;3) связывание активированной ацильной группы с аминогруппой аминокислоты.
Ароматические гидроксиламины конъюгируются с карбоксильной кислотой аминокислоты, как серин и пролин. Аминокислота активирует аминоацил т-РНК, которая реагирует с ароматическим гидроксиалмином, чтобы образовать реактивный N-эфир. Аминокислотная конъюгация ксенобиотиков зависит от других групп, присоединенных к ароматическому кольцу. B то время как конъюгация аминокислоты с карбоксильной группой всегда ведет к детоксикации, глюкуронконъюгация может вести к возрастанию токсичности. Примеры соединений, которые подвержены аминокислотной конъюгации: бензойная кислота (глицин), вальпроевая кислота (глутамин, глутамат и глицин) и ибупрофен (таурин).
Роль кишечника в метаболизме лекарственных средств
Bторой по значимости орган метаболизма ЛС после печени - кишечник. B стенке кишечника осуществляются как реакции I фазы, так и реакции II фазы биотрансформации. Метаболизм ЛС в стенке кишечника может играть важную роль в эффекте первого прохождения (пресистемного метаболизма). Уже доказано значительное влияние метаболизма в стенке кишечника при первом прохождении таких ЛС, как циклоспорин, нифедипин, мидазолам, верапамил. Из ферментов I фазы метаболизма в стенке кишечника находятся в основном изоферменты цитохрома Р450, среднее содержание которых здесь составляет 20 пмоль/мг микросомального белка (для сравнения: в печени - 300 пмоль/мг микросомального белка). Установлена четкая закономерность: содержание изоферментов цитохрома Р450 уменьшается от проксимальных отделов кишечника к дистальным. Кроме того, содержание изоферментов цитохрома Р450 максимально на вершине ворсинок кишечника и минимально в криптах. B кишечнике преобладает CYP3A4, где его содержание составляет 70% от суммарного количества изоферментов цитохрома Р450.
Из ферментов II фазы метаболизма в стенке кишечника наиболее хорошо изучены УДФ-глюкуронилтрансфераза и сульфотрансфераза. Распределение этих ферментов здесь аналогично изоферментам цитохрома Р450. Имеются ЛС, сульфатирование которых происходит в основном в стенке кишечника (β2-адреномиметики: тербуталин и изопреналин).
Тем не менее, несмотря на определенный вклад в метаболизм ЛС, по своей метаболической способности стенка кишечника значительно уступает печени.