Клиническая фармакология : учебник / В. Г. Кукес, Д. А. Сычев [и др. ] ; под ред. В. Г. Кукеса, Д. А. Сычева. - 6-е изд. , испр. и доп. - Москва : ГЭОТАР-Медиа, 2021. - 1024 с. : ил. - 1024 с. - ISBN 978-5-9704-58815 |
Аннотация
Шестое издание учебника исправлено и дополнено новыми сведениями с учетом последних достижений клинической фармакологии, а также новых государственных образовательных стандартов. Даны современные представления о фармакокинетических процессах, указаны принципы диагностики, коррекции и профилактики нежелательных лекарственных реакций, раскрыты новые механизмы взаимодействия лекарственных средств (на уровне транспортеров). В главе "Основы рациональной фармакотерапии" отражены основные клинико-фармакологические технологии эффективного и безопасного применения лекарственных средств. Клиническая фармакология отдельных групп лекарственных средств рассмотрена с учетом современных представлений о механизме действия, а также с позиций доказательной и персонализированной медицины. Изложена клиническая фармакология новых групп лекарственных средств. Главы, в которых освещены темы, не входящие в примерную программу, размещены в электронной версии учебника, код доступа к которой указан на первом форзаце книги под защитным слоем.
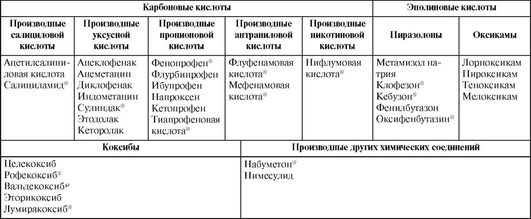
25.1. Нестероидные противовоспалительные средства
По химическому строению НПВС в основном относятся к производным слабых органических кислот. Они обладают сходными фармакологическими эффектами.
Классификация современных НПВС по химическому строению представлена в табл. 25.1.
Однако клиническое значение имеет представленная ниже классификация НПВС, основанная на селективности их действия по отношению к изоформам ЦОГ: (ЦОГ-1 и ЦОГ-2).
Таблица 25.1. Классификация современных нестероидных противовоспалительных средств по химическому строению
Классификация НПВС, основанная на селективности в отношении ЦОГ-1 и ЦОГ-2
Механизм действия и основные фармакодинамические эффекты
К основным фармакологическим эффектам НПВС относятся:
Ключевой элемент механизма фармакологических эффектов НПВС - угнетение синтеза простагландинов, обусловленное ингибированием ЦОГ, ключевого фермента метаболизма арахидоновой кислоты, предшественника простагландинов. Механизм действия НПВС был открыт в 1971 г. группой исследователей из Великобритании во главе с Дж. Вейном (J. Vane). В том же году они же выдвинули гипотезу, что именно антипростагландиновая активность НПВС лежит в основе их противовоспалительного, жаропонижающего и анальгетического действия. Тогда же стало очевидным, что, поскольку простагландины играют исключительно важную роль в физиологической регуляции ЖКТ и почечного кровообращения, характерный побочный эффект, возникающий в процессе лечения НПВС, - развитие патологии этих органов.
В начале 1990-х годов появились новые факты, позволившие рассматривать простагландины в качестве центральных медиаторов важнейших процессов, протекающих в организме человека, включая эмбриогенез, овуляцию и беременность, костный метаболизм, рост и развитие клеток нервной системы, репарацию тканей, функцию почек и ЖКТ, тонус сосудов и свертывание крови, иммунный ответ и воспаление, клеточный апоптоз и др. Было открыто существование двух изоформ ЦОГ: структурного изофермента (ЦОГ-1), регулирующего образование простагландинов, участвующих в обеспечении нормальной (физиологической) функциональной активности клеток, и индуцируемого изофермента (ЦОГ-2), экспрессия которого регулируется иммунными медиаторами (цитокинами), принимающими участие в развитии иммунного ответа и воспаления.
Наконец, в 1994 г. была сформулирована гипотеза, согласно которой противовоспалительное, анальгетическое и жаропонижающее действие НПВС связано с их способностью ингибировать ЦОГ-2, в то время как наиболее часто встречающиеся НЛР (поражение ЖКТ, почек, нарушение агрегации тромбоцитов) связаны с подавлением активности ЦОГ-1.
Арахидоновая кислота, которая образуется из мембранных фосфолипидов под влиянием фермента фосфолипазы А2, с одной стороны, служит источником медиаторов воспаления (провоспалительных простагландинов и лейкотриенов), а с другой стороны, из нее синтезируется ряд биологически активных веществ, участвующих в физиологических процессах организма (простациклин, тромбоксан А2, гастропротекторные и вазодилатирующие простагландины и др.). Таким образом, метаболизм арахидоновой кислоты осуществляется по двум путям (рис. 25.1):
Простагландины - это основные медиаторы воспаления. Они обладают следующими биологическими эффектами:
-
сенсибилизируют ноцицепторы к медиаторам боли (гистамин, брадикинин) и понижают порог болевой чувствительности;
-
повышают чувствительность сосудистой стенки к другим медиаторам воспаления (гистамин, серотонин и др.), вызывая локальное расширение сосудов (покраснение), увеличение сосудистой проницаемости (отек);
-
повышают чувствительность гипоталамических центров терморегуляции к действию вторичных пирогенов (ИЛ-1 и др.), образующихся под влиянием микроорганизмов (бактерии, вирусы, грибки, простейшие) и их токсинов.
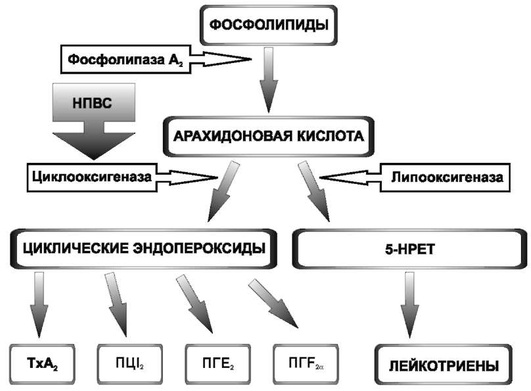
Рис. 25.1. Схема метаболизма простаноидов: ТхА2 - тромбоксан А2; ПЦI2 - простациклин I2; ПГЕ2 - простагландин Е2; ПГF2 α - простагландин F2 α; 5-НРЕТ - 5-гидроксипероксиэйкозотетраеновая кислота. Объяснение в тексте
Таким образом, общепризнанная концепция механизма анальгетического, антипиретического и противовоспалительного эффектов НПВС основана на представлениях об угнетении синтеза провоспалительных простагландинов путем ингибирования ЦОГ.
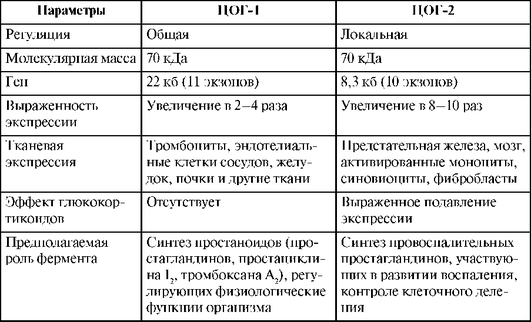
Установлено существование как минимум двух изоферментов ЦОГ: ЦОГ-1 и ЦОГ-2 (табл. 25.2). ЦОГ-1 - это изоформа, экспрессирующаяся в нормальных условиях и ответственная за синтез простаноидов (простагландинов, простациклина, тромбоксана А2), участвующих в регуляции физиологических функций организма (гастропротекция, агрегация тромбоцитов, состояние почечного кровотока, тонус матки, сперматогенез и др.). ЦОГ-2 - это индуцированная изоформа, участвующая в синтезе провоспалительных простагландинов. Экспрессию ЦОГ-2 в мигрирующих и других клетках стимулируют медиаторы воспаления - цитокины. Анальгетический, антипиретический и противовоспалительный эффекты НПВС обусловлены ингибированием ЦОГ-2, тогда как НЛР (ульцерогенность, геморрагический синдром, бронхоспазм, токо-литический эффект и др.) обусловлены ингибированием ЦОГ-1.
Таблица 25.2. Сравнительная характеристика ЦОГ-1 и ЦОГ-2 (по De Witt D. et al., 1993)
Установлено, что ЦОГ-1 и ЦОГ-2 обладают сходной трехмерной структурой, с небольшими различиями. Так, ЦОГ-2 имеет гидрофильный и гидрофобный карманы (каналы), а ЦОГ-1 - только гидрофобный карман. Это позволило разработать ряд ЛС, с высокой селективностью ингибирующих ЦОГ-2 (см. табл. 25.2). Молекулы этих ЛС имеют такую структуру, что своей гидрофильной частью они связываются с гидрофильным карманом, а гидрофобной частью - с гидрофобным карманом ЦОГ. Таким образом, они способны взаимодействовать лишь с ЦОГ-2, имеющей и гидрофильный, и гидрофобный карманы, тогда как большинство других НПВС, взаимодействуя лишь с гидрофобным карманом, связываются и с ЦОГ-2, и с ЦОГ-1.
Существуют и другие механизмы противовоспалительного действия НПВС:
-
анионные свойства НПВС позволяют им проникать в бислой фосфолипидных мембран иммунокомпетентных клеток и непосредственно влиять на взаимодействие белков, предотвращая клеточную активацию на ранних стадиях воспаления;
-
НПВС повышают уровень внутриклеточного кальция в Т-лимфоцитах, способствуя увеличению пролиферации и синтеза ИЛ-2;
По противовоспалительной активности НПВС можно расположить в следующей последовательности: индометацин > флурбипрофен > диклофенак > пироксикам > кетопрофен > напроксен > фенилбутазон > ибупрофен > метамизол натрия > аминофеназонx > ацетилсалициловая кислота.
Большим анальгетическим, чем противовоспалительным, эффектом обладают те НПВС, которые вследствие своей химической структуры нейтральны, меньше накапливаются в воспалительной ткани, быстрее проникают через ГЭБ и подавляют в ЦНС ЦОГ, а также влияют на таламические центры болевой чувствительности. Отмечая центральный анальгетический эффект НПВС, нельзя исключить и периферическое их действие, связанное с антиэкссудативным эффектом, снижающим накопления медиаторов боли и уменьшающим механическое давление на болевые рецепторы в тканях.
Антиагрегантный эффект НПВС обусловлен блокированием образования синтеза тромбоксана А2. Так, ацетилсалициловая кислота необратимо ингибирует ЦОГ-1 в тромбоцитах, и при приеме разовой дозы препарата клинически значимое снижение агрегации тромбоцитов у больного наблюдается в течение 48 ч и более, что значительно превышает время ее выведения из организма. Восстановление агрегационной способности после необратимого ингибирования ЦОГ-1 ацетилсалициловой кислотой происходит, видимо, за счет появления в кровяном русле новых популяций тромбоцитов. Однако большинство НПВС обратимо ингибируют ЦОГ-1, и по мере снижения их концентрации в крови наблюдается восстановление агрегационной способности циркулирующих в сосудистом русле тромбоцитов.
НПВС обладают умеренным десенсибилизирующим действием благодаря следующим механизмам:
-
ингибирование простагландинов в очаге воспаления и лейкоцитах, что понижает хемотаксис моноцитов;
-
снижение образования гидрогептанотриеновой кислоты, что уменьшает хемотаксис Т-лимфоцитов, эозинофилов и полиморфно-ядерных лейкоцитов в очаге воспаления;
-
торможение бласттрансформации (деления) лимфоцитов вследствие блокады образования простагландинов.
Наиболее выражен десенсибилизирующий эффект у индометацина, мефенамовой кислотыx, диклофенака и ацетилсалициловой кислоты.
Фармакокинетика
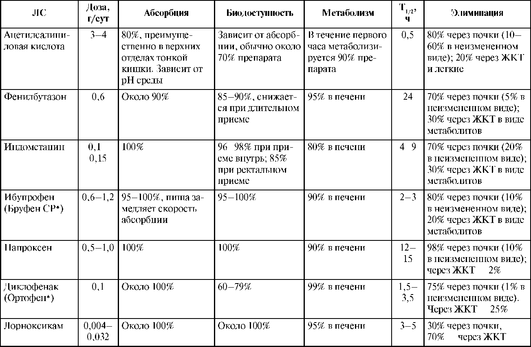
Общее свойство НПВС - достаточно высокая абсорбция и биодоступность при приеме внутрь (табл. 25.3). Лишь ацетилсалициловая кислота и диклофенак имеют биодоступность на уровне 30-70%, несмотря на высокую степень абсорбции.
T1/2 для большинства НПВС составляет 2-4 ч, однако есть и препараты, длительно циркулирующие в организме (например, фенилбутазон и пироксикам), что позволяет назначать их 1-2 раза в сутки. Всем НПВС, за исключением ацетилсалициловой кислоты, присуща высокая степень связывания с белками плазмы крови (90-99%), что при взаимодействии с другими ЛС может привести к изменению концентрации их свободных фракций в плазме крови.
НПВС метаболизируются, как правило, в печени, и их метаболиты экскретируются почками. Продукты метаболизма НПВС обычно не обладают фармакологической активностью.
Фармакокинетика НПВС описывается двухкамерной моделью, где одна из камер - ткани и синовиальная жидкость. Терапевтический эффект препаратов при суставных синдромах в определенной степени связывают со скоростью накопления и величиной концентрации НПВС в синовиальной жидкости, которая возрастает постепенно и после прекращения применения препарата сохраняется значительно дольше, чем в крови. Однако прямой корреляции между концентрацией их в крови и синовиальной жидкости не наблюдается.
Некоторые НПВС (индометацин, ибупрофен, напроксен) элиминируются из организма на 10-20% в неизмененном виде, поэтому состояние выделительной функции почек может существенно влиять на концентрацию и конечный клинический эффект. Скорость выведения НПВС зависит от величины введенной дозы, а также от рН мочи. Поскольку многие препараты этой группы относятся к слабым органическим кислотам, они быстрее выводятся при щелочной реакции мочи, чем при кислой.
Показания к применению
В качестве патогенетического лечения НПВС назначают при синдроме воспаления (мягких тканей, опорно-двигательного аппарата, после операций и травм, при ревматизме, неспецифических поражениях миокарда, легких, паренхиматозных органов, первичной дисменореи, аднексите, проктите и т.д.). НПВС также широко применяют для симптоматического лечения болевого синдрома различного генеза, а также при лихорадочных состояниях.
Таблица 25.3. Фармакокинетика некоторых нестероидных противовоспалительных средств
Нежелательные лекарственные реакции и противопоказания к назначению
Существенное ограничение при выборе НПВС - осложнения со стороны ЖКТ. В этом плане все НЛР, вызываемые НПВС, условно подразделяют на несколько основных категорий.
Симптоматические НЛР наблюдаются у 30-40% больных, чаще - при длительном приеме НПВС, и в 5-15% случаев они становятся причиной отмены лечения уже в течение первых 6 мес. Между тем диспепсия, по данным эндоскопического исследования, не сопровождается эрозивно-язвенными изменениями слизистой оболочки ЖКТ. В случаях же их появления (без особых клинических проявлений), преимущественно при распространенном эрозивно-язвенном процессе, повышается риск кровотечений.
Согласно анализу, проведенному FDA, ежегодно поражение ЖКТ, связанное с приемом НПВС, становится причиной 100-200 тыс. госпитализаций и 10-20 тыс. смертельных исходов.
Среди механизмов развития НПВС-гастропатии лежит ингибирование активности фермента ЦОГ, имеющего два изомера: ЦОГ-1 и ЦОГ-2. Угнетение активности ЦОГ-1 приводит к снижению синтеза простагландинов в слизистой оболочке желудка. В эксперименте показано, что экзогенно введенные простагландины способствуют повышению устойчивости слизистой оболочки к таким повреждающим агентам, как этанол, желчные кислоты, растворы кислоты и солей, а также НПВС. Поэтому функция простагландинов по отношению к гастродуоденальной слизистой оболочке носит протективный характер, обеспечивая:
Эрозивно-язвенные поражения желудка встречаются и при парентеральном применении НПВС, и при их применении в виде свечей, что лишний раз подтверждает системное угнетение выработки простагландинов.
Таким образом, снижение синтеза простагландинов, а следовательно, защитных резервов слизистой оболочки желудка и двенадцатиперстной кишки и служит основной причиной НПВС-гастропатии.
Другие объяснения основаны на том, что уже через короткое время после введения НПВС наблюдается повышение проницаемости слизистой оболочки для ионов водорода и натрия. Предполагается, что НПВС (непосредственно или через провоспалительные цитокины) могут вызывать апоптоз эпителиальных клеток. Это подтверждается наблюдениями, согласно которым НПВС, покрытые кишечно-растворимой оболочкой, значительно реже вызывают изменения слизистой оболочки желудка (и менее выраженные) в первые недели лечения. Однако при длительном их применении все же, вероятно, возникающая системная супрессия синтеза простагландинов способствует появлению желудочных эрозий и язв.
Значение инфекции Helicobacter pylori в качестве фактора риска развития эрозивно-язвенных поражений желудка и двенадцатиперстной кишки в большинстве зарубежных клинических исследований не подтверждается. Наличие этой инфекции ассоциировано, прежде всего, с существенным увеличением количества дуоденальных язв и только с незначительным увеличением язв, локализующихся в желудке.
Столь частое возникновение подобных эрозивно-язвенных повреждений объясняется наличием так называемых факторов риска (табл. 25.4).
Таблица 25.4. Факторы риска эрозивно-язвенных повреждений при применении нестероидных противовоспалительных средств (Насонов Е.Л., 1999)
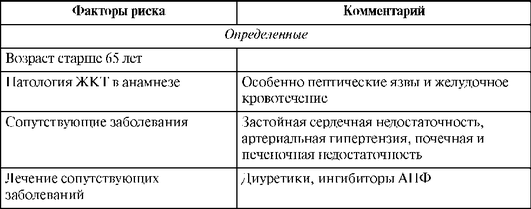
Окончание табл. 25.4
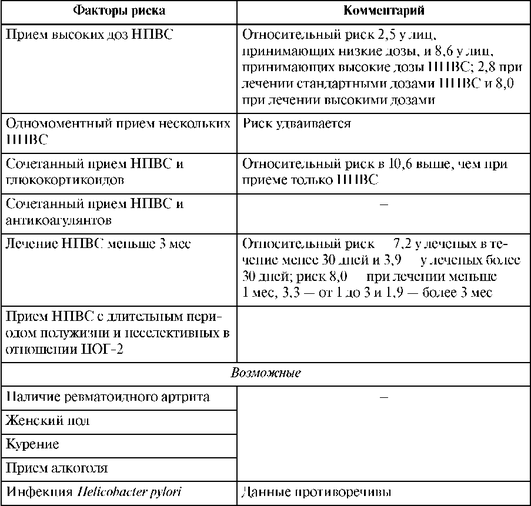
Как видно из приведенных данных, роль НПВС чрезвычайно важна. Среди основных особенностей НПВС-гастропатий выделены преимущественная локализация эрозивно-язвенных изменений в антральном отделе желудка и отсутствие субъективной симптоматики (или она умеренно выражена).
Эрозии желудка и двенадцатиперстной кишки, связанные с приемом НПВС, часто не проявляются какой-либо клинической симптоматикой либо у больных отмечаются лишь незначительно выраженные временами возникающие боли в эпигастральной области и (или) диспепсические расстройства, которым пациенты нередко не придают значения и поэтому не обращаются за медицинской помощью. В ряде случаев больные настолько привыкают к своим незначительным по интенсивности болям в животе и дискомфорту, что при обращении в поликлинику по поводу своего основного заболевания даже не сообщают о них лечащему врачу (основное заболевание беспокоит больных значительно больше). Даже существует мнение, что НПВС уменьшают интенсивность симптомов желудочно-кишечных поражений благодаря их местному и общему обезболивающему действию.
Наиболее часто первые клинические симптомы эрозивно-язвенных поражений желудка и двенадцатиперстной кишки - появление слабости, потливости, бледности кожных покровов, незначительных кровотечений, а затем - рвоты и мелены. Авторы большинства исследований подчеркивают, что риск возникновения НПВС-гастропатии максимален в первый месяц их назначения. Поэтому, назначая НПВС на длительный срок, каждый практикующий врач обязан оценить возможный риск и пользу от его назначения и обратить особое внимание на факторы риска НПВС-гастропатии.
При наличии факторов риска и развитии диспепсических симптомов показано проведение эндоскопического исследования. В случае обнаружения признаков НПВС-гастропатии необходимо или отказаться от приема НПВС, или выбрать способ протекции слизистой оболочки ЖКТ. Отмена препаратов, хотя и не приводит к излечиванию НПВС-гастропатии, но позволяет купировать симптоматические НЛР, повышает эффективность противоязвенного лечения и снижает риск возникновения рецидивов язвенно-эрозивного процесса в ЖКТ. При невозможности прервать лечение следует максимально уменьшить среднюю суточную дозу препарата, а также проводить протективное лечение слизистой оболочки ЖКТ, способствующее снижению гастро-токсичности НПВС.
Существуют три способа медикаментозного преодоления гастро-токсичности:
В середине 1980-х годов был синтезирован мизопростол - синтетический аналог простагландина Е, служащий специфическим антагонистом негативного влияния НПВС на слизистую оболочку ЖКТ.
Проведенные в 1987-1988 гг. контролируемые клинические испытания подтвердили высокую эффективность мизопростола при лечении НПВС-индуцированных гастропатий. Знаменитое исследованиеMUCOSA (1993-1994), включившее более 8 тыс. пациентов, установило, что мизопростол - это весьма действенное профилактическое средство, позволяющее существенно снизить риск развития серьезных гастродуоденальных осложнений при длительном использовании НПВС. В США и Канаде мизопростол относят к препаратам первой линии для лечения и профилактики НПВС-индуцированных гастропатий. На основе мизопростола созданы комбинированные ЛС, содержащие НПВС, например Артротек*, содержащий 50 мг диклофенака натрия и 200 мкг мизопростола.
К сожалению, мизопростол имеет ряд существенных недостатков, в первую очередь связанных с его системным действием (диспепсии и диареи), неудобной схемой применения и высокой стоимостью, что ограничило его распространение в нашей стране.
Другой способ защиты слизистой оболочки ЖКТ - применение омепразола (20-40 мг/сут). Классическое исследование OMNIUM (омепразол vs. мизопростол) позволило установить, что омепразол в целом также эффективен для лечения и профилактики НПВС-индуцированных гастропатий, как и мизопростол, используемый в стандартной дозировке (800 мкг/сут на 4 приема для лечения и 400 мкг на 2 приема для профилактики). При этом омепразол лучше купирует диспепсические явления и значительно реже вызывает НЛР.
Однако в последние годы появились данные, согласно которым ингибиторы протонной помпы при НПВС-индуцированных гастропатиях не всегда производят ожидаемый эффект. Их лечебное и профилактическое действие в значительной степени может зависеть от различных эндо- и экзогенных факторов и прежде всего от инфицированности слизистой оболочки Helicobacter pylori. В условиях хеликобактерной инфекции ингибиторы протонной помпы оказываются существенно более эффективными. Так, в одной из работ, включившей 537 больных с эндоскопически выявленной язвой желудка в анамнезе и длительно принимавших НПВС, у которых отсутствовала Helicobacter pylori, было показано, что ингибиторы протонной помпы в качестве профилактического средства достоверно менее эффективны, чем гастропротектор мизопростол (Graham D. et al., 2002).
Монотерапия невсасывающимися антацидами (Маалокс*, Алма-гель*) и сукральфатом (препарат, обладающий пленкообразующими, антипепсическими и цитопротективными свойствами), хотя и применяется для купирования симптомов диспепсии, неэффективна для лечения или профилактики НПВС-гастропатии.
По данным эпидемиологических исследований в США, примерно 12-20 млн человек принимают одновременно с НПВС гипотензивные препараты, а в целом НПВС назначают более чем 1/3 больных, страдающих артериальной гипертензией.
Известно, что простагландины играют важную роль в физиологической регуляции сосудистого тонуса и функции почек. Простагландины, модулируя вазоконстрикторный и антинатрийуретический эффект ангиотензина II, взаимодействуют с компонентами РААС, обладают вазодилатирующей активностью в отношении сосудов почек (простагландин Е2 и простациклин), оказывают прямое натрийуретическое действие (простагландин Е2).
Ингибируя системный и локальный (внутрипочечный) синтез простагландинов, НПВС могут вызывать увеличение АД не только у больных артериальной гипертензией, но и у лиц с нормальным АД. Установлено, что у пациентов, регулярно принимающих НПВС, наблюдается увеличение АД в среднем на 5,0 мм рт.ст. Риск НПВС-индуцированной артериальной гипертензии особенно высок у лиц пожилого возраста, длительно принимающих НПВС, с сопутствующими заболеваниями ССС.
Характерное свойство НПВС - взаимодействие с гипотензивными препаратами. Установлено, что такие НПВС, как индометацин, пироксикам и напроксен в средних терапевтических дозах и ибупрофен в высокой дозе, способны снижать эффективность гипотензивных препаратов, в основе гипотензивного действия которых преобладают простагландинзависимые механизмы, а именно β-адреноблокаторов (пропранолол, атенолол), диуретиков (фуросемид, гидрохлоротиазид), празозинаx, каптоприла.
В последние годы определенное подтверждение получила точка зрения о том, что НПВС, более селективные в отношении ЦОГ-2, чем ЦОГ-1, не только в меньшей степени повреждают ЖКТ, но и проявляют меньшую нефротоксическую активность. Установлено, что именно ЦОГ-1 экспрессируется в артериолах, клубочках почки и собирательных канальцах, играет важную роль в регуляции периферической сосудистой резистентности, почечного кровотока, клубочковой фильтрации, экскреции натрия, синтеза антидиуретического гормона и ренина. Проведенный анализ результатов, касающихся риска развития артериальной гипертензии на фоне лечения наиболее распространенными НПВС, в сопоставлении с данными литературы о селективности препаратов в отношении ЦОГ-2 / ЦОГ-1, показал, что лечение более селективными в отношении ЦОГ-2 препаратами ассоциируется с меньшим риском артериальной гипертензии по сравнению с менее селективными препаратами.
Согласно циклооксигеназной концепции, наиболее целесообразно назначать короткоживущие, быстродействующие и быстровыводящиеся НПВС. К ним в первую очередь относятся лорноксикам, ибупрофен, диклофенак, нимесулид.
Антиагрегантное действие НПВС также способствует возникновению желудочно-кишечных кровотечений, хотя при применении этих ЛС могут возникнуть и другие проявления геморрагического синдрома.
Бронхоспазм при применении НПВС наиболее часто возникает у больных с так называемым аспириновым вариантом бронхиальной астмы. Механизм этого эффекта связан также с блокадой НПВС ЦОГ-1 в бронхах, при этом основной путь метаболизма арахидоновой кислоты - липооксигеназный, в результате которого увеличивается образование лейкотриенов, вызывающих бронхоспазм.
Несмотря на то что применение селективных ингибиторов ЦОГ-2 отличается большей безопасностью, уже сейчас имеются данные о вызываемых ими НЛР: развитие ОПН, задержка заживления язв желудка, обратимое бесплодие.
Опасный побочный эффект производных пирозалона (метамизол натрия, фенилбутазон) - гематотоксичность. Актуальность этой проблемы обусловлена широким применением в России метамизола натрия. Более чем в 30 странах применение метамизола натрия резко ограничено или вообще запрещено. Это решение основано на Международном исследовании по агранулоцитозу (IAAAS), в котором было продемонстрировано, что при применении метамизола натрия риск развития агранулоцитоза возрастает в 16 раз. Агранулоцитоз - прогностически неблагоприятный побочный эффект производных пирозалона, которому свойственна высокая летальность (30-40%) от связанных с ним инфекционных осложнений (сепсис и др.).
Следует также упомянуть о редком, но прогностически неблагоприятном осложнении применения ацетилсалициловой кислоты - синдроме Рея. Синдром Рея представляет собой острое заболевание, характеризующееся тяжелой энцефалопатией в сочетании с жировой дегенерацией печени и почек. Развитие синдрома Рея связано с применением ацетилсалициловой кислоты, как правило, после перенесенных вирусных инфекций (гриппа, ветряной оспы и т.д.). Чаще всего синдром Рея развивается у детей с возрастным пиком в 6 лет.
При синдроме Рея отмечается высокая летальность, которая может достигать 50%.
Нарушение функций почек обусловлено ингибирующим влиянием НПВС на синтез вазодилатирующих простагландинов в почках, а также прямым токсическим действием на ткань почек. В ряде случаев наблюдается иммуноаллергический механизм нефротоксического действия НПВС. Факторы риска развития почечных осложнений - это сердечная недостаточность, артериальная гипертензия (особенно нефрогенная), ХПН, избыточная масса тела. В первые недели приема НПВС может усугубляться почечная недостаточность, связанная с замедлением гломерулярной фильтрации. Степень нарушения функций почек варьирует от незначительного повышения уровня креатинина в крови до анурии. Также у ряда больных, получающих фенилбутазон, метамизол натрия, индометацин, ибупрофен и напроксен, может развиваться интерстициальная нефропатия с нефротическим синдромом или без него. В отличие от функциональной почечной недостаточности, органическое поражение развивается при длительном приеме НПВС (более 3-6 мес). После отмены препаратов патологическая симптоматика регрессирует, и исход осложнения благоприятный. При приеме НПВС (прежде всего фенилбутазона, индометацина, ацетилсалициловой кислоты) также наблюдается задержка жидкости и натрия.
Гепатотоксическое действие может развиваться по иммуноаллергическому, токсическому или смешанному механизму. Иммуноаллергические гепатиты наиболее часто развиваются в начале курса лечения НПВС; связь между дозой ЛС и тяжестью клинической картины отсутствует. Токсический гепатит развивается на фоне длительного приема препаратов и, как правило, сопровождается желтухой. Поражения печени наиболее часто регистрируются при применении диклофенака.
Поражения кожи и слизистых оболочек наблюдается в 12-15% всех случаев осложнений при применении НПВС. Обычно кожные проявления возникают на 1-3-й неделе применения и чаще имеют доброкачественное течение, проявляются зудящими сыпями (скарлатиноили кореподобными), фотосенсибилизацией (сыпь появляется только на открытых участках тела) либо крапивницей, обычно развивающейся параллельно с отеком. К более тяжелым кожным осложнениям относятся полиморфная эритема (может развиваться на фоне приема любого НПВС) и пигментная фиксированная эритема (специфичная для препаратов пиразолонового ряда). Прием препаратов, относящихся к производным энолиновой кислоты (пиразолоны, оксикамы), может осложняться токсикодермией, развитием пемфигуса и обострением течения псориаза. Для ибупрофена характерно возникновение алопеции. Местные кожные осложнения могут развиваться при парентеральном или накожном способе применения НПВС; они проявляются в виде гематом, индураций либо эритемоподобных реакций.
Чрезвычайно редко при применении НПВС развиваются анафилактический шок и отек Квинке (0,01-0,05% всех случаев осложнений). Факторы риска развития аллергических осложнений - это атопическая предрасположенность и аллергические реакции на препараты данной группы в анамнезе.
Поражения нейросенсорной сферы при приеме НПВС возникают в 1-6%, а при использовании индометацина - до 10% случаев. В основном они проявляются головокружением, головными болями, ощущением утомления и расстройством сна. Для индометацина характерно развитие ретинопатии и кератопатии (отложение препарата в сетчатке и роговице). Длительный прием ибупрофена может привести к развитию неврита зрительного нерва.
Нарушения психики при приеме НПВС могут проявляться в виде галлюцинаций, спутанности сознания (наиболее часто наблюдаются на фоне приема индометацина, до 1,5-4% случаев, что связано с высокой степенью проникновения препарата в ЦНС). Возможно транзиторное снижение остроты слуха при приеме ацетилсалициловой кислоты, индометацина, ибупрофена и препаратов группы пиразолона.
НПВС обладают тератогенным влиянием. Например, прием ацетилсалициловой кислоты в I триместре беременности может приводить к расщеплению верхнего нёба у плода (8-14 случаев на 1000 наблюдений). Прием НПВС в последние недели беременности способствует торможению родовой деятельности (токолитический эффект), что связано с ингибированием синтеза простагландина F2а, что может также привести к преждевременному закрытию артериального протока у плода и развитию гиперплазии в сосудах малого круга.
Противопоказания к назначению НПВС:
В последние годы было показано, что длительное применение селективных ингибиторов ЦОГ-2 может существенно повышать риск развития сердечно-сосудистых осложнений, прежде всего ХСН и инфаркта миокарда. По этой причине был снят с регистрации во всех странах мира рофекоксибx, а другие селективные ингибиторы ЦОГ-2 не рекомендуется применять у пациентов с высоким риском сердечно-сосудистых осложнений.
Взаимодействие
При использовании НПВС необходимо учитывать возможность их взаимодействия с другими ЛС, особенно с непрямыми антикоагулянтами, мочегонными, гипотензивными и противовоспалительными препаратами других групп (см. приложение 3). Следует помнить, что НПВС могут значительно снижать эффективность практически всех гипотензивных ЛС. У больных ХСН применение НПВС способствует увеличению частоты декомпенсаций за счет нивелирования положительных эффектов ингибиторов АПФ и мочегонных ЛС.
Тактика выбора нестероидных противовоспалительных средств
Противовоспалительный эффект НПВС необходимо оценивать в течение 1-2 нед. Если лечение привело к ожидаемым результатам, его продолжают до полного исчезновения воспалительных изменений.
Согласно современной стратегии лечения боли существуют несколько принципов назначения НПВС:
-
индивидуализированный: доза, способ введения, лекарственная форма определяются индивидуально (особенно у детей), с учетом интенсивности боли и на основании регулярного мониторинга;
-
«лестничный»: ступенчатое обезболивание при соблюдении унифицированных диагностических подходов;
-
своевременности введения: интервал между введениями определяют по степени тяжести боли и фармакокинетическим особенностям действия препарата и его лекарственной формы; возможно использование ЛС длительного действия, которые при необходимости можно дополнять препаратами быстрого действия;
-
адекватности способа введения: предпочтение отдают введению внутрь (как наиболее простой, эффективный и наименее болезненный способ).
Часто возникающие острые или хронические боли служат поводом к длительному приему НПВС, что требует не только оценки их эффективности, но и безопасности.
Для выбора необходимого НПВС необходимо учитывать этиологию заболевания, особенности механизма действия препарата, в частности его способности повышать порог восприятия боли и вызывать хотя бы временное прерывание проведения болевого импульса на уровне спинного мозга.
При планировании фармакотерапии необходимо учитывать два момента.
-
Противовоспалительное действие НПВС прямо пропорционально зависит от степени сродства к ЦОГ и от кислотности раствора выбранного препарата, обеспечивающей концентрацию в зоне воспаления. Анальгетическое и жаропонижающее действие развивается тем быстрее, чем более нейтральный рН имеет раствор НПВС. Такие препараты быстрее проникают в ЦНС, угнетая центры болевой чувствительности и терморегуляции.
-
Чем короче T1/2, тем меньше выражена энтерогепатическая циркуляция и меньше риск кумуляции или нежелательного лекарственного взаимодействия и тем безопаснее препарат НПВС.
Чувствительность больных к НПВС даже одной группы варьирует в широких пределах. Например, при неэффективности ибупрофена при ревматоидном артрите, напроксен, который также относится к производным пропионовой кислоты, уменьшает боли в суставах. У больных с синдромом воспаления и сопутствующим сахарным диабетом (при котором глюкокортикоиды противопоказаны) рационально применение ацетилсалициловой кислоты, действие которой сопровождается небольшим гипогликемическим эффектом, связанным с увеличением поглощения глюкозы тканями.
Производные пиразолона, и в частности фенилбутазон, особенно эффективны при анкилозирующем спондилоартрите (болезни Бехтерева), ревматоидном артрите, узловатой эритеме и др.
Учитывая, что многие НПВС, оказывая выраженное терапевтическое действие, вызывают большое количество НЛР, их выбор надо проводить с учетом развития прогнозируемого побочного действия (табл. 25.5).
Трудность выбора НПВС при аутоиммунных заболеваниях обусловлена также и тем, что они оказывают симптоматический эффект и не влияют на течение ревматоидного артрита, а также не предотвращают развитие деформации суставов.
Таблица 25.5. Относительный риск возникновения осложнений со стороны желудочно-кишечного тракта при применении нестероидных противовоспалительных средств
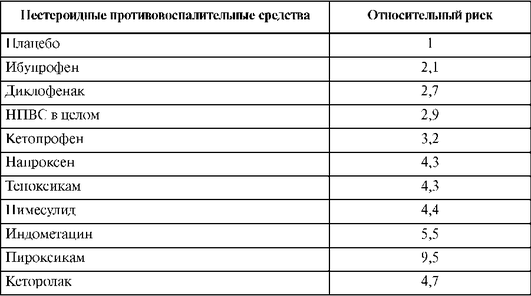
Примечание. За 1 принят риск развития осложнений со стороны ЖКТ при применении плацебо.
Для эффективного обезболивающего действия НПВС должны обладать:
Схематично эти положения можно представить следующим образом.
По убыванию противовоспалительного действия НПВС можно расположить так: индометацин > диклофенак >пироксикам > кетопрофен >ибупрофен > кеторолак >лорноксикам > ацетилсалициловая кислота.
По убыванию анальгетической активности НПВС можно расположить следующим образом: лорноксикам > кеторолак > диклофенак > индометацин > ибупрофен > ацетилсалициловая кислота > кетопрофен.
По риску кумуляции и нежелательному лекарственному взаимодействию НПВС можно расположить следующим образом: пироксикам > мелоксикам > кеторолак > ибупрофен > диклофенак > лорноксикам.
Жаропонижающее действие НПВС достаточно хорошо выражено у препаратов как с высокой, так и с низкой противовоспалительной активностью. Выбор их зависит от индивидуальной переносимости, возможного взаимодействия с применяемыми лекарственными препаратами и прогнозируемыми НЛР.
Между тем у детей в качестве жаропонижающего средства препаратом выбора служит парацетамол, не относящийся к НПВС. В качестве антипиретика второго ряда, при непереносимости или неэффективности парацетамола, можно применять ибупрофен. Ацетилсалициловую кислоту и метамизол натрия нельзя назначать детям до 12 лет из-за опасности развития синдрома Рея и агранулоцитоза соответственно.
У пациентов с высоким риском кровотечений или имеющих перфорации вследствие язв, индуцированных НПВС, следует рассмотреть вопрос о совместном назначении с НПВС ингибиторов протонного насоса или синтетического аналога простагландина - мизопростола. Антагонисты Н2-гистаминовых рецепторов, как было показано, предотвращают только язву двенадцатиперстной кишки, и поэтому их нельзя рекомендовать в профилактических целях. Альтернативой этому подходу служит назначение больным данной категории селективных ингибиторов ЦОГ-2.
Оценка эффективности нестероидных противовоспалительных средств
Критерии эффективности НПВС определяются заболеванием, при котором применяют данные ЛС.
Мониторинг обезболивающей активности нестероидных противовоспалительных средств
Несмотря на объективность существования боли, она всегда субъективна. Поэтому если пациент, предъявляя жалобы на боль, не делает никаких попыток (явных или скрытых) избавиться от нее, стоит усомниться в ее присутствии. Напротив, если пациент страдает от боли, он всегда это демонстрирует либо окружающим, либо самому себе, либо стремится обратиться к врачу.
Для оценки интенсивности болевого синдрома и эффективности проводимой терапии существует несколько способов (табл. 25.6).
Таблица 25.6. Способы градации интенсивности болевого синдрома
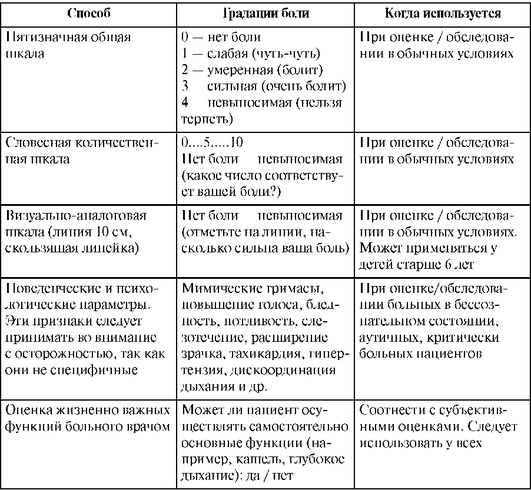
Наиболее распространены визуально-аналоговая шкала (ВАШ) и шкала облегчения боли.
При применении визуально-аналоговой шкалы больной отмечает уровень выраженности болевого синдрома на 100-миллиметровой шкале, где «0» - отсутствие боли, «100» - максимальная боль. При мониторинге острой боли измеряют ее уровень до введения препарата и через 20 мин. При мониторинге хронической боли временной интервал исследования ее интенсивности определяют индивидуально (в соответствии с визитами к врачу), возможно ведение пациентом дневника.
Для оценки эффективности проведенного обезболивания используют шкалу облегчения боли. Через 20 мин после введения препарата пациенту задают вопрос: «Уменьшилась ли интенсивность боли у вас после введения препарата, по сравнению с болью до введения препарата?» Возможные варианты ответа оценивают в баллах:
Важно также оценивать время наступления отчетливого обезболивающего эффекта.
Продолжительность утренней скованности (определяется в часах с момента пробуждения).
Суставной индекс - это суммарная выраженность боли, возникающей в ответ на стандартное по силе надавливание на исследуемый сустав в области суставной щели. Болезненность в труднодоступных пальпации суставах определяют по объему активных и пассивных движений (тазобедренные, позвоночник) или при сжатии (суставы стопы). Болезненность оценивают по четырехбалльной системе:
Суставной счет - определяется количеством суставов, в которых выявлена болезненность при пальпации.
Функциональный индекс ЛИ - определяют с помощью опросника, содержащего 17 вопросов, выясняющих возможность выполнения ряда элементарных бытовых действий с участием различных групп суставов.
Также для оценки эффективности НПВС применяют индекс припухлости - суммарное числовое выражение припухлости, которую оценивают визуально по следующей градации:
Оценку припухлости проводят для следующих суставов: локтевых, лучезапястных, пястно-фаланговых, проксимальных межфаланговых суставов кистей, коленных и голеностопных суставов. Окружность проксимальных межфаланговых суставов вычисляют суммарно для левой и правой кисти. Силу сжатия кисти оценивают либо с помощью специального прибора, либо по сжатию манжетки тонометра, наполненной воздухом до давления 50 мм рт.ст. Больной проводит рукой по 3 сжатия. Учитывают среднее значение. При поражении суставов ног применяют тест, оценивающий время прохождения отрезка пути. Тест Кейтеля - это функциональный тест, оценивающий объем движений в суставах.