Клиническая фармакология : учебник / В. Г. Кукес, Д. А. Сычев [и др. ] ; под ред. В. Г. Кукеса, Д. А. Сычева. - 6-е изд. , испр. и доп. - Москва : ГЭОТАР-Медиа, 2021. - 1024 с. : ил. - 1024 с. - ISBN 978-5-9704-58815 |
Аннотация
Шестое издание учебника исправлено и дополнено новыми сведениями с учетом последних достижений клинической фармакологии, а также новых государственных образовательных стандартов. Даны современные представления о фармакокинетических процессах, указаны принципы диагностики, коррекции и профилактики нежелательных лекарственных реакций, раскрыты новые механизмы взаимодействия лекарственных средств (на уровне транспортеров). В главе "Основы рациональной фармакотерапии" отражены основные клинико-фармакологические технологии эффективного и безопасного применения лекарственных средств. Клиническая фармакология отдельных групп лекарственных средств рассмотрена с учетом современных представлений о механизме действия, а также с позиций доказательной и персонализированной медицины. Изложена клиническая фармакология новых групп лекарственных средств. Главы, в которых освещены темы, не входящие в примерную программу, размещены в электронной версии учебника, код доступа к которой указан на первом форзаце книги под защитным слоем.
12.10. Ингибиторы ангиотензинпревращающего фермента
К группе ингибиторов АПФ относят каптоприл, беназеприлx, эналаприл, цилазаприл, периндоприл, хинаприл, рамиприл, лизиноприл, фозиноприл, спираприл, трандолаприл. Эти препараты широко применяются для лечения артериальной гипертензии, ИБС и ХСН, поскольку в патогенезе этих состояний большую роль играет активация РААС (рис. 12.1).
Механизм действия и основные фармакодинамические эффекты
Ренин взаимодействует с α2-глобулином (ангиотензиногеном) с образованием слабоактивного декапептида ангиотензина I. Последний под влиянием АПФ превращается в октапептид ангиотензин II. Ангио-тензин II оказывает выраженное сосудосуживающее действие, а также стимулирует секрецию альдостерона и способствует задержке натрия в организме, увеличению объема циркулирующей крови и калийурезу. Кроме того, АПФ усиливает разрушение брадикинина (вазодилатирующее вещество), участвует в биохимических превращениях нейропептидов (метэнкефалина, нейротензина). В норме активации прессорных систем (РААС и САС), вызывающих вазоконстрикцию, противостоит действие депрессорной системы (калликреин-кининовой, с ключевым веществом - брадикинином), вызывающей вазодилатацию. АПФ участвует в работе обеих систем: и вазодилатирующей, и вазокон-стрикторной. При различных заболеваниях, в том числе артериальной гипертензии, ХСН, нормальная регуляция нарушается, и преобладают эффекты прессорных систем.
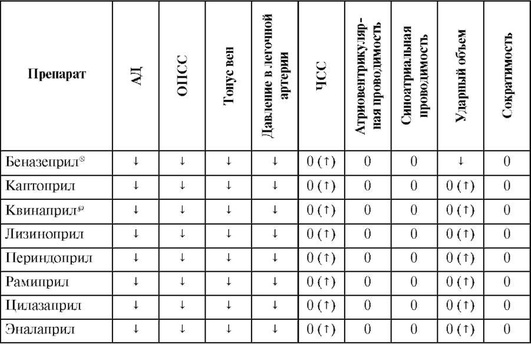
Рис. 12.1. Ренин-ангиотензин-альдостероновая система
АПФ содержится в крови (плазменное звено РААС) и многих тканях, в частности - эндотелиальных, нервных (в том числе в головном мозге), сердце, эпителии почечных канальцев, семенных придатков и других (тканевая РААС). Действие тканевой и плазменной РААС различается: плазменная РААС активируется быстро, но оказывает кратковременное действие. Активность тканевых РААС нарастает постепенно, однако сохраняется долговременно. Считается, что до 90% всего объема РААС приходится на органы и ткани и всего 10% - на плазму.
Ангиотензин II, образующийся в результате деятельности как тканевой, так и плазменной РААС, вазоконстрикторное действие осуществляет через несколько механизмов:
Тканевое звено РААС ответственно за развитие органных поражений. Так, ангиотензин II, синтезирующийся в миокарде, активирует протоонкогены, стимулирует гипертрофию и фиброз мышечных волокон. Кроме того, он активирует локальный синтез норадреналина. Аналогичные изменения наблюдаются в гладкой мускулатуре периферических сосудов и приводят к ее гипертрофии.
Степень сродства (аффинности) различных ингибиторов АПФ как к тканевому, так и к плазменному АПФ различна. Преимущества имеют ингибиторы АПФ, обладающие высоким сродством к обоим АПФ, особенно к тканевому (поскольку именно тканевый АПФ определяет развитие органных поражений).
Ингибиторы АПФ препятствуют многогранному вазоконстрикторному эффекту ангиотензина II. Они вызывают повышение содержания в плазме крови ренина и снижение концентрации ангиотензина II, а также препятствуют разрушению брадикинина, уменьшают выделение альдостерона. В результате ослабляются вазопрессорный, антидиуретический и антинатрийуретический эффекты ангиотензина II, усиливается сосудорасширяющее и натрийуретическое действие брадикинина.
Есть данные о том, что ингибиторы АПФ активируют простагландины сосудистой стенки и самостоятельно оказывают вазодилатирующее действие. Препараты этой группы уменьшают тонус сосудов, главным образом артериол, вследствие чего снижается АД, ОПСС и, соответственно, постнагрузка. Уменьшение содержания альдостерона приводит к снижению концентрации натрия, а также к задержке калия (особенно при применении препаратов в больших дозах). В отличие от многих других вазодилататоров, ингибиторы АПФ, как правило, не вызывают рефлекторную тахикардию. Одновременно происходит увеличение концентрации брадикинина (активный вазодилататор). В результате сложного механизма сосудорасширяющего действия ингибиторы АПФ расширяют и венозные сосуды, уменьшая возврат крови к сердцу (преднагрузка) и давление в малом круге кровообращения. На фоне применения ингибиторов АПФ у пациентов с артериальной гипертензией и нормальным функционированием почек почечный кровоток и клубочковая фильтрация практически не изменяются или даже увеличиваются.
Основные фармакодинамические эффекты препаратов этой группы представлены в табл. 12.33.
Таблица 12.33 (часть 1). Фармакодинамика ингибиторов ангиотензинпревращающего фермента
Примечание. Для прямого фармакологического эффекта: «↓» - снижение; «↑» - повышение; «0» - отсутствие. Для рефлекторного эффекта - то же в скобках.
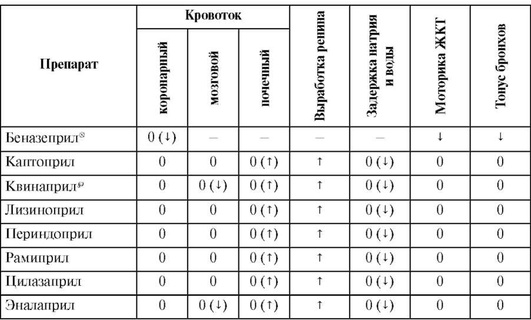
Таблица 12.33 (часть 2). Фармакодинамика ингибиторов ангиотензинпревращающего фермента
Примечание. Для прямого фармакологического эффекта: «↓» - снижение; «↑» - повышение; «0» - отсутствие. Для рефлекторного эффекта - то же в скобках.
Уменьшая образование ангиотензина II не только в плазме крови, но, например, в сердце, ингибиторы АПФ препятствуют прогрессированию дилатации левого желудочка (его ремоделированию) и вызывают обратное развитие гипертрофии миокарда (исследование PREAMI).
Ингибиторы АПФ способны улучшать функцию эндотелия, уменьшать агрегацию тромбоцитов, подавлять многие аспекты атерогенеза, поэтому данные препараты обладают антиишемическим потенциалом. Для лечения ИБС рекомендовано применение рамиприла (эффективность подтверждена в исследовании HOPE) и периндоприла (эффективность подтверждена в исследовании EUROPA).
Препараты этой группы увеличивают объемную скорость коронарного кровотока и уменьшают напряжение стенок желудочков. Они могут оказать антиаритмическое действие, связанное с влиянием на трофические процессы в миокарде, увеличением содержания ионов калия и магния в крови, снижением содержания адреналина.
Поскольку ангиотензин II активирует симпатические центры продолговатого мозга, усиливая симпатические влияния на сердце и сосуды, а также стимулирует передачу импульсов в симпатических нервных окончаниях и вегетативных ганглиях, стимулирует секрецию адреналина в мозговом слое надпочечников, применение ингибиторов АПФ уменьшает влияние симпатической нервной системы на тонус сосудов.
Ингибиторы АПФ не оказывают воздействия на мозговое кровообращение. Кровоток в сосудах мозга поддерживается на достаточном уровне и на фоне снижения АД (PROGRESS). Препараты этой группы не влияют на обмен липидов, мочевой кислоты, предотвращают отрицательное влияние диуретиков на электролитный баланс. Ингибиторы АПФ не вызывают подъема АД и увеличения постнагрузки сразу после их отмены, т.е. для них не характерен синдром отмены.
Ингибиторы АПФ обладают выраженным нефропротективным действием, поскольку они оказывают благоприятное влияние на внутрипочечную гемодинамику. При длительном применении эти ЛС действуют на два основных фактора прогрессирования почечной недостаточности: внутриклубочковую гипертензию и тубулоинтерстициальный фиброз (ангиотензин II обладает неблагоприятными внутрипочечными гемо-динамическими эффектами, а также пролиферативными и профиброгенными эффектами). Кроме того, снижая системное АД и уменьшая протеинурию, ингибиторы АПФ воздействуют на два других фактора прогрессирования поражения почек.
Классификация ингибиторов ангиотензинпревращающего фермента
Ингибиторы АПФ, по химической структуре связывающейся с АПФ части молекулы, можно разделить на 3 группы, хотя общепринятой классификации не существует.
-
Ингибиторы АПФ, содержащие сульфгидрильную группу (каптоприл).
-
Ингибиторы АПФ, содержащие карбоксильную группу или карбоксиалкилдипептиды (эналаприл, лизиноприл, рамиприл, периндоприл, цилазаприл, беназеприлx, хинаприл, трандолаприл, спираприл).
-
Ингибиторы АПФ, содержащие фосфорильную группу (фозиноприл).
Фармакокинетика
Фармакокинетические параметры ингибиторов АПФ представлены в табл. 12.34.
Таблица 12.34. Фармакокинетика ингибиторов ангиотензинпревращающего фермента
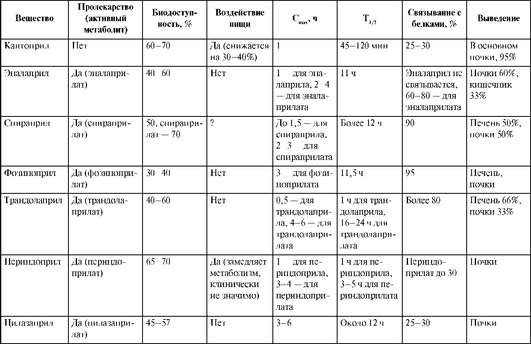
Окончание табл. 12.34
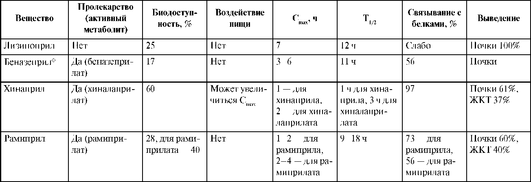
Реальное клиническое значение имеют некоторые особенности фармакокинетики ингибиторов АПФ: биодоступность, биотрансформация (представляет ли собой препарат активное вещество или пролекарство, которое превращается в организме в активные метаболиты), пути элиминации и продолжительность торможения активности АПФ. Указанные обстоятельства позволяют по фармакокинетическим свойствам разделить ингибиторы АПФ на две группы.
Пролекарства всасываются из кишечника путем активного транспорта с помощью транспортера 1 олигопептидов (PEPT1), затем превращаются в активную форму путем гидролиза эфирной связи в энтероцитах и гепатоцитах (например, эналаприл превращается в эналаприлат). Действие препаратов этой группы развивается медленнее и длится дольше. Кроме того, их эффективность снижается при нарушении функций печени.
Каптоприл
Каптоприл действует как активный препарат, биодоступность - 60-70%, быстро всасывается, но всасывание уменьшается на 30-40% при одновременном приеме пищи, поэтому его следует принимать натощак, за 1-1,5 ч до приема пищи. После приема внутрь быстро всасывается из ЖКТ не менее 75% принятой дозы. Максимум концентрации в крови наступает через 1 ч после приема внутрь. Связывание с белками плазмы крови составляет 25-30%. Примерно половина поступившего количества каптоприла метаболизируется в печени, в основном до неактивных дисульфидных конъюгатов. Эти метаболиты способны снова превращаться в каптоприл. Активность каптоприла делает реальным его применение в качестве препарата экстренной помощи, в частности, для купирования гипертонических кризов. Каптоприл имеет короткий T1/2 (45-120 мин), а T1/2 его метаболитов составляет 9-12 ч, поэтому необходим 3-4-кратный прием препарата в сутки, выделяется преимущественно с мочой (75-95%). При нарушении функций почек T1/2 увеличивается до 21-32 ч, происходит кумуляция препарата, поэтому необходимо корректировать дозу. Каптоприл проникает через фетоплацентарный барьер, в низких концентрациях его обнаруживают в женском молоке. Через ГЭБ не проходит.
Карбоксиалкилдипептиды
Все карбоксиалкилдипептиды превосходят каптоприл по длительности действия, так как имеют более длительный T1/2, и их применяют 1- 2 раза в сутки. Они меньше связываются с белками пищи, следовательно, их можно принимать независимо от еды. Все карбоксиалкилдипептиды, за исключением лизиноприла, представляют собой пролекарства, и для образования активных метаболитов необходима их биотрансформация в печени. Поэтому данные ЛС необходимо применять с осторожностью у лиц с печеночной недостаточностью, а также их нельзя использовать в качестве средств экстренной помощи. Основной путь элиминации практически всех ингибиторов АПФ, а также их активных и неактивных метаболитов - почечная экскреция. Поэтому у больных с явной или скрытой почечной недостаточностью, особенно у пожилых пациентов, дозы ингибиторов АПФ должны быть уменьшены.
Спираприл, фозиноприл, трандолаприл
Спираприл, фозиноприл, трандолаприл инактивируются преимущественно печенью и выводятся с желчью через кишечник. Следовательно, их можно применять для лечения больных с нарушением функции почек.
Спираприл
После приема внутрь примерно 45% спираприла абсорбируется из ЖКТ. Cmax спираприла в плазме крови достигается через 49-90 мин, а его активного метаболита спираприлата - через 2-3 ч. Абсолютная биодоступность спираприла составляет примерно 50%, а спираприлата - примерно 70%. Около 90% спираприла и спираприлата связывается с белками плазмы крови. Спираприл почти полностью гидролизуется в печени до спираприлата. Выведение спираприла из организма происходит двухфазно. Первая фаза длится 2 ч, вторая - 40 ч. Спираприл и его активный метаболит примерно в одинаковых пропорциях выводится из организма с мочой и калом.
Фозиноприл
После приема внутрь из ЖКТ абсорбируется около 30-40% активного вещества. Степень абсорбции не зависит от приема пищи. Cmax активного метаболита фозиноприла (фозиноприлата) в плазме крови достигается через 3 ч. Связывание с белками плазмы - 95%. Фозино-прилат характеризуется относительно малым объемом распределения и в незначительной степени связывается с клеточными компонентами крови. Он не проникает через ГЭБ. Гидролиз фозиноприла с образованием фармакологически активного фозиноприлата происходит в слизистой оболочке ЖКТ и частично в печени. Фозиноприлат выводится в неизмененном виде почками и печенью. T1/2 - 11,5 ч. У пациентов с нарушением функций почек общий клиренс фозиноприлата из организма примерно вдвое ниже, чем у пациентов с нормальным функционированием почек, в то время как всасывание, биодоступность и связывание с белками заметно не изменены. Сниженное выведение почками компенсируется повышенным выведением печенью. Клиренс фозиноприлата при гемодиализе и перитонеальном диализе в среднем составляет 2 и 7% соответственно.
Трандолаприл
После приема внутрь трандолаприл быстро всасывается из ЖКТ. Cmax в плазме крови достигается почти через 30 мин. Абсорбция трандолаприла - 10%, трандолаприлата - 40-60% и не зависит от приема пищи. Трандолаприл очень быстро исчезает из плазмы крови, гидролизуясь до трандолаприлата. Количество образующегося трандолаприлата не зависит от приема пищи. Время достижения Cmax трандолаприлата в плазме крови составляет 4-6 ч. Связывание трандолаприлата с белками плазмы крови - более 80%. T1/2 трандолаприла из плазмы составляет менее 1 ч, а трандолаприлата - 16-24 ч. Выводится через 67% через кишечник и 33% почками. Концентрация трандолаприлата в плазме крови значительно выше у больных с клиренсом креатинина менее или равно 30 мл/мин. Концентрация трандолаприла в плазме крови у пациентов с циррозом печени может быть в 10 раз выше, чем у здоровых. Фармакокинетика трандолаприла /трандолаприлата не изменяется у пациентов с компенсированным нарушением функционирования печени.
Эналаприл
Эналаприл - это пролекарство, которое в печени превращается в активное вещество - эналаприлат. Биодоступность составляет 40-60% и не изменяется при приеме пищи (можно принимать после еды). Cmax в крови достигается через 2-4 ч, T1/2 - более 11 ч. Эналаприл не связывается с белками крови, в отличие от эналаприлата (связь с белками крови 60-80%). Метаболизируется в печени. Эналаприл выводится почками, в основном в виде активных метаболитов. Поражение печени или почек увеличивает время начала и длительность действия препарата.
Периндоприл
При приеме внутрь быстро всасывается. Cmax в крови достигается через 1 ч. Биодоступность составляет 65-70%. В процессе метаболизма(в печени) периндоприл биотрансформируется с образованием активного метаболита периндоприлата (около 20%) и пяти неактивных соединений. Связывание периндоприлата с белками плазмы крови незначительное, с АПФ - до 30%, что зависит от концентрации препарата. Прием пищи замедляет всасывание периндоприла, но клинического значения это не имеет. Периндоприлат выводится из организма через почки, T1/2 - 3-5 ч. T1/2 периндоприла составляет 1 ч. T1/2 свободной фракции метаболита - 3-5 ч. Диссоциация связанного с АПФ перин-доприлата медленная, поэтому эффективный T1/2 составляет 25 ч. У пожилых пациентов и при сердечной или почечной недостаточности T1/2 увеличивается, что приводит к накоплению препарата в крови (требуется коррекция дозы).
Цилазаприл
Биодоступность - 60%. Всасывание не зависит от приема пищи (можно принимать после еды). Связь с белками плазмы крови незначительная (25-30%). В печени цилазаприл метаболизируется с образованием активного метаболита - цилазаприлата. Выводится почками (в основном в виде активных метаболитов).
Лизиноприл
К отличительным фармакокинетическим чертам лизиноприла относятся очень низкая липофильность, отсутствие метаболизма в организме (вследствие низкой липофильности) и экскреция с мочой (100%). Абсорбция - 30% (6-60%). Биодоступность - 25-50%, прием пищи на нее не влияет. Не метаболизируется в печени. Пик концентрации в крови отмечается через 7 ч (6-8) после приема препарата. Лизиноприл слабо связывается с белками плазмы крови. T1/2 препарата составляет 12 ч. Выводится почками в неизмененном виде. При нарушении функционирования почек может происходить его накопление в крови, так как T1/2 удлиняется до 50 ч (требуется коррекция дозы). Лизиноприл незначительно проникает через ГЭБ и плацентарный барьер.
Беназеприл
Биодоступность - 17%. В печени превращается в беназеприлат. T1/2 - 11 ч. Выводится почками.
Хинаприл
Хинаприл быстро абсорбируется из ЖКТ, и прием пищи на абсорбцию не влияет. Биодоступность составляет 38%. Cmax хинаприла в плазме крови достигается в течение 1 ч. В печени препарат гидролизуется в хинаприлат. Cmax хинаприлата в плазме крови достигается через 2 ч после приема внутрь хинаприла. Примерно 97% хинаприла или хина-прилата циркулирует в плазме крови в связанном с белками виде. Почками выводится 61% препарата. T1/2 хинаприла 1 ч, хинаприлата - 3 ч. У больных с почечной недостаточностью T1/2 хинаприлата увеличивается (требуется коррекция дозы). Выведение хинаприлата снижается у пожилых людей, а также у лиц с алкогольным циррозом печени (за счет нарушения деэтерификации хинаприла).
Рамиприл
Одновременный прием пищи не влияет на абсорбцию препарата. Биодоступность составляет 15-28% (для рамиприлата - 45%). В печени рамиприл превращается в рамиприлат (который в 6 раз активнее рамиприла). Рамиприлат выводится главным образом почками, частично экскретируется с калом. T1/2 рамиприлата составляет 9-18 ч. Рамиприл и рамиприлат связываются с белками плазмы крови (73 и 56% соответственно). T1/2 составляет 10-11 ч и увеличивается при почечной недостаточности (коррекция дозы). Выводится через почки (56%) и ЖКТ (38%).
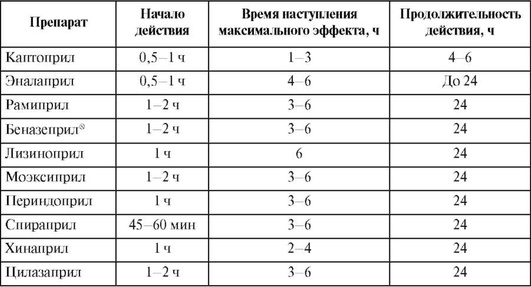
Основные временные характеристики действия ингибиторов АПФ представлены в табл. 12.35.
Таблица 12.35. Основные временные характеристики действия ингибиторов ангиотензинпревращающего фермента
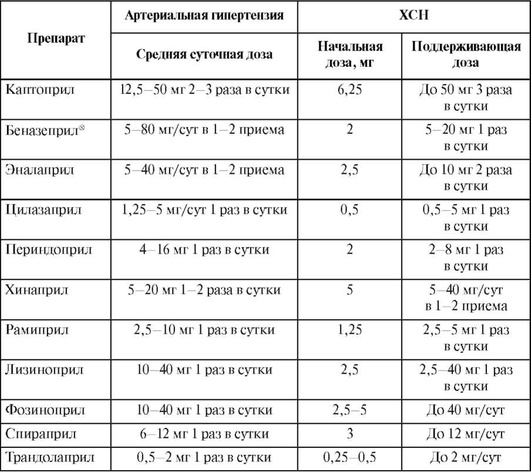
Показания к применению и режим дозирования
Согласно современным европейским и российским рекомендациям по лечению артериальной гипертензии, антигипертензивные препараты следует выбирать исходя из дополнительных показаний. При артериальной гипертензии как первичной, так и вторичной ингибиторы АПФ служат препаратами первого выбора при наличии диабетической и недиабетической нефропатии, протеинурии, недиабетической нефропатии, ХСН, ИБС (ОИМ, постинфарктный кардиосклероз - все ингибиторы АПФ, стенокардия - периндоприл, рамиприл), гипертрофии левого желудочка, мерцательной аритмии, метаболического синдрома, атеросклероза сонных артерий, дисфункции левого желудочка или ХСН.
Отмечено выраженное гипотензивное действие ингибиторов АПФ, как у больных с высоким, так и с нормальным содержанием ренина в плазме крови, поскольку оно связано с повышением содержания бра-дикинина в крови.
Каптоприл применяют для лечения гипертонических кризов. Лечение начинают с минимальных доз и потом титруют до средних. Применение максимальных доз в настоящее время считают нецелесообразным, альтернатива такому подходу - применение комбинированной терапии. Оптимальные комбинации при лечении артериальной гипертензии для ингибиторов АПФ - сочетание с тиазидными диуретиками или блокаторами медленных кальциевых каналов.
Также есть препарат эналаприлат для внутривенного введения, применяющийся при лечении гипертонических кризов, а также отека легких в составе комплексной терапии.
Согласно современным клиническим рекомендациям, больным ИБС для улучшения прогноза жизни следует назначать ингибиторы АПФ: периндоприл (исследование HOPE) и рамиприл (исследование EUROPA). Основываясь на результатах рандомизированных клинических исследований, при остром инфаркте миокарда рекомендована тактика максимально раннего назначения ингибиторов АПФ (зофеноприла, лизиноприла или каптоприла) больным высокого риска (в первую очередь пациентам с обширным передним инфарктом миокарда), не имеющим противопоказаний к назначению ингибиторов АПФ (выраженной гипотензии, нестабильной гемодинамики и др.). Дозу ингибитора АПФ при этом необходимо тщательно титровать: начинать лечение с минимальной дозы, затем по возможности увеличивать ее до целевой.
Кроме того, ингибиторы АПФ - это один из основных классов препаратов, применяемых для лечения ХСН. Они обязательны к назначению для всех пациентов с сердечной недостаточностью при отсутствии противопоказаний к назначению (класс доказательства I, уровень А), независимо от исходного уровня АД (повышенное или нормальное), этиологии и стадии ХСН. Начальная доза у пациентов с сердечной недостаточностью должна быть ниже, чем при лечении артериальной гипертензии, в дальнейшем необходимо титрование до целевых или максимально переносимых доз (табл. 12.36). Эти ЛС не только уменьшают выраженность симптомов сердечной недостаточности, замедляют прогрессирование ХСН, но и увеличивают среднюю продолжительность жизни этих пациентов.
Таблица 12.36. Рекомендуемые дозы ингибиторов вращающего фермента для лечения артериальной гипертензии и хронической сердечной недостаточности
При наличии ХПН дозу большинства ингибиторов АПФ снижают, за исключением фозиноприла, трандолаприла и беназеприлаx.
Нежелательные лекарственные реакции и противопоказания к назначению
Ингибиторы АПФ обычно хорошо переносятся. НЛР в основном незначительные и быстро исчезают: головокружение, головная боль, усталость, тошнота, снижение аппетита. Однако возможно развитие и более тяжелых НЛР, особенно при применении максимальных доз препаратов.
Отмечены артериальная гипотензия вплоть до коллапса (наиболее часто возникает после приема первой дозы препарата - «гипотензия первой дозы»), тахикардия на фоне снижения АД (особенно у больных с гипонатрийемией или получающих диуретики).
Возможно появление или усиление нарушения функционирования почек (особенно при сочетании с диуретиками), протеинурия.
Со стороны органов дыхания: сухой кашель, очень редко - бронхит, удушье, синусит, ринит, бронхоспазм. Сухой кашель - один из самых известных побочных эффектов ингибиторов АПФ, хотя его частота и невелика. Он обусловлен накоплением брадикинина вследствие блокады АПФ, участвующего в его метаболизме. В таких ситуациях необходимо назначение антагонистов рецепторов ангиотензина II, поскольку они нейтрализуют активность РААС не за счет блокады АПФ, а путем воздействия на рецепторы к ангиотензину II, поэтому метаболизм брадикинина не меняется.
Со стороны печени, поджелудочной железы, ЖКТ: тошнота, боли в эпигастральной области, рвота, диарея, запор, дисфагия, потеря аппетита (редко); при применении препаратов, метаболизирующихся в печени, - повышение содержания в крови ферментов печени, билирубина, гепатит, холестатическая желтуха, печеночная недостаточность.
Дерматологические НЛР: сыпь, фотосенсибилизация.
Также могут возникать тревожность, депрессия, нарушения сна, снижение слуха, нарушение зрения, невралгии, невропатии, парестезии, тремор, головокружение, крапивница, кожный зуд, ангионевротический отек, гиперкалиемия.
Очень редко наблюдают лейкопению, агранулоцитоз (особенно опасен у больных аутоиммунными заболеваниями), анемию.
Ингибиторы АПФ противопоказаны при беременности, лактации, в детском возрасте, при выраженном нарушении функций почек, гиперкалиемии, состоянии после трансплантации почек, первичном гиперальдостеронизме, ангионевротическом отеке при лечении ингибиторами АПФ в анамнезе, двустороннем стенозе почечных артерий, гипертрофической кардиомиопатии. С осторожностью следует их назначать больным с нарушением функций печени и почек, находящимся на гемодиализе.
Контроль лабораторных показателей
До начала применения ингибиторов АПФ и систематически во время лечения необходимы общий анализ крови, а также контроль содержания в плазме крови электролитов, мочевины, креатинина, билирубина и ферментов печени.
Взаимодействие
Основные виды лекарственного взаимодействия представлены в приложении 3. При использовании в составе комбинированной терапии с другими антигипертензивными препаратами может быть аддитивный эффект, наблюдающийся также при сочетании с ЛС для общей анестезии, с этанолом. Гипотензивное действие снижают НПВС, в том числе селективные ингибиторы ЦОГ-2 (задержка Na+ и снижение синтеза простагландинов), особенно на фоне низкой концентрации ренина, и эстрогены (задержка Na+). Если ингибиторы АПФ используют в сочетании с диуретиком, вызывающим потерю калия, происходит уменьшение гипокалиемии, вызванной диуретиком. Одновременное применение с ингибиторами АПФ калийсберегающих диуретиков, а также препаратов калия у больных с нарушением функций почек может привести к существенному повышению калия в сыворотке крови. Ослабляют действие ЛС, содержащих теофиллин.
Одновременное применение с инсулинами и пероральными гипогликемическими ЛС повышает риск развития гипогликемии. При одновременном назначении ингибиторов АПФ и препаратов лития возможно повышение уровня лития в плазме крови. Могут усиливать действие этанола.