Детская пульмонология : национальное руководство
Детская пульмонология : национальное руководство / под ред. Б. М. Блохина. - Москва : ГЭОТАР-Медиа, 2021. - 960 с. (Серия "Национальные руководства") - ISBN 978-5-9704-5857-0 |
Аннотация
В национальном руководстве "Детская пульмонология" рассмотрены особенности анатомии дыхательных путей, специфика нарушений мукоцилиарного клиренса. Освещены вопросы генетики, хирургии, онкологии, паразитологии, фтизиатрии, сомнологии. Представлена информация о механизмах, обеспечивающих поддержание функции дыхания в норме и при патологии, об изменении функциональных показателей регуляции и ритма дыхания, а также о наиболее характерных вариантах нарушений дыхания. Структурированы сведения по этиологии, патогенезу органов дыхания, приведены современные рекомендации по профилактике, диагностике, лечению респираторных заболеваний, обобщен опыт отечественных и зарубежных педиатрических школ.
Описаны респираторная терапия при острой дыхательной недостаточности, вопросы физиологии дыхания. Большое внимание уделено асфиксии новорожденных, аспирационному синдрому, приступам апноэ, аномалиям развития. Рассмотрены различные интерстициальные болезни, в том числе идиопатический легочный фиброз, интерстициальные пневмонии, саркоидоз. В книгу вошли сведения о фармакотерапии при бронхитах, пневмониях, облитерирующем бронхиолите, грибковых заболеваниях легких, легочной форме муковисцидоза, хроническом легочном сердце и легочной гипертензии, бронхиальной астме, а также о ведении больных с инфекционными и обструктивными заболеваниями легких.
Издание предназначено врачам-педиатрам, ординаторам, студентам медицинских вузов.
ГЭОТАР-Медиа
Б.М. Блохин, К.Г. Каграманова
1.1. ВСТУПЛЕНИЕ
В структуре общей заболеваемости болезни органов дыхания занимают первое место в детской популяции. Наиболее частым заболеванием органов дыхания у детей являются острый бронхит, а также бронхопневмонии, которые осложняют течение респираторных заболеваний и детских инфекций, таких как корь, коклюш, скарлатина, ветряная оспа и др.
Известно, что из-за особенностей анатомо-физиологического развития в раннем возрасте возможно развитие транзиторных эпизодов бронхиальной обструкции; в ряде случаев эти эпизоды исчезают к 6 годам и не ведут к формированию бронхиальной астмы (БА) в более позднем возрасте. Постоянные респираторные симптомы (длительный кашель, прогрессирующая одышка), возникающие на 1-м году жизни, задержка темпов физического развития должны настораживать врача в отношении пороков развития дыхательной системы. Группу высокого риска развития хронических заболеваний органов дыхания, связанных с обструкцией нижних дыхательных путей (например, БА), составляют дети, часто болеющие респираторными инфекциями. Повторные эпизоды респираторных заболеваний, сопровождающихся бронхиальной обструкцией, усугубляют бронхиальную гиперреактивность; все это на фоне наследственной отягощенности по атопическим заболеваниям создает условия для реализации генерализованной реакции и повышенной чувствительности с формированием БА. Легочные симптомы также могут возникать у детей с пороками развития респираторной системы.
Респираторные нарушения, помимо врожденных пороков и реактивных заболеваний дыхательных путей, также могут быть единственным симптомом гастроэзофагеальной рефлюксной болезни (ГЭРБ), когда из-за несостоятельности кардиального сфинктера происходит заброс кислого желудочного содержимого в пищевод, гортань, трахею и бронхи. Недооценка этих симптомов приводит к тяжелым необратимым изменениям в дистальном отделе пищевода, таким как пептический стеноз пищевода. Нередко причиной респираторных нарушений у детей до 5-летнего возраста могут быть инородные тела.
Поиск оптимальных лечебно-диагностических технологий, позволяющих проводить диагностику и своевременную коррекцию нарушений проходимости бронхов, считают актуальной проблемой в практике врача-педиатра и пульмонолога.
1.2. ПЛАН ОБСЛЕДОВАНИЯ ОРГАНОВ ДЫХАНИЯ
АНАМНЕЗ
Обследование больного начинают со сбора полного анамнеза, который включает анамнез жизни и заболевания. Болезни органов дыхания могут быть спровоцированы факторами окружающей среды (такими как колебания температуры), вредными веществами [сигаретный дым, городской смог, динитрогена оксид (Азота закись♠ )]. При обследовании пациента с респираторными жалобами также необходимо выяснить жилищно-бытовые условия ребенка. Сюда входит тип отопительной системы, наличие кондиционера, домашних животных, соседство с причинно-значимыми аллергенами. Следует также выяснить тип постельного белья и наличие мягкой мебели и мягких игрушек в квартире. Важно отметить наличие или отсутствие волокон животного или растительного происхождения в перьевых подушках и мягкой мебели, а также систему очистки, фильтрации и кондиционирования или увлажнения воздуха.
Большой объем информации может быть получен при наблюдении за ребенком во время сбора анамнеза. Врач обязательно должен расспросить самого ребенка, так как дети с 3-4-летнего возраста часто знают вещи, которые они не рассказывали родителям (например, плохая переносимость физической нагрузки или факт попадания инородного тела в дыхательные пути). Некоторые признаки или симптомы заболевания дыхательных путей у детей преимущественно проявляются во время сна, и поэтому врач должен спросить об этом.
Легочные симптомы часто вызываются провоцирующими факторами. У детей с БА важным провоцирующим фактором возникновения кашля и одышки могут быть физические упражнения, эмоциональное возбуждение, изменение климата, экспозиция холодного или сухого воздуха, контакт с аллергеном. Смех также может провоцировать кашель или одышку. Иногда причиной развития респираторных симптомов во время еды могут быть аспирация инородного тела или гастроэзофагеальный рефлюкс (ГЭР), дисфагия или бронхопищеводный свищ.
Особенности эпидемиологической обстановки также считают важными диагностическими критериями. При подозрении на нетипичную инфекцию следует расспросить о недавних путешествиях в экзотические районы, возможности контакта с экзотическими животными и потенциальными факторами риска инфекции вируса иммунодефицита человека (ВИЧ) у ребенка или родителей.
Сбор анамнеза следует начинать с особенностей течения беременности и родов, динамики роста и веса. Необходимо спросить о применяемых в настоящее время медикаментах и наличии лекарственной аллергии. Наследственный анамнез может помочь выявить заболевания дыхательной системы, имеющие наследственную предрасположенность. Это наследственные заболевания с аутосомно-рецессивным типом наследования, такие как муковисцидоз (МВ) и дефицит α1 -антитрипсина (α1 -АТ), а также различные иммунодефицитные состояния, хроническая гранулематозная болезнь, которые сопровождаются серьезными легочными осложнениями.
ФИЗИКАЛЬНЫЙ ОСМОТР
Осмотр общий служит одним из наиболее важных, но зачастую пренебрегаемых аспектов физикального из-за стремления провести врачом осмотр только заинтересованных органов и систем. Следует оценить общее состояние здоровья ребенка, внимательно осмотреть на наличие цианоза, бледности и учащенного дыхания. Важно оценить физическое развитие по центильной шкале, измерив рост и массу тела ребенка. Наиболее тяжелые легочные заболевания, такие как МВ, сопровождаются задержкой роста, что также можно выявить при общем осмотре. Очень важным физическим признаком, на наличие или отсутствие которого необходимо обращать внимание, служит утолщение ногтевых фаланг. Симптом проявляется в виде утолщения кончиков пальцев за счет разрастания или отека соединительной ткани под основанием ногтя. Это выявляют при визуальном осмотре или пальпации. Причины возникновения данного симптома приведены в табл. 1.1.
| Заболевания легких | Заболевания сердца | Заболевания печени | Желудочно-кишечные заболевания | Другие |
|---|---|---|---|---|
Бронхоэктатическая болезнь |
Врожденные синие пороки сердца |
Подострый бактериальный эндокардит |
Болезнь Крона |
Тиреотоксикоз |
Муковисцидоз |
Подострый бактериальный эндокардит |
Хроническая застойная СН |
Язвенный колит |
|
Синдром неподвижных ресничек |
Хроническая застойная сердечная недостаточность (СН) |
Хроническая инфекционная диарея |
||
Облитерирующий бронхиолит Хронические инфекции легких Злокачественные опухоли (первичные и вторичные) Интерстициальный фиброз |
Полипоз |
Тщательный осмотр позволяет выявить многие признаки, особенно у детей младшего возраста. Необходимо определить частоту дыхания (ЧД) ребенка, ритм и дыхательное усилие. Значительное увеличение ЧД наблюдают у детей при снижении эластичности дыхательных путей, лихорадке, анемии и метаболическом ацидозе. Страх также может приводить к гипервентиляции. Уменьшение ЧД можно наблюдать у детей с угнетением центральной нервной системы (ЦНС) и при метаболическом алкалозе. Нормальная ЧД в зависимости от возраста представлена в табл. 1.2.
| Возраст | Частота дыхания, в минуту |
|---|---|
Недоношенные новорожденные |
40-80 |
Доношенные новорожденные |
40-60 |
Грудной возраст |
35-48 |
1-3 года |
28-35 |
4-6 лет |
24-26 |
7-9 лет |
21-23 |
10-12 лет |
18-20 |
13-15 лет |
16-18 |
Взрослые |
12-16 |
Для определения ЧД, характера и глубины дыхания ребенок должен сидеть тихо и не плакать. Одежда должна быть удалена с верхней половины тела ребенка, так чтобы грудную клетку можно было тщательно исследовать.
ЧД служит важным показателем респираторного статуса. Любые факторы, ухудшающие механику дыхания, могут приводить к одышке. Поскольку тревога или волнение могут увеличить ЧД, то исследование дыхания в покое наиболее достоверно. Грудные дети младше 1 года жизни имеют ЧД во сне 25-35 в минуту, тогда как в период бодрствования эти же дети могут иметь 40-80 в минуту. С возрастом ЧД во сне постепенно снижается и достигает уровня взрослого человека - 10-15 в минуту.
Колебания ритма дыхания наблюдают в норме у детей в возрасте до 3 мес, когда респираторные паузы могут доходить до 10 с. У детей с застойной СН или повышением внутричерепного давления может возникнуть циклическое увеличение и уменьшение дыхательного объема, чередующиеся с периодами апноэ, так называемое дыхание Чейна-Стокса (табл. 1.3).
| Тип дыхания | Признаки |
|---|---|
Умеренная обструкция |
Частота дыхания (ЧД) изменяется незначительно, повышение дыхательного объема |
Тяжелая обструкция |
Повышение ЧД, работы дыхательной и вспомогательной мускулатуры, беспокойство, цианоз |
Рестрикция |
Увеличение ЧД, снижение дыхательного объема |
Дыхание Куссмауля |
Увеличение ЧД, повышение дыхательного объема, равномерное глубокое дыхание (наблюдают при метаболическом ацидозе, например, при декомпенсации сахарного диабета) |
Дыхание Чейна-Стокса |
Постепенно повышающийся дыхательный объем, сопровождающийся последовательно постепенным снижением дыхательного объема и апноэ (наблюдают при поражении центральной нервной системы, передозировке препаратов, вызывающих угнетение дыхательного центра, сердечной недостаточности, уремии или недоношенности) |
Дыхание Биота |
Атаксическое или периодическое дыхание с респираторным усилием, сопровождающееся апноэ (наблюдают при поражении ствола мозга или объемном образовании в задней черепной ямке) |
Удушье |
Низкая ЧД, вариабельный дыхательный объем (наблюдают при гипоксии, шоке, сепсисе, асфиксии) |
Необходимо также учитывать характер, глубину и степень дыхательного усилия. Гиперпноэ (увеличение глубины дыхания) может развиваться при лихорадке, ацидозе, отравлении, заболеваниях легких или сильном беспокойстве (синдром гипервентиляции, приступ страха). Гиперпноэ без признаков респираторного дистресса заставляет предположить внелегочную причину (ацидоз, лихорадка, отравление, эмоциональное возбуждение, психоз). Возникновение затрудненного дыхания должно насторожить врача относительно легочной патологии.
Затруднение дыхания проявляется увеличением ЧД, раздуванием крыльев носа, включением вспомогательной мускулатуры в акт дыхания, например грудино-ключично-сосцевидных мышц, втяжением уступчивых мест грудной клетки - межреберных промежутков, надключичного и диафрагмального пространства. Участие вспомогательной мускулатуры в акте дыхания указывает на респираторный дистресс, который может быть вызван повышенной резистентностью дыхательных путей при астме или уменьшением эластичности легких при интерстициальном фиброзе. При увеличении одышки вследствие обструкции дыхательных путей или снижения легочной растяжимости внутригрудное давление может стать более отрицательным, в связи с чем могут отмечать втяжение уступчивых мест грудной клетки. Увеличение инспираторной одышки приводит к раздуванию крыльев носа. «Хрюканье» (усиленный выдох через частично закрытую голосовую щель) может свидетельствовать о гипоксии, ателектазе, пневмонии или отеке легких. Важный момент - визуальная оценка экскурсии грудной клетки. В норме отмечают равномерность участия в акте дыхания обеих ее половин, движение грудной клетки и передней стенки живота на вдохе направлено кнаружи. Движение грудной клетки внутрь во время вдоха характерно для парадоксального дыхания. Это наблюдают при потере ригидности грудной клетки, например, у детей с параличом межреберных мышц при поражении спинного мозга. Этот феномен можно наблюдать у здоровых детей в возрасте до 1 года с очень податливой грудной клеткой. Парадоксальное дыхание также возможно у пациентов с обструкцией верхних дыхательных путей. У детей с нарушением дыхания нередко можно обнаружить втяжение нижней латеральной части грудной клетки при вдохе, что в конце концов приводит к образованию вдавления, называемого гаррисоновой бороздой. Иногда ее можно обнаружить у детей с БА. Необходимо также обратить внимание на наличие врожденных аномалий и микроаномалий.
Дыхательные шумы заслуживают тщательного исследования. Стридор, обычно слышимый на вдохе, бывает грубым звуком, который исходит из верхних дыхательных путей и вызывается частичной обструкцией верхних дыхательных путей. Если стридор сопровождается признаками респираторного дистресса, требуется немедленное вмешательство. Стридор может быть хроническим, врожденным. В случаях присоединения респираторной инфекции он приобретает большую клиническую значимость. Свистящее дыхание вызывается частичной обструкцией нижних дыхательных путей и выслушивается на выдохе. Свист может быть грубым и низкочастотным (обычно из крупных дыхательных путей) или высокочастотным музыкальным (из мелких периферических дыхательных путей). Обструкция, приводящая к сужению просвета бронхов и сопровождаемая свистом, может быть вызвана скоплением секрета в дыхательных путях, утолщением стенок бронхов из-за воспалительного отека и их инфильтрации, а также симптомами бронхоспазма.
ПАЛЬПАЦИЯ
Пальпацию шеи и грудной клетки, как правило, начинают с лимфатических узлов, затем исследуют трахею, которую осматривают с целью выявления образований по срединной линии или рудиментарных элементов. Небольшое отклонение трахеи вправо считают вариантом нормы. Оно обусловлено прохождением нисходящей дуги аорты слева. Выраженное отклонение в какую-либо сторону может указывать на ателектаз с той же стороны или перерастяжение с противоположной стороны, например, при пневмотораксе. При пневмонии нарушение крово- и лифмообращения может проявляться утолщением кожной складки на стороне воспаления. При пальпации можно уловить усиление голосового дрожания на стороне уплотнения легочной ткани при пневмонии, его ослабление при наличии жидкости или воздуха в плевральной полости, а также ощутить шум трения плевры при сухом плеврите.
ПЕРКУССИЯ
Перкуссию грудной клетки выполняют путем легкого поколачивания средним пальцем доминирующей руки по средней фаланге среднего пальца другой руки. Руки обязательно должны быть теплыми. У новорожденных и грудных детей удобнее использовать метод «непосредственной» перкуссии одним пальцем. Исследуют передние, латеральные и задние отделы путем сравнения перкуторного звука на симметричных участках справа и слева. При уплотнении тканей или наличии плеврального выпота резонанс уменьшается. Увеличение резонанса возможно при смещении легкого избыточным количеством воздуха, что наблюдают при эмфиземе или пневмотораксе.
АУСКУЛЬТАЦИЯ
Аускультацию грудной клетки выполняют с помощью диафрагмы фонендоскопа. Характер основных дыхательных шумов может быть бронхиальным, в норме хорошо выслушиваемый на вдохе и выдохе над трахеей. Периферические дыхательные шумы - везикулярные. Из-за малых размеров грудной клетки у детей младшего возраста в норме в периферических отделах можно услышать бронхиальное дыхание, которое образуется в крупных дыхательных путях, и его называют пуэрильным. Следует оценить дыхательные шумы, в норме они должны быть одинаковыми на симметричных участках и везикулярными или пуэрильными по характеру. К дополнительным дыхательным шумам относят хрипы, крепитацию и шум трения плевры.
Хрипы - музыкальные, длительные звуки, образующиеся при сужении дыхательных путей. Распространение сужения дыхательных путей вглубь бронхиального дерева при астме обусловливает возникновение большого количества разнокалиберных хрипов различной высоты, так называемых полифонических. Для обструкции крупных дыхательных путей, например, инородным телом характерны монофонические хрипы постоянной локализации, выслушиваемые как на вдохе, так и на выдохе. Интенсивность хрипов зависит от респираторного усилия. Иногда, чтобы выслушать хрипы, следует просить пациента сделать глубокий, форсированный вдох и выдох. У детей младшего возраста можно надавить руками на верхнюю часть грудной клетки во время выдоха, установив диафрагму фонендоскопа ниже ключицы. Такой прием называют «выдавливанием хрипов».
Крепитация (от лат. crepitare - скрипеть, хрустеть) - немузыкальные, прерывающиеся легочные шумы, которые в зависимости от длительности и частоты можно разделить на нежные и грубые. Нежные крепитирующие шумы напоминают звук, возникающий при разминании пальцами пучка волос около уха, выслушиваются в конце вдоха, характерны для интерстициального легочного фиброза, пневмонии и ранних стадий отека легких. Крепитацию иногда трудно отличить от мелкопузырчатых влажных хрипов. В отличие от последних, ее слышно только в самом конце вдоха, и она не меняется после кашля. Вызывают крепитацию жидкость или секрет в альвеолярном пространстве или терминальных бронхиолах. Грубые крепитирующие шумы можно выслушать в начале вдоха и во время выдоха. Они часто слышны у рта. Грубые крепитирующие шумы образуются при повышении бронхиальной секреции или уплотнении ткани легких. Этот звук может исчезать после нескольких глубоких вдохов или кашля.
Наблюдения, сделанные во время аускультации грудной клетки у маленьких детей, могут вводить врача в заблуждение, так как дети не могут сделать достаточно глубокий вдох для образования слышимых крепитаций или хрипов, несмотря на наличие жидкости в альвеолах и мелких дыхательных путях. В большинстве случаев у маленьких детей можно дождаться, по крайней мере, одного глубокого вдоха, а у старших детей врач может индуцировать более глубокое дыхание, прося их имитировать «задувание свечи».
В последнюю очередь (из-за наиболее негативно воспринимаемого детьми этапа осмотра) следует провести осмотр верхних дыхательных путей. Всегда следует проводить осмотр носа и определять проходимость носовых ходов. Исследование носовой раковины проводят с помощью отоскопа. У детей с ринитом, БА, МВ нередко можно обнаружить полипы в полости носа, а носовые раковины у детей с аллергией могут выглядеть рыхлыми и иметь синюшную окраску. При осмотре ротоглотки обращают внимание на размеры языка, целостность твердого и мягкого нёба, а также на наличие стекающего воспалительного отделяемого по задней стенке глотки, наблюдаемого при аденоидитах и синуситах. Необходимо обратить внимание на размер миндалин, наличие спаек между их дужками и миндалинами при хроническом тонзиллите. Следует провести пальпацию фронтального, этмоидального и максиллярного параназальных синусов на предмет болезненности. Эти физикальные данные в комбинации с исследованием возможной девиации трахеи и сердца, движений грудной клетки, перкуссии, присутствия или отсутствия дыхательных шумов помогают идентифицировать внутригрудную патологию.
1.3. ЭТИОЛОГИЯ СИНДРОМА ШУМНОГО ДЫХАНИЯ
Шумное дыхание у младенцев и детей - частая причина беспокойства и обращения к педиатру. К этим шумам относят храп, стридорозное и свистящее дыхание. Все они обусловлены турбулентным потоком воздуха, образующимся при обструкции дыхательных путей. Обструкция может локализоваться в любом месте от верхних дыхательных путей до дистальных отделов трахеобронхиального дерева. В табл. 1.4 представлены возможные причины шумного дыхания.
| Причины | Заболевания |
|---|---|
Анатомические |
Атрезия хоан |
Подглоточный стеноз |
|
Врожденная мембрана гортани |
|
Компрессия сосудистым кольцом |
|
Трахеоэзофагеальная фистула |
|
Краниофациальные аномалии: микрогнатия, макроглоссия, функциональные |
|
Инородные тела |
|
Врожденные пороки сердца |
|
Инфекционные |
Круп |
Эпиглоттит |
|
Заглоточный абсцесс |
|
Мононуклеоз |
|
Инфекции верхних дыхательных путей |
|
Функциональные |
Ларингомаляция |
Трахеомаляция |
|
Гастроэзофагеальный рефлюкс |
|
Обструктивные приступы апноэ во сне |
|
Неврологические |
Энцефалоцеле |
Корковый паралич |
|
Паралич голосовых связок |
|
Гипотония/гипорефлексия |
|
Неоплазии |
Опухоли гортани: папиллома, гемангиома |
Медиастинальные опухоли |
|
Гигрома, ангио-, нейрофиброма |
|
Метаболические |
Болезни накопления |
Шумное дыхание встречают как при доброкачественных заболеваниях, так и при жизнеугрожающей обструкции дыхательных путей. Предрасполагают к развитию обструкции анатомо-физиологические особенности: узость дыхательных путей, недостаточная эластичность легких, податливость хрящей бронхиального дерева, недостаточная ригидность грудной клетки, склонность к формированию отеков, гиперсекреция вязкой слизи, слабое развитие гладкой мускулатуры бронхов у детей. Именно поэтому незначительное увеличение продукции секрета и небольшой отек слизистой оболочки приводят к значительному сужению просвета дыхательных путей, которое, в свою очередь, приводит к выраженному повышению сопротивления в них. Кроме того, дыхательные пути ребенка структурно более податливы, подвержены коллапсу от инспираторного давления, служащего результатом повышения резистентности дыхательных путей. Это вызывает дальнейшее сужение дыхательных путей, в тяжелых случаях приводя к развитию дыхательной недостаточности (ДН).
Поскольку шумное дыхание может быть вызвано многими причинами с обструкцией дыхательных путей различной локализации, то обследование может быть весьма сложным. Главной задачей в этом случае служит определение уровня локализации и тяжести обструкции. Анамнез и физикальный осмотр могут выявить этиологию и локализацию процесса, но всегда необходима прямая визуализация обструкции.
Обструкцию верхних дыхательных путей определяют как блокаду части дыхательных путей, локализованную выше места бифуркации трахеи. Обструкцию верхних дыхательных путей определяют во время вдоха, так как давление в верхних дыхательных путях отрицательно относительно атмосферного давления. Данное отрицательное давление может вызывать характерные шумы, ассоциированные с обструкцией верхних дыхательных путей. Последняя представлена как обструкцией носа, ассоциированной с ринитом, так и угрожающей жизни блокадой гортани или верхней части трахеи. Обструкция носа обычно более неприятна, чем опасна, так как возможно ротовое дыхание; но она может стать серьезной проблемой у новорожденных, которые дышат преимущественно через нос. Спектр заболеваний, вызывающих обструкцию верхних дыхательных путей, представлен в табл. 1.5.
| Возраст | Наиболее частые причины обструкции |
|---|---|
Новорожденные |
Аспирация меконием, амниотической жидкостью |
Врожденный подсвязочный стеноз |
|
Атрезия хоан |
|
Микрогнатия (синдром Робена, синдром Коллинза, синдром Ди Джорджи) |
|
Новорожденные |
Макроглоссия (синдром Беквита-Видемана, гипотиреоз, болезнь Помпе, трисомия 21, гемангиома) |
Мембрана, расщелины, атрезия гортани |
|
Ларингоспазм (интубация, аспирация, транзиторный) |
|
Паралич голосовых связок (слабый крик, моно- или билатеральный, с повышением внутричерепного давления или без него при синдроме Арнольда-Киари или другой патологии ЦНС) |
|
Мембрана, стеноз, маляция, атрезия трахеи |
|
Глоточный коллапс (причина апноэ у недоношенных новорожденных) |
|
Смещение назального хряща |
|
Стеноз грушевидной апертуры носа |
|
Носовое энцефалоцеле |
|
Грудной возраст |
Вирусный круп (наиболее частая этиология у детей от 6 мес до 4 лет) |
Бактериальный трахеит (токсический, высокая температура) |
|
Инородное тело дыхательных путей или пищевода (внезапный кашель) |
|
Ложный (рецидивирующий) круп |
|
Папилломатоз гортани |
|
Заглоточный абсцесс |
|
Гипертрофия миндалин или аденоидов |
|
Тимомегалия |
|
Дифтерия (нечасто) |
|
Младенцы |
Ларингомаляция (наиболее частая этиология) |
Подсвязочный стеноз (врожденный, приобретенный после интубации) |
|
Гемангиома |
|
Опухоль языка (дермоидная, тератома, эктопия щитовидной железы) |
|
Дискинезия гортани |
|
Папилломатоз гортани |
|
Сосудистое кольцо |
|
Риниты |
|
Дети в возрасте старше 2 лет |
Эпиглоттиты (надгортанник, складки надгортанника) |
Ингаляционные повреждения (ожоги, токсические газы, углеводороды) |
|
Инородные тела |
|
Медикаментозные риниты |
|
Ангионевротический отек (семейный анамнез) |
|
Анафилаксия (аллергический анамнез, стридор, гипотензия) |
|
Травма (перелом трахеи или гортани) |
|
Перитонзиллярный абсцесс (подростки) |
|
Мононуклеоз |
|
Ангина Людвига (гнилостная аденофлегмона) |
|
Дифтерия (нечасто) |
1.4. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ОБСТРУКЦИИ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Клиническим проявлением, наиболее часто связанным с обструкцией верхних дыхательных путей, считают инспираторный стридор, реже он может проявляться в виде экспираторного шума.
Стридор - грубый звук, образующийся в гортани, вызванный вибрацией из-за турбулентного воздушного потока при прохождении через суженный участок верхних дыхательных путей. Наиболее важными характеристиками стридора считают его громкость, высоту и фазу дыхания, на которой он появляется (табл. 1.6).
| Качество | Характеристика |
|---|---|
Громкость |
|
Громкий звук |
Выраженное сужение дыхательных путей |
Внезапное ослабление звука (при выраженном стридоре) |
Усилившаяся обструкция, ослабление дыхательных движений, возникновение коллапса дыхательных путей |
Высота звука |
|
Высоко звучащий стридор |
Обструкция на уровне голосовых связок |
Низко звучащий стридор |
Обструкция выше голосовых связок - верхний отдел гортани, гортанная часть глотки |
Средняя высота стридора |
Обструкция ниже голосовых складок |
Фаза дыхания |
|
Инспираторный стридор |
Поражение выше голосовых складок - коллапс мягких тканей при отрицательном давлении во время вдоха |
Двухфазный стридор |
Поражение на уровне голосовых складок либо подскладочного отдела |
Экспираторный стридор |
Поражение на уровне нижних отделов дыхательных путей |
Охриплость свидетельствует о вовлечении голосовых связок. Если стридорозное дыхание меняется при изменении положения головы или шеи ребенка, это свидетельствует о надскладочной этиологии стридора. У детей с ларингомаляцией или глоточной гипотонией стридор уменьшается во время крика в связи с усилением мышечного тонуса. Наоборот, обструктивные поражения ниже голосовой щели при крике из-за увеличения скорости вдыхаемого потока обычно вызывают усиление стридора. У многих детей стридор уменьшается во время сна, так как в это время наименьшая скорость инспираторного потока. Позиционный стридор может свидетельствовать об анатомических особенностях организма. Дети с обструкцией верхних дыхательных путей обычно имеют втяжение над грудиной вследствие разницы давления в трахее и атмосфере. Обструкция в нижних дыхательных путях редко приводит к надгру-динной ретракции у детей. Дифференциальная диагностика между подскладочной и надскладочной обструкцией представлена на рис. 1.1 (см. цв. вклейку) и в табл. 1.7.
| Признак | Надсвязочные (надскладочные) | Подсвязочные (подскладочные) |
|---|---|---|
Стридор |
Тихий |
Громкий |
Голос |
Приглушенный |
Хриплый |
Дисфагия |
Да |
Нет |
Сидячее положение тела или выгибание спины |
Да |
Нет |
Лающий кашель |
Нет |
Да |
Лихорадка |
Высокая (40 °С) |
Низкой степени (38-39 °С) |
Токсичность |
Да |
Нет, если нет трахеита |
Тризм |
Да |
Нет |
Слюнотечение |
Да |
Нет |
Отек лица |
Нет |
Нет, если нет ангионевро-тического отека |
В ситуациях внезапного появления стридора или при невозможности исключения быстрой прогрессии обструкции дыхательных путей (например, при эпиглоттите) необходимо немедленно начать лечение. Если данные за обструкцию неубедительны, необходимо дальнейшее обследование. Шумное дыхание может исчезнуть во время кашля, при крике, плаче, так как наиболее частой причиной у детей, приводящей к шумному дыханию, является скопление слизи в верхних дыхательных путях вследствие инфекции. Для определения этиологии шумного дыхания необходимо придерживаться четкого плана проведения адекватных и информативных диагностических тестов. Нередко может потребоваться направление этих пациентов к оториноларингологу для лечения выявленных аномалий дыхательных путей.
У новорожденных и младенцев может возникнуть шумное дыхание или стридор с 1-го месяца жизни (табл. 1.8). Стридор у новорожденных считают симптомом частичной обструкции дыхательных путей большого диаметра, уровень поражения оценивают исходя из характеристик стридора и сопутствующих признаков (срыгивание, цианоз). Необходимо обращать внимание на изменение характеристик крика или хрипов, наличие кашля или других признаков инфекции верхних дыхательных путей, а также на любые эпизоды апноэ или цианоза. Исчезновение симптомов при изменении положения тела также служит важным диагностическим признаком. Всем больным с врожденной патологией гортани и трахеи необходимо медико-генетическое консультирование.
| Критерий | Характеристика |
|---|---|
Ларингомаляция |
|
Анатомическая классификация |
Аномалия развития надгортанника - мягкий надгортанник, западающий в просвет гортани |
Аномалия развития черпаловидных хрящей и черпалонадгортанной складки |
|
Смешанная форма - западение надгортанника и черпаловидных хрящей в просвет дыхательных путей |
|
Клиническая картина |
Обычно протекает «доброкачественно» и самопроизвольно исчезает к 1,5-2 годам жизни. Мальчики страдают в 2 раза чаще. Стридор обычно появляется с рождения. Симптомы могут быть преходящими и усиливаться при положении ребенка на спине, во время крика и возбуждения. У большинства детей - только шумное дыхание. В некоторых случаях ларингомаляция может вызывать признаки стеноза гортани |
Принципы лечения |
В случае клинической картины только шумного дыхания оперативное лечение не показано, стридор исчезает к 1,5-2 годам. При признаках стеноза гортани могут потребоваться интубация и трахеотомия. В тяжелых случаях показано оперативное лечение - нанесение надрезов на надгортаннике, рассечение черпалонадгортанных складок или удаление части черпаловидных хрящей |
Паралич голосовых складок |
|
Причины |
Обнаруживают у детей с другими врожденными аномалиями, поражением центральной нервной системы |
Идиопатические |
|
Ятрогенная - при травме возвратного гортанного нерва |
|
Клиническая картина |
Высокотональный стридор и афония при двустороннем параличе. Слабый крик при одностороннем параличе, сила голоса с возрастом постепенно возрастает, дыхательная функция не страдает |
Лечение |
Около 50% детей с двусторонним параличом нуждаются в трахеотомии |
Врожденные рубцовая мембрана и подскладочный стеноз |
|
Причины развития |
В результате неполного разделения зародышевой мезенхимы между двумя стенками формирующейся гортани. Чаще обнаруживают приобретенные рубцовые стенозы как результат продленной чрезгортанной назотрахеальной интубации |
Клиническая картина |
Признаки обструкции верхних дыхательных путей - двухфазный стридор, тахипноэ, цианоз, беспокойство, раздувание крыльев носа, участие в акте дыхания вспомогательной мускулатуры. При локализации мембраны в области голосовых складок отмечают нарушения голоса вплоть до афонии. Полная атрезия гортани практически не совместима с жизнью. Рубцовая мембрана, локализующаяся только в области передней комиссуры, клинически проявляется только изменением голоса («петушиный крик») |
Лечение |
При выборе тактики лечения необходимо учитывать, что дыхание может улучшаться с ростом гортани. Дети с небольшой переднекомиссуральной синехией могут быть оставлены под наблюдением без оперативного лечения. Больные с мембраной средних размеров, вызывающей нарушение дыхания, требуют лазерной деструкции в период новорожденности. Дети с выраженной мембраной нуждаются в трахеотомии в период новорож-денности с последующей операцией (с помощью лазера или наружным доступом) в более старшем возрасте |
Кисты гортани |
|
Клиническая картина |
Стридор возникает при росте кисты в просвет дыхательных путей или сдавлении мягких тканей гортани. Дисфагия при локализации на гортанной и язычной поверхности надгортанника. Часто кисты развиваются у детей с интубацией в анамнезе, могут быть множественными. Небольшие кисты голосовых складок клинически проявляются только охриплостью |
Лечение |
Для лечения используют аспирацию содержимого кисты с последующим иссечением ее стенок микроинструментами или СО2 -лазером |
Подскладковая гемангиома |
|
Клиническая картина |
Угрожает жизни ребенка. Средняя летальность составляет 8,5%. Гемангиома имеется с рождения и подвергается росту в течение первых месяцев жизни. Стридор обычно появляется на 2-3-м месяце жизни, первые симптомы заболевания обычно ошибочно диагностируют как круп. Стридор двухфазный, голос может быть не изменен. Более половины детей имеют гемангиомы кожи. Девочки страдают чаще мальчиков. Тяжесть заболевания зависит от размера гемангиомы. В случае присоединения острой респираторной вирусной инфекции (ОРВИ) или при беспокойстве дыхание может ухудшаться |
Лечение |
Используют СО2 -лазерную деструкцию гемангиомы с последующей гормональной терапией |
Трахеомаляция |
|
Классификация |
Диффузная и локальная форма трахеомаляции |
Клиническая картина |
Проявляется экспираторным стридором. При эндоскопии обнаруживают резкое сужение на выдохе просвета трахеи, которая может принимать различную форму. Симптомы заболевания часто спонтанно исчезают на 2-3-м году жизни |
Лечение |
При выраженных дыхательных нарушениях может потребоваться трахеотомия |
Врожденный стеноз трахеи |
|
Классификация |
Органический стеноз - связан с локальным дефектом хрящевых полуколец трахеи или избыточным образованием хрящевой ткани, приводит к формированию твердого хрящевого выпячивания в просвет трахеи |
Функциональные стенозы связаны с чрезмерной мягкостью хрящей - локальная форма трахеомаляции |
|
Клиническая картина |
Экспираторный стридор сразу после рождения. Стридор усиливается при беспокойстве или кормлении ребенка, резко ухудшается во время ОРВИ. Приступы удушья, ошибочно диагностируемые как круп. Для исключения сдавливания трахеи извне необходимо рентгеноконтрастное исследование пищевода |
Лечение |
Благоприятный прогноз, в большинстве случаев спонтанно излечиваются |
Сосудистое кольцо |
|
Причины |
Аномальная конфигурация больших сосудов (удвоение дуги аорты, добавочная левая легочная артерия) может вызывать сдавление дистальных отделов трахеи |
Клиническая картина |
Стридор усиливается при плаче или кормлении, положении ребенка на спине. Срыгивание, дисфагия. Диагноз устанавливают с помощью рентгенографии пищевода с рентгеноконтрастным препаратом и аортографии |
Лечение |
Хирургическое |
Трахеопищеводный свищ |
|
Причины |
В основе порока лежит неполное развитие трахеопищеводной стенки, сочетаясь с атрезией пищевода |
Клиническая картина |
Проявляется при первом же кормлении ребенка тяжелыми приступами удушья, кашля и цианоза. Быстро присоединяется тяжелая аспирационная пневмония |
Лечение |
Хирургическое вмешательство на ранних сроках |
Появление или ухудшение симптомов во время кормления характерно для аспирации, что может быть следствием ларинготрахеальной расщелины или трахео-эзофагеального свища. Предшествующие эпизоды интубации могут свидетельствовать о наличии подсвязочного или трахеального стеноза (рис. 1.2, см. цв. вклейку).
Важно также обратить внимание на постоянный характер дыхательных шумов или наличие периодов, когда они исчезают. Нужно оценить характер дыхательных шумов во время глубокого сна, когда спонтанный дыхательный объем у ребенка уменьшается. Храп во сне может свидетельствовать об обструктивных приступах апноэ во сне, вызываемых, как правило, гипертрофией аденоидов или миндалин.
Для функциональных нарушений, таких как ларингомаляция, характерно улучшение состояния в покое или при спокойном дыхании.
Необходимо отметить также любые сочетанные нарушения акта глотания. У всех детей, начинающих ходить, в случае появления острых симптомов следует в первую очередь подумать о проглатывании или аспирации инородного тела. Несмотря на то что проглоченный предмет может находиться в пищеводе, он может давить на заднюю стенку трахеи и частично перекрывать ее просвет. У детей школьного возраста и подростков появление одышки и боли в груди может свидетельствовать об опухоли средостения. Нужно помнить о ГЭР, а также обратить внимание на связь дыхательных шумов с кашлем и отметить их особенности.
Аускультация будет более информативной, если дополнительные дыхательные шумы соотносить с фазой дыхательного цикла. Для обструкции верхних дыхательных путей характерен стридор, возникающий на вдохе. Шумы из крупных дыхательных путей, связанные с трахеомаляцией, слышны на выдохе, но при тяжелой обструкции их выслушивают и на вдохе, и на выдохе. Чтобы дифференцировать шумы из верхних отделов дыхательных путей от шумов из нижних отделов, следует провести аускультацию через рот и прослушать боковые поверхности шеи. Если ребенок спокойно реагирует на осмотр, врач при осмотре может попробовать его немного растормошить, чтобы выявить патологические дыхательные шумы или оценить новые, появляющиеся при увеличении объема дыхания. У младенцев дыхательные шумы необходимо оценивать в положении на спине и животе, так как надларингеальная обструкция ухудшается в положении на спине.
Пальпация печени и селезенки во время обследования органов пищеварения помогает заподозрить болезни накопления, которые могут обусловливать патологические дыхательные шумы вторично за счет инфильтрации гортани. Очень важен тщательный неврологический осмотр на предмет гипотонии или дисрефлексии.
1.5. ДИАГНОСТИКА
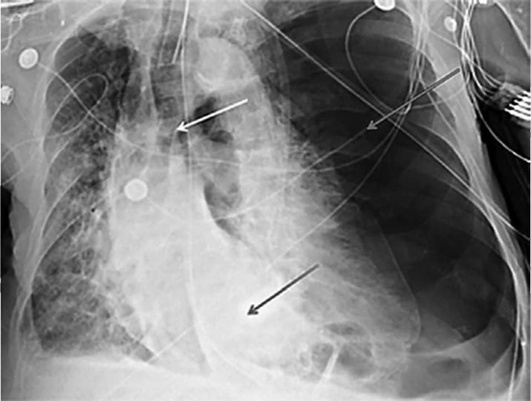
Всем детям с шумным дыханием необходимо выполнить рентгенографию органов грудной клетки в двух проекциях (прямой и боковой). На рентгенограмме следует внимательно оценить тень сердца и крупных сосудов, определить их размер и ориентацию. К примеру, при сдавлении трахеи извне сосудистым кольцом диагноз можно предположить с помощью рентгенографии пищевода с рентгеноконтрастным препаратом и аортографии (рис. 1.3).
При подозрении на наличие трахеопищеводного свища при проведении контрастной рентгенографии можно обнаружить затекание рентгеноконтрастного вещества через трахеопищеводный свищ из пищевода в трахеобронхиальное дерево.
Поражение легких может быть вторичным вследствие аспирации, инфекции или патологии со стороны сердца. Необходимо тщательно исследовать органы грудной клетки для выявления опухоли, так как компрессия дыхательных путей опухолью часто приводит к появлению шумного дыхания.
Рентгенографические исследования ребенка со стридором должны включать исследования боковых проекций шеи и носоглотки и прямую проекцию шеи, сделанную в момент разгибания головы (рис. 1.4).
Пространство под голосовой щелью на прямой проекции должно быть симметричным, а латеральные стенки дыхательных путей должны круто спадаться. Асимметрия свидетельствует о подскладочном стенозе или повреждении объемным образованием, тогда как узкое конусовидное сужение свидетельствует о подскладочном отеке.
Прямая визуализация дыхательных путей служит самым информативным методом при шумном дыхании. Основным способом диагностики считают эндоскопию (рис. 1.5, 1.6, см. цв. вклейку). Гибкий эндоскоп позволяет четко определить динамическую компрессию, так как пациенты получают лишь небольшую седацию и дышат самостоятельно. Однако для проведения полного обследования задней части глотки может потребоваться жесткая бронхоскопия.
При подозрении на опухоль головы, шеи или средостения показано проведение компьютерной томографии (КТ). Стеноз и атрезию хоан лучше всего визуализируют с помощью КТ. Аномалии строения сосудов, которые могут вызывать наружную компрессию дыхательных путей, например, аномалии дуги аорты, компрессию безымянной артерии и левого или правого главного бронха легочными артериями, лучше всего визуализируют при магнитно-резонансной томографии (МРТ). Ее лучше проводить после того, как наружная компрессия будет доказана на бронхоскопии. Поиск метаболических нарушений проводят по клиническим показаниям.
В педиатрической практике при обследовании детей с шумным дыханием могут применять методики полисомнографии. Клиническую оценку тяжести обструкции и определение этиологии проводят по данным обследования неврологической, сердечно-сосудистой и дыхательной систем.
Шумное дыхание может быть постоянным или периодическим. Как правило, стридор слышен на выдохе и обусловлен частичной обструкцией дыхательных путей. Хотя чаще всего свистящие хрипы наблюдают при астме, любое заболевание, приводящее к сужению дыхательных путей, может сопровождаться хрипами.
Ключевыми признаками для определения этиологии хрипов служат возраст пациента и время появления симптомов. Периодический, генерализованный и полифонический стридор (комбинация звуков различной высоты) характерен для астмы. Если такой же шум выслушивают у младенца с симптомами инфекции верхних дыхательных путей и при отсутствии подобных эпизодов в прошлом, более вероятен диагноз ложного крупа. Для фиксированной обструкции крупных дыхательных путей, вызванной аспирацией инородного тела, характерно внезапное появление мономорфного (звук одного тона) стридора постоянной локализации. Если в подобной ситуации наблюдают прогрессию стридора, более вероятно наружное сдавление дыхательных путей увеличенными лимфатическими узлами или любой другой массой в грудной клетке.
Несмотря на то что стридор чаще встречают при респираторных заболеваниях, некоторые пациенты могут самостоятельно его вызывать во время агравирован-ного форсированного выдоха при астме. И наоборот, отсутствие хрипов не гарантирует отсутствия значительной обструкции дыхательных путей. Действительно, при прогрессии обструкции до полной или почти полной непроходимости будет обращать на себя внимание ослабление, вплоть до полного отсутствия, стридо-розных шумов при аускультации на фоне увеличивающегося затруднения дыхания и дыхательной нагрузки, что считают симптомом тяжелого респираторного дистресса.
Дифференциальная диагностика стридора весьма широка, и всегда следует думать о других причинах его возникновения, даже у пациентов с БА в анамнезе. Частая причина появления стридора у детей в возрасте от 1 до 3 лет - проглатывание или аспирация инородного тела (рис. 1.7). Давление последнего на дыхательные пути провоцирует появление кашля, и для этой проблемы характерны локализованные односторонние хрипы.
Выявление на рентгенограмме вторичного асимметричного перерастяжения, обусловленного клапанным эффектом, требует немедленных действий. Проведение рентгенографии органов грудной клетки на вдохе и выдохе может привести к усилению асимметричного перерастяжения и помогает в уточнении диагноза. У младенцев, которые не могут произвольно вдохнуть и выдохнуть, боковая рентгенография справа и слева в положении лежа может выявить перерастяжение, так как в таком положении средостение не смещается в сторону пораженного легкого. Однако рентгенография будет информативной, только если инородное тело рентгеноконтрастно. У детей самым распространенным инородным телом является арахис. При аспирации инородного тела у детей симптомы могут отсутствовать вплоть до развития вторичной инфекции.
1.6. ОБСТРУКЦИЯ НИЖНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ
В противоположность закупорке верхних дыхательных путей, обструкция нижних дыхательных путей чаще сопровождается экспираторной, нежели инспираторной, одышкой. Во время вдоха внутригрудное давление становится отрицательным относительно атмосферного. Следовательно, дыхательные пути имеют тенденцию увеличивать свой диаметр во время вдоха, и, если нет реальной, относительно фиксированной, обструкции (или увеличения секреции в дыхательных путях), во время вдоха производится немного дыхательных шумов или их совсем нет. Давление внутригрудное увеличивается относительно атмосферного во время выдоха, таким образом имея тенденцию к коллапсу внутри-грудных дыхательных путей и вызывая свистящее дыхание. Свист (wheezing) - относительно непрерывный экспираторный звук, обычно более музыкальный, чем стридор, который вызывается турбулентным потоком воздуха. Частичная обструкция дыхательных путей может вызывать свист только во время поздней фазы выдоха.
Этиология свистящего дыхания множественна (табл. 1.9), наиболее частая причина - диффузная бронхиальная обструкция в результате сокращения гладкой мускулатуры бронхов, воспаления дыхательных путей или избыточной секреции.
| Механизмы развития | Острые причины | Хронические или рецидивирующие причины |
|---|---|---|
Реактивные заболевания дыхательных путей |
БА, реакции гиперчувствительности |
Реакции гиперчувствительности, аллергический аспергиллез |
Отек бронхов |
Инфекции, вдыхание раздражающих газов или макрочастиц, повышение венозного легочного давления |
Застойная СН |
Гиперсекреция бронхов |
Инфекции, вдыхание раздражающих газов или макрочастиц, холинергические препараты |
Бронхиты, бронхоэктазы, МВ, цилиарная дискинезия |
Аспирация |
Инородные тела, аспирация содержимого желудка |
Инородное тело, желудочно-пищеводный рефлюкс, трахео-пищеводный свищ |
Динамический коллапс дыхательных путей |
- |
Бронхо-, трахеомаляция |
Компрессия дыхательных путей опухолью или кровеносными сосудами |
- |
Сосудистое кольцо, аномальная безымянная артерия, дилатация легочной артерии (отсутствие легочного клапана), кисты бронхов и легких, лимфатические узлы или опухоли |
Внутренние поражения дыхательных путей |
- |
Эндобронхиальные опухоли и грануляции, стеноз бронхов или трахеи, облитерирующий брон-хиолит, последствия бронхолегочной дисплазии (БЛД) |
1.7. ЭПИДЕМИОЛОГИЯ СИНДРОМА СВИСТЯЩЕГО ДЫХАНИЯ
Шумное свистящее дыхание (в англоязычной литературе - wheezing) считают признаком синдрома бронхообструкции, занимает одно из первых мест в клинической картине респираторных заболеваний у детей и встречается практически у каждого 3-го ребенка (по разным данным, частота wheezing у детей раннего возраста - от 3 до 30%). Более чем у половины детей эпизоды свистящего дыхания рецидивируют.
Wheezing - комплекс симптомов, таких как экспираторная одышка, спазматический кашель, удушье, которые развиваются вследствие прогрессирующего нарушения бронхиальной проходимости. Патофизиологической основой синдрома свистящего дыхания (wheezing) бывают отек и гиперплазия слизистой оболочки вследствие воспаления, бронхоспазм, гиперпродукция вязкого секрета и нарушение мукоцилиарного клиренса.
Наиболее частой причиной свистящего дыхания у детей служат реактивные заболевания дыхательных путей. Свистящее дыхание, начинающееся в первые недели или месяцы жизни и персистирующее, несмотря на максимальную бронхо-дилатирующую терапию, требует диагностического поиска. Из-за небольшого размера дыхательных путей у детей в возрасте до 2-3 лет жизни вирусная инфекция часто сопровождается обструкцией.
Наиболее важной причиной бронхиальной обструкции у детей раннего возраста служит воспаление, вызванное вирусной инфекцией (вирус парагриппа, риносинтициальный вирус, аденовирус). По данным ряда клинических исследований, риносинтициальный вирус считают наиболее частой причиной обструкций (обструктивный бронхит, бронхиолит) у детей раннего возраста (согласно различным исследованиям, риносинтициальный вирус был причиной бронхооб-струкции от 40 до 78% случаев). Наиболее тяжело протекает бронхиолит, являясь лидирующей причиной госпитализации детей раннего возраста. Отмечена высокая частота рецидивирующих обструкций после перенесенного бронхиолита, вызванного риносинтициальным вирусом (рис. 1.8, см. цв. вклейку). Так, по данным проспективного исследования 47 детей в возрасте до 1 года, госпитализированных с клинической картиной бронхиолита, вызванной риносинтициальной инфекцией, в дальнейшем частота повторных эпизодов обструкции и выставленного клиницистом диагноза БА в возрасте 7 и 13 лет была достоверно выше в сравнении с группой контроля.
Известно, что наиболее тяжело бронхиолит протекает у недоношенных. В этой связи интересны данные исследования по профилактике риносинтициальной инфекции у 429 недоношенных (33-35 нед) здоровых детей, получавших паливизумаб (214 детей) либо плацебо (215 детей) в течение месяца в сезон риносинтициальной инфекции. Применение паливизумаба достоверно уменьшало частоту госпитализаций по поводу риносинтициальной инфекции (с 5,1 до 0,9%), на 65% снижало количество дней с эпизодами свистящего дыхания в течение 1-го года жизни (рис. 1.9).
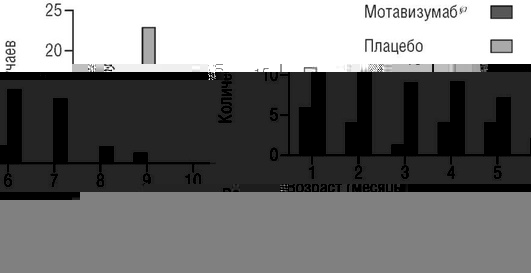
В другом рандомизированном американском исследовании у 2127 здоровых недоношенных детей (33-36 нед), получавших 5 доз мотавизумабаρ в течение месяца, отмечалось уменьшение госпитализаций на 87% в сравнении с группой пациентов, получавших плацебо (рис. 1.10).
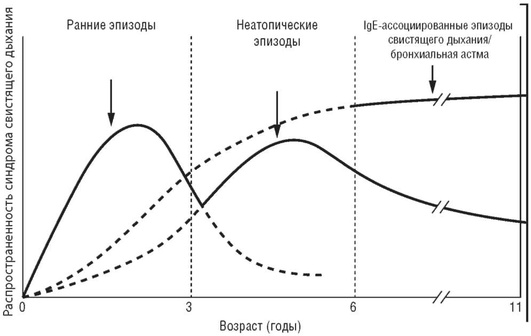
Ряд авторов указывают на то, что в раннем возрасте возможно развитие транзиторного состояния бронхиальной обструкции, обусловленное анатомо-физиологическими особенностями на фоне вирусных инфекций, которое исчезает к 6 годам и не ведет к формированию какой-либо нозологической формы в более позднем возрасте. Долгосрочные исследования в течение 11 лет наблюдения за 1246 детьми, перенесшими эпизоды свистящего дыхания (рис. 1.11), демонстрируют, что при раннем старте обструкций («транзиторные ранние свистельщики - transient early wheezers») к 3 годам частота эпизодов свистящего дыхания значительно снижается (Tucson study); также в этом исследовании отмечено, что при старте эпизодов свистящего дыхания к 3-летнему возрасту частота обструкций и выставленного диагноза БА значительно возрастает у детей с IgE-опосредованной сенсибилизацией (IgE-обусловленные «свистельщики» - IgE-associated wheeze/ asthma) и снижается в группе детей без атопии (non-atopic wheezers).
E.Horak и соавт. в своем исследовании также отмечают наибольшую частоту формирования БА у детей с повторными эпизодами бронхообструкции на фоне сопутствующей атопии, наследственной отягощенности и выявленной сенсибилизации.
Синдром свистящего дыхания служит признаком какого-либо заболевания, диагноз уточняют с помощью клинико-анамнестических данных, лабораторных и инструментальных методов обследования. Для определения обратимости бронхиальной обструкции полезно применение бронходилататоров. Свистящее дыхание, локализованное в одной области грудной клетки, считают очень опасным симптомом, который требует немедленного диагностического поиска, так как чаще всего вызвано инородным телом бронха, компрессией бронха увеличенными лимфатическими узлами средостения, парабронхиальными кистами и опухолями.
Дети, у которых диагностировано реактивное заболевание дыхательных путей, не нуждаются в рентгенографическом обследовании при каждом эпизоде свистящего дыхания. Детям со значительным РДС, лихорадкой, аспирацией в анамнезе, локальной симптоматикой в легких или персистирующим свистом должны выполнять снимки грудной клетки в прямой и боковой проекциях как часть их диагностического обследования. Генерализованное вздутие грудной клетки с уплощением диафрагмы и увеличением переднезаднего диаметра грудной клетки свидетельствует о диффузной обструкции мелких дыхательных путей. Локализованное расширение, особенно на экспираторных снимках, говорит о локализованной бронхиальной обструкции, как при инородном теле или анатомических аномалиях.
Синдром свистящего дыхания (wheezing) также характерен для детей с неспецифическими хроническими заболеваниями легких (ХЗЛ), такими как МВ, врожденные пороки развития бронхов и легких (синдром Вильямса-Кемпбелла, Зиверта-Картагенера, первичная цилиарная дискинезия), хронические бронхолегочные процессы на фоне иммунодефицита (ИД). Механизмы обструкции обусловлены фибропластическими изменениями стенок бронхов, стенозом, деформацией и облитерацией просвета бронхов, развитием экспираторного коллапса бронхов, эмфиземы легких. Причины wheezing при неспецифических ХЗЛ связаны с морфологическими изменениями (деформация, бронхомаляция), хроническим воспалением, вызванным бактериальной флорой, нарушением мукоцилиарного клиренса из-за повышения вязкости слизи (МВ), нарушением эвакуации (синдром Картагенера, цилиарная дискинезия и др.). Бронхиальная обструкция способствует рецидивирующему течению инфекционного и воспалительного процесса, служит основой для его прогрессирования и распространения. Wheezing при ХЗЛ у детей имеет особенности: одышка в покое выражена умеренно, отсутствуют характерные приступы затрудненного дыхания, удушья; отмечают неполный и поздний эффект при использовании бронходилататоров. У детей с неспецифическими ХЗЛ обструкция в ряде случаев может быть обусловлена бронхолегочным аспергиллезом, пневмоцистной инфекцией. Бронхиальная обструкция при неспецифических ХЗЛ часто принимает хроническое течение, приводя к необратимым изменениям стенок бронхов, усиливаясь при обострении основного заболевания.
1.8. МЕТОДЫ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ ОРГАНОВ ДЫХАНИЯ
РЕНТГЕНОГРАФИЯ
Рентгенография грудной клетки служит методом диагностики респираторных заболеваний у детей. Насколько технически корректно будет она проведена, настолько правильно она будет интерпретирована. Для снижения лучевых нагрузок на ребенка рекомендовано использовать рентгенодиагностические аппараты, оборудованные цифровыми усилителями рентгеновского изображения. Наиболее частая проблема у детей при рентгеновском обследовании - невозможность получить адекватный вдох. Наружные кожные складки, ротация или другая неправильная позиция грудной клетки или движения при рентгеновском исследовании также могут вызвать искажение или неясное изображение.
Диагностической находкой у детей с длительным респираторным анамнезом (повторные бронхиты и пневмонии) может быть обнаружение декстрокардии на рентгенограмме, что в сочетании с обратным расположением внутренних органов, бронхоэктазами и пансинуситом говорит о генетическом дефекте ресничек (синдром Зиверта-Картагенера) (рис. 1.12).
Ребенку со стридором необходимо проведение рентгенографии грудной клетки в двух проекциях (прямой и боковой) для оценки тени сердца и крупных сосудов, органов дыхания в случае сдавления дыхательных путей извне различными образованиями.
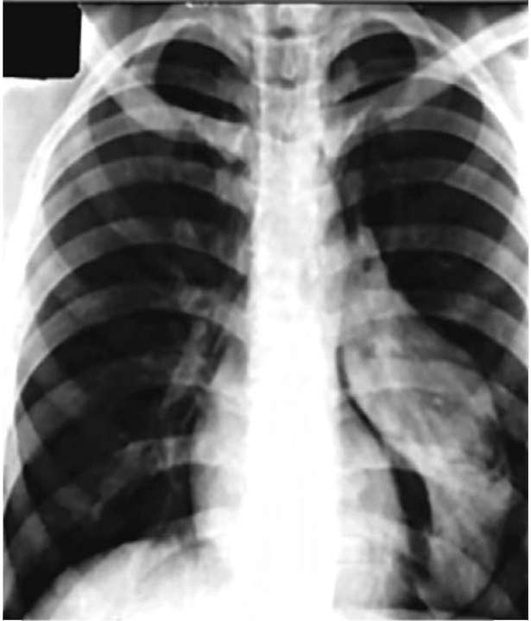
При бронхопневмонии на рентгенограмме обнаруживают инфильтраты, усиление легочного рисунка между ними и корнем легкого, размытость структуры корня. Рентгенография необходима при резком ухудшении состояния ребенка, например при подозрении на пневмоторакс у ребенка с обструкцией нижних дыхательных путей, о чем могут свидетельствовать быстрое нарастание острой ДН (ОДН), уменьшение частоты сердечных сокращений (ЧСС) и артериального давления (АД) или нарушение кровообращения, ослабление дыхательных шумов при аускультации (рис. 1.13-1.15).
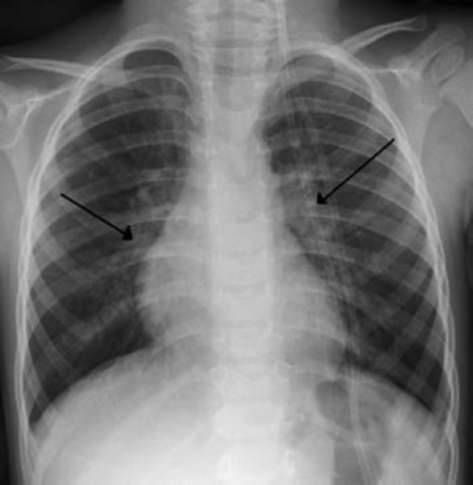
Рентгенографию грудной клетки следует проводить в прямой и боковой проекциях. Экспираторные проекции или флюороскопии помогают в определении наличия частичной обструкции бронхов, при которой легкое или его доля вследствие эмфиземы выглядят раздутыми. Флюороскопию используют также для оценки подвижности диафрагмы и функции диафрагмального нерва.
Частые бронхопневмонии раннего детского возраста приводят к тому, что поражаются еще не окрепшие стенки бронхов и развиваются бронхоэктазы (бронхо-эктатическая болезнь). Диагностировать бронхоэктазы можно лишь с помощью бронхографии, которую у детей выполняют под наркозом в рентгеновском кабинете с одновременным контрастированием бронхов обоих легких водорастворимым контрастным препаратом.
При проведении бронхографии встречают смешанные бронхоэктазы, когда обнаруживают цилиндрические и мешотчатые деформации. Расположенные в верхних долях кистовидные бронхоэктазы нередко имеют туберкулезный генез и возникают в результате посттуберкулезного сужения бронха. Мешотчатые брон-хоэктазы на бронхограммах видны в виде слепо заканчивающихся, резко расширенных бронхов IV-VI порядков, сближенных между собой и лишенных боковых ветвей (рис. 1.16).
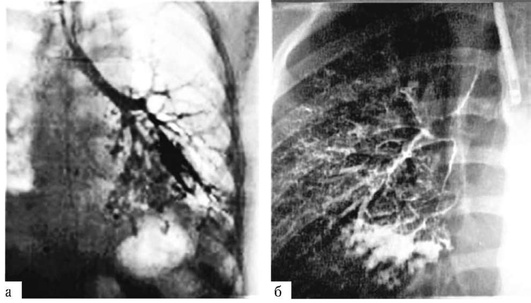
Наиболее информативны бронхограммы в боковых проекциях, на которых хорошо видны не только долевые, но и сегментарные бронхи. В норме бронхи заполняются контрастным веществом вплоть до терминальных разветвлений, при этом они равномерно суживаются к периферии и имеют ровные гладкие контуры.
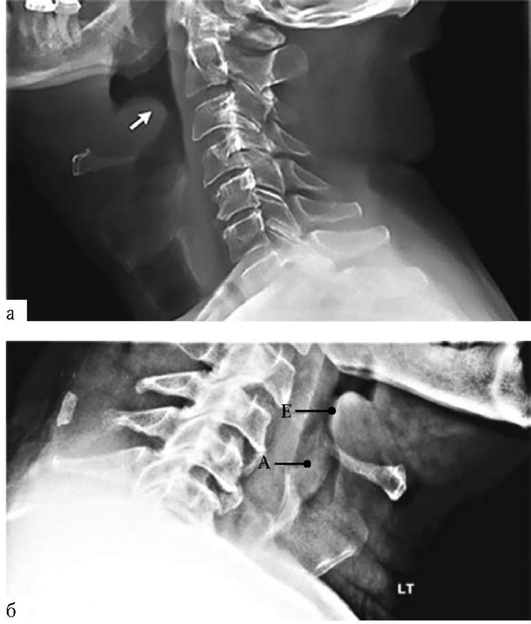
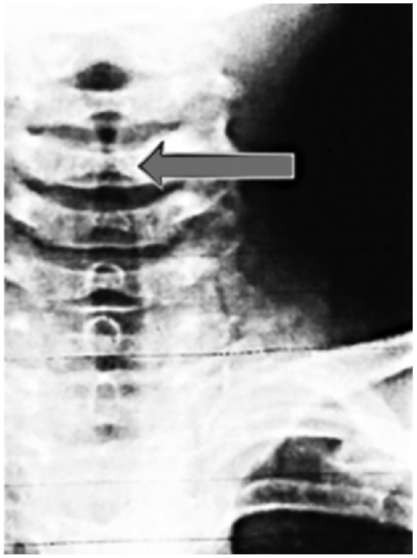
Рентгенография органов шеи в боковой проекции помогает оценить состояние верхних дыхательных путей, заглоточного пространства, области над голосовой щелью и под ней и дифференцировать над- и подскладочный отек (рис. 1.17, 1.18).
Эзофагография с бария сульфатом часто имеет большое значение в диагностике заболеваний грудной клетки у детей. Нарушения глотания или перистальтики пищевода, сосудистые кольца, трахеопищеводные свищи или ГЭР могут приводить к аспирации и рецидивирующим или персистирующим заболеваниям легких. На рентгенограмме пищевода могут выявляться аномальные сосудистые структуры, которые сдавливают пищевод. При поиске трахеопищеводного свища контрастное вещество должны вводить под давлением через катетер в пищевод (рис. 1.19). При заглатывании бария сульфата сложнее выявить трахеопищеводный свищ.
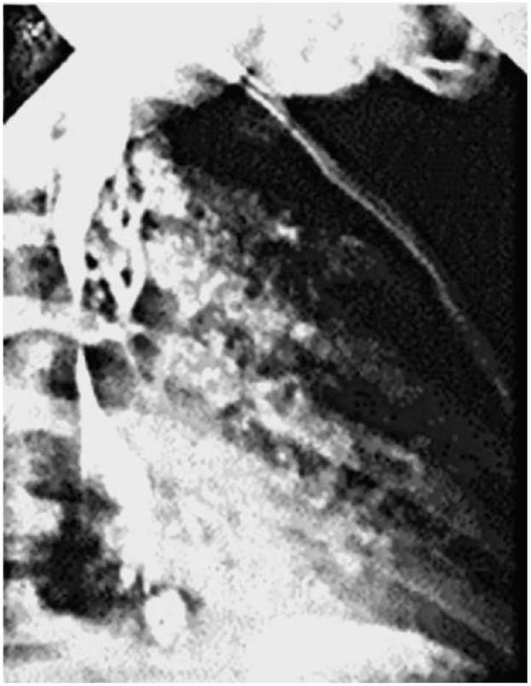
Пневмомедиастинография - рентгеноконтрастное исследование, при котором благодаря введению воздуха в средостение лучше контрастируются его органы. Показанием к проведению исследования служат в первую очередь рентгенологически определяемые тени в области средостения или примыкающих к нему участках. Газ, введенный в средостение, либо окаймляет полоской воздуха патологическое образование при его локализации в средостении, либо оттесняет его, если оно находится вне средостения (рис. 1.20).
КТ необходима в дифференциальной диагностике заболеваний грудной клетки у детей, особенно в определении поражения средостения или корня легкого, для исследования интерстициальной ткани легких (рис. 1.21). Современная спиральная КТ, позволяющая выполнять снимки с высокой разрешающей способностью и последующей трехмерной реконструкцией, предоставляет информацию о размерах и строении органов грудной клетки и различных патологических образований - полостей, объемных образований, спаек, скоплении жидкости, бронхоэктазов, сосудистых образований.
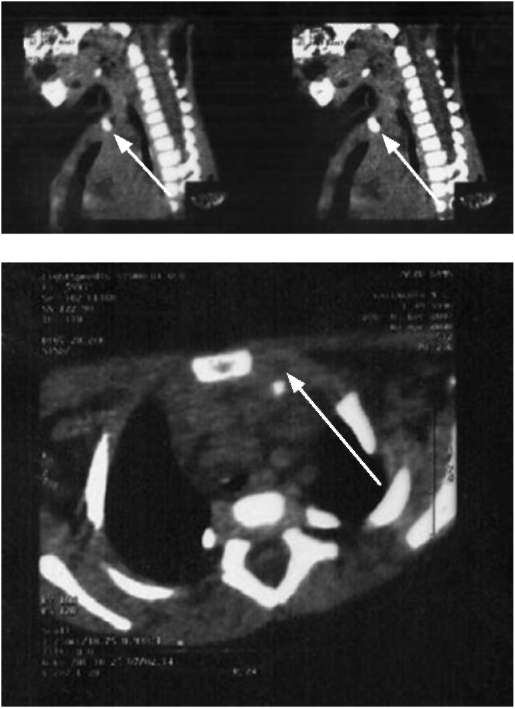
Возможность сканирования грудной клетки с меньшим временем задержки дыхания и на одном вдохе, что особенно важно в педиатрии, значительно повышает качество изображения. При КТ рентгеноморфологические признаки воспалительных процессов в легких удается обнаружить на более ранних сроках заболевания. Спиральный компьютерный томограф позволяет значительно сократить время исследования, снизить облучение больного и обнаружить в легких мелкие узелковые образования и патологические изменения, не всегда определяемые при обычной КТ. Доза облучения больного при КТ не превышает той, которую пациент получает при обычном рентгенологическом исследовании. Таким образом, при современной КТ высокого разрешения возможна визуализация более мелких деталей изучаемых объектов, их границ и структуры. На 16-срезовых компьютерных томографах возможны динамические исследования, позволяющие изучать васкуляризацию изучаемых структур по накоплению контрастного вещества. Это используют при диагностике легочной секвестрации, легочных артериовенозных фистул, идиопатического фиброза легких.
МРТ можно использовать для выявления патологии трахеи, бронхов и органов средостения, однако приоритет отдают КТ. МРТ имеет и некоторые преимущества. Так, она предпочтительнее, чем КТ, в оценке корней легких, плевры, грудной стенки. При МР-исследовании средостения имеется возможность по разнице релаксационных характеристик уверенно дифференцировать тканевые и содержащие жидкость структуры, в том числе сосудистые образования. Эффективность МРТ возрастает в условиях контрастного усиления, позволяющего выявлять злокачественную опухолевую инфильтрацию плевры, грудной стенки, наиболее четко визуализировать взаимосвязь между крупными сосудами и дыхательными путями. Преимущество МРТ перед другими способами заключается в оценке сосудистого русла малого круга кровообращения.
Радионуклидные методы исследования (сцинтиграфия) используют для определения степени нарушения регионарного кровотока и региональной вентиляции. Метод дополняет данные рентгенографии. Он технически прост, не имеет противопоказаний, лучевая нагрузка незначительная. Исследование позволяет произвести функциональную и визуальную оценку капиллярного кровообращения в области легких.
Для оценки альвеолярной вентиляции и бронхиальной проходимости используют методику ингаляционной (вентиляционной) сцинтиграфии. Больным дают вдыхать газовую смесь, содержащую радиоактивный нуклид. Наиболее часто используют инертный газ ксенон [Ксенон-133, в изотоническом растворе♠ ] (133 Хе) и аэрозоль микросфер альбумина сыворотки крови человека (МСА), меченного технецием [99mТс] сестамиби (99m Тс). Получаемое сцинтиграфическое изображение дает информацию о поступлении газа в различные отделы легких. Места сниженного накопления радиофармпрепарата соответствуют участкам нарушенной вентиляции, что наблюдают при любых бронхолегочных заболеваниях, сопровождающихся нарушением бронхиальной проходимости, альвеолярной вентиляции, альвеолярно-капиллярной диффузии (опухолевые и рубцовые стенозы бронхов, обструктивный бронхит, БА, эмфизема легких, пневмосклерозы).
Состояние кровотока в малом круге кровообращения оценивают с помощью перфузионной сцинтиграфии (рис. 1.22, см. цв. вклейку). Внутривенно вводят раствор, содержащий макроагрегаты или микросферы альбумина человеческой сыворотки крови, меченного 99m Tc (99m Tc-MAA или 99m Тс-МСА). Эти частицы поступают в малый круг кровообращения, где в связи со своими относительно большими размерами на короткое время задерживаются в капиллярном русле. Испускаемые радионуклидом γ-кванты регистрируются γ-камерой. При поражении сосудов легких макроагрегаты (микросферы) не проникают в капиллярную сеть патологически измененных участков легких, которые на сцинтиграммах будут отображаться в виде дефектов накопления радионуклида. Эти нарушения легочного кровотока могут быть обусловлены самыми различными заболеваниями, и потому их считают неспецифическими.
Ультразвуковое исследование (УЗИ) в пульмонологии используют главным образом при исследовании плевры, оценке функции правого желудочка (ПЖ) и давления в легочной артерии. Допплеровская регистрация скорости потока в легочной артерии позволяет не только качественно, но и количественно оценить выраженность легочной гипертензии (ЛГ), определить среднее давление в легочной артерии. В норме среднее давление в легочной артерии не превышает 20 мм рт.ст. Повышение систолического давления в легочной артерии выше 25 мм рт.ст. в покое и более 30 мм рт.ст. при нагрузке, а диастолического давления выше 12 мм рт.ст., позволяет диагностировать ЛГ. УЗИ может выявить скопление жидкости при эмпиеме или осложненном плевральном выпоте (например, после перенесенных пневмонии, абсцесса легкого, туберкулеза). Дисфункция диафрагмы (например, паралич или парез) может также быть оценена с помощью УЗИ. Ультразвук в настоящее время все чаще используют при исследовании придаточных пазух носа. Эхосинусоскопия служит альтернативой рентгеновскому обследованию, по диагностической значимости существенно ему не уступая.
ИССЛЕДОВАНИЕ ГАЗОВ КРОВИ И КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ
Показатели кислотно-основного состояния и газового состава крови находятся в неразрывной связи. Газовый состав вместе с показателями кислотно-основного состояния используют для оценки функций дыхательной системы. Исследование pO2 парциального напряжения СО2 в капиллярной крови отражает величину альвеоярно-локапиллярного газообмена. Исследование показателей кислотно-основного состояния дает представление о сдвигах газообмена в результате дыхательных расстройств и компенсаторной роли буферных систем. При ДН наблюдают снижение уровня кислорода в артериальной крови, тогда как содержание углекислого газа, в зависимости от типа ДН, может быть повышенным, нормальным или сниженным. При этом возможно нарушение кислотно-основного равновесия - респираторный ацидоз или алкалоз, которые необходимо дифференцировать, соответственно, с метаболическими ацидозом, алкалозом или смешанными нарушениями кислотно-основного состояния и газового состава крови. Сдвиг рН зависит от степени компенсаторного включения буферных систем. Степень артериальной гипоксемии оценивают как небольшую (pO2 85-70 мм рт.ст.), умеренную (pO2 70-60 мм рт.ст.) и значительную (pO2 ниже 60 мм рт.ст.).
У детей с ХЗЛ вследствие значительных компенсаторных резервов гипоксемия может длительное время не развиваться или присутствовать лишь в периоде обострения болезни. Показатели кислотно-основного состояния и газового состава капиллярной крови высоко коррелируют с таковыми артериальной крови, но при условии отсутствия выраженных нарушений микроциркуляции. Насыщение гемоглобина кислородом в артериальной крови можно определить с помощью пульсоксиметрии с применением датчика, позволяющего оценить разницу в поглощении двух лучей красного цвета различной длины волны в капиллярной крови. Комбинации показателей кислотно-основного состояния и газового состава капиллярной и венозной крови, а также уровня измерения насыщения (сатурации) кислородом артериальной крови (Sa O2 ) по данным пульсоксиметрии бывает, как правило, достаточно для принятия клинического решения.
Пульсовая оксигемометрия - измерение Sa O2 , используя поглощение света. Это безболезненный, неинвазивный, относительно простой и достоверный метод измерения оксигенации. Устройство, состоящее из источника света и датчика, крепят на палец руки или ноги. Показатели Sa O2 выводятся на дисплей монитора. В норме Sa O2 находится в пределах 92-95%.
Капнография - мониторинг содержания углекислого газа в выдыхаемом воздухе. Наиболее часто используют у интубированных и находящихся на искусственной вентиляции легких (ИВЛ) пациентов. Прибор регистрирует весь процесс выведения углекислого газа из легких - сначала из дыхательных путей, где остается атмосферный газ от предыдущего вдоха, то есть из мертвого пространства, затем из альвеол. Регистрацию капнограммы проводят при спокойном дыхании как через загубник, так и через носовой катетер. Таким образом, капнограмма служит как бы зеркалом вентиляционного процесса в легких. Капнографию применяют для выявления острых нарушений дыхания: в анестезиологической практике, реанимационных отделениях и палатах интенсивной терапии, где необходимо следить за быстро меняющимся состоянием больного. Это исследование используют для выявления признаков хронической легочной недостаточности, кроме записи капнограммы спокойного дыхания, имеется ряд проб. Плато в конце выдоха указывает на синхронность поступления выдыхаемого воздуха одинакового состава из разных участков легких. При неравномерности распределения вентиляции и вентиляционно-перфузионных отношений форма капнограммы изменяется: плато отсутствует, кривая становится более острой в конце выдоха. Для оценки капнограммы используют различные индексы, отражающие крутизну кривой выдоха. Капнография позволяет без особых трудностей по оценке формы капнограммы сделать заключение о нарушении вентиляционной функции легких - появлении неравномерного распространения вентиляции к кровотоку, увеличении неэффективной вентиляции мертвого пространства, наличии очень плохо вентилируемых пространств. Все это свидетельствует о нарушении газообменной функции легких и может быть квалифицировано как легочная недостаточность.
ИССЛЕДОВАНИЕ ФУНКЦИИ ВНЕШНЕГО ДЫХАНИЯ
Легочные функциональные тесты широко применяют для диагностики и коррекции лечения заболеваний легких.
Спирометрия позволяет определить жизненную емкость и экспираторный поток (табл. 1.10), плетизмография дает возможность определить объем легких. Можно также определить ригидность, уступчивость и диффузионную способность, максимальное давление на вдохе и выдохе и максимальную спонтанную вентиляцию.
Спирометрия необходима для оценки дыхательных объемов при спокойном дыхании и форсированном выдохе. При проведении маневра форсированного выдоха после глубокого вдоха необходимо сделать максимально быстрый и полный выдох.
| Показания | Противопоказания |
|---|---|
Выявление обструктивных и рестриктивных нарушений |
Пневмоторакс |
Установление причины респираторных симптомов (кашель, одышка, стридор, хрипы) |
Острый инфаркт миокарда |
Оценка эффективности лечения бронхолегочных заболеваний [БА, хроническая обструктивная болезнь легких (ХОБЛ)] |
Первые 2 нед после операций на брюшной стенке, офтальмологических операций |
Оценка физического состояния пациента |
Тяжелая БА, выраженное обострение |
Активный туберкулез |
Примечание. БА - бронхиальная астма; ХОБЛ - хроническая обструктивная болезнь легких.
Спирометрия может быть проведена у большинства детей в возрасте 6 лет и старше. Довольно часто даже у старших детей случаются сложности с выполнением маневра форсированного выдоха, поэтому необходима тренировка (обучение маневру), а в интерпретации результатов следует проявлять большую осмотрительность. Прогнозируемые значения функции легких основаны на возрасте пациента. Экспираторная кривая поток-объем может быть очень информативной, так как скорость потока при низких легочных объемах относительно не зависит от усилий и отражает функционирование периферических дыхательных путей.
Основные параметры, оцениваемые при спирометрии, - время, поток и объем. Наиболее важными параметрами, оцениваемыми при проведении форсированного выдоха, служат форсированная жизненная емкость легких (ФЖЕЛ), объем форсированного выдоха за 1-ю секунду (ОФВ1 ), соотношение ОФВ1 /ФЖЕЛ, максимальные объемные скорости на уровнях 25, 50 и 75% ФЖЕЛ, пиковая скорость выдоха (ПСВ). График поток-объем считают наиболее простым и информативным для оценки параметров форсированного выдоха (рис. 1.23).
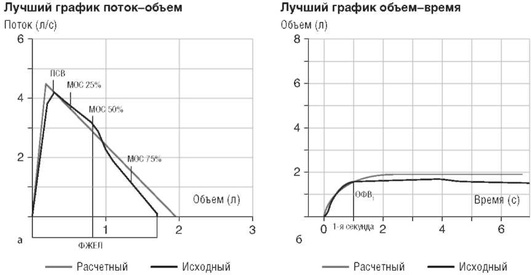
Показатели форсированного выдоха очень чувствительны к патологическим изменениям легочной ткани. При эмфиземе легких за счет деструкции альвеол снижается эластичность легочной ткани, возрастает сопротивление воздушному потоку, что приводит к снижению скорости выдоха. При БА за счет увеличения сопротивления при прохождении воздуха вследствие бронхоспазма, отека и воспаления, при неспецифических ХЗЛ за счет утолщения слизистой, увеличенной бронхиальной секреции отмечают снижение максимального экспираторного потока. При маневре ФЖЕЛ определяют максимальный объем воздуха, который пациент может выдохнуть после максимально глубокого вдоха (табл. 1.11).
| Причины снижения параметров форсированной жизненной емкости легких | Причины повышения параметров форсированной жизненной емкости легких |
|---|---|
Патология легочной ткани: резекция легкого, ателектаз, фиброз, застойная сердечная недостаточность |
Акромегалия |
Обструктивные заболевания: бронхиальная астма (БА), хроническая обструктивная болезнь легких (ХОБЛ), неспецифические хронические заболевания легких (муковисцидоз, бронхолегочная дисплазия и др.) |
|
Уменьшение размеров грудной клетки |
|
Нарушение функции дыхательных мышц - межреберных, диафрагмы, брюшной стенки |
|
Патология плевры (плевральный выпот, опухоли) |
Самым информативным параметром считают объем воздуха, выдыхаемый за 1-ю секунду при выполнении маневра форсированного выдоха, - ОФВ1 . При обструктивных нарушениях, вызванных БА, ХОБЛ, МВ, БЛД, отмечают нарушение проходимости дыхательных путей, и ОФВ1 снижается соответственно степени обструкции. Снижение ОФВ1 отмечают также и при рестриктивных нарушениях за счет фиброза или вследствие деформации грудной клетки.
Соотношение параметров ОФВ1 /ФЖЕЛ. ОФВ1 составляет достаточно постоянную долю ФЖЕЛ независимо от размера легких. В норме соотношение ОФВ1 / ФЖЕЛ у детей составляет около 90%, с возрастом скорость выдоха снижается в большей степени, чем объем, и у взрослого человека этот параметр составляет 75-80%. При легочной рестрикции параметры ОФВ1 и ФЖЕЛ снижаются пропорционально, соотношение ОФВ1 /ФЖЕЛ не уменьшено; при обструкции ОФВ1 снижается больше, чем ФЖЕЛ, соотношение ОФВ1 /ФЖЕЛ уменьшено (табл. 1.12).
| Функциональные параметры | Рестриктивные нарушения (легочный фиброз, заболевания плевры, деформация грудной клетки, нервно-мышечные заболевания) | Обструктивные нарушения (БА, ХОБЛ, бронхоэктазы, БЛД, МВ) |
|---|---|---|
ФЖЕЛ |
Уменьшена |
Нормальная или уменьшена |
ОФВ1 |
Уменьшена пропорционально (ФЖЕЛ) |
Уменьшается больше, чем ФЖЕЛ |
ОФВ/ФЖЕЛ |
Соотношение не изменяется из-за пропорционального снижения ОФВ1 и ФЖЕЛ либо даже повышено |
Соотношение в норме либо уменьшено <70-75% |
ПСВ |
Уменьшена |
Уменьшена |
Максимальные объемные скорости 25-75% |
В норме |
Уменьшена или в норме |
Примечание. ФЖЕЛ - форсированная жизненная емкость легких; БА - бронхиальная астма: ХОБЛ - хроническая обструктивная болезнь легких; БЛД - бронхолегочная дисплазия; МВ - муковисцидоз; ОФВ1 - объем форсированного выдоха за 1-ю секунду
Визуальный анализ кривой поток-объем считают ценным практическим методом. В норме кривая имеет вид прямоугольного треугольника, высота которого соответствует ПСВ, а основание - ФЖЕЛ; восходящая и нисходящая часть треугольника приближена к прямой линии, вариантом нормы служит наличие «плато» на нисходящей части (см. рис. 1.23).
Кривая поток-объем у пациента с рестриктивными нарушениями имеет почти нормальную форму, в то время как легочный объем и поток значительно уменьшены (рис. 1.24, см. цв. вклейку). При обструктивных заболеваниях кривая имеет вогнутую форму и пологое нисходящее колено, что отражает уменьшение скорости воздушного потока при прохождении через бронхи различного калибра. Степени деформации кривой зависят от степени выраженности бронхоспазма (рис. 1.25, см. цв. вклейку).
Для диагностики и дифференциальной диагностики БА основными оцениваемыми параметрами считают определение ОФВ1 и связанной с ним ФЖЕЛ, измерение форсированной ПСВ, максимальные объемные скорости на уровне 25, 50 и 75% объема ФЖЕЛ; снижение параметров максимальных объемных скоростей 25-75% служит чувствительным критерием наличия спазма мелких бронхов (см. рис. 1.25).
Исследование функции легких также может быть использовано для определения обратимости обструкции, характерной для БА. Если врач предполагает у больного наличие бронхоспазма, а функциональное исследование не выявило значимых обструктивных нарушений, то проводят пробу с бронходилататорами, так как в случае скрытого бронхоспазма параметры бронхиальной проводимости после ингаляции повышаются. Функцию внешнего дыхания (ФВД) регистрируют до ингаляции и через 15-20 мин после нее. Тест для определения обратимости бронхиальной обструкции (реверсивный тест) используют для исследования реактивности дыхательной системы: прирост показателей бронхиальной проходимости считают достоверным при увеличении ОФВ1 более чем на 12%, или 200 мл, после ингаляции β2 -агонистов короткого действия. У пациентов с результатами функциональных тестов, соответствующими обструктивной патологии, значительное улучшение функции легких после вдоха бронходилататоров отражает реактивное заболевание дыхательных путей. Эти исследования необходимы не только для установления диагноза, но также для контроля терапии БА (рис. 1.26, см. цв. вклейку).
При дифференциальной диагностике БА у взрослых наибольшую сложность представляют больные с ХОБЛ. Диагноз ХОБЛ должен быть заподозрен у всех пациентов с наличием кашля, мокроты, одышки, воздействием факторов риска в анамнезе. Для таких больных характерна постоянная, мало меняющаяся симптоматика. Диагноз подтверждают с помощью спирометрических методов. ФВД характеризуется обструктивным типом вентиляционных нарушений, проявляющихся прогрессирующим снижением пиковой скорости выдоха из-за возрастающего сопротивления в дыхательных путях, и постепенным ухудшением газообменной функции легких, что указывает на необратимый характер обструкции дыхательных путей. Величина ОФВ1 через 15 мин после ингаляции β2 -агониста менее 80% должных величин в сочетании с отношением ОФВ1 /ФЖЕЛ менее 70% подтверждает наличие частично необратимых обструктивных изменений. При БА обычны высокие приросты воздушных объемов, демонстрируется положительный бронхолитический тест, а при ХОБЛ этого не наблюдают. Важным элементом дифференциальной диагностики считают снижение ОФВ1 на 50 мл/год и более у больных ХОБЛ, чего не наблюдают при БА. Таким образом, бронхиальная обструкция при ХОБЛ неуклонно прогрессирует и обратима лишь частично (табл. 1.13).
| Тип обратимости | Параметры |
|---|---|
Обструкция полностью обратима (типичная БА) |
Возрастание ОФВ1 >12%, или 200 мл, базальных параметров, ОФВ1 достигает нормальных значений (>80-85% нормальных значений) |
Обструкция частично обратима (частично обратимый вариант ХОБЛ) |
ОФВ1 возрастает до 12%, или 200 мл нормальных значений, но остается менее 80%, соотношение ОФВ/ФЖЕЛ <70% |
Обструкция необратима (необратимый вариант ХОБЛ) |
Увеличение ОФВ1 <12%, или 200 мл, базальных параметров |
Для диагностики БА также используют специальные тесты с оценкой функции легких до введения ацетилхолина, гистамина или после нагрузки. Ингаляционные провокационные пробы с метахолиномρ или холодным сухим воздухом - важное исследование в диагностике реактивных заболеваний дыхательных путей, но такие тесты требуют наличия более сложного оборудования и специальной экспертизы и могут быть проведены только в специализированных отделениях.
БРОНХОФОНОГРАФИЯ
Исследование ФВД с помощью спирометрии бывает невозможно провести детям в возрасте до 5 лет, так как они не способны выполнять форсированные дыхательные маневры. Именно поэтому у детей применяют метод бронхофонографии, который позволяет визуализировать звуковые характеристики дыхания. Принцип работы комплекса основан на фиксировании и последующей оценке частотно-амплитудных характеристик дыхательных шумов, что позволяет визуализировать и объективно оценивать выраженность нарушений. Основными преимуществами данного метода считают отсутствие необходимости кооперации с пациентом и неинвазивность, что позволяет использовать бронхофонографию даже у новорожденных.
Для записи и регистрации дыхательных шумов используют специальный чувствительный датчик, соединенный с лицевой маской. Обработка полученных бронхофонограмм осуществляется с помощью пакета прикладных программ с определением акустической работы дыхания, выраженной в наноджоулях (нДж), а также путем вычисления относительного коэффициента K в соответствующих частотных диапазонах. Акустический эквивалент работы дыхания - интегральная характеристика энергетических затрат бронхолегочной системы на возбуждение акустического сигнала (площадь под кривой бронхофонограммы во временной области).
Сканирование респираторной волны производится в частотном диапазоне от 0,2 до 12,6 кГц. Выделяют три зоны частотного спектра: 0,2-1,2 кГц (низкочастотный диапазон), >1,2-5,0 (средние частоты, в данном диапазоне регистрируются шумы верхних дыхательных путей, гортани, трахеи, крупных бронхов), >5,0 кГц (высокочастотный диапазон - характеризует проходимость нижних дыхательных путей). Основное диагностическое значение имеет высокочастотный спектр с частотой 5,0-12,6 кГц, который характеризует проходимость нижних дыхательных путей вплоть до мелких бронхиол. Увеличение акустической работы дыхания в данном частотном диапазоне свидетельствует о нарушении бронхиальной проходимости. Наличие признаков бронхообструкции можно определить уже при визуальной оценке бронхофонограммы, когда регистрируются высокоамплитудные колебания в спектрах высоких частот (более 5,0 кГц) (рис. 1.27, см. цв. вклейку). Таким образом, бронхофонография позволяет диагностировать обструктивные нарушения легочной вентиляции.
Пикфлоуметрия - исследование определения максимальной скорости прохождения воздуха по бронхам на выдохе (ПСВ) с помощью специального портативного прибора - пикфлоуметра. Он позволяет определить максимальную скорость потока воздуха у детей старше 5 лет при форсированном выдохе. Обычно ПСВ снижается при обструкции дыхательных путей, этот показатель используют для ежедневного мониторинга при БА и подборе доз противовоспалительных препаратов. К сожалению, эти показатели в большой степени зависят от усилия на выдохе и отражают главным образом функцию крупных и средних бронхов. Таким образом, при нормальных показателях скорости потока в мелких бронхах можно наблюдать выраженное воспаление и обструкцию.
Мониторирование БА с помощью пикфлоуметра позволяет определять обратимость бронхиальной обструкции, выполнить оценку тяжести течения заболевания, гиперреактивности бронхов, эффективности лечения, прогнозировать обострения БА.
Пикфлоуметрию рекомендовано проводить 2 раза в сутки с интервалом 10-12 ч: утром, сразу после пробуждения и приема лекарственных препаратов (значения пикфлоуметрии в этот период минимальны), и вечером перед сном. При проведении исследования больной вдыхает максимально возможный объем и затем производит максимальный выдох в прибор. Измерение следует провести 3 раза подряд и выбрать максимальное значение из трех.
Важна оценка суточных колебаний ПСВ. Повышенная чувствительность к внешним раздражителям выражается также в большей вариабельности обструкции в течение дня - утренние показатели обычно ниже, чем вечерние. При хорошо контролируемой БА показатели находятся почти на прямой с небольшими отклонениями в течение суток и изо дня в день (рис. 1.28).
Признаком бронхиальной гиперреактивности считают снижение утреннего значения ПСВ относительно вечернего на 20% и более («утренний провал»). Возникновение «провалов» указывает на гиперреактивность бронхов, что требует коррекции лечения. При адекватной терапии «утренние провалы» исчезают. Для нестабильной, неконтролируемой БА характерны суточные колебания ПСВ 30% и более (рис. 1.29). Суточный разброс значений ПСВ рассчитывают по формуле:
Суточный разброс = (ПСВ вечером - ПСВ утром ) / 0,5 (ПСВ вечером +
+ ПСВ утром) × 100.
Каждый пациент с БА должен иметь план самоконтроля в зависимости от параметров ПСВ (табл. 1.14).
| Зона | Пиковая скорость выдоха, %* | Симптомы** | Рекомендации |
|---|---|---|---|
Зеленая |
>80 |
Отсутствуют либо минимальны |
Обычная базисная терапия согласно плану лечения бронхиальной астмы |
Желтая |
60-80 |
Умеренные: кашель, свистящее дыхание |
Изменение плана лечения согласно плану (увеличение объема базисной терапии, добавление бронхолитиков короткого действия), досрочное посещение врача |
Красная |
<60 |
Существенное ухудшение самочувствия, появление ночных симптомов, приступы затрудненного дыхания |
План терапии обострения - бронхолитики, противовоспалительная терапия через небулайзер. Срочно посетить врача для коррекции лечения |
Примечание.
* Должных или лучших значений.
** Даже если симптомов нет, при стабильном снижении пиковой скорости выдоха и/или увеличении ее среднесуточной вариабельности обратиться к врачу для коррекции лечения.
ОПРЕДЕЛЕНИЕ МАРКЕРОВ ВОСПАЛЕНИЯ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Неинвазивные методы диагностики иммунного воспаления дыхательных путей.
Вспомогательным методом диагностики БА, доступным в настоящее время в специализированных отделениях, служит неинвазивное измерение маркеров воспаления дыхательных путей. Неинвазивными маркерами воспаления при БА и ХОБЛ являются уровни выделяемого оксида азота (NO) или углерода (СО) (рис. 1.30; 1.31, см. цв. вклейку).
Оценка воспаления дыхательных путей также может быть выполнена путем исследования мокроты на наличие эозинофилов и метахроматических клеток.
ЭНДОСКОПИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Ларингоскопия - метод визуального исследования гортани. Различают непрямую, или зеркальную, прямую, ретроградную и микроларингоскопию. Непрямую ларингоскопию проводят взрослым и детям старшего возраста с помощью специального гортанного зеркала. Для освещения используют лобный осветитель или рефлектор, отражающий свет лампы. Для предупреждения рвотного рефлекса ротовую и гортанную часть глотки и верхнего отдела гортани смазывают или орошают 1-2% раствором лидокаина либо 2% раствором пиромекаинаρ . При непрямой ларингоскопии получают полуобратное изображение гортани: правая и левая половина сохраняют свое положение, надгортанник (образующий переднюю часть гортани) представляется в гортанном зеркале расположенным сзади, задние отделы гортани (черпаловидные хрящи и межчерпаловидное пространство) - спереди (рис. 1.32).
Прямая ларингоскопия (директоскопия, ортоскопия) основана на возможности выпрямить угол между осью полости рта и гортани при запрокидывании головы обследуемого. Прямую ларингоскопию выполняют, используя ларингоскопы, с помощью которых проводят и другие диагностические и лечебные манипуляции (удаляют инородные тела, вводят бронхоскопические и интубационные трубки); их также используют при оперативных вмешательствах (рис. 1.33). Наиболее удобны для осмотра гортани и различных манипуляций ларингоскопические наборы, имеющие волоконные световоды, сменные клинки (шпатели). Прямая ларингоскопия позволяет детально осмотреть гортань и осуществить необходимые манипуляции.

Ларингоскопия часто полезна в диагностике стридора, ее должны проводить тщательно в соответствующих условиях с использованием седации и анестезии. Прямая ларингоскопия без наркоза у новорожденных или маленьких детей может быть травматичной. Прямая ларингоскопия с использованием гибкого бронхо-скопа или назофарингоскопа имеет диагностические преимущества в сравнении с непрямой ларингоскопией (рис. 1.34; 1.35, 1.36, см. цв. вклейку).
Ретроградную ларингоскопию проводят у лиц, перенесших трахеостомию. Маленькое носоглоточное зеркало вводят, предварительно подогрев до температуры тела, через трахеостому. При ретроградной ларингоскопии видны верхний отдел трахеи, подголосовая полость и нижняя поверхность голосовых складок.
Микроларингоскопия - осмотр гортани с помощью специального операционного микроскопа с фокусным расстоянием 350-400 мм. Осмотр гортани через микроскоп может сочетаться с непрямой или прямой ларингоскопией. Микроларингоскопия имеет особенно большое значение для диагностики опухолевых поражений гортани.
Бронхоскопия - эндоскопический метод оценки слизистой оболочки и просвета трахеи и бронхов. Бронхоскопию выполняют после обязательного предварительного рентгенологического исследования органов грудной полости в прямой и боковой проекциях, так как во время бронхоскопии можно осмотреть бронхи до V-VI порядка включительно и нельзя увидеть периферические отделы легких. Показаниями к бронхоскопии служат центральные или периферические, доброкачественные или злокачественные опухоли легких, бронхоэктатическая болезнь, длительно текущая пневмония, МВ, абсцесс легкого, кровохарканье и легочное кровотечение неясной этиологии, опухоли средостения и патология плевры, инородные тела трахеобронхиального дерева, подозрение на туберкулез. Диагностическое исследование выполняют с помощью гибких эндоскопов, которые вводят в просвет трахеи и бронхов (табл. 1.15). Эндоскопическое исследование выполняют натощак, чтобы избежать случайного заброса остатков пищи или жидкости в дыхательные пути при рвотных движениях или кашле, поэтому последний прием пищи должен быть не позже 21 ч накануне исследования.
| Показания к бронхоскопии | Противопоказания к бронхоскопии |
|---|---|
Продолжающиеся необъяснимые кашель и хрипы |
Абсолютных противопоказаний нет!!! Относительные противопоказания |
Необъяснимая одышка или свистящее дыхание |
Острые воспалительные и инфекционные заболевания |
Подозрение на врожденные пороки развития дыхательных путей |
Сердечно-сосудистая недостаточность III степени |
Рецидивирующие инфекции дыхательных путей |
Пароксизмальная тахикардия |
Устойчивые изменения на рентгенограмме грудной клетки |
Атриовентрикулярная блокада |
Ателектаз легкого, доли или сегмента |
Нарушения свертывающей системы крови |
Подозрение на трахеоэзофагеальный или бронхо-эзофагеальный свищ |
Непереносимость анестетиков и препаратов для общего обезболивания |
Опухоль средостения |
Крайне тяжелое состояние больного, когда уточнение диагноза не может повлиять на лечебную тактику |
Химические или термические ожоги трахеобронхиального дерева |
|
Трахеобронхиальные стриктуры и стенозы |
|
Абсцесс легкого |
|
Экстубация трахеи после длительной ИВЛ |
|
Постановка, оценка положения, санация и извлечение канюли трахеостомической трубки |
|
Состояние после операции по поводу реконструкции легких |
|
Травмы грудной клетки |
|
Бронхогенные кисты |
|
Кистозный фиброз |
|
Диагностический бронхоальвеолярный лаваж |
|
Бронхоскопическая биопсия легкого |
Фибробронхоскопия позволяет обследовать носовые ходы, гортань и трахео-бронхиальное дерево. При бронхоскопии исследуют структуру дыхательных путей, берут образцы для различных диагностических исследований. При соответствующем оборудовании и адекватной квалификации врача для детей любого возраста нет абсолютных противопоказаний к бронхоскопии. В современных видеоэндоскопах благодаря использованию высокоэффективных линз и точных систем цифровой обработки сигнала с помощью мегапиксельных ПЗС-матриц удается получить четкое высококачественное изображение, увеличенное примерно в 100 раз, при этом цветопередача не ухудшается. Благодаря использованию видеоэндоскопов удается выявить мельчайшие изменения слизистой оболочки, что позволяет диагностировать патологические образования этих органов на ранней стадии развития.
В зависимости от используемого медицинского оборудования выделяют ригидную и гибкую бронхоскопию (фибробронхоскопию) (табл. 1.16). Фиброскопы применяют для большинства диагностических целей, тогда как ригидные бронхоскопы используют для удаления инородных тел, бужирования стенозов трахеи, а также у пациентов, находящихся на ИВЛ. Биопсия слизистой дыхательных путей также возможна с помощью гибкого бронхоскопа. Бронхоскопия, сопровождающаяся бронхоальвеолярным лаважем, помогает в диагностике легочных инфекций у иммунокомпрометированных пациентов.
| Бронхоскопия | Преимущества, особенности применения | Недостатки применения |
|---|---|---|
Ригидная. Дыхательные бронхоскопы фирмы «Karl Storz», обеспеченные устройством для искусственной вентиляции легких |
Можно выполнять при сохраненном спонтанном дыхании с использованием ингаляционных анестетиков или на фоне искусственной вентиляции легких. Необходимость подбора тубуса бронхоскопа в соответствии с возрастом |
Увеличивается риск травматизации, отека голосовых связок и подсвязочного пространства из-за анатомо-физиологических особенностей дыхательных путей ребенка. Сложность доступа и осмотра голосовых связок, невозможность визуализации верхнедолевых и сегментарных бронхов |
Гибкая. Используют бронхоскопы фирм «Olympus», «Fujinon» и «Karl Storz» |
Позволяет получать высококачественные изображения. Удобство введения и надежность. Малый диаметр позволяет использовать у детей раннего возраста, возможность осмотра верхнедолевых и периферических бронхов малого диаметра. Можно выполнять под местной анестезией у детей старшей возрастной группы, у остальных пациентов - под общей анестезией |
Снижение оксигенации артериальной крови из-за сужения эндотрахеальной трубки после введения фиброскопа (для предотвращения гипоксии ограничивают время санации и подают смесь с повышенным содержанием увлажненного кислорода). Для улучшения оксигенации и предупреждения осложнения возможна дополнительная вентиляция через установленный в трахею катетер |
Микроволоконная оптика совершила переворот во всей торакальной медицине. Хотя гибкие бронхоскопы были разработаны для взрослых, под общей анестезией их можно использовать даже детям младшего возраста. Прямая визуализация дыхательных путей позволяет поставить диагноз врожденных или приобретенных аномалий дыхательных путей, выявить инородное тело, извлечь его с помощью жесткого отсоса, удалить слизистые пробки путем лаважа, используя канал для отсоса в приборе (рис. 1.37-1.39, см. цв. вклейку).
Бронхоскопия, так же как и рентгенография, не служит методом диагностики БА, так как изменения слизистой оболочки при БА неспецифичны. Однако диагностическая бронхосокопия может быть показана в тех случаях, когда адекватная терапия бронхообструкции не приносит должного эффекта и необходимо исключить наличие механических препятствий проходимости дыхательных путей (инородное тело, пороки развития, различные новообразования). Бронхоскопия также может быть необходима для уточнения характера эндобронхиального воспаления при наличии слизисто-гнойной мокроты (рис. 1.40, см. цв. вклейку).
Лечебная бронхоскопия при БА показана у больных с большим количеством гнойной мокроты (рис. 1.41, см. цв. вклейку) при выявленном с помощью рентгенографии ателектазе легких.
При тяжелом астматическом статусе с угрозой остановки дыхания, резистентном к терапии, вопрос о соотношении эффективности и безопасности проведения бронхоскопии считают крайне сложным. Это связано с тем, что ОДН у больных со status asthmaticus вызвана закупоркой терминальных бронхов плотными слизистыми сгустками, но инструментальное исследование может осложниться ларинго- и бронхоспазмом, непосредственно угрожающим жизни больного. Именно поэтому в лечении таких сложных пациентов должны участвовать квалифицированные анестезиологи-реаниматологи, клиницисты, имеющие большой опыт в проведении бронхоскопии у детей с БА.
Бронхоскопия служит эффективным способом лечения пациентов с хроническими воспалительными заболеваниями носоглотки, гортани, трахеи и легких. Курсы лечебных бронхоскопий эффективны при пневмонии или абсцессе легкого, МВ, бронхоэктатической болезни. Основными лекарственными веществами, которые врачи используют во время лечебных бронхоскопий, являются антисептики, антибиотики, муколитики и иммуномодуляторы. В ходе лечебной бронхоскопии удается восстановить дренажную функцию бронхов, удалив гнойное содержимое из бронхиального дерева, осуществлять целенаправленное воздействие на микрофлору бронхов и вводить препараты, снижающие вязкость секрета. Бронхоальвеолярный лаваж используют для получения бронхиального секрета и дальнейшего микроскопического и культурального исследования. Трансбронхиальную биопсию и игольную аспирацию чаще применяют у взрослых, чем у детей (рис. 1.42, см. цв. вклейку). Микроволоконную бронхоскопию также применяют при проведении селективной бронхографии и затрудненной эндотрахеальной интубации.
Во время бронхоскопии также производят удаление различных образований. Методика удаления доброкачественных образований носоглотки, гортани, трахеи и крупных бронхов с помощью радиоволновой коагуляции безопасна, так как не образуется коагуляционный струп, как при электрокоагуляции, который может отторгнуться на 3-7-е сутки и вызвать кровотечение.
Торакоскопия - визуализация плевральной полости с помощью эндоскопа.
Медиастиноскопия - метод исследования переднего средостения, предназначенный для биопсии паратрахеальных и бифуркационных лимфатических узлов и легочной ткани. При медиастиноскопии можно удалять паратрахеальные кисты, кистоподобные образования. Показанием к расширенной медиастиноскопии служит также рак верхней и средней, а иногда нижней трети пищевода.
Эзофагоскопию проводят при подозрении на ГЭРБ. Респираторные нарушения, особенно у детей младшего возраста, нередко служат единственным диагностическим признаком ГЭРБ. Последняя может играть роль в формировании картины БА как за счет прямой аспирации желудочного содержимого, так и по механизму рефлекторных связей. Присоединение ГЭР ухудшает течение БА, по данным некоторых авторов, в 25% случаев. По ряду сообщений, у пациентов с ночными симптомами БА данную болезнь встречают в 60% случаев. Фиброгастроскопия и типичный анамнез поражения желудка и пищевода позволяют верифицировать ГЭРБ (рис. 1.43, см. цв. вклейку).
ЛЕЧЕБНО-ДИАГНОСТИЧЕСКИЕ ПРОЦЕДУРЫ ПРИ НАЛИЧИИ ПЛЕВРАЛЬНОГО ВЫПОТА
Торакоцентез - исследование, проводимое путем пункции грудной клетки и извлечения жидкости из плевральной полости. Это исследование должны проводить всем больным с жидкостью в полости плевры, так как оно позволяет окончательно подтвердить диагноз плеврита, получить материал для исследования, крайне важный для окончательного распознавания той болезни, которая привела к накоплению жидкости. Торакоцентез выполняют как с диагностической, так и с лечебной целью.
Причиной появления плеврального выпота у детей могут быть пневмония, злокачественные опухоли, туберкулез, СН, гипопротеинемия или нарушение лимфатического дренажа. Жидкость из плевральной полости получают как для диагностических целей, так и для уменьшения респираторного дистресса. Полученную плевральную жидкость исследуют лабораторно - проводят бактериоскопию после окраски мазков по Грамму, посев на питательные среды для анаэробных и аэробных культур, определяют удельный вес, уровень глюкозы и белка, количество эритроцитов и лейкоцитов, pH и активность лактатдегидрогеназы (ЛДГ). На основании этих данных плевральную жидкость разделяют на транссудат и экссудат (табл. 1.17). При подозрении на злокачественное заболевание необходимо выполнить цитологическое исследование плевральной жидкости.
| Параметры | Экссудат | Транссудат |
|---|---|---|
Белок, г/л |
>2,5 |
<2,6 |
Соотношение уровня белка в плевральной жидкости к уровню белка в плазме, % |
>50 |
<50 |
Активность лактатдегидрогеназы, ЕД |
>200 |
<200 |
pH |
<7,20 |
>7,20 |
Удельный вес |
>1015 |
<1015 |
Потовая проба. Данный тест используют для диагностики МВ - определение уровня хлоридов и натрия в поте. Выполняют в специальной лаборатории с помощью ионофореза пилокарпина по методике, описанной в 1959 г. Гибсоном и Куком. Этот метод применим у детей раннего возраста. Пот собирают на предварительно взвешенной фильтровальной бумаге или марле в течение 30 мин, после чего определяют уровень хлоридов. Уровень хлоридов >60 мЭкв/л на образце весом более 75 мг считают диагностически значимым для МВ, но для подтверждения диагноза необходимо исследование повторить дважды. Уровень хлоридов от 40 до 60 мэкв/л считают пограничным, и тест следует повторить. Несмотря на точность данного метода, известно много причин получения как ложноположительных, так и ложноотрицательных результатов (табл. 1.18).
| Ложноположительный результат | Ложноотрицательный результат |
|---|---|
Лабораторная ошибка |
Лабораторная ошибка |
Погрешности питания |
Периферические отеки |
Несахарный диабет |
|
Некомпенсированная надпочечниковая недостаточность |
|
Некомпенсированный гипотиреоидизм |
|
Нервная анорексия |
|
Наследственный холестаз |
|
Фукозидоз |
|
Эктодермальная дисплазия |
|
Гипогаммаглобулинемия |
|
Гипопаратиреоидизм |
|
Гликогенозы I типа |
|
Синдром Клайнфельтера |
|
Атопический дерматит |
|
Мукополисахаридоз |
|
Сегментарный гипогидроз |
Определение α1 -АТ проводят при подозрении на его дефицит. Заболевание начинается в молодом возрасте и характеризуется прогрессирующей эмфиземой, но могут наблюдать рецидивирующий обструктивный синдром, рецидивирующий бронхит, повторные пневмонии. Симптомы α1 -АТ-зависимой эмфиземы легких обычно не появляются до третьего 10-летия жизни. Дефицит α1 -АТ приводит к повышенному накоплению протеолитических ферментов и последующему повреждению тканей. К эмфиземе легких приводит хроническое воспаление (вследствие инфекции или загрязнения воздуха), так как при данном заболевании легочная ткань ничем не защищена от протеаз лейкоцитов, привлеченных в воспалительный очаг. Замещаясь соединительной тканью, паренхима легких со временем теряет свою эластичность; развиваются обструктивные явления; формируется эмфизема, которая возникает первично, на фоне хронического бронхита или другого неспецифического ХЗЛ. Чаще всего расширяется весь ацинус, и эмфизема характеризуется как панацинарная.
ИССЛЕДОВАНИЕ МОКРОТЫ
Мокрота - патологический секрет дыхательных путей, выделяемый при кашле, представляет собой структурированный гель, образованный молекулами гликопротеинов, соединенных между собой поперечными дисульфидными, кальциевыми, водородными и электростатическими связями. Трахеобронхиальный секрет продуцируется слизистыми и серозными клетками подслизистых желез, бокаловидными клетками и клетками Клара. В него входят сурфактант альвеолярных пневмоцитов, компоненты плазмы, секретируемые местно белки, продукты дегенерации и распада собственных клеток и микроорганизмов. Образцы мокроты хотя и важны в оценке воспалительного процесса, но их часто трудно получить у маленьких детей. Микроскопическое исследование позволяет определить источник образца мокроты. Мокрота содержит макрофаги, клетки реснитчатого эпителия. Материал, содержащий большое количество клеток десквамативно-го эпителия, наиболее вероятно получен не из нижних дыхательных путей или сильно контаминирован. Именно поэтому диагностические исследования, проведенные на таком образце мокроты, могут приводить к ложным результатам. Инфицированная мокрота при окраске мазков по Грамму должна содержать полиморфно-ядерные лейкоциты и хотя бы один превалирующий микроорганизм в большем количестве. Если мокрота не может быть получена, в отдельных ситуациях целесообразно получение промывных вод легких при бронхоскопии для микробиологической и цитологической диагностики (бронхоальвеолярный лаваж).
БИОПСИЯ ЛЕГКОГО
В диагностике заболеваний легких имеет значение также проведение биопсии. Хотя трансбронхиальную биопсию легкого через бронхоскоп применяют у взрослых пациентов, торакотомия с открытой биопсией имеет больше преимуществ. Торакотомия позволяет хирургу осмотреть и пропальпировать легкое, а также выбрать наилучшее место для проведения биопсии. Открытая биопсия обеспечивает достаточный материал для различных диагностических исследований. Место биопсии должно быть выбрано после оценки пораженной доли на рентгенограмме. В большинстве случаев новорожденные и дети переносят биопсию легких хорошо.
1.9. АЛЛЕРГОЛОГИЧЕСКОЕ И ИММУНОЛОГИЧЕСКОЕ ОБСЛЕДОВАНИЕ
Аллергическая патология легких (прежде всего это БА) - широко распространенное состояние. Для диагностики необходимо подтверждение аллергической сенсибилизации. Для этого проводят кожные пробы и иммунологические исследования.
КОЖНЫЕ АЛЛЕРГОЛОГИЧЕСКИЕ ПРОБЫ
Постановку кожных тестов считают диагностическим методом обнаружения специфической сенсибилизации организма путем введения через кожу аллергена и оценки величины и характера развившегося при этом отека или воспалительной реакции. Существуют разные методы кожного тестирования с аллергенами: прик-тесты, скарификационные, аппликационные, внутрикожные тесты.
Для проведения кожного тестирования используют стандартные серийные аллергены, изготовленные из пыльцы растений, домашней пыли, шерсти, пуха, эпидермиса животных и птиц, пищевых продуктов и другого сырья. Принцип постановки кожных тестов основан на том, что нанесенный на кожу (или в нее) причинно-значимый аллерген вступает во взаимодействие с антиген-презентирующими клетками и Т-лимфоцитами. В коже антиген-презентирующими клетками служат клетки Лангерганса и макрофаги. Результатом такого взаимодействия при наличии сенсибилизации служат высвобождение медиаторов аллергии и развитие местной аллергической реакции, интенсивность которой фиксирует врач-аллерголог (рис. 1.44, 1.45, см. цв. вклейку и табл. 1.19).
| Вид теста | Показания | Преимущества | Недостатки |
|---|---|---|---|
Аппликационные пробы |
Подозрение на очень высокую степень чувствительности. Диагностика контактного дерматита, фотодерматозов. Диагностика профессиональных заболеваний |
Метод диагностики клеточно-опосредованных заболеваний |
Нежелательные местные реакции. Риск системных реакций |
Прик-тест |
Основной метод диагностики для выявления сенсибилизации к респираторным, пищевым, грибковым, эпидермальным аллергенам |
Высоко специфичен, высокочувствителен, воспроизводим, безопасный, требует меньшей поверхности кожи, реже возникают ложноположительные реакции |
Местные реакции. Риск системных реакций |
Скарификационные тесты |
Выявление сенсибилизации к респираторным, пищевым, эпидермальным аллергенам |
Дешевизна |
Низкая информативность (эксперты EAACI)*, высокая частота ложно-положительных реакций, низкая специфичность, травматичность, местные реакции, риск системных реакций |
Внутрикожные тесты |
Выявление сенсибилизации к аллергенам бактериального и грибкового происхождения. Несоответствие клинической картины и результатов скарификационных и прик-тестов (тесты отрицательные, клиническая картина резко положительная) |
Более чувствительны, чем прик-тест и скарификационные аллергологические пробы |
Менее специфичны, чем прик-тесты, могут спровоцировать нежелательные осложнения |
Примечание. * Dreborg S., Frew A. & EAACI Subcommittee on skin tests // Allergy. 1993. Vol. 48. Suppl. 14. P. 48-82. Suzuki Y. et al. Arerugi. 2009. N 58. P. 1619-1628.
Из кожных проб наибольшую простоту применения и воспроизводимость результатов показали прик-тесты. В настоящее время эксперты Европейской академии аллергологии и клинической иммунологии (EAACI) не рекомендуют использовать скарификационные кожные тесты для диагностики аллергии ввиду их низкой информативности. Основным методом кожного тестирования при специфической аллергодиагностике служит проба уколом (prick-укол), или прик-тест. Он менее травматичен по сравнению со скарификационными пробами, требует меньшей поверхности кожи, поэтому больным ставят большее число проб, и при этом в организм поступает минимальное количество аллергенов.
Для постановки прик-тестов используют специальные прик-ланцеты. Для каждого аллергена, тест-контрольной жидкости и гистамина используют отдельный ланцет. Тестирование проводят следующим способом: после обработки этанолом (Этиловым спиртом♠ ) внутренней поверхности предплечья на расстоянии 2,5 см друг от друга наносят капли экстракта аллергенов, тест-контрольную жидкость, гистамин, после чего одноразовым прик-ланцетом через каплю делают укол глубиной 1 мм (рис. 1.46, см. цв. вклейку). Результаты теста оценивают через 20 мин, измеряя образовавшийся волдырь по максимальному диаметру (рис. 1.47, 1.48, см. цв. вклейку). По сравнению со скарификационными пробами в ответ на прик-тест значительно реже возникают ложноположительные реакции.
Зуд, эритему, появление папулы оценивают как положительную реакцию. Неспецифическую реактивность кожи определяют по реакции на гистамин, при нормальной реактивности кожи диаметр папулы или эритемы составляет 3-4 мм. В качестве отрицательного контроля (тест-контрольная жидкость) оценивают реакцию на 50% раствор глицерола (Глицерина♠ ) либо 0,9% раствор натрия хлорида, не содержащий экстракта аллергена. Отрицательная или вялая реакция на гистамин свидетельствует о приеме антигистаминных препаратов (табл. 1.20-1.22). Положительная реакция на контрольную жидкость возможна при ярком дермографизме. Плюсами кожных тестов служит дешевизна в сравнении с лабораторными исследованиями. Преимуществом метода считают возможность прогнозирования вероятности респираторной аллергии в зависимости от величины положительной реакции.
Результат |
Прик-тест |
Интрадермальный тест |
||
Волдырь, мм |
Гиперемия, мм |
Волдырь, мм |
Гиперемия, мм |
|
Отрицательный |
<2 |
<3 |
<3 |
<5 |
+ |
2-3 |
3-5 |
3-5 |
5-10 |
++ |
3 |
6-10 |
6-10 |
11-20 |
+++ |
4-6 |
11-20 |
11-15 |
21-40 |
++++ |
>6, псевдоподии |
>20 |
>15 |
>40 |
Примечание. * Ring J. Angewandte Allergologie. 1988, AWMF-Guideline. N. 061/026; 2009.
| Ложноотрицательные реакции | Ложноположительные реакции |
|---|---|
Инактивация аллергена в результате неправильного его хранения |
Нарушение техники проведения кожного тестирования (слишком близкое расстояние между аллергенами, повторное использование прик-теста) |
Использование аллергенов с истекшим сроком годности |
Загрязнение аллергена посторонними примесями при неправильном его хранении |
Снижение реактивности кожи [пожилой и старческий возраст, заболевания нейроэндокринной системы (сахарный диабет, хронический гемодиализ)] |
Уртикарный дермографизм |
Прием пациентом антигистаминных препаратов и других медикаментов, тормозящих высвобождение гистамина из клеток-мишеней или снижающих реактивность кожи |
Клинически не проявляемая перекрестная чувствительность к гомологичному аллергену |
Нарушение техники проведения кожного тестирования |
|
Постановка кожных тестов ранее чем через 4 нед после системной реакции (истощение антител) |
|
Ранний детский возраст |
|
Другие иммунные механизмы заболевания (не-IgЕ-опосредованные) |
| Препараты | Степень | Продолжительность ингибирующего эффекта, время отмены препарата | Клиническая значимость |
|---|---|---|---|
Системные H1 -антигистаминные препараты |
++++ |
2-7 сут |
Да |
Топические Н1 -антигистаминные препараты |
0 |
Не отменяют |
Нет |
Системные Н2 -антигистаминные препараты |
+ |
Отмена в день проведения аллергопроб |
Нет |
Имипрамины |
++++ |
До 21 сут |
Да |
Фенотиазины |
++ |
До 10 сут |
Да |
Системные глюкокортикоидные препараты, доза <30 мг/сут менее 1 нед |
0 |
Не отменяют |
Нет |
Системные глюкокортикоиды, доза 10 мг/сут |
0 |
Не отменяют |
- |
Системные глюкокортикоиды при длительном применении |
± |
Неизвестен |
Нет |
Топические глюкокортикоиды: интраназальные, ингаляционные глюкокортикоиды |
0 |
Не отменяют |
Нет |
Топические кожные глюкокортикоиды |
++ |
До 7 сут |
Да |
Допамин |
+ |
Не отменяют |
Нет |
Клонидин |
+ |
Не отменяют |
Нет |
β2 -Агонисты |
0 |
Не отменяют |
- |
Монтелукаст |
0 |
Не отменяют |
- |
Определение уровней IgE в сыворотке крови играет важную роль в диагностике аллергических заболеваний органов дыхания. Основные показания для назначения лабораторных методов аллергодиагностики, которые проводят in vitro:
-
непрерывно рецидивирующее течение заболевания без периодов ремиссии;
-
поливалентная сенсибилизация, когда отсутствует возможность проведения тестирования in vivo сразу со всеми предполагаемыми аллергенами в ограниченные сроки обследования;
-
ложноположительный или ложноотрицательный результат при кожном тестировании;
Специфичность и чувствительность современных методик зависят от типа аллергена и колеблются от 85-100% при ингаляционных аллергенах до 67% при определении аллергенов эпидермальных и 59% - грибковых. Возможно определение уровня IgE-антител как в сыворотке крови, так и на поверхности базофилов. Применение данного метода необходимо не только для определения причинно-значимого аллергена с целью его дальнейшей элиминации, но и для определения показаний к аллерген-специфической иммунотерапии (АСИТ), прогнозирования последующего течения аллергического заболевания. Диагноз ставят на основе комбинации данных клинического анамнеза и наличия положительных результатов кожных тестов или выявленных IgE к конкретному аллергену.
Для аллергологической диагностики (определение специфических IgE) применяют метод иммуноферментного анализа (ИФА), радиоаллергосорбентный тест, множественный аллергоадсорбентный тест, с помощью которого можно провести исследование сразу с 36 аллергенами. Используют также в клинической практике непрямой, прямой базофильный тест, реакцию аллерген-специфического высвобождения гистамина (РСВГ) из базофилов периферической крови в ответ на воздействие специфического аллергена.
ИФА. С его помощью производят количественное определение аллерген-специфических IgE в крови больного. Принцип метода в том, что на первом этапе исследования испытуемый аллерген ковалентно связывается с твердой фазой (бумажный диск, активированный полимер и др.). При добавлении сыворотки больного происходит связывание аллергена, фиксированного на твердой фазе, с антителом, если в сыворотке присутствуют соответствующие данному аллергену антитела. После отмывания несвязавшихся IgE добавляют антитела против IgE, меченные флуо-рохромом (пероксидазой хрена, β-галактозидазой и др.). Происходит образование комплекса: аллерген на твердой фазе + специфический IgE + антитела анти-IgE (антитела против IgE). Несвязавшиеся антитела удаляются. Уровни специфического IgE-связывания определяют по интенсивности свечения (реакцию оценивают в интервале I-IV класса). Чем выше показатель свечения по отношению к негативному контролю (сыворотка, в которой отсутствуют специфические IgE-антитела), тем больше специфических IgE в сыворотке пациента. Специфический характер реакции учитывают на основе позитивного контроля (IgE-связывание интенсивностью IV класса). Ценность этого метода в том, что для его проведения сразу с большим количеством аллергенов требуется небольшое количество сыворотки.
Радиоаллергосорбентный тест. С помощью этого метода также производят количественное определение аллерген-специфических IgE в крови. Аллерген, соединенный ковалентно с бумажным диском, реагирует со специфическим IgE крови больного. После отмывания неспецифического IgE добавляют радиоактивно меченный (125 I) анти-IgE. Образуется комплекс: специфический IgE + меченый анти-IgE. Радиоактивность этого комплекса измеряют с помощью γ-счетчика. Чем больше радиоактивность, тем выше содержание специфического IgE в крови больного.
Иммунохемилюминесценция (иммунофлюоресценция). Для определения IgE в сыворотке крови больного применяют методы, основанные на эффекте хемилюминесценции. Принцип постановки теста такой же, как и при ИФА и радиоаллергосорбентном тесте, но в качестве индикатора реакции используют фотореагенты (А, B, C, D), свечение которых [тест MAST-CLA(Cl1)] регистрируют на люмино-, фотометре.
«Золотым стандартом» аллергодиагностики, согласно данным Всемирной организацией здравоохранения (ВОЗ), считают иммунохемилюминесцентный метод детектирования с помощью технологии ImmunoCAP (Immuno Solid-phase Allergy Chip). Метод ImmunoCAP рекомендован Федеральной службой США, контролирующей производство, хранение и реализацию пищевых продуктов, лекарственных препаратов и косметических средств (FDA - от англ. Food and Drug Administration), для точной диагностики аллергии (производители «Pharmacia Diagnostics AB», «ThermoPhisher» , «ThermoPhisher» и др.). В русскоязычной литературе метод описан как «Аллергочип ImmunoCAP», в англоязычной - ImmunoCAP ISAC (serum). Этот метод использует иммунохемилюминесценцию на иммунном твердофазном аллергочипе. При создании аллергочипа использованы сверхточные технологии и принципы microarray, применяют очищенные природные или рекомбинантные аллергокомпоненты, иммобилизованные на твердой фазе (биочип).
Аллерген-ассоциированные IgE-антитела детектируют через связывание с вторичными флюоресцентно меченными анти-IgE-антителами. Результаты теста определяют полуколичественно в стандартизованных единицах ISAC Standardized Units (ISU) с помощью сканера биочипов и оценивают с помощью специального программного обеспечения.
«Аллергочип ImmunoCAP» - комплексное исследование, позволяющее обнаружить предрасположенность к аллергической реакции и в последующем исследовать сенсибилизацию к конкретному аллергену. Исследование позволяет производить компонентную аллергодиагностику, то есть определять сенсибилизацию к конкретному специфическому компоненту аллергена.
Данная методика обеспечивает возможность обнаружения сверхнизких концентраций IgE-антител и других показателей в сверхмалом количестве крови пациента, позволяет проанализировать наличие чувствительности сразу более чем к 100 аллергокомпонентам из 51 источника аллергенов. Точность определения уровня антител - 0,01 кЕ/л. Чувствительность метода составляет 93%, а специфичность - 89% (рис. 1.49, см. цв. вклейку).
Аллергокомпонентная диагностика очень важна для выявления основной и перекрестной реактивности у пациентов с поливалентной сенсибилизацией. Проведение аллергокомпонентной диагностики необходимо для уточнения диагноза и определения необходимости выполнения и последующей эффективности АСИТ, оценки риска осложнений при АСИТ.
К примеру, основным аллергенным компонентом пыльцы березы является белок Bet v1 (из группы PR-10), так называемый мажорный аллерген, он также служит компонентом пыльцы других деревьев (ольха, лещина, бук, каштан, дуб, ясень, акация). До 50% пациентов с аллергией на пыльцу березы имеют сопутствующую сенсибилизацию к растительной пище (орехи, косточковые, соя, киви и др.), так как эти растительные продукты содержат PR-10, белки, похожие на Bet v1. Поскольку большинство белков группы PR-10 распадаются при нагревании и гидролизе, при употреблении перекрестных аллергенов в сыром виде возможно возникновение местных реакций («оральный аллергический синдром»).
Минорные аллергены пыльцы березы Bet v2 относят к группе профилинов. Они перекрестные с профилинами и полкальцинами трав, что иногда может быть причиной ложноположительных результатов при проведении кожного тестирования (табл. 1.23).
Источник |
Компонент |
Семейство и функции белка |
Возможная перекрестная реактивность |
Особенности |
Береза |
Bet v1 |
PR-10 |
Фрукты, овощи, орехи, бобы, пыльца деревьев |
Индикатор для аллерген-специфической иммунотерапии при аллергии к пыльце березы |
Bet v2 |
Профилин |
Фрукты, овощи, орехи, бобы, злаки, пряности, пыльца луговых и сорных прав, латекс |
- |
|
Bet v4 |
Полкальцин |
Пыльца деревьев, сорных и луговых трав |
- |
Таким образом, у пациентов, сенсибилизированных к Bet v1, АСИТ с высокой долей вероятности будет эффективна, тогда как для пациентов, сенсибилизированных минорными аллергенами АСИТ пыльцой березы, - малоэффективна. Эффективность АСИТ будет высокой при сенсибилизации к Bet v1 и отсутствии сенсибилизации к Bet v2/Bet v4, средней при сенсибилизации к Bet v1, Bet v2 и Bet v4. Сенсибилизация к Bet v2 и Bet v4 без сенсибилизации к Bet v1 будет сигнализировать о низкой эффективности АСИТ.
Определение медиаторов воспаления (гистамин, триптаза) проводят методами ИФА или радиоиммунного анализа после провокационной пробы. В назальном секрете, мокроте, бронхоальвеолярной лаважной жидкости возможно определение эозинофильного катионного протеина.
Определение триптазы необходимо для оценки риска анафилактических реакций. Повышенный уровень триптазы отражает увеличенное количество тучных клеток, что особенно опасно в случае указания на признаки системной анафилаксии в анамнезе.
Метод оценки активации базофилов аллергенами (тест антигенной стимуляции клеток, тест активации базофилов, метод проточной цитометрии) предназначен для определения IgE-опосредованных реакций и основан на определении в человеческой гепаринизированной крови экспрессируемых на базофилах СD63, секретируемых в ответ на стимуляцию аллергеном (рис. 1.50).
Протокол исследования включает три этапа: выделение популяции лимфоцитов из стабилизированной этилендиаминтетрауксусной кислотой крови, стимуляция лимфоцитарной суспензии специфическими аллергенами и ИФА лейкотриенов, синтезированных базофилами во время стимуляции.
Тест считают высокочувствительным и специфичным. В качестве положительного контроля для каждого образца используют моноклональные антитела к высокоаффинному рецептору для IgE, обеспечивающие имитацию связывания IgE-антител с рецептором на мембране базофилов, что повышает специфичность метода. Маркерами активации базофилов являются СD63 и CD203c
Тест специфичен для определения IgE-опосредованной аллергии к ингаляционным аллергенам, особенно в ситуациях, когда кожные тесты нельзя проводить по разным причинам. У маленьких детей не только выполнение кожных тестов сложно осуществить технически, но и определение сывороточных IgE у них менее надежно и хуже коррелирует с клиническими симптомами. Тест активации базофилов проводят в случае, когда существует несоответствие результатов кожных тестов и истории болезни.
ИММУНОЛОГИЧЕСКИЕ МЕТОДЫ ОБСЛЕДОВАНИЯ
Распространены методы выявления иммуноглобулинов (Ig) классов А, М и G в сыворотке крови методами ИФА, иммунофлюоресценции. Выявление видо-специфических антител (IgM) свидетельствует о наличии активной инфекции, определение специфических антител (IgG) указывает на перенесенную инфекцию. Коммерческие препараты, используемые для специфической диагностики инфекционных заболеваний, относят в основном к методам агглютинации, преципитации, нейтрализации вирусов, торможения гемагглютинации, пассивной гемагглютинации, коагглютинации, латексагглютинации, реакции связывания комплемента, иммунофлюоресценции, ИФА. Значительно реже для этих целей используют радиоиммунологический анализ. Многочисленные сравнительные исследования показывают: метод ИФА выше чувствительности иммунофлюорес-центных и радиоиммунологических методов. Значительный прогресс в диагностике инфекций достигнут в связи с внедрением полимеразной цепной реакции (ПЦР). Положительная ПЦР свидетельствует о присутствии возбудителя в мокроте, мазке со слизистой оболочки носа или задней стенки глотки.
Иммунологическое обследование рекомендовано проводить при подозрении на ИД. Большинство первичных иммунодефицитных состояний дебютирует в раннем детском возрасте повышенной склонностью к инфекционным заболеваниям, в том числе к инфекциям дыхательной системы (повторные пневмонии, отиты и др.). В связи с низкой настороженностью педиатров отмечают высокую инвалидизацию и смертность пациентов с первичными иммунодефицитными состояниями. Показанием к иммунологическому обследованию считают наличие в анамнезе больного повторных пневмоний, тяжелых инфекционных процессов, например сепсиса, гнойного менингита, остеомиелита, гнойных инфекций кожи, наличие в семейном анамнезе смертей детей с клинической картиной инфекционного заболевания и диагнозом первичного ИД (рис. 1.51, 1.52). Рутинные лабораторные методы позволяют заподозрить ИД и на догоспитальном этапе. К примеру, стойкая лимфопения менее 1500/мкл у детей младшего возраста, как правило, служит признаком ИД с поражением клеточного звена иммунитета. Скрининговое исследование должны начинать с определения концентрации IgM, IgG и IgA с последующим количественным определением основных клеточных популяций лимфоцитов: Т-, В-лимфоцитов, естественных киллеров (NK - от англ. natural killer). При подозрении на дефект системы комплемента общая гемолитическая активность комплемента и индивидуальные компоненты комплемента как классического, так и альтернативного пути активации могут быть измерены иммуно-химическими и функциональными методами. Оценка иммунного ответа может включать определение гуморального ответа на специфические вакцинальные антигены, например дифтерийные и столбнячные токсины, убитые полиоанти-гены и т.д. Качественную оценку клеточного иммунитета, как правило, проводят in vitro путем определения ответа лимфоцитов на митогены и специфические антигены. Оценку фагоцитоза проводят методом измерения степени редукции красителя нитросинего тетразолия после специфического стимулирования клеток крови. Дополнительно возможна in vitro оценка хемотаксиса, хемокинеза, а также продукции и секреции отдельных воспалительных цитокинов.
1.10. МЕТОДЫ ГЕННОГО ЗОНДИРОВАНИЯ
Интенсивное развитие молекулярной биологии и создание базы генетических исследований послужили основой генетической инженерии. В области диагностики возникло и бурно развивается направление по определению специфических нуклеотидных последовательностей дезоксирибонуклеиновой (ДНК) и рибонуклеиновой кислоты (РНК), так называемое генное зондирование. В основе подобных методик лежит способность нуклеиновых кислот к гибридизации - образованию 2-цепочных структур за счет взаимодействия комплементарных нуклеотидов (А-Т, Г-Ц). Для определения искомой последовательности ДНК (или РНК) специально создают так называемый зонд полинуклеотид с определенной последовательностью оснований. В его состав вводят специальную метку, позволяющую идентифицировать образование комплекса. ДНК-зонды широко используют для диагностики наследственных генных заболеваний, например муковисцидоза (рис. 1.53), генетического дефекта ресничек (синдром Зиверта-Картагенера - обратное расположение внутренних органов, синуситы, бронхоэктазы).
К примеру, генное зондирование на носительство МВ выглядит так: с помощью ПЦР амплифицируют геномную ДНК и продукт переносят на 2 нейлоновых фильтра, один из которых гибридизуют с Р32Р-зондом на нормальный аллель, а второй - с 32Р-зондом на мутантный аллель ΔF508. Образование гибридов обнаруживают радиоавтографически.
Существенным этапом в развитии методов генного зондирования послужило использование полимеразной реакции амплификации. Этот подход позволяет увеличить концентрацию определенной (заранее известной) последовательности ДНК в пробе за счет синтеза многочисленных копий in vitro. Реакция амплификации позволяет существенно повысить чувствительность анализа при генном зондировании.
Для многих первичных ИД описана хромосомная локализация дефектного гена (рис. 1.54), что создает основу для выявления генетических носителей и пренатальной диагностики первичных ИД.
В настоящее время пренатальную диагностику проводят на образцах фетальной крови, амниотических клетках или при биопсии ворсинок хориона.
Используя технику рекомбинантных ДНК, удается исследовать варианты генов, ответственных за развитие многих заболеваний. Этим способом идентифицированы точечные мутации, вызванные заменой одного азотистого основания, делениями или вставками, которые приводят к появлению аллелей, кодирующих функционально неактивные белки. Дефектные «полиморфы» возникают как за счет изменений в кодирующих участках гена, так и в результате мутаций в некодирующих областях, тесно примыкающих к генам и вызывающих нарушение их работы.
СПИСОК РЕКОМЕНДОВАННОЙ ЛИТЕРАТУРЫ
-
Александрова А.Н., Лавренова Г.В., Шахназаров А.Э. Заболевания органов дыхания. Санкт-Петербург : Диалог, 2000. 286 с.
-
Блохин Б.М., Котлуков В.К, Румянцев А.Г. и др. Синдром бронхиальной обструкции у детей раннего возраста с респираторными инфекциями различной этиологии: особенности клинических проявлений и иммунного ответа // Педиатрия. 2006. № 3. С. 14-21.
-
Зайцева С.В., Муртазаева О.А. Синдром бронхиальной обструкции у детей // Трудный пациент. 2012. № 2. С. 34-39.
-
Кондратенко И.В., Бологов А.А. Первичные иммунодефициты. Москва : Медпрактика-М, 2005. 232 с.
-
Маслова И.В., Солониченко В.Г., Солдатский Ю.Л., Онуфриева Е.К. Генетические аспекты врожденной патологии гортани и трахеи // Вестник оториноларингологии. 1999. № 2. С. 30-33.
-
Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика». 4-е изд. Москва : Оригинал-макет, 2012.
-
Овсянников Д.Ю., Петрук Н.И., Кузьменко Л.Г. Бронхолегочная дисплазия у детей // Педиатрия. 2004. № 1. С. 91-94.
-
Павлинова Е.Б., Оксеньчук Т.В., Кривцова Л.А. Бронхофонография как метод для прогнозирования исходов респираторного дистресс-синдрома у недоношенных новорожденных // Бюллетень сибирской медицины. 2011. Т. 10, № 4. С. 126-127.
-
Солдатский Ю.Л., Онуфриева Е.К. Подскладковая гемангиома как причина стеноза гортани у детей раннего возраста // Вестник оториноларингологии. 1997. № 6. С. 19-21.
-
Солдатский Ю.Л., Онуфриева Е.К., Маслова И.В. Стридор у новорожденных и детей грудного возраста. В кн.: Материалы V Конгресса педиатров России Здоровый ребенок», 16-18.02.1999. Москва, 1999. С. 430-431.
-
Таточенко В.К. Практическая пульмонология детского возраста. Москва : Медпрактика-М, 2006. С. 22-24.
-
Щербина А.Ю., Пашанов Е.Д. Иммунология детского возраста : практическое руководство по детским болезням. Москва : Медпрактика-М, 2006. 432 с.
-
Чучалин А.Г. Хроническая обструктивная болезнь легких : практическое руководство для врачей. 2-е изд. Москва : Колорит студио, 2004. С. 15-18.
-
American Academy of Pediatrics Subcommittee on Diagnosis and Management of Bronchiolitis. Diagnosis and management of bronchiolitis // Pediatrics. 2006. Vol. 118, N 4. P. 1774-1793.
-
European Respiratory Society. European Lung White Book: Huddersfield, European Respiratory Society Journals Ltd, 2003.
-
Global Strategy for Asthma Management and Prevention (2017). http://ginasthma.org/.
-
GOLD Guidelines. COPD Diagnosis and Management. Global Initiative for Chronic Obstructive Pulmonary Disease (2016). http://goldcopd.org/
-
Bousquet J. et al. Practical guide to SPTs in allergy to aeroallergens // Position paper. Allergy. 2012. N 67. P. 18-24.
-
Buckley R.H. Primary immunodeficiency or not? Making the correct diagnosis // J. Allergy Clin. Immunol. 2006. Vol. 117, N 4. P. 756-758.
-
Bergmann R.E., Kliegman R.V.M et al. Nelson Textbook of Pediatrics 1996-chapters 320, 321, 232, 324.
-
Chernik V., Kendig E.L. Disorder of the respiratory tract in children. Philadelfia, 1990. 1055 p.
-
Conley M.E., Notarangelo L.D., Etzioni A. Diagnostic criteria for primary immunodeficiencies // Clinical Immunology. 1999. Vol. 93, N 3. P. 190-197.
-
Dreborg S., Frew A. & EAACI Subcommittee on skin tests // Allergy. 1993. P. 48-82.
-
Fisher M.R. Magnetic resonance for evaluation of the thorax. Chest 95, 1996. 1985 p.
-
Fleisher T.A., Oliveira J.B. Functional and molecular evaluation of lymphocytes // J. Allergy Clin. Immunol. 2004. N 114. P. 227-234.
-
Folds J.D., Schmitz J.L. Clinical and laboratory assessment of immunity // J. Allergy Clin. Immunol. 2000. N 111. P. S702-711.
-
Friedman E.M., Vastola A.P., McGill T.J., Healy G.B. Chronic pediatric stridor: etiology and outcome // Laryngoscope. 1990. Vol. 100. P. 277-280.
-
Frank P.I., Morris J.A., Hazell M.L. et al. Long term prognosis in preschool children with wheeze: longitudinal postal // BMJ. 2008. Vol. 336, N 7658. P. 1423-1426.
-
Hamilton R.G., Franklin Adkinson N. Jr. In vitro assays for the diagnosis of IgE-mediated disorders // J. Allergy Clin. Immunol. 2004. N 114. P. 213-225.
-
Horak E. Wheezing in infants and toddlers: new insights // Wien. Klin. Wochenschr. 2004. Vol. 116, N 1-2. P. 15-20.
-
Immune Deficiency Foundation (IDF). Clinical Focus, March 2011.
-
Immune Deficiency Foundation (IDF). Diagnostic & Clinical Care Guidelines for Primary Immunodeficiency Diseases, 2008, Vol. 10, N 14. P. 22-23.
-
Kovacevic S., Nikolic S. Risk factors associated with wheezing illness in young children. Abs. 10 Congress ERS, 2000. 486 p.
-
Kraft M. Approach to the patient with respiratory disease. Philadelphia, PA : Elsevier Saunders, 2016. 83 p.
-
Kupeli E., Feller-Kopman D., Mehta A.C. Diagnostic bronchoscopy. Philadelphia, PA : Elsevier Saunders, 2016. 22 p.
-
Kurukulaaratchy R.J., Fenn M., Twiselton R. et al. The prevalence of asthma and wheezing illnesses amongst 10-year-old schoolchildren // Respir. Med. 2002. Vol, 96. N 3. P. 163-169.
-
Lung Infection-A Public Health Priority Mizgerd // JP. 2006. Vol. 3, N 2. e76 p.
-
Maarten O. Blanken, Maroeska M. Rovers, Jorine M.et al. Respiratory Syncytial Virus and recurrent wheeze in healthy preterm infants // N. Engl. J. Med. 2013. N 368. P. 1791-1799.
-
Mahler V. Prick and Intracutaneous Testing and IgE Testing: Kanerva’s Occupational Dermatology. Springer, 2nd ed. 2012. P. 943-960.
-
Miller M.R., J. Hankinson J, Brusasco V. et al. Standardisation of spirometry // Eur. Respir. J. 2005. N 26. P. 319-338.
-
Mauro R., Pool S., Lockhart C. Differenciation of epiglottitis from laringotraheitis in the child with stridor // Am. J. Dis. Child. 1988. N 142. P. 679-682.
-
Mulholland K. Childhood lung infections: A permanent global emergency // Lancet. 2007. Vol. 370, N 9583. P. 285-289.
-
National Asthma Education and Prevention Program. Expert Panel Report 3 (EPR-3): Guidelines for the Diagnosis and Management of Asthma-Summary Report 2007 // J. Allergy Clin. Immunol. 2007. Vol. 120, N 5. P. 194-138.
-
O’Brien K., Chandran A., Wealtherhaltz R. et al. Efficacy of motavizumab for the prevention of respiratory syncytial virus disease in healthy Native American Infant: a phase 3 randomised double-blind placebo controlled trial // Lancet Infect. Dis. 2015. N 15. P. 1398-1408.
-
Sigurs N., Bjarnason R., Sigurbergsson F., Kjellman B. Respiratory syncytial virus bron-chiolitis in infancy is an important risk factor for asthma and allergy at age 7 // Am. J. Respir. Crit. Care. Med. 2000. N 161. P. 1501-1507.
-
Sigurs N., Gustafsson P.M., Bjarnason R. et al. Severe respiratory syncytial virus bronchiolitis in infancy and asthma and allergy at age 13 // Am. J. Respir. Crit. Care. Med. 2005. N 171. P. 137-1341.
-
Schnapp L.M., Cohen N.H. Pulse oximetry: Uses and abuses // Chest. 1990. N 98. 1244 p.
-
Scanlon P.D. Respiratory function: mechanisms and testing. Philadelphia, PA : Elsevier Saunders, 2016. 85 p.
-
Van Kampen V. et al. EAACI position paper: SPT in the diagnosis of occupational type I allergies // Allergy. 2013. N 68. P. 560-584.