Зверева, В. В. Медицинская микробиология, вирусология и иммунология : Т. 2 : учебник / под ред. Зверева В. В. , Бойченко М. Н. - Москва : ГЭОТАР-Медиа, 2021. - 472 с. - ISBN 978-5-9704-5836-5. |
Аннотация
В создании книги принимали участие сотрудники кафедр микробиологии, вирусологии и иммунологии Первого Московского государственного медицинского университета им. И.М. Сеченова, Российского национального исследовательского медицинского университета им. Н.И. Пирогова, Московского государственного медико-стоматологического университета им. А.И. Евдокимова, Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Военно-медицинской академии им. С.М. Кирова, государственных медицинских университетов Омска, Оренбурга, Челябинска.
Издание состоит из двух томов, включающих 19 глав, в которых последовательно разбираются вопросы общей и частной микробиологии, вирусологии и иммунологии. Материал, изложенный в обоих томах, значительно переработан согласно современным научным тенденциям и дополнен новыми рисунками, схемами, таблицами.
Учебник написан в соответствии с официально утвержденными программами преподавания микробиологии, вирусологии и иммунологии для студентов лечебного, педиатрического и медико-профилактического факультетов медицинских вузов.
Гриф
Рекомендовано ФГАУ "Федеральный институт развития образования" в качестве учебника для использования в учебном процессе образовательных организаций, реализующих программы высшего образования по специальностям 31.05.01 "Лечебное дело", 31.05.02 "Педиатрия", 32.05.01 "Медико-профилактическое дело"
Возбудители туберкулеза
Туберкулез (от лат. tuberculum - «бугорок») - первично-хроническое заболевание человека и животных, сопровождающееся поражением различных органов и систем. Чаще всего поражаются органы дыхания. Тем не менее практически все ткани и органы могут быть затронуты патологическим туберкулезным процессом. Основу патологического процесса составляет специфическая гранулема - воспалительная реакция тканей, имеющая вид узелка или бугорка.
Бактериальную природу туберкулеза установил в 1882 г. Р. Кох, за это великое открытие он в 1911 г. был удостоен Нобелевской премии. Всемирный день борьбы с туберкулезом по решению ВОЗ отмечают 24 марта, когда Кох объявил о сделанном им открытии. Символом борьбы с туберкулезом в России считают белую ромашку.
В настоящее время в мире ежегодно регистрируют 10 млн новых случаев заболевания, а каждый год на Земле 3 млн человек умирают от туберкулеза.
Таксономия. Вызывающие заболевание виды микобактерий туберкулеза (МБТ) объединены в так называемый МБТ-комплекс, включающий M. tuberculosis - человеческий вид, M. bovis - бычий вид, M. africanum - промежуточный вид, Mycobacterium bovis BCG, M. microti и M. canettii. Нетуберкулезные микобактерии (НТМБ) - представители рода Mycobacterium, патогенные/условно-патогенные виды, способны вызывать заболевания у человека (лепру, микобактериозы).
Морфология и тинкториальные свойства, особенности культивирования. Клеточная стенка микобактерий имеет сложное строение. Она состоит из плазматической мембраны, окруженной жесткой многослойной клеточной стенкой, которая состоит из пептидогликанов, арабиногалактанов и миколовых кислот. Во внешнем слое находятся различные экстрактивные липиды, обеспечивающие микобактериям гидрофобность, что придает клетке устойчивость к токсическим веществам. Жесткая клеточная стенка, в свою очередь, окружена еще одним внешним слоем - капсулой.
Миколовые кислоты присутствуют в виде свободных сульфолипи-дов и корд-фактора (от англ. cord - жгут, веревка), благодаря которому они растут в виде кос или жгутов (рис. 15-10). Клеточная мембрана и слои клеточной стенки пронизаны порами, обеспечивающими транспорт веществ.

Вследствие большого количества липидов в клеточной стенке мико-бактерии плохо воспринимают анилиновые красители. Для этой цели в практике используют окраску по Цилю-Нельсену, в основу которой положен принцип термокислотного протравливания. В препаратах обнаруживают микобактерии в виде ярко-красных кислотоустойчивых палочек.
Микобактерии туберкулеза (M. tuberculosis) - строгие аэробы. Они довольно требовательны к питательным средам. Им нужны факторы роста: витамины группы B, аспарагиновая и глютаминовая аминокислоты. Стимулятором роста служит лецитин. Для подавления роста сопутствующей микрофлоры к средам добавляют красители (малахитовый зеленый) и антибиотики, не действующие на микобактерии.
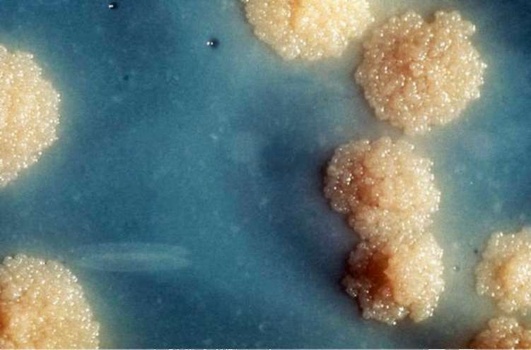
Оптимальная температура культивирования микобактерий - 37 °С (рН - 6,8-7,2). На плотных средах рост отмечен на 15-20-й день в виде кремового, белого или бледно-желтого чешуйчатого налета с неровными краями (R-форма колоний), напоминающего цветную капусту (рис. 15-11). На жидких средах через 5-7 дней они растут в виде толстой твердой сухой бугристо-морщинистой пленки кремового цвета (цвета слоновой кости).
К M. tuberculosis наибольшей восприимчивостью обладают морские свинки. M. bovis - микроаэрофилы, растут на средах медленнее, чем M. tuberculosis, пируватозависимы. При росте на плотных средах на 21-60-й день образуют мелкие шаровидные влажные, почти прозрачные колонии серовато-белого цвета (S-форма колоний). При культивировании на жидких средах сначала растут в глубине среды, образуя в последующем тонкую влажную пленку на поверхности среды. Высокопатогенны для кроликов.
M. africanum выделяют от больных туберкулезом людей в тропической Африке.
Для культивирования возбудителей легочного туберкулеза, определения чувствительности к антибиотикам и выделения чистой культуры ВОЗ рекомендует использовать среду Левенштейна-Йенсена. Среду Финна-2 применяют для культивирования M. bovis и возбудителей внелегочного туберкулеза.
При внутриклеточном размножении, а также при росте на жидких питательных средах и микрокультивировании на стеклах в жидкой среде (методе микрокультур Прайса) через 48-72 ч у вирулентных штаммов выявляют корд-фактор, из-за которого микобактерии склеиваются и растут в виде переплетенных девичьих кос или жгутов. Корд-фактор относят к факторам патогенности микобактерий. Авирулентные штаммы возбудителей туберкулеза и НТМБ при микрокультивировании не образуют корд-фактора и растут беспорядочно. В отличие от возбудителей туберкулеза, растущих в культуре клеток HeLa в виде кос, условно-патогенные микобактерии дают ветвистый рост, а сапрофитные не размножаются.
Дифференциацию M. bovis, M. tuberculosis от НТМБ проводят по способности образовывать каталазу и никотиновую кислоту (ниацин), которая накапливается в жидкой питательной среде и дает с раствором цианида калия и хлорамином Б ярко-желтое окрашивание (ниациновая проба Конно).
Дифференциацию M. tuberculosis от M. bovis осуществляют по способности первых редуцировать нитраты в нитриты (положительный нитратредуктазный тест).
Химический состав, антигенная структура и факторы патогенности.
Основные химические компоненты микобактерий - белки (туберкуло-протеины), углеводы и липиды. К ним образуются антифосфатидные, антипротеиновые и антиполисахаридные антитела, определение которых свидетельствует об активности инфекционного процесса и имеет прогностическое значение. Туберкулопротеины - основные носители антигенных свойств микобактерий, высокотоксичны, вызывают развитие реакции гиперчувствительности IV типа. На долю полисахаридов приходится 15% сухой массы вещества микобактерий. В отличие от других бактерий, на долю липидов приходится от 10 до 60% сухой массы вещества микобактерий. Миколовая кислота, входящая в состав липид-ных комплексов и находящаяся в соединении с высокомолекулярным спиртом фтиоциролем, обусловливает кислото-, спирто- и щелочеу-стойчивость данных микроорганизмов.
Основные патогенные свойства возбудителей туберкулеза обусловлены прямым или иммунологически опосредованным действием липидов и их комплексов с туберкулопротеинами и полисахаридами.
Эти медленно размножающиеся, «бронированные» микроорганизмы поражают долгоживущие клетки - макрофаги. Они обладают способностью подавлять фагоцитоз. Бактерии чаще всего выбирают макрофаги легких, обладающих низкой микробоцидной активностью.
Устойчивость в окружающей среде. Благодаря наличию липидов микобактерии обладают гидрофобной клеточной стенкой, что делает их устойчивыми в окружающей среде. Возбудитель сохраняет свою жизнеспособность в сухом состоянии до 3 лет. Возбудители туберкулеза устойчивы к органическим и неорганическим кислотам, щелочам, многим окислителям и некоторым антисептикам. Тем не менее облученная солнечным светом культура микроорганизмов погибает в течение 1,5 ч, а под воздействием ультрафиолетовых лучей - через 2-3 мин, поэтому наиболее действенными мерами, позволяющими снизить степень инфицированности, считают адекватную вентиляцию и воздействие ультрафиолета. При кипячении микобактерии погибают через 5 мин, а при пастеризации - в течение 30 мин. Для дезинфекции используют активированные растворы хлорамина, вызывающие гибель возбудителей туберкулеза в течение 3-5 ч.
Эпидемиология, патогенез и клиническая картина. Росту заболеваемости туберкулезом способствуют неблагоприятные социально-экономические факторы, а также высокая выживаемость микобактерий в окружающей среде и широкое распространение штаммов с множественной лекарственной устойчивостью к антибиотикам и химиопрепаратам, лекарственно-зависимых форм возбудителей туберкулеза («штаммов-убийц»), например штамма «Биджинг».
Основной механизм заражения при туберкулезе - аэрогенный. Входными воротами при этом могут быть слизистая оболочка полости рта, миндалины, бронхи и легкие. Реже заражение может происходить пищевым путем при употреблении мясо-молочных продуктов. Мерцательный эпителий верхних дыхательных путей задерживает и удаляет большую часть микобактерий, проникающих в организм человека, и лишь менее 10% бактерий достигает альвеол легких и захватывается альвеолярными макрофагами. В первую очередь микобактерии инфицируют альвеолярные макрофаги, эпителиальные и дендритные клетки. Для заражения бывает достаточно до 10 бактерий. Проникая в макрофаг в результате фагоцитоза, микобактерии блокируют созревание фагосомы (ее слияние с лизосомами). Начинают размножаться внутри фагосомы, и таким образом препятствуют запуску макрофагами программы апоптоза.
Только 5-15% среди инфицированных лиц заболевают туберкулезом в активной форме. В большинстве случаев бактерия и хозяин поддерживают состояние равновесия, при котором микобактерии существуют в организме человека в персистентной форме на протяжении десятилетий. Однако ослабление иммунной системы хозяина может стимулировать их активное размножение.
В основе специфической воспалительной реакции при туберкулезе лежит реакция гиперчувствительности IV типа, сопровождающаяся образованием эпителиоидно-клеточных гранулем. Последние состоят из очага казеозного некроза в центре, содержащего микобактерии и окруженного эпителиоидными и гигантскими клетками Пирогова- Лангханса, образовавшимися из гистиоцитов и макрофагов при их пролиферации. Таким образом, гранулема - специфическая реакция макроорганизма, направленная на ограничение распространения микроорганизма.
Противотуберкулезный иммунитет формируется в ответ на проникновение в организм микобактерий в процессе инфекции или вакцинации и носит нестерильный, инфекционный характер, что обусловлено длительной персистенцией L-форм бактерий в макроорганизме. Он проявляется через 4-8 нед после попадания микроорганизмов в макроорганизм. Решающую роль играют клеточные факторы иммунитета. Несмотря на клиническое или рентгенологическое выздоровление, с микробиологических позиций выздоровления от туберкулеза не происходит.
Микробиологическая диагностика. Наиболее специфичными для туберкулеза органов дыхания считают обнаружение микобактерий туберкулеза, их генетических маркеров, а также совокупности морфологических признаков туберкулезной гранулемы: казеозного некроза, эпите-лиоидных клеток, гигантских клеток Пирогова-Лангханса.
Материалом для исследования служат мокрота, реже промывные воды бронхов и желудка, плевральная и спинномозговая жидкость, моча, а также кусочки тканей и органов, взятые на исследование во время операции или биопсии. Обнаружение в патологическом материале возбудителей туберкулеза служит прямым доказательством активности инфекционного процесса.
Диагностическая чувствительность метода микроскопии обычно составляет не более 50% среди всех впервые выявленных больных туберкулезом легких. Методы микроскопии не позволяют дифференцировать микобактерию туберкулеза от НТМБ и имеют невысокую чувствительность, требующую наличия 10 000 бактериальных клеток в 1 см3 мокроты. Методы микроскопии, обладающие относительно невысокой чувствительностью, сохраняют тем не менее свою актуальность, так как доступны, не требуют сложного аналитического лабораторного оборудования.
В качестве основного диагностического микроскопического исследования рекомендуют применять методы микроскопии с окраской люминесцентными красителями. Основное преимущество такой микроскопии перед световой микроскопией с окраской по Цилю-Нельсену состоит в большей чувствительности и лучшей эргономике и контрастности изображения, использовании меньших увеличений объектива и, соответственно, возможности просматривать большую площадь мазка в поле зрения.
Диагностическая чувствительность микроскопии с окраской люминесцентными красителями в среднем на 10% выше, чем микроскопии с окраской по Цилю-Нельсену.
Бактериологическое исследование более чувствительно, чем бактериоскопическое. Метод позволяет выявить возбудителей туберкулеза при наличии в исследуемом материале всего нескольких десятков жизнеспособных микроорганизмов. Помимо определения видовой принадлежности выделенной чистой культуры микобактерий, обязательно определяют чувствительность микобактерий к антибиотикам. Недостатком метода считают его длительность (3-8 нед).
Культивирование микроорганизмов в жидкой питательной среде повышает обнаружение микобактерий примерно на 10% по сравнению с выявлением на плотных питательных средах. В настоящее время широко используют системы культивирования микроорганизмов с автоматической детекцией наличия роста микобактерий, которые позволяют значительно упростить процедуру считывания результатов культивирования.
Биологическая проба позволяет обнаружить от одной до пяти микобактерий в исследуемом материале. Метод эффективен при исследовании одноразового материала (кусочков тканей и органов, взятых во время операции, биопсийного материала). Его считают основным дифференциально-диагностическим тестом при определении видовой принадлежности и вирулентности патогенных и условно-патогенных микобактерий.
Аллергодиагностика заключается в определении повышенной чувствительности макроорганизма к аллергену туберкулину, наступившей вследствие заражения возбудителями туберкулеза или вакцинации бациллой Кальметта-Герена с помощью кожной аллергической пробы Манту. В основе аллергодиагностики лежит развитие реакции гиперчувствительности IV типа. Реакция на пробу Манту с дозой 2 ТЕ может быть:
В настоящее время реакция Манту с туберкулином постепенно вытесняется более современным диагностическим тестом «Диаскин», где вместо туберкулина используют генно-инженерные белки микобактерий ЕSАТ-6 (Early-Secreted Antigenic Target) и CFP-10 (Culture Filtrate Protein), которые отсутствуют у M. bovis BCG.
Федеральная служба по надзору в сфере здравоохранения сообщает o принятом ЗАО «ГЕНЕРИУМ» решении приостановить реализацию препарата «Диаскинтест» для лечебно-профилактических и санитарно-профилактических учреждений.
Аллергическую реакцию организма in vitro можно выявить, используя квантифероновый тест (QuantiFERON®-ТВ Gold). Метод основан на определении γ-интерферона, высвобождаемого сенсибилизированными Т-клетками, стимулированными in vitro специфическими протеинами микобактерий туберкулеза, входящих в Mycobacterium tuberculosis complex. Эти протеины отсутствуют в вакцинных штаммах M. bovis BCG и в большинстве НТМБ, за исключением M. kansasii, M. szulagai, M. marinum. В исследуемой крови пациента определяют содержание γ-INF, результат анализируют в совокупности с данными, полученными из двух других пробирок (выполняющих роль контрольных).
Молекулярно-генетический метод широко используют не только для диагностики туберкулеза, но и для определения частоты лекарственной устойчивости микобактерий. Для этих целей широко применяют ПЦР. Широкое распространение в диагностике туберкулеза и микобактериозов получил и метод гибридизации ДНК с применением микробиочипов.
К альтернативным методам диагностики туберкулеза относят обнаружение антител к антигенам микобактерий туберкулеза в РНГА и тест-системах ИФА. Они позволяют определить степень активности процесса, оценить эффективность лечения и решить вопрос об иммунокоррекции.
Экспресс-диагностика туберкулеза основана на применении РИФ, а также метода лазерной флюоресценции. Новым направлением считают комплексное использование бактериоскопического метода и ПЦР. Получение положительного ответа бактериоскопическим методом и ПЦР позволяет диагностировать туберкулез и рекомендовать немедленное назначение противотуберкулезных препаратов по классической схеме. Отрицательный результат ПЦР при наличии кислотоустойчивых микобактерий в мазках позволяет исключить присутствие возбудителей туберкулеза и рекомендовать назначение препаратов, активных в отношении НТМБ. В других ситуациях рекомендуют ожидать результатов бактериологического исследования.
Иммунохроматографический метод идентификации выросших культур микроорганизмов основан на определении наличия специфического антигена микобактерий туберкулеза, позволяет получить результат идентификации в течение 15 мин. Данный метод может быть рекомендован в качестве основного при идентификации культур, выросших на жидких или плотных питательных средах, а также в контаминированных культуральных образцах.
Лечение. Противотуберкулезные препараты разделяют на две основные группы. К первой относят изониазид, рифампицин, пиразинамид, этамбутол, стрептомицин. Их называют основными, или препаратами первого ряда. Эти препараты используют для лечения больных, у которых туберкулез был выявлен впервые. К препаратам второго ряда относят протионамид, этионамид, рифабутин, аминосалициловую кислоту, циклосерин, фторхинолоны, офлоксацин, ломефлоксацин, левофлоксацин, канамицин, капреомицин. Препараты второго ряда называют резервными. Их применяют для лечения больных туберкулезом в случаях, когда возбудитель устойчив к препаратам первого ряда или при их непереносимости.
Основные проблемы лечения туберкулеза - множественная лекарственная устойчивость микобактерий к изониазиду и рифампицину независимо от наличия устойчивости к другим противотуберкулезным препаратам и так называемая широкая лекарственная устойчивость к изониазиду, рифампицину, любому препарату из группы фторхинолонов, канамицину, амикацину, капреомицину, независимо от наличия устойчивости к другим противотуберкулезным препаратам. Mикобактерии способны быстро изменяться и переходить в неактивное (персистентное) состояние, что обеспечивает им устойчивость к антибиотикам.
Специфическая профилактика. Для создания активного искусственно приобретенного иммунитета в России применяют вакцину для профилактики туберкулеза [Вакцину туберкулезную (БЦЖ)♠ и Вакцину туберкулезную для щадящей первичной иммунизации (БЦЖ-М)♠ ]. Они представляют собой живые микобактерии вакцинного штамма БЦЖ-1, полученного французскими учеными А. Кальметтом и К. Гереном путем длительного культивирования M. bovis на картофельно-глицериновом агаре с добавлением желчи. Вакцинацию БЦЖ проводят у новорожденных внутрикожно с последующей ревакцинацией в соответствии с утвержденным календарем прививок. Вакцина для профилактики туберкулеза [Вакцина туберкулезная для щадящей первичной иммунизации (БЦЖ-М)♠ ] - препарат с уменьшенным вдвое содержанием микобактерий Кальметта-Герена в прививочной дозе.
Однако прививка не может бороться с персистентной формой инфекции. Интенсивно развиваются исследования, направленные на создание новых средств профилактики туберкулеза (конструирование синтетических рекомбинантных субъединичных вакцин нового поколения, имеющих антигенные детерминанты не только активных, но и персистирующих форм микобактерий).
Химиопрофилактика заключается в применении противотуберкулезных препаратов для предупреждения инфицирования, развития заболевания и генерализации инфекции у лиц, подвергающихся наибольшей опасности заражения туберкулезом.