Неонатология. Клинические рекомендации / под ред. Н. Н. Володина, Д. Н. Дегтярева, Д. С. Крючко. - Москва : ГЭОТАР-Медиа, 2020. - 320 с. - 320 с. - ISBN 978-5-9704-5817-4 |
Аннотация
Книга содержит клинические рекомендации по наиболее распространенным в неонатальной практике заболеваниям новорожденных, подготовленные ведущими специалистами Российского общества неонатологов и Российской ассоциации специалистов перинатальной медицины. В издании рассмотрены эпидемиология, патогенез, клиническая картина, классификация, современные методы диагностики и дифференциальной диагностики, а также подходы к медикаментозному и немедикаментозному лечению гемолитической и геморрагической болезней новорожденных, непрямой гипербилирубинемии, врожденной пневмонии, инвазивного кандидоза, мекониальной аспирации, открытого артериального протока у недоношенных. Подробно изложены также технологии парентерального питания, энтерального вскармливания и терапевтической гипотермии новорожденных. В разделе "В помощь практическому врачу" приведены методические рекомендации по профилактике и контролю госпитальной инфекции и по оказанию базовой помощи и организации грудного вскармливания в перинатальном центре. Соблюдение международной методологии, использование современных литературных источников в подготовке данного издания гарантируют его актуальность, достоверность и обобщение лучшего мирового опыта и знаний.
Клинические рекомендации по неонатологии предназначены практикующим врачам-неонатологам, педиатрам, терапевтам, врачам других специальностей, а также студентам старших курсов медицинских вузов.
pin(X039-94RNHJMB,mb3,A)
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ
Согласовано и утверждено Российским обществом неонатологов и Российской ассоциацией специалистов перинатальной медицины
Авторы: Антонов А.Г., Дегтярев Д.Н. (модератор рабочей группы), Нароган М.В., Карпова А.Л., Сенькевич О.А., Сафаров А.А., Сон Е.Д., Малютина Л.В.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Гемолитическая болезнь плода и новорожденного (ГБН) - изоиммунная гемолитическая анемия, возникающая в случаях несовместимости крови матери и плода по эритроцитарным антигенам, при этом антигены локализуются на эритроцитах плода, а антитела к ним вырабатываются в организме матери.
Билирубиновая энцефалопатия (БЭ), или ядерная желтуха, - поражение нервной системы, возникающее вследствие повреждения неконъюгированным билирубином нейронов, составляющих ядра головного мозга [1-4].
Синдром холестаза - состояние, характеризующееся нарушением оттока желчи, которое сопровождается повышением уровня прямой фракции билирубина в крови [5, 6].
КРАТКАЯ ИНФОРМАЦИЯ
Определение
ГБН - изоиммунная гемолитическая анемия, возникающая в случаях несовместимости крови матери и плода по эритроцитарным антигенам, при этом антигены локализуются на эритроцитах плода, а антитела (АТ) к ним вырабатываются в организме матери [1, 3, 5].
Этиология и патогенез
Возникновение иммунологического конфликта возможно, если на эритроцитах плода присутствуют антигены, отсутствующие на мембранах клеток у матери. Так, иммунологической предпосылкой для развития ГБН является наличие резус-положительного плода у резус-отрицательной беременной. При иммунологическом конфликте вследствие групповой несовместимости у матери в большинстве случаев определяется O(I) группа крови, а у плода A(II) или реже B(III). Более редко ГБН развивается из-за несовпадения плода и беременной по другим групповым (Дафф, Келл, Кидд, Льюис, MNSs и т.д.) системам крови.
К попаданию эритроцитов плода в кровоток матери и возникновению иммунологического конфликта в случаях антигенной несовместимости по факторам крови предрасполагает предшествовавшая изосенсибилизация вследствие абортов, выкидышей, внематочной беременности, родов, при которых иммунная система матери вырабатывает антитела к эритроцитарным антигенам. Если антитела относятся к иммуноглобулинам (Ig) класса G (к подклассам IgG1, IgG3, IgG4), они беспрепятственно проникают через плаценту. С увеличением их концентрации в крови повышается вероятность развития ГБН. Антитела подкласса IgG2 обладают ограниченной способностью трансплацентарного транспорта, антитела класса IgM, к которым относятся в том числе α- и β-агглютинины, не проникают через плаценту.
Реализация ГБН по резус-фактору, как правило, происходит обычно при повторных беременностях, а развитие ГБН в результате конфликта по групповым факторам крови возможно уже при первой беременности. При наличии иммунологических предпосылок для реализации обоих вариантов ГБН чаще развивается по системе АВ0. При этом возникновение гемолиза вследствие попадания в кровь ребенка с А(II) группой крови материнских анти-А-антител встречается чаще, чем при попадании в кровь ребенка с В(III) группой крови анти-В-антител. Однако в последнем случае проникновение анти-В-антител приводит к более тяжелому гемолизу, нередко требующему заменного переливания крови. Тяжесть состояния ребенка и риск развития ядерной желтухи при ГБН по АВ0-системе менее выражены по сравнению с ГБН по резус-фактору. Это объясняется тем, что групповые антигены А и В экспрессируются многими клетками организма, а не только эритроцитами, что приводит к связыванию значительного количества антител в некроветворных тканях и препятствует их гемолитическому воздействию [3, 7].
Эпидемиология
ГБН в России в 2014-2016 гг. диагностировалась у 0,9-1,0% новорожденных согласно 32-й форме Росстата.
Коды по Международной классификации болезней 10-го пересмотра
Классификация
По конфликту между матерью и плодом по системе АВ0 и другим эритроцитарным факторам крови
По клиническим проявлениям выделяют формы заболевания
По степени тяжести [1-3, 5, 8]
-
Легкое течение диагностируется при наличии умеренно выраженных клинико-лабораторных или только лабораторных данных. В пуповинной крови определяется уровень гемоглобина более 140 г/л, билирубина - менее 68 мкмоль/л. Для лечения может требоваться лишь фототерапия (ФТ).
-
При средней тяжести ГБН в пуповинной крови определяется уровень гемоглобина 100-140 г/л, билирубина - 68-85 мкмоль/л. Требуются интенсивная ФТ и часто операция заменного переливания крови (ОЗПК).
-
Тяжелая степень соответствует отечной форме ГБН, тяжелой анемии - гемоглобин менее 100 г/л, или тяжелой гипербилирубинемии - более 85 мкмоль/л при рождении, может сопровождаться нарушением дыхания и сердечной деятельности, развитием БЭ.
Комментарии. Классификация по степени тяжести основана на обобщенных данных указанных источников литературы.
По наличию осложнений
ДИАГНОСТИКА
Жалобы и анамнез
При сборе анамнеза обращают внимание на резус-принадлежность и группу крови матери и новорожденного, соматический и акушерско-гинекологический анамнез матери, наличие ГБН в текущей или предыдущих беременностях, выявление во время беременности прироста титра анти-D-антител у Rh(-) женщины, наличие ультразвуковых признаков ГБН, гестационный возраст (ГВ) и антропометрические показатели новорожденного.
Физикальное обследование
Отечная форма гемолитической болезни плода и новорожденного
С первых минут жизни характерны общий отечный синдром (анасарка, асцит, гидроперикард, гидроторакс), выраженная бледность кожи и слизистых оболочек, гепатомегалия и спленомегалия; желтуха отсутствует или слабо выражена. Большинство детей имеют низкую оценку по шкале Апгар в связи с наличием тяжелой дыхательной и сердечно-сосудистой недостаточности. Данная форма часто сопровождается шоком и геморрагическим синдромом за счет тромбоцитопении и/или развития диссеминированного внутрисосудистого свертывания.
Желтушная форма гемолитической болезни плода и новорожденного
При рождении могут быть желтушно прокрашены околоплодные воды, оболочки пуповины, первородная смазка. Характерны раннее развитие желтухи (до 24 ч жизни) на фоне побледнения кожного покрова и видимых слизистых оболочек, увеличение печени и селезенки.
Визуальный осмотр не является надежным показателем уровня билирубина [9, 27, 31].
Анемическая форма гемолитической болезни плода и новорожденного
Степень выраженности клинических проявлений зависит от степени снижения гемоглобина. Развиваются бледность кожного покрова, увеличение размеров печени и селезенки. При выраженной анемии отмечают вялость, плохое сосание, тахикардию, возможны приглушенность тонов сердца, систолический шум.
Отдаленные проявления гемолитической болезни плода и новорожденного
У 83% детей с ГБН, родившихся после 34-й недели, развивается поздняя анемия (после 7-го дня жизни, в течение первых 3 мес жизни) [10]. Проявляется бледностью кожного покрова, увеличением размеров печени и селезенки. При выраженной анемии характерны вялость, плохое сосание, тахикардия, систолический шум.
Осложнения гемолитической болезни плода и новорожденного
Ядерная желтуха. Вначале развивается клиническая картина билирубиновой интоксикации: вялость, снижение мышечного тонуса, снижение аппетита, срыгивания, рвота, патологическое зевание, монотонный крик, ротаторный нистагм, блуждающий взгляд. При оказании немедленной помощи (ОЗПК) возникшие изменения могут быть обратимы. Далее развивается клиническая картина острой БЭ: опистотонус, пронзительный крик, невозможность сосания, апноэ, выбухание большого родничка, патологическая глазодвигательная симптоматика (симптом заходящего солнца, нистагм), судороги. У недоношенных детей клиническая картина может быть стертой. Классические признаки хронической БЭ могут проявляться отсроченно - через 4-6 мес.
Синдром холестаза - желтуха с зеленоватым оттенком, печень увеличена, насыщенный цвет мочи.
Комментарии. При ГБН по системе АВ0 отечная форма практически не встречается (описана в единичных случаях), и, как правило, заболевание протекает более легко, чем ГБН по резус-фактору [1, 3, 5, 11].
Лабораторная диагностика
Если кровь матери характеризуется отрицательным резус-фактором, новорожденному рекомендуется обязательно проводить определение группы крови и резус-фактора, прямой пробы Кумбса в крови из пуповины [31].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2а).
Комментарии. Прямая проба Кумбса является положительной при наличии фиксированных антител на поверхности эритроцитов, что, как правило, наблюдается при ГБН по резус-фактору [5, 35]. Следует учитывать, что контаминация вартоновым студнем, спонтанная агглютинация эритроцитов, технические погрешности могут приводить к ложноположительной пробе Кумбса, а незначительное количество IgG и технические погрешности - к ложноотрицательной [35]. Введение анти-D-иммуноглобулина на 28-й неделе беременности может привести к положительному результату прямой пробы Кумбса за счет пассивной передачи антител плоду (около 15% случаев) [4, 5, 35]. Следует помнить, что выраженность пробы Кумбса не коррелирует с тяжестью ГБН [5, 12].
Если кровь матери 0 (I) и резус-положительная, то рекомендуется определение группы крови новорожденного и прямой пробы Кумбса в крови из пуповины. Однако более важное значение имеют надлежащее наблюдение за новорожденным, выявление ранней гипербилирубинемии [31]
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3).
Комментарии. В очень редких случаях возможны затруднения интерпретации или ошибочные результаты определения группы по системе АВ0 в крови пуповины, что связывают с различными причинами: слабой агглютинацией, контаминацией вартоновым студнем, техническими погрешностями [32-34]. Необходимо соблюдать правильную технику забора крови из пуповины, избегать контаминации крови вартоновым студнем и использовать правильную лабораторную подготовку пуповинной крови к исследованию. В сомнительных случаях рекомендуется повторное определение группы крови по системе АВ0 у ребенка [32, 33].
Определение прямой пробы Кумбса для диагностики ГБН по системе АВ0 имеет ограниченное значение. Как положительный, так и отрицательный результат не имеют определяющей роли в установлении данного диагноза. Положительная прямая проба Кумбса при отсутствии симптомов гемолиза не является критерием диагностики ГБН по системе АВ0. Отрицательная прямая проба Кумбса не исключает этот диагноз. Кроме того, положительная прямая проба Кумбса встречается при аутоиммунной гемолитической анемии, сенсибилизации эритроцитов лекарственными препаратами [35-37].
В случаях, когда причина гемолиза неясна, рекомендуется непрямая проба Кумбса, предназначенная для выявления антител, присутствующих в исследуемой сыворотке. Это более чувствительный тест для выявления материнских изоантител, чем прямая проба Кумбса [5, 11].
Новорожденным, имеющим факторы риска развития ГБН по резус-фактору, рекомендуется контроль за уровнем общего билирубина (ОБ) и гемоглобина в крови пуповины [5, 11].
Комментарии. В случаях невозможности выполнения анализов из крови пуповины осуществляется взятие крови ребенка непосредственно после рождения.
Всем новорожденным с подозрением на развитие ГБН показано исследование гемоглобина и ОБ в крови. Если желтуха появилась в первые 24 ч, необходимо неотложное исследование уровня ОБ [1-3, 5, 13, 18].Уровень билирубина интерпретируется с учетом ГВ и постнатального возраста ребенка [5, 15, 27, 30, 31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3).
Новорожденным с ГБН рекомендуется общий анализ крови с исследованием тромбоцитов. По показаниям, в зависимости от тяжести состояния и формы ГБН, - определение в крови фракций билирубина, уровня глюкозы, общего белка, альбумина, аланинаминотрансферазы, аспартатаминотрансферазы, γ-глютамилтранспептидазы, щелочной фосфатазы, электролитов, газового состава и кислотно-основного состояния крови, коагулограммы. Наиболее тяжелые нарушения метаболизма и свертывания крови (гипопротеинемия, гипогликемия, гипоксемия, ацидоз, тромбоцитопения, диссеминированное внутрисосудистое свертывание) характерны для отечной формы ГБН [1, 3, 5, 8, 11].
Для ГБН характерно повышение уровня ретикулоцитов, отражающее компенсаторную реакцию эритроидного ростка костного мозга на течение гемолиза, что может быть использовано как дополнительный, подтверждающий диагноз тест течения гемолиза [5].
Комментарии. Нормальные значения уровня ретикулоцитов в первые дни составляют: у доношенных детей - 4-7% (200 000-400 000/?L), у недоношенных - до 6-10% (до 400 000-550 000/?L). К 4-му дню количество ретикулоцитов снижается до 1% (до 50 000/?L) [13]. При ΓБНуровень ретикулоцитов достигает 10-40% [5].
Повышение прямой фракции билирубина более 17 мкмоль/л при уровне ОБ менее 85,5 мкмоль/л или более 20% при уровне ОБ более 85,5 мкмоль/л характеризует развитие синдрома холестаза, что также часто сопровождается повышением уровня щелочной фосфатазы и γ-глютамилтранспептидазы [5, 6].
Инструментальная диагностика
При среднетяжелых и тяжелых формах ГБН рекомендуются:
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
ЛЕЧЕНИЕ
Консервативное лечение
Лабораторными критериями для выбора консервативной или оперативной тактики лечения в первые часы жизни ребенка являются исходная концентрация ОБ и гемоглобина в пуповинной крови [1, 5, 8, 9, 11].
В первые сутки жизни тактика ведения новорожденных с ГБН и риском ее развития осуществляется в соответствии с алгоритмом (приложение Б). В последующий период важным лабораторным критерием выбора тактики лечения является уровень билирубина (приложение 2-4).
Ведение новорожденных, у которых была выполнена внутриутробная трансфузия крови, осуществляется по общим правилам и принципам лечения ГБН [14].
Фототерапия (ФТ) является наиболее эффективным методом консервативной терапии ГБН.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1а).
Комментарии. Особенности проведения ФТ при ГБН [2-5, 9].
-
ФТ проводится в соответствии с показаниями (приложения 1-2).
-
Для ФТ используются предназначенные для лечения гипербилирубинемии новорожденных лампы и устройства. Расстояние между ребенком и источником ФТ должно быть по возможности минимальным в соответствии с инструкцией производителя.
-
Если используется один источник ФТ, то рекомендуется менять положение ребенка для облучения живота и спины каждые 3-4 ч.
-
У детей с риском ОЗПК рекомендуется интенсивная ФТ - одновременно сверху, сбоку и снизу с помощью нескольких источников или с помощью специального устройства с встроенными несколькими лампами.
-
Поверхность тела ребенка на фоне ФТ должна быть максимально открыта. Подгузник может быть оставлен на месте.
-
Глаза и половые органы (у мальчиков) должны быть защищены светонепроницаемым материалом, при защите глаз следует отдавать предпочтение специальным очкам.
-
При проведении ФТ контролируются температура тела ребенка, адекватность питания, динамика массы тела, регулярность мочеиспускания/ диурез.
-
Детям с низкой массой тела может потребоваться увеличение суточного объема жидкости на фоне ФТ на 10-20 мл/кг в сутки по сравнению с физиологической потребностью. Доношенным детям дополнительного введения жидкости чаще не требуется.
-
ФТ проводится до и после ОЗПК, а также, при наличии технических возможностей, - во время процедуры ОЗПК (с помощью фиброоптической системы).
-
Универсальных критериев для прекращения ФТ нет. Ориентиром служит отсутствие патологического прироста билирубина, а также снижение его уровня на 17-34 мкмоль/л ниже значений, которые являются показанием к ФТ [2, 5, 15].
-
Спустя 12-24 ч после окончания ФТ необходимо выполнить контрольное исследование билирубина.
-
При внутривенном введении жировых эмульсий на фоне ФТ необходимо проводить светозащитные мероприятия, так как воздействие света на жировую эмульсию способствует образованию токсичных гидроперекисей [16]. Уровень убедительности рекомендаций В (уровень достоверности доказательств 2).
-
Не допускается переливание вирусинактивированной (патогенинактивированной) свежезамороженной плазмы (СЗП) реципиентам детского возраста, находящимся на ФТ [17].
Трансфузия эритроцитарной массы показана:
Комментарии. Показания к гемотрансфузии определяются клиническими рекомендациями по лечению анемии с учетом возраста; гемотрансфузия проводится в соответствии с правилами подбора компонентов крови у детей с ГБН [17, приложение 5].
Препараты внутривенных Ig класса G. Данные об их эффективности при ГБН противоречивы.
Предполагается, что высокие дозы Ig блокируют Fc-рецепторы клеток ретикулоэндотелиальной системы и тем самым позволяют снизить гемолиз и, следовательно, уровень билирубина, что, в свою очередь, уменьшает число ОЗПК [1, 5, 9, 19, 20]. Однако ряд последних исследований, которые характеризовались возможностью применения современных методов интенсивной ФТ и лучшим качеством исследований, не выявили положительных эффектов от назначения Ig. Кроме того, вряде исследований, опубликованных после 2012 г., обращается внимание на возможность развития тяжелых осложнений, ассоциированных с использованием Ig [некротизирующий энтероколит (НЭК), тромбоз, перфоративный аппендицит, гемолиз, почечная недостаточность, анафилаксия] [5, 10, 13, 21, 22].
Рутинное применение препаратов внутривенных Ig при ГБН не показано. Вместе с тем их применение может быть рекомендовано консилиумом врачей, если он придет к выводу, что польза от этого в конкретном случае ГБН превышает потенциальные риски. Применение препаратов внутривенных Ig класса G в индивидуальных случаях по решению консилиума возможно после получения добровольного согласия родителей [22].
Инфузионная терапия. Токсическим действием обладает непрямой жирорастворимый билирубин, поэтому его уровень не может быть снижен путем избыточного перорального или внутривенного введения раствора декстрозы (Глюкозы♠). Инфузионная терапия проводится только в том случае, если состояние ребенка с риском развития дегидратации и гипогликемии не позволяет увеличить объем жидкости энтерально в соответствии с потребностью ребенка [5, 10].
Желчегонная терапия. Может быть рекомендована только в случае развития синдрома холестаза [10, 23]. Проводится препаратом урсодезоксихолевой кислоты в виде суспензии из расчета 20-30 мг/кг в сутки в два приема.
Введение раствора альбумина человека. Доказательств, что инфузия альбумина человека улучшает долгосрочные исходы у детей с тяжелой гипербилирубинемией, нет, поэтому его рутинное применение не рекомендуется [10].
Фенобарбитал. Эффект при ГБН не доказан, применение в целях лечения ГБН недопустимо.
Применение других медикаментозных средств из группы гепатопротекторов. При ГБН не доказано и недопустимо.
Эпоэтин бета (Эритропоэтин♠). Рутинное использование не рекомендуется в виду наличия ограниченных данных о его эффективности при поздней анемии, связанной с ГБН [10].
Препараты железа. У новорожденных с ГБН имеется тенденция к избытку железа из-за гемолиза и проведенных гемотрансфузий. Избыток железа имеет множественные неблагоприятные последствия для здоровья. Назначений препаратов железа в первые 3 мес у детей с ГБН, особенно перенесших гемотрансфузии и ОЗПК, следует избегать. Назначение показано только при доказанном железодефиците (отсутствии повышения уровня ферритина) [10].
Фолиевая кислота. Нет доказательств эффективности. Однако часто применяется, учитывая затяжную анемию, в дозе 0,1-0,25 мг/сут [10].
Хирургическое лечение
Операция заменного переливания крови
Показания к ОЗПК определяются в соответствии приложениями 1-2.
В случае появления клинических симптомов острой БЭ заменное переливание крови проводится независимо от уровня билирубина.
ОЗПК в первую очередь направлена на удаление свободного (непрямого) билирубина, цель операции - предотвратить развитие ядерной желтухи при неэффективности консервативной терапии.
Наиболее эффективное удаление билирубина из крови достигается при замене крови пациента компонентами крови донора (эритроцитарная масса и плазма) в объеме двух ОЦК.
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1а).
При наличии показаний к ОЗПК у детей с желтушной формой ГБН операция всегда проводится в стандартном объеме (замена двух ОЦК).
Подготовка и проведение операции.
-
Обязательно получение от родителей информированного согласия на проведение ОЗПК.
-
Манипуляцию выполняют в палате/отделении реанимации и интенсивной терапии новорожденных (ПИТН/ОРИТН).
-
До начала операции у новорожденных в тяжелом состоянии стандартными методами интенсивной терапии должны быть устранены ацидоз, гипоксемия, гипогликемия, электролитные нарушения, гемодинамические расстройства, гипотермия и т.д.
-
ОЗПК проводит бригада, состоящая как минимум из двух человек: врача и детской медицинской сестры.
-
Дети не должны получать энтеральное питание (ЭП) в течение последних 3 ч до предполагаемого начала операции.
-
Непосредственно перед операцией в желудок должен быть введен постоянный зонд, через который необходимо периодически удалять содержимое желудка.
-
Операция выполняется при строгом соблюдении правил асептики и антисептики.
-
В течение всего процесса подготовки к ОЗПК, выполнения операции и последующего ведения ребенка необходим постоянный мониторинг витальных функций [частота сердечных сокращений (ЧСС), частота дыхания, сатурация кислорода, артериальное давление, температура тела].
-
Донорскую кровь и/или ее компоненты при ОЗПК переливают из расчета 160-180 мл/кг массы тела для доношенного ребенка и 170-180 мл/кг для недоношенного (пример расчета объема замещения представлен в приложении 6).
-
Соотношение эритроцитарной массы/взвеси и СЗП составляет 2:1.
-
Согласно Приказу Минздрава России от 2 апреля 2013 г. № 183н «Об утверждении правил клинического использования донорской крови и/или ее компонентов» [17], при трансфузии (переливании) донорской крови и/или эритроцитсодержащих компонентов новорожденным:
-
переливаются эритроцитсодержащие компоненты, обедненные лейкоцитами (эритроцитарная взвесь, эритроцитарная масса, отмытые эритроциты, размороженные и отмытые эритроциты);
-
при подборе компонентов донорской крови для трансфузии (переливания) учитывается, что мать является нежелательным донором СЗП для новорожденного, поскольку плазма матери может содержать аллоиммунные антитела против эритроцитов новорожденного, а отец является нежелательным донором эритроцитсодержащих компонентов, поскольку против антигенов отца в крови новорожденного могут быть антитела, проникшие из кровотока матери через плаценту;
-
наиболее предпочтительной является трансфузия негативного по цитомегаловирусу эритроцитсодержащего компонента;
-
не допускается переливание вирусинактивированной (патогенинактивированной) СЗП;
-
для заменного переливания крови используются эритроцитсодержащие компоненты со сроком хранения не более 5 дней с момента заготовки компонента;
-
подбор компонентов донорской крови в зависимости от специфичности аллоантител осуществляется следующим образом:
-
при ГБН, вызванной аллоиммунизацией к антигену D системы резус, используются одногруппные резус-отрицательные эритро-цитсодержащие компоненты и одногруппная резус-отрицательная СЗП;
-
при несовместимости по антигенам системы АВ0 переливаются отмытые эритроциты или эритроцитарная взвесь и СЗП согласно приложению 5, соответствующие резус-принадлежности и фенотипу ребенка;
-
при одновременной несовместимости по антигенам систем АВ0 и резус переливают отмытые эритроциты или эритроцитарную взвесь 0(I) группы резус-отрицательные и СЗП AB (IV) резус-отрицательную;
-
при ГБН, вызванной аллоиммунизацией к другим редким антигенам эритроцитов, осуществляется индивидуальный подбор донорской крови.
-
-
Порядок проведения ОЗПК:
-
зафиксировать конечности ребенка путем надежного пеленания, кожа живота остается открытой;
-
установить пупочный катетер со строгим соблюдением правил асептики и антисептики и зафиксировать его;
-
при наличии противопоказаний к катетеризации пупочной вены ОЗПК проводят через любую другую центральную вену;
-
компоненты донорской крови предварительно необходимо согреть до температуры 36-37 °С;
-
первую порцию выводимой крови необходимо отобрать для биохимического исследования на уровень билирубина;
-
далее последовательно проводят постепенное выведение крови ребенка и последующее восполнение выведенного объема;
-
объем одного замещения (однократного выведения крови) и одного восполнения (однократного введения компонентов крови) не должен превышать 5 мл/кг под обязательным контролем за показателями гемодинамики, дыхания и функций почек;
-
после каждых 100 мл замещающей среды (эритроцитарной массы и плазмы) ввести 1-2 мл 10% раствора кальция глюконата, предварительно разведенного в 5 мл 5% декстрозы (Глюкозы♠) (только между шприцами с эритроцитарной массой!);
-
перед окончанием операции осуществляется забор крови на билирубин;
-
в результате операции (с учетом крови, взятой на биохимическое исследование) суммарный объем вводимых компонентов донорской крови должен быть равен суммарному объему выведенной крови ребенка.
NB! О безусловной эффективности ОЗПК свидетельствует более чем двукратное снижение билирубина к концу операции.
В послеоперационном периоде:
-
удаление пупочного катетера сразу после операции не рекомендуется в связи с вероятностью повторного проведения ОЗПК;
-
контроль за уровнем билирубина выполняется через 12 ч после ОЗПК, далее по показаниям, но не реже 1 раза в 24 ч до 7 сут жизни;
-
контроль за гликемией - через 1 ч после ОЗПК, далее по показаниям;
-
после окончания трансфузии (переливания) донорской крови и/или ее компонентов донорский контейнер с оставшейся донорской кровью и/ или ее компонентами (5 мл), а также пробирка с кровью реципиента, использованная для проведения проб на индивидуальную совместимость, подлежат обязательному сохранению в течение 48 ч при температуре 2-6 °С в холодильном оборудовании [17].
На фоне ОЗПК возможно развитие осложнений [5, 9, 18, 24, 25].
Операция частичного заменного переливания крови
Проводится у новорожденных с отечной формой ГБН в максимально короткие сроки после рождения. У наиболее тяжелых пациентов процедура проводится в родильном зале [5, 13, 18, 26].
Учитывая тяжелую анемию и гемическую гипоксию тканей и органов ребенка с отечной формой ГБН, сразу после первичной стабилизации в родильном зале необходимо осторожно провести частичное заменное переливание крови, избегая перегрузки кровообращения в условиях сердечной недостаточности (гипоксическое повреждение миокарда). Частичное заменное переливание осуществляется с заменой 45-90 мл/кг крови ребенка аналогичным объемом эритроцитарной массы 0(I) резус-отрицательной группы. Исходный уровень гемоглобина при этом у ребенка может не учитываться. Технология проведения аналогична вышеописанной ОЗПК, только выведенный объем крови замещается исключительно эритроцитарной массой.
После стабилизации общего состояния ребенка, на которую может потребоваться от 1 до 12 ч, операция должна быть продолжена для замены крови ребенка донорской в объеме, эквивалентном двум ОЦК [18].
Иное лечение
Стабилизация состояния и интенсивная терапия при отечной форме гемолитической болезни плода и новорожденного
После рождения ребенка немедленно (в течение 5-10 с) пережимают пуповину в целях предупреждения развития гиперволемии. Стабилизация состояния таких пациентов требует высокого уровня интенсивного ведения и координации неонатальной команды. Риск токсического воздействия билирубина сразу после рождения не является их проблемой. Показаны немедленная интубация и искусственная вентиляция легких (ИВЛ) с положительным давлением на вдохе. У недоношенных детей рассматривается введение препаратов сурфактанта [5, 18].
После частичного заменного переливания крови продолжается по-синдромная терапия, направленная на стабилизацию функции дыхания, показателей центральной гемодинамики, коррекцию основных метаболических нарушений (гипогликемии, гипокальциемии, гипонатриемии, гиперкалиемии, гипопротеинемии, ацидоза), улучшение функций почек, профилактику и лечение геморрагических осложнений [1-3, 5, 18].
Торакоцентез и лапароцентез
Неэффективность ИВЛ на фоне выраженной анасарки у детей с отечной формой ГБН является показанием к проведению торако- и лапароцентеза в целях дренирования полостей и улучшения респираторной функции. При этом избегают избыточного и быстрого удаления асцитической жидкости из-за опасности системной гипотензии [5, 13, 26]. При пункции учитывают, что печень и селезенка увеличены.
РЕАБИЛИТАЦИЯ
Рекомендуются:
ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
Профилактика
Профилактика ГБН по резус-фактору проводится с помощью назначения антирезусного Ig [анти-Rh(D)-Ig] резус-отрицательной матери, не имеющей резус-иммунизации, с учетом современных клинических рекомендаций [28, 29].
Диспансерное наблюдение
-
В связи с высокой частотой развития поздней анемии, которая может потребовать трансфузии эритроцитов, после выписки из стационара рекомендуется проводить контроль за гемоглобином 1 раз в 2-4 нед (по показаниям чаще) в течение первых 3 мес жизни.
-
Вопрос о профилактических прививках решают индивидуально с учетом противопоказаний, имеющихся в инструкциях к вакцинам.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ, ВЛИЯЮЩАЯ НА ТЕЧЕНИЕ И ИСХОД ЗАБОЛЕВАНИЯ
Дополнительные факторы, повышающие риск развития БЭ.
-
Факторы, повышающие проницаемость гематоэнцефалического барьера для билирубина: гиперосмолярность крови, ацидоз, кровоизлияния в мозг, нейроинфекции, артериальная гипотензия.
-
Факторы, повышающие чувствительность нейронов головного мозга к токсическому действию неконъюгированного билирубина: недоношенность, тяжелая асфиксия, голодание, гипогликемия, анемия.
-
Факторы, снижающие способность альбумина в крови прочно связывать неконъюгированный билирубин: недоношенность, гипоальбуминемия, инфекция, ацидоз, гипоксия, повышение уровня неэстерифицированных жирных кислот в крови, использование сульфаниламидов, фуросемида, фенитоина (Дифенина♠), диазепама, индометацина, салицилатов, полусинтетических пенициллинов, цефалоспоринов.
СПИСОК ЛИТЕРАТУРЫ
-
Неонатология: национальное руководство. Краткое издание / под ред. Н.Н. Володина. М.: ГЭОТАР-Медиа, 2013. 896 с.
-
Неонатология: национальное руководство / под ред. Н.Н. Володина. М.: ГЭОТАР-Медиа, 2007. 848 с.
-
Шабалов Н.П. Неонатология: в 2 т. 5-е изд., испр. и доп. М.: МЕД-пресс-информ, 2009. 1504 с.
-
Рооз Р., Генцель-Боровичеши О., Прокитте Г. Неонатология: практические рекомендации. М.: Медицинская литература, 2011. 568 с.
-
Gomella T.L. Neonatology: Management, Procedures, On-Call Problems, Diseases, and Drugs. 7th ed. Medical Publishing Division, 2013. 1113 p.
-
Feldman А.G., Sokol R.J. Neonatal cholestasis // Neoreviews. 2013. Vol. 14, N 2. doi: 10.1542/neo.14-2-e63.
-
Kaplan M., Na’amad M., Kenan A. et al. Failure to predict hemolysis and hyperbilirubinemia by IgG subclass in blood group A or B infants born to group O mothers // Pediatrics. 2009. Vol. 123, N 1. P. e132-e137.
-
Gleason C.A., Devaskar S.U. Avery’s Diseases of the Newborn. 9th ed. Philadelphia: Elsevier; Saunders, 2011. 1520 p.
-
Hansen A.R., Eichenwald E.C., Stark A.R., Martin C.R. Cloherty and Stark’s Manual of Neonatal Care. 8th ed. Wolters Kluwer, 2016. 1124 p.
-
Ree I.M.C., Smits-Wintjens V.E.H.J., van der Bom J.G., van Klink J.M.M. et al. Neonatal management and outcome in alloimmune hemolytic disease // Expert Rev. Hematol. Published online 05 Jun 2017. doi: 10.1080/17474086.2017.1331124.
-
Sinha S., Miall L., Jardine L. Essential Neonatal Medicine. 5th ed. Chichester: Wiley; Blackwell, 2012. 388 p.
-
Полин Р.А., Спитцер А.P. Секреты неонатологии и перинатологии: пер. с англ. / под общ. ред. Н.Н. Володина. М.: БИНОМ, 2011. 622 с.
-
Alarcon P., Werner E., Christensen R.D. Neonatal Hematology Pathogen-esis, Diagnosis, and Management of Hematologic Problems. 2nd ed. Cambridge University Press, 2013.
-
Altunyurt S., Okyay E., Saatli B., Canbahishov T., Demir N. et al. Neonatal outcome of fetuses receiving intrauterine transfusion for severe hydrops complicated by Rhesus hemolytic disease // Int. J. Gynaecol. Obstet. 2012. Vol. 117, N 2. P. 153-156.
-
Maisels M.J.,Watchoko J.F., Bhutani V.K., Stevenson D.K. An approach to the management of hyperbilirubinemia in the preterm infant less than 35 weeks of gestation // J. Perinatol. 2012. Vol. 32, N 9. P. 660-664. doi: 10.1038/jp.2012.71.
-
Koletzko B., Goulet O., Hunt J., Krohn K. et al.; for the Parenteral Nutrition Guidelines Working GrouP. Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for Clinical Nutrition and Metabolism (ESPEN), Supported by the European Society of Paediatric Research (ESPR) // J. Pediatr. Gastroenterol. Nutr. 2005. Vol. 41. P. 1-87.
-
Приказ Минздрава России от 2 апреля 2013 г. № 183н «Об утверждении правил клинического использования донорской крови и (или) ее компонентов».
-
Избранные клинические рекомендации по неонатологии / под ред. Е.Н. Байбариной, Д.Н. Дегтярева. М.: ГЭОТАР-Медиа, 2016. 237 с.
-
Alcock G.S., Liley H. Immunoglobulin infusion for isoimmune haemolytic jaundice in neonates (Cochrane Review) // The Cochrane Library. Issue 2. Chichester, UK: John Wiley and Sons, 2004.
-
Miqdad A.M., Abdelbasit O.B., Shaheed M.M., Seidahmed M.Z. et al. Intravenous immunoglobulin G (IVIG) therapy for significant hyperbilirubinemia in AB0 hemolytic disease of the newborn // J. Matern. Fetal Neonatal Med. 2004. Vol. 16. P. 163-166.
-
Louis D., More K., Oberoi S., Shah P.S. Intravenous immunoglobulin in isoimmune haemolytic disease of newborn: an updated systematic review and meta-analysis // Arch. Dis. Child. Fetal Neonatal Ed. 2014. Vol. 99. F325-F331.
-
Keir A.K., Dunn M., Callum J. Should intravenous immunoglobulin be used in infants with isoimmune haemolytic disease due to AB0 ncompatibility? // J. Paediatr. Child Health. 2013. Vol. 49. P. 1072-1078.
-
Smits-Wintjens V.E.H.J., Rath M.E.A., Lindenburg I.T.M. et al. Cholestasis in neonates with red cell alloimmune hemolytic disease: incidence, risk factors and outcome // Neonatology. 2012. Vol. 101. P. 306-310.
-
Smits-Wintjens V.E.H.J., Walther F.J., Lopriore E. Rhesus haemolytic disease of the newborn: postnatal management, associated morbidity and long-term outcome // Semin. Fetal Neonatal Med. 2008. Vol. 13. P. 265-271.
-
Steiner L.A., Bizzarro M.J., Ehrenkranz R.A., Gallagher P.G. A decline in the frequency of neonatal exchange transfusions and its effect on exchange-related morbidity and mortality // Pediatrics. 2007. Vol. 120, N 1. P. 27-32.
-
Nandyal R.R. Hemolytic disease of the newborn // J. Hematol. Thromb. Dis. 2015. Vol. 3. P. 203-205. doi: 10.4172/2329-8790.1000203.
-
Bhutani V.K., Maisels M.J., Stark A.R., Buonocore G.; Expert Committee for Severe Neonatal Hyperbilirubinemia; European Society for Pediatric Research; American Academy of Pediatrics. Management of jaundice and prevention of severe neonatal hyperbilirubinemia in infants > or = 35 weeks gestation // Neonatology. 2008. Vol. 94, N 1. P. 63-67. doi: 10.1159/000113463.
-
Приказ Минздрава России от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)».
-
Савельева Г.М., Адамян Л.В., Курцер М.А., Сичинава Л.Г. и др. Резус-сенсибилизация. Гемолитическая болезнь плода. Клинические рекомендации (протокол). М., 2017. 16 с.
-
Maisels M.J., Bhutani V.K., Bogen D., Newman T.B. et al. Hyperbilirubinemia in the newborn infant >or =35 weeks' gestation: an update with clarifications // Pediatrics. 2009. Vol. 124, N 4. P. 1193-1198. doi: 10.1542/peds.2009-0329.
-
American Academy of Pediatrics Subcommittee on Hyperbilirubinemia. Management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation // Pediatrics. 2004. Vol. 114, N 1. P. 297-316.
-
Bhat S., Singh K., Shastry S. // IJLM (The Internet Journal of Laboratory Medicine). 2009. Vol. 4, N 1 Р. 1-4.
-
Schrader C.M., Billings A.N. False neonatal AB0 blood typing due to contamination of the cord blood // AMSRJ. 2015. Vol. 1, N 2. P. 157-162.
-
Liu L.T., Liang X.L., Han J.L., Li Q. et al. Quality control for AB0 blood group typing of neonatal umbilical cord blood // Zhongguo Shi Yan Xue Ye Xue Za Zhi. 2010. Vol. 18, N 3. P. 790-792.
-
Keir A., Agpalo M., Lieberman L., Callum J. How to use: the direct antiglobulin test in newborns // Arch. Dis. Child. Educ. Pract. Ed. 2015. Vol. 100, N 4. P. 196-203.
-
Kristinsdottir T., Kjartansson S., Hardardottir H., Jonsson T. et al. Positive Coomb’s test in newborns; causes and clinical consequences Summary of cases diagnosed in the Blood Bank in the years 2005 to 2012 // Laeknabladid. 2016. Vol. 102, N 7-8. P. 326-331.
-
Dinesh D. Review of positive direct antiglobulin tests found on cord blood sampling // J. Paediatr. Child Health. 2005. Vol. 41, N 9-10. P. 504-507.
ПРИЛОЖЕНИЯ
Приложение 1. Алгоритмы ведения пациента
Тактика ведения детей с риском развития гемолитической болезни новорожденных и гемолитической болезнью новорожденных в первые сутки жизни
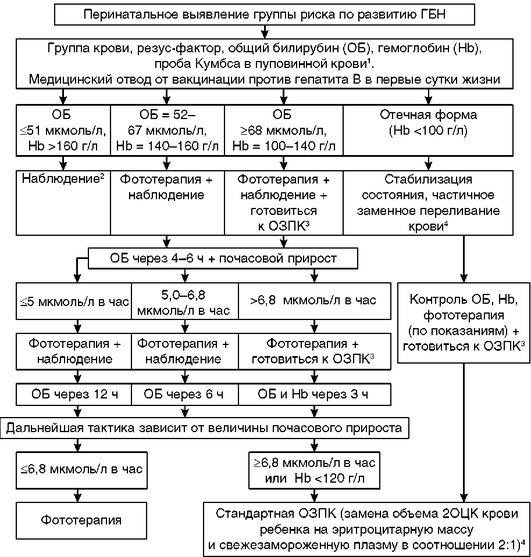
1 Пояснения по особенностям проведения и интерпретации представлены в тексте клинического руководства.
2 При появлении желтухи в течение первых 24 ч жизни - неотложное исследование общего билирубина, дальнейшая тактика ведения зависит от величины почасового прироста билирубина.
3 Заказать необходимые препараты крови (плазма + эритроцитарная масса), стабилизировать жизненно важные функции организма.
4 Подбор компонентов проводится в соответствии с Приказом Минздрава России от 2 апреля 2013 г. № 183н «Об утверждении правил клинического использования донорской крови и/или ее компонентов»
Приложение 2. Показания к фототерапии доношенных и поздних недоношенных детей (гестационный возраст 35-37 нед) в раннем неонатальном периоде [5, 9, 30]
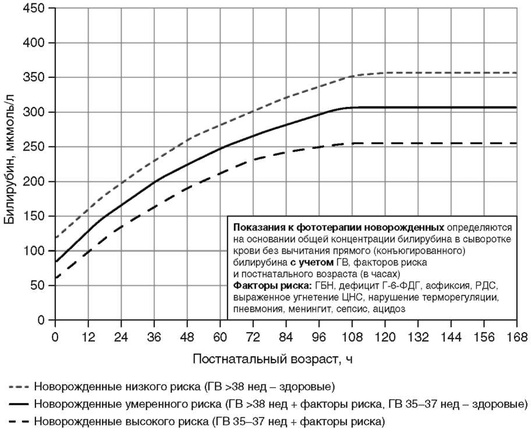
Приложение 3. Показания к операции заменного переливания крови доношенных и поздних недоношенных детей (гестационный возраст 35-37 нед) в раннем неонатальном периоде [5, 9]

Приложение 4. Показания к фототерапии и операции зaмeннoгo переливания крови у недоношенных новорожденных с гeстaционным возрастом менее 35 нед в зависимости от гестационного возраста (уровень общего билирубина в крови) [5, 9, 15]
| Гестационный возраст, нед* | Начало фототерапии** | Операция заменного переливания крови** |
|---|---|---|
<28 0/7 |
85-103 мкмоль/л |
188-239 мкмоль/л |
28 0/7-29 6/7 |
103-137 мкмоль/л |
205-239 мкмоль/л |
30 0/7-31 6/7 |
137-171 мкмоль/л |
222-274 мкмоль/л |
32 0/7-33 6/7 |
171-205 мкмоль/л |
256-308 мкмоль/л |
34 0/7-34 6/7 |
205-239 мкмоль/л |
291-325 мкмоль/л |
* Использовать ПКВ для ФТ (например, для ребенка с ГВ 29 0/7 нед и возрастом 7 дней применять значения билирубина для ПКВ 30 0/7 нед). ** Использовать меньшие значения билирубина у детей с ГБН.
Приложение 5. Таблица подбора донорской крови и/или ее компонентов для трансфузии (переливания) детям до 4 мес жизни при гемолитической болезни по системе АВ0 или подозрении на гемолитическую болезнь [17]
№ |
Мать |
Ребенок |
Переливаемая среда |
|
эритроцитарная масса или взвесь |
свежезамороженная плазма |
|||
1 |
O(I) |
A(II) |
O(I) |
A(II), AB(IV) |
2 |
O(I) |
B(III) |
O(I) |
B(III), AB(IV) |
3 |
A(II) |
B(III) |
O(I) |
B(III), AB(IV) |
4 |
B(III) |
A(II) |
O(I) |
A(II), AB(IV) |
5 |
A(II) |
AB(IV) |
A(II), O(I) |
AB(IV) |
6 |
B(III) |
AB(IV) |
B(III), O(I) |
AB(IV) |
Приложение 6. Пример расчета объема компонентов крови для операции заменного переливания крови
Масса тела ребенка - 3000 г.
ГЕМОРРАГИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННЫХ
Согласовано и утверждено Российским обществом неонатологов и Российской ассоциацией специалистов перинатальной медицины
Авторы: Дегтярев Д.Н., Карпова А.Л. (модератор рабочей группы), Мебелова И.И., Нароган М.В., Романенко В.А., Сапун О.И., Строева Л.Е.
ОПРЕДЕЛЕНИЕ, КЛАССИФИКАЦИЯ, ЭТИОЛОГИЯ, ПАТОГЕНЕЗ И ФАКТОРЫ РИСКА
Геморрагическая болезнь новорожденных (ГрБН) (код по МКБ-10 - Р53), или витамин К-зависимый геморрагический синдром - приобретенное или врожденное заболевание, проявляющееся повышенной кровоточивостью у новорожденных и детей первых месяцев жизни вследствие недостаточности факторов свертывания крови (II, VII, IX, X), активность которых зависит от витамина К [5, 7, 10, 26, 29, 41, 32].
Классификация геморрагической болезни новорожденных
-
Ранняя форма - симптомы появляются в течение 24 ч после рождения. Ранняя форма часто связана с приемом матерью препаратов, нарушающих метаболизм витамина К. Эта форма болезни не может быть предупреждена путем назначения витамина К после родов. Характерны кровавая рвота, легочное кровотечение, мелена, кровоизлияние в органы брюшной полости, надпочечники [5, 10, 27, 35, 43, 44, 48].
-
Классическая форма проявляется кровоточивостью на 2-7-е сутки жизни. Наиболее часто развивается у новорожденных при недостаточном поступлении молока и отсутствии профилактического применения витамина К сразу после рождения. Характерны желудочно-кишечные кровотечения, кожные геморрагии, кровотечения из пупочной ранки, кровотечения из носа и нарушение свертывания крови в местах инъекций. Внутричерепные кровоизлияния менее типичны для классической формы ГрБН [5, 10, 27, 35, 43, 44, 48].
-
Отсроченная, или поздняя, форма характеризуется появлением симптомов в период с 8-го дня до 6 мес жизни [19, 41], хотя, как правило, манифестация приходится на возраст 2-12 нед [5, 27, 41, 46]. Заболевание встречается у детей, находящихся на исключительном грудном вскармливании и не получивших профилактику витамином К после рождения. В половине случаев поздняя форма ГрБН развивается на фоне заболеваний и состояний ребенка, способствующих нарушению синтеза и всасывания витамина К (холестаз, синдром мальабсорбции). При этой форме часто регистрируются внутричерепные кровоизлияния (50-75%), кожные геморрагии, кровотечения из мест инъекций, пупочной ранки и желудочно-кишечного тракта (ЖКТ) и т.д. [11, 35, 42, 43, 46].
Без профилактики частота ранней и классической ГрБН составляет 0,25-1,7%, поздней - 4,4-7,2 на 100 000 новорожденных [43]. В странах, где витамин К назначается парентерально непосредственно после рождения, частота ГрБН равна 0,01% и менее. Частота заболевания не зависит от пола и расы ребенка.
Этиология и патогенез
Биологическая роль витамина К состоит в активировании γ-карбоксилирования остатков глутаминовой кислоты в протромбине (фактор II), проконвертине (фактор VII), антигемофильном глобулине В (фактор IX) и факторе Стюарта-Прауэра (фактор Х), а также в анти-протеазах С и S плазмы, играющих важную роль в антисвертывающей системе [31, 51], а также остеокальцине и других белках. При недостатке витамина К в печени происходит синтез неактивных факторов II, VII, IX и X, неспособных связывать ионы кальция и полноценно участвовать в свертывании крови [5].
В природе встречаются два типа витамина К: витамин К1, или филлохинон, широко представленный в продуктах питания (зеленые овощи, растительные масла, молочные продукты), и витамин К2, или менахинон, который синтезируется кишечной микрофлорой и всасывается в малых количествах.
Менадионρ - синтетический водорастворимый аналог витамина К, иногда называемый витамином К3, в настоящее время не используется для профилактики ГрБН в развитых зарубежных странах [45]. Менадионρ действует не сам, а проходит метаболический путь превращения в печени в филлохинон (К1) и менахинон (К2), поэтому эффект его после поступления в организм развивается медленно [3].
Перенос витамина К через плаценту ограничен, поэтому его запасы в печени новорожденных, как и концентрация в крови пуповины, очень низкие [43, 52]. Кроме того, витамин К относится к группе жирорастворимых, поэтому всасывание его из кишечника возможно только при наличии солей желчных кислот. Возможности депонирования витамина К в организме очень низкие, а период полураспада витамин К-зависимых факторов свертывания очень короткий. Вследствие всего вышеперечисленного дефицит витамина К при недостаточном его поступлении развивается очень быстро.
У здоровых новорожденных содержание в плазме крови витамин К-зависимых факторов свертывания составляет 30-60% уровня взрослых. Их концентрация увеличивается постепенно и достигает уровня взрослых к 6-й неделе жизни. Практически у всех здоровых доношенных новорожденных в первые 5 дней жизни отмечается сопряженное снижение уровня прокоагулянтов, физиологических антикоагулянтов и плазминогена [4].
Для новорожденного единственным источником витамина К является его экзогенное поступление: с женским молоком, искусственной питательной смесью или в виде лекарственного препарата. Количество витамина К, получаемого ребенком, зависит от характера вскармливания. Уровень витамина К1 в грудном молоке составляет от 1 до 10 мкг/л [21, 26], в среднем 2,0-2,5 мкг/л [22, 33], что существенно ниже, чем в искусственных молочных смесях (около 50 мкг/л - в смесях для доношенных детей, 60-100 мкг/л - в смесях для недоношенных).
Таким образом, новорожденные в силу своих физиологических характеристик свертывающей системы и метаболизма витамина К имеют предрасположенность к развитию витамин К-зависимого геморрагического синдрома. При этом значимыми факторами, способствующими развитию ГрБН, являются исключительное грудное вскармливание и отсутствие профилактического назначения витамина К сразу после рождения [25, 27].
Факторы риска развития геморрагической болезни новорожденных [5, 8, 19, 27, 52]
-
Отсутствие профилактического введения витамина К сразу после рождения ребенка.
-
Длительное парентеральное питание (ПП) в условиях неадекватного снабжения витамином К.
-
Заболевания и состояния ребенка, способствующие нарушению синтеза и всасывания витамина К:
-
Прием матерью во время беременности лекарственных средств:
-
антикоагулянтов непрямого действия (из группы неодикумаринов, варфарин);
-
противосудорожных препаратов (барбитураты, карбамазепин, фенитоин и др.);
-
больших доз антибиотиков широкого спектра действия (особенно цефалоспорины);
-
нестероидных противовоспалительных средств непосредственноперед родами (ацетилсалициловая кислота, индометацин и другиетромбоцитарные ингибиторы).
-
Вклад перечисленных факторов риска в развитие болезни будет, соответственно, различаться в зависимости от формы ГрБН (см. классификацию ГрБН).
КЛИНИКО-ЛАБОРАТОРНАЯ ХАРАКТЕРИСТИКА
Клиническая картина ГрБН характеризуется появлением спонтанных кровотечений любой локализации:
-
из пупочной ранки (в том числе при отпадении остатка пуповины);
-
на фоне дефицита витамина К могут прогрессировать гематомы в месте травмы (кефалогематома, экхимозы);
-
для поздней формы характерны внутричерепные кровоизлияния: субдуральные гематомы (40%), паренхиматозные (40%), внутрижелудочковые (10%) и субарахноидальные (10%) кровоизлияния [56]. Более чем у 1/3 детей за несколько недель до кровоизлияния в мозг могут появляться экхимозы [46]. Как правило, внутричерепные кровоизлияния регистрируются у детей, находящихся на исключительно грудном вскармливании.
Другие проявления ГрБН:
Лабораторная диагностика
Обследование при подозрении на ГрБН.
Для ГрБН характерно следующее [5, 10, 27, 43].
-
Удлинение протромбинового времени, часто в 4 раза и более, снижение ПТИ, повышение международного нормализованного отношения.
-
Удлинение активированного частичного тромбопластинового времени (АЧТВ).
-
Как правило, нормальный уровень фибриногена и тромбоцитов. Первыми при ГрБН изменяются показатели протромбиновых тестов, а в более тяжелых случаях присоединяется удлинение АЧТВ.
При оценке коагулограммы необходимо учитывать, что нормативные значения показателей гемостаза у новорожденных и детей первых месяцев жизни отличаются от референсных значений взрослых и подвержены существенным изменениям сразу после рождения.
У недоношенных детей имеются свои особенности гемостаза, в зависимости от ГВ характеризующиеся значительным размахом значений.
Для новорожденных и недоношенных детей характерна гипокоагуляционная направленность плазменно-коагуляционного звена гемостаза на фоне повышения внутрисосудистого свертывания крови и активности фибринолиза (повышение уровня ПДФ и D-димеров) [9, 16, 17, 37-40].
Абсолютные значения показателей гемостаза зависят от реагента и анализатора, поэтому в каждой лаборатории рекомендуется определять собственные референсные значения для новорожденных и недоношенных детей в соответствии с используемой методикой [2, 39, 40].
Референсные значения гемостаза для новорожденных и недоношенных детей из различных источников информации представлены в приложении 1.
Прямые лабораторные тесты, которые могли бы отвергнуть или подтвердить в клинической практике дефицит витамина К, практически отсутствуют.
Определение витамина К не представляет собой диагностической ценности вследствие его низкой концентрации у новорожденных [42].
В диагностике дефицита витамина К может помочь определение уровня PIVKA (Protein Induced by Vitamin K Absence or Antagonism). Дефицит витамина К сопровождается повышением уровня аномальных форм К-зависимых факторов свертывания крови, к которым относится декарбоксилированная форма протромбина - PIVKA-II. В разных исследованиях показано, что от 10 до 52% новорожденных независимо от ГВ имеют повышенный уровень PIVKA-II в пуповинной крови. К 3-5-му дню жизни высокий уровень PIVKA-II обнаруживается у 50-60% детей, находящихся на грудном вскармливании и не получивших профилактического введения витамина К. В случае адекватного обеспечения ребенка витамином К уровень PIVKA-II снижается к 2-3-й неделе жизни. Данный тест может помочь в диагностике скрытого дефицита витамина К, однако он не отнесен к основным диагностическим маркерам ГрБН на практике [27, 28, 34, 58].
NB! Для ГрБН характерно удлинение протромбинового времени на фоне нормального уровня тромбоцитов и фибриногена [42]. Диагноз подтверждается нормализацией протромбинового времени и прекращением кровотечения после введения витамина К (уровень доказательности А) [44].
Дифференциальная диагностика
Дифференциальную диагностику ГрБН проводят с заболеваниями, проявляющимися геморрагическим синдромом у новорожденных, а также с рядом заболеваний, не связанных с нарушением гемостаза.
-
Синдром проглоченной крови. Для исключения кровотечения из ЖКТ показано проведение пробы Апта-Даунера: кровянистые рвотные массы или кал разводят водой и получают розовый раствор, содержащий гемоглобин. После центрифугирования 4 мл надосадочной жидкости смешивают с 1 мл 1% раствора натрия гидроксида. Изменение цвета жидкости (оценка через 2 мин) на коричневый свидетельствует о наличии в ней гемоглобина А (свойственного материнской крови), а сохранение розового цвета - о наличии гемоглобина ребенка (щелочно-резистентный фетальный гемоглобин) [5].
-
Другие причины кровотечений (травмы, эрозии, папилломы ЖКТ, ангиоматоз кишечника, мальформации сосудов и др.).
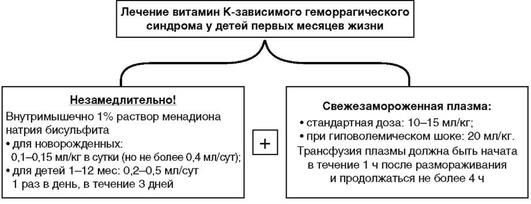
ЛЕЧЕНИЕ
-
Любому новорожденному с подозрением на ГрБН незамедлительно должен быть введен витамин К, не дожидаясь лабораторного подтверждения.
-
Если заболевание манифестировало вне стационара, показана срочная госпитализация.
-
При кровоточивости рекомендуется одновременное введение СЗП и менадиона натрия бисульфита (Викасола♠) [5]. Эта рекомендация обусловлена тем, что менадион натрия бисульфит является в настоящее время единственным зарегистрированным в нашей стране препаратом для лечения витамин К-зависимых кровотечений, и его действие начинается только через 8-24 ч после введения (приложение 2).
-
Правила применения 1% раствора менадиона натрия бисульфита.
-
Кратность введения: возможно как однократное введение, так и 2-3 раза в сутки [5, 59].
-
Длительность курса лечения - от 2-3 [3, 5, 10] до 3-4 [59] дней. При необходимости курс лечения можно повторить после 4-дневного перерыва [59].
-
Противопоказания: гиперкоагуляция, тромбоэмболия, ГБН. C осторожностью - при дефиците глюкозо-6-фосфатдегидрогеназы [59].
-
Токсическое действие. Менадионρ обладает окисляющим действием на фетальный гемоглобин, приводя к гемолизу, образованию метгемоглобина и телец Гейнца в эритроцитах. По-видимому, это связано с нарушением метаболизма глютатиона и усиливается недостаточной антиоксидантной защитой у новорожденных и особенно недоношенных детей [28, 45, 47]. В связи с этим высокие дозы (более 10 мг) и длительное назначение препарата (более 3 дней) не рекомендуются [3, 10].
-
Необходимо использовать менадион натрия бисульфит тех производителей, которые разрешают его применение у новорожденных. Например, препарат «Викасол♠», произведенный ООО «Эллара», согласно оригинальной инструкции к нему, противопоказан для новорожденных и детей до 1 года, в отличие от аналогичного препарата других производителей.
-
Свежезамороженная плазма вводится в дозе 10-15 мл/кг [5]. Трансфузия СЗП должна быть начата в течение 1 ч после ее размораживания и продолжаться не более 4 ч [6].
-
Вместо плазмы возможно использование концентрированного препарата протромбинового комплекса [5, 27]. Назначение его должно быть мониторировано из-за риска тромбоэмболических осложнений [13].
-
Следует помнить, что, согласно Приказу Минздрава России от 2 апреля 2013 г. № 183н «Об утверждении правил клинического использования донорской крови и/или ее компонентов», не допускается переливание вирусинактивированной (патогенинактивированной) СЗП реципиентам детского возраста, находящимся на ФТ [6]. Связано это с тем, что одна из технологий обеспечения вирусинактивации плазмы выполняется путем добавления в плазму метиленового синего, который связывается с нуклеиновыми кислотами вирусов, а затем активируется светом с длиной волны 590 нм с выделением синглетного кислорода, разрушающего нуклеиновые кислоты вируса. Далее метиленовый синий из плазмы удаляется абсорбирующим фильтром. Длина волны света, активирующего метиленовый синий, не очень отличается от длины волны света, используемого при ФТ. Тогда теоретически при ФТ есть риск дальнейшей активации остатков метиленового синего с образованием атомарного кислорода и соответствующими последствиями уже в организме ребенка, поэтому на время трансфузии вирусинактивированной плазмы следует прекратить ФТ.
ПРОФИЛАКТИКА
Учитывая токсичность менадионаρ у новорожденных, особенно недоношенных детей, с 1960-х гг. этот препарат не рекомендуется для профилактики и лечения ГрБН [28, 45].
В развитых зарубежных странах профилактическое введение витамина К проводится всем новорожденным, при этом используются препараты витамина К1, которые лишены токсического действия на эритроциты новорожденных, более эффективны и предпочтительны для применения (могут вводиться внутривенно, внутримышечно, внутрь; действие их начинается быстро: после внутривенного введения - в течение часа, после внутримышечного - в течение 2-3 ч). Однократная парентеральная доза витамина К1 ρ в первые сутки жизни профилактирует как классическую, так и позднюю форму ГрБН (уровень доказательности А) [25, 30, 42, 43, 44, 46, 50].
Учитывая отсутствие в настоящее время зарегистрированного в нашей стране препарата витамина К1 ρ, для профилактики витамин К-зависимого геморрагического синдрома рекомендуется внутримышечное введение 1% раствора менадиона натрия бисульфита (приложение 3). С этой целью препарат вводят внутримышечно однократно в первые часы после рождения, из расчета 1 мг/кг (0,1 мл/кг), но не более 0,4 мл/кг [3, 10, 59]. При хирургических вмешательствах с возможным сильным паренхиматозным кровотечением рекомендуется профилактическое назначение в течение 2-3 дней перед операцией [59].
В проведенных исследованиях применение менадионаρ показало свою эффективность для профилактики классической формы ГрБН у доношенных детей. Введение менадионаρ внутримышечно (в том числе в дозе 1 мг) приводило к существенному повышению ПТИ, снижению АЧТВ, ПВ, уровня PΓVKA-II и частоты кровотечений, при этом токсических влияний зарегистрировано не было (уровень доказательности С) [9, 20, 23, 44].
Хотя профилактическое введение витамина К в настоящее время рекомендовано всем новорожденным, вопрос о режиме и дозах витамина К для недоношенных детей все еще остается открытым [15, 18, 27, 28, 32].
Для адекватной нутритивной поддержки и предотвращения развития витамин К-зависимого геморрагического синдрома ориентируются на потребность новорожденных и недоношенных детей в витамине К (табл. 1).
Таблица 1. Суточная потребность в витамине К у новорожденных
| При энтеральном питании | При парентеральном питании | |
|---|---|---|
Доношенные и дети первых месяцев жизни |
2 мкг/кг в сутки [33, 36, 53] |
200 мкг в сутки [1, 27, 55] |
Недоношенные |
8-10 мкг/кг в сутки [27] 4,4-28,0 мкг/кг в сутки [12] |
10 мкг/кг в сутки [55]* 80 мкг/кг в сутки [1, 27] |
* Рекомендуется, но пока невозможно, так как жирорастворимые витамины вводят в виде препарата «Виталипид Н детский♠ ». Стандартная доза «Виталипида Н детского♠ » (4 мл/кг в сутки) обеспечивает большие дозы поступления витамина К (80 мкг/кг в сутки). Побочных действий в настоящее время не зарегистрировано, однако отмечается, что эта доза для недоношенных детей чрезмерна, особенно если сочетается с дополнительным парентеральным введением витамина К в первые сутки жизни [15, 28].
При ПП показано назначение витаминного комплекса «Виталипид Н детский♠ ». Содержание витамина К1 в нем составляет 20 мкг в 1 мл. При полном ПП стандартной дозой является 4 мл/кг в сутки для новорожденных с массой тела менее 2,5 кг и 10 мл/сут для остальных детей [60]. На фоне перехода на ЭП доза соответственно уменьшается.
При отсутствии использования комплексного витаминного препарата на протяжении полного ПП целесообразно применение менадиона натрия бисульфита с учетом возрастной потребности в витамине К под контролем ПТИ.
Синдром мальабсорбции и синдром холестаза относятся к особым состояниям, требующим дотации витамина К, так как в этих случаях нарушается всасывание витамина К из кишечника [14]. При ПП витамин К можно вводить парентерально в соответствии с возрастной потребностью. При полном ЭП единых подходов к дотации витамина К для данных пациентов нет. В зарубежных странах рекомендуется дополнительное введение витамина К1 ρ внутрь в дозе от 1 мг 1 раз в неделю до 2,5-5,0 мг 2 раза в неделю или ежедневно; парентерально витамин К1 ρ добавляется в дозе 1-5 мг при ухудшении показателей свертывания крови. Для индивидуального подбора дозы и пути введения контролируется протромбиновое время (или ПТИ, или международное нормализованное отношение) [24, 27, 49, 54]. Поскольку в нашей стране разрешенным для детей первого года жизни является только раствор для внутримышечного введения менадиона натрия бисульфита, по-видимому, целесообразно его назначение в данных группах пациентов в дозе 1 мг/кг (не более 4 мг/кг) для новорожденных или 2-5 мг/кг для детей 1-12 мес 1 раз в неделю под контролем ПТИ.
Для повышения концентрации витамина К в грудном молоке кормящим женщинам необходимо рекомендовать продукты, богатые витамином К1 (приложение 4), а также поливитаминные комплексы, содержащие витамин К1, так как суточное потребление матерью 2,5-5,0 мг филлохинона приводит к значительному повышению концентрации витамина К в грудном молоке (в 20 раз) и плазме новорожденного (уровень доказательности D) [10, 28, 48].
ДАЛЬНЕЙШЕЕ ВЕДЕНИЕ (GPPS)
-
Новорожденный с геморрагической болезнью после стабилизации состояния и прекращения кровотечения должен быть переведен на второй этап выхаживания для дальнейшего обследования и лечения.
-
Вакцинация (против гепатита В и туберкулеза) детям с ГрБН в периоде новорожденности не рекомендуется.
-
Новорожденные, перенесшие ГрБН, подлежат стандартной диспансеризации на амбулаторном этапе.
-
Пример формулировки клинического диагноза: «геморрагическая болезнь новорожденного, классическая форма, желудочно-кишечное кровотечение (Р53)».
ПРОГНОЗ
-
При отсутствии легочного кровотечения и внутричерепных кровоизлияний прогноз, как правило, благоприятный [5].
-
При наличии внутричерепного кровоизлияния прогноз определяется локализацией и выраженностью кровоизлияния.
-
Смертность при поздней ГрБН в случае развития внутричерепных кровоизлияний составляет 15-20%, а неблагоприятные отдаленные последствия (двигательный и интеллектуальный дефицит) отмечаются у 20-50% детей [56, 57].
МЕДИКО-ЮРИДИЧЕСКИЕ АСПЕКТЫ
-
Обязательно получение от законного представителя ребенка согласия на медицинские вмешательства (в том числе на профилактическое введение витамина К).
-
В случае отказа родителей от профилактических мер следует зафиксировать это в информированном согласии.
-
В медицинской документации должны быть указаны доза введенного витамина К, путь и дата введения препарата.
-
Если после рождения ребенку не введен витамин К, а в последующем развилось кровотечение, это может быть поводом для судебного иска.
ПЕРСПЕКТИВЫ
После регистрации в России препарата витамина клинические рекомендации по профилактике и лечению витамин К-зависимого синдрома у детей должны быть пересмотрены.
СПИСОК ЛИТЕРАТУРЫ
-
Адамкин Д.Х. Стратегии питания младенцев с очень низкой массой тела при рождении: пер. с англ. под ред. Е.Н. Байбариной. М.: ГЭОТАР-Медиа, 2013. 176 с.
-
Дорофеева Е.И., Демихов В.Г. и др. Особенности гемостаза у новорожденных детей // Тромбоз, гемостаз и реология. 2013. № 1 (53). C. 44-47.
-
Маркова И.В., Калиничева В.И. Педиатрическая фармакология. Л.: Медицина, 1987. С. 495.
-
Момот А.П. Патология гемостаза. Принципы и алгоритмы клинико-лабораторной диагностики. СПб.: ФормаТ, 2006. 208 c.
-
Неонатология: национальное руководство. Краткое издание / под ред. Н.Н. Володина. М.: ГЭОТАР-Медиа, 2013. 896 с.
-
Приказ Минздрава России от 2 апреля 2013 г. № 183н «Об утверждении правил клинического использования донорской крови и (или) ее компонентов».
-
Рооз Р., Генцель-Боровичеши О., Прокитте Г. Неонатология: практические рекомендации. М.: Мед. лит., 2011. 568 с.
-
Урсуленко Е.В., Мартынович Н.Н., Толмачева О.П., Ованесян С.В. Случай поздней геморрагической болезни у ребенка 6 недель, осложнившейся развитием острого нарушения мозгового кровообращения и гемотораксом // Сибир. мед. журн. 2012. № 2. С. 114-118.
-
Шабалов Н.П., Иванов Д.О., Шабалова Н.Н. Гемостаз в динамике первой недели жизни как отражение механизмов адаптации к внеутробной жизни новорожденного // Педиатрия. 2000. № 3. С. 84-91.
-
Шабалов Н.П. Неонатология: в 2 т. 5-е изд., испр. и доп. М.: МЕД-пресс-информ, 2009. 1504 с.
-
Янг Т., Мангум Б. NeoFax 2006 (Неофакс 2006) / пер. с англ. М. Сека-чевой. М.: Веретея, 2006. 332 с.
-
Agostoni С., Buonocore G. et al. Enteral nutrient supply for preterm infants: commentary from the European Society for Paediatric Gastroenterology, Hepa-tology, and Nutrition Committee on Nutrition // J. Pediatr. Gastroenterol. Nutr. 2010. Vol. 50. P. 1-9.
-
Alarcón P., Werner E., Christensen R.D. Neonatal Hematology Pathogenesis, Diagnosis, and Management of Hematologic Problems. 2nd ed. Cambridge University Press, 2013.
-
American Academy of Pediatrics, Committee statement, Committee on Nutrition. Vitamin K supplementation for infants receiving milk substitute infant formulas and for those with fat malabsorption // Pediatrics. 1971. Vol. 48. P. 483-487.
-
American Academy of Pediatrics, Committee on Nutrition. Nutritional needs of preterm infants // Pediatric Nutrition Handbook. Elk Grove Village, 1998. P. 55-87.
-
Andrew M., Paes B., Milner R. et al. Development of the human coagulation system in the full-term infant // Blood. 1987. Vol. 70. P. 165-172.
-
Andrew M, Paes B, Milner R. et al. Development of the human coagulation system in the healthy premature infant // Blood. 1988. Vol. 72. P. 1651-1657.
-
Ardell S., Offringa M., Soll R. Prophylactic vitamin K for the prevention of vitamin K deficiency bleeding in preterm neonates (Protocol).
-
Burke C.W. Vitamin K deficiency bleeding // J. Pediatr. Health Care. 2013. Vol. 27, N 3. P. 215-221.
-
Chawla D., Deorari A.K., Saxena R., Paul V.K. et al. Vitamin K1 versus vitamin K3 for prevention of subclinical vitamin deficiency: a randomized controlled trial // Indian Pediatr. 2007. Vol. 44, N 11. P. 817-822.
-
Clarke P., Shearer M.J. Vitamin K deficiency bleeding: the readiness is all // Arch. Dis. Child. 2007. Vol. 92. P. 741-743.
-
Composition of Foods Raw, Processed, Prepared. National Nutrient Database for Standard Reference, Release 27, August 2014. URL: https://www.ars.usda.gov/Services/docs.htm?docid=24912.
-
Dyggve H.V., Dam H., Sondergaard E. Comparison of the action of vitamin K1 with that of synkavit in the newborn // Acta Paediatr. 1954. Vol. 43, N 1. P. 27-31.
-
Feldman A.G., Sokol R.J. Neonatal cholestasis // Neoreviews. 2013. Vol. 14, N 2. P. e63.
-
Gleason C.A., Devaskar S.U. Avery’s Diseases of the Newborn. 9th ed. Philadelphia: Elsevier; Saunders, 2011. 1520 p.
-
Global Neonatal Consensus Symposium: Feeding the Preterm Infant. Guest editor R. Uauy // J. Pediatr. 2013. Vol. 162, N 3. P. 116.
-
Gomella T.L. Neonatology: Management, Procedures, On-Call Problems, Diseases, and Drugs. McGraw-Hill, 2013.
-
Greer F.R. Controversies in neonatal nutrition: macronutrients and micronutrients // Gastroenterology and Nutrition: Neonatology Question and Controversies. 2nd ed. / ed. J. Neu. Philadelphia: Elsevier; Saunders, 2012. P. 129-155.
-
Hey E. Vitamin K - what, why, and when // Arch. Dis. Child. Fetal Neonatal Ed. 2003. Vol. 88. P. 80-83.
-
Ipema H.J. Use of oral vitamin K for prevention of late vitamin K deficiency bleeding in neonates when injectable vitamin K is not available // Ann. Pharmacother. 2012. Vol. 46. P. 879-883.
-
Joshi A., Jaiswal J.P. Deep vein thrombosis in protein S deficiency // J. Nepal Med. Assoc. 2010. Vol. 49. P. 56-58.
-
Josty T.L., Matthes J.W.A. Prophylaxis of neonatal vitamin K deficiency bleeding in premature infants // Arch. Dis. Child. Fetal Neonatal Ed. 2001. Vol. 84. P. F218.
-
Klein C.J. Nutrient requirements for preterm infant formulas // J. Nutr. 2002. Vol. 132. P. 1395S-1577S.
-
Kumar D., Greer F.R., Super D.M., Suttie J.W. et al. Vitamin K status of premature infants: implications for current recommendations // Pediatrics. 2001. Vol. 108, N 5. P. 1117-1122.
-
Laubscher B., Banziger O., Schubiger G.; the Swiss Paediatric Surveillance Unit (SPSU). Prevention of vitamin K deficiency bleeding with three oral mixed micellar phylloquinone doses: results of a 6-year (2005-2011) surveillance in Switzerland // Eur. J. Pediatr. 2013. Vol. 172. P. 357-360.
-
Lippi G., Franchini M. Vitamin K in neonates: facts and myths // Blood Transfus. 2011. Vol. 9. P. 4-9.
-
Mitsiakos G., Papaioannou G. et al. Haemostatic profile offull-term, healthy, small for gestational age neonates // Thromb. Res. 2009. Vol. 124. P. 288-291.
-
Mitsiakos G., Giougi Е. et al. Haemostatic profile of healthy premature small for gestational age neonates // Thromb. Res. 2010. Vol. 126. P. 103-106.
-
Monagle P., Barnes C. et al. Developmental haemostasis // Thromb. Haemost. 2006. Vol. 95. P. 362-372.
-
Monagle P., Massicotte P. Developmental haemostasis: secondary haemostasis // Semin. Fetal Neonatal Med. 2011. Vol. 16. P. 294-300.
-
NHMRC (National Health and Medical Research Council) (2010). Joint statement and recommendations on Vitamin K administration to newborn infants to prevent vitamin K deficiency bleeding in infancy - October 2010 (the Joint Statement). Commonwealth of Australia. URL: www.ag.gov.au/cca. ISBN. Online: 1864965053.
-
Nimavat D.J. Hemorrhagic Disease of Newborn. Updated: Sep 26, 2014. URL: http://emedicine.medscape.com/article/974489-overview.
-
Notes from the field: late vitamin K deficiency bleeding in infants whose parents declined vitamin K prophylaxis - Tennessee, 2013 // MMWR Morb. Mortal. Wkly ReP. 2013. Vol. 62, N 45. P. 901-902.
-
Puckett R.M., Offringa M. Prophylactic vitamin K for vitamin K deficiency bleeding in neonates // Cochrane Database Syst. Rev. 2000. Vol. 4. CD002776.
-
Report of Committee on Nutrition: vitamin K compounds and the water-soluble analogues // Pediatrics. 1961. Vol. 28. P. 501-507.
-
Schulte R., Jordan L.C., Morad A., Naftel R.P. et al. Rise in late onset vitamin K deficiency bleeding in young infants because of omission or refusal of prophylaxis at birth // Pediatr. Neurol. 2014. Vol. 50. P. 564-568.
-
Shahal Y., Zmora E., Katz M., Mazor D., Meyerstein N. Effect of vitamin K on neonatal erythrocytes // Biol. Neonate. 1992. Vol. 62, N 6. P. 373-378.
-
Shearer M.J. Vitamin K deficiency bleeding (VKDB) in early infancy // Blood Rev. 2009. Vol. 23. P. 49-59.
-
Shneider B.L., Magee J.C., Bezerra J.A. et al. Efficacy of fat-soluble vitamin supplementation in infants with biliary atresia // Pediatrics. 2012. Vol. 130. P. e607-е614.
-
Takahashi D., Shirahata A., Itoh S., Takahashi Y. et al. Vitamin K prophylaxis and late vitamin K deficiency bleeding in infants: Fifyh nationwide survey in Japan // Pediatr. Int. 2011. Vol. 53. P. 897-901.
-
Takemoto C.M. Venous thromboembolism in cystic fibrosis // Pediatr. Pulmonol. 2012. Vol. 47. P. 105-112.
-
Thureen P.J., Hay W.W. Jr. Neonatal Nutrition and Metabolism. 2th ed. Cambridge University Press, 2006.
-
Trumbo P., Yates A.A., Schlicker S., Poos M. Dietary reference intakes: vitamin A, vitamin K, arsenic, boron, chromium, copper, iodine, iron, manganese, molybdenum, nickel, silicon, vanadium, and zinc // J. Am. Diet Assoc. 2001. Vol. 101, N 3. P. 294-301.
-
van Hasselt P.M., de Koning T.J., Kvist N. et al. Prevention of vitamin K deficiency bleeding in breastfed infants: lessons from the Dutch and Danish Biliary Atresia Registries // Pediatrics. 2008. Vol. 121, N 4. P. e857-e863.
-
Vanek V.W., Borum P. et al. A.S.P.E.N. Position Paper. Recommendations for changes in commercially available parenteral multivitamin and multi-trace element products // Nutr. Clin. Pract. 2012. Vol. 27, N 4. P. 440-491.
-
Volpe J.J. Neurology of the Newborn. 5th ed. Philadelphia: Elsevier, 2008. 1094 p.
-
Volpe J.J. Intracranial hemorrhage in early infancy-renewed importance of vitamin K deficiency // Pediatr. Neurol. 2014. Vol. 50. P. 545-546.
-
von Kries R., Kreppel S., Becker A., Tangermann R. et al. Acarboxyprot-hrombin concentration (corrected) after oral prophylactic vitamin K // Arch. Dis. Child. 1987. Vol. 62. P. 938-940.
-
Инструкции к препарату «Викасол» производителей, которые разрешают его применение у новорожденных.
ПРИЛОЖЕНИЯ
Приложение 1
Таблица 2. Референсные значения показателей гемостаза у доношенных детей в зависимости от возраста и взрослых, по данным разных источников [16, 17, 37, 39]
| Показатель | Автор | 30 мин | 1-е сутки | 3-и сутки | 5-е сутки | 30-е сутки | 90-е сутки | Взрослые |
|---|---|---|---|---|---|---|---|---|
ПВ, с |
Mitsiakos G., 2009 |
15,5 (13,4-19,0) |
||||||
Andrew M., 1987, 1988 |
13 (10,1-15,9) |
12,4 (9,5-15,3) |
11,8 (9,3-14,3) |
11,8 (9,3-14,3) |
12,4 (10,8-13,9) |
|||
MonagLe P., 2006 |
15,6 (14,4-16,4) |
14,9 (13,5-16,4) |
13,1 (11,5-15,3) |
13,0 (11,5- 14,5) |
||||
АЧТВ, с |
Mitsiakos G., 2009 |
42 (30-57) |
||||||
Andrew M., 1987, 1988 |
42,9 (31,3-54,5) |
42,6 (25,4-55,2) |
40,4 (25,6-55,2) |
37,1 (24,1-50,1) |
33,5 (26,6-40,3) |
|||
MonagLe P., 2006 |
38,7 (34,3- 44,8) |
36,3 (29,5- 42,2) |
39,3 (35,1-46,3) |
33,2 (28,6- 38,2) |
||||
МНО |
Mitsiakos G., 2009 |
1,23 (1,01- 1,60) |
||||||
MonagLe P., 2006 |
1,26 (1,15- 1,35) |
1,2 (1,05- 1,35) |
1,00 (0,86-1,22) |
1,00 (0,8- 1,2) |
||||
ТВ, с |
Andrew M., 1987, 1988 |
23,5 (18,7-28,3) |
23,1 (17,0-29,2) |
24,3 (19,4-29,2) |
25,1 (20,5-29,7) |
25,0 (19,7-30,3) |
||
MonagLe P., 2006 |
17,1 (16,3-17,6) |
16,6 (16,2- 17,2) |
||||||
Фибриноген, г/мл |
Mitsiakos G., 2009 |
1,85 (0,65-3,24) |
||||||
Andrew M., 1987, 1988 |
2,8 (1,7-4,0) |
3,1 (1,6-4,6) |
2,7 (1,6-3,8) |
2,4 (1,1-3,8) |
2,78 (1,56-4,00) |
|||
MonagLe P., 2006 |
2,8 (1,92-3,74) |
3,3 (2,03-4,01) |
2,42 (0,82-3,83) |
3,1 (1,9-4,3) |
||||
Примечание. Представлены средние значения (95% доверительный интервал).
Таблица 3. Референсные значения показателей гемостаза у недоношенных детей, 30-36 нед гестации в зависимости от возраста, по данным разных источников [17, 38]
| Показатель | Автор | 30 мин | 1-е сутки | 5-е сутки | 30-е сутки | 90-е сутки |
|---|---|---|---|---|---|---|
ПВ, с |
Mitsiakos G., 2010 |
16,4 (13,3-21,4) |
||||
Andrew M., 1988 |
13 (10,6-16,2) |
11,8 (10,0-13,6) |
12,3 (10,0-14,6) |
13 (10,6-16,2) |
||
АЧТВ, с |
Mitsiakos G., 2010 |
51 (34,2-102,9) |
||||
Andrew M., 1988 |
53,6 (27,5-79,4) |
50,5 (26,9-74,1) |
44,7 (26,9-62,5) |
39,5 (28,3-50,7) |
||
МНО |
Mitsiakos G., 2010 |
1,32 (1,02-1,85) |
||||
ТВ, с |
Andrew M., 1988 |
24,8 (19,2-30,4) |
24,1 (18,8-24,4) |
24,4 (18,8-29,9) |
25,1 (19,4-30,8) |
|
Фибриноген, г/мл |
Mitsiakos G., 2010 |
1,83 (0,64-4,78) |
||||
Andrew M., 1988 |
2,43 (1,5-3,7) |
2,8 (1,6-4,2) |
2,5 (1,5-4,1) |
2,46 (1,5-3,5) |
Примечание. Представлены средние значения (95% доверительный интервал).
Таблица 4. Референсные значения протромбинового индекса по Квику у новорожденных [7]
| Недоношенные 30-36 нед | Доношенные | Значения, как у взрослых, достигаются | |
|---|---|---|---|
ПТИ, % |
46 (35-115) |
72 (50-95) |
К 1-4 нед |
Приложение 2. Лечение геморрагической болезни новорожденных
Приложение 3. Профилактика геморрагической болезни новорожденных
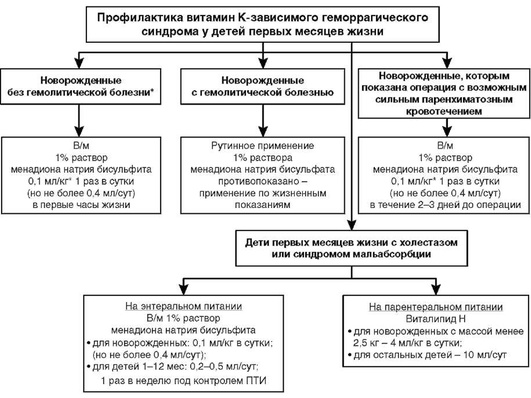
* Может рассматриваться 3-кратное введение (1 раз в сутки) в случае наличия геморрагического синдрома у детей первых месяцев жизни, имеющих факторы риска по развитию геморрагической болезни.
Приложение 4. Содержание витамина К1 в пищевых продуктах [15]
| Продукты | Содержание, мкг/100 г |
|---|---|
Листовые овощи |
|
Петрушка сырая |
1640,0 |
Свекла листья, зеленые, вареные |
484,0 |
Шпинат свежий |
483,0 |
Лук зеленый, перо и луковица |
207,3 |
Салат, сырые зеленые листья |
174,0 |
Брокколи |
101,0 |
Капуста сырая белокочанная |
60,0 |
Капуста цветная |
16,0 |
Прочие овощи |
|
Горох зеленый консервированный |
21,4 |
Огурцы свежие |
16,4 |
Морковь |
13,2 |
Помидоры красные |
7,9 |
Горох дробленый вареный |
5,0 |
Перец сладкий |
4,9-7,4 |
Фасоль вареная |
3,5 |
Редис сырой |
2,2 |
Картофель отварной |
2,1 |
Растительное масло |
|
Оливковое масло |
48,5 |
Масло соевое для салатов (гидрогенизированное) |
25,0 |
Масло растительное подсолнечное |
5,1 |
Мясо, птица, колбасы |
|
Цыплята |
4,0 |
Баранина постная |
3,8 |
Говядина постная тушеная |
1,6 |
Сосиска говяжья |
1,6 |
Молочные продукты |
|
Масло соленое сливочное |
7,0 |
Сливки цельные |
3,3 |
Сыр чеддер, швейцарский |
2,4 |
Йогурт низкой жирности |
0,2 |
Молоко 1% жирности |
0,08 |
Яйцо |
|
Яйцо вареное |
0,4 |
Рыба, морепродукты |
|
Тунец, консервированный без добавления масла |
0,3 |
Лосось копченый |
0,15 |
Хлеб и мучные изделия |
|
Хлеб белый |
3,2 |
Печенье овсяное обезжиренное |
1,0 |
Хлеб ржаной пониженной калорийности |
0,4 |
Макароны |
0,1 |
Блюда из круп |
|
Гречневая крупа приготовленная |
1,9 |
Овсяная каша быстрого приготовления |
0,5 |
Рис белый |
0,0 |
Фрукты |
|
Чернослив |
59,5 |
Сливы |
6,4 |
Груша |
4,5 |
Изюм без косточек |
3,5 |
Абрикосы |
3,4 |
Яблоки |
2,2 |
Бананы |
0,5 |
Ягоды |
|
Ежевика |
19,8 |
Черника |
19,3 |
Орехи, семечки |
|
Тыквенные семечки |
47,3 |
Орехи кешью |
34,5 |
Орехи фундук |
14,1 |
Орехи грецкие |
2,8 |
Подсолнечника семечки |
2,8 |
Арахис |
0,0 |
Напитки |
|
Какао, сухой порошок без сахара |
1,9 |
Чай |
0,0 |
Конфеты, сахар, мед |
|
Молочный шоколад |
9,2 |
Карамель |
2,0 |
Зефир, мармелад, мед, сахар |
0,0 |
ТАКТИКА ВЕДЕНИЯ ДОНОШЕННЫХ И НЕДОНОШЕННЫХ НОВОРОЖДЕННЫХ С НЕПРЯМОЙ ГИПЕРБИЛИРУБИНЕМИЕЙ
Согласовано и утверждено Российским обществом неонатологов и Российской ассоциацией специалистов перинатальной медицины
Авторы: Володин Н.Н., Дегтярев Д.Н., Дегтярева А.В., Карпова А.Л., Мебелова И.И., Пруткин М.Е., Сенькевич О.А. (модератор рабочей группы), Харламова Н.В.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Гипербилирубинемия (от греч. hyper + билирубин + haima - «кровь») - любое увеличение концентрации билирубина в сыворотке или плазме крови сверх нормативных значений.
Непрямая гипербилирубинемия - повышение концентрации, обусловленное преимущественно (более чем на 80%) непрямой фракцией билирубина.
Гипербилирубинемия в неонатологии - состояния, при которых у доношенных и недоношенных ГВ 35-36 нед отмечается повышение концентрации ОБ в сыворотке крови более 256 мкмоль/л, а у детей, родившихся до 35-й недели гестации, - повышение концентрации ОБ более 171 мкмоль/л (уровень доказательности B).
Желтуха - визуальное проявление повышенного уровня билирубина в крови. У доношенных новорожденных появляется при уровне билирубина более 67 мкмоль/л, у недоношенных - более 120 мкмоль/л (уровень доказательности C).
Повышение концентрации билирубина в крови у новорожденных и развитие желтухи может быть вызвано как физиологическими, так и патологическими причинами. К раннему появлению, прогрессирующему нарастанию и высокой интенсивности желтухи следует относиться как к симптомам потенциально опасного заболевания (уровень доказательности D).
Нарушение структуры и функции головного мозга, обусловленное непрямой гипербилирубинемией, носит название билирубиновой энцефалопатии (БЭ), или ядерной желтухи.
Ранними предикторами повышенного риска развития БЭ у доношенных новорожденных являются концентрация ОБ в пуповинной крови более 51 мкмоль/л, почасовой прирост ОБ более 6,8 мкмоль/л в час, появление желтухи в первые 24 ч жизни.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Физиологическая желтуха
Основные физиологические причины повышения концентрации билирубина в сыворотке крови у детей в первые дни жизни (уровень доказательности D):
-
более высокая скорость образования билирубина, обусловленная физиологической полицитемией и более короткой продолжительностью жизни эритроцитов, содержащих фетальный гемоглобин (70-90 дней по сравнению с 110-120 днями у взрослых);
-
функционирующий венозный проток и уменьшенная перфузия крови в пространстве Диссе препятствуют полноценному захвату билирубина гепатоцитами;
-
сниженная активность фермента глюкуронилтрансферазы, обеспечивающей конъюгацию билирубина, и недостаточная концентрация Y-протеина, обеспечивающего транспорт билирубина в гепатоцитах;
-
исходно низкая экскреторная функция печени (1-2% экскреторной способности печени взрослого);
-
усиленная реабсорбция билирубина из тонкой кишки вследствие высвобождения билирубина из химической связи с глюкуроновой кислотой под влиянием повышенной активности фермента β-глюкоронидазы.
Непрямая гипербилирубинемия, вызванная патологическими причинами
Несоответствие хотя бы по одному из типичных для физиологической желтухи клинических и лабораторных признаков с высокой вероятностью свидетельствует о том, что нарушение обмена билирубина вызвано патологическими причинами.
Факторы риска патологической гипербилирубинемии у доношенных новорожденных.
-
Восточноазиатское или средиземноморское происхождение (уровень доказательности B).
-
Несовместимость по системе АВ0 или резус-фактору матери и плода (уровень доказательности B).
-
Использование окситоцина в родах (уровень доказательности D).
-
Желтуха, развившаяся в первые сутки жизни (уровень доказательностиB).
-
Кефалогематома/экхимозы, крупные гемангиомы (уровень доказательности B).
-
Гипогалактия при исключительно грудном вскармливании (уровень доказательности C).
-
Нарушенное сосание/недостаточное питание (уровень доказательности C).
-
Эксикоз (патологическая убыль массы тела) (уровень доказательности B).
-
Врожденные и перинатальные инфекции (уровень доказательности B).
-
Дефицит глюкозо-6-фосфатдегидрогеназы (уровень доказательности B).
Практически всегда гипербилирубинемия у недоношенных детей, родившихся ранее 35-й недели гестации, обусловлена нефизиологическими причинами.
В большинстве случаев патологической гипербилирубинемии, возникающей на первой неделе жизни, отмечается преобладание в крови непрямой фракции билирубина (уровень доказательности C).
ЭПИДЕМИОЛОГИЯ
Желтуха на первой неделе жизни регистрируется у 60-80% здоровых доношенных новорожденных (уровень доказательности A).
КОДЫ ПО МЕЖДУНАРОДНОЙ КЛАССИФИКАЦИИ БОЛЕЗНЕЙ 10-ГО ПЕРЕСМОТРА
-
Р59 Неонатальная желтуха, обусловленная другими и неуточненными причинами.
-
Р59.0 Неонатальная желтуха, связанная с преждевременным родоразрешением.
-
Р59.2 Неонатальная желтуха вследствие других и неуточненных повреждений клеток печени.
-
Р59.8 Неонатальная желтуха, обусловленная другими уточненными причинами.
КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ
По ведущим патогенетическим механизмам все случаи непрямой гипербилирубинемии у новорожденных можно разделить на четыре группы.
Наиболее вероятные причины, приводящие к непрямой патологической гипербилирубинемии у новорожденных с учетом ведущих патогенетических механизмов, перечислены в табл. 1 (уровень доказательности C).
Таблица 1. Основные причины непрямой патологической гипербилирубинемии у новорожденных
| Гиперпродукция билирубина |
|---|
|
Нарушение конъюгации билирубина |
|
Повышение кишечной реабсорбции |
Обструкция ЖКТ или кишечная непроходимость (при пилоростенозе, атрезиях кишечника, болезни Гиршпрунга, мекониальном илеусе или мекониальной пробке), парез кишечника |
Смешанного генеза |
Ранний и поздний неонатальный сепсис. Внутриутробная инфекция различной этиологии (листериоз, цитомегалия, краснуха, токсоплазмоз, гепатит В, герпес, сифилис и др.). Глубокая степень недоношенности (выраженная морфофункциональная незрелость) ребенка |
КЛИНИЧЕСКАЯ КАРТИНА
Ведущие патогенетические механизмы развития гипербилирубинемии во многом определяют время возникновения и степень выраженности гипербилирубинемии. Раннее распознавание конкретной причины нарушений билирубинового обмена позволяет не только прогнозировать течение желтухи, но и эффективно предупреждать осложнения, ассоциированные с гипербилирубинемией (уровень доказательности C).
Для физиологической желтухи характерны:
-
отсутствие клинико-лабораторных признаков анемии или полицитемии;
-
появление желтой окраски кожи в возрасте более 24 ч жизни (почасовой прирост билирубина в 1-е сут составляет менее 3,4 мкмоль/л, суммарно за первые сутки - менее 85,5 мкмоль/л);
-
максимальная выраженность желтой окраски лица, туловища и конечностей на 3-4-е сутки жизни, желтуха не распространяется на ладони и стопы;
-
не наблюдается патологических оттенков желтой окраски кожи (серого, зеленоватого, лимонного);
-
максимальная концентрация ОБ не более 255 мкмоль/л, концентрация прямой фракции билирубина не выше 34 мкмоль/л;
-
быстрое уменьшение интенсивности и распространенности желтухи после 4-х суток жизни, угасание желтухи к 8-10-м суткам жизни.
Примерно в половине случаев при физиологическом течении желтухи к 3-4-м суткам возникает кратковременная непрямая гипербилирубинемия, которая не имеет негативных клинических последствий и не требует никаких медицинских вмешательств (уровень доказательности D).
Понятие «физиологическая желтуха» применимо только по отношению к доношенным новорожденным и недоношенным ГВ 35-36 нед (уровень доказательности D). Это состояние кодированию по МКБ не подлежит и при анализе заболеваемости новорожденных не учитывается.
Патологическая желтуха. Любые отклонения в клинической картине и динамике лабораторных показателей, характеризующих билирубиновый обмен, от физиологических должны рассматриваться как признаки патологической желтухи, причина которой требует дополнительного клинико-лабораторного обследования ребенка.
NB! Во всех случаях развития патологической гипербилирубинемии, обусловленной гиперпродукцией билирубина и в части случаев нарушением конъюгации билирубина, возникает риск развития метаболического поражения центральной нервной системы (ЦНС) за счет потенциальной нейротоксичности высокой концентрации неконъюгированного билирубина в крови (уровень доказательности C).
Билирубиновая энцефалопатия
При использовании современных перинатальных технологий БЭ (код по МКБ-10 - Р57) является предотвратимым состоянием (уровень доказательности D).
БЭ у доношенных новорожденных развивается в случаях превышения концентрации ОБ в сыворотке крови выше 342 мкмоль/л с выраженнымииндивидуальными различиями концентраций (от 342 до 684 мкмоль/л), при которых происходит метаболическое поражение головного мозга (уровень доказательности B).
В последние два десятилетия частота БЭ в различных странах мира находится в диапазоне от 0,4 до 2,7 на 100 000 популяции (уровень доказательности В).
Вероятность развития БЭ при патологической гипербилирубинемии повышается на фоне таких факторов риска, как (уровень доказательности B):
-
недоношенность или морфофункциональная незрелость организма ребенка (уровень доказательности B);
-
тяжелая врожденная и неонатальная инфекция (сепсис, менингит) (уровень доказательности B);
-
дефицит глюкозо-6-фосфатдегидрогеназы (уровень доказательностиC);
-
гипоальбуминемия (концентрация сывороточного альбумина менее 25 г/л) (уровень доказательности C);
-
выраженный метаболический ацидоз (pH артериальной крови менее 7,15 более 1 ч) (уровень доказательности C);
-
тяжелая асфиксия новорожденного (оценка по шкале Апгар менее 4 баллов), артериальная гипотензия, апноэ, потребность в ИВЛ (уровень доказательности C);
-
гипотермия (ректальная температура менее 35 °С) (уровень доказательности C);
-
обширная травма мягких тканей в родах, массивные кефалогематомы, перивентрикулярные, ВЖК и субарахноидальные кровоизлияния (уровень доказательности C);
Кроме того, ряд препаратов (в первую очередь, антибиотиков), могут вытеснять билирубин из связи с альбумином (уровень доказательности C).
У недоношенных детей вероятность БЭ развивается при более низких концентрациях билирубина, чем у доношенных новорожденных, и зависит от концентрации билирубина в крови и массы тела ребенка при рождении.
У детей, родившихся с очень низкой и экстремально низкой массой тела (ОНМТ и ЭНМТ), БЭ может возникнуть даже после умеренного повышения концентрации ОБ в сыворотке крови (в диапазоне 171- 255 мкмоль/л) (уровень доказательности B).
В повседневной неонатологической практике при определении риска развития БЭ ориентируются на минимальные пороговые концентрации билирубина в сыворотке крови, при которых в прошлом регистрировались случаи развития ядерной желтухи.
В течении БЭ можно условно выделить четыре фазы.
-
Асфиктическую фазу. Характерно нарастание признаков билирубиновой интоксикации - угнетение безусловно-рефлекторной деятельности: апноэ, апатия, вялость, сонливость, вялое сосание, монотонный крик, срыгивания, рвота, блуждающий взгляд. При неблагоприятном течении эти признаки в большинстве случаев появляются на 4-й день жизни и в случаях экстренного проведения ОЗПК носят обратимый характер (уровень доказательности A).
-
Спастическую фазу. При неэффективном лечении появляются классические признаки ядерной желтухи: спастичность, ригидность затылочных мышц, вынужденное положение тела с опистотонусом, негнущимися конечностями и сжатыми в кулак кистями; периодическое возбуждение и резкий мозговой крик, выбухание большого родничка, подергивание мышц лица, крупноразмашистый тремор рук, исчезновение рефлекса Моро и видимой реакции на сильный звук, сосательного рефлекса; нистагм, апноэ, брадикардия, летаргия, иногда повышение температуры тела; судороги, симптом заходящего солнца. Эта фаза имеет продолжительность от нескольких дней до нескольких недель, поражение ЦНС носит необратимый характер.
-
Фазу ложного неврологического благополучия и полного или частичного исчезновения спастичности (2-3 мес жизни).
-
Фазу формирования клинической картины неврологических осложнений (после 3-5 мес жизни): параличи, парезы, атетоз, хореоатетоз, глухота, детский церебральный паралич, задержка психического развития, дизартрия (уровень доказательности B).
Первые две фазы заболевания являются признаком острого метаболического поражения ЦНС и обозначаются термином «острая БЭ». Отдаленные неврологические нарушения, вызванные нейротоксическим действием билирубина (4-я фаза), обозначаются термином «хроническая БЭ».
Развитие классических признаков острой БЭ в случаях непрямой гипербилирубинемии характерно для доношенных новорожденных и недоношенных, родившихся на 35-36-й нед гестации (уровень доказательности A). У глубоко недоношенных детей при надпороговых значениях гипербилирубинемии характерные клинические признаки острой БЭ могут отсутствовать или маскироваться симптомами других патологических состояний, но во втором полугодии жизни у них появляются типичные признаки хронической БЭ (уровень доказательности D).
В целях раннего выявления, оценки динамики и определения тяжести БЭ у новорожденных L. Jonson, V.K. Bhutani, K. Karp и соавт. предложили балльную шкалу, позволяющую учитывать степень выраженности неврологических дисфункций, характеризующих острую БЭ (табл. 2).
Таблица 2. Балльная оценка степени тяжести клинических проявлений билирубиновой энцефалопатии у новорожденных в остром периоде
| Клинические симптомы | Билирубин-ассоциированная дисфункция центральной нервной системы, баллы | Острая билирубиновая энцефалопатия |
|---|---|---|
Психический статус |
||
Физиологический |
0 |
Нет |
Сонный, требует пробуждения на кормление |
1 |
Минимальная |
Летаргия/вялое сосание или раздражительность/возбуждение с повышенным сосательным рефлексом |
2 |
Умеренная |
Сопор, апноэ, отказ от еды, судороги, кома |
3 |
Тяжелая |
Мышечный тонус |
||
Физиологический |
0 |
Нет |
Гипотония от легкой до умеренной |
1 |
Минимальная |
Гипертония от легкой до умеренной, чередующаяся с гипотонией, разгибание шеи и туловища в ответ на стимуляцию |
2 |
Умеренная |
Персистирующий шейно-тонический синдром и опистотонус, стереотипные движения в виде педалирования или подергивания в руках и ногах |
3 |
Тяжелая |
Характер крика |
||
Физиологический |
0 |
Нет |
Высокотональный при пробуждении |
1 |
Минимальная |
Пронзительный, тяжело успокоить |
2 |
Умеренная |
Безутешный плач/слабый крик или отсутствует |
3 |
Тяжелая |
Суммарная оценка*: |
||
* Интерпретация результатов: 1-3 балла - минимальная; 4-6 баллов - умеренная; 7-9 баллов - тяжелая БЭ.
Предупреждение билирубиновой энцефалопатии
В случаях выявления патологической гипербилирубинемии первоочередные усилия должны быть направлены на предотвращение критических концентраций билирубина в крови, при которых вероятно развитие БЭ.
Медицинские мероприятия, направленные на профилактику БЭ, можно условно разделить на четыре этапа.
-
Клинико-анамнестический и клинико-лабораторный скрининг новорожденных на возможность развития или наличие патологической гипербилирубинемии (выявление группы риска).
-
Определение степени и выявление ведущего патогенетического механизма развития гипербилирубинемии.
-
Подготовка и проведение лечебных мероприятий, направленных на уменьшение концентрации непрямого билирубина (НБ) в сыворотке крови:
-
создание оптимальных условий медицинского ухода и при необходимости проведение интенсивной терапии основного и сопутствующих заболеваний;
-
в случаях недостаточной эффективности ФТ - подготовка и проведение ОЗПК, при необходимости - создание дополнительных условий, повышающих ее эффективность;
-
клинико-лабораторный мониторинг безопасности и эффективности комплекса лечебных мероприятий (до момента полного их завершения).
-
-
Выявление или подтверждение конкретной причины развития непрямой гипербилирубинемии, потребовавшей медицинского вмешательства, при необходимости (в диагностически сложных случаях) - продолжение дифференциально-диагностических мероприятий и лечения основного и сопутствующего заболеваний.
Первые три этапа должны быть организованы в любой медицинской организации акушерско-гинекологического или педиатрического профиля независимо от ее функционального уровня. Для организации четвертого этапа может потребоваться перевод ребенка в учреждение третьего уровня (в перинатальный центр или детскую многопрофильную или специализированную больницу).
Клиническая характеристика наиболее частых причин патологической непрямой гипербилирубинемии, возникающей в позднем неонатальном периоде
Конъюгационные желтухи
Желтуха, связанная с составом грудного молока, наблюдается у 0,5- 2,5% здоровых доношенных детей, находящихся на грудном вскармливании, вследствие повышенного содержания метаболитов прогестерона и неэстерифицированных длинноцепочечных жирных кислот, которые конкурентно ингибируют глюкуронилтрансферазу, наличия глюкуронидазы, высокой активности фермента липопротеинлипазы в молозиве и грудном молоке. Часто этот вариант гипербилирубинемии ассоциирован с приемом гормональных препаратов и некоторых других лекарственных средств во время беременности, стимуляции родовой деятельности. У новорожденных с желтухой, связанной с составом грудного молока, наблюдается более высокая концентрация НБ в крови к 4-6-му дню жизни, которая продолжает нарастать, достигая пика к 10-15-му дню жизни. Состояние ребенка при этом удовлетворительное, отмечается хорошая прибавка массы тела. Если ребенок продолжает получать грудное молоко, желтуха держится 4-6 нед и затем начинает постепенно ослабевать. Уровень НБ в крови нормализуется к 16-й неделе жизни. Прекращение грудного вскармливания на 48-72 ч способствует быстрому снижению концентрации НБ, как правило, не менее чем на 40% и имеет диагностическое значение при данном варианте гипербилирубинемии. После возобновления кормления грудью НБ может повыситься, но он не достигает исходного уровня и в дальнейшем постепенно снижается. Вместе с тем длительная отмена грудного молока в целях полной нормализации билирубина нецелесообразна, так как в большинстве случаев уровень билирубина не превышает 340 мкмоль/л.
Транзиторная семейная гипербилирубинемия новорожденных (синдром Люцея-Дрискола) является разновидностью желтухи, связанной с составом грудного молока, механизм ее развития связывают с наличием неидентифицированного фактора, ингибирующего ферментную систему трансферазы глюкуроновой кислоты в грудном молоке. Желтуха появляется с первых дней жизни, имеет тенденцию к прогрессивному нарастанию и затяжному течению. Уровень НБ в крови может превышать 340 мкмоль/л, что обусловливает необходимость своевременной диагностики и лечения. Отмена грудного вскармливания на 2-3 дня способствует снижению уровня билирубина и, следовательно, имеет диагностическое значение. Исследование химического состава грудного молока позволяет дифференцировать данный вариант гипербилирубинемии с другими желтухами, связанными с составом грудного молока, что не является принципиальным с практической точки зрения.
В основе желтухи, обусловленной исключительно грудным вскармливанием, лежит первоначально недостаточный объем питания, что способствует усилению липолиза и, как следствие, повышению в крови неэстерифицированных жирных кислот, нарушающих процесс захвата билирубина гепатоцитом и подавляющих активность глюкуронилтрансферазы. Вторым фактором, способствующим гипербилирубинемии, является замедление пассажа по кишечнику и, как следствие, повышение реабсорбции билирубина. Этот вариант желтухи отмечается у 12% детей, находящихся на грудном вскармливании в период становления лактации и не получающих должный объем питания. Она появляется на 2-4-е сутки жизни, пик приходится на 3-6-й день, по мере увеличения объема кормления нормализуются обменные процессы, восстанавливается пассаж по кишечнику, и к концу первого месяца жизни желтуха купируется. Как правило, первоначальная потеря массы тела составляет8-10% и более, общее состояние ребенка не страдает. В случае большой потери массы тела у детей на исключительно грудном вскармливании необходимо обеспечить докорм ребенка.
Конъюгационная желтуха при гипотиреозе. Гормоны щитовидной железы регулируют активность глюкуронилтрансферазы, их дефицит может стать причиной нарушения конъюгации билирубина. Подтверждением диагноза является низкий уровень Т3, Т4 и повышение тиреотропного гормона в крови.
Наследственные формы конъюгационных желтух. Синдром Жильбера - наследственное заболевание (частота в популяции составляет от 2 до 6%), передающееся по аутосомно-доминантному типу и связанное с нарушением захвата билирубина синусоидальной мембраной гепатоцита. Отмечается снижение до 50% нормы активности глюкуронил-трансферазы печени. Желтуха обычно выражена умеренно, в пределах 80-120 мкмоль/л, случаев БЭ не описано, общее состояние не нарушается. Клинические проявления могут отмечаться со 2-3-х суток жизни, причем интенсивность желтухи может меняться каждые 3-5 нед. С диагностической целью может быть использован фенобарбитал в терапевтической дозе 5 мг/кг в сутки в течение 3 дней; характерно снижение билирубина на 50-60%, что позволяет с высокой вероятностью предположить данный синдром. Дополнительное диагностическое значение имеет анализ родословной, свидетельствующий о синдроме Жильбера в семье. Подтверждение диагноза возможно на основании генетического тестирования.
Синдром Криглера-Найяра - наследуемая негемолитическая желтуха с повышением НБ вследствие врожденной недостаточности глюкуронилтрансферазы. Механизм желтухи сводится к полной или почти полной неспособности печени конъюгировать билирубин. Известны две генетически гетерогенные формы, и в связи с этим выделяют два типа.
Синдромом Криглера-Найяра I типа передается по аутосомно-рецессивному типу. Характерна интенсивная желтуха с 15-50-кратным превышением нормального уровня НБ в сыворотке крови, которая без лечения сопровождается развитием БЭ. Гипербилирубинемия развивается в течение первых дней после рождения и сохраняется всю жизнь. Назначение фенобарбитала (с дифференциально-диагностической целью) не приводит к уменьшению сывороточной концентрации билирубина. Диагноз устанавливается на основании прогрессивного нарастания уровня НБ, не связанного с гемолизом эритроцитов, и отрицательной реакции на назначение фенобарбитала с дифференциально-диагностической целью (отсутствие снижения концентрации билирубина после назначения фенобарбитала в возрастной дозе в течение 3 дней). Подтверждается молекулярно-генетическими методами. Использование ФТ является наиболее эффективным методом консервативного лечения детей раннего возраста, позволяющим несколько снизить уровень билирубина и зафиксировать его на некоторое время. В течение первых 10 дней жизни оптимально постоянное проведение ФТ в целях поддержания уровня билирубина ниже 340 мкмоль/л, затем продолжительность ФТ может быть уменьшена до 10-16 ч в сутки. В дальнейшем чувствительность гематоэнцефалического барьера снижается, в связи с чем уровень билирубина может подниматься выше 340 мкмоль/л, но не более чем до 500 мкмоль/л. Сегодня нет однозначного мнения об уровне билирубина у детей старше 1 мес, который является токсичным (диапазон колебаний литературных данных - от 500 до 800 мкмоль/л). Имеется собственный опыт наблюдения ребенка с синдромом Криглера-Найяра I типа с повышением уровня билирубина до 650 мкмоль/л без развития признаков БЭ). Радикальным методом лечения служит трансплантация печени или гепатоцитов; в ургентных ситуациях, при высоком риске развития БЭ, показано проведение ОЗПК или плазмафереза.
Синдром Криглера-Найяра II типа передается по аутосомно-доминантному типу, является прогностически более благоприятным заболеванием и сопровождается менее выраженной желтухой с 5-20-кратным повышением НБ в сыворотке крови. Отличительной особенностью этой формы служит уменьшение ОБ на фоне 3-дневного применения фенобарбитала не менее чем на 50-60%. Дефицит глюкуронилтрансферазы менее выражен, уровень ОБ в сыворотке крови варьирует от 91 до 640 мкмоль/л, но чаще всего не превышает 340 мкмоль/л. Развитие БЭ отмечается редко и в основном происходит в раннем неонатальном периоде при участии других патологических факторов. Динамический контроль за показателями НБ в сыворотке крови и раннее назначение фенобарбитала, своевременное и адекватное проведение ФТ позволяют эффективно снизить уровень ОБ и предупредить развитие энцефалопатии. В целях подтверждения диагноза возможно проведение молекулярно-генетического исследования.
Желтуха, обусловленная повышенной реабсорбцией билирубина в кишечнике, - вторичная вследствие повышения реабсорбции билирубина в кишечнике, что может быть обусловлено обструкцией ЖКТ или кишечной непроходимостью при пилоростенозе, болезни Гиршпрунга, мекониальном илеусе, при парезах кишечника и др. Исключение врожденных и приобретенных заболеваний ЖКТ должно входить в план дополнительного обследования ребенка с поздней или затянувшейся желтухой.
ДИАГНОСТИКА
Жалобы и анамнез (клинико-анамнестические данные)
В группу высокого риска по развитию непрямой гипербилирубинемии сразу после рождения должны быть выделены:
-
новорожденные, с клиническими и/или лабораторными признаками гемолитической болезни;
-
новорожденные с выраженными признаками морфофункциональной незрелости, в том числе глубоко недоношенные дети;
-
новорожденные с множественными подкожными кровоизлияниями и обширными кефалогематомами;
-
новорожденные, нуждающиеся в реанимационной и интенсивной терапии в раннем неонатальном периоде, включая детей с внутриутробной инфекцией и неонатальным сепсисом;
-
новорожденные с высоким риском раннего проявления болезней обмена или наследственных гемолитических анемий (отягощенный семейный анамнез или наличие соответствующих лабораторных признаков);
-
наличие в семье других детей с выраженной гипербилирубинемией, требующей лечения в неонатальном периоде.
Типичные проявления
Исторически сложилось, что в целях раннего выявления гипербилирубинемии многие неонатологи ориентируются в первую очередь на изменение цвета кожного покрова. Безусловно, раннее появление желтухи (до 24 ч жизни), нарастание после 4 сут и сохранение более 2 нед свидетельствуют о наличии патологической гипербилирубинемии. Появление желтухи в первые 24 ч свидетельствует о гиперпродукции билирубина, вызванного патологическим гемолизом эритроцитов, а нарастание желтухи после 4 сут жизни с высокой вероятностью указывает на нарушение конъюгации билирубина в печени и его недостаточной экскреции (уровень доказательности B).
Дополнительную информацию о патологической природе желтухи может иметь появление на ее фоне лимонного (типично для ГБН), зеленоватого (типично для холестаза) или сероватого (типично для сепсиса) оттенка кожи.
Первоначально желтый цвет приобретает кожа лица и туловища ребенка. Дальнейшее нарастание концентрации билирубина, независимо от причины, приводит к распространению желтухи и окрашиванию кожи конечностей. Увеличение концентрации билирубина более 255- 306 мкмоль/л сопровождается прокрашиванием ладоней и стоп (уровень доказательности C).
Комментарии. В 1969 г. доктор Л.И. Крамер (Kramer L.I.) предложил выделять пять степеней выраженности желтухи новорожденных (приложение 1), каждой из которых соответствует свой диапазон концентрации билирубина в сыворотке крови. В настоящее время эксперты РОН считают, что клиническая оценка степени выраженности желтухи на основе шкалы Крамера субъективна и требует подтверждения гипербилирубинемии инструментальными и лабораторными методами. Шкала Крамера может быть использована для определения необходимости забора крови на биохимический анализ билирубина у доношенных новорожденных в тех медицинских организациях, в которых отсутствуют аппараты для чрескожного определения билирубина (уровень доказательности D).
NB! Однократная оценка по Крамеру в большинстве случаев не позволяет дифференцировать физиологическую и патологическую гипербилирубинемию.
Однако описание во врачебных дневниках желтухи с указанием кожных зон, предложенных Крамером, помогает определить показания к биохимическому исследованию крови. Желтое окрашивание двух и трех зон не позволяет исключить или подтвердить гипербилирубинемию, распространение желтухи на четвертую и пятую кожные зоны практически всегда свидетельствует о наличии гипербилирубинемии, но не позволяет объективно оценивать вероятность развития БЭ. Таким образом, распространение желтухи на четвертую и пятую зоны по Крамеру у доношенного новорожденного должно рассматриваться как показание к биохимическому исследованию крови. Вместе с тем при ранней выписке новорожденных из акушерского стационара такой подход не позволяет прогнозировать нарастание желтухи после 3 сут. Кроме того, шкалу Крамера нельзя применять у недоношенных и новорожденных с дефицитом массы тела. Шкала Крамера не может быть использована для оценки эффективности ФТ (уровень доказательности D).
Все вышеизложенное подчеркивает существенное ограничение возможностей использования визуальной оценки степени желтухи для скрининга детей, составляющих группу риска по развитию БЭ (уровень доказательности A).
Чрескожное измерение концентрации билирубина
Более объективным методом оценки скорости и степени накопления билирубина в коже ребенка, чем визуальная оценка, является чрескожное измерение отраженного от кожи и подкожных тканей света с помощью специальных приборов (уровень доказательности В). В настоящее время с этой целью в РФ успешно используются приборы отечественного и зарубежного производства («Билитест», производство «Техномедика», Россия; билирубинометры JM-103, JM-105, производство Draeger Medical Systems, США; BiliCheck, производство Philips, Нидерланды и др.).
Общим для всех приборов является то, что только в диапазоне концентраций ОБ от 100 до 255 мкмоль/л отмечается прямая линейная зависимость между показателями содержания билирубина в коже и сыворотке крови у доношенных и недоношенных новорожденных ГВ более 35 нед. При концентрации билирубина более 255 мкмоль/л требуется перепроверка уровня билирубина стандартными лабораторными методами (уровень доказательности B).
Особенности и ограничения чрескожного измерения уровня билирубина, не зависящие от конструкции прибора:
-
исследование уровня билирубина чрескожным методом показано всем доношенным новорожденным с желтухой независимо от степени ее выраженности;
-
измерение уровня билирубина должно проводиться только в области лба и/или грудины. Для определения показаний к повторному измерению или срочному определению концентрации ОБ в крови стандартными лабораторными методами могут быть использованы процентильные кривые V.K. Bhutani;
-
данный метод измерения билирубина не может быть использован после начала ФТ (уровень доказательности B).
Вместе с тем, учитывая определенные различия в диагностических алгоритмах и конструктивные особенности, чрескожное измерение билирубина должно выполняться в строгом соответствии с инструкцией по эксплуатации конкретного прибора.
Процентильные кривые уровня билирубина крови, измеренного чрескожным методом у детей, родившихся на сроке беременности более 34 нед, предназначенные для определения степени риска развития патологической гипербилирубинемии, представлены в приложении B2.
При ранней выписке новорожденного из акушерского стационара целесообразно воспользоваться алгоритмом, представленным на рис. 1 (уровень доказательности D).
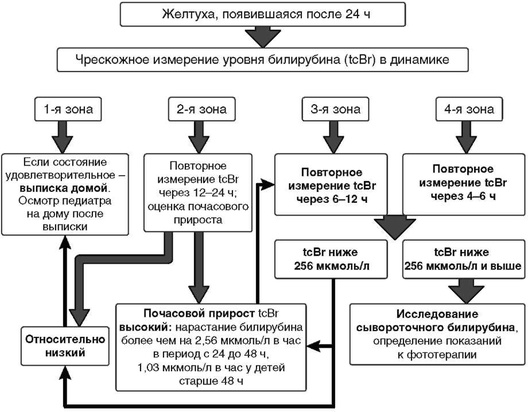
Рис. 1. Алгоритм использования чрескожного измерения билирубина при ранней выписке новорожденного из акушерского стационара
Рациональное использование приборов для чрескожного измерения билирубина у новорожденных в условиях акушерского стационара позволяет: 1) уменьшить неоправданно широкое использование забора крови на билирубин у доношенных новорожденных; 2) более объективно выделять среди клинически здоровых новорожденных группу риска по развитию непрямой патологической гипербилирубинемии; 3) предотвращать раннюю выписку домой новорожденных, у которых имеется потенциальный риск отсроченного развития БЭ (уровень доказательности B).
Особенности использования приборов для чрескожного измерения билирубина у недоношенных детей. Несмотря на попытки использования чрес-кожного измерения билирубина у глубоко недоношенных новорожденных, его прогностическая ценность у недоношенных детей, родившихся ранее 35-й нед беременности, требует дальнейшего изучения (уровень доказательности A).
Лабораторная диагностика
Методы измерения концентрации билирубина в крови у новорожденных
Своевременное измерение концентрации билирубина в крови у новорожденных имеет ключевое значение для определения медицинской тактики ведения при подозрении на патологическую желтуху. Несмотря на то что нейротоксическим действием обладает в основном непрямая фракция билирубина, лечебная стратегия на первой недели жизни, независимо от причины и характера развития желтухи, строится исходя из абсолютных значений ОБ в крови, а не его отдельных фракций.
Стандартное лабораторное исследование концентрации билирубина в крови показано (уровень доказательности A):
Клинико-лабораторные характеристики основных патологических причин непрямой гипербилирубинемии
Гипербилирубинемия, обусловленная избыточным гемолизом эритроцитов. Повышенное образование билирубина вследствие гемолиза эритроцитов может быть обусловлено иммунным конфликтом междуэритроцитами матери и плода, наследственными нарушениями структуры или функции эритроцитов, гемоглобинопатиями, ятрогенными факторами (лекарственный гемолиз - высокие дозы Викасола♠), рядом инфекционных заболеваний (врожденные инфекции - цитомегалия, герпес, краснуха, токсоплазмоз, листериоз, сифилис; неонатальный сепсис).
Наиболее опасной с точки зрения развития БЭ причиной гипербилирубинемии является ГБН.
Клинико-лабораторная характеристика гемолитической болезни плода и новорожденного подробно описана в соответствующем протоколе
Лабораторные критерии ГЕН.
-
Концентрация билирубина в пуповинной крови (в момент рождения) - при легких формах по Rh и во всех случаях AB0-несовместимости не более 51 мкмоль/л; при тяжелых формах по Rh и редким факторам - существенно выше 51 мкмоль/л.
-
Концентрация гемоглобина в пуповинной крови в легких случаях - на нижней границе нормы, в тяжелых - существенно снижена.
-
Почасовой прирост билирубина в первые сутки жизни больше 5,1 мкмоль/л в час.
-
Максимальная концентрация ОБ на 3-4-е сутки в периферической или венозной крови у доношенных новорожденных; при отечной и желтушной формах она существенно выше 256 мкмоль/л.
-
ОБ крови повышается преимущественно за счет непрямой фракции.
-
Относительная доля прямой фракции (при условии отсутствия холестатических осложнений) составляет менее 20%.
-
Уменьшение количества эритроцитов и повышение количества ретикулоцитов в периферической и венозной крови в течение 1 нед жизни.
Для наследственных гемолитических желтух (дефицит глюкозо-6-фосфатдегидрогеназы, серповидноклеточная анемия, наследственный микросфероцитоз и др.) характерно отсроченное (после 24 ч жизни) появление признаков гемолиза, а также изменение формы и размеров эритроцитов при морфологическом исследовании мазка крови, нарушение их осмотической стойкости.
Несмотря на отличия в патогенезе, сходными клиническими и лабораторными признаками сопровождаются гипербилирубинемии, обусловленные полицитемией/повышенной вязкостью крови, а также повышенным экстравазальным образованием билирубина (при множественных и обширных экхимозах, больших кефалогематомах и др.).
Гипербилирубинемия, обусловленная нарушением конъюгации билирубина (конъюгационные желтухи)
Конъюгационные желтухи обусловлены преимущественным нарушением конъюгации билирубина в гепатоцитах [желтухи, связанные с исключительно грудным вскармливанием (при гипогалактии) и особенностями состава грудного молока (семейной транзиторной гипербилирубинемии Ариаса-Люцея-Дрискола) (при нормальном уровне лактации); желтухи, обусловленные диабетической фетопатией и врожденным гипотиреозом. Выраженные нарушения конъюгации билирубина отмечаются при ряде наследственных заболеваний: синдроме Криглера-Найяра I и II типа, синдроме Жильбера и др.].
Для конъюгационных желтух характерны следующие признаки.
-
-
концентрация ОБ в пуповинной крови (в момент рождения) - менее 51 мкмоль;
-
концентрация гемоглобина в пуповинной крови соответствует норме;
-
почасовой прирост билирубина в первые сутки жизни менее 6,8 мкмоль/л в час;
-
максимальная концентрация ОБ на 3-4-е сутки в периферической/ венозной крови у доношенных детей более 255 мкмоль/л;
-
Гипербилирубинемия, обусловленная повышением кишечной реабсорбции, чаще всего наблюдается при высокой кишечной непроходимости. Клиническая картина зависит от причины кишечной непроходимости (атрезия двенадцатиперстной кишки, пилоростеноз, обструкция кишечника объемным образованием и т.п.), а также сопутствующих симптомов обезвоживания и гипогликемии.
Лабораторные критерии сходны с критериями конъюгационной желтухи.
Непрямая гипербилирубинемия смешанного генеза чаще всего является ранним клиническим проявлением врожденной или перинатальной инфекции. Клиническая картина и лабораторные признаки являются составной частью симптомокомплекса TORCHES или сепсиса.
Стандартный план обследования новорожденного с подозрением на патологическую желтуху
-
Физикальный осмотр (степень распространенности желтухи, размеры печени и селезенки, цвет стула и мочи).
-
Группа крови и резус-фактор, в случае подозрения на ГБН - проба Кумбса.
-
Клинический анализ крови (гемоглобин, ретикулоциты, особенности лейкоцитарной формулы крови и др.).
-
Биохимический анализ крови (билирубин и его фракции, другое - по показаниям).
ЛЕЧЕНИЕ
Консервативное лечение
Лечебные мероприятия, направленные на уменьшение концентрации непрямого билирубина в сыворотке крови
Общие принципы
-
Создание оптимальных условий для ранней неонатальной адаптации ребенка.
-
Все здоровые и условно здоровые новорожденные нуждаются в проведении раннего (начиная с первого часа жизни) и регулярного грудного вскармливания (уровень доказательности B). Необходимо рекомендовать матери кормить грудью[1] как минимум 8-12 раз в сутки без ночного перерыва в течение первых нескольких дней жизни. Увеличение частоты кормления грудью снижает вероятность последующей тяжелой гипербилирубинемии у новорожденных при грудном вскармливании (уровень доказательности D).
-
Дополнительное введение воды либо растворов декстрозы (Глюкозы♠) новорожденным, находящимся на грудном вскармливании, при отсутствии признаков дегидратации не показано, так как не предупреждает развитие гипербилирубинемии и не снижает уровень ОБ в сыворотке.
-
В качестве крайней меры может рассматриваться временное (1-3 дня) прекращение грудного вскармливания и переход на кормление адаптированной смесью, что может способствовать снижению уровня билирубина и/или повышению эффективности ФТ в случае желтухи, обусловленной составом грудного молока (уровень доказательности D). В случаях медицинских противопоказаний к раннему прикладыванию к груди или избыточной убыли первоначальной массы тела к 3-4-му дню жизни новорожденным необходимо организовать докорм адаптированной питательной смесью.
-
Поддержание оптимальной температуры тела, обеспечение достаточным количеством жидкости и питательных веществ, профилактика гипогликемии, гипоксемии и ацидоза.
Фототерапия
Основным методом лечения непрямой гипербилирубинемии является ФТ. При неэффективности ФТ и угрозе развития БЭ показано проведение ОЗПК (уровень доказательности A).
Виды фототерапии
-
Традиционная - использование одного источника света - люминесцентной лампы голубого света.
-
LED ФТ - использование светодиодов, обеспечивает меньшие потери жидкости организмом.
-
Фиброоптическая ФТ - использование одного источника света с волоконно-оптическим кабелем, через который световой луч проходит на гибкую светящуюся поверхность, на которую помещается ребенок или может быть ею обернут. Может быть использована у недоношенных новорожденных, не требует защиты глаз.
-
Комбинированная ФТ - осуществляется с помощью двух источников света и более (две единицы и более или сочетание ламп обычной и фиброоптической ФТ). Показана для лечения как доношенных, так и недоношенных новорожденных при наличии хотя бы одного признака:
Проведение ФТ в непрерывном режиме (в течение суток, допустимы лишь перерывы на кормление и манипуляции не более 30 мин) более предпочтительно (уровень доказательности A).
Техника фототерапии при использовании установок с традиционными и LED-источниками света
-
Обнаженный ребенок помещается в кувез или в кроватку с термоматрасом (выбор режима зависит от ГВ ребенка, особенностей терморегуляции, при этом температура тела ребенка должна быть в пределах 36,6-37,0 °С).
-
Глаза ребенка и половые органы мальчиков должны быть защищены светонепроницаемым материалом.
-
Источник ФТ располагается над ребенком на высоте 50-55 см; если ребенок находится в кувезе, то расстояние от верхней стенки кувеза до лампы ФТ должно быть 5 см.
-
ФТ с помощью установок, не предназначенных для домашнего использования, должна проводиться в палатах для новорожденных под контролем среднего медицинского персонала.
-
Каждые 1-2 ч ФТ необходимо менять положение ребенка по отношению к источнику света, переворачивая его поочередно вверх животом или спиной.
-
При отсутствии противопоказаний необходимо сохранять кормление материнским молоком в полном объеме.
-
Физиологическая потребность ребенка в жидкости увеличивается на 10-20%, при невозможности увеличения объема питания проводится инфузионная терапия.
-
В процессе ФТ нельзя ориентироваться на цвет кожного покрова и показатели приборов для чрескожного измерения билирубина.
-
Всем детям, получающим ФТ, необходимо ежедневно проводить биохимический анализ крови на билирубин (при угрозе БЭ - каждые 6-12 ч); только результаты стандартного биохимического анализа крови могут служить критерием эффективности ФТ.
-
ФТ может быть прекращена, если отсутствуют признаки патологического прироста билирубина, а концентрация ОБ в сыворотке крови стала ниже значений, послуживших основанием для начала ФТ.
-
Через 12 ч после окончания ФТ необходимо контрольное исследование уровня билирубина в крови.
-
У некоторых детей в ответ на ФТ может появиться аллергическая сыпь, участиться и измениться цвет стула, появиться бронзовый оттенок кожи, которые бесследно исчезают после прекращения ФТ.
Показания к фототерапии и операции заменного переливания крови у доношенных новорожденных и недоношенных детей гестационного возраста 35 нед и более при непрямой гипербилирубинемии, не связанной с гемолитической болезнью плода и новорожденного
В раннем неонатальном периоде основываются на определении пороговых значений ОБ в сыворотке крови в зависимости от постнатального возраста в часах и наличия или отсутствия факторов риска. При быстром нарастании уровня билирубина и при критической гипербилирубинемии ФТ необходимо проводить в непрерывном режиме (уровень доказательности B). Во всех случаях наличия у ребенка факторов риска, повышающих вероятность развития БЭ, ФТ необходимо начинать при минимальных значениях билирубина. Показания, разработанные Американской академией педиатрии в 2004 г., представлены в приложениях 3 и 4 (уровень доказательности D).
Комментарии. Важно отметить, что показания к ФТ и ОЗПК (Американская академия педиатрии, 2004), определяют тактику ведения только детей ГВ 35 нед и более и ограничены ранним неонатальном периодом. В связи с недостаточностью объективных данных об условиях, при которых БЭ может возникнуть у новорожденных после окончания первой недели жизни, большинство экспертов РОН предлагают расширить действие этих рекомендаций до конца неонатального периода. Вместе с тем у доношенных детей с наследственными нарушениями обмена (например, с синдромом Криглера-Найяра), нуждающихся в длительном проведении ФТ, показания к ОЗПК должны определяться консилиумом специалистов с учетом патогенеза заболевания и индивидуальной реакции ЦНС ребенка на хроническую непрямую гипербилирубинемию (мнение экспертов РОН, уровень доказательности D).
Показания к фототерапии и операции заменного переливания крови у недоношенных детей гестационного возраста менее 35 нед при непрямой гипербилирубинемии, не связанной с гемолитической болезнью плода и новорожденного
Эксперты РОН для определения показаний к ФТ и ОЗПК у недоношенных, с учетом ГВ и дополнительных факторов риска, рекомендуют использовать модифицированные рекомендации Американской академии педиатрии, представленные в приложениях 5 и 6.
Вместе с тем, учитывая высокий риск осложнений ОЗПК у глубоко недоношенных детей, окончательное решение о проведении операции удетей, родившихся ранее 32-й недели гестации, должен принимать консилиум врачей-специалистов (мнение экспертов РОН, уровень доказательности D).
Эффективность при непрямой гипербилирубинемии, не связанной с ГБН, должна оцениваться каждые 12 ч после ее начала путем измерения концентрации ОБ в сыворотке крови стандартными лабораторными методами. В случае неэффективности ФТ осуществляется подготовка и проведение ОЗПК (уровень доказательности A). Показания к операции, разработанные Американской академией педиатрии в 2004 г., представлены в приложении 6 (уровень доказательности A).
При снижении концентрации ОБ на фоне проводимой ФТ лечение продолжается до момента, когда при плановом биохимическом исследовании билирубина его концентрация оказывается на 25% ниже значений, явившихся показанием к началу ФТ. Через 12 ч после завершения ФТ должно быть проведено контрольное исследование билирубина; продолжение ФТ при концентрациях билирубина ниже указанных в приложениях 3 и 5 является необоснованным и потенциально опасным.
Оперативное лечение
При неэффективности ФТ основным методом оперативного лечения гипербилирубинемии, угрожающей развитием БЭ, является ОЗПК.
Правила подготовки и проведения операции
-
Обязательно получение от родителей информированного согласия на проведение ОЗПК.
-
Дети не должны получать ЭП в течение последних 3 ч до предполагаемого начала операции.
-
В желудок перед операцией должен быть введен постоянный зонд, через который необходимо периодически удалять содержимое желудка.
-
В течение всего процесса подготовки к ОЗПК, выполнения операции и последующего ведения ребенка необходим постоянный мониторинг витальных функций (ЧCC, частоты дыхания, сатурации, артериального давления, температуры тела).
-
Донорская кровь и/или ее компоненты при ОЗПК переливают из расчета 150-170 мл/кг массы тела для доношенного ребенка и 170-180 мл/кг для недоношенного (пример расчета объема замещения представлен в приложении 7).
-
Соотношение эритроцитарной массы/взвеси и СЗП составляет 2:1.
-
Согласно Приказу Минздрава России от 2 апреля 2013 г. № 183н «Об утверждении правил клинического использования донорской крови и/ или ее компонентов», при трансфузии (переливании) донорской крови и/или эритроцитсодержащих компонентов новорожденным:
-
переливают эритроцитсодержащие компоненты, обедненные лейкоцитами (эритроцитарная взвесь, эритроцитарная масса, отмытые эритроциты, размороженные и отмытые эритроциты);
-
при подборе компонентов донорской крови для трансфузии (переливания) учитывается, что мать является нежелательным донором СЗП для новорожденного, поскольку плазма матери может содержать аллоиммунные антитела против эритроцитов новорожденного, а отец является нежелательным донором эритроцитсодержащих компонентов, поскольку против антигенов отца в крови новорожденного могут быть антитела, проникшие из кровотока матери через плаценту;
-
наиболее предпочтительной является трансфузия негативного по цитомегаловирусу эритроцитсодержащего компонента;
-
для ОЗПК используются эритроцитсодержащие компоненты со сроком хранения не более 5 дней с момента заготовки компонента;
-
подбор компонентов донорской крови осуществляется в соответствии с группой крови и резус-фактором реципиента.
-
-
Манипуляцию выполняют в ПИТН/ОРИТН (в акушерских отделениях медицинской организации I уровня оказания перинатальной помощи - в процедурном кабинете).
-
До начала операции у новорожденных, которые находятся в тяжелом состоянии, стандартными методами интенсивной терапии должны быть устранены ацидоз, гипоксемия, гипогликемия, электролитные нарушения, гемодинамические расстройства, гипотермия и т.д.
-
ОЗПК проводит бригада, состоящая как минимум из двух человек: врача (неонатолога/анестезиолога-реаниматолога/педиатра) и детской медицинской сестры.
-
Обязательно строгое соблюдение правил асептики и антисептики.
Техника проведения операции заменного переливания крови
-
Следует уложить ребенка в заранее согретую открытую реанимационную систему с сервоконтролем.
-
Зафиксировать конечности ребенка путем надежного пеленания, кожа живота остается открытой.
-
При строгом соблюдении правил асептики и антисептики установить и зафиксировать пупочный катетер с присоединенным к нему заранее тройником.
-
При наличии противопоказаний к катетеризации пупочной вены ОЗПК проводят через любую другую центральную вену.
-
Компоненты донорской крови предварительно необходимо согреть до температуры 36-37 °С.
-
Первую порцию выводимой крови необходимо отобрать для биохимического исследования на уровень билирубина.
-
Далее последовательно проводят постепенное выведение крови ребенка и последующее восполнение выведенного объема.
-
Объем одного замещения (однократного выведения крови) и одного восполнения (однократного введения компонентов крови) зависит от массы тела ребенка, ГВ и тяжести состояния ребенка (у доношенных - 10-20 мл/кг, у недоношенных - 5-10 мл/кг под обязательным контролем показателей гемодинамики, дыхания и функций почек).
-
После каждых 100 мл замещающей среды (эритроцитарной массы и плазмы) вводят 1-2 мл 10% раствора кальция глюконата или 0,5 мл 10% раствора хлористого кальция, предварительно разведенных в 5 мл 5% декстрозы (Глюкозы♠) (только между шприцами с эритроцитарной массой!).
-
Перед окончанием операции осуществляется забор крови на билирубин.
-
В результате операции (с учетом крови, взятой на биохимическое исследование) суммарный объем вводимых компонентов донорской крови должен быть равен суммарному объему выведенной крови ребенка.
NB! О безусловной эффективности ОЗПК свидетельствует более чем двукратное снижение концентрации билирубина в сыворотке крови ребенка к концу операции.
Ведение ребенка в послеоперационном периоде
-
ЭП после ОЗПК начинают с осторожностью, малыми порциями (дробно), под контролем кишечной перистальтики, с постепенным расширением объема кормления при условии удовлетворительной переносимости кормления.
-
Удаление пупочного катетера сразу после операции не рекомендуется в связи с вероятностью повторного проведения ОЗПК.
-
Контроль за уровнем билирубина выполняется через 12 ч после ОЗПК, далее по показаниям, но не реже 1 раза в 24 ч до 7 сут жизни.
-
Контроль за гликемией - через 1 ч после ОЗПК, далее по показаниям. Согласно Приказу Минздрава России № 183н, после окончаниятрансфузии (переливания) донорской крови и/или ее компонентов донорский контейнер с оставшейся донорской кровью и/или ее компонентами (5 мл), а также пробирка с кровью реципиента, использованная для проведения проб на индивидуальную совместимость, подлежат обязательному сохранению в течение 48 ч при температуре 2-6 °С в холодильном оборудовании.
Возможные осложнения операции заменного переливания крови
В процессе ОЗПК и в раннем постоперационном периоде возможно развитие следующих осложнений (уровень доказательности С).
Неэффективные и потенциально опасные методы лечения, которые следует исключить из клинической практики
-
Инфузионная терапия имеет ограниченные показания при гипербилирубинемии, если нет других показаний, так как уровень токсического непрямого жирорастворимого билирубина не может быть снижен введением дополнительных водных растворов. Дополнительная инфузия водного раствора 5-10% декстрозы (Глюкозы♠) новорожденным с гипербилирубинемией показана только при развитии эксикоза на фоне интенсивной ФТ, парентеральное введение жидкости определяется другими показаниями (рвота, патологическая потеря жидкости и др.) (мнение экспертов РОН, уровень доказательности D).
-
Включение в программу инфузионной терапии СЗП и альбумина человека при гипербилирубинемии не рекомендуется и не оправдано с позиции доказательной медицины. Данные препараты должны применяться по строгим показаниям (уровень доказательности B).
-
Назначение фенобарбитала. Значимая индукция ферментов печени происходит не ранее 3 дней от момента его применения, чаще к концу первой недели жизни. Кроме того, при лечении желтухи фенобарбиталом возникают нежелательные эффекты в виде вялости, угнетения дыхания и снижения активности сосания. По этим причинам в течение последних 15-20 лет фенобарбитал для лечения гипербилирубинемии в мире не применяется (уровень доказательности A).
-
Нет убедительных научных доказательств и патогенетического обоснования для лечения непрямой гипербилирубинемии гепатопротективными и желчегонными препаратами [такими как фосфолипиды (Эссенциале Н♠), каперсы колючей экстракт + кассии западной экстракт + паслена черного плодов экстракт + тамарикса двудомного плодов экстракт + терминалии чебулы плодов экстракт (Лив.52♠), артишока листьев экстракт (Хофитол♠) и др.]. Препараты урсодезоксихолевойкислоты показаны только при развитии синдрома холестаза (мнение экспертов РОН, уровень доказательности D).
ВЫПИСКА ИЗ СТАЦИОНАРА
Условия выписки из стационара доношенных новорожденных с непрямой гипербилирубинемией
Условия выписки доношенных новорожденных, получавших ФТ по поводу непрямой гипербилирубинемии, не связанной с ГБН:
-
концентрация билирубина в сыворотке крови менее той, которая требует лечения спустя 12 ч и более после окончания ФТ;
-
в случае ранней выписки необходимо ориентироваться на центильную кривую V.K. Bhutani и учитывать реальные возможности педиатрической службы региона обеспечить динамическое наблюдение за ребенком после выписки из стационара.
При выписке ребенка из отделения патологии новорожденных и недоношенных детей следует помнить, что непрямая гипербилирубинемия редко является единственным патологическим состоянием, определяющим длительность стационарного лечения. Сроки выписки ребенка зависят от результатов лечения основного и сопутствующих заболеваний.
Особенности наблюдения на амбулаторном этапе за новорожденным с гипербилирубинемией
Наиболее опасным периодом с точки зрения риска развития БЭ являются первые 7 дней жизни (уровень доказательности B), следовательно, тактика наблюдения и лечения ребенка не отличается от таковой в условиях стационара. У детей старше 7 дней жизни риск БЭ уменьшается, однако недостаточно объективных данных для изменения показаний к лечению в позднем неонатальном периоде (мнение экспертов РОН, уровень доказательности D).
Во всех случаях патологической желтухи, генез которой не уточнен, необходимо проведение дополнительного обследования.
Таким образом, поводом для госпитализации ребенка в отделение патологии новорожденных и недоношенных детей перинатального центра или детской больницы являются как необходимость дополнительного обследования, которое трудно организовать в условиях детской поликлиники, так и необходимость лечения патологической гипербилирубинемии.
СПИСОК ЛИТЕРАТУРЫ
-
Таболин В.А. Билирубиновый обмен у новорожденных. М.: Медицина, 1967.
-
Савельева Г.М., Коноплянников А.Г., Курцер М.А., Панина О.Б. Гемолитическая болезнь плода и новорожденного. М.: ГЭОТАР-Медиа, 2011.
-
Шабалов Н.П. Неонатология: учебное пособие: в 2 т. 5-е изд. М.: ГЭО-ТАР-Медиа, 2016.
-
Неонатология: национальное руководство. Краткая версия / под ред. Н.Н Володина. М.: ГЭОТАР-Медиа, 2013.
-
Сидельникова В.М., Антонов А.Г. Гемолитическая болезнь плода и новорожденного. М.: Триада-Х, 2004.
-
Практическое руководство по неонатологии / под ред. Г.В. Яцык. М.: Медицинское информационное агентство, 2008.
-
Дегтярева А.В., Дегтярев Д.Н. Современные принципы диагностики и лечения негемолитической гипербилирубинемии у доношенных и поздних недоношенных детей в раннем неонатальном периоде // Неонатология: новости, мнения, обучение. 2014. № 3 (5). С. 67-76.
-
Gomella T.L., Cunningham M.D. Neonatology: Management, Procedures, On Call Problems, Diseases, and Drugs. 7th ed. McGraw-Hill, 2013.
-
Bhutani V.K., Johnson L., Sivieri E.M. Predictive ability of a predischarge hour-specific serum bilirubin for subsequent significant hyperbilirubinemia in healthy-term and near-term newborns // Pediatrics. 1999. Vol. 103, N 1. P. 6-14.
-
Keren R., Tremont K., Luan X. et al. Visual assessment ofjaundice in term and late preterm infants // Arch. Dis. Child. Fetal Neonatal Ed. 2009. Vol. 94, N 5. F317-F322.
-
Volpe J.J. Bilirubin and brain injury // Neurology of the Newborn. 5th ed. Philadelphia, PA: W.B. Saunders, 2008. P. 619.
-
Wennberg R.P., Ahlfors C.E., Bhutani V. et al. Toward understanding ker-nicterus: a challenge to improve the management ofjaundiced newborns // Pediatrics. 2006. Vol. 117, N 2. P. 474-485.
-
Bellarosa C., Muchova L., Vitek L. et al. Bilirubin metabolism and transport // Care of the Jaundiced Neonate / eds D.K. Stevenson, M.J. Maisels, J.F. Watchko J.F. New York: McGraw-Hill, 2012. P. 55.
-
Hansen T.W.R., Bratlid D. Physiology of neonatal unconjugated hyperbilirubinemia // Care of the Jaundiced Neonate / eds D.K. Stevenson, M.J. Maisels, J.F. Watchko J.F. New York: McGraw-Hill, 2012. P. 65.
-
Kaplan M., Muraca M., Hammerman C. et al. Imbalance between production and conjugation of bilirubin: a fundamental concept in the mechanism of neonatal jaundice // Pediatrics. 2002. Vol. 110, N 4. P. e47.
-
Bhutani V.K., Stark A.R., Lazzeroni L.C. et al. Predischarge screening for severe neonatal hyperbilirubinemia identifies infants who need phototherapy // J. Pediatr. 1999. Vol. 162, N 3. P. 477-482.
-
Maisels M.J., Newman Т.В. The epidemiology of neonatal hyperbilirubinemia // Care of the Jaundiced Neonate / eds D.K. Stevenson, M.J. Maisels, J.F. Watchko J.F. New York: McGraw-Hill, 2012. P. 97.
-
Watchko J.F., Lin Z. Genetics of neonatal jaundice // Care of the Jaundiced Neonate / eds D.K. Stevenson, M.J. Maisels, J.F. Watchko J.F. New York: McGraw-Hill, 2012. P. 1.
-
Newman Т.В., Liljestrand P., Escobar G.J. Jaundice noted in the first 24 hours after birth in a managed care organization // Arch. Pediatr. Adolesc. Med. 2002. Vol. 156, N 12. P. 1244-1250.
-
Maisels M.J., DeRidder J.M., Kring E.A. et al. Routine transcutaneous bili-rubin measurements combined with clinical risk factors improve the prediction of subsequent hyperbilirubinemia // J. Perinatol. 2009. Vol. 29, N 9. P. 612-617.
-
Keren R., Luan X., Friedman S. et al. A comparison of alternative risk-assessment strategies for predicting significant neonatal hyperbilirubinemia in term and near-term infants // Pediatrics. 2008. Vol. 121, N 1. P. e170-179.
-
Bertini G., Dani C., Trochin M. et al. Is breastfeeding really favoring early neonatal jaundice? // Pediatrics. 2001. Vol. 107, N 3. P. E41.
-
Garcia F.J., Nager A.L. Jaundice as an early diagnostic sign of urinary tract infection in infancy // Pediatrics. 2002. Vol. 109. P. 846-851.
-
Maisels M.J., Newman Т.В. Neonatal jaundice and urinary tract infections // Pediatrics. 2003. Vol. 112. P. 1213-1214.
-
Bender G.J., Cashore W.J., Oh W. Ontogeny of bilirubin-binding capacity and the effect of clinical status in premature infants born at less than 1300 grams // Pediatrics. 2007. Vol. 120. P. 1067-1073.
-
Ross M.E., Waldron P.E., Cashore W.J. et al. Hemolytic disease of the fetus and newborn // Neonatal Hematology, Pathogenesis, Diagnosis, and Management of Hematologic Problems. 2nd ed. / eds P.A. de Alarcon, E.J. Werner, R.D. Chris-tensen. Cambridge, UK: Cambridge University Press, 2013. P. 65.
-
Maisels M.J., Newman Т.В. Bilirubin and neurological dysfunction - do we need to change what we are doing? // Pediatr. Res. 2001. Vol. 50, N 6. P. 677.
-
Heimler R., Sasidharan P. Neurodevelopmental and audiological outcome of healthy term newborns with moderately severe non-haemolytic hyperbilirubinemia // J. Paediatr. Child Health. 2010. Vol. 46. P. 588-591.
-
Watchko J.F., Tiribelli C. Bilirubin-induced neurologic damage - mechanisms and management approaches // N. Engl. J. Med. 2013. Vol. 369, N 21. P. 2021-2030.
-
Okumura A., Kidokoro H., Shoji H. et al. Kernicterus in preterm infants // Pediatrics. 2009. Vol. 123. P. e1052-e1058.
-
Huang M.-J., Kua K.-E., Teng H.-C. et al. Risk factors for severe hyperbilirubinemia in neonates // Pediatr. Res. 2004. Vol. 56. P. 682-689.
-
Watchko J.F., Maisels M.J. Jaundice in low birth weight infants - pathobiology and outcome // Arch. Dis. Child. Fetal Neonatal Ed. 2003. Vol. 88. P. F455-F458.
-
Morris B.H., Oh W., Tyson J.E. et al. Aggressive vs. conservative phototherapy for infants with extremely low birth weight // N. Engl. J. Med. 2008. Vol. 359. P. 1885-1896.
-
Wagle S., Deshpande P.G., Itani O., Windle M.L. et al. Hemolytic Disease of Newborn. Updated: Sep 26. 2014. URL: http://emedicine.medscape.com/article/974349.
-
Amin S.B., Charafeddine L., Guillet R. Transient bilirubin encephalopathy and apnea of prematurity in 28 to 32 weeks gestational age infants // J. Perinatol. 2005. Vol. 25. P. 386-390.
-
Shapiro S.M. Kernicterus // Care of the Jaundiced Neonate / eds D.K. Stevenson, M.J. Maisels, J.F. Watchko. New York: McGraw-Hill, 2012. P. 229-242.
-
Shapiro S.M. Chronic bilirubin encephalopathy: diagnosis and outcome // Semin. Fetal Neonatal Med. 2010. Vol. 15. P. 157-163.
-
Ip S., Glicken S., Kulig J. et al. Management of Neonatal Hyperbilirubinemia. Rockville, MD: U.S. Department of Health and Human Services, Agency for Healthcare Research and Quality. AHRQ Publication, 2003.
-
Maisels M.J., Clune S., Coleman K. et al. The natural history ofjaundice in predominantly breast-fed infants // Pediatrics. 2014. Vol. 134, N 2. P. E340-e345. doi: 10.1542/peds.2013-4299.
-
Davis A.R., Rosenthal P., Escobar G. et al. Interpreting conjugated bilirubin levels in newborns // J. Pediatr. 2011. Vol. 158. P. 562-565.
-
Maisels M.J., Baltz R.D., Bhutani V. et al. Management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation // Pediatrics. 2004. Vol. 114. P. 297-316.
-
Kramer L.I. Advancement of dermal icterus in the jaundiced newborn // Am. J. Dis. Child. 1969. Vol. 118. P. 454-458.
-
Maisels M.J., Bhutani V.K., Bogen D. et al. Hyperbilirubinemia in the newborn infant >35 weeks' gestation: an update with clarifications // Pediatrics. 2009. Vol. 124, N 4. P. 1193-1198.
-
Jaundice in Newborn Babies under 28 Days. Neonatal Jaundice. National Institute for Health and Clinical Excellence, 2010.
-
Bhutani V.K., Stark A.R. et al. Predischarge Screening for Severe Neonatal Hyperbilirubinemia Identifies Infants Who Need Phototherapy. Department of Neonatal and Developmental Medicine, Lucile Packard Children’s Hospital, Department of Pediatrics, Stanford University. Stanford, 2012.
-
DeLuca D., Engle W., Jackson G. Transcutaneous bilirubinometry: hepatol-ogy research and clinical developments. New York: Nova Biomedical, 2013.
-
Schumacher R. Transcutaneous bilirrubinometry and diagnostic tests: «The right job for the tool» // Pediatrics. 2002. Vol. 110. P. 407-408.
-
Maisels M.J., Newman Т.В. Prevention, screening, and postnatal management of neonatal hyperbilirubinemia // Care of the Jaundiced Neonate / eds D.K. Stevenson, M.J. Maisels, J.F. Watchko. New York: McGraw-Hill, 2012. P. 175.
-
Wainer S., Rabi Y., Parmar S.M. et al. Impact of skin tone on the performance of a transcutaneous jaundice meter // Acta Paediatr. 2009. Vol. 98. P. 1909.
-
Nagar G., Vandermeer B., Campbell S. et al. Reliability of transcutaneous bilirubin devices in preterm infants: a systematic review // Pediatrics. 2013. Vol. 132. P. 871-881.
-
De Luca D., Jackson G.L., Tridente A. et al. Trans cutaneous bilirubin nomograms: a systematic review of population differences and analysis of bilirubin kinetics // Arch. Pediatr. Adolesc. Med. 2009. Vol. 163, N 11. P. 1054-1059.
-
Poland R.L., Hartenberger C., McHenry H. et al. Comparison of skin sites for estimating serum total bilirubin in in-patients and out-patients: chest is superior to brow // J. Perinatol. 2004. Vol. 24. P. 541.
-
Yaser A., Tooke L., Rhoda N. Interscapular site for transcutaneous bilirubin measurement in preterm infants: a better and safer screening site // J. Perinatol. 2014. Vol. 34. P. 209.
-
Maisels M.J., Kring E. Transcutaneous bilirubin levels in the first 96 hours in a normal newborn population of 35 or more weeks' of gestation // Pediatrics. 2006. Vol. 117. P. 1169.
-
Tan K.L., Dong F. Transcutaneous bilirubinometry during and after phototherapy // Acta Paediatr. 2003. Vol. 92. P. 327.
-
Brumbaugh J.E., Gourley G.R. Bilirubin and its various fractions // Care of the Jaundiced Neonate / eds D.K. Stevenson, M.J. Maisels, J.F. Watchko. New York: McGraw-Hill, 2012. P. 41.
-
Glader B., Allen G.A. Neonatal hemolysis // Neonatal Hematology, Pathogenesis, Diagnosis, and Management of Hematologic Problems. 2nd ed. / eds P.A. de Alarcon, E.J. Werner, R.D. Christensen. Cambridge, UK: Cambridge University Press, 2013. P. 91.
-
Stevenson D.K., Fanaroff A.A., Maisels M.J. et al. Prediction of hyperbili-rubinemia in near-term and term infants // Pediatrics. 2001. Vol. 108. P. 31-39.
-
Mehta S., Kumar P., Narang A. A randomized controlled trial of fluid supplementation in term neonates with severe hyperbilirubinemia // J. Pediatr. 2005. Vol. 147. P. 781-785.
-
Boo N.Y., Lee H-T. Randomized controlled trial of oral versus intravenous fluid supplementation on serum bilirubin level during phototherapy of term infants with severe hyperbilirubinemia // J. Paediatr. Child Health. 2002. Vol. 38. P. 151-155.
-
Maisels M.J., McDonagh A.F. Phototherapy for neonatal jaundice // N. Engl. J. Med. 2008. Vol. 358. P. 920-928.
-
Maisels M.J., Newman Т.В. Phototherapy and other treatments // Care of the Jaundiced Neonate / eds D.K. Stevenson, M.J. Maisels, J.F. Watchko. New York: McGraw-Hill, 2012. P. 195.
-
Newman Т.В., Liljestrand P., Jeremy R.J. et al. Outcomes among newborns with total serum bilirubin levels of 25 mg per deciliter or more // N. Engl. J. Med. 2006. Vol. 354. P. 1889-1900.
-
Bhutani V.K. Committee on Fetus and Newborn. Technical report: phototherapy to prevent severe neonatal hyperbilirubinemia in the newborn infant 35 or more weeks of gestation // Pediatrics. 2011. Vol. 128. P. e1046.
-
Maisels M.J., Kring E.A., DeRidder J. Randomized controlled trial of light-emitting diode phototherapy // J. Perinatol. 2007. Vol. 27. P. 565-567.
-
Maisels M.J., Watchko J.F., Bhutani V.K. et al. An approach to the management of hyperbilirubinemia in the preterm infant less than 35 weeks of gestation // J. Perinatol. 2012. Vol. 32. P. 660.
-
Clinical Practice Guideline. Management of hyperbilirubinemia in the newborn infant >35 weeks of gestation // Pediatrics. 2004. Vol. 114. P. 297-316.
-
Ip S., Chung M., Kulig J. et al. An evidence-based review of important issues concerning neonatal hyperbilirubinemia // Pediatrics. 2004. Vol. 114. P. e130-e153.
-
Barrington K.J., Sankaran K. Canadian Paediatric Society Fetus and Newborn Committee. Guidelines for the detection, management and prevention of hyperbilirubinemia in term and late preterm newborn infants // Paediatr. Child Health. 2007. Vol. 12, suppl. B. P. 1B-12B.
ПРИЛОЖЕНИЯ
Приложение 1. Клиническая оценка распространенности желтухи у новорожденных по Крамеру (Kramer L.I., 1969)

| Зоны по Крамеру | Предполагаемый уровень билирубина, мкмоль/л |
|---|---|
1-я |
31,5-136 |
2-я |
93,5-204 |
3-я |
136-280 |
4-я |
187-306 |
5-я |
>255 |
Приложение 2. Процентильные кривые уровня билирубина в крови, измеренного чрескожным методом у доношенных и недоношенных детей гестационного возраста 35-37 нед (Bhutani V.K. et al., 1999)
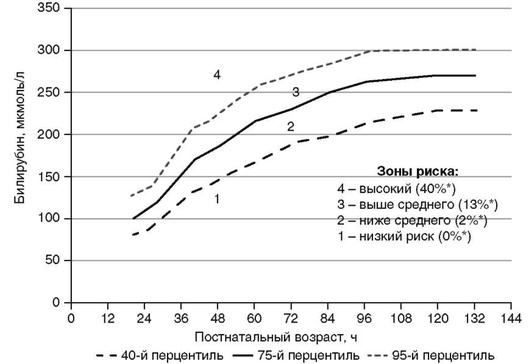
* Вероятность отсроченного развития клинически значимой гипербилирубинемии.
Приложение 3. Показания к фототерапии у доношенных и недоношенных детей гестационного возраста 35 нед и более в раннем неонатальном периоде

Приложение 4. Показания к операции обменного переливания крови у доношенных и недоношенных детей гестационного возраста 35 нед и более в раннем неонатальном периоде

Приложение 5. Показания к фототерапии в раннем неонатальном периоде у недоношенных детей разного гестационного возраста
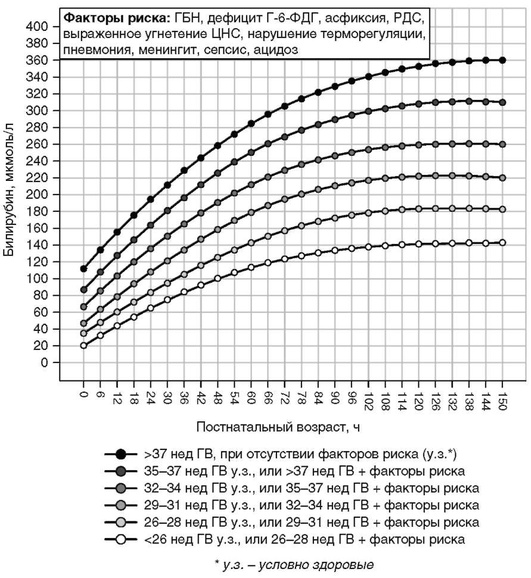
Приложение 6. Показания к операции обменного переливания крови в раннем неонатальном периоде у недоношенных детей разного гестационного возраста
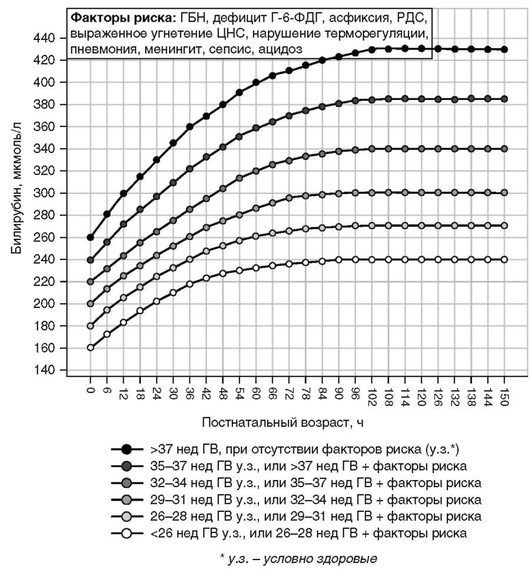
Приложение 7. Пример расчета объема компонентов крови для операции заменного переливания крови
-
Масса тела ребенка - 3000 г = 3 кг[2].
Приложение 8. Операция заменного переливания крови/частичной обменной трансфузии[3]
Ф.И.О. ребенка_Дата рождения «_»_20_г. № истории_
Дата выполнения процедуры «_»_20_г. Врач_М/с_
Показания к проведению ОЗПК/ЧОТ_.
Согласие матери на проведение ОЗПК/ЧОТ получено.
Порядок проведения ОЗПК/ЧОТ.
-
общий объем ОЗПК = 2 ОЦК (1 ОЦК = 80 - 90 мл/кг). Расчет для ребенка = (80 - 90 × массу ребенка × 2).
-
Объем ЧОТ = ОЦК (80 - 90 мл/кг) масса тела, кг (Нt ребенка - Ht желаемый):Ht ребенка. Расчет для ребенка =мл ×_г × (-) :=_мл.
-
Для ОЗПК решено использовать эритроцитарную массу ( ) группы,Rh( )_и СЗП( ) группы, Rh( )_в соотношении 2:1, дляребенка взято количество эритроцитарной массы_мл, СЗП_мл.
-
В_ч_мин после проверки группы крови и резус-фактора больногои донора двумя сериями стандартных сывороток, после проведения пробы на совместимость крови донора и больного по группе АВ0 и резус-фактору, после проведения биологической пробы сделан вывод о том, что кровь совместима.
-
Способ введения и выведения сред: внутривенно дробно медленно путемвыведения_мл крови ребенка и выведения_мл эритроцитарноймассы/СЗП/физиологического раствора.
-
ОЗПК/ЧОТ начато «_»_20_г. в_ч_мин, закончено «_»_20_г. в_ч_мин.
-
Патологических реакций во время ОЗПК/ЧОТ не отмечено/отмечено_.
Подпись врача, проводившего ОЗПК/ЧОТ_.
Подпись ассистента (врач, медицинская сестра)_.
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ НОВОРОЖДЕННЫХ
Согласовано и утверждено Российским обществом неонатологов, Российской ассоциацией специалистов перинатальной медицины. Одобрено Союзом педиатров России
Авторы: Балашова Е.Н., Бабак О.А., Володин Н.Н., Грошева Е.В., Дегтярев Д.Н., Жиркова Ю.В., Ионов О.В., Карпова А.Л., Киртбая А.Р., Крючко Д.С., Кучеров Ю.И., Ленюшкина А.А., Макарова О.Ю., Монахова О.А., Мостовой А.В., Нароган М.В., Пруткин М.Е. (модератор рабочей группы), Рюмина И.И., Сапун О.И., Чубарова А.И. (модератор рабочей группы), Штатнов М.К.
ВВЕДЕНИЕ
Широкие популяционные исследования последних лет доказывают, что здоровье населения в разные возрастные периоды существенным образом зависит от нутритивной обеспеченности и скорости роста поколения во внутриутробном и раннем постнатальном периоде. Риск развития таких распространенных заболеваний, как гипертония, ожирение, сахарный диабет 2-го типа, остеопороз, повышается при наличии нутритивной недостаточности в перинатальном периоде. Интеллектуальное и психическое здоровье также имеют прямую зависимость от состояния питания в этот период развития индивидуума.
Современное развитие неонатологии позволяет обеспечить выживание большинства детей, родившихся недоношенными. Наиболее актуально в настоящее время стоит задача снижения инвалидизации и улучшения состояния здоровья недоношенных детей. Сбалансированное и правильно организованное питание является одной из важнейших составляющих выхаживания недоношенных детей, определяющих не только ближайший, но и отдаленный прогноз.
Термин «сбалансированное и правильно организованное питание» означает, что назначение каждого из компонентов питания должно основываться на потребностях ребенка в данном ингредиенте. Соотношение ингредиентов питания должно способствовать формированию правильного метаболизма, а также удовлетворению особых потребностей при некоторых заболеваниях перинатального периода. Технология назначения питания должна быть оптимальной для его полноценного усвоения.
Представленный протокол отвечает следующим целям.
Парентеральным (от греч. рara - «около» и enteron - «кишка») питанием называется такой вид нутритивной поддержки, при котором питательные вещества вводятся в организм, минуя ЖКТ. ПП может быть полным, когда оно полностью компенсирует потребность в питательных веществах и энергии, или частичным, когда часть потребности в питательных веществах и энергии компенсируется за счет ЖКТ.
ПОКАЗАНИЯ
ПП (полное или частичное) показано новорожденным, если ЭП невозможно или недостаточно (не покрывает 90% потребности в питательных веществах).
ПРОТИВОПОКАЗАНИЯ
ПП не проводится на фоне реанимационных мероприятий и начинается сразу после стабилизации состояния на фоне подобранной терапии. Хирургические операции, ИВЛ и потребность в инотропной поддержке не являются противопоказанием к ПП.
Жидкость
Оценка объема жидкости, который требуется новорожденному, - чрезвычайно важный параметр при назначении ПП. Особенности гомеостаза жидкости у новорожденных определяются перераспределением между межклеточным пространством и сосудистым руслом, которое происходит в первые несколько дней жизни, а также возможными потерями через незрелую кожу у детей с ЭНМТ.
Потребность в воде с нутритивными целями определяется необходимостью следующих процессов.
Помимо обеспечения питанием, жидкость может потребоваться также для восполнения объема циркулирующей крови (ОЦК) при шоке.
Постнатальный период в зависимости от изменений водно-электролитного обмена можно разделить на три периода: период транзиторной убыли массы тела, период стабилизации массы и период стабильного нарастания массы тела.
В транзиторный период происходит убыль массы тела за счет потерь воды. Величину убыли массы тела желательно минимизировать у недоношенных путем предотвращения испарения жидкости, но она не должна быть менее 2% массы при рождении.
В период транзиторной убыли массы тела концентрация натрия в экстрацеллюлярной жидкости возрастает. Ограничение натрия в этот период понижает риск некоторых заболеваний у новорожденных, но гипонатриемия (менее 125 ммоль/л) недопустима в связи с риском повреждения мозга. Потери натрия с калом у здоровых доношенных детей оцениваются как 0,02 ммоль/кг в сутки. Назначение жидкости целесообразно в количестве, позволяющем удерживать концентрацию натрия в сыворотке крови ниже 150 ммоль/л.
Обмен воды и электролитов в транзиторный период у недоношенных новорожденных, по сравнению с доношенными, характеризуется: 1) высокими потерями экстрацеллюлярной воды и повышением концентрации электролитов плазмы в связи с испарением с кожи; 2) меньшей стимуляцией спонтанного диуреза; 3) низкой толерантностью к колебаниям ОЦК и осмолярности плазмы.
Период стабилизации массы характеризуется сохранением сниженного объема экстрацеллюлярной жидкости и солей, но дальнейшие потери массы тела прекращаются. Диурез остается сниженным до уровня 1-2 мл/кг в час и менее, фракционная экскреция натрия составляет 1-3% количества в фильтрате. В этот период снижаются потери жидкости с испарением, поэтому не требуется значительного увеличения объема вводимой жидкости, становится необходимым восполнение потери электролитов, экскреция которых почками уже увеличивается. Увеличение массы тела по отношению к массе при рождении в этот период не является приоритетной задачей при условии правильного парентерального и энтерального питания.
Период стабильного нарастания массы у доношенных новорожденных начинается обычно после 7-10-го дня жизни. На первое место при назначении нутритивной поддержки выходят задачи обеспечения физического развития. Здоровый доношенный ребенок прибавляет в среднем 7-8 г/кг в сутки (максимум до 14 г/кг в сутки). Скорость роста недоношенного ребенка должна соответствовать скорости роста плода внутриутробно - от 21 г/кг у детей с ЭНМТ до 14 г/кг у детей с массой 1800 г и более.
Функции почек в этот период еще снижены, поэтому для введения достаточного для роста количества пищевых веществ требуются дополнительные количества жидкости. Высокоосмолярные продукты в качестве питания вводить нельзя. Концентрация натрия в плазме остается постоянной при поступлении натрия извне в количестве 1,1-3,0 ммоль/ кг в сутки. Скорость роста существенно не зависит от поступления натрия при обеспечении жидкостью в количестве 140-170 мл/кг в сутки.
Объем жидкости в составе ПП рассчитывается с учетом:
Уровень натрия должен поддерживаться на уровне 135-145 ммоль/л.
У детей с ОНМТ и ЭНМТ увеличение уровня натрия часто свидетельствует о дегидратации. В этой ситуации следует увеличить объем жидкости, не исключая препаратов, содержащих натрий, так как для детей с ЭНМТ характерен синдром поздней гипонатриемии, связанный с нарушением почечной функции и повышенным потреблением натрия на фоне ускоренного роста. Снижение уровня натрия может являться сигналом о гипергидратации.
Объем жидкости у новорожденных должен рассчитываться таким образом, чтобы суточная потеря массы не превышала 4%, а потеря массы за первые 7 дней жизни не превышала 10% у доношенных и 15% у недоношенных.
Ориентировочные объемы вводимой жидкости представлены в табл. 1.
Таблица 1. Ориентировочные потребности в жидкости у новорожденных
Масса тела, г |
Суточный объем жидкости в зависимости от возраста, мл/кг в сутки |
|||
<24 ч |
24-48 ч |
48-72 ч |
>72 ч |
|
<750 |
90-110 |
110-150 |
120-150 |
130-190 |
750-999 |
90-100 |
110-120 |
120-140 |
140-190 |
1000-1499 |
80-100 |
100-120 |
120-130 |
140-180 |
1500-2500 |
70-80 |
80-110 |
100-130 |
110-160 |
>2500 |
60-70 |
70-80 |
90-100 |
110-160 |
Энергия
Следует стремиться к полному покрытию всех компонентов потребляемой энергии с помощью парентерального питания и ЭП. Только в случае наличия показаний к полному ПП все потребности необходимо обеспечивать парентеральным путем. В остальных случаях парентерально должно вводиться лишь то количество энергии, которое недополучено энтеральным путем.
Наиболее высокая скорость роста характерна для наименее зрелых детей, поэтому необходимо как можно раньше обеспечить ребенка энергией для роста. В транзиторный период предпринимают усилия для минимизации потерь энергии (выхаживание в условиях термонейтральной зоны, ограничение испарения с кожи, охранительный режим). Как можно быстрее (1-3 сут жизни) обеспечивают поступление энергии, равной обмену покоя - 45-60 ккал/кг. Увеличивают калорийность ПП ежедневно на 10-15 ккал/кг в целях достижения калорийности 105 ккал/кг к 7-10-м суткам жизни. При частичном ПП теми же темпами увеличивают суммарное поступление энергии в целях достижения калорийности 120 ккал/кг к 7-10-м суткам жизни. Отменяют ПП, только когда калорийность ЭП достигнет не менее 100 ккал/кг. После отмены ПП продолжают контроль за антропометрическими показателями, проводят коррекцию питания.
При невозможности достижения оптимального физического развития при исключительно ЭП - продолжают ПП. Примерный расход энергии у недоношенных новорожденных представлен в табл. 2.
Таблица 2. Компоненты энергетического обмена у недоношенных новорожденных
| Критерий | Примерный расход, ккал/кг в сутки |
|---|---|
Основной обмен |
40-60 |
Двигательная активность |
5-10 |
Поддержание температуры тела |
0-8 |
Синтез новых тканей |
17 |
Запасаемая энергия (в зависимости от композиции тканей) |
60-80 |
Экскретируемая энергия (учитывается при значимой доле ЭП) |
6-8% общего поступления |
Жиры являются более энергоемким субстратом, чем углеводы. Белки у недоношенных детей также частично могут использоваться организмом для получения энергии. Избыток небелковых калорий, вне зависимости от источника, используется для синтеза жиров.
Белки
Современные исследования показывают, что белки являются не только важным источником пластического материала для синтеза новых белков, но и энергетическим субстратом, особенно у детей с ЭНМТ и ОНМТ. Около 30% поступающих аминокислот может использоваться для целей синтеза энергии. Приоритетной же задачей является обеспечение синтеза новых белков в организме ребенка. При недостаточной обеспеченности небелковыми калориями (углеводами, жирами) доля белка, используемого для синтеза энергии, увеличивается, а на пластические цели используется меньшая доля, что нежелательно. Дотация аминокислот в дозе 3 г/кг в сутки в течение первых 24 ч после рождения у детей с ОНМТ и ЭНМТ является безопасной и связана с лучшей прибавкой массы тела (уровень доказательности А).
Препараты альбумина человека, СЗП и другие компоненты крови не являются препаратами для ПП. При назначении ПП их не следует принимать в расчет в качестве источника белка.
В случае использования препаратов, предназначенных для введения новорожденному, метаболический ацидоз является крайне редким осложнением применения аминокислот у новорожденных. Метаболический ацидоз не является противопоказанием к применению аминокислот. Необходимо помнить, что метаболический ацидоз в большинстве случаев является проявлением другого заболевания, не имея отношения к дотации белка.
ПОТРЕБНОСТЬ В БЕЛКАХ
Потребность в белке определяется количеством белка исходя из количества, необходимого на синтез и ресинтез белка в организме (запасаемый белок), идущего на окисление как источник энергии и количества экскретируемого белка.
Оптимальное количество белка или аминокислот в питании определяется ГВ ребенка, так как композиционный состав тела меняется по мере роста плода. У наименее зрелых плодов в норме скорость синтеза белка выше, чем у более зрелых, большую долю во вновь синтезированных тканях занимает белок. Именно поэтому чем меньше ГВ, тем больше потребность в белке. Оптимальное соотношение белка и небелковых калорий в питании плавно меняется от 4 г и более/100 ккал у наименее зрелых недоношенных до 2,5 г/100 ккал у более зрелых. Это позволяет моделировать композицию массы тела, характерную для здорового плода.
ТАКТИКА ДОТАЦИИ БЕЛКОВ
Стартовые дозы, темп увеличения и целевой уровень дотации белка в зависимости от ГВ указаны в приложении 1.
У детей с массой тела при рождении менее 1500 г дотация парентерального белка должна оставаться неизменной до достижения объема ЭП 50 мл/кг в сутки.
1,2 г аминокислот из растворов для ПП эквивалентно примерно 1 г белка. Для рутинного расчета принято округлять это значение до 1 г.
Обмен аминокислот у новорожденных имеет ряд особенностей, поэтому для безопасного ПП следует использовать препараты белка, разработанные с учетом особенностей обмена аминокислот у новорожденных и разрешенные с рождения (приложение 2). Препараты для ПП взрослых не должны применяться у новорожденных.
Дотация аминокислот может осуществляться как через периферическую вену, так и через центральный венозный катетер.
КОНТРОЛЬ ЗА БЕЗОПАСНОСТЬЮ И ЭФФЕКТИВНОСТЬЮ ДОТАЦИИ БЕЛКА
На сегодняшний день не разработано эффективных тестов, позволяющих контролировать достаточность и безопасность парентерального введения белка. Оптимально использовать для этой цели показатель азотистого баланса, однако в практической медицине для интегральной оценки состояния белкового обмена используется мочевина.
Контроль за уровнем мочевины информативен в отношении безопасности применения аминокислот начиная со 2-й недели жизни. Исследование следует проводить с периодичностью 1 раз в 7-10 дней. При этом низкий уровень мочевины (менее 1,8 ммоль/л) будет свидетельствовать о недостаточной обеспеченности белком. Повышение уровня мочевины не может однозначно трактоваться как маркер чрезмерной белковой нагрузки. Мочевина может повышаться также вследствие почечной недостаточности (тогда будет также повышаться уровень креатинина) и быть маркером повышенного катаболизма белка при недостатке энергетических субстратов или самого белка.
Жиры
Биологическая роль липидов:
ПОТРЕБНОСТЬ В ЖИРАХ
Стартовые дозы, темп увеличения и целевой уровень дотации жиров в зависимости от ГВ указаны в приложении 1.
В случае если необходимо ограничить потребление жиров, не следует уменьшать дозу ниже 0,5-1,0 г/кг в сутки, так как именно эта доза позволяет предотвратить дефицит эссенциальных жирных кислот.
Современные исследования указывают на преимущества использования в ПП жировых эмульсий, содержащих четыре вида масел(оливковое масло, соевое масло, рыбий жир, среднецепочечные триглицериды), которые являются не только источником энергии, но и источником незаменимых жирных кислот, в том числе ω-3 жирных кислот. В частности, использование таких эмульсий снижает риск развития холестаза.
ТАКТИКА ДОТАЦИИ ЖИРОВ
-
Наименьшее число осложнений вызывает применение 20% жировой эмульсии. Жировые эмульсии, разрешенные для применения в неонатологии, приведены в приложении 2.
-
Инфузия жировой эмульсии должна проводиться равномерно с постоянной скоростью в течение суток.
-
Дотация жировых эмульсий должна осуществляться преимущественно через периферическую вену.
-
Если инфузия жировой эмульсии проводится в общий венозный доступ, следует соединять инфузионные линии максимально близко к коннектору катетера, при этом необходимо использовать фильтр для жировой эмульсии.
-
Системы, через которые проводится инфузия жировой эмульсии, и шприц с эмульсией необходимо защищать от света.
-
Максимально допустимая доза при полном ПП не должна превышать 3 г/кг в сутки.
-
Тактика назначения жировых эмульсий представлена в приложении 1.
КОНТРОЛЬ ЗА БЕЗОПАСНОСТЬЮ И ЭФФЕКТИВНОСТЬЮ ДОТАЦИИ ЖИРОВ
Контроль за безопасностью вводимого количества жиров проводится на основании контроля за концентрацией триглицеридов в плазме крови через сутки после изменения скорости введения. При невозможности контролировать уровень триглицеридов следует проводить тест прозрачности сыворотки. При этом за 2-4 ч до анализа необходимо приостановить введение жировых эмульсий.
В норме уровень триглицеридов не должен превышать 2,26 ммоль/л (200 мг/дл), хотя, по данным рабочей группы по ПП Германии (GerMedSci, 2009), уровень триглицеридов в плазме не должен превышать 2,8 ммоль/л. Некоторые препараты (например, амфотерицин В и стероиды) приводят к повышенной концентрации триглицеридов.
Если уровень триглицеридов выше допустимого, следует уменьшить дотацию жировой эмульсии на 0,5 г/кг в сутки (табл. 3).
Побочные эффекты и осложнения внутривенного введения липидов, в том числе гипергликемия, возникают чаще при скорости введения, превышающей 0,15 г/кг в час.
Таблица 3. Ограничения для введения жировых эмульсий
Персистирующая легочная гипертензия |
Дотация жировых эмульсий не должна превышать 2 г/кг в сутки |
Гипербилирубинемия |
Раннее введение липидов клинически значимо не увеличивает уровень гипербилирубинемии. Инфузия жировых эмульсий должна быть отменена при тяжелой гипербилирубинемии, требующей операции замен-ного переливания крови |
Сепсис |
Существует недостаточно доказательств для того, чтобы рекомендовать изменение дотации жировых эмульсий при сепсисе |
Идиопатическая тромбоцитопения |
Требуется регулярное исследование сывороточной концентрации триглицеридов и коррекция дозы по результатам исследования |
Углеводы
Углеводы - основной источник энергии и обязательный компонент ПП независимо от срока гестации и массы тела при рождении.
У взрослых эндогенная продукция глюкозы начинается при уровне поступления глюкозы ниже 3,2 мг/кг в минуту, у доношенных новорожденных - ниже 5,5 мг/кг в минуту (по некоторым данным, 7,2 г/кг в сутки), у недоношенных новорожденных - при скорости поступления глюкозы (энтерально и парентерально) менее 7,5-8,0 мг/кг в минуту (44 ммоль/кг в минуту, или 11,5 г/кг в сутки). Базовая продукция глюкозы без экзогенного введения примерно равна у доношенных и недоношенных и составляет 3,0-5,5 мг/кг в минуту через 3-6 ч после кормления. У доношенных новорожденных базовая продукция глюкозы покрывает 60-100% потребностей, тогда как у недоношенных детей - только 40-70%. Это означает, что без экзогенного введения у недоношенных детей будут происходить быстрое истощение небольших запасов гликогена и распад собственных белков и жира. Соответственно, минимально необходимой является скорость поступления глюкозы, позволяющая минимизировать ее эндогенную продукцию.
ПОТРЕБНОСТЬ В УГЛЕВОДАХ
Потребность новорожденного в углеводах рассчитывается на основе потребности в калориях и скорости утилизации глюкозы. В случае переносимости углеводной нагрузки (уровень глюкозы в крови не более 8 ммоль/л) ее следует увеличивать ежедневно на 0,5-1,0 мг/кг в минуту, но не более 12 мг/кг в минуту.
ТАКТИКА ДОТАЦИИ УГЛЕВОДОВ
Один грамм глюкозы содержит 3,4 кал.
Тактика назначения представлена в приложении 1.
КОНТРОЛЬ ЗА БЕЗОПАСНОСТЬЮ И ЭФФЕКТИВНОСТЬЮ ДОТАЦИИ УГЛЕВОДОВ
Контроль за безопасностью и эффективностью дотации декстрозы (Глюкозы♠) осуществляется путем мониторирования уровня глюкозы в крови. Если уровень глюкозы в крови составляет от 8 до 10 ммоль/л, углеводную нагрузку не следует увеличивать.
Необходимо помнить, что гипергликемия часто является симптомом другого заболевания, которое следует исключить.
Если уровень глюкозы в крови пациента остается ниже 3 ммоль/л, следует увеличить углеводную нагрузку на 1 мг/кг в минуту. Если уровень глюкозы в крови пациента при контроле составляет менее 2,2 ммоль/л, следует болюсно ввести раствор 10% декстрозы (Глюкозы♠) из расчета 2 мл/кг.
Необходимо помнить, что гипогликемия - состояние, опасное для жизни, которое может привести к инвалидности.
Подробно тактика при диагностировании гипогликемии и гипергликемии рассмотрена в соответствующем протоколе.
Электролиты и микроэлементы
КАЛИЙ
Калий является основным внутриклеточным катионом. Его основная биологическая роль - обеспечение нервно-мышечной передачи импульсов.
Начальные показатели дотации калия, темп увеличения указаны в приложении 3.
Назначение калия детям с ЭНМТ возможно после того, как концентрация в сыворотке крови не будет превышать 4,5 ммоль/л, с момента установления адекватного диуреза, обычно не ранее 3-4 сут жизни. Среднесуточная потребность в калии у детей с ЭНМТ с возрастом увеличивается и достигает к началу 2-й нед жизни 3-4 ммоль/кг.
Критерием гиперкалиемии в раннем неонатальном периоде является повышение концентрации калия в крови более 6,5 ммоль/л, а после 7 дней жизни - более 5,5 ммоль/л. Гиперкалиемия - серьезная проблема у новорожденных с ЭНМТ, возникающая даже при адекватных функциях почек и нормальном обеспечении калием (неолигурическая гиперкалиемия). Быстрое повышение уровня сывороточного калия в течение первых суток жизни характерно для крайне незрелых детей. Причиной этого состояния могут быть гиперальдостеронизм, незрелость дистальных почечных канальцев, метаболический ацидоз.
Γипокалиемия - состояние, при котором концентрация калия в крови составляет менее 3,5 ммоль/л. Наиболее частые причины гипокалиемии в периоде новорожденности - избыточное выведение калия с мочой (особенно при длительном назначении диуретиков), проведение инфузионной терапии без добавления калия, реже - большие потери жидкости с рвотой и каловыми массами. Терапия глюкокортикоидами (преднизолоном, гидрокортизоном), интоксикация сердечными гликозидами также сопровождаются развитием гипокалиемии. Клинически для гипокалиемии характерны нарушения сердечного ритма (тахикардия, экстрасистолия), полиурия. Терапия гипокалиемии основана на восполнении уровня эндогенного калия (приложение 3).
НАТРИЙ
Натрий является основным катионом внеклеточной жидкости, содержание которого определяет осмолярность последней. Начальные показатели дотации натрия, темп увеличения указаны в приложении 3.
Плановое назначение натрия начинают с 3-4-х суток жизни или с более раннего возраста при снижении сывороточного содержания натрия менее 140 ммоль/л. Потребность в натрии у новорожденных составляет 3-5 ммоль/кг в сутки.
У детей с ЭНМТ нередко развивается синдром поздней гипонатриемии, обусловленный нарушением почечных функций и повышенным потреблением натрия на фоне ускоренного роста.
Γипернатриемия - повышение концентрации натрия в крови более 145 ммоль/л. Гипернатриемия развивается у детей с ЭНМТ в первые 3 дня жизни вследствие больших потерь жидкости и свидетельствует о дегидратации. Следует увеличить объем жидкости, не исключая препаратов натрия. Более редкая причина гипернатриемии - избыточное внутривенное поступление натрия гидрокарбоната или других натрий-содержащих препаратов.
Γипонатриемию (уровень натрия в плазме менее 130 ммоль/л), возникшую в первые 2 дня на фоне патологической прибавки массы тела и отечного синдрома, называют гипонатриемией разведения. В такой ситуации следует пересмотреть объем вводимой жидкости в пользу его увеличения. В остальных случаях показано дополнительное введение препаратов натрия при снижении его концентрации в сыворотке крови ниже 125 ммоль/л.
КАЛЬЦИЙ И ФОСФОР
Ион кальция принимает участие в различных биохимических процессах в организме. Он обеспечивает нервно-мышечную передачу, принимает участие в мышечном сокращении, обеспечивает свертывание крови, играет важную роль в формировании костной ткани. Постоянный уровень кальция в сыворотке крови поддерживается гормонами паращитовидных желез и кальцитонином. При недостаточной дотации фосфора происходит его задержка почками и, как следствие, исчезновение фосфора в моче. Недостаток фосфора приводит к развитию гипер-кальциемии и гиперкальциурии, а в дальнейшем - к деминерализации костей и развитию остеопении недоношенных. Начальные показатели дотации кальция, темп увеличения указаны в приложении 3.
Неонатальная гипокальциемия - патологическое состояние, развивающееся при концентрации кальция в крови менее 2 ммоль/л (ионизированного кальция менее 0,75-0,87 ммоль/л) у доношенных и 1,75 ммоль/л (ионизированного кальция менее 0,62-0,75 ммоль/л) у недоношенных новорожденных. Перинатальными факторами риска развития гипокальциемии считают недоношенность, перенесенную асфиксию, инсулинозависимый сахарный диабет у матери, врожденную гипоплазию паращитовидных желез.
Признаки гипокальциемии у новорожденного: часто бессимптомное течение, нарушение дыхания (тахипноэ, апноэ), неврологическая симптоматика (синдром повышенной нервно-рефлекторной возбудимости, судороги), снижение плотности костей.
Признаки дефицита фосфора у новорожденных: снижение плотности костей, рахит, переломы, боль в костях, сердечная недостаточность.
МАГНИЙ
Концентрация в сыворотке составляет 0,7-1,1 ммоль/л. Однако истинный дефицит магния не всегда диагностируется, так как только около 0,3% общего содержания магния в организме содержится в сыворотке крови. Физиологическое значение магния велико. Магний контролирует энергозависимые процессы (аденозинтрифосфорную кислоту), участвует в синтезе белков, нуклеиновых кислот, жиров, фосфолипидов сурфактанта и клеточных мембран, участвует в кальциевом гомеостазе и метаболизме витамина D, является регулятором ионных каналов и, соответственно, клеточных функций (ЦНС, сердце, мышечная ткань, печень и др.). Магний необходим для поддержания уровня калия и кальция в крови.
Введение магния в состав ПП начинают со 2-х суток жизни в соответствии с физиологической потребностью 0,2-0,3 ммоль/кг в сутки (приложение 3). До начала введения магния исключают гипермагниемию, особенно если женщине вводились препараты магния в родах.
Введение магния тщательно контролируют и отменяют при холестазе, так как магний - один из элементов, который метаболизируется печенью.
При уровне магния менее 0,5 ммоль/л могут появляться клинические симптомы гипомагниемии, которые сходны с симптомами гипокальциемии (в том числе судороги). При рефрактерной к лечению гипокальциемии следует исключить наличие гипомагниемии.
В случае симптоматической гипомагниемии назначают магния сульфат из расчета по магнию 0,1-0,2 ммоль/кг внутривенно в течение 2-4 ч (при необходимости можно повторять через 8-12 ч). Раствор магния сульфата 25% перед введением разводят не менее чем 1:5. Во время введения контролируют ЧCC, артериальное давление. Поддерживающая доза - 0,15-0,25 ммоль/кг в сутки внутривенно в течение 24 ч.
Γипермагниемия диагностируется при уровне магния выше 1,15 ммоль/л. Причины гипермагниемии: передозировка препаратов магния, гипермагниемия у матери вследствие лечения преэклампсии в родах. Проявляется гипермагниемия синдромом угнетения ЦНС, артериальной гипотензией, депрессией дыхания, снижением моторики пищеварительного тракта, задержкой мочи.
ЦИНК
Цинк участвует в обмене энергии, макронутриентов и нуклеиновых кислот. Быстрый темп роста глубоко недоношенных детей обусловливает их более высокую потребность в цинке по сравнению с доношенными новорожденными. Глубоко недоношенные дети и дети с высокими потерями цинка, обусловленными диареей, наличием стомы, тяжелыми заболеваниями кожи, требуют включения цинка сульфата в ПП.
СЕЛЕН
Селен является антиоксидантом и компонентом активной глутатионпероксидазы - фермента, защищающего ткани от повреждения активными формами кислорода. Низкий уровень селена часто встречается у недоношенных детей, что способствует развитию у данной категории детей бронхолегочной дисплазии (БЛД) и ретинопатии недоношенных.
Потребность в селене у недоношенных детей - 1-3 мг/кг в сутки (актуально при очень длительном ПП в течение нескольких месяцев).
В настоящее время в России не зарегистрированы препараты фосфора, цинка и селена для парентерального введения, что делает невозможным их использование у новорожденных в отделении реанимации и интенсивной терапии.
Витамины
ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ
Виталипид Н детский♠ используется у новорожденных для обеспечения суточной потребности в жирорастворимых витаминах А, D2, E, K1. Потребность - 4 мл/кг в сутки. Виталипид Н детский♠ добавляется в жировую эмульсию. Полученный раствор перемешивают легким покачиванием, затем используют для парентеральных инфузий. Назначается в зависимости от ГВ и массы тела одновременно с назначением жировой эмульсии.
ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ
Солувит Н♠ (Soluvit N) применяется как составная часть ПП для удовлетворения суточной потребности в водорастворимых витаминах (таких как тиамина мононитрат, рибофлавина натрия фосфат дигидрат, никотинамид, пиридоксина гидрохлорид, натрия пантотенат, натрия аскорбат, биотин, фолиевая кислота, цианокобаламин). Потребность - 1 мл/кг в сутки. Раствор Солувита Н♠ добавляют к растворам декстрозы (Глюкозы♠) (5, 10, 20%), жировой эмульсии или в раствор для ПП (центральный или периферический доступ). Назначается одновременно с началом ПП.
Мониторинг при парентеральном питании
Одновременно с началом ПП необходимо определить следующие показатели.
Во время ПП необходимо ежедневно определять следующие показатели.
При длительном (более 1 нед) ПП еженедельно необходимо определять следующие показатели.
ОСЛОЖНЕНИЯ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
Инфекционные осложнения. ПП является одним из основных факторов риска госпитальной инфекции наряду с катетеризацией центральной вены и проведением ИВЛ. Проведенный метаанализ не показал существенных различий в частоте инфекционных осложнений при использовании центральных и периферических сосудистых катетеров.
Экстравазация раствора и возникновение инфильтратов, которые могут быть причиной формирования косметических или функциональных дефектов. Чаще всего это осложнение развивается при использовании периферических венозных катетеров.
Выпот в плевральную полость/перикард встречается с частотой 1,8/1000 поставленных глубоких линий, летальность составляет 0,7/1000 установленных линий.
Холестаз встречается у 10-12% детей, получающих длительное ПП. Доказанными эффективными способами профилактики холестаза являются насколько возможно более раннее начало ЭП и применение препаратов жировых эмульсий для парентерального питания с добавлением рыбьего жира (СМОФлипид♠).
Кроме того, к осложнениям парентерального питания можно отнести гипо- и гипергликемию, электролитные нарушения, развитие флебита, остеопении (при отсутствии дотации препаратов фосфора и кальция).
АЛГОРИТМ РАСЧЕТА ПРОГРАММЫ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
Данная схема является приблизительной и учитывает только ситуации с успешным усвоением ЭП.
Порядок расчета парентерального питания у недоношенных детей
1. Расчет суточного объема жидкости. Умножаем массу тела ребенка в килограммах на расчетную дозу жидкости на килограмм массы тела (см. приложение 1). При наличии показаний к повышению или снижению потребления жидкости доза корригируется индивидуально.
В данный объем входят все жидкости, вводимые ребенку: ПП, ЭП, жидкость в составе парентерально вводимых антибиотиков.
Минимальное трофическое питание (менее 25 мл/кг в сутки), обязательно проводимое в первые сутки жизни, не учитывается в общем объеме жидкости:
m (кг) × доза жидкости (мл/кг в сутки) = суточная доза жидкости(мл/сут).
2. Расчет объема ПП. При объеме ЭП, превышающем трофический:
суточная доза жидкости (мл/сут) - объем ЭП (мл/сут) = суточныйобъем ПП.
3. Расчет суточного объема раствора белка. Умножаем массу тела ребенка в килограммах на расчетную дозу парентерального белка на килограмм массы тела (см. приложение 1) с учетом вводимого энтерального белка (при объеме ЭП, превышающем трофический):
m (кг) × доза белка (г/кг в сутки) = суточная доза белка (г/сут).
При использовании 10% раствора аминокислот суточную дозу белка умножаем на 10:
суточная доза белка (г/сут) × 10 = количество 10% раствора аминокислот (мл/сут).
При расчете частичного ПП в суточном объеме ЭП высчитывается доза белка в граммах и результат вычитается из суточной дозы белка.
4. Расчет суточного объема эмульсии жиров. Умножаем массу тела ребенка в килограммах на расчетную дозу жира на килограмм массы тела (см. приложение 1) с учетом вводимого энтерального белка (при объеме ЭП, превышающем трофический):
m (кг) × доза жира (г/кг в сутки) = суточная доза жира (г/сут).
При использовании 20% эмульсии жиров суточную дозу жиров умножаем на 5, при использовании 10% умножаем на 10, получаем объем (мл/сут):
суточная доза жира (г/сут) × 5 = количество 20% эмульсии жиров(мл/ сут).
При расчете частичного ПП в суточном объеме ЭП высчитывается доза жира в граммах и результат вычитается из суточной дозы жира.
5. Расчет суточного объема электролитов.
Расчет дозы натрия при использовании физиологического раствора:
m (кг) × доза натрия (ммоль/л)(см. приложение 3) = объем NaCl 0,9% (мл) 0,15.
Расчет дозы натрия при использовании 10% раствора хлорида натрия в составе комбинированного раствора:
m (кг) × доза натрия (ммоль/л)(см. приложение 3) = объем NaCl 10% (мл) 1,7.
Расчет дозы калия:
m (кг) × доза калия (ммоль/л)(см. приложение 3) =объем К 4% (мл) 0,56.
Расчет дозы кальция:
m (кг) × доза кальция (ммоль/л)(см. приложение 3) × 3,3 =объем кальция глюконата 10% (мл); m (кг) × доза кальция (ммоль/л)(см. приложение 3) × 1,1 = объем кальция хлорида 10% (мл).
Расчет дозы магния:
m (кг) × доза магния (ммоль/л)(см. приложение 3) = объем магниясульфат 25% (мл).
6. Расчет суточного объема витаминов. Препарат водорастворимых витаминов (Солувит Н♠ детский) - 1 мл/кг в сутки. Растворить, добавив в один из растворов:
Солувит Н♠ детский - 1 мл/кг в сутки.
Препарат жирорастворимых витаминов (Виталипид Н детский♠) добавляется только в раствор жировой эмульсии для ПП из расчета 4 мл/кг:Виталипид Н детский♠ - 4 мл/кг в сутки.
7. Расчет суточного объема углеводов.
-
7.1. Вычисляем количество граммов глюкозы в сутки: умножаем массу тела ребенка в килограммах на расчетную дозу (скорость поступления) глюкозы, умножаем на коэффициент 1,44:скорость введения углеводов (мг/кг в минуту) × m (кг) × 1,44 = дозаглюкозы (г/сут).
-
7.2. При расчете частичного ПП в суточном объеме ЭП высчитываем дозу углеводов в граммах и вычитаем из суточной дозы углеводов.
8. Расчет объема вводимой жидкости, приходящейся на глюкозу.
Из суточной дозы жидкости вычесть объем ЭП, суточный объем белка, жиров, электролитов, жидкость в составе парентерально вводимых антибиотиков:
суточный объем ПП (мл) - суточный объем белка (мл) - суточный объем жировой эмульсии (мл) - суточный объем электролитов (мл) - объем жидкости в составе парентерально вводимых антибиотиков, инотропных препаратов и т.д. - объем растворов витаминов (мл) = объем раствора глюкозы (мл).
9. Подбор объемов растворов декстрозы (Глюкозы♠).
При изготовлении раствора вне аптеки из стандартных 5, 10 и 40% декстрозы (Глюкозы♠) есть два варианта расчета. Первый вариант.
-
Вычисляем, в каком объеме 40% декстрозы (Глюкозы♠) содержится заданное количество сухой декстрозы (Глюкозы♠) (г/сут):доза декстрозы (Глюкозы♠) (г/сут) × 10 = декстрозы (Глюкозы♠) 40% (мл).
-
Вычисляем количество воды, которое необходимо добавить:объем жидкости, приходящейся на декстрозу (Глюкозу♠) - объем 40% глюкозы = объем воды (мл).
Второй вариант.
-
Рассчитываем объем раствора декстрозы (Глюкозы♠) с большей концентрацией: доза углеводов (г) × 100 - объем общего раствора декстрозы (Глюкозы♠) (мл) × С1 = С2 - С1 = объем 40% глюкозы,где С1 - меньшая концентрация (например, 10%); С2 - большая (например, 40%).
-
Вычисляем объем раствора меньшей концентрации: объем растворов декстрозы (Глюкозы♠) (мл) - объем декстрозы (Глюкозы♠) в концентрации С2 = объем глюкозы концентрации С1.
10. Контроль за полученной концентрацией декстрозы (Глюкозы ♠ ) в комбинированном растворе:
суточная доза глюкозы (г) × 100/суммарный объем раствора (мл) = концентрация декстрозы (Глюкозы♠) в растворе (%).
Допустимый процент сравнивается с рекомендациями по введению в центральную/периферическую вену.
11. Контроль за калорийностью питания.
-
11.2. Расчет калорийности ПП:доза липидов г/сут × 9 + доза декстрозы (Глюкозы♠) г/сут × 4 =калорийность ПП ккал/сут; аминокислоты не учитываются как источник калорий, хотя и могут использоваться в энергетическом обмене.
-
11.3. Значение общей калорийности питания:калорийность ЭП (ккал/сут) + калорийность ПП (ккал/сут)/массутела (кг).
12. Составление листа инфузионной терапии.
Внести объемы инфузионных растворов в лист.
13. Расчет скорости введения растворов.
Оптимальным для начала терапии считается поступление компонентов ПП с одинаковой скоростью в течение суток. При длительном ПП постепенно переходят на циклическую инфузию.
Расчет скорости введения основного раствора:объем общего раствора декстрозы (Глюкозы♠) с белком, витаминами и электролитами/24 ч = скорость введения (мл/ч).
Расчет скорости введения эмульсии жиров:объем эмульсии жиров с витаминами/24 ч = скорость введения жировой эмульсии (мл/ч).
ВЕНОЗНЫЕ ДОСТУПЫ ПРИ ПАРЕНТЕРАЛЬНОМ ПИТАНИИ
ПП может осуществляться как через периферические, так и через центральные венозные доступы.
Периферический доступ используется тогда, когда не планируется проводить ПП длительно и не будут использоваться гиперосмолярные растворы.
Центральный венозный доступ применяется тогда, когда планируется длительное ПП с использованием гиперосмолярных растворов. Обычно в качестве косвенного показателя осмолярности используется концентрация декстрозы (Глюкозы♠) в растворе. В периферическую вену не рекомендуется вводить растворы с концентрацией декстрозы (Глюкозы♠)более 12,5%.
Однако для более точного расчета осмолярности раствора можно использовать формулу:осмолярность (мосм/л) = [аминокислоты (г/л) × 8] + [декстроза (Глюкоза♠) (г/л) × 7] + [натрий (ммоль/л) × 2] + [фосфор (мг/л) × 0,2] - 50.
Растворы, расчетная осмолярность которых превышает 850- 1000 мосм/л, в периферическую вену вводить не рекомендуется.
В клинической практике при расчете осмолярности следует считать концентрацию сухого вещества.
ТЕХНОЛОГИЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ И ПРОВЕДЕНИЯ ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ
Растворы для ПП должны приготавливаться в отдельном помещении. Помещение должно соответствовать вентиляционным стандартам особо чистого помещения. Приготовление растворов должно проводиться в ламинарном шкафу. Приготовление растворов для ПП следует поручать наиболее опытной медицинской сестре. Перед приготовлением растворов медицинская сестра должна провести хирургическую обработку рук, надеть стерильную шапочку, маску, стерильный халат и стерильные перчатки. В ламинарном шкафу должен быть накрыт стерильный стол.
Приготовление растворов должно проводиться с соблюдением всех правил асептики и антисептики. Допускается смешивание в одном пакете растворов декстрозы (Глюкозы♠), аминокислот и электролитов.
Для профилактики тромбоза катетера в раствор следует добавлять гепарин. Доза гепарина может определяться либо из расчета 0,5-1,0 ЕД на 1 мл готового раствора, либо 25-30 ЕД на килограмм массы тела в сутки.
Жировые эмульсии с жирорастворимыми витаминами готовятся в отдельном флаконе или шприце без добавления гепарина.
В целях профилактики катетер-ассоциированной инфекции следует заполнять инфузионную систему в стерильных условиях и стремиться как можно реже нарушать ее герметичность. С этой точки зрения представляется обоснованным при ПП использование инфузионных волюметрических помп с достаточной точностью дозирования раствора на малых скоростях введения. Шприцевые дозаторы более целесообразно использовать тогда, когда объем вводимой среды не превышает объем одного шприца. Для обеспечения максимальной герметичности целесообразно при сборе контура для инфузии использовать трехходовые краники и безыгольные коннекторы для введения разовых назначений. Смена инфузионного контура у постели больного должна также проводиться с соблюдением всех правил асептики и антисептики.
ВВЕДЕНИЕ ЭНТЕРАЛЬНОГО ПИТАНИЯ
Начиная с первых суток жизни при отсутствии противопоказаний необходимо начинать трофическое питание. В дальнейшем, в случае переносимости трофического питания, объем ЭП должен планомерно расширяться. До тех пор, пока объем ЭП не достигнет 50 мл/кг, следует проводить корректировку парентерально вводимой жидкости, но не парентерально вводимых нутриентов. После того как объем ПП превысит 50 мл/кг, частичное ПП следует проводить по остаточному принципу, покрывая дефицит ЭП.
При достижении объема ЭП 120-140 мл/кг ПП может быть прекращено.
ПРИЛОЖЕНИЯ
Приложение 1. Потребность в жидкости и основных нутриентах при парентеральном питании в зависимости от массы тела при рождении
| Масса тела при рождении, г | <750 г | 750-1250 г | 1250-1500 г | 1500- 2000 г | >2000 г | |
|---|---|---|---|---|---|---|
Жидкость, мл/кг |
От |
80-100 |
80-100 |
80-100 |
80-100 |
60-80 |
До |
150-160 |
150-160 |
150-160 |
150-160 |
140-160 |
|
Белки*, г/кг в сутки |
Стартовая доза |
2,5-3,0 |
2,0-3,0 |
2,0-3,0 |
2,0-3,0 |
1,0-1,5 |
Оптимальная доза |
4,0 |
4,0 |
3,0-3,5 |
3,0 |
2,0 |
|
Максимально допустимая доза** (ЭП + ПП) |
4,5 |
4,0 |
3,5 |
2,5 |
||
Шаг |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
|
Жиры, г/кг в сутки |
Стартовая доза, г/кг в сутки |
2,0-3,0 |
1,0-3,0 |
1,0-3,0 |
1,5 |
1,0 |
Шаг, г/кг в сутки |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
|
Минимальная доза при необходимости ограничения дотации |
0,5-1,0 |
|||||
Максимально допустимая доза при полном ПП, г/кг в сутки |
3,0 |
|||||
Максимально допустимая доза при частичном ПП (суммарно ЭП + ПП) |
4,5-6,0 |
3,0-4,0 |
3,0 |
3,0 |
3,0 |
|
Углеводы |
От, мг/кг в минуту |
4,0-7,0 |
||||
До, мг/кг в минуту |
4,0-7,0 |
4,0-7,0 |
5,0-7,0 |
6,0-7,0 |
6,0-8,0 |
|
Максимально допустимая доза (ПП), г/кг в сутки |
12,0 |
12,0 |
12,0 |
12,0 |
12,0 |
|
Шаг, мг/кг в минуту |
1,0 |
1,0 |
1,0 |
1,0 |
1,0-2,0 |
|
* Белковая нагрузка не изменяется до достижения объема ЭП 50 мл/кг в сутки. ** Точно не определена, потребность повышается при состояниях, сопровождающихся высоким катаболизмом.
Приложение 2. Препараты для парентерального питания в Российской Федерации, применяемые у новорожденных
| Международное непатентованное наименование | Препарат | Производитель |
|---|---|---|
Специализированный раствор аминокислот |
Аминокислоты для парентерального питания (Аминовен Инфант♠ ) |
Fresenius Kabi (Германия) |
Жировые эмульсии, содержащие преимущественно длинноцепочечные триглицериды |
Жировые эмульсии для парентерального питания (Интралипид♠ , Липовеноз♠ , Липофундин♠ ) |
Fresenius Kabi (Германия) Fresenius Kabi (Германия) B Braun Group |
Жировые эмульсии, содержащие длинно- и среднецепочечные триглицериды |
Жировые эмульсии для парентерального питания (Липофундин MCT/LCT♠ ) |
B Braun Group |
Жировые эмульсии, содержащие четыре вида масел (оливковое масло, соевое масло, рыбий жир, среднецепочечные триглицериды) |
Жировые эмульсии для парентерального питания (СМОФлипид♠ ) |
Fresenius Kabi (Германия) |
Водорастворимые витамины |
Солувит Н♠ |
Fresenius Kabi (Германия) |
Жирорастворимые витамины |
Виталипид Н детский♠ |
Fresenius Kabi (Германия) |
Приложение 3. Потребность новорожденных в электролитах при парентеральном питании
| Ион | Срок начала введения | Источник | Перевод в систему СИ (мэкв в ммоль)* | Количество раствора, содержащее 1 ммоль | Физиологическая потребность суточная | Особенности экстремально низкой массы тела |
|---|---|---|---|---|---|---|
К |
2-3-и сутки жизни |
4% KCl - 0,54 ммоль/мл; 7,5% KCl - 1 ммоль/мл; 10% KCl - 1,35 ммоль/мл; калия и магния аспарагинат (Панангин♠) - 0,25 ммоль/мл |
Для К 1 мэкв = 1 ммоль |
1,85 мл 4% KCl = 1 ммоль |
Возрастает 1-4 ммоль/кг. При повторных введениях фуросемида (Лазикса♠) - 3-4 ммоль/кг |
2-3 ммоль/кг |
К (мл 4%) = физиологическая потребность суточная (1-4 ммоль/кг) × масса (кг) × × 1,85 |
||||||
Са |
Конец первых суток жизни (профилактика ранней гипокаль-циемии) |
10% кальция глюконат - 0,45 мэкв/мл (0,23 ммоль/мл); 10% Са хлорид - 0,136 мэкв/мл |
Для Са 1 мэкв = 0,5 ммоль |
4,4 мл 10% кальция глюконата = 1 ммоль |
Возрастает 0,25- 1,0 ммоль/ кг (1-3 мл/ кг, или 100- 200 мг/кг) |
0,5- 1,0 ммоль/кг, или 2-4 мл/ кг (200- 400 мг/кг) |
Кальция глюконат (мл 10%) = физиологическая потребность суточная (1-2 мл/кг) × масса (кг) |
||||||
Na |
С момента установления диуреза (3-и сут жизни) |
0,9% NaCL - 0,15 ммоль/мл; 10% NaCL - 1,5 ммоль/мл |
Для Na 1 мэкв = 1 ммоль |
6,6 мл 0,9% NaCL = 1 ммоль; 0,66 мл 10% NaCL = 1 ммоль |
2-3 ммоль/кг |
1-3-и сутки - характерна гипер-натриемия, с 4-х суток - гипо- (3- 4 ммоль/кг); к 14-м суткам - до 6-8 ммоль/ кг |
Cl |
- |
- |
Для Cl 1 мэкв = 1 ммоль |
- |
2-6 ммоль/кг |
- |
Mg |
1-е сутки жизни (профилактика гипомагни-емии) |
25% MgSO4 |
Для Mg 1 мэкв = 0,5 ммоль |
1 ммоль = 1 мл 25% MgSO4 |
0,2 мл/кг 25% MgSO4 (50 мг/кг) |
50-100 мг/ кг |
ЭНТЕРАЛЬНОЕ ВСКАРМЛИВАНИЕ НЕДОНОШЕННЫХ ДЕТЕЙ
Согласовано и утверждено Российским обществом неонатологов и Российской ассоциацией специалистов перинатальной медицины
Авторы: Грошева Е.В., Дегтярева А.В., Ионов О.В., Ленюшкина А.А., Нароган М.В., Рюмина И.И., Киртбая А.Р.
ТЕРМИНОЛОГИЯ
ЭП - вид нутритивной поддержки, при котором питательный субстрат (грудное молоко, специализированная смесь для искусственного вскармливания) поступает в ЖКТ в полном или частичном объеме внутрь (кормление из бутылочки, грудное вскармливание), через зонд либо через гастроили еюностому. ЭП считается полным, когда все нутриенты вводятся через ЖКТ в количествах, соответствующих физиологическим потребностям. Нутритивные потребности недоношенного ребенка определяются фактической массой тела, ПКВ, наличием и тяжестью течения фонового заболевания. ЭП считается частичным, когда количество вводимых энтерально питательных веществ не соответствует физиологическим потребностям ребенка, что требует восполнения с помощью парентерального способа введения нутриентов.
Раннее трофическое питание (минимальное ЭП) - начатое в течение первых 3-4 сут от рождения и пролонгированное (до 1 нед и более) введение энтерального субстрата новорожденному в объеме, не превышающем 12-24 мл/кг в сутки. Минимальное ЭП имеет клинические преимущества перед задержкой начала ЭП, так как позволяет избежать нежелательных последствий длительного голодания у тяжелобольных новорожденных: атрофии и нарушения целостности слизистой оболочки ЖКТ, снижения активности пищеварительных ферментов и секреции гормонов, снижения толерантности к последующей пищевой нагрузке. Эти преимущества имеют под собой физиологическое обоснование и обширный базис преклинических исследований, однако в метаанализах рандомизированных клинических исследований на сегодня их документировать не удается. Доказано, что минимальное ЭП не увеличивает риск НЭК.
Минимальное ЭП показано с рождения всем недоношенным новорожденным, не имеющим противопоказаний к ЭП, при наличии состояний, препятствующих увеличению объема энтеральной нагрузки. Объем трофического питания не учитывается при расчете необходимой жидкости, нутриентов и энергообеспечения.
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ
Показания к ЭП. ЭП показано всем недоношенным детям независимо от массы тела, ГВ и тяжести состояния, за исключением имеющих противопоказания.
Противопоказания к ЭП.
ФАКТОРЫ РИСКА СНИЖЕНИЯ ТОЛЕРАНТНОСТИ К ЭНТЕРАЛЬНОЙ НАГРУЗКЕ
-
Остро возникшее жизнеугрожающее состояние, требующее реанимационных мероприятий.
-
Асфиксия при рождении, сопровождающаяся лактат-ацидозом и полиорганной недостаточностью.
-
Артериальная гипотензия, шок, флюктуация артериального давления.
-
Декомпенсированные дыхательные/метаболические расстройства (по данным кислотно-основного состояния и газового состава крови).
-
Предшествовавший нулевой или маятникообразный конечно-диастолический кровоток в пупочной артерии плода.
-
Тяжелая задержка внутриутробного развития (масса тела при рождении менее 3-го перцентиля).
-
Наличие гемодинамически значимого функционирующего артериального протока (ГЗФАП), терапия ГЗФАП нестероидными противовоспалительными средствами.
Данные состояния не являются абсолютными противопоказаниями к ЭП, однако их наличие повышает риск плохой переносимости ЭП. Решение о начале/продолжении и темпе расширения объема ЭП в этих случаях принимается индивидуально на основании данных клинического мониторинга, под контролем признаков непереносимости питания.
Как правило, остро возникшее нарушение, подвергшееся быстрой коррекции, не требует задержки начала или внесения изменений в существующий режим ЭП. Если нарушение требует пролонгированной коррекции, то начало ЭП допустимо отложить на период, необходимыйдля его устранения, либо (при уже начатом ЭП) временно уменьшить объем ЭП до трофического.
В ряде клинических ситуаций, ранее считавшихся лимитирующими факторами для ЭП (наличие катетеров в сосудах пуповины, медикаментозная терапия ГЗФАП, нарушения диастолического кровотока в артерии пуповины), накоплен положительный опыт, не предусматривающий отказа от начала и расширения объема ЭП.
Решение о начале/продолжении ЭП у детей, имеющих факторы риска снижения толерантности к пищевой нагрузке, принимается индивидуально под контролем клинических параметров и переносимости ЭП. Допустимо отложить начало ЭП на срок 24-48 ч, если пациенту требуется респираторно-гемодинамическая стабилизация.
При хорошей переносимости объем питания увеличивают не более чем на 10-20 мл/кг в сутки.
При появлении признаков непереносимости объем питания снижают до трофического (12-24 мл/кг в сутки).
При прогрессирующем ухудшении состояния (стойкая декомпенсация показателей респираторного статуса, кислотно-основного состояния, гемодинамики), подозрении на НЭК ЭП отменяют.
После временной отмены ЭП решение о его возобновлении должно основываться на индивидуальной оценке статуса ребенка, которая проводится с периодичностью 1 раз в 24 ч.
СПОСОБЫ ВВЕДЕНИЯ ПИТАТЕЛЬНОГО СУБСТРАТА
Грудное вскармливание возможно при наличии следующих условий:
Кормление из бутылочки через соску. Недоношенных детей более 32 нед ПКВ независимо от массы тела можно, как правило, кормить из бутылочки:
Показания к кормлению через зонд.
Предпочтение отдается орогастральному зонду во избежание появления или усугубления респираторных нарушений.
Зондовое введение нутриентов осуществляется в периодическом и непрерывном режиме.
-
Непрерывный - введение суточного объема ЭП без перерыва в течение24 ч.
-
Периодический (капельное введение через шприцевый дозатор или болюсное введение) - введение суточного объема ЭП в течение 24-часового периода с интервалами. Кратность введения, длительность разового введения, интервал между кормлениями, а также объем каждого последующего кормления устанавливается врачом для каждого ребенка.
При капельном введении грудного молока через шприцевый дозатор шприц должен размещаться канюлей вверх под углом 45° к горизонтальной плоскости в целях предотвращения потери жиров.
Одним из вариантов периодического кормления является болюсное, когда питательный субстрат медленно вводится с помощью шприца со скоростью, не превышающей 2 мл/мин, или самотеком.
Для детей с ОНМТ и ЭНМТ допустимыми являются как непрерывный, так и периодический режимы питания. Непрерывный и капельный периодический режимы являются способами улучшения переносимости ЭП в случаях, когда это необходимо.
Преимущества непрерывного способа введения энтерального субстрата.
К преимуществам периодического способа следует отнести соответствие физиологической цикличности выработки гастроинтестинальных гормонов и ферментов.
Кормление через гастро-, эзофаго- и еюностому показано при полной непроходимости верхних отделов ЖКТ.
Кормление недоношенных через транспилорический зонд не рекомендуется.
АЛГОРИТМ НАЧАЛА И РАСШИРЕНИЯ ОБЪЕМА ЭНТЕРАЛЬНОГО ПИТАНИЯ
Время первого кормления и его начальный объем определяются ГВ, массой тела при рождении и тяжестью состояния ребенка, а также фактором доступности молозива/грудного молока.
Для детей менее 32 нед гестации безопасным считается стартовый объем 20-25 мл/кг в сутки. При отсутствии противопоказаний ЭП недоношенного ребенка должно быть начато в первые часы жизни. В любом случае не следует откладывать начало ЭП недоношенных новорожденных на срок более 24-72 ч жизни.
Расширение объема питания проводится дифференцированно в зависимости от массы тела, ГВ и клинического состояния ребенка.
В настоящее время нет доказанных стратегий безопасного в отношении риска НЭК увеличения объема ЭП недоношенным новорожденным с ЭНМТ. Исторически (в основном на основании результатов когортных исследований) сложился консервативный подход, при котором минимальное ЭП у детей с ЭНМТ пролонгировалось независимо от клинического состояния новорожденного на 4-7 дней жизни. Около 50% клиницистов и в современных условиях продолжают придерживаться этого подхода. Однако при использовании консервативной стратегии не доказано уменьшение риска смертности и НЭК, тогда как восстановление массы тела при рождении происходит позже, требуется больше времени для достижения полного ЭП, возрастает риск инфекционных осложнений.
В ряде современных рандомизированных клинических исследований продемонстрированы преимущества быстрого увеличения объема энтеральной нагрузки (более 25 мл/кг в сутки) перед медленным (менее 25 мл/кг в сутки) с рождения у детей с ОНМТ и ЭНМТ, однако данных в отношении новорожденных с ЭНМТ по-прежнему недостаточно.
Рекомендуемый диапазон увеличения объема энтеральной нагрузки (срождения):
Алгоритм начала и расширения объема ЭП - см. в приложении, табл. 4.
СУБСТРАТ ЭНТЕРАЛЬНОГО ПИТАНИЯ
Грудное молоко
Исключительный приоритет в качестве субстрата ЭП при вскармливании недоношенных детей имеет сцеженное грудное молозиво/молоко, даже если количество его у матери незначительное. Частота реализации НЭК при вскармливании грудным молоком в несколько раз ниже, чем при искусственном вскармливании.
Преимущества нативного молока:
В процессе «созревания» грудного молока происходит снижение его энергетической ценности, белка и содержания основных минералов, что не соответствует высоким физиологическим потребностям недоношенных детей, поэтому необходимо обогащение грудного молока. Обогащение может проводиться по одному из нутриентов (монокомпонентное обогащение) либо комплексно с помощью добавления фортификатора - мультикомпонентного продукта, увеличивающего питательную ценность грудного молока за счет дополнительного введения белков, углеводов, витаминов и минералов.
Показания к обогащению грудного молока:
Условия и правила обогащения грудного молока следующие.
-
Обогащение молозива и переходного молока (первые 10-14 дней) нецелесообразно ввиду их изначально высокой осмолярности за счет большего содержания белка и натрия по сравнению со зрелым молоком.
-
Обогащение зрелого грудного молока рекомендуется после достижения суточного объема ЭП около 100 мл/кг. При хорошей переносимости энтеральной нагрузки и возможности поступательно увеличивать объем питания обогащение может быть начато несколько позже - после достижения объема 150 мл/кг.
-
Обогащение зрелого грудного молока повышает его осмолярность в среднем до 400 мосм/кг, что может быть причиной дискинезии ЖКТ. Повышение осмолярности грудного молока при обогащении происходит в течение 20 мин от начала добавления фортификатора, и в течение последующих 24 ч осмолярность не меняется, поэтому сокращение времени кормления и изменение режима питания не предотвращают возможность дискинезии ЖКТ, обусловленную повышенной осмолярностью питательного субстрата.
-
В первый день обогащения грудного молока добавляется 1/4-1/2 от рекомендуемой дозы фортификатора. В дальнейшем, при отсутствии признаков непереносимости питания, рекомендуется полное обогащение согласно инструкции производителя.
-
Обогащение грудного молока рекомендуется проводить до 52 нед ПКВ с учетом нутритивного статуса ребенка, по показаниям (масса тела ребенка менее 25-го перцентиля с учетом скорригированного возраста) можно использовать дольше.
Смеси для недоношенных
При отсутствии или недостаточном количестве грудного молока рекомендуется специализированная смесь для вскармливания недоношенных и маловесных детей.
В настоящее время эти продукты представлены в двух формах - жидкой и сухой.
Готовые стерильные жидкие специализированные смеси для вскармливания новорожденных рекомендуются для применения на госпитальном этапе выхаживания недоношенных. Их преимущества заключаются в стерильности, постоянстве стандартизированного состава и осмолярности, физико-химической стабильности, экономии времени и трудозатрат персонала на приготовление, более низком риске контаминации по сравнению с сухими смесями.
Смеси для недоношенных детей различаются по содержанию основных макронутриентов, прежде всего, по содержанию белка, что позволяет подобрать необходимый вариант, ориентируясь на физиологические потребности в нутриентах и объем ЭП, который может усвоить ребенок. Уноворожденных массой менее 1000 г для достижения потребности в белке 4,0-4,5 г/кг может потребоваться использование специального продукта - белковой добавки (для новорожденных, находящихся как на естественном вскармливании, так и на искусственном). Широкое распространение получила на сегодня двухэтапная система искусственного вскармливания недоношенных, предусматривающая наличие двух смесей - стартовой, предназначенной для детей менее 1800 г, и последующей (так называемая смесь после выписки) - для детей массой 1800 г и более.
Критерии для перевода на последующую смесь: ПКВ 40 нед, масса тела более 1800 г (в зависимости от того, что наступит раньше), соответствие показателя массы тела ПКВ (не менее 25-го перцентиля по таблице физического развития), стабильная положительная динамика параметров физического развития.
Назначение адаптированной молочной смеси для доношенных детей ориентировочно возможно при достижении массы 3000 г, но при условии, что усвояемый объем будет обеспечивать физиологическую потребность в нутриентах, а показатели физического развития ребенка соответствуют скорригированному возрасту (масса тела ребенка более 25-го перцентиля с учетом скорригированного возраста).
Не рекомендуется разведение любых молочных смесей, не предусмотренное инструкцией!
Вопрос о целесообразности использования у недоношенных детей смесей на основе частично и полностью гидролизованного белка дискутабелен. В современных международных рекомендациях по ЭП (ESPGAN, 2010 и др.) вопрос о преимуществах цельного или гидролизованногобелка в питании недоношенных не рассматривается. Большинство коммерчески доступных смесей для недоношенных с хорошо изученной клинической эффективностью производится из цельного белка. На рынке продуктов детского питания РФ отсутствуют специализированные смеси для вскармливания недоношенных детей, произведенные на основе частично или полностью гидролизованного белка, в том числе смеси на основе аминокислот. Высокая осмолярность смесей, содержащих свободные аминокислоты, может явиться дополнительным фактором неблагоприятного воздействия на ЖКТ ребенка.
Публикации, посвященные исследованию клинической эффективности гидролизатов у недоношенных, немногочисленны. В отдельных публикациях упоминаются нежелательные биохимические эффекты при применении смесей на основе гидролиза. Ряд исследований указывает на отсутствие значимой разницы между цельным и гидролизованным белком в отношении показателей нутритивной ценности и влияния на биохимические показатели сыворотки. Потенциальные клинические преимущества глубоких гидролизатов, такие как ускорение пассажа питательного субстрата по ЖКТ, показаны в единичных наблюдениях, широко не исследовались и не доказаны. Неизвестно, является ли ускорение пассажа истинным клиническим преимуществом, так как в основе этого эффекта лежит более высокая осмотическая активность субстрата. Таким образом, убедительного научного обоснования для рутинного назначения недоношенным смесей на основе гидролизованного белка на сегодня не имеется.
По физико-химическим характеристикам белковый гидролизат обладает лучшей растворимостью в грудном молоке, чем цельный белок, и этим объясняется широкое использование гидролизатов при производстве продуктов - обогатителей грудного молока.
Смеси на основе гидролиза белка показаны недоношенным при непереносимости белка коровьего молока, а также в периоде рекон-валесценции после перенесенного НЭК и обширных оперативных вмешательств на толстой и тонкой кишке при отсутствии грудного молока. Продукты на основе гидролиза также рекомендуются недоношенным в составе обогатителей грудного молока.
НЕПЕРЕНОСИМОСТЬ ЭНТЕРАЛЬНОГО ПИТАНИЯ
Нарушение толерантности к ЭП различной степени выраженности - частое явление у недоношенных новорожденных, обусловленное как функциональной незрелостью ЖКТ, так и высокой частотой патологии, оказывающей влияние на переносимость энтеральной нагрузки. Грамотная интерпретация признаков непереносимости питания необходима как для коррекции функциональных нарушений, так и для своевременного предупреждения грозного осложнения - НЭК.
Признаки непереносимости ЭП.
Диагностическая ценность отдельных признаков дискинезии ЖКТ у недоношенных различна. Так, объем остаточного содержимого желудка при трофическом питании может превышать разовый объем кормления и не является патологическим при отсутствии других признаков дискинезии ЖКТ и признаков инфекционного токсикоза. Объем остаточного содержимого желудка при суточном объеме питания, превышающем трофическое, до 1/2 разового объема может являться вариантом нормы.
Нет необходимости регулярно контролировать остаточное содержимое желудка при отсутствии дискинезии ЖКТ.
Окрашивание остаточного желудочного содержимого желчью у глубоко недоношенных детей на 1-2-й неделе жизни без других признаков дискинезии ЖКТ и признаков инфекционного токсикоза также не считается патологическим и не является противопоказанием к увеличению объема ЭП. Этот признак в изолированном варианте у недоношенных детей обусловлен незрелостью моторики ЖКТ.
Действия при начальных проявлениях непереносимости питания (1-2 признака легкой или средней степени выраженности).
-
При кормлении зондовым способом рекомендуется положить ребенка на живот или на левый бок с приподнятым головным концом для улучшения моторной функции ЖКТ, профилактики гастроэзофагеального рефлюкса и апноэ.
-
При наличии стойкого вздутия живота без других признаков непереносимости, часто возникающего у детей, находящихся на CPAP, показано открытие зонда за 20-30 мин до кормления для предотвращения аэрофагии. Может также потребоваться смена зонда на таковой большего диаметра.
-
Допустимо использовать мягкую стимуляцию опорожнения кишечника - применение свечей на основе глицерина или газоотводной трубки (1-2 раза в сутки).
При нарастании клинической выраженности и одновременном появлении нескольких признаков непереносимости необходимо исключитьНЭК.
КОНТРОЛЬ ЗА ЭФФЕКТИВНОСТЬЮ ЭНТЕРАЛЬНОГО ПИТАНИЯ
Физическое развитие
Первоначальная потеря массы тела не должна превышать 15%. В дальнейшем хорошее физическое развитие характеризуют параметры (масса тела, рост, окружность головы), соответствующие внутриутробной скорости роста (прибавка массы тела 15 г/кг в сутки, роста - более 0,9 см/нед, окружность головы - более 0,9 см/нед) (рис. 1).
Лабораторные показатели
Содержание гемоглобина определяется 1 раз в 7-10 дней.
Содержание в крови белка, альбумина, глюкозы, мочевины, натрия, калия, кальция, фосфора, щелочной фосфатазы определяется 1 раз в 2 нед (по показаниям - чаще).
Сочетание стойкого снижения мочевины (менее 1,5 ммоль/л) с прогрессирующей гипоальбуминемией (менее 25 г/л) указывает на дефицит белкового обеспечения. Зарегистрированная гипофосфатемия (менее 1,8 ммоль/л) в сочетании с повышением концентрации щелочной фосфатазы свидетельствует о развитии остеопении недоношенных.
Таблица 1. Референсные значения биохимических показателей крови (сводные данные из цитируемых источников)
| Показатель | Значение |
|---|---|
Общий белок, г/л |
42-76 |
Альбумин, г/л |
26-46 |
Мочевина, ммоль/л |
(1,5) 1,8-7,0 |
Щелочная фосфатаза, ЕД/л |
130-700 |
Кальций, ммоль/л |
1,8-2,6 |
Кальций ионизированный, ммоль/л |
1,0-1,3 |
Фосфор, ммоль/л |
1,3-2,6 |
НЕДОНОШЕННЫЕ С ОСОБЫМИ ПОТРЕБНОСТЯМИ ПИТАНИЯ
Синдром холестаза
-
Повышенное содержание среднецепочечных триглицеридов (не менее 30%, оптимально 40-50% в зависимости от степени выраженности холестаза).
-
Жирорастворимые витамины назначают внутрь при длительности холестаза более 10 дней [колекальциферол (Витамин D3♠) по 800-1200 МЕ/ сут, витамин Е по 50-120 МЕ/сут, ретинол (Витамин А♠) по 2500- 5000 МЕ/сут, витамин К по 1 мг/кг в сутки]. Учитывая высокое содержание витамина А в специализированных смесях для недоношенных детей, назначение препарата ретинола (Витамина А♠) внутрь должно проводиться под контролем сывороточного уровня. Косвенным признаком дефицита витамина К является снижение ПТИ или повышение международного нормализованного отношения.
-
Дополнительное назначение препаратов кальция (50 мг/кг), цинка (1 мг/кг) и фосфора (25 мг/кг).
Тяжелая форма бронхолегочной дисплазии, хроническая сердечнососудистая недостаточность
В условиях повышенной энергетической потребности и необходимости ограничения жидкости могут быть рекомендованы специализированные лечебные высококалорийные смеси, содержащие 100 ккал в 100 мл.
ФИЗИОЛОГИЧЕСКИЕ ПОТРЕБНОСТИ НЕДОНОШЕННЫХ ДЕТЕЙ
Потребность в жидкости
Допустимый объем при полном ЭП при условии, что назначенный объем питания восполнит потребность в нутриентах и энергии, составляет 135-200 мл/кг в сутки. Детям, нуждающимся в респираторной поддержке и кислородотерапии, имеющим признаки сердечно-сосудистой и дыхательной недостаточности, не рекомендуется увеличение объема более 160 мл/кг в сутки (табл. 2).
Таблица 2. Физиологическая потребность в жидкости (мл) в зависимости от массы и возраста ребенка
| Масса тела Возраст, сут | >2000 г | <2000 г |
|---|---|---|
1 |
60-70 |
60-90 |
2-3 |
70-90 |
90-120 |
4-5 |
90-120 |
120-140 |
6-7 |
120-160 |
140-160 |
>7 |
160-180 (135-200) |
160-180 (135-200) |
Потребность в белке
При частичном и полном ЭП потребность в белке зависит от массы тела при рождении и составляет:
У детей, достигших массы тела 2200 г, может и далее сохраняться повышенная потребность в белке - 3,2 г/кг в сутки, если они имеют проявления постнатальной гипотрофии (менее 25-го перцентиля по массе тела), недостаточную динамику параметров физического развития. Такое количество белка ребенок может получить при пролонгированном вскармливании специализированной смесью «после выписки» из стационара. Однако рекомендации по длительности применения обогащенного питания у недоношенных в настоящее время не имеют достаточной доказательной базы и требуют дальнейших исследований.
Потребность в белке является доминирующим показателем, на который ориентируются при назначении ЭП, потребность в энергии имеет второстепенное значение.
Потребность в энергии
При частичном и полном ЭП потребность в энергии составляет 110- 135 ккал/кг в сутки. Энергообеспечение увеличивается по мере возраста ребенка (табл. 3).
Таблица 3. Минимальная потребность в энергообеспечении в зависимости от возраста
| День жизни | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
8-10 |
Ккал/кг |
30-40 |
40 |
50 |
60 |
70 |
80 |
Потребность недоношенных детей в витаминах и микроэлементах (табл. 4)
Таблица 4. Суточная потребность в витаминах и микроэлементах
| Нутриенты | Потребность, кг/сут |
|---|---|
Витамин А, мкг (1 мкг = 3,33 МЕ) |
400-1000 |
Витамин D, МЕ |
800-1000 МЕ/сут (независимо от массы тела) |
Витамин К, мкг |
4,4-28 |
Витамин Е, мг |
2,2-11 |
Витамин С, мг |
11-46 |
Витамин В1, мкг |
140-300 |
Витамин В2, мкг |
200-400 |
Витамин В6, мкг |
45-300 |
Витамин В12 , мкг |
0,1-0,77 |
Фолаты, мкг |
35-100 |
Ниацин, мкг |
380-5500 |
Биотин, мкг |
1,7-16,5 |
Пантотенат, мг |
0,33-2,1 |
Натрий, мг |
69-115 |
Калий, мг |
66-132 |
Соли кальция, мг |
120-140 |
Фосфор, мг |
60-90 |
Магний, мг |
8-15 |
Железо, мг |
2-3 |
Цинк, мг |
1,1-2,0 |
СПИСОК ЛИТЕРАТУРЫ
-
Адамкин Д.Х. Стратегии питания младенцев с очень низкой массой тела при рождении: пер. с англ. под ред. Е.Н. Байбариной. М.: ГЭОТАР-Медиа, 2013. 176 с.
-
Безопасное приготовление, хранение и обращение с сухой детской смесью. Руководящие принципы. ВОЗ, 2007. 26 с.
-
Ведение детей, рожденных с экстремально низкой массой тела. Клинический обзор международных данных // Информационно-образовательный вестник. Здоровье семьи. 2011. № 2. 24 с.
-
Вскармливание недоношенных детей: методические рекомендации / сост.: Нароган М.В., Ворона Л.Д., Коровина И.В. М., 2012. 32 с.
-
Интенсивная терапия и принципы выхаживания детей с экстремально низкой и очень низкой массой тела при рождении: методическое письмо / под ред. Е.Н. Байбариной, Д.Н. Дегтярева, В.И. Широковой. М., 2011. 70 с.
-
Нароган М.В., Яцык Г.В., Сюткина Е.В. Исследование энергетического обмена методом непрямой калориметрии у новорожденных детей // Вопр. соврем. педиатрии. 2006. № 4. С. 39-43.
-
Национальная программа оптимизации вскармливания детей первого года жизни в Российской Федерации. М., 2011. 68 с.
-
Пясецкая Н.М. Paнняя анемия недоношенных детей. Профилактика и лечение рекомбинантным эритропоэтином (эпоэтин-бета): учебное пособие. Киев, 2004. 26 с.
-
Рациональное вскармливание недоношенных детей: методические указания / Боровик Т.Э., Яцык Г.В, Ладодо К.С. и др. М., 2012. 68 с.
-
Рооз Р., Генцель-Боровичеши О., Прокитте Г. Неонатология. Практические рекомендации. М.: Медицинская литература, 2011. 568 с.
-
Современные принципы выхаживания детей с очень низкой и экстремально низкой массой тела при рождении: учебное пособие / Сост.: Та-мазян Г.В., Захарова Н.И., Нароган М.В. и др. М., 2011. 27 с.
-
Шаафсма А., Грибакин С.Г., Гаранкина Т.И., Давыдовская А.А. Значение оптимального переваривания белка для повышения его пищевой ценности, формирования полезной кишечной микрофлоры и уменьшения сенсибилизации иммунной системы // Педиатрия. 2013. Т. 92. № 1. С. 93-96.
-
Aggett P.S., Agostoni С., Axelsson I. et al. Feeding preterm infants after hospital discharge. A commentary by the ESPGHAN Committee on Nutrition // J. Pediatr. Gastroenterol. Nutr. 2006. Vol. 42. P. 596-603.
-
Agostoni С., Axelsson I., Goulet O. et al. Preparation and handling of powdered infant formula: a commentary by the ESPGHAN Committee on Nutrition // J. Pediatr. Gastroenterol. Nutr. 2004. Vol. 39. P. 320-322.
-
Agostoni С., Buonocore G. et al. Enteral nutrient supply for preterm infants: commentary from the European Society for Paediatric Gastroenterology, Hepa-tology, and Nutrition Committee on Nutrition // J. Pediatr. Gastroenterol. Nutr. 2010. Vol. 50. P. 1-9.
-
Leaf A., Dorling J., Kempley S., McCormick K. et al. Early or delayed enteral feeding for preterm growth-restricted infants: a randomized trial // Pediatrics. 2012. Vol. 129. P. e1260-е1268.
-
Agarwal R., Singal A. Effect of fortification with human milk fortifier (HMF) and other fortifying agents on the osmolality of preterm breast milk // Indian Pediatr. 2004. Vol. 41. P. 63-67.
-
Arslanoglu S., Corpeleijn W., Moro G. et al. Donor human milk for preterm infants: current evidence and research directions. A Comment by the ESP-GHAN Committee on Nutrition // J. Pediatr. Gastroenterol. Nutr. 2013. Vol. 57. P. 535-542.
-
Arslanoglu S., Moro G.E., Ziegler E.E. Adjustable fortification of human milk fed infants: does it make a difference? // J. Perinatol. 2006. Vol. 26. P. 614-621.
-
Barrus D.M. Romano-Keeler J., Carr C. et al. Impact of enteral protein supplementation in premature infants // Res. ReP. Neonatol. 2012. Vol. 2. P. 25-31.
-
Bhatia J. Human milk and the premature infants // J. Perinatol. 2007. Vol. 27. P. S71-S74.
-
Bhatia J. Post-discharge nutrition of preterm infants // J. Perinatol. 2005. Vol. 25. P. S15-S16.
-
Breastfeeding and the use of human milk. Policy statement. From American Academy of Pediatrics // Pediatrics. 2012. Vol. 129, N 3. P. e827-e841.
-
Carlo D., Simone P., Jacopo B. et al. Near-infrared spectroscopy measurements of splanchnic tissue oxygenation during continuous versus intermittent feeding method in preterm infants // J. Pediatr. Gastroenterol. Nutr. 2013. Vol. 56, N 6. P. 652-656.
-
Christensen R.D., Henry E. et al. Pattern of daily weight among low weight neonates in the neonatal intensive care unit: data from a multihospital health-care system // J. Perinatol. 2006. Vol. 26. P. 37-43.
-
Cooke R., Embleton N., Rigo J. et al. High protein pre-term infant formula: effect on nutrient balance, metabolic status and growth // Pediatr. Res. 2006. Vol. 59, N 2. P. 265-270.
-
Corpeleij n W.E., Kouwenhoven S.M.P., Paap M.C. et al. Intake of own mother’s milk during the first days of life is associated with decreased morbidity and mortality in very low birth weight infants during the first 60 days of life // Neonatology. 2012. Vol. 102. P. 276-281.
-
Cossey V., Vanhole C., Eerdekens A. et al. Pasteurization of mother’s own milk for preterm infants does not reduce the incidence of late-onset sepsis // Neonatology. 2013. Vol. 103. P. 170-176.
-
De Curtis M., Rigo J. The nutrition of preterm infants // Early Hum. Dev. 2012. Vol. 88, suppl. 1. P. S5-S7.
-
do Nascimento M.B., Issler H. Breastfeeding in premature infants: in-hospi-tal clinical management // J. Pediatr. 2004. Vol. 80, suppl. 5. P. S163-S172.
-
Edmond K., Bahl R. Optimal Feeding of Low-Birth-Weight Infants. Technical Review. Geneva: WHO, 2006.
-
Ehrenkranz R.A., Dusick A.M., Vohr B.R. et al. Growth in the neonatal intensive care unit influences neurodevelopmental and growth outcomes of extremely low birth weight infants // Pediatrics. 2006. Vol. 117. P. 1253-1261.
-
Gomella T.L. Neonatology: Management, Procedures, On-Call Problems, Diseases, and Drugs. McGraw-Hill, 2009. 894 p.
-
Griffin I.J., Cooke R.J. Nutrition of preterm infants after hospital discharge // J. Pediatr. Gastroenterol. Nutr. 2007. Vol. 45. P. S195-S203.
-
Groh-Wargo Sh., Sapsford A. Enteral nutrition support of the preterm infant in the neonatal intensive care unit // Nutr. Clin. Pract. 2009. Vol. 24, N 3. P. 363-376.
-
Hay W.W. Jr. Strategies for feeding the preterm infant // Neonatology. 2008. Vol. 94, N 4. P. 245-254.
-
Human vitamin and mineral requirements. Report of a Joint FAO/WHO Expert Consultation. Bangkok, Thailand. FAO & WHO. Rome, 2002.
-
Kashyap S., Schulze K.F., Ramakrishnan R. et al. Evaluation of a mathematical model for predicting the relationship between protein and energy intakes of low-birth-weight infants and the rate and composition of weight gain // Pediatr. Res. 1994. Vol. 35. P. 704-712.
-
Kuschel C.A., Harding J.E. Multicomponent fortified human milk for promoting growth in preterm infants (Review) // The Cochrane Library. 2009.
-
Kuschel C.A., Harding J.E. Protein supplementation of human milk for promoting growth in preterm infants // Cochrane Database Syst. Rev. 2000. Vol. 2. CD000433.
-
Lucas A. Programming by early nutrition: an experimental approach // J. Nutr. 1998. Vol. 128, N 2. P. 401S-406S.
-
McCormick F.M., Henderson G., Fahey T., McGuire W. Multinutrient fortification of human breast milk for preterm infants following hospital discharge // The Cochrane Library. 2010.
-
Morgan J., Bombell S., McGuire W. Early trophic feeding versus enteral fasting for very preterm or very low birth weight infants // Cochrane Database Syst. Rev. 2009. Vol. 3. CD000504.
-
Morgan J., Young L., McGuire W. Delayed introduction of progressive enteral feeds to prevent necrotising enterocolitis in very low birth weight infants (Review) // The Cochrane Library. 2011.
-
Morgan J., Young L., McGuire W. Slow advancement of enteral feed volumes to prevent necrotising enterocolitis in very low birth weight infants (Review) // The Cochrane Library. 2011.
-
NeoFax / Young T.E., Mangum B. M. Montvale: Thomson Reuters, 2010.
-
O’Connor D.L., Khan S. et al. Growth and nutrient intakes of human milk-fed preterm infants provided with extra energy and nutrients after hospital discharge // Pediatrics. 2008. Vol. 121, N 4. P. 766-776.
-
Parish A., Bhatia J. Feeding strategies in the ELBW infant // J. Perinatol. 2008. Vol. 28. P. S18-S20.
-
Parker L.A., Sullivan S., Krrueger C. et al. Effect of early breast milk expression on milk volume and timing of lactogenesis stage II among mothers of very low birth weight infants: a pilot study // J. Perinatol. 2012. Vol. 32. P. 205-209.
-
Patole S. Nutrition for the Preterm Neonate. A Clinical Perspective. Springer, 2013. P. 450.
-
Premji S.S., Fenton T.R., Sauve R.S. Higher versus lower protein intake in formula-fed low birth weight infants // Cochrane Database Syst. Rev. 2006. Vol. 1. CD003959.
-
Ramenghi L.A., Fumagalli M., Bassi L. et al. Brain maturation of preterm newborn babies: new insights // J. Pediatr. Gastroenterol. Nutr. 2007. Vol. 45. P. S143-S146.
-
Rigo J., Senterre J. Nutritional needs of premature infants: current issues // J. Pediatr. 2006. Vol. 149. P. S80-88.
-
Roggero P., Gianni M.L., Amato O. et al. Growth and fat free mass gain in preterm infants after discharge: a randomized controlled trial // Pediatrics. 2012. Vol. 130, N 5. P. e1215-e1221.
-
Roggero P., Gianni M.L., Amato O. et al. Influence of protein and energy intakes on body composition of formula-fed preterm infants after term // J. Pediatr. Gastroenterol. Nutr. 2008. Vol. 47. P. 375-378.
-
Roggero P., Gianni M.L., Morlacchi L. et al. Blood urea nitrogen concentrations in low-birth-weight preterm infants during parenteral and enteral nutrition // J. Pediatr. Gastroenterol. Nutr. 2010. Vol. 51, N 2. P. 213-215.
-
Shulman R.J., Ou C., Smith E.O. Evaluation of potential factors predicting attainment of full gavage feedings in preterm infants // Neonatology. 2012. Vol. 99. P. 38-44.
-
Thompson A.M., Bizzarro M.J. Necrotizing enterocolitis in newborns: pathogenesis, prevention and management // Drugs. 2008. Vol. 68. P. 1227-1238.
-
Thureen P. J. Early aggressive nutrition in the neonate // Pediatr. Rev. 1999. Vol. 20. P. e45-e55.
-
Thureen P. J. Neonatal nutrition: assessment, development and management // Presentation. Minneapolis, MN, October 2, 2008.
-
Tsang R.C., Uauy R., Koletzko B., Zlotkin S. (eds). Nutrition of the Preterm Infant. Cincinnati, OH: Digital Education Publishing, 2005. P. 415-416.
-
Yildiz A., Arikan D. The effects of giving pacifiers to premature infants and making them listen to lullabies on their transition period for total oral feeding and sucking success // J. Clin. Nurs. 2012. Vol. 21, N 5-6. P. 644-656.
-
Young T.E. Nutritional support and bronchopulmonary dysplasia // J. Perinatol. 2007. Vol. 27. P. S75-S78.
-
Ziegler E.E. Protein requirements of very low birth weight infants // J. Pediatr. Gastroenterol. Nutr. 2007. Vol. 45. S170-S174.
-
Ziegler E.E., Carlson S.J., Nelson S.E. Interventional strategies to promote appropriate growth // Maternal and child nutrition: the first 1,000 days // Nestle Nutrition Institute Workshop Series. 2013. Vol. 74. P. 181-192.
-
Zlotkin S.H., Bryan M.H., Anderson G.H. Intravenous nitrogen and energy intakes required to duplicate in utero nitrogen accretion in prematurely born human infants // J. Pediatr. 1981. Vol. 99. P. 115-120.
-
Maas C. et al. A historic cohort study on accelerated advancement of enteral feeding volumes in very premature infants // Neonatology. 2013. Vol. 103. P. 67-73.
-
Clyman R., Wickremasinghe A., Jhaveri N., Hassinger D.C. et al.; Ductus Arteriosus Feed or Fast with Indomethacin or Ibuprofen (DAFFII) Investigators. Enteral feeding during indomethacin and ibuprofen treatment of a patent ductus arteriosus // J. Pediatr. 2013. Vol. 163, N 2. P. 406-411.
-
Джозеф Нью. Гастроэнтерология и питание. Проблемы и противоречия в неонатологии: пер. с англ. М.: Логосфера, 2014. 512 с.
-
Скворцова В.А., Боровик Т.Э., Нетребенко О.К., Трусова С.А. Стратегии вскармливания недоношенных детей: вчера, сегодня, завтра // Неонатология, 2014. № 4. С. 55-63.
ПРИЛОЖЕНИЕ
Таблица 5. Алгоритм начала и расширения объема энтерального питания
| Масса тела при рождении, г | Начальный объем | Объем увеличения энтерального питания (с первых суток жизни) | Примечания | |
|---|---|---|---|---|
>1200 г |
12-24 мл/кг в сутки |
30-40 мл/кг в сутки |
- |
|
1000-1200 г |
12-24 мл/кг в сутки |
20-30 мл/кг в сутки |
- |
|
<1000 г, факторы риска |
12-24 мл/кг в сутки |
При хорошей переносимости ЭП |
10-20 мл/кг в сутки |
- |
При наличии признаков непереносимости ЭП |
Не увеличивать объем более трофического (12-24 мл/кг в сутки) |
Повторная оценка через сутки* |
||
Факторы риска
|
||||
* ЭП детей, имеющих факторы риска в сочетании с признаками непереносимости ЭП, проводится в индивидуальном режиме под контролем клинических параметров.
Таблица 6. Выбор субстрата энтерального питания недоношенных
| Субстрат | Содержание белка, г/100 мл | Показания |
|---|---|---|
Грудное молоко/молозиво |
Молозиво 2,8-5,7 (4,3). Переходное 1,7-2,5 (2,1). Зрелое 0,9-1,2 (1,1) |
Все дети - при наличии молока у матери* |
Грудное молоко зрелое + фортификатор |
1,1+1,1=2,2 |
Дети менее 1800 г и/или менее 34 нед ГВ** |
Грудное молоко зрелое + фортификатор + белковая добавка |
≥2,5 |
Дети менее 1000 г, имеющие недостаточное обеспечение белком после введения фортификатора (см. табл. 3) |
Смесь для недоношенных*** |
2,2-2,6 |
Отсутствие или недостаток грудного молока |
Смесь для недоношенных + белковая добавка |
≥2,5 |
Дети менее 1000 г, имеющие недостаточное обеспечение белком при вскармливании смесью (см. табл. 6) |
Смесь для недоношенных «после выписки» |
1,9-2,0 |
Масса тела более 1800 г**** |
Смесь для доношенных, обогащенная железом |
≤1,6 |
Масса тела более 3000 г**** |
Смесь на основе глубокого гидролизата белка |
1,8-2,1 |
Непереносимость БКМ. Реконвалесценты НЭК, дети после обширных резекций толстого и тонкого кишечника (при отсутствии ГМ) |
* Для детей с ОНМТ и ЭНМТ при отсутствии материнского молока в качестве начального субстрата в стационаре следует отдавать предпочтение донорскому молоку.
** Фортификация рекомендуется не ранее 10-12 сут жизни, после достижения объема грудного молока 100-150 мл/кг. При несоответствии массы тела ГВ/ПКВ показания к фортификации расширяются.
*** Выбор смеси для недоношенных основывается на содержании белка. Необходимое содержание белка вычисляется исходя из физиологической потребности в белке и объема ЭП (см. табл. 7).
**** Рекомендуемые критерии для перевода детей на смесь после выписки и смесь для доношенных выполнимы при соответствии массы тела ГВ и устойчивой положительной динамике параметров физического развития.
Таблица 7. Рекомендуемое содержание белка в энтеральном субстрате для обеспечения физиологической потребности недоношенных
| Категория новорожденных | Потребность в белке | Содержание белка в субстрате, обеспечивающее физиологическую потребность (при объеме питания 160 мл/кг) |
|---|---|---|
<1000 г |
4,0-4,5 г/кг |
≥2,5 г/100 мл |
1000-1800 г |
4,0-3,5 г/кг |
2,5-2,2 г/100 мл |
1800-2200 г |
3,5-3,2 г/кг |
2,2-2,0 г/100 мл |
2200-3000 г |
3,2-2,5 г/кг |
2,0-1,6 г/100 мл |
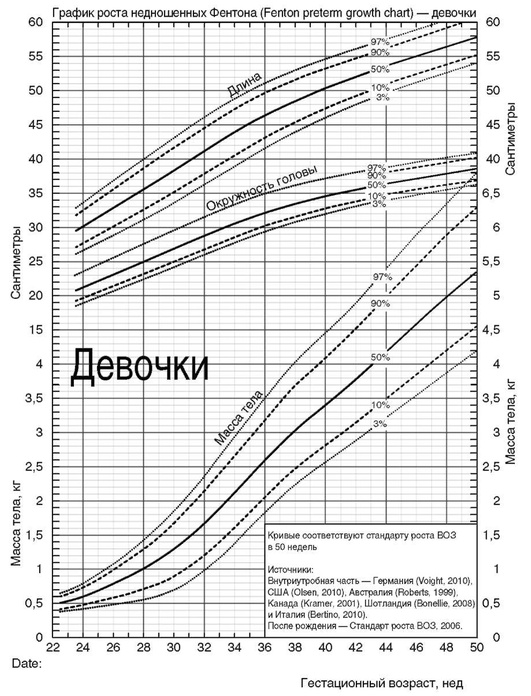
Рис. 1. Распределение показателей массы тела, длины и окружности головы от 3-го до 97-го центиля у девочек с 22-й по 50-ю неделю постконцептуального возраста
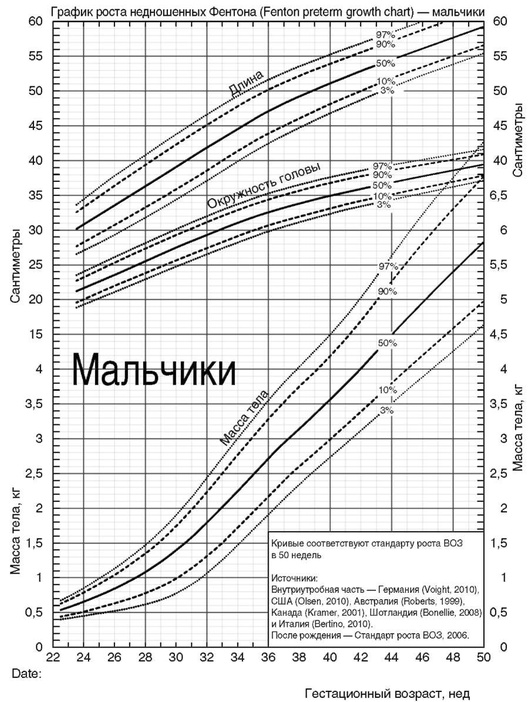
Рис. 2. Распределение показателей массы тела, длины и окружности головы от 3-го до 97-го центиля у мальчиков с 22-й по 50-ю неделю постконцептуального возраста
ОТКРЫТЫЙ АРТЕРИАЛЬНЫЙ ПРОТОК У НЕДОНОШЕННЫХ ДЕТЕЙ
Согласовано и утверждено Российским обществом неонатологов и Российской ассоциацией специалистов перинатальной медицины
Авторы: Буров А.А., Дегтярев Д.Н., Иванов Д.О., Ионов О.В., Крючко Д.С. (модератор рабочей группы), Мовсесян Р.Р., Мостовой А.В., Нагорная Ю.В., Пруткин М.Е., Разумовский А.Ю., Сапун О.И.
Одной из патологий, усугубляющих тяжесть состояния недоношенных детей, является функционирование открытого артериального протока (ОАП) с шунтированием крови из аорты в легочную артерию, сопровождающееся переполнением сосудов малого круга кровообращения и обеднением большого круга. Частота встречаемости гемодинамически значимого ОАП находится в обратной зависимости от ГВ. Частота ОАП у новорожденных с ОНМТ составляет от 50 до 70% [1].
ВОПРОСЫ ТЕРМИНОЛОГИИ
В отечественной медицинской литературе для обозначения функционирования артериального протока используется ряд терминов: «открытый боталлов проток, открытый артериальный проток», «функционирующий артериальный проток», чаще «гемодинамически значимый функционирующий артериальный проток», кроме того, встречается термин «функционирующие фетальные коммуникации».
В зависимости от степени недоношенности ребенка, длительности функционирования протока, направления и выраженности шунтирования крови ОАП в одних случаях может рассматриваться как вариант нормы, в других - как патологическое состояние.
У доношенных детей длительно функционирующий ОАП в подавляющем большинстве случаев является признаком врожденного порока сердца. Причиной этого состояния является нарушение формирования протока. Длительно функционирующий ОАП у недоношенного ребенка, как правило, является признаком морфофункциональной незрелости сердечно-сосудистой системы.
Основополагающим фактором, определяющим клиническую значимость функционирования ОАП, является направление шунтирования крови. У большинства недоношенных детей системное артериальное давление значительно превышает давление в системе легочной артерии. Следствием этого является лево-правое шунтирование крови по артериальному протоку (из аорты в легочную артерию).
Использование терминов «открытый артериальный проток» и «гемодинамически значимый функционирующий артериальный проток» правомочно только в случае шунтирования крови из аорты в легочную артерию (слева направо).
Состояние шунтирования крови по протоку в обратном направлении - из легочной артерии в аорту (справа налево) обозначается рядом других терминов в зависимости от конкретной клинической ситуации: «персистирующая легочная гипертензия», «синдром персистирующих фетальных коммуникаций», «фетальное кровообращение» и т.д.
В то же время следует обратить внимание на то, что, согласно существующей Международной классификации болезней 10-го пересмотра, для обозначения патогенетически и клинически разных состояний, касающихся функционирования ОАП, используется один и тот же код - Р29.3 «Задержка закрытия артериального протока у новорожденного» (шунтирование крови слева направо) и «Стойкое фетальное кровообращение у новорожденного» (шунтирование крови справа налево) (раздел «Отдельные состояния, возникающие в перинатальном периоде»).
ФИЗИОЛОГИЯ ФУНКЦИОНИРОВАНИЯ
Функционирование артериального протока является основным компонентом фетального кровообращения, осуществляющим связь между легочной артерией и аортой в условиях, когда легкие ребенка не функционируют, а органом газообмена является плацента. Направление тока крови по протоку определяется высоким сопротивлением сосудов легких и низким сопротивлением сосудов плаценты. Кровь направляется справа налево - из легочной артерии в аорту.
После рождения, после перевязки пуповины и первого вдоха происходит падение давления в легочных сосудах и увеличение системного сосудистого сопротивления, в результате чего меняется направление тока крови по протоку на обратное - слева направо, то есть из аорты в легочную артерию.
При этом артериальный проток под действием кислорода спазмируется, но его немедленного закрытия не происходит. У большинства новорожденных артериальный проток функционирует в течение 12-72 ч с преимущественно лево-правым сбросом, но гемодинамического значения это не имеет. Целый ряд механизмов, к которым в том числе относятся утолщение интимы и спазмирование сосуда, приводят к функциональному его закрытию. В дальнейшем, в связи с прекращением токакрови по протоку, закрываются сосуды, кровоснабжающие мышечную стенку, ишемия приводит к апоптозу клеток гладкомышечной оболочки сосуда. Процесс анатомического закрытия и превращения протока в артериальную связку занимает несколько месяцев.
Обычно закрытие протока происходит в течение первых 24-48 ч жизни вне зависимости от ГВ. В то же время у новорожденных с ОНМТ и особенно у детей с ЭНМТ часто наблюдается нарушение механизмов закрытия артериального протока. Даже в случае, если после рождения происходит функциональное закрытие сосуда, у этой категории детей редко достигается этап глубокой ишемии мышечной стенки протока, что создает предпосылки для его повторных открытий.
Случаи, при которых функционирование артериального протока сопровождается значительными (подтвержденными эхокардиографически) нарушениями гемодинамического статуса, обозначаются как гемодинамически значимый ОАП.
Таблица 1. Факторы, способствующие персистированию открытого артериального протока у недоношенных новорожденных
| Антенатальные факторы | Постнатальные факторы |
|---|---|
Применение нестероидных противовоспалительных средств в III триместре беременности* |
Асфиксия при рождении |
Применение в родах простагландина F1α |
РДС |
Хориоамнионит |
Применение сурфактанта |
Отсутствие антенатальной профилактики РДС |
Гипервентиляция легких |
Недоношенность |
Пневмоторакс |
Анемия |
|
Избыточная инфузионная терапия |
|
Фототерапия** |
|
Применение оксида азота |
* Индуцируют повышенную эндогенную продукцию оксида азота (NO), гибель гладкомышечных клеток и утрату контрактильной способности протока. В дальнейшем новорожденные могут быть нечувствительны к ингибиторам циклооксигеназы.
** Транзиторный вазодилатирующий эффект, ослабляющий первичную констрикцию ОАП.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ФУНКЦИОНИРОВАНИЯ
Клинические проявления зависят от объема шунтируемой через артериальный проток крови и компенсаторных возможностей организма новорожденного, которые не всегда зависят от ГВ. К компенсаторным механизмам можно отнести способность увеличивать сердечный выброс за счет силы и/или ЧСС, лимфодренажную функцию легких, способность перераспределять сниженный кровоток в большом круге кровообращения за счет периферических сосудов.
Клинические проявления ОАП у детей с ЭНМТ можно подразделить на два основных аспекта: снижение системного кровотока вследствие «обкрадывания» большого круга кровообращения и повышение кровенаполнения системы легочной артерии, вызванное шунтированием большого количества крови из аорты.
В зависимости от сроков проявления клинические признаки функционирования протока можно подразделить на ранние (в первые 7 сут после рождения) и поздние (2-4 нед жизни).
В первую неделю жизни функционирование артериального протока можно подозревать при клинических проявлениях, таких как следующие.
Кроме того, ОАП может стать причиной ранних внутрижелудочковых кровоизлияний (ВЖК).
К поздним проявлениям функционирования ОАП относится появление застойной сердечной недостаточности.
Следует помнить, что такие клинические признаки ОАП, как систолический шум, разлитой верхушечный толчок, изменения артериального давления (включая артериальную гипотонию и систоло-диастолическую разницу), эпизоды апноэ, неустойчивая сатурация, у новорожденных с ЭНМТ и ОНМТ имеют крайне низкую чувствительность и специфичность. Их наличие не позволяет ставить диагноз ОАП и назначать специфическое лечение, ориентируясь только на клинические признаки.
«Золотым стандартом» диагностики ОАП является допплерэхокардиография. Доказано, что появление эхокардиографических признаков значимости ОАП опережает типичные клинические проявления в среднем на 2-3 сут. Своевременная эхокардиографическая диагностика ОАП позволяет поставить диагноз и при наличии показаний начать лечение.
Связь между РДС и ОАП является хорошо изученным и доказанным фактом. В основе негативного воздействия на легочную ткань лежит перегрузка малого круга кровообращения вследствие возврата большой части крови к легким, минуя большой круг кровообращения, что приводит к интерстициальному отеку. Низкое онкотическое давление плазмы и высокая проницаемость капилляров, характерные для недоношенных новорожденных, приводят к пропотеванию жидкости в просвет альвеолы, инактивации сурфактанта и усугублению тяжести РДС. В первые 24-72 ч этот эффект нивелируется усилением лимфатического оттока отлегких. Однако если проток остается открытым дольше этого периода, происходят значительные нарушения механики легких и прогрессивное ухудшение газообмена. Ряд исследований показывает, что ОАП является фактором риска развития БЛД, НЭК и ретинопатии недоношенных. Не исключена его роль в формировании БЛД [3].
ДИАГНОСТИКА
Единственным методом диагностики гемодинамической значимости ОАП является эхокардиография.
Показания к проведению эхокардиографии
Эхокардиография проводится в возрасте до 48 ч жизни у всех новорожденных из группы риска, к которым относятся:
В дальнейшем динамическая эхокардиография проводится не позднее чем через 48 ч после первичной, а также в случае если:
Гемодинамическая значимость
ОАП можно считать гемодинамически значимым, если имеются все основные критерии и как минимум один из дополнительных критериев.
Критерии гемодинамической значимости
-
-
Диаметр ОАП более 1,5 мм (при массе тела менее 1500 г)[4].
-
-
Дополнительные подразделяются на две группы.
-
Критерии переполнения малого круга кровообращения.
-
Отношение размеров левого предсердия к корню аорты (LA/Ao) - не менее 1,5.
-
Диастолическая скорость кровотока в легочной артерии - не менее 0,42 м/с.
-
Отношение сердечного выброса левого желудочка к кровотоку в верхней полой вене (LVO/SVC) - более 4,0.
-
Сердечный выброс левого желудочка - не менее 300 мл/кг в минуту.
-
Отношение конечно-диастолического размера левого желудочка к размеру корня аорты (LVd/Ao) - более 2,1.
-
-
Рентгенологические признаки ОАП. К рентгенологическим признакам функционирования ОАП можно отнести признаки переполнения сосудов малого круга кровообращения (диффузное усиление бронхососудистого рисунка, подчеркнутость междолевой плевры) и увеличение левых отделов сердца. Проведение рентгенографии органов грудной клетки для диагностики ОАП не является обязательным. Исследование обычно проводится в рамках дифференциальной диагностики респираторных нарушений.
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ ОТКРЫТОГО АРТЕРИАЛЬНОГО ПРОТОКА
Лечение гемодинамически значимого ОАП основано на подавлении синтеза простагландинов - одного из основных факторов, поддерживающих проток открытым. С этой целью используют нестероидные противовоспалительные средства - ингибиторы циклооксигеназы. К наиболее распространенным препаратам относятся внутривенные формы ибупрофена и индометацина, которые одинаково эффективны в закрытии ОАП. При сравнении этих двух препаратов выявлены преимущества ибупрофена, связанные со снижением риска развития НЭК и острой почечной недостаточности.
В последние годы накоплен большой опыт применения пероральных форм нестероидных противовоспалительных средств в виде сиропов, что позволило провести сравнительный метаанализ основных препаратов и лекарственных форм нестероидных противовоспалительных средств для терапии ОАП у недоношенных детей. На основании проведенного анализа был сделан вывод об одинаковой эффективности пероральной и внутривенной форм ибупрофена и было подтверждено преимущество ибупрофена (в том числе и в пероральной форме) перед индометацином во всех его формах (per os и внутривенно) в отношении снижения риска развития НЭК [4]. Кроме того, парацетамол (Ацетаминофен♠) в настоящее время рассматривается как возможная альтернатива индометацину и ибупрофену в будущем для закрытия ОАП [5].
Однако до настоящего времени в РФ не выработан единый механизм назначения препаратов «вне инструкции» (off-label), поэтому назначение любых других форм нестероидных противовоспалительных средств, кроме зарегистрированных на территории РФ для лечения ОАП, рутинно не рекомендуется.
В РФ в настоящее время зарегистрирован только один препарат для закрытия ОАП - ибупрофен для внутривенного введения Педеа♠.
Показания
Клинические рекомендации в отношении показаний к началу медикаментозной терапии ОАП у недоношенных детей значительно различаются не только в разных странах, но нередко и в пределах одной страны - в разных клиниках. На основании проанализированных данных рекомендуется назначение ингибиторов циклооксигеназы в зависимости от ГВ пациента.
Гемодинамическая значимость определяется по данными эхокардиографии (критерии гемодинамической значимости - см. выше). Для определения гемодинамической значимости протока данные о клинической симптоматике не учитываются.
Таблица 2. Рекомендации по назначению медикаментозной терапии открытого артериального протока в зависимости от гестационного возраста пациента
| Гестационный возраст | Рекомендации |
|---|---|
<28 нед |
Рекомендуется проведение пресимптоматической (до появления клинической симптоматики) медикаментозной терапии ОАП на основании данных ЭхоКГ о гемодинамической значимости ОАП |
28-32 нед |
Рекомендуется начать лечение при наличии клинических проявлений функционирования ОАП (легочное кровотечение; зависимость от респираторной поддержки, сохраняющаяся более 48 ч, или прогрессирующая дыхательная недостаточность; значительная артериальная гипотензия) |
32-34 нед |
Назначение медикаментозной терапии ОАП может быть рассмотрено в индивидуальном порядке при наличии зависимости от респираторной терапии, прогрессировании гемодинамической значимости ОАП |
В случае если антенатальная профилактика РДС не проводилась, показания к медикаментозной терапии ОАП могут быть расширены. Тактика консервативной терапии при гемодинамически значимом ОАП должна быть определена внутренним протоколом клиники.
Противопоказания
-
Жизнеугрожающее инфекционное заболевание (сепсис), лечение которого не начато.
-
Активное кровотечение, нарушение коагуляции (лечение может быть начато после антигеморрагической терапии при условии прекращения кровотечения).
-
ВЖК II-IV степени (лечение может быть начато после антигеморрагической терапии при условии отсутствия прогрессирования ВЖК).
-
Количество тромбоцитов менее 60×109/л (лечение может быть начато после трансфузии тромбоцитарной массы).
-
Подозрение на НЭК и другую хирургическую абдоминальную патологию.
-
Выраженная гипербилирубинемия, требующая операции заменного пере ливания крови.
-
Нестероидные противовоспалительные средства могут быть назначены не ранее чем через 24 ч после применения глюкокортикоидов.
-
Абсолютное противопоказание - состояние шунтирования крови из легочной артерии в аорту, при котором функционирование ОАП является жизненно необходимым. Врожденный порок сердца: атрезия легочной артерии, тетрада Фалло, коарктация аорты и др., а также перси-стирующая легочная гипертензия.
Дозы и курс лечения
Ибупрофен (Педеа♠). Курс терапии состоит из трех внутривенных введений препарата с интервалами между введениями 24 ч.
Доза ибупрофена рассчитывается в зависимости от массы тела:
При раннем применении (в первые 3-4 дня жизни) ибупрофена внутривенно у недоношенных детей его эффективность достигает 75-80%. Исключение составляют дети, родившиеся на сроке гестации менее 25 нед и имеющие массу тела при рождении менее 750 г.
Через 48 ч после последнего введения проводится эхокардиографическое исследование и оцениваются наличие артериального протока и его гемодинамическая значимость. При наличии гемодинамически значимого ОАП назначают второй курс внутривенного ведения ибупрофена.
Если через 48 ч после окончания второго курса внутривенного ведения ибупрофена гемодинамически значимый ОАП сохраняется, следует рассмотреть вопрос о хирургическом вмешательстве.
Убедительных данных, свидетельствующих о необходимости отмены ЭП в период введения препаратов, нет. Дети, получающие ЭП в период лечения, в дальнейшем быстрее достигают объема полного ЭП, отсутствует увеличение риска развития НЭК, перфорации кишечника и развития инфекционных заболеваний [6].
Контроль за безопасностью введения препарата
Особенности ведения новорожденных с гемодинамически значимым открытым артериальным протоком
При наличии временных противопоказаний к специфической терапии ОАП ведение новорожденных с гемодинамически значимым открытым артериальным протоком имеет ряд особенностей.
-
Использование объемозамещающих растворов в первые дни жизни при артериальной гипотонии у новорожденных с ОАП может привести к ухудшению гемодинамической ситуации и усилению отека легких. При отсутствии четких указаний на гиповолемию терапию артериальной гипотонии следует начинать с допамина (2-20 мкг/кг в минуту).
-
Проведенные исследования показали, что недоношенные с ОАП способны значительно увеличивать сердечный выброс в целях компенсации шунтирования крови через проток, поэтому рутинное назначение инотропных препаратов детям с ОАП не требуется. Кроме того, избыточная α-адренергическая стимуляция может привести к усугублению лево-правого шунтирования крови.
-
При оценке адекватности оксигенации новорожденного с ОАП следует помнить, что, несмотря на то что персистирование ОАП - результат сниженной чувствительности стенки протока к действию кислорода, избыточное увеличение насыщения артериальной крови кислородом приводит к увеличению лево-правого шунтирования вследствие снижения легочного сосудистого сопротивления.
-
Использование дигоксина возможно только при развитии застойной сердечной недостаточности при длительном функционировании протока.
-
В настоящее время доказано, что ограничение объема вводимой жидкости при функционировании ОАП нецелесообразно, так как, незначительно снижая легочный кровоток, этот метод «лечения» приводит к значительному снижению перфузии органов.
-
Следует избегать назначения фуросемида в первую неделю жизни, так как его влияние на катаболизм простагландинов приводит к повышению уровня циркулирующего PGE2.
ХИРУРГИЧЕСКАЯ КОРРЕКЦИЯ ОТКРЫТОГО АРТЕРИАЛЬНОГО ПРОТОКА
Показания
Хирургическая коррекция ОАП у недоношенного ребенка показана при одновременном наличии трех признаков:
Вопрос о целесообразности хирургической коррекции ОАП решается консилиумом с участием неонатолога, кардиолога (при наличии ставки кардиолога в лечебном учреждении), специалиста функциональной диагностики, кардиохирурга или детского торакального хирурга. Показания к хирургическому вмешательству формулируются лечащим неонатологом.
Учитывая низкую эффективность и высокий процент осложнений медикаментозной терапии у новорожденных ГВ менее 25 нед, в отдельных случаях вопрос о терапии этой категории пациентов может быть решен консилиумом в пользу первичной хирургической коррекции.
Противопоказания
Наличие пневмонии не является противопоказанием к операции, так как функционирование ОАП является одним из факторов, способствующих поддержанию инфекционного процесса в легких.
Необходимые условия для проведения операции
Для новорожденных с ЭНМТ рекомендуется проведение операции в условиях одного стационара, без транспортировки, возможно в условиях отделения реанимации новорожденных. Проведение операции возможно при наличии у стационара лицензии по детской хирургии.
Подготовка к операции
Залогом успешной операции и минимизации риска для недоношенного ребенка является тщательная подготовка новорожденного к вмешательству. К моменту начала операции ребенок должен иметь нормальную температуру тела (36,5-37,5 °С), компенсированные значения кислотно-основного состояния, газового состава крови и биохимические показатели.
Кроме того, необходимо получить информированное согласие родителей на операцию и проведение анестезиологического пособия, переливание компонентов крови, выполнение других инвазивных мероприятий, а также провести перечисленные ниже дополнительные исследования и манипуляции непосредственно перед операцией.
Подготовка пациента к операции
-
Эхокардиографическое исследование сертифицированным специалистом (если не проводилось ранее).
-
Рентгенография с верификацией положения эндотрахеальной трубки и венозных катетеров.
-
За 6 ч до операции прекращается энтеральное кормление, ребенок переводится на полное ПП.
-
Во время операции нет необходимости отменять ПП. Однако если есть основания для частичной отмены ПП (ограниченный венозный доступ), то подобная отмена должна быть кратковременной. Инфузию декстрозы (Глюкозы♠) отменять не следует.
-
Должны быть подготовлены препараты крови (СЗП и эритроцитарная масса).
-
Осмотр врачом-анестезиологом накануне операции с оценкой риска анестезии по ASA.
-
Сосудистый доступ обеспечивается центральным и периферическим венозными катетерами.
Важным организационным моментом является обеспечение возможности выполнения операции в условиях отделения реанимации новорожденных или максимально приближенной к реанимационному отделению операционной, избегая продолжительной транспортировки пациента. Детям, находящимся в тяжелом состоянии, рекомендовано выполнение операции в открытом кувезе, чтобы избежать этапа перекладывания.
Анестезиологическое пособие
-
Положение ребенка - на левом боку. Мониторинг проводится по Гарвардскому стандарту: ЧCC, неинвазивное измерение артериального давления каждые 2-3 мин, SpO2, частота дыхания, температура тела, капнометрия. ИВЛ продолжается в предоперационном режиме вентиляции, возможно ужесточение параметров респираторной поддержки интраоперационно.
-
Тип анестезии - тотальная внутривенная анестезия.
-
Индукция: диазепам по 0,5 мг/кг + фентанил по 5-10 мкг/кг + атра-куриум по 0,6 мг/кг.
-
Инфузионная терапия: 6-10 мл/кг в час с учетом струйных введений препаратов.
-
Интраоперационно существует вероятность возникновения необходимости подключения кардиотонической терапии.
-
Поддержание анестезии: фентанил по 5-10 мкг/кг + атракуриум по 0,6 мг/кг каждые 30 мин, диазепам по 0,5 мг/кг каждые 60 мин.
-
Методика клипирования открытого артериального протока
Существуют различные методы хирургического закрытия ОАП. Однако у недоношенных детей с низкой массой тела, ОНМТ и ЭНМТ должен применяться максимально щадящий вид оперативного вмешательства. Операцией выбора является клипирование ОАП с использованием мышцесохраняющего мини-доступа. При этом применяется специальный набор инструментов (самофиксирующийся ранорасширитель, ретрактор легкого, длинный зажим для диссекции протока, клип-аппликатор и клипсы, мобильная налобная лампа, бинокулярная лупа), который позволяет создать достаточное операционное пространство,обеспечить обзор всех его отделов, соблюдая при этом принцип минимальной травматичности.
Для клипирования ОАП больного укладывают на правый бок, выполняют разрез кожи и подкожной жировой клетчатки в проекции четвертого межреберья слева, позади лопатки, в безмышечной области, длиной 1,5-2,0 см, тупо расслаивают мышцы, разводят ребра. Устанавливают самофиксирующийся ранорасширитель после инструментальной отслойки медиастинальной плевры, при этом сохраняя целостность плевральной полости. Ретрактором легкое оттесняют кпереди и идентифицируют блуждающий и возвратный нервы, левую подключичную артерию, используя их как анатомические ориентиры для обнаружения артериального протока. Мобилизацию последнего ограничивают выделением верхнего и нижнего краев протока без циркулярного его выделения. После этого накладывают клипсу Small или Medium в зависимости от размера протока, используя клип-аппликатор диаметром 5 или 10 мм. При этом захватывают проток за адвентицию, приподнимают и сжимают клипсой.
Описанная оперативная техника, помимо быстроты и относительной простоты исполнения, сводит к минимуму риск кровотечения и потребность в электрокоагуляции, устраняет необходимость в дренировании плевральной полости и предотвращает возможность деформации грудной клетки по мере роста ребенка.
Кроме того, существует методика торакоскопического клипирования ОАП. Применение данной операции возможно у недоношенных детей со стабильной гемодинамикой, при наличии соответствующего оборудования [эндоскопический (2-3 мм) инструментарий] для торакоскопического клипирования ОАП.
Особенности послеоперационного ведения
Непосредственно после оперативного вмешательства или в ближайшее после него время проводятся следующие мероприятия.
Не рекомендуется снимать ребенка с ИВЛ и переводить на самостоятельное дыхание в течение минимум 48 ч.
Энтеральное кормление следует начать с небольших объемов через 6 ч после операции при условии сохранного пассажа по кишечнику. ПП, при отсутствии противопоказаний к его проведению, следует возобновить сразу по окончании операции.
Послеоперационное обезболивание. Послеоперационное обезболивание является обязательным. В первые послеоперационные сутки проводится внутривенное капельное введение фентанила из расчета 5 мкг/ кг в час или морфина 40 мкг/кг в час, на вторые сутки доза обезболивания снижается на 50%, в последующем, на третьи и четвертые послеоперационные сутки, обезболивание проводится по показаниям при оценке интенсивности болевого синдрома у ребенка.
Послеоперационные осложнения
-
Дисфункция миокарда левого желудочка (отек легких). В связи с резко изменившейся гемодинамической ситуацией (высокая преднагрузка и низкая постнагрузка меняются на резкое повышение постнагрузки и снижение преднагрузки) в послеоперационном периоде возможно развитие дисфункции миокарда левого желудочка, что может проявиться клинической картиной отека легких. Следует тщательно следить за объемом вводимой жидкости, стараясь избегать перегрузки. При развитии клинической картины отека легких следует незамедлительно:
-
сократить объем вводимой жидкости до 140-150 мл/кг, желательноне меняя скорости поступления декстрозы (Глюкозы♠);
-
назначить добутамин с дозы 5 мкг/кг в минуту, увеличивая дозу на 5 мкг/кг каждые 15 мин;
-
одновременно оценить другие возможные причины нарушенной оксигенации;
-
при возможности проведения ЭхоКГ - контролировать ФВ (норма - 60-80%), увеличивать дозу добутамина до нормализации сократительной способности миокарда, допустимо до 20-25 мкг/кг в минуту;
-
при одновременном развитии гипотонии - присоединить допамин, увеличивая дозу с 5 мкг/кг в минуту, при неэффективности - эпинефрин (Адреналин♠);
-
при нарушенной оксигенации - увеличивать концентрацию кислорода во вводимой смеси.
-
-
Артериальная гипотония развивается вследствие нарушения регуляции периферического сосудистого тонуса в условиях резко изменившейся гемодинамической ситуации. При сохраняющейся гипотензии после проверки дозировки наркотических анальгетиков терапию следует начать с введения допамина. При отсутствии реакции на увеличение дозы допамина - вводить гидрокортизон внутривенно по 1-2 мг/кг в сутки в 2-3 введения или дексаметазон по 0,1 мг/кг и далее по 0,05 мг/кг внутривенно каждые 12 ч. При отсутствии эффекта - эпинефрин (Адреналин♠).
-
Пневмоторакс. Обнаружение небольшого количества воздуха в грудной полости непосредственно после операции может быть связано с неполным его удалением при зашивании грудной полости. Если этот воздух не препятствует работе легких и отсутствуют признаки напряженного пневмоторакса, дренировать грудную полость и удалять воздух не нужно.
Значительно реже возможно развитие артериальной гипертонии (вследствие резкого прекращения шунтирования и увеличения сердечного выброса), ателектаза легкого, хилоторакса.
Имеются также описания формирования пареза левой голосовой связки после хирургической коррекции артериального протока в периоде новорожденности [7, 8]. В дальнейшем редко возможны формирование деформаций грудной клетки и сколиоз.
Кроме того, описано влияние хирургической коррекции ОАП на отдаленные исходы. Существует связь хирургической коррекции с увеличением частоты неблагоприятных неврологических исходов, таких как детский церебральный паралич, задержка умственного развития, слепота, потеря слуха, требующая аппаратной коррекции, а также повышение риска развития тяжелой ретинопатии недоношенных и БЛД [9-11].
СПИСОК ЛИТЕРАТУРЫ
-
Clyman R.I., Couto J., Murphy G.M. Patent ductus arteriosus: are current neonatal treatment options better or worse than no treatment at all? // Semin. Perinatol. 2012. Vol. 36. P. 123-129.
-
Arayici S., Kadioglu S.G., Oncel M.Y. et al. The effect of histological chorio-amnionitis on the short-term outcome of preterm infants ≤32 weeks: a single-center study // J. Matern. Fetal Neonatal Med. 2014. Vol. 27, N 11. P. 1129-1133.
-
Chock V.Y., Punn R., Oza A. et al. Predictors of bronchopulmonary dysplasia or death in premature infants with a patent ductus arteriosus // Pediatr. Res. 2014. Vol. 75, N 4. P. 570-575.
-
Ohlsson A., Walia R., Shah S.S. Ibuprofen for the treatment of patent ductus arteriosus in preterm and/or low birth weight infants // Cochrane Database Syst. Rev. 2013. Vol. 4. CD003481. doi: 10.1002/14651858.CD003481.pub5.
-
Ohlsson A., Shah P.S. Paracetamol (acetaminophen) for patent ductus arteriosus in preterm or low birth weight infants // Cochrane Database Syst. Rev. 2018. Vol. 4. CD010061. doi: 10.1002/14651858.CD010061.pub3.
-
Clyman R., Wickremasinghe A., Jhaveri N. et al.; Ductus Arteriosus Feed or Fast with Indomethacin or Ibuprofen (DAFFII) Investigators. Enteral feeding during indomethacin and ibuprofen treatment of a patent ductus arteriosus // J. Pediatr. 2013. Vol. 163, N 2. P. 406-411.
-
Strychowsky J.E., Rukholm G., Gupta M.K., Reid D. Unilateral vocal fold paralysis after congenital cardiothoracic surgery: a meta-analysis // Pediatrics. 2014. Vol. 133, N 6. P. e1708-e1723.
-
Марасина А.В., Захарова М.Л., Мостовой А.В. и др. Парез левой голосовой складки после хирургического лечения открытого артериального протока у недоношенных детей // Уральский мед. журн. 2014. № 01 (115). С. 69-75.
-
Kabra N.S., Schmidt B., Roberts R.S., Doyle L.W. et al. Neurosensory impairment after surgical closure of patent ductus arteriosus in extremely low birth weight infants: results from the Trial of Indomethacin Prophylaxis in Preterms // J. Pediatr. 2007. Vol. 150, N 3. P. 229-234.
-
Vedovato S., Lo Iacono A., Morando C., Suppiej A. et al. Sensorineural hearing loss in very low birth weight infants with histological chorioamnionitis // J. Matern. Fetal Neonatal Med. 2015. Vol. 28, N 8. P. 895-899.
-
Chorne N., Leonard С., Piecuch R., Clyman R.I. Patent ductus arteriosus and its treatment as risk factors for neonatal and neurodevelopmental morbidity // Pediatrics. 2007. Vol. 119. P. 1165-1171.
ПРИЛОЖЕНИЕ
Алгоритм ведения недоношенного новорожденного с гемодинамически значимым открытым артериальным протоком
ИНВАЗИВНЫЙ КАНДИДОЗ У НОВОРОЖДЕННЫХ
Согласовано и утверждено Российским обществом неонатологов и Российской ассоциацией специалистов перинатальной медицины
Авторы: Антонов А.Γ., Байбарина Е.Н., Балашова Е.Н., Володин Н.Н., Дегтярев Д.Н., Зубков В.В., Иванов Д.О., Ионов О.В., Карпова А.Л., Киртбая А.Р., Климко Н.Н., Крючко Д.С., Ленюшкина А.А., Любасовская Л.А., Нароган М.В., Никитина И.В. (модератор рабочей группы), Припутневич Т.В., Приходько Н.А., Родченко Ю.В., Рындин А.Ю., Чубарова А.И.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
-
Микоз - распространенное инфекционное заболевание, вызванное паразитическими патогенными и условно-патогенными микроскопическими грибами. Характер течения и тяжесть заболевания микозом зависят от вида гриба, локализации очага инфекции и состояния макроорганизма.
-
Кандидоз - грибковое заболевание, вызываемое дрожжеподобными грибами рода Candida. Всех представителей данного рода относят к условно-патогенным микроорганизмам.
-
Кандидоз новорожденного - инфекционное заболевание органов и систем новорожденного, вызванное грибами рода Candida.
-
Поверхностный (неинвазивный) кандидоз - инфекция, вызванная грибами рода Candida, которая сопровождается избыточным ростом колоний гриба на слизистых оболочках или в просвете полого органа.
-
Инвазивный кандидоз - тяжелая грибковая инфекция, вызванная грибами рода Candida, которая может проявляться кандидемией и/или вовлечением в процесс любых внутренних органов.
КРАТКАЯ ИНФОРМАЦИЯ
Определение
Инвазивный кандидоз - тяжелая грибковая инфекция, вызванная грибами рода Candida, которая может проявляться кандидемией и/или вовлечением в процесс любых органов и систем ребенка [29].
Этиология и патогенез
Candida spp. - одноклеточные дрожжеподобные грибы. Образуют псевдомицелий и мицелий. В настоящее время известно более 150 видов грибов рода Candida, среди которых основное значение как возбудители кандидоза имеют не более 10 видов (C. albicans, C. parapsilosis, C. lusitaniae, C. tropicalis и др.) [35, 36].
Candida spp. - естественные обитатели кожи и слизистых оболочек человека. Грибковая инфекция возникает при локальных и системных нарушениях противоинфекционной защиты организма человека.
Пути инфицирования: эндогенный и экзогенный.
При эндогенном пути инфицирования происходит адгезия грибов на поверхности кожи и/или слизистых оболочках, которая сопровождается инвазией в поверхностные слои покровных тканей с поражением стенки лимфатических и кровеносных сосудов, что приводит к гематогенному (при иммунодефицитных состояниях - и лимфогенному) распространению микроорганизмов с последующей генерализацией инфекционного процесса и диссеминацией в ткани внутренних органов. Может быть и негематогенный путь распространения, например, через слизистую оболочку ЖКТ в брюшную полость.
Экзогенный путь передачи грибов - через контаминированный хирургический инструментарий, внутрисосудистые катетеры, дренажи, при нарушении техники проведения ПП [35]. В последние годы у недоношенных детей, получающих лечение в условиях отделения реанимации и интенсивной терапии, наряду с кандидозом стали выявлять случаи инфекций, связанных с оказанием медицинской помощи, вызванных другими дрожжеподобными грибами (Malassezia spp., Rhodotorula spp. и др.) [13].
Эпидемиология
По данным экспертной группы Российской ассоциации специалистов перинатальной медицины, частота инвазивного кандидоза (ИК) у новорожденных в структуре инфекционно-воспалительных заболеваний составляет от 15 до 30%.
Частота возникновения ИК у новорожденных обратно пропорциональна сроку гестации и массе тела при рождении и составляет от 2,6 до 3,1% у новорожденных с ОНМТ и от 10 до 16% у новорожденных с ЭНМТ [19]. В 10% случаев грибы рода Candida являются причиной нозокомиального сепсиса у детей с ЭНМТ при рождении, находящихся на лечении в условиях ОРИТН [23].
Среди пациентов с ЭНМТ при рождении летальность на фоне ИК составляет 34% в сравнении с 14% у данной категории пациентов без ИК[38].
Показатель летальности при кандидемии составляет 20-40%, кандидозном менингите - 50%, а при поражении двух органов и более и/или систем данный показатель может увеличиваться до 57% [13, 15, 31, 38].
По данным литературы, кандидемию выявляют у 37-50% детей в сочетании с кандидозным менингитом [29, 31]. Частота изолированного кандидозного менингита при развитии инвазивного кандидоза у новорожденных достигает 10-20% [29].
Поражение почек диагностируют у 10-35% новорожденных на фоне кандидемии. Поражение почек, как правило, сопровождается кандидурией и в ряде случаев развитием почечной недостаточности [13, 29].
Код по Международной классификации болезней 10-го пересмотра [8]
Факторы риска развития инвазивного кандидоза
Основные факторы риска развития инвазивного кандидоза у новорожденных следующие [29].
-
Недоношенность (масса тела при рождении менее 1000 г и ГВ менее 27 нед).
-
Терапия антибактериальными препаратами широкого спектра действия, особенно цефалоспоринами III поколения и карбапенемами.
-
Использование в терапии антацидов и блокаторов Н2-рецепторов.
-
Наличие кандидозной инфекции у матери во время настоящей беременности и родов.
К поверхностным кандидозам относят кандидоз ЖКТ: кандидозный стоматит, глоссит, хейлит, гингивит, кандидоз верхних дыхательных путей, интертригинозный (пеленочный) дерматит.
Клинические проявления поверхностного кандидоза зависят от локализации очага поражения. Поражение кожи может выглядеть как интертригинозный, или пеленочный, дерматит, наиболее характерный для новорожденных. Высыпания на коже могут иметь характер распространенной макулопапулезной сыпи красного цвета, с фестончатыми краями, имеющей сливной характер, с последующим формированием эрозий. Сыпь может располагаться на любых участках тела. Поражение слизистой оболочки наиболее часто происходит в ротовой полости (молочница). На языке и слизистой оболочке ротовой полости появляются обильные белесоватые творожистые наложения. Клиническая картина развивается чаще всего на 5-14-й день жизни. Помимо молочницы, возможно развитие стоматита, глоссита, хейлита и гингивита [16, 17].
Кандидоз ЖКТ занимает третье место по частоте выявляемости у доношенных новорожденных, но находится на первом месте у недоношенных детей. При кандидозе ЖКТ у ребенка отмечаются диспепсические явления различной степени выраженности [29]. Следует отметить, что развитие поверхностного кандидоза верхних дыхательных путей наиболее вероятно у новорожденных, находящихся на традиционной ИВЛ [3,13]. Для кандидоза мочеполовой системы характерны умеренный лейкоцитоз, незначительная протеинурия, наличие дрожжевых клеток и/или псевдомицелия гриба в моче [29, 32]. При выявлении Candida spp. в моче обязательно следует исключить наличие ИК.
Клиническая картина
Клиническая картина ИК неспецифична и имеет все признаки воспалительного процесса. Наблюдаются как локальные, так и общие симптомы инфекции. О развитии ИК могут свидетельствовать нарастание признаков инфекционного токсикоза вплоть до появления полиорганной недостаточности [10]. Диссеминированный кандидоз (грибковый сепсис) протекает в виде кандидемии либо в сочетании кандидемии и поражения внутренних органов. Частота развития кандидемии у новорожденных обратно пропорциональна сроку гестации и массе тела при рождении и составляет у новорожденных с ОНМТ при рождении 2-6,8%, в то время как у новорожденных с ЭНМТ достигает 16% [29]. Заболеваемость ИК увеличивается с 3% в 28 нед гестации до 24% в 24 нед гестации [32]. По данным ряда авторов, среди пациентов с ЭНМТ при рождении частота кандидемии составляет 7%, при этом показатели летальности могут достигать 30% [20]. Очень важно, что кандидемия часто является промежуточным этапом в процессе диссеминации грибов, поэтому функциональные методы диагностики, такие как эхокардиография, НСГ, офтальмоскопия, ультразвуковое исследование почек, являются необходимыми диагностическими мероприятиями у новорожденных.
При развитии кандидозного менингита клинические проявления в первые дни и недели заболевания выражены незначительно, отмечаются признаки медленно нарастающего гипертензионного или гипертензионно-гидроцефального синдрома. Характерна глазная симптоматика: симптом Грефе, нистагм, страбизм. Температурная реакция может отсутствовать или быть субфебрильной [3]. В ряде случаев отмечаются характерные изменения при исследовании спинномозговой жидкости: при умеренном повышении показателей цитоза наблюдается значительное повышение содержания белка [16]. Тем не менее при исследовании спинномозговой жидкости после поясничной пункции показатели находятся в пределах нормативных значений у половины новорожденных с кандидозным менингитом. Летальность при подтвержденных грибковых менингитах высока и может достигать 50% [16]. При ИК у новорожденных в 1-10% случаев отмечаются явления кандидозного эндокардита [31]. Чаще повреждаются митральный и трикуспидальный клапаны, возможно повреждение миокарда и перикарда. Симптомы заболевания сходны с бактериальным эндокардитом.
На электрокардиограмме отмечаются признаки перегрузки правых отделов. По данным эхокардиографии обнаруживают типичные признаки эндокардита [17, 29, 32].
На фоне длительной кандидемии (более 5 дней) возможно развитие грибкового поражения печени и селезенки [17, 29, 32], а также кандидозного остеомиелита или остеоартрита [29, 32]. У новорожденных также отмечены случаи перфорации кишечника с развитием кандидозного перитонита [32].
ДИАГНОСТИКА
Анамнез
Необходимо уточнение данных анамнеза матери в отношении:
Физикальное обследование
При подозрении на грибковую инфекцию необходимо проводить осмотр новорожденного в родильном блоке и в неонатальных отделениях (таких как реанимация и интенсивная терапия, патология новорожденных, хирургия новорожденных) на наличие клинических проявлений кандидоза в виде поражений кожи и слизистых оболочек, признаков инфекционного токсикоза (бледность, сероватый колорит кожного покрова и др.), диспепсических расстройств (вздутие живота, ослабление перистальтики, нарушение усвоения ЭП), признаков нарушения мочеотделения (олиго- и/или анурия), дыхательных нарушений (бради- и/ или тахипноэ, апноэ, лабильность насыщения гемоглобина крови кислородом, нарастание потребности в дополнительной подаче кислорода, потребность в респираторной терапии) и гемодинамических расстройств (тахи- и/или брадикардия, артериальная гипотензия), наличие желтухи, гепатоспленомегалии, геморрагических нарушений.
Лабораторная диагностика
Микробиологические методы
-
Посев крови является «золотым стандартом» диагностики системных инфекций у новорожденных, включая инвазивный кандидоз. Согласно рекомендациям ESCMID (2012), при подозрении на развитие кандидемии следует осуществлять посев крови у новорожденных в количестве не менее 2 мл не менее 2 раз в сутки в течение 3 дней подряд. Однако, учитывая значительные технические трудности, связанные с осуществлением пункций интактных вен у недоношенных новорожденных, а также принимая во внимание величину ОЦК у детей с ОНМТ и ЭНМТ при рождении 80-90 мл на 1 кг массы тела, допускается взятие от 1 до 2 мл крови на одно исследование. При этом сбор необходимого объема крови проводится в соответствии с инструкцией производителя флаконов для гематологических анализаторов.
-
В некоторых случаях в качестве экспресс-метода для диагностики микозов возможно использование прямой микроскопии нативного материала (крови, мочи, биоптатов, мазков со слизистых оболочек) с последующей окраской мазков по Граму или метиленовым синим при 1000-кратном увеличении с иммерсией не менее чем в 100 полях зрения. Однако диагностическая ценность прямой микроскопии низка, что связано с тем, что для визуализации дрожжевых клеток или псевдомицелия гриба обсемененность биологического материала должна составлять не менее 104 КОЕ/мл. При низком титре возбудителя в биологическом материале вероятность визуализации возбудителя в нативном материале крайне низка.
-
При подозрении на развитие кандидоза мочевыделительной системы необходимо осуществить посев мочи, собранной через стерильный мочевой катетер.
При выявлении Candida spp. в моче необходимо исключить развитие кандидемии и кандидоза ЦНС. Г. У всех детей при подозрении на развитие кандидоза проводится классическое культуральное исследование соскоба со слизистых оболочек зева и ануса новорожденного путем посева клинического материала на зарегистрированные в РФ селективные питательные среды (агар Сабуро, агар Диксона) с дальнейшим определением вида гриба по биохимическим показателям (с использованием автоматических бактериологических анализаторов или зарегистрированных в РФ тест-систем) или методом матрично-ассоциированной лазерной десорбции/ионизации на времяпролетном масс-спектрометре (MALDI-TOF). Для видовой дифференцировки видов грибов допускается использование хромогенных сред (различные виды грибов образуют на поверхности питательного агара колонии разного цвета). Окраска колоний зависит от производителя питательной среды, оценку видовой принадлежности грибов проводят в соответствии с инструкцией производителя.
Колонизация нескольких локусов (3 и более) является независимым фактором риска и предиктором прогрессирования для грибкового сепсиса (Manzoni P., 2006). Д. При выявлении кандидемии следует исключить поражение почек и ЦНС. При подозрении на развитие инвазивного кандидоза ЦНС необходимо проведение поясничной пункции с последующим культуральным исследованием спинномозговой жидкости. Посевы крови, спинномозговой, асцитической и плевральной жидкостей производят с использованием флаконов с жидкой питательной средой для культивирования в автоматических гематологических анализаторах. При наличии в лаборатории масс-спектрометра рекомендуется проведение прямой идентификации грибов из положительной гемокультуры методом MALDI-TOF-MS-анализа, при отрицательномрезультате - осуществление высева на плотные питательные среды с последующей биохимической или MALDI-TOF-MS-идентификацией выросших колоний грибов [13].
Определение чувствительности выделенных изолятов грибов к анти-микотическим препаратам можно проводить с помощью автоматических бактериологических анализаторов или использовать зарегистрированные в РФ тест-системы для определения чувствительности грибов к антимикотическим препаратам.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1a).
Молекулярно-генетические методы
В настоящее время в РФ отсутствуют зарегистрированные стандартизированные коммерческие тест-системы для полимеразной цепой реакции (ПЦР) для выявления грибов Candida. Рутинное применение методов полимеразной цепной реакции для диагностики инвазивного кандидоза в клиниках страны невозможно.
Другие диагностические тесты
-
Определение маннана (компонента клеточной стенки Candida) и антител к маннану в сыворотке крови методом иммуноферментного анализа - единственные зарегистрированные в нашей стране иммунологические тесты для диагностики инвазивного кандидоза. Данные тесты имеют высокую чувствительность и специфичность (80 и 93% соответственно) лишь при совместном их выполнении. Следует отметить, что при ИК, вызванном видами Candida non-albicans, имеется низкая экспрессия маннана, следовательно, выше риск получения ложно-отрицательных значений. Минимальный объем крови, необходимый для исследования, составляет 1 мл. Эффективность применения этого метода диагностики инвазивного кандидоза у новорожденных изучена недостаточно.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3). -
Методики определения 1,3-b-D-глюкана и антител к ростовым трубкам C. albicans (CAGTA) в настоящее время проходят процесс регистрации в РФ и не могут быть использованы в клинической практике.
-
Изменения общего анализа крови являются неспецифическими, наиболее часто отмечаются анемия и тромбоцитопении.
Функциональные и инструментальные методы диагностики
Функциональные и инструментальные методы диагностики служат, как правило, для выявления очагов диссеминации грибкового процесса у пациентов.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1a).
Алгоритмы диагностики грибковых инфекций у новорожденных представлены в приложениях 1-2.
ЛЕЧЕНИЕ ИНВАЗИВНОГО КАНДИДОЗА. АНТИМИКОТИЧЕСКАЯ ПРОФИЛАКТИКА
Основные принципы терапии инвазивного кандидоза
Эмпирическая и целенаправленная антимикотическая терапия
-
Стартовая эмпирическая антимикотическая терапия должна быть назначена не позднее первых 12 ч от момента подозрения на наличие инвазивного кандидоза и/или выявления Candida spp. при посеве крови и/ или материала из иных стерильных локусов (спинномозговой жидкости, плевральной жидкости и др.).
-
Максимально раннее начало эмпирической антимикотической терапии улучшает последующий прогноз в плане выживаемости и снижения инвалидизации у новорожденных.
-
После получения результатов микробиологических исследований крови и/или материала из иных стерильных локусов необходимо выполнить коррекцию эмпирической антимикотической терапии.
-
Целенаправленная антимикотическая терапия должна быть назначена с учетом чувствительности выявленного возбудителя к антимикотическим препаратам.
-
Наряду с проведением целенаправленной антимикотической терапии необходимо осуществлять замену всех сосудистых и иных катетеров, эндотрахеальной трубки, любых видов дренажей с момента постановки диагноза инвазивного кандидоза. Отсроченное удаление катетеров при кандидемии может быть связано с увеличением показателей летальности у новорожденных.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 2a).
Алгоритм терапии инвазивного кандидоза у новорожденных представлен на рис. 1, 2.
Длительность терапии ИК должна составлять не менее 14 дней от первого отрицательного результата посева крови или материала из очага поражения.
При поражении ЦНС лечение инвазивного кандидоза продолжают в течение 4 нед после исчезновения клинических симптомов инфекции и отрицательного результата посева спинномозговой жидкости.
При терапии кандидозного эндокардита, медиастинита или остеомиелита сроки лечения могут составлять более 6 мес. В этих случаях необходимо сочетание терапии противогрибковыми лекарственными средствами с хирургическим лечением.
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2a).

Рис. 1. Алгоритм антимикотической терапии при клиническом подозрении на развитие инвазивного кандидоза до момента получения микробиологического подтверждения
Рис. 2. Алгоритм терапии инвазивного кандидоза у новорожденных
Профилактика ИК у новорожденных включает [29]:
-
инфекционный контроль в отделениях реанимации новорожденных;
-
ограничение применения в терапии новорожденных блокаторов H2-рецепторов и стероидов;
-
раннее начало энтерального кормления молозивом и нативным материнским молоком;
-
антимикотическую профилактику у пациентов групп риска развития инвазивного кандидоза.
Показания к специфической антимикотической профилактике флуконазолом новорожденным - пациентам ОРИТН следующие.
-
Всем новорожденным с ЭНМТ при частоте ИК у детей, находящихся в отделении, более 2%.
-
Детям с ЭНМТ (при частоте ИК в отделении менее 2%) в случае наличия таких дополнительных факторов риска, как центральный венозный катетер, наличие уретрального катетера, АБТ карбапенемами или цефалоспоринами III-IV поколения.
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2a).
Специфическая антимикотическая профилактика проводится флуконазолом в дозе 3-6 мг/кг в сутки внутривенно или внутрь 2 раза в неделю во время пребывания в отделении реанимации и интенсивной терапии и при наличии факторов риска развития ИК. Длительность профилактики не должна составлять более 6 нед.
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2a).
Необходимо начинать с внутривенных форм препарата с последующим переходом на прием внутрь.
При лечении инвазивного кандидоза у новорожденных следует проводить контроль за уровнем ферментов печени (щелочной фосфатазы, аспартатаминотрансферазы, аланинаминотрансферазы) и креатинина 1 раз в неделю, учитывая потенциальную гепатотоксичность и нефротоксичность противогрибковых препаратов.
Препараты первой линии, используемые для целенаправленной антимикотической терапии у новорожденных, представлены в табл. 1.
Таблица 1. Препараты для целенаправленной антимикотической терапии у новорожденных в зависимости от вида выявленного возбудителя [15]
| Возбудители | Препарат первой линии |
|---|---|
C. albicans |
Флуконазол |
C. parapsilosis |
Флуконазол. Эхинокандины. Амфотерицин B [липосомальный] |
C. tropicalis, C. glabrata, C. krusei, C. guillermondii, C. famata, C. norvegensis |
Эхинокандины |
Среди антимикотических препаратов из группы эхинокандинов лишь микафунгин разрешен к применению в неонатологии (табл. 2).
Таблица 2. Использование антимикотических препаратов в неонатологии
| Препарат | Возможность назначения детям |
|---|---|
Микафунгин |
Да, в том числе новорожденным |
Каспофунгин |
С 3 мес |
Анидулафунгин |
Нет |
Рекомендуемые дозы микафунгина при лечении инвазивного кандидоза у новорожденных, в том числе недоношенных детей, представлены в табл. 3.
Таблица 3. Дозы микафунгина при лечении инвазивного кандидоза у новорожденных, в том числе недоношенных детей
| Параметр | Дозы | Ссылки |
|---|---|---|
Микафунгин |
4-10 мг/кг в сутки, при отсутствии эффекта и подозрении на развитие инфекции ЦНС (гематогенный кандидозный менингоэнце-фалит) 10 мг/кг в сутки |
Инструкция по медицинскому применению препарата |
2-4 мг/кг в сутки |
Natarajan, 2009; Антонов А.Г., 2012 [2] |
|
4-10 мг/кг в сутки. 10 мг/кг в сутки при гематогенном кандидозном менингоэнцефалите |
ESCMID 2012. Clin. Microbiol. Infect 2012. Vol. 18 (Suppl. 7). P. 38-52 [29] |
|
Продолжительность курса |
Не менее 15 дней |
Natarajan, 2009; Антонов А.Г., 2012 [2] |
РЕАБИЛИТАЦИЯ
Специфических мероприятий по реабилитации после болезни нет. В подавляющем большинстве случаев реабилитация не требуется, а при необходимости проводится по общепринятым алгоритмам и протоколам.
ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
Профилактика грибковых инфекций у новорожденных должна начинаться во время беременности и после рождения ребенка. Профилактические мероприятия включают:
СПИСОК ЛИТЕРАТУРЫ
-
Антонов А.Г., Никитина И.В., Митрохин С.Д. Клинические рекомендации по профилактике и лечению грибковых инфекций у новорожденных в условиях отделения реанимации и интенсивной терапии // Неонатология: новости, мнения, обучение. 2013. № 2. С. 80-88.
-
Антонов А.Г., Приходько Н.А., Анкирская А.С. Лечение грибковой инфекции у глубоко недоношенных детей // Рос. вестн. перинатол. и педиатр. 2012. Т. 57, № 5. С. 13-16.
-
Веселов А.В., Козлов Р.С. Инвазивный кандидоз: современные аспекты эпидемиологии, диагностики, терапии и профилактики у различных категорий пациентов // Клин. микробиол. и антимикроб. химиотерап. 2016. Т. 18, № 2. С. 286-304.
-
Веселов А.В., Климко Н.Н., Кречикова О.И., Клясова Г.А. и др. In vitro активность флуконазола и вориконазола в отношении более 10 000 штаммов дрожжей: результаты 5-летнего проспективного исследования ARTEMIS Disk в России // Клин. микробиол. и антимикроб. химиотер. 2008. Т. 10, № 4. С. 345-354.
-
Колбин А.С. и др. Частота инвазивного кандидоза у недоношенных новорожденных, рожденных на сроке гестации менее 32 недель // Клин. микробиол. и антимикроб. химиотер. 2005. Т. 7, № 2. С. 189-194.
-
Кулага В.В., Романенко И.М., Афонин С.Л. Грибковые болезни и их осложнения. М.: МИА, 2010.
-
Любасовская Л.А., Припутневич Т.В., Анкирская А.С., Дегтярев Д.Н. и др. Особенности микробной колонизации новорожденных в отделении реанимации и интенсивной терапии // Рос. вестн. перинатол. и педиатр. 2013. № 3. С. 87-91.
-
Международная классификация болезней десятого пересмотра МКБ-10 (принята 43-й Всемирной ассамблеей здравоохранения).
-
Никитина И.В., Ионов О.В., Приходько Н.А. Современные подходы к диагностике, терапии и профилактике инвазивных микозов у новорожденных // Неонатология. 2014. № 4. С. 64-72.
-
Никитина И.В., Ионов О.В., Приходько Н.А., Припутневич Т.В. и др. Инвазивные микозы в неонатологии: профилактика, диагностика и терапия // Акуш. и гин. 2015. № 4. С. 84-90.
-
Припутневич Т.В. Оптимизация микробиологической диагностики оппортунистических инфекций у беременных и новорожденных на основе протеометрических и молекулярно-генетических методов: автореф. дис. … д-ра мед. наук. М., 2014.
-
Припутневич Т.В., Мелкумян А.Р., Ильина Е.Н., Митрохин С.Д. и др. Прямая идентификация микроорганизмов из гемокультур с помощью метода MALDI-TOF-MS в сравнении с методом ПЦР // Клин. микробиол. и антимикроб. химиотер. 2014. Т. 16, № 1. С. 21-26.
-
Приходько Н.А. Совершенствование диагностики, профилактики и лечения инвазивных микозов у недоношенных новорожденных в условиях стационара: автореф. дис. … канд. мед. наук. М., 2016.
-
Приходько Н.А., Припутневич Т.В., Никитина И.В., Ионов О.В. и др. Применение препарата микафунгин при лечении инвазивных кандидозов у недоношенных детей в условиях отделения реанимации и интенсивной терапии новорожденных // Неонатология. 2015. № 4. С. 84-90.
-
Диагностика и лечение микозов в отделениях реанимации и интенсивной терапии: Российские рекомендации. 2-е изд. доп. и перераб. / отв. ред. Н.Н. Климко. М.: Фармтек, 2015. 96 с.
-
Самсыгина Г.А., Буслаева Г.Н. Кандидоз новорожденных и детей первых месяцев жизни. М., 2008. С. 108-110.
-
Сергеев А.Ю., Сергеев Ю.В. Грибковые инфекции: руководство для врачей. М., 2008.
-
Шухов В.С., Байбарина Е.Н., Рюмина И.И., Зубков В.В. Антимикробная терапия у детей: практическое руководство М.: ГЭОТАР-Медиа, 2016. 320 с.
-
Aliaga S., Clark R., Laughon M. et al. Changes in the incidence of candidiasis in neonatal intensive care units // Pediatrics. 2014. Vol. 133, N 2. P. 236-242.
-
Ascher S.B. Antifungal therapy and outcomes in infants with invasive Candida infections // Pediatr. Infect. Dis. J. 2012. Vol. 31. Р. 439-443.
-
Austin N., Guire W. Prophylactic systemic antifungal agents to prevent mortality and morbidity in very low birth weight infants // Cochrane Database Syst. Rev. 2015. Vol. 10. CD003850.
-
Barton M. Invasive candidiasis in low birth weight preterm infants: risk factors, clinical course and outcome in a prospective multicenter study of cases and their matched controls // BMC Infect. Dis. 2014. Vol. 14. Р. 327.
-
Benjamin D., Stoll B., Fanaroff A. et al. Neonatal candidiasis among extremely low birth infants: risk factors, mortality rates, and neurodevelopmental outcomes at 18 to 22 months // Pediatrics. 2006. Vol. 117. P. 84-92.
-
Calderone R., Clancy C. (eds). Candida and Candidiasis. Washington: AMS Press, 2012. 524 p.
-
Gaitanis G., Magiatis P., Hantschke M. The Malassezia genus in skin and systemic diseases // Clin. Microbiol. Rev. 2012. Vol. 25. P. 106-133.
-
Gow N., van de Veedonk F., Broun A. et al. Candida albicans morphogenesis and host defence: discriminating invasion from colonization // Nat. Rev. Mi-crobiol. 2012. Vol. 10, N 2. P. 112-122.
-
Greenberg R.G., Benjamin D.K. Neonatal candidiasis: diagnosis, prevention, and treatment // J. Infect. 2014. Vol. 69. Р. 19-22.
-
Greenberg R.G., Benjamin D.K., Gantz M.G., Cotton C.M. et al. Empiric antifungal therapy and outcomes in extremely low birth weight infants with invasive candidiasis // J. Pediatr. 2012. Vol. 161. P. 264-269.
-
Hope W.W. et al. ESCMID Guideline for the diagnosis and management of Candida diseases 2012: prevention and management of invasive infections in neonates and children caused by Candida spp // Clin. Microbiol. Infect. 2012. Vol. 18, N 7. P. 38-52.
-
Hospenthal D.R., Rinaldi M.G. Diagnosis and Treatment of Human Mycoses. Totowa: Humana Press, 2013. Р. 16-18.
-
Pappas P.G., Kauffman C.A., Andes D.R. et al. Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America // Clin. Infect. Dis. 2015. Vol. 62, N 4. P. 1-50.
-
Kaufman D. Fungal infections in preterm infants // Medscape. Jun 25, 2014.
-
Kaufman D.A., Manzoni P. Strategies to prevent invasive candidal infection in extremely preterm infants // Clin. Perinatol. 2010. Vol. 37, N 3. P. 611-628. doi: 10.1016/j.clp.2010.06.003.
-
Naidoo E. Neonatal invasive fungal infection in England 2004-2010 // Clin. Microbiol. Infect. 2014. Vol. 20, N 9. P. 936-941.
-
Van de Veerdonk F., Kullberg B., Netea M. Pathogenesis of invasive candidiasis // Curr. Opin. Crit. Care. 2010. Vol. 16, N 5. P. 453-459.
-
Wey S.B., Wenzel R. et al. A guide to infection control in the hospital. B.C. Decker, 1998. P. 154-158.
-
Zilberberg M., Shorr Α., Kollef Μ. Sekular trends in candidemia-related hospitalization in the United States, 2000-2005 // Infect. Control HosP. Epidemiol. 2008. Vol. 29, N 10. P. 978-980.
-
Zaoutis T., Heydon K., Locatio R. Outcomes attributable to neonatal candidiasis // Clin. Infect. Dis. 2007. Vol. 44, N 9. P. 1187-1193.
ПРИЛОЖЕНИЯ
Приложение 1. Алгоритм диагностики грибковых инфекций у недоношенных новорожденных в условиях отделения реанимации и интенсивной терапии новорожденных в первые 24 ч жизни
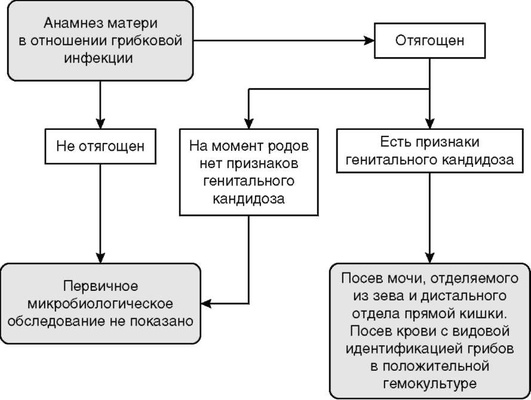
Приложение 2. Алгоритм диагностики грибковых инфекций у недоношенных новорожденных после 24 ч жизни (в отделении реанимации и интенсивной терапии новорожденных и отделении патологии новорожденных и недоношенных детей)

ВРОЖДЕННАЯ ПНЕВМОНИЯ
Согласовано и утверждено Российским обществом неонатологов и Российской ассоциацией специалистов перинатальной медицины
Авторы: Антонов А.Γ., Байбарина Е.Н., Балашова Е.Н., Дегтярев Д.Н., Зубков В.В., Иванов Д.О., Ионов О.В., Карпова А.Л., Киртбая А.Р., Крохина К.Н., Крючко Д.С., Ленюшкина А.А., Ли А.Γ., Малютина Л.В., Мебелова И.И., Никитина И.В., Петренко Ю.В., Рындин А.Ю., Рюмина И.И., Романенко В.А.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Пневмония - острое инфекционное заболевание с преимущественным поражением респираторных отделов легких и накоплением воспалительного экссудата внутри альвеол, выявляемого при объективном и рентгенологическом исследованиях.
КРАТКАЯ ИНФОРМАЦИЯ
Определение
Врожденная пневмония - острое инфекционное заболевание с преимущественным поражением респираторных отделов легких и накоплением воспалительного экссудата внутри альвеол, выявляемого при объективном и рентгенологическом исследованиях, как правило, в первые 72 ч жизни [1, 2].
Этиология и патогенез
Причиной врожденной пневмонии является внутриутробное или интранатальное инфицирование плода микроорганизмами различной этиологии трансплацентарным, восходящим или контактным путем. Возбудителями врожденной пневмонии являются [1, 3-6]:
-
бактерии: Escherichia coli, Enterobacter aerogenes, Klebsiella spp., Pseudomo-nas aeruginosa, Group B Streptococcus, Staphylococcus epidermidis, Staphylococcus aureus, Haemophilus influenza, Кlebsiella pneumoniae, Pneumococcus;
-
Атипичные возбудители: Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Mycoplasma pneumoniae, Listeria monocytogenes, Treponema pallidum, Mycobacterium tuberculosis;
-
вирусы: Herpes simplex virus, Cytommegalovirus (CMV), Respiratory syncytial virus, Rubella;
Патогенез и патологическая анатомия
Большую роль в развитии врожденной пневмонии играют инфекционно-воспалительные заболевания органов мочевой и половой систем матери (пиелонефрит, хориоамнионит, эндометрит и т.д.), гестационная зрелость плода, состояние системы сурфактанта и бронхолегочного аппарата, пороки развития бронхиального дерева, перенесенная внутриутробная гипоксия, асфиксия в родах, аспирация мекония и околоплодных вод. Недоношенность, респираторный дистресс-синдром (РДС), нарушение сердечно-легочной адаптации, гипоксия плода способствуют развитию инфекционного процесса вследствие функциональной, морфологической и иммунологической незрелости ткани легких.
Заболевание развивается вследствие гематогенного заноса возбудителя в последние дни или недели беременности, или в результате инфицирования легких при поступлении в них околоплодных вод (зараженных при эндометрите, хориоамнионите и т.д.), или при аспирации инфицированного содержимого родовых путей. Во всех случаях обнаруживают двустороннее поражение легких (как альвеол, так и интерстиция). Данные изменения обусловливают возникновение после рождения гиперкапнии, гипоксемии, смешанного ацидоза и гипоксии, ухудшение синтеза сурфактанта, что вызывает появление ателектазов, паренхиматозного отека легких, повышение внутрилегочного давления. В результате прогрессирующей гипоксии, ацидоза и нарушения микроциркуляции очень быстро развивается полиорганная недостаточность (вначале сердечно-легочная, затем других органов).
Рентгенологическая картина пневмоний определяется типом инфильтрации ткани и стадией воспаления [6].
Типы инфильтрации:
-
альвеолярный тип инфильтрации - наблюдается при заполнении воспалительным экссудатом воздухсодержащих альвеол (уплотнение, консолидация воздухсодержащих пространств);
-
интерстициальный тип инфильтрации - наблюдается при заполнении экссудатом межальвеолярных пространств, при этом альвеолы содержат воздух (симптом матового стекла).
Стадии воспаления.
-
Стадия инфильтрации (первая неделя болезни). Затенение легочной ткани без четких контуров и границ, которое, как правило, локализуется в периферических отделах сегментов и долей. В определенных участках затенение может быть ограничено межсегментарными или междолевыми перегородками, в смежных сегментах выявляются реакции интерстициума.
-
Стадия рассасывания (вторая неделя болезни). Продолжительность и интенсивность инфильтрации уменьшаются, возможна визуализация дольковых затенений и очаговых теней различного размера в сочетании с участками легочной ткани обычной или повышенной пневматизации на фоне усиления легочного рисунка за счет интерстициального компонента.
-
Стадия интерстициальных изменений (конец второй - начало третьей недели). Инфильтративные изменения отсутствуют, выявляются интерстициальные изменения на месте инфильтрации в виде перибронхиальных изменений, сетчатой деформации легочного рисунка, тяжистости.
Эпидемиология
Заболеваемость пневмонией среди доношенных новорожденных, по литературным источникам, составляет около 1%, а у недоношенных - около 10%. Летальность при врожденной пневмонии составляет 5-10% [5].
По данным официальной статистики, в РФ за 2015 г. врожденная пневмония диагностирована у 0,98% недоношенных новорожденных с массой тела при рождении 1000 г и более и у 20,77% новорожденных - от 500 до 999 г. Летальность от врожденной пневмонии доношенных новорожденных составила 1,66%, недоношенных детей, родившихся с массой тела 1000 г и более, - 2,3%, детей, родившихся с ЭНМТ, - 11,8% (форма № 32).
Коды по Международной классификации болезней 10-го пересмотра
Врожденная пневмония (Р23).
-
Р23.3 Врожденная пневмония, вызванная стрептококками группы В.
-
Р23.4 Врожденная пневмония, вызванная кишечной палочкой (Esche-richia coli).
-
Р23.6. Врожденная пневмония, вызванная другими бактериальными агентами: Haemophilus influenzae, Klebsiella, Mycoplasma, стрептококком, за исключением группы В.
-
Р23.8. Врожденная пневмония, вызванная другими возбудителями.
Реже врожденную пневмонию вызывают вирус краснухи, простого герпеса 2-го типа, цитомегаловирус, а также заболевание может быть проявлением врожденного бактериального сепсиса, врожденного туберкулеза, токсоплазмоза, листериоза, малярии и кандидоза, тогда оно регистрируется под кодом соответствующих инфекций (Р35 «Врожденные вирусные инфекции»). Пневмония как симптом раннего врожденного сифилиса регистрируется под кодом А50.
Термин «неонатальная пневмония» более емкий и объединяет врожденные (Р23), аспирационные (Р24) и приобретенные, в том числе нозокомиальные, пневмонии. Последние, в соответствии с МКБ-10, классифицируются по этиологическому принципу; для их статистического учета используются коды с буквенным обозначением J (класс Х «Болезни органов дыхания»).
Клиническая классификация
Неонатальные пневмонии классифицируются (табл. 1):
-
по времени возникновения: внутриутробная (врожденная, которая проявилась в первые 72 ч жизни) и неонатальная (ранняя и поздняя);
-
по этиологии: вирусная, бактериальная (микробная), паразитарная, грибковая, смешанная;
-
по распространенности процесса: очаговая, сегментарная, долевая, односторонняя, двусторонняя;
Таблица 1. Классификация неонатальных пневмоний (Сотникова К.А., 1985) [7]
| Период возникновения | Этиология | Тип | Тяжесть | Течение |
|---|---|---|---|---|
Внутриутробные (врожденные). Неонатальные (приобретенные):
|
|
Бронхопневмонии:
|
|
|
Клиническая картина
Ранние клинические симптомы врожденной пневмонии неспецифичны.
-
Дыхательные нарушения (тахипноэ от 60 и выше в покое, втяжение межреберий и/или западение грудины, инспираторное втягивание яремной вырезки над грудиной, раздувание крыльев носа, пенистое отделяемое изо рта). Данные клинические признаки неспецифичны и могут наблюдаться и при других патологических состояниях, в частности, при критических врожденных пороках сердца. В целях дифференциальной диагностики и исключения врожденного порока сердца необходимо провести гипероксический тест, измерение артериального давления на нижних и верхних конечностях, определить пре- и постдуктальное насыщение крови кислородом, эхокардиографию.
-
Общие признаки болезни и признаки инфекционного токсикоза: вялость, мышечная гипотония/дистония, мраморность и серый колорит кожи, бледность кожи с периоральным цианозом и/или акроцианозом, который усиливается при возбуждении или при кормлении, снижение тургора тканей, снижение или отсутствие сосательного рефлекса, отказ от кормления, нарушение терморегуляции (как гипертермия, так и отсутствие возможности удерживать тепло), появление ранней желтухи (без риска развития ГБН по системе АВ0 и резус-фактору).
-
-
при аускультации легких - ослабленное или жесткое дыхание, локализованные влажные мелкопузырчатые и крепитирующие хрипы, при слиянии очагов может выслушиваться бронхиальное дыхание. При ослабленном дыхании хрипы могут не выслушиваться;
-
при перкуссии грудной клетки - притупление перкуторного звука над проекцией инфильтрации легочной ткани.
-
Все описанные клинические проявления неспецифичны и могут наблюдаться у новорожденных на фоне других заболеваний дыхательной системы, поэтому в диагностике большое значение имеют факторы риска инфекционного процесса у новорожденного, рентгенологическое и лабораторное исследования.
ДИАГНОСТИКА
Анамнез
Факторы риска со стороны матери и ребенка:
Физикальное обследование
При осмотре обращают на себя внимание нестабильная температура (более 38,5 или менее 36 °С), снижение насыщения крови кислородом, тахипноэ более 60 в минуту или эпизоды апноэ, экспираторный стон, втяжение податливых участков грудной клетки, ослабленное дыхание, наличие разнокалиберных хрипов в легких, вялость, бледность, мраморность и сероватый оттенок кожи, отказ от сосания, сонливость или изменения неврологического состояния; вздутие живота, неусвоение пищи, тахикардия более 180 в минуту, глухость тонов сердца, снижение эффективности проводимой респираторной терапии, приводящее в том числе к усилению параметров ИВЛ; возможно гнойное содержимое в трахее.
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2b).
Инструментальная диагностика
-
Рекомендуется рентгенография грудной клетки.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1а).
Комментарии. Рентгенологическая картина зависит от фазы и тяжести заболевания. Диффузное снижение прозрачности легочных полей, ретикулогранулярный рисунок и полоски просветлений в области корня легкого (воздушная бронхограмма) неспецифичны и могут выявляться не только при врожденной пневмонии, но и при раннем неонатальном сепсисе, РДС. -
Рекомендуется проведение эхокардиографии, НСГ, ультразвукового исследования органов брюшной полости (зависит от технических возможностей медицинского учреждения).
-
Рекомендуется электрокардиография (при наличии отклонений со стороны сердечной деятельности: аритмии, выраженной брадиили тахикардии и т.п.).
-
Рекомендуется неинвазивный мониторинг основных показателей, особенно у новорожденных, нуждающихся в респираторной терапии (ЧCC, частота дыхания, артериальное давление, SaO2, температура тела, диурез).
Лабораторная диагностика
-
Бактериологические посевы (содержимого зева, аспирата из трахеи, кала, по возможности крови и др.) с определением чувствительности выделенной микрофлоры к антибиотикам.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1b). -
Рекомендуется исследование уровня С-реактивного белка в крови (СРБ) не ранее 6 ч жизни [8].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3).
Комментарии. Определение уровня СРБ и клинический анализ крови целесообразно повторить спустя 48 ч, если в первые сутки жизни ребенка диагноз поставить затруднительно. РДС характеризуется отрицательными маркерами воспаления и отрицательным результатом микробиологического исследования крови. Повышение уровня СРБ является ранним признаком бактериальной инфекции у доношенных детей, тогда как подобная закономерность между его концентрацией в крови у недоношенных детей и наличием у них инфекционной патологии четко не доказана.
Общий клинический анализ крови
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3).
-
Рекомендуется проведение полимеразной цепной реакции крови в режиме реального времени на грамположительную и грамотрицательную микрофлору, TORCH-инфекции, вирусы, атипичные возбудители и грибы в случае длительного нахождения матери на стационарном лечении во время данной беременности, проведение неоднократных курсов АБТ, гормональной и/или цитотоксической терапии, наличие у матери имплантированных органов или устройств (искусственные клапаны), а также в случае наличия факторов риска развития инфекции у матери.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3).
Комментарии. Проведение полимеразной цепной реакции крови зависит от технических возможностей лаборатории. -
Рекомендуется определение кислотно-основного состояния и газового состава крови, уровня лактата, глюкозы, билирубина.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3).
Комментарии. Определение лактата в крови зависит от технических возможностей экспресс-лаборатории и ее наличия. -
Не рекомендуется прокальцитониновый тест в диагностике врожденной пневмонии.
Комментарии. Метаанализ 22 рандомизированных исследований показал, что прокальцитониновый тест более чувствителен при диагностике нозокомиальной инфекции, а не врожденной [9]. Повышенный уровень прокальцитонина в сыворотке крови на 7-е сутки АБТ свидетельствует о необходимости продолжения или смены АБТ. Определение прокальцитонина не является обязательным тестом у новорожденных, выполнение его зависит от возможностей лаборатории медицинского учреждения.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3).
Критерии диагностики врожденной пневмонии
Для подтверждения диагноза используются две группы критериев: основной и вспомогательные. Диагноз врожденной пневмонии может быть подтвержден, если выявлен основной и/или три вспомогательных диагностических признака и более [5, 10].
1 Верхняя граница нормативных значений СРБ определяется используемым методом и типом анализатора.
Основной критерий диагностики врожденной пневмонии - наличие инфильтративных теней на рентгенограмме легких (в первые 3 сут жизни).
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1а).
Комментарии. Рентгенологические симптомы врожденной пневмонии не обладают необходимой специфичностью и достаточно вариабельны, поэтому только на их основании практически невозможно сделать заключение об этиологическом факторе воспалительного процесса. В большинстве случаев отмечается двустороннее поражение легочной ткани, как правило, в виде пятнистой картины легких - сочетание участков уплотнения легочной ткани и компенсаторного повышения воздушности. Может обнаруживаться выпот в плевральных полостях. Изменение легочной ткани в сочетании с плевральным выпотом позволяет с большой вероятностью предположить наличие бактериальной пневмонии, нежели какой-либо другой причины дыхательных нарушений, особенно если этиологическим фактором заболевания является стрептококк группы В [11-13]. Очаги уплотнения легочной ткани, как правило, затрагивают несколько долей. Выраженное уплотнение, ограниченное одной отдельно взятой долей, сравнительно редко встречается у новорожденных [14].
Вспомогательные диагностические критерии врожденной пневмонии
Представленная ниже таблица отражает общие признаки для диагностики у новорожденных сепсиса и пневмонии и используется в качестве доработанных вспомогательных диагностических критериев врожденной пневмонии.
О течении у ребенка инфекционного процесса свидетельствует наличие как минимум двух клинических и одного лабораторного признака (табл. 2).
Таблица 2. Клинико-лабораторные признаки течения инфекционного процесса у детей с постконцептуальным возрастом менее 44 нед [15]
| Клинические признаки инфекции | |||
|---|---|---|---|
Измененная температура тела:
|
|||
Проявления сердечно-сосудистой недостаточности:
|
|||
Респираторные нарушения:
|
|||
Проявления почечной недостаточности:
|
|||
Изменения кожи и подкожной клетчатки:
|
|||
Проявления со стороны ЖКТ:
|
|||
Неврологические проявления:
|
|||
Проявления геморрагического синдрома:
|
|||
Другие проявления:
|
|||
Лабораторные признаки инфекционного процесса |
|||
Содержание лейкоцитов:
|
|||
Абсолютное количество нейтрофилов:
|
|||
Возраст, ч |
>1500 г |
Возраст, ч |
≤1500 г |
0-6 |
<2000 кл/мкл |
0-6 |
<500 кл/мкл |
>6-12 |
<4000 кл/мкл |
>6-12 |
<1500 кл/мкл |
>12-24 |
<6000 кл/мкл |
>12-30 |
<1800 кл/мкл |
>24-48 |
<4000 кл/мкл |
>30-48 |
<1500 кл/мкл |
>48-72 |
<2000 кл/мкл |
>48 |
<1100 кл/мкл |
Отношение доли юных форм к общему количеству нейтрофилов (нейтрофильный индекс):
|
|||
Особенности морфологии нейтрофилов (исследуется в сомнительных случаях):
|
|||
Тромбоцитопения:
|
|||
Повышение уровней маркеров воспаления:
|
|||
Метаболический ацидоз:
|
|||
Исследование плаценты: такие изменения в плаценте, как децедуит, фунизит, инфильтрация тканей плаценты, могут косвенно указывать на реализацию инфекционного процесса у новорожденного и являются дополнительным фактором при постановке диагноза пневмонии у новорожденного (зависит от уровня лечебного учреждения, оказывающего помощь новорожденным) |
|||
Рентгенограмма грудной клетки:
|
|||
Эпизоды интолерантности к глюкозе, зарегистрированные как минимум дважды [при соответствующей возрасту скорости поступления декстрозы (Глюкозы♠)]:
|
|||
Воспалительные изменения в клиническом анализе мочи: лейкоцитурия свыше 10-15 в поле зрения в сочетании с бактериурией и протеинурией (содержание белка более 0,2 мг/л) - после 48 ч |
|||
Дифференциальная диагностика
ЛЕЧЕНИЕ ВРОЖДЕННОЙ ПНЕВМОНИИ
Консервативное лечение
Лечение врожденной пневмонии должно включать мероприятия одновременно по нескольким направлениям.
Этиотропная терапия
Антибактериальная терапия - основной элемент терапии врожденной пневмонии.
-
АБТ по подозрению на реализацию врожденной пневмонии показана в как можно более ранние сроки после рождения следующим категориям детей с дыхательными нарушениями: пациентам с ОНМТ при рождении, ЭНМТ при рождении, а также новорожденным, с рождения потребовавшим проведения ИВЛ. Предпочтительно начинать АБТ не позднее 2 ч жизни, новорожденным с ЭНМТ - в родильном зале. Первое введение препаратов стартовой схемы осуществляется одномоментно.
-
АБТ при наличии показаний по результатам первичного клинико-лабораторного исследования. К данной категории относятся пациенты массой свыше 1500 г при рождении, имевшие дыхательные нарушения, но не потребовавшие традиционной ИВЛ, а также находящиеся на неинвазивной дыхательной терапии (CPAP, неинвазивной ИВЛ) или пациенты без респираторной терапии.
-
АБТ, начатая по подозрению в первые сутки жизни, отменяется при отсутствии клинико-лабораторных и инструментальных данных, подтверждающих наличие врожденной пневмонии в течение 72 ч жизни.
-
При установленном диагнозе пневмонии эмпирическая схема АБТ продолжается 7 дней (минимальный курс АБТ при врожденной пневмонии), затем проводится клинико-лабораторное исследование с контролем маркеров воспаления. При нормализации уровней маркеров воспаления и клинического анализа крови (общего анализа крови) АБТ отменяется.
Схемы стартовой АБТ [приложение 2] [5, 18, 19].
-
Схема А: применение эмпирической АБТ - комбинации ампициллина + гентамицина.
-
Схема Б: предусматривает проведение АБТ у новорожденных, у матерей которых подтвержден высев микрофлоры, резистентной к препаратам эмпирической схемы АБТ. Целесообразно использовать защищенные пенициллины.
-
Комментарии. Предпочтение отдается парентеральному введению антибиотиков (внутривенно). Не рекомендуется назначать препараты, содержащие амоксициллин и клавулановую кислоту, в связи с возможным неблагоприятным воздействием клавулановой кислоты на кишечную стенку, особенно у недоношенных новорожденных. Нецелесообразно включение в стартовую схему АБТ вместо полусинтетического пенициллина цефалоспоринов из-за отсутствия активности в отношении Listeria monocitogenes [15].
-
Целенаправленная терапия рекомендуется после получения лабораторных анализов с определением чувствительности к антибактериальным препаратам. В случае отсутствия чувствительности выделенных возбудителей к препаратам стартовой схемы их необходимо заменить антибактериальными препаратами, к которым выявлена чувствительность.
Продолжительность и тактика АБТ определяются в каждом случае индивидуально и зависят от тяжести состояния ребенка и нормализации клинических и лабораторных данных.
Патогенетически обоснованная интенсивная терапия
В связи с тем что незрелость и недоношенность способствуют развитию пневмонии, клинические проявления в первые часы и сутки жизни неспецифичны, направление терапии практически ничем не отличается от таковой при РДС у новорожденных и принципы ее применения те же (см. Клинические рекомендации «Респираторный дистресс-синдром», 2017).
-
Рекомендуется профилактика гипотермии в родильном зале у недоношенных новорожденных [20, 21].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1a).
Комментарии. См. Методическое письмо Минздрава России от 21 апреля 2010 г. № 15-4/10/2-320 «Первичная и реанимационная помощь новорожденным детям» [22]. -
Рекомендуется отсроченное пережатие и пересечение пуповины при рождении.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1b).
Комментарии. Пережатие и пересечение пуповины спустя 60 с после рождения у недоношенных новорожденных с ОНМТ и ЭНМТ приводит к значительному снижению частоты некротического энтероколита, ВЖК, сепсиса, снижению потребности в гемотрансфузиях [23, 24]. -
Рекомендуется начать респираторную терапию в условиях родильного зала.
Уровень убедительности рекомендаций А (уровень достоверности доказательств lb).
Комментарии. Респираторная терапия является ключевым направлением в лечении дыхательных расстройств у новорожденных, включая детей с врожденной пневмонией. Она должна решать следующие задачи: достижение и поддержка адекватного газообмена и альвеолярной вентиляции, минимизация риска вентилятор-ассоциированного повреждения легких и нарушения кардиогемодинамики, достижение комфорта пациента путем ликвидации десинхронизации. На сегодняшний день появился ряд новых методов респираторной терапии у новорожденных, в том числе в родильном зале [18, 22, 25]. При ИВЛ преимущество отдается вентиляции с контролем по объему, поскольку данная стратегия определяет адекватный и постоянный дыхательный объем, а также минутную вентиляцию при низком давлении в дыхательных путях. Раннее начало респираторной терапии позволяет сократить ее длительность, ограничиться более мягкими параметрами вентиляции [3, 18, 22]. -
Рекомендуется инвазивная респираторная терапия в родильном зале: * при неэффективности CPAP и ИВЛ маской.
*Уровень убедительности рекомендаций А (уровень достоверности доказательств lb).
Комментарии. ИВЛ у недоношенных проводится при сохраняющейся на фоне CPAP брадикардии и/или при длительном (более 5 мин) отсутствии самостоятельного дыхания. Инвазивная ИВЛ в родильном зале под контролем дыхательного объема у глубоко недоношенных пациентов является перспективной технологией, позволяющей минимизировать ИВЛ-ассоциированные повреждения легких. -
Рекомендуется мониторинг показателей ЧCC и SрО2 методом пульсо-ксиметрии:** в родильном зале при оказании первичной и реанимационной помощи новорожденным.
Уровень убедительности рекомендаций А (уровень достоверности доказательств lb).
Комментарии. См. Методическое письмо Минздрава России от 21 апреля 2010 г. № 15-4/10/2-3204 «Первичная и реанимационная помощь новорожденным детям» [22]. -
Рекомендуется введение сурфактанта:
-
недоношенным детям с дыхательными расстройствами по показаниям независимо от массы тела при рождении [26-36].
Уровень убедительности рекомендаций А (уровень достоверности доказательств la). Комментарии:-
Методическое письмо Минздрава России от 21 апреля 2010 г. № 15- 4/10/2-3204 «Первичная и реанимационная помощь новорожденным детям» и Клинические рекомендации «Респираторный дистресс-синдром», 2017 [18, 22];
-
сурфактант может быть использован у недоношенных новорожденных при РДС, осложненном врожденной пневмонией, но требуется более высокая его дозировка или кратность его введения [37].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 1).
-
-
-
Рекомендуется проведение неинвазивной респираторной терапии в отделении реанимации и интенсивной терапии.
Рекомендуется проведение неинвазивной респираторной терапии в сочетании с сурфактантной терапией по показаниям у недоношенных с дыхательными нарушениями [38-41].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1a).
Комментарии. См. Методическое письмо Минздрава России от 21 апреля 2010 г. № 15-4/10/2-3204 «Первичная и реанимационная помощь новорожденным детям» и Клинические рекомендации «Респираторный дистресс-синдром», 2017 [18, 22]. -
Рекомендуется ИВЛ у тех пациентов, у которых неинвазивные методы респираторной терапии оказались неэффективными.
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1a).
Комментарии. Показаниями к ИВЛ также являются тяжелые сопутствующие состояния: шок, судорожный статус, легочное кровотечение. Следует минимизировать продолжительность инвазивной ИВЛ. По возможности следует проводить ИВЛ с контролем дыхательного объема, что сокращает ее длительность и позволяет снизить частоту таких осложнений, как БЛД и ВЖК [42-48]. Обязательным условием для успешного использования данного вида дыхательной терапии у новорожденных является возможность регулярно контролировать газовый состав крови. Не рекомендуются рутинная седация и аналгезия всем детям на ИВЛ [49].
Неэффективность традиционной ИВЛ является показанием к переводу на высокочастотную осцилляторную вентиляцию легких. При высокочастотной осцилляторной вентиляции легких за счет стабилизации объема альвеол происходит уменьшение ателектазов, увеличение площади газообмена и улучшение легочного кровотока. В результате правильно проводимой терапии становится адекватным соотношение вентиляции и перфузии, что приводит к улучшению газообмена в легких.
Основными принципами инфузионной терапии являются:
-
расчет объема жидкости и ПП исходя из физиологических потребностей и патологических потерь;
-
инфузионная программа составляется с учетом индивидуальных особенностей постнатального созревания функций почек;
-
необходимость клинико-лабораторного контроля за водно-электролитным балансом для оценки адекватности инфузионной программы;
-
в случае нарушения периферической и/или центральной гемодинамики показано назначение кардиотонических препаратов.
Симптоматическая терапия
Симптоматическая терапия подразумевает создание оптимальных условий выхаживания новорожденных.
-
В зависимости от тяжести состояния новорожденный с подозрением на врожденную пневмонию должен быть переведен в ОРИТН, палату интенсивной терапии или в отделение патологии новорожденных.
-
Ребенку показаны пребывание в условиях микроклимата кувеза, ограничение сенсорной стимуляции (защита от света, шума, прикосновений), контроль за температурой тела в зависимости от терморегуляции, постуральная поддержка, профилактика болевого синдрома.
-
При геморрагических расстройствах применяется антигеморрагическая терапия.
-
По возможности наиболее раннее начало ЭП, предпочтение отдается грудному молоку.
РЕАБИЛИТАЦИЯ
У доношенных детей, перенесших врожденную пневмонию, отдаленный прогноз, как правило, благоприятный. У глубоко недоношенных детей - риск развития БЛД. Развитие госпитальной инфекции в условиях ОРИТН ухудшает исход и прогноз основного заболевания.
ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
Профилактика врожденной пневмонии заключается в своевременном выявлении и лечении инфекционных заболеваний у матери во время беременности.
Необходимо строжайшее соблюдение санитарно-эпидемического режима в родильном доме, отделениях для новорожденных и недоношенных.
За ребенком раннего возраста, перенесшим пневмонию, осуществляют наблюдение на протяжении 1 года. Необходимы максимальное пребывание ребенка на свежем воздухе, полноценное питание, лечебная физкультура, массаж, закаливающие процедуры.
СПИСОК ЛИТЕРАТУРЫ
-
Зубков В.В., Рюмина И.И. Акушерство: национальное руководство. Раздел 5. Заболевания плода и новорожденного. Глава 59. Врожденные и перинатальные инфекции. 2-е изд., перераб. и доп. / под ред. Г.М. Савельевой, Г.Т. Сухих, В.Н. Серова, В.Е. Радзинского. М.: ГЭОТАР-Медиа, 2015.
-
Черняховский О.Б, Абрамова И.В., Полянчикова О.Л. Внутриутробные инфекции у новорожденных, факторы риска // Рос. вестн. перинатол. и педиатр. 2009. № 1. С. 80-88.
-
Duke T. Neonatal pneumonia in developing countries // Arch. Dis. Child. Fetal Neonatal Ed. 2005. Vol. 5. P. 90-94.
-
Суворова М.П., Яковлев С.В., Дворецкий Л.И. Проблемы диагностики и антибактериальной терапии госпитальной пневмонии // Антибиотики и химиотер. 2001. Т. 46, № 9. С. 40-44.
-
Неонатология: национальное руководство / под ред. Н.Н. Володина. М.: ГЭОТАР-Медиа, 2008. 749 с.
-
Волянюк Е.В., Сафина А.И. Врожденная пневмония у недоношенных: особенности этиологии, диагностики и лечения // Практическая медицина. 2011. № 5 (53). C. 55-59.
-
Неонатология: руководство для врачей / под ред. В.В. Гаврюшова, К.А. Сотниковой. Л.: Медицина, 1985.
-
Володин Н.Н., Долгов В.В., Дегтярев Д.Н. и др. Белки «острой фазы» воспаления при бактериальных инфекциях у новорожденных детей // Рос. вестн. перинатол. и педиатр. 2000. Т. 45, № 1. С. 10-13.
-
Bhatti M., Chu A., Hageman J.R., Schreiber M., Alexander K. Future directions in the evaluation and management of neonatal sepsis // Neoreviews. 2012. Vol. 13. P. e103. doi: 10.1542/neo.13-2-e103.
-
Зубков В.В., Байбарина Е.Н., Рюмина И.И., Дегтярев Д.Н. Диагностическая значимость признаков пневмонии у новорожденных детей // Акуш. и гин. 2012. № 7. С. 68-73.
-
Haney P.J., Bohlman M., Chen-Chih J.S. Radiographic findings in neonatal pneumonia // AJR Am. J. Roentgenol. 1984. Vol. 143. P. 23-26.
-
Leonidas J.C., Hall R.T., Beatty E.C. et al. Radiographic findings in early onset neonatal group B streptococcal septicemia // Pediatrics. 1977. Vol. 59, suppl. P. 1006-1011.
-
Payne N.R., Burke B.A., Day D.L. et al. Correlation of clinical and pathologic findings in early onset neonatal group B streptococcal infection with disease severity and prediction of outcome // Pediatr. Infect. Dis. J. 1988. Vol. 7. P. 836-847.
-
Swischuk L.E. Respiratory system // Imaging of the Newborn, Infant, and Young Child. 4th ed. Baltimore: Williams and Wilkins, 1997. P. 43-47.
-
Ионов О.В., Никитина И.В., Зубков В.В., Митрохин С.Д. и др. Порядок обследования новорожденных с подозрением на инфекционную патологию и правила назначения антибактериальной терапии, принятые в отделении реанимации и интенсивной терапии новорожденных ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России // Неонатология. 2014. № 1. С. 95-106.
-
Hedlund G.L., Griscom N.T., Cleveland R.H., Kirks D.R. Respiratory system // Practical Pediatric Imaging: Diagnostic Radiology of Infants and Children. 3rd ed. / eds D.R. Kirks, N.T. Griscom. Philadelphia: Lippincott; Raven, 1998. P. 715-717.
-
Radiological Imaging of the Neonatal Chest. 2nd revised ed. / ed. V. Dono-qhue. Springer, 2008. 362 p.
-
Антонов А.Г., Буркова А.С., Ионов О.В., Киртбая А.P. и др. Избранные клинические рекомендации по неонатологии / под ред. Е.Н. Байбариной, Д.Н. Дегтярева. М.: ГЭОТАР-Медиа, 2016. 240 с.
-
Шухов В.С., Байбарина Е.Н., Рюмина И.И., Зубков В.В. Антимикробная терапия у детей: практическое руководство. М.: ГЭОТАР-Медиа, 2016. 320 с.
-
Wyllie J., Bruinenberg J., Roehr C.C., Rüdiger M. et al. European Resuscitation Council Guidelines for Resuscitation 2015 Section 7. Resuscitation and support of transition of babies at birth // Resuscitation. 2015. Vol. 95. P. 249-263.
-
Wyckoff M.H., Aziz K., Escobedo M.B., Kapadia V.S. et al. 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Part 13: Neonatal Resuscitation // Circulation. 2015. Vol. 132. P. S543-S560.
-
Методическое письмо Минздрава России «Первичная и реанимационная помощь новорожденным детям» от 21 апреля 2010 г. № 15-4/10/2-320.
-
Committee on Obstetric Practice, American College of Obstetricians and Gynecologists: Committee Opinion No. 543. Timing of umbilical cord clamping after birth // Obstet. Gynecol. 2012. Vol. 120. P. 1522-1526.
-
Rabe H., Diaz-Rossello J.L., Duley L., Dowswell T. Effect of timing of umbilical cord clamping and other strategies to influence placental transfusion at preterm birth on maternal and infant outcomes // Cochrane Database Syst. Rev. 2012. Vol. 8. CD003248.
-
Lista G., Castoldi F., Cavigioli F., Bianchi S. et al. Alveolar recruitment in the delivery room // J. Matern. Fetal Neonatal Med. 2012. Suppl. 1. P. 39-40.
-
Soll R., Ozek E. Prophylactic protein free synthetic surfactant for preventing morbidity and mortality in preterm infants // Cochrane Database Syst. Rev. 2010. Vol. 1. CD001079.
-
Verlato G., Cogo P.E., Benetti E., Gomirato S. et al. Kinetics of surfactant in respiratory diseases of the newborn infant // J. Matern. Fetal Neonatal Med. 2004. Vol. 16, suppl. 2. P. 21-24.
-
Cogo P.E., Facco M., Simonato M., Verlato G. et al. Dosing of porcine surfactant: effect on kinetics and gas exchange in respiratory distress syndrome // Pediatrics. 2009. Vol. 124. P. e950-e957.
-
Singh N., Halliday H.L., Stevens T.P., Suresh G. et al. Comparison of animal-derived surfactants for the prevention and treatment of respiratory distress syndrome in preterm infants // Cochrane Database Syst. Rev. 2015. Vol. 12. CD010249.
-
Speer C.P., Gefeller O., Groneck P., Laufkötter E. et al. Randomised clinical trial of two treatment regimens of natural surfactant preparations in neonatal respiratory distress syndrome // Arch. Dis. Child. Fetal Neonatal Ed. 1995. Vol. 72. P. F8-F13.
-
Sandri F., Plavka R., Ancora G., Simeoni U. et al.; CURPAP Study Group: Prophylactic or early selective surfactant combined with nCPAP in very preterm infants // Pediatrics. 2010. Vol. 125. P. e1402-e1409.
-
Rojas-Reyes M.X., Morley C.J., Soll R. Prophylactic versus selective use of surfactant in preventing morbidity and mortality in preterm infants // Cochrane Database Syst. Rev. 2012. Vol. 3. CD000510.
-
Rich W., Finer N.N., Gantz M.G., Newman N.S. et al.; SUPPORT and Generic Database Subcommittees of the Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network: Enrollment of extremely low birth weight infants in a clinical research study may not be representative // Pediatrics. 2012. Vol. 129. P. 480-484.
-
Göpel W., Kribs A., Ziegler A., Laux R. et al. Avoidance of mechanical ventilation by surfactant treatment of spontaneously breathing preterm infants (AMV): an open-label, randomised, controlled trial // Lancet. 2011. Vol. 37, N 9803. P. 1627-1634.
-
Herting E. Less invasive surfactant administration (LISA) - ways to deliver surfactant in spontaneously breathing infants // Early Hum. Dev. 2013. Vol. 89, N 11. P. 875-880.
-
Rautava L., Eskelinen J., Häkkinen U., Lehtonen L.; PERFECT Preterm Infant Study GrouP. 5-year morbidity among very preterm infants in relation to level of hospital care // Arch. Pediatr. Adolesc. Med. 2013. Vol. 167. P. 40-46.
-
Tan K., Lai N.M., Sharma A. Surfactant for bacterial pneumonia in late preterm and term infants // Cochrane Database Syst. Rev. 2012. Vol. 2. CD008155.
-
Bancalari E., Claure N. The evidence for noninvasive ventilation in the preterm infant // Arch. Dis. Child. Fetal Neonatal Ed. 2013. Vol. 98. P. F98-F102.
-
De Paoli A.G., Davis P.G., Faber B., Morley C.J. Devices and pressure sources for administration of nasal continuous positive airway pressure (NCPAP) in preterm neonates // Cochrane Database Syst. Rev. 2002. Vol. 3. P. CD002977.
-
Reynolds P., Leontiadi S., Lawson T., Otunla T. et al. Stabilisation of premature infants in the delivery room with nasal high flow // Arch. Dis. Child. Fetal Neonatal Ed. 2016. Vol. 101. P. F284-F287.
-
Wilkinson D., Andersen C., O’Donnell C.P., de Paoli A.G. et al. High flow nasal cannula for respiratory support in preterm infants // Cochrane Database Syst. Rev. 2016. Vol. 2. CD006405.
-
Erickson S.J., Grauaug A., Gurrin L., Swaminathan M. Hypocarbia in the ventilated preterm infant and its effect on intraventricular haemorrhage and bronchopulmonary dysplasia // J. Paediatr. Child Health. 2002. Vol. 38. P. 560-562.
-
Ambalavanan N., Carlo W.A., Wrage L.A., Das A. et al.; SUPPORT Study Group of the NICHD Neonatal Research Network. PaCO2 in surfactant, positive pressure, and oxygenation randomized trial (SUPPORT) // Arch. Dis. Child. Fetal Neonatal Ed. 2015. Vol. 100. P. F145-F149.
-
Woodgate P.G., Davies M.W. Permissive hypercapnia for the prevention of morbidity and mortality in mechanically ventilatednewborn infants // Cochrane Database Syst. Rev. 2001. Vol. 2. P. CD002061.
-
Dobson N.R., Patel R.M., Smith P.B., Kuehn D.R. et al. Trends in caffeine use and association between clinical outcomes and timing of therapy in very low birth weight infants // J. Pediatr. 2014. Vol. 164. P. 992-998.
-
Taha D., Kirkby S., Nawab U., Dysarrt K.C. et al. Early caffeine therapy for prevention of bronchopulmonary dysplasia in preterm infants // J. Matern. Fetal Neonatal Med. 2014. Vol. 27. P. 1698-1702.
-
Lodha A., Seshia M., McMillan D.D., Barrington K. et al.; Canadian Neonatal Network. Association of early caffeine administration and neonatal outcomes in very preterm neonates // JAMA Pediatr. 2015. Vol. 169. P. 33-38.
-
Jefferies A.L. Postnatal corticosteroids to treat or prevent chronic lung disease in preterm infants // Paediatr. Child Health. 2012. Vol. 17. P. 573-574.
-
Bellù R., de Waal K., Zanini R. Opioids for neonates receiving mechanical ventilation: a systematic review and meta-analysis // Arch. Dis. Child. Fetal Neonatal Ed. 2010. Vol. 95. P. F241-F251.
ПРИЛОЖЕНИЯ
Приложение 1. Алгоритм ведения новорожденного с врожденной пневмонией
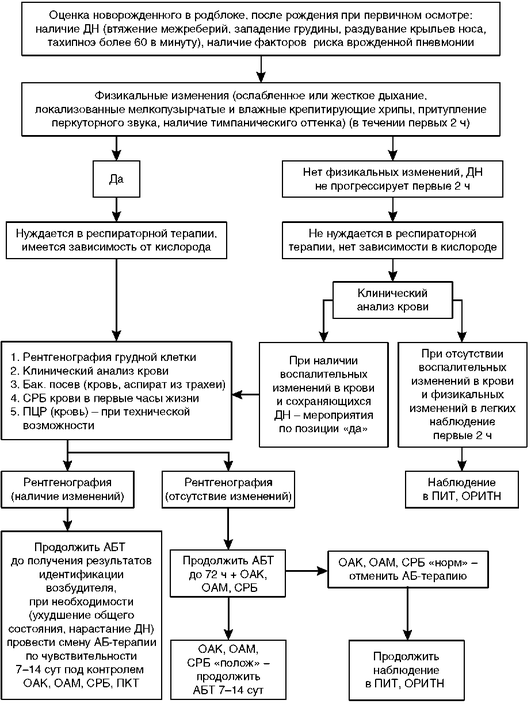
Приложение 2. Антибактериальные препараты и режим их дозирования у новорожденных[5]
| Схема А. Стартовая АБТ: ампициллин + гентамицин | |
|---|---|
Ампициллин (Ampicillin) Режим дозирования препарата |
|
Новорожденным |
25 мг/кг каждые 6 ч внутривенно (суточная доза 100 мг/кг в 4 введения) внутривенно. При тяжелом течении инфекции указанная доза может быть удвоена |
Гентамицин (Gentamicin) Максимальный курс - 7 дней. Режим дозирования препарата |
|
Новорожденные на 1-й нед жизни:
|
2,5 мг/кг каждые 36 ч внутривенно |
|
2,5 мг/кг каждые 18 ч внутривенно |
|
2,5 мг/кг каждые 12 ч внутривенно |
Дети старше 1-й нед жизни |
7,5 мг/кг массы тела в сутки, распределенные на 3 приема (по 2,5 мг/кг вводить каждые 8 ч) внутривенно |
Ампициллин + сульбактам (Ampicillin + Sulbactam) В случае необходимости продолжения стартовой терапии - по схеме ампициллин + гентамицин более 7 сут. Режим дозирования препарата |
|
Новорожденным в возрасте до 1 нед жизни |
75 мг/кг в сутки внутривенно, интервал введения - каждые 12 ч |
Новорожденным старше 1 нед жизни |
в суточной дозе 150 мг/кг внутривенно, кратность - каждые 8 ч |
Схема Б. Целенаправленная АБТ в случаях подтвержденного высева у матери микрофлоры, резистентной к стартовой схеме АБТ |
|
Ванкомицин (Vancomycin) Длительность введения препарата не должна составлять менее 60 мин. При возможности проводят мониторинг концентрации ванкомицина в крови. Режим дозирования препарата |
|
Новорожденные: |
Стартовая доза - 15 мг/кг внутривенно |
|
10 мг/кг каждые 12 ч внутривенно |
|
10 мг/кг каждые 8 ч внутривенно |
Нетилмицин (Netilmicin) Режим дозирования препарата |
|
|
3 мг/кг каждые 12 ч внутривенно |
|
3 мг/кг каждые 8 ч внутривенно |
Линезолид (Linezolid) Длительность введения препарата не должна составлять менее 30 мин. Режим дозирования препарата |
|
Новорожденные и дети до 11 лет |
10 мг/кг каждые 8 ч внутривенно |
Эртапенем (Ertapenem) Длительность введения препарата не должна составлять менее 30 мин. Требуется оформление информированного согласия! Режим дозирования препарата |
|
Дети в возрасте от 3 мес до 12 лет |
15 мг/кг каждые 12 ч внутривенно |
Метронидазол (Metronidazole) Длительность введения препарата не должна составлять менее 30 мин. Требуется оформление информированного согласия! Режим дозирования препарата |
|
Дети до 12 лет |
Начальная доза - 7,5 мг/кг внутривенно, вводится каждые 8 ч в течение 3 сут. Затем - по 7,5 мг/кг каждые 12 ч |
Меропенем (Meropenem)) Длительность введения препарата не должна составлять менее 30 мин. Требуется оформление информированного согласия! Режим дозирования препарата |
|
Дети в возрасте от 3 мес до 12 лет |
10-20 мг/кг каждые 8 ч внутривенно в зависимости от тяжести инфекции. При менингите - по 40 мг/кг внутривенно каждые 8 ч |
Цефтриаксон (Ceftriaxone) Режим дозирования препарата |
|
Новорожденные:
|
50 мг/кг однократно в сутки внутривенно 75 мг/кг однократно в сутки внутривенно При бактериальном менингите у детей до 12 лет - 100 мг/кг однократно в сутки внутривенно |
Имипенем + [циластатин] (Imipenem + Cilastatin) Длительность введения препарата не должна составлять менее 30 мин. Требуется оформление информированного согласия! Режим дозирования препарата |
|
Дети от 3 мес и старше |
15 мг/кг каждые 6 ч внутривенно |
Цефоперазон + сульбактам (Cefoperazone + Sulbactam) Режим дозирования препарата |
|
Новорожденные и дети |
40 мг/кг каждые 12 ч внутривенно |
Цефтазидим (Ceftazidime) Режим дозирования препарата |
|
Дети в возрасте до 2 мес |
30 мг/кг каждые 12 ч внутривенно |
Дети в возрасте старше 2 мес |
50 мг/кг каждые 12 ч внутривенно |
Эритромицин (Erythromycin) Режим дозирования препарата |
|
Дети первых 3 мес жизни |
20 мг/кг каждые 12 ч внутрь |
Дети начиная с 4-го мес жизни и до 18 лет |
25 мг/кг каждые 12 ч внутрь |
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПРОВЕДЕНИЮ ТЕРАПЕВТИЧЕСКОЙ ГИПОТЕРМИИ У НОВОРОЖДЕННЫХ
Согласовано и утверждено Российским обществом неонатологов и Российской ассоциацией специалистов перинатальной медицины
Авторы: Буров А.А., Горев В.В., Горелик К.Д., Дегтярева М.Г., Ионов О.В., Карпова А.Л., Киртбая А.Р., Малютина Л.В., Мебелова И.И., Мостовой А.В., Мустафина-Бредихина Д.М., Мухаметшин Р.Ф., Пруткин М.Е., Романенко К.В. (модератор рабочей группы), Сапун О.И., Фомичев М.В.
ВВЕДЕНИЕ
Гипоксически-ишемическая энцефалопатия (ГИЭ), возникающая вследствие перенесенной асфиксии при рождении, остается одной из самых актуальных проблем неонатологии ввиду высокого риска развития тяжелых неврологических нарушений и летального исхода. По данным мировой статистики, частота тяжелой ГИЭ в популяции новорожденных составляет от 0,37 до 3 на 1000 родившихся живыми [1, 2].
В патогенезе ГИЭ выделяют фазы первичного и вторичного повреждения нервной ткани. Первичное повреждение развивается в момент воздействия асфиксии и характеризуется необратимой гибелью клеток головного мозга, объем которой зависит от глубины и длительности гипоксии. Вторичное повреждение активизируется в фазу реоксигенации-реперфузии спустя 2-12 ч после первичного повреждения. Вторичное повреждение вызывается активизацией ряда патогенетических механизмов (глутаматного и кальциевого стресса, свободнорадикального повреждения, асептического воспалительного процесса), активацией апоптоза, приводящих к увеличению объема нейронального повреждения и ухудшению прогноза для жизни и здоровья [3]. В настоящее время в мировой практике не известен ни один лекарственный препарат, нейропротективные свойства которого могли бы существенно уменьшить повреждающее действие указанных патогенетических механизмов, а егоэффективность была бы подтверждена в клинических исследованиях высокого уровня [3, 4].
Одной из перспективных методик, позволяющих снизить неблагоприятные последствия поражения ЦНС, является терапевтическая гипотермия, которая признана наиболее эффективным и безопасным методом нейропротекции у детей, перенесших тяжелую асфиксию при рождении. В многочисленных экспериментальных работах было показано, что гипотермия способствует снижению метаболических потребностей организма [5, 6], уменьшению вторичного энергодефицита клеток [7], блокированию высвобождения глутамата [8], блокированию синтеза свободнорадикальных частиц [9], ингибированию воспаления [10] и апоптоза [3, 11].
Клинические исследования, посвященные использованию терапевтической гипотермии у новорожденных, систематизированные в Кокрановском обзоре, включавшем 11 работ и 1505 пациентов, демонстрируют значительное снижение летальности и тяжелых неврологических нарушений в 18-22 мес жизни, а также в более старшем возрасте (7 лет жизни) [12-19]. При этом риск развития выраженных неврологических дефицитов у детей, перенесших умеренную и тяжелую асфиксию при рождении и прошедших терапевтическую гипотермию, снижается на 20-25% [13]. Методика терапевтической гипотермии в настоящее время включена в национальные рекомендации многих стран мира, при условии соблюдения критериев отбора и протоколов проведения гипотермии у доношенных и поздних недоношенных новорожденных, рожденных в умеренной или тяжелой асфиксии, основанных на данных опубликованных рандомизированных клинических исследований (уровень доказательности 2А) [20-26, 34, 42]. Данный метод терапии рекомендован к применению у новорожденных обновленными в 2015 г. Европейскими протоколами по реанимации [62].
В настоящее время в мировой практике применяются такие методы аппаратной терапевтической гипотермии, как селективная (краниоцеребральная) и общая. Проведенные клинические исследования демонстрируют снижение частоты развития детского церебрального паралича и других тяжелых психоневрологических нарушений [27], а также отсутствие достоверных различий в побочных эффектах между этими методами [19]. В то же время в ряде работ указывается на большую эффективность общей гипотермии [19, 28], поэтому в некоторых странах данная методика наиболее приоритетна.
В Кокрановском систематическом обзоре 2013 г. было показано статистически значимое снижение летальности у новорожденных с ГИЭ, получавших общую гипотермию. В то же время достоверного снижения летальности у новорожденных, которым проводилась селективная гипотермия, выявлено не было [19].
В литературе также обсуждается применение неаппаратной, так называемой пассивной терапевтической гипотермии и терапевтическойгипотермии с использованием охлаждающих термоэлементов в том случае, если отсутствует возможность проведения аппаратной терапевтической гипотермии. В доступных публикациях демонстрируется улучшение неврологических исходов, но в то же время предупреждается о высоком риске развития тяжелой гипотермии, приводящей к неблагоприятным эффектам (уровень доказательности 2В) [29, 30, 31]. Ограничением для использования данного метода в рутинной практике являются значительные сложности с прогнозированием скорости снижения температуры у ребенка после начала применения физических методов охлаждения. В исследовании L.S. Dahm и соавт. (1972) показано, что у здорового ребенка при отключении лучистого тепла ректальная температура снижается с 37,5 °С до 36,0 °С через 30 мин после рождения [32]. В 2015 г. опубликованы результаты систематического обзора и метаанализ эффективности терапевтической гипотермии, проводимой при использовании низкотехнологичных методик. Результаты анализа показали, что применение данного метода достоверно снижает смертность и неврологическую заболеваемость у новорожденных [63]. Однако все исследователи указывают на высокие риски чрезмерной гипотермии или недопустимых колебаний температуры у детей. Использование пассивной терапевтической гипотермии и терапевтической гипотермии с использованием охлаждающих термоэлементов должно сопровождаться строгим температурным контролем в целях предотвращения умеренной и тяжелой гипотермии.
Коды по международной классификации болезней 10-го пересмотра, применяемые у детей, нуждающихся в терапевтической гипотермии
Терминология
Тяжелая асфиксия при рождении - это состояние, характеризующееся низкой оценкой по шкале Апгар и комплексом клинико-лабораторных признаков нарушения состояния ребенка [36, 51]. Код по МКБ-10 - Р21.0.
ГИЭ развивается в первые часы жизни и характеризуется комплексом неврологических нарушений различной степени тяжести, наступивших в результате асфиксии при рождении [36]. Степень тяжести ГИЭ определяется по модифицированной шкале Н. Sarnat, М. Sarnat (1976) в модификации B. Stoll, R. Kliegman (2004) (приложение 1). Код по МКБ-10 - Р91.6 [50].
Следует отметить, что сама по себе низкая оценка по шкале Апгар может быть следствием медикаментозной депрессии плода или других факторов, приводящих к угнетению дыхания, и не всегда является самостоятельным критерием, определяющим наличие гипоксического поражения ЦНС у новорожденного. Лишь комплекс как клинических, так и лабораторных маркеров, включая низкую оценку по шкале Апгар, может говорить об асфиксии в родах, которая, в свою очередь, приводит к ГИЭ различной степени тяжести [36, 51]. ГИЭ средней и тяжелой степени тяжести является показанием к терапевтической гипотермии. При ГИЭ легкой степени тяжести терапевтическая гипотермия не показана.
Церебральная ишемия - это состояние, которое возникает в результате широкого спектра причин, приводящих к ишемии мозга, таких как сепсис, шок, ГИЭ, РДС и др. В соответствии с Классификацией перинатальных поражений нервной системы у новорожденных (приложение 2) степень церебральной ишемии определяется выраженностью неврологических нарушений, а также характером и распространенностью структурно-морфологических изменений вещества головного мозга. Диагноз «церебральная ишемия» ставится по истечении раннего неонатального периода после уточнения характера и выраженности структурного поражения головного мозга с помощью методов нейровизуализации. Код по МКБ-10 - 91.0.
ПОРЯДОК ДЕЙСТВИЙ ДЛЯ ВЫЯВЛЕНИЯ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ К ТЕРАПЕВТИЧЕСКОЙ ГИПОТЕРМИИ ПРИ РОЖДЕНИИ РЕБЕНКА В АСФИКСИИ
Порядок действий для выявления показаний к терапевтической гипотермии
Общие критерии отбора на терапевтическую гипотермию для новорожденных, потребовавших первичных реанимационных мероприятий в родильном зале:
Далее критерии выбора подразделяются на три группы: А, В и С. Необходимо последовательно оценить новорожденного по указанным группам. При выявлении одного критерия из группы следует переходить к оценке наличия критериев из следующей группы. Наличие хотя бы одного критерия в каждой из трех групп является показанием к терапевтической гипотермии [20-26, 33].
-
-
основываются на результатах амплитудно-интегрированной электроэнцефалографии (аЭЭГ);
-
электроэнцефалографию следует проводить до введения противо-судорожных и седативных препаратов, если последние показаны, поскольку противосудорожные препараты оказывают влияние на результаты аЭЭГ;
-
запись проводится в течение 20-30 мин, используется как минимум один канал записи при бипариетальном положении электродов, скорость развертки - 6 см/ч. Регистрация одного из патологических паттернов, указанных ниже, является окончательным предиктором необходимости проведения терапевтической гипотермии:
-
паттерн с нормальной амплитудой (верхний край тренда - максимальная амплитуда, более 10 мкВ, нижний край тренда - минимальная амплитуда, более 5 мкВ) в сочетании с повторными судорогами (приложение 6, рис. 2, б; 2, в);
-
прерывистый паттерн с максимальной амплитудой более 10 мкВ, минимальной амплитудой менее 5 мкВ. Циклическая вариабельность отсутствует (приложение 6, рис. 1, б);
-
постоянный низкоамплитудный паттерн с максимальной амплитудой менее 10 мкВ, минимальной амплитудой менее 5 мкВ. Циклическая вариабельность отсутствует (приложение 6, рис 1, в);
-
судорожный статус (непрерывная судорожная активность в течение 20 мин и более) на фоне любого из перечисленных паттернов (приложение 6, рис. 1, г; 2, б; 2, в) [12, 64, 65].
-
-
Представленная схема выявления показаний к терапевтической гипотермии является оптимальной.
При отсутствии возможности оценить критерии группы С процедура терапевтической гипотермии должна начинаться по результатам оценки критериев первых двух групп (А и В). Ведущими показаниями в данном случае являются документированный метаболический ацидоз и полиорганные поражения. Также необходимо выявление анамнестических данных, указывающих на причины развития асфиксии. Оценка аЭЭГ должна быть выполнена при поступлении ребенка в медицинскую организацию, имеющую возможность проведения данного метода исследования.
Согласно Приказу Минздрава России от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю«акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)» и Приказу Минздрава России от 15 ноября 2012 г. № 921н «Об утверждении Порядка оказания медицинской помощи по профилю «неонатология», в стандарт оснащения ПИТН (поста)/ОРИТН входит прибор для мониторирования электрической активности мозга [34, 35].
Оценка ребенка по вышеуказанным критериям должна осуществляться в максимально короткие сроки. Оптимальное время начала терапевтической гипотермии - в течение первых 2 ч после рождения. Охлаждение, начатое позднее 6 ч, снижает эффективность терапии [20-26,33, 36, 39, 40].
Противопоказания к проведению процедуры [20-26, 33, 36-38]
ПРОВЕДЕНИЕ ТЕРАПЕВТИЧЕСКОЙ ГИПОТЕРМИИ
Стартовые мероприятия
При наличии в родильном зале признаков группы А и В необходимо начать пассивную терапевтическую гипотермию:
-
провести контроль за кислотно-щелочным равновесием и газовым составом крови при возможности проведения данного обследования в учреждении;
-
в пределах 20 мин после рождения начать контроль за ректальной температурой с фиксацией температуры каждые 15 мин. Глубина введения датчика в прямую кишку - 5 см;
На этапе ПИТН/ОРИТН:
-
при наличии технической возможности провести НСГ, начать запись аЭЭГ;
-
контролировать ректальную и аксиллярную температуру каждые 15 мин;
-
контролировать целевую ректальную температуру (33,5-34,0 °С);
-
не согревать ребенка до полной оценки критериев необходимости проведения или противопоказаний к проведению терапевтической гипотермии;
-
при отсутствии показаний к терапевтической гипотермии или выявлении противопоказаний пассивная терапевтическая гипотермия прекращается. Согревание ребенка проводится с повышением ректальной температуры на 0,2-0,5 °С в час, в дальнейшем выполняется стандартная терапия в зависимости от клинической ситуации;
-
при наличии показаний к терапевтической гипотермии охлаждение осуществляется в течение 72 ч.
Для медицинских организаций (акушерских стационаров) 1-й и 2-й группы в случае рождения ребенка, удовлетворяющего критериям терапевтической гипотермии, обязательно срочное сообщение о рождении ребенка в медицинскую организацию 3-й группы/реанимационно-консультативный центр не позднее 30-60 мин после рождения и совместное определение дальнейшей тактики ведения пациента.
Вне зависимости от группы, к которой относится медицинская организация, в случае рождения ребенка, удовлетворяющего критериям проведения терапевтической гипотермии, и отсутствия в данной медицинской организации возможности проведения аппаратной гипотермии оптимальным решением является организация неотложного перевода пациента в медицинскую организацию, где есть условия для проведения аппаратной гипотермии.
Тактика маршрутизации должна быть регламентирована региональным протоколом.
Последующие действия
Пассивная терапевтическая гипотермия в медицинских организациях при планируемой транспортировке ребенка (GPPs)
До приезда транспортной реанимационной бригады медицинской организации 3-й группы пассивная терапевтическая гипотермия должна продолжаться по следующему алгоритму:
-
ребенок должен находиться в отключенной открытой реанимационной системе или в отключенном инкубаторе с открытыми окнами;
-
контроль за ректальной температурой проводится каждые 15 мин, используется электронный мониторинг температуры, данные мониторинга температуры должны быть отражены в медицинской документации;
-
четкая фиксация начальной температуры и времени достижения целевой температуры;
-
время достижения целевой ректальной температуры - 60 мин после начала пассивной гипотермии;
-
при снижении или повышении температуры провести проверку положения ректального датчика;
-
при сохраняющейся температуре выше 34,5 °С в течение 1 ч пассивного охлаждения возможно проведение терапевтической гипотермии с использованием охлаждающих термоэлементов (гелевых пакетов, емкостей с холодной водой);
-
не использовать пакеты со льдом в связи с высоким риском развития тяжелой гипотермии, повреждения кожного покрова;
-
при снижении температуры до 33,5 °С в целях предотвращения переохлаждения может возникнуть необходимость в дополнительном обогреве, чтобы удержать целевую температуру тела ребенка (приложение 8);
-
при невозможности контроля за ректальной температурой обеспечить поддержание аксиллярной температуры в диапазоне 34-35 °С;
-
при невозможности достижения целевой температуры - консультация с учреждением 3-й группы.
Межгоспитальная транспортировка ребенка для проведения аппаратной гипотермии
Проведение терапевтической гипотермии не является противопоказанием к транспортировке новорожденного. Противопоказания к транспортировке определяются по общепринятым критериям или критериям, установленным локальными протоколами.
Оптимальным является использование аппаратной терапевтической гипотермии во время транспортировки (см. ниже «Аппаратная терапевтическая гипотермия»).
При отсутствии такой возможности в процессе транспортировки должна продолжаться пассивная терапевтическая гипотермия по следующему алгоритму:
-
перед транспортировкой - установка и фиксация ректального датчика;
-
контроль за ректальной температурой перед транспортировкой и далее каждые 15 мин, используется электронный мониторинг температуры, данные мониторинга температуры должны быть отражены в медицинской документации;
-
при снижении ректальной температуры до 33,5 °С - повысить температуру инкубатора на 0,5 °С;
-
при повышении ректальной температуры выше 34 °С снизить температуру инкубатора на 0,5 °С;
-
при сохраняющейся температуре выше 34 °С и невозможности снижения температуры транспортного инкубатора возможно проведение терапевтической гипотермии с использованием охлаждающих термоэлементов (гелевых пакетов, емкостей с холодной водой);
-
при возможности проведения аппаратной терапевтической гипотермии во время транспортировки диапазон ректальной температуры следует поддерживать строго между 33-34 °С, оптимальная ректальная температура должна составлять 33,5 °С.
Аппаратная терапевтическая гипотермия
-
Порядок эксплуатации аппарата гипотермии должен четко соответствовать инструкции по его использованию.
-
Продолжительность терапевтической гипотермии с установленной целевой температурой должна составлять 72 ч.
-
Диапазон ректальной температуры следует поддерживать между 33- 34 °С, оптимальная ректальная температура - 33,5 °С.
Пассивная терапевтическая гипотермия и терапевтическая гипотермия с использованием охлаждающих термоэлементов в медицинских организациях при невозможности проведения аппаратной терапевтической гипотермии
-
Продолжительность терапевтической гипотермии с установленной целевой температурой должна составлять 72 ч.
-
Ребенок должен находиться в отключенной открытой реанимационной системе или в отключенном инкубаторе. Кожный покров ребенка остается открытым, подгузник подкладывается, но не застегивается.
-
Температура окружающей среды - 18-24 °С. Оптимальным является создание условий для пребывания пациента в одноместной палате.
-
Четкая фиксация начальной температуры и времени достижения целевой температуры.
-
Алгоритм проведения пассивной терапевтической гипотермии и терапевтической гипотермии с использованием охлаждающих термоэлементов представлен в приложении 8.
-
Для мониторинга ректальной температуры оптимальным является использование полифункциональных мониторов. Используются совместимые ректальные термистерные термодатчики. Внешний диаметр стандартного ректального датчика, предназначенного для новорожденного, составляет 2 мм, глубина введения - 5 см.
Кроме терапевтической аппаратной и терапевтической пассивной гипотермии существует методика охлаждения с применением охлаждающих термоэлементов - гелевых пакетов и емкостей с холодной водой, расположенных по флангам ребенка, - терапевтическая гипотермия с использованием охлаждающих термоэлементов.
При отсутствии аппаратов для терапевтической гипотермии в целях обеспечения целевого уровня температуры возможно использование гелевых пакетов. Гелевые пакеты помещают в термостат с температурой 34 °С и последовательно меняют у пациента, обкладывая его. Согретые гелевые пакеты отправляют в термостат (уровень доказательности С)[55].
При отсутствии аппаратов для терапевтической гипотермии для обеспечения целевого уровня температуры также возможно использование емкостей с холодной водой [63], обернутых в пеленку, которые располагаются на расстоянии 5-15 см от пациента.
Расположение охлаждающих термоэлементов, их размещение вокруг тела ребенка, длительность использования могут варьировать в зависимости от клинической ситуации (GPPs).
Все методы терапевтической гипотермии (аппаратная, пассивная, с использованием охлаждающих термоэлементов) позволяют достигнуть целевого уровня температуры [56].
Методики пассивной гипотермии и гипотермии тела ребенка с использованием охлаждающих термоэлементов по сравнению с аппаратной гипотермией сопряжены с высоким риском непреднамеренных отклонений от целевой температуры. В целях предупреждения этого обязательным условием пассивной терапевтической гипотермии и терапевтической гипотермии с использованием охлаждающих термоэлементов является непрерывный электронный мониторинг ректальной температуры. Целевая ректальная температура составляет 33,5-34,0 °С.
При наличии в субъекте РФ медицинской организации, обладающей возможностью проведения аппаратной терапевтической гипотермии, необходимо в региональном протоколе разработать четкую маршрутизацию, позволяющую обеспечить максимальную доступность аппаратной терапевтической гипотермии для новорожденных, нуждающихся в данном методе терапии.
Согревание
-
После окончания терапевтической гипотермии проводится согревание с повышением ректальной температуры не более 0,3-0,5 °С в час, до достижения ректальной температуры 37 °С, при стабильном состоянии ребенка длительность фазы согревания составляет 7-9 ч.
-
При пассивной терапевтической гипотермии или терапевтической гипотермии с использованием охлаждающих термоэлементов согревание проводится с той же скоростью, оптимально с использованием серво-контроля.
-
При экстренном прекращении терапевтической гипотермии согревание проводится с той же скоростью.
-
Важно не допускать перегревания ребенка после процедуры согревания, необходимо поддерживать ректальную температуру в диапазоне 36,5- 37,0 °С.
-
Контроль за ректальной температурой проводится в течение 24 ч после достижения нормотермии.
-
Если при согревании возникнут судороги, следует на несколько часов прекратить дальнейшее согревание и начать противосудорожную терапию, согревание с той же скоростью можно возобновить только в том случае, если судороги не возобновлялись в течение минимум 2 ч [41-43].
-
При согревании происходит периферическая вазодилатация, что может привести к системной гипотензии. Коррекция может быть проведена внутривенным введением 10 мл/кг 0,9% раствора натрия хлорида. Если ребенок получает инотропную поддержку, возможно увеличение доз вазоактивных препаратов. При наличии сомнений целесообразно оценить данные эхокардиографии для выбора дальнейшей тактики коррекции гемодинамических нарушений [41, 42].
Побочные эффекты
Как правило, терапевтическая гипотермия хорошо переносится пациентами. В отдельных случаях встречаются следующие неблагоприятные реакции, которые, как правило, устраняются после прекращения сеанса гипотермии:
Показания к экстренному прекращению терапевтической гипотермии
Процедуру терапевтической гипотермии следует прекратить в следующих ситуациях:
-
доступные методы респираторной поддержки не позволяют купировать гипоксемию (SpO2 менее 90%);
-
имеются признаки жизнеугрожающей коагулопатии, которые не удается купировать стандартной терапией;
-
тяжелые нарушения сердечного ритма, не купируемые фармакологическими средствами;
-
сохраняются выраженные гемодинамические нарушения, которые не удается купировать с помощью восполнения ОЦК и применением инотропных препаратов [44, 45].
Мониторинг
Объем мониторинга может быть расширен согласно возможностям и региональным протоколам, действующим в различных медицинских организациях.
Обследование
При поступлении в ПИТН/ОРИТН ребенку проводится стандартное обследование:
-
лабораторное исследование: общий анализ крови и мочи, биохимический анализ крови, газовый состав крови, кислотно-щелочное равновесие, уровень глюкозы в крови, коагулограмма, бактериологическое исследование;
-
параклинические исследования: НСГ, рентгенография органов грудной и брюшной полости, эхокардиография, другие исследования по показаниям;
-
для объективизации неврологического статуса и степени ГИЭ всем новорожденным следует провести оценку по шкале Н. Sarnat, М. Sarnat (1976) в модификации B. Stoll, R. Kliegman (2004) (приложение 1).
На фоне терапевтической гипотермии:
-
контроль за газовым составом крови, кислотно-щелочным равновесием, уровнем глюкозы в крови;
-
другие лабораторные и параклинические исследования по показаниям. После окончания терапевтической гипотермии:
-
в возрасте 14-21 сут - магнитно-резонансная томография головного мозга;
-
при подозрении на субдуральные кровоизлияния целесообразно провести компьютерную/магнитно-резонансную томографию головного мозга до начала лечебной гипотермии для исключения субдуральных гематом;
-
объем, кратность проводимых клинического и параклинического исследований, частота консультаций специалистов должны соответствовать требованиям, указанным в Приказе Минздрава России от 10 мая 2017 г. № 203н «Об утверждении критериев оценки качества медицинской помощи» [66] (приложение 8).
Стабилизация состояния пациента в условиях проведения терапевтической гипотермии
Целевые значения витальных показателей во время терапевтической гипотермии [41]
Сопутствующую интенсивную терапию в процессе терапевтической гипотермии следует проводить по общепринятым правилам и показаниям [33].
Особенности ухода
-
Предпочтительнее расположение ребенка в открытой реанимационной системе, со встроенными весами.
-
При использовании костюма не следует затягивать его туго вокруг тела ребенка.
-
Крепление датчиков прибора для мониторирования электрической активности мозга, контроль за кожным покровом в месте установки датчиков проводится согласно требованиям, описанным в руководстве по проведению аЭЭГ у новорожденных [36].
Респираторная поддержка
-
ИВЛ не является обязательным условием для терапевтической гипотермии.
-
Необходимо поддерживать уровень газового состава крови в пределах предложенных выше целевых значений.
-
Следует помнить, что и гипокапния, и гиперкапния могут быть опасны и могут усугубить повреждение мозга.
-
Показания к переводу на самостоятельное дыхание не отличаются от стандартных подходов.
Сосудистый доступ
Оптимально обеспечение одного центрального и одного периферического венозного доступа.
Гемодинамическая поддержка
Проводится по общим правилам для поддержания уровня артериального давления в пределах предложенных выше целевых значений.
Инфузионная терапия, нутритивная поддержка
Расчет суточной потребности жидкости проводится согласно следующим принципам:
-
учитывая возможную задержку жидкости на фоне перенесенной асфиксии, необходимо проводить контроль за балансом жидкости, диурезом, коррекцию инфузионной терапии;
-
при отсутствии противопоказаний показано ПП согласно протоколу[57];
-
при отсутствии противопоказаний показано ЭП в соответствии с протоколом [57]; оптимальным нутритивным субстратом является материнское молоко [49].
Антибактериальная терапия
Противосудорожная и седативная терапия
-
Показанием к противосудорожной терапии являются клинические судороги или признаки судорожной активности, выявленные при аЭЭГ.
-
Показание к назначению наркотических анальгетиков - наличие дрожи.
-
Перечень препаратов, используемых для противосудорожной терапии, показания к назначению наркотических анальгетиков могут быть изменены в соответствии с локальными протоколами и формулярами.
Свертывание крови
-
Гипотермия может оказать неблагоприятное влияние на гемостаз, если изначально пациент имеет аномальные показатели, как это бывает у некоторых детей, перенесших асфиксию.
-
Рекомендуется контроль за коагулограммой до начала гипотермии.
-
Снижение температуры тела на 3,5 °С в среднем на 30% снижает коагуляцию, подобные изменения не требуют лечения при отсутствии кровоточивости.
-
При наличии клинических и лабораторных признаков синдрома диссеминированного внутрисосудистого свертывания показана трансфузия СЗП.
Ведение ребенка, получавшего терапевтическую гипотермию, в отделении патологии новорожденных и недоношенных детей, в отделении катамнеза (GPPs)
-
Курация ребенка и формирование плана дальнейшей терапии, реабилитации, катамнестичеcкого наблюдения и диспансеризации проводятся совместно с врачом-неврологом.
-
Последующее наблюдение ребенка после выписки в обязательном порядке осуществляется на этапе катамнеза в течение как минимум 18 мес жизни.
-
Длительность катамнестического наблюдения может быть увеличена согласно региональным протоколам.
ВЕДЕНИЕ МЕДИЦИНСКОЙ ДОКУМЕНТАЦИИ
-
На проведение терапевтической гипотермии должно быть получено информированное добровольное согласие законного представителя ребенка (пример согласия представлен в приложении 3).
-
В случае перегоспитализации ребенка для терапевтической гипотермии в другой стационар необходимо оформление информированного добровольного согласия законного представителя ребенка на проведение процедуры в родильном доме, во время транспортировки, в другом ле-чебно-профилактическом учреждении, а также согласие на транспортировку.
-
В случае невозможности получения информированного добровольного согласия законного представителя ребенка решение о терапевтической гипотермии принимается врачебным консилиумом (пример заключения врачебного консилиума представлен в приложении 4).
-
Законным представителям ребенка необходимо предоставить памятку для родителей, в которой подробно разъяснены основные аспекты терапевтической гипотермии (приложение 5).
-
При перегоспитализации ребенка на фоне терапевтической гипотермии информация о процедуре отмечается в карте транспортировки.
-
Проведение терапевтической гипотермии отражается в истории развития новорожденного/медицинской карте стационарного больного/ картах интенсивной терапии и не требует оформления отдельной медицинской документации.
-
В регионах, где организованы центры, концентрирующие пациентов для терапевтической гипотермии, необходимо разработать территориальный протокол, определяющий тактику врачей родовспомогательных учреждений по взаимодействию с врачами центров, проводящих терапевтическую гипотермию, и оказанию помощи новорожденным на этапе родильного дома до транспортировки.
-
Формулировка и кодирование клинического диагноза:
-
при переводе ребенка из родильного зала во вкладыше-карте первичной и реанимационной помощи новорожденному в родильном зале, регламентированной Методическим письмом от 21 апреля 2010 г. № 15-4/10/2-3204 «Первичная и реанимационная помощь новорожденным детям» [58], ставится предварительный диагноз «тяжелая асфиксия при рождении». Код по МкБ-10 - Р21.0;
-
на момент принятия решения о терапевтической гипотермии ставится и обосновывается клинический диагноз «гипоксически-ишемическая энцефалопатия» с указанием степени тяжести и ведущих неврологических синдромов согласно классификации Н. Sarnat, М. Sarnat (1976) в модификации B. Stoll, R. Kliegman (2004) [59, 61]. Код по МКБ-10 - Р91.6 [50];
-
кроме того, на основании действующих в РФ нормативных актов, регламентирующих в том числе порядок оплаты оказания неонатологической медицинской помощи [52-54], в структуре клинического диагноза в основной патологии также должен фигурировать диагноз «церебральная ишемия» с указанием степени тяжести. Код по МКБ-10 - Р91.0.
-
Пример формулировки клинического диагноза. Тяжелая асфиксия при рождении (Р21.0). Гипоксически-ишемическая энцефалопатия средней (тяжелой) степени (Р91.6). Церебральная ишемия II (III) степени(Р91.0).
СПИСОК ЛИТЕРАТУРЫ
-
Hayakawa M., Ito Y., Saito S. et al. Incidence and prediction of outcome in hypoxic-ischemic encephalopathy in Japan // Pediatr. Int. 2014. Vol. 56, N 2. P. 215-221.
-
Kurinczuk J.J., White-Koning M., Badawi N. Epidemiology of neonatal encephalopathy and hypoxic-ischaemic encephalopathy // Early Hum. Dev. 2010. Vol. 86, N 6. P. 329-338.
-
Задворнов А.А., Голомидов А.В., Григорьев Е.В. Неонатальная терапевтическая гипотермия: как она работает? // Неонатология: новости, мнения, обучение. 2016. № 1. С. 49-54.
-
Volpe J.J. Neurology of Newborn. 5th ed. Philadelphia: W.B. Saunders, 2008. 1120 p.
-
Laptook A.R., Corbett R.J., Sterett R. et al. Quantitative relationship between brain temperature and energy utilization rate measured in vivo using 31P and 1H magnetic resonance spectroscopy // Pediatr. Res. 1995. Vol. 38, N 6. P. 919-925.
-
Williams G.D., Dardzinski B.J., Buckalew A.R. et al. Modest hypothermia preserves cerebral energy metabolism during hypoxia-ischemia and correlates with brain damage: a 31P nuclear magnetic resonance study in unanesthetized neonatal rats // Pediatr. Res. 1997. Vol. 42, N 5. P. 700-708.
-
Thoresen M., Simmond M., Satas S. et al. Effective selective head cooling during posthypoxic hypothermia in newborn piglets // Pediatr. Res. 2001. Vol. 49. P. 594-599.
-
Bruno V.M., Goldberg M.P., Dugan L.L. et al. Neuroprotective effect of hypothermia in cortical cultures exposed to oxygenglucose deprivation or excitatory amino acids // J. Neurochem. 1994. Vol. 63, N 4. P. 1398-1406.
-
Kil H.Y., Zhang J., Piantadosi C.A. Brain temperature alters hydroxyl radical production during cerebral ischemia/reperfusion in rats // J. Cereb. Blood Flow Metab. 1996. Vol. 16, N 1. P. 100-106.
-
Goss J.R., Styren S.D., Miller P.D. et al. Hypothermia attenuates the normal increase in interleukin 1 beta RNA and nerve growth factor following traumatic brain injury in the rat // J. Neurotrauma. 1995. Vol. 12, N 2. P. 159-167.
-
Fukuda H., Tomimatsu T., Watanabe N. et al. Post-ischemic hypothermia blocks caspase-3 activation in the newborn rat brain after hypoxia-ischemia // Brain Res. 2001. Vol. 910, N 1-2. P. 187-191.
-
Gluckman P.D., Wyatt J.S., Azzopardi D. et al. Selective head cooling with mild systemic hypothermia after neonatal encephalopathy: multicentre randomized trial // Lancet. 2005. Vol. 365, N 9460. P. 663-670.
-
Shankaran S., Laptook A.R., Ehrenkranz R.A. et al.; National Institute of Child Health and Human Development Neonatal Research Network. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy // N. Engl. J. Med. 2005. Vol. 353, N 15. P. 1574-1584.
-
Azzopardi D.V., Strohm B., Edwards A.D. et al.; TOBY Study GrouP. Moderate hypothermia to treat perinatal asphyxial encephalopathy // N. Engl. J. Med. 2009. Vol. 361, N 14. P. 1349-1358.
-
Zhou W.H., Cheng G.Q., Shao X.M. et al.; China Study GrouP. Selective head cooling with mild systemic hypothermia after neonatal hypoxicischemic encephalopathy: a multicenter randomized controlled trial in China // J. Pediatr. 2010. Vol. 157, N 3. P. 367-372.
-
Simbruner G., Mittal R.A., Rohlmann F. et al. Systemic hypothermia after neonatal encephalopathy: outcomes of neo.nEURO.network RCT // Pediatrics. 2010. Vol. 126, N 4. P. e771-778.
-
Jacobs S.E., Morley C.J., Inder T.E. et al.; Infant Cooling Evaluation Collaboration. Whole-body hypothermia for term and near-term newborns with hypoxic-ischemic encephalopathy: a randomized controlled trial // Arch. Pediatr. Adolesc. Med. 2011. Vol. 165, N 8. P. 692-700.
-
Azzopardi D., Strohm B., Marlow N. et al.; TOBY Study GrouP. Effects of hypothermia for perinatal asphyxia on childhood outcomes // N. Engl. J. Med. 2014. Vol. 371, N 2. P. 140-149.
-
Jacobs S.E., Berg M., Hunt R. et al. Cooling for newborns with hypoxic isch-aemic encephalopathy // Cochrane Database Syst. Rev. 2013. Vol. 1. CD003311.
-
Perlman M., Shah P. Time to adopt cooling for neonatal hypoxic-ischemic encephalopathy: response to a previous commentary // Pediatrics. 2008. Vol. 121, N 3. P. 616.
-
Azzopardi D., Strohm B., Edwards A.D. et al.; Steering Group and TOBY Cooling Register Participants. Treatment of asphyxiated newborns with moderate hypothermia in routine clinical practice: how cooling is managed in the UK outside a clinical trial // Arch. Dis. Child. Fetal Neonatal Ed. 2009. Vol. 94, N 4. P. F260.
-
Higgins R.D., Raju T., Edwards A.D. et al. Hypothermia and other treatment options for neonatal encephalopathy: an executive summary of the Eunice Kennedy Shriver NICHD workshop // J. Pediatr. 2011. Vol. 159, N 5. P. 851-858.
-
National Institute for Health and Clinical Excellence. Therapeutic hypothermia with intracorporeal temperature monitoring for hypoxic perinatal brain injury [Electronic resource]. URL: http://www.nice.org.uk/guidance/ipg347. (date of access August 19, 2014)
-
Takenouchi T., Iwata O., Nabetani M. et al. Therapeutic hypothermia for neonatal encephalopathy: JSPNM & MHLW Japan Working Group Practice Guidelines Consensus Statement from the Working Group on Therapeutic Hypothermia for Neonatal Encephalopathy, Ministry of Health, Labor and Welfare (MHLW), Japan, and Japan Society for Perinatal and Neonatal Medicine (JSPNM) // Brain Dev. 2012. Vol. 34, N 2. P. 165-170.
-
Wyckoff M.H., Aziz K., Escobedo M.B. et al. Part 13: Neonatal Resuscitation: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care // Circulation. 2015. Vol. 132, N 18, suppl. 2. P. S543-S560.
-
Perlman J.M., Wyllie J., Kattwinkel J. et al. Part 7. Neonatal Resuscitation: 2015 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations // Circulation. 2015. Vol. 132, N 16, suppl. 1. P. S204-S241.
-
Tagin M.A., Woolcott C.G., Vincer M.J. et al. Hypothermia for neonatal hypoxic ischemic encephalopathy: an updated systematic review and meta-analysis // Arch. Pediatr. Adolesc. Med. 2012. Vol. 166, N 6. P. 558-566.
-
Sarkar S., Donn S.M., Bapuraj J.R. et al. Distribution and severity of hypox-ic-ischaemic lesions on brain MRI following therapeutic cooling: selective head versus whole body cooling // Arch. Dis. Child. Fetal Neonatal Ed. 2012. Vol. 97, N 5. P. F335-F339.
-
Bharadwaj S.K., Bhat B.V. Therapeutic hypothermia using gel packs forterm neonates with hypoxic ischaemic encephalopathy in resource-limited settings: a randomized controlled trial // J. TroP. Pediatr. 2012. Vol. 58. P. 382-388.
-
Robertson N.J., Hagmann C.F., Acolet D. et al. Pilot randomizedtrial of therapeutic hypothermia with serial cranial ultrasound and18-22 month follow-up for neonatal encephalopathy in a low resourcehospital setting in Uganda: study protocol // Trials. 2011. Vol. 12. P. 138.
-
Thayyil S., Shankaran S., Wade A. et al. Whole-body cooling in neonatal encephalopathy using phase changing material // Arch. Dis. Child. Fetal Neonatal Ed. 2013. Vol. 98. P. F280-F281.
-
Dahm L.S., James L.S. Newborn temperature and calculated heat loss in the delivery room // Pediatrics. 1972. Vol. 49, N 4. P. 504-513.
-
Ионов О.В., Балашова Е.Н., Киртбая А.Р. и др. Протокол проведения лечебной гипотермии детям, родившимся в асфиксии // Неонатология: новости, мнения, обучение. 2014. № 2. С. 81-44.
-
Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)» (приложения 8 и 11) [Электронный ресурс]: приказ Минздрава России от 1 ноября 2012 г. № 572н. URL: http:// base.garant.ru/70352632/ (дата обращения: 06.07.2016)
-
Об утверждении Порядка оказания медицинской помощи по профилю «неонатология» (приложение № 6) [Электронный ресурс]: приказ Минздрава России от 15 ноября 2012 г. № 921н. URL: http://ivo.garant.ru/#/ document/70293290:2. (дата обращения: 06.07.2016)
-
Дегтярев Д.Н., Ионов О.В., Киртбая А.Р. и др. Амплитудно-интегри-рованная электроэнцефалография и селективная гипотермия в неонатоло-гической практике. М.: Локус-Станди, 2013. 60 с.
-
Shah P.S. Hypothermia: a systematic review and meta-analysis of clinical trials // Semin. Fetal Neonatal Med. 2010. Vol. 15, N 5. P. 238-246.
-
Roka A., Azzopardi D. Therapeutic hypothermia for neonatal hypoxic-ischaemic encephalopathy // Early Hum. Dev. 2010. Vol. 86. P. 361-367.
-
Руководство по перинатологии / под ред. Д.О. Иванова. СПб.: Ин-форм-Навигатор, 2015. 1216 с.
-
Liu L., Yenari M.A. Therapeutic hypothermia: neuroprotective mechanisms // Front. Biosci. 2007. Vol. 12. P. 816-825.
-
Thoresen M. Hypothermia after perinatal asphyxia: selection for treatment and cooling protocol // J. Pediatr. 2011. Vol. 158, N 2. Suppl. P. e45-e49.
-
Thoresen M. Supportive care during neuroprotective hypothermia in the term newborn: Adverse effects and their prevention // Clin. Perinatol. 2008. Vol. 35. P. 749-763.
-
UK TOBY Cooling Register Clinician’s Handbook. Version 4, May 2010 [Electronic resource]. URL: https://www.npeu.ox.ac.uk/downloads/files/toby-register/Register-Clinicans-Handbook1-v4-07-06-10.pdf. (date of access July 15, 2016)
-
Mosalli R. Whole body cooling for infants with hypoxic-ischemic encepha-lopathy // J. Clin. Neonatol. 2012. Vol. 1, N 2. P. 101-106.
-
Therapeutic Hypothermia for infants >35 wks with moderate or severe Hypoxic Ischaemic Encephalopathy (HIE) Clinical Guideline Background [Electronic resource]. URL: http://www.indabook.org/preview/qirdg3abul3Uk-2R9EGZm_8d1U8Oc0CwAHQOybF90xs,/Therapeutic-Hypothermia-for-in-fants-gt-35-wks-with.html?query=Hypothermia-Protocol-Guidelines. (date of access July 15, 2016)
-
Strohm B., Hobson A., Brocklehurst P. et al. Subcutaneous fat necrosis after moderate therapeutic hypothermia in neonates // Pediatrics. 2011. Vol. 128, N 2. P. 450-452.
-
Woods A.G., Cederholm C.K. Subcutaneous fat necrosis and whole-body cooling therapy for neonatal encephalopathy // Adv. Neonatal. Care. 2012. Vol. 12, N 6. P. 345-348.
-
Gunn A.J., Bennet L. Brain cooling for preterm infants // Clin. Perinatol. 2008. Vol. 35. P. 735-748.
-
Thyagarajan B., Tillqvist E., Baral V. et al. Minimal enteral nutrition during neonatal hypothermia treatment for perinatal hypoxic-ischaemic encephalopathy is safe and feasible // Acta Paediatr. 2015. Vol. 104, N 2. P. 146-151.
-
О направлении перечня добавленных и исключенных рубрик МКБ-10 [Электронный ресурс]: письмо МЗ РФ от 05.12. 2014 г. № 13-2/1664. URL: http://docs.cntd.ru/document/420250776. (дата обращения: 06.07.2016)
-
Use and abuse of the APGAR score. Committee on Fetus and Newborn, American Academy of Pediatrics and Committee on obstetrics practice, American College of Obstetricians and Gynecologists // Pediatrics. 1996. Vol. 98, N 1. P. 141-142.
-
Об утверждении «Методических рекомендаций по способам оплаты специализированной медицинской помощи в стационарных условиях и в дневных стационарах на основе групп заболеваний, в том числе клинико-статистических групп (КСГ) и клинико-профильных групп (КПГ) за счет средств системы обязательного медицинского страхования» [Электронный ресурс]: приказ Федерального фонда ОМС от 14.11.2013 г. № 229. URL: http://www.garant.ru/products/ipo/prime/doc/70418710/ (дата обращения: 07.07.2016)
-
О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2016 год [Электронный ресурс]: постановление Правительства РФ от 19.12.2015 № 1382. URL: http://www.garant.ru/products/ipo/prime/doc/71189846/ (дата обращения: 07.07.2016)
-
Об утверждении стандарта специализированной медицинской помощи детям при разрыве внутричерепных тканей и кровоизлиянии вследствие родовой травмы, других родовых травмах центральной нервной системы, внутричерепных нетравматических кровоизлияниях, судорогах новорожденных, тяжелой асфиксии, ишемии мозга, церебральной лейкомаляции, неонатальной коме [Электронный ресурс]: приказ МЗ РФ от 1 июля 2015 г. № 397ан. URL: http://base.garant.ru/71133988/ (дата обращения: 07.07.2016)
-
Bharadwaj S.K., Bhat B.V. Therapeutic hypothermia using gel packs for term neonates with hypoxic ischaemic encephalopathy in resource-limited settings: a randomized controlled trial // J. TroP. Pediatr. 2012. Vol. 58, N 5. P. 382-388.
-
Ramos G., Brotschi B., Latal B. et al. Swiss Neonatal Network. Therapeutic hypothermia in term infants after perinatal encephalopathy: the last 5 years in Switzerland // Early Hum. Dev. 2013. Vol. 89, N 3. P. 159-164.
-
Балашова Е.Н., Бабак О.А., Володин Н.Н. и др. Парентеральное питание новорожденных // Неонатология: новости, мнения, обучение. 2014. № 3. С. 104-115.
-
Первичная и реанимационная помощь новорожденным детям [Электронный ресурс]: метод. письмо МЗ РФ и СР № 15-4/10/2-3204 от 21.04.2010 г. URL: http://pismochinovnika.ru/pismo_sborka/pismo_minzdravsocrazvit_435.htm. (дата обращения: 15.07.2016)
-
Sarnat H. B., Sarnat M.S. Neonatal encephalopathy following fetal distress: a clinical and electroencphalographic study // Arch. Neurol. 1976. Vol. 33. P. 696-705.
-
Классификация перинатальных поражений нервной системы у новорожденных (методические рекомендации). М.: Российская ассоциация специалистов перинатальной медицины, 2000. 40 с.
-
Stoll B.J., Kliegman R.M., Jenson H.B. Nervous system disorders // Nelson Textbook of Pediatrics. 17th ed. Philadelphia: Saunders, 2004. Ch. 88. P. 561-569.
-
Wyllie J., Bruinenberg J., Roehr C.C. et al. European Resuscitation Council Guidelines for resuscitation 2015. Section 7: resuscitation and support of transition of babies at birth // Resuscitation. 2015. Vol. 95. P. 249-263.
-
Rossouw G., Irlam J., Horn A.R. Therapeutic hypothermia for hypoxic ischaemic encephalopathy using low-technology methods: a systematic review and meta-analysis // Acta Paediatr. 2015. Vol. 104, N 12. P. 1217-1228.
-
al Naqeeb N., Edwards A.D., Cowan F.M. et al. Assessment of neonatal encephalopathy by amplitude-integrated electroencephalography // Pediatrics. 1999. Vol. 103. P. 1263-1271.
-
Hellstrom-Westas L., Rosen I., DeVries L.S. Amplitude-integrated EEG Classification and Interpretation in Preterm and term infants // Neoreviews. 2006. Vol. 7. P. 76-86.
-
«Об утверждении критериев оценки качества медицинской помощи» [Электронный ресурс]: приказ Министерства здравоохранения РФ от 10 мая 2017 г. № 203н. URL: http://www.garant.ru/products/ipo/prime/doc/71575880/ (дата обращения: 05.05.2018.)
ПРИЛОЖЕНИЯ
Приложение 1. Классификация гипоксически-ишемической энцефалопатии (стадии/степени гипоксически-ишемической энцефалопатии у доношенных детей по Sarnat Н., Sarnat М., 1976, в модификации Stoll B., Kliegman R., 2004) [59, 61]
| Показатель | Стадия I | Стадия II | Стадия III |
|---|---|---|---|
Уровень сознания |
Беспокойство |
Летаргия |
Ступор, кома |
Мышечный тонус |
Нормальный |
Гипотония |
Вялость |
Поза |
Легкая дистальная флексия |
Значительная дистальная флексия |
Децеребрация |
Периостальные рефлексы |
Повышены |
Повышены |
Снижены или угнетены |
Миоклонусы |
Есть |
Есть |
Отсутствуют |
Рефлекс Моро |
Сильный |
Слабый |
Отсутствует |
Зрачки |
Мидриаз |
Миоз |
Неадекватная реакция, сниженная фотореакция |
Судороги |
Нет |
Фокальные, мультифокальные |
При децеребрации |
Электроэнцефалография |
Нормальная |
Низковольтные изменения - судорожная активность |
Периодический паттерн с изопотенциальными фазами, позже - изопотенциальный |
Продолжительность |
Менее 24 ч |
24 ч-14 дней |
Часы, недели |
Прогноз |
Хороший |
Вариабельный |
Смерть, тяжелые нарушения |
Приложение 2. Классификация перинатальных поражений нервной системы у новорожденных (РАСМП, 2000) [60] I. Гипоксические поражения нервной системы
| Патогенетическая характеристика | Нозологическая форма | Основные клинические симптомы и синдромы |
|---|---|---|
I.А. P91.0. Церебральная ишемия |
Церебральная ишемия I степени (легкая) |
Возбуждение и/или угнетение ЦНС (не более 5-7 сут) |
Церебральная ишемия II степени (средней тяжести) |
Угнетение ЦНС и/или возбуждение (более 7 сут). Судороги. Внутричерепная гипертензия. Вегетативно-висцеральные нарушения |
|
Церебральная ишемия III степени (тяжелая) |
Прогрессирующая потеря церебральной активности свыше 10 сут. Угнетение → кома. Угнетение → возбуждение → судороги. Угнетение → судороги → кома. Судороги (возможен эпистатус). Дисфункция стволовых отделов мозга. Декортикация. Децеребрация. Вегетативно-висцеральные нарушения. Прогрессирующая внутричерепная гипертензия |
|
I.Б. P52. Внутричерепные кровоизлияния гипоксического генеза |
Внутрижелудочковое кровоизлияние I степени (субэпендимальное) (характерны для недоношенных) |
Отсутствие специфических неврологических симптомов |
Внутрижелудочковое кровоизлияние II степени (субэпендимальное + интравентрикулярное) (характерны для недоношенных) |
Шок. Апноэ. Угнетение → кома. Судороги. Внутричерепная гипертензия (быстро- или медленнопрогрессирующая) |
|
Внутрижелудочковое кровоизлияние III степени (субэпендимальное + интравентрикулярное + перивентрикулярное) (характерны для недоношенных) |
Шок. Апноэ. Глубокое угнетение → кома. Судороги (чаще тонические). Внутричерепная гипертензия (быстро- или медленнопрогрессирующая с дисфункцией каудальных отделов ствола) |
|
Первичное субарахноидальное кровоизлияние (чаще у недоношенных) |
Гипервозбудимость ЦНС. Гиперестезия. Парциальные (фокальные) клонические судороги. Внутричерепная гипертензия (острая гидроцефалия) |
|
Кровоизлияние в вещество головного мозга (паренхиматозное) (чаще у недоношенных) |
Клиническая картина зависит от локализации и объема кровоизлияния. Возможно бессимптомное течение. Гипервозбудимость → судороги. Глубокое угнетение → кома. Парциальные (фокальные) судороги. Внутричерепная гипертензия |
|
I.В. Сочетанные ишемические и геморрагические поражения ЦНС (нетравматические) |
Клиническая картина и тяжесть состояния определяются ведущим типом поражения и локализацией |
|
II. Травматические повреждения нервной системы |
||
II.A. Р10. Внутричерепная родовая травма |
Эпидуральное кровоизлияние |
Ранняя внутричерепная гипертензия. Гипервозбудимость. Судороги. Иногда расширение зрачка на стороне кровоизлияния |
Субдуральное кровоизлияние. Супратенториальное кровоизлияние |
Бессимптомное течение. Гемипарез. Парциальные судороги. Расширение зрачка на стороне очага (непостоянно!). Внутричерепная гипертензия (прогрессирующая) |
|
Субтенториальное (инфратенториальное) кровоизлияние |
Острая внутричерепная гипертензия. Тонические судороги. Бульбарные нарушения. Угнетение → кома. Прогрессирующие нарушения дыхания и сердечной деятельности |
|
Внутрижелудочковое кровоизлияние |
Гипервозбудимость → угнетение. Судороги (фокальные, мультифокальные). Прогрессирующая внутричерепная гипертензия → гидроцефалия. Нарушения дыхания и сердечной деятельности |
|
Паренхиматозное кровоизлияние (геморрагический инфаркт) |
Гипервозбудимость. Угнетение → кома. Судороги. Прогрессирующая внутричерепная гипертензия. Очаговые нарушения (зависят от локализации и объема гематомы). Возможно бессимптомное течение |
|
Субарахноидальное кровоизлияние |
Гипервозбудимость. Гиперестезия. Острая наружная гидроцефалия. Судороги. Угнетение → «бодрствующая» кома. |
|
II.Б. Р11.5. Родовая травма спинного мозга |
Кровоизлияние в спинной мозг (растяжение, разрыв, надрыв; с травмой или без травмы позвоночника) |
Спинальный шок. Дыхательные нарушения. Двигательные и чувствительные нарушения. Нарушения функций сфинктеров. Синдром Клода-Бернара-Горнера |
II.В. Р14. Родовая травма периферической нервной системы |
Травматическое повреждение плечевого сплетения. Проксимальный тип Эрба-Дюшена (С5-С6) |
Вялый парез проксимального отдела руки (рук) |
Дистальный тип Дежерина-Клюмпке (С7-Т1) |
Вялый парез дистального отдела руки (рук). Синдром Клода-Бернара-Горнера |
|
Тотальный паралич (С5-Т1) |
Вялый тотальный парез руки (рук). Синдром Клода-Бернара-Горнера. Дыхательные нарушения (редко) |
|
Повреждение диафрагмального нерва (C3-C5) |
Дыхательные нарушения (парадоксальное дыхание, тахипноэ). Возможно бессимптомное течение |
|
Травматическое повреждение лицевого нерва. Травматическое повреждение других периферических нервов |
На стороне поражения:
|
|
III. Дисметаболические и токсико-метаболические повреждения нервной системы |
||
Патогенетическая характеристика |
Нозологическая форма |
Основные клинические симптомы и синдромы |
III.A. Р70-Р71. Преходящие нарушения обмена веществ |
Ядерная желтуха (БЭ) |
Угнетение. Апноэ. Судороги. Опистонус. Повторные дистонические атаки. Симптом заходящего солнца |
Гипогликемия |
Бессимптомное. Угнетение/возбуждение. Судороги |
|
Гипомагнеземия |
Гипервозбудимость. Судороги |
|
Гипермагнеземия |
Угнетение → кома. Апноэ |
|
Гипокальциемия |
Гипервозбудимость. Судороги. Тетанические мышечные спазмы. Артериальная гипотензия. Тахикардия |
|
Гипонатриемия |
Бессимптомно. Угнетение. Артериальная гипотензия. Судороги. Кома |
|
Гипернатриемия |
Гипервозбудимость. Артериальная гипертензия. Тахикардия |
|
III.Б. P04. Токсико-метаболические нарушения функций ЦНС |
Состояния, обусловленные приемом во время беременности алкоголя, табакокурение, употребление наркотиков и медикаментов, вызывающих зависимость. Состояния, обусловленные действием на ЦНС токсинов (вирусных, бактериальных). |
Гипервозбудимость. Судороги. Гиперакузия. Угнетение. Кома |
Состояния, обусловленные действием на ЦНС лекарственных препаратов (или их сочетаний), введенных плоду и новорожденному |
||
IV. Поражение ЦНС при инфекционных заболеваниях перинатального периода |
||
IV.A. Р35-Р37. Поражение ЦНС при внутриутробных инфекциях (TORCH-синдром, энцефалит, менингит, менингоэнцефалит) |
Цитомегаловирусная инфекция. Герпетическая инфекция. Токсоплазмоз. Врожденная краснуха. ECHO-вирусы и др. Сифилис |
|
IV.Б. Поражение ЦНС при неонатальном сепсисе (менингит, менингоэнцефалит, вентрикулит, энцефалит) |
Стрептококковая инфекция. Стафилококковая инфекция. Колибактериальная инфекция. Клебсиеллезная инфекция. Синегнойная инфекция. Листериоз. Кандидоз |
Менингеальный. Внутричерепная гипертензия. Судороги. Кома. Гидроцефалия. Очаговые нарушения |
Комментарии к разделу I.
Гипоксические поражения ЦНС.
I.А. P91.0 «Церебральная ишемия» (ГИЭ, перинатальное гипоксическое поражение мозга).
Церебральная ишемия I степени (легкая).
Пример диагноза: Р91.0 «Церебральная ишемия I степени» или «Гипоксически-ишемическое поражение ЦНС I степени».
Церебральная ишемия II степени (средней тяжести).
-
Факторы, свидетельствующие о внутриутробной гипоксии плода; асфиксия средней тяжести при рождении; экстрацеребральные причины церебральной гипоксии, возникшие постнатально.
-
Угнетение ЦНС, возбуждение или смена фаз церебральной активности (длительностью более 7 сут).
-
Судороги у недоношенных чаще тонические или атипичные (судорожные апноэ, стереотипные спонтанные оральные автоматизмы, трепетание век, миоклонии глазных яблок, гребущие движения рук, педалирование - ног). У доношенных - мультифокальные клонические. Приступы обычно кратковременные, однократные, реже повторные.
-
Внутричерепная гипертензия (транзиторная, чаще у доношенных).
-
-
Нарушения метаболизма (гипоксемия, гиперкарбия, ацидоз более выраженные и стойкие).
НСГ - локальные гиперэхогенные очаги в мозговой ткани (у недоношенных чаще в перивентрикулярной области, у доношенных - субкортикально).
Магнитно-резонансная томография - очаговые повреждения в паренхиме мозга определяются в виде изменения характера магнитно-резонансного сигнала на Т1- и Т2-взвешенных изображениях.
Компьютерная томография головного мозга - локальные очаги пониженной плотности в мозговой ткани (у недоношенных чаще в перивентрикулярной области, у доношенных - субкортикально и/или кортикально).
ДЭГ - признаки гипоперфузии в средней мозговой артерии у доношенных и передней мозговой артерии у недоношенных. Увеличение диастолической составляющей скорости кровотока, снижение индекса резистентности.
Пример диагноза: Р91.0 «Церебральная ишемия II степени» или «Гипоксически-ишемическое поражение ЦНС II степени».
В случаях диагностики конкретных структурных изменений мозга выставляется дополнительный код (например, Р91.2 «Церебральная лейкомаляция новорожденного»).
Церебральная ишемия III степени (тяжелая).
-
Факторы приводящие к внутриутробной гипоксии плода и/или тяжелой перинатальной асфиксии, экстрацеребральные причины стойкой гипоксии мозга (врожденный порок сердца, тяжелые формы синдрома дыхательных расстройств, гиповолемический шок и др.).
-
Прогрессирующая потеря церебральной активности - свыше 10 сут (в первые 12 ч жизни глубокое угнетение или кома, в период с 12-24 ч - кратковременное нарастание уровня бодрствования, с 24-72 ч - нарастание угнетения или кома).
НСГ - диффузное повышение эхогенности мозговой паренхимы, характерно для доношенных. Повышение эхогенности перивентрикулярных структур характерно для недоношенных. Сужение боковых желудочков. В последующем образуются кистозные перивентрикулярные полости у недоношенных и появляются признаки атрофии больших полушарий головного мозга с пассивным расширением ликворных пространств.
Компьютерная томография: снижение плотности мозговой паренхимы, сужение ликворных пространств, мультифокальные кортикальные и субкортикальные очаги пониженной плотности, изменение плотности базальных ганглиев и таламуса - преимущественно у доношенных, перивентрикулярные кистозные полости - у недоношенных.
Магнитно-резонансная томография - поражения в паренхиме мозга определяются в виде изменения магнитно-резонансного сигнала на Т1-и Т2-взвешенных изображениях.
ДЭГ - паралич магистральных артерий мозга с переходом в стойкую церебральную гипоперфузию. Снижение диастолической скорости кровотока, изменение характера кривой (лизинговый или маятникообразный ее характер). Увеличение индекса резистентности.
Пример диагноза: Р91.0 «Церебральная ишемия III степени» или «Гипоксически-ишемическое поражение ЦНС III степени».
В случаях диагностики конкретных структурных изменений мозга выставляется дополнительный код.
Приложение 3
Форма №_
утверждена приказом руководителя
от «_»_20_г. №_
ИНФОРМИРОВАННОЕ ДОБРОВОЛЬНОЕ СОГЛАСИЕ законного представителя на проведение терапевтической гипотермии
Я,_, являясь законным
(Ф.И.О. законного представителя пациента)
представителем пациента:_
(Ф.И.О. пациента)
Получил (-а) от лечащего врача_
(Ф.И.О. лечащего врача)
подробную информацию о диагнозе пациента:_
(наименование диагноза)
и даю свое согласие на проведение пациенту терапевтической гипотермии.
Я подтверждаю, что мне в полной мере и в доступной форме разъяснены характер, особенности и ход проведения терапевтической гипотермии, выражающейся в лечебном охлаждении организма в целях защиты мозга и улучшения прогноза на дальнейшее нервно-психическое развитие моего ребенка.
Я подтверждаю, что получил (-а) полную информацию о том, что во время терапевтической гипотермии могут возникнуть обратимые осложнения (побочные эффекты), и в этом случае я согласен (согласна) на прекращение терапевтической гипотермии врачами по их усмотрению.
Получив полную информацию (в том числе в печатном варианте в виде памятки) о возможных последствиях и осложнениях в связи с проведением терапевтической гипотермии, я подтверждаю, что мне понятен смысл всех терминов, на меня не оказывалось давление и я осознанно принимаю решение о ее проведении пациенту.
Я имел (-а) возможность задавать любые вопросы и на все вопросы получил (-а) исчерпывающие ответы.
Мне разъяснено также мое право отказаться от проведения пациенту терапевтической гипотермии.
Я,_
(Ф.И.О. законного представителя пациента)
на проведение терапевтической гипотермии_
[прописью «СОГЛАСЕН» («СОГЛАСНА») или «НЕ СОГЛАСЕН» («НЕ СОГЛАСНА»)]
Законный представитель пациента_
(подпись, расшифровка подписи)
паспорт кем выдан
дата выдачи адрес регистрации:
Дата: «_»_20_г.
Я свидетельствую, что разъяснил (-а) законному представителю суть, риск и альтернативу проведения терапевтической гипотермии, дал (-а) ответы на все вопросы.
Я также свидетельствую, что законный представитель пациента _прочитал (-а) и расписался (расписалась)
(Ф.И.О. законного представителя)
в моем присутствии.
Врач:_
(Ф.И.О., подпись)
Дата: «_»_20_г.
Приложение 4
РЕШЕНИЕ КОНСИЛИУМА о проведении пациенту терапевтической гипотермии
г.«»_20_г.
Консилиум_в составе:
(наименование медицинской организации)
изучил историю болезни и клиническую ситуацию в отношении следующего пациента:
Ф.И.О. пациента:_
Дата рождения: «»_20_г. История болезни: №
Лечащий врач:_
Текущий диагноз (подтвержден/не подтвержден): Гипоксически-ишемическая энцефалопатия_степени_
(вписать степень тяжести, указать ведущие неврологические синдромы)
Проводимые методы лечения (необходимое подчеркнуть и/или вписать): Искусственная вентиляция легких; инфузионная терапия и парентеральное питание; антибактериальная терапия; терапия неонатального шока; профилактика геморрагической болезни новорожденного; гемостатическая терапия; коррекция метаболических нарушений; другое_
Обоснование назначения лечебной гипотермии с оценкой ранее проводимого лечения. Наличие у новорожденного гестационного возраста более 35 нед и массой тела при рождении более 1800 г, потребовавшего проведения первичных реанимационных мероприятий в родильном зале, показаний к выполнению терапевтической гипотермии (необходимое подчеркнуть).
Критерии группы А. Оценка по шкале Апгар не более 5 на 10-й минуте жизни или сохраняющаяся потребность в ИВЛ на 10-й минуте жизни, или в первом анализе крови, взятом в течение первых 60 мин жизни (пуповинной, капиллярной или венозной), водородный показатель менее 7,0, или в первоманализе крови, взятом в течение 60 мин жизни (пуповинной, капиллярной или венозной), дефицит оснований (ВЕ) не менее 16 моль/л.
Критерии группы В. Клинически выраженные судороги (тонические, клонические, смешанные), или мышечная гипотония и гипорефлексии, или выраженный гипертонус и гипорефлексии, или нарушения зрачкового рефлекса (сужен и не реагирует на затемнение, расширен и не реагирует на свет, слабая реакция зрачка на изменение освещения).
Критерии группы С (данные аЭЭГ). Верхний край зубцов кривой более 10 мкВ, нижний край зубцов кривой менее 5 мкВ. Кривая может прерываться пиками или сериями пиков более 25 мкВ, или верхний край зубцов менее 10 мкВ, кривая прерывается и периодически выглядит изолинией и/или прерывается сериями пиков менее 10 мкВ, или сплошные серии пиков с вольтажом более 25 мкВ, или изолиния с вольтажом менее 5 мкВ, судорожные приступы.
Учитывая изложенное, в связи с невозможностью получения информированного добровольного согласия у законных представителей пациента консилиум принимает решение о проведении пациенту
_
(Ф.И.О. пациента)
лечебной гипотермии по жизненным показаниям не позднее 6 ч после рождения и в течение 72 ч.
Врач_(_)
Врач_(_)
Врач_(_)
Приложение 5. Терапевтическая гипотермия (искусственное лечебное охлаждение) всего тела у новорожденных
Памятка для родителей
Терапевтическая гипотермия (от греч. hypo- + thermos - «тепло») - искусственное охлаждение тела в целях снижения интенсивности метаболических процессов в организме и повышения устойчивости ребенка к перенесенному недостатку кислорода во время родов. Термин «терапевтический» с латинского языка переводится как «лечебный».
Терапевтическая гипотермия осуществляется путем охлаждения ребенка. Температура тела ребенка искусственно снижается от нормальной 36,7 °С до 33,5-34,5 °С.
Медицинское наименование этой процедуры - «терапевтическая гипотермия с интракорпоральным температурным мониторингом в целях лечения перинатальных гипоксических повреждений головного мозга».
Выделяют несколько причин таких повреждений, основные из которых:
-
прерывание кровотока через пуповину (истинные узлы пуповины, сдавление, тугое обвитие пуповины вокруг шеи и т.д.);
-
нарушение газообмена через плаценту (преждевременная отслойка плаценты, предлежание плаценты и др.);
-
нарушение кровообращения в материнской части плаценты (чрезмерно активные схватки, очень низкое или очень высокое артериальное давление у матери и др.);
-
уменьшение количества кислорода в крови матери (анемия, сердечнососудистые заболевания, дыхательная недостаточность).
Многочисленные научные исследования, проведенные в ведущих клиниках Европы и США, доказали эффективность терапевтической гипотермии, а результаты практического применения этого метода показали, что в дополнение к стандартной схеме лечения применение терапевтической гипотермии улучшает показатели нервно-психического развития детей, снижается риск инвалидизации. Кроме того, терапевтическая гипотермия не оказывает никакого отрицательного влияния на развитие ребенка в будущем.
Как и при любом лечении, охлаждение всего организма может приводить к различным побочным эффектам, таким как отеки, снижение количества тромбоцитов в крови, нарушения ритма сердца, повреждение кожного покрова, ухудшение свертываемости крови и т.д. Часть этих эффектов может потребовать дополнительного лечения. В случае возникновения любой негативной реакции организма ребенка на терапевтическую гипотермию ее проведение будет немедленно прекращено и начнется согревание.
Во время терапевтической гипотермии ребенка можно кормить грудным молоком (не считая внутривенного питания), это будет очень полезно для малыша.
Для того чтобы своевременно помочь ребенку, терапевтическая гипотермия должна быть начата не позднее первых 6 ч жизни, поэтому решение должно быть принято в ближайшее время, в противном случае проведение терапевтической гипотермии становится бесполезным.
Приложение 6. Классификация фоновой биоэлектрической активности головного мозга доношенных новорожденных (по Naqeeb Al., 1999 [64])
Фоновая аЭЭГ-активность расценивается как активность с нормальной амплитудой при верхней границе паттерна не менее 10 мкВ и нижней не менее 5 мкВ. Вариант нормы (рис. 1, а).
Умеренные отклонения от нормы характеризуются величиной верхней границы паттерна не менее 10 мкВ и нижней не более 5 мкВ. Высокая вариабельность амплитуды при отсутствии циклической вариабельности биоэлектрической активности (рис. 1, б).
Тяжелые нарушения, депрессия биоэлектрической активности при верхней границе не более 10 мкВ и нижней не более 5 мкВ (рис. 1, в).
Судорожный статус - продолженная судорожная активность, высокоамплитудный паттерн с низкой вариабельностью амплитуд (рис. 1, г).

Рис. 1. Приложение 7. Классификация судорожной биоэлектрической активности головного мозга доношенных новорожденных (по Hellström-Westas L., 2006) [65]
Рис. 2. а - одиночные судороги; б - повторяющиеся судороги; в - эпилептический статус
Приложение 8. Техника пассивной терапевтической гипотермии и терапевтической гипотермии с использованием охлаждающих термоэлементов (GPPs)
-
В случае рождения ребенка в тяжелой асфиксии в родильном зале при проведении реанимационных мероприятий необходимо отключить реанимационный стол. Ребенок охлаждается очень быстро, поэтому в родильном зале необходимо проводить контроль за температурой тела.
-
При переводе в ПИТН/ОРИТН необходимо отключить обогрев в транспортном кувезе. Подогрев кислородно-воздушной смеси следует обеспечивать в обычном режиме (температура не менее 37 °С).
-
Предпочтительно непосредственно в ПИТН/ОРИТН выложить ребенка в открытую реанимационную систему. Желательно также обеспечить ребенка системой обогрева с подогреваемым матрасиком, так как в ходе процедуры может возникнуть необходимость в повышении температуры тела ребенка.
-
В условиях ПИТН/ОРИТН необходимо обязательно обеспечить контроль за ректальной температурой в динамике непрерывно в течение всего периода пассивной гипотермии и последующего согревания. Данный мониторинг может быть реализован с помощью температурных ректальных датчиков стандартных мониторов слежения за витальными функциями либо с помощью других устройств (электронного термометра). Датчик должен быть помещен ректально на глубину не менее 5 см. Контроль за температурой должен проводиться непрерывно с регистрацией в листе интенсивной терапии не реже 1 раза в 15 мин.
-
Ректальная температура тела ребенка в ходе пассивной терапевтической гипотермии не должна быть ниже 33,5-34,0 °С, так как при более низких значениях увеличивается риск развития умеренной и тяжелой гипотермии. Включение матрасика и установка температуры его нагрева на 1 °С более ректальной температуры выполняется в случае снижения ректальной температуры до 33,5 °С, выключается при достижении ректальной температуры 34 °С.
-
Как правило, дополнительных усилий по охлаждению ребенка не требуется. Новорожденные без обогрева достаточно быстро охлаждаются. Может возникнуть необходимость в дополнительном обогреве, чтобы удержать целевую температуру тела ребенка. С этой целью могут быть использованы матрасики с подогревом или включение лучистого тепла открытого реанимационного места. Температура подогрева (матрасика или стола) при этом устанавливается на 1 °С выше ректальной температуры.
-
Для поддержания целевой температуры тела новорожденного нередко требуется применение дополнительных способов охлаждения (снижение температуры воздуха в палате, где находится ребенок, применение охлаждающих термоэлементов). Важно помнить, что охлаждающие термоэлементы не прислоняются к коже ребенка, а располагаются на расстоянии от нее не менее 5-15 см, завернутые в одно-двуслойную пеленку.
-
В ходе согревания наиболее оптимально использовать матрасик с подогревом или лучистое тепло открытой реанимационной системы. Температуру обогрева устанавливают выше ректальной температуры ребенка на 0,5-1,0 °С. Согревание проводится с повышением ректальной температуры не более 0,3-0,5 °С/ч до достижения ректальной температуры 37 °С. Длительность фазы согревания составляет 7-9 ч.
СИНДРОМ АСПИРАЦИИ МЕКОНИЯ У НОВОРОЖДЕННЫХ
Согласовано и утверждено Российским обществом неонатологов и Российской ассоциацией специалистов перинатальной медицины
Авторы: Буров А.А., Дегтярев Д.Н., Иванов Д.О., Карпова А.Л., Ли А.Г., Мерзликина С.С., Межинский С.С., Мостовой А.В. (модератор рабочей группы), Петренко Ю.В., Сапун О.И., Шабалов Н.П.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Синдром аспирации мекония (САМ) - дыхательное расстройство, обусловленное попаданием мекония вместе с околоплодными водами в дыхательные пути ребенка до родов или в момент рождения.
Синдром утечки воздуха - тяжелое состояние новорожденных, характеризующееся повреждением воздухоносных путей и альвеол с последующим выходом из них воздуха, распространением перибронхиально и накоплением в полостях и тканях организма.
ПЛГН - симптомокомплекс, развивающийся при широком круге легочных, внелегочных и кардиальных патологических состояний (при структурно нормальном сердце). При этом высокая сопротивляемость легочных сосудов и нарушенная реактивность легочной артериальной сети вызывают право-левое шунтирование крови через ОАП и/или овальное окно, приводящее к развитию системной гипоксемии.
Переношенный ребенок - ребенок, родившийся в срок беременности 42 полные недели или более (294 дня или более).
КРАТКАЯ ИНФОРМАЦИЯ
Определение
Синдром аспирации мекония (САМ) - дыхательное расстройство, обусловленное попаданием мекония вместе с околоплодными водами в дыхательные пути ребенка до родов или в момент рождения [1].
Синоним - синдром мекониальной аспирации у новорожденных.
Этиология и патогенез
САМ чаще наблюдается у переношенных или доношенных новорожденных. Аспирация содержащих меконий околоплодных вод может возникнуть до родов или в момент рождения. Редко наблюдается выход мекония в околоплодные воды до полных 34 нед [2]. Появление мекония в околоплодных водах - результат стимуляции созревающего кишечника вследствие гипоксического стресса. У почти доношенного плода кишечник достаточно зрелый, и вагусная стимуляция от головного мозга при компрессии пуповины или других состояниях, сопровождающихся гипоксией, может вызвать перистальтику и релаксацию ректального сфинктера, приводя к пассажу мекония. Меконий, попадая в околоплодные воды, уменьшает их антибактериальную активность и впоследствии увеличивает риск перинатальной бактериальной инфекции. Однако самое тяжелое осложнение пассажа мекония, возникшего внутриутробно, - аспирация загрязненных меконием околоплодных вод. Аспирация мекониальными водами может возникнуть, если у плода на фоне прогрессирующей гипоксии развивается дистресс, приводящий к возникновению паттерна гаспинг-дыхания. Аспирация вызывает гипоксию после рождения за счет четырех легочных эффектов: обструкции дыхательных путей, дисфункции сурфактанта, химического пневмонита, легочной гипертензии [3].
-
Обструкция дыхательных путей. Полная обструкция дыхательных путей меконием приводит к ателектазам. Частичная обструкция вызывает задержку газа (воздушные ловушки) и перерастяжение альвеол. Это часто называют клапанным эффектом. Газ воздушных ловушек (перерастягивая легкое) может вызывать повреждение легкого с выходом в плевральную полость (пневмоторакс), средостение (пневмомедиастинум) или перикард (пневмоперикард) [4].
-
Вторичный дефицит сурфактанта. Меконий деактивирует сурфактант и может угнетать синтез сурфактанта [5, 6]. Некоторые компоненты мекония, особенно свободные жирные кислоты (пальмовая, стеариновая, олеиновая), имеют минимальное поверхностное натяжение выше сурфактанта, в результате чего уменьшается альвеолярная поверхность, вызывая диффузные ателектазы [7].
-
Аспирационный пневмонит. Энзимы, желчные соли и свободные жирные кислоты мекония раздражают дыхательные пути и паренхиму, способствуя выбросу цитокинов, которые вызывают диффузный пневмонит. Развитие асептического воспалительного процесса в респираторном отделе легких возможно через несколько часов после аспирации.
Все эти легочные эффекты могут вызвать серьезные нарушения перфузионно-вентиляционных отношений и привести к развитию ПЛГН.
У части детей через 48-72 ч после рождения САМ осложняется развитием аспирационной пневмонии.
Эпидемиология
Околоплодные воды могут быть окрашены меконием в 8-20% всех родов [1, 2, 8, 9], причем после полных 42 нед частота достигает 23-52% [10, 11]. У 2-9% новорожденных, у которых околоплодные воды были окрашены меконием, развивается клиническая картина САМ [2, 12, 13]. Около 1/3 новорожденных с САМ требуют интубации трахеи и механической вентиляции легких [13]. Летальность при САМ в связи с тяжелыми повреждениями паренхимы легких и развитием легочной гипертензии может достигать 20%. Другие осложнения, включая синдром утечки воздуха, встречаются у 10-30% детей с САМ.
Код по Международной классификации болезней 10-го пересмотра
Классификация
По степени тяжести
САМ подразделяется [2]:
-
на легкое течение - кислородная зависимость сохраняется менее 48 ч, новорожденный нуждается менее чем в 40% кислороде;
-
среднюю степень тяжести - новорожденный нуждается более чем в 40% кислороде в течение более 48 ч, отсутствуют признаки синдрома утечки воздуха;
-
тяжелое течение - необходимость во вспомогательной вентиляции легких в течение более 48 ч. Частым осложнением при тяжелом течении является ПЛГН.
Осложнения
САМ [15].
-
-
может развиваться практически на любой стадии, поскольку САМ относится к заболеваниям, которые сопровождаются формированием воздушных ловушек. Эту особенность необходимо постоянно принимать во внимание при проведении реанимационных мероприятий и интенсивной терапии. Наиболее важно помнить об этом в тех ситуациях, когда внезапно происходит ухудшение состояния ребенка либо изначально имеет место тяжелое течение заболевания.
-
-
Аспирационная пневмония и сепсис:
-
за исключением сепсиса, все остальные варианты инфекционных процессов, как правило, не провоцируют отхождение мекония;
-
особенно у недоношенных новорожденных необходимо помнить о возможности развития листериоза;
-
меконий представляет собой благоприятную среду для роста микроорганизмов, поэтому возможно развитие вторичных инфекционных процессов.
-
ДИАГНОСТИКА
Жалобы и анамнез
Необходимо тщательно собрать и оценить анамнез в целях выявления факторов риска развития САМ. Факторы риска:
-
острая гипоксия плода вследствие обвития пуповиной вокруг шеи ребенка, преждевременной отслойки плаценты и др.;
-
хроническая гипоксия плода, обусловленная плацентарной недостаточностью, гемолитической болезнью плода, сахарным диабетом у матери, артериальной гипертензией у матери, преэклампсией и эклампсией;
-
курение, наркотическая зависимость матери (особенно кокаиновая) [2].
Физикальное обследование
-
Рекомендуется на этапе постановки диагноза оценить симптомы дыхательных расстройств у новорожденного по шкале Доунса (приложение 2) [16] или Сильвермана.
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2b).
Комментарии. Вследствие образования воздушных ловушек и чрезмерного растяжения альвеол грудная клетка постепенно принимает бочкообразную форму, поэтому при перкуссии может определяться коробочный звук, чередующийся с участками притупления в связи с образованием ателектазов. При аускультации выслушивается ослабленное или жесткое дыхание, обилие разнокалиберных хрипов.
Лабораторная диагностика
-
Рекомендуется для оценки степени тяжести дыхательной недостаточности провести анализ кислотно-основного состояния и газового состава крови [20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3).
Комментарии. В зависимости от выраженности мекониальной аспирации может отмечаться развитие респираторного либо метаболического ацидоза вследствие гипоксемии и гиперкарбии. Ацидоз любого генеза, в свою очередь, увеличивает риск развития либо потенцирует формирование персистирующей легочной гипертензии [4]. -
Рекомендуется в случае развития дыхательных расстройств у ребенка из группы риска по развитию САМ выполнить бактериологическое исследование содержимого трахеи и крови на стерильность [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3).
Комментарии. Выбор тактики АБТ у новорожденных с САМ желательно проводить с учетом результатов бактериологического исследования. -
Рекомендуется выполнить общий (клинический) развернутый анализ крови с определением нейтрофильного индекса [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3).
Комментарии. Необходимо проводить дифференциальную диагностику с врожденной пневмонией.
Инструментальная диагностика
-
Рекомендуется провести рентгенографию органов грудной клетки [20].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1a).
Комментарии. Мекониальная аспирация приводит к формированию характерных изменений, обнаруживаемых при рентгенографии органов грудной полости, таких как появление диффузных, полиморфных, неоднородных по структуре узелковых инфильтратов, локальных либо генерализованных, расположенных асимметрично либо симметрично; увеличение воздушности неизмененной легочной ткани; признаки утечки воздуха; плевральный выпот; кардиомегалия. Полная окклюзия дыхательных путей приводит к формированию ателектазов. Ателектазы могут быть двусторонними, диффузными/распространенными, неоднородными по структуре и полиморфными по форме и размерам или более четкими в виде отдельных узелков. Наличие ателектазов является наиболее значимым прогностическим признаком в отношении тяжести дыхательной недостаточности и смертности. Вследствие повреждения альвеолярного эндотелия в дыхательных путях накапливается жидкость, развивается альвеолярный отек легких и появляется плевральный выпот. Частичное перекрытие просвета дыхательных путей и альвеол мекониальным детритом приводит к формированию воздушных ловушек, а также сопровождается гипервентиляцией отдельных участков легких, что рентгенологически проявляется более легким/усиленным прохождением через данную зону рентгеновских лучей, а также более низким стоянием диафрагмы на стороне поражения. Чрезмерное растяжение дыхательных путей и альвеол может приводить к разрыву альвеол с последующим выходом воздуха в интерстициальное пространство, расширением интерстициальных лимфатических сосудов и распространением по ним далее вышедшего воздуха, а также выходом его в плевральную полость и средостение. Кардиомегалия может быть следствием перенесенной асфиксии либо отсроченным проявлением ПЛΓН [4].
Дифференциальная диагностика
Дифференциальную диагностику проводят:
При диагностике РДС характерными признаками на рентгенограмме являются диффузное снижение прозрачности легочных полей (симптом матового стекла), контрастирование воздухом бронхов (воздушная бронхограмма). Важно отметить, что при наличии болезни гиалиновых мембран отмечается тенденция к тому, что легкие выглядят пропорционально, диффузно уменьшенными в размерах вследствие дефицита сурфактанта, в то время как при наличии САМ определяется повышенная воздушность задействованных в процессе дыхания участков легочной ткани.
Диагностика транзиторного тахипноэ новорожденных. Заболевание может встречаться у детей любого ГВ, но более характерно для поздних недоношенных и доношенных новорожденных, особенно после родоразрешения путем кесарева сечения. Заболевание характеризуется отрицательными маркерами воспаления и быстрым регрессом дыхательных нарушений и рентгенологической симптоматики. Последняя характеризуется легким или умеренным повышением воздушности легочной ткани, симметричным усилением рисунка в области корней легких, возможно появление плеврального выпота с усилением междолевой плевры. Рентгенологическая картина возвращается к нормальной через 48-72 ч [4].
Диагностика раннего неонатального сепсиса, врожденной пневмонии. Характерны положительные маркеры воспаления, определяемые в динамике в первые 72 ч жизни. Рентгенологические симптомы врожденной пневмонии неспецифичны. В большинстве случаев отмечается двустороннее поражение легочной ткани, как правило, в виде пятнистой картины легких - сочетание участков уплотнения легочной ткани и компенсаторного повышения воздушности. Может обнаруживаться выпот в плевральных полостях [21, 22, 23]. При пневмонии, вызваннойстрептококками группы В, на рентгенограммах отмечается усиление рисунка за счет сетчатых/зернистых структур, особенно в случае сочетания с дефицитом сурфактанта [24]. Очаги уплотнения легочной ткани, как правило, затрагивают несколько долей. Выраженное уплотнение, ограниченное одной отдельно взятой долей, сравнительно редко встречается у новорожденных [25].
ЛЕЧЕНИЕ
Консервативное лечение
Помощь новорожденному с синдромом аспирации мекония в родильном зале
Рекомендуется дифференцированный подход к оказанию помощи в родильном зале новорожденным с околоплодными водами, содержащими меконий [26]. Акушеры должны заранее предупредить врачей-неонатологов, если околоплодные воды окрашены меконием и имеются признаки дистресса плода.
-
Не рекомендуется санация ротоглотки после рождения головки плода, так как это не снижает вероятности развития дыхательной недостаточности или клинически выраженного САМ, включая новорожденных, где имело место наличие густого мекония, отмечались признаки дистресса у плода или родоразрешение выполнялось абдоминальным путем [19].
-
Не рекомендуются рутинная интубация и санация трахеи через интубационную трубку, если на момент рождения у новорожденного ЧCC более 100 в минуту, спонтанное дыхание эффективное, хороший мышечный тонус [27, 28].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2b).
Комментарии. При наличии мекония в околоплодных водах у ребенка, имеющего показания к ИВЛ, следует начать ИВЛ маской. Интубация трахеи и санация показаны при подозрении на обструкцию трахеи меконием (отсутствует экскурсия грудной клетки при масочной ИВЛ) [59]. -
Не рекомендуется проведение лаважа желудка при наличии окрашенных меконием околоплодных вод [29, 30].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2b).
Комментарии. В случае отсутствия лаважа желудка в родильном зале при наличии мекония в околоплодных водах не зарегистрировано вторичных осложнений, связанных с регургитацией и/или аспирацией мекониального желудочного содержимого [29]. В то же время лаваж желудка рассматривается как потенциально опасная манипуляция, поскольку введение рото- или назогастрального зонда в родильном зале нередко сопровождается развитием апноэ и/или брадикардии [30].
Использование респираторной поддержки в условиях родильного зала
-
Рекомендуется начать респираторную поддержку в родильном зале по показаниям [26].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2a). Комментарии.-
ИВЛ в родильном зале может проводиться:
-
аппаратом ИВЛ традиционным [26]. В целях безопасности желательно применять саморасправляющиеся мешки объемом не более 240 мл с клапаном положительного давления PEEP и манометром для контроля за пиковым давлением. В настоящее время, как правило, в родильном зале применяются нетриггерные режимы ИВЛ, контролируемые по давлению. Однако в перспективе более безопасными и эффективными могут стать режимы ИВЛ с контролем дыхательного объема. Параметры ИВЛ подбираются в зависимости от степени выраженности дыхательных нарушений и определяются механическими свойствами легких. Основным индикатором эффективности ИВЛ в родильном зале является увеличивающаяся ЧСС, а также видимые экскурсии грудной клетки. Уровень кислорода для доношенных новорожденных устанавливается на старте 21% и в дальнейшем увеличивается пошагово для поддержания целевого уровня сатурации (Методическое письмо от 21 апреля 2010 г. № 15-4/10/2- 3204 «Первичная и реанимационная помощь новорожденным детям»). Скорость потока устанавливается 8-10 л/мин. Уровень положительного PEEP устанавливается в пределах 5-6 см вод.ст. [31]. Давление вдоха (пиковое давление) регулируется в зависимости от видимых глазом экскурсий грудной клетки и оксигенации, определенной с помощью транскутанного пульсоксиметра. Важно помнить, что в случае отсутствия видимых экскурсий грудной клетки необходимо проверить проходимость дыхательных путей, в зависимости от ситуации сменить эндотрахеальную трубку или увеличить давление вдоха. ИВЛ в условиях родильного зала проводится с частотой 35-40 вдохов в минуту в целях предотвращения гипокапнии [32]. Для поддержания заданной частоты ИВЛ с помощью ручного аппарата вентиляции легких эффективно использование устройства с метрономом [33].
Лечебно-охранительный режим
-
Рекомендуется создать оптимальный температурный режим для уменьшения потребления кислорода и энергии [34].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1b).
Комментарии. Создание оптимального температурного режима осуществляется с помощью специального медицинского оборудования, позволяющего обеспечивать термонейтральный климат (кувез, открытая реанимационная система, матрасик с подогревом, источник лучистого тепла). Под термонейтральным климатом следует понимать температуру окружающей среды, при которой температура тела ребенка поддерживается в пределах 36,5-37,5 °С. -
Рекомендуется обеспечить минимизацию прикосновений к ребенку и манипуляций, особенно в случае развития ПЛГН [34].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1b).
Комментарии. Соблюдение лечебно-охранительного режима важно, поскольку беспокойство может увеличивать проявления ПЛГН и право-левое шунтирование крови, приводя к дополнительной гипоксемии и ацидозу. Может возникнуть необходимость в седативной терапии для уменьшения беспокойства ребенка [35]. Санация эндотрахеальной трубки не должна быть рутинной, проводится только по показаниям. Желательно использовать закрытые санационные системы, поскольку они позволяют наиболее оптимально уменьшить эпизоды гипоксемии, связанные с санацией, а также снизить риск инфицирования [28].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1b).
Респираторная терапия у новорожденных с синдромом аспирации мекония
-
Рекомендуется при наличии показаний начать ИВЛ [36].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1b). Комментарии.-
Необходимо избегать гипоксемии и гиперкапнии, поддерживая сатурацию гемоглобина кислородом (SpO2) 91-95%.
-
Потребность в механической ИВЛ возникает приблизительно у 30-40% новорожденных с САМ [1, 38]. Выбор режима ИВЛ представлен в приложении 3, параметров ИВЛ - в приложении 4.
При возрастающей потребности в увеличении параметров традиционной ИВЛ необходимо рассмотреть вопрос о высокочастотной осцилляторной вентиляции (ВЧО ИВЛ) [39, 40-42] или высокочастотной струйной ИВЛ [43]. По данным литературы, около 20-30% всех детей с САМ, находящихся на ИВЛ, нуждаются в ВЧО ИВЛ [12, 36, 41]. Основными показаниями к переводу больного с традиционной ИВЛ на ВЧО ИВЛ является рефрактерная гипоксемия и/или потребность в высоком МАР (8-10 см вод.ст. и более), а также высокий уровень FiO2 (0,6 и более) для поддержания целевого уровня SpO2 91-95% [40, 44]. Подбор параметров ВЧО ИВЛ представлен в приложении 5. -
Следует помнить, что доказательства эффективности применения CPAP у новорожденных с САМ отсутствуют. Кроме того, CPAP при САМ может увеличивать риск развития пневмоторакса [37]. Однако из всех новорожденных с САМ, нуждающихся в респираторной поддержке, примерно 10-20% получают респираторную терапию только в виде назального CPAP. Кроме того, до 1/4 новорожденных с САМ, потребовавших проведения интубации и механической ИВЛ, получают CPAPдо и/или после ИВЛ. CPAP обычно эффективен с давлением 5-8 см H2 O, с применением как биназальных, так и мононазальных канюль.
-
За исключением чрезвычайных обстоятельств, интубация новорожденного с САМ должна выполняться с премедикацией. Значительная утечка воздуха при ИВЛ является серьезным барьером для эффективной вентиляции, и в большинстве случаев требуется эндотрахеальная трубка большего внутреннего диаметра, обычно не менее 3,5 мм [44].
-
При подтверждении САМ можно рассмотреть вопрос о сурфактантной терапии [45]. Терапия сурфактантом может быть представлена в виде болюсного эндотрахеального введения и реже - бронхоальвеолярного лаважа. Обе процедуры являются рискованными, требуют дальнейших исследований, поэтому не могут быть рекомендованы для рутинного использования, однако могут быть показаны при тяжелой гипоксемии, не поддающейся коррекции другими методами респираторной терапии [46, 47, 58].
-
В случае развития ПЛГН возможно проведение терапии ингаляцией оксида азота (NO) [48]. Крупные рандомизированные контролируемые исследования демонстрируют улучшение исходов при применении ингаляции оксида азота у новорожденных с ПЛГН, а также уменьшение риска перевода детей на экстракорпоральную мембранную оксигенацию или летального исхода [49]. Однако в РФ оксид азота не зарегистрирован как медицинский газ (применение off-label). При его назначении необходимо проведение врачебного консилиума и взятие согласия на его использование по жизненным показаниям у законных представителей ребенка [50].
-
В тяжелых случаях проявления ПЛГН может потребоваться проведение экстракорпоральной мембранной оксигенации при наличии технической и организационной возможности.
-
-
Рекомендуется медикаментозная седация при ИВЛ [1, 44].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2a).
Комментарии. Седация при ИВЛ проводится для уменьшения потребления кислорода и исключения работы дыхания у новорожденных по показаниям (особенно при развитии ПЛГН) с учетом индивидуальных особенностей. Показания: одышка более 80 вдохов в минуту, выраженное участие дыхательной мускулатуры в акте дыхания, сопротивление аппарату, при котором происходит снижение оксигенации. Используются опиоидные анальгетики и бензодиазепины [35, 44]. Применение мышечных релаксантов может быть использовано в период стабилизации состояния у пациентов со стойкой рефрактерностью к опиоидным анальгетикам и бензодиазепинам и сопутствующей легочной гипертензией. Медикаментозные средства, которые могут быть использованы у новорожденных в целях синхронизации с аппаратом ИВЛ, представлены в приложении 6.
Антибактериальная терапия
-
Рекомендуется назначить стартовую АБТ до исключения инфекционного процесса и получения результатов бактериологического исследования [20].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2b).
Комментарии. Антибактериальная терапия при аспирации мекония проводится в связи с высоким риском развития инфекционного процесса, так как меконий способствует росту бактерий. Стартовая АБТ включает комбинацию ампициллина с аминогликозидом. Важно отметить, что отбор крови на бактериологическое исследование необходимо провести перед первым введением антибактериального препарата. Дальнейшая тактика АБТ выбирается согласно результатам бактериологического исследования. При получении отрицательного результата культуры крови и отрицательных повторных маркеров воспаления АБТ можно отменить.
РЕАБИЛИТАЦИЯ
Специфические мероприятия для реабилитации после САМ отсутствуют.
ПРОФИЛАКТИКА
Учитывая факторы риска развития САМ, к мерам профилактики относится профилактика перенашивания и состояний, приводящих к развитию гипоксии плода, как хронической, так и острой. Согласно приложению 5 к «Порядку оказания медицинской помощи по профилю "акушерство и гинекология" (за исключением использования вспомогательных репродуктивных технологий)», утвержденному приказом Министерства здравоохранения РФ от 1 ноября 2012 г. № 572н, в целях своевременного выявления дистресса плода и принятия тактического решения по методу родоразрешения показаны аускультация плода в родах (каждые 30 мин в первом периоде, после каждой потуги во втором периоде), продолжительная или непрерывная кардиотокограмма плода во время родов (индуцированные роды, переношенная беременность, фетоплацентарная недостаточность и т.д.), ведение партограммы в родах. Необходимо непрерывное обучение медицинского персонала родовспомогательного учреждения методам первичной реанимации и интенсивной терапии при САМ.
Диспансерное наблюдение
Форма помощи
Несмотря на планирование диагностических и лечебных мероприятий новорожденным с аспирацией мекония, помощь носит неотложный характер. Отсрочка начала неотложных действий и адекватной терапии приводит к снижению показателей общей выживаемости среди новорожденных и утяжеляет прогноз у конкретного больного.
СПИСОК ЛИТЕРАТУРЫ
-
Wiswell T.E., Tuggle J.M., Turner B.S. Meconium aspiration syndrome: have we made a difference? // Pediatrics. 1990. Vol. 85, N 5. P. 715-721.
-
Cleary G.M., Wiswell T.E. Meconium-stained amniotic fluid and the meconium aspiration syndrome: an update // Pediatr. Clin. North Am. 1998. Vol. 45, N 3. P. 511-529.
-
Singh B.S., Clark R.H., Powers R.J., Spritzer A.R. Meconium aspiration syndrome remains a significant problem in the NICU: outcomes and treatment patterns in term neonates admitted for intensive care during a ten-year period // J. Perinatol. 2009. Vol. 29, N 7. P. 497-503.
-
Radiological Imaging of the Neonatal Chest. 2nd revised ed. / ed. V. Dono-qhue. Springer, 2008. 362 p.
-
Janssen D.J., Carnielli V.P., Cogo P. et al. Surfactant phosphatidylcholine metabolism in neonates with meconium aspiration syndrome // J. Pediatr. 2006. Vol. 149, N 5. P. 634-639.
-
Clark D.A., Nieman G.F., Thompson J.E. Surfactant displacement by meconium free fatty acids: an alternative explanation for atelectasis in meconium aspiration syndrome // J. Pediatr. 1987. Vol. 110, N 5. P. 765-770.
-
Terasaka D., Clark D.A., Singh B.N., Rokahr J. Free fatty acids of human meconium // Biol. Neonate. 1986. Vol. 50, N 1. P. 16-20.
-
Nathan L., Leveno K.J., Carmody III T.J., Kelly M.A. et al. Meconium: a l990’s perspective on an old obstetric hazard // Obstet. Gynecol. 1994. Vol. 83, N 3. P. 329-332.
-
Ross M.G. Meconium aspiration syndrome - more than intrapartum meconium // N. Engl. J. Med. 2005. Vol. 353, N 9. P. 946-948.
-
Ostrea E.M. Jr, Naqvi M. The influence of gestational age on the ability of the fetus to pass meconium in utero: clinical implications // Acta Obstet. Gynecol. Scand. 1982. Vol. 61, N 3. P. 275-277.
-
Usher R.H., Boyd M.E., McLean F.H., Kramer M.S. Assessment of fetal risk in postdate pregnancies // Am. J. Obstet. Gynecol. 1988. Vol. 158, N 2. P. 259-264.
-
Dargaville P.A., Copnell B. The epidemiology of meconium aspiration syndrome: incidence, risk factors, therapies, and outcome // Pediatrics. 2006. Vol. 117, N 5. P. 1712-1721.
-
Velaphi S., Vidyasagar D. Intrapartum and post-delivery management of infants born to mothers with meconiumstained amniotic fluid: evidence-based recommendations // Clin. Perinatol. 2006. Vol. 33, N 1. P. 29-42.
-
Ghidini A., Spong C.Y. Severe meconium aspiration syndrome is not caused by aspiration of meconium // Am. J. Obstet. Gynecol. 2001. Vol. 185, N 4. P. 931-938.
-
National Women’s Health at Auckland City Hospital, Auckland, New Zealand Newborn Services Clinical Guideline «Meconium-stained Liquor and Meconium Aspiration». Clinical Practice Committee, May, 2016. URL: http://www.adhb.govt.nz/newborn/Guidelines/Admission/MeconiumStainedLiquorAnd-MAS.htm.
-
Downes J.J., Vidyasagar D., Boggs T.R. Jr, Morrow G.M. 3rd. Respiratory distress syndrome of newborn infants. I. New clinical scoring system (RDS score) with acid-base and blood-gas correlations // Clin. Pediatr. (Phila.). 1970 Vol. 9, N 6. P. 325-331.
-
Wiswell T.E., Gannon C.M., Jacob J., Goldsmith L. et al. Delivery room management of the apparently vigorous meconium-stained neonate: results of the multicenter, international collaborative trial // Pediatrics. 2000. Vol. 105, N 1. P. 1-7.
-
Blackwell S.C., Moldenhauer J., Hassan S.S., Redman M.E. et al. Meconium aspiration syndrome in term neonates with normal acid base status at delivery: is it different? // Am. J. Obstet. Gynecol. 2001. Vol. 184, N 7. P. 1422-1425; discussion P. 1425-1426.
-
Vain N.E., Szyld E.G., Prudent L.M., Wiswell T.E. et al. Oropharyngeal and nasopharyngeal suctioning of meconium-stained neonates before delivery of their shoulders: multicentre, randomised controlled trial // Lancet. 2004. Vol. 364, N 9434. P. 597-602.
-
Неонатология: в 2 т. Т. 2 / под ред. Т.Л. Гомеллы, М.Д. Каннингамм, Ф.Г. Эяля ; пер. с англ. под ред. Д.Н. Дегтярева. М.: БИНОМ. Лаборатория знаний, 2015. 864 с.
-
Haney P.J., Bohlman M., Sun C.C. Radiographic findings in neonatal pneumonia // AJR Am. J. Roentgenol. 1984. Vol. 143, N 1. P. 23-26.
-
Leonidas J.C., Hall R.T., Beatty E.C., Fellows R.A. Radiographic findings in early onset neonatal group b streptococcal septicemia // Pediatrics. 1977. Vol. 59, N 6. Pt 2. P. 1006-1011.
-
Payne N.R., Burke B.A., Day D.L., Christenson P.D. et al. Correlation of clinical and pathologic findings in early onset neonatal group B streptococcal infection with disease severity and prediction of outcome // Pediatr. Infect. Dis. J. 1988. Vol. 7, N 12. P. 836-847.
-
Hedlund G.L., Griscom N.T., Cleveland R.H., Kirks D.R. Respiratory system // Practical pediatric imaging: diagnostic radiology of infants and children. 3rd ed. / eds D.R. Kirks, N.T. Griscom. Philadelphia: Lippincott; Raven, 1998. P. 715-717.
-
Swischuk L.E. Respiratory system // Imaging of the Newborn, Infant, and Young Child. 4th ed. Baltimore: Williams and Wilkins, 1997. P. 43-47.
-
Методическое письмо Минздравсоцразвития РФ от 21 апреля 2010 г. № 15-4/10/2-3204 «Первичная и реанимационная помощь новорожденным детям» для использования в работе лечебно-профилактических учреждений, оказывающих медицинскую помощь новорожденным.
-
Wyllie J., Perlman J.M., Kattwinkel J. et al. Part 7: Neonatal resuscitation: 2015 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations // Resuscitation. 2015. Vol. 95. P. e169-e201.
-
Обеспечение эпидемиологической безопасности медицинских технологий в отделениях реанимации и патологии новорожденных и недоношенных детей. Федеральные клинические рекомендации. М., 2015. 58 с.
-
Narchi H., Kulaylat N. Is gastric lavage needed in neonates with meconium-stained amniotic fluid? // Eur. J. Pediatr. 1999. Vol. 158. P. 315-317.
-
Aguilar A.M., Vain N.E. The suctioning in the delivery room debate // Early Hum. Dev. 2011. Vol. 87S. P. S13-S15.
-
Wyllie J., Perlman J.M., Kattwinkel J., Atkins D.L. et al. Neonatal Resuscitation Chapter Collaborators. Part 11: neonatal resuscitation: 2010 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations // Resuscitation.2010. Vol. 81, suppl. 1. P. e260-e287.
-
Wyckoff M.H., Aziz K., Escobedo M.B., Kapadia V.S. et al. Part 13: Neonatal Resuscitation: 2015 American Heart Association Guidelines Update for Car-diopulmonary Resuscitation and Emergency Cardiovascular Care // Circulation. 2015. Vol. 132, N 18. Suppl. 2. P. S543-560.
-
Cocucci C., Madorno M., Aguilar A., Acha L. et al. A metronome for pacing manual ventilation in a neonatal resuscitation simulation // Arch. Dis. Child. Fetal Neonatal Ed. 2015. Vol. 100, N 1. F47-F49.
-
Storme L., Aubry E., Rakza T., Houeijeh A. et al.; French Congenital Diaphragmatic Hernia Study GrouP. Pathophysiology of persistent pulmonary hypertension of the newborn: impact of the perinatal environment // Arch. Cardiovasc. Dis. 2013. Vol. 106, N 3. P. 169-177.
-
Aranda J.V., Carlo W., Hummel P., Thomas R. et al. Analgesia and sedation during mechanical ventilation in neonates // Clin. Ther. 2005. Vol. 27, N 6. P. 877-899.
-
Singh B.S., Clark R.H., Powers R.J., Spritzer A.R. Meconium aspiration syndrome remains a significant problem in the NICU: outcomes and treatment patterns in term neonates admitted for intensive care during a ten-year period // J. Perinatol. 2009. Vol. 29, N 7. P. 497-503.
-
Goldsmith J.P. Continuous positive airway pressure and conventional mechanical ventilation in the treatment of meconium aspiration syndrome // J. Perinatol. 2008. Vol. 28, suppl. 3. P. S49-S55.
-
Wiswell T.E., Gannon C.M., Jacob J., Goldsmith L. et al. Delivery room management of the apparently vigorous meconium-stained neonate: results of the multicenter, international collaborative trial // Pediatrics. 2000. Vol. 105, N 1. P. 1-7.
-
Hachey W.E., Eyal F.G., Curtet-Eyal N.L., Kellum F.E. High-frequency oscillatory ventilation versus conventional ventilation in a piglet model of early meconium aspiration // Crit. Care Med. 1998. Vol. 26, N 3. P. 556-561.
-
Мостовой А.В. Комплексная терапия легочной гипертензии у новорожденных с применением высокочастотной осцилляторной вентиляции легких и ингаляции оксида азота: дис. … канд. мед. наук. СПб., 2003.
-
Tingay D.G., Mills J.F., Morley C.J., Pellicano A. et al. Trends in use and outcome of newborn infants treated with high frequency ventilation in Australia and New Zealand, 1996-2003 // J. Paediatr. Child Health. 2007. Vol. 43, N 3. P. 160-166.
-
Pellicano A., Tingay D.G., Mills J.F., Fasulakis S. et al. Comparison of four methods of lung volume recruitment during high frequency oscillatory ventilation // Intensive Care Med. 2009. Vol. 35, N 11. P. 1990-1998.
-
Kamlin O., Loughnan P., Dargaville P., Mills J., McDougall P. Outcomes from the first seven years of rescue therapy with high frequency jet ventilation in critically ill newborns in a tertiary referral centre // Proceedings of the 19th Annual Conference of High Frequency Ventilation in Infants. Snowbird, Utah, 2002.
-
Dargaville P.A. Respiratory support in meconium aspiration syndrome: a practical guide // Int. J. Pediatr. 2012. Vol. 2012. Article ID 965159.
-
Dargville P.A., Mills J.F. Surfactant therapy for meconium aspiration syndrome: current status // Drugs. 2005. Vol. 65, N 18. P. 2569-2591.
-
Dargaville P.A., Mills J.F., Copnell B., Loughnan P.M. et al. Therapeutic lung lavage in meconium aspiration syndrome: a preliminary report // J. Paediatr. Child Health. 2007. Vol. 43, N 7-8. P. 539-545.
-
Dargville P.A. Innovation in surfactant therapy I: surfactant lavage and surfactant administration by fluid bolus using minimally invasive techniques // Neonatology. 2012. Vol. 101, N 4. P. 328-336.
-
Finer N.N., Barrington K.J. Nitric oxide for respiratory failure in infants born at or near term // Cochrane Database Syst. Rev. 2006. Vol. 4. CD000399.
-
Lakshminrusimha S., Keszler M. Persistent pulmonary hypertension of the newborn // Neoreviews. 2015. Vol. 16, N 12. P. e680-e692.
-
Буров А.А. Терапия оксидом азота в неонатологии // Неонатология: новости, мнения, обучение. 2014. Т. 4, № 6. С. 73-86.
-
Bernstein G., Mannino F.L., Heldt G.P. et al. Randomized multicenter trial comparing synchronized and conventional intermittent mandatory ventilation in neonates // J. Pediatr. 1996. Vol. 128, N 4. P. 453-463.
-
Wu R., G.F. Zheng G.F., Tian Z.F. et al. Treatment of neonates with me-conium aspiration syndrome by proportional assist ventilation and synchronized intermittent mandatory ventilation: a comparision study // Minerva Pediatr. 2016. Vol. 68, N 4. P. 262-268.
-
Fox W.W., Berman L.S., Downes J.J. Jr et al. The therapeutic application of end expiratory pressure in the meconium aspiration syndrome // Pediatrics. 1975. Vol. 56, N 2. P. 214-217.
-
Bernstein G., Knodel E., Heldt G.P. Airway leak size in neonates and auto-cycling of three flow-triggered ventilators // Crit. Care Med. 1995. Vol. 23, N 10. P. 1739-1744.
-
Sharma S., Clark S., Abubakar K., Keszler M. Tidal volume requrements in mechanically ventilated infants with meconium aspiration syndrome // Am. J. Perinatol. 2015. Vol. 32, N 10. P. 916-919.
-
Bouziri A., Clark S., Abubakar K., Keszler M. et al. Management of meconium aspiration syndrome with high frequency oscillatory ventilation // Tunis Med. 2011. Vol. 89, N 7. P. 632-637.
-
Alexander J., Milner A.D. Determination of gas-trapping during high frequency oscillatory ventilation // Acta Pediatr. 1997. Vol. 86, N 3. P. 268-273.
-
Hahn S., Choi H.J., Soll R., Dargaville P.A. Lung lavage for meconium aspiration syndrome in newborn infants // Cochrane Database Syst. Rev. 2013. Vol. 4. CD003486.
-
Wyllie J., Bruinenberg J., Roehr C.C., Rüdiger M., Trevisanuto D. et al. European Resuscitation Council Guidelines for Resuscitation 2015. Section 7. Resuscitation and support of transition of babies at birth // Recuscitation. 2015. Vol. 95. P. 249-363.
ПРИЛОЖЕНИЯ
Приложение 1. Алгоритмы ведения пациента
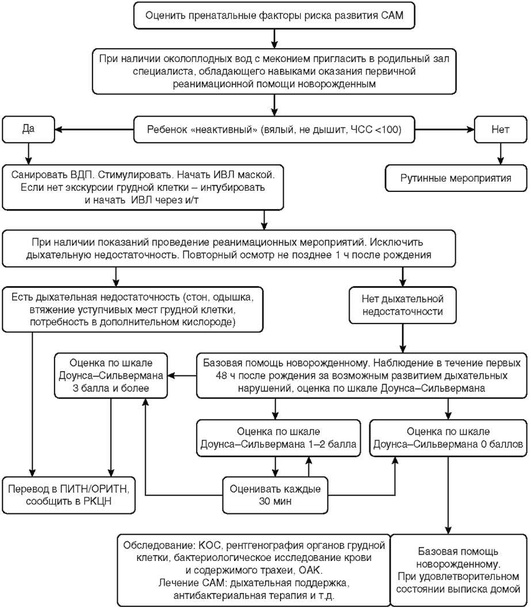
Приложение 2. Шкала оценки респираторного дистресс-синдрома у новорожденных по Доунсу [16]
| Шкала | 0 | 1 | 2 |
|---|---|---|---|
Частота дыхания, в минуту |
<60 |
60-80 |
>80 |
Цианоз |
Отсутствует при дыхании c FiO2 0,21 |
Присутствует при дыхании с FiO2 0,21-0,4 |
Присутствует или отсутствует при дыхании с FiO2 более 0,4 |
Втяжение уступчивых мест грудной клетки |
Отсутствует |
Умеренное |
Тяжелое |
Стоны |
Отсутствуют |
Слышны с помощью стетоскопа |
Слышны на расстоянии |
Проведение дыхания в легких |
Ясное |
Задержка или ослабленное |
Не слышно или проводится очень плохо |
Примечание. При оценке дыхательной недостаточности по шкале Доунса производится подсчет баллов в зависимости от клинических проявлений:
-
1-3 балла - предполагается наблюдение за пациентом, оценка состояния каждые 30 мин до момента исчезновения признаков дыхательной недостаточности либо до момента перевода больного на респираторную поддержку;
-
4-5 баллов - состояние, при котором допускается применение CPAP-терапии, однако необходимо помнить о возможных последствиях применения CPAP в виде воздушных ловушек или развития синдрома утечек воздуха;
-
6 баллов и более - прямое показание к началу механической ИВЛ через эндотрахеальную трубку.
Приложение 3. Выбор режима искусственной вентиляции легких [39]
При ИВЛ у некоторых пациентов можно использовать пациент-триггерную вентиляцию в качестве стартовой при условии получения на ИВЛ удовлетворительного газового состава крови (отсутствие гипервентиляции, гипокапнии). Однако целесообразнее, учитывая высокий риск синдрома утечки воздуха у новорожденных с САМ, использовать в качестве стартовой принудительную ИВЛ (IMV) в условиях медикаментозной седации. В случае использования принудительного режима ИВЛ (медикаментозная седация) могут быть рекомендованы режимы ИВЛ с двойным контролем [например, Volume Guarantee, PRVC (Pressure Regulated Volume Control - режим ИВЛ, регулируемый по давлению, контролируемый по объему)] в целях оптимизации минутного объема вентиляции и обеспечения постоянного дыхательного объема в условиях изменяющихся механических свойств легких [55].
При неэффективности традиционной ИВЛ ребенок может быть переведен на ВЧО ИВЛ (см. клинические рекомендации по врожденной пневмонии, с. 170).
Приложение 4. Подбор параметров искусственной вентиляции легких
| Параметры ИВЛ | Значения | Комментарии |
|---|---|---|
Пиковое давление (pip) |
От 12 см вод.ст. и выше |
Учитывая снижение комплаенса (податливости) легких, возникающее при САМ, потребность в пиковом давлении для достижения целевого дыхательного объема 5-6 мл/кг значительно варьирует. Высокие уровни пикового давления могут привести к вторичным, ассоциированным c ИВЛ, повреждениям легких, поэтому при вентиляции с управляемым давлением уровень пикового давления должен быть индивидуальным и подбираться в зависимости от показателей экспираторного дыхательного объема [44, 55] |
PEEP |
4-7 см вод.ст. |
Применение PEEP обязательно у новорожденных с САМ, находящихся на ИВЛ. Уровень PEEP должен обеспечивать функциональную остаточную емкость легких и препятствовать развитию ателектазов, не приводя к избыточному растяжению ткани легких. Более высокие значения PEEP (8-14 см вод.ст.) не приводят к дальнейшему улучшению показателей оксигенации, однако могут оказать отрицательное влияние на центральную гемодинамику, а также быть причиной развития синдромов утечки воздуха [44] |
Частота дыхания (Rate) |
Стартовая частота дыхания - в пределах возрастной нормы (30-40 в минуту) [40] |
Учитывая высокий риск формирования непреднамеренного PEEP (autoPEEP), нецелесообразно на старте вентиляции устанавливать частоту дыхания не более 40 в минуту. Минутный объем вентиляции должен обеспечивать элиминацию углекислого газа (CO2) для достижения значения уровня углекислого газа в крови (pCO2) в пределах 40-6 мм рт.ст. и водородный показатель 7,3-7,4, что позволит сохранить адекватный церебральный и легочный кровоток [44]. В динамике необходимо осуществлять индивидуальный подбор частоты дыхания с учетом клинико-лабораторных, рентгенологических данных и респираторных показателей, характеризующих механические свойства бронхолегочной системы (податливость и сопротивление дыхательных путей) |
Временные интервалы дыхательного цикла (Tin/Tex) |
Соотношение вдоха и выдоха не менее 1:2 |
Для заполнения легких доношенного ребенка требуется более длительное время вдоха, чем у недоношенного, что связано с различной сопротивляемостью дыхательных путей и податливостью легочной ткани [44]. Длительное время вдоха может быть использовано для вовлечения спавшихся альвеол в процесс газообмена, однако необходимо помнить, что последующее за этим укорочение экспираторного времени при сохраненной частоте дыхательных циклов может способствовать формированию воздушных ловушек и повышать риск баро- и волюмотравмы. Подбор инспираторного и экспираторного времени при САМ должен осуществляться с использованием таких показателей респираторной механики, как податливость легочной ткани (комплаенс) и сопротивление дыхательных путей. Графический мониторинг и непосредственно кривая «поток- время» могут быть очень полезны для подбора оптимального времени вдоха и выдоха |
Приложение 5. Подбор параметров высокочастотной осцилляторной искусственной вентиляции легких
| Параметры ИВЛ | Значения | Комментарии |
|---|---|---|
Среднее давление в дыхательных путях (MAP) |
Необходимо использовать оптимальное МАР для поддержания адекватной оксигенации [44]. Традиционно устанавливается на 2-4 см вод.ст. выше, чем при традиционной ИВЛ |
У детей с выраженными ателектазами может потребоваться высокое МАР для вовлечения большего количества альвеол в процесс вентиляции в сравнении с традиционной ИВЛ. Пошаговое исполнение маневра рекруитмента может быть эффективным [44]. Как только оксигенация улучшится, МАР снижают пошагово в сочетании с процентом кислорода [56] |
Частота при ВЧО ИВЛ |
От 8 до 10 Гц [46] |
При увеличении частоты вентиляции до 15 Гц наблюдается ухудшение состояния с формированием воздушных ловушек [44] |
Амплитуда колебаний |
Подбирается по формуле МАР × 2, в дальнейшем регулируется под визуальным контролем и контролем за газовым составом крови |
Амплитуда колебаний определяет степень элиминации углекислого газа. При задержке СО2 в легких возможно увеличение значения амплитуды до МАР × 3. В дальнейшем необходимо снижать частоту вентиляции, так как при увеличении амплитуды выше троекратного МАР резко возрастает риск повреждения легких [44, 56] |
Соотношение вдоха и выдоха |
Практически на всех современных аппаратах имеется возможность установить соотношение вдоха и выдоха как 1:2, или 33% |
При увеличении соотношения вдоха и выдоха до 1:1 на ВЧО ИВЛ увеличивается риск формирования воздушных ловушек и синдрома утечки воздуха [57] |
Приложение 6. Препараты для медикаментозной синхронизации с аппаратом искусственной вентиляции легких
| Препарат | Анатомо-терапевтическо-химическая классификация | Разовая доза | Доза для продленного внутривенного введения | Примечания |
|---|---|---|---|---|
Седативные препараты |
||||
Диазепам** # |
N05BA01 |
0,1-0,3 мг/кг |
Нет |
Постоянная инфузия малоэффективна |
Мидазолам** |
N05CD08 |
0,05-0,1 мг/кг |
<32 нед: 0,03 мг/кг в час (0,5 мкг/кг в минуту); >32 нед: 0,06 мг/кг в час (1 мкг/кг в минуту) |
- |
Гипнотики |
||||
Натрия оксибутират** |
N01AX |
50-100 мг/кг |
20-60 мг/кг в час |
- |
Опиоидные анальгетики |
||||
Фентанил**# |
N01AH01 |
0,25-3,0 мкг/кг |
1-10 мкг/кг в час |
- |
Тримеперидин**# |
N01AH |
0,05-0,2 мг/кг |
0,1-0,2 мг/кг в час |
- |
Морфин** |
N02AA01 |
50-100 мкг/кг |
10-15 мкг/кг в час |
- |
Трамадол**# |
N02AX02 |
1-2 мг/кг |
0,1-0,2 мг/кг в час |
- |
Миорелаксанты |
||||
Пипекурония бромид**# |
M03AC06 |
40 мкг/кг |
10-20 мкг/кг в час |
- |
Атракурия безилат** |
M03AC04 |
0,3-0,6 мг/кг |
0,3-0,6 мг/кг в час |
- |
Рокурония бромид**# |
M03AC09 |
0,6 мг/кг |
0,3-0,6 мг/кг в час |
- |