Практическая пульмонология : руководство для врачей / под ред. В. В. Салухова, М. А. Харитонова. - Москва : ГЭОТАР-Медиа, 2020. - 416 с. : ил. - ISBN 978-5-9704-5780-1. |
Аннотация
В руководстве с позиций практического врача подробно изложены современные данные о клинической картине, этиологии, патогенезе, диагностике, лечении и оказании неотложной помощи больным с наиболее частой патологией органов дыхания. Особое внимание уделено принципам и методам функциональной, лучевой и эндоскопической диагностики болезней органов дыхания, детально освещены воп росы клинической оценки результатов функциональных тестов. Представленные дифференциально-диагностические алгоритмы отражают доказательную базу международных и отечественных клинических рекомендаций и консенсусов. Особенным достоинством руководства является большое количество блок-схем и рисунков, облегчающих восприятие материала, а также наличие резюме в конце глав и некоторых разделов с перечислением ключевых положений изложенного. При написании книги использован богатый опыт лечения больных с заболеваниями органов дыхания и преподавания пульмонологии на кафедре известнейшего отечественного терапевта-пульмонолога - академика Н.С. Молчанова. Руководство предназначено практикующим врачам-терапевтам, пульмонологам, врачам общей практики, интернам, ординаторам, аспирантам.
3.2.3. МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОКАЗАТЕЛЕЙ БИОМЕХАНИКИ ДЫХАНИЯ
Спирография
Спирография - метод графической регистрации изменений легочных объемов при выполнении различных дыхательных маневров.
Спирография - рутинный метод исследования. В настоящее время в плане получения спирографической кривой он практически не применяется, однако именно этот метод отличается наибольшей разработанностью методических стандартов, нормативов и критериев для оценки отклонений показателей от нормы. Наряду с определением статических объемов (ЖЕЛ, ее компоненты) спирографическое исследование позволяет получить информацию об изменениях объема легких во времени, то есть об изменениях объемной скорости дыхания, что значительно повышает информативность метода.
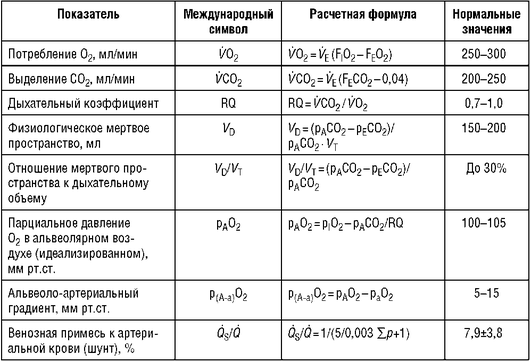
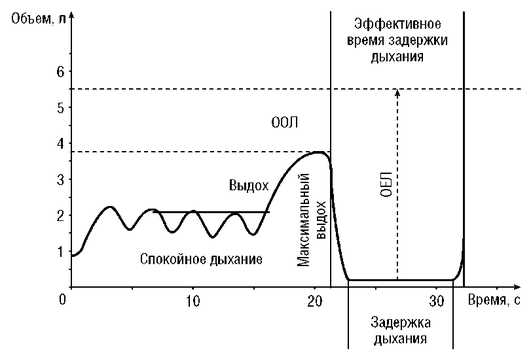
Спирографическая кривая дает возможность оценить легочные объемы и емкости: ЖЕЛ, ФЖЕЛ, ДО, РОвд и РОвыд, Е (рис. 3-2).
С помощью спирографа возможно определение ООЛ методом разведения инертного газа, например гелия (конвекционный метод). Для этого необходимы газоанализатор гелия (приставка к спирографу) и газ гелий. Если определен ООЛ, можно рассчитать величину ОЕЛ и ФОЕ.
Наличие движущейся ленты кимографа позволяет получить информацию об изменениях объема легких во времени: ОФВ25-75 и СОС75-85), а также некоторые показатели вентиляции: минутный объем дыхания (МОД), максимальную вентиляцию легких (МВЛ), потребление организмом кислорода (ПО2).
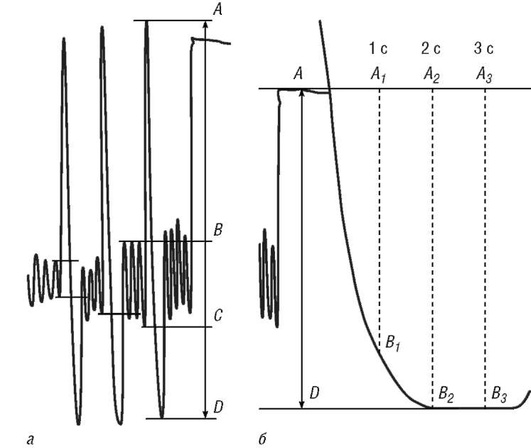
Современные спироанализаторы по своей сути являются пневмотахографами. В отличие от спирографов они регистрируют не объем (литры), а поток (объемную скорость движения воздуха - литры в секунду). Изменения объема (спирограмму) получают, интегрируя пневмотахограмму (рис. 3-3).
Процедура исследования. Противопоказаний к проведению спирографического исследования (как и других способов изучения ФВД) нет. Следует, однако, учитывать, что некоторые пациенты не могут (а иногда не хотят) правильно выполнить необходимые дыхательные маневры (дети младших возрастных групп, умственно отсталые или незаинтересованные в исследовании лица, а также больные, страдающие выраженным ожирением, кахексией, тяжелой степенью сердечной и легочно-сердечной недостаточности, миастенией и т.д.).
Исследование проводят в первой половине дня натощак или через 1-1,5 ч после легкого завтрака. Следует исключить все факторы, вызывающие эмоциональное возбуждение.
Перед исследованием необходим 10-15-минутный отдых. Пациент не должен курить по меньшей мере в течение 1-1,5 ч перед исследованием. Целесообразно за 8-12 ч до исследования отменить агонисты, холинолитики, теофиллины короткого действия, за 48 ч - пролонгированные препараты.
Повторные измерения проводят в сходных условиях, на том же аппарате и желательно в присутствии того же лаборанта. Перед исследованием пациенту необходимо подробно объяснить, а иногда и продемонстрировать особенности выполнения дыхательных маневров. Поскольку исследование основано на тесном контакте с испытуемым, правильный инструктаж позволяет получить наилучшие результаты.
Поза испытуемого во время исследования отражается на результатах теста. Измерения должны проводиться в сидячем положении больного. Необходимо освободить грудь и живот от стягивающей одежды. Удаление зубных протезов не рекомендуется, так как это вызывает утечку воздуха.
Дыхательные пути пациента подключают к прибору посредством загубника или мундштука. Мундштук должен находиться между зубами и обхватываться губами. Для предотвращения утечки воздуха необходимо использовать носовой зажим.
Пациенту предлагают выполнить ряд дыхательных маневров.
Основу спирографического исследования составляет определение ЖЕЛ, ФЖЕЛ, ОФВ1 с расчетом индекса Тиффно (ОФВ1/ЖЕЛ) и индекса Генслера (ОФВ1/ФЖЕЛ), МВЛ. Указанный комплекс содержит достаточно большой объем информации об анатомических и функциональных возможностях аппарата внешнего дыхания.
Первый тест спирограммы - определение ЖЕЛ. После записи спокойного дыхания пациенту предлагают после максимально глубокого вдоха сделать полный спокойный выдох (см. рис. 3-2). Выдох не должен быть особенно быстрым, так как это уменьшает величину ЖЕЛ, и очень медленным, так как наступающее при выдохе возбуждение дыхательного центра может прервать выдох. Маневр повторяют трижды, для измерений берется наибольшая величина. Для регистрации второго теста - кривой форсированного выдоха (ФЖЕЛ) - больному предлагают сделать максимальный вдох, кратковременную задержку дыхания (во время которой кимограф переключается на большую скорость движения ленты) и резкий форсированный (с наибольшим усилием) полный выдох (см. рис. 3-2). Тест ФЖЕЛ выполняется не менее трех раз.
При выполнении форсированного выдоха необходимо учитывать, что скорость изменения объема легких только в начальной части выдоха (примерно 25-30% ОФВ) зависит от усилий дыхательной мускулатуры. Максимальные усилия исследуемый должен прилагать только в начале пробы. Значительные усилия в средней или конечной части выдоха могут привести к снижению тока воздуха. Особое внимание следует обратить на глубину вдоха и выдоха, так как недостаточно глубокий вдох или выдох приведет к искажению показателей. Имеет значение и продолжительность форсированного выдоха. Выдох должен быть сделан на максимуме усилия, приложенного в самом начале выдоха, и продолжаться не менее 6 с или до выхода кривой ФЖЕЛ на плато. У пожилых пациентов с выраженной бронхиальной обструкцией для достижения плато требуется более 6 с, однако и в этих случаях не рекомендуется продолжать выдох дольше 15 с.
Маневр ФЖЕЛ следует выполнять с осторожностью:
При определении МВЛ больному предлагают дышать максимально глубоко и часто в течение 10 или 15 с. Глубина дыхания при выполнении МВЛ должна примерно соответствовать прямолинейному участку кривой форсированного выдоха.
Пневмотахография
Пневмотахография - метод графической регистрации объемной скорости движения воздуха (потока) на протяжении дыхательного цикла. Простота и надежность регистрации параметров, хорошая повторяемость, большая информативность результатов сделали пневмотахографию одним из наиболее часто используемых методов исследования вентиляционной функции легких.
Пневмотахограф состоит из следующих основных узлов: пневмотахографической трубки, дифференциальных манометров, усилителя, интегратора и регистрирующего устройства. Скорость воздушного потока измеряют с помощью пневмотахографической трубки и дифференциального манометра путем регистрации перепада давления. Изменения давления и скорость воздушного потока коррелируют между собой, поэтому регистрация показаний дифференциального манометра позволяет количественно определить моментальные значения и путем интегрирования - средние величины объемной скорости вдыхаемого и выдыхаемого воздуха.
Пневмотахографические трубки обладают небольшим сопротивлением, а регистрация показаний манометров - малой инерционностью, что позволяет записывать пневмотахограмму как при спокойном, так и при форсированном дыхании.
Процедура исследования. Широкое распространение получила пневмотахограмма форсированного выдоха - кривая поток-объем (рис. 3-4). Для выполнения теста испытуемый после спокойного выдоха делает максимальный вдох и затем форсированный выдох до уровня ООЛ, после чего следует форсированный вдох до уровня ОЕЛ. Начальный вдох должен быть максимально полным с паузой на вершине вдоха менее 2 с, а выдох - максимально сильным и продолжаться до выхода кривой на плато или более 6 с (пока «весь воздух не выйдет из легких»). Исследования проводят в положении сидя и после небольшого отдыха повторяют 3-5 раз. Для анализа выбирают наибольшие значения ФЖЕЛ и ОФВ1. Оценивают степень вариабельности дыхательных маневров (воспроизводимость), которая для ФЖЕЛ и ОФВ1 не должна превышать 150 мл. Если максимальные значения ФЖЕЛ не превышают 1 л, допустимая разница между маневрами может составлять 100 мл.
Кривая поток-объем пневмотахограммы не похожа на спирографическую кривую форсированного выдоха. Спирографическая кривая фиксирует объем воздуха (в литрах), и только движущаяся лента кимографа позволяет отнести этот объем ко времени - получаем ОФВ1 - объем форсированного выдоха за первую секунду. Пневмотахографическая кривая поток-объем отображает поток (объемную скорость движения воздуха, л/с) и его изменения во время
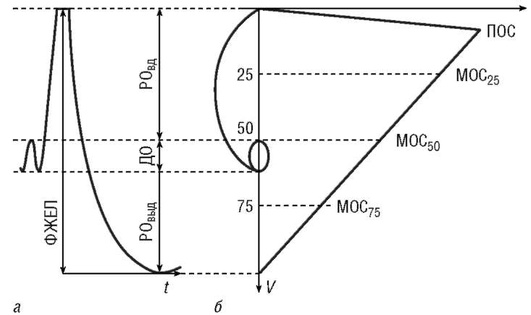
На рис. 3-5 схематически представлена кривая поток-объем здорового человека. Экспираторная часть петли имеет форму почти прямоугольного треугольника, основанием которого является ФЖЕЛ, а вершиной - ПОС, то есть самая большая объемная скорость движения воздуха, которая была достигнута больным при выполнении маневра форсированного выдоха (ФЖЕЛ). После достижения пика выдоха скорость потока плавно снижается и становится нулевой при достижении уровня остаточного объема легких. Начальная часть экспираторной кривой (примерно 25-30% ФЖЕЛ) зависит от прилагаемого человеком мышечного усилия, в дальнейшем скорость экспираторного потока определяется объемом легких, эластичностью легочной ткани, диаметром бронхов и сопротивлением дыхательных путей воздушному потоку. Инспираторная часть кривой (рис. 3-5) имеет симметричную куполообразную форму с достижением максимальной объемной скорости примерно в середине вдоха.
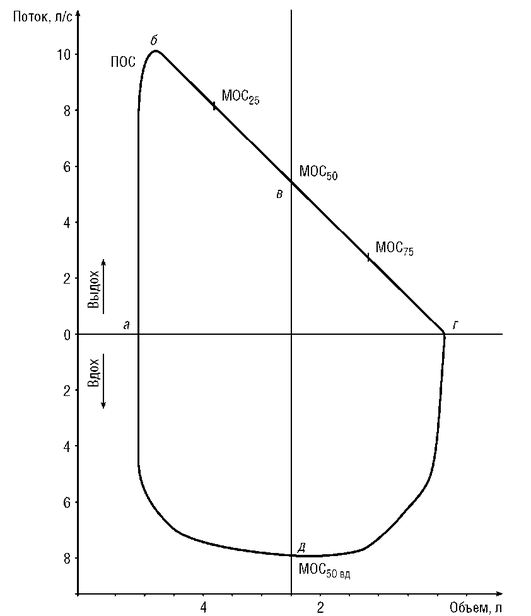
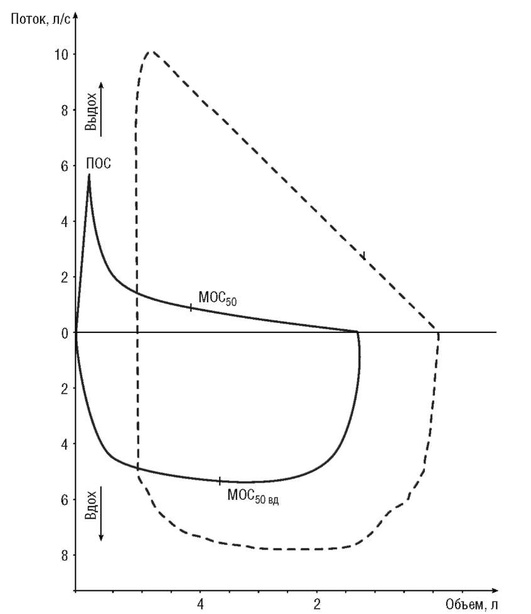
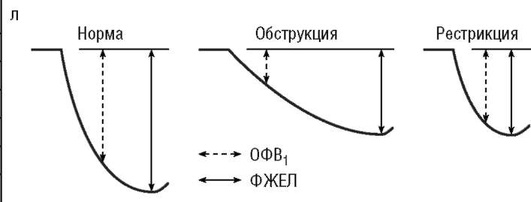
Патология легких приводит к изменению формы и размеров петли поток-объем. При обструктивных нарушениях кривая теряет форму прямоугольного треугольника, уменьшается по амплитуде, приобретает характерный заостренно-вогнутый вид (рис. 3-6). Считается, что «вогнутость» кривой выдоха - чувствительный индикатор обструкции даже при нормальных значениях ОФБ1 и индекса Тиффно. Увеличение ОЕЛ сдвигает петлю поток-объем влево.
При рестриктивных нарушениях кривая поток-объем напоминает уменьшенную копию нормальной кривой с примерно пропорциональным уменьшением всех составляющих ФЖЕЛ и показателей потоков (рис. 3-7).
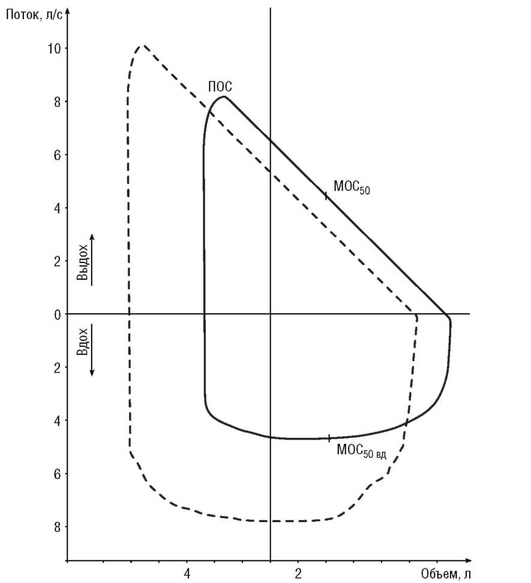
Снижение ОЕЛ при рестриктивной патологии легких («маленькое легкое») приводит к смещению петли поток-объем вправо.
Своеобразные изменения формы кривой характерны для обструкции верхних дыхательных путей.
Компьютерная обработка кривой поток-объем позволяет получить целый ряд показателей для оценки вентиляционной функции легких:
-
форсированная жизненная емкость легких (ФЖЕЛ - FVC, forsed volume capacity) - максимальный объем воздуха, выдыхаемый из легких при форсированном выдохе после максимального вдоха;
-
объем форсированного выдоха за первую секунду (ОФВ1 - FEV1, forsed expiratory volume) - максимальный объем воздуха, выдыхаемый из легких за первую секунду форсированного выдоха;
-
индекс Генслера (ОФВ1/ФЖЕЛ - FEV1/FVC) - отношение ОФВ1 к ФЖЕЛ;
-
пиковая объемная скорость форсированного выдоха (ПОС - PEF, peak expiratory flow) - максимальная скорость потока, которая была достигнута в процессе выполнения форсированного выдоха;
-
максимальная объемная скорость выдоха на уровне 25% ФЖЕЛ (МОС25 - MEF25, maximal expiratory flow at 25% of FVC);
-
максимальная объемная скорость выдоха на уровне 50% ФЖЕЛ (МОС50 - MEF50, maximal expiratory flow at 50% of FVC);
-
максимальная объемная скорость выдоха на уровне 75% ФЖЕЛ (МОС75 - MEF75, maximal expiratory flow at 75% of FVC);
-
средняя объемная скорость выдоха на уровне 25-75% ФЖЕЛ (СОС25-75 - FEF25-75, forsed expiratory flow between 25-75% of the FVC);
-
средняя объемная скорость выдоха на уровне 75-85% ФЖЕЛ (СОС75-85 - FEF75-85, forsed expiratory flow between 75-85% of the FVC);
-
максимальная объемная скорость вдоха на уровне 50% ФЖЕЛ (МОС50 вд - FIF50, forsed inspiratory flow at 50% of FVC).
Должные величины, градации нормы и патологии
Для правильного представления о функции аппарата внешнего дыхания полученные результаты следует сопоставить с так называемыми должными величинами.
Должная величина - теоретически наиболее вероятная величина показателя, предсказанная по установленной у здоровых людей зависимости между данным показателем, возрастом и антропометрическими характеристиками субъекта. Иначе говоря, должной называется величина, которая должна быть у данного субъекта соответственно его росту, массе тела, возрасту и полу. Должные величины рассчитывают по специальным формулам, выведенным в результате обследования достаточно представительных групп здоровых лиц.
Должные величины основных спирографических и пневмотахографических показателей заложены в современных спироанализаторах, где все расчеты выполняются автоматически.
Работа дыхания
Работа дыхания - интегральный показатель, меняющийся при большинстве заболеваний, связанных с нарушениями механики дыхания.
Изменения анатомо-физиологических свойств аппарата дыхания приводят к значительному увеличению энергетической стоимости дыхания. Если в норме работа дыхательной мускулатуры по преодолению упругого и вязкого (эластического и аэродинамического) сопротивлений составляет при общей вентиляции (МОД) 10 л/мин всего 0,25 кгм/мин, то у больных с выраженной патологией она может возрасти в 2-4 раза. А если учесть, что больным из-за нарушений вентиляции необходима большая величина МОД, то работа дыхания в покое может увеличиться в 5-6 раз. У здорового человека подобные энерготраты на вентиляцию возникают при быстрой ходьбе и беге.
Соответственно энергетическим затратам возрастает и кислородная стоимость дыхания. Если при спокойном дыхании у здорового человека на работу дыхательных мышц затрачивается примерно 2-5%, а при тяжелой физической работе - до 20% поглощенного кислорода, то при выраженной патологии легких дыхательные мышцы потребляют 20-30% общего объема кислорода уже в покое.
Возрастание энергетической стоимости вентиляции и истощение дыхательной мускулатуры составляют основу возникновения дыхательного дискомфорта, чувства затрудненного дыхания, нехватки воздуха, то есть комплекса ощущений, входящих в понятие одышки. Попытки увязать возникновение одышки с конкретной величиной работы дыхания оказались безуспешными, поскольку имеет значение индивидуальное восприятие возросшей работы подобно тому, как индивидуален порог восприятия боли.
Определение остаточного объема легких методом разведения инертного газа
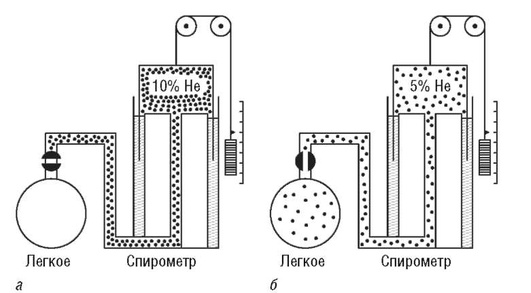
Остаточный объем легких, а также объемы и емкости, в состав которых он входит - ОЕЛ, ФОЕ, не могут быть определены по спирографической кривой. Используются конвекционные методы (смешивания и вымывания инертных газов) и бодиплетизмография. Наиболее широко применяется метод разведения гелия (или другого газа, в частности, неона) в закрытой системе, для чего используются соответствующие газоанализаторы.
Инертный газ безвреден для организма и физиологически инертен. Он хорошо распределяется по всему объему легких и не проходит через аэрогематический барьер.
Метод основан на сравнении концентрации инертного газа до и после смешивания в объеме легких. На рис. 3.8 продемонстрирована схема исследования ООЛ с помощью спирографа и инертного газа гелия. Воздухоносные пути обследуемого соединяются со спирографом, содержащим гелий в известной концентрации. Обследуемый делает несколько вдохов и выдохов, в результате гелий разводится в объеме легкие-спирограф, и концентрация его в спирографе и легких выравнивается. По изменению исходной концентрации гелия в спирографе после подсоединения к нему пациента получают величину объема легких.
Существуют и другие методы определения ООЛ (ФОЕ): метод вымывания азота, методы однократного вдоха газовой смеси (кислорода, гелия).
Бодиплетизмография
Метод общей плетизмографии (плетизмографии всего тела, бодиплетизмографии) позволяет определить внутригрудной объем (величину, близкую ФОЕ) и бронхиальное сопротивление.
Метод основан на барометрическом принципе. В его основе лежит закон Бойля-Мариотта (pV = const), позволяющий связать давление в герметичной камере с давлением в альвеолах. Иными словами, плетизмограф - это система с постоянным объемом и, следовательно, с переменным давлением в камере при изменении в ней объема газа или объема тела обследуемого.
Бодиплетизмограф представляет собой герметичную камеру объемом около 800 л (рис. 3-9). Пациент, помещенный внутрь камеры, дышит через пневмотахографическую трубку воздухом камеры. Участок трубки, соединенный с загубником, может быть перекрыт электромагнитной заслонкой, которая изолирует дыхательные пути и легкие от объема камеры. Непосредственно могут быть измерены давление в камере, ротовой полости (равное альвеолярному в момент перекрытия воздушного потока) и все показатели, определяемые методом пневмотахографии (рис. 3-10).
Определение бронхиального сопротивления (Raw) основано на синхронном измерении объемной скорости воздушного потока и колебаний давления в герметичной камере плетизмографа (рис. 3-11).
Процедура исследования. Противопоказаний к проведению исследования нет. Существуют ограничения, связанные с выполнением маневра форсированного выдоха. Пациента усаживают в камеру бодиплетизмографа. Проводят инструктаж пациента (при открытой двери кабины), объясняют цели исследования, а также необходимость правильного выполнения дыхательных маневров. Пациент во время исследования должен сидеть прямо, с расправленными плечами, плотно придерживая руками щеки и подбородок. Дряблость щек, дна полости рта влияют на результаты исследования, создавая большой разброс давления в ротовой полости. Не рекомендуется удалять зубные протезы. Пациент плотно обхватывает мундштук губами, на нос надевается зажим.
Больному предлагают сделать четыре спокойных вдоха и выдоха через пневмотахографическую трубку, а затем увеличить частоту дыхания до 60- 90 в минуту. Во время исследования вдыхаемый и выдыхаемый потоки воздуха измеряют пневмотахографом. Движения грудной клетки изменяют объем воздуха в герметичной кабине, а следовательно, и давление воздуха в кабине.

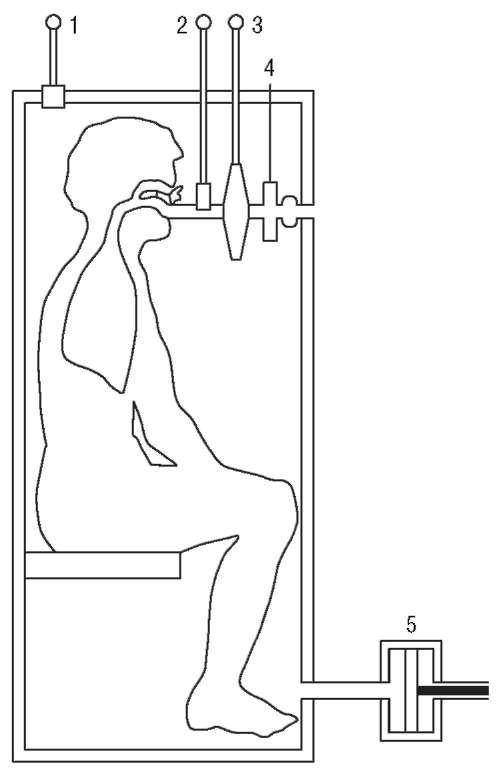
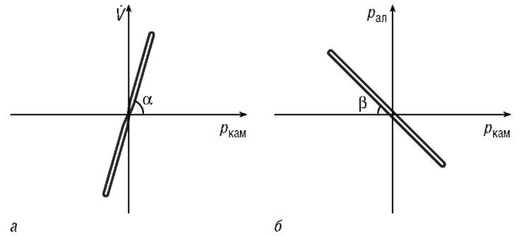
Изменения давления в кабине улавливаются чувствительным датчиком. Аппарат строит график поток-давление. Регистрация указанных параметров в координатах поток-давление в камере (V-ркам) позволяет записать петлю бронхиального сопротивления (см. рис. 3-11 и 3-12). Угол наклона петли характеризует количественную сторону параметра.
Метод общей плетизмографии позволяет не только определить величину бронхиального сопротивления, но и качественно оценить форму петель, что иногда может оказаться более информативным, чем абсолютная величина Raw (рис. 3-13). Прямолинейная форма петли с большим углом наклона свидетельствует об отсутствии обструкции бронхов. Увеличенный наклон к оси абсцисс характеризует повышение бронхиального сопротивления. Для эмфиземы легких характерно расширение петли на выдохе («булавовидная» форма). Отсутствие смыкания восходящей и нисходящей петель указывает на наличие невентилируемого объема газа.
Таким образом, синхронная регистрация давления и потока (петли давление-поток) позволяет определить аэродинамическое (бронхиальное) сопротивление. Нормальные значения Ram не превышают 2,5-3,5 см вод.ст./(л/с) [2,5 см вод.ст./(л/с) для мужчин и 3 см вод.ст./(л/с) для женщин]. При усилении дыхания аэродинамическое сопротивление увеличивается до 5-10 см вод.ст./(л/с).
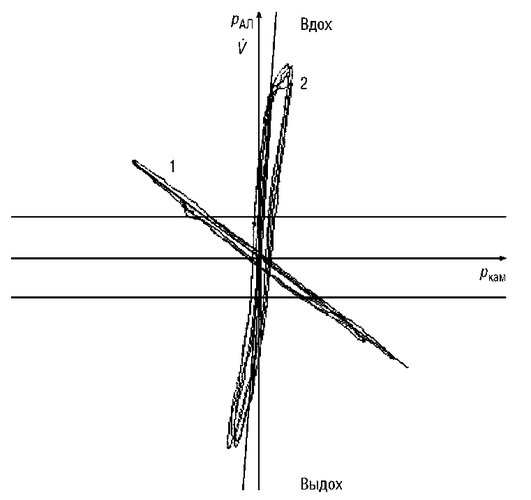
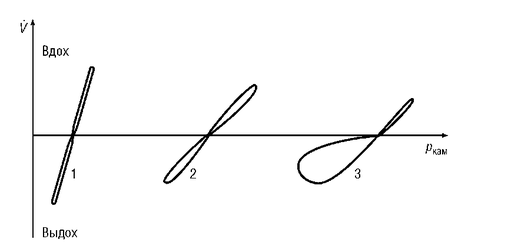
В условиях патологии даже при спокойном дыхании бронхиальное сопротивление может превысить норму в 5-10 раз. Значительное увеличение этого показателя более характерно для обструкции проксимальных отделов бронхиального дерева.
С помощью бодиплетизмографа возможно определение внутригрудного объема (ВГО). Этот объем соответствует ФОЕ, но в отличие от последней включает весь объем газа, находящийся в легких после спокойного выдоха, в том числе и не принимающий участия в вентиляции.
Процедура исследования. Пациенту, находящемуся в закрытой кабине (загерметизированной камере) плетизмографа, предлагают выполнить маневр Пфлюгера - сделать попытки вдоха и выдоха при перекрытой дыхательной трубке. Маневр Пфлюгера - имитация вдоха и выдоха воздухом, который находится в легких, поскольку дыхательные пути пациента отделены от окружающего воздуха. Количество воздуха в легких не меняется, а меняется его объем, так как происходит то сжатие, то разрежение воздуха. При изменении объема воздуха в легких меняется и альвеолярное давление, которое во время перекрытия электромагнитной заслонкой дыхательных путей становится равным давлению в ротовой полости, и его колебания могут быть измерены. Движения грудной клетки во время выполнения маневра Пфлюгера изменяют объем воздуха и давление в герметичной камере. Давление в камере также может быть измерено. Таким образом, определение ВГО основано на синхронной регистрации колебаний альвеолярного давления (рал) и давления внутри камеры (ркам) (см. рис. 3-11 и 3-12).
Во время перекрытия воздушного потока система легкие-камера делится на две подсистемы: «легкие» и «камера». Для каждой из подсистем и для системы в целом применим закон Бойля-Мариотта, согласно которому произведение давления газа на его объем при постоянной температуре является константой (pV = const). Для системы легкие-камера эта зависимость может быть выражена уравнением, в левой части которого находятся исходные давление и объем альвеол, в правой - давление и объем при выполнении маневра Пфлюгера:
где VA - объем альвеол; ратм - атмосферное давление; ΔVкам - изменение объема воздуха в камере; ΔPa - изменение давления в альвеолах.
Давление в полости рта в момент перекрытия воздушного потока равно альвеолярному, и его колебания при выполнении маневра Пфлюгера могут быть измерены. Регистрируя давление в камере и связанные с этим изменения ее объема, можно рассчитать объем легких.
У здоровых молодых людей ВГО и ФОЕ практически равны. В условиях патологии различия между ВГО и ФОЕ могут достигать 2-3 л, что свидетельствует о значительной неравномерности распределения воздуха в легких.
Таким образом, определение внутригрудного объема уточняет структуру ОЕЛ, а его сравнение с ФОЕ, измеренной газоаналитическими методами, позволяет судить о равномерности вентиляции.
Оценка результатов исследования вентиляционной функции легких
Изменения механических свойств аппарата дыхания проявляются следующими типами вентиляционных нарушений:
Диагностическое значение определения легочных объемов
Жизненная емкость легких - один из важнейших, наиболее часто измеряемых и информативных показателей ФВД. Величина ЖЕЛ, как и других легочных объемов, зависит от пола, роста, возраста, массы тела, физического состояния организма. При одинаковых массе, росте и возрасте ЖЕЛ у женщин меньше, чем у мужчин. С момента рождения и до 30-35 лет ЖЕЛ увеличивается, затем постепенно снижается. ЖЕЛ увеличивается также с возрастанием степени физической тренированности. Величина ЖЕЛ у здорового человека среднего возраста колеблется в пределах 3500-5500 мл, но может быть менее 2000 и более 7000 мл.
В большинстве случаев снижение ЖЕЛ является результатом абсолютного уменьшения количества функционирующей легочной ткани вследствие пневмофиброза, пневмосклероза (особенно диффузного характера), ателектаза, пневмонии, абсцессов, кист, опухолей с поражением значительного количества паренхимы легких, хирургического удаления легочной ткани, утраты легкими эластических свойств (эмфизема), обширных плевральных сращений, экссудативного плеврита, гидроторакса, отека легких, застоя в малом круге кровообращения.
Часто снижение ЖЕЛ обусловлено недостаточным расправлением легких при отсутствии первичного легочного заболевания вследствие изменений грудной клетки и позвоночника (кифоз, сколиоз позвоночника, деформация грудной клетки, последствия хирургических вмешательств на грудной клетке), ограничения движений диафрагмы и брюшной стенки при дыхании (парез диафрагмального нерва, острые заболевания органов брюшной полости, состояние после лапаротомии, ожирение, беременность и т.д.), болевых ощущений при дыхании (пневмония, плеврит, межреберная невралгия, миалгии, переломы ребер, ушибы грудной клетки и т.д.), общей мышечной слабости (алиментарная дистрофия, авитаминозы, инфекционные заболевания, миастения, переутомление).
Перечисленные выше факторы ограничивают максимальный вдох, уменьшение ЖЕЛ происходит за счет резервного объема вдоха.
Умеренное снижение величины ЖЕЛ, в основном за счет уменьшения резервного объема выдоха, наблюдается при бронхиальной обструкции.
В некоторых случаях величина ЖЕЛ может быть нормальной даже при явной недостаточности внешнего дыхания, например, при изолированных нарушениях диффузии кислорода через аэрогематический барьер или при выраженном несоответствии вентиляционно-перфузионных отношений.
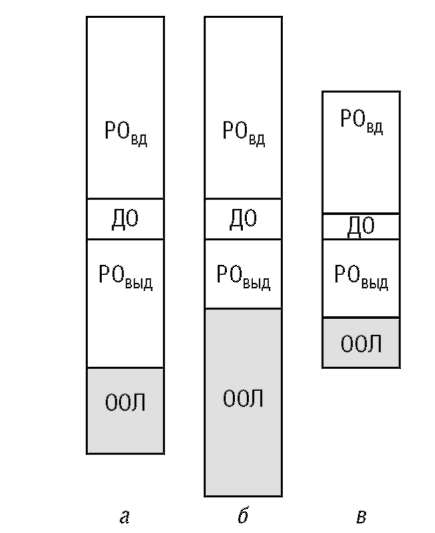
ЖЕЛ состоит из дыхательного объема, резервного объема вдоха и резервного объема выдоха. Если ЖЕЛ принять за 100%, то на долю ДО приходится около 10-15%, а РОвд примерно равен РОвыд и каждый составляет около 40-45% ЖЕЛ (обычно РОвыд меньше РОвд).
Дыхательный объем в норме составляет около 500 мл. Реальная величина ДО может быть получена при длительном спокойном дыхании. Считается возможным уменьшение ДО при ограничительных процессах. Тенденция к увеличению ДО наблюдается при обструкции бронхов, но изменения ДО даже при тяжелой патологии, как правило, мало выражены и имеют малую диагностическую ценность.
Увеличение ООЛ происходит при потере легкими эластических свойств. Как известно, просвет мелких бронхов поддерживается напряжением эластических структур стромы легких, радиально растягивающих бронхи. Остаточный объем представляет собой тот объем легких, при котором экспираторное усилие перекрывает мелкие бронхи и препятствует дальнейшему опорожнению легких. Чем беднее эластический каркас легких, тем раньше (при меньшем объеме выдоха) спадаются бронхи и тем больший объем воздуха остается в легких. Этим объясняется увеличение ООЛ при эмфиземе легких.
Аналогичная картина имеет место при нарушениях бронхиальной проходимости, когда измененные («гиперреактивные») бронхи спадаются до окончания полного выдоха. Иной механизм нарушения бронхиальной проходимости при так называемой гипотонической дискинезии (коллапсе трахеи и крупных бронхов), когда релаксация, пролабирование мембранозной части их стенки приводит к сужению, а иногда и полному перекрытию просвета трахеи и бронхов на выдохе.
Указанные процессы приводят к увеличению ООЛ и перестройке структуры ОЕЛ - значительному увеличению доли остаточного объема в ОЕЛ. Изменение соотношения ООЛ/ОЕЛ, в норме составляющее 25-35%, считается патогномоничным для эмфиземы легких. В случае преходящих нарушений соотношения остаточного объема и ОЕЛ правильнее говорить об остром вздутии легких.
Остаточный объем уменьшается при рестриктивных процессах в легких.
Функциональная остаточная емкость представляет собой тот основной объем, в котором происходят процессы внутриальвеолярного смешивания газов. Она характеризует соотношение эластических сил легких и грудной клетки. Когда дыхательная мускулатура полностью расслаблена, система «легкие - грудная клетка» предоставлена действию своих внутренних эластических сил и занимает положение спокойного выдоха, которое соответствует объему ФОЕ. Если ФОЕ увеличена, можно предполагать снижение эластичности легкого, если ФОЕ уменьшена - более вероятно снижение эластичности грудной клетки.
В тех случаях когда имеется резкое снижение эластичности легкого, например при эмфиземе легких, тяга грудной клетки кнаружи значительно преобладает над тягой легкого внутрь, положение равновесия системы оказывается сдвинутым в инспираторном направлении. Грудная клетка приобретает характерный для эмфиземы легких бочкообразный вид, она как бы застывает в положении вдоха, ФОЕ при этом оказывается увеличенной.
В норме ФОЕ составляет около 50% ОЕЛ.
ФОЕ служит «буфером» против больших колебаний парциального давления кислорода и углекислого газа в альвеолярном воздухе. Очень малая ФОЕ физиологически невыгодна, так как в этом случае рА02 подвергается значительным изменениям в течение дыхательного цикла. Это может привести к неравномерной вентиляции и легкой гипоксии. Увеличенная ФОЕ создает затруднения в тех случаях, когда требуется быстрое изменение состава альвеолярного воздуха (например, в условиях операции или при реанимационных мероприятиях).
Величина общей емкости легких, зависящая от изменения ее составных частей - жизненной емкости и остаточного объема, очень вариабельна. Уменьшение ОЕЛ является основным достоверным критерием рестриктивных нарушений вентиляции. При обструктивной патологии увеличение остаточного объема приводит, как правило, к увеличению ОЕЛ. Возможен и такой вариант обструктивных нарушений, когда ОЕЛ увеличивается мало, но происходит типичное для обструкции перераспределение объемов в рамках ОЕЛ - увеличение ООЛ и уменьшение ЖЕЛ. Аналогичное соотношение ООЛ и ЖЕЛ характерно и для смешанных нарушений вентиляции. Изменения структуры ОЕЛ представлены на рис. 3-14.
ОЕЛ снижена у больных с обширными поражениями легких (фиброз, отек, экссудат, ателектаз) или при сжатии части легочной ткани (пневмоторакс, гидроторакс). При эмфиземе легких величина ОЕЛ обычно нормальна или слегка увеличена.
Диагностическое значение параметров петли поток-объем и форсированного выдоха спирограммы
Исследование бронхиальной проходимости основано на определении объемной скорости движения воздуха по бронхиальному дереву. Сужение просвета бронхов увеличивает сопротивление дыхательных путей потоку воздуха и лучше выявляется при ускорении движения воздуха, поэтому все пробы по изучению бронхиальной проходимости проводятся, как правило, при форсированном дыхании с определением скорости воздушного потока.
В клинической практике наибольшее распространение получило определение ФЖЕЛ и ОФВ1.
Форсированная жизненная емкость легких - это ЖЕЛ, выполненная при форсированном дыхании, и все факторы, вызывающие снижение ЖЕЛ, действуют и на ФЖЕЛ. Однако ускорение движения воздуха при форсированном дыхании создает дополнительное сопротивление воздушному потоку. ФЖЕЛ равна ЖЕЛ только у 10% здоровых лиц, у остальных она на 100-300 мл меньше ЖЕЛ. Повышение сопротивления току воздуха, наблюдающееся при БА, ХОБЛ, эмфиземе легких, увеличивает разницу между ЖЕЛ и ФЖЕЛ до 1,5 л и более.
При тяжелой обструктивной патологии легких выполнение маневра ФЖЕЛ можно заменить выполнением форсированного выдоха за 6 с (ОФВ6 - «суррогатная» ФЖЕЛ). Это снижает риск развития синкопальных состояний, уменьшает утомляемость больного. Однако должные величины ОФВ6 еще не разработаны, поэтому пока рекомендуют использовать традиционную ФЖЕЛ (Федеральные клинические рекомендации Российского респираторного общества по использованию спирометрии, 2014).
ОФВ1 - объем форсированного выдоха за первую секунду маневра ФЖЕЛ. Это наиболее воспроизводимый и самый информативный показатель вентиляционной функции легких. Необходимо сравнить его величину с должной. При любых нарушениях ОФВ1 уменьшается: при обструктивных - за счет замедления форсированного выдоха, а при рестриктивных - за счет уменьшения всех легочных объемов.
Широко используется так называемый индекс Тиффно - отношение ОФВ1 к ЖЕЛ. Этот показатель снижается при обструктивном синдроме, так как уменьшается ОФВ1 при незначительном изменении ЖЕЛ. При рестриктивном синдроме за счет пропорционального уменьшения всех легочных объемов (ОФВ1 и ЖЕЛ) индекс Тиффно не меняется или даже увеличивается (относительно быстрый выдох малого объема воздуха). Таким образом, индекс Тиффно позволяет дифференцировать обструктивные и рестриктивные нарушения вентиляционной функции легких. Отношение ОФВ1 к ФЖЕЛ (индекс Тенслера) также является достаточно чувствительным показателем бронхиальной обструкции, и в настоящее время предпочтение отдается именно ему. Некоторые авторы считают, что оценка степени обструкции по индексу Генслера менее корректна, так как при обструкции степень уменьшения ФЖЕЛ может быть больше, чем степень уменьшения ЖЕЛ.
Начальные проявления бронхиальной обструкции могут быть выражены снижением объемной скорости выдоха на уровне 25-75% ФЖЕЛ (СОС25-75) при условии неизмененных величины ОФВ1 и индекса Тиффно. Этот показатель в меньшей степени зависит от произвольного усилия испытуемого и объективно отражает проходимость бронхов.
Скорость потока воздуха зависит не только от проходимости бронхов. Другая причина, вызывающая снижение объемной скорости движения воздуха, особенно в дистальных отделах дыхательных путей, - снижение эластической ретракции (отдачи) легких. Этот механизм играет важную роль в понижении МОС 75, СОС75-85 у больных эмфиземой легких.
До недавнего времени достаточно распространенным было мнение о том, что по кривой форсированного выдоха можно определить и уровень бронхиальной обструкции. Считалось, что МОС25 отражает уровень проходимости крупных, МОС50 - средних, СОС25-75 - крупных и средних бронхов, а показатели потока в конце выдоха (МОС75, СОС75-85) характеризуют проходимость мелких бронхов. Последующие исследования в области механики дыхания не подтвердили этих предположений. В настоящее время от определения уровня обструкции по кривой ФЖЕЛ отказались или это делается с некоторой долей условности.
По мнению ряда авторов, максимальные объемные скорости воздушного потока на разных уровнях ФЖЕЛ (МОС25, МОС50, МОС75) не обладают высокой воспроизводимостью, зависят от приложенного усилия, подвержены инструментальной ошибке и поэтому не играют существенной роли в определении типа и тяжести нарушений вентиляции (Федеральные клинические рекомендации Российского респираторного общества по использованию спирометрии, 2014).
Пиковая объемная скорость форсированного выдоха (ПОС) не изменяется при слабо выраженной обструкции дыхательных путей. Нормальные величины пиковой объемной скорости не исключают наличия обструктивных нарушений. Портативные пикфлоуметры, используемые больными в домашних условиях, определяют именно ПОС.
Типы нарушений легочной вентиляции
В табл. 3-8 приведены показатели ФВД здоровых людей.
Показатель |
Обозначение |
Нормальные значения |
|
|---|---|---|---|
мужчины: возраст 40 лет, вес 75 кг, рост 175 см |
женщины: возраст 40 лет, вес 60 кг, рост 160 см |
||
1. Вентиляция |
|||
Спирография |
|||
Общая емкость легких, л |
ОЕЛ |
6,4 |
4,9 |
Функциональная остаточная емкость, л |
ФОЕ |
3,2 |
2,6 |
Остаточный объем, л |
ОО |
1,5 |
1,2 |
Емкость вдоха, л |
Евд |
3,2 |
2,3 |
Резервный объем выдоха, л |
РОвыд |
1,7 |
1,4 |
Жизненная емкость легких, л |
ЖЕЛ |
4,9 |
3,7 |
Форсированная жизненная емкость легких, л |
ФЖЕЛ |
4,8 |
3,3 |
Объем форсированного выдоха за первую секунду, л |
ОФВ1 |
3,8 |
2,8 |
Отношение объема форсированного выдоха за первую секунду к ФЖЕЛ, % |
ОФЕ1 ФЖЕЛ |
76 |
77 |
Средняя объемная скорость середины выдоха, л/с |
СОС25-75 |
4,8 |
3,6 |
Средняя объемная скорость первого литра, л/с |
СОС200-1200 |
9,4 |
6,1 |
Кривая поток-объем |
|||
Мгновенная объемная скорость при 50% ФЖЕЛ, л/с |
МОС50 |
6,1 |
4,6 |
Мгновенная объемная скорость при 75% ФЖЕЛ, л/с |
МОС75 |
3,1 |
2,5 |
Аэродинамическое сопротивление |
|||
Полное аэродинамическое сопротивление, см вод.ст.-с/л |
R л |
<3,0 |
- |
Сопротивление дыхательных путей, см вод.ст.-с/л |
R д.п |
<2,5 |
- |
Растяжимость легких |
|||
Статическое транспульмональное давление на уровне ОЕЛ, см вод.ст. |
R ст. ОЕЛ |
25±5 |
- |
Статическая растяжимость легких, л/см вод.ст. |
C л |
0,2 |
- |
Растяжимость дыхательной системы в целом (легких и грудной клетки), л/см вод.ст. |
C д.с |
0,1 |
- |
Динамическая растяжимость легких при частоте дыхания 20 мин-1, л/см вод.ст. |
C 20 |
0,25±0,05 |
- |
2. Газообмен (на уровне моря) |
|||
Парциальное давление кислорода в артериальной крови, кПа (мм рт.ст.) |
PaO2 |
12,7±0,7 (95±5) |
- |
Парциальное давление углекислого газа в артериальной крови, кПа (мм рт.ст.) |
PaCO2 |
5,3±0,3 (40±2) |
- |
Насыщение гемоглобина кислородом в артериальной крови |
SaO2 |
0,97±0,02 (97±2%) |
- |
pH артериальной крови |
PH |
7,40±0,02 |
- |
Бикарбонат артериальной крови, мэкв/л |
HCO3 |
24±2 |
- |
Избыток (дефицит) оснований, мэкв/л |
BE |
0±2 |
- |
Диффузионная способность легких для CO, мл/с-мм рт.ст. (мл/мин-мм рт.ст.) |
0,42 (25) |
- |
|
Объем мертвого пространства, мл/кг |
V м.п |
2 |
- |
Отношение объема мертвого пространства к дыхательному объему: |
V м.п/ДО |
||
|
- |
35% ДО |
- |
|
- |
20% ДО |
- |
Альвеолярно-артериальная разница по кислороду, кПа (мм рт.ст.) |
P(A-a)O2 |
2,7 (20) |
- |
Нарушения вентиляционной функции легких по обструктивному типу
Обструктивные нарушения приводят к снижению скорости форсированного выдоха. Уменьшается объем воздуха, который пациент успевает выдохнуть за 1 с (ОФВх). Снижение ОФВх, индекса Генслера (ОФВ1/ЖЕЛ) и индекса Тиффно (ОФВ1/ЖЕЛ) - самые надежные показатели бронхиальной обструкции. Поскольку ОФВ1 снижается и при рестриктивных нарушениях легочной вентиляции, более надежными критериями обструкции являются индекс Тиффно и отношение ОФВ1/ФЖЕЛ (индекс Генслера) - табл. 3-9 и рис. 3-15.
| Показатели | Рестриктивные расстройства | Обструктивные расстройства | Смешанные расстройства |
|---|---|---|---|
ЖЕЛ |
Снижена |
В норме или снижена |
Снижена |
ООЛ |
Снижен |
В норме или увеличен |
Снижен или увеличен |
ОЕЛ |
Снижена |
В норме или увеличена |
Снижена |
ООЛ/ОЕЛ |
В норме или снижено |
В норме или увеличено |
Увеличено или снижено |
ОФВ1 |
Снижен |
Снижен |
Снижен |
Индекс Тиффно |
В норме или увеличен |
Снижен |
Снижен |
ПОС |
В норме или снижена |
Снижена |
Снижена |
МОС25, МОС50, МОС75 |
В норме или снижены |
Снижены |
Снижены |
СОС25-75 |
В норме или снижена |
Снижена |
Снижена |
При обструктивных нарушениях снижаются и другие показатели кривой поток-объем: МОС25, МОС50, МОС75, СОС25-75, СОС75-85, ПОС. Изменяется форма кривой. Она теряет форму треугольника, становится вогнутой, уменьшается по амплитуде.
Ранними признаками вентиляционных нарушений обструктивного характера могут быть изменения объемной скорости выдоха на уровне 25-75% ФЖЕЛ (СОС25-75) и, главное, «вогнутость» кривой даже при нормальных значениях ОФВ1 и индексов Тиффно и Генслера.
Бронхиальная обструкция приводит к изменениям статических легочных объемов. При выраженной обструкции снижается величина ЖЕЛ. Тяжелые обструктивные нарушения вызывают увеличение ООЛ и ОЕЛ (эффект динамической «воздушной ловушки»), развитие эмфиземы легких (см. рис. 3-15).
Нарушения вентиляционной функции легких по рестриктивному типу
Рестриктивные нарушения легочной вентиляции обусловлены процессами, ограничивающими растяжимость легких. Это может быть следствием поражения легочной ткани или связано с заболеваниями грудной клетки, позвоночника и др.
Наличие рестриктивных нарушений можно заподозрить (но не диагностировать!) уже на первых этапах функционального исследования: снижение ЖЕЛ, увеличение индексов Тиффно и Генслера (ОФВ1/ЖЕЛ и ОФВ1/ФЖЕЛ более 80-90%). Поскольку на величину ЖЕЛ влияет и бронхиальная обструкция (в том числе обратимая), следует ориентироваться на ЖЕЛ, полученную после фармакологической пробы («снять с ЖЕЛ налет обструктивных нарушений»). Однако и в этом случае диагностика рестриктивных нарушений только по величине ЖЕЛ будет поверхностной и ориентировочной. Необходимо определение ОЕЛ, так как обоснованное заключение о наличии рестриктивных нарушений может быть сделано только при снижении ЖЕЛ, ООЛ, ОЕЛ. Однако определение ОЕЛ, ООЛ, ФОЕ сопряжено с методическими трудностями, поскольку необходимо использовать методы разведения газов или бодиплетизмографию, что недоступно многим лечебным учреждениям. В связи с этим диагностика рестриктивных нарушений большинством специалистов по функциональной диагностике осуществляется по величине ЖЕЛ (после фармакологической пробы), или в случае смешанных нарушений дается характеристика обструктивных расстройств и оговаривается снижение ЖЕЛ.
Рестриктивная патология приводит к снижению практически всех легочных объемов: ЖЕЛ, ФЖЕЛ, ОФВ1, ООЛ, ОЕЛ, ФОЕ, Евд (см. рис. 3-14 и 3-15) при нормальных или увеличенных значениях отношения ОФВ1 к ЖЕЛ и ФЖЕЛ. Могут быть незначительно снижены МОС 50, МОС75, СОС25-75. Надежными критериями рестриктивных нарушений являются снижение ОЕЛ и увеличение индексов Тиффно и Генслера более 80-90%.
Форма кривой поток-объем существенно не меняется, она становится уменьшенным вариантом нормальной кривой или приобретает вытянутый вид и сдвигается вправо (см. рис. 3-7). Иногда недостаточное усилие при выполнении маневра поток-объем или периферическая обструкция могут привести к снижению ОФВ1 и ЖЕЛ при нормальном их соотношении.
Нарушения вентиляционной функции легких по смешанному типу
При смешанном типе вентиляционных расстройств имеют место как обструктивные, так и рестриктивные нарушения. Снижение ЖЕЛ и ОФВ1 в большей степени, чем индекса Тиффно, свидетельствует о преобладании рестрикции. Преобладание обструкции можно констатировать при значительном уменьшении индекса Тиффно и «вогнутости» кривой поток-объем. Для определения типа вентиляционных нарушений можно использовать табл. 3-9.
Интерпретация результатов исследования вентиляционной функции легких
Интерпретацию всех спирографических показателей проводят при сравнении фактических величин с должными. Наиболее широко используется оценка следующих величин: ЖЕЛ/ДЖЕЛ, ФЖЕЛ/ДФЖЕЛ, ОФВ1/ДОФВ1, ОФВ1/ЖЕЛ, ОФВ1/ФЖЕЛ (здесь ДЖЕЛ, ДФЖЕЛ, ДОФВ1 - должные значения ЖЕЛ, ФЖЕЛ и ОФВ1 соответственно). Спирографическое заключение выносят после проведения соответствующих расчетов и оценки полученных результатов по установленным критериям выраженности нарушений (табл. 3-10, 3-11).
Показатель |
Норма |
Условная норма |
Изменения |
||
|---|---|---|---|---|---|
умеренные, I степень |
значительные, II степень |
резкие, III степень |
|||
Х- 1,0 σ |
1,0-1,65 σ |
1,65-3,0 σ |
3,0-5,0 σ |
более 5,0 σ |
|
ЖЕЛ, % должной |
Более 90 |
90-85 |
64-70 |
69-50 |
Менее 50 |
МВЛ, % должной |
Более 85 |
85-75 |
74-55 |
54-35 |
Менее 35 |
ОФВ1 % должной |
Более 85 |
85-75 |
74-55 |
54-35 |
Менее 35 |
ОФВ1/ЖЕЛ |
Более 70 |
70-65 |
65-55 |
54-40 |
Менее 40 |
ОЕЛ, % должной (при обструкции) |
Менее 110 |
110-115 |
116-125 |
126-140 |
Более 140 |
ОЕЛ, % должной (при рестрикции) |
Более 90 |
90-85 |
74-60 |
Менее 60 |
ООЛ, % должной |
До 25 |
125-140 |
141-175 |
176-225 |
Более 225 |
ООЛ/ОЕЛ, % прироста по сравнению с должным |
Примечание: X - среднее арифметическое; σ - среднее квадратическое отклонение.
Показатель |
Граница нормы |
Градация отклонений |
||
|---|---|---|---|---|
умеренное |
значительное |
резкое |
||
ОЕЛ, % должного |
80-125 |
126-135 |
136-145 |
>145 |
79-75 |
74-60 |
<60 |
||
ЖЕЛ, % должного |
≥80 |
79-71 |
70-51 |
<51 |
ООЛ, % должного |
85-150 |
151-200 |
201-250 |
>250 |
84-70 |
69-50 |
<50 |
||
ООЛ/ОЕЛ, % должного |
≤140 |
141-170 |
171-210 |
>210 |
R, кПа-с/л |
≤030 |
0,31-0,60 |
0,61-0,80 |
>0,80 |
ОФВ1, % должного |
≥80 |
79-61 |
60-51 |
<51 |
ОФВ1/ЖЕЛ |
≥0,70 |
<0,70 |
||
ОФВ1/ФЖЕЛ |
≥0,70 |
<0,70 |
||
CL, % должного |
50-150 |
<50 и >150 |
||
CR, кПа/л |
0,31-0,60 |
0,61-0,80 |
0,81-1,00 |
>1,00 |
0,30-0,21 |
0,20-0,11 |
<0,11 |
||
ДСЛзд, % должного |
≥80 |
79-61 |
60-51 |
<51 |
Альвеолярный объем, % должного |
≥80 |
79-61 |
60-51 |
<51 |
ра 02, % должного |
≥80 |
79-71 |
70-61 |
<61 |
ра С02, мм рт.ст. |
35-45 |
<35 и >45 |
||
Sa02, % |
≥95 |
<95 |
||
Примечание: R - общее бронхиальное сопротивление; CL - статическая растяжимость легких; CR - индекс ретракции (coefficient of retraction); ДСЛзд - диффузионная способность легких, выполненная с задержкой дыхания.
В настоящее время границы нормы и патологии, степень тяжести нарушений вентиляционной функции легких все еще являются предметом дискуссии.
В практической работе большинство исследователей пользуются критериями, разработанными отечественными авторами (Л.Л. Шик, Н.Н. Канаев, Р.Ф. Клемент и др. - см. табл. 3-10). Некоторые авторы делают выбор в пользу системы Европейского сообщества угля и стали, Европейского респираторного общества (табл. 3-11).
Обычно за нижний предел нормы потоковых параметров (МОС25, МОС50, МОС75, СОС25-75, СОС75-85, ПОС) принимают значение показателя, равное 60-65% должной величины.
Фармакологические тесты для выявления обратимости бронхиальной обструкции (пробы с бронходилататорами)
Выявление нарушений бронхиальной проходимости, определение ее тяжести - начальный этап в программе постановки функционального диагноза при обструктивных заболеваниях легких. Следующим шагом является определение степени обратимости обструкции. Для этого используются так называемые фармакологические пробы - исследование показателей бронхиальной обструкции до использования бронхорасширяющих препаратов и после их приема.
Чаще исследуют влияние бронходилататоров на показатели кривой поток-объем, главным образом на ФЖЕЛ и ОФВ1.
Выбор назначаемого препарата и дозы. Бронходилатационный ответ на конкретный препарат зависит от фармакологической группы препарата, способа его введения, назначаемой дозы, времени после введения препарата, вариабельности бронхиальной обструкции и ее обратимости.
Обычно используют ингаляционные симпатомиметики - β2-агонисты [сальбутамол, фенотерол (Беротек Н♠) и др.]. Фармакологическую пробу можно проводить и другими бронхорасширяющими препаратами (одним или несколькими последовательно). Необходимо учитывать способ введения препарата (ингаляционный, внутривенный) и повторное исследование бронхиальной проходимости проводить с учетом времени максимума действия препарата при соответствующем пути введения.
Согласно Федеральным клиническим рекомендациям Российского респираторного общества по использованию спирометрии (2014) и Требованиям Европейского респираторного общества и Американского торакального общества 2005 г., бронходилатационный тест проводят следующим образом.
-
Доза короткодействующего β-агониста и холинолитика - четыре последовательно вводимые ингаляционные дозы. Обычно используют сальбутамол или фенотерол в максимальной разовой дозе 400 мкг (4 ингаляции по 100 мкг с интервалом 30 с). При наличии противопоказаний [высокая частота сердечных сокращений (ЧСС), тремор] вводят 2 дозы адреномиметика. При использовании м-холинолитика максимальная разовая доза составляет 160 мкг (4 дозы по 40 мкг).
-
Повторное исследование после введения β-агониста - через 15-30 мин, после введения холинолитика - через 30-45 мин.
Достижение воспроизводимости. Исследование считается воспроизводимым и завершенным, если пациенту удается выполнить три технически правильных попытки, при которых разница между максимальными и минимальными величинами ОФВ1 и ФЖЕЛ не превышает 5% и/или 150 мл.
Способ расчета бронходилатационного ответа. Единого взгляда на интерпретацию результатов исследования не существует из-за различия способов математического расчета прироста ОФВ1.
Достаточно распространенным является метод измерения обратимости обструкции бронхов по приросту ФЖЕЛ или ОФВ1, выраженному в процентах исходной величины:
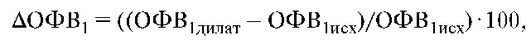
где АОФВ1 - изменение объема форсированного выдоха за первую секунду, % исходного; ОФВ1дилат - объем форсированного выдоха за первую секунду после бронходилатации, мл; ОФВ1исх - исходный объем форсированного выдоха за первую секунду, мл.
Достаточно корректным считается способ расчета прироста ФЖЕЛ или ОФВ1 по отношению к должным величинам ОФВ1:
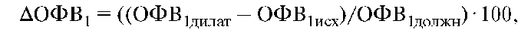
где АОФВ1 - изменение объема форсированного выдоха за первую секунду, % должного; ОФВ1дилат - объем форсированного выдоха за первую секунду после бронходилатации, мл; ОФВ1исх - исходный объем форсированного выдоха за первую секунду, мл; ОФВ1должн - должный объем форсированного выдоха за первую секунду, мл.
Достоверный бронходилатационный ответ по своему значению должен превышать спонтанную вариабельность обструкции и реакцию на бронхолитики здоровых лиц. Тест рассматривается как положительный в случае прироста ОФВ1 и/или ФЖЕЛ не менее 12% исходного и не менее чем на 200 мл (по данным ряда авторов, критерием положительного теста служит прирост ОФВ1 не менее 15% должного и не менее 200 мл) (Клинические рекомендации Российского респираторного общества, 2014, Европейского респираторного общества и Американского торакального общества, 2005).
Положительная фармакологическая проба указывает на ведущую роль бронхоспазма в генезе бронхиальной обструкции у конкретного пациента и может быть (с определенными оговорками) использована в качестве критерия при дифференциальной диагностике БА и ХОБЛ, поскольку БА функционально определяется как обратимая обструкция, а ХОБЛ - как преимущественно необратимое или частично обратимое нарушение бронхиальной проходимости.
Отрицательная фармакологическая проба не исключает бронхоспазма, так как не каждое бронхолитическое средство способно купировать бронхоспазм у конкретного больного; нередко недостаточно эффективными оказываются даже многие последовательно применяемые бронхорасширяющие препараты различного механизма действия.
Провокационные (бронхоконстрикторные) тесты
Чувствительность и реактивность дыхательных путей могут быть изучены с помощью провокационных тестов. Провокационные пробы проводят с фармакологическими препаратами (ацетилхолин, метахолин, гистамин), физическими раздражителями (неизотонические аэрозоли, холодный или сухой воздух, физическая нагрузка), сенсибилизирующими агентами (аллергены, профессиональные сенсибилизаторы).
Гиперчувствительность (hypersensitivity) - повышенная чувствительность к раздражителю.
Гиперреактивность (hyperreactivity) - чрезмерная бронхоконстрикторная реакция на раздражитель. Оба эти понятия объединены обобщающим термином «гипервосприимчивость» (hyperresponsiveness).
Легочная вентиляция
Общая вентиляция
Постоянство газового состава альвеолярного воздуха поддерживается адекватным уровнем легочной вентиляции. Объем вентиляции определяется глубиной дыхания - дыхательным объемом (ДО) и частотой дыхания (ЧД). Объем воздуха, вентилируемого легкими в течение 1 мин, называется минутным объемом дыхания (МОД) или общей вентиляцией:
МОД = ДО ? ЧД.
Эти показатели широко варьируют в зависимости от потребностей организма, в покое у здоровых людей ДО ~ 0,4-0,6 л, ЧД ~ 12-16 в минуту, а МОД ~ 5-6 л/мин, обеспечивая потребление кислорода в количестве 0,2 л/мин.
Минутный объем дыхания исследуют в условиях основного обмена или после 20-30-минутного отдыха, так как любое повышение энерготрат ведет к увеличению потребления кислорода и возрастанию МОД.
Повышение МОД называют общей гипервентиляцией, снижение - общей гиповентиляцией.
Минутный объем дыхания увеличивается при повышении потребности организма в кислороде (например, вследствие физической нагрузки или увеличения уровня тканевого дыхания при воспалительном процессе, тиреотоксикозе и пр.), при затруднении нормальной вентиляции легкого (как результат обструктивных форм бронхолегочной патологии), при ухудшении диффузии кислорода через аэрогематический барьер (фиброзирующий альвеолит, отек легких) и т.д. В ряде случаев трудно выявить факторы, увеличивающие МОД. Большую роль играет состояние центральной нервной системы, в частности дыхательного центра. Следует помнить об увеличении МОД вследствие неврогенных причин, например при истерии.
Уменьшение МОД обусловлено в большинстве случаев угнетением дыхательного центра (отравление наркотическими средствами, барбитуратами, инсульты, опухоли и травмы мозга), гипоксемическим торможением центральной нервной системы («гипоксемический наркоз») у больных с тяжелыми явлениями недостаточности кровообращения и внешнего дыхания. Общая вентиляция (МОД) уменьшается при снижении потребности организма в кислороде, например у хорошо тренированных людей в покое, у больных гипотиреозом и т.д.
Максимальная вентиляция легких
Максимальная вентиляция легких (МВЛ) - максимальный объем воздуха, который может быть провентилирован за 1 мин при условии предельного увеличения глубины и скорости дыхания.
Величина МВЛ варьирует в широких пределах. Она в значительной степени зависит от пола, роста, массы тела, возраста и тренированности испытуемого. За нормальную величину МВЛ у здоровых людей среднего возраста принимают значения, равные 80-100 л/мин (100 л/мин для мужчин и 80 л/мин для женщин). У спортсменов величина МВЛ находится в пределах 120-150 л/мин, достигая в отдельных случаях 200 л/мин.
Максимальную вентиляцию легких определяют с помощью спирографа, пневмотахографа. МВЛ дает представление о функциональных возможностях системы дыхания и широко применяется в физиологии труда и спорта. На основании МВЛ и измерения содержания кислорода во вдыхаемом и выдыхаемом воздухе можно рассчитать максимальное потребление кислорода.
Ограничение МВЛ при патологии легких может быть вызвано нарушениями бронхиальной проходимости, ригидностью легочной ткани, тугоподвижностью грудной клетки и другими причинами, вызывающими уменьшение ЖЕЛ. По своему физиологическому смыслу проба МВЛ является многократно повторенной пробой ОФВЬ поэтому величина МВЛ часто используется для оценки бронхиальной обструкции. Аналогично изменениям ОФВ1 уменьшение МВЛ наблюдается как при рестриктивном, так и при обструктивном синдроме.
Альвеолярная вентиляция
Для осуществления газообмена важен не весь объем воздуха, вентилирующего легкие, а только та часть, которая вентилирует альвеолярное пространство, - альвеолярная вентиляция (АВ или VA). Ее величина определяется глубиной и частотой дыхания, а также объемом мертвого пространства.
Мертвое дыхательное пространство - часть объема легких, в котором не происходит газообмена между воздухом и кровью. Различают анатомическое и физиологическое (функциональное) мертвое пространство.
К анатомическому мертвому пространству относится кондуктивная зона дыхательных путей («от зубов до альвеол»): ротовая и носовая полости, глотка, гортань, трахея, бронхи и бронхиолы. Величина его относительно стабильна и составляет около 150 мл. У женщин величина анатомического мертвого пространства меньше, чем у мужчин.
Функциональное мертвое пространство включает анатомическое и так называемое альвеолярное пространство. Последнее не имеет четких анатомических границ - это часть дыхательной зоны, неэффективная в отношении обмена газов. Основная причина его возникновения - несоответствие вентиляции кровотоку. Если группа альвеол вентилируется, но не перфузируется, то воздух, вентилирующий эти альвеолы, не принимает участия в газообмене. Вентиляция этих альвеол подобна вентиляции мертвого пространства. В здоровых легких количество таких участков невелико, поэтому в норме объемы анатомического и функционального мертвого пространства практически одинаковы.
Величина физиологического мертвого пространства у здорового человека среднего возраста в состоянии покоя колеблется в пределах 150-200 мл (0,2-0,35 дыхательного объема). При многих заболеваниях легких, когда имеются нарушения вентиляционно-перфузионных отношений, объем функционального мертвого пространства может оказаться значительно больше анатомического.
Под альвеолярной вентиляцией понимают ту часть МОД, которая достигает альвеол и участвует в газообмене с кровью; остальная часть составляет вентиляцию мертвого пространства.
Объем функционального мертвого пространства можно рассчитать, зная содержание или парциальное давление СО2 в выдыхаемом и альвеолярном воздухе.
Величина альвеолярной вентиляции пропорциональна интенсивности метаболических процессов в организме, отражением которой достаточно точно может служить количество выделяемого легкими углекислого газа. Если расчет функционального мертвого пространства не входит в задачу исследования, то правомерна формула расчета альвеолярной вентиляции (VA) через парциальное давление CO2 в альвеолах (pACO2) и его количество, выделенное за определенный отрезок времени (VACO2).
Нормальной величиной альвеолярной вентиляции является та, которая обеспечивает нормальный газовый состав альвеолярного воздуха. Отношение альвеолярной вентиляции к общей (АВ/МОД или VA/V) характеризует эффективность вентиляции и у здоровых людей в покое составляет около 70% МОД (2-2,5 л/мин на 1 м2 поверхности тела). При физической нагрузке отношение АВ/МОД несколько увеличивается.
При заболеваниях легких может наблюдаться как избыточная, так и недостаточная альвеолярная вентиляция. Альвеолярная гипервентиляция часто имеет компенсаторный характер и направлена на улучшение условий обмена кислорода в легких. Иногда она является проявлением нарушений регуляции дыхания.
В основе альвеолярной гиповентиляции лежат нарушения механики дыхания, увеличение энергетической стоимости вентиляции, истощение дыхательной мускулатуры.
Альвеолярная гипер- и гиповентиляция приводят к изменениям газового состава альвеолярного воздуха и, как следствие этого, - газового состава артериальной крови и кислотно-основного состояния.
Неравномерность вентиляции не является патогномоничным симптомом какого-либо заболевания легких и может наблюдаться при обструктивной патологии, эмфиземе, воспалительных процессах, пневмосклерозе, застойных явлениях, опухолях, плевральном выпоте и др.
Неравномерность вентиляции приводит к изменению газового состава альвеолярного воздуха и артериализации крови в легких (если только кровоток в легочных капиллярах не уменьшен пропорционально снижению вентиляции).
Газовый состав альвеолярного воздуха. Содержание кислорода и углекислого газа в альвеолах зависит от уровня альвеолярной вентиляции и интенсивности газообмена.
В атмосферном воздухе содержится 20,9 об. % кислорода, 0,03 об. % углекислого газа, 79,1 об. % азота. Содержание в объемных процентах означает количество миллилитров газа в 100 мл газовой смеси. В воздухе содержится также очень небольшое количество благородных газов.
Альвеолярный воздух полностью (на 100%) насыщен водяными парами, имеет температуру 37 °C.
У здоровых людей поглощение кислорода в покое колеблется в пределах 250-300 мл/мин, составляя в среднем 280 мл/мин. Выделение углекислого газа равно 230 мл/мин с колебаниями 200-250 мл/мин.
Отношение объема выделенного CO2 к объему поглощенного O2, или так называемый дыхательный коэффициент, составляет 230/280 ≈ 0,8.
При атмосферном давлении 760 мм рт.ст., альвеолярной вентиляции 5000 мл/мин, содержании O2 во вдыхаемом воздухе 20,9 об. % содержание кислорода в альвеолярном воздухе составит 14 об. % (с колебаниями 13,6-14,9 об. %), углекислого газа 5,6 об. % (с колебаниями 4,8-6,1 об. %).
Согласно закону Дальтона парциальное давление каждого газа в смеси газов пропорционально его объемному содержанию.
При спокойном дыхании парциальное давление кислорода в альвеолах pАO2) составит 100 мм рт.ст., углекислого газа pАС02) - 40 мм рт.ст. Колебания указанных величин у здоровых людей могут составлять: для парциального давления кислорода 90-110 мм рт.ст., для парциального давления углекислого газа 35-45 мм рт.ст.
Низкое содержание и низкое парциальное давление кислорода в альвеолярном воздухе называется альвеолярной гипоксией, высокое [например, при искусственной вентиляции легких (ИВЛ)] - альвеолярной гипероксией.
Высокое, низкое, нормальное содержание и парциальное давление углекислого газа в альвеолах называются соответственно альвеолярной гиперкапнией, гипокапнией, нормокапнией.
Мы считаем целесообразным привести в данном разделе терминологию нормальных и патологических типов вентиляции, поскольку в большинстве случаев для определения типа вентиляции необходимо изучение газового состава альвеолярного воздуха.
Нормовентиляция - нормальная вентиляция, при которой парциальное давление C02 в альвеолах (pAC02) поддерживается на уровне около 40 мм рт.ст.
Гипервентиляция - усиленная вентиляция, превышающая метаболические потребности организма (pAC02 <40 мм рт.ст.).
Гиповентиляция - сниженная вентиляция по сравнению с метаболическими потребностями организма (paC02 >40 мм рт.ст.).
Повышенная вентиляция - любое увеличение альвеолярной вентиляции по сравнению с уровнем покоя независимо от парциального давления газов в альвеолах (например, при физической работе).
Эупноэ - нормальная вентиляция в покое, сопровождающаяся субъективным чувством комфорта.
Гиперпноэ - увеличение глубины дыхания независимо от того, увеличена ли при этом частота дыхания.
Тахипноэ - увеличение частоты дыхания.
Брадипноэ - уменьшение частоты дыхания.
Апноэ - остановка дыхания, обусловленная главным образом отсутствием физиологической стимуляции дыхательного центра.
Диспноэ (одышка) - неприятное субъективное ощущение недостаточности дыхания или затрудненного дыхания.
Ортопноэ - выраженная одышка, связанная с застоем крови в легочных капиллярах в результате левопредсердной и левожелудочковой сердечной недостаточности; больному трудно находиться в горизонтальном положении.
Асфиксия - остро протекающее удушье, обусловленное нарушением газообмена между организмом и внешней средой с повышением парциального давления углекислого газа и снижением парциального давления кислорода в альвеолярном воздухе; возникает при закрытии просвета дыхательных путей или первичном угнетении дыхательного центра.
Способы изучения вентиляции и газового состава альвеолярного воздуха.
Изучение основных показателей общей вентиляции (МОД, ДО, ЧД), МВЛ, поглощения и коэффициента использования кислорода возможно с помощью спирографа.
Для расчета более информативных величин: альвеолярной вентиляции, объема функционального дыхательного мертвого пространства, парциального давления кислорода и углекислого газа в альвеолярном воздухе - необходимо использование различного рода газоанализаторов.
По принципу действия газоанализаторы делятся на:
-
_ механические_ (объемные и манометрические), принцип работы - определение объема пробы газа после удаления из нее анализируемого компонента;
-
тепловые газоанализаторы, принцип работы - использование тепловых свойств газов;
-
магнитные газоанализаторы - используются парамагнитные свойства кислорода;
-
оптико-акустические газоанализаторы (капнографы, определение CO2 ), принцип действия - поглощение углекислым газом инфракрасных лучей;
-
масс-спектрометры позволяют количественно определять содержание кислорода, углекислого газа и азота в выдыхаемом воздухе или газовой смеси; принцип действия - ионизация молекул газов в условиях высокого вакуума с последующим разделением ионов по массам.
В табл. 3-12 приведены показатели легочного газообмена (расчетные формулы и нормативы).
|
Примечание. VE- минутный объем дыхания (по выдоху); FIO2 и FEO2 - концентрация O2 во вдыхаемом и выдыхаемом воздухе; FECO2 - концентрация CO2 в выдыхаемом воздухе; PACO2 и PECO2 - парциальное давление CO2 в альвеолах и выдыхаемом воздухе; PaCO2 - парциальное давление CO2 в артериальной крови; PIO2 и PAO2 - парциальное давление O2 во вдыхаемом воздухе и альвеолах; PaO2 - парциальное давление O2 в артериальной крови; Q, QS - общий кровоток (минутный объем кровообращения), кровоток через шунт; Σρ - атмосферное давление за вычетом парциального давления водяных паров и парциальных давлений O2 и CO2 в артериальной крови.
Диффузия газов
Диффузионная способность легких
Переход кислорода из альвеолярного воздуха в кровь легочных капилляров, а диоксида углерода (углекислого газа) - в обратном направлении происходит путем диффузии газов через альвеолярно-капиллярную мембрану. Диффузия - физический процесс транспорта газа из области с большей его концентрацией в область с меньшей концентрацией. Парциальное давление кислорода в альвеолах (100 мм рт.ст.) значительно выше, чем его напряжение в венозной крови, поступающей в капилляры легких (40 мм рт.ст.). Градиент парциального давления для углекислого газа направлен в обратную сторону (46 мм рт.ст. в начале легочных капилляров и 40 мм рт.ст. в альвеолах). Эти градиенты давлений являются движущей силой диффузии газов в легких.
Количественная сторона процесса описывается первым законом диффузии Фика, согласно которому скорость диффузионного потока через слой ткани прямо пропорциональна площади этого слоя, разности парциального давления по обе его стороны и обратно пропорциональна толщине слоя. Скорость диффузии зависит также от специфических свойств газов и тканей, через которые он проникает (плотность и вязкость среды, температура, молекулярная масса диффундирующих веществ, их растворимость и т.п.).

Для характеристики диффузии газов используют величину, называемую диффузионной способностью легких или трансфер-фактором (фактором переноса).
В условиях организма диффузионная способность легких зависит прежде всего от площади и толщины мембраны.
Диффузионная способность отражает количество миллилитров газа, проходящего через альвеолярно-капиллярную мембрану за 1 мин при разности парциального давления газа между конечными точками диффузии 1 мм рт.ст.
В связи с более высокой растворимостью углекислого газа в биологических жидкостях он диффундирует через ткани примерно в 20 раз быстрее, чем кислород, и затруднений для его диффузии через альвеолярно-капиллярную мембрану не возникает.
Время пребывания крови в легочных капиллярах не превышает 0,75-1 с. Если за это время парциальное давление O2 в капиллярах и альвеолах не достигает равновесия, кровь покидает капилляры с низким содержанием кислорода. У здоровых людей в покое диффузия кислорода осуществляется всего за 0,3 с. Диффузионная способность легких должна снизиться не менее чем в 2 раза по сравнению с нормой, чтобы возникла гипоксемия, то есть снижение насыщения артериальной крови кислородом.
При физической нагрузке скорость кровотока возрастает, при этом уменьшается время контакта крови с кислородом. Однако у здоровых людей артериализация крови не нарушается, так как наряду с повышением скорости кровотока значительно увеличивается площадь газообмена за счет более глубокого дыхания. Это связано с расправлением складок мембраны, увеличением количества вентилируемых альвеол, расширением функционирующих и раскрытием добавочных сосудов. Единственной причиной нарушения диффузии кислорода у здоровых людей может быть физическая работа на большой высоте в горах, когда градиент парциального давления O2 между альвеолами и венозной кровью начальной части легочного капилляра снижается с 60 до 30 мм рт.ст.
При заболеваниях легких, сопровождающихся нарушениями проницаемости аэрогематического барьера, диффузионная способность при нагрузке не может увеличиться в должной степени и возникает гипоксемия. Именно поэтому больным с диффузионными нарушениями свойственно быстрое и значительное нарастание гипоксемии при физической нагрузке.
Поскольку диффузионная способность легких в значительной степени зависит от площади газообмена, толщины и свойств альвеолярно-капиллярной мембраны, все заболевания, патологические состояния, изменяющие ее морфологические и функциональные свойства, приводят к нарушениям диффузии кислорода в легких. Для углекислого газа эти нарушения минимальны (практически отсутствуют) ввиду высокой диффузионной способности CO2.
Снижение диффузионной способности встречается при самой различной легочной патологии, но при ряде заболеваний (идиопатический фиброзирующий альвеолит, саркоидоз Бека, муковисцидоз, канцероматоз, гранулематозы, пневмокониозы и др.) нарушения диффузии выступают на первый план, являясь ведущим механизмом нарушения функции легких.
Методы оценки диффузионной способности легких основаны на применении монооксида углерода (СО).
Монооксид углерода (угарный газ) обладает большим сродством к гемоглобину (в 220 раз большим, чем кислород). Проникая через альвеолярно-капиллярную мембрану, он быстро и в большом объеме связывается с гемоглобином практически без повышения парциального давления СО в плазме крови. Градиент давления СО между альвеолами и кровью капилляров остается высоким, скорость кровотока, объем крови в капиллярах не сказываются на диффузии этого газа. Следовательно, количество монооксида углерода, перешедшее из альвеол в кровь легочных капилляров, зависит только от свойств диффузионного барьера, то есть перенос СО ограничен только диффузией. Это делает СО идеальным газом для исследования диффузионной способности легких.
Токсическое действие монооксида углерода на организм исключается благодаря применению низких концентраций и кратковременности экспозиции.
Существует несколько методов определения диффузионной способности легких с помощью монооксида углерода. Из них наиболее часто используют метод с задержкой дыхания (одиночного вдоха, Длзд) и метод устойчивого состояния (Длуст).
Метод одиночного вдоха с задержкой дыхания (Длзд) (single-breath) является наиболее распространенным. Согласно документам Американского торакального общества и Европейского респираторного общества он считается надежным, доступным и хорошо стандартизированным тестом.
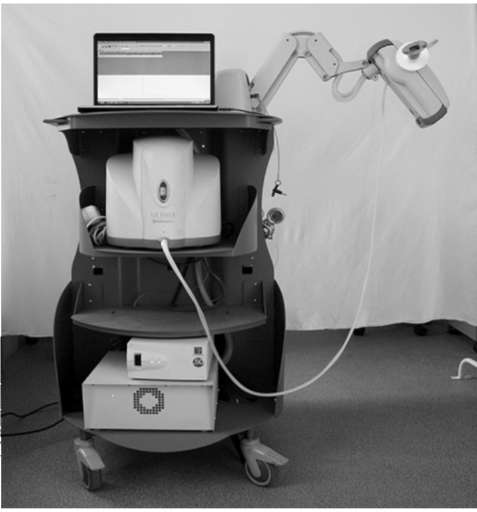
На рис. 3-16 и 3-17 изображены аппаратура (диффузион-тест) и кривая определения диффузионной способности легких методом single-breath.
Процедура исследования. Проводят инструктаж пациента, объясняют суть предлагаемых дыхательных маневров. Обследуемый должен сидеть прямо, с расправленными плечами, плотно обхватывая губами мундштук. На нос надевают зажим. Очень важно избегать утечки воздуха и газовой смеси. Дверь кабины бодиплетизмографа может быть открыта, герметичности камеры не требуется. После спокойного дыхания через пневмотахографическую трубку (четыре вдоха и выдоха) пациент делает глубокий вдох газовой смеси, содержащей 0,2-0,3% C0 и 10% гелия (неона), задерживает дыхание на 10 с, затем выполняет глубокий спокойный выдох. По исходной концентрации монооксида углерода определяют его парциальное давление в альвеолах. Конечную концентрацию монооксида углерода определяют в пробе выдохнутой газовой смеси. Измерив исходную величину pAC0 и сравнив ее с напряжением СО в конце выдоха, рассчитывают скорость прохождения монооксида углерода через мембрану. Использование гелия (неона) позволяет рассчитать весь объем альвеол (метод разведения).
Преимуществом пробы является ее быстрота; роль больного невелика и заключается лишь в том, чтобы вдохнуть и задержать дыхание на 10 с, хотя и этот простой маневр может быть недоступен ряду больных.
У здоровых людей диффузионная способность легких, измеренная методом задержки дыхания и приведенная к поверхности тела, составляет в среднем 18 мл/мин/мм рт.ст./м2.
Снижение диффузионной способности легких в 2 раза и более является плохим прогностическим признаком. Если резервные возможности легких сохранены и возможна гипервентиляция альвеол, то повышением парциального давления кислорода в альвеолах удается улучшить диффузию кислорода. Сочетание диффузионных нарушений с гиповентиляцией быстро приводит к развитию выраженной гипоксемии.
Вентиляционно-перфузионные отношения
Эффективность легких как газообменного органа зависит от того, в какой степени при прочих равных условиях соответствуют друг другу величины кровотока и вентиляции в различных участках легких.
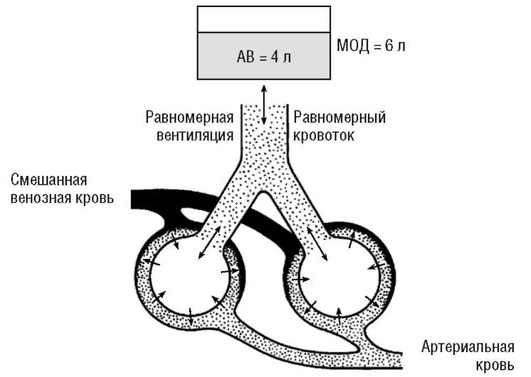
За нормальную среднюю величину отношения вентиляция:кровоток принимают значения, находящиеся в диапазоне 0,8-1,0. Иногда удобнее выразить это отношение как 4:5, поскольку альвеолярная вентиляция у человека в покое примерно 4 л/мин, а легочный кровоток около 5 л/мин.
Указанное соотношение должно сохраняться и на уровне отдельных функциональных легочных единиц (рис. 3-18).
Следовательно, условием эффективного газообмена в легких является равномерное распределение вентиляционно-перфузионных отношений по всему объему легких: хорошо вентилируемые альвеолы должны хорошо перфузироваться, а перфузия плохо вентилируемых альвеол должна быть снижена.
Однако и в норме регионарная структура распределения легочного кровотока не вполне равномерна и соответствует функциональным зонам Уэста, разделенным в зависимости от внутриальвеолярного давления и давления в мельчайших артериях и венах. Ведущим фактором в зональном распределении кровотока является гравитация.
При любой патологии легких возникает огромное число факторов, действующих как на вентиляцию, так и на кровоток в отдельных участках легких и увеличивающих неравномерность распределения вентиляционно-перфузионных отношений: нарушения микроциркуляции в сосудах малого круга кровообращения, микротромбообразование, эмболизация, облитерация части сосудистого русла, регионарные нарушения вентиляции, связанные с механической неоднородностью легких, нарушениями бронхиальной проходимости, эластической растяжимости и др.
При вентиляционно-перфузионном отношении, равном 0,2, насыщение артериальной крови кислородом снижается до 84%, а при 0,1 - до 77%.
Нарушения вентиляционно-перфузионных отношений - главная причина гипоксемии при большинстве заболеваний легких. Морфологической ее основой являются факторы, определяющие неравномерность вентиляции. Однако при совершенной регуляции кровотока и своевременной его редукции в плохо вентилируемых участках легких (рефлекс Эйлера-Лильестранда) гипоксемия не возникает. Это подтверждается клиническими наблюдениями, когда резкие патоморфологические изменения не сопровождаются значительной гипоксемией, и, наоборот, скудные морфологические изменения в легких приводят к выраженным нарушениям артериализации крови.
Для выявления нарушений распределения вентиляции и кровотока используются методы радионуклидной диагностики, капнография, масс-спектрометрия, определение отношения вентиляции мертвого пространства к альвеолярной вентиляции, выявление легочного шунтирования.
Газы крови
Транспорт кислорода и диоксида углерода. Газовый состав артериальной крови является конечным результатом и отражением функции аппарата внешнего дыхания в целом.
Кислород связывается кровью двумя способами:
Соединение кислорода с гемоглобином является основной формой существования O2 в крови и способом его переноса к тканям.
Гемоглобин (Hb), присоединивший кислород, становится оксигемоглобином (HbO2). Реакцию связывания кислорода гемоглобином называют не окислением, а оксигенацией, обратный процесс носит название дезоксигенации. Не связанный с кислородом гемоглобин называют дезоксигемоглобином. Термины «окисленный» и «восстановленный» гемоглобин употреблять не следует.
На основании строения, молекулярной массы гемоглобина и кислорода найдена так называемая константа Хюффнера (1,39 мл/г), определяющая количество кислорода, которое может связать 1 г гемоглобина. В условиях организма константа Хюффнера равна примерно 1,34 мл/г. Это обусловлено тем, что и у здорового человека часть гемоглобина состоит из измененных форм, которые не могут соединяться с кислородом.
Если известно содержание гемоглобина крови, можно рассчитать кислородную емкость крови - максимальное количество кислорода, которое может связать гемоглобин при его полном насыщении O2. При содержании гемоглобина 150 г/л количество кислорода в 1 л крови составит 1,34 мл ? 150 = 201 мл; в 100 мл крови - 20,1 мл или 20,1 об. %.
Процентное отношение количества O2, реально связанного с гемоглобином, к кислородной емкости крови называется насыщением (saturation) гемоглобина кислородом (SaO2 или HbO2). Другими словами, SaO2, HbO2 - это отношение оксигемоглобина к общему количеству гемоглобина.
В норме насыщение артериальной крови кислородом (Sa O2, HbO2) составляет 96-98%. Небольшое «недонасыщение» (2-4%) объясняется некоторой неравномерностью вентиляции и незначительным внутрилегочным шунтированием, которые имеют место и у здоровых людей.
Напряжение (парциальное давление) кислорода в артериальной крови (рaO2 в норме колеблется в пределах 95-100 мм рт.ст. Газовый состав крови претерпевает с возрастом некоторые изменения. Напряжение O2 в артериальной крови здоровых молодых людей в среднем составляет 95-100 мм рт.ст.; к 40 годам оно снижается примерно до 80 мм рт.ст., а к 70 годам - до 70 мм рт.ст. Эти изменения связаны с тем, что с возрастом увеличивается неравномерность функционирования различных участков легких.
Снижение SaO2 (HbO2) или paO2 в артериальной крови называется артериальной гипоксемией.
В соответствии с законом действующих масс насыщение гемоглобина кислородом (SaO2 ) зависит от его напряжения (рaO2 ) в крови. Графически эту зависимость отражает кривая диссоциации оксигемоглобина, имеющая S-образную форму (рис. 3-19). Впервые кривая диссоциации оксигемоглобина получена Дж. Баркрофтом. Она называется также сатурационной кривой O2.
Конфигурация кривой имеет большой физиологический смысл и объясняет процессы оксигенации крови в легких и дезоксигенации ее в тканях. Форма кривой не зависит от направления процесса. В области высоких значений paO2 кислород прочно связан с гемоглобином, в то время как при низких значениях paO2 гемоглобин легко отдает кислород или, напротив, обильно его поглощает. Значениям высоких напряжений кислорода соответствует горизонтальный участок кривой. Это свидетельствует о том, что насыщение артериальной крови кислородом сохраняется на высоком уровне даже при существенных сдвигах paO2. Снижение прочности связи гемоглобина с кислородом в области среднего и нижнего участка кривой обеспечивает поступление кислорода в ткани. Так, падение рaO2 в области пологой верхней части кривой на 20 мм рт.ст. (до 80 мм рт.ст.) существенно не отразится на насыщении крови кислородом (SaO2 = 94,5%). С другой стороны, при низком напряжении кислорода в тканевых капиллярах (крутой нижний участок кривой) падение paO2 даже на 5 мм рт.ст. снижает SaO2 на 7%. Освобождающийся при этом кислород активно включается в процессы тканевого метаболизма.
Конфигурация кривой диссоциации оксигемоглобина обусловлена, главным образом, химическими свойствами гемоглобина, однако существует и ряд других факторов, которые смещают кривую диссоциации, увеличивая или уменьшая ее наклон, не изменяя при этом S-образную форму.
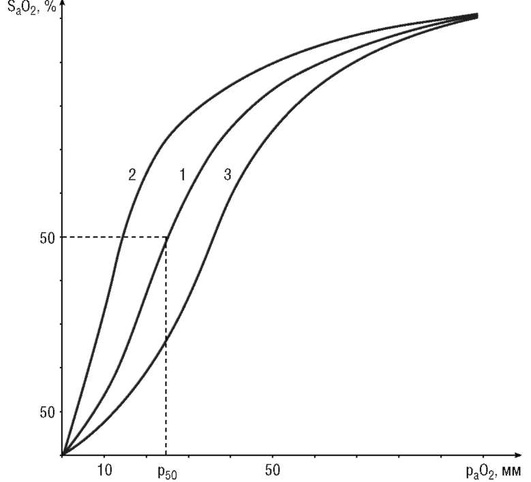
К таким факторам относятся температура, напряжение углекислого газа и активная реакция (рН) крови. Все эти важные параметры гомеостаза могут существенно меняться в условиях патологии. Снижение рН, увеличение pa C02 и повышение температуры смещают кривую диссоциации оксигемоглобина вправо, а противоположные изменения этих параметров - влево.
Большое диагностическое значение имеет величина альвеолярно-артериального градиента кислорода, то есть разности между парциальным давлением O2 в альвеолах (100-110 мм рт.ст.) и напряжением его в артериальной крови (95-100 мм рт.ст.). В норме эта величина составляет 5-10 мм рт.ст. Альвеолярно-артериальный градиент обусловлен тремя факторами: относительным несоответствием легочной вентиляции кровотоку (распределительный фактор), шунтированием (сбросом) части смешанной венозной крови в артериальное русло и затруднением диффузии кислорода через аэрогематический барьер.
Венозная кровь насыщена кислородом на 73-75%. В артериальной крови содержание кислорода составляет 20,1 об. % (0,20 л O2 на 1 л крови), в венозной 15 об. % (0,15 л O2 на 1 л крови). Насыщение венозной крови кислородом широко варьирует в зависимости от уровня метаболизма различных органов и тканей.
Диоксид углерода (CO2) - конечный продукт обменно-окислительных процессов в клетках, переносится кровью к легким и удаляется через них во внешнюю среду (99,5% CO2 покидает организм через легкие и только незначительная часть выделяется почками).
Диоксид углерода может переноситься как в физически растворенном виде, так и в составе обратимых химических соединений. Химические реакции связывания CO2 сложнее и многообразнее, чем реакции присоединения кислорода. Это обусловлено тем, что механизмы, отвечающие за транспорт CO2, должны обеспечивать поддержание постоянства кислотно-основного состояния крови.
Зависимость содержания CO2 в крови от его напряжения описывается кривой, аналогичной кривой диссоциации оксигемоглобина. Положение кривой связывания CO2 зависит от степени оксигенации крови.
Эти закономерности иллюстрирует диаграмма CO2-CO2 (по Фену и Рану), которая помогает ориентироваться во взаимоотношениях в крови кислорода и углекислого газа. Диаграмма широко используется в клинико-физиологических исследованиях. С ее помощью определяются по известным парциальным давлениям O2 и CO2 насыщение артериальной крови кислородом и содержание в ней углекислого газа, и, наоборот, по известному насыщению артериальной крови кислородом и содержанию в ней углекислого газа - парциальные давления O2 и CO2.
В нормальных условиях в артериальной крови напряжение CO2 (paCO2 ) составляет в среднем около 40 мм рт.ст. (35-45 мм рт.ст.), в смешанной венозной крови - около 46 мм рт.ст. Общее содержание CO2 в артериальной крови составляет 43-49 об. % и в венозной - 50-55 об. %.
Напряжение и содержание CO2 в крови с возрастом изменяются незначительно.
Количество выделяемого диоксида углерода определяется его концентрацией в альвеолярном воздухе и объемом альвеолярной вентиляции. Недостаточная вентиляция приводит к повышению парциального давления CO2 в альвеолярном воздухе (альвеолярной гиперкапнии) и, соответственно, к увеличению напряжения углекислого газа в артериальной крови (артериальной гиперкапнии). При гипервентиляции происходят обратные изменения - развивается альвеолярная и артериальная гипокапния.
Таким образом, напряжение углекислого газа в крови (pa CO2), с одной стороны, характеризует эффективность газообмена и деятельность аппарата внешнего дыхания, с другой - является важнейшим показателем кислотно-основного состояния, его дыхательным компонентом.
Исследование газового состава крови. Идеальным объектом изучения газового состава крови является артериальная кровь, полученная пункцией локтевой или бедренной артерии. Газовый состав венозной крови не может быть использован как показатель функции аппарата внешнего дыхания, так как содержание в ней O2 и CO2 зависит еще и от уровня обмена веществ и скорости кровотока в тканях.
Забор крови и ее доставка к аппарату должны осуществляться без доступа воздуха (в шприце, закрытом капилляре, сосуде под вазелиновым маслом). Шприц и иглу для пункции необходимо промыть гепарином натрия.
Необходимость получения крови из артерии исключает возможность повторных исследований на протяжении короткого периода времени, поэтому широкое распространение получило исследование малых порций капиллярной крови, полученных из кончика пальца или мочки уха.
Еще Холденом было показано, что если руку человека держать в течение 20 мин в водяной бане с температурой воды 38 °C, то в этих условиях газовый состав крови из подкожной вены руки станет идентичным газовому составу артериальной крови. Еще более близок к артериальной газовый состав капиллярной крови.
Используемая в настоящее время измерительная аппаратура предусматривает исследование минимальных порций крови (0,1 мл), которые можно получить из кончика разогретого пальца или мочки уха, предварительно добившись того, чтобы кровоток в ней был максимален (растирание).
Для определения газового состава крови могут быть использованы различные методы.
В настоящее время наиболее доступным и широко распространенным способом изучения оксигенации крови являются оксиметрические методы. Они основаны на различии оптических свойств (спектров поглощения) гемоглобина и оксигемоглобина.
Для определения насыщения крови кислородом (SaO2 или HbO2) используются спектрофотометры - приборы, в которых видимый свет при помощи призмы или дифракционной решетки раскладывается в спектр. Затем из спектра выделяется узкая полоса лучей с определенной длиной волны (монохроматический свет) и пропускается через исследуемый раствор (порцию крови). Поглощение света зависит от оптических свойств крови. Для определения соотношения между интенсивностью падающего и прошедшего через раствор света используется фотоэлемент.
Кюветная оксигемометрия предусматривает забор крови. Оксигемометрия с ушным датчиком, а также пульсовая оксиметрия, при которой датчик накладывается на палец, ушную раковину или другой участок тела, обеспечивает бескровное длительное наблюдение за изменениями насыщения крови кислородом (рис. 3-20).
Напряжение кислорода и углекислого газа крови можно измерить с помощью специальных электродов. Для определения напряжения кислорода применяют полярографический метод.
Напряжение (парциальное давление) углекислого газа в крови определяется аппаратами для исследования кислотно-основного состояния крови. Напряжение углекислого газа, с одной стороны, показатель газового состава, с другой - важнейший компонент кислотно-основного состояния крови.
Нарушения газового состава артериальной крови и дыхательная недостаточность: определение, критерии и классификация
Окончательную оценку эффективности функции легких дают на основе анализа газового состава крови. Недостаточность аппарата внешнего дыхания проявляется нарушениями газового состава крови, которые могут быть вызваны (табл. 3-13):
Признаки |
Причины нарушения газового состава крови |
|||
|---|---|---|---|---|
альвеолярная гиповентиляция |
снижение диффузии |
нарушения вентиляционно-перфузионных соотношений |
внутрилегочное шунтирование |
|
Нарушения газового состава крови |
Гипоксемия, гиперкапния, респираторный ацидоз |
Гипоксемия без гиперкапнии |
Гипоксемия без гиперкапнии |
Гипоксемия без гиперкапнии |
Влияние ингаляции кислорода |
Устраняет гипоксемию |
Устраняет гипоксемию |
Устраняет гипоксемию |
Не устраняет гипоксемии |
Влияние физической нагрузки |
Гипоксемия нарастает |
Гипоксемия нарастает |
Гипоксемия уменьшается |
Не влияет на газовый состав крови |
Рассмотрим причины нарушения газового состава крови подробнее.
-
Следствием альвеолярной гиповентиляции является так называемая полная (тотальная, глобальная) недостаточность аппарата внешнего дыхания, когда нарушается газообмен как кислорода, так и диоксида углерода (СО2).
В альвеолярном воздухе снижается парциальное давление кислорода и нарастает парциальное давление диоксида углерода, развиваются артериальная гипоксемия и гиперкапния. Респираторный ацидоз, возникающий при задержке СО2 в крови, компенсируется задержкой оснований.
При длительной ингаляции кислорода артериальная гипоксемия может уменьшиться или исчезнуть, так как вдыхание O2 повышает его напряжение в альвеолярном воздухе, а следовательно, и в артериальной крови. Вместе с тем устранение гипоксемического фактора стимуляции дыхания может привести к еще большей гиповентиляции и дальнейшему повышению напряжения CO2 в альвеолярном воздухе и артериальной крови.
При физической нагрузке гипоксемия, обусловленная гиповентиляцией, нарастает. В некоторых случаях увеличение МОД улучшает вентиляцию плохо вентилировавшихся альвеол, и артериальная гипоксемия может уменьшиться или даже исчезнуть.
-
Нарушения диффузии вызывают артериальную гипоксемию и повышение альвеоло-артериального градиента для кислорода. Диоксид углерода свободно проникает через аэрогематический барьер, и при гипервентиляции может наступить даже гипокапния.
Таким образом, нарушения диффузии проявляются гипоксемией без гиперкапнии.
При физической нагрузке гипоксемия нарастает, так как увеличение скорости кровотока в легочных капиллярах сокращает время контакта крови с воздухом альвеол.
Ингаляция кислорода уменьшает или ликвидирует гипоксемию, поскольку повышение парциального давления газа в альвеолах создает высокий альвеоло-артериальный градиент O2 и улучшает его диффузию даже при значительных изменениях аэрогематического барьера.
-
Нарушение вентиляционно-перфузионных соотношений - наиболее частая причина артериальной гипоксемии. Содержание диоксида углерода в крови обычно нормальное или сниженное, то есть имеет место артериальная гипоксемия без гиперкапнии.
Гипоксемия ликвидируется вдыханием кислорода вследствие повышения его напряжения в гиповентилируемых альвеолах.
Физическая нагрузка, улучшая равномерность вентиляции альвеол, уменьшает или ликвидирует артериальную гипоксемию.
-
Анатомическое шунтирование предполагает сброс венозной (неартериализированной) крови через внутрилегочные анастомозы. Так называемое сосудистое короткое замыкание, или функциональное шунтирование, представляет собой крайнюю степень нарушения вентиляционно-перфузионных отношений, когда кровоснабжаемый участок легкого полностью лишен вентиляции (крупозная пневмония, ателектаз, пневмоторакс). Степень гипоксемии зависит от величины венозного сброса. Гиперкапнии, как правило, нет.
Ингаляция кислорода не устраняет гипоксемии. Физическая нагрузка существенно не меняет газовый состав крови.
Единого определения дыхательной недостаточности нет, как нет и общепринятой классификации, которая удовлетворяла бы клиницистов, патофизиологов и других специалистов.
В настоящее время наиболее распространенным является следующее определение: дыхательная недостаточность - это неспособность системы внешнего дыхания обеспечить нормальный газовый состав артериальной крови. Используется и определение дыхательной недостаточности, основанное на показателях газового состава крови: парциальное давление (напряжение) кислорода в артериальной крови (рaCO2) менее 60 мм рт.ст. (по мнению других авторов - менее 55 мм рт.ст.), а парциальное давление СО2 (paCO2) более 45 мм рт.ст. (по утверждению других авторов - более 50 мм рт.ст.).
Дыхательная недостаточность классифицируется по патогенезу (табл. 3-14), скорости развития (табл. 3-15), степени тяжести (табл. 3-16).
Признаки |
Тип дыхательной недостаточности |
|
|---|---|---|
гипоксемическая (паренхиматозная, легочная, дыхательная недостаточность 1-го типа) |
гиперкапническая (вентиляционная, «насосная», дыхательная недостаточность 2-го типа) |
|
Ведущие патогенетические механизмы |
|
|
Клинические ситуации |
|
|
Основные нарушения газового состава крови и кислотно-основного состояния |
|
|
Отношение к кислородотерапии |
Гипоксемия трудно поддается кислородотерапии |
Гипоксемия хорошо поддается кислородотерапии, но при неконтролируемой подаче O2 может развиться гиперкапническая кома |
| Острая дыхательная недостаточность | Хроническая дыхательная недостаточность |
|---|---|
Развитие в течение минут-дней |
Развитие в течение месяцев-лет |
Ассоциирована с гипоксемией и/или респираторным ацидозом (при вентиляционной дыхательной недостаточности) или алкалозом |
Ассоциирована с гипоксемией и/или гиперкапнией |
Непосредственно жизнеугрожающее состояние |
Потенциально жизнеугрожающее состояние |
| Степень тяжести | Парциальное давление (напряжение) кислорода в артериальной крови ра02, мм рт.ст. | Насыщение артериальной крови кислородом Sa O2 (HbO2), % |
|---|---|---|
Норма |
≥80 |
≥95 |
I |
60-79 |
90-94 |
II |
40-59 |
75-89 |
III |
<40 |
<75 |
Нарушения функции внешнего дыхания при различных формах легочной патологии
Функциональный диагноз является неотъемлемой частью клинического диагноза. Знание клиницистом вопросов функциональной диагностики значительно расширяет возможности распознавания того или иного патологического процесса и правильного его лечения.
Известно, что основное назначение системы дыхания - обеспечение нормального газового состава крови - достигается действием трех механизмов: вентиляции, диффузии и легочного кровотока. Патологические изменения легких функционального и морфологического характера затрагивают в той или иной степени деятельность всех трех механизмов с преимущественным участием каждого из них при определенной нозологической форме.
Главной задачей вентиляции является обеспечение нормального газового состава альвеолярного воздуха. Для характеристики вентиляционных нарушений используются легочные объемы, отражающие определенные уровни взаимодействия эластических сил грудной клетки и легких. Наиболее информативными считаются ОЕЛ, ЖЕЛ, ООЛ и ФОЕ. Предложены убедительные трактовки их отклонений от нормы. Так, уменьшение ЖЕЛ, ООЛ и ОЕЛ характеризует ограничительные (рестриктивные) изменения аппарата вентиляции.
Нарушения бронхиальной проходимости и утрата легкими эластических свойств существенно изменяют структуру ОЕЛ: увеличивается ООЛ, уменьшается ЖЕЛ; ООЛ достигает максимальных величин при сочетании эмфиземы легких и бронхиальной обструкции.
Выделено несколько механизмов нарушения бронхиальной проходимости: бронхоспазм, коллапс мелких бронхов при утрате легкими эластических свойств, отечно-воспалительные изменения бронхиального дерева со скоплением в просвете бронхов патологического содержимого, фиброз и облитерация бронхов, коллапс трахеи и крупных бронхов. При БА доминирует бронхоспазм, при ХОБЛ - отечно-воспалительные изменения и фиброз бронхов. Коллапс мелких бронхов на выдохе наиболее характерен для эмфиземы легких. Нагноительные заболевания легких также могут сопровождаться нарушениями бронхиальной проходимости, но в этих случаях преимущественными являются рестриктивные нарушения ФВД.
Для оценки бронхиальной проходимости используют простые и достаточно информативные тесты: форсированную ЖЕЛ (ФЖЕЛ); ОФВ1; ОФВ1 и отношение ОФВ1 к ЖЕЛ (индекс Тиффно) или к ФЖЕЛ (индекс Генслера). Выраженную бронхиальную обструкцию характеризует снижение всех показателей кривой поток-объем, в том числе ОФВ1, индексов Тиффно и Генслера. При минимальных нарушениях бронхиальной проходимости могут быть сниженными показатели объемной скорости движения воздуха на уровне 25-75% ФЖЕЛ (СОС25-75) при неизмененных величинах ОФВ1 и соответствующих индексов. Показано использование фармакологических проб с бронходилататорами и провокационных тестов.
Эффективность вентиляции, оцениваемая по объему альвеолярной вентиляции, при обструктивных процессах в легких может быть значительно снижена. Альвеолярная гиповентиляция сопровождается обычно альвеолярной гипоксией и гиперкапнией, то есть уменьшением парциального давления кислорода и повышением парциального давления СО2 в альвеолярном воздухе. Еще более неблагоприятные условия для обмена кислорода в легких создаются при сочетании гиповентиляционного синдрома с нарушениями диффузии газов через альвеолярно-капиллярную мембрану. Процесс диффузии газов особенно страдает при выраженном пневмосклерозе, пневмофиброзе, диссеминированных заболеваниях легких, то есть при уменьшении поверхности газообмена и изменении морфологических и физико-химических свойств легочной мембраны. Далее мы проанализируем обобщенные результаты многолетнего опыта сотрудников 1 кафедры (терапии усовершенствования врачей) Военно-медицинской академии им. С.М. Кирова Министерства обороны Российской Федерации по изучению ФВД больных с различными формами частной легочной патологии в сопоставлении с анализом обширной отечественной и зарубежной литературы.
Пневмония
Изменения ФВД при пневмонии разнообразны по своему характеру и степени выраженности. Большинством авторов отмечена зависимость основных параметров дыхания от фазы заболевания, остроты воспалительного процесса, распространенности инфильтративных изменений в легких. При пневмонии нарушается вентиляция, страдают легочные объемы, имеют место нарушения бронхиальной проходимости, развивается артериальная гипоксемия.
В остром периоде при наличии температуры и интоксикации происходит снижение ЖЕЛ. Растяжимость легких может снижаться вдвое по сравнению с нормой. Эти изменения в значительной мере обусловлены уменьшением подвижности ребер и диафрагмы, а также астенизацией больного. Увеличение ООЛ при пневмонии указывает на поражение мелких бронхов.
Нарушения бронхиальной проходимости осложняют течение пневмонии и, по мнению ряда авторов, являются одним из возможных патогенетических механизмов перехода острого воспалительного процесса в легких в различные формы хронических заболеваний легких. По нашим данным, нарушения бронхиальной проходимости легкой степени выявляются примерно у трети больных пневмонией. Изучение реакции на бронхолитические препараты доказывает доминирующую роль в генезе бронхиальной обструкции бронхо-спастического компонента, однако определенную роль играет и отечно-конгестивный фактор. Бронхиальная обструкция приводит к неравномерному распределению воздуха в альвеолах, появлению гиповентилируемых участков. Разумеется, при пневмонии эти нарушения не достигают столь выраженной степени, как при ХОБЛ.
При пневмонии наблюдается гипервентиляция (общая и альвеолярная). При учащении дыхания возрастает МОД, коэффициент использования кислорода уменьшается. Известно, что при хронических обструктивных заболеваниях легких даже при значительном увеличении МОД наблюдается альвеолярная гиповентиляция вследствие неравномерного распределения воздуха в альвеолах. При пневмонии имеет место истинная альвеолярная гипервентиляция. Она подтверждается увеличением объема альвеолярной вентиляции, некоторым повышением парциального давления кислорода и тенденцией к снижению парциального давления СО2 в альвеолах.
При пневмонии отмечаются значительные нарушения диффузии, что объясняется увеличением межклеточной жидкости не только в участках, пораженных пневмонией, но и в окружающей легочной ткани. Наши исследования свидетельствуют о том, что выраженная инфильтрация легочной ткани сопровождается ухудшением диффузии кислорода в легких.
Для пневмонии характерна артериальная гипоксемия различной степени выраженности. Она закономерно выявляется при тяжелом течении пневмонии. Как известно, непосредственными причинами артериальной гипоксемии являются неравномерность вентиляции по отношению к кровотоку, альвеолярная гиповентиляция, нарушения диффузии кислорода, поступление неоксигенированной венозной крови в артериальную систему большого круга кровообращения через артериовенозные анастомозы или шунты.
Наличие при пневмонии альвеолярной гипервентиляции и частое развитие респираторного алкалоза исключают роль недостаточной вентиляции. Диффузионные нарушения могут быть причиной артериальной гипоксемии, хотя в большинстве случаев они не достигают такой степени выраженности, чтобы обусловить возникновение значительной гипоксемии в покое. Увеличение альвеолярно-капиллярного градиента давления кислорода подтверждает участие этого механизма развития артериальной гипоксемии. Однако основной причиной нарушения артериализации крови при пневмонии следует считать примесь венозной крови к артериальной из-за сохранения кровотока в невентилируемых в связи с пневмонией участках легких. Роль физиологического шунтирования в развитии артериальной гипоксемии подтверждена нами радионуклидными исследованиями гемодинамики малого круга кровообращения.
Кислотно-основное состояние крови у больных пневмонией существенно не нарушается. У части больных выявлены ацидотические сдвиги метаболического характера, а также артериальная гипокапния со смещением рН в сторону алкалоза.
После уменьшения интоксикации и нормализации температуры гипервентиляция и гипоксемия становятся менее выраженными или исчезают. Заметно уменьшаются и другие нарушения, однако нормализация большинства параметров происходит медленно. Нарушения дыхания у многих больных ликвидируются позднее, чем наступает выздоровление по клиническим и рентгенологическим данным.
Изучение нарушений дыхания помогает осуществить более эффективное и полноценное лечение больных с этой распространенной формой легочной патологии. В остром периоде болезни большое значение имеет определение степени оксигенации крови (раO2 и HbC2). Выраженность артериальной гипоксемии тесно коррелирует с тяжестью заболевания, имеет прогностическое значение и определяет показания к оксигенотерапии. Большое значение имеет выявление наличия и генеза бронхиальной обструкции. Лечение, направленное на восстановление нарушенной бронхиальной проходимости, сокращает сроки выздоровления и уменьшает частоту затяжного течения пневмонии. Наличие ограничительных нарушений вентиляции диктует необходимость активного применения лечебной физкультуры.
Нормализация показателей ФВД является важным критерием полноты выздоровления, сроков восстановления трудоспособности и определяет показания для реабилитации и диспансеризации больных.
Хронический бронхит
Обычное спирографическое исследование при хроническом необструктивном бронхите может не выявить нарушений вентиляции, однако при динамическом исследовании отмечается лабильность ЖЕЛ и ОФВ1, не выходящая за пределы нормы, но превышающая их повторяемость. Под влиянием проводимого лечения и при использовании фармакологических тестов часто наступает достоверное увеличение основных спирографических показателей, указывающее на имевшиеся ранее изменения. В периоде обострения заболевания диагностируются преходящие нарушения бронхиальной проходимости. Исследование объемной скорости воздушного потока выявляет ее снижение на уровне форсированного выдоха второй половины ЖЕЛ (СОС75-85). Как правило, длительное многолетнее наблюдение выявляет прогрессирующее снижение ЖЕЛ и ОФВ1.
Углубленное исследование ФВД позволяет выявить у части больных хроническим необструктивным бронхитом некоторое снижение растяжимости легких, нарушения равномерности вентиляции, незначительное снижение напряжения кислорода в артериальной крови (раС2), нарастание альвеолярно-артериального градиента pO2, признаки нарушения вентиляционно-перфузионных отношений по данным капнографического исследования.
При наличии клинической картины хронического необструктивного бронхита, если последний не сопровождается нарушениями дыхания, имеются основания говорить об изолированном поражении крупных бронхов. Признаки механической негомогенности легких более свойственны поражению бронхов среднего калибра, а отклонение от нормы показателей газообмена является достоверным доказательством поражения мелких бронхов.
Хроническая обструктивная болезнь легких
Хроническая обструктивная болезнь легких - хроническое заболевание, которое характеризуется прогрессирующим ограничением скорости воздушного потока. В основе ХОБЛ лежит хронический воспалительный ответ легких на воздействие ингаляционных патогенных агентов.
В генезе бронхиальной обструкции при ХОБЛ ведущая роль принадлежит воспалительным изменениям бронхов: гипертрофии и отеку слизистой оболочки, скоплению в бронхах патологического секрета, органическим изменениям стенки бронхов в виде их сужения, а иногда и частичной облитерации. Экспираторный коллапс трахеи и крупных бронхов, имеющий место у части больных, является дополнительным фактором бронхиальной обструкции. При наличии эмфиземы легких включается еще один механизм обструкции - спадение мелких бронхов на выдохе при утрате легкими эластических свойств. Бронхоспастический компонент, удельный вес которого может быть значительным, все же не определяет выраженности бронхиальной обструкции. Нарастание обструктивных нарушений обычно связано с активизацией воспалительного процесса.
Нарушение бронхиальной проходимости у больных ХОБЛ формируется за счет обратимого и необратимого компонентов. Обратимый компонент формируется из спазма гладкой мускулатуры, отека слизистой оболочки бронхов и гиперсекреции слизи, возникающих под влиянием повышения тонуса блуждающего нерва и выделения большого спектра воспалительных медиаторов. В процессе прогрессирования болезни обратимый компонент постепенно утрачивается. Необратимый компонент бронхиальной обструкции определяется развивающейся эмфиземой и перибронхиальным фиброзом.
Бронхиальная обструкция носит генерализованный характер, что выражается в снижении объема форсированного выдоха, уменьшении объемной скорости потока на различных уровнях ФЖЕЛ и увеличении бронхиального сопротивления. Изучение ЖЕЛ, ФЖЕЛ, ОФВ1 и отношения ОФВ1 к ЖЕЛ и ФЖЕЛ формирует функциональный диагноз ХОБЛ. О наличии бронхиальной обструкции свидетельствует снижение ОФВ1/ФЖЕЛ менее 70%. Этим показателям принадлежит ведущая роль и в объективной оценке степени тяжести заболевания.
Оцениваются постбронходилатационный ОФВ1 (в % к должному - ОФВ1 /Д) и его отношение к ФЖЕЛ (индекс Генслера). Легкая степень ХОБЛ характеризуется нормальной величиной ОФВ1 (≥80%), средняя - снижением ОФВ1 /Д от 50 до 80%, тяжелая - от 30 до 50%. При крайне тяжелой ХОБЛ ОФВ1 составляет менее 30% должной величины. При всех степенях тяжести ХОБЛ индекс Генслера менее 70% - признак обструктивных нарушений.
Для дифференциальной диагностики патогенетических механизмов обструкции могут быть использованы фармакологические тесты, проводимые по общепринятой методике. Выраженная лабильность показателей бронхиальной проходимости, ее улучшение под влиянием бронхолитических средств обычно указывают на ведущую роль бронхоспазма. Если положительная динамика отмечается под влиянием противовоспалительного лечения, это свидетельствует скорее об отечно-воспалительной природе обструкции. Нормализации ОФВ1 в тесте с бронходилататорами у больных ХОБЛ практически никогда не происходит.
Выявлению экспираторного коллапса дыхательных путей может помочь исследование бронхиального сопротивления (Raw): значительное увеличение его при выдохе характерно для этого вида патологии.
Существенные изменения претерпевают легочные объемы, особенно ООЛ и ОЕЛ. Отмечается закономерное нарастание ООЛ, величина которого может в 2-3 раза превысить норму. Увеличивается доля остаточного объема в ОЕЛ. Далеко не всегда происходит пропорциональное росту ООЛ увеличение ОЕЛ; последняя часто остается в пределах нормы. Это объясняется различиями механизмов и уровня бронхиальной обструкции. При преобладании обструкции на уровне крупных бронхов наблюдается увеличение ООЛ, но ОЕЛ не возрастает. Преобладание периферической обструкции обычно приводит к более значительному росту ООЛ (при тех же значениях бронхиального сопротивления) и содружественному увеличению ОЕЛ.
Растяжимость легких, как правило, не изменяется. Снижение ее, связанное с механической неоднородностью легких, можно обнаружить при учащении дыхания.
Неоднородность механических свойств легких - одно из наиболее характерных проявлений обструктивной патологии. Различные участки легких различаются по растяжимости и бронхиальному сопротивлению, а следовательно, процесс их заполнения и опорожнения происходит с разной скоростью. В некоторых зонах вентиляция резко уменьшена или отсутствует. Нарушается процесс распределения воздуха в легких, что приводит к неравномерности вентиляции. Неравномерность распределения воздуха в легких обнаруживается методами вымывания инертных газов. Имеет большое значение сравнение величины ООЛ, измеренного конвекционным и барометрическим методами, то есть с помощью разведения инертных газов и общей плетизмографии. Невентилируемая зона (разница между ВГО и ООЛ) может достигать 2-3 л и более.
Неравномерность вентиляции, учащение и уменьшение глубины дыхания приводят к росту величины мертвого пространства и его доли в общем объеме вентиляции. Если в норме отношение альвеолярной вентиляции к общей величине МОД составляет 65-75%, то при тяжелой обструктивной патологии оно снижается до 30-40%. Для поддержания необходимого объема альвеолярной вентиляции больные увеличивают МОД, возрастает работа дыхания, но это не приводит к увеличению альвеолярной вентиляции. При общей гипервентиляции сохраняется альвеолярная гиповентиляция (так называемая истинная альвеолярная гиповентиляция) с соответствующими изменениями газового состава альвеолярного воздуха и артериальной крови (альвеолярная и артериальная гиперкапния).
Увеличение сопротивления дыханию и повышение МОД требует больших усилий дыхательной мускулатуры. Возрастает работа дыхания; у тяжелых больных она увеличивается в несколько раз по сравнению с нормой. Постоянная перегрузка дыхательной мускулатуры приводит к снижению ее сократительной способности.
Неравномерность легочной вентиляции создает основу для возникновения вентиляционно-перфузионных нарушений, что является главной, но не единственной причиной артериальной гипоксемии. Следствием альвеолярной гиповентиляции является низкое парциальное давление кислорода в альвеолах - альвеолярная гипоксия. Нарушения диффузии не играют решающей роли в нарушениях газообмена при ХОБЛ. Снижение диффузионной способности при ХОБЛ означает присоединение эмфиземы легких. Измерение диффузионной способности легких дает информацию о функциональном вкладе эмфиземы в ХОБЛ и часто бывает полезным при обследовании пациентов с одышкой, несоразмерной с выраженностью ограничения скорости воздушного потока.
Таким образом, на определенном этапе ХОБЛ свойственно развитие гиповентиляционного синдрома, в генезе которого тесно сочетаются альвеолярная гиповентиляция, увеличение общей вентиляции и работы дыхания, снижение сократительной способности дыхательной мускулатуры и уменьшение чувствительности аппарата регуляции дыхания. Эти нарушения газообмена приводят к альвеолярной гипоксии и гиперкапнии, артериальной гипоксемии и гиперкапнии, нарушениям кислотно-основного состояния в виде респираторного ацидоза. Респираторный ацидоз может быть компенсирован увеличением буферных оснований или усугублен их недостатком.
Газовый состав крови и показатели кислотно-основного состояния могут быть использованы для определения степени тяжести обострения ХОБЛ (табл. 3-17).
Тяжесть обострения |
Критерии |
||
|---|---|---|---|
раO2, мм рт.ст. |
paCO2, мм рт.ст. |
рН |
|
Тяжелое |
<60 |
<45 |
- |
Крайне тяжелое |
<60 |
>45 |
>7,35 |
Жизнеугрожающее |
<60 |
>45 |
<7,35 |
Бронхиальная астма
Ключевыми словами определения БА являются «хроническое воспалительное заболевание дыхательных путей», «бронхиальная гиперреактивность», «повторяющиеся эпизоды хрипов, одышки, кашля», «распространенная, но вариабельная и обратимая бронхиальная обструкция».
При этом заболевании в генезе бронхиальной обструкции ведущая роль принадлежит спазму гладкой мускулатуры бронхов. Поскольку гладкомышечная ткань представлена в основном в крупных бронхах, то спазм проявляется преимущественно их сужением. Однако это не единственный механизм бронхиальной обструкции. Аллергический отек слизистой оболочки бронхов приводит к сужению бронхов и более мелкого калибра. Скопление в бронхах вязкой, трудно отделяемой стекловидной мокроты может даже привести к их обтурации. Бронхиальная гиперреактивность является важной патофизиологической особенностью БА, которая проявляется сужением бронхов у больных астмой в ответ на стимулы, не вызывающие бронхоспазма у здоровых людей. Таким образом, диагностика БА заключается в выявлении обратимой бронхиальной обструкции и признаков гиперреактивности бронхов.
Ремиссия БА может протекать без видимых нарушений ФВД. При обострении проявляются значительные нарушения бронхиальной проходимости, лучше выявляемые при форсированном дыхании. Показатели ФВД у больного БА могут за короткое время изменяться от полностью нормальных значений до значений, характерных для выраженной обструкции. Изучение бронхиального сопротивления обнаруживает увеличение его как на вдохе, так и на выдохе.
Для диагностики и наблюдения за больными БА чаще всего используют исследование ФЖЕЛ и ОФВ1 а также измерение пиковой скорости выдоха (ПСВ). ОФВ1 является более надежным показателем, чем ПСВ.
Для характеристики изменений выраженности бронхиальной обструкции используются термины «обратимость» и «вариабельность». Термином «обратимость» обозначают быстрое (через несколько минут) увеличение ОФВ1 или ПСВ после бронхолитика короткого действия или более медленное (в течение нескольких дней, недель) - после адекватной терапии БА.
Вариабельность - колебания выраженности бронхиальной обструкции в течение определенного времени, например в течение суток (суточная вариабельность), дней, месяцев.
Общепринятым критерием диагностики БА служит прирост ОФВ1 ≥12% и ≥200 мл по сравнению со значением до ингаляции. Поскольку снижение ОФВ1 может быть следствием различных заболеваний легких, следует определять отношение ОФВ1 /ФЖЕЛ. В норме ОФВ1 /ФЖЕЛ ≥0,75-0,80.
Пиковая скорость выдоха, определяемая с помощью пикфлоуметра, является важным методом диагностики и оценки эффективности лечения БА. Метод широко используется в амбулаторной практике. ПСВ измеряют утром, сразу после пробуждения, до приема препаратов; обычно при этом получают минимальную для больного величину ПСВ. Вечером ПСВ измеряют перед сном, получая, как правило, более высокий показатель. Суточную вариабельность ПСВ определяют следующим образом: находят разность между максимальным и минимальным значениями в течение дня; эту величину соотносят в процентах к средней за день ПСВ, усредненной за 1-2 нед.
Другим методом оценки вариабельности ПСВ является сравнение минимальной ПСВ (полученной при измерениях в течение 1 нед) с лучшим показателем, определенным за этот же период времени.
Изменения ПСВ в течение суток более чем на 20% (при измерении ПСВ 2 раза в сутки - более чем на 10%) или прирост ПСВ после ингаляции бронхолитика ≥20% указывают на наличие БА.
Показатели ФВД (наряду с клиническими признаками) могут быть использованы для определения тяжести течения БА. От ХОБЛ бронхиальную астму отличают преходящий характер и выраженная лабильность обструкции. При развитии астматического приступа или статуса нарушения бронхиальной проходимости нарастают с угрожающей стремительностью.
Положительные фармакологические пробы с бронхолитическими препаратами не являются вполне надежными тестами для дифференциальной диагностики ХОБЛ и БА. Во-первых, в генезе бронхиальной обструкции при ХОБЛ также участвует бронхоспазм, а во-вторых, больные БА нередко проявляют выраженную рефрактерность к большинству или отдельным фармакологическим средствам. Следует, однако, учесть, что при БА показатели, характеризующие бронхиальную проходимость, увеличиваются более чем на 15%, а при ХОБЛ - менее 15%.
Фармакологические провокационные тесты для дифференциальной диагностики также не вполне пригодны. Термин «гиперреактивность» бронхов не является синонимом диагноза БА. Эти состояния - сложные функциональные нарушения, отражающие возможность преходящей обструкции дыхательных путей. Неспецифическая бронхиальная гиперреактивность выявляется у подавляющего большинства больных БА (95%). При других заболеваниях легких, а также у курильщиков и здоровых людей может обнаруживаться легкая степень гиперреактивности бронхов.
Нарушения бронхиальной проходимости обычно сочетаются с изменениями ОЕЛ и ее структуры. В период обострения увеличивается ООЛ и его доля в ОЕЛ. Величина остаточного объема иногда достигает 300-400% должного или 70-80% ОЕЛ.
Считается, что нарушения растяжимости и диффузионной способности легких для БА не характерны, если нет выраженной эмфиземы легких.
Больные БА склонны к гипервентиляции (общей и альвеолярной), которая может наблюдаться и во время приступа удушья. Однако при нарастании тяжести приступа, развитии астматического статуса гипервентиляция сменяется фазой альвеолярной гиповентиляции с нарастанием парциального давления СО2 в альвеолярном воздухе и артериальной крови (pACC2 и paCC2), появлением альвеолярной и артериальной гиперкапнии.
Основной причиной артериальной гипоксемии при БА являются нарушения вентиляционно-перфузионных отношений в легких, поэтому гипоксемия может наблюдаться и при отсутствии гиповентиляции. Во время приступа удушья и тем более астматического статуса наблюдается значительное снижение парциального давления кислорода в альвеолах и напряжения его в артериальной крови.
Астматический статус - эпизод острой дыхательной недостаточности вследствие обострения БА. В настоящее время более распространены термины «тяжелое обострение бронхиальной астмы» или «острая тяжелая астма», которые, по существу, являются синонимами астматического статуса.
Изменения показателей вентиляции и газового состава крови являются (наряду с клиническими признаками) важнейшими критериями оценки тяжести состояния больного, что и определяет врачебную тактику (табл. 3-18).
Показатель |
Тяжесть обострения |
||
|---|---|---|---|
легкая |
средняя |
тяжелая |
|
ПОС после первого введения бронхолитика, процент от должного или наилучшего индивидуального значения |
>80 |
Около 60-80 |
<60 (<100 л/с у взрослых, или эффект длится менее 2 ч) |
paO2 (при дыхании воздухом), мм рт.ст. |
Нормальное |
>60 |
<60 (возможен цианоз) |
paCO2, мм рт.ст. |
<45 |
<45 |
45 (возможна дыхательная недостаточность) |
HbO2 (при дыхании воздухом), % |
>95 |
91-95 |
<90 |
Эмфизема легких
Под эмфиземой легких понимают необратимое патологическое увеличение воздушного пространства дистальнее терминальных бронхиол, сопровождающееся деструкцией альвеолярных стенок без сопутствующего их фиброза. Традиционное морфологическое деление эмфиземы на панацинарную и центрилобулярную находит подтверждение в различии клинико-рентгенологических и функциональных признаков заболевания. Ранее выделялись две формы эмфиземы: первичная (панацинарная, «идиопатическая», А-тип, «одышечный» вариант) и вторичная (центрилобулярная, обструктивная, бронхитическая, В-тип, «кашляющий» вариант). Соответственно этому делению описывались два клинических фенотипа больных: «розовый пыхтельщик» и «синий отечник (одутловатик)». В последних руководствах в разделе эмфиземы легких рассматривается только первичная эмфизема, а вторичная отнесена к ХОБЛ.
Изменения ФВД при эмфиземе связаны с утратой легкими эластических свойств. Увеличивается растяжимость легких (compliance, С), иногда в несколько раз по сравнению с нормой. Изменяется структура ОЕЛ - увеличивается остаточный объем легких. ООЛ представляет собой тот объем легких, при котором экспираторное усилие перекрывает просвет бронхов и препятствует их дальнейшему опорожнению. Чем беднее эластический каркас легких, тем при меньшем объеме выдоха спадаются бронхи.
При первичной эмфиземе ЖЕЛ долго остается в пределах нормы, однако за счет остаточного объема значительно увеличивается ОЕЛ, то есть происходит перерастяжение паренхимы и подлинное увеличение легкого. Увеличение ООЛ при вторичной эмфиземе сопровождается снижением ЖЕЛ, поэтому ОЕЛ не увеличивается или даже уменьшается.
Обструктивный синдром при первичной эмфиземе появляется поздно и лишь после того, как не менее трети легкого занято эмфиземой. Обструктивный синдром также связан с изменениями эластической структуры легких. Ведущую роль в его генезе играет коллапс мелких бронхов на выдохе. При выраженной эмфиземе с формированием воздушных «ловушек» на кривой поток-объем появляется характерный признак (так называемый зуб акулы), когда резкое снижение скорости экспираторного потока сразу после пика сменяется пологим участком кривой, отражающим экспираторный коллапс респираторных бронхиол. Объем форсированного выдоха за первую секунду при первичной эмфиземе снижается в большей степени, чем бронхиальное сопротивление (Raw).
При ХОБЛ и вторичной эмфиземе легких нарушения бронхиальной проходимости играют ведущую роль, возникают рано и выражены в большей степени, чем при первичной эмфиземе. Изменения ОФВ1 и бронхиального сопротивления идут параллельно.
Растяжимость легких (С) при первичной эмфиземе увеличена или нормальна, при вторичной - чаще снижена.
При той и другой форме эмфиземы имеют место выраженная механическая негомогенность легких и нарушения равномерности вентиляции.
Для первичной эмфиземы характерно снижение диффузионной способности легких вследствие уменьшения функционирующей паренхимы легких и редукции альвеолярно-капиллярной мембраны. При вторичной эмфиземе диффузионная способность легких страдает в меньшей степени.
Достаточно выражены, особенно при вторичной эмфиземе, перфузионные нарушения. При первичной эмфиземе плохо вентилируемые зоны так же плохо и кровоснабжаются, а при вторичной эмфиземе кровоток в плохо вентилируемых зонах сохранен. С этим связана большая выраженность гипоксемии при бронхитическом типе («синий отечник»).
Гиперкапния также в большей степени характерна для бронхитического (вторичного) типа эмфиземы. При первичном типе гиперкапнии нет или она появляется при физической нагрузке.
Американским торакальным обществом разработаны критерии функционального диагноза эмфиземы легких: снижение диффузионной способности легких (менее 80% должной) при одновременном снижении ОФВ1 (менее 80% должного) и/или повышении ООЛ более 120%.
Хронические нагноительные заболевания легких
В эту группу заболеваний обычно включают бронхоэктазии, хронические абсцессы и кистозную гипоплазию легких. Наличие очага инфекции неизбежно приводит к развитию хронического бронхита. Патоморфологическая картина включает и другие изменения: пневмосклероз, эмфизему легких, плевральные сращения и т.д. Сложный комплекс патоморфологических изменений создает неоднородную картину дыхательных расстройств.
При ограниченных бронхоэктазах, сопровождающихся локальным эндо-бронхитом, ФВД, как правило, не нарушена. У части больных при более углубленном исследовании определяются умеренные отклонения: возрастание бронхиального сопротивления, увеличение ООЛ, нарушения равномерности вентиляции, увеличение энергетической стоимости дыхания.
Развернутая картина заболевания сопровождается разнообразными изменениями функции дыхания. Нарушения вентиляции по рестриктивному типу против ожидания встречаются лишь у 15-20% больных, а доминируют смешанная и обструктивная формы патологии.
Ведущим механизмом дыхательных расстройств являются нарушения бронхиальной проходимости, выявляемые спирографически, пневмотахографически и при исследовании бронхиального сопротивления. Они обусловлены воспалительными изменениями бронхов: гипертрофией слизистой оболочки, скоплением патологического секрета. Не исключается влияние и других механизмов бронхиальной обструкции.
Нагноительные заболевания легких характеризуются снижением растяжимости, однако ее величина не достигает тех значений, которые свойственны фиброзам легких.
Исследование легочных объемов выявляет изменения структуры ОЕЛ. О преобладании ограничительных механизмов свидетельствует уменьшение ЖЕЛ, ООЛ, ОЕЛ. При выраженной бронхиальной обструкции закономерно увеличиваются остаточный объем и его доля в ОЕЛ.
Снижение диффузионной способности легких, имеющее место при бронхоэктазиях и абсцессах, обусловлено наличием пневмосклероза и активностью воспалительного процесса. Выраженность изменений, как правило, не достигает значительной степени.
Механическая неоднородность легочной ткани приводит к неравномерному распределению воздуха в легких и нарушению вентиляционно-перфузионных отношений. Ведущей причиной артериальной гипоксемии, наблюдаемой при нагноительных заболеваниях легких, являются вентиляционно-перфузионные расстройства, снижение диффузионной способности легких, анатомическое шунтирование. Выраженность гипоксемии на ранних стадиях заболевания обычно невелика, в дальнейшем нарушение артериализации крови в легких может достигать значительной степени.
Альвеолярная гиповентиляция с соответствующими изменениями газового состава крови в виде артериальной гиперкапнии не характерна для нагноительных заболеваний легких. Наличие артериальной гиперкапнии и выраженной гипоксемии свидетельствует о далеко зашедшем патологическом процессе, в клинической картине которого доминируют уже не бронхо-эктазы, а ХОБЛ.
Таким образом, ведущими механизмами нарушений дыхания при бронхо-эктазиях и хронических абсцессах являются уменьшение растяжимости легких, прогрессирующее ухудшение бронхиальной проходимости, механическая негомогенность легких и вентиляционно-перфузионные нарушения, сочетающиеся с диффузионными расстройствами. Преобладание ограничительных механизмов наблюдается лишь у части больных и на определенном этапе болезни. Дальнейшее развитие заболевания сближает его с клиническими проявлениями ХОБЛ.
Диссеминированные заболевания легких
Термин «диссеминированные заболевания легких» объединяет ряд заболеваний, которые характеризуются прогрессирующей одышкой инспираторного характера, рентгенологическим синдромом двусторонней легочной диссеминации, рестриктивным типом вентиляционных нарушений, снижением диффузионной способности легких. Среди диссеминированных заболеваний выделяют интерстициальные заболевания легких (фиброзирующие альвеолиты, гранулематозы, пневмокониозы, пневмомикозы, системные васкулиты с поражением легких), болезни накопления (альвеолярный протеиноз, бронхолегочный амилоидоз, альвеолярный микролитиаз) и заболевания легких опухолевой природы (бронхиолоальвеолярный рак, метастатическое поражение легких).
Для указанной патологии характерно снижение растяжимости легких, иногда в 3-4 раза по сравнению с нормой. Растяжимость легких зависит прежде всего от состояния эластических и коллагеновых структур стромы легкого. При выраженных фиброзных изменениях уменьшаются ЖЕЛ и ОЕЛ. Остаточный объем легких снижается в меньшей степени, поэтому происходит увеличение отношения ООЛ/ОЕЛ.
Признаков обструктивной патологии, как правило, нет. Они развиваются только при сопутствующей хронической обструктивной патологии легких. Величина, характеризующая бронхиальное сопротивление, даже уменьшается, так как калибр бронхов оказывается увеличенным относительно объема легких.
Показатели бронхиальной проходимости, определяемые при форсированном дыхании, не претерпевают существенных изменений. ОФВ1 и МВЛ снижаются, но в меньшей степени, чем жизненная емкость легких. Вследствие этого индекс Тиффно не изменяется или даже превышает норму. Объемная скорость потока воздуха остается нормальной. Формируется ограничительный (рестриктивный) тип вентиляционных нарушений.
Механическая неоднородность легких определяется неодинаковой растяжимостью различных участков легких.
Легочные фиброзы характеризуются значительными нарушениями диффузии. Они развиваются вследствие значительных морфологических изменений альвеолярно-капиллярной мембраны. Как известно, диффузионная способность легких зависит от поверхности газообмена, толщины, морфологической сохранности и физико-химических свойств мембраны. Углекислый газ свободно проникает даже через измененную альвеолярно-капиллярную мембрану вследствие хорошей растворимости в биологических средах. Затруднения диффузии возникают только для кислорода.
Особенностью нарушений дыхания при диффузных легочных фиброзах является альвеолярная гипервентиляция, направленная на улучшение газообмена. Она характеризуется некоторым снижением парциального давления CO2 в альвеолярном воздухе (pACO2) и незначительным повышением парциального давления кислорода (рАO2).
Газовый состав крови характеризуется артериальной нормоили гипокапнией и артериальной гипоксемией. Напряжение диоксида углерода (paCO2) нормальное или сниженное, поскольку диффузия CO2 не нарушена и газовый состав крови по CO2 существенно не отличается от газового состава альвеолярного воздуха. Артериальная гипоксемия объясняется выраженными расстройствами диффузии. Происходит увеличение альвеолярно-артериального градиента парциального давления кислорода (то есть разности между рАO2 и раO2), что иногда удается выявить раньше, чем наличие гипоксемии.
Таким образом, для симптомокомплекса нарушений дыхания при фиброзах легких характерно уменьшение растяжимости легких и легочных объемов, рестриктивный тип нарушений вентиляции, снижение диффузионной способности легких, альвеолярная гипервентиляция и артериальная гипоксемия.
Исследование сложного комплекса патофизиологических нарушений дыхания, соответствующего той или иной нозологической форме патологии легких, помогает в их дифференциальной диагностике.
Ключевые положения