Миастения и миастенические синдромы
Миастения и миастенические синдромы [Электронный ресурс] / Санадзе А.Г. - М. : ГЭОТАР-Медиа, 2019.
Миастения и миастенические синдромы / Санадзе А. Г. - Москва : ГЭОТАР-Медиа, 2019. - 256 с. (Серия "Библиотека врача-специалиста") - ISBN 978-5-9704-5170-0 |
Аннотация
Настоящее руководство освещает современные представления об эпидемиологии, патогенетических механизмах формирования двигательных расстройств, клинических формах, критериях диагностики, а также стратегии и тактике лечения миастении и миастенических синдромов. Второе издание книги дополнительно подчеркивает актуальность проблемы, определяемую несомненным увеличением частоты встречаемости и объективными сложностями диагностики миастении, а также бесспорным интересом врачей различных специальностей к представленной информации. Особенности распределения двигательных нарушений и их связь с возрастом дебюта болезни, фактором наличия или отсутствия тимомы, отсутствие зависимости тяжести течения заболевания от концентрации аутоантител к ацетилхолиновым рецепторам и другим синаптическим и внесинаптическим антигенным мишеням показывают неоднородность группы пациентов, объединенных диагнозом "миастения". В связи с этим представленные методы количественной оценки выраженности двигательных расстройств (QMGs), а также современная клиническая классификация (MGFA) в сочетании с иммунологическими исследованиями концентрации аутоантител к ацетилхолиновым рецепторам, титин-белку, потенциалзависимым кальциевым каналам наряду с традиционными фармакологическими пробами и электромиографическим тестированием нервно-мышечной передачи являются критериями диагностики миастении.
Издание предназначено врачам различных медицинских специальностей.
С18
Глава 9
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ СОСТОЯНИЯ ДВИГАТЕЛЬНЫХ ЕДИНИЦ И МЫШЕЧНЫХ ВОЛОКОН У БОЛЬНЫХ С МИАСТЕНИЕЙ
ИССЛЕДОВАНИЕ МЫШЦ С ПОМОЩЬЮ КОНЦЕНТРИЧЕСКИХ ИГОЛЬЧАТЫХ ЭЛЕКТРОДОВ
В основе изучения состояния скелетных мышц с помощью концентрических игольчатых электродов лежит определение параметров потенциалов двигательных единиц (ПДЕ), отражающих размеры двигательных единиц, которые являются функциональным элементом каждой скелетной мышцы. Основными параметрами ПДЕ являются их длительность и амплитуда.
Длительность ΠДЕ определяет уровень поражения периферического нейромоторного аппарата. Увеличение средней длительности 20 зарегистрированных потенциалов ДЕ свидетельствует о неврогенном характере патологии, ее уменьшение указывает на мышечный уровень поражения. Длительность ПДЕ измеряется в миллисекундах. Для каждой мышцы имеются свои величины нормы, которые зависят от возраста человека. Допускаются отклонения от нормы не более ±12% [4].
Амплитуда ΠДЕ при неврогенных заболеваниях, как правило, увеличивается в соответствии с увеличением длительности. При первично-мышечных и синаптических заболеваниях она может быть как сниженной, так и нормальной, и в редких случаях - увеличенной. В норме в скелетных мышцах средняя амплитуда у взрослых составляет 500-700 мкВ, максимальная величина амплитуды ПДЕ в большинстве мышц не превышает 1500 мкВ.
Форма ΠДЕ диагностического значения не имеет и оценивается только с точки зрения количества фаз в потенциале. В норме ПДЕ, как правило, имеет 3 фазы. Если ПДЕ имеет 5 и более фаз, он расценивается как полифазный, что указывает на изменение структуры двигательной единицы в мышце. В норме число полифазных потенциалов ДЕ составляет 5-10% [9].
При миастении игольчатая ЭМГ позволяет получить дополнительную информацию о возможности вовлечения в патологический процесс мышечного субстрата, связанного как с особенностями самой миастении, так и с сочетанием ее с другими аутоиммунными или паранеопластическими состояниями [2, 3, 6, 7, 11]. Изучение изменения параметров ПДЕ до и после введения адекватной дозы антихолинэстеразных препаратов позволяет получить информацию о степени «заблокированности» мышечных волокон в двигательных единицах, определяемой по степени уменьшения величин средней длительности ПДЕ в обследованных мышцах. Игольчатую электромиографию больным миастенией необходимо также проводить, если выявляются какие-то особенности клиники, отмечается недостаточная компенсация на фоне приема антихолинэстеразных препаратов, для исключения миопатии, связанной с длительным лечением глюкокортикоидными препаратами, и в ряде других случаев [1, 3, 5, 7].
ИЗМЕНЕНИЕ ПОТЕНЦИАЛОВ ДВИГАТЕЛЬНЫХ ЕДИНИЦ ПРИ МИАСТЕНИИ
В литературе имеются лишь отдельные и весьма противоречивые сообщения, основанные на результатах игольчатой ЭМГ у больных с миастенией. Большинство авторов считают типичным для миастении уменьшение длительности ПДЕ и отсутствие спонтанной активности мышечных волокон [19, 24]. Другие, наряду со снижением длительности ПДЕ, находят в мышцах больных миастенией спонтанную активность мышечных волокон - ПФ и ПОВ [3, 5, 6, 7, 26]. Причем, по мнению многих авторов, степень уменьшения средней длительности ПДЕ у большинства больных с миастенией коррелирует со степенью снижения силы в исследуемой мышце[3, 5, 6, 11]. Однако имеющиеся в литературе данные об изменении параметров ПДЕ при миастении базируются на анализе относительно небольшого числа исследований нередко неоднородных групп больных.
Считается также, что отличительной чертой ПДЕ, регистрируемых при миастении, является отсутствие или малая выраженность полифазных ПДЕ и наличие простых по форме, трехфазных потенциалов. Данные других авторов, наоборот, свидетельствуют об увеличении количества полифазных ПДЕ (от 30 до 70%) примерно у 1 /3 больных с миастенией [20].
Учитывая такую разноречивость данных, представляемых различными авторами, нами была проведена серия исследований по подробному анализу параметров ПДЕ при миастении и их изменению в зависимости от функционального состояния мышцы. Наши данные базируются на обследовании 340 мышц больных с миастенией в возрасте от 10 до 76 лет. Давность болезни к моменту первичного обследования больных колебалась от 6 мес до 11 лет.
Длительность ПДЕ. При исследовании ПДЕ этих больных показано, что в 22% мышц средняя длительность ПДЕ находилась в границах нормальных отклонений. В этих же мышцах была сохранной и сила. В 53% мышц отмечалось уменьшение средней длительности ПДЕ разной степени выраженности. При этом степень уменьшения средней длительности ПДЕ не всегда коррелировала со степенью снижения силы в исследуемой мышце. У некоторых больных при значительном снижении силы мышцы длительность ПДЕ была уменьшена не более чем на 30%. В 26% мышц наблюдалось увеличение средней длительности ПДЕ на 10-14%. При миастении увеличение длительности ПДЕ, как правило, указывает на присоединение какого-то невритического компонента, в большинстве случаев не относящегося к патологии синапса. Было выявлено, что минимальная длительность ПДЕ, зарегистрированная в мышцах больных с миастенией, составила 3,5 мс, максимальная - 15,4 мс.
Средняя длительность всех ПДЕ, зарегистрированных в мышцах больных с миастенией, была равна 10,0±2,7 мс, что в процентном отношении составило 89,5±11,2% по отношению к норме, т.е. средняя длительность всех ПДЕ у больных с миастенией была всего на 10% меньше нормы. Однако при анализе ПДЕ в каждой конкретной мышце оказалось, что разброс величин их средней длительности был довольно значительным и по отношению к возрастной норме составил 66-114%, т.е. в одних мышцах средняя длительность могла быть значительно уменьшена (на 34%), в других - увеличена (на 14%). Таких мышц с увеличенной средней длительностью ПДЕ было всего 5%, а потенциалов увеличенной длительности было 7% из всех изученных нами ПДЕ.
Особенность больных с миастенией заключаласьв том, что у них в 80% мышц выявлялось различное число ПДЕ значительно уменьшенной длительности, в норме не выявляемой. Somnier F.E. et al. (1999) тоже находили такие ПДЕ в мышцах больных с миастенией и предложили называть их «миопатическими» потенциалами [25]. Мы выявили у больных с миастенией 31% таких «миопатических» ПДЕ [12].
Со снижением силы мышцы средние величины нормализованной длительности постепенно уменьшались: от 103,5±28,8% при силе мышцы 5 баллов до 73,3±12,6% при силе мышцы 1-2 балла. Такая же тенденция наблюдалась и в разбросе всех без исключения величин длительности: наибольшая, индивидуальная средняя, минимальная и максимальная величины с падением силы снизились почти вдвое от начальной величины.
При анализе ПДЕ, зарегистрированных у больных с миастенией в сочетании с тимомой, существенных различий величин средней длительности выявлено не было. Средняя длительность всех ПДЕ, зарегистрированных в мышцах этих больных, в процентном отношении составила 87,9±10,6% по отношению к норме, т.е. была на 12% меньше нормы. Несмотря на очень близкие средние величины длительности ПДЕ в этих двух группах больных, при миастении, сочетающейся с тимомой, все величины длительности ПДЕ были несколько меньше, но различия не были статистически достоверными.
Амплитуда ΠДЕ. Наши данные показали, что при миастении амплитуда ПДЕ может быть как нормальной, так и сниженной, а в некоторых случаях даже повышенной. В мышцах больных с миастенией она колебалась от 100 до 2800 мкВ, но средняя амплитуда всех ПДЕ составила 508,7±198,7 мкВ, т.е. находилась в границах нормы. Среднее число ПДЕ в мышце, амплитуда которых была более 1500 мкВ, составило всего 8%, но в одних мышцах таких ПДЕ не было вообще, в других мышцах оно достигало 35%. Из всех изученных нами потенциалов 12% имели резко сниженную амплитуду (100-276 мкВ).
В обследованной группе больных с миастенией в сочетании с тимомой амплитуда отдельных ПДЕ колебалась от 149 до 1965 мкВ, но средняя амплитуда ПДЕ была статистически достоверно ниже, чем у больных с миастенией без тимомы, и составляла 411,8±192,1 мкВ. Кроме того, у больных с тимомой в 20% мышц средняя амплитуда была снижена, тогда как у больных с миастенией без тимомы не было выявлено мышц со снижением средней амплитуды.
Наибольшая амплитуда ПДЕ у больных с миастенией была выявлена при силе мышцы 5 баллов. Средние величины амплитуды ПДЕ снижались при ухудшении функционального состояния мышцы, составляя от 541 мкВ при силе мышцы 5 баллов до 336 мкВ при силе мышцы 3 балла, причем различие было статистически достоверным (p <0,05). При дальнейшем снижении силы мышцы средняя величина несколько выросла (455 мкВ).
Полифазия ПДЕ. Средняя величина полифазии составила 24,2±19,3%, но в 24% мышц не было зарегистрировано ни одного полифазного ПДЕ. По нашим данным, в мышцах больных с миастенией число полифазных ПДЕ в мышце колебалось от 0 до 30%, у больных с тимомой - от 0 до 45%, при этом среднее число полифазных ПДЕ было вдвое больше у больных с тимомой (11,0±7,9 и 22,0±9,8 соответственно). В некоторых мышцах число полифазных потенциалов достигало 50-70%, причем оно зависело от функционального состояния мышцы. Так, при силе мышцы 5 баллов оно составило 28,2±21,1%, при силе 4 балла - 25,8±19,5%, при силе 3 балла оно снизилось еще на 10% (15,8±17,7%), при дальнейшем снижении силы средняя величина практически не изменилась (16,7±14,4%).
Однако следует принять во внимание, что наличие в мышце больного миастенией большого количества полифазных потенциалов и ПДЕ увеличенной амплитуды и длительности может указывать на перестройку структуры ДЕ. Причем факторы, приводящие к реорганизации ДЕ, в каждом конкретном случае требуют более подробного анализа [18].
Результаты проведенного нами исследования структуры двигательных единиц позволяют утверждать, что имеются существенные различия в характере их изменения при миастении с отсутствием и наличием тимомы. Для миастении без тимомы характерны дифференцированные изменения ПДЕ: нередко у одного и того же больного наблюдается значительное уменьшение длительности ПДЕ в наиболее пораженных мышцах и нормальные параметры ПДЕ - в непораженной. При сочетании миастении с тимомой процесс, как правило, генерализованный, и параметры ПДЕ изменены одинаково во всех мышцах.
Следует также отметить, что при сочетании миастении с гипотиреозом, полимиозитом и другими заболеваниями характер изменения ПДЕ меняется и соответствует изменениям, наблюдаемым при этих сопутствующих заболеваниях. Так, при сочетании миастении с полимиозитом на фоне лечения глюкокортикоидными препаратами может значительно увеличиться полифазия ПДЕ (до 80%), за счет которой обычно нарастает и длительность ПДЕ, однако длительность может увеличиться не более чем на 15-20% от нормальной средней величины.
Таким образом, можно заключить, что у больных с миастенией преобладающее число ПДЕ имело нормальную амплитуду, но почти в каждой мышце регистрировалось некоторое количество ПДЕ резко сниженной амплитуды. При миастении, сочетающейся с тимомой, таких ПДЕ было значительно больше [5]. У большинства больных со снижением силы мышцы происходит постепенное снижение длительности, амплитуды, полифазии ПДЕ, а также числа потенциалов, длительность и амплитуда которых превышают нормальные величины.
Не было выявлено четкой зависимости между амплитудой ПДЕ и их длительностью. В одной и той же мышце могли регистрироваться ПДЕ нормальной длительности, но несколько сниженной амплитуды и, наоборот, ПДЕ резко сниженной длительности могли иметь нормальную амплитуду.
ВЛИЯНИЕ АНТИХОЛИНЭСТЕРАЗНЫХ ПРЕПАРАТОВ НА ИЗМЕНЕНИЕ ПАРАМЕТРОВ ПДЕ
В связи с положительным воздействием антихолинэстеразных препаратов на состояние больных с миастенией в литературе неоднократно обсуждался вопрос об их влиянии на параметры ПДЕ. Всеми авторами, как правило, отмечалось увеличение средней длительности и амплитуды ПДЕ после однократного введения соответствующей дозы прозерина (неостигмина) [2, 8, 14, 21].
Однако при проведении специального исследования у 100 больных миастенией, никогда не принимавших глюкокортикоидных препаратов, нам удалось выявить более сложные закономерности изменения ПДЕ [1]. Прежде всего, было отмечено, что введение прозерина не у всех больных с миастенией увеличивало силу мышцы. В таких случаях параметры ПДЕ до и после введения прозерина существенно не менялись, число ПДЕ в мышце со значительно уменьшенной длительностью оставалось неизменным, что может служить указанием на наличие у этих больных так называемой «миастенической миопатии» [12, 25]. Не наблюдалось существенного изменения средних величин параметров ПДЕ и в клинически непораженных мышцах, где средняя длительность до введения прозерина была нормальной.
В тех случаях, когда сила исследуемой мышцы увеличивалась на 1-2 балла, было выявлено три типа изменения ПДЕ на введение прозерина [1].
1- й тип - увеличение средней длительности ПДЕ (39% исследованных мышц).
2- й тип - отсутствие изменений средней длительности при нарастании амплитуды ПДЕ (37% исследованных мышц).
3- й тип - еще большее снижение средней длительности ПДЕ, сопровождавшееся увеличением амплитуды некоторых потенциалов.
Сопоставление силы мышц и гистограмм распределения ПДЕ по длительности до и после введения прозерина позволило установить, что увеличение длительности и амплитуды ПДЕ (первый и второй типы), сочетающееся с нарастанием мышечной силы, связано с разблокированием определенного количества исходно заблокированных мышечных волокон в двигательных единицах. Причем отсутствие полифазии в потенциалах позволяет предположить, что заблокированными являются самые дистальные мышечные волокна.
Уменьшение средней длительности ПДЕ (третий тип) связано с появлением после введения прозерина определенного количества потенциалов резко сниженной длительности, которых до введения прозерина в мышце не наблюдалось, их пропорция в общем количестве зарегистрированных ПДЕ возросла, что привело к уменьшению величины средней длительности ПДЕ. Последнее может подтвердить высказанное мнение некоторых авторов о том, что при миастении могут быть заблокированы не только мышечные волокна, но и отдельные двигательные единицы, которые могут частично разблокироваться после введения прозерина и генерировать потенциалы уменьшенной длительности, которые включаются в двигательный акт и увеличивают силу мышцы [27].
СПОНТАННАЯ АКТИВНОСТЬ МЫШЕЧНЫХ ВОЛОКОН И ДВИГАТЕЛЬНЫХ ЕДИНИЦ В МЫШЦАХ БОЛЬНЫХ С МИАСТЕНИЕЙ
В норме в расслабленной мышце никакой спонтанной активности не регистрируется. При неврогенных заболеваниях может регистрироваться два вида спонтанной активности мышечных волокон - потенциалы фибрилляций (ПФ) и положительные острые волны (ПОВ). ПФ при неврогенных (и синаптических) заболеваниях - это потенциалы денервированных мышечных волокон, утративших связь с терминалями аксона, но они могут быть реиннервированы и войти в состав другой двигательной единицы. ПОВ - это ЭМГ-признак погибших мышечных волокон, которые по каким-то причинам не смогли получить иннервацию. Чем больше зарегистрировано ПФ в мышце, тем больше степень ее денервации. Чем больше выявлено в мышце ПОВ, тем больше в ней погибших мышечных волокон.
В отношении выявления спонтанной активности мышечных волокон у больных миастенией в литературе также нет единого мнения. Одни авторы упоминали о наличии ПФ и ПОВ у больных с миастенией, другие их не находили [19, 24]. В нашем исследовании ПФ и ПОВ были выявлены в 33% обследованных мышц больных с миастенией, но их число в мышце не было велико и составляло от 1 до 5 ПФ (среднее число 1,3±1,1). В 67% мышц больных данной группы спонтанной активности выявлено не было. Было также отмечено, что ПФ выявляются гораздо чаще у больных с миастенией в сочетании с тимомой.
ПОВ были выявлены лишь в 21% мышц, причем они регистрировались в тех же мышцах, в которых были выявлены и ПФ. Выраженность их в мышце не превышала 2 ПОВ, средняя величина составила всего 0,4±0,7 ПОВ. Единичные потенциалы фасцикуляций (ПФЦ) были выявлены в 13% мышц.
Полученные результаты показали, что у больных с миастенией в ряде случаев имеет место денервация отдельных мышечных волокон, проявляющаяся в виде ПФ, тогда как ПОВ, свидетельствующие о гибели мышечного волокна, выявлялись в редких случаях и были единичными.
Приведенные данные позволяют считать, что появление у больных миастенией спонтанной активности мышечных волокон объясняется наличием далеко зашедших денервационных изменений, обусловленных характерным для миастении расстройством нервно-мышечной передачи [10]. Это согласуется с фактом отсутствия спонтанной активности у подавляющего большинства больных с обратимыми нарушениями нервно-мышечной передачи, а также с нарастанием степени ее выраженности в мышцах, в которых после введения прозерина не удавалось достичь полного восстановления длительности ПДЕ. При этом лишь в 11% таких мышц были выявлены ПФ и всего в 3% - ПОВ. В тех случаях, когда введение прозерина приводило лишь к частичной компенсации синаптического дефекта, ПФ и ПОВ регистрировались в большем числе мышц.
исследование нервно-мышечной передачи методом джиттера у больных с миастенией
В шестидесятых годах прошлого столетия была разработана методика, позволяющая регистрировать потенциалы отдельных мышечных волокон в пределах одной двигательной единицы [13]. В дальнейшем все основные исследования с помощью этой методики были выполнены Stalberg E. et al. и обобщены в его монографии в соавторстве с Trontelj J. [29]. Специальный игольчатый электрод c очень малой отводящей поверхностью диаметром 25 мкм вводится в двигательную точку мышцы таким образом, чтобы в зоне его отведения оказались два волокна одной и той же двигательной единицы. При стимуляции нерва или произвольном напряжении мышцы регистрируется комплекс из двух (или более) потенциалов этих мышечных волокон.
В зависимости от скорости достижения критической величины потенциала концевой пластинки (ПКП), способной вызвать потенциал действия (ПД) мышечного волокна, второй потенциал может возникать с задержкой во времени.
При наличии триггерного устройства в электромиографе первый потенциал комплекса, запускающий развертку луча на мониторе, будет находиться в строго фиксированном месте. Второй же будет появляться с различными интервалами времени по отношению к первому, т.е. можно наблюдать так называемый джиттер («пляску») - вариацию межимпульсного интервала в серии наложенных друг на друга методом суперпозиции вторых ответов (рис. 8).
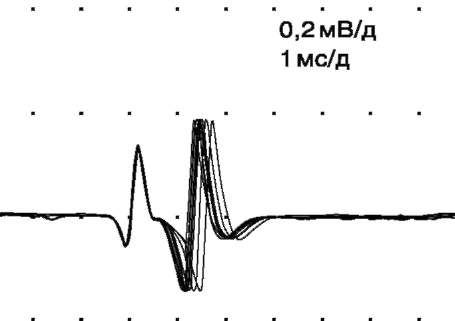
В норме джиттер составляет 5-50 мкс в зависимости от возраста пациента и исследуемой мышцы [23]. Увеличение средних значений джиттера отражает нарушение нервно-мышечной передачи: чем больше величина джиттера, тем более выражено ее нарушение.
На основании обследования методом джиттера 900 больных с миастенией было показано, что джиттер существенно увеличен не только в клинически пораженных, но и в клинически здоровых мышцах, и даже в тех, в которых не было выявлено декремента амплитуды М-ответа при стимуляции частотой 3 имп/с. [15]. У больных с окулярной формой миастении увеличение средней величины джиттера было обнаружено в 100% случаев при исследовании лицевых мышц и в 85% случаев в общем разгибателе пальцев кисти [22, 23].
Показано, что чем хуже функциональное состояние мышцы, тем больше средняя величина джиттера [23]. Как правило, джиттер у больных с миастенией увеличен даже на фоне приема антихолинэстеразных препаратов. В очень редких случаях у больных с глазной формой миастении и больных с легкой слабостью в конечностях на фоне приема антихолинэстеразных препаратов джиттер был нормальным. Однако после отмены препаратов на 24 ч он увеличился у всех этих больных. Поэтому, несмотря на то что джиттер, как правило, увеличен у всех больных с миастенией, авторы предлагают у больных с легкой формой миастенических расстройств перед проведением обследования отменить прием АХЭ-препаратов не менее чем на 24 ч. Если в общем разгибателе пальцев, наиболее часто тестируемом при подозрении на миастению, джиттер окажется нормальным, прежде чем окончательно исключить диагноз миастении, необходимо провести определение джиттера в мышце лица m. frontalis. И наоборот, если в мышце с выраженной слабостью джиттер нормальный, диагноз миастении может быть исключен.
При наиболее выраженном нарушении нервно-мышечной передачи, кроме значительного увеличения джиттера (иногда до 1000 мкс) наблюдается периодическое выпадение второго ответа в паре, т.е. блокирование импульса, связанное с тем, что в силу выраженности синаптических расстройств амплитуда ПКП недостаточна для того, чтобы генерировать ПД мышечного волокна (рис. 9).
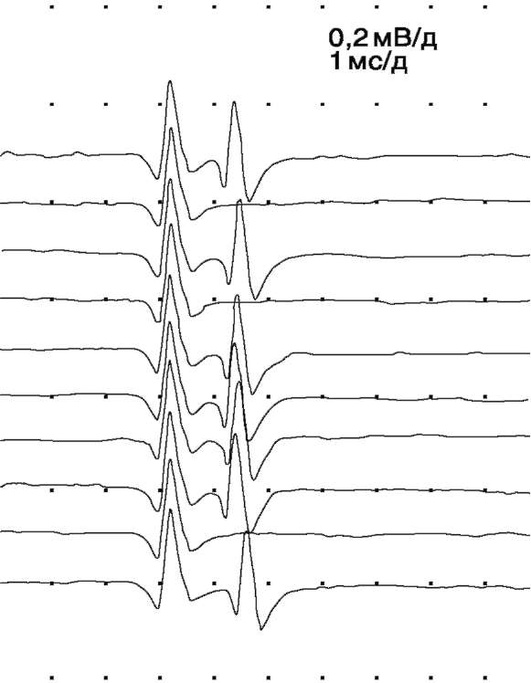
Блокирование импульса у больных с миастенией возникает, как правило, при увеличении джиттера, вдвое превышающем верхние границы нормальных величин (100 и более мкс) [22]. Характерной особенностью больных с миастенией является то, что в одной и той же мышце могут быть пары мышечных волокон, как с большим, так и с незначительно увеличенным джиттером. Причем это может наблюдаться даже в одной и той же двигательной единице [22].
Sanders D. и Howard J. (1981) при обследовании большого числа больных с миастенией выявили блокирование импульса в парах мышечных волокон. При исследовании общего разгибателя пальцев у больных, находящихся в ремиссии после проведенного лечения в 4% случаев, у больных с глазной формой миастении в 5% случаев и у больных с генерализованной формой миастении в 28% случаев. При сравнении диагностической значимости декремент-теста и джиттера эти же авторы показали, что декремент-тест выявил нарушение нервно-мышечной передачи у 76% обследованных ими больных с миастенией, а при проведении джиттера оно было выявлено у 99% больных [23]. Антитела к ацетилхолиновому рецептору были выявлены у 70-90% больных с миастенией. Если антитела не выявлены у больных с клинической картиной миастении, им рекомендуют сделать джиттер.
Описаны случаи увеличения джиттера у больных с миастенией, у которых до нагрузки джиттер находился на верхней границе нормы (менее 40 мкс). После нагрузки он значительно увеличился уже через несколько минут. У здоровых людей даже при очень длительной нагрузке джиттер не увеличивается [17].
Сопоставление числа блокированных пар при изучении потенциалов отдельных мышечных волокон с максимальной величиной декремента амплитуды (площади) М-ответа при непрямой супрамаксимальной стимуляции мышцы частотой 3 имп/с у 46 больных с миастенией показало наличие прямой корреляции. Полученные данные указывают на то, что декремент при стимуляции мышцы отражает число блокированных импульсов при изучении потенциалов отдельных мышечных волокон [15].
Введение АХЭ-препаратов приводит к заметному снижению величины джиттера, что может служить подтверждением положительного эффекта при клинически сомнительной пробе. На фоне лечения также отмечается уменьшение величины джиттера и количества блокированных пар. При наступлении ремиссии блокирование импульсов наблюдается крайне редко, но средняя величина джиттера все равно не достигает нормальных величин [16].
Однако джиттер-феномен может изучаться не только при произвольной активации мышцы, но и в ответ на стимуляцию нерва. Тогда измеряется не межимпульсный интервал, а время от нанесения стимула до появления импульса, временная вариативность этих ответов также является отражением джиттера [28, 29, 30]. Нормальные величины джиттера, полученные при аксональной стимуляции общего разгибателя пальцев кисти, составили в среднем 30 мкс с индивидуальными колебаниями от 40 до 25 мкс.
ЛИТЕРАТУРА
-
Гехт Б.М. Теоретическая и клиническая электромиография. - Л.: Наука, 1990. - 230 с.
-
Гехт Б.М., Густайнис В.В., Касаткина Л.Ф., Никитин С.С., Ноздрагева Л.В. Электромиографический и морфологический анализ изменения двигательных единиц при миастении с тимомой и полимиозитом, терминальной полиневропатии с миастени-ческим синдромом // Журн. невропатол. и психиатр. - 1981. - T. 81. - № 11. - С. 1624-1632.
-
Гехт Б.М., Касаткина Л.Ф., Самойлов М.И., Санадзе А.Г. Электромиография в диагностике нервно-мышечных заболеваний. - Таганрог, 1997. - 370 с.
-
Касаткина Л.Ф. Особенности течения денервационно-реиннервационного процесса при различных уровнях поражения периферического нейромоторного аппарата // Дис. докт. мед. наук. - М.: 1996. - 374 с.
-
Касаткина Л.Ф., Гехт Б. М., Галкина О.И. Изменение потенциалов двигательных единиц скелетных мышц при миастении и ее сочетании с тимомой // Актуальные вопросы клинической транспортной медицины. - 2005. - Т. 13. - С. 460-475.
-
Касаткина Л.Ф., Гильванова О.В., Галкина О.И. Игольчатая электромиография в дифференциальной диагностике некоторых острых состояний патологии периферического нейромоторного аппарата // Функциональная диагностика. - № 2. - 2004. - С. 71-76.
-
Кузин М.И., Гехт Б.М. Миастения. - М.: Медицина, 1996. - 224 С.
-
Лобзин В.С., Оболенский С.В., Ролле М.Н. Экстракорпоральная гемосорбция в интенсивной терапии миастении // Журн. невропатол. и психиатр. - 1986. - Т. 86. - № 8. - С. 1152-1155.
-
Мак-Комас А. Дж. Скелетные мышцы. - Киев: Олимпийская литература, 2001. - 407 c.
-
Поздняков О.М., Бабакова Л.Л. Пластичность нервно-мышечного синапса в патологии // Арх. патол. - 1998. - Т. 98. - № 3. - C. 50-53.
-
Санадзе А.Г., Касаткина Л.Ф. Клиническая элетромиография для практических неврологов. - М.: ГЭОТАР-Медиа. - 2007 - 63 с.
-
Санадзе А.Г., Касаткина Л.Ф., Сиднев Д.В., Галкина О.И., Давыдова Т.В., Бабакова Л.Л., Поздняков О.М. К вопросу о «миастенической миопатии» // Журнал Патогенез. - 2005. - Т. 4. - № 1. - С. 9-17.
-
Ekstedt J. Human single muscle fiber action potentials // Acta Neurol. Scand. - 1964. - Vol. 61. - P. 1-96.
-
Evoli A., Batocchi A.P., Minisci C., Di Schino C., Tonali P. Clinical characteristic and prognosis of myasthenia gravis in older people // J. Am. Geriatr. Soc. - 2000. - Vol. 48. - P. 1442-1448.
-
Gilchrist J., Massey J., Sanders D. Single fiber EMG and repetitive nerve stimulation on the same vuscle in myasthenia gravis // Muscle Nerve. - 1994. - Vol. 17. - P. 171-175.
-
Howard J., Sanders D. Serial single-fiber EMG studies in myasthenik patients treated with corticosteroids and plasma exchange therapy // Muscle Nerve. - 1981. - Vol. 4. - P. 254.
-
Ingram D., Davis G., Schwartz M., Swash M. The effect of continious voluntary activation on neuromuscular transmission; a SFEMG study on myasthenia gravis and anterior horn cell disorders // Electroencephalogr. Clin. Neurophysiol. - 1985. - Vol. 60. - P. 207-213.
-
Kondo K., Monden Y. Thymoma and myasthenia gravis: a clinical study of 1089 patients from Japan // Ann. Thorac. Surg. - 2005. - Vol. 79. - N 1. - P. 219-224.
-
Ludin H. Electromyography in practice. - Stuttgart, 1980. - 174 p.
-
Negri S., Caraceni T. Myasthenia gravis: parameters the motor unit potentials and modifications induced by endrophonium chloride // Clinical studies in mycology / B.A. Kakulas (Ed.). - Amsterdam: Excerpta medica, 1973. - P. 381.
-
Oosterhuis H.J.G.H., Hootsmans W.J.M., Veenhuyzen H.B., Zadelhoff J. The mean duration of motor unit action potentials in patients with myasthenia gravis // Electroenceph. Clin. Neurophysiol. - 1972. - Vol. 32. - P. 697-700.
-
Sanders D., Haward J. Single fiber electromyography in the diagnosis of myasthenia gravis // Muscle Nerve. -1981. - Vol. 4. - P . 253-255.
-
Sanders D., Stalberg E. Single fiber electromyography // Muscle Nerve. - 1996. - Vol. 19. - P. 1069-1083.
-
Somnier F.E. Myasthenia gravis // J. Dan. Med. Bull. - 1996. - Vol. 43. - N 1. - P. 1-10.
-
Somnier F.E., Skeie G.O., Aarli J.A., Trojaborg W. EMG evidence of myopathy and the occurrence of titin autoantibodies in patient with myasthenia gravis // Europ. J. Neurol. - 1999. - N 6. - P. 555-563.
-
Stalberg E. Clinical electrophysiology in myasthenia gravis // J. Neurol. Neurosurg. Psy- chiat. - 1980. - Vol. 43. - P. 622-633.
-
Stalberg E., Antoni L. Computer-aided EMG analysis // Progress in clinical neurophysiol- ogy. - Basel, 1983. - P. 186.
-
Stalberg E., Sanders D. Electrophysiological tests of the neuromuscular transmission // Neurology: Clinical Neurophysiology / Stalberg E., Young R. (Eds.). Butterworths. - London, 1981. - 88 p.
-
Stalberg E., Trontelj J. Single fiber electromyography.Studies in Healthy and Diseased Muscles. - NY.: Raven Press, 1994.
-
Trontelj J., Stalberg E. Single motor end-plates in myasthenia gravis and LEMS at different firing rates // Muscle Nerve. - 1991. - Vol. 14. - P. 226-232.