Миастения и миастенические синдромы
Миастения и миастенические синдромы [Электронный ресурс] / Санадзе А.Г. - М. : ГЭОТАР-Медиа, 2019.
Миастения и миастенические синдромы / Санадзе А. Г. - Москва : ГЭОТАР-Медиа, 2019. - 256 с. (Серия "Библиотека врача-специалиста") - ISBN 978-5-9704-5170-0 |
Аннотация
Настоящее руководство освещает современные представления об эпидемиологии, патогенетических механизмах формирования двигательных расстройств, клинических формах, критериях диагностики, а также стратегии и тактике лечения миастении и миастенических синдромов. Второе издание книги дополнительно подчеркивает актуальность проблемы, определяемую несомненным увеличением частоты встречаемости и объективными сложностями диагностики миастении, а также бесспорным интересом врачей различных специальностей к представленной информации. Особенности распределения двигательных нарушений и их связь с возрастом дебюта болезни, фактором наличия или отсутствия тимомы, отсутствие зависимости тяжести течения заболевания от концентрации аутоантител к ацетилхолиновым рецепторам и другим синаптическим и внесинаптическим антигенным мишеням показывают неоднородность группы пациентов, объединенных диагнозом "миастения". В связи с этим представленные методы количественной оценки выраженности двигательных расстройств (QMGs), а также современная клиническая классификация (MGFA) в сочетании с иммунологическими исследованиями концентрации аутоантител к ацетилхолиновым рецепторам, титин-белку, потенциалзависимым кальциевым каналам наряду с традиционными фармакологическими пробами и электромиографическим тестированием нервно-мышечной передачи являются критериями диагностики миастении.
Издание предназначено врачам различных медицинских специальностей.
С18
Глава 2
АНТИГЕННЫЕ МИШЕНИ ПРИ МИАСТЕНИИ
При миастении антитела (АТ) и аутореактивные Т-клетки поражают антигенные мишени полипептидной природы, расположенные на постсинаптической мембране и в мышечной клетке. К ним относятся: мышечный ацетилхолиновый рецептор (АХP), мышечная специфическая тирозинкиназа (MuSK), рианодиновый рецептор (RyR), титин-протеин и другие белки миоцитов. В последние годы расширено понятие об антигенных мишенях при миастении. Так, обнаружены АТ к некоторым цитокинам, ганглиозидам миелина нервной ткани и другим белковым структурам (рис. 2).
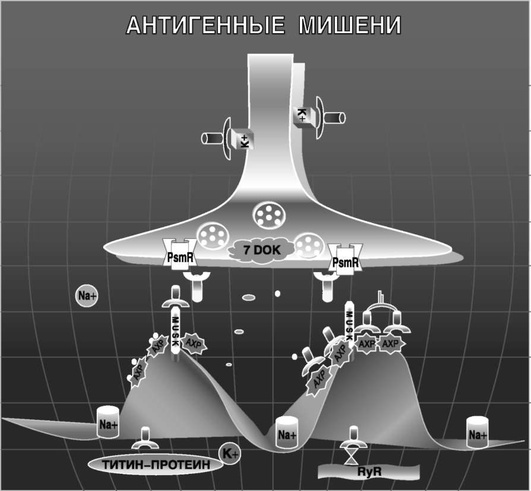
СИНАПТИЧЕСКИЕ МОЛЕКУЛЯРНЫЕ МИШЕНИ
АХР - основная поражаемая мишень при миастении. Его лигандом является нейромедиатор ацетилхолин, под действием которого происходит деполяризация плазматической мембраны [18]. АХP состоит из пяти субъединиц [(α)2 βγδ], аминокислотная последовательность которых установлена на основании клонирования и секвенирования к ДНК в 80-х годах в лаборатории Noda M. et al., (1983). Все субъединицы мышечного АХP: α-, β-, γ- и δ - гликозилированы. В зависимости от стадии развития в онтогенезе мышечный АХP имеет два варианта: эмбриональный, содержащий γ-субъединицу, и взрослый, в котором γ-субъединица заменяется на ε-субъединицу [38]. При генерализованной форме миастении основные регионы для связывания аутоантител расположены на экстрацеллюлярном участке 67-76 α-субъединицы АХP (главный иммуногенный регион - MIR), а при миастении с тимомой - на цитоплазматическом участке 371-378 той же субъединицы (очень иммуногенный цитоплазматический эпитоп - VICE-alpha) [19]. АТ к MIR выявляются у 80-90% больных [1, 2, 38]. При глазной форме миастении АТ направлены не к α1-, а к γ-субъединице АХP, локализованной у взрослых людей только в экстраокулярных мышцах [38]. Это обстоятельство позволило разработать иммунологический экспресс-метод дифференциальной диагностики окулярной формы миастении и эндокринной офтальмопатии, а также прогнозировать генерализацию патологического процесса. Методом иммуноблоттинга проведен скрининг популяции антител сыворотки крови у больных с различными формами миастении и с эндокринной офтальмопатией. Было выявлено, что при генерализованной форме миастении аутоантитела связываются с α1- или α1- и γ-субъединицами, а при глазной форме - только с γ-субъединицей. При эндокринной офтальмопатии и в контрольной группе здоровых добровольцев антитела ко всем субъединицам АХP отсутствовали [6].
MuSK - мембранная белковая молекула, принимающая участие в формировании кластеров АХP на постсинаптической мембране при участии агрина и рапсина. DeChiara T.M. et al. (1996), Gautam M. et al. (1999) установили, что MuSK взаимодействует с агрином и активирует каскад сигналов, ответственных за все этапы формирования синапса, включая организацию постсинаптической мембраны. Агрин синтезируется мотонейронами и, транспортируясь вниз по моторному аксону, попадает в синаптическую щель. Далее агрин взаимодействует с MuSK-постсинаптическим мембранным компонентом, который фосфорилирует связанные с рапсином субъединицы АХP. Агрин, MuSK и рапсин сконцентрированы в нервно-мышечном синапсе. Очевидно, что при формировании нервно-мышечного соединения необходима целостность всех компонентов, что было доказано в экспериментах на животных с нокаутом соответствующих генов [14, 15]. В последнее время было установлено, что 45- 50% больных серонегативной миастенией имеют АТ к MuSK [17].
LRP4 - мембранная белковая молекула липопротеина низкой плотности, относящегося к подклассу IgG1. Так же как и MuSK, принимает участие в формировании кластеров АХP на постсинаптической мембране при участии агрина. Zhang B. et al. (2012) установили, что LRP4 и MuSK взаимодействуют с агрином и активируют каскад сигналов, ответственных за все этапы формирования синапса, включая организацию постсинаптической мембраны. Антитела к LRP4 выявляются у 9,2% больных с дважды негативной миастенией, т.е. с той, при которой не выявляются антитела ни к АХP, ни к MuSK. Было установлено, что у больных БАС частота повышения концентрации антител к LRP4 превышает таковую при миастении и составляет 23% [42].
ВНЕСИНАПТИЧЕСКИЕ МОЛЕКУЛЯРНЫЕ МИШЕНИ
Мышечный белок титин - гигантский белок с молекулярной массой приблизительно 3000 kDa, который охватывает расстояние от Z-диска до М-линии саркомера [23, 24, 40] Его открыли независимо друг от друга в конце 1970-х годов Maruyama K. и Wang K. Титин состоит из соединенных друг с другом иммуноглобулиноподобных областей и уникальной области, богатой пирролидин-альфа-карбоновой кислотой (P), глутаматом (E), лизином (K) и валином (V), - так называемая PEVK-область [22]. Титин имеет две главные функции: управляет расположением саркомера и обеспечивает его эластичность [24, 34]. Было показано, что антититин АТ относятся к подклассам IgG 1 и IgG 4 и обладают способностью активировать белки системы комплемента [32]. АТ к титину обнаружены в сыворотках крови 80-90% пациентов с миастенией с тимомой [8, 12, 32]. Основная антигенная детерминанта титин-белка (MIR) экспрессирована в опухолевых эпителиоцитах тимом и, вероятно, является первичным антигеном, индуцирующим аутоиммунную реакцию против мышечного титин-протеина [16].
Рецепторы кальцийвысвобождающих каналов саркоплазматического ретикулума (RyR) относятся к хемовозбудимым каналам, лигандом которых является алкалоид растительного происхождения - рианодин и кофеин. Структура рецептора была установлена клонированием и секвенированием Takeshima H. et al. (1989) и Zorzato F. et al. (1990). Он был получен в лабораторных условиях методом экспрессии соответствующей кДНК в COS-1 клетки [13]. RyR - трансмембранный белок, состоящий из четырех гомологичных субъединиц с м.м. 450 кДа. Внутримембранный фрагмент субъединицы рецептора многократно пересекает мембрану и образовывает Са2 +-канал. Цитоплазматическая часть молекулы, так называемая «ножка», ориентирует направление выхода Са2+ . Концевая СООН-область имеет некоторую гомологию с трансмембранными областями АХP [37, 41]. АТ связываются с главным иммуногенным регионом (799-1172) RyR. Некоторые сыворотки также реагируют и с короткой, более центрально расположенной областью (участок 2595-2935) [35]. Появление у больных с миастенией с тимомой АТ к RyR рассматривается рядом авторов как признак злокачественного течения заболевания, уровень которых (АТ к RyR) коррелирует с тяжестью патологического процесса и смертностью [27, 28, 32, 35].
Интерлейкин-12 (ИЛ-12) - гетеродимерный цитокин, состоящий из двух ковалентно связанных гликозилированных субъединиц р35 и р40, первоначально выделен из B-лимфобластной линии клеток [20, 36]. ИЛ-12 стимулирует синтез определенных подклассов антител и цитокинов, направляя иммунный ответ по Th1-типу. ИЛ-12 существует в трех формах: гетеродимерной p70 (состоит из p35 и p40 субъединиц), гомодимерной p(40)2 и мономерной p40 [30]. Увеличение уровня этого цитокина было выявлено в сыворотке крови больных с миастенией [3]. Структурная гомология среди ИФ-α, ИФ-ω, ИЛ-12 и АХP предполагает наличие возможных перекрестных взаимодействий аутоантител к ним. ИФ-α2 имеет самую высокую гомологию (приблизительно 20%) с цитоплазматическим участком мышечного АХP [25, 26]. Очень высокий уровень АТ к ИЛ-12 и ИФ-α выявлен при миастении с тимомой [5, 7, 25]. Причем уровень АТ к ИЛ-12 не связан с уровнем АТ к АХP [25]. Выработка АТ к цитокинам предполагает различные механизмы аутоиммунного процесса. Например, изолированное увеличение антител к ИЛ-12 и (или) ИФ-α характерно для рецидива тимомы [25]. Эффекты экзогенного и эндогенного ИЛ-12 исследовались на модели экспериментальной миастении [26]. Было выявлено, что нарушения нервно-мышечной передачи коррелируют с Th1-опосредованными IgG2a анти-АХP АТ, но не с Th2-зависимыми IgG1 АТ. Этот факт позволил объяснить отсутствие корреляции между количеством циркулирующих АТ и тяжестью патологического процесса [9, 34]. Авторы предположили, что при иммунном ответе Th2-типа, анти-АХP-аутоантитела не обладают комплемент-фиксирующими свойствами в отличие от АТ к АХP при иммунном ответе Th1-типа. Это может быть связано с различиями в структуре эффекторного участка (Fc-фрагмент) IgG АТ, который ответственен за связывание с комплементом. Вместе с тем оба типа АТ выявляются с помощью иммуноферментного анализа, поскольку антигенсвязывающая область (Fab-фрагмент) у них аналогична.
Особенности двигательных расстройств у больных с различными клиническими формами миастении могут быть связаны с определенным набором поражаемых мишеней и уровнем антител к ним [8, 39]. Клиническим подтверждением этому являются более частое повышение уровня антител к титин-белку и рианодиновым рецепторам у больных с миастенией, сочетающейся с тимомой, и больных с поздним началом миастении без тимомы [8, 12, 27, 32], избирательность краниобульбарных расстройств и их недостаточная компенсация на фоне введения антихолинэстеразных препаратов у больных с серонегативной миастенией [11, 38].
Вместе с тем существуют АТ, которые могут выявляться в сыворотке крови не только у больных с миастенией, но и при других нервно-мышечных заболеваниях, например при некоторых аутоиммунных полиневропатиях. Так, АТ к ганглиозидам миелиновой оболочки нервов выявлялись у 98% больных полиневропатией и 60% больных с миастенией [31]. Возможно, что определенная часть двигательных нарушений при миастении может быть связана с наличием АТ не только к различным субъединицам АХP, но и к определенным ганглиозидам - GQ1b и GT1b, GT1a [4, 39]. Ганглиозиды относятся к классу гликосфинголипидов и состоят из олигосахаридной части, N-ацетилнейраминовой (сиаловой) кислоты и церамида. Они также являются рецепторами для АТ, токсинов и вирусов [33]. Эти молекулы обеспечивают стабильность клеточных мембран. Ганглиозиды различаются олигосахаридным участком, количеством сиаловых кислот и церамидом. Вероятно, это разнообразие углеводной части делает эти липиды носителями специфической информации [10].
Таким образом, изучение антигенных мишеней позволяет выделять различные клинико-иммунологические варианты миастении, что будет способствовать разработке новых дифференцированных подходов к диагностике и лечению этого заболевания.
ЛИТЕРАТУРА
-
Гехт Б.М., Ланцова В.Б., Сепп Е.К. Роль аутоантител к АХР в патогенезе миастении // Неврологический журнал. - 2003. - Т. 8.- Приложение № 1. - С. 35-37.
-
Гехт Б.М., Ланцова В.Б., Сепп Е.К. Клиническое значение количественного определения антител в сыворотке крови по взаимодействию с фрагментом мышечного ацетилхолинового рецептора у больных миастенией // Журнал невропатологии и психиатрии им. С.С. Корсакова. - Т. 103. - № 2. - 2003. - С. 34-37.
-
Ланцова В.Б., Сепп Е.К. Антигенные мишени при миастении // Журнал Иммунологии и аллергии. - Т. 5. - № 1. - 2004. - С. 196-198.
-
Ланцова В.Б., Сепп Е.К. Полиморфизм нервно-мышечных заболеваний и ганглиозиды как мишени патологического процесса // Тез. Докл. 13 Российск. конфер. «Ней-роиммунология». - №. 2. - Т. II. - СПб., 2004. -С. 58.
-
Ланцова В.Б., Сепп Е.К., Сиднев Д.В., Щербакова Н.И., Санадзе А.Г. Клиническое значение определения интерлейкина-12 при миастении // Тез. докл. Третий Российский конгресс по патофизиологии. - М., 2004. - С. 101-102.
-
Ланцова В.Б., Сепп Е.К. Применение метода иммуноблоттинга для дифференциальной диагностики различных форм миастении и эндокринной офтальмопатии // Журнал экспериментальной биологии и медицины. - № 10. - Т. 140. - 2005. - С. 478-480.
-
Ланцова В.Б., Сепп Е.К. Метод определения антител к интерферону альфа-2 при миастении // Тез. Докл. 13 Российск. конфер. «Нейроиммунология». - Т. 3. - №. 2. - СПб., 2005. - С. 188-189.
-
Санадзе А.Г., Сиднев Д.В., Ланцова В.Б., Сепп Е.К., Давыдова Т.В., Щербакова Н.И. Клинические, электрофизиологические и иммунологические особенности миастении пожилого возраста и миастении в сочетании с тимомой // Патогенез. - Т. 1. - № 2. - 2003. - С. 62-66.
-
Сепп Е.К., Ланцова В.Б. Миастения. Клиника, диагностика, лечение и патофизиология. - М., 2002. - 65 с.
-
Хухо Ф. Нейрохимия: Основы и принципы / Пер. с англ. - М.: Мир, 1990. - 384 с.
-
Щербакова Н.И., Санадзе А.Г, Сиднев Д.В., Руднигенко В.А. Клинические и электромиографические особенности серонегативной миастении // Журнал неврологии и психиатрии им. С.С. Корсакова. - Т. 102. - № 1. - 2007. - С. 51-53.
-
Aarli J.A., Stefasson K., Marton L.S., Wollmann R.L. Patients with myasthenia gravis and thymoma have in their sera IgG autoantibodies against titin // Clin. Exp. Immunol. - 1990. - Vol. 82 (2). - P. 284-288.
-
Chen S.R.W., Zhang L., MacLennan D.H. Antibodies as probes for Ca2 + activation sites in the Ca2+ release channel (ryanodine receptor) of rabbit skeletal muscle sarcoplasmic reticulum // J. Biol. Chem. - 1993. - Vol. 268. - 13414-13421.
-
DeChiara T.M., Bowen D.C., Valenzuela D.M., Simmons M.V., Poueymirou W.T., Thomas S., Kinetz E., Compton D.L., Rojas E., Park J.S., Smith C., DiStefano P.S., Glass D.J., Burden S.J., Yancopoulos G.D. The receptor tyrosine kinase MuSK is required for neuromuscular junction formation in vivo // Cell . - 1996. - Vol. 85(4). - H. 501-512.
-
Gautam M., DeChiara T.M, Glass D.J., Yancopoulos G.D., Sanes J.R. Distinct phenotypes of mutant mice lacking agrin, MuSK, or rapsyn // Developmental Brain Research. - 1999. - Vol. 114. - P. 171-178.
-
Gautel M., Lakey A., Barlow D.P., Holmes Z., Scales S., Leonard K. et al. Titin antibodies in myasthenia gravis: identification of a major immunogenic region of titin // Neurology. - 1993. - Vol. 43 (8). - H. 1581-1585.
-
Hoch W., McConville J., Helms S., Newsom-Davis J., Melms A., Vincent A. Auto-antibodies to the receptor tyrosine kinase MuSK in patients with myasthenia gravis without acetylcholine receptor antibodies // Nat Med. - 2001 Mar. - Vol. 7(3). - 365-368.
-
Hucho F. Neurotransmitter receptors // New comprehensive biochemistry. Amsterdam: Elsevier Science Publishers. - 1992. - P. 3-13.
-
Kawanami S., Mori S., Ueda H. Homology between Fas and nicotinic acetylcholine receptor protein in a thymoma with myasthenia gravis - immunohistochemical and biochemical study // Fukuoka Idaku Zasshi. - 2000. - Vol. 91. - N 5. - P. 123-131.
-
Kobayashi M., Fitz L., Ryan M., Hewick R.M., Clark S.C., Chan S., Loudon R., Sherman F., Perussia B., Trinchieri G. Identification and purification of natural killer cell stimulatory factor (NKSF), a cytokine with multiple biological effects on human lymphocytes // J. Exp. Med. - 1989. - Vol. 170. - P. 827.
-
Kusner L.L., Mygland A., Kaminski H.J. Ryanodine receptor gene expression thymomas // Muscle Nerve. - 1998. - Vol. 21. - N 10. - P. 1299-303.
-
Ladeit S., Kolmerer B. Titins: giant proteins in charge of muscle ultrastructure and elasticity // Science. - 1995. - Vol. 270 (5234). - P. 293-296.
-
Maruyama K. Connectin, an elastic protein of striated muscle // Biophys. Chem. - 1994. - Vol. 50. - P. 73-85.
-
Maruyama K. Connectin:titin, giant elastic protein of muscle // FASEB J. - 1997. - Vol. 11. - P. 341-345.
-
Meager A., Wadhwa M., Dilger P., Bird C., Thorpe R., Newsom-Davis J., Willcox N. Anti-cytokine autoantibodies in autoimmunity: preponderance of neutralizing autoantibodies against interferon-alpha, interferon-omega and interleukin-12 in patients with thymoma and/or myasthenia gravis // Clin. Exp. Immunol. - 2003. - Vol. 132. - P. 128-136.
-
Moiola L., Galbiati F., Martino G., Amadio S., Brambilla E., Comi G. et al. IL-12 is involved in the induction of experimental autoimmune myasthenia gravis, an antibody-mediated disease // Eur. J. Immunol. - 1998. - Vol. 28. - P. 2487-2497.
-
Mygland A., Aarli J.A., Matre R., Gilhus N.E. Ryanodine receptor antibodies related to severity of thymoma associated myasthenia gravis // J. Neurol. Neurosurg. Psychiatry. - 1994. - Vol.57. - N 7. - P. 843-846.
-
Mygland A., Kuwajima G., Mikoshiba K., Tysnes O.B., Aarli J.A., Gilhus N.E. Thymomas express epitopes shared by the ryanodine receptor // J. Neuroimmunol. - 1995. - Vol. 62. - N 1. - P. 79-83.
-
Noda M., Furutani Y., Takahashi et al. Cloning and sequence analysis of calf c DNA and human genomic DNA encoding α-subunit precursor of muscle acetylcholine receptor //Nature. - 1983. - Vol. 305. - P. 818-824.
-
Presky D.H., Gubler U., Chizzonite R.A., Gately M.K. IL-12 receptors and receptor antagonists // Res Immunol. - 1995. - Vol. 146. - P. 439.
-
Рestronk A., Choksi R. Multifocal motor neuropathy: Serum IgM anti-GM1 ganglioside antibodies in most patients detected using covalent linkage of GM1 to ELISA plates //Neurology. - 1997. - Vol. 49. - P. 1289-1292.
-
Romi F., Skeie G.O., Vedeler C., Aarli J.A., Zorzato F., Gilhus N.E. Complement activation by titin and ryanodine receptor autoantibodies in myasthenia gravis. A study of IgG subclasses and clinical correlations // J. Neuroimmunol. - 2000. - Vol. 111(1-2). - P. 169-176.
-
Sato T., Serizawa T., Ohtake F., Nakamura M., Terabayashi T., Kawanishi Y., Okahata Y. Quantitative measurements of the interaction between monosialoganglioside monolayers and wheat germ agglutinin WGA by a quartz-crystal microbalance // Biochimica et Bio-physica Acta. - 1998. - Vol. 1380. - P. 82-92.
-
Skeie G.O., Bentsen P.T., Freiburg A., Aarli J.A., Gilhus N.E. Cell mediated immune response against titin in myasthenia gravis: evidence for the involvement of Th1 and Th2 cells // Scand. J. Immunol. - 1998. - Vol. 47. - P. 76-81.
-
Skeie G.O., Lundep P.K., Sejer E.R., Sted O.M., Mygland A.Ê., Aarlli J.A, Gilhus N.E. Auto-immunity against the ryanodine receptor in myasthenia gravis // Acta Physiol Scand. - 2001. - Vol. 171. - P. 379-384.
-
Stern A.S., Podlaski F.J, Hulmes J.D., Pan Y-C.E., Quinn P.M., Wolitzky A.G., Familletti P.C., Stremlo D.L., Truitt T., Chizzonite R., Gatley M.K. Purification to homogeneity and partial characterization of cytotoxic lymphocyte maturation factor from human B-lymphoblastoid cells // Proc. Natl. Acad. Sci. USA. - 1990. - Vol. 87. - P. 6808.
-
Takeshima H., Nishimura S., Matsumoto T. et al. Primary structure and expression from complementary DNA of skeletal muscle ryanodine receptor // Nature. - 1989. - Vol. 339. - P. 439-445.
-
Vincent A. Seronegative Myasthenia Gravis: a plasma factor inhibition agonist-induced acetylcholine receptor function copurifies with IgM // Ann. Neurol. - 1991. - Vol. 30. - P. 550-557.
-
Vincent A., Beeson D., Lang B. Molecular targets for autoimmune and genetic disorders of neuromuscular transmission // Eur. J. Biochem. - 2000. - Vol. 267. - P. 6717-6728.
-
Wang K., McClureJ., Tu A. Titin: major myofibrillar components of striated muscle // Proc. Natl. Acad. Sci.USA . - 1979. - Vol. 76. - P. 3698-3702.
-
Zorzato F., Fujii J., Otsu K. et al. Molecular cloning of DNA encoding human and rabbit forms of the Ca 2+ release channel (ryanodine receptor) of skeletal muscle sarcoplasmic reticulum // J. Biol. Chem. - 1990. - Vol. 265. - P. 2244-2256.
-
Zhang B., Tzartos B.S., Belimeri M. et al. Autoantibodies to lipoprotein-related 4 in patients with double-seronegative myasthenia gravis // Arch. Neurol. - 2012. - Vol. 69. - № 4. - P. 445-451.