Миастения и миастенические синдромы
Миастения и миастенические синдромы [Электронный ресурс] / Санадзе А.Г. - М. : ГЭОТАР-Медиа, 2019.
Миастения и миастенические синдромы / Санадзе А. Г. - Москва : ГЭОТАР-Медиа, 2019. - 256 с. (Серия "Библиотека врача-специалиста") - ISBN 978-5-9704-5170-0 |
Аннотация
Настоящее руководство освещает современные представления об эпидемиологии, патогенетических механизмах формирования двигательных расстройств, клинических формах, критериях диагностики, а также стратегии и тактике лечения миастении и миастенических синдромов. Второе издание книги дополнительно подчеркивает актуальность проблемы, определяемую несомненным увеличением частоты встречаемости и объективными сложностями диагностики миастении, а также бесспорным интересом врачей различных специальностей к представленной информации. Особенности распределения двигательных нарушений и их связь с возрастом дебюта болезни, фактором наличия или отсутствия тимомы, отсутствие зависимости тяжести течения заболевания от концентрации аутоантител к ацетилхолиновым рецепторам и другим синаптическим и внесинаптическим антигенным мишеням показывают неоднородность группы пациентов, объединенных диагнозом "миастения". В связи с этим представленные методы количественной оценки выраженности двигательных расстройств (QMGs), а также современная клиническая классификация (MGFA) в сочетании с иммунологическими исследованиями концентрации аутоантител к ацетилхолиновым рецепторам, титин-белку, потенциалзависимым кальциевым каналам наряду с традиционными фармакологическими пробами и электромиографическим тестированием нервно-мышечной передачи являются критериями диагностики миастении.
Издание предназначено врачам различных медицинских специальностей.
С18
Глава 10
ИММУНОЛОГИЧЕСКИЕ ТЕСТЫ В ДИАГНОСТИКЕ МИАСТЕНИИ
методика определения концентрации антител к ацетилхолиновым рецепторам
Концентрация антител к ацетилхолиновым рецепторам определяется радиоиммунологическим методом с помощью коммерческой тест-системы (DLD Diagnostika GMBH, Германия). Образцы сыворотки крови хранятся при -20 °С. Непосредственно перед проведением анализа сыворотки размораживаются, отбираются аликвоты по 5 мкл и помещаются в пробирки. К пробам добавляется по 100 мкл 125 I-рецептора ацетилхолина (удельная активность - 342 Ci/ммоль), 50 мкл антител к иммуноглобулину G человека, перемешивается и инкубируется в течение 30 мин при комнатной температуре. Затем добавляется по 1 мл промывочного буфера, центрифугируется в течение 20 мин при 3000 об/мин, надосадочная жидкость удаляется декантацией. Полученный осадок ресуспензируется и повторяется процедура промывки. Определяется радиоактивность проб и вычисляется концентрация антител, выражаемая в нмоль/л, по формуле:
С = (cpm. - cpmn )×D×F,
где С - концентрация антител, нмоль/л; D - фактор, учитывающий дату изготовления набора; F - фактор, учитывающий удельную активность метки; cpmi - радиоактивность пробы, имп/мин; cpmn - радиоактивность негативного контроля, имп/мин.
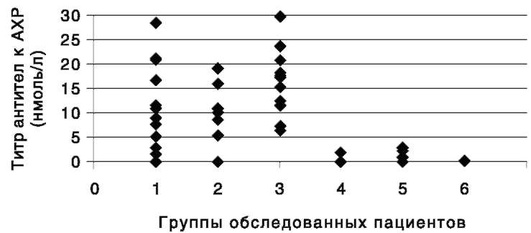
Повышенным титром антител к ацетилхолиновым рецепторам считается значение, превышающее 0,50 нмоль/л (рис. 10).
методика определения уровня антител к титин-белку
Уровень антител к титину определяется методом твердофазного иммуно-ферментного анализа с помощью коммерческой тест-системы (DLD Diagnostika GMBH, Германия). Тестируемые и контрольные сыворотки вносятся в лунки планшета по 100 мкл в разведении 1:101. После инкубации в течение 1 ч при комнатной температуре планшеты промываются и обрабатываются меченными ферментом вторичными антителами против иммуноглобулинов человека. Затем планшеты инкубируются в течение 30 мин при комнатной температуре, отмываются и вносятся в лунки по 100 мкл субстратной смеси. Через 15 мин инкубации в темноте при комнатной температуре реакцию останавливают и определяют оптическую плотность в каждой лунке при длине волны 450 нм с использованием считывающего устройства Mini-reader (DYNATECH). Уровень антител к титину выражают в условных единицах индексом «К», представляющим собой отношение оптической плотности тестируемой сыворотки к оптической плотности калибратора, входящего в тест-систему.
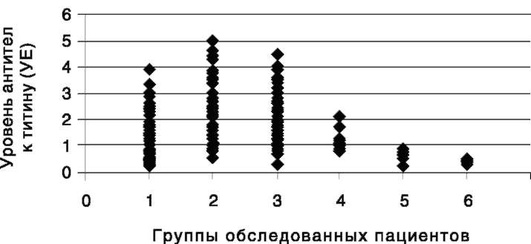
Повышенным уровнем антител к титину считается значение «К», превышающее 1,0 условную единицу (УЕ) (рис. 11).
методика определения концентрации антител к потенциалзависимым кальциевым каналам
Концентрация антител к потенциалзависимым P/Q-кальциевым каналам определяется радиоиммунологическим методом с помощью коммерческой тест-системы (DLD Diagnostika GMBH, Германия). Образцы сыворотки крови больных хранятся при -20 °С. Непосредственно перед проведением анализа сыворотки размораживаются, центрифугируются при 3000 об/мин 15 мин, затем отбираются аликвоты по 25 мкл и разводятся буфером в 10 раз. Пробы сыворотки (по 2 от каждого больного), а также позитивный и негативный контроли вносятся в пробирки в объеме 25 мкл. Для определения общего связывания (Т)
используются очищенные потенциалзависимые кальциевые каналы, меченные 125 I-ω-конотоксином. Для оценки неспецифического связывания (NSB) используется тот же препарат, насыщенный немеченым ω-конотоксином. Метки T и NSB добавляются в соответствующие пробирки в объеме 50 мкл, пробы перемешиваются и инкубируются 1 ч при комнатной температуре. Затем к каждой пробе добавляется 125 мкл антисыворотки к человеческому IgG, перемешивается и инкубируется 1 ч при комнатной температуре. По истечении этого срока добавляется по 1 мл промывочного буфера, тщательно перемешивается, и центрифугируются пробирки в течение 10 мин при 4000 об/мин. Жидкость удаляется декантацией, добавляется еще по 1 мл промывочного буфера, ресуспендируется осадок и повторно центрифугируются пробирки в течение 10 мин при 4000 об/мин. Определяется радиоактивность проб и вычисляется концентрация антител, выражаемая в пмоль/л, по формуле:
С = (cpmi - cpmn ) × D × F,
где С - концентрация антител, пмоль/л; D - фактор, учитывающий дату изготовления набора; F - фактор, учитывающий удельную активность метки; cpmi - радиоактивность пробы, имп/мин; cpmn - радиоактивность негативного контроля, имп/мин.
Повышенным титром антител к потенциалзависимым кальциевым каналам считается значение, превышающее 20 пмоль/л.
МЕТОДИКА ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ АНТИТЕЛ К МЫШЕЧНОЙ СПЕЦИФИЧЕСКОЙ КИНАЗЕ
Концентрация антител к мышечной специфической киназе (MuSK) определяется радиоиммунологическим методом с помощью коммерческой тест-системы (DLD Diagnostika GMBH, Германия). Образцы сыворотки крови больных хранятся при -20 °С. Непосредственно перед проведением анализа сыворотки размораживаются, разводятся в 10 раз промывочным буфером и центрифугируются в течение 10 мин при 3000 об/мин для устранения нерастворимых частиц. К 50 мкл разбавленной сыворотки добавляется 50 мкл раствора 125 I-MuSK (удельная активность - 2,729 Ки/ммоль), перемешивается на вортексе и инкубируется в течение ночи при комнатной температуре. К пробам добавляется 50 мкл антител к IgG человека, перемешивается на вортексе и инкубируется в течение 2 ч при температуре 4 °С. После инкубации добавляется 25 мкл реактива, усиливающего преципитацию, повторно перемешивается и добавляется 1 мл промывочного буфера. Центрифугируется в течение 20 мин при 3000 об/мин, надосадочная жидкость декантируется, к осадку повторно добавляется 1 мл промывочного буфера, перемешивается на вортексе и центрифугируется в течение 20 мин при 3000 об/мин. Надосадочная жидкость декантируется и измеряется радиоактивность осадка на счетчике CliniGamma 1272 («LKB-Wallac», Швеция) в течение 1 мин. Концентрация антител рассчитывается по формуле:
С = (cprmi - cpmn ) × D × F,
где С - концентрация антител, нмоль/л; D - фактор, учитывающий дату изготовления набора; F - фактор, учитывающий удельную активность метки; cpmi - радиоактивность пробы, имп/мин; cpmn - радиоактивность негативного контроля, имп/мин.
литература
-
Aarli J.A. Titin, thymoma, and myasthenia gravis // Arch. Neurol. - 2001. - Vol. 58. - P. 869-890.
-
Aarli J.A., Stefansson K., Marton L., Wollmann R.L. Patient with myasthenia gravis and thymoma have in their sera IgG autoantibodies against titin // Clin. Exp. Immunol. - 1990. - Vol. 82. - N 2. - P. 284-288.
-
Aarli J.A., Skeie G., Mygland A., Gilhus N. Muscle striation antibodies in myasthenia gravis. Diagnostic and functional significance // Ann. N.Y. Acad. Sci. - 1998. - Vol. 841. - P. 505-515.
-
Bowen D.C., Park J.S., Bodine S. et al. Localization and regulation of MuSK at the neuromuscular junction // Dev. Biol. - 1998. - Vol. 199. - N 2. - P. 309-319.
-
Hoch W., McConville J., Helms S., Newsom-Davis J., Melms A., Vincent A. Auto-antibodies to the receptor tyrosine kinase MuSK in patients with myasthenia gravis without acetylcholine receptor antibodies // Nat. Med. - 2001. - Vol. 7. - N 3. - P. 365-368.
-
Lennon V.A. Serological diagnosis of myasthenia gravis and Lambert - Eaton myasthenic syndrome // Handook of Myasthenia gravis / Ed. R. Lisak, Marcel Dekker. - 1994. - Vol. 7. - P. 149-164.
-
Lennon V.A., Kryzer Th.J., Griesmann G.E., O’Suilleabhain P.E., Windebank A.J., Woppmann A., Miljanich G.P., Lambert E.H. Calcium channel antibodies in the Lambert-Eaton syndrome and other paraneoplastic syndromes // N. Engl. J. Med. - 1995. - Vol. 332. - P. 1467-1474.
-
Lindstrom J. Acetylcholine receptor and myasthenia // Muscle & Nerve. - 2000. - N 23. - P. 453-477.