Неотложная педиатрия : национальное руководство / под ред. Б. М. Блохина. - Москва : ГЭОТАР-Медиа, 2017. - 832 с. : ил. - 832 с. - ISBN 978-5-9704-5044-4. |
Аннотация
Руководство по неотложной педиатрии подготовлено авторским коллективом, члены которого имеют большой клинический опыт работы в различных областях медицины и в преподавании. С современных позиций освещены вопросы проведения немедленных реанимационных мероприятий (ILS) и расширенной сердечно-легочной реанимации, мероприятий неотложной медицинской помощи, клинической диагностики и лечения угрожающих жизни состояний при различной патологии у детей. Национальное руководство по неотложной педиатрии предназначено для врачей-педиатров, врачей общей практики, оказывающих неотложную помощь детям, для врачей скорой медицинской помощи, интернов, врачей-ординаторов и может быть использовано студентами медицинских вузов для углубления знаний в данной области неотложной медицины.
Дыхание - сложный процесс, в котором участвуют многие органы и системы, и при нарушении одного или нескольких из них нарушается главная физиологическая функция - газообмен.
Определенные анатомо-физиологические особенности органов дыхания у детей предрасполагают к возникновению синдрома ОДН при различных заболеваниях респираторного тракта.
Возникающие при заболеваниях отек слизистых оболочек, выделение слизи, бронхиальная гиперреактивность приводят к значительному сужению дыхательных путей, а иногда к их полной обтурации, в частности при стенозах гортани, бронхитах, бронхиолитах.
Обструкция дыхательных путей
Обструктивные нарушения дыхания у детей зависят от разных причин и имеют разноуровневую локализацию препятствия. Независимо от причины и характера препятствия острая и подострая обструкции дыхательных путей - драматическая клиническая ситуация с быстро нарастающей гипоксией. Обструкция приводит к тотальному нарушению газообмена - асфиксии, которая может закончиться летально.
Если препятствие газопотоку во время дыхания возникает в полости рта, глотки или гортани, дыхательные нарушения рассматривают как обструкцию ВДП (табл. 3-1), ниже гортани - обструкцию нижних дыхательных путей.
Локализация сужения |
Причины |
|
|---|---|---|
инфекционные неинфекционные |
||
Надсвязочные |
Заглоточный абсцесс. Перитонзиллярный абсцесс. Дифтерия зева. Эпиглоттит |
Аспирации ИТ. Аллергический отек. Ожог дыхательных путей |
Подсвязочные |
Дифтерия гортани. Вирусный ларинготрахеобронхит. Бактериальный трахеит |
Ларингоспазм. Подсвязочный отек |
У детей состояния, вызывающие обструкцию ВДП, разделяют на врожденные и приобретенные (табл. 3-2).
| Врожденные заболевания | Приобретенные заболевания и повреждения |
|---|---|
Сужения внутреннего просвета дыхательных путей: подсвязочный стеноз, мембрана, киста, ларингоцеле, опухоль, ларингомаляция, ларинготрахеоэзофагеальная мембрана, трахеомаляция, трахеопищеводный свищ. Наружные сдавливания и повреждения: сосудистое кольцо, цистогигрома. Родовая травма. Неврологические нарушения. Аномалии черепно-лицевой области. Гипокальциемия |
Инфекции: заглоточный абсцесс, ангина Людвига, ларинготрахеобронхит, эпиглоттит, грибковая инфекция, перитонзиллярный абсцесс, дифтерия, бактериальный трахеит. Травма: постинтубационный отек, посттрахеостомический стеноз. Ожоги дыхательных путей (термический или химический). Аспирации ИТ. Системные нарушения. Опухоли. Неврологические повреждения. Хроническая обструкция ВДП. Гипертрофический тонзиллит и аденоиды |
СИНДРОМ КРУПА
Круп (от шотл. croup - каркать) - любое заболевание ВДП, которое приводит к стенозу гортани.
Круп объединяет сходные по симптомам заболевания - ларингит, ларинготрахеит, ларинготрахеобронхит. В зависимости от заболевания различают круп дифтерийный, гриппозный и др.
Дифтерия зева и гортани (истинный круп)
Дифтерия - острое инфекционное заболевание, вызываемое токсигенными штаммами дифтерийной палочки, передаваемыми преимущественно воздушно-капельным путем, характеризующиеся развитием фибринозного воспаления в месте входных ворот, лихорадкой, синдромом интоксикации и частыми осложнениями со стороны сердечно-сосудистой и нервной систем.
Больные дифтерией зева нуждаются в экстренной помощи в связи с возможностью тяжелых общих осложнений или стеноза гортани. Это заболевание часто наблюдают у детей в возрасте 2-6 лет. Диагностика основана на клинической картине.
Диагностические признаки токсической дифтерии ротоглотки:
-
токсический отек нёбных миндалин, подкожной клетчатки шеи, регионарных лимфатических узлов;
-
распространение налетов за пределы нёбных миндалин, на нёбные дужки, язычок, мягкое и твердое нёбо, заднюю стенку глотки;
-
развитие токсических осложнений, таких как инфекционно-токсический шок (ИТШ), нефроз, миокардит.
Диагностические признаки дифтерии гортани:
-
постепенное нарастание симптомов дисфонии до беззвучного кашля, афонии;
-
инспираторный стридор с втяжением «уступчивых» мест грудной клетки;
-
пленчатые беловато-желтоватые или сероватые налеты сначала в пределах преддверия гортани, затем в зоне голосовой щели;
-
подчелюстные и заднешейные регионарные лимфатические узлы значительно увеличены, болезненны, с отеком тканей вокруг них;
Диагноз необходимо подтвердить бактериологически, что удается не всегда. Тактика ведения больных - экстренная госпитализация в инфекционное отделение, транспортировка с возвышенным положением верхней половины туловища и оксигенотерапией. Независимо от стадии заболевания немедленно вводят противодифтерийную сыворотку, которая нейтрализует циркулирующий дифтерийный экзотоксин. Доза сыворотки определяется распространенностью процесса и стадией заболевания - 15 000-40000 МЕ. Об эффективности действия противодифтерийной сыворотки свидетельствуют уменьшение интоксикации, разрыхление и «таяние» фибринозных налетов.
Поддержание свободной проходимости дыхательных путей необходимо в течение первых 3-5 сут госпитализации. При дифтерии зева больной находится с постоянным воздуховодом; или сохраняют эндотрахеальную интубацию; при дифтерии гортани - назотрахеальная продленная интубация. Дезинтоксикационное инфузионное лечение проводят преимущественно кристаллоидными растворами - 10 мл/кг. Целесообразно парентеральное введение глюкокортикоидов: дексаметазона (Дексазон♠ ) - 2-3 мг/кг; допамина - 2-6 мг/кг в 1 мин; седативных препаратов - диазепама (Седуксен♠ ), мидазолама. Антибактериальное лечение проводят всем больным дифтерией.
Острый стенозирующий ларинготрахеит (ложный круп)
Круп - угрожающее жизни поражение ВДП различной этиологии, характеризуемое стенозом гортани различной степени выраженности с «лающим» кашлем, дисфонией, инспираторной или смешанной одышкой.
Частые возбудители острого стенозирующего ларинготрахеита (ОСЛТ) - вирусы парагриппа, гриппа, респираторно-синцитиальный вирус, микоплазма пневмонии. Преобладающий этиологический фактор воспаления гортани и трахеи, сопровождающий развитие синдрома крупа, - вирус гриппа и парагриппа. Бактериальный ларингит встречают крайне редко. Бактериальная флора, активизирующаяся при острой респираторной вирусной инфекции (ОРВИ) или присоединяющаяся при внутрибольничном инфицировании, имеет большое значение в тяжелом, осложненном течении ларинготрахеобронхита.
Предрасполагающие факторы развития крупа - особенности детской гортани и трахеи:
Обилие лимфоидной ткани у детей раннего возраста с большим числом тучных клеток и сосудов, слабое развитие эластических волокон в слизистой оболочке и подслизистой основе быстро приводят к отеку подскладочного пространства и способствуют развитию острого стенозирующего ларинготрахеита.
Изменения при крупе локализуются исключительно в подскладочной области, где расположена богато васкуляризованная соединительная ткань. Воспаление распространяется по направлению к трахее, так как плотно сросшаяся слизистая оболочка с подлежащими тканями в области голосовых складок препятствует его распространению вверх (рис. 3-1).
Клиническая картина
Острый стенозирующий ларинготрахеит начинается с продромальных явлений: субфебрильная или повышенная температура тела и катаральные явления в течение 1-3 дней. Начало заболевания часто внезапное, преимущественно ночью. Ребенок просыпается от приступа грубого «лающего» кашля, шумного затрудненного дыхания. Клинические проявления крупа динамичны и прогрессируют во времени от нескольких минут до 1-2 сут, от стадии компенсации до асфиксии.
Дисфония нарастает по мере прогрессирования отека в подскладочном пространстве. Кашель сухой, «лающий», короткий, отрывистый. Инспираторный стридор - стенотическое дыхание, обусловленное затрудненным прохождением вдыхаемого воздуха через суженную гортань. Дыхание приобретает шумный характер с раздуванием крыльев носа, последовательным включением дыхательных мышц и втяжением уступчивых мест грудной клетки.
Степень стеноза определяют по тяжести клинической картины (табл. 3-3).
В отечественной и международной практике широко используют шкалу Уэстли, которая позволяет дать унифицированную объективную оценку клинических симптомов и помогает в последующем мониторировании (табл. 3-4).
Суммарная балльная оценка основных параметров от 0 до 17 баллов позволяет оценить тяжесть крупа:
Симптом |
Степень стеноза гортани |
|||
|---|---|---|---|---|
1 |
II |
III |
IV |
|
Общее состояние |
Удовлетворительное или средней тяжести, сознание ясное, периодическое возбуждение |
Средней тяжести, сознание ясное, постоянное возбуждение |
Тяжелое или очень тяжелое, сознание спутанное, постоянное значительное возбуждение |
Крайне тяжелое, сознание отсутствует |
Цвет кожи |
Легкий цианоз вокруг рта при беспокойстве |
Умеренно выраженный цианоз носогубного треугольника |
Выраженный цианоз кожи лица, акроцианоз, мраморность кожи |
Цианоз кожи всего тела |
Участие вспомогательных мышц |
Раздувание крыльев носа в покое отсутствует, при беспокойстве умеренное |
Втяжение межреберных промежутков и надключичных ямок, выраженное даже в состоянии покоя |
Выраженное, при поверхностном дыхании может отсутствовать |
Менее выражено |
Дыхание |
Не учащено |
Умеренно учащено |
Учащено, возможно поверхностное |
Прерывистое, поверхностное |
Пульс |
Соответствует температуре тела |
Учащен |
Значительно учащен |
Значительно учащен, нитевидный, иногда замедлен |
Пульсоксиметрия |
Норма 95-98% |
< 95% |
< 92% |
|
Признак |
Балл* |
|||||
|---|---|---|---|---|---|---|
0 |
1 |
2 |
3 |
4 |
5 |
|
Втяжение уступчивых мест грудной клетки |
Нет |
Легкое |
Умеренное |
Выраженное |
||
Стридор |
Нет |
При беспокойстве |
В покое |
|||
Цианоз |
Нет |
При беспокойстве |
В покое |
|||
Сознание |
Ясное |
Дезориентация |
||||
Дыхание |
Нормальное |
Затруднено |
Значительно затруднено |
|||
*Максимальное число баллов: втяжение уступчивых мест грудной клетки - 3 балла, стридор - 2 балла, цианоз - 5 баллов, дезориентация - 5 баллов, затруднение дыхания - 2 балла.
Диагностика и дифференциальная диагностика острого стенозирующего ларинготрахеита
-
Анамнез, данные лабораторных и инструментальных (прямая ларингоскопия, рентгенография шейного отдела позвоночника и др.) методов исследования позволяют проводить дифференциальную диагностику с другими заболеваниями, вызывающими обструкцию ВДП. Дифференциальную диагностику проводят по основному симптому острого стенозирующего ларинготрахеита - стенотическому дыханию. В первую очередь следует исключить дифтерию, ИТ гортани, заглоточный абсцесс, ларингоспазм. Иногда необходима дифференциальная диагностика с ларинготрахеитом и бронхиальной астмой (ЁА) (табл. 3-5).
-
Вирусологическое, бактериологическое исследования выделяемого материала (слизь из ротоглотки, носа) по необходимости.
-
При подозрении на дифтерийный круп - бактериоскопия мазков, взятых из мест поражения, бактериологическое исследование на бациллу Леффлера.
-
Высокоинформативные симптомы - изменение голоса, «лающий» кашель, шумное дыхание, стридор, проявления ОРВИ.
| Заболевание | Особенности |
|---|---|
Дифтерийный (истинный) круп |
Преимущественно у непривитых детей, стадийность течения и постепенное развитие. На фоне прогрессирования интоксикации голос становится резко осипшим, уменьшается громкость кашля, отсутствует усиление голоса при плаче, крике. Фибринозные налеты в гортани нередко сочетаются с фибринозными налетами в глотке |
Корь |
Круп появляется в конце катарального периода (ранний коревой круп) и в период пигментации сыпи (поздний коревой круп) с типичной клинической картиной |
Эпиглоттит |
Быстрое прогрессирование симптомов стенозирования дыхательных путей на фоне выраженной дисфагии (ребенку трудно глотать даже слюну), бурно нарастающей интоксикации с гипертермией, тахикардией, беспокойством или спутанностью сознания. Изменение голоса отсутствует, голос тихий. Кашель нехарактерен, вынужденное положение - поза «принюхивания». При осмотре задней стенки глотки - темно-вишневая инфильтрация корня языка, а иногда и увеличенный вишневого цвета надгортанник |
Аспирация ИТ |
Приводит к стридорозному дыханию и приступообразному кашлю. Симптомы появляются внезапно на фоне полного здоровья, в светлое время дня, во время игры или еды |
Ларингоспазм |
Повторение приступов несколько раз в день у детей в возрасте от 6 до 24 мес с признаками рахита и другими проявлениями повышенной нервно-мышечной возбудимости. Голос не изменен, кашель отсутствует, отмечают затруднение вдоха и «петушиный» крик на выдохе |
Заглоточный абсцесс |
Острое начало с высокой температурой тела, голос не изменен, грубый кашель отсутствует, речь невнятная с носовым оттенком. Дыхание храпящее, рот открыт. Глотание затруднено, болезненно, отказ от еды. У грудного ребенка отмечают слюнотечение, вынужденное положение (голова запрокинута назад и в больную сторону); возможен тризм жевательных мышц. При фарингоскопии выявляют отек и выпячивание задней стенки глотки |
Папилломатоз гортани |
Напоминает острый стенозирующий ларинготрахеит, если ребенок с папилломатозом заболел ОРВИ. В анамнезе отмечены аналогичные приступы стенотического дыхания и осиплость голоса, осиплость голоса сохраняется и вне проявлений ОРВИ. Окончательная диагностика - прямая ларингоскопия и гистологическое исследование |
Лечение
Оценка степени стеноза гортани определяет медицинскую тактику и объем медицинских вмешательств.
Лечебные мероприятия при крупе направлены на быстрое восстановление дыхательной функции и улучшение состояния больного, предупреждение прогрессирования стеноза гортани, обструктивного трахеобронхита и летального исхода. Эффективность лечебных мер при остром стенозе гортани зависит от своевременности их применения.
Патогенетически обосновано использование глюкокортикоидов (ГК), оказывающих противовоспалительное действие, уменьшающих отек гортани и экссудацию, снижающих проницаемость капилляров.
Первая линия лечения крупа - ингаляция через небулайзер ингаляционного ГК будесонид в дозе 2 мг однократно или 1 мг 2 раза через 30 мин.
Исследования дозозависимого эффекта при титровании дозы будесонида показывают быстрый клинический эффект и улучшение функциональных показателей уже в течение 15-30 мин с максимальным улучшением через 3-6 ч. Эффект будесонида обусловлен быстрым поступлением ингаляционного ГК непосредственно в дыхательные пути, его высокой местной противовоспалительной активностью и выраженным противосудорожным действием. Средство доставки препарата - небулайзер.
При невозможности проведения ингаляции, выраженном беспокойстве ребенка проводят парентеральное введение ГК.
-
Дексаметазон, уровень доказательности - класс А. При крупе легкой и средней степени тяжести улучшает состояние ребенка по балльной системе оценки Уэстли в течение 6-12-24 ч. Клинический опыт свидетельствует, что улучшение состояния ребенка проявляется уже через 2-3 ч после применения дексаметазона. Он уменьшает частоту и продолжительность интубации, госпитализации и повторных обращений за медицинской помощью; уменьшает продолжительность симптомов у детей с легким, средним и тяжелым течением заболевания, необходимость применения эпинефрина (Адреналина♠ ). Наиболее рекомендуемая доза - 0,3-0,6 мг/кг однократно (максимальная доза - 8-12 мг), при необходимости повторяют через 12 ч. Он начинает действовать через 1-2 ч, пик максимальной эффективности - через 6 ч; продолжительность действия - 36-72 ч. Рандомизированные исследования показали, что эффективность применения внутрь или внутримышечно одинакова.
-
Преднизолон применяют при нарастающем стенозе гортани в дозе 1-2 мг/кг парентерально.
-
При крупе II-III степени бригадой скорой медицинской помощи проводят ингаляцию через небулайзер эпинефрина 0,1% раствор - 0,1-0,2 мг/кг (не более 5 мг) в 3 мл 0,9% растворе натрия хлорида. Противопоказания к применению эпинефрина - врожденный порок сердца или аритмия.
Лечение ГК продолжают в течение нескольких дней (табл. 3-6).
Показания к госпитализации:
| Лечение | Результат |
|---|---|
Стеноз гортани I степени (<2 баллов): эмоциональный и психический покой; доступ свежего воздуха; комфортное положение ребенка; по показаниям, жаропонижающее лечение. Ингаляция через небулайзер будесонида 2 мг (независимо от возраста ребенка), разведенного в 0,9% растворе натрия хлорида до полного распыления препарата. Оценка эффективности лечения с динамическим мониторированием жизненно важных функций [частота сердечных сокращений (ЧСС), частота дыхания (ЧД), пульсоксиметрия]. Повторная оценка симптомов через 20 мин |
Купирование явлений обструкции и стабилизация дыхания. Стабилизация и поддержание жизненно важных функций |
Стеноз гортани II степени (3-7 баллов): ингаляция увлажненного 40% кислорода; ингаляция будесонида 2 мг, разведенного в 0,9% растворе натрия хлорида до полного распыления препарата; дексаметазон 0,6 мг/кг внутримышечно или преднизолон 2-5 мг/кг. Оценка эффективности лечения с динамическим мониторированием жизненно важных функций (ЧСС, ЧД, пульсоксиметрия). Повторная оценка симптомов через 20 мин |
Госпитализация в инфекционное отделение стационара после проведения лечебных мероприятий. Транспортировка в положении сидя |
Стеноз гортани III степени (>8 баллов): ингаляция увлажненного чистого кислорода. Медикаментозное лечение: ингаляция эпинефрина (Адреналина♠) 0,1% раствора - 0,1-0,2 мг/кг (не более 5 мг) через небулайзер в 3 мл 0,9% раствора натрия хлорида до полного распыления препарата; ингаляция будесонида 2 мг, разведенного в 2-3 мл 0,9% растворе натрия хлорида до полного распыления препарата в течение 15 мин; преднизолон 2-5 мг/кг или дексаметазон 0,6 мг/кг внутримышечно или внутривенно. Оценка эффективности лечения с динамическим мониторированием жизненно важных функций (ЧСС, ЧД, пульсоксиметрия). Повторная оценка симптомов через 20 мин |
|
Стеноз гортани IV степени: оксигенотерапия увлажненным чистым кислородом; дексаметазон 0,6 мг/кг или преднизолон 5 мг/кг внутривенно; реанимационные мероприятия. Интубация трахеи трубкой диаметром на 0,5 меньше возрастного размера или коникотомия с предварительным введением 0,1% раствора атропина (Атропина сульфата♠) 10 мкг/кг (0,05 мл на год жизни) и диазепама (Реланиума♠) 0,3-0,5 мг/кг внутривенно. Для временного поддержания дыхания допустима пункция трахеи 2-3 иглами большого диаметра |
Госпитализация в отделение реанимации и интенсивной терапии |
Препараты, не рекомендуемые при лечении острого стенозирующего ларинготрахеита:
АНГИОНЕВРОТИЧЕСКИЙ ОТЕК ГОРТАНИ
Ангионевротический отек может быть наследственным и аллергической природы.
Наследственный ангионевротический отек - заболевание, которое передается по аутосомно-доминантному типу, носит, как правило, семейный характер и обусловлено генетическим дефектом ингибитора первого компонента комплемента (С1-ингибитора). При отсутствии С1-ингибитора или уменьшении его активности происходит избыточная продукция брадикинина, вызывающего отеки.
Первые проявления наследственного ангионевротического отека наблюдают обычно в раннем детском возрасте, однако у 25% больных дебют заболевания приходится на возраст после 15 лет. В крови у больного определяют дефицит нейраминогликопротеина или наличие его неактивной формы - С1-ингибитора.
Клинически это проявляется образованием отеков любой локализации вследствие незначительного физического (механического) действия на ткани. Отеки появляются спонтанно либо провоцируются травмами, хирургическими вмешательствами, экстракцией и лечением зубов, ОРВИ, приемом препаратов-ингибиторов ангиотензин-превращающего фермента (АПФ). Перенесенный нервный стресс предшествует появлению отека у 30-40% больных. Отеки распространяются на лицо, гортань, конечности, половые органы и кишечную стенку; возможны значительные боли в брюшной области. Продолжительность эпизодических отеков 1-3 дня. Наиболее угрожающе возникновение отека гортани, который приводит к гибели больного от асфиксии. При этом антигистаминные препараты и системные ГК при этих отеках неэффективны.
Анализ больных с асфиксией при наследственном ангионевротическом отеке показал существенное повышение риска у больных с недиагностированным наследственным ангионевротическим отеком, а также подтверждена необходимость своевременной диагностики заболевания.
Лечение наследственного ангионевротического отека связано с восполнением дефицита С1-ингибитора. При распространении отека на гортань - обеспечение свободной проходимости ВДП: интубация трахеи; при ее невозможности следует произвести крикотиреоидотомию или трахеостомию.
Ранее в педиатрической практике для лечения приступов активно использовали андрогены и антифибринолитики. Однако признано, что препараты рС1-INH более безопасны и эффективны, особенно у детей. Кроме того, обширные данные свидетельствуют об эффективности рС1-INH в лечении приступов.
Для профилактики и лечения наследственного ангионевротического отека доступен ряд современных методов, хотя опыт их применения у детей недостаточен: C1-INH, очищенный от плазмы; рекомбинантный C1-INH; ингибиторы калликреина и антагонисты рецепторов брадикинина.
Аллергическая форма ангионевротического отека гортани развивается вследствие сенсибилизации организма к пищевым и лекарственным аллергенам, к аллергенам микроклещей домашней пыли, животных и др. Часто наблюдают у детей с наследственной предрасположенностью к аллергии.
Нередко у больных обнаруживают атопический дерматит, пищевую и лекарственную аллергию. Заболевание начинается остро, иногда молниеносно. На фоне полного здоровья при отсутствии катаральных явлений, нормальной температуре тела возникает стеноз гортани различной степени, иногда сопровождающийся охриплостью. Нередко он сочетается с другими аллергическими проявлениями (отек губ, глаз, крапивница).
Лечение необходимо начинать с устранения аллергена. Для снятия аллергического отека применяют Адреналин♠ , парентерально вводят ГК, антигистаминные препараты.
ЭПИГЛОТТИТ
Острый эпиглоттит - причина прогностически серьезной обструкции гортани за счет сужения дыхательных путей вследствие обширного воспалительного отека слизистой оболочки надгортанника и черпалонадгортанных складок.
Отсутствие адекватного лечения заболевания приводит к тяжелой, иногда смертельной обструкции ВДП. Это определяет необходимость своевременной диагностики заболевания, интенсивной и адекватной тактики лечения.
Наиболее частый возбудитель - гемофильная палочка типа b, реже гемолитический стрептококк, золотистый стафилококк, пневмококк.
До введения вакцинации против гемофильной инфекции частота заболеваний, вызванных этим возбудителем, у детей до 5 лет в разных странах была в пределах 30-130 на 100000 детей. В странах, в которых проводится вакцинация против гемофильной инфекции, этиологическая структура эпиглоттита изменилась; среди возбудителей инфекции стали преобладать стрептококки.
Предрасположенность детей к этому заболеванию обусловлена анатомическими и физиологическими особенностями дыхательных путей в детском возрасте.
Клиническая картина
Для эпиглоттита характерно острое начало и быстро прогрессирующее ухудшение состояния за счет глубокой депрессии дыхания. Начавшись внезапно, с быстрого подъема температуры тела, эпиглоттит протекает с тяжелым общим состоянием, першением и болью в горле, особенно при глотании, слюнотечением, дисфагией, которая связана с болевым фактором и выраженностью воспаления в гортани. Голос изменяется от осиплости до афонии. Ребенок беспокоен, отказывается от еды; характерны стридор и диспноэ. Вследствие быстро нарастающей обструкции и респираторного дистресса бледность сменяется цианозом, появляются вялость, угнетение сознания. Асфиксия наступает через 4-5 ч после начала заболевания в результате ущемления отечного надгортанника в просвете голосовой щели или неподвижности черпаловидных хрящей и голосовых складок за счет отека.
При осмотре ребенок занимает вынужденное положение - поза «треножника»: сидит, наклонив туловище вперед, опершись руками на колени с выдвинутым вперед подбородком, шейный отдел позвоночника максимально разогнут, язык выступает из ротовой полости, обильное слюнотечение. Ребенок часто спокоен, если не возбужден вследствие гипоксии. При вдохе и выдохе прослушиваются звуки с преобладанием низких тонов. У ребенка с эпиглоттитом редко наблюдают кашель.
Тяжелый стридор, ретракция области над грудиной и под ней с цианозом свидетельствуют об угрозе полной непроходимости дыхательных путей. Это тяжелое осложнение с остановкой дыхания может быть спровоцировано чрезмерно активным обследованием больного, включая использование шпателя для осмотра ротовой части глотки.
Диагностика эпиглоттита нередко затруднена, но важна, так как своевременное антибактериальное лечение предотвращает прогрессирование обструкции.
В гемограмме отмечают выраженные воспалительные изменения: лейкоцитоз, палочкоядерный сдвиг формулы влево, увеличение скорости оседания эритроцитов (СОЭ). Положительные результаты посевов культуры крови получают в среднем у 66% больных, при посеве слизи из зева - 39%.
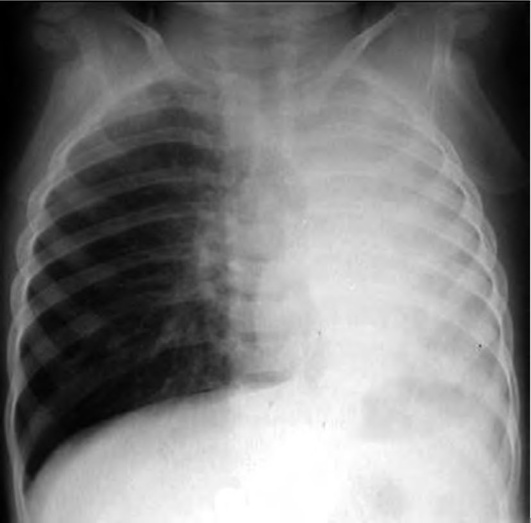
Дополнительный метод диагностики - рентгенография шейного отдела в переднезадней и латеральной проекциях (рис. 3-2). Проведение исследования - иногда причина отсрочки восстановления проходимости дыхательных путей. Рентгенографию необходимо выполнять только при сомнительном диагнозе и при сопровождении ребенка врачом, владеющим методикой интубации. Рентгенографию производят в вертикальном положении ребенка. Не следует пытаться получить рентгенограммы у больных с тяжелыми расстройствами дыхания. Диагностические признаки - тень надгортанника при увеличенном объеме набухшей мягкой ткани и, что более важно, округленный и утолщенный край черпалонадгортанных складок (положительный «симптом большого пальца»). Однако отрицательные данные рентгенографии не исключают эпиглоттит, особенно в ранней стадии. Для диагностики рекомендуют использовать ультразвуковое исследование (УЗИ).
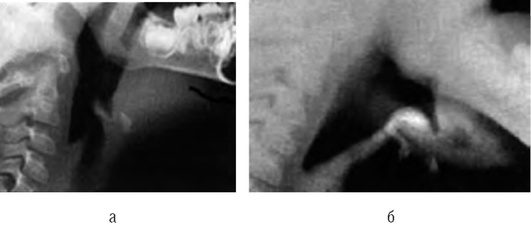
Обследование ребенка, оценку его состояния необходимо выполнять в палате интенсивной терапии стационара. Лучший метод диагностики - осмотр гортани гибким эндоскопом. При отсутствии фиброскопа применяют зеркальную или прямую ларингоскопию. При осмотре обнаруживают ярко-красный утолщенный малоподвижный надгортанник, на котором определяют пузыри, заполненные геморрагической жидкостью, серовато-грязные островки омертвевшего эпителия, густые слизисто-гнойные или геморрагические выделения. Отек и гиперемия часто распространяются на черпаловидно-надгортанные складки, черпаловидные хрящи и ложные голосовые связки.
Особо сложна дифференциальная диагностика болезни для врачей амбулаторного звена и скорой помощи, поскольку эпиглоттит сопровождается клиническими симптомами, похожими на стенозирующий ларинготрахеит вирусной этиологии. На догоспитальном этапе диагностика эпиглоттита основана только на знании особенностей клинических проявлений заболевания и их отличий от клинической картины крупа, что особенно важно в связи с разной тактикой ведения этих больных (табл. 3-7).
Тактика ведения на догоспитальном этапе
| Признак | Эпиглоттит | Острый стенозирующий ларинготрахеит (вирусный круп) |
|---|---|---|
Возраст |
Любой |
6 мес - 3 года |
Сезонность |
Отсутствует |
Осень-весна |
Этиология |
Бактериальная |
Вирусная |
Развитие заболевания |
Очень быстрое (часы) |
Часто постепенное |
Положение тела |
Сидячее |
Любое |
Запрокидывание головы |
Типично |
Нетипично |
Выдвижение вперед нижней челюсти |
Типично |
Нетипично |
Беспокойство |
Не выражено |
Выражено |
«Дыхательная паника» |
Типична |
Нетипична |
Голос, плач |
Приглушенный, затрудняющий речь |
Хриплый |
Дисфагия |
Всегда |
Отсутствует |
«Лающий» кашель |
Нехарактерен, возможен сухой кашель |
Всегда |
Слюнотечение |
Типично |
Нетипично |
Цианоз |
Всегда |
Редко |
Темп прогрессирования дыхательной недостаточности |
Быстрый |
Постепенный |
Температура тела |
Высокая |
Субфебрильная, нормальная |
Красный надгортанник |
Всегда |
Редко |
Картина крови |
Лейкоцитоз со сдвигом формулы влево |
Как правило, норма |
Эффект от гормонотерапии |
Отсутствует |
Положительный |
Распространенные ошибки ведения ребенка на догоспитальном этапе:
-
необоснованное применение антигистаминных и нейроплегических препаратов, обладающих седативным эффектом;
-
попытка осмотреть гортань, дотрагиваясь до корня языка шпателем, - возможна остановка дыхания;
-
необоснованное применение небулизированных ЛС - ипратропия бромида + фенотерола (Беродуал♠ ), будесонида (Пульмикорт♠ ) - патогенетически не обосновано и приводит к потере времени;
-
транспортировка в положении лежа - внезапная остановка дыхания.
При тяжелом нарушении дыхания и появлении признаков декомпенсации дыхательной недостаточности необходимо восстановление проходимости дыхательных путей. Назотрахеальная интубация под общей анестезией предпочтительна как более безопасный метод в связи с лучшей переносимостью и меньшим числом осложнений. При выполнении назотрахеальной интубации необходимо учитывать высокую вероятность возникновения полной обструкции дыхательных путей, которая обусловлена отеком входа в гортань, задержкой эвакуации мокроты и ларингоспазмом.
Трахеостомия - крайняя мера.
У многих детей с острым эпиглоттитом, несмотря на восстановление проходимости дыхательных путей с помощью интубации трахеи или трахеостомии, сохраняется гипоксемия. Клинические исследования показали, что гипоксемия связана не с пневмоническими изменениями, а с интерстициальным отеком, вызванным, вероятнее всего, токсическим действием. Ингаляция 30% кислорода в таких случаях достаточна для нормализации газообмена.
Исход заболевания в целом благоприятный и во многом зависит от своевременности неотложного лечения ребенка.
БАКТЕРИАЛЬНЫЙ ТРАХЕИТ
Бактериальный трахеит - не частое, но жизнеугрожающее заболевание; характеризуется острым воспалением трахеи бактериального происхождения, сопровождаемым скоплением густой гнойной мокроты, которая иногда напоминает мембраны. Отсюда другое название этого заболевания - «псевдомембранозный трахеит». Фибринозно-гнойное воспаление с формированием пленок распространяется из подсвязочного пространства на нижележащие отделы, о чем свидетельствует сохранение дыхательной недостаточности после интубации.
Надгортанник и черпаловидный хрящ обычно не поражены, но описаны случаи сочетания эпиглоттита и трахеита.
Этиология
Самый частый возбудитель - Staphylococcus aureus, Haemophilus influenzae тип b, beta-hemolytic Streptococcus, preumococcus, Moraxella catarrhalis; иногда грамотрицательные энтрогенные бактерии и Pseudomomonas aeruginosa.
Бактериальный трахеит часто возникает зимой и осенью у детей в возрасте от 6 мес до 8 лет. Средний возраст - 5 лет.
Описаны случаи заболевания как осложнение после тонзиллэктомии или аденоидотомии.
Клиническая картина
Симптомы заболевания с вирусным ларинготрахеобронхитом: у ребенка выражена интоксикация, наблюдают лихорадку и признаки прогрессирующей обструкции ВДП, которые проявляются стридором, глухим голосом, дисфагией, навязчивым кашлем. Крупозный кашель и отсутствие слюнотечения позволяют отличить это состояние от эпиглоттита.
При заболевании большой риск - появление обструкции нижних дыхательных путей с последующей гипоксемией, остановкой дыхания и смертью. Смертность при таком состоянии 4-20%. Большая вероятность развития тяжелой пневмонии, переходящей в ОРДС.
Лечение проводят в отделении интенсивной терапии; необходимы ранняя интубация с агрессивной санацией трахеи, внутривенное введение антибиотиков: цефуроксима, цефтриаксона или цефотаксима. Если возникает подозрение на анаэробную инфекцию, необходимо применять клиндамицин.
Обструкция нижних дыхательных путей
СИНДРОМ ОСТРОЙ БРОНХИАЛЬНОЙ ОБСТРУКЦИИ
Обструктивные нарушения дыхания в нижних дыхательных путях возникают при обструкции трахеи на уровне карины, крупных и средних бронхов.
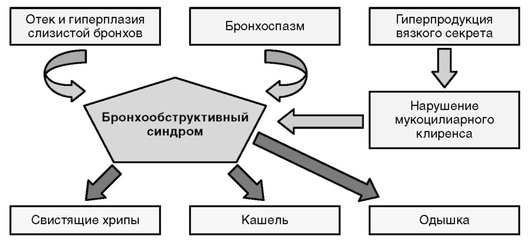
Бронхообструктивный синдром (БОС) - симптомокомплекс, связанный с нарушением бронхиальной проходимости функционального или органического генеза.
Синдром острой бронхиальной обструкции часто развивается на фоне острого или рецидивирующего обструктивного бронхита, бронхиолита. К обструкции нижних дыхательных путей приводят БА, другие хронические неспецифические заболевания легких, отек легких, аспирационный синдром.
БОС достаточно часто встречают у детей, особенно первых 3 лет жизни. На его возникновение и развитие влияют различные факторы, и прежде всего ОРВИ.
Частота бронхиальной обструкции на фоне инфекционных заболеваний нижних дыхательных путей у детей раннего возраста составляет 5-40%. У детей с отягощенным аллергическим семейным анамнезом БОС, как правило, развивается чаще - 30-40%.
Анатомо-физиологические факторы, предрасполагающие к развитию БОС у детей:
Основа синдрома - диффузная обструкция воздухопроводящих путей. От ее степени, механизмов формирования, уровня развития (проксимальный или дистальный) зависят клинические проявления болезни. Проявления БОС тесно связаны с механизмом бронхиальной обструкции.
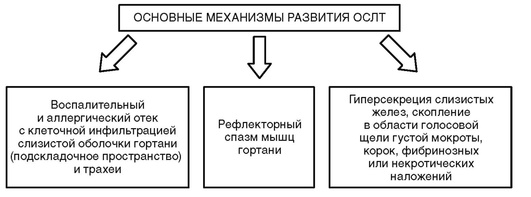
Патогенетические механизмы бронхообструкции (рис. 3-3) - спазм гладких мышц бронхов, отек слизистой оболочки бронхиального дерева с возможной транссудацией отечной жидкости в просвет бронхов, гиперсекреция слизи, гнойные корки с механической обструкцией ими просвета бронхов, коллапс бронхиол из-за давления на них извне раздутыми альвеолами. Спазм бронхиальных мышц и дискинезия бронхов обусловливают разнообразную клиническую картину заболевания.
Нарушения бронхиальной проходимости в большинстве случаев обусловлены всеми этими механизмами, но у каждого больного возможно преобладание какого-либо фактора в большей степени, чем и обусловлено разнообразие клинических признаков.
Клиническая картина БОС у детей:
-
удлиненный свистящий выдох, который слышен на расстоянии от больного;
-
вздутая грудная клетка при осмотре (горизонтальное положение ребер), участие в акте дыхания вспомогательных мышц, втяжение межреберных промежутков; признаки дыхательной недостаточности отсутствуют;
-
кашель сухой, приступообразный, длительный; в конце первой недели переходит во влажный;
-
аускультативно выслушивают жесткое дыхание, выдох удлинен, много сухих свистящих хрипов, возможны средне- и крупнопузырчатые малозвучные хрипы;
-
на рентгенограмме грудной клетки - разрежение легочной картины в латеральных отделах легких и сгущение в медиальных (скрытая эмфизема).
Важная особенность формирования обратимой бронхиальной обструкции у детей первых 3 лет жизни - преобладание воспалительного отека и гиперсекреции вязкой слизи над бронхоспастическим компонентом.
У детей старшего возраста в генезе обструкции преобладает бронхоспазм вследствие действия биологически активных веществ - гистамина, серотонина, медленно реагирующей субстанции анафилаксии и др., бронхиальная обструкция возникает внезапно и быстро.
Для синдрома острой бронхиальной обструкции характерны гипоксемия, дыхательный ацидоз.
Степень тяжести ОДН коррелирует со степенью бронхиальной обструкции. При оценке тяжести необходимо помнить, что нарастание дыхательных нарушений может не сопровождаться дальнейшим учащением дыхания. Следует оценивать участие вспомогательных мышц в акте дыхания, выраженность втяжений уступчивых мест грудной клетки, наличие экспираторной одышки, характер кашля.
По выраженности обструкции выделяют легкую степень тяжести, среднетяжелую и скрытую бронхиальную обструкцию (табл. 3-8).
Клинические признаки |
Степень тяжести бронхиальной обструкции |
||
|---|---|---|---|
легкая |
среднетяжелая |
тяжелая |
|
Малопродуктивный кашель |
+ |
+ |
+ |
Дыхание при аускультации |
Сухие свистящие хрипы в конце выдоха |
Сухие свистящие хрипы на вдохе и выдохе |
Громкое свистящее дыхание на вдохе и выдохе |
Дистанционные хрипы |
При беспокойстве |
Слышны на расстоянии |
Слышны на расстоянии |
Экспираторная одышка |
При беспокойстве и физическом напряжении |
В покое |
Выраженная в покое |
Участие вспомогательных мышц в дыхании |
Втяжение межреберных промежутков при беспокойстве |
Втяжение уступчивых мест грудной клетки в покое |
Выраженное участие всех дыхательных мышц |
Изменение сознания |
Не изменено или возбуждение |
Возбуждение или вялость |
Вялость |
ЧСС |
Умеренная тахикардия или норма |
Тахикардия |
Выраженная тахикардия |
Цианоз |
Отсутствует |
Носогубного треугольника |
Бледность, цианоз носогубного треугольника |
Бронхиальную обструкцию у детей раннего возраста, как правило, диагностируют на основании клинико-анамнестических данных и результатах физического и функционального обследования. В первые годы жизни ребенка проводят исследование периферического сопротивления дыхательных путей (техника прерывания потока) и бодиплетизмографию, позволяющие с определенной вероятностью выявить и оценить обструктивные и рестрективные изменения.
Для диагностики БОС и определения степени его выраженности у детей старше 5 лет используют инструментальные методы исследования и запись кривой форсированной жизненной емкости легких, оценку скорости потока выдыхаемого воздуха с помощью пикфлуометра.
При оценке функционального состояния системы дыхания у больного с бронхообструкцией на всех этапах обследования обязательно выполнение фармакологических проб с бронхолитиками (симпатомиметики, холиноблокаторы). Это дает возможность не только восстановить обратимость нарушений бронхиальной проходимости, но и предположить механизмы их формирования. Например, при улучшении показателей бронхиальной проходимости (значительным считается прирост их на 15% и более по сравнению с исходным уровнем) после ингаляции симпатомиметика можно говорить о преобладании бронхоспазма в генезе БОС.
Лечение БОС прежде всего необходимо направить на устранение причины заболевания, которое привело к обструкции.
Для лечения синдрома острой бронхиальной обструкции в качестве средств первой помощи рекомендуют использовать β2 -адреномиметики короткого действия (сальбутамол) ингаляционно через небулайзер (2,5 мл - 1 небула) или дозированный аэрозольный ингалятор (ДАИ; 100 мкг на ингаляцию) со спейсером. Однако ДАИ даже при наличии маски или спейсера не всегда удается использовать у детей раннего возраста.
Для небулайзерной терапии используют антихолинергические препараты, блокирующие мускариновые м3 -рецепторы для ацетилхолина - ипатропиум бромид (Атровент♠ ) 100-250 мг, а через ДАИ - 20 мкг в ингаляционной дозе, 2-4 дозы.
Физиологическая особенность детей раннего возраста - наличие относительно небольшого числа β2 -адренорецепторов. С возрастом их число увеличивается и чувствительность к действию медиаторов повышается. Чувствительность м-холинорецепторов достаточно высока с первых месяцев жизни. Таким образом, наиболее часто в комплексном лечении БОС у детей раннего возраста используют комбинированный препарат Беродуал♠ , состоящий из ипатропия бромида и β2 -агониста короткого действия фенотерола. Доза препарата через небулайзер - 0,5-1 мл на 1 ингаляцию, с помощью ДАИ - 1-2 дозы со спейсером большого объема.
Теофиллины короткого действия - аминофиллин (Эуфиллин♠ ), обладая бронхолитической и в определенной мере противовоспалительной активностью, имеют большое число побочных эффектов, что связано с небольшой «терапевтической широтой» препарата (близость терапевтической и токсической концентрации). Европейским респираторным обществом рекомендовано использование препаратов теофиллина только при мониторировании его сывороточной концентрации, которая не коррелирует с введенной дозой препарата. Теофилины - препараты второй очереди, их используют при недостаточном эффекте β2 -агонистов и антихолинергических препаратов. При выраженной бронхообструкции аминофиллин (Эуфиллин♠ ) вводят внутривенно в дозе 4-5 мг/кг.
Тяжелое течение БОС у детей требует применения топических или реже системных ГК. Используют ингаляционный ГК: будесонид в небулах 0,5-1 мг или флутиказон (Фликсотид♠ ) 50-100 мкг, парентерально преднизолон в дозе 1-2 мг/кг (табл. 3-9).
| Оказание медицинской помощи | Результат |
|---|---|
Медикаментозное лечение Ингаляции через небулайзер: сальбутамол (Вентолин♠) - детям старше 18 мес 2,5 мг (1 небула); ипатропиум бромид (Атровент♠): детям до 6 лет - раствор для ингаляции 250 мкг/мл 0,4-1 мл (8-20 капель), детям 6-12 лет - 1 мл (20 капель), старше 12 лет - 2 мл (40 капель); Беродуал♠ (комбинированный препарат, включающий фенотерол - 500 мкг/мл, ипатропия бромид - 20 мкг/мл) детям до 6 лет - 10 капель, старше 6 лет - 20 капель. Все препараты для ингаляций разводятся 2-3 мл 0,9% раствора натрия хлорида. Среднее время ингаляции - 15 мин. Оценка эффективности лечения через 20 мин, динамическое мониторирование жизненно важных функций (ЧСС, ЧД, сатурации). Повторная оценка тяжести обструкции |
Ликвидация бронхоспазма, купирование или уменьшение тяжести дыхательной недостаточности |
При сохранении явлений обструкции: будесонид (Пульмикорт♠) - 0,25-0,5 мг в 2-3 мл раствора 0,9% натрия хлорида, ингаляционно через небулайзер до полного распыления препарата в течение 15 мин. При неудовлетворительном эффекте: преднизолон - 2-5 мг/кг внутримышечно или внутривенно. При невозможности проведения ингаляции: аминофиллин (Эуфиллин♠) - 2,4% 4 мг/кг (1 мл на каждый год жизни) в разведении 0,9% раствором натрия хлорида внутривенно струйно медленно в течение 10-15 мин. Оксигенотерапия чистым увлажненным кислородом. Интубация трахеи, вспомогательная ИВЛ при декомпенсации состояния |
Госпитализация; транспортировка в положении сидя |
ОСТРЫЙ БРОНХИОЛИТ
Заболевание часто наблюдают у детей до 1 года жизни; протекает с БОС и дыхательной недостаточностью. По данным разных авторов, летальность достигает 7%, причем все умершие дети в возрасте до 6 мес. Часть детей с ОДН, поступающих в больницу с разными диагнозами (пневмония, БА, ОРВИ и др.), в действительности страдают острым бронхиолитом.
Бронхиолит часто протекает с аллергическим компонентом, поэтому ухудшение состояния может быть внезапным. Острый бронхиолит наблюдают у детей, перенесших респираторный дистресс-синдром новорожденных. При бронхиолите поражены мелкие бронхиолы, вплоть до альвеолярных ходов.
Для большинства случаев бронхиолита доказана вирусная этиология в сочетании с аллергическим фоном; выделяют респираторный синцитиальный вирус, парагрипп, риновирусы. Бронхиолы при этом инфильтрированы, проходимость резко нарушена, как при приступе БА.
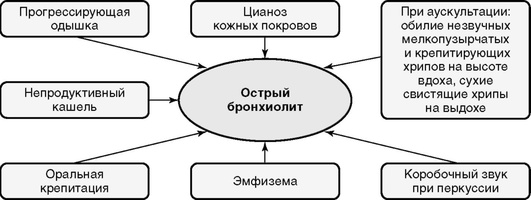
Клиническая картина
Заболевание развивается внезапно: гипертермия, одышка, выраженное беспокойство. В легких на выдохе выслушивают свистящие хрипы, активизирована работа дыхательных мышц. Работа межреберных и диафрагмальных мышц, участвующих в акте дыхания, при остром бронхиолите увеличена в среднем в 6 раз. Дыхание становится частым и поверхностным, создается впечатление, что грудная клетка эмфизематозна (рис. 3-4).
Тяжесть дыхательной недостаточности при бронхиолите определяют по шкале Флетчера (табл. 3-10).
| Критерий | 0 баллов | 1 балл | 2 балла | 3 балла |
|---|---|---|---|---|
ЧД в минуту |
Менее 40 |
40-50 |
51-60 |
Более 60 |
Затрудненное дыхание |
Нет |
Слегка |
Только при выдохе |
При выдохе и вдохе менее 1:1 |
Отношение времени вдоха и выдоха |
2,5:1 |
1,3:1 |
1:1 |
Менее 1:1 |
Участие вспомогательных дыхательных мышц |
Нет |
Сомнительно |
Умеренное |
Выражено |
При рентгенологическом исследовании выявляют отчетливую эмфизематозность легочных полей.
Лечение детей с бронхиолитом зависит от тяжести заболевания. Большинство детей имеют умеренные симптомы, и их лечат амбулаторно. Госпитализация показана больным группы риска, детям с обструкцией, вызывающей гипоксемию, апноэ, детям, неспособным принимать пищу внутрь, и при отсутствии дома адекватного ухода. Гипоксия, метаболический и респираторный ацидоз с их клинико-физиологическими проявлениями - естественное следствие бронхиолита. Парциальное давление кислорода в артериальной крови (ра О2 ) снижается до 55-65 мм рт.ст.
Неотложная терапия бронхиальной обструкции при бронхиолите зависит от степени тяжести состояния ребенка. Хороший эффект дают ингаляции β2 -агониста короткого действия (сальбутамол) или комбинированного препарата ипратропия бромид + фенотерол (Беродуал♠ ). Применение ГК оправдано у тяжелых больных. При риске остановки дыхания выполняют интубацию трахеи, СЛР. При обезвоживании, невозможности кормления - инфузионная терапия. Оксигенотерапия показана при снижении сатурации кислорода менее 92%, через носовой катетер или канюли. Ее эффект может повысить CPAP-терапия [1] - постоянное положительное давление в дыхательных путях.
БРОНХИАЛЬНАЯ АСТМА
Бронхиальная астма (БА) - одно из наиболее распространенных хронических заболеваний, которым страдают около 5-10% детей.
БА - гетерогенное заболевание, которое характеризуется хроническим воспалением дыхательных путей. Его диагностируют по респираторным симптомам (свистящее дыхание, одышка, стеснение в груди или кашель), вариабельным по длительности и интенсивности в сочетании с обратимой обструкцией дыхательных путей.
БА - актуальная проблема. Наравне с повседневным ростом числа больных, страдающих этим заболеванием, отмечена устойчивая тенденция к увеличению числа детей, которые нуждаются в оказании неотложной помощи. Их часто госпитализируют в стационар в связи с тяжелыми обострениями, угрожающими жизни.
При этом хроническом рецидивирующем заболевании значительно ограничена социальная и физическая активность больного. Исследования показали, что адекватное лечение БА значительно улучшает жизнедеятельность и повышает качество жизни таких детей. Основная цель врача - выбор методов лечения БА, в результате которых наступает стойкая ремиссия заболевания вне зависимости от его тяжести. Основные цели лечения БА - достижение хорошего контроля симптомов и поддержание нормального уровня активности ребенка. Важна минимизация риска обострений, нарушений в развитии легких и возникновения побочных эффектов.
Клиническая картина
Обострение БА протекает в виде острого приступа или затяжного состояния бронхиальной обструкции.
Приступ БА как проявление обострения - остро развившееся и/или нарастающее экспираторное удушье, затрудненное и/или свистящее дыхание, спастический кашель либо сочетание этих симптомов при значительном снижении показателя пиковой скорости выдоха (ПСВ). Сужение дыхательных путей обусловлено сокращением гладких мышц стенки бронха, отеком дыхательных путей, утолщением стенки бронха, гиперсекрецией слизи. Важный патофизиологический механизм обострения БА - гетерогенность вентиляции легких.
Для тяжелых обострений БА характерна гипоксемия. Гиперкапния возникает намного реже: ра СО2 поднимается до 45-60 мм рт.ст. только у 13% больных, превышает 60 мм рт.ст. - лишь у 4% больных. Это обусловлено тем, что в ответ на гипоксемию увеличивается ЧД, развивается респираторный алкалоз.
Обострение в виде затяжного состояния бронхиальной обструкции характеризуется длительным (в течение дней, недель, месяцев) затруднением дыхания с клинически выраженным синдромом бронхиальной обструкции, на фоне которого повторяются острые приступы БА различной тяжести.
Тяжесть обострения БА оценивают в соответствии с классификацией Глобальной стратегии по борьбе с бронхиальной астмой (GINA - от англ. Global Initiative for Asthma) 2014 г. (табл. 3-11).
В соответствии с классификацией GINA 2014 г. при легком приступе БА у больного выслушивают удлиненный выдох, сухие свистящие хрипы в конце выдоха, втяжение уступчивых мест грудной клетки не выражено, ЧД нормальная или увеличена на 30%, умеренная тахикардия, сознание не изменено, речь не страдает.
При среднетяжелом приступе БА общее состояние больного нарушено; над легкими определяют коробочный оттенок перкуторного звука, прослушивают свистящие хрипы; уступчивые места грудной клетки втянуты, продолжительность выдоха в 2 раза больше продолжительности вдоха, ЧД увеличивается на 50%, тахикардия.
Тяжелый приступ БА характеризуется признаками дыхательной недостаточности: цианоз носогубного треугольника, крыльев носа, мочек ушей. Бронхиальная проходимость нарушена, свистящие хрипы прослушивают как при вдохе, так и при выдохе; выражено втяжение уступчивых мест грудной клетки, выдох превышает по продолжительности вдох более чем в 2 раза; ЧД увеличивается более чем на 50%. У больных обнаруживают тенденцию к повышению артериального давления (АД), выраженную тахикардию.
| Признак | Легкое | Умеренное | Тяжелое | Угроза остановки дыхания |
|---|---|---|---|---|
Одышка |
Ходьба |
Разговор |
В покое |
- |
Психика |
Нет возбуждения |
Нет возбуждения |
Возбуждение |
Оглушенность, сонливость |
Разговор |
Предложения |
Фразы |
Слова |
- |
Свистящее дыхание |
Умеренное, обычно на выдохе |
Громкое |
Громкое |
Отсутствие свистов |
Положение |
Может лежать |
Предпочитает сидеть |
Ортопноэ |
- |
ЧСС в минуту |
<100 |
100-120 |
>120 |
Брадикардия, аритмия |
ЧД в минуту |
>20 |
>20 |
>30 |
Слабые дыхательные усилия |
ПСВ, % |
>80 |
50-80 |
<50 (<100 мл/мин) |
<33 |
Сатурация кислородом периферической крови (SpO2), % |
>95 |
91-95 |
<90 |
<90, цианоз |
Показатели выраженности обструкции бронхов - ПСВ, падение которой при БА находится в прямой зависимости от тяжести обострения. Величины ПСВ в пределах 50-80% должных значений свидетельствуют об умеренной или легкой степени нарушения бронхиальной проходимости, менее 50% должных значений - тяжелом обострении БА.
Повторные приступы, выражающиеся одышкой, втяжением уступчивых мест грудной клетки, хрипами, навязчивым и непродуктивным кашлем, особенно ночью и/или ранним утром - обструкция бронхиального дерева, частично обратимая спонтанно или под влиянием лечения.
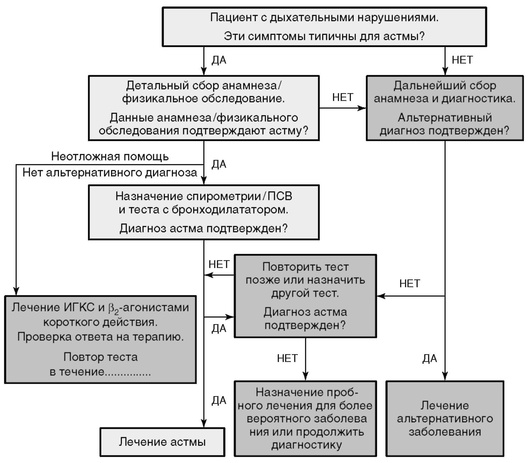
Диагностика БА (рис. 3-5) основана на анамнезе и характерной клинической картине, что особенно актуально для детей раннего возраста, на доказательстве обратимой обструкции дыхательных путей тестом с бронходилататором или другими тестами. Тесты, подтверждающие БА, рекомендованы до начала базисного лечения, на фоне которого, иногда достаточно длительного, не удается подтвердить обратимость и наличие скрытого бронхоспазма. Если невозможно подтвердить БА с помощью теста с бронходилататором, его необходимо повторить позже или начать пробное лечение для исключения или подтверждения БА. Использование пробного базисного лечения значительно облегчает диагностику и выбор дальнейшей тактики лечения.
Цель лечения БА - достижение и поддержка контроля заболевания. Каждый больной в зависимости от уровня контроля БА получает лечение, соответствующее одной из 5 ступеней. Лечение - непрерывный цикл: оценка уровня контроля БА, лечение до достижения контроля БА и мониторинг поддержания контроля.
Астматический статус
Астматический статус - тяжелое, угрожающее жизни осложнение течения БА. Его следует отличать от тяжелого приступа БА или серии следующих друг за другом приступов удушья на фоне обострения болезни. Ключевой признак астматического статуса - снижение эффективности бронхорасширяющих препаратов, и в первую очередь симпатомиметиков. Важную роль в патогенетическом механизме развития астматического статуса играет уменьшение числа адренергических рецепторов, расположенных в стенке бронхов, и снижение их чувствительности, развитие ОДН, сопровождаемой изменением газового состава крови - гипоксемией и гиперкапнией. Сочетание у больного этих признаков с приступом БА указывает на развитие астматического статуса.
Таким образом, астматический статус характеризуется клиническими признаками:
При ухудшении состояния больного исчезают дыхательные шумы, появляются диффузный цианоз, признаки сердечно-сосудистой недостаточности, метаболический ацидоз, гиперинфляция грудной клетки; снижается объем форсированного выдоха за 1-ю секунду; наступает асфиксия с потерей сознания, судорогами, гиподинамией, снижение ПСВ до уровня менее 40% должных величин.
Обострения и смертельный исход часто связаны с недооценкой степени тяжести больного, неправильными действиями при его наступлении и недостаточным лечением.
Для успешного лечения обострения БА необходимо его начинать при появлении самых ранних признаков ухудшения: учащении приступов удушья, отсутствии эффекта от ранее купировавших приступ средств, уменьшении продолжительности действия бронхорасширяющих препаратов и увеличении суточных доз бронхолитиков. Необходимо оценить наличие резкого прекращения приема ингаляционного ГК.
Причины смерти взрослых от БА, по данным Всемирной организации здравоохранения (ВОЗ), - асфиксия, гипоксия, обусловленная диффузным спазмом гладких мышц, спонтанный пневмоторакс, тромбоз ветвей легочной артерии, декомпенсированное легочное сердце, бесконтрольный прием больших доз β2 -агонистов (смерть вследствие развития угрожающих жизни нарушений ритма). Наиболее частая причина смерти детей при БА - асфиксия вследствие неадекватного лечения во время приступа, который быстро прогрессирует, приводя к смерти. Летальному исходу в немалой степени способствует недооценка врачом и окружающими степени тяжести состояния больного. Это ведет к отсутствию адекватного лечения.
У большинства больных молодого возраста смертельный исход наступает быстро, во время катастрофически прогрессирующего приступа. Анализируя причины летальных исходов в приступном периоде БА, констатировано наступление смерти в течение 1 ч - у 20% детей, в течение 2 ч после начала приступа - у 50%. Быстрое развитие фатального приступа дало основание многим клиницистам говорить о внезапной смерти при БА. Однако термин «внезапная смерть» при БА достаточно условен и далеко не всегда правомерен. По данным Британской ассоциации врачей, 9 из 10 летальных исходов можно предотвратить при своевременном адекватном лечении с обязательным использованием ГК. Резкое снижение дозы или отмена ГК, игнорирование лечения ГК, несмотря на клинические показания, - возможные причины летального исхода у детей.
Развитие асфиксии - признак крайней степени тяжести БА. Всех больных, ранее перенесших хотя бы однократно критическую ситуацию, угрожавшую жизни больного, необходимо отнести в группу риска смертельного исхода БА. Эти дети в анамнезе неоднократно госпитализированы в реанимационное отделение, перенесли клиническую смерть. У отдельных детей тяжелейшие приступы приводят к потере сознания, а при реанимационных мероприятиях нередко используют ИВЛ. Летальный исход у детей обусловлен асфиксией вследствие обтурации просвета бронхов, вплоть до мельчайших бронхиол, патологическим секретом. При этом густая, вязкая резиноподобная слизь образует слизистые пробки, обтурирующие просвет бронхов.
Тактика врача при лечении приступа БА
Детей, больных БА, лечат на основе принципов международной GINA 2014 г. и разработанных в России Национальных программ профилактики и лечения БА у детей.
Основа лечения обострения - многократное назначение быстродействующего ингаляционного β2 -агониста короткого действия, антихолинергического препарата или их комбинации; раннее применение системных ГК и ингаляции кислорода. Измерения ЧСС, ЧД и контроль симптомов помогают при лечении, однако определение легочной функции и пульсоксиметрия - ведущие методы.
При лечении необходимо мониторировать показатели тяжести состояния, особенно ПСВ у больных старше 5 лет, ЧСС, ЧД и показатели пульсоксиметрии у детей. При наличии пикфлоуметра или спирометра регистрируют степень снижения объема форсированного выдоха в 1-ю секунду или ПСВ менее 80% должных либо нормальных значений. Важный диагностический критерий - значительное увеличение объема форсированного выдоха за 1-ю секунду на 12% и более, ПСВ на 15% и более после ингаляции β2 -агонистов короткого действия. При тяжелой БА у многих больных возможна потеря эластических свойств легких. При этом наблюдают феномен «воздушной ловушки».
Пульсоксиметрия у детей особенно информативна, поскольку оценить у них объективные показатели функции легких затруднительно, а сатурация кислорода менее 92% - надежный признак показания к госпитализации больного. Насыщение крови кислородом у маленьких детей должно быть выше 95%. У детей, состояние которых ухудшается и при высокопоточной кислородотерапии, а сатурация составляет менее 90%, следует определять газы артериальной крови.
Пульсоксиметрия оценивает состояние оксигенации, ответ на лечение бронходилататорами и проводимую кислородотерапию. Низкая сатурация после проведения лечения отражает ухудшение состояния.
Рентгенография не относится к стандартным методам исследования, однако ее следует проводить при отсутствии ответа на лечение для исключения пневмоторакса, сопутствующих заболеваний легких. В приступном периоде БА у детей раннего возраста на рентгенограмме грудной клетки отмечают резкое эмфизематозное вздутие легких, горизонтальное положение ребер, широкие межреберные промежутки, усиление сосудистого рисунка, расширение легочных корней. Во время приступа БА преимущественно субсегментарные ателектазы, которые обычно быстро расправляются, выявляют у 6-7% больных (рис. 3-6).
Объем лечения при приступе БА зависит от степени тяжести обострения (табл. 3-12).
При легком приступе БА используют ингаляции одного из бронходилататоров с помощью ДАИ или небулайзера:
Лечение оценивают через 20 мин, при неудовлетворительном эффекте повторно используют дозу бронхолитического препарата. Критерии эффективности лечения: уменьшение одышки, количества сухих хрипов в легких и увеличение ПСВ.
При отсутствии эффекта повторно оценивают степень тяжести приступа БА и в соответствии с состоянием корригируют лечение.
| Тяжесть обострения | Алгоритм лечения |
|---|---|
Легкий приступ |
|
Среднетяжелый приступ |
|
Тяжелый приступ |
|
Астматический статус |
|
При среднетяжелом приступе проводят ингаляцию бронхолитических препаратов через ДАИ или, что предпочтительнее, через небулайзер: сальбутамол либо фенотерол + ипратропия бромид в течение 5-10 мин. Используют ингаляционные ГК (Пульмикорт♠ 1-2 мг), системные ГК внутрь или парентерально (преднизолон 1-2 мг/кг, дексаметазон 0,3-0,6 мг/кг). Лечение оценивают через 20 мин, при неудовлетворительном эффекте повторно дают дозу бронхолитического препарата, ГК.
После ликвидации острого, легкого и среднетяжелого приступа продолжают бронходилатационное лечение β2 -агонистами каждые 4-6 ч в течение 24-48 ч. При среднетяжелом приступе возможен перевод на пролонгированные бронхолитики (β2 -агонисты) до нормализации клинических и функциональных данных. В дальнейшем проводят коррекцию базисного противовоспалительного лечения.
Лечение больных с тяжелым обострением БА:
При тяжелом обострении БА проводят интенсивное продолжительное ингаляционное лечение раствором сальбутамола (0,15-0,3 мг/кг) или ипратропия бромида + фенотерола (Беродуала♠ , 50 мкг фенотерола на 1 кг массы тела) через небулайзер с интервалом 20 мин в течение 1 ч, затем каждые 1-4 ч или длительная небулизация. Применяют системные ГК - преднизолон внутримышечно, внутривенно 60-120 мг или внутрь 2 мг/кг. Для лечения тяжелых обострений БА у детей используют и другие ГК в эквивалентных дозах. По противовоспалительному эффекту 5 мг преднизолона соответствуют 25 мг кортизона ацетата, 20 мг гидрокортизона, 4 мг метилпреднизолона, 750 мкг дексаметазона или бетаметазона.
Применение аминофиллина (Эуфиллина♠ ) в настоящее время при приступах БА ограничено побочными эффектами. Однако его применение возможно при постоянном мониторировании его концентрации в крови. Необходимость инфузионного лечения аминофиллином (Эуфиллином♠ ) у детей с тяжелым обострением БА обусловлена наличием у них выраженной, иногда тотальной обструкции бронхов, связанной с бронхоспазмом и закрытием просвета бронхов густым вязким секретом, затрудняющим попадание аэрозолей β2 -агонистов или ипратропия бромида + фенотерола (Беродуала♠ ) в нижние дыхательные пути. Больным с тяжелым обострением БА аминофиллин (Эуфиллин♠ ) вводят внутривенно капельно из расчета 0,9 мг/кг ежечасно до выведения ребенка из тяжелого состояния. Физиологический раствор вводят из расчета 12 мл на 1 кг массы тела в первый час и по 50-80 мл/кг в сутки в зависимости от возраста ребенка для поддерживающего лечения.
Инфузионное лечение аминофиллином (Эуфиллином♠ ) целесообразно проводить под контролем концентрации аминофиллина в сыворотке крови, что позволяет поддерживать оптимальные терапевтические концентрации аминофиллина (Эуфиллина♠ ) в пределах 10-15 мкг/мл и избежать развития побочных явлений.
При удовлетворительном эффекте лечения (улучшение состояния, увеличение ПСВ, ра О2 ) небулайзерное лечение продолжают каждые 4-6 ч в течение 24-48 ч, дают повторно системные ГК 1-2 мг/кг каждые 6 ч. При неудовлетворительном эффекте (нарастание симптомов, отсутствие увеличения ПСВ, ра О2 ) необходимо повторное введение системных ГК: преднизолон в дозе 2 мг/кг внутривенно, внутримышечно (суммарная доза 10 мг/кг в сутки) или внутрь детям до 1 года - 1-2 мг/кг в сутки, 1-5 лет - 20 мг/сут, старше 5 лет - 20-60 мг/сут; внутривенное введение аминофиллина (Эуфиллина♠ ) непрерывно или дробно каждые 4-5 ч под контролем концентрации аминофиллина в крови. После ликвидации тяжелого приступа применяют бронхолитические препараты [β2 -агонисты короткого действия сальбутамол, ипратропия бромид + фенотерол (Беродуал♠ )] каждые 4 ч в течение 3-5 дней; возможен перевод на пролонгированные бронхолитики (β2 -агонисты, метилксантины). Системные ГК (преднизолон) применяют внутривенно, внутримышечно или внутрь в дозе 1-2 мг/кг в сутки в течение 3-5 дней до купирования бронхиальной обструкции. Коррекцию базисной терапии ингаляционным ГК проводят с увеличением дозы в 1,5-2 раза.
Лечение при астматическом статусе
Клинически значимая острая гипоксемия при астматическом статусе определяет в его лечении важность оксигенотерапии чистым кислородом. Необходимы постоянное мониторирование АД, ЧД, ЧСС, пульсоксиметрия. Внутривенное введение ГК в больших дозах оказывает при астматическом статусе противовоспалительное и противоотечное действие, восстанавливает чувствительность адренергических рецепторов бронхов. Вследствие тяжелой бронхиальной обструкции ингаляционные ГК не достигают основной точки приложения своего действия - мелких бронхов. Они лишь раздражают слизистую оболочку крупных бронхов и способны усугубить бронхоспазм на фоне выраженной бронхиальной гиперреактивности. Системное действие ингаляционных ГК вследствие их всасывания невелико и не дает заметный эффект при астматическом статусе.
После катетеризации вены вводят внутривенно преднизолон 2-5 мг/кг или дексаметазон 0,3-0,5 мг/кг; подкожно эпинефрин (Адреналин♠ ) 0,01 мл/кг или 1:1000 (1 мг/мл) (максимальная доза 0,3 мл). При отсутствии эффекта применяют внутривенную инфузию 2,4% раствора аминофиллина (Эуфиллина♠ ) 4-6 мг/кг в течение 20-30 мин с последующим продолжением в дозе 0,6-0,8 мг/кг в час, используя изотонический раствор хлорида натрия и 5% раствор декстрозы (Глюкозы♠ , 1:1). При нарастающей гипоксии выполняют интубацию, ИВЛ, продолжают инфузионное лечение глюкозо-солевыми растворами в дозе 30-50 мл/кг со скоростью 10-15 капель в минуту. Показания для ИВЛ - прогрессирующее ухудшение состояния больного, гипоксемия, гиперкапния, утомление дыхательных мышц, сопорозное сознание, остановка дыхания, стадия «немого легкого».
Восстановление чувствительности β-адренорецепторов на фоне стероидной терапии при астматическом статусе в дальнейшем дает основание для применения бронхолитических средств, в частности симпатомиметиков. По-видимому, риск их применения при астматическом статусе на фоне обязательной стероидной терапии преувеличен. Осторожное, но достаточно активное бронхолитическое лечение важно после купирования астматического статуса.
Полное купирование обострения БА обычно происходит постепенно. Показатели функции легких нормализуются в течение нескольких дней, а снижение гиперчувствительности дыхательных путей - нескольких недель. Симптомы и физические объективные признаки не являются точным индикатором бронхиальной обструкции. Интенсивное лечение следует продолжать до тех пор, пока показатели функции легких (ПСВ или объем форсированного выдоха на 1-ю секунду) не вернутся к значениям, близким к нормальным или наилучшим индивидуальным. Особенности лечения бронхолитическими препаратами Ингаляции быстродействующих бронхолитиков - важнейший компонент лечения обострений БА. Бронхолитики I линии - быстродействующие β2 -агонисты: сальбутамол и фенотерол. При резистентности к лечению I линии β2 -агонистами добавляют бронхолитик II линии - м-холинолитик ипратропия бромид с фенотеролом или холинолитик ипратропия бромид (табл. 3-13).
| Название | Группа | ДАИ, мкг | Доза | Раствор для ингаляций | Доза |
|---|---|---|---|---|---|
Сальбутамол (Вентолин♠, Саламол♠) |
β2-Агонист |
100 |
2 ингаляции 3-4 раза в сутки |
Небула - 1 мг/1-2,5 мл |
1-2,5 мл однократно |
Фенотерол + ипратропия бромид (Беродуал♠) |
β2-Агонист + м-холинолитик |
Фенотерол 50 + ипратропия бромид 20 |
2 ингаляции 3-4 раза в сутки |
1 мл - фенотерол 500 мкг + ипратропия бромид 250 мкг |
До 6 лет - до 10 капель 3-4 раза в сутки; 6-12 лет - 10-20 капель 3-4 раза |
Ипратропия бромид (Атровент♠) |
м-Холинолитик |
20 мкг |
2 ингаляции 3-4 раза в сутки |
1 мл - 250 мкг |
8-20 капель 4 раза |
β2 -Агонисты - стимуляторы адренергических рецепторов - при ингаляционном применении дают быстрый (через 3-5 мин) бронходилатирующий эффект. Их применяют в ДАИ, ДАИ со спейсером, в аэролайзере и в виде растворов для распыления через небулайзер.
Физиологическая особенность детей раннего возраста - относительно небольшое число β2 -адренорецепторов; с возрастом их число увеличивается и повышается чувствительность к действию медиаторов.
Чувствительность м-холинорецепторов достаточно высока с первых месяцев жизни. Комбинированный бронхоспазмолитический препарат Беродуал♠ , в состав которого входят фенотерол и ипратропия бромид, более эффективен, чем раздельное применение составляющих его препаратов. Компоненты препарата имеют разные точки приложения и механизмы действия. Комбинация препаратов обеспечивает лучший эффект, чем применение отдельно каждого препарата (ПСВ и объем форсированного выдоха на 1-ю секунду). Преимущества комбинированных препаратов ипратропия бромида в сочетании с β2 -агонистами выявлены и у больных с недостаточным ответом на монотерапию β2 -агонистами. Вагус-опосредованный бронхоспазм у таких больных невозможно эффективно купировать при монотерапии β2 -агонистами. Преимущества комбинированного лечения особенно заметны при тяжелых обострениях Ба (уровень доказательности А). Холинолитическим эффектом ипратропия бромида обусловлена и более выраженная динамика гиперкринии и дискринии, отделения большого количества мокроты у детей и у взрослых с обострениями БА.
Использование рекомендаций GINA 2014 г. по ступенчатому лечению обострения БА, как на догоспитальном этапе, так и в стационаре, позволяет значительно уменьшить частоту тяжелых обострений БА, в том числе частоту астматических состояний, и вероятность летальных исходов.
В последние годы в клиническую практику внедрены высокоактивные, эффективные и патогенетически обоснованные препараты, при использовании которых в значительной степени решают задачи контроля течения БА и поддержания качества жизни на достаточно высоком уровне.
АСПИРАЦИОННЫЙ СИНДРОМ
Аспирация - попадание ИТ, жидкости в дыхательные пути в результате их засасывания потоком вдыхаемого воздуха.
Аспирация может быть бессимптомной или фатальной. Когда дети со сниженным уровнем сознания аспирируют содержимое желудка с рвотой, это приводит к тяжелой пневмонии или ОРДС. Наиболее частые причины аспирационного синдрома:
Клиническая картина аспирации ИТ у детей разнообразна: остро развившееся угрожаемое состояние по типу обструкции дыхательных путей или состояние, сопровождаемое хроническим кашлем.
Клинические признаки обструкции ИТ:
Очень важна дифференциальная диагностика обструкции дыхательных путей, вызванной ИТ, инфекцией или аллергической реакцией.
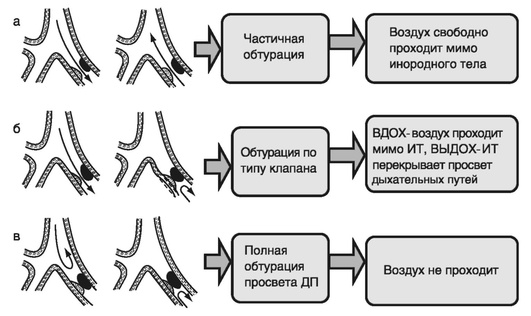
По механизму обструкции дыхательных путей ИТ различают: на необтурирующие просвет, обтурирующие по типу «клапана» и полностью обтурирующие просвет дыхательных путей (рис. 3-7).
ИТ может находиться в носовых ходах, гортани, трахее, бронхах, в ткани самого легкого, в плевральной полости. Несмотря на многообразие клинических симптомов, необходимо выделять наиболее характерные признаки определенной локализации ИТ в дыхательных путях.
ИТ гортани встречается реже, чем в нижних дыхательных путях, но представляет большую угрозу для жизни ребенка вследствие стеноза. Ребенок обычно поступает в ближайшие сроки после аспирации.
В гортани ИТ задерживается на уровне вестибулярных и голосовых складок. В результате попадания в гортань ИТ наступает острая асфиксия, которая даже при небольших его размерах - результат рефлекторного спазма мышц гортани. Начальный период продолжается, как правило, 10-30 мин, сопровождаясь удушьем. Одышка носит инспираторный характер; дыхание может быть бесшумным, шумным, астматическим, стридорозным, свистящим. Постепенно вследствие истощения защитных рефлексов наступает успокоение.
Кашель - частый симптом ИТ дыхательных путей, носит приступообразный характер и иногда не прекращается ни днем, ни ночью.
Кровохарканье свидетельствует о ранении слизистой оболочки ИТ.
Перкуторно над легкими определяют коробочный звук, при аускультации выслушивают ослабленное дыхание. Прямая ларингоскопия - диагностическое и лечебное мероприятие.
Подозрение на ИТ дыхательных путей - основание для дальнейшего обследования.
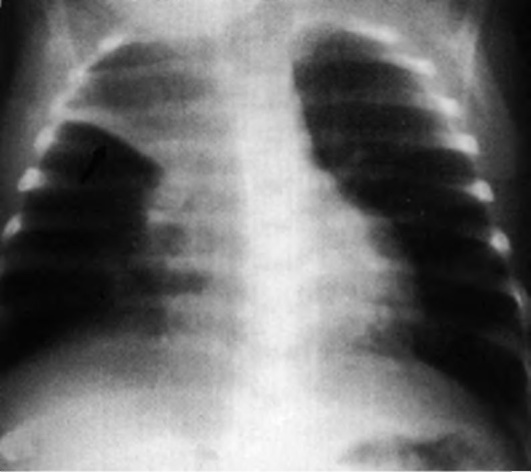
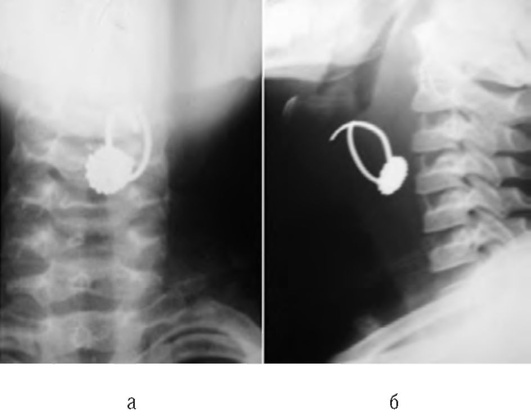
Основной вспомогательный метод диагностики аспирации ИТ - рентгенологическое исследование (рис. 3-8). Рентгенограмма в прямой и боковой проекции и томограмма шеи при рентгеноконтрастном ИТ помогают точно его локализовать.
На обзорной рентгенограмме органов грудной клетки отмечают повышенную прозрачность легочных полей.
ИТ трахеи может быть фиксированным и баллотирующим. Особая группа - ИТ, располагающиеся на бифуркации трахеи.
Состояние больного при ИТ, фиксированном в трахее, очень тяжелое. Дыхание учащено и затруднено, наблюдают втяжение уступчивых мест грудной клетки, выражен акроцианоз. Ребенок старается занять положение, в котором ему легче дышать. Голос обычно чистый. При перкуссии отмечают коробочный звук над всей поверхностью легких.
Баллотирующее ИТ - большая опасность для жизни. Часто оно имеет гладкую поверхность, например семена арбуза, подсолнуха, кукурузы, гороха и др. Такой предмет при кашле, смехе, беспокойстве легко перемещается в трахеобронхиальном дереве. Током воздуха ИТ подбрасывается к голосовой щели, раздражает истинные голосовые связки, которые мгновенно смыкаются. В этот момент слышен звук хлопанья ИТ о сомкнутые связки.
Баллотирующее ИТ опасно и тем, что, попадая поочередно в левый и правый бронх, вызывает рефлекторный спазм мельчайших бронхиол. Это сразу ухудшает состояние больного. Дыхание становится частым и поверхностным без значительного втяжения уступчивых мест грудной клетки, но с выраженным цианозом видимых слизистых оболочек и акроцианозом.
Иногда баллотирующее ИТ ущемляется в голосовой щели и вызывает удушье. При длительном спазме голосовых связок возможен летальный исход.
Коварность баллотирующего ИТ в том, что в момент аспирации больной часто испытывает кратковременное удушье, а затем на некоторое время его состояние улучшается.
Большую опасность представляет ИТ, фиксированное в бифуркации трахеи. При дыхании оно смещается в ту или иную сторону и закрывает вход в главный бронх, вызывая его полную обтурацию с развитием ателектаза легкого. Состояние больного в таком случае ухудшается, одышка и цианоз нарастают. При формировании клапанного стеноза трахеи или главного бронха возможна обтурационная эмфизема легкого.
Несмотря на яркие признаки аспирации ИТ, диагностика затруднена, так как при баллотирующем ИТ объективные данные осмотра минимальны. Достоверный метод диагностики аспирации ИТ в трахею и бронх - трахеобронхоскопия (рис. 3-9, см. цв. вклейку).
ИТ гортани и трахеи даже небольших размеров представляет большую угрозу для жизни ребенка вследствие развития острой асфиксии. Неотложная помощь - быстрейшее удаление ИТ. Если произошла полная обтурация просвета гортани ИТ и кашель неэффективный, продолжительный, приступообразный, сознание сохранено, следует выполнить приемы для удаления ИТ из верхних дыхательных путей (ВДП). Существуют определенные особенности оказания помощи детям до 1 года жизни и детям старше года (рис. 3-10).
Неотложная помощь - быстрейшее удаление ИТ, устранение спазма бронхов и бронхиол. Детям до 1 года жизни следует нанести 5 ударов по спине, держа ребенка животом вниз, голова ребенка должна находиться ниже туловища; перевернуть ребенка и произвести 5 толчков в грудную клетку на уровне нижней трети грудины на один палец ниже сосков. У детей старше 1 года выполняют прием Геймлиха до 5 раз, находясь сзади сидящего или стоящего ребенка. Если ИТ видно, его извлекают корнцангом, пинцетом, щипцами Мэгилла. Из ротоглотки отсосом аспирируют рвотные массы, остатки пищи. После освобождения дыхательных путей производят ингаляции чистым кислородом с помощью маски и дыхательного мешка.
Немедленное вмешательство при частичной обструкции дыхательных путей (при нормальном цвете кожи и кашлевом рефлексе) не показано. Пальцевое исследование и удаление ИТ вслепую у детей противопоказано, так как возможно продвижение ИТ вглубь с развитием полной обструкции.
Обтурация бронха ИТ ведет к гиповентиляции и ателектазу соответствующей зоны легкого. Это быстро приводит к герметической закупорке бронха. Воздух в легочную ткань не поступает, а воздух, содержащийся в альвеолах, всасывается. Легкое становится безвоздушным (рис. 3-11).
Клиническая картина ИТ главного бронха зависит от характера ИТ, его величины, формы, локализации и длительности пребывания в бронхе. Часто в первые дни после аспирации ИТ родители к врачу не обращаются. Это приводит к ряду осложнений и позднему оказанию медицинской помощи.
Крупное ИТ с неровной поверхностью, не полностью закрывающее просвет бронха, нередко образует вентильный стеноз бронха (рис. 3-12). Во время вдоха воздух попадает в нижележащие дыхательные пути, а при выдохе вследствие изменения положения ИТ и клапанного механизма воздух задерживается, что приводит к значительной эмфиземе легкого. При вдохе органы средостения смещаются в здоровую сторону. Купол диафрагмы со стороны легкого, где находится ИТ, уплощен и малоподвижен. В связи с тяжелым состоянием больной преимущественно в первые часы и дни после аспирации ИТ поступает в лечебное учреждение.
Клиническая картина ИТ долевого бронха чрезвычайно разнообразна. Общее состояние больных в ближайшие дни после аспирации ИТ обычно удовлетворительное. Жалобы на кашель, сначала сухой, а затем с мокротой. Объективные данные осмотра изменены локально - в долях легких. Эти данные выражены тем ярче, чем больше ИТ закрывает просвет бронха и находится в нем долго. Иногда быстро развивается ателектаз доли легкого. Аускультативно выслушивают сухие и влажные хрипы.
Тяжелое состояние ребенка, как правило, наблюдают во время аспирации, в дальнейшем остаются одышка и кашель, быстро развиваются бронхит, пневмония.
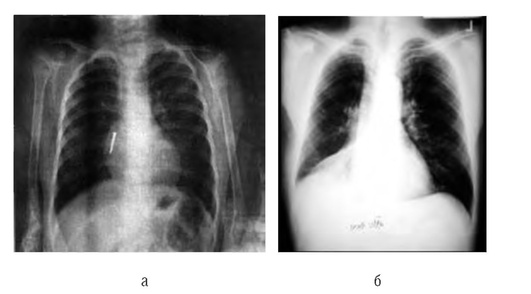
Рентгенологически часто выявляют ателектаз доли или сегмента (рис. 3-13). ИТ часто локализуется в правом главном и нижнедолевом бронхах.
Рентгенологически нередко выявляются множественные ателектазы, симптом Гольцкнехта-Якобсона - смещение тени средостения при вдохе в сторону частичной закупорки бронха ИТ. Рентгенологически симптом выявляют более отчетливо при форсированном дыхании, при рывкообразном вдохе и кашлевом толчке, когда смещение срединной тени приобретает толчкообразный характер.
Трахеобронхоскопия - диагностическое и лечебное мероприятие при ИТ трахеи и бронхов. После своевременного удаления ИТ воспалительные изменения в нижних дыхательных путях подвергаются обратному развитию.
Паренхиматозные заболевания легких
ОТЕК ЛЕГКИХ
Отек легких - патологическое состояние, при котором по тем или иным причинам в легочном интерстиции, а в дальнейшем и в альвеолах избыточно скапливается жидкость, проникающая в них из легочных капилляров. Это приводит к нарастающей во времени тяжелой дыхательной недостаточности.
Отек легких развивается вследствие повышения гидростатического давления в легочных сосудах, снижения онкотического давления плазмы, повышения проницаемости сосудистой стенки, повышения внутригрудного давления и перераспределения крови из большого в малый круг кровообращения.
Необходимо различать два принципиально различных типа отека легких (табл. 3-14).
| Гемодинамический отек легких (кардиогенный) | Токсический отек легких (некардиогенный) |
|---|---|
Повышение давления в левом желудочке:
Повышение давления в левом предсердии:
Гиперволемия:
Кардиомиопатия. Инфаркт миокарда. Нарушение сердечного ритма |
Вдыхание ядовитых газов и дымов (окись азота, озон, фосген, окись кадмия, аммиак, хлор, фторид, хлорид водорода). Эндотоксикозы (сепсис, перитонит, панкреатит и др.). Инфекционные заболевания (лептоспироз, менингококцемия, пневмония и др.). Тяжелые аллергические реакции. Аспирация кислого содержимого желудка |
У детей, в отличие от взрослых, чаще наблюдают некардиогенный отек легких, который обусловлен значительным увеличением отрицательного давления в грудной клетке при некупируемой обструкции дыхательных путей, возобновлении спонтанного дыхания после его остановки и длительной СЛР, аспирации, тяжелой гипоксии (повышение проницаемости капилляров), после утопления.
Важный фактор развития некардиогенного отека легких - гипопротеинемия.
Очень важно дифференцировать гидростатический отек легких от отека, вызванного повышенной сосудистой проницаемостью, поскольку это определяет выбор лечения.
Гидростатический отек легких возникает в результате разных причин, которые повышают внутрисосудистое гидростатическое давление. Наиболее частые из них у детей - левожелудочковая недостаточность, аритмии, митральный порок, гипергидратация вследствие избыточной инфузионной терапии, состояние после утопления.
В клинической картине отмечают одышку, кашель с кровянистой мокротой (рис. 3-14). При аускультации - влажные хрипы, иногда клокочущее дыхание; ра О2 всегда снижено; наступают дыхательный и метаболический ацидоз; тахикардия, переходящая в тахиаритмию, нарушения сердечного ритма, одышка с втяжением уступчивых мест грудной клетки. При осмотре выявляют отеки на ногах. Важный показатель - увеличение центрального венозного давления (ЦВД) (15-18 см вод.ст.).
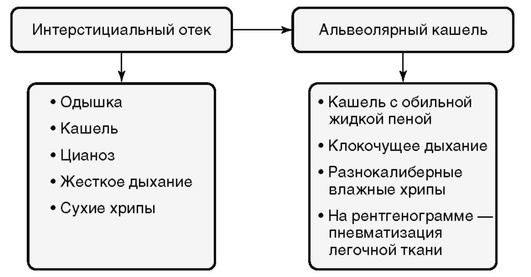
Отек легких диагностируют на основании клинических, рентгенологических и лабораторных данных. На рентгенограмме - кардиомегалия, изменения конфигурации сердца, однако левожелудочковая недостаточность может возникать и при нормальных размерах сердца. При гидростатическом отеке увеличены размеры легочных сосудов, их очертания становятся расплывчатыми, возникает интерстициальный, а затем альвеолярный отек легких.
Рентгенологические признаки помогают отличить кардиогенный и некардиогенный отек легких (табл. 3-15, рис. 3-15).
| Признак | Кардиогенный отек | Некардиогенный отек |
|---|---|---|
Размеры сердца |
Нормальные или увеличены |
Обычно нормальные |
Сосудистая тень |
Нормальная или увеличена |
Нормальная или меньше нормы |
Сосудистое распределение |
Равномерное или «перевернутое» |
Нормальное или равномерное |
Распределение отека |
Равномерное или центральное |
Пятнами или периферическое |
Плевральный выпот |
Есть |
Не всегда |
Перибронхиальный выпот |
Есть |
Не всегда |
Септальные линии |
Есть |
Не всегда |
Воздушная бронхограмма |
Не всегда |
Обычно есть |

Отек легких вследствие повышенной проницаемости сосудов (некардиогенный отек легких) - респираторный дистресс-синдром взрослых. Он возникает на фоне какого-либо критического состояния (травма, шок, утопление, вдыхание дыма, передозировка ЛС, сепсис и др.), имеет определенную фазность развития. Отличительный признак некардиогенного отека - гипоксемия (ра О2 <50 мм рт.ст. при ингаляции 60% кислородом). На рентгенограмме грудной клетки выявляют диффузные инфильтраты в легких. Характерно увеличение концентрации белка в альвеолярной жидкости.
Лечение
Важнейшее условие успешного лечения отека легкого - устранение гипергидратации, а при гипертонической и изотонической гипергидратации - создание отрицательного баланса ионов натрия, увеличение содержания которого приводит к отеку тканей. Лечение отека легких - восстановление нормального градиента давления в легочных капиллярах и альвеолах, седация и устранение гипоксии (рис. 3-16).
Оксигенотерапию проводят 40-50% увлажненным кислородом, пропущенным через 33% раствор Этилового спирта♠ , с помощью носовых катетеров, масок с созданием положительного давления к концу выдоха (ПДКВ). В наиболее тяжелых случаях показаны интубация трахеи, аспирация пенистой мокроты из дыхательных путей через интубационную трубку не более 20-30 с и ИВЛ с высокой фракцией кислорода во вдыхаемом воздухе (FiO2 ) в режиме ПДКВ. Больному необходимо придать сидячее положение, поскольку оно в силу постурального эффекта снижает внутрисосудистое давление в верхних отделах легких.
Для седации применяют диазепам (Седуксен♠ ), дроперидол внутримышечно или внутривенно, фенобарбитал; при значительном двигательном возбуждении детям старше 6 мес - морфин или натрия оксибутират внутривенно.
Показаны салуретики - фуросемид (Лазикс♠ ) внутривенно с удвоением дозы до получения эффекта. Увеличения сократительной способности миокарда достигают введением сердечных гликозидов (дигоксин, строфантин-К, Коргликон♠ ) или препаратов с положительным инотропным действием (добутамин, допамин).
Больных с некардиогенным отеком легких, нуждающихся в ИВЛ, необходимо вентилировать с низким дыхательным объемом (6 мл/кг) и пиковым давлением в дыхательных путях менее 30 см вод.ст. с постоянным ПДКВ.

ОСТРЫЙ РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ
ОРДС - неспецифическое острое повреждение легких, проявляющееся тяжелой дыхательной недостаточностью вследствие отека легких, в основе которого лежит повреждение различных структур аэрогематического барьера. Основной признак синдрома - гипоксемия, отражающая несостоятельность транспорта кислорода в легких.
Этот синдром известен под рядом других названий: шоковое легкое, травматическое легкое, влажное легкое, респираторное легкое, прогрессирующее легочное уплотнение, геморрагические ателектазы, синдром гиалиновых мембран. Несмотря на то что этиологические факторы ОРДС у взрослых различны, все они прямо или косвенно действуют на легкое, вызывая повреждение его структур.
ОРДС, особенно в ранней стадии, трудно диагностировать, вследствие чего летальность при нем превышает 50%. Так, у тяжелых больных ОРДС нередко расценивают как отек легких, вызванный левожелудочковой недостаточностью.
Возможная непосредственная причина ОРДС - аспирационный синдром (аспирация кислого желудочного сока в легкие, при утоплении - массивная аспирация воды), отравление ЛС, травма, вдыхание ядовитых газов, ингаляция кислорода в высоких концентрациях, тяжелые заболевания (пневмония, сепсис, панкреатит, туберкулез, диабетический кетоацидоз, уремия, шок любой этиологии), искусственное кровообращение, микроэмболия малого круга кровообращения и др.
Часто первичный этиологический фактор ОРДС - тяжелая политравма. Сепсис, вызванный грамотрицательной флорой, - тоже одна из причин шокового легкого.
Наиболее важные механизмы повреждения легкого при ОРДС - синдром капиллярного просачивания, повреждения легочного эндотелия, повышение сопротивления дыхательных путей и диссеминированное внутрисосудистое свертывание (ДВС). Вследствие гипоксии, повышенного интерстициального давления жидкости или ДВС возрастает легочное сосудистое сопротивление; уменьшается функциональная остаточная емкость; увеличивается градиент ра О2 ; возникает тяжелая гипоксемия, не поддающаяся лечению высокими концентрациями кислорода, уменьшается количество функциональных респираторных единиц; происходит задержка ра СО2 и развиваются респираторный ацидоз, анаэробный гликолиз и метаболический ацидоз.
Клиническая картина ОРДС независимо от причины протекает по стадиям.
-
I стадия - повреждение, 6 ч после стрессового воздействия; при клиническом и рентгенологическом исследовании изменений в легких не выявляют.
-
II стадия - кажущаяся устойчивость, 6-12 ч после стрессового воздействия:
-
III стадия - дыхательная недостаточность, 12-24 ч после стрессового воздействия; клиническая картина выраженной ОДН:
-
значительное падение ра О2 (менее 50 мм рт.ст., несмотря на ингаляцию 60% кислорода), жесткое дыхание;
-
сухие хрипы в легких (появление влажных хрипов свидетельствует о накоплении жидкости в альвеолярном пространстве);
-
на рентгенограмме - выраженный интерстициальный отек легких, в краевых отделах средней и нижней долей на фоне усиленного сосудистого рисунка видны очаговые тени, иногда горизонтальные линии (рис. 3-17).
Критерии диагностики ОРДС:
Лечение
Специфического лечения ОРДС не существует. Лечение направлено на ликвидацию гипоксии.
Для преодоления легочного барьера транспорту кислорода, кроме обычной оксигенотерапии, необходимы специальные меры: применение ПДКВ, щадящие режимы ИВЛ.
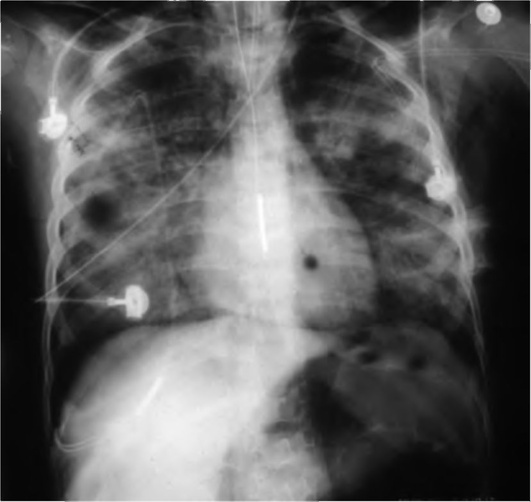
При бронхоспастическом компоненте - бронхолитическое лечение: гормоны парентерально, ингаляционные ГК через небулайзер или ДАИ, комбинированные препараты.
Ликвидация гемодинамических нарушений предусматривает поддержание адекватной центральной и периферической гемодинамики, достаточного кровоснабжения органов и тканей.
Режим ПДКВ - один из основных методов лечения ОРДС. Он позволяет поддерживать адекватную оксигенацию артериальной и смешанной венозной крови (ра О2 60 мм. рт.ст., pa CO2 30 мм рт.ст.) при минимальной концентрации кислорода (40-50%) во вдыхаемой смеси. ИВЛ необходима при нарастании признаков ОРДС (ра О2 <60 мм рт.ст., тахикардия, соответствующие изменения на рентгенограмме).
Показания к ИВЛ:
Принципы проведения ИВЛ при ОРДС:
Альтернативные методы ИВЛ при ОРДС:
При ИВЛ с ПДКВ в дыхательных путях создают постоянное положительное давление, что способствует «раскрытию» нефункционирующих альвеол и ателектатических участков, в результате чего улучшается вентиляция альвеол, которые раньше не вентилировались или вентилировались плохо и в которых происходило шунтирование крови. В целом это приводит к равномерному распределению коэффициентов в соотношении вентиляция/кровоток и повышению ра О2 .
Инфузионная терапия направлена на поддержание нормального водного, электролитного и белкового баланса организма.
Большинство авторов отмечают летальность при ОРДС более 50%. Частота летальных исходов возрастает, если в процесс, кроме легких, вовлечены другие органы. ДВС-синдром тоже ухудшает прогноз, который зависит и от основной причины, вызвавшей ОРДС.
Нервно-мышечные нарушения дыхания
Нарушение функции нервно-мышечного аппарата происходит в результате:
-
депрессии дыхательного центра (например, под воздействием седативных средств, структурного повреждения вследствие сосудистых заболеваний или травмы, лишения сна, голодания, гипотиреоза, метаболического алкалоза);
-
дисфункции диафрагмального нерва (например, идиопатического двустороннего диафрагмального паралича или вследствие травмы, диффузной невропатии и миопатии);
-
нервно-мышечных нарушений (например, повреждения спинного мозга, миастении, амиотрофического бокового склероза, полиомиелита, синдрома Гийена-Барре и мышечных дистрофий);
-
деформации грудной клетки (например, сколиоза, анкилозирующего спондилита и фиброторакса);
-
гиперинфляции - одной из наиболее частых и важных причин дисфункции дыхательных мышц при хронической обструктивной болезни легких и БА;
-
нарушений, вызванных ЛС (например, панкурония бромидом♠ , сукцинилхолином♠ , аминогликозидами);
-
сниженной доставки кислорода к периферическим тканям (анемия, циркуляторная недостаточность, гипоксемия, сепсис).
Наиболее частая периферическая невропатия, ведущая к ОДН, - синдром Гийена-Барре.
Синдром Гийена-Барре - острая воспалительная демиелинизирующая полирадикулоневропатия аутоиммунной этиологии. Характерный признак заболевания - периферические параличи и белково-клеточная диссоциация в ликворе (в большинстве случаев).
В развивающихся странах заболевание у детей наблюдают с частотой 1,1 на 100000 населения. При этом распространенность синдрома Гийена-Барре у детей младше 4 лет - 1,7 на 100000 населения, у детей старше 10 лет эти показатели значительно ниже - 0,1 на 100000 населения. В развитых странах распространенность у детей до 15 лет - 0,4 на 100000 населения, однако каких-либо существенных отличий между возрастом в этом диапазоне не отмечено. Синдром Гийена-Барре очень редко наблюдают у малышей до 1 года. В целом, наиболее часто заболевание у детей наблюдают в возрасте от 1 года до 6-8 лет, при этом девочки и мальчики болеют одинаково часто.
Как и у взрослых, среди заболеваний, предшествующих развитию синдрома Гийена-Барре, преобладают инфекции респираторного и желудочно-кишечного тракта (ЖКТ). Среди других болезней - корь, краснуха, ветрянка, простой герпес, гепатиты А и В.
Синдром Гийена-Барре - причина поступления в отделение интенсивной терапии более половины больных с нервно-мышечными заболеваниями. Раннее обнаружение имеет большое значение, так как примерно 20-45% таким больным необходима ИВЛ.
Диагностика нервно-мышечных заболеваний, требующих неотложной помощи, основана:
-
на анамнезе - появление нарушения глотания, слабости дыхательных мышц и наличие подобных заболеваний у родственников;
-
клиническом осмотре - конфигурация грудной клетки, нарушение дыхания, аритмия, мышечный тонус, сила и мышечная масса;
-
инструментальных и лабораторных обследованиях - биохимия крови (концентрация креатинфосфокиназы), гормональный профиль, концентрация витамина В12 и фолиевой кислоты, электромиография, биопсия мышечной ткани, проба с любым антихолинэстеразным средством.
Лечение детей с нервно-мышечными заболеваниями - комплексная и неотложная задача.
Основные направления лечения:
Расстройства дыхания во сне
Расстройства дыхания во сне - достаточно частая форма нарушения сна. В общей популяции распространенность наиболее тяжелого и клинически значимого из этих расстройств - синдрома обструктивных апноэ во сне (СОАС) составляет 2-4%. Среди детей распространенность феноменов расстройств дыхания во сне значительно варьирует и связана с возрастом и различными факторами риска:
Наиболее интересные факты - ассоциация расстройств дыхания во сне с выраженной оториноларингологической патологией и положительный семейный анамнез; малая встречаемость ожирения у детей с расстройствами дыхания во сне.
В Международной классификации расстройств сна выделен ряд патологических состояний, сопровождаемых нарушениями дыхания во сне: апноэ во сне грудных детей, привычный храп, СОАС, синдром центральных апноэ во сне, синдром центральной альвеолярной гиповентиляции и синдром врожденной центральной гиповентиляции.
СОАС (синдром обструктивных апноэ во сне) - состояние, при котором повторяются эпизоды обструкции верхних дыхательных путей (ВДП) во время сна, приводящие к падению уровня насыщения крови кислородом. Это проявляется длительными эпизодами прекращения шума дыхания и храпа во время сна, которые часто сопровождаются повышенной двигательной активностью.
Храп всегда сопутствует СОАС, что свидетельствует о непосредственном отношении нестабильности мягкого нёба к этому нарушению дыхания (табл. 3-16).
| Ночью | Днем |
|---|---|
Громкий храп. |
Плохая успеваемость. |
Респираторные паузы и всхрапывания. |
Повышенная дневная сонливость, гиперактивность. |
Затрудненное дыхание. |
Отставание в учебе. |
Беспокойный сон. |
Нарушение поведения. |
Повышенная потливость. |
Патологическая агрессивность. |
Ночные страхи. |
Патологическая застенчивость. |
Ночные кошмары. |
Социальная замкнутость. |
Энурез. |
Трудности в обучении. |
Нарушение внимания |
Утренняя головная боль |
Часто у таких детей наблюдают ночной энурез, повышение потоотделения, утреннюю головную боль, ночные страхи. Подозрение на связь энуреза с обструктивными апноэ возникает, если энурез у ребенка повторяется.
Дети с большим числом апноэ во сне отстают в психомоторном развитии, у них отмечают задержку роста. Это связывают с нарушением продукции соматотропного гормона и действием гипоксического фактора. Наряду с моторной заторможенностью возможны нарушения глотания и артикуляции. Объективные инструментальные исследования не всегда фиксируют достоверные патологические апноэ во время сна, изредка определяют небольшое число центральных, смешанных или непродолжительных обструктивных респираторных пауз. Тогда часто используют термин «синдром резистентности верхних дыхательных путей». Следовательно, даже частичная окклюзия ВДП приводит к клинической картине, характерной для СОАС. Фактор, влияющий на степень ее выраженности, - отсутствие полной обструкции ВДП, усилие, которое затрачивает ребенок на дыхание во сне, и степень выраженности нарушений сна, связанных с этим дополнительным усилием.
Как и у грудных детей, у старших детей во время сна появляются или усиливаются клинические симптомы гастроэзофагеального рефлюкса, приводящие к развитию СОАС:
Наиболее частая причина обструктивных апноэ у детей - сужение ВДП вследствие аденотонзиллярной гипертрофии. Характерный ее признак - «аденоидное лицо» с «тупым» выражением, периорбитальной отечностью и дыханием через рот. Аномалии лицевого скелета (микрогнатия, ретрогнатия, макроглоссия, аномалии носа) и ожирение тоже располагают к развитию СОАС в детском возрасте. При этом для вдоха и обеспечения заданного объема вдыхаемого воздуха необходимо большее инспираторное усилие. Следствие - более высокое трансмуральное давление на вдохе, что и способствует окклюзии глотки во время вдоха. Даже частичное ухудшение проходимости воздуха на уровне носовых ходов может провоцировать апноэ.
Однако существует «идиопатический» СОАС, при котором тщательное исследование не выявляет причин апноэ. При этой форме часто наблюдают наследственную предрасположенность к храпу и СОАС.
Из ведущих причин апноэ у старших детей S.H. Sheldon и соавт. (1992) выделяют:
Синдром центральных апноэ во сне - состояние, при котором возникают множественные эпизоды прекращения или снижения дыхательного усилия во время сна, ведущие к падению уровня насыщения крови кислородом. Отличия от СОАС - преобладающая форма апноэ во сне: чаще возникают центральные апноэ, свидетельствующие о прерывании дыхательных движений диафрагмы. Наиболее типичные клинические проявления этого синдрома у детей - жалобы на беспокойный сон, частые ночные пробуждения, повышенная двигательная активность во сне, утренняя головная боль. Следствие грубых органических изменений ЦНС - полная утрата автоматического контроля вентиляции у этих больных, в результате чего лишь участие высших корковых структур способно обеспечить дыхательную активность. Отсутствие этого участия во время сна приводит к остановке дыхания, что получило образное название «синдром проклятия Ундины». Согласно легенде, неверный муж Ундины был лишен всех автоматических функций и мог дышать лишь до тех пор, пока помнил об этой необходимости.
Апноэ во сне у грудных детей - группа состояний, при которых имеются множественные центральные или обструктивные апноэ во время сна у новорожденных и грудных детей. В первый месяц жизни это проявляется повторяющимися эпизодами задержек дыхания с цианозом, внезапной бледностью или гипотензией. В дальнейшем отмечают задержку роста, вялость, снижение мышечного тонуса в нижних конечностях. Выраженным сердечным аритмиям, включая асистолию, подвержены около 1% детей с апноэ грудного возраста. Апноэ у грудных детей - значительный фактор риска синдрома внезапной смерти этих детей. Апноэ могут быть как центрального, так и обструктивного характера и возникать (в особенности при апноэ у недоношенных) даже в период бодрствования. Причины апноэ во сне у грудных детей многообразны - и замедление созревания центральных хеморецепторов, и перинатальное повреждение нервной системы, и анатомически узкие дыхательные пути вследствие врожденных или приобретенных аномалий.
Обследование детей следует начинать с детального сбора анамнеза. Кардинальный признак обструктивного сонного апноэ - ночной храп ребенка. Родители нередко не придают его храпу во сне большого значения, полагая, что это явление достаточно безобидное. Сбор анамнеза должен включать анализ информации о самочувствии ребенка в дневные часы. Повышенная дневная сонливость, нарушение поведения, необычайная агрессивность, ухудшение школьной успеваемости, гиперактивное поведение и снижение внимания часто указывают на выраженные нарушения дыхания во время сна.
Объективное физикальное обследование должно оценивать интегративность дыхательной и сердечно-сосудистой системы. Важную роль в генезе апноэ играют анатомические изменения со стороны ВДП, которые требуют первоочередного исключения. Необходимы осмотр ВДП (носоглотка, ротоглотка, язык), выявление анатомических особенностей верхней и нижней челюсти, шеи, в том числе поиск возможных новообразований, исследование трахеи, оценка состояния мягких тканей диафрагмы рта и мышц ВДП. Современные диагностические методы выявляют у людей, страдающих идиопатическим СОАС, сужение просвета ВДП как в состоянии бодрствования, так и во время сна. Компьютерная томография (КТ) головы и шеи позволяет обнаружить существенное сужение просвета ротоглотки в состоянии бодрствования у таких больных.
Для определения поперечного сечения и объема полости глотки, гортани и трахеи используют УЗИ. При этом отмечена выраженная корреляция данных, полученных при исследовании, с числом регистрируемых апноэ за 1 ч сна. При обследовании пациентов, страдающих СОАС, выявляют повисающее, «маятнико-образное» мягкое нёбо и избыточные складки слизистой оболочки в ротоглотке.
При детальном неврологическом обследовании пациента выявляют задержку психомоторного развития и различные отклонения в поведении. СОАС - не всегда результат функциональных изменений, связанных с нарушением тонуса мышц и ВДП во время сна. Органические поражения ЦНС - объемные процессы в задней черепной ямке, бульбарный полиомиелит, инфаркт ствола и полушарий головного мозга - могут сочетаться с СОАС.
Жалоба на повышенную сонливость днем требует детального обследования и дифференциальной диагностики с рядом патологических состояний, являющихся следствием органического поражения ЦНС. Повышенную сонливость днем можно объективно подтвердить при проведении множественного теста на латентность сна.
Полисомнография - запись в течение сна ряда показателей функций организма. Для идентификации стадий сна используют показатели электроэнцефалограммы, электроокулограммы и электромиограммы. Для оценки дыхания во сне применяют дополнительные датчики ороназального потока воздуха, дыхательных движений грудной и брюшной стенок, шума дыхания, насыщения крови кислородом (сатурации).
Критерии диагностики синдрома детского обструктивного апноэ сна определяют при сочетании клинических проявлений и инструментальных данных.
-
Выявление при полисомнографическом исследовании одного или обоих видов нарушений:
-
один и более эпизодов обструктивных апноэ, смешанных апноэ или гиповентиляция на час сна (индекс дыхательных расстройств ≥1 эпизоду в час);
-
характерный образец обструктивной гиповентиляции - гиперкарбия [парциальное давление углекислого газа (pCO2 ) >50 мм рт.ст.] не менее чем в течение 25% времени сна и одного из признаков:
-
Критерии диагностики первичного центрального апноэ сна младенца определяют также при сочетании клинических проявлений и инструментальных данных.
-
Цианоз или апноэ; регистрация при мониторинге эпизодов центрального апноэ или десатураций во сне.
-
Полисомнографическим исследованием либо альтернативным мониторированием обнаружение одной из ситуаций:
-
Эти нарушения не обусловлены другим расстройством сна, соматическим или неврологическим заболеванием, либо использованием ЛС.
Для оценки ночной гиповентиляции необходима капнография, однако в связи с редкостью первичных синдромов ночной гиповентиляции при полисомнографии этот показатель не регистрируют.
Наиболее типичные характеристики ночного сна у детей с расстройствами дыхания во сне - увеличение числа активаций и пробуждений от сна, уменьшение проявлений глубоких стадий (3-4) медленного сна и фазы быстрого сна, повышение двигательной активности во время сна.
Лечение
У грудных детей с апноэ во сне применяют дыхательные аналептики [аминофиллин (Эуфиллин♠ ), кофеин] в возрастных дозах на весь период высокого риска синдрома внезапной смерти (3-6 мес жизни). Лечение корригируют после повторных исследований дыхания во время сна. При СОАС и первичном храпе для обследования и лечения ребенка часто направляют к отоларингологу.
У больных с СОАС легкой степени для нормализации состояния ВДП применяют комплекс мероприятий: методы рефлексотерапии, гомеопатического лечения и общеукрепляющие процедуры (галотерапия, массаж, дыхательная гимнастика). При более тяжелом СОАС необходима аденоидэктомия. Ее эффективность достигает 85%, при этом в течение 1 мес после операции наряду с симптомами обструктивного апноэ уходят и связанные с ним состояния: ночной энурез, снохождение. Одновременная с аденоидэктомией тонзиллэктомия значительно снижает вероятность повторных проблем с дыханием во сне.
Часто родители детей с подтвержденным диагнозом обструктивного апноэ сна отказываются от хирургического лечения. В этом случае рекомендуют применять чрезмасочную вентиляцию с постоянным положительным давлением во время сна (СиПАП-терапия). Предотвращение обструкции достигается за счет того, что в дыхательных путях постоянно (и на выдохе, и на вдохе) поддерживается положительное давление воздуха, формируя «воздушную шину», не дающую их стенкам спадаться. В качестве сопутствующего эффекта сразу же прекращается храп.
Подбор эффективного давления воздуха проводят в стационаре под контролем полисомнографии.
СиПАП-терапия не приводит к излечению, однако позволяет прожить месяцы и годы без вреда для здоровья ребенка до момента, когда размеры дыхательных путей станут достаточными для того, чтобы обструкция дыхательных путей во время сна не возникала.
Дети с первичным храпом подлежат динамическому наблюдению, так как отсутствие нарушений дыхания во сне и насыщения крови кислородом позволяет выбирать «выжидательную» тактику, учитывая пластичность детского лицевого скелета и возможность увеличения просвета дыхательных путей по мере его роста.
Из ЛС применяют ксантиновые производные, противосудорожные препараты.
Метод хирургической коррекции СОАС у взрослых и старших детей - увулопалатофарингопластика: резекция миндалин, язычка, немышечной части мягкого нёба и дополнительных складок слизистой оболочки на задней стенке ротоглотки.
Лечение центральных апноэ - комплекс мероприятий для устранения нарушений дыхания. В тяжелых случаях утраты автоматического контроля за функцией дыхания рекомендуют применение дыхательных пейсмекеров - приборов для электрической стимуляция дыхательных мышц (диафрагмы).
Учитывая, что развитию расстройства дыхания во сне способствует комплекс неспецифических нарушений (аллергизация, частые инфекционные заболевания), важна роль реабилитационных мероприятий как традиционной, так и альтернативной медицины в схемах лечения таких больных.
Острая дыхательная недостаточность
ОДН - быстро нарастающее тяжелое состояние, обусловленное несоответствием возможностей внешнего дыхания метаболическим потребностям организма, при котором наступает максимальное напряжение компенсаторных механизмов дыхания и кровообращения с последующим их истощением. При этом состоянии легкие не обеспечивают нормальный газовый состав артериальной крови: нарушение доставки необходимого объема кислорода в артериальную кровь и выведения соответствующего объема углекислого газа из венозной крови в альвеолы.
Классификация
С практической точки зрения и на основании патофизиологических механизмов ОДН разделяют на три ее вида (рис. 3-18).

-
Гипоксемическая (нормовентиляционная или нормокапническая) ОДН характеризуется недостаточной оксигенацией и относительно адекватной вентиляцией. В крови - низкое ра О2 (гипоксемия) с нормальным или слегка сниженным ра СО2 (нормоили гипокапния). Основной патофизиологический механизм - нарушение вентиляционно-перфузионных отношений, появление право-левого внутрилегочного шунтирования, нарушение диффузии без изменения альвеолярной вентиляции, при этом альвеоло-артериальная разница по кислороду увеличена.
-
Гиперкапническая (вентиляционная) ОДН характеризуется нарушением альвеолярной вентиляции; в крови - уменьшение ра О2 (гипоксемия) и увеличение ра СО2 (гиперкапния). Распространенный патофизиологический механизм - патологическое увеличение вентиляционно-перфузионных отношений, которое сначала приводит к умеренному увеличению минутного объема дыхания, приводящего к уменьшению ра СО2 . После этого резко снижается минутный объем дыхания, что приводит к выраженной гиперкапнии, которая характеризует этот вид ОДН. Конечный результат - значительная альвеолярная гиповентиляция (pa CO2 >50 мм рт.ст.). Этот вид ОДН часто встречают при заболеваниях дыхательных путей, дыхательных мышц и грудной клетки.
-
Смешанную ОДН часто наблюдают у больных с хроническими обструктивными заболеваниями легких. Для нее характерны гипервентиляция, увеличение альвеоло-артериальной разницы и гипоксемия, которая менее выражена, чем при первом виде.
Заболевания, для которых характерен переход первого вида ОДН во второй вид, - астматический статус, тяжелая пневмония, эпиглоттит. Иногда второй вид ОДН переходит в первый вид: при аспирационном синдроме, отравлении барбитуратами.
Патофизиологические механизмы ОДН различаются в зависимости от ее этиологии, но все они приводят к нарушению внутрилегочного газообмена. В основном все эти нарушения обусловлены четырьмя основными механизмами, которые отвечают за клинические проявления и изменения показателей газового состава крови:
В педиатрии наиболее распространенный патофизиологический механизм ОДН - нарушение вентиляционно-перфузионных отношений; самый редкий - нарушение альвеолярно-капиллярной диффузии. К развитию ОДН и обострению хронической дыхательной недостаточности может привести не только один механизм, но и несколько.
Этиология
Дыхательная недостаточность развивается из-за нарушений функций ЦНС, периферической нервной системы, дыхательных путей, легочной паренхимы сердца. Развитие дыхательной недостаточности обусловлено многими причинами (табл. 3-17).
Клиническая диагностика
Клинические проявления ОДН разнообразны и зависят от этиологии и влияния нарушений газообмена на органы-мишени (легкие, сердце, мозг). Специфической симптоматики ОДН не существует.
Диагностика основана на клинической картине и осмотре, подтверждается анализом газов крови, который определяет вид и тяжесть ОДН.
| Гипоксемическая | Гиперкапническая |
|---|---|
ОРДС. Аспирация, ателектаз. Бронхиолит. Кардиогенный отек легких. Муковисцидоз. Эмболия (жировая, воздушная). Интерстициальное заболевание легких. Тяжелая пневмония. Ингаляция токсичных газов. Трансфузионное поражение легких. Травма (контузия легких). Радиация. Сепсис |
Дыхательный центр Опиаты, барбитураты, анестетики. Центральная гипервентиляция (синдром Ундины) Верхние мотонейроны Травма шейного отдела спинного мозга. Демиелинизирующие заболевания. Опухоли Передний рог спинного мозга Полиомиелит. Синдром Вердинга-Хоффмана Нижние мотонейроны Синдром Гийена-Барре Нейромышечные соединения Ботулизм, столбняк. Миастения, рассеянный склероз. Отравление фосфорными соединениями Грудная стенка, плевра Кифосколиоз. Массивный плевральный выпот. Пневмоторакс. Ожирение, мышечная дистрофия Увеличение сопротивления дыхательных путей Обструкция ВДП (круп, дифтерия, эпиглоттит, ИТ, паралич голосовых связок). Обструкция нижних дыхательных путей. БА, бронхит, бронхиолит. ИТ |
Гипоксемия - снижение ра О2 <60 мм рт.ст., сатурация гемоглобина кислородом (Sa O2 ) <90%. В начальной стадии появляются тахипноэ, тахикардия, умеренная артериальная гипертензия, периферическая вазоконстрикция, в последующем брадикардия, гипотензия, цианоз, нарушение интеллектуальной функции, судороги, дезориентация, кома. При легкой гипоксемии появляются умеренная гиповентиляция, нарушение интеллекта. Тяжелая гипоксемия (ра О2 <45 мм рт.ст.) вызывает легочную гипертензию, нарушение СВ, функции миокарда и почек (задержка натрия), ЦНС (головная боль, сомнолентность, судороги, энцефалопатия), появляется склонность к анаэробному метаболизму с последующим развитием лактат-ацидоза.
Гиперкапния (ра СО2 >60 мм рт.ст) сопровождается другими симптомами, ранняя диагностика и оценка ее тяжести зависят от результатов определения газового состава крови. Сначала больной эйфоричен, говорлив, кожные покровы горячие, гиперемированы, покрыты профузным потом, АД и ЦВД повышены, тахикардия. В дальнейшем появляются обильное потоотделение, гиперсаливация и бронхиальная гиперсекреция с последующей ацидотической комой; сознание постепенно утрачивается; больной «успокаивается», впадает в карбонаркоз. Зрачки, сначала суженные, быстро расширяются до максимума; арефлексия. Побочные эффекты гипоксемии, гиперкапнии и лактат-ацидемии оказывают синергичные или аддитивные действия на другие органы. Респираторный ацидоз потенцирует гипертензивный эффект, вызванный гипоксемией, усиливает неврологическую симптоматику.
Клинические признаки ОДН различаются в зависимости от возраста (табл. 3-18).
| Система | Симптомы |
|---|---|
Общее состояние |
Слабость, потливость |
Дыхательная |
Тахипноэ. Брадипноэ. Апноэ. Ослабление или отсутствие дыхательных звуков. Цианоз. Парадоксальное дыхание. Раздувание крыльев носа. «Кряхтящий выдох». Свистящее дыхание |
Сердечно-сосудистая |
Тахикардия. Брадикардия. АГ. Артериальная гипотензия. Аритмия. Парадоксальный пульс. Остановка сердца |
ЦНС |
Отек диска зрительного нерва. Респираторная энцефалопатия. Кома. Астериксис |
У дошкольников и школьников легко диагностируют признаки усталости, слабости, нарушение интеллектуальной функции и потливость. У грудных детей часто наблюдают снижение активности, раздражительность и судороги. У детей с факторами риска или нейромышечными заболеваниями необходимо заподозрить ОДН при внимательном наблюдении за клиническими проявлениями возможного дыхательного дистресса.
При появлении у ребенка одного или нескольких клинических признаков дыхательной недостаточности необходимо заподозрить ОДН и выполнить анализ газового состава крови, что поможет не только подтвердить диагноз, но и мониторировать клиническую картину (табл. 3-19).
| Показатели | Артериальная кровь | Венозная кровь | Легочная артерия |
|---|---|---|---|
раО2, мм рт.ст. |
100 |
40 |
40 |
Насыщение гемоглобина кислородом SаО2,% |
96-98 |
70 |
75 |
раСО2, мм рт.ст. |
40 |
46 |
45 |
PH |
7,40 |
7,36 |
7,35 |
Степень дыхательного дистресса не всегда коррелирует со степенью оксигенации и альвеолярной вентиляции, необходима общая клинико-лабораторная оценка. Для клинической и лабораторной диагностики ОДН необходима ее своевременная и адекватная оценка (табл. 3-20).
Эффективность интенсивной терапии ОДН на догоспитальном этапе зависит от ее своевременности. Интенсивная терапия неотложных состояний должна носить опережающий характер, лечебные мероприятия следует начинать как можно раньше, предотвращая возможные необратимые изменения. Лечебные мероприятия при ОДН у детей условно разделяют на общие и специфические.
| Клинические | Лабораторные |
|---|---|
Тахипноэ, брадипноэ, апноэ. Парадоксальный пульс. Уменьшение или отсутствие дыхательных шумов. Стридор, свистящее дыхание, «хрюканье». Выраженное втяжение уступчивых мест грудной клетки с использованием вспомогательных дыхательных мышц. Цианоз при введении 40% кислорода (исключить врожденный порок сердца). Нарушения сознания различной степени |
раО2 <60 мм рт.ст. при введении 60% кислорода (исключить врожденный порок сердца). р СО2 >60 мм рт.ст. pH <7,3. Жизненная емкость легких <15 мл/кг. Максимальное инспираторное давление <25 см вод.ст. |
Общие мероприятия:
-
поддержание нормотермии, так как гипертермия увеличивает потребность в кислороде;
-
при показаниях - введение назогастрального зонда для уменьшения растяжения желудка и предотвращения возможной аспирации;
-
восстановление и поддержание проходимости дыхательных путей;
-
респираторная поддержка - неинвазивная, вспомогательная и ИВЛ, высокочастотная вентиляция легких.
Лечение ОДН
Различные методы лечения дыхательной недостаточности направлены:
Восстановление и поддержание проходимости дыхательных путей выполняют мануальными и инструментальными приемами:
Воздуховоды - назофарингеальные и орофарингеальные трубки Гведела. Для реанимации следует иметь трубки, как минимум, трех размеров для взрослых, грудных детей и детей старшего возраста. Орофарингеальный воздуховод отодвигает корень языка вперед и предупреждает обструкцию дыхательных путей. Его желательно вводить под визуальным контролем с помощью шпателя или клинка ларингоскопа. Неправильное расположение орофарингеального воздуховода вызывает западение языка в глотку и приводит к обструкции дыхательных путей.
Эндотрахеальная интубация - наиболее эффективный способ защиты дыхательных путей от аспирации, что особенно актуально при нарушениях сознания.
Показания к эндотрахеальной интубации:
Крикотиреотомию применяют, если невозможно выполнить интубацию и адекватную вентиляцию; используют набор для крикотиреотомии. Техники выполнения:
Крикотиреотомия позволяет проводить оксигенацию в течение короткого времени - до 30 мин. Она эффективна, позволяет предотвращать остановку дыхания и поиск более адекватного восстановления проходимости дыхательных путей.
Трахеостомия показана больным, у которых велика необходимость респираторной поддержки более 10-14 дней. Трахеостомия позволяет обеспечить удобство больного при разговоре, приеме пищи, снижает риск повреждения гортани, облегчает уход за дыхательными путями, уменьшает сопротивление дыхательных путей. Однако трахеостомия приводит к инфекционным осложнениям, кровотечению и стенозу трахеи. Использование перкутанной дилатационной трахеостомии - безопасная альтернатива традиционной трахеостомии.
Показание к ургентной кислородотерапии - снижение ра О2 <60 мм рт.ст. или сатурации кислородом гемоглобина артериальной крови (SаО2 ) <90% (у новорожденных ра О2 <50 мм рт.ст. или SаО2 <88%).
Показание к длительной кислородотерапии - снижение ра О2 <55 мм рт.ст. или SаО2 <88% в покое при дыхании воздухом (ра О2 56-59 мм рт.ст. или SаО2 89% при наличии легочного сердца или при гематокрите >55%).
Абсолютные противопоказания к кислородотерапии отсутствуют. Цель кисло-родотерапии - коррекция гипоксемии и достижение значений ра О2 60-65 мм рт. ст. или SаО2 90-93%.
Ингаляционный путь введения ЛС - естественный, физиологический, не травмирующий ткани путь. Для получения аэрозолей высокой степени дисперсности применяют ультразвуковые установки. При ОДН средней и тяжелой степени в клинической практике часто применяют небулайзерную терапию, позволяющую вводить в ингаляциях бронхолитические и другие ЛС в больших дозах.
Оксид азота (NO) диффундирует из альвеол в гладкие мышцы сосудистой стенки и затем прочно связывается с гемоглобином, расширяет кровеносные сосуды легких, прилегающие к стенке вентилируемых альвеол, улучшая вентиляционно-перфузионное соотношение. Оксид азота инактивируется при связывании с гемоглобином; ингалируемый оксид азот вызывает селективную вазодилатацию в легких без нарушения системного сосудистого сопротивления. Это приводит к уменьшению шунтового кровотока и улучшает оксигенацию. Оксид азота снижает давление в легочной артерии, в связи с этим его целесообразно использовать у больных с ОДН с легочной гипертензией и недостаточностью правого желудочка. Использование ингаляций азота рекомендуют больным с рефрактерной гипоксемией (ра О2 /FiO2 <120 мм рт.ст.).
Положительное давление в дыхательных путях применяют как при спонтанном дыхании больного при СиПАП-терапии, так и при респираторной поддержке методом ПДКВ. При СиПАП-терапии положительное давление создают на вдохе и на выдохе, а при ПДКВ - только на выдохе. СиПАП-терапию проводят с помощью герметичной носовой (или лицевой) маски и генератора воздушного потока; ее применяют в качестве самостоятельного метода при ОДН у больных с синдромом ночного апноэ, трахеомаляцией, рестриктивными заболеваниями грудной клетки, отеком легких.
Неинвазивная вентиляция легких - вентиляционное пособие без использования интубационной или трахеостомической трубки. Она позволяет избежать многих инфекционных и механических осложнений ИВЛ, повреждения гортани и трахеи, обеспечивая эффективное восстановление газообмена и достижение разгрузки дыхательных мышц у больного с ОДН. Во время неинвазивной вентиляции легких больной связан с респиратором с помощью носовых или лицевых масок; больной находится в сознании, и не требуется применения седативных и миорелаксирующих препаратов. Масочная вентиляция - более комфортная процедура, чем обычная вентиляция: больной может разговаривать, принимать пищу, получать сеансы физиотерапии, откашливать мокроту. Еще одно важное достоинство неинвазивной вентиляции легких - возможность быстрого ее прекращения и немедленного возобновления при необходимости.
Показания к неинвазивной вентиляции легких при ОДН:
Противопоказания к неинвазивной вентиляции легких:
Искусственная и вспомогательная вентиляция легких
Показания к ИВЛ должны учитывать не только отсутствие эффекта от консервативного лечения и тяжести функциональных нарушений, но и быстроту их развития и потенциальную обратимость процесса, вызвавшего ОДН. При респираторной поддержке проводят комплексную клиническую и функциональную оценку состояния больного.
Показания к ИВЛ
В клинической практике используют преимущественно экспираторный метод ИВЛ, основанный на периодическом вдувании газа в легкие. Несмотря на то что в современных респираторах многие параметры регулируются независимо, принципиально важно выделить два параметра, определяющих вентиляцию, - давление и объем. В респираторах, ориентированных на давление, дыхательный объем - производное от величины установленного давления. При использовании респираторов, ориентированных на объем, давление в дыхательных путях зависит от объема поступившего в легкие газа.
Высокочастотная вентиляция - вентиляция, при которой используют частоты, во много раз (300-1200 в минуту) превышающие нормальную частоту и дыхательный объем.
В педиатрической практике наибольшее распространение получила осцилляторная вентиляция, при которой с помощью различных устройств в дыхательном контуре создают высокочастотные низкоамплитудные колебания газа. При этом как вдох, так и выдох активны.
Коррекция ацидоза зависит от этиологии, степени ОДН и ее продолжительности. Полная коррекция респираторного ацидоза обычно не требуется, так как при улучшении легочной вентиляции с помощью или без помощи ИВЛ респираторный ацидоз устраняется. При метаболическом ацидозе необходимо улучшить кровообращение, тканевую оксигенацию и введение бикарбоната натрия, если pH <7,20.
Поддержание СВ - важный момент в лечении ОДН, так как от него зависят содержание кислорода в артериальной крови и доставка кислорода в ткани. Для увеличения концентрации кислорода в артериальной крови необходимо оценить содержание гемоглобина; при его снижении необходимо переливание крови.
СПИСОК ЛИТЕРАТУРЫ
-
Зайцева О.В. Дифференциальный диагноз бронхообструктивного синдрома у детей (лекция) // Клиническая и неотложная педиатрия. - 2015. - № 1. - С. 6б-75.
-
Круп у детей (острый обструктивный ларингит). Клинические рекомендации // Клиническая и неотложная педиатрия. - 2015. - № 1. - С. 103-110.
-
Новик Г.А., Халева Е.Г. Глобальная инициатива по бронхиальной астме 2014, диагностика и ступенчатая терапия. Что нового? // Клиническая и неотложная педиатрия. - 2015. - № 1. - С. 30-34.
-
Полуэктов М.Г., Левин Я.И. Сомнология и медицина сна. - М. : Медфорум, 2013. - 431 с.
-
Руководство по респираторной медицине / под ред. Н. Мэскел, Э. Миллар; пер. с англ. под ред. С.Н. Авдеева. - М. : ГЭОТАР-Медиа, 2014. - 600 с.
-
Соболева М.К., Успенская С.А. Эпиглоттит у детей // Вестн. НГУ. Сер.: Биология, клиническая медицина. - 2011. - Т. 9, вып. 2. - С. 343-252.
-
Таточенко В.К. Болезни органов дыхания у детей. - М. : Педиатръ, 2012. - 480 с.
-
Яковлев В.Н., Алексеев В.Г. Отек легких (различие патогенеза и лечения). - М. : Новомосковск, 2012. - 12 с.
-
Al-Ansari K., Sakran M., Davidson B.L. et al. Nebulized 5% or 3% hypertonic or 0.9% saline for treating acute bronchiolitis in infants // J. Pediatr. - 2010. - Vol. 157, N 4. - P. 630-634.
-
American Academy of Sleep Medicine. International Classification of Sleep Disorders. Diagnostic and Coding Manual. 3rd. ed. - Westchester : American Academy of Sleep Medicine, 2014.
-
Barclay L. AAP Updates Guidelines on Bronchiolitis in Young Children. Medscape Medical News. URL: http://www.medscape.com/viewarticle/833884. [Accessed: November 1, 2014].
-
Beigelman A., Chipps B.E., Bacharier L.B. Update on the utility of corticosteroids in acute pediatric respiratory disorders // Allergy Asthma Proc. - 2015. - Vol. 36, N 5. - P. 332-338.
-
Bjornson C., Russell K.F., Vandermeer B. et al. Nebulized epinephrine for croup in children // Cochrane Database Syst. Rev. - 2011. - Vol. 2: CD006619.
-
Bradley J.S., Byington C.L., Shah S.S. et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the pediatric infectious diseases society and the infectious diseases society of america // Clin. Infect. Dis. - 2011. - Vol. 53, N 7. - P. 25-76.
-
Brooks M. Suctioning impacts hospital stay in infants with bronchiolitis // Medscape Medical News. - March 4, 2013. URL: http://www.medscape.com/viewarticle/780246. [Accessed: March 26, 2013].
-
Brown T. Pediatric Bronchiolitis: Intermittent Pulse Oximetry OK // Medscape Medical News. URL: http://www.medscape.com/viewarticle/850335. September 01, 2015. [Accessed: September 02, 2015].
-
Charles R., Fadden M., Brook J. Acute epiglottitis // BMJ. - 2013. - Vol. 347. - P. 5235.
-
D’Agostino J. Pediatric airway nightmares // Emerg. Med. Clin. North Am. - 2010. - Vol. 28, N 1. - P. 119-126.
-
Delany D.R., Johnston D.R. Role of direct laryngoscopy and bronchoscopy in recurrent croup // Otolaryngol. Head Neck Surg. - 2015. - Vol. 152, N 1. - P. 159-164.
-
Global Initiative for Asthma. Global strategy for asthma management and prevention 2014 (revision). - Ch. 1. Definition, description and diagnosis of asthma. - P. 1-3. URL: www/ginaasthma.org.
-
High-Frequency Oscillatory Ventilation Risky in Pediatric Respiratory Failure // Medscape. - 2014 Jan 24. URL: http://www.medscape.com/viewarticle/819731. [Accessed: Feb 4, 2014].
-
Holmes A. Croup: What It Is and How to Treat It // US Pharm. - 2013. - Vol. 38, N 7. - P. 47-50.
-
Ibrahimov M., Yollu U., Akil F. et al. Laryngeal foreign body mimicking croup // J. Craniofac. Surg. - 2013. - Vol. 24, N 1. - P. 7-8.
-
Leboulanger N., Garabedian E.N. Airway management in pediatric head and neck infections // Infect. Disord. Drug Targets. - 2012. - Vol. 12, N 4. - P. 256-260.
-
Mandal A., Kabra S.K., Lodha R. Upper airway obstruction in children // Indian J. Pediatr. - 2015. - Vol. 82, N 8. - P. 737-744.
-
McCulloh R., Koster M., Ralston S. et al. Use of Intermittent vs Continuous Pulse Oximetry for Nonhypoxemic Infants and Young Children Hospitalized for Bronchiolitis: A Randomized Clinical Trial // JAMA Pediatr. - 2015. - Vol. 169. - Р. 898-904.
-
Miller E.K., Gebretsadik T., Carroll K.N. et al. Viral etiologies of infant bronchiolitis, croup, and upper respiratory illness during four consecutive years // Pediatr. Infect. Dis. J. - 2013. - Vol. 32, N 9. - P. 950-955.
-
Miranda A.D., Valdez T.A., Pereira K.D. Bacterial tracheitis: a varied entity // Pediatr. Emerg. Care. - 2011. - Vol. 27, N 10. - P. 950-953.
-
Papoff P., Moretti C., Cangiano G. et al. Incidence and predisposing factors for severe disease in previously healthy term infants experiencing their first episode of bronchiolitis // Acta Paediatr. - 2011. - Vol. 100, N 7. - P. 17-23.
-
Petrocheilou A., Tanou K., Kalampouka E. et al. Viral croup: diagnosis and a treatment algorithm // Pediatr. Pulmonol. - 2014. - Vol. 49, N 5. - P. 421-429.
-
Schuh S., Freedman S., Coates A. et al. Effect of oximetry on hospitalization in bronchiolitis: a randomized clinical trial // JAMA. - 2014. - Vol. 312, N 7. - P. 712-718.
-
Shah V.P., Tunik M.G., Tsung J.W. Prospective Evaluation of Point-of-Care Ultrasonography for the Diagnosis of Pneumonia in Children and Young Adults // Arch. Pediatr. Adolesc. Med. - 2012. - Vol. 10. - P. 1-7.
-
Skjerven H.O., Hunderi J.O., Brugmann-Pieper S.K. et al. Racemic adrenaline and inhalation strategies in acute bronchiolitis // N. Engl. J. Med. - 2013. - Vol. 368, N 24. - P. 2286-2293.
-
Stapleton F.B. Reliance on oximetry readings increases hospital admissions for mild-to-moderate bronchiolitis // Journal Watch. - 2014 Aug 26. URL: http://www.jwatch.org/na35521/2014/08/26/.
-
Tibballs J., Watson T. Symptoms and signs differentiating croup and epiglottitis // J. Paediatr. Child Health. - 2011. - Vol. 47, N 3. - P. 77-82.
-
Vinci R., Bauchner H. Bronchiolitis, deception in research, and clinical decision making // JAMA. - 2014. - Vol. 312. - Р. 699. URL: http://dx.doi.org/10.1001/ jama.2014.8638. - See more at: http://www.jwatch.org/na35521/2014/08/26/reliance-oximetry-readings-increases-hospital-admissions#sthash.wV5KboJA.MinQI3Ow.dpuf.
-
Zoorob R., Sidani M., Murray J. Croup: an overview // Am. Fam. Physician. - 2011. - Vol. 83, N 9. - P. 1067-1073