Интенсивная терапия. Т. 1 : национальное руководство / под ред. И. Б. Заболотских, Д. Н. Проценко. - 2-е изд. , перераб. и доп. - Москва : ГЭОТАР-Медиа, 2020. - 1136 с. - ISBN 978-5-9704-5017-8 |
Аннотация
Второе издание национального руководства "Интенсивная терапия" содержит современную информацию о диагностике и лечении критических состояний различной этиологии и патогенеза. Особое внимание уделено особенностям интенсивной терапии в периоперационный период у пациентов с сопутствующими заболеваниями. Благодаря объединению усилий ведущих специалистов России удалось отразить согласованную позицию по актуальным вопросам современной реаниматологии и интенсивной терапии и учесть сведения доказательной медицины. Все главы прошли этап независимого рецензирования.
Издание предназначено, прежде всего, анестезиологам-реаниматологам, а также врачам всех специальностей, студентам старших курсов медицинских вузов, клиническим ординаторам, аспирантам.
3.9. ПЕРИОПЕРАЦИОННОЕ ВЕДЕНИЕ ПАЦИЕНТОВ С СОПУТСТВУЮЩЕЙ ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТЬЮ
И.Б. Заболотских, Н.В. Трембач
Введение
Дыхательная недостаточность (ДН) - состояние организма, при котором не обеспечивается поддержание нормального газового состава артериальной крови либо оно достигается за счет повышенной работы внешнего дыхания, приводящей к снижению функциональных возможностей организма, либо поддерживается искусственным путем.
Встречаемость периоперационной ДН разнится от исследования к исследованию в значительных пределах и зависит от того, что авторы подразумевали под таковой (табл. 3.39).
Таблица 3.39. Эпидемиология периоперационной дыхательной недостаточности
| Проявления ДН | Частота, % |
|---|---|
ИВЛ в течение 48 ч после операции или реинтубация в течение 30 дней |
3,1 |
ИВЛ в течение 48 ч после операции или реинтубация вследствие острой дыхательной или сердечно-сосудистой недостаточности |
3,0 |
ОРДС |
2,6 |
Эпизоды умеренной гипоксемии |
|
(SpO2 86-90%) (70% остаются не распознанными анестезиологом) |
53 |
Эпизоды тяжелой гипоксемии |
|
(SpO2 <81%) (продолжительность в среднем 2-3 мин) |
20 |
Развитие гипоксемии в течение 5 дней после операции |
4,2 |
Послеоперационная ДН на фоне интактных легких |
73 |
Оценка легочного риска
Существует несколько шкал, позволяющих оценить риск развития ДН или легочных осложнений.
В 2015 г. на основании исследования, проведенного на 5384 больных [11], была представлена шкала риска ДН (табл. 3.40), которая определялась авторами как гипоксемия в течение 5 дней.
Таблица 3.40. Шкала риска дыхательной недостаточности [11]
| Фактор риска | Баллы |
|---|---|
Связанные с состоянием пациента |
|
Предоперационное SpO2 |
|
>96 |
0 |
91-95 |
7 |
≤90 |
10 |
Симптомы респираторного заболевания (по крайней мере, один) |
10 |
Связанные с состоянием пациента |
|
Застойная СН |
|
Нет |
0 |
I класс по NYHA |
3 |
≥II класса по NYHA |
8 |
Хроническое заболевание печени |
7 |
Связанные с оперативным вмешательством |
|
Экстренность |
12 |
Локализация |
|
Периферические операции |
0 |
Лапаро-/торакоскопия |
3 |
Лапаротомия |
7 |
Торакотомия |
12 |
Длительность |
|
≤2 ч |
0 |
2-3 ч |
5 |
>3 ч |
10 |
На основании указанной шкалы возможно прогнозирование послеоперационной ДН в виде гипоксемии (коэффициент дискриминации 0,82, критерий Хосмера-Лемешева 7,08) (табл. 3.41).
Таблица 3.41. Интерпретация шкалы риска послеоперационной дыхательной недостаточности [11]
| Риск | Баллы | Частота |
|---|---|---|
Низкий |
Менее 12 |
1,1% (0,7-1,5) |
Средний |
12-22 |
4,6% (3-5,6) |
Высокий |
Более 23 |
18,8% (15-21,8) |
Факторы риска развития легочных осложнений, связанные с состоянием пациента
ОЖИРЕНИЕ
Диагноз ожирения ставят при увеличении ИМТ более 30 кг/м2, морбидного ожирения - более 40 кг/м2.
Метаболические особенности при ожирении.
Особенности системы внешнего дыхания при ожирении.
ВОЗРАСТ
Риск развития респираторных осложнений повышается в 3,5 раза в период от 50 до 80 лет вне зависимости от сопутствующей патологии и тяжести оперативного вмешательства. Это связано с изменениями в системе дыхания. Тем не менее некоторые исследования не подтверждают эту закономерность, что свидетельствует о большем значении сохранности физиологических резервов организма, чем биологического возраста как такового. Пожилой и старческий возраст, таким образом, не может быть причиной отмены оперативного вмешательства. Следует помнить о том, что у пожилых людей часто встречаются вялотекущие и трудно диагностируемые заболевания.
КУРЕНИЕ
У курильщиков повышен риск периоперационных легочных осложнений. Риск уменьшается до минимального при отказе за 6 мес до операции, однако увеличенный риск послеоперационной пневмонии сохраняется в течение 1 года.
Патогенетические изменения, развивающиеся при курении.
-
Гиперреактивность дыхательных путей увеличивает риск бронхоконстрикции.
-
Повышение paCO2 при курении снижает доставку кислорода тканям.
-
У всех мужчин старше 45 лет объем форсированного выдоха за первую секунду (ОФВ1) снижается на 20 мл в год, а у курящих людей скорость снижения ОФВ1 составляет 33 мл в год.
Респираторные осложнения, прогнозируемые у курильщиков.
ПОВЫШЕНИЕ ВНУТРИБРЮШНОГО ДАВЛЕНИЯ
Смещение диафрагмы в сторону грудной полости (с повышением давления в ней), а также прямое действие повышенного ВБД на нижнюю полую вену приводят к значительному снижению венозного возврата, механической компрессии сердца и магистральных сосудов (и, как следствие, повышению давления в системе малого круга). При внутрибрюшной гипертензии происходит снижение дыхательного объема и ФОЕ легких, коллабирование альвеол базальных отделов (появляются участки ателектазов), значительное нарушение биомеханики дыхания (вовлечение вспомогательной мускулатуры, увеличение кислородной цены дыхания). Высокий уровень ВБД (более 12 мм рт.ст. при внутрибрюшной гипертензии) является неблагоприятным фактором и зачастую сочетается с риском развития в ближайшем послеоперационном периоде острого респираторного дистресс-синдрома, требующего проведения инвазивных методов респираторной поддержки. С увеличением ВБД частота продленной послеоперационной ИВЛ достоверно повышается. Увеличение значений ВБД приводит к ухудшению оксигенации как у пациентов на спонтанном дыхании, так и у пациентов на ИВЛ.
СОПУТСТВУЮЩАЯ РЕСПИРАТОРНАЯ ПАТОЛОГИЯ
Пациенты с сопутствующей патологией легких находятся в группе повышенного риска развития легочных осложнений.
ОБСТРУКТИВНАЯ ПАТОЛОГИЯ
Астма.
Нет достоверных данных, что наличие в анамнезе астмы увеличивает частоту ПОЛО, однако неадекватная терапия астмы в предоперационном периоде может привести к развитию периоперационных легочных осложнений.
Хронические обструктивные болезни легких (ХОБЛ) относят к числу наиболее распространенных заболеваний. В структуре заболеваемости они входят в список лидирующих по числу дней нетрудоспособности, причинам инвалидности и занимают четвертое место среди причин смерти. При этом в развитых странах мира прогнозируется увеличение смертности от ХОБЛ в недалеком будущем. ХОБЛ наносят значительный экономический ущерб, связанный с временной и стойкой утратой трудоспособности самой активной части населения. ХОБЛ - собирательное понятие, которое объединяет группу хронических болезней дыхательной системы: хронический обструктивный бронхит, эмфизему легких, БА тяжелого течения, облитерирующий бронхиолит и бронхоэктатическую болезнь.
Признак, по которому формируется группа ХОБЛ, - медленно прогрессирующая необратимая бронхиальная обструкция с нарастающими явлениями хронической ДН. ХОБЛ рассматривают и как симптомокомплекс с признаками терминальной ДН (ОФВ1 <1,5 л или 30% от должной величины), то есть прогрессирование болезни, приведшее к утрате обратимого компонента бронхиальной обструкции и легочному сердцу. На этой стадии ХОБЛ нивелируется нозологическая принадлежность болезни. Наиболее часто (около 90%) причиной ХОБЛ является хронический обструктивный бронхит (ХОБ), около 1% составляет эмфизема легких (вследствие дефицита a1-антитрипсина), около 10% приходится на БА тяжелого течения.
Бронхоэктатическая болезнь - хроническое заболевание, характеризующееся локальным расширением бронхов вследствие деструктивного воспалительного процесса, вовлекающего стенку бронха.
Бронхиолит - заболевание детского возраста, обусловленное чаще всего респираторно-синцитиальным вирусом. Процесс может сопровождаться вирусной пневмонией, ревматоидным артритом. Пациенты часто получают кортикостероиды для снижения воспалительного процесса.
Обструктивное сонное апноэ присутствует у всех тучных людей - чаще у мужчин (иМт >30), при этом чаще встречается в возрасте более 50 лет и у детей с гипертрофией миндалин, для диагностики необходимо определение индекса обструктивного сонного апноэ (количество эпизодов апноэ за ночь) >5 у 24% мужчин и 9% женщин. Заболевание нередко сопровождается дневной сонливостью - у 16% мужчин и 22% женщин. Диагноз формируется при опросе пациента или беседе с его родственниками, однако в 90% случаев синдром не диагностирован.
РЕСТРИКТИВНАЯ ПАТОЛОГИЯ
Причины рестриктивной дыхательной недостаточности
Интерстициальные болезни легких - группа заболеваний, объединенная рентгенологическим синдромом двустороннего поражения, представлена приблизительно 200 нозологическими единицами, что составляет около 20% всех заболеваний легких.
Интерстициальные болезни легких являются гетерогенной группой болезней с общими клиническими проявлениями, изменениями физиологии дыхания и определенным патоморфологическим сходством. Несмотря на полиморфизм клинико-морфологических проявлений интерстициальных болезней легких, все они морфологически проявляются фиброзирующим альвеолитом со стереотипными изменениями альвеолярной мембраны и легочного интерстиция: в начале заболевания - в виде альвеолита, по мере прогрессирования - с постепенным замещением интерстициальным фиброзом, на терминальных стадиях - формированием «сотового легкого», дисплазией и малигнизацией эпителия альвеол и мелких бронхов.
В группу интерстициальных болезней легких входят различные болезни с установленной и неустановленной этиологией, с иммунным и неиммунным патогенезом, сопровождающиеся и не сопровождающиеся образованием гранулем.
Отек легких (ОЛ) - патологическое состояние, характеризующееся проникновением внутрисосудистой жидкости в просвет альвеол. Может быть обусловлен повышением давления в легочных капиллярах или увеличением их проницаемости.
Заболевания грудной клетки и плевры являются причиной компрессии легких и снижения легочных объемов, что приводит к гиповентиляции. Работа дыхания увеличивается вследствие нарушения механических свойств грудной клетки и повышения сопротивления дыхательных путей. Деформация грудной клетки может приводить к компрессии легочных сосудов и острой правожелудочковой недостаточности.
Факторы риска, связанные с оперативным вмешательством
ДЛИТЕЛЬНОСТЬ
Длительное оперативное вмешательство (>3-4 ч) - независимый фактор риска респираторных осложнений.
ЭКСТРЕННОСТЬ
У пациентов, подвергшихся экстренным операциям, риск развития легочных осложнений в 2,6 раза выше, чем при плановых оперативных вмешательствах.
ЛОКАЛИЗАЦИЯ
ПОЗИЦИОНИРОВАНИЕ (табл. 3.42)
Таблица 3.42. Влияние положения на операционном столе на респираторную систему
| Положение | Влияние на дыхание |
|---|---|
Горизонтальное |
Смещение диафрагмы в краниальном направлении. Снижение ФОЕ. Возникновение зависимых зон на фоне ИВЛ. Повышение сопротивления дыхательных путей в результате уменьшения ФОЕ |
Тренделенбурга |
Значительное снижение легочных объемов. Повышенный риск аспирации. Высокий риск образования ателектазов |
Приподнятая головная часть |
Повышение ФОЕ. Снижение работы дыхания при спонтанной вентиляции |
На животе |
Снижение легочно-торакального комплайнса. Увеличение работы дыхания |
Сидя |
Увеличение ФОЕ. Увеличение работы дыхания |
ТЕХНИКА ОПЕРАТИВНОГО ВМЕШАТЕЛЬСТВА
Предоперационная оценка состояния больного
АЛГОРИТМ ПРЕДОПЕРАЦИОННОЙ ОЦЕНКИ ПАЦИЕНТА
-
Выявление факторов риска возникновения респираторных осложнений при подготовке, проведении оперативного вмешательства, анестезии и в раннем послеоперационном периоде.
-
2а. Обследование пациентов группы риска - определение наличия ДН и степени ее компенсации.
-
2б. Обследование пациентов, готовящихся к оперативному вмешательству, без признаков патологии респираторной системы - определение состояния респираторной системы и выявление компенсированной (скрытой) ДН.
-
2в. Использование методик: физикального, клинико-лабораторного, инструментального исследований, функциональных тестов и проб.
-
Наиболее характерные жалобы при респираторной патологии.
Одышка.
-
Наиболее важный прогностический фактор дисфункции дыхательной системы, которая может развиться в послеоперационном периоде.
-
Одышка и общее недомогание отмечаются у 1/3 госпитализированных больных и являются самыми распространенными жалобами.
-
Градация дооперационной одышки связана с послеоперационным выживанием.
-
Риск смерти после торакальных операций увеличивается от 8% у больных без одышки до 56% у больных при ее наличии.
Таблица 3.43. Степени тяжести одышки
| Степень | Тяжесть | Описание |
|---|---|---|
0 |
Нет |
Одышка не беспокоит, за исключением очень тяжелой нагрузки |
1 |
Легкая |
Одышка возникает при быстрой ходьбе или подъеме на возвышение |
2 |
Средняя |
Одышка приводит к более медленной ходьбе по сравнению с другими людьми того же возраста, или появляется необходимость делать остановки при ходьбе в своем темпе по ровной поверхности |
3 |
Тяжелая |
Одышка заставляет делать остановки при ходьбе на расстояние около 100 м или через несколько минут ходьбы по ровной поверхности |
4 |
Крайне тяжелая |
Одышка не позволяет выходить из дома или появляется при одевании и раздевании |
ФИЗИКАЛЬНОЕ ОБСЛЕДОВАНИЕ
Что необходимо оценить при осмотре?
СИМПТОМЫ, ОТРАЖАЮЩИЕ СУЩЕСТВУЮЩУЮ ПАТОЛОГИЮ ЛЕГКИХ
ЛЕГОЧНЫЕ ФУНКЦИОНАЛЬНЫЕ ТЕСТЫ
Показания к исследованию легочных функциональных тестов в предоперационном периоде.
При курении и нарушениях дыхания в анамнезе у вышеописанных категорий пациентов должны обязательно проводиться легочные функциональные тесты (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - B). Хотя легочные функциональные тесты (спирометрия с определением диффузионной емкости легких или без такового) четко определяют пациентов, у которых неблагоприятен исход резекционной торакальной хирургии, и пациентов с низкой выживаемостью после операций, уменьшающих легочные объемы (табл. 3.44), их роль в оценке легочной функции при других операциях остается неясной.
Таблица 3.44. Клиническое значение величин легочных функциональных тестов
| Легочные функциональные тесты | Норма | Клиническое значение отклонений |
|---|---|---|
Жизненная емкость легких (ЖЕЛ) |
65-75 мл/кг |
↓ЖЕЛ (пневмония, ателектаз, легочный фиброз, болевой синдром, метеоризм), <15 мл/кг - риск легочных осложнений |
ОФВ1 |
3-4,5 л |
|
Форсированная ЖЕЛ |
50-60 мл/кг |
ОФВ1 /форсированная ЖЕЛ отражает степень обструкции бронхов, <50% - высокий риск легочных осложнений |
Максимальное статическое инспираторное давление (Pimax) |
125 см вод.ст. |
<25 см вод.ст. - неспособность глубоко вдохнуть |
Средняя экспираторная скорость (СОС 25-75%) |
4,5-5 л/с |
Чувствительный показатель ранней обструкции мелких бронхов, <50% - риск легочных осложнений |
Максимальное статическое экспираторное давление (PEmax) |
+200 см вод.ст. |
<+40 см вод.ст. - снижение способности кашлять |
Скорость пикового потока |
>8 л/с |
<3 л/с в предоперационном периоде - снижение эффективности кашля |
Для определения обратимости бронхиальной обструкции проводится проба с бронхолитиками (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - B). Пациент должен воздержаться от приема β2-агонистов короткого действия не менее 6 ч, пролонгированных β2-агонистов - не менее 12 ч, холинолитиков длительного действия - не менее 36 ч до спирометрии. Необходимо воздержаться от курения не менее 1 ч перед исследованием.
Методика теста:
При проведении теста на обратимость бронхообструкции применяют следующие препараты:
-
β2-агонисты короткого действия (начиная с минимальной дозы до максимально допустимой: сальбутамол - 200-400 мкг, фенотерол - 100-800 мкг) с измерением бронходилатационного ответа через 10-15 мин;
-
холинолитик ипратропия бромид (начиная с минимальных доз - 40 мкг, до максимально возможных - 160 мкг) с измерением бронходилатационного ответа через 30 мин.
Возможно проведение бронходилатационных тестов с назначением более высоких доз препаратов, которые ингалируют через небулайзеры. Повторные исследования ОФВ1 в этом случае следует проводить после ингаляции максимально допустимых доз: через 15 мин после ингаляции 2,5-5 мг сальбутамола или 0,5-1,5 мг фенотерола или через 30 мин после ингаляции 500 мкг ипратропия бромида.
Анализ газов артериальной крови выполняется при тяжелой степени сопутствующей респираторной патологии и для уточнения диагноза (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - С). Гиперкапния с показателем paCO2 >45-50 мм рт.ст. сопровождается повышенным риском развития ПОЛО. Пульсоксиметрия должна выполняться у всех пациентов с признаками ДН (уровень убедительности рекомендаций - I, уровень достоверности доказательств - A).
Патогенез периоперационной дыхательной недостаточности
ЦЕНТРОГЕННАЯ (ВЕНТИЛЯЦИОННАЯ) ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
Причины.
Факторы, способствующие опиоид-ассоциированной депрессии дыхания.
Факторы, способствующие формированию центрогенной ДН при бензодиазепин-ассоциированной депрессии дыхания.
Гипоксемия у больных ХОБЛ.
-
При ХОБЛ десатурация во сне более выражена и прогрессирует быстрее, чем у обычных пациентов, за счет частого поверхностного паттерна вентиляции в фазу быстрого сна.
-
В совокупности с послеоперационным снижением ФОЕ и действием опиоидов быстрая десатурация приводит к риску тяжелой гипоксемии в послеоперационном периоде на фоне медикаментозного сна.
Синдром гиповентиляции.
Гиповентиляция в ходе анестезии (при сохранении спонтанного дыхания или во время индукции).
НЕЙРОМЫШЕЧНАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
При отсутствии исходной патологии нейромышечная ДН формируется в результате воздействия препаратов для анестезии на респираторную мускулатуру и легочные объемы, связанные с ее состоянием.
Индукция анестезии приводит к потере тонуса инспираторной и увеличению тонуса экспираторной мускулатуры, что сопровождается ростом ВБД, смещением диафрагмы в краниальном направлении и уменьшением ФОЕ. Это приводит к снижению сил, поддерживающих объем легких, и увеличению сил, направленных на его уменьшение. В падении величины ФОЕ при индукции играют также роль такие факторы, как увеличение внутригрудного объема крови, ателектазирование, мышечная релаксация. Снижение ФОЕ, вызываемое этими причинами, достигает 500 мл, или 75-80% от его исходной величины. Максимальное снижение ФОЕ происходит в течение первых нескольких минут после начала анестезии (при отсутствии других факторов риска существенно в течение анестезии не снижается).
Причины дисфункции респираторной мускулатуры, связанные с применением миорелаксантов.
Профилактика нейромышечной ДН, связанной с применением миорелаксантов.
-
Использование препаратов короткого действия (частота развития остаточной нейромышечной блокады выше в 5 раз, а ПОЛО - в 3 раза при использовании панкурония бромида, в сравнении с короткодействующими миорелаксантами) (уровень убедительности рекомендаций - I, уровень достоверности доказательств - B).
-
Использование нейромышечного мониторинга (уровень убедительности рекомендаций - I, уровень достоверности доказательств - B).
Мониторинг нейромышечного блока.
Способ оценки восстановления мышечной проводимости.
Лечение нейромышечной ДН, связанной с применением миорелаксантов (В).
-
Неостигмина метилсульфат 1,25-2,5 мг в/в (максимально до 5 мг) или при использовании миорелаксанта рокурония бромида - сугаммадекс (Брайдан♠) 2 мг/кг (максимально до 16 мг/кг). Неостигмин следует вводить только при появлении клинических признаков самостоятельного дыхания или ответа на TOF-стимуляцию более 25%. Рекомендовано предварительное (за 5-10 мин) введение атропина в дозе 7-15 мкг/кг.
-
Лечение суксаметониевого апноэ - ИВЛ до полного восстановления нейро-мышечной проводимости с седацией.
НАРУШЕНИЕ КРОВООБРАЩЕНИЯ ПО МАЛОМУ КРУГУ
ТЭЛА - очень сложная клиническая проблема, которая нередко становится причиной ОСН и смерти больного. Быстрая и корректная диагностика ТЭЛА является краеугольным камнем ведения этой патологии, поскольку чем раньше установлен диагноз, тем более эффективным может быть лечение. Для определения риска Европейское общество кардиологов рекомендует ориентироваться на три группы маркеров: клинические маркеры, маркеры дисфункции ПЖ и маркеры повреждения миокарда.
Ни клинические признаки, ни стандартные методы обследования не дают возможности ни подтвердить, ни исключить диагноз ТЭЛА. К чувствительным и специфичным методам диагностики этой патологии относятся определение D-димера, ЭхоКГ, КТ с контрастированием, вентиляционно-перфузионная сцинтиграфия, ангиография, а также методы диагностики тромбоза глубоких вен нижних конечностей (ультрасонография, КТ-венография).
Европейское общество кардиологов (ESC, 2014) предлагает алгоритмы диагностики при ТЭЛА высокого и невысокого риска (рис. 3.11 и 3.12).
Вероятность ТЭЛА предварительно можно оценить по шкале M.W. Roges и P.S. Wells (2001):
-
клинические симптомы тромбоза глубоких вен нижних конечностей - 3 балла;
-
при проведении дифференциального диагноза ТЭЛА более вероятна, чем другие патологии, - 3 балла;
-
иммобилизация или хирургическое вмешательство на протяжении последних 3 дней - 1,5 балла;
-
тромбоз глубоких вен нижних конечностей или ТЭЛА в анамнезе - 1,5 балла;
-
онкологическая патология в настоящее время или давностью до 6 мес - 1 балл.
Если сумма не превышает 2 баллов, вероятность ТЭЛА низкая; при сумме баллов 2-6 - умеренная; более 6 баллов - высокая.
Основными направлениями лечения ТЭЛА являются гемодинамическая и респираторная поддержка, реперфузия (тромболизис или хирургическое удаление эмболов из легочных артерий), антикоагулянтная терапия. При этом стратегия лечения существенно зависит от степени риска.
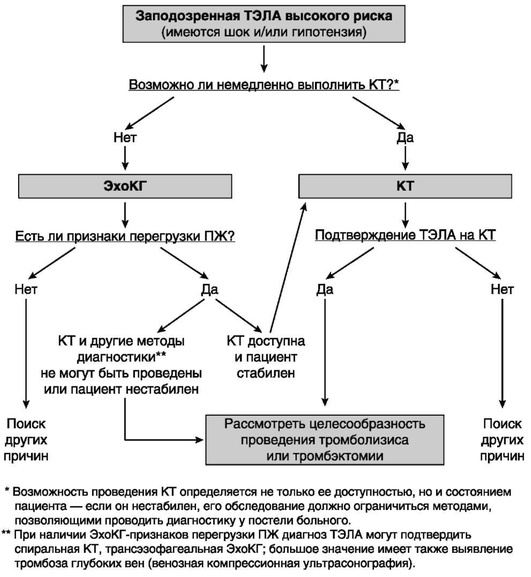
Рис. 3.11. Алгоритм диагностики при тромбоэмболии легочной артерии высокого риска (Guidelines on the diagnosis and management of acute pulmonary embolism. European Heart Journal, 2014)
Тромболитическая терапия (рекомендации экспертов Европейского общества кардиологов, 2014)
ТЛТ рекомендована пациентам с ТЭЛА, имеющим клинические проявления шока или гипотензии (уровень убедительности рекомендаций - I, уровень достоверности доказательств - A).
Рутинное применение тромболизиса не рекомендовано больным с ТЭЛА без шока или гипотензии (уровень убедительности рекомендаций - III, уровень достоверности доказательств - B).
ТЛТ может быть применена у лиц с ТЭЛА при умеренном/высоком уровне риска и клиническими проявлениями гемодинамической декомпенсации (уровень убедительности рекомендаций - II, уровень достоверности доказательств - B).
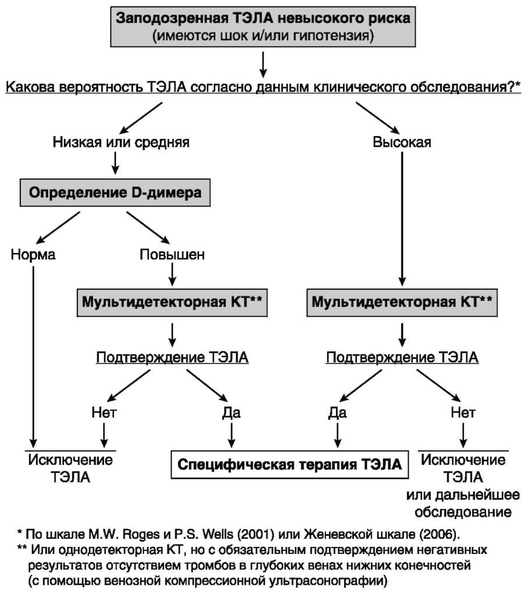
Рис. 3.12. Алгоритм диагностики при тромбоэмболии легочной артерии невысокого риска (Guidelines on the diagnosis and management of acute pulmonary embolism. European Heart Journal, 2014)
Среди тромболитиков могут быть использованы стрептокиназа (250 000 ед. - нагрузочная доза в течение 30 мин, затем внутривенная поддерживающая инфузия со скоростью 100 000 ед/ч на протяжении 12-24 ч), алтеплаза (100 мг внутривенно в течение 2 ч), ретеплаза (рекомбинантный препарат алтеплазы) и урокиназа.
Факторы риска кровотечения и противопоказания к применению тромболитиков при тромбоэмболии легочной артерии (адаптировано из рекомендаций АССР, 2016)
Антикоагулянтная терапия (рекомендации экспертов Европейского общества кардиологов, 2014)
Пациентам с острым эпизодом ТЭЛА обычно необходимо одновременное назначение парентерального антикоагулянта (НМГ, или фондапаринукса, или НФГ внутривенно или подкожно) и антагониста витамина K (варфарина). Парентеральный антикоагулянт рекомендуется продолжать обычно не менее 5 дней и до момента, когда МНО будет находиться на уровне ≥2,0 в течение не менее 24 ч. Парентеральный антикоагулянт следует начать принимать еще в процессе ожидания результатов диагностических мероприятий, направленных на подтверждение диагноза ТЭЛА, при высокой вероятности ее наличия, а также при умеренной вероятности (в этом случае - если время ожидания результатов диагностических тестов >4 ч). При низкой вероятности ТЭЛА начинать лечение парентеральным антикоагулянтом не следует до получения результатов обследования. НФГ вводится с целью удержания АЧТВ в пределах значений, в 1,5-2,5 раза превышающих нормальный показатель (уровень убедительности рекомендаций - I, уровень достоверности доказательств - C).
Новые пероральные антикоагулянты - прямой ингибитор тромбина дабигатрана этексилат и антагонисты Ха-фактора коагуляции ривароксабан и апиксабан могут использоваться в начальном и последующем лечении ТЭЛА. Дабигатрана этексилат (по 150 мг 2 раза в день, а у лиц в возрасте ≥80 лет - по 110 мг 2 раза в день) назначается лицам, которые уже получали лечение парентеральным антикоагулянтом на протяжении 5-10 дней; ривароксабан (по 20 мг 1 раз в сутки во время еды) и апиксабан могут быть использованы без предварительного применения парентерального антикоагулянта.
Среди парентеральных антикоагулянтов у лиц с острым эпизодом ТЭЛА НМГ или фондапаринукс предпочтительнее, чем НФГ (вводимый как подкожно, так и внутривенно).
Применение НФГ внутривенно может быть предпочтительным режимом парентеральной антикоагулянтной терапии у следующих категорий пациентов:
После перенесенного эпизода ТЭЛА больным обычно показана длительная антикоагулянтная терапия, для которой могут использоваться антагонист вита мина K (варфарин) либо новые пероральные антикоагулянты - дабигатрана этексилат (по 150 мг 2 раза в день, а у лиц в возрасте ≥80 лет - по 110 мг 2 раза в день), ривароксабан (по 20 мг 1 раз в день) и апиксабан. Применение НМГ, дабигатрана этексилата, ривароксабана и апиксабана может быть ограничено при СКФ <30 мл/мин.
Катетерное устранение тромба (рекомендации АССР, 2016)
Катетерные методы устранения тромба или хирургическая эмболэктомия из системы легочной артерии могут быть использованы (при наличии соответствующих опыта и возможностей) у больных с острым эпизодом ТЭЛА, ассоциированным с гипотензией:
В центрах, обладающих значительным опытом, может применяться комбинация катетерных методов и тромболизиса (если риск кровотечений не является высоким), либо же катетерные подходы используют при неуспехе тромболизиса. Хирургическая эмболэктомия также может быть использована у лиц с ТЭЛА, которым требуется хирургическое устранение тромба из правого предсердия, а также если необходимо закрытие овального окна при его незаращении (например, при парадоксальной эмболии).
Установка фильтра в нижнюю полую вену (рекомендации АССР, 2016)
Установка фильтра в нижнюю полую вену может быть рекомендована больным с острым эпизодом ТЭЛА при наличии противопоказаний к проведению антикоагулянтной терапии. Пациентам с острой ТЭЛА, которые получают лечение антикоагулянтами, не следует устанавливать такие фильтры. Если после установки интракавального фильтра через какое-то время риск кровоточивости снижается и назначение антикоагулянтов становится возможным, то таким больным следует проводить обычную антикоагулянтную терапию. Вопрос об установке фильтра в нижнюю полую вену может быть рассмотрен у больных, имеющих повторные эпизоды ТЭЛА, несмотря на поддержание терапевтических уровней антикоагуляции.
ТОРАКО-ДИАФРАГМАЛЬНАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
Торако-диафрагмальная ДН может быть вызвана расстройствами биомеханики дыхания в результате патологии грудной клетки (перелом ребер, кифосколиоз, болезнь Бехтерева), высоким стоянием диафрагмы (парез желудка и кишечника, асцит, избыточная масса тела), а также патологией плевры (облитерация плевральной полости, гемоторакс, пневмоторакс, плеврит, гидроторакс).
Наиболее распространенная причина торако-диафрагмальной ДН - пневмоторакс (табл. 3.45).
Таблица 3.45. Причины и диагностика пневмоторакса
| Причины | Диагностические признаки |
|---|---|
|
|
Важной клинической задачей является диагностика пневмоторакса, рентгенография носит вспомогательный характер. Основными клиническими признаками пневмоторакса на фоне самостоятельного дыхания являются боль в грудной клетке, одышка, ослабление экскурсии грудной клетки и дыхательных шумов с одной стороны, во время проведения ИВЛ - ослабление экскурсии грудной клетки и дыхательных шумов с одной стороны, а также быстрый рост пикового давления и давления плато в дыхательных путях. При большом скоплении воздуха в плевральной полости к этим нарушениям присоединяется гипоксемия (цианоз), при напряженном пневмотораксе - гипотензия и набухание шейных вен.
Напряженный пневмоторакс должен быть немедленно переведен в открытый до рентгенологического исследования на основании клинических признаков - болей в грудной клетке, цианоза, тахикардии, гипотензии, набухания шейных вен, ослабления дыхания с одной стороны (уровень убедительности рекомендаций - I, уровень достоверности доказательств - A). При подозрении на напряженный пневмоторакс производится пункция плевральной полости толстой иглой во II межреберье по среднеключичной линии, после чего выполняется дренирование плевральной полости.
Лечение пневмоторакса.
ДИНАМИЧЕСКАЯ ГИПЕРИНФЛЯЦИЯ (ПЕРЕРАЗДУВАНИЕ) АЛЬВЕОЛ
У больных с ХОБЛ при проведении ИВЛ возможно возникновение динамической гиперинфляции (перераздувания альвеол) с развитием аутоПДКВ, которая, как и пневмоторакс, может сопровождаться резким падением АД и гипоксемией. Признаками гиперинфляции во время проведения ИВЛ являются увеличение давления в дыхательных путях, гипотензия и гипоксемия, которые обычно возникают вскоре после начала ИВЛ. Дифференциально-диагностическим признаком, отличающим это состояние от пневмоторакса, является ослабление экскурсии грудной клетки и дыхательных шумов с обеих сторон, а также недостижение нуля на кривой потока на выдохе и наличие аутоПДКВ.
При выявлении динамической гиперинфляции целесообразно немедленно произвести рассоединение дыхательного контура от пациента до полного выдоха и затем перенастройку параметров ИВЛ - уменьшение ПДКВ, укорочение времени вдоха и удлинение соотношения вдоха к выдоху (уровень убедительности рекомендаций - I, уровень достоверности доказательств - B).
БРОНХОЛЕГОЧНАЯ (ОБСТРУКТИВНАЯ) ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
Причины повышения сопротивления дыхательных путей разнообразны, обструкция может произойти на любом этапе анестезии.
Индукция.
Поддержание анестезии.
Выход из анестезии.
ИВЛ у пациентов с ХОБЛ (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - B)
-
ИВЛ повышает давление в булле, что может привести к разрыву буллы, пневмотораксу или бронхоплевральной фистуле.
-
При ИВЛ необходимо не допускать чрезмерного повышения давления в дыхательных путях и иметь под рукой инструментарий для немедленной декомпрессии плевральной полости.
-
Не следует добиваться значений paCO2 и pH, равных 40 и 7,4 мм рт. ст (соответственно).
-
Следует избегать развития динамической гиперинфляции (перераздувания) альвеол (см. ниже).
РЕСТРИКТИВНАЯ ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
Острый респираторный дистресс-синдром
Факторы, приводящие к развитию ОРДС в интраоперационном периоде.
-
Невыполнение концепции безопасной (протективной) ИВЛ с установкой ДО более 10 мл/кг и Рпик более 30 см вод.ст., а также использование токсичных фракций кислорода (более 60%) независимо ассоциируются с развитием ОРДС (А), причем тяжесть повреждения легких зависит от продолжительности ИВЛ.
-
Непрямое повреждение легких - длительное ИК, гипергидратация, массивная трансфузия СЗП, системное воспаление.
-
Причиной ОРДС может стать повреждение грудного лимфатического протока.
-
Ограничение инфузии может уменьшить выраженность, но не предотвратить ОРДС (В).
-
Применение в предоперационном периоде химиотерапии (препарат цисплатин и др.) увеличивает риск развития послеоперационного ОРДС.
Аспирационный пневмонит
Аспирация - попадание желудочного содержимого в дыхательные пути ниже уровня истинных голосовых связок. Протекает по-разному - от отсутствия клиники до развития тяжелого пневмонита и/или ОРДС. Доля аспирационного пневмонита в структуре смертности, связанной с анестезией, около 9% [22]. В настоящее время частота аспирационного синдрома варьирует от 1-5 случаев на 3000-10 000 плановых анестезий и 1 случая на 600 экстренных анестезий у взрослых пациентов. Аспирация может произойти незаметно на всех этапах анестезии - от вводного наркоза до восстановления.
Для развития аспирационного синдрома необходимо сочетание двух условий:
Повреждение легких возникает сразу после аспирации и нарастает в течение нескольких часов. Первая фаза (1-2 ч) - прямая реакция легких на повреждение кислотой, что приводит к интерстициальному отеку, снижению комплайнса и шунтированию крови (химический пневмонит). Вторая фаза (спустя 2-6 ч) связана с развитием острого воспалительного ответа на первичное повреждение и обусловлена выбросом медиаторов воспаления (TNF, α-IL-8 и кислородные радикалы) и может привести к ОДН [17].
Аспирация нейтрального содержимого повреждает сурфактант, развиваются ателектазы, присоединяется гипоксия. Повреждения легких и воспалительный ответ выражены в меньшей степени.
Аспирация твердого содержимого вызывает обструкцию дыхательных путей, гипоксию и гиперкапнию, позже - воспалительную реакцию на инородное тело.
Сочетание твердого и жидкого кислого содержимого вызывает более яркую клиническую картину и более тяжелое состояние больного.
Аспирационная пневмония может развиться как при вдыхании инфицированного материала, так и за счет присоединения вторичной бактериальной инфекции к химическому пневмониту. Клиника сходна с течением внебольничной пневмонии (ВП), однако частота развития осложнений (образование полостей или абсцедирование) при аспирационной пневмонии выше.
Признаки и симптомы в первой фазе повреждения легких кислотой: кашель, цианоз, стридорозное дыхание - в 30-40%; затем апноэ, брадикардия и гипотензия; гипертермия - около 90% случаев; позднее - астмоидная одышка, тахипноэ и хрипы - в 70%; шок. Появляются инфильтраты и ОЛ на фоне тахикардии, гипотонии, нарушения венозного давления, гипоксемия.
Профилактика аспирационного синдрома включает следующие направления:
Предоперационное голодание. Питание перед плановыми операциями (включая кесарево сечение) должно соответствовать временным интервалам (уровень убедительности рекомендаций - I, уровень достоверности доказательств - A) [23]: 2 и более часа для прозрачной жидкости (вода, соки без мякоти, чай или кофе без молока); 4 ч для грудного молока; не менее 6 ч для легкой пищи, конфет, молока (включая молочные смеси) и непрозрачных жидкостей.
Снижение объема и кислотности желудочного содержимого. Примерно у 50% людей, не принимавших перед операцией пищу, остаточный объем содержимого желудка превышает 25 мл с рН около 2. К тому же боль, тревога и стресс через активацию симпатической нервной системы замедляют опорожнение желудка. Поэтому актуально снижение интенсивности желудочной секреции до относительно «безопасных» значений (рН >2,5 и объем менее 25 мл) и применение во время вводной анестезии комплекса противоаспирационных мероприятий (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - C).
Опорожнение желудка с помощью зонда уменьшает объем желудочного содержимого, внутрижелудочное давление и риск регургитации. Однако зондовое опорожнение недостаточно эффективно из-за остаточного содержимого в желудке, снижения тонуса и предотвращения закрытия нижнего сфинктера пищевода (уровень убедительности рекомендаций - IIb, уровень достоверности доказательств - C) [24].
Интубация трахеи в сознании под местной анестезией - метод выбора при риске легочной аспирации (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - C). Однако чрезмерная седация и/или передозировка местного анестетика сводят на нет защитные рефлексы пациента.
Быстрое последовательное введение в анестезию используют у пациентов при угрозе регургитации и аспирации. Однако у пациентов высокого риска эта технология может вызвать выраженные гемодинамические сдвиги и быть несостоятельной при трудной интубации трахеи [25].
Прием Селлика (пережатие пищевода придавливанием гортани к позвоночнику) - стандарт во время вводной анестезии и интубации трахеи у пациентов с потенциально полным желудком, может помочь предотвратить попадание желудочного содержимого в дыхательные пути [25]. Однако нет убедительных клинических данных о снижении частоты аспирации и смертности при выполнении приема Селлика [18] (уровень убедительности рекомендаций - IIb, уровень достоверности доказательств - C).
Защита дыхательных путей. Раздувание манжетки интубационной трубки. Однако это не гарантирует полной профилактики аспирации. Содержимое желудка может пройти мимо нераздутой или недостаточно раздутой манжеты (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - C).
Выбор оптимального cпocoбa анестезии. Выполнение операции в условиях регионарной анестезии теоретически снижает риск аспирации. Однако опасность аспирации при регионарной анестезии остается, так как ее часто дополняют седацией, а при необходимости - ИВЛ (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - C) [1].
Ателектазы
Факторы риска возникновения ателектазов.
Ателектазы при операциях на верхнем этаже брюшной полости и торакальных операциях.
Предоперационная подготовка и модификация факторов риска при бронхообструктивных заболеваниях и состояниях
Несмотря на увеличенный риск легочных осложнений, не существует каких-либо специфических противопоказаний к оперативному лечению больных с бронхообструктивной патологией. Однако необходима предоперационная оценка с целью определения тяжести заболевания и назначения адекватного лечения, если оно не проводилось. Отмена планового оперативного вмешательства необходимо только при обострении ХОБЛ.
У пациентов высокого риска необходим отказ от курения (уровень убедительности рекомендаций - I, уровень достоверности доказательств - A) (табл. 3.46).
МЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ НАРУШЕНИЯ БРОНХИАЛЬНОЙ ОБСТРУКЦИИ
Активная терапия нарушения легочных функций (в соответствии с рекомендациями GOLD, 2013 - Global Initiative for Chronic Obstructive Lung Disease, Глобальная инициатива по хронической обструктивной болезни легких - http://www.goldcopd.com):
-
антибиотики (у пациентов с ХОБЛ и продуктивным кашлем 10-дневный курс антибиотикотерапии снижает частоту послеоперационной пневмонии, плановая операция должна быть отложена до окончания курса антибиотикопрофилактики) (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - C).
Таблица 3.46. Профилактика осложнений у курильщиков
| Срок отказа от курения | Плюсы | Минусы |
|---|---|---|
2-3 дня |
Нормализация уровней угарного газа (карбоксигемоглобина) и никотина. Снижение частоты интраоперационной ишемии миокарда. Улучшение дренажной функции бронхов |
Повышение реактивности дыхательных путей: риск развития интра- и послеоперационного бронхоспазма, ларингоспазма. Возможно появление или обострение реактивных респираторных заболеваний. Увеличение продукции мокроты. Повышение риска ТГВ. Раздражительность, беспокойство |
1-2 нед |
Нормализация продукции мокроты. Снижение реактивности дыхательных путей. Снижение риска ТГВ |
- |
4-8 нед |
Уменьшение частоты:
|
- |
2 года |
«Нормализация» ОФВ1 |
- |
Предоперационная бронходилатация:
-
при астме/ХОБЛ необходимо применение максимальной бронходилатирующей терапии (в соответствии с рекомендациями Global Initiative for Asthma - http://www.ginasthma.org);
-
пациенты, рефрактерные к терапии симпатомиметиками и холинолитиками, должны получать кортикостероиды;
-
пациенты с гиперреактивностью бронхов [объем форсированного выдоха за 1 с (ОВФ1) менее 70% и увеличением ОФВ1 более чем на 10% после приема бронходилататоров] на фоне постоянного применения бронходилататоров должны пройти 5-дневный предоперационный курс терапии кортикостероидами (40 мг/день метилпреднизолона), что значительно снижает частоту постинтубационного затруднения дыхания.
При проведении физиотерапии в предоперационном периоде частота ПОЛО снижается.
При ДН 2-й и 3-й степени (ОВФ1 менее 50% от должной с paO2 менее 55 мм рт.ст. соответственно) необходима предварительная госпитализация для обследования и проведения активной терапии.
ПРОФИЛАКТИКА ПЕРИОПЕРАЦИОННОГО БРОНХОСПАЗМА
-
Профилактика бронхоспазма - дополнительно к другим мероприятиям - 1-2 мг/кг гидрокортизона, у пациентов, получающих кортикостероиды, - 4 мг/кг, в случае его отсутствия - преднизолон или дексаметазон в эквивалентных дозах (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - B).
-
У пациентов с астмой, находящихся в группе риска развития бронхоспазма, особенно при интубации трахеи, возможной профилактикой этого состояния может являться ежедневное назначение коротких α2-агонистов и системных кортикостероидов в течение 5 дней перед операцией (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - B).
-
Включение в схему индукции анестезии внутривенной инъекции раствора лидокаина в дозе 1,5-2 мг/кг (уровень убедительности рекомендаций - IIa, уровень достоверности доказательств - C).
-
При БА в премедикации не использовать H2-блокаторы (уровень убедительности рекомендаций - III, уровень достоверности доказательств - C).
-
Назначение антибиотиков с профилактической целью не показано (уровень убедительности рекомендаций - III, уровень достоверности доказательств - C).
ПРОФИЛАКТИКА ГИПЕРИНФЛЯЦИИ
Предоперационная подготовка и модификация факторов риска при рестриктивных заболеваниях и состояниях
ОСОБЕННОСТИ АНЕСТЕЗИИ ПРИ РЕСТРИКТИВНОЙ ПАТОЛОГИИ ЛЕГКИХ
Причины респираторных нарушений при индукции анестезии.
Респираторные нарушения на этапе поддержания анестезии.
Возможные респираторные нарушения в послеоперационном периоде.
Оптимизация анестезиологического обеспечения при рестриктивной патологии. Региональная анестезия позволяет избежать снижения ФОЕ и уменьшает риск развития гипоксемии.
ПРОФИЛАКТИКА ГИПОКСЕМИИ В ПРЕДОПЕРАЦИОННОМ ПЕРИОДЕ У ТУЧНЫХ ПАЦИЕНТОВ И ПАЦИЕНТОВ С СИНДРОМОМ ОБСТРУКТИВНОГО СОННОГО АПНОЭ
-
Интубация: проблемы трудной интубации подробно освещены в рекомендациях Федерации анестезиологов-реаниматологов (ФАР) по данной проблеме (http://far.org.ru/recomendation).
Рекомендации для интраоперационной респираторной терапии. Требуется более высокий уровень инспираторного давления в дыхательных путях.
Экстубация тучных пациентов.
-
Большой риск дыхательной депрессии и обструкции дыхательных путей.
-
Нельзя проводить экстубацию трахеи у пациентов с не полностью восстановившимся сознанием. Важно, чтобы пациент имел адекватный респираторный драйв и минутный объем дыхания.
-
Лучше задержать экстубацию для достижения всех необходимых условий.
-
В идеале проводится при восстановлении полной активности пациента, в полусидячем положении после создания ПДКВ для профилактики ателектазов.
-
До экстубации должна подаваться смесь воздуха и кислорода. Чистый кислород или кислород с динитрогена оксидом (Азота закисью♠) увеличивают риск развития ателектазов и неблагоприятно влияют на дыхательную функцию.
Список литературы
-
Гурьянов В.А. Предоперационное обследование. Операционно-анестезиологический риск // Анестезиология : национальное руководство / под ред. А.А. Бунятяна, В.М. Мизикова. М. : ГЭОТАР-Медиа, 2011. С. 448-467.
-
Евдокимов Е.А., Лихванцев В.В. Ошибки, опасности и осложнения общей анестезии // Анестезиология : национальное руководство / под ред. А.А. Бунятяна, В.М. Мизикова. М. : ГЭОТАР-Медиа, 2011. С. 521-559.
-
Заболотских И.Б. Послеоперационная тошнота и рвота: механизмы, факторы риска, прогноз и профилактика. М. : Практическая медицина, 2009.
-
Кассиль В.Л., Выжигина М.А., Лескин Г.С. Искусственная и вспомогательная вентиляция легких. СПб. : Медицина, 2004. 480 с.
-
Лебединский К.М., Мазурок В.А., Нефедов А.В. Основы респираторной поддержки. СПб. : Человек, 2008. 208 с.
-
Магомедов М.А., Заболотских И.Б. Миоплегия. М. : Практическая медицина, 2010. 224 с.
-
American College of Physicians: preoperative pulmonary function testing // Ann. Intern. Med. 1990. Vol. 112. P. 793-794.
-
Amini N., Kim Y., Hyder O., Spolverato G. A nationwide analysis of the use and outcomes of perioperative epidural analgesia in patients undergoing hepatic and pancreatic surgery // Am. J. Surg. 2015. Vol. 210, N 3. P. 483-491.
-
Arozullah A.M., Khuri S.F., Henderson W.G. et al. Development and validation of a multifactorial risk index for predicting postoperative pneumonia after major noncardiac surgery // Ann. Intern. Med. 2001. Vol. 135. P. 847-857.
-
Bishop M.J., Cheney F.W. Anesthesia for patients with asthma. Low risk but not no risk // Anesthesiology. 1996. Vol. 85, N 3. P. 460-467.
-
Canet J., Sabate' S., Mazo V., Gallart L. Development and validation of a score to predict postoperative respiratory failure in a multicentre European cohort: a prospective, observational study // Eur. J. Anaesthesiol. 2015. Vol. 32, N 7. P. 458-470.
-
Cartin-Ceba R., Sprung J., Gajic O. et al. The aging respiratory system. Anesthetic strategies to minimize perioperative pulmonary complications // Geriatr. Anesthesiol. 2009. Vol. 11. P. 149-164.
-
Cereda M. Pulmonary risk assessment // Perioperative Medicine: Managing for Outcomes. 1st ed. 2008. Ch. 10. P. 105-119.
-
Hans G.A., Sottiaux T.M., Lamy M.L. et al. Ventilatory management during routine general anaesthesia // Eur. J. Anaesthesiol. 2009. Vol. 26, N 1. P. 1-8.
-
Kurup V. Respiratory diseases // Anesthesia and Co-Existing Disease. 2008. Ch. 9. P. 161-196.
-
Liu S.S. et al. Effect of postoperative analgesia on major postoperative complications: a systematic update of the evidence // Ahesthesia Analg. 2007. Vol. 104, N 3. P. 689-702.
-
Marik P.E. Aspiration Pneumonitis and Pneumonia. Textbook of Critical Care. 5th ed. ch. 76 / eds M.P. Fink et al. Elsevier, 2005.
-
Neilipovitz D.T., Crosby E.T., Moppett I.K. Respiratory risk // Consent, Benett and Risk in Anesthetic Practice. 2007. Ch. 12.
-
Nafiu O.O., Ramachandran S.K., Ackwerh R. Factors associated with and consequences of unplanned post-operative intubation in elderly vascular and general surgery patients // Eur. J. Anaesthesiol. 2011. Vol. 28, N 3. Р. 220-224.
-
Srinivas R.B. Preoperative evaluation of the patient with pulmonary disease // Chest. 2007. Vol. 132. P. 1637-1645.
-
Weijs T.J., Ruurda J.P., Nieuwenhuijzen G.A., van Hillegersberg R. Strategies to reduce pulmonary complications after esophagectomy // World J. Gastroenterol. 2013. Vol. 19, N 39. P. 6509-6514.
-
Perlas A., Chan V.W., Lupu C.M. et al. Ultrasound assessment of gastric content and volume // Anesthesiology. 2009, Jul. Vol. 111, N 1. P. 82-89.
-
American Society of Anesthesiologists Committee. Practice guidelines for preoperative fasting and the use of pharmacologic agents to reduce the risk of pulmonary aspiration: application to healthy patients undergoing elective procedures: an updated report by the American Society of Anesthesiologists Committee on Standards and Practice Parameters // Anesthesiology. 2011, Mar. Vol. 114, N 3. P. 495-511.
-
Bauer V.P. The Evidence against Prophylactic Nasogastric Intubation and Oral Restriction // Clin. Colon. Rectal. Surg. 2013 Sep. Vol. 26, N 3. P. 182-185.
-
Algie C.M., Mahar R.K., Tan H.B. et al. Effectiveness and risks of cricoid pressure during rapid sequence induction for endotracheal intubation // Cochrane Database Syst. Rev. 2015, Nov. Vol. 18, N 11. CD011656.