Челюстно-лицевая хирургия / под ред. Кулакова А. А. - Москва : ГЭОТАР-Медиа, 2019. - 692 с. (Серия "Национальные руководства") - ISBN 978-5-9704-4853-3 |
Аннотация
Национальное руководство "Челюстно-лицевая хирургия" содержит актуальную информацию о современных методах диагностики и лечения заболеваний челюстно-лицевой области. В нем рассмотрены такие темы, как обезболивание и особенности его использования в челюстно-лицевой хирургии; современные взгляды на этиологию, патогенез, клиническую картину, диагностику и лечение одонтогенных и неодонтогенных воспалительных заболеваний, травм и новообразований челюстно-лицевой области, а также заболеваний слюнных желез и нервов лица; микрохирургическая аутотрансплантация тканей челюстно-лицевой области. Представлены также главы, посвященные диагностике и планированию лечения пациентов с врожденными и приобретенными дефектами и деформациями челюстно-лицевой области.
В подготовке настоящего издания в качестве авторов-составителей и рецензентов принимали участие ведущие специалисты в области челюстно-лицевой хирургии.
Все рекомендации прошли этап независимого рецензирования.
Руководство предназначено челюстно-лицевым хирургам и другим врачам смежных специальностей, а также студентам старших курсов медицинских высших учебных заведений, ординаторам, аспирантам.
Ч-38
12.1. СОСУДИСТЫЕ ПОРАЖЕНИЯ ГОЛОВЫ И ШЕИ У ДЕТЕЙ
В.В. Рогинский, А.Г. Надточий, А.С. Григорьян, Ю.Ю. Соколов, Ю.Л. Солдатский
Термин «гемангиома» был предложен Рудольфом Вирховым (Rudolf Wirhov) в 1964 г. Ему же принадлежит и первая систематизация гемангиом, которые он разделял по их макроскопическому строению на простые (капиллярные), кавернозные и гроздьевидные (рацемозные).
Все последующие классификации в основе своей опирались на классификацию Вирхова, модифицируя ее с учетом анатомических особенностей сосудистого поражения, глубины его распространенности, микроскопической картины превалирующих сосудов, сочетания различных гистологических типов опухолевых клеток.
Революционным событием, обеспечившим прорыв в понимании биологической сущности гемангиом, стало исследование J.B. Mulliken, J. Glowacki, результаты которого были опубликованы в 1982 г. Авторы доказали, что в биологическом отношении гемангиомы неоднородны: у части гемангиом клетки эндотелия обладают выраженной пролиферативной активностью (и по этому признаку авторы отнесли их к опухолям), а у другой части гемангиом пролиферативная активность эндотелия отсутствует (и по этому признаку авторы отнесли их к порокам развития - мальформациям). Опираясь на результаты этого исследования, авторы создали принципиально новую классификацию, позиционировав ее как биологическую, основанную на клинических и эндотелиальных характеристиках сосудистых образований (цит. по Mulliken J.B., Glowacki J. Plast Reconstr Surg, 1982). Это положение в настоящее время является общепризнанным - оно отражено в последней дополненной классификации сосудистых аномалий [Международное общество по изучению сосудистых аномалий (ISSVA)], 2014 г. (табл. 12.1).
Таблица 12.1. Классификация сосудистых аномалий Международного общества по изучению сосудистых аномалий (принята на 20-й конференции Международного общества по изучению сосудистых аномалий, Мельбурн, апрель 2014)
| Сосудистые аномалии | ||||
|---|---|---|---|---|
сосудистые опухоли |
сосудистые мальформации |
|||
Доброкачественные |
Простые |
Комбинированные° |
По названию крупных сосудов |
Ассоциированные с другими аномалиями |
Злокачественные |
КМ |
Капилляровенозная мальформация, капилляролимфатическая мальформация Лимфовенозная мальформация, капилляролимфовенозная мальформация Капилляроартериовенозная мальформация* Капилляролимфоартериовенозная мальформация* и др. |
Детально описаны на сайте http://www/issva/org/classification |
Детально описаны на сайте http://www/issva/org/classification |
° Определяется наличием двух или более типов сосудистых мальформаций в одном очаге поражения.
* Поражения с высокой скоростью потока.
Детская и врожденная гемангиома
Детская и врожденная гемангиома (гиперплазия кровеносных сосудов - ГКС) - опухолеподобное образование из кровеносных сосудов, в основе которого лежит пролиферация клеток эндотелия капилляров, обладающее выраженной тенденцией к самопроизвольной инволюции.
Термин «гемангиома» широко используется до настоящего времени. Термин - это не только формальное определение, за постановкой диагноза следуют действия. Определение заболевания с префиксом «ома» подразумевает опухолевый характер, что дает основание проводить агрессивные методы лечения.
Группой исследователей (Рогинский В.В. и соавт., 2010) было предложено выделить данный тип поражения из группы опухолей в отдельную группу, названную «гиперплазия кровеносных сосудов», и рассматривать их с позиции не опухолевого роста, а реактивной пролиферации эндотелия, вызванной нарушениями во внутриутробном формировании плода.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Предшествующим фактором развития ГКС у детей является гипоксия плода в период гестации, возникающая на фоне токсикоза, угрозы прерывания беременности, обвития пуповины, преэклампсии, антифосфолипидного синдрома, нефропатии, острого респираторного заболевания, приема лекарственных препаратов и другие причины.
ГКС имеет ряд характерных клинических проявлений, позволяющих идентифицировать ее как особую нозологическую форму. Появляются очаги ГКС при рождении или в первые 2 нед жизни ребенка (стадия первичных проявлений). С 2-3-й недели до 4-6 мес жизни отмечается бурный рост (стадия активного роста). С 6-9 мес начинается постепенная инволюция (стадия начала инволюции), которая длится несколько месяцев, а иногда и лет (стадия выраженной инволюции). Кроме того, процесс инволюции может быть неполным, что проявляется остаточными деформациями в виде объемных образований, представленных жировой и фиброзной тканью, избыточными участками кожи и слизистой оболочки, с изменением цвета и структуры кожи (стадия резидуальных проявлений). На коже в стадии резидуальных проявлений могут оставаться расширенные венозные сплетения.
ЭПИДЕМИОЛОГИЯ
Частота встречаемости ГКС варьирует от 1:100 до 1:1200 новорожденных. Из них в челюстно-лицевой области (ЧЛО) и шеи локализуются 68-80%.
КОДЫ ПО МЕЖДУНАРОДНОЙ КЛАССИФИКАЦИИ БОЛЕЗНЕЙ 10-ГО ПЕРЕСМОТРА
Гемангиома (D18):
D18.0 Гемангиома любой локализации
КЛАССИФИКАЦИИ
В настоящее время наиболее востребованной среди специалистов, зоной интересов которых является ЧЛО, остается клинико-анатомическая классификация сосудистых аномалий ISSVA 2014 г.
Сосудистые опухоли представлены в ней следующим образом (табл. 12.2).
Таблица 12.2. Классификация сосудистых опухолей Международного общества по изучению сосудистых аномалий
Доброкачественные сосудистые опухоли |
Инфантильная гемангиома/гемангиома детского возраста (Are details) |
Врожденная гемангиома |
Быстро инволютирующая (RICH) |
Неинволютирующая (NICH) |
Частично инволютирующая (PICH) |
Пучковая ангиома |
Веретеновидноклеточная гемангиома |
Эпителиоидная гемангиома |
Пиогенная гранулема (также известная как дольковая капиллярная гемангиома) |
Другие |
Местноагрессивные или пограничные сосудистые опухоли |
Капошиформная гемангиоэндотелиома |
Ретиформная гемангиоэндотелиома |
Папиллярная лимфатическая внутрисосудистая ангиоэндотелиома (PILA), опухоль Дабска |
Сложная гемангиоэндотелиома |
Саркома Капоши |
Другие |
Злокачественные сосудистые опухоли |
Ангиосаркома |
Эпителиоидная гемангиоэндотелиома |
Другие |
Классификация патологических образований из кровеносных сосудов ЧЛО и шеи у детей В.В. Рогинского и соавт. (2010)
Основное расхождение взглядов в этих классификациях в вопросе о детских и врожденных гемангиомах, которые в классификации ISSVA относятся к опухолям, а в классификации В.В. Рогинского и соавт. к реактивным процессам - ГКС. Понятия RICH, NICH, PICH связаны с временем начала и окончания инволюции. Если гиперплазия возникает внутриутробно, то она может пройти часть пути инволюции до родов, и оставшаяся часть будет протекать медленно или инволюция не будет закончена полностью (NICH). Чаще всего наблюдается RICH, т.е. быстро инволютирующая гиперплазия, реже PICH - частично инволютирующая гиперплазия. В случае PICH инволютирует сосудистый компонент, а жировой и фиброзный могут остаться.
ЭТИОЛОГИЯ
Еще Вирховым (1863) установлено образование гемангиом в местах, где у эмбриона располагаются жаберные щели, т.е. в зоне слияния эмбриональных бугров: веки, уши, щеки, губы, носощечные области. Это объясняет появление сосудистой гиперплазии в ЧЛО с наиболее сложной анатомией, большим количеством эмбриональных бугров на единицу ткани. Периферические отделы бугров являются наиболее активно развивающейся зоной, обеспечивающей рост и слияние бугров. Поэтому именно периферическая зона эмбриональных бугров, как метаболически наиболее активная, является наиболее чувствительной к гипоксии плода, и именно в ней можно ожидать развитие реактивной сосудистой гиперплазии, направленной на компенсацию гипоксии. Таким образом, сосудистая гиперплазия (СГ) возникает не в эмбриональных щелях, а на периферии эмбриональных бугров: это может быть либо в месте слияния бугров (например, околоушно-жевательная, щечная и подглазничная области, корень носа), либо в периферической части бугра (кончик носа, верхняя губа).
Главная особенность СГ - это ее свойство подвергаться инволюции.
Ткани СГ представлены избыточной клеточной массой, которые должны васкуляризироваться. Если темп роста СГ (клеточной массы) опережает темп васкуляризации, то клетки СГ начинают некротизироваться. Это проявляется изъязвлением. Изъязвление в данном случае проявление трофических нарушений из-за гипоксии ткани. После изъязвления происходит рубцевание, что способствует инволюции.
Выявлено, что для так называемой инфантильной гемангиомы в фазе быстрого роста характерно увеличение метаболизма в клетках эндотелия (экспрессия белка - транспортера глюкозы GLUT-1), нарастание фактора роста эндотелия (VEGF).
В 2010 г. впервые в мировой практике СГ как нозология выделена группой исследователей (В.В. Ро-гинский, А.Г. Надточий, А.С. Григорьян и др.). Главное, что было достигнуто, - это понимание, что так называемые детские и врожденные гемангиомы не являются опухолями, а представляют собой реактивные развивающиеся, а затем инволитирующие процессы - гиперплазии. Предположительно их возникновение связано с гипоксией тканей плода.
ДИАГНОСТИКА
Диагноз «гиперплазия кровеносных сосудов» является клиническим, устанавливается на основании клинического и инструментальных методов исследования: опрос (анамнез жизни пациента, включая антенатальный период (акушерский анамнез матери) и анамнез заболевания), визуальный осмотр, данные физикального обследования, дополнительных лучевых и функциональных методов исследований (УЗИ, компьютерная капилляроскопия, МРТ, эндоскопическое исследование, КТ). При появлении первых признаков заболевания, помимо осмотра педиатра, необходима консультация челюстно-лицевого хирурга.
Первые три пункта обязательны для первичной диагностики. На основании этих данных выставляют первичный диагноз, определяется дальнейшая тактика.
Назначается наблюдение/лечение. При трудностях в дифференциальной диагностике проводится компьютерная капилляроскопия. Эндоскопическое исследование показано всем детям с дыхательными нарушениями и множественными поражениями в области нижней трети лица и в области шеи.
Последнее выполняется при локализации обширного очага поражения в параорбитальной области для выявления возможной деформации орбиты.
Жалобы и анамнез
Обнаружение ярко-красного сосудистого образования на коже лица, головы и/или шеи при рождении или появлении такового в первые 2 нед жизни рассматривать как подозрение на ГКС.
При рождении определяется ГКС, прошедшая ряд стадий внутриутробно. В первые 2 нед жизни проявляется ГКС, которая в последующем будут иметь стадийность клинической картины. ГКС не имеет специфичной локализации, но чаще располагается в зоне слияния эмбриональных бугров. В 20% случаев наблюдается множественность поражения на лице.
Проводится опрос матери: как протекала беременность, наблюдались ли токсикоз, угроза прерывания, предлежание плаценты, если да - то в каком триместре, принимала ли мать ребенка какие-либо лекарственные препараты, какие болезни перенесла, имелись на работе вредные факторы условия с целью выявления провоцирующих факторов формирования ГКС.
Выявление провоцирующих факторов формирования ГКС на определенных сроках позволяет уточнить время развития ГКС и сделать предположение именно о данном заболевании. Выясняется у родителей пациента, как менялась клиническая картина сосудистого образования.
От степени клинических проявлений и активности роста образования зависит выбор тактики лечения или наблюдения. Большая часть поражений быстро увеличивается в объеме, в этом случае необходимо назначать терапию.
Первичный осмотр
Ярко-красное пятно на коже свидетельствует о наличии ГКС в стадии первичных проявлений. При глубокой локализации очагов ГКС кожа может быть обычной окраски. В случае объемного поражения имеет место активный рост. Проводится оценка размера или объема ГКС, интенсивности окраски, наличие/отсутствие белесоватых очагов в зоне ГКС. Появление участков (зон) побледнения свидетельствует о начале инволюции. Помимо лица и головы осматриваются все поверхности тела и конечностей. Выявляются возможные множественные очаги поражения, свищи в области грудной клетки, деформация грудины, что свидетельствует о синдромальном характере заболевания (рис. 12.1-12.7).
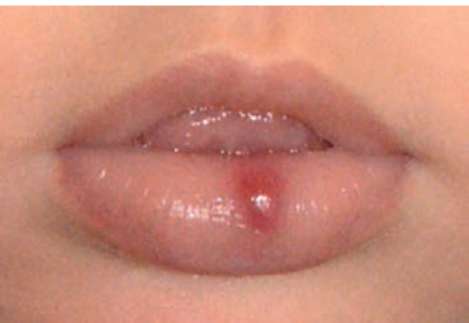
Рис. 12.1. На слизистой оболочке красной каймы возвышающееся над ней патологическое образование красного цвета. Возраст 1 мес
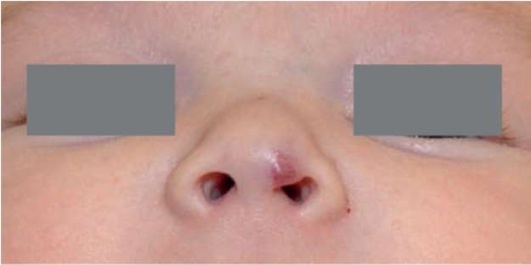
Рис. 12.2. Концевой отдел носа увеличен в объеме, возвышающиеся над кожей патологическое образование красного цвета. Возраст 2 нед
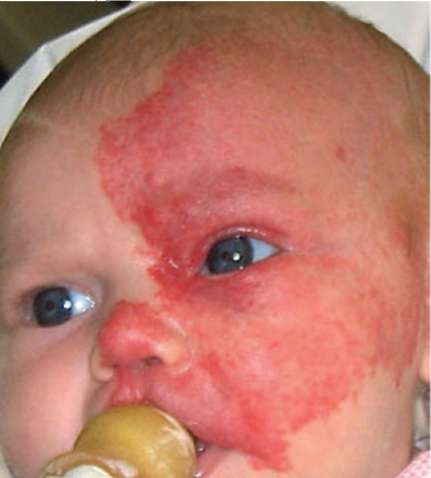
Рис. 12.3. Сливное пятно красного цвета разной интенсивности в отдельных участках - в лобной, теменной, щечной областях и в области верхней губы. Быстро распространяющееся по периферии. Возраст 1,5 мес
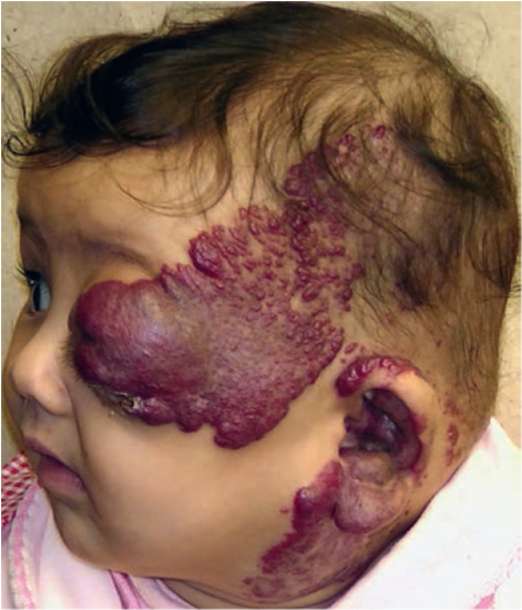
Рис. 12.4. Объемное образование ярко-багрового цвета в щечной, параорбитальной, лобной, височной, околоушной и на мочке уха
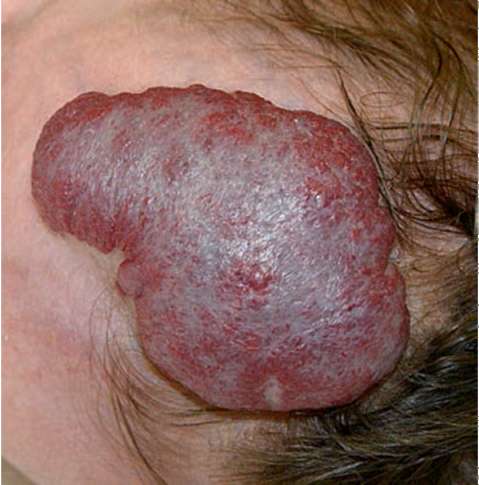
Рис. 12.5. На поверхности центральных участков патологического образования зоны серовато-белого неравномерного окрашивания (побледнения). Возраст 8 мес
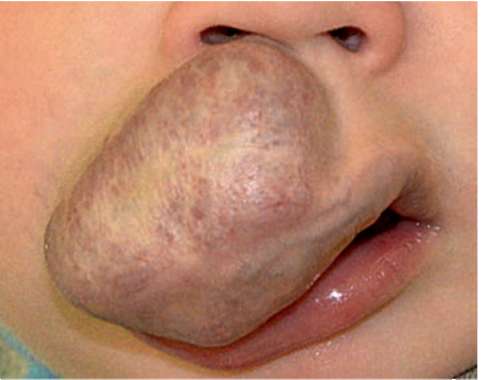
Рис. 12.6. Участки бледно-серого цвета преобладают на поверхности патологического образования. Наиболее интенсивные побледнения в центре. Возраст 1,5 года
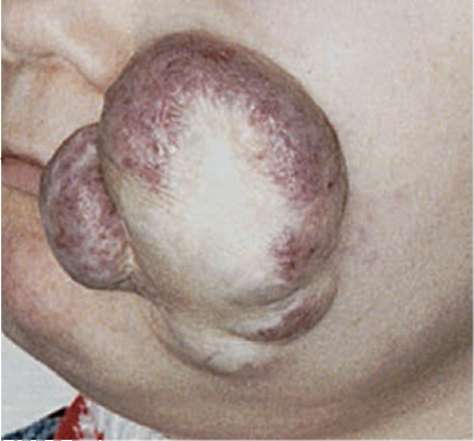
Рис. 12.7. На поверхности патологического образования преобладают участки белого цвета. По периферии сохраняются участки неинтенсивного багрового окрашивания. Диагноз «очаг гиперплазии в щечной области в резидуальной стадии»
Пальпаторно очаги ГКС представляют возвышающиеся над кожей или слизистой оболочкой объемные образования мягкоэластической консистенции с относительно четкими границами, безболезненные. Симптом наполнения отрицательный или слабоположительный. При надавливании патологический очаг не исчезает. При выявлении очагов поражения в области нижней трети лица и шеи необходимо проведение эндоскопического исследования гортаноглотки.
Инструментальная диагностика
Визуализация ГКС с использованием УЗИ, в том числе в режиме допплеровского картирования. УЗИ позволяет оценить структуру ГКС, локализацию, определить тип и скорость кровотока. Типичными для сосудистой гиперплазии эхографическими признаками является наличие большого количества расширенных сосудов с пульсирующим кровотоком различного скоростного диапазона от низкоскоростного (до 4-7 см/с) до высокоскоростного (более 20 см/с). При этом расширенные сосуды выявляются не только в массиве гиперплазии, но и в подлежащих тканях (рис. 12.8).
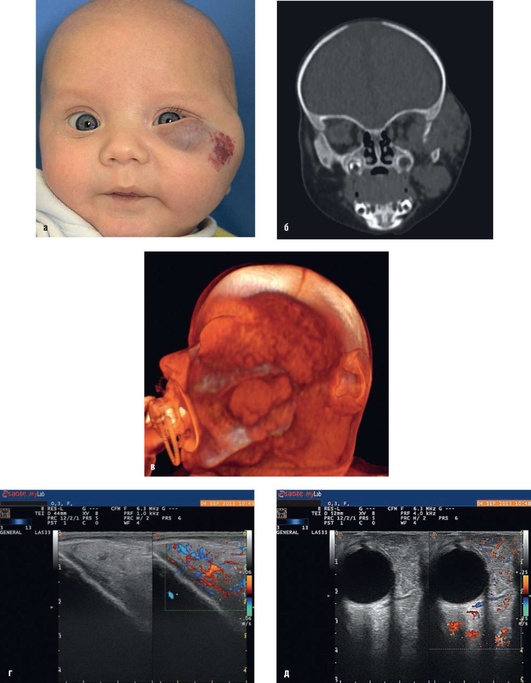
Рис. 12.8. Диагноз «гиперплазия кровеносных сосудов левой половины лица». Дифференциальный диагноз проводился с истинной опухолью: а - внешний вид больного; б - МСКТ-реконструкция в коронарной плоскости; в - 3D-реконструкция: дополнительное образование в височной, щечной областях и в орбите слева с деформацией костей лицевого скелета; г - ультразвуковое исследование с цветовым допплеровским картированием кровотока: объем тканей в височной области увеличен, имеется развитая сеть активно функционирующих сосудов диаметром до 2-3 мм; д - ультразвуковое исследование с цветовым допплеровским картированием кровотока: в наружных отделах левой орбиты и в ретробульбарной области - развитая сеть активно функционирующих сосудов диаметром до 2 мм
Компьютерная капилляроскопия проводится при наличии кожных проявлений ГКС любой локализации с целью подтверждения диагноза и определения стадии ГКС. Компьютерная капилляроскопия является неинвазивным методом, позволяющим визуализировать микрососуды капиллярного русла, что позволяет дифференцировать ГКС от мальформации кровеносных сосудов (МКС), определить стадию ГКС. Она позволяет с высокой степенью достоверности формировать представления о динамике изменений в очаге ГКС в процессе как самопроизвольной инволюции, так и в режиме мониторирования в процессе лечения.
При наличии объемных очагов ГКС, локализующихся в сложных анатомо-топографических областях, проводится МРТ. Основной недостаток:
Дополнительные методы диагностики - МРТ и РКТ - показаны к применению в возрасте до 6 мес, только при наличии жизнеугрожающих состояний и необходимости срочного оперативного вмешательства.
При выявлении очагов поражений в области нижней трети лица и шеи необходимо проведение эндоскопического исследования гортаноглотки.
После хирургического лечения выполняется морфологическое исследование удаленной ткани ГКС для подтверждения диагноза.
Выполняется также иммуногистохимическое исследование удаленной ткани ГКС с антителами к белку-транспортеру глюкозы GLUT-1 для подтверждения диагноза и определения стадии ГКС.
В стадии первичных проявлений, активного роста, начала инволюции эндотелий ГКС экспрессирует GLUT-1. В стадии выраженной инволюции экспрессия GLUT-1 снижается. В стадии резидуальных проявлений GLUT-1 может определяться в минимальных количествах или вообще отсутствовать.
ПРИНЦИПЫ ЛЕЧЕНИЯ
Лечение детей с ГКС головы и шеи должно проводиться дифференцированно с учетом возможности самопроизвольной инволюции. В настоящее время наиболее рациональными методами помощи детям с ГКС являются динамическое наблюдение, медикаментозное (консервативное) лечение, хирургическое лечение, лазерная терапия. Выбор тактики лечения зависит от размеров, локализации, стадии ГКС, клинических проявлений.
Динамическое наблюдение
В стадии начальных проявлений при отсутствии активного роста и небольшой площади поражения (фокальная форма) рекомендуется динамическое наблюдение со сроком контроля каждые 2 нед, первые 2 мес. Затем 1 раз в месяц и далее 1 раз в 3-6 мес.
Консервативное лечение
При активном росте ГКС и в стадии начала инволюции (при наличии выраженного сосудистого компонента) рекомендуется проводить консервативное лечение ß-адреноблокаторами (внутрь или местно).
В 2008 г. экспертная группа во главе с C. Leaute-Labreze впервые опубликовали данные об эффективном применении пропранолола у детей грудного возраста с быстрорастущими гемангиомами критических локализаций. В России во многих клиниках проводится медикаментозное лечение детей с ГКС ß-адреноблокаторами [пропранолол (Анаприлин♠ , Обзидан♠ )], но до сих пор нет клинических рекомендаций к их применению для лечения пациентов с ГКС. Лечение детей с ГКС ß-адреноблокаторами проводится под контролем детского кардиолога с предварительным стационарным обследованием и подбором дозы препарата, которая меняется по мере роста ребенка.
Лечение необходимо начинать при активном росте ГКС, увеличении объема ГКС, расположенных в глубоких слоях мягких тканей (рис. 12.9).
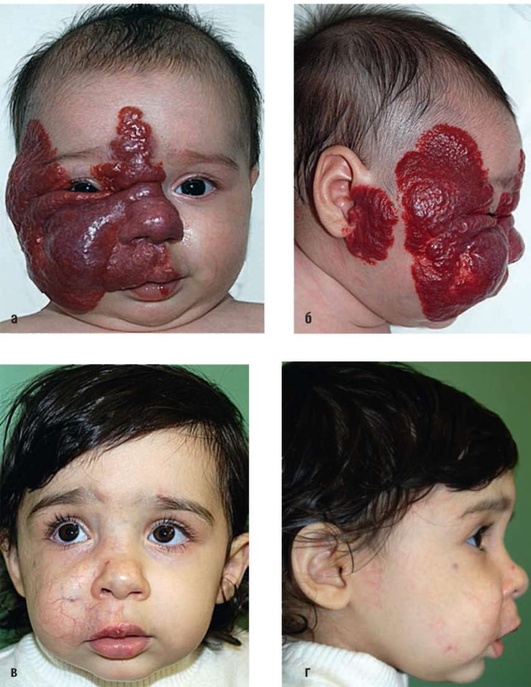
Рис. 12.9. Гиперплазия кровеносных сосудов правой половины лица. Стадия активного роста. Возраст 2 мес. Начато лечение пропранололом: а, б - фас, профиль до лечения; в, г - фас, профиль через год после начала лечения
При росте поверхностной ГКС по площади и отсутствии объемного роста рекомендовано применение ß-адреноблокаторов местно в форме крема или аппликации раствора (тимолол, тимолол-орфангель).
Хирургическое лечение
В случаях некритической локализации пациенту с фокальной ГКС небольших размеров в стадии инволюции и резидуальных проявлений рекомендовано хирургическое лечение. При обширных ГКС в стадии выраженной инволюции и резидуальных проявлений, в том числе после проведения консервативного лечения, рекомендовано хирургическое удаление очагов ГКС, не подвергшихся полной инволюции.
В 10% наблюдается неполная инволюция. На фоне самопроизвольной инволюции или после консервативного лечения регрессирует сосудистый компонент ГКС, а фиброзно-жировой компонент в ряде случаев инволютирует не полностью. В таких случаях показана хирургическая коррекция с целью удаления объема очага ГкС, не подвергшегося полной инволюции.
Рекомендуется проведение антибиотикопрофилактики в раннем послеоперационном периоде в течение 5-7 дней вне зависимости от локализации, объема ГКС, возраста ребенка для снижения риска возникновения инфекционных осложнений (рис. 12.10-12.13).
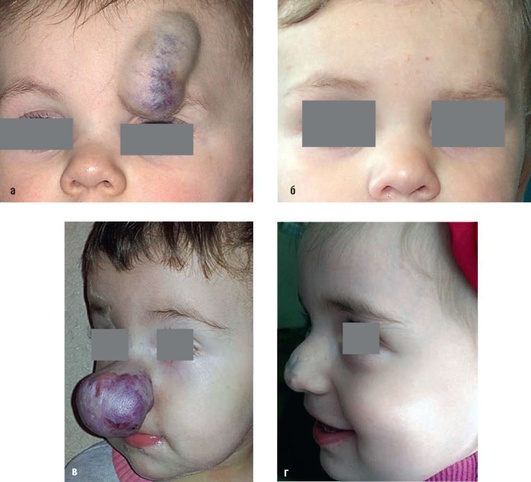
Рис. 12.10. Гиперплазия в лобной и параорбитальной областях. Резидуальная стадия: а - объемное образование серовато-белого окрашивания с отдельными расширенными венами; б - через 3 мес после хирургического удаления. Рубец в лобной области; в - гиперплазия в области концевого отдела носа - стадия начала инволюции; г -пациентка через 3 г после операции - удаление патологических тканей
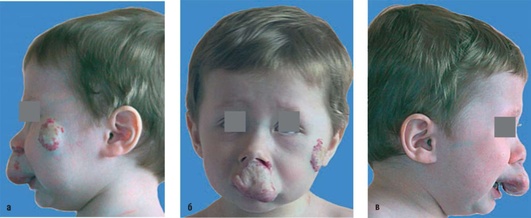
Рис. 12.11. а-в - фас, профиль справа и слева. Пациент, 1,5 года. Диагноз «гиперплазия кровеносных сосудов верхней губы и скуловой области (резидуальная стадия)»
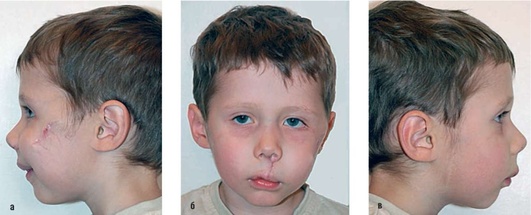
Рис. 12.12. а-в - тот же пациент в 4 года: фас, профиль справа и слева после оперативного лечения
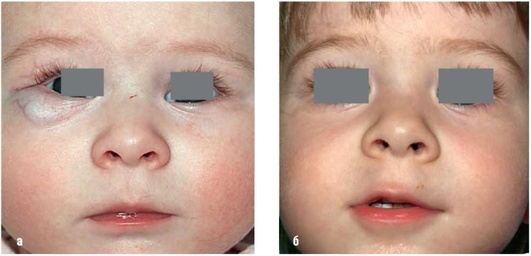
Рис. 12.13. Гиперплазия в области нижнего века (резидуальная стадия). Возраст 6 мес: а - до лечения; б - через год после хирургического лечения парируя его по границе. Удаление фрагментами приводит к кровотечениям и чревато неполным удалением невизуализированной патологической ткани.
Лазерная терапия
При неполной инволюции сосудистого компонента на коже поверхностной ГКС хороший эффект дает этапная лазерная терапия как метод выбора лечения. Она же проводится при остаточной сосудистой сетке, обусловленной расширенными мелкими венами, образовавшимися от давления очага ГКС на кожу.
Для лечения детей с сосудистыми образованиями применяются различные виды лазеров: неодимовый лазер на гранате, лазер на парах меди, лазер на парах бромида меди, александритовый, диодный лазер. Однако в настоящее время наиболее эффективными признаны импульсные лазеры на красителях с ламповой накачкой. Лечение многоэтапное, проводится от 4 до 10 сеансов лазерной терапии с частотой 1 раз в 1-1,5 мес (рис. 12.14).
Реабилитация
Рекомендован отвод от прививок до полной инволюции ГКС.
Риск кровотечений при удалении очагов ГКС невысокий, так как кровоснабжение очага осуществляется одним сосудом, который легко перевязать. Удаление очага ГКС необходимо производить полностью, пре-
ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
Всем пациентам после завершения лечения рекомендуется проводить повторные осмотры через 6 и 12 мес.
Проводится капилляроскопия и УЗИ через 6 и 12 мес после завершения лечения.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ, ВЛИЯЮЩАЯ НА ТЕЧЕНИЕ И ИСХОД ЗАБОЛЕВАНИЯ
Отвод от прививок снимается через 6 мес после самопроизвольной инволюции или устранения очага ГКС.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ДЕТЕЙ С ГИПЕРПЛАЗИЕЙ КРОВЕНОСНЫХ СОСУДОВ В СОСТАВЕ PHACE-СИНДРОМА
Необходимы наблюдение и лечение у различных специалистов: нейрохирурга, невролога, педиатра, кардиолога, хирурга-ортопеда.
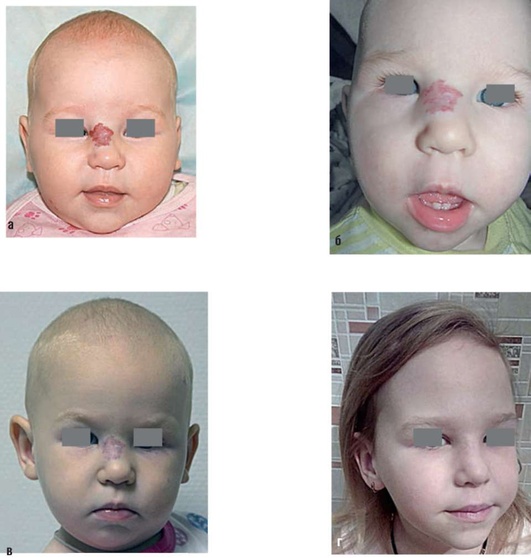
Рис. 12.14. Диагноз «гиперплазия кровеносных сосудов в области корня носа и угла глаза»: а - фас в 5 мес. Пятно интенсивно-красного цвета с участками побледнения в центре; б - фас в 11-12 мес после аппликаций тимололом 0,5%); в - фас в 1,5 года, начата фототерапия; г - та же больная в 5 лет после фототерапии
Выявление множественных врожденных аномалий, таких как пороки развития задней черепной ямки, аномалии развития артерий, пороки сердца, расщепление грудины, абдоминальные тяжи, наряду с ГКС свидетельствуют о наличии у ребенка PHACE-синдрома.
Часть II
Мальформации кровеносных сосудов
Коды по МКБ-10
Гемангиома (D18)
D18.0 Гемангиома любой локализации Год утверждения (частота пересмотра): 2017 (пересмотр каждые 3 года).
МКС (син.: ангиодисплазия). Порок развития кровеносных сосудов, носящий преимущественно врожденный характер. Характерным признаком МКС является нарушение гемодинамики.
Капиллярная мальформация (КМ) - это гемодинамически низкоскоростные сосудистые нарушения капиллярной сети кожи и слизистых оболочек, поражающие микроциркуляторное русло и иногда распространяющиеся на глубокие слои, особенно в ЧЛО. Они также включают в себя такие понятия, как сосудистые пятна новорожденных и телеангиэктазии.
АВМ - это гемодинамически активная сосудистая патология с высокой скоростью кровотока, развивающаяся в результате дефекта артериальной и венозной систем с формированием прямых сообщений между кровеносными сосудами различного калибра.
ВМ - гемодинамически неактивные, слабопотоковые сосудистые мальформации с участием собирательной части сосудистой сети.
Коды по МКБ-10
Гемангиома (D18)
D18.0 Гемангиома любой локализации
КЛАССИФИКАЦИЯ
Фрагмент обновленной классификации сосудистых аномалий ISSVA 2014 г. Сосудистые мальформации Простые
Смешанные мальформации
Комбинации различных форм мальформаций (капилляровенозная мальформация, капилляролимфатическая мальформация, лимфовенозная мальформация, капилляролимфовенозная мальформация, капилляроартериовенозная мальформация, капилляролимфоартериовенозная мальформация).
Ассоциированные с другими аномалиями
Синдромы, включающие МКС (синдромы Клиппель-Треноне, Паркса-Веббера, Штурге-Веббера, Мафучи, CLOVES-синдром, Протея и др.).
ЭПИДЕМИОЛОГИЯ
МКС в области головы и шеи составляют от 5 до 14% других сосудистых поражений данной локализации. Около 80% всех МКС составляют поражения мелких вен, венул и капилляров.
ЭТИОЛОГИЯ
Этиология МКС в настоящее время остается до конца не изученной. В настоящее время достигнут определенный прогресс в генетическом изучении ряда ангиодисплазий, по отношению к которым доказано наличие определенных генных мутаций.
В большинстве случаев МКС определяются в первые годы жизни. В дальнейшем рост мальформации происходит пропорционально росту ребенка. Интенсивный рост патологического образования обычно присущ пациентам женского пола в период полового созревания и беременности. Также отмечается бурный рост при наличии провоцирующих факторов, таких как: травма, инфекция, стресс-фактор.
ДИАГНОСТИКА
Диагноз «мальформация кровеносных сосудов» является клиническим, устанавливается на основании клинического и инструментальных методов исследования: опрос (анамнез жизни пациента, включая антенатальный период (акушерский анамнез матери) и анамнез заболевания, начиная с интранатального периода), визуальный осмотр, данные физикального обследования, дополнительных лучевых и функциональных методов исследований.
При капиллярной форме используется компьютерная капилляроскопия, при более глубоком поражении - УЗИ, МРТ; при подозрении на внутрикостное поражение - КТ. МРТ выполняется для уточнения распространенности поражения, локализации, уточнения топографии. Его необходимо в обязательном порядке проводить перед оперативным вмешательством. Первым симптомом может быть неожиданное кровотечение из носа, слизистых оболочек рта, при удалении зуба или случайной находкой врача, например, на слизистых оболочках.
Жалобы и анамнез
Обнаружение сосудистого образования на коже лица, головы и/или шеи при рождении или в первые годы жизни следует рассматривать как подозрение на МКС. При рождении определяются КМ, ВМ как единичный флебэктаз, АВМ могут имитировать КМ в первые годы жизни с последующим проявлением классической клинической картины.
Проводится опрос матери о течении беременности, уточняется наличие МКС у ближайших родственников с целью выявления наследственных форм и синдромов, в состав которых входят МКС. У родителей пациента выясняют, как менялась клиническая картина сосудистого образования: наличие ускоренного роста в период пубертата, вследствие травмы.
От степени клинических проявлений и активности роста образования зависит выбор тактики и сроков лечения (рис. 12.15-12.18).
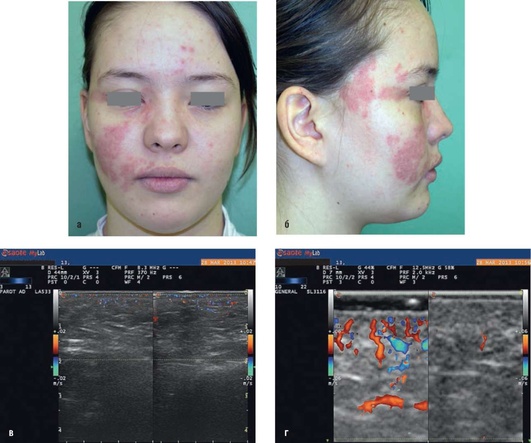
Рис. 12.15. Пациентка, 13 лет. Диагноз «капиллярная мальформация кровеносных сосудов правой половины лица»: а - фас; б - профиль; в - при ультразвуковом исследовании: в дерме выявляется избыточно развитая сосудистая сеть, представленная субмиллиметровыми сосудами с низкоскоростным кровотоком (до 2 см/с). Подкожная клетчатка структурно и гемодинамически не изменена; г - при ультразвуковом исследовании высокого разрешения: представлена разница в гемодинамике в дерме на пораженной (1) и здоровой (2) стороне
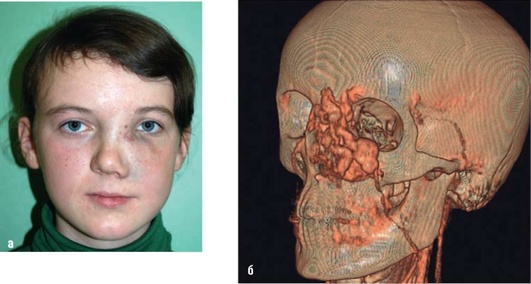
Рис. 12.16. Пациентка 16 лет. Диагноз «артериовенозная мальформация в области подглазничной, параорбитальной и ската носа слева»: а - фас; б - 3D-реконструкция МСКТ с контрастированием: кровоснабжение патологического образования осуществляется из лицевой и глазничной артерий слева
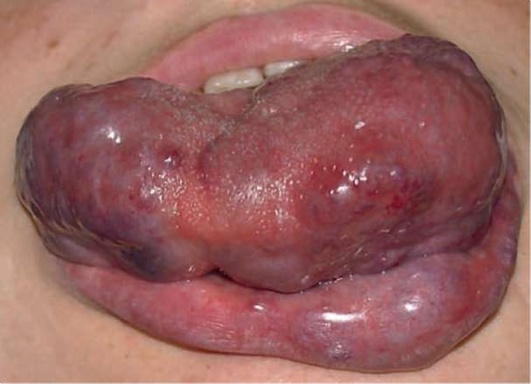
Рис. 12.17. Пациент, 10 лет. Диагноз «венозная мальформация языка, дна полости рта, нижней губы». Закрывание рта затруднено. Тяжелая форма венозной мальформации языка и нижней губы. Функция языка нарушена
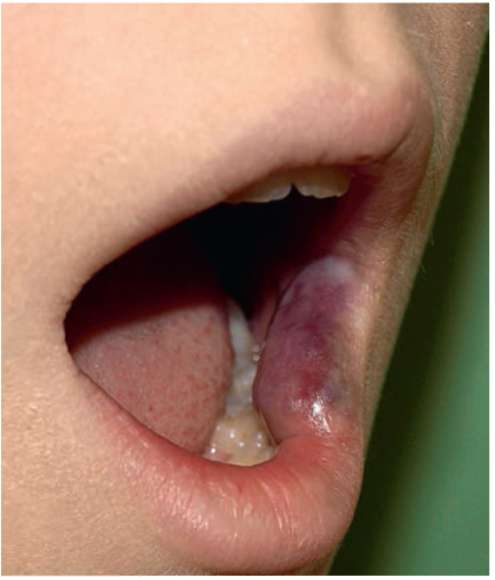
Рис. 12.18. Пациентка, 14 лет. Диагноз «венозная мальформация нижней губы слева»
Физикальное обследование
Проводится оценка размера, объема, формы МКС. Наличие участков ярко-красного окраса на кожных покровах различной интенсивности может свидетельствовать о капиллярной форме мальформации или смешанной формы КМ-АВМ на ранних сроках. Наличие флебэктаза свидетельствует о наличии ВМ. АВМ и ВМ присуще наличие симптома наполнения.
Инструментальная диагностика
Проводится визуализация АВМ и ВМ с использованием УЗИ, в том числе в режиме допплеровского картирования.
УЗИ позволяет оценить скорость кровотока, наличие шунтов, определить форму мальформации.
Целесообразно проведение компьютерной капилляроскопии КМ любой локализации с целью подтверждения диагноза и определения эффективности лазерного лечения. Компьютерная капилляроскопия является неинвазивным методом, позволяющим визуализировать микрососуды капиллярного русла, что позволяет подтвердить диагноз, дифференцировать МКС от ГКС.
При наличии обширных ВМ, АВМ, смешанной мальформации, локализующихся в сложных анатомо-топографических областях, проводится МРТ. При выявлении КМ половины лица, наличии эпилептических припадков рекомендовано проведение МРТ головного мозга. Основной недостаток - необходимость использования наркозного пособия при проведении МРТ у детей в возрасте до 5-6 лет.
При подозрении на внутрикостное поражение ВМ, АВМ, смешанную мальформацию, локализующихся в сложных анатомо-топографических областях, проводится КТ. При выявлении поражения слизистой оболочки альвеолярного отростка челюстей необходимо в обязательном порядке проводить КТ (рис. 12.19-12.20).
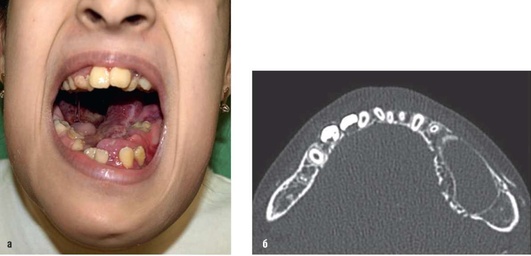
Рис. 12.19. Пациентка, 11 лет. Диагноз «мальформация кровеносных сосудов нижней трети лица дна полости рта и нижней челюсти»: а - внешний вид и открытый рот. Альвеолярные отростки нижней челюсти значительно утолщены. Вокруг зубов разрастания патологических тканей, которые почти полностью закрывают коронки отдельных зубов. В области языка ткани некротизированы с фибринозным налетом. Зубные ряды деформированы; б - мультиспиральная компьютерная томограмма нижней челюсти: тело нижней челюсти слева увеличено в объеме, имеется разрежение структуры кости, корковый слой истончен и смещен, местами фрагментирован. В корковом слое - множественные дефекты, обусловленные расширенными сосудами
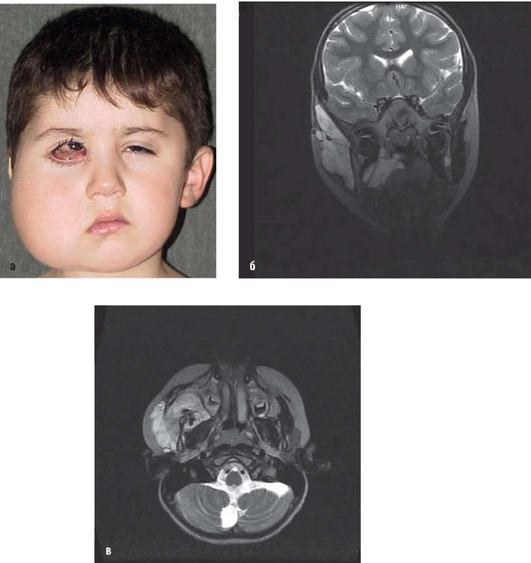
Рис. 12.20. Пациент, 5 лет. Диагноз «венозная мальформация правой половины лица, правой глазницы»: а - фас: выраженная асимметрия лица за счет припухлости правой половины лица, экзофтальм, выбухающие сосудистые разрастания в области нижнего века; б , в - на магнитно-резонансных томограммах: в фронтальной (б) и аксиальной (в) проекциях - многокамерное, полостное образование в глубоких тканях височной, околоушно-жевательной и щечной областях справа, распространяющееся в крылочелюстное и окологлоточное пространство
При диагностировании АВМ проводится селективная ангиография. Последняя позволяет выявить питающие сосуды АВМ и наметить план лечения. Она также необходима для подтверждения или опровержения синдрома Штурге-Вебера.
ЛЕЧЕНИЕ
Лечение детей с МКС головы и шеи должно проводиться дифференцированно с учетом формы МКС. В настоящее время наиболее рациональными методами лечения детей с МКС являются хирургическое лечение, лазерная терапия, радиочастотная и лазерная абляции, рентгеноэндоваскулярная окклюзия, комбинация методов. Выбор тактики лечения зависит от размеров и формы МКС.
Хирургическое лечение
Хирургическое лечение рекомендовано в случаях поражения одной и двух анатомических областей, а также в составе комбинированного лечения для коррекции асимметрии. При поражении одной и двух анатомических областей возможно полное удаление МКС с устранением образовавшегося дефекта местными тканями (рис. 12.21-12.23).
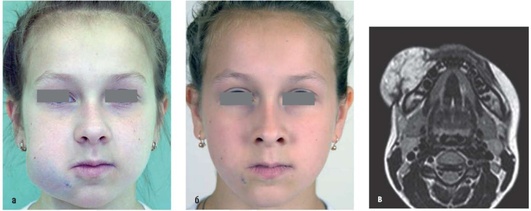
Рис. 12.21. Пациентка, 12 лет. Диагноз «венозная мальформация правой щечной области»: а - внешний вид до операции; б - внешней щечной области - дополнительное образование ячеистой структуры с гиперинтенсивным сигналом на Т2 -взвешенных изображениях. Девочке проводилась склерозирующая и СВЧ-терапия - без эффекта. Затем выполнены 2 операции с интервалом в 6 мес с использованием радиочастотной абляции в открытом режиме с хорошим эффектом
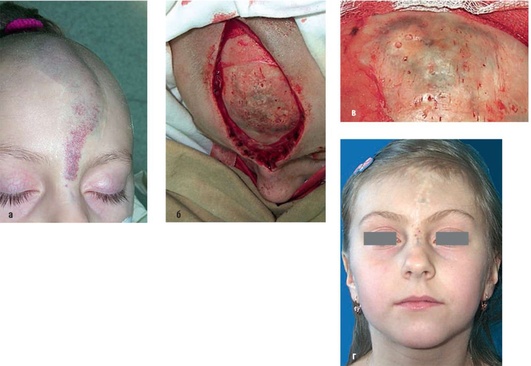
Рис. 12.22. Пациентка, 12 лет. Диагноз «мальформация кровеносных сосудов лобной области и переносицы»: а - внешний вид до операции; б, в - интраоперационная картина после удаления мягкотканной части мальформации. Кости черепа умеренно вздуты, в отдельных участках изменения окраски; г - внешний вид после операции
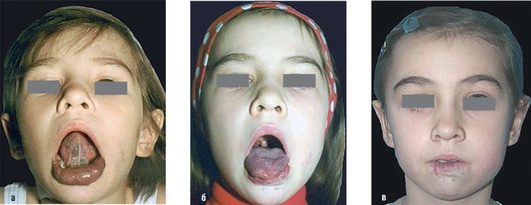
Рис. 12.23. Пациентка, 4 года 8 мес. Диагноз «венозная мальформация нижнего отдела лица и шеи»: а - внешний вид до начала лечения; б - внешний вид после первой операции; в - внешний вид после четырех операций на шее, нижней губе и языке
Лазерное лечение
При выявлении КМ любой локализации рекомендовано лазерное лечение.
Для лечения сосудистых образований применяются различные виды лазеров: неодимовый лазер на гранате, лазер на парах меди, лазер на парах бромида меди, александритовый, диодный лазер. Однако в настоящее время наиболее эффективными признаны PDL и IPL. Перед началом лечения необходимо исключить поражение более глубоких слоев.
При выявлении КМ с поражением не только кожных покровов, но и подлежащих тканей лечение рекомендовано начинать с глубоких отделов, используя для этого другие методы, например закрытую радиочастотную абляцию (РЧА), склеротерапию.
Для лечения пациентов с КМ с вовлечением подлежащих тканей в качестве первого этапа необходимо вызвать фиброз или удалить патологические ткани, питающие КМ, в противном случае лазерное лечение будет малоэффективным.
Лазерная и радиочастотная термоабляции
При диагностировании обширной МКС сложной анатомической локализации, поражающей глубокие слои, методом выбора может быть радиочастотная термоабляция (РЧА).
Обширные МКС, поражающие глубокие слои, делают хирургическое иссечение не только невозможным, но иногда и опасным для жизни пациента ввиду массивного интраоперационного кровотечения. Данный метод может проводиться как монолечение, так и входить в состав комбинированного лечения. Данную процедуру необходимо проводить под ультразвуковым контролем для четкой визуализации места воздействия. Не следует проводить РЧА при поверхностном расположении МКС ввиду риска термического ожога кожных покровов. РЧА может проводиться чрескожно и/или через слизистую оболочку (рис. 12.24-12.25).
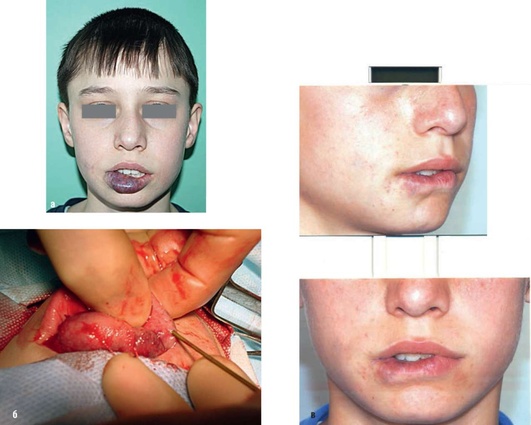
Рис. 12.24. Пациент, 12 лет. Диагноз «венозная мальформация в области языка, дна полости рта, нижней губы»: а - фас. Объем нижней губы увеличен, пораженный участок синюшно-багрового цвета; б- чресслизистая радиочастотная абляция в области нижней губы. Игла электрода введена в толщу нижней губы; в - фас после операции. Сосудистые полости ликвидированы. Показана хирургическая коррекция нижней губы по эстетическим показаниям
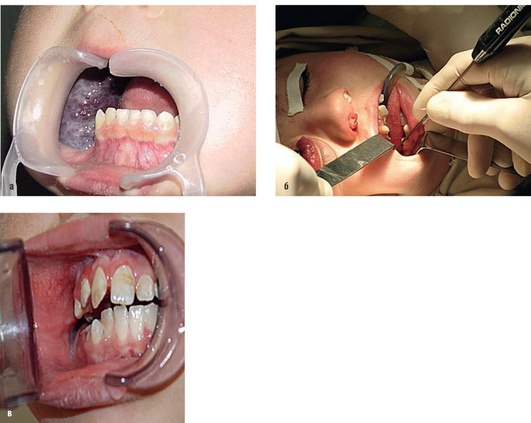
Рис. 12.25. Пациент, 5 лет. Диагноз «венозная мальформация правой половины лица кавернозного типа»: А - открытый рот. Выбухающее объемное образование синюшного цвета на слизистой оболочке правой щеки; Б - под наркозом вколота игла электрода через слизистую оболочку патологического образования. Проведена абляция в нескольких направлениях; В - открытый рот того же больного через 6 мес. Полное исчезновение патологического образования в данной области
При диагностировании обширной МКС сложной анатомической локализации, поражающую поверхностные слои, рекомендовано проводить лазерную абляцию. При поражении поверхностных слоев следует отказаться от РЧА в пользу лазерной абляции. Лазерная абляция позволяет точечно воздействовать на патологические ткани и существенно снижает риск развития термического ожога. Данная процедура также может быть использована как монометод и входить в состав комбинированного лечения. Процедура проводится с использованием Nd:YAG- или Ho:YAG-лазера.
Склерозирование
Склеротерапия рекомендована в качестве альтернативного малоинвазивного метода лечения пациентов с АВМ и ВМ.
Данный метод не требует проведение общего наркоза, за исключением ситуаций, когда возраст ребенка менее 6 лет. Склерозирование может использоваться как самостоятельный метод или входить в состав комбинированного лечения. В качестве склерозантов используются следующие препараты: этанол, блеомицин, доксициклин, лауромакрогол 400 (Этоксисклерол♠ ), натрия тетрадецилсульфат (Фибро-Вейн♠ ).
Рентгеноэндоваскулярная окклюзия
При диагностировании АВМ рекомендовано проведение рентгеноэндоваскулярной окклюзии в качестве первого этапа комбинированного лечения.
Как самостоятельный метод эндоваскулярная окклюзия нецелесообразна ввиду развития коллатерального кровоснабжения на 3-4-е сутки. Противопоказаниями к проведению рентгеноэндоваскулярной окклюзии является наличие питающих сосудов из бассейна внутренней сонной артерии ввиду риска миграции эмболов и развития инсульта. Проведение данного метода при ВМ неэффективно ввиду наличия множества питающих сосудов и невозможности их полного окклюзирования, однако данный метод следует использовать при прогнозировании массивного интраоперационного кровотечения, при проведении хирургического лечения.
Комбинированное лечение
Используется при выявлении обширных АВМ, ВМ сложной анатомической локализации. Лечение пациентов с АВМ начинается с ангиографии с возможной эмболизацией питающих сосудов с последующим проведением радиочастотной, лазерной абляции для фиброзирования зоны воздействия с последующим проведением хирургической коррекции для достижения удовлетворительного эстетического результата. При выявлении ВМ проведение эндоваскулярной окклюзии малоэффективно.
Реабилитация
В послеоперационном периоде, после проведения РЧА и лазерной абляции, рекомендовано ношение давящей повязки в течение не менее 10 дней. После первых этапов лечения и достижения хороших или удовлетворительных результатов, например, произошло полное запустевание кавернозных полостей или их фиброзирование, остались рубцы после осложнений (некрозы). Все это может проявляться наличием объемных или деформирующих поражений, которые потребуют хирургической коррекции.
ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
Всем пациентам после завершения лечения необходимо проводить повторные осмотры у челюстно-лицевого хирурга через 6 и 12 мес. Рекомендовать проведение УЗИ через 6 и 12 мес после завершения лечения.
Рекомендовать проведение МРТ мягких тканей головы и/или шеи через 12 мес после лечения; МСКТ костей лицевого скелета через 12 мес после лечения у детей с внутрикостными поражением.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ, ВЛИЯЮЩАЯ НА ТЕЧЕНИЕ И ИСХОД ЗАБОЛЕВАНИЯ
После проведения РЧА и лазерной абляции необходимо освобождение от физической нагрузки в течение 6 мес.
Лимфатические мальформации
ЛМ - порок развития лимфатической системы. Ранее данное заболевание относили к доброкачественным опухолям их лимфатических сосудов, в связи с чем использовался термин «лимфангиома», который отождествлялся с «гигромой» (син.: кистозная лимфангиома). В последние два десятилетия лимфангиомы относят к порокам развития лимфатической системы. Однако до сих пор некоторые авторы продолжают использовать термин «лимфангиома» (рис. 12.26).
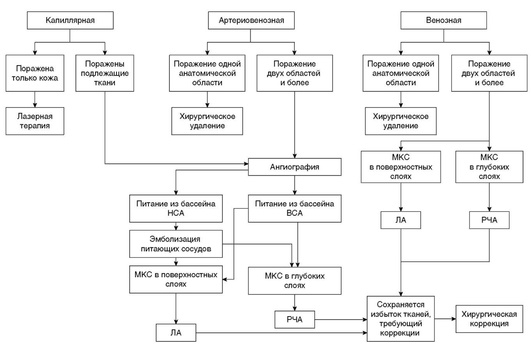
Рис. 12.26. Алгоритм лечения пациента с мальформациями кровеносных сосудов
Коды по МКБ-10: Д18.1 Лимфангиома любой локализации.
КЛАССИФИКАЦИЯ
В международной классификации стоматологических болезней на основе МКБ-10 выделены следующие нозологические формы:
Термин «мальформация» в данной классификации не фигурирует.
Согласно обновленной классификации ISSVA 2014 г, ЛМ включены в группу «сосудистые мальформации» и классифицируются следующим образом:
ЭПИДЕМИОЛОГИЯ
В группе сосудистых аномалий ЛМ занимают значимое место. Частота встречаемости ЛМ у детей, по данным разных авторов, варьирует от 1:1000 до 1:16 000 новорожденных. Лицо, шея, начальные отделы пищеварительного тракта - вот наиболее частые места локализации поражения. У 10% больных с проявлениями ЛМ на языке обнаруживаются изменения слизистой оболочки желудочно-кишечного тракта воспалительного или гиперпластического характера (чаще в толстой кишке - до 88,9%).
В группе «сосудистые мальформации» выделены комбинированные сосудистые мальформации, среди которых обозначены капиллярно-лимфатические, лимфовенозные, капиллярно-лимфовенозные, капиллярно-лимфоартериовенозные мальформации. Понятие «лимфангиома» в классификации ISSVA отсутствует как таковое.
ЭТИОЛОГИЯ
Современные данные об этиологии и патогенезе лимфатической системы позволяют заключить, что ЛМ не являются истинными опухолями, а формируются внутриутробно вследствие дизэмбриогенеза лимфатической системы. Существует несколько теорий развития так называемых лимфангиом и ЛМ, основанные на различиях в понимании эмабриогенеза лимфатической системы. Ряд авторов считают, что лимфатическая система формируется из венозной. Другие авторы полагают, что лимфатическая система формируется независимо от кровеносной системы, вступая с ней в связь вторично.
ДИАГНОСТИКА
Диагноз «лимфатическая мальформация» является клиническим, устанавливается на основании клинического и инструментальных методов исследования: опрос (анамнез жизни пациента, включая акушерский анамнез матери и анамнез заболевания), визуальный осмотр, данные физикального обследования, дополнительных лучевых и функциональных методов исследований (УЗИ, МРТ, КТ).
Далее как для уточнения диагноза, так и для определения топографических взаимоотношений патологических тканей со здоровыми обязательно выполнение МРТ. Это помогает также выбору тактики, оценке рисков хирургического вмешательства, выбору тактики лечения (хирургическая, консервативная). При наличии признаков костных поражений выполняется КТ-исследование. Оно необходимо как при первичных признаках поражения костей, так и при вторичных деформациях, проявляющихся спустя несколько лет от начала заболевания.
В отдельных случаях проводится пункция патологического образования. Она выполняется как с диагностической целью, так и с лечебной (уменьшения давления на дыхательные пути, пищеварительный тракт).
Эндоскопический метод исследования показан при локализации поражения в области гортаноглотки.
Рекомендовано выполнить осмотр челюстно-лицевым хирургом при появлении первых признаков заболевания.
Первые два пункта обязательны для первичной диагностики. На основании этих данных выставляют первичный диагноз, определяется дальнейшая тактика.
Жалобы и анамнез
Обнаружение объемного образования в области лица и/или шеи при рождении или появлении такового в первый год жизни рассматривать как подозрение на ЛМ.
До 80% ЛМ проявляются при рождении или в первый год жизни ребенка. Клинически определяется объемное образование тестоватой консистенции.
Уточняется у матери, было ли образование выявлено пренатально на скрининговых УЗИ. Если да, то на каком сроке беременности и какой диагноз был поставлен. Пренатальное выявление макрокистозных форм ЛМ возможно с 27-28-й неделе, что позволяет спланировать родоразрешение и оказать необходимую помощь ребенку сразу после рождения.
Выясняется у родителей пациента, как менялась клиническая картина ЛМ. Отмечались ли эпизоды воспаления ЛМ, если да, то какие при этом наблюдались функциональные нарушения.
О выраженности клинической картины, наличия воспалений ЛМ в анамнезе, наличия нарушения жизненно важных функций (дыхания, глотания, зрения) зависит выбор тактики наблюдения или лечения, определения сроков и объема операции.
Первичный осмотр
Проводится оценка объема и размеров поражения, локализация, наличие/отсутствие патогномоничных пузырьков на слизистой оболочке или на коже, оценка содержимого пузырьков (светло-желтое лимфатическое или лимфогеморрагическое), оценка наличия/ отсутствия нарушения жизненно важных функций. Пальпаторно выявляется консистенция патологических образований. Мягкоэластическая консистенция типична, но следует иметь в виду наличие кровоизлияний, в том числе организованных, наличие лимфатических узлов, как по периметру поражения, так и в глубине поражения, спаянных с последним, между кистозными полостями. В период обострения воспаления кожа на очаге поражения с покраснениями, инфильтрация окружающих тканей.
Наличие пузырьков со светлым лимфатическим содержимым позволяет подтвердить диагноз клинически. Наличие большого количества пузырьков с геморрагическим содержимым свидетельствует о воспалении ЛМ в настоящее время, что требует консервативного лечения. Выявление нарушения жизненно важных функций требует принятия экстренных мер - наложения трахеостомы и/или гастростомы (рис. 12.27-12.29).
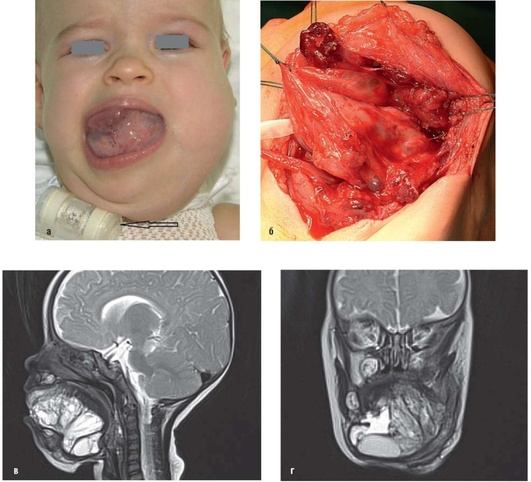
Рис. 12.27. Пациентка, 8 мес. Диагноз «лимфатическая мальформация в околоушно-жевательной, поднижнечелюстной областях, шеи, языка, дна полости рта, гортаноглотки»: а - внешний вид (фас) до операции. Выбухание патологических тканей в области дна полости рта. Язык смещен кверху и вправо. Припухлость в щечной, околоушно-жевательной области. Трахеостома; б - этап удаления патологических тканей в поднижнечелюстной области, окологлоточном пространстве и области дна полости рта. Патологическая ткань представлена многокамерными образованиями, спаянными между собой, заполненными светлым жидким содержимым (макрокисты); в, г - магнитно-резонансная томограмма: в тканях дна полости рта и в языке - дополнительное образование, представленное множественными напряженными и ненапряженными кистозными полостями и собственными тканями с гиперинтенсивным сигналом на Т2 -взвешенных изображениях
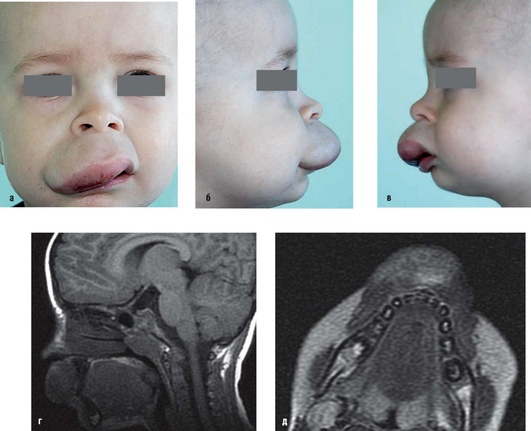
Рис. 12.28. Пациент, 4 года. Диагноз «лимфатическая мальформация (мелкокистозная форма) верхней губы, щечной области справа»: а-в - внешний вид: верхняя губа значительно увеличена в объеме. Участок избыточной пигментации на коже, единичные пузырьковые высыпания. На слизистой оболочке красной каймы - участки кровоизлияний; г, д - магнитно-резонансные картины того же пациента
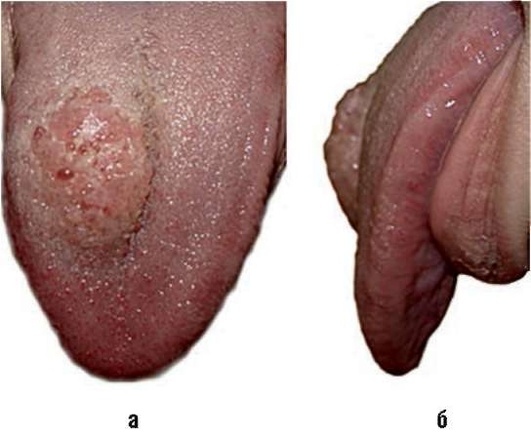
Рис. 12.29. Пациентка, 16 лет 9 мес. Диагноз «лимфатическая мальформация в области языка справа (ограниченная форма)»: а - вид сверху; б - вид сбоку. Объемное образование с четкими границами. На слизистой оболочке объемного образования характерные пузырьки с лимфатическим и кровянистым содержимым
Инструментальная диагностика
Визуализация ЛМ с использованием УЗИ, в том числе в режиме допплеровского картирования и эластографии, один из легкодоступных, информативных методов исследования. УЗИ позволяет оценить структуру, локализацию ЛМ, определить наличие или отсутствие кровотока в зоне ЛМ, что позволяет дифференцировать ЛМ от МКС. Эластография позволяет оценить плотность тканей, что важно для дифференциальной диагностики и оценки результатов лечения. Выявление кист различного диаметра позволяет выбрать адекватную тактику лечения с учетом возможности их удаления или склерозирования.
Магнитно-резонансная томография
При наличии объемных ЛМ, локализующихся в сложных анатомо-топографических областях, необходимо проведение МРТ. МРТ позволяет более точно определить локализацию ЛМ, ее структуру и форму.
Однако основным недостатком является необходимость использования наркозного пособия при проведении МРТ у новорожденных и детей раннего детского возраста.
При поражении дна полости рта, глотки, шеи необходимо провести эндоскопическое исследование, для выявления возможного поражения слизистых оболочек гортаноглотки (рис. 12.30-12.32).
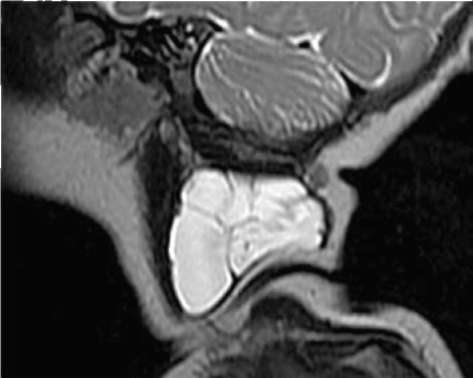
Рис. 12.30. Пациент, 4 мес. Диагноз «макрокистозная лимфатическая мальформация в области боковой поверхности шеи слева». Магнитно-резонансная томограмма в сагиттальной плоскости: в тканях латерального отдела шеи - дополнительное образование, представленное множественными кистозными полостями с гиперинтенсивным сигналом на Т2 -взвешенных изображениях
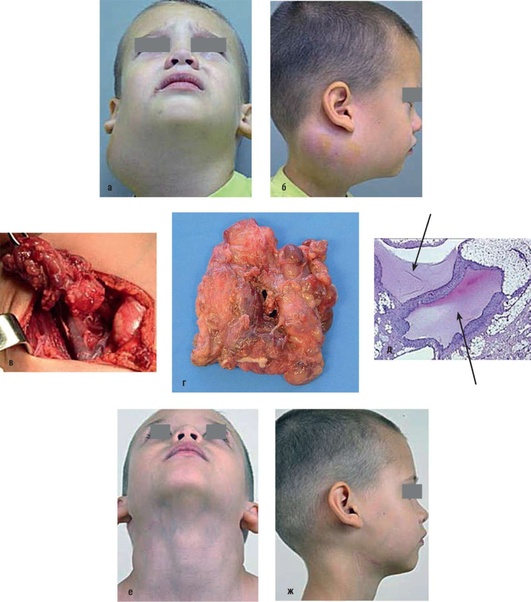
Рис. 12.31. Пациент, 4 года. Диагноз «лимфатическая мальформация шеи, подчелюстной и заушной областей». До лечения: а - фас; б - профиль; в - интраоперационная картина - последний этап удаления патологического образования; г - макропрепарат. удаленное патологическое образование; д - микроскопическая картина. Стрелками помечены кистозные образования. Через 6 мес после удаления патологического образования: е - фас; ж - профиль
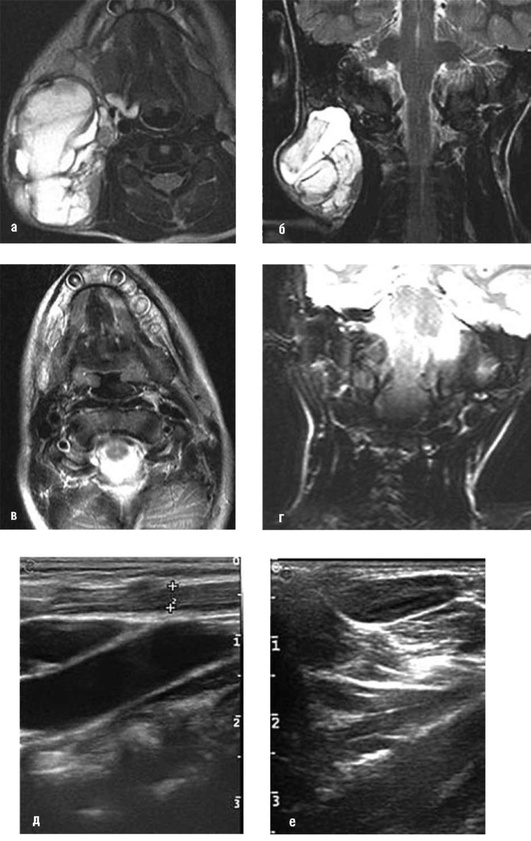
Рис. 12.32. Магнитно-резонансные томограммы и ультразвуковое исследование того же больного (на рис. 12.31): а, б - магнитно-резонансные томограммы до операции; в, г - магнитно-резонансные томограммы после операции; д - ультразвуковое исследование до операции; е - ультразвуковое исследование после операции
После хирургического лечения выполняется морфологическое исследование удаленной ЛМ для подтверждения диагноза. Оно позволяет определить форму ЛМ (макро-, микрокистозная, смешанная макро- и микрокистозная), диагностировать комбинированную лимфовенозную мальформацию. Иммуногистохимическое исследование удаленной ЛМ с антитетами к специфическому маркеру Podoplanin (D2-40) позволяет окончательно верифицировать диагноз.
ПРИНЦИПЫ ЛЕЧЕНИЯ
Лечение детей с ЛМ головы и шеи должно быть начато как можно в более ранние сроки с целью предoтвpaщeния увеличения объема ЛM, сокращения числа воспалений ЛM, предупреждения вторичных деформаций лицевого скелета, возникновения нарушения жизненно важных функций. В настоящее время ведущим методом лечения остается хирургический.
Хирургическое лечение в случае локализации ЛM в одной анатомической области показано радикальное хирургическое лечение в 1-2 этапа. В большинстве случаев детям с ЛM, локализующейся в одной анатомической области, требуется однократное хирургическое лечение.
При обширных ЛM, локализующейся в двух и более анатомических областях, показано многоэтапное хирургическое лечение.
В среднем проводится от 2 до 5 операций, но в ряде случаев требуется более 10 операций.
Проводится интраоперационная антибиотикопрофилактика в раннем послеоперационном периоде, в течение 5-7 дней всем пациентам вне зависимости от локализации, объема ЛM, возраста ребенка для снижения риска возникновения инфекционных осложнений. После удаления ЛM накладывается давящая повязка в течение не менее 10 дней.
В случае внутрикостных ЛM или наличия вторичных деформаций костей лицевого скелета и черепа, после удаления ЛM в мягких тканях показаны операции в объеме контурной коррекции или ортогнатической операции.
У детей с ЛM языка, дна полости рта, в поднижнечелюстных областях с ростом ребенка возникают деформации, связанные с поражением костей и нарушения прикуса, функциональные нарушения (затруднение приема пищи, пережевывания). В случае локализации ЛM, например в области орбиты, в лобной, затылочной областях, возможно потребуется коррекция (сошлифовывание) избыточных костных тканей в данных областях.
Ультразвуковая деструкция при хирургическом удалении ЛM в сложных анатомических областях с использованием ультразвуковой деструкции с аспирацией.
Ультразвуковая деструкция при хирургическом удалении позволяет малоинвазивно разрушить и аспирировать ткани ЛM, расположенные в труднодоступных областях. Обработка ультразвуковым деструктором полостей ЛM вызывает рубцевание в послеоперационном периоде, что снижает риск рецидива ЛM и снижает количество воспалений.
При наличии патогномоничных пузырьков ЛM на слизистой оболочке полости рта, языка, носа, конъюнктивы показано использование ультразвуковой деструкции с аспирацией для их удаления.
Ультразвуковая деструкция поверхностных элементов ЛM (пузырьков с лимфатическим или лимфо-геморрагическим содержимым) позволяет добиться стойкого положительного результата, заключающегося в значительном снижении количества вновь появляющихся пузырьков. Лечение многоэтапное, проводится от 2 до 5 сеансов с частотой 1 раз в 3-6 мес (рис. 12.33).
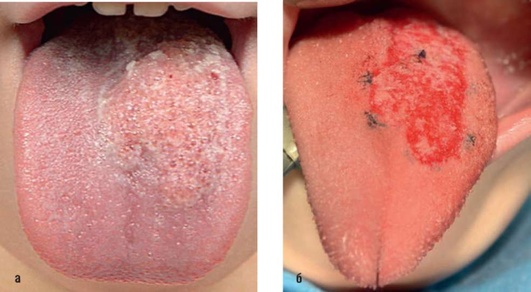
Рис. 12.33. Диагноз «лимфатическая мальформация языка (микрокистозная форма)». Произведена ультразвуковая деструкция с аспирацией. Отдельные узловые швы в месте кровотечений: а - до операции; б - после операции
Воспалительный процесс и связанные с ним отеки, увеличение объема тканей (в первую очередь языка) служат противопоказанием для проведения операции. Необходимо провести интенсивную противовоспалительную терапию и, если позволяют условия, санацию рта. Затем с небольшим интервалом оперативное вмешательство.
Консервативное лечение
При наличии воспаления ЛM хирургическое лечение проводят после купирования симптомов воспаления и устранения явлений выраженного лимфостаза. В консервативное лечение входит антибактериальная, десенсибилизирующая, дезинтоксикационная терапия, физиолечение и мероприятия, направленные на улучшение лимфодренажа (непрямая эндолимфатическая терапия), санация рта (санация может быть расширена за счет устранения явлений хронического тонзиллита, аденоидов, лечения по поводу воспаления придаточных пазух, дакриоцистита, экземы и прочих заболеваний).
Лазерная терапия
Для удаления ЛM в виде пузырьков на слизистой оболочке эффективно применение хирургических лазерных установок.
Используются CO2-, Nd:YAG-, Ho:YAG-лазеры. Лечение многоэтапное, проводится от 2 до 5 сеансов лазерной терапии с частотой 1 раз в 6-12 мес.
Склерозирование
Для лечения первичных (ранее не оперированных) детей с макрокистозными формами ЛM используется в качестве метода выбора склерозирование.
Оно проводится различными склерозантами из разных фармакологических групп. Наиболее часто используемыми являются 70% раствор этанола, доксициклин, блеомицин, пицибанилρ . Также применяются лауромакрогол 400 (Этоксисклерол♠ ), натрия тетрадецилсульфат (Фибро-Вейн♠ ), этиблок.
Для лечения ранее оперированных детей с макрокистозными формами ЛM используется склерозирование остаточных макрокистозных полостей. Cклерозирование рекомендовано в послеоперационном периоде при длительной лимфорее (более 4-6 дней). Его проводят через дренажную трубку (т.е. промывание полости). После проведения склерозирования рекомендовано использование давящей повязки в течение 7-10 дней.
При использовании любых склерозантов, за исключением пицибанилаρ (ОК-432), необходимо ношение давящей повязки после процедуры. Применение пицибанилаρ не требует сдавливания области вмешательства.
Ортодонтическое лечение
При лечении детей с ЛM в области языка, дна полости рта необходимо своевременно начать ортодонтическое лечение. Несвоевременно начатое ортодонтическое лечение или его отсутствие приводит к необратимым деформациям верхней и нижней челюсти, зубных рядов. Это лечение должно быть комплексным, комбинироваться с хирургическим.
Стоматологическое лечение
При лечении детей с ЛМ в области языка, дна полости рта необходимы выявление кариеса зубов и его осложнений, своевременная санация рта.
Осложненный кариес зубов является провоцирующим фактором воспаления ЛМ. В связи с этим возможен «порочный круг»: ребенку с обширной ЛМ языка, когда язык увеличен в объеме в 2-3 раза, выстоит из полости рта, не могут выполнить должным образом санацию полости рта, что продолжает усугублять клиническую картину. В этом случае лечение должно начинаться с хирургического этапа.
Реабилитация
Рекомендован медицинский отвод от прививок при наличии частых воспалений ЛМ (2-3 раза в год и более).
ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
Рекомендовано всем пациентам после завершения лечения проводить повторные осмотры у челюстно-лицевого хирурга через 6 и 12 мес. В эти же сроки проводится повторное УЗИ.
МРТ мягких тканей головы и/или шеи проводится через 12 мес после завершения лечения.
МСКТ костей лицевого скелета проводится через 12 мес после завершения лечения у детей с внутри-костными ЛМ или наличием вторичных деформаций костей.
Контрольные осмотры у стоматолога и ЛОР-врача проводится 1 раз в 6 мес.
Рекомендуется проводить контрольные осмотры у ЛОР-врача 1 раз в 6 мес, у гастроэнтеролога 1 раз в год.
ОСОБЕННОСТИ ЛЕЧЕНИЯ ДЕТЕЙ С ЛИМФАТИЧЕСКИМИ МАЛЬФОРМАЦИЯМИ ГОЛОВЫ И ШЕИ
Необходимы наблюдение и лечение у различных специалистов: челюстно-лицевого хирурга, ортодонта, детского стоматолога, ЛОР-врача, гастроэнтеролога.
С целью уменьшения числа воспаления ЛМ необходимо устранение очагов хронической инфекции: осложненного кариеса зубов, хронического тонзиллита, аденоидита, отита, гайморита и т.п. Наличие ЛМ в области головы и/или шеи, по данным исследований российских ученых, сопровождается гиперплазией лимфоидной ткани желудочно-кишечного тракта, заболевания желудочно-кишечного тракта (гастриты, дуодениты), что требует наблюдения и/или лечения у гастроэнтеролога.
При выявлении по данным МРТ распространения ЛМ в грудную полость и средостение необходимо проводить лечение такого пациента в условиях многопрофильной больницы (рис. 12.34).
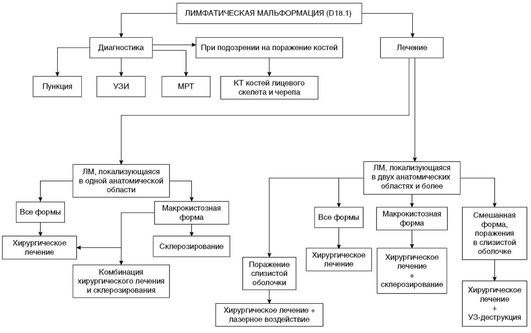
Рис. 12.34. Алгоритм диагностики и лечения детей с лимфатическими мальформациями ставления // Ультразвуковая диагностика. 1999. № 3. С. 57-63.
Литература
-
Дан В.Н., Сапелкин С.В. Ангиодисплазии (врожденные пороки развития сосудов). М. : Вердана, 2008.
-
Детская хирургия : национальное руководство / под ред. Ю.Ф. Исакова, А.Ф. Дронова. М. : ГЭОТАР-Медиа, 2009. 1168 с.
-
Детская челюстно-лицевая хирургия // Руководство к практическим занятиям : учебное пособие / под ред. О.З. Топольницкого, А.П. Гургенадзе. М. : ГЭОТАР-Медиа, 2015. 168 с.
-
Коротких Н.Г. и др. Мультидисциплинарный подход к лечению обширных ангиодисплазий лица и шеи // Вестн. новых медицинских технологий. 2011. Т. 18, № 2. С. 357.
-
Корсак А.К., Клецкий С.К. Лимфангиомы челюстно-лицевой области и шеи у детей [Электронный ресурс]. 2013.
-
Кузьменкова Л.О. Диагностика и клинико-морфо-логическая характеристика гиперплазии кровеносных сосудов у детей в челюстно-лицевой области и шеи : дис. … канд. мед. наук. М., 2013. 173 с.
-
Лимфангиомы челюстно-лицевой области у детей : методические рекомендации / под ред. С.В. Дьяковой. М. : МГМСУ, 1999. 22 с.
-
Ломака М.А. Диагностика и лечение детей с лимфатическими мальформациями головы и шеи : дис. . канд. мед. наук. М., 2016. 153 с.
-
Ломака М.А., Рогинский В.В., Надточий А.Г., Павелко Г.А. и др. Диагностика и лечение детей с лимфатическими мальформациями языка // Стоматология детского возраста и профилактика. 2015. Т. 53, № 2. С. 55-61.
-
Надточий А.Г., Васильева М.А., Кременецкая Л.Е. Кистозные лимфангиомы лица и шеи у детей: клинические, эхографические и патоморфологические сопоставления // Ультразвуковая диагностика. 1999. № 3. С. 57-63.
-
Репина Э.А. Тактика лечения детей с гиперплазией кровеносных сосудов у детей в челюстно-лицевой области : дис. … канд. мед. наук. М., 2013. 148 с.
-
Рогинский В.В., Овчинников И.А., Надточий А.Г., Рыжов Р.В. и др. Радиочастотная термоабляция у больных с поражениями кровеносных сосудов челюстно-лицевой области // Head and Neck/Голова и шея (Российское издание). 2015. № 1. С. 31-35.
-
Рогинский В.В., Надточий А.Г., Смирнов Я.В., Рыжов Р.В., Мальформация кровеносных сосудов у детей: выбор метода лечения // Стоматология. 2014. № 93. С. 56.
-
Рогинский В.В., Неробеев А.Г., Надточий А.Г., Овчинников И.А. и др. Малоинвазивные методы лечения сосудистых поражений головы и шеи // Онкопедиатрия. 2015. № 3. С. 323.
-
Рогинский В.В., Надточий А.Г., Григорян А.С., Соколов Ю.Ю. и др. Диагностика образований из кровеносных сосудов челюстно-лицевой области и шеи у детей // Стоматология детского возраста и профилактика. 2010. № 1. С. 56-61.
-
Рогинский В.В., Надточий А.Г., Павелко Г.А., Овчинников И.А. Методы лечения детей с мальформациями лимфатической системы головы и шеи // Стоматология. 2014. Т. 93, № 6. С. 57.
-
Стоматология. Специальный выпуск к VVII съезду педиатров России «Актуальные проблемы педиатрии» / под ред. А.А. Кулакова. М., 2013. 48 с.
-
Balakrishnan K., Majesky M., Perkins J. Head and neck lymphatic tumors and bony abnormalities: a clinical and molecular review // Lymphat. Res. Biol. 2011. Vol. 9, N 4. P. 205-212.
-
Balakrishnan K., Menezes M., Chen B., Magit A. et al. Primary surgery vs primary sclerotherapy for head and neck lymphatic malformations // J. Am. Assoc. Otolaryngol. Head Neck Surg. 2014. Vol. 140, N 1. P. 41-45.
-
Buckmiller L., Richter G., Suen J. Diagnosis and management of hemangiomas and vascular malformations of the head and neck // Oral Dis. 2010. Vol. 16, N 5. P. 405-418.
-
Enjolras O., Wassef M., Chapot R. Color Atlas of Vascular Tumors and Vascular Malformations. London : Cambridge University Press, 2007. 310 p.
-
Enjolras O., Mulliken J. Vascular tumors and vascular malformations (new issues) // Adv. Dermatol. 1998. Vol. 12. P. 375.
-
Erdmann M.W. et al. Multidisciplinary approach to the management of head and neck arteriovenous malformations // Ann. R. Coll. Surg. Engl. 1995. Vol. 77, N 1. P. 53-59.
-
Greenberger S. Infantile hemangioma: new insights on pathogenesis and beta blockers mechanisms of action // Angiogenesis-Based Dermatology. London : Springer, 2017. P. 27-39.
-
Karapurkar A., Desai S., Goleria K., Pandit S. et al. The management of hemangiomas and vascular malformations of head and neck. New Delhi : Jaypee Brothers Medical Publishers, 2012. 222 p.
-
Khan Z.A. et al. Multipotential stem cells recapitulate human infantile hemangioma in immunodeficient mice // J. Clin. Invest. 2008. Vol. 118, N 7. P. 2592-2599.
-
Leaute-Labreze C., Hoeger P., Mazereeuw-Hautier J., Guibaud L. et al. A randomized, controlled trial of oral pro-pranolol in infantile hemangioma // N. Engl. J. Med. 2015. Vol. 372, N 8. P. 735-746.
-
Leaute-Labreze C., Harper J.I., Hoeger P.H. Infantile haemangioma // Lancet. 2017. Vol. 390, N 10090. P. 85-94.
-
Lee S., Jung H., Jang Y., Lee W. Usefulness of various immunohistochemical markers in the differential diagnosis of lymphatic malformations; focused on D2-40, Prox-1, VEGFR3 and LYVE-1 // Book of Abstracts of 20th Workshop of the International Society for the Study of Vascular Anomalies. Melbourne, 2014. P. 79.
-
Lei Z., Huang X., Sun Z., Zhang W. et al. Surgery of lymphatic malformations in oral and cervicofacial regions in children // Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 2007. Vol. 104, N 3. P. 338-344.
-
Marler J.J., Mulliken J.B. Current management of hemangiomas and vascular malformations // Clin. Plast. Surg. 2005. Vol. 32, N 1. P. 99-116.
-
Miccoli S., Tempesta A., Limongelli L., Caporusso C. et al. Oro-Facial Lymphatic Malformation: management with a new three steps Laser protocol // Ann. Stomatol. (Roma). 2013. Vol. 4, N 2. P. 31.
-
Mulliken J., Burrows P., Fishman S. Mulliken and Young’s Vascular Anomalies Hemangiomas and Malformations. 2nd ed. New York : Oxford University Press, 2013. 1095 p.
-
Prey S., Voisard J.J., Delarue A., Lebbe G. et al. Safety of propranolol therapy for severe infantile hemangioma // JAMA. 2016. Vol. 315, N 4. P. 413-415.
-
Puttgen K., Lucky A., Adams D., Pope E. et al. Topical timolol maleate treatment of infantile hemangiomas // Pediatrics. 2016. Vol. 138, N 3. Article ID e20160355.
-
Raphael M.F., Breur J.M., Vlasveld F.A., Elbert N.J. Treatment of infantile hemangiomas: therapeutic options in regard to side effects and adverse events - a review of the literature // Expert Opin. Drug Saf. 2016. Vol. 15, N 2. P. 199-214.
-
Schwarcz R., Simon G., Cook T., Goldberg R. Sclerosing therapy as first line treatment for low flow vascular lesions of the orbit // Am. J. Opthalmol. 2006. Vol. 141, N 2. P. 333339.
-
The 19th International Workshop on Vascular Anomalies. ISSVA 2012. Malmo, Sweden, 16-19 June 2012.
-
The 20th International Workshop on Vascular Anomalies. ISSVA 2014. Melbourne, Australia, 1-4 April 2014.
-
Tille J.C., Pepper M.S. Hereditary vascular anomalies new insights into their pathogenesis // Arterioscler. Thromb. Vasc. Biol. 2004. Vol. 24, N 9. P. 1578-1590.
-
Tucci F.M. et al. Head and neck vascular anomalies in children // Int. J. Pediatr. Otorhinolaryngol. 2009. Vol. 73. P. 71-76.
-
Wassef M., Adams D., Alomari A., Baselga E. et al. Updating and expanding the ISSVA classification of vascular anomalies: a proposal // Book of Abstracts of 20th Workshop of the International Society for the Study of Vascular Anomalies. Melbourne, 2014. P. 26.