Терапевтическая радиология
Терапевтическая радиология : национальное руководство / Каприн А. Д. , Мардынский Ю. С. - Москва : ГЭОТАР-Медиа, 2018. - 704 с. - ISBN 978-5-9704-4658-4 |
Аннотация
Национальное руководство по терапевтической радиологии содержит достоверную современную информацию об основных способах диагностики и лучевой терапии новообразований различной локализации и неопухолевых заболеваний. Впервые значительное внимание в книге уделено проблемам модификации радиочувствительности опухоли и здоровых тканей, радионуклидной, фотодинамической, адронной терапии, лучевому патоморфозу злокачественных новообразований, токсическим последствиям лучевой терапии.
В подготовке настоящего издания в качестве авторов-составителей и рецензентов участвовали ведущие специалисты в области лучевой терапии.
Руководство предназначено онкологам, онкорадиологам, врачам смежных специальностей, интернам, ординаторам и аспирантам по профильной специальности.
Панова И.Е., Гюнтнер Е.И., Павленко Е.С., Семенова Л.Е.
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ КОЖИ ВЕК
Синонимы: опухоли придаточного аппарата глаза, опухоли защитного аппарата глаза. Код по МКБ-10
С43. Злокачественная меланома кожи.
C44. Другие злокачественные новообразования кожи.
Заболеваемость злокачественными опухолями кожи век составляет 2,0-3,5 на 100 тыс. населения. Злокачественные новообразования кожи век диагностируют преимущественно в ранних стадиях (86,6%), часто они имеют множественный (15,1%) и первично-множественный (5,4% в сочетании с опухолями органов репродуктивной системы и пищеварительного тракта) характер. Метастатическое поражение (на сроках до 5 лет) наблюдают у 6,7% пациентов с плоскоклеточным раком кожи, аденокарциномой век и меланомой кожи век. В структуре злокачественных новообразований кожи век превалирует базально-клеточный рак (94,02%), реже встречаются метатипический (2,89%) и плоскоклеточный (1,95%) рак кожи век, аденокарцинома мейбомиевой железы (0,74%) и меланома кожи век (0,4%).
Базально-клеточный рак протекает преимущественно в виде узловой формы (68,7%), реже - язвенной (23,3%), плоскостной (7,1%) и склеродермоподобной (0,9%); метатипический рак - в виде язвенной (53,5%) и узловой формы (46,5%). Плоскоклеточный рак встречается в виде эндофитной (65,5%) и экзофитной формы (34,5%); в клинической картине меланомы кожи век превалирует узловая форма поражения (83,3%).
Рецидивирующее течение злокачественных новообразований кожи век наблюдается у 7,5-11,4% пациентов, в структуре рецидивов превалирует базально-клеточный рак кожи век (94,1%). Рецидивы диагностируют преимущественно на сроке до 5 лет (74,6%), многократные рецидивы наблюдают при язвенной форме, распространенном характере поражения; чаще они возникают после криодеструкции и короткодистанционной лучевой терапии.
Понятие «злокачественные опухоли кожи» объединяет в себе новообразования кожного покрова, происходящие из эпидермиса и придаточного аппарата кожи (сальные, потовые железы, волосяные фолликулы), а также меланоцитов. За последние 30 лет наблюдается неуклонный рост заболеваемости злокачественными эпителиальными опухолями кожи (в 1,96 раза), в структуре злокачественных опухолей органа зрения данная патология занимает лидирующее место (до 80%).
Факторы риска возникновения рака кожи включают солнечную инсоляцию, повышенную фоточувствительность кожи, энзиматический дефект восстановления ДНК, рентгеновское и другие виды ионизирующего облучения, воздействие на кожу минеральных масел, смол, мышьяка, инсектицидов, нефтепродуктов и других химических веществ, фенотипические особенности (светлые кожа и волосы, голубые или зеленые глаза, веснушки). Патология может возникнуть на фоне различных предраковых заболеваний (кожный рог, старческий кератоз, пигментная ксеродерма, папиллома), а также на фоне рубцов после прививок и ожогов. Меланома развивается из первичного приобретенного меланоза (75%), на фоне предшествующих невусов (20%) или de novo (около 5%).
Базально-клеточный рак как наиболее часто встречаемая злокачественная опухоль кожи век характеризуется медленным местнодеструирующим ростом, отсутствием болевого синдрома, крайне редким метастазированием, возможностью множественного и первично-множественного поражения.
Метатипический рак имеет схожие черты с базально-клеточным раком, в диагностике основная роль отводится патогистологическому исследованию.
Плоскоклеточный рак отличается резко выраженным инвазивным ростом и высокой склонностью к лимфогенному метастазированию, возможна внутри-кожная и гематогенная диссеминация раковых клеток. Нередко возникает на фоне предрака в пограничной зоне между эпидермисом кожи и эпителием слизистой оболочки (интермаргинальный край века).
Меланома кожи век представляет собой пигментированную, быстро растущую опухоль с возможностью лимфогематогенной диссеминации.
Частота возникновения рецидивов после хирургического лечения составляет 10,5%.
Классификация TNM (7-е издание, 2009 г.)
КАРЦИНОМА КОЖИ ВЕКА
-
-
Т1 - опухоль не более 5 мм в наибольшем измерении без прорастания в хрящ века (тарзальную пластинку) и край века.
-
Т2а - опухоль более 5 мм, но не более 10 мм в наибольшем измерении или опухоль любых размеров, прорастающая в хрящ века (тарзальную пластинку) или край века.
-
Т2Ь - опухоль более 10 мм, но не более 20 мм в наибольшем измерении или опухоль, прорастающая через всю толщу века.
-
Т3а - опухоль более 20 мм в наибольшем измерении, либо опухоль любых размеров, прорастающая в прилежащие структуры глазного яблока и глазницы, или опухоль с периневральной инвазией.
-
Т3Ь - опухоль, полная резекция которой требует энуклеации, экзентера-ции или резекции кости.
-
Т4 - нерезектабельная опухоль из-за распространенной инвазии в ткани глазного яблока, глазницы, черепно-лицевых структур или головного мозга.
Стадии карциномы кожи века представлены в табл. 7-1.
| Стадии | Т | N | М |
|---|---|---|---|
Стадия О |
Tis |
NO |
МО |
Стадия IA |
T1 |
NO |
МО |
Стадия IB |
T2a |
NO |
МО |
Стадия IC |
T2B |
NO |
МО |
Стадия II |
ТЗа |
NO |
МО |
Стадия IIIA |
ТЗb |
NO |
МО |
Стадия IIIB |
Любая Т |
N1 |
МО |
Стадия IIIC |
T4 |
Любая N |
МО |
Стадия IV |
Любая Т |
Любая N |
M1 |
ЗЛОКАЧЕСТВЕННАЯ МЕЛАНОМА КОЖИ
Т - первичная опухоль (степень распространения опухоли классифицируют после ее удаления).
N - региональные лимфатические узлы.
-
N2 - метастазы в двух или трех региональных лимфатических узлах, либо сателлит (сателлиты), либо транзитный метастаз.
-
N3 - метастазы в четырех или более региональных лимфатических узлах, либо связанное (единое) метастатическое поражение региональных лимфатических узлов, либо сателлитные, либо транзитные метастазы с метастазами в региональных лимфатических узлах (узле).
Примечание: сателлиты - скопления опухолевых клеток или узелки (микроили макроскопические) в пределах 2 см от первичной опухоли; транзитные метастазы поражают кожу и подкожные ткани на расстоянии более 2 см от первичной опухоли, но не дальше места расположения региональных лимфатических узлов.
ПАТОЛОГОАНАТОМИЧЕСКАЯ КЛАССИФИКАЦИЯ МЕЛАНОМЫ (PTNM)
-
-
рТх - первичная опухоль не может быть оценена (включает результаты шейв-биопсии, т.е. биопсии с помощью дерматома, и регрессирующие меланомы).
-
pTis - меланома in situ (уровень I по Кларку: атипичная меланоцитарная гиперплазия, тяжелая меланоцитарная дисплазия, отсутствие инвазивного роста.
-
pN - региональные лимфатические узлы (категории pN соответствуют категориям N).
-
pN0 - при региональной лимфаденэктомии гистологическое исследование должно включать не менее 6 лимфатических узлов. Если в лимфатических узлах метастазы не выявлены, но исследовано меньшее количество узлов, то классифицируют как pN0. При классификации, базирующейся исключительно на биопсии «сторожевого» лимфатического узла без последующего его удаления, используют обозначение (sn), например pN1(sn).
-
-
-
-
рM1 - отдаленный метастаз подтвержден при гистологическом исследовании. Стадии меланомы кожи века представлены в табл. 7-2.
-
| Стадии | Т | N | М |
|---|---|---|---|
Стадия О |
pTis |
NO |
МО |
Стадия I |
pT1 |
NO |
МО |
Стадия Ia |
pT1a |
NO |
МО |
Стадия IB |
pT1B |
NO |
МО |
Стадия IIA |
pT2a |
NO |
МО |
Стадия IIB |
pT2B |
NO |
МО |
Стадия IIC |
рТЗа |
NO |
МО |
Стадия III |
рТЗb |
NO |
МО |
Стадия IIIa |
pT4a |
NO |
МО |
Стадия IIIB |
pT4B |
NO |
МО |
Стадия IIIC |
Любая Т |
N1, N2, N3 |
МО |
Стадия IV |
pT1a-4a |
N1a, 2a |
МО |
рТ1-4а |
N1b, 2b, 2c |
МО |
|
pT1b-4b |
N1a, 2a, 2c |
МО |
|
рT1b-4b |
N1B, 2b |
МО |
|
Любая pT |
N3 |
МО |
|
Любая pT |
Любая N |
M1 |
Диагностика
БАЗАЛЬНО-КЛЕТОЧНЫЙ РАК КОЖИ ВЕК
Синонимы: базалиома, базально-клеточная эпителиома, разъедающая язва, карциноид кожи). Наиболее распространенная локализация - нижнее веко и область внутреннего угла глазной щели, реже - наружный угол и верхнее веко. Опухоль может распространяться на две или более анатомо-топографические зоны с вовлечением структур вспомогательного аппарата глаза, глазного яблока, орбиты и периорбитальных областей. Базально-клеточный рак преимущественно имеет вид одиночного ограниченного образования, выявляют и множественные очаги, также может сочетаться с другими злокачественными новообразованиями, чаще всего с раком кожи, органов пищеварительной, дыхательной и репродуктивной системы.
Жалобы: на наличие опухолевидного образования на коже, иногда зуд в области образования.
Анамнез: опухоль длительно растет из предшествующих уплотнений.
Клинически выделяют 4 формы базально-клеточного рака кожи век: узловая (в том числе пигментированный вариант), язвенная (в том числе разрушающий вариант), плоскостная и склеродермоподобная формы.
ПЛОСКОКЛЕТОЧНЫЙ РАК КОЖИ ВЕК
Синонимы: сквамозно-клеточный или чешуйчатоклеточный рак, спиноцеллю-лярный рак. Это наиболее злокачественная эпителиальная опухоль. Метастазирует лимфогенным путем при распространенных стадиях.
Клинически выделяют узловую и язвенную (эндофитную) формы плоскоклеточного рака кожи.
Метатипический рак кожи век занимает промежуточное положение между базально-клеточным и плоскоклеточным по гистологической картине, обладает высокой степенью инвазивности и возможностью метастазирования. Частота в структуре опухолей кожи варьирует от 0,18 до 2%.
МЕЛАНОМА КОЖИ ВЕК
Синонимы: злокачественная меланома, пигментная злокачественная опухоль. Самая злокачественная опухоль кожи, развивающаяся в результате перерождения меланоцитов и меланобластов - пигментных клеток, продуцирующих пигмент меланин.
При всех злокачественных опухолях кожи век проводят цитологическое исследование, УЗИ, КТ, МРТ, биопсию, а также офтальмологическое обследование (визометрия, биомикроскопия, тонометрия, офтальмоскопия).
Дифференциальная диагностика базально-клеточного рака кожи проводится прежде всего с плоскоклеточным раком, для которого характерны быстрый рост образования, отсутствие четких границ, раннее метастазирование в регионарные лимфатические узлы.
К заболеваниям, с которыми необходимо проводить дифференциальную диагностику рака кожи век, относят себорейный кератоз, кератоакантому, трихоэпи-телиому, ботриомикому и др.
Дифференциальную диагностику меланом кожи следует проводить с пигментированными образованиями эпителиального генеза, ангиомами с кровоизлияниями, старческим кератозом, прогрессирующими невусами.
Беспигментные формы следует дифференцировать с папилломатозом, плоскоклеточным и базально-клеточным раком, раком сальных желез.
Диагностический алгоритм при злокачественном новообразовании кожи век включает обязательные процедуры: визуальный осмотр первичной опухоли и всего кожного покрова пациента; пальпаторное исследование первичной опухоли и окружающих ее мягких тканей; пальпаторное исследование всех доступных пальпации периферических групп лимфатических узлов; осмотр опухоли под увеличением; забор цитологического материала с поверхности опухоли; УЗИ первичной опухоли с целью определения ее толщины и глубины инвазии; консультация хирурга и химиотерапевта, радиолога, терапевта; электрокардиография (ЭКГ).
Дополнительные процедуры (по показаниям) могут включать инцизион-ную или эксцизионную биопсию опухоли (при отсутствии убедительных данных клинического и цитологического исследования), УЗИ лимфатических узлов регионарного лимфатического коллектора, пункцию предушных и подчелюстных лимфатических узлов, УЗИ органов брюшной полости и забрюшинного пространства; рентгенографию или КТ органов грудной клетки, КТ орбиты и черепа, сцинти-графию опорного скелета; КТ головного мозга; ПЭТ-КТ всего тела, консультацию анестезиолога (при планировании оперативного лечения).
Лечение
При выборе метода лечения у конкретного пациента необходимо учитывать кли-нико-морфологические особенности опухоли, размеры и анатомо-топографическую локализацию очага, распространенность, возраст и наличие сопутствующей патологии, возможные ограничения каждого метода и предпочтения пациента.
Для лечения больных с опухолями кожи век могут быть использованы криогенная терапия, лазерная фотодеструкция, фотодинамическая и лучевая терапия, операция.
При базально-клеточном раке кожи век, плоскостной, узловой форме с элева-цией не более 0,5 мм показан криогенный метод лечения.
Противопоказания: меланома кожи век, злокачественные опухоли, выходящие за пределы кожи, распространяющиеся на ресничный край, пальпебральную конъюнктиву, при наличии регионарных или отдаленных метастазов.
Методика: для достижения полной радикальности применяют прием дробного криовоздействия, т.е. проводят несколько циклов замораживания-оттаивания. Сокращение экспозиции криовоздействия при одновременном увеличении циклов замораживания-оттаивания обеспечивает полноту деструкции опухоли без увеличения зоны некроза, что сохраняет окружающие ткани. Диаметр аппликатора должен превышать максимальный диаметр опухоли на 3 мм, т.е. в зону криовоздей-ствия должно быть включено не менее 3 мм окружающих здоровых тканей. Время экспозиции зависит от клинической формы, величины, локализации опухоли и составляет 30-180 с. Всего выполняют три процедуры. Используют жидкий азот.
Полная эпителизация наступает на 20-30-е сутки (в зависимости от размеров опухоли).
При криодеструкции возможны осложнения: выраженные воспалительные явления в зоне криовоздействия, присоединение вторичной инфекции, кровотечения после отторжения некротических тканей, рожа, перихондрит, выворот века, конъюнктивит.
Лечение лазерным излучением получило широкое распространение в связи с хорошим терапевтическим и косметическим эффектом, минимальной кровопо-терей, стерильностью, щадящим действием.
Показания: узловая и поверхностная формы базально-клеточного рака кожи век, в том числе при множественном характере поражения с размерами очагов не более 8-10 мм.
Фотодинамическая терапия применяется при поверхностном раке кожи, поскольку монохромный свет способен проникать в ткани до определенной глубины.
Эффект фотодинамической терапии зависит от толщины опухоли (не более 10-15 мм), дозы сенсибилизатора, способа подачи света и гистологического строения опухоли.
Показания: базально-клеточный рак, множественное поражение, поверхностная и узловая (небольшой проминенции) формы, резистентность к ранее проведенной терапии.
Побочные эффекты: повышенная фоточувствительность кожи, болевой синдром, аллергические реакции.
*Лучевая терапия *поверхностных карцином кожи век - альтернатива хирургическому методу, но ожидаемый эффект необходимо сопоставлять с риском осложнений, возрастающим с увеличением объема облучения и дозы. В единственном рандомизированном исследовании Avril с соавт. (1997 г.) продемонстрировали преимущество хирургического метода перед облучением базально-клеточных карцином кожи лица, включая опухоли кожи век. Применялась конвенциональная лучевая терапия (85-250 кВ), поверхностная контактная терапия (50 кВ) и внутритканевая брахитерапия 192Ir. 4-летняя частота рецидивов составила 7,5% в группе лучевой терапии и 0,7% в группе хирургического лечения. Косметический результат был лучше после операции. Ретроспективный анализ шести исследований, опубликованный R. Frakulli и соавт. в 2015 г., показал, что брахитерапия немеланомных образований кожи век размером ≤3,5 см обеспечивает высокий локальный контроль и приемлемый косметический результат. Вместе с тем не установлено преимуществ какой-либо методики дистанционного или контактного облучения образований кожи век относительно локального контроля или риска осложнений. Очевидно, что лучевая терапия карцином кожи век имеет преимущества в тех случаях, когда операция сопряжена с риском косметических или функциональных дефектов. Выбор же техники облучения зависит от имеющегося оборудования и опыта клиники.
При местнораспространенных новообразованиях кожи век лучевая терапия может применяться в комбинации с операцией для улучшения локального контроля или самостоятельно с паллиативной целью.
Лучевая терапия показана при:
-
карциноме распространенностью Т1-2, локализующейся на коже верхнего или нижнего века, угла глаза при отсутствии поражения ребра века и тарзо-конъюнктивальной пластинки и при отказе от операции; при локализации опухоли в области внутреннего угла глаза показана интубация слезных канальцев полипропиленовой нитью на весь период облучения до стихания лучевых реакций;
-
высоком риске рецидива после операции с положительным или близким краем резекции;
-
наличии местнораспространенного нерезектабельного опухолевого процесса;
Лучевая терапия проводится с радикальной целью как этап комбинированного лечения, а также с паллиативной целью.
Она может быть реализована в виде ортовольтной и близкофокусной рентгенотерапии (Dmax), терапии электронами высоких энергий (доза предписывается по 90% изодозе от дозного максимума - Dmax), терапии тормозным излучением высоких энергий, контактной лучевой терапии в режиме высокой (HDR - от англ. high dose rate) или низкой мощности дозы (LDR - от англ. low dose rate).
Выбор метода и способа лучевой терапии зависит от особенностей роста, размеров и расположения опухоли. Лучевая терапия не рекомендована при веррукозной карциноме.
При базально-клеточном раке кожи век радикальная лучевая терапия реализуется в виде: СОД 35 Гр за 5 фракций, либо СОД 50 Гр за 15 фракций, либо СОД 55 Гр за 20 фракций, либо СОД 60 Гр за 30 фракций; послеоперационной лучевой терапии с СОД 50 Гр за 20 фракций.
При плоскоклеточном раке кожи век возможно лечение с СОД 50 Гр за 15 фракций, либо СОД 55 Гр за 20 фракций, либо СОД 64 Гр за 32 фракции, а также послеоперационная лучевая терапия с СОД 50 Гр за 20 фракций или СОД 60 Гр за 30 фракций.
При проведении лучевой терапии по поводу меланомы кожи век необходимо предусмотреть защиту роговицы и хрусталика во время сеанса рентгенотерапии и терапии электронами за счет применения индивидуальных свинцовых защитных линз.
Возможность, риск и тяжесть ранних и поздних лучевых повреждений нарастает с увеличением объема облучения и значения суммарной дозы. Более значимы поздние повреждения, частота которых возрастает по мере увеличения времени после облучения. Такие повреждения могут быть причиной функциональных и косметических дефектов.
Наиболее часто встречаются мадароз, пигментация, телеангиоэктазии, фиброз; значительно реже возникают такие значимые повреждения, как стеноз слезного канальца, катаракта, эктропион, энтропион, изъязвление роговицы.
Оперативное лечение при возможности иссечения опухоли предпочтительно. При распространенном процессе проводят расширенные оперативные вмешательства с удалением век, энуклеацией глазного яблока, экзентерацией орбиты.
Комбинированное лечение при распространенных стадиях злокачественных эпителиальных опухолей кожи век повышает резектабельность и онкологическую радикальность, снижает частоту рецидивов.
Диспансеризация
Диспансеризация осуществляется 1 раз в 3 мес в течение первого года после лечения, 1 раз в 6 мес в течение второго года, затем 1 раз в год пожизненно с тщательным полным онкологическим осмотром, если течение процесса не требует изменения тактики ведения. В соответствии с приказом Министерства здравоохранения Российской Федерации от 19.04.999 № 135 «О совершенствовании системы государственного ракового регистра», пациенты со злокачественными новообразованиями кожи, гистологически определяемыми как базально-клеточный рак, подлежат снятию с диспансерного учета через 5 лет после окончания специального лечения в том случае, если оно привело к полному излечению и в течение 5 лет диспансерного наблюдения у больного не было рецидивов заболевания и метастазов.
Прогноз
Прогноз при базально-клеточном раке благоприятный - опухоль крайне редко метастазирует (около 1%), преимущественно в регионарные лимфатические узлы. При базально-клеточном раке выздоровление после лечения наступает в 95-97% случаев, возможны рецидивы.
Прогноз при плоскоклеточном раке неблагоприятный, особенно при поздних стадиях. Возможно метастазирование в регионарные лимфатические узлы, прорастание в орбиту, пазухи, интракраниально. Смертность от продолженного роста в течение 5 лет достигает 2%.
Прогноз при меланоме кожи век для жизни очень серьезен и зависит от толщины и степени инвазии опухоли. При наличии отдаленных метастазов >80% больных умирают в течение 5 лет (очень высокий риск); при толщине опухоли >4 мм (инвазия по Кларку IV-V), поражении регионарных лимфатических узлов высок риск развития рецидивов в течение 5 лет; при толщине опухоли 2,0-4,0 мм (инвазия по Кларку III) риск развития рецидивов (15-50%); при толщине менее 2,0 мм (инвазия по Кларку I-II) риск рецидивирования низкий (до 15%).
Узловая форма имеет худший прогноз в связи с ранним возникновением инвазии опухолевыми клетками тканей по вертикали. Ухудшается прогноз при распространении меланомы на реберный край века, интермаргинальное пространство, конъюнктиву век, своды и в орбиту. На исход заболевания влияют наличие метастазов в регионарных лимфатических узлах, пожилой возраст пациента.
АДЕНОКАРЦИНОМА МЕЙБОМИЕВОЙ ЖЕЛЕЗЫ
Синонимы: рак мейбомиевой железы, карцинома мейбомиевой железы.
Код по МКБ-10
C44.1. Злокачественные новообразования кожи века, включая спайку век.
Это злокачественная опухоль, возникающая из придатков (мейбомиевой железы) кожи век и характеризуемая агрессивным, нередко мультицентричным ростом, регионарным и отдаленным метастазированием.
На долю данного новообразования приходится <1% всех опухолей век. Среди злокачественных опухолей оно встречается в 5% случаев. Диагностируют опухоль обычно на пятой декаде жизни, одинаково часто у женщин и мужчин.
Классификация TNM (7-е издание)
-
-
Т1 - опухоль не более 5 мм в наибольшем измерении без прорастания в хрящ века (тарзальную пластинку) и край века.
-
Т2а - опухоль более 5 мм, но не более 10 мм в наибольшем измерении или опухоль любых размеров, прорастающая в хрящ века (тарзальную пластинку) или край века.
-
Т2Ь - опухоль более 10 мм, но не более 20 мм в наибольшем измерении или прорастающая через всю толщу века.
-
Т3а - опухоль более 20 мм в наибольшем измерении, либо опухоль любых размеров, прорастающая в прилежащие структуры глазного яблока и глазницы, либо опухоль с периневральной инвазией.
-
Т3Ь - опухоль, полная резекция которой требует энуклеации, экзентера-ции или резекции кости.
-
Т4 - нерезектабельная опухоль из-за распространенной инвазии в ткани глазного яблока, глазницы, черепно-лицевых структур или головного мозга.
Стадии аденокарциномы мейбомиевой железы представлены в табл. 7-3.
| Стадия | Т | N | М |
|---|---|---|---|
Стадия О |
Tis |
NO |
МО |
Стадия Ia |
T1 |
NO |
МО |
Стадия IB |
T2a |
NO |
МО |
Стадия IC |
T2b |
NO |
МО |
Стадия II |
ТЗа |
NO |
МО |
Стадия IIIA |
ТЗЬ |
NO |
МО |
Стадия IIIB |
Любая Т |
N1 |
МО |
Стадия IIIC |
T4 |
Любая N |
МО |
Стадия IV |
Любая Т |
Любая N |
M1 |
Диагностика включает стандартное офтальмологическое исследование (визо-метрия, биомикроскопия, тонометрия, гониоскопия, осмотр глазного дна с широким зрачком). Обязательна пальпация регионарных лимфатических узлов.
Начальная стадия заболевания аналогична халязиону - появление безболезненных припухлости и уплотнения в толще века. К тревожным симптомам относят втянутость края века или со стороны слизистой оболочки при незначительных воспалительных изменениях, желтоватый цвет новообразования, рецидивирующие мейбомииты. Другой вариант клинической картины - врастание опухоли в тарзальную пластинку и выход на конъюнктиву с образованием папиллома-тозных плоских разрастаний, не поддающихся обычному медикаментозному лечению. В поздней стадии заболевания процесса распространяется в орбиту и регионарные лимфатические узлы.
Лабораторные исследования включают общий анализ крови, общий анализ мочи, биохимический анализ крови.
Инструментальные исследования
Информативность цитологического исследования невелика. Возможно выполнение соскоба либо, при наличии изъязвления, мазка-отпечатка.
Наиболее информативна инцизионная/эксцизионная биопсия опухоли с обязательным последующим патологогистологическим, а в ряде случаев - иммуноги-стохимическим исследованием.
УЗИ и КТ глазного яблока и орбит проводят при подозрении на распространение опухоли в глазное яблоко или орбиту.
В ряду дифференциальной диагностики находятся воспалительные и бактериальные заболевания век и конъюнктивы.
Признаками злокачественности следует считать длительный анамнез, инфильтрацию тканей вокруг образования, уменьшенную секрецию желез, наличие пигментации или побледнение кожи над узлом, васкуляризацию и признаки распада опухоли.
Основные цели лечения - радикальность, органосохранность.
Возможности применения лучевой терапии у пациентов с аденокарциномой мейбомиевой железы ограниченны вследствие низкой радиочувствительности образования и близости структур с низкой толерантностью к ионизирующему излучению. Лучевую терапию можно применять в самостоятельном варианте при отказе от операции или в комбинации с хирургическим методом для улучшения локального контроля.
Дистанционная лучевая терапия реализуется с радикальной целью при I-II стадии и при отказе от операции или рецидиве после операции. СОД - 60-66 Гр за 6-7 нед.
При паллиативной лучевой терапии суммарную и разовую дозы выбирают индивидуально, предпочтительно гипофракционирование.
Послеоперационная лучевая терапия при положительном или близком крае резекции предусматривает СОД 60-65 Гр за 6-7 нед.
Для проведения медикаментозного лечения единых стандартов не выработано. В отдельных случаях применяют платиносодержащие лекарственные препараты.
В качестве хирургического лечения используют иссечение опухоли с пластикой дефекта. Обязательное условие - биомикроскопический контроль оперативного вмешательства, иссечение в пределах здоровых тканей (≥1 см от границ опухоли).
Наличие признаков распространения на своды и бульбарную конъюнктиву требует выполнения экзентерации орбиты.
Послеоперационные осложнения могут включать рубцовую деформацию век с развитием лагофтальма, эктропиона, энтропиона, дислокации кожного рубца с изменением формы глазной щели, трихиаза, укорочения века с возможным появлением язвы роговицы, слезотечением (при удалении слезных точек). После орбитотомии возникают диплопия, птоз, снижение зрительных функций.
Диспансеризация пациента осуществляется пожизненно. Пациентов наблюдают в течение первого года после лечения 1 раз в 3 мес, в течение второго года - 1 раз в 6 мес, затем 1 раз в год пожизненно, если течение процесса не требует изменения тактики ведения.
Непосредственно после лечения по показаниям назначают противовоспалительные препараты в инстилляциях (например, дексаметазон 0,1% по 1 капле 4 раза в сутки в течение 2 нед, диклофенак по 1 капле 3 раза в сутки до месяца), стимуляторы регенерации (например, глазной гель Солкосерил*, гель с декспанте-нолом [Корнерегель♠] по 1 капле 2-3 раза в день 1-2 нед), слезозаместительные препараты (например, гипромеллоза по 1 капле 4 раза в сутки 2-3 нед).
Контролем эффективности лечения служит комплексное клинико-инструмен-тальное обследование, которое включает исследование органа зрения (биомикроскопия, тонометрия, офтальмоскопия, периметрия, диафаноскопия), УЗИ, КТ, в ряде случаев - МРТ.
Для оценки распространенности опухолевого процесса показаны УЗИ органов брюшной полости 2 раза в год, УЗИ регионарных лимфатических узлов 2 раза в год, рентгенография органов грудной клетки 1 раз в год. По показаниям выполняют КТ/МРТ головного мозга, сцинтиграфию костей скелета, ПЭТ-КТ всего тела.
Прогноз (для зрения и жизни) неблагоприятный в связи с высокой частотой рецидивов и смертности от дистантных метастазов. От дистантных метастазов в течение 5 лет умирают 50-67% больных.
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ КОНЪЮНКТИВЫ
Синонимы: рак конъюнктивы, карцинома конъюнктивы. Код по МКБ-10 - С69.
Пик заболеваемости злокачественными опухолями конъюнктивы приходится на возраст 40-60 лет. Мужчины болеют в 2-3 раза чаще, чем женщины. В этио-патогенезе заболевания важная роль отводится ультрафиолетовому облучению.
Рак конъюнктивы может развиваться как первично, так и на фоне доброкачественных опухолей и предраковых заболеваний.
Первичный рак конъюнктивы характеризуется агрессивным течением, быстрым инфильтративным ростом, прорастанием в глазное яблоко, орбиту, окружающие ткани, метастазированием в регионарные лимфатические узлы и чаще имеет строение неороговевающей карциномы.
Малигнизация доброкачественных опухолей и предраковых состояний (в частности, рака Боуэна) сопровождается ускорением темпов роста опухоли, поверхностной инфильтрацией тканей, наиболее часто возникает в области лимба.
Несмотря на возможность развития меланомы конъюнктивы de novo, наиболее часто опухоль развивается в результате злокачественной трансформации невусов и меланоза.
Классификация TNM (7-е издание)
Карцинома конъюнктивы
Стадии: в настоящее время стадии использовать не рекомендуется.
Злокачественная меланома конъюнктивы
-
-
Tis - меланома in situ [1] в пределах эпителия конъюнктивы.
-
Т1 - меланома конъюнктивы глазного яблока.
-
Т1а - опухоль поражает не более одного квадранта [2].
-
Т1Ь - опухоль поражает более одного, но не более двух квадрантов.
-
Т1с - опухоль поражает более двух, но не более трех квадрантов.
-
-
Т2 - злокачественная конъюнктивальная меланома не конъюнктивы глазного яблока, поражающая конъюнктиву век, свода и/или сосочка.
Патологоанатомическая классификация меланомы (pTNM)
-
-
pT1a - опухоль толщиной не более 0,5 мм с инвазией в собственное вещество.
-
pT1b - опухоль толщиной более 0,5 мм, но не более 1,5 мм с инвазией в собственное вещество.
-
pT1c - опухоль толщиной более 1,5 мм с инвазией в собственное вещество.
-
pT2a - опухоль толщиной не более 0,5 мм с инвазией в собственное вещество.
-
pT2b - опухоль толщиной более 0,5 мм, но не более 1,5 мм с инвазией в собственное вещество.
-
pT2c - опухоль толщиной более 1,5 мм с инвазией в собственное вещество.
-
pT3 - меланома, прорастающая в глазное яблоко, веко, носослезную систему, пазухи или глазницу.
-
pN - региональные лимфатические узлы (категория pN соответствует категории N).
Категории pM0 и pMx в настоящее время не используют.
Гистологическая классификация
Гистологическая градация отражает источник развития опухоли.
При данной локализации новообразований в настоящее время стадии использовать не рекомендовано.
Диагностика
В процессе диагностики опухоли проводят стандартное офтальмологическое исследование (визометрия, биомикроскопия, тонометрия, гониоскопия, осмотр глазного дна). Обязательна пальпация регионарных лимфатических узлов.
При плоскоклеточном раке конъюнктивы больные жалуются на покраснение конъюнктивы, ощущение инородного тела, слезотечение, болезненность, появление быстро растущего образования.
Опухоль часто развивается на фоне измененной конъюнктивы (ожог, доброкачественные опухоли, предраковые состояния и др.).
На бульбарной конъюнктиве или интермаргинальном крае века выявляют образование с узловым или, реже, диффузным характером роста, розового цвета, бугристое, васкуляризированное; при значительных размерах образования на поверхности появляется кровоточащее изъязвление. Возможно распространение на роговицу, склеру, в орбиту и окружающие ткани.
При меланоме конъюнктивы выявляют образования темного (коричневого, черного) или розово-коричневого цвета, покраснения глазного яблока; пациенты жалуются на ощущение «инородного» тела.
Наиболее часто (до 70%) заболевание возникает на конъюнктиве глазного яблока, нередко в результате злокачественной трансформации невуса. Опухоль может быть пигментированной или беспигментной, последняя длительное время протекает без выраженных клинических проявлений. Характеризуется быстрым ростом в виде узла, возможно наличие множественных очагов, поверхность гладкая, блестящая, бугристая, пигментация неоднородная, возможно распыление пигмента по краям образования. Характерны выраженная васкуляризация и формирование сети расширенных, застойно-полнокровных сосудов вокруг. По мере роста меланомы возможно прорастание в роговицу и окружающие ткани, поверхность образования изъязвляется, появляется кровоточивость. Характерно возникновение сателлитов в результате образования отсевов и контакта с основным опухолевым узлом.
При лимфоме конъюнктивы клиническая картина довольна типична: преимущественно в области переходных складок конъюнктивы определяются студенистой консистенции разрастания розовато-желтоватого цвета в виде валика с гладкой поверхностью. Разрастания могут распространяться на полулунную складку, конъюнктиву глазного яблока, орбиту. Большинство первичных лимфом конъюнктивы - MALT-омы (мальтомы) низкой степени злокачественности.
При саркоме Капоши пациент предъявляет жалобы на наличие кровоточащего узлового образования в толще век, появление косметических дефектов, вызванных ростом опухоли (энтропион, эктропион, лагофтальм, трихиаз век и др.). В анамнезе иммуносупрессия, инфекция вирусом иммунодефицита человека (ВИЧ).
Опухоль преимущественно развивается в нижнем своде (70% случаев), реже в эпибульбарной конъюнктиве (30%). Узловая опухоль ярко-бордового цвета, плотной консистенции. Часто сопровождается развитием изъязвления.
Лабораторные исследования включают общий анализ крови, общий анализ мочи, биохимическое исследование крови.
Инструментальные исследования предусматривают цитологическое исследование, инцизионную/эксцизионную биопсию опухоли с последующим патологоги-стологическим исследованием (не проводят при меланоме конъюнктивы); УЗИ глазного яблока; ультразвуковую биомикроскопию переднего отрезка глазного яблока; КТ/МРТ орбит с контрастированием.
Для оценки распространенности опухолевого процесса показаны УЗИ органов брюшной полости, УЗИ регионарных лимфатических узлов, рентгенография органов грудной клетки. По показаниям выполняют КТ/МРТ головного мозга, сцин-тиграфию костей скелета, ПЭТ-КТ всего тела.
Дифференциальная диагностика направлена на исключение неспецифической и специфической воспалительной патологии переднего отрезка глазного яблока (конъюнктивит, эписклерит, пингвекула, мейбомиит и др.); доброкачественных и предраковых новообразований конъюнктивы (папиллома, гемангио-ма, эпителиома Боуэна, липома, невус и др.), ее рубцовых изменений.
Отличительные от рака конъюнктивы диагностические признаки папилломы - наличие, чаще в нижнем своде, множественных пронизанных сосудами образований красно-розового цвета, основания в виде «ножки», мягкой консистенции; у взрослых возможно развитие ороговевающей папилломы у лимба в виде одиночного недвижимого полупрозрачного образования серовато-белого цвета.
Для эпителиомы Боуэна характерны возникновение сероватой полупрозрачной бляшки, напоминающей птеригиум с беловатыми вкраплениями, более медленный рост образования.
Меланому конъюнктивы чаще приходится дифференцировать с доброкачественными пигментными образованиями - невусом и меланозом конъюнктивы.
Лечение
Лучевая терапия
Возможности дистанционной лучевой терапии ограничены близостью структур с низкой толерантностью к ионизирующему излучению. В связи с этим лучевую терапию применяют преимущественно при рецидивах или с паллиативной целью при нерезектабельных опухолях. Контактная лучевая терапия имеет существенные преимущества перед дистанционным облучением за счет высокого градиента дозы.
Лучевую терапию злокачественных опухолей конъюнктивы следует проводить в радиологических отделениях или центрах, располагающих необходимым оборудованием, при участии специалистов с опытом лечения новообразований данной локализации.
Лучевая терапии показана при карциноме конъюнктивы до 10 мм в случае отказа от операции, высоком риске рецидива после операции с положительным или близким краем резекции, наличием местно-распространенного нерезекта-бельного опухолевого процесса, рецидиве опухоли после хирургического вмешательства.
Лучевую терапию проводят с радикальной, послеоперационной и паллиативной целью. При этом используют: ортовольтную рентгенотерапию (дозу предписывают на поверхность опухоли - Dmax); терапию электронами с энергией 4 или 6 МэВ (дозу предписывают по 90% изодозе от дозного максимума - Dmax); гамма-терапию и терапию тормозным излучением высоких энергий (при местно-распространенном процессе с паллиативной целью); аппликационную брахи-терапию (проводят в самостоятельном варианте или в сочетании с эксцизией опухоли, лазерокоагуляцией, криодеструкцией или фотодинамической терапией с применением стронциевых офтальмоаппликаторов или офтальмоаппликаторов с I-125).
Аппликационная брахитерапия противопоказана при толщине опухоли более 5 мм и при распространении опухоли за пределы полулунной складки или слезного мясца.
При плоскоклеточном раке конъюнктивы используют дистанционную лучевую терапию с радикальной целью (СОД 64-66 Гр, РОД 2,0 Гр), послеоперационную лучевую терапию (СОД 60 Гр, РОД 2,0 Гр), аппликационную брахитерапию (СОД зависит от типа офтальмоаппликатора и цели лечения).
При меланоме конъюнктивы используют дистанционную лучевую терапию (при отказе от операции) с СОД 60-66 Гр и РОД 2,0-3,0 Гр; аппликационную брахите-рапию (СОД зависит от типа офтальмоаппликатора и цели лечения).
При лимфоме конъюнктивы используется дистанционная лучевая терапия с СОД 36-40 Гр за 18-20 фракций по 2,0 Гр; аппликационная брахитерапия (СОД зависит от типа офтальмоаппликатора).
Среди поздних лучевых осложнений отмечают телеангиоэктазии, развитие синдрома сухого глаза, язвы роговицы, катаракту.
Медикаментозное лечение зависит от типа новообразования. Так, при саркоме Капоши химиотерапию проводят при распространенных процессах или невозможности использования других методов лечения (хирургического, лучевой терапии). Эффективность ее низкая. Лечение проводят до прогрессирования или непереносимой токсичности. При проведении лекарственной терапии в основном используют винбластин, этопозид, доксорубицин, паклитаксел.
При лимфомах конъюнктивы применяют химиотерапию по стандартным для данного морфологического варианта схемам.
Для локального лечения рака и меланомы конъюнктивы возможно применение 0,4% раствора митомицина (инстилляции до 4 раз в день), γ -интерферона ( Ингарон*), что позволяет добиться уменьшения образований и снизить риск локальных рецидивов. Однако четких доказательств использования этих методов для разрушения злокачественных опухолей пока нет.
Оперативное лечение в зависимости от ситуации предусматривает возможность иссечения опухоли, энуклеации глазного яблока, экзентерации орбиты.
Диспансеризация
Диспансеризация осуществляется в течение первого года после лечения 1 раз в 3 мес, в течение второго года - 1 раз в 6 мес, затем 1 раз в год пожизненно, если течение процесса не требует изменения тактики ведения.
Непосредственно после лечения по показаниям назначают противовоспалительные препараты в инстилляциях (дексаметазон 0,1% по 1 капле 4 раза в сутки в течение 2 нед, диклофенак по 1 капле 3 раза в день до месяца), стимуляторы регенерации (Солкосерил* глазной гель по 1 капле 2-3 раза в день 1-2 нед), сле-зозаместительные препараты (например, гипромеллоза по 1 капле 4 раза в день в течение 2-3 нед).
Контролем за эффективностью лечения служит комплексное клинико-инстру-ментальное обследование, которое включает: исследование органа зрения (биомикроскопия, тонометрия, офтальмоскопия, периметрия, диафаноскопия), УЗИ, КТ, в ряде случаев - МРТ.
Прогноз
Прогноз при конъюнктивальной меланоме неблагоприятный. Летальность составляет 12% в течение 5 лет и 25% в течение 10 лет. При гематогенном мета-стазировании смертность достигает 22-30%. При адекватном лечении 5-летняя выживаемость составляет 95%. Исход лечения во многом зависит от локализации и размеров опухоли. При меланомах толщиной до 1,5 мм прогноз более благоприятный. Если толщина опухоли достигает 2 мм и больше, увеличивается риск возникновения регионарных и дистантных метастазов. Прогноз ухудшается в случае распространения опухоли на слезное мясцо, своды и пальпебральную конъюнктиву. При эпибульбарной меланоме, особенно локализующейся в области лимба, прогноз более благоприятный.
УВЕАЛЬНАЯ МЕЛАНОМА
Синоним: меланома сосудистой оболочки глаза, внутриглазная меланома, злокачественная меланома, меланобластома, меланокарцинома, меланосарко-ма и др.
Коды по МКБ-10
С69. Злокачественное новообразование глаза и его придаточного аппарата.
С69.3. Злокачественное новообразование сосудистой оболочки.
С69.4. Злокачественное новообразование радужки и цилиарного тела.
Увеальная меланома - злокачественная опухоль увеального тракта (радужки, цилиарного тела, сосудистой оболочки), развивающаяся из клеток, образующих пигмент меланин, вследствие их злокачественной трансформации в увеальном тракте. Новообразование характеризуется инфильтративным ростом, преимущественно гематогенным метастазированием.
Заболеваемость увеальной меланомой составляет 0,6-1,2 на 100 тыс. населения, преобладает у женщин. Пик приходится на возраст 55 лет, описаны случаи заболевания у детей и подростков (2,9 случая на 1 млн населения).
Смертность при увеальной меланоме варьирует от 27 до 58,6% в зависимости от патогистологического варианта.
Развитие увеальной меланомы происходит de novo, а также в результате злокачественной трансформации образований, содержащих меланин. Возможна генетическая предрасположенность - на семейные формы приходится 0,37%.
Патогистологически выделяют веретеноклеточную А и В, эпителиально-клеточную и смешанно-клеточную формы; последняя встречается наиболее часто. Возможны некротические варианты без четкого определения типа клеток. Наиболее неблагоприятно протекают эпителиоидноклеточная и смешанные формы.
Течение заболевания
Стадия I - ареактивная, начальная: период латентного роста; период функциональных нарушений.
Стадия II - развитие осложнений: вторичная глаукома; воспаление оболочек глаза.
Стадия III - прорастание опухоли за пределы глазного яблока.
Стадия IV - генерализация процесса с развитием отдаленных метастазов.
Прорастание опухоли за пределы глазного яблока происходит, как правило, соответственно локализации - по эмиссариям, под глазными мышцами, в зоне шлеммова канала, lamina cribrosa. Прорастание опухоли в орбиту сопровождается развитием экзофтальма, иногда разрушением стенок глазницы; возможно прорастание в окружающие структуры (интракраниально, придаточные пазухи носа). Генерализация процесса сопровождается появлением гематогенных метастазов, факторами риска возникновения которых выступают пожилой возраст и большой диаметр опухоли. Наиболее часто метастазы выявляют в печени (93%), легких (24%), реже диагностируют метастазы в лимфатические узлы, кости, головной мозг, кожу, подкожную клетчатку, селезенку, контралатераль-ные глаз и орбиту.
Осложнения естественного течения - отслойка сетчатки, токсический увеит, вторичная глаукома, гемофтальм, осложненная катаракта.
Классификация TNM (7-е издание)
-
-
Т0 - отсутствие данных о первичной опухоли.
Радужка
Меланома радужки развивается и локализуется преимущественно в данной области сосудистой оболочки глаза. Если менее половины объема опухоли находится в пределах радужки, опухоль может развиваться из ресничного тела, поэтому ее необходимо классифицировать соответственно. -
Т2 - опухоль сливается с ресничным телом или распространяется в собственно ресничное тело, собственно сосудистую оболочку, либо и то, и другое.
-
Т3 - опухоль сливается с ресничным телом или распространяется в ресничное тело, собственно сосудистую оболочку, либо и то, и другое с распространением на склеру.
-
Т2 - размер опухоли категории 2.
-
Т2а - опухоль без вовлечения ресничного тела и без распространения за пределы глаза.
-
T2c - опухоль не более 5 мм в диаметре без вовлечения ресничного тела, но с распространением за пределы глаза.
-
Т2d - опухоль не более 5 мм в диаметре с вовлечением ресничного тела и с распространением за пределы глаза.
-
-
Т3 - размер опухоли категории 3.
-
Т3а - опухоль без вовлечения ресничного тела и без распространения за пределы глаза.
-
Т3с - опухоль не более 5 мм в диаметре без вовлечения ресничного тела, но с распространением за пределы глаза.
-
Т3d - опухоль не более 5 мм в диаметре с вовлечением ресничного тела и с распространением за пределы глаза.
-
-
Т4 - размер опухоли категории 4.
-
Т4а - опухоль без вовлечения ресничного тела и без распространения за пределы глаза.
-
Т4с - опухоль не более 5 мм в диаметре без вовлечения ресничного тела, но с распространением за пределы глаза.
-
Т4d - опухоль не более 5 мм в диаметре с вовлечением ресничного тела и с распространением за пределы глаза.
-
Т4е - опухоль более 5 мм в диаметре, опухоль любого размера с распространением за пределы глаза.
-
Патологоанатомическая классификация рTNM
Категории рТ и рN соответствуют категориям Т и N.
Стадии представлены в табл. 7-4.
| стадия I | T1a | NO | МО |
|---|---|---|---|
стадия IIa |
T1B-d, T2a |
NO |
МО |
стадия IIB |
T2b, ТЗа |
NO |
МО |
Стадия IIIa |
T2c-d |
NO |
МО |
Т3b-c |
NO |
МО |
|
T4a |
NO |
МО |
|
стадия IIIB |
Т3d |
NO |
МО |
T4b-c |
NO |
МО |
|
стадия IIIC |
T4d-e |
NO |
МО |
стадия IV |
любая Т |
N1 |
МО |
любая Т |
Любая N |
M1 |
Классификация меланомы представлена в табл. 7-5.
| Толщина, мм | — | ||||||
|---|---|---|---|---|---|---|---|
>15 |
— |
— |
— |
— |
4 |
4 |
4 |
12,1-15,0 |
— |
— |
— |
3 |
3 |
4 |
4 |
9.1-12.0 |
— |
3 |
3 |
3 |
3 |
3 |
4 |
6,1-9,0 |
2 |
2 |
2 |
2 |
3 |
3 |
4 |
3,1-6,0 |
1 |
1 |
1 |
2 |
2 |
3 |
4 |
≤3 |
1 |
1 |
1 |
1 |
2 |
2 |
4 |
наибольший диаметр основания, мм |
<3 |
3,1-6,0 |
6,1-9,0 |
9,1-12.0 |
12,1-15.0 |
15.1-18,0 |
>18 |
Для меланомы радужки характерно внезапное появление или увеличение образования радужной оболочки розоватого или темного (коричневого) цвета.
Меланома цилиарного тела отличается бессимптомным течением. Диагностика на ранних стадиях возможна при тщательном осмотре в условиях максимального медикаментозного мидриаза.
При меланоме хориоидеи в зависимости от локализации (центральная, экваториально-периферическая) выявляют жалобы на снижение остроты зрения, наличие пятна, искры, завесы в поле зрения, боли.
Наиболее частая локализация меланомы - сосудистая оболочка (до 85%), реже - цилиарное тело и радужная оболочка. Увеальная меланома характеризуется преимущественно монолатеральным поражением, изредка встречаются билатеральные меланомы.
Офтальмологическое обследование включает визометрию с коррекцией, периметрию, офтальмоскопию, гониоскопию, биомикроскопию, диафаноскопию, тонометрию, экзофтальмометрию, осмотр глазного дна.
Меланома радужной оболочки по характеру роста может быть узловой, смешанной и анулярной.
Узловая форма меланомы радужки имеет вид нечетко очерченного узла, про-минирующего в переднюю камеру. Цвет варьирует от розового до темно-коричневого. При биомикроскопии можно визуализировать собственную сосудистую сеть опухоли (особенно при слабопигментированной форме), а также неравномерный характер пигментации с распылением пигмента вокруг; возможны отсевы опухоли.
Смешанная форма меланомы радужки отличается плоскостным характером роста, отсутствием четких границ, распылением пигмента по поверхности радужной оболочки, возможностью врастания в мышцу, расширяющую зрачок, с изменением его формы. Прогрессирование процесса сопровождается застойными изменениями в сосудах радужки, появлением сателлитов опухоли, помутнением и дислокацией хрусталика, при контакте с роговицей - развитием эпителиально-эндотелиальной дистрофии вследствие токсического воздействия на задний эпителий роговицы.
Анулярная меланома радужки отличается бессимптомным течением и диффузным ростом; нередко первым симптомом бывает повышение внутриглазного давления. При осмотре обращают на себя внимание сглаженность рисунка радужки, которая приобретает шагреневый вид, ригидность зрачка.
Меланома цилиарного тела. Первыми клиническими признаками часто выступают расширение эписклерального сосуда соответственно локализации опухоли. Медленный рост опухоли сопровождается развитием компликатной катаракты, дислокацией хрусталика, прорастанием в угол передней камеры глаза с развитием офтальмогипертензии, отслойкой сетчатки. При осмотре с широким зрачком опухоль коричневого (реже более светлого) цвета визуализируется за хрусталиком.
Меланома хориоидеи. Меланома хориоидеи имеет узловую форму роста или, реже, диффузную.
В начальной стадии роста меланома хориоидеи выглядит как округлый, слегка проминирующий очаг аспидного или желто-коричневого цвета. Часто на поверхности опухоли видны поля оранжевого пигмента липофусцина. По мере роста меланомы в ней появляются собственные сосуды, может усиливаться пигментация. Рост опухоли сопровождается отслойкой сетчатки, возникающей вследствие транссудации из сосудов опухоли. Возможно формирование грибовидной формы опухоли, что нередко сопровождается прорывом мембраны Бруха. Появление на поверхности меланомы единичных или множественных геморрагий, клеточной экссудации в стекловидном теле свидетельствует об агрессивном течении и признаках распада в опухоли.
Диффузная меланома характеризуется распространенным утолщением хорио-идеи, толщина ее обычно не превышает 2,5 мм. Типичны раннее врастание опухоли в зрительный нерв и распространение за пределы склеры.
По степени пигментации различают слабо-, умеренно- и густопигментирован-ные опухоли; редко встречается беспигментный вариант.
Инструментальная диагностика
Используют диафаноскопию, УЗИ глазного яблока и орбиты; ультразвуковую биомикроскопию переднего отрезка глаза; внутривенную ангиографию с флуоресцеином натрия (ФАГ) или индоцианином зеленым (ICG); оптическую когерентную томографию сетчатки (ОКТ); МРТ, КТ орбит с контрастированием. При невозможности установить диагноз неинвазивными методами под наркозом проводят тонкоигольную аспирационную биопсию меланомы хориоидеи (ТИАБ).
Дифференциальная диагностика зависит от характера и локализации процесса.
Меланому радужки следует дифференцировать от невуса, кисты пигментного эпителия и стромальной кисты радужки, мезодермальной дистрофии, опухолей радужки, ювенильной ксантогранулемы, инкапсулированного инородного тела.
Меланому цилиарного тела дифференцируют от других опухолей, прорастающих в цилиарное тело, саркоидоза, кисты пигментного эпителия, катаракты nigra, стафиломы склеры, субконъюнктивального кровоизлияния.
Наиболее часто приходится дифференцировать меланому хориоидеи с такими заболеваниями, как пигментный невус хориоидеи, гемангиома, гранулема, субре-тинальное кровоизлияние и возрастная макулодистрофия.
-
Пигментный невус хориоидеи. Общее: наличие пигментированного очага на глазном дне без проминенции или с небольшой проминенцией, с дистрофическими изменениями на поверхности. Отличительные признаки меланомы: наличие большей проминенции (более 2,5 мм), включений липофусцина, серозная отслойка сетчатки (нейроэпителия), собственная сосудистая сеть в опухоли, характерные ОКТ- и ФАГ-признаки, наличие скотомы в поле зрения.
-
Гемангиома хориоидеи. Общее: наличие под сетчаткой проминирующего очага розового цвета с сероватым оттенком. Отличительные признаки меланомы: отсутствие визуализации сосудов опухоли в хориоидальную фазу при проведении ангиографии, наличие ультразвукового признака экскавации хорио-идеи в основании опухоли.
-
Гранулема хориоидеи. Общее: наличие в области увеального тракта проми-нирующего очага различного цвета и размеров. Отличительные признаки меланомы: отсутствие выраженных признаков воспаления в стекловидном теле и переднем отделе глаза, фибропластического компонента на глазном дне, характерного анамнеза, отличительные ультразвуковые, ОКТ- и ангио-графические признаки.
-
Метастатическое поражение увеальной оболочки. Общее: наличие в области увеального тракта проминирующего очага различного цвета и размеров. Отличительные признаки меланомы: отсутствие «стелющегося» характера роста, вкраплений пигмента типа «следов рыси», наличие онкологического анамнеза, отличительные ультразвуковые, ОКТ- и ангиографические признаки.
Лечение
При лечении увеальной меланомы могут быть использованы отграничивающая лазеркоагуляция (ОЛК), лазерная деструкция опухоли, транспупиллярная термотерапия (ТТТ), дистанционная и контактная лучевая терапия.
Лучевая терапия увеальной меланомы
Возможности конвенциональной дистанционной лучевой терапии ограничены радиорезистентностью меланомы и близостью структур с низкой толерантностью к ионизирующему излучению. Современные технологии лучевой терапии, такие как брахитерапия, ионная и протонная терапия, позволяют подвести высокие дозы и обеспечить высокий локальный контроль с приемлемым риском осложнений.
Брахитерапия - контактное транссклеральное облучение внутриглазной опухоли с применением радиоактивных источников (стронций/иттрий-90, рутений/ родий-106, изотоп йода-125), осуществляется непрерывным способом посредством эписклеральной фиксации офтальмоаппликатора, при выборе которого учитывают мощность излучения и необходимую поглощенную дозу. Adams с соавт. (1988) не отметили достоверных различий выживаемости среди 223 пациентов, получивших брахитерапию, и 416 пациентов с увеальной меланомой, подвергнутых энуклеации.
Показания к брахитерапии: диаметр опухоли до 15 мм, проминенция опухоли до 5,5 мм.
Противопоказания к брахитерапии (абсолютные): превышение указанных размеров опухоли, признаки экстрабульбарного роста, мультицентричный рост опухоли; наличие отдаленных метастазов.
Планирование брахитерапии производят с учетом высоты и максимального диаметра опухоли, ее локализации. С учетом индивидуальных особенностей опухоли рассчитывают время экспозиции для обеспечения подведения к вершине опухоли дозы 130-140 Гр при использовании рутениевых аппликаторов (рис. 7-1) и 200270 Гр при использовании стронциевых аппликаторов.
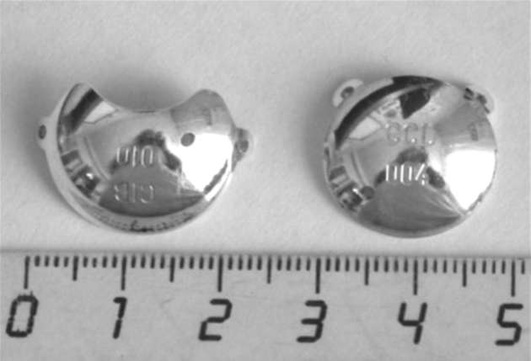
Фиксацию офтальмоаппликатора производят в операционной с применением общего обезболивания при максимальном мидриазе под контролем транспупил-лярной диафаноскопии.
Техника фиксации офтальмоаппликатора. Производят разрез конъюнктивы в квадранте локализации опухоли. Конъюнктива отсепаровывается, возможно наложение лигатур на соседние прямые мышцы (а также пересечение одной из них) для лучшей визуализации основания опухоли. Осуществляют транспупил-лярную диафаноскопию, маркировку границ опухоли (рис. 7-2 на цветной вклейке). Офтальмоаппликатор, соответствующий размерам и локализации опухоли, фиксируют к склере двумя швами, проведенными через его кольца с предварительной маркировкой места наложения швов (рис. 7-3, 7-4 на цветной вклейке). При этом аппликатор должен перекрывать намеченные границы опухоли на 2-3 мм. После фиксации аппликатора на конъюнктиву накладывают непрерывный шов. Под конъюнктиву вводят 0,3 мл раствора дексаметазона. Для ограничения подвижности глазного яблока и снижения возможности смещения аппликатора накладывают асептическую бинокулярную повязку.
Пациент в послеоперационном периоде находится в индивидуальной палате, где ежедневно осуществляется наблюдение в течение всего времени до удаления радиоактивного источника. При необходимости возможно проведение ультразвукового контроля соответствия расположения офтальмоаппликатора основанию опухоли. В случае их несовпадения корректируют дозу облучения или положение аппликатора.
В послеоперационном периоде назначают антибактериальные препараты широкого спектра действия (например, левофлоксацин, моксифлоксацин по 1 капле 3 раза в сутки в течение 5 дней), противовоспалительные (дексаметазон 0,1% по 1 капле 4 раза в сутки в течение 2 нед, диклофенак по 1 капле 3 раза в сутки до 1-3 мес), стимулятор регенерации (Солкосерил* глазной гель по 1 капле 2-3 раза в день 1-2 нед), слезозаместительные препараты (например, гипромеллоза по 1 капле 4 раза в сутки 2-3 нед). По показаниям проводят купирование болевого синдрома: метамизол натрия 50% - 2,0 мл внутримышечно (в/м), либо кетопро-фен 2,0 мл в/м.
При брахитерапии увеальной меланомы с применением офтальмоаппликаторов с радионуклидами рутений-106 + родий-106 начальные проявления лучевых реакций выявляют на 2-3-й день после эписклеральной фиксации офтальмоапплика-тора, максимальной выраженности они достигают на 5-7-й день и купируются к 1,5-2 мес. Интенсивность лучевой реакции зависит от степени выраженности экссудативного (реактивного) процесса и клинически классифицируется следующим образом.
-
Лучевые реакции I степени возникают на 2-3 сутки, максимальной выраженности достигают к 10 дням. Клинические проявления купируются к 1-1,5 мес. При офтальмологическом исследовании наблюдают локальный отек, расширение сосудов конъюнктивы, снижение фотореакции зрачка, наличие клеточной взвеси в стекловидном теле «+», на глазном дне в зоне лучевого воздействия - ограниченный отек сетчатки, неравномерность калибра сосудов сетчатки и увеличение выраженности экссудативной отслойки сетчатки не более чем в одном квадранте глазного дна.
-
Лучевые реакции II степени отличаются более ранним развитием, диффузным отеком периорбитальной клетчатки, возможностью частичного птоза верхнего века, пареза прямой мышцы, распространенным отеком конъюнктивы, нередко с петехиальными кровоизлияниями; могут наблюдаться признаки ирита, клеточная реакция в стекловидном теле увеличивается до «++». На глазном дне наблюдается распространенный отек, субтотальная высокая экссудативная отслойка сетчатки, выраженная неравномерность калибра сосудов сетчатки с единичными паравазальными полосчатыми кровоизлияниями.
-
Лучевые реакции III степени манифестируют на 1-й день облучения, достигают максимальной выраженности в течение первой недели и отличаются затяжным течением (до 2 мес). Клинически проявляются выраженным отеком конъюнктивы и периорбитальной клетчатки, возможным выраженным птозом верхнего века и офтальмоплегией, хемозом, значительным расширением конъюнктивальных сосудов с кровоизлияниями. Клеточная реакция в стекловидном теле повышается до «+». На фоне распространенного отека на глазном дне экссудативная выраженность отслойки сетчатки увеличивается до высокой тотальной или воронкообразной. При этом сосуды сетчатки резко расширены, появляются полосчатые и штрихообразные кровоизлияния.
Ранние осложнения брахитерапии: экссудативная отслойка сетчатки, лучевой васкулит, тромбоз центральной вены сетчатки (при юкстапапиллярных мелано-мах), гемофтальм, лучевой некроз склеры.
Поздние осложнения брахитерапии: ретино- и нейроретинопатия, дегенерация сетчатки в макулярной зоне, катаракта, помутнение стекловидного тела, неоваску-лярная глаукома.
При выраженной лучевой реакции, а также при наличии кровоизлияния в стекловидное тело назначают внутрь нестероидный противовоспалительный препарат (например, нимесулид по 1 таблетке 2 раза в сутки), аскорбиновую кислоту по 1 таблетке 3 раза в день; внутривенно раствор преднизолона или дексаметазона 6-8 мг, местно - дексаметазон в каплях (3-4 раза), дексаметазон под конъюнктиву (0,3 мл).
При выраженном отеке сетчатки используют раствор декстрозы 40% - 10,0 мл внутривенно ежедневно; при офтальмогипертензии - ацетазоламид по 1 таблетке 2-3 раза в течение 3-5 дней, β-адреноблокаторы (инстилляции 0,25% раствора тимолола 1-2 раза в день), ингибиторы карбоангидразы (бринзоламид в инстил-ляциях 1-2 раза в день).
Для лечения меланом хориоидеи с высотой опухоли 5 мм и более используют так называемый метод Sandwich therapy (метод «бутерброда»), заключающийся в применении транспупиллярной термотерапии (ТТТ) и брахитерапии, при этом ТТТ проводят до или после брахитерапии в течение 3-4 мес. По разным данным, полный регресс меланомы хориоидеи получен у 78-97% пациентов при сроках наблюдения от 15 мес до 5 лет. Применение двух разных методик лечения оказывает воздействие как на основание опухоли (брахитерапия), так и на ее верхушку (ТТТ), что обусловливает потенцирование эффекта и возможную результативность применения методики.
Протонная и ионная терапия не имеют ограничений по размерам опухоли и в ряде случаев позволяют избежать энуклеации глазного яблока.
Радиохирургия, выполняемая на аппаратах «Гамма-нож» и «Кибер-нож», теоретически за счет высокой точности подведения дозы при условии отсутствия движений глазного яблока во время облучения может обеспечивать хорошую защиту критических структур глаза, что снижает риск осложнений. Однако показания к этому виду лечения, методика облучения и эффективность нуждаются в дальнейшем научном изучении.
Для лечения диссеминированной меланомы применяют также химиотерапию: дакарбазин (производные нитрозомочевины), препараты платины и винкаалка-лоиды (винбластин) в режиме монотерапии. Однако их эффективность не превышает 9%.
Дакарбазин может быть использован в комбинации с такими препаратами, как цисплатин, винбластин.
Один из методов лечения увеальной меланомы может быть оперативное вмешательство.
Послеоперационные осложнения. После лазерных видов лечения возможно развитие различных осложнений: окклюзии ретинальных сосудов, кровоизлияний (ретинальных, субретинальных, интравитреальных), ретинальной тракции, разрывов, отслойки сетчатки, интравитреальной дисперсии пигмента, катаракты и др.; после локальной эксцизии увеальной меланомы возможно развитие увеита, гемофтальма, субретинальных кровоизлияний, вторичной гипертензии или гипотонии, отслойки сетчатки, осложненной катаракты, субатрофии глаза; энуклеация, экзентерация могут осложниться несостоятельностью послеоперационного шва, лизисом трансплантата, нагноением раны, абсцессом и флегмоной орбиты.
Контролем за эффективностью органосохранного лечения служит комплексное клинико-инструментальное обследование, которое включает исследование органа зрения (биомикроскопия, тонометрия, офтальмоскопия, периметрия, диафано-скопия, внутривенная флуоресцентная ангиография, УЗИ с цветовым допплеров-ским картированием (ЦДК), КТ, в ряде случаев - МРТ.
Осмотр пациента проводят с периодичностью 1 раз в 3 мес в течение первого года после лечения, в течение следующего года - 1 раз в 6 мес с обязательным комплексным УЗИ орбит при каждом посещении, 1 раз в год по показаниям выполняют КТ/МРТ орбит, в последующем наблюдение осуществляют пожизненно с периодичностью 1 раз в год, если течение процесса не требует дополнительного вмешательства. Кроме того, в процессе наблюдения за больным после лечения каждые 6 мес проводят общее клинико-инструментальное обследование с консультацией онколога на предмет исключения генерализации процесса.
На сегодняшний день официально признаны 16 клинико-морфологических критериев прогноза увеальной меланомы. К ним относят размеры, локализацию, тип гистологического строения опухоли, степень склеральной инвазии, наличие или отсутствие очагов эпибульбарного роста, факт соприкосновения края опухоли с диском зрительного нерва или факт распространения опухоли кпереди за экватор, наличие субретинальной жидкости, характер или тип ангиогенеза, показатели клеточной пролиферации (например, митотический индекс), возраст пациента, количество и состав тумор-инфильтрирующих лимфоцитов в строме опухоли, наличие генетических аберраций, характер и спектр экспрессии ассоциированных с меланомой антигенов, уровень экспрессии активаторов и ингибиторов плазминогена и уровень их рецепции. Установлено, что размер опухоли служит одним из наиболее важных клинических маркеров для прогнозирования течения заболевания. Увеличение толщины опухоли, как и увеличение наибольшего диаметра базальной части опухоли, повышает риск развития метастазов. С увеличением толщины опухоли частота встречаемости метастазов повышается с 6% для опухолей толщиной 0-1,0 мм до 51% для опухолей с толщиной более 10,0 мм.
Общая 5-летняя выживаемость больных увеальной меланомой составляет 91%, 10-летняя - 84%, 14-летняя - 79%. Прогноз для жизни при наличии прорастания опухоли за пределы глаза плохой.
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ ОРБИТЫ
Первичные злокачественные опухоли орбиты составляют до 0,1% всех злокачественных опухолей и 20% среди всех первичных опухолей орбиты. Мужчины и женщины болеют одинаково часто. Опухоли встречаются в различном возрасте, более 42% приходится на трудоспособный возраст. В последние годы прослеживается тенденция к «омоложению» злокачественных новообразований орбиты - до 25% возникают в возрасте до 20 лет.
Этиология неизвестна. Многообразие тканевых структур глазницы определяет полиморфность их гистогенеза и различную степень злокачественности.
Общие жалобы для большинства первичных злокачественных опухолей орбиты: выстояние и ограничение подвижности глазного яблока (экзофтальм), двоение (диплопия), опущение верхнего века (птоз), умеренный болевой синдром. Преимущественно процесс односторонний. Как правило, симптоматика нарастает быстро.
При осмотре выявляют отек верхнего века, птоз, односторонний экзофтальм, иногда со смещением, затруднение репозиции глазного яблока, ограничение объема движений глазного яблока вплоть до полной офтальмоплегии.
В процессе диагностики используют экзофтальмометрию; пальпацию края орбиты; биомикроскопию, пальпацию региональных лимфатических узлов.
Карцинома слезной железы характеризуется быстрым ростом, клиническая картина нарастает за 3-6 мес. Чаще заболевание возникает у женщин. Развитие возможно в любом возрасте. Поражение одностороннее. Характерны экзофтальм со смещением (книзу и кнутри), болевой синдром. При пальпации в верхненаружном квадранте орбиты определяется плотная бугристая опухоль, несмещаемая. Движения глазного яблока ограничены. Репозиция резко затруднена. Характерно раннее метастазирование в регионарные лимфатические узлы.
Саркомы орбиты - наиболее часто встречаемые опухоли (до 1/3) в детском возрасте, источником развития их может быть любая ткань. В орбите встречают ангиосаркомы, лейомиосаркомы, нейросаркомы, липосаркомы, фибросаркомы, остео-саркомы и т.д.
Крайне агрессивное течение имеет рабдомиосаркома. Болеют чаще молодые пациенты (возраст до 25 лет). Источник роста опухоли - клетки скелетных мышц. Одностороннее поражение сопровождается выраженным экзофтальмом со смещением, птозом, ограничением движений глазного яблока, затруднением репозиции, болевым синдромом. При пальпации опухоль чаще локализуется в верхневнутреннем квадранте орбиты, плотная, бугристая, несмещаемая. Характерен лагофтальм с выраженным хемозом. При выраженном экзофтальме возникают изменения на роговице вплоть до ее полного расплавления. На глазном дне - застойный диск зрительного нерва. Возможно прорастание в соседние анатомические структуры (инвазия в костные структуры, синусы, интракраниальный рост).
Злокачественная неходжкинская лимфома орбиты - наиболее частая злокачественная опухоль орбиты. В большинстве случаев заболевание представлено В-клеточной лимфомой низкой степени злокачественности. Поражаются одна или обе орбиты. Характерны безболезненный экзофтальм, иногда со смещением глазного яблока, отек периорбитальных тканей. При поражении передних отделов орбиты можно пальпировать чаще гладкую поверхность опухоли плотной консистенции. В одной или обеих орбитах может располагаться несколько опухолей, особенно часто при поражении лимфомой других органов и тканей. При прогрессировании процесса в орбите развивается хемоз, становится невозможной репозиция глазного яблока, характерны изменения на глазном дне (застой диска зрительного нерва), снижается острота зрения.
При обследовании больных опухолями орбиты проводят, помимо стандартных лабораторных исследований, включающих общий анализ крови, общий анализ мочи и биохимическое исследование крови, ряд специальных исследований по показаниям: УЗИ, КТ и МРТ орбит; рентгенографию орбит.
Для получения клеточного материала опухоли для цитологического и иммуно-цитохимического исследования проводят ТИАБ.
Обязательное условие для проведения ТИАБ - точная топометрия патологического очага в орбите с использованием УЗИ, КТ или МРТ.
Один из видов пункционной морфологической диагностики новообразований орбиты - трепанобиопсия. Она позволяет получить фрагмент опухолевой ткани и провести ее морфологическое исследование, включая иммуногистохимический анализ.
Лечение
Лечение злокачественных опухолей орбиты, как правило, комбинированное или комплексное. План лечения разрабатывают с учетом индивидуальных анатомо-топографических особенностей орбиты, размеров опухоли, ее типа и степени инвазии в орбитальные ткани, состояния костных стенок, регионарных лимфатических узлов, наличия отдаленных метастазов. Предпочтение должно быть отдано органосохранному лечению. Выжидательная тактика недопустима.
Лучевая терапия злокачественных опухолей орбит проводится в соответствии с принципами лечения конкретной морфологической формы и стадии заболевания. Лучевую терапию следует проводить с применением современных технологий, обеспечивающих точное подведение дозы излучения и защиту органов риска (3D-конформная лучевая терапия, лучевая терапия с модуляцией интенсивности, стереотаксическая лучевая терапия, протонная терапия).
Радиотерапию проводят как этап комплексного лечения с консолидирующей целью или как метод выбора при локализованных первичных лимфомах орбит; с радикальной целью при небольших отграниченных опухолях и отказе от операции; с паллиативной целью при местнораспространенной нерезектабельной опухоли.
Послеоперационная лучевая терапия показана после органосохраняющих операций при высоком риске рецидива; после экзентерации орбиты при наличии роста опухоли по краю резекции.
Значение суммарной дозы определяется принципами лечения данной морфологической формы и стадией заболевания.
Режим фракционирования дозы определяется применяемой технологией, прогнозом и риском осложнений. При благоприятном прогнозе предпочтительно стандартное фракционирование, при распространенном и метастатическом процессе - гипофракционирование.
Перед планировочной КТ и при каждом сеансе облучения выполняют фиксацию головы подголовником и термопластической маской.
Клинический объем (CTV) включает визуализируемую при КТ/МРТ опухоль с отступом 1-2 см, соответствующим зоне субклинического распространения с учетом анатомических барьеров, ограничивающих рост опухоли.
При послеоперационной лучевой терапии CTV включает ложе опухоли, визуализируемое по дооперационным КТ-сканам и рентгеноконтрастным меткам при его маркировке во время операции.
Планируемый объем (РTV) включает клинический объем с отступом, учитывающим возможные погрешности и смещения.
При дозиметрическом планировании необходимо учитывать максимальные допустимые дозы на органы риска, недопустимо превышение значения толерантных доз для глазного яблока, хрусталика и зрительного нерва противоположной опухоли стороны.
Максимальные допустимые дозы на органы риска в соответствии с параметрами оптимизации QUANTEC при облучении опухолей орбит составляют:
При наличии резектабельной опухоли показано оперативное вмешательство.
Химиотерапия при саркоме орбиты - основной метод лечения при диссе-минированном процессе. Наиболее часто используют доксорубицин, ифосфамид и дакарбазин. У пациентов моложе 65 лет при общем удовлетворительном состоянии возможно проведение комбинированного лечения ифосфамид + доксоруби-цин. При ангиосаркомах наиболее эффективны таксаны.
В качестве препаратов второй линии используют доцетаксел и гемцитабин, комбинация которых наиболее эффективна.
Диспансерное наблюдение онколога осуществляют 1 раз в 3 мес в течение первого года после лечения, 1 раз в 6 мес в течение второго года, затем 1 раз в год пожизненно (если течение процесса не требует изменения тактики ведения) с контрольными исследованиями (УЗИ орбит, органов брюшной полости, рентгенография органов грудной клетки), по показаниям - КТ (МРТ) орбит с контрастированием, ПЭТ-КТ.
При саркомах орбиты прогноз для жизни и зрения плохой. Нередко возникает рецидив опухоли в относительно короткие сроки. Комплексное лечение рабдомио-саркомы орбиты в начальных стадиях позволяет достичь 5-летней выживаемости у 83% пациентов. При раке слезной железы прогноз для жизни пациентов весьма серьезный. По разным данным, смертность достигает 45-70%, а 5- и 10-летняя выживаемость составляют 45 и 25% соответственно. При лимфоме орбиты прогноз для жизни и зрения относительно благоприятный: 80-85% пациентов переживают 5-летний период.
Литература
-
Бровкина А.Ф. Болезни орбиты. - М.: Медицина, 1993. - 240 с.
-
Бровкина А.Ф. Болезни орбиты: руководство для врачей. - 2-е изд. - М.: Медицинское информационное агентство, 2008. - 256 с.
-
Бровкина А.Ф. Лучевая терапия в лечении опухолей органа зрения // РМЖ. Клиническая офтальмология. - 2003. - № 1. - С. 15-20.
-
Бровкина А.Ф. Офтальмоонкология. - М.: Медицина, 2002. - 424 с.
-
Бровкина А.Ф., Амирян А.Г., Лелюк В.Г. Роль высокочастотного дуплексного сканирования в дифференциальной диагностике увеальных меланом и отграниченных гемангиом хориоидеи // Вестн. офтальмол. - 2005. - № 6. - С. 3-5.
-
Бровкина А.Ф., Гришина Е.Е., Яценко О.Ю., Андрейченко А.М. Первый опыт лечения Ингароном меланомы конъюнктивы // Опухоли головы и шеи. - 2012. - № 2. - С. 9-12.
-
Бровкина А.Ф., Панова И.Е., Саакян С.В. Офтальмоонкология: новое за последние два десятилетия // Вестн. офтальмол. - 2014. - № 6. - С. 13-19.
-
Буйко А.С. 10-летний опыт радиотерапии увеальных меланом стадии Т3 - результаты и показатели выживаемости больных // Опухоли и опухолеподобные заболевания органа зрения. - М., 1998. - С. 86-88.
-
Буйко А.С. Злокачественные эпителиальные опухоли кожи век - встречаемость, факторы риска, классификация, диагностика, методы лечения и их результативность // Офтальмол. журн. - 2009. - № 1-2. - С. 49-59.
-
Важенин А.В., Панова И.Е. Избранные вопросы онкоофтальмологии. - М.: Изд-во РАМН, 2006. - 156 с.
-
Волгин В.Н., Соколова Т.В. Особенности течения базально-клеточного рака кожи в современных условиях // Врач. - 2009. - № 2. - С. 6-9.
-
Ганцев Ш.Х., Юсупов А.С. Плоскоклеточный рак кожи // Практ. онкол. - 2012. - Т. 13. - № 2. - С. 80-91.
-
Диагностика и тактика лечения злокачественных опухолей орбиты: клинические рекомендации. - М.: Ассоциация врачей-офтальмологов, 2015. - URL: http://avo-portal.ru/doc/fkr (дата обращения: 29.08.2016).
-
Диагностика увеальной меланомы и основные принципы ее лечения. Клинические рекомендации. М.: Ассоциация врачей-офтальмологов, 2015 г. - URL: http://avo-portal.ru/doc/fkr (дата обращения: 25.08.2016).
-
Ермаков А.В. Меланомы кожи: современные принципы ранней диагностики и профилактики // Онкология. - 2014. - Т. 2. - № 3. - С. 100-108.
-
Линник Л.Ф., Магарамов Д.А., Яровой А.А. и др. Лазерная транспупиллярная термотерапия меланом хориоидеи // Офтальмохирургия. - 2002. - № 3. - С. 45-50.
-
Лихванцева В.Г., Анурова О.А. Опухоли век: клиника, диагностика, лечение. - М.: ГЭОТАР-Медиа, 2007. - 448 с.
-
Мустафина Ж.Г., Долматова И.А., Сарсембекова К.Т. Значение магнитно-резонансной томографии в диагностике новообразований орбиты // Достижения и перспективы офтальмологии: сб. тр. юбил. науч.-практ. конф. - М., 2001. - С. 73-75.
-
Онкология: клинические рекомендации / Под ред. В.И. Чиссова, С.Л. Дарьяловой. - М.: ГЭОТАР-Медиа, 2007. - 720 с.
-
Онкология: национальное руководство / Под ред. В.И. Чиссова, М.И. Давыдова. - М.: ГЭОТАР-Медиа, 2008. - 1072 с.
-
Офтальмология: национальное руководство. Краткое издание / Под ред. С.Э. Аветисова, Е.А. Егорова, Л.К. Мошетовой, В.В. Нероева, Х.П. Тахчиди. - М.: ГЭОТАР-Медиа, 2014. - 736 с.
-
Панова И.Е., Сусло И.С., Кученкова И.А. Сравнительная клинико-морфологиче-ская характеристика базально-клеточного рака кожи век при первично-множественном и изолированном поражениях // Опухоли головы и шеи. - 2011. - № 4. - С. 54-57.
-
Полякова С.И. Дифференциальная диагностика новообразований слезной железы лимфоидного генеза // Офтальмол. журн. - 2000. - № 3. - С. 16-22.
-
Полякова С.И. Современные возможности диагностики новообразований слезной железы // Опухоли и опухолеподобные заболевания органа зрения: тез. науч.-практ. конф. с междунар. участием. - М., 1998. - С. 39.
-
Пустынский И.Н. Современная стратегия лечения больных базально-клеточным и плоскоклеточным раком кожи головы и шеи: дис. … д-ра мед. наук. - М., 2014. - 284 с.
-
Регенеративная хирургия / Под ред. Э.Р. Мулдашева. - Уфа: Башкортостан, 2014. - 432 с.
-
Семилетова Ю.В., Анисимов В.В., Вагнер Р.И. Лечение больных первичной меланомой кожи. Современное состояние проблемы // Сибир. онкол. журн. - 2010. - № 4. - С. 71-77.
-
Adams K.S., Abramson D.H., Ellsworth R.M., Haik B.G. et al. Cobalt plaque versus enucleation for uveal melanoma: comparison of survival rates // Br. J. Ophthalmol. - 1988. - Vol. 72. - P. 494-497.
-
Avril M.F., Auperin A., Margulis A. et al. Basal cell carcinoma at the face: surgery or radiotherapy? Results of a randomized study // Br. J. Cancer. - 1997. - Vol. 76. - P. 100-106.
-
Blum E.S., Yang J., Komatsubara K.M. et al. Clinical management of uveal and conjunctival melanoma // Oncology (Williston Park). - 2016. - Vol. 30. - N.1.- P. 29-32, 34-43, 48.
-
Buljan M., Bulat V., Situm M. et al. Variations in clinical presentation of basal cell carcinoma // Acta Clin. Croat. - 2008. - Vol. 47. - N. 1. - P. 25-30.
-
Char D.H., Kroll S.M., Castro J. Ten-year follow-up of helium ion therapy for uveal melanoma // Am. J. Ophthalmol. - 1998. - Vol. 125. - P. 81.
-
Damato B.E., Heimann H., Kalirai H., Coupland S.E. Age, survival predictors, and metastatic death in patients with choroidal melanoma: tentative evidence of a therapeutic effect on survival // JAMA Ophthalmol. - 2014. - Vol. 132. - N. 5. - P. 605-613.
-
Damato B.E., Jager M.J., Desjardins L., Kivela T. et al. Local resection of uveal melanoma. In: Current Concepts in Uveal Melanoma. 1st ed. - Basel: Karger, 2011. - P. 66-80.
-
Eibl-Lindner K. et al. Robotic radiosurgery for the treatment of medium and large uveal melanoma // Melanoma Res. - 2016. - Vol. 26. - N. 1. - P. 51-57.
-
Fard A.M., Pourafkari L., Nader N.D. Conjunctival squamous cell carcinoma // N. Z. Med. J. - 2015. - Vol. 128. - N. 1422. - Р. 69.
-
Frakulli R. et al. Brachytherapy in non-melanoma skin cancer of eyelid: a systematic review // Contemp. Brachyther. - 2015. - Vol. 7. - N. 6. - P. 497-502.
-
Freier J.E. et al. Eye and orbit and ocular // Principles and Practice of Radiation Oncology. 5th ed. / Eds C.A. Perez et al. - Philadelphia, 2008. - P. 890.
-
Frucht-Pery J., Rozenman Y., Pe’er J. Topical mitomycin-C for partially excised conjunctival squamous cell carcinoma // Ophthalmology. - 2002. - Vol. 109. - N. 3. - P. 548-552.
-
Fusting B.H., Feucht M., Richard G. Transpupillary Thermotherapy of malignant choroidal melanoma - follow up after 15 months // Invest. Ophthalmol. Vis. Sci. - 2003. - Vol. 44. ARVO E-Abstract 4974.
-
Giordano Resti A., Sacconi R., Baccelli N. et al. Outcome of 110 basal cell carcinomas of the eyelid treated with frozen section-controlled excision: mean follow-up over 5 years // Eur. J. Ophthalmol. - 2014. - Vol. 24. - N. 4. - P. 476-482.
-
Gunduz K., Esmaeli B. Diagnosis and management of malignant tumors of the eyelid, conjunctiva and orbit // Expert Rev. Ophthalmol. - 2008. - Vol. 3. - N. 1. - P. 63-75.
-
Kearsley J.H., Fitchew R.S., Taylor R.G. Adjunctive radiotherapy with strontium-90 in the treatment of conjunctival squamous cell carcinoma // Int. J. Radiat. Oncol. Biol. Phys. - 1988. - Vol. 119. - P. 435-443.
-
Keunen J.E., Bartlema Y.M., Journe-de Korver J.G. et al. Five year follow-up of 50 patients with choroidal melanoma after combined treatment with brachytherapy and transpupillary thermotherapy // Invest. Ophthalmol. Vis Sci. - 2001. - Vol. 42. - N. 4. - P. 109. ARVO Abstract 594.
-
Khong J.J., Muecke J. Complications of mitomycin C therapy in 100 eyes with ocular surface neoplasia // Br. J. Ophthalmol. - 2006. - Vol. 90. - N. 7. - P. 819-822.
-
Kirkegaard M.M., Coupland S.E., Prause J.U., Heegaard S. Malignant lymphoma of the conjunctiva // Surv. Ophthalmol. - 2015. - Vol. 60. - N. 5. - P. 444-458.
-
Knani L., Romdhane O., Ben Rayana N. et al. Clinical study and risk factors for recurrence of basal cell carcinoma of the eyelid: results of a Tunisian series and review of the literature [Article in French] // J. Fr. Ophtalmol. - 2014. - Vol. 37. - N. 2. - P. 107-114.
-
Marigo F.A., Finger P.T., Mc Cormick S.A. et al. Iris and ciliary body melanomas: ultrasound biomicroscopy with histopathologic correlation // Arch. Ophthalmol. - 2000. - Vol. 118. - N. 11. - P. 1515-1521.
-
McCaffery S., Simon E., Fischbein Т. Three-dementional high-resolution magnetic resonance imaging of ocular and orbital malignancies // Arch. Оphthalmol. - 2002. - Vol. 120. - N. 6. - Р. 352-356.
-
Midena E., Pilotto E., de Belvis V. et al. Choroidal vascular changes after transpupillary thermotherapy for choroidal melanoma // Ophthalmology. - 2004. - Vol. 110. - P. 2216-2222.
-
Prabhakaran V.C., Gupta A., Huilgol S.C. et al. Basal cell carcinoma of the eyelids // Compr. Ophthalmol. Update. - 2007. - Vol. 8. - N. 1. - P. 1-14.
-
Schallenberg M., Niederdräing N., Steuhl K.P., Meller D. Topical mitomycin C as a therapy of conjunctival tumours // Ophthalmology. - 2008. - Vol. 105. - N. 8. - P. 777-784.
-
Shields C.L., Cater J., Shields J.A. et al. Combined plaque radiotherapy and transpupillary thermotherapy for choroidal melanoma: tumor control and treatment complications in 270 consecutive patients // Arch. Ophthalmol. - 2002. - Vol. 120. - N. 7. - P. 933-940.
-
Shields J.A., Shields C.L. Introocular Tumors: Atlas and Textbook. - Philadelphia: W.B. Saunders, 1992. - 539 p.
-
Singh A.D., Eagle R.C., Shields C.L. et al. Enucleation following transpupillary thermotherapy of choroidal melanoma: clinicopathologic correlations // Arch. Ophthalmol. - 2003. - Vol. 121. - N. 3. - P. 397-400.
-
Ullman S., Augburger J.J., Brady L.W. Fractionated epibulbar I-125 plaque radiotherapy for recurrent mucoepidermoid carcinoma of the bulbar conjunctiva // Am. J. Ophthalmol. - 1995. - Vol. 119. - P. 102-103.
-
Мооу С.М. De Yong PTVM. Prognostic parameters in uveal melanoma: a review // Surv. Opthalmol. - 1996. - Vol. 41. - P. 215-228.