Терапевтическая радиология
Терапевтическая радиология : национальное руководство / Каприн А. Д. , Мардынский Ю. С. - Москва : ГЭОТАР-Медиа, 2018. - 704 с. - ISBN 978-5-9704-4658-4 |
Аннотация
Национальное руководство по терапевтической радиологии содержит достоверную современную информацию об основных способах диагностики и лучевой терапии новообразований различной локализации и неопухолевых заболеваний. Впервые значительное внимание в книге уделено проблемам модификации радиочувствительности опухоли и здоровых тканей, радионуклидной, фотодинамической, адронной терапии, лучевому патоморфозу злокачественных новообразований, токсическим последствиям лучевой терапии.
В подготовке настоящего издания в качестве авторов-составителей и рецензентов участвовали ведущие специалисты в области лучевой терапии.
Руководство предназначено онкологам, онкорадиологам, врачам смежных специальностей, интернам, ординаторам и аспирантам по профильной специальности.
Богатырева Т.И., Павлов В.В.
Коды классической лимфомы Ходжкина по МКБ-10:
лимфоцитарное преобладание - С81.0; нодулярный склероз - С81.1; смешанно-клеточный вариант - С81.2; лимфоидное истощение - С81.3; другие формы - С81.7; лимфома Ходжкина БДУ - С81.9.
Соотношение различных гистологических вариантов классической лимфомы Ходжкина отличается относительной стойкостью. По нашим данным, отмечена следующая частота вариантов: лимфоцитарное преобладание - 3%, нодулярный склероз I типа - 48%, нодулярный склероз II типа - 14%, смешанноклеточный вариант - 27%, лимфоидное истощение - 4%. Неклассифицируемые случаи составили 4%.
Заболеваемость классической лимфомой Ходжкина в России и развитых странах составляет 2-3 случая на 100 тыс. населения в год, смертность достигает 0,77 случая на 100 тыс. населения.
Больные лимфомой Ходжкина составляют 20-30% числа всех заболевших злокачественной лимфомой. Мужчины болеют несколько чаще женщин. Болезнь имеет бимодальное возрастное распределение c пиками в возрасте 25-30 и после 60 лет. До середины XX в. лимфому Ходжкина считали фатальным заболеванием. В настоящее время благодаря развитию методов лучевой и лекарственной терапии 80-90% больных с впервые установленным диагнозом могут рассчитывать на излечение.
Термин «лимфома Ходжкина» был введен ВОЗ в 2001 г. после установления моноклонального происхождения опухолевых клеток при этом заболевании и заменил ранее принятые названия (болезнь Ходжкина, лимфогранулематоз). Лимфома Ходжкина представляет собой В-клеточную лимфому с выраженным реактивным полиморфноклеточным микроокружением. В классификации ВОЗ 2008 г. на основе молекулярных и иммунологических методов выделяют классическую лимфому Ходжкина, которая составляет до 95% всех случаев и объединена общим иммунофенотипом (CD15+, CD30+, CD20±). Около 5% случаев представлены нодулярной лим-фомой Ходжкина с лимфоидным преобладанием, имеющей иной иммунофенотип (CD15-, CD30-, CD20+, CD45+).
Диагноз устанавливают по биопсированному лимфатическому узлу, редко - по биоптату из экстралимфатического очага. При гистологическом исследовании патогномоничными для классической лимфомы Ходжкина считают двуядерные клетки
Березовского-Рид-Штернберга. Для нодулярной лимфомы Ходжкина с лимфоид-ным преобладанием диагностическими служат опухолевые LP-клетки.
Особенность классической лимфомы Ходжкина состоит в том, что в очаге поражения доля злокачественных клеток не превышает 0,1-1%; они расположены среди реактивного клеточного микроокружения, которое представлено лимфо-идными клетками, гистиоцитами, эозинофилами, плазмоцитами, макрофагами, фибробластами и другими клетками. С учетом выраженности и характера фиброза, особенностей реактивного клеточного фона, а также количества и морфологии опухолевых клеток выделяют четыре гистологических варианта классической лимфомы Ходжкина, что нашло отражение в кодах МКБ.
Единой концепции этиологии и патогенеза лимфомы Ходжкина в данное время не существует. Множество исследований, посвященных оценке риска возникновения и развития заболевания в зависимости от разнообразных факторов инфекционного, генетического, социоэкономического или гигиенического характера, позволяют предположить, что этот диагноз, несмотря на единый фенотип классической лимфомы Ходжкина, объединяет группу заболеваний.
Прослежена генетическая предрасположенность: родственники больных первой степени родства имеют 5-кратный риск болезни, а однояйцовый близнец заболевшего - 99-кратный риск. Предполагают, что генетический риск заболевания лимфомой Ходжкина реализуется через генетически детерминированный уровень секреции интерлейкина-6. Повышенный риск заболевания имеют также лица со снижением иммунитета вследствие ВИЧ-инфекции, врожденного или приобретенного в результате цитостатической терапии иммунодефицита.
В 70% случаев болезнь начинается с шейной лимфоаденопатии. При естественном течении заболевания процесс способен длительно (порою годами) распространяться в пределах лимфатической системы за счет путей физиологической рециркуляции лимфоцитов и вовлекать все новые и новые группы лимфатических узлов.
Когда первичной локализацией заболевания становятся лимфатические узлы средостения (до 15% случаев), от появления первых признаков до установления диагноза нередко проходит до 1-1,5 года.
Относительно редко (до 7% случаев) лимфома Ходжкина манифестирует поражением паховых или абдоминальных лимфатических узлов. При бессимптомном течении процесс может продвигаться в направлении наддиафрагмальной области, захватывая последовательно новые группы лимфатических коллекторов, пока не проявится поражением шейных или подмышечных лимфатических узлов, позволяющим заподозрить болезнь. Подобные случаи характерны для смешанно-клеточного варианта лимфомы Ходжкина у мужчин.
Появление так называемых Б-симптомов (лихорадка, ночные поты, необъяснимая потеря веса) ускоряет обращение в лечебное учреждение пациентов с лимфа-денопатией в той или иной области. Наличие как минимум одного из системных симптомов дает основания подозревать более продвинутую стадию заболевания. Жалобы на кожный зуд различной степени интенсивности, вплоть до нестерпимого, предъявляют до 10% больных, не имеющих Б-симптомов, и 30% пациентов с Б-симптомами. Изредка встречается характерный для лимфомы Ходжкина симптом болей в пораженных лимфатических узлах после приема алкоголя.
Клеткам лимфомы Ходжкина свойственна активная секреторная деятельность. Комбинации цитокинов и других факторов, вырабатываемых клетками опухоли и ее микроокружения, в значительной мере предопределяют разнообразие морфологической и клинической картины классической лимфомы Ходжкина (табл. 28-1).
| Цитокины | Клинико-биологические эффекты |
|---|---|
ФНО, ЛТ-α, ИЛ-1, ИЛ-6 |
Б-симптомы (повышение температуры тела поти потеря веса) |
ТРФ-β, ФИЛ, ТФРИЛ-1, ФНО |
Склероз |
ИЛ-5, ГМ-КСФ, ИЛ-2, ИЛ-3 |
Эозинофилия |
ИЛ-6, ИЛ-11 |
Плазмоцитоз |
ИЛ-6, ИЛ-11, ФИЛ |
Тромбоцитоз |
ТРФ-β, ИЛ-10 |
Иммунодефицит |
М-КСФ |
Повышение активности щелочной фосфатазы |
ИЛ-8, ФНО, ТРФ-β |
Накопление и активация нейтрофилов |
ИЛ-1, ИЛ-6, ИЛ-11, ФИЛ |
Острая фаза воспаления |
ИЛ - интерлейкин, ФНО - фактор некроза опухоли, ТРФ - трансформирующий ростковый фактор, ФИЛ - фактор, ингибирующий лейкоз, М-КСФ - колониестимулирующий фактор макрофагов, ГМ-КСФ - гранулоцитарно-макрофагальный колониестимулирующий фактор.
Система стадирования Ann Arbor для больных с впервые установленным диагнозом лимфомы Ходжкина разработана 60 лет назад для удобства планирования и проведения лучевой терапии; в модификации Cotswold (Котсуолд, 1989 г.) она сохраняет свое значение для регистрации степени распространения заболевания в пределах лимфатической системы (I-II стадии - поражение лимфатических коллекторов по одну сторону диафрагмы, III стадия - по обе стороны). Распространению на органы (IV стадия) обычно предшествует манифестация процесса в соответствующих регионарных группах лимфатических узлов.
При формулировании диагноза лимфомы Ходжкина обязательно указание гистологического варианта и особенностей иммунофенотипа ввиду необходимости дифференциальной диагностики с другими CD30-позитивными лимфомами. При рецидиве рекомендовано проведение повторной биопсии, особенно при проявлениях болезни, не характерных для лимфомы Ходжкина.
Первичное обследование больного лимфомой Ходжкина решает следующие задачи:
-
получение данных о распространении процесса на момент установления диагноза;
-
выявление факторов неблагоприятного прогноза для выбора соответствующей прогностической (лечебной) группы;
-
оценка соматического статуса с точки зрения возможных ограничений при назначении лечения и подборе необходимой сопроводительной терапии.
Лабораторные исследования в процессе диагностики включают: развернутый анализ крови, определение скорости оседания эритроцитов (СОЭ), биомаркеров (альбумин, β2-микроглобулин, ЛДГ, гамма-глутамилтранспептидаза, С-реактивный белок, сывороточное железо, ферритин) и показателей функций печени и почек, проведение серологических тестов на ВИЧ, гепатиты В и С, RW.
Инструментальные методы исследования включают: цифровую рентгенографию, УЗИ, КТ, ПЭТ.
Согласно рекомендациям Международной группы по лучевой терапии в лечении лимфом ILROG, к проведению диагностической (стадирующей) КТ или ПЭТ-КТ необходимо привлекать не только гематологов-онкологов, но и радиотерапевта, особенно при ранних стадиях заболевания.
К дополнительным методам обследования при необходимости относят: сцин-тиграфию костей скелета с 99п1Тс; МРТ, билатеральную (слепую) трепанобиопсию подвздошной кости.
Среди функциональных исследований следует отметить эхокардиографию и исследование функции внешнего дыхания.
Определение прогностической (терапевтической) группы
По итогам клинического обследования определяют прогностическую группу, к которой должен быть отнесен больной для прохождения лечения. В последние десятилетия при всех стадиях лимфомы Ходжкина приоритет отдают комбинированному (полихимиолучевому) лечению. Разработана и оценена в рандомизированных исследованиях система прогностических групп, позволяющая выбирать оптимальный объем лекарственной и лучевой терапии.
Прогностические группы при лимфоме Ходжкина стадии. В Российских клинических рекомендациях по диагностике и лечению лимфопролиферативных заболеваний 2016 г. на усмотрение практических врачей предложено два варианта факторов неблагоприятного прогноза для выбора терапии при лимфоме Ходжкина: рекомендации Германской группы по изучению лимфомы Ходжкина (GHSG - German Hodgkin’s Lymphoma Study Group) и рекомендации Группы по изучению лимфом у взрослых Европейской организации по изучению и лечению рака (EORTC/GELA - European Organization for Research and Treatment of Cancer/Groupe d’Etude des Lymphomes de l’Adult). Аналогичным образом представлены и рекомендации Европейского общества медицинской онкологии ESMO (The European Society for Medical Oncology).
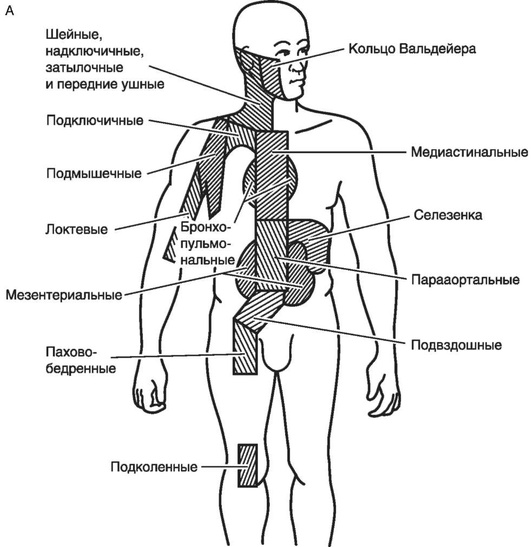
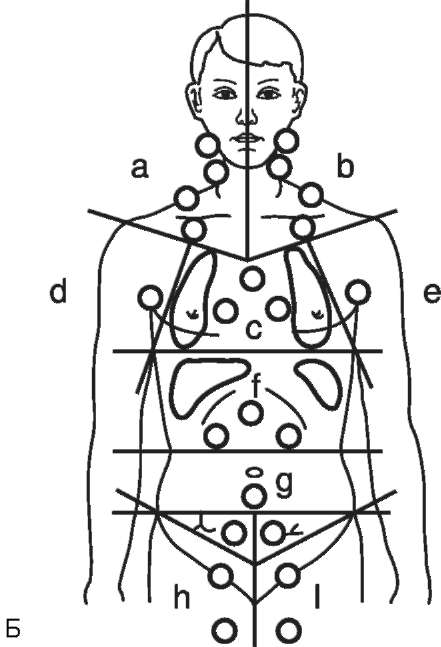
К общепринятым факторам риска отнесены: массивное поражение средостения (Х); локализованное экстранодальное поражение - подстадия Е (GHSG); возраст ≥50 лет (EORTC/GELA); СОЭ >30 мм/ч при подстадии Б и СОЭ >50 мм/ч при подстадии А; вовлечение ≥3 областей лимфатических коллекторов (GHSG) или ≥4 областей (EORTC/GELA) (рис. 28.1).
Больные лимфомой Ходжкина I-II стадий, не имеющие перечисленных факторов риска, получают лечение по программе для ранних стадий с благоприятным прогнозом, а остальные - по протоколам для ранних стадий с неблагоприятным прогнозом. Германская группа GHSG выделяет в отдельную категорию больных лимфомы Ходжкина IIБХЕ-стадии с наличием массивного поражения средостения (Х) и локализованного экстранодального поражения (подстадия Е), относя их к лечебной группе для распространенных стадий.
Трактовка факторов риска у больных лимфомой Ходжкина I-II стадий сопровождается некоторыми сложностями. Термин «зона» (region) был предложен для учета вовлеченных лимфатических коллекторов с целью установления стадии заболевания в соответствии с Анн-Арборской классификацией (1971 г.) и послужил основой для формирования стандартных полей при разработке методики радикальной лучевой терапии. Понятие «область» (area) было введено GHSG для формирования прогностических групп; одна область включает несколько функционально смежных зон (regions), как пораженных, так и не пораженных (рис. 28-1).
Массивное поражение лимфатических узлов (прежде всего, медиастинальных) сохраняет свою значимость как важнейший фактор, влияющий на выбор лечения и его результат. Вместе с тем метод расчета индекса Х отличается в Европе и США, что привносит разночтения в интерпретацию этого показателя и может повлиять на принятие решений по конкретному пациенту. На конференции 1989 г. в Котсуолде, где был введен индекс Х, рекомендовалось подсчитывать отношение поперечного размера опухоли на рентгенограмме к диаметру грудной клетки на уровне ThV-ThVI (медиастино-торакальный индекс, или МТИ) и считать величину МТИ >0,33 признаком массивного (bulky) поражения. В настоящее время с учетом разработок Европейской группы лимфом (EORTC) фактором риска считают МТИ ≥0,35. В США и Канаде принято подсчитывать индекс MMR (отношение максимального диаметра опухоли на прямой рентгенограмме грудной клетки к максимальному внутриторакальному диаметру грудной клетки над диафрагмой) и считать фактором риска MMR ≥0,33; аналогичный подсчет используется Германской группой. Поскольку у конкретного больного величина индекса зависит от знаменателя, прогностические значимости МТИ ≥0,35 и MMR ≥0,33 практически совпадают. В то же время использование в качестве фактора риска величины МТИ ≥0,33 может способствовать необоснованному назначению более интенсивной терапии.
Прогностические группы при лимфоме Ходжкина III-IV стадий. Больных с III и IV стадией принято объединять в группу распространенных стадий; в протоколах Германской группы лечения лимфомы Ходжкина (GHSG) к ним относят также стадию IIБХЕ. Для распространенных стадий разработан международный прогностический индекс (МПИ). Неблагоприятный прогноз связывают с МПИ ≥4 или МПИ ≥3 (табл. 28-2).
| Концентрация альбумина <40 г/л |
|---|
Концентрация гемоглобина <105 г/л |
Мужской пол |
Возраст старше 45 лет |
IV стадия |
Число лейкоцитов >15х109/Л |
Число лимфоцитов <8% или <0,6х109/Л |
Современные международные стандарты комбинированной терапии при первичной лимфоме Ходжкина опираются на доказательную базу, полученную в рамках многолетних клинических и рандомизированных исследований со сроками наблюдения 10-15 лет и сохраняют свое значение в условиях, когда ПЭТ-КТ не проводилась или недоступна.
Рекомендуемые схемы лечения предусматривают проведение, в зависимости от прогностической группы, от 2-4 до 6-8 циклов полихимиотерапии. При меньшем количестве циклов дозой 30 Гр облучают все зоны исходного поражения, при большем - только остаточные очаги размером более 2,5 см. При ранних стадиях используют преимущественно 4-компонентную полихимиотерапию по схеме ABVD (доксорубицин, блеомицин, винбластин, дакарбазин). Выбор схемы при распространенных (поздних) стадиях зависит от исторически сложившихся предпочтений.
В 2013 г. были выпущены первые Российские клинические рекомендации по диагностике и лечению лимфомы Ходжкина, составленные при участии экспертов Национальной всеобщей раковой сети США (NCCN), в которых с целью снижения токсичности индукционной химиотерапии при распространенных стадиях заболевания был сделан шаг в сторону выбора схемы полихимиотерапии в зависимости от числа баллов по МПИ: больным III-IV стадий при МПИ 0-2 и подстадии А рекомендовали схему ABVD, при МПИ 3-7 - BEACOPP-14.
В табл. 28-3 представлены обновленная схема выделения прогностических групп и рекомендуемые объемы лечения, приведенные в Российских клинических рекомендациях по диагностике и лечению лимфомы Ходжкина в 2016 г.
| Лечебная группа | Схема полихимиотерапии | Лучевая терапия |
|---|---|---|
Ранние стадии, благоприятный прогноз |
2-4 цикла АВVD |
30 Гр на зоны исходного поражения |
Ранние стадии, неблагоприятный прогноз |
4-6 циклов АВVО или 2 цикла BEACOPPesc + 2 цикла ABVD |
30 Гр на зоны исходного поражения |
Поздние стадии, благоприятный прогноз (МПИ 0-2, А-стадия) |
6-8 циклов АВVD |
30-36 Гр на резидуальную опухоль более 1,5 см |
Поздние стадии, неблагоприятный прогноз (Б-стадия, или МПИ 3-7) |
8 циклов ВЕАСОРР-14 или 6 циклов BEACOPPesc или 6 циклов EACOPP-14 |
30-36 Гр на резидуальную ПЭТ-позитивную опухоль более 2.5 см |
МПИ - международный прогностический индекс, ПЭТ - томография позитронно-эмиссионная, ABVD - доксорубицин + блеомицин + винбластин + дакарбазин, BEACOPP - этопозид + доксорубицин + циклофосфамид + блеомицин + винкристин + прокарбазин + преднизолон.
Факторы риска при стадии:
Фактор риска при III-IV стадии: ≥3 балла по МПИ.
Единого мнения относительно оптимальной схемы индукции ремиссии для больных лимфомой Ходжкина III-IV стадий до настоящего времени не сложилось.
В МРНЦ эту категорию пациентов подразделяли на две лечебные группы в зависимости от наличия клинических факторов риска раннего (в I-II курсах) прогрессирования, выявленных в период использовании 4-компонентных схем полихимиотерапии. К этим факторам относят:
С учетом заведомо большей токсичности BEACOPPesc на вооружение была взята схема BEACOPP-21, которую назначали с целью повышения эффективности индукционной химиотерапии при лимфоме Ходжкина IIXE, III-IV стадий у больных с факторами риска ранней прогрессии, причем использовали данную схему преимущественно в первой половине курса химиотерапии (см. табл. 28-6 далее). Остальным больным с поздними стадиями заболевания, а также при I-II стадии лечение проводили на основе схемы ABVD, признанной во всем мире «золотым стандартом». Эти и другие модификации лекарственного и лучевого компонентов комбинированной терапии, направленные на уменьшение риска ятрогенных последствий лечения без снижения его эффективности, были изучены в рамках проспективных клинических исследований, к 2016 г. включивших более 900 больных лимфомой Ходжкина I-IV стадий. Анализ результатов 1998-2008 гг. выявил ассоциацию неудач применения схемы ABVD с абсолютной лимфоцитопенией периферической крови, а неудач схемы BEACOPP-21 - с наличием 4 баллов по МПИ и более. На этом основании больным с неблагоприятной I-II стадией и абсолютной лимфоцитопенией вместо схемы ABVD назначают BEACOPP-21, а больных с поздними стадиями лимфомы Ходжкина распределяют в три прогностические группы, где им проводят химиотерапию различной интенсивности (ABVD, BEACOPP-21 или BEACOPP-14).
Текущие программы МРНЦ обладают функционально-сберегающим потенциалом и сохраняют свое значение прежде всего в отсутствие исходной или промежуточной ПЭТ-КТ. Ниже приведены основные особенности терапевтических подходов в лечении классической лимфомы Ходжкина.
Выбор первой линии полихимиотерапии при ранних стадиях с неблагоприятным прогнозом (ABVD или BEACOPP-21) и при распространенных стадиях (ABVD, BEACOPP-21 или BEACOPP-14) осуществляют в соответствии с факторами риска прогностической модели МРНЦ, что способствует обоснованному и адресному применению токсичных схем полихимиотерапии у ограниченного числа больных.
При ранних стадиях с благоприятным прогнозом проводят суммарно не менее шести циклов полихимиотерапии, что, во-первых, улучшает контроль возможных субклинических очагов, а во-вторых, уменьшает долю пациентов с частичной регрессией исходных очагов поражения с 30% после 4 циклов до 10% после 6 циклов. Таким образом, у большинства пациентов становится допустимым использование СОД 20 Гр в режиме стандартного фракционирования (РОД 1,8-2 Гр однократно 5 раз в неделю) вместо рекомендуемых стандартом 30 Гр.
При всех стадиях в последних 1-2 циклах индукционной химиотерапии назначают схему СОРР/CVPP, что:
Исключение делают для больных с множественным поражением костей или костного мозга.
Консолидирующую лучевую терапию на исходно пораженные зоны с неполной регрессией опухоли после полихимиотерапии по схеме ABVD и/или резидуальные (±ПЭТ-позитивные) образования после полихимиотерапии на основе схемы BEACOPP проводят в режиме ускоренного гиперфракционирования (два сеанса в день, РОД 1,3 Гр +1,5 Гр с интервалом 4-4,5 ч). Использование режима неравномерного дробления укрупненной суточной дозы уменьшает риск отдаленных лучевых повреждений, сопутствующий традиционному облучению до СОД 36-45 Гр при той же степени местного контроля.
В табл. 28-4 представлены схема выделения прогностических групп и программы лечения ранних стадий лимфомы Ходжкина, разработанные в МРНЦ за период с 1998 по 2016 г. Факторы риска для ранних стадий, используемые нами, в большей степени совпадают с позициями исследователей EORTC/GELA, т.е. у больных с стадиями с благоприятным прогнозом допустимо вовлечение до трех лимфатических областей. Важное условие: это должны быть только области а, b и с, но без вовлечения корней легких (см. рис. 28-1); Б-симптомы не допустимы. У больных I-ПА стадии с благоприятным прогнозом абсолютная лимфоци-топения до начала лечения не встречается; ее наличие дает основание поставить под сомнение адекватность обследования или интерпретации полученных данных.
| Лечебная группа | Схема полихимиотерапии | Лучевая терапия |
|---|---|---|
I-IIA стадия без факторов риска |
АВVDх4 ±СОРРх1-2 |
Лучевая терапия на зоны исходного поражения: при неполной регрессии 20-22 Гр в режиме ускоренного гиперфракционирования (1,3 Гр +1,5 Гр с интервалом 4,5 ч); при полной регрессии 20 Гр в режиме стандартного фракционирования (по 1,8-2 Гр 5 дней в неделю) |
I-II стадия с факторами риска б, в, г, д |
АВVОх4-6 ± СОРРх1-2 |
|
I-II стадия с факторами риска а, е |
ВЕАСОРР-21х4 + СVРРх2 |
Лучевая терапия на резидуальные опухолевые массы >2,5 см в суммарной дозе 20-22 Гр в режиме ускоренного гиперфракционирования |
Факторы риска для ранних стадий лимфомы Ходжкина: а - массивное поражение средостения (Х); б - экстранодальное поражение (Е); в - Б-симптомы; г - скорость оседания эритроцитов >50 мм/ч при подстадии А; д - более трех вовлеченных областей. е - содержание лимфоцитов <900 клеток и/или CD4+Т-лимфоцитов <200 клеток в 1 мкл крови (дополнительный фактор, МРНЦ).
У больных лимфомой Ходжкина стадий с общепринятыми факторами риска частота случаев абсолютной лимфоцитопении в дебюте заболевания, по данным МРНЦ, варьирует от 8% для всей группы до 14% в подгруппе IIXE(A,Б). Необходимость учета этого достаточно редкого фактора неблагоприятного прогноза иллюстрируют данные, представленные в табл. 28-5.
Прогностическая группа МРНЦ |
Число больных |
10-летняя выживаемот % |
|
Общая |
Без прогрессии |
||
I-IIА стадия без факторов риска |
73 |
100 |
94±3 |
I-II стадия с факторами риска, кроме абсолютной лимфоцитопении |
183 |
97±1,4 |
91±2 |
IIXE(A,Б) |
29 |
97±2,9 |
85±6,9 |
Остальные |
154 |
97±1,7 |
92±2,2 |
I-II стадия с факторами риска в том числе абсолютной лимфоцитопенией |
16 |
50,2±12,7 |
32,4±12,7 |
В табл. 28-6 представлены схема выделения прогностических групп и программы лечения поздних стадий лимфомы Ходжкина в МРНЦ.
Допустимость сокращения числа циклов BEACOPP-21 или ABVD путем перехода в конце курса индукционной химиотерапии на более мягкую схему (соответственно CVPP или СОРР) подтверждена в отдаленных наблюдениях. Аналогичная тактика принята в отношении ограничения числа курсов BEACOPP-14.
| Лечебная группа | Схема полихимиотерапии | Лучевая терапия |
|---|---|---|
III-IV стадия без факторов риска |
АВVОх5-7 ± СОРРх1-2 |
20-22 Гр в режиме ускоренного гиперфракционирования (1,3 Гр +1,5 Гр два раза в день с интервалом 4,5 ч): на резидуальные опухолевые массы и/или зоны исходно массивного поражения |
III-IV стадия, факторы риска 1, 2, 3 |
ВЕАСОРР 21х4-6 ± СVРРх1-2 |
|
III-IV стадия, факторы риска 4, 5 |
ВЕАСОРР-14х2-4 ВЕАСОРР-21х2-4 ± СVРРх2 |
Факторы риска включают: 1 - гистологические варианты «нодулярный склероз II типа» или «лимфоидное истощение»; 2 - специфический перикардит; 3 - вовлечение костей или костного мозга в сочетании с массивным поражением селезенки; 4 - абсолютная лимфоцитопения; 5 - оценка по Международному прогностическому индексу ≥4.
При поздних стадиях лимфомы Ходжкина возможность снижения интенсивности полихимиотерапии во второй половине курса лечения была изучена в протоколе HD12 GHSG, показавшем сходные результаты при сравнении 8 кур сов BEACOPPэск и сочетания 4 курсов BEACOPPэск с 4 курсами BEACOPP-21 (схема 4+4); 10-летняя выживаемость без прогрессии составила 82,6 и 80,6% соответственно, а общая выживаемость - 87,3 и 86,8%. Аналогичный подход, направленный на снижение бремени ятрогенных последствий, получил применение при ПЭТ-адаптированной терапии: в случае полного метаболического ответа на 2 цикла BEACOPPэск переходят на лечение по схеме ABVD×4 (GELA, Israel) либо сокращают число курсов BEACOPPэск в пользу BEACOPP-21 (HD18, GHLG).
Однако обратная тактика - повышение интенсивности полихимиотерапии у больных с ПЭТ-позитивными очагами после 2 циклов ABVD путем перехода на BEACOPPэск (PET adapted Chemo, GITIL; RATHL) или на терапию спасения (HD 0801б IIL) - оказалась менее успешной с точки зрения общего результата лечения.
Учет факторов риска позволяет адресно использовать современные схемы первой линии полихимиотерапии в лечении больных с поздней стадией лимфомы Ходжкина уже в первых двух циклах химиотерапии. В итоге (табл. 28-7) примерно у 30% пациентов для получения высоких показателей излеченности было достаточно начать лечение со схемы ABVD, а у 40% больных с повышенным риском ранней прогрессии была успешно использована схема BEACOPP-21. У больных с абсолютной лимфоцитопенией и/или МПИ ≥4 баллов переход на схему BEACOPP-14 несколько улучшил показатели выживаемости в сравнении с результатами BEACOPP-21, хотя только 26 из 43 (60%) больных смогли получить от 2 до 5 курсов. Основной проблемой была миелотоксичность, не позволявшая соблюсти 14-дневный интервал между курсами. Можно полагать, что больные с исходной лимфоцитопенией и/или МПИ ≥4 баллов получат лучшие шансы на излечение только после того, как станут доступными таргетная терапия или иммунотерапия.
Прогностическая группа МРНЦ |
Исходная схема полихимиотерапии |
Число больных |
10-летняя выживаемость % |
|
Общая |
Без прогрессии |
|||
III-IV стадия без факторов риска |
АВVD |
129 |
96±2,3 |
88±3 |
III-IV стадия, факторы риска 1, 2, 3 |
ВЕАСОРР-21 |
193 |
88±2,7 |
80±3,3 |
III-IV стадия, факторы риска 4, 5 |
ВЕАСОРР-21 (по 2006 г.) |
83 |
73±7,2 |
64.2±6.0 |
ВЕАСОРР-14 (,после 2006 г.) |
43 |
81±8,2 |
72±7,0 |
|
Факторы риска включают: 1 - гистологические варианты «нодулярный склероз II типа» или «лимфоидное истощение»; 2 - специфический перикардит; 3 - вовлечение костей или костного мозга в сочетании с массивным поражением селезенки; 4 - абсолютная лимфоцитопения; 5 - оценка по Международному прогностическому индексу ≥4 балла.
В Российских клинических рекомендациях 2014-2016 гг. к группе благоприятного прогноза, подлежащей лечению по схеме ABVD, отнесены больные с МПИ 0-2 и подстадией А. Однако назначение схемы ABVD всем пациентам с МПИ 0-2 и подстадией А не вполне гарантирует благоприятный исход лечения.
Оценка эффективности лечения
Результаты лечения оценивают после 2-го и 4-го циклов, по завершении всего курса химиотерапии и после лучевого лечения. Обследование включает клинические анализы и повторение визуализирующих методик, при возможности - ПЭТ-КТ.
При планировании ПЭТ-исследования необходимо предварительно проверить концентрацию глюкозы в крови (особенно у больных, получавших большие дозы глюкокортикоидов).
Критерии определения эффективности проведенного лечения зависят от конечной методики оценки (заключительная ПЭТ-КТ или рутинная КТ).
При проведении ПЭТ-КТ оценку эффективности лечения осуществляют с использованием 5-балльной шкалы, основанной на визуальном сравнении интенсивности накопления дезоксиглюкозы-фтор 18F в патологическом очаге с интенсивностью накопления препарата в неизмененных отделах средостения и в правой доле печени:
-
1 балл - отсутствие накопления препарата в ранее определявшемся очаге поражения;
-
2 балла - накопление препарата в очаге поражения меньше интенсивности накопления в средостении;
-
3 балла - накопление препарата в очаге поражения выше, чем в средостении, но не превышает накопление в печени;
-
4 балла - накопление препарата в очаге несколько выше, чем в печени;
-
5 баллов - накопление препарата в очаге значительно выше, чем в печени, или появились новые очаги поражения.
На любом этапе обследования, вне зависимости от вида и размеров патологических очагов по КТ-составляющей, интенсивность 1-2 балла по Deauville относят к безусловному полному метаболическому ответу (ПЭТ-негативному), который свидетельствует о полной ремиссии. Возможность уменьшить количество курсов полихимиотерапии, снизить ее интенсивность, исключить лучевую терапию или снизить дозу облучения в подобных случаях изучают в текущих протоколах ПЭТ-адаптированной терапии для разных прогностических групп.
Результаты в 3, 4 и 5 баллов регистрируют как ПЭТ-позитивные, но трактуют по разному.
Результат в 3 балла после окончания лечения засчитывают как полную ремиссию. Результат в 4 и 5 баллов засчитывают как частичную ремиссию при условии снижения интенсивности накопления в очаге по отношению к исходной ПЭТ-КТ:
Результат в 4 и 5 баллов без существенного снижения интенсивности накопления по отношению к исходной ПЭТ-КТ указывает на отсутствие ответа или стабилизацию заболевания.
Прогрессирование констатируют при результате в 4 и 5 баллов с увеличением интенсивности накопления по отношению к исходной ПЭТ-КТ и/или при появлении новых очагов заболевания на любом этапе (промежуточный или заключительный).
С учетом все большей доступности ПЭТ-КТ становится возможной ранняя оценка эффективности избранной схемы полихимиотерапии. Особенно важно это делать при использовании схемы ABVD с целью раннего выявления химиорезистентности.
При результате ПЭТ-КТ-2 с накоплением 5 баллов (когда активность исходного очага значительно превышает накопление в печени и/или есть новые очаги) рекомендована биопсия. В случае подтверждения жизнеспособности опухолевых клеток пациента переводят на программу для рефрактерных форм; хорошей опцией при недостаточной эффективности ABVD считают схему BEACOPPesc.
В случае ПЭТ-КТ-2 с накоплением в 3-4 балла:
При лечении поздних стадий лимфомы Ходжкина на основе схемы ВЕАСОРР промежуточную ПЭТ-КТ-2 целесообразно проводить накануне 5-го курса. В рамках клинических протоколов изучают возможность снижения ятрогенной нагрузки у больных с полным метаболическим ответом путем перехода на схему ABVD, замены BEACOPPesc на BEACOPPbas и др.) Доказательной базы для применения этого подхода в рутинной клинической практике до настоящего времени нет.
Заключительная ПЭТ-КТ показана больным с поздними стадиями после завершения 6-8 циклов полихимиотерапии (до лучевой терапии), когда необходимо оценить жизнеспособность резидуальных образований, уточнить показания к лучевому лечению и выбрать СОД. В этих случаях целесообразно сместить обследование на более позднее время в пределах допустимого 6-недельного интервала между окончанием химиотерапии и началом лучевого лечения.
Резидуальные образования с активностью 3-4 балла по шкале Deauville считают возможным облучать до СОД 45 Гр.
Финальную ПЭТ-КТ с целью подтверждения полной ремиссии проводят через 3 мес после завершения программы химиотерапии или через 6 мес после химиолу-чевого лечения, когда минимизируются ранние лучевые реакции и снижается риск ложноположительных результатов.
Лучевая терапия
Задача лучевого лечения лимфомы Ходжкина в современных программах комбинированной терапии заключается в закреплении ремиссии, достигнутой путем первичной или противорецидивной химиотерапии, т.е. в обеспечении стойкого подавления местных проявлений заболевания. Это относится и к самым агрессивным схемам полихимиотерапии: согласно итогам протокола HD12 GHSG, после 8 курсов полихимиотерапии по схеме BEACOPPэск 10-летняя выживаемость без прогрессии была достоверно ниже у больных, не получивших лучевую терапию на области первично массивных или резидуальных образований, и составила 83,5% против 88,6% у получавших лучевое лечение, отмечена также тенденция к снижению общей выживаемости при исключении лучевой терапии (90,2 против 93%).
Как самостоятельное лечебное воздействие лучевая терапия показана при ранних стадиях нодулярной лимфомы Ходжкина с лимфоидным преобладанием. У больных классической лимфомой Ходжкина самостоятельная радиотерапия может быть использована в случае непереносимости химиотерапии или противопоказаний к ее проведению, а также при первично-резистентных формах и рецидивах.
Международная группа экспертов в области лучевой терапии лимфом выпустила в 2014 г. рекомендации, в которых указана необходимость совместной консультации гематологов-онкологов и радиотерапевтов еще на этапе проведения диагностической КТ или ПЭТ-КТ.
Противопоказания к лучевой терапии: резкое ослабление сопротивляемости организма в результате интенсивной химиотерапии, тяжелые декомпенсиро-ванные заболевания сердечно-сосудистой, дыхательной систем, печени и почек, а также психические заболевания и туберкулез.
Рекомендуемый перерыв между полихимиотерапией и лучевой терапией зависит от количества циклов полихимиотерапии:
2 цикла - перерыв 2 нед;
4 цикла - перерыв 2-3 нед;
6-8 циклов - перерыв 4-6 нед.
Рекомендуемые объем облучения и дозы в целом определяются программой лечения для каждой прогностической группы.
Реальный объем лучевого лечения может варьировать в зависимости от качества проведенной химиотерапии.
Объемы облучения при самостоятельной лучевой терапии лимфомы Ходжкина претерпели эволюцию от первых опытов паллиативного облучения пораженных лимфатических узлов, опубликованных в 1902-1903 гг., до создания концепции излечивающей лучевой терапии для лимфомы I, II и ША стадии.
Снижение риска поздних лучевых повреждений при обеспечении местного контроля заболевания остается важнейшей стратегией развития методик лучевой терапии лимфомы Ходжкина.
На V Международном симпозиуме по лечению лимфомы Ходжкина в 2001 г. в качестве альтернативы крупнопольным методикам была представлена обновленная версия многопольного варианта радиотерапии - облучение пораженных лимфатических областей, или «вовлеченных полей» (involved field radiation therapy, IFRT). Методика IFRT опирается на технологию 2D-планирования; стандартные поля формируются на основании анатомических ориентиров по рентгеновским изображениям, при поражении единичного лимфатического узла облучается весь регион, отступы фиксированные.
Развитие технологии 3D-конформной лучевой терапии и визуализирующих методик (МРТ, ПЭТ-КТ) стало основой новых концепций, предложенных в первую очередь для комбинированной терапии ранних стадий лимфомы Ходжкина. В 2006 г. группой лимфом EORTC обнародована методология облучения исходно пораженных лимфатических узлов (involved node radiotherapy, INRT), при которой возможность существенного сокращения объема облучения опирается на обязательное выполнение ПЭТ-КТ до начала лекарственной терапии. Компромиссная версия - облучение пораженных мест (involved site radiotherapy, ISRT) - разработана для условий, когда точная информация о числе и локализации очагов до начала химиотерапии недоступна. В обоих случаях объем облучения становится существенно меньше, чем при облучении пораженных областей IFRT (рис. 28-2 на цветной вклейке). Дальнейшие перспективы защиты органов риска усматривают в облучении с модуляцией интенсивности (IMRT), при задержке дыхания на глубине вдоха (рис. 28-3 на цветной вклейке) или контроле дыхательных движений (respiratory-gated), а также в использовании протонной лучевой терапии.
Приступая к планированию облучения больного лимфомой Ходжкина, радиотерапевт должен учитывать, что проявления заболевания в виде опухолевых образований лимфоидной ткани чаще всего первично имеют множественный характер и отличаются от большинства солидных опухолей рядом особенностей, оказывающих влияние на задачи лучевого лечения, объем облучения, РОД (способ фракционирования) и СОД.
Вероятность излечения 80-90% и молодой возраст большинства пациентов повышают ожидаемую продолжительность жизни. Поскольку отдаленные последствия современной лучевой терапии проявятся лишь спустя 10-15 лет, текущей задачей радиотерапевтов остается определение необходимого и достаточного объема облучения с точки зрения воздействия на опухоль и максимального - в отношении органов риска.
Задачи радиотерапевта при осуществлении трехмерного планирования:
Объемы облучения при лимфоме Ходжкина определяются в соответствии с рекомендациями Международной комиссии по радиационным единицам и измерениям МКРЕ-62, МКРЕ-83 (ICRU report 83). Традиционные поля многопольного варианта лучевой терапии (IFRT), формируемые на основании стандартных анатомических ориентиров, остаются актуальными для больных классической лимфомой Ходжкина при недостаточной информативности данных первичного обследования или в рамках лечения первично рефрактерных форм и рецидивов заболевания.
При условии адекватного первичного обследования и доступности его визуальной документации в зону облучения может быть включено только место расположения пораженных лимфатических узлов (ISRT). При проведении ISRT поле облучения соответствует размерам поражения до химиотерапии, но прилегающие критические органы и ткани без признаков исходного вовлечения (например, легкие, сердце, кости, почки) подлежат защите.
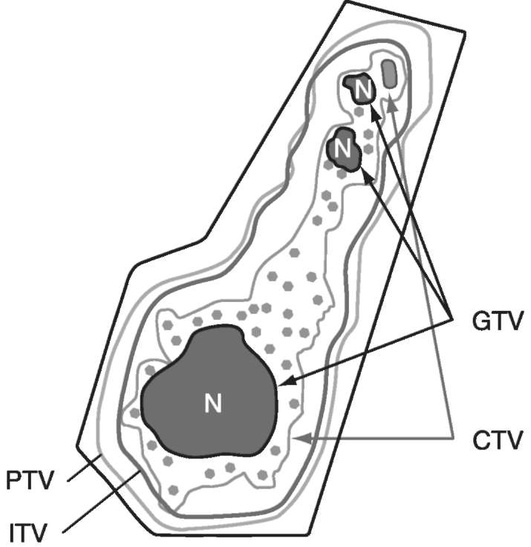
За основу планирования принимают макроскопический объем опухоли (GTV), зарегистрированный до химиотерапии пальпаторно и на основании визуализирующих методик (рис. 28-4).
Клинический объем мишени (CTV) определяют с учетом исходного GTV, но он может быть увеличен на основании врачебного суждения за счет включения предполагаемого субклинического распространения или ввиду отсутствия адекватной информации визуализирующих методик. При доступности 4D-компьютерной симуляции конфигурация CTV может быть откорректирована на смещение мишени за счет респираторных движений с учетом внутреннего объема мишени (ITV).
Планируемый объем мишени (PTV) включает клинический объем мишени (CTV) с добавлением отступов, величина которых зависит от особенностей укладки пациента, возможности его иммобилизации, потенциальных погрешностей при воспроизведении и др.
Для расчета дозового распределения используют доступные системы планирования (2D, 3D, 4D), задача которых состоит в выборе оптимального соотношения между покрытием опухоли (желательна гомогенность в облучаемом объеме ±7%) и воздействием на критические органы и ткани.
КТ-топометрия (КТ-разметка) предшествует этапу планирования и осуществляется при обязательном участии радиотерапевта. Перед этим систематизируют всю информацию, полученную по данным предшествующих визуализирующих методик в отношении расположения и размеров резидуальных опухолевых образований (R-GTV), которые обычно составляют незначительную долю основного объема первичной опухоли (исходного GTV). Все локализации R-GTV подлежат поиску при проведении КТ-разметки и регистрации их расположения в лечебном положении больного.
У больных с IV стадией лимфомы Ходжкина к R-GTV могут быть дополнительно отнесены:
-
остаточные образования на месте бывшей сливной инфильтрации или очагового поражения легкого;
-
участки уплотнения перикарда и/или объемное поражение плевры при их специфическом поражении;
-
рентгенологически определяемые очаги деструкции или склероза в опорных частях скелета (позвонки, бедренные кости);
У больных лимфомой Ходжкина остаточная опухоль может быть представлена отдельными очагами, расположенными на расстоянии, что усложняет оконтурива-ние и выбор правильных отступов в сторону нормальных тканей. Принято считать, что очаги с расстоянием менее 5 см необходимо включать в одно поле. Проведение лучевой терапии под контролем КТ (image-guided RT) позволяет с большей точностью воспроизводить запланированное облучение. Оконтуривание органов риска обязательно для учета потенциальных последствий лучевой терапии. Определение толерантных доз на нормальные ткани проводят на основе рекомендаций QUANTEC (Quantative Analyses of Normal Tissue Effects in the Clinics).
Современную методику облучения пораженных мест (ISRT) применяют в тех случаях, когда визуализацию поражения до начала полихимиотерапии нельзя считать оптимальной для облучения вовлеченных лимфатических узлов (INRT). В этом случае с учетом клинических соображений и доступной визуальной информации оконтуривают CTV большего размера для компенсации погрешностей в определении прехимиотерапевтического GTV. Так же поступают, если исходные данные доступны, но совмещение изображений (fusion) технически невозможно, и радиотерапевт оконтуривает CTV на планирующей установке.
При формировании CTV для лимфатических узлов шейных, медиастиналь-ных и парааортальных групп отступ от GTV составляет 2 см в краниокаудальном направлении и 1 см в других направлениях. Для лимфатических узлов корней легких и общеподвздошных лимфатических узлов используют отступ 1 см в перед-незаднем направлении и 2 см в других направлениях. Для подмышечных, пахово-подвздошных и бедренных лимфатических узлов отступ GTV-CTV составляет 2 см во всех направлениях. Различия отступа опираются на клинические наблюдения и предназначены скомпенсировать возвращение на свое место нормальных структур после регрессии опухолевых узлов. Поправка для PTV в 1 см опирается на трехмерное планирование и зависит от анатомической локализации.
Следует особо отметить, что перечисленные способы уменьшения объема облучения целесообразны при том условии, что количество циклов предшествовавшей полихимиотерапии по схеме ABVD (или аналогичной) и дозы химиопрепаратов соответствовали запланированным, а сегментация рентгеновского изображения для оконтуривания GTV и последующая выработка CTV сделаны на современной технической базе и клинически адекватны. При любой методике формирования полей для уменьшения погрешностей при проведении лучевой терапии крайне важна иммобилизация пациента.
Облучение экстранодальных локализаций лимфомы Ходжкина. Значительную сложность для лучевых терапевтов представляют случаи, когда устойчивые очаги находятся вне стандартных лимфатических областей. У пациентов с массивным поражением средостения в процесс часто вовлекаются ткани грудной стенки вне проекции средостения, плевра и перикард, легочная ткань. Нередко объемное поражение не имеет четких границ либо множественные очаги расположены в проекции критических органов.
Необходимость облучения экстранодальных локализаций чаще всего возникает в случаях контактного распространения с пораженных групп лимфатических узлов и чревата избыточным воздействием на органы риска. Лечебные планы, как правило, индивидуализированы, но учет соотношения GTV/CTV/PTV обязателен. К наиболее частым показаниям относят:
Для лечения больных с местнораспространенными формами лимфомы Ходжкина, устойчивыми к проведенной химиотерапии, разработана оригинальная методика разнообъемного облучения. Лучевое лечение проводят дважды в день через встречные поля: первый сеанс через большее, индивидуально формируемое поле, включающее анатомические области субклинического распространения заболевания (CTV), а второй сеанс, с интервалом 5 ч, - через меньшее поле, область высокой дозы которого должна быть подведена в контуры видимой опухоли (GTV). Облучение большим полем проводят один раз в день разовой дозой 1,25-1,5 Гр; СОД ограничена толерантностью критических органов и за 10-12 дней облучения не должна превысить 12-14 Гр при облучении обоих легких, 15-18 Гр на одно легкое, 14-15 Гр на печень, 12-15 Гр на перикард (сердце). Сеансы облучения меньшим полем проводят через 5 ч в РОД 1,35-1,5 Гр. С учетом вклада большого поля необходимой СОД 20-24 Гр в GTV удается достичь за 6-8 сеансов (рис. 28-5).
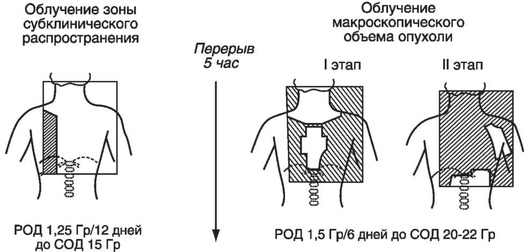
Последовательность облучения желаемых объемов (вовлеченных зон, областей или узлов) зависит от степени ответа на химиотерапию: в первую очередь воздействуют на области с частичным метаболическим ответом (ПЭТ-позитивной опухолью, вне зависимости от ее размера); во вторую очередь - на ПЭТ-негативные объемные образования.
При этом важно учитывать долю кроветворного костного мозга, попадающего в проекцию поля облучения, так как угнетение кроветворения в этих участках наступает уже после СОД 10 Гр. Единовременно облучаемый объем не должен включать суммарно более 15-20% костного мозга (в среднем три анатомических области поражения), следующий этап лучевого лечения может быть проведен после 4-недельного перерыва на восстановление показателей периферической крови.
Поскольку при облучении областей лимфооттока стандартными встречными полями перепад поглощенной дозы в облучаемом объеме (PTV) достигает 20-30%, правильнее выбирать для GTV такую разовую дозу, при которой в здоровых тканях она не превысит 2 Гр. Подобная тактика может быть применима для большинства случаев с полным или неподтвержденным полным (ПЭТ-негативным) ответом на химиотерапию, при котором размеры отдельной остаточной опухоли не превышают 2,5 см.
Однако нередки ситуации, когда размеры или конфигурация остаточного опухолевого образования настолько велики, что трудно или невозможно избежать перепада дозы в пределах PTV, не нанося ущерба здоровым тканям (например, при частичном или невыраженном ответе на химиотерапию медиастинальных лимфатических узлов).
Суммарная очаговая доза. Последний метаанализ кривых «доза-эффект» при самостоятельной лимфоме Ходжкина показал, что для местного контроля очагов с вероятностью 50, 90, 95 и 98% достаточны СОД 19, 30,5, 34 и 37,5 Гр соответственно. Для контроля субклинических очагов с вероятностью 98% считают достаточной СОД 32,5 Гр. При комбинированном химиолучевом лечении рекомендации по СОД опираются исключительно на клинический опыт, накопленный в рамках рандомизированных исследований.
Стандарты лечения при ранних стадиях лимфомы Ходжкина предполагают облучение всех вовлеченных зон (region) в СОД 30 Гр в режиме классического фракционирования вне зависимости от прогностической группы (благоприятная или неблагоприятная) и вне зависимости от степени регрессии опухоли по данным КТ или полноты метаболического ответа.
При поздних стадиях лимфомы Ходжкина ввиду увеличения числа циклов полихимиотерапии допустимо облучение только зон с остаточной опухолью и зон исходно массивного поражения, однако стандарты лечения предусматривают применение СОД 30-36 Гр, а при резидуальной опухоли с активностью 3-4 балла по шкале Довиль - до 45 Гр.
Приведенные рекомендации по суммарным дозам облучения относятся в основном к клинически определяемому объему опухоли (GTV). Они не рассматривают возможного диапазона СОД для одной отдельно взятой лимфатической области (или поля), т.е. возможности облучения в разных суммарных очаговых дозах GTV и зоны субклинического распространения опухолевого процесса (CTV).
В отечественной литературе при облучении вовлеченных анатомических областей после 2-4 циклов полихимиотерапии рекомендуют СОД 30-35 Гр. При закреплении ремиссии после 6-8 циклов предлагают варьировать СОД в зависимости от общего ответа на химиотерапию: 20-30 Гр при достижении полной ремиссии, 30-35 Гр при частичной ремиссии, 35-40 Гр на первично массивные очаги поражения с неполной регрессией. Представляет интерес методика зонального сокращения полей, позволяющая облучить в разных суммарных очаговых дозах GTV и зоны субклинического распространения опухолевого процесса.
Исследования показали, что качество жизни больных лимфомой Ходжкина после облучения лимфатических областей дозой 36-40 Гр в режиме классического фракционирования неудовлетворительно. Лечению сопутствуют ранние и поздние лучевые осложнения (пульмониты, пневмофиброзы, перикардиты, гипотиреоз), с увеличением сроков наблюдения растет риск ишемической болезни сердца и радиационно-индуцированных опухолей.
В связи с этим была предложена тактика консолидирующей лучевой терапии, при которой у больных с частичной ремиссией после шести циклов полихимиотерапии дозой 40 Гр классическим фракционированием облучали только лимфатические области с остаточными или исходно массивными опухолевыми образованиями. Вовлеченные зоны с полной регрессией опухоли облучали дозой 20 Гр. Эффективность дифференцированного подхода к выбору СОД в зависимости от степени регрессии опухоли в каждой отдельной зоне поражения подтвердилась в отдаленных наблюдениях. Подобная тактика сохраняет свою актуальность в рамках современных схем полихимиотерапии и продолжает использоваться в протоколах МРНЦ. У больных с ранними стадиями при частичной ремиссии лимфатические зоны с полной регрессией опухоли облучают дозой 20 Гр в режиме классического фракционирования. Сокращение числа областей, получивших радикальную дозу, уменьшает интегральную дозу облучения и снижает риск развития вторых опухолей.
Для создания альтернативы конвенциональному облучению очагов лимфомы Ходжкина до СОД 40 Гр был мобилизован терапевтический потенциал мульти-фракционирования, которое реализует различия в скорости репарации сублетальных повреждений опухолью и нормальными тканями опухолевого ложа, создавая благоприятные условия для резорбции опухоли и защищая критические органы и ткани от поздних лучевых повреждений.
Ускоренным гиперфракционированием за рубежом именуют дробление дневной дозы на 2-3 фракции с РОД в диапазоне от 1,35 до 1,65 Гр. В исследованиях с учетом высокой радиочувствительности лимфомы Ходжкина как опухоли лим-фоидного происхождения к режиму ускоренного гиперфракционирования можно отнести дробление дневной дозы на 2 фракции в диапазоне РОД от 1,35 до 1,5 Гр.
При подготовке к проведению лучевого лечения больному рекомендуют: провести санацию зубов, исключить курение и употребление алкогольных напитков, если это не было сделано перед химиотерапевтическим этапом; по возможности проводить время на свежем воздухе; употреблять до 2,5-3 л жидкости в день; следить за состоянием кожи, находящейся в поле облучения, - при возможности держать ее открытой, избегать расчесов, царапин, соприкосновения с грубой одеждой, не применять раздражающие (спиртовые) жидкости и мази, тепловые процедуры, избегать инсоляций и повреждений во время бритья; следить за состоянием слизистых оболочек рта, пищевода, желудка (не употреблять очень горячую, холодную, твердую, сухую пищу); при облучении областей ниже диафрагмы соблюдать диету, щадящую кишечник, следить за стулом, оценивать биохимические показатели крови; сохранять маркировку полей облучения.
При осуществлении лучевого лечения контролируют содержание лейкоцитов и тромбоцитов в крови один раз в неделю, при лейкопении - один раз в три дня. Проводят сопроводительное лечение, направленное на профилактику лучевых осложнений, симптоматическую и общеукрепляющую терапию, профилактику бактериальных и вирусных инфекций. До исчезновения реактивных изменений кожи не рекомендовано пользоваться горячей водой и носить одежду из синтетической ткани.
После окончания лучевого лечения на область средостения рекомендованы:
В первые 3 мес после облучения средостения при появлении кашля, подъеме температуры показана внеплановая рентгенография органов грудной клетки; в случае выявления лучевой реакции парамедиастинальной легочной ткани (инфильтративные изменения в проекции полей облучения) показано назначение глюкокортикоидов в дозе 20-25 мг/сут с постепенным убавлением в течение месяца, антибиотиков (при возможности мокроту исследуют на чувствительность) или сульфаниламидов (ко-тримоксазол [Бисептол♠]), десенсибилизирующих средств.
После завершения всей программы химиолучевого лечения пациент должен вернуться под наблюдение химиотерапевта или онкогематолога, который проведет итоговое рестадирование. Для регрессии остаточного опухолевого образования необходимо отвести срок не менее 2-3 мес после завершения лучевой терапии, поэтому детальное обследование всех локализаций заболевания с целью констатации общего ответа на лечение и регистрации достигнутой степени регрессии обычно проводят в пределах 2-3 мес после окончания всего курса лечения. В этот же период регистрируют и при необходимости назначают лечение ранних лучевых реакций, отмечают их исходы. Сказанное относится к проведению ПЭТ-КТ.
Больной подлежит диспансерному наблюдению, в рамках которого проводят регулярное обследование. Задачи обследования отличаются в зависимости от времени, прошедшего после окончания лечения.
В первые два года после окончания лечения, когда выявляют большинство рецидивов, выполняют:
Перечисленные обследования повторяют один раз в 6 мес до 5 лет, далее один раз в год. Контрольную КТ проводят только при наличии остаточных образований, ограничиваясь областью, где они есть (грудная клетка, живот, таз), один раз в 6 мес до констатации полного или неподтвержденного полного ответа. В случае облучения шеи показан ежегодный контроль функции щитовидной железы. Эхокардиографию и спирометрию выполняют через полгода после окончания лечения, далее - с учетом жалоб или по достижении возраста 40 лет.
Литература
-
Байсоголов Г.Д., Исаев И.Г., Павлов В.В. Отдаленные результаты лекарственной и комбинированной (химио- и лучевой) терапии больных с IIIB-IV стадией лимфогранулематоза // Мед. радиол. - 1980. - № 1. - C. 32-36.
-
Бардычев М.С., Цыб А.Ф. Местные лучевые повреждения. - М.: Медицина, 1985. - 240 с.
-
Богатырева Т.И. Комбинированное и лучевое лечение первичной и рецидивной лимфомы Ходжкина на основе интенсивных режимов фракционирования дозы: авто-реф. дис. … д-ра мед. наук. - Обнинск, 2006. - 40 с.
-
Богатырева Т.И. Способ лучевого лечения больных злокачественными лимфома-ми. - Патент на изобретение RU 2 278 707 С2, 27.06.2006.
-
Богатырева Т.И., Афанасова Н.В., Павлов В.В., Яннаева Ю.Г. Лучевые реакции легких после облучения средостения у больных лимфомой Ходжкина, получавших бле-омицин-содержащие схемы полихимиотерапии (ABVD, BEACOPP) // REJR (Russion Electronic Journal of Radiology. Российский электронный журнал лучевой диагностики). - 2012. - Т. 2. - № 2. - С. 82-83.
-
Богатырева Т.И., Кравченко Т.В., Афанасова Н.В. и др. Снижение суммарной дозы при облучении химиорезистентных очагов лимфомы Ходжкина в режиме ускоренного гиперфракционирования (проспективное рандомизированное исследование // Вопр. онкол. - 2006. - Т. 52. - № 5. - С. 544-549.
-
Богатырева Т.И., Павлов В.В. Оптимальное место схемы ABVD в лечении распространенных стадий лимфомы Ходжкина: опыт МРНЦ применительно к предложениям Российских клинических рекомендаций по диагностике и лечению лимфомы Ходжкина 2014 г. // Злокачественные опухоли. - 2015. - № 4. - Спецвып. 2. - С. 100-101.
-
Богатырева Т.И., Павлов В.В., Данилова М.А. и др. Применение ABVD и BEACOPP в лечении поздних стадий лимфомы Ходжкина: результаты проспективного исследования в МРНЦ РАМН // Материалы научно-практической конференции «Актуальные вопросы диагностики и лечения лимфомы Ходжкина. 15-17 апреля 2010 г. - Обнинск, 2010. - С. 10-12.
-
Богатырева Т.И., Павлов В.В., Конова О.А. Сочетание абсолютной и относительной лимфоцитопении: устойчивый фактор неблагоприятного прогноза при лимфоме Ходжкина // Материалы научно-практической конференции «Актуальные вопросы диагностики и лечения лимфомы Ходжкина. 15-17 апреля 2010 г. - Обнинск, 2010. - С. 12-13.
-
Богатырева Т.И., Павлов В.В., Столбовой А.В. Лечение лимфомы Ходжкина: пособие для врачей / Под ред. Ю.С. Мардынского. - Обнинск: МРНЦ РАМН, 2010. - 60 с.
-
Богатырева Т.И., Павлов В.В., Шкляев С.С. Рецидивы лимфомы Ходжкина: возможности продления жизни без высокодозной химиотерапии // Врач. - 2012. - № 11. - С. 5-8.
-
Богатырева Т.И., Столбовой А.В., Копп М.Ю. и др. Лимфома Ходжкина: трудности на пути реализации стандартов лечения и их преодоление // Врач. - 2011. - № 12. - С. 34-40.
-
Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2007 г. // Вестн. РОНЦ им. Н.Н. Блохина РАМН. - 2009. - Т. 20. - № 3. - Прил. 1.
-
Дарьялова С.Л., Бойко А.В., Черниченко А.В. Современные возможности лучевой терапии злокачественных опухолей // Рос. онкол. журн. - 2000. - № 1. - С. 48-55.
-
Канаев С.В. Лечение больных лимфомой Ходжкина благоприятной и промежуточной прогностических групп // Практ. онкол. - 2007. - Т. 8. - № 2. - С. 73-81.
-
Лимфома Ходжкина: монография / Под ред. В.П. Харченко. - М.: Русское слово - РС, 2009. - 320 с.
-
Лорие Ю.Ю. Опухолевая прогрессия и вопросы биологии лимфогранулематоза // Тер. арх. - 2000. - № 7. - С. 76-80.
-
Мардынский Ю.С., Лесков В.П. Расщепление суточной очаговой дозы при лучевой терапии злокачественных новообразований // Мед. радиол. - 1980. - № 2. - С. 79-83.
-
Павлов В.В., Богатырева Т.И., Шахтарина С.В., Даниленко А.А. Оптимизация лучевого компонента в программах комбинированного химиолучевого лечения больных лимфомой Ходжкина // Терапевтическая радиология: руководство для врачей / Под ред. А.Ф. Цыба, Ю.С. Мардынского. - М.: Медицинская книга, 2010. - С. 461-505.
-
Российские клинические рекомендации по диагностике и лечению лимфопроли-феративных заболеваний / Под ред. И.В. Поддубной, В.Г. Савченко. - М., 2016.
-
Цыб А.Ф., Нестайко Т.О., Богатырева Т.И., Гусева З.А. Кардиальная функция больных лимфомой Ходжкина в отдаленные сроки после химиолучевого лечения с различным фракционированием дозы при облучении средостения // Радиация и риск. - 2009. - Т. 18. - № 4. - С. 82-95.
-
Ярмоненко С.П., Коноплянников А.Г., Вайнсон А.А. Клиническая радиобиология. - М.: Медицина, 1992. - 320 с.
-
Andr M., Fortpied C., Viviani S. et al. Overall survival impact of BEACOPP versus ABVD in advanced Hodgkin lymphoma: a pooled analysis of 4 randomized trials // Haematologica. - 2016. - Vol. 101. - Suppl. 5. - P. 19.
-
Bogatyreva T.I., Pavlov V.V. Long-term results of risk-adapted therapy for advanced Hodgkin’s lymphoma: one-center experience (1998-2012) // Hematologica. - 2013. - Vol. 98. - Suppl. 2. - P. 8.
-
Campo E., Swerdlow S.H., Harris N.L., Pileri S. et al. The 2008 WHO classification of lymphoid neoplasms and beyond: evolving concepts and practical applications // Blood. - 2011. - Vol. 117. - P. 5019-5032.
-
Cheson B.D., Fisher R.I., Barrington S.F. et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification // J. Clin. Oncol. - 2014. - Vol. 32. - P. 3059-3068.
-
Diehl V., Franklin J., Hasenclever D. et al. BEACOPP, a new dose-escalated and accelerated regimen, is at least as effective as COPP/ABVD in patients with advanced-stage Hodgkin’s lymphoma: interim report from a trial of the German Hodgkin’s Lymphoma Study Group // J. Clin. Oncol. - 1998. - Vol. 16. - P. 3810-3821.
-
Eichenauer D.A., Engert A., Andre M., Federico M. et al.; on behalf of the ESMO Guidelines Working Group. Hodgkin’s lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. - 2014. - Vol. 25. - Suppl. 3. - P. 70-75. - doi: 10.1093/annonc/mdu181.
-
Franklin J., Pluetschow A., Paus M., Specht L. et al. Second malignancy risk associated with treatment of Hodgkin’s lymphoma: meta-analysis of the randomized trials // Ann. Oncol. - 2006. - Vol. 17. - N. 12. - P. 1749-1760.
-
Friedberg J.W., Li H., Schöder H. et al. Long-term follow-up of SWOG S0816: response-adapted therapy of advanced stage Hodgkin lymphoma using early interim FDG-PET imaging // Hematologica. - 2016. - Vol. 101. - Suppl. 5. - P. 19.
-
Girinsky T., van der Maazen R., Specht L. et al. Involved-node radiotherapy (INRT) in patients with early Hodgkin lymphoma: concepts and guidelines // Radiother. Oncol. - 2006. - Vol. 79. - P. 270-277.
-
Hasenclever D., Diehl V.; for the International Prognostic Factors Project on advanced Hodgkin’s disease. A prognostic score to predict tumor control in advanced Hodgkin’s disease // N. Engl. J. Med. - 1998. - Vol. 339. - P. 1506-1515.
-
Hoppe B.S., Flampouri S., Zaiden R. et al. Involved-node proton therapy in combined modality therapy for Hodgkin lymphoma: results of a phase 2 study // Int. J. Radiat. Oncol. Biol. Phys. - 2014. - Vol. 89. - P. 1053-1059.
-
Josting A., Nogova L., Franklin J. et al. Salvage radiotherapy in patients with relapsed and refractory Hodgkin’s lymphoma: a retrospective analysis from the German Hodgkin Lymphoma Study Group // J. Clin. Oncol. - 2005. - Vol. 23. - P. 1522-1529.
-
Looney W., Hopkins H.A., Tubiana M. Experimental and clinical studies оf alternating chemotherapy and radiotherapy // Cancer Metastasis Rev. - 1989. - Vol. 8. - N. 1. - P. 53-79.
-
Referenced with permission from The NCCN Clinical Practice Guidelines in Oncology® for Hodgkin Lymphoma V.2.2016. © National Comprehensive Cancer Network, Inc. 2011. All rights reserved. Accessed 6/20, 2016. To view the most recent and complete version of the guideline, go online to www.nccn.org. NATIONAL COMPREHENSIVE CANCER NETWORK®, NCCN®, NCCN GUIDELINES®, and all other NCCN Content are trademarks owned by the National Comprehensive Cancer Network, Inc.
-
Specht L., Yahalom J., Illidge T., Berthelsen A.K. et al. Modern radiation therapy for Hodgkin lymphoma: field and dose guidelines from the International Lymphoma Radiation Oncology Group (ILROG) // Int. J. Radiat. Oncol. Biol. Phys. - 2014. - Vol. 89. - P. 854.
-
Terekhova A., Bogatyreva T., Konova O., Danilova M. et al. Hemopoiesis restoration in sternal bone marrow after low dose accelerated hyperfractionated radiotherapy for mediastinal Hodgkin’s lymphoma // Ann. Oncol. - 2004. - Vol. 15. - Suppl. 3. - P. 163.
-
Vardhana S., Younes A. The immune microenvironment in Hodgkin lymphoma: T-cells, B-cells, and immune checkpoints // Haematologica. - 2016. - Vol. 101. - P. 794-802.
-
Vijayakumar S., Myranthopoulos L.C. An update dose-response analysis in Hodgkin’s disease // Radiother. Oncol. - 1992. - Vol. 24. - P. 1-13.
-
von Tresckow B., Kreissl S., Haverkamp H. et al. BEACOPP-escalated followed by radiotherapy of initial bulk or residual disease in advanced-stage Hodgkin lymphoma; long-term follow-up of the GHSG HD9 and HD12 trials // Hematologica. - 2016. - Vol. 101. - Suppl. 5. - P. 18.
-
Withers H.R. Biological basis for altered fractionation schemes // Cancer. - 1985. - Vol. 55. - P. 2086-2095.
-
Yahalom J. The lymphomas // Treatment Planning in Radiation Oncology / ed. F.M. Khan. - Philadelphia, Baltimore: Lippincott Williams and Wilkins, 2007. - P. 343-356.
-
Yahalom J., Gulati S.C., Toia M., Maslak P. et al. Accelerated hyperfractionated total-lymphoid irradiation, high-dose chemotherapy and autologous bone marrow transplantation for refractory and relapsed patients with Hodgkin’s disease // J. Clin. Oncol. - 1993. - Vol. 11. - P. 1062-1070.
-
Yahalom J., Mauch P. The involved-field is back: issues in delineating the radiation field in Hodgkin’s disease // Ann. Oncol. - 2002. - Vol. 13. - Suppl. 1. - P. 79-83.