Психиатрия : национальное руководство / гл. ред. : Ю. А. Александровский, Н. Г. Незнанов.- Москва : ГЭОТАР-Медиа, 2018. - 1008 с. - ISBN9785970444627 |
Аннотация
Национальные руководства - первая в России серия практических руководств по основным медицинским специальностям, включающих всю основную информацию, необходимую врачу для непрерывного последипломного образования. В отличие от большинства других руководств в национальных руководствах равное внимание уделено профилактике, диагностике, фармакотерапии и немедикаментозным методам лечения.
Второе издание национального руководства "Психиатрия" содержит современную и актуальную информацию об организации психиатрической помощи, о методах диагностики и лечения психически больных. Отдельный раздел посвящён описанию основных психических болезней в соответствии с МКБ-10.
В подготовке настоящего издания в качестве авторов-составителей и рецензентов принимали участие известные специалисты-психиатры. Все рекомендации по диагностике и лечению прошли этап независимого рецензирования.
Руководство предназначено психиатрам, клиническим психологам, интернам, ординаторам, аспирантам, студентам старших курсов медицинских высших учебных заведений.
Авторы, редакторы и издатели руководства предприняли максимум усилий, чтобы обеспечить точность представленной информации, в том числе дозировок лекарственных средств. Учитывая постоянные изменения, происходящие в медицинской науке, они рекомендуют уточнять дозы лекарственных средств по соответствующим инструкциям. Пациенты не могут использовать эту информацию для диагностики и самолечения.
11.4.1. Психофармакотерапия
С.Н. Мосолов, Э.Э. Цукарзи
Шизофрения - заболевание, в отношении которого помощь не может быть ограничена только биологическим лечением. Она, безусловно, должна включать психосоциальное лечение и психосоциальную реабилитацию, психотерапию и различные организационные формы помощи (Джонс П.Б., Бакли П.Ф., 2008). Это соответствует современной парадигме о биопсихосоциальной природе психических расстройств, а также отвечает положениям о бригадном подходе в работе с больными и приближению оказания помощи к общественно ориентированной психиатрии. Цели и стратегии лекарственной терапии шизофрении определяются фазой и тяжестью заболевания (Краснов В.Н., Гурович И.Я., Мосолов С.Н. и др., 2007). Основным методом лечения больных шизофренией, получившим массовое распространение в клинической практике, в настоящее время является ПФТ.
Базовым классом психофармакологических средств, применяемых при шизофрении вот уже более 60 лет, являются антипсихотические средства или нейролептики, которые относятся к ЛС психолептического действия и способны, прежде всего, редуцировать психотическую (галлюцинаторно-бредовую) симптоматику и психомоторное возбуждение (Авруцкий Г.Я., Недува А.А., 1988).
По химическому строению различают следующие антипсихотические препараты.
Алифатические фенотиазины обладают сильной адренолитической и холинолитической активностью, что клинически проявляется выраженным седативным эффектом и мягким действием на экстрапирамидную систему. Пиперазиновые фенотиазины и бутирофеноны обладают слабыми адренолитическими и холинолитическими свойствами, но сильными дофаминблокирующими, т.е. наиболее выраженным глобальным антипсихотическим действием, и значительными экстрапирамидными и нейроэндокринными побочными эффектами. Пиперидиновые фенотиазины, тиоксантены и бензамиды занимают промежуточное положение и обладают преимущественно средним антипсихотическим действием и умеренно или слабо выраженными экстрапирамидными и нейроэндокринными побочными явлениями. Производные дибензазепинов (клозапин, кветиапин, оланзапин и азенапин) имеют отчетливый седативный эффект и редко вызывают неврологические расстройства и гиперпролактинемию (ГП).
Собственно антипсихотическое действие нейролептиков традиционно связывают с блокадой D2-дофаминовых рецепторов и изменением дофаминергической нейро-трансмиссии, что, в свою очередь, может вызвать экстрапирамидные расстройства и ГП (Карлсон А., Лекрубье И., 2004). Развитие тех или иных клинических эффектов блокады D2-рецепторов зависит от воздействия на различные дофаминергические пути в ЦНС. Угнетение нейротрансмиссии в мезолимбической системе ответственно за развитие собственно антипсихотического эффекта, в нигростриальной области - за экстрапирамидные побочные эффекты (нейролептический псевдопаркинсонизм), а в тубероинфундибулярной зоне - за нейроэндокринные нарушения, в том числе ГП. Арвид Карлссон в 60-е годы прошлого века обратил внимание на то, что дофаминовые агонисты вызывают шизофреноподобную психотическую симптоматику, а дофаминовые антагонисты (нейролептики) ее предотвращают, и предположил, что продуктивные (позитивные) симптомы ассоциируются с гиперстимуляцией D2-дофаминовых рецепторов в подкорковых областях. Это предположение легло в основу дофаминергической гипотезы шизофрении и действия нейролептиков, за которую Карлссон в 2000 г. был удостоен Нобелевской премии. В последующем при появлении нейровизуализационных ПЭТ-исследований эта теория полностью подтвердилась. Кроме того, выяснилось, что в мезокортикальных и особенно в префронтальной коре у больных шизофренией наблюдается снижение дофаминергической активности, чем объясняется наличие негативной симптоматики и когнитивных нарушений. В соответствии с модифицированной дофаминергической гипотезой шизофрении, предложенной Карлссоном в конце 90-х годов:
-
когнитивные нарушения и негативная симптоматика связаны с недостаточной стимуляцией в префронтальной коре вследствие недостатка дофамина;
-
когнитивные нарушения и негативная симптоматика связаны с дисфункцией лобной коры и являются следствием недостаточной компенсации синаптического дефекта;
-
недостаток синаптической трансмиссии по механизму обратной связи активирует дофаминергические нейроны, повышает гиперстимуляцию D2-рецепторов в подкорковых структурах и приводит к развитию позитивной симптоматики.
Новые исследования показали также, что недостаточность D1-рецепторов и нарушения межсинаптических связей в префронтальной коре связаны с гипофункцией глутаматных NMDA(N-метил-D-аспартат)-рецепторов.
В соответствии с этой гипотезой дофаминовые эффекты «идеального нейролептика», по мнению Карлссона, должны заключаться в повышении дофаминергической активности в мезолимбических путях для коррекции негативной симптоматики и когнитивных нарушений; в снижении дофаминергической активности в мезокортикальных путях для достижения антипсихотического эффекта и в слабом воздействии на нигростриальную и тубероинфундибулярную системы для минимизации экстрапирамидных побочных эфффектов и нейроэндокринных нарушений. Понятно, что добиться таких разнонаправленных эффектов у одного препарата практически невозможно. Тем не менее оказалось, что антипсихотические средства неодинаково связываются D2-рецепторами в разных структурах головного мозга. Одни препараты обладают сильным сродством и блокируют рецепторы на длительное время, другие, напротив, быстро высвобождаются из мест связывания. Если это происходит на уровне нигростриальной области и блокада D2-рецепторов не превышает 70%, то экстрапирамидные побочные эффекты (паркинсонизм, дистония, акатизия) либо не развиваются, либо выражены незначительно. Антипсихотики, обладающие антихолинергической активностью, реже вызывают экстрапирамидную симптоматику (ЭПС), поскольку холинергическая и дофаминергическая системы находятся в реципрокных отношениях и блокада мускариновых рецепторов I типа приводит к активизации дофаминергической передачи. На таком же механизме действия основана способность центральных антихолинергических препаратов (тригексифенидила, биперидена) корригировать нейролептические экстрапирамидные нарушения. Некоторые препараты при применении в малых дозах способны блокировать пресинаптические D2/3-рецепторы и парадоксально облегчать дофаминергическую нейропередачу, в том числе на корковом уровне. В клинической картине это проявляется в виде дезингибирующего или активирующего эффекта.
Атипичные антипсихотики могут также блокировать 5HT2-серотониновые рецепторы, с чем связывают их способность уменьшать выраженность негативной симптоматики и когнитивных нарушений у больных шизофренией, поскольку серотониновые рецепторы II типа расположены преимущественно в коре головного мозга (особенно во фронтальных областях) и их блокада приводит к опосредованной стимуляции дофаминергической передачи. Помимо указанных, нейролептические средства связываются со множеством других центральных и периферических рецепторов (табл. 11.9), что коррелирует с различными клиническими (как положительными, так и отрицательными) эффектами. Например, выраженность антигистаминной блокады ассоциируется с повышением массы тела и сонливостью, адренолитическое действие - с седацией и ортостатической гипотензией, антихолинергическое - с запорами, нарушением аккомодации, сухостью во рту, задержкой мочеиспускания и одновременно с уменьшением частоты и выраженности ЭПС. Клинические последствия связывания с некоторыми другими рецепторами недостаточно ясны до сих пор (например, D1, D2, 5HT1, 5HT6 5HT7 глутаматные, NMDA-рецепторы). Считается, что блокада 5HT1-рецепторов активирует дофаминергическую нейропередачу и, следовательно, уменьшает выраженность депрессии, негативной симптоматики и когнитивных нарушений, а блокада 5HT7-рецепторов участвует в регуляции сна, процессов памяти и обучения, терморегуляции. Улучшение когнитивных функций также происходит при воздействии на 5HT6-рецепторы и адренорецепторы II типа. Сравнительные профили нейроре-цепторного связывания современных антипсихотических препаратов позволяют условно разделить антипсихотические препараты на 6 групп, подробное описание которых дано в главе 29.4 (табл. 29.3).
Таким образом, современный уровень знаний о нейрохимических механизмах действия антипсихотиков позволяет предложить новую, более патогенетически ориентированную фармакодинамическую классификацию этой группы психотропных средств (табл. 11.9), которая в значительной степени может предсказать спектр психотропной активности, переносимость и вероятные лекарственные взаимодействия того или иного препарата. Другими словами, профиль нейрохимической активности препарата в существенной мере определяет особенности клинического действия, которыми нужно руководствоваться при выборе того или иного нейролептика у конкретного больного.
Данная классификация имеет большое значение для практики, так как позволяет прогнозировать эффективность и переносимость той или иной группы антипсихотиков и на этом основании проводить дифференцированный выбор терапии. Однако эта классификация не лишена недостатков. При схожести профилей биохимической активности с клинических позиций вряд ли правомерно отнесение к одной группе сульпирида, амисульприда и галоперидола в силу различий величины антипсихотического эффекта и риска экстрапирамидных расстройств, или клозапина и кветиапина - из-за выраженного различия антипсихотического эффекта. Эти особенности клинического действия препаратов связаны с другими индивидуальными фармакодинамическими параметрами. На эффективность и переносимость, помимо специфичности рецепторного связывания, влияют порог занятости числа рецепторов (клинический эффект наступает при блокаде более 60-70% рецепторов), рецеп-торная активность (агонизм-антагонизм) и сила аффинитета к рецепторам в разных структурах мозга, которая определяется временем диссоциации (освобождения) молекулы препарата из мест рецепторного связывания (рис. 11.3).
Таблица 11.9. Клинико-нейрохимическая классификация антипсихотических препаратов
| Группы и особенности нейрохимического действия | Препараты | Клинические эффекты |
|---|---|---|
I. Селективные блокаторы дофаминовых рецепторов |
Галоперидол, сульпирид, амисульприд |
Выраженное антипсихотическое действие. Антинегативные, дезингибирующие эффекты (при применении в небольших дозах). Высокий риск ЭПС и ГП |
II. Активные блокаторы дофаминовых рецепторов и умеренные блокаторы серотониновых и αгадренергических рецепторов |
Трифлуоперазин, перфеназин, флуфеназин, зуклопентиксол, флупентиксол |
Выраженное антипсихотическое действие. Высокий риск ЭПС и ГП, умеренный риск гипотензии |
III. Неизбирательные блокаторы дофаминовых и серотониновых рецепторов с недифференцированным влиянием на рецепторы других нейромедиаторных систем |
Хлорпромазин, левомепромазин, тиоридазин, хлорпротиксен |
Выраженное седативное действие, умеренный антипсихотический эффект. Низкий или умеренный риск ЭПС и ГП, высокий риск вегетативных (адрено-литических, холинолитических и антигистаминных побочных эффектов) |
IV. Сбалансированные блокаторы дофаминовых и серотониновых рецепторов при умеренной активности в отношении αгадренергических рецепторов |
Рисперидон, зипрасидон, сертиндол, палиперидон |
Отчетливое антипсихотическое и умеренное антинегативное действие. Умеренный риск сердечно-сосудистых нарушений. Относительно низкий риск ЭПС и нейроэндокринных нарушений (за исключением дозозависимых эффектов и ГП у рисперидона и палиперидона) |
V. Блокаторы серотониновых и в меньшей степени дофаминовых рецепторов с недифференцированным влиянием на рецепторы других нейромедиаторных систем |
Клозапин, оланзапин, кветиапин, азенапин |
Выраженное или умеренное антипсихотическое и седативное действие. Высокий риск метаболических нарушений, вегетативных побочных эффектов и др., низкий риск ЭПС и нейроэндокринных нарушений |
VI. Частичные агонисты дофаминовых рецепторов |
Арипипразол, амисульприд (?) |
Умеренное антипсихотическое и антинегативное действие с дезингибирующим компонентом. Низкий риск ЭПС, нейроэндокринных, метаболических и вегетативных побочных эффектов |
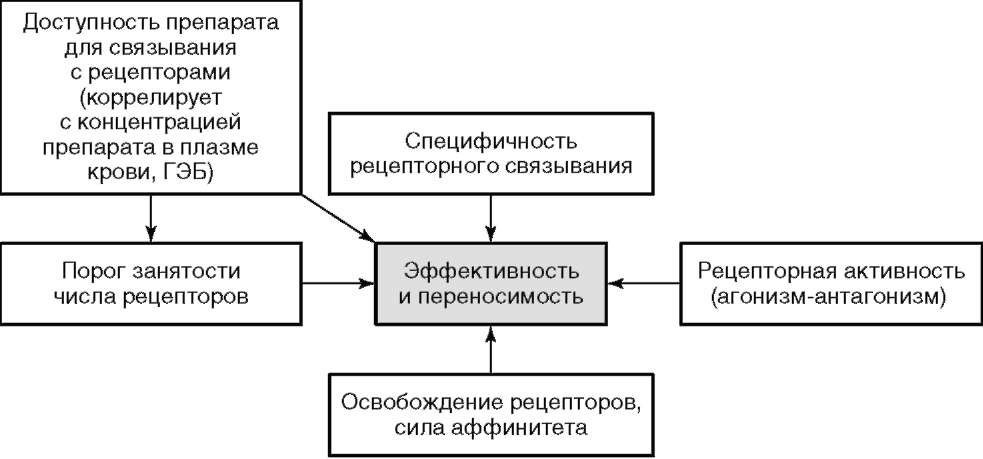
Рис. 11.3. Фармакологические факторы, влияющие на клиническую эффективность антипсихотической терапии. ГЭБ - гематоэнцефалический барьер
Например, сульпирид в небольших дозах связывается преимущественно с пресинаптическими D3-рецепторами, которые усиливают выброс дофамина и вызывают парадоксальный дезингибирующий, активирующий эффект, а кветиапин слабо блокирует D2-рецепторы и быстро высвобождается из мест связывания, что в клинике проявляется относительно слабым антипсихотическим эффектом и полным отсутствием ЭПС. Кроме того, аффинитет отдельных рецепторов к D2-рецепторам в различных структурах мозга может различаться. Имеет значение и доступность препарата для связывания с рецепторами, которая коррелирует с концентрацией препарата в плазме крови и цереброспинальной жидкости (см. рис. 11.3). В частности, рисперидон и его метаболит (палиперидон) плохо проникают через гематоэнцефалический барьер, и чтобы обеспечить эффективную блокаду D2-рецепторов в лимбических структурах, его концентрация в крови должна быть выше, чем у других препаратов, что повышает вероятность блокады этих рецепторов в гипофизарной области, которая, как известно, находится за пределами гематоэнцефалического барьера и непосредственно омывается кровью. С этим, в частности, связывается повышенный риск развития ГП.
Разнообразные клинические проявления шизофрении, по-видимому, не являются следствием поражения какого-либо одного нейробиологического субстрата, а связаны с вовлечением в патогенез множества нейрональных путей с различными нейромедиаторными и нейрорецепторными механизмами. Поскольку каузальной терапии шизофрении не найдено, воздействие на те или иные сферы психопатологической симптоматики более эффективно с помощью применения либо препаратов с широким мультирецепторным механизмом действия, либо комбинированной терапии, более прицельно влияющей на затронутые нейрорецепторные системы (Мосолов С.Н., 2010).
В спектре клинической активности антипсихотиков выделяют несколько определяющих параметров:
-
глобальное антипсихотическое (инцизивное) действие - способность препарата равномерно редуцировать различные проявления психоза и препятствовать прогредиентности заболевания;
-
первичное седативное (затормаживающее) действие, необходимое для быстрого купирования галлюцинаторно-бредового или маниакального возбуждения, сопровождается глобальным депримирующим действием на ЦНС, в том числе явлениями брадипсихизма, нарушениями концентрации внимания, снижением вигилитета (уровня бодрствования) и гипнотическим действием;
-
избирательное (селективное) антипсихотическое действие связано с преимущественным воздействием на отдельные симптомы-мишени, например бред, галлюцинации, расторможенность влечений, нарушения мышления или поведения; обычно развивается вторично вслед за глобальным антипсихотическим эффектом;
-
активирующее (растормаживающее, дезингибирующее и антиаутистическое) антипсихотическое действие обнаруживается прежде всего у больных шизофренией с негативной (дефицитарной) симптоматикой;
-
когнитотропное действие - способность некоторых атипичных антипсихотиков улучшать высшие корковые функции (память, внимание, исполнительскую деятельность, коммуникативные и познавательные процессы);
-
депрессогенное действие - способность некоторых, преимущественно седативных, антипсихотиков при длительном применении вызывать специфические (заторможенные) депрессии; некоторые препараты (например, кветиапин, арипипразол, сертиндол, зипрасидон, тиоридазин, флупентиксол, сульпирид) обладают определенной способностью редуцировать депрессивную симптоматику у больных шизофренией;
-
неврологическое (экстрапирамидное) действие связано с влиянием на экстрапирамидную систему; проявляется неврологическими нарушениями - от острых (пароксизмальных) до хронических (практически необратимых); неврологическое действие минимально у атипичных антипсихотиков;
-
соматотропное действие связано в основном с выраженностью адренолитических, антигистаминных и антихолинергических свойств препарата; проявляется в нейровегетативных и эндокринных побочных эффектах, в том числе гипотензивных реакциях, ГП и метаболических нарушениях.
Наибольшее значение при выборе нейролептика имеет соотношение глобального антипсихотического действия с первичным седативным. На этом основании выделяют:
-
группу седативных антипсихотиков (левомепромазин, хлорпромазин, про-мазин, хлорпротиксен, алимемазин, перициазин и др.), которые независимо от дозы быстро вызывают определенный затормаживающий эффект;
-
препараты с мощным глобальным антипсихотическим действием, или инцизивные антипсихотики (галоперидол, зуклопентиксол, пипотиазин, тио-проперазин®, трифлуоперазин, флуфеназин), которым при применении в малых дозах свойственны активирующие эффекты, а с увеличением дозы возрастают и их купирующие психотическую (галлюцинаторно-бредовую) и маниакальную симптоматику свойства.
Дезингибирующие антипсихотики (сульпирид и др.), преимущественно (т.е. в большом диапазоне доз) обладающие растормаживающим, активирующим действием.
Отдельную группу в силу особого механизма действия и спектра психотропной активности составляют так называемые атипичные антипсихотики, или антипсихотики второго поколения (АВП) (клозапин, оланзапин, рисперидон, кветиапин, арипипразол, сертиндол, палиперидон, амисульприд, зипрасидон, азенапин и др.), которые, в отличие от традиционных нейролептиков или антипсихотиков первого поколения (АПП), обладая отчетливым антипсихотическим эффектом, не вызывают или вызывают дозозависимые экстрапирамидные расстройства и способны корригировать негативные и когнитивные нарушения у больных шизофренией. Наиболее выраженным глобальным антипсихотическим эффектом среди атипичных антипсихотиков обладают клозапин, оланзапин и рисперидон. Клозапин обычно рассматривается как препарат резерва и применяется преимущественно в случаях резистентности к другим антипсихотическим средствам. Внутримышечное введение оланзапина и зипрасидона применяется для купирования выраженного психомоторного возбуждения при шизофрении и маниакальных состояниях. Седативное действие наиболее выражено у клозапина, кветиапина и оланзапина, дезингибирующая активность - у сертиндола, арипипразола, палиперидона, азенапина и амисульприда (при применении в дозах до 300 мг/сут). Кветиапин показан также для лечения депрессивных состояний при биполярном аффективном расстройстве, при генерализованном тревожном расстройстве; кветиапин и арипипразол используются также как средство для усиления действия антидепрессантов при резистентных депрессиях. Клозапин применяется также у больных с повторными суицидальными попытками для коррекции и профилактики суицидоопасного поведения. Другими словами, второе поколение антипсихотических средств представляется неоднородной группой препаратов, существенно различающихся как по механизму действия, так и по спектру клинической активности.
Дифференцированный подход к назначению осуществляется с учетом клинической картины, индивидуальной переносимости и в соответствии со спектром психофармакологического действия и побочных эффектов антипсихотического препарата.
При шизофрении антипсихотики могут применяться как курсом для купирования острого психоза, так и длительно в целях непрерывного подавления продуктивной симптоматики при хроническом течении психоза или для профилактики рецидивов и сдерживания темпа прогредиентности, а также для коррекции негативных (дефицитарных) расстройств.
Существенно облегчает проведение длительной амбулаторной терапии применение пролонгированных форм антипсихотиков (галоперидола деканоат, зуклопентиксола деканоат, флуфеназина деканоат, флупентиксола деканоат, рисперидон микросферы, палиперидона пальмитат). Пролонгированные формы позволяют обеспечить максимальную непрерывность терапевтического воздействия, надежный контроль их приема в случае несоблюдения больными режима терапии, а также более низкие суммарную дозу препарата и стоимость лечения.
Назначение антипсихотических препаратов в сочетании (особенно вместе с атипичными антипсихотиками) не рекомендуется (во всех современных клинических руководствах рекомендуется проведение монотерапии), поскольку возрастает риск развития побочных явлений и преждевременной смертности вследствие лекарственных взаимодействий. Однако в некоторых клинических ситуациях, например при сочетании галлюцинаторно-бредовой симптоматики с некупируемым возбуждением, иногда допустимо назначать в виде короткого курса два нейролептика: один - с седативным эффектом, другой - с мощным антипсихотическим (например, галоперидол с левомепромазином, хлорпротиксеном или хлорпромазином), или сочетание инцизивного антипсихотика с анксиолитиком (например, галоперидол с бромдигидрохлорфенилбензодиазепином (Феназепамом♠) или лоразепамом). Существуют и другие клинические показания для совместного назначения антипсихотиков и психофармакологических препаратов других классов, например антидепрессантов при развитии депрессии. Однако в этом случае требуется более тщательный и частый мониторинг физического состояния больных.
Дозы антипсихотика подбирают индивидуально. При отсутствии ургентных показаний (например, острый психоз или сильное возбуждение) дозу обычно повышают постепенно до достижения терапевтического результата. Вначале вводят небольшую тестовую дозу (например, 25-50 мг хлорпромазина), при отсутствии в течение 2 ч аллергических или других реакций (повышение температуры тела, острые дискинезии) дозу постепенно увеличивают.
При замене одного антипсихотика другим следует руководствоваться следующими примерными эквивалентами доз для приема внутрь (так называемые хлор-промазиновые или аминазиновые эквиваленты) (табл. 11.10).
Таблица 11.10. Спектр психотропной активности, дозы и хлорпромазиновые эквиваленты антипсихотических средств
| Препарат | Седативное действие | Антипсихотическое действие | Аминазиновый эквивалент, усл. ед. | Средняя суточная доза, мл | Суточные дозы, применяемые в стационаре, мг |
|---|---|---|---|---|---|
Хлорпромазин |
++++ |
++ |
1,0 |
300 |
100-800 |
Левомепромазин |
++++ |
+ |
1,5 |
200 |
100-500 |
Клозапин |
++++ |
+++ |
2,0 |
150 |
50-900 |
Тиоридазин |
+++ |
+ |
1,0 |
300 |
150-800 |
Хлорпротиксен |
+++ |
++ |
2,0 |
150 |
30-500 |
Перициазин |
+++ |
+ |
1,5 |
200 |
100-300 |
Зуклопентиксол |
+++ |
+++ |
4,0 |
75 |
25-150 |
Кветиапин |
+++ |
++ |
1,0 |
400 |
50-750 |
Алимемазин |
++ |
+ |
3,0 |
100 |
25-400 |
Перфеназин |
++ |
++ |
8,0 |
36 |
12-64 |
Трифлуоперазин |
++ |
+++ |
15,0 |
20 |
10-60 |
Галоперидол |
++ |
++++ |
20,0 |
15 |
5-100 |
Дроперидол |
++ |
++++ |
50,0 |
6 |
2-40 |
Оланзапин |
++ |
+++ |
30,0 |
10 |
5-20 |
Зипрасидон |
++ |
++ |
2,5 |
120 |
40-160 |
Тиаприд |
++ |
+ |
1,0 |
300 |
200-600 |
Флупентиксол |
+ |
++ |
20,0 |
12 |
3-18 |
Рисперидон |
+ |
+++ |
75,0 |
4-6 |
2-8 |
Флуфеназин |
+ |
++ |
35,0 |
8 |
2-20 |
Азенапин |
+ |
++ |
20,0 |
15 |
10-20 |
Палиперидон |
+ |
++ |
33,0 |
9 |
6-12 |
Сертиндол |
- |
++ |
20,0 |
16 |
8-20 |
Арипипразол |
- |
++ |
20,0 |
15 |
10-30 |
Амисульприд |
- |
+++ |
1,0 |
400 |
150-800 |
Сульпирид |
- |
+ |
0,5 |
600 |
200-240 |
Примечание. ++++ - сильное (максимально выраженное) действие, +++ - выраженное, ++ - умеренное, + - слабое, - -действие отсутствует. Препараты упорядочены по степени убывания седативных свойств и нарастанию активирующих.
Приведенные дозы и хлорпромазиновые эквиваленты используют при пероральном приеме препаратов, в случае парентерального введения дозу следует уменьшить в среднем в 2 раза. Подбор более высоких доз должен проводиться в специализированных учреждениях. Приведенные хлорпромазиновые эквиваленты не могут быть экстраполированы на максимальные дозы препаратов. Использование высоких доз, превосходящих рекомендуемые, не обнаружило прироста терапевтической эффективности, но может приводить к увеличению числа побочных эффектов. Низкие дозировки (меньше 300 мг хлорпромазинового эквивалента в сутки) обычно не обеспечивают достижение желательного терапевтического эффекта, а дозировки, превышающие 900 мг хлорпромазинового эквивалента, не дают увеличения эффективности в сравнении с использованием средних дозировок (категория доказательности A).
Согласно концепции хлорпромазиновых эквивалентов, которые, в целом, соответствуют силе связывания препарата с D2 -рецепторами, все нейролептики представляются взаимозаменяемыми и делятся на низкопотентные, требующие применения высоких терапевтических доз и имеющие маленький хлорпромазиновый эквивалент (к ним относятся преимущественно седативные нейролептики), и высокопотентные, при применении которых аналогичный антипсихотический эффект достигается с использованием более низких дозировок. В эту группу попадают преимущественно мощные, инцизивные нейролептики, имеющие соответственно высокий хлорпромазиновый эквивалент и способные предотвращать прогрессирование шизофренического процесса.
При переходе с типичного антипсихотика на атипичный обычно проводят постепенную отмену старых препаратов с «наложением» по времени новой терапии. Седативные антипсихотики с выраженным антихолинергическим действием отменяют медленнее, чем инцизивные препараты. В среднем дозу снижают на 30-50% каждые 3 дня.
При проведении терапии и подборе доз имеют значение некоторые фармакокинетические параметры, которые для нового поколения антипсихотических средств приведены в табл. 11.11. Большинство антипсихотиков при пероральном приеме быстро всасываются из желудочно-кишечного тракта и подвергаются экстенсивному печеночному метаболизму различными изоэнзимами цитохрома Р450. Препараты, ингибирующие эти субстраты (например, большинство селективных ингибиторов реаптейка серотонина), могут повышать концентрацию антипсихотика в плазме крови. После глюкуронирования в печени метаболиты выводятся с мочой и калом. Единственными препаратами среди атипичных антипсихотиков, которые подвергаются незначительному метаболизму в печени и выводятся почками в неизмененном виде, являются амисульприд и палиперидон. Как правило, активное вещество обладает высокой липофильностью и легко проникает через гематоэнцефалический барьер. Период полувыведения основных нейролептиков (галоперидол, хлорпромазин) составляет около суток, пик концентрации в плазме крови достигается через 3-4 ч, метаболизм осуществляется преимущественно изо-энзимами 2D6 и 3А4.
Таблица 11.11. Фармакокинетика атипичных антипсихотиков
| Препарат | Пик концентрации в плазме крови, ч | Связывание с белками крови, % | Период полувыведения, ч | Активные метаболиты | Биодоступность, % | Метаболизм через цитохром Р450 |
|---|---|---|---|---|---|---|
Азенапин |
0,5-1,5 |
95 |
13-39 |
+ |
35 |
1А2; 3А4; реже 2D6 |
Амисульприд |
1-3 |
17 |
11-13 |
>70 |
23% с мочой в неизмененном виде |
|
Арипипразол |
3-5 |
>99 |
75-146 |
+ |
87 |
3А4; 2D6 |
Зипрасидон |
6-8 |
>99 |
4-10 |
+/- |
60 |
3А4; 1А2 |
Кветиапин |
1,2-1,8 |
83 |
6 |
+/- |
≥73 |
3А4 |
Клозапин |
2,5-3 |
95 |
8-12 |
+/- |
27-47 |
1А2; 2Е1; 3А4; 2С19 |
Оланзапин |
5-8 |
93 |
21-54 (30) |
- |
60 |
1А2; 2D6; UGT |
Палиперидон |
24 |
79 |
24 |
- |
>70 |
60% с мочой в неизмененном виде |
Рисперидон |
1-2 |
90 |
3-20 |
+ |
70 |
2D6; 3А4 |
Сертиндол |
10 |
>99 |
48-96 |
+ |
~74 |
2D6; 3А4 |
UGT - уридинглюкуронозилтрансфераза.
Отмена антипсихотических препаратов должна проводиться постепенно под тщательным контролем врача во избежание риска развития синдрома отмены или обострения симптоматики.
Наиболее частыми и тяжелыми побочными эффектами антипсихотической фармакотерапии являются экстрапирамидные. Риск их развития выше при лечении нейролептиками из группы пиперазиновых фенотиазинов и бутирофенонов. Их легко распознать, а возникновение весьма трудно предвидеть, так как оно связано с дозировкой, особенностями самого препарата и индивидуальной чувствительностью больного. Клиническими формами экстрапирамидных нарушений являются:
-
паркинсонические симптомы (например, тремор, мышечная ригидность, в том числе симптом «зубчатого колеса», двигательная заторможенность, гипоми-мия), которые могут нарастать постепенно;
-
дистоническая симптоматика (гиперкинезы лица и туловища, например тор-тиколлис, окулогирный криз), которая может наблюдаться уже после приема первых доз;
-
акатизия (неусидчивость), которая может быть ошибочно расценена как усиление психомоторного возбуждения вследствие основного заболевания;
-
поздняя дискинезия, развивающаяся, как правило, при длительном применении инцизивных нейролептиков.
Паркинсоническая симптоматика исчезает после отмены препарата или может быть уменьшена назначением центральных холинолитических средств, так называемых корректоров нейролептической терапии (табл. 11.12).
Использование этих препаратов для профилактики экстрапирамидных расстройств при антипсихотической терапии необоснованно и не рекомендуется, так как экстрапирамидные расстройства развиваются не у каждого больного (Rummel-Kluge C. et al., 2012). Кроме того, антипаркинсонические препараты могут способствовать развитию поздней дискинезии и ухудшать ее течение, а также вызывать лекарственную зависимость и когнитивные нарушения. К наиболее распространенным корректорам нейролептической терапии с антихолинергическим действием относятся бипериден и тригексифенидил. Оба препарата обладают центральной и периферической способностью блокировать м-холинорецепторы и ганглиоблокирующей активностью, уменьшают тремор, мышечную ригидность и брадикинезию. Бипериден в несколько меньшей степени блокирует периферические рецепторы и может вызывать психомоторное возбуждение, а тригексифенидил обладает слабым дозозависимым эйфоризирующим эффектом. Препараты противопоказаны при закрытоугольной глаукоме, задержке мочи, кишечной непроходимости и гиперплазии предстательной железы и могут вызывать следующие побочные явления: сухость во рту, мидриаз, парез аккомодации, диспепсию, запоры, задержку мочи, тахикардию, снижение АД, слабость, головокружение, спутанность, делириозную симптоматику, кожную сыпь, нарушения памяти. При острых нейролептических дискинезиях помогает в/м или в/в введение антагониста Н1 гистаминовых рецепторов - дифенгидрамина, при парентеральном введении которого возможно снижение АД вследствие ганглиоблокирующего действия, а также снижение судорожного порога.
Основную опасность представляет поздняя дискинезия, так как она носит необратимый характер, не исчезает после отмены терапии и практически не поддается лечению. К группе повышенного риска относятся больные пожилого возраста, длительно получающие нейролептики в высоких дозах, что требует более частого и внимательного контроля их состояния. В редких случаях поздняя дискинезия может развиться после кратковременного применения нейролептика в небольших дозах. Поздняя дискинезия значительно реже возникает при использовании АВП.
Гипотензия и нарушения терморегуляции - дозозависимые побочные эффекты, которые могут привести к травме из-за внезапного падения или к гипотермии, особенно у пожилых больных; поэтому назначение нейролептиков больным после 70 лет должно иметь очень серьезные основания.
| Экстрапирамидные симптомы | Рекомендуемое лечение |
|---|---|
Острая дистония |
По 5-10 мг биперидена, по 2 мг тригексифенидила или дифенилгидрамин по 50-75 мг |
Псевдопаркинсонизм |
77sizeяяя Тригексифенидил по 2-12 мг (в отдельных случаях до 20 мг), бипериден по 5-10 мг |
Акатизия |
Пропранолол по 10-20 мг, бипериден по 5-10 мг, бензодиазепины [диазепам по 5-10 мг, бромдигидрохлорфенилбензодиазепин (Феназепам♠) по 0,5-1 мг] |
ЗНС |
Отмена нейролептика; детоксикационная, инфузионная и гомеостатическая терапия |
Поздняя дискинезия |
По возможности прекращение приема нейролептика тетра-беназин; витаминотерапия (С, Е); смена препарата, предпочтительно использование атипичных антипсихотиков |
ЗНС (акинеторигидный симптомокомплекс; центральная лихорадка; вегетативные расстройства - колебания сосудистого тонуса, тахикардия, бледность, профузный пот; недержание мочи; спутанность сознания; ступор) - редкое, опасное для жизни состояние; может развиться при лечении любым нейролептиком (Weinmann S., Read J., Aderhold V., 2009). При его возникновении необходимы неотложные мероприятия: отмена нейролептика, назначение корректоров, антипиретиков, бензодиазепинов; дезинтоксикационная, инфузионная и гомеостатическая терапия; мышечные релаксанты (дантролен); непрямые агонисты дофамина (бромокриптин). Продолжительность синдрома (обычно 5-10 дней после отмены нейролептика) может существенно удлиняться в случае использования пролонгированных антипсихотиков.
К общим противопоказаниям относят индивидуальную непереносимость, токсический агранулоцитоз в анамнезе, закрытоугольную глаукому, аденому предстательной железы (для препаратов с антихолинергическими свойствами), порфирию, паркинсонизм, феохромоцитому (для бензамидов), аллергические реакции на нейролептики в анамнезе, тяжелые нарушения функции почек и печени, заболевания сердечно-сосудистой системы в стадии декомпенсации, острые лихорадочные состояния, интоксикацию веществами, угнетающими ЦНС, кому, беременность, кормление грудью (особенно производные фенотиазина).
Несмотря на лучшую, в целом, переносимость, особенно в отношении развития ЭПС, при применении АВП нередко наблюдаются увеличение массы тела (особенно при применении клозапина и оланзапина), головокружение, ортостатическая гипотония (особенно в период титрации дозы), сопровождающаяся в некоторых случаях ритмом синкоп или рефлекторной тахикардией, ЭПС (как правило, нерезко выраженная и транзиторная, корригируемая снижением дозы или анти-холинергическими препаратами), редко - поздняя дискинезия (при длительном приеме), крайне редко - удлинение интервала QT с нарушением ритма (сертиндол, азенапин, зипрасидон), судорожный синдром (клозапин), диабет 2-го типа (инсулинорезистентная гипергликемия), особенно у предрасположенных больных (при применении клозапина и оланзапина) (Peterson K. et al., 2010).
Следует соблюдать осторожность при лечении атипичными антипсихотиками больных с заболеваниями сердечно-сосудистой системы (в том числе с удлинением интервала QT на ЭКГ), метаболическими нарушениями, диабетом 2-го типа, эпилепсией и БП. Они в меньшей степени, по сравнению с классическими нейролептиками, усиливают действие алкоголя и влияют на скорость реакций, что важно для больных, занятых потенциально опасными видами деятельности и управляющих транспортными средствами. Учитывая способность некоторых препаратов ускорять клиническое манифестирование диабета 2-го типа, у предрасположенных больных перед началом лечения рекомендуется проводить тест на толерантность к глюкозе («сахарную кривую»), а в процессе терапии определять содержание глюкозы 1 раз в 3 мес в течение года и каждые 6 мес в последующем.
Наиболее частые побочные эффекты атипичных антипсихотиков: увеличение массы тела (особенно при применении клозапина и оланзапина, реже - при применении рисперидона и кветиапина), головокружение, ГП (особенно при применении рисперидона, амисульприда, палиперидона и, реже, оланзапина), орто-статическая гипотензия (особенно в период титрации дозы), сопровождающаяся в некоторых случаях ритмом синкоп или рефлекторной тахикардией, ЭПС (как правило, нерезко выраженная и транзиторная, корригируемая снижением дозы или антихолинергическими препаратами), редко - поздняя дискинезия (при длительном приеме), крайне редко - ЗНС и диабет 2-го типа (инсулинорезистентная гипергликемия), особенно у предрасположенных больных (при применении кло-запина и оланзапина) (Rummel-Kluge C. et al., 2010). При применении клозапина возможно развитие лейкопении или агранулоцитоза (что требует регулярного мониторинга лейкоцитарной формулы крови), а также судорожного синдрома (дозозависимый эффект) и миокардита (в первые месяцы лечения). Все эти побочные явления требуют немедленной отмены препарата.
Сертиндол, зипрасидон, азенапин и тиоридазин могут удлинять интервал QT и вызывать потенциально опасные для жизни нарушения сердечного ритма, поэтому при их применении необходимы ЭКГ-мониторинг и определение содержания калия и магния в плазме крови, особенно в период подбора дозы. Реже удлинение интервала QT наблюдалось при применении галоперидола и рисперидона. При удлинении интервала QT более 450 мс препарат следует отменить.
Частота возникновения побочных эффектов при назначении некоторых препаратов представлена в табл. 11.13.
Таблица 11.13. Частота развития побочных эффектов при применении атипичных антипсихотиков и галоперидола
Препарат |
||||||||||
Побочные эффекты |
Галоперидол |
Арипипразол |
Амисульприд |
Зипрасидон |
Клозапин |
Кветиапин |
Оланзапин |
Палиперидон |
Рисперидон |
Сертиндол |
Акатизия/паркинсонизм |
+++ |
+ |
++ |
+ |
0 |
+ |
+ |
+ |
++ |
+ |
Поздняя дискинезия |
+++ |
? |
(+) |
? |
0 |
? |
(+) |
? |
(+) |
? |
Судорожный синдром |
+ |
0 |
0 |
0 |
++ |
0 |
0 |
0 |
0 |
0 |
Удлинение интервала QT |
(+) |
(+) |
(+) |
+ |
(+) |
(+) |
(+) |
(+) |
(+) |
+ |
Нарушения обмена глюкозы |
(+) |
0 |
(+) |
0 |
+++ |
+ |
+++ |
(+) |
+ |
0 |
Нарушения липидного обмена |
(+) |
0 |
(+) |
0 |
+++ |
+ |
+++ |
+ |
+ |
0 |
Запоры |
+ |
? |
++ |
0 |
+++ |
+ |
++ |
+ |
++ |
0 |
Гипотензия |
+ |
+ |
(+) |
+ |
++ |
() |
() |
+ |
++ |
+ |
Агранулоцитоз |
0 |
0 |
0 |
0 |
+ |
0 |
0 |
0 |
0 |
0 |
Увеличение массы тела* |
+ |
(+) |
+ |
(+) |
+++ |
++ |
+++ |
++ |
++ |
(+) |
ГП |
+++ |
0 |
+++ |
(+) |
0 |
(+) |
(+) |
+++ |
+++ |
0 |
Галакторея |
++ |
0 |
++ |
0 |
0 |
0 |
0 |
++ |
++ |
0 |
Дисменорея |
++ |
0 |
++ |
0 |
0 |
(+) |
0 |
++ |
++ |
0 |
Седация |
+ |
(+) |
(+) |
(+) |
+++ |
++ |
(+) |
+ |
0 |
|
ЗНС |
(+) |
? |
? |
? |
(+) |
(+) |
(+) |
? |
(+) |
? |
Холинолитические нарушения |
(+) |
0 |
0 |
(+) |
+++ |
+ |
++ |
(+) |
(+) |
(+) |
Сексуальные нарушения |
+ |
(+) |
+ |
(+) |
++ |
(+) |
+ |
+ |
+ |
(+) |
Приапизм |
(+) |
(+) |
? |
(+) |
? |
(+) |
(+) |
? |
(+) |
? |
Нарушение моторики желудочно-кишечного тракта, эзофагеальный рефлюкс, аспирация пищи |
(+) |
(+) |
? |
(+) |
(+) |
(+) |
(+) |
? |
(+) |
? |
Примечания. 0 - отсутствуют, (+) - отдельные случаи (отсутствует разница с плацебо), + - очень редкие побочные эффекты (менее 1%), ++ - редкие побочные эффекты (менее 10%), +++ - частые побочные эффекты (более 10%), ? - данные отсутствуют. * - увеличение массы тела в течение 6-10 нед: + - незначительное (0-1,5 кг), ++ - среднее (1,5-3 кг), +++ - сильное (более 3 кг).
Кроме того, как следует из табл. 11.11, атипичные антипсихотики большей частью активно метаболизируются в печени и являются субстратом для серьезных лекарственных взаимодействий.
Пролонгированные формы антипсихотиков, используемые для поддерживающей или противорецидивной терапии у больных с хроническими формами шизофрении, облегчают возможность проведения непрерывного лечения в случаях несоблюдения режима терапии; при длительном применении достигается ресурсосберегающий эффект за счет более низкой стоимости курсовой терапии.
К преимуществам пролонгированных лекарственных форм нейролептиков, по сравнению с пероральными, относят:
-
максимальную непрерывность терапевтического воздействия и более высокую эффективность при длительном применении;
-
надежный контроль за приемом нейролептика, что снижает необходимость контролировать врачом соблюдение режима терапии (регулярное посещение врача);
-
в случае развития рецидива становится ясно, что это не связано с несоблюдением терапевтического режима (облегчается принятие правильного решения о дальнейшей терапии);
-
более стабильную и низкую равновесную концентрацию нейролептика в крови (уменьшение риска развития «пиковых» побочных эффектов) и доступность препарата непосредственно в мозге;
-
более безопасное достижение принципа минимальной эффективной дозы (поэтапное снижение);
-
избегание проблем с абсорбцией в желудочно-кишечном тракте и эффектов, связанных с эффектом «первого прохождения через печень и кишечник», более предсказуемый метаболизм и редкие лекарственные взаимодействия;
-
более низкую суммарную дозу препарата, необходимого для терапевтического воздействия, что снижает риск развития поздних дискинезий, требует значительно меньших доз корректоров и уменьшает общую стоимость лечения;
-
уменьшение риска случайной или преднамеренной передозировки;
-
более удобный для работающих больных лекарственный режим, что имеет важное психотерапевтическое значение, поскольку сглаживает ощущение привязанности к ЛС;
-
более низкую курсовую стоимость лечения (фармакоэкономическая эффективность при длительном приеме с учетом снижения числа рецидивов и госпитализаций).
К минусам пролонгированных лекарственных форм традиционно относят уменьшение гибкости терапии, увеличение срока подбора оптимальной дозы, длительные период достижения равновесной концентрации препарата в плазме крови и период полувыведения, а также потенциальный риск развития тяжелых аллергических реакций и ЗНС с неизбежным длительным присутствием провоцирующего препарата в организме. Кроме того, инъекции масляных растворов довольно болезненны и могут вызывать местные воспалительные реакции. Больные также часто негативно первично относятся к инъекциям пролонгов, считая их дополнительным стигматизирующим фактором. Отчасти это связано с недостаточной информированностью пациентов о преимуществах такой терапии, что обычно случается, когда решение принимается врачом без консультации с больным и его родственниками. Вместе с тем после начала терапии большинство больных меняют свое негативное отношение, отмечая лучшую эффективность, переносимость и удобство применения по сравнению с таблетками, и предпочитают эти инъекции в последующем лечении.
Лечение обычно начинают в стационаре сразу после купирования острой психотической симптоматики. На фоне приема таблеток делают внутримышечно инъекцию препарата в минимальной дозе. Если больной ранее получал корректоры, их не отменяют. В случае хорошей переносимости (отсутствия побочных эффектов в течение первой недели лечения) дозу препарата с пролонгированным действием постепенно увеличивают, а таблетки отменяют. Цель лечения - поддержать оптимальный функциональный уровень больного с помощью минимально эффективной дозы (Uchida H. et al., 2011). После стабилизации психического состояния дозу нейролептика можно постепенно снижать двумя способами: либо уменьшая разовую дозу, либо увеличивая интервал между инъекциями (последнее правило неприменимо для рисперидона конста и палиперидона пальмитата). Антипсихотики пролонгированного действия вводят внутримышечно с интервалом 2-12 нед.
Подбор дозы осуществляют индивидуально. Примерные дозы и длительность действия препаратов приведены в табл. 11.14. При переводе больного с одного препарата на другой можно использовать следующие ориентировочные эквиваленты:
Эти эквиваленты не могут быть экстраполированы на максимальные дозы. При переводе больного на инъекционный рисперидон пролонгированного действия (Рисполепт Конста♠) с первой инъекцией вводят 25 мг (независимо от дозы типичного антипсихотика); обычно это делается за неделю до последней инъекции применяемого антипсихотика пролонгированного действия или вместо него.
Таблица 11.14. Примерные дозы и длительность действия антипсихотиков пролонгированного действия
| Препарат | Доза, мг | Длительность действия |
|---|---|---|
Галоперидола деканоат |
50-300 |
3-4 нед |
Зуклопентиксола ацетат |
50-200 |
3-4 сут |
Зуклопентиксола деканоат |
200-750 |
2-3 нед |
Палиперидона пальмитат месячного действия (Ксеплион♠) |
50-150 |
4 нед |
Палиперидона пальмитат трехмесячного действия (Тревикта♠) |
175-525 |
3 мес |
Рисперидон микросферы |
25-50 |
2 нед |
Флупентиксола деканоат |
20-200 |
2-3 нед |
Флуфеназин |
25-100 |
2-4 нед |
Верифицированных дифференцированных показаний к назначению препаратов пролонгированного действия не существует. Однако зуклопентиксол более показан при возбуждении и агрессивности, в то время как флупентиксол может усиливать эту симптоматику. Частота экстрапирамидных расстройств при использовании пролонгированных форм типичных антипсихотиков такая же, как при использовании непролонгированных препаратов. В наибольшей степени экстрапирамидные побочные явления выражены при применении флуфеназина деканоата и галоперидола деканоата. При назначении рисперидона конста и палиперидона пальмитата ЭПС развивается значительно реже. Препараты палиперидона не имеют клинически значимого печеночного метаболизма, поэтому их можно применять вместе с препаратами, метаболизируемыми изоферментами системы цитохрома Р450.
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ ПСИХОФАРМАКОТЕРАПИИ
В проведении медикаментозной терапии шизофрении выделяют 3 этапа.
Первый этап - купирующая терапия - начинается сразу же после постановки предварительного диагноза и заканчивается установлением клинической ремиссии, т.е. продолжается до существенной или полной редукции психоза. При адекватной антипсихотической фармакотерапии этот этап может продолжаться от нескольких недель до нескольких месяцев (для достижения полного терапевтического контроля состояния обычно требуется 4-8 нед). Основными задачами являются редукция тяжести психоза, коррекция нарушений поведения и сопутствующих симптомов (возбуждения, агрессии, суицидальных тенденций, кататонических и аффективных симптомов). Эффективность фармакотерапии тем выше, чем больше выражены признаки остроты психоза (острое начало, психомоторное возбуждение, напряженные аффекты - тревога, страх, экстаз, растерянность, депрессия, агрессивность, яркие галлюцинаторно-бредовые переживания, острый чувственный бред, нарушения сна, негативизм, расстройства сознания, грубые нарушения социальной адаптации), изменчивость, калейдоскопичность симптоматики и динамическая нестабильность состояния в целом. Эффективность ниже при постепенном развитии заболевания, наличии в преморбидном периоде личностных изменений, негативной симптоматики и когнитивных нарушений, при систематизированном интерпретативном бреде, гебефренической симптоматике, отсутствии признаков критического отношения к болезни, пассивности поведения, при застывших, малоподвижных формах с редукцией динамического потенциала и снижением реактивности.
Второй этап - долечивание или стабилизация - заключается в продолжении эффективной антипсихотической терапии вплоть до достижения ремиссии с полной или значительной редукцией продуктивной симптоматики; воздействии на негативную симптоматику и когнитивные нарушения; восстановлении, по возможности, прежнего уровня социальной адаптации больного. Этап может продолжаться от 3 до 9 мес (в среднем около 6 мес) от начала острой фазы заболевания. Обычная схема предполагает постепенное уменьшение дозы антипсихотика после установления ремиссии. Важно раннее выявление возможного рецидива и своевременное усиление антипсихотической терапии. При персистировании резидуальной негативной симптоматики необходимо ослабление седативного влияния препаратов, применявшихся в остром периоде, и подключение антипсихотических средств с дезингибирующей активностью c целью создания оптимального лекарственного режима для проведения психотерапии, налаживания интерперсональных связей и социально-трудовой реабилитации.
С учетом того что шизофрения обычно характеризуется хроническим и рецидивирующим течением, у большинства больных требуется переход к третьему этапу - длительной амбулаторной или противорецидивной терапии, которая направлена на удержание стабильной ремиссии, предотвращение развития новых психотических эпизодов (приступов) и замедление темпа прогредиентности заболевания. Этот этап, прежде всего, определяется спонтанными тенденциями течения процесса и частотой приступообразования. Обычно после двух и более психотических эпизодов терапия проводится неопределенно долго, но не менее 1-2 лет, чтобы можно было оценить ее эффективность. Этап включает сохранение достигнутой редукции позитивной симптоматики (симптоматической ремиссии), влияние на негативные и когнитивные расстройства, обеспечение противорецидивного эффекта, формирование приверженности терапии, а также поддержание доприступного уровня социального функционирования и качества жизни пациента.
Лечение проводят с учетом психопатологической структуры обострения (приступа), которая определяет выбор базового антипсихотического препарата, а также особенностей терапевтической или спонтанной трансформации синдрома в процессе лечения, с чем может быть связана замена или присоединение других методов терапии. Выбор препарата осуществляют с учетом спектра психотропной активности нейролептика и характера возникающих побочных эффектов, а также противопоказаний к применению и возможных лекарственных взаимодействий (Мосолов С.Н., Цукарзи Э.Э., Капилетти С.Г., 2012). Режим дозирования, средние и максимально допустимые суточные дозы и возможный путь введения конкретного антипсихотика зависят от характера и выраженности психопатологической симптоматики, соматического состояния и возраста больного.
В случае развития острого психоза (обострения, рецидива или экзацербации процесса) с актуализацией и генерализацией психотической симптоматики, нарастанием ее выраженности, явлениями страха, тревоги, выраженным психомоторным возбуждением, агрессивностью, враждебностью следует прибегать к назначению нейролептиков с выраженным седативным компонентом действия (клозапин, оланзапин, хлорпромазин, левомепромазин, хлорпротиксен и др.), в том числе парентерально.
При преобладании в структуре психоза галлюцинаторно-параноидных расстройств (психические автоматизмы, псевдогаллюцинации, бред воздействия, преследования) предпочтение отдают нейролептикам с выраженными антигаллюцинаторным и антибредовым эффектами (галоперидол, трифлуоперазин, рисперидон).
При полиморфизме психопатологических расстройств с симптоматикой более глубоких регистров (кататонической, гебефренной) и серьезной дезорганизацией всей психической деятельности, речевой разорванностью, грубыми нарушениями поведения необходимо назначение нейролептиков с мощным общим антипсихотическим (инцизивным) действием, таких как оланзапин, клозапин, зуклопентиксол (Fenton M., Coutinho E., Campbell C., 2004).
При купировании повторных эпизодов (рецидивов) выбор антипсихотической терапии должен основываться на предыдущем опыте лечения с учетом эффективности и переносимости прежних методов терапии, лекарственной формы препарата, наличия коморбидных психических и соматических расстройств, а также потенциальных лекарственных взаимодействий с сопутствующей терапией (Мосолов С.Н. и соавт., 2003; Hasan A. et al., 2012). К сожалению, доказательных исследований по изучению дифференцированного воздействия различных антипсихотиков на отдельные клинические синдромы и формы течения шизофрении не проводилось. Большая часть их была проведена на пациентах с параноидной формой шизофрении. Однако имеются отдельные доказательные данные по лечению больных с кататонией (кататонической формой шизофрении), большим удельным весом депрессивной, негативной симптоматики (резидуальная и простая форма шизофрении), а также при терапевтической резистентности. Доказательных исследований по терапии гебефренной и других рано начавшихся (ядерных) формах шизофрении не проводилось. Тем не менее имеется экспертное мнение о преимуществе в данных случаях АПП и АВП, обладающих более мощным глобальным антипсихотическим эффектом (галоперидол, зуклопентиксол, клозапин, оланзапин, рисперидон). В целом все АВП и АПП могут быть терапией выбора у пациентов с острым психотическим эпизодом (рис. 11.4) (категория доказательности A) (Leucht S., Corves C., Arbter D., 2009; Мосолов С.Н., Цукарзи Э.Э., Алфимов П.В., 2014). АВП характеризуются меньшим риском развития неврологических (экстрапирамидных) побочных эффектов, в особенности - поздней дискинезии и ЗНС. Более того, у АВП существуют определенные преимущества в отношении лучшей комплаентности и преждевременного прекращения терапии (категория доказательности B/С) (Johnsen E., Jorgensen H.A., 2008).
Необходимость смены препарата рассматривается только после того, как терапия настоящим антипсихотиком, в случае отсутствия противопоказаний и хорошей переносимости, была проведена в течение как минимум 4-6 нед в оптимальной терапевтической дозировке (категория доказательности C) (Tandon R. et al., 2008). В качестве промежуточного шага при отсутствии терапевтического эффекта целесообразно повышение дозы антипсихотика до максимально разрешенной в действующей на территории РФ инструкции к препарату. Достаточно часто проведение антипсихотической терапии сопровождается развитием ЭПС. В этом случае необходимо применение терапевтических мероприятий по ее купированию. При персистировании ЭПС в дальнейшем, несмотря на ее коррекцию, целесообразен перевод на другой антипсихотик с более благоприятным профилем неврологической переносимости (см. рис. 11.4).

Рис. 11.4. Алгоритм биологической терапии обострения шизофрении АПП - антипсихотики первого поколения, АВП - антипсихотики второго поколения , ЭСТ - электросудорожная терапия
В случае достижения терапевтического эффекта при приеме АПП без развития выраженных побочных явлений не рекомендуется смена АПП на АВП (категория доказательности C). В то же время при неэффективности АПП целесообразен перевод на терапию АВП (категория доказательности B) (см. рис. 11.4). При неэффективности второго курса антипсихотического препарата психотическая симптоматика расценивается как терапевтически резистентная с необходимостью проведения специальных лечебных мероприятий.
Терапевтически резистентная шизофрения диагностируется при отсутствии уменьшения выраженности психопатологической симптоматики и/или иных ключевых симптомов на фоне терапии двумя антипсихотиками различных химических классов (как минимум один из антипсихотиков должен быть АВП) в рекомендуемых терапевтических дозировках на протяжении как минимум 6-8 нед каждым препаратом. Первым шагом при указании на терапевтическую резистентность должен быть контроль приема терапии, в том числе, при возможности, путем определения концентрации ЛС в плазме крови. У пациентов с терапевтически резистентной шизофренией клозапин должен быть рассмотрен в качестве средства первой линии выбора (категория доказательности B) (см. рис. 11.4) (Wahlbeck K. et al., 1999; Данилов Д.С., 2010). Целевая дозировка клозапина распределяется в диапазоне 100-900 мг/сут (категория доказательности B/C) (Lewis S.W. et al., 2006). Пациенты, получающие терапию клозапином, требуют контроля гематологических и кардиологических побочных эффектов, а также изменений на ЭЭГ (снижение порога судорожной готовности). Комбинирование клозапина с другим АВП [предпочтительно амисульпридом (С), рисперидоном ©, арипипразолом (D)] может иметь преимущества в сравнении с монотерапией (McEvoy J.P. et al., 2006).
В определенных случаях при отсутствии эффекта терапии могут быть использованы другие терапевтические альтернативы, такие как иные АВП, стратегии аугментации (антидепрессанты, нормотимики) с учетом ключевых симптомов, комбинированная терапия антипсихотиками с ЭСТ, а также применение ТМС (особенно при преобладании вербального псевдогаллюциноза) или плазмафереза (ПФ) для преодоления явлений адаптации к ранее эффективной антипсихотической терапии. Однако доказательства эффективности данных стратегий ограничены (категория D). Также в качестве одного из «последних» терапевтических вариантов, возможно применение инсулинокоматозной терапии. Необходимо отметить ограниченность доказательных данных об эффективности инсулинокоматозной терапии, особенно в сравнении с другими противорезистентными методиками (категория доказательности С). Малоизученными являются аспекты безопасности инсулинокоматозной терапии, особенно отдаленные (категория доказательности D).
Некоторые АВП могут иметь преимущество над другими АВП и АПП в отношении общей эффективности и в отдельных клинических ситуациях (рис. 11.5) (категория доказательности B/C). Например, у больных с первым эпизодом шизофрении (манифестный приступ) aнтипсихотическая терапия должна проводиться с большой осторожностью ввиду высокого риска развития ЭПС. В связи с этим оптимальным является постепенная титрация дозы антипсихотика со стремлением использовать минимально возможную эффективную дозировку. У таких пациентов эффективная терапевтическая доза антипсихотика может быть ниже в сравнении с хроническими больными (категория доказательности A). Препаратами первого выбора могут быть как АПП, так и АВП (категория доказательности A). В связи с меньшим риском развития экстрапирамидных симптомов в случае первого эпизода шизофрении предпочтение в первую очередь должно быть отдано АВП (категория доказательности C). Особое внимание на этом этапе заболевания должно уделяться созданию оптимального лекарственного режима для проведения психотерапевтических и социально-реабилитационных мероприятий, а также для формирования приверженности к терапии.
При терапии негативных симптомов шизофрении следует дифференцировать первичные и вторичные негативные симптомы (Мосолов С.Н., 2001). Невозможно сделать выводы об общем превосходстве АВП над АПП в отношении терапии вторичных негативных симптомов, однако некоторые АВП имеют преимущество в отношении терапии первичных негативных симптомов (категория доказательности B). Имеются достаточные данные об эффективности амисульприда и оланзапина (категория доказательности A) и некоторые данные об эффективности кветиапина и зипрасидона (категория доказательности B) в терапии больных шизофренией с преимущественно негативной (первичной) симптоматикой (см. рис. 11.5) (Kirkpatrick B. et al., 2006). АПП также эффективны в терапии вторичных негативных симптомов, за исключением связанных с ЭПС (категория доказательности A), при этом нет достаточных данных об их эффективности у больных с преобладанием первичной негативной симптоматики. Имеются ограниченные и, в целом, противоречивые данные об эффективности некоторых антидепрессантов (преимущественно СИОЗС) при их комбинированном назначении с антипсихотиками (категория доказательности D). Более убедительные результаты получены при применении миртазапина в комбинации как с АПП, так и с АВП (категория доказательности B).
Наличие когнитивных нарушений является основной преградой для социальной и профессиональной реабилитации больных шизофренией (Swartz M.S. et al., 2007). Когнитивный дефицит наиболее выражен у пациентов с отчетливой дефицитарной симптоматикой и при поздних дискинезиях (Rund B.R., 1998). Антипсихотические препараты обладают небольшой либо умеренной эффективностью в отношении когнитивных нарушений (категория доказательности B) (Мосолов С.Н., Кабанов С.О., Сулимов Г.Ю., 2002; Mishara A.L., Goldberg T.E., 2004). Результаты сравнения АПП и АВП являются противоречивыми (Davidson M. и соавт., 2009). В некоторых исследованиях приводятся данные о превосходстве АВП, в то время как в других - об отсутствии отличий. Тем не менее ни в одном из исследований нет данных о преимуществе АПП, в связи с чем может быть рекомендовано назначение АВП с некоторыми ограничениями доказательных данных (категория доказательности C) (см. рис. 11.5). Имеются данные об эффективности некоторых ингибиторов холинэстеразы (донепезил и галантамин) при их присоединении к антипсихотику (категория доказательности C).
Депрессивные симптомы могут встречаться на всех этапах шизофрении, а именно в продромальной фазе, в структуре психоза и после наступления ремиссии, в виде резидуальных постприступных симптомов. Депрессивные симптомы необходимо дифференцировать от побочных эффектов антипсихотической терапии (в первую очередь - от нейролептической дисфории, акинезии и акатизии) и первичных негативных симптомов шизофрении (рис. 11.6). Однако первым диагностическим шагом в данном случае является выявление возможных проявлений психоза, которые могут обусловливать депрессию. В этом случае единственным терапевтическим выбором должно быть усиление антипсихотической терапии. Еще одним первостепенным диагностическим шагом является определение суицидального риска. Оно включает в себя направленное клиническо-анамнестическое обследование с последующим выявлением и динамической оценкой факторов риска суицида (например, по Колумбийской шкале суицидального риска). При выявлении факторов риска суицидального поведения, особенно при сопряженности их с имеющейся психотической симптоматикой, целесообразна замена антипсихотика на клозапин (категория доказательности В) (см. рис. 11.5) (Wahlbeck K. et al., 1999).
Также необходимо выявить возможную связь депрессии с реактивными механизмами и дезадаптацией. В данном случае показано проведение психотерапии и реабилитационных мероприятий. Показанием к коррекции терапии в первую очередь является длительность и тяжесть депрессивных симптомов (см. рис. 11.6). Преимущественно может быть рекомендован перевод на некоторые АВП, в большей степени обладающие эффективностью по отношению к депрессивной симптоматике (категория доказательности B/C). Назначение антидепрессантов ограничивается преимущественно так называемыми постпсихотическими депрессиями при неэффективности других терапевтических мероприятий. Предпочтительно назначение СИОЗС, а при их неэффективности - селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН) и ТЦА (категория доказательности B/C) (Whitehead C. et al., 2003). При терапевтической рефрактер-
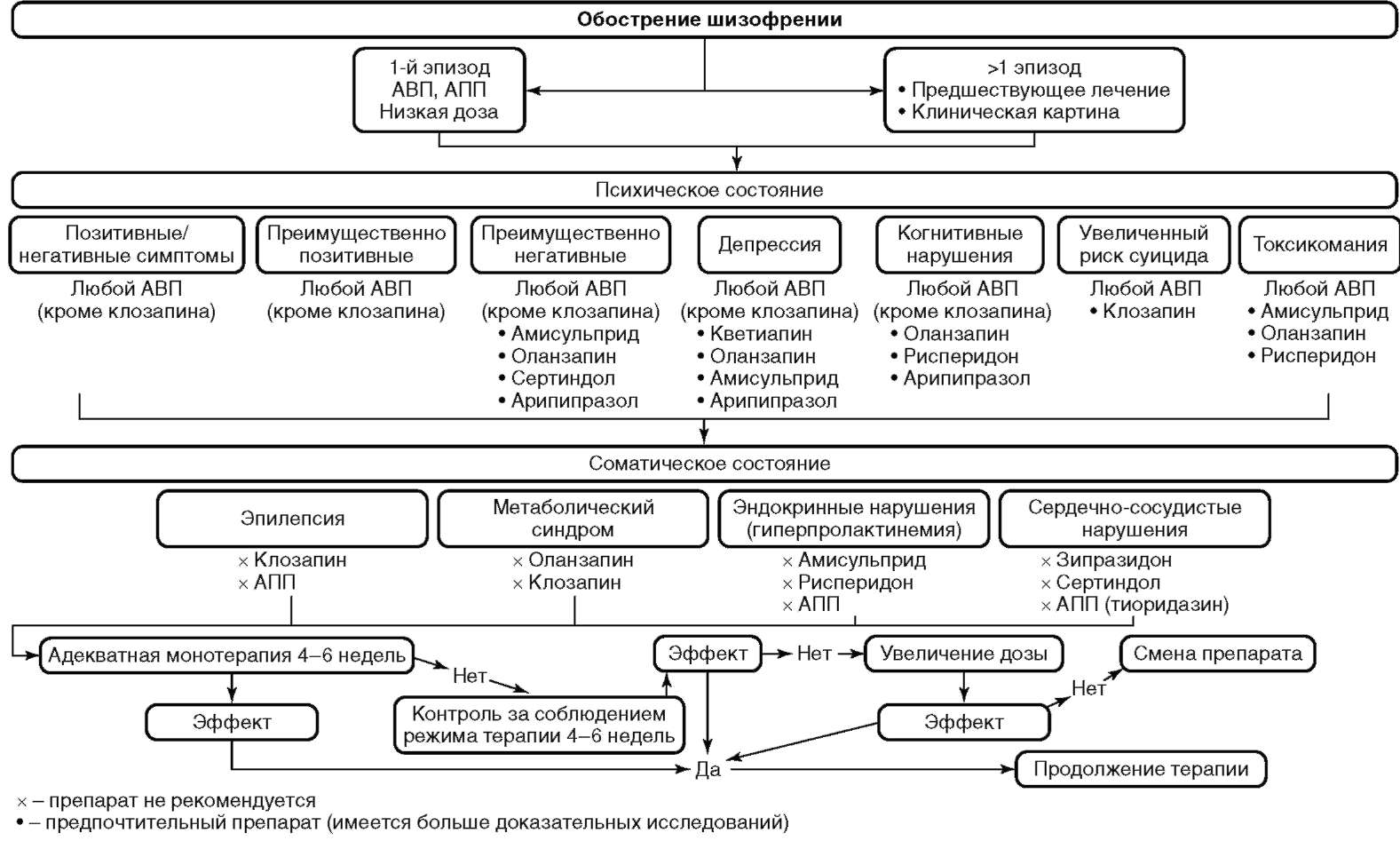
Рис. 11.5. Алгоритм выбора антипсихотиков в отдельных клинических сценариях ности депрессивной симптоматики необходимо проведение противорезистентных мероприятий (категория доказательности С/D) (см. рис. 11.6).
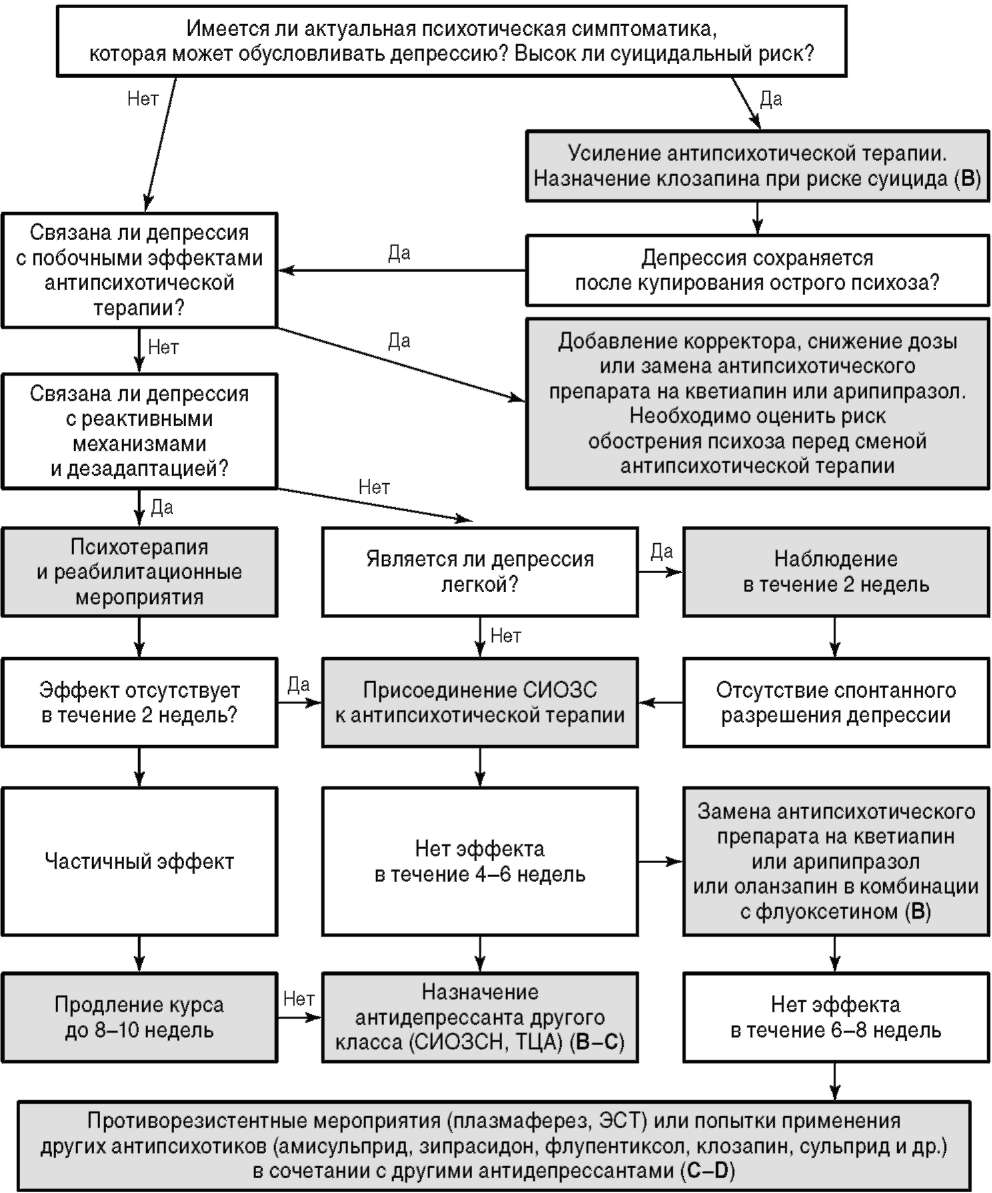
Рис. 11.6. Алгоритм терапии депрессии при шизофрении
Нередко у больных с острыми приступами шизофрении врачу приходится сталкиваться с задачей быстрой коррекции поведения с купированием психомоторного возбуждения и агрессии. Проявления агрессии, а также состояния с высоким риском ее развития требуют проведения ургентных терапевтических мероприятий (Цукарзи Э.Э., 2013). Они включают применение быстрой транквилизации (БТ), а при необходимости - фиксации или изоляции. Наряду с этим необходимо применение методик поведенческой терапии. В случае нетяжелых проявлений агрессии (вербальная агрессия и т.д.) и быстрого успокоения пациента проведение БТ может быть нецелесообразно. При проведении БТ необходимы навыки по оценке рисков, сопряженных с возможным достижением глубокой седации (развитие артериальной гипотонии и угнетения дыхания). Также желательно обеспечение техническими средствами, необходимыми для ургентной помощи при развитии побочных эффектов, в том числе возможность назначения флумазенила (антагониста бензодиазепиновых рецепторов) (Wolkowitz D.M., Pickar D., 1991).
При нетяжелом возбуждении и комплаентности пациента пероральные формы ЛС с седативным компонентом действия могут быть более предпочтительны. В начале терапии препараты должны быть назначены в наиболее низких эффективных дозировках, которые в случае необходимости могут быть постепенно повышены. Более тяжелые формы возбуждения требуют применения парентеральной терапии (рис. 11.7). При купировании возбуждения желательно, чтобы терапевтический эффект был достигнут на уровне успокоения или легкой седации. При необходимости допускается достижение глубокой седации или даже анестезии. Применение для контроля возбуждения БТ рассматривается как средство последней линии. Однако при крайне тяжелом возбуждении, сопряженным с рисками агрессии, ее следует применять незамедлительно.
Бензодиазепины (лоразепам) и АПП демонстрируют сравнимую эффективность в терапии возбуждения и агрессии (категория доказательности C) (Volz A. et al., 2007; Blumer D., 2009). Назначение диазепама, бромдигидрохлорфенил-бензодиазепина и других бензодиазепинов (кроме лоразепама), а также низкопотентных антипсихотиков (хлорпромазин, левомепромазин и хлорпротиксен) для терапии возбуждения рекомендуется с осторожностью в связи с худшей переносимостью и более длительным периодом полувыведения (категория доказательности C). Парентеральные формы АВП не уступают в эффективности внутримышечной форме галоперидола (категория доказательности A), но вызывают меньшее число неврологических побочных эффектов (категория доказательности A). Комбинированное назначение парентеральных форм бензодиазепинов (диазепама, бромдигидрохлорфенилбензодиазепина) или лоразепама вместе с антипсихотиком может быть рекомендовано у пациентов с выраженным возбуждением и агрессией (категория доказательности C). При этом необходимо учитывать повышенный риск развития побочных эффектов. В связи с риском развития дыхательной недостаточности необходимо избегать комбинированного назначения внутримышечной формы бензодиазепинов с клозапином. Ввиду риска развития внезапной смерти следует также избегать комбинированного назначения внутримышечной формы оланзапина и бензодиазепинов.
Применение ЭСТ при некупирующемся психотическом возбуждении показано при наличии в клинической картине кататонических симптомов, острого чувственного бреда и циркулярного аффекта (категория доказательности С/D) (Blumer D., 2009).
Фиксация и изоляция могут применяться только в кризисных ситуациях. Необходимость их назначения должна быть тщательно документирована и объяснена пациенту.
Важнейшим параметром, определяющим выбор антипсихотика в остром периоде, является предполагаемое соотношение эффективности и переносимости препарата у конкретного пациента. В отдельных клинических ситуациях имеются доказательства преимущества тех или иных антипсихотических препаратов (Hasan A. et al., 2015). Эти данные для АВП суммированы на рис. 11.5. Например, клозапин в качестве препарата первого выбора рекомендуется только в двух случаях: при терапевтической резистентности (категория доказательности В) и увеличении суицидального риска (категория доказательности В). При преобладании первичной негативной симптоматики убедительные данные имеются в отношении амисульприда и, в меньшей степени, ряда других антипсихотиков (см. выше текст о терапии негативных симптомов). При большом удельном весе депрессивной симптоматики целесообразен выбор кветиапина и арипипразола (см. текст выше и рис. 11.5). Кроме того, при первичном выборе антипсихотика следует учитывать индивидуальные особенности соматического и неврологического состояния пациента. Например, при повышенной массе тела, диабете 2-го типа и метаболическом синдроме не рекомендуется назначать оланзапин и клозапин (категория доказательности В/С); при нейроэндокринных нарушениях, связанных с ГП, не рекомендуется назначать АПП, амисульприд и рисперидон (категория доказательности С); при нарушениях сердечного ритма - сертиндол, зипрасидон и тиоридазин (категория доказательности С), а при судорожном синдроме или снижении порога судорожной готовности - клозапин и некоторые АПП (категория доказательности В/С) (Hasan A. et al., 2013).
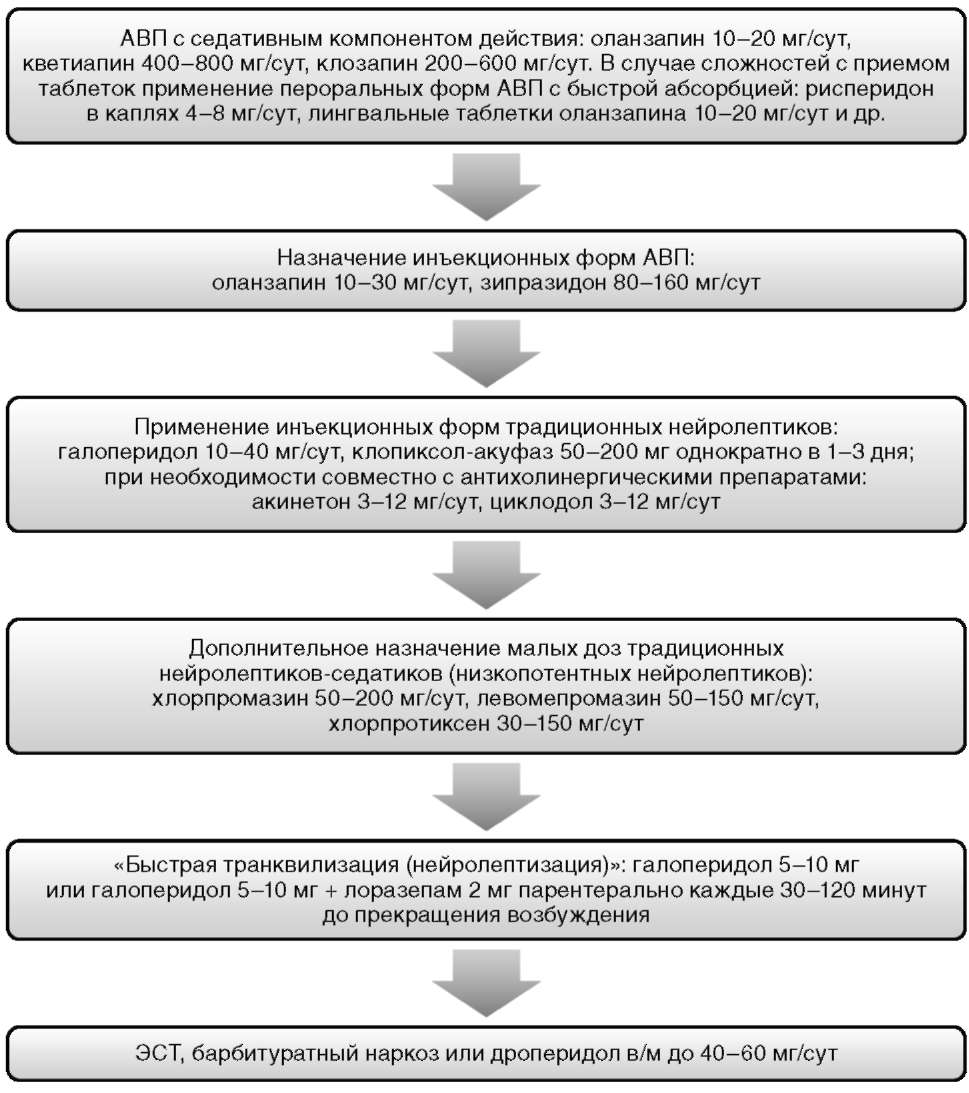
Рис. 11.7. Алгоритм терапии некупирующегося психотического возбуждения и агрессивности
Основными критериями эффективности лечения острого психоза при шизофрении являются:
-
достижение симптоматической ремиссии (отсутствие или слабая выраженность основных симптомов шизофрении, входящих в принятые диагностические критерии, включая галлюцинаторно-бредовую и негативную симптоматику);
-
нормализация поведения, исчезновение психомоторного возбуждения;
-
восстановление прежнего (доприступного) уровня социального функционирования.
Несмотря на назначение адекватной ПФТ, далеко не во всех психотических эпизодах при шизофрении можно рассчитывать на достижение полной редукции симптоматики и формирование критики к заболеванию. Наилучшие результаты обычно наблюдаются при лечении острых психозов, в структуре которых представлены проявления чувственного бреда и циркулярный аффект. При большом удельном весе параноидной симптоматики и признаках непрерывного течения можно рассчитывать лишь на частичную редукцию психоза, инкапсуляцию и дезактуализацию бредовых переживаний и упорядочивание поведения, позволяющие выписать больного из стационара и продолжить терапию в амбулаторных условиях. В любом случае основной целью острого этапа купирующей терапии должно быть достижение симптоматической ремиссии, для определения которой можно пользоваться специально разработанными для основных клинических форм шизофрении соответствующими операциональными критериями (Mosolov S.N. et al., 2012, 2014). В случаях неустойчивости достигнутой ремиссии при проведении долечивающей или стабилизирующей антипсихотической терапии дозы эффективного антипсихотика остаются прежними или снижаются незначительно, что по-прежнему требует пристального внимания врача за динамикой состояния больного. В этом случае, а также при неуверенности со стороны врача в комплаентности больного, уже в условиях стационара возможен перевод пациента на инъекционные антипсихотики пролонгированного действия.
Антипсихотики являются эффективными препаратами для профилактики рецидивов (категория доказательности А). При этом вероятность развития рецидива по сравнению с плацебо сокращается в несколько раз. АПП и АВП не различаются между собой по степени редукции симптоматики при длительной противо-рецидивной терапии (категория доказательности А) (NICE, 2010; Rabinowitz J. et al., 2009). Имеется ряд данных в пользу отдельных АВП по показателям частоты прекращения терапии и профилактике рецидивов (категория доказательности В) (Lieberman J.A. et al., 2005; Kishimoto T., Agarwal V. et al., 2011). Снижение риска развития неврологических побочных эффектов, в частности поздней дискинезии, является преимуществом АВП (категория доказательности С). При длительной терапии, когда вторичная негативная симптоматика становится менее выраженной, некоторые АВП обладают рядом преимуществ в отношении коррекции негативной симптоматики (категория доказательности С) (Nasrallah H.A. et al., 2009).
При многолетней терапии поздняя дискинезия и метаболические побочные эффекты оказывают наибольшее влияние на состояние здоровья пациента. Необходимы непрерывный мониторинг (см. табл. 11.13) и раннее выявление и лечение этих побочных эффектов.
При проведении длительной противорецидивной терапии желательно использовать тот антипсихотический препарат, который обладал наилучшим эффектом и переносимостью у данного пациента в ходе купирования последнего обострения и в процессе стабилизации состояния, т.е. на первых двух этапах терапии. Подбор антипсихотического препарата у каждого пациента необходимо проводить индивидуально с учетом предшествующего применения определенных групп препаратов и профиля побочных эффектов.
В случае прекращения терапии в течение 1-2 лет после острого психоза наблюдается высокий риск рецидива. У пациентов с первым эпизодом рекомендуется непрерывная антипсихотическая терапия в течение по крайней мере одного года (категория доказательности С). У пациентов с несколькими эпизодами следует решить вопрос о поддерживающей терапии на протяжении 2-5 лет (при сохраняющейся симптоматике и частых рецидивах - пожизненная терапия) (категория доказательности С) (Dixon L.B., Perkins B., Calmes C., 2009). Прежде всего, многолетняя терапия показана при непрерывном течении шизофрении, при злокачественных и рано начавшихся формах (Sikich L. et al., 2008). При приступообразном течении длительность противорецидивной терапии определяется принципом разумной достаточности. Тем не менее длительность лечения необходимо определять индивидуально с учетом мотивации пациента, психосоциальной ситуации и некоторых других факторов. У пациентов с попытками суицида или грубым агрессивным поведением и частыми рецидивами также рекомендуется продолжение антипсихотической терапии на протяжении неопределенно долгого срока.
Во всех случаях для профилактики рецидива рекомендуется непрерывная антипсихотическая терапия (категория доказательности A). Стратегии прерывистой терапии могут подходить только пациентам с шизофренией, которые отказываются от непрерывного поддерживающего режима, или если имеются противопоказания к непрерывной поддерживающей терапии.
При проведении длительной противорецидивной терапии у больных с низкой комплаентностью рекомендуются антипсихотические препараты пролонгированного действия, которые имеют ряд преимуществ, описанных выше в этой главе.
В настоящее время имеются достаточные данные в поддержку использования антипсихотических препаратов-депо первого поколения для профилактики рецидивов шизофрении (категория доказательности A), тем не менее невозможно выявить достоверных различий в эффективности между пероральными препаратами и лекарственными формами-депо (категория доказательности A) (Adams C.E. et al., 2001). Имеется достаточный объем данных в поддержку использования инъекционной формы рисперидона и палиперидона длительного действия для лечения шизофрении (категория доказательности A). Существует также ряд данных в поддержку превосходства клинической эффективности лекарственной формы-депо в сравнении с пероральным препаратом (категория доказательности C).
Критериями эффективности длительной амбулаторной терапии являются:
-
удержание симптоматической ремиссии в течение минимум 6 мес;
-
предотвращение рецидивов, в том числе требующих госпитализаций, минимум в течение 1 года;
-
сохранение максимально возможного для данной формы заболевания уровня социального и личностного функционирования;
-
предотвращение нарушений терапевтического режима (низкой комплаентности) и формирование приверженности терапии (применение психообразовательных методик);
-
отсутствие или своевременная коррекция побочных эффектов длительной антипсихотической терапии;
-
сохранение удовлетворительного качества жизни больного, в том числе удовлетворенность проводимой терапией и общим состоянием своего здоровья;
В целом индивидуальный подбор адекватной и, значит, максимально эффективной ПФТ на разных этапах лечения больного шизофренией по-прежнему остается достаточно сложной и творческой задачей для врача. Клиническая обоснованность выбора антипсихотического препарата должна сочетаться с постоянной динамической оценкой психического и соматического состояния пациента, которая позволяет своевременно изменять интенсивность и характер терапевтического воздействия. При этом при оказании стационарной и амбулаторной помощи необходимо соблюдать преемственность и комплексность проводимого лечения с привлечением адекватных методов психотерапии и социальной реабилитации.
Список литературы
-
Авруцкий Г.Я., Недува А.А. Лечение психически больных. 2-е изд. М. : Медицина, 1988. 528 с.
-
Данилов Д.С. Терапия шизофрении (атипичные нейролептики и индивидуальная организация лечебного процесса). М., 2010.
-
Джонс П.Б., Бакли П.Ф. Шизофрения. Клиническое руководство (перевод с английского) / под общ. ред. С.Н. Мосолова. М., 2008.
-
Карлсон А., Лекрубье И. Дофаминовая теория патогенеза шизофрении: руководство для врачей / под ред. С.Н. Мосолова. Лондон, 2004.
-
Краснов В.Н., Гурович И.Я., Мосолов С.Н. и др. Психиатрическая помощь больным шизофренией: клиническое руководство. 2-е изд. / под ред. В.Н. Краснова, И.Я. Гуровича, С.Н. Мосолова, А.Б. Шмуклера. М., 2007.
-
Мосолов С.Н. Шкалы психометрической оценки симптоматики шизофрении и концепция позитивных и негативных расстройств. М.: Новый цвет, 2001.
-
Мосолов С.Н. Некоторые актуальные теоретические проблемы диагностики, классификации, нейробиологии и терапии шизофрении: сравнение зарубежного и отечественного подходов // Журн. неврол. и психиатр. 2010. Т. 110, № 6. С. 4-11.
-
Мосолов С.Н., Кабанов С.О., Сулимов Г.Ю. Коррекция нейрокогнитивного дефицита у больных шизофренией при длительной антипсихотической терапии // Новые достижения в терапии психических заболеваний. М., 2002. С. 110-126.
-
Мосолов С.Н., Кузавкова М.В., Калинин В.В., Еремин А.В. и др. Анализ влияния атипичных антипсихотиков на 5-факторную модель шизофрении // Соц. и клин. психиатрия. 2003. Т. 13, № 3. С. 45-52.
-
Мосолов С.Н., Цукарзи Э.Э., Алфимов П.В. Алгоритмы биологической терапии шизофрении // Соврем. терапия психических расстройств. 2014. № 1. С. 27-36.
-
Мосолов С.Н., Цукарзи Э.Э., Капилетти С.Г. Антипсихотическая фармакотерапия шизофрении: от научных данных к клиническим рекомендациям // Биологические методы терапии психических расстройств. Доказательная медицина - клинической практике : сборник / под ред. С.Н. Мосолова. М., 2012. С. 11-61.
-
Цукарзи Э.Э. Неотложная помощь при агрессивном поведении. Часть II. Ведение пациентов // Соврем. терапия психических расстройств. 2013. № 2. С. 31-40.
-
Adams C.E., Fenton M., Quraishi S. et al. Systematic meta-review of depot antipsychotic drugs for people with schizophrenia // Br. J. Psychiatry. 2001. Vol. 179. P. 290-299.
-
Blumer D. Catatonia and the neuroleptics: psychobiologic significance of remote and recent findings // Compr. Psychiatry. 1997. Vol. 38, N4. P. 193-201.
-
Davidson M., Galderisi S., Weiser M. et al. Cognitive effects of antipsychotic drugs in first-episode schizophrenia and schizophreniform disorder: a randomized, open-label clinical trial (EUFEST) // Am. J. Psychiatry. 2009. Vol. 166. P. 675-682.
-
Dixon L.B., Perkins B., Calmes C. Guideline watch (September 2009): Practice Guideline for the treatment of patients with schizophrenia. 2009.
-
Fenton M., Coutinho E., Campbell C. Zuclopenthixol acetate in the treatment of acute schizophrenia and similar serious mental illnesses (Cochrane Review) // The Cochrane Library. Issue 2. Chichester, UK : John Wiley and Sons, 2004.
-
Hasan A., Falkai P., Wobrock T., Lieberman J. et al. World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for Biological Treatment of Schizophrenia, Part 1: Update 2012 on the acute treatment of schizophrenia and the management of treatment resistance // World J. Biol. Psychiatry. 2012. Vol. 13. P. 318-378.
-
Hasan A., Falkai P., Wobrock T., Lieberman J. et al. World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for Biological Treatment of Schizophrenia. Pt 2: Update 2012 on the long-term treatment of schizophrenia and management of antipsychotic-induced side effects // World J. Biol. Psychiatry. 2013. Vol. 14. P. 2-44.
-
Hasan A., Falkai P., Wobrock T., Lieberman J. et al. World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for biological treatment of schizophrenia part 3: update 2015 management of special circumstances: depression, suicidality, substance use disorders and pregnancy and lactation // World J. Biol. Psychiatry 2015. Vol. 16, N 3. P. 142-170.
-
Johnsen E., Jorgensen H.A. Effectiveness of second generation antipsychotics: a systematic review of randomized trials // BMC Psychiatry. 2008. Vol. 8. P. 31.
-
Kirkpatrick B., Fenton W.S., Carpenter W.T. et al. The NIMH-MATRICS consensus statement on negative symptoms // Schizophr. Bull. 2006. Vol. 32. P. 214-219.
-
Kishimoto T., Agarwal V., Kishi T., Leucht S. et al. Relapse prevention in schizophrenia: a systematic review and meta-analysis of second generation antipsychotics versus first-generation antipsychotics // Mol. Psychiatry. 2011. Vol. 12. P. 432-436.
-
Leucht S., Corves C., Arbter D., Engel R. Et al. Second-generation versus first-generation antipsychotic drugs for schizophrenia: a meta-analysis // Lancet. 2009. Vol. 373. P. 31-41.
-
Lewis S.W., Barnes T.R., Davies L. et al. Randomized controlled trial of effect of prescription of clozapine versus other second-generation antipsychotic drugs in resistant schizophrenia // Schizophr. Bull. 2006. Vol. 32. P. 715-723.
-
Lieberman J.A., Stroup T.S., McEvoy J.P. et al. Effectiveness of antipsychotic drugs in chronic schizophrenia // N. Engl. J. Med. 2005. Vol. 353, N 12. P. 1209-1223.
-
McEvoy J.P., Lieberman J.A., Stroup J.P. et al. Effectiveness of clozapine versus olanzapine, quetiapine and risperidone in patients with chronic schizophrenia who did not respond to prior antipsychotic treatment // Am. J. Psychiatry. 2006. Vol. 163. P. 600-610.
-
Mishara A.L., Goldberg T.E. A meta-analysis and critical review of the effects of conventional neuroleptic treatment on cognition in schizophrenia: opening a closed book // Biol. Psychiatry. 2004. Vol. 55. P. 1013-1022.
-
Mosolov S.N., Potapov A.V., Ushakov U.V. Remission in schizophrenia: results of cross-sectional with 6-month follow-up period and 1-year observational therapeutic studies in an outpatient population // Ann. Gen. Psychiatry. 2012. Vol. 11. P. 1-11.
-
Mosolov S.N., Potapov A.V., Ushakov U.V. et al. Design and validation of standardized clinical and functional remission criteria in schizophrenia // Neuropsychiatr. Dis. Treat. 2014. Vol. 10. P. 167-181.
-
Nasrallah H.A., Keshavan M.S., Benes F.M. et al. Proceedings and Data From The schizophrenia Summit: a clinical appraisal to improve the management of schizophrenia // J. Clin. Psychiatry. 2009. Vol.70, suppl. 1. P. 4-46.
-
NICE. Guideline on Core Interventions in the Treatment and Management of Schizophrenia in Adults in Primary and Secondary Care (updated edition). London, 2010.
-
Peterson K., Carson S., McDonagh M. et al. Drug Class Review. Atypical Antipsychotic Drugs 2010. Oregon Health and Science University Portland, Oregon Final Update, July 2010.
-
Rabinowitz J., Levine S., Barkai O. et al. Dropout rates in randomized clinical trials of antipsychotics: a meta-analysis comparing firstand second-generation drugs and an examination of the role of trial design features // Schizophr. Bull. 2009. Vol. 35, N 4. P. 775-788.
-
Rummel-Kluge C., Komossa K., Leucht S. et al. Head-to-head comparisons of metabolic side effects of second generation antipsychotics in the treatment of schizophrenia: a systematic review and meta-analysis // Schizophr. Res. 2010 Nov. Vol. 123, N 2-3. P. 225-233.
-
Rummel-Kluge C., Komossa K., Leucht S. et al. Second-generation antipsychotic drugs and extrapyramidal side effects: a systematic review and meta-analysis of head-to-head comparisons // Schizophr. Bull. 2012. Vol. 38, N 1. P. 167-177.
-
Rund B.R. A review of longitudinal studies of cognitive functions in schizophrenia patients // Schizophr. Bull. 1998. Vol. 24. P. 425-435.
-
Sikich L., Franzier J.A., McClellan J. et al. Double-blind comparison of firstand second-generation antipsychitics in early-onset schizophrenia and schizo-affective disorder: findings from the treatment of early-onset schizophrenia spectrum disorders (TEOSS) study // Am. J. Psychiatry. 2008. Vol. 165. P. 1420-1431.
-
Swartz M.S., Perkins D.O., Stroup T.S. et al. Effects of antipsychotic medications on psychosocial functioning in patients with chronic schizophrenia: findings from the NIMH CATIE study // Am. J. Psychiatry. 2007. Vol. 164. P. 428-436.
-
Tandon R., Moller H.J. Belmaker R.H. et al. World Psychiatry Association Pharmacopsychiatry Section statement on comparative effectiveness of antipsychotics in the treatment of schizophrenia // Schizophr. Res. 2008. Vol. 100. P. 20-38.
-
Uchida H., Suzuki T., Takeuchi H. et al. Low dose vs standard dose of antipsychotics for relapse prevention in schizophrenia: meta-analysis // Schizophr. Bull. 2011. Vol. 37, N 4. P. 788-799.
-
Volz A., Khorsand V., Gillies D. et al. Benzodiazepines for schizophrenia // Cochrane Database Syst. Rev. 2007. Vol. 1. CD006391.
-
Wahlbeck K., Cheine M., Essali A. et al. Evidence of clozapine?s effectiveness in schizophrenia: a systematic review and meta-analysis of randomized trials // Am. J. Psychiatry. 1999. Vol. 156. P. 990-999.
-
Weinmann S., Read J., Aderhold V. Influence of antipsychotics on mortality in schizophrenia: systematic review // Schizophr. Res. 2009. Vol. 113. P. 1-11.
-
Whitehead C., Moss S., Cardno A. et al. Antidepressants for the treatment of depression in schizophrenia: a systematic review // Psychol. Med. 2003. Vol. 33. P. 589-599.
-
Wolkowitz D.M., Pickar D. Benzodiazepine in the treatment of schizophrenia: a review and reappraisal // Am. J. Psychiatry. 1991. Vol. 148. P. 714-726.