Психиатрия : национальное руководство / гл. ред. : Ю. А. Александровский, Н. Г. Незнанов.- Москва : ГЭОТАР-Медиа, 2018. - 1008 с. - ISBN9785970444627 |
Аннотация
Национальные руководства - первая в России серия практических руководств по основным медицинским специальностям, включающих всю основную информацию, необходимую врачу для непрерывного последипломного образования. В отличие от большинства других руководств в национальных руководствах равное внимание уделено профилактике, диагностике, фармакотерапии и немедикаментозным методам лечения.
Второе издание национального руководства "Психиатрия" содержит современную и актуальную информацию об организации психиатрической помощи, о методах диагностики и лечения психически больных. Отдельный раздел посвящён описанию основных психических болезней в соответствии с МКБ-10.
В подготовке настоящего издания в качестве авторов-составителей и рецензентов принимали участие известные специалисты-психиатры. Все рекомендации по диагностике и лечению прошли этап независимого рецензирования.
Руководство предназначено психиатрам, клиническим психологам, интернам, ординаторам, аспирантам, студентам старших курсов медицинских высших учебных заведений.
Авторы, редакторы и издатели руководства предприняли максимум усилий, чтобы обеспечить точность представленной информации, в том числе дозировок лекарственных средств. Учитывая постоянные изменения, происходящие в медицинской науке, они рекомендуют уточнять дозы лекарственных средств по соответствующим инструкциям. Пациенты не могут использовать эту информацию для диагностики и самолечения.
12.2. ЛЕЧЕНИЕ БОЛЬНЫХ С РЕКУРРЕНТНЫМ ДЕПРЕССИВНЫМ РАССТРОЙСТВОМ
С.Н. Мосолов, Е.Г. Костюкова
РДР является хроническим заболеванием, характеризующимся рекуррентными эпизодами сниженного настроения, которые часто сопровождаются соответствующими изменениями поведения, восприятия и когнитивными нарушениями (мышления, памяти и внимания). Эти расстройства, как правило, полностью редуцируются в периоды ремиссий, и степень социальной дезадаптации пациентов определяется частотой, длительностью и тяжестью развивающихся у них рецидивов депрессивной симптоматики. Высокая распространенность РДР (среди мужчин - около 6%, среди женщин - до 15%), частое рецидивирование (у 85% больных отмечаются повторные эпизоды), склонность к затяжному течению и хронификации эпизодов, утяжеление течения и исходов соматических и психических коморбидных расстройств, а также многочисленные другие проблемы, связанные с ущербом, наносимым этим заболеванием, определяют высокий интерес специалистов к новым возможностям в области терапии депрессии. Требующие лечения депрессии наблюдаются примерно у 25% больных психиатрических стационаров, у 65% больных амбулаторной психиатрической сети и как минимум у 10% всех больных непсихиатрических лечебных учреждений.
Важной для понимания течения РДР и его терапии является динамическая модель заболевания, предложенная D.J. Kupfer в 1991 г. (рис. 12.5).
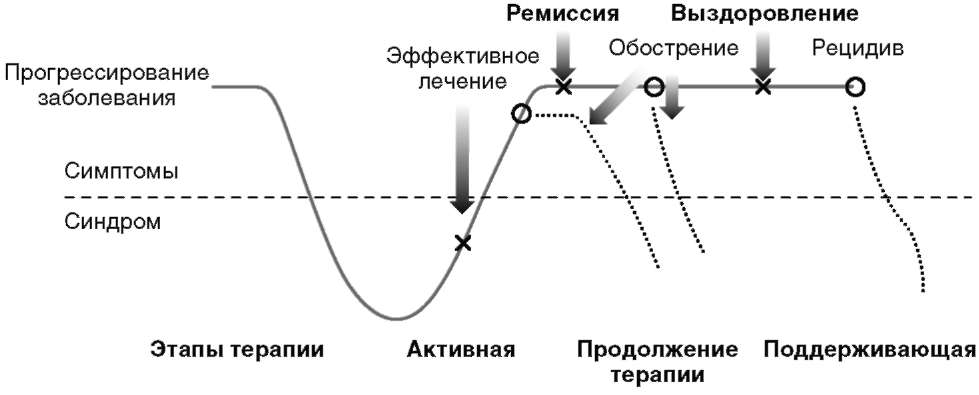
Рис. 12.5. Схема течения рекуррентного депрессивного расстройства и этапов терапии
В соответствии с этой моделью в лечении РДР важно следовать всем трем основным терапевтическим этапам: 1) купирующая (активная) терапия; 2) продолженная или стабилизирующая терапия; 3) длительная противорецидивная (профилактическая) терапия.
На всех этапах терапии РДР препаратами первого выбора являются антидепрессанты или тимоаналептики. Механизм действия антидепрессантов заключается в повышении активности серотонинергической и норадренергической нейропередачи. ИМАО блокируют моноаминоксидазу (МАО) - фермент, ответственный за окислительное дезаминирование монаминов (серотонина, норадреналина, дофамина, тирамина и др.). ТЦА угнетают механизм обратного захвата моноаминов (преимущественно норадреналина и серотонина) и связываются с различными постсинаптическими рецепторами (гистаминовыми, холиновыми, адренергическими и др.), что определяет развитие различных периферических побочных эффектов. Некоторые препараты избирательно блокируют обратный захват серотонина (СИОЗС) или норадреналина (ребоксетин). Существуют антидепрессанты двойного механизма действия: одновременно блокируют обратный захват серотонина и норадреналина (милнаципран, венлафаксин, дулоксетин) или норадреналина и дофамина (бупропион) и не связываются с постсинаптическими рецепторами. Другие препараты обладают сложным рецепторным воздействием с опосредованным облегчением норадренергической или серотонинергической нейропередачи (миртазапин, тразодон, агомелатин). Механизм действия некоторых антидепрессантов недостаточно ясен или является поливалентным с одновременным угнетением белков - транспортеров моноаминов и мультимодальным рецепторным воздействием (вортиоксетин). Более подробно нейрохимический механизм действия и классификация антидепрессантов излагаются в Главе 29.5 и в наших других работах (Мосолов С.Н., 2012).
Исследования со строгим дизайном показывают, что общая эффективность антидепрессантов оценивается на уровне 50-70% при депрессии умеренной тяжести и тяжелой (Bauer M. et al., 2002), тимоаналептический эффект любого антидепрессанта развивается не ранее 2-4-й недели терапии, а для достижения ремиссии требуется в среднем 6-8 нед. В то же время известно, что по результатам открытых натуралистических исследований, в которых ведение пациента максимально приближено к обычной практике, показатели эффективности антидепрессантов оказываются значительно более высокими. Например, по данным наших собственных исследований различных антидепрессантов нового поколения, проводившихся по строгим протоколам, но без использования плацебо-контроля, эффективность большинства исследуемых препаратов варьировалась от 60 до 80% (Мосолов С.Н., Костюкова Е.Г., 2002; Мосолов и др., 2012). Такие различия в показателях плаце-бо-контролируемых и открытых исследований объясняются, прежде всего, высоким плацебо-эффектом (Мосолов С.Н. и др., 2002; Greenberg R.P., Fisher S., 1989). Значительный вклад в общую эффективность терапии в практике вносит также квалификация врача, который благодаря своему опыту может предвидеть, какой из препаратов «больше подойдет» данному пациенту или какой пациент лучше отреагирует на данный препарат. Это отражает очевидные преимущества индивидуального выбора препарата для достижения наилучших результатов лечебного процесса, хотя доказательных данных о тех ориентирах, которые могут быть использованы для дифференцированного подхода к терапии и которые, по всей вероятности, лежат в основе интуиции опытного врача, крайне мало.
С практической точки зрения основной задачей купирования депрессии является как можно более быстрое воздействие на наиболее тягостные для пациента симптомы. Их быстрое купирование не только облегчает страдания, но также может существенно сокращать суицидальный риск - в тяжелых случаях, или снижать социальную дезадаптацию - в более легких. Депрессивный синдром, характеризуясь классической депрессивной триадой, имеет множество клинических вариантов, что связано, прежде всего, с доминированием тех или иных симптомов в структуре синдрома, интенсивностью и окраской гипотимного аффекта, а также с личностными особенностями больного. Трудно представить себе двух пациентов, страдающих депрессией, у которых картина заболевания была бы полностью идентична.
В то же время современные возможности науки не позволяют выделить какие-либо биологические маркеры эффективности терапии антидепрессантами или установить точные клинические прогностические факторы эффективности того или иного антидепрессанта. Однако результаты рандомизированных клинических исследований (РКИ) позволяют получить достаточно точные характеристики разных групп препаратов и дифференцировать различия отдельных тимоаналептиков внутри этих групп. Такие характеристики или спектры соматотропной и психотропной активности могут быть использованы для дифференцированного подхода к выбору препарата и персонализации терапии в зависимости от соматоневрологического статуса пациента и клинических особенностей депрессивного синдрома. Например, такой побочный эффект антидепрессанта, как седация, может быть использован для достижения быстрого эффекта на первом этапе терапии у больных с выраженной бессонницей, а прибавка веса тела - на первом этапе терапии у больных со снижением аппетита и потерей веса. Напротив, при гиперфагии и связанным с ней выраженным психологическим дискомфортом быстрый симптоматический эффект может оказать препарат, имеющий в числе своих побочных эффектов подавление аппетита (например, флуоксетин, бупропион).
ТЦА и антидепрессанты нового поколения имеют различный спектр побочных эффектов, что может стать решающим фактором при выборе препарата в отдельных клинических случаях. Так, для ТЦА наиболее характерны антихолинергические (сухость во рту, запоры, нарушение зрения, задержка мочи, тахикардия), сердечно-соcудистые (α-адренергическая блокада, ортостатическая гипотензия, брадиаритмия, тахикардия), антигистаминные (седация, прибавка веса) побочные эффекты и неврологические симптомы (легкий миоклонус, судорожные состояния при передозировке, делирий у пожилых пациентов). ТЦА и тетрациклические антидепрессанты не должны назначаться пациентам с сердечно-сосудистыми заболеваниями умеренной и выраженной тяжести, закрытоугольной глаукомой, гипертрофией простаты, с когнитивными нарушениями, судорожными состояниями и делириозными расстройствами.
Спектр побочных эффектов СИОЗС включает в себя желудочно-кишечные (тошнота, рвота, диарея), активацию/беспокойство (ажитация, расстройства сна), сексуальную дисфункцию (нарушения эрекции и задержку эякуляции у мужчин, утрату либидо и аноргазмию у женщин и мужчин) и неврологические (усиление головных болей напряжения и мигрени). Поэтому больным с наличием такой симптоматики в анамнезе антидепрессанты нового поколения следует назначать с осторожностью и выбирать среди них те, которые вызывают меньший риск экзацербации имеющихся у пациента расстройств.
Несмотря на единый спектр побочных эффектов антидепрессантов нового поколения, препараты внутри этой группы могут различаться по частоте их развития. Венлафаксин чаще вызывает тошноту и рвоту, пароксетин чаще, чем все другие препараты, приводит к развитию побочных эффектов со стороны сексуальной сферы, миртазапин и пароксетин чаще вызывают прибавку веса, сертралин - диарею (Sartorius N. et al., 2007; Cipriani A. et al., 2009; AHrQ, 2011). В целом выбор антидепрессанта в каждом индивидуальном случае должен проводиться с учетом предрасположенности пациента к развитию того или иного побочного эффекта, в особенности тех, которые имеют тяжелые медицинские последствия.
Полученные к настоящему моменту результаты клинических исследований не представили доказательств преимущества того или иного класса антидепрессантов по эффективности или скорости развития эффекта, хотя имеются данные о различии их эффективности при отдельных вариантах депрессивного синдрома. Результаты одного из метаанализов 102 РКИ, включавших 10 706 пациентов, не выявили различий в эффективности СИОЗС и ТЦА, но все же дали основания предполагать некоторые преимущества в эффективности ТЦА в госпитальных случаях (Anderson I.M., 2000). Анализ 248 сравнительных и плацебо-контролируемых РКИ показал, что антидепрессанты нового поколения не различаются существенно между собой по эффективности при лечении депрессий у больных среднего возраста (AHRQ 2011). В то же время метаанализ позволил выявить статистически достоверные различия в эффективности некоторых препаратов. Так, оказалось, что эффективность эсциталопрама выше, чем у циталопрама, сертралина - выше, чем у флуоксетина, венлафаксина - выше, чем у флуоксетина. В другом метаанализе, включавшем 117 РКИ (25 928 пациентов), было установлено, что в прямых и непрямых сравнительных исследованиях эсциталопрам, сертралин, миртазапин и венлафаксин статистически достоверно превосходили по эффективности и переносимости дулоксетин, флувоксамин, флуоксетин, пароксетин и ребоксетин (Cipriani A. et al., 2009).
Для оптимального выбора препарата и повышения эффективности терапии в психиатрии традиционно выделяют различные типы депрессивного синдрома (например, психотическая, меланхолическая, тревожная, адинамическая депрессия и т.д.) (Мосолов С.Н., 1995; Тиганов А.С., 1999; Вертоградова О.П., Петухов В.В., 2005 и др.). Однако исследований, касающихся эффективности антидепрессантов в узких подгруппах больных с различными вариантами депрессивного синдрома, крайне мало. В основном они касаются меланхолического варианта депрессии, которая рассматривается как прототип «эндогенной биологической» депрессии и считается наиболее чувствительной к действию антидепрессантов (Möller H.-J., 2009).
По данным исследований Danish University Antidepressant Group (DUAG, 1986, 1999), показатели ремиссии у госпитальных больных, большинство из которых имели меланхолический вариант депрессии, были выше при лечении кломипрамином в сравнении с пароксетином, циталопрамом и обратимым ИМАО типа А - моклобемидом. Амитриптилин, кломипрамин и венлафаксин оказались несколько эффективнее СИОЗС при тяжелой меланхолической депрессии (Bauer et al., 2009).
РКИ, в которых прицельно изучалось влияние антидепрессантов нового поколения непосредственно на симптоматику тревоги в структуре депрессивного синдрома, не выявил каких-либо различий между препаратами (Sartorius N. et al., 2007; AHRQ, 2011). Также нет каких-либо доказательных данных, касающихся различий в эффективности препаратов при других проявлениях депрессивного синдрома, таких как нарушения психомоторной сферы, снижение энергии или ангедония. Лишь в одном исследовании имеются указания на большую эффективность сертралина в сравнении с флуоксетином у больных с психомоторным возбуждением (Flament M.F. et al., 1999).
Таким образом, спектры тимоаналептического действия антидепрессантов нового поколения остаются малоизученными. В то же время изучение сравнительных профилей тимоаналептического действия позволяет определить место антидепрессанта в соответствии с классификацией Кильхольца, получившей наибольшее распространение в России и основанной на выделении препаратов с преимущественно седативным и стимулирующим действием (Kielholz P., 1965; Костюкова Е.Г., Мосолов С.Н., 2013). Для индивидуального дифференцированного подхода к выбору антидепрессанта на современном этапе по-прежнему актуален тезис Кильхольца о применении антидепрессантов с седативными и анксиолити-ческими свойствами при тревожных депрессиях и со стимулирующим (активирующим) действием при заторможенных формах. Еще до появления антидепрессантов нового поколения отечественные рекомендации по терапии в качестве основного критерия для индивидуального подбора ТЦА использовали различия в структуре депрессивного синдрома, указывая, что моторная и интеллектуальная заторможенность лучше поддается стимулирующему действию имипрамина, а тревога - седативному влиянию амитриптилина (Авруцкий Г.Я., Недува А.А., 1981).
Несмотря на сохраняющуюся практическую ценность такой классификации, используемое в ней понятие «седативного» эффекта требует уточнения, так как большинство антидепрессантов нового поколения практически полностью лишены седативных свойств, но обладают выраженным анксиолитическим действием. Очевидно, что при проведении тимоаналептической терапии симптоматика тревоги может редуцироваться за счет следующих факторов: 1) мощности стимулирующего воздействия на серотониновые рецепторы 1-го типа - истинное анксиолитическое действие; 2) антихолинергического, α-адренергического, антигистаминового действия - седативный эффект; 3) в структуре депрессивного синдрома по мере общей редукции выраженности депрессивной симптоматики.
Для ТЦА разделить понятие седативного и анксиолитического эффектов практически невозможно в связи с их мощным антихолинергическим, α-адренергическим и антигистаминным действием, нивелирующим клинические проявления различий между препаратами по степени их влияния на серотониновые рецепторы 1-го типа. При лечении ТЦА редукция тревоги, как правило, сопровождается избыточной седацией, гиперсомнией, физической слабостью, вялостью, наблюдающимися на протяжении всего курса терапии, вызывая у пациента существенный дискомфорт, и часто являются причиной несоблюдения режима терапии или отказа от нее. В то же время, учитывая, что именно наличие тревоги в структуре депрессивного синдрома в значительной степени определяет степень суицидального риска, выраженная седация при использовании ТЦА является некоторой «гарантией безопасности» у пациентов с суицидальными тенденциями.
Влияние антидепрессантов нового поколения на мускариновые, α-адренергические и гистаминовые рецепторы незначительно. Это определяет малую выраженность и низкую частоту возникновения избыточной седации при их использовании. Поэтому, анализируя редукцию симптоматики тревоги в процессе терапии этими препаратами, можно говорить об их истинном анксиолитическом действии. Отсутствие избыточной седации у антидепрессантов нового поколения существенно расширяет возможности терапии и увеличивает комплаентность больных. В то же время отсутствие седативных свойств требует от врача повышенного контроля в отношении суицидальных тенденций пациента. Такой контроль, наряду с представлением о влиянии назначенного препарата на симптомы тревоги и заторможенности, особенно важен на первом этапе терапии, поскольку усиление тревоги, связанное с возможным активирующим действием вновь назначенного препарата, может увеличить суицидальные тенденции. С другой стороны, назначение пациенту с адинамической депрессией препарата, обладающего выраженными седативными свойствами, может привести к отказу от терапии в связи с усилением дискомфорта, связанного с симптомами заторможенности.
Наши собственные результаты сравнительного изучения профилей тимоаналептического действия антидепрессантов нового поколения (флуоксетина, флувоксамина, пароксетина, сертралина, миртазапина, циталопрама, эсциталопрама, милнаципрана, венлафаксина и агомелатина), включавших 270 пациентов среднего возраста с умеренной и тяжелой депрессией, позволили выявить различия между препаратами по степени выраженности у них влияния на симптоматику тревоги и заторможенности в структуре депрессии. Оказалось, что эти свойства препаратов меняются с течением времени на протяжении курса купирующей терапии. Для оценки выраженности анксиолитического и активирующего действия каждого из препаратов в разные временные точки терапии анализировался коэффициент (К) соотношения редукции симптомов тревоги и заторможенности по шкале Гамильтона (К равен частному от деления процентного изменения значения показателя психической тревоги на процентное изменение значения показателя заторможенности). Результаты этого анализа показали, что к концу исследования значение коэффициента К для всех препаратов было близким к единице, что отражало полноценную редукцию симптоматики тревоги и заторможенности в структуре депрессивного синдрома. Однако наиболее информативными для выявления сравнительных особенностей спектра тимоаналептического действия изучаемых антидепрессантов оказались результаты анализа значений К в процессе терапии (рис. 12.6).
Наиболее стабильны во всех точках исследования оказались значения К для пароксетина, циталопрама, эсциталопрама и сертралина. Для сертралина отмечалось некоторое преобладание на всем протяжении терапии противотревожного действия над активирующим, для пароксетина, циталопрама и эсциталопрама наблюдалась практически равномерная редукция тревоги и заторможенности. Это позволило определить перечисленные препараты как наиболее сбалансированные в отношении влияния на тревогу и заторможенность в структуре депрессивного симптомокомплекса. Наиболее активирующими в ряду исследуемых антидепрессантов оказались флуоксетин и милнаципран. Для флуоксетина преобладание активирующего эффекта особенно отчетливо проявлялось в первую неделю лечения (значение К приобретало отрицательное значение за счет усиления тревоги). Аналогичной динамике подвергался спектр тимоаналептического действия милнаципрана. Противоположный флуоксетину полюс занимал флувоксамин. Для него значение К на первом этапе терапии было значительно выше единицы, что свидетельствует о более выраженном редуцирующем влиянии препарата на симптоматику тревоги по сравнению с заторможенностью. Профиль действия миртазапина наиболее радикально менялся с течением времени по сравнению с другими препаратами. Если в первые две недели лечения его редуцирующее влияние на выраженность тревоги значительно превышало активирующий эффект, то в последующем он приобретал свойства сбалансированного препарата. В отличие от остальных исследуемых антидепрессантов, для миртазапина невозможно разграничить противотревожное действие в первые две недели лечения с отчетливым седативным эффектом, вероятно обусловленным выраженным антигистаминным и адренолитическим действием препарата. С практической точки зрения представляется крайне важным выявление различий антидепрессантов по их влиянию на симптоматику тревоги и заторможенности на первом этапе терапии, который особенно ответственен для врача, назначившего антидепрессант.
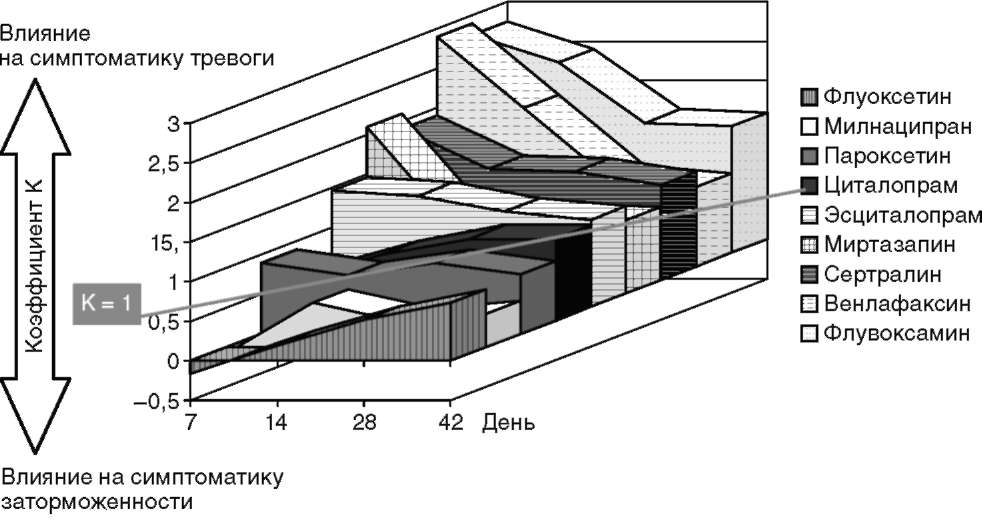
Рис. 12.6. Колебания значения коэффициента К в процессе терапии
На рис. 12.7 представлена клиническая классификация имеющихся на рынке антидепрессантов, расположенных по степени выраженности активирующих и седативных свойств в соответствии со схемой Кильхольца. К группе препаратов с отчетливыми седативными свойствами относят амитриптилин, доксепин, тразодон, миансерин, миртазапин и флувоксамин, а к группе препаратов с активирующим действием - ИМАО (моклобемид и пирлиндол), флуоксетин, имипрамин и милнаципран. Остальные антидепрессанты (большинство СИОЗС, а также некоторые препараты с мощным тимоаналептическим действием - кломипрамин, венлафаксин) относятся к препаратам сбалансированного действия, у них сложно выделить какой-либо доминирующий ранний седативный или стимулирующий эффект (см. рис. 12.7). Первичный выбор антидепрессанта часто определяется этой схемой - при выраженной тревоге и суицидальных мыслях назначают препараты с седативными свойствами, а при преобладании в структуре депрессии психомоторной заторможенности - препараты со стимулирующим компонентом действия. Несоблюдение этого элементарного принципа может существенно снизить эффективность тимоаналептической терапии и даже привести к утяжелению состояния. Например, применение активирующих антидепрессантов при сложных тревожно-бредовых или тревожных депрессивных синдромах может вызвать временное усиление тревоги, психомоторную ажитацию, обострение психотической симптоматики, страх, нарушения сна, актуализировать суицидальные тенденции. С течением времени первичные активирующий и седативный эффекты антидепрессантов обычно постепенно истощаются вследствие процессов рецепторной адаптации, и на первый план выходят собственно анксиолитический и тимоана-лептический эффекты.
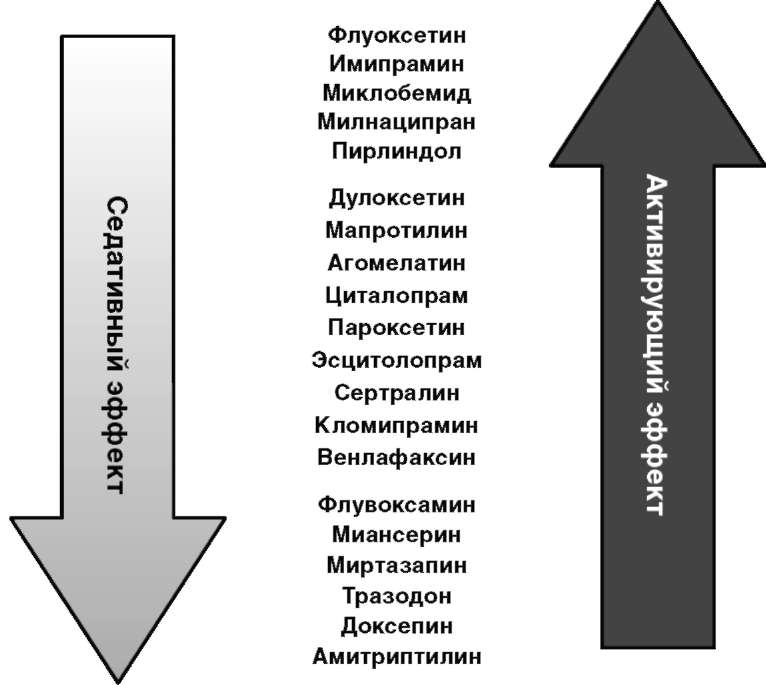
Рис. 12.7. Клиническая классификация современных антидепрессантов в соответствии с соотношением первичного активирующего и седативного эффектов
Характеристики спектров тимоаналептического действия могут быть одним из ориентиров при выборе антидепрессанта в каждом индивидуальном случае, наряду с теми факторами, которые предлагают современные международные рекомендации по терапии депрессии.
Индивидуальный выбор антидепрессанта для каждого конкретного пациента зависит от различных факторов, которые должны приниматься во внимание. К ним относятся предшествующий опыт использования данного препарата (наличие или отсутствие эффекта); сопутствующие заболевания, течение которых может ухудшиться в связи с назначением антидепрессанта; сопутствующее назначение других, в том числе непсихотропных, препаратов, которые могут вступать во взаимодействие с антидепрессантом; побочные эффекты препарата, которые могут оказывать влияние на качество жизни пациента и комплаенс; атипичные черты депрессивного эпизода, тип депрессии; опыт врача по использованию данного препарата; история эффективности препарата у родственников первой линии; предпочтения пациента, стоимость и доступность антидепрессанта (Bauer et al., 2002).
Показано, что алгоритмы являются эффективными методами оптимизации оказания психиатрической помощи в целях предотвращения развития резистентных к терапии депрессий (Adli M. et al., 2003; Mann J.J., 2005) и снижения затрат на лечение (Ricken R. et al., 2011). Ниже представлен алгоритм биологической терапии острых эпизодов или рецидивов депрессии у больных среднего возраста, который рассматривает первый этап терапии при депрессивном эпизоде умеренной и тяжелой выраженности, а также определяет возможности и последовательность действий в случае развития терапевтической резистентности. При составлении настоящего алгоритма использовались данные литературы (систематические обзоры, метаанализы) и следующие клинические рекомендации международных экспертных групп: The Texas Medication Algorithm Project - TMAP (Trivedi M.H. et al., 2004), American Psychiatric Association practice guideline for the treatment of patients with Major Depressive Disorder (APA, 2010), The Sequenced Treatment Alternatives to Relieve Depression - STAR*D (Rush A.J. et al., 2004), The German algorithm project - GAP (Adli M. et al., 2003; Bauer et al., 2009), S3-Leitlinie/ Nationale Versorgungs Leitlinie Unipolare Depression-Langfassung (DGPPN, 2009), World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for Biological Treatment of Unipolar Depressive Disorders (Bauer et al., 2002, 2013), Canadian Network for Mood and Anxiety Treatments (CANMAT), Clinical guidelines for the management of major depressive disorder in adults (CANMAT, 2001; 2009), The treatment and management of depression in adults. British guidelines for exellence practice (NICE, 2009; Anderson I.M. et al., 2000), Clinical practice recommendations for depression (Malhi G.S. et al., 2009), Royal Australian and New Zealand College of Psychiatrists clinical practice guidelines for mood disorders (Malhi G.S. et al., 2015). Каждый вариант терапии оценивался на основании убедительности или уровня доказательности ее эффективности, а также по степени рекомендации с учетом соотношения риск/польза (эффективность/безопасность), т.е. с учетом не только доказанной эффективности, но и частоты и тяжести побочных эффектов, возможных лекарственных взаимодействий и в соответствии с общей практической целесообразностью.
Уровни (категории) убедительности доказательств эффективности метода терапевтического вмешательства.
-
Доказательства получены на основе хорошо спланированных РКИ с воспроизводимыми результатами. Получено подтверждение в метаанализах.
-
Доказательства получены на основе ограниченного числа РКИ с неоднородными результатами и/или несовершенством методологии и/или недостаточным количеством пациентов.
-
Доказательства получены преимущественно на основе открытых нерандомизированных исследований или на основе РКИ с противоречивыми результатами. Опубликованы сведения об успешном клиническом применении.
-
Достоверных доказательств эффективности в настоящее время не получено или получены противоречивые (неоднозначные) результаты. Рекомендации к применению основаны на консенсусном мнении экспертов.
Уровень рекомендации по соотношению риск/польза:
Основной целью первого этапа купирующей терапии депрессивного эпизода при РДР является достижение ремиссии, которая традиционно определяется как: 1) отсутствие критериальных (основных) симптомов депрессии, а суммарная выраженность резидуальных симптомов не должна превышать 7 баллов по шкале Гамильтона для оценки депрессий (17 пунктов) (Hamilton, 1960) или 10 баллов по шкале Монтгомери-Асберг (Monthomery, Asberg M., 1979); 2) восстановление психосоциального уровня функционирования. Вместе с тем не следует забывать, что РДР является хроническим заболеванием и в большинстве случаев требует долгосрочного лечения, поэтому даже глубокая редукция депрессивной симптоматики не всегда означает наступление стойкой ремиссии и требует обязательного долечивания резидуальных симптомов. Для пациентов, удовлетворяющих современным диагностическим критериям депрессивного эпизода (МКБ-10) или так называемой большой депрессии (DSM-IV, DSM-5), следует рассмотреть возможность применения антидепрессивной или тимоаналептической терапии. При этом следует заметить, что современные критерии депрессивного синдрома могут включать довольно гетерогенные группы больных с различными типами депрессий в диапазоне от биологически детерминированных состояний (так называемых эндогенных или меланхолических депрессий) до в разной степени ситуационно спровоцированных или связанных с личностной патологией (так называемых реактивных или невротических депрессий). К сожалению, большинство РКИ ЛС с антидепрессивным эффектом использовало обобщенные недифференцированные критерии депрессивного эпизода, и не представляется возможным выделить их доказательную эффективность в отношении отдельных клинических вариантов, например при тревожной, меланхолической (с соматическими симптомами), атипичной, заторможенной (с кататоническими симптомами), сезонной или с преобладанием когнитивных нарушений. Тем не менее некоторые антидепрессанты были лучше, по сравнению с остальными, изучены при некоторых особых вариантах депрессивного синдрома, и там, где это возможно, мы старались сделать соответствующее примечание.
Постановка диагноза и первичная оценка депрессивного синдрома, включая тщательное соматическое обследование пациента, должна проводиться врачом-психиатром. До начала терапии следует составить индивидуальный план лечения, учитывающий преемственность различных этапов терапии, эффективность и переносимость предшествующей терапии, клинические особенности состояния (например, наличие психотической симптоматики, возбуждения, тревоги, нарушений сна или атипичных симптомов), тяжесть болезни и риск суицида, комплаентность больного, злоупотребление ПАВ, наличие сопутствующих заболеваний и принимаемую в связи с ними терапию, возможность наступления беременности и другие индивидуальные факторы, способные повлиять на эффективность и переносимость назначаемого антидепрессанта. При наличии показаний (например, в случае сочетания психотических симптомов и суицидальных мыслей) следует рассмотреть вопрос о стационарном лечении. Проведение тимоаналептической терапии в острой фазе заболеваний требует также как минимум еженедельного динамического наблюдения за психическим и соматическим состоянием пациента, включая периодическую ревизию диагноза и оценку суицидального риска, мониторирование ответа на терапию и развитие побочных эффектов, а также проверку комплаентности больного и формирование приверженности терапии с использованием различных психообразовательных методик.
Не существует доказательных данных о большей эффективности или более быстром начале действия антидепрессантов какого-либо одного класса, хотя при тяжелых, требующих госпитализации депрессиях некоторые ТЦА (амитриптилин и кломипрамин) и венлафаксин оказываются несколько эффективнее, чем СИОЗС (Anderson I.M. et al., 2000; APA, 2010 и др.). Антидепрессанты прежде всего различаются по профилю побочных эффектов, потенциалу взаимодействия с другими препаратами и опасности передозировки. Более новые антидепрессанты второго (например, бупропион, пирлиндол, мапротилин, миансерин, тразодон, моклобемид) и третьего (например, СИОЗС, СИОЗСН, миртазапин, агомелатин, вортиоксетин) поколений в целом переносятся лучше, чем ТЦА первого поколения, что способствует уменьшению вероятности самостоятельного отказа пациентов от их приема.
12.2.1. Общие рекомендации терапии острого депрессивного эпизода в рамках рекуррентного депрессивного расстройства
Лечение легких депрессивных эпизодов обычно осуществляется амбулаторно в рамках первичного звена психиатрической помощи. В зависимости от индивидуальных особенностей и/или запросов пациента возможно назначение антидепрессантов, которые достаточно эффективны (преимущественно используются СИОЗС, агомелатин и другие препараты новых поколений), хотя во многих случаях можно ограничиться применением психотерапевтических, психообразовательных или социально-реабилитационных методов, а также средств растительного происхождения, например экстракта зверобоя (B3) (Linde K. et al., 2008). Преимущественный выбор в пользу антидепрессантов по сравнению с психотерапией следует осуществлять у больных с наличием развернутых депрессий в анамнезе, с хорошим эффектом антидепрессантов в прошлых эпизодах, наличием субпороговых депрессий в течение последних двух лет, в также при отсутствии эффекта психосоциальных интервенций или при наличии РДР у ближайших родственников (DGPPN et al., 2009; NICE, 2009; APA, 2010; Baghai T.C. et al., 2011).
Лечение больных с умеренным депрессивным эпизодом в зависимости от особенностей депрессии и социальных условий проводят амбулаторно, полустационарно или в стационаре. Учитывая высокий риск резкого изменения состояния, а также вероятное появление суицидальных мыслей у одиноких больных, проживающих отдельно от родственников, лечение предпочтительнее осуществлять в условиях стационара или полустационара. При депрессивном эпизоде умеренной тяжести монотерапия антидепрессантами является первой линией выбора. Препаратами первого ряда большей частью считаются СИОЗС, далее следуют миртазапин, СИОЗСН и тетрациклики, бупропион и агомелатин (A1). ТЦА обычно рассматриваются как препараты второго выбора. Что касается ИМАО, то в этом вопросе меньше согласия, но препаратами выбора могут считаться моклобемид и пирлиндол, хотя ИМАО чаще используют при лечении атипичных депрессий и на стадиях резистентности к терапии. На первом этапе используют преимущественно пероральные формы лекарственных препаратов. Психотерапию при возможности проводят в сочетании с фармакотерапией.
Тимоаналептический эффект в среднем развивается через 3-4 нед лечения, однако в некоторых случаях, особенно при применении СИОЗС, улучшение развивается более постепенно, и для достижения полноценного эффекта приходится ждать 4-6 или даже 8 нед. Вместе с тем у большинства респондеров клиническое улучшение становится заметным уже в течение первых 2 нед лечения. Обычно такой ранний ответ связан с более благоприятным прогнозом курсовой эффективности проводимого терапии. Поэтому отсутствие всякого улучшения в течение 3-4 нед является первым временным порогом для попытки смены терапии.
Лечение больных с тяжелым депрессивным эпизодом проводят в условиях стационара. Для максимально быстрого достижения эффекта необходимо преимущественное использование внутримышечного и/или внутривенно-капельного способа введения антидепрессантов. Психотерапия на первых этапах лечения такой депрессии, как правило, неэффективна. Имеются определенные доказательства несколько большей эффективности кломипрамина, амитриптилина и венлафаксина по сравнению с СИОЗС при тяжелых депрессиях с меланхолическими чертами (DUAG, 1999; Anderson I.M., 2001 и др.) Больные с высоким суицидальным риском требуют особо тщательного надзора и специальной психологической коррекции, следует иметь в виду вероятность передозировки антидепрессанта вследствие приема большого количества препарата с суицидальной целью (по сравнению с СИОЗС более тяжелые последствия в этом случае наблюдаются при приеме ТЦА, венлафаксина и миртазапина). При сохраняющихся суицидальных намерениях необходимо рассматривать возможность быстрого проведения ЭСТ.
Лечение тяжелого депрессивного эпизода c психотическими симптомами (бредовая депрессия) проводят в условиях стационара. Терапевтическая тактика направлена на быстрейшее достижение «обрыва» психоза. Такие больные заметно лучше реагируют на комбинированную терапию антидепрессантом с антипсихотиком, чем на терапию с использованием препаратов лишь одной из упомянутых групп (Farahani A., Correll C.U., 2012 и др.), поэтому с первых дней назначают преимущественно мощные антидепрессанты в сочетании с атипичными антипсихотиками (B3). Если прием препарата per os затруднен в связи с психическим состоянием больного, возможно в/м применение нейролептиков. В случае хорошей переносимости дозы препаратов быстро доводят до максимальных.
Минимум в 30-50% случаев депрессивных эпизодов у пациентов не достигается достаточная эффективность любого из выбранных антидепрессантов при адекватно проведенной терапии первой линии. В такой ситуации необходимо еще раз проверить, правильно ли был поставлен диагноз, достаточна ли доза назначенного препарата и степень комплаентности пациента. С целью выявления фармакокинетических причин недостаточной эффективности (псевдорезистентность) целесообразно определение концентрации препарата в крови и проведение генотипирования для выявления лиц с замедленным или ускоренным метаболизмом определенных антидепрессантов. Это особенно важно при проведении сочетанной терапии препаратами, метаболизируемыми теми же изоферментами цитохрома Р450.
Далее возможны следующие варианты стратегий: 1) с целью преодоления возможных явлений псевдорезистентности повышение дозы назначенного антидепрессанта до максимальной (в основном имеет смысл при применении ТЦА и венлафаксина) или переход к парентеральному введению ТЦА; 2) переключение на антидепрессант другого фармакологического класса (например, с СИОЗС на ТЦА или селективные ингибиторы обратного захвата норадреналина); 3) переключение на другой антидепрессант в рамках того же фармакологического класса (например, с одного СИОЗС на другой); 4) сочетание двух антидепрессантов с разным механизмом действия (например, препарат СИОЗС или антидепрессант двойного действия с миртазапином); 5) аугментация (потенцирование) действия антидепрессанта другими агентами (например, литием, тиреоидным гормоном или атипичным антипсихотиком - кветиапином или арипипразолом) с целью повышения антидепрессивной эффективности; 6) сочетание антидепрессанта с психотерапевтической интервенцией; 7) одномоментная отмена; 8) сочетание антидепрессанта с нелекарственной биологической терапией [например, депривация сна, светотерапия, электросудорожная терапия (ЭСТ), ТМС, ПФ и др.]. ЭСТ следует рассматривать как стратегию первого выбора только в особых ситуациях, требующих быстрого облегчения тяжелой депрессии (например, при тяжелой психотической депрессии, тяжелой депрессии с психомоторной заторможенностью, стойкой резистентности к фармакотерапии, отказе от приема пищи, высоком риске суицида), у пациентов, которые ранее положительно отвечали на ЭСТ, и у беременных женщин, особенно в I триместре беременности.
Доказательства обоснования приведенных стратегий весьма ограниченны, поскольку РКИ на больших выборках больных не проводилось. В настоящее время нет четкого консенсуса о предпочтительности какой-либо из стратегий при лечении пациентов, не отвечающих на терапию. Особенно это касается препаратов второго выбора. При анализе данных проекта STAR*D было показано, что процент пациентов с ремиссиями можно увеличить с 27%, достигнутых при использовании терапии первого выбора, до кумулятивного уровня 67% - после всех четырех последующих шагов терапевтически вмешательств. Однако вероятность достижения ремиссии после первых двух курсов терапии была выше (20-30%), чем после двух последних (10-20%) (Gaynes B.N. et al., 2009).
Пошаговый терапевтический алгоритм лечения эпизода РДР умеренной или тяжелой выраженности без психотических симптомов и без учета синдромальных особенностей депрессии предполагает последовательное применение всех вышеперечисленных стратегий и включает 5 этапов (рис. 12.8).
На первом этапе в качестве первого курса терапии некоего «усредненного» депрессивного эпизода можно выбрать любой антидепрессант с доказанной клинической эффективностью. Однако для лечения тяжелой депрессии лучше сразу выбрать препарат с широким спектром нейрохимического механизма действия (СИОЗСН, тетрациклические антидепрессанты, ТЦА). При этом предпочтение в силу лучшей переносимости следует отдать СИОЗСН (венлафаксин, дулоксетин, милнаципран) (А1), а потом ТЦА (имипрамин, амитриптилин, кломипрамин) (А2) или другим гетероциклическим препаратам первого поколения (мапротилин, пирлиндол, пипофезин, тразодон и др.) (А2), которые обладают несколько лучшей переносимостью, но и меньшей эффективностью. Для лечения умеренно выраженной депрессии предпочтение отдается СИОЗС и другим антидепрессантам нового поколения (А1). При наличии эффекта в течение 3-4 нед терапию продолжают вплоть до достижения ремиссии, а в случае отсутствия динамики или недостаточного эффекта (степень редукции симптоматики от 25 до 50%) можно переходить ко второму курсу или этапу терапии: смене препарата или в случае подозрения на наличие псевдорезистентности попробовать нарастить дозу до максимальной или частично перейти на парентеральный путь введения (в основном это касается ТЦА). Смену неэффективного антидепрессанта обычно проводят на препарат с другим механизмом действия. В метаанализе Papakostas J.I. и соавт. (2008) показано небольшое, но статистически значимое преимущество замены на препарат с другим механизмом действия (в качестве препаратов первой линии применялись СИОЗС). Более убедительные доказательства эффективности такой смены по сравнению с переключением на другой препарат из той же группы или одного механизма действия отсутствуют (Bschor T., Baethge C., 2010). Тем не менее современные определения терапевтически резистентной депрессии предполагают неэффективность (т.е. редукция симптоматики по шкале Гамильтона составляет не более 50%) двух последовательных курсов адекватной монотерапии длительностью в среднем 3-4 нед фармакологически различных по структуре и нейрохимическому действию антидепрессантов (Мосолов С.Н., 1995; Мазо Г.Э., 2004; Trivedi М.Н., 2004; Мазо Г.Э., Trivedi M.H., 2012; Быков Ю.В. и др., 2013).
При недостаточности клинического эффекта и отсутствии явных причин такой неэффективности, включая ошибочную диагностику (например, биполярного расстройства II типа), некомплаентность, коморбидные психические и соматические заболевания и другие факторы (см. рис. 12.5), считается, что больному свойственна относительная резистентность и нужно переходить к третьему этапу терапии, т.е. собственно противорезистентным мероприятиям, которые включают в себя:

Рис. 12.8. Алгоритм действий при терапевтически резистентном эпизоде рекуррентной депрессии
При этом в зависимости от ситуации можно выбрать любой вариант терапии с длительностью курса 3-4 нед, однако предпочтение следует отдавать средствам с доказанной эффективностью и хорошей переносимостью, а также учитывать возможные лекарственные взаимодействия, в том числе возникающие вследствие конкурентного печеночного метаболизма.
Рациональные сочетания антидепрессантов используют комплементарные механизмы действия для достижения синергического тимоаналептического эффекта. Комбинированная терапия позволяет не потерять частичный ответ от изначальной монотерапии. К негативным сторонам такой стратегии следует отнести повышенный риск взаимодействий между используемыми препаратами, усиление побочных эффектов и более высокие экономические затраты. Существуют лишь единичные данные РКИ, свидетельствующие в пользу комбинированной стратегии, в том числе сочетания ТЦА и СИОЗС (Nelson, 1998; DeBattista C. et al., 2003). Наиболее убедительные данные получены в 9 РКИ в отношении комбинации ингибиторов механизма обратного захвата (например, СИОЗС, ТЦА, СИОЗСН и др.) с блокаторами α2 -адренергических ауторецепторов (например, миртазапин, миансерин и др.) (A2) (Ferreri M. et al., 2001; Carpenter L.L. et al., 2002). Преимуществом такой комбинации является седативный эффект, который оказывается полезным при бессоннице и тревоге, недостатком - повышенный риск антигистаминовых побочных эффектов (прибавка веса и избыточная седация) и антихолинергических побочных эффектов (снижение концентрации внимания и спутанность). Cледует избегать сочетания ИМАО с СИОЗС и другими серотонинергическими антидепрессантами (например, кломипрамин, венлафаксин и др.) вследствие потенциальной возможности развития серотонинового синдрома (Мосолов С.Н. и др., 2000; Finfgeld D.L., 2004).
Стратегия комбинированного использования антидепрессантов и антипсихотиков обычно применяется при психотической депрессии. В нескольких РКИ была показана эффективность присоединения кветиапина, арипипразола, оланзапина и рисперидона к СИОЗС при неэффективности первого курса монотерапии СИОЗС (Papakostas J.I. et al., 2007; Komossa K. et al., 2010 и др.). Наиболее убедительные данные были получены в отношении кветиапина, арипипразола и оланзапина (последнего только в сочетании с флуоксетином) (А2). Вместе с тем при присоединении любого АВП возрастает общее число побочных эффектов, включая ГП, метаболические нарушения (увеличение массы тела, дислипидемия, нарушение углеводного обмена), лейкопению, седацию и сонливость, антихолинергические и экстрапирамидные побочные эффекты, что требует тщательной оценки риск/польза при их использовании вместе с антидепрессантами. Рекомендуемой начальной дозой арипипразола, назначаемого в целях аугментации, является 2-5 мг/cут. Увеличение дозы выше 5 мг/день должно проводиться постепенно под контролем эффективности с интервалом не менее одной недели, с максимальной конечной дозой 15 мг/сут. При этом следует учитывать возможность развития акатизии. Согласно инструкции по применению кветиапина замедленного высвобождения, терапию следует начинать с однократного вечернего приема 50 мг, на 3-й день дозу можно увеличить до 150 мг (однократный вечерний прием) и далее до 300 мг/сут (применение более высоких доз не изучалось). Необходимо учитывать возможность появления седации и набора веса. Имеются также старые открытые исследования по усилению тимоаналептического эффекта антидепрессантов некоторыми антипсихотиками первого поколения (АПП) (сульпирид, флупентиксол, трифлуоперазин) (D) (Авруцкий Г.Я., Недува А.А., 1988; Мосолов С.Н., 1995).
Наиболее изученным средством аугментации действия различных антидепрессантов являются соли лития, включая ТЦА и СИОЗС (А2) (Bauer, Dopfmer S., 1999; Zullino D., Baumann P., 2001; Crossley N.A., Bauer, 2007). Даже небольшие дозы лития (концентрация в крови 0,4-0,8 ммоль/л) в течение нескольких дней могут привести к улучшению в состоянии больного. Курс терапии не превышает 2-4 нед, однако в случае достижения эффекта терапию следует продолжить в течение нескольких месяцев. Комбинировать антидепрессанты с литием нужно осторожно, поскольку повышенные дозировки могут привести к развитию нейротоксических реакций (миоклония, атаксия, возбуждение, спутанность), а при сочетании с L-триптофаном (так называемый ньюкаслский или серотониновый коктейль) - к серотониновому неврологическому синдрому (Мосолов С.Н. и др., 2000). Кроме того, нежелательные явления при терапии литием включают кардиотоксичность, нефротоксичность, тиреотоксичность и прибавку веса. Из-за узкого терапевтического диапазона требуется регулярный контроль концентрации лития в крови. Считается, что литий может менять рецепторную чувствительность постсинаптической мембраны и усиливать действие серотонина. Имеются отдельные открытые клинические исследования эффективности присоединения ламотриджина и карбамазепина (D), однако РКИ не обнаружили преимуществ по сравнению с плацебо. Нельзя исключить, что случаи эффективности были связаны с ошибочной диагностикой РДР и невыявлением у больных БАР II типа (Mosolov S.N. et al., 2014) или «скрытой биполярности» (Dudek D. et al., 2010).
Среди других методов лекарственной аугментации эффекта антидепрессантов при резистентных депрессиях наибольшую доказательность имеет применение Т3 в дозе 25-50 мг/сут в течение 1 мес (В3). Эффект обычно наступает в первые дни лечения. Препарат мешает связыванию антидепрессантов с белками крови и повышает их свободную фракцию в крови. В процессе терапии нередко развиваются явления гипертиреоидизма (головные боли, гипергидроз, тахикардия, тремор, аритмия, боли в сердце), возможно повышение АД. Несмотря на наличие нескольких РКИ с положительным результатом, метаанализ статистически значимого превосходства над плацебо не обнаружил (Aronson R. et al., 1996). В нескольких открытых исследованиях был получен положительный эффект при использовании высоких дозировок L-тироксина (Т4) (Bauer et al., 2002). Результаты исследования STAR*D, в котором рандомизированно изучалась аугментация с применением Т3 или лития у пациентов с недостаточной эффективностью монотерапии циталопрамом, показали недостоверные различия в эффективности, но при этом отмечалось меньшее число нежелательных эффектов (и прерывания терапии по этой причине) при использовании Т3 (Nierenberg A.A. et al., 2006).
И наконец, стратегия перевода на монотерапию необратимыми ИМАО (C4) широко применялась прежде (Вовин Р.Я., Аксенова И.О., 1982; Авруцкий Г.Я., Недува А.А., 1988; Нуллер Ю.Л., Михаленко И.Н., 1988; Мосолов, 1995), но не используется в последние годы вследствие возможности развития гипертонического криза и исчезновения этой группы антидепрессантов из клинической практики. Тем не менее в ряде случаев перевод на селективные обратимые ИМАО (пирлиндол, моклобемид) может оказать быстрый положительный эффект, поскольку речь идет о совершенно другом механизме действия и стимулировании выброса в синаптическую щель всех трех моноаминовых нейромедиаторов.
В случае неэффективности указанных мероприятий переходят к четвертому этапу, который также состоит из нескольких опций:
-
другие специальные методы лекарственной аугментации эффекта антидепрессанта (пиндолол, буспирон, L-триптофан, метилфенидатρ, L-дофа и другие дофаминовые агонисты, иммуномодуляторы, токоферол, фолиевая кислота);
-
другие методы электростимуляции мозга [ТМС, глубокая стимуляция мозга (DBS), магнито-конвульсивная терапия, стимуляция блуждающего нерва и др.];
-
другие методы нелекарственной терапии (депривация сна, светотерапия, ПФ, нормобарическая гипоксия, лазеротерапия (ЛТ), физические упражнения, рефлексотерапия, разгрузочно-диетическая терапия и др.);
-
одномоментная отмена с диуретиками или терапией «прикрытия»;
-
присоединение адекватной психотерапии (например, КПТ и др.).
Центральной опцией этого этапа и одного из самых мощных методов преодоления терапевтической резистентности при депрессиях, безусловно, является проведение курса ЭСТ в виде монотерапии или на фоне применения антидепрессантов. Эффективность курса из 8-12 сеансов ЭСТ (2-4 нед, 3 сеанса в неделю через день) хорошо доказана (Pagnin D. et al., 2004; Prudic J. et al., 2004; Rasmussen K.G. et al., 2007), составляет 50-80% (Авруцкий Г.Я. и др., 1989; Fink M. 2001; Нельсон А.И., 2005; Dombrovski A.Y. et al., 2005) и превышает все другие стратегии (В2). Поэтому при отсутствии противопоказаний с целью противодействия дальнейшего затягивания и хронификации депрессии ЭСТ следует предпочесть всем другим методам этого этапа. В настоящее время в качестве стандарта безопасности используется модифицированная ЭСТ с кратковременным внутривенным наркозом, применением миорелаксантов и искусственной вентиляцией легких, при которой почти полностью устраняется судорожный компонент припадка. ЭСТ характеризуется хорошей безопасностью и переносимостью (нежелательные явления возникают в 0,4% случаев) и не имеет абсолютных противопоказаний, кроме повышенного внутричерепного давления. Необходимо проявлять осторожность у больных с цереброваскулярной недостаточностью, сердечно-сосудистыми заболеваниями, например недавно перенесенным ИМ, ишемией миокарда, застойной сердечной недостаточностью, аритмией, или имеющими кардиостимулятор, а также с пациентами с абдоминальной аневризмой и тяжелым остеопорозом. Среди побочных эффектов наиболее важными являются мнестические нарушения в период лечения, которые менее выражены при унилатеральном наложении электродов. Однако битемпоральная ЭСТ несколько более эффективна (Sackeim H.A. et al., 2000). ЭСТ можно применять на любой стадии лечения резистентной депрессии, в зависимости от клинической картины и от необходимости получения быстрого эффекта. Психотические депрессии с бредовыми переживаниями, выраженными психомоторным возбуждением или заторможенностью, высоким риском суицида, с отказом от приема пищи, противопоказаниями к фармакотерапии (например, непереносимость или беременность) являются основными показаниями для раннего применения ЭСТ. Кроме того, ЭСТ следует рассматривать как средство более раннего выбора при известной эффективности метода в прошлых эпизодах.
Еще одним мощным средством преодоления терапевтической резистентности с обрывом депрессивной симптоматики является оригинальная отечественная разработка - одномоментная отмена (Прохорова И.С., 1975). Этап «насыщения» лекарственными препаратами при проведении одномоментной отмены предполагает наращивание доз ТЦА и антихолинергических корректоров (иногда в схему также включается нейролептик) до максимально переносимых (т.е. до появления побочных эффектов) и длится 10-14 дней. Затем выполняется одномоментная отмена терапии. Для усиления эффекта отмены используют диуретики, обильное питье, в/в вливание изотонического раствора натрия хлорида или ПФ. У половины больных критическая редукция депрессивной симптоматики наступает на 5-10-й день после отмены (Авруцкий Г.Я., Недува А.А., 1981; Малин Д.И., Костицын Н.В., 1993; Мосолов С.Н., 1995). Для коррекции выраженных соматовегетативных расстройств в этот период назначаются симптоматические средства и бензодиазепиновые транквилизаторы. К сожалению, метод был разработан и широко апробирован в 70-80-е гг. прошлого века и имеет низкий ранг доказательности (С3).
Помимо ЭСТ и одномоментной отмены, можно попытаться использовать и другие, не применявшиеся ранее методы аугментации или комбинированной терапии III этапа, особенно с рангом рекомендации А2 и В2, а также другие лекарственные методы аугментации антидепрессантов (см. рис. 12.8).
Сочетание СИОЗС с пиндололом (антагонист ß-адренорецептора и 5-HT1А рецепторов) заметно повышает скорость тимоаналептического ответа (Portella et al., 2011). В метаанализе 4 РКИ показано преимущество пиндолола над плацебо на ранних этапах лечения и отсутствие такового после 2-й недели терапии © (Ballesteros J., Callado L.F., 2004). Побочные эффекты пиндолола включали сонливость, тошноту, брадикардию, ортостатическую гипотензию, потливость и сухость во рту. В исследовании STAR*D бупропион или буспирон (частичный агонист рецепторов 5-HT1А) добавляли к циталопраму при его недостаточной предшествующей эффективности. В обеих группах показатели ремиссии составляли около 30% (Trivedi M.H. et al., 2006). При вторичном анализе результатов исследования буспирон оказался статистически достоверно менее эффективен по сравнению с бупропионом. По результатам последнего метаанализа, использование пиндолола и буспирона (D) для аугментации антидепрессантов не рекомендуется (Connolly K.R., Thase M.E., 2011).
В 3 РКИ для аугментации антидепрессантов с положительным эффектом применялись ω-3 полиненасыщенные жирные кислоты в дозе 1 г/сут, а именно эйкозапентаеновая и докозагексаеновая (Peet M., Horrobin D.F., 2002; Nemets B. et al., 2002; Su K.P. et al., 2003). Помимо хорошей переносимости эссенциальные жирные кислоты отличаются другими преимуществами, в том числе снижением риска сердечно-сосудистых заболеваний.
Метилфенидатρ - психостимулятор, применяющийся для лечения СДВГ, рекомендуется в дозе 20-30 мг/сут утром и днем в дополнение к основной терапии антидепрессантами (С). Эффект обычно наступает в первые дни терапии, курс 2-3 нед. Метилфенидатρ повышает содержание ТЦА в плазме крови. Среди побочных явлений этого препарата возможно повышение АД и усиление психотической (галлюцинаторно-бредовой симптоматики). Ни в одном из двух РКИ не показано глобального преимущества метилфенидатаρ над плацебо (Patkar A.A. et al., 2006; Ravindran A.V. et al., 2008). Однако апатия и утомляемость достоверно в большей степени редуцировались в группе метилфенидатаρ.
Имеются сведения об эффективности в качестве аугментирующих средств антидепрессантов и многих других препаратов L-триптофана, L-дофы и других дофаминовых агонистов, модафинилаρ, резерпина, α- и ß-адреноблокаторов, антиоксидантов, иммуномодуляторов, витамина E, средств растительного происхождения и др. (Вовин Р.Я., Аксенова И.О., 1982; Нуллер Ю.Л., Аксенова И.О., 1982; Мосолов С.Н. и др., 1995; Мазо Г.Э., Незнанов Н.Г., 2012; Bauer et al., 2013). Исследования этих методов аугментации были преимущественно открытыми и проводились без необходимого контроля и рандомизации, поэтому в настоящее время их уровень доказательности является низким (D) (см. рис. 12.8).
В практической деятельности антидепрессанты часто сочетаются с бензодиазепиновыми препаратами (до 30-60% больных РДР), которые не оказывают тимоаналептического эффекта и обычно присоединяются по симптоматическим показаниям для коррекции тревоги и бессонницы. Тем не менее пациенты, принимающие такую комбинированную терапию, чаще давали ответ на 1-4-й неделях лечения, по сравнению с пациентами на монотерапии антидепрессантами (Furukawa T.A. et al., 2001). Пользу от добавления анксиолитиков следует взвешенно рассматривать с учетом рисков развития зависимости, нарушений памяти и поведенческой токсичности. Бензодиазепины не следует назначать пациентам, злоупотреблявшим ранее или злоупотребляющим в настоящее время ПАВ и склонных к формированию зависимости. Следует ограничивать максимальную продолжительность применения бензодиазепинов у депрессивных пациентов 4-6 нед.
Помимо ЭСТ в последнее время широкое распространение для лечения депрессий получили и другие методы электростимуляции мозга (см. рис. 12.8), наиболее изученным из которых является ТМС. Опубликовано большое число работ, посвященных применению ТМС с различными параметрами стимуляции при депрессии, как в качестве монотерапии, так и для усиления эффекта антидепрессантов (например, с СИОЗС - Conca A. et al., 1996; Poulet E. et al., 2004; Rumi D.O. et al., 2005; Rossini D. et al., 2005; Bretlau L.G. et al., 2008 и др.). Высокочастотная импульсная или циклическая, транскраниальная магнитная стимуляция (rTMC) (5-20 Гц) обычно оказывает умеренный стимулирующий эффект, а низкочастотная (1 Гц) - успокаивающий, противотревожный. Наиболее распространенным вариантом при терапевтически резистентной депрессии является высокочастотная унилатеральная rTMC с наложением на проекцию левой дорсолатеральной префронтальной коры. В сравнении с ЭСТ процедура менее эффективна, но значительно лучше переносится больными (Нельсон А.И., 2005; Ильин С.А. и др., 2008; Цукарзи Э.Э. и др., 2015) и лучше корригирует когнитивные нарушения (Пуговкина О.Д. и др., 2006). Кроме редко возникающей умеренной головной боли и дискомфорта в месте стимуляции, никаких побочных эффектов после 2-недельного курса ТМС не возникает. В редких случаях описывались спровоцированные ТМС эпилептические судороги (Loo C.K. et al., 2008). Метаанализы контролируемых исследований (в сравнении с процедурой псевдо-ТМС) стабильно показывают небольшой положительный эффект 2-недельного курса ТМС (Kozel F.A., George M.C., 2002; Martin J.L. et al., 2003; Mosimann U.P. et al., 2004; Herrmann L.L., Ebmeier K.P., 2006). Однако неоднородность терапевтических групп, их небольшие выборки больных и различающийся дизайн исследований на настоящем этапе не позволяют с уверенностью говорить о полностью доказанной эффективности этого метода (С3).
Стимуляция блуждающего нерва предполагает непрямую стимуляцию мозга через блуждающий нерв. Небольшой генератор имплантируется слева над ключицей и с помощью электрода подключается к левому вагусу. Генератор посылает в нерв ритмические электрические импульсы в течение 30 с каждые 5 мин. Данные нескольких РКИ (George M.S. et al., 2005; Rush A.J. et al., 2005; Nahas Z. et al., 2007; Nierenberg A.A. et al., 2008) и последующего метаанализа (Daban C. et al., 2008) не обнаружили различий в эффективности через 10 нед применения метода стимуляции блуждающего нерва по сравнению с имитацией воздействия, но показали более высокую эффективность через год терапии. Несмотря на отсутствие убедительных доказательств эффективности стимуляции блуждающего нерва при терапевтически резистентных депрессиях (D4), в 2005 г. метод был разрешен к применению в США. К недостаткам метода следует отнести его инвазивный характер и ряд побочных эффектов (охриплость голоса, стимуляция кашлевого рефлекса и др.).
DBS предполагает стереотаксическое размещение миниатюрных электродов в определенных нейроанатомических областях мозга под контролем нейровизуализации. Электроды подключаются к проводнику, который соединен с имплантированным под кожу грудной клетки генератором высокочастотных электрических импульсов. При терапевтически резистентных депрессиях целевыми зонами для билатерального размещения электродов являются подмозолистая часть поясной извилины, чечевидное ядро, а также корковая зона Бродмана 25 (BA25). Исследования на небольших группах больных показали эффективность DBS как в остром, так и отдаленном периодах депрессии (D4) (Kopell B.H. et al., 2004; Giacobbe P., Kennedy S.H., 2006; Lozano A.M. et al., 2008; Schlaepfer T.E. et al., 2008 и др.). К недостаткам метода относятся инвазивность хирургической процедуры, ограниченная доступность и высокая стоимость методики, а также неопределенность в том, какие параметры стимуляции являются оптимальными.
Имеются немногочисленные данные и об экспериментальном применении при терапевтически резистентных депрессиях и других новых методов электростимуляции мозга (см. рис. 12.8). В частности, магнито-конвульсивная терапия является вариантом импульсной rTMC с усилением мощности, необходимым для провокации эпилептиформного припадка. При сопоставимой эффективности магнито-конвульсивная терапия приводит к менее выраженным по сравнению с ЭСТ когнитивным и мнестическим нарушениям (D4) (Lisanby, 2001; Higgins E.S., George M.S., 2008). К другим неинвазивным экспериментальным методикам относятся также транскраниальная прямая электростимуляция ТПЭСМ (D4) (Shiozawa P. et al., 2014; Tortella G. et al., 2015; Tortella G. et al., (Higgins E.S., George M.S., 2008; Bersani F.S. et al., 2013).
Среди других нелекарственных методов терапии для усиления эффекта антидепрессантов следует отметить светотерапию (В3) (при сезонном аффективном расстройстве, так называемых зимних депрессиях) (Tuunainen A. et al., 2004; NICE, 2009; Симуткин Г.Г., 2014; Мосолов С.Н., 2014), депривацию сна (С3) (Wirz-Justice A., van den Hoofdakker R.H., 1999; Giedke H. et al., 2003; Симуткин Г.Г., 2014), физические упражнения (C3) (Mead G.E. et al., 2008), рефлексотерапию (D) (Портнов Ф.Г., 1980; Ernst E., 2009), разгрузочно-диетическую терапию (D) (Николаев Ю.С. и др., 1979; Теренковский Д.И., 1982; Авруцкий Г.Я., Недува А.А., 1988; Подкорытов В.С., 2003), внутривенное лазерное облучение крови - ВЛОК (D) (Вернекина Н.С. и др., 1994; Сайкин М.А. и др., 1998; Мосолов С.Н. и др., 1999), облучение крови ультрафиолетом (D) (Кекелидзе З.И. и др., 1993), нормо-барическую гипоксию (D) (Каримулаев И.А. и др., 2002), ПФ (D) (Малин Д.И., Костицын Н.В., 1993; Малин Д.И., 1997) и др.
На любом этапе лечения дополнительное воздействие всегда может оказать подключение адекватной психотерапии (В3), которая больше фокусируется на текущих проблемах пациента и включает элементы психообразования (Frank E. et al., 2000). Это особенно важно у пациентов с недостаточной комплаентностью (Rush A.J., Thase M.E., 1999). Наиболее изученные и эффективные при депрессии формы психотерапии - это КПТ, поведенческая и межличностная (интерперсональная) терапия (Segal Z.V. et al., 2001). Несмотря на частое использование психотерапии во время лечения антидепрессантами, свидетельства в поддержку данного подхода неоднозначны (Jundal, Thase M.E., 2003; de Jonghe F. et al., 2004).
В случае неэффективности всех перечисленных этапов, и особенно курса ЭСТ, следует думать об абсолютной резистентности и переходить к пятому этапу, включающему длительные курсы не использованных ранее антидепрессантов, новые варианты комбинированной терапии, включая сочетание ингибиторов пресинап-тического захвата с ИМАО, и другие противорезистентные мероприятия, в том числе новые методы электростимуляции мозга. При достижении эффекта необходимо продолжать эффективную терапию еще на протяжении 6-9 мес, добиваясь при этом полной редукции резидуальной симптоматики и достижения стабильной ремиссии (B3) (Rush A.J., Kupfer D.J., 2001; Geddes J.R. et al., 2003 и др.). 12.2.2. Продолженная и профилактическая терапия
Продолженная терапия в настоящее время считается обязательным этапом даже при единичном депрессивном эпизоде и следует за купирующей терапией. Ее целью является предотвращение рецидива перенесенного депрессивного эпизода. Риск обострений среди пациентов, не получающих поддерживающей ПФТ в первые полгода после прекращения симптомов депрессии, в среднем равен 50%. Адекватная по срокам и дозе фармакотерапия снижает угрозу рецидива депрессии до 10% (Thase M.E., 2003). Максимальная эффективность терапии на данном этапе обнаружена при использовании эффективного в купирующий период антидепрессанта с сохранением прежней дозы (Frank E. et al., 1990; Kupfer D.J. et al., 1992).
Хронический рецидивирующий характер течения РДР определяет необходимость проведения вторичной профилактики рецидивов заболевания. В настоящее время под профилактическим эффектом подразумевается способность ряда препаратов при длительном непрерывном приеме подавлять развитие рецидива или уменьшать выраженность очередной аффективной фазы. ПФТ была и остается до настоящего времени единственным эффективным методом предотвращения рецидивов РДР. Целесообразность профилактической терапии при РДР на современном этапе обосновывается следующими фактами (Montgomery S.A. et al., 1989; Kupfer D.J., 1991, 1992; Hirschfeld R.M., 2001):
-
около 50-80% пациентов с депрессивным расстройством отмечают в течение жизни повторное обострение;
-
риск обострений нарастает с возрастом и пропорционален числу перенесенных эпизодов;
-
с увеличением числа эпизодов длительность ремиссий сокращается;
-
имеются данные об эффективности антидепрессантов в целях профилактики депрессивных эпизодов;
-
терапевтический ответ на антидепрессивную терапию может ослабевать с увеличением числа перенесенных эпизодов;
-
с каждым эпизодом нарастает инвалидизация и снижается качество жизни пациентов.
Современный этап изучения длительной терапии РДР предъявляет высокие требования к терминологии, используемой при ее описании и анализе результатов. Работа по созданию единого терминологического языка в области профилактики РДР завершилась к началу 90-х гг. (Montgomery S.A. et al., 1989; Franк, 1991; Kupfer D.J., 1991).
Неполная ремиссия - период, во время которого отмечается значительное улучшение, но симптомы (не достигающие синдромального единства) сохраняются.
Полная ремиссия - отсутствие каких-либо признаков аффективного расстройства на протяжении 6 мес.
Выздоровление - ремиссия длительностью более 6 мес, но также ограниченная во времени.
Обострение - возобновление симптоматики до уровня значительной степени выраженности в период ремиссии (до выздоровления).
Повторный эпизод - развитие нового депрессивного эпизода после выздоровления от предыдущего.
ВОЗ рекомендует назначать профилактическую терапию больным, у которых было два тяжелых депрессивных эпизода в течение последних 5 лет, и продолжать ее не менее двух лет после исчезновения всех симптомов депрессивного расстройства (ВОЗ, 1989).
До введения в клиническую практику антидепрессантов нового поколения для предотвращения рецидивов РДР использовались препараты нормотимического действия. Несмотря на эффективность противорецидивного действия солей лития при РДР в нескольких РКИ (Prien R.F. et al., 1973; Fieve R.R. et al., 1976), а также положительные результаты ряда открытых исследований карбамазепина, в настоящее время более изученными и признанными для профилактики РДР препаратами являются антидепрессанты. В рекомендациях Всемирной федерации общества биологической психиатрии (WFSBP) предложено использование карбамазепина при непереносимости антидепрессантов и лития (Bauer et al., 2002). Также карбамазепин может быть использован для интенсификации профилактической терапии при неэффективности монотерапии антидепрессантами (Bauer et al., 2002).
Уже первые исследования противорецидивной эффективности ТЦА (амитриптилин, имипрамин, нортриптилин (Prien R.F. et al., 1973; Coppen A. et al., 1978; Frank E. et al., 1990; Kupfer D.J. et al., 1992) при РДР показали их преимущество перед плацебо. Способность достоверно уменьшать риск рецидива депрессии выявлена также у препаратов тетрациклической структуры с различным механизмом действия - мапротилина (Rouillon F. et al., 1991) и миансерина (Kishimoto A. et al., 1994). В то же время препятствием для длительного использования гетероциклических антидепрессантов является почти неизбежное развитие у больных побочных эффектов, ограничивающее возможность применения адекватных доз препаратов.
Современные подходы к проведению профилактической терапии РДР предполагают непрерывное длительное (не менее 3-5 лет) применение антидепрессантов в стандартной дозе, оказавшейся эффективной в период купирования депрессивной фазы. При этом показано, что снижение дозы уменьшает эффективность профилактической терапии (Frank E. еt al., 1990). В связи с этим при использовании для профилактики РДР ТЦА возникает дилемма: низкие дозы ТЦА обладают слабой профилактической активностью, а нежелательные явления, возникающие при использовании высоких доз ТЦА, часто приводят к прекращению пациентами приема профилактической терапии.
В отличие от ТЦА антидепрессанты нового поколения обладают хорошей переносимостью во всем диапазоне дозировок, что является важным их преимуществом при проведении длительной терапии. Противорецидивная эффективность препаратов этой группы при РДР изучена в многочисленных слепых плацебо-контролируемых и сравнительных зарубежных исследованиях, обзор которых можно найти в наших прежних работах (Мосолов С.Н., 2012).
При продолженной и профилактической терапии РДР применяются различные стратегии (Altamura C.A. et al., 1993).
-
Активная терапевтическая стратегия - продолжение фармакотерапии антидепрессантом (нормотимиком) в полной терапевтической дозе (рекомендована при частом рецидивировании, значительной тяжести депрессивных эпизодов и относительном соматоневрологическом благополучии пациентов).
-
Продолжение фармакотерапии антидепрессантом (нормотимиком) в редуцированной дозе (рекомендуется при более благоприятной форме течения РДР. Очевидно, что в ряде случаев эффективная терапевтическая доза оказывается достаточно высокой, что сопровождается побочными эффектами. Известно, что большинство ТЦА при длительном применении обладают кардиотоксическим действием, многие антидепрессанты гепатотоксичны, так что вопрос о целесообразности длительной терапии в больших дозах у некоторых категорий пациентов (пожилых, соматически неблагополучных) иногда решается в пользу уменьшения дозы антидепрессанта. Стратегия может использоваться у пациентов с нетяжелыми формами депрессии (легкий депрессивный эпизод) или нечастыми депрессиями (2 и менее депрессивных эпизода за 5 лет).
-
Прекращение фармакотерапии антидепрессантом (нормотимиком) по завершении долечивающей терапии (4-6 мес) с ранним началом лечения при первых признаках новой фазы (может использоваться у пациентов с нетяжелыми формами депрессии (легкий депрессивный эпизод) или нечастыми депрессиями (2 и менее депрессивных эпизода за 5 лет).
Одним из наиболее важных в области долгосрочной терапии РДР является вопрос показаний для прекращения профилактической терапии. Исходя из данных некоторых длительных (3-5 лет) исследований пациентов с диагнозом РДР (Frank E. et al., 1990; Kupfer D.J. et al., 1992), отменять поддерживающую терапию вообще не следует. При плановом окончании профилактической терапии или вынужденном преждевременном прекращении (из-за плохой комплаентности или соматических причин) рекомендуется отмена препарата путем поэтапного снижения дозы. Период снижения дозы должен занимать не менее 4-6 мес, что связано с возможностью развития симптомов отмены. Обычно они транзиторны и быстро купируются при повторном назначении антидепрессанта. Риск их развития тем выше, чем больше выражены антихолинергические свойства препарата, выше используемая доза и чем длительнее период приема. Среди антидепрессантов новой генерации симптомы отмены наиболее характерны для венлафаксина и СИОЗС с коротким периодом полувыведения (например, пароксетина) и менее характерны для флуоксетина (Tint A. et al., 2007). Резкая отмена ТЦА может вызвать холинергический феномен «отдачи» (гриппоподобное состояние, миалгия, схватывающие боли в животе).
Больные, получающие длительную профилактическую терапию, нуждаются в регулярном наблюдении врача с целью выявления ранних признаков рецидива и своевременного их купирования, мониторирования возможных побочных эффектов терапии и соблюдения режима приема лекарств, проведении психотерапевтических мероприятий, направленных на мотивирование пациента к продолжению лечения, а также на оказание помощи в случае возникновения психотравмирующих ситуаций (схема 1).
Схема 1. Основные правила вторичной профилактической терапии (адаптировано из Malhi G.S. et al., 2009).
-
Обсудить с пациентом преимущества и недостатки длительной терапии в сравнении с риском рецидива.
-
Установить контакт с пациентом с целью выявления первых признаков рецидива и своевременного их купирования; разработать программу здорового образа жизни для снижения риска рецидива.
-
Помогать пациенту в планировании и выполнении реабилитационных мероприятий.
-
Пересматривать лечебный план в случае возникновения коморбидных заболеваний и психосоциальных стрессов.
-
Проводить активное динамическое наблюдение с целью раннего выявления рецидива депрессивной симптоматики.
-
Использовать психотерапевтические методики для профилактики рецидивов.
-
Проводить профилактическую фармакотерапию:
-
антидепрессанты снижают риск развития и тяжесть рецидивов депрессии, но даже при непрерывном приеме антидепрессанта может развиться рецидив;
-
при лечении антидепрессантами необходимо поддерживать ту дозу, которая оказалась эффективной в период купирующей терапии;
-
монотерапия лития карбонатом может использоваться при непереносимости антидепрессантов (например, нарушения сексуальной сферы); необходим регулярный мониторинг и контроль концентрации лития в крови.
-
-
ЭСТ имеет ограниченные доказательства эффективности при профилактике рецидивов РДР (Frederikse M. et al., 2006), однако в ряде исследований она была сопоставима с эффектом нортриптилина и лития карбоната и превосходила плацебо (Gagne G.G. Jr et al., 2000; Kellner C.H. et al., 2006).
Несмотря на значительный прогресс тимоаналептической терапии РДР, сохраняется ряд серьезных препятствий для успешной фармакотерапии на всем протяжении заболевания. По-прежнему не решена проблема резистентности к терапии антидепрессантами, следствием которой является увеличение числа пациентов с хронифицированным течением заболевания. Нерешенной проблемой является и отставленный эффект большинства антидепрессантов (4-6 нед). Недостаточно разработан и дифференцированный подход к выбору антидепрессанта при проведении терапии. Индивидуализация терапии или дифференцированный подход к ее выбору для каждого конкретного пациента является важной и сложной актуальной задачей. Несмотря на то что депрессия является одним из наиболее благоприятно протекающих психических заболеваний и имеет тенденцию к спонтанному разрешению, использование самых современных возможностей терапии даже при установленном и верифицированном диагнозе позволяет добиться полноценной ремиссии только у 60-70% пациентов.
Принимая во внимание сложность и недостаточную изученность этиопато-генеза депрессии, гетерогенность депрессивных состояний и индивидуальные особенности каждого пациента, неудивительно, что препараты с доказанным тимоаналептическим действием оказываются недостаточно эффективными у значительной части больных. Возможно, дифференцированный подход к их назначению поможет улучшить результаты терапии. Обеспечить точность такого дифференциально-диагностического подхода могли бы лишь биологические маркеры эффективности, например фармакокинетические, учитывающие особенности метаболизма пациента, или фармакогенетические данные. Однако до настоящего времени, несмотря на интенсивные исследования, проводящиеся в этой области, возможность использования их результатов для оптимизации терапии депрессии остается делом будущего (Möller H.-J., 2009).
Как видно из результатов метаанализов, описанных выше, антидепрессанты нового поколения в целом сопоставимы по эффективности. А сделанные в ряде исследований попытки установить различия влияния курсовой терапии препаратов на различные составляющие депрессивного синдрома или на депрессии разной типологии не увенчались успехом. Очевидно, что в настоящее время только тщательный клинический анализ каждого конкретного случая и дифференцированный выбор препарата могут повысить индивидуальную эффективность лечения.
Традиционно зарубежными и отечественными авторами предлагается индивидуальный выбор препарата в зависимости от тяжести депрессии, специфических особенностей пациента, его анамнеза, психопатологического статуса, предиспозиции к развитию тех или иных побочных эффектов терапии и других медицинских аспектов. Однако в исследованиях, проведенных за рубежом, отсутствует анализ динамики терапии различными антидепрессантами, который касался бы начальных этапов терапии. Отечественный опыт показывает, что при выборе антидепрессанта комплексный анализ клинической ситуации в динамике терапии с включением в него представлений о спектрах тимоаналептического и соматотропного действия препаратов, наряду с общепринятыми ориентирами, во многих случаях позволяет сократить период «подбора» адекватной терапии и сроки достижения ремиссии.
Для решения всех проблем, имеющихся в области терапии РДР, необходимо не только продолжение фундаментальных исследований патогенеза депрессии и создание новых, более совершенных препаратов, удовлетворяющих всем клиническим требованиям терапии РДР, но и проведение исследований, направленных на разработку дифференцированных подходов к применению уже имеющихся антидепрессантов.
Список литературы
-
Авруцкий Г.Я., Мосолов С.Н., Шаров А.И. Сравнительная эффективность тимо-аналептической терапии депрессивных и депрессивно-бредовых состояний при фазно-протекающих психозах // Соц. и клин. психиатрия. 1991. № 1. С. 84-91.
-
Авруцкий Г.Я., Недува А.А. Лечение психически больных. М.: Медицина, 1981. С. 345.
-
Авруцкий Г.Я., Недува А.А., Мощевитин С.Ю. и др. Применение электросудорожной терапии (ЭСТ) в психиатрической практике : методические рекомендации. М., 1989. 42 с.
-
Алфимов П.В., Костюкова Е.Г., Мосолов С.Н. Современные методы преодоления терапевтической резистентности при рекуррентной депрессии // Биологические методы терапии психических расстройств (доказательная медицина - клинической практике). М.: Социально-политическая мысль, 2012. С. 438-473.
-
Быков Ю.В., Беккер Р.А., Резник М.К. Депрессии и резистентность : практическое руководство. М.: РИОР; ИНФРА-М, 2013. 373 с.
-
Вернекина Н.С., Картелишев А.В., Игельник М.В. Лазеротерапия в комплексном лечении психически больных // Соц. и клин. психиатрия. 1994. № 4. С. 125-130.
-
Вертоградова О.П., Петухов В.В. Затяжные депрессии (закономерности формирования, прогноз, терапия) // Соц. и клин. психиатрия. 2005. № 4. С. 18-23.
-
Вовин Р.Я., Аксенова И.О. Затяжные депрессивные состояния. Л. : Медицина, 1982. 191 с.
-
Ильин С.А., Цукарзи Э.Э., Мосолов С.Н. Сравнительная эффективность и переносимость циклической транскраниальной магнитной стимуляции и электросудорожной терапии при затяжных, терапевтически резистентных депрессиях // Соц. и клин. психиатрия. 2008. № 2. С. 73-80.
-
Каримулаев И.А., Калинин В.В., Мосолов С.Н. Применение метода адаптации к периодической нормобарической гипоксии в лечении фармакорезистентных депрессий // Новые достижения в терапии психических заболеваний. М., 2002. С. 579-592.
-
Кекелидзе З.И., Тваладзе М.Г., Чечелашвили А.П., Чхеидзе М.А. Роль и место инфузий облученной ультрафиолетом аутокрови в лечении депрессивных состояний // Соц. и клин. психиатрия. 1993. № 3. С. 88-94.
-
Костюкова Е.Г., Мосолов С.Н. Дифференцированный подход к применению антидепрессантов // Соврем. терапия психических расстройств. 2013. № 3. С. 2-12.
-
Костюкова Е.Г., Мосолов С.Н., Граненов П.В. и др. Сравнительная эффективность флувоксамина и амитриптилина при лечении умеренной и тяжелой депрессии // Новые достижения в терапии психических заболеваний. М., 2002. С. 305-315.
-
Мазо Г.Э. Терапевтически резистентные депрессии: подходы к терапии // Соц. и клин. психиатрия. 2004. № 4. С. 59-65.
-
Мазо Г.Э., Незнанов Н.Г. Терапевтически резистентные депрессии. СПб. : Береста, 2012. 448 с.
-
Малин Д.И. Плазмаферез в психиатрии и наркологии. М.: Спутник, 1997. 143 с.
-
Малин Д.И., Костицын Н.В. Плазмаферез в сочетании с одномоментной отменой психотропных средств в лечении резистентных депрессивных состояний у больных с эндогенными психозами // Соц. и клин. психиатрия. 1993. № 3. С. 95-99.
-
Международная классификация болезней. Классификация психических и поведенческих расстройств. 10-й пересмотр / ВОЗ. СПб. : АДИс, 1994. 303 с.
-
Мосолов С.Н. Клиническое применение современных антидепрессантов. СПб. : Медицинское информационное агентство, 1995. 566 с.
-
Мосолов С.Н. Новые достижения в терапии психических заболеваний. М.: Бином, 2002. 622 с.
-
Мосолов С.Н. Резистентность к психофармакотерапии и методы ее преодоления // Психиатрия и психофармакотер. 2004. № 2. С. 128-132.
-
Мосолов С.Н. Биологические методы терапии психических расстройств (доказательная медицина - клинической практике). М.: Социально-политическая мысль, 2012. 1080 с.
-
Мосолов С.Н. Новые достижения в терапии психических заболеваний. М.: Бином, 2002. 622 с
-
Мосолов С.Н., Костюкова Е.Г. Актуальные вопросы фармакотерапии депрессий // Новые достижения в терапии психических заболеваний. М., 2002. С. 211-223.
-
Мосолов С.Н., Костюкова Е.Г. и др. Некоторые методические проблемы клинического изучения антидепрессантов (на примере российского мультицентрового двойного слепого плацебо-контролируемого исследования ребоксетина) // Новые достижения в терапии психических заболеваний. М., 2002. С. 245-266.
-
Мосолов С.Н., Костюкова Е.Г., Сердитов О.В. Cеротониновый синдром при лечении депрессии // Междунар. журн. медицинской практики. 2000. № 8. С. 28-33.
-
Мосолов С.Н., Костюкова Е.Г., Ушкалова А.В. и др. Эффективность и переносимость агомелатина при депрессивных состояниях // Биологические методы терапии психических расстройств. Доказательная медицина - клинической практике. М., 2012. С. 387-437.
-
Мосолов С.Н., Мисионжник Э.Ю., Цукарзи Э.Э. и др. Применение дофаминстимулирующей терапии у резистентных к антидепрессантам больных эндогенными депрессиями // Соц. и клин. психиатрия. 1995. № 4. С. 76-81.
-
Мосолов С.Н., Узбеков М.Г., Цукарзи Э.Э. и др. Применение внутривенной низкоинтенсивной гелий-неоновой лазеротерапии и изменение ряда биохимических параметров у резистентных к психофармакотерапии больных шизофренией // Соц. и клин. психиатрия. 1999. Т. 9, № 2. С. 57-62.
-
Нельсон А.И. Электросудорожная терапия в психиатрии, наркологии и неврологии. М.: Бином. Лаборатория знаний, 2005. 368 с.
-
Николаев Ю.С., Полищук Ю.И., Заиров Г.К., Незнамов Г.Г. Разгрузочно-диетическая терапия нервно-психических заболеваний : методические рекомендации. М., 1979.
-
Нуллер Ю.Л., Михаленко И.Н. Аффективные психозы. Л. : Медицина, 1988. 329 с.
-
Подкорытов B.C., Чайка Ю.Ю. Депрессии. Современная терапия : руководство для врачей. Харьков : Торнадо, 2003. 352 с.
-
Портнов Ф.Г. Электропунктурная рефлексотерапия. Рига, 1980. 217 с.
-
Прохорова И.С. Некоторые теоретические и практические аспекты применения одномоментной отмены психотропных средств : автореф. дис. … канд. мед. наук. М., 1975. 22 с.
-
Психофармакологические и противоэпилептические препараты, разрешенные к применению в России. 2-е изд., испр. и перераб. / под ред. С.Н. Мосолова. М., 2004.
-
Пуговкина О.Д., Холмогорова А.Б., Цукарзи Э.Э. и др. Динамика когнитивных функций у пациентов с резистентными депрессиями при применении электросудорожной терапии и транскраниальной магнитной стимуляции // Соц. и клин. психиатрия. 2006. № 2 (16). С. 47-51.
-
Сайкин М.А., Мосолов С.Н., Капилетти С.Г. и др. Эффективность внутривенного гелий-неонового лазерного облучения крови у больных эндогенными депрессиями, резистентными к психофармакотерапии // Аффективные и шизоаффективные психозы : материалы научно-практической конференции с международным участием / Г.П. Пантелеева, М.Я. Цуцульковская. М., 1998. С. 252.
-
Симуткин Г.Г. Нелекарственные методы хронобиологической терапии аффективных расстройств // Хронобиологическая теория аффективных расстройств / под ред. С.Н. Мосолова. М.: Аванпорт, 2014. С. 164-217.
-
Теренковский Д.И. Разгрузочно-диетическая терапия в сочетании с психотерапией ипохондрических состояний психогенного генеза : автореф. дис. … канд. мед. наук. М., 1982. 18 с.
-
Тиганов А.С. Руководство по психиатрии : в 2 т. / под ред. А.С. Тиганова. М.: Медицина, 1999. Т. 1. 712 с.
-
Хронобиологическая теория аффективных расстройств / под ред. С.Н. Мосолова. М.: Аванпорт, 2014. 352 с.
-
Цукарзи Э.Э., Ильин С.А., Мосолов С.Н. Применение транскраниальной магнитной стимуляции и электросудорожной терапии при терапевтически резистентных депрессиях // Соврем. терапия психических заболеваний. 2015. № 4. С. 25-33.
-
Adli M., Rush A.J., Moller H.J., Bauer M. Algorithms for optimizing the treatment of depression: making the right decision at the right time // Pharmacopsychiatry. 2003. Vol. 36, suppl. 3. P. S222-S229.
-
AHRQ (Agency Health Research Quality): Comparative Effectiveness Review / RTI- UNC Evidence-Based Practice Center Research. Triangle Park, NC. AHRQ Publication No. 12-EHC012-EF, 2011. N 46.
-
Altamura C.A., Percudani M. The use of antidepressants for long-term treatment of recurrent depression: rationale, current methodologies and future directions // J. Clin. Psychiatry. 1993. Vol. 54, suppl. 8. P. 29-38.
-
American Psychiatric Association Practice Guideline for the Treatment of Patients with Major Depressive Disorder. 3rd ed. Washington, DC : APA Press, 2010.
-
American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 5th ed. (DSM-5). Arlington, VA : American Psychiatric Publishing, 2013.
-
Anderson I.M. Meta-analytical studies on new antidepressants // Br. Med. Bull. 2001. Vol. 57. P. 161-178.
-
Anderson I.M. Selective serotonin reuptake inhibitors versus tricyclic antidepressants: a meta-analysis of efficacy and tolerability // J. Affect. Disord. 2000. Vol. 58. P. 19-36.
-
Angst J. The course of affective disorders // Psychopathology. 1986. Vol. 19, suppl. 2. P. 47-52.
-
Aronson R., Offman H. J., Joffe R.T. et al. Triiodothyronine augmentation in the treatment of refractory depression. A meta-analysis // Arch. Gen. Psychiatry. 1996. Vol. 53, N 9. P. 842-848.
-
Baghai T.C., Blier P., Baldwin D.S. et al. General and comparative efficacy and effectiveness of antidepressants in the acute treatment of depressive disorders: a report by the WPA section of pharmacopsychiatry // Eur. Arch. Psychiatry Clin. Neurosci. 2011. Vol. 261, suppl. 3. P. 207-245.
-
Ballesteros J., Callado L.F. Effectiveness of pindolol plus serotonin uptake inhibitors in depression: a meta-analysis of early and late outcomes from randomised controlled trials // J. Affect. Disord. 2004. Vol. 79, N 1-3. P. 137-147.
-
Bauer M., Baur H., Berghofer A., Strohle A. et al. Effects of supraphysiological thyr-oxine administration in healthy controls and patients with depressive disorders // J. Affect. Disord. 2002. Vol. 68, N 2-3. P. 285-294.
-
Bauer M., Dopfmer S. Lithium augmentation in treatment-resistant depression: meta-analysis of placebo-controlled studies // J. Clin. Psychopharmacol. 1999. Vol. 19, N 5. P. 427-434.
-
Bauer M., Pfennig A., Linden M. et al. Efficacy of an algorithm-guided treatment compared with treatment as usual: a randomized, controlled study of inpatients with depression // J. Clin. Psychopharmacol. 2009. Vol. 29, N 4. P. 327-333.
-
Bauer M., Pfennig A., Severus E. et al. World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for biological treatment of unipolar depressive disorders. Pt 1: update 2013 on the acute and continuation treatment of unipolar depressive disorders // World J. Biol. Psychiatry. 2013.
-
Bauer M., Tharmanathan P., Volz H. et al. The effect of venlafaxine compared with other antidepressants and placebo in the treatment of major depression: A meta-analysis // Eur. Arch. Psychiatry Clin. Neurosci. 2009. Vol. 259. P. 172-185.
-
Bauer M., Whybrow P.C., Angst J. et al. World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for Biological Treatment of Unipolar Depressive Disorders, Pt 1: Acute and Continuation Treatment of Major Depressive Disorder // World J. Biol. Psychiatry. 2002. Vol. 3. P. 5-43.
-
Bauer M., Whybrow P.C., Angst J. et al. World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for Biological Treatment of Unipolar Depressive Disorders, Pt 2: Maintenance treatment of major depressive disorder and treatment of chronic depressive disorders and subthreshold depressions // World J. Biol. Psychiatry. 2002. Vol. 3, N 2. P. 69-86.
-
Bersani F.S., Minichino A., Enticott P.G. et al. Deep transcranial magnetic stimulation as a treatment for psychiatric disorders: a comprehensive review // Eur. Psychiatry. 2013. Vol. 28, N 1. P. 30-39.
-
Bretlau L.G., Lunde M., Lindberg L. et al. Repetitive transcranial magnetic stimulation (rTMS) in combination with escitalopram in patients with treatment-resistant major depression: a double-blind, randomised, sham-controlled trial // Pharmacopsychiatry. 2008. Vol. 41, N 2. P. 41-47.
-
Bschor T., Baethge C. No evidence for switching the antidepressant: systematic review and meta-analysis of RCTs of a common therapeutic strategy // Acta Psychiatr. Scand. 2010. Vol. 121, N 3. P. 174-179.
-
CANMAT. Canadian Network for Mood and Anxiety Treatments (CANMAT) Clinical guidelines for the management of major depressive disorder in adults // J. Affect. Dis. 2009. Vol. 117, suppl. 1. P. S26-S43.
-
Carpenter L.L., Yasmin S., Price L.H. A double-blind, placebo-controlled study of antidepressant augmentation with mirtazapine // Biol. Psychiatry. 2002. Vol. 51, N 2. P. 183-188.
-
Cipriani A., Furukawa T.A., Salanti G. et al. Comparative efficacy and acceptability of 12 new-generation antidepressants: a multiple-treatments meta-analysis // Lancet. 2009. Vol. 373, N 9665. P. 746-758.
-
Conca A., Koppi S., Konig P. et al. Transcranial magnetic stimulation: a novel antide-pressive strategy? // Neuropsychobiology. 1996. Vol. 34. P. 204-207.
-
Connolly K.R., Thase M.E. If at first you don’t succeed: a review of the evidence for antidepressant augmentation, combination and switching strategies // Drugs. 2011. Vol. 71, N 1. P. 43-64.
-
Coppen A., Chose K., Montgomery S.A., Bailey J. et al. Continuation therapy with amitriptyline in depression // Br. J. Psychiatry. 1978. Vol. 133. P. 28-33.
-
Cowen P.J. New drugs, old problems // Adv. Psychiatr. Treat. 2005. Vol. 11. P. 19-27.
-
Crossley N.A., Bauer M. Acceleration and augmentation of antidepressants with lithium for depressive disorders: two meta-analyses of randomized, placebo-controlled trials // J. Clin. Psychiatry. 2007. Vol. 68, N 6. P. 935-940.
-
Daban C., Martinez-Aran A., Cruz N., Vieta E. Safety and efficacy of Vagus Nerve Stimulation in treatment-resistant depression. A systematic review // J. Affect. Disord. 2008. Vol. 110, N 1-2. P. 1-15.
-
de Jonghe F., Hendricksen M., van A.G. et al. Psychotherapy alone and combined with pharmacotherapy in the treatment of depression // Br. J. Psychiatry. 2004. Vol. 185. P. 37-45.
-
DeBattista C., Solvason H.B., Poirier J. et al. A prospective trial of bupropion SR augmentation of partial and non-responders to serotonergic antidepressants // J. Clin. Psychopharmacol. 2003. Vol. 23, N 1. P. 27-30.
-
DGPPN, BÄK, KBV für die Leitliniengruppe Unipolare Depression (2009) S3-Leitlinie/ Nationale Versorgungs Leitlinie Unipolare Depression-Langfassung. Berlin, Düsseldorf : DGPPN, ÄZQ AWMF2009.
-
Dombrovski A.Y., Mulsant B.H., Haskett R.F. et al. Predictors of remission after elec-troconvulsive therapy in unipolar major depression // J. Clin. Psychiatry. 2005. Vol. 66, N 8. P. 1043-1049.
-
DUAG - Danish University Antidepressant Group. Citalopram: clinical effect profile in comparison with clomipramine. A controlled multicenter study // Psychopharmacology (Berl.). 1986. Vol. 90. P. 131-138.
-
DUAG - Danish University Antidepressant Group. Paroxetine: a selective serotonin reuptake inhibitor showing better tolerance, but weaker antidepressant effect than clomip-ramine in a controlled multicenter study // J. Affect. Disord. 1999. Vol. 18. P. 289-299.
-
Dudek D., Rybakowski J.K., Siwek M. et al. Risk factors of treatment resistance in major depression: association with bipolarity // J. Affect. Disord. 2010. Vol. 126, N 1-2. P. 268-271.
-
Ernst E. Is reflexology an effective intervention? A systematic review of randomised controlled trials // Med. J. Aust. 2009. Vol. 191, N 5. P. 263-266.
-
Farahani A., Correll C.U. Are antipsychotics or antidepressants needed for psychotic depression? A systematic review and meta-analysis of trials comparing antidepressant or antipsychotic monotherapy with combination treatment // J. Clin. Psychiatry. 2012. Vol. 73, N 4. P. 486-496.
-
Ferreri M., Lavergne F., Berlin I. et al. Benefits from mianserin augmentation of fluo-xetine in patients with major depression non-responders to fluoxetine alone // Acta Psychiatr. Scand. 2001. Vol. 103, N 1. P. 66-72.
-
Fieve R.R., Dunner D.I., Kumbarachi T., Stallone F. Lithium carbonate in affective disorders. A double-blind study of prophylaxis in unipolar recurrent depression // Arch. Gen. Psychiatry. 1976. Vol. 32, N 12. P. 1541-1544.
-
Finfgeld D.L. Serotonin syndrome and the use of SSRIs // J. Psychosoc. Nurs. Ment. Health Serv. 2004. Vol. 42, N 2. P. 16-20.
-
Fink M. Convulsive therapy: a review of the first 55 years // J. Affect. Disord. 2001. Vol. 63, N 1-3. P. 1-15.
-
Flament M.F., Lane R.M., Zhu R. et al. Predictors of an acute antidepressant response to fluoxetine and sertraline // Int. Clin. Psychopharmacol. 1999. Vol. 14, N 5. P. 259-275.
-
Frank E., Kupfer D. J. et al. Three-year outcome for maintenance therapies in recurrent depression // Arch. Gen. Psychiatry. 1990. Vol. 47. P. 1093-1099.
-
Frank E., Thase M.E., Spanier C. et al. Psychotherapy of affective disorders // Contemporary Psychiatry / eds H. Helmchen, F. Henn, H. Lauter, N. Sartorius. Heidelberg : Springer, 2000. P. 348-363.
-
Frederiksen M., Petrides G., Kellner C. Continuation and maintenance electroconvul-sive therapy for the treatment of depressive illness: a response to the National Institute for Clinical Excellence report // J. ECT. 2006. Vol. 22. P. 13-17.
-
Furukawa T.A., Streiner D.L., Young L.T. Antidepressant plus benzodiazepine for major depression // Cochrane Database Syst. Rev. 2001. Vol. 2. CD001026.
-
Gagne G.G., Furman M.J., Carpenter L.L., Price L.H. Efficacy of continuation ECT and antidepressant drugs compared to long-term antidepressants alone in depressed patients // Am. J. Psychiatry. 2000. Vol. 157. P. 1960-1965.
-
Gaynes B.N., Warden D., Trivedi M.H. et al. What did STAR*D teach us? Results from a large-scale, practical., clinical trial for patients with depression // Psychiatr. Serv. 2009. Vol. 60, N 11. P. 1439-1445.
-
Geddes J.R., Carney S.M., Davies C. et al. Relapse prevention with antidepressant drug treatment in depressive disorders: a systematic review // Lancet. 2003. Vol. 361, N 9358. P. 653-661.
-
George M.S., Rush A.J., Marangell L.B. et al. A one-year comparison of vagus nerve stimulation with treatment as usual for treatment-resistant depression // Biol. Psychiatry. 2005. Vol. 58, N 5. P. 364-373.
-
Giacobbe P., Kennedy S.H. Deep brain stimulation for treatment-resistant depression: a psychiatric perspective // Curr. Psychiatry Rep. 2006. Vol. 8, N 6. P. 437-444.
-
Giedke H., Klingberg S., Schwarzler F., Schweinsberg M. Direct comparison of total sleep deprivation and late partial sleep deprivation in the treatment of major depression // J. Affect. Disord. 2003. Vol. 76, N 1-3. P. 85-93.
-
Greenberg R.P., Fisher S. Examining antidepressant effectiveness: findings, ambiguities, and some vexing puzzles. The limits of biological treatments for psychological distress: comparisons with psychotherapy and placebo / eds S. Fisher, R.P. Greenberg. Hillsdale, N.Y. : Lawrence Erlbaum Associates, 1989. P. 1-37.
-
Grunze H., Vieta E., Goodwin G.M. et al. The World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for the Biological Treatment of Bipolar Disorders: Update 2010 on the treatment of acute bipolar depression // World J. Biol. Psychiatry. 2010. Vol. 11, N 2. P. 81-109.
-
Hamilton M. A rating scale for depression // J. Neurol. Neurosurg. Psychiatry. 1960. Vol. 23. P. 56-62.
-
Herrmann L.L., Ebmeier K.P. Factors modifying the efficacy of transcranial magnetic stimulation in the treatment of depression: a review // J. Clin. Psychiatry. 2006 Dec. Vol. 67, N 12. P. 1870-1876.
-
Higgins E.S., George M.S. Brain Stimulation Therapies for Clinicians. Washington, DC : American Psychiatric Press, 2008.
-
Hirschfeld R.M. A Clinical importance of long-term antidepressant treatment // Br. J. Psychiatry. Suppl. 2001. Vol. 42. P. 4-8.
-
Jindal R.D., Thase M.E. Integrating psychotherapy and pharmacotherapy to improve outcomes among patients with mood disorders // Psychiatr. Serv. 2003. Vol. 54, N 11. P. 1484-1490.
-
Kellner C.H., Knapp R.G., Petrides G. et al. Continuation electroconvulsive therapy vs pharmacotherapy for relapse prevention in major depression: a multisite study from the Consortium for Research in Electroconvulsive Therapy (CORE) // Arch. Gen. Psychiatry. 2006. Vol. 63. P. 1337-1344.
-
Kielholz P. Psyhiatrische Pharmakotherapie in Klinic und Praxis. Bern, Stuttgart, 1965. 293 р.
-
Kishimoto A., Mizukawa R. с соавт.. Prophylactic effect of mianserin of recurrent depression // Acta Psychiatr. Scand. 1994 Jan. Vol. 89, N 1. P. 46-51.
-
Komossa K., Depping A.M., Gaudchau A. et al. Second-generation antipsychotics for major depressive disorder and dysthymia // Cochrane Database Syst. Rev. 2010. Vol. 12. CD008121.
-
Kopell B.H., Greenberg B., Rezai A.R. Deep brain stimulation for psychiatric disorders // J. Clin. Neurophysiol. 2004. Vol. 21. P. 51-67.
-
Kozel F.A., George M.S. Meta-analysis of left prefrontal repetitive transcranial magnetic stimulation (rTMS) to treat depression // J. Psychiatr. Pract. 2002. Vol. 8, N 5. P. 270-275.
-
Kupfer D.J. Long-term treatment of depression // J. Clin. Psychiatry. 1991. Vol. 52, suppl. 5. P. 28-34.
-
Kupfer D.J. Management of recurrent depression // J. Clin. Psychiatry. 1993. Vol. 54, suppl. P. 29-33.
-
Kupfer D.J., Frank E., Perel J.M. Five-year outcome for maintenance therapies in recurrent depression // Arch. Gen. Psychiatry. 1992. Vol. 49. P. 769-773.
-
Linde K., Berner M.M., Kriston L. St John’s wort for major depression // Cochrane Database Syst. Rev. 2008. Vol. 4. CD000448.
-
Loo C.K., McFarquhar T.F., Mitchell P.B. A review of the safety of repetitive transcranial magnetic stimulation as a clinical treatment for depression // Int. J. Neuropsychopharmacol. 2008. Vol. 11, N 1. P. 131-147.
-
Lozano A.M., Mayberg H.S., Giacobbe P. et al. Subcallosal cingulate gyrus deep brain stimulation for treatment-resistant depression // Biol. Psychiatry. 2008. Vol. 64, N 6. P. 461-467.
-
Malhi G.S., Adams D., Porter R. et al. Clinical practice recommendations for depression. Clinical overview // Acta Psychiatr. Scand. 2009. Vol. 119, suppl. 439. P. 8-26.
-
Malhi G.S., Bassett D., Boyce P. et al. Royal Australian and New Zealand College of Psychiatrists clinical practice guidelines for mood disorders // Aust. N. Z. J. Psychiatry. 2015. Vol. 49, N 12. P. 1087-1206.
-
Mann J.J. The medical management of depression // N. Engl. J. Med. 2005. Vol. 353, N 17. P. 1819-1834.
-
Martin J.L., Barbanoj M.J., Schlaepfer T.E. et al. Repetitive transcranial magnetic stimulation for the treatment of depression. Systematic review and meta-analysis // Br. J. Psychiatry. 2003. Vol. 182. P. 480-491.
-
Mead G.E., Morley W., Campbell P. et al. Exercise for depression. // Cochrane Database Syst. Rev. 2008. Vol. 4. CD004366.
-
Möller H.-J. Antidepressants: Controversies about their efficacy in depression, their effect on suicidality and their place in a complex psychiatric treatment approach // World J. Biol. Psychiatry. 2009. Vol. 10, N 3. P. 180-195.
-
Montgomery S.A., Asberg M. A new depression scale designed to be sensitive to change // Br. J. Psychiatry. 1979. Vol. 134. P. 382-389.
-
Montgomery S.A., Green M., Baldwin D. Prophylactic treatment of depression: a public health issue // Neuropschobiology. 1989. Vol. 22. P. 216.
-
Mosimann U.P., Schmitt W., Kosel M. et al. Repetitive Transcranial Magnetic Stimulation (rTMS) as a Putative Treatment for Major Depression - A Sham Controlled Study in Relatively Older Patients // Psychiatry Res. 2004, Vol. 126, N 2. P. 123-133.
-
Mosolov S.N., Ushkalova A., Kostyukova E. et al. Bipolar II disorder in patients with a current diagnosis of recurrent depression // Bipolar Disord. 2014, Vol.16, № 4, P. 389-399.
-
Nahas Z., Teneback C., Chae J.H. et al. Serial vagus nerve stimulation functional MRI in treatment-resistant depression // Neuropsychopharmacology. 2007. Vol. 32, N 8. P. 1649-1660.
-
Nelson J.C. Treatment of antidepressant nonresponders: augmentation or switch? // J. Clin. Psychiatry. 1998. Vol. 59, suppl. 15. P. 35-41.
-
Nemets B., Stahl Z., Belmaker R.H. Addition of omega-3 fatty acid to maintenance medication treatment for recurrent unipolar depressive disorder // Am. J. Psychiatry. 2002. Vol. 159, N 3. P. 477-479.
-
NICE. The treatment and management of depression in adults (updated edition). The British Psychological Society and The Royal College of Psychiatrists, 2009.
-
Nierenberg A.A., Alpert J.E., Gardner-Schuster E.E. et al. Vagus nerve stimulation: 2-year outcomes for bipolar versus unipolar treatment-resistant depression // Biol. Psychiatry. 2008. Vol. 64, N 6. P. 455-460.
-
Nierenberg A.A., Fava M., Trivedi M.H. et al. A comparison of lithium and T(3) augmentation following two failed medication treatments for depression: a STAR*D report // Am. J. Psychiatry. 2006. Vol. 163, N 9. P. 1519-1530.
-
Pagnin D., Pini S., Cassano G.B. Efficacy of ECT in depression: a meta-analytic review // J. ECT. 2004. Vol. 20, N 1. P. 13-20.
-
Papakostas G.I., Fava M., Thase M.E. Treatment of SSRI-resistant depression: a meta-analysis comparing withinversus across-class switches // Biol. Psychiatry. 2008. Vol. 63, N 7. P. 699-704.
-
Papakostas G.I., Shelton R.C., Smith J. et al. Augmentation of antidepressants with atypical antipsychotic medications for treatment-resistant major depressive disorder: a meta-analysis // J. Clin. Psychiatry. 2007. Vol. 68, N 6. P. 826-831.
-
Patkar A.A., Masand P.S., Pae C.U. et al. A randomized, double-blind, placebo-controlled trial of augmentation with an extended release formulation of methylphenidate in outpatients with treatment-resistant depression // J. Clin. Psychopharmacol. 2006. Vol. 26, N 6. P. 653-656.
-
Peet M., Horrobin D.F. A dose-ranging study of the effects of ethyl-eicosapentaenoate in patients with ongoing depression despite apparently adequate treatment with standard drugs // Arch. Gen. Psychiatry. 2002. Vol. 59, N 10. P. 913-919.
-
Poulet E., Brunelin J., Boeuve C. et al. Repetitive transcranial magnetic stimulation does not potentiate antidepressant treatment // Eur. Psychiatry. 2004. Vol. 19, N 6. P. 382-383.
-
Prien R.F., Klett C.H.,Caffey E.M. Lithium carbonate and imipramine in prevention of affective episodes. A comparison in recurrent affective illness // Arch. Gen. Psychiatry. 1973 Sep. Vol. 29, N 3. P. 420-425.
-
Prudic J., Olfson M., Marcus S.C. et al. Effectiveness of electroconvulsive therapy in community settings // Biol. Psychiatry. 2004. Vol. 55, N 3. P. 301-312.
-
Rasmussen K.G., Mueller M., Knapp R.G. et al. Antidepressant medication treatment failure does not predict lower remission with ECT for major depressive disorder: a report from the consortium for research in electroconvulsive therapy // J. Clin. Psychiatry. 2007. Vol. 68, N 11. P. 1701-1706.
-
Ravindran A.V., Kennedy S.H., O’Donovan M.C. et al. Osmotic-release oral system methylphenidate augmentation of antidepressant monotherapy in major depressive disorder: results of a double-blind, randomized, placebo-controlled trial // J. Clin. Psychiatry. 2008. Vol. 69, N 1. P. 87-94.
-
Ricken R., Wiethoff K., Reinhold T. et al. Algorithm-guided treatment of depression reduces treatment costs - results from the randomized controlled German Algorithm Project (GAPII) // J. Affect. Disord. 2011. Vol. 134, N 1-3. P. 249-256.
-
Rossini D., Lucca A., Zanardi R. et al. Transcranial magnetic stimulation in treatment-resistant depressed patients: a double-blind, placebo-controlled trial // Psychiatry Res. 2005a. Vol. 137, N 1-2. P. 1-10.
-
Rouillon F. et al. Prophylactic efficacy of maprotiline on unipolar depression relapse // J. Clin. Psychiatry. 1991 Oct. Vol. 52, N 10. P. 423-431.
-
Rumi D.O., Gattaz W.F., Rigonatti S.P. et al. Transcranial magnetic stimulation accelerates the antidepressant effect of amitriptyline in severe depression: a double-blind placebo-controlled study // Biol. Psychiatry. 2005. Vol. 57, N 2. P. 162-166.
-
Rush A.J., Fava M., Wisniewski S.R. et al. Sequenced treatment alternatives to relieve depression (STAR*D): rationale and design // Control Clin. Trials. 2004. Vol. 25, N 1. P. 119-142.
-
Rush A.J., Kupfer D.J. Strategies and tactics in the treatment of depression // Treatment of Psychiatric Disorders / ed. G.O. Gabbard. Washington, DC : American Psychiatric Publishing, 2001. P. 1417-1439.
-
Rush A.J., Sackeim H.A., Marangell L.B. et al. Effects of 12 months of vagus nerve stimulation in treatment-resistant depression: a naturalistic study // Biol. Psychiatry. 2005. Vol. 58, N 5. P. 355-363.
-
Rush A.J., Thase M.E. Psychotherapies for depressive disorders // WPA Series. Evidence and Experience in Psychiatry. Vol. 1. Depressive Disorders / eds M. Maj, N. Sartorius. Chichester, UK : John Wiley and Sons, 1999. P. 161-206.
-
Sackeim H.A., Prudic J., Devanand D.P. et al. A prospective, randomized, double-blind comparison of bilateral and right unilateral electroconvulsive therapy at different stimulus intensities // Arch. Gen. Psychiatry. 2000. Vol. 57, N 5. P. 425-434.
-
Sartorius N., Baghai T.C., Baldwin D.S. et al. Antidepressant medications and other treatment of depressive disorders: a cinp task based on review of evidence // Int. J. Neuropsychopharmacol. 2007. Vol. 10, suppl. 1. P. 1-207.
-
Schlaepfer T.E., Cohen M.X., Frick C. et al. Deep brain stimulation to reward circuitry alleviates anhedonia in refractorymajor depression // Neuropsychopharmacology. 2008. Vol. 33, N 2. P. 368-377.
-
Segal Z.V., Kennedy S.H., Cohen N.L. Clinical guidelines for the treatment of depressive disorders. V. Combining psychotherapy and pharmacotherapy // Can. J. Psychiatry. 2001. Vol. 46, suppl. 1. P. S59-S62.
-
Shiozawa P., Fregni F., Benseñor I.M. et al. Transcranial direct current stimulation for major depression: an updated systematic review and meta-analysis // Int. J. Neuropsychopharmacol. 2014. Vol. 17. P. 1443-1452.
-
Su K.P., Huang S.Y., Chiu C.C. et al. Omega-3 fatty acids in major depressive disorder. A preliminary double-blind, placebo-controlled trial // Eur. Neuropsychopharmacol. 2003. Vol. 13, N 4. P. 267-271.
-
Thase M.E. Achieving remission and managing relapse in depression // J. Clin. Psychiatry. 2003. Vol. 64, suppl. 18. P. 3-7.
-
Tint A., Haddad P.M., Anderson I.M. The effect of rate of antidepressant tapering on the incidence of discontinuation symptoms: a randomised study // J. Psychopharmacol. 2008. Vol. 22. P. 330-332.
-
Tortella G., Casati R., Aparicio L. et al. Transcranial direct current stimulation in psychiatric disorders // World J. Psychiatry. 2015. Vol. 5, N 1. P. 88-102.
-
Trivedi M.H., Fava M., Wisniewski S.R. et al. Medication augmentation after the failure of SSRIs for depression // N. Engl. J. Med. 2006. Vol. 354, N 12. P. 1243-1252.
-
Trivedi M.H., Rush A.J., Crismon M.L. et al. Clinical results for patients with major depressive disorder in the Texas Medication Algorithm Project // Arch. Gen. Psychiatry. 2004. Vol. 61, N 7. P. 669-680.
-
Tuunainen A., Kripke D.F., Endo T. Light therapy for non-seasonal depression // Cochrane Database Syst. Rev. 2004. Vol. 2. CD004050.
-
WHO Mental Health Collaborating Centres. Pharmacotherapy of depressive disorders. A consensus statement // J. Affect. Disord. 1989. Vol. 17. P. 197-198.
-
Wirz-Justice A., Van den Hoofdakker R.H. Sleep deprivation in depression: what do we know, where do we go? // Biol. Psychiatry. 1999. Vol. 46, N 4. P. 445-453.
-
Zullino D., Baumann P. Lithium augmentation in depressive patients not responding to selective serotonin reuptake inhibitors // Pharmacopsychiatry. 2001. Vol. 34, N 4. P. 119-127.