Офтальмология
geotar
Офтальмология / Аветисова С. Э. , Егорова Е. А. , Мошетовой Л. К. , Нероева В. В. , Тахчиди Х. П. - Москва : ГЭОТАР-Медиа, 2018. - 904 с. (Серия "Национальные руководства") - ISBN 978-5-9704-4449-8 |
Аннотация
В отличие от большинства других изданий в национальном руководстве по офтальмологии особое внимание уделено профилактике, патогенезу, современным методам диагностики, медикаментозным, лазерным и хирургическим методам лечения глазных заболеваний. В книгу вошли общие и частные вопросы офтальмологии, содержащие объединенную согласованную позицию известных отечественных специалистов. Рекомендации по диагностике, лечению и профилактике отдельных нозологических единиц разработаны ведущими офтальмологами России. В подготовке настоящего издания в качестве авторов-составителей и рецензентов участвовали специалисты-офтальмологи - сотрудники МНИИ глазных болезней им. Гельм - гольца, МНТК "Микрохирургия глаза" им. акад. С.Н. Федорова, ФГБНУ "НИИГБ", РНИМУ им. Н.И. Пирогова, РМАНПО, кафедр офтальмологии ведущих вузов страны. Руководство предназначено врачам-офтальмологам, студентам старших курсов медицинских вузов, интернам, ординаторам, аспирантам.
Глава 17. Оптическая когерентная томография глаза
А.Г. Щуко, С.И. Жукова
Оптическая когерентная томография (ОКТ, англ. OCT - optical coherence tomography) - современный неинвазивный бесконтактный метод прижизненной визуализации и анализа морфологических особенностей структур оптически прозрачных тканей глаза, основанный на принципе световой интерферометрии.
Теоретические основы метода были разработаны в 1995 г. американским офтальмологом К. Пулиафито. В 1996-1997 гг. компания Carl Zeiss Meditec внедрила в клиническую практику первый прибор. В настоящее время современную офтальмологию сложно представить без оптической когерентной томографии. За годы существования метод претерпел изменения и на смену временным томографам пришли спектральные, которые уступили место спектральным томографам высокого разрешения. С 1997 г. новый метод диагностики начал активно использоваться в России, первый прибор был приобретен иркутским филиалом МНТК «Микрохирургия глаза» имени С.Н. Федорова. Это был первый опыт использования оптической когерентной томографии в офтальмологии на территории Российской Федерации и стран СНГ.
ФИЗИЧЕСКИЕ ОСНОВЫ МЕТОДА
Изображение строится на основе различий в поглощении и отражении света разными слоями ткани [18, 20].
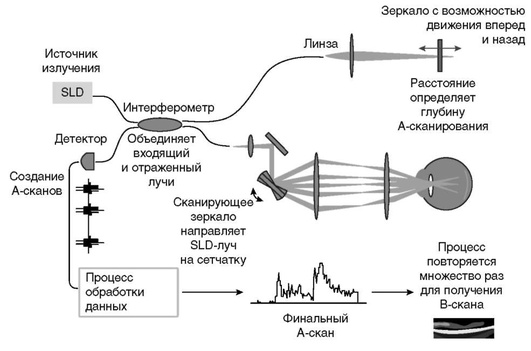
В первых ОКТ-приборах использовался последовательный (временной) метод построения изображения (time-domain optical coherence tomography, TD-OCT) (рис. 17-1).
В основе метода лежит принцип работы интерферометра, предложенный А.А. Михельсоном. Луч света низкой когерентности от суперлюминесцентного светодиода разделяется на два пучка, один из которых отражается исследуемым объектом, в то время как другой проходит по референтному пути внутри прибора и отражается зеркалом, положение которого регулируется исследователем. При равенстве длины луча, отраженного от исследуемой ткани, и луча от зеркала возникает явление интерференции, регистрируемое све-тодиодом, которое, в свою очередь, анализируется программным обеспечением. Результаты сканирования представляются в виде серого или псевдоцветного изображения. Каждая точка измерения соответствует одному А-скану. Получаемые одиночные А-сканы суммируются, формируя двумерное изображение. Осевое разрешение приборов первого поколения 8-10 мкм, скорость сканирования 400 А-сканов в секунду. Появление артефактов и снижение качества сканов обусловлено движением глаз, возникающим во время исследования.
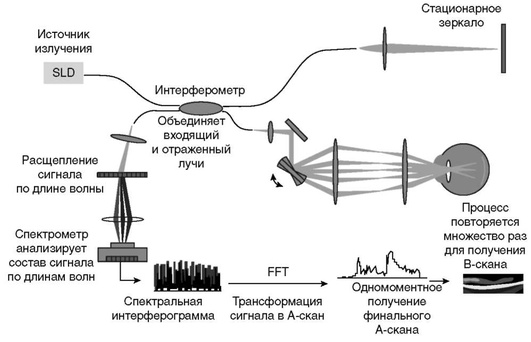
С появлением высокоскоростных камер на смену временным пришли спектральные томографы [7, 10]. Источником света в спектральных томографах является широкополосный суперлюминесцентный диод, позволяющий получить низкокогерентный луч, содержащий несколько длин волн. Как и во временной, в спектральной ОКТ луч света разделяется на два пучка, один из которых отражается от исследуемого объекта (глаза), а второй - от фиксированного зеркала. На выходе интерферометра свет пространственно разлагается по спектру, и весь спектр регистрируется высокоскоростной камерой. Затем с помощью математического преобразования Фурье происходят обработка спектра интерференции и формирование линейного А-скана (рис. 17-2).
В отличие от временной ОКТ, где линейный А-скан получается за счет последовательного измерения отражающих свойств каждой отдельной точки, в спектральной ОКТ линейный А-скан формируется за счет одномоментного измерения лучей, отраженных от каждой отдельной точки [4, 7]. Осевое разрешение современных спектральных ОКТ-сканеров 3-7 мкм, а скорость сканирования - более 26 тыс. А-сканов в секунду. Более высокая скорость сканирования позволяет значительно улучшить качество получаемых изображений путем уменьшения артефактов, возникающих при движениях глаз во время исследования [4].
В спектральных томографах высокого разрешения (swept-source OCT, SS-OCT) используются лазерные источники, у которых частота излучения перестраивается с большой скоростью в пределах определенной спектральной полосы (свипиро-вание частоты). Во время цикла перестройки частоты регистрируется изменение не частоты, а амплитуды отраженного сигнала [15]. Благодаря использованию двух параллельных фотодетекторов скорость сканирования увеличивается до 70-100 тыс. А-сканов. Технология SS-OCT (за счет увеличения длины волны и скорости сканирования) обеспечивает возможность визуализации глубоких структур, таких как хориоидея и решетчатая пластинка ДЗН [12-14, 21] (рис. 17-3, см. цв. вклейку).
Развитие метода, создание и внедрение в практику новой генерации приборов способствовали расширению наших знаний о структурах глаза, совершенствованию трактовки получаемых данных. Современные оптические когерентные томографы позволяют получить изображения, сопоставимые с микроскопическим исследованием (рис. 17-4, см. цв. вклейку).
С учетом имеющегося в настоящее время объема знаний в 2014 г. международной группой экспертов (International Nomenclature for Optical Coherence Tomography Panel) представлен уточненный вариант трактовки нормальной ОКТ-анатомии сетчатки. Большинство слоев сохранило прежние названия, однако некоторые претерпели принципиальные изменения (табл. 17-1).
| Старое название | Новое название |
|---|---|
Внутренние сегменты фоторецепторов |
Миоидная зона |
Сочленение внутренних и наружных сегментов фоторецепторов |
Эллипсоидная зона |
Мембрана Вирхова (линия вершин колбочек) |
Сочленение колбочек с пигментным эпителием |
Пигментный эпителий сетчатки |
Комплекс «пигментный эпителий сетчатки - мембрана Бруха» |
Внутренний отдел наружного ядерного слоя (ранее не выделялся) |
Слой волокон Генле |
Хориоидея |
Кориокапилляры. Слой Саттлера. Слой Галлера |
Скорость эволюции томографов начинает превышать способности специалистов по анализу и интерпретации данных. Увеличилось количество данных, которое необходимо описать, классифицировать и оценивать. В офтальмологической практике возможности современных ОКТ-сканеров широко используются в диагностике и мониторинге как переднего отрезка, так и патологии макулярной области сетчатки и зрительного нерва. Современные оптические когерентные томографы позволяют строить трехмерные модели исследуемой области и карты толщины отдельных слоев сетчатки, что позволяет объективно оценивать динамику патологического процесса и эффективность лечения. Томографы последнего поколения благодаря использованию инновационных технологий позволяют визуализировать кровоток сетчатки и диска зрительного нерва, что открывает принципиально новые возможности в диагностике и лечении заболеваний сетчатки.
ПОКАЗАНИЯ К ПРОВЕДЕНИЮ ОПТИЧЕСКОЙ КОГЕРЕНТНОЙ ТОМОГРАФИИ
В офтальмологии диагностическую ценность оптической когерентной томографии трудно переоценить.
При диагностике заболеваний переднего отрезка глаза ОКТ используют для оценки: прекорнеальной слезной пленки и профиля слезного мениска; роговицы до и после выполнения рефракционных операций и кератопластики; УПК, иридохрусталиковых взаимоотношений, состояния вновь созданных путей оттока внутриглазной жидкости в различные сроки после антиглаукомных операций; иридокорнеальных сращений при травмах, воспалительных и дистрофических заболеваниях роговицы и переднего отрезка в целом; положения хрусталика и интраокулярных имплантов (ИОЛ, дренажи, роговичные кольца, искусственная радужка).
Убедительно продемонстрирована диагностическая ценность метода при патологии макулярной области (разрывы, отеки, дегенерации, ретиношизис); очаговых изменениях витреоретинального интерфейса и витреоретинальном тракционном синдроме; эпиретинальных мембранах; серозной и геморрагической отслойке сетчатки и пигментного эпителия; диабетической ретинопатии; ретинальной неоваскуляризации; дистрофических изменениях сетчатки; глаукоме и др.
ПРОТИВОПОКАЗАНИЯ К ПРОВЕДЕНИЮ ОПТИЧЕСКОЙ КОГЕРЕНТНОЙ ТОМОГРАФИИ
Абсолютных противопоказаний к проведению обследования нет. Однако для получения изображения высокого качества необходимы прозрачность оптических сред и нормальное состояние слезной пленки. При выраженных нарушениях слезной пленки непосредственно перед исследованием рекомендуется закапывание в конъюнктивальную полость препаратов искусственной слезы. Исследование затруднено при помутнении оптических сред на любом уровне, выраженном нистагме, треморе головы, отсутствии центральной фиксации и низкой остроте зрения, когда пациент не видит фиксационной метки. Высокий астигматизм и децентрация ИОЛ снижают качество исследования. При выраженном миозе (менее 3 мм) исследование выполняется в условиях медикаментозного мидриаза. Если пациенту накануне исследования проводили офтальмоскопию с использованием панфундус-линзы, линзы Гольдмана либо гониоскопию, то сканирование возможно только после вымывания контактной среды из конъюнктивальной полости.
АНАЛИЗ И ИНТЕРПРЕТАЦИЯ ПОЛУЧЕННЫХ ИЗОБРАЖЕНИЙ
Следует отметить, что на сегодняшний день технология ОКТ развивается быстрее, чем возможности ее детального стандартизированного анализа. В связи с этим все более актуальной становится задача клинической интерпретации получаемых томограмм, которая складывается из качественного анализа (анализ морфологии, структуры и рефлективности) и количественной оценки параметров исследуемой зоны (измерение толщины, площади, объема, поверхностное картирование).
Детальное изучение сканов лучше проводить в черно-белом, нежели псевдоцветном изображении. Оттенки цветных изображений ОКТ заданы программным обеспечением системы, каждый оттенок связан с определенной степенью рефлективности. Поэтому на цветном изображении мы видим большое разнообразие цветных оттенков, в то время как в действительности имеет место последовательное изменение рефлективности ткани. Черно-белое изображение позволяет выявить минимальные отклонения оптической плотности ткани и рассмотреть детали, которые могут остаться незамеченными на цветном изображении. Некоторые структуры могут быть лучше видны на негативных изображениях [3, 22].
ОПТИЧЕСКАЯ КОГЕРЕНТНАЯ ТОМОГРАФИЯ ПЕРЕДНЕГО ОТРЕЗКА ГЛАЗА
В последние годы возрастает интерес офтальмологов к изучению диагностических возможностей ОКТ при исследовании переднего сегмента глаза. Использование метода позволяет получить изображение переднего сегмента глазного яблока, провести измерения структур роговицы, УПК, хрусталика методом безопасной и точной биометрии, оценить положение ИОЛ.
В настоящее время на рынке офтальмологического оборудования представлены различные модели для исследования переднего отрезка глаза: специализированный прибор только для переднего отрезка глазного яблока - Visante ОСТ (Carl Zeiss Meditec), а также томографы, снабженные модулем для исследования структур переднего сегмента глаза (Optovue, Canon, Cirrus и др.).
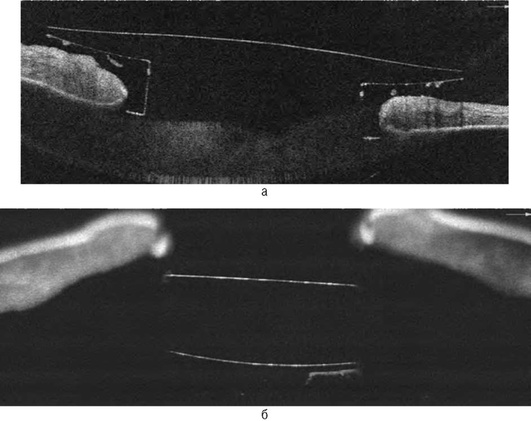
Новые возможности для исследования слезной жидкости открыл метод оптической когерентной томографии слезного мениска (СМ) - ОКТ-менискометрия [2, 8]. Исследуют нижний мениск, результат фиксируется через 3-4 с после мигания. Метод позволяет детально визуализировать слезный мениск и точно измерить его геометрические параметры (рис. 17-5, см. цв. вклейку).
Высота слезного мениска измеряется как расстояние от точки мениско-роговичного контакта до точки контакта мениска с краем нижнего века. Радиус слезного мениска рассчитывается как расстояние между линией, соединяющей края мениска, и точкой наибольшей его вогнутости. Радиус мениска определяет характер взаимодействия слезной жидкости с конъюнктивой и роговицей глаза, опосредованно отражая качественное и количественное состояние слезной жидкости и поверхности глаза. Угол смачиваемости слезного мениска отражает степень сродства слезной жидкости с эпителием роговицы и конъюнктивой глаза и является индикатором стабильности слезной пленки. Отмечены высокие диагностическая чувствительность и специфичность ОКТ-менискометрии в диагностике различных патологических состояний слезной пленки (рис. 17-6).
Особое значение приобретает возможность бесконтактной визуализации структур переднего отрезка глаза у пациентов с деструктивно-воспалительными заболеваниями роговицы (рис. 17-7-17-9, см. цв. вклейку).
Высока диагностическая ценность ОКТ в рефракционной хирургии для предоперационного исследования роговицы и оценки роговичного лоскута и стромы в послеоперационном периоде (рис. 17-10, см. цв. вклейку), поскольку все современные методы кераторефракционной хирургии в той или иной степени приводят к изменению морфологической структуры роговой оболочки.
В последние годы в связи с развитием новых технологий в рефракционной хирургии пристальное внимание уделено изучению эпителия (рис. 17-11-17-16, см. цв. вклейку), изменению эпителиального слоя и влиянию его толщины на рефракционные показатели после перенесенных хирургических вмешательств [1].

Современные томографы позволяют получать пахиметрические карты и осуществлять картирование эпителия. Полученные данные включают в себя карту толщины роговицы и эпителиального слоя, соответствующие зоне сканирования (см. рис. 17-13, 17-14), которые составляются на основе интерполяции данных радиальных сканов (по 8 меридианам через 22,5° в 16 320 точках). Параметры статистического значения отражают усредненные значения толщины роговицы и эпителия в центральной зоне и в радиальных сегментах средней и периферической зон, минимальное и максимальное значение, разницу между ними, стандартное отклонение значения толщины по площади измерения.
При обследовании пациентов с ИОЛ визуализация линзы возможна только в пределах видимости (рис. 17-17). Ограничения визуализации структур переднего отрезка обусловлены поглощением оптических лучей пигментным листком радужной оболочки.
ОКТ позволяет определить глубину передней камеры глаза в любой интересующей зоне, измерить внутренний диаметр, ширину УПК (рис. 17-18, см. цв. вклейку), объективно оценить степень открытия УПК (рис. 17-19, 17-20). Эти измерения более точны по сравнению с ультразвуковым А-методом и УБМ [6, 9, 19, 23].
ОКТ переднего отрезка глаза является информативным и безопасным методом оценки морфофункционального состояния зоны антиглаукомной операции, позволяет визуализировать все структуры зоны операции, оценить их морфоме-трические характеристики и оптическую плотность тканей (рис. 17-21, см. цв. вклейку). Бесконтактность метода дает возможность исследовать зону операции с самых ранних сроков после вмешательства, что позволяет выявить прогностические признаки эффективности вмешательства.
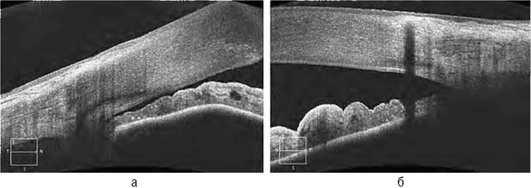

Исследование радужки ограничено, поскольку, как уже было сказано выше, пигментный эпителий радужки затрудняет проникновение света [6]. Визуализация задней поверхности радужки и цилиарного тела при ОКТ недостаточна. Исследование ограничивается оценкой размеров и глубины дефектов и патологических образований (кисты, новообразования, синехии) (рис. 17-22, см. цв. вклейку).
ОПТИЧЕСКАЯ КОГЕРЕНТНАЯ ТОМОГРАФИЯ ЗАДНЕГО ПОЛЮСА ГЛАЗА
Наибольшую ценность метод оптической когерентной томографии представляет в диагностике заболеваний заднего полюса глаза для выявления патологических изменений сетчатки и зрительного нерва, объективной оценки динамики патологического процесса при естественном течении заболевания, проведении хирургического или медикаментозного лечения, оценке его эффективности. Анализ результатов сканирования, как и при интерпретации данных исследования переднего отрезка, складывается из изучения морфологии сетчатки и хориоидеи, их рефлективности и количественной оценки (табл. 17-2).
| Вид анализа | Критерии оценки | |
|---|---|---|
Качественный |
Морфологические изменения |
Деформация сетчатки в целом (concavus, convexus) |
Изменение контура поверхности сетчатки |
||
Интраретинальные структурные изменения |
||
Субретинальные изменения |
||
Рефлективность |
Высокая |
|
Средняя |
||
Низкая |
||
Области затенения |
||
Локальные патологические структурные образования,сегментация |
Преретинальные |
|
Эпиретинальные |
||
Интраретинальные |
||
Субретинальные |
||
Количественный |
Измерение толщины |
Сетчатки |
Отдельных слоев |
||
Патологических образований |
||
Измерение площади, объема |
||
Поверхностное картирование |
||
Анализ морфологии позволяет выявить деформации сетчатки в целом, ее поверхности и отдельных слоев, изменение профиля макулы и фовеолы, неровности на поверхности сетчатки, складки, разрывы, витреоретинальные тяжи, преретинальные и эпиретинальные мембраны, экссудаты, друзы, хориоретинальные неоваскулярные мембраны.
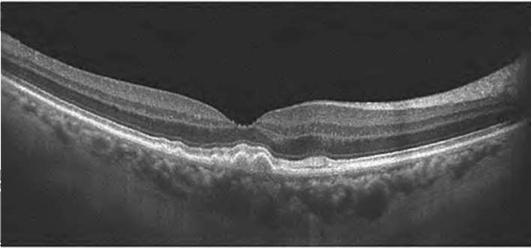
При оценке деформации сетчатки в целом следует обращать внимание на профиль сетчатки. Вогнутая (concave) деформация сетчатки встречается при миопии высокой степени и задней стафиломе (рис. 17-23), выпуклая (convex) - при отслойке пигментного эпителия сетчатки (ПЭС) (рис. 17-24), отслойке нейроэпителия (рис. 17-25), субретинальной неоваскуляризации (рис. 17-26), кистах, опухолях. Ретинальные друзы сопровождаются появлением неоднородных волнообразных складок линии пигментного эпителия и хориокапилляров (рис. 17-27).
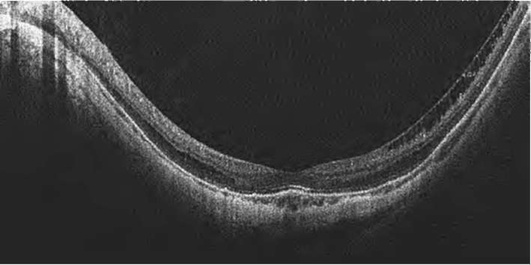
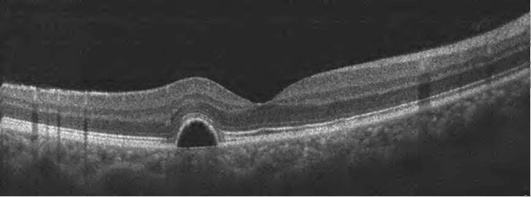
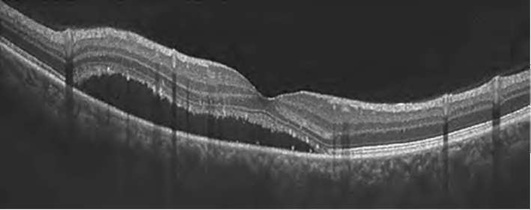
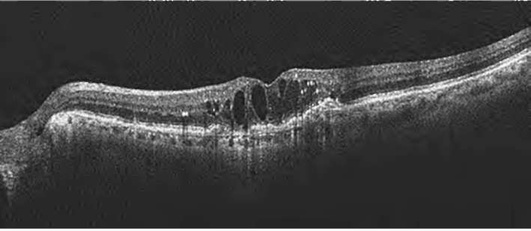
Исчезновение центральной ямки свидетельствует о наличии ретинального отека (рис. 17-28, 17-29). Накопление интраретинальной жидкости ведет не только к изменению структуры сетчатки, но и к увеличению ее толщины. Вначале появляются незначительные признаки в виде снижения рефлективности тканей и увеличения толщины сетчатки (рис. 17-28). По мере нарастания отека сетчатка приобретает губчатый вид. Далее наступает фаза кистозного отека (рис. 17-29).
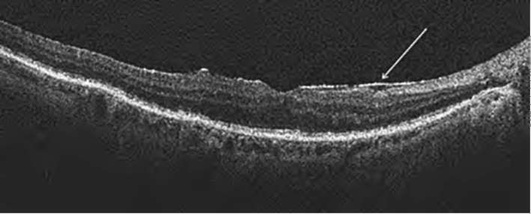
Происходит накопление жидкости в интраретинальных полостях радиально от фовеа. Кистозные полости образуются преимущественно в наружном плексиформ-ном и наружном ядерном слоях. Отек, первоначально локализуясь в глубоких слоях сетчатки, постепенно распространяется, захватывая все слои. Сенсорная сетчатка утолщается, макулярный контур приобретает неправильную форму, вплоть до полного исчезновения. Характерный признак макулярного отека - отсутствие фовеолярного углубления. Складки на поверхности сетчатки формируются в результате воздействия эпиретинальных мембран (рис. 17-30, 17-31). Сама эпи-ретинальная мембрана дифференцируется в виде линии на поверхности сетчатки, приводя в ряде случаев к формированию макулярных разрывов (рис. 17-32).
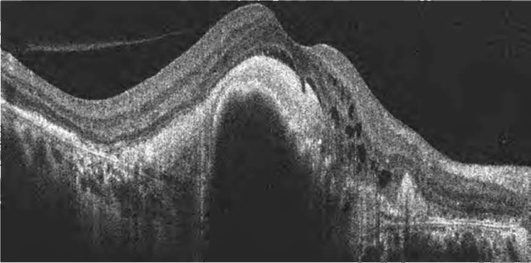
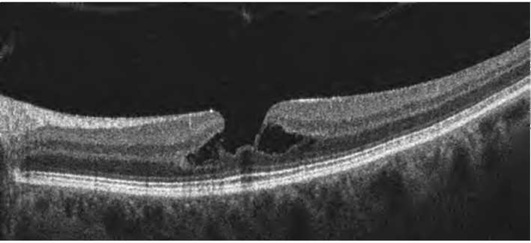
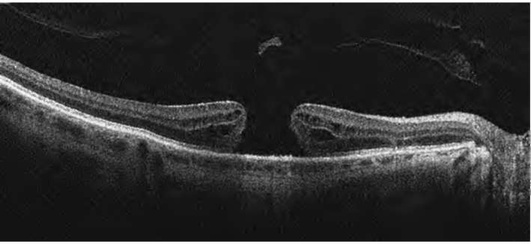
Оценка витреоретинальных взаимоотношений важна с точки зрения дифференциальной диагностики, прогноза течения, выбора тактики лечения и оценки его эффективности. В 2013 г. предложена новая классификация патологии витрео-ретинального интерфейса, появление которой предопределили развитие ОКТ, появление новых данных о патогенетических механизмах, определяющих прогноз хирургического вмешательства, появление новых методов лечения (окриплазмин*) (табл. 17-3, рис. 17-31-17-34).
| Патология | Варианты | |
|---|---|---|
Витреоретинальная адгезия |
Локальная (<1500 мкм) |
|
Распространенная |
||
Витреоретинальная тракция |
Локальная (<1500 мкм) |
|
Распространенная |
||
Изолированная |
||
Сочетанная |
||
Разрыв |
Сквозной |
Малый(»250-400 мкм) |
Средний (>400 мкм) |
||
Большой (>400 мкм) |
||
C витреоретинальными тракциями |
||
Без витреоретинальныхтракций |
||
Первичный (ВМА, ВРТ) |
||
Вторичный (контузия, возрастная миакулодистрофия - ВМД и др.) |
||
Ламеллярный |
||
Псевдоразрыв |
||
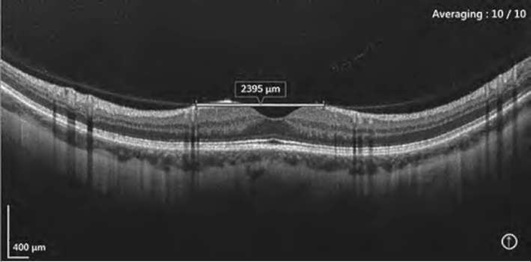
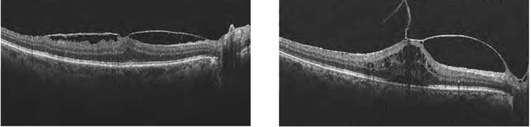
Выраженность тракционного воздействия на сетчатку лучше оценивать, анализируя трехмерные (3D-сканы) и en-face-изображения (фронтальные или С-сканы). En-face-изображения обеспечивают возможность точной топографической привязки, анализа масштаба и топологии дефектов различных слоев сетчатки [на уровне поверхности сетчатки - отображает изменения витреоретинального интерфейса (рис. 17-35, см. цв. вклейку), на уровне сетчатки - отек (рис. 17-36, см. цв. вклейку), эксудаты, параллельно отслойки ПЭС и ПЭС-друзы] (рис. 17-37, см. цв. вклейку).
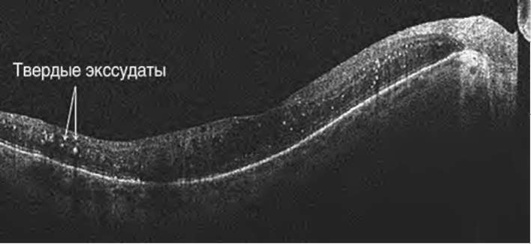
Рефлективность слоев сетчатки и патологических образований является основой анализа ОКТ. Высокой рефлективностью в норме обладают слой нервных волокон, эллипсоидная зона фоторецепторов, комплекс «ПЭС-мембрана Бруха», хориокапилляры, при патологии - скопление пигмента, гипертрофия ПЭС, невус (рис. 17-38, см. цв. вклейку), рубцовая ткань, геморрагии (рис. 17-39, см. цв. вклейку), неоваскулярные мембраны (см. рис. 17-26), воспалительные инфильтраты, ватообразные фокусы, твердые экссудаты (см. рис. 17-28, 17-29). Плексиформные слои обладают средней рефлективностью, фоторецепторы и ядерные слои - низкой. К гипорефлективным структурам при патологии относятся интраретиналь-ные кисты и полости (отек, шизис) (см. рис. 17-29, 17-32, 17-35), экссудативная отслойка нейроэпителия (см. рис. 17-25), отслойка ПЭС (см. рис. 17-24), гипопиг-ментация ПЭС.
Ткань с высокой оптической плотностью ведет себя как экран, затеняя подлежащие структуры. В норме эффект тени дают сосуды сетчатки, при патологии пре-ретинальные образования, ватообразные очаги, расположенные в поверхностных слоях сетчатки, интраретинальные геморрагии (см. рис. 17-39), лазерные коагуляты, твердые липидные экссудаты в глубоких слоях (см. рис. 17-28, 17-29).
Сегментация подразумевает исследование расположения и взаимоотношения слоев сетчатки на основе анализа их рефлективности. Первостепенную важность сохраняет изучение слоя нервных волокон сетчатки (СНВС) и ганглиозных клеток. Сегментация позволяет рассчитывать параметры внутренней (комплекса ганглиозных клеток) (рис. 17-40, см. цв. вклейку) и наружной сетчатки (слои между ПЭС и внутренним плексиформным слоем). Возможно проведение трехмерной реконструкции поверхности сетчатки, слоя пигментного эпителия (рис. 17-41, см. цв. вклейку), наружной пограничной мембраны и др. Программное обеспечение приборов (Cirrus 5000, Zeiss) позволяет не только визуализировать элевацию ПЭС, но и определить ее площадь и объем, оценить изменения в динамике (рис. 17-42, см. цв. вклейку). В случае патологических изменений сетчатки (отек, атрофия, включения) сегментация становится некорректной.
Картирование сетчатки наиболее информативно при нарушении сегментации и деформации сетчатки, оценке патологического процесса в динамике при естественном течении заболевания либо оценке эффективности лечения (рис. 17-43, см. цв. вклейку).
Оценка ДЗН и слоя нервных волокон наиболее часто используется для диагностики и мониторинга глаукомы. Анализ данных, как и при оценке структур сетчатки, предоставляет качественную и количественную информацию. Количественный анализ диска зрительного нерва позволяет измерить и оценить площадь и объем экскавации ДЗН, площадь и объем самого диска, соотношения диаметра экскавации и диска, глубину экскавации (рис. 17-44, см. цв. вклейку).
Анализ кольцевых перипапиллярных сканов позволяет судить о толщине СНВС (рис. 17-45, а, см. цв. вклейку). Наибольшую толщину слой нервных волокон имеет в верхних и нижневисочных отделах. При дистрофических процессах происходит его истончение. Участки истончения слоя нервных волокон вокруг ДЗН по данным ОКТ коррелируют с дефектами поля зрения и потерей нейроглии.
Диаметр радиального сканирования перипапиллярной зоны - 3,4 мм в направлении: висок-верх-нос-низ (TSNIT) (рис. 17-45, б, см. цв. вклейку).
Стандартный протокол исследования ДЗН (рис. 17-46, см. цв. вклейку) включает в себя: LSO-фундус-изображение (1), карту толщины СНВС (2), отклонения толщины от нормы (5), значимость отклонения (8), параметры ДЗН (3), линейные сканы (4, 7), профиль толщины СНВС (10), оценку толщины СНВС, представленную графически (9, 11) и в таблице в сравнении с нормативной базой.
Оценивая изменение толщины СНВС в динамике, возможно рассчитать ожидаемую скорость их изменений (рис. 17-47, см. цв. вклейку). Чем больше количество обследований, чем более выражены изменения и больше срок наблюдения, тем более достоверна информация о прогрессировании и его скорости.
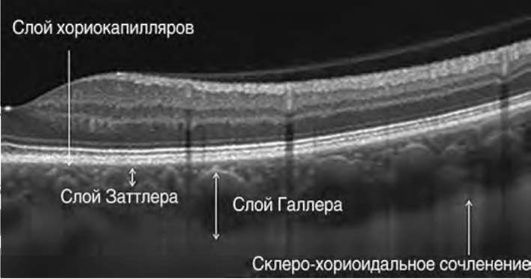
Поскольку меланин сосудистой оболочки и пигментного эпителия экранирует свет, отраженный от склеры и хориоидеи, до недавнего времени визуализация хориоидеи была затруднена. С учетом неоднородной оптической плотности и отсутствия четких разделительных границ особые определения в новой номенклатуре получили слои хориоидеи. Слой хориокапилляров определен как узкая полоска умеренной рефлективности во внутренних отделах хориоидеи. Слой Заттлера - широкий слой круглых или овальных гиперрефлективных контуров с гипорефлективным центром в средних отделах хориоидеи. Слой Галлера - широкий слой овальных гиперрефлективных контуров с гипорефлективным центром в наружных отделах хориоидеи. Склеро-хориоидальное сочленение - зона по наружной границе хориоидеи с выраженным изменением структуры, где крупные круглые или овальные контуры примыкают к гомогенной области различной рефлективности (рис. 17-48).
Толщина хориоидеи определяется как расстояние между наружной границей пигментного эпителия и внутренней границей склеры (рис. 17-49, см. цв. вклейку). Наибольшую толщину хориоидея имеет в области фовеолы (в среднем 287-272 мкм в возрасте 30 лет), что объясняется наибольшей концентрацией в этой области фоторецепторов и наиболее высокими уровнями метаболизма и потребления кислорода этой структурой. По направлению к височному и носовому отделам толщина хориоидеи уменьшается, с носовой стороны она тоньше. С возрастом толщина сосудистой оболочки уменьшается на 1,56 мкм в год. При осевой миопии увеличение переднезадней оси (ПЗО) на 0,33 мм (1 D) сопровождается уменьшением толщины хориоидеи на 8 мкм [16, 17].
Эволюция развития оптической когерентной томографии привела к появлению нового метода исследования - ОКТ-ангиографии (ОКТА), что открывает принципиально новые возможности в диагностике и лечении заболеваний сетчатки. Визуализация сосудистого русла стала возможной благодаря увеличению скорости сканирования, использованию инновационных режимов и алгоритмов исследования [11].
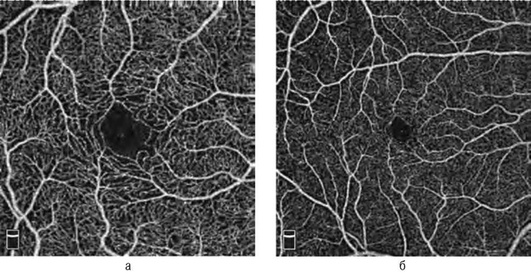
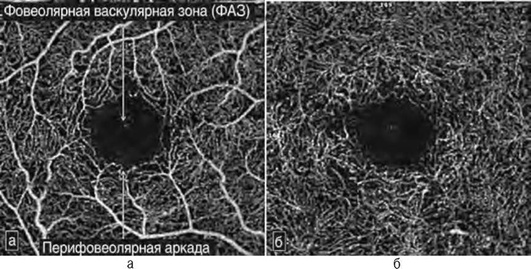
ОКТА - неинвазивный безопасный информативный метод оценки микроциркуляции при сосудистых заболеваниях и неоваскулярных процессах на глазном дне, позволяющий определять локализацию, форму, структуру и площадь патологических сосудистых изменений. В отличие от ФАГ, ОКТА отражает картину сосудистого русла с учетом сегментации сетчатки. На ангиограммах сетчатки в режиме автоматической сегментации информация представлена в виде карт поверхностной капиллярной сети, расположенной на уровне слоя нервных волокон, глубокого сосудистого сплетения - между внутренним ядерным и наружным плексиформ-ным слоями, наружной (аваскулярной зоны) сетчатки и хориоидального кровотока (рис. 17-50, см. цв. вклейку, 17-53) [Lumbroso В., Huang D., Romano A. et al. Clinical En Face OCT Atlas, Mastropasqua R., Agnifili L., Gregorio A. et al.]. Используя функцию послойного исследования ОКТА реконструкции в режиме ручной установки глубины и толщины среза возможен анализ на любом уровне. Площадь визуализации кровотока лимитирована длинной скана (2×2, 3×3, 6×6 и 8×8 мм). Сканы большого размера (6×6 и 8×8 мм) дают более полное представление о ходе крупных сосудов, сканы малого размера (2×2, 3×3 мм) позволяют визуализировать мелкую сосудистую сеть (рис. 17-51). В норме сосудистый рисунок поверхностной капиллярной сети выглядит в виде белых линейных структур, ориентированных центростремительно к фовеа, вблизи которой они образуют перифовеолярную аркаду, ограничивающую фовеальную аваскулярную зону. Крупные ветви дихотомически делятся на более мелкие, образуя густую сеть (рис. 17-52, а). Глубокая капиллярная сеть состоит из более однородных по диаметру капилляров с большим количеством горизонтальных и вертикальных анастомозов (рис. 17-52, б).
В ряде случаев ОКТА является достойной альтернативой контрастным методам исследования (см. рис. 17-54, 17-55, см. цв. вклейку), что имеет немаловажное значение для пациентов с тяжелой соматической патологией и с аллергическими реакциями.
Метод имеет высокую чувствительность и специфичность в определении неоваскулярного компонента, позволяя определить форму, структуру, площадь и, в отличие от ФАГ, четкую локализацию патологических сосудистых изменений с учетом сегментации сетчатки (см. рис. 17-55, см. цв. вклейку, 17-56).
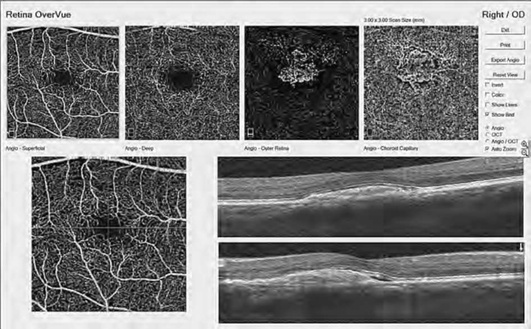

Изменение площади новообразованных сосудов позволяет осуществлять мониторинг заболевания и оценивать эффективность проводимой антиангиогенной терапии (рис. 17-57, см. цв. вклейку).
Статистические параметры ОКТА - плотность сосудистого потока, площадь аваскулярных зон, площадь неоваскулярных мембран обеспечивают объективную оценку кровотока сетчатки при различных заболеваниях и выступают в качестве критерия эффективности лечебных мероприятий [5]. Новым словом в диагностике нейродегенеративных заболеваний является оценка перфузии ДЗН (см. рис. 17-58, 17-59, см. цв. вклейку). Оценка кровотока осуществляется на уровне ДЗН (Angio-NerveHead) и на уровне радиальных перипапиллярных капилляров (Angio Radial Peripapillar Capillaries) (см. рис. 17-58). Несмотря на отсутствие объективных количественных критериев оценки кровотока ДЗН и перипапиллярной сетчатки, результаты качественного анализа, основанного на субъективной оценке плотности капилляров и площади аваскулярных зон, представленные в виде аксиальных сканов и сосудистых карт, наглядно демонстрируют чувствительность и специфичность метода. Интенсивность кровотока зависит от стадии заболевания (см. рис. 17-59). При прогрессировании заболевания глаукоматозные изменения в виде расширения экскавации ДЗН и дистрофических изменений СНВС сопровождаются снижением интенсивности кровотока как самого диска, так и перипапиллярной сетчатки в виде секторального (см. рис. 17-59, б-1) либо диффузного (см. рис. 17-59, в-1) уменьшения плотности капилляров. Дальнейшее развитие и совершенствование технологии, разработка алгоритмов оценки закономерностей гемодинамических и морфофункциональ-ных взаимоотношений ДЗН и перипапиллярной сетчатки у пациентов с глаукомой могут быть использованы для прогнозирования функциональных исходов антиглаукомных операций и выбора средств медикаментозной терапии.
Технология оптической когерентной томографии продолжает активно развиваться и совершенствоваться, открывая новые горизонты в решении проблемы слепоты и слабовидения.
СПИСОК ЛИТЕРАТУРЫ
Клокова О.А., Фомин А.В., Дамашаускас Р.О. и др. Особенности состояния эпителия роговицы после рефракционных вмешательств по данным AVANTI RTVue XR // Соврем. технологии в офтальмологии. - 2013. - № 3. - 152 с.
Лобанова О.С. «In vivo» визуализация слезной пленки и глазной поверхности у пациентов с дисфункцией мейбомиевых желез // «Федоровские чтения», 85 лет со дня рождения академика С.Н. Федорова. - М., 2012. - С. 212.
Родин А.С., Большунов А.В., Табель В.П, Габлер Б. Применение оптической когерентной томографии для диагностики ретинальной патологии // Рефракционная хирургия и офтальмология. - 2001. - Т. 3, № 1. - С. 26-29.
Свирин А.В., Кийко Ю.И., Обруч Б.В., Богомолов А.В. Спектральная когерентная оптическая томография: принципы и возможности метода // Клин. офтальмол. - 2009. - Т. 10, № 2. - C. 50-53.
Щуко А.Г., Злобин И.В., Юрьева Т.Н., Михалевич И.М. Комплексная оценка факторов риска окклюзии ретинальных вен и разработка классификационных критериев ишемии сетчатки // Вестн. офтальмол. - 2014. - № 5. - С. 54-59.
Baikoff G. Anterior segment OCT and phakic intraocular lenses: a perspective // J. Cataract Refract. Surg. - 2006. - Vol. 32. - P. 1827-1835.
Choma M.A., Sarunic M.V., Yang C.H., Izatt J.A. Sensitivity advantage of swept source and Fourier domain optical coherence tomography // Optics Express. - 2003. - Vol. 11, N 18. - P. 2183-2189.
Czajkowski G, Laudencka A., Malukiewicz G. Tear meniscus measurement by spectral optical coherence tomography // Optom. Vis. Sci. - 2012. - Vol. 89, N 3. - P. 336-342.
Dada T., Sihota R., Gadia R. et al. Comparison of anterior segment optical coherence tomography and ultrasound biomicroscopy for assessment of the anterior segment // J. Cataract Refract. Surg. - 2007. - Vol. 33. - P. 837-840.
Fercher A.F., Hitzenberger C.K., Kamp G, El-ZaiatS.Y. Measurement of intraocular distances by backscattering spectral interfereometry // Optics Commun. - 1995. - Vol. 117. - P. 43-48.
Lumbroso B., Huang D, Romano A. et al. Clinical En Face OCT Atlas. - New Delhi, London, Philadelphia, Panama: Jaypee-Higlights Medical Publisher, 2013. - 482 p.
Mansouri K, Medeiros F.A., Marchase N. et al. Assessment of choroidal thickness and volume during the water drinking test by swept-source optical coherence tomography // Ophthalmology. - 2013. - Vol. 120, N 12. - P. 2508-2516.
Mansouri K, Nuyen B., Weinreb R.N. Improved visualization of deep ocular structures in glaucoma using high penetration optical coherence tomography // Expert Rev. Med. Devices. - 2013. - Vol. 10, N 5. - P. 621-628.
Mastropasqua R., Agnifili L, Gregorio A. et al. Optical Coherence Tomography Angiography in Retinal Vascular Diseases and Choroidal Neovascularization // J. Ophthalmol. - Vol. 2015. - Article ID 343515. - 8 p.
Park H.Y., Shin H.Y., Park C.K. Imaging the posterior segment of the eye using swept-source optical coherence tomography in myopic glaucoma eyes: comparison with enhanced-depth imaging // Am. J. Ophthalmol. - 2014. - Vol. 157, N 3. - P. 550-557.
Potsaid B, Baumann B, Huang D. et al. Ultrahigh speed 1050nm swept source / Fourier domain OCT retinal and anterior segment imaging at 100,000 to 400,000 axial scans per second // Optics Express. - 2010. - Vol. 18, N 19. - P. 20 029-20 048.
Povazay B., Bizheva K., Hermann B. et al. Enhanced visualization of choroidal vessels using ultrahigh resolution ophthalmic OCT at 1050 nm // Optics Express. - 2003. - Vol. 11, N 17. - P. 1980-1986.
Puliafito C.A., Hee M.R., Lin C.P. et al. Imaging of macular diseases with optical coherence tomography // Ophthalmology. - 1995. - Vol. 102, N 2. - P. 217-229.
Sarodia U. Visualization of aqueous shunt position and patency using anterior segment optical coherence tomography // Am. J. Ophthalmol. - 2007. - Vol. 143. - P. 1054-1056.
SchumanJ.S., Hee M.R., Arya A.V. et al. Optical coherence tomography: a new tool for glaucoma diagnosis // Curr. Opin. Ophthalmol. - 1995. - Vol. 6, N 2. - P. 89-95.
Takayama K., Hangai M, Kimura Y. et al. Three-dimensional imaging of lamina cribrosa defects in glaucoma using sweptsource optical coherence tomography // Invest. Ophthalmol. Vis. Sci. - 2013. - Vol. 54, N 7. - P. 4798-4807.
Wang R.K. Signal degradation by multiple scattering in optical coherence tomography of dense tissue: a Monte Carlo study towards optical clearing of biotissues // Phys. Med. Biol. - 2002. - Vol. 47, N 13. - P. 2281-2299.
Wirbelauer Ch. Histopathological correlation of corneal diseases with optical coherence tomography // Graefes Arch. Clin. Exp. Ophthalmol. - 2007. - Vol. 240. - P. 727-734.