Офтальмология
geotar
Офтальмология / Аветисова С. Э. , Егорова Е. А. , Мошетовой Л. К. , Нероева В. В. , Тахчиди Х. П. - Москва : ГЭОТАР-Медиа, 2018. - 904 с. (Серия "Национальные руководства") - ISBN 978-5-9704-4449-8 |
Аннотация
В отличие от большинства других изданий в национальном руководстве по офтальмологии особое внимание уделено профилактике, патогенезу, современным методам диагностики, медикаментозным, лазерным и хирургическим методам лечения глазных заболеваний. В книгу вошли общие и частные вопросы офтальмологии, содержащие объединенную согласованную позицию известных отечественных специалистов. Рекомендации по диагностике, лечению и профилактике отдельных нозологических единиц разработаны ведущими офтальмологами России. В подготовке настоящего издания в качестве авторов-составителей и рецензентов участвовали специалисты-офтальмологи - сотрудники МНИИ глазных болезней им. Гельм - гольца, МНТК "Микрохирургия глаза" им. акад. С.Н. Федорова, ФГБНУ "НИИГБ", РНИМУ им. Н.И. Пирогова, РМАНПО, кафедр офтальмологии ведущих вузов страны. Руководство предназначено врачам-офтальмологам, студентам старших курсов медицинских вузов, интернам, ординаторам, аспирантам.
Глава 7. Конфокальная прижизненная микроскопия роговицы
С.Э. Аветисов, Г.Б. Егорова
Конфокальная микроскопия - один из современных методов исследования; позволяет проводить прижизненный мониторинг состояния роговицы с визуализацией тканей на клеточном и микроструктурном уровне.
Данный метод в силу оригинальной конструкции микроскопа и его большой разрешающей способности позволяет визуализировать живые ткани роговицы, измерить толщину каждого из ее слоев, а также оценить степень морфологических нарушений.
ЦЕЛЬ
Охарактеризовать морфологические изменения роговицы, возникающие при различных воспалительных и дистрофических ее заболеваниях, а также вследствие хирургических вмешательств и воздействия КЛ.
Данные морфологического исследования необходимы, чтобы оценить тяжесть патологического процесса, эффективность лечения и определить тактику ведения больного.
ПОКАЗАНИЯ
ПРОТИВОПОКАЗАНИЯ
Относительное противопоказание - выраженное раздражение глаза на фоне острого воспалительного процесса.
ПОДГОТОВКА
Проведение данного исследования возможно без применения анестетиков. На объектив линзы конфокального микроскопа помещают каплю иммерсионной жидкости. Это исключает непосредственный контакт линзы с роговицей и сводит к минимуму риск повреждения эпителия.
МЕТОДИКА
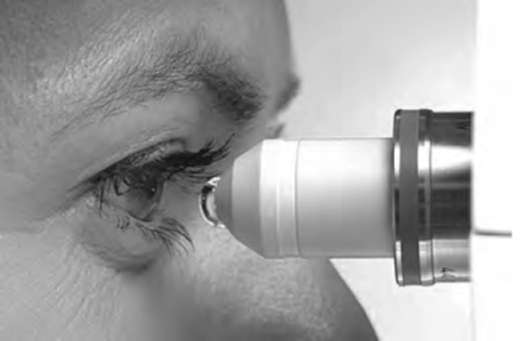
Исследование выполняют на конфокальном микроскопе ConfoScan 4 (Nidek) с увеличением в 500 раз. Прибор позволяет осмотреть роговицу по всей ее толщине.
Размер исследуемой зоны составляет 440×330 мкм, толщина слоя сканирования - 5 мкм. Линзу с каплей геля (глазной гель с декспантенолом 5%, Корнерегель*) подводят к роговице до касания и устанавливают так, чтобы толщина слоя иммерсионной жидкости составляла 2 мм. Конструкция прибора позволяет исследовать роговицу в центральной зоне и ее парацентральных участках (рис. 7-1; рис. 7-2, см. цв. вклейку).
ИНТЕРПРЕТАЦИЯ
Нормальная морфологическая картина роговицы
Передний эпителий состоит из 5-6 слоев клеток. Средняя толщина всего эпителия - приблизительно 50 мкм. По морфологической структуре выделяют следующие слои (изнутри кнаружи): базальный, шиповидных клеток и поверхностный.
-
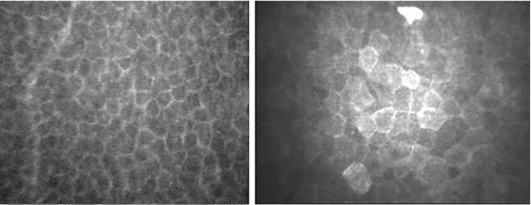
Самый внутренний (базальный) слой представлен маленькими плотными цилиндрическими клетками без видимого ядра. Границы базаль-ных клеток четкие, яркие (рис. 7-3).
-
Средний слой состоит из 2-3 пластов шиповидных (крылатых) клеток с глубокими инвагинациями, в которые встраиваются выросты соседних клеток. Микроскопически границы клеток довольно хорошо различимы, а ядра могут не определяться или быть нечеткими (рис. 7-4).
-
Поверхностный слой эпителия представлен одним или двумя пластами полигональных клеток с четкими границами и гомогенной плотностью. Ядра обычно ярче, чем цитоплазма, в которой также можно различить околоядерное темное кольцо (рис. 7-5). Среди клеток поверхностного слоя различают темные и светлые. Повышенная отражательная способность эпителиальных клеток свидетельствует о снижении в них уровня метаболизма и начинающейся их десквамации.
Боуменова мембрана - прозрачная структура, не отражающая свет, поэтому в норме при конфокальной микроскопии ее визуализация невозможна.
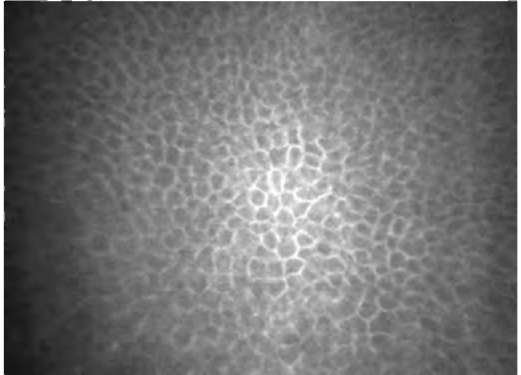
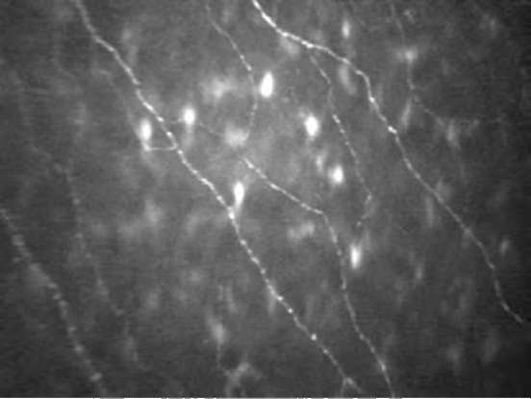
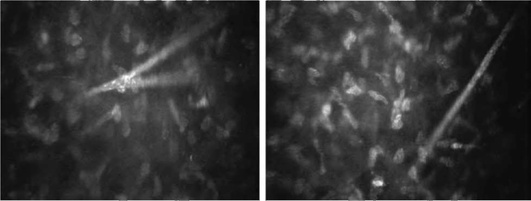
Суббазальное нервное сплетение находится под боуменовой мембраной. В норме нервные волокна выглядят как параллельно идущие на темном фоне яркие полосы, контактирующие между собой. Рефлективность (отражательная способность) может быть неравномерной по протяжению волокна (рис. 7-6).
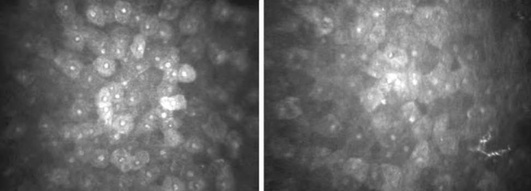
Строма роговицы занимает от 80 до 90% толщины роговицы и состоит из клеточного и внеклеточного компонентов. Основные клеточные элементы стромы - кератоциты; составляют примерно 5% объема. Типичная микроскопическая картина стро-мы включает несколько ярких неправильной овальной формы тел (ядер кератоцитов), которые лежат в толще прозрачного темно-серого или черного матрикса. В норме визуализация внеклеточных структур невозможна из-за их прозрачности. Строма может быть условно разделена на субслои: передний (расположен непосредственно под боуменовой мембраной и составляет 10% толщины стромы), переднесредний, средний и задний. Средняя плотность кератоцитов выше в передней строме, постепенно их количество уменьшается по направлению к задним слоям. Плотность клеток передней стромы почти в два раза больше, чем клеток задней стромы (если плотность клеток передней стромы принять за 100%, то плотность клеток задней составит около 53,7%). В передней строме ядра кератоцитов имеют округлую бобовидную форму, а в задней - овальную и более вытянутую (рис. 7-7, 7-8).
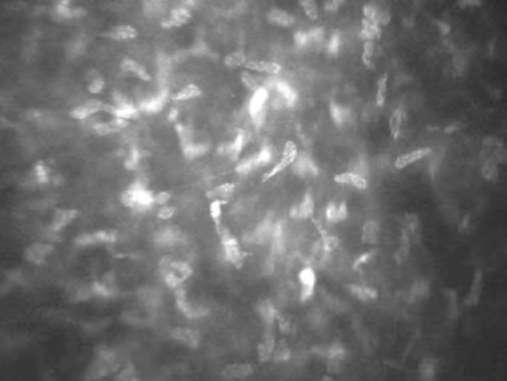
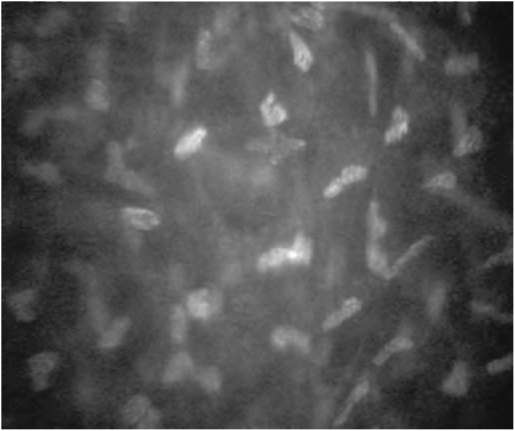
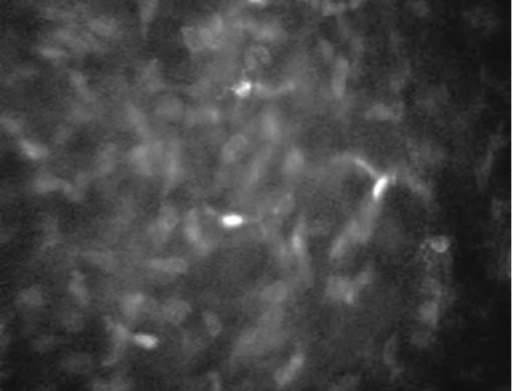
Ядра кератоцитов могут различаться по яркости. Повышение отражательной способности ядер кератоцитов может возникать в ответ на экзогенный или эндогенный стресс и быть результатом увеличения степени светорассеяния окружающими тканями роговицы. В норме в поле зрения встречаются единичные ядра кератоцитов с повышенной отражательной способностью (рис. 7-9).
Нервные волокна в передней строме роговицы визуализируются в виде ярких гомогенных полос, нередко образующих бифуркации (рис. 7-10).
Десцеметова мембрана в норме прозрачна и не визуализируется при конфокальной микроскопии.
Задний эпителий представляет собой монослой гексагональных или полигональных плоских клеток с равномерно светлой поверхностью на фоне четких темных межклеточных границ (рис. 7-11). В приборе заложена возможность мануального или автоматического подсчета плотности клеток, их площади и коэффициента вариабельности.

Патологические изменения строения роговицы
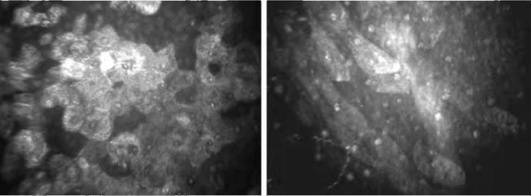
Кератоконус характеризуется значительными изменениями в переднем эпителии и строме роговицы.
-
Передний эпителий. Обнаруживают различные варианты эпителиопатии (рис. 7-12):
-
большое количество светлых клеток указывает на их повышенную десквамацию; поверхностные клетки при этом деформируются и вытягиваются в косом направлении;
-
участки с повышенной отражательной способностью свидетельствуют о нарушении их прозрачности.
-
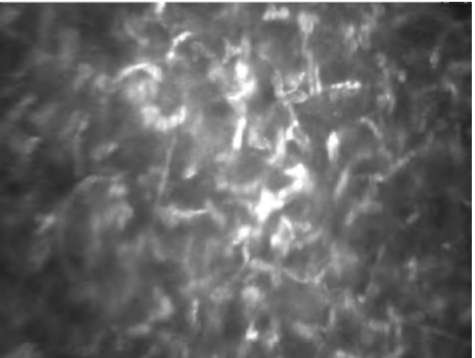
Строма. Основные изменения представлены микростриями, которые выглядят как разнородные тонкие линии со сниженной отражательной способностью (гипорефлекторные), контрастирующие с более светлой стромой (рис. 7-13). Типичны также изменение формы и ориентации кератоцитов, наличие большого количества кератоцитов с повышенной отражательной способностью, а также тенденция к помутнению стромы (рис. 7-14).
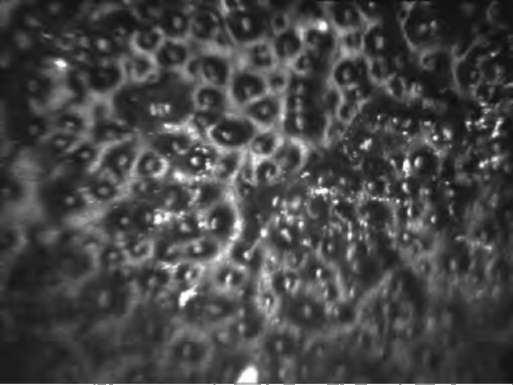
Дистрофия Фукса . Данные конфокальной микроскопии позволяют подтвердить диагноз и оценить тяжесть патологического процесса (рис. 7-15).

ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕЗУЛЬТАТ
На результат исследования влияют:
ОСЛОЖНЕНИЯ
Отсутствуют.
АЛЬТЕРНАТИВНЫЕ МЕТОДЫ
Биомикроскопия роговицы.
СПИСОК ЛИТЕРАТУРЫ
Jalbert I., Stapleton F, Papas E. et al. In vivo confocal microscopy of the human cornea // Brit. J. Ophthalmol. - 2003. - Vol. 87, N 2. - Р. 225-236.
Mastropasqua L, Nubile M. Confocal Microscopy of the Cornea // SLACK Incorporated. USA. - 2002. - P. 122.
Oliveira-Soto L., Efron N. Morphology of corneal nerves using confocal microscopy // Cornea. - 2001. - Vol. 20, N 4. - P. 374-384.
Patel S, McLaren J., Hodge D. et al. Normal human keratocyte density and corneal thickness measurement by using confocal microscopy in vivo // Invest. ophthalmol. Vis. Sci. - 2001. - Vol. 42, N 2. - Р. 333-339.
Somodi S., Hahnel C., Slowic C. et al. Confocal in vivo microscopy and confocal laser-scanning fluorescence microscopy in keratoconus // Ger. J. Ophthalmol. - 1996. - Vol. 5, N 6. - Р. 518525.
Wygledowska-Promienska D., Rokita-Wala I., Gierek-Ciaciura S. et al. The alterations in the corneal structure at III/IV stage of keratoconus by means of confocal microscopy and ultrasound biomicroscopy before penetrating keratoplasty // Klin. Oczna. - 1999. - Vol. 101, N 6. - Р. 427-432.