Пародонтология / под ред. Янушевича О. О. , Дмитриевой Л. А. - Москва : ГЭОТАР-Медиа, 2018. - 752 с. (Серия "Национальные руководства") - ISBN 978-5-9704-4365-1 |
Аннотация
Во втором издании руководства с учетом современного уровня развития пародонтологии освещены этиология и патогенез, диагностика, клиническая картина и профилактика заболеваний пародонта, организационные мероприятия при курации данного контингента пациентов.
Руководство написано с учетом современной классификации болезней (МКБ-10) на основе квалификационной характеристики специалистов, оказывающих помощь пациентам с гингивитом, пародонтитом, пародонтозом. Дано описание современных материалов, медикаментов, оборудования, технологий и методов лечения, применяемых в пародонтологии.
Издание предназначено для врачей-стоматологов, врачей при подготовке к аккредитации, студентов старших курсов стоматологических вузов, клинических ординаторов, аспирантов, слушателей циклов повышения квалификации.
П18
Л.А. Дмитриева, З.Э. Ревазова, И.С. Бобр
Современные методы комплексного обследования пациентов с болезнями пародонта позволяют выявлять ранние признаки поражения тканей пародонта, отслеживать клиническую симптоматику в динамике, определять прогноз как для отдельных участков пародонта, так и для стоматологического статуса пациента, оценивать эффективность назначенных методов лечения. Диагностические мероприятия должны осуществляться на протяжении всего периода комплексного лечения пациентов с патологией пародонта, быть точными и объективными. Для обследования пациентов с болезнями пародонта используют следующие методы:
КЛИНИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Этапы клинического обследования пациентов с заболеваниями пародонта:
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ЗДОРОВЬЯ ПАЦИЕНТА
На первом этапе клинического обследования необходимо оценить общее состояние здоровья пациента, расспросить о системных заболеваниях, выявить и оценить врожденные и приобретенные факторы риска, узнать о приеме лекарственных препаратов. Следует обратить внимание на возраст пациента, вероятность эмоционального и психологического стресса, генетическую патологию, эндокринные нарушения, болезни крови, метаболические расстройства и болезни пищеварительной системы. Перечисленные факторы следует рассматривать в нескольких плоскостях. Во-первых, при системных заболеваниях могут быть изменены или нарушены защитные механизмы организма, что повышает предрасположенность к пародонтиту. Некоторые состояния, такие как беременность, аллергия, вредные привычки, прием лекарственных препаратов, влияют на развитие заболеваний пародонта, их течение и исход лечения. Оценка общего состояния здоровья пациента определяет показания для выбора метода использования и вида стоматологического анестетика. Во-вторых, системные заболевания, такие как сахарный диабет, эндокринные расстройства, болезни крови, сердечно-сосудистые заболевания, болезни ЖКТ, а также инфекционные и венерические заболевания, могут иметь выраженную симптоматику в полости рта. Кроме того, эти заболевания могут быть впервые выявлены на пародонтологическом приеме.
ОЦЕНКА СТОМАТОЛОГИЧЕСКОГО И ПАРОДОНТОЛОГИЧЕСКОГО АНАМНЕЗА
Следует собрать полный стоматологический и пародонтологический анамнез. Выясняют, когда впервые пациент заметил беспокоящие его симптомы, их характер, наличие кровоточивости, боли, неприятных ощущений в десне, наличие запаха изо рта (галитоз), частоту абсцедирования. Обязательно спрашивают о ранее проведенном стоматологическом лечении, его эффективности, результате, какие лекарственные средства и методы лечения использовались. После этого переходят к объективной оценке клинического состояния полости рта и тканей пародонта.
ОБЩЕЕ СТОМАТОЛОГИЧЕСКОЕ ОБСЛЕДОВАНИЕ ПАЦИЕНТА
Общее стоматологическое обследование включает внеротовое и внутриротовое обследование. При внеротовом обследовании во время беседы с пациентом оценивают конфигурацию лица, симметричность, соотношение его частей. Обращают внимание на цвет, целостность кожных покровов и состояние красной каймы губ. При открывании рта отмечают наличие девиации (смещение нижней челюсти относительно средней линии при движении), щелчка в суставе. Внутриротовое обследование проводят визуально, пальпаторно, при помощи зеркала, зондов и оценивают следующие характеристики.
Состояние мягких тканей рта
Определяют цвет, увлажненность, наличие патоморфологических элементов на слизистой оболочке рта, цвет, величину и состояние сосочков языка. В норме слизистая оболочка преддверия полости рта розового цвета, более яркая в области щек и губ по сравнению с бледной слизистой десны, умеренно увлажнена, эластичная. Дорсальная поверхность языка в норме покрыта сосочками, из-за чего имеет бархатистый вид. Слизистая оболочка вентральной поверхности языка гладкая и тонкая, через нее просвечивают язычные вены. Оценивают размер, цвет языка, симметричность его половин, наличие налета, его цвет, плотность, наличие складок на дорсальной поверхности. В норме на слизистой оболочке полости рта имеются мелкие слюнные и сальные железы (железы Фордайса).
Расположение челюстных дуг и состояние прикуса
Окклюзия - это смыкание зубных рядов или отдельных групп зубов-антагонистов. Соотношение зубных рядов при смыкании челюстей в центральной окклю зии называется прикусом.
Прикус оценивают при смыкании зубов верхней и нижней челюсти. Определяют взаимное расположение челюстных дуг, глубину резцового перекрытия. Нарушение положения зуба в зубном ряду (вестибулярное, оральное положение, тортоаномалия), отсутствие зуба, скученное положение зубов затрудняют естественное очищение и соблюдение гигиены полости рта.
Вид прикуса определяет особенности макроморфологии элементов височно-нижнечелюстных суставов - высоту и ширину суставной впадины и бугорков, размеры и форму суставной головки, величину ее наклона по отношению к шейке.
Можно выделить три наиболее часто встречающихся у взрослых типа сочленений.
-
Умеренно выпукло-вогнутый сустав, характеризующийся средней выпуклостью суставной поверхности головки и ее суставной площадки, средней высотой суставного бугорка, средней шириной и глубиной суставной впадины и небольшим наклоном шейки суставного отростка вперед по отношению к горизонтальной плоскости. Этот тип сочленения чаще соответствует ортогнатическому прикусу, является примером гармоничного соотношения элементов височно-нижнечелюстного сустава и обеспечивает наиболее адекватное соотношение шарнирных и скользящих движений.
-
«Плоский» сустав характеризуется уплощенной головкой, невысоким суставным бугорком, но широкой суставной впадиной и почти вертикальным переходом головки в шейку мыщелкового отростка. Этому типу сочленения чаще соответствует прямой прикус. При этом преобладают скользящие движения, а шарнирные сведены к минимуму. В то же время при таком строении сочленения фиброзно-хрящевое покрытие окаймляет не только задний, но и передний скат бугорка. Если при таком строении сустава на окклюзионных поверхностях зубов моделировать высокие бугры, то может возникнуть травма тканей пародонта.
-
Подчеркнуто выпукло-вогнутый сустав характеризуется глубокой и узкой суставной впадиной, высоким узким и выпуклым суставным бугорком, большим углом наклона мыщелкового отростка к шейке с выпуклой суставной поверхностью головки. Этот тип сочленений характеризуется преобладанием в нем шарнирных движений и чаще встречается при глубоком резцовом перекрытии или прогнатическом соотношении зубных рядов.
Если при таком строении сустава на окклюзионных поверхностях зубов моделировать плоские бугры, а глубокий прикус переводить в нейтральный или прямой, - неизбежна травма мягких тканей сустава. При этом могут возникнуть дислокация межсуставного диска и, как следствие, щелчки, перфорация диска, боли, ограничение подвижности, анкилоз.
Таким образом, форма элементов сочленения коррелирует с видом прикуса (рис. 10-1).
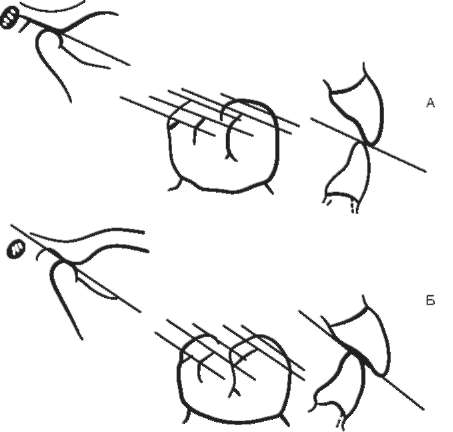
Рис. 10-1. Корреляция видов прикуса с макроморфологией элементов ВНЧС (Хватова, 2005)
Окклюзионная диагностика. Диагностика окклюзии имеет исключительное значение в обследовании пациентов с болезнями пародонта. Одним из важных этапов клинического обследования является определение окклюзии и выявление окклюзионных супраконтактов. Диагностику преждевременных окклюзионных контактов выполняют разными способами: обследуя твердые ткани зубов, с помощью артикуляционной бумаги, посредством фольги, с помощью пластин базисного воска. Для маркировки окклюзионных контактов применяют артикуляционную бумагу, шелк, фольгу, тонкие пластинки «бюгельного воска-02», которым придается форма слепочной ложки, а также пинцеты для удерживания этих материалов. Для начального определения супраконтактов могут быть использованы окклюзиограммы (воск, окклюзионный силикон).
Артикуляционная бумага и фольга выпускаются толщиной от 8 до 200 мк и представляют собой маркировочные полоски, окрашенные с одной или двух сторон. Оптимальная толщина фольги 8-12 мк исключает чрезмерную маркировку.
Артикуляционная фольга бывает красного, белого, зеленого, синего и черного цвета. Красную фольгу можно, например, использовать для отметки центрических, а синюю и зеленую - эксцентрических супраконтактов. Матовая поверхность фольги имеет окрашивающий слой.
Артикуляционная бумага и более толстая фольга увеличивают площадь маркировки и используются на первых этапах изучения окклюзионных контактов, как и тонкие полоски воска.
Интенсивно окрашенные контакты зубов имеют форму круга или овала со светлым центральным участком. Этот светлый участок является истинным местом контакта зубов. Исследования окклюзии проводят в два этапа: сначала посредством толстой артикуляционной бумаги синего цвета, затем используют фольгу (толщиной 8 мк) красного цвета, которая окрашивает эпицентр синего овала. Красные контактные пункты хорошо видны на окружающем синем фоне.
Окклюзия - важная составляющая часть зубочелюстной системы, ее нельзя рассматривать изолированно. Все органы зубочелюстной системы находятся в тесной взаимосвязи. Окклюзия, пародонт, височно-нижнечелюстной сустав, жевательные мышцы, нервная система - основные звенья этой системы. Последствия нарушений окклюзии могут проявиться в любом звене зубочелюстной системы.
Типичные осложнения окклюзионных нарушений:
Перед проведением восстановительных мероприятий в полости рта всегда следует оценить правильность выполнения уже имеющихся реставраций. Иначе своими действиями можно еще более усугубить ситуацию. Следует тщательно формировать рельеф окклюзионной поверхности в соответствии с определенными правилами.
Различают пять основных видов окклюзии:
Признаки центральной окклюзии. Опорные бугорки боковых зубов в одновременном двустороннем контакте с краевыми ямками двух соседних зубов противоположной челюсти (за исключением заднещечных бугорков нижних моляров и передненёбных - верхних моляров, которые в контакте с центральными фиссурами своих антагонистов. Передние зубы имеют легкий контакт.
Опорные бугорки (щечные - зубов нижней челюсти и нёбные зубов верхней челюсти) контактируют точечно со скатами бугорков зубов-антагонистов. Защитные, направляющие бугорки (язычные - зубов нижней челюсти и щечные зубов верхней челюсти) защищают язык и щеки от их попадания между зубами. Площадь всех точечных контактов центральной окклюзии около 4 мм2.
Суставные головки расположены в передневерхнем отделе суставных ямок напротив основания суставных бугорков. Жевательные мышцы одновременно и равномерно сокращены.
Передняя окклюзия - контакт передних зубов «встык», дезокклюзия в области боковых зубов или контакты дистальных бугров последних моляров (рис. 10-2).
Рис. 10-2. Передняя окклюзия
Разновидности рабочих окклюзионных контактов в норме при боковых окклюзиях
-
Клыково-фронтальная функция с Клыковым доминированием (окклюзия, «защищенная клыками») - боковая окклюзия (правая и левая), при которой на рабочей стороне в контакте клыки, а все остальные зубы как на рабочей, так и на балансирующей стороне - вне контакта (рис. 10-3).
-
Клыково-фронтальная функция - боковая окклюзия (правая и левая), при которой на рабочей стороне в контакте клыки и частично боковые резцы, а все остальные зубы как на рабочей, так и на балансирующей стороне - вне контакта (рис. 10-4).
-
Окклюзия «групповых» контактов - боковая окклюзия (правая и левая), при которой клыки, вестибулярные бугры одного или нескольких боковых зубов рабочей стороны имеют контакты в боковой окклюзии, а на балансирующей стороне - дезокклюзия зубов (рис. 10-5).
Эти три разновидности рабочих окклюзионных контактов соответствуют интактным зубным рядам взрослого и могут быть обозначены как «окклюзионная норма».
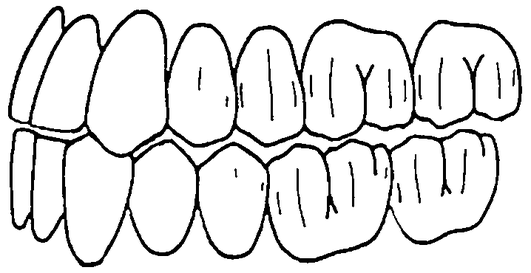
Рис. 10-3. Клыково-фронтальная функция с клыковым доминированием
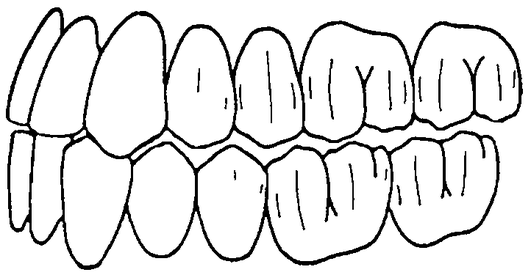
Рис. 10-4. Клыково-фронтальная функция
Рис. 10-5. Окклюзия «групповых» контактов
Сбалансированная окклюзия - при которой зубы при всех движениях челюсти имеют равномерный контакт как на рабочей, так и на балансирующей стороне. Такая окклюзия должна создаваться на съемных протезах при полном отсутствии зубов.
«Идеальная» окклюзия - имеет идеализированные характеристики, редко встречается, используется с целью сравнения с имеющимися отклонениями.
Неприемлемая окклюзия - имеет отклонения от «окклюзионной нормы» при наличии симптомов нарушенной функции и недостаточной адаптации зубо-челюстной системы, при этом обнаруживаются структурные и функциональные нарушения, может быть показано лечение.
Приемлемая окклюзия - при которой существуют отклонения от «окклюзионной нормы» (неправильно расположенные зубы, их стертость и др.), однако имеется адаптация зубочелюстной системы к этим отклонениям, нет дисфункциональных расстройств, окклюзия эстетически удовлетворяет больного и не требует лечения. Приемлемую окклюзию называют «адаптированной», «биологической», «органической».
Основные признаки приемлемой окклюзии:
-
отсутствие супраконтактов в центральной окклюзии, в центральном соотношении и на пути перехода из одного положения в другое;
-
отсутствие балансирующих контактов при боковых окклюзионных движениях нижней челюсти (в пределах окклюзионных контактов рабочей стороны, то есть при смещении нижней челюсти на половину ширины премоляра). Поскольку на рабочей стороне при жевании нижняя челюсть изгибается вниз, а на балансирующей - вверх, некоторые авторы для выявления балансирующих контактов предлагают в качестве нагрузки прикусывание в течение нескольких минут ватного валика на рабочей стороне (Mоtsch);
-
стабильная центральная окклюзия - скаты опорных бугров располагаются в фиссурах и краевых ямках противолежащих зубов;
-
в передней окклюзии контакт резцов, боковые зубы - вне контакта;
-
отсутствие фремитуса (функциональной мобильности) - движения зубов при их контакте с антагонистами. Фремитус возникает в тех случаях, когда ослаблены периодонтальные связки. Зачастую фремитус нельзя увидеть, но его можно почувствовать пальцем, когда зубы сомкнуты или когда они друг за друга цепляются при эксцентрических движениях нижней челюсти;
-
наличие расслабления (релаксации) жевательных мышц, позволяющее устанавливать нижнюю челюсть в любую окклюзию при незначительном или даже при полном отсутствии сопротивления со стороны пациента. Это свидетельствует о том, что жевательные мышцы функционируют без чрезмерных нагрузок со стороны окклюзии.
Проявления мышечно-суставной дисфункции
Для выявления симптомов мышечно-суставной дисфункции можно провести тест короткого предварительного обследования. Следует оценить признаки:
Результаты теста короткого предварительного обследования на наличие мышечно-суставной дисфункции:
Если выявлена мышечно-суставная дисфункция, то пациент нуждается в дальнейшем дополнительном обследовании мышц челюстно-лицевой области и височно-нижнечелюстного сустава.
Состояние твердых тканей зубов, качество реставраций и ортопедических конструкций
Обследуя твердые ткани зубов, при помощи зонда определяют наличие над- и поддесневых кариозных полостей, качество краевого прилегания пломб, воссоздание контактного пункта, нависающие края, качество и расположение десневого края реставрации относительно края десны. Проводят диагностику и дифференциальную диагностику некариозных поражений твердых тканей зубов: клиновидных дефектов, эрозии эмали, флюороза, гипоплазии, гиперплазии, пигментации зубов. Это необходимо для составления последовательного плана лечения и определения методов и средств лечения некариозных поражений. Так, лечение поражений, характеризующихся утратой или изменением цвета твердых тканей зуба, следует выполнять после купирования воспалительного процесса в пародонте. Определенную сложность представляет диагностика нёбно-десневой бороздки. Начинаясь в центральной ямке на нёбной поверхности латеральных резцов верхней челюсти в виде воронки, бороздка пересекает шейку зуба и распространяется по корню на различную длину (рис. 10-6, см. цв. вклейку).
Нёбно-десневая бороздка является ретенционным пунктом для налета, затрудняя индивидуальную гигиену полости рта. При зондировании вдоль нёбно-десневой бороздки может определяться глубокий узкий пародонтальный карман. Различные проявления гиперплазии эмали могут способствовать локализованным воспалительным процессам в пародонте. Эмалевая капля определяется как бугорок на поверхности зуба размером 1-4 мм. Локализация может быть различной: на коронковой части зуба, в области шейки или на поверхности корня. В первых двух случаях можно наблюдать несостоятельность индивидуальной гигиены в этой области. В случае расположения эмалевой капли на поверхности корня она может никак не проявляться. При шеечной эктопии определяют распространение эмали в виде клина ниже эмалево-цементной границы. Чаще всего шеечная эктопия проявляется на молярах нижней челюсти. Волокна периодонта, прикрепляясь к цементу корня, смещены в область бифуркации, на поверхности эмали существует только эпителиальное прикрепление, менее прочное, чем соединительнотканное, что может быть причиной раннего вовлечения фуркации в патологический процесс.
Оценивают прилегание коронки или пломбы, толщину и расположение края реставрации относительно края десны. Препарирование твердых тканей зуба следует проводить с созданием придесневого уступа, который должен располагаться на уровне маргинального отдела свободной десны или в пределах десневой борозды. Ниже подробно будут обоснованы требования к соотношению десневого края реставрации и маргинальной десны с точки зрения концепции биологической ширины.
Наличие имплантатов, состояние тканей вокруг имплантатов
Врачебная тактика подробно описана в гл. 26.
Подвижность зубов
Незначительная подвижность зубов считается нормальной и может варьировать в течение суток в зависимости от нагрузки. Физиологической считается подвижность зуба в альвеоле приблизительно на 0,1-0,2 мм в горизонтальной плоскости. Функциональную подвижность (фремитус-симптом) определяют в положении привычной окклюзии и при движении нижней челюсти, устанавливая кончик указательного пальца на каждый зуб по очереди. Для определения патологической подвижности используют нерабочие концы ручек инструментов для осмотра, например зеркала и зонда, которыми попеременно надавливают на вестибулярную и язычную поверхности коронки зуба (рис. 10-7, см. цв. вклейку).
Классификация Миллера в модификации Флезара включает следующие степени подвижности зубов:
-
I степень - подвижность зуба не более 1 мм в горизонтальной плоскости относительно вертикальной оси;
-
II степень - значительная подвижность зуба в горизонтальной плоскости (в вестибулооральном и медиодистальном направлении) более 1 мм, но без нарушения функции;
-
III степень - резко выраженная подвижность во всех направлениях (более 1 мм), легко определяемые вертикальные движения, нарушение функции.
Во время внутриротового осмотра важно распознать местные этиологические факторы, например неправильную технику чистки зубов, наличие зубных отложений, отсутствующие зубы, а также выявить у пациента парафункциональные привычки, такие как:
При бруксизме, скрежетании зубами определяется чрезмерная и/или неравномерная стираемость твердых тканей зубов.
ХАРАКТЕРИСТИКА АНАТОМО-ТОПОГРАФИЧЕСКИХ ОСОБЕННОСТЕЙ ТКАНЕЙ ПАРОДОНТА
Условием нормального функционирования любой системы организма является совершенство ее морфологических и функциональных взаимоотношений. В этой связи углубленное изучение анатомических параметров зубов и челюстей, определяющих стабильность функционирования зубочелюстной системы, представляет интерес как для объяснения механизмов возникновения заболеваний, так и в целях прогнозирования состояния пародонта. На данный момент значение некоторых факторов с этой точки зрения изучено хорошо.
Одной из причин деструкции тканей пародонта являются местные травматические факторы:
Состояние мягких тканей преддверия полости рта не только влияет на состояние пародонта, но и является главной причиной очаговых повреждений, чаще - обнажения корней зубов или стойко сохраняющегося воспаления. Требуется объективно охарактеризовать ширину прикрепленной десны во всех участках, глубину преддверия полости рта, уровень прикрепления уздечки губы (в основном нижней), языка и тяжей переходной складки, а также толщину прикрепленной десны. Толщина прикрепленной десны (обычно в совокупности со структурой подлежащей альвеолярной кости) позволяет прогнозировать вероятность рецессии десны (если речь идет о лицах молодого возраста) либо установить ее причину у взрослых и оценить возможность и целесообразность ее хирургического устранения.
Наибольшие дискуссии ведутся относительно глубины преддверия полости рта; по классификации Г.Ю. Пакалнса, мелким считается преддверие глубиной менее 5 мм, средним - от 5 до 10 мм, глубоким - более 10 мм. Измерение глубины преддверия проводится пародонтальным зондом. Измеряется расстояние от края десны до мукогингивальной линии (она является границей между прикрепленной десной и подвижной слизистой оболочкой) в области центрального резца нижней челюсти, то есть за глубину преддверия принимается сумма краевой и прикрепленной десны. Правильнее же оценивать по отдельности ширину как свободной, так и прикрепленной десны в области всех зубов.
Ширина свободной десны в норме в разных участках зубных рядов составляет примерно от 0,5 до 2,5 мм и является относительно постоянной величиной, а ширина прикрепленной десны зависит от формы альвеолярного отростка (альвеолярной части), вида прикуса и положения отдельных зубов. Прикрепленная десна переходит в подвижную слизистую оболочку переходной складки. В норме прикрепленная (альвеолярная) часть десны служит своеобразным буфером между мышцами губ и свободной десной. При недостаточной ширине прикрепленной десны напряжение губ и натяжение уздечки способствуют рецессии десны.
Исследованиями Е.А. Горбатовой показано, что большое значение в возникновении рецессии десны имеет не собственно ширина прикрепленной десны, а соотношение величин прикрепленной и свободной десны. При соотношении 1:1 количество пациентов с патологией пародонта составляет 90,5%, тогда как при соотношении 8:1 этот показатель снижается до 28,6%. В клинической практике необходимо ориентироваться на оптимальное соотношение 5:1.
При этом 5 мм - это минимальный размер, до которого, по мнению автора, следует расширять зону прикрепленной десны при проведении хирургических мани пуляций.
В зависимости от того, какие мягкотканные структуры изменены, определяются четкие поражения пародонта. Низкое прикрепление уздечки верхней губы,
высокое прикрепление уздечки нижней губы приводят к деструкции в области центральных резцов. Глубокое разрушение опорных структур пародонта с язычной стороны резцов является результатом короткой и высоко прикрепленной уздечки языка. Мелкое преддверие полости рта является причиной обнажения шеек фронтальной группы зубов нижней челюсти, включая премоляры, а зачастую - генерализованной рецессии. Тянущие тяжи слизистой оболочки переходных складок клинически проявляют свое действие в виде локализованных рецессий разной степени в участках их прикрепления.
Патогенетический механизм воздействия данных аномалий заключается в следующем. Отсутствие достаточной прикрепленной десны при мелком преддверии полости рта приводит к постоянной травматизации десны пищевым комком и задержке пищевых остатков. Во время артикуляции и жевания происходят однотипные субпороговые функциональные нагрузки, ведущие к нарушению кровоснабжения десны.
Воздействие на сосуды микроциркуляторного русла сопровождается изменением гидростатического давления в них и как следствие этого - появлением гемо- и лимфостаза, периваскулярного отека, диапедеза форменных элементов крови, агрегации эритроцитов и, наконец, тромбоза сосудов. При длительном действии перегрузки нарушаются процессы местного тканевого обмена, происходят набухание и деструкция коллагеновых волокон, снижается минерализация костных структур, что приводит к их резорбции.
В переднем отделе челюстей клыки имеют тонкий слой кортикальной кости. В подобных случаях внутрикостное кровоснабжение вестибулярных участков кости минимально или вообще отсутствует; кровоснабжение их в основном осуществляется за счет сосудов надкостницы.
Повреждение сосудов надкостницы может приводить к потере кортикальной пластинки кости. При этом образуется щелевидный (дигисценция) или окончатый (фенестрация) дефекты. В этих местах десна очень чувствительна к механическим повреждениям и микробным воздействиям.
Основными признаками возникающих нарушений являются анемия и подвижность краевой десны при отведении нижней или верхней губы, щек, языка.
При длительном воздействии травматических факторов отмечаются рецессия десны с обнажением шеек и корней зубов, расхождение зубов с образованием диастем и трем, формирование глубоких карманов. Рентгенологически определяется резорбция костной ткани альвеолярного отростка.
Существенное значение имеет определение биотипа десны. Его определяют, аккуратно поместив пародонтальный зонд в десневую борозду и оценивая прозрачность десневого края. Если кончик зонда просвечивает через маргинальную десну - биотип тонкий. Если же инструмент не виден из-за объемного десневого края - биотип толстый. Для визуальной оценки биотипа существуют специальные зонды Colorvue Biotype Probe (Hu-Friedy) (рис. 10-11).

Рис. 10-11. Зонды для определения биотипа десны Colorvue Biotype Probe
В наборе три зонда: с белым, зеленым и синим кончиками, которые поочередно помещают в десневую борозду. Если белый кончик виден сквозь маргинальные мягкие ткани, то биотип тонкий (рис. 10-12, а, см. цв. вклейку). Если же не виден, то используют зонд с зеленым наконечником. Если он просвечивает, значит, биотип средний (рис. 10-12, б, см. цв. вклейку), если нет - используют таким же образом зонд с синим кончиком. Если синий кончик виден сквозь ткани - биотип толстый (рис. 10-12, в, см. цв. вклейку), если же не виден - очень толстый.
ОЦЕНКА ОСНОВНЫХ ПОКАЗАТЕЛЕЙ ПАРОДОНТОЛОГИЧЕСКОГО СТАТУСА
Для оценки клинического состояния тканей пародонта проводят:
1. Определение гигиенического состояния полости рта
Одним из наиболее действенных способов мотивации пациента является окрашивание микробного налета индикаторами. Селективное окрашивание выполняют при помощи нетоксичных красителей, которые неспецифически реагируют с любым органическим субстратом (с матриксом бляшки, бактериальными клетками, пищевыми остатками). Различают стойкие красители (на основе эритрозинаρ, метилтиониния хлорида), применяемые в том случае, когда за мотивированием следуют гигиенические процедуры, и нестойкие (содержащие соединения йода), которые используют только для визуализации зубного налета (табл. 10-1).
Таблица 10-1. Цвет окрашивания зубов в зависимости от красителя
| Вид красителя | Цвет окрашивания |
|---|---|
Раствор Люголя♠ |
Желтовато-коричневый |
Раствор Шиллера-Писарева |
Желтовато-коричневый |
Водный раствор метилтиониния хлорида |
Голубовато-синий |
Таблетки Эритрозинаρ |
Грязно-красный |
Водный раствор Фуксина основного♠ |
Грязно-красный |
Дифференциальные красители окрашивают налет в разные цвета в зависимости от давности его образования. При окрашивании налета 0,75% раствором флуоресцеина натрия зубная бляшка при обычном освещении кажется желтой, а при синем или ультрафиолетовом освещении становится ярко-зеленого цвета.
Последовательность проведения диагностического окрашивания:
С практической точки зрения врач оценивает состояние гигиены полости рта пациента по двум категориям: удовлетворительное и неудовлетворительное. Более точную и объективную информацию получают, если перечисленные клинические проявления представлены в виде числовых характеристик или специальных индексов:
Гигиенический индекс Грина-Вермильона (Green J.C., Vermillion J.R., 1964) позволяет раздельно оценить количество зубного налета и зубного камня. Для определения индекса обследуют 6 зубов:
Оценка зубного налета проводится визуально или с помощью окрашивающих растворов (Фуксина основного♠, эритрозинаρ, Шиллера-Писарева) (рис. 10-13, см. цв. вклейку).
Коды и критерии для оценки зубного налета:
0 - зубной налет не определяется;
1 - налет покрывает не более 1/3 поверхности коронки зуба;
2 - налетом покрыто до 2/3 поверхности коронки зуба;
3 - налет покрывает более 2/3 поверхности коронки зуба.
После выявления зубного налета проводят оценку над- и поддесневого зубного камня с помощью стоматологического зонда.
Коды и критерии для оценки зубного камня:
0 - зубной камень не определяется;
1 - наддесневой зубной камень покрывает не более 1/3 поверхности зуба;
2 - наддесневой зубной камень покрывает более 1/3, но менее 2/3 поверхности зуба или имеются отдельные отложения поддесневого зубного камня в пришеечной области зуба;
3 - наддесневой зубной камень покрывает более 2/3 поверхности зуба или имеются значительные отложения поддесневого камня вокруг пришеечной области зуба.
Значения, полученные для каждого компонента индекса, складывают и делят на количество обследованных поверхностей, а затем суммируют оба значения. Формула для расчета:
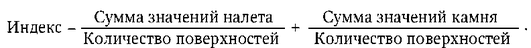
Оценочные критерии
-
Значения суммарного индекса: 0,0-1,2 - хорошая гигиена полости рта; 1,3-3,0 - удовлетворительная гигиена полости рта; 3,1-6,0 - плохая гигиена полости рта.
-
Значения показателей зубного налета или зубного камня: 0,0-0,6 - хорошая гигиена полости рта; 0,7-1,8 - удовлетворительная гигиена полости рта; 1,9-3,0 - плохая гигиена полости рта.
Индекс Силнес-Лое (Silness J., Löe H., 1962) основан на определении налета в придесневой области. Количество налета оценивают в области каждого зуба с помощью зонда, которым проводят вокруг шейки зуба, слегка вводя его в десне-вую бороздку (рис. 10-14, см. цв. вклейку).
Уровень гигиены оценивают по следующей шкале:
0 - на кончике зонда налета нет;
1 - на зонде небольшое количество налета;
2 - визуально определяется тонкий слой налета около шейки зуба, а его количество на зонде значительное;
3 - визуально в придесневой области определяется значительное количество налета и пищевых остатков.
Полученные оценки складывают и делят на количество обследуемых зубов.
Интердентальный гигиенический индекс HYG (Rateitchak E. et al., 1989). Этот индекс фиксирует межзубные поверхности, не имеющие зубных отложений.
Он позволяет выявить даже незначительный налет в области аппроксимальных поверхностей (рис. 10-15, см. цв. вклейку).
2. Определение интенсивности и распространенности воспалительной реакции
В основе клинически видимых явлений воспаления лежат морфологические изменения в тканях пародонта, которые подразделяются на 4 стадии (Page R.C., Schrоеder H.E., 1976) на основании динамики клеточного состава инфильтратов:
Стадия начального воспаления (доклиническая) по своей морфологической картине полностью соответствует острому васкулиту, видимых клинических признаков воспаления десны еще нет.
Фаза раннего воспаления клинически проявляется в виде незначительного воспаления краевой десны и кровоточивости десны при чистке зубов. Для стадии раннего воспаления характерно:
Третья стадия прогрессирующего воспалительного процесса - это фаза установившегося воспаления. Она протекает на фоне все усугубляющихся поражений сосудов краевого пародонта и нарушений кровотока.
Поэтому, кроме видимого воспаления, появляются отечность и цианоз десневого края - первый признак недостаточности венозного отдела и лимфатических образований, выпота в ткань и распада эритроцитов (рис. 10-16, см. цв. вклейку).
Фаза установившегося воспаления при морфологическом исследовании характеризуется преобладанием в клеточном инфильтрате плазматических клеток, которые отражают вовлечение иммунного ответа на повреждение. Подтверждением этого является присутствие в составе инфильтрата иммуноглобулинов и комплемента, которые как участвуют в защите от факторов повреждения, так одновременно и сами играют роль в разрушении тканей.
В стадию установившегося воспаления наблюдается картина смешанного инфильтрата: полиморфноядерных лейкоцитов (ПМЯЛ), мелких и средних лимфоцитов, крупных плазматических клеток. Это свидетельствует о том, что в тканях наблюдается одновременно картина и хронического, и острого воспаления.
Активизируются остеокласты, однако выраженных разрушений кости еще не происходит, поэтому при условии надежного устранения повреждающих агентов и ликвидации воспалительной реакции явления остеопороза исчезают.
Если лечебные меры воздействия на этих этапах не проводятся, то фаза установившегося воспаления переходит в IV фазу - прогрессирующего воспаления.
Ее главное отличие: плазматические клетки составляют до 80% всех клеток экссудата, что свидетельствует о хронизации воспаления и активном вовлечении иммунных механизмов воспаления.
Глубокие поражения претерпевают сосуды пародонта, его кровоснабжение нарушается. Прогрессирует разрушение коллагеновых тканевых элементов.
Основной источник кровоточивости десны - это многочисленные новообразованные капилляры в воспаленных тканях, которые обнажаются под участками изъязвленного эпителия. Поскольку стенки этих молодых капилляров очень слабые, легкопроницаемые, при давлении зондом или гладилкой либо даже под действием воздушной струи кровь выходит из них.
Механизм углубления пародонтального кармана заключается в апикальной пролиферации соединительного эпителия вдоль цемента корня с последующим отделением десны.
На стадиях гингивита есть возможность надежного полного удаления причинных микроорганизмов, то есть гарантированного предупреждения прогрессирова-ния воспаления.
Проникновение же микроорганизмов вглубь костных структур пародонта ограничивает эффективность механической обработки, в чем и состоит сложность лечения пародонтита.
Итак, локальные патологические механизмы заболеваний пародонта, запущенные бактериальной колонизацией, представляют собой цепь взаимоусиливающихся, взаимозависимых реакций, которые могут спровоцировать значительные деструктивные процессы. При этом деструкция способствует дальнейшему прогрессированию бактериальной колонизации и агрессии. Интенсивность этих реакций, весьма вариабельная у разных индивидуумов и в разных участках полости рта, определяет реальный прогноз поражений пародонта. Если она в достаточной степени ограничена, бактериальная агрессия будет подавлена и здоровье пародонта сохранено.
Определение степени поражения тканей пародонта - это задача, которую необходимо решить на первом этапе обследования.
Для этих целей разработано множество индексов, из которых в клинической практике наиболее часто применяют следующие.
Для оценки тяжести гингивита (а в последующем - и регистрации динамики процесса) используют папиллярно-маргинально-альвеолярный индекс РМА (Shour I., Massler M., 1947). Предложены различные модификации этого индекса, но на практике чаще используют индекс РМА в модификации С. Parma (1960).
Индекс РМА основан на учете воспаления в разных зонах десны. Применение этого индекса более обоснованно у детей, так как он разработан для диагностики гингивита. Однако этот индекс очень показателен и при пародонтите как один из составляющих, так как он отражает выраженность воспалительной реакции и позволяет оценить эффективность противовоспалительного лечения.
Оценивают состояние десны у каждого зуба после окрашивания ее раствором Шиллера-Писарева (рис. 10-17, см. цв. вклейку). При этом воспаленные участки десны приобретают коричневую окраску за счет присутствия гликогена при наличии воспаления.
Оценка индекса РМА проводится по следующим кодам и критериям:
0 - отсутствие воспаления;
1 - воспаление только десневого сосочка (Р);
2 - воспаление и маргинальной десны (М);
3 - воспаление и альвеолярной десны (А).
Индекс РМА рассчитывают по формуле:
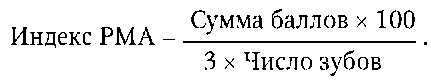
Количество учитываемых зубов (при сохранении целостности зубных рядов) варьирует в зависимости от возраста: 6-11 лет - 24 зуба; 12-14 лет - 28 зубов; 15 лет и старше - 30 зубов.
В норме индекс РМА равен 0. Чем больше цифровое значение индекса, тем выше интенсивность гингивита.
Индекс кровоточивости Мюллемана (Műhlemann H.R., 1971) в модификации Коуэлл (Cowell I., 1975) используют для оценки кровоточивости.
При этом состояние десен изучают в области «зубов Рамфьорда» с щечной и язычной (нёбной) поверхностей с помощью пуговчатого или специально затупленного зонда. Кончик зонда без давления прижимают к стенке бороздки и медленно проводят по медиальной и дистальной стороне зубов (рис. 10-18, см. цв. вклейку).
Интенсивность кровоточивости оценивают по следующей шкале:
0 - кровоточивость при зондировании отсутствует;
1 - кровоточивость появляется не раньше чем через 30 с;
2 - кровоточивость возникает или сразу после зондовой пробы, или в пределах 30 с;
3 - кровоточивость возникает при приеме пищи, чистке зубов или под действием воздушной струи пистолета.
Значение индекса рассчитывается как частное от деления суммы показателей на количество обследованных зубов.
Пародонтальный индекс Рассела (Russel A., 1956) предназначен для определения тяжести пародонтита.
Оценивают состояние пародонта в области всех зубов по следующей шкале:
0 - пародонт интактный;
1 - воспаление распространяется не на всю десну, а захватывает лишь ее часть;
2 - десна воспалена вокруг всего зуба, но кармана нет, зубодесневое соединение сохранено;
6 - воспаление всей десны, имеется пародонтальный карман, резорбция костной ткани на 1/3, но зуб устойчив, его функция не нарушена;
8 - наблюдается значительная деструкция всех тканей пародонта, резорбция костной ткани на 1/2, функция зуба нарушена, зуб подвижен. Обследуют весь зубной ряд (рис. 10-19, см. цв. вклейку).
Показателем индекса является кратное от деления суммы полученных значений на количество обследованных зубов.
Существенным недостатком этого индекса является очень большая величина интервала и как следствие - очень невысокая демонстративность его значения для общей оценки, особенно при очаговых формах поражения.
Показательность индекса Рассела возрастает в сочетании с индексом Сэндлер-Сталя (Sandler-Stahl, 1957), который позволяет оценить распространенность воспаления и/или деструкции. Индекс определяется соотношением количества зубов с пораженным пародонтом и количества имеющихся зубов, умноженным на 100%.
Коммунальный пародонтальный индекс (коллектив экспертов ВОЗ, 1982) разработан для оценки тяжести поражения тканей пародонта и определения усредненной потребности в специализированном пародонтологическом лечении значительного контингента обследованных, то есть этот индекс в первую очередь предназначен для эпидемиологических обследований, тогда как в клинической практике наиболее обоснованны вышеприведенные индексные оценки.
3. Измерение глубины зондирования патологических карманов
Одним из важных гистологических отличий гингивита от пародонтита является сохранение зубодесневого соединительнотканного прикрепления. Воспаление при гингивите характеризуется отеком и гиперемией десны. Увеличиваясь в размере, десна закрывает часть коронки зуба и образует ложный (десневой) карман. Глубина ложного кармана соответствует расстоянию от края десны до эмалево-цементного соединения.
Для маркировки дна ложного кармана (под анестезией) используют пинцет Крейна-Каплана с шипиком на конце одной бранши. При смыкании браншей после введения в карман гладкой бранши шипик прокалывает десну снаружи, оставляя кровоточащие точки, которые являются ориентиром для разреза при гингивэктомии.
При пародонтите происходит потеря прикрепления, миграция соединительного эпителия в апикальном направлении, его трансформация в эпителий пародонтального кармана.
Метод измерения глубины пародонтальных карманов, запись и интерпретация результатов зондирования. Расстояние от десневого края до наиболее глубокой точки кармана (до кончика зонда) называется глубиной пародонтального кармана (рис. 10-20, см. цв. вклейку).
Пародонтальный зонд удерживают в руке подобно ручке для письма. Стоматологическое зеркало удерживают в другой руке и отодвигают им щеку или язык для лучшей визуализации обследуемой области. Рабочую часть зонда располагают параллельно поверхности корня, кончик находится на поверхности твердых тканей зуба, и аккуратно продвигают в пародонтальный карман до сопротивления. Рекомендуемое давление на инструмент при зондировании составляет 20-25 г, его иногда сравнивают с давлением на простой карандаш при письме. Можно проверить силу давления, зондируя ногтевое ложе. При достаточном усилии зондирование безболезненное.
Пародонтальный зонд шагающими движениями проводят вдоль поверхности зуба, измеряя глубину пространства между десной и зубом в шести точках вокруг каждого зуба:
Все 6 цифр фиксируют в пародонтограмме напротив соответствующего зуба (рис. 10-21).
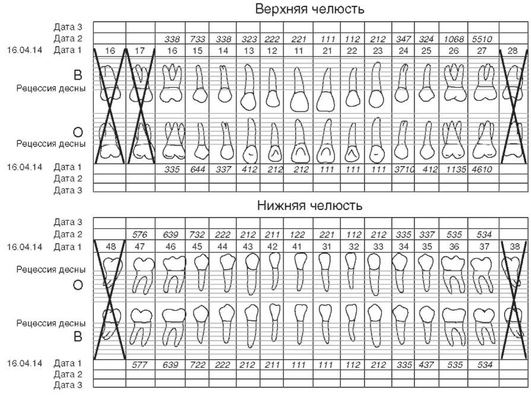
Рис. 10-21. Пародонтограмма
Для измерения глубины карманов можно использовать зонды с различной маркировкой. С целью выявления даже незначительных изменений глубины кармана рекомендуется применять зонды с обозначением каждого миллиметра.
ВАЖНО! Результаты зондирования могут быть искажены в следующих случаях:
-
кончик зонда упирается в поддесневой зубной камень, неровности корня, что препятствует его движению. При этом измеренная глубина кармана будет меньше его истинной глубины;
-
кончик зонда свободно расположен в пародонтальном кармане, находится не в контакте с поверхностью корня зуба. В таком случае можно «пропустить» узкие, глубокие костные карманы, так как зонд будет касаться вершины костного края.
4. Выявление наличия рецессии десны, определение класса рецессии
Рецессия десны может быть локализованной (затрагивающей менее 30% зубов) (рис. 10-22, см. цв. вклейку) и генерализованной (рис. 10-23, см. цв. вклейку).
Для оценки возможностей хирургического лечения и благоприятного прогноза закрытия рецессии необходимо учитывать объем окружающих тканей, от которых зависит питание лоскута, а также величину рецессии межзубных сосочков.
Классификация по P.D. Miller (1985) ориентирована на выбор метода лечения рецессии десны с одновременным прогнозом результата лечения.
-
Класс I. Рецессия в пределах прикрепленной десны, не выходящая за слизисто-десневое соединение. Потеря десны и/или кости в межзубных промежутках отсутствует.
-
Класс II. Рецессия, распространяющаяся за линию слизисто-десневого соединения. Потеря десны и/или кости в межзубных промежутках отсутствует.
-
Класс III. Рецессия I или II класса сочетается с поражением аппроксимальных поверхностей.
-
Класс IV. Потеря десны и кости в межзубных промежутках (один или оба межзубных сосочка находятся на уровне десны), циркулярная рецессия.
В пародонтограмме точками отмечают значения вертикального измерения рецессии десны, которые затем соединяют непрерывной линией.
5. Определение уровня клинического прикрепления
Величина клинического прикрепления - это расстояние от эмалево-цементного соединения до дна кармана, измеряется в миллиметрах.
Определение убыли клинического прикрепления обладает большей точностью и соответственно большей диагностической ценностью по сравнению с определением глубины пародонтальных карманов. Измеряют расстояние от эмалево-цементного соединения до кончика зонда, то есть от уровня, где в норме должно находиться соединительнотканное прикрепление, до дна пародонтального кармана в наиболее глубокой точке (рис. 10-24, см. цв. вклейку).
При зондировании кончик инструмента может проникать в десневую борозду или в пародонтальный карман на различную глубину в зависимости от интенсивности воспаления тканей (их сопротивляемости при зондировании). Эпителиальное прикрепление менее прочное по сравнению с соединительнотканным, поэтому может быть перфорировано при зондировании. Для предотвращения этого пародонтальные зонды-проубы оснащены закругленным кончиком. Однако при воспалении даже при минимальном давлении кончик инструмента легко проникает сквозь эпителий и соединительную ткань.
6. Определение степени поражения фуркаций
Для определения степени вовлечения фуркации в патологический процесс используют специальный закругленный градуированный фуркационный зонд (Nabers) или обычный пародонтальный зонд (рис. 10-25, см. цв. вклейку).
Классификации фуркационных дефектов
-
Классификация Гликмана (Glickman, 1958), основанная на анализе горизонтальной потери межкорневой кости:
-
I класс - скрытый развивающийся процесс в желобке фуркации с вовлечением надкостницы без потери кости (или потеря кости в пределах надкостницы);
-
II класс - поражение кости без возможности проведения зонда насквозь (несквозная потеря кости);
-
IV класс - сквозная потеря кости с полным обнажением фуркации вследствие рецессии десны.
-
-
Классификация Линде (J. Lindhe, 1983), основанная на анализе горизонтальной потери интеррадикулярной кости:
-
I класс - деструкция межкорневой перегородки на 1/3 ее поперечного сечения или меньше;
-
II класс - деструкция межкорневой перегородки превышает 1/3 ее поперечного сечения, но не образует сквозного дефекта;
-
III класс - деструкция межкорневой кости в горизонтальном направлении с формированием сквозного дефекта.
-
-
Классификация Хампта (Hempt и соавт.), основанная на горизонтальной потере кости:
-
Классификация Тарноу-Флетчер (Tarnow О., Fletcher P., 1984), основанная на анализе вертикальной утраты костной ткани в области фуркации:
На рентгенологических снимках представлены классы фуркационных дефектов по Тарноу-Флетчер (рис. 10-26, 10-27).
Величину костной деструкции измеряют от эмалево-цементной границы до дна пародонтального кармана как с помощью зондирования, так и по данным рентгенографии - с достаточно приблизительной точностью. Истинную же величину костной деструкции, которая зачастую отличается от величины, определяемой методом зондирования, можно оценить только во время хирургических вмешательств на пародонте, после откидывания слизисто-надкостничного лоскута.
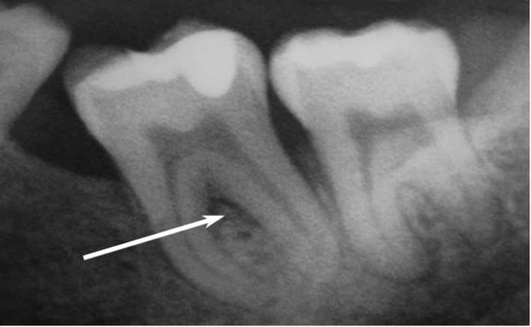
Рис. 10-26. Фуркационный дефект I класса
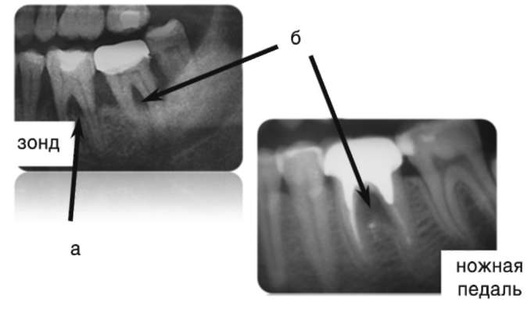
Рис. 10-27. Фуркационные дефекты: а - II класса; б - III класса
Для оценки состояния костной ткани альвеолярных отростков используют костный показатель Фукса (Fuchs M., 1954). Индекс Фукса позволяет судить об убыли костной ткани относительно длины корня. Оценку состояния кости проводят с помощью интерпроксимальных рентгенограмм. Корень зуба условно делят на три части, уровень костной деструкции оценивают относительно этих частей по 4-балльной системе:
-
4 - признаки резорбции альвеолярной кости отсутствуют или зуб удален по поводу осложненного кариеса;
-
0 - зуб вне кости или отсутствует из-за патологии пародонта. Подсчитывают сумму показателей для всех зубов или исследуемого участка и делят на число, которое должно соответствовать здоровому пародонту в области исследуемых зубов (количество зубов, умноженное на 4). Полученный показатель представляет собой дробное число между 0 и 1. Вычисление индекса проводят по формуле:
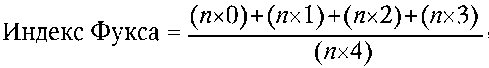
где n - число зубов с соответствующей степенью деструкции (0, 1, 2, 3, 4).
Таким образом, значение индекса Фукса равно 0, когда резорбция костной ткани доходит до верхушки корней; 0,25 - резорбция костной ткани на 2/3 длины корня; 0,5 - резорбция костной ткани на 1/2 длины корня; 0,75 - резорбция костной ткани на 1/3 длины корня; 1 - нормальное состояние костной ткани.
Оценку костных карманов проводят по классификации Гольдмана-Коэна (Goldman-Cohen, 1980) только в ходе хирургических вмешательств вследствие несовершенства рентгенологических методик из-за эффекта наслоения костных теней. Выделяют три типа дефектов:
7. Определение количества и характера экссудата пародонтального кармана
Патологический воспалительный процесс возникает и впоследствии трансформируется в зубодесневой бороздке. Именно в этом малом пространстве постоянно идут сложные процессы защиты внутренних структур пародонта от микробных и токсических воздействий.
При появлении в придесневой области повреждающих агентов через высокопроницаемые стенки сосудов, расположенных под эпителием зубодесневой бороздки, выходит жидкая часть крови, а также клеточные, гуморальные и ферментные компоненты защиты, по составу во многом напоминающие состав плазмы крови. Это и есть десневая жидкость.
Десневая жидкость - это результат инвазии повреждающих агентов и защиты против них. Даже при клинически нормальном состоянии пародонта в десневой бороздке постоянно происходит и микробная атака, и воспалительная - различной интенсивности - реакция на нее.
В норме десневая жидкость вырабатывается в незначительных количествах, однако при воспалительных явлениях ее объем резко увеличивается вследствие нарастания внутритканевого (интерстициального) давления и повышения проницаемости сосудов в собственной пластинке.
На стадиях развившегося воспалительно-деструктивного процесса определяется уже не десневая жидкость, а раневой экссудат, который может быть серозным, серозно-гнойным или гнойным.
Важное диагностическое значение имеет количественный и качественный состав клеточных элементов в жидкости десневой борозды, который указывает на характер и активность воспалительного процесса. Наиболее типичными клетками в этой жидкости в норме являются нейтрофильные гранулоциты и моноциты. При хронических воспалительных заболеваниях в жидкости десневой борозды содержатся гранулоциты, главным образом нейтрофилы (70-80%), моноциты/ макрофаги (10-20%), тучные клетки (5%) и Т-лимфоциты (5%), в то время как В-лимфоциты обычно не обнаруживаются.
В настоящее время разработаны специальные диагностические полоски-стрипы для забора десневой жидкости. Стандартизованная процедура отбора проб (около 30 с экспозиции стрипов в десневых карманах) обеспечивает относительно воспроизводимые результаты их биохимического анализа.
Кроме того, появились и коммерческие диагностические системы для выявления отдельных компонентов десневой жидкости, абсорбированной стрипами (Periocheck Enzymatic System, Prognostik System, Periograd). Анализ содержания метаболитов липидного метаболизма и цитокинов может быть надежно осуществлен иммунохимическим анализом, в частности микрометодами ELISА; для ряда продуктов деградации соединительнотканного матрикса используются хроматография и гель-электрофорез. Этот набор методов непрерывно совершенствуется, что способствует их внедрению в пародонтологическую практику.
Анализ десневой жидкости открывает широкие диагностические и прогностические возможности при заболеваниях пародонта. Контроль отдельных факторов десневой жидкости может применяться также для оценки эффективности лечения.
Однако на сегодня данные исследования используются сугубо в научных целях. Практики же ограничиваются констатацией количества и качества экссудата как при характеристике клинического исходного состояния пародонта, так и его динамики в ходе лечения.
Обследование с помощью традиционных методов не всегда позволяет получить полные и точные данные, а на ранних стадиях заболевания, когда видимых симптомов еще не наблюдается, многие из пациентов не соглашаются на проведение некомфортной процедуры пародонтологической диагностики.
С появлением на российском рынке высокотехнологичных диагностических систем отечественная стоматология за последнее время сделала большой скачок вперед, вплотную приблизившись к мировым стандартам. Стоматологи сейчас имеют возможность работать на современных установках, используют последние разработки мировых производителей, постоянно внедряют новые достижения в свою практику.
Автоматизированный метод диагностики воспалительных заболеваний пародонта
Компьютерные технологии позволяют на качественно новом уровне проводить раннюю диагностику заболеваний пародонта с точностью измерения деструктивных поражений до 0,2 мм, что в 10 раз точнее мануальных измерений. Лучшей на сегодняшний день компьютерной технологией ранней диагностики заболеваний тканей пародонта считается автоматизированная система «Флорида Проуб» (Florida Probe).
Аппаратно-программный комплекс «Флорида Проуб» был разработан в 1988 г. специалистами университета Гейнсвилл, штат Флорида (США). Это управляемая компьютером система для проведения полной клинической диагностики и анализа заболеваний тканей пародонта (рис. 10-27). Данная система прошла всю необходимую процедуру регистрации и сертификации в России, апробирована и с успехом применяется в стоматологических клиниках.
Электронная измерительная система «Флорида Проуб» имеет титановый зонд с подвижной муфтой диаметром 0,5 мм (рис. 10-28), который обеспечивает плавность зондирования, постоянное давление зондирования 20 г/см2 и воспроизводимость результатов с точностью до 0,2 мм. Также имеются одноразовые диагностические зонды (рис. 10-29, см. цв. вклейку).
Затем проводят обследование пациента с регистрацией данных. При измерении глубины кармана зонд вертикально вводят в пародонтальный карман, край трубки при этом находится на уровне маргинальной десны. Кончик титанового зонда перемещается внутри трубки, а край трубки является точкой отсчета.
Важной особенностью системы является то, что зонд управляется не рукой врача, а компьютерной системой, что значительно повышает комфортность и точность зондирования. Измерения производятся автоматически и фиксируются цифровым индикатором. При помощи педали ножного переключателя результаты измерений автоматически заносятся в компьютер.
«Флорида Проуб» позволяет регистрировать следующие клинические параметры:
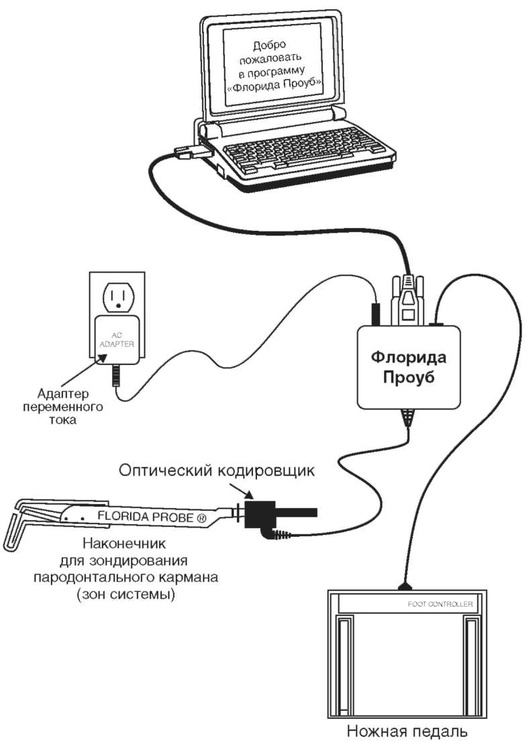
Рис. 10-27. Схема устройства системы «Флорида Проуб»
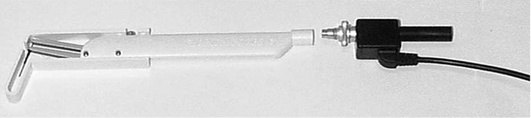
Рис. 10-28. Диагностический зонд системы «Флорида Проуб»
Обследование пациента с использованием системы «Флорида Проуб» начинают с заполнения персональной странички. В ней указывают данные пациента, вводят внутриротовые фотографии и заполняют графы индивидуальных заметок. Внутриротовые фотографии вводят в базу данных через цифровой фотоаппарат.
Полученная информация выдается на монитор, в печатном варианте в виде графической пародонтальной карты (рис. 10-30, см. цв. вклейку) и в звуковом сопровождении.
Следует сказать, что звуковое сопровождение при обследовании является очень мощным мотивационным фактором в силу именно автоматической беспристрастности, что заставляет пациента значительно серьезнее оценить состояние своего стоматологического здоровья. Пародонтальная карта очень информативна для врача и пациента. В ней использованы основные цветовые клинические коды. Здесь же дается их расшифровка. Пациент без труда может сам разобраться в представленной информации. Таблицы выдаются на руки пациенту, что способствует более глубокому осознанию своей проблемы. При повторном обследовании у пациента появляется возможность сравнить свои пародонтальные карты и сделать выводы об успешности лечения.
Важным показателем автоматизированных систем, подобных «Флорида Проуб», является относительная простота их использования. Сама процедура обследования не вызывает никакого дискомфорта и болевых ощущений у пациентов.
Исследования состояния пародонта с помощью системы «Флорида Проуб» показали высокую степень точности и воспроизводимости результатов измерения глубины десневого кармана и уровня прикрепления со стандартными отклонениями повторных замеров от 0,2 до 0,3 мм. Эти отклонения значительно меньше тех, которые возникают при использовании ручных зондов, - от 0,5 до 1,3 мм. Кроме того, при использовании «Флорида Проуб» затрачивается значительно меньше времени. Компьютерная фиксация результатов обследования сокращает его длительность до 15-20 мин (Magnusson I. еt al., 1998; Олесова В.Н., Кузьминых О.М., 2004).
Периодонтальный тест
Данный тест проводят c помощью прибора «Периотест», определяют динамическую подвижность зубов, а также оценивают устойчивость внутрикостных имплантатов.
Динамической подвижностью называют способность пародонта амортизировать импульсные воздействия направленных на зуб внешних сил.
Физический принцип работы «Периотеста» - генерация механического ударного импульса и передача его для анализа функционального состояния тканей пародонта или тканей вокруг имплантата. Прибор состоит из двух частей: приборного блока компьютерного анализа и наконечника, соединенных между собой кабелем. Рабочий элемент прибора - боек (пестик), включает пьезоэлемент, который работает в двух режимах (генераторном и поемном).
Методика измерения: наконечник устанавливают горизонтально и под прямым углом к середине вестибулярной поверхности коронки исследуемого зуба или формирователя десны. Далее проводят заложенное в программе автоматическое перкутирование зуба или формирователя десны 16 раз (4 с со скоростью 4 в секунду). Удар бойком проводят через промежутки 25 мс. За этот период возбужденный ударом импульс проходит по зубу или по имплантату, передается тканям, их окружающим, и отражается от них.
Результаты измерения получают в звуковом виде и в виде цифрового индекса на дисплее. В зависимости от состояния тканей пародонта (степени атрофии костной ткани) или тканей, окружающих имплантат, степени остеоинтеграции имплантата сигнал существенно меняется.
Наиболее распространенный критерий оценки подвижности зуба - индекс Миллера. Существует статистически значимая связь между величиной периотеста и индексом подвижности зубов по Миллеру (табл. 10-2).
Таблица 10-2. Связь между величиной периотеста и индексом подвижности зубов
| Шкала Миллера | Степень подвижности | Уровень величин периотеста (условные единицы) |
|---|---|---|
0 |
Клинически устойчивые зубы |
-8…+9 |
I |
Ощутимая подвижность |
+10?+19 |
II |
Видимая подвижность |
+20?+29 |
III |
Подвижность при надавливании языком или губами |
+30?+50 |
РЕНТГЕНОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Последним компонентом первичного клинического обследования пациента с заболеваниями пародонта является рентгенологическое исследование, которое позволяет уточнить клиническую ситуацию и выбрать правильную тактику при планировании лечения.
Все известные рентгенологические методы, применяемые в стоматологии, можно расположить в порядке убывания диагностической ценности для исследования тканей пародонта следующим образом.
Необходимо помнить, что для качественной и количественной оценки снижения минерализации губчатой и компактной костной ткани пародонта информативно применение рентгеновской компьютерной томографии с гистографическим анализом.
Гистографический анализ проводят при помощи программно обеспеченной функции Evaluate region of interest, которую поддерживают, в частности, такие компьютерные томографы, как «Соматом Плюс 4» и «Соматом АР Стар», имеющие шкалу рентгеновской плотности от -1024 до +3071 ед. Х.
Оценка гистограмм (рис. 10-31, см. цв. вклейку) проводится на основе изучения профиля гистограммы и колебаний рентгеновской плотности - минимальной (Пmin), средне-арифметической (Пса), максимальной (Пmax) и стандартного отклонения (СО). Рассчитывают также коэффициент гетерогенности Кг = Пmax : Пmin
Рентгеновская плотность костных структур пародонта у здоровых лиц в области компактной кости варьирует от 1399 (Пmin) до 2281 (Пmax), среднее значение (Пса) составляет 1755±166; в области губчатой кости - от 5 до 594, в среднем 189±121 (Колотилов Н.Н. и др., 2006).
При пародонтите происходит изменение количественных показателей гистограммы: резкое снижение Пmin; увеличение Кг; сдвиг гистограммы в область низкой плотности и в область отрицательных значений.
Подводя итоги сказанного, можно заключить, что клиническое обследование больных с заболеваниями пародонта, особенно при достаточной квалификации стоматолога и наличии соответствующих технических средств, является первоочередным и незаменимым компонентом диагностического процесса при заболеваниях пародонта.
Современные методы лучевой диагностики подробно описаны в гл. 13.
ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Методы лабораторной диагностики воспалительных заболевания тканей пародонта можно систематизировать на:
Микробиологические методы исследования
В настоящее время доказано, что главную роль в развитии ВЗП играет бактериальная флора зубного налета или биопленка, которая является первичным фактором, вызывающим повреждение пародонта.
Данные литературы позволяют утверждать, что при ВЗП как для диагностики, так и для выбора адекватного этиопатогенетического лечения высокую практическую значимость имеют микробиологические исследования: изучение состава микрофлоры и ее чувствительности к антибактериальным препаратам.
При определении состава микрофлоры полости рта в настоящее время применяется целый ряд классических методов. Так, для изучения качественного состава микрофлоры проводят идентификацию микроколоний и/или микробных тел при микроскопии. Количественную оценку микрофлоры проводят путем посева на селективные и неселективные среды с последующим подсчетом колоний микроорганизмов. При выборе метода лечения проводят оценку чувствительности микрофлоры к лекарственным препаратам.
Вместе с тем за последние полтора столетия были разработаны и внедрены в лабораторную практику новые, высокочувствительные методы изучения микрофлоры: проточная цитометрия, серологические исследования, анализ белков, сравнение ДНК-последовательностей и др. Однако многие из этих методов требуют приготовления бактериальных культур, что радикально удлиняет время анализа (например, проточная цитометрия), к тому же после культивирования невозможно определить начальную концентрацию микроорганизма в образце, соотношение погибших и живых клеток. Биохимические методы, основанные на определении специфических для каждого типа клеток соединений (ферментов, витаминов, кислот и пр.), также нельзя считать стопроцентно пригодными для идентификации, поскольку многие микроорганизмы имеют сходные характеристики (Desai et al., 2003).
Сравнительно недавно для идентификации бактерий стали использовать масс-спектроскопию. Масс-спектрометр сортирует молекулы клетки по соотношению молекулярная масса / заряд и составляет характеристические наборы значений для каждого типа клеток (Jarman et al., 2000). Этот метод также ограниченно годен для диагностики, поскольку клетки разных видов микроорганизмов часто обладают очень сходными молекулами, а количество этих молекул может сильно варьировать на разных стадиях клеточного цикла (Desai et al., 2003).
Высокоспецифичными методами определения микробных антигенов являются иммуноблоттинг и полимеразная цепная реакция (ПЦР), но и они имеют свои недостатки.
Таким образом, существует множество диагностических методов, позволяющих определять качественный и количественный состав бактериальной микрофлоры полости рта. На стоматологическом рынке представлен целый ряд современных диагностических систем, что способствовало более широкому внедрению микробиологических методов в стоматологическую практику.
МЕТОДЫ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ
Микроскопирование. Изучение качественного состава микроорганизмов в зубном налете, содержимом зубодесневых борозд и пародонтальных карманов проводят с помощью микроскопии в темном поле или фазово-контрастной микроскопии (рис. 10-32) по М.О. Биргеру (1982).

Рис. 10-32. Микроскоп БИОЛАРМ Р-15 с насадкой для фазового контраста
При исследовании методом фазовоконтрастной микроскопии определяют процентное содержание пяти морфологических форм микроорганизмов (кокки, неподвижные палочки, подвижные палочки, извитые формы, филаменты). Предполагается при этом, что отсутствие поражений пародонта сочетается в основном с кокковой флорой и низким количеством подвижных бактерий, а при заболеваниях пародонта преобладают палочки, спирохеты и подвижные бактерии.
Для количественной оценки рассчитывают коэффициент устойчивости микроорганизмов как соотношение неподвижных и подвижных форм микроорганизмов. В норме коэффициент устойчивости равен 3,4. При заболеваниях пародонта он может снижаться до значений 0,7-0,8. Поэтому динамика этого показателя в определенной мере позволяет оценить эффективность избранной лечебной тактики и своевременно ее изменить. Однако далеко не всегда этот показатель коррелирует с выраженным улучшением клинического состояния. Следовательно, этот метод необходимо оценивать достаточно сдержанно.
Культивирование. Со времен Коха и Пастера культивирование было основным методом выделения и изучения свойств микроорганизмов. Современные знания лишь представляют более полный спектр микроорганизмов биопленки (Nair, 2004).
Одним из часто применяющихся в клинической практике культуральных микробиологических методов является метод секторных посевов по Голду (Gold J, 1965).
Для определения количественного состава микроорганизмов методом секторных посевов материал собирают посредством стерильного стандартного диска диаметром 6 мм, изготовленного из целлофановой пленки толщиной 40 мкм.
Диск вводят в пародонтальный карман пуговчатым зондом так, чтобы он был согнут пополам. Оставляют на 1 мин для заполнения пространства между согнутыми краями диска содержимым пародонтального кармана, после чего диск извлекают пинцетом и помещают в пробирку с фосфатным буфером. Количественный состав микроорганизмов оценивают по числу микроколоний на единицу площади диска.
Метод полуколичественной оценки роста аэробной и анаэробной флоры
разработан для культивирования факультативных аэробных и анаэробных микроорганизмов. Материал для микробиологического исследования забирают целлофановым диском и помещают его в пробирки с питательной средой для контроля стерильности, обогащенной пептоном, с добавками твина и гемина (производства г. Оболенск Московской обл.). Создание анаэробных условий обеспечивается содержанием в составе среды тиогликолята натрия.
Образование колоний после инкубации на поверхности питательной среды и в глубину до 1 см оценивают как рост аэробной флоры, а формирование колоний в более глубоких слоях питательной среды - как рост факультативных анаэробных микроорганизмов.
Для выявления дисбиотических сдвигов в полости рта проводят исследование микрофлоры на дисбактериоз по критериям В.В. Хазановой (1996):
Для дисбиотического сдвига характерны незначительные изменения: повышение количества одного какого-либо вида условно-патогенного микроорганизма в 10 раз и более при сохранении нормального видового состава микрофлоры полости рта. Эта форма сдвига протекает обычно латентно или компенсированно, без выраженных клинических признаков заболевания.
Дисбактериоз I-II степени (субкомпенсированная форма) характеризуется более выраженными изменениями состава микрофлоры, когда выявляются 2-3 патогенных вида на фоне снижения титра негемолитического стрептококка или лактобактерий.
Увеличение уровня патогенной монокультуры при резком снижении количества или полном отсутствии основных представителей нормальной микрофлоры (негемолитический стрептококк и лактобактерии) расценивается как дисбактериоз III степени.
Наличие ассоциации патогенных видов бактерий с дрожжеподобными грибами рода Candida характеризуется как IV степень дисбактериоза.
Хотя такое деление весьма условно, тем не менее оно позволяет составить наиболее адекватные схемы индивидуальной терапии.
Материал для исследования забирают натощак без предварительной чистки зубов: пациент тщательно полощет полость рта стерильным изотоническим раствором натрия хлорида (10 мл), полученную смывную жидкость используют для приготовления разведений и прямого посева на дифференциально-диагностические среды - кровяной и желточно-солевой агары, среды Эндо и Сабуро и специальную среду для выделения лактобактерий. Рост факультативных микроорганизмов учитывают после инкубации с последующей идентификацией по общепринятой методике.
Микробиологические исследования свидетельствуют о том, что у пациентов с пародонтитом легкой степени выявляются изменения микрофлоры полости рта в виде так называемого дисбиотического сдвига. У больных со средней степенью пародонтита дисбиотический сдвиг наблюдается в 67% случаев, в то время как у 33% больных отмечается дисбактериоз I-II степени. Наиболее выраженные нарушения микробиоценоза полости рта обнаружены у пациентов с тяжелой степенью пародонтита, у которых дисбактериоз I-II степени выявлен в 100% случаев (Фоменко Е.В., 2004).
Для практикующих специалистов наиболее важно определение чувствительности микроорганизмов к антибиотикам. Для этой цели используют два метода: диско-диффузионный и метод разведений антибиотика в плотной или жидкой питательной среде.
Методика С.М. Навашина (1982) заключается в определении чувствительности выделенной микрофлоры к антибиотикам путем диффузии в агар с помощью бумажных дисков, пропитанных антибиотиками.
Чувствительность микроорганизмов к антибиотикам определяют по диаметру окружности свободной от колоний зоны вокруг диска, которая свидетельствует о задержке роста микрофлоры: «чувствительный», «среднечувствительный», «устойчивый».
Критерии определения чувствительности микроорганизмов к антибиотикам представлены в табл. 10-3.
Таблица 10-3. Критерии определения чувствительности микроорганизмов к антибиотикам
Антибиотики |
Диаметр зон задержки роста бактерий, мм |
||
устойчивые |
среднеустойчивые |
чувствительные |
|
Цефалексин♠ |
<11 |
12-16 |
>17 |
Доксициклин♠ |
<12 |
13-19 |
>20 |
Эритромицин♠ |
<14 |
15-18 |
>19 |
Линкомицин♠ |
<19 |
20-23 |
>24 |
Необходимо отметить, что примерно 50-60% микрофлоры, вегетирующей в тканях пародонта, относится к труднокультивируемым видам микроорганизмов. Некоторые виды микробов не формируют видимых глазом колоний (Roszak, Colwell, 1987; Staley, Konopka, 1985). Следовательно, они не могут быть получены в виде чистой культуры и могут быть охарактеризованы только косвенно.
Целый ряд микробиологических методов на сегодня имеет в большей мере теоретический интерес, поэтому мы ограничимся лишь краткой их характеристикой.
БИОХИМИЧЕСКИЕ МЕТОДЫ ИДЕНТИФИКАЦИИ
С появлением в 1964 г. на рынке бумажных полосок с PathoTec реагентами фирмы General Diagnostics Division of Warner-Chikott Laboratories, которые позволяли выявить некоторые специфические ферменты, синтезируемые клинически значимыми бактериями (лизин- и орнитиндекарбоксилазу, уреазу, индол и т.д.), было положено начало коммерческим системам идентификации, ручным и автоматизированным, с помощью которых можно было корректно идентифицировать микроорганизмы (Mann, Gandelman, 1965).
Все коммерческие биохимические системы идентификации основаны на выявлении пяти основных свойств:
Изменение рН среды происходит из-за жизнедеятельности бактерий (при утилизации преимущественно углеводов накапливаются кислоты, белков - соединения с щелочной реакцией) и выявляется по изменению цвета красителя. Изменение цвета в этих системах является следствием гидролиза или обесцвечивания комплекса соответствующего фермента с хромогеном либо флюорогеном.
Четвертый метод - простое визуальное определение роста выделенного микроорганизма в присутствии субстрата: размножающиеся клетки вызывают помутнение среды в ячейке. Эта реакция также длительная и требует не менее 10 ч (O’Hara, 2005).
Пятый метод идентификации - хроматография конечных продуктов метаболизма жирных кислот - отличается большей информативностью и меньшим временем анализа по сравнению с остальными методами. Недостатком данного метода является невозможность идентифицировать роды и виды микроорганизмов.
Проточная цитометрия позволяет не только выявлять инфицирование микроорганизмами, но и определять спектр их чувствительности, причем длительность исследования не превышает нескольких часов. Подвергнутые воздействию антибиотиков (in vivo или in vitro) микроорганизмы сравнивают с контрольными образцами того же штамма для установления их жизнеспособности, а также изменений в нуклеиновых кислотах, белках, оболочке клеток и т.п., что позволяет оценить как степень эффекта антибиотика, так и точку приложения его действия.
Тем не менее вопрос стандартизации метода и адекватной интерпретации его результатов остается актуальным до сих пор (Davey, 2002).
Метод капиллярного электрофореза основан на разделении одиночных клеток в электрическом поле в соответствии с их поверхностным зарядом.
Клеточная стенка грамотрицательных микробов состоит из трех слоев: бислой липидов, тонкий слой пептидогликанов, внешний двойной слой, покрытый липополисахаридами. Последние и формируют заряд грамотрицательных микроорганизмов. Грамположительные микробы имеют на поверхности толстый слой пептидогликанов, в составе которого преобладает тейхоевая кислота, способствующая формированию на мембране отрицательного электрического заряда (Garrett, Grisham, 1999). Вирусы имеют внешний белковый слой на мембране. Остатки аминокислот также способны заряжаться. Мембраны и клеточная стенка грибов содержат белки и липидные молекулы, придающие им характеристический заряд.
Капиллярный электрофорез - быстрый, с высокой разрешающей способностью метод с минимальной подготовкой образца (Desai, Armstrong, 2003).
Иммунохимические методы анализа основаны на специфическом связывании определяемого соединения соответствующими антителами. К антителу прикрепляется метка, которая обнаруживает себя при образовании комплекса антиген-антитело. В качестве метки могут быть использованы ферменты, которые осуществляют либо цветную реакцию (иммуноферментный анализ), либо флуоресцентное свечение (иммунофлуоресценция).
Таким образом, иммунохимические методы выявляют не возбудителя заболевания, а молекулы, сопутствующие ему, следовательно, они являются непрямыми методами анализа.
Гибридизация in situ. Этот молекулярно-биологический метод основан на специфической гибридизации специального олигонуклеотидного зонда с рибосом рибонуклеиновой кислоты (РНК), присутствующих во всех клетках, структура которых хорошо изучена. Процедура гибридизации in situ: клетки фиксируются (на подложке или в тонком срезе) и в процессе фиксации погибают. Мертвая клетка становится проницаемой для крупных молекул, в том числе для олигонуклеотидных зондов. На слой клеток наносится краситель с зондами, которые проникают внутрь клетки и связываются там с рибосомными РНК, если она совпадает с их последовательностью. Затем избыточное количество красителя отмывают, а связавшиеся зонды обнаруживают микроскопически по развитию той или иной окраски. Если целевых последовательностей рибосомных РНК нет, то цветной реакции не наблюдается. При использовании флуоресцентных красителей метод называется FISH (fluorescence in situ hybridization).
Метод достаточно прост и в соединении с проточной цитометрией используется для количественного анализа микробных сообществ (Amann et al., 1995), а также для обнаружения клеток, зараженных вирусом или внутриклеточными паразитами (Глик, Пастернак, 2002).
Наибольший интерес на сегодня представляет метод ПЦР.
ПЦР имитирует естественную репликацию нуклеиновых кислот и позволяет получать фрагменты последовательности ДНК в количествах, достаточных для опре деления.
ПЦР используется в диагностике инфекционных, онкологических, генетических заболеваний. В отличие от иммуноферментного анализа ДНК-диагностика позволяет выявить возбудителя заболевания с помощью его генома в очень низкой концентрации.
ПЦР-анализ клинического образца включает в себя три основных этапа (рис. 10-33): пробоподготовка (выделение ДНК из клинического материала), амплификация (умножение фрагментов ДНК) и регистрация результатов. Из клинических образцов, взятых от больных и доставленных в ПЦР-лабораторию, выделяют нуклеиновые кислоты (ДНК или РНК), являющиеся матрицей в реакции амплификации.
Амплификация - это многократно повторяющиеся циклы синтеза специфической области нуклеиновой кислоты при помощи термостабильного фермента ДНК-полимеразы. Поскольку в каждом цикле удваивается число копий амплифицируемого участка, за 30-40 циклов происходит накопление коротких специфических фрагментов в количестве, достаточном для их дальнейшего определения с помощью электрофореза в агарозном геле, путем гибридизации со специфическим олигонуклеотидным зондом или с использованием метода масс-спектрометрии. Отличительной особенностью ПЦР-диагностики является универсальность подхода для выявления различных инфекционных агентов.
Методика ПЦР позволяет обнаружить микроорганизмы в таких минимальных количествах, которые нельзя выявить другими методами. Основной прием - это применение универсальных праймеров, гибридизирующихся с генами рибосомных РНК всех микроорганизмов. Схема с использованием универсальных праймеров работает, если в микробном сообществе до 20 видов. При большем количестве видов микроорганизмов возникают технические трудности.
В стоматологии современные молекулярные методы открывают новые перспективы в решении вопросов этиологии и патогенеза стоматологических заболеваний, а значит и в решении насущных задач профилактики и лечения, в частности вопросы выбора антибактериальных средств и контроля их эффективности, выявление резистентности микроорганизмов.
Сочетание методов ПЦР и культивирования позволяет идентифицировать намного большее количество образцов бактериального налета и зубных бляшек, сокращает суммарное время анализа и повышает чувствительность метода исследования благодаря молекулярным методам, тогда как первичный посев снимает проблему излишней чувствительности метода ПЦР.
Встречающееся расхождение данных, полученных с помощью культуральных методов и с применением молекулярных методов диагностики микрофлоры полости рта, объясняется несовершенством способов видовой идентификации бактерий и наличием в образцах некультивируемых микроорганизмов (Haffajee et al., 2000; Shiloah et al., 2000).
Разработано большое количество молекулярных методов, основанных на ПЦР, одним из которых является ПЦР в реальном времени (real-time PCR).
Таким образом, метод ПЦР имеет решающее значение для диагностики представителей анаэробной микрофлоры, микроаэрофилов, внутриклеточных паразитов, так как они относятся к некультивируемым или трудно культивируемым микроорганизмам.
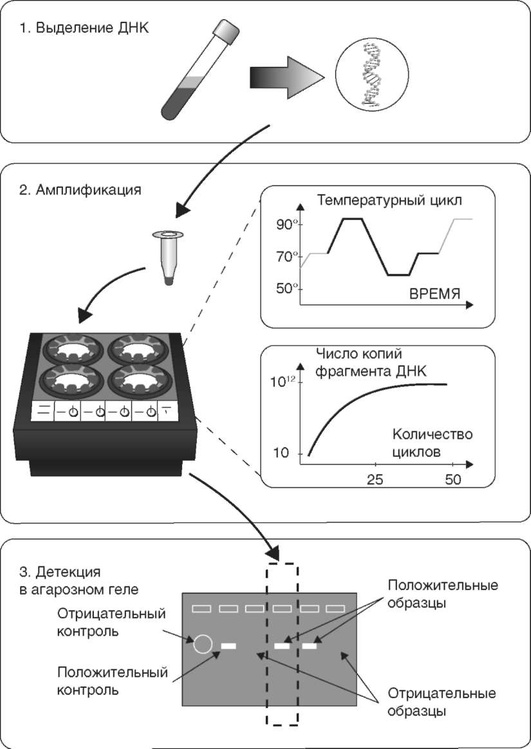
Рис. 10-33. Этапы проведения полимеразной цепной реакции
ПЦР ни в коем случае не заменяет, а лишь дополняет спектр традиционных методов (микроскопический, культуральный, биохимический и т.д.), используемых в диагностике заболеваний пародонта, обеспечивая определение качественного и количественного состава микрофлоры ротовой полости, антибиотико-устойчивости исследуемых микроорганизмов, контроля эффективности лечения.
Справедливости ради стоит сказать, что ценность этой методики и в научном, и в клиническом аспектах все же, на наш взгляд, резко преувеличена, так как полагаться на определяющую роль и пародонтальных комплексов, и конкретных пародонтопатогенов не вполне резонно в силу как огромного микробного представительства в норме и при патологии, так и крайне сложных их взаимоотношений. К тому же этот, безусловно, большой бросок - не более чем технический рывок именно на сегодня, который вполне может смениться новым, более мощным, а значит, и новой, более ценной информацией.
Иммунологические методы исследования
Большая роль в патогенезе ВЗП отводится состоянию местных и общих факторов неспецифической и специфической защиты у различных групп пациентов (Хазанова В.В., Земская Е.А., 1976; Терехова Н.В., Грудянов А.И., 1984). Установлено, что длительно текущий воспалительный процесс в пародонте часто сопровождается изменением показателей иммунитета - как клеточного, так и гуморального (Жяконис И.М., 1986; Шаповалов В.Д., 1995; Левина М.Я., Орехова Л.Ю., 1997; Иванюшко Т.П., 2002).
В связи с этим все большее значение в диагностике ВЗП приобретают иммунологические методы исследования, которые позволяют изучить состояние неспецифической и специфической защиты организма.
К факторам неспецифической защиты относятся:
Специфическими факторами защиты являются иммуноглобулины (Ig) разных типов, которые синтезируются под влиянием конкретного антигена и специфически с ним реагируют:
IgM - активирует систему комплемента;
IgE - связывается со специфическими рецепторами на поверхности тучных клеток и базофилов с высвобождением из этих клеток медиаторов аллергии;
IgA - секретируется в различные жидкости организма, обеспечивая секреторный иммунитет;
IgD - функционирует в основном в качестве мембранных рецепторов для антигена;
IgG - проявляет разнообразные виды активности.
ОЦЕНКА МЕСТНОГО ИММУНИТЕТА
Для изучения состояния местных факторов защиты исследуют смешанную нестимулированную слюну. Определяют следующие показатели:
1. Определение концентрации лизоцима в смешанной слюне. Из неспецифических факторов защиты особого внимания заслуживает протеолитический фермент лизоцим, который разрушает один из основных компонентов оболочки бактериальной клетки, в результате чего происходит ее растворение. Лизоцим обладает широким спектром биологической активности. Он оказывает бактерицидное действие на грамположительные бактерии, дрожжеподобные грибы рода Candida (Lee Е.O., Kim J.D., 1995; Seki T., 1995; Chung W., Hancock R.E.W., 2000), а также выраженное бактериостатическое воздействие в отношении грамотрицательных микроорганизмов (Ellison R.T., Giehl T.J., 1991). Одной из функций лизоцима является предотвращение бактериальной адгезии к слизистой оболочке (Macura A.B., Bankowska B., 1989). Кроме того, лизоцим активирует действие секреторного IgA, который связывает и инактивирует бактериальные токсины, препятствуя повреждению слизистой оболочки.
В экспериментах in vitro и in vivo было показано, что лизоцим тормозит выделение таких вазоактивных веществ, как катехоламины, простагландины, тромбоксан (Щербакова Э.Г. и др., 1984). R.W. Park (1996) установил, что лизоцим связывается в тканях с эластином, в силу чего предохраняет ткани от повреждения эластазой.
Исследование концентрации лизоцима в слюне проводят методом К.А. Каграмановой и З.В. Ермольевой (1966).
Установлено, что при хроническом воспалительном процессе в пародонте происходит снижение уровня лизоцима в слюне, причем снижение титра лизоцима наблюдается именно в период обострения воспалительного процесса в пародонте (Фоменко Е.В., 2004).
2. Определение секреторного иммуноглобулина А в смешанной слюне.
Иммуноглобулины А - это секреторные иммуноглобулины, включающие 2 субкласса: IgA1 (90%) и IgA2 (10%). Это основной вид иммуноглобулинов, участвующих в местном иммунитете. Они препятствуют прикреплению бактерий к слизистой, нейтрализуют энтеротоксин, активируют фагоцитоз и комплемент.
Определение уровня IgA в слюне проводят с использованием моноспецифических антисывороток к секреторному иммуноглобулину А с помощью иммуноферментного анализа.
У больных пародонтитом уровень IgA в слюне отличается значительным разнообразием и колеблется от 0 до 800 мкг/мл, что объясняется различной скоростью секреции слюны.
При пародонтите как легкой, так средней и тяжелой степени в слюне возможно также повышение уровня секреторного IgA к специфическим бактериальным патогенам (Канканян А.П., Леонтьев В.К., 1998). Увеличение секреторного IgA свидетельствует о сенсибилизации тканей токсинами микроорганизмов.
Содержание IgA слюны находится в прямой зависимости от интенсивности саливации (Лемецкая Т.И., 1998). При нормальной интенсивности слюноотделения у больных пародонтитом уровень IgA выше, чем у здоровых лиц, и более чем в 2 раза превышает его содержание у больных пародонтитом со сниженной секреторной активностью слюнных желез. Повышение уровня секреторного IgA в слюне, очевидно, обусловлено усилением его местного синтеза за счет дополнительного антигенного раздражения (микробный фактор).
Во всех случаях неблагоприятного течения пародонтита отмечается снижение содержания секреторного IgA в слюне. Так, резкое снижение (до 30-60 мкг/мл) или даже полное отсутствие секреторного IgA в слюне наблюдается у большинства больных с тяжелой степенью пародонтита (Фоменко Е.В., 2004). В этих случаях, вероятно, происходит срыв адаптационных механизмов, сопровождающийся снижением уровня лизоцима и секреторного IgA (Олейник И.И., Лемецкая Т.И., 1981).
Как известно, IgA осуществляет неспецифические защитные функции эпителиальных слоев. По-видимому, дезорганизация этого механизма, способствуя бактериальной агрессии, может быть использована в целях прогноза при хроническом пародонтите. Уровни IgA в десневой жидкости демонстрируют относительно надежные прогностические качества, и низкая его концентрация коррелирует с неблагоприятным прогнозом заболевания (Lamster et al., 1994).
ИММУНОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПЕРИФЕРИЧЕСКОЙ КРОВИ
При иммунологическом исследовании периферической крови оценивают состояние клеточной неспецифической защиты (состояние Т- и В-систем иммунитета, функциональную активность ПМЯЛ), а также специфических факторов защиты (содержание сывороточных антител к пародонтопатогенным бактериям).
1. Оценка клеточной неспецифической защиты. При исследовании клеточной неспецифической защиты оценивают состояние Т- и В-систем иммунитета:
-
определение содержания Т-лимфоцитов (СD3+) и их субпопуляций - Т-хелперов (СD4+); Т-киллеров (CD16+) и Т-супрессоров (СD8+); иммунорегуляторный индекс - соотношение Т-хелперов и Т-супрессоров) (Ярилин А.А., 1981);
-
определение количества В-лимфоцитов (СD22+) проводят по методу А.Н. Че-редеева (1976);
-
определение уровня циркулирующих иммунных комплексов в сыворотке крови по методу Л.С. Косицкой и соавт. (1983).
Изменения активности клеточного звена иммуногенеза могут иметь как положительное, так и отрицательное значение в патогенезе заболеваний пародонта. У пациентов с хроническим генерализованным пародонтитом выявлены выраженные изменения со стороны иммунной системы: угнетение Т- и стимуляция В-клеточного звена иммунной системы, которая не завершается адекватным накоплением плазматических клеток и возникновением эффективного гуморального ответа. Увеличение содержания в периферической крови лимфоцитов, экспрессирующих рецепторы индукции апоптоза СD95 L (Fas-L), может приводить к усилению апоптоза лимфоцитов и, возможно, является причиной развития Т-клеточного дефицита (Воложин А.И., 2005).
У больных с типичными формами ВЗП в крови снижается содержание Т- и В-лимфоцитов, а также Т-лимфоцитов-хелперов. При этом резко возрастает число естественных киллеров (СD16+) и цитотоксичных Т-лимфоцитов (СD8+). Это указывает на повышенную агрессивность клеток иммунной системы, что может способствовать развитию клеточных иммунопатологических реакций. Повышение супрессорной активности может рассматриваться как реакция организма, направленная на подавление воспалительных процессов.
Важным фактором иммунорезистентности тканей пародонта является функциональная активность ПМЯЛ. Известно, что функциональная активность фагоцитирующих клеток в значительной степени обусловлена их способностью генерировать активные формы кислорода, обладающие бактерицидными свойствами. С генерацией активных форм кислорода связан феномен биохемилюминесценции нейтрофилов, на котором основан биохемилюминесцентный анализ фагоцитарной активности ПМЯЛ. Доказано, что интенсивность люминолзависимой хемилюминесценции прямо коррелирует с состоянием функциональной активности ПМЯЛ (Писаревский В.Е., 1988). Данный метод позволяет оценить резервные возможности фагоцитов и опосредованно судить об эффективности лечения и прогнозе заболевания.
В каждой порции крови, взятой из десны, оценивают спонтанную и активированную (зимозаном) хемилюминесценцию.
Измерения интенсивности хемилюминесценции (тыс. имп/мин) проводят на биохемилюминометре (рис. 10-34) через каждые 5 мин (в течение 4 с) и заканчивают через 20 мин после достижения пика хемилюминесценции.
Результат определяют как отношение между максимальной интенсивностью стимулированной и спонтанной хемилюминесценцией в условных единицах.

Рис. 10-34. Биохемилюминометр БХЛ-06 с программным обеспечением
Одновременно рассчитывают количественное содержание лейкоцитов по общепринятой методике. Процентный показатель форм лейкоцитов, участвующих в фагоцитозе, определяют путем подсчета их в мазках крови (окраска по Романовскому-Гимзе). Расчет фагоцитарной активности лейкоцитов проводят на 1 млн клеток.
Несмотря на то что показатели у каждого конкретного пациента имеют сугубо индивидуальные величины, выявлены и общие закономерности. В зависимости от степени тяжести хронического воспалительного процесса в пародонте показатели активности ПМЯЛ варьируют в пределах от 0,63±0,02 до 4,35±0,02 μV на 1 млн клеток (Петрухина Н.Б., 2004). Такой разброс хемилюминесцентного ответа лейкоцитов объясняют неоднородностью пула клеток при пародонтите.
Поэтому важным диагностическим критерием при оценке функциональной активности лейкоцитов является сравнение показателей спонтанной и индуцированной хемилюминесценции.
У пациентов с пародонтитом средней степени тяжести показатели индуцированной хемилюминесценции в 1,3 раза выше спонтанной хемилюминесценции и составляют 2,14±0,02 и 1,62±0,02 μV соответственно. У пациентов с пародонтитом тяжелой степени в 50% случаев показатели спонтанной и индуцированной хемилюминесценции практически однозначны, это говорит о том, что ответа со стороны активированных нейтрофилов практически нет или он минимален. Среднее значение спонтанной хемилюминесценции составляет 1,27±0,02 μV, а индуцированной - 1,45±0,02 μV. При быстропрогрессирующем пародонтите ответ на стимуляцию отсутствует в 70% случаев, это указывает на значительное истощение резервных возможностей лейкоцитов у данного контингента (спонтанная хемилю-минесценция - 0,63±0,02 μV, индуцированная - 0,67±0,02 μV).
Таким образом, у большинства пациентов с ВЗП, особенно с быстропрогресси-рующими формами, выявляется снижение функциональной активности ПМЯЛ. Эти нарушения связывают как с врожденным дефектом нейтрофилов (Gifford R.H., 1970), так и с повреждающим воздействием веществ, накапливающихся в больших количествах в очагах воспаления: интерлейкинов, продуктов метаболизма патогенной микрофлоры и т.д. (Agarwal S. et al., 1996).
Морфологические и цитохимические исследования показывают, что у пациентов с пародонтитом отмечается высокий процент морфологического атипизма нейтрофилов, изменение активности ферментов и содержания гликогена в этих клетках. В нейтрофилах десневой крови морфологические нарушения проявляются дисгранулоцитопоэзом в виде токсогенной зернистости и гипогрануляции (в 33% случаев при средней степени пародонтита и в 68% - при тяжелой). В периферической крови отмеченные изменения выявлены в 37,5% случаев, причем только у пациентов с тяжелой степенью пародонтита.
Значительно расширяют знания о характере патологического процесса в тканях пародонта результаты цитохимических исследований нейтрофилов.
2. Изучение специфических факторов защиты. Содержание иммуноглобулинов различных классов в сыворотке крови определяют по методу Манчини и соавт. (Manchini et al., 1965).
Увеличение титра антител, в отличие от параметров клеточного иммунитета, в целом признается защитной реакцией, способной оказать благоприятное влияние на течение заболевания. Вместе с тем изучение иммунологических показателей у пациентов с заболеваниями пародонта не выявило у них существенных нарушений гуморального иммунитета (Genko, 1992). Об этом же свидетельствуют результаты исследований МакАртура и Кларка (McArthur, Clark, 1993).
Однако показатели сывороточных антител к пародонтопатогенным бактериям могут быть в определенной мере использованы с целью прогноза течения процесса либо объяснения его повышенной активности, причем этот диагностический тест имеет довольно высокую чувствительность и специфичность (Genco et al., 1985).
В частности, у здоровых лиц и у пациентов с заболеваниями пародонта в неактивной фазе уровень антител в сыворотке стабилен на протяжении длительного периода наблюдения (Ebersole et al., 1992). Однако при наличии активных деструктивных поражений пародонта уровень специфических антител повышается в весьма значительной степени.
Специфичность антител к определенным бактериальным патогенам позволяет использовать их в качестве дополнения к микробиологическим методам анализа зубных бляшек.
ЦИТОТОКСИЧЕСКИЕ РЕАКЦИИ
Цитотоксические реакции наблюдаются в случаях, когда антитела реагируют непосредственно с антигенами, присутствующими на клетках тканей, либо с антигенами, которые являются натуральными тканевыми компонентами. Итогом этих взаимодействий является разрушение тканевых структур. Чаще всего такие цитотоксичные антитела представлены иммуноглобулинами классов G и M. Кроме того, в процессе их связывания с антигенами обычно активируется и система комплемента.
Подтверждением наличия цитотоксических реакций является повышение содержания в десневой жидкости компонентов расщепления комплемента - белков G3α, G5α, а также иммуноглобулинов и ряда белков, принимающих активное участие в индуцировании и течении воспаления: α-2-макроглобулина, α-1-антитрипсина, трансферрина и медленно реагирующей субстанции α.
Активация данных соединений характерна для хронических форм воспаления пародонта.
Активация фрагмента комплемента С4 наблюдается при атипичных формах пародонтита, а именно - при ювенильном пародонтите. Наличие активированного белка С4 позволяет дифференцировать типичные и атипичные формы поражений пародонта. Изучение динамики α-2-макроглобулина, α-1-антитрипсина в процессе лечения позволяет объективизировать эффективность лечебных воздействий и прогнозировать течение процесса в пародонте.
Учитывая значимость определения перечисленных иммунологических показателей, следует четко понимать, что все они являются обязательным атрибутом защитного воспалительного ответа организма, поэтому выявление самого факта их изменений надо трактовать очень осторожно.
Во-первых, очень сложно ориентироваться на усредненные значения в норме, так как они очень индивидуальны и колеблются в довольно широких диапазонах.
Во-вторых, чтобы оценить эффект проводимого лечения в отношении конкретных показателей, следует четко осознавать, что после достижения видимого клинического результата иммунологические исследования целесообразно проводить не ранее чем через 3 нед, так как, единожды разрегулированные, они нормализуются достаточно медленно.
Биохимические методы исследования
В последние годы появилось новое понимание ключевой роли нарушений структуры и функций клеточных мембран в развитии воспаления.
ПРОЦЕССЫ ПЕРЕКИСНОГО ОКИСЛЕНИЯ И ПОВЕДЕНИЕ АНТИОКСИДАНТНОЙ СИСТЕМЫ ЗАЩИТЫ ОРГАНИЗМА
Исследования последних лет свидетельствуют о значительной роли в патогенезе ВЗП свободнорадикального окисления липидов.
Патогенные бактерии могут приводить к тканевому поражению в силу двух причин:
Собственно бактериальные и токсические воздействия заключаются в том, что высвобождаемые бактериями зубной бляшки ферменты оказывают литический эффект на соединительнотканный волоконный каркас пародонта (коллагеназа, протеаза), эпителиальные структуры (кератаза), поверхностные структуры клеток (нейраминидаза).
Стремясь к локализации агрессии микроорганизмов, ответные реакции в тканях пародонта сами могут приводить к воспалительным и дегенеративным изменениям.
Ответные реакции тканей пародонта на повреждение включают массированную активацию комплемента и аккумуляцию лейкоцитов, прежде всего ПМЯЛ и макрофагов, а также фибробластов и тучных клеток, подвергшихся деструктивному воздействию микробных агентов. Происходит их активация с высвобождением свободнорадикальных продуктов и дегрануляция с высвобождением протеолитических ферментов и цитокинов (простагландины, лейкотриены, интерлейкины, фактор некроза опухолей). Эта защитная реакция направлена на разрушение бактериальных патогенов, но одновременно приводит к воспалительным и деструктивным поражениям тканей пародонта.
Воспалительный процесс приводит к потреблению кислорода тканями пародонта без достаточной его утилизации, что способствует резкому увеличению содержания активных форм кислорода, интенсификации перекисного окисления липидов мембран клеток и образованию эндопероксидов.
Происходящее вследствие первичного воспалительного ответа ухудшение трофики тканей пародонта, в свою очередь, приводит к еще большему нарушению кислородного питания тканей и изменению энергетического процесса, обеспечивающего жизнеспособность клеток. Включаются примитивные способы выработки энергии при помощи перекисного и свободнорадикального окисления с образованием большого количества высокотоксичных продуктов: супероксиданиона, малонового диальдегида и др.
Ухудшение микроциркуляции при пародонтите усугубляется тем, что перекисное окисление снижает антиагрегационную способность тканей пародонта. Образуются лейкоцитарно-тромбоцитарные агрегаты, которые блокируют микроциркуляторное русло, включая даже относительно крупные артериолы. Это усугубляет ишемию тканей, способствует дальнейшему развитию отека.
В норме процессам перекисного окисления липидов противостоит антиоксидантная система защиты. В здоровом организме соотношение между свободно-радикальным окислением и антиоксидантной защитой оптимальное. Повышение концентрации свободных радикалов приводит к нарушению функционирования и, в конечном счете, к гибели клеток. Хроническое течение ВЗП и нарастающие при этом гипоксия и поражение ферментных систем клеток способствуют постепенному падению антиоксидантной активности тканей - фактически последнего наиболее устойчивого механизма защиты (Конторщикова К.Н., 2000).
Перекисное окисление липидов - это свободнорадикальный процесс, протекающий на полиненасыщенных жирных кислотах с образованием активных форм кислорода.
Антиоксидантная система - это весь комплекс процессов, включающих систему генерации радикалов кислорода и липидных гидроперекисей.
ОЦЕНКА СОСТОЯНИЯ ПРОЦЕССОВ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ И АНТИОКСИДАНТНОЙ СИСТЕМЫ
Состояние процессов свободнорадикального окисления липидов в ротовой жидкости и десневой крови оценивают по интенсивности перекисного окисления липидов и активности антиоксидантной системы защиты. Скрининговым методом для оценки состояния процессов перекисного окисления липидов и антиоксидантной системы является индуцированная биохемилюминесценция, при которой происходит каталитическое разложение перекиси водорода ионами металла с переменной валентностью - двухвалентного железа (Кузьмина Е.Н. и др., 1983).
Интенсивность индуцированной хемилюминесценции измеряют в течение 30 с. Значения индуцированной хемилюминесценции представляются в виде кинетической кривой. Для ее оценки используют наиболее информативные показатели:
-
Imax (импульс/с) - максимальная интенсивность свечения. Этот показатель позволяет судить о потенциальной способности биологического объекта к свободнорадикальному окислению. Значения этой величины зависят от концентрации общих липидов в субстрате;
-
S - светосумма (за 30 с) - отражает прежде всего количество радикалов, соответствующих обрыву цепи свободнорадикального окисления, она обратно пропорциональна активности антиоксидантной системы (Fletcher D.L. et al., 1973);
-
Imax/S (отн.ед.) - отношение максимальной интенсивности к светосумме хемилюминесценции за 30 с. Этот коэффициент коррелирует с изменением tg угла наклона кривой хемилюминесценции и характеризует общую (суммарную) антиоксидантную систему (Kontorschikova C.N., 1995).
В норме основной показатель перекисного окисления липидов (Imax) составляет от 4 до 8 импульс/с в пересчете на 1 мг общих липидов.
В десневой крови у пациентов с ВЗП отмечается усиление свободнорадикальных процессов, причем показатели перекисного окисления липидов существенно зависят от степени тяжести и клинической формы заболевания. Значения основного показателя перекисного окисления липидов у пациентов с ВЗП зачастую резко превышают норму и варьируют от 8,52 до 27,75 в зависимости от степени выраженности деструкции тканей и активности воспалительного процесса в пародонте. У пациентов с ярко выраженным воспалением и тяжелой степенью поражения отмечаются самые высокие значения перекисного окисления липидов. Так, у пациентов с пародонтитом средней степени тяжести основной показатель перекисного окисления липидов составляет в среднем 9,34±0,29, что на 17% выше нормы. Еще выше данный показатель у пациентов с пародонтитом тяжелой степени - 10,09±0,65 (Петрухина Н.Б., 2004). У пациентов с быстропрогрессирующим пародонтитом основной показатель перекисного окисления липидов превышает норму в 3,5-4,0 раза и его значения находятся в пределах от 10,86±5,52 до 30,07±6,92 в зависимости от степени выраженности деструкции и активности процесса (Безрукова И.В., 2004).
В то же время активность антиоксидантной системы защиты не зависит от степени тяжести заболевания, но имеет сильную зависимость от активности процессов воспаления в пародонте: у пациентов с хроническим генерализованным пародонтитом показатели антиоксидантной системы находятся в пределах нормы (0,37±0,03 - при средней степени и 0,35±0,02 - при тяжелой степени), тогда как у лиц с быстропрогрессирующим пародонтитом снижены до 0,25±0,02 (при норме от 0,3 до 0,6). Это свидетельствует об истощении антиоксидантной системы защиты при длительном течении активных воспалительно-деструктивных процессов в тканях пародонта.
Таким образом, индуцированная хемилюминесценция не только наглядно демонстрирует потенциальную способность биологического объекта (в данном случае десневой крови) к перекисному окислению липидов, но и характеризует ответную реакцию со стороны антиоксидантной системы защиты на индукцию процесса перекисного окисления липидов, отражая активность всех имеющихся антиоксидантов плазмы крови. Именно поэтому данный метод позволяет оценить уровень компенсаторных механизмов, направленных против свободнорадикального окисления.
Цитологические методы исследования
Цитологические методы исследования позволяют неинвазивно, а значит безболезненно и за короткое время, определить характер патологических изменений, происходящих в тканях, проследить динамику процессов в очаге поражения, оценить эффективность лечения и прогнозировать отдаленные результаты.
Современным ответвлением цитологии является цитоморфометрия, которая основывается на математической обработке результатов цитограмм и количественной оценке содержания различных клеточных элементов.
Цитоморфометрический метод (Григорьян А.С. и др., 1998) основан на изучении клеточных элементов цитограмм отпечатков с десны.
МЕТОДИКА ПОЛУЧЕНИЯ МАТЕРИАЛА ДЛЯ ЦИТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
Забор материала для цитологического исследования проводят с помощью заготовленных резиновых клиньев (рис. 10-35, см. цв. вклейку). Эти клинья-мишени хранят в чашках Петри, залитыми 70% раствором этанола (Спирта этилового♠).
Перед забором отпечатков с десны мишень извлекают пинцетом из чашки Петри, высушивают струей сухого воздуха из воздушного пистолета. При введении мишени в десневую борозду одна поверхность мишени должна касаться зуба, а вторая - внутренней поверхности кармана (десневой бороздки).
Цитологический материал переносят в виде отпечатков на предметное стекло. С каждого зуба получают 2 типа отпечатков: один с десны, другой с зуба. При направлении отпечатков в лабораторию на цитологическое исследование забранный на предметное стекло материал сопровождают кратким описанием клинических данных.
МЕТОДИКА МИКРОСКОПИРОВАНИЯ
Отпечатки окрашивают и исследуют под микроскопом с использованием иммерсионной системы при различных увеличениях с помощью окуляров ×10 (или ×20) и объектива ×40. Увеличения варьируют в зависимости от режима исследования. В режиме обзора на больших полях цитограмм используют средние увеличения, при необходимости изучения деталей клеточных структур и при подсчете клеток применяют максимальные увеличения (включая иммерсию).
При исследовании цитологического материала анализируют не только качественные признаки, но и количественные показатели цитограмм.
Подсчет клеток проводят в двух основных клеточных популяциях цитограмм: эпителиальной и соединительнотканной, при этом исследуют не меньше 3-5 полей.
При подсчете эпителиальных клеток сначала устанавливают их число в поле. Затем в том же поле зрения проводят подсчет клеток с явными признаками цитопатологии и выводят относительный (к общему числу эпителиальных клеток) показатель содержания клеток с каждым из типов цитопатологии: базофилия цитоплазмы, дистрофические изменения (вакуолизация цитоплазмы, деструкция ядра и т.д.), «фагирующие» клетки, X-клетки. Для клеток с указанными типами цитопатологии выводят средние относительные (в процентах) показатели, которые затем используют для вычисления индекса деструкции.
Соединительнотканные клетки - лейкоциты, моноциты (отдельно - сохранившие цитоплазму и отдельно - голоядерные элементы), фибробласты (эндотелиоподобные клетки) также подсчитывают в 3-5 полях зрения, фиксируют число клеток в абсолютных цифрах, затем выводят средние показатели, которые служат материалом для вычисления воспалительно-деструктивного индекса.
МАТЕМАТИЧЕСКИЙ АППАРАТ ЦИТОМОРФОМЕТРИЧЕСКОГО МЕТОДА
В основу цитоморфометрического метода положено определение двух показателей: индекса деструкции, отражающего относительное содержание в эпителиальной популяции клеток с признаками цитопатологии, и воспалительно-деструктивного индекса, который основывается на соотношении клеток, входящих в состав воспалительного инфильтрата на различных этапах его развития.
Отдельные клетки с цитопатологией можно встретить и в норме. Но в условиях патологии они возрастают в числе и, что важно, нарастает число сочетаний различных типов цитопатологии.
ИНТЕРПРЕТАЦИЯ ПОКАЗАТЕЛЕЙ
Цитоморфометрический метод предназначен для оценки воспалительного и деструктивного процессов в пародонте.
Интенсивность воспаления определяется воспалительно-деструктивным индексом. В норме воспалительно-деструктивный индекс составляет от 0 до 20 ед.
Интенсивность деструкции определяют индексом деструкции. В норме индекс деструкции составляет от 20 до 650 ед.
Индекс деструкции и воспалительно-деструктивный индекс достаточно плотно коррелируют со степенью тяжести воспалительных и деструктивных изменений в пародонте. Так, при гингивите индекс деструкции возрастает до 700-1000 ед, воспалительно-деструктивный индекс составляет от 21 до 50 ед. При пародонтите индекс деструкции достигает 1100-6000 ед, воспалительно-деструктивный индекс составляет от 9 до 50 ед.
В ходе лечения наблюдается снижение этих индексов, причем степень этого снижения соответствует эффективности лечебных результатов.
ФУНКЦИОНАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
К функциональным методам исследования состояния тканей пародонта относятся:
Нарушения микроциркуляции в тканях пародонта являются одним из факторов патогенеза ВЗП. Многочисленные исследования, проведенные за последнее время, показали, что изменения в сосудах микроциркуляторного русла при пародонтите носят весьма разнообразный характер (Weissman, Moskros, 1968; Варшавский А.И., 1977; Цимбалистов А.В., Цимбалистов Е.А., 1982). При этом важно отметить, что в сосудах могут происходить как структурные, так и функциональные изменения: нарушается их проницаемость, уменьшается число функционирующих капилляров, изменяются агрегационные свойства крови, приводящие к снижению перфузии микроциркуляторного русла кровью.
По данным А.И. Варшавского (1977), изменения всех компонентов микроциркуляторного русла десны происходят одновременно. Степень же этих изменений зависит от длительности хронического воспалительного процесса. На структуру и функцию микроциркуляторного русла десны и тканей пародонта могут оказывать влияние различные факторы: функциональная нагрузка, вазоактивные вещества, температурные раздражители и др. Показаны некоторые закономерные изменения в сосудах при пародонтите в динамике (Киселев А.Ф., 1973; Варшавский А.И., 1973; 1977).
При заболеваниях пародонта в процесс вовлекаются все сосуды. Наблюдаются явления пролиферации и набухания эндотелия, расслоение эластических волокон, в результате эндотелий сосудов становится проницаемым, возникает отек десны. Так, при пародонтите легкой степени тяжести просвет артериол и прекапилляров сужается. Отмечаются некоторые склеротические изменения, выражающиеся в утолщении и гиалинизации средней оболочки сосудов, умеренном склерозе интимы. Также происходит запустевание отдельных капилляров, явления стаза, венозного застоя. Наряду с малоизмененными сосудами обнаруживаются капилляры с необратимыми изменениями в их структуре (Политун А.М. и др., 1976). При средней и тяжелой степенях пародонтита просвет сосудов значительно уменьшается, наружный слой увеличивается, за счет разрастания субстрата сосудистой стенки некоторые артериолы облитерируются. Кроме того, нарастают гиалиноз, фиброз прекапилляров и артериол, что приводит к нарушению окислительно-восстановительного баланса, в дальнейшем - к гипоксии, нарушению метаболизма сосудистой стенки за счет преобладания склеротических процессов. Наблюдаются изменения в базальной мембране, она реплицируется, нарушается ее плотность на отдельных участках, происходит лизис волокон в околососудистой зоне (Чупрунова Л.Д., Иванчикова Л.А., 1975; Чернух А.М., 1975; Ковалев Е.В., 1988).
Состояние гемодинамических процессов в пародонте объективно отражают данные функциональных методов исследования (Логинова Н.К., Кречина Е.К. и др., 1994; Гусева И.В., Ежова Е.Г., 2001; Белокопытова В.В., 2002).
Реопародонтография
Реопародонтография - это метод оценки функционального состояния сосудов тканей пародонта путем регистрации пульсирующего в них потока крови. Пульсовый объем крови зависит от функционального состояния регионарных сосудов, а тонус сосудов - от артериального давления и местных факторов, например медиаторов воспаления и жевательной нагрузки. Реопародонтография позволяет давать качественную и количественную характеристику кровенаполнения тканей и состояния тонуса регионарных сосудов, исходя из оценки конфигурации пульсовой кривой и ее амплитудно-временных показателей (Логинова Н.К., 1994).
Для выявления функциональных изменений в системе кровоснабжения пародонта проводят визуальный анализ реограмм. Из числовых параметров используют реографический индекс, который линейно связан с амплитудой пульсовых кривых и характеризует интенсивность пульсового кровенаполнения исследуемых тканей. Для оценки тонуса сосудов данного региона используют индекс периферического сопротивления и индекс эластичности стенок. В расчетные показатели входит также показатель тонуса сосудов, который основан на измерении временных отрезков пульсовой кривой, зависящих от частоты пульса.
Для проведения реографии используют многофункциональный программно-аппаратный комплекс «Диастом» (рис. 10-36), который предназначен для регистрации и автоматической обработки реографических кривых. Электродную систему (рис. 10-37, см. цв. вклейку) располагают в полости рта таким образом, чтобы исследуемая зона находилась между внутренними электродными площадками при нейтраполярной методике реографии.

Рис. 10-36. Диагностический комплекс «Диастом»
Метод позволяет оценить такие характеристики сосудов, как эластичность их стенок, тонус; определить степень их повреждения.
Визуальная оценка пульсовых кривых (рис. 10-38) показывает, что у пациентов с ВЗП происходит повышение тонуса сосудов, о чем свидетельствуют пологая анакрота, уплощенная вершина и сглаженная дикротическая волна, расположенная близко к вершине.
Рис. 10-38. Реопародонтограмма
При цифровой оценке полученных при проведении реопародонтограммы кривых наибольшее внимание уделяют значениям индекса периферического сопротивления и индекса эластичности, поскольку эти величины связаны между собой и являются обратно зависимыми.
Индекс периферического сопротивления
Индекс периферического сопротивления, в норме составляющий 80-90%, при пародонтите значительно возрастает (до 116,4-124,2%), что свидетельствует о вазоконстрикции сосудов либо их склеротических изменениях (Логинова Н.К., 2002).
Индекс эластичности
Индекс эластичности в норме составляет 70-80%. Снижение индекса эластичности свидетельствует о начинающихся склеротических изменениях сосудов, повышение - демонстрирует хорошую эластичность сосудистых стенок.
Реографический индекс
Реографический индекс является показателем интенсивности кровенаполнения тканей пародонта. В норме реографический индекс составляет 0,36 Ом. При пародонтите происходит резкое снижение интенсивности кровотока, о чем свидетельствует невысокий реографический индекс (0,075-0,08 Ом).
Лазерная допплеровская флоуметрия
Метод лазерной допплеровской флоуметрии основан на лазерной допплеровской низкочастотной спектроскопии с использованием излучения гелий-неонового лазера малой мощности и длины волны 632,8 нм, которая хорошо проникает в поверхностные слои тканей.
Ткани организма в оптическом плане могут быть охарактеризованы как мутные среды. Отражение лазерного излучения от движущихся в микрососудах эритроцитов приводит к изменению частоты сигнала (эффект Допплера), что позволяет определить интенсивность микроциркуляции в исследуемом участке тела. Обратное рассеяние монохроматического зондирующего сигнала формируется в результате многократного рассеяния на поверхности эритроцитов. Поэтому спектр отраженного сигнала после многократного детектирования, фильтрации и преобразования дает интегральную характеристику капиллярного кровотока в заданной единице объема тканей, которая складывается из средней скорости движения эритроцитов, показателя капиллярного гематокрита и числа функционирующих капилляров.
Используют лазерный анализатор скорости поверхностного капиллярного кровотока «ЛАКК-01» (НПП «ЛАЗМА», Россия), оснащенный гелий-неоновым лазером (ЛГН-207 Б) с мощностью лазерного излучения на выходе световодного кабеля не менее 0,3 мВт. Лазерный анализатор кровотока ЛАКК-01 (рис. 10-39) разрешен Минздравом России для применения в практическом здравоохранении (протокол № 1 от 13.01.1993 г. Комиссии по клинико-диагностическим приборам).
При проведении исследований вычисляют следующие статистические характеристики микроциркуляции: среднее арифметическое значение - М, среднее квадратическое отклонение среднего арифметического - СКО (σ), коэффициент вариаций - Kv.
Измерения проводят у пациентов в положении сидя (угол наклона спины 95-100°), голову фиксируют на подголовнике. Запись исходной допплерограммы проводят на уровне средней трети ороговевающей части слизистой оболочки альвеолярного отростка. Измерения выполняют в области резцов, премоляров и моляров верхней и нижней челюстей (рис. 10-40, см. цв. вклейку). Продолжительность каждого измерения 30 с.

Рис. 10-39. Лазерный анализатор капиллярного кровотока ЛАКК-01
Для характеристики гемодинамических процессов определяют соотношение сопротивления на путях притока и оттока крови.
Данные лазерной допплеровской флоуметрии объективно отражают состояние тканевых систем пародонта и могут служить для оценки степени патологических изменений при ВЗП (рис. 10-41).
Рис. 10-41. Лазерная допплеровская флоуметрограмма
При изучении показателей лазерной допплеровской флюорограммы у больных пародонтитом установлено снижение интенсивности капиллярного кровотока в среднем на 30% нормального уровня, обусловленное воспалительно-деструктивными процессами в пародонте. Степень сосудистых нарушений зависит и от тяжести деструктивных изменений (Кречина Е.К., 2006).
При пародонтите средней степени тяжести микроциркуляторные расстройства выражаются в следующем: уровень капиллярного кровотока снижается на 18% по сравнению с нормой, среднее квадратическое отклонение амплитуды колебаний кровотока (σ) - на 40,2%, вазомоторная активность (Kv) - на 26%, что свидетельствует о снижении перфузии тканей кровью и активности кровотока.
Отмечается также падение абсолютных значений амплитуд в области всех ритмов: низкочастотного - на 54,7%, высокочастотного - на 51,4%, пульсового - на 39,6% (рис. 10-42). Наблюдается увеличение сосудистого тонуса на 25,5% и падение внутрисосудистого сопротивления на 26,7%. Тенденция этих изменений отражается и на значениях интегрального индекса флаксмоций, который был снижен на 14,8%.
При тяжелой степени пародонтита показатели капиллярного кровотока значительно снижены по сравнению с нормой: М - на 28,9%, σ - на 59%, Kv - на 41,6%, что указывает на выраженное ухудшение кровотока в системе микроциркуляции. Амплитуда низкочастотного ритма снижается в 4 раза, высокочастотного - в 2,3 раза, пульсового - в 2,5 раза. Сосудистый тонус выше нормы на 59,9%, а внутрисосудистое сопротивление - ниже на 45%. Снижение интегрального индекса флаксмоций составляет 42,3% нормы.
Рис. 10-42. Амплитудно-частотный спектр лазерной допплеровской флоуметрограммы
При быстропрогрессирующем пародонтите уровень капиллярного кровотока резко снижен - на 46,7% по сравнению с нормой. Среднее квадратическое отклонение амплитуды колебаний кровотока снижается в 3,1 раза, а вазомоторная активность сосудов - в 1,6 раза.
Метод позволяет определить как исходное состояние микроциркуляторных процессов в десне, так и на основании их изменения в ходе последующих измерений оценить либо динамику процесса, либо эффективность лечебных мероприятий.
Ультразвуковая высокочастотная допплерография
Метод ультразвуковой высокочастотной допплерографии также основан на эффекте Допплера - это эффект изменения частоты отраженного сигнала от движущегося объекта (рис. 10-43). При отсутствии движения исследуемой среды (крови) допплеровского сигнала не существует.
Для оценки состояния кровотока используют следующие параметры:

Рис. 10-43. Прибор «Минимакс-Допплер-К» (ООО «СП-Минимакс», Россия) для проведения ультразвуковой высокочастотной допплерографии
Визуальный сигнал артериального русла характеризуется большой амплитудой, наличием систолических и диастолических пиков, выраженной вершиной.
Сигнал участка микроциркуляторного русла характеризуется волнообразной картиной окрашенного спектра без острых пиков.
Максимальная систолическая скорость кровотока Vas=0,724 см/с.
Конечная диастолическая скорость кровотока Vakd=0,405см/с.
Максимальная объемная систолическая скорость кровотока Qas=0,034мл/мин.
Использование данных показателей позволяет определить и степень нарушений, и динамику процесса (рис. 10-44, см. цв. вклейку).
ПОЛЯРОГРАФИЯ
Полярография - это метод электрохимического анализа, который применяется для определения концентрации (напряженности) кислорода в тканях пародонта (Вольвач С.И., 1984).
Полярография является графической регистрацией зависимости силы тока от напряжения при прохождении его через растворы или биологические ткани. Основное назначение метода - диагностика гипоксии в тканях пародонта и ее степени.
В настоящее время разработана компьютерная методика, которую проводят с помощью полярографа с системой активного и пассивного электродов и специального программного обеспечения Polar (ЗАО «Аквилон-СПб», Санкт-Петербург). Подключение полярографа к компьютеру обеспечивает автоматизацию процедуры измерений (от задания условий измерения до полной обработки результатов, включая отображение вольтамперограмм на дисплее и/или принтере) (рис. 10-45, см. цв. вклейку).
В качестве диагностического критерия нарушений процессов кислородного метаболизма при полярографических исследованиях тканей пародонта рекомендуется использовать гипоксическую пробу - вдыхание газовой смеси, содержащей 10% кислорода и 90% азота (Ежова Е.Г., 2001).
Графическая запись позволяет выявить скорость подъема или снижения напряженности кислорода, что дает более точную характеристику обменных процессов. Оценку кислородного снабжения тканей пародонта осуществляют по временным полярограммам, используя следующие величины: исходный показатель парциального давления кислорода - рО2 исх, максимальный уровень напряжения кислорода - рО2 макс, время доставки кислорода к тканям - tдоставки , время подъема полярографической кривой до максимального значения - tподъема . С помощью этих показателей можно оценить не только степень гипоксии, но и способность утилизации кислорода тканями.
В норме парциальное напряжение кислорода в тканях пародонта составляет 38-40 мм рт.ст. При проведении кислородной пробы уровень парциального давления кислорода в интактном пародонте возрастает до 176 мм рт.ст. (Лемецкая Т.И., 1998).
Уже на начальных стадиях воспаления отмечается недостаточная оксигенация тканей пародонта и наблюдается снижение скорости потребления кислорода. С развитием воспалительного процесса происходит нарастание гипоксии тканей пародонта (Вольвач С.И., 1984; 1993; Кречина Е.К., 1988; Улитовский С.Б., 2000).
Эхоостеометрия
Ультразвуковая остеометрия (эхоостеометрия) - метод количественной оценки состояния плотности костной ткани путем измерения времени прохождения ультразвуковых колебаний через исследуемый участок кости. Данный метод основан на том, что скорость прохождения звука в разных средах различна и зависит от плотности: чем плотнее среда, тем быстрее проходит в ней звук, и наоборот. Эхоостеометрия отличается большой чувствительностью к изменениям минеральной насыщенности костной ткани, поэтому позволяет получить объективную информацию о плотности кости и оценить ее механические (прочностные) свойства в конкретном участке.
Ультразвуковую остеометрию проводят с помощью эхоостеометра ЭОМ-01Ц (рис. 10-46, см. цв. вклейку). Радиоимпульс частотой 1,2 МГц поступает на передающую ультразвуковую головку (УЗГ-1), с помощью которой зондирующий сигнал передается через мягкие ткани в кость. Пройдя участок кости, сигнал возвращается в прибор для измерения.
С помощью этого метода можно измерить плотность костной ткани альвеолярного отростка. Показатель определяют для верхней и нижней челюстей. У здоровых людей без патологических изменений в тканях пародонта скорость распространения ультразвуковых волн на верхней челюсти составляет в среднем 3100 м/с, на нижней челюсти - 3320 м/с. У лиц с заболеваниями пародонта показатели эхоостеометрии уменьшаются с 2950 м/с при незначительных клинических проявлениях до 2450-2500 м/с - при тяжелой форме пародонтита. По изменению этих показателей можно оценить и степень нарушений, и динамику процесса, и эффективность проведенного лечения.
Сроки проведения повторных функциональных исследований отличаются от сроков проведения иммунологических и биохимических контролей, поскольку именно с сосудистыми изменениями связана клиническая динамика. Что касается эхоостеометрии, то на этот метод распространяются закономерности, правомерные для иммунологических и биохимических, так как процессы реминерализации не являются скоротечными.
Таким образом, существующие на сегодня методы позволяют специалисту получить достаточно разностороннюю информацию о состоянии пародонта. При этом выбор конкретных методов должен определяться тем, какое конкретно явление предполагает изучить врач или исследователь. Если использование клинических показателей состояния пародонта обязательно в связи с увеличивающейся ответственностью врача за свою работу, то выбор лабораторных методов во многом зависит от реальных возможностей и от компетенции специалиста в области этиологии и патогенетических механизмов развития патологических изменений в пародонте. Только в таком случае существующие методы могут обеспечить необходимую и самую значимую информацию как для качественной диагностики патологического процесса, так и в целях объективизации хода лечебного процесса, своевременной его коррекции, а также использоваться в качестве прогностических критериев.
СПИСОК ЛИТЕРАТУРЫ
-
Безрукова И.В., Грудянов А.И. Агрессивные формы пародонтита. - М., МИА, 2002.
-
Григорьян А.С., Грудянов А.И., Рабухина Н.А., Фролова О.А. Болезни пародонта. - М., 2004.
-
Грудянов А.И., Рабухина Н.А., Фролова О.А. Болезни пародонта: патогенез, диагностика, лечение. - 2004.
-
Дмитриева Л.А. Современные аспекты клинической пародонтологии. - М.: МЕД-пресс, 2001.
-
Заболевания пародонта / Под ред. Л.Ю. Ореховой. - М.: ПолиМедиаПресс, 2004.
-
Логинова Н.К., Кречина Е.К. Микроциркуляция в тканях пародонта // Стоматология. - 1998. - Т. 1. - № 77. - С. 25-27.
-
Николаева Е.Н., Царев В.Н., Щербо С.Н. и др. Применение новой тест-системы, основанной на полимеразной цепной реакции, в пародонтологии // Институт стоматологии. - 2004. - Т. 25. - № 4. - С. 63-66.
-
Пародонтит XXI век / Под ред. О.О. Янушевича, Л.А. Дмитриевой, З.Э. Ревазовой. - М.: ГЭОТАР-Медиа, 2016.
-
Пародонтологическая азбука / Под ред. П. Феди, А. Вернино, Д. Грей.
-
Пародонтология / Под ред. Г.Ф. Вольф, Э.М. Ратейцхак, К. Ратейцхак. - М.: МЕДпресс-информ, 2008.
-
Рабухина Н.А., Аржанцев А.П. Рентгендиагностика в стоматологии. - М.: МИА, 1999.
-
Терапевтическая стоматология. Национальное руководство / Под ред. Л.А. Дмитриевой, Ю.М. Максимовского. - М.: ГЭОТАР-Медиа, 2009.
-
Терапевтическая стоматология: учебник: в 3 ч. / Под ред. Г.М. Барера. - М.: ГЭОТАР-Медиа, 2008. - Ч. 2. Болезни пародонта.
-
Цепов Л.М., Николаев А.И. Диагностика и лечение заболеваний пародонта. - М.: МЕДпресс-информ., 2002.
-
Carranza F.A., Newman M.G. Clinical Periodontology. - Philadelphia, W.B. Saunders Co., 1996.
-
Fuchs M. Periodontal index // Czas. Stomatol. - 1954. - Vol. 7. - N. 1. - P. 1-5.
-
Magnusson I., Clark W. Automatic probe technology-saving time and improving accuracy // Calif. Dent. Assoc. J. - 1990. - Vol. 18. - P. 25-28.