Российские клинические рекомендации. Ревматология / Е. Л. Насонов - Москва : ГЭОТАР-Медиа, 2017. - 464 с. - ISBN 978-5-9704-4261-6 |
Аннотация
Издание содержит клинические рекомендации по наиболее распространенным ревматическим заболеваниям и синдромам, подготовленные Ассоциацией ревматологов России. Они детально описывают действия врача по диагностике, лечению, профилактике и реабилитации. Соблюдение международной методологии при подготовке клинических рекомендаций гарантирует их современность, достоверность, обобщение лучшего мирового опыта и знаний, применимость на практике. Поэтому клинические рекомендации имеют преимущества перед традиционными источниками информации (учебники, монографии, руководства) и позволяют врачу принимать обоснованные клинические решения. Клинические рекомендации по ревматологии предназначены практикующим врачам-ревматологам, терапевтам, врачам всех специальностей, студентам старших курсов медицинских вузов.
ВВЕДЕНИЕ
Системная склеродермия (ССД), или прогрессирующий системный склероз, - представитель склеродермической группы болезней, включающей также очаговую склеродермию, диффузный эозинофильный фасциит, склеродерму Бушке, индуцированные формы склеродермии и псевдосклеродермические синдромы. Прогрессирующее течение ССД приводит к развитию необратимых распространенных фиброзных изменений и нарушению функций органов, что определяет высокую инвалидизацию больных и общий плохой прогноз болезни. Заболеваемость составляет 3-20 случаев на 1 млн населения в год, распространенность - 30-300 случаев на 1 млн. ССД чаще встречается у женщин (соотношение 5-7:1), с дебютом в возрасте 30-60 лет. Лечение больных ССД должно быть по возможности ранним, комплексным и проводится в зависимости от клинической формы, скорости прогрессирования заболевания и выраженности органной патологии. Необходимо длительное лечение, которое может быть пожизненным.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
ССД, или прогрессирующий системный склероз, - полиорганное заболевание, в основе которого лежат иммунные нарушения и вазоспастические сосудистые реакции по типу феномена Рейно, сопровождающиеся активацией фиброзообразования и избыточным отложением компонентов внеклеточного матрикса (коллагена) в тканях и органах.
КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЯ
Клинические формы ССД.
-
Диффузная форма - имеет острое начало и быстропрогрессирующее течение. Поражение кожи начинается с пальцев и распространяется выше локтевых и коленных суставов, захватывая кожу лица, груди, живота. В дебюте - часто артрит, миозит, лихорадка и значительная потеря массы тела. Рано вовлекаются жизненно важные органы: сердце, легкие, почки и ЖКТ. Характерно обнаружение антител к топоизомеразе I (Scl-70). Пятилетняя выживаемость составляет 50-60%.
-
Лимитированная форма - проявляется феноменом Рейно, а первые клинические признаки поражения кожи (в области кистей, стоп и лица) появляются в среднем через 5 лет от начала феномена Рейно. Преобладают ишемические сосудистые расстройства на пальцах (рубчики и изъязвления, уменьшение объема мягких тканей дистальных фаланг). Склеротическое поражение внутренних органов выражено умеренно, примерно в 6-10% случаев обнаруживают ЛАГ. Характерно обнаружение антицентромерных антител. Течение медленнопрогрессирующее и относительно доброкачественное. Пятилетняя выживаемость составляет 85-90%.
-
ССД без склеродермы, или висцеральная форма, - болезнь имеет все характерные проявления, кроме уплотнения кожи. К самым частым проявлениям относят феномен Рейно, фиброзирующий процесс в паренхиме легких и поражение сердца.
-
Ювенильная ССД - около 10% заболевают в детском возрасте. У детей реже встречаются феномен Рейно и поражение внутренних органов, поражение кожи часто представлено очаговым или линейным поражением, гемиформами. Специфичные для ССД иммунологические маркеры встречаются только у половины больных. Прогноз более благоприятный, чем у заболевших в возрасте старше 16 лет.
-
Перекрестная форма - при которой у больного ССД одновременно имеются признаки другого РЗ, удовлетворяющего соответствующим критериям диагноза: РА, дерматомиозита (ДМ)/полимиозита (ПМ), СКВ и др.
Варианты течения.
Варианты течения, отражающие темпы прогрессирования, имеют основное значение в выборе тактики ведения больного.
-
Острое, быстропрогрессирующее - развитие генерализованного фиброза кожи и внутренних органов в первые 1-2 года от начала заболевания, быстро приводящее к органной недостаточности (легких, почек, сердца, ЖКТ).
-
Подострое - умеренное прогрессирование заболевания с признаками иммунного воспаления (плотным отеком кожи, миозитом, артритом), нередки перекрестные формы.
-
Хроническое, медленнопрогрессирующее течение с преобладанием сосудистой патологии, нарастанием периферических ишемических расстройств (язвы, некрозы), умеренных кожных проявлений (склеродактилия, «склеродермическое» лицо) и висцеральной патологии [поражение ЖКТ, интерстициальное поражение легких (ИПЛ), ЛАГ].
Активность заболевания.
-
Высокая - преобладают экссудативные, острые и подострые, интерстициальные и сосудистые проявления в виде плотного отека (индурации) кожи, эритемы и капилляритов, экссудативного полиартрита, плеврита, интерстициальной пневмонии, миокардита, эзофагита и/или дуоденита, почечной патологии (острая склеродермическая нефропатия) и др. Определяют повышение СОЭ, CРБ, гипергаммаглобулинемию, снижение компонентов комплемента.
-
Умеренная - фиброзные изменения различной локализации с преобладанием пролиферации: индурация кожи, индуративно-пролиферативный полиартрит, адгезивный плеврит, кардиосклероз, склеродермический эзофагит, дуоденит, субклиническая нефропатия и др.
-
Низкая - преимущественно функциональные, дистрофические и склеротические изменения различной локализации, сосудистые расстройства.
Стадии.
-
Очень ранняя (или доклиническая), когда у больного с феноменом Рейно выявляют позитивный АНФ [>1:320 в непрямой реакции иммунофлюоресценции (НРИФ)] и/или «склеродермические» аутоантитела, а также склеродермический тип изменений при капилляроскопии.
-
Антиядерные антитела или АНФ появляются на доклинической стадии, и за время болезни могут быть обнаружены у подавляющего большинства пациентов. Специфичными для ССД считают антицентромерные антитела (частота выявления - 10-20%), Scl-70 (20- 30%) и антитела к полимеразе III рибонуклеиновой кислоты (РНК) (4-6%). Обычно больной имеет только один тип аутоантител, не меняющийся в процессе развития болезни.
-
-
Начальная, когда, кроме феномена Рейно, выявляют 1-3 клинически очевидные локализации болезни: отек кистей или склеродактилию, гипотонию пищевода, телеангиэктазии, дигитальные рубчики и др.
-
Стадия развернутых клинических появлений, отражающих системный характер процесса.
-
Поздняя (терминальная) - при развитии необратимой недостаточности жизненно важных органов.
Осложнения.
ДИАГНОСТИКА И ЛЕЧЕНИЕ
Примеры формулировок клинических диагнозов.
-
ССД острого течения, диффузная форма, ранняя стадия, активность III степени: феномен Рейно (дигитальные язвы, некроз ногтевой фаланги III пальца левой кисти), склеродактилия, ИПЛ, кардиопатия (нарушения ритма и проводимости), гипотония пищевода, эрозивный эзофагит. Серопозитивность по антителам к Scl-70. Дыхательная недостаточность I степени.
-
ССД подострого течения, лимитированная форма, активность II степени: феномен Рейно, склеродактилия, полиартрит (неэрозивный), миопатия, поражение сердца (миокардит?), ЖКТ. Позитивность по АНФ (в высоком титре).
-
ССД хронического течения, лимитированная форма, активность минимальная: феномен Рейно, склередема (отек кистей), телеангиэктазии, ЛАГ, гипотония пищевода. Позитивность по антицентромерным антителам. Сердечная недостаточность II степени.
-
ССД, доклиническая стадия: феномен Рейно, иммунологические (+АНФ) и капилляроскопические (склеродермического типа) нарушения.
Диагноз/группа диагнозов в соответствии с МКБ-10.
Виды, формы, условия оказания медицинской помощи
Виды оказания медицинской помощи - специализированная, в том числе высокотехнологичная, а также скорая.
Формы медицинской помощи - плановая, неотложная.
Условия оказания помощи - амбулаторно, в дневном стационаре, стационарно.
ДИАГНОСТИКА И ЛЕЧЕНИЕ
Диагностика очень ранней, или доклинической, стадии системной склеродермии
Подозрение на раннюю ССД должно возникнуть у врача, если при осмотре или в анамнезе у больного имеется феномен Рейно, особенно в сочетании с отечностью кистей. Такому больному необходимо определить в сыворотке крови АНФ. Наличие триады - феномена Рейно, отека кистей и позитивного теста на АФН - служит основанием для направления пациента на консультацию к ревматологу.
На рис. 6.1 представлен алгоритм диагностики доклинической стадии ССД.
После физикального осмотра ревматологу следует направить больного на видеокапилляроскопию и определение «склеродермических» аутоантител. При обнаружении как минимум одного из этих предикторов ССД пациенту устанавливается диагноз очень раннего системного склероза, и он должен наблюдаться ревматологом. В план ведения больного следует включить дополнительные исследования для выявления возможной патологии внутренних органов:
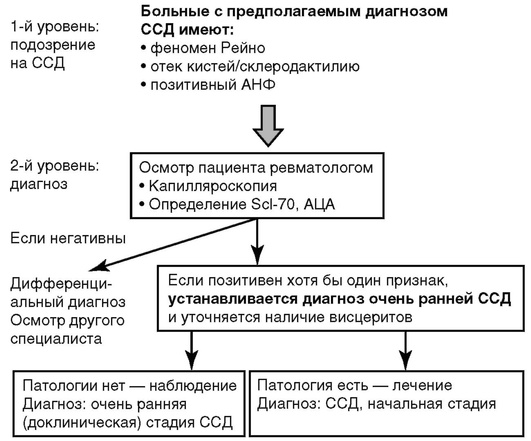
Рис. 6.1. Алгоритм диагностики ранней (доклинической) стадии системной склеродермии
-
мультиспиральную КТ органов грудной клетки для исключения ИПЛ или (что менее предпочтительно из-за низкой чувствительности) рентгенографию органов грудной клетки;
-
функциональные легочные тесты - спирометрию и определение диффузионной способности легких для выявления рестриктивных и других вентиляционных нарушений;
-
исследование пищевода (манометрию или рентгенографию пищевода или фиброгастроскопию - для оценки тонуса нижнего сфинктера пищевода, выявления гипотонии, гастроэзофагеального рефлюкса, эзофагита и др.);
-
электрокардиографию и эхокардиографию для уточнения кардиальной патологии - нарушений ритма и проводимости, очаговых изменений миокарда, исключения ЛАГ.
Критерии диагноза ССД.
Для постановки диагноза ССД рекомендуется применение классификационных критериев прогрессирующего системного склероза (ACR/ EULAR, 2013) (табл. 6.1).
Таблица 6.1. Классификационные критерии системной склеродермии
| Параметры | Варианты признаков | Баллы |
|---|---|---|
Проксимальная склеродерма: симметричное уплотнение и утолщение (индурация) кожи обеих рук выше пястно-фаланговых суставов |
- |
9 |
Уплотнение и утолщение кожи пальцев* |
Склередема. Пальцы дистальнее пястно-фаланговых суставов |
2 4 |
Дигитальная ишемия* |
Язвочки Рубчики |
2 3 |
Телеангиэктазии |
- |
2 |
Капилляроскопические изменения |
- |
2 |
ЛАГ и/или ИПЛ |
- |
2 |
Феномен Рейно |
- |
3 |
Склеродермические аутоантитела (анти ScL-70, антицентромерные, к РНК-полимеразе III) |
- |
3 |
* При наличии двух признаков в расчет принимается большее значение.
Cогласно этим критериям, пациент классифицируется как имеющий достоверный диагноз ССД, если суммарная оценка параметров равна или превышает 9 баллов.
Комментарии к табл. 6.1.
-
Склередема, или отек кистей, - увеличение массы мягких тканей пальцев рук из-за отечности кожи, сопровождается уменьшением выраженности кожного рисунка и разглаживанием складок кожи.
-
Склеродактилия - уплотнение кожи пальцев рук дистальнее пястно-фаланговых суставов, сгибательные контрактуры пястно-фаланговых суставов за счет периартикулярного фиброза, уменьшение объема мягких тканей концевых фаланг, ограничение объема движений и силы сжатия кистей.
-
Дигитальные рубчики и язвочки - расположенные в области дистальной фаланги или проксимального межфалангового сустава рубцовые изменения кожи или дефекты, образовавшиеся в результате ишемии, а не травмы или других экзогенных причин.
-
Феномен Рейно - эпизоды преходящей дигитальной ишемии вследствие вазоконстрикции дигитальных артерий, прекапиллярных артериол и кожных артериовенозных шунтов под влиянием холодной температуры и эмоционального стресса.
-
Телеангиэктазии - видимые пятнисто-расширенные поверхностные кровеносные сосуды, которые исчезают при надавливании и медленно заполняются, когда давление уменьшается. Телеангиэктазии при ССД округлой формы, хорошо отграничены друг от друга и могут локализоваться как на коже, так и на слизистых оболочках.
-
Видеокапилляроскопия ногтевого ложа - неинвазивный метод визуального исследования капилляров in vivo, отличается простотой исполнения и не требует дорогостоящего оборудования или расходных материалов. Для исследования достаточно обычного светового микроскопа и осветительного устройства. Объектом исследования являются капилляры сосочков папиллярной дермы. Признаки микроангиопатии: изменение плотности капилляров, расширение капилляров, аваскулярные участки, микрогеморрагии, неоангиогенез и дезорганизация архитектоники капиллярной сети ногтевого ложа.
-
Диагноз ЛАГ. Методом скрининга больных ЛАГ является трансторакальная доплеровская эхокардиография. Более чем у 90% больных ЛАГ выявляется трикуспидальная регургитация, что позволяет рассчитать систолическое давление в легочной артерии с помощью модифицированного уравнения Бернулли. Расчетное давление в легочной артерии в наибольшей мере коррелирует с результатами катетеризации правых отделов сердца и является надежным неинвазивным методом контроля за динамикой ЛАГ. «Золотым стандартом» диагностики ЛАГ является катетеризация правых отделов сердца. Метод позволяет оценивать такие характеристики, как легочное сосудистое сопротивление и давление заклинивания в легочной артерии. Серологическими маркерами ЛАГ являются повышение уровня мозгового натрийуретического пептида и N-терминального мозгового натрийуретического пропептида.
Алгоритм «Обнаружение» для скрининга больных ССД на наличие ЛАГ представлен на рис. 6.2.
Факторы риска неблагоприятных исходов, определяющих тактику ведения больных
Тактику ведения определяют следующие факторы.
-
К общим факторам риска неблагоприятного прогноза при ССД относят пожилой возраст дебюта заболевания, мужской пол, быстрое прогрессирование, диффузную форму, высокую степень уплотнения и распространения кожи в дебюте, раннее вовлечение внутренних органов, обнаружение Scl-70.
-
Прогноз ССД ухудшает прогрессирование ИПЛ. Риск прогрессирования ИПЛ выше у больных с низкими показателями функциональных легочных тестов при первом обращении и большим объемом распространения фиброзирующего процесса по данным мультиспиральной КТ органов грудной клетки. Назначение лечения иммуносупрессивными препаратами показано больным с одышкой в первые 5-7 лет от начала болезни, если по данным мультиспиральной КТ органов грудной клетки объем поражения легких превышает 20%, и/или форсированная жизненная емкость легких <70% должной, и/или отмечено снижение форсированной жизненной емкости легких на М0% исходной за предшествующие 3-12 мес.
-
Прием ГК у больных ССД ассоциируется с более высоким риском острого повреждения почек, чем у больных, не получавших ГК. Именно поэтому при назначении ГК необходим тщательный контроль за АД и функциями почек. Следует с большой осторожностью назначать ГК больным ССД с факторами риска развития склеродермического почечного криза, к которым относятся диффузная форма, ранняя стадия (особенно 1-3-й годы), быстрое прогрессирование кожного синдрома и суставных контрактур, мужской пол, пожилой возраст, наличие антител к рибонуклеопротеазе III, прием больших доз ГК (>15 мг/сут).
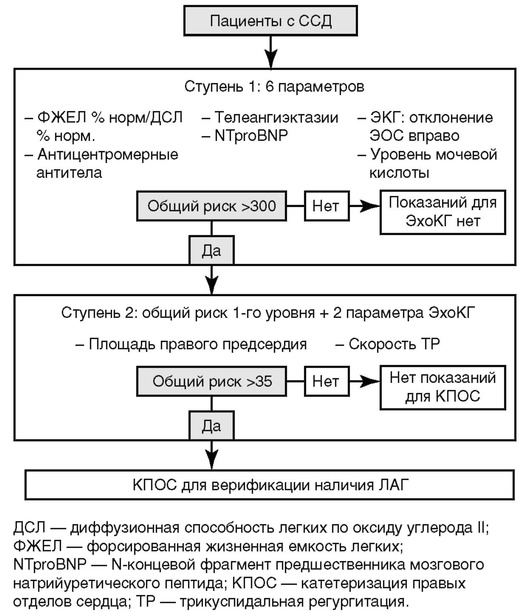
Рис. 6.2. Алгоритм «Обнаружение» для скрининга больных системной склеродермией на наличие легочной артериальной гипертензии
-
Эффективность приема ингибиторов ангиотензин-превращающего фермента в целях профилактики развития склеродермического почечного криза не доказана и, возможно, ухудшает последующее его течение. Однако при наличии показаний, таких как АГ, выраженный феномен Рейно, ХСН, протеинурия, назначение ингибиторов ангиотензин-превращающего фермента целесообразно.
Модели пациента
-
Больной ССД в любом возрасте с быстрым прогрессированием, поражением внутренних органов и неблагоприятными факторами прогноза в начальной и развернутой стадиях болезни - специализированная, в том числе высокотехнологичная, медицинская помощь в условиях стационара с переходом на этап амбулаторной помощи и/или дневного стационара.
-
Больной ССД в любом возрасте с медленным прогрессированием без тяжелого поражения внутренних органов - специализированная медицинская помощь в амбулаторных условиях и/или условиях дневного стационара.
-
Больной с очень ранней ССД - специализированная медицинская помощь в условиях стационара с переходом на этап амбулаторной помощи и/или дневного стационара.
Методы лечения прогрессирующей системной склеродермии
Основные цели фармакотерапии:
Профилактика обострений.
-
Пациентам рекомендуют отказаться от курения, потребления кофе и лекарственных средств, провоцирующих вазоспазм, носить теплую одежду, избегать воздействия холода и вибрации, а также избегать психоэмоциональных перегрузок (уровень доказательности С).
-
Для профилактики обострений и генерализации процесса необходимо как можно более раннее выявление заболевания и своевременное активное лечение в стационаре, а затем в амбулаторных условиях. Рекомендуется обращаться к врачу при ухудшении самочувствия и в назначенные сроки, оптимально - 1 раз в 6 мес; строго соблюдать рекомендованный режим, диету и лечение; не изменять дозы активно действующих медикаментозных средств без согласования с врачом.
-
Важно проводить реабилитационную терапию и разумное закаливание организма путем систематической ЛФК, повторных курсов массажа, прогулок на свежем воздухе. Правильное своевременное лечение и трудоустройство улучшают прогноз заболевания в целом, позволяют сохранить работоспособность и поддержать жизненный уровень больных ССД. При активном, остром и подостром течении заболевания больные длительно нетрудоспособны, поэтому при показаниях их переводят на инвалидность, а при хроническом течении они ограниченно трудоспособны и должны быть освобождены от тяжелой физической работы, охлаждения и температурных колебаний, соприкосновения с химическими агентами, металлом и т.д.
Феномен Рейно и ишемические дигитальные язвы.
-
Блокаторы кальциевых каналов, ингибиторы фосфодиэстеразы 5-го типа (ФДЭ5) и простаноиды, которые уменьшают частоту, продолжительность и выраженность атак феномена Рейно.
-
Препаратами первого ряда являются блокаторы кальциевых каналов дигидропиридинового ряда, в первую очередь нифедипин (уровень доказательности А). Нифедипин назначают в дозе 20-60 мг/сут в 2-3 приема внутрь. Для длительного приема предпочтительными являются длительно действующие антагонисты кальция.
-
Применяют ингибиторы ФДЭ5 (уровень доказательности А), которые рекомендуется назначать при недостаточном эффекте антагонистов кальция или их неэффективности. Ингибитор фосфодиэстеразы 5-го типа силденафил назначают по 50-100 мг/сут, оптимальным считают прием по 20-25 мг 3 раза в сутки.
-
Для лечения тяжелого феномена Рейно, при неэффективности антагонистов кальция и ингибиторов фосфодиэстеразы 5-го типа назначают простаноиды для внутривенного применения - илопрост (уровень доказательности А) и аналог простагландина Е алпростадил (уровень доказательности С). Илопрост для внутривенного введения не только снижает частоту и выраженность атак феномена Рейно, но и оказывает положительное действие на заживление, поэтому рекомендуется для лечения активных дигитальных язв (уровень доказательности А). Илопрост назначают внутривенно из расчета 0,5- 2,0 нг/кг в минуту по 20 (реже по 50 мкг) на инфузию (продолжительностью >6 ч) 3-5-дневными курсами 2-3 раза в год. Альпростадил назначают курсами по 10-15 введений 2-3 раза в год по 20-60 мкг на внутривенную инфузию (длительностью <3 ч). В особо тяжелых случаях возможна комбинация простаноидов с другими вазоактивными препаратами.
-
Для лечения феномена Рейно дополнительно применяют селективный ингибитор обратного захвата серотонина флуоксетин (уровень доказательности С), который назначают в таблетках (20 мг/сут).
-
Для заживления ишемических трофических расстройств, в первую очередь дигитальных язв и некрозов, при неэффективности пероральной терапии вазодилататорами других групп рекомендуется применение илопроста внутривенно по схемам, приведенным выше (уровень доказательности А), или ингибиторов ФДЭ5 (уровень доказательности А). Силденафил применяют в дозе 100 мг (возможно увеличение до 200 мг) в сутки. Имеются данные о высокой эффективности тадалафила в дозе 20 мг/сут как для лечения, так и предупреждения развития дигитальных язв, но имеющейся информации пока недостаточно для использования его в широкой практике.
-
Для предупреждения развития новых язв, особенно у больных с множественными дигитальными язвами, которые рецидивируют несмотря на лечение антагонистами кальция, ингибиторами ФДЭ5 и простаноидами, рекомендуется неселективный блокатор эндотелиновых рецепторов 1-го типа бозентан (уровень доказательности A). Бозентан назначают в таблетках по 62,5 мг дважды в сутки в течение 4 нед, после чего дозу увеличивают до 125 мг 2 раза в сутки и продолжают в течение 12-20 нед.
-
-
Одновременно с вазодилататорами рекомендуется прием препаратов, подавляющих агрегацию тромбоцитов [низкие дозы ацетилсалициловой кислоты (Аспирина♠)].
-
Для уменьшения болей при дигитальных язвах применяют НПВП, парацетамол и слабые опиоиды (трамадол) в адекватных дозах. Инфицированные дигитальные язвы требуют местного и/или системного применения антибиотиков широкого спектра действия, которые целесообразно назначать после посева содержимого раны на микрофлору и чувствительность к антибиотикам.
Алгоритм лечения ишемических дигитальных язв приведен на рис. 6.3.
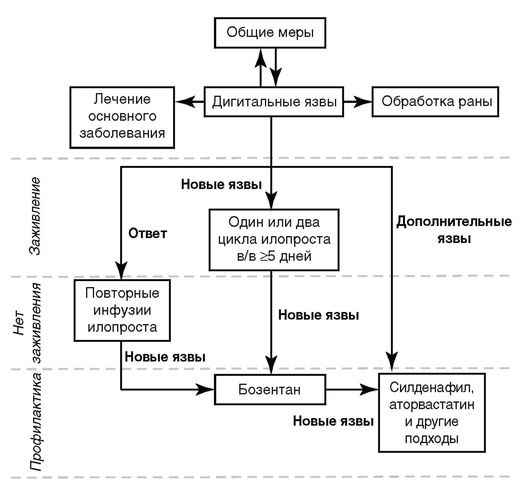
Рис. 6.3. Алгоритм лечения дигитальных язв при системной склеродермии
Легочная артериальная гипертензия.
ЛАГ - повышение давления в легочной артерии выше 25 мм рт.ст. в покое (при катетеризации правых отделов сердца), обусловлена поражением артериального русла легких. Лечение ЛАГ включает средства традиционной терапии: диуретики, сердечные гликозиды (при возникновении наджелудочковых нарушений ритма). При выраженной гипоксемии (сатурации <90%) показана кислородотерапия. Антикоагулянты назначают только при тромботических осложнениях. При ЛАГ не рекомендуется назначение β-адреноблокаторов, ингибиторов ангиотензин-превращающего фермента, антагонистов рецепторов ангиотензина II (ивабрадина).
-
ЛАГ-специфическую терапию применяют только после уточнения диагноза и генеза ЛАГ и осуществляют в соответствии с международными рекомендациями. ЛАГ-специфическая терапия способствует улучшению переносимости физических нагрузок, замедлению прогрессирования болезни за счет регресса изменений в легочных сосудах, приводит к улучшению качества жизни и выживаемости (уровень доказательности В) (экстраполяция из данных РКИ, включивших больных ЛАГ, ассоциированной с системными РЗ).
-
Препараты для ЛАГ-специфической терапии способствуют вазодилатации и снижению давления в легочной артерии посредством разных механизмов и включают антагонисты рецепторов эндотелина-1 (бозентан, мацитентан, амбризентан), ингибиторы ФДЭ5 (силденафил, тадалафил) и риоцигуат.
-
Антагонисты рецепторов эндотелина-1 подавляют его вазоконстриктивное действие за счет связывания с рецепторами А- и В-типа или только с рецепторами А-типа. К первым относятся бозентан и мацитентан, а представителем селективных антагонистов является амбризентан. Бозентан рекомендуется в стартовой дозе 62,5 мг 2 раза в сутки. Через 4 нед, при хорошей переносимости, увеличивают дозы до 125 мг 2 раза в сутки.
-
Ингибиторы ФДЭ5 подавляют инактивацию циклического гуанозинмонофосфата в клетках. Силденафил применяют в суточной дозе 50-200 мг. К применению одобрена доза силденафила 20 мг 3 раза в сутки. Тадалафил является селективным ингибитором ФДЭ5, который принимают 1 раз в сутки (2,5-4,0 мг). Варденафил также относится к селективным ингибиторам ФДЭ5 и назначается по 20 мг 2 раза в сутки.
-
Стимуляторы растворимой гуанилатциклазы повышают синтез гуанозинмонофосфата. Препаратом этого класса является риоцигуат, который назначают внутрь 3 раза в сутки по 1 мг (максимальная суточная доза - 7,5 мг). Сочетание стимуляторов гуанилатциклазы и ингибиторов ФДЭ5 противопоказано из-за артериальной гипотензии и других серьезных побочных эффектов.
-
Для лечения ЛАГ применяют аналоги простациклина (уровень доказательности В). Илопрост для лечения ЛАГ доступен в виде инфузии для внутривенного введения, перорального использования и аэрозоля. Ингаляционный илопрост эффективно снижает давление в легочной артерии. В сутки требуется от 6 до 12 ингаляций для поддержания стабильного эффекта. Период полувыведения илопроста составляет 20-25 мин, продолжительность действия - 45-60 мин. При использовании ультразвукового небулайзера продолжительность ингаляции составляет 5 мин. Аналогами простациклина являются также эпопростенол℘ в инфузионной форме (уровень доказательности А) и трепростинил℘ (для внутривенного и подкожного введения и в виде аэрозоля).
-
Выбор терапии зависит от клинического состояния и тяжести, которые классифицируются по функциональной шкале ВОЗ.
-
К I ФК относят бессимптомных пациентов или с симптомами, минимально ограничивающими обычную физическую активность, а к IV ФК относят пациентов с наибольшими ограничениями физической активности, которые возникают даже в покое.
-
У больных с ФК препаратами первой линии являются бозентан и силденафил. Кроме этих препаратов, у больных с III ФК может быть применен ингаляционный илопрост. При развитии IV ФК, как правило, назначают комбинированную терапию этими препаратами.
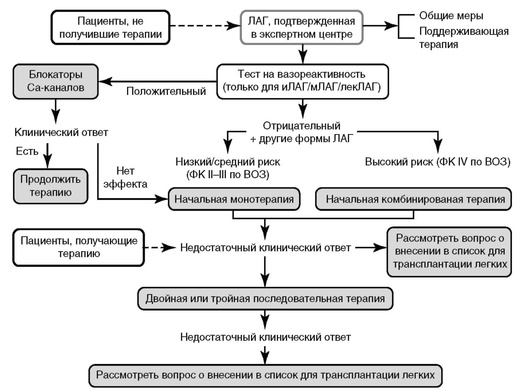
Рис. 6.4. Схема определения терапии легочной артериальной гипертензии
Поражение кожи.
Основная цель фармакотерапии поражения кожи при ССД - уменьшение выраженности и распространенности уплотнения кожи.
-
Для лечения ранней диффузной ССД рекомендуется МТ в дозе 10- 15 мг/сут (уровень доказательности А).
-
Имеются данные об уменьшении выраженности индурации кожи на фоне применения ММФ, ЦФг и АЗА.
-
Пеницилламин (250-500 мг/сут) рекомендуется на ранней стадии (в течение первых 3-5 лет болезни) или при нарастании выраженности и распространенности уплотнения кожи у больных диффузной ССД (уровень доказательности С).
-
При прогрессирующем диффузном поражении кожи применяют ГК в виде монотерапии или в сочетании с вышеперечисленными препаратами.
Интерстициальное поражение легких.
-
Выбор терапии при поражении легких осуществляется с учетом исходной тяжести ИПЛ и при очевидном риске прогрессирования (рис. 6.5).
-
Контроль за эффективностью терапии осуществляют по уровню форсированной жизненной емкости легких (уровень доказательности А), которую необходимо определять не реже 1 раза в 6 мес (уровень доказательности В).
-
Об эффективности терапии свидетельствуют стабилизация или повышение уровня форсированной жизненной емкости легких. Для лечения ИПЛ при ССД применяют ГК внутрь в дозе 10-15 мг/сут (уровень доказательности С) в сочетании с иммуносупрессантами.
-
Не выявлено достоверной ассоциации между улучшением показателей легочной функции и применением высоких доз ГК.
-
Основное место в лечении ИПЛ при ССД занимает ЦФ (уровень доказательности А) в сочетании с ГК.
-
ЦФ назначают внутривенно в дозе 500-750 мг/м2 в месяц или внутрь в дозе 1-2 мг/кг в сутки в зависимости от эффективности и переносимости препарата (уровень доказательности А). Способ введения ЦФ (внутрь или внутривенный) значимо не влияет на уровень изменения показателей функциональных легочных тестов и частоту побочных реакций. Длительность курса ЦФ определяется индивидуально в зависимости от клинической ситуации и переносимости, полагают, что она должна быть не менее 6 мес (уровень доказательности С). При хорошей переносимости препарата длительность терапии может составлять 12 мес и более до стабилизации интерстициального процесса в легких.
-
Применяют также ММФ, эффективность которого сравнима с эффективностью ЦФ (уровень доказательности А). ММФ назначают как в качестве индукционной терапии ИПЛ (в случае непереносимости или неэффективности, в том числе вторичной, ЦФ), так и в качестве поддерживающей после стабилизации легочного процесса на фоне терапии ЦФ. Лечение ММФ начинают с суточной дозы 1000 мг/сут (в два приема) в течение 2-4 нед, увеличивая ее до 2000-3000 мг/сут (в два приема) в случае хорошей переносимости (уровень доказательности С).
-
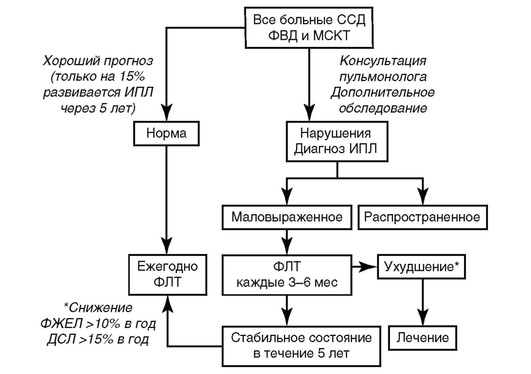
Рис. 6.5. Тактика ведения пациентов с интерстициальным поражением легких при системной склеродермии
-
В случае неэффективности или непереносимости терапии ЦФ и/или ММФ возможно применение АЗА (по 100 мг/сут) или ЦсА (в дозе, не превышающей 2,5 мг/кг в сутки) в течение 12-18 мес (уровень доказательности С).
-
Целесообразно применять только у больных тяжелой формой ССД с плохим прогнозом (быстропрогрессирующее течение в первые 4-5 лет болезни, диффузная форма с поражением внутренних органов и высоким риском развития органной недостаточности). Эффективность этого метода превосходит лечение ЦФ (уровень доказательности А).
-
Лечение проводят только в специализированных учреждениях, имеющих опыт трансплантации стволовых клеток.
Поражение почек.
-
Наиболее прогностически неблагоприятное проявление ССД - острая нефропатия по типу склеродермического почечного криза (острая склеродермическая почка), при которой летальность превышает 40-50%. Основные проявления склеродермического почечного криза - внезапное развитие острого повреждения почки и злокачественной АГ.
-
Критерии острого повреждения почек: увеличение уровня креатинина >26,5 ммоль/л (>0,3 мг/дл) в течение 48 ч или увеличение уровня сывороточного креатинина >1,5 раза от изначального уровня, достоверно или предположительно развившееся в течение 7 сут.
-
В 10-20% случаев диагностируется нормотензивный склеродермический почечный криз.
-
Лечение ГК, особенно в дозе более 15 мг/сут, ассоциируется с высоким риском развития склеродермического почечного криза (уровень доказательности С).
-
-
Препаратами первой линии в лечении склеродермического почечного криза являются ингибиторы ангиотензин-превращающего фермента. Агрессивная гипотензивная терапия ингибиторами ангиотензинпревращающего фермента в высоких дозах, начатая немедленно после установления диагноза, может стабилизировать или улучшить функции почек (уровень доказательности С).
-
Лечение начинают с каптоприла по 12,5-25,0 мг с титрованием дозы до максимальной (50 мг 3 раза в сутки) до снижения АД. Снижение АД проводят в течение 2-3 сут, но без выраженных колебаний его уровня. Резкое падение АД может привести к значительному снижению почечной перфузии и, как следствие, острому канальцевому некрозу. При недостаточной эффективности монотерапии ингибиторами ангиотензинпревращающего фермента к лечению добавляют гипотензивные препараты других групп (блокаторы кальциевых каналов, моксонидин, нитропруссид и др.).
-
Назначение диуретиков целесообразно только при наличии абсолютных показаний, таких как застойная сердечная недостаточность, в связи с их способностью усиливать высвобождение ренина.
-
Применения неселективных β-адреноблокаторов следует избегать.
-
При стабилизации АД можно перейти на прием ингибиторов ангиотензин-превращающего фермента длительного действия. При необходимости проводят заместительную почечную терапию.
-
Восстановление или улучшение функций почек после склеродермического почечного криза возможно в отдаленном периоде в срок до 2 лет. Если после этого срока сохраняется потребность в гемодиализе, следует ставить вопрос о трансплантации почки.
-
У пациентов с ССД необходимо регулярно проводить оценку функций почек. С этой целью у пациентов с ССД, как и в общей популяции, целесообразно определять скорость клубочковой фильтрации, используя расчетную формулу CKD-EPI (Ghronic Kidney Desease Epidemiology Collaboration).
Поражения ЖКТ.
Наиболее частые формы поражения ЖКТ при ССД - желудочно-пищеводный рефлюкс и гастроэзофагеальная рефлюксная болезнь. Последняя, проявляющаяся клинически и эндоскопически, требует постоянного лечения ингибиторами протонного насоса. Длительное лечение рефлюкса у больных ССД ИПП в высоких дозах безопасно и эффективно как в отношении симптомов, так и предотвращения эзофагита и стриктур. Если симптомы сохраняются, несмотря на проводимую терапию, рекомендуется проведение 24-часовой рН-метрии для оценки необходимости повышения дозы препаратов в целях нормализации кислотного рефлюкса, которая в ряде случаев может достигать 2-3 стандартных дневных доз.
-
Показаны дробное питание, сон на кровати с приподнятым головным концом, нежелательно ложиться в течение 2 ч после приема пищи, необходимо отказаться от приема жирной пищи, курения и приема алкоголя.
-
Медикаментозная терапия включает применение антисекреторных препаратов и прокинетиков.
-
При желудочно-пищеводном рефлюксе и для предупреждения язв пищевода и стриктур назначают ингибиторы протонного насоса (уровень доказательности В). Ингибиторы протонового насоса эффективнее снижают кислотность желудочного сока и уменьшают проявления гастроэзофагеальной рефлюксной болезни в сравнении с применением блокаторов Н2-рецепторов.
-
-
При нарушении моторики ЖКТ (дисфагии, раннем насыщении, отрыжке, псевдообструкции и др.) назначают прокинетики - метоклопрамид и домперидон, которые увеличивают давление нижнего пищеводного сфинктера, ускоряют эвакуацию содержимого из желудка и увеличивают перистальтику тонкой кишки (уровень доказательности С).
-
Прокинетический эффект дают эритромицин (100-150 мг 2 раза в сутки) и азитромицин (400-500 мг 1 раз в сутки) в течение 4 нед, которые уменьшают тошноту, рвоту и приступы болей в эпигастральной области.
-
Комбинация прокинетиков и антисекреторных препаратов улучшает состояние пациентов с рефлюкс-эзофагитом.
-
-
При развитии синдрома мальабсорбции, обусловленного избыточным бактериальным ростом, показана антибиотикотерапия (уровень доказательности D).
-
При синдроме мальабсорбции применяют следующие антибактериальные препараты: тетрациклин по 250 мг 4 раза в сутки, доксициклин по 0,1 г 2 раза в сутки, мономицин℘ по 100 мг 2 раза в сутки, амоксициллин + клавулановая кислота (Амоксиклав♠ ) по 875 мг 2 раза в сутки, цефалексин по 250 мг 4 раза в сутки, ципрофлоксацин по 500 мг 2 раза в сутки, норфлоксацин по 400 мг 2 раза в сутки, метронидазол по 250 мг 3 раза в сутки и др. Длительность курса - 10 дней, при недостаточной эффективности курс продлевают до 3-4 нед.
-
-
Хирургическое вмешательство, которое эффективно для лечения идиопатической гастроэзофагеальной рефлюксной болезни, при ССД показано пациентам с наиболее тяжелым течением этого состояния.
Поражение сердца.
Проявления кардиальной патологии обусловлены как собственно склеродермическим поражением сердца, так и ассоциацией с ЛАГ, системной АГ на фоне поражения почек, гипертонической болезни или других сопутствующих коморбидных состояний с вовлечением сердца (ИБС, атеросклероз и др.). При признаках воспаления (перикардите, миокардите) лечение проводят ГК, иммуносупрессантами. Одновременно используется весь арсенал сердечно-сосудистых препаратов с учетом их индивидуальной возможности снижать потребление миокардом кислорода, оказывать противоаритмическое и вазодилатирующее действие, улучшать диастолическую функцию миокарда и повышать толерантность к физическим нагрузкам без снижения сердечного выброса.
Поражения суставов.
Лечение поражения суставов при ССД сходно с терапией поражения суставов при РА. В зависимости от выраженности артрита назначают ГХ, с осторожностью при одновременном поражении легких - МТ или лефлуномид, а также СУЛЬФ в виде монотерапии при общей низкой активности болезни или в сочетании с низкими дозами ГК.
Воспалительная миопатия.
При развитии миопатии назначают ГК как в монотерапии, так и в сочетании с МТ. Дозы ГК, необходимые для лечения больных ССД с миопатией, могут быть ниже, чем при идиопатических воспалительных миопатиях (ИВМ), особенно у пациентов, позитивных по PM/Scl-антителам.
-
Необходимо учитывать, что высокие дозы ГК при ССД могут спровоцировать развитие склеродермического почечного криза.
-
В то же время при недостаточной эффективности монотерапии ГК рекомендуется назначение МТ или внутривенного иммуноглобулина в дозе 0,5-1,0 г/кг массы тела.
-
При неэффективности может быть проведен курс внутривенных инфузий метилпреднизолона по 250-500 мг в неделю (уровень доказательности D).
Применение ГИБП.
Имеется позитивный опыт применения при ССД ингибиторов ФНО-α, АБЦ, РТМ, антител к трансформирующему фактору роста-β1 (фрезолизумаба℘) и др.
-
Наибольший опыт накоплен в отношении моноклональных антител к CD20-антигену В-лимфоцитов - ритуксимаба (РТМ).
-
На фоне лечения РТМ отмечены уменьшение кожного фиброза и стабилизация или улучшение функций легких (уровень доказательности С).
-
У больных ССД РТМ применяют при неэффективности или невозможности проведения стандартной терапии иммуносупрессантами (назначенных по поводу поражения жизненно важных органов), при тяжелом течении заболевания с высокой активностью и неблагоприятными факторами прогноза (уровень доказательности С).
-
РТМ назначают по 2 г внутривенно через 6-12 мес, уменьшая дозу до 1,0-0,5 г при достижении эффекта. Лечение поводят в течение 2-4 лет.
-
Реабилитационные мероприятия
Основная цель реабилитации - восстановительное лечение и профилактика осложнений, направленные на уменьшение сосудистых осложнений и прогрессирование фиброза.
Реабилитация показана всем пациентам с минимальной (хроническая форма) и умеренной (подострая и обострение хронической формы) степенью активности. Реабилитационные мероприятия составляют физиотерапевт, врач ЛФК и ревматолог.
Комплекс реабилитационных мероприятий основывается на имеющихся в момент осмотра клинических проявлениях заболевания и их выраженности, степени активности, стадии развития, сопутствующей патологии и может быть представлен активной, умеренной или пассивной реабилитацией.
-
Активная реабилитация показана пациентам с хроническим течением заболевания, минимальной степенью активности (вазоспастические и трофические нарушения, СОЭ до 20 мм/ч). При активной реабилитации мероприятия включают ЛФК, массаж, физиотерапию, рефлексотерапию, трудотерапию, образовательные программы (уровень доказательства В/С). ЛФК состоит из комплекса упражнений для органов дыхания, внутренних органов, коррекции движения, мимики лица, гимнастики для кистей и стоп, занятий на тренажерах. Физиотерапевтические методы лечения включают электрофорез и ионофорез с сосудистыми, антиоксидантными, антифиброзными и противовоспалительными препаратами, парафином (уровень доказательности В/С). Местно на наиболее пораженные области (кисти, стопы и др.) рекомендуется использовать 15-25% раствор диметилсульфоксида в виде аппликаций, возможно его сочетание с сосудистыми и противовоспалительными препаратами. На курс - 10-20 аппликаций по 30-40 мин, при хорошей переносимости - повторные курсы (с интервалом 2-3 мес) в течение года. Возможно применение электропроцедур - электрофореза или ионофореза с гиалуронидазой (Лидазой♠) на кисти и стопы, использование ультразвука, лазерной терапии, акупунктуры и др.
-
Умеренная реабилитация показана пациентам с ССД при подострой и обострении хронической формы, с умеренной степенью активности (артралгии, артриты, адгезивный плеврит, кардиосклероз, СОЭ в пределах 20-35 мм/ч). Реабилитационные мероприятия состоят из ЛФК, трудотерапии, образовательных программ. ЛФК состоит из комплекса упражнений для органов дыхания, мимики лица, гимнастики для кистей и стоп.
-
Пассивная реабилитация показана пациентам с острым течением ССД, высокой степенью активности (лихорадка, полиартрит, миозит, кардиопатия, нефропатия, СОЭ более 35 мм/ч). Проводят психокоррекцию и ЛФК в частично постельном режиме.
Список литературы
-
Ревматология : клинические рекомендации / под ред. Е.Л. Насонова. М. : ГЭОТАР-Медиа. 2010. С. 523-558.
-
Гусева Н.Г. Системная склеродермия и псевдосклеродермические синдромы. М. : Медицина. 1993.
-
Avouac J., Fransen J., Walker U.A. et al. Preliminary criteria for the very early diagnosis of systemic sclerosis: results of a Delphi Consensus Study from EULAR Scleroderma Trials and Research Group // Ann. Rheum. Dis. 2011. Vol. 70, N 3. P. 476-481.
-
Van den Hoogen F., Khanna D., Fransen J. et al. 2013 classification criteria for systemic sclerosis: an American college of rheumatology/European league against rheumatism collaborative initiative // Ann. Rheum. Dis. 2013 Nov. Vol. 72, N 11. P. 1747-1755.
-
Minier T., Guiducci S., Bellando-Randone S. et al. Preliminary analysis of the very early diagnosis of systemic sclerosis (VEDOSS) EUSTAR multicentre study: evidence for puffy fingers as a pivotal sign for suspicion of systemic sclerosis // Ann. Rheum. Dis. 2014. Vol. 73, N 12. P. 2087-2093.
-
Kowal-Bielecka O., Landewe R., Avouac J. et al. EULAR recommendations for the treatment of systemic sclerosis: a report from the EULAR Scleroderma Trials and Research group (EUSTAR) // Ann. Rheum. Dis. 2009. Vol. 68, N 5. P. 620-628.
-
Ананьева Л.П. Лечение системной склеродермии с учетом национальных рекомендаций и рекомендаций Европейской лиги по борьбе с ревматизмом (EULAR) // Фарматека. 2014. № 10 (283). С. 79-86.
-
Kowal-Bielecka O., Fransen J., Jerome Avouac J. et al. Update of EULAR recommendations for the treatment of systemic sclerosis // Ann. Rheum. Dis. 2016 Nov 9.
-
Young A., Khanna D. Systemic sclerosis: a systematic review on therapeutic management from 2011 to 2014 // Curr. Opin. Rheumatol. 2015. Vol. 27, N 3. P. 241-248.
-
Stewart M., Morling J.R. Oral vasodilators for primary Raynaud’s phenomenon // Cochrane Database Syst. Rev. 2012. Vol. 7. CD006687.
-
Pope J., Fenlon D., Thompson A. et al. Iloprost and cisaprost for Raynaud’s phenomenon in progressive systemic sclerosis // Cochrane Database Syst. Rev. 1998. Vol. 2. CD000953. doi: 10.1002/14651858.
-
Pope J., Harding S., Khimdas S. et al. Agreement with guidelines from a large database for management of systemic sclerosis: results from the Canadian Scleroderma Research Group // J. Rheumatol. 2012. Vol. 39, N 3. P. 524-531.
-
Riemekasten G., Becker M., Seibold J.R. Vasodilators. EULAR Textbook on systemic sclerosis. 2013. P. 322-328.
-
Tingey T., Shu J., Smuczek J. et al. A meta-analysis of healing and prevention of digital ulsers (DU) in systemic sclerosis (SSc) // Arthritis Care Res. (Hoboken). 2013 April 1. doi: 10.1002/acr.22018.
-
Рекомендации ESC/ERS по диагностике и лечению легочной гипертензии 2015 г. // Рос. кардиол. журн. 2016. № 5 (133). С. 5-64.
-
Galie N., Hoeper M.M., Humbert M. et al. Committee for Practice Guidelines (CPG). Guidelines for the diagnosis and treatment of pulmonary hypertension: the Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT) // Eur. Heart J. 2009 Oct. Vol. 30, N 20. P. 2493-2537.
-
Sobanski V., Launay D., Hachulla E., Humbert M. Current Approaches to the Treatment of Systemic-Sclerosis-Associated Pulmonary Arterial Hypertension (SSc-PAH) // Curr. Rheumatol. Rep. 2016. Vol. 18, N 2. P. 10.
-
Волков А.В., Юдкина Н.Н., Николаева Е.В. и др. Бозентан: существенное увеличение продолжительности жизни пациентов с легочной артериальной гипертонией, ассоциированной с системными ревматическими заболеваниями // Тер. арх. 2014. Т. 86, № 5. С. 32-39.
-
Волков А.В., Юдкина Н.Н., Курмуков И.А. и др. Влияние силденафила на клинические проявления и гемодинамические показатели у больных легочной артериальной гипертензией, ассоциированной с системными ревматическими заболеваниями // Системные гипертензии. 2014. Т. 11, № 3. С. 61-66.
-
Волков А.В., Николаева Е.В., Юдкина Н.Н. и др. Влияние терапии силденафилом на выживаемость пациентов с легочной артериальной гипертензией, ассоциированной с системными заболеваниями соединительной ткани (результаты проспективного наблюдения) // Тер. арх. 2015. Т. 87, № 11. С. 62-67.
-
Николаева Е.В., Юдкина Н.Н., Курмуков И.А. и др. Клинико-гемодинамическая характеристика и возможности терапии у больных тяжелой легочной артериальной гипертензией IV функционального класса, ассоциированной с системными заболеваниями соединительной ткани // Тер. арх. 2015. Т. 87, № 5. С. 24-32.
-
Чазова И.Е., Авдеев С.Н., Царева Н.А. и др. Клинические рекомендации по диагностике и лечению легочной гипертонии // Тер. арх. 2014. Т. 86, 9. С. 4-23.
-
Clements P.J., Furst D.E., Wong W.K. et al. High-dose versus low-dose D-penicillamine in early diffuse systemic sclerosis: Analysis of a two-year, double-blind, randomized, controlled clinical trial // Arthritis Rheum. 1999. Vol. 42. P. 1194-1203.
-
Pope J.E., Bellamy N., Seibold J.R. et al. A randomized, controlled trial of methotrexate versus placebo in early diffuse scleroderma // Arthritis Rheum. 2001. Vol. 44, N 6. P. 1351-1358.
-
Van den Hoogen F.H., Boerbooms A.M., Swaak A.J. et al. Comparison of methotrexate with placebo in the treatment of systemic sclerosis: a 24 week randomized double-blind trial, followed by a 24 week observational trial // Br. J. Rheumatol. 1996. Vol. 35, N 4. P. 364-372.
-
Low A.H., Lee P. Indirect evidence for the efficacy of methotrexate in diffuse systemic sclerosis // J. Rheumatol. 2008. Vol. 35, N 11. P. 2286.
-
Le E.N., Wigley F.M., Shah A.A. et al. Long-term experience of mycophenolate mofetil for treatment of diffuse cutaneous systemic sclerosis // Ann. Rheum. Dis. 2011. Vol. 70, N 6. P. 1104-1107.
-
Derk C.T., Grace E., Shenin M. et al. A prospective open-label study of mycophenolate mofetil for the treatment of diffuse systemic sclerosis // Rheumatology (Oxford). 2009. Vol. 48, N 12. P. 1595-1599.
-
Mendoza F.A., Nagle S.J., Lee J.B., Jimenez S.A. A prospective observational study of mycophenolate mofetil treatment in progressive diffuse cutaneous systemic sclerosis of recent onset // J. Rheumatol. 2012. Vol. 39, N 6. P. 1241-1247.
-
Tashkin D.P., Elashoff R., Clements P.G. et al. Cyclophosphamide versus placebo in scleroderma lung disease // N. Engl. J. Med. 2006. Vol. 354. P. 2655-2666.
-
Hoyles R.K., Ellis R.W., Wellsbury J. et al. A Multicenter, prospective, randomized, double-blind, placebo-controlled trial of corticosteroids and intravenous cyclophosphamide followed oral azathioprine for the treatment of pulmonary fibrosis in scleroderma // Arthritis Rheum. 2006. Vol. 54, N 12. P. 3962-3970.
-
Nannini C., West C.P., Ervin P.J., Matesson E.L. Effects of cyclophosphamide on pulmonary function in patients with scleroderma and interstitial lung disease: systematic review and meta-analysis of randomized controlled trials and observational prospective cohort studies // Arthritis Res. Ther. 2008. Vol. 10, N 5.
-
Nadashkevich O., Davis P., Fritzler M., Kovalenko W. A randomized unblinded trial of cyclophosphamide versus azathioprine in the treatment of systemic sclerosis // Clin. Rheumatol. 2006 Mar. Vol. 25, N 2. P. 205-212.
-
Calguneri M., Apras S., Ozbalkan Z. et al. The efficacy of oral cyclophosphamide plus prednisolone in early diffuse systemic sclerosis // Clin. Rheumatol. 2003 Oct. Vol. 22, N 4-5. P. 289-294.
-
Poormoghim H., Moradi Lakeh M., Mohammadipour M. et al. Cyclophosphamide for scleroderma lung disease: a systematic review and meta-analysis // Rheumatol. Int. 2012. Vol. 32, N 8. P. 2431-2444. doi: 10.1007/s00296-011-1967-y.
-
Perez Campos D., Estevez Del Toro M., Pena Casanovas A. et al. Are high doses of prednisone necessary for treatment of interstitial lung disease in systemic sclerosis? // Rheumatol. Clin. 2012 Mar-Apr. Vol. 8, N 2. P. 58-62.
-
Steen V.D., Medsger T.A.Jr. Case-control study of corticosteroids and other drugs that either precipitate or protect from the development of scleroderma renal crisis // Arthritis Rheum. 1998 Sep. Vol. 41, N 9. P. 1613-1619.
-
Tzouvelekis A., Galanopoulos N., Bouros E. et al. Effect and safety of mycophenolate mofetil or sodium in systemic sclerosis-associated interstitial lung disease: a meta-analysis // Pulm. Med. 2012. Article ID 143637.
-
Nihtyanova S.I., Brough G.M., Black C.M., Denton C.P. Mycophenolate mofetil in diffuse cutaneous systemic sclerosis - a retrospective analysis // Rheumatology (Oxford). 2007. Vol. 46. P. 442-445.
-
Liossis S.N.C., Bounas A., Andonopoulos A.P. Mycophenolate mofetil as first-line treatment improves clinically evident early scleroderma lung disease // Rheumatology (Oxford). 2006. Vol. 45. P. 1005-1008.
-
Omair M.A., Alahmadi A., Johnson S.R. Safety and effectiveness of mycophenolate in systemic sclerosis. A systematic review // PLoS One. 2015 May 1. Vol. 10, N 5. Article ID e0124205. doi: 10.1371/journal.pone.0124205.
-
Dheda K., Lalloo U.G., Cassim B. et al. Experience with azathioprine in systemic sclerosis associated with interstitial lung disease // Clin. Rheumatol. 2004 Aug. Vol. 23, N 4. P. 306-309.
-
Morton S.J., Powell R.J. Cyclosporin and tacrolimus: their use in a routine clinical setting for scleroderma // Rheumatology (Oxford). 2000 Aug. Vol. 39, N 8. P. 865-869.
-
Filaci G., Cutolo M., Basso M. et al. Long-term treatment of patients affected by systemic sclerosis with cyclosporin A // Rheumatology (Oxford). 2001 Dec. Vol. 40, N 12. P. 1431-1432.
-
Steen V.D., Syzd A., Jonson J.P. et al. Kidney Disease other than renal crisis in patients with diffuse scleroderma // J. Rheumatol. 2005. Vol. 32. P. 649-655.
-
Shinohara M., Washida N., Tanaka A. et al ACE inhibitor-induced acute renal failure in a patient with progressive systemic sclerosis: ischemic nephropathy mimicking PSS renal crisis // Intern. Med. 2007. Vol. 46, N 18. P. 1605-1607.
-
Hudson M.., Baron M., Tatibouet S. et al. Exposure to ACE inhibitors prior to onset of scleroderma renal crisis - Results from the International Scleroderma Renal Crisis Survey // Semin. Arthritis Rheum. 2014. Vol. 43. P. 666-672.
-
Trang G., Steele R., Baron M., Hudson M. Corticosteroids and the risk of scleroderma renal crisis: a systematic review // Rheumatol. Int. 2012 Mar. Vol. 32, N 3. P. 645-653.
-
Denton C.P., Lapadula G., Mouthon L., Muller-Ladner U. Renal complications and scleroderma renal crisis // Rheumatology (Oxford). 2009. Vol. 48. P. iii32-iii35.
-
Caron M., Hudson M., Baron M., Nessim S.; Canadian Scleroderma Research Group, Steele R.J Longitudinal Study of Renal Function in Systemic Sclerosis // Rheumatol. 2012 Aug 1.
-
Levey A.S., Stevens L.A., Schmid C.H. et al. A new equation to estimate glomerular filtration rate // Ann. Intern. Med. 2009. Vol. 150. P. 604-612.
-
Iudici M., Fasano S., Iacono D. et al. Prevalence and factors associated with glucocorticoids (GC) use in systemic sclerosis (SSc): a systematic review and metaanalysis of cohort studies and registries // Clin. Rheumatol. 2014. Vol. 33, N 2. P. 153-164.
-
Baron M., Bernier P., Cote L.F. et al. Screening and therapy for malnutrition and related gastro-intestinal disorders in systemic sclerosis: recommendations of a North American expert panel // Clin. Exp. Rheumatol. 2010 Mar-Apr. Vol. 28, N 2. Suppl. 58. P. S42-S46.
-
Spiera R.F., Gordon J.K., Mersten J.N. et al. Imatinib mesylate (Gleevec) in the treatment of diffuse cutaneous systemic sclerosis: results of a 1-year, phase IIa, single-arm, open-label clinical trial // Ann. Rheum. Dis. 2011 Jun. Vol. 70, N 6. P. 1003-1009.
-
Keyszer G., Christopeit M., Fick S. et al. Treatment of severe progressive systemic sclerosis with transplantation of mesenchymal stromal cells from allogenic related donors: report of five cases // Arthritis Rheum. 2011. Vol. 63. P. 2540-2542.
-
Foocharoen C., Chunlertrith K., Mairiang P. et al. Effectiveness of addon therapy with domperidone vs alginic acid in proton pump inhibitor partial response gastro-oesophageal reflux disease in systemic sclerosis: randomized placebo-controlled trial // Rheumatology (Oxford). 2016 May 13. pii: kew216. (Epub ahead of print).
-
Maddali Bongi S., Del Rosso A., Galluccio F. et al. Efficacy of a tailored rehabilitation program for systemic sclerosis // Clin. Exp. Rheumatol. 2009. Vol. 27, N 3. Suppl. 54. P. 44-50.
-
Poole J.L. Musculoskeletal rehabilitation in the person with scleroderma // Curr. Opin. Rheumatol. 2010. Vol. 22, N 2. P. 205-212.
-
Del Papa N., Zaccara E. From mechanisms of action to therapeutic application: A review on current therapeutic approaches and future directions in systemic sclerosis // Best Pract. Res. Clin. Rheumatol. 2015 Dec. Vol. 29, N 6. P. 756-769.
-
Van Laar J.M., Farge F., Sont J.K. et al. The ASTIS trial: autologous stem cell transplantation versus IV pulse cyclophosphamise in poor prognosis systemic sclerosis, first results // Ann. Rheum. Dis. 2012. Vol. 71, suppl. 3. P. 151.
-
van Laar J.M., Farge D. et al. Autologous Hematopoietic Stem Cell Transplantation vs Intravenous Pulse Cyclophosphamide in Diffuse Cutaneous Systemic Sclerosis. A Randomized Clinical Trial // JAMA. 2014. Vol. 311, N 24. P. 2490-2498.
-
Phumethum V., Jamal S., Johnson S.R. Biologic therapy for systemic sclerosis: a systematic review // J. Rheumatol. 2011 Feb. Vol. 38, N 2. P. 289-296.
-
Smith V.P., Van Praet J.T., Vandooren B.R. et al. Rituximab in diffuse cutaneous systemic sclerosis: an open-label clinical and histopathological study // Rheum. Dis. 2010. Vol. 69. P. 193-197.
-
Bosello S., De Santis M., Lama G. et al. B cell depletion in diffuse progressive systemic sclerosis: safety, skin score modification and IL-6 modulation in an up to thirty-six months follow-up open-label trial // Arthritis Res. Ther. 2010. Vol. 12. P. R54.
-
Daoussis D., Liossis S.-N.C., Tsamandas A.C. et al. Experience with rituximab in scleroderma: results from a 1-year, proof-of-principle study // Rheumatology (Oxford). 2010. Vol. 49. P. 271-280.
-
Daoussis D., Liossis S.-N.C., Tsamandas A.C. et al Effect of long-term treatment with rituximab on pulmonary function and skin fibrosis in patients with diffuse systemic sclerosis // Clin. Exp. Rheumatol. 2012. Vol. 30, suppl. 71. P. S17-S22.
-
Jordan S., Distler J.H.W., Maurer B. et al. Effects and safety of rituximab in systemic sclerosis: an analysis from the European Scleroderma Trial and Research (EUSTAR) group // Ann. Rheum. Dis. 2015. Vol. 74. P. 1188-1194.
-
Ананьева Л.П., Десинова О.В., Конева О.А. и др. Лечение ритуксимабом интерстициального поражения легких при системной склеродермии // Науч.-практ. ревматология. 2013. № 5. С. 514-523.
-
Ананьева Л.П., Соловьев С.К., Бекетова Т.В. и др. Анти-В-клеточная терапия при системных аутоиммунных ревматических заболеваниях: эффективность и переносимость у 229 больных // Науч.-практ. ревматология. 2014. № 5. С. 495-506.
-
Khanna D., Denton C.P., Jahreis A. Safety and efficacy of subcutaneous tocilizumab in adults with systemic sclerosis (faSScinate): a phase 2, randomised, controlled trial // Lancet. 2016 May 5. pii: S0140-6736(16)00232-4. doi: 10.1016/ S0140-6736(16)00232-4. (Epub ahead of print).
-
Tashkin D.P., Roth M.D., Clements P.J. et al. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomised controlled, double-blind, parallel group trial // Lancet Respir. Med. 2016 Jul 25. pii: S2213-2600 (16) 30152-7.