Пульмонология : Национальное руководство. Краткое издание / под ред. А. Г. Чучалина - Москва : ГЭОТАР-Медиа, 2016. - 800 с. - ISBN 978-5-9704-3787-2 |
Аннотация
В книге обсуждаются общие и частные вопросы пульмонологии, даются рекомендации по диагностике, лечению и профилактике заболеваний органов дыхания.
В подготовке издания в качестве авторов и рецензентов участвовали ведущие сотрудники ФГБУ "НИИ пульмонологии" ФМБА России, ЦНИИ туберкулеза РАМН, Института иммунологии ФМБА России, Санкт-Петербургского государственного университета, Рязанского государственного медицинского университета им. акад. И. П. Павлова и других медицинских учреждений страны.
Сокращенная версия руководства включает всю основную информацию, необходимую врачу для непрерывного последипломного образования. Предназначено терапевтам, пульмонологам, студентам старших курсов вузов, интернам, ординаторам, аспирантам.
Гриф
Краткое издание национального руководства рекомендовано Российским респираторным обществом и Ассоциацией медицинских обществ по качеству
Поражение легких, спровоцированное ЛС, назначаемыми в режиме общепринятой терапии, среди всех проявлений лекарственной болезни составляет от 10 до 15%. В понятие лекарственной болезни не включают патологические процессы, возникающие по причине передозировки ЛС, выдачи или приема по ошибке другого ЛС. Представляем некоторые препараты, вызывающие поражение органов дыхания.
Клинические проявления изменений в легких, вызванных ЛС, чрезвычайно разнообразны (рис. 34.1) и представлены широким спектром различных по тяжести изменений - от малосимптомных «летучих» инфильтратов до жизнеугрожающих состояний по типу тяжелого респираторного дистресс-синдрома (табл. 34.1). Они определяются индивидуальной предрасположенностью организма к фармакологическому воздействию лекарств и являются неспецифичными. Тяжесть лекарственного поражения легких, как правило, не зависит от длительности лекарственного воздействия.
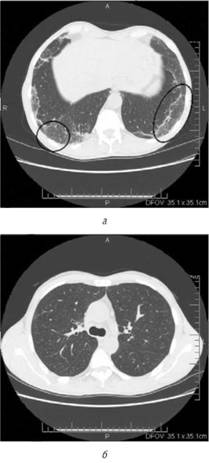
Рис. 34.1. Пневмонит, вызванный приемом сульфасалазина. Симптом «матового стекла» (а). КТ легких: картина после отмены сульфасалазина (б)
Восприимчивость легких к воздействию ЛС определяется тем, что соединения, входящие в состав ЛС, и их метаболиты при прохождении через сосудистое русло легких в условиях высокого напряжения кислорода подвергаются окислению, превращаясь в реактогенные субстанции, обладающие свойствами свободных радикалов. Кроме того, в легких вырабатывается множество медиаторов, часть которых, например компоненты ренин-ангиотензин-альдостероновой системы, является мишенью для ЛС.
Таблица 34.1. Механизмы негативного влияния ЛС на легкие
| Механизмы повреждения | ЛС, вызывающее пневмотоксическую реакцию | Клинические проявления, вызванные ЛС |
|---|---|---|
Оксидативный стресс |
Нитрофураны |
Бронхиальная обструкция |
Непосредственно токсическое действие на альвеоло-капиллярный барьер |
Цитостатики |
Фиброзирующий альвеолит |
Отложение липидных соединений в клетках |
Амиодарон |
Фиброзирующий альвеолит, облитерирующий бронхиолит |
Образование иммунных комплексов, антител |
Антибиотики |
Волчаночноподобные реакции |
Риск побочных эффектов лекарственного воздействия увеличивается в пожилом возрасте, для носителей гена быстрого ацетилирования в системе Н L А, под влиянием табачного дыма и алкоголя. Механизмы влияния факторов риска на течение лекарственной болезни легких представлены более быстрым накоплением в крови токсичных субстанций лекарственного происхождения вследствие ускорения реакций перекисного окисления липидов и апоптоза, снижением местных защитных реакции в легких, мукоцилиарной дисфункцией, потерей дезинтоксикационной функции печени. Портальная гипертензия у больных с алкогольной болезнью печени за счет портопульмональных шунтов приводит к более быстрому поступлению токсичных продуктов в легкие.
Риск легочной ятрогении увеличивается при сочетанной терапии, например при одновременном назначении цитостатиков, препаратов группы колониестимулирующего фактора и радиационных методов лечения. Повреждающий эффект цитостатиков реализуется за счет повышения синтеза Р450 и снижения антиоксидантной защиты вследствие истощения содержания глутатиона.
Сроки обратного развития изменений в легких после отмены пневмотоксичного препарата точно не установлены. Выраженный остаточный фиброз наблюдается у больных после терапии противоопухолевыми препаратами, цитостатиками, причем эти изменения требуют назначения препаратов для поддержания функций легких.
Варианты лекарственных поражений легких
В зависимости от особенностей клинических, радиологических, морфологических особенностей лекарственно-индуцированных поражений легких известны следующие варианты заболевания:
Нередко один и тот же препарат индуцирует целый спектр изменений, своеобразие которых определяется участием реакций клеточного и гуморального иммунитета. Наиболее частым проявлением лекарственной болезни является реакция гиперчувствительности и бронхообструктивный синдром (табл. 34.2). Лекарственные легочные эозинофилии могут развиваться после приема любых лекарственных препаратов (см. табл. 34.1). Через некоторое время (в среднем от 2 ч до 10 сут) после попадания ЛС в организм появляются лихорадка, озноб, сухой кашель, очаговые тени или ограниченное затемнение легочных полей; в периферической крови у части больных наблюдается плевральный выпот с большим количеством эозинофилов. Клиническая картина анафилаксии, БА, гиперреактивности дыхательных путей также возможна при приеме любых ЛС. Наиболее распространены в популяции лекарственные реакции на препараты, влияющие на ренин-ангиотензин-альдостероновую систему, β-блокаторы, НПВП, антибиотики, половые гормоны и др. Лекарственно-индуцированный синдром бронхиальной обструкции, как правило, вынуждает заменить ЛС или совсем прекратить лечение.
Таблица 34.2. Бронхообструктивный синдром лекарственного генеза
| Лекарственное средство | Особенности лекарственной реакции | Терапия |
|---|---|---|
Ацетилсалициловая кислота и другие НПВП |
Вызывают обострение бронхообструктивного синдрома у 5-10% больных бронхиальной астмой; характерны эозинофилия, риносинусопатия |
Отмена ЛС; симптоматическое назначение бронхолитиков; ГКС |
Химиотерапевтические средства |
Бронхиальная обструкция в сочетании с интерстициальной болезнью легких, васкулопатией |
|
Неселективные и селективные β-блокаторы |
Дозозависимость; пути введения; у пациентов с обструктивной болезнью легких кардиоселективные средства теряют избирательность по мере повышения дозы ЛС |
|
Препараты антихолинэстеразы |
Дозозависимость; выраженность тяжести реакции обусловлена путями введения; у восприимчивых пациентов потенцируют холинергическое действие |
Бронхолитики, антагонисты антихолинэстеразы по показаниям |
Половые гормоны |
Бронхоспазм, лекарственные геморрагии, тромбоэмболии |
Отмена ЛС; бронхолитики по показаниям, симптоматические средства, антикоагулянты |
D-пеницилламин |
Тяжесть пневмотоксической реакции не зависит от дозы ЛС. Возможен облитерирующий бронхиолит у пациентов с ревматоидным артритом |
Отмена ЛС; бронхолитики; ГКС |
Антибиотики |
Пневмотоксичность не зависит от пути введения, дозы, возможен IgE-обусловленный бронхоспазм |
Отмена ЛС; бронхолитики, ГКС по показаниям |
Облитерирующий бронхиолит
Среди причин облитерирующего бронхиолита (ОБ) известны нитрофураны, сульфаниламиды, пенициллины, аспирация минеральных масел, наркотики, цитостатики, соли золота; 25% лекарственного ОБ приходится на амиодарон. В патогенезе ОБ участвуют факторы транскрипции (активатор протеина 1, интерферона γ, фактора роста тромбоцитов, интегринов и др.), модулирующие функции фибробластов и поддерживающие процессы ремоделирования легких. В результате происходит необратимая перестройка дыхательных путей с формированием пневмосклероза, эмфиземы. Даже при своевременной отмене ЛС возвращения к первоначальным показателям ФВД не происходит.
Отек легких
Некардиогенный отек легких проявляется ОРДС уже через несколько часов после введения препаратов вне зависимости от концентрации препарата в крови: наркотиков (героина), наркотических анальгетиков (морфина, тримеперидина, метадона), вдыхания кокаина, местного применения анестетиков (орофарингеальные аппликации лидокаина), при приеме салицилатов и т.п. При лечении цитостатиками частота отека легких возрастает до 20%. Введение блеомицина, циклофосфамида, изофосфамида℘, метотрексата интратрахеально приводит к развитию лекарственных осложнений в течение 1 мес лечения. Среди более редких причин отека легких известны диуретики, заболевание проявляется остро, через 20-60 мин при системном введении. При приеме токолитиков риск побочных эффектов увеличивается при перегрузке парентеральным введением растворов, многоплодной беременности, анемии, лечении стероидами с целью ускорения созревания плода и при нестабильной гемодинамике у матери.
В основе патогенеза лекарственно-индуцированного отека легких лежит повреждение легочного эндотелия с увеличением сосудистой проницаемости. Клинически некардиогенный отек легких характеризуется нарастающей одышкой, удушьем, рентгенологически - двусторонней инфильтрацией в легких. Вследствие быстроты лекарственной реакции размеры сердца могут сохраняться в пределах нормы, что отличает лекарственную реакцию от легочно-сердечной недостаточности вследствие декомпенсации легочного сердца при хронических заболеваниях легких.
Лекарственная СКВ
Легкие при лекарственной СКВ вовлекаются в 50-75% случаев и нередко являются ведущим в клинической картине органом-мишенью. Клинико-лабораторный синдром, вызванный ЛС, имеет сходство с СКВ - артралгии, миалгии, полисерозит, кожные изменения, анемия, повышение СОЭ, поражение почек. Возникает при приеме различных препаратов, в том числе дифенилгидантоина℘, гидралазина, противотуберкулезных средств, метилдопы, сердечных гликозидов, стрептомицина, сульфаниламидов, тетрациклинов и др.
Особенностью клинической картины лекарственного поражения легких являются плевральный выпот без плевральных болей, множественная инфильтрация, пневмонит. В отличие от спонтанной волчанки, лекарственная СКВ развивается с одинаковой частотой у женщин и мужчин. Основным отличием лекарственной СКВ является отсутствие типичных для спонтанной формы заболевания LE-клеток. Поражения кожи в виде дискоидной эритемы, поражение нервной системы, почечная патология при лекарственной СКВ встречаются редко.
Приблизительно у 50% пациентов, употребляющих прокаинамид, в течение 2 мес могут появиться антиядерные антитела, у 10% развиваются плевральные выпоты, пневмонит. Дифференциальная диагностика между лекарственной волчанкой и СКВ представлена в табл. 34.3.
Таблица 34.3. Дифференциальная диагностика лекарственной и спонтанной СКВ
| Характеристика | СКВ | Лекарственная СКВ |
|---|---|---|
Возраст, лет |
20-40 |
50 |
Женщины/мужчины |
9:1 |
1:1 |
Раса |
Любая |
Не чернокожие |
Тип ацетилирования |
Быстрые и медленные |
Быстрые |
Артриты,% |
90 |
95 |
Плевроперикардит, % |
50 |
50 |
Гепатомегалия, % |
25 |
25 |
Поражения кожи, % |
74 |
10-20 |
Поражение почек, % |
53 |
5 |
Поражение ЦНС, % |
32 |
0 |
Антинуклеарный фактор, % |
95 |
Редко |
LE-клетки, % |
90 |
Отсутствуют |
Комплемент |
Снижен |
Норма |
Иммунные комплексы |
Повышены |
Норма |
Поражения легких при противоопухолевой терапии
К легочным проявлениям лекарственной болезни, вызванной химиотерапевтическими препаратами, относятся неинфекционные, неопухолевые заболевания. Среди препаратов с высокой пневмотоксичностью известны бихлорэтилнитрозоурацил℘, блеомицин, бусульфан, хлорамбуцил, циклофосфамид, мелфалан, митомицин.
Наиболее часто изменения в легких представлены сочетанием отека, различных форм интерстициальной пневмонии, эозинофильной пневмонией. Предрасполагающими к возникновению реакций со стороны легких на противоопухолевую и цитостатическую терапию факторами являются пожилой возраст, анамнез курения, высокие дозы препаратов, сочетание химио- и радиотерапии, быстрая отмена ГКС, реакции отторжения трансплантата, кислородотерапия, введение колониестимулирующего фактора и стволовых клеток. Замена противоопухолевых средств не исключает возможности новых побочных реакций со стороны органов дыхания.
Первые признаки поражения легких возникают в течение 3-12 нед от начала основного лечения противоопухолевыми средствами. При КТ легких обнаруживаются изменения в виде «матового стекла», утолщения межальвеолярных перегородок. В жидкости бронхоальвеолярного лаважа наблюдаются сдвиги за счет увеличения фракции нейтрофилов и лимфоцитов, повышения активности интерлейкинов-6 и -8. При морфологическом исследовании ткани легкого определяется воспалительная реакция с преимущественным вовлечением интерстиция. Представляется очевидным, что тяжесть поражения легких у больных лейкемией определяется не только токсическим влиянием метаболитов препаратов, но и массивным лизисом атипических клеток. Последнее усиливает повреждение капилляров легочного интерстиция, повышает их проницаемость, вызывая подобные острому дистресс-синдрому расстройства.
Некоторые противоопухолевые препараты, в частности митомицин, являются причиной гемолитико-уремического синдрома. После достижения токсичной дозы митомицина (часто в сочетании с виндезином) у больных развиваются гемолитическая анемия, тромбоцитопения, ретикулоцитоз, гемодинамические расстройства (системная гипо- или гипертензия), изменения сознания, припадки, неврологические расстройства, почечная недостаточность. В основе указанных изменений лежит микроангиопатия с явлениями тромбоцитопатии, образованием микротромбов в сосудах легких и почках. Предполагают, что иммунопатологические процессы, индуцированные митомицином, связаны с образованием антител к гломерулярным базальным мембранам, а также антител к фосфолипидам, что в сочетании с другими системными проявлениями делает лекарственные формы этого поражения легких близкими к синдрому Гудпасчера или антифосфолипидному синдрому.
До сих пор отсутствуют единые критерии, позволяющие прогнозировать пневмотоксический риск химиотерапевтических препаратов. Наиболее информативным считается быстрое снижение диффузионной способности легких на начальных этапах химиотерапии даже при отсутствии значимых изменений на рентгенограммах или КТ-изображениях легких. Легочные побочные реакции в ответ на противоопухолевые препараты обычно развиваются у больных с поливалентной аллергией, наследственной предрасположенностью. Нарушение функций почек и печени также усиливает негативное влияние лекарств на органы дыхания.
Лекарственно-индуцированные поражения легких при ревматоидном артрите
Изменения в легких у больных с системными заболеваниями соединительной ткани, получающих иммуносупрессивную терапию, определяются сочетанным эффектом как иммунопатологических реакций в рамках основного заболевания, так и ятрогении.
Интерстициальный пневмонит и, как результат необратимых изменений в легких, легочный фиброз развиваются при длительном лечении метотрексатом в суммарной дозе 2,5-1400 мг/нед. Имеются данные о возникновении ятрогенных последствий приема метотрексата как через несколько недель, так и через 5 лет от начала терапии. Тяжесть течения не зависит от длительности приема и недельной дозы препарата. Рентгенологические изменения, как и при других заболеваниях легких у больных, получавших лечение метотрексатом, представлены типичными для интерстициального пневмонита диффузными инфильтратами, усилением легочного рисунка, при использовании КТ визуализируются деформация сосудистого русла, периваскулярная инфильтрация, у 20% больных регистрируются явления эозинофильного васкулита, гранулематоз. Особенностью морфологических изменений в легком, индуцированных метотрексатом, являются диспластические изменения эпителия, и прежде всего гиперплазия пневмоцитов 2-го типа, что указывает на риск злокачественной трансформации у таких больных. Возможна также эозинофильная пневмония, в том числе по типу синдрома Леффлера с гранулематозом, совпадающая с периодом лечения метотрексатом и спонтанно исчезающая после отмены препарата.
Обратная эволюция внутригрудных изменений наступает у большинства больных - у 85% без остаточных явлений в виде следового фиброза. Повторное применение цитостатиков у большинства (60-70%) больных приводит к более тяжелому рецидиву заболевания, чем при первоначальном лечении.
Поражение легких при приеме солей золота впервые описано Savilati в 1948 г. и считается достаточно редким (до 1% случаев), тогда как поражение других органов проявляется чаще (до 2050%). R. H. Winterbauer (1979) описал «золотую» пневмопатию у больных ревматоидным артритом. Клинически поражение легких при приеме препаратов золота проявляется фиброзирующим альвеолитом, чаще подострого течения с сильной одышкой, непродуктивным кашлем, лихорадкой, дерматитом. Рентгенологически у больных обнаруживается инфильтрация, по форме напоминающая крылья бабочки, у 39% больных - «летучие» инфильтраты с гиперэозинофилией, бронхообструкцией. ГКС эффективны у большинства больных, но могут сохраняться остаточные явления в легких в виде фиброза.
Побочные эффекты биотерапии ревматоидного артрита посредством препаратов, моделирующих функции фактора некроза опухолей, изучены недостаточно. Известны КТ-изменения по типу пневмонита, бронхообструктивного синдрома. У больных ревматоидным артритом и болезнью Крона одновременное применение метотрексата или других иммуномодуляторов снижает образование антител к ремикейду и повышает концентрацию последнего в плазме.
Амиодароновое легкое
Токсические эффекты оказывает производное амиодарона - дезэтиламиодарон, обладающий свойствами положительно заряженного амфифильного соединения. Амиодарон и его метаболиты накапливаются в легких, печени, коже. На сегодняшний день амиодарон по-прежнему остается одним из главных этиологических факторов тяжелого интерстициального пневмонита и ОРДС. Высокая частота ятрогенных осложнений, вызванных амиодароном, становится основной причиной отмены препарата, что затрудняет ведение кардиологических больных.
Морфологическим субстратом амиодаронового легкого является фосфолипидоз. Гистологически обнаруживаются макрофаги, нагруженные каплями жира, в лизосомах накапливается электронно-плотный материал, состоящий из липидамиодароновых комплексов. Как правило, легочная токсичность развивается при поддерживающей дозе препарата более 400 мг/сут. При снижении дозы до 200 мг/сут уменьшается и тяжесть легочных поражений.
Клинически амиодароновое поражение легких характеризуется одышкой, непродуктивным кашлем, реже наблюдаются лихорадка, слабость, потеря массы тела, плевральные боли. Кроме патологии легких, обнаруживаются системные поражения: сероголубое прокрашивание кожи, фотодерматит, гипер- и гипотиреоидизм, поражение роговицы, диспепсия, периферическая нейропатия, экстрапирамидные симптомы, печеночные нарушения, угнетение кроветворения, брадикардия. При рентгенологическом исследовании, компьютерной томографии в легких выявляется диффузная инфильтрация, в том числе асимметричная и с преобладанием в верхних долях. Показатели ФВД демонстрируют рестриктивный тип дыхательных нарушений.
Токсические эффекты амиодарона усугубляются у больных при хирургических вмешательствах, так как стимулируется окисление препарата в условиях нагрузки кислородом, входящим в состав дыхательных смесей. Ведение больных, принимающих амиодарон, предусматривает регулярное исследование ФВД, DLCO, проведение КТ. При тяжелом течении токсической реакции рекомендуют назначение преднизолона в дозе 40-60 мг/сут в течение 2-6 мес с постепенным снижением суточной дозы. Следует учитывать вероятность рецидива амиодароновой легочной токсической реакции после отмены ГКС.