Нефрология. Клинические рекомендации / под ред. Е. М. Шилова, А. В. Смирнова, Н. Л. Козловской. - М. : ГЭОТАР-Медиа, 2016. - 816 с. - ISBN 978-5-9704-3714-8. |
Аннотация
Первые национальные клинические рекомендации по нефрологии подготовлены коллективом экспертов, в который вошли не только специалисты-нефрологи ведущих нефрологических школ России, но и представители других медицинских специальностей, тесно сотрудничающие с нефрологами, - кардиологи, эндокринологи, инфекционисты, педиатры, генетики. Издание содержит информацию по наиболее распространенным нефрологическим заболеваниям и синдромам. Представленные в нем клинические рекомендации детально описывают действия врача по диагностике, лечению, профилактике и реабилитации пациентов. Соблюдение международной методологии при подготовке клинических рекомендаций гарантирует их современность, достоверность, обобщение лучшего мирового опыта и знаний, обеспечивает возможность практического применения. Именно поэтому клинические рекомендации обладают преимуществами по сравнению с традиционными источниками информации (учебники, руководства, монографии), что позволит врачу в короткие сроки принимать обоснованные решения в сложных клинических ситуациях. Клинические рекомендации по нефрологии предназначены не только практикующим врачам-нефрологам, но и терапевтам, педиатрам, представителям смежных дисциплин. Они также могут использоваться для обучения студентов старших курсов и клинических ординаторов терапевтических специальностей.
АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ ПРИ ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК
Введение
Между АГ и ХБП существует тесная взаимосвязь: с одной стороны, развитие ХБП и снижение функции почек приводят к повышению АД, с другой стороны, наличие АГ связано со значительным ухудшением прогноза пациентов с ХБП из-за повышенного риска развития ТПН и ССО.
Распространенность АГ при ХБП в 2-3 раза выше, чем в общей популяции. АГ, хотя и не входит в число диагностических критериев ХБП, является важным ее проявлением. Нередко повышение АД бывает первым симптомом, который заставляет пациента с ХБП обратиться к врачу и пройти обследование. Развитие АГ характерно для наиболее активных и тяжелых форм нефропатий; повышение АД или ухудшение ответа на антигипертензивную терапию может указывать на обострение заболевания почек или его прогрессирование. В то же время уменьшение выраженности АГ свидетельствует об эффективности патогенетического лечения заболевания почек, послужившего ее причиной.
По данным популяционных исследований, повышение АД, в первую очередь систолического, связано с увеличением риска ТПН, независимо от возраста, пола и расы. Адекватная коррекция АГ достоверно отдаляет наступление ТПН. Неблагоприятное влияние АГ на риск ССО усиливается при наличии ХБП, взаимодействуя с почечными факторами риска ССО (снижение функции почек, нарушения фосфорно-кальциевого обмена и вторичный гиперпаратиреоз, анемия, хроническое воспаление, гиперурикемия и др.). Механизмы повышения АД при нефропатиях разной природы имеют свои особенности, определяемые их патогенезом. В то же время АГ может рассматриваться как универсальный фактор риска прогрессирования ХБП, а ее адекватное лечение является важной составляющей нефро-/кардиопротективной стратегии.
Принципы оценки повышения АД и его коррекции, разработанные для эссенциальной АГ, не могут быть механически перенесены на пациентов с вторичной почечной АГ, которая имеет ряд особенностей. Наличие ХБП - повышенной АУ/ПУ и нарушения функции почек - меняет подходы к стратификации риска ССО, определению целевого АД, выбору лекарственных препаратов и требует существенного пересмотра всей тактики антигипертензивной терапии. Вследствие этого проблема диагностики и лечения вторичной почечной АГ требует рассмотрения в рамках отдельных рекомендаций.
По современным представлениям, определять тактику коррекции АГ и оценивать ее эффективность следует в русле двуединой кардио-/нефропротективной стратегии, направленной на снижение частоты ССО, представляющих основную причину гибели пациентов с ХБП, и на снижение риска развития ТПН. К сожалению, в исследованиях, проводившихся в прошлые годы, не предусматривалось комбинированной оценки почечных и сердечно-сосудистых исходов.
Имеющиеся на сегодняшний день РКИ в основном посвящены оценке эффективности различных лекарственных препаратов в отдельных группах больных, сформированных в соответствии с определенными критериями отбора. Число исследований по определению целевых значений АД при ХБП, изучению комбинированной терапии почечной АГ, невелико, а их результаты противоречивы, в связи с чем рекомендации, посвященные этим важнейшим вопросам, не обладают большой доказательностью и силой и постоянно пересматриваются. Для совершенствования тактики коррекции АГ при ХБП необходимы длительные обсервационные исследования, ценную информацию могут дать регистры ХБП.
Данные рекомендации являются продолжением серии клинических рекомендаций НОНР (НОНР) и используют подходы к коррекции АГ при ХБП, сформулированные в международных и зарубежных национальных рекомендациях [5, 13, 16, 17, 22, 67, 71, 88, 92] отражают достижения российской науки в этой области медицины. Они согласуются с рекомендациями по диагностике и лечению АГ Российского медицинского общества по артериальной гипертонии Всероссийского научного общества кардиологов [23], учитывают опыт и современные воззрения, обобщенные в учебниках и руководствах.
Рекомендации адресованы нефрологам, а также кардиологам, эндокринологам, терапевтам, семейным врачам, врачам кабинетов медицинской профилактики и Центров здоровья, которые могут столкнуться в своей практике с проблемой АГ у пациентов с ХБП.
Определения
Почечная АГ, самый частый вариант вторичной АГ, - синдром, который является проявлением заболевания почек, характеризуется повышением уровня АД (САД ≥140 мм рт.ст. и/или ДАД ≥90 мм рт.ст.), приводит к поражению сердечно-сосудистой системы и ускоряет прогрессировать ХБП.
Однако наиболее частой причиной сочетания повышенного АД и ХБП в популяции является не вторичная почечная АГ, а развитие гипертонической нефропатии у больных эссенциальной АГ. Возможно и развитие самостоятельного заболевания почек, например, ХГН у лиц, уже страдающих в течение ряда лет эссенциальной АГ. Вторичная почечная АГ имеет ряд особенностей, связанных с природой первичного заболевания почек и возможностью воздействовать на АГ путем проведения его патогенетической терапии.
Особенности вторичной почечной АГ и ее лечения
-
Развитие и тяжесть АГ тесно связаны с активностью и стадией первичного заболевания почек.
-
ХБП является самостоятельной причиной эндотелиальной дисфункции, ремоделирования миокарда и артерий, нарушений обмена (белкового и пуринового, липидного, углеводного, фосфорно-кальциевого, водно-электролитного), неблагоприятно влияющих на АД и риск ССО.
-
Тактика лечения вторичной почечной АГ является неотъемлемой составляющей кардио-/нефропротективной стратегии, которая определяется характером и особенностями заболевания почек.
-
Возможно снижение или полная нормализация АД за счет успешного патогенетического лечения первичного заболевания почек. В то же время некоторые препараты, применяемые для лечения заболеваний почек, сами могут способствовать повышению АД (кортикостероиды, циклоспорин А♠, препараты, стимулирующие эритропоэз).
-
У пациентов с выраженной ПУ и/или снижением функции почек отмечается более раннее и более выраженное поражение органов-мишеней, что влияет на выбор антигипертензивных препаратов, определяя предпочтение средств с нефро-, кардио- и вазопротективным действием.
-
При вторичной почечной АГ по сравнению с эссенциальной АГ без поражения почек труднее добиться снижения АД, чаще наблюдается резистентность к лечению.
-
При снижении функции почек возрастает риск нежелательных явлений при назначении ИАПФ, БРА, ингибиторов ренина, тиазидных мочегонных. Изменяется фармакокинетика гидрофильных антигипертензивных препаратов, возникает опасность их передозировки.
Но в реальной клинической практике, когда отсутствуют данные о профилактических регулярных измерениях АД и достоверный нефрологический анамнез, дифференцировать разные варианты причинно-следственных связей между АГ и ХБП затруднительно или невозможно. Важно подчеркнуть, что с момента появления сочетания АГ и ХБП, независимо от того, что послужило первопричиной, данные факторы начинают взаимодействовать по принципу порочного круга: наличие неконтролируемой АГ способствует дальнейшему повреждению почек, а прогрессирование ХБП приводит к появлению дополнительных причин повышения АД.
В соответствии с Российскими и международными рекомендациями по диагностике и лечению АГ [23, 88], выделяют несколько категорий нормального и повышенного АД (табл. 1).
| Категория АД | САД | ДАД | |
|---|---|---|---|
Оптимальное |
<120 |
и |
<80 |
Нормальное |
120-129 |
и/или |
80-84 |
Высокое нормальное |
130-139 |
и/или |
85-89 |
АГ 1-й степени |
140-159 |
и/или |
90-99 |
АГ 2-й степени |
160-179 |
и/или |
100-109 |
АГ 3-й степени |
≥180 |
и/или |
»110 |
Изолированная систолическая АГ |
≥140 |
и |
<90 |
Если по уровню САД и ДАД пациент попадает в разные категории, предпочтение отдается более высокой категории АД.
Как показали клинические исследования, в подавляющем большинстве случаев ХБП уровни САД и ДАД либо соответствуют одной категории, либо имеется изолированная систолическая АГ. Изолированная диастолическая АГ встречается редко [31]. В процессе прогрессирования ХБП и снижения функции почек отмечается увеличение как САД, так и ДАД, но САД растет в большей мере - за счет ремоделирования и кальциноза магистральных артерий, со снижением их эластичности вследствие нарушения фосфорно-кальциевого обмена и воздействия уремических токсинов. Таким образом, тяжесть АГ при ХБП, в первую очередь, определяет САД [36]. В соответствии с этим во многих клинических исследованиях, включающих пациентов с ХБП, уровень САД был использован в качестве основного целевого показателя.
ХБП - наднозологическое понятие, объединяющее всех пациентов с признаками повреждения почек или значительным снижением их функции (СКФ ниже 60 мл/мин/1,73 м2 ), сохраняющимися в течение 3 и более месяцев [16, 17, 67].
Стадия |
СКФ |
|
|---|---|---|
уровень, мл/мин/1,73 м2 |
описание |
|
С1 |
>90 |
Оптимальная или повышенная* |
С2 |
60-89 |
Незначительно сниженная* |
С3а |
45-59 |
Умеренно сниженная |
С3б |
30-44 |
Существенно сниженная |
С4 |
15-29 |
Резко сниженная |
С5 |
<15 |
ТПН** |
* При СКФ ≥60 мл/мин/1,73 м2 для диагностики ХБП обязательно наличие признаков повреждения почек.
** Если пациент с ТПН находится на диализе, используются обозначения ХБП 5Д (т.е. диализ), либо ХБП 5 ГД (т.е. ГД), ХБП 5 ПД (т.е. ПД). Для больных с трансплантированной почкой стадия ХБП индексируется в зависимости от функции трансплантата (от С1 до С5), а в конце добавляется буква Т.
|
А/Кр - отношение концентраций альбумина и креатинина, ОБ/Кр - отношение концентраций общего белка и креатинина.
* - включая НС, при котором суточная экскреция альбумина >2200 мг/сут, А/Кр > 2200 мг/г или 220 мг/ммоль, суточная ПУ >3500 мг/сут, ОБ/Кр >3500 мг/г или 350 мг/моль.
Рекомендация 2.1. Трактовку АГ при ХБП следует проводить с учетом патогенетических особенностей заболевания почек, стадии ХБП и всего комплекса клинических проявлений. Наличие АГ, как правило, свидетельствует о более тяжелом течении нефропатии (НГ).
Частота АГ при ХБП 3-5 стадий значительно выше, чем в общей популяции, и увеличивается по мере снижения функции почек. Связь АГ с СКФ показана в крупных популяционных исследованиях [101, 103]. На 1-2-й стадиях ХБП частота АГ составляет 40%, т.е. близка к частоте АГ в общей популяции. При СКФ ниже 60 мл/мин/1,73 м2 частота АГ резко увеличивается и при СКФ ниже 30 мл/мин/1,73 м2 достигает 75%, а у больных с ТПН до начала проведения ЗПТ превышает 90%. Это связано со снижением функции почек, приводящим к неадекватной экскреции натрия, дисбалансу почечных прессорных и депрессорных гормональных систем и развитием новых дополнительных причин повышения АД, характерных для поздних стадий ХБП - кальцинозом и склерозом артерий, эндотелиальной дисфункции и повреждения вследствие нарушения элиминации почками воспалительных цитокинов, усугубления нарушений липидного и пуринового обмена, анемии [121].
Частота и выраженность АГ зависят от нозологического диагноза, особенно на ранних стадиях ХБП. АГ занимает важное место в клинической картине различных заболеваний почек, отражает их активность и особенности течения [3, 10, 11, 102].
Наиболее высокая частота АГ отмечается при сосудистых нефропатиях (ишемической болезни почек, ТМА) - 80-90%. АГ развивается на ранних стадиях заболевания, нередко является первым клиническим проявлением поражения почек. Тяжесть АГ, как правило, отражает выраженность ишемии почечной ткани и коррелирует со снижением СКФ. АД и СКФ на ранних стадиях могут быть нормализованы при улучшении почечного кровотока. На поздней стадии заболевания спонтанная нормализация АД может быть признаком снижения функции сердца и предвестником острой левожелудочковой недостаточности. Для сочетания выраженной АГ, раннего и потенциально обратимого снижения СКФ и минимальной ПУ как характерного для сосудистых нефропатий симптомокомплекса в последние годы предложено название - синдром ишемической (сосудистой) нефропатии.
У пациентов с ХБП при СД частота АГ достигает 70-85% [6]. Высокий уровень АД отражает как тяжесть поражения почек, так и выраженность метаболических нарушений, в первую очередь, ожирения. Кроме того, тяжелая АГ нередко является проявлением атеросклероза почечных артерий и сосудов головного мозга, который характерен для больных СД, но может развиваться независимо от наличия и течения диабетической нефропатии [6, 24].
При первичном и вторичных ГН АГ встречается в 60-70% случаев [11, 20]. Развитие АГ на ранних стадиях нефрита в сочетании с гематурией входит в понятие остронефритический синдром, который отражает активность нефрита. Развитие АГ на ранних стадиях ХГН нередко сочетается со снижением функции почек; при этом оба нарушения являются потенциально обратимыми в случае успешной иммуносупрессивной терапии. Корреляции АД с уровнем ПУ не наблюдается: у больных с массивной ПУ и НС может быть нормальное АД или склонность к гипотензии. Однако сочетание НС с АГ более неблагоприятно для прогноза, чем изолированный НС. Частота АГ при разных морфологических вариантах ХГН варьирует в широких пределах. Она наиболее высока при экстракапиллярном (нефрите с полулуниями) и мембранопролиферативном вариантах ХГН (более 85%), несколько меньше при ФСГС, мезангио-пролиферативном ГН и МН (60-80%). Значительно реже АГ встречается при БМИ (40-60%), она характерна для поздней стадии данного морфологического варианта ХГН.
Самая низкая частота АГ (20-35%) наблюдается при хроническом тубулоинтерстициальном нефрите и амилоидозе почек (при AL-амилоидозе возможна тяжелая гипотензия, связанная с отложением амилоида в надпочечниках и симпатических ганглиях). Развитие АГ при этих заболеваниях наблюдается на поздних стадиях, когда имеется выраженное нарушение функции почек.
Рекомендация 2.2. АГ при ХБП следует рассматривать как прогностически неблагоприятный фактор, повышающий риск развития ТПН и ССО (1A).
Методика стратификации комбинированного риска развития ТПН и ССО, предложенная экспертами KDIGO [67], строится на определении категорий снижения функции почек и АУ и не предусматривает оценку уровня АД. Однако это не означает отрицание роли АГ в прогрессировании ХБП и как фактора высокого сердечно-сосудистого риска. Напротив, в условиях олигонефронии (дефицита функционально активной почечной ткани), приводящей к нарушению работы почек по выведению натрия, воспалительных цитокинов и других факторов, повреждающих эндотелий, даже высокое нормальное АД может оказывать неблагоприятное воздействие на почки и сердечно-сосудистую систему.
У людей без ХБП система саморегуляции почечного кровотока препятствует передаче системной АГ на почечные клубочки за счет адекватного сужения прегломерулярных почечных сосудов мышечного типа.
При эссенциальной гипертонии в результате работы этих механизмов почки поражаются значительно позже других органов-мишеней. При вторичной почечной АГ отмечается гиперактивация ренин-ангиотензиновой, симпатоадреналовой систем, гиперпродукция эндотелиального релаксирующего фактора (NO), что приводит к дисрегуляции почечного кровотока, проявляющейся дилатацией прегломерулярных сосудов мышечного типа и сужением выносящих артериол. В результате развивается гиперперфузия почечных клубочков и клубочковая гипертензия. Даже незначительное повышение системного АД усугубляет клубочковую гипертензию, приводя к повреждению почечного эндотелия, гломеруломегалии, сопровождающейся перерастяжением мезангия и повреждением подоцитов с формированием гломерулосклероза. На ранних стадиях ХБП нарушения почечного кровотока носят функциональный и потенциально обратимый характер. Прогрессирование нефросклероза и длительное повреждающее воздействие системной АГ на почечные сосуды мышечного типа ведет к развитию артериолосклероза, в результате чего происходит необратимая утрата их способности регулировать перфузию клубочков и защищать их от гемодинамического повреждения при повышенном системном АД.
Данные о неблагоприятном влиянии высокого АД на почки получены в крупных популяционных исследованиях, однако в первую очередь они касаются пациентов с эссенциальной гипертонией. Влияние вторичной почечной АГ на прогрессирование ХБП оценить труднее, поскольку она взаимодействует с целым рядом прогностических факторов. По данным проведенных клинических исследований у больных ХГН, СД, поликистозной болезнью почек (ПБП), было показано, что уровень АД независимым образом влияет на риск дальнейшего ухудшения функции почек [20, 82]. Исследования о влиянии АГ на риск ССО у пациентов с ХБП также показывают ее неблагоприятное прогностическое значение, а коррекция АГ по данным отдельных исследований при первичных нефропатиях приводит к улучшению прогноза [112, 126], однако доказательная база невелика.
Рекомендация 3.1. Основу диагностики АГ при ХБП составляет измерение АД врачом или другим медицинским работником методом Н.С. Короткова в условиях покоя (НГ).
Повторные измерения АД врачом на сегодняшний день остаются наиболее достоверным методом диагностики АГ, по которому имеется наибольшая доказательная база. Измерение АД при ХБП проводится в условиях относительного покоя (в положении сидя, после 5-минутного отдыха), в соответствии с методикой, описанной в Национальных рекомендациях по диагностике и лечению АГ [23]. Для оценки уровня АД на каждой руке следует выполнить не менее двух измерений с интервалом не менее 1 мин; при разнице АД ≥5 мм рт.ст. производят одно дополнительное измерение; за конечное (регистрируемое) значение принимают минимальное из трех измерений.
При подозрении на поражение периферических сосудов (в рамках системного васкулита, атеросклероза и т.д.) АД и пульс определяют на руках и на ногах.
Учитывая высокий риск ортостатической гипотензии у пациентов с ХБП, измерение АД в стандартных условиях рекомендуется периодически дополнять измерением в вертикальном положении тела, сразу после вставания. Если после вставания САД снижается на 20 и более мм рт.ст. и/или ДАД снижается на 10 и более мм рт.ст., это определяется как ортостатическая (постуральная) гипотензия. Особо важное значение данная проба имеет в период подбора антигипертензивной терапии, при назначении α-адреноблокаторов и других средств, которые могут вызывать резкое снижение АД.
Рекомендация 3.2. Измерение АД является обязательным исследованием при каждом осмотре пациента с ХБП терапевтом, нефрологом или врачом другой специальности (НГ).
Измерение АД входит в число обязательных исследований пациента с ХБП. Разовое обнаружение повышенных цифр АД недостаточно для диагностики АД, оно должно получить подтверждение при 2-3 повторных измерениях.
Необходимость многократных измерений у пациента с диагностированной АГ обусловлена высокой лабильностью цифр АД, которая может усиливаться на поздних стадиях ХБП вследствие гиперактивации симпато-адреналовой системы, тяжелой эндотелиальной дисфункции, нарушения работы барорецепторов, ремоделирования сердечно-сосудистой системы и других причин. Изменение течения ХБП, необходимость точной оценки ответа на патогенетическое лечение заболевания почек и антигипертензивную терапию также требуют регулярных измерений АД. Недостаточно частые измерения могут быть причиной как недостаточной эффективности антигипертензивной терапии (из-за недооценки тяжести АГ и недостижения целевых показателей АД), так и ее осложнений, обусловленных развитием эпизодов гипотензии.
Цифры АД должны указываться в протоколе врачебного осмотра. В эпикризе и другой медицинской документации, отражающей состояние пациента за длительный период времени, следует приводить наиболее типичное, а также максимальное и минимальное значения АД за время наблюдения. Если за период наблюдения происходили изменения выраженности повышения АД на фоне терапии или вследствие прогрессирования заболевания почек, эти изменения также должны отражаться в медицинской документации.
Рекомендация 3.3. Суточное мониторирование артериального давления (СМАД), а также регулярный самостоятельный контроль артериального давления (СКАД) пациентом существенно расширяют возможности диагностики АГ, помогают в оценке эффективности и безопасности антигипертензивной терапии при ХБП и должны по возможности дополнять измерения АД врачом (НГ).
СМАД и СКАД дают более полное и точное представление о состоянии системы регуляции АД и тяжести АГ, позволяют оценивать АД в естественных для пациента условиях вне медицинского окружения, выявлять кратковременные подъемы АД, колебания АД на фоне привычных нагрузок, эпизоды гипотензии на фоне лечения, приводящие к ишемии сердца, головного мозга и почек. СМАД, кроме того, позволяет диагностировать феномен гипертонии и гипотензии в период сна, оценивать показатели суточного ритма АД, имеющие самостоятельное прогностическое значение при ХБП [12, 43].
Критерии диагностики АГ по результатам измерений АД, сделанных врачом, полученных самим пациентом в домашних условиях, и СМАД, различны (табл. 4). Изолированная клиническая АГ (так называемый феномен гипертонии на белый халат, т.е. несовпадение данных измерений АД врачом, показывающих повышенные значения, и самоизмерений АД пациентом в домашних условиях или СМАД, показывающих нормальные значения) при наличии ХБП следует рассматривать как состояние, не требующее назначения антигипертензивных препаратов [23, 88].
Изолированная амбулаторная АГ (или скрытая гипертония, т.е. несовпадение данных измерений АД врачом, показывающих нормальные значения, и самоизмерений АД пациентом в домашних условиях или СМАД, показывающих повышенные значения) независимо от наличия ХБП является состоянием, связанным с повышенным риском ССО; тактика лечения строится, как при обычной АГ [23, 88].
Среднее дневное (среднее значение АД за период бодрствования) и среднее ночное АД (среднее значение АД за период ночного сна) - показатели СМАД с лучшей воспроизводимостью по сравнению с данными разовых измерений АД врачом и более четко коррелирующие с неблагоприятным прогнозом со стороны почек и сердечно-сосудистой системы [12, 43].
Степень ночного снижения АД рассчитывается по формуле:
(АД ср. дневное - АД ср. ночное) х 100% / АД ср. дневное.
У здоровых лиц в ночные часы отмечается физиологическое снижение АД - на 10 -22% от среднедневного уровня. Недостаточная степень ночного снижения (<10%) встречается с высокой частотой на поздних стадиях ХБП и связана с повышенным риском ее прогрессирования. Избыточное снижение АД в ночные часы (>22%) также является неблагоприятным вариантом нарушения суточного ритма, поскольку связано с развитием ночной гипотензии, приводящей к гипоксическому повреждению сердца, головного мозга, почек и вызывает компенсаторную гиперактивацию вазопрессорных механизмов в период бодрствования. Дополнительные показатели вариабельности АД (стандартное отклонение от средних значений, скорость утреннего подъема) у пациентов с ХБП могут свидетельствовать о гиперактивации симпатоадреналовой системы, особенно характерной для поздних стадий ХБП, однако их клиническое и прогностическое значение требует уточнения.
| Метод измерения АД | САД, мм рт.ст. | ДАД, мм рт.ст. | |
|---|---|---|---|
Измерение АД врачом в стационаре или амбулатории |
≥140 |
и/или |
»90 |
СМАД: среднее дневное АД |
≥135 |
и/или |
»85 |
СМАД: среднее ночное АД |
≥120 |
и/или |
»70 |
Самоизмерения АД пациентом в домашних условиях |
≥135 |
и/или |
»85 |
Учитывая значительное повышение сердечно-сосудистого риска и нестабильность АД, нарушение физиологического снижения АД в ночные часы при ХБП, коррелирующие со степенью снижения СКФ [12, 19, 81], наличие ХБП является показанием к проведению СМАД у пациентов с признаками АГ по данным измерений врачом или при подозрении на изолированную амбулаторную АГ (при нормальном уровне АД при измерении врачом, но повышенных его значениях при СКАД или наличии гипертрофии миокарда левого желудочка, гипертонической ретинопатии): при первичном обследовании, в дальнейшем - один раз в год или при изменении течения АГ и ответа на терапию (резком нарастании тяжести АГ, развитии резистентности к лечению, появлении нестабильности АД по данным самоизмерений, появлении симптомов гипотензии).
Проведение СМАД не исключает необходимость регулярного СКАД пациентом. Для СКАД рекомендуются аппараты с осциллометрическим принципом измерения АД с манжетой, накладываемой на плечо, которые удобны для самоконтроля и не требуют специальных навыков измерения. Однако от врача требуется убедиться в правильности самоизмерения АД пациентом, проконтролировав его технику и проведя контрольное измерение методом Н.С. Короткова; при необходимости провести его обучение. Больные ХБП с наличием АГ должны самостоятельно контролировать АД не реже 2 раз в сутки. Полученные результаты следует фиксировать в дневнике самоконтроля и предоставлять лечащему врачу при каждом обследовании. На основании результатов СКАД и контрольного измерения АД врачом выносится заключение об эффективности антигипертензивной терапии, ее адекватности определенным для данного больного целевым значениям АД.
Рекомендация 3.4. Сочетание ХБП и АГ требует исключения реноваскулярной болезни, которая может быть как первой причиной повышения АД и нарушения функции почек, так и развиваться на фоне уже существующей АГ и ХБП (НГ).
Наиболее частыми причинами поражения почечных артерий являются атеросклероз и фибромускулярная дисплазия; более редкие причины - системные васкулиты, АФС. Бессимптомный атеросклеротический стеноз почечной артерии встречается у 1,7% условно здорового населения, фибромускулярная дисплазия - у 6,6% [93]. Среди лиц с резистентной АГ частота стеноза почечной артерии достигает 20% [63].
Атеросклеротический стеноз почечной артерии является одной из ведущих причин ТПН у пожилых. В то же время снижение функции почек, и СД [24] являются факторами риска ускоренного развития атеросклероза. Таким образом, ишемическая болезнь почек может развиться на фоне уже существующих АГ и ХБП как новая причина повышения АД и падения СКФ, существенно ухудшая прогноз и меняя подходы к лечению.
Оценка факторов риска реноваскулярной болезни должна проводиться как у лиц с впервые выявленной АГ, так и у пациентов с длительным анамнезом повышения АД и ХБП, особенно в случаях изменения характера АГ [9]. Лицам, входящим в группу высокого риска реноваскулярной болезни, показано проведение ультразвуковой допплерографии как неинвазивного и безопасного метода исследования почечных сосудов. При обнаружении признаков гемодинамически значимого стеноза почечной артерии по данным ультразвуковой допплерографии и высокой вероятности успеха ангиопластики (см. «Рекомендации по консервативному ведению реноваскулярной артериальной гипертонии и ишемической болезни почек») необходимо направить пациента в центр сосудистой хирургии, где проводятся рентгеноконтрастные исследования или МРТ-ангиография для верификации диагноза и определения тактики хирургического лечения.
Факторы риска реноваскулярной болезни
-
Резкое нарастание тяжести уже имеющейся АГ, развитие резистентности к эффективной ранее антигипертензивной терапии.
-
Снижение функции почек, впервые выявленное в пожилом возрасте.
-
Развитие резкого (более чем на 30%) повышения уровня креатинина сыворотки в ответ на назначение ИАПФ или блокатора ангиотензиновых рецепторов.
-
Атеросклероз с признаками ишемического поражения нескольких органов.
-
Клиническая картина системного заболевания соединительной ткани.
Рекомендация 3.5. Обследование пациента с АГ при ХБП включает комплекс физических, лабораторных и инструментальных методов, который определяется особенностями ХБП и задачами уточнения причин и факторов риска повышения АД, оценки состояния органов-мишеней АГ и риска сердечно-сосудистых осложнений (ССО) (НГ).
План обследования пациента с АГ при ХБП строится на основе рекомендаций по ведению данной нозологической формы ХБП, а также отражает задачи уточнения причин повышения АД, оценки риска ССО и разработки тактики его снижения. В ряде случаев АГ является первым симптомом системного аутоиммунного заболевания, заставившим пациента обратиться к врачу. Впервые выявленное сочетание АГ, прогрессирующего снижения функции почек и мочевого синдрома (который нередко носит умеренный характер) требует специального исследования для исключения СКВ, системного васкулита, АФС (АТ к нативной ДНК, антинуклеарных АТ, С3- и С4-фракций комплемента, АТ к цитоплазме нейтрофилов, АТ к кардиолипину, АТ к β2-гликопротеину 1-го типа, волчаночного антикоагулянта).
Повышение АД и риска ССО при ХБП, как правило, обусловлено целым рядом факторов, как общепопуляционных (злоупотребление солью, СД, ожирение, гиперлипидемия, курение), так и связанных с заболеванием почек (снижение СКФ, нарушения фосфорно-кальциевого обмена, анемия и хроническое воспаление, синдром БЭН), причем многие из них являются изменяемыми. Комплексное обследование, учитывающее их во всей совокупности, является важным условием правильной оценки прогноза и разработки оптимальной стратегии кардио-/ нефропротективной терапии. Общие принципы обследования больного с АГ, изложенные в Национальных рекомендациях по диагностике и лечению АГ [23], применимы и к пациентам с ХБП. Однако существует ряд особенностей в подходах к обследованию пациентов с АГ при ХБП, в первую очередь стадий С3-5, когда на первый план выходят специфические почечные факторы сердечно-сосудистого риска, резко повышается частота ССО и существенно меняется их спектр.
Физические и клинико-лабораторные методы исследования пациента с АГ при ХБП
Лабораторные исследования:
Инструментальные исследования:
-
электрокардиография в 12 отведениях с расчетом показателей гипертрофии миокарда левого желудочка: индекса Соколова-Лайона или Корнельского показателя - не реже 2 раз в год;
-
ЭхоКГ с определением индекса массы миокарда (ИМ МЛЖ) и фракции выброса левого желудочка, а также диастолической функции - при первичном обследовании, в дальнейшем не менее 1 раза в 2 года; при отсутствии достижения целевого АД, или наличии признаков прогрессирования гипертрофии миокарда левого желудочка, или наличии ХБП С3б-5 - не менее 1 раза в год;
-
ультразвуковая допплерография сосудов почек - см. рекомендацию 5.4;
-
дуплексное исследование сосудов шеи с целью определения толщины комплекса «интимамедиа», выявления атеросклеротических бляшек, оценки ригидности сосудистой стенки - у мужчин старше 40 лет, женщин старше 50 лет при ХБП С1-3а - не реже 1 раза в 2 года; при ХБП С4-5, независимо от возраста - не реже 1 раза в 1 год****;
-
исследование лодыжечно-плечевого индекса, дуплексное исследование артерий нижних конечностей - при наличии высокого риска (ХБП С3б-5) атеросклероза артерий нижних конечностей или жалоб, физических признаков, характеризующих нарушение проходимости****;
-
исследование скорости пульсовой волны - у мужчин старше 40 лет, женщин старше 50 лет при ХБП С1-3а - не реже 1 раза в 2 года; при ХБП С4-5, независимо от возраста - не реже 1 раза в 1 год****
Консультации специалистов:
-
консультация окулиста - при первичном обследовании, далее по показаниям;
-
консультация эндокринолога - при первичном обследовании, далее по показаниям;
-
консультация невролога - при наличии жалоб, клинических признаков нарушения мозгового кровотока, выраженного нарушения проходимости сосудов шеи по данным дуплексного исследования
Примечания: * - для пациентов с ХБП С4-5.
** - при ПУ менее 0,5 г/л желательно дополнительное исследование АУ как более чувствительного метода; в зависимости от нозологической формы ХБП могут дополнительно потребоваться другие лабораторные исследования.
*** - для пациентов с ПУ более 1 г/л или ХБП С4-5.
**** - при наличии возможности.
Для выявления ведущих причин АГ необходимо тщательное изучение анамнеза, сопоставление сроков выявления АГ и ХБП, оценка изменения выраженности повышения АД и чувствительности к антигипертензивным препаратам на фоне этиотропной и патогенетической терапии заболевания почек. При физическом и инструментальном исследовании особое внимание уделяют состоянию центральных и периферических сосудов, учитывая развитие ремоделирования магистральных артерий и раннего атеросклероза у пациентов с ХБП. Большое значение имеет диагностика нарушений обмена веществ, спектр которых на поздних стадиях ХБП значительно расширяется. Наличие ПУ, при этом развитие синдрома БЭН, проявляющегося низким ИМТ, дефицитом жировой и мышечной ткани, гипоальбуминемией, может иметь более неблагоприятное значение, чем избыточное питание.
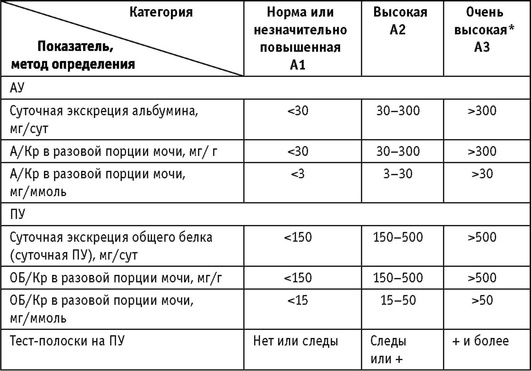
Рекомендация 3.6. Наличие АГ, степень повышения АД и риск ССО отражаются в диагнозе пациента после указания нозологической формы ХБП, ее стадии (табл. 2) и категории АУ/ПУ. Стратификация риска ССО проводится с учетом СКФ и АУ/ПУ (табл. 5) (НГ).
Стратификация риска ССО при ХБП имеет свои особенности. Использование шкалы SCORE или Фремингемской методики расчета сердечнососудистого риска при ХБП дает неправильные (существенно заниженные по сравнению с реальными исходами больных) результаты [124]. Рекомендуется использовать систему стратификации комбинированного риска ТПН и ССО у больных ХБП, разработанную экспертной группой KDIGO (Kidney Disease: Improving Global Outcomes) [67], которая базируется на двух основных показателях - уровне СКФ и категории АУ/ПУ (табл. 5).
Написанию рекомендаций KDIGO по ведению ХБП, ставших важной вехой в развитии концепции ХБП, предшествовал метаанализ 45 когорт, включавших представителей общей популяции, групп риска ХБП, людей с выявленной ХБП - в общей сложности 1 555 332 человек [78]. С высокой степенью доказательности было установлено, что при СКФ ниже 60 мл/мин/1,73 м2 отмечается резкое повышение смертности и риска неблагоприятных почечных исходов, что существует прямая связь между выраженностью АУ и риском ССО и ТПН, что пациенты с одной и той же стадией ХБП характеризуются более неблагоприятным прогнозом при более выраженной АУ, причем эти закономерности отмечаются у лиц как моложе, так и старше 65 лет. На основании этого исследования экспертная группа KDIGO подтвердила, что АУ 30-300 мг/г (т.е. в пределах, когда тест на ПУ может быть слабоположительным или отрицательным) имеет неблагоприятное значение и служит достоверным критерием ХБП. Более того, повышение общей и сердечно-сосудистой смертности было отмечено даже при АУ 10-29 по сравнению с категорией <10 мг/г. Серия опубликованных в последующем метаанализов показала, что неблагоприятное влияние на риск развития ТПН и ССО СКФ ниже 60 мл/ мин/1,73 м2 и повышения АУ проявляется вне зависимости от возраста, пола, наличия артериальной гипертонии и СД [52, 58, 86, 94].
Стадии ХБП |
АУ* |
|||||
|---|---|---|---|---|---|---|
А1 |
А2 |
A3 |
||||
оптимальная или незначительно повышенная |
высокая |
очень высокая |
||||
<30 мг/г <3 мг/ммоль |
30-300 мг/г 3-30 мг/ммоль |
>300 мг/г >30 мг/ммоль |
||||
СКФ, мл/мин/1,73 м2 |
С1 |
Высокая или оптимальная |
≥90 |
Низкий** |
Умеренный |
Высокий |
С2 |
Незначительно снижена |
60-89 |
Низкий** |
Умеренный |
Высокий |
|
СЗа |
Умеренно снижена |
45-59 |
Умеренный |
Высокий |
Очень высокий |
|
СЗб |
Существенно снижена |
30-44 |
Высокий |
Очень высокий |
Очень высокий |
|
С4 |
Резко снижена |
15-29 |
Очень высокий |
Очень высокий |
Очень высокий |
|
С5 |
ТПН |
<15 |
Очень высокий |
Очень высокий |
Очень высокий |
|
* АУ определяется как отношение алъбумин/креатинин в разовой (предпочтительно утренней) порции мочи; АУ >300 мг/г соответствует уровню ПУ >0,5 г/л. СКФ - рассчитывается по формуле CKD-EPI.
** низкий риск - т.е. как в общей популяции. При отсутствии признаков повреждения почек категории СКФ С1 или С2 не удовлетворяют критериям ХБП.
Ключевое значение величины СКФ и АУ/ПУ для оценки риска развития ТПН и ССО у пациентов с ХБП не умаляет важность коррекции АГ для улучшения общего и почечного прогноза. При этом уровень АУ/ПУ является определяющим критерием индивидуального выбора целевого АД и антигипертензивных препаратов.
Рекомендация 4.1. Определение целевого АД и тактика ведения пациентов с АГ при ХБП должны быть подчинены общим задачам кардио-/нефропротекции и индивидуализированы с учетом возраста, нозологической формы ХБП, выраженности АУ/ПУ, функции почек, наличия сердечно-сосудистых заболеваний и метаболических нарушений (НГ).
По современным представлениям, определять тактику коррекции АГ и оценивать ее эффективность следует в русле двуединой кардио-/нефропротективной стратегии, направленной на снижение частоты ССО, представляющих основную причину гибели пациентов с ХБП, и на снижение риска развития ТПН [14, 17]. Существуют рациональные аргументы в пользу более строгого контроля АД при АГ, связанной с ХБП, - как с точки зрения задач нефропротекции, поскольку вследствие нарушений ауторегуляции почечного кровотока даже начальное повышение АД вызывает клубочковую гипертензию и развитие гломерулосклероза, так и кардиопротекции, поскольку ХБП является доказанным фактором повышенного риска ССО. Однако наличие ХБП связано с повышением резистентности к лечению, а также существенным повышением риска побочных эффектов антигипертензивных препаратов. По этим двум причинам задача более строгого контроля АД при ХБП может быть трудновыполнимой и связанной с серьезными осложнениями.
Сегодня очевидно, что пациенты с ХБП - гетерогенная группа, по-разному отвечающая на антигипертензивную терапию. Преимущества более строгого контроля АД, определенных классов антигипертензивных препаратов, чувствительность к терапии, снижающей АД, ее переносимость и безопасность - на все эти важнейшие характеристики, от которых зависит тактика лечения, влияет целый ряд факторов.
Возраст, величина АУ/ПУ и степень снижения функции, определяющие риск ССО, наличие СД, ожирения, являются важнейшими из них. Наличие нарушений мозгового кровообращения, ишемической болезни сердца, нарушений ритма необходимо учитывать при выборе целевого АД и антигипертензивных препаратов в соответствии с Национальными рекомендациями по контролю АГ [23]. Нарушения липидного и пуринового обмена связаны с высоким риском ССО, резистентностью к антигипертензивным препаратам, повышенным риском их побочных действий [16, 22].
Рекомендация 4.2. У больных ХБП без СД с нормальной или незначительно повышенной АУ (категория А1) рекомендуется начинать лечение препаратами, снижающими АД, при стойком повышении САД ≥140 или ДАД ≥90 мм рт.ст. и добиваться достижения уровня САД <140 и ДАД <90 мм рт.ст. (табл. 6) (1В).
Рекомендация 4.3. У больных ХБП без СД с высокой АУ (категория А2) целесообразно начинать лечение препаратами, снижающими АД, при стойком повышении САД ≥130 или ДАД ≥80 мм рт.ст. и добиваться достижения уровня САД <130 и ДАД <80 мм рт.ст. (2D).
Рекомендация 4.4. У больных ХБП без СД с очень высокой АУ и/или ПУ >0,5 г/сут (категория А3) целесообразно начинать лечение препаратами, снижающими АД, при стойком повышении САД >130 или ДАД >80 мм рт.ст. и добиваться достижения уровня САД <130 и ДАД <80 мм рт.ст. (2С).
Рекомендация 4.5. У больных ХБП с СД с нормальной или незначительно повышенной АУ (категория А1) рекомендуется начинать лечение препаратами, снижающими АД, при стойком повышении САД ≥140 или ДАД ≥85 мм рт.ст. и добиваться достижения уровня САД <140 и ДАД <85 мм рт.ст. (1В).
Рекомендация 4.6. У больных ХБП с СД с высокой и очень высокой АУ и/или ПУ >0,5 г/сут (категории А2 и A3) целесообразно начинать лечение препаратами, снижающими АД, при стойком повышении САД ≥130 или ДАД ≥80 мм рт.ст. и добиваться достижения уровня САД <130 и ДАД <80 мм рт.ст. (2D).
Рекомендация 4.7. Независимо от этиологии ХБП и уровня АУ/ПУ не рекомендуется добиваться снижения САД до уровня <120 мм рт.ст. и ДАД до уровня <70 мм рт.ст. (НГ).
Рекомендация 4.8. Важнейшим условием эффективности и безопасности терапии, снижающей АД, у пациентов с ХБП является регулярный контроль переносимости лечения, стабильности достигнутых результатов, выявление резких колебаний АД, эпизодов ортостатической и ночной гипотензии по данным СКАД, СМАД (по возможности) и измерений АД врачом в ортостатической пробе (НГ).
Рекомендация 4.9. Обеспечение хорошей индивидуальной переносимости антигипертензивной терапии и исключение эпизодов гипотензии у пациентов с ХБП являются приоритетными по отношению к задаче снижения АД до целевого уровня (НГ).
Рекомендация 4.10. При плохой переносимости антигипертензивной терапии у пациентов с ХБП необходима коррекция целевого уровня АД в сторону более высоких значений: если первоначально целевой уровень САД определялся <130 мм рт.ст., то при плохой переносимости он должен быть повышен до 130-139 мм рт.ст.; при плохой переносимости целевого уровня САД <140 мм рт.ст. он должен быть повышен до 140-149 мм рт.ст. (НГ).
Рекомендация 4.11. Достижение целевого уровня АД при ХБП должно проводиться постепенно с регулярным контролем переносимости антигипертензивной терапии, что важно как для повышения безопасности терапии, так и для хорошей приверженности лечению со стороны пациентов (НГ).
Идея о целесообразности снижения АД до уровня ниже высокого нормального с целью предотвращения развития ТПН была основана на результатах эпидемиологических исследований. Так, исследование MRFIT (332 544 мужчины, средняя длительность наблюдения 16 лет) показало, что у лиц с высоким нормальным АД риск ТПН в 1,9 раз выше, чем у лиц с оптимальным АД (<120/80 мм рт.ст.) [73]. Интервенционное исследование MDRD, в котором было изучено влияние сочетания МБД и строгого контроля АД на скорость снижения функции почек, показало, что более строгий контроль АД по сравнению со стандартной терапией (АД <140/90 мм рт.ст.) снижал риск ТПН у больных с выраженной ПУ [74], что нашло отражение в многочисленных рекомендациях по контролю АД [23, 41, 48, 92].
Однако положение о необходимости более строгого (<130/80 мм рт.ст.) контроля АД при ХБП до настоящего времени остается недоказанным. Оценка отдаленных исходов вне рамок основного исследования MDRD, а также других исследований по контролю АД при ХБП не показала достоверных различий по риску неблагоприятного почечного исхода у больных с более строгим контролем АД [29, 107, 110]. По данным метаанализа, включающего 37 348 больных, более интенсивный контроль АД оказывал дополнительное вазопротективное действие, однако не уменьшал смертность пациентов с ХБП [85].
У больных СД в исследовании United Kingdom Prospective Diabetes Study (UKPDS) [118] были установлены преимущества более строгого контроля АД в отношении риска ССО. В исследовании Hypertension Optimal Treatment (HOT) также было показано, что достижение уровня ДАД <85 мм рт.ст. сопровождается улучшением прогноза больных СД за счет снижения риска ССО. На основании данных исследований современные европейские рекомендации по контролю АГ [88] определяют целевой уровень ДАД у больных СД <85 мм рт.ст.
Исследование ACCORD, где сравнивалась эффективность более строгого (<130 мм рт.ст.) контроля САД по сравнению с 130-140 мм рт.ст. у больных СД [44], а также метаанализ, посвященный результатам традиционного и более строгого контроля АД у больных СД [30], не показали преимуществ более агрессивной тактики.
Современные американские рекомендации по контролю АД [65, 123] и ведению пациентов с ХБП С1-3 [100], в отличие от более ранних, не предусматривают более строгого контроля АД при ХБП. В то же время рекомендации KDIGO по контролю АГ при ХБП, рекомендации Европейского общества кардиологов 2013 г. и Российские рекомендации по кардионефропротекции не исключают попытку достижения АД ниже 130/80 мм рт.ст. при хорошей переносимости [17, 71, 88].
Сохраняющаяся неопределенность относительно целевого уровня АД при ХБП - одного из важнейших вопросов нефропротективной стратегии - объясняется прежде всего малой доказательной базой, особенно касающейся пациентов с выраженной ПУ. Значительная неоднородность пациентов с ХБП, многообразие факторов, влияющих у них на общий и почечный прогноз, затрудняют анализ результатов клинических исследований. Для доказательства пользы и безопасности строгого контроля АД при ХБП требуются РКИ, включающие очень большое число пациентов и предусматривающее многолетнее наблюдение.
Важным требованием к РКИ, направленным на уточнение уровня целевого АД при ХБП, является комплексный анализ неблагоприятных почечных и сердечно-сосудистых исходов. Имеются данные, что более строгий контроль АГ с момента ее выявления, даже если и не влияет на риск развития ТПН, улучшает выживаемость пациентов за счет снижения риска ССО на стадии проведения ЗПТ [76].
Наиболее часто применяемыми средствами для снижения АД при ХБП являются ИАПФ и БРА, обладающие помимо антигипертензивного антипротеинурическим и нефропротективным действием, кроме того, назначается МБД и другие компоненты нефропротективного лечения. Поэтому оценка самостоятельного вклада достижения целевого АД в улучшение прогноза представляет сложную задачу. Кроме того, строгого контроля АД удается достичь лишь у 20-50% пациентов с ХБП из-за высокой частоты резистентности к лечению, а у больных пожилого возраста, составляющих большую долю лиц с ХБП, строгий контроль АД может быть опасен из-за риска ССО.
Установленным на сегодня фактором, существенно влияющим на эффективность строгого контроля АД при ХБП, является уровень ПУ [74]. Длительное наблюдение за лицами, входившими в исследование AASK, хотя не установило преимуществ более строгого контроля АД в целом по группе, однако показало их в подгруппе лиц с выраженной ПУ [29]. Значение исходного уровня ПУ для целесообразности более низкого целевого АД при ХБП с точки зрения почечных исходов показал и метаанализ [84] .
| Стадия | АУ, мг/сут (категория) | Целевое АД* | Сила и доказательность рекомендации |
|---|---|---|---|
ХБП 1-5 без СД |
<30 (А1) |
<140/90 |
1B |
30-300 (А2) |
<130/80 |
2D |
|
>300 (А3) |
<130/80 |
2C |
|
ХБП 1-5 с СД |
<30 (А1) |
<140/85 |
1B |
≥30 (А2-А3) |
<130/80 |
2D |
|
ХБП 5Д |
<140/90 |
2D |
|
ХБП Т |
<130/80 |
2D |
* Во всех перечисленных клинических ситуациях не рекомендуется добиваться снижения САД до уровня <120 мм рт.ст. и ДАД до уровня <70 мм рт.ст. ХБП 5Д - больные, находящихся на диализе, ХБП Т - больные с пересаженной почкой.
Таким образом, у всех пациентов с ХБП не вызывает сомнения необходимость снижения АД до уровня ниже 140/90 мм рт.ст. (за исключением больных СД, у которых была доказана целесообразность снижения ДАД до уровня ниже 85 мм рт.ст. [59, 118], и особых возрастных групп - см. разделы 8. «Принципы лечения артериальной гипертензии при хронической болезни почек у детей и подростков» и 9. «Принципы лечения артериальной гипертензии при хронической болезни почек у пациентов пожилого и старческого возраста»). У больных с высокой и очень высокой величиной отношения АУ/ПУ, составляющих прогностически наиболее неблагоприятную группу, целесообразна, несмотря на малую доказательную базу, попытка достижения АД ниже 130/80 мм рт.ст. при условии хорошей переносимости (табл. 6).
Вопрос о нижнем пределе оптимальных значений АД при ХБП крайне важен для обеспечения безопасности терапии, недостаточно отражен в современных рекомендациях также из-за малой доказательной базы. В рекомендациях KDOQI по контролю АД при ХБП [92] обозначена нижняя граница оптимальных значений САД - 110 мм рт.ст. на основе данных завершенного незадолго до их написания метаанализа, показавшего, что в отношении функции почек неблагоприятны цифры САД как выше 130, так и ниже 110 мм рт.ст. [64]. При низких цифрах АД вследствие централизации кровотока развивается ишемия почек, приводящая к их повреждению. Роль гипоксии как самостоятельного фактора прогрессирования ХБП обсуждается в литературе [49, 91], однако сегодня, к сожалению, отсутствуют доступные и достоверные методы, позволяющие мониторировать изменения внутрипочечной гемодинамики на фоне антигипертензивной терапии.
Вторичный анализ результатов исследований Atherosclerosis Risk in Communities Study (ARIC) и Cardiovascular Health Study (CHS) [125], посвященный риску ССО при ХБП в зависимости от уровня АД, выявил J-образную зависимость между ними: риск сосудистых катастроФ был достоверно выше при САД как выше 130, так и ниже 120 по сравнению с диапазоном 120-130 мм рт.ст., который был признан авторами оптимальным при ХБП.
Большое значение для выявления нестабильности АД на фоне терапии, эпизодов гипотензии имеет СМАД, а также самоконтроль (см. рекомендацию 3.3). Стремление достичь целевого уровня АД не должно приводить к эпизодам гипотензии, чреватым не только ухудшением коронарного и церебрального кровотока, но и развитием ишемии почек.
Достижение целевого АД должно проводиться постепенно (при 2-3-й степени повышения АД - в срок от нескольких недель до нескольких месяцев), с использованием СКАД, СМАД (по возможности), под контролем динамики креатинина и калия сыворотки крови, избегая эпизодов гипотензии, плохого самочувствия. Постепенность снижения АД способствует лучшей переносимости терапии и повышению приверженности пациентов. Кроме того, при постепенном подходе к снижению АД при ХБП исключается необоснованно большой объем фармакотерапии, поскольку окончательное решение о необходимом числе антигипертензивных препаратов и выбор их оптимальных доз осуществляется, когда уже реализованы долгосрочные эффекты диеты и других немедикаментозных методов лечения, имеющих большое значение при ХБП.
Рекомендация 5.1. Диета и коррекция образа жизни являются важными составляющими лечения больных с АГ при ХБП. Хотя при наличии ХБП только этих методов, как правило, недостаточно для снижения АД до целевого уровня, они необходимы, так как существенно повышают ответ на медикаментозное лечение, уменьшают его объем и повышают безопасность (НГ).
Рекомендация 5.2. Диета больным с АГ при ХБП подбирается с учетом ее особенностей и стадии. Она должна быть в первую очередь подчинена задачам нефропротекции, коррекции метаболических и электролитных нарушений, связанных с заболеванием почек (НГ).
Диета и коррекция образа жизни, направленные на снижение АД, не применяются при ХБП самостоятельно - без медикаментозной антигипертензивной терапии (в отличие от эссенциальной АГ без ХБП, при которой на ранних стадиях возможно ограничиться только нелекарственными методами лечения). Однако их роль при ХБП очень велика, поскольку нелекарственные методы не только существенно повышают эффективность лекарств, снижающих АД, но и повышают их безопасность. Низкосолевая и МБД увеличивают антигипертензивное и антипротеинурическое действие ИАПФ и БРА в 1,5-2 раза.
Диета при ХБП сложна, особенно на 3б-5 стадиях, поскольку подчинена целому комплексу задач профилактики и коррекции нарушений фосфорно-кальциевого, пуринового, липидного обмена, гиперкалиемии и метаболического ацидоза. Продукты, богатые калием, широко рекомендуемые пациентам с эссенциальной АГ, должны быть строго ограничены при ХБП С3б-5, так как они не только усугубляют склонность к гиперкалиемии, но и способствуют развитию гиперурикемии и гиперфосфатемии. На этих стадиях также должно быть ограничено употребление рыбы, овсяной и гречневой круп, богатых фосфором (табл. 7).
| Нарушение обмена | Нежелательные продукты |
|---|---|
Нарушение пуринового обмена. Гиперурикемия: мочевая кислота в сыворотке крови для мужчин >415 мкмоль/л, для женщин >385 мкмоль/л |
Наваристые бульоны, субпродукты - печень, почки, сердце, язык и т.д., паштеты, колбасные изделия, полуфабрикаты, телятина, свинина (можно в ограниченном количестве говядину, птицу), пищевые концентраты - бульонные кубики, супы из пакетика и т.д., копчености, мясные и рыбные консервы, продукты быстрого приготовления (fast food), бобовые - зеленый горошек, фасоль, бобы, чечевица, продукты из сои, какао, шоколад, мед, орехи, семечки, крепкий черный чай и кофе, виноград, изюм, виноградные вина и коньяки. |
Нарушение фосфорно-кальциевого обмена. Гиперфосфатемия: фосфор >1,4 ммоль/л |
Те же продукты, что при нарушении пуринового обмена (см. выше). Дополнительно ограничить морскую и речную рыбу (не более 1 раза в неделю), креветки, икру, сыры, крупы - овсяную, гречневую, пшенную, манную (кроме риса и кукурузы), отруби |
Полужирным шрифтом выделены продукты, обычно рекомендуемые пациентам с артериальной гипертонией и сердечно-сосудистыми заболеваниями без ХБП, но противопоказанные при данных нарушениях обмена.
В условиях снижения функции почек особое значение приобретает сбалансированность и полноценность рациона. Питание должно быть регулярным, по возможности частым - 3 основных приема пищи и 2 легких перекуса. Рацион должен содержать большое количество овощей и фруктов (с учетом некоторых ограничений, см. табл. 7). Субпродукты, консервы, пищевые концентраты, продукты быстрого приготовления и полуфабрикаты, а также шипучие напитки, богатые фосфором, содержащие искусственные красители и синтетические вкусовые добавки, должны быть исключены.
Рекомендация 5.3. Всем больным с АГ при ХБП рекомендуется ограничение потребления соли - менее 2 г (<90 ммоль) натрия (соответствует 5 г хлорида натрия), если нет противопоказаний (1С).
Увеличение потребления соли является важным фактором, способствующим повышению АД у пациентов с ХБП. Ограничение потребления соли при эссенциальной гипертонии оказывает достоверный антигипертензивный эффект [45]. Несмотря на отсутствие крупномасштабных долгосрочных РКИ по изучению роли ограничения потребления соли у пациентов с ХБП, нет оснований полагать, что при этом не должно наблюдаться снижения АД. Установлено, что низконатриевая диета у пациентов, получающих БРА, приводит не только к дополнительному снижению АД, но также и АУ или ПУ [47, 98, 113, 120]. Ограничение потребления хлорида натрия нецелесообразно в клинических ситуациях, связанных с повышенной потерей натрия с мочой (сольтеряющая почка), поскольку может приводить к гиповолемии.
Возможность косвенного контроля потребления соли дает биохимический анализ мочи с расчетом суточной экскреции натрия.
Рекомендация 5.4. Всем больным с АГ при ХБП, за исключением пациентов с НС, ХБП С5Д и другими состояниями, связанными с задержкой жидкости, целесообразно соблюдение расширенного водного режима - потребление не менее 2 л воды в сутки (2D).
Потребление жидкости в объеме не менее 2 л в сутки на сегодня принято в качестве нормы здорового образа жизни. Однако, по данным анкетирования работников одного из предприятий г. Москвы [15], 65,7% опрошенных старались ограничивать потребление жидкости, что сочеталось со значительно более высокой частотой АУ по сравнению с лицами, потреблявшими много жидкости [отношение рисков 1,357 (0,837-2,199)].
Неоправданное ограничение потребления жидкости ведет к гиповолемии, сопровождается уменьшением перфузии почек и развитием их хронической ишемии, патологической активацией РАС и системы аргинин-вазопрессин, является причиной функциональной перегрузки канальцевого аппарата почек, фактором риска его токсического повреждения вследствие высокой концентрированности мочи, развития инфекции мочевых путей [83].
Неблагоприятное значение сниженного потребления жидкости в отношении функции почек было показано в эпидемиологических исследованиях [42, 115]. В условиях гиповолемии существенно повышается риск побочных эффектов препаратов, подавляющих РАС (см. рекомендацию 6.6).
Расширенный водный режим у больных с АГ при ХБП должен сочетаться со строгим ограничением потребления натрия (см. выше).
Рекомендация 5.5. Всем взрослым больным с ХБП С3а-5 и детям с ХБП С4-5 (не получающим диализа) с целью нефропротекции, а также для повышения эффективности антигипертензивных препаратов рекомендуется МБД (0,6-0,8 г/кг) с проведением регулярного контроля питательного статуса и профилактикой синдрома БЭН (1С).
Рекомендация 5.6. Всем больным с АГ при ХБП рекомендуется поддерживать ИМТ в пределах 20-25 кг/м2 (1D).
Пациентам с ХБП С1-2 рекомендуется обычное потребление белка (1,0-1,2 г/кг/сут). Избыточное потребление белка (≥ 1,3 г/кг/сут) может неблагоприятно повлиять на течение ХБП и должно быть исключено. Начиная с 3а стадии ХБП, показана малобелковая диета (МБД) (0,6-0,8 г/кг); чем значительнее снижение СКФ, тем более строгое ограничение потребления белка требуется. МБД благоприятно влияет на почечную гемодинамику, уменьшая клубочковую гипертензию и гиперфильтрацию. Ограничение потребления белка способствует более полной коррекции АГ, уменьшению выраженности нарушений пуринового, фосфорно-кальциевого обмена, гиперкалиемии и метаболического ацидоза. На 4-5-й стадиях ХБП (до начала заместительной терапии), когда отмечается выраженное повышение продуктов азотистого обмена, может быть использована низкобелковая диета (0,3-0,6 г/кг/сут). В условиях значительного ограничения потребления белка важно, чтобы не менее половины его было представлено белками животного происхождения, обладающими наибольшей пищевой ценностью.
Исключение составляют дети, у которых, учитывая важность достаточного потребления белка для роста и развития и отсутствие доказательной базы о влиянии МБД на течение ХБП в этой возрастной группе, она рекомендуется на 4-5-й стадиях ХБП (до начала лечения диализом) с целью коррекции гиперфосфатемии и уремии, а также пациенты с ХБП С5Д, которым показана высокобелковая диета в связи со значительными потерями белка в течение процедуры диализа.
Избыточный вес и ожирение, которые все чаще встречаются у пациентов с ХБП в последние годы, связаны с резким повышением риска ССО, развитием резистентности к антигипертензивной и нефропротективной терапии [122]. Больным с ХБП рекомендуется поддержание ИМТ в пределах 20-25 кг/м2 и окружности талии <102 см у мужчин и <88 см у женщин. У лиц с ожирением уменьшение массы тела на 5-10% от исходной приводит к достоверному снижению риска развития ССО, улучшению контроля АД, что крайне важно для прогноза ХБП. Снижение веса должно быть постепенным и обеспечиваться за счет планомерного ограничения высококалорийных продуктов, богатых легкодоступными углеводами, дозированных физических нагрузок. Применение пищевых добавок для снижения веса, вызывающих обезвоживание организма, сухого голодания недопустимо.
Дефицит потребления незаменимых аминокислот и недостаточная калорийность суточного рациона приводят к развитию синдрома белково-энергетической недостаточности (БЭН), при котором наблюдаются гиперкатаболизм и утилизация собственных белков организма, в первую очередь мышц, резкое повышение смертности от сердечно-сосудистых и инфекционных осложнений. Синдром БЭН - одно из серьезных осложнений, часто встречающихся на поздних стадиях ХБП (С4-С5) и неблагоприятно влияющих на прогноз. Развитию данного синдрома способствует снижение аппетита и отвращение к белковой пище, часто возникающие вследствие уремии, а также неадекватная диета. Ограничение потребления белка при ХБП должно быть контролируемым и не вызывать ухудшения нутритивного статуса.
Признаки синдрома БЭН могут быть выявлены при осмотре больного (снижение веса и ИМТ, уменьшение толщины кожно-жировой складки, окружности бицепса), при проведении биохимического анализа крови (альбумин <35 г/л, парадоксальный рост мочевины и мочевой кислоты, калия, несмотря на дефицит потребления аминокислот).
Назначение комплекса кетоаналогов незаменимых аминокислот (Кетостерил♠ по 1 таб. на 5 кг массы тела в сутки или 0,1 г/кг/сут) и высокая калорийность рациона (30-35 ккал/кг/сут) в сочетании с достаточной физической активностью позволяют ограничивать потребление белка, избегая синдрома БЭН, при этом наблюдается замедление прогрессирования ХБП [16, 51, 55, 62]. При назначении низкобелковой диеты использование препаратов кетокислот является обязательным.
Учитывая сложность диеты при ХБП, изменения ее требований в зависимости от стадии заболевания, важность строгой сбалансированности, пациентам с ХБП с высоким и очень высоким риском ТПН и ССО показаны консультация диетолога, регулярный контроль рациона питания и нутритивного статуса, ведение пищевых дневников.
Рекомендация 5.7. Всем больным с АГ при ХБП рекомендуется индивидуальный подбор комплекса лечебной физкультуры с учетом состояния сердечно-сосудистой системы и переносимости. Физические упражнения должны быть равномерно распределены в течение недели, их общая продолжительность должна составлять не менее 3 ч в неделю (1D).
Благоприятное разностороннее влияние дозированных физических нагрузок на показатели здоровья показано в многочисленных исследованиях представителей общей популяции. Несмотря на отсутствие клинических исследований влияния физических упражнений на уровень АД и прогноз пациентов с ХБП (кроме единичных небольших по объему исследований пациентов с ТПН), нет оснований полагать, что их эффекты должны быть иными, чем у представителей общей популяции.
Дозированные физические нагрузки показаны всем пациентам с ХБП, кроме больных с тяжелыми формами НС с олигурией, больных с острым повреждением почек. Аэробные нагрузки (плавание, быстрая ходьба, занятия на велотренажере и эллиптическом тренажере) необходимы для оптимизации веса, АД, снижения риска ССО. Полезны и силовые упражнения для улучшения белкового обмена, укрепления мышц. В то же время бег трусцой, занятия на беговой дорожке, верховая езда и другие упражнения, связанные со значительным сотрясением тела, нежелательны людям, склонным к опущению почки.
Занятия физкультурой должны быть регулярными и равномерно распределены в течение недели - как минимум по 30 мин в день 5-7 раз в неделю или по часу 3 раза в неделю.
Рекомендация 5.8. Всем больным с АГ при ХБП, подверженным курению, рекомендуется отказ от него - в том числе с целью кардио- и нефропротекции (1D).
Рекомендация 5.9. Потребление алкоголя больным с АГ при ХБП рекомендуется ограничить - не более 20 г чистого этанола в сутки для мужчин и не более 10 г/сут для женщин (1D).
Курение является одним из основных изменяемых факторов риска развития ССО, развития ХБП и развития ТПН у пациентов с уже имеющейся ХБП [45]. Прием алкоголя вызывает как кратковременное, так и долгосрочное повышение АД. Систематической обзор результатов четырех исследований показал, что ограничение потребления алкоголя в общей популяции привело к снижению САД на 3,8 мм рт.ст. (95% ДИ [18] 1,4-6,1), а ДАД - на 3,2 мм рт.ст. (95% ДИ 1,4-5,0). Пагубное потребление алкоголя негативно влияет и на состояние почек.
Несмотря на отсутствие клинических исследований влияния отказа от курения и ограничение потребления алкоголя на уровень АД и прогноз пациентов с ХБП, нет оснований полагать, что их эффекты должны быть иными, чем у представителей общей популяции.
Рекомендация 5.10. Необходимо тщательно изучать фармакологический анамнез больных с АГ при ХБП, по возможности ограничивать или исключать прием препаратов, повышающих АД и неблагоприятно влияющих на почки (анальгетики, НПВС, включая селективные ингибиторы циклооксигеназы-2) (НГ).
Значительная часть пациентов с ХБП в России регулярно принимает анальгетики и НПВП (по данным анкетирования до 30%) по поводу головных болей, болей в спине, артралгий, болезненных месячных, как правило, не ставя об этом в известность нефролога. Регулярный прием анальгетиков, НПВП, включая селективные ингибиторы циклооксигеназы-2, связан с развитием резистентности к антигипертензивной терапии вследствие снижения экскреции натрия, оказывает токсическое и ишемическое повреждающее действие на почки, приводящее к тубулоинтерстициальному фиброзу и нарушению их функции. При обследовании пациента с АГ при ХБП необходимо целенаправленно выявлять наличие болевого синдрома любой локализации, который сам предрасполагает к развитию резистентной АГ, и факт регулярного приема анальгетиков, НПВП, а также других препаратов, способствующих повышению АД (гормональные контрацептивы, заместительная терапия женскими половыми гормонами, симпатомиметики, препараты спорыньи, анаболические стероиды и др. (см. Рекомендацию 6.11) с последующим направлением к соответствующему специалисту с целью коррекции терапии с максимально возможным ограничением приема препаратов, оказывающих нежелательное влияние на уровень АД, сердечно-сосудистую систему и почки.
Рекомендация 6.1. Выбор препаратов для снижения АД при ХБП определяется, в первую очередь, целями нефро-/кардиопротекции и должен проводиться с учетом данных клинических исследований об их влиянии на почечные и сердечно-сосудистые исходы, а также данных о безопасности их применения на данной стадии ХБП (НГ).
Группы препаратов, снижающих АД, существенно различаются по влиянию на центральную гемодинамику, ССО и прогрессирование ХБП (табл. 8).
При выборе препаратов отдают предпочтение средствам, оказывающим помимо снижения АД, дополнительные органопротективные эффекты в отношении почек и сердечно-сосудистой системы. Задачи нефропротекции являются приоритетными, особенно у пациентов с высоким риском прогрессирования ХБП (см. табл. 8) поскольку сохранение функции почек при ХБП является важнейшим условием снижения риска ССО.
Нефропротективные свойства, т.е. способность достоверно отдалять наступление терминальной почечной недостаточности (ТПН) по данным рандомизированного клинического исследования (РКИ), доказаны для представителей двух классов - ингибиторов ангиотензинпревращающего фермента (ИАПФ) и блокаторов рецептора ангиотензина (БРА) - у пациентов с очень высокой АУ или выраженной ПУ (категория А3). При АУ категории А2 имеются рациональные аргументы и мнения экспертов в пользу назначения ИАПФ или БРА, однако в настоящее время отсутствуют РКИ, с высокой степенью доказательности подтверждающие преимущества препаратов, подавляющих РАС, перед другими препаратами, снижающими АД (см. рекомендации 6.1-6.5). При АУ класса А1 препараты, подавляющие ренин-ангиотензиновую систему (РАС), не имеют преимуществ по сравнению с другими антигипертензивными средствами [71].
В экспериментальных исследованиях было показано, что недигидропиридиновые антагонисты кальция (АКнд) могут оказывать антипротеинурический эффект за счет снижения внутриклубочкового давления, воздействуя, подобно ИАПФ и БРА, преимущественно на выносящую артериолу. В то же время нифедипин преимущественно расширяет приносящую артериолу, усиливая гиперперфузию клубочков, клубочковую гипертензию и повышая АУ. Однако значение этих особенностей при клиническом применении АК остается недостаточно изученным. Самостоятельное применение АКнд с нефропротективной целью - как альтернативы ИАПФ или БРА - не рекомендуется. Сочетанное применение с препаратами, подавляющими РАС, нивелирует негативное влияние АКнд на почечную гемодинамику и АУ.
Благоприятное влияние на риск ССО показано для многих классов препаратов, снижающих АД (см. табл. 8), в крупных РКИ, включающих в том числе пациентов с ХБП и больных СД.
Особенности влияния различных групп препаратов, снижающих АД, на риск ССО в зависимости от наличия ХБП, ее стадии, нозологической формы не изучены. При определении препаратов выбора у пациентов с ХБП руководствуются общими принципами, изложенными в Национальных рекомендациях по лечению АГ [22, 23], учитывая наличие ишемической болезни сердца, аритмии, сердечной недостаточности, облитерирующего атеросклероза периферических артерий, метаболического синдрома.
Поскольку антигипертензивная терапия назначается на длительное время, немаловажное значение для выбора препаратов играют факторы, влияющие на приверженность пациентов лечению: использование препаратов, более доступных по цене, имеющих пролонгированное действие с возможностью однократного приема в течение суток, фиксированных комбинаций антигипертензивных средств, которые позволяют уменьшить число принимаемых таблеток.
Рекомендация 6.2. У пациентов с ХБП без СД с очень высокой АУ и/или ПУ >0,5 г/сут (категория А3) рекомендуется назначение ИАПФ или БРА (1B).
Рекомендация 6.3. У пациентов с ХБП без СД с высокой АУ (категория А2) целесообразно назначение ИАПФ или БРА (2D).
Рекомендация 6.4. У пациентов с ХБП с СД с очень высокой АУ и/или ПУ >0,5 г/сут (категория А3) рекомендуется назначение ИАПФ или БРА (1B).
Рекомендация 6.5. У пациентов с ХБП с СД с высокой АУ (категория А2) целесообразно назначение ИАПФ или БРА (2D).
Гиперактивация РАС, приводящая к нарушению почечной гемодинамики (клубочковой гипертензии и ишемии почечного тубулоинтерстиция), усилению ПУ и протеинурического ремоделирования почечных канальцев, играет ключевую роль в прогрессировании ХБП [119]. Поэтому применение препаратов, подавляющих РАС, - ИАПФ и БРА занимает центральное место в нефропротективной стратегии [46].
| Группы препаратов | Снижение риска ССО | Нефропротекция | Клинические ситуации в пользу применения |
|---|---|---|---|
ИАПФ |
+++ |
+++ |
ХБП А2-3, хроническая сердечная недостаточность, гипертрофия и дисфункция левого желудочка сердца, постинфарктный кардиосклероз, СД |
БРА |
+++ |
+++ |
ХБП А2-3, хроническая сердечная недостаточность, гипертрофия и дисфункция левого желудочка сердца, постинфарктный кардиосклероз, СД |
Основные нежелательные явления |
Противопоказания |
||
Резкое падение функции почек у больных с двусторонним гемодинамически значимым стенозом почечных артерий, гиповолемией, снижением сердечного выброса, выраженной ХПН. Гиперкалиемия. Непродуктивный сухой кашель. Ангионевротический отек. Гипотензия. Снижение ответа на препараты, стимулирующие эритропоэз. Нарушение внутриутробного развития (пороки сердца и др.). Другие: головокружение, судороги, парестезии, диспепсия, желтуха, цитопения, аллергические реакции |
Беременность, лактация, гиперкалиемия, двусторонний стеноз почечных артерий или стеноз артерии единственной почки, дегидратация, резкое падение СКФ(»50% от исходного уровня) в ответ на назначение ИАПФ или БРА в анамнезе |
||
Резкое падение функции почек у больных с двусторонним гемодинамически значимым стенозом почечных артерий, гиповолемией, снижением сердечного выброса, выраженной ХПН. Гиперкалиемия (редко). Гипотензия. Нарушение внутриутробного развития (пороки сердца и др.). Снижение ответа на препараты, стимулирующие эритропоэз. Другие: редко - непродуктивный сухой кашель, головокружение, судороги, парестезии, миалгии, диспепсия, цитопения, ангионевротический отек, аллергические реакции |
Беременность, лактация, гиперкалиемия, двусторонний стеноз почечных артерий или стеноз артерии единственной почки, дегидратация, резкое падение СКФ (»50% от исходного уровня) в ответ на назначение ИАПФ или БРА в анамнезе |
||
Группы препаратов |
Снижение риска ССО |
Нефропротекция |
Клинические ситуации в пользу применения |
Тиазидные диуретики |
+++ |
- |
Неосложненная метаболическими нарушениями АГ, хроническая сердечная недостаточность, отеки, изолированная систолическая АГ, АГ у пожилых, высокий риск инфаркта миокарда и нарушения мозгового кровообращения |
Петлевые диуретики |
? |
- |
Хроническая сердечная недостаточность, отеки, нарушение фильтрационной функции почек |
Блокаторы альдосте роновых рецепторов |
++ |
+ |
Хроническая сердечная недостаточность, постинфарктный кардиосклероз, резистентные отеки |
Основные нежелательные явления |
Противопоказания |
||
Водно-электролитные: гипокалиемия, гипохлоремический алкалоз, гипонатриемия, гиповолемия, гипомагниемия, судороги, парестезии. Метаболические: гиперурикемия, обострение подагры, снижение толерантности к углеводам, глюкозурия, гиперлипидемия. Гемодинамические и коагулологические: ортостатическая гипотензия, тромбозы, тромбоэмболии. Другие: снижение потенции, гемолиз, цитопения, расстройства зрения, желтуха, запоры, аллергические реакции |
Подагра, гиперурикемия, беременность и кормление грудью, гипонатриемия, гиповолемия, острая или быстро прогрессирующая ПН, ХБП С4-5, гиперкальциемия, гиперчувствительность к сульфаниламидам |
||
Водно-электролитные: гипокалиемия, гипохлоремический алкалоз, гипонатриемия, гипомагниемия, гиперкальциурия, судороги, мышечная слабость, парестезии. Метаболические: гиперурикемия, обострение подагры, снижение толерантности к углеводам, глюкозурия, гиперлипидемия. Гемодинамические и коагулологические: ортостатическая гипотензия, тромбозы, тромбоэмболии. Другие: снижение потенции, желтуха, диарея, запор, тошнота, анорексия, поражение внутреннего уха, цитопения, интерстициальный нефрит, аллергические реакции |
Подагра, гиперурикемия, беременность и кормление грудью, гипонатриемия, гиповолемия, СД тяжелого течения, гиперчувствительность к сульфаниламидам |
||
Водно-электролитные: гиперкалиемия. Гормональные: гинекомастия, боль в молочных железах, снижение потенции у мужчин, нарушение менструального цикла или аменорея, метроррагия в климактерическом периоде, гирсутизм, изменение голоса у женщин, алопеция, гипертрихоз. Онкологические: сообщалось о случаях рака молочной железы у мужчин и женщин при длительном применении альдактона. Другие: зуд, крапивница, цитопения. |
Гиперкалиемия, гипонатриемия, гиперкальциемия, острая или быстро прогрессирующая ПН, ХБП С4-5, беременность, болезнь Аддисона, нарушение менструальной функции, метаболический ацидоз Не рекомендуется длительное лечение альдактоном, особенно мужчин, из-за риска рака молочной железы |
||
Группы препаратов |
Снижение риска ССО |
Нефропротекция |
Клинические ситуации в пользу применения |
Дигидропиридиновые антагонисты кальция (АКд) |
+++ |
- |
Изолированная систолическая АГ, АГ у пожилых, стенокардия, атеросклероз периферических и сонных артерий, синдром Рейно, АГ у беременных |
Недигидропиридиновые антагонисты кальция (АКнд) |
+++ |
+ |
Стенокардия, атеросклероз сонных артерий, суправентрикулярная тахикардия, нефропатии с выраженной ПУ |
Агонисты имидазоли новых рецепторов |
+ |
- |
Метаболический синдром, СД |
Основные нежелательные явления |
Противопоказания |
||
Сердечно-сосудистые: тахикардия, сердцебиения, гиперемия кожи лица, гипотензия. Другие: отеки лодыжек и стоп, головокружение, аллергические реакции, редко - гиперплазия десен. Возможно усиление ПУ и усиление клубочковой гипертензии; данные эффекты нивелируются при совместном назначении с ингибитором АПФ или БРА |
Тахиаритмии, нестабильная стенокардия, выраженный аортальный стеноз, выраженная хроническая сердечная недостаточность |
||
Сердечно-сосудистые: синусовая брадикардия, атриовентрикулярная блокада, гипотензия, снижение сократимости миокарда, гиперемия кожи лица. Общемозговые: головная боль, головокружение, нервозность, заторможенность, сонливость, слабость, утомляемость. Желудочно-кишечные: тошнота, запоры; редко - гиперплазия десен. Другие: мышечная слабость, парестезии, отеки конечностей, аллергические реакции |
Атриовентрикулярная блокада ст., синдром слабости синусового узла, выраженная синусовая брадикардия, выраженная хроническая сердечная недостаточность, тяжелый стеноз устья аорты, беременность, лактация |
||
Общемозговые: головокружение, слабость, депрессия. Сердечно-сосудистые: гипотензия, приливы. Желудочно-кишечные: ксеростомия, диспепсия. Другие: расстройства половой функции,: кожные высыпания, зуд |
Нежелательно назначение при тяжелой хронической сердечной недостаточности, атриовентрикулярной блокаде II-III ст. |
||
Группы препаратов |
Снижение риска ССО |
Нефропротекция |
Клинические ситуации в пользу применения |
β-Адреноблокаторы |
+++ |
- |
Стенокардия, постинфарктный кардиосклероз, хроническая сердечная недостаточность (с осторожностью, начиная с малых доз), тахиаритмии, АГ у беременных |
α-Адреноблокаторы, |
- |
- |
Доброкачественная гиперплазия предстательной железы |
α, β-адреноблокаторы |
+ |
- |
|
Снижение АД является лишь одним из механизмов благоприятного воздействия данных лекарственных средств на течение ХБП: они также обладают антипротеинурическим действием, устраняют клубочковуюгипертензию и ишемию почечного тубулоинтерстиция, подавляют процессы воспаления и фиброгенеза [75]. По данным ряда проспективных исследований лечение ИАПФ или БРА существенно снижает риск развития ТПН у больных ХБП диабетической и недиабетической природы [39, 80, 90, 106].
Окончание табл. 8
| Основные нежелательные явления | Противопоказания |
|---|---|
Сердечно-сосудистые: брадикардия, гипотензия, ухудшение кровоснабжения конечностей у больных атеросклерозом, нарушение проводимости миокарда, атриовентрикулярная блокада, снижение сократимости миокарда. Респираторные: бронхоспазм, бронхообструкция, вазомоторный ринит. Метаболические: снижение толерантности к углеводам, гиперлипидемия. Общемозговые: слабость, головокружение, вялость, повышенная утомляемость, снижение концентрации внимания, депрессия, нарушения сна. Синдром отмены. Другие: ослабление потенции, мышечные судороги, миалгии, мышечная слабость, парестезии, нарушение зрения, ксерофтальмия и ксеростомия, цитопения, аллергические реакции |
Атриовентрикулярная блокада II-III ст., синдром слабости синусового узла, выраженная синусовая брадикардия, выраженная хроническая сердечная недостаточность, бронхиальная астма, другие хронические обструктивные заболевания легких, атеросклероз периферических артерий (можно с осторожностью кардиоселективные β-адреноблокаторы); нежелательно назначение спортсменам и физически активным лицам |
Сердечно-сосудистые: гипотензия, тахикардия. Общемозговые: головокружение, синкопальные состояния. Другие: редко - ксеростомия, тошнота, дискомфорт в брюшной полости, запоры |
Ортостатическая гипотензия в анамнезе, тяжелая хроническая сердечная недостаточность, выраженный стеноз аортального и митрального клапанов, тяжелые нарушения функции печени, беременность, кормление грудью |
Так, в исследовании REIN, при использовании ИАПФ рамиприла у больных с недиабетическими формами ХБП (ХГН, ПБП) риск развития ТПН или значительного снижения СКФ уменьшался на 49% по сравнению с группой получавших плацебо в дополнение к обычной антигипертензивной терапии [55].
Однако широкое применение агрессивной блокады РАС (см. комментарий к рекомендации 6.8) и шаблонное назначение данных препаратов всем пациентам с ХБП без учета их индивидуальных особенностей неоправданно. Важно учитывать, что РАС при ХБП не только взаимодействует с механизмами гемодинамического и протеинурического повреждения почек, но ее гиперактивация играет определенную приспособительную роль, поддерживая внутриклубочковое давление, особенно в условиях гипоперфузии почек, например при застойной сердечной недостаточности, атеросклерозе почечных артерий.
Как нефропротективный потенциал, так и частота осложнений при лечении препаратами, подавляющими РАС, варьируют в широких пределах. На их эффективность влияет исходный уровень АУ/ПУ [103], генетические особенности, в частности полиморфизм гена АПФ [37, 95]: наиболее отчетливое благоприятное влияние терапии на почечные исходы отмечается в самых прогностически неблагоприятных группах - у больных с исходно более высокой ПУ и DD-вариантом полиморфизма гена АПФ.
Большое значение имеет раннее назначение препаратов, подавляющих РАС: хотя они не теряют способности оказывать антипротеинурическое и нефропротективное действие на поздних стадиях заболевания, однако решающую роль играет продолжительность их приема - по мере увеличения длительности терапии положительные почечные эффекты данных средств накапливаются [108].
К сожалению, ранние предикторы, позволяющие предсказывать хороший нефропротективный эффект препаратов, подавляющих РАС, до настоящего времени не разработаны. По данным РКИ [56], их благоприятное влияние на скорость прогрессирования ХБП прямо пропорционально их антипротеинурическому действию. Хорошим признаком может считаться снижение ПУ в 1,5-2 раза от исходного уровня или ее стойкое уменьшение до уровня ниже 0,5 г/сут, однако оно достигается не сразу, а спустя 3-6 мес непрерывного лечения, когда и следует оценивать эффект.
Рекомендация 6.6. Назначение препаратов, подавляющих РАС, пациентам с ХБП С3а-5 связано с повышенным риском осложнений, который нарастает по мере снижения функции почек и у больных пожилого возраста. Лечение данными средствами должно проводиться на фоне тщательного мониторинга уровня креатинина и калия сыворотки. Пациентов необходимо информировать о необходимости во время данного лечения соблюдать адекватный водный режим, исключающий гиповолемию, и ограничивать потребление продуктов, богатых калием, но предупреждать о нежелательности его сочетания с препаратами, ухудшающими почечный кровоток (анальгетики и НПВП, включая селективные ингибиторы циклооксигеназы-2), противопоказании данных препаратов во время беременности.
Рекомендация 6.7. При стойком (сохраняющемся в течение 2 нед) повышении концентрации креатинина сыворотки более чем на 30% от исходного уровня препарат, подавляющий РАС, должен быть отменен и проведено обследование для исключения реноваскулярной болезни (см. рекомендацию 2.4) (НГ).
Данные РКИ [39, 80, 90, 106], а также многолетний опыт применения ИАПФ и БРА показывают, что они могут назначаться с высокой степенью безопасности как на ранних, так и на поздних стадиях ХБП. Тем не менее при использовании препаратов, подавляющих РАС, у пациентов с ХБП требуется повышенная осторожность. Кроме мучительного сухого кашля, ангионевротического отека, нарушений внутриутробного развития плода при их приеме во время беременности, следует учитывать такие серьезные побочные действия, как гиперкалиемия, острое повреждение почек, анемия, характерные для пациентов с ХБП, риск которых прямо пропорционален степени снижения СКФ.
Основным механизмом нефропротективного действия ИАПФ и БРА является расширение выносящей артериолы, приводящее к устранению клубочковой гипертензии, которая развивается в условиях гиперперфузии почечных клубочков и характерна для большинства больных с ХБП. В противоположной ситуации - гипоперфузии почечных клубочков, развивающейся при гиповолемии, уменьшении сердечного выброса, нарушении проходимости почечных сосудов вследствие их обструкции или вазоконстрикции, препараты, подавляющие РАС, перестают оказывать нефропротективное действие и могут вызвать острое повреждение почек, поскольку устраняют сужение выносящей артериолы - единственный механизм, поддерживающий клубочковое давление при снижении их кровоснабжения.
Факторами риска гипоперфузии почечных клубочков являются пожилой возраст, наличие СД, застойной сердечной недостаточности, тяжелого атеросклероза, неадекватный водный режим, неадекватный и бесконтрольный прием диуретиков, анальгетиков и НПВП. В этих ситуациях нужна повышенная осторожность: начальное назначение препаратов, блокирующих РАС, необходимо проводить в минимальных дозах с постепенным их титрованием, обеспечивать более частый мониторинг уровня креатинина и калия сыворотки крови.
Гиперкалиемия развивается при назначении ИАПФ и БРА вследствие подавления продукции альдостерона. Ее предотвращению способствуют низкокалиевая диета и назначение салуретиков.
БРА по сравнению с ИАПФ значительно реже вызывают сухой кашель, ангионевротический отек и гиперкалиемию и могут рассматриваться в качестве альтернативы при непереносимости ИАПФ.
Риск развития острого повреждения почек при использовании обеих групп препаратов, подавляющих РАС, одинаков, поэтому при появлении данного осложнения обе группы в дальнейшем должны быть исключены.
Контроль уровня креатинина и калия сыворотки крови должен проводиться до назначения препарата, подавляющего РАС, или увеличения его дозы и затем повторно - через 3-5 дней. Увеличение уровня креатинина на величину менее 30% от исходного считается благоприятным признаком, поскольку отражает устранение клубочковой гипертензии и гиперфильтрации. При его повышении на 30-50% рекомендуется повторное определение с интервалом в 1 нед. Если повышение уровня креатинина через 2 нед наблюдения сохраняется выше 30%, препарат должен быть отменен. Если повышение уровня креатинина составляет ≥50% от исходного, препарат должен быть немедленно отменен. При резком (≥30%) повышении уровня креатинина сыворотки больной должен быть направлен на обследование для исключения реноваскулярной болезни (см. рекомендацию 3.4).
Рекомендация 6.8. В большинстве случаев АГ при ХБП монотерапия оказывается недостаточной и следует применять комбинированное лечение препаратами, снижающими АД, из разных фармакологических групп. При САД ≥160 и/или ДАД ≥100 возможно начинать лечение сразу двумя препаратами. Нередко для достижения целевого уровня АД при ХБП требуется сочетание 3-4 антигипертензивных препаратов с соблюдением мер безопасности, изложенных в разделе «Целевое артериальное давление у пациентов с артериальной гипертензией», рекомендации 4.7-4.9 (НГ).
По данным РКИ, в которых ставилась задача более строгого контроля АД, для достижения его целевого уровня при ХБП необходима комбинация из 3 и более препаратов. К сожалению, возможности комбинированной терапии АГ при ХБП изучены в небольшом числе исследований.
При АУ категории А1, при которой ИАПФ и БРА не обладают преимуществами по сравнению с антигипертензивными препаратами из других групп, комбинированная терапия проводится в соответствии с общими принципами, сформулированными в Национальных рекомендациях по лечению АГ [23].
При более выраженной АУ/ПУ, когда ИАПФ или БРА являются препаратами первого выбора, эффективность дополнительной антигипертензивной терапии должна оцениваться с точки зрения ее влияния на риск развития ТПН и ССО.
Учитывая ключевую роль гиперактивации РАС в прогрессировании ХБП и ремоделировании миокарда, в последние годы активно изучалась возможность агрессивной ее блокады с использованием препаратов, действующих на данную вазоактивную систему на разном уровне. Однако, как показал ряд РКИ, посвященных различным сочетаниям ИАПФ, БРА и ингибитора ренина [32, 53, 89, 96], такая тактика не обладает преимуществом перед монотерапией ИАПФ или БРА в отношении почечных исходов и общей выживаемости и при этом связана со значительным повышением риска побочных эффектов.
Так, в исследовании ONTARGET, которое было спланировано с целью изучить клиническую эффективность и безопасность стратегии двойной блокады РААС с помощью ИАПФ рамиприла и БРА телмисартана и включало свыше 25 тыс. пациентов с периодом наблюдения более 5,5 лет, прицельная оценка почечных исходов показала, что комбинация ИАПФ и БРА была ассоциирована с повышением риска необходимости в диализе, удвоения уровня креатинина сыворотки и смертности, по сравнению с изолированным применением обоих препаратов [89].
В исследовании NEPHRON-D [54], в которое включали пациентов с ДН с выраженной АУ (не менее 300 мг/г), при которой преимущества комбинированного лечения должны были бы проявляться наиболее отчетливо, в группе комбинированного лечения лозартаном и лизиноприлом частота неблагоприятных почечных исходов была незначительно ниже по сравнению с монотерапией лозартаном, не было преимуществ в отношении смертности и сердечно-сосудистых исходов. В то же время частота гиперкалиемии и острой ПН была достоверно выше при комбинированной терапии. Систематический обзор, включающий 21 708 пациентов, также не показал преимуществ комбинированного лечения при ХБП в отношении риска снижения функции почек и ССО [87].
Еще одна комбинация, на которую возлагали определенные надежды в отношении более эффективной нефропротекции, - присоединение к ИАПФ или БРА антагониста альдостерона, роль которого в прогрессировании нефросклероза и кардиосклероза активно обсуждается [8, 28, 60, 111]. Однако метаанализ, включающий 27 контролируемых или квазиконтролируемых исследований, в которых изучали эффекты присоединения альдактона к ИАПФ или БРА или их сочетанию [37], показал, что комбинированное лечение более эффективно снижает ПУ, но в то же время чаще вызывает гиперкалиемию и не имеет преимуществ в отношении сохранения функции почек и риска ССО.
Таким образом, достижение максимального антипротеинурического эффекта за счет использования агрессивной комбинированной блокады РАС в настоящее время признано рискованной тактикой, не дающей заметных преимуществ в отношении эффективности нефропротекции и значительно повышающей риск осложнений.
Наиболее оптимальными считаются комбинации ИАПФ или БРА с диуретиком или антагонистом кальция. Назначение тиазидного или петлевого диуретика в 1,5-2 раза усиливает антигипертензивный и антипротеинурический эффект препаратов, подавляющих РАС [47, 120]. Однако при назначении мочегонных следует учитывать опасность гиповолемии и ограничения в использовании тиазидов при выраженном снижении СКФ (см. рекомендацию 9 этого раздела).
Post hoc анализ результатов крупного исследования ACCOMPLISH свидетельствует о превосходстве комбинации ИАПФ (беназеприл℘) с антагонистом кальция (амлодипин) над комбинацией беназеприла℘ с тиазидным диуретиком [гидрохлоротиазид (Гидрохлортиазид♠)] в отношении замедления прогрессирования ХБП [33].
В исследовании OSCAR, в которое включали пожилых пациентов с СКФ ниже 60 мл/мин/1,73 м2, были показаны преимущества в отношении эффективности контроля АД и неблагоприятных сердечно-сосудистых исходов комбинированного лечения БРА олмесартаном в сочетании с антагонистом кальция амлодипином по сравнению с монотерапией БРА в высокой дозе [72]. В исследовании ZAFRA [104] было показано, что назначение АКд лерканидипина в дополнение к терапии, подавляющей РАС, приводит к дополнительному снижению ПУ и тенденции к повышению СКФ. Комбинация АКд с препаратом, подавляющим РАС, как говорилось выше (рекомендация 8.1), нивелирует его неблагоприятное действие на почечную гемодинамику. Польза такого сочетания обусловлена более частым достижением целевого АД в группе комбинированной терапии.
При недостаточном контроле АД в качестве дополнения к проводимой комбинированной терапии - ИАПФ (или БРА) и диуретик и/или антагонист кальция - могут назначаться агонисты имидазолиновых рецепторов, β-адреноблокаторы.
α-Адреноблокаторы, оказывающие мощный антигипертензивный эффект, но не обладающие органопротективными свойствами, а также α-, β-адреноблокаторы используются как препараты резерва в случае тяжелой, резистентной к стандартной терапии АГ. При их назначении необходимо исключать ночную гипотензию и ортостатическую гипотензию (см. рекомендации 2.1, 2.3).
Следует избегать сочетания АКнд и β-адреноблокатора, учитывая их однонаправленное влияние на ЧСС и проводимость миокарда.
Рекомендация 6.9. У больных с нарушением функции почек меняется фармакокинетика и эффективность многих препаратов, снижающих АД, повышается риск их побочных действий, что необходимо учитывать при выборе лекарств и их доз (НГ).
При СКФ <60 мл/мин/1,73 м2 нарушается фармакокинетика препаратов с преимущественно почечным путем выведения, возникает риск передозировки даже при использовании средних терапевтических доз, поэтому следует отдавать предпочтение средствам с преимущественно печеночным путем выведения (табл. 9).
Снижение функции почек приводит к уменьшению чувствительности к тиазидным и, в меньшей степени, петлевым диуретикам, что требует увеличения их доз. В то же время из-за сниженной экскреции мочевой кислоты при использовании тиазидных и, в меньшей степени, петлевых диуретиков повышается риск развития уратного криза, что лимитирует их использование.
Антагонисты альдостерона не рекомендуются к использованию при ХБП С4-5 из-за высокого риска гиперкалиемии.
Рекомендация 6.10. Антигипертензивная терапия у пациентов с АГ при ХБП должна сочетаться с коррекцией нарушений пуринового, липидного, углеводного, фосфорно-кальциевого обмена, анемии в соответствии с общими принципами нефро/кардиопротективной стратегии (НГ).
Разнообразные нарушения обмена веществ встречаются при ХБП значительно чаще, чем в общей популяции, и усугубляются по мере ее прогрессирования. Гиперурикемия, гиперлипидемия, снижение толерантности к углеводам, нарушения фосфорно-кальциевого обмена и анемия способствуют повышению АД и риска ССО. Кроме того, они могут лимитировать назначение некоторых антигипертензивных препаратов (диуретиков, β-адреноблокаторов).
Для своевременного выявления и коррекции данных нарушений должны проводиться регулярные обследования с последующим индивидуальным подбором диеты и, при необходимости - медикаментозной терапии (аллопуринол, статины, эзетимиб и др.) в соответствии с Рекомендациями по диагностике и ведению ХБП, лечению анемии, гиперлипидемии, нарушений фосфорно-кальциевого обмена [7, 16, 22, 68-71].
| Стадия ХБП | Особенности антигипертензивной терапии |
|---|---|
С3а |
Требуется осторожность при назначении препаратов с преимущественно почечным путем выведения. ИАПФ и БРА: умеренно повышенный риск гиперкалиемии. Тиазидные диуретики: эффективность умеренно снижена, риск гиперурикемии высокий. Петлевые диуретики: высокая эффективность; назначаются в небольших дозах, повышенный риск гиперурикемии. Антагонисты альдостерона: повышенный риск гиперкалиемии |
С3б |
Нежелательно назначение препаратов с преимущественно почечным путем выведения. ИАПФ и БРА: высокий риск гиперкалиемии. Тиазидные диуретики: эффективность низкая, риск гиперурикемии очень высокий. Петлевые диуретики: эффективность умеренно снижена (может потребоваться увеличение дозы), высокий риск гиперурикемии. Антагонисты альдостерона: высокий риск гиперкалиемии |
С4-5 |
Крайне нежелательно назначение препаратов с преимущественно почечным путем выведения. ИАПФ и БРА: очень высокий риск гиперкалиемии♠, повышен риск острого снижения функции почек. Тиазидные диуретики: не применяются из-за неэффективности и опасности уратного криза. Петлевые диуретики: диуретики выбора; эффективность снижена, высокий риск гиперурикемии. Антагонисты альдостерона: назначение не рекомендуется |
* Высокий риск гиперкалиемии не является противопоказанием к назначению данных препаратов, однако при этом необходим строгий контроль за соблюдением низкокалиевой диеты. Риск гиперкалиемии снижается при их сочетании с петлевыми диуретиками.
Рекомендация 6.11. Больные с резистентной АГ нуждаются в дополнительном обследовании для уточнения причин недостаточного ответа на антигипертензивную терапию и ее коррекции, а также более частом мониторинге основных целевых показателей ХБП и маркеров ССО.
Резистентность или рефрактерность к антигипертензивной терапии при ХБП представляет серьезную проблему, поскольку более чем у половины пациентов не удается достичь целевых значений АД [77]. Резистентной считают АГ, при которой сохраняется САД ≥140 и/или ДАД ≥90 мм рт.ст., несмотря на регулярный прием комбинации из трех и более препаратов, снижающих АД [25, 127].
Следует отличать истинную резистентность от мнимой, связанной с низкой приверженностью пациентов принципам лечения и другими причинами, приводящими к невозможности выполнить в полной мере назначения врача по приему антигипертензивных препаратов [109, 114, 127].
При выяснении причин резистентности АГ к лечению необходимо уточнять правильность соблюдения рекомендаций, касающихся диеты (ограничения соли), исключения курения, употребления наркотических препаратов, алкоголя, возможную связь данного феномена с одновременным приемом лекарственных средств, способствующих повышению АД и снижению чувствительности к антигипертензивным средствам (анальгетики, НПВП, препараты спорыньи, препараты женских половых гормонов, анаболические стероиды, циклоспорин, такролимус, препараты, стимулирующие эритропоэз, симпатомиметики и др.). Если назначены энтеросорбенты, необходимо исключить их одновременный прием с антигипертензивными и другими препаратами.
При отсутствии ответа на антигипертензивную терапию также необходимо исключить феномен так называемой псевдогипертонии, связанной с неправильной методикой измерения АД (использование манжеты размером, не соответствующим окружности плеча) или выраженным атеросклерозом и кальцинозом сосудов у пожилых и пациентов с ХБП С4-5, когда вследствие очень высокой жесткости плечевой артерии она не может быть пережата манжетой.
Основными причинами истинной резистентности АГ к лечению при ХБП являются: персистирующая активность нефрита при аутоиммунных заболеваниях почек, выраженное снижение СКФ, ожирение и инсулинорезистентность, синдром ночного апноэ, выраженный атеросклероз сосудов, кровоснабжающих головной мозг, развитие вазоренальной АГ, наличие системного васкулита, АФС, развитие на фоне ХБП других вариантов вторичной АГ (эндокринных). Выявление феномена резистентной АГ требует повторного многостороннего обследования с целью исключения перечисленных факторов, которое включает проведение СМАД и ультразвуковой допплерографии сосудов почек (см. рекомендации 3.3-3.5).
Преодоление резистентности возможно за счет увеличения объема антигипертензивной терапии - сочетания препарата, подавляющего РАС, с несколькими мочегонными (тиазид + петлевой диуретик; антагонист альдостерона + петлевой диуретик), АКд, β-, α- или α,β-адреноблокаторы. Новые назначения должны делаться поэтапно с интервалом не менее 5-7 дней для оценки переносимости.
Современные методы хирургического лечения резистентной АГ - эндоваскулярная аблация симпатического сплетения почечной артерии (почечная денервация) и электрическая стимуляция барорецепторов каротидного синуса - остаются недостаточно изученными [57]. Их эффективность и безопасность при наличии ХБП требуют оценки в ходе проспективных исследований. В настоящее время СКФ <45 мл/ мин/1,73 м2 является противопоказанием для их проведения.
Рекомендация 7.1. У больных, получающих лечение ГД, необходима максимальная индивидуализация тактики лечения АГ с обеспечением стабильности АД, исключением эпизодов интрадиализной и ортостатической гипотензии (НГ).
Рекомендация 7.2. У больных, получающих лечение ГД, в большинстве случаев целесообразно начинать терапию препаратами, снижающими АД, при стойком повышении САД ≥140 или ДАД ≥90 мм рт.ст. и добиваться при хорошей переносимости достижения уровня САД <140, но не ниже 120 и ДАД <90, но не ниже 70 мм рт.ст. (2D).
Рекомендация 7.3. У больных, получающих лечение ПД, целесообразно начинать терапию препаратами, снижающими АД, при стойком повышении САД ≥140 или ДАД >90 мм рт.ст. и добиваться при хорошей переносимости достижения уровня САД <140, но не ниже 120 и ДАД <90, но не ниже 70 мм рт.ст. (2D).
Рекомендация 7.4. У больных с трансплантированной почкой целесообразно, независимо от уровня АУ/ПУ, начинать лечение препаратами, снижающими АД, при стойком повышении САД ≥130 или ДАД ≥80 мм рт.ст. и добиваться при хорошей переносимости достижения уровня САД <130, но не ниже 120 и ДАД <80, но не ниже 70 мм рт.ст. (2D).
Рекомендация 7.5. При плохой переносимости указанных целевых значений АД для пациентов с ХБП С5, получающих ЗПТ, склонности к эпизодам гипотензии проводится коррекция тактики лечения в соответствии с п. 6.9-6.10.
Рекомендация 7.6. Для детей и подростков, больных пожилого и старческого возраста, получающих ЗПТ, устанавливаются целевые значения АД в соответствии с теми же принципами, что и для пациентов данных возрастных групп с АГ и ХБП, не получающих ЗПТ (см. разделы 8. «Принципы лечения артериальной гипертензии при хронической болезни почек у детей и подростков» и 9. «Принципы лечения артериальной гипертензии при хронической болезни почек у пациентов пожилого и старческого возраста»).
Определение тактики коррекции АГ у больных, получающих ЗПТ, представляет большие трудности [79]. С одной стороны, они входят в группу очень высокого риска ССО (относительный риск смертности от ССО у пациентов, получающих лечение ГД, в десятки раз выше, чем в общей популяции [50]), что может служить весомым аргументом в пользу более строгого контроля АД. С другой стороны, для них характерна высокая лабильность АД, в связи с чем на фоне мощной антигипертензивной терапии возможны эпизоды гипотензии, связанные с риском ишемического поражения сердца и головного мозга, а также с гиперактивацией вазопрессорных гормональных систем, приводящих к дальнейшему резкому повышению АД [18]. К сожалению, до настоящего времени отсутствует доказательная база, позволяющая оценивать влияние различной тактики антигипертензивной терапии пациентов с ХБП С5Д и ХБП Т на риск осложнений и выживаемость. Высокая смертность, связанная с целым рядом факторов, значительная неоднородность пациентов, получающих ЗПТ, по клиническим характеристикам, прогностическим факторам и тактике самой ЗПТ ограничивает возможность установить самостоятельное влияние антигипертензивной терапии на прогноз.
ЗПТ является основным средством снижения АД у пациентов с ТПН, развитие или нарастание тяжести АГ может быть одним из проявлений неадекватности диализа или развития дисфункции трансплантата почки. Имеются данные, что эффективный в отношении достижения «сухого веса» ГД позволяет добиться нормализации АД у большинства пациентов с ХБП С5Д [40, 61].
В то же время в течение процедуры ГД возможно развитие эпизодов как резкого повышения АД, так и интрадиализной гипотензии. Интрадиализная гипотензия является серьезным осложнением, требующим преждевременного прекращения процедуры ГД. Ее основными причинами являются особенности режима проведения ГД (высокая скорость ультрафильтрации, которую приходится устанавливать у больных, не соблюдающих водно-солевой режим, что приводит к избыточной задержке жидкости в междиализный период, неправильное определение «сухого веса»), сердечная недостаточность, тяжелая вегетативная дисфункция, характерные для пациентов с ХБП С5Д. Одной из дополнительных причин интрадиализной гипотензии может быть и неадекватная (агрессивная) антигипертензивная терапия.
Учитывая большую вариабельность АД в интрадиализный и междиализный период, наиболее информативным методом оценки тяжести АГ у больных, получающих лечение ГД, является 48-часовое автоматическое мониторирование [26, 27, 34]. СКАД у пациентов с ХБП С5Д также несет важную информацию - данные самоизмерений более тесно коррелируют с развитием гипертрофии миокарда левого желудочка у этих больных, чем цифры АД, измеренные врачом до или после диализа [27].
При каузальных измерениях АД для оценки эффективности антигипертензивной терапии следует ориентироваться на уровень АД непосредственно перед очередным сеансом ГД. Для ответа на вопрос, насколько антигипертензивная терапия безопасна, следует учитывать измерения АД, выполненные в течение процедуры диализа. У пациентов с ХБП С5Д при врачебных осмотрах также рекомендуется чаще выполнять тест на наличие постуральной (ортостатической) гипотензии.
Высокая вариабельность АД характерна и для пациентов с ТПН, получающих лечение ПД, у которых часто отмечается ночная гипертония [4], что определяет важность проведения у них регулярного СМАД.
ИАПФ и БРА, а также АК занимают важное место в лечении пациентов, получающих лечение диализом, благодаря их кардио- и вазопротективным свойствам. У больных со склонностью к интрадиализной гипотензии или гипертонии могут использоваться антигипертензивные препараты с коротким периодом полувыведения, что позволяет избирательно соответственно ослаблять или усиливать воздействие на уровень АД во время процедуры ГД.
Пациенты с трансплантированной почкой - также очень неоднородная группа, характеризующаяся сочетанием многих факторов, влияющих на уровень АД. Ингибиторы кальциневрина, назначаемые с целью профилактики отторжения трансплантата, могут ухудшать почечный кровоток и способствовать повышению АД. В то же время высокий уровень АД неблагоприятно влияет на функцию трансплантата и повышает риск смерти от ССО. Тактика антигипертензивной терапии у этих пациентов с ТПН, в отличие от больных с ХБП С5Д, определяется двойной целью: снижения риска ССО и сохранения функции трансплантата почки.
На стадиях, когда проводится подбор иммуносупрессивной терапии и велик риск резкого ухудшения функции трансплантата, следует отдавать предпочтение при выборе антигипертензивной терапии АКд, повышающим перфузию клубочков. У больных со стабильной функцией трансплантата, с наличием повышенной АУ/ПУ, могут использоваться ИАПФ или БРА - как с целью кардиопротекции, так и защиты трансплантата от гемодинамического повреждения вследствие его гиперперфузии [2].
Таким образом, для пациентов с ХБП, получающих ЗПТ, необходима максимальная индивидуализация лечения препаратами, снижающими АД. При лечении ГД и ПД, когда антигипертензивная терапия назначается с целью снижения риска ССО, в большинстве случаев целесообразно добиваться снижения АД до уровня <140/90 мм рт.ст. При склонности к интрадиализной, ортостатической или ночной гипотензии целевой уровень может быть увеличен до <150/90 мм рт.ст. не видят оснований для пересмотра принятой в прошлые годы точки зрения, что для данной категории больных, характеризующихся крайне высоким риском ССО, желательно поддерживать АД на уровне.
И в то же время необходимо принимать усиленные, по сравнению с более ранними стадиями ХБП, меры по обеспечению безопасности антигипертензивной терапии и исключению эпизодов гипотензии (интрадиализной, ночной, ортостатической).
Для пациентов пожилого и старческого возраста, процент которых ежегодно увеличивается среди получающих ЗПТ, рекомендуется придерживаться общих принципов коррекции АГ для данной возрастной группы (см. раздел 9. «Принципы лечения артериальной гипертензии при хронической болезни почек у пациентов пожилого и старческого возраста»). Это же касается и детей и подростков, получающих ЗПТ (см. раздел 8. «Принципы лечения артериальной гипертензии при хронической болезни почек у детей и подростков»).
Рекомендация 8.1. У детей и подростков с ХБП рекомендуется начинать лечение препаратами, снижающими АД, при его уровне, стойко превышающим 90-ю перцентиль для соответствующего пола и возраста (1С).
Рекомендация 8.2. При лечении АГ у детей и подростков с ХБП целесообразно добиваться снижения систолического и ДАД до уровня ниже 90-й перцентили для соответствующего пола и возраста (2D).
Рекомендация 8.3. Предпочтительной комбинацией для лечения АГ у детей является сочетание ИАПФ и АК (2D).
Рекомендация 8.4. Лечение АГ у младенцев целесообразно начинать с применения амлодипина (2D).
Развитие АГ в детском возрасте имеет наиболее неблагоприятное значение, поскольку означает, что в течение многих десятков лет почки и сердечно-сосудистая система будут подвергаться пагубному воздействию повышенного АД [21], при этом снижение АД в данной возрастной группе хорошо переносится. В РКИ, включавшем 385 детей и подростков в возрасте от 3 до 18 лет, по данным 5-летнего наблюдения отмечалось преимущество при более строгом контроле АД (до уровня ниже 50-й перцентили для соответствующего пола и возраста), по сравнению с менее строгим контролем (в пределах 50-95-й перцентили) - относительный риск развития ТПН в 1-й группе составлял 0,65 (0,44; 0,94) [128]. На этих данных основывается мнение экспертов группы KDIGO [71] о том, что в детском и подростковом возрасте при наличии ХБП необходимо снижать АД до уровня ниже 50-й перцентили для соответствующего пола и возраста, вызывающее возражение оппонентов [116] в связи с недостаточностью доказательной базы для столь агрессивного подхода.
Необходимы долгосрочные и более представительные РКИ для определения целевого АД у детей и подростков с АГ при ХБП. Авторы данных рекомендаций считают на сегодня целесообразным проводить антигипертензивную терапию в соответствии с общими принципами, отраженными в Национальных рекомендациях по лечению АГ у детей и подростков [1], т.е. до уровня ниже 90-й перцентили. Вместе с тем не исключается попытка более строгого контроля АД, особенно при выраженной ПУ, при обязательном условии тщательного контроля переносимости.
ИАПФ и БРА занимают столь же важное место в коррекции АГ у детей и подростков с ХБП, что и у взрослых. При этом авторы считают, что их выбор должен определяться, так же как и у взрослых, выраженностью АУ/ПУ. Учитывая данные о нарушении органогенеза (развитии пороков сердца, нарушении развития сосудов и тубулярного аппарата почек) при медикаментозной блокаде РАС у беременных, а также отсутствие сведений о безопасности ИАПФ и БРА в младенческом возрасте, авторы не рекомендуют использовать данные препараты в этой возрастной группе.
Рекомендация 9.1. У пациентов с ХБП пожилого и старческого возраста тактика снижения АД должна быть максимально адаптирована к возрастным особенностям, состоянию сердечно-сосудистой системы, учитывать наличие сопутствующих заболеваний. Оптимальный уровень АД подбирается индивидуально с учетом переносимости лечения (НГ).
Рекомендация 9.2. Пациентам с впервые выявленной АГ при ХБП в пожилом возрасте, моложе 80 лет, рекомендуется начинать ее лечение при стойком повышении САД до уровня >160 мм рт.ст. и поддерживать его в пределах 140-149 мм рт.ст. (1С).
Рекомендация 9.3. Пациентам с впервые выявленной АГ при ХБП в пожилом возрасте, моложе 80 лет, с очень высокой АУ или выраженной ПУ (категория А3) целесообразно начинать ее лечение при стойком повышении САД в пределах 140-159 мм рт.ст. и поддерживать его в пределах 120-139 мм рт.ст. под строгим контролем безопасности терапии и при условии хорошей переносимости (2D).
Рекомендация 9.4. Пациентам с впервые выявленной АГ при ХБП в возрасте >80 лет целесообразно начинать ее лечение при стойком повышении САД до уровня >160 мм рт.ст. и поддерживать его в пределах 140-149 мм рт.ст. под строгим контролем безопасности терапии и при условии хорошей переносимости (2D).
Рекомендация 9.5. ДАД у пациентов пожилого и старческого возраста с АГ при ХБП рекомендуется во всех случаях снижать до уровня ниже 90 мм рт.ст., кроме больных СД, у которых рекомендуется поддерживать ДАД на уровне ниже 85 мм рт.ст. (1С).
Рекомендация 9.6. Лечение АГ при ХБП у пациентов пожилого и старческого возраста следует начинать с небольших доз с постепенным их увеличением под тщательным контролем, учитывая очень высокий риск водно-электролитных нарушений (в том числе дегидратации, гипер- и гипокалиемии), острого нарушения функции почек, ортостатической гипотензии, нежелательных лекарственных взаимодействий (НГ).
Рекомендация 9.7. Пациентам с АГ и ХБП с подобранной и хорошо переносимой антигипертензивной терапией с наступлением пожилого возраста целесообразно ее продолжать в прежнем объеме, поддерживая АД на привычном для пациента уровне с более тщательным контролем переносимости (2D).
При выявлении АГ или ХБП впервые в пожилом и старческом возрасте необходимо тщательное диагностическое обследование (см. раздел 3. «Тактика обследования»), включающее исследование почечных артерий и сосудов шеи для исключения вазоренальной АГ и оценки состояния церебрального кровотока.
Наличие ХБП характеризует прогностически наиболее неблагоприятную часть субпопуляции пожилого и старческого возраста, поскольку отражает прогрессирование гипертонической болезни, СД и метаболического синдрома, развитие сердечной недостаточности, лекарственной болезни. Поэтому оценить пользу различных режимов антигипертензивной терапии в данной группе крайне сложно [99].
Контроль АД у пожилых связан со значительными трудностями из-за нестабильности АД, нарушения проходимости коронарных и церебральных артерий, повышения риска побочных эффектов антигипертензивных средств в условиях полипрагмазии и полиорганной недостаточности. Осложнения, обусловленные эпизодами гипотензии на фоне антигипертензивной терапии, могут оказать пагубное влияние на прогноз, перевешивающее благоприятные эффекты достижения целевого АД.
Авторы данных рекомендаций, учитывая крайне ограниченный объем и противоречивые результаты РКИ, касающихся контроля АД у пациентов пожилого и старческого возраста, не считают возможным четко определить целевые значения АД при ХБП для данной возрастной категории.
Авторы также подчеркивают важность максимальной индивидуализации лечения, более тщательного контроля в этой возрастной группе за переносимостью терапии, целесообразность проведения СМАД, измерения АД в ортостатической пробе для исключения склонности к эпизодам ночной и постуральной гипотензии.
Пациентам с впервые выявленной АГ при ХБП в пожилом или старческом возрасте тактика ведения строится в соответствии с общими рекомендациями по контролю АГ [88, 99]. На сегодня не вызывает сомнения необходимость лечения АГ у лиц пожилого возраста, однако в исследованиях, показавших его пользу, достигнутое АД в среднем оставалось выше 140 мм рт.ст. [129]. Имеется солидная доказательная база в пользу того, чтобы у больных пожилого и старческого возраста начинать лечение при стойком повышении САД до уровня ≥160 мм рт.ст. и поддерживать его в пределах 140-150 мм рт.ст. [35].
В то же время не отрицается целесообразность лечения у пожилых при стойком повышении САД в пределах 140-159 мм рт.ст. [88] и его поддержания в пределах 120-139 мм рт.ст., особенно при наличии выраженной ПУ (более 0,5 г/л). Однако принцип снижения АД у пожилых до уровня ниже 140 мм рт.ст. на сегодня не имеет строгой доказательной базы. Анализ подгруппы больных старческого возраста в исследовании FEVER выявил уменьшение числа сердечно-сосудистых событий при снижении САД ниже 140 мм рт.ст., по сравнению с их частотой при САД, равном 145 мм рт.ст. [130]. В то же время два японских исследования не подтвердили преимуществ такой тактики [66, 95]. Попытка снижения АД до уровня ниже 140 мм рт.ст. у пожилого больного требует наиболее тщательного контроля безопасности и переносимости лечения (в первую очередь, исключения эпизодов гипотензии), который возможен только при высокой приверженности регулярным обследованиям, включающим в том числе биохимическое исследование сыворотки крови с определением уровня креатинина и калия, и проведении регулярных СКАД, а по возможности - СМАД. Достижение целевого АД у пожилых пациентов с ХБП должно проводиться постепенно с титрованием доз препаратов и контролем переносимости на каждом этапе.
Метаанализ не показал значения возраста для выбора препаратов, снижающих АД [117]. Он осуществляется в соответствии с принципами, изложенными выше (см. раздел «Фармакотерапия»). При высоких значениях АУ/ПУ (А3) препаратами выбора являются ИАПФ или БРА. При их использовании у пожилых необходим наиболее тщательный контроль за уровнем креатинина и калия сыворотки, исключение гиповолемии за счет адекватного водного режима.
Таким образом, контроль АГ при ХБП по-прежнему занимает важное место в арсенале нефро-/кардиопротективной стратегии, обеспечивая достоверное снижения риска развития ТПН и ССО. В то же время представляется первостепенным уделять более пристальное внимание вопросам переносимости и безопасности снижения АД при ХБП. Агрессивная тактика снижения АД и подавления РАС связана с серьезными осложнениями, которые могут перевешивать ожидаемую пользу. Накопленный опыт показывает необходимость индивидуализации терапии - как в отношении определения целевого АД, так и препаратов первого выбора. Достижение целевого АД должно проводиться настойчиво, последовательно, но постепенно и неагрессивно.
На сегодняшний день большая часть рекомендаций по лечению АГ у пациентов с ХБП имеет низкую степень доказательности, что отражает не только малую базу РКИ, но и значительную неоднородность больных по спектру факторов, влияющих на почечный и общий прогноз. Не вызывает сомнения необходимость (как в планировании научных исследований, так и в повседневной клинической практике) комплексного подхода с учетом всей совокупности традиционных и почечных факторов, влияющих на уровень АД и риск ССО у пациентов с ХБП.
Проблема безопасного преодоления резистентной АГ, отмечающейся более чем у половины пациентов с ХБП, ждет своего разрешения. Необходимы новые РКИ, обсервационные исследования, посвященные разработке критериев для персонифицированного контроля АГ при ХБП.
СПИСОК ЛИТЕРАТУРЫ
-
Александров А.А., Кисляк О.А., Леонтьева И.В., Розанов В.Б. Диагностика, лечение и профилактика артериальной гипертензии у детей и подростков // Кардиоваскуляр. тер. и профилактика. 2009. Т. 8. № 4. С. 253-288..
-
Багдасарян А.Р., Столяревич Е.С., Ким И.Г., Суханов А.В. и др. Влияние эналаприла на скорость прогрессирования хронической трансплантационной нефропатии // Нефрология и диализ. 2003. Т. 5. № 1. С. 42-47.
-
Боровкова Н.Ю. Артериальная гипертензия при хроническом гломерулонефрите. Вопросы патогенеза. Терапия / НГМА. Н. Новгород, 2012.
-
Ветчинникова О.Н., Агальцов М.В., Пронина В.П., Кулаков Н.В. и др. Особенности течения синдрома артериальной гипертензии у больных хронической почечной недостаточностью на перитонеальном диализе // Нефрология и диализ. 2006. Т. 8, № 2. С. 158-163.
-
Дедов И.И., Шестакова М.В. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Вып. 7 // Сахар. диабет. 2015. Т. 18(1S). С. 1-112.
-
Дедов И.И., Шестакова М.В. Сахарный диабет и артериальная гипертензия : руководство для врачей. М. : Медицинское информационное агентство, 2006. 344 с.
-
Добронравов В.А., Волков М.М., Смирнов А.В., Рожинская Л.Я. и др. Национальные рекомендации по минеральным и костным нарушениям при хронической болезни почек // Нефрология и диализ. 2011. Т. 13, № 1. С. 33-51.
-
Карабаева А.Ж., Каюков И.Г., Смирнов А.В., Есаян A.M. Ренин-ангиотензин-альдостероновая система при хронической болезни почек // Нефрология. 2006. Т. 10, № 4. С. 43-48.
-
Кутырина И.М., Балкаров И.М., Швецов М.Ю., Козловская Н.Л. и др. Ишемическая болезнь почек и сочетанные хронические нефропатии: клинические и прогностические особенности // Тер. арх. 2007. № 6. С. 44-49.
-
Кутырина И.М., Фомин В.В., Швецов М.Ю. Артериальная гипертензия как фактор прогрессирования хронических заболеваний почек // Нефрология : национальное руководство / под ред. Н.А. Мухина. М. : ГЭО-ТАР-Медиа, 2009. С. 42-48.
-
Кутырина И.М., Мартынов С., Швецов М.Ю. Артериальная гипертония при хроническом гломерулонефрите: частота выявления и эффективность лечения // Тер. арх. 2004. № 9. С. 10-15.
-
Мартынов С., Швецов М.Ю., Кутырина И.М. Нарушения суточного ритма артериального давления у больных хроническим гломерулонефритом // Тер. арх. 2006. № 1. С. 23-27.
-
Методические рекомендации. Диспансерное наблюдение больных хроническими неинфекционными заболеваниями и пациентов с высоким риском их развития / под ред. С.А. Бойцова, А.Г. Чучалина. М., 2014.
-
Мухин Н.А., Фомин В.В., Моисеев С.В., Швецов М.Ю. Нефрогенная артериальная гипертония: эволюция лечения // Тер. арх. 2005. № 8. С. 70-78.
-
Нагайцева С.С., Швецов М.Ю., Герасимов А.Н., Журавлева Е.А. и др. Исследование альбуминурии как маркера хронической болезни почек у взрослого трудоспособного населения // Альманах клин. мед. 2014. № 30. С. 37-45.
-
Национальные рекомендации. Хроническая болезнь почек: основные принципы скрининга, диагностики, профилактики и подходы к лечению / под ред. А.В. Смирнова // Нефрология. 2012. Т. 16, № 1. С. 15-89.
-
Национальные рекомендации. Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардионефропротекции / под ред. В.С. Моисеева, Н.А. Мухина // Клин. нефрология. 2014. № 2. С. 4-29.
-
Николаев А.Ю. Особенности диализной гипертонии // Нефрология. 2000. № 1. С. 96-98.
-
Серов В.А., Шутов A.M., Серова Д.В., Шевченко С.В., Шмелько-ва Е.Ю. Особенности суточного профиля артериального давления у больных хроническим кардиоренальным синдромом // Артериал. гипертензия. 2014. Т. 20, № 6. С. 538-545.
-
Тареева И.Е., Швецов М.Ю., Краснова Т.Н., Кутырина И.М. и др. Артериальная гипертония при волчаночном нефрите // Тер. арх. 1997. Т. 69, № 6. С. 13-17.
-
Цыгин А.Н. Артериальная гипертензия и ее лечение у детей с заболеваниями почек // Педиатр. фармакология. 2003. Т. 1, 3 1. С. 71-74.
-
Чазова И.Е., Недогода С.В., Жернакова Ю.В., Сусеков А.В. и др. Рекомендации по ведению больных артериальной гипертонией с метаболическими нарушениями // Кардиол. вестн. 2014. Т. XX(XII), № 1. С. 3-57.
-
Чазова И.Е., Ратова Л.Г., Бойцов С.А., Небиеридзе Д.В. Диагностика и лечение артериальной гипертензии (Рекомендации Российского медицинского общества по артериальной гипертонии и Всероссийского научного общества кардиологов) // Систем. гипертензии. 2010. № 3. С. 5-26.
-
Шамхалова М.Ш., Клефортова И.И., Шестакова М.В., Ремизов О.В. и др. Стеноз почечных артерий у больных сахарным диабетом 2-го типа: клиника, диагностика, прогностическая значимость // Тер. арх. 2010. № 6. С. 15-21.
-
Acelajado M.C., Calhoun D.A. Resistant hypertension: who and how to evaluate // Curr. Opin. Cardiol. 2009. Vol. 24, N 4. P. 340-344.
-
Agarwal R., Anderse M.J. Prognostic importance of ambulatory blood pressure recordings in patients with chronic kidney disease // Kidney Int. 2006. Vol. 69, N 7. P. 1175-1180.
-
Agarwal R., Peixoto A.J., Santos S.F.F., Zoccali C. Out-of-office blood pressure monitoring in chronic kidney disease // Blood Press. Monit. 2009. Vol. 14, N 1. P. 2-11.
-
Ahn J.H., Hong H.C., Cho M.J., Kim Y.J. et al. Effect of eplerenone, a selective aldosterone blocker, on the development of diabetic nephropathy in type 2 diabetic rats // Diabetes Metab. J. 2012. Vol. 36, N 2. P. 128-135.
-
Appel L.J., Wright J.T., Greene T., Agodoa L.Y. et al. Intensive blood-pressure control in hypertensive chronic kidney disease // N. Engl. J. Med. 2010. Vol. 363, N 10. P. 918-929.
-
Arguedas J.A., Leiva V., Wright J.M. Blood pressure targets for hypertension in people with diabetes mellitus // Cochrane Database Syst. Rev. 2013. Issue 10: CD008277.
-
Arulkumaran N., Diwakar R., Tahir Z., Mohamed M. et al. Pulse pressure and progression of chronic kidney disease // J. Nephrol. 2010. Vol. 23, N 2. P. 189-193.
-
Bakris G.L., Ruilope L., Locatelli F., Ptaszynska A. et al. Treatment of microalbuminuria in hypertensive subjects with elevated cardiovascular risk: results of the IMPROVE trial // Kidney Int. 2007. Vol. 72, N 7. P. 879-885.
-
Bakris G.L., Sarafidis P.A., Weir M.R., Dahlof B. et al. Renal outcomes with different fixed-dose combination therapies in patients with hypertension at high risk for cardiovascular events (ACCOMPLISH): a prespecified secondary analysis of a randomised controlled trial // Lancet. 2010. Vol. 375, N 9721. P. 1173-1181.
-
Bangash F., Agarwal R. Masked hypertension and white-coat hypertension in chronic kidney disease: a meta-analysis // Clin. J. Am. Soc. Nephrol. 2009. Vol. 4, N 3. P. 656-664.
-
Beckett N.S., Peters R., Fletcher A.E., Staessen J.A. et al. Treatment of hypertension in patients 80 years of age or older // N. Engl. J. Med. 2008. Vol. 358, N 18. P. 1887-1898.
-
Bell E.K., Gao L., Judd S., Glasser S.P., McClellan W. et al. Blood pressure indexes and end-stage renal disease risk in adults with chronic kidney disease // Am. J. Hypertens. 2012. Vol. 25, N 7. P. 789-796.
-
Bolignano D., Palmer S.C., Navaneethan S.D., Strippoli G.F.M. Aldoste-rone antagonists for preventing the progression of chronic kidney disease // Co-chrane database Syst. Rev. 2014. Issue 4: CD007004.
-
Bos H., Andersen S., Rossing P., De Zeeuw D. et al. Role of patient factors in therapy resistance to antiproteinuric intervention in nondiabetic and diabetic ne-phropathy // Kidney Int. Suppl. 2000. Vol. 75. P. S32-S37.
-
Brenner B., Cooper M., Zeeuw D. de, Keane W. et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropa-thy // N. Engl. J. Med. 2001. Vol. 345. P. 861-869.
-
Charra B. Fluid balance, dry weight, and blood pressure in dialysis // Hemo-dial. Int. 2007. Vol. 11, N 1. P. 21-31.
-
Chobanian A., Bakris G., Black H. The seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure: the JNC 7 report // JAMA. 2003. Vol. 289, N 19. P. 2560-2573.
-
Clark W.F., Sontrop J.M., Macnab J.J., Suri R.S. et al. Urine volume and change in estimated GFR in a community-based cohort study // Clin. J. Am. Soc. Nephrol. 2011. Vol. 6, N 11. P. 2634-2641.
-
Covic A., Goldsmith D. Ambulatory blood pressure monitoring: an essential tool for blood pressure assessment in uraemic patients // Nephrol. Dial. Transplant. 2002. Vol. 17, N 10. P. 1737-1741.
-
Cushman W.C., Evans G.W., Byington R.P., Goff D.C. et al. Effects of intensive blood-pressure control in type 2 diabetes mellitus // N. Engl. J. Med. 2010. Vol. 362, N 17. P. 1575-1585.
-
Dickinson H.O., Mason J.M., Nicolson D.J., Campbell F. et al. Lifestyle interventions to reduce raised blood pressure: a systematic review of randomized controlled trials // J. Hypertens. 2006. Vol. 24, N 2. P. 215-233.
-
Drawz P.E., Rosenberg M.E. Slowing progression of chronic kidney disease // Kidney Int. Suppl. 2013. Vol. 3, N 4. P. 372-376.
-
Esnault V.L.M., Ekhlas A., Delcroix C., Moutel M.-G. et al. Diuretic and enhanced sodium restriction results in improved antiproteinuric response to RAS blocking agents // J. Am. Soc. Nephrol. 2005. Vol. 16, N 2. P. 474-481.
-
European Society of Hypertension-European Society of Cardiology Guidelines Committee. 2003 European Society of Hypertension-European Society of Cardiology guidelines for the management of arterial hypertension // J. Hypertens. 2003. Vol. 21, N 6. P. 1011-1053.
-
Fine L.G., Norman J.T. Chronic hypoxia as a mechanism of progression of chronic kidney diseases: from hypothesis to novel therapeutics // Kidney Int. 2008. Vol. 74, N 7. P. 867-872.
-
Foley R., Parfrey P., Sarnak M. Clinical epidemiology of cardiovascular disease in chronic renal disease // Am. J. Kidney Dis. 1998. Vol. 32. P. 112-119.
-
Fouque D., Pelletier S., Mafra D., Chauveau P. Nutrition and chronic kidney disease // Kidney Int. 2011. Vol. 80, N 4. P. 348-357.
-
Fox C.S., Matsushita K., Woodward M., Bilo H.J.G. et al. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without diabetes: a meta-analysis // Lancet. 2012. Vol. 380, N 9854. P. 1662-1673.
-
Fried L.F., Emanuele N., Zhang J.H., Brophy M. et al. Combined angiotensin inhibition for the treatment of diabetic nephropathy // N. Engl. J. Med. 2013. Vol. 369, N 20. P. 1892-1903.
-
Fried L.F., Emanuele N., Zhang J.H., Brophy M. et al. Combined angiotensin inhibition for the treatment of diabetic nephropathy // N. Engl. J. Med. 2013. Vol. 369, N 20. P. 1892-1903.
-
Garneata L., Mircescu G. Effect of low-protein diet supplemented with keto acids on progression of chronic kidney disease // J. Ren. Nutr. 2013. Vol. 23, N 3. P. 210-213.
-
Gisen T., Gruppo G., Epidemiologici S. Randomised placebo-controlled trial of effect of ramipril on decline in glomerular filtration rate and risk of terminal renal failure in proteinuric, non-diabetic nephropathy // Lancet. 1997. Vol. 349. P. 1857-1863.
-
Grassi G., Mancia G. New therapeutic approaches for resistant hypertension // J. Nephrol. 2012. Vol. 25, N 3. P. 276-281.
-
Hallan S.I., Matsushita K., Sang Y., Mahmoodi B.K. et al. Age and association of kidney measures with mortality and end-stage renal disease // JAMA. 2012. Vol. 308, N 22. P. 2349-2360.
-
Hansson L., Zanchetti A., Carruthers S.G., Dahlof B. et al. Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial. HOT Study Group // Lancet. 1998. Vol. 351, N 9118. P. 1755-1762.
-
Hollenberg N.K. Aldosterone in the development and progression of renal injury // Kidney Int. 2004. Vol. 66, N 1. P. 1-9.
-
Horl W.H. Hypertension in end-stage renal disease: different measures and their prognostic significance // Nephrol. Dial. Transplant. 2010. Vol. 25, N 10. P. 3161-3166.
-
Ikizler T.A., Cano N.J., Franch H., Fouque D. et al. Prevention and treatment of protein energy wasting in chronic kidney disease patients: a consensus statement by the International Society of Renal Nutrition and Metabolism // Kidney Int. 2013. Vol. 84, N 6. P. 1096-1107.
-
Van Jaarsveld B.C., Krijnen P., Derkx F.H., Deinum J. et al. Resistance to antihypertensive medication as predictor of renal artery stenosis: comparison of two drug regimens // J. Hum. Hypertens. 2001. Vol. 15, N 10. P. 669-676.
-
Jafar T., Stark P., Schmid C., Landa M. Progression of chronic kidney disease: the role of blood pressure control, proteinuria, and angiotensin-converting enzyme inhibition: a patient-level meta-analysis // Ann. Intern. Med. 2003. Vol. 139, N 4. P. 244-252.
-
James P., Oparil S., Carter B.L., Cushman W.C. et al. 2014 Evidence-Based Guideline for the Management of High Blood Pressure in Adults: Report From the Panel Members Appointed to the Eighth Joint National Committee (JNC 8) // JAMA. 2014. Vol. 311, N 5. P. 507-520.
-
JATOS group. Principal results of the Japanese trial to assess optimal systolic blood pressure in elderly hypertensive patients (JATOS) // Hypertens. Res. 2008. Vol. 31, N 12. P. 2115-2127.
-
Kidney Disease Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease // Kidney Int. Suppl. 2013. Vol. 3, N 1. P. 1-150.
-
Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease - mineral and bone disorder (CKD-MBD) // Kidney Int. 2009. Vol. 76, suppl. 113. P. S1-S130.
-
Kidney Disease: Improving Global Outcomes (KDIGO) Lipid Work Group. KDIGO Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease // Kidney Int. Suppl. 2013. Vol. 3, N 3. P. 259-305.
-
KidneyDisease: Improving Global Outcomes (KDIGO) Anemia Work Group. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease // Kidney Int. Suppl. 2012. Vol. 2, N 4. P. 279-335.
-
KidneyDisease: Improving Global Outcomes (KDIGO) Blood Pressure Work Group. KDIGO Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease // Kidney Int. 2012. Vol. 2, N 5.
-
Kim-Mitsuyama S., Ogawa H.M.K. An angiotensin II receptor blocker-cal-cium channel blocker combination prevents cardiovascular events in elderly high-risk hypertensive patients with chronic kidney disease better than high-dose angiotensin II receptor blockade alone // Kidney Int. 2013. Vol. 83. P. 167-176.
-
Klag M.J., Whelton P.K., Randall B.L., Neaton J.D. et al. Blood pressure and end-stage renal disease in men // N. Engl. J. Med. 1996. Vol. 334, N 1. P. 13-18.
-
Klahr S., Levey A.S., Beck G.J., Caggiula A.W. et al. The effects of dietary protein restriction and blood-pressure control on the progression of chronic renal disease. Modification of Diet in Renal Disease Study Group // N. Engl. J. Med. 1994. Vol. 330, N 13. P. 877-884.
-
Kobori H., Nangaku M., Navar L.G., Nishiyama A. The intrarenal renin-angiotensin system: from physiology to the pathobiology of hypertension and kidney disease // Pharmacol. Rev. 2007. Vol. 59, N 3. P. 251-287.
-
Ku E., Glidden D. V, Johansen K.L., Sarnak M. et al. Association between strict blood pressure control during chronic kidney disease and lower mortality after onset of end-stage renal disease // Kidney Int. 2015. Vol. 87, N 5. P. 1055-1060.
-
Kuznik A., Mardekian J., Tarasenko L. Evaluation of cardiovascular disease burden and therapeutic goal attainment in US adults with chronic kidney disease: an analysis of national health and nutritional examination survey data, 2001-2010 // BMC Nephrol. 2013. Vol. 14, N 1. P. 132.
-
Levey A., de Jong P., Coresh J., El Nahas M. The definition, classification, and prognosis of chronic kidney disease: a KDIGO Controversies Conference report // Kidney Int. 2011. Vol. 80. P. 17-28.
-
Levin N.W., Kotanko P., Eckardt K.-U., Kasiske B.L. et al. Blood pressure in chronic kidney disease stage 5D-report from a Kidney Disease: Improving Global Outcomes controversies conference // Kidney Int. 2010. Vol. 77, N 4. P. 273-284.
-
Lewis E., Hunsicker L., Clarke W., Berl T. Renoprotective effect of the an-giotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes // N. Engl. J. Med. 2001. Vol. 345, N 12. P. 851-860.
-
Liu M., Takahashi H., Morita Y., Maruyama S. et al. Non-dipping is a potent predictor of cardiovascular mortality and is associated with autonomic dysfunction in haemodialysis patients // Nephrol. Dial. Transplant. 2003. Vol. 18, N 3.<p. 563-569.
-
Ljutic D., Kes P. The role of arterial hypertension in the progression of non-diabetic glomerular diseases // Nephrol. Dial. Transplant. 2003. Vol. 18, suppl. 5. P. v28-v30.
-
Lotan Y., Daudon M., Bruyere F., Talaska G. et al. Impact of fluid intake in the prevention of urinary system diseases: a brief review // Curr. Opin. Nephrol. Hypertens. 2013. Vol. 22, suppl. 1. P. S1-S10.
-
Lv J., Ehteshami P., Sarnak M.J., Tighiouart H. et al. Effects of intensive blood pressure lowering on the progression of chronic kidney disease: a systematic review and meta-analysis // CMAJ. 2013. Vol. 185, N 11. P. 949-957.
-
Lv J., Neal B., Ehteshami P., Ninomiya T. et al. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: a systematic review and meta-analysis // PLoS Med. 2012. Vol. 9, N 8. Article ID e1001293..
-
Mahmoodi B.K., Matsushita K., Woodward M., Blankestijn P.J. et al. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without hypertension: a meta-analysis // Lancet. 2012. Vol. 380, N 9854. P. 1649-1661.
-
Maione A., Navaneethan S.D., Graziano G., Mitchell R. et al. Angiotensin-converting enzyme inhibitors, angiotensin receptor blockers and combined therapy in patients with microand macroalbuminuria and other cardiovascular risk factors: a systematic review of randomized controlled trials // Nephrol. Dial. Transplant. 2011. Vol. 26, N 9. P. 2827-2847.
-
Mancia G., Fagard R., Narkiewicz K., Redon J. et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // Eur. Heart J. 2013. Vol. 34, N 28. P. 2159-2219.
-
Mann J.F.E., Schmieder R.E., McQueen M., Dyal L. et al. Renal outcomes with telmisartan, ramipril, or both, in people at high vascular risk (the ONTAR-GET study): a multicentre, randomised, double-blind, controlled trial // Lancet. 2008. Vol. 372, N 9638. P. 547-553.
-
Maschio G., Alberti D., Janin G., Locatelli F. et al. Effect of the Angio-tensin-Converting - Enzyme Inhibitor Benazepril on the Progression of Chronic Renal Insufficiency // N. Engl. J. Med. 1996. Vol. 334, N 15. P. 939-945.
-
Nangaku M., Fujita T. Activation of the renin-angiotensin system and chronic hypoxia of the kidney // Hypertens. Res. 2008. Vol. 31, N 2. P. 175-184.
-
National Kidney Foundation. K/DOQI clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease // Am. J. Kidney Dis. 2004. Vol. 43. P. S1-S290.
-
Neymark E., LaBerge J.M., Hirose R., Melzer J.S. et al. Arteriographic detection of renovascular disease in potential renal donors: incidence and effect on donor surgery // Radiology. 2000. Vol. 214, N 3. P. 755-760.
-
Nitsch D., Grams M., Sang Y., Black C. et al. Associations of estimated glomerular filtration rate and albuminuria with mortality and renal failure by sex: a meta-analysis // BMJ. 2013. Vol. 346. P. f324.
-
Ogihara T., Saruta T., Rakugi H., Matsuoka H. et al. Target blood pressure for treatment of isolated systolic hypertension in the elderly: valsartan in elderly isolated systolic hypertension study // Hypertension. 2010. Vol. 56, N 2. P. 196-202.
-
Parving H.-H., Brenner B.M., McMurray J.J. V, de Zeeuw D. et al. Baseline characteristics in the Aliskiren Trial in Type 2 Diabetes Using Cardio-Renal End-points (ALTITUDE) // J. Renin Angiotensin Aldosterone Syst. 2012. Vol. 13, N 3. P. 387-393.
-
Perna A., Ruggenenti P., Testa A., Spoto B. et al. ACE genotype and ACE inhibitors induced renoprotection in chronic proteinuric nephropathies // Kidney Int. 2000. Vol. 57. P. 274-281.
-
Phillips C.O., Kashani A., Ko D.K., Francis G., Krumholz H.M. Adverse effects of combination angiotensin II receptor blockers plus angiotensin-converting enzyme inhibitors for left ventricular dysfunction: a quantitative review of data from randomized clinical trials // Arch. Intern. Med. 2007. Vol. 167, N 18. P. 1930-1936.
-
Pimenta E., Oparil S. Management of hypertension in the elderly // Nat. Rev. Cardiol. 2012. Vol. 9, N 5. P. 286-296.
-
Qaseem A., Hopkins R.H., Sweet D.E., Starkey M. et al. Screening, monitoring, and treatment of stage 1 to 3 chronic kidney disease: A clinical practice guideline from the American College of Physicians // Ann. Intern. Med. 2013. Vol. 159, N 12. P. 835-847.
-
Rao M.V., Qiu Y., Wang C., Bakris G. Hypertension and CKD: Kidney Early Evaluation Program (KEEP) and National Health and Nutrition Examination Survey (NHANES), 1999-2004 // Am. J. Kidney Dis. 2008. Vol. 51, N 4. Suppl. 2. P. S30-S37.
-
Ridao N., Luno J., Garcia de Vinuesa S., Gomez F. et al. Prevalence of hypertension in renal disease // Nephrol. Dial. Transplant. 2001. Vol. 16, suppl. 1. P. 70-73.
-
Rimoldi S.F., Scherrer U., Messerli F.H. Secondary arterial hypertension: when, who, and how to screen? // Eur. Heart J. 2013. Vol. 35, N 19. P. 1245-1254.
-
Robles N.R., Ocon J., Gomez C.F., Manjon M. et al. Lercanidipine in patients with chronic renal failure: the ZAFRA study // Ren. Fail. 2005. Vol. 27, N 1. P. 73-80.
-
Ruggenenti P., Perna A., Mosconi L., Matalone M. et al. Proteinuria predicts end-stage renal failure in non-diabetic chronic nephropathies. The «Gruppo Italiano di Studi Epidemiologici in Nefrologia» (GISEN) // Kidney Int. Suppl. 1997. Vol. 63. P. S54-S57.
-
Ruggenenti P., Perna A., Gherardi G., Gaspari F. et al. Renal function and requirement for dialysis in chronic nephropathy patients on long-term ramipril : REIN follow-up trial // Lancet. 1998. Vol. 352. P. 1252-1256.
-
Ruggenenti P., Perna A., Loriga G., Ganeva M. et al. Blood-pressure control for renoprotection in patients with non-diabetic chronic renal disease (REIN-2): multicentre, randomised controlled trial // Lancet. 2005. Vol. 365, N 9463. P. 939-946.
-
Ruggenenti P., Perna A., Remuzzi G., Dacco C. ACE Inhibitors to Prevent End-Stage Renal Disease: When to Start and Why Possibly Never to Stop: A Post-Hoc Analysis of the REIN Trial Results // J. Am. Soc. Nephrol. 2001. Vol. P. 2832-2837.
-
Sarafidis P.A. Epidemiology of resistant hypertension // J. Clin. Hypertens. (Greenwich). 2011. Vol. 13, N 7. P. 523-528.
-
Sarnak M.J., Greene T., Wang X., Beck G. et al. The effect of a lower target blood pressure on the progression of kidney disease: long-term follow-up of the modification of diet in renal disease study // Ann. Intern. Med. 2005. Vol. 142, N 5. P. 342-351.
-
Schrier R.W., Masoumi A., Elhassan E. Aldosterone: role in edematous disorders, hypertension, chronic renal failure, and metabolic syndrome // Clin. J. Am. Soc. Nephrol. 2010. Vol. 5, N 6. P. 1132-1140.
-
Sim J.J., Bhandari S.K., Shi J., Reynolds K. et al. Comparative risk of renal, cardiovascular, and mortality outcomes in controlled, uncontrolled resistant, and nonresistant hypertension // Kidney Int. 2015. May 6. doi: 10.1038/ki2015.
-
Slagman M.C.J., Waanders F., Hemmelder M.H., Woittiez A.-J. et al. Moderate dietary sodium restriction added to angiotensin converting enzyme inhibition compared with dual blockade in lowering proteinuria and blood pressure: randomised controlled trial // BMJ. 2011. Vol. 343. P. d4366.
-
Smith S.M. Epidemiology, prognosis, and treatment of resistant hypertension // Pharmacotherapy. 2013. Vol. 33, N 10. P. 1071-1086.
-
Sontrop J.M., Dixon S.N., Garg A.X., Buendia-Jimenez I. et al. Association between water intake, chronic kidney disease, and cardiovascular disease: a cross-sectional analysis of NHANES data // Am. J. Nephrol. 2013. Vol. 37, N 5. P. 434-442.
-
Taler S.J., Agarwal R., Bakris G.L., Flynn J.T. et al. KDOQI US commentary on the 2012 KDIGO clinical practice guideline for management of blood pressure in CKD // Am. J. Kidney Dis. 2013. Vol. 62, N 2. P. 201-213.
-
Turnbull F., Neal B., Ninomiya T., Algert C. et al. Effects of different regimens to lower blood pressure on major cardiovascular events in older and younger adults: meta-analysis of randomised trials // BMJ. 2008. Vol. 336, N 7653. P. 1121-1123.
-
UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKP-DS 38. UK Prospective Diabetes Study Group // BMJ. 1998. Vol. 317, N 7160. P. 703-713.
-
Velez J.C.Q. The importance of the intrarenal renin-angiotensin system // Nat. Clin. Pract. Nephrol. 2009. Vol. 5, N 2. P. 89-100.
-
Vogt L., Waanders F., Boomsma F., de Zeeuw D. et al. Effects of dietary sodium and hydrochlorothiazide on the antiproteinuric efficacy of losartan // J. Am. Soc. Nephrol. 2008. Vol. 19, N 5. P. 999-1007.
-
Wadei H.M., Textor S.C. The role of the kidney in regulating arterial blood pressure // Nat. Rev. Nephrol. 2012. Vol. 8, N 10. P. 602-609.
-
Weber M.A., Jamerson K., Bakris G.L., Weir M.R. et al. Effects of body size and hypertension treatments on cardiovascular event rates: subanalysis of the ACCOMPLISH randomised controlled trial // Lancet. 2013. Vol. 381, N 9866. P. 537-545.
-
Weber M.A., Schiffrin E.L., White W.B., Mann S. et al. Clinical practice guidelines for the management of hypertension in the community: a statement by the American Society of Hypertension and the International society of Hypertension // J. Clin. Hypertens. (Greenwich). 2014. Vol. 16, N 1. P. 14-26.
-
Weiner D.E., Tighiouart H., Elsayed E.F., Griffith J.L. et al. The Framing-ham predictive instrument in chronic kidney disease // J. Am. Coll. Cardiol. 2007. Vol. 50, N 3. P. 217-224.
-
Weiner D.E., Tighiouart H., Levey A.S., Elsayed E. et al. Lowest systolic blood pressure is associated with stroke in stages 3 to 4 chronic kidney disease // J. Am. Soc. Nephrol. 2007. Vol. 18, N 3. P. 960-966.
-
Weir M.R. Hypertension and the kidney: perspectives on the relationship of kidney disease and cardiovascular disease // Clin. J. Am. Soc. Nephrol. 2009. Vol. 4, N 12. P. 2045-2050.
-
White W.B., Turner J.R., Sica D.A., Bisognano J.D. et al. Detection, evaluation, and treatment of severe and resistant hypertension: proceedings from an American Society of Hypertension Interactive forum held in Bethesda, MD, U.S.A., October 10th 2013 // J. Am. Soc. Hypertens. 2014. Vol. 8, N 10. P. 743-757.
-
Wiihl E., Trivelli A., Picca S., Litwin M. et al. Strict blood-pressure control and progression of renal failure in children // N. Engl. J. Med. 2009. Vol. 361, N 17. P. 1639-1650.
-
Zanchetti A., Grassi G., Mancia G. When should antihypertensive drug treatment be initiated and to what levels should systolic blood pressure be lowered? A critical reappraisal // J. Hypertens. 2009. Vol. 27, N 5. P. 923-934.
-
Zhang Y., Zhang X., Liu L., Zanchetti A. Is a systolic blood pressure target <140 mmHg indicated in all hypertensives? Subgroup analyses of findings from the randomized FEVER trial // Eur. Heart J. 2011. Vol. 32, N 12. P. 1500-1508.
РЕНОВАСКУЛЯРНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТЕНЗИЯ И ИШЕМИЧЕСКАЯ БОЛЕЗНЬ ПОЧЕК
Кодирование по Международной классификации болезней 10-го пересмотра
Класс IX: Болезни системы кровообращения.
Определение
Под реноваскулярной гипертензией (РВГ) понимают патологическое состояние, развивающееся вследствие стенозирующего заболевания почечных артерий, приводящего к повреждению почечных механизмов регуляции гемодинамики, и характеризующееся длительным и стойким повышением АД М40/90 мм рт.ст.
Ишемическая болезнь почек (ишемическая нефропатия) представляет собой опосредованное ишемией хроническое повреждение паренхимы почек вследствие двустороннего стеноза почечных артерий или одностороннего стеноза почечной артерии единственной почки, проявляющееся в стойком снижении СКФ <60 мл/мин/1,73 м2. Снижение СКФ регистрируется примерно в половине случаев стенозирующих поражений почечных артерий.
Эпидемиология
Атеросклеротическое поражение почечных артерий занимает второе место по распространенности после коронарных артерий и встречается у 1-5% больных с АГ. В целом у лиц старше 65 лет стеноз почечной артерии наблюдается в 6,8% случаев (у мужчин - в 9,1%, у женщин - в 5,5%). При этом содружественное поражение почечных артерий наблюдается при коронарном атеросклерозе у больных с ишемической болезнью сердца в 35-55% случаев, при атеросклерозе периферических артерий нижних конечностей - в 22-59% случаев. Причем больные с отсутствием стеноза почечных артерий при документированном стенозе коронарных артерий спустя два года в 11% случаев приобретают стеноз почечных артерий, по данным повторных ангиографий. В 19-29% случаев всех атеросклеротических стенозов почечных артерий они бывают двусторонними.
Наличие стеноза почечной артерии у больных с ишемической болезнью сердца является независимым фактором риска смерти даже в случае проведения коронарной реваскуляризации. Смертность больных выше при наличии двустороннего стеноза по сравнению с односторонним, а также при более выраженной степени стеноза по сравнению с менее выраженной.
Этиология и патогенез
Наиболее частыми причинами стеноза почечной артерии являются атеросклероз и фибромускулярная дисплазия (врожденное расстройство). Другие причины (системные васкулиты, субтотальные тромботические окклюзии, опухолевые заболевания) встречаются значительно реже. Атеросклероз почечных артерий может быть изолированным или сочетаться с поражением других бассейнов.
Фибромускулярная дисплазия развивается чаще всего вследствие медиальной фиброплазии, представленной ленточными повреждениями в срединной части почечной артерии. Скрининговые ангиографии у потенциальных доноров почки показали, что такие повреждения могут протекать бессимптомно без повышения АД в 3-6% случаев. Однако когда они достигают гемодинамической значимости, в большинстве случаев развивается АГ. Более того, около 15% всех случаев рефрактерной АГ обусловлены фибромускулярной дисплазией. Помимо фибромускулярной дисплазии в детском возрасте причинами РВГ могут также быть: нейрофиброматоз 1-го типа, туберозный склероз, синдром Вильямса, синдром Марфана, катетеризация пупочной артерии, синдром врожденной краснухи и др.
Патогенез АГ при стенозе почечной артерии обусловлен развитием ишемии почки и ишемии юкстагломерулярного аппарата, генерирующего ренин. Гиперренинемия, а также задержка натрия и воды вследствие ишемической тубулопатии и повреждение простагландин-синтезирующих клеток тубулоинтерстициальной ткани, участвующих в регуляции АД, приводят к его повышению.
Клиническая картина
Гемодинамически значимым считается стеноз почечной артерии, составляющий ≥70% от ее диаметра при визуальной оценке ангиограммы или УЗИ или стеноз 50-70% с систолическим градиентом давления ≥20 мм рт.ст. или средним градиентом ≥10 мм рт.ст. Не существует ранжирования стеноза по степеням тяжести клинических проявлений.
Обычно развивается осевой или проксимальный стеноз почечной артерии.
При РВГ развивается клиническая картина, характерная для первичной АГ. Однако чаще при РВГ в отличие от первичной АГ наблюдаются тяжелые, рефрактерные к терапии формы болезни. Также при РВГ может регистрироваться снижение СКФ, изменения мочевого осадка в виде небольшой протеинурии. При инфаркте почки на стороне стенозированной артерии нередко возникает болевой синдром, макро- и микрогематурия при отсутствии явлений обструкции при выполнении УЗИ или КТ (МРТ), острое повреждение почек. В последующем на стороне инфаркта может развиться нефросклероз.
Клинические проявления ишемической нефропатии заключаются в регистрации снижения СКФ и иногда появлении невысокой протеинурии. В дальнейшем может регистрироваться одно- или двустороннее уменьшение размеров почек, обусловленное нефросклерозом.
Диагностика
В таблице 1 приведены клинические ситуации, позволяющие с той или иной степенью вероятности заподозрить наличие у больного стеноза почечной артерии.
Дебют АГ в возрасте до 30 лет или тяжелой АГ после 55 лет |
Акселеративная АГ (внезапное и стойкое ухудшение течения ранее контролируемой АГ) |
Рефрактерная или злокачественная АГ |
Острое снижение почечной функции [повышение креатинина плазмы более чем на 26 мкмоль/л/сут (0,3 мг/дл/сут) или в 1,5 раза от исходного и более] в ответ на применение блокаторов РААС (ингибиторы АПФ, блокаторы рецепторов к ангиотензину II) |
Необъяснимое уменьшение размера почки или разница между длинами почек более 15 мм |
Мультисосудистый атеросклероз коронарных артерий или периферических артерий |
Внезапный необъяснимый отек легких |
Необъяснимая застойная хроническая сердечная недостаточность или рефрактерная стенокардия |
Наличие перечисленных признаков повышает настороженность в отношении РВГ. К сожалению, широкое распространение АГ не позволяет скринировать всех больных с АГ на предмет выявления стеноза почечных артерий.
Рекомендация 1. Проведение диагностических исследований, направленных на выявление клинически значимого стеноза, показано больным с дебютом АГ в возрасте до 30 лет при отсутствии иных причин ее развития (1В), а также пациентам с тяжелой АГ (3-я степень) (2С) или при наличии одного из шести условий: внезапное и стойкое ухудшение течения ранее контролируемой АГ; рефрактерная АГ; злокачественная АГ (1В); острое снижение почечной функции [повышение креатинина плазмы более чем на 26 мкмоль/л (0,3 мг/дл) или в 1,5 раза от исходного и более] в ответ на применение блокаторов РААС (1А); необъяснимое уменьшение размера почки или разница между длинами почек более 15 мм (1В).
Под рефрактерной АГ следует понимать такую форму АГ, при лечении которой отмечается отсутствие достижения целевых значений АД при применении трех и более антигипертензивных препаратов в субмаксимальных терапевтических дозах (один из препаратов - диуретик).
Под злокачественной АГ понимают АГ, протекающую с развитием острого повреждения органов-мишеней (острое повреждение почек, декомпенсированная хроническая сердечная недостаточность, отек соска зрительного нерва и кровоизлияния на сетчатке).
Основным методом диагностики, к которому прибегают в первую очередь, является УЗИ почечных артерий с изучением их анатомии и/или скорости кровотока. При наличии диагностических возможностей у клиники также может использоваться КТ- и МРТ-ангиография. В ряде случаев сначала прибегают к УЗИ, а затем к КТ- или МРТ-ангиографии, тем самым сокращая число необоснованных томографических процедур. В таблице 2 приведены диагностические критерии стеноза почечной артерии по данным разных диагностических процедур.
| Метод исследования | Параметры |
|---|---|
УЗИ |
Рено-аортальный скоростной индекс (пиковая систолическая скорость в почечной артерии/пиковая систолическая скорость в аорте) >3,5 Пиковая систолическая скорость в почечной артерии >180 см/с Конечно-диастолическая скорость в почечной артерии >90 см/с Снижение почечного резистивного индекса <75-80 |
КТ-ангиография, МРТ-ангиография |
Уменьшение диаметра почечной артерии более 50% (умеренный стеноз), более 70% (выраженный или гемодинамически значимый стеноз) |
Почечная ангиография |
Уменьшение диаметра почечной артерии более 50% (умеренный стеноз), более 70% (выраженный или гемодинамически значимый стеноз) |
Градиент давления в зоне стеноза |
>10 мм рт.ст. |
Без провокации На введении папаверина или дофамина |
>20 мм рт.ст. |
Фракционный резерв кровотока |
<0,9 |
Рекомендация 2. УЗИ почечного артериального кровотока является скрининговым методом исследования стеноза почечной артерии и ее ветвей (1А). КТ-ангиография (пациентам с нормальной почечной функцией) и МРТ-ангиография могут рекомендоваться в качестве скрининга при наличии диагностических возможностей учреждения (2В).
«Золотым стандартом» диагностики остается ангиография почечных артерий. Данный метод является инвазивным, требующим специального оснащения (сосудистый центр) и квалификации специалистов (рентгенангиохирурги), однако его точность в настоящее время является непревзойденной среди методик прижизненного исследования архитектуры почечного кровотока. Более того, данный метод является неотъемлемой частью эндоваскулярного вмешательства.
Ангиографическое исследование несет низкий риск осложнений (смерть во время и после процедуры - 0,24%, диализ - 0,09%, формирование псевдоаневризмы бедренной артерии - 4,6%). Однако процедура проводится с осторожностью при развитии ХПН ввиду повышения риска развития контраст-индуцированной нефропатии. В случае, если ангиография проводится пациенту с уровнем креатинина крови, не превышающим 176 мкмоль/л (2 мг/дл), риск осложнений, связанных с процедурой, или смерти не меняется, при более высоких значениях риск повышается. Для профилактики контраст-индуцированной нефропатии эффективно использование низкоосмолярных контрастов, проведение периоперационной профилактики с применением инфузий физиологического раствора (в объеме 1 мл/кг/ч в течение 12 ч до и 24 ч после процедуры, 0,5 мл/кг/ч при фракции выброса менее 35% или хронической сердечной недостаточности функционального класса >2), или ацетилцистеина (N-ацетилцистеина♠) или раствора натрия гидрокарбоната и проведение превентивного гемодиализа или гемофильтрации. Ангиография не может являться скрининговым методом диагностики и осуществляется только при наличии признаков стеноза по данным УЗИ или КТ-/МРТ-ангиографии или каптоприлового теста при условии обсуждения вопроса о дальнейшей реваскуляризации. Также ангиография может выполняться параллельно при проведении коронароангиографии или артериографии периферических сосудов нижних конечностей. Это обусловлено высокой частотой обнаружения стенозов почечных артерий у больных с ишемической болезнью сердца при проведении коронароангиографии (до 48%).
Рекомендация 3. Выполнение почечной ангиографии целесообразно у больных с полисосудистым атеросклеротическим поражением коронарных артерий при ишемической болезни сердца или периферических артерий в момент проведения ангиографии этих артерий (2В), а также в случае проведения коронароангиографии или ангиографии периферических артерий в случае, если имеются условия, перечисленные в Рекомендации 1 (1А). Также ангиографию следует применять при выявлении признаков стеноза почечной артерии с помощью УЗИ или КТ-(МРТ)ангиографии или других методов в случае, если предполагается проведение оперативной коррекции стеноза (1А).
В числе методов диагностики также могут фигурировать и функциональные пробы с каптоприлом. Первый вариант пробы связан с проведением нефросцинтиграфии до и после применения каптоприла, второй вариант - с регистрацией активности ренина плазмы крови до и после применения каптоприла.
Рекомендация 4. Нефросцинтиграфия с каптоприлом, так же как и определение активности ренина в почечной и кубитальной вене, а также каптоприловый тест с ренином (определение активности ренина плазмы до и после применения каптоприла) не рекомендуются в качестве скринингового теста (2В).
Рениновый тест с каптоприлом проводится в нескольких модификациях. В одной модификации используется периферическая кровь из кубитальной вены, в другом - кровь из почечной вены. Активность ренина определяется исходно и после дачи пациенту каптоприла. Условием соблюдения правил выполнения теста является отмена за 1 нед до проведения теста препаратов, влияющих на секрецию ренина (антигипертензивные препараты, диуретики, НПВС). Это наравне со сложностями диагностического обеспечения (активность ренина лучше определять радиоиммунным методом, для чего необходимо наличие радионуклидной лаборатории) ограничивает применение данного теста в широкой клинической практике. Положительным считается прирост активности ренина ≥15% от исходного значения. Выполнение нефросцинтиграфии с каптоприлом в большинстве случаев также ограничивается отсутствием радионуклидной лаборатории. Вместе с тем оба теста могут быть рекомендованы в отношении больных, у которых имеются диагностические сложности или противопоказания для выполнения визуализирующих методов (УЗИ, КТ-, МРТ-ангиография). В частности, для больных, страдающих ожирением, клаустрофобией, а также пациентов с особенностями сосудистого русла (раннее разветвление почечных артерий, распространение стеноза на сегментарные и дуговые артерии при сохранении проходимости магистрального ствола почечной артерии) данные тесты могут быть единственной возможностью, предваряющей ангиографическое исследование.
Дифференциальная диагностика
Дифференциальная диагностика в основном разворачивается вокруг гипертензионного синдрома как такового. РВГ дифференцируют с первичной АГ (гипертонической болезнью) и другими вторичными гипертензиями. Обнаружение стеноза может служить поводом для диагностики РВГ. Однако первичная АГ (гипертоническая болезнь) могла предшествовать развитию стеноза и усиливаться вследствие его развития, тем самым приобретая сочетанный генез. Развитие тубулоинтерстициального фиброза вследствие ишемической нефропатии также вносит свой вклад в развитие АГ и может способствовать ее поддержанию после реваскуляризации. Таким образом, генез АГ при наличии стеноза почечной артерии может иметь сочетанный характер, о чем, в частности, свидетельствует сохранение АГ после устранения стеноза.
Лечение
Основные подходы к лечению больных представлены в таблице 3. Методы немедикаментозной коррекции во многом идентичны таковым при первичной АГ (гипертонической болезни) и атеросклерозе (если генез стеноза атеросклеротический). Исследований влияния немедикаментозной терапии на течение и прогноз именно РВГ не проводилось.
Немедикаментозные мероприятия (как при атеросклерозе иных локализаций) |
Отказ от курения |
Нормализация веса тела |
Борьба с гиподинамией |
Диета с ограничением тугоплавких жиров и углеводов, поваренной соли (<5 г натрия хлорида) |
Медикаментозная терапия |
Ингибиторы АПФ и антагонисты ангиотензина II рецепторов (при одностороннем стенозе) |
Антагонисты медленных кальциевых каналов |
β-адреноблокаторы |
Диуретики |
Препараты центрального действия (агонисты имидазолиновых рецепторов) |
Гиполипидемические препараты |
Хирургические методы |
Эндоваскулярные процедуры (стентирование, баллонная ангиопластика со стентированием) |
Реконструкция почечной артерии (почечная и трансаортальная эндартерэктомия, аорторенальное протезирование, разные виды шунтирования) |
Нефрэктомия (практически не используется) |
Подходы к медикаментозной терапии формируются так же, как и при гипертонической болезни, однако имеют свои особенности (ограничения) в части назначения блокаторов РААС при двустороннем стенозе почечных артерий.
Рекомендация 5. Ингибиторы АПФ (1А), блокаторы ангиотензина II рецепторов (1В) являются эффективными препаратами для лечения АГ, ассоциированной с односторонним стенозом почечной артерии. β-Адреноблокаторы и антагонисты кальциевых каналов (1А) являются эффективными препаратами для лечения АГ с одно- или двусторонним стенозом почечных артерий (1А). Также могут назначаться препараты центрального действия и диуретики при одно- и двустороннем стенозе почечных артерий (2В).
При определении целевых значений снижения АД следует полагаться на рекомендации, касаемые АГ, ассоциирующиеся с ХБП. Отдельно исследований по данной проблеме при РВГ не проводилось.
Рекомендация 6. У больных ХБП без сахарного диабета с нормальной или незначительно повышенной альбуминурией (категория А1) рекомендуется добиваться достижения уровня систолического АД <140 мм рт.ст. и диастолического АД <90 мм рт.ст. (1В); с высокой альбуминурией (категория А2) - достижения уровня систолического АД <130 мм рт.ст. и диастолического АД <80 мм рт.ст. (2D); с очень высокой альбуминурией и/или протеинурией >0,5 г/сут (категория А3) - достижения уровня систолического АД <130 мм рт.ст. и диастолического АД <80 мм рт.ст. (2С).
Рекомендация 7. У больных ХБП с сахарным диабетом с нормальной или незначительно повышенной альбуминурией (категория А1) рекомендуется добиваться достижения уровня систолического АД <140 мм рт.ст. и диастолического АД <80 мм рт.ст. (1В); с высокой и очень высокой альбуминурией (категории А2 и A3) - достижения уровня систолического АД <130 мм рт.ст. и диастолического АД <80 мм рт.ст. (2D).
Важнейшим условием эффективности и безопасности терапии, снижающей АД, у пациентов с РВГ является стабильность достигнутых результатов, исключение резких колебаний АД, эпизодов ортостатической и ночной гипотонии, повышения уровня креатинина крови и снижения СКФ. Добиваться снижения систолического АД до уровня <120 мм рт.ст. не рекомендуется (НГ).
Медикаментозная терапия АГ у больных со стенозом почечной артерии сопровождается развитием ее окклюзии в течение года наблюдения в 16% случаев. В связи с этим антигипертензивную терапию необходимо дополнять гиполипидемической при атеросклеротическом генезе стеноза.
Рекомендация 8. Показания к реваскуляризации.
-
Бессимптомный стеноз. Чрескожная реваскуляризация может применяться при бессимптомном гемодинамически значимом одно- или двустороннем стенозе почечных артерий (2С). Проведение реваскуляризации в этом случае с целью сохранения функции почки и поддержания жизнеспособности органа в настоящее время не имеет достаточной доказательной базы (НГD).
-
АГ. Чрескожная реваскуляризация имеет преимущества перед медикаментозной терапией и показана больным с АГ и гемодинамически значимым одно- или двусторонним стенозом и при внезапном и стойком ухудшении течения ранее контролируемой АГ, рефрактерной АГ, злокачественной АГ; остром снижении почечной функции в ответ на применение блокаторов РААС; необъяснимом уменьшении размера почки или разницы между длинами почек более 15 мм (2В).
-
Сохранная почечная функция. Чрескожная реваскуляризация может быть выполнена при двустороннем гемодинамически значимом стенозе почечных артерий, а также при одностороннем стенозе нормально функционирующей почки и прогрессирующей ХБП (2В). Возможность проведения чрескожной реваскуляризации может быть рассмотрена в случае развития хронической ХПН при длине почки > 7 см, однако доказательная база в данном случае недостаточна (НДD).
-
Застойная сердечная недостаточность и нестабильная стенокардия. Чрескожная реваскуляризация показана больным со стенозом почечных артерий и развитием рецидивирующих обострений хронической сердечной недостаточности, а также необъяснимым генезом ее или внезапным необъяснимым отеком легких (2В). Чрескожная реваскуляризация гемодинамически значимого стеноза может быть выполнена больным с нестабильной стенокардией (2В).
При проведении проспективных исследований оказалось, что эффективный медикаментозный контроль при РВГ не уступает по своей эффективности в плане прогноза сохранения почечной функции и снижения смертности больных методам хирургической коррекции и даже является более предпочтительным. В связи с этим Рекомендация 8 демонстрирует клинические ситуации, когда следует отдавать предпочтение хирургическим методам коррекции. В остальных случаях проводится медикаментозная терапия.
Рекомендация 9. Стентирование почечной артерии показано при наличии атеросклеротического стеноза устья артерии. Баллонная ангиопластика с постановкой стента рекомендуется при фибромускулярной дисплазии почечной артерии (1В). Хирургическая сосудистая реконструкция (в первую очередь, протезирование) показана больным с фибромускулярной дисплазией почечной артерии и клиническими показаниями к вмешательству (распространение дисплазии на сегментарные артерии или наличие макроаневризмы) (1В). Хирургическая сосудистая реконструкция также показана при атеросклеротическом поражении и множественных малых почечных артериях или раннем первичном разветвлении магистральной почечной артерии (1В), а также при комбинации с параренальной аортальной реконструкцией (аневризма аорты, аортально-подвздошные окклюзионные процессы) (1С).
В основном для хирургического лечения стенозирующих процессов в почках применяют эндоваскулярные вмешательства (баллонная ангиопластика со стентированием) и только в тех случаях, когда проведение их становится невозможным, прибегают в операциям сосудистой реконструкции.
Течение и прогноз
Большинство исследований включает 5-летнее наблюдение за пациентами и лишь некоторые предполагают 10-летнюю и более проспекцию. Эффективный медикаментозный контроль позволяет снизить риск развития как почечных (нефросклероз, ХПН), так и сердечно-сосудистых осложнений (инфаркт миокарда, мозговой инсульт, застойная хроническая сердечная недостаточность). Удельный вес рестенозов в течение первого года наблюдения после почечной реваскуляризации колеблется от 2 до 8%, в течение 5-летнего наблюдения - от 15 до 60%.
Постепенно наблюдается снижение почечной функции с развитием ишемической нефропатии.
СПИСОК ЛИТЕРАТУРЫ
-
ACC/AHA Guidelines for the Management of Patients with Peripheral Arterial Disease (Lower Extremity, Renal, Mesenteric, and Abdominal Aortic). A Collaborative Report from the American Associations for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients with Peripheral Arterial Disease) - Summary of Recommendations // J. Vasc. Interv. Radiol. 2006. Vol. 17. P. 1383-1398.
-
AIUM Practice Guideline for the Performance of Native Renal Artery Duplex Sonography. 2013 by the American Institute of Ultrasound in Medicine. Guideline developed in conjunction with the American College of Radiology (ACR), the Society for Pediatric Radiology (SPR), and the Society of Radiologists in Ultrasound (SRU).
-
Conlon P.J., Little M.A., Pieper K., Mark D.B. Severity of renal vascular disease predicts mortality in patients undergoing coronary angiography // Kidney Int. 2001. Vol. 60. P. 1490-1497.
-
Cooper C.J., M.D., Murphy T.P., Cutlip D.E. et al. Stenting and medical therapy for atherosclerotic renal-artery stenosis // N. Engl. J. Med. 2014. Vol. 370. P. 13-22.
-
Garovic V.D., Textor S.C. Renovascular hypertension and ischemic nephropathy // Circulation. 2005. Vol. 112. P. 1362-1374.
-
Gray B.H., Olin J.W., Childs M.B. et al. Clinical benefit of renal artery angioplasty with stenting for the control of recurrent and refractory congestive heart failure // Vasc. Med. 2002. Vol. 7. P. 275-279.
-
Guidelines on myocardial revascularization. The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) // Eur. Heart J. 2010. Vol. 31. P. 2501-2555.
-
Hansen K.J., Edwards M.S., Craven T.E. et al. Prevalence of renovascular disease in the elderly: a population based study // J. Vasc. Surg. 2002. Vol. 36. P. 443-451.
-
Indications for Renal Arteriography at the Time of Coronary Arteriography. A Science Advisory From the American Heart Association Committee on Diagnostic and Interventional Cardiac Catheterization, Council on Clinical Cardiology, and the Councils on Cardiovascular Radiology and Intervention and on Kidney in Cardiovascular Disease // Circulation. 2006. Vol. 114. P. 1892-1895.
-
van Jaarsveld B.C., Krij nen P., Pieterman H. et al. The effect of balloon angioplasty on hypertension in atherosclerotic renal artery stenosis. Dutch Renal Artery Stenosis Intervention Cooperative Study Group // N. Engl. J. Med. 2000. Vol. 342. P. 1007-1014.
-
Kumar S.K., MacGinley R., Mantha M. et al. Natural history and progression of atherosclerotic renal vascular stenosis. Guidelines // Nephrology. 2010. Vol. 15. P. S204-S209.
-
Lonati C., Morganti А. Clinical Management of Renovascular Hypertension. Practical recommendations from the Italian Society of Hypertension (SIIA) // High Blood Press Cardiovasc. Prev. 2013. Vol. 20. P. 257-260.
-
Neymark E., LaBerge J.M., Hirose R. et al. Arteriographic detection of re-novascular disease in potential renal donors: incidence and effect on donor surgery // Radiology. 2000. Vol. 214. P. 755-760.
-
Rihal C.S., Textor S.C., Breen J.F. et al. Incidental renal artery stenosis among a prospective cohort of hypertensive patients undergoing coronary angiography // Mayo Clin. Proc. 2002. Vol. 77. P. 309-316.
-
Safian R.D., Textor S.C. Renal-artery stenosis // N. Engl. J. Med. 2001. Vol. 344. P. 431-442.
-
Sattur S., Prasad H., Bedi U. et al. Renal artery stenosis - an update // Postgrad. Med. 2013. Vol. 125, N 5. P. 43-50.
-
Scoble J.E. The epidemiology and clinical manifestations of atherosclerotic renal disease // Renal Vascular Disease / eds A.C. Novick, J.E. Scoble, G. Hamilton. London : W.B. Saunders, 1996. P. 303-314.
-
Textor S.C., Lerman L. Renovascular hypertension and ischemic nephropathy // Am. J. Hypertens. 2010. Vol. 23, N 11. P. 1159-1169.
-
Wheatley K., Ives N., Gray R., Kalra P.A. et al. Revascularization vs. medical therapy for renal-artery stenosis // N. Engl. J. Med. 2009. Vol. 361. P. 1953-1962.
-
White C.J. Optimizing outcomes for renal artery intervention // Circ. Car-diovasc. Interv. 2010. Vol. 3. P. 184-192.
ДИАБЕТИЧЕСКАЯ НЕФРОПАТИЯ
Раздел 1. Введение: Клиническое значение проблемы, определение, эпидемиология, патогенез
Хроническое повреждение почек при СД ассоциируется с резким снижением общей выживаемости больных СД (Valmadrid C.T., 2000) и является одной из наиболее частых причин развития ТПН (US Renal Data System: Annual Data Report, 2010). Необходимость применения дорогостоящих методов ЗПТ (ГД, ПД, ТП) для лечения больных с развернутыми сосудистыми осложнениями СД и находящихся в стадии ТПН, в условиях дефицита ресурсов здравоохранения имеет существенное социально-экономическое значение. Применение ЗПТ у больного с СД полностью не снимает остроту проблемы, поскольку выживаемость этой категории больных в сравнении с другими почечными заболеваниями остается низкой, в первую очередь из-за сердечно-сосудистой патологии, при малоудовлетворительном качестве жизни. Причины дисфункции почек при СД гетерогенны. Среди них диабетическая нефропатия (ДН) является наиболее распространенной, поэтому вопросы ее профилактики, диагностики и терапии являются важной проблемой диабетологии и нефрологии.
Под термином «диабетическая нефропатия» (синоним - «диабетический гломерулосклероз») понимают ряд типичных морфологических изменений почечной ткани, развивающихся при СД типа 1 и 2 (СДТ1, СДТ2). Изменения касаются всех структур почечной ткани - клубочков, канальцев, интерстиция и сосудов (Osterby R. et al., 1992; Mauer S.M. et al., 1988; Shestakova M. еt al., 1992; Parving H.H. et al., 1996). Гломерулярные повреждения связаны с утолщением базальной мембраны (ГБМ), увеличением мезангиального матрикса (МезМ), последующим развитием узелкового и/или диффузного интеркапиллярного гломерулосклероза.
Тубулоинтерстициальные и сосудистые изменения заключаются в развитии дистрофии канальцев и атрофии эпителия канальцев, фиброза интерстиция, артериологиалиноза и артериосклероза.
Эпидемиология ДН исследована в отношении ее клинических проявлений - высокой АУ, стойкой ПУ, снижения СКФ, ТПН.
ТПН. В развитых странах от 20 до 50% от общего количества поступающих для лечения ЗПТ являются пациентами с СД. В России СД как причина ТПН составляет 11,3% от всех случаев ЗПТ (Бибков Б.Т., Томилина Н.А., 2009), что может объясняться рядом причин: дефицитом диализных мест, низкой продолжительностью жизни в популяции и высокой сердечно-сосудистой смертностью СДТ1. Кумулятивная распространенность АУ 30-299 мг/сут после 15 лет течения СД достигает плато и составляет 20-30%, а стойкая ПУ развивается примерно в половине этих случаев. В отсутствие интенсивного мониторинга и лечения кумулятивная распространенность случаев ТПН в течение 30 лет после дебюта СД достигает >15%. Снижение СКФ <60 мл/мин наблюдается у 10% больных с АУ <300 мг/сут и в 50-60% случаев стойкой ПУ.
СДТ2. Суммарная распространенность клинических проявлений ДН существенно не отличается от таковой при СДТ1. В отличие от СДТ1 распространенность АУ и стойкой ПУ при СДТ2 в России несколько ниже, чем в среднем, по общемировым данным, что связано с более низкой продолжительностью жизни населения и высокой смертностью от сердечно-сосудистой патологии. Снижение СКФ <60 мл/мин наблюдается у 40% больных с АУ <300 мг/сут и в 70-80% случаев стойкой ПУ (Добронравов В.А. и соавт., 2004).
Патогенез ДН определяется механизмами, направленными на процессы стимуляции гиперпродукции матрикса, развития гломерулосклероза и интерстициального фиброза, которые коррелируют со структурными и функциональными изменения почек при ДН:
-
метаболическими последствиями гипергликемии, образованием и депозицией в почках продуктов повышенного гликирования;
-
формированием и прогрессированием гломерулярной гипертензии на фоне нарушений ауторегуляции внутрипочечной гемодинамики и системной АГ;
-
дисфункцией подоцитов. На эти механизмы и должны, в первую очередь направляться терапевтические вмешательства.
Раздел 2. Скрининг, диагностика и прогноз диабетической нефропатии
Рекомендация 2.1. При выявлении изменений со стороны почек и дифференциальной диагностике у пациентов с СД, в особенности с 2-м типом болезни, следует иметь в виду другие этиологические факторы дисфункции почек.
Комментарий. ДН - не единственный вариант поражения почек при СД, которое может быть обусловлено другими факторами. Из них наиболее частыми являются системная АГ, ишемия почек, вторичный ФСГС, иммунные гломерулопатии. У пациента с СД повышен риск заболеваний мочевыводящих путей с вовлечением почек или без такового: бессимптомной бактериурии, цистита, острого (в том числе эмфизематозный) и хронического пиелонефрита, папиллярного некроза, перинефрального абсцесса, а также атонии мочевого пузыря с развитием гидронефроза. СД является также фактором риска развития острого повреждения почек, что следует учитывать при анализе случаев внезапного ухудшения функции органа.
Дифференциальная диагностика при стойкой ПУ. Консультация нефролога оправданна во всех случаях впервые выявленной ПУ у больных с любым типом СД, поскольку не все случаи ПУ у пациентов с СД связаны с ДН. Возможные признаки недиабетического поражения почек (показания к биопсии почки и морфологической диагностике): развитие ПУ <5 лет от начала СД, быстрое развитие ПУ, значительная ПУ (А4) без снижения СКФ <60 мл/мин, быстропрогрессирующее снижение функции почек, отсутствие ретинопатии (при СДТ1), гематурия, снижение СКФ в отсутствие ПУ.
Рекомендация 2.2. В диагностике ранних стадий ДН, включая скрининг, ключевое значение имеет определение мочевой экскреции альбумина, которая отражает формирование типичных морфологических изменений в почках (НГ).
Рекомендация 2.2.1. Исследование АУ следует выполнять ежегодно у больных с установленным диагнозом СДТ1 более 5 лет назад и у всех пациентов с СДТ2, начиная от момента установления диагноза (НГ).
Комментарий. Эволюция ДН заключается в постепенном (многолетнем) развитии и прогрессировании типичных морфологических изменений почек, основными клиническими маркерами которых являются АУ и СКФ. Современная индексация АУ представлена в табл. 1.
| Индекс АУ | АО | А1 | А2 | A3 | А4 |
|---|---|---|---|---|---|
Краткая характеристика (аббревиатура) |
Оптимальная |
Повышенная |
Высокая |
Очень высокая |
Нефротическая |
Диапазон (мг/сут или мг/г креатинина мочи) |
<10 |
10-29 |
30-299 |
300-1999* |
>2000** |
Скрининг и мониторинг |
Оценка экскреции альбумина с мочой |
Оценка экскреции белка с мочой |
|||
* Соответствует суточной ПУ >0,5 г.
** Соответствует суточной ПУ >3,5 г.
|
Характерное течение ДН у больных СДТ1 заключается в постепенном нарастании АУ и снижении СКФ на фоне прогрессирования морфологических изменений (табл. 2). С возникновением морфологических изменений почечной ткани, соответствующих стадии 2, совпадает развитие АГ. Между прогрессированием сосудистых изменений (включая ретинопатию) и ДН также имеется отчетливый параллелизм.
Клинико-морфологические проявления поражения почек при СДТ2 более гетерогенны. Это обусловлено влиянием на почки и гипергликемии per se, и системных сосудистых процессов - АГ, атеросклероза, дисфункции эндотелия, возрастных изменений, которые у половины больных предшествуют выявлению СД. При СДТ2 повышение АД, АУ и даже ПУ часто обнаруживают в дебюте болезни (40-50, 15-40 и 7-10%). Только у части пациентов СДТ2 (30-40%) имеют место типичные проявления ДН; в значительной доле случаев СДТ2 обнаруживают фибропластические изменения на фоне поражения внутрипочечных сосудов без типичного для ДН поражения клубочков; у ряда больных можно обнаружить сочетание повреждений, вызванных поражением сосудов и диабетом. У 30-50% больных СДТ2 наблюдается снижение СКФ<60 мл/ мин в отсутствие существенной ПУ (АУ А0-А2), что в большей степени может быть клиническим отражением сосудистого нефросклероза, чем ДН.
При обоих типах СД развитие стойкой ПУ связано с ухудшением АГ и резким ускорением темпов прогрессирования ДН до ТПН (Matsumae T. et al., 1999).
Клинико-морфологические корреляции. В целом, рост АУ и снижение СКФ являются клиническими эквивалентами прогрессирования морфологических изменений в почках при ДН. Начальное повышение АУ 10-29 мг/сут связано с утолщением ГБМ. Больные с АУ 30-299 мг/сут, как правило, имеют достаточно отчетливые изменения, в виде утолщения ГБМ и увеличения МезМ. Вместе с тем АУ <10 мг/сут не гарантирует отсутствия ДН - такие пациенты, наряду с нормальной морфологической картиной, могут иметь и изменения, практически не отличимые от таковых при АУ А1-А2. При АУ 10-299 мг/сут диапазон изменений почечной ткани также может быть достаточно широк, особенно при СДТ2 - от практически полного отсутствия светооптических изменений до выраженных и соответствующих таковым в протеинурической стадии болезни. Стойкой ПУ (АУ А3-А4) соответствуют выраженные изменения почек, типичные для развернутой ДН, однако степень выраженности гломеруло- и тубулоинтерстициального склероза - основных предикторов отдаленного прогноза - может существенно различаться. Снижение СКФ коррелирует с фракционным объемом МезМ, степенью склеротических изменений клубочка и интерстиция, атрофией канальцев и сосудистыми изменениями, являясь другим важным показателем, характеризующим течение и прогноз почечной патологии.
Рекомендация 2.3. Оценку долгосрочного прогноза ДН следует в первую очередь основывать на качестве метаболического контроля диабета, уровнях АУ/ПУ и АД (1A).
Комментарий. Факторы, связанные с риском развития и прогрессирования ДН. Общие факторы риска, ускоряющие развитие и прогрессирование любой стадии ДН (табл. 2), включают недостаточный контроль гипергликемии, раннее начало СДТ1, АГ, дислипопротеидемию, табакокурение, мужской пол, наследственную предрасположенность (Шестакова М.В. и соавт., 2006).
Стадия 1. В развитии преклинической стадии ДН играют роль два основных фактора - качество метаболического контроля и наследственная предрасположенность. Гипергликемия может оказывать влияние на почечную ткань через целый ряд механизмов - усиление метаболизма глюкозы по сорбитоловому пути, нарушение миоинозитолового пути и транспорта, повышение синтеза и накопление диацилглицерола, увеличение содержания в циркуляции и тканях продуктов неферментного гликирования белков и липопротеидов. Гипергликемия также приводит к развитию клубочковой гиперфильтрации - важному фактору патогенеза ДН. Клинический аспект генетической детерминации заключается в существенном увеличении риска развития ДН при наличии у родителей пациента с СД АГ и/или серьезных сосудистых инцидентов. Есть данные об увеличении рисков развития и прогрессирования ДН у лиц с DD-генотипом ангиотензинконвертазы (Solini A. et al., 2002; Rudberg S. et al., 2000; Горашко Н.М. и соавт., 2002).
Стадия 2. Уровень АУ 10-29 мг/сут (А1) является предиктором дальнейшего прогрессирования АУ до стадии АУ (А2) при обоих типах СД (Forsblom C.M. et al., 1998; Murussi M. et al., 2002; The Microalbuminuria Collaborative Study Group, 1999; Gall M.A. et al., 1997), а также увеличения сердечно-сосудистых рисков (Yusuf S. et al., 2000; Gerstein H. et al., 2001). Начальное повышение АД практически всегда ассоциируется с развитием стадии АУ у больных СДТ1, но не имеет такого прогностического значения при СДТ2, так как является повышенным у 30-60% больных уже в дебюте болезни.
Стадия 3. Повышение и систолического, и диастолического АД заметно ускоряет, а агрессивная антигипертензивная терапия в значительной степени замедляет прогрессирование ДН от стадии 2 до стадии 3. Основным предиктором развития стадии 3 ДН (стойкой ПУ) является персистирующая АУ 30-299 мг/сут. Если уровень АУ достиг 30-299 мг/сут в течение 10 лет после дебюта СДТ1, то риск развития стойкой ПУ составляет 83-88%; если высокий уровень АУ появился позже, то шансы развития стадии 3 снижаются до 20-50%. В среднем, при обоих типах СД ежегодно 6-8% больных переходят из стадии 2 в стадию 3 (Wirta O.R. et al., 1996; Deferrari G. et. al., 1998). Помимо повышенного «почечного» риска АУ 30-299 мг/сут при СД связана с резким увеличением сердечно-сосудистой смертности этих пациентов (Garg J.P., Bakris G.L., 2002; Klausen К. et al., 2004).
Больные, у которых развилась стойкая ПУ (АУ 300 мг/сут), являются группой высокого риска развития ТПН в течение ближайших нескольких лет (Gall M.A. et al., 1997; Ravid M. et al., 1996). Основными факторами риска в этой стадии являются уровень суточной ПУ, АД и гликемии, а при СДТ2 еще ожирение.
Рекомендация 2.4. Оценку наличия и тяжести поражения почек при СД следует проводить в соответствии с универсальной классификацией ХБП на основе определения СКФ и уровня АУ/ПУ, которые также целесообразно использовать для мониторинга течения заболевания (НГ).
Комментарий. В соответствии с рекомендациями KDOQI (2002), Американской диабетической ассоциации (2005) и Национальными рекомендациями по ХБП (2012) поражение почек при СД в целом и ДН в частности, следует подразделять в соответствии с универсальной классификацией ХБП. Данная классификация предполагает определение стадии любого хронического повреждения почек по уровню СКФ с индексацией по уровню АУ.
АУ/ПУ. Диагностика ранних стадий ДН и наблюдение за их течением может базироваться в рутинной практике только на определении АУ. Для скрининга допустимо использование полуколичественных методов (тест-полоски на альбумин мочи), но положительный тест требует количественного подтверждения с определением суточной АУ или отношения альбумин/креатинин мочи в утренней порции мочи (Eknoyan G. et al., 2003; American Diabetes Association, 2004). Исследование альбумина в разовой порции мочи менее надежно. Контроль АУ надо проводить у всех больных 1 раз в год, начиная с 4-го года от момента выявления СДТ1 и вне зависимости от длительности болезни при СДТ2. Выявление АУ ≥30 мг/сут требует подтверждения ad min в 2 из 3 последовательных тестов. Подтверждение АУ ≥30 мг/сут с высокой вероятностью говорит о развитии 2-й стадии ДН, является показанием для терапии и требует контроля ≥2 раз в год.
Оценка уровня ПУ по общему анализу мочи не пригодна ни для диагностики ранних стадий ДН, ни для контроля и течения ДН и эффективности лечения из-за неудовлетворительной чувствительности и воспроизводимости метода. При стойкой ПУ (АУ >300 мг) для контроля ДН следует использовать суточную потерю белка или отношение белок мочи/креатинин мочи в разовой ее порции ежеквартально (Eknoyan G. et al., 2003; American Diabetes Association, 2004). Выполнению плановых тестов на АУ/ПУ должен предшествовать рутинный анализ мочи, поскольку ИМП, гематурия, наряду с острыми фебрильными состояниями, тяжелой физической нагрузкой, кратковременной выраженной гипергликемией могут исказить их результаты (Mogensen C.E. et al., 1995).
СКФ. При проведении амбулаторного скрининга и мониторинга достаточно использовать значения СКФ по расчетным формулам (рСКФ), основанным на определении концентрации креатинина сыворотки (Pcr), пола, возраста и расы больного. Международные и национальные рекомендации сводятся к тому, что определение Per не может заменить оценку СКФ и должно сопровождаться соответствующим расчетом СКФ. СКФ необходимо контролировать не менее 1 раза в год у пациентов с 1-2-й стадиями ДН; не менее 2 раз в год у пациентов со стойкой ПУ. При снижении СКФ<60 мл/мин ее контроль надо проводить не реже чем 1 раз в 3 мес для оценки темпов прогрессирования и решения вопроса о начале подготовки к диализу.
Контроль АД. Измерения АД должны проводиться так часто, как это необходимо для его адекватной коррекции. Целесообразно использовать самоконтроль, а в сомнительных случаях проводить СМАД. Поскольку АГ у больных СДТ1 практически всегда ассоциируется с развитием ДН, этот симптом является указанием для внепланового контроля уровня АУ. Регулярный контроль АД критичен при уже определенной ДН, так как является важным фактором риска и показателем эффективности проводимой антигипертензивной терапии.
Методы визуализации почек. Симметричное увеличение размеров и объема почек при сонографии характерно для ДН и также связано с более быстрым прогрессированием болезни (Крюкова Н.Ю., Добронравов В.А., 2003). Визуализацию почек с применением рентгеноконтрастных препаратов следует выполнять по строгим показаниям из-за риска развития острого повреждения органа.
Раздел 3. Принципы профилактики и лечения диабетической нефропатии
Рекомендация 3.1. Стратегический планлечебныхмероприятий определяется стадией ХБП (НГ).
Рекомендация 3.2. Профилактика и лечение ДН должны быть основаны на своевременной оценке и коррекции основных факторов риска развития ДН - гипергликемии и АГ (1A).
Рекомендация 3.2.1. У больных ДН следует рассматривать целевой уровень HbA1С 6,5-7,0% с поправкой на индивидуальные особенности пациента (2В).
Рекомендация 3.3. Основной целью терапии развившейся ДН является предупреждение развития ТПН и снижение сердечно-сосудистых рисков (НГ).
Рекомендация 3.4. Лечебные мероприятия должны воздействовать на основные патогенетические механизмы и факторы риска, влияющие на развитие и прогрессирование ДН; наибольшая эффективность в отношении замедления прогрессирования ДН может быть достигнута при многофакторном подходе (2C).
Рекомендация 3.5. Консультацию нефролога для уточнения тактики ведения больного с ДН следует назначить в случаях развития ПУ, снижения СКФ до уровня <60 мл/мин, недостаточного контроля гипертензии (НГ).
Комментарий. Общими принципами превентивной нефрологии являются как можно более раннее обнаружение почечных осложнений СД и связанных с ними состояний, поскольку эффективность терапевтических интервенций тем выше, чем раньше назначено лечение. В этом смысле точку зрения о необходимости консультации нефролога в случае развития явной почечной дисфункции (ХБП 4-5-й стадии) следует признать устаревшей. Практический опыт показывает, что совместное ведение больного с ДН диабетологом и нефрологом, начиная с ранних стадий заболевания, является наиболее эффективным в отношении максимального замедления темпов прогрессирования болезни и отдаления сроков развития ТПН.
Повышение АУ, стойкая ПУ, а также снижение СКФ являются мощными факторами риска развития и прогрессирования сердечно-сосудистой патологии у больных СД, поэтому параллельное решение вопросов кардиопротекции должно входить в объем лечебно-диагностических мероприятий наряду с профилактикой и терапией почечного процесса.
ИЗМЕНЕНИЯ СТИЛЯ ЖИЗНИ
Рекомендация 3.6. Пациентам с ДН следует рекомендовать терапевтические изменения стиля жизни, касающиеся ограничения потребления хлорида натрия и белка с пищей, отказ от курения и коррекцию массы тела.
Комментарий. Изменения в диете должны касаться двух позиций - ограничения потребления NaCl и белка. Для СД характерна почечная ретенция и увеличение пула обмениваемого натрия, что является причиной АГ и снижения эффективности ряда антигипертензивных препаратов (ИАПФ, БРА, БКК). Суточное потребление NaCl следует сократить до 3-5 г/сут. Ограниченное потребление белка (до 0,8 г/кг/сут) может несколько замедлить прогрессирование ДН (Pedrini M.T. et al., 1996; Andersen S. et al., 2000). Целесообразно частично заменять животные белки растительными. Имеет значение и ограничение в диете животных при увеличении содержания полиненасыщенных жиров (Gross J.L. et al., 2002; Ros E. et al., 2004). Калорийность пищи должна составлять около 30-35 ккал/кг/сут.
Отказ от табакокурения является одним из необходимых моментов изменения стиля жизни пациента с СД, поскольку определенно показано, что эта вредная привычка ассоциирована и с риском развития ДН, и с ее ускоренным прогрессированием (Orth S.R., 2002).
Снижение массы тела необходимо при ИМТ >27 кг/м2 .
КОНТРОЛЬ ГЛИКЕМИИ
Рекомендация 3.7. В любой стадии ДН необходимо стремиться к снижению Hb1C до индивидуального целевого уровня (6,5-7,0%); при планировании метаболического контроля следует учитывать уровень СКФ (1А).
Комментарий. В любой стадии ДН необходимо добиваться индивидуального целевого уровня Hb1С (6,5-7,0%), что позволяет снижать риск развития и прогрессирования ДН при обоих типах СД [Reichard P. et al., 1993; The Diabetes Control and Complications (DCCT) Research Group, 1993; UK Prospective Diabetes Study (UKPDS) Group, 1998; EDIC, 2003; ADVANCE, 2008]. Уровень СКФ накладывает существенные ограничения на выбор перорального сахароснижающего препарата у пациентов с СДТ2: при СКФ <60 мл/мин не следует использовать метформин, глибенкламид; при СКФ <30 мл/мин требуется коррекция дозы большинства препаратов, в том числе инсулина.
КОНТРОЛЬ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
Рекомендация 3.8. У больных ДН контроль АГ является принципом базовой терапии; целевые уровни АД у больных ДН составляют: систолическое <140 мм рт.ст и диастолическое <80 мм рт.ст. (2В).
Рекомендация 3.8.1. Антигипертензивная терапия должна быть индивидуализирована, а снижения САД <120 мм рт.ст. и ДАД <70 мм рт.ст. следует избегать (2В).
Рекомендация 3.8.2. Более низкие значения САД (<130 мм рт.ст.) могут рассматриваться у отдельных пациентов с ДН, у которых польза от ренопротективного эффекта перевешивает потенциальные риски (более молодые с высокой ПУ/АУ) (2С).
Рекомендация 3.9. Препаратами выбора при лечении АГ с любой стадией ДН являются средства, блокирующие РААС: ИАПФ - у больных СДТ1 и БРА - у больных СДТ2 типа (1А).
Рекомендация 3.9.1. При непереносимости ИАПФ и БРА взаимозаменяемы (НГ).
Рекомендация 3.10. Второй линии являются салуретики, БКК, ингибиторы ренина; в качестве последних ступеней терапии АГ следует рассматривать β-блокаторы, α-блокаторы (урапидил) и препараты центрального действия (НГ).
Рекомендация 3.11. Не следует использовать дигидропиридиновые БКК в качестве монотерапии, их применение ограничивается необходимостью дополнительного контроля гипертензии на фоне ИАПФ или БРА (2В).
Рекомендация 3.12. Применение ИАПФ/БРА следует сопровождать мониторингом уровня калия сыворотки крови и контролем гиперкалиемии (2С).
Комментарий. Лечение АГ является одним из главных принципов профилактики и лечения ДН, что приводит к снижению заболеваемости и темпов прогрессирования уже развившейся ДН (UK Prospective Diabetes Study (UKPDS) Group, 1998; ADVANCE, 2008). Предлагаемые целевые уровни АД у больных ДН ранее составляли: САД <130 мм рт.ст. и ДАД <80 мм рт.ст. Вместе с тем до настоящего времени не представлено доказательств того, что положительные эффекты такого агрессивного снижения АД, включая ренопротективный эффект, перевешивают потенциальные риски. Поэтому в настоящее время мнения экспертов сводятся к тому, что целевой уровень САД должен находиться в пределах 130-139 мм рт.ст. У части больных (особенно более молодого возраста) можно рассматривать снижение САД до уровня менее 130 мм рт.ст. как попытки получить более выраженный ренопротективный эффект. Антигипертензивная терапия должна быть индивидуализирована, а снижения САД <120 мм рт.ст. и ДАД <70 мм рт.ст. следует избегать.
Препаратами выбора при лечении АГ у больных с любой стадией ДН являются средства, блокирующие РААС: ИАПФ и БРА, поскольку эти лекарства помимо эффекта в отношении системного АД обладают целым рядом других ренопротективных свойств (см. ниже). Эффективность этих препаратов в отношении снижения темпов прогрессирования ДН на разных ее стадиях показана в целом ряде проспективных исследований (Lewis E.J. et al., 1993; Laffel L.M., McGill J.B., Gans D.J., 1995; Bakris G.L. et al., 2000; UK Prospective Diabetes Study (UKPDS) Group, 1998; Lewis E.J. et al., 2001; Brenner B.M. et al., 2001; Parving H.H. et al., 2001). Обнадеживающие предварительные данные получены для алискирена (селективного ингибитора ренина). Немаловажным обстоятельством для выбора данных препаратов являются и их хорошо известные положительные эффекты в отношении сердечно-сосудистой патологии.
Применение ИАПФ и БРА должно сопровождаться мониторированием концентрации калия в сыворотке крови из-за риска гиперкалиемии вследствие подавления продукции альдостерона. Это часто бывает у пациентов с СКФ <60 мл/мин и требует соответствующих ограничений в диете, а также назначения петлевых диуретиков. Существенное снижение СКФ (>30% от исходной) в течение 4 нед от момента начала терапии ИАПФ/БРА требует ревизии ситуации, в первую очередь в отношении наличия двустороннего стеноза почечных артерий. Стеноз почечной артерии целесообразно исключить при сочетании СДТ2 и АГ до назначения ИАПФ/БРА. АГ при ДН часто проявляет резистентность к проводимой терапии, поэтому у многих пациентов необходимо проводить комбинированную терапию. При недостаточной коррекции АД к терапии следует добавить диуретики, поскольку формирование избыточного пула натрия у пациентов с ДН является одним из основных факторов АГ и снижения эффективности ИАПФ/БРА. Тиазидные диуретики/индапамид в низких дозах целесообразно использовать при СКФ >50 мл/мин, при более низких значениях СКФ показано применение петлевых диуретиков (фуросемид, торасемид). БКК нецелесообразно использовать в качестве монотерапии из-за их неблагоприятного влияния на гломерулярную гемодинамику, однако они могут быть использованы в комбинации с ИАПФ/БРА для усиления антигипертензивного эффекта. В качестве последних ступеней терапии АГ используют β-блокаторы, α-блокаторы (урапидил) и препараты центрального действия.
КОНТРОЛЬ ПРОТЕИНУРИИ
Рекомендация 3.13. Снижение АУ/ПУ следует рассматривать как отдельную цель терапевтических вмешательств; основой фармакотерапии являются средства, блокирующие компоненты РАС, назначение которых также оправдано у больных с нормотензией, с учетом индивидуальной переносимости (2B).
Рекомендация 3.14. При недостаточной эффективности средств, блокирующих компоненты РАС, антипротеинурический эффект может быть усилен при добавлении недигидропиридиновых, в меньшей степени, дигидропиридиновых БКК (2B).
Комментарий. Выраженность АУ/ПУ является интегральным показателем тяжести морфологических изменений почек и одним из главных прогностических факторов. Поэтому снижение АУ/ПУ любой степени выраженности является специальной и весьма важной задачей терапии ДН. ИАПФ/БРА и алискирен, помимо системного антигипертензивного действия, обладают также рядом локальных ренопротективных эффектов как за счет торможения продукции медиаторов почечного повреждения на уровне клубочков, канальцев и интерстиция, так и за счет снижения внутриклубочковой гипертензии. Клинически эти эффекты проявляются в снижении АУ и замедлении темпов прогрессирования ДН. Назначение ИАПФ/БРА полностью оправдано у больных с нормотензией, так как ренопротективное действие этих препаратов, по крайней мере отчасти, не зависит от изменений системного АД. Вместе с тем, системная АГ в условиях ДН может привносить существенный вклад в формирование гломерулярной гипертензии из-за нарушения ауторегуляции афферентной артериолы. Вследствие этого максимальный ренопротективный эффект терапии ИАПФ/БРА в отношении снижения АУ и темпов снижения СКФ у больных с ДН и АГ следует ожидать в случае достижения целевого уровня АД.
Дозы ИАПФ/БРА для достижения антипротеинурического действия существенно больше тех, которые вызывают снижение АД, поэтому титровать дозу препаратов следует, ориентируясь по уровню АУ/ПУ, вплоть до максимальной. Наращивание дозы ИАПФ/БРА, как правило, не приводит к дополнительному снижению АД, коррекцию которого следует осуществлять параллельно с помощью препаратов других групп.
Клинически эффект от назначения ИАПФ следует определять по снижению (ранее повышенного АД) и уменьшению экскреции белка с мочой. Отсутствие подобной динамики не является причиной для отмены препарата данной группы, поскольку даже в этом случае его ренопротективное действие будет частично сохраняться.
Антипротеинурический эффект может быть усилен при комбинации разных классов препаратов. Так, добавление недигидропиридиновых БКК (нБКК - верапамил, дилтиазем) к ИАПФ приводит к дальнейшей регрессии ПУ на фоне благоприятных изменений почечной гемодинамики (Добронравов В.А., 2003; Bakris G.L., 1998). Комбинация ИАПФ и БРА также может снижать ПУ более значительно, чем каждый из этих препаратов в отдельности (Mogensen C.E., 2000; Jacobsen P., 2003). С учетом этих данных, целесообразно использовать сочетание ИАПФ/ БРА + нБКК или ИАПФ + БРА для попытки получения дополнительного эффекта в отношении ПУ (АУ А3-А4). Имеются данные об эффективности сочетания алискирена и БРА. Такую сочетанную терапию необходимо проводить под строгим контролем калия сыворотки крови для избежания гиперкалиемии.
Рекомендация 3.15. У больных ДН целью гиполипидемической терапии является уровень липопротеидов низкой плотности <2,5 ммоль/л и <1,8 ммоль/л для пациентов с сердечно-сосудистой патологией (2В).
Коррекция дислипопротеидемии. может способствовать снижению ПУ, темпов падения СКФ, уменьшению сосудистых событий (Fried L.F. et al., 2001; Collins R. et al., 2003). Целью гиполипидемической терапии при СД является уровень липопротеидов низкой плотности <2,5 ммоль/л и <1,8 ммоль/л для пациентов с сердечно-сосудистой патологией (ESC-EASD Guidelines, 2012; KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012). Статины или их комбинация с эзетимибом являются лечением выбора, снижая общий холестерин (ОХ),триглицериды и несколько повышая липопротеиды высокой плотности (ЛПВП).При СКФ<30 мл/мин дозировка аторвастатина и правастатина остается прежней, дозу других статинов необходимо снижать в 2-3 раза. Эффективный контроль ПУ у больных ДН сам по себе может способствовать улучшению или стабилизации липидных нарушений (Ravid M. et al., 1995; Добронравов В.А., 2002).
Рекомендация 3.16. У больных ДН выявление и лечение осложнений прогрессирующей дисфункции почек следует проводить в соответствии с международными и национальными рекомендациями по ХБП (НГ).
Терапия осложнений прогрессирующей дисфункции почек включает диагностику и коррекцию анемии, метаболического ацидоза, нарушений фосфатно-кальциевого метаболизма, дисэлектролитемии.
Подготовка больных к началу ЗПТ включает психологический тренинг, обучение, информацию родственников больных, решение вопросов трудоустройства, формирование сосудистого доступа при СКФ 25 мл/мин, а также вакцинацию против гепатита В.
СПИСОК ЛИТЕРАТУРЫ
-
Горашко Н.М., Шестакова М.В., Чистяков Д.А. и др. Ассоциация полиморфных генов генов-кандидатов с диабетической нефропатией у больных сахарным диабетом 1 типа // Сахар. диабет. 2002. № 1. С. 38-44.
-
Трофименко И.И., Добронравов В.А., Быстрова Н.Н., Дроздова Ю.В. и др. Распространенность снижения скорости клубочковой фильтрации у больных сахарным диабетом // Тер. арх. 2008. № 6. С. 48-52.
-
Шестакова М.В., Кошель Л.В., Вагодин В.А., Дедов И.И. Факторы риска прогрессирования диабетической нефропатии у больных с длительным течением сахарного диабета по данным ретроспективного анализа // Тер. арх. 2006. № 5. С. 60-64.
-
ADVANCE Collaborative Group, Patel A., MacMahon S., Chalmers J., Neal B. et al. Intensive blood glucose control and vascular outcmes in patients with type 2 diabetes // N. Engl. J. Med. 2008 Jun 12. Vol. 358, N 24. P. 2560-2572.
-
American Diabetes Association. Diabetes 2001 Vital Statistics. Alexandria, VA : ADA, 2001.
-
American Diabetes Association: Hypertension management in adults with diabetes (Position Statement) // Diabetes Care. 2004. Vol. 27, suppl. 1. P. S65-S67.
-
American Diabetes Association: Standards of medical care in diabetes (Position Statement) // Diabetes Care. 2004. Vol. 27, suppl. 1. P. S15-S35.
-
Anderson E.J., Richardson M., Castle G., Cercone S. et al. Nutrition interventions for intensive therapy in the Diabetes Control and Complications Trial. The DCCT Research Group // J. Am. Diet. Assoc. 1993 Jul. Vol. 93, N 7. P. 768-772.
-
Bakris G.L. et al. The role of combination antihypertensive therapy and the progression of renal disease hypertension: looking toward the next millennium // Am. J. Hypertens. 1998. Vol. 11. P. 158S-162S.
-
Bakris G.L., Williams M., Dworkin L., Elliott W.J. et al. Preserving renal function in adults with hypertension and diabetes: a consensus approach // Am. J. Kidney Dis. 2000. Vol. 36. P. 646-661.
-
Brenner B.M., Cooper M.E., de Zeeuw D., Keane W.F. et al. Effects of losar-tan on renal and cardiovascular outcomes in patients with type 2 diabetes and ne-phropathy // N. Engl. J. Med. 2001. Vol. 345. P. 861-869.
-
Brenner B.M., Cooper M.E., de Zeeuw D., Keane W.F. et al. RENAAL Study Investigators. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy // N. Engl. J. Med. 2001 Sep 20. Vol. 345, N 12. P. 861-869.
-
Chalmers J., Joshi R., Kengne A.P., MacMahon S. Blood pressure lowering withfixed combination perindopril-indapamide: key findings from ADVANCE // J. Hypertens. Suppl. 2008 Jun. Vol. 26, N 2. P. S11-S15.
-
Collins R., Armitage J., Parish S., Sleigh P. et al.; Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol-lowering with simvastatin in 5963 people with diabetes: a randomised placebo-controlled trial // Lancet. 2003 Jun 14. Vol. 361, N 9374. P. 2005-2016.
-
Cost effectiveness analysis of improved blood pressure control inhyperten-sive patients with type 2 diabetes: UKPDS 40. UK Prospective Diabetes Study Group // BMJ. 1998 Sep 12. Vol. 317, N 7160. P. 720-726.
-
Deferrari G., Repetto M., Calvi C., Ciabattoni M. et al. Diabetic nephropathy: from microto microalbuminuria // Nephrol. Dial. Transplant. 1998. Vol. 13, suppl. 8. P. 11-15.
-
DeFronzo R.A. Diabetic nephropathy: etiologic and therapeutic considerations // Diabetes Rev. 1995. Vol. 3. P. 510-564.
-
Delahanty L.M., Halford B.N. The role of diet behaviors in achieving improved glycemic control in intensively treated patients in the Diabetes Control and Complications Trial // Diabetes Care. 1993 Nov. Vol. 16, N 11. P. 1453-1458.
-
Diabetes Control and Complications Trial Research Group: The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus // N. Engl. J. Med. 1993. Vol. 329. P. 977-986.
-
Diabetes Control and Complications Trial/Epidemiology of Diabetes interventions and Complications (DCCT/EDIC) Research Group, Nathan D.M., Zinman B., Cleary P.A., Backhand J.Y. et al. Modern-day clinical course of type 1 diabetes mellitus after 30 years' duration: the diabetes control and complications trial/epidemiology of diabetes interventions and complications and Pittsburgh epidemiology of diabetes complications experience (1983-2005) // Arch. Intern. Med. 2009 Jul 27. Vol. 169, N 14. P. 1307-1316.
-
Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group // Lancet. 1998 Sep 12. Vol. 352, N 9131. P 854-865. Erratum in: Lancet. 1998 Nov 7. Vol. 352, N 9139. P. 1558.
-
Efficacy of atenolol and captopril in reducing risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 39. UK Prospective Diabetes Study Group // BMJ. 1998 Sep 12. Vol. 317, N 7160. P. 713-720.
-
Eknoyan G., Hostetter T., Bakris G.L., Hebert L. et al. Proteinuria and other markers of chronic kidney disease: a positionstatement of the national kidney foundation (NKF) and the national institute ofdiabetes and digestive and kidney diseases (NIDDK) // Am. J. Kidney Dis. 2003 Oct. Vol. 42, N 4. P. 617-622.
-
Fried L.F., Forrest K.Y., Ellis D., Chang Y. et al. Lipidmodulation in insulin-dependent diabetes mellitus: effect on microvascular outcomes // J. Diabetes Complications. 2001 May-Jun. Vol. 15, N 3. P. 113-119.
-
Fried L.F., Orchard T.J., Kasiske B.L. Effect of lipid reduction on thepro-gression of renal disease: a meta-analysis // Kidney Int. 2001 Jan. Vol. 59, N 1. P. 260-269.
-
Gall M.A., Hougaard P., Borch-Johnsen K., Parving H.H. Risk factors for development of incipient and overt diabetic nephropathy in patients with non-insulin dependent diabetes mellitus: prospective, observational study // BMJ. 1997 Mar 15. Vol. 314, N 7083. P. 783-788.
-
Gall M.A. Albuminuria in non-insulin-dependent diabetes mellitus. Prevalence, causes, and consequences // Dan. Med. Bull. 1997 Nov. Vol. 44, N 5. P. 465-485. Review. PubMed PMID: 9408734.
-
Garg J.P., Bakris G.L. Microalbuminuria: marker of vascular dysfunction, risk factor for cardiovascular disease // Vasc. Med. 2002 Feb. Vol. 7, N 1. P. 35-43.
-
Gerstein H.C., Mann J.F., Yi Q., Zinman B. et al.; HOPE Study Investigators. Albuminuria and risk of cardiovascular events, death, and heart failure in diabetic and nondiabetic individuals // JAMA. 2001 Jul 25. Vol. 286, N 4. P. 421-426.
-
Gross J.L., Zelmanovitz T., Moulin C.C., De Mello V. et al. Effect of a chicken-based diet on renal function and lipid profile in patients with type 2 diabetes: a randomized crossover trial // Diabetes Care. 2002 Apr. Vol. 25, N 4. P. 645-651.
-
Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary. The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and of the European Association for the Study of Diabetes (EASD) // Eur. Heart J. 2007. Vol. 28, N 1. P. 88-136.
-
Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group // Lancet. 1998 Sep 12. Vol. 352, N 9131. P. 837-853. Erratum in: Lancet. 1999 Aug 14. Vol. 354, N 9178. P. 602.
-
K/DOQI dinical Practice Guidelines and Ginical Practice Reccomenda-tions for Diabetes and Chronic Kidney Disease // Am. J. Kidney Dis. 2007. Vol. 49. P. S1-S179.
-
Klausen K., Borch-Johnsen K., Feldt-Rasmussen B., Jensen G. et al. Very low levels of microalbuminuria are associated with increased risk of coronary heart disease and death independently of renal function, hypertension, and diabetes // Circulation. 2004 Jul 6. Vol. 110, N 1. P. 32-35.
-
Klausen K.P., Parving H.H., Scharling H., Jensen J.S. The association be-tweenmetabolic syndrome, microalbuminuria and impaired renal function in the general population: impact on cardiovascular disease and mortality // J. Intern. Med. 2007 Oct. Vol. 262, N 4. P. 470-478.
-
Klausen K.P., Scharling H., Jensen G., Jensen J.S. New definition ofmi-croalbuminuria in hypertensive subjects: association with incident coronary heart disease and death // Hypertension. 2005 Jul. Vol. 46, N 1. P. 33-37.
-
Laffel L.M., McGill J.B., Gans D.J. The beneficial effect ofangiotensin-con-verting enzyme inhibition with captopril on diabetic nephropathy in normotensive IDDM patients with microalbuminuria. North American Microalbuminuria Study Group // Am. J. Med. 1995 Nov. Vol. 99, N 5. P. 497-504.
-
Lewis E.J., Hunsicker L.G., Bain R.P., Rohde R.D. The effect of angio-tensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group // N. Engl. J. Med. 1993. Vol. 329. P. 1456-1462.
-
Lewis E.J., Hunsicker L.G., Bain R.P., Rohde R.D. The effect ofangio-tensin-converting-enzyme inhibition on diabetic nephropathy. The Collaborative Study Group // N. Engl. J. Med. 1993 Nov 11. Vol. 329, N 20. P. 1456-1462. Erratum in: N. Engl. J. Med. 1993 Jan 13. Vol. 330, N 2. P. 152.
-
Lewis E.J., Hunsicker L.G., Clarke W.R., Berl T. et al. Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes // N. Engl. J. Med. 2001. Vol. 345. P. 851-860.
-
Manley S. Haemoglobin A1c - a marker for complications of type 2 diabetes: the experience from the UK Prospective Diabetes Study (UKPDS) // Clin. Chem. Lab. Med. 2003 Sep. Vol. 41, N 9. P. 1182-1190.
-
Matsumae T., Jimi S., Uesugi N., Takebayashi S. et al. Clinical and mor-phometrical interrelationships in patients with overt nephropathy induced by non-insulin-dependent diabetes mellitus. A lightand electron-microscopy study // Nephron. 1999 Jan. Vol. 81, N 1. P. 41-48.
-
Mauer S.M., Bilous R.W., Ellis E., Harris R. et al. Some lessons from the studies of renal biopsies in patients with insulin-dependent diabetes mellitus // J. Diabetes Complications. 1988 Oct-Dec. Vol. 2, N 4. P. 197-202.
-
Mogensen C.E., Keane W.F., Bennett P.H., Jerums G. et al. Prevention of diabetic renal disease with special reference to microalbuminuria // Lancet. 1995. Vol. 346. P. 1080-1084.
-
Mogensen C.E., Keane W.F., Bennett P.H., Jerums G. et al. Prevention of diabetic renal disease with special reference to microalbuminuria // Lancet. 1995 Oct 21. Vol. 346, N 8982. P. 1080-1084.
-
Mogensen C.E., Neldam S., Tikkanen I., Oren S. et al. Randomised controlled trial of dual blockade of renin-angiotensin system in patients with hypertension, microalbuminuria, and non-insulin dependent diabetes: the Candesartan and Lisinopril Microalbuminuria (CALM) Study // BMJ. 2000. Vol. 321, N 7274. P. 1440-1444.
-
Mogensen C.E., Neldam S., Tikkanen I., Oren S. et al. Randomised controlled trial of dual blockade of renin-angiotensin system in patients with hypertension, microalbuminuria, and non-insulin dependent diabetes: the candesartan and lisinopril microalbuminuria (CALM) study // BMJ. 2000 Dec 9. Vol. 321, N 7274. P. 1440-1444.
-
Mogensen C.E. ACE inhibitors and antihypertensive treatment in diabetes: focus on microalbuminuria and macrovascular disease // J. Renin. Angiotensin Aldosterone Syst. 2000 Sep. Vol. 1, N 3. P. 234-239.
-
Mogensen C.E. Diabetic nephropathy: evidence for renoprotection and practice // Heart. 2000 Sep. Vol. 84, suppl. 1. P. i26-i28.
-
Nathan D.M., Cleary P.A., Backlund J.Y., Genuth S.M. et al.; Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Study Research Group. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes // N. Engl. J. Med. 2005 Dec 22. Vol. 353, N 25. P. 2643-2653.
-
National Kidney Foundation. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 update // Am. J. Kidney Dis. 2012. Vol. 60, N 5. P. 850-886.
-
Osterby R., Nyberg G., Karlberg I., Svalander C. Glomerular volume in kidneys transplanted into diabetic and non-diabetic patients // Diabet. Med. 1992 Mar. Vol. 9, N 2. P. 144-149.
-
Osterby R. Glomerular structural changes in type 1 (insulin-dependent) diabetes mellitus: causes, consequences, and prevention // Diabetologia. 1992 Sep. Vol. 35, N 9. P. 803-812.
-
Parving H.H., Lehnert H., Brochner-Mortensen J., Gomis R. et al. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes // N. Engl. J. Med. 2001. Vol. 345. P. 870-878.
-
Pedrini M.T., Levey A.S., Lau J., Chalmers T.C. et al. The effect of dietary protein restriction on the progression of diabetic and nondiabetic renal diseases: a meta-analysis // Ann. Intern. Med. 1996 Apr 1. Vol. 124, N 7. P. 627-632.
-
Predictors of the development of microalbuminuria in patients with Type 1 diabetes mellitus: a seven-year prospective study. The Microalbuminuria Collaborative Study Group // Diabet. Med. 1999 Nov. Vol. 16, N 11. P. 918-925.
-
Ravid M., Lang R., Rachmani R., Lishner M. Long-term renoprotective effect of angiotensin-converting enzyme inhibition in non-insulin-dependent diabetes mellitus. A 7-year follow-up study // Arch. Intern. Med. 1996 Feb 12. Vol. 156, N 3. P. 286-289.
-
Reichard P., Nillson B.-Y., Rosengwist V. The effect of long-term intensified insulin treatment on the development of microvascular complications of diabetes mellitus // N. Engl. J. Med. 1993. Vol. 329. P. 304-309.
-
Schwartz V. [Critical notes on the results of studies (ACCORD, ADVANCE, VADT)of the efficiency of intensive therapy of type 2 diabetes mellitus] // Klin. Med. (Mosk.). 2011. Vol. 89, N 3. P. 18-20. Review. Russian.
-
Shestakova M., Mukhin N., Dedov I., Titov V. et al. Protein-loading test, urinary albumin excretion and renal morphology in diagnosis of subclinical diabetic nephropathy // J. Int. Med. 1992. Vol. 231, N 3. P. 213-217.
-
Solini A., Dalla Vestra M., Saller A., Nosadini R. et al. The angiotensin-converting enzyme DD genotype is associated with glomerulopathy lesions in type 2 diabetes // Diabetes. 2002 Jan. Vol. 51, N 1. P. 251-255.
-
Tight blood pressure control and risk of macrovascular and microvascu-larcomplications in type 2 diabetes: UKPDS 38. UK Prospective Diabetes Study Group // BMJ. 1998 Sep 12. Vol. 317, N 7160. P. 703-713. Erratum in: BMJ. 1999 Jan 2. Vol. 318, N 7175. P. 29.
-
UK Prospective Diabetes Study Group: Efficacy of atenolol and captopril in reducing the risk of macrovascular complications in type 2 diabetes (UKPDS 39) // BMJ. 1998. Vol. 317. P. 713-720.
-
UK Prospective Diabetes Study Group: Intensive blood glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33) // Lancet. 1998. Vol. 352. P. 837-853.
-
UK Prospective Diabetes Study Group: Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes (UKPDS 38) // BMJ. 1008. Vol. 317. P. 703-713.
-
Vandenhaute V. Palliative care and type II diabetes: A need for newguide-lines? // Am. J. Hosp. Palliat. Care. 2010 Nov. Vol. 27, N 7. P. 444-445.
-
Watkins P. The UKPDS. A model for gathering the evidence for the management of chronic diseases. UK Prospective Diabetes Study Group // J. R. Coll. Physicians Lond. 1998 Nov-Dec. Vol. 32, N 6. P. 510-511.
-
Wirta O., Pasternack A., Laippala P., Turjanmaa V. Glomerular filtration rate and kidney size after six years disease duration in non-insulin-dependent diabetic subjects // Clin. Nephrol. 1996 Jan. Vol. 45, N 1. P. 10-17.
-
Wirta O.R., Pasternack A.I., Mustonen J.T., Koivula T.A. et al. Urinary albumin excretion rate and its determinants after 6 years in non-insulin-dependent diabetic patients // Nephrol. Dial. Transplant. 1996 Mar. Vol. 11, N 3. P. 449-456.
-
Writing Team for the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Research Group. Sustained effect ofintensive treatment of type 1 diabetes mellitus on development and progression of diabetic nephropathy: the Epidemiology of Diabetes Interventions and Complications (EDIC) study // JAMA. 2003 Oct 22. Vol. 290, N 16. P. 2159-2167.