Нефрология. Клинические рекомендации / под ред. Е. М. Шилова, А. В. Смирнова, Н. Л. Козловской. - М. : ГЭОТАР-Медиа, 2016. - 816 с. - ISBN 978-5-9704-3714-8. |
Аннотация
Первые национальные клинические рекомендации по нефрологии подготовлены коллективом экспертов, в который вошли не только специалисты-нефрологи ведущих нефрологических школ России, но и представители других медицинских специальностей, тесно сотрудничающие с нефрологами, - кардиологи, эндокринологи, инфекционисты, педиатры, генетики. Издание содержит информацию по наиболее распространенным нефрологическим заболеваниям и синдромам. Представленные в нем клинические рекомендации детально описывают действия врача по диагностике, лечению, профилактике и реабилитации пациентов. Соблюдение международной методологии при подготовке клинических рекомендаций гарантирует их современность, достоверность, обобщение лучшего мирового опыта и знаний, обеспечивает возможность практического применения. Именно поэтому клинические рекомендации обладают преимуществами по сравнению с традиционными источниками информации (учебники, руководства, монографии), что позволит врачу в короткие сроки принимать обоснованные решения в сложных клинических ситуациях. Клинические рекомендации по нефрологии предназначены не только практикующим врачам-нефрологам, но и терапевтам, педиатрам, представителям смежных дисциплин. Они также могут использоваться для обучения студентов старших курсов и клинических ординаторов терапевтических специальностей.
Введение
На рубеже XX и XXI вв. мировое сообщество столкнулось с глобальной проблемой, имеющей не только медицинское, но и огромное социально-экономическое значение, - пандемией хронических неинфекционных болезней, которые ежегодно уносят миллионы жизней, приводят к тяжелым осложнениям, связанным с потерей трудоспособности и необходимостью высокозатратного лечения.
Среди них заболевания почек занимают важное место из-за значительной распространенности в популяции, резкого снижения качества жизни, высокой смертности пациентов и приводят к необходимости применения дорогостоящих методов заместительной терапии в терминальной стадии - диализа и пересадки почки.
В то же время развитие медицинской науки и фармакологии в конце XX в. заложило основы для разработки новых высокоэффективных и доступных методов профилактики, позволяющих существенно замедлить прогрессирование хронических заболеваний почек, снизить риск развития осложнений и затраты на лечение. Такие подходы оказались применимы к подавляющему большинству пациентов с почечной патологией, независимо от ее причины.
Данные обстоятельства требуют от систем здравоохранения новой стратегии в отношении дефиниции и стратификации тяжести хронической почечной патологии. Назрела необходимость выработки простых критериев и универсальной классификации, позволяющих оценивать степень нарушения функции почек, прогноз и четко планировать те или иные лечебные воздействия.
Общепризнанная унифицированная трактовка тяжести поражения почек необходима также для решения медико-социальных и медико-экономических проблем. Только на основе универсальных подходов и единой терминологии можно проводить адекватную оценку заболеваемости и распространенности, составлять региональные и национальные регистры пациентов с нарушением функции почек и на этой основе рассчитывать потребность в соответствующих методах лечения, а также планировать необходимые финансовые затраты.
Исторически первая попытка решения этих вопросов была инициирована в начале XXI в. Национальным почечным фондом США (National Kidney Foundation - NKF). Проведенный анализ многочисленных публикаций по вопросам диагностики и лечения заболеваний почек, прогностической роли ряда показателей, терминологических понятий лег в основу концепции хронической болезни почек (ХБП) [National Kidney Foundation KD: Clinical practice guidelines for chronic Kidney disease: Evaluation, classification and stratification // Am J Kidney Dis 2002; 39 (Suppl. 1): S1-S266]. В дальнейшем в разработке данной модели принимали участие эксперты Европейской почечной ассоциации и Европейской ассоциации диализа и трансплантации (ERA-EDTA) (European Best Practice, 2002) и KDIGO [3] (Kidney Disease: Improving Global Outcomes) (Levey A.S. и соавт., 2005; Levey A.S. и соавт., 2010).
К настоящему времени понятие ХБП и ее классификация получили мировое признание. Начиная с 2003 г. проблему ХБП неоднократно обсуждали на различных форумах отечественных нефрологов, в связи с чем пленум правления Научного общества нефрологов России (НОНР) (Москва, 17-18 октября 2007 г.), детально проанализировав данную проблему, счел необходимым разработать соответствующие национальные рекомендации.
Раздел 1. Хроническая болезнь почек как важная медицинская и социальная проблема
Рекомендация 1.1. Внедрение концепцииХБП в практическую работу системы национального здравоохранения следует рассматривать как важный стратегический подход к снижению общей и сердечно-сосудистой смертности, увеличению продолжительности жизни населения, а также к снижению расходов на госпитальное лечение осложнений нарушения функции почек и проведение заместительной почечной терапии (ЗПТ).
Комментарий. Распространенность ХБП сопоставима с такими социально значимыми заболеваниями, как гипертоническая болезнь и сахарный диабет (СД), а также ожирение и метаболический синдром. Признаки повреждения почек и/или снижение скорости клубочковой фильтрации (СКФ) выявляют, как минимум, у каждого десятого представителя общей популяции. При этом сопоставимые цифры были получены как в индустриальных странах с высоким уровнем жизни, так и в развивающихся странах со средним и низким доходом населения (табл. 1). Результаты проведенных эпидемиологических исследований в России показали, что проблема ХБП для нашей страны является не менее острой.
Страна |
Исследование |
Распространенность ХБП |
|
|---|---|---|---|
1-5-я стадии, % |
3-5-я стадии, % |
||
США |
NHANES, 1999-2006 |
15 |
8,1 |
Нидерланды |
PREVEND, 2005 |
17,6 |
- |
Испания |
EPIRCE, 2005 |
12,7 |
- |
Китай |
Beijing study, 2008 |
14 |
6,5 |
Япония |
Imai и соавт., 2007 |
- |
18,7 |
Австралия |
AusDiab, 2008 |
13,4 |
7,7 |
Конго |
Kinshasa study, 2009 |
12,4 |
8 |
Признаки ХБП отмечаются более чем у 1/3 больных с хронической сердечной недостаточностью; снижение функции почек наблюдается у 36% лиц в возрасте старше 60 лет, у лиц трудоспособного возраста; снижение функции отмечается в 16% случаев, а при наличии сердечно-сосудистых заболеваний его частота возрастает до 26% (Добронравов В.А. и соавт., 2004; Смирнов А.В. и соавт., 2004; Бикбов Б.Т., Томилина Н.А., 2009; Шалягин Ю.Д. и соавт., 2011). Эти данные заставляют пересмотреть традиционное представление об относительной редкости болезней почек среди населения и требуют коренной перестройки системы оказания помощи этой категории больных.
По данным официальной статистики, почечная смертность относительно низка. Это связано с развитием методов заместительной терапии [диализ и трансплантация почки (ТП)], а также с тем, что непосредственной причиной гибели пациентов с нарушенной функцией почек (на додиализном и диализном этапах лечения) являются сердечно-сосудистые осложнения. Поэтому в официальных отчетах случаи смерти больных с нарушенной функцией почек учитываются как обусловленные сердечно-сосудистыми причинами, а роль заболевания почек как основного фактора сердечно-сосудистого риска игнорируется.
Снижение функции почек, по современным представлениям, является самостоятельной и важной причиной ускоренного развития патологических изменений сердечно-сосудистой системы. Это обусловлено рядом метаболических и гемодинамических нарушений, которые развиваются у больных со сниженной СКФ, когда возникают и выходят на первый план нетрадиционные, «почечные» факторы сердечно-сосудистого риска: альбуминурия (АУ)/протеинурия (ПУ), системное воспаление, оксидативный стресс, анемия, гипергомоцистеинемия и др. (Смирнов А.В. и соавт., 2005).
Оказание помощи пациентам с ХБП требует высоких материальных затрат (Смирнов А.В. и соавт., 2006; Бикбов Б.Т., Томилина Н.А., 2009; Xue J.L. и соавт., 2001; Bommer J., 2002; Schiepati A., Remuzzi G., 2005). В первую очередь это касается проведения ЗПТ - диализа и ТП, которая жизненно необходима пациентам с терминальной почечной недостаточностью, развивающейся в исходе нефропатий различной природы. По ориентировочным оценкам, во всем мире на программы диализа в начале 2000-х гг. ежегодно выделялось 70-75 млрд долл. США (Xue J.L. и соавт., 2001). В США расходная часть бюджета системы Medicare, направляемая на обеспечение ЗПТ, достигает 5%, тогда как доля этих пациентов составляет всего 0,7% от общего числа больных, охваченных данной системой (U.S. Renal Data System, 2004). В России, по данным Регистра Российского диализного общества, в 2007 г. различные виды ЗПТ получали более 20000 человек, ежегодный прирост числа этих больных в среднем составляет 10,5%. В нашей стране средний возраст больных, получающих ЗПТ, составляет 47 лет, т.е. в значительной мере страдает молодая, трудоспособная часть населения. На сегодняшний день, несмотря на определенный прогресс в развитии ЗПТ в России в течение последних 10 лет, обеспеченность населения РФ этими видами лечения остается в 2,5-7 раз ниже, чем в странах Евросоюза, в 12 раз ниже, чем в США (Бикбов Б.Т., Томилина Н.А., 2009). В то же время возможности нефропротективной терапии, которая позволяет затормозить прогрессирование ХБП и стабилизировать функцию почек, а затраты на которую в 100 раз ниже, чем на ЗПТ, используются неэффективно.
Таким образом, быстрый рост в популяции числа больных со сниженной функцией почек - не узкоспециальная, а общемедицинская междисциплинарная проблема, имеющая серьезные социально-экономические последствия (Смирнов А.В., 2005; Мухин Н.А., 2008; Remuzzi G. и соавт., 2004; de Portu S. и соавт., 2011). Она требует, с одной стороны, перестройки и усиления нефрологической службы - не только за счет открытия новых диализных центров и развития трансплантологии, но и укрепления ее структур, направленных на проведение этиотропного, патогенетического и нефропротективного лечения с целью предотвращения терминальной почечной недостаточности (ТПН). С другой стороны, необходима всемерная интеграция нефрологии и первичного звена здравоохранения, а также других специальностей с целью проведения широких профилактических мероприятий, ранней диагностики ХБП, обеспечения преемственности лечения и эффективного использования имеющихся ресурсов.
Концепция ХБП, обеспечивающая унификацию подходов как к профилактике, так и к диагностике и лечению нефропатий разной природы, создает предпосылки для решения этих важных задач здравоохранения.
Раздел 2. Определение, критерии диагноза и классификация хронической болезни почек
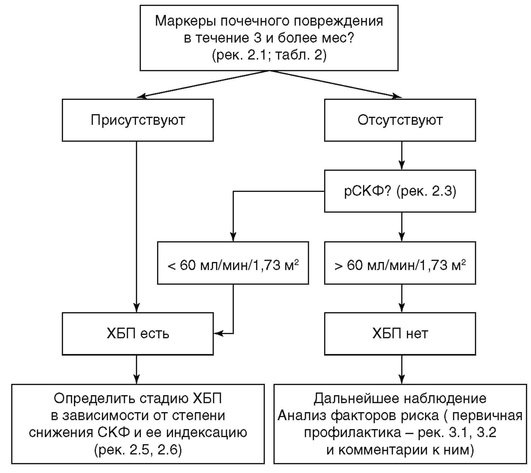
Рекомендация 2.1. Под ХБП следует понимать наличие любых маркеров, связанных с повреждением почек и персистирующих в течение более трех месяцев вне зависимости от нозологического диагноза.
Комментарий. Под маркерами повреждения почек следует понимать любые изменения, выявляющиеся при клинико-лабораторном обследовании, которые отражают наличие патологического процесса в почечной ткани (табл. 2).
| Маркер | Примечания |
|---|---|
Повышенная АУ/ПУ |
См. рекомендацию 2.4 |
Стойкие изменения в осадке мочи |
Эритроцитурия (гематурия), цилиндрурия, лейкоцитурия(пиурия) |
Изменения электролитного состава крови и мочи |
Изменения сывороточной и мочевой концентрации электролитов, нарушения кислотно-щелочного равновесия и др. (в том числе характерные для синдрома канальцевой дисфункции, синдром Фанкони, почечные тубулярные ацидозы, синдромы Барттера и Гительмана, нефрогенный несахарный диабет и т.д.) |
Изменения почек по данным лучевых методов исследования |
Аномалии развития почек, кисты, гидронефроз, изменение размеров почек и др. |
Патоморфологические изменения в ткани почек, выявленные при прижизненной нефробиопсии |
Признаки активного необратимого повреждения почечных структур, специфические для каждого хронического заболевания почек, и универсальные маркеры нефросклероза, указывающие на хронизацию процесса |
Стойкое снижение СКФ менее 60 мл/ мин/1,73 м2 |
Указывает на наличие ХБП даже при отсутствии повышенной АУ/ПУ и других маркеров повреждения почек |
Критерием снижения функции почек является уровень СКФ, стандартизированной на поверхность тела, находящийся ниже нормальных значений, т.е. ниже 90 мл/мин/1,73 м2. СКФ в пределах 60-89 мл/ мин/1,73 м2 расценивают как начальное или незначительное ее снижение. Для установления ХБП в этом случае необходимо наличие также маркеров почечного повреждения. При их отсутствии ХБП не диагностируется. Для лиц 65 лет и старше это расценивают как вариант возрастной нормы. Лиц моложе этого возраста относят в группу высокого риска развития ХБП, им рекомендуют контроль состояния почек не реже 1 раза в год, активную профилактику ХБП.
Если СКФ ниже 60-89 мл/мин/1,73 м2, наличие ХБП устанавливается даже при отсутствии каких-либо маркеров почечного повреждения.
Трехмесячное ограничение (критерий стойкости) в качестве временного параметра определения ХБП было выбрано потому, что в данные сроки острые варианты развития дисфункции почек, как правило, завершаются выздоровлением или приводят к очевидным клинико-морфологическим признакам хронизации процесса.
ХБП - понятие наднозологическое, в то же время оно не является формальным объединением хронических почечных заболеваний различной природы в одну большую аморфную группу, подменяя этиологический принцип. Понятие ХБП, с одной стороны, отражает наличие общих факторов риска развития и прогрессирования нефропатий, универсальных механизмов формирования нефросклероза и вытекающих отсюда способов первичной и вторичной профилактики, а также наличие общего исхода - ТПН.
Следует подчеркнуть, что понятие ХБП не отменяет нозологический подход к диагностике заболеваний почек. Необходимо добиваться идентификации конкретной причины (или причин) развития повреждения почек, для того чтобы установить нозологический диагноз и максимально рано назначить соответствующую этиотропную и патогенетическую терапию. В то же время концепция ХБП при разных нозологических формах является универсальным инструментом для определения степени нарушения функции, расчета риска развития ТПН и сердечно-сосудистых осложнений, планирования и оценки эффективности нефропротективного лечения, подготовки и начала ЗПТ.
Рекомендация 2.2. Диагноз ХБП следует устанавливать на основании следующих критериев:
-
выявление любых клинических маркеров повреждения почек, подтвержденных на протяжении периода длительностью не менее 3 мес;
-
наличие маркеров необратимых структурных изменений органа, выявленных однократно при прижизненном морфологическом исследовании органа или при его визуализации;
-
снижение СКФ <60 мл/мин/1,73 м2, сохраняющееся в течение 3 и более месяцев, вне зависимости от наличия других признаков повреждения почек.
Комментарий. Диагностика ХБП может базироваться на выявлении любых морфологических и клинических маркеров почечного повреждения в зависимости от клинической ситуации. Для постановки диагноза ХБП целесообразно руководствоваться следующим алгоритмом.
В соответствии с определением, для диагностики ХБП необходимо подтверждение наличия маркеров повреждения почек при повторных исследованиях как минимум в течение 3 мес. Такой же интервал необходим для подтверждения снижения уровня СКФ<60 мл/мин, в том случае, если СКФ<60 мл/мин выступает в роли единственного маркера ХБП. Для диагностики ХБП может оказаться достаточным однократное исследование, если оно недвусмысленно указывает на необратимые структурные изменения органа (данные визуализирующих инструментальных методов или прижизненного морфологического исследования).
Рекомендация 2.3. Для оценки СКФ в широкой (амбулаторной) клинической практике целесообразно применять значения этого показателя, полученные на основании расчетных формул (рСКФ), включающих пол, возраст пациента и концентрацию креатинина в сыворотке крови; клиренсовые методы при необходимости наиболее точного определения СКФ предпочтительно использовать в условиях стационара.
Рекомендация 2.3.1. У больных ХБП недопустимо использование только концентрации креатинина в сыворотке крови с целью оценки функции почек; каждое определение концентрации креатинина в сыворотке крови или указание на него в медицинской документации должно сопровождаться расчетом СКФ.
Комментарий. До настоящего времени нет метода исследования СКФ, безупречного с точки зрения точности, доступности и удобства использования.
Наиболее точными являются клиренсовые методы оценки функции почек - по клиренсу экзогенных веществ: инулина, 51Cr-ЭДТА (этилендиаминтетрауксусная кислота), 99mTcDTPA (диэтилентриаминопентауксусная кислота), 1251-йоталамата или йогексола, которые вводятся в кровь. Они остаются «золотым стандартом» измерения СКФ, однако техническая сложность и трудоемкость, необходимость введения чужеродного вещества в кровь, высокая стоимость ограничивают их применение. В настоящее время они используются в научных исследованиях, а также в клинических ситуациях, когда требуется максимально точное определение СКФ, например, при оценке функции почек на фоне химиотерапии (ХТ) или у потенциального родственного донора. Радиоизотопные методы исследования СКФ позволяют раздельно оценить функциональное состояние правой и левой почки, что имеет значение при заболеваниях с односторонним поражением, некоторых аномалиях почек и т.д. Клиренсовые методы исследования СКФ с использованием экзогенных веществ являются стандартными для проверки точности всех других методов.
Оценка СКФ по клиренсу эндогенного вещества - креатинина, который поступает в кровь естественным образом в процессе самообновления мышечной ткани с примерно постоянной скоростью, более удобно, хотя и менее точно, чем по клиренсу экзогенных веществ. Проводится проба Реберга-Тареева, основанная на сборе мочи в течение 24 ч. Определяются объем суточной мочи, концентрация креатинина в суточной моче и в крови, взятой после завершения пробы. СКФ рассчитывается по приведенной формуле.
Формула для оценки СКФ по клиренсу креатинина (в пробе Реберга-Тареева):
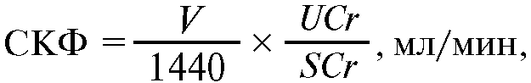
где V - объем мочи, собранной за сутки, мл; UCr - концентрация креатинина в суточной моче; SCr - концентрация креатинина в сыворотке крови, взятой в конце пробы.
Полученный результат необходимо стандартизировать на площадь поверхности тела пациента, которая может быть рассчитана по формулам Дюбуа или Хейкока.
Стандартизация СКФ на площадь поверхности тела пациента (S):
СКФстанд. = СКФ х 1,73 / Sтела, мл/мин/1,73 м2.
S тела рассчитывается:
по формуле Дюбуа:
S тела = 0,007184 х Мтела0,423 х Рост0,725,
или по формуле Хейкока:
S тела = 0,02 х Мтела0,54 х Рост0,40,
где М тела - масса тела, кг; Рост - рост тела, см.
Сбор суточной мочи представляет определенные затруднения для пациентов, особенно амбулаторных. Кроме того, высока вероятность ошибки, связанной с неправильным сбором мочи или неточным измерением ее объема. Для точности пробы необходим достаточный суточный диурез (не менее 1000 мл).
В широкой практике, учитывая трудности, связанные с проведением пробы Реберга-Тареева, состояние функции почек было принято оценивать по уровню креатинина сыворотки крови, поскольку он находится в обратной, хотя и нелинейной зависимости от СКФ. Как показали многочисленные исследования, такой подход является грубым, неточным и поэтому некорректным. Он не учитывает различные факторы, помимо клубочковой фильтрации, оказывающие влияние на кинетику креатинина: величину мышечной массы, которая определяет скорость поступления креатинина в кровь и зависит от пола и возраста, а также канальцевую секрецию креатинина, которая у здоровых людей не превышает 10% от общего количества выводимого с мочой креатинина, а у больных с 3б-5-й стадиями ХБП может превышать 40%. Таким образом, у пожилых людей, женщин, лиц с небольшой мышечной массой, при выраженных стадиях ХБП использование уровня креатинина крови для оценки функции почек приводит к ошибке - завышению СКФ по сравнению с ее истинным значением, определяемым при помощи клиренсовых методов с использованием экзогенных веществ, а значит, недооценке тяжести ХБП.
Уровень креатинина, превышающий референсные значения, безусловно, свидетельствует о нарушении функции почек. Однако важно подчеркнуть, что во многих случаях и при значениях креатинина, укладывающихся в референсные пределы, СКФ может быть существенно снижена.
По современным представлениям, уровень сывороточного креатинина вследствие указанных погрешностей не может быть использован ни для оценки выраженности дисфункции почек, ни для решения вопроса о начале заместительной терапии.
С начала 70-х годов прошлого века делаются попытки разработать формулу, которая позволила бы, определив уровень креатинина сыворотки крови и несколько дополнительных показателей, влияющих на его образование в организме, получить расчетную СКФ, наиболее близкую по значению к истинной СКФ, измеренной по клиренсу инулина или другими точными методами.
Первой формулой, получившей широкое применение в нефрологии, клинической фармакологии и других областях медицины, стала формула Кокрофта-Голта (Cockcroft D.W., Gault M.H., 1976). Она проста, однако полученное значение желательно стандартизировать на поверхность тела пациента, что значительно усложняет расчеты.
В 1990-е гг. группой экспертов на основании данных исследования MDRD (Modification of Diet in Renal Disease) (Levey A.S. и соавт., 1999) были предложены новые уравнения, более точные, чем формула Кокрофта-Голта, и не требующие дополнительной стандартизации на поверхность тела, а также знания антропометрических показателей, получившие название формул MDRD. Чтобы рассчитать СКФ при помощи сокращенного варианта формулы MDRD, достаточно знать уровень креатинина сыворотки крови, пол, возраст и расу пациента, что делает ее очень удобной для скрининговых исследований и амбулаторной практики. Однако формула MDRD имеет ряд существенных недостатков. На 3-5-й стадиях ХБП она точнее отражает функцию, чем формула Кокрофта-Голта, однако при истинной СКФ выше 60 мл/мин/1,73 м2 она дает неточные (заниженные) результаты (Hallan S. и соавт., 2004; Ma Y.C. и соавт., 2006; Ibrahim S. и соавт., 2008). Уравнения MDRD, полученные при обследовании популяции Северной Америки, некорректно отражают уровень СКФ у представителей монголоидной расы и ряда этносов (Matsuo S. и соавт., 2009), что актуально для многонационального населения России.
В 2009-2011 гг. той же группой исследователей был разработан наиболее универсальный и точный метод расчета СКФ, работающий на любой стадии ХБП и у представителей всех трех рас - уравнения CKD-EPI (табл. 3).
Нужный вариант выбирается в зависимости от расы, пола и уровня креатинина сыворотки пациента.
Разработчикам удалось преодолеть обе причины искажений: влияние различий в мышечной массе лиц разного возраста и пола и ошибку, связанную с активацией канальцевой секреции креатинина на поздних стадиях ХБП. Формула создана на основании базы данных, включающей 8254 больных. Ее точность была проверена на 4014 пациентах из США и Европы и 1022 больных из Китая, Японии и Южной Африки (у японцев и южноафриканцев она давала значительную погрешность). Она является наиболее универсальной и точной из всех используемых на сегодня формул.
Результаты исследований, выполненных в Санкт-Петербургском научно-исследовательском институте нефрологии, показали, что стратификация стадий ХБП на основе CKD-EPI-метода оценки СКФ довольно близко совпадает с данными, полученными с помощью референтного метода - плазматического клиренса 99mTcDTPA.
Полученные данные позволяют рекомендовать CKD-EPI-метод оценки рСКФ как оптимальный для амбулаторной клинической практики в настоящее время. Дополнительной стандартизации на поверхность тела, так же как при использовании формулы MDRD, не требуется.
| Раса | Пол | SCr*, мг/100 мл** | Формула |
|---|---|---|---|
Чернокожие |
Женский |
≤0,7 |
167х(0,993)Возрастх(SCr/0,7)-0,328 |
Чернокожие |
Женский |
>0,7 |
167х(0,993)Возрастх(SCr/0,7)-1,210 |
Чернокожие |
Мужской |
≤0,9 |
164х(0,993)Возрастх(SCr/0,9)-0,412 |
Чернокожие |
Мужской |
>0,9 |
164х(0,993)Возрастх(SCr/0,9)-1,210 |
Азиаты |
Женский |
≤0,7 |
151х(0,993)Возрастх(SCr/0,7)-0,328 |
Азиаты |
Женский |
>0,7 |
151х(0,993)Возрастх(SCr/0,7)-1,210 |
Азиаты |
Мужской |
≤0,9 |
149 х(0,993)Возрастх(SCr/0,9)-0,412 |
Азиаты |
Мужской |
>0,9 |
149 х (0,993) Возрастх (SCr/0,9)-1,210 |
Испаноамериканцы и индейцы |
Женский |
≤0,7 |
145 х (0,993)Возрастх (SCr/0,7)-0,328 |
Испаноамериканцы и индейцы |
Женский |
>0,7 |
145 х (0,993)Возраст х (SCr/0,7)-1,210 |
Испаноамериканцы и индейцы |
Мужской |
≤0,9 |
143 х (0,993)Возраст х (SCr/0,9)-0,412 |
Испаноамериканцы и индейцы |
Мужской |
>0,9 |
143 х (0,993)Возраст х (SCr/0,9)-1,210 |
Белые и остальные |
Женский |
≤0,7 |
144 х (0,993)Возраст х (SCr/0,7)-0,328 |
Белые и остальные |
Женский |
>0,7 |
144 х (0,993)Возраст х (SCr/0,7)-1,210 |
Белые и остальные |
Мужской |
≤0,9 |
141 х (0,993)Возраст х (SCr/0,9)-0,412 |
Белые и остальные |
Мужской |
>0,9 |
141 х (0,993)Возраст х (SCr/0,9)-1,210 |
* SCr - концентрация креатинина в сыворотке крови.
** SCr, мг/100 мл = (SCr, мкмоль/л)х0,0113.
Для удобства пользования формулой разработаны компьютерные программы и номограммы (см. Приложение). Для широкого внедрения расчетных методов оценки функции почек рекомендуется, чтобы каждое определение уровня креатинина сыворотки в биохимической лаборатории сопровождалось расчетом СКФ по уравнениям CKD-EPI, которые должны быть заложены в программное обеспечение лаборатории. В бланке лаборатории, помимо уровня креатинина сыворотки, должен обязательно указываться уровень СКФ, рассчитанный по формуле CKD-EPI для данного больного.
Формулы CKD-EPI, MDRD, Кокрофта-Голта разработаны для взрослых. Для оценки функции почек у детей используется формула Шварца (Schwartz):
СКФ = k х Рост / SCr,
где Рост - рост, см; SCr - концентрация креатинина в сыворотке крови; k - возрастной коэффициент (табл. 4).
Таким образом, на сегодняшний день в медицинской практике используется целый ряд формул для расчета СКФ. У взрослых наиболее безупречным с точки зрения универсальности и точности является метод CKD-EPI, который вытесняет устаревшие формулы MDRD и Кокрофта-Голта. С целью унификации подходов к диагностике ХБП НОНР рекомендует оценивать СКФ у взрослых методом CKD-EPI. У детей рекомендуется использовать формулу Шварца.
| Возраст | k для SCr, мг/100 мл | k для SCr, мкмоль/л |
|---|---|---|
<1 года |
0,33 |
29 |
>1 года |
0,45 |
40 |
2-12 лет |
0,55 |
49 |
13-21 год М |
0,70 |
62 |
13-21 год Ж |
0,55 |
49 |
Существует ряд ситуаций, в которых использование расчетных методов оценки СКФ некорректно:
-
нестандартные размеры тела (пациенты с ампутацией конечностей, бодибилдеры);
-
выраженные истощение и ожирение [индекс массы тела (ИМТ) <15 и >40 кг/м2 ];
-
быстрое снижение функции почек [острый и быстро прогрессирующий гломерулонефрит (ГН), острое повреждение почек];
-
необходимость назначения токсичных препаратов, выводимых почками (например, ХТ) - для определения их безопасной дозы;
В таких обстоятельствах необходимо воспользоваться, как минимум, стандартным измерением клиренса эндогенного креатинина (проба Реберга-Тареева) или другими клиренсовыми методами (обычно плазматическими или почечными клиренсами комплексонов или рентгеновских контрастов - табл. 5).
| Метод определения СКФ | Технические особенности | Достоинства | Ограничения | Область применения |
|---|---|---|---|---|
По клиренсу экзогенных веществ (инулина, гломерулотропных радиофармацевтических препаратов и др.) |
В кровь вводится вещество, обладающее следующими свойствами: полностью выводится путем клубочковой фильтрации, при этом не реабсорбируется, не секретируется и не разрушается в почечных канальцах и мочевых путях. Через определенный промежуток времени исследуется концентрация данного вещества в крови пациента и в объеме мочи, собранной за это время (или определяется только концентрация вещества в плазме крови через определенные промежутки времени), на основании чего рассчитывается клиренс. Проводится стандартизация на поверхность тела |
Высокая точность |
Дорогостоящие, технически сложные и инвазивные исследования, требующие введения в организм чужеродного вещества |
Необходимость особо точного измерения СКФ (например, прогнозирование начала диализа, у потенциальных доноров, при подборе доз химиопрепаратов, научные исследования) |
По клиренсу креатинина (проба Реберга-Тареева) |
Определяется концентрация креатинина в сыворотке крови пациента и пробе мочи, собранной накануне за сутки. На основании концентраций креатинина, объема мочи и времени исследования (24 ч = 1440 мин) рассчитывается клиренс креатинина. Проводится стандартизация на поверхность тела |
Приемлемая точность. Может применяться у людей с нестандартными мышечной массой и скоростью поступления креатинина в кровь |
Требуется сбор суточной мочи. Возможны погрешности вследствие неправильного сбора и измерения ее объема. У пациентов с Зб-5-й стадиями ХБП может завышать значение СКФ |
Обследование стационарных больных. Уточнение результатов, полученных при помощи формул, для решения принципиальных лечебно-диагностических и экспертных вопросов. Использование в случаях, когда формулы неприменимы |
Расчет по формулам |
Определяется концентрация креатинина в сыворотке крови. На основании ее значения с учетом пола и возраста пациента по специальным формулам (MDRD или CKD-EPI) рассчитывается уровень СКФ. При использовании формулы Кокрофта-Голта необходима дополнительная стандартизация на поверхность тела, более современные формулы этого не требуют |
Не требуют сбора суточной мочи и исключают возможные связанные с ним ошибки. Учитывают усиливающуюся канальцевую секрецию креатина у пациентов с Зб-5-й стадиями ХБП, предотвращая завышение значения СКФ. Формулы учитывают антропометрические, тендерные и возрастные особенности, влияющие на кинетику креатинина |
В ряде ситуаций недостаточно точны и не рекомендуются к применению у людей с нестандартными размерами тела и мышечной массой - см. комментарий к рекомендациям 2.3 и 2.3.1 |
Скрининг ХБП, амбулаторные обследования пациентов с ХБП и условно здорового населения. Динамический контроль амбулаторных и стационарных пациентов |
Рекомендация 2.4. У каждого больного с ХБП следует выполнять исследование уровня АУ/ПУ, поскольку этот показатель имеет важное значение для диагностики ХБП, оценки прогноза ее течения, риска сердечно-сосудистых осложнений, а также выбора тактики лечения.
Рекомендация 2.4.1. Для оценки АУ/ПУ следует определять ее уровень в суточной моче или отношение альбумин/креатинин, или общий белок/креатинин в разовой, предпочтительно утренней порции мочи.
Рекомендация 2.4.2. Исследование экскреции альбумина с мочой следует проводить с целью диагностики и мониторинга ХБП при отсутствии ПУ в разовых порциях мочи или уровне ПУ <0,5 г/сут (или ее эквивалента по определению отношения общий белок мочи/креатинин мочи).
Комментарий. Имеющиеся в настоящее время данные позволяют утверждать, что скрининг и диагностика ХБП, основанные только на расчете СКФ, не являются клинически и экономически эффективной стратегией предупреждения ТПН и сердечно-сосудистых заболеваний. Одновременная оценка двух основных показателей - СКФ и АУ/ПУ - занимает центральное место в первичной диагностике ХБП еще и потому, что эти показатели используются для определения прогноза, контроля течения и/или темпов прогрессирования на фоне терапии.
Следует иметь в виду, что для ранних стадий ХБП (1-2) характерно бессимптомное течение, а явные клинические проявления и изменения почек, по данным визуализирующих методов исследования, как правило, указывают на далеко зашедший процесс. В клинической практике при отсутствии любых других признаков хронического повреждения почек повышенный уровень АУ может быть единственным показателем, отражающим субклиническое течение ХБП. В особенности это касается медленно развивающихся почечных процессов, таких как сосудистые поражения почек в результате артериальной гипертензии (АГ), диабета, ожирения, что принципиально важно для осуществления мер по вторичной профилактике сердечно-сосудистых осложнений и прогрессирования ХБП.
АУ/ПУ в концепции ХБП-K/DOQI рассматривается как маркер ренальной дисфункции. Однако физиологическое и клиническое значение этого показателя более широкое.
Данный признак отражает, по крайней мере, следующие патофизиологические сдвиги:
Учитывая вышесказанное, АУ можно и нужно считать кардинальной интегральной характеристикой ХБП, а не только ее маркером (Смирнов А.В. и соавт., 2010).
Общепринятой считалась следующая градация выраженности экскреции альбумина с мочой: нормоальбуминурия - <30 мг/cут (30 мг/г креатинина мочи), микроальбуминурия - 30-299 мг/сут (30-299 мг/г креатинина мочи), макроальбуминурия/протеинурия - >300 мг/сут (>300 мг/г креатинина мочи). Тем не менее при использовании АУ для диагностики и классификации ХБП существенным и пока дискутируемым моментом остается граница нормального значения этого показателя (Смирнов А.В. и соавт., 2008; Смирнов А.В. и соавт., 2010; Levey A.S. и соавт., 2005; Levey A.S. и соавт., 2010).
Длительное время нормальным уровнем АУ считали его мочевую экскрецию <30 мг/сут. В Рекомендациях Научно-исследовательского института нефрологии Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова в качестве нижней границы нормы был предложен более строгий показатель мочевой экскреции альбумина - 15 мг/сут (или 15 мг альбумина/г креатинина мочи) (Смирнов А.В. и соавт., 2008). Однако накопленные в настоящее время сведения делают более обоснованной верхнюю границу нормы экскреции альбумина почками 10 мг/сут (или 10 мг альбумина/г креатинина мочи), поскольку уровень экскреции альбумина в диапазоне 10-29 мг/сут отчетливо ассоциируется с повышением рисков общей и сердечнососудистой смертности (Brantsma A.H. и соавт., 2005; Forman J.P., Brenner B.M., 2005; Klausen K.P. и соавт., 2005; Schmieder R.E. и соавт., 2007; Levey A.S. и соавт., 2010).
Проблема градации АУ/ПУ стала предметом дискуссии на Лондонской конференции KDIGO 2009 г. Были оставлены прежние градации выраженности АУ (стадии АУ) - <30; 30-299; >300 мг альбумина/г креатинина мочи. Вместо традиционной терминологии «нормоальбуминурия-микроальбуминурия макроальбуминурия/протеинурия» для описания выраженности мочевой экскреции альбумина предложено использовать определения «оптимальный» (<10 мг/г), «высоконормальный» (10-29 мг/г), «высокий» (30-299 мг/г), «очень высокий» (300-1999 мг/г) и «нефротический» (>2000 мг/г). Использование терминов «нормоальбуминурия», «микроальбуминурия», «макроальбуминурия» в настоящее время нежелательно (Levey A.S. и соавт., 2010).
Рекомендация 2.5. В практической работе ХБП следует разделять на стадии в зависимости от значений СКФ.
Комментарий. Суммарный анализ многочисленных публикаций, частично цитированных выше, показал, что почечный и кардиоваскулярный прогноз существенно зависит от величины СКФ. Поэтому уже в первом варианте классификации ХБП было предложено разделять ее на 5 стадий (National Kidney Foundation KD: 2002).
Этот основной принцип стратификации тяжести ХБП сохраняется до настоящего времени. В то же время накопление новых данных заставило несколько его модифицировать. Прежде всего это касается 3-й стадии ХБП.
Такое разделение целесообразно, поскольку почечный и сердечнососудистый прогнозы неодинаковы в группах лиц с ХБП 3-й стадии с СКФ от 59 до 45 мл/мин/1,73 м2 и от 44 до 30 мл/мин/1,73 м2. Если в подгруппе лиц с СКФ от 59 до 45 мл/мин/1,73 м2 весьма высоки сердечно-сосудистые риски при умеренных темпах прогрессирования ХБП, то у пациентов с градацией СКФ в пределах от 44 до 30 мл/мин/1,73 м2 риск развития ТПН оказывается выше, чем риск летальных сердечнососудистых осложнений (Go A.S. и соавт., 2004; Levey A.S. и соавт., 2005; Glynn L.G. и соавт., 2007; Levey A.S. и соавт., 2010).
Целесообразность градации 3-й стадии ХБП на две подстадии (3а и 3б) была обоснована в Рекомендациях Научно-исследовательского института нефрологии Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова: определение, классификация, диагностика и основные направления профилактики хронической болезни почек у взрослых, опубликованных в 2008 г. (Смирнов А.В. и соавт., 2008).
Позже необходимость такого подхода была поддержана другими отечественными специалистами (Шилов Е.М. и соавт., 2011). Кроме того, на представительной конференции в октябре 2009 г. в Лондоне эксперты KDIGO также пришли к консенсусу по этому вопросу. Поэтому в настоящее время следует рекомендовать следующую стратификацию тяжести ХБП по уровню СКФ (табл. 6).
Стадии по СКФ, описание и границы (мл/мин/1,73 м2) |
Обозначение |
Характеристика |
Уровень СКФ |
|---|---|---|---|
С1 |
Высокая или оптимальная |
>90 |
|
С2 |
Незначительно сниженная |
60-89 |
|
С3а |
Умеренно сниженная |
45-59 |
|
С3б |
Существенно сниженная |
30-44 |
|
С4 |
Резко сниженная |
15-29 |
|
С5 |
ТПН |
<15 |
Рекомендация 2.6. Каждую стадию ХБП следует индексировать в зависимости от выраженности АУ/ПУ; для случаев ЗПТ следует указывать ее вид - диализ (Д) и трансплантация (Т).
Комментарий. Имеющиеся к настоящему времени данные, включая метаанализ более 1,5 млн наблюдений (Levey A.S. и соавт., 2010, 2011), определенно указывают на то, что риски общей и сердечно-сосудистой смертности, развития ТПН, острого повреждения почек и прогрессирования ХБП существенно отличаются в зависимости от уровня мочевой экскреции альбумина в любом диапазоне СКФ. В табл. 7 представлена модификация стратификации мочевой экскреции альбумина, предложенная KDIGO (Levey A.S. и соавт., 2010).
| Индексация, описание и границы (альбумин, мг/креатинин, г) | ||||
|---|---|---|---|---|
А0 |
A1 |
A2 |
A3 |
А4 |
Оптимальная |
Повышенная |
Высокая |
Очень высокая |
Нефротическая |
<10 |
10-29 |
30-299 |
300-1999* |
≥2000** |
* Соответствует суточной ПУ ≥0,5 г.
** Соответствует суточной ПУ ≥3,5 г.
У больных с А3-А4, что соответствует ПУ ≥0,5 г/сут, для оценки тяжести поражения почек вместо исследования АУ, с точки зрения экономии бюджета, можно использовать определение общего белка в суточной моче (суточная ПУ) или отношения общий белок/креатинин в утренней порции мочи.
Очевидно, что у больных, получающих лечение постоянным гемодиализом (ГД) или перитонеальным диализом (ПД), необходимости в индексации АУ/ПУ нет.
Рекомендация 2.7. В каждом случае ХБП следует стремиться к идентификации конкретной этиологической причины (или причин) развития повреждения почек (нозологии). В исключительных случаях диагноз ХБП может быть установлен без детализации (диагностики) ее причины, до проведения окончательной диагностики или когда диагноз почечного заболевания не удается установить, несмотря на тщательно проведенное обследование.
Рекомендация 2.7.1. В медицинской документации на первом месте следует указывать нозологический диагноз и основные проявления заболевания; термин ХБП с указанием стадии по СКФ, индекса АУ/ПУ и вид ЗПТ следует отмечать после описания нозологической формы.
Комментарий. Следует подчеркнуть, что понятие ХБП в первую очередь, направлено на необходимость выявления факта персистирующего повреждения почек и оценки их глобальной функции. В то же время оно ни в коей мере не отменяет этиологического подхода к диагностике и терапии конкретного заболевания почек. Необходимость установления нозологического диагноза и включение первичной патологии почек в концепцию ХБП вновь были подчеркнуты в последних предложениях KDIGO (Levey A.S. и соавт., 2010), что также соответствует традициям отечественной медицины.
Термин «ХБП» должен указываться в диагнозе после описания нозологической формы и проявлений основного почечного заболевания. Примеры формулировки диагноза.
-
Гипертоническая болезнь III ст. Риск 4. Гипертонический нефросклероз. ХБП С3а А1.
-
Мембранопролиферативный гломерулонефрит (МБПГН). НС. ХБП 5д (постоянный ГД с 12.05.2010).
-
IgA-нефропатия. Остронефритический синдром. Постоянный ГД с 15.03.2008 по 17.04.2010. Аллотрансплантация почки от родственного донора от 18.04.2010. ХБП С1А3т.
При временной неопределенности конкретных причин повреждения почек, а также при невозможности уточнения этиологического диагноза, употребляется только термин «ХБП» с указанием стадии, что позволяет оценить текущий прогноз заболевания и объем лечебных мероприятий (Levey A.S. и соавт., 2005).
Следует отметить, что соответствующие изменения были внесены в Международную классификацию болезней 10-го пересмотра (МКБ-10) [http://www.who.int/classifications/icd/ICD-10%20Updates%202007.pdf], в которой устаревший термин «хроническая почечная недостаточность» был заменен на термин «хроническая болезнь почек» (код N18). Коды N18.1-N18.5 следует использовать для обозначения стадий ХБП (табл. 8).
| Стадии ХБП | Код МКБ-10** |
|---|---|
С1 |
N18.1 |
С2 |
N18.2 |
С3а |
N18.3 |
С3б |
|
С4 |
N18.4 |
С5 |
N18.5 |
* Для обозначения этиологии ХБП следует использовать соответствующие коды заболеваний.
** Кодом N18.9 обозначаются случаи ХБП с неуточненной стадией.
Это устраняет препятствия для широкого внедрения диагноза ХБП в отечественную практику медицинского статистического учета, использующую для кодировки заболеваний систему МКБ-10.
Раздел 3. Скрининг и мониторинг хронической болезни почек
Рекомендация 3.1. Под скринингом ХБП следует понимать раннюю диагностику как самой ХБП, так и факторов риска (ФР) ее развития.
Комментарий. Существенное влияние на развитие и прогрессирование хронических заболеваний почек в той или иной популяции может оказать целый ряд факторов. К ним относятся распространенность некоторых инфекций, прием ряда лекарственных препаратов, алкоголь и курение, состояние окружающей среды, климат, характер и традиции питания, генетические особенности популяции и др. (Смирнов А.В. и соавт., 2002, 2004; Мухин Н.А. и соавт., 2004; Hsu C.-Y. и соавт., 2003; McClellan W.M. и соавт., 2003).
Очень важно, что многие факторы, ассоциирующиеся с развитием дисфункции почек, одновременно являются и традиционными сердечно-сосудистыми факторами риска, среди которых артериальная гипертония, СД, возраст, мужской пол, дислипидемия, ожирение, метаболический синдром, табакокурение.
В то же время результаты многочисленных исследований указывают на то, что кардиоваскулярные риски, которые в кардиологии принято относить к нетрадиционным [анемия, хроническое воспаление, гипергомоцистеинемия, увеличение синтеза асимметричного диметиларгинина, оксидативный стресс, активация ренин-ангиотензин-альдостероновой системы (РААС), стресс, гиперурикемия, натрийуретические факторы разного происхождения и др.], ассоциируются и, скорее всего, обусловлены прогрессирующей дисфункцией почек (Есаян А.М., 2002; Мухин Н.А. и соавт., 2004: Смирнов А.В. и соавт., 2005; Saito A. и соавт. 2010).
В концептуальной модели ХБП Национальным почечным фондом США и KGIGO была предпринята попытка классифицировать ФР (Levey A.S. и соавт., 2005). Выделяли группы ФР:
Однако провести четкую грань между рядом факторов ХБП (например, инициации и прогрессирования) не представляется возможным, в этой связи предложена градация ФР, основанная на данных эпидемиологических исследований. Выделяют ФР развития ХБП и факторы ее прогрессирования (которые во многом повторяют ФР развития, но также включают ряд клинических характеристик ХБП), причем каждую группу разделяют на модифицируемые и немодифицируемые (табл. 9-10).
| Немодифицируемые | Модифицируемые |
|---|---|
Пожилой возраст. Мужской пол. Исходно низкое число нефронов (низкая масса тела при рождении). Расовые и этнические особенности Наследственные факторы (в том числе семейный анамнез по ХБП) |
Диабет. АГ. Аутоиммунные болезни. Хроническое воспаление/системные инфекции. Инфекции и конкременты мочевых путей. Обструкция нижних мочевых путей. Лекарственная токсичность. Высокое потребление белка Дислипопротеидемия. Табакокурение. Ожирение/метаболический синдром. Гипергомоцистеинемия. Беременность |
| Немодифицируемые | Модифицируемые |
|---|---|
Пожилой возраст. Мужской пол. Исходно низкое число нефронов (низкая масса тела при рождении). Расовые и этнические особенности |
Персистирующая активность основного патологического процесса. Высокие уровни:
Плохой метаболический контроль СД. Ожирение/метаболический синдром. Дислипопротеидемия. Табакокурение. Анемия. Метаболический ацидоз. Беременность. Нарушения кальций-фосфорного обмена (гиперпаратиреоз). Высокобелковая диета и повышенное потребление натрия с пищей |
Рекомендация 3.2. Всем лицам с наличием хотя бы одного из ФР ХБП следует проводить регулярные обследования с определением рСКФ и уровня АУ/ПУ не реже 1 раза в год.
Комментарий. Проблема скрининга ХБП, учитывая ее высокую распространенность и трудности ранней диагностики, очень серьезна.
Решение данной задачи возможно только при тесном сотрудничестве нефрологов и врачей общей практики, кардиологов, эндокринологов-диабетологов, урологов, других специалистов. Объем и частота исследований, подходы к скринингу ХБП у представителей тех или иных групп риска должны включаться в соответствующие национальные рекомендации, как это сделано в отношении скрининга диабетической нефропатии (Дедов И.И., Шестакова М.В., 2006).
Рекомендация 3.3. Больным с впервые выявленными снижением СКФ <60 мл/мин/1,73 м2, АУ/ПУ А3-А4, неконтролируемой АГ показана первичная консультация нефролога.
Пациенты с выявленной ХБП должны подвергаться регулярному медицинскому наблюдению с участием нефролога; частота наблюдения определяется тяжестью ХБП (стадией и индексом); больные с С4-С5 стадиями ХБП должны находиться под наблюдением в диализном центре по месту жительства для подготовки к заместительной терапии и ее планового начала.
Комментарий. Несмотря на то что большую часть случаев ХБП в популяции представляют вторичные нефропатии (при СД, АГ, атеросклерозе, системных заболеваниях соединительной ткани и др.), данные пациенты нуждаются в совместном ведении соответствующим специалистом (эндокринологом, кардиологом, ревматологом и т.д.) и нефрологом. К ведению пациентов с урологическими заболеваниями также должен привлекаться нефролог, если имеются даже начальные признаки ухудшения функции почек.
Основные показания к амбулаторной консультации нефролога.
Впервые выявленные и подтвержденные при повторном исследовании.
-
АГ впервые выявленная в возрасте моложе 40 лет или старше 60 лет. Резистентная к лечению АГ.
-
Нарушение концентрационной функции почек, канальцевые нарушения (никтурия, полиурия, стойкая депрессия удельного веса мочи, глюкозурия при нормальном уровне сахара в крови).
-
Признаки синдрома Фанкони, других тубулопатий, резистентного рахита у ребенка, особенно в сочетании с нарушением физического развития.
Основные показания к специализированному нефрологическому стационарному обследованию.
Основные задачи нефрологического обследования.
-
Оценить общий и почечный прогноз, скорость дальнейшего прогрессирования ХБП и риск сердечно-сосудистых осложнений (ССО).
-
Выявить больных с ближайшей угрозой ТПН для постановки на учет в диализном центре.
-
Разработать тактику этиотропной, патогенетической и нефропротективной терапии.
-
Предоставить больному рекомендации по диете и образу жизни с целью снижения риска прогрессирования ХБП и сердечно-сосудистого риска.
-
Определить тактику и частоту дальнейших обследований нефрологом (табл. 11).
Стадия ХБП |
Индекс АУ |
||||
|---|---|---|---|---|---|
А0 |
А1 |
А2 |
А3 |
А4 |
|
1-2 |
Ежегодно |
Ежегодно |
Ежегодно |
Каждые 6 мес |
Каждые 3 мес |
3а-3б |
Каждые 6 мес |
Каждые 6 мес |
Каждые 6 мес |
Каждые 3 мес |
Каждые 3 мес |
4** |
Каждые 3 мес |
Каждые 3 мес |
Каждые 3 мес |
Каждые 6 нед |
Каждые 6 нед |
5** |
Каждые 6 нед |
Каждые 6 нед |
Каждые 6 нед |
Каждые 6 нед |
Каждые 6 нед |
* При необходимости чаще.
** Обязательна постановка на учет в диализном центре.
Рекомендация 3.4. Каждый визит к нефрологу или другому специалисту, наблюдающему пациента с ХБП, должен сопровождаться регистрацией текущей стадии ХБП и индекса АУ в медицинской документации.
Комментарий. Такой подход позволяет по мере накопления данных о течении ХБП более точно оценивать темпы ее прогрессирования и планировать соответствующую коррекцию характера и объема лечебно-диагностических мероприятий, а также прогнозировать потребность в ЗПТ.
Раздел 4. Профилактика и основные подходы к лечению
Рекомендация 4.1. Основой первичной профилактики ХБП является устранение или минимизация факторов риска ее развития в соответствии с принципами доказательной медицины.
Комментарий. Подходы к первичной профилактике ХБП не отделимы от мероприятий по ее скринингу и выявлению факторов риска (см. табл. 9). Основой первичной профилактики ХБП являются диспансерное наблюдение представителей групп риска, разработка индивидуальных медицинских рекомендаций по контролю модифицируемых факторов риска, контроль их выполнения.
Рекомендация 4.2. Наличие ХБП следует считать важным независимым фактором риска развития и прогрессирования сердечно-сосудистых заболеваний. Пациенты с отсутствием традиционных факторов сердечно-сосудистого риска, но страдающие ХБП стадий С1-С2 и АУ А1 относятся к группе среднего риска; пациенты с ХБП стадий С1-С2 и АУ А2-А3 или ХБП стадии С3а независимо от уровня АУ/ПУ относятся к группе высокого риска; пациенты с ХБП стадий С3б-С5 независимо от уровня АУ/ПУ и традиционных факторов риска принадлежат к группе очень высокого риска.
Комментарий. Выраженность нарушения функции почек тесно связана с развитием сердечно-сосудистых заболеваний. При этом даже умеренное снижение СКФ (Henry R.M. и соавт., 2002; Majunath G. и соавт., 2003; Segura J. и соавт., 2004; Mann J.F.E., 2005; Vanholder R. и соавт., 2005; Nitsch D. и соавт., 2006; Levey A.S. и соавт., 2010) или появление сравнительно небольшой ПУ/АУ связано с нарастанием риска развития кардиоваскулярных заболеваний и сопровождается повышением уровня общей смертности (Brantsma A.H. и соавт., 2005; Forman J.P., Brenner B.M., 2005; Klausen K.P. и соавт., 2005; Schmieder R.E. и соавт., 2007). Все это дает основания рассматривать пациентов с ХБП как самостоятельную важную группу сердечно-сосудистого риска и требует тщательной стратификации таких больных. При этом при оценке степени сердечно-сосудистых рисков следует пользоваться общепринятыми градациями (Рекомендации НИИ нефрологии, 2008).
Рекомендация 4.3. Вторичная профилактика ХБП должна быть одновременно направлена на замедление темпов прогрессирования ХБП (ренопротекция) и предупреждение развития сердечно-сосудистой патологии (кардиопротекция).
Комментарий. Рено- и кардиопротекция представляет собой двуединую задачу, требующую комплексного подхода, поскольку прогрессирующее снижение функции почек и развитие ССО тесно взаимосвязаны, и каждый из этих факторов имеет решающее значение для общего прогноза.
ССО являются основной причиной гибели пациентов с ХБП, в то же время почечная дисфункция и АУ - важнейшие факторы сердечно-сосудистого риска.
Общность причин (АГ, нарушения углеводного, жирового, пуринового, фосфорно-кальциевого обмена и др.) и механизмов прогрессирования (например, гиперактивация РААС, экспрессия медиаторов воспаления и факторов фиброгенеза) поражения почек и сердечно-сосудистой системы дает основание особо выделять методы профилактики, нелекарственного и лекарственного лечения с двойным положительным эффектом: рено- и кардиопротективным, что имеет большое значение для пациентов с ХБП. К ним относятся низкосолевая диета, борьба с ожирением и курением, коррекция нарушений углеводного обмена, лечение препаратами, подавляющими РААС [ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы ангиотензиновых рецепторов, ингибиторы ренина], статинами, некоторыми антагонистами кальция и препаратами, улучшающими микроциркуляцию. Эффективность новых методов лечения пациентов с ХБП следует оценивать в первую очередь по их влиянию на комбинированный исход, включающий развитие ТПН и ССО.
Общие принципы снижения сердечно-сосудистого риска, закрепленные в соответствующих национальных рекомендациях, сохраняют силу и для пациентов с ХБП, поскольку снижение функции почек способствует усугублению или появлению de novo целого ряда традиционных факторов сердечно-сосудистого риска (АГ, гиперлипидемия, инсулинорезистентность, гиперурикемия, воспаление) и значительно потенцирует их негативное влияние на прогноз. В то же время, проводя кардиопротективные мероприятия, необходимо учитывать особенности пациентов с ХБП на 3-5-й стадиях: опасность диеты, богатой калием, повышенный риск осложнений ИАПФ и других препаратов, подавляющих РААС, низкую эффективность и риск нежелательных явлений тиазидных мочегонных и др.
Однако решающее значение имеет торможение прогрессирования дисфункции почек - не только с точки зрения отдаления неблагоприятного исхода в виде ТПН, но и как важнейшая мера кардиопротекции, специфическая для пациентов с ХБП, поскольку риск ССО резко повышается на каждой стадии ХБП и задолго до ТПН. При выборе доз и тактики применения препаратов с двойным рено- и кардиопротективным действием задачи ренопротекции (максимальное снижение АУ/ПУ и стабилизация функции) являются первостепенными.
Рекомендация 4.4. Объем и направленность лечебно-диагностических мероприятий у больных с ХБП определяются выраженностью снижения функции почек (стадией ХБП).
Комментарий. Общие подходы к первичной и вторичной профилактике ХБП, основные лечебно-диагностические мероприятия представлены в табл. 12.
| Стадия | Рекомендуемые мероприятия |
|---|---|
Наличие факторов риска развития ХБП |
Регулярный скрининг ХБП, мероприятия по снижению риска ее развития |
С1 |
Диагностика и этиотропное лечение основного заболевания почек. Коррекция общих патогенетических факторов риска ХБП с целью замедления темпов ее прогрессирования. Диагностика состояния сердечно-сосудистой системы и коррекция терапии. Контроль факторов риска развития и прогрессирования ССО |
С2 |
Мероприятия по стадии 1 + Оценка скорости прогрессирования и коррекция терапии |
С3а-3б |
Мероприятия по стадии 2 + Выявление, профилактика и лечение системных осложнений дисфункции почек (анемия, дизэлектролитемия, ацидоз, гиперпаратиреоз, гипергомоцистеинемия, БЭН и др.) |
С4 |
Мероприятия по стадии 3 + Подготовка к ЗПТ |
С5 |
ЗПТ + Выявление, профилактика и лечение системных осложнений почечной недостаточности (ПН) (анемии, нарушений водно-электролитного, кальций-фосфатного баланса, ацидоза, гипергомоцистеинемии, БЭН) |
Рекомендация 4.5. Пациентам с ХБП или наличием ее факторов риска при необходимости следует давать рекомендации по терапевтическому изменению стиля жизни.
Комментарий. Важным направлением профилактики и лечения ХБП является коррекция образа жизни и характера питания с целью наиболее полного воздействия на модифицируемые (изменяемые) факторы риска развития и прогрессирования ХБП. Результаты ряда исследований свидетельствуют о том, что значения ИМТ >25 кг/м2 у молодых людей даже при отсутствии у них специфической почечной патологии, АГ и СД ассоциируются с нарастанием риска развития ТПН (Hsu C.Y. и соавт., 2006). Показано, что гемодинамические изменения в почках (нарастание СКФ и фильтрационной фракции) отмечаются у молодых здоровых людей с ИМТ ≥25 кг/м2 при высоком потреблении соли (Krikken J.A. и соавт., 2007). Поэтому пациентам с ХБП и(или) лицам с факторами риска ХБП, имеющим избыточную массу тела, должны быть даны рекомендации по коррекции массы тела (поддержание ИМТ в пределах 20-25 кг/м2 за счет коррекции калорийности рациона и достаточной физической активности - при отсутствии противопоказаний 30 мин аэробных нагрузок, например, быстрая ходьба, не менее 4-5 дней в неделю) и ограничению поваренной соли в пище. Не менее значимым в профилактике ХБП является ограничение потребления алкоголя.
Эпидемиологические исследования свидетельствуют, что курение является дозозависимым фактором риска снижения СКФ и появления микроальбуминурии (Pinto Siersma S.J. и соавт., 2000). При этом негативное влияние курения на состояние почек имеет место как у мужчин, так и женщин (Haroun N.K. и соавт., 2003). Наиболее ярко этот эффект проявляется у курящих гипертоников (Warmoth L. и соавт., 2005). Результаты исследования, выполненного в России, также показали, что у пациентов с коронарной болезнью сердца без явных признаков первичной почечной патологии величины рСКФ оказываются достоверно ниже, чем у никогда не куривших больных (Смирнов А.В. и соавт., 2006).
Хорошо известно, что высокий уровень поступления хлорида натрия с пищей четко ассоциирован с развитием и прогрессированием АГ, которая, в свою очередь, служит важной детерминантой повреждения почек и сердца. На фоне высокого потребления соли усиливаются эффекты ангиотензина II и альдостерона. Однако повреждающее действие высокосолевой диеты на органы-мишени не исчерпывается влиянием хлорида натрия на системную и внутрипочечную гемодинамику, оно может реализовываться механизмами, не связанными напрямую с ростом АД (Burnier M. и соавт., 2007; Krikken J.A. и соавт., 2007).
В частности было показано, что при значительном содержании в рационе хлорида натрия в эндотелии почек и аорты возрастает экспрессия важного профиброгенного цитокина - трансформирующего фактора роста-β (Ritz E., 2006; Ritz E. и соавт., 2006).
Имеющиеся в настоящее время данные дают основания рекомендовать пациентам с ХБП и лицам, относящимся к группе риска по ХБП, суточное потребление натрия <2,4 г (что соответствует <6,0 г поваренной соли).
В настоящее время одним из важных факторов инициации и прогрессирования ХБП становится лекарственная нефротоксичность (Lopez-Novoa J.M. и соавт., 2011). К потенциально опасным для почек препаратам относятся многочисленные обезболивающие и противовоспалительные средства, широко применяемые в неврологии, ревматологии, хирургии, рентгеноконтрастные вещества, ряд антибиотиков, мочегонные. Многие из этих препаратов свободно доступны в аптеках, рекламируются в средствах массовой информации, поэтому принимаются бесконтрольно. У больных с нарушенной функцией почек резко повышается риск нежелательных явлений лечения и непредсказуемых лекарственных взаимодействий. Особенно значимы в данном плане последствия непрерывного нарастания числа рентгеноконтрастных процедур. Имеющиеся данные однозначно свидетельствуют о том, что даже кратковременное транзиторное ухудшение функции почек после введения рентгеновского контраста ассоциируется с ухудшением почечного и сердечно-сосудистых прогнозов и нарастанием уровня общей смертности (Волгина Г.В., 2006; Каюков И.Г. и соавт., 2007) Неблагоприятно на состоянии почек сказываются некоторые пищевые добавки (тайские травы, «сжигатели жиров», питательные смеси для наращивания мышечной массы). У больных пожилого возраста с выраженным атеросклерозом резкое снижение функции почек могут вызвать лекарства из групп ИАПФ, широко назначаемые по поводу АГ, сердечной недостаточности. Особенно высок риск данного осложнения у людей, резко ограничивающих потребление воды или бесконтрольно принимающих мочегонные препараты.
В этой связи важное значение в профилактике развития и прогрессирования ХБП приобретает комплекс мер по предупреждению лекарственной нефротоксичности - широкое информирование пациентов о вреде самолечения, отказ от бесконтрольного приема анальгетиков, антибиотиков, пищевых добавок и др., тщательный выбор врачом лекарственных препаратов, назначаемых пациентам с ХБП и в группах ее риска, мониторинг показателей функции почек при необходимости проведения у данной категории лиц рентгеноконтрастных исследований и т.д. О важности составляющих здорового образа жизни, имеющих прямое отношение к здоровью почек, необходимо информировать не только пациентов, но и все население, используя различные средства и ресурсы (центры здоровья, лекции и семинары для населения, популярные печатные издания, радио, телевидение, интернет).
Рекомендация 4.6. Целевыми уровнями АД у пациентов с ХБП и АГ следует считать: у больных с оптимальной степенью АУ (<10 мг/г) - систолическое артериальное давление (САД) <140 и диастолическое <90 мм рт.ст.; при более высокой степени АУ или наличии ПУ - САД <130 и диастолическое <80 мм рт.ст.: антигипертензивная терапия должна быть индивидуализирована, а снижения САД <120 мм рт.ст. следует избегать.
Рекомендация 4.7. У пациентов с ХБП и АГ, нуждающихся в фармакологической коррекции, для достижения целевых уровней АД, в качестве препаратов первой линии или основного компонента комбинированного лечения следует назначать ИАПФ или блокаторы АТ1-рецепторов ангиотензина II (БРА), если их применение не противопоказано.
Рекомендация 4.8. Пациентам с ХБП c индексами АУ/ПУ А2-А3 и отсутствием АГ также следует назначать ИАПФ или БРА с целью достижения антипротеинурического эффекта.
Комментарий. Повышения АД и ХБП тесно взаимосвязаны по принципу порочного круга. АГ, как эссенциальная, так и вторичная почечная, обладает доказанным в ходе проспективных исследований неблагоприятным влиянием не только на риск ССО, но и на скорость прогрессирования ХБП. В то же время эффективная антигипертензивная терапия достоверно отдаляет время наступления ТПН, является важным средством кардиопротекции (Maki D.D. и соавт., 1995; He J., Whelton P.K., 1999; Jafar T.H. и соавт., 2003; Casas J.P. и соавт., 2005; Ritz E., 2010; Segura J., Ruilope L.M., 2011).
Необходимость снижения АД до общепопуляционной нормы (ниже 140/90 мм рт.ст.) при ХБП не вызывает сомнения. В середине 1990-х гг. появились данные, свидетельствующие о пользе, с точки зрения почечного прогноза, снижения АД при ХБП до уровня значительно ниже общепопуляционной нормы - <125/75 мм рт.ст., особенно у пациентов с выраженной и массивной ПУ (>1 г/сут) (Peterson J.C. и соавт., 1995). Однако доказательная база для рекомендации жесткого контроля АД у больных с выраженной ПУ до настоящего времени остается недостаточной. В крупных исследованиях, включающих больных с СД и АУ >30-300 мг/сут, с высокой степенью доказательности была установлена польза более мягкого контроля АД - до уровня ниже 130/80 мм рт.ст., но также ниже общепопуляционной нормы. В то же время приоптимальной степени АУ преимуществ более строгого контроля АД, чем <140/90 мм рт.ст., не установлено. Таким образом, на сегодняшний день при оптимальной АУ АД рекомендуется контролировать на уровне ниже 140/90 мм рт.ст., при более выраженной АУ и ПУ - на уровне ниже 130/80 мм рт.ст. (табл. 13). При ПУ >1 г/сут возможна попытка еще более выраженного снижения АД, однако решение об этом должно приниматься после тщательного анализа клинических особенностей пациента и с большой осторожностью.
На сегодняшний день имеются веские аргументы (Jafar T.H. и соавт., 2003), свидетельствующие о неблагоприятном влиянии низкого уровня АД (САД <110 мм рт.ст.) на скорость прогрессирования ХБП.
Авторы связывают полученные результаты с острым и хроническим ишемическим повреждением почек в условиях гипотонии. Для риска ССО при ХБП тоже была показана J-образная зависимость от уровня АД - он повышался как при САД выше 130, так и ниже 120 мм рт.ст. (Weiner D.E. и соавт., 2007).
Строгий контроль АД может быть опасен у пожилых пациентов, при распространенном атеросклерозе. Контроль АД в пределах узкого коридора (САД 120-129 мм рт.ст.) представляет значительные трудности. Для исключения эпизодов гипотонии рекомендуется обязательный мониторинг уровня АД методом самоизмерений (с обучением пациента и периодическим врачебным контролем) и, по возможности, использование суточного автоматического мониторирования АД. У больных пожилого и старческого возраста со склонностью к развитию эпизодов гипотонии, приводящих к ухудшению самочувствия и появлению жалоб, характерных для нарушения коронарного и церебрального кровотока, коррекцию артериальной гипертонии следует проводить с повышенной осторожностью.
У этих больных приемлемым уровнем САД следует считать 140-160 мм рт.ст.
Для контроля АД у детей следует использовать номограммы, отражающие перцентильные параметры с учетом пола и возраста больных, корригируя целевой уровень АД по мере роста ребенка; целевым уровнем снижения АД следует считать 75-й перцентиль для данного пола и возраста.
У больных пожилого и старческого возраста при выраженном атеросклерозе, склонности к развитию эпизодов гипотонии коррекцию артериальной гипертонии следует проводить с повышенной осторожностью с максимальной индивидуализацией лечения.
Доказательная база для определения целевого АД у диализных больных и пациентов с трансплантированной почкой еще более ограничена. На сегодняшний день для этих категорий лиц с ХБП оптимальными считаются также цифры АД ниже 130/80 мм рт.ст. Однако следует принимать во внимание, что опасность эпизодов гипотонии на фоне антигипертензивной терапии у больных с ТПН значительно выше, чем на других стадиях ХБП, особенно у получающих лечение ГД.
| АУ, мг/сут | Целевое АД, мм рт.ст. | Препараты выбора |
|---|---|---|
Менее 30 |
120-139/<90 |
Нет |
30-300 |
120-129/<80 |
ИАПФ или БРА |
Более 300 |
120-129/<80 |
ИАПФ или БРА* |
* При ПУ >1 г/сут, не снижающейся при монотерапии ИАПФ или БРА, оправданно комбинированное лечение несколькими препаратами, подавляющими РААС, под строгим контролем СКФ и уровня калия крови.
Для достижения целевого АД при ХБП большое значение имеют нелекарственные методы лечения, включающие ограничение потребления соли, поддержание ИМТ в пределах 20-25 кг/м2, достаточную физическую активность, отказ от курения, ограничение потребления алкоголя (рекомендация 4.5).
Среди препаратов, снижающих АД, при АУ >30 мг/сут и ПУ средствами первого выбора являются ИАПФ или БРА. Преимущества данных препаратов в первую очередь определяются их способностью уменьшать АУ/ПУ. По данным проспективных контролируемых исследований (REIN, RENAAL, IDNT и др.), у больных с диабетической и недиабетическими нефропатиями они достоверно снижают риск развития ТПН. У больных с АУ >30 мг/сут и ПУ они могут применяться с антипротеинурической целью даже при нормальном уровне АД. Антипротеинурические и ренопротективные свойства ИАПФ и БРА проявляются на разных стадиях ХБП, однако по мере снижения функции повышается риск их побочных действий - гиперкалиемии и снижения СКФ. Резкое падение СКФ при назначении данных средств нередко развивается у пожилых пациентов на фоне гиповолемии и может быть первым признаком скрытого гемодинамически значимого билатерального стеноза почечной артерии, который является противопоказанием для их дальнейшего применения. Для выявления возможного стеноза почечной артерии у больных с падением СКФ от исходного уровня более чем на 30% после назначения ИАПФ или других средств используют методы лучевой диагностики: ультразвуковую допплерографию, магнитно-резонансную томографию (МРТ) и др.
При А0 и А1 степени АУ препараты, подавляющие РААС, не обладают преимуществами по сравнению с другими группами средств, снижающих АД.
Большинству пациентов с ХБП требуется комбинация нескольких препаратов, снижающих АД, из разных групп для достижения его целевого уровня. ИАПФ и БРА хорошо сочетаются с мочегонными и антагонистами кальция. Следует учитывать, что на 3б стадии ХБП резко снижается эффективность тиазидных мочегонных и растет риск их нежелательных явлений (гиперурикемия, уратный криз). На этой и более поздних стадиях ХБП предпочтительнее петлевые диуретики. Некоторые антагонисты кальция (недигидропиридинового ряда) оказывают дополнительный антипротеинурический эффект, в то время как нифедипин может усиливать ПУ.
В педиатрической практике целевых уровней АД в 80% случаев удается достигнуть при использовании сочетания ИАПФ с антагонистами кальция.
Комбинация препаратов, подавляющих ренин-ангиотензиновую систему (РАС) на разных уровнях (ингибитор ренина + БРА, ингибитор ренина + ИАПФ, ИАПФ + БРА) с целью достижения более полного антипротеинурического эффекта, представляется оправданной с патогенетической точки зрения. Однако данные клинических исследований противоречивы. Результаты недавно проведенного исследования ONTARGET показали, что широкое применение комбинации ИАПФ и БРА при ХБП не оправданно - при отсутствии выраженной ПУ она может оказывать негативное влияние на функцию почек (Mann J.F. и соавт., 2008). Поэтому комбинированное лечение ИАПФ и БРА в настоящее время рекомендуется только при А3-А4 степени АУ, в случае, если монотерапия не дала ожидаемого эффекта. В последние годы были получены данные о благоприятном сочетании ингибитора ренина и БРА с точки зрения снижения АУ, улучшения почечного прогноза и хорошей переносимости у больных с диабетической нефропатией (ДН).
Рекомендация 4.9. У пациентов с ХБП необходима ранняя коррекция метаболических и гомеостатических нарушений, связанных с ренальной дисфункцией.
Комментарий. Дислипопротеидемия, ожирение и метаболический синдром. Гиперлипидемия ухудшает прогноз любого почечного заболевания, а гиполипидемическая терапия способствует сохранению функции почек (Fried Z.F. и соавт., 2001). Однако лишь в последнее время внимание исследователей было обращено на изучение связи между дислипопротеидемией и функциональным состоянием почек у лиц без первичной патологии этого органа. В эпидемиологических исследованиях было установлено, что гиперхолестеринемия (Schaeffner E.S. и соавт., 2003), гипертриглицеридемия (Muntner P. и соавт., 2000) и низкие значения холестерина липопротеидов высокой плотности (Schaeffner E.S. и соавт., 2003) являются независимыми предикторами снижения функции почек в общей популяции условно-здоровых людей.
Избыточная масса тела и ожирение ассоциированы со многими гемодинамическими и структурными изменениями почек, которым предшествует ряд метаболических расстройств. У людей с данными нарушениями более высокий, чем в общей популяции, риск развития ХБП и ТПН. У пациентов с избыточной массой тела и ожирением чаще выявляется МАУ, и у данной категории лиц при уже имеющемся заболевании почек темпы роста АУ и прогрессирования почечной дисфункции опережают таковые в группе пациентов без ожирения. Диабетическая нефропатия, гипертонический нефросклероз, фокальный и сегментарный гломерулосклероз, рак почек, уратный и оксалатный нефролитиаз - наиболее часто встречающиеся нефрологические и урологические заболевания в популяции людей с ожирением. Появились данные, указывающие на возможность обратного развития ассоциированных с ожирением патологических, в том числе почечных, изменений, что достигается в результате коррекции ожирения путем уменьшения калорийности питания, хирургических вмешательств, приема снижающих гастроинтестинальную абсорбцию энергосодержащих веществ (Kopple J.D., Feroze U., 2001).
Вероятность развития ХБП возрастает при сочетании нескольких факторов риска. Данное положение находит яркое подтверждение при метаболическом синдроме. Оказалось, что распространенность ХБП в общей популяции при наличии одного фактора риска (СКФ<60 мл/ мин) увеличивалась с 0,9 до 9,2%, если присутствовали все пять признаков метаболического синдрома. Соответственно этому распространенность МАУ возрастала с 4,9 до 20,1% (Chen J. и соавт., 2004).
В то же время имеются данные, свидетельствующие о том, что значение метаболического синдрома как одного из потенциальных условий появления ХБП наиболее существенно у сравнительно молодых (моложе 60 лет) людей (Tanaka H. и соавт., 2006).
Целесообразность применения гиполипидемических препаратов у больных с ХБП определяется необходимостью замедления атерогенеза и прогрессирования почечного фиброза. В этих случаях вопрос о назначении гиполипидемической терапии и, в частности, статинов, как наиболее эффективных и безопасных препаратов, должен решаться положительно (Смирнов А.В., 2002). Как показали результаты одного из метаанализов, включившего 50 исследований (30 144 пациента с различными стадиями ХБП), статины по сравнению с плацебо достоверно уменьшают уровни общего холестерина в сыворотке крови, холестерина липопротеидов низкой плотности и величину суточной ПУ. Однако существенного влияния на СКФ не зарегистрировано. Под воздействием статинов также отмечалось значимое уменьшение частоты фатальных и нефатальных ССО. Тем не менее, значимого эффекта в отношении общей смертности не зарегистрировано. При этом позитивные последствия применения статинов существенно не зависели от стадии ХБП. Побочные эффекты препаратов отмечались редко, и их частота достоверно не отличалась от таковой в группах пациентов, получающих плацебо (Strippoli G.F. и соавт., 2008).
В любом случае дислипидемию у больных с ХБП С1-С3а стадий следует лечить в соответствии с текущими рекомендациями, разработанными для общей популяции [Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза (IV пересмотр)].
Анемия как предиктор развития гипертрофии левого желудочка (Locatelli F. и соавт., 2003) и ишемической болезни сердца (Muntner P. и соавт., 2005) ассоциируется с ухудшением качества жизни, ростом кардиоваскулярных осложнений и увеличением частоты госпитализаций у пациентов с ХБП (Locatelli F. и соавт., 2003). Развивающаяся вследствие недостаточной продукции эндогенного эритропоэтина (ЭПО) и ухудшения снабжения костного мозга железом анемия способствует повышению нагрузки на сердце за счет тахикардии и увеличения ударного объема, что, в свою очередь, вызывает почечную вазоконстрикцию и задержку жидкости. В конечном итоге формируется замкнутый порочный патогенетический круг, описанный как кардиоренальный анемический синдром, в котором застойная сердечная недостаточность (ЗСН), ХБП и анемия взаимно усугубляют друг друга (Silverberg D.S. и соавт., 2004).
Коррекция анемии при ХБП С5д стадии на основе применения эритропоэзстимулирующих агентов и препаратов железа в настоящее время является одним из основных принципов ведения таких больных. Более сложно оценить подходы к коррекции анемии на додиализных стадиях ХБП. Можно было ожидать, что раннее лечение анемии должно замедлять прогрессирование как почечных, так и кардиоваскулярных повреждений. При этом следует иметь в виду, что с учетом так называемых плеотропных эффектов ЭПО можно рассчитывать на его рено- и кардиопротекторные эффекты независимо от влияния данного гормона на эритропоэз (Шутов А.М. и соавт., 2006).
Однако результаты масштабных разработок (CHOIR, CREATE, TREAT и ряда других) привели к неоднозначным заключениям (Drueke T.B. и соавт., 2006; Singh A.K. и соавт., 2006; Macdougall I.C. и соавт., 2007; Locatelli F. и соавт., 2010). В любом случае коррекция анемии требует осторожности, поскольку даже сравнительно невысокие уровни гемоглобина (Hb) (>120 г/л), которые могут быть достигнуты в процессе такого лечения, сопровождаются ухудшением почечного и кардиоваскулярного прогноза. Основные положения ряда имеющихся рекомендаций по данному вопросу суммированы в работе F. Locatelli и соавт. (2009). В настоящее время идет доработка международных рекомендаций по лечению анемии у больных с ХБП.
Лечебное питание. Хорошо известно, что высокое потребление белка (в первую очередь животного) ассоциируется со своеобразными гемодинамическими сдвигами в почках, которые выражаются в снижении почечного сосудистого сопротивления, нарастании почечного кровотока и гломерулярной ультрафильтрации. На этом фоне уменьшается коэффициент гломерулярной ультрафильтрации (Kf). Снижение Kf в данных условиях рассматривается в качестве реакции, призванной ограничить неконтролируемый рост СКФ в отдельном нефроне. Понятно, что в такой ситуации уменьшение величины Kf должно приводить к усугублению интрагломерулярной гипертензии. Очевидно, такие изменения могут способствовать акцелерации почечных повреждений по гемодинамическому механизму (Кучер А.Г. и соавт., 2004; Кучер А.Г. и соавт., 2007).
Однако влияние значительного количества протеинов в рационе на состояние почек не исчерпывается только гемодинамическими эффектами.
Например, на фоне повышенного потребления белка наблюдается нарастание конечных продуктов гликирования, которые запускают сложный каскад реакций, включающий генерацию активных форм кислорода. Последние, в свою очередь, активируют сигнальные пути митоген-активируемых протеинкиназ, протенкиназы С и активаторов транскрипции. Это сопровождается нарастанием экспрессии провоспалительных (NF-κΒ, моноцитарного хемоаттрактантного протеина-1, фактора некроза опухолей-α) и профибротических (трансформирующего фактора роста-β, фактора роста соединительной ткани, фактора роста тромбоцитарного происхождения) субстанций. В такой ситуации происходит трансформация канальцевых клеток в миофибробласты, что в конечном итоге приводит к тубулярной атрофии и фиброзу интерстиция. Свой вклад в формирование почечных повреждений в условиях высокого потребления белка вносит усугубление ацидоза и активация эндотелина-1 (Uribarri J. и соавт., 2006; Wesson D.E. и соавт., 2007).
Необходимо отметить, что вопрос о взаимоотношениях между потреблением белков и состоянием почек крайне сложен (Lentine K. и соавт., 2004; Pecoits-Filho R., 2007).
По-видимому, такие взаимосвязи определяются не только количеством, но и качеством пищевого протеина. Есть основания считать, что растительные белки оказывают меньшую нагрузку на почки, чем животные. При этом протеины сои (даже при высоком потреблении белка) оказывают, возможно, не только меньшее негативное влияние на почечную гемодинамику, но и обладают кардиопротективным, нефропротективным и антисклеротическим действием (Кучер А.Г. и соавт., 2007; Uribarri J. и соавт., 2006; Sacks F.M. и соавт., 2006).
В практике лечения больных на додиализных стадиях ХБП используется довольно много вариантов диетических предписаний, связанных с ограничением поступления белка, хотя результаты применения малобелковой диеты (МБД) (0,6-0,8-1,0 г белка/кг массы тела/сут) в плане замедления прогрессирования ХБП оказались неоднозначными (Klahr S. и соавт., 1994; Hansen H.P. и соавт., 2002; Meloni C. и соавт., 2002; Pijls L.T. и соавт., 2002; Meloni C. и соавт., 2004). Тем не менее последние накопленные данные позволяют полагать, что ограничение белка в рационе действительно приводит к умеренному позитивному эффекту в плане почечного прогноза при ХБП (Fouque D., Laville M., 2009).
У детей с ХБП содержание белка в рационе должно соответствовать возрастной норме, поскольку его дефицит отрицательно сказывается на росте и развитии. Исключение могут составлять ситуации с крайней степенью выраженности гиперфосфатемии и гиперпаратиреоидизма.
Включение в МБД комбинации эссенциальных аминокислот и их кетоаналогов приводит к замедлению прогрессирования ХБП (Teschan P.E. и соавт., 1998; Prakash S. и соавт., 2004; Mitch W.E., 2005). При использовании препарата эссенциальных аминокислот и их кетоаналогов длительное применение МБД в додиализном периоде не вызывает нарушения белкового обмена, что благоприятно отражается на результатах последующей заместительной терапии (Chauveau P. и соавт., 2009).
Наконец, опыт многолетнего использования МБД с включением соевого изолята SUPRO 760 (0,3-0,4 г белка/кг/ИМТ/сут на основе обычных продуктов питания плюс соевый изолят из расчета 0,3-0,2 г белка/ кг/ИМТ/сут) свидетельствует о том, что такие рационы действительно могут замедлить прогрессирование ХБП, по крайней мере у части больных (Кучер А.Г. и соавт., 2007).
При формировании рационов у пациентов с ХБП можно руководствоваться рекомендациями JNC 7, модифицированными для ХБП (табл. 14) (Смирнов А.В. и соавт., 2009).
Нарушения минерального обмена. Нарушения гомеостаза кальция и фосфора и проявления вторичного гиперпаратиреоза прогрессируют по мере снижения СКФ. При этом критическим значением рСКФ, при котором начинают наблюдаться подавление активности 1а-гидроксилазы в почках, повышение сывороточной концентрации неорганического фосфора, уменьшение концентрации кальция в сыворотке крови и нарастание уровня паратгормона (ПТГ), считается 60 мл/мин/1,73 м2. Эти изменения не только вызывают развитие остеодистрофии, но и способствуют кальцификации сосудов и мягких тканей и увеличивают уровень кардиоваскулярной заболеваемости и смертности на более поздних стадиях ХБП (Goodman W.G. и соавт., 2004).
| Нутриент | Стадия ХБП | |
|---|---|---|
Стадии С1-С4 |
||
Натрий, г/сут* |
<2,4 |
|
Общее количество жиров, % энергообеспечения |
<30 |
|
Насыщенные жиры, % энергообеспечения |
<10 |
|
Холестерин, мг/сут |
<200 |
|
Углеводы, % энергообеспечения** |
50-60 |
|
Стадии С1-С2 |
Стадии С3а-С4 |
|
Белок, г/кг/сут, % энергообеспечения*** |
1,0/13 |
0,6-0,8/10 |
Фосфор, г/сут |
1,7 |
0,8-1,0 |
Калий, г/сут |
>4 |
2-4 |
* Не рекомендовано при солевом истощении.
** Исходя из того, что энергообеспеченность за счет белков, жиров и углеводов составляет 100%.
*** Потребление белка 1,3-1,4 г/кг/сут соответствует обычной западной диете (Fouque D. и соавт., 2011). Такой уровень потребления белка для пациентов с ХБП представляется завышенным. При ХБП 1-2 стадий содержание протеина в рационе не должно превышать 1,0 г/кг/сут.
За последние два десятилетия существенно расширились представления о кальций-фосфорном гомеостазе, его нарушениях при ХБП и подходах к коррекции этих расстройств (Добронравов В.А., 2011). К наиболее крупным достижениям в физиологии и патофизиологии гомеостаза кальция и фосфора следует отнести открытие фосфатурических гормонов (прежде всего фактора роста фибробластов 23) и расшифровку механизмов его действия на клеточно-молекулярном уровне с участием вспомогательного белка klotho. Пересмотрены представления о роли внепочечной экспрессии 1а-гидроксилазы и возможном участии этого фактора в развитии внекостной (в том числе сосудистой) кальцификации. Наконец, появилась и начала внедряться целая серия принципиально новых классов фармакологических препаратов, воздействующих на разные стороны гомеостаза кальция и фосфора или минеральный обмен в костной ткани: бифосфонаты, кальцимиметики, активаторы рецепторов витамина D, севеламер, лантана карбонат и др. В нефрологии все это послужило причиной для создания новых концепций, например, «chronic kidney disease and mineral and bone disorders - CKD-MBD» (отечественный эквивалент - минеральные и костные нарушения при хронической болезни почек) и существенному пересмотру действующих рекомендаций по диагностике, профилактике, контролю и лечению таких расстройств (Практические рекомендации KDIGO… , 2011).
Заключение
За 10 лет, прошедшие с момента создания концепции ХБП, во всем мире накоплен огромный объем данных, показывающих высокую распространенность заболеваний почек и большой социально-экономический ущерб, связанный с развитием ТПН. Не вызывает сомнения, что важная задача предупреждения дальнейшего прироста больных с ПН, снижения расходов на высокозатратную ЗПТ и уменьшения сердечно-сосудистого риска в популяции, обусловленного почечной дисфункцией, выходит за рамки одной медицинской специальности. Концепция ХБП создает универсальную платформу для широкого и эффективного взаимодействия всего медицинского сообщества с целью профилактики, раннего выявления и торможения прогрессирования хронических заболеваний почек разной этиологии, без чего сегодня невозможно реализовать масштабные задачи отечественного здравоохранения по сбережению работоспособного населения и оздоровлению нации.
Представленные рекомендации не только обобщают принятые в мире подходы к решению данной проблемы, но и используют результаты отечественных исследований и накопленный на сегодняшний день опыт адаптации иностранных и международных рекомендаций по ХБП к российским условиям. Очевидно, что дальнейшие перспективы внедрения концепции ХБП в практику отечественного здравоохранения связаны не только с совершенствованием основных ее положений, но и с разработкой более детальных рекомендаций по отдельным направлениям ведения больных с дисфункцией почек.
ПРИЛОЖЕНИЕ
Номограмма для расчета СКФ на основании уровня креатинина сыворотки крови, с учетом пола, возраста и расы (по формуле CKD-EPI, 2011 г.)
Женщины, европеоидная раса |
||||||||
|---|---|---|---|---|---|---|---|---|
креатинин сыворотки, мкмоль/л |
возраст, лет |
стадия ХБП |
||||||
20 |
30 |
40 |
50 |
60 |
70 |
80 |
||
40 |
144 |
135 |
125 |
117 |
109 |
102 |
95 |
1 |
50 |
134 |
125 |
117 |
109 |
101 |
94 |
88 |
2 |
60 |
126 |
118 |
110 |
102 |
95 |
89 |
83 |
|
70 |
108 |
100 |
94 |
87 |
81 |
76 |
71 |
|
80 |
92 |
85 |
80 |
74 |
69 |
65 |
60 |
|
90 |
80 |
74 |
69 |
64 |
60 |
56 |
52 |
3а |
100 |
70 |
65 |
61 |
57 |
53 |
49 |
46 |
|
110 |
62 |
58 |
54 |
51 |
47 |
44 |
41 |
3б |
120 |
56 |
52 |
49 |
45 |
42 |
40 |
37 |
|
130 |
51 |
48 |
44 |
41 |
38 |
36 |
33 |
|
140 |
47 |
43 |
40 |
38 |
35 |
33 |
31 |
|
150 |
43 |
40 |
37 |
35 |
32 |
30 |
28 |
4 |
160 |
40 |
37 |
34 |
32 |
30 |
28 |
26 |
|
170 |
37 |
34 |
32 |
30 |
28 |
26 |
24 |
|
180 |
34 |
32 |
30 |
28 |
26 |
24 |
23 |
|
190 |
32 |
30 |
28 |
26 |
24 |
23 |
21 |
|
200 |
30 |
28 |
26 |
25 |
23 |
21 |
20 |
|
210 |
29 |
27 |
25 |
23 |
22 |
20 |
19 |
|
220 |
27 |
25 |
23 |
22 |
20 |
19 |
18 |
|
230 |
26 |
24 |
22 |
21 |
19 |
18 |
17 |
|
240 |
24 |
23 |
21 |
20 |
18 |
17 |
16 |
|
250 |
23 |
22 |
20 |
19 |
17 |
16 |
15 |
|
260 |
22 |
21 |
19 |
18 |
17 |
16 |
14 |
5 |
270 |
21 |
20 |
18 |
17 |
16 |
15 |
14 |
|
280 |
20 |
19 |
18 |
16 |
15 |
14 |
13 |
|
290 |
19 |
18 |
17 |
16 |
15 |
14 |
13 |
|
300 |
19 |
17 |
16 |
15 |
14 |
13 |
12 |
|
310 |
18 |
17 |
15 |
14 |
13 |
13 |
12 |
|
320 |
17 |
16 |
15 |
14 |
13 |
12 |
11 |
|
330 |
17 |
15 |
14 |
13 |
12 |
12 |
11 |
|
340 |
16 |
15 |
14 |
13 |
12 |
11 |
10 |
|
350 |
15 |
14 |
13 |
12 |
12 |
11 |
10 |
|
360 |
15 |
14 |
13 |
12 |
11 |
10 |
10 |
|
370 |
14 |
13 |
12 |
12 |
11 |
10 |
9 |
|
380 |
14 |
13 |
12 |
11 |
11 |
10 |
9 |
|
390 |
13 |
13 |
12 |
11 |
10 |
9 |
9 |
|
400 |
13 |
12 |
11 |
11 |
10 |
9 |
9 |
|
410 |
13 |
12 |
11 |
10 |
10 |
9 |
8 |
|
420 |
12 |
11 |
11 |
10 |
9 |
9 |
8 |
|
430 |
12 |
11 |
10 |
10 |
9 |
8 |
8 |
|
Мужчины, европеоидная раса |
||||||||
креатинин сыворотки, мкмоль/л |
возраст, лет |
стадия ХБП |
||||||
20 |
30 |
40 |
50 |
60 |
70 |
80 |
||
40 |
163 |
152 |
141 |
132 |
123 |
114 |
107 |
1 |
50 |
148 |
138 |
129 |
120 |
112 |
104 |
97 |
|
60 |
138 |
128 |
120 |
111 |
104 |
97 |
90 |
|
70 |
129 |
120 |
112 |
105 |
98 |
91 |
85 |
2 |
80 |
122 |
114 |
106 |
99 |
92 |
86 |
80 |
|
90 |
106 |
98 |
92 |
85 |
80 |
74 |
69 |
|
100 |
93 |
87 |
81 |
75 |
70 |
65 |
61 |
|
110 |
83 |
77 |
72 |
67 |
63 |
58 |
54 |
3а |
120 |
75 |
69 |
65 |
60 |
56 |
52 |
49 |
|
130 |
68 |
63 |
59 |
55 |
51 |
48 |
44 |
3б |
140 |
62 |
58 |
54 |
50 |
47 |
44 |
41 |
|
150 |
57 |
53 |
49 |
46 |
43 |
40 |
37 |
|
160 |
53 |
49 |
46 |
43 |
40 |
37 |
35 |
|
170 |
49 |
46 |
42 |
40 |
37 |
34 |
32 |
|
180 |
46 |
43 |
40 |
37 |
34 |
32 |
30 |
|
190 |
43 |
40 |
37 |
35 |
32 |
30 |
28 |
4 |
200 |
40 |
37 |
35 |
33 |
30 |
28 |
26 |
|
210 |
38 |
35 |
33 |
31 |
29 |
27 |
25 |
|
220 |
36 |
33 |
31 |
29 |
27 |
25 |
23 |
|
230 |
34 |
32 |
29 |
27 |
26 |
24 |
22 |
|
240 |
32 |
30 |
28 |
26 |
24 |
23 |
21 |
|
250 |
31 |
29 |
27 |
25 |
23 |
22 |
20 |
|
260 |
29 |
27 |
25 |
24 |
22 |
21 |
19 |
|
270 |
28 |
26 |
24 |
23 |
21 |
20 |
18 |
|
280 |
27 |
25 |
23 |
22 |
20 |
19 |
18 |
|
290 |
26 |
24 |
22 |
21 |
19 |
18 |
17 |
|
300 |
25 |
23 |
21 |
20 |
19 |
17 |
16 |
|
310 |
24 |
22 |
21 |
19 |
18 |
17 |
16 |
|
320 |
23 |
21 |
20 |
18 |
17 |
16 |
15 |
|
330 |
22 |
20 |
19 |
18 |
17 |
15 |
14 |
5 |
340 |
21 |
20 |
18 |
17 |
16 |
15 |
14 |
|
350 |
20 |
19 |
18 |
17 |
15 |
14 |
13 |
|
360 |
20 |
18 |
17 |
16 |
15 |
14 |
13 |
|
370 |
19 |
18 |
17 |
15 |
14 |
13 |
13 |
|
380 |
18 |
1 |
16 |
15 |
14 |
13 |
12 |
|
390 |
18 |
17 |
16 |
14 |
14 |
13 |
12 |
|
400 |
17 |
16 |
15 |
14 |
13 |
12 |
11 |
|
410 |
17 |
16 |
15 |
14 |
13 |
12 |
11 |
|
420 |
16 |
15 |
14 |
13 |
12 |
12 |
11 |
|
430 |
16 |
15 |
14 |
13 |
12 |
11 |
10 |
|
440 |
15 |
14 |
13 |
13 |
12 |
11 |
10 |
|
450 |
15 |
14 |
13 |
12 |
11 |
11 |
10 |
|
460 |
15 |
14 |
13 |
12 |
11 |
10 |
10 |
|
470 |
14 |
13 |
12 |
12 |
11 |
10 |
9 |
|
480 |
14 |
13 |
12 |
11 |
11 |
10 |
9 |
|
490 |
14 |
13 |
12 |
11 |
10 |
10 |
9 |
|
500 |
13 |
12 |
12 |
11 |
10 |
9 |
9 |
|
Женщины, монголоидная раса |
||||||||
креатинин сыворотки, мкмоль/л |
возраст, лет |
стадия ХБП |
||||||
20 |
30 |
40 |
50 |
60 |
70 |
80 |
||
40 |
151 |
141 |
132 |
123 |
114 |
107 |
99 |
1 |
50 |
141 |
131 |
122 |
114 |
106 |
99 |
92 |
|
60 |
133 |
124 |
115 |
107 |
100 |
93 |
87 |
2 |
70 |
113 |
105 |
98 |
92 |
85 |
80 |
74 |
|
80 |
96 |
90 |
84 |
78 |
73 |
68 |
63 |
|
90 |
83 |
78 |
72 |
68 |
63 |
59 |
55 |
3а |
100 |
73 |
68 |
64 |
59 |
55 |
52 |
48 |
|
110 |
65 |
61 |
57 |
53 |
49 |
46 |
43 |
3б |
120 |
59 |
55 |
51 |
48 |
44 |
41 |
39 |
|
130 |
53 |
50 |
46 |
43 |
40 |
38 |
35 |
|
140 |
49 |
46 |
42 |
40 |
37 |
34 |
32 |
|
150 |
45 |
42 |
39 |
36 |
34 |
32 |
29 |
4 |
160 |
42 |
39 |
36 |
34 |
31 |
29 |
27 |
|
170 |
39 |
36 |
34 |
31 |
29 |
27 |
25 |
|
180 |
36 |
34 |
31 |
29 |
27 |
25 |
24 |
|
190 |
34 |
31 |
29 |
27 |
25 |
24 |
22 |
|
200 |
32 |
30 |
28 |
26 |
24 |
22 |
21 |
|
210 |
30 |
28 |
26 |
24 |
23 |
21 |
20 |
|
220 |
28 |
26 |
25 |
23 |
21 |
20 |
19 |
|
230 |
27 |
25 |
23 |
22 |
20 |
19 |
18 |
|
240 |
25 |
24 |
22 |
21 |
19 |
18 |
17 |
|
250 |
24 |
23 |
21 |
20 |
18 |
17 |
16 |
|
260 |
23 |
22 |
20 |
19 |
17 |
16 |
15 |
|
270 |
22 |
21 |
19 |
18 |
17 |
16 |
14 |
5 |
280 |
21 |
20 |
18 |
17 |
16 |
15 |
14 |
|
290 |
20 |
19 |
18 |
16 |
15 |
14 |
13 |
|
300 |
19 |
18 |
17 |
16 |
15 |
14 |
13 |
|
310 |
19 |
17 |
16 |
15 |
14 |
13 |
12 |
|
320 |
18 |
17 |
16 |
15 |
14 |
13 |
12 |
|
330 |
17 |
16 |
15 |
14 |
13 |
12 |
11 |
|
340 |
17 |
16 |
15 |
14 |
13 |
12 |
11 |
|
350 |
16 |
15 |
14 |
13 |
12 |
11 |
11 |
|
360 |
16 |
15 |
14 |
13 |
12 |
11 |
10 |
|
370 |
15 |
14 |
13 |
12 |
11 |
11 |
10 |
|
380 |
15 |
14 |
13 |
12 |
11 |
10 |
10 |
|
390 |
14 |
13 |
12 |
11 |
11 |
10 |
9 |
|
400 |
14 |
13 |
12 |
11 |
10 |
10 |
9 |
|
410 |
13 |
12 |
12 |
11 |
10 |
9 |
9 |
|
420 |
13 |
12 |
11 |
10 |
10 |
9 |
8 |
|
430 |
13 |
12 |
11 |
10 |
9 |
9 |
8 |
|
Мужчины, монголоидная раса |
||||||||
креатинин сыворотки, мкмоль/л |
возраст, лет |
стадия ХБП |
||||||
20 |
30 |
40 |
50 |
60 |
70 |
80 |
||
40 |
172 |
160 |
149 |
139 |
130 |
121 |
113 |
1 |
50 |
157 |
146 |
136 |
127 |
118 |
110 |
103 |
|
60 |
145 |
136 |
126 |
118 |
110 |
102 |
95 |
|
70 |
136 |
127 |
119 |
111 |
103 |
96 |
90 |
|
80 |
129 |
120 |
112 |
105 |
98 |
91 |
85 |
2 |
90 |
112 |
104 |
97 |
90 |
84 |
78 |
73 |
|
100 |
98 |
92 |
85 |
80 |
74 |
69 |
64 |
|
110 |
87 |
82 |
76 |
71 |
66 |
62 |
57 |
3а |
120 |
79 |
73 |
68 |
64 |
59 |
55 |
52 |
|
130 |
71 |
67 |
62 |
58 |
54 |
50 |
47 |
|
140 |
65 |
61 |
57 |
53 |
49 |
46 |
43 |
3б |
150 |
60 |
56 |
52 |
49 |
45 |
42 |
39 |
|
160 |
56 |
52 |
48 |
45 |
42 |
39 |
36 |
|
170 |
52 |
48 |
45 |
42 |
39 |
36 |
34 |
|
180 |
48 |
45 |
42 |
39 |
36 |
34 |
32 |
|
190 |
45 |
42 |
39 |
37 |
34 |
32 |
30 |
|
200 |
42 |
40 |
37 |
34 |
32 |
30 |
28 |
4 |
210 |
40 |
37 |
35 |
32 |
30 |
28 |
26 |
|
220 |
38 |
35 |
33 |
31 |
29 |
27 |
25 |
|
230 |
36 |
33 |
31 |
29 |
27 |
25 |
24 |
|
240 |
34 |
32 |
30 |
28 |
26 |
24 |
22 |
|
250 |
32 |
30 |
28 |
26 |
24 |
23 |
21 |
|
260 |
31 |
29 |
27 |
25 |
23 |
22 |
20 |
|
270 |
30 |
28 |
26 |
24 |
22 |
21 |
19 |
|
280 |
28 |
26 |
25 |
23 |
21 |
20 |
19 |
|
290 |
27 |
25 |
24 |
22 |
20 |
19 |
18 |
|
300 |
26 |
24 |
23 |
21 |
20 |
18 |
17 |
|
310 |
25 |
23 |
22 |
20 |
19 |
18 |
16 |
|
320 |
24 |
22 |
21 |
19 |
18 |
17 |
16 |
|
330 |
23 |
22 |
20 |
19 |
17 |
16 |
15 |
|
340 |
22 |
21 |
19 |
18 |
17 |
16 |
15 |
|
350 |
22 |
20 |
19 |
17 |
16 |
15 |
14 |
5 |
360 |
21 |
19 |
18 |
17 |
16 |
15 |
14 |
|
370 |
20 |
19 |
18 |
16 |
15 |
14 |
13 |
|
380 |
20 |
18 |
17 |
16 |
15 |
14 |
13 |
|
390 |
19 |
18 |
16 |
15 |
14 |
13 |
12 |
|
400 |
18 |
17 |
16 |
15 |
14 |
13 |
12 |
|
410 |
18 |
17 |
15 |
14 |
13 |
13 |
12 |
|
420 |
17 |
16 |
15 |
14 |
13 |
12 |
11 |
|
430 |
17 |
16 |
15 |
14 |
13 |
12 |
11 |
|
440 |
16 |
15 |
14 |
13 |
12 |
12 |
11 |
|
450 |
16 |
15 |
14 |
13 |
12 |
11 |
10 |
|
460 |
15 |
14 |
13 |
13 |
12 |
11 |
10 |
|
470 |
15 |
14 |
13 |
12 |
11 |
11 |
10 |
|
480 |
15 |
14 |
13 |
12 |
11 |
10 |
10 |
|
490 |
14 |
13 |
12 |
12 |
11 |
10 |
9 |
|
500 |
14 |
13 |
12 |
11 |
11 |
10 |
9 |
|
СПИСОК ЛИТЕРАТУРЫ
-
Бикбов Б.Т., Томилина Н.А. Состояние заместительной терапии больных с хронической почечной недостаточностью в Российской Федерации в 1998-2007 гг. (Аналитический отчет по данным Российского регистра заместительной почечной терапии) // Нефрология и диализ. 2009. Т. 11, № 3. С. 144-233.
-
Дедов И.И., Шестакова М.В. (ред.). Алгоритмы специализированной медицинской помощи больным с сахарным диабетом. 2-е изд. М., 2006.
-
Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза (IV пересмотр). Российские рекомендации. М., 2009.
-
Добронравов В.А. Эпидемиология диабетической нефропатии: общие и региональные проблемы // Нефрология. 2002. Т. 6, № 1. С. 16-22.
-
Добронравов В.А. Современный взгляд на патофизиологию вторичного гиперпаратиреоза. Роль фактора роста фибробластов 23 и klotho // Нефрология. 2011. Т. 15, № 4. С. 11-20.
-
Добронравов В.А., Смирнов А.В., Драгунов С.В. и др. Эпидемиология хронической болезни почек в Вологодской области // Нефрология. 2004. Т. 8, № 1. С. 36-41.
-
Добронравов В.А., Смирнов А.В., Драгунов С.В. и др. Эпидемиология хронической почечной недостаточности в Северо-Западном регионе России: на пути к созданию регистра хронической почечной болезни // Тер. арх. 2004. Т. 76, № 9. С. 57-61.
-
Есаян А.М. Тканевая ренин-ангиотензиновая система почки. Новая стратегия нефропротекции // Нефрология. 2008. Т. 6, № 3. С. 8-16.
-
Каюков И.Г., Смирнов А.В., Добронравов В.А. Рентгеноконтрастная нефропатия // Нефрология. 2007. Т. 11, № 3. С. 93-101.
-
Кучер А.Г., Каюков И.Г., Есаян А.М., Ермаков Ю.А. Влияние количества и качества белка в рационе на деятельность почек // Нефрология. 2004. Т. 8, № 2. С. 14-34.
-
Кучер А.Г., Каюков И.Г., Григорьева Н.Д., Васильев А.Н. Лечебное питание на различных стадиях хронической болезни почек // Нефрология и диализ. 2007. Т. 9, № 2. С. 118-136.
-
Мухин Н.А., Балкаров И.М., Моисеев В.С. и др. Хронические прогрессирующие нефропатии и образ жизни современного человека // Тер. арх. 2004. Т. 76, № 9. С. 5-10.
-
Мухин Н.А., Моисеев В.С., Кобалава Ж.Д. и др. Кардиоренальные взаимодействия: клиническое значение и роль в патогенезе заболеваний сердечно-сосудистой системы и почек // Тер. арх. 2004. № 6. С. 39-46.
-
Национальные рекомендации по профилактике, диагностике и лечению артериальной гипертонии. М., 2008.
-
Нефрология : национальное руководство / под ред. Н.А. Мухина. М. : ГЭОТАР-Медиа, 2009. 720 с.
-
Практические рекомендации KDIGO по диагностие, профилактике и лечению минеральных и костных нарушений при хронической болезни почек (ХБП-МКН). Краткое изложение рекомендаций // Нефрология. 2011. Т. 15, № 1. С. 88-95.
-
Смирнов А.В., Есаян А.М., Каюков И.Г. Хроническая болезнь почек: на пути к единству представлений // Нефрология. 2002. Т. 6, № 4. С. 11-17.
-
Смирнов А.В. Дислипопротеидемии и проблемы нефропротекции // Нефрология. 2002. Т. 6, № 2. С. 8-14.
-
Смирнов А.В., Каюков И.Г., Есаян А.М. и др. Превентивный подход в современной нефрологии // Нефрология. 2004. Т. 8, № 3. С. 7-14.
-
Смирнов А.В., Добронравов В.А., Бодур-Ооржак А.Ш. и др. Эпидемиология и факторы риска хронических болезней почек: региональный уровень общей проблемы // Тер. арх. 2005. № 6. С. 20-27.
-
Смирнов А.В., Добронравов В.А., Бодур-Ооржак А.Ш. и др. Распространенность и заболеваемость поздними стадиями хронической болезни почек в Республике Тыва // Нефрология. 2005. Т. 9, № 4. С. 25-29.
-
Смирнов А.В., Добронравов В.А., Каюков И.Г. Кардиоренальный континуум: патогенетические основы превентивной нефрологии // Нефрология. 2005. Т. 9, № 3. С. 7-15.
-
Смирнов А.В., Каюков И.Г., Есаян А.М. и др. Проблема оценки скорости клубочковой фильтрации в современной нефрологии: новый индикатор - цистатин С // Нефрология. 2005. Т. 9, № 3. С. 16-27.
-
Смирнов А.В., Добронравов В.А., Каюков И.Г. и др. Эпидемиология и социально-экономические аспекты хронической болезни почек // Нефрология. 2006. Т. 10, № 1. С. 7-13.
-
Смирнов А.В., Седов В.М., Лхаахуу Од-Эрдэнэ, Каюков И.Г. и др. Снижение скорости клубочковой фильтрации как независимый фактор риска сердечно-сосудистой болезни // Нефрология. 2006. Т. 10, № 4. С. 7-17.
-
Смирнов А.В., Добронравов В.А., Каюков И.Г. и др. Рекомендации Научно-исследовательского института нефрологии Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова: определение, классификация, диагностика и основные направления профилактики хронической болезни почек у взрослых. СПб. : Левша, 2008. 51 с.
-
Смирнов А.В., Добронравов В.А., Каюков И.Г. Проблема модификации классификации хронической болезни почек // Нефрология. 2010. Т. 15, № 2. С. 7-15.
-
Смирнов А.В., Кучер А.Г., Каюков И.Г., Есаян А.М. Руководство по лечебному питанию для больных хронической болезнью почек. СПб.; Тверь : Триада, 2009. 240 с.
-
Шилов Е.М. Хроническая болезнь почек и программа народосбережения России. Саратов, 2011.
-
Швецов М.Ю., Бобкова И.Н., Колина И.Б., Камышова Е.С. Современные принципы диагностики и лечения хронической болезни почек : методическое руководство для врачей. Саратов, 2011.
-
Шутов А.М., Саенко Ю.В. Плеотропные кардиопротективные эффекты эритропоэтина // Нефрология. 2006. Т. 10, № 4. С. 18-22.
-
Bommer J. Prevalence and socio-economic aspects of chronic kidney disease // Nephrol. Dial. Transplant. 2002. Vol. 17, N 11. Suppl. P. 8-12.
-
Brantsma A.H., Bakker S.J., Hillege H.L. et al. Urinary albumin excretion and its relation with C-reactive protein and the metabolic syndrome in the prediction of type 2 diabetes // Diabetes Care. 2005. Vol. 28, N 10. P. 2525-2530.
-
Burnier M., Phan O., Wang Q. High salt intake: a cause of blood pressu-reindependent left ventricular hypertrophy? // Nephrol. Dial. Transplant. 2007. Vol. 22, N 9. P. 2426-2429.
-
Casas J.P., Chua W., Loukogeorgakis S. et al. Effect of inhibitors of the reni-nangiotensin system and other antihypertensive drugs on renal outcomes: systematic review and meta-analysis // Lancet. 2005. Vol. 366, N 9502. P. 2026-2233.
-
Chauveau P., Couzi L., Vendrely B. et al. Long-term outcome on renal replacement therapy in patients who previously received a keto acid-supplemented very-low-protein diet // Am. J. Clin. Nutr. 2009. Vol. 90, N 4. P. 969-974.
-
Chen J., Munter P., Hamm L.Z. et al. The metabolic syndrome and chronic kidney disease in US adults // Ann. Intern. Med. 2004. Vol. 140. P. 167-174.
-
Chobanian A.V., Bakris G.L., Black H.R. et al. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report // JAMA. 2003. Vol. 289, N 19. P. 2560-2572.
-
Cockcroft D.W., Gault M.H. Prediction of creatinine from serum creatinine // Nephron. 1976. Vol. 16, N 1. P. 31-41.
-
Delanaye P., Cavalier E., Mariat C. et al. MDRD or CKD-EPI study equations for estimating prevalence of stage 3 CKD in epidemiological studies: which difference? Is this difference relevant? // BMC Nephrol. 2010. Vol. 11. P. 8. Published online 2010 June 1. doi:10.1186/1471-2369-11-8.
-
de Portu S., Citarella A., Cammarota S., Menditto E., Mantovani L.G. Pharmaco-Economic Consequences of Losartan Therapy in Patients Undergoing Diabetic End Stage Renal Disease in EU and USA // Clin. Exp. Hypertens. 2011. Vol. 33, N 3. P. 174-178.
-
Drueke T.B., Locatelli F., Clyne N. et al. CREATE Investigators. Normalization of hemoglobin level in patients with chronic kidney disease and anemia // N. Engl. J. Med. 2006. Vol. 355, N 20. P. 2071-2084.
-
European Best Practice Guidelines, Expert Group on Hemodialysis, European Renal Association. Section I. Measurement of renal function, when to refer and when to start dialysis // Nephrol. Dial. Transplant. 2002. Vol. 17, suppl. 7. P. 7-15.
-
Foley R.N., Wang C., Snyder J.J., Collins A.J. Cystatin C levels in U.S. adults, 1988-1994 versus 1999-2002: NHANES // Clin. J. Am. Soc. Nephrol. 2009. Vol. 4, N 5. P. 965-972.
-
Forman J.P., Brenner B.M. «Hypertension» and microalbuminuria♠^ : The bell tolls for thee // Kidney Int. 2006. Vol. 69. P. 22-28.
-
Fouque D., Laville M. Low protein diets for chronic kidney disease in non diabetic adults // Cochrane Database Syst. Rev. 2009. Issue 3: CD001892.
-
Fouque D., Pelletier S., Mafra D., Chauveau P. Nutrition and chronic kidney disease // Kidney Int. 2011. Vol. 80, N 4. P. 348-357.
-
Fried Z.F., Orchard T.J., Kasiske B.Z. Effect of lipid reduction on the progression of renal disease: a meta-analysis // Kidney Int. 2001. Vol. 59. P. 260-269.
-
Roissarrt M., Rosserrt J., Jacquot C., Paillard M., Houillier P. Predictive performance of the modification of diet in renal disease and Cockcroft-Gault equations for estimating renal function // J. Am. Soc. Nephrol. 2005. Vol. 16, N 3. P. 763-773.
-
Glynn L.G., Reddan D., Newell J. et al. Chronic kidney disease and mortality and morbidity among patients with established cardiovascular disease: a West of Ireland community-based cohort study // Nephrol. Dial. Transplant. 2007. Vol. 22, N 9. P. 2586-2594.
-
Go A.S., Chertow G.M., Fan D. et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization // N. Engl. J. Med. 2004. Vol. 351, N 13. P. 1296-305.
-
Goodman W.G., London G., Amann K. et al. Vascular calcification in chronic kidney disease // Am. J. Kidney Dis. 2004. Vol. 43, N 3. P. 572-579.
-
Hallan S., Asberg A., Lindberg M., Johnsen H. Validation of the Modification of Diet in Renal Disease formula for estimating GFR with special emphasis on calibration of the serum creatinine assay // Am. J. Kidney Dis. 2004. Vol. 44, N 1. P. 84-93.
-
Hansen H.P., Tauber-Lassen E., Jensen B.R., Parving H.H. Effect of dietary protein restriction on prognosis in patients with diabetic nephropathy // Kidney Int. 2002. Vol. 62, N 1. P. 220-228.
-
Haroun N.K., Jaar B.G., Hoffman S.C. et al. Risk factors for chronic Kidney disease: a prospective study of 23.534 men and women in Washington Country, Maryland // J. Am. Soc. Nephrol. 2003. Vol. 14. P. 2934-2941.
-
He J., Whelton P.K. Elevated systolic blood pressure and risk of cardiovascular and renal disease: overview of evidence from observational epidemiologic studies and randomized controlled trials // Am Heart J. 1999. Vol. 138, N 3. Pt 2. P. 211-219.
-
Henry R.M., Kostense P.J., Bos G. et al. Mild renal insufficiency is associated with increased cardiovascular mortality: the Hoorn Study // Kidney Int. 2002. Vol. 62. P. 1402-1407.
-
Hsu C-Y., Lin F., Vittinghoff E., Shlipac M.G. Racial differences in the progression from chronic renal insufficiency to end-stage renal disease in the United State // J. Am. Soc. Nephrol. 2003. Vol. 14. P. 2902-2907.
-
Hsu C.Y., McCulloch C.E., Iribarren C., Darbinian J., Go A.S. Body mass index and risk for end-stage renal disease // Ann. Intern. Med. 2006. Vol. 144, N 1. P. 21-28.
-
Ibrahim S., Rashid L., Darai M. Modification of diet in renal disease equation underestimates glomerular filtration rate in egyptian kidney donors // Exp. Clin. Transplant. 2008. Vol. 6, N 2. P. 144-148.
-
Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS33). UK Prospective Diabetes Study (UKPDS) Group // Lancet. 1998. Vol. 352, N 9131. P. 837-853.
-
Jafar T.H., Stark P.C., Schmid C.H. et al. AIPRD Study Group. Progression of chronic kidney disease: the role of blood pressure control, proteinuria, and angiotensin-converting enzyme inhibition: a patient-level meta-analysis // Ann. Intern. Med. 2003. Vol. 139, N 4. P. 244-252.
-
Joint Speciality Committee on Renal Medicine of the Royal College of Physicians and the Renal Association atRCoGP. Chronic Kidney Disease in adults: UK guidelines for management and referral. London : Royal College of Physicians, 2006.
-
Kidney Disease Outcome Quality Initiative. K/DOQI clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease // Am. J. Kidney Dis. 2004. Vol. 43. P. S1-S290.
-
Klahr S., Levey A.S., Beck G.J. et al.The effects of dietary protein restriction and blood-pressure control on the progression of chronic renal disease. Modification of Diet in Renal Disease Study Group // N. Engl. J. Med. 1994. Vol. 330, N 13. P. 877-884.
-
Klausen K.P., Scharling H., Jensen G., Jensen J.S. New definition of microalbuminuria in hypertensive subjects: association with incident coronary heart disease and death // Hypertension. 2005. Vol. 46, N 1. P. 33-37.
-
Kopple J.D., Feroze U. The effect of obesity on chronic kidney disease // J. Ren. Nutr. 2011. Vol. 1, N 1. P. 66-71.
-
Krikken J.A., Lely A.T., Bakker S.J., Navis G. The effect of a shift in sodium intake on renal hemodynamics is determined by body mass index in healthy young men // Kidney Int. 2007. Vol. 71, N 3. P. 260-265.
-
Lentine K., Wrone E.M. New insights into protein intake and progression of renal disease // Curr. Opin. Nephrol. Hypertens. 2004. Vol. 13, N 3. P. 333-336.
-
Levey A.S., Bosch J.P., Lewis J.B. A more accurate method to estimate glomerular filtration rate from serum creatinine; a new prediction equation // Ann. Intern. Med. 1999. Vol. 130, N 8. P. 461-470.
-
Levey A.S., Greene T., Kusek J.W., Beck G.J. A simplified equation to predict glomerular filtration rate from serum creatinine // J. Am. Soc. Nephrol. 2000. Vol. 11. P. A0828.
-
Levey A.S., Eckardt K.U., Tsukamoto Y. et al. Definition and classification of chronic kidney disease: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO) // Kidney Int. 2005. Vol. 67, N 6. P. 2089-2100.
-
Levey A.S., Stevens L.A., Schmid C.H. et al. A new equation to estimate glomerular filtration rate // Ann. Intern. Med. 2009. Vol. 150. P. 604-612.
-
Levey A.S., de Jong P.E., Coresh J. et al. The definition, classification and prognosis of chronic kidney disease: a KDIGO Controversies Conference report // Kidney Int. 2010. URL: http:/www.kidney-international.org.
-
Locatelli F., Aljama P., Canaud B. et al. Anaemia Working Group of European Renal Best Practice (ERBP). Target haemoglobin to aim for with erythro-poiesis-stimulating agents: a position statement by ERBP following publication of the Trial to reduce cardiovascular events with Aranesp therapy (TREAT) study // Nephrol. Dial. Transplant. 2010. Vol. 25, N 9. P. 2846-2850.
-
Locatelli F., Covic A., Eckardt K.U. et al. ERA-EDTA ERBP Advisory Board. Anaemia management in patients with chronic kidney disease: a position statement by the Anaemia Working Group of European Renal Best Practice (ERBP) // Nephrol. Dial. Transplant. 2009. Vol. 24. P. 348-354.
-
Locatelli F., Pozzoni P., Del Vecchio L. Epidemiology of chronic kidney disease in Italy: Possible therapeutical approaches // J. Nephrol. 2003. Vol. 16. P. 1-10.
-
Lopez-Novoa J.M., Rodriguez-Pena A.B., Ortiz A. et al. Etiopathology of chronic tubular, glomerular and renovascular nephropathies: clinical implications // J. Transl. Med. 2011. Vol. 9. P. 13. Published online 2011 Jan 20. doi: 10.1186/1479-5876-9-13.
-
Ma Y.C., Zuo L., Chen J.H. et al. Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease // J. Am. Soc. Nephrol. 2006. Vol. 17, N 10. P. 2937-2944.
-
Maki D.D., Ma J.Z., Louis T.A., Kasiske B.L. Long-term effects of anti-hypertensive agents on proteinuria and renal function // Arch. Intern. Med. 1995. Vol. 155, N 10. P. 1073-1080.
-
MacKinnon M., Shurraw S., Akbari A. et al. Combination therapy with an angiotensin receptor blocker and an ACE inhibitor in proteinuric renal disease: a systematic review of the efficacy and safety data // Am. J. Kidney Dis. 2006. Vol. 48, N 1. P. 8-12.
-
Mann J.F.E. Cardiovascular risk in patients with mild renal insufficiency: implication for the use of ACE inhibitors // Presse Med. 2005. Vol. 34, N 18. P. 1303-1308.
-
Mann J.F., Schmieder R.E., McQueen M. et al. The ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial (ONTARGET®) Investigators. Renal outcomes with telmisartan, ramipril, or both, in people at high vascular risk (the ONTARGET® study): a multicentre, randomised, double-blind, controlled trial // Lancet. 2008. Vol. 372. P. 547-553.
-
Matsuo S., Imai E., Horio M. et al. Revised equations for estimated GFR from serum creatinine in Japan // Am. J. Kidney. Dis. 2009. Vol. 53, N 6. P. 982-992.
-
McClellan W.M., Flanders W.D. Risk factors for progressive chronic kidney disease // J. Am. Soc. Nephrol. 2003. Vol. 14. P. S65-S70.
-
Meloni C., Morosetti M., Suraci C. et al. Severe dietary protein restriction in overt diabetic nephropathy: benefits or risks? // J. Ren. Nutr. 2002. Vol. 12, N 2. P. 96-101.
-
Meloni C., Tatangelo P., Cipriani S., Rossi V. et al. Adequate protein dietary restriction in diabetic and nondiabetic patients with chronic renal failure // J. Ren. Nutr. 2004. Vol. 14, N 4. P. 208-213.
-
Mitch W.E. Dietary therapy in CKD patients - the current status // Am. J. Nephrol. 2005. Vol. 25, suppl. 1. P. 7-8.
-
Muntner P., He J., Astor B.C. et al. Traditional and nontraditional risk factors predict coronary heart disease in chronic kidney disease: results from the Atherosclerosis Risk in Communities Study // J. Am. Soc. Nephrol. 2005. Vol. 16. P. 529-538.
-
Majunath G., Tighionart H., Ibrahim H. et al. Level of kidney function as a risk factors for atherosclerotic cardiovascular outcomes in the community // J. Am. Coll. Cardiol. 2003. Vol. 41. P. 47-55.
-
Macdougall I.C., Temple R.M., Kwan J.T. Is early treatment of anaemia with epoetinalpha beneficial to pre-dialysis chronic kidney disease patients? Results of a multicentre, open-label, prospective, randomized, comparative group trial // Nephrol. Dial. Transplant. 2007. Vol. 22, N 3. P. 784-793.
-
Muntner P., Coresh J., Smith J.C. et al. Plasma lipids and risk of developing renal dysfunction: the atherosclerosis risk in communities study // Kidney Int. 2000. Vol. 58. P. 293-301.
-
National Kidney Foundation KD. Clinical practice guidelines for chronic Kidney disease: Evaluation, classification and stratification // Am. J. Kidney Dis. 2002. Vol. 39, suppl. 1. P. S1-S266.
-
Nitsch D., Dietrich D.F., von Eckardstein A. et al. Prevalence of renal impairment and its association with cardiovascular risk factors in a general population: results of the Swiss SAPALDIA study // Nephrol. Dial. Transplant. 2006. Vol. 21, N 4. P. 935-944.
-
Ohkubo Y., Kishikawa H., Araki E. et al. Intensive insulin therapy prevents the progression of diabetic microvascular complications in Japanese patients with non-insulindependent diabetes mellitus: a randomized prospective 6-year study // Diabetes Res. Clin. Pract. 1995. Vol. 28, N 2. P. 103-117.
-
Pecoits-Filho R. Dietary protein intake and kidney disease in Western diet // Contrib. Nephrol. 2007. Vol. 155. P. 102-112.
-
Рerthoux F., Jones E., Gellert R. et al. Epidemiological data of treated end-stage renal failure in the European Union (EU) during the year 1995; Report of European Renal. Association Registry and the National Registries // Nephrol. Dial. Transplant. 1999. Vol. 14. P. 2332-2342.
-
Peterson J.C., Adler S., Burkart J.M. et al. Blood pressure control, proteinuria, and the progression of renal disease. The Modification of Diet in Renal Disease Study // Ann. Intern. Med. 1995. Vol. 123, N 10. P. 754-762.
-
Pijls L.T., de Vries H., van Eijk J.T., Donker A.J. Protein restriction, glomerular filtration rate and albuminuria in patients with type 2 diabetes mellitus: a randomized trial // Eur. J. Clin. Nutr. 2002. Vol. 56, N 12. P. 1200-1207.
-
Pinto-Siersma S.J., Mulder J., Janssen W.M. et al. Smoking is related to albuminuria and abnormal renal function in nondiabetic persons // Ann. Intern. Med. 2000. Vol. 133. P. 585-591.
-
Prakash S., Pande D.P., Sharma S. et al. Randomized, double-blind, pla-cebocontrolled trial to evaluate efficacy of ketodiet in predialytic chronic renal failure // Ren. Nut. 2004. Vol. 14, N 2. P. 89-96.
-
Remuzzi G., Ruggenenti P., Perna A. et al. RENAAL Study Group Continuum of renoprotection with losartan at all stages of type 2 diabetic nephropathy: a post hoc analysis of the RENAAL trial results // J. Am. Soc. Nephrol. 2004. Vol. 15, N 12. P. 3117-3125.
-
Riccioni G. Aliskiren in the treatment of hypertension and organ damage // Cardiovasc. Ther. 2011. Vol. 29, N 1. P. 77-87.
-
Ritz E. Hypertension and kidney disease // Clin. Nephrol. 2010. Vol. 74, suppl. 1. P. S39-S43.
-
Ritz E. Salt-friend or foe? // Nephrol. Dial. Transplant. 2006. Vol. 21, N 8. P. 2052-2056.
-
Ritz E., Dikow R., Morath C., Schwenger V. Salt-a potential, "uremic toxin"? // Blood Purif. 2006. Vol. 24, N 1. P. 63-66.
-
Rodger R.S.C., Williams B. Consensus conference on early chronic kidney disease. Foreword // Nephrol. Dial. Transplant. 2007. Vol. 22, suppl. 9. P. IX 1.
-
Rodrigo E. et al. Measurement of renal function in pre-ESRD patients // Kidney Int. 2002. Vol. 61, suppl. 80. P. S11-S17.
-
Rule A.D., Larson T.S., Bergstralh E.J. et al. Using serum creatinine to estimate glomerular filtration rate: accuracy in good health and in chronic kidney disease // Ann. Intern. Med. 2004. Vol. 141. P. 929-937.
-
Rutkowski B. Changing pattern of end-stage renal failure in Central and Eastern Europe // Nephrol. Dial. Transplant. 2002. Vol. 15. P. 156-160.
-
Sacks F.M., Lichtenstein A., Van Horn L., Harris W. et al. Soy protein, isoflavones, and cardiovascular health: a summary of a statement for professionals from the american heart association nutrition committee // Arterioscler. Thromb. Vasc. Biol. 2006. Vol. 26, N 8. P. 1689-1692.
-
Saito A., Kaseda R., Hosojima M., Sato H. Proximal tubule cell hypothesis for cardiorenal syndrome in diabetes // Int. J. Nephrol. 2011. Article ID 957164.
-
Schaeffner E.S., Kurth T., Curhan G.C. et al. Cholesterol and the risk of renal dysfunction in apparently healthy men // J. Am. Soc. Nephrol. 2003. Vol. 14. P. 2084-2091.
-
Schmieder R.E., Schrader J., Zidek W. et al. Low-grade albuminuria and cardiovascular risk: what is the evidence? // Clin. Res. Cardiol. 2007. Vol. 96, N 5. P. 247-257.
-
Schiepati A., Remuzzi G. Chronic renal disease as a public health problem: Epidemiology, social and economic implications // Kidney Int. 2005. Vol. 68, suppl. 98. P. S7-S10.
-
Segura J., Campo C., Ruilope L.M. Effect of proteinuria and glomerular filtration rate on cardiovascular risk in essential hypertension // Kidney Int. 2004. Suppl. 92. P. S45-S49.
-
Silverberg D.S., Wexler D., Iaina A. The role of anemia in the progression of congestive heart failure. Is there a place for erythropoietin and intravenous iron? // J. Nephrol. 2004. Vol. 17, N 6. P. 749-761.
-
Singh A.K., Szczech L., Tang K.L. et al. CHOIR Investigators. Correction of anemia with epoetin alfa in chronic kidney disease // N. Engl. J. Med. 2006. Vol. 355, N 20. P. 2085-2098.
-
Strippoli G.F., Navaneethan S.D., Johnson D.W. et al. Effects of statins in patients with chronic kidney disease: meta-analysis and meta-regression of randomised controlled trials // BMJ. 2008. Vol. 336, N 7645. P. 645-651.
-
Teschan P.E., Beck G.J., Dwyer J.T. et al. Effect of a ketoacid-aminoacid-supplemented very low protein diet on the progression of advanced renal disease: a reanalysis of the MDRD feasibility study // Clin. Nephrol. 1998. Vol. 50, N 5. P. 273-283.
-
Tanaka H., Shiohira Y., Uezu Y. et al. Metabolic syndrome and chronic kidney disease in Okinawa, Japan // Kidney Int. 2006. Vol. 69, N 2. P. 369-374.
-
The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group // N. Engl. J. Med. 1993. Vol. 329, N 14. P. 977-986.
-
U.S. Renal Data System. USRDR 2004 Annual Data Report. Bethesda, MD : National Institute of Health, National Institute of Diabetes and Digestive and Kidney Diseases, 2004.
-
Uribarri J., Tuttle K.R. Advanced glycation end products and nephrotoxicity of high-protein diets // Clin. J. Am. Soc. Nephrol. 2006. Vol. 1, N 6. P. 1293-1299.
-
Vanholder R. et al. Chronic kidney disease as cause of cardiovascular morbidity and mortality // Nephrol. Dial. Transplant. 2005. Vol. 20, N 6. P. 1048-1056.
-
Warmoth L., Regalado M.M., Simoni J. et al. Cigarette smoking enhances increased urine albumin excretion as a risk factor for glomerular filtration rate decline in primary hypertension // Am. J. Med. Sci. 2005. Vol. 330, N 3. P. 111-119.
-
Weiner D.E., Tighiouart H., Levey A.S. et al. Lowest systolic blood pressure is associated with stroke in stages 3 to 4 chronic kidney disease // J. Am. Soc. Nephrol. 2007. Vol. 18, N 3. P. 960-966.
-
Wesson D.E., Nathan T., Rose T., Simoni J., Tran R.M. Dietary protein induces endothelin-mediated kidney injury through enhanced intrinsic acid production // Kidney. Int. 2007. Vol. 71, N 3. P. 210-221.
-
Williams B., Poulter N.R., Brown M.J. et al. British Hypertension Society. Guidelines for management of hypertension: report of the fourth working party of the British Hypertension Society, 2004-BHS IV // J. Hum. Hypertens. 2004. Vol. 18, N 3. P. 139-185.
-
Xue J.L., Ma J.Z., Louis T.A., Collins A.J. Forecast of the number of patients with end-stage renal disease in the United States to the year 2010 // J. Am. Soc. Nephrol. 2001. Vol. 12. P. 2753-2758.