Нефрология. Клинические рекомендации / под ред. Е. М. Шилова, А. В. Смирнова, Н. Л. Козловской. - М. : ГЭОТАР-Медиа, 2016. - 816 с. - ISBN 978-5-9704-3714-8. |
Аннотация
Первые национальные клинические рекомендации по нефрологии подготовлены коллективом экспертов, в который вошли не только специалисты-нефрологи ведущих нефрологических школ России, но и представители других медицинских специальностей, тесно сотрудничающие с нефрологами, - кардиологи, эндокринологи, инфекционисты, педиатры, генетики. Издание содержит информацию по наиболее распространенным нефрологическим заболеваниям и синдромам. Представленные в нем клинические рекомендации детально описывают действия врача по диагностике, лечению, профилактике и реабилитации пациентов. Соблюдение международной методологии при подготовке клинических рекомендаций гарантирует их современность, достоверность, обобщение лучшего мирового опыта и знаний, обеспечивает возможность практического применения. Именно поэтому клинические рекомендации обладают преимуществами по сравнению с традиционными источниками информации (учебники, руководства, монографии), что позволит врачу в короткие сроки принимать обоснованные решения в сложных клинических ситуациях. Клинические рекомендации по нефрологии предназначены не только практикующим врачам-нефрологам, но и терапевтам, педиатрам, представителям смежных дисциплин. Они также могут использоваться для обучения студентов старших курсов и клинических ординаторов терапевтических специальностей.
1. Определение, эпидемиология
Фокально-сегментарный гломерулосклероз (ФСГС) - форма гломерулопатии, для которой характерно склерозирование отдельных сегментов (сегментарные изменения) в части клубочков (фокальные изменения); остальные клубочки в начале болезни интактны.
Этот морфологический тип изменений трудно отличим от БМИ. Полагают, что это разной тяжести варианты или разные стадии одного и того же заболевания, объединяемые термином «идиопатический нефротический синдром».
Эпидемиология
-
ФСГС - самая частая причина НС у взрослых (20-25%) и стероидрезистентного НС у детей (более 50%).
-
В структуре идиопатического НС ФСГС занимает до 35% у взрослых, до 20% - у детей.
-
Как прогрессирующая форма поражения почек ФСГС является наиболее частой причиной ТПН, требующей ЗПТ.
-
ФСГС рецидивирует в трансплантированной почке у 30-50% больных.
2. Этиология, классификация
Различают первичную (идиопатическую) и вторичную формы ФСГС.
Классификация
1. Генетически обусловленный:
2. Ассоциированный с вирусами (ВИЧ, парвовирус В19, цитомегаловирус (CMV), вирус Эпштейна-Барр (EBV), вирус Коксаки и др.).
3. Индуцированный лекарствами (героин, интерферон-α, адриамицин℘ , доксорубицин, препараты лития, анаболические стероиды, памидронати др.).
4. Адаптивные структурно-функциональные изменения, вызванные гипертрофией клубочков или гиперфильтрацией:
4.1. при уменьшении массы почечной ткани (олигомеганефрония, односторонняя агенезия, дисплазия почечной ткани, кортикальный некроз, рефлюкс-нефропатия, нефрэктомия, хроническая трансплантационная нефропатия, низкий вес при рождении, поздняя стадия любого заболевания почек со снижением массы действующих нефронов и др.);
4.2. при изначально нормальном числе нефронов (АГ, СД, ожирение, врожденные «синие» пороки сердца, серповидноклеточная анемия).
5. Злокачественные новообразования (лимфома и др.).
6. Неспецифические ФСГС-подобные изменения, вызванные сморщиванием почек при гломерулярных заболеваниях [очаговый пролиферативный ГН, пурпура Шенлейна-Геноха, МН, волчаночный нефрит (ВН), тромботическая микроангиопатия (ТМА)].
3. Механизм развития
При ФСГС выявляется поражение подоцитов различной этиологии, в связи с чем это заболевание относят к группе подоцитопатий.
Основную роль в развитии ФСГС отводят повреждению подоцитов вследствие молекулярного генетического дефекта, воздействия циркулирующих факторов проницаемости или внешних повреждающих агентов.
-
Структурные нарушения подоцитов, дезорганизация их актинового цитоскелета, сглаживание ножек, слияние фильтрационных щелей приводят к развитию ПУ. При длительном и/или выраженном воздействии повреждающего фактора активируются механизмы апоптоза, подоциты погибают, теряют связь с ГБМ, слущиваются в мочевое пространство, оголяя в этих местах участки ГБМ. Имея высокие адгезивные свойства, оголенная ГБМ формирует синехии с капсулой Боумена. В местах сращивания с ГБМ и в мезангиуме образуются очаги фиброза. В зонах фокально-сегментарного склероза фильтрация меняет свое направление в сторону интерстиция, окружающего клубочек. В итоге образуются глобальный гломерулосклероз и интерстициальный фиброз. Кроме того, подоциты в ходе повреждения подвергаются трансдифференциации, приобретают свойства фибробластов и участвуют в синтезе экстрацеллюлярного матрикса, ускоряя формирование очагов фиброза.
-
В качестве факторов проницаемости рассматривают кардиотропино-подобный цитокин 1 (из семейства ИЛ-6), растворимый рецептор к урокиназе, гемопексин и др. При ФСГС и БМИ активность циркулирующих факторов проницаемости зависит от баланса между продукцией этих факторов (в результате Т-клеточной дисрегуляции) и потерей с мочой их ингибиторов (предположительно липопротеидов высокой плотности). Мишенью факторов проницаемости могут являться белки щелевидной диафрагмы подоцитов (подоцин, нефрин, CD2AP и др.), участвующие в поддержании структуры и селективности гломерулярного фильтра.
-
При вирус-индуцированном ФСГС допускают прямое повреждающее действие вируса на подоциты или через освобождение воспалительных цитокинов, взаимодействующих с подоцитарными рецепторами.
-
В повреждении подоцитов при вторичном ФСГС, связанном с уменьшением массы почек, рефлюкс-нефропатией, ожирением, важную роль играют гемодинамические механизмы - адаптивная внутриклубочковая гипертензия и гиперфильтрация с увеличением объема клубочков, ведущие к повышению механической нагрузки на подоциты. Гиперпродукция ангиотензина II и усиление синтеза трансформирующего ростового фактора β вызывают активацию апоптоза, реорганизацию цитоскелета и дедифференциацию подоцитов.
4. Клиническая картина
-
НС развивается более чем у 70% больных, персистирующую ПУ без НС имеют <30% пациентов.
-
У большинства больных НС и ПУ сочетаются с микрогематурией, макрогематурия редка.
-
При генетических вариантах ФСГС в начале проявлений болезни ПУ часто носит субнефротический характер.
-
Развитие вторичной стероидрезистентности у детей в большинстве случаев может быть связано с трансформацией минимальных изменений в ФСГС.
-
При ряде вторичных форм ФСГС отмечают клинические и лабораторные признаки заболевания, вызвавшего поражение почек.
5. Принципы диагностики
5.1. Диагноз ФСГС основывается на данных морфологического исследования (НГ).
Биопсию почки проводят с дифференциально-диагностической целью и для оценки морфологических критериев прогноза.
У детей до 12 лет биопсия проводится, как правило, только при подтверждении стероидрезистентности.
Морфологические критерии ФСГС
Общие признаки
-
На светооптическом уровне - в начале заболевания изменения квалифицируются как минимальные, в последующем выявляются зоны склероза и гиалиноза в некоторых сегментах отдельных клубочков (не более 60% клубочков в препарате), умеренная клеточная пролиферация, адгезия петель клубочков к капсуле с образованием синехий. Фокальные изменения начинаются либо превалируют на кортикомедуллярном уровне, затем вовлекаются клубочки поверхностных отделов коркового вещества. Выявляется разной степени интерстициальный фиброз.
-
При иммунофлуоресцентном исследовании - в склерозированных сегментах свечение IgM и С3, при вторичных формах ФСГС возможно выявление и других иммуноглобулинов; в неизмененных клубочках свечение отсутствует.
-
При электронной микроскопии наблюдаются гипертрофия и вакуолизация подоцитов, слияние ножковых отростков, пенистого вида материал в просвете капилляров, пенистые клетки в мезангии, виллезная трансформация подоцитов, отслойка подоцитов, оголение участков БМК, синехии с капсулой, жировая и белковая дистрофия эпителия канальцев.
Морфологические варианты ФСГС
В зависимости от локализации зон повреждения в клубочках выделяют гистологические варианты болезни, различающиеся по клиническим проявлениям, частоте и скорости прогрессирования в ХПН.
-
Верхушечный вариант (tip-lesion).
-
Чаще встречается у представителей белой расы, реже у афроамериканцев (15%).
-
Характеризуется пролапсом склерозированной дольки в начальный отдел проксимального канальца. Повреждение тубулоинтерстициальной зоны и сосудов по сравнению с другими вариантами ФСГС менее выражено.
-
Клинические проявления: у 80% - выраженная ПУ с тяжелым НС, реже, чем при других вариантах ФСГС, развивается АГ и ПН, лучший ответ на стероидную терапию, полные ремиссии НС развиваются у 50% больных.
-
Прогноз вполне благоприятный - 5-летняя почечная выживаемость - 76%.
Клинические проявления: НС встречается реже - в 55% случаев, у 80% больных выявляется АГ.
Редко достигаются полные (10%) и частичные (10%) ремиссии, тем не менее прогноз вполне благоприятный: почечная выживаемость составляет к 3 годам 75%.
-
Коллабирующий вариант (коллабирующая гломерулопатия).
-
Встречается преимущественно (91%) у представителей черной расы.
-
Характеризуется пролиферацией подоцитов с образованием клеточных полулуний, коллапсом капиллярных петель всего клубочка, с образованием свободного подкапсульного пространства, быстрым развитием склероза. Характерны выраженные тубулоинтерстициальные изменения.
-
Развивается вследствие дедифференцировки подоцитов с потерей ими маркеров зрелых подоцитов, экспрессии маркеров пролиферации и эпитопов макрофагов.
-
Подобные изменения наблюдаются при ВИЧ-ассоциированной нефропатии, гломерулопатии, вызванной памидронатом, нефропатии у героиновых наркоманов.
-
Клинические проявления: высокая ПУ, тяжелый НС, ПН уже в начале болезни и быстро (в среднем через 15 мес) прогрессирует до терминальной ХПН (ТХПН). Ответ на кортикостероиды наблюдается у 25% больных.
-
Прогноз неблагоприятный: по сравнению с другими вариантами ФСГС, почечная выживаемость наихудшая - 33% к 3 годам.
-
-
Является самым редким (3%) и наименее изученным вариантом ФСГС.
-
Характеризуется расширением мезангия, пролиферацией подоцитов, а также пролиферацией эндотелия со стазом лейкоцитов в просвете капилляра, коллапсом капиллярных петель. Может быть поврежден любой сегмент (перихилярный или периферический). Наблюдается накопление лейкоцитов и пенистых клеток.
-
Редкость клеточного варианта, возможно, связана с отсутствием варианта как такового, потому что вышеуказанные изменения могут встречаться при других вариантах ФСГС, например, при верхушечном варианте.
-
По ответу на лечение, скорости развития ТПН занимает промежуточное положение между tip-lesion и коллабирующей нефропатией.
-
-
Неспецифический вариант (иногда называемый классическим).
-
Морфологические изменения клубочка трудно отнести к какому-либо другому варианту, поэтому он встречается чаще всего (42%).
-
Тубулоинтерстициальные повреждения, как правило, не выражены.
-
Клинические проявления занимают промежуточную позицию между другими вариантами ФСГС: НС развивается у 67% больных, АГ - у 80%, полные ремиссии достигаются у 13% больных.
-
Прогноз вполне благоприятный: 3-летняя почечная выживаемость - 65%.
-
Сегментарные склеротические изменения в клубочках также могут выявляться при пролиферативных формах ГН и других гломерулопатиях.
5.2. Клиническая диагностика идиопатического ФСГС должна базироваться на исключении вторичных причин заболевания (НГ).
ФСГС представляет собой целую группу патологических состояний, объединенных не конкретным этиологическим фактором, а характером гистологических изменений. Сегментарные склеротические изменения в клубочках могут быть вызваны различными факторами и встречаться при различных состояниях, в том числе при уже имеющейся патологии почек (полулунном ГН, IgA-нефропатии, СА, болезни Фабри и др.), что отражает конечную точку в гистопатологической эволюции совершенно различных биологических процессов. Поэтому очень важно исключить вторичность ФСГС.
5.3. Не использовать генетическое обследование в рутинной практике (НГ).
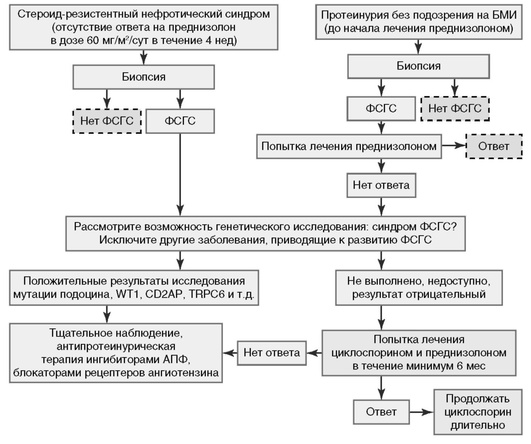
Нет убедительной доказательной базы для целесообразности проведения генетического тестирования взрослых с ФСГС даже в случаях стероидрезистентности. При отсутствии семейного анамнеза ФСГС мутации в генах нефрина (NPHS1), подоцина (NPHS2), ACTN4, CD2AP и TRPC-6 обнаружены только у 0-3% взрослых больных с ФСГС. Очевидно, что у детей она значительно выше. Вариабельность этих мутаций в отношении их клинического фенотипа и противопоказаний к иммуносупрессивной терапии пока не выяснена.
У детей молекулярно-генетическое исследование показано при раннем дебюте НС и наличии сибсов с аналогичными проявлениями.
6. Дифференциальная диагностика
Дифференциальную диагностику идиопатического ФСГС проводят с другими формами ГН и вторичным ФСГС, для чего необходима комплексная оценка клинико-лабораторных данных, морфологическое исследование ткани почки (НГ).
7. Лечение
7.1. Редкость спонтанных ремиссий при идиопатическом ФСГС обосновывает необходимость достижения медикаментозной ремиссии (НС).
7.2. Лечение больных идиопатическим ФСГС без НС.
Рекомендация 7.2.1. Больным ФСГС без НС с ПУ>0,5 г/сут показано назначение ИАПФ или БРА как с антипротеинурической целью, так и для замедления развития фиброза в почках (НГ).
Рекомендация 7.2.2. Пациенты должны находиться под регулярным наблюдением нефролога для контроля уровня ПУ, АГ, креатинина с целью своевременного выявления показаний для иммуносупрессивной терапии (НГ).
Рекомендация 7.2.3. Пациентам с АГ показано своевременное лечение антигипертензивными препаратами. С позиций нефро- и кардиопротекции предпочтительны ИАПФ или БРА (НГ).
Рекомендация 7.2.4. У пациентов с ФСГС и дислипидемией проводится коррекция нарушений липидного обмена согласно соответствующим рекомендациям для больных ХБП (НГ).
Лечение препаратами, блокирующими РААС
7.3.1. Больным ФСГС с НС показано назначение препаратов, блокирующих РААС - ИАПФ, БРА (НГ).
ИАПФ или БРА назначают всем больным с НС при отсутствии противопоказаний к их применению.
Иммуносупрессивная терапия
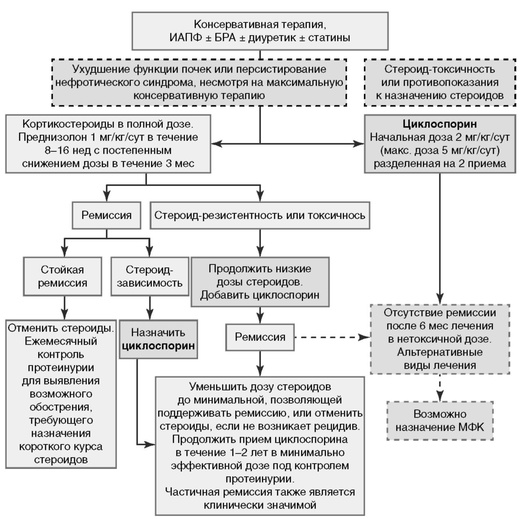
7.3.2. Инициальная терапия идиопатического ФСГС у взрослых (рис. ,1).
Рекомендация 7.3.2.1. Рекомендуется применение КС (1С).
Иммуносупрессивную терапию следует начинать, когда в результате максимальной консервативной терапии не удается снизить ПУ до величины <3 г/сут.
Цели терапии - достижение полной или частичной ремиссии ПУ, сохранение СКФ (табл. 1).
Рекомендация 7.3.2.2. Преднизолон предлагается назначать взрослым больным ежедневно в один прием в дозе 1 мгк/кг (максимально 80 мг/сут) или в альтернирующем режиме один прием через день в дозе 2 мгк/кг (максимально 120 мг/сут) (2С).
Рекомендация 7.3.2.3. В качестве инициальной терапии предлагается назначать высокие дозы КС как минимум в течение 4 нед; продолжать КС в высоких дозах при удовлетворительной их переносимости максимально до 16 нед или до достижения полной ремиссии, если она разовьется ранее 16 нед (2D).
Протокол лечения преднизолоном.
-
Преднизолон принимать ежедневно 1 мг/кг/сут (максимально 80 мг/сут) или в альтернирующем режиме 2 мг/кг/сут (максимально 120 мг/сут) минимум 4 нед (1 мес) максимум 16 нед (4 мес). Возможен вариант лечения, когда вначале проводят пульс-терапию преднизолоном (3 введения по 15 мг/кг, но не более 1000 мг на введение), а далее применяют описанную выше схему лечения преднизолоном 1 мг/кг/сут или 2 мг/ кг/сут в альтернирующем режиме.
-
После этого дозу преднизолона постепенно (по 2,5 мг в неделю) уменьшают до 0,6 мг/кг/сут (примерно 6 мес) и сохраняют в течение 1 мес. При достижении дозы преднизолона 20-30 мг/сут во избежание подавления функции надпочечников рекомендуется альтернирующий режим приема преднизолона. Перевод на альтернирующий режим возможен и ранее, особенно у пожилых пациентов.
-
В последующем снижают дозу преднизолона каждые 2 нед по 2,5 мг до поддерживающей - 10-15 мг/сут. В случаях полной и неполной ремиссии поддерживающая терапия продолжается около 24 мес, при необходимости она может быть продлена до 5 лет.
-
При абсолютной неэффективности такой схемы в течение первого года лечения следует обсудить другие варианты терапии.
Рекомендация 7.3.2.4. Дозу КС предлагается снижать постепенно в течение 6 мес после достижения полной ремиссии (2D).
Рекомендация 7.3.2.5. У пациентов с относительными противопоказаниям или непереносимостью высоких доз КС в качестве препаратов первой линии предлагается использовать КНИ (2D).
Терапия циклоспорином обеспечивает ремиссию ФСГС у значительной части пациентов (в среднем 40-50% у взрослых и до 60-70% у детей). Большинство этих пациентов стероидрезистентны, у стероидчувствительных больных ответ на терапию циклоспорином лучше.
Протокол лечения циклоспорином.
-
Циклоспорин назначается при персистировании ПУ >3 г/сут, несмотря на терапию преднизолоном (до 16 нед), а также в случаях, когда взрослые пациенты не достигли хотя бы частичной ремиссии (см. табл. 1) после 8 нед ежедневного приема преднизолона.
-
Циклоспорин также назначают больным стероидзависимым ФСГС (см. табл. 1), а также при наличии противопоказаний или выраженных побочных эффектах КС-терапии (неконтролируемый диабет, психические заболевания, тяжелый остеопороз, язвенная болезнь желудка или двенадцатиперстной кишки, ожирение и т.д.).
-
Терапию циклоспорином следует проводить с коррекцией на возраст и функцию почек. Циклоспорин следует применять с осторожностью у пациентов с СКФ <60 мл/мин/1,73м2 и с тубулоинтерстициальными изменениями в ткани почки; не использовать при СКФ<30 мл/ мин/1,73м2 и при выраженных тубулоинтерстициальных изменениях в ткани почки. При решении вопроса о назначении циклоспорина для оценки СКФ целесообразно проведение пробы Реберга, а не использование расчетных формул.
-
Терапию циклоспорином следует начинать с низких доз (2 мг/кг/сут в 2 приема с 12-часовым перерывом) с постепенным ее увеличением в среднем до 3,5-4 мг/кг/сут под тщательным фармакокинетическим контролем. Доза циклоспорина не должна превышать 5 мг/кг/сут. Для достижения максимального эффекта требуется длительное лечение (>6-12 мес), при терапии циклоспорином <6 мес наиболее часто развиваются рецидивы НС.
-
В первый месяц лечения уровень циклоспорина в крови контролируют 1 раз в неделю, подбирая дозу до оптимального значения по нулевой точке С0 в пределах 125-175 нг/мл (С2 <500 нг/мл).
-
Контроль за уровнем препарата в крови (С0 ) во 2-й месяц лечения осуществляют 1 раз в 2 нед, с 3-го по 6-й месяц - 1 раз в месяц, далее - 1 раз в 2 мес.
-
В дни контроля концентрации циклоспорина в крови мониторируют также следующие показатели: уровни креатинина, альбумина, билирубина, глюкозы, трансаминаз, электролитов в крови. Оценивают динамику ПУ.
-
Дозу циклоспорина в крови уменьшают при увеличении С0 >250 нг/мл или при нарастании креатинина крови более чем на 30% от исходного уровня либо увеличении сывороточного уровня трансаминаз и билирубина.
-
После достижения полной ремиссии дозу циклоспорина снижают постепенно по 0,5 мг/кг/сут до минимально эффективной дозы (1,5-2 мг/ кг/сут) и проводят такую поддерживающую терапию в течение 1-2 лет.
-
Если при применении циклоспорина в течение 6 мес ответа на терапию не наблюдается (минимальным ответом следует считать снижение ПУ на 50% по сравнению с исходным уровнем) или развиваются значимые нежелательные эффекты, должен рассматриваться вопрос о замене циклоспорина другим препаратом.
-
Пациенты, достигшие ремиссии, со стабильной функцией почек, получающие поддерживающую дозу циклоспорина <2 мг/кг/сут, имеют низкий риск развития нефротоксичности. У пациентов, требующих более высоких доз циклоспорина, после 24 мес лечения циклоспорином необходимо проведение повторной пункционной биопсии почек для оценки признаков хронической циклоспориновой нефротоксичности.
-
Применение циклоспорина возможно как в виде монотерапии (при наличии противопоказаний к кортикостероидам), так и в сочетании с преднизолоном. Преднизолон назначается в дозе 0,15 мг/кг/сут в течение 4-6 мес, затем постепенно снижается до 5-7,5 мг/сут и сохраняется до конца лечения циклоспорином.
7.3.3. Лечение рецидивов ФСГС.
Рекомендация 7.3.3.1. Лечение рецидива НС (табл. 1 у больных ФСГС предлагается проводить в соответствии с рекомендациями для рецидивирующей БМИ у взрослых - при редких рецидивах повторить курс терапии преднизолоном или провести лечение КНИ (2D).
7.3.4. Лечение стероидрезистентного ФСГС.
Рекомендация 7.3.4.1. Для лечения стероидрезистентного ФСГС (табл. 1) предлагается использовать циклоспорин в дозе 3-5 мг/кг/сут в 2 приема как минимум в течение 4-6 мес (2В).
Рекомендация 7.3.4.2. При достижении частичной или полной ремиссии предлагается продолжить лечение циклоспорином как минимум в течение 12 мес, с последующим постепенным снижением дозы (2D).
Рекомендация 7.3.4.3. У пациентов со стероидрезистентным ФСГС и непереносимостью циклоспорина предлагается лечение микофенолата мофетилом (2С).
7.4. Лечение ФСГС у детей (рис. 2).
Рекомендация 7.4.1. Выявление ФСГС у детей в большинстве случаев происходит после проведения нефробиопсии, назначенной в результате констатации стероидрезистентности. Детям раннего возраста, с субнефротической ПУ и при наличии сибсов с НС желательно проведение молекулярно-генетического исследования, положительный результат которого с большой долей вероятности предсказывает неэффективность иммуно-супрессивной терапии. Следует исключить синдромальные состояния, на фоне которых может развиться ФСГС (синдром Шимке, синдром Пирсона, синдром Шарко-Мари-Тут и др.) (2D).
Рекомендация 7.4.2. При отсутствии данных за вторичный или генетический характер ФСГС показано лечение КНИ - циклоспорин в дозе 3-6 мг/кг в 2 приема с 12-часовым интервалом под контролем концентраций в крови (С0 - 70-100 нг/мл, С2 - 500-1000 нг/мл), креатинина, калия и АД.
Рекомендация 7.4.3. Лечение циклоспорином желательно сочетать с преднизолоном в дозе 0,5-1 мг/кг через день. При побочных косметических эффектах возможна замена циклоспорина на такролимус, однако опыт применения последнего недостаточен.
Рекомендация 7.4.4. При отсутствии ремиссии на фоне лечения циклоспорином в течение 3-6 мес возможно применение 3-6 пульсовых введений метилпреднизолона в дозе 20 мг/кг.
Рекомендация 7.4.5. При достижении полной или частичной ремиссии НС на протяжении 6 мес применения циклоспорина показано продление терапии еще не менее чем на 6 мес.
Рекомендация 7.4.6. При рецидиве НС возможно повторное применение пульсов метилпреднизолона и или продолжить лечение циклоспорином.
Рекомендация 7.4.7. При рефрактерности к лечению циклоспорином возможно достижение ремиссии применением микофенолата мофетила.
Рекомендация 7.4.8. Применение алкилирующих агентов при ФСГС у детей не рекомендуется.
Рекомендация 7.4.9. У детей с ФСГС и субнефротической ПУ, а также при рефрактерности к иммуносупрессивной терапии показано длительное применение ИАПФ и/или БРА для снижения ПУ и замедления прогрессирования ХБП.
Полная ремиссия |
Снижение ПУ до уровня <0,2 г/сут (или <20 мг/моль (<0,2 г/г креатинина) и альбумин сыворотки >35 г/л |
Частичная ремиссия |
Снижение ПУ до уровня <0,2-20 г/сут (или <20200 мг/моль, <0,2-20 г/г креатинина) и стабильная СКФ (изменение креатинина <25%) или Снижение ПУ до уровня <0,2-3,5 г/сут и снижение >50% от исходного уровня, стабильная СКФ |
Рецидив |
Увеличение ПУ >3,5 г/сут или (>350 мг/моль, >3,5 г/г креатинина) и альбумин сыворотки >35 г/л после того, как была достигнута полная ремиссия |
Стероидрезистентность |
Персистирующая ПУ, несмотря на лечение преднизолоном 1 мг/кг/сут или 2 мг мг/кг через день, проводимое >4 мес |
Стероидчувствительность |
2 рецидива во время курса стероидной терапии или в период 2 нед после завершения курса стероидной терапии |
8. Прогноз
-
Прогноз при идиопатическом ФСГС, протекающем без НС и нарушения функции почек, благоприятный - риск развития ТПН низкий, почечная выживаемость в течение 6,5-9 лет более 95%. Больные ФСГС с персистирующей ПУ (даже без НС) имеют повышенный риск ССО. Снизить риск прогрессирования ХБП и сердечно-сосудистых заболеваний позволяют препараты, блокирующие РААС.
-
Среди морфологических признаков прогностически неблагоприятными являются:
-
Значительно возрастает доля ФСГС в структуре ТПН (до 50%), что указывает в целом на прогрессирующий характер заболевания.
СПИСОК ЛИТЕРАТУРЫ
-
Грене Г.-Й., Кисс Е. Нефротический синдром: гистопатологическая диагностика. Болезнь минимальных изменений, фокально-сегментарный гломерулосклероз, мембранозная нефропатия // Нефрология. 2007. Т. 11, № 4. С. 88-94.
-
Захарова Е.В. Роль циклоспорина в лечении идиопатического гломерулонефрита и волчаночного нефрита // Нефрология и диализ. 2010. Т. 12, № 2. С. 126-141.
-
Козловская Л.В. Хронический гломерулонефрит: аргументы в пользу циклоспорина // Клин. нефрология. 2010. № 3. С. 56-61.
-
Комарова О.В., Матвеева М.В., Цыгин А.Н., Леонова Л.В. и др. Эффективность и безопасность пролонгированной терапии циклоспорином детей с фокально-сегментарным гломерулосклерозом // Вопр. соврем. педиатрии. 2010. Т. 9, № 4. С. 155-159.
-
Смирнов А.В. Лечение гломерулопатий циклоспорином: правильный подход с неверным обоснованием // Нефрология. 2010. Т. 14, № 4. С. 9-22.
-
Смирнов А.В. Практические вопросы применения циклоспорина в лечении гломерулопатий // Нефрология. 2010. Т. 14, № 4. С. 96-102.
-
Braun N., Schmutzler F., Lange C. et al. Immunosuppressive treatment for focal segmental glomerulosclerosis in adults // Cochrane Database Syst. Rev. 2008. Issue 3: CD003233.
-
Cattran D.C., Appel G.B., Hebert L.A. et al. A randomized trial of cyclo-sporine in patients with steroid-resistant focal segmental glomerulosclerosis. North America Nephrotic Syndrome Study Group // Kidney Int. 1999. Vol. 56, N 6. P. 2220-2226.
-
Cattran D.C., Alexopoulos E., Heering P. et al. Cyclosporin in idiopathic glomerular disease associated with the nephritic syndrome: workshop recommendations // Kidney Int. 2007. Vol. 72, N 12. P. 1429-1447.
-
Chun M.J., Korbet S.M., Schwartz M.M. et al. Focal segmental glomerulosclerosis in nephrotic adults: presentation, prognosis, and response to therapy of the histologic variants // J. Am. Soc. Nephrol. 2004. Vol. 8. P. 2169-2177.
-
D’Agati V. Pathologic classification of focal segmental glomerulosclerosis // Semin. Nephrol. 2003. Vol. 23, N 2. P. 117-134.
-
Deegens J.K. Review of diagnosis and treatment of focal glomerulosclerosis // Neth. J. Med. 2008. Vol. 66, N 3. P. 11-16.
-
Gipson D., Gipson K., Gipson P., Watkins S. et al. Therapeutic approach to FSGS in children // Pediatr. Nephrol. 2007. Vol. 22. P. 28-36.
-
Kidney Diseases: Improving Global Outcomes (KDIGO) Glomerulonephritis Work Group. KDIGO Clinical Practice Guideline for glomerulonephritis // Kidney Int. Suppl. 2012. Vol. 2, N 2. P. 139-274.
-
Korbet S.M. Treatment of primary FSGS in adults // J. Am. Soc. Nephrol. 2012. Vol. 23. P. 1769-1776.
-
Korbet S.M. Treatment of primary FSGS in adults // Kidney Int. 2002. Vol. 62, N 6. P. 2301-2310.
-
Senthil Nayagam L. Mycophenolatemofetil ore standard therapy for membranous nephropathy and focal segmental glomerulosclerosis: a pilot study // Nephrol. Dial. Transplant. 2008. Vol. 23, N 6. P. 1926-1930.
-
Shankland S.J. The podocyte’s response to injury: Role in proteinuria and glomerulosclerosis // Kidney Int. 2006. Vol. 69. P. 2131-2147.
МЕМБРАНОЗНАЯ НЕФРОПАТИЯ
1. Определение, эпидемиология
Мембранозная нефропатия (МН) (синоним мембранозный ГН) - вариант иммуноопосредованной гломерулопатии, характеризующийся диффузным утолщением и изменением структуры гломерулярной базальной мембраны вследствие субэпителиальной и интрамембранозной депозиции иммунных комплексов (ИК) и отложения матриксного материала, продуцируемого пораженными подоцитами. Клеточная пролиферация при МН не выявляется
Эпидемиология
-
МН составляет 12-23% всех морфологических вариантов первичного ГН у взрослых и 1-5% у детей.
-
Первичная МН развивается чаще у взрослых (особенно в возрасте 30-50 лет), среди заболевших преобладают мужчины (2,2м:1ж). У мужчин МН протекает тяжелее, чем у женщин.
-
У взрослых МН - самая частая причина НС - 20-40% случаев, у детей она выявляется менее чем у 2% больных с НС.
-
Вторичная МН чаще развивается у детей (75%), а не у взрослых (25%).
-
МН рецидивирует в трансплантате у 10% больных, может развиться в трансплантате de novo .
2. Классификация, этиология
Классификация
Основой формирования ИК является образование аутоантител к внутренним антигенам клубочка. У 70-80% пациентов выявляются АТ к подоцитарному трансмембранному рецептору фосфолипазы А2 М-типа (PLA2 R-AT) (преимущественно IgG4 класса). У 20-30% пациентов с первичной МН внутренние антигены клубочков и аутоантитела к ним не идентифицированы
Является результатом специфического поражения клубочков ИК, в которые включены экзогенные (вирусные, опухолевые и др.) антигены. Развивается на фоне аутоиммунных заболеваний, опухолей, инфекций, лекарственных воздействий
Связывают с фетоматеринской иммунизацией женщин АТ к нейтральной эндопептидазе (NEP) (мембраноассоциированному антигенному белку подоцитов) и развитием типичной МН у плода.
Аллоиммунный механизм развития наблюдается в случае de novo развившейся посттрансплантационной МН у NEP-дефицитных реципиентов.
Механизм развития
Иммунокомплексный.
-
In situ формируются ИК из связанного с подоцитами антигена и ауто-антител IgG-класса, что ведет к активации комплемента по классическому пути с образованием в субэпителиальном пространстве мембраноатакующего комплекса - МАC (С5в-9). Основной субкласс АТ при идиопатической МН - IgG4, при вторичных формах МН могут обнаруживаться субэпителиальные и интрамембранозные депозиты и других субклассов - IgG1, IgG3 и др.
-
МАC (С5в-9) вызывает сублетальное повреждение подоцитов через образование реактивных кислородных радикалов и эйкозаноидов, реорганизацию активного цитоскелета, диссоциацию белков щелевидной диафрагмы путем прямого цитопатического действия. В результате этих повреждений усиливается проницаемость гломерулярной капиллярной стенки, развивается ПУ.
3. Клиническая картина
-
У большинства больных развивается НС (80%), реже ПУ без НС (20%).
-
АГ в начале заболевания наблюдается редко, в дальнейшем она развивается у 20-50% больных.
-
Содержание комплемента в сыворотке крови при первичной МН не изменено, при ряде вторичных форм (СКВ, HBV-инфекция) может быть снижено.
-
При вторичной форме отмечают клинические и лабораторные признаки заболевания, вызвавшего развитие МН.
-
У больных МН с НС чаще, чем при других морфологических вариантах ГН, развиваются тромботические осложнения, в том числе тромбоз почечных вен (29%), тромбозы глубоких вен конечностей (17%), легочные тромбоэмболии (17%).
4. Принципы диагностики
Рекомендация 4.1. Диагноз МН основывается на данных морфологического исследования (НГ).
Морфологические критерии МН
Общие признаки
На светооптическом уровне отмечаются изменение капиллярной стенки за счет утолщения гломерулярной базальной мембраны, отсутствие клеточной пролиферации, при иммуногистохимическом исследовании - фиксация разных классов IgG и компонентов комплемента (С3, С5в-9), при электронной микроскопии - субэпителиальные депозиты.
Стадии МН
-
На первой стадии светооптически базальная мембрана не изменена, а при электронной микроскопии на ее эпителиальной стороне выявляют гранулы электронноплотного материала (иммуногистохимически ему соответствуют отложения иммуноглобулинов и комплемента). Изменения очаговые, сегментарные.
-
На второй стадии светооптически находят утолщение стенок капилляров, при серебрении тонких срезов видны пунктирность, шипики на эпителиальной стороне мембраны. Электронно-микроскопически выявляют диффузно распределенные по базальной мембране всех капилляров субэпителиальные гранулы электронно-плотного материала.
-
Третья стадия МН светооптически характеризуется выраженным диффузным утолщением и неравномерным окрашиванием стенок капилляров клубочка. При электронной микроскопии выявляют замурованные веществом базальной мембраны отложения, имеющие зернистую структуру и меньшую электронную плотность, чем в первых двух стадиях.
-
В четвертой стадии базальная мембрана неравномерной толщины, просветы капилляров сужены. При электронной микроскопии в резко утолщенной базальной мембране обнаруживают полости с остатками бывших там ранее отложений электронноплотного материала. Иммунофлюоресценция в этой стадии, как правило, дает отрицательные результаты.
Принципы диагностики
Первые две стадии морфологических изменений выявляют у больных на 1-2-м году болезни, при них возможны обратное развитие ПУ, ремиссия НС, обусловленные регрессом мембранозной трансформации клубочков. Третью стадию МН наблюдают на 4-5-м году болезни, клинически она проявляется высокой ПУ, НС, возможно формирование ПН. Четвертую стадию морфологических изменений наблюдают в период от 5 до 10 лет болезни и позднее, эти изменения, как правило, необратимые, клубочковые изменения усугублены явлениями склероза в интерстиции, сосудистыми изменениями. Клинически для этой стадии характерны явления ПН, артериальная гипертония.
Рекомендация 4.2. Клиническая диагностика идиопатической МН должна базироваться на исключении всех возможных вторичных причин заболевания (НГ).
-
Первоочередная задача обследования больного с впервые выявленной МН - исключить вторичные причины заболевания (табл. 1). Необходимы тщательный сбор анамнеза, комплексная оценка клинико-лабораторных данных.
-
Больным МН, относящимся к старшей возрастной группе (особенно старше 65 лет), должен быть проведен онкопоиск с целью исключения паранеопластического характера нефропатии.
Причины вторичной мембранозной нефропатии
СКВ, ревматоидный артрит, смешанное заболевание соединительной ткани, дерматомиозит, анкилозирующий спондилит, системная склеродермия, миастения гравис, буллезный пемфигоид, аутоиммунный тиреоидит, синдром Шегрена, височный артериит, болезнь Крона, реакция «трансплантат против хозяина»
Гепатит В, гепатит С, ВИЧ, малярия, шистосомиаз, филяриоз, сифилис, энтерококковый эндокардит, эхинококкоз, лепра.
Карциномы (легких, пищевода, толстой кишки, молочной железы, желудка, почек, яичников, простаты, полости рта и гортани).
Не карциномы (ходжкинская лимфома, неходжкинская лимфома, хроническая лимфоцитарная лейкемия, мезотелиома, меланома, опухоль Вильмса, аденома печени, ангиофолликулярная лимфома, шваннома, нейробластома, ганглионейрома надпочечников).
Золото, пеницилламины, буцилламин℘, препараты ртути, каптоприл, пробенецид℘, триметадион℘, нестероидные противовоспалительные средства, ингибиторы циклооксигеназы 2, клопидогрел, литий, формальдегид, углеводородные соединения.
Саркоидоз, серповидноклеточная анемия, поликистоз, дефицит α1-антитрипсина, болезнь Вебера-Кристиана, первичный билиарный цирроз, системный мастоцитоз, синдром Гийена-Баре, уртикарный васкулит, гемолитико-уремический синдром, герпетиформный дерматит, миелодисплазия).
5. Дифференциальная диагностика
Рекомендация 5.1. Дифференциальную диагностику проводятсдругими протеинурическими формами ГН, для чего обязательно морфологическое исследование ткани почки (НГ).
Рекомендация 5.2. Клинические проявления МН не различаются при идиопатическом и вторичном вариантах заболевания, в этой связи дифференциальная диагностика этих форм должна базироваться на исключении всех возможных вторичных причин МН (НГ).
Рекомендация 5.3. Детальное морфологическое исследование ткани почки, в частности уточнение преобладающего класса IgG, выявление АТ к PLA2R при иммунофлюоресценции, а также обнаружение этих АТ в сыворотке крови могут быть полезными при разграничении первичной и вторичной форм МН, однако диагностическая значимость и специфичность этих тестов нуждаются в дальнейших исследованиях (НГ).
6. Лечение
6.1. У больных идиопатической МН возможно развитие спонтанных ремиссий (НГ).
Спонтанные ремиссии
-
Примерно у 20% пациентов с идиопатической МН развиваются полные спонтанные ремиссии НС (ПУ <0,3 г/сут, подтвержденная дважды с интервалом исследования в 1 нед, при нормальном уровне альбумина сыворотки крови), у 15-20% - частичные спонтанные ремиссии НС (ПУ <3,5 г/сут или снижение ПУ >50% от исходно высокого уровня, подтвержденные дважды с интервалом исследования в 1 нед, сопровождающиеся улучшением или нормализацией показателя альбумина сыворотки крови).
Около 15-30% больных имеют один или более рецидивов НС, у 50% больных наблюдается персистирующий НС.
-
Спонтанные ремиссии могут продолжаться 18-24 мес, но в большинстве случаев они крайне нестабильны.
-
Частота достижения спонтанных ремиссий у больных МН тем ниже, чем более высокая ПУ выявляется на момент постановки диагноза.
-
Несмотря на нестабильность спонтанных ремиссий, при возможности их достижения прогноз у больных с МН более благоприятный, чем у пациентов с персистирующим НС.
-
Предсказать, у кого из больных МН разовьется спонтанная ремиссия, не представляется возможным.
-
По немногочисленным наблюдениям у детей частота спонтанных ремиссий составляет от 30% до 75%. Они более вероятны при отсутствии АГ и при дебюте заболевания в младшем возрасте.
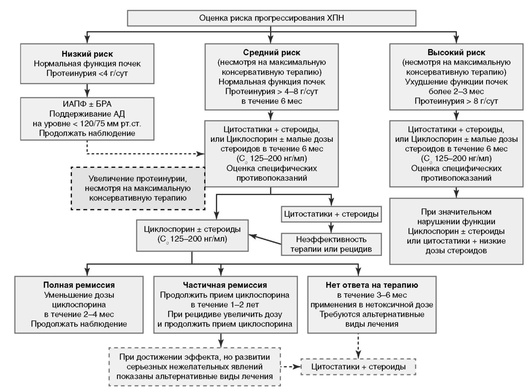
6.2. Современная тактика лечения больных МН основывается на стратификации рисков).
Рекомендация 6.2.1. Установлены основные факторы, с наибольшей точностью предсказывающие почечный прогноз. Неблагоприятное прогностическое значение имеют высокая персистирующая ПУ, нарушение функции почек на момент диагноза и/или ее ухудшение в течение 6 мес наблюдения (1В).
Рекомендация 6.2.2. С меньшей степенью доказательности в качестве предикторов прогрессирования МН рассматриваются мужской пол, возраст (старше 50 лет), наличие артериальной гипертонии, гистологические признаки тубулоинтерстициального фиброза и канальцевой атрофии, уровень экскреции с мочой IgG, С5в-9 и др. (НГ).
Стратификация риска прогрессирования МН:
-
Низкий риск прогрессирования имеют больные МН с ПУ <4 г/сут, с нормальной функцией почек на момент диагноза и сохраняющие ее в течение 6 мес наблюдения (с вероятностью 85-90% ПН не разовьется в ближайшие 10 лет).
-
Средний риск прогрессирования имеют пациенты с ПУ 4-8 г/сут, с нормальной функцией почек и без ее ухудшения в течение 6 мес наблюдения (с вероятностью 50-55% прогрессирование ХБП через 10 лет).
-
Высокий риск прогрессирования имеют больные МН с ПУ >8 г в сутки, независимо от состояния функции почек (с вероятностью 65-80% прогрессирование ХБП в течение 10 лет), а в сочетании с нарушенной функцией почек, а также при выявлении тубулоинтерстициальных изменений в ткани почек эта вероятность значительно увеличивается.
6.3. Лечение больных идиопатической МН без НС (рис. 1).
Рекомендация 6.3.1. Больным МН без НС с нормальной функцией почек нецелесообразно проведение иммуносупрессивной терапии, так как риск развития ПН у них минимален и они не подвержены опасным проявлениям НС (НГ).
Рекомендация 6.3.2. Пациенты должны находиться под регулярным наблюдением нефролога для своевременного выявления АГ, роста ПУ, креатинина (НГ).
Рекомендация 6.3.3. При ПУ >0,5 г/сут назначаются ИАПФ или БРА как с антипротеинурической целью, так и для замедления развития фиброза в почках (НГ).
Рекомендация 6.3.4. У пациентов с МН и дислипидемией проводится коррекция нарушений липидного обмена согласно соответствующим рекомендациям для больных ХБП (НГ).
Рекомендация 6.3.5. Пациентам с АГ показано своевременное лечение антигипертензивными препаратами, с позиций нефро- и кардиопротекции предпочтительны ИАПФ или БРА (НГ).
6.4. Лечение больных идиопатической МН с НС (рис. 1).
Рекомендация 6.4.1. В связи с возможностью развития при идиопатической МН спонтанных ремиссий (30-35% случаев), у пациентов с НС, у которых не наблюдаются быстрое ухудшение функции почек и осложнения НС, оправданна попытка отсрочить начало иммуносупрессивной терапии как минимум на 6 мес с назначением препаратов, блокирующих РААС (ИАПФ, БРА). Нефропротективная терапия без назначения иммуносупрессантов при идиопатической МН с НС может быть более 6 мес при четкой тенденции к снижению ПУ, стабильной функции почек, отсутствии осложнений HC (НГ).
Показания к иммуносупрессивной терапии
Рекомендация 6.4.2. Инициальную иммуносупрессивную терапию рекомендуют только больным МН с НС при наличии как минимум одного из следующих условий:
Рекомендация 6.4.2.1. Экскреция белка превышает 4 г в сутки у взрослых (более 2,5 г/л в сутки у детей), сохраняется на уровне >50% от исходного и не имеет тенденции к снижению на фоне антигипертензивной и антипротеинурической терапии в течение периода наблюдения как минимум 6 мес (1В).
Рекомендация 6.4.2.2. Имеются тяжелые, инвалидизирующие и жизнеугрожающие симптомы, связанные с НС (1С).
Рекомендация 6.4.2.3. Креатинин сыворотки повышается на 30% или более в течение 6-12 мес от момента постановки диагноза (но рСКФ не более 25-30 мл/мин/1,73 м2 ), и эти изменения не могут быть объяснены другими осложнениями (2С).
Рекомендация 6.4.3. Позднее начало иммуносупрессивной терапии, когда развилась ПН и имеются выраженные тубулоинтерстициальные изменения в ткани почки, малоэффективно. Кроме того, у больных с ПН выше риск осложнений иммуносупрессивной терапии (НГ).
Рекомендация 6.4.4. Иммуносупрессивная терапия не применяется у больных МН: со стабильным креатинином >3,5 мг/дл (>320 мкмоль/л) (или рСКФ <30 мл/мин/1,73 м2) и уменьшением размеров почек по данным ультразвукового исследования (УЗИ) (длина почки <8 см) или у пациентов с тяжелыми или потенциально жизнеугрожающими инфекциями (НГ).
Иммуносупрессивная терапия больных МН с НС
Рекомендация 6.4.5. Инициальная иммуносупрессивная терапия.
Рекомендация 6.4.5.1. Для инициальной терапии МН рекомендуется 6-месячный курс с чередованием циклов кортикостероидов внутрь и в/в и алкилирующих препаратов (циклофосфамид или хлорамбуцил) (1B).
При лечении МН алкилирующими цитостатиками в сочетании с кортикостероидами у 60% больных удается достичь полной ремиссии, что в 1,52 раза превышает таковую при лечении КНИ с кортикостероидами.
Рекомендация 6.4.5.2. Так как циклофосфамид эквивалентен по эффективности хлорамбуцилу, но имеет меньше побочных реакций, для инициальной терапии предпочтительнее применение циклофосфамида (2B).
Рекомендация 6.4.5.3. Дозу циклофосфамида и хлорамбуцила модифицируют в соответствии с возрастом больного и рСКФ (НГ).
Схема Понтичелли:
* Контролировать уровни креатинина сыворотки, альбумина, лейкоцитов периферической крови и экскрецию белка с мочой каждые 2 нед в течение первых 2 мес, затем ежемесячно до 6 мес. Если количество лейкоцитов в периферической крови снижается <3,5х109/л, отменить циклофосфамид или хлорамбуцил до восстановления лейкоцитов >4,0х109/л.
Рекомендация 6.4.5.4. Безуспешность лечения констатируют только при отсутствии достижения ремиссии минимум после 6 мес указанной терапии, если не пришлось его прекратить по причине резкого снижения функции почек или развития жизнеугрожающих осложнений НС (1С).
Рекомендация 6.4.5.5. При быстром снижении функции почек (удвоение креатинина сыворотки в течение 1-2 мес наблюдения) при отсутствии массивной ПУ (>15 г/сут) показана повторная биопсия почки для уточнения причины нарастания (НГ).
Рекомендация 6.4.5.6. Альтернативой преднизолону и алкилирующим агентам для инициальной терапии МН являются КНИ (циклоспорин, такролимус).
Циклоспорин, помимо иммуносупрессорного действия на уровне T-и B-клеток, оказывает непосредственное воздействие на подоциты. Он блокирует кальцинейрин-опосредованное дефосфорилирование синаптоподина (защищает его от протеолиза), стабилизируя таким образом актиновый цитоскелет подоцита.
Рекомендация 6.4.5.6а. Циклоспорин или такролимус рекомендуется использовать для инициальной терапии МН минимум 6 мес у больных с НС, отвечающим критериям проведения инициальной терапии (см. выше), которые имеют противопоказания к применению преднизолона/алкилирующих препаратов (тяжелый диабет, психические расстройства, остеопороз, нарушение репродуктивной функции) или отказываются от их циклического приема (1С).
Циклоспорин: 3,5-5,0 мг/кг/сут внутрь в 2 приема в равных дозах с интервалом в 12 ч, в комбинации с преднизолоном 0,15 мг/кг/сут в течение 6 мес.
Такролимус: 0,05-0,075 мг/кг/сут в 2 приема в равных дозах с интервалом в 12 ч без преднизолона в течение 6-12 мес.
Рекомендация 6.4.5.6b. Терапию данными препаратами начинать с наименьшей рекомендованной дозы и повышать ее постепенно во избежание острой нефротоксичности. Необходимо регулярно мониторировать концентрацию препаратов в крови в период инициальной терапии, а также при выявлении необъяснимого повышения креатинина крови (>20%) в любом периоде лечения (НГ).
-
Острая нефротоксичность развивается в первые 3 мес лечения, тесно связана с увеличением дозы циклоспорина. Проявляется развитием АГ, снижением СКФ и увеличением уровня креатинина сыворотки крови, в основе которых лежат вызванные циклоспорином системная вазоконстрикция и сужение приносящей артериолы в клубочках. Поэтому необходим мониторинг АД, уровня креатинина и концентрации циклоспорина в крови. С целью профилактики гипертензивного побочного действия циклоспорина и его констриктивного воздействия на афферентную артериолу клубочков могут быть использованы антагонисты кальция.
-
В первый месяц лечения уровень циклоспорина в крови контролируют 1 раз в неделю, подбирая дозу до оптимального значения по нулевой точке С0 в пределах 125-200 нг/мл (С2 <500 нг/мл).
-
Контролируют уровень препарата в крови (С0) во 2-й месяц лечения 1 раз в 2 нед, с 3 по 6-й месяц - 1 раз в месяц, далее - 1 раз в 2 мес.
-
При увеличении концентрации креатинина более чем на 30% от исходного уровня (даже в рамках нормальных его значений) требуется снижение его дозы - обычно на 1 мг/кг/сут. Если доза циклоспорина снижена на 1 мг/ кг/сут, а уровень креатинина продолжает превышать 30% от базального уровня, циклоспорин временно отменяют. Когда креатинин снизится до уровня, не превышающего 15% от исходного, можно возобновить прием циклоспорина в более низких дозах.
-
Особой формой острой циклоспориновой нефротоксичности (особенно в детской практике) является ТМА, обусловленная повреждением эндотелия сосудов микроциркуляторного русла (ишемия, активация РААС, прямое нефротоксическое действие циклоспорина), агрегацией тромбоцитов и активацией протромбогенных плазменных факторов. Развитие ТМА требует отмены циклоспорина. Сочетанное применение циклоспорина с кортикостероидами снижает риск развития этого осложнения, но не предупреждает его.
-
Хроническая нефротоксичность может отмечаться даже в случаях строгого соблюдения дозировки циклоспорина, как правило, при длительном его применении. В развитии этого осложнения, помимо сосудистых причин (см. выше), важную роль играет активация профиброгенных и провоспалительных цитокинов. Морфологическими эквивалентами хронической циклоспориновой нефротоксичности являются тубулоинтерстициальный фиброз, атрофия и микрокальцификация канальцев, гиалиноз срединной оболочки артериол, гипертрофия юкстагломерулярного аппарата клубочков. В тяжелых случаях развивается фокально-сегментарный или глобальный гломерулосклероз. В диагностике хронической циклоспориновой нефротоксичности большое значение имеет нефробиопсия, которую лучше всего выполнять на регулярной основе (1 раз в год или реже по показаниям). Регулярный прием блокаторов РААС, статинов способен предотвратить выраженные изменения в почечной паренхиме, обусловленные хронической циклоспориновой нефротоксичностью.
Рекомендация 6.4.5.6с. У пациентов, которые не достигли полной или частичной ремиссии в течение 6 мес, предлагается отменять КНИ (2С).
Рекомендация 6.4.5.6d. Предлагается снижать дозу КНИ с интервалами 4-8 нед до 50% от начальной дозы, если ремиссия сохраняется, нет признаков токсичности, и продолжать такое лечение как минимум 12 мес (2С).
Рекомендация 6.4.5.7. Для инициальной терапии при идиопатической МН не рекомендуется монотерапия кортикостероидами (1В).
Рекомендация 6.4.5.8. Для инициальной терапии МН предлагается не применять:
Рекомендация 6.4.5.8а. Препараты МФК (2С).
Рекомендация 6.4.5.8b. Ритуксимаб (2D).
Рекомендация 6.4.5.9. При лечении идиопатической МН у детей предлагается:
Рекомендация 6.4.5.9а. Использовать рекомендации по лечению для взрослых (2С);.
Рекомендация 6.4.5.9b. Не назначать более одного курса циклической терапии кортикостероидами и алкилирующими агентами (2D).
Рекомендация 6.4.5.9с. С учетом большей вероятности спонтанных ремиссий и риска необратимой гонадотоксичности при применении алкилирующих агентов лечение МН у детей предпочтительно начинать с КНИ под контролем концентрации в крови.
Целевой уровень С0 для циклоспорина 70-100 нг/мл, для такролимуса - 5-10 нг/мл. Общую продолжительность терапии желательно ограничить 1-2 годами с последующей попыткой снижения дозы (НГ).
Рекомендация 6.4.6. Терапия резистентных форм.
Рекомендация 6.4.6.1 . Для лечения идиопатической МН, резистентной к терапии преднизолоном и алкилирующими препаратами, предлагается применять КНИ (2C).
Рекомендация 6.4.6.2. Лечение пациентов с МН, резистентной к КНИ, предлагается проводить с использованием преднизолона/алкилирующих препаратов (2C).
Рекомендация 6.4.6.3. Для лечения МН, резистентной к терапии преднизолоном и алкилирующими препаратами, а также к КНИ, возможно применение ритуксимаба, однако доказательная база нуждается в усилении (НГ).
Рекомендация 6.4.7. Терапия рецидивов НС.
Рекомендация 6.4.7.1. Лечение рецидивов НС у больных с МН предлагается проводить повторными курсами тех же препаратов, которые ранее вызывали ремиссию (2D).
Рекомендация 6.4.7.2. В тех случаях, когда в качестве инициальной терапии использовались циклические 6-месячные курсы кортикостероидов/ алкилирующих препаратов, предлагается повторять эту схему для лечения рецидивов не более одного раза (2В).
Рекомендация 6.4.8. При противопоказаниях к активной иммуносупрессивной терапии или при ее неэффективности целесообразно проводить лечение ИАПФ или БРА, гиполипидемическими препаратами (НГ).
Рекомендация 6.4.9. Больным МН с НС при снижении сывороточного альбумина <2,5 г/дл и при наличии дополнительных факторов риска тромбозов (иммобилизация, обезвоживание, интеркуррентные инфекции, хирургические вмешательства и др.) предлагается профилактическая антикоагулянтная терапия с использованием варфарина (2С).
7. Прогноз
-
У нелеченных больных идиопатической МН с НС прогрессирование с развитием ТПН через 5 лет наблюдается у 14% пациентов, через 10 лет - у 30%, через 15 лет - у 40%. У детей развитие ПН отмечено в 17-25% случаев.
-
Факторами неблагоприятного прогноза являются ПУ >8 г/сут, снижение почечной функции на момент постановки диагноза, мужской пол, возраст старше 50 лет, выраженность тубулоинтерстициального фиброза, отсутствие ответа на лечение (см. Рекомендацию 6.2.2).
СПИСОК ЛИТЕРАТУРЫ
-
Аткинс Р.К. Гломерулонефриты // Нефрология и диализ. 2000. Т. 2, № 4. С. 225-229.
-
Захарова Е.В. Роль циклоспорина в лечении идиопатического гломерулонефрита и волчаночного нефрита // Нефрология и диализ. 2010. Т. 12. № 2. С. 126-141.
-
Козловская Л.В. Хронический гломерулонефрит: аргументы в пользу циклоспорина // Клин. нефрология. 2010. № 3. С. 56-61.
-
Мухин Н.А., Козловская Л.В. Мембранозная нефропатия: как дифференцировать первичный и вторичный варианты // Клин. нефрология. 2009. № 2. С. 75-78.
-
Смирнов А.В. Лечение гломерулопатий циклоспорином: правильный подход с неверным обоснованием // Нефрология. 2010. Т. 14, № 4. С. 9-22.
-
Смирнов А.В. Практические вопросы применения циклоспорина в лечении гломерулопатий // Нефрология. 2010. Т. 14, № 4. С. 96-102.
-
Beck L.H., Bonegio R.G., Lambeau G. et al. M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy // N. Engl. J. Med. 2009. Vol. 361. P. 11-21.
-
Beck L.H., Fervenza F.C. Beck D.M. et al. Rituximab-induced depletion of anti-PLA2 R autoantibodies predicts response in membranous nephropathy // J. Am. Soc. Nephrol. 2011. Vol. 22. P. 1543-1550.
-
Bomback A.S., Derebail V.K., McGregor J.G. Rituximab therapy for membranous nephropathy // Clin. J. Am. Soc. Nephol. 2009. Vol. 4. P. 734-744.
-
Branten A.J. Mycophenolate mofetil in idiopathic membranous nephropa-thy. Clinical trial with comparison to a historical control group treated with cyclo-phosphamide // Am. J. Kidney Dis. 2007. Vol. 50. P. 248-256.
-
Cattran DC. Cyclosporin in idiopathic glomerular disease associated with the nephritic syndrome: workshop recommendations // Kidney Int. 2007. Vol. 72, N 12. P. 1429-1447.
-
Cattran D.C. North America nephrotic syndrome study G: Cyclosporin in patients with steroid resistant membranous nephropathy: a randomize trial // J. Am. Soc. Nephrol. 2001. Vol. 59. P. 1484-1490.
-
Cattran D.C. Management of Idiopathic membranous nephropathy. What and when for treatment // J. Am. Soc. Nephrol. 2005. Vol. 16. P. 1188-1194.
-
Debeick H., Lefeu F., Kemper M.J. et al. Early childhood membranous nephropathy induced by antibodies to cationic bovine serum albumin // N. Engl. J. Med. 2011. Vol. 364. P. 2101-2110.
-
Glassock R.J. The pathogenesis of idiopathic membranous nephropathy: a 50-year odyssey // Am. J. Kidney Dis. 2010. Vol. 38. P. 157-167.
-
Glassock R.J. Diagnosis and natural course of membranous nephropathy // Semin. Nephrol. 2003. Vol. 23. P. 324-332.
-
Kidney Diseases: Improving Global Outcomes (KDIGO) Glomerulonephritis Work Group. KDIGO Clinical Practice Guideline for glomerulonephritis // Kidney Int. Suppl. 2012. Vol. 2, N 2. P. 139-274.
-
Ponticelli C. Membranous nephropathy // J. Nephrol. 2007. Vol. 20, N 3. P. 268-287.
-
Ronco P., Debeic H. Advances in membranous nephropathy: success stories of a long journey // Clin. Exp. Pharmacol. Physiol. 2011. Vol. 38. P. 410-416.