Клиническая лабораторная диагностика. В 2 томах. Том 1. : национальное руководство / Под ред. В. В. Долгова - Москва : ГЭОТАР-Медиа, 2013. - 928 с. (Серия "Национальные руководства") - ISBN 978-5-9704-2467-4 |
Аннотация
Национальное руководство по клинической лабораторной диагностике разработано и рекомендовано Научно-практическим обществом специалистов клинической лабораторной медицины. В издании отражены все разделы клинических лабораторных исследований, представленные ведущими специалистами научных, образовательных и лечебно-профилактических учреждений, расположенных в Центральном, Северо-Западном, Сибирском, Уральском, Северо-Кавказском федеральных административных округах.
В том I включены материалы о научных основах и общей организации лабораторного обеспечения медицинской помощи в нашей стране, об аналитических технологиях и диагностическом применении наиболее часто используемых в клинической лабораторной диагностике биохимических, гематологических, коагулологических, цитологических исследований.
Наряду с этим представлены современные данные о передовых высокотехнологичных методах лабораторной диагностики и их применении при ряде состояний при беременности, онкологических заболеваниях, эндокринных нарушениях и наследственных болезнях обмена веществ, отравлениях. Представленные сведения основаны на данных современной научной литературы, рекомендациях профессиональных обществ специалистов, стандартах медицинской помощи, многолетнем научно-практическом опыте авторов.
Руководство предназначено для сотрудников клинико-диагностических лабораторий, врачей различных клинических дисциплин, студентов медицинских образовательных учреждений. Материалы руководства могут быть использованы как для базового медицинского образования, так и для последипломной подготовки.
В этой главе содержится информация о биохимических исследованиях, наиболее часто используемых в клинической практике. Применение биохимических исследований в клинической диагностике опирается на фундаментальные представления о химическом составе клеток и биологических жидкостей организма человека, закономерно происходящих в них процессах метаболизма, специфической связи определенных соединений и веществ с функциями органов и физиологических систем, первичных биохимических расстройствах, вызывающих определенные болезни, вызванных болезнями вторичных нарушениях биохимического равновесия.
Из всего обилия соединений, когда-либо обнаруженных в тканях и биологических жидкостях организма человека, в клинико-биохимических исследованиях внимание привлечено к той части соединений, обнаружение или измерение содержания которых позволяет достоверно охарактеризовать определенную функцию организма или состояние определенного органа, т.е. несет диагностическую информацию. Поэтому из примерно 5 млн белков человеческого организма в повседневной лабораторной практике исследуют около 200 (хотя в ходе поиска новых, диагностически важных белковых соединений, например для онкодиагностики, в рамках исследований протеома изучают тысячи белковых молекул).
Результаты клинико-биохимических исследований позволяют не только яснее представлять механизмы патогенеза определенных болезней, но и создавать диагностические алгоритмы с использованием достаточно специфичных и чувствительных биомаркеров искомых патологических процессов. Сфера клинико-биохимических исследований охватывает широкий круг аналитов, имеющих различные характеристики их структуры и свойств, - от простых ионов и малых органических молекул до сложных высокомолекулярных соединений, выполняющих функции катализа и регуляции процессов метаболизма. В связи с этим в современной клинической химии принято подразделять изучаемые аналиты на отдельные классы соответственно их особенностям. В руководствах применяют различные подходы для классификации и рассмотрения клинико-химических аналитов:
-
по особенностям структуры (например, белки, липиды, углеводы);
-
связи с функцией определенных органов (например, показатели функции печени, почек);
-
собственной функциональной роли (например, гормоны и медиаторы, факторы кислотно-основного равновесия);
-
связи с поражениями определенных органов и систем (например, биохимия диабета, биохимические изменения при неврологических и психических расстройствах).
В данном руководстве применена классификация аналитов по их основным функциям в обмене веществ: ферменты, субстраты и продукты химических реакций, индивидуальные белки, газы и электролиты, витамины и биоактивные медиаторы. В рамках каждого класса биохимические тесты расположены в алфавитном порядке. Приведены сведения о каждом аналите, изучаемом в практической лаборатории: основная биохимическая характеристика, данные о структуре, исследуемом материале (пробе), референтных пределах, клиническом использовании, влияющих факторах.
Лабораторные тесты можно выполнять различными методами, имеющими особенности референтных пределов, подготовки пациентов, взятия и хранения материала, лекарственной интерференции. Именно поэтому при описании некоторых тестов значения референтных пределов соотнесены с определенным методом исследования, а также возрастом и полом. При биохимических исследованиях оценивают клиническую значимость комплекса показателей, каждый из которых имеет специфическое значение. При использовании данных лабораторных исследований в клинической диагностике врач обычно сопоставляет результат исследования с должными значениями, свойственными состоянию здоровья (референтными пределами). При этом следует иметь в виду те пределы, которые использует данная лаборатория. Это необходимо потому, что в условиях отсутствия стандартизированных технологий и при применении лабораториями аналитических тест-систем, не имеющих калибровки едиными калибраторами, референтные пределы могут существенно отличаться от значений, приводимых в литературе. Стандартизация методов достигается применением международных рекомендаций: DGKC - рекомендации Немецкого общества клинической химии, IFCC - рекомендации Международной федерации клинической химии. К сожалению, на практике в лабораториях могут применяться методы, отличающиеся от рекомендованных профессиональными организациями специалистов.
Приводимые применительно к каждому аналиту сведения о возможных ситуациях, связанных с повышением или понижением его концентрации или активности, обусловлены тем, что многие компоненты клеток и биожидкостей полифункциональны, они могут испытывать влияние многих одновременно происходящих в организме процессов. Следует применять способы оценки диагностической специфичности и чувствительности теста, его предсказательного значения по отношению к искомой патологии. Не менее важно при интерпретации результатов исследований учитывать наличие возможных влияющих факторов: применяемых лекарственных средств и других лечебных процедур, условий перед взятием пробы биоматериала (время суток, прием пищи, физическую активность) и др. Если нет специального указания, для плановых биохимических исследований кровь забирают из вены утром натощак (через 8-10 ч после последнего приема пищи). Необходимо учитывать, что влияние на результат исследования перечисленных при описании тестов лекарственных препаратов и других факторов зависит от индивидуальных особенностей пациента, схем лечения и др.
ФЕРМЕНТЫ
Активность ферментов определяется с диагностическими целями в сыворотке, секретах, тканевой жидкости. Ферменты обладают субстратной специфичностью, т.е. только определенные реакции могут катализироваться конкретным ферментом. Большая часть ферментов в сыворотке крови - это тканевые ферменты, попадающие в кровь в результате разрушения клеток или секреции. Несмотря на то что концентрация ферментов в клетках в 1000-10 000 выше, чем в плазме, в норме только очень незначительная их активность регистрируется в плазме. Причинами повышения активности ферментов при патологии являются: прямое поражение клеточных мембран, в частности вирусами и химическими соединениями; гипоксия, аноксия и ишемия тканей; иногда активность ферментов увеличивается в результате повышенного синтеза в тканях. Имеются ферменты, которые присутствуют только в определенной ткани или одной из тканей в высокой концентрации. При поражении этой ткани в крови появляются органоспецифические ферменты (табл. 4-1).
Таблица 4-1. Специфичность ферментов для диагностики патологии
| Фермент | Орган | Диагностическое значение |
|---|---|---|
α-Амилаза |
Поджелудочная железа, слюнные железы |
Острый панкреатит, отит |
АЛТ |
Печень |
Заболевания паренхимы печени |
АСТ |
Миокард, печень |
Инфаркт миокарда, заболевания паренхимы печени, поражения скелетных мышц |
ГГТ |
Печень |
Патология желчевыводящих путей, алкоголизм |
КК |
Скелетные мышцы, сердце, гладкие мышцы |
Инфаркт миокарда, поражения мышечной ткани |
КФ |
Простата, костная ткань |
Аденома, рак простаты, метаболические заболевания костной ткани |
ЛДГ |
Печень, сердце, скелетные мышцы, эритроциты, тромбоциты, лимфатические узлы |
Заболевания паренхимы печени, инфаркт миокарда, гемолиз, неэффективный эритропоэз, лимфомы |
Липаза |
Поджелудочная железа |
Острый панкреатит |
Холинэстераза |
Печень |
Отравления фосфорорганическими соединениями, заболевания паренхимы печени |
ЩФ |
Печень, костная ткань, кишечник, почки |
Метаболические заболевания костной ткани, гепато-билиарная патология |
Единица активности ферментов
В системе СИ единицей активности ферментов является катал (кат), который соответствует количеству фермента, которое превращает 1 моль субстрата за 1 с. Наряду с изменением активности ферментов в каталах единицу количества фермента можно характеризовать и другой величиной - международной единицей (МЕ): количество фермента, которое катализирует превращение1 микромоля (мкмоль) субстрата в 1 мин. При этом объемная активность фермента выражается как МЕ/л, удельная активность - как МЕ/мг белка. При необходимости выразить результаты в каталах следует пересчитать конечные результаты по представленному ниже алгоритму.
| Единица | Коэффициент перевода | Единица |
|---|---|---|
мккат/л |
60 |
ЕД/л |
нкат/л |
0,06 |
ЕД/л |
ЕД/д |
0,9167 |
мккат/л |
ЕД/л |
16,67 |
нкат/л |
ПРЕАНАЛИТИЧЕСКИЕ ОСОБЕННОСТИ
Преаналитические требования при исследовании ферментов однотипные. Если нет специального указания, для плановых биохимических исследований кровь забирают из вены утром натощак (через 8-10 ч после последнего приема пищи). Следует избегать гемолиза; до исследования сыворотку можно хранить в течение дня при комнатной температуре, неделю - при +4 °С.
Аланинаминотрансфераза
Аланинаминотрансфераза (АЛТ) относится к группе аминотрансфераз, содержащих в качестве кофермента производное витамина В6 пиридоксальфосфат; АЛТ катализирует обратимую реакцию дезаминирования аминокислоты аланина. Продукт дезаминирования (пируват) метаболизируется во многих направлениях, включая распад с выделением энергии, синтез глюкозы и др. Наиболее высокую активность фермента обнаруживают в печени (цитоплазме гепатоцитов), поджелудочной железе, сердце, скелетных мышцах, эритроцитах, почках.
Референтные пределы (ориентировочные): 5-40 ЕД/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Выявление и оценка выраженности цитолитического синдрома при диагностике и мониторинге заболеваний печени. Тест используют вместе с определением АСТ. При типичном течении острых вирусных гепатитов гипераминотрансфераземия развивается у 97% больных за неделю до появления клинических симптомов (примерно у 50% больных - за 5 сут до гепатомегалии или желтухи, у 90% - за 2 сут до желтухи). Гипераминотрансфераземия достигает максимума (повышение в 5-10 раз и более) на 1-2-й неделе заболевания, что в основном совпадает с появлением желтухи или максимальной клинической тяжестью болезни. У 90% больных активность АЛТ выше активности АСТ, но при тяжелом поражении паренхимы может быть обратное соотношение, что связано с «утеканием» в кровь не только цитоплазматической, но и митохондриальной изоформы АСТ (АЛТ локализована в цитоплазме гепатоцитов). Нормализация показателей происходит обычно через 6-7 нед заболевания (у некоторых пациентов - в течение 90 сут). Удлинение периода гипераминотрансфераземии может свидетельствовать о переходе острого процесса в хронический, но судить об окончании патологического процесса в печени по этому тесту не всегда возможно. Отсутствие гипераминотрансфераземии не исключает хронизации процесса. При остром алкогольном гепатите происходит повышение активности аминотрансфераз, в большинстве случаев 2-3-кратное (не более чем в 5 раз); как правило, активность АСТ увеличивается в большей степени, чем АЛТ, что объясняется токсическим поражением не только гепатоцитов, но и миоцитов, кардиомиоцитов. При хронических персистирующих гепатитах вне обострения активность аминотрансфераз в сыворотке крови, как правило, находится в референтных пределах; в период обострения повышена у 70-80% больных, но относительно немного - в 2-5 раз. При легких формах хронического активного гепатита активность ферментов может быть такой же, как при хроническом персистирующем гепатите, при более тяжелых формах увеличение активности аминотранфераз у 85-90% больных обычно в пределах от 2,5 до 10 выше референтных пределов (нормы).
Увеличением активности фермента сопровождаются:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение активности: гемолиз in vivo или in vitro, терапия гепарином, пероральные контрацептивы, изониазид, кодеин, кортизон, гепатотоксичные препараты.
Альфа-амилаза общая
Фермент, катализирующий гидролитическое расщепление полисахаридов пищи - крахмала и гликогена до мальтозы. Секретируется в полость рта слюнными железами (изоферменты амилазы S-типа) и в ЖКТ поджелудочной железой (изоферменты амилазы Р-типа). Ткани, наиболее богатые ферментом, - околоушные слюнные железы, поджелудочная железа. Значительно меньшую активность амилазы обнаруживают в слизистой оболочке кишечника, печени, легких, скелетных мышцах, почках, фаллопиевых трубах. Основным источником фермента в сыворотке крови в норме являются слюнные железы (60%) и поджелудочная железа (40%). Оба изофермента α-амилазы имеют молекулярную массу около 45 кДа, поэтому фильтруются в почках и экскретируются с мочой. Тем не менее в составе мочи больший удельный вес приходится на панкреатический изофермент.
Референтные пределы представлены в табл. 4-2.
Таблица 4-2. Референтные пределы альфа-амилазы общей в сыворотке крови
| Возраст | ЕД/л | мккат/л |
|---|---|---|
До года |
5-65 |
0,08-1,08 |
1-70 лет |
25-125 |
0,42-2,08 |
>70 лет |
20-160 |
0,33-2,67 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
При остром панкреатите активность амилазы в крови начинает увеличиваться через 3-12 ч после приступа боли, достигает максимума через 20-30 ч, превышая верхнюю границу референтных пределов в 5-10 раз в зависимости от степени проходимости протоков и размера поражения паренхимы поджелудочной железы. При некротическом панкреатите гиперамилаземия выше, чем при отечном. В случае острого геморрагического некротизирующего панкреатита с обширной деструкцией поджелудочной железы амилаза крови может не увеличиваться или даже снижаться, что является плохим прогностическим признаком. В стационарах частота выявления гиперамилаземии у больных с острым панкреатитом - 82-97%. При хроническом панкреатите исследование амилазы позволяет выявить обострение (для диагностики хронического панкреатита более информативны инструментальные исследования и некоторые тесты со стимуляцией ферментов), при этом уровень гиперамилаземии, так же как гиперамилазурии и гиперлипаземии, меньше, чем при остром панкреатите. Ценность тестов для выявления обострений снижается по мере развития в поджелудочной железе атрофическисклерозирующего процесса, проявляющегося гипосекрецией ферментов. Наиболее чувствительный ферментный индикатор обострений хронического панкреатита и более специфичный, чем альфа-амилаза, маркер острого панкреатита - повышение P-изоферментов (панкреатической) амилазы в сыворотке крови.
Увеличением активности фермента в крови в 5-10 раз сопровождаются:
до 5 раз:
-
прободение при внематочной беременности (выход в кровоток амилазы фаллопиевых труб);
-
заболевания слюнных желез - эпидемический паротит, камни в слюнной железе или ее протоке;
-
макроамилаземия (образование комплексов амилазы с белками плазмы, имеющими большую молекулярную массу), в связи с чем снижено выведение амилазы почками (может быть у здоровых людей);
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение активности: средства, вызывающие сокращение сфинктера Одди (наркотические анальгетики, бетанехолΨ, секретин и др.), некоторые антибиотики, сульфаниламиды, рентгенологическое исследование слюнных желез и их протоков.
Амилаза мочи
Материал: случайная порция или суточная моча. Сбор суточной мочи: после утреннего мочеиспускания отметить время и 24 ч собирать мочу в сухую чистую емкость, хранящуюся в прохладном месте; после сбора мочу перемешать, измерить объем, указать его в направлении на анализ; около 50 мл отлить в контейнер для исследования и отправить в лабораторию. До исследования мочу можно хранить 2 сут при комнатной температуре, 10 сут - при +4 °С, 3 нед - при -20 °С.
Референтные пределы: 1-17 ЕД/л, или 0,02-0,28 мккат/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг цитолитического синдрома при остром и хроническом панкреатите, реже - выявление паротита.
Увеличение экскреции амилазы почками происходит вслед за развитием гипер амилаземии, запаздывая на 6-10 ч. Степень повышения амилазы в моче всегда более выражена, чем в крови. Причиной амилазурии является не только гиперамилаземия, но и повышенный клиренс фермента вследствие подавления канальцевой реабсорбции при панкреатите. Амилазурия может сохраняться в течение нескольких дней после нормализации уровня сывороточной амилазы. Следует учитывать зависимость этого показателя от скорости клубочковой фильтрации, она может быть изменена при панкреатите и особенно при панкреатите у больных с почечной недостаточностью.
Увеличением активности фермента в моче сопровождаются:
Альфа-амилаза панкреатическая
Группа изоферментов α-амилазы, присутствующих в наибольшем количестве в ацинарных клетках поджелудочной железы. В норме в сыворотке крови у 73% здоровых людей присутствуют Р2-изофермент, у 10% может также выявляться Р1-амилаза.
Референтные пределы представлены в табл. 4-3.
Таблица 4-3. Референтные пределы α-амилазы панкреатической в сыворотке крови
| Возраст | ЕД/л | мккат/л |
|---|---|---|
5 сут-6 мес |
<8 |
<0,13 |
6-12 мес |
<23 |
<0,38 |
>12 мес |
<50 |
<0,83 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг цитолитического синдрома при остром и хроническом панкреатите. Более чувствительный и специфичный индикатор цитолиза ацинарных клеток поджелудочной железы, чем общая альфа-амилаза.
Увеличением активности фермента сопровождаются:
Аспартатаминотрансфераза
Аспартатаминотрансфераза (АСТ) относится к группе ферментов аминотрансфераз, содержащих в качестве кофермента производное витамина В6 пиридоксальфосфат; АСТ катализирует обратимую реакцию дезаминирования аминокислоты аспартата. Продукт дезаминирования - щавелевоуксусная кислота метаболизируется во многих направлениях, включая распад с выделением энергии, синтез глюкозы и др. АСТ широко распространена в органах и тканях организма человека, присутствует в митохондриях и цитоплазме клеток. Наибольшая активность фермента обнаружена в сердечной мышце, затем, по убыванию, - в печени (в цитоплазме и митохондриях гепатоцитов), скелетных мышцах, головном мозге, семенниках и почках. Высокая активность АСТ обнаружена в эритроцитах.
Референтные пределы (ориентировочные): 5-40 Ед/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Выявление и оценка выраженности цитолитического синдрома при диагностике и мониторинге заболеваний печени, сердца. Тест используют вместе с определением активности АЛТ.
При остром инфаркте миокарда (ОИМ) активность АСТ начинает повышаться через 6-12 ч, достигая максимума через 24-48 ч (активность АСТ может увеличиваться в 10-15 раз, что коррелирует с площадью некроза миокарда). При неосложненном течении острого инфаркта миокарда нормализация активности происходит через 4-6 сут. Если через 3-4 сут активность АСТ не снижается, это является прогностически неблагоприятным признаком.
Увеличением активности фермента сопровождаются:
Гамма-глутамилтрансфераза
Гамма-глутамилтрансфераза (ГГТ) - фермент, катализирующий одну из реакций переноса аминокислот из плазмы крови в клетки, а также реакции в процессах реабсорбции аминокислот из желчи и мочи в кровь. В значительных количествах фермент обнаруживают в эпителии извитых канальцев нефрона, желчных канальцах и ближайших к просвету частях эпителиальных клеток, выстилающих желчный проток. Наибольшую активность фермента отмечают в цитоплазме и гладком эндоплазматическом ретикулуме (микросомах) гепатоцитов, расположенных в области воротной вены. Основным источником сывороточной активности фермента являются гепатоциты.
ГГТ не фильтруется в почках, но активность фермента в моче в 2-6 раз выше, чем в крови. В моче повышение активности фермента свидетельствует о поражении проксимальных канальцев нефрона.
Материал (проба): сыворотка крови; избегать гемолиза. Можно хранить 7 сут при +4 °С, годы - при -20 °С.
Референтные пределы (ориентировочные): женщины - менее 30 ЕД/л, мужчины - менее 50 ЕД/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг лечения заболеваний печени и билиарного тракта. Повышение фермента при этом является многозначным: отражает внутри- и внепеченочный холестаз (вследствие деструкции желчевыводящих путей), в некоторой степени - цитолиз паренхиматозных клеток (фермент менее чувствителен к поражениям паренхимы, чем аминотрансферазы), является показателем индукции микросомальной гамма-глутамилтрансферазы алкоголем и гепатотоксичными лекарственными препаратами, может отражать поражение печени злокачественным процессом (при этом причины гиперферментемии разнородны). При острых вирусных гепатитах происходит увеличение активности ГГТ до 10 раз (чаще в 5 раз), что обусловлено в основном развитием холестаза, поэтому при холеста тической форме гиперферментемия более выражена; сроки максимума сходны с таковыми для аминотрансфераз, нормализация происходит позже. При алкогольном гепатите активность ГГТ увеличивается в 20 раз, при лекарственном - варьирует в зависимости от природы и дозы лекарственного препарата. Увеличение активности ГГТ может выявляться при отсутствии повышения активности аминотрансфераз. При хронических гепатитах выраженность гиперферментемии зависит от активности процесса. При декомпенсированном циррозе увеличение активности ГГТ может быть не связано со снижением биосинтеза фермента. При первичном билиарном циррозе возможно повышение до 10 норм еще в бессимптомной стадии. При гепатоцеллюлярной карциноме у 90% больных без желтухи активность ГГТ увеличивается в 10-20 раз, с желтухой - до 30 раз. Увеличение активности возможно задолго до появления клинических симптомов и изменения других биохимических показателей. При метастазах в печень, сопровождающихся клиническими симптомами, активность ГГТ меняется так же, как при первичном раке печени. Наиболее высокая активность фермента наблюдается при метастазах в области воротной вены или по ходу желчных путей, чувствительность как показатель поражения печени метастатическим процессом составляет около 96%.
Особую ценность тест представляет для выявления патологий гепатобилиарной системы у детей (после 2 лет) и беременных, когда сывороточная активность других ферментов, используемых в гепатологии, повышена физиологически. Сывороточная активность фермента не изменяется при патологии костной ткани, поэтому тест используется для установления источника повышенной активности щелочной фосфатазы.
Увеличением активности фермента сопровождаются:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение активности: терапия барбитуратами, фенитоином, стрептокиназой, гепатотоксичными лекарственными препаратами.
Кислая фосфатаза
Кислая фосфатаза (КФ) - группа ферментов, катализирующих гидролитическое отщепление фосфатной группы от различных органических соединений с максимальной активностью в кислой среде (pH <7,0). Ферменты присутствуют в лизосомах печени, селезенки, эритроцитах, тромбоцитах, костном мозге, макрофагах и остеокластах. Самая высокая активность кислой фосфатазы отмечается в предстательной железе (простатическая кислая фосфатаза). У мужчин половину содержащейся в сыворотке крови кислой фосфатазы вырабатывает предстательная железа, остальное дают печень и разрушающиеся тромбоциты, эритроциты. У женщин источниками фермента в сыворотке крови являются печень, эритроциты и тромбоциты. Большинство тканей содержат несколько изоферментов кислой фосфатазы.
Референтные пределы представлены в табл. 4-4.
Таблица 4-4. Референтные пределы кислой фосфатазы в сыворотке крови
| Возраст, пол | ЕД/л |
|---|---|
<14 лет |
<5,5 |
>14 лет, женский |
<5,5 |
>14 лет, мужской |
<6,5 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг рака простаты (более информативна кислая фосфатаза простатическая).
Увеличением активности фермента сопровождаются:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение активности: гемолиз, цистоскопия, катетеризация мочевого пузыря, пальпация простаты (активность возрастает на 25-30%, нормализуется через 24 ч), биопсия, операция на простате (нормализация через несколько суток), дефекация с напряжением, повышенная температура, сексуальная активность.
Кислая фосфатаза простатическая
Метод исследования: расчетный - определяют общую и непростатическую КФ в пробе с добавлением тартрата, ингибирующего простатическую КФ; по разнице рассчитывают активность простатической КФ.
Референтные пределы: мужчины старше 14 лет - менее 2,6 ЕД/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг рака простаты.
Увеличением активности фермента сопровождаются:
-
рак простаты (увеличение в 10-20% случаев у пациентов без метастазов, в 20-40% случаев - при метастазах без поражения костей, в 40-90% случаев - при метастазах в костную ткань; увеличение в 10-40 раз в зависимости от количества продуцирующих фермент клеток);
-
орхиэктомия (эстрогенотерапия приводит к снижению активности фермента; сохранение высокой активности фермента, как правило, свидетельствует о резистентности больного к проводимому лечению);
Креатинкиназа
Креатинкиназа (КК) - фермент, участвующий в энергопродукции, катализирует фосфорилирование креатина и его дефосфорилирование с образованием АТФ. Наибольшая активность фермента выявлена в скелетных мышцах и миокарде, меньшая - в головном мозге, плаценте, гладких мышцах, прямой кишке, предстательной железе и других тканях. Изоферменты КК состоят из двух субъединиц, обозначаемых как M (Muscle - мышца) и B (Brain - мозг). Известны три цитоплазматических изофермента, различающихся комбинацией субъединиц: MM-КК, MB-КК, BB-КК. Общей КК называют их суммарную активность в сыворотке крови. В веществе головного мозга КК представлена почти на 100% BB-КК. В скелетных мышцах присутствует в основном MM-КК. В наибольших количествах MB-КК присутствует в миокардиоцитах. Гладкие мышцы интестинального тракта (желудка, кишечника) и матки содержат в основном BB-КК и менее 10% MB-КК. Именно поэтому увеличение в сыворотке крови MB-КК - один из наиболее специфичных показателей цитолиза и некроза кардиомиоцитов.
BB-КК - изофермент, который не проходит гематоэнцефалический барьер и в норме в сыворотке или плазме крови не обнаруживается. Общая КК крови в норме состоит на 95% из MM-КК и на 5% - из MB-КК. Появление большого количества B-субъединицы, как правило, свидетельствует о нарушении гематоэнцефалического барьера при черепно-мозговых травмах, инсультах.
Референтные пределы (ориентировочные): женщины - менее 170 ЕД/л, мужчины - менее 190 ЕД/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Выявление и мониторинг цитолитического синдрома при заболеваниях миокарда и скелетной мускулатуры. При диагностике острого инфаркта миокарда, миокардитов более специфичным показателем поражения миокарда является увеличение MB-КК, чем возрастание активности общей КК.
Для дифференциальной диагностики нейрогенных мышечных заболеваний и миопатий, а также для наблюдения за течением последних определение сывороточной активности КК является наиболее информативным ферментативным тестом. Несмотря на то что обычные клинические проявления заболеваний мышц - мышечная слабость, истощение и боль - могут наблюдаться как при миопатиях, так и при нарушении иннервации, многие формы миопатий сопровождаются специфическим увеличением активности КК в сыворотке крови, в отличие от нейрогенных заболеваний мышц, при которых подобные изменения обычно отсутствуют. Однако при детских нейрогенных заболеваниях мышц на ранних стадиях мышечной атрофии (например, в восстановительной стадии полиомиелита), если они протекают тяжело, может наблюдаться повышение уровня КК, обычно превышающее верхнюю границу нормы не более чем в 2 раза. Изменения КК в сыворотке могут иметь место в доклинический период наследуемых миопатий, а также при носительстве (доказано для дистрофии Дюшенна). При интерпретации лабораторных данных необходимо учитывать, что наиболее высокие величины гиперферментемии удается обнаружить на ранних стадиях миопатий. Позже, когда значительная часть мышечной ткани уже претерпела патологические изменения и биосинтез КК в мышцах снижен, уровень КК в сыворотке может быть понижен.
Увеличением активности фермента сопровождаются:
-
острый инфаркт миокарда (повышение активности, часто коррелирующее с обширностью инфаркта, может быть обнаружено через 4-6 ч после инфаркта, максимум достигается через 12-24 ч, снижение - через 2-4 сут; в первые 12 ч после болевого приступа активность повышена в 80-89% случаев крупноочагового инфаркта и в 60-64% - мелкоочагового; достижение пика активности и нормализация могут наблюдаться раньше указанных временных диапазонов при тромболизисе и реперфузии коронарных сосудов; рационально проводить повторное определение активности фермента каждые 12 ч в первые 2-3 сут, при подозрении на рецидив, повторный инфаркт миокарда);
-
заболевания скелетных мышц - полимиозиты, дерматомиозиты, мышечные дистрофии;
-
операционное или травматическое повреждение миокарда, скелетных мышц (как правило, ниже троекратного превышения верхней границы нормы, нормализуется через 5-10 сут после повреждения);
-
гипотиреоидизм (вероятно, из-за генерализованного увеличения мембранной проницаемости);
-
аритмии, застойная сердечная недостаточность, эмболия легочной артерии (редко);
-
гипоксические поражения миокарда и скелетных мышц при шоке, гипертермии.
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение активности: гемолиз, внутримышечные инъекции (превышение верхней границы нормы в 5-8 раз после однократной инъекции сохраняется 48 ч, в отдельных случаях - до недели после прекращения инъекций), интенсивная физическая нагрузка, умеренная физическая нагрузка после малоподвижного образа жизни, амфотерицин B, карбеноксолонΨ, карбромалΨ, клофибратΨ, этанол (у больных с алкоголизмом), сочетанные введения галоганаΨ и сукцинилхолинаΨ во время наркоза, отравление барбитуратами.
Креатинкиназа-MB
Референтные пределы: представлены в табл. 4-5.
Таблица 4-5. Референтные пределы креатинкиназы-MB в сыворотке крови
| Пол | ЕД/л | мккат/л |
|---|---|---|
Мужской |
<15 |
<0,25 |
Женский |
<20 |
<0,33 |
Определение массовой концентрации КК-МВ Материалы (проба): сыворотка, плазма, цельная кровь.
Метод: иммунохимический («сэндвич», моноклональные антитела к субъединицам КК-МВ).
Референтные пределы: для мужчин - менее 5,0 мкг/л, для женщин - менее 2,5 мкг/л; относительный индекс (отношение массовой концентрации КК-МВ к активности общей КК) - менее 2%.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Увеличением активности фермента сопровождаются:
-
острый инфаркт миокарда (динамика, как правило, соответствует таковой для КК общей; характерно возрастание соотношения MB-КК/КК более 25%; повторное определение MB-КК более информативно, чем единичное);
-
миопатии (источником MB-КК в этих случаях, по крайней мере частично, служит сердечная мышца, повреждение которой часто сопровождается дистрофией, а кроме того - скелетные мышцы; диагностическая ценность изменения MB-КК не превышает таковую для КК общей; при дистрофии Дюшенна активность MB-КК увеличена в несколько раз у 90% больных, при других миопатиях изменение менее выраженно);
-
карциномы прямой кишки, легких, яичников, простаты, эндометрия;
Лактатдегидрогеназа
Лактатдегидрогеназа (ЛДГ) - фермент, катализирующий обратимую реакцию превращения пирувата в лактат в процессе распада и синтеза глюкозы. Содержится в цитоплазме клеток практически всех органов и тканей организма. Наибольшая активность - в миокарде, почках, скелетной мускулатуре, паренхиме печени, эритроцитах; меньшая - в лимфоцитах, легких, поджелудочной железе.
Референтные пределы: менее 250 ЕД/л, менее 4,2 мккат/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг заболеваний печени и миокарда. Увеличение активности ЛДГ в сыворотке крови отражает цитолиз, некроз кардиомиоцитов и гепатоцитов. Тест можно использовать для диагностики и мониторинга лечения заболеваний скелетных мышц (миопатии), некоторых злокачественных новообразований. Чувствительность и специфичность возрастают при сочетании с исследованием 5 изоферментов ЛДГ. ЛДГ-1 - наиболее специфичный изофермент для патологии сердечной мышцы. Для определения активности ЛДГ-1 используют гидроксибутиратдегидрогеназную реакцию (а-ГБДГ).
Увеличением активности фермента сопровождаются:
-
застойная сердечная недостаточность (при развитии гипоксии печени и других органов);
-
острые гепатиты (при вирусных гепатитах - увеличение в течение первой недели желтушного периода в 2-3 раза и более, при типичном течении нормализация активности на 5-8-й неделе);
-
хронические гепатиты различной этиологии (как правило, лишь в период обострения);
-
миопатии различной этиологии, исключая дистрофию нейрогенного характера (более информативным ферментативным тестом является креатинкиназа);
-
острый инфаркт миокарда (начало увеличения - через 10-24 ч, максимальная активность - через 36-72 ч, нормализация - через 10-15 сут и более);
-
травма почек, скелетных мышц, печени, миокарда, легких, селезенки;
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение активности: беременность, гемолиз in vitro, даже минимальный вследствие высокой активности ЛДГ в эритроцитах, гемотрансфузия, терапия гепарином (у 30% больных), анальгетики ненаркотические и наркотические, этанол, клофибратΨ, дикумаринΨ, имипрамин, метотрексат, нитрофураны, хинидин, сульфаниламиды.
Липаза
Липаза - фермент, катализирующий гидролиз триглицеридов (нейтрального жира) с высвобождением жирных кислот в клетках жировой ткани, а также в тонкой кишке, куда фермент секретируется поджелудочной железой. Увеличение активности в сыворотке крови, как правило, является следствием цитолиза и некроза ацинарных клеток поджелудочной железы.
Референтные пределы представлены в табл. 4-6.
Таблица 4-6. Референтные пределы липазы в сыворотке крови
| Возраст | ЕД/л | мккат/л |
|---|---|---|
5 сут-18 лет |
<130 |
<2,2 |
>18 лет |
<190 |
<3,2 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг острого и хронического панкреатита. В отличие от альфа-амилазы, активность липазы не повышается при паротите, внематочной беременности, аппендиците.
Увеличением активности фермента сопровождаются:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение активности: лекарственные препараты, провоцирующие спазм сфинктера Одди (наркотические анальгетики, секретин и др.) или развитие панкреатита (тетрациклины, сульфаниламиды, цитостатики и др.), терапия гепарином.
Трипсин
Трипсин - фермент (гидролаза), участвующий в переваривании белков в кишечнике. Продуцируется экзокринными клетками поджелудочной железы в виде неактивного предшественника (трипсиногена), превращающегося в трипсин в кишечнике под действием энтерокиназы энтероцитов и следов трипсина. Некоторое количество этого фермента в норме проникает из клеток поджелудочной железы в кровь в виде трипсина, трипсиногена и трипсина, связанного с панкреатическим ингибитором. В крови трипсин ингибируется в результате связывания со специфическими белками плазмы - α1-антитрипсином и др. Повышение активности трипсина в сыворотке крови отражает цитолиз клеток поджелудочной железы, у новорожденных ассоциируется с врожденным муковисцидозом.
Методы исследования: иммунохимические (иммуноферментный, иммунохе милюминесцентный, радиоиммунный).
Референтные пределы зависят от особенностей антител в составе реагента, определяющих выявление разных форм (свободного трипсина, связанного с белковыми ингибиторами плазмы крови, трипсиногена), поэтому при интерпретации результатов исследования рекомендуют использовать сведения лаборатории о референтных пределах.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика панкреатита. Оценка функционального состояния поджелудочной железы. Ранняя постнатальная диагностика муковисцидоза (в первые несколько недель жизни). При положительном результате исследования иммунореактивного трипсина проводят исследование пота.
Увеличением активности фермента сопровождаются:
Уменьшением активности фермента сопровождаются:
ВЛИЯЮЩИЕ ФАКТОРЫ
Суточный биоритм, максимальный уровень вечером. Увеличение активности: панкреатография, стимуляторы поджелудочной железы (холецистокинин, бомбезин, секретин, церулеин), прием пищи.
Холинэстераза
Различают два типа холинэстераз, катализирующих реакции гидролиза различных эфиров: первый - истинная ХЭ (холинэстераза I, ацетилхолинэстераза) содержится преимущественно в эритроцитах, нервно-мышечных синапсах скелетной мускулатуры, центральной нервной системе; второй - S-псевдохолинэстераза или холинэстераза II, находится в сыворотке (плазме) крови, печени, гладкой мускулатуре.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Раннее выявление и оценка степени снижения белоксинтезирующей функции печени.
Диагностика острых и хронических отравлений фосфорорганическими соединениями (карбофосом, хлорофосом и т.п.), которые необратимо связываются с холинэстеразами и ингибируют их (ингибируется также и истинная ХЭ, однако псевдохолинэстераза снижается раньше). Накопление в нервных синапсах ацетилхолина приводит к нарушениям проводимости в симпатической нервной системе.
Оценка чувствительности к мышечным релаксантам (дитилину♠, местинонуΨ), в норме подверженным быстрому распаду под действием ХЭ. У некоторых больных после их введения наступает длительный период апноэ и/или миорелаксации. Это ассоциируется с низкой активностью или отсутствием ХЭ в сыворотке крови, что может быть связано либо с врожденной наследуемой недостаточностью ХЭ, либо с хроническим отравлением фосфорорганическими соединениями. Если есть подозрения на патологию первого рода, рекомендуют обследование родственников и при выявлении пониженного уровня ХЭ - выдачу медицинского заключения об опасности введения дитилина♠ и его аналогов.
Референтные пределы представлены в табл. 4-7.
Таблица 4-7. Референтные пределы холинэстеразы в сыворотке крови
| Возраст, пол | ЕД/л | мккат/л |
|---|---|---|
<40 лет |
5300-12900 |
88-215 |
Женщины 16-39 лет, не принимающие пероральные контрацептивы, небеременные |
5300-11200 |
88-187 |
Снижением активности фермента сопровождаются:
Увеличением активности фермента сопровождаются:
ВЛИЯЮЩИЕ ФАКТОРЫ
Снижение активности: карбамат, циклофосфамид, эстрогены, тестостерон, пероральные контрацептивы, фенотиазины, рентгеноконтрастные средства.
Щелочная фосфатаза
Щелочной фосфатазой (ЩФ), или общей щелочной фосфатазой, называют группу ферментов, катализирующих гидролитическое отщепление фосфатной группы от различных органических соединений с максимальной активностью в щелочной среде. Щелочная фосфатаза широко распространена в тканях человека, особенно много этого фермента в слизистой оболочке кишечника, остеобластах (остеокласты не содержат фермента, остеоциты содержат немного), эпителиоцитах желчных протоков, образующих просвет желчных канальцев в гепатоцитах, проксимальных отделах извитых канальцев почек, плаценте, легких.
Референтные пределы представлены в табл. 4-8.
Таблица 4-8. Референтные пределы щелочной фосфатазы в сыворотке крови
| Возраст | ЕД/л | мккат/л |
|---|---|---|
Новорожденные |
<420 |
<7 |
Дети |
<480 |
<8 |
Взрослые |
<150 |
<2,5 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Выявление и мониторинг поражений костей, сопровождающихся повышением активности остеобластов (остеодистрофий, остеомаляции, метастазов и некоторых первичных опухолей костной ткани), а также внутри- и внепеченочного холестаза.
Увеличением активности фермента сопровождаются:
Снижением активности фермента сопровождаются (возможно):
Щелочная фосфатаза костная
Представляет собой глипопротеид, находящийся на поверхности остеобластов. Количественное определение костной щелочной фосфатазы дает полезную информацию о костном ремоделировании, эффективности антирезорбтивной терапии.
Метод исследования: иммуноферментный анализ (ИФА).
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Значительное увеличение костной щелочной фосфатазы наблюдается при повышенной активности остеобластов: рост костей, болезнь Педжета, возобновление движений после длительного постельного режима, переломы, деформирующий остит, рахит, гиперпаратиреоидизм, остеогенная саркома, миелома, костный туберкулез, лейкозы.
Снижение костной щелочной фосфатазы отмечается при гипофосфатаземии, кретинизме.
СУБСТРАТЫ И ПРОДУКТЫ БИОХИМИЧЕСКИХ РЕАКЦИЙ
Альбумин
Альбумин - белок, синтезируемый печенью. На долю альбумина приходится 55-60% белка в сыворотке крови. Основные функции альбумина: транспорт, поддержание постоянства коллоидно-осмотического давления и обеспечение клеток аминокислотами. При гипоальбуминемии снижается онкотическое давление плазмы, жидкость не возвращается в кровеносное русло, по такому принципу развиваются белковые («голодные») отеки.
Время полужизни альбумина в плазме - 15-20 сут, поэтому даже полное прекращение синтеза альбумина печенью не должно сопровождаться значительным его снижением в сыворотке крови на протяжении 3-4 сут. В острых ситуациях гипоальбуминемия наблюдается при потере альбумина с мочой или при пропо тевании вместе с жидкостью в ткани и полости.
Референтные пределы: 30-50 г/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Неблагоприятна пониженная концентрация альбумина, особенно тяжелый прогноз у больных с хроническими заболеваниями печени. Для них повышение концентрации альбумина после гипоальбуминемии указывает на успешное лечение.
Увеличением концентрации (гиперальбуминемией) сопровождаются:
Уменьшением концентрации (гипоальбуминемией) сопровождаются:
-
сниженный синтез альбумина (недоедание, синдром мальабсорбции, болезни печени);
-
повышенная потеря альбумина (нефротический синдром, энтероколиты, ожоги, кровотечения, выпот, экссудат);
-
повышенный распад альбумина (сепсис, лихорадка, травмы, новообразования, синдром Кушинга, гипертиреоз, гиперкортицизм);
Интерференция.
-
Физиологическая гипоальбуминемия проявляется у детей до третьего месяца жизни, у женщин - в III триместре беременности.
-
Положение тела и физическая активность могут влиять на уровень альбумина. У госпитализированных пациентов (постельный режим) концентрация альбумина на 5-10 г/л ниже нормы.
-
Пережатие сосудов во время взятия крови может несколько повысить концентрацию белка в крови.
Белок общий
Общий белок - сумма всех белков в сыворотке крови (всего около 100), по особенностям структуры молекул их делят на альбумины и глобулины. Белки в сыворотке крови поддерживают онкотическое давление и, следовательно, объем крови, участвуют в процессах гемостаза, поддержании постоянства pH крови, связывают и транспортируют жирные кислоты, билирубин, стероидные и тиреоидные гормоны, железо, медь, кальций; некоторые плохо растворимые в воде витамины и другие низкомолекулярные компоненты плазмы крови участвуют в иммунных реакциях (иммуноглобулины, опсонины, белки острой фазы). Большая часть белков в сыворотке крови синтезируется в печени, иммуноглобулины - плазматическими клетками.
Референтные пределы представлены в табл. 4-9.
Таблица 4-9. Референтные пределы общего белка в сыворотке крови
| Возраст | г/л |
|---|---|
<1 года |
44-73 |
1-2 года |
56-75 |
2-14 лет |
60-80 |
>14 лет |
65-85 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Выявление нарушений белкового обмена при различных патологических состояниях (острых и хронических инфекциях, заболеваниях печени и почек, онкологических заболеваниях, мальабсорбции при хронических заболеваниях желудочно-кишечного тракта, голодании, ожогах, критических состояниях и др.). В сочетании с альбумином и белковыми фракциями - для оценки диспротеинемии.
Увеличением концентрации (гиперпротеинемией) сопровождаются:
-
гипергаммаглобулинемия (следствием, как правило, является абсолютная гиперпротеинемия);
-
аутоиммунная патология (системная красная волчанка, ревматоидный артрит, ревматизм и т.д.);
-
моноклональные гаммапатии, связанные с миеломой, макроглобулинемией, амилоидозом, лимфомой;
-
полиурия при синдроме неадекватной секреции вазопрессина и др.
Уменьшением концентрации (гипопротеинемией) сопровождаются:
-
снижение синтеза белков при недостаточном поступлении и/или усвоении белков пищи (голодание, панкреатиты, энтероколиты, неадекватное парентеральное или зондовое питание);
-
заболевания печени с синдромом гепатодепрессии (циррозы, гепатиты, токсическое поражение печени);
-
потери белков (плазмопотеря при обширных ожогах, протеинурия при заболеваниях почек, экссудативная энтеропатия при энтеритах);
-
усиленный распад белков (послеоперационное состояние, тяжелые соматические заболевания, продолжительная гипертермия, ожоговая болезнь, онкопатология);
-
выход белков из сосудистого русла, образование экссудатов и транссудатов;
ВЛИЯЮЩИЕ ФАКТОРЫ
Уменьшение концентрации: гипергидратация при массивной инфузионной терапии, физиологически - во время беременности (особенно в III триместре).
Ложное повышение может быть вызвано длительным наложением жгута при венепункции, изменением положения тела из горизонтального в вертикальное (в течение 30 мин).
Белковые фракции в сыворотке крови
Белки в сыворотке крови имеют разные размеры и заряд молекул. Этим обусловлена разная подвижность белков в разделяющей среде под действием электрического поля, что позволяет разделять их на фракции (группы) методом электрофореза. Вариантами электрофореза, используемыми в клинических лабораториях, выделяют пять фракций: альбумины, α1-, α2-, β- и γ-глобулины. Фракция альбумина однородна. Глобулиновые фракции содержат множество функционально различных белков, но на изменение показателей электрофореграммы влияет лишь часть белков, концентрация которых в норме или при патологии составляет не менее 1 г/л:
Изменение соотношения белковых фракций в сыворотке крови (диспротеинемия) наблюдается при многих патологических состояниях, но исследование белковых фракций клинически информативно лишь при парапротеинемических гемобластозах, системных аутоиммунных патологиях, нефротическом синдроме, хронических гепатитах и циррозе печени разной этиологии, в ряде случаев острого и хронического воспаления. За исключением диагностики парапротеинемических гемобластозов, более точную информацию позволяют получить исследования отдельных белков в сыворотке крови (специфических белков), их изменения специфичны для соответствующего патологического состояния.
Материал (проба): сыворотка крови; избегать гемолиза и примеси фибриногена из-за преждевременного отделения сыворотки. До исследования можно хранить 3 сут при +4 °С, 3 нед - при -20 °С.
Метод исследования: электрофорез на пластинках с агарозным гелем.
Референтные пределы представлены в табл. 4-10.
Таблица 4-10. Референтные пределы белковых фракций в сыворотке крови для взрослых
| Белковые фракции | Референтные пределы, % |
|---|---|
Альбумин |
60,5-74,2 |
α1-Глобулины |
1,1-4,3 |
α2-Глобулины |
4,2-10,9 |
β-Глобулины |
8,4-12,8 |
γ-Глобулины |
6,4-17,0 |
Варианты электрофореза в разных лабораториях значительно отличаются, поэтому референтные пределы должны быть уточнены лабораторией.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Выявление и мониторинг диспротеинемии при острых и хронических воспалительных заболеваниях, диффузных заболеваниях соединительной ткани, хронических гепатитах и циррозе печени разной этиологии. Диагностика миеломной болезни и других моноклональных гаммапатий.
Основные типы протеинограмм
-
Острофазный ответ - повышение α1- и α2-глобулинов в связи с усилением биосинтеза в печени белков острой фазы при воспалении любой этиологии (травма, хирургическое вмешательство, острый инфаркт миокарда, инфекция и др.).
-
Хроническое воспаление - увеличение γ-глобулинов (хронические гепатиты разной этиологии, ревматоидный артрит, некоторые хронические инфекции).
-
Цирроз печени - увеличение γ-глобулинов, слияние β- и γ-глобулинов вследствие мезенхимально-воспалительного синдрома, при развитии гепатодепрессивного синдрома возможно снижение альбумина.
-
Нефротический синдром - повышение α2-глобулинов в связи с усилением синтеза и повышением сывороточного уровня α2-макроглобулина, возможно снижение альбумина из-за его массивной потери с мочой.
-
Моноклональная гаммапатия - появление на электрофореграмме отдельной дискретной полосы в области глобулярных фракций (моноклональный белок, М-градиент, М-белок), состоящей из иммуноглобулинов или их фрагментов, синтезирующихся злокачественно трансформированными клонами В-лимфоцитов. Концентрации М-белка более 15 г/л с высокой вероятностью свидетельствует о миеломной болезни. При болезни легких цепей М-белок при электрофорезе сыворотки может не определяться, поскольку легкие цепи иммуноглобулинов (белок Бенс-Джонса) проходят через почечный фильтр и выводятся с мочой. Появление М-белка может наблюдаться при хронических гепатитах, циррозе печени, а также у некоторых пациентов престарелого возраста без клинических патологий, ассоциированных с моноклональной гаммапатией. Имитировать М-белок могут высокие концентрации C-реактивного белка и некоторых других острофазных белков, а также фибриноген. При выявлении М-белка необходима его последующая иммунохимическая идентификация методом электрофореза с иммунофиксацией.
ВЛИЯЮЩИЕ ФАКТОРЫ
Беременность (III триместр), прием андрогенов, эстрогенов, глюкокортикоидов.
Белок мочи
В норме выведение белка с мочой не превышает 0,08 г/сут, что обусловлено ограничением поступления в первичную мочу белков плазмы почечным фильтром, а также реабсорбцией в канальцах фильтрующихся в небольшом количестве низкомолекулярных белков. Некоторое количество белка в норме поступает в мочу в результате его секреции эпителием канальцев почек (белок Тамма-Хорсфалля).
Материал (проба): суточная моча - после утреннего мочеиспускания отметить время и 24 ч собирать мочу в сухую чистую емкость, хранящуюся в прохладном месте; по окончании сбора мочу перемешать, измерить объем, указать его в направлении; около 50 мл отлить в контейнер для исследования в лаборатории. Избегать интенсивных физических нагрузок, по согласованию с врачом исключить прием диуретиков; до исследования мочу можно хранить 7 сут при +4 °С, месяц - при -20 °С.
Методы определения: турбидиметрия с сульфосалициловой кислотой, колориметрия с пирогаллоловым красным.
Референтные пределы: менее 80 мг/сут; менее 250 мг/сут после интенсивной физической нагрузки.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг заболеваний почек. Выявление и мониторинг нефропатии при сахарном диабете, артериальной гипертензии (см. «Альбумин»). Выявление и мониторинг поражений почек при интоксикации, инфекционных и аутоиммунных заболеваниях.
Увеличение концентрации (протеинурия).
-
Функциональная протеинурия обусловлена транзиторным увеличением проницаемости капилляров клубочков вследствие:
-
-
Преренальная протеинурия обусловлена парапротеинемией (миеломной болезнью, лимфопролиферативными заболеваниями).
-
Ренальная протеинурия обусловлена замедлением почечного кровотока с увеличением проницаемости капилляров клубочков или увеличением проницаемости клубочковой мембраны, снижением канальцевой реабсорбции вследствие их повреждения (застойной сердечной недостаточностью, лихорадкой, гломерулонефритом, пиелонефритом, амилоидозом почек, липоидным нефрозом, туберкулезом почки, геморрагическими лихорадками, геморрагическим васкулитом, нефропатией беременных, диабетической нефропатией, нефропатией при артериальной гипертензии).
-
При минимальных повреждениях клубочков почек, снижении канальцевой реабсорбции наблюдается потеря низкомолекулярных белков, преимущественно альбумина (селективная протеинурия). При более выраженных патологических изменениях в клубочках нефрона в мочу попадают и более крупные белковые молекулы (неселективная протеинурия). Массивная потеря белка с мочой при нефротическом синдроме (>3 г/сут) всегда связана с клубочковой протеинурией и может приводить к гипопротеинемии.
-
Постренальная протеинурия связана с поступлением белков воспалительного экссудата в мочу при патологиях мочевыводящих путей (воспалении, инфекциях, опухолях мочеточников, мочевого пузыря, уретры).
-
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания: аминогликозиды, глюкокортикоиды, эналаприл, интерферон, изониазид, сульфониламиды, нестероидные противовоспалительные препараты, некоторые антибиотики и противогрибковые средства.
Билирубин
Продукт распада порфиринового кольца гемоглобина и других гемсодержащих белков в клетках ретикулоэндотелиальной системы, селезенке и печени. Билирубин содержится в сыворотке крови в виде двух фракций: прямого (связанного, конъюгированного) и непрямого (свободного, несвязанного) билирубина, составляющих общий билирубин. При распаде гемоглобина первоначально образуется билирубин, который из-за плохой растворимости в воде является токсичным: при повышении его содержания он растворяется в липидах мембран и вызывает нарушения их функционирования. В норме в плазме крови билирубин связывается с альбумином (непрямой билирубин), что предотвращает его проникновение в липидные слои мембран. В печени при участии фермента уридинди фосфатглюкуронилтрансферазы гепатоцитов свободный билирубин связывается с глюкуроновой кислотой с образованием водорастворимого конъюгированного (прямого) билирубина, секретируемого в желчные протоки. В кишечнике происходят химические превращения билирубина под действием ферментов микрофлоры с образованием пигмента стеркобилиногена (стеркобилина), который выводится из организма в основном с калом и частично с мочой. В клинических лабораториях измеряют концентрацию общего и прямого билирубина, по разнице рассчитывают концентрацию непрямого билирубина. Если общий билирубин не превышает референтных пределов, допустимо не проводить измерение прямого билирубина. При гипербилирубинемии более 27-34 мкмоль/л развивается синдром желтухи (легкая форма - до 85 мкмоль/л, среднетяжелая - 86-169 мкмоль/л, тяжелая форма - свыше 170 мкмоль/л), обусловленный накоплением билирубина в тканях организма с появлением желтой окраски кожи и конъюнктивы. По патобиохимическим особенностям развития выделяют механическую (обтурационную), паренхиматозную и гемолитическую желтуху, а также физиологическую желтуху новорожденных, гемолитическую болезнь новорожденных. При гипербилирубинемии с повышением прямого билирубина он может быть обнаружен в моче, поскольку почечный фильтр в норме проницаем для этого низкомолекулярного пигмента. Поступления в мочу непрямого билирубина при повышении его плазменной концентрации не происходит (задерживается почечным фильтром из-за комплексированного с ним альбумина), за исключением случаев патологий почек с поражением почечного фильтра.
Материал (проба): сыворотка крови; избегать гемолиза и воздействия света. До исследования можно хранить в темноте 48 ч при комнатной температуре, 7сут - при +4 °С, 6 мес - при -20 °С.
Референтные пределы: новорожденные 1 сут - до 68 мкмоль/л; взрослые и дети (кроме периода новорожденности) - до 19 мкмоль/л (билирубин прямой; конъюгированный до 6,8 мкмоль/л).
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Выявление и мониторинг желтухи при гемолитических анемиях, заболеваниях печени, холестазе. Дифференциальная диагностика желтух.
Увеличение концентрации (гипербилирубинемия).
-
Состояния, связанные с повышенным гемолизом эритроцитов и усилением продукции билирубина; гипербилирубинемия развивается в основном за счет непрямого билирубина (острые и хронические гемолитические анемии, талассемия, массивные переливания крови, несовместимость при гемотрансфузии, физиологическая желтуха новорожденных, гемолитическая болезнь новорожденных). У новорожденных физиологическая желтуха наблюдается в первую неделю жизни, когда происходит ускоренное разрушение эритроцитов в связи со сменой типов гемоглобина на фоне еще не совершенной билирубин-конъюгирующей системы гепатоцитов. При гемолитической болезни новорожденных, вызванной чаще всего несовместимостью крови матери и ребенка по резус-принадлежности, может наблюдаться гораздо более значительное повышение уровня билирубина крови (до токсических величин 200 мкмоль/л и выше).
-
Заболевания печени с поражением гепатоцитов и связанным с этим ослаблением образования прямого билирубина и его транспорта в желчь, а также «утеканием» прямого билирубина в кровь; гипербилирубинемия развивается за счет прямого и непрямого билирубина (острые и хронические заболевания печени, первичный и метастатический рак печени, правожелудочковая сердечная недостаточность, холестатический гепатит, первичный билиарный цирроз печени, токсическое поражение печени четыреххлористым водородом, хлороформом, трихлорэтиленом, фторотаном, алкоголем, некоторыми лекарственными препаратами).
-
Обтурация внутри- и внепеченочных желчных протоков; гипербилирубинемия развивается в основном за счет прямого билирубина (желчнокаменная болезнь, опухоли поджелудочной железы, гельминтозы).
-
Врожденные гипербилирубинемические синдромы, развивающиеся вследствие генетически детерминированных дефектов метаболизма в гепатоцитах: синдром Жильбера (идиопатическая неконъюгированная гипербилирубинемия); синдром Криглера-Найяра (отсутствие или дефицит уридиндифосфат глюкуронилтрансферазы); синдром Дабина-Джонсона (нарушение транспорта билирубина из гепатоцитов в желчь); синдром Ротора (идиопатическая семейная доброкачественная гипербилирубинемия с адекватным повышением конъюгированного и неконъюгированного билирубина).
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания: гемолиз in vivo или in vitro (аналитическая интерференция), гепатотоксичные и холестатические лекарственные препараты, а также препараты, вызывающие гемолиз.
Гликированный гемоглобин
Образование гликированного гемоглобина (НЬА1с) в крови определяется уровнем гликемии и длительностью контакта гемоглобина с глюкозой.
Методы исследования: высокоэффективная жидкостная хроматография, жидкостная ионообменная хроматография, аффинная хроматография, иммуно турбидиметрия, электрофорез.
Материал (проба): цельная кровь (с ЭДТА) стабильна 4-7 сут при +4 °С, 30 сут - при -20 °С.
Референтные пределы: в сыворотке крови - менее 6,1% общего гемоглобина.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Уровень гликированного гемоглобина в эритроцитах является интегральным показателем углеводного обмена за предшествующие 6-8 нед и отражает риск развития осложнений сахарного диабета. Интерпретация представлена в табл. 4-11.
Таблица 4-11. Контрольные параметры (цель лечения) сахарного диабета
| Типы диабета | Норма | Адекватный контроль | Неадекватный контроль |
|---|---|---|---|
Сахарный диабет 1-го типа HbA1r,% |
<6,1 |
6,1-7,5 |
>7,5 |
Сахарный диабет 2-го типа |
Низкий риск ангиопатии |
Риск макроангиопатии |
Риск микроангиопатии |
HbA1r,% |
<6,5 |
6,5-7,5 |
>7,5 |
Измерение концентрации НЬА1с показано для выявления нарушенной толерантности к глюкозе, в том числе сахарного диабета, «скрытых» или доманифестных форм и диабета беременных. Используется для оценки компенсации сахарного диабета, эффективности лечения и степени риска осложнений.
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Глюкоза в крови
Глюкоза - моносахарид, являющийся основным энергетическим субстратом для большинства тканей организма. Концентрация глюкозы в плазме (сыворотке) крови - интегральный показатель обмена углеводов в организме. К повышению концентрации глюкозы в крови ведут поступление углеводов (крахмала, гликогена, сахарозы и др.) с пищей, распад гликогена в печени, синтез глюкозы в печени из продуктов распада белков, жиров и углеводов (глюконеогенез). Отток глюкозы из крови в ткани происходит вследствие ее использования для синтеза запасной формы глюкозы - гликогена в основном в печени и скелетных мышцах, синтеза гетерополисахаридов, высших жирных кислот (при избыточном поступлении в организм углеводов). Соотношение скорости процессов образования и утилизации глюкозы, следовательно, и концентрация глюкозы в крови регулируются гормонами. Гипергликемический эффект в норме оказывают несколько гормонов - глюкагон, кортизол, адреналин, глюкокортикоиды, усиливающие различные процессы образования глюкозы в тканях. Инсулин - единственный гипогликемический гормон. Стимуляция транспорта глюкозы из крови в клетки и активация фермента глюкокиназы (гексокиназы) инсулином ведут к усилению всех процессов утилизации глюкозы в тканях-мишенях для этого гормона (печени, скелетных мышцах, жировой ткани). Инсулиновая недостаточность, развивающаяся вследствие ослабления продукции инсулина поджелудочной железой и/или снижения количества рецепторов к инсулину на клетках-мишенях, ведет к гипергликемии после приема углеводов с пищей (в течение 1-2 ч - при нарушении толерантности к глюкозе, в течение 8 ч и более - при сахарном диабете). У здоровых беременных из-за потребления глюкозы растущим плодом ее уровень натощак может быть немного снижен по сравнению с небеременными. Адаптивные гормональные сдвиги при беременности вызывают некоторое повышение толерантности к инсулину в организме женщины, что направлено на увеличение доступности глюкозы для плода. У некоторых женщин относительная недостаточность инсулина может вызвать развитие диабета беременных (гестационного диабета), проходящего после родов.
Материал (проба): сыворотка (быстро отделять от форменных элементов крови до исследования; можно хранить 8 ч при комнатной температуре, 72 ч - при +4 °С), цельная кровь, плазма крови, забранная с гепарином и фторидом натрия в качестве ингибитора гликолиза (до исследования можно хранить сутки при комнатной температуре, 7 сут - при +4 °С).
Референтные пределы представлены в табл. 4-12.
Таблица 4-12. Референтные пределы глюкозы
| Возраст | Глюкоза в сыворотке крови, ммоль/л | Глюкоза цельной (капиллярной) крови, ммоль/л |
|---|---|---|
Новорожденные |
2,8-4,4 |
2,5-4,1 |
Взрослые |
4,0-6,1 |
3,3-5,5 |
Концентрация глюкозы в сыворотке крови примерно на 11-14% выше, чем в цельной крови, из-за разведения растворенной в плазме глюкозы форменными элементами крови. Концентрация глюкозы в гепаринизированной плазме на 5% ниже содержания глюкозы в сыворотке. Вследствие утилизации глюкозы в тканях цельная венозная кровь содержит меньше глюкозы, чем капиллярная кровь из пальца (натощак примерно на 0,1 ммоль/л, после приема пищи - на 15-20%, большая разница может быть у пациентов с нарушениями микроциркуляции, например при шоке).
Лабораторные критерии диагноза сахарного диабета (ВОЗ, 1999): сочетание клинических симптомов диабета (полиурия, полидипсия, необъяснимая потеря массы тела) и случайных (независимого от времени предыдущего приема пищи). Критерии нарушения толерантности глюкозы и сахарного диабета на основе уровня глюкозы в крови представлены в табл. 4-13.
Таблица 4-13. Диагностический уровень концентрации глюкозы, ммоль/л
Диагноз |
Момент взятия пробы |
Цельная кровь |
Плазма венозной крови |
|
венозная |
капиллярная |
|||
Норма |
Натощак |
3,3-5,5 |
3,3-5,5 |
4,0-6,1 |
Через 2 ч после нагрузки глюкозой |
<6,7 |
<7,8 |
<7,8 |
|
Нарушение толерантности к глюкозе |
Натощак |
<6,1 |
<6,1 |
<7,0 |
Через 2 ч после нагрузки глюкозой |
>6,7 и <10,0 |
>7,8 и <11,1 |
>7,8 и <11,1 |
|
Сахарный диабет |
Натощак |
>6,1 |
>6,1 |
>7,0 |
Через 2 ч после нагрузки глюкозой |
>10,0 |
>11,1 |
>11,1 |
|
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг сахарного диабета, диабета беременных, нарушения толерантности к глюкозе. Выявление и мониторинг нарушений углеводного обмена при недостаточности надпочечников, гипофиза, заболеваниях печени, сепсисе, шоке и других критических состояниях. Скрининг нарушений углеводного обмена в группах риска развития сахарного диабета (ожирение, возраст старше 45 лет, сахарный диабет 1-го типа в семейном анамнезе). Дифференциальная диагностика комы (гипо- и гипергликемической комы).
Увеличение концентрации глюкозы (гипергликемию) вызывают:
-
увеличение продукции гипергликемических гормонов (феохромоцитома, тиреотоксикоз, акромегалия, гигантизм, синдром Кушинга);
-
снижение продукции инсулина при заболеваниях поджелудочной железы (острый и хронический панкреатит, опухоли поджелудочной железы);
-
травма, опухоли, операционные повреждения головного мозга, кровоизлияние в мозг.
Уменьшение концентрации (гипогликемию) вызывают:
-
повышение продукции инсулина (аденома или карцинома β-клеток островков Лангерганса - инсулинома);
-
снижение продукции гипергликемических гормонов (недостаточность α-клеток островков Лангерганса, болезнь Аддисона, адреногенитальный синдром, гипопитуитаризм, гипотиреоз);
-
ослабление гликогенной функции печени при циррозе, тяжелых гепатитах разной этиологии, первичном раке печени, гемохроматозе, алкогольной интоксикации;
-
ферментопатии (болезнь Гирке, галактоземия, нарушенная толерантность к фруктозе);
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания: глюкокортикоиды, никотиновая кислота, адреналин, некоторые диуретики, нестероидные противовоспалительные препараты, морфин, кофеин, курение.
Уменьшение содержания: без добавления ингибитора гликолиза длительное хранение плазмы, сыворотки до отделения от форменных элементов крови, сгустка; анаболические стероиды, пропранолол, амфетамин, леводопа.
Глюкоза в моче
Материал (проба): суточная моча; исключить применение диуретиков. До исследования можно хранить 48 ч при -20 °С.
Референтные пределы: менее 0,08 ммоль/сут (большинство тест-систем нечувствительны к такой концентрации и дают отрицательный результат).
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Мониторинг сахарного диабета беременных, нарушения толерантности к глюкозе. Диагностика и мониторинг почечного диабета, патологий почек с нарушением канальцевой реабсорбции.
С мочой глюкоза в норме не выводится, поскольку после фильтрации в почечных клубочках полностью реабсорбируется в проксимальных канальцах. При гипергликемии выше 9-10 ммоль/л (почечный порог для глюкозы) развивается глюкозурия. Глюкозурия не является диагностическим критерием сахарного диабета, поскольку экскреция глюкозы с мочой зависит не только от уровня гликемии, отражающей инсулярную функцию, но и от функционирования почек - способности почечных канальцев реабсорбировать глюкозу, скорости клубочковой фильтрации. Глюкозурия на фоне нормогликемии может развиваться при некоторых заболеваниях почек из-за снижения почечного порога, а также во время нормальной беременности из-за того, что физиологическое повышение клубочковой фильтрации неадекватно абсорбционной способности канальцев. Одним из критериев компенсации сахарного диабета 2-го типа является аглюкозурия, при сахарном диабете 1-го типа допускается потеря глюкозы с мочой 20-30 г/сут. При диабетическом гломерулосклерозе почечный порог для глюкозы возрастает, поэтому глюкозурия не развивается даже при выраженной гипергликемии.
Увеличение экскреции (глюкозурия) связано:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания: глюкокортикоиды, адреналин, некоторые диуретики, нестероидные противовоспалительные препараты, никотиновая кислота, морфин.
Креатинин в сыворотке крови
Креатинин - конечный продукт неферментативного распада креатинфосфата и креатина, участвующих в энергообеспечении мышечного сокращения. Креатинин выводится из крови почками, относится к беспороговым веществам, которые поступают в мочу путем фильтрации, не реабсорбируются и не секретируются в канальцах. Увеличение концентрации креатинина в сыворотке крови отражает снижение скорости клубочковой фильтрации. Креатинин не является чувствительным показателем нарушений фильтрационной способности почек на ранних стадиях, может оставаться в референтных пределах при поражении значительной части нефронов, с другой стороны, медленнее, чем мочевина, изменяется при гемодиализе у больных с почечной недостаточностью. Именно поэтому этот тест обычно используют одновременно с определением мочевины: ее сывороточная концентрация более чувствительна к функциональным изменениям состояния почек. Дополнительно для оценки полезен расчет скорости клубочковой фильтрации по клиренсу эндогенного креатинина (см. «Проба Реберга»). На уровень креатинина в сыворотке влияет скорость его продукции в мышцах (мышечная масса), в меньшей степени, чем на уровень мочевины, влияет характер пищи.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг заболеваний почек, выявление и мониторинг нарушений функций почек любой этиологии. Заболевания скелетных мышц.
Референтные пределы представлены в табл. 4-14.
Таблица 4-14. Референтные пределы креатинина в крови
| Возраст, пол | мкмоль/л |
|---|---|
<1 года |
18-35 |
1-14 лет |
27-62 |
>14 лет, женский |
53-97 |
>14 лет, мужской |
62-115 |
Увеличение концентрации наблюдается:
-
при снижении клубочковой фильтрации при дисфункции почек любой этиологии (снижении почечной перфузии, заболеваниях почек, обтурации мочевыводящих путей);
-
эндокринных нарушениях, сопровождающихся изменением метаболизма скелетных мышц (акромегалии и гигантизме, гипертиреозе);
-
некрозе скелетных мышц, воспалительных и метаболических заболеваниях с вовлечением мышц;
Уменьшение концентрации наблюдается при снижении мышечной массы тела.
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания: мясная диета, беременность (физиологически), нефро токсичные препараты.
Креатинин в моче
Материал (проба): суточная моча; избегать интенсивных физических нагрузок, по согласованию с врачом исключить прием диуретиков. До исследования можно хранить 4 сут при +4 °С, месяц - при -20 °С.
Референтные пределы представлены в табл. 4-15.
Таблица 4-15. Референтные пределы креатинина в моче
| Возраст, пол | мкмоль/кг в сутки |
|---|---|
<1 года |
71-177 |
Дети |
71-194 |
Подростки |
71-265 |
>14 лет, мужской |
124-230 |
>14 лет, женский |
97-177 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг заболеваний почек, выявление и мониторинг нарушений функций почек любой этиологии.
Увеличение суточной экскреции креатинина с мочой указывает на увеличение почечной фильтрации и/или повышенное образование креатина и креатинина в скелетных мышцах. Увеличением концентрации сопровождаются:
Уменьшение суточной экскреции креатинина с мочой указывает на снижение уровня почечной фильтрации (более точно можно оценить по клиренсу эндогенного креатинина; см. «Проба Реберга») и/или сниженное образование креатина и креатинина в мышцах. Уменьшением концентрации сопровождаются:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания: мясная пища, белковая диета, беременность.
Уменьшение содержания: вегетарианская пища.
Клиренс креатинина - проба Реберга
Проба Реберга - оценка скорости клубочковой фильтрации (СКФ) по клиренсу эндогенного креатинина. Креатинин относится к беспороговым веществам, которые поступают в мочу путем фильтрации, не реабсорбируются и не секретируются в канальцах. Именно поэтому количество креатинина, выводимого за определенное время с мочой, равно количеству креатинина, поступившего в первичную мочу. Измерив концентрацию креатинина в сыворотке крови (она равна уровню креатинина в первичной моче) и моче, а также объем мочи, выделяемой за определенное время (обычно за сутки), можно рассчитать клиренс креатинина, характеризующий СКФ по формуле:
клиренс креатинина, мл/мин = (концентрация креатинина в моче × диурез, мл)/(концентрация креатинина в сыворотке крови × время сбора мочи, мин).
Фильтрация в почках зависит от роста и массы тела, поэтому клиренс креатинина рассчитывают на стандартную среднюю поверхность тела, равную 1,73 м2. Для этого в направлении на исследование, кроме объема мочи, собранной за сутки, указывают рост и массу тела.
Материал (проба): сыворотка крови, суточная моча при обычном водном режиме. До исследования можно хранить при +4 °С до 6 сут, при -20 °С - 6 мес.
Референтные пределы представлены в табл. 4-16.
Таблица 4-16. Референтные пределы клиренса креатинина
Возраст, годы |
мл/мин на 1,73 м2 |
|
мужской пол |
женский пол |
|
<1 |
65-100 |
65-100 |
1-30 |
88-146 |
81-134 |
30-40 |
82-140 |
75-128 |
40-50 |
75-133 |
69-122 |
50-60 |
68-126 |
64-116 |
60-70 |
61-120 |
58-110 |
>70 |
55-113 |
52-105 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Выявление и мониторинг нарушений гломерулярной функции почек.
Увеличение концентрации:
Уменьшение концентрации:
При выраженной почечной недостаточности СКФ, оцененная пробой Реберга, может быть завышена (при значительно повышенном уровне креатинина в плазме крови он может поступать в мочу путем секреции в почечных канальцах). В этой ситуации сывороточный уровень креатинина может быть более чувствительным индикатором изменения функции клубочков.
ВЛИЯЮЩИЕ ФАКТОРЫ
Физические нагрузки, крепкий чай, кофе, алкоголь, прием кортикотропина, кортизола, тироксина, метилпреднизолона, фуросемида (следует исключить прием этих препаратов при проведении пробы).
Лактат
Лактат - продукт анаэробного метаболизма глюкозы, активирующегося при снижении обеспечения тканей кислородом. Источником лактата в крови в норме являются скелетные мышцы (при физической работе), а также эритроциты, неспособные расщеплять глюкозу аэробным путем из-за отсутствия митохондрий. Отток лактата из крови обусловлен его использованием для синтеза глюкозы (глюконеогенеза) в печени, в меньшей степени - в почках. Накопление лактата в тканях, крови может быть следствием:
Накопление лактата может привести к метаболическому ацидозу (при концентрации в плазме артериальной крови >7 ммоль/л) с характерным увеличением анионного интервала.
Материал (проба): плазма крови, забранная с оксалатом (ЭДТА) и ингибитором гликолиза - фторидом натрия. При необходимости до исследования можно хранить 3 сут при +4 °С.
Референтные пределы представлены в табл. 4-17.
Таблица 4-17. Референтные пределы лактата в плазме крови
| Материал | ммоль/л |
|---|---|
Плазма венозной крови |
<2,2 |
Плазма артериальной крови |
<1,6 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Оценка адекватности доставки кислорода в ткани при всех критических состояниях, сопровождающихся нарушениями кровообращения, внешнего дыхания, кислородтранспортной функции крови. Исследования в спортивной физиологии и медицине.
Увеличение концентрации:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: наложение жгута при взятии венозной крови; интоксикация аспирином♠, адреналин♠ (особенно в избыточных дозах), этанол, фруктоза, глюкоза, изониазид (передозировка), метформин, метилпреднизолон, налидиксовая кислота, фенформинΨ, сахароза, тербуталинΨ, тетракозактринΨ.
Снижение концентрации: метиленовый синий, морфин.
Мочевая кислота
Низкомолекулярное азотсодержащее вещество, конечный продукт распада пуриновых азотистых оснований - аденина и гуанина, входящих в состав свободных нуклеотидов и нуклеиновых кислот. Выводится из организма с мочой. При повышенном образовании мочевой кислоты в тканях и связанным с этим увеличением ее концентрации в плазме крови могут образовываться кристаллы натриевых солей мочевой кислоты - уратов, что лежит в основе патогенеза подагры. Клинические проявления подагры (артриты, мочекаменная болезнь, уратная нефропатия) обусловлены отложением кристаллов уратов в суставной жидкости, окружающих суставы тканях, паренхиме или канальцах почек. Повышенному образованию мочевой кислоты способствуют врожденная недостаточность участвующих в обмене пуринов ферментов, усиленный катаболизм нуклеиновых кислот при массивном разрушении тканей, повышенном потреблении животной пищи, богатой пуринами. Риск подагры нарастает по мере увеличения гиперурикемии, но клинические проявления подагры не всегда тесно коррелируют с ее уровнем. Гиперурикемия ассоциируется с метаболическим синдромом.
Референтные пределы представлены в табл. 4-18.
Таблица 4-18. Референтные пределы мочевой кислоты в сыворотке крови
| Возраст, пол | мкмоль/л |
|---|---|
<14 лет |
120-320 |
>14 лет, мужской |
210-420 |
>14 лет, женский |
150-350 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг подагры, в том числе у больных, имеющих метаболический синдром. Исключение подагры как причины мочекаменной болезни.
Увеличение концентрации:
Уменьшение концентрации:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: длительное голодание, физическая нагрузка, диета, богатая пуриновыми основаниями, употребление алкоголя, прием β-адреноблокаторов, глюкокортикоидов, цитостатиков (при лейкозах, лимфомах, миеломной болезни, полицитемии), тиазидных диуретиков, салицилатов, теофиллина, метформина.
Уменьшение концентрации: низкопуриновая диета, прием аллопуринола, глюкокортикоидов, азатиоприна.
Мочевина в сыворотке крови
Мочевина - синтезируемый в печени конечный продукт детоксикации эндогенного аммиака, образующегося при распаде белков и других азотсодержащих соединений. Около 90% мочевины выводится с мочой; мочевина фильтруется в клубочках, частично пассивно реабсорбируется и секретируется в канальцах. Концентрация мочевины в плазме (сыворотке) крови отражает соотношение скорости ее образования и выведения с мочой. Скорость синтеза мочевины возрастает при потреблении чрезмерно обогащенной белком пищи, усиленном эндогенном катаболизме в условиях голодания или повреждения тканей, при всасывании аминокислот и пептидов после кровоизлияния в желудочно-кишечный тракт. Однако существенное увеличение содержания мочевины в плазме (сыворотке) крови, как правило, указывает на нарушение функций почек. Это заключение почти однозначно при содержании мочевины в плазме крови, превышающем 15 ммоль/л. Вероятность нарушения функций почек возрастает, если при соответствующих данных анамнеза выявлены отклонения в общем анализе мочи (обнаружение белка, цилиндров, клеток крови), диурезе и/или повышенный уровень креатинина. Существенное возрастание концентрации мочевины ведет к увеличению осмолярности плазмы крови, что может влиять на гидратацию клеток.
Выделение мочевины с мочой зависит от скорости распада эндогенных белков и поступления пищевых белков, необходимых для обеспечения организма субстратами (аминокислотами) для синтеза белков и других азотсодержащих соединений, включая азотистые основания нуклеотидов. Именно поэтому исследование экскреции мочевины с мочой используется для оценки баланса между процессами синтеза и распада белков в организме - азотистого баланса. Отрицательный азотистый баланс проявляется задержкой роста у детей, снижением массы тела, снижением скорости заживления ран, а также нарушениями, обусловленными снижением скорости пролиферации клеток быстрообновляемых тканей и синтеза короткоживущих белков (гипоальбуминемией, анемией, мальабсорбцией, интеркуррентными инфекциями в связи с недостаточностью иммунной системы и др.).
Референтные пределы представлены в табл. 4-19.
Таблица 4-19. Референтные пределы мочевины в сыворотке крови
| Возраст | ммоль/л |
|---|---|
<14 лет |
1,8-6,4 |
14-60 лет |
2,5-6,4 |
>60 лет |
2,9-7,5 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Оценка и мониторинг выделительной функции почек. Оценка мочевинообразующей функции печени при печеночной недостаточности различной этиологии.
Увеличение концентрации:
-
острые или хронические заболевания почек, обтурация мочевыводящих путей
-
снижение почечной перфузии (застойная сердечная недостаточность, шок);
-
изоосмотическая дегидратация при рвоте, диарее, повышенном диурезе или потоотделении;
-
увеличение синтеза мочевины при повышенном катаболизме белка (желудочно-кишечном кровотечении, ожогах, инфекциях, послеоперационном состоянии и др.).
Уменьшение концентрации:
-
повышенная скорость клубочковой фильтрации, обусловленная беременностью, чрезмерным объемом внутривенных инфузий, неадекватной секрецией антидиуретического гормона;
-
снижение синтеза мочевины при функциональной недостаточности печени (печеночной коме, гепатите, циррозе, острой гепатодистрофии, отравлении фосфором, мышьяком);
-
мальабсорбция и/или недостаточность белка в рационе (в связи со снижением продукции аммиака и соответственно синтеза мочевины);
-
врожденная недостаточность ферментов гепатоцитов, участвующих в процессе синтеза мочевины (орнитиновом цикле).
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: диета с высоким содержанием белка, прием нефротоксичных лекарственных препаратов, увеличенный катаболизм эндогенных белков при гипертиреозе, приеме глюкокортикоидов.
Уменьшение концентрации: вегетарианская низкобелковая диета.
Мочевина в моче
Материал (проба): суточная моча.
Референтные пределы представлены в табл. 4-20.
Таблица 4-20. Референтные пределы мочевины в суточной моче
| Возраст | ммоль/сут |
|---|---|
<1 года |
10-100 |
1-4 года |
50-200 |
4-8 лет |
130-280 |
8-14 лет |
200-450 |
>14 лет |
428-714 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Контроль азотистого баланса у больных в тяжелом состоянии, получающих зондовое энтеральное и парентеральное питание. Корректно оценить азотистый баланс с использованием этого теста можно лишь при отсутствии тяжелой печеночной и почечной недостаточности, сопровождающейся соответственно снижением биосинтеза мочевины, уменьшением ее экскреции с мочой.
Увеличением, указывающим на отрицательный азотистый баланс, сопровождаются:
Уменьшением, указывающим на положительный азотистый баланс, сопровождаются:
Азотистый баланс может быть рассчитан по формуле:
АБ (г) = суточное поступление белка - 6,25 × (суточный азот мочевины + 4 г),
где 6,25 - коэффициент пересчета содержания азота в белок, 1 г азота = 6,25 г белка; 4 г - поправка на выведение организмом азота не в составе мочевины.
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: диета с высоким содержанием белка, лечение анаболическими стероидами, соматотропным гормоном, инсулином.
Уменьшение концентрации: диета с низким содержанием белка, лечение глюкокортикоидами.
Порфобилиноген
Порфобилиноген - промежуточный метаболит синтеза порфиринового кольца гема. Синтез гема происходит главным образом в печени и костном мозге, начинается с образования 5-8-аминолевулиновой кислоты, из которой образуются порфобилиноген и другие метаболиты. Наследственные и приобретенные нарушения синтеза гема, сопровождающиеся повышением содержания предшественников гема - порфириногенов, а также продуктов их окисления в тканях и крови, появлением их в моче, называют порфириями. Наследственные порфирии обусловлены генетическими дефектами какого-либо из восьми ферментов, участвующих в синтезе гема. Поскольку гем является ингибитором аминолевулинатсинтазы, активность этого фермента повышается, что приводит к накоплению аминолевулиновой кислоты и порфириногенов. При тяжелых формах порфирий наблюдают нейропсихические расстройства, нарушения функций ретикулоэндотелиальной системы, повреждения кожи. При легких формах наследственных порфирий заболевание может протекать бессимптомно, обострение вызывается приемом некоторых лекарственных препаратов, являющихся индукторами аминолевулинатсинтазы. Порфирии наблюдают при отравлениях свинцом, галогенсодержащими гербицидами и инсектицидами, являющимися ингибиторами отдельных ферментов процесса синтеза гема.
Материал (проба): моча свежая, случайная порция для качественного теста; суточная, собранная в темную емкость с 5 г углекислого натрия; собирают во время или немедленно после приступа болей в животе. До исследования можно хранить при +4 °С до 14 сут, при -20 °С - несколько недель.
Методы исследования: качественный тест с реактивом Эрлиха, флюориметрия, колориметрия после выделения методом анионообменной хроматографии и реакции с реактивом Эрлиха.
Референтные пределы: отрицательные (<8,8 мкмоль/л, или <15 мкмоль/сут).
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика врожденных и приобретенных порфирий. При подозрении на порфирию количественный тест следует проводить даже при отрицательном качественном тесте. На первом этапе диагностики порфирии наиболее информативно одновременное определение в моче порфобилиногена, 5-δ-аминолевулиновой кислоты и общих порфиринов. Установление формы врожденной порфирии проводят в специализированных лабораториях с применением комплекса методов, включающих высокоэффективную жидкостную хроматографию, а также генетический анализ. Для постановки диагнозов отравления свинцом и профессиональной передозировки свинца предпочтительнее проводить определение свинца в крови.
Увеличение концентрации:
Свободные жирные кислоты
Свободные жирные кислоты (СЖК), или неэтерифицированные жирные кислоты, в организме служат источником метаболической энергии, субстратом для структур клеточной мембраны, а также предшественниками для многих внутриклеточных сигнальных молекул, таких как простагландины. СЖК выделяются из жировой ткани при липолизе. На процесс выделения оказывают влияние диета и колебания уровня инсулина. Патологические состояния, такие как инсулинорезистентность при патогенезе сахарного диабета 2-го типа, ожирение, злокачественные болезни и метаболический синдром, ассоциируются с повышенным содержанием СЖК в крови и содействуют развитию сердечно-сосудистых заболеваний.
Материал (проба): сыворотка крови, забранной утром через 12-14 ч после последнего приема пищи. Определение СЖК следует проводить в течение не более 2 ч после забора крови. В противном случае из-за возможного наличия в образце липазной активности может происходить гидролиз содержащихся в нем триглицеридов с образованием дополнительных количеств СЖК, что может привести к завышению их истинной концентрации.
Референтные пределы: женщины - 0,1-0,45 ммоль/л, мужчины - 0,1-0,6 ммоль/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика первичных нарушений липидного обмена (в комплексе с электрофоретическим анализом липопротеидов и другими исследованиями, выполняемыми в специализированных лабораториях). Диагностика вторичных нарушений липидного обмена. Оценка риска атеросклероза и его осложнений. Мониторинг коррекции атерогенных нарушений липидного обмена.
Увеличение концентрации:
Уменьшение концентрации:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: прием пищи менее чем за 12 ч до исследования, высококалорийная пища, диета с высоким содержанием углеводов, беременность, пероральные контрацептивы, прием β-адреноблокаторов, глюкокортикоидов, эстрогенов, диуретиков.
Уменьшение концентрации: прием холестираминаΨ, витамина C, прогестинов, лечение гепарином.
Триглицериды
Триглицериды (ТГ) - эфиры спирта глицерола и высших жирных кислот. Основная функция - энергетический субстрат. Синтез эндогенных ТГ осуществляется в печени и жировой ткани; в эпителии тонкой кишки происходит ресинтез ТГ из продуктов переваривавания пищи - моноглицеридов и жирных кислот. Из тонкой кишки ТГ транспортируются лимфой в виде мелкодисперсных капель - хиломикронов (транспортная форма липидов), расщепляющихся в крови липопротеидлипазой эндотелия; образованные при этом жирные кислоты поступают в клетки жировой ткани, где депонируются в составе триглицеридов, а также в мышцы и другие ткани, где используются как энергетический субстрат. В жировой ткани ТГ могут гидролизоваться активируемой глюкагоном липазой, поступающие в кровь жирные кислоты используются различными тканями как энергетический субстрат. Синтезированные в печени ТГ и ТГ поступающих сюда ремнантов (остатков) хиломикронов переносятся кровью в составе липопротеидов очень низкой плотности (ЛПОНП). Содержание ТГ в плазме (сыворотке) крови изменяется в течение дня в связи с приемом пищи: увеличивается через 30-60 мин после приема пищи, что из-за присутствия хиломикронов придает плазме мутность (хилез), и возвращается к исходному уровню в течение 12 ч. Повышенный уровень ТГ может быть обусловлен увеличением содержания в плазме крови хиломикронов и/или ЛПОНП. Нахождение плазмы при +4…+8 °С в течение 12-18 ч сопровождается появлением сливкообразного слоя с просветлением плазмы, что характерно для гиперлипидемии, обусловленной хиломикронами, сохранение мутности плазмы - для повышенного содержания ЛПОНП. Повышенная концентрация триглицеридов в крови ассоциируется с повышенным риском развития атеросклероза и ишемической болезни сердца.
Референтные пределы: триглицериды - 0,5-1,7 ммоль/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика первичных нарушений липидного обмена (в комплексе с электрофоретическим анализом липопротеидов и другими исследованиями, выполняемыми в специализированных лабораториях). Диагностика вторичных нарушений липидного обмена. Оценка риска атеросклероза и его осложнений. Мониторинг коррекции атерогенных нарушений липидного обмена.
Увеличение концентрации.
Уменьшение концентрации:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: прием пищи менее чем за 12 ч до исследования, высококалорийная пища, диета с высоким содержанием углеводов, беременность, пероральные контрацептивы, прием β-адреноблокаторов, глюкокортикоидов, эстрогенов, диуретиков.
Уменьшение концентрации: прием холестираминаΨ, витамина C, прогестинов, лечение гепарином.
Холестерин общий
Холестерин (холестерол) - многоатомный циклический спирт, структурный компонент мембран клеток, исходный субстрат при синтезе половых гормонов, глюкокортикоидов, желчных кислот, витамина D. Синтезируется в печени (до 80%) и поступает в организм с продуктами животного происхождения (мясом, сливочным маслом, яйцами и др.). Транспортируется в крови в составе липопротеидов низкой плотности (ЛПНП), высокой плотности (ЛПВП), очень низкой плотности (ЛПОНП). Общий холестерин включает как этерифицированный (связанный эфирной связью с жирной кислотой), так и свободный холестерин липопротеидов всех видов. Повышенное содержание общего холестерина в крови ассоциируется с высоким риском атеросклероза и ишемической болезни сердца.
Материал (проба): сыворотка крови, забранная утром не ранее чем через 12-14 ч после последнего приема пищи. Для оценки атерогенных нарушений не рекомендуют проводить исследование в течение 3 мес после острых заболеваний, включая острый инфаркт миокарда.
Референтные пределы: 3,1-5,2 ммоль/л.
Риск развития ишемической болезни сердца и ее осложнений:
У больных с ишемической болезнью сердца, атеросклерозом периферических и сонных артерий, аневризмой брюшного отдела аорты, а также сахарным диабетом 2-го типа оптимальным является уровень менее 4,5 ммоль/л.
При концентрации 5,0 ммоль/л и выше для оценки атеросклеротических изменений необходимо исследовать холестерол в комплексе с триглицеридами, ХС-ЛПВП и ХС-ЛПНП с расчетом индекса атерогенности.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
-
Диагностика первичных нарушений липидного обмена (в комплексе с электрофоретическим анализом липопротеидов и другими исследованиями, выполняемыми в специализированных лабораториях).
-
Мониторинг коррекции атерогенных нарушений липидного обмена.
-
Оценка эффективности гиполипидемической терапии (статинами).
Увеличение концентрации.
Уменьшение концентрации:
-
тяжелые острые заболевания, включая острый инфаркт миокарда, сепсис, обширные ожоги (обусловлено острым повреждением тканей; снижение до 40% исходного уровня в течение первого дня болезни, возвращение к состоянию до болезни на протяжении 3 мес);
-
печеночная недостаточность, связанная с некрозом гепатоцитов, циррозом печени, гепатокарциномой;
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: пища, богатая холестерином и ненасыщенными жирными кислотами, терапия андрогенами, циклоспоринами, тиазидными диуретиками, эргокальциферолом (высокие дозы), глюкокортикоидами, леводопой, амиодароном.
Уменьшение концентрации: пища с низким содержанием холестерина и высоким содержанием полиненасыщенных кислот (может снизить на 10-15%), прием препаратов, снижающих уровень холестерола, а также терапия эстрогенами, интерфероном, неомицином, тироксином, кетоконазолом, ингибиторами моноаминооксидазы.
Холестерин липопротеидов высокой плотности (ХС-ЛПВП)
Липопротеиды высокой плотности - сложные мицеллы, состоящие из фосфолипидов, специфических белков, синтезируемых в гепатоцитах, - аполипопротеинов (апо-белков) и гидрофобных липидов, преимущественно холестерина. ЛПВП осуществляют в крови транспорт липидов, включая ХС, от клеток периферических тканей, в том числе кровеносных сосудов сердца, в печень, где он может выводиться из организма в виде желчных кислот. Сниженный уровень ХС-ЛПВП рассматривают как фактор риска развития атеросклероза.
Референтные пределы: 0,9-1,9 ммоль/л.
Рекомендации Всероссийского научного общества кардиологов, 2004
Снижение концентрации ХС-ЛПВП менее 0,9 ммоль/л для мужчин и менее 1,2 ммоль/л для женщин связывают с повышенным риском развития ишемической болезни сердца и ее осложнений, уровень выше 1,56 ммоль/л играет защитную роль. Для корректной оценки атерогенных нарушений липидного обмена необходимо исследовать комплекс показателей: триглицериды, ХС общий, ХС-ЛПНП, ХС-ЛПВП с расчетом индекса атерогенности.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Увеличение концентрации:
Уменьшение концентрации:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: циметидинΨ, циклофенилΨ, эстрогены, производные фибриновой кислоты, статины, никотиновая кислота, фенобарбитал, снижение массы тела у пациентов с ожирением.
Уменьшение концентрации: богатая углеводами или полиненасыщенными жирными кислотами диета, прием β-адреноблокаторов, даназола, интерферона, диуретиков, прогестинов, андрогенов.
ИНДЕКС АТЕРОГЕННОСТИ
Индекс атерогенности - показатель атерогенных нарушений липидного обмена, а также адекватности проводимой гиполипидемической терапии. Оценивают в комплексе с результатами других тестов липидного профиля.
Метод исследования: расчет с использованием результатов исследования холестерина общего, ХС-ЛПВП по формуле (Климов А.Н., 1995):
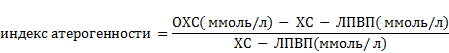
Рекомендуемые пределы: не более 4 ЕД (Европейские рекомендации III пересмотра, 2003; рекомендации Всероссийского научного общества кардиологов, 2004).
Холестерин липопротеидов низкой плотности (ХС-ЛПНП)
Липопротеиды низкой плотности - сложные мицеллы, состоящие из фосфолипидов, специфических белков, синтезируемых в гепатоцитах (апо-белков), ХС и триглицеридов; образуются из ЛПОНП в результате метаболизма в крови, переносят ХС из печени к клеткам периферических тканей. Уровень ХС-ЛПНП в крови положительно коррелирует с риском развития ИБС более тесно, чем уровень общего холестерина. Патогенез атеросклероза включает перекисное поражение компонентов ЛПНП под действием местных факторов воспаления, их захват макрофагами сосудистых стенок и включение ХС-ЛПНП в состав образующихся атеросклеротических бляшек.
Референтные пределы: 2,1-3,5 ммоль/л.
Увеличение концентрации ХС-ЛПНП более 3,5 ммоль/л ассоциируется с повышенным риском развития ИБС и ее осложнений; 3,5-4,1 ммоль/л - пограничный риск, более 4,1 ммоль/л - высокий. У больных с ИБС, атеросклерозом периферических и сонных артерий, аневризмой брюшного отдела аорты, а также СД 2-го типа оптимальным признан уровень ХС-ЛПНП менее 2,6 ммоль/л. Для корректной оценки атерогенных нарушений липидного обмена необходимо исследовать комплекс показателей: триглицериды, холестерин общий, ХС-ЛПНП, ХС-ЛПВП - с расчетом индекса атерогенности.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Увеличение концентрации:
-
первичная гиперлипопротеидемия типов IIa и IIb (семейная гиперхолестеринемия, комбинированная семейная гиперхолестеринемия);
-
синдромы и заболевания, сопровождающиеся изменением метаболизма ЛПНП, - гипотиреоз, нефротический синдром, хроническая почечная недостаточность, холестаз, хронические заболевания печени, порфирия, сахарный диабет, синдром Кушинга, неврогенная анорексия.
Уменьшение концентрации:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: β-адреноблокаторы, андрогены, прогестины, циклоспорин, диуретики, глюкокортикоиды, богатая холестерином диета.
Уменьшение концентрации: салицилаты, холестираминΨ, эстрогены, фибраты, статины, интерферон, кетоконазол, никотиновая кислота, тироксин, богатая полиненасыщенными жирными кислотами диета.
Холестерин липопротеидов очень низкой плотности
Липопротеиды очень низкой плотности (ЛПОНП) - сложные мицеллы, состоящие из фосфолипидов, специфических белков (апо-белков), а также холестерина и триглицеридов, преимущественно экзогенных. Основное место синтеза ЛПОНП - печень, небольшое количество их поступает в плазму крови из кишечника. Основная роль этих частиц - транспорт триглицеридов из печени в периферические ткани. В крови ЛПОНП превращаются в ЛПНП в результате гидролиза триглицеридов под действием липопротеинлипазы. Поскольку ЛПОНП участвуют в механизме образования атеросклеротических бляшек, их относят к высокоатерогенным липопротеидам. Гиперлипемия, обусловленная ЛПОНП, как и хиломикронами, придает плазме мутность (хилез), но, в отличие от мутности, обусловленной хиломикронами, она не отделяется в виде слоя при хранении плазмы в течение 12-18 ч при 4 °С.
Метод исследования: в большинстве лабораторий не определяется. Расчетный метод по формуле Фридвальда в настоящее время использовать не рекомендуют.
Для количественного определения ЛПОНП используют электрофорез липопротеидов.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Увеличение концентрации:
-
вторичные дислипопротеидемии, сопровождающиеся патологическими состояниями, - ожирением, хронической почечной недостаточностью, нефротическим синдромом, сахарным диабетом с кетоацидозом, гипотиреозом, хроническим алкоголизмом, острым и хроническим панкреатитом, гипофизарной недостаточностью, болезнью Ниманна-Пика, системной красной волчанкой, гликогенозами;
ИНДИВИДУАЛЬНЫЕ БЕЛКИ
Альфа1-антитрипсин
Глобулин, относящийся к группе ингибиторов сериновых протеиназ, на его долю приходится более 80% антипротеазной активности сыворотки. Способен инактивировать трипсин, химотрипсин, коллагеназу, плазмин, тромбин и лейкоцитарную эластазу. Относится к острофазным белкам.
Материал (проба): сыворотка крови. Можно хранить при 4 °С 72 ч, при -20 °С - до 3 мес, дольше - при -70 °С.
Методы исследования: иммунотурбидиметрия, нефелометрия.
Референтные пределы: 0,9-2,0 г/л (у детей до 3 лет - 0,8-2,0 г/л).
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Выработка α1-антитрипсина при реакциях острой фазы повышается примерно в 5 раз в течение 48 ч. Дефицит α1-антитрипсина обусловлен генетически и сопровождается гепатитом новорожденных, циррозом печени в раннем возрасте, заболеваниями легких с развитием эмфиземы у молодых людей 20-30 лет.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания: последний триместр беременности, высокие концентрации эстрогенов (прием эстрогенсодержащих контрацептивов), анаболические стероиды.
Альфа1-кислый гликопротеин (орозомукоид)
Подавляет иммунореактивность, изменяет адгезивность тромбоцитов, связывает гормоны и лекарственные препараты, обладающие основными свойствами. Белок острой фазы воспаления.
Референтные пределы: 0,5-1,2 г/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика острых воспалительных состояний. Исследование в динамике позволяет оценить течение воспалительного процесса, при оперативном лечении опухолей - диагностировать рецидив. Вместе с гаптоглобином используют для выявления гемолиза (повышение уровня орозомукоида при нормальном уровне гаптоглобина указывает на реакцию острой фазы с умеренным гемолизом).
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Альфа2-макроглобулин
Ингибитор, инактивирующий большинство протеаз, включая ферменты системы свертывания крови, фибринолиза, калликреин плазмы и компоненты комплемента. Является транспортным белком для некоторых ферментов, гормонов, цинка. Ингибирует бласттрансформацию лимфоцитов.
Референтные пределы: в сыворотке (плазме) крови - 1,3-3,0 г/л; у новорожденных содержание почти в 2 раза выше, чем у взрослых, у женщин примерно на 20% выше, чем у мужчин.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Снижение содержания в плазме крови обычно связано с повышенной протеолитической активностью при панкреатитах, недостаточном питании и нарушении синтетической способности печени. При гипоальбуминемии синтез α2-макроглобулина в печени компенсаторно повышается.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Антистрептолизин-О
Антистрептолизин-О (АСЛ-О) представляет собой антитела к стрептолизину (антигену β-гемолитического стрептококка группы А).
Референтные пределы: младше 14 лет - менее 150 ЕД/мл; старше 14 лет - менее 200 ЕД/мл.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Является маркером стрептококковой инфекции в организме: его уровень повышается через 1 нед после инфекции, достигает пика через 3-5 нед и снижается через 6-12 мес. Стойкое повышение уровня связано с развитием ревматизма. В период реконвалесценции показатель ниже, чем в острый период, поэтому может использоваться для наблюдения за динамикой течения, оценки степени активности ревматического процесса. Максимальную диагностическую и прогностическую ценность имеет серийное исследование (с интервалом около 1 нед). Используют при дифференциальной диагностике ревматизма с ревматоидным артритом, при котором степень повышения АСЛ-О значительно меньше. Титр АСЛ-О может быть повышен и у здоровых носителей стрептококка.
Увеличение содержания:
Антитромбин
Антитромбин (АТ) - гликопротеид, формирующий стабильное соединение с сериновыми протеазами плазменного гемостаза. АТ - наиболее значимый ингибитор системы свертывания крови. Ингибирует тромбин и другие сериновые протеазы плазменного звена гемокоагуляции: факторы IXa, Ха, XIa, XIIa и калликреин.
Материал (проба): цитратная плазма. Стабильна при -25 °С до 2 нед.
Методы исследования: иммунотурбидиметрия, нефелометрия, метод с хромогенным субстратом.
Референтные пределы: в плазме крови - 0,2-0,4 г/л (80-120%), у новорожденных - наполовину меньше и достигает уровня взрослых к 6 мес.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Концентрация снижена при повышенном риске тромбообразования. Длительная гепаринотерапия может приводить к снижению активности АТ в плазме крови, а лечение высокими дозами гепарина, особенно нефракционированным (высокомолекулярным) гепарином, - к транзиторному снижению АТ по механизму потребления, особенно у больных с тяжелой патологией, в критических случаях, при ДВС-синдроме, сепсисе, злокачественных опухолях. Снижение АТ до 50% нормальных значений - фактор риска развития венозных тромбозов.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Аполипротеины А-I и А-II
Аполипротеины А-I и А-II (апоА-I и апоА-II) синтезируются в стенке кишечника, откуда транспортируются в составе хиломикронов и накапливаются в ЛПВП. Являются основными белковыми компонентами липопротеидов высокой плотности. Активируют липазу и ингибируют лецитилхолинацетилтрансферазу. Физиологическая роль апоА-1 - обратный транспорт холестерина из клеток в печень.
Референтные пределы в сыворотке крови: апоА-I - 1,1-1,8 г/л; апоА-II - 0,1-0,5 г/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Для диагностики наследственных форм нарушений обмена липидов.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Аполипопротеин В
Аполипопротеин В (апоВ) имеет две формы: апоВ-48, синтезирующийся в ЖКТ и являющийся наиболее важным структурным белком ХМ, и апоВ-100, синтезирующийся в печени. АпоВ-100 присутствует во всех атерогенных фракциях липопротеинов: ЛПНП, ЛПОНП, ЛППП и липопротеине(а) - ЛП(а). Уровень апоВ, измеренный иммунотурбидиметрическим методом, большей частью отражает содержание апоВ-100 в частицах ЛПНП, лучше соответствует количеству частиц ЛПНП в сыворотке, чем ХС-ЛПНП. Измерение апоВ ЛПНП имеет преимущества перед измерением ХС-ЛПНП, что обусловлено постоянным содержанием белка в частице ЛПНП, в то время как количество ХС может варьировать в широких пределах.
Референтные пределы: апоВ-100 - 0,8-1,5 г/л; апоВ-48 - менее 0,5 г/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Для выявления и характеристики различных типов гипер- и гиполипопротеидемии при ишемической болезни сердца, сахарном диабете, нарушениях функций щитовидной железы, заболеваниях печени и др.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
ОТНОШЕНИЕ апоА-I/апоВ
Абсолютные значения уровней апоА-I и апоВ в сыворотке (плазме) крови могут варьировать в широких пределах, тогда как отношение апоА-I/апоВ является величиной значительно более стабильной и может быть использовано как ранний индикатор нарушений липидного обмена и риска атеросклероза.
Рекомендуемое значение апоА-I/апоВ - более 1,1. Превышение коэффициента связано со снижением риска развития сердечно-сосудистой патологии, снижение - с увеличением риска.
Липопротеин(а)
ЛП(а) - сложная молекула, имеющая структурное сходство с ЛПНП. Блокирует связывание плазминогена со сгустком фибрина, подавляет фибринолиз, способствует тромбообразованию.
Референтные пределы: в сыворотке крови - менее 0,3 г/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Независимый фактор риска сердечно-сосудистых заболеваний. Используется для выявления наследственных нарушений, повышенного риска заболеваний сердечно-сосудистой системы, атеросклероза, решения вопроса о назначении гиполипидемической терапии.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Гаптоглобин
Основная функция гаптоглобина - связывание свободного гемоглобина при внутрисосудистом гемолизе, что предохраняет организм от потери железа. Он выполняет защитную функцию, образуя комплексы с белками, освобождающимися при распаде клеток, является ингибитором катепсинов, транспортирует витамин B12. Комплекс «гемоглобин-гаптоглобин» обладает высокой пероксидазной активностью, тормозит перекисное окисление липидов. В острой фазе воспаления концентрация гаптоглобина в сыворотке повышается до 3 раз в течение 48 ч.
Референтные пределы: в сыворотке - 0,3-2,0 г/л. У новорожденных может быть значительно ниже, увеличивается в течение первых пяти дней жизни в 3 раза по сравнению с моментом рождения.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Определение гаптоглобина используют при диагностике анемий, для дифференциальной диагностики повышенного гемолиза (уровень гаптоглобина снижен) с неэффективным эритропоэзом (уровень гаптоглобина нормальный). При интерпретации следует учитывать результаты измерения концентрации реактантов острой фазы. Уровень гаптоглобина повышается при воспалительных и некробиотических процессах, отражая степень деструкции соединительной ткани (коллагенозах, ревматизме, сепсисе, остром инфаркте миокарда, пневмониях, опухолях).
Увеличение содержания:
Снижение содержания (<0,25 г/л):
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Глобулин, связывающий половые гормоны
Глобулин, связывающий половые гормоны (ГСПГ), участвует в связывании и транспорте половых гормонов (например, тестостерон и 5-дигидротестостерон с высоким сродством, эстрадиол несколько слабее). Защищает тестостерон и эстрадиол от метаболической инактивации во время их транспорта от места секреции к органу-мишени.
Референтные пределы в сыворотке крови (старше 14 лет): женщины (до 50 лет) - 20-120 нмоль/л, мужчины - 13-71 нмоль/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Уровень синтеза ГСПГ в печени зависит от половых гормонов: эстрогены увеличивают, а андрогены снижают его продукцию. Сниженние уровня ГСПГ бывает при гирсутизме, угрях обыкновенных и синдроме поликистозных яичников. Уровень ГСПГ на поздних стадиях беременности или после введения эстрогенов увеличен. После 60 лет содержание ГСПГ возрастает примерно на 1,2% в год.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Иммуноглобулин A
Иммуноглобулин А(IgА) составляет 10-15% общего количества иммуноглобулинов сыворотки крови. Представлен двумя формами - сывороточной и секреторной. Сывороточные IgA вызывают активацию комплемента по альтернативному пути, а также обеспечивают специфическое связывание некоторых антигенов. Секреторные IgA содержатся в продуктах внешней секреции (слезной жидкости, слюне, поте, желчи, слизи бронхиального и кишечного эпителия, влагалище, сперме), обеспечивая антибактериальную и антивирусную защиту поверхностей. Секреторные IgA, продуцируемые В-клетками, внутри слизистого слоя селективно связываются с бактериями и предупреждают их адгезию к стенке, что обеспечивает защиту организма от проникновения внутрь бактерий. Присутствие IgA в грудном молоке защищает новорожденных от кишечной инфекции.
Референтные пределы представлены в табл. 4-21.
Таблица 4-21. Референтные пределы иммуноглобулина A в сыворотке (плазме) крови
| Возраст | г/л |
|---|---|
1-3 мес |
0,05-0,5 |
4-6 мес |
0,08-0,8 |
7-12 мес |
0,3-1,4 |
2 года |
0,3-1,2 |
3-5 лет |
0,4-1,8 |
6-13 лет |
0,6-2,3 |
Взрослые |
0,7-4,0 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Маркер активации гуморального иммунитета. У пожилых пациентов более информативен, чем IgM, при первичной инфекции. Используют в диагностике возвратных инфекций, особенно желудочно-кишечного тракта и органов дыхания. В секретах определяют для оценки местного иммунитета.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Иммуноглобулин D
Иммуноглобулин D (IgD) присутствует в сыворотке (плазме) крови в низких концентрациях (около 1% всех иммуноглобулинов). IgD образуются в В-лимфоцитах и остаются прикрепленными к их поверхности. Преобладающий иммуноглобулин на поверхности развивающихся В-клеток. Возможно, действует как рецептор, запускающий процесс роста и развития В-лимфоцитов. Считается, что к классу IgD принадлежат аутоиммунные противоядерные антитела, а также антитела к инсулину и пенициллину.
Референтные пределы: в сыворотке (плазме) крови - менее 0,15 г/л.
Увеличение содержания:
Снижение содержания:
Иммуноглобулин Е
Иммуноглобулин Е (IgE) - минорный класс иммуноглобулинов (около 0,2% всех сывороточных иммуноглобулинов). Накапливается преимущественно в коже и слизистых оболочках, где сорбируется за счет Fc-рецепторов на поверхности тучных клеток, базофилов и эозинофилов. В результате присоединения специфического антигена происходят дегрануляция этих клеток и выброс биологически активных веществ (медиаторов воспаления), что приводит к клиническим проявлениям аллергии.
Референтные пределы в сыворотке (плазме) крови: менее 0,3 мг/л (<100 МЕ/мл).
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Определение общего и специфических IgE используют в диагностике аллергии.
Увеличение содержания:
Снижение содержания:
Иммуноглобулин G
Иммуноглобулин G (IgG) составляет около 75% всех иммуноглобулинов в сыворотке крови человека. Главный опсонизирующий Ig для нейтрофилов и моноцитов. Fc-рецепторы этих клеток присоединяют в первую очередь IgG1, в меньшей степени - IgG3. Иммуноглобулины IgG1, IgG2 и IgG4 осуществляют активацию комплемента по классическому пути, что обусловливает их важнейшую роль в образовании иммунных комплексов и нейтрализации токсинов. IgG - единственные иммуноглобулины, проникающие через плацентарный барьер из крови матери в кровь плода (активный транспорт), обеспечивая защиту новорожденных от инфекции.
Референтные пределы представлены в табл. 4-22.
Таблица 4-22. Референтные пределы иммуноглобулина G в сыворотке (плазме) крови
| Возраст | г/л |
|---|---|
Новорожденные |
7,0-16,0 |
1-3 мес |
2,5-7,5 |
4-6 мес |
1,8-8,0 |
7-12 мес |
3-10 |
2 года |
3,5-10,0 |
3-5 лет |
5-13 |
6-13 лет |
6-14 |
Взрослые |
7-16 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Чаще всего используют в диагностике и мониторинге острых и хронических инфекционных заболеваний, оценке эффективности вакцинации.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Иммуноглобулин М
Иммуноглобулин М (IgM) составляет 5-10% общего количества иммуноглобулинов сыворотки крови. Синтезируется при первичном иммунном ответе: в начале ответа появляются антитела класса IgM. Способен к активации комплемента, в связи с чем служит посредником в цитотоксических реакциях. К IgM принадлежат антимикробные антитела, антитела к системе групп крови АВ0, холодовые аутоиммунные противоэритроцитарные антитела, ревматоидные факторы и др. IgM имеет большое значение в возникновении и поддержании аутоиммунных заболеваний.
Референтные пределы представлены в табл. 4-23.
Таблица 4-23. Референтные пределы иммуноглобулина M в сыворотке (плазме) крови
| Возраст | г/л |
|---|---|
Новорожденные |
0,1-0,3 |
1-3 мес |
0,1-0,7 |
4-6 мес |
0,2-1,0 |
7-12 мес |
0,3-1,0 |
2 года |
0,4-1,4 |
3-5 лет |
0,4-1,8 |
6-13 лет |
0,4-1,6 |
Взрослые |
0,4-2,3 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
IgM чаще всего используют в диагностике острых инфекционных заболеваний (в том числе и в скрининговых исследованиях) и обострения хронических.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Комплемент С3
Центральный компонент системы комплемента. Синтезируется в печени, макрофагах-моноцитах, фибробластах. Синтез ускоряется в острой фазе воспаления (активатор - интерлейкин-6), распад - при болезнях с формированием иммунных комплексов по альтернативному пути активации комплемента. Уровень в сыворотке может быстро падать при ожогах или потере белка (энтеропатия). Основная функция - активация системы комплемента через классический и альтернативный пути, а также опсонизация и хемотаксис.
Материал (проба): сыворотка крови. Определение при использовании иммунохимических методов лучше проводить не ранее чем через 1 ч инкубации при 37 °С, когда все молекулы С3 будут трансформированы в С3с.
Методы исследования: иммунотурбидиметрия, иммуноферментный.
Референтные пределы: в сыворотке крови - 0,9-1,8 г/л, у детей не старше 3 мес - 0,6-1,5 г/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Белок острой фазы, содержание которого в крови повышается при инфекциях, хронических неинфекционных заболеваниях. Применяют при подозрении на врожденный дефект комплемента (рецидивирующие инфекции, ангионевротический отек или болезнь Квинке, аутоиммунные заболевания), для диагностики и мониторинга болезней иммунных комплексов.
Увеличение содержания:
Снижение содержания:
-
снижение синтеза (мембранопролиферативный гломерулонефрит, тяжелый белковый дефицит);
-
повышенный катаболизм (мембранопролиферативный гломерулонефрит, системная красная волчанка, синдром Шегрена, ревматоидный артрит, серповидноклеточная анемия, аутоиммунная гемолитическая анемия, грамотрицательная бактериемия, респираторный дистресс-синдром новорожденных);
-
воспалительные и инфекционные заболевания, в том числе бактериальный эндокардит, паразитарные инвазии, инфицирование грибами;
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Комплемент С4
Компонент классического пути активации комплемента. Основное место синтеза - печень.
Референтные пределы: в плазме крови взрослых - 1-0,4 г/л, детей не более3 мес - 0,07-0,3 г/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Определение С4 важно для диагностики иммунокомплексных заболеваний, сопровождающихся адсорбированием С4 на иммунных комплексах и снижением его концентрации в крови.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Лептин
Лептин - белок, вырабатываемый адипоцитами жировой ткани, играет ключевую роль в регулировании массы тела, влияя на активность энергетического метаболизма и чувство сытости. В гипоталамусе взаимодействие лептина с рецептором приводит к чувству насыщения и отказа от пищи. Снижение запасов жировой ткани приводит к уменьшению секреции лептина, что дает сигнал мозгу противодействовать потере жиров и способствует возникновению чувства голода. Уровень лептина повышается с увеличением жировой ткани. Ожирение связано со снижением чувствительности тканей к лептину.
Лептин регулирует нейроэндокринную функцию гипоталамуса, повышая расход энергии за счет увеличения метаболизма глюкозы, липидов и снижения потребления пищи. Уровень лептина в крови коррелирует с количеством и размерами адипоцитов жировой ткани.
Материал (проба): сыворотка (плазма) крови. До исследования можно хранить при 2-8 °С 24 ч, при -16 °С - 3 мес, при -40 °С - год. Нельзя использовать гемолизированные образцы.
Метод исследования: иммунохимический.
Референтные пределы: для иммуноферментного метода - до 5-10 нг/мл.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Лептин способствует уменьшению аппетита, снижению потребления пищи. В печени тормозит действие инсулина на глюконеогенез и гликогенолиз. В мышечной ткани увеличивает захват глюкозы и синтез гликогена. Повышает скорость липолиза, усиливает окисление СЖК в жировой ткани. Усиливает термогенез.
Увеличение содержания:
Снижение содержания:
Миоглобин
Белок, содержащийся в клетках скелетных мышц и миокарда. Обеспечивает депонирование кислорода и облегчает его транспорт к митохондриям, где происходит окислительное фосфорилирование.
Референтные пределы: в сыворотке крови у женщин старше 14 лет - 12-76 мкг/л, у мужчин старше 14 лет - 19-92 мкг/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
При диагностике заболеваний сердца и скелетных мышц (некроза, травмы, ишемии). Поступает в кровь при любом повреждении, некрозе, лизисе ткани скелетной мускулатуры или миокарда. Степень гипермиоглобинемии зависит от размеров очага некроза. Один из самых ранних маркеров инфаркта миокарда (обнаруживают уже через 2 ч после приступа; увеличение концентрации может быть 10-кратным). Применяют для ранней диагностики, мониторинга и прогнозирования течения заболевания. Поскольку не является специфическим маркером инфаркта миокарда, диагноз следует подтверждать более специфичными для поражения сердечной мышцы маркерами. Поскольку миоглобин выводится в неизмененном виде с мочой, его концентрация в крови зависит от функций почек.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Мозговой натрийуретический пептид
Мозговой натрийуретический пептид (BNP) - гормон пептидной природы, синтезируемый миоцитами желудочков сердца и нейронами головного мозга. BNP ингибирует ренин-ангиотензин-альдостероновую систему, способствует усиленной экскреции натрия и дилатации периферических сосудов. В плазме крови BNP находится в виде нескольких форм прогормонов (proBNP), имеющих различные свойства и биологическую активность, при их расщеплении образуются пептиды, в том числе собственно BNP и терминальная часть (Nt-proBNP).
Материал (проба): сыворотка (плазма) крови. Кровь сразу после взятия необходимо поместить на лед и центрифугировать не позднее чем через час. Хранить сыворотку (плазму) можно при -20 °С. Не следует использовать липемичные образцы.
Метод исследования: иммунохимический.
Референтные пределы зависят от метода определения. Для иммуноферментного метода - менее 350 фмоль/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Секреция BNP увеличивается при повышении напряжения миокарда, увеличении давления в левом желудочке сердца и механическом растяжении предсердий. Именно поэтому его уровень в плазме крови коррелирует с функциональным классом сердечной недостаточности, показателями систолической и диастолической функции миокарда. Измерение содержания BNP в плазме крови эффективно для оценки лечения пациентов с сердечно-сосудистыми заболеваниями и прогноза у пациентов с острым коронарным синдромом, сердечной недостаточностью (его уровень увеличивается пропорционально угрозе остановке сердца) и пороками клапанов сердца.
У больных с сердечно-сосудистыми заболеваниями повышение уровня BNP является независимым фактором риска развития тяжелых осложнений (острого инфаркта миокарда, инсульта) и смертности.
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Остеокальцин
Остеокальцин (ОК) - чувствительный и неинвазивный маркер обмена в кости. Неколлагеновый белок матрикса кости, синтезируется остеобластами и одонтобластами. Концентрация остеокальцина в крови отражает метаболическую активность остеобластов костной ткани, поскольку изменяется в результате нового синтеза, а не освобождения при резорбции кости. Предполагается участие остеокальцина и в регуляции процесса резорбции.
Методы исследования: иммунохемилюминесценция, иммуноферментный.
Материал (проба): гепаринизированная плазма, заморозить немедленно. Стабильна при -20 °С до 14 мес.
Референтные пределы: женщины до менопаузы - 4,4-17 мкг/л, после менопаузы - 3,6-28 мкг/л; мужчины - 2,7-25,0 мкг/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Для диагностики нарушений метаболизма костной ткани (целесообразно определять в комплексе с деоксипиридинолином мочи - продуктом распада коллагена кости и показателем костной резорбции), гиперкальциемического синдрома, атакже при мониторинге заболеваний костной ткани и оценке эффективности лечения. При выраженном снижении клубочковой фильтрации уровень остеокальцина в крови может быть завышенным. При наличии в кровотоке фрагментов остеокальцина, образующихся при частичном его разрушении в сосудистом русле под воздействием циркулирующих протеаз либо из-за его разрушения в процессе резорбции кости, также могут быть получены завышенные значения.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Преальбумин (транстиретин)
Транспортный белок тироксина. В комплексе с ретинолсвязывающим белком транспортирует витамин A (ретинол). Синтез происходит в гепатоцитах и стимулируется глюкокортикоидами.
Референтные пределы: в сыворотке крови у детей не старше 4 лет - 0,1-0,2 г/л, старше 4 лет - 0,2-0,4 г/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Показатель нарушения синтетической функции печени, очень чувствительный негативный острофазовый реактант (снижается до 20% средних величин).
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания в сыворотке крови:
Снижение содержания в сыворотке крови:
Прокальцитонин
Прокальцитонин (PCT) является предшественником гормона кальцитонина, поддерживающего постоянную концентрацию кальция в крови. У здоровых людей за счет протеолиза из прокальцитонина в клетках щитовидной железы образуется гормон кальцитонин.
Материал (проба): сыворотка крови. До исследования можно хранить при +4 °С 72 ч, при -20 °С - до 3 мес, дольше - при -70 °С.
Метод исследования: иммунохимический.
Референтные пределы: для иммуноферментного метода - менее 0,5 нг/мл.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
При тяжелых инфекционных заболеваниях уровень прокальцитонина в плазме резко возрастает. Системный воспалительный ответ приводит к синтезу прокальцитонина в макрофагах и моноцитарных клетках различных органов. Уровень прокальцитонина в плазме крови при системном воспалительном ответе повышается раньше, чем других белков острой фазы.
Увеличение содержания:
Ревматоидный фактор
Ревматоидный фактор (РФ) - аутоантитела, относящиеся ко всем классам иммуноглобулинов (до 90% - IgM), направленные против Fc-фрагмента собственных иммуноглобулинов G. Опасны способностью поражать синовиальные оболочки суставов и стенки сосудов.
Материал (проба): сыворотка крови, взятая натощак. Может храниться при +4 °С 72 ч, при -20 °С - до 6 мес, дольше - при -70 °С.
Методы исследования: иммунотурбидиметрия, иммуноферментный.
Референтные пределы: менее 15 МЕ/мл.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Для определения активности процесса, мониторинга, прогноза и контроля эффективности лечения ревматических, других аутоиммунных и хронических воспалительных заболеваний. В зависимости от наличия РФ выделяют серопозитивную и серонегативную формы ревматоидного артрита. Высокие концентрации РФ связаны с развитием системных (внесуставных) поражений соединительной ткани и высокой активностью деструктивных процессов. У детей с ювенильным ревматоидным артритом ревматоидный фактор часто отрицателен. Считается важным прогностическим признаком исхода ревматоидного артрита.
Увеличение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания: пожилой возраст.
С-реактивный белок
С-реактивный белок (СРБ) - компонент иммунного ответа. Может связывать не только полисахариды, присутствующие на поверхности бактерий, грибов и паразитов, но и полианионы, поликатионы, нуклеиновые кислоты. Присоединенный к мембранам микроорганизмов и поврежденным клеткам, СРБ активирует каскад комплемента, способствует фагоцитозу. Способен активировать тромбоциты. Важными функциями являются распознавание потенциально токсичных веществ, образующихся при распаде собственных клеток организма, связывание их, детоксикация и удалении из крови.
Материал (проба): сыворотка крови. Может храниться при +4 °С 72 ч, при -20 °С - до 6 мес, дольше - при -70 °С.
Методы исследования: радиальная иммунодиффузия, иммунотурбидиметрия, нефелометрия, латексная агглютинация, иммуноферментный.
Референтные пределы: в сыворотке крови - 0,06-5,0 мг/л. В первые пять дней жизни СРБ - менее 10 мг/л. После 5-го дня - менее 5 мг/л, как у взрослых.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Главный белок острой фазы (уровень СРБ повышается в течение 6-10 ч после заболевания, травмы, хирургического вмешательства). Применяют для оценки активности воспалительных процессов, наблюдения за их динамикой, дифференциальной диагностики бактериальных и вирусных инфекций, выбора адекватного лечения и контроля за его эффективностью. После травмы или операции при отсутствии осложнений концентрация СРБ возвращается к норме в следующие 5-7 сут. Плохой прогноз, если СРБ более 200 мг/л более 10 сут или через 7-10 сут происходит только незначительное его снижение. Заметное увеличение СРБ типично за 1-2 сут до летального исхода.
Увеличение содержания:
-
40-200 мг/л - острое воспаление и бактериальные инфекции средней тяжести, после травмы или хирургического вмешательства;
-
персистенция СРБ указывает на сохраняющийся в организме воспалительный процесс, неадекватное лечение, плохой прогноз - незначительное, в пределах нормальных значений (до 5 мг/л) увеличение концентрации (табл. 4-24).
Таблица 4-24. Оценка активности воспалительных процессов по уровню C-реактивного белка
| СРБ - 10-50 мг/л | СРБ >50 мг/л |
|---|---|
Местные бактериальные инфекции. Инфаркт миокарда (максимум после 2 сут). Вирусные инфекции. Хронические инфекции (туберкулез, сифилис). Саркоидоз. Ревматоидный артрит. Псориатический артрит, подагра. Заболевания соединительной ткани, такие как СКВ, дерматомиозит. Язвенный колит. Внутриутробная инфекция |
Тяжелые бактериальные, в том числе послеоперационные, инфекции (сепсис, пневмония,пиелонефрит). Активный ревматоидный артрит. Крайне активный серонегативный спондилоартрит. Системные васкулиты. Активная болезнь Крона. Тромбоз глубоких вен. Острый панкреатит. Метастазирующие некротизирующие опухоли |
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
БАЗОВЫЙ УРОВЕНЬ С-РЕАКТИВНОГО БЕЛКА
Базовый уровень С-реактивного белка (hs-СРБ) - концентрация СРБ, которая стабильно выявляется у практически здоровых людей или у пациентов при отсутствии острого воспалительного процесса либо вне обострения заболевания.
Материал (проба): сыворотка крови. Может храниться при 4 °С 72 ч, при -20 °С - до 6 мес, дольше - при -70 °С.
Методы исследования: иммунотурбидиметрия с усилением латексом, нефелометрия, иммуноферментный.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Уровень hs-СРБ 3-10 мг/л - признак вялотекущего воспалительного процесса, связан с высоким риском сердечно-сосудистых заболеваний и их осложнений (инфаркта миокарда, мозгового инсульта), а также риском внезапной сердечной смерти у людей, не страдающих сердечно-сосудистыми заболеваниями. Применяют для выделения пациентов, нуждающихся в профилактическом лечении, для оценки эффективности профилактики сердечно-сосудистых заболеваний и их осложнений: при отказе от курения, регулярной физической нагрузке, лечении ожирения базовый уровень СРБ снижается. Определение hs-СРБ может стимулировать пациента к изменению образа жизни, отказу от вредных привычек.
Увеличение содержания:
-
повышенный риск развития сердечно-сосудистых заболеваний у практически здоровых взрослых людей;
-
у больных с ИБС повышенный риск ранних и отсроченных осложнений после коронарного шунтирования, высокий риск последующего рестеноза;
-
у больных с нестабильной стенокардией и острым инфарктом миокарда риск летальности:
-
хронические воспалительные заболевания (системные ревматические);
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Трансферрин
Металлсвязывающий транспортный белок плазмы крови, основной переносчик железа к клеткам. Связывание с трансферрином предупреждает токсический эффект железа. Каждая молекула трансферрина может связать максимум два иона Fe3+, что эквивалентно 1,4 мг железа на 1 г трансферрина. В качестве сопутствующего аниона обычно связывается бикарбонат.
Референтные пределы: концентрация в сыворотке крови. Менее 7 дней - 1,3-3,6 г/л; более 1 года - 2,0-3,6 г/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Выявление функционального (скрытого) дефицита железа и перегрузки организма железом. Дифференциальная диагностика, мониторинг лечения железодефицитной анемии. У пациентов с уремией и находящихся на гемодиализе трансферрин непригоден для определения недостатка железа.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Тропонины I и T
Тропонины I и T (ТрI, ТрТ) - фрагменты сократительного белкового комплекса поперечнополосатых мышц и мышцы сердца, участвующие в процессе регуляции мышечного сокращения. Отношение концентрации тропонинов внутри мышечных клеток и в плазме крови намного выше, чем для ферментов и миоглобина, что делает эти белки высокочувствительными маркерами поражения миокарда.
Материал (проба): сыворотка (плазма) крови. Стабильна при -20 °С до 3 мес.
Методы исследования: иммуноферментный, иммунохемилюминесценция, радиоиммунологический.
Референтные пределы: в сыворотке (плазме) крови. ТрI - менее 0,1 мкг/л; ТрТ - менее 0,01 мкг/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Ранние и высокоспецифичные маркеры поражения миокарда: уровень в плазме крови повышается через 4-8 ч после начала болей в груди; увеличенная концентрация в крови сохраняется до 4-10 сут после инфаркта миокарда. Уровень тропонинов в плазме крови коррелирует с летальностью. Используют для диагностики инфаркта миокарда, выбора тактики лечения больных с острым коронарным синдромом, в том числе пациентов с нестабильной стенокардией, обследования пациентов с инфарктом миокарда и нестабильной стенокардией в прогностических целях, контроля за эффективностью лечения.
Увеличение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания: гемолиз.
Фактор некроза опухоли-α
Фактор некроза опухоли-α (ФНО-α) - полипептидный цитокин, продуцируется главным образом активированными макрофагами и обладает иммуномодулирующими и провоспалительными свойствами. ФНО-α регулирует выработку В-клетками антител, стимулирует цитотоксичность Т-клеток. Участвует в регуляции апоптоза и межклеточного взаимодействия иммунокомпетентных клеток. ФНО-α может вырабатываться клетками миокарда при таких патологических состояниях, как инфаркт миокарда, повышение давления и объема левого желудочка.
Материал (проба): сыворотка (плазма) крови, которую необходимо использовать сразу или хранить в замороженном виде. Образцы нельзя повторно замораживать и оттаивать. Нельзя использовать гемолизированные и липемичные образцы.
Референтные пределы: для иммуноферментного метода - 0-50 пг/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Участвует в патогенезе некоторых аутоиммунных заболеваний и атеросклероза, развитии кахексии при хронических инфекциях, реакции «транплантат против хозяина». Негативно влияет на опухолевые и инфицированные вирусами клетки. Уровень ФНО-α у пациентов с сепсисом и тяжелыми инфекциями коррелирует с тяжестью и исходом заболевания.
Увеличение содержания:
Ферритин
Растворимый в воде комплекс железа с белком апоферритином. Белок, обеспечивающий депонирование железа в организме. Ферритин содержит примерно 15-20% общего количества железа в организме взрослого человека. Каждая клетка тела и все жидкости организма содержат ферритин. Циркулирующий в кровотоке ферритин практически не содержит железа, но его количество находится в равновесии с резервным депо железа. Хотя в крови ферритин присутствует в небольших количествах, его концентрация в плазме отражает запасы железа в организме. Снижение уровня ферритина - первый показатель уменьшения запасов железа.
Референтные пределы: в сыворотке (плазме) крови. 6 мес-15 лет - 15-120 мкг/л; мужчины - 30-300 мкг/л; женщины до 50 лет - 10-160 мкг/л, старше 50 лет - как у мужчин.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Концентрация ферритина в сыворотке крови прямо коррелирует с количеством депонированного железа в организме, ее измерение используют для диагностики и мониторинга дефицита или избытка железа, дифференциальной диагностики анемий, слежения за развитием опухолей. В отличие от железа, уровень ферритина не имеет суточного ритма, его концентрация не зависит от эстрогенов и синтеза в печени, однако концентрация ферритина повышается в острой фазе воспаления. Особое значение имеет контроль лечения железом, так как перегрузка клеток железом приводит к их поражению.
Увеличение содержания:
-
гипохромная анемия с нормальным или увеличенным депо железа;
-
повышение запасов железа в тканях, анемия вследствие инфекции или злокачественного новообразования (лимфогранулематоза, острого лейкоза);
-
гемотрансфузии, пероральное и парентеральное лечение препаратами железа;
-
реакции острой фазы (воспаление, инфекции, злокачественные опухоли);
Снижение содержания (при дефиците железа):
Для диагностики латентного недостатка железа, помимо ферритина, следует определить уровни трансферрина, железа и сделать гемограмму.
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение концентрации:
Фибриноген
Белок, молекулы которого обладают свойством быстро полимеризоваться в токе крови с образованием фибрина, способного закрывать повреждение сосуда и предотвращать потерю крови. Синтезируется в печени и мегакариоцитах и содержится в тромбоцитах, а также в некоторых тканях: головном мозге, легких, костном мозге, где γ-цепи фибриногена, видимо, выступают в роли молекул адгезии.
Материал (проба): плазма крови. Стабильна при -20 °С несколько месяцев.
Методы исследования: иммунотурбидиметрия, клоттинговый.
Референтные пределы: в плазме крови - 1,8-3,5 г/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика врожденных или приобретенных дефицитов либо дефектов фибриногена (афибриногенемии, гипофибриногенемии, дисфибриногенемии); мониторинг тромболитической терапии. Повышенные концентрации фибриногена являются фактором риска заболеваний сердечно-сосудистой системы. Является показателем коагулограммы первичного скрининга. Относится к белкам острой фазы воспаления.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
Фибронектин
Присутствует на поверхности многих клеток, во всех жидкостях организма. Участвует в формировании межклеточных контактов, клеточной дифференцировке, злокачественной трансформации. Является основной молекулой адгезии в венозной и капиллярной сети. В плазме ограничивает протеолиз. Стимулирует ретракцию сгустка фибрина.
Референтные пределы: в сыворотке - 0,25-0,4 г/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Содержание фибронектина в плазме повышено примерно у трети больных со злокачественными новообразованиями и более чем у половины больных со злокачественными опухолями печени, поджелудочной железы или желчевыводящих протоков. При первичном раке печени диагностическая чувствительность определения фибронектина выше, чем α-фетопротеина, при одновременном их определении - выше 80%. Диагностическое значение фибронектина ограничено его неспецифичностью и частым увеличением при доброкачественных опухолях.
В асцитической жидкости фибронектин измеряют при дифференциальной диагностике асцита различного происхождения: при асците неопухолевой природы (циррозе печени) содержание фибронектина значительно ниже, чем у больных с асцитом опухолевой природы.
Увеличение содержания:
Снижение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Снижение содержания: недоедание.
Церулоплазмин
Белок плазмы крови, молекула которого содержит 6 или 7 ионов меди. Церулоплазмин транспортирует медь, связывая 90-95% меди в плазме крови. Участвует в обмене (окисляя Fe2+ до Fе3+ ), транспорте и утилизации железа. Играет важную роль в регулировании окислительно-восстановительного потенциала. Обладает антиоксидантной активностью: предупреждает окисление липидов в мембране клеток, способствует увеличению синтеза оксида азота эндотелием сосудов, тем самым контролирует NO-зависимую вазодилатацию. Церулоплазмин способен инактивировать свободные радикалы кислорода, предотвращая окисление полиненасыщенных жирных кислот, усиливает окисление аскорбиновой кислоты, катехоламинов, серотонина и соединений, содержащих сульфгидрильные группы, в частности гомоцистеина и цистеина.
Влияет на процессы тромбообразования, являясь прокоагулянтом.
Референтные пределы: в плазме (сыворотке) крови менее 5 сут - 0,05-0,4 г/л; более 1 года - 0,2-0,6 г/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика наследственных заболеваний, связанных с нарушением метаболизма меди. Снижение уровня церулоплазмина в сочетании с повышенными концентрациями СРБ имеет место при стенокардии и является неблагоприятным прогностическим признаком в отношении возникновения рестеноза у больных с ИБС после ангиопластики и стентирования коронарных артерий.
Увеличение содержания:
Снижение содержания:
-
дефицит белка при нефротическом синдроме, гастроэнтеропатии с потерей белка, синдроме мальабсорбции;
-
стенокардия (уровень церулоплазмина обратно пропорционально связан с функциональным классом стенокардии);
-
предшествует рестенозу у больных с ИБС после ангиопластики и стентирования коронарных артерий.
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Снижение содержания:
МИНЕРАЛЫ и ЭЛЕКТРОЛИТЫ
Железо
Микроэлемент, входящий в состав гемоглобина, ряда ферментов (цитохромов тканевого дыхания, оксидазы, супероксиддисмутазы и др.) и иных белков, участвующих в обеспечении тканей кислородом и его использовании клетками главным образом для энергопродукции. В организм железо поступает с растительной и животной пищей, его всасывание в кишечнике усиливается при дефиците и ограничивается при избытке в организме. В плазме крови ионы железа нековалентно и обратимо связаны с транспортным белком трансферрином. Уровень трансферрина и его насыщение железом изменяются в зависимости от концентрации железа в плазме крови. Поступление железа в клетки опосредуется мембранными рецепторами к трансферрину. В мононуклеарных фагоцитах костного мозга, селезенки, печени железо временно депонируется в форме комплекса с белком ферритином, содержание которого в сыворотке крови отражает запасы железа в организме (см. «Ферритин»). Дефицит железа в организме вследствие хронической кровопотери, мальабсорбции и других патологических процессов ведет к развитию анемии.
Материал (проба): сыворотка крови; избегают гемолиза и длительного хранения над сгустком крови. Можно хранить 3 нед при +4 °С, годы - при -20 °С. Исследование проводят не ранее чем через 5-7 сут после прекращения приема железосодержащих пищевых добавок или лекарственных препаратов, переливания крови или эритроцитов.
Референтные пределы представлены в табл. 4-25.
Таблица 4-25. Референтные пределы железа в сыворотке крови
| Пол, возраст | мкмоль/л |
|---|---|
<1 года |
7,2-17,9 |
1-14 лет |
9,0-21,5 |
Женский, >14 лет |
7,2-25,2 |
Мужской, >14 лет |
10,2-28,6 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Дифференциальная диагностика анемий, контроль терапии железодефицитной анемии. Выявление железодефицита при хронических инфекционных заболеваниях, системных воспалительных заболеваниях, нарушенном питании, мальабсорбции, гипо- и авитаминозах. Диагностика гемохроматоза, отравлений препаратами железа. При решении диагностических задач рекомендуют назначать исследование сывороточного железа в комплексе с другими биохимическими показателями обмена железа (трансферрином, общей железосвязывающей способностью или ферритином) и гематологическими исследованиями.
Увеличение концентрации (часто сочетается с повышенным отложением железа в паренхиматозных тканях и эпителии):
Уменьшение концентрации:
-
железодефицитные анемии вследствие повышенных потерь железа организмом (острых и хронических кровопотерь), недостаточного поступления железа в организм при молочно-растительной диете, синдроме мальабсорбции, хронических заболеваниях желудка и кишечника, повышенного потребления железа (во время беременности, в период лактации, в подростковом возрасте, после интенсивных физических нагрузок);
-
анемия при хронических заболеваниях (диффузных заболеваниях соединительной ткани, туберкулезе, грибковых инфекциях), онкопатологии, в том числе при острых и хронических лейкозах, лимфомах, миеломе;
-
хронические заболевания печени (гепатит, цирроз) в связи со снижением биосинтеза трансферрина.
ВЛИЯЮЩИЕ ФАКТОРЫ
Суточный, менструальный ритмы.
Увеличение содержания: лечение хлорамфениколом, метотрексатом, цисплатином, эстрогенами, прием эстрогенсодержащих оральных контрацептивов.
Уменьшение содержания: лечение аллопуринолом, метформином, глюкокортикоидами, прием больших доз ацетилсалициловой кислоты, анаболических стероидов; повышенное потребление железа (во время беременности, в период лактации, в подростковом возрасте, после интенсивных физических нагрузок).
Железосвязывающая способность сыворотки общая
Показатель способности сыворотки связывать ионы железа; отражает концентрацию главным образом трансферрина, а также небольшого количества других железосвязывающих белков плазмы крови, зависит от скорости биосинтеза трансферрина гепатоцитами, повышающейся при дефиците железа в организме. Тест менее информативен, чем определение трансферрина.
Референтные пределы представлены в табл. 4-26.
Таблица 4-26. Референтные пределы общей железосвязывающей способности сыворотки
| Возраст | мкмоль/л |
|---|---|
<2 лет |
17,9-71,6 |
2 лет, взрослые |
44,8-76,1 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Увеличение:
Уменьшение:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение: поздние сроки беременности.
Калий в сыворотке
Калий - основной внутриклеточный катион, участвующий в поддержании мембранного заряда клеток, механизмах возбуждения нервных и мышечных волокон. Его концентрация внутри клеток существенно выше, чем во внеклеточной жидкости, включая плазму крови. Концентрация калия в плазме зависит от его поступления в организм, распределения между клетками и внеклеточной жидкостью, выведения из организма почками, а также потовыми железами и кишечником. В почках калий фильтруется, практически полностью реабсорбируется в проксимальных канальцах и секретируется в дистальных отделах сопряженно с реабсорбцией натрия (секреция усиливается альдостероном). Снижение клубочковой фильтрации ведет к уменьшению экскреции калия с мочой и повышению его концентрации в крови. Многие диуретики, усиливающие экскрецию натрия и воды, увеличивают потери калия с мочой. Изменение рН крови при ацидозе увеличивает выход калия из клеток в плазму, при алкалозе - его поступление в клетки. Введение инсулина вызывает увеличение перехода калия в клетки параллельно транспорту глюкозы. Гиперкалиемия связана с риском остановки сердца. Гипокалиемия может вызывать нарушения сердечного ритма, мышечную слабость, атонию кишечника, ослабление рефлексов, гипотонию.
Референтные пределы представлены в табл. 4-27.
Таблица 4-27. Референтные пределы калия в сыворотке крови
| Возраст | ммоль/л |
|---|---|
<1 года |
4,1-5,3 |
1-14 лет |
3,4-4,7 |
>14 лет |
3,5-5,5 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Контроль калиемии при острой и хронической почечной недостаточности,сердечной недостаточности, ацидозе и алкалозе, при гемодиализе, приеме диуретиков, сердечных гликозидов. Исключение патологической концентрации калия как причины нарушений сердечного ритма. Диагностика и мониторинг надпочечниковой недостаточности.
Увеличение концентрации (гиперкалиемия):
-
избыточное поступление калия в организм (быстрое вливание растворов калия);
-
выход калия из клеток во внеклеточную жидкость при массивном гемолизе, рабдомиолизе, распаде опухолей, тяжелых повреждениях тканей, глубоких ожогах, злокачественной гиперпирексии, ацидозе;
-
сниженное выделение калия почками (острая почечная недостаточность с олиго- и анурией, ацидозом, терминальная стадия ХПН, болезнь Аддисона, псевдогипоальдостеронизм, гипофункция ренин-ангиотензинальдостероновой системы, шоковые состояния, ишемия тканей);
Уменьшение концентрации (гипокалиемия):
-
недостаточное поступление калия в организм при хроническом голодании;
-
потеря калия с мочой при почечном канальцевом ацидозе, почечной недостаточности, синдроме Фанкони, синдроме Конна (первичном альдостеронизме), вторичном альдостеронизме, синдроме Кушинга, осмотическом диурезе (при сахарном диабете), алкалозе;
-
потеря калия организмом с кишечными секретами при частой рвоте, профузной диарее, аденоме ворсинок кишечника, кишечных свищах, отсасывании содержимого желудка через назогастральный зонд;
-
усиленное поступление калия внутрь клеток при лечении глюкозой и инсулином, семейном периодическом параличе, алкалозе;
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: гемолиз, длительное хранение плазмы, сыворотки до отделения от форменных элементов крови, сгустка, амилоридΨ, спиронолактон, триамтерен, аминокапроновая кислота, противоопухолевые средства, дигоксин, нестероидные противовоспалительные препараты, триметоприм-сульфаметоксазол, гипотермия, введение большого количества жидкости с высоким содержанием калия.
Уменьшение концентрации: прием глюкокортикоидов, диуретиков (кроме калийсберегающих), β-адреноблокаторов, аминогликозидных антибиотиков, введение АКТГ, альдостерона; лечение мегалобластной анемии витамином B12 или фолиевой кислотой.
Калий в моче
Материал (проба): суточная моча (после утреннего мочеиспускания отметить время и 24 ч собирать мочу в сухую чистую емкость, хранящуюся в прохладном месте; по окончании сбора мочу перемешать, измерить объем, указать его в направлении; около 50 мл отлить в контейнер для исследования в лаборатории). До исследования можно хранить 2 мес при +4 °С, год - при -20 °С.
Метод исследования: ионселективные электроды.
Референтные пределы представлены в табл. 4-28.
Таблица 4-28. Референтные пределы экскреции калия с мочой
| Возраст | ммоль/сут |
|---|---|
<1 года |
1-20 |
1-4 года |
10-30 |
4-14 лет |
10-60 |
>14 лет |
30-100 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Мониторинг баланса поступления и потерь. Контроль терапии гормональных нарушений, особенно надпочечников. Почечная недостаточность. Метаболический алкалоз.
Увеличение (гиперкалиурия):
Уменьшение (гипокалиурия):
При внепочечных потерях гипокалиурия, как правило, до 10 ммоль/л, при почечных потерях, часто связанных с приемом диуретиков, - более 10 ммоль/л.
ВЛИЯЮЩИЕ ФАКТОРЫ
Экскреция калия с мочой зависит от диеты. Гиперкалиурия: введение АКТГ, кортизола и гидрокортизона, прием диуретиков. Петлевые диуретики угнетают механизм транспорта калия; осмотические диуретики и ингибиторы карбангидразы угнетают проксимальную реабсорбцию калия; все формы диуретиков увеличивают доставку жидкости к собирательным трубочкам, что усиливает секрецию и выведение калия; все диуретики, истощая запасы натрия и повышая концентрацию альдостерона в крови, вторично стимулируют секрецию калия.
Кальций
Кальций - один из минеральных веществ организма человека, выполняющий множество функций. Концентрация кальция в цитоплазме примерно в 1000 раз выше его уровня во внеклеточной жидкости, включая плазму крови. Такое распределение кальция поддерживается Са-АТФазой клеточной мембраны и мембраны саркоплазматического ретикулума в миоцитах, что необходимо для выполнения этим ионом ряда регуляторных функций: процессов секреции гормонов, внутриклеточной реализации эффектов множества биологически активных соединений, инициации мышечного сокращения. Ионы кальция, связываясь с натриевыми каналами нервной и мышечной ткани, определяют порог их возбуждения. В связи с этим уровень кальция в сыворотке крови - один из наиболее жестко контролируемых параметров гомеостаза, который зависит от метаболизма костной ткани, поступления кальция с пищей и выведения с мочой. Около 99% кальция организма вместе с фосфатами образует гидроксиапатиты минеральной фазы костной ткани костей скелета и зубов. Основными регуляторами обмена кальция являются гиперкальциемические гормоны - кальцитриол (активная форма витамина B3) и паратиреоидный гормон (повышают уровень кальция в плазме крови, усиливая его всасывание в тонкой кишке, реабсорбцию в почках, резорбцию костной ткани), а также гипокальциемический гормон кальцитонин (снижает уровень кальция в плазме крови в основном через усиление минерализации костной ткани). В норме эффекты паратгормона и кальцитриола на почки и кишечник имеют определяющее значение для обеспечения содержания кальция в организме, необходимого для формирования и обновления костной ткани. На обмен гидроксиапатитов костной ткани влияют также половые гормоны, при повышенном уровне - глюкокортикоиды и тиреоидные гормоны. В плазме крови кальций содержится в трех формах, находящихся в динамическом равновесии: ионы кальция (свободный кальций) - около 50%; кальций, связанный с белками (преимущественно с альбумином), - около 40%; комплексированный с низкомолекулярными анионами кальций (бикарбонатами, фосфатами, лактатом, цитратом) - около 10%. Общим кальцием в плазме крови называют суммарную концентрацию всех этих форм кальция. Соответствующие регуляторные функции, так же как модуляция продукции гормонов, поддерживающих кальциевый гомеостаз, осуществляются ионизированным кальцием. Отклонения от референтных пределов плазменного уровня ионизированного кальция проявляются нарушением нервной и мышечной возбудимости, а также сократительной способности миокарда и гладких мышц, включая гладкие мышцы кровеносных сосудов. Эти нарушения более выражены при быстром развитии гипо- или гиперкальциемии. Возникновение тетании и судорог возможно при ионизированном кальции менее 0,8 ммоль/л; его угрожающий жизни уровень - менее 0,7 ммоль/л. Дефицит Ca+2 в организме ведет к нарушению минерализации костной ткани.
Материал (проба): сыворотка или кровь, забранная с гепарином при минимальном пережатии вены. Для определения общего кальция сыворотку можно хранить 3 нед при +4 °С, 6 мес - при -20 °С. Для определения ионизированного кальция рекомендуют использовать плазму крови или цельную кровь с гепарином, которую следует хранить плотно закупоренной не более 2 ч при +4 °С.
Методы определения: кальций общий измеряют колориметрическим методом, ионизированный - ионселективной потенциометрией.
Референтные пределы представлены в табл. 4-29.
Таблица 4-29. Референтные пределы общего кальция
| Пол, возраст | ммоль/л |
|---|---|
<10 сут |
1,9-2,6 |
10 сут-2 года |
2,25-2,75 |
2-12 лет |
2,2-2,7 |
Женский, >12 лет |
2,2-2,5 |
Мужской, 12-60 лет |
2,1-2,55 |
Мужской, >60 лет |
2,2-2,5 |
Кальций ионизированный в плазме крови (гепарин) у новорожденных изменяется по дням жизни, у взрослых старше 18 лет - 1,03-1,23 ммоль/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Выявление нарушений обмена кальция при остеопении и остеопорозе, остеомаляции, гипотонии мышц, судорожном синдроме, парестезиях, хронических заболеваниях кишечника с мальабсорбцией, аритмиях, метастазах злокачественных опухолей в костную ткань, гипертиреозе, гиперпаратиреозе, дефиците кальцитриола, лечении глюкокортикоидами, панкреатите, у пациентов отделений интенсивной терапии и реанимации. Интерпретация результатов определения общего кальция крови в ряде ситуаций осложняется зависимостью этого показателя от концентрации в плазме крови белков и органических анионов, с которыми связан кальций. Для оценки вовлеченности нарушений кальциевого гомеостаза в развитие неврологических и сердечно-сосудистых расстройств необходимо исследование ионизированного кальция. Предлагаемые формулы для расчета ионизированного кальция по общему кальцию, общему белку и альбумину в ряде ситуаций неприменимы, так как их использование может приводить к ошибкам.
Увеличение концентрации (гиперкальциемия) (связано чаще всего с усилением мобилизации кальция из костной ткани):
-
первичный гиперпаратиреоз (аденома или карцинома паращитовидных желез);
-
эктопический синтез паратгормона при раке легких, почек, яичников, мочевого пузыря, пищевода, опухолях головы и шеи;
-
вторичный гиперпаратиреоз при хронической почечной недостаточности, гиповитаминозе D (уровень общего, так же как и ионизированного, кальция периодически может быть в референтных пределах или снижен в сочетании с изменением уровня фосфатов и повышенной активностью щелочной фосфатазы);
-
распад костной ткани в очагах гиперплазии при гемобластозах;
-
остеолизис при злокачественных опухолях костной ткани, метастазах в костную ткань (чаще всего при раке молочной железы, легких, почек);
-
саркоидоз, туберкулез, гистоплазмоз (в связи с повышенной абсорбцией кальция в кишечнике);
-
идиопатическая гиперкальциемия новорожденных (синдром Вильямса);
-
увеличение ионизированного кальция в результате изменений связывания кальция с белками и органическими анионами плазмы крови:
Уменьшение концентрации (гипокальциемия):
-
недостаточное всасывание кальция из кишечника и/или снижение его реабсорбции в почках:
-
гиповитаминоз D при рахите у детей и остеомаляции у взрослых (в результате сниженной инсоляции, мальабсорбции и нарушений питания);
-
гипопаратиреоз (послеоперационный, аутоиммунный, синдром Ди Георге);
-
псевдогипопаратиреоз (наследственный дефицит рецепторов к паратгормону);
-
тяжелая гипомагниемия, гипермагниемия (вызывает нарушение продукции и механизмов действия паратгормона);
-
печеночная недостаточность, хроническая почечная недостаточность, связанная с уменьшением образования кальцитриола из витамина D;
-
гипоальбуминемия (снижается общий кальций, тогда как ионизированный может находиться в референтных пределах);
-
-
снижение ионизированного кальция в результате изменений связывания кальция с белками и органическими анионами плазмы крови:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение: стаз при взятии крови, изменение горизонтального положения тела в положение сидя, диэтилстилбэстрол, тамоксифен, лечение витамином D, кальцитриолом, тиазидными диуретиками.
Уменьшение: кальцитонины, аминогликозиды, фуросемид, барбитураты (у пожилых), противосудорожные средства, чрезмерное употребление слабительных, индапамид, гемодиализ при низкой концентрации кальция в диализате.
Магний
Около 50% магния организма находится в составе минеральной фазы костной ткани. Магний является антагонистом кальция по ряду эффектов в мягких тканях (изменению сосудистого тонуса, возбудимости нервных и мышечных клеток, свертыванию крови и др.), где он содержится преимущественно в клетках (49% всего магния). Магний входит в состав почти 300 ферментов, участвует в синтезе белка, секреции паратгормона, образует комплексы с нуклеиновыми кислотами, фосфолипидами клеточных мембран, уменьшая их текучесть и проницаемость. Всасывание поступающего с пищей магния происходит в тонкой кишке, зависит от содержания жира в пище и тормозится кальцием и фосфатами. Главным органом регуляции содержания магния в организме являются почки. При дефиците магния его реабсорбция из первичной мочи составляет 100%, при поступлении в организм в повышенном количестве выделение магния почками усиливается. Факторы, регулирующие гомеостаз магния, мало изучены. В плазме крови около 65% магния находится в ионизированной форме, 35% - в виде комплексов с цитратом и альбумином. Концентрация магния в клетках поддерживается на постоянном уровне даже при значительных изменениях его содержания в плазме крови. При гипомагниемии создаются условия для возникновения желудочковых экстрасистол, повышения активности сухожильных рефлексов, атаксии, дезориентации, судорожных состояний, развития гипокальциемии. При гипермагниемии (выше 1,5 ммоль/л) могут наблюдаться тошнота, рвота, сонливость, мышечная слабость, брадикардия, атриовентрикулярная блокада.
Референтные пределы: 0,70-1,05 ммоль/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Клинические ситуации, создающие риск нарушений гомеостаза магния и/или сопровождающиеся сенсорными и нейромышечными симптомами таких нарушений.
Увеличение концентрации (гипермагниемия):
Уменьшение концентрации (гипомагниемия):
-
наиболее часто - хронический алкоголизм (из-за сниженного содержания магния в рационе, нарушения его абсорбции в кишечнике и повышенной экскреции почками);
-
мальабсорбция при раке, колите, сниженной функции поджелудочной железы, резекции желудка, кишечника;
-
диабетический кетоацидоз или некомпенсированный сахарный диабет (перемещение магния из клеток и усиление экскреции почками вследствие глюкозурии);
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение: чрезмерное использование магнийсодержащих препаратов (антацидов, слабительных, растворов для клизм).
Уменьшение: препараты, увеличивающие почечную экскрецию (петлевые диуретики, амфотерицин, гентамицин, дигоксин, циклоспорин), белково-калорийное питание, передозировка диуретиков, длительный прием слабительных, бикарбонаты, теофиллин.
Медь
Медь - микроэлемент организма человека, компонент многих ферментов, катализирующих окисление веществ молекулярным кислородом в процессах энергопродукции, синтеза нейромедиаторов, пигмента меланина и др. Свободные ионы меди, так же как ионы других металлов с переменной валентностью, могут инициировать перекисное повреждение белков и липидов. Именно поэтому в плазме крови медь связана с синтезируемым печенью гликопротеидом - церулоплазмином. Этот белок одновременно с медьтранспортной функцией проявляет антиоксидантную активность: функционируя как ферроксидаза в плазме крови, он восстанавливает свободные ферриионы в ферро-ионы, связываемые белком трансферрином. В норме с пищей поступает 2-5 мг меди в сутки, из них всасывается около 30%. Из организма медь выводится с желчью (около 89%) и со слущенным эпителием слизистой оболочки кишечника (16%). С мочой выделяется лишь около 4% всосавшейся меди. Проявления дефицита меди включают анемию, нейтропению, различные костно-суставные нарушения, снижение пигментации кожи, патологию со стороны ЦНС и сердечно-сосудистой системы. Для болезни Вильсона-Коновалова (генетически обусловленного дефицита церулоплазмина и/или его рецепторов) характерным является прогрессирующее поражение нервной системы и печени, обусловленное токсическими эффектами меди, откладывающейся в этих органах. Избыток меди может вызывать признаки отравления (тошноту, рвоту, диарею, боли в животе), сопровождающиеся снижением активности и биосинтеза некоторых ферментов.
Референтные пределы представлены в табл. 4-30.
Таблица 4-30. Референтные пределы общей меди в сыворотке крови
| Возраст, пол | мкмоль/л |
|---|---|
<4 мес |
1,4-7,2 |
4-6 мес |
4-17 |
7-12 мес |
8-21 |
Мужской |
12-24 |
Женский |
11-22 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг лечения врожденных нарушений обмена меди.
Увеличение концентрации (чаще всего обусловлено поступлением меди в кровь из разрушенных клеток):
Уменьшение концентрации:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: беременность (в связи с физиологическим усилением биосинтеза церулоплазмина под действием эстрогенов), прием эстрогенов, пероральных контрацептивов, фенобарбитала.
Натрий в сыворотке
Натрий - основной катион внеклеточной жидкости (около 96% содержится вне клеток), определяющий величину ее осмотического давления, содержание в ней воды и, таким образом, поддерживающий объем внеклеточной жидкости. Участвует в механизме возбуждения нервных и мышечных клеток. Снижение уровня в плазме крови может приводить к различным неврологическим нарушениям. Поступает с пищей при обычной диете в избыточных количествах и практически полностью всасывается в кишечнике; избыток экскретируется почками, являющимися основным звеном регуляции гомеостаза натрия. Ионы натрия фильтруются в почечных клубочках, а затем подвергаются регулируемой реабсорбции в разных отделах почечных канальцев. Главными регуляторами обмена натрия являются ренин-ангиотензин-альдостероновая система, вазопрессин (антидиуретический гормон), предсердный натриуретический гормон. Изменения баланса натрия сопровождаются многими патологическими состояниями.
Референтные пределы: 136-145 ммоль/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика и мониторинг надпочечниковой недостаточности. Выявление нарушений электролитного гомеостаза при заболеваниях почек, обезвоживании (рвоте, диарее). Мониторинг терапии диуретиками.
Увеличение концентрации (гипернатриемия):
Уменьшение концентрации (гипонатриемия):
-
потеря натрия при рвоте, диарее, сильной потливости при адекватном водном и неадекватном солевом замещении;
-
гипотоническая гипергидратация (избыточное парентеральное введение жидкости, сниженное выведение воды при почечной недостаточности, повышенной секреции вазопрессина, дефиците глюкокортикоидов);
-
гипонатриемия разведения с отеками и асцитом при хронической сердечной недостаточности, циррозе печени, печеночной недостаточности, нефротическом синдроме;
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: избыточное введение солей натрия, например гипертонического раствора натрия хлорида, введение АКТГ, бикарбоната натрия, прием анаболических стероидов, андрогенов, глюкокортикоидов, эстрогенов, оральных контрацептивов, метилдопы.
Уменьшение концентрации: передозировка диуретиков, прием аминогликозидов, нестероидных противовоспалительных препаратов, амитриптилина, галоперидола, введение гипертонического раствора глюкозы.
Натрий в моче
Материал (проба): суточная моча
Референтные пределы представлены в табл. 4-31.
Таблица 4-31. Референтные пределы экскреции натрия с мочой
| Возраст | ммоль/сут |
|---|---|
<1 года |
1-10 |
1-7 лет |
10-60 |
7-14 лет |
40-170 |
>14 лет |
130-260 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Мониторинг водно-электролитного гомеостаза при патологии почек, надпочечников, черепно-мозговой травме, сахарном диабете. Контроль применения диуретиков.
Изменения выделения натрия с мочой связаны с изменениями осмолярности плазмы крови, объема циркулирующей крови и зависят от поступления с пищей, перераспределения между секторами внеклеточной жидкости, экскреции почками. Усиление потери натрия с мочой - одна из важнейших причин гиповолемии. При внепочечных потерях содержание натрия в суточной моче - менее 10 ммоль/л; при потерях через почки, обусловленных недостаточностью альдостерона, - более 30 ммоль/л; при острой преренальной олигурии - менее 10 ммоль/л; при остром некрозе почечных канальцев - более 30 ммоль/л.
Увеличение (гипернатриурия):
Снижение (гипонатриурия):
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение: кофеин, терапия кальцитонином, ингибиторами карбоангидразы, цисплатином, диуретиками, допамином, гепарином, прогестероном, тетрациклином.
Уменьшение: лечение глюкокортикоидами, адреналином.
Фосфор неорганический
Фосфатные анионы относятся к числу основных анионов организма. Около 85% фосфора присутствует в костной ткани в виде солей кальция - гидроксиапатитов. В мягких тканях фосфаты содержатся преимущественно внутри клеток, где выполняют роль структурного компонента органических соединений (нуклеиновых кислот, фосфолипидов, коферментов и др.), участвуют в энергетическом обмене (обмене креатинфосфата, АТФ), поддержании кислотно-основного равновесия (в форме свободных фосфатных анионов). Фосфаты выводятся с мочой, часть гидрофосфатных анионов первичной мочи превращается в дигидрофосфаты в результате связывания секретируемых в мочу протонов. Экскреция фосфатов с мочой зависит от поступления их с пищей, возраста, мышечной массы, почечной функции, времени суток. Концентрация фосфатов в плазме крови важна для процесса минерализации костной ткани и зависит главным образом от их реабсорбции в канальцах почек, соотношения скорости образования и резорбции костной ткани, выхода из мягких тканей. Обмен фосфатов и тесно связанный с ним обмен кальция регулируют биологически активная форма витамина D - кальцитриол (гиперфосфатемический эффект), паратгормон (эффект зависит от уровня кальцитриола), кальцитонин (гипофосфатемический эффект). Гипофосфатемия менее 0,3 ммоль/л может сопровождаться нарушением энергетического обмена в клетках, проявляющегося рабдомиолизом, неврологической симптоматикой и др. Клинические симптомы, ассоциированные с гиперфосфатемией, обусловлены, как правило, одновременно развивающейся гипокальциемией.
Референтные пределы представлены в табл. 4-32.
Таблица 4-32. Референтные пределы фосфора неорганического
| Возраст, пол | ммоль/л |
|---|---|
<2 лет |
1,45-2,16 |
2-12 лет |
1,45-1,78 |
12-60 лет |
0,87-1,45 |
>60 лет, женский |
0,90-1,32 |
>60 лет, мужской |
0,74-1,20 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ В КОМПЛЕКСЕ С ИССЛЕДОВАНИЕМ КАЛЬЦИЯ В СЫВОРОТКЕ КРОВИ
Метаболические заболевания костной ткани. Оценка гомеостаза фосфатов и кальция при почечной недостаточности. Оценка гомеостаза фосфатов и кальция при дисфункции паращитовидных желез.
Увеличение концентрации:
Уменьшение концентрации:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: гемолиз, цитостатики (вследствие цитолиза), андрогены, β-адреноблокаторы, фуросемид, физические нагрузки, прием алкоголя, фосфорсодержащих препаратов и пищевых добавок, постельный режим.
Уменьшение концентрации: салицилаты (отравление), кальцитонин, эстрогены, пероральные контрацептивы, изониазид, глюкокортикоиды, внутривенные инфузии растворов глюкозы, инсулина, менструация.
Хлориды
Хлорид - основной анион внеклеточной жидкости, содержание хлорида в которой в 40-50 раз выше, чем в цитоплазме клеток. В организм поступает с пищей и почти полностью всасывается в желудочно-кишечном тракте. В почках ионы хлора фильтруются в клубочках, затем реабсорбируются в канальцах. Его выделение с мочой изменяется при воздействии эндогенных факторов и лекарственных препаратов, влияющих на почечную реабсорбцию натрия и воды, а также при состояниях, связанных с изменениями кислотно-щелочного равновесия. Это основной анион секретов желудка. При потере хлорида развивается алкалоз, при избытке - ацидоз. Содержание хлоридов в крови, как правило, изменяется параллельно изменению содержания натрия. Изолированное изменение концентрации хлорида наблюдается при нарушениях кислотно-щелочного баланса. Определение хлоридов в крови используют чаще всего при оценке кислотно-щелочного баланса.
Референтные пределы: 98-107 ммоль/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Мониторинг и динамическое наблюдение расстройств кислотно-основного состояния при различных заболеваниях. Заболевания почек. Несахарный диабет. Патология надпочечников.
Увеличение концентрации (гиперхлоремия):
Уменьшение концентрации (гипохлоремия):
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение концентрации: метилдопа, терапия андрогенами, эстрогенами.
Уменьшение концентрации: передозировка диуретиков, длительный прием слабительных, бикарбонаты, хроническое применение слабительных, теофиллин.
5-δ-аминолевулиновая кислота
5-δ-аминолевулиновая кислота - промежуточный метаболит, образующийся при синтезе порфиринового кольца гема. Синтез гема происходит главным образом в печени и костном мозге и начинается с образования 5-δ-аминолевулиновой кислоты,из нее затем образуются порфобилиноген и другие метаболиты. Наследственные и приобретенные нарушения синтеза гема называют порфириями. Порфирии сопровождаются повышением содержания предшественников гема - порфириногенов, а также продуктов их окисления в тканях и крови, появлением их в моче. Наследственные порфирии обусловлены генетическими дефектами какого-либо из восьми ферментов, участвующих в синтезе гема. При этих заболеваниях отмечают снижение образования гема. Поскольку гем служит ингибитором аминолевулинатсинтазы, активность этого фермента повышается, что приводит к накоплению 5-δ-аминолевулиновой кислоты и порфириногенов.
Приобретенные порфирии могут развиваться при отравлениях веществами, являющимися ингибиторами отдельных ферментов синтеза гема (свинцом, галогенсодержащими гербицидами и инсектицидами).
Материал (проба): моча суточная, собранная в темную емкость с 10 мл 6М-соляной кислоты (после утреннего мочеиспускания отметить время и 24 ч собирать мочу в сухую чистую емкость, хранящуюся в прохладном месте; по окончании сбора мочу перемешать, измерить объем, указать его в направлении; около 50 мл отлить в контейнер для исследования в лаборатории).
Референтные пределы: менее 34 мкмоль/л, или менее 40 мкмоль/сут.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика врожденных и приобретенных порфирий, свинцового отравления.
Увеличение:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение: аминоацетон, аммиак, глюкозамин, пенициллины.
Витамин B12 (кобаламин)
Витамин B12 - незаменимый компонент пищи. Это единственный витамин, синтезируемый почти исключительно микроорганизмами. Основным источником витамина для человека является животная пища, наиболее богата витамином печень. В печени из витамина B12 образуются его биологически активные формы - коферменты метилкобаламин и дезоксиаденозилкобаламин, катализирующие в составе соответствующих ферментов реакции переноса одноуглеродных групп. Эти реакции необходимы для синтеза в организме нуклеиновых кислот, образования и депонирования активных форм фолиевой кислоты, превращения гомоцистеина в аминокислоту метионин, распада жирных кислот с нечетным числом углеродных атомов и других метаболических процессов.
При недостатке витамина B12, так же как при дефиците фолиевой кислоты, снижается скорость пролиферации клеток, что проявляется нарушением кроветворения (развивается мегалобластная анемия), а также нарушением регенерации эпителия и связанным с этим глосситом, стоматитом и мальабсорбцией. Дефицит витамина может сопровождаться неврологическими расстройствами (полиневритами, фуникулярным миелозом), объясняемыми токсичностью продуктов неполного распада жирных кислот с нечетным числом углеродных атомов и некоторых аминокислот. Гиповитаминоз B12 может развиваться при некоторых патологиях ЖКТ (атрофическом гастрите, тотальном удалении желудка и др.). Это обусловлено нарушением всасывания витамина B12 в тонкой кишке, происходящим после связывания витамина с внутренним фактором Касла - гликопротеидом, синтезируемым обкладочными клетками слизистой оболочки желудка. В связи с депонированием витамина в печени симптомы гиповитаминоза B12 могут появиться лишь через 5-6 лет сниженного поступления в организм этого витамина.
Известны генетически обусловленные формы гиповитаминоза B12, при которых вследствие недостаточности ферментов превращения витамина в кофермент или плазменного белка-переносчика витамина - транскобаламина развивается мегалобластная анемия, проявляющаяся в первые месяцы после рождения.
Материал (проба): плазма крови, забранная с ЭДТА; избегать гемолиза, защищать от света. До исследования можно хранить при комнатной температуре не более 15 мин, 4 ч - при +4 °С, 2 мес - при -20 °С.
Референтные пределы: представлены в табл. 4-33.
Таблица 4-33. Референтные пределы витамина B12
| Возраст | пг/мл |
|---|---|
Новорожденные |
160-1300 |
Взрослые |
180-900 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Дифференциальная диагностика макроцитарных анемий. Контроль обеспеченности витамином при хронических воспалительных заболеваниях и анатомических пороках тонкой кишки, атрофическом гастрите, строгой вегетарианской диете.
Увеличение концентрации:
Уменьшение концентрации:
ВЛИЯЮЩИЕ ФАКТОРЫ
Уменьшение концентрации: беременность, прием цитостатиков, аминогликозидов, противосудорожных средств (фенобарбитала), холестирамина, пероральных контрацептивов, ранитидина, метформина.
Гомоцистеин
Гомоцистеин - непротеиногенная аминокислота, образующаяся во многих тканях в процессе деметилирования аминокислоты метионин. Некоторое количество гомоцистеина необратимо превращается в цистеин, но большая его часть вновь превращается в метионин при участии ферментов, коферментами которых являются производные витаминов B6, B9 (фолиевая кислота), B12. Нарушения превращений гомоцистеина вследствие генетически обусловленных или приобретенных дефектов ферментов его обмена, а также при дефиците указанных витаминов ведут к его накоплению в клетках и, как следствие этого, в плазме крови. Гипергомоцистеинемия ассоциируется с развитием дисфункции и поражения эндотелия, что обусловлено цитотоксическим эффектом гомоцистеина. Гипергомоцистеинемия является независимым фактором риска сердечно-сосудистых заболеваний: повышение уровня гомоцистеина в плазме крови на 5 мкмоль/л увеличивает риск атеросклеротического поражения сосудов на 80% у женщин и на 60% у мужчин, общий риск смерти - в 1,3-1,7 раза. Гипергомоцистеинемия более 15 мкмоль/л ассоциируется с повышенным риском развития болезни Альцгеймера. Снижение повышенного уровня гомоцистеина в плазме крови может предотвращать возникновение сердечно-сосудистых осложнений.
Материал (проба): гепаринизированная плазма, отделенная от форменных элементов центрифугированием крови сразу после ее получения. Можно хранить 7 сут при -20 °С.
Референтные пределы: мужчины - 6,3-15,0 мкмоль/л; женщины - 4,6-12,5 мкмоль/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Определение риска развития атеросклероза и его осложнений. Диагностика генетически обусловленной гомоцистеинурии. Выявление гипергомоцистеинемии как одной из возможных причин акушерских патологий (фетоплацентарной недостаточности, гипоксии плода, преэклампсии и эклампсии), артериальных и венозных тромбозов.
Увеличение концентрации:
Уменьшение концентрации:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение: курение, прием алкоголя, кофе (кофеина), лечение циклоспорином, сульфасалазином, метотрексатом, карбамазепином, фенитоином; закись азота.
Интерлейкин-2
Интерлейкин-2 (ИЛ-2) - цитокин, вырабатываемой Т-лимфоцитами, играет важную роль в иммунном ответе; активирует факторы, участвующие в противовирусной, противобактериальной и противоопухолевой защите. ИЛ-2 стимулирует пролиферацию и секрецию лимфоцитами интерферона у, активирует моноциты и макрофаги, участвует в дифференцировке и пролиферации Т-лимфоцитов.
Материал (проба): сыворотка крови. До исследования можно хранить при -16 °С до 3 мес, до года - при -40 °С. Нельзя использовать гемолизированные образцы.
Метод исследования: иммуноферментный.
Референтные пределы: 0-1 пг/л.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Для оценки тяжести инфекционно-воспалительных заболеваний, эффективности проводимого лечения, а также прогнозирования течения.
Увеличение содержания:
Интерлейкин-6
Цитокин, регулирующий иммунный ответ (способствует созреванию В-лимфоцитов в антителпродуцирующие клетки, пролиферации и дифференцировке Т-клеток), реакции острой фазы, воспаление, онкогенез и гемопоэз. Стимулирует синтез острофазных белков (СРБ, фибриногена, гаптоглобина и др.), тормозит синтез провоспалительных цитокинов (ИЛ-1β, ФНО-α). Вырабатывается различными активированными клетками, в том числе Т-лимфоцитами, моноцитами, фибробластами, клетками эндотелия и др.
Материал (проба): сыворотка (плазма) крови. До исследования можно хранить при -2…-8 °С 24 ч, при -16 °С - 3 мес, при -40 °С - год. Нельзя использовать сильно гемолизированные образцы.
Метод исследования: иммунохимический.
Референтные пределы: для иммуноферментного метода - 0-10 пг/мл.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Принимает участие в патогенезе многих заболеваний, в том числе инфекционно-воспалительных. Уровень ИЛ-6 измеряют для оценки иммунного статуса.
Увеличение содержания:
ВЛИЯЮЩИЕ ФАКТОРЫ
Увеличение содержания:
Фенилаланин
Фенилаланин - незаменимая аминокислота. Генетически обусловленное нарушение обмена фенилаланина - фенилкетонурия (пировиноградная олигофрения), которая является одной из наиболее распространенных ферментопатий (1:10 000). При этой патологии недостаточность фенилаланингидроксилазы, катализирующей превращение фенилаланина в тирозин, ведет к накоплению фенилаланина в крови и усилению экскреции с мочой продуктов дезаминирования аланина - фенилпировиноградной кислоты (фенилкетона). Наиболее тяжелые проявления фенилкетонурии - нарушения умственного и физического развития. При скрининге новорожденных на фенилкетонурию положительные результаты скрининговых тестов (экспресс-теста с хлоридом железа на фенилкетонурию и др.) должны быть подтверждены количественным определением фенилаланина.
Материал (проба): плазма (сыворотка) крови; немедленно после взятия крови охладить, отцентрифугировать и заморозить в течение часа после взятия. До исследования можно хранить при -20 °С 7 сут.
Метод исследования: флюориметрия.
Референтные пределы представлены в табл. 4-34.
Таблица 4-34. Референтные пределы фенилаланина
| Возраст | мкмоль/л |
|---|---|
Новорожденные, доношенные с нормальной массой тела |
73-206 |
Новорожденные с низкой массой тела или недоношенные |
121-454 |
Новорожденные с фенилкетонурией, 2-3 сут после рождения |
>272 |
Новорожденные с фенилкетонурией, 10 сут после рождения |
907-1815 |
Взрослые |
48-109 |
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Диагностика фенилкетонурии.
Увеличение концентрации:
ВЛИЯЮЩИЕ ФАКТОРЫ
У новорожденных наблюдаются суточные колебания уровня фенилаланина (наивысшие значения - в 7 ч вечера, наиболее низкие - в 7 ч утра).
Увеличение концентрации: аспартам, котримоксазолΨ.
Уменьшение концентрации: аскорбиновая кислота (у недоношенных), глюкоза, прогестерон (высокие дозы).
Фолиевая кислота (фолацин)
Водорастворимый витамин, активные формы (тетрагидрофолиевые кислоты) образуются в печени, в качестве коферментов участвуют в синтезе нуклеотидов, что обеспечивает нормальное протекание синтеза РНК и ДНК, процессов пролиферации клеток. В конечном итоге этот витамин стимулирует эритро-, лейко- и тромбоцитопоэз, пластические и регенераторные процессы во всех органах и тканях. Недостаток фолиевой кислоты, так же как и дефицит витамина B12 (активныеформы фолиевой кислоты образуются в печени при участии витамина B12), ведет к развитию мегалобластной анемии. Дефицит ФК у беременных, как правило, обусловленный повышенной потребностью в этом витамине, может приводить к невынашиванию беременности, мертворождению, частичной или полной отслойке плаценты; у плода повышает риск развития врожденных пороков. Фолиевая кислота участвует в обмене аминокислоты метионина (синтезе метионина из гомоцистеина), а также образовании кофермента синтазы оксида азота. С этими эффектами фолиевой кислоты связывают ее антиатерогенное действие.
Референтные пределы: 3-17 нг/мл.
КЛИНИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Дифференциальная диагностика анемий. Диагностика вызванных химиотерапией или лучевой терапией нарушений со стороны крови (анемии, лейкопении).
Увеличение концентрации:
ВЛИЯЮЩИЕ ФАКТОРЫ
Уменьшение концентрации: прием препаратов, нарушающих всасывание фолиевой кислоты (аспирина♠, противосудорожных препаратов, эстрогенов, нитрофуранов, пероральных контрацептивов, антацидов, сульфасалазина) и ее антагонистов (триметоприма, метотрексата, азатиоприна, зидовудина).
МАРКЕРЫ ОБМЕНА КОСТНОЙ ТКАНИ
Кость - специализированная соединительная ткань, образующая вместе с хрящом скелет. Кость, как и все соединительные ткани, состоит из клеток и внеклеточного матрикса, образованного коллагеновыми волокнами и неколлагеновыми белками. Костный матрикс способен кальцифицироваться. Кальцифицированный костный матрикс неинертен, в нем происходят обменные процессы при участии костных клеток - остеоцитов. На протяжении жизни в различных участках кости происходит замена минерализованного матрикса на вновь образованную кость. Этот процесс получил название ремоделирования, или костного оборота. Он включает удаление старой кости - резорбцию и синтез нового костного матрикса с последующей его минерализацией - формирование кости. Цикл ремоделирования сопровождается выходом в кровоток кальция, компонентов матрикса и ферментов, секретированных костными клетками. Процесс резорбции кости осуществляется остеокластами и мононуклеарными клетками, процесс формирования кости - остеобластами.
Остеокласт образуется из предшественников моноцитарного ряда, это большая клетка с несколькими ядрами, содержащими ядрышки. В месте контакта с костью остеокласт образует рифленую кайму. В ее выступах локализуется протонная помпа, создающая кислую среду около клетки. Эндоплазматическая ретикулярная сеть в цитоплазме синтезирует тартратрезистентную кислую фосфатазу, протеазы и другие лизосомальные ферменты, транспортирующиеся к зоне контакта с костью лизосомальными пузырьками. Костный минерал растворяется кислой средой, а матрикс - ферментами. Процесс образования остеокластов из предшественников и активация остеокластов тонко регулируются гуморальными [паратиреоидным гормоном (ПТГ) и ПТГ-подобным пептидом] и местными тканевыми факторами (фактором некроза опухоли, трансформирующим ростовым фактором, интерлейкином-1, интерлейкином-6 и др.).
Остеобласт происходит из клеток соединительной ткани костного мозга, являясь клеткой, формирующей кость. Он секретирует основные компоненты матрикса (коллаген I типа, гликопротеины, другие специфические белки), специальные ферменты (щелочную фосфатазу, коллагенозу и др.), способствует формированию минерализованного матрикса. Дифференцировка остеобластов и их функция тонко регулируются большим количеством гуморальных и местных тканевых факторов. Костный матрикс содержит в основном коллаген I типа (более 90%), много неколлагеновых белков матрикса, играющих важную роль в минерализации кости, другие тканевые составляющие, такие как протеогликаны. Минерализация кости происходит при высокой местной концентрации кальция и фосфора для формирования гидроксиапатита. В создании условий для отложения гидроксиапатита большая роль принадлежит щелочной фосфатазе.
Для изучения обмена кости применяют следующие методы: измерение плотности кости, сцинтиграфию скелета с радиоактивным изотопом технеция, гистоморфометрию костных биоптатов, кинетические исследования после введения изотопа кальция, определение биохимических маркеров костного ремоделирования. В клинико-диагностических лабораториях активно внедряются биохимические методы оценки метаболизма костной ткани. Биохимические маркеры дают информацию о патогенезе заболеваний скелета и скорости ремоделирования. Их можно использовать для контроля эффективности лечения в короткие сроки и идентификации больных с быстрой потерей костной массы. Биохимические маркеры показывают усредненную скорость ремоделирования всего скелета, а не отдельных его областей. Различают биохимические маркеры формирования и резорбции кости, характеризующие функции остеобластов и остеокластов.
Маркеры формирования костной ткани
К биохимическим маркерам формирования кости (табл. 4-35) относятся костный изофермент щелочной фосфатазы (КЩФ), остеокальцин (ОК), карбокси- и аминотерминальные пропептиды проколлагена 1-го типа (КТПП 1 и АТППК 1).
Таблица 4-35. Биохимические маркеры формирования кости
| Маркер | Тканевая специфичность | Метаболизм |
|---|---|---|
Костная щелочная фосфатаза (КЩФ) |
Синтезируется остеобластами; синтез возрастает в процессе дифференциации остеобластов. Уровень в крови коррелирует с данными гистоморфометрии кости и состоянием формирования кости, измеренным с помощью Са47 |
Выводится почками; время полужизни в крови (t1/2) 1-2 сут |
Остеокальцин (ОК) |
Синтезируется остеобластами и одонтобластами. Уровень в крови коррелирует с данными гистоморфометрии кости и состоянием формирования кости, измеренным с помощью Са47 |
Выводится почками; в крови присутствуют интактные молекулы ОК и их фрагменты; t1/2 несколько мин |
Карбокси-и аминотерминальные пропептиды проколлагена 1-го типа (КТППК 1 и АТППК 1) |
Находятся в тканях, содержащих коллаген 1-го типа (преимущественно в костях и коже). Образуются в результате отщепления от молекулы проколлагена 1-го типа под воздействием пептидаз. Отражают синтез остеобластами коллагена 1-го типа. Уровень КТППК 1 в крови коррелирует с данными гистоморфометрии кости и включением в кость Са47 |
КТППК 1 метаболизируется в печени; t1/2 в крови - 6-8 мин. Соответствующие данные в отношении АТППК 1 отсутствуют |
Костная щелочная фосфатаза
В кости щелочная фосфатаза (КЩФ) секретируется остеобластами. Она участвует в созревании матрикса и его минерализации. Синтез КЩФ возрастает в процессе дифференциации остеобластов при ускоренном формировании кости. Костный изофермент ЩФ наиболее термолабильный - инактивируется при 55 ?С. Специфичность КЩФ, а так же такие характеристики ее метаболизма, как время полужизни в крови, составляющее 1-2 сут, отсутствие метаболизма в печени, выведение из крови почками, приближают КЩФ к идеальным маркерам активности остеобластов. Значительное увеличение ее активности в сыворотке крови наблюдается при повышенной деятельности остеобластов: росте костей (у детей активность выше, чем у взрослых; она увеличивается в последний триместр беременности), при возобновлении движений после длительного постельного режима, переломах, деформирующем остите, болезни Педжета, рахите, гиперпаратиреозе. Это характерно и для процессов остеомаляции (злокачественных опухолей костей, миеломы), а также костного туберкулеза и лейкозов. Повышение активности костной ЩФ при рахите отмечается чаще, чем увеличение содержания неорганического фосфора; при выздоровлении активность ЩФ нормализуется позднее, чем уровень Ca и P, примерно в те же сроки, что и рентгенологические показатели.
Интерпретация данных исследования КЩФ бывает затруднена, что связано с половыми и возрастными особенностями ее активности и недостаточной специфичностью методов, используемых для ее определения (тартратрезистентная фракция ЩФ). Наиболее адекватными методами исследования КЩФ считаются РИА и ИФА с моноклональными антителами.
Остеокальцин
Остеокальцин (ОК) - неколлагеновый кальцийсвязывающий белок с молекулярной массой 5,7 кДа, синтезируемый остеобластами и одонтобластами и определяемый в сыворотке крови. ОК обогащен гаммакарбоксиглутаминовой кислотой, для его синтеза требуется витамин К. Более 90% синтезируемого остеобластами ОК у молодых и около 70% у взрослых людей включается в костный матрикс, а остальная часть попадает в кровоток. Точно установить долю синтезированного остеобластами ОК, попадающую в кровоток, не представляется возможным. Она может меняться в зависимости от характера метаболических нарушений в кости. Выводится ОК из кровотока почками (посредством клубочковой фильтрации и деградации в почечных канальцах). При выраженном снижении клубочковой фильтрации, в частности при хронической почечной недостаточности, уровень ОК в крови может быть завышенным. Наличие в кровотоке фрагментов ОК из-за частичного его разрушения в сосудистом русле под воздействием циркулирующих протеаз или его разрушения в процессе резорбции кости также может приводить к завышенным значениям. Кроме того, уровень ОК в крови подвержен большим суточным колебаниям. Вместе с тем получена хорошая корреляция между уровнем ОК в крови и данными инвазивных методов оценки процесса формирования кости при различных метаболических поражениях скелета. Именно поэтому, несмотря на все вышеописанные ограничения, ОК в крови рассматривается как один из самых информативных биохимических маркеров формирования кости и скорости ремоделирования. Наиболее адекватными методами исследования ОК считаются радиоиммунный и иммуноферментный анализы с использованием антител.
Карбокси- и аминотерминальные пропептиды проколлагена 1-го типа
Карбокси- и аминотерминальные пропептиды проколлагена 1-го типа (КТППК1и АТППК 1; PICH и PINP - в английской аббревиатуре). Коллаген 1-го типа - основной белок, составляющий 90% органического матрикса кости. Он синтезируется остеобластами в виде предшественника проколлагена 1-го типа, представляющего собой большую молекулу, содержащую с C- и N-концов частично глобулярные фрагменты (КТППК 1 и АТППК 1), которые отделяются от основной молекулы с помощью специфических пептидаз после выброса проколлагена из клетки.
Помимо кости, они присутствуют во всех тканях, содержащих коллаген 1-го типа. В сосудистое русло из костей телопептиды выходят исключительно в процессе резорбции. Для определения КТТК 1 и АТТК 1 применяют РИА и ИФА с использованием моноклональных антител.
Маркеры резорбции костной ткани
Биохимические маркеры резорбции кости представлены в табл. 4-36. Пиридинолин и дезоксипиридинолин (ПИД и ДПИД), карбокси- и аминотерминальные телопептиды коллагена 1-го типа (КТТК 1 и АТТК 1), оксипролин (ОПр), фрагмент коллагена 1-го типа галактозилоксилизин (ГОЛ) попадают в кровоток из зоны резорбции. Тартратрезистентная кислая фосфатаза - фермент, секретируемый остеокластами, попадает в повышенном количестве в кровоток при увеличении количества и возрастании активности остеокластов.
Таблица 4-36. Биохимические маркеры резорбции кости
| Маркер | Тканевая специфичность | Метаболизм |
|---|---|---|
Пиридиновые поперечные связи пиридинолин (ПИД) и дезоксипиридинолин (ДПИД) |
Формируются между концевой областью одной молекулы коллагена и спиралевидной областью другой. Способствуют стабилизации коллагена. ДПИД присутствует преимущественно в кости, освобождается только в процессе ее резорбции |
Экскретируются с мочой; не метаболизируются в печени |
Карбокси- и аминотерминальные телопептиды коллагена 1-го типа (КТТК 1, АТТК 1) |
Присутствуют во всех тканях, содержащих коллаген 1-го типа. В соединении с поперечными связями выбрасываются из костей только в процессе их резорбции |
|
Маркер |
Тканевая специфичность |
Метаболизм |
Оксипролин (ОПр) |
Присутствует во всех молекулах коллагена и эластина. Появляется в экстрацеллюлярной жидкости при формировании (из-за частичной деградации вновь синтезированного коллагена вне костного матрикса) и резорбции кости |
Метаболизируется в печени; 10-15% выводится почками |
Галактозилоксилизин(ГОЛ) |
Присутствует только в коллагене; содержится в 5-7 раз больше в коллагене костей, чем в коллагене кожи. Освобождается только в процессе резорбции кости |
Не метаболизируется в печени. Экскретируется в неизмененном виде с мочой |
Костная тартратрезистентная кислая фосфатаза (ТРКФ) |
Присутствует в остеокластах и других макрофагах |
Пиридинолин и дезоксипиридинолин
В костном коллагене присутствуют поперечные связи между отдельными молекулами коллагена, играющие большую роль в его стабилизации. Они представлены в виде пиридинолина (оксилизилпиридинолина) и дезоксипиридинолина (лизилпиридинолина). Поперечные связи формируются экстрацеллюлярно после отложения молекул коллагена в матрикс. В результате резорбции, осуществляемой остеокластами, при разрушении коллагена возможен их выход из кости в сосудистое русло. Наиболее специфичным для костей является ДПИД, поскольку он содержится преимущественно в костях и в небольшом количестве в дентине, аорте и связках. ПИД, помимо костей, присутствует в достаточном количестве в хрящах. ПИД и ДПИД не метаболизируются в организме, а экскретируются с мочой. Для оценки резорбции используется отношение их концентрации к уровню креатинина в моче. Для анализа используют суточную или утреннюю мочу.
Определяют свободные ПИД и ДПИД в моче, применяя ИФА с использованием моноклональных антител к ПИД или ДПИД. Уровень маркеров в моче у женщин несколько выше, чем у мужчин, и повышается с возрастом.
Оксипролин в моче
Оксипролин (ОПр) составляет около 14% аминокислотного состава коллагена, продуцируемого остеобластами. ОПр образуется в результате гидроксилирования пролина в процессе модификации проколлагеновых цепей, которая частично имеет тканевую специфичность. Около 85-90% ОПр, освобождающегося из костей в результате разрушения коллагена, метаболизируется в печени и только 10-15% появляется в моче. При этом около 10% ОПр, появляющегося в моче, образуется не в результате резорбции, а в результате деградации вновь синтезированных проколлагеновых пептидов или новых коллагеновых молекул, не использованных при построении костного матрикса. Именно поэтому появляющийся в моче ОПр отражает суммарно и функцию остеобластов (процесс формирования), и функцию остеокластов (процесс резорбции), но доля ОПр, образуемого в результате резорбции, превалирует. Используя исследование ОПр в моче для оценки скорости ремоделирования, следует иметь в виду, что он не является специфичным только для костей, поскольку содержится, хотя и в меньшем количестве, во всех типах коллагеновых молекул. Кроме того, он может появляться в моче в результате приема пищи, содержащей коллаген.
Галактозилоксилизин в моче
Галактозилоксилизин (ГОЛ) образуется, как и ОП, в остеобластах в результате гидроксилирования лизина с последующим гликозилированием (присоединением галактозы). Содержится исключительно в коллагене, преимущественно в коллагене 1-го типа, находящегося в костях. Его нет в коллагеновых пептидах и поэтому он не выбрасывается из костей в процессе формирования, а появляется в сосудистом русле исключительно в процессе резорбции. ГОЛ не метаболизируется в печени, экскретируется с мочой.
Тартратрезистентная кислая фосфатаза
Тартратрезистентная кислая фосфатаза (ТРКФ) - один из 6 изоферментов кислой фосфатазы, находится в большом количестве в остеокластах и секретируется ими во внеклеточную среду во время резорбции. Она присутствует и в других клетках, особенно макрофагах. Поскольку активность ТРКФ в сыворотке крови возрастает при состояниях, характеризуемых усилением процесса резорбции кости, а также имеется корреляция между ее активностью и данными гистоморфометрии, ТРКФ используют для определения выраженности резорбтивных процессов в скелете.
Биохимические маркеры ремоделирования кости при заболеваниях скелета
Для всех заболеваний скелета характерны те или иные нарушения процессов ремоделирования кости, что сопровождается возникновением отклонений в уровне биохимических маркеров. Для всех заболеваний, кроме остеомаляции и сенильного остеопороза, характерно ускорение ремоделирования с усилением процессов резорбции кости. Формирование кости при этом может быть снижено, нормально или даже повышено, но степень усиления формирования всегда меньше, чем степень усиления резорбции. Иными словами, происходит нарушение нормального соотношения между процессами резорбции и формирования кости. Такое же нарушение характерно для сенильного остеопороза (остеопороза I типа), при котором наблюдается снижение формирования на фоне нормальной резорбции вследствие нарушения функций остеобластов. У здоровых людей в результате деятельности остеобластов резорбированная полость полностью заполняется вновь образованной костью. При остеопорозе область резорбции заполняется лишь частично, что ведет к прогрессирующему истончению трабекул и даже их исчезновению из-за перфоративной резорбции.
Первичный остеопороз сопровождается отчетливым повышением ПИД и КТТК 1. При остеопорозе вследствие дефицита эстрогенов у женщин показана линейная зависимость между ДПИД и степенью снижения плотности предплечья, а также среднегодовой потерей плотности кости шейки бедра. Выявлено, что значение ДПИД в моче более 7,4 нМ/мМ креатинина указывает на риск потери костной массы. Кроме того, риск переломов шейки бедра наибольший при сочетании высокой экскреции ДПИД с низкой плотностью кости. Экскреция ДПИД и ПИД у больных на фоне перелома бедра больше, чем у больных, имевших переломы в анамнезе. Из других заболеваний скелета наибольшая экскреция ДПИД наблюдается при раке грудной железы с метастазами в кость из-за большого, хотя и локального, разрушения скелета. Из метаболических заболеваний скелета самая высокая экскреция ДПИД и ПИД - при первичном гиперпаратиреозе, болезни Педжета и гипертиреозе, что связано с самой большой скоростью ремоделирования кости.
Биохимические маркеры формирования кости при различных заболеваниях скелета изменяются по-разному, при этом важен уровень каждого маркера в отдельности, поскольку они характеризуют разные функции остеобластов.
При первичном гиперпаратиреозе, остеопорозе у женщин после менопаузы выявлено повышение как костного изофермента щелочной фосфатазы, так и ОК, но если при гиперпаратиреозе степень повышения обоих маркеров аналогична, при остеопорозе повышение ОК незначительное, а КЩФ отчетливое, но меньше, чем при первичном гиперпаратиреозе. При болезни Педжета диссоциация между двумя маркерами такого же типа, как и при первичном остеопорозе. При гипертиреозе и акромегалии оба маркера в пределах нормы или незначительно повышены, а при гипопаратиреозе - понижены. Дискордантные отклонения в уровне КЩФ и ОК установлены при хронической почечной недостаточности, метастазах злокачественных опухолей в кости, остеомаляции, а также при эндогенном и экзогенном гиперкортицизме. Для хронической почечной недостаточности характерно повышение ОК при нормальной величине КЩФ, а для гиперкортицизма, остеомаляции и метастазов в кости - повышение КЩФ и понижение ОК. Тем не менее при хронической почечной недостаточности выявлена высокая и достоверная прямая корреляция между ОК и КЩФ. Нормальные величины КЩФ ассоциируются с умеренным повышением ОК, а повышение КЩФ, выявленное у трети больных, - с наиболее высокими значениями ОК. Выявлена также прямая корреляция между ОК и уровнем ПТГ в крови. Наиболее высокий ОК наблюдался у больных с гиперпаратиреоидной субпериостальной резорбцией на рентгенограммах костей. В исследованиях КЩФ в травматологии показано, что после перелома происходит постепенное повышение уровня фермента, свидетельствующее об активации остеобластов, нарастающее до 13-й недели после травмы с последующим постепенным снижением.
Болезнь Педжета и гипертиреоз характеризуются повышением КТППК 1, в то время как у женщин с дефицитом эстрогенов он остается в пределах нормы. У онкологических больных повышение КТППК 1 наблюдается только при метастазах в кости и печень. Вместе с тем глюкокортикоидная терапия вызывает снижение КТППК 1, степень которого при лечении преднизолоном прямо зависит от суточной дозы препарата.
Для интерпретации результатов определения биохимических маркеров формирования кости необходимо знать состояние резорбции кости. Особенно трудна оценка повышения уровня биохимических маркеров формирования кости, которая при сочетании с усилением резорбции свидетельствует, как правило, об ускорении ремоделирования с потерей костной массы. Например, при гипертиреозе наблюдается увеличение ПИД более чем в 3 раза, указывающее на увеличение резорбции и значительное ускорение ремоделирования. Вместе с тем ОК и КЩФ повышаются незначительно, что свидетельствует об отставании процессов формирования кости от процессов резорбции.
В основе возникновения постменопаузального остеопороза лежит дефицит эстрогенов, который первично влечет активизацию процесса резорбции кости с вторичным усилением процесса формирования вследствие спаренности обоих процессов. Потери костной массы возникают в результате преобладания резорбирующих кость процессов и могут быть как быстрыми, так и медленными, в зависимости от степени усиления резорбции и степени нарушения соотношения между процессами ремоделирования кости. Именно поэтому для постменопаузального остеопороза характерно увеличение таких маркеров резорбции, как ПИД, ДПИД, КТТК 1 и ОПр, а также различной степени выраженности увеличение маркеров формирования кости - ОК, КЩФ и КТПП. По соотношению изменения маркеров резорбции и формирования можно судить о скорости костных потерь, предсказать риск развивающегося перелома кости, при котором находят снижениеОК и увеличение ДПИД и ТРКФ, а также выбрать оптимальную терапию (при высокой скорости костного оборота предпочтительны препараты, подавляющие резорбцию, а при низкой - стимулирующие формирование кости) и оценить ее эффективность.
Остеопороз при первичном гиперпаратиреозе развивается в результате первичного усиления процесса резорбции кости остеокластами под действием паратиреоидного гормона и процесса формирования кости вследствие вторичной активизации остеобластов. Таким образом, при первичном гиперпаратиреозе имеет место высокая скорость ремоделирования, которая неизбежно сопровождается потерями костной массы и характеризуется значительным повышением уровня как маркеров резорбции (ПИД, ДПИД), так и маркеров формирования кости (ОК и КЩФ).
Остеопороз при гипертиреозе, как и при первичном гиперпаратиреозе, развивается вследствие активизации остеокластов, т.е. первичного усиления резорбтивных процессов в скелете. Изменения со стороны костного оборота и биохимических маркеров резорбции и формирования аналогичны изменениям при первичном гиперпаратиреозе.
ОСТЕОПОРОЗ ПРИ ЭНДОГЕННОМ (БОЛЕЗНИ КУШИНГА) И ЭКЗОГЕННОМ ГИПЕРКОРТИЦИЗМЕ, РАЗВИВАЮЩЕМСЯ ВСЛЕДСТВИЕ ДЛИТЕЛЬНОГО ЛЕЧЕНИЯ ГЛЮКОКОРТИКОИДАМИ
Патогенез возникновения костных потерь при избытке глюкокортикоидов связывают с прямым подавлением глюкокортикоидами формирования кости остеобластами, а также с увеличением резорбции кости вследствие активизации остеокластов, вызываемой ПТГ. Его уровень повышается в ответ на гипокальциемию (вторичный гиперпаратиреоз), возникающую в результате вызываемого глюкокортикоидами нарушения всасывания кальция в кишечнике и снижения реабсорбции кальция в почках. Таким образом, на тканевом уровне происходит подавление формирования кости. При этом резорбция кости может быть либо нормальной, либо усиленной, что и приводит к нарушению баланса между этими двумя процессами в местах ремоделирования кости и соответственно к потере костной массы.
При остеопорозе, вызванном экзогенным и эндогенным гиперкортицизмом, наблюдают снижение ОК и нормальный уровень КЩФ. Поскольку, по данным гистоморфометрии, избыток глюкокортикоидов вызывает уменьшение количества остеобластов, снижение ОК может быть обусловлено как подавлением синтеза ОК активными остеобластами, так и уменьшением их количества. Глюкокортикоиды стимулируют продукцию остеобластами КЩФ, поэтому ее нормальные значения у больных с остеопорозом можно объяснить комбинацией двух противоположных влияний глюкокортикоидов на остеобласты (усилением продукции КЩФ каждой клеткой и уменьшением количества продуцирующих клеток). Показано, что при систематическом лечении глюкокортикоидами наблюдается выраженное снижение не только ОК, но и КТППК 1, составляющее 48 и 38% соответственно, при этом степень снижения КТППК 1-го зависит от дозы преднизолона. Глюкокортикоиды подавляют синтез коллагена 1-го типа остеобластами. Значительных изменений со стороны показателей резорбции кости при глюкокортикоидном остеопорозе не выявлено.
ИСПОЛЬЗОВАНИЕ БИОХИМИЧЕСКИХ МАРКЕРОВ ДЛЯ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ СКЕЛЕТА
Для большинства заболеваний скелета характерно ускорение ремоделирования с усилением резорбции, поэтому для контроля лечения используют главным образом маркеры резорбции кости. В исследовании ПИД и ДПИД после 3 мес лечения эстрогенами женщин с постменопаузальным остеопорозом выявлено снижение резорбции кости. Более длительное лечение ведет к дальнейшему уменьшению ДПИД, сопровождаемому нарастанием плотности кости. Лечение бисфосфонатами женщин, страдающих остеопорозом, также ведет к прогрессирующему снижению ДПИД с достижением нормальных величин к шестому месяцу лечения. Лечение бисфосфонатами при болезни Педжета сопровождается закономерным снижением ПИД, ДПИД, ОПр и КЩФ, ДПИД нормализуется к 4-му, ПИД - к 5-му, ОПр - к 7-му, а КЩФ - только к 24-му месяцу терапии. Такое же отсроченное снижение КЩФ характерно для гипертиреоидного остеопороза. На фоне лечения карбимазолом, радиоактивным йодом, а также после тиреоидэктомии ПИД и ОК снижались уже через месяц, в то время как КЩФ через месяц повышалась и снижалась лишь через 4 мес. Возможно, такая динамика КЩФ обусловлена активацией репаративных процессов в скелете. Определение ПИД и ДПИД до и после удаления аденомы паращитовидных желез демонстрирует хорошую эффективность операции.