Наследственные болезни : национальное руководство / Под ред. Н. П. Бочкова, Е. К. Гинтера, В. П. Пузырева - Москва : ГЭОТАР-Медиа, 2012. - 936 с. (Серия "Национальные руководства") - ISBN 978-5-9704-2231-1 |
Аннотация
Национальные руководства - первая в России серия практических руководств по основным медицинским специальностям, включающих всю основную информацию, необходимую врачу для непрерывного последипломного образования.
Национальное руководство "Наследственные болезни" содержит актуальную, современную информацию о геноме человека, общих вопросах медицинской генетики, клинической генетике. Руководство состоит из двух частей, в которых излагаются теоретические и клинические вопросы медицинской генетики. В первой части представлены новейшие данные по теоретическим вопросам медицинской генетики. Сведения об организации и функциях генома, генов и хромосом изложены в понятной для врачей форме, но без излишнего упрощения. Во второй части представлены вопросы клинической генетики, а именно методы диагностики наследственных болезней (от клинического уровня до секвенирования ДНК и РНК), принципов лечения и профилактики отдельных нозологических форм. Поскольку в национальных руководствах по другим специальностям описаны многочисленные наследственные болезни, на них можно найти ссылки [см. "Перечень наследственных болезней (синдромов), описание которых представлено в других национальных руководствах" на компакт-диске]. Приложение к руководству на компакт-диске включает более полную информацию по некоторым главам, электронную версию руководства, обширный иллюстративный материал, приложения, перечень наследственных болезней, описанных в других руководствах, фармакологический справочник. В подготовке настоящего издания в качестве авторов-составителей и рецензентов принимали участие ведущие ученые разных специальностей: генетики, иммунологи, невропатологи, фармакологи, онкологи и другие специалисты. Все рекомендации прошли этап независимого рецензирования.
Руководство предназначено для врачей-генетиков, врачей лаборантов-генетиков, врачей смежных специальностей, интернов, ординаторов, аспирантов, особенно по таким дисциплинам, как педиатрия, акушерство-гинекология, нервные болезни.
Гриф
Национальное руководство рекомендовано Российским обществом медицинских генетиков и Ассоциацией медицинских обществ по качеству
Глава 7. Мутационный процесс у человека
ВВЕДЕНИЕ
Наследственность и изменчивость - базовые свойства всех живых организмов, обеспечивающие, с одной стороны, видовую целостность, с другой, в совокупности с естественным отбором - приспособленность и эволюционное развитие в меняющихся условиях окружающей среды.
Первично наследственная изменчивость является следствием мутагенеза, под которым принято понимать процесс возникновения мутаций (от лат. mutatio - изменение), образующихся спонтанно или под влиянием многих физических, химических, биологических факторов, называемых мутагенами. Мутационный процесс - это не только процесс возникновения мутаций (мутагенез), но также накопление, распространение и элиминация мутаций.
Присутствие мутагенов в среде обитания человека, потенциально способных повреждать генетические структуры клеток, рассматривается как негативная ситуация с тяжелыми медицинскими и биологическими последствиями.
Homo sapiens как биологический вид выведен из-под давления естественного отбора вследствие медицинских и гигиенических достижений, что делает его «восприимчивым» к накоплению генетического груза. Человечество отягощено огромным грузом патологических мутаций. Возникновение даже незначительных генетически обусловленных отклонений воспринимается как психотравмирующая ситуация, в более серьезных случаях представляет значительную медицинскую проблему, а также приводит к существенному снижению качества жизни и инвалидизации. По существующим оценкам, у 70% людей в течение жизни проявляется хотя бы один генетически обусловленный дефект, снижающий продолжительность и/или качество жизни (Peltonen L., McKusick V.A., 2001).
Мутационный процесс является первоосновой возникновения наследственных болезней, около 20% которых обусловлены мутациями de novo. До 60-х годов ХХ в. интерес к мутагенезу был сосредоточен на индукции мутаций в зародышевых клетках, поскольку именно они определяют формирование генетического груза популяции. Мутации в соматических клетках в тот период рассматривались как индикаторный показатель мутагенных воздействий. Сегодня становится все очевиднее, что повреждения ДНК и мутации в соматических клетках могут иметь самостоятельную патогенетическую значимость.
Современная экологическая ситуация характеризуется широким распространением мутагенов различной природы, подавляющее большинство из которых имеет антропогенное происхождение и введено в среду обитания на протяжении жизни 4-5 поколений. Это определяет необходимость повышенного внимания врачей к оценке мутагенных воздействий на пациента. Различные аспекты мутационного процесса разбираются в настоящей главе.
ОБЩИЕ ПРЕДСТАВЛЕНИЯ О МУТАЦИЯХ И МЕХАНИЗМАХ МУТАГЕНЕЗА
Со времен Г. Де Фриза, впервые введшего понятие «мутация» и определившего его как внезапное, скачкообразное и наследуемое изменение признака (фенотипа), этот термин стал употребляться более широко с иными смысловыми оттенками, определяемыми конкретной областью исследования. Например, в молекулярной биологии под мутацией понимают долговременное изменение в нуклеотидной последовательности ДНК, в цитогенетике - хромосомные аномалии, в клинической генетике - наследственные синдромы. С генетической точки зрения мутация - это изменение наследственных структур в геноме на генном, хромосомном или геномном уровне организации.
Классификация мутаций. Методы выявления мутаций
Первая и наиболее общая классификация мутаций была предложена Г. Меллером в 1932г., в которой он предложил выделять:
-
аморфные мутации - приводящие к утрате признака например ферментопатии с утратой способности к выработке ферментов, альбинизм;
-
гипоморфные мутации - приводящие к недоразвитию признака (микрофтальмия, карликовость);
-
гипермофные мутации - приводящие к избыточному развитию признака (полидакталии, гипертрихоз ушной раковины);
-
неоморфные мутации - приводящие к развитию нетипичного признака; аномальных белков (гемоглобинопатии), новообразований (ретинобластома, полипоз прямой кишки);
-
антиморфные мутации - приводящие к появлению признака, прямо противоположного типичному, например несвертываемость крови (гемофилия).
В дальнейшем, в зависимости от контекста и направлений исследований, мутации стали подразделять:
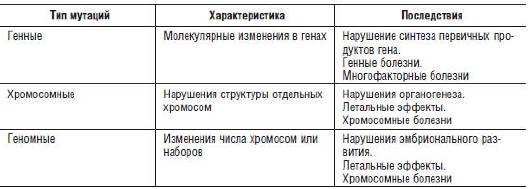
Все перечисленные классификационные термины широко используются до настоящего времени. Однако по мере развития представлений о структурной организации генома наибольшее распространение получила классификация, подразделяющая мутации на генные, хромосомные и геномные, т.е. в зависимости от уровня организации генетического материала.
ГЕННЫЕ МУТАЦИИ
Генные мутации традиционно рассматриваются как субмикроскопические изменения структуры ДНК, затрагивающие последовательность нуклеотидов одного гена. Они могут быть однонуклеотидными, т.е. затрагивающими одну пару оснований, или быть представлены делециями, дупликациями, инверсиями и инсерциями групп нуклеотидных пар.
Однонуклеотидные замены лежат в основе широкого генетического полиморфизма (SNP - single nucleotide polymorphisms). Речь идет о заменах, для которых в популяции имеются различные варианты аллелей, с частотой редкого аллеля не менее 1%. Именно с этой категорией генных мутаций связывают многообразие индивидуальных реакций на средовые факторы различной природы.
Биологическое значение генных мутаций существенно зависит от того, каким образом мутация сказывается на точности трансляции генетической информации. Принято выделять несколько типов изменений в экзоне.
Нонсенс-мутации останавливают трансляцию за счет преобразования кодирующего триплета в стоп-кодон.
Миссенс-мутации приводят к искажению информации в кодоне и включению в белок аминокислоты, отличной от типичной для данной белковой молекулы в данном положении.
Сеймсенс-мутации не меняют кодирующей способности триплета в рамках выраженности генетического кода, а следовательно, не приводят к замене аминокислоты в структуре белка.
Сплайсинг-мутации возникают на стыке экзона и интрона, они изменяют донорный и/или акцепторный сайты сплайсинга и нарушают его реализацию.
Помимо однонуклеотидных замен, могут происходить вставки или потери отдельных нуклеотидов, приводящие к мутациям сдвига рамки считывания (frameshift). Данная форма молекулярного повреждения приводит к изменению структуры кодируемого пептида и/или остановке его синтеза.
Наконец, в отдельную категорию генных мутаций относят так называемые «динамические» мутации, выражающиеся в увеличении числа триплетных повторов в промоторных и кодирующих областях генов. Предполагается, что они возникают за счет эффекта «проскальзывания» при репликации.
ХРОМОСОМНЫЕ МУТАЦИИ
К этой категории относят мутации, нарушающие целостность хромосом в пределах разрешающей способности светового микроскопа (около 1 млн пар нуклеотидов). Различают следующие варианты хромосомных мутаций: делеции, дупликации, реципрокные и нереципрокные транслокации, пери- и парацентрические инверсии, инсерции (вставочный вариант транслокации). Таким образом, формат хромосомных мутаций практически совпадает с форматом генных мутаций, а различия между ними характеризуются разной длиной перемещаемых нуклеотидных участков, что определяет принципиально разное «поведение» мутантных локусов или участков хромосом в мейозе. Наличие хромосомной мутации ведет к нарушениям конъюгации в мейозе и образованию новых «перестроек» хромосом.
В экспериментальной генетике in vitro и in vivo хромосомные мутации называют хромосомными аберрациями. Современные представления о механизме возникновения и классификации хромосомных аберраций, а также сведения, раскрывающие взаимосвязь мутагенного воздействия на разных стадиях клеточного цикла с образованием хромосомных аберраций разного типа, были подробно описаны (Бочков Н.П., Чеботарев А.Н., 1989). Возникновение хромосомных аберраций всегда связано с индукцией молекулярных нарушений, которые приводят к разрывам двух цепей ДНК. Агенты, вызывающие аберрации хромосом (хромосоморазрывающие агенты), часто называют кластогенами.
В результате хромосомных мутаций возникает генетический дисбаланс, в подавляющем большинстве случаев приводящий к гибели клеток. В отличие от стабильных хромосомных аберраций (реципрокные транслокации и инверсии), способных к воспроизводству в ряду поколений клеток, такие события объединяются в группу нестабильных хромосомных аберраций. Достоверно установлено, что инверсии и транслокации вносят существенный вклад в формирование генетически аномальных гамет и нежизнеспособных зигот. В отдельных случаях генетический дисбаланс может служить причиной хромосомной болезни.
Согласно классическим представлениям, повреждения ДНК в G1- и S-периоды приводят к появлению аберраций хромосомного типа, в G2-периоде клеточного цикла - к индукции аберраций хроматидного типа. Трансформация первичного повреждения ДНК в хромосомную аберрацию может происходить только в делящейся клетке.
ГЕНОМНЫЕ МУТАЦИИ
Изменение числа хромосом в клетке - это геномные мутации. Выделяют две категории геномных мутаций:
-
полиплоидия- возникает, когда происходит увеличение хромосомного набора, кратное числу хромосом в гаплоидном наборе;
-
анеуплоидия- хромосомный набор меняется на одну или большее число хромосом. Потеря одной хромосомы приводит к моносомии, приобретение добавочной хромосомы соответственно к трисомии по конкретной хромосоме.
Механизм возникновения геномных мутаций, связанный с нарушением расхождения хромосом за счет факторов (анеугенов), влияющих на ахроматическое веретено деления, принципиально отличается от механизма возникновения генных и хромосомных мутаций.
Механизмы мутагенеза
В общем виде можно выделить два этапа становления генных и хромосомных мутаций.
Первый этап - возникновение первичных повреждений ДНК, выражающихся в изменении нуклеотидной последовательности, химической модификации азотистых оснований, разрывах цепей ДНК под действием тех или иных событий или агентов.
Второй этап - репарация первичных повреждений ДНК, итогом которой может быть либо восстановление целостности ДНК, либо закрепление первичного повреждения в форме мутационного изменения. Возникновение геномных мутаций связано с нарушением процесса расхождения хромосом в клеточных делениях или при гаметогенезе.
Эти классические представления, сложившиеся в области исследования мутагенеза к 70-м годам прошлого века, вполне современны и к настоящему времени в достаточной степени детализированы. В частности, выявлены варианты первичных повреждений ДНК, в ряде случаев показана их специфичность по отношению к действующему фактору, существенно расширены знания о процессах репарации ДНК в клетках млекопитающих, установлены механизмы нарушения функции ахроматического веретена.
Первичные повреждения ДНК и их значение
Сведения об известных предмутационных первичных повреждениях ДНК суммированы на рис. 7-1 (см. цв. вклейку).
В качестве основных источников мутагенеза, вызывающих указанные первичные повреждения ДНК, наиболее известны ошибки процесса репликации ДНК.
В процессе репликации одна из нитей ДНК наращивается непрерывно, другая прерывисто собирается из так называемых «фрагментов Оказаки». Этот сложно синхронизированный процесс является источником двух типичных ошибок: неправильного включения нуклеотидов и «проскальзывания по цепи», что приводит к неправильному спариванию оснований и может служить источником возникновения генных мутаций, преимущественно типа замены одиночных пар нуклеотидов.
В ходе нормального функционирования генома возникает еще несколько возможностей появления мутаций.
Первая связана с перемещением мобильных элементов генома, в результате которых возникают дупликации и инсерции в молекуле ДНК.
Вторая обусловлена ошибками мейотической или митотической (сестринские хроматидные обмены) рекомбинации. В результате может происходить потеря или приобретение дополнительных фрагментов ДНК, что приводит к возникновению дупликаций и делеций.
Третья возможность связана с воздействиями случайных тепловых флуктуаций, приводящих к депуринизации.
Важно отметить, что, несмотря на высокую частоту первичных повреждений, наблюдающихся в клетке (например, до 5 тыс. депуринизаций в день на клетку), лишь очень незначительная часть (менее 0,001%) из них остается нерепарированой. Именно поэтому в каком-то смысле спонтанный мутагенез - это не столько ошибки репликации, ретротранспозиции или рекомбинации, сколько ошибки системы репарации. Все более очевидно, что основным источником первичных, в том числе плохо репарабельных, поражений ДНК является атака этой молекулы свободнорадикальными метаболитами, возникающими при окислительном стрессе.
Повреждения ДНК следует рассматривать не только как предмутационные события, но и как самостоятельный патогенетический фактор. Это направление исследований находится в самом начале развития и базируется на следующих аргументах.
Даже временные функциональные сбои генетической программы за счет интенсификации процесса первичного повреждения ДНК могут сказываться на функционировании «белковой машины» клетки. Умозрительно можно предложить не один сценарий, приводящий к нарушению, например, альтернативного сплайсинга белков.
Индукция разрывов может быть эпигенетическим инструментом регуляции клеточной дифференцировки, апоптоза, гибели клетки.
Накоплено большое количество сведений, указывающих на повышение уровней повреждений ДНК при различных заболеваниях. Первичны они по отношению к заболеванию или возникают как вторичное звено патогенеза - вопрос дискуссионный, но их наличие бесспорно.
Выявлены корреляции между химической индукцией повреждений ДНК в эмбриональных клетках и тератогенезом.
Таким образом, можно предположить, что под действием первичных повреждений ДНК может системно изменяться или нарушаться регуляция функционирования генома клетки. Имеются прямые указания на повреждения ДНК в атеросклеротических бляшках. У пациентов с факторами повышенного риска атеросклероза (курение и сахарный диабет) наблюдается существенное повышение уровней повреждений ДНК.
Репарация как этап становления мутаций
Репарация генетических повреждений - свойство клеток живых организмов исправлять повреждения, возникшие в ДНК, и, таким образом, сохранять генетическую информацию в ряду клеточных делений и поколений организмов. Важность этого процесса подчеркивается тем, что оценочная частота повреждений ДНК в каждой клетке за сутки составляет 104-106 событий (Schärer O.D., 2003).
Изучение различных аспектов репарации ДНК является одним из наиболее интенсивно развивающихся разделов современной молекулярной биологии. К настоящему моменту имеются сведения о более чем 130 генах репарации у человека, которые были клонированы и секвенированы, однако функции многих из них остаются неясными.
Репарация реализуется по одному из возможных механизмов:
Реверсионная репарация протекает без деградации и последующего репаративного синтеза ДНК. Она приводит к исправлению алкилированных оснований, а также однонитевых разрывов ДНК посредством ДНК-полинуклеотидлигаз.
Эксцизионная репарация рассматривается как ведущий и, вероятно, наиболее древний механизм репарации ДНК. Она протекает в несколько последовательных стадий:
Эксцизионная репарация оснований (BER) устраняет поврежденные (окисленные, восстановленные, алкилированные, дезаминированные) основания, апуриновые/апиримидиновые сайты (АП), неспаренные основания, неканонические пары оснований, однонитевые разрывы ДНК.
Объектом эксцизионной репарации нуклеотидов (NER) служат их аддукты с ксенобиотиками, пиримидиновые димеры, а также, возможно, внутринитевые сшивки и сшивки ДНК-белок. В этом случае, в отличие от BER, происходит выщепление не отдельных оснований, а существенных фрагментов ДНК размером до 103 пар оснований.
Репарация неправильно спаренных оснований (mismatch repair, MMR) устраняет ошибочно спаренные основания, возникающие как ошибки репликации ДНК либо в результате окисления или метилирования оснований. В процессе MMR эффективно восстанавливаются пары GT, AC, CG, AA, делеции и инсерции от одной до трех пар оснований. Пары TT, CT, CC, GA, делеции и инсерции из четырех пар оснований репарируются плохо, а из пяти и более оснований не распознаются белками этой системы репарации, которые принято обозначать как MutSα-комплекс (MSH2-MSH6-белки).
Рекомбинационная репарация обеспечивает восстановление целостности ДНК при двунитевых разрывах. Они лежат в основе образования хромосомных аберраций. Согласно современным представлениям, репарация двунитевых разрывов возможна в эукариотической клетке двумя основными путями: гомологической рекомбинацией (HR) и негомологичным соединением концов ДНК (non-homologous end-joining, NHEJ), которое может быть ошибочным и безошибочным.
Нарушения репарации двунитевых разрывов (дефекты белков репарации Nbs, Wrn, Blm, RecQL4) наблюдаются у больных с синдромами Блума, Вернера, Неймегена. Сводку заболеваний, при которых обнаруживаются дефекты репарации, можно найти в литературе.
Таким образом, мутационный процесс в существенной степени зависит от эффективности работы систем репарации ДНК, которые либо осуществляют, либо не осуществляют исправления первичных предмутационных изменений в процессе безошибочной или, в некоторых случаях, ошибочной репарации ДНК. Регистрируемый уровень мутирования по любому генотоксикологическому маркеру всегда отражает баланс между интенсивностью генотоксического воздействия и эффективностью деятельности систем репарации. При этом часть клеток, имеющих массированные генотоксические поражения, может элиминироваться.
Нет сомнения, что полиморфизмы отдельных генов репарации и «репарационные фенотипы», определяющие согласованную, взаимодополняющую и взаимоперекрывающуюся деятельность элементов «репарационной сети», могут играть определяющую роль в формировании индивидуальной чувствительности человека к действию мутагенных факторов различной природы.
МУТАЦИОННЫЙ ПРОЦЕСС В ЗАРОДЫШЕВЫХ КЛЕТКАХ
Методы учета мутаций и оценки интенсивности мутационного процесса
Для учета мутаций в зародышевых клетках человека применяются методы, позволяющие оценивать частоту мутантов по генным мутациям (наследственные болезни, видимые или биохимические мутации), хромосомным и геномным мутациям (хромосомные болезни), доминантным леталям (сборная группа), аномальным спермиям (генные мутации).
Интенсивность мутационного процесса у человека на генном уровне можно оценивать двумя подходами: на основе учета фенотипов или популяционных эффектов (событий).
Фенотипический подход позволяет оценивать частоту мутаций в определенных локусах прямым или непрямым путем. Прямой метод используется в оценках признаков или болезней с доминантным или кодоминантным наследованием. В сферу этого подхода попадают клинически хорошо диагностируемые, видимые, летальные и некоторые биохимические признаки. Регистрируемые признаки должны иметь полную проявляемость в гетерозиготном генотипе. Сущность метода сводится к определению частоты рождения детей с мутантным фенотипом у здоровых родителей (изолированные или спорадические случаи). Поскольку мутации относительно редки, то, во-первых, можно объединить события в одну группу «сторожевых фенотипов», а во-вторых, надо предусматривать, чтобы выборки обследованных статистически соответствовали таким частотам. При этом речь идет о сотнях тысяч детей.
Для прямой оценки частоты генных мутаций в зародышевых клетках применяются биохимические методы. Мутации по мономерным белкам легко обнаруживаются электрофоретически. Проведены большие исследования с анализом более 30 локусов (электрофоретические варианты белков, эритроцитарные ферменты). Эта методика вполне приемлема для массовых исследований и может быть включена в систему учета генных мутаций.
Регистрация генных мутаций на уровне ДНК возможна, и она точнее других, но из-за трудоемкости и дороговизны применять ее в популяционных исследованиях вряд ли под силу даже в больших программах.
Популяционный подход основан на оценке летальных эффектов от инбредных браков, соотношения полов, элиминации мутаций в стационарных или изолированных популяциях. При этом можно провести суммарный учет мутаций в целом геноме или в отдельных локусах. Непрямой метод основан на принципе равновесия между мутационным процессом и элиминацией мутантов, имеющих пониженную жизнеспособность. Зная частоту мутантов в популяции и их плодовитость относительно плодовитости немутантных особей, можно определить интенсивность мутационного процесса.
При использовании и прямого, и непрямого методов необходимо принимать во внимание возможные ошибки, которые подробно разобраны в литературе (Бочков Н.П., Чеботарев А.Н., 1989).
Методы оценки частоты возникновения хромосомных и геномных мутаций сходны с прямым методом учета доминантных мутаций, т.е. определяется число мутантов в изучаемой популяции. В большинстве случаев хромосомные болезни являются следствием вновь возникших мутаций на геномном и хромосомном уровнях. Для установления факта «новой» или «унаследованной» родителями мутации достаточно исследовать их кариотипы. Необходимо отметить, что для большинства хромосомных болезней методы оценки их частот трудоемки. Они требуют тотального кариотипирования больших групп населения. Исключение составляют трисомия по хромосоме 21 (клиническая диагностика) и аномалии в числе хромосом (определение полового хроматина). Основная трудность оценки частот возникновения хромосомных болезней состоит в том, что при многих этих формах организм погибает на разных стадиях онтогенеза, начиная с раннего эмбриогенеза. Именно поэтому кариотипирование необходимо проводить в материалах спонтанных абортов, мертворожденных и живорожденных.
Широкое внедрение метода экстракорпорального оплодотворения позволило более точно, чем раньше, оценивать частоту хромосомных и геномных мутаций на ранних стадиях эмбрионального развития.
Современные методы с использованием флюоресцентной гибридизации in situ (FISH-метод) позволяют прямым подходом оценивать частоту анеуплоидии в спермиях.
Спонтанный мутагенез
Мутационный процесс интенсивно протекает в зародышевых клетках на генном, хромосомном и геномном уровнях. Несмотря на многочисленные методы оценки частот мутаций, все результаты показывают существенный размах колебаний (для генных болезней в 10-100 раз). Связано это, в первую очередь, с тем, что вновь возникшая мутация может влиять на созревание гамет, оплодотворение и развитие в раннем эмбриональном периоде. Однако методические возможности, позволяющие оценить интенсивность отбора мутантных гамет, зигот и эмбрионов, очень затруднены.
Несмотря на большое число работ, посвященных изучению частоты возникновения генных мутаций у человека, пока еще нельзя сформулировать выводы о темпе и общих закономерностях спонтанного мутагенеза. По частоте генных мутаций имеются данные по 25 наиболее четко клинически диагностируемым наследственным болезням (Бочков Н.П., Чеботарев А.Н., 1989). Эти обобщенные данные показывают колебания от 2 до 120 мутантов на 1 млн гамет. Трудно ответить на вопрос, действительно ли разница в частоте мутаций/локус/поколение связана с разной частотой в разных локусах или это обусловлено методическими особенностями исследований? Например, частоту мутаций в локусе миопатии Дюшенна оценили как 1×10-4, нейрофиброматоза - 2×10-5, а в большинстве локусов - 1×10-6.
Обобщенные данные, включая электрофоретические, позволяют предполагать, что частота спонтанных мутаций у человека (на локус/гамету/поколение) находится в пределах 10-5-10-7. Оценки сделаны по канонам классической генетики. Примерно такой же диапазон колебаний наблюдается у лабораторных животных.
Более точную расшифровку интенсивности мутагенеза предстоит сделать на молекулярно-генетическом уровне, как это выполнено с оценкой частоты мутаций в микросателлитах (Eckert K.A., Hile S.E., 2009). Прямые наблюдения изменения длины аллелей между родителями и потомками позволяют оценить частоты мутаций в микросателлитах у человека. Частоты мутаций в ди- и тетрануклеотидных повторах составляют 10-2-10-6 на локус/гамету/поколение. Наблюдаемые вариации связаны со структурой аллеля как такового, включая размер мотива, длину и нуклеотидные композиции. Ясно, что вариации частот мутаций составляют несколько порядков, и более точные данные вряд ли можно получить по многим локусам, ответственным за синтез белков.
Интенсивность мутагенеза можно рассчитывать на 1 пару оснований/поколение. Этот темп мутаций составляет 2,2×10-9. Мутации возникают в кодирующих и некодирующих регионах, и частота их колеблется в зависимости от многих внутренних факторов: нуклеотидной последовательности, локусов, регионов хромосом, отдельных хромосом. Такие выводы сделаны на основе сопоставления сиквенсов геномов человека и млекопитающих (Ellegren H., Smith N.G.С., Webster M.T., 2003).
Частота спонтанных мутаций не является абсолютно стабильной величиной. В многочисленных исследованиях выявлена зависимость спорадических случаев, т.е. в основном новых мутаций, ряда аутосомно-доминантных заболеваний от возраста родителей (ахондроплазия, нейрофиброматоз, синдром Апера, синдром Марфана и др.). Природу этой закономерности объяснить однозначно пока не удалось.
В литературе не раз затрагивался вопрос о различиях в темпах спонтанного мутирования у мужчин и женщин. Хотя выводы не по всем изученным заболеваниям совпадают, все же можно сделать заключение, что генные мутации у мужчин возникают чаще, чем у женщин. Эту разницу объясняют непрерывным обновлением сперматогенного эпителия в постнатальном онтогенезе.
Методические условия для оценок хромосомного и геномного мутагенеза позволяют адекватно судить о частотах событий, которые происходят чаще, чем генные мутации, что облегчает составление репрезентативных выборок. Однако для объективной оценки необходимо выполнять два условия: 1) цитогенетически обследовать родителей мутантов, чтобы исключить унаследованные случаи; 2) обследовать материал абортов или индивидуумов на разных стадиях онтогенеза в связи с большой летальной компонентой хромосомных и геномных мутаций.
Многочисленные цитогенетические исследования живо- и мертворожденных, материала спонтанных абортов, полярных телец, бластоцист, спермиев позволяют сделать обобщение о темпах и структуре мутагенеза в зародышевых клетках:
-
частота анеуплоидии в спермиях составляет примерно 8-10%. Возможно, что часть анеуплоидных сперматоцитов погибает при созревании, т.е. не исключается более высокая частота возникновения анеуплоидии в сперматогониях;
-
частота анеуплоидных яйцеклеток колеблется от 10 до 20% и выше. Большая часть таких яйцеклеток погибает до оплодотворения;
-
частота анеуплоидных бластоцист и ранних зародышей близка к 8-10%;
-
среди абортусов (ткани эмбрионов, плодов и оболочек) около 50% с хромосомными аномалиями;
-
летальные эффекты хромосомных аномалий разные в зависимости от вовлеченных в аномалии хромосом. Например, моносомные зиготы по длинным хромосомам не развиваются; моносомные зиготы по Х-хромосоме в 90-99% погибают либо на стадии бластоцисты, либо вскоре после имплантации; 2/3 зародышей с трисомией 21 элиминируются путем спонтанных абортов;
-
суммарно 90% зародышей с хромосомными аномалиями отсеиваются отбором;
-
частота анеуплоидий по многим хромосомам повышается с возрастом женщин, особенно после 35 лет; возраст мужчин имеет определенное значение, но после 45 лет;
-
примерно 20% всех форм хромосомных аномалий относятся к мозаичным формам;
-
частота хромосомных мутаций в гаметах составляет примерно 1/1000;
-
нерасхождение хромосом у женщин происходит чаще, чем у мужчин, и чаще в первом мейотическом делении, чем во втором.
Индуцированный мутагенез
Еще в 30-х годах ХХ в. Г. Меллер и Н.В. Тимофеев-Ресовский обратили внимание на возможность радиационного мутагенеза у человека, исходя из его универсальности. Прямых данных о радиационно-индуцированном мутагенезе в зародышевых клетках у человека на генном уровне мало, но на основании экстраполяций, полученных в опытах на животных, в возможности таких эффектов не приходится сомневаться. Вопрос заключается только в количественной оценке эффектов, которая была сделана на основе изучения потомства облученных в Японии людей.
Проанализировано более 70 тыс. исходов беременности в Хиросиме и Нагасаки с расчетом удваивающей дозы облучения. В целом не выявлено связи между здоровьем детей и облучением родителей, кроме небольшого повышения частоты врожденных пороков развития у детей супружеских пар, облученных в дозе 100 сЗв и более. Эти данные представлены в табл. 7-1.
Таблица 7-1. Повторная оценка мутагенных эффектов ионизирующих излучений в Хиросиме и Нагасаки (% от общего числа)
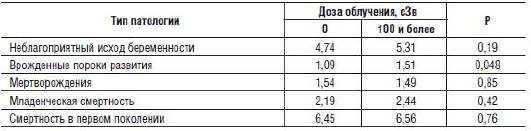
Анализ показал, что доза облучения, удваивающая число мутаций для разных показателей, колеблется от 69 до 252 сЗв, а в среднем составляет не менее 150 сЗв.
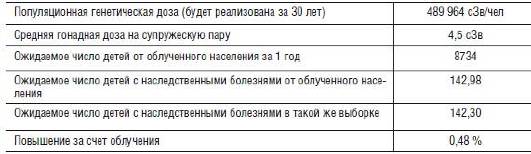
Данные о генетических последствиях радиоактивных выбросов в Уральском регионе весьма противоречивы (Бочков Н.П. и др., 1996; Ижевский П.В., 2006), что вполне понятно, поскольку речь идет о суммарной гонадной дозе обоих супругов в 4,5 сЗв. Расчеты показывают (табл. 7-2), что повышение числа детей с наследственными болезнями у облученных родителей составляет не более 0,48%. Такую долю повышения трудно уловить в выборке из 8-9 тыс. новорожденных в год на всей территории Восточно-Уральского следа.
Таблица 7-2. Генетические последствия радиоактивных выбросов в Уральском регионе (по расчетам UNSCEAR)
Что касается генетических последствий облучения в результате аварии на Чернобыльской АЭС, то убедительных данных по повышению генных мутаций или хромосомных болезней не получено, включая анализ новорожденных по Европейскому регистру. Лишь в одной работе (Дуброва Ю.Е., 2006) обнаружили повышение числа мутаций в локусах варьирующих тандемных повторов у потомства облученных людей. Однако подтверждения этих находок не получено. Расчеты возможных генетических эффектов облучения от аварии на Чернобыльской АЭС в популяциях представлены в табл. 7-3 и 7-4.
Таблица 7-3. Возможные генетические последствия от аварии на Чернобыльской АЭС (ликвидаторы, эвакуированные, жители «загрязненных» зон)

Таблица 7-4. Всего генетических последствий от аварии на Чернобыльской АЭС в первых двух поколениях (% к спонтанному уровню)
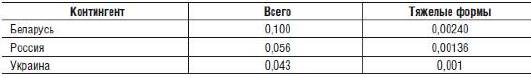
Как видно из данных табл. 7-3 и 7-4, число индуцированных радиацией случаев составит не более 0,2%, а число тяжелых форм - 0,001-0,002%.
Причинная связь между облучением родителей и рождением детей с хромосомными болезнями в течение почти 50 лет не дали однозначного ответа. Все-таки больше можно склоняться к тому, что такая связь не выявлена.
Генетические последствия в потомстве от действия химических веществ изучены менее подробно, чем от действия радиации. В основном эффекты оценивались путем учета внутриутробной смертности и врожденных пороков развития при действии анестезирующих газов, винилхлорида и хлоропрена. Полученные немногочисленные данные свидетельствуют о возможности мутагенных эффектов от действия химических веществ на зародышевые клетки, но строгих доказательств их наличия у экспонированных людей не получено. Нельзя еще говорить о конкретных дозовых зависимостях. Вместе с тем из года в год накапливаются наблюдения, настораживающие в отношении мутагенеза в зародышевых клетках и указывающие на необходимость более детального генетического мониторинга в группах, подвергающихся воздействию химических факторов (производственных, пищевых, лекарственных, бытовых, коммунальных).
Заключение
Границы знаний о мутационном процессе в зародышевых клетках у человека существенно расширились, и многие ранние представления о нем принципиально изменились. В то же время перед современными исследователями стоят «старые вопросы». Не обоснованы еще правила экстраполяции количественных закономерностей с in vitro на in vivo как при радиационном, так и при химическом мутагенезе. Предстоит расшифровка «вмешательства» процессов биотрансформации ксенобиотиков в эффекты мутагенеза. Экстраполяции мутационных последствий с соматических на зародышевые клетки еще не разработаны, в том числе не оценены барьерные функции семенников и яичников для химических мутагенов.
Наследственная изменчивость не ограничивается только мутационной изменчивостью. Новые исследования в области генетики человека показывают, что есть еще индуцированные факторами окружающей среды эпигенетические процессы (Dolinoy D.C., Jirtle R.L., 2008). Вся суть учения о мутационном процессе и генетическом грузе приобретает новое звучание.
ЗАКОНОМЕРНОСТИ МУТАЦИОННОГО ПРОЦЕССА В СОМАТИЧЕСКИХ КЛЕТКАХ
Общие положения
О наличии мутагенеза в соматических клетках известно с начала развития генетики как научной дисциплины. Описано явление мозаицизма у многочисленных видов растений и животных, которое является следствием мутаций в соматических клетках. В последние 15-20 лет уделяется большое внимание мозаичным формам наследственных болезней, роли мутаций в соматических клетках в канцерогенезе, иммунодефицитных состояниях, старении, лучевой болезни и других патологических состояниях (Бочков Н.П. и др., 2011). Серьезная значимость мутагенеза в соматических клетках определила выделение группы наследственных болезней, названных «приобретенные наследственные болезни» (McKusick, 2006).
Спонтанный мутагенез
Количественная оценка спонтанного уровня генных мутаций в соматических клетках in vivo изучена еще недостаточно, хотя эти данные важны для прогнозирования потери гетерозиготности в клетках по онкогенам и развития опухолей, а также для выяснения связи соматических мутаций с нормальными и патологическими процессами в организме. Имеются данные по оценке спонтанного уровня мутаций в двух локусах: гипоксантинфосфорибозил-трансферазы (лимфоциты) и гликофорин А (эритроциты). Средняя частота мутаций равна 2-4×10-6. На первый взгляд, это не очень высокая частота, но исходя из огромного количества соматических клеток и примерно 20 тыс. генов в каждой клетке, нетрудно представить весь объем соматической наследственной изменчивости. Таким образом, в организме постоянно поддерживается высокий уровень изменчивости, а мутантные клетки или погибают путем апоптоза, или успешно размножаются, или просто выключаются из функции органа.
Экспериментальные данные на культурах клеток показывают, что спонтанная частота, или базовый уровень генных мутаций, составляет 1×10-4-10-5 клеток, т.е. выше, чем in vivo, что можно объяснить «стрессом » на условия культивирования.
Закономерностям и количественной оценке мутагенеза в соматических клетках посвящено большое количество работ (Бочков Н.П. и др., 2001; Srám R.J. et al., 1998; Anderson D., 2010), главным образом по учету хромосомных аберраций в культуре лимфоцитов периферической крови. Помимо этого показателя, об интенсивности хромосомного мутагенеза можно судить по частоте сестринских хроматидных обменов и микроядер, хотя последние являются суммарным показателем хромосомных (ацентрические фрагменты) и геномных (отставшие хромосомы) мутаций.
В результате методически сходных исследований, включающих цитогенетический анализ сотен тысяч метафаз, установлено, что уровень спонтанного мутирования человека, выражаемый через число клеток с хромосомными аберрациями, составляет 1-3% и не зависит от половой принадлежности. При этом спектр хромосомных аберраций преимущественно представлен одиночными, реже парными, фрагментами хромосом. Аберрации обменного типа чрезвычайно редки и, как правило, свидетельствуют о воздействии каких-то неучтенных мутагенных факторов. Иногда встречающиеся в литературе оценки, превышающие указанные показатели, могут быть объяснены особенностями культивирования клеток, малым объемом экспериментальных выборок или недостаточно строгим отбором добровольцев, вовлекаемых в исследование. В пользу этого свидетельствуют данные об изменении спонтанного выхода клеток с хромосомными аберрациями в зависимости от витаминной обеспеченности доноров и состава культуральных сред.
Анализ большой базы данных, полученных на протяжении 30 лет (1,2 тыс. человек, 330 тыс. клеток) показал, что спонтанный уровень колеблется в зависимости от времени года, а его частота снижается и повышается в периоды изменений магнитного поля Земли с периодом 4,5 года (Бочков Н.П. и др., 2001; Чеботарев А.Н. и др., 2002). За последний 20-летний период спонтанный уровень хромосомных аберраций в г. Москве увеличился в два раза, что можно объяснить ухудшением экологической обстановки.
В костном мозге частота хромосомных аберраций составляет 1,5%. Можно полагать, что хромосомная изменчивость в лимфоцитах и клетках костного мозга, а возможно, и в других клетках, примерно одинакова.
Оценки сестринских хроматидных обменов (СХО), полученные разными авторами в разные годы (1970-2000 гг.), составляют 7-8 обменов на 1 клетку в контрольных культурах лимфоцитов периферической крови (Дурнев А.Д., Середенин С.Б., 1998, Landi S. et al., 2000).
Таким образом, обобщая вышесказанное, можно заключить, что уровень спонтанного мутирования в соматических клетках является достаточно консервативным показателем, колеблющимся в незначительных пределах. На это указывают данные цитогенетических исследований, проводимых в разных странах в течение последних 50 лет: частота лимфоцитов периферической крови человека с нестабильными аберрациями хромосом лежит в пределах 1-3%, микроядер 3,6-7 на 1 тыс. клеток и СХО примерно 7-8 на клетку.
Особый интерес представляет исследование зависимости спонтанного мутирования от возраста, что связано как с необходимостью методической оптимизации эпидемиологических цитогенетических исследований, так и дальнейшим развитием фундаментальных представлений о причинах и механизмах старения (мутационная теория старения). Одни авторы указывают, что в детском и юношеском возрасте частота аберраций значительно ниже, чем у взрослых (Merlo D.F. et al., 2007), другие не находят принципиальных различий в частоте выхода клеток с хромосомными аберрациями у молодых, взрослых или пожилых пациентов (Бочков Н.П. и др., 2001). Анализ данного вопроса затрудняется тем, что возраст - это не только физиологическое состояние организма, но еще и стиль жизни: вредные привычки, диета, место жительства, стрессогенные нагрузки, сопутствующие заболевания и еще ряд факторов, которые, по экспериментальным данным, могут отражаться на уровне спонтанного мутирования. Если пренебречь этими факторами, тогда увеличение спонтанного мутирования при старении выглядит очевидным и подтверждается не только учетом нестабильных хромосомных аберраций, но также транслокаций сестринских хроматидных обменов, микроядер, анеуплоидий, мутаций по устойчивости к 6-тиогуанину и гипоксантину, разрывов ДНК и может быть объяснено общим падением адаптационных возможностей организма, в частности снижением ДНК-репарирующей способности клеток.
Спонтанная частота геномных мутаций в соматических клетках (полиплоидии, анеуплоидии) изучалась меньше, чем хромосомных мутаций. Обусловлено это тем, что метод кариотипирования для учета геномных мутаций имеет большие методические недостатки. В процессе приготовления цитогенетических препаратов происходит разброс хромосом, ведущий к искусственно вызванной моносомии. В последнее время для учета анеуплоидии стали использовать FISH-метод применительно к интерфазным клеткам. Эта достаточно строгая методика позволяет избегать ошибок.
Работы, выполненные на лимфоцитах периферической крови, культурах стволовых клеток из костного мозга и жировой ткани, показывают, что частота анеуплоидных клеток по каждой хромосоме составляет 1-2%. Следовательно, общая частота анеуплоидии по всем хромосомам составляет 25-40% клеток. Большая часть анеуплоидных клеток погибает при делении, потому что повышение частоты анеуплоидии в ряду клеточных поколений не отмечается. В характеристике спонтанного мутагенеза на геномном уровне больше вопросов, чем ответов. Например, нет ответа на вопросы: одинакова ли частота нерасхождения и отставания разных хромосом; какова частота геномных мутаций у людей разного возраста и пола; зависит ли частота анеуплоидии от типа клеток, и т.п.
В заключение настоящего раздела следует отметить, что изучение спонтанного уровня мутирования является одним из фундаментальных направлений генотоксикологических исследований, необходимость которых определяется потребностью реальных представлений о спонтанном мутагенезе и факторах, приводящих к его вариабельности. Без их учета невозможны экстраполяция результатов, полученных при экспериментальной оценке генотоксичности ксенобиотиков в модельных тест-системах, и генетический мониторинг человеческих популяций.
Индуцированный мутагенез
Индуцированный мутагенез является предметом интенсивных исследований с 20-х годов ХХ в. В целом его изучение в соматических клетках относилось к трем главным направлениям в генетике: как модели для изучения организации генома; как модели изучения индуцированного мутагенеза в зародышевых клетках; как индикатора генетических эффектов факторов окружающей среды. Последнее из названных направлений будет подробно разобрано в данной главе.
Индуцированный мутагенез - это универсальное явление или всеобщее свойство живых организмов, которые отличаются только видовыми характеристиками чувствительности к факторам, усиливающим мутагенез. Живых существ, абсолютно толерантных к мутационной индукции, среди эукариот не обнаружено.
ОБЩИЕ ЗАКОНОМЕРНОСТИ ИНДУЦИРОВАННОГО МУТАГЕНЕЗА
Закономерности индуцированного мутагенеза на генном уровне в соматических клетках изучались мало, и никаких обобщений по этому вопросу сделать нельзя.
Основное внимание к закономерностям индуцированного мутагенеза было проявлено на хромосомном уровне при радиационных и химических воздействиях.
Основные параметры индуцированного мутагенеза следующие: доза-эффект (мощность дозы или фракционирование для ионизирующих излучений), время- эффект, время после воздействия, специфичность мутагена, комбинированное действие, межиндивидуальные вариации.
Доза-эффект. Кривые доза-эффект получены в многочисленных экспериментах с радиационными источниками и химическими мутагенами in vitro (разные культуры) и in vivo (лимфоциты). Хотя характер кривых и количественные закономерности радиационного мутагенеза отличаются друг от друга у разных авторов, все же основные выводы не вызывают сомнений. Частота хромосомных аберраций возрастает с увеличением дозы облучения или химического мутагена. Эта закономерность проявляется in vitro и in vivo. Характер дозовых зависимостей для разных типов аберраций не одинаков: количество фрагментов возрастает по линейной зависимости, а остальные аберрации - нелинейно. Количество разрывов хромосом, индуцируемых на единицу дозы мутагена, неодинаково при разных дозах. Из-за большого разнообразия химических соединений количественные закономерности индукции хромосомных аберраций чрезвычайно многообразны. Действие химических веществ осуществляется не только при прямом взаимодействии со структурными компонентами хромосом, но и при влиянии их на клеточный метаболизм или эффективность репарации повреждений. Закономерность «доза или концентрация-эффект» во всех случаях сохраняется. На эффективность действия химических мутагенов при одной и той же концентрации влияет температура.
Время-эффект (мощность дозы) и время после воздействия. Частота хромосомных аберраций зависит от мощности дозы облучения клеток. При уменьшении мощности дозы облучения или ее фракционирования снижается двухударный компонент хромосомных аберраций. Влияние мощности дозы проявляется в уменьшении аддитивного эффекта на 20-30%. Хроническое облучение менее эффективно, чем острое, что объясняется репарационными процессами. Что касается химических мутагенов, то, безусловно, длительность воздействия влияет на цитогенетический эффект. Концентрация и время экспозиции определяют дозу воздействия химических мутагенов. Характер экспозиционных зависимостей во многом обусловлен типом мутагена.
Значение отсроченности в реализации мутагенного воздействия не вызывает сомнений. Однако «следы» индуцированного мутагенеза сохраняются, и поэтому различают даже такие формы, как трансмиссивный, отсроченный и задержанный мутагенез в соматических клетках, определяемый нестабильностью генома.
Специфичность мутагенных факторов и эффект. Эта закономерность выявлена и для радиационного, и для химического мутагенеза. Частота и характер хромосомных аберраций зависят от типа ионизирующих излучений (α-, β-, γ-излучения, нейтроны). Быстрые нейтроны наиболее эффективны в отношении индукции хромосомных аберраций. Существует количественная и качественная специфика действия химических мутагенов. Вещества, содержащие несколько активных (алкилирующих) групп, более эффективны, чем монофункциональные соединения. По типу образуемых хромосомных аберраций, дозовым зависимостям, типу распределения аберраций по клеткам химические мутагены можно подразделить на два класса: одноцентровые и многоцентровые. В первом случае все активные группы присоединены к одному атому молекулы, во втором - они находятся в разных местах молекулы.
Комбинированное действие мутагенов. Совместное действие разных мутагенов может в принципе давать аддитивный (суммированный), синергичный (усиливающий) и антагонистичный (ослабляющий) эффект. Основной вывод по этому вопросу следующий: радиация и истинные химические мутагены, а также разные химические мутагены обладают аддитивным эффектом в реальных дозах экспозиции. Это правило не является абсолютным, потому что имеются вещества - модификаторы мутагенеза - антимутагены и комутагены (о данных веществах будет рассказано ниже).
Индивидуальные колебания индуцированного уровня хромосомных аберраций. Индивидуальные вариации частоты хромосомных аберраций при радиационных воздействиях имеют место, но они нечасто встречаются и нерезко выражены. Скорее, они обусловлены генетическими вариациями репаративных процессов. В химическом мутагенезе вариации выражены значительнее. Колебания химически индуцированного мутагенеза обусловлены не только вариациями репаративных процессов, но и генетически детерминированными процессами биотрансформации ксенобиотиков (мутагенов). Описаны протективные и предрасполагающие сочетания аллелей ряда генов для спонтанного и химически индуцированного мутагенеза.
Значение индуцированного мутагенеза в подверженности болезням. Мутагены могут вести к плохо репарируемым повреждениям ДНК и вызывать различные типы мутаций, экспрессия которых в клетке ведет к новым характеристикам клеточного фенотипа и, следовательно, к ранней или прогрессивно развивающейся патологии. Это справедливо для хронических дегенеративных болезней (рак, сердечно-сосудистые болезни, диабет). Мутагенез может также ускорять негативные эффекты процессов старения или повышать вероятность возникновения болезней, которые ассоциированы с преждевременным старением и возрастной патологией, например болезни Альцгеймера.
Основные сведения о медицинской значимости мутагенеза представлены в табл. 7-5.
Таблица 7-5. Медицинские и биологические последствия мутагенеза
Канцерогенез. Имеются доказательства, что мутации играют ключевую роль в канцерогенезе. Инициация опухоли начинается с точковых мутаций в соматических клетках. Более поздние стадии развития рака основываются на таких процессах, как быстрая пролиферация клеток, амплификация генов, хромосомные перестройки. Важны также эпигенетические изменения, включая метилирование ДНК, модификацию гистонов, микро-РНК.
На рис. 7-2 представлено развитие генерализованного рака и атеросклероза с ключевыми точками взаимодействия генотоксичных химических веществ. Мутационные исследования традиционно фокусируются на ДНК-реактивных канцерогенах, которые взаимодействуют с ДНК в связи с метаболической активацией. Однако важна также роль не только активных соединений, непосредственно повреждающих ДНК, но и патологических процессов (хронического воспаления). Как возможный потенциальный альтернативный источник образования активных соединений идентифицирована и третья группа мутагенов, ингибирующая топоизомеразу II, чей первичный мутагенный эффект проявляется на хромосомном уровне.
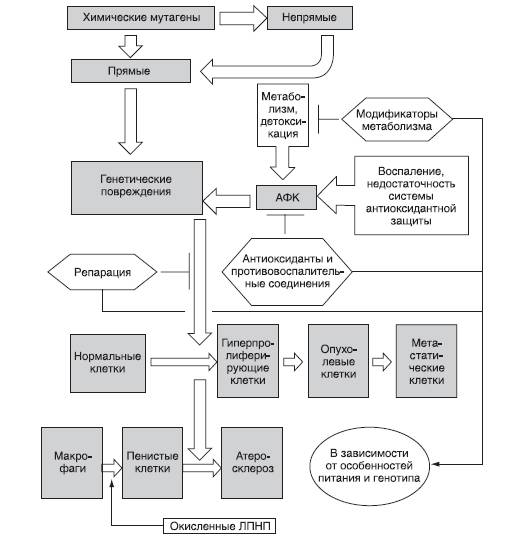
Рис. 7-2. Роль генотоксикантов в канцерогенезе и атерогенезе (АФК - активные формы кислорода, ЛПНП - липопротеиды низкой плотности)
Сердечно-сосудистые заболевания. Некоторые атеросклеротические бляшки имеют моноклональное происхождение. Предположительно соматические мутации играют роль на ранних стадиях атеросклероза. ДНК-аддукты, окислительные повреждения ДНК и другие типы генетических повреждений обнаруживаются в атеросклеротических бляшках, а именно - потеря гетерозиготности, микросателлитная нестабильность, варьирующее число повторов, структурные хромосомные изменения.
МОДИФИКАЦИЯ И ПРОФИЛАКТИКА МУТАГЕНЕЗА
Общие положения
Исходя из реальной отрицательной значимости индуцированного мутагенеза, возникает вопрос о его профилактике, которую логично проводить на основе широкого генетического скрининга, направленного на выявление мутагенов и предотвращение их контакта с людьми. Однако, несмотря на все усилия, предпринимаемые в этом направлении, не менее 10% населения систематически контактируют с промышленными мутагенами. Мутагены широко представлены среди экотоксикантов, пищевых контаминантов и лекарств некоторых групп, они возникают при термической обработке пищи, сгорании табака, углеводородов, являются естетвенными метаболитами ряда растений и образуются в организме человека.
Таким образом, строить профилактику индуцированного мутагенеза только на основе генетического скрининга недостаточно. В этой связи внимание привлекает явление модификации индуцированного мутагенеза, которое может выражаться в усилении (комутагенная модификация) или ослаблении (антимутагенная модификация) эффектов мутагенов.
Индукция мутаций - многоэтапный процесс, составляющими которого являются поступление, распределение, биотрансформация и выведение ксенобиотика, его накопление в клетках-мишенях, взаимодействие с ДНК, действие репарационных и других защитных систем. Очевидно, что влиянием на любой из перечисленных этапов становления мутаций можно модифицировать действие мутагена.
Каждое звено становления мутаций может рассматриваться как биологическая мишень для модификации мутагенеза, что выводит исследования в этой сфере за рамки эмпирических подходов, позволяет вести направленный поиск и изучение модификаторов мутагенеза. Важно, что одно и то же соединение может оказывать воздействие не на одну, а сразу на несколько мишеней и разнонаправленно модифицировать мутагенные эффекты, в одних случаях проявляя антимутагенные, в других комутагенные свойства. Последние типичны для многих природных и синтетических антиоксидантов, особенно фенольных производных.
Многие мутагены реализуют повреждающее действие через индукцию окислительного стресса и связанного с ним образования эндогенных мутагенов: свободных радикалов, перекисей, альдегидов. В этом случае мутагенез может быть модифицирован влиянием на эффективность антиоксидантной защиты.
Имеется два бесспорных классификационных термина, отражающих возможную разнонаправленность модификации мутагенеза, - антимутаген и комутаген, соответственно вещества, ослабляющие и усиливающие генотоксическое действие мутагенов. Соединения, обладающие собственным мутагенным потенциалом, не могут рассматриваться как модификаторы мутагенеза. Все варианты их взаимодействия с другими мутагенами удовлетворительно описываются в рамках общебиологических представлений о синергизме, аддитивности или антагонизме действия биологически активных веществ.
Комутагенез
Комутагенез - увеличение повреждающего действия заведомых мутагенов под действием немутагенных соединений. Комутагены не обладают собственной мутагенной активностью, поэтому беспрепятственно проникают через сито генетического скрининга, но могут играть существенную роль в увеличении популяционного генетического груза, усиливая эффекты слабых средовых мутагенов. Работ по выявлению возможных комутагенов немного, тем не менее можно уверенно указать на комутагенную активность фенольных и полифенольных соединений синтетического и природного происхождения, а также некоторых других антиоксидантов. Пищевым комутагеном является краситель «желтый солнечный закат» (E 110), широко распространенный в безалкогольных напитках. Показаны комутагенные эффекты некоторых красных вин, что, вероятно, связано с высоким содержанием в их составе полифенольных соединений. Имеются сообщения о комутагенных эффектах кофеина и ванилина. Продемонстрирована повышенная чувствительность клеток крови здоровых доноров, принимавших витаминные комплексы определенного количественного и качественного состава, к действию ряда мутагенов (Voronina E.S. et al., 2008; Durnev A.D. et al., 2009).
Среди фармакологических средств комутагенная активность в экспериментах на млекопитающих установлена у гипотензивных средств - представителей всех трех известных химических групп блокаторов кальциевых каналов.
Антимутагенез
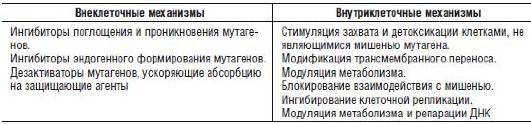
Антимутагенная модификация мутагенеза рассматривается как биологическая основа защиты наследственности человека. Механизмы антимутагенеза очень разнообразны. Их основные варианты представлены в табл. 7-6.
Таблица 7-6. Механизмы антимутагенеза
В настоящее время опубликованы сведения о нескольких сотнях соединений, проявивших антимутагенную активность в экспериментальных условиях. Однако многие из них основаны на результатах, полученных в экспериментах на микроорганизмах, дрожжах и насекомых, что затрудняет экстраполяцию на высших животных и человека.
Современные исследования в области антимутагенеза развиваются в двух направлениях: фармакологическом и нутрициологическом.
Фармакологические исследования направлены на поиски путей купирования эффектов соединений, в первую очередь лекарств, обладающих заведомой мутагенной активностью, но применяемых в силу медицинской необходимости, а также для купирования аномально высокого уровня мутирования, наблюдающегося при некоторых заболеваниях и у людей с вредными привычками.
Эти работы базируются на детальном изучении механизмов мутагенного действия и предполагают создание специфических фармакологических корректоров мутагенеза.
По своим задачам разработка корректора мутагенеза принципиально не отличается от разработки любого фармакологического средства на основе синтетического или природного соединения. Предполагаемый корректор не только должен обладать высокой специфической антимутагенной активностью к избранному мутагену или группе мутагенов, обладающих сходными механизмами повреждающего действия, но также отвечать всем требованиям, предъявляемым к безопасности лекарственных средств. Правильно сконструированный фармакологический антимутаген способен полностью устранять эффект мутагена.
В ряде работ установлены и всесторонне исследованы in vivo антимутагенные свойства ряда лекарств и лекарств-кандидатов. Особенно перспективным в качестве фармакологического антимутагена является отечественный анксиолитик афобазол♠, проявивший защитные свойства в широком диапазоне доз, а также в разных тканях по отношению к широкому кругу химических мутагенов.
Основываясь на изучении механизма действия мутагена, профилей фармакокинетики и распределения мутагена, а также возможных модификаторов его эффектов, можно добиться полного устранения мутагенного эффекта. Особое значение этот подход имеет для коррекции мутагенных эффектов незаменимых лекарств.
Так, этилтиобензимидазол (бемитил) полностью устраняет мутагенный эффект диоксидина♠ без влияния на эффективность этого антимикробного лекарства.
Нутрициологическое направление ведет поиски путей увеличения устойчивости к мутагенным воздействиям за счет использования пищевых веществ или продуктов. Наиболее ярким примером исследований в этом направлении является изучение роли эссенциальных нутриентов в формировании устойчивости к мутагенным воздействиям. В частности, в наших исследованиях было показано, что некоторые витаминно-минеральные комплексы определенного количественного и качественного состава могут значимо увеличивать устойчивость клеток человека ex vivo к цитогенетическим воздействиям разных химических мутагенов, добавляемых in vitro (Voronina E.S. et al., 2008; Durnev A.D. et al., 2009).
Большой интерес вызывают работы, направленные на создание антимутагенных функциональных продуктов и биологически активных добавок. Их развитие базируется на широком скрининге антимутагенных свойств пищевых соединений. В наших исследованиях на млекопитающих антимутагенные свойства были выявлены у каротиноидных и антоциановых красителей, подсластителя аспартама, природных метаболитов (убихинона, бетаина, липидовита, экстракта древесины дуба, экстракта березовой коры, байколинатов) и ряда других. На их основе были разработаны и успешно апробированы ряд антимутагенных функциональных продуктов и биологически активных добавок.
Большинство известных антимутагенов относится к растительным пищевым веществам, но антимутагенные свойства выявлены также у некоторых синтетических пищевых соединений, например у подсластителя аспартама. Как правило, эффективность пищевых антимутагенов относительно невысока. Под их влиянием эффекты тех или иных мутагенов снижаются не более чем на 25-40%. Кроме того, в пищевой биомассе антимутагенный эффект отдельных привнесенных пищевых соединений в большинстве случаев нивелируется, что создает дополнительные сложности при создании пищевых функциональных антимутагенных продуктов.
В целом проблема защиты генома с помощью фармакологических и нутрициологических антимутагенов далека от окончательного решения, несмотря на очевидные перспективы развития и первый положительный опыт их практического использования. Для подавляющего большинства известных антимутагенов не раскрыто их влияние на зародышевые клетки, не освещена проблема возможных комутагенных эффектов, особенно применительно к «вторичным» тканям, не разработаны подходы к индивидуальной и популяционной оценке антимутагенной профилактики негативных медицинских последствий мутагенеза. Кроме того, неясны этические и деонтологические вопросы назначения фармакологических антимутагенов и применения антимутагенных пищевых продуктов для профилактики вероятностных и отдаленных эффектов мутагенеза. Вместе с этим антимутагенная профилактика и предупреждение контакта человека с мутагенными и комутагенными веществами - это путь для реального ослабления мутагенной нагрузки на человека.
Заключение
Генетика человека прошла большой путь в оценке и понимании сущности мутационного процесса. В 20-30-х годах ХХ в. первоначальная постановка вопроса сводилась к доказательству наличия «свежих» мутаций в популяциях человека и разработке методов оценки частоты мутаций (Девенпорт Ч., Холдейн Дж., Меллер Г., Пенроуз Л.).
В 50-е годы ХХ в. Г. Меллер снова привлек внимание к грузу мутаций у человека в связи с повышением радиационного фона Земли. Открытие хромосомных болезней послужило новым толчком для изучения груза мутаций. Цитогенетические методы дали возможность изучать самым подробным образом интенсивность мутационного процесса на хромосомном и геномном уровнях.
К 70-м годам ХХ в. резко возросло внимание к изучению мутационного процесса в связи с пониманием серьезности последствий химического мутагенеза не только в зародышевых, но и в соматических клетках. Накопленный огромный материал позволяет сделать следующие выводы.
Мутагенез является универсальным и фундаментальным свойством всех живых организмов, включая человека. Мутации возникают в зародышевых и соматических клетках, на генном, хромосомном и геномном уровнях. Частота спонтанных мутаций в соматических клетках выше, чем в зародышевых клетках.
Мутагенез - многоэтапный процесс. Первым этапом является нарушение химической структуры ДНК. Предмутационные или первичные повреждения ДНК - это изменение нуклеотидной последовательности, химическая модификация азотистых оснований, образование аддуктов, разрывы цепей ДНК. Вторым этапом мутагенеза является высокоэффективная система репарации первичных повреждений. При этом либо восстанавливается целостность ДНК, либо первичное повреждение закрепляется в форме мутации.
Интенсивность мутагенеза существенно повышается под действием многих физических, химических и биологических факторов (индуцированный мутагенез). Изучены общие закономерности индуцированного мутагенеза: зависимость эффекта от дозы или концентрации, времени воздействия и послевоздействия, специфики мутагенного фактора, комбинированного действия мутагенов.
Проникновение к ДНК является необходимым условием мутагенеза только для ДНК-реактивных мутагенов, другие действуют опосредованно через индукцию образования эндогенных мутагенов (ДНК-нереактивные мутагены). Большинство мутагенов имеют смешанный характер действия и реализуют оба механизма. Доминирующий механизм может меняться от дозы, пути поступления и др.
Интенсивность спонтанного и индуцированного мутагенеза зависит от генотипических особенностей организма, определяющих активность репарационных систем и биотрансформацию ксенобиотиков-мутагенов.
Мутагены «наводняют» среду обитания человека. Известно более тысячи доказанных на клетках человека химических мутагенов. Они встречаются в пище, лекарствах, производственных факторах, коммунальной среде, атмосфере городов, воде.
Индуцированный мутагенез может быть модифицирован как в сторону уменьшения (антимутагенез), так и в сторону увеличения (комутагенез) под действием лекарственных и пищевых факторов.
Медицинская значимость мутагенеза определяется ведущей ролью индуцированных мутаций в увеличении генетического груза, уровней врожденных пороков развития, наследственных, онкологических и сложно наследуемых заболеваний, снижении общей приспособленности человека.
Среда обитания человека постоянно меняется. С коммерческими целями только в западных странах производится ежегодно около 60 тыс. видов химических веществ. Общее их производство из года в год экспоненциально увеличивается, составляя миллиарды тонн. Не вызывает сомнений, что многие факторы нашей среды являются потенциальными мутагенами. Это широкий спектр естественных и синтетических химических веществ в воздухе, которым мы дышим, в воде, которую мы пьем, в пище, которую мы едим, на рабочем месте, где мы работаем, в больнице, где мы лечимся, в коммунальной среде, где мы живем.
Наш груз мутаций складывался десятками тысячелетий. Все, что человечество накопило в популяциях, - это наше прошлое. С ним мы живем в настоящем. С генетической точки зрения мы живем в резко меняющихся условиях, повышающих мутационный процесс. Одним из существенных факторов динамики генетического груза является индуцированный мутагенез, которым можно управлять. От этого зависит будущее груза мутаций в популяциях человека.
В проблеме «груз мутаций» как в фокусе концентрируются наиболее важные теоретические и прикладные проблемы генетики человека. Чем точнее они будут решаться, тем меньше для общества будет весить этот груз.
Феноменальные успехи в молекулярной биологии в последние несколько десятилетий существенно увеличили список новых технологий и подходов, основанных на реализации проекта генома человека. Во всех областях биомедицинских исследований сделан огромный рывок, и генетическая токсикология - не исключение.
Две главные задачи генотоксикологии на сегодняшний день:
Анализ литературы по мутагенезу в историческом аспекте высвечивает факт, что стержневые экспериментальные протоколы в генотоксикологии оставались неизменными более 40 лет, а генетика в этот период преобразовалась. Следовательно, тестирование веществ на вредные эффекты для человека и окружающей среды необходимо пересмотреть с учетом современных генетических технологий, поскольку речь идет об охране здоровья и генетической безопасности человечества в XXI веке.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Бочков Н.П., Аклеев А.В., Балева Л.С. Генетические последствия Челябинских и Чернобыльских радиоактивных загрязнений // Вестн. РАМН. - 1996. - № 6. - С. 64-72.
Бочков Н.П., Пузырев В.П., Смирнихина С.А. Клиническая генетика. 4-е изд. - М.: ГЭОТАР-Медиа, 2011. - 554 с.
Бочков Н.П., Чеботарев А.Н. Наследственность человека и мутагены внешней среды. - М.: Медицина, 1989. - 272 с.
Бочков Н.П., Чеботарев А.Н., Катосова Л.Д. и др. База данных для анализа количественных характеристик частоты хромосомных аберраций в культуре лимфоцитов периферической крови человека // Генетика. - 2001. - Т. 37, № 4. - С. 549-559.
Дуброва Ю.Е. Нестабильность генома среди потомков облученных родителей. Факты и их интерпретация // Генетика. - 2006. - Т. 42, № 10. - С. 1335-1347.
Дурнев А.Д. Токсикология наночастиц // Бюл. экспер. биол. и мед. - 2008. - Т. 145, № 1. - С. 78-80.
Дурнев А.Д., Середенин С.Б. Мутагены: скрининг и фармакологическая профилактика воздействий. - М.: Медицина, 1998. - 328 с.
Дурнев А.Д., Середенин С.Б. Комутагенез - новое направление исследований в генотоксикологии // Бюл. экспер. биол. и мед. - 2003. - Т. 135, № 6. - С. 604-612.
Дурнев А.Д., Сиднева Е.С., Жанатаев А.К. и др. Защитное действие витаминов при индуцированном мутагенезе // Вестн. РАМН. - 2007. - № 7. - С. 6-13.
Ижевский П.В. Генетические последствия облучения // Мед. генетика. - 2006. - № 3(45). - С. 3-12.
Чеботарев А.Н., Бочков Н.П., Ораевский В.Н. и др. Влияние изменения магнитного поля Земли на частоту спонтанных хромосомных аберраций в соматических клетках человека // Докл. РАН. - 2002. - Т. 384, № 4. - С. 566-568.
Altieri F., Grillo C., Maceroni M., Chichiarelli S. Antioxid DNA damage and repair: from molecular mechanisms to health implications // Redox Signal. - 2008. - Vol. 10(5). - P. 891-937.
Anderson D. A European perspective on the role of EMS societies. How do they help public health and research and the development of regulations? // Environ. Mol. Mutagen. - 2010. - May 5.
Andreassi M.G., Botto N. Genetic instability, DNA damage and atherosclerosis // Cell Cycle. - 2003. - Vol. 2(3). - P. 224-227.
Dolinoy D.C., Jirtle R.L. Environmental epigenomics in human health and disease // Environ. Mol. Mutagen. - 2008. - Vol. 49(1). - P. 4-8.
Eckert K.A., Hile S.E. Every microsatellite is different: Intrinsic DNA features dictate mutagenesis of common microsatellites present in the human genome // Mol. Carcinog. - 2009. - Vol. 48(4). - P. 379-388.
Elespuru R.K., Sankaranarayanan K. New approaches to assessing the effects of mutagenic agents on the integrity of the human genome // Mutat. Res. - 2007. - Vol. 616. - P. 83-89.
Ellegren H., Smith N.G., Webster M.T. Mutation rate variation in the mammalian genome // Curr. Opin. Genet. Dev. - 2003. - Vol. 13(6). - P. 562-568.
Ferguson L.R., Philpott M. Nutrition and mutagenesis // Annu. Rev. Nutr. - 2008. - Vol. 28. - P. 313-329.
Kocsis A., Molnar H. Genotoxicity: Evaluation, Testing and Prediction. - New York: Nova Science Publishers, 2009. - P. 157-187.
Landi S., Iazzolino E., Barale R. Are baseline frequencies of SCEs, CAs, and MN in human lymphocytes related to hematological values? // Mutat. Res. - 2000. - Vol. 469(1). - P. 159-166.
McKusick V.A. A 60-year tale of spots, maps, and genes // Annu. Rev. Genomics Hum. Genet. - 2006. - Vol. 7. - P. 1-27.
Merlo D.F., Ceppi M., Stagi E. еt al. Baseline chromosome aberrations in children // Toxicol. Lett. - 2007. - Jul. 30. - P. 60-67.
Neel J.V., Schull W.J., Awa A.A. еt al. The children of parents exposed to atomic bombs: estimates of the genetic doubling dose of radiation for humans // Am. J. Hum. Genet. - 1990. - Vol. 46(6). - P. 1053-1072.
Peltonen L., McKusick V.A. Genomics and medicine. Dissecting human disease in the postgenomic era // Science. - 2001. - Vol. 291(5507). - P. 1224-1229.
Schärer O.D. Chemistry and biology of DNA repair // Angew. Chem. Int. Ed. Engl. - 2003. - Vol. 42. - P. 2946-2974.
Srám R.J., Rössner P., Peltonen K. et al. Chromosomal aberrations, sister-chromatid exchanges, cells with high frequency of SCE, micronuclei and comet assay parameters in 1,3-butadieneexposed workers // Mutat. Res. - 1998. - Vol. 419(1-3). - P. 145-154.
Yoshida T. Micronutrients and Health Research. - New York: Nova Science Publishers, 2008. - P. 279-291.