Наследственные болезни : национальное руководство / Под ред. Н. П. Бочкова, Е. К. Гинтера, В. П. Пузырева - Москва : ГЭОТАР-Медиа, 2012. - 936 с. (Серия "Национальные руководства") - ISBN 978-5-9704-2231-1 |
Аннотация
Национальные руководства - первая в России серия практических руководств по основным медицинским специальностям, включающих всю основную информацию, необходимую врачу для непрерывного последипломного образования.
Национальное руководство "Наследственные болезни" содержит актуальную, современную информацию о геноме человека, общих вопросах медицинской генетики, клинической генетике. Руководство состоит из двух частей, в которых излагаются теоретические и клинические вопросы медицинской генетики. В первой части представлены новейшие данные по теоретическим вопросам медицинской генетики. Сведения об организации и функциях генома, генов и хромосом изложены в понятной для врачей форме, но без излишнего упрощения. Во второй части представлены вопросы клинической генетики, а именно методы диагностики наследственных болезней (от клинического уровня до секвенирования ДНК и РНК), принципов лечения и профилактики отдельных нозологических форм. Поскольку в национальных руководствах по другим специальностям описаны многочисленные наследственные болезни, на них можно найти ссылки [см. "Перечень наследственных болезней (синдромов), описание которых представлено в других национальных руководствах" на компакт-диске]. Приложение к руководству на компакт-диске включает более полную информацию по некоторым главам, электронную версию руководства, обширный иллюстративный материал, приложения, перечень наследственных болезней, описанных в других руководствах, фармакологический справочник. В подготовке настоящего издания в качестве авторов-составителей и рецензентов принимали участие ведущие ученые разных специальностей: генетики, иммунологи, невропатологи, фармакологи, онкологи и другие специалисты. Все рекомендации прошли этап независимого рецензирования.
Руководство предназначено для врачей-генетиков, врачей лаборантов-генетиков, врачей смежных специальностей, интернов, ординаторов, аспирантов, особенно по таким дисциплинам, как педиатрия, акушерство-гинекология, нервные болезни.
Гриф
Национальное руководство рекомендовано Российским обществом медицинских генетиков и Ассоциацией медицинских обществ по качеству
Глава 16. Биохимические и молекулярногенетические методы диагностики наследственных болезней
Несмотря на большие возможности клинической диагностики наследственных болезней, многие вопросы приходится решать с помощью биохимических и молекулярно-генетических методов. Широкий клинический полиморфизм наследственных болезней, частичное совпадение симптомов разных наследственных и ненаследственных заболеваний и необходимость обнаружения гетерозиготных носителей - все это требует использования биохимических или молекулярно-генетических методов диагностики, применение которых при наследственных нарушениях всегда более точно, чем использование клинических методов.
Хотя история применения биохимических методов диагностики наследственных болезней насчитывает около 100 лет, первая половина этого пути отмечена лишь единичными примерами диагностики отдельных болезней с использованием качественных биохимических исследований мочи. Их применение началось с диагностики алкаптонурии в начале XX в., что позволило А. Гарроду открыть наследственные болезни обмена веществ, обусловленные блоком ферментативной реакции. В 30-х годах была открыта простая реакция мочи с хлоридом железа (зеленая окраска) при фенилкетонурии.
Широкое применение лабораторных методов диагностики наследственных болезней началось в 50-х годах XX в. Это, вероятно, было связано не только с прогрессом клинической биохимии, но и с повышением в этот период интереса к наследственным заболеваниям.
Генетика человека и медицинская генетика взяли на вооружение многочисленные методы лабораторных исследований (биохимические, молекулярно-биологические, иммунологические), что и обусловило формирование и интенсивное развитие клинической генетики как медицинской дисциплины.
Лабораторная диагностика наследственных болезней (феноили генотипирование индивидуумов) направлена на идентификацию одной из трех ступеней нарушения.
Установление этиологии наследственного заболевания или характеристика генотипа, т.е. определение конкретной мутации. Этих целей достигают с помощью цитогенетических или молекулярно-генетических методов.
Биохимические и иммунохимические методы позволяют регистрировать первичный продукт гена. Возможна регистрация специфических метаболитов, возникших в процессе патологического действия мутации.
Последнюю выполняют на уровне жидкостей (кровь, моча, секрет) или клеток, а следовательно, на этой ступени можно воспользоваться биохимическими и иммунологическими методами, что и нашло применение в клинической практике. Например, иммунологические исследования широко применяют для диагностики первичных (наследственных) иммунодефицитных состояний и антигенной несовместимости матери и плода, а биохимические - для диагностики наследственных болезней обмена веществ.
Молекулярно-генетические методы диагностики наследственных болезней стали внедрять в практику с 70-х годов XX в., и до настоящего времени они остаются активно развивающейся областью науки и медицины. Ежегодно происходит настолько существенное развитие технологий, что количественные улучшения приводят к качественному изменению методов (полимеразная цепная реакция → количественная полимеразная цепная реакция; секвенирование → параллельное секвенирование и др.). Молекулярно-генетические методы обязаны своим развитием Кери Мюллису - изобретателю полимеразной цепной реакции (1986), которая лежит в основе всех широко используемых в клинической диагностике молекулярно-генетических тестов. ПЦР - метод амплификации ДНК in vitro. За несколько часов можно размножить определенную последовательность ДНК в количестве, превышающем исходное в миллион раз и более, что позволяет работать с минимальным объемом исходного материала (вплоть до одной клетки). Амплифицированную ДНК затем анализируют с помощью различных методов.
Развиваясь в качестве самостоятельной группы методов, молекулярногенетическая диагностика обогатила и дополнила классическую цитогенетику, что привело к созданию молекулярно-цитогенетических методов.
Определенные взаимные проникновения есть и в области иммунологических и молекулярно-генетических методов. Благодаря беспрецедентно высокой чувствительности в настоящее время молекулярно-генетические и биохимические методы получили широкое распространение и заслуженное признание практически во всех областях медицины.
Биохимические методы
Биохимические показатели (первичный белковый продукт гена, накопление патологических метаболитов внутри клетки и во внеклеточных жидкостях) лучше отражают сущность болезни, чем клинические симптомы, не только в диагностическом, но и в генетическом аспекте. Значимость биохимических методов повышалась по мере их совершенствования (электрофорез, хроматография, спектроскопия и др.) и описания наследственных болезней. В 80-х годах ХХ в. был выделен целый раздел - наследственные болезни обмена веществ, т.е. заболевания с различными биохимическими нарушениями.
Биохимические методы направлены на определение биохимического фенотипа организма. Уровни, на которых оценивают фенотип, могут быть разными - от первичного продукта гена (полипептидной цепи) до конечных метаболитов в крови, моче или поте. Биохимические методы чрезвычайно многообразны, и их значение в диагностике наследственных болезней постоянно возрастает. Разработка молекулярно-генетических методов диагностики частично снизила интерес к биохимическим исследованиям, но вскоре стало ясно, что в большинстве случаев указанные методы дополняют друг друга, поскольку молекулярногенетически описывают генотип, а биохимически - фенотип. Болезнь в конечном счете - фенотип. В связи с этим, несмотря на сложность, а иногда и дороговизну биохимических методов, им принадлежит существенная роль в диагностике моногенных наследственных заболеваний. Современные высокоточные технологии (высокоэффективная жидкостная хроматография, хромато-масс-спектрометрия, газовая хроматография, тандемная спектрометрия) позволяют идентифицировать любые метаболиты, специфичные для конкретной наследственной болезни.
На первый взгляд может показаться, что самый точный метод диагностики - определение мутации на уровне ДНК. Тем не менее это не всегда так. Реализация действия гена - сложный процесс, поэтому нормальная структура гена, а точнее - отсутствие мутации, не всегда служит полной гарантией нормального биохимического фенотипа.
Принципы биохимической диагностики наследственных болезней менялись в процессе развития генетики человека и биохимии. Так, до 50-х годов XX в. диагностика была направлена на поиски специфичных для каждого заболевания метаболитов в моче (алкаптонурия, фенилкетонурия). С 50-х до 70-х годов упор в диагностике был сделан на обнаружение энзимопатий. Разумеется, поиски метаболитов в конечных реакциях при этом не исключались. Наконец, с 70-х годов главным объектом диагностики стали белки разных групп. К настоящему времени все они служат предметом биохимической диагностики.
Оценка метаболитов в биологических жидкостях - необходимый этап диагностики аминоацидопатий, органических ацидурий, мукополисахаридозов, митохондриальных и пероксисомных болезней, дефектов метаболизма пуринов и пиримидинов и др. Для этих целей используют методы качественного химического анализа, спектрофотометрические способы количественной оценки соединений, а также различные виды хроматографии.
Хроматографические методы анализа играют важнейшую роль в диагностике наследственных болезней обмена (НБО). Это обусловлено тем, что современный арсенал хроматографических технологий чрезвычайно широк и позволяет эффективно и информативно разделять сложные многокомпонентные смеси, к которым в том числе относят и биологический материал. Для количественного анализа маркеров-метаболитов НБО успешно применяют такие хроматографические методы, как газовая и высокоэффективная жидкостная хроматография (ВЭЖХ), а также хромато-масс-спектрометрия (ХМС). Газовая хроматография и ВЭЖХ - универсальные методы разделения сложных смесей соединений, отличающиеся высокой чувствительностью и воспроизводимостью. В обоих случаях разделение осуществляют в результате различного взаимодействия компонентов смеси с неподвижной и подвижной фазами хроматографической колонки. Для газовой хроматографии подвижной фазой служит газ-носитель, для ВЭЖХ - жидкость (элюент). Выход каждого соединения фиксирует детектор прибора, сигнал которого преобразуется в пики на хроматограмме. Каждый пик характеризуется временем удерживания и площадью. Следует отметить, что газовую хроматографию проводят, как правило, при высокотемпературном режиме, поэтому ограничением для ее применения считают термическую неустойчивость соединений. Для ВЭЖХ не существует подобных ограничений, так как в этом случае анализ проводят в мягких условиях.
Масс-спектрометрия - аналитический метод, с помощью которого можно получать как качественную (структура), так и количественную (молекулярная масса или концентрация) информацию об анализируемых молекулах после их преобразования в ионы. Существенное отличие масс-спектрометрии от других физико-химических аналитических методов состоит в том, что в масс-спектрометре определяют непосредственно массу молекул и их фрагментов. Результаты представляют графически (так называемый масс-спектр). Иногда невозможно анализировать сложные многокомпонентные смеси молекул без их предварительного разделения. Это можно сделать либо хроматографически (жидкостная или газовая хроматография), либо использовать два последовательно соединенных массспектрометра (тандемная масс-спектрометрия - ТМС). ТМС позволяет охарактеризовать структуру, молекулярную массу и провести количественную оценку 3000 соединений одновременно. При этом для проведения анализа длительная подготовка проб не требуется (как, например, для газовой хроматографии), а время исследования занимает несколько секунд. Нозологические формы НБО, которые можно диагностировать с использованием ТМС, представлены в табл. 16-1.
Таблица 16-1. Заболевания, диагностируемые с помощью тандемной масс-спектрометрии
| Аминоацидопатии | Органические ацидурии | Дефекты митохондриального β-окисления |
|---|---|---|
Лейциноз (болезнь с запахом мочи типа «кленового сиропа»); некетотическая гиперглицинемия; тирозинемия; гомоцистинурия; цитруллинемия; гиперорнитинемия; фенилкетонурия; недостаточность орнитинтранскарбамилазы; недостаточность аргиназы; синдром гиперорнитинемии- гипераммониемии- гомоцитруллинемии; недостаточность карбамоилфосфатсинтетазы; недостаточность аргининосукциназы; недостаточность аргининсукцинатлиазы |
Недостаточность биотинидазы; недостаточность синтетазы голокарбоксилаз; изовалериановая ацидурия; глутаровая ацидурия 1-го типа; глутаровая ацидурия 2-го типа; пропионовая ацидурия; метилмалоновая ацидурия |
Недостаточность среднецепочечной ацил-КоА-дегидрогеназы жирных кислот; недостаточность короткоцепочечной ацил-КоА-дегидрогеназы жирных кислот; недостаточность длинноцепочечной ацил-КоА-дегидрогеназы жирных кислот; первичная недостаточность карнитина; недостаточность карнитинпальмитоилтранслоказы 1; недостаточность карнитинпальмитоилтранслоказы 2; недостаточность β-оксотиолазы; недостаточность HMG-лиазы |
ТМС - одно из перспективных направлений в развитии программ диагностики НБО, поскольку позволяет количественно и в микроколичествах биологического материала определять множество метаболитов. В настоящее время в некоторых странах ТМС применяют для массового скрининга новорожденных на наследственные болезни.
В связи с многообразием биохимических методов, применяемых в лабораторной диагностике наследственных болезней, в их использовании должна быть определенная система. У пробанда или члена его семьи нереально исключить все наследственные болезни, которые могут попасть в поле зрения при обследовании пациента. Если применять максимально возможное число методов диагностики, то каждое обследование станет очень трудоемким и долгим. Исходную схему обследования строят на клинической картине болезни, генеалогических сведениях и биохимической стратегии, которые позволяют определить ход обследования на основе поэтапного исключения определенных классов наследственных болезней обмена (просеивающий метод).
Необходимо подчеркнуть, что, в отличие от цитогенетических и молекулярногенетических исследований, биохимические методы многоступенчаты. Для их проведения требуется аппаратура разных классов. Материалом для биохимической диагностики могут быть моча, пот, плазма и сыворотка крови, форменные элементы крови, культуры клеток (фибробласты, лимфоциты) и биоптаты мышц. При использовании просеивающего метода в биохимической диагностике можно выделить два уровня: первичный и уточняющий. Каждый из них может быть по-разному «нагружен» реакциями в зависимости от возможностей лаборатории.
Основная цель первичной диагностики заключается в том, чтобы обнаружить здоровых людей и отобрать пациентов для последующего уточнения диагноза. В программах первичной диагностики в качестве материала используют мочу и небольшое количество крови. Программы могут быть массовыми и селективными. Массовые просеивающие программы описаны в гл. 15.
Селективные диагностические программы предусматривают проверку биохимических аномалий обмена (моча, кровь) у пациентов с подозрением на генные наследственные болезни. Фактически они должны функционировать в каждой большой больнице. Показания для их применения достаточно широкие, а стоимость каждого анализа невысока.
В селективных программах можно использовать простые качественные реакции (например, тест с хлоридом железа для диагностики фенилкетонурии или с динитрофенилгидразином для обнаружения кетокислот) или более точные методы, позволяющие обнаруживать большие группы отклонений. Газовую хроматографию применяют для диагностики НБО органических кислот и ряда аминоацидопатий. С помощью электрофореза гемоглобинов диагностируют заболевания из группы гемоглобинопатий.
На рис. 16-1 представлены результаты биохимической диагностики метилмалоновой ацидурии. При патологических изменениях концентрация органических кислот мочи повышается в десятки раз по сравнению с нормой.
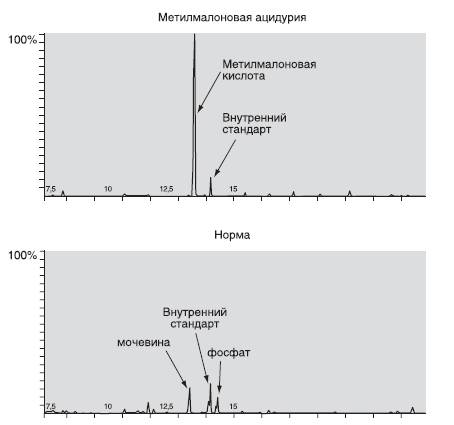
Рис. 16-1. Газовая хроматография: масс-спектрометрия образцов мочи в норме и при метилмалоновой ацидурии. По оси абсцисс - время удерживания (мин); по оси ординат - интенсивность сигнала (%)
Нередко приходится углублять биохимический анализ от количественного определения метаболита до измерения активности фермента (использование нативных тканей или культивированных клеток), например, с помощью спектрофлюориметрии или спектрометрии (в зависимости от применяемого субстрата). Следует отметить, что определение активности ферментов при наследственных заболеваниях - не рутинная процедура, проводимая только в специализированных лабораториях. В современных условиях очень многие этапы биохимической диагностики выполняют автоматически, в частности с помощью аминоанализаторов.
Селективные диагностические программы обеспечивают только предположительное обнаружение больных с НБО. Методы подтверждающей диагностики включают количественное определение метаболитов, исследование их кинетики, энзимо- и ДНК-диагностику (табл. 16-2).
Таблица 16-2. Методы подтверждающей диагностики
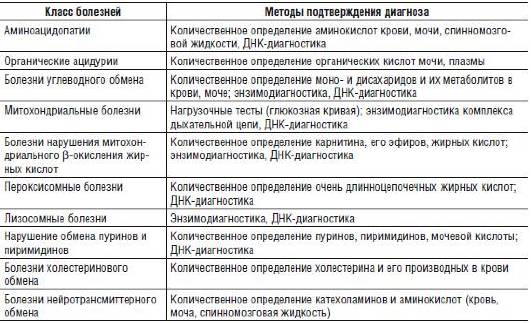
Как видно из табл. 16-2, методы подтверждения диагноза многообразны и специфичны для разных классов болезней.
Показания для применения биохимических методов диагностики у новорожденных: нарушения сознания, судороги, нарушения ритма дыхания, мышечная гипотония, нарушения вскармливания, желтуха, специфический запах мочи и пота, метаболический ацидоз с дефицитом оснований и гипогликемия. У детей более старшего возраста биохимические методы используют во всех случаях подозрения на НБО (задержка физического и умственного развития, потеря приобретенных функций, увеличение размеров внутренних органов), а также при клинической картине, специфичной для определенного заболевания.
Биохимические методы применяют для диагностики наследственных болезней и гетерозиготных состояний у взрослых (гепатолентикулярная дегенерация, недостаточность α1 -антитрипсина, недостаточность глюкозо-6-фосфатдегидрогеназы и др.). При диагностике многих болезней биохимические методы заменяют молекулярно-генетическими в связи с их большей точностью или экономичностью. Принципиально важным считают правильное сочетание тех и других методов.
Молекулярно-генетические методы
ПОКАЗАНИЯ К МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОМУ ТЕСТИРОВАНИЮ
До сих пор в диагностике наследственных заболеваний основную роль играют осмотр, сбор анамнеза и генеалогических данных. Многие формы наследственных нарушений можно быстро и надежно диагностировать с помощью молекулярногенетических методов. Их диагностические возможности позволяют не только уточнить диагноз и различить гено- и фенокопии, но и разобраться в других сложных случаях, проводить пресимптоматическую, пренатальную и неонатальную диагностику, организовывать программы просеивающей диагностики, а также определять носительство у родственников больных и оказывать помощь при планировании семьи.
При определении показаний для молекулярно-генетической диагностики наследственных заболеваний необходимо учитывать особенности этих тестов по сравнению с большинством широко распространенных в медицине лабораторных методов диагностики, которые обусловлены самой этиологией нарушений:
Эти особенности в сочетании с главной заповедью врача «не навреди» накладывают ряд ограничений на применение молекулярно-генетических тестов. Возможность установления диагноза задолго до возникновения первых признаков заболевания далеко не всегда благоприятно сказывается на здоровье, психологическом и социальном благополучии пациента. При некоторых тяжелых и неизлечимых наследственных заболеваниях (например, при хорее Гентингтона) знание пациентом своего диагноза может иметь ряд отрицательных последствий и сделать его жизнь невыносимой задолго до того, как разовьется клиническая картина.
Определение показаний к диагностическим тестам не ограничено техническими вопросами доступности биологического материала или инвазивностью процедуры. Дефекты ДНК отражены во всех ядросодержащих клетках организма, поэтому в большинстве случаев для анализа можно взять любую ткань или биологическую жидкость. Чаще всего в качестве образцов используют цельную кровь или пятна высохшей крови, слюну, буккальный соскоб, мочу, амниоциты или ворсинки хориона. Конкретные показания к назначению молекулярно-генетической диагностики указаны в подразделах этой главы.
ВИДЫ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОЙ ДИАГНОСТИКИ
Диагностическое тестирование Наиболее очевидное применение молекулярно-генетической диагностики - диагностическое тестирование, которое проводят у пациентов с признаками заболевания. В большинстве случаев оно требуется для подтверждения диагноза, хотя иногда необходимо для дифференциальной диагностики. Даже при назначении такого тестирования необходимо иметь в виду два обстоятельства, характерных только для наследственных заболеваний.
Тест чрезвычайно высокоспецифичен и не даст положительного ответа даже при очень сходном заболевании (например, ДНК-тестирование спиноцеребеллярной атаксии 1-го типа не позволит определить спиноцеребеллярную атаксию 2-го типа).
Несмотря на то что в такой ситуации не возникает серьезных этических проблем, характерных для предсказательной диагностики, положительные результаты анализа автоматически «перемещают» кровных родственников пробанда в группу высокого риска, что часто имеет для них существенное психологическое значение и вызывает большую обеспокоенность своим здоровьем и планированием деторождения.
Пренатальная и предимплантационная диагностика Проводимая в настоящее время молекулярно-генетическая пренатальная диагностика предусматривает либо забор плодного материала (хорионбиопсия, амниоцентез, кордоцентез), либо отбор эмбрионов при проведении ЭКО. В первом случае инвазивная процедура сама по себе несет небольшой риск осложнения течения беременности. По этой причине следует уделять особое внимание обоснованию показаний к проведению такого тестирования. В частности, в этих случаях необходимо предварительно провести тестирование родителей плода и убедиться в существовании мутаций, которые могут быть переданы ребенку.
При проведении ЭКО из бластоцисты для анализа забирают одну клетку, что значительно усложняет проведение тестирования и требует применения высокочувствительных методов, основанных на ПЦР. Тем не менее такие анализы часто входят в стандарт процедуры отбора эмбрионов не только у пар с зарегистрированным носительством мутантных генов, но и проходящих процедуру по причине бесплодия. Подобные манипуляции безусловно повышают шансы на рождение здорового ребенка в случае успешной подсадки и вынашивания эмбриона.
В пренатальной диагностике молекулярно-генетические методы используют для определения не только генных, но и хромосомных болезней. Молекулярные методы не позволяют обнаруживать хромосомные перестройки и мозаичность индивидуума с мутантными клетками до 15-20%.
Определение носительства Определение носительства - один из характерных для медицинской генетики молекулярно-генетических тестов с абсолютно уникальными показаниями и возможностями. Его обычно применяют в семье, в которой у кого-либо из родственников уже обнаружено заболевание и установлена связанная с ним мутация. Таким образом, речь идет об определении аутосомно-рецессивных мутаций в гетерозиготном состоянии у здоровых людей. Результаты тестирования важны при планировании деторождения. Положительный результат служит показанием для тестирования на носительство супруга, что в конечном счете позволяет не только рассчитать шансы на рождение здоровых и больных детей, но и определить показания и подготовить супругов к инвазивной пренатальной диагностике.
Предсказательное тестирование сложно наследуемых заболеваний Это одно из самых новых и активно развиваемых направлений медицинской генетики. Предсказательное генотипирование - одновременно и причина, и следствие развития новых высокопроизводительных методов анализа ДНК и растущих возможностей быстрого и дешевого определения тысяч полиморфизмов у тысяч здоровых и больных людей. В то же время оно вызывает больше всего споров этического и специального технического характера. Этот вид анализа в классическом варианте проводят у здоровых людей с целью определения мутации аутосомнодоминантного заболевания. В зависимости от пенетрантности мутаций результат предоставляет некоторую количественную оценку риска развития заболевания по сравнению с популяционным риском.
Современные методы позволяют оценивать риск наследственной предрасположенности, хотя с профессиональной точки зрения нет очевидных решений, каким именно образом оценивать риск, формируемый за счет вклада множества предрасполагающих и защитных факторов в вероятность развития заболевания. Трактовка полученных результатов требует привлечения квалифицированного и опытного специалиста, разбирающегося как в генетических аспектах, так и в особенностях группы нарушений, при которых выполняют тестирование (сердечнососудистые, психические заболевания, опухоли, нарушения репродукции и др.).
С этической точки зрения возникает целый ряд непростых вопросов. Здоровый человек получает удручающую информацию о его здоровье, которое еще только может испортиться в будущем. Ее открытие может повлечь за собой поражение в правах при страховании и поиске работы и вызвать трудности при создании семьи. По этим причинам широкое внедрение предсказательного тестирования поддерживают не все профессиональные генетики. Тем не менее в настоящее время как в России, так и за рубежом доступны отдельные тесты и специально подобранные панели полиморфизмов генов, определение которых позволяет уточнить предрасположенность к различным заболеваниям, а значит и дает возможность заниматься их целенаправленной профилактикой. По числу исследуемых генов и сложности интерпретации результатов к этой же группе тестов можно отнести диагностические панели генетических маркеров, используемых в онкологии для оценки прогноза течения заболевания и предварительной оценки эффективности лечения. В этом направлении удалось добиться более заметных положительных результатов. Были разработаны информативные панели маркеров, показавшие свою диагностическую значимость в крупных клинических исследованиях. Благодаря этому при определенных видах опухолей молекулярно-генетическое тестирование биоптатов в некоторых странах входит в стандарт обследования пациента [например, тест Mammoprint - Agendia (США) при раке молочной железы].
ФАРМАКОГЕНЕТИЧЕСКОЕ ТЕСТИРОВАНИЕ
Определение полиморфизмов, существенно влияющих на чувствительность индивидуумов к лекарственным препаратам, служит, по существу, предсказательным генотипированием, но оно не создает серьезных психологических проблем. Цель фармакогенетического тестирования - оценка влияния определенного полиморфизма гена на реакцию организма пациента на лекарственное средство.
ТЕХНИЧЕСКИЕ ВОПРОСЫ И МЕТОДЫ
Сбор образцов
Чаще всего в качестве образца используют кровь больного, получение которой (до 1 мл) совмещают со стандартным забором крови, проводимым при большинстве обращений к врачу. Необходимо помнить, что кровь для ДНК-диагностики собирают в отдельную пробирку с антикоагулянтом ЭДТА, но не гепарином. Собранная таким образом кровь может храниться при комнатной температуре или в холодильнике в течение нескольких дней и оставаться пригодной для анализа, что облегчает доставку образцов в диагностическую лабораторию. В то же время присутствие одинаковых генов в любых ядросодержащих клетках организма, а также во всех его жидкостях и средах открывает широкие возможности для забора материала, в том числе в случае, когда предпочтительны неинвазивные процедуры. Соскоб со слизистой оболочки ротовой полости или слюна - достаточный материал для определениия любых изменений в ДНК. Кроме того, ДНК остается стабильной после высушивания образцов крови, что позволяет направлять их для анализа почтой в другие города и даже страны, а также обращаться к архивным материалам и биопсийным препаратам. Образцы тканей или ДНК можно замораживать для длительного хранения.
Выбор метода
В основе большинства применяемых в клинической практике молекулярногенетических тестов лежит ПЦР. Далее амплифицированную ДНК анализируют с помощью различных методов. Выбор конкретной методики зависит от типа изучаемой мутации (однонуклеотидные замены, делеции и вставки, полиморфизм числа тандемных повторов, метилирование и др.), а также возможностей, предпочтений и загруженности диагностической лаборатории.
Ниже кратко описаны молекулярно-генетические методы, используемые в диагностических целях при наследственных заболеваниях, болезнях с наследственной предрасположенностью и опухолях.
Полиморфизм длины амплифицированных фрагментов
Один из самых простых молекулярно-генетических методов - анализ полиморфизма длины амплифицированных фрагментов. Метод не предъявляет особых требований к условиям ПЦР, а продукты амплификации можно анализировать с помощью электрофореза в агарозном или акриламидном геле. Праймеры для ПЦР подбирают относительно легко, но так, чтобы с двух сторон ограничивать область полиморфизма. После проведения ПЦР продукты амплификации наносят на гель и проводят электрофорез в присутствии маркеров длины нуклеотидных фрагментов (рис. 16-2, см. цв. вклейку). Метод позволяет получать результат в течение 3-4 ч с момента доставки образца в лабораторию.
Это исследование позволяет определять небольшие вставки и делеции, а также различия в числе тандемных повторов (полиморфизм VNTR - variable number of tandem repeats), что используют в судебно-медицинской практике, при определении родства и при болезнях экспансии повторов. В настоящее время распространена модификация метода - количественная флюоресцентная ПЦР. Добавление флюоресцентных красителей к праймерам и использование капиллярного электрофореза позволяет проводить мультиплексные реакции с количественной оценкой амплификата. Этот метод применяют в пренатальной диагностике для определения анеуплоидии, делеций и вставок, где он заменяет трудоемкие цитогенетические методы.
Полиморфизм длины рестрикционных фрагментов
Для обнаружения однонуклеотидных замен часто применяют анализ ПДРФ. После амплификации в ПЦР фрагмента ДНК, содержащего место возможной замены нуклеотида, амплификат обрабатывают ферментом (рестриктазой). Благодаря специфичности действия рестриктазы, узнающей определенную короткую (обычно - от 4 до 6 букв) нуклеотидную последовательность, можно подобрать такие ферменты, которые будут разрезать только дикий или только мутантный тип аллеля. Продукты рестрикции разделяют с помощью электрофореза. По образованию полос в геле, соответствующих коротким, длинным или и тем, и другим фрагментам, определяют соответственно один и другой гомозиготный вариант или гетерозиготное состояние по данному аллелю (рис. 16-3, см. цв. вклейку). Недостаток метода - существование дополнительной процедуры - рестрикции, удлиняющей время исполнения анализа до 3-24 ч в зависимости от протокола обработки рестриктазой. Кроме того, не во всех случаях однонуклеотидных замен удается подобрать специфичный для этого локуса фермент. Тем не менее метод оценки ПДРФ - один из распространенных в диагностике, так как хорошо различает однонуклеотидные полиморфизмы, широко распространенные как при моногенных, так и при многофакторных заболеваниях.
Аллельспецифичная полимеразная цепная реакция
Один из распространенных методов анализа точковых мутаций - аллельспецифичная ПЦР. Праймеры подбирают так, чтобы они оканчивались точно в месте мутации. В таком случае специфичность их взаимодействия с матрицей зависит от существования или отсутствия мутации (рис. 16-4, см. цв. вклейку). К сожалению, полимераза, используемая в ПЦР, часто продолжает работу даже при неполной комплементарности, что приводит к получению ложноположительных результатов ПЦР. Кроме того, в классическом виде аллельспецифичная ПЦР требует использования отдельной пробирки на каждую пару праймеров, что усложняет и удорожает проведение анализа. Метод распространен не так широко, как оценка ПДРФ, хотя потенциально имеет такую же область применения. В настоящее время его чаще применяют в научно-исследовательских целях, а не в прикладных диагностических.
Количественная полимеразная цепная реакция
С помощью добавления в смесь для ПЦР молекул, которые способны флюоресцировать при наработке продукта амплификации, удается не только повысить чувствительность и специфичность реакции, но и получить точную количественную оценку содержания искомой матрицы в образце, а также в значительной степени ускорить и упростить протокол проведения анализа. Наибольшее распространение получили две разновидности количественной ПЦР (ПЦР в реальном времени).
В первом случае в смесь добавляют флюорофор, который неспецифически взаимодействует с двойной спиралью ДНК и при этом многократно увеличивает уровень флюоресценции. Этот вариант отличается простотой оптимизации условий и дешевизной.
Во втором случае в смесь добавляют зонд - олигонуклеотид, специфичный для последовательности, которую амплифицируют (рис. 16-5, см. цв. вклейку). При прохождении реакции все большие его количества взаимодействуют с образующейся искомой ДНК. При этом полимераза в ходе своей работы разрушает зонд и высвобождает связанный с ним флюорофор, который начинает светиться. Чем больше синтезировано ПЦР-продуктов, тем более интенсивна флюоресценция.
Преимущество метода заключается в возможности использования разных флюорофоров для различных зондов и проведении нескольких реакций в одной пробирке. Количественная ПЦР не требует выполнения дополнительных процедур (например, электрофореза), что не только сокращает время проведения анализа, но и существенно снижает риск контаминации, так как флюоресценцию образцов анализируют в закрытых пробирках.
С помощью количественной ПЦР можно определять большой перечень мутаций: протяженные и небольшие делеции, однонуклеотидные полиморфизмы и дупликации, в том числе целых хромосом (анеуплодии).
В целом можно сказать, что количественная ПЦР в диагностике занимает самые прочные позиции, благодаря сочетанию высокой специфичности, чувствительности и скорости проведения анализа. В лабораториях с большим потоком анализов этим методом по возможности заменяют любые другие исследования, в том числе не требующие количественной оценки, поскольку его применение позволяет снизить риск контаминации образцов.
Мультиплексная лигазозависимая амплификация
Мультиплексная лигазозависимая амплификация (МЛЗА) (распространенный вариант в русскоязычной литературе без перевода - MLPA - multiple ligase dependent probe amplification) - относительно новый, дешевый, высокопроизводительный и специфичный метод анализа широкого спектра мутаций - однонуклеотидных полиморфизмов, небольших и крупных делеций.
В основе метода лежит специфичное лигирование двух олигонуклеотидных проб (рис. 16-6), подобранных таким образом, что исследуемая мутация лежит на их стыке. Лигирование с помощью специальной высокоспецифичной лигазы происходит с очень высокой точностью, обеспечивающей распознавание комплементарного нуклеотида. При этом в каждую пробу вводят различную по длине маркерную последовательность, чтобы различать отдельные аллели, а концы проб замыкают универсальными праймерами. В результате амплификации лигированных проб получают набор продуктов с длинами, соответствующими различным аллелям. В одной реакции без труда можно анализировать десятки аллелей, если продукты амплификации подвергать капиллярному электрофорезу. Более того, амплитуда пиков при капиллярном электрофорезе - высоковоспроизводимая характеристика набора ампликонов, что дает возможность определять дозу гена - диагностировать потерю гетерозиготности или, напротив, амплификацию гена. В целом метод применим для диагностики большинства мутаций: замены, делеции и вставки (как однонуклеотидной, так и протяженной). Он также находит применение в пренатальной диагностике анеуплоидии.
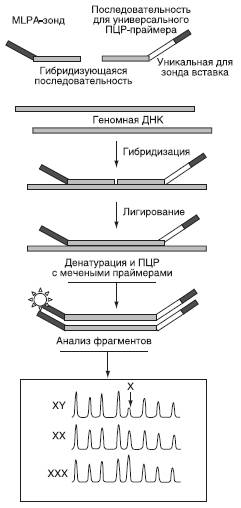
Рис. 16-6. Схема мультиплексной лигаметодов. Для молекулярно-генетического зозависимой амплификации
Секвенирование
Метод секвенирования - «золотой стандарт» молекулярной генетики. С его помощью можно провести поиск новых, редких и подтверждение известных мутаций. Диагностика многих наследственных заболеваний включает проведение секвенирования: предрасположенность к раку яичников и молочной железы (BRCA1 и BRCA2), нейрофиброматоз, фенилкетонурия, муковисцидоз и др. При отсутствии распространенных мутаций, приводящих к наследственному заболеванию, часто секвенируют ген для обнаружения более редких или новых мутаций. Для некоторых генов, имеющих небольшие размеры, прямое секвенирование с успехом применяют в качестве основного метода сканирования мутаций. Например, удобным оказалось его применение для определения мутаций в гене фактора IX свертывания крови (гемофилия В). Один из существенных недостатков технологии секвенирования - его дороговизна, но из года в год снижать его стоимость позволяет применение новых методик.
Масс-спектрометрия
Один из высокотехнологичных методов диагностики - масс-спектрометрия, принцип которой изложен в разделе биохимических анализа на масс-спектрометре подбирают олиго нуклеотиды встык к исследуемому полиморфизму, после чего их наращивают на один нуклеотид, комплементарный изучаемому. Масс-спектрометр позволяет быстро и точно определить добавленный нуклеотид. Для проведения анализа также требуются предварительная амплификация последовательности в ПЦР и последующая очистка амплификата перед гибридизацией со специфической пробой. Дополнительные процедуры и использование специальных реагентов становятся оправданными при проведении большого количества однотипных тестов. Этот метод позволяет оценивать однонуклеотидные замены и небольшие делеции и вставки. Кроме того, оценка соотношения множества пиков полиморфизмов в гетерозиготном состоянии позволяет обнаруживать анеуплоидию. Производительность прибора составляет сотни анализов в сутки.
Биологические микрочипы
Метод биологических чипов занял свою нишу в основном в научных исследованиях, но на его основе также разработаны клинические диагностические методики.
Чипы - небольшие (2-10 см2) полимерные или стеклянные пластины либо мембраны, на которые нанесено от сотен до десятков тысяч различных биологических проб: ДНК, РНК, белки или клетки. В зависимости от этих зондов различают ДНК-, РНК-, белковые и клеточные микрочипы.
В клинической и медико-генетической практике наибольшее распространение получили ДНК-чипы. Их используют для анализа спектра мутаций или аллельных вариантов разных генов, а также для анализа экспрессии генов. Микрочиповая технология за счет экономии реактивов и пространства расположения проб позволяет проводить тысячи анализов одновременно с использованием минимальных количеств материала. Эффективность метода в полной мере понятна при необходимости единовременной оценки большого числа параметров (например, характера экспрессии десятков генов в образце опухолевой ткани при определении прогноза лечения). С помощью ДНК-чипов можно анализировать как протяженные, так и короткие транслокации, дупликации и делеции. Микрочипы применяют при сравнительной геномной гибридизации, используя вместо контрольных (нормальных) метафазных хромосом специально составленные наборы проб.
Технология приготовления микрочипов в настоящее время коммерциализирована, и многочисленные фирмы (в том числе в России) могут по заказу подготовить любой вариант чипа.
Интерес к использованию микрочипов в клинической практике связан, в частности, с поиском ассоциаций генетических полиморфизмов с заболеваниями и использованием этой технологии в предсказательной медицине. Биологические чипы создают для диагностики конкретных заболеваний, поиска полиморфных систем генов детоксикации и фармакогенетически оправданного лекарственного лечения лейкозов, туберкулеза и бронхиальной астмы.
Микрочипы, как и масс-спектрометрический анализ, секвенирование и, отчасти, МЛЗА, относят к категории высокопроизводительных методов, позволяющих в короткие сроки проводить сотни и тысячи исследований. Эти методы пока не имеют устойчивых ниш и во многих случаях представляют альтернативное решение одних и тех же задач. Окончательный выбор зачастую зависит от финансовых возможностей, особенности организации лаборатории и объема выполняемых исследований.
Метилспецифичная полимеразная цепная реакция
В ряде случаев причиной заболевания служит не изменение нуклеотидной последовательности генов, а сбой регуляторных механизмов реализации программы генома. Среди так называемых эпигенетических причин дисфункции наиболее широко известны нарушения метилирования CpG-динуклеотидов в регуляторных, часто промоторных, областях различных генов. Чаще всего такие изменения возникают в злокачественных опухолях. Среди наследственных синдромов, вызванных ошибками метилирования, наибольшую известность получили синдромы Прадера-Вилли, Ангельмана и Беквита-Видеманна.
Суть метилспецифичной реакции состоит в том, что ДНК обрабатывают бисульфитом натрия, в результате чего все неметилированные остатки цитозина конвертируются в урацил, а метилированные не изменяются. После этого проводят ПЦР с праймерами, соответствующими метилированной и неметилированной последовательностям. По тому, с какой парой праймеров происходит амплификация, можно судить о метилировании. Легко заметить, что эта реакция - разновидность аллельспецифичной ПЦР на предварительно измененной матрице, и ей присущи все ее недостатки. Кроме того, следует отметить дополнительные трудности, связанные с необходимостью бисульфитной конверсии: сложность в подборе праймеров, неполную конверсию и возможность оценки только единичных CpGдинуклеотидов. Этот метод относительно дешев и прост. Он нашел применение в диагностике злокачественных новообразований и болезней импринтинга.
Метилчувствительная полимеразная цепная реакция
В ряде случаев в области изучаемого CpG-динуклеотида можно найти последовательность, распознаваемую особыми ферментами - метилчувствительными рестриктазами. В отличие от обычных рестриктаз активность этих ферментов зависит от состояния метилирования CpG-динуклеотида, входящего в состав специфичной для фермента последовательности. При метилировании ДНК становится устойчивой к действию фермента. Применение метода ограничено возможностью подбора рестриктаз, необходимых для оценки данного CpG-динуклеотида, анализа только одного CpG-динуклеотида в реакции и сложностью определения неполного метилирования.
Бисульфитный сиквенс
При определении метилирования, как и при диагностике обычных мутаций, наиболее полную информацию предоставляет сиквенс или бисульфитный сиквенс. Высокий интерес к эпигенетическим механизмам регуляции генома и растущие возможности высокопроизводительных методов анализа ДНК позволяют предполагать развитие и внедрение новых клинических методов диагностики уровня метилирования генов на основе не только секвенирования, но и микрочиповых технологий, масс-спектрометрии и др.
Методы мутационного скрининга
Если характер мутации неизвестен, а клиническая картина заболевания позволяет предположить, в каких генах могла произойти мутация, то в лабораторной диагностике наследственных болезней нередко прибегают к разработке индивидуальной (семейной) диагностической процедуры и применяют следующие, по сути своей, исследовательские методы поиска новых мутаций:
Чувствительность просеивающих методов обнаружения мутаций достаточно высока, что в сочетании с их невысокой стоимостью дает возможность установления диагноза в сложных случаях, когда поиск известных мутаций не дал результата.
ТИПЫ НАРУШЕНИЙ, ОПРЕДЕЛЯЕМЫХ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИМИ МЕТОДАМИ
Определение точковых мутаций
Однонуклеотидные замены и небольшие делеции можно определить с помощью гибридизации образца ДНК с аллельспецифичными олигонуклеотидными пробами и проведения аллельспецифической ПЦР. Для проведения флюоресцентной ПЦР, в которой аллели будут отличаться цветом флюоресценции, можно подобрать универсальные праймеры и аллельспецифичные зонды. Если аллельспецифичные пробы подобрать стык в стык, а их концы снабдить универсальными праймерами, то можно провести простую или мультиплексную лигазозависимую амплификацию. Кроме того, в большинстве случаев с помощью компьютерного анализа последовательности ДНК можно обнаружить, что исследуемый полиморфизм изменяет последовательность, специфичную для одной из сотен известных в настоящий момент бактериальных рестриктаз. Соответственно его можно обнаружить с помощью анализа полиморфизма длины рестрикционных фрагментов, проведенного после предварительной амплификации фрагмента ДНК, содержащего полиморфизм. При организации крупного потока образцов с необходимостью анализа одних и тех же полиморфизмов масс-спектрометрию целесообразно использовать в качестве высокопроизводительного метода исследований однонуклеотидных полиморфизмов и небольших делеций. При необходимости анализа большого количества редких полиморфизмов бывает выгоднее провести секвенирование последовательности ДНК.
Определение протяженных делеций
Протяженные делеции - одни из самых сложных мутаций не только для поиска новых, но и для определения в диагностических целях уже известных. Часто их определяют по отсутствию гибридизационного сигнала или его ослаблению в различных приложениях - от гибридизации по Саузерну до анализа цитогенетических препаратов с помощью флюоресцентных зондов.
Для клинической диагностики разрабатывают методики на основе ПЦР с оценкой сравнительной интенсивности получаемых ампликонов. Высокочувствительным и воспроизводимым методом анализа делеций, в том числе в гетерозиготном состоянии, показала себя МЛЗА. При анализе на капиллярном электрофорезе продуктов амплификации с нескольких разных локусов продемонстрирована высокая воспроизводимость относительных интенсивностей сигналов от каждого фрагмента, благодаря чему можно определять дозу гена.
Определение тандемных повторов
Для определения числа тандемных повторов в большинстве случаев достаточно проведения анализа полиморфизма длины амплифицированных фрагментов с помощью электрофореза в акриламидном геле или капиллярного электрофореза. Реже требуется использование гибридизационных техник, таких как гибридизация по Саузерну.
Определение множества редких мутаций
При многих заболеваниях обнаружены не один-два полиморфизма, а десятки относительно редких, разбросанных по всему гену мутаций. В таких случаях стараются разработать молекулярно-генетические подходы, основанные на высокопроизводительных технологиях. На микрочипах можно расположить десятки аллельспецифичных проб, с которыми гибридизуют амплифицированный фрагмент ДНК пациента. С помощью секвенирования можно определить последовательность гена и обнаружить новые мутации. В то же время необходимо иметь в виду, что секвенирование в большинстве случаев проводят в экзонах, и оно не затрагивает такие важные части гена, как интроны, промоторы и энхансеры, где могут находиться патогенетически значимые мутации. С другой стороны, при обнаружении новых мутаций возникает вопрос об их функциональном значении: часто они могут не приводить к изменению аминокислотной последовательности, а даже если приводят к замене, это необязательно сказывается на функции белка. Нередко прямое определение большого числа мутаций невозможно, в том числе в силу высокой стоимости такого анализа. В таких случаях используют просеивающие методы поиска мутаций - анализ полиморфизма конформации одноцепочечных молекул ДНК, гетеродуплексный анализ, градиентный денатурирующий электрофорез в геле и др. Эти методы неспецифичны и требуют перепроверки обнаруженных изменений другими способами, что превращает диагностическую процедуру в научно-исследовательскую. Это возможно только в исследовательской лаборатории, располагающей соответствующими возможностями и персоналом.
Поиск неизвестных генов, связанных с заболеванием. Косвенная ДНК-диагностика
До сих пор обсуждались методы и подходы, используемые при анализе мутаций в известных генах. В некоторых случаях, несмотря на установленную наследственную этиологию заболевания, остается неизвестной его молекулярно-генетическая основа, и, следовательно, прямая диагностика невозможна. В таких случаях необходимо проводить анализ сцепления высокополиморфных маркеров с заболеванием в больших семьях, в которых доступны образцы ДНК родственников и есть подробное клиническое описание каждого члена семьи. Благодаря тому что в настоящее время расшифрован геном человека, а в базах данных содержатся миллионы записей об индивидуальных отличиях, исследователям доступны высокоинформативные панели маркеров как на основе классических, различающихся по числу тандемных повторов полиморфизмов, так и однонуклеотидных полиморфизмов, обеспечивающих беспрецедентно плотное покрытие генома (в среднем один полиморфизм на 500-1000 нуклеотидов). Полиморфные ДНК-маркеры и интегральная карта их расположения позволяют определить и проследить в поколениях хромосому, несущую патологический ген. Необходимость выбора и анализа десятков, а иногда и сотен информативных генетических маркеров, а также построение родословной объясняет то, что анализ сцепления остается непростой процедурой. Он требует высокой квалификации сотрудников и всемерного содействия со стороны семьи. Кроме того, такое исследование продолжает оставаться дорогим (от нескольких тысяч долларов) и затратным по времени.
Заключение
Как следует из вышесказанного, существует довольно много биохимических и молекулярно-генетических методов диагностики наследственных болезней. Они оказались настолько универсальными, что нашли применение не только в медицинской генетике, но и в онкологии, диагностике инфекционных заболеваний, судебной медицине, общей терапевтической практике и др. Одни и те же болезни можно диагностировать разными методами, а быстрое развитие ДНК-технологий и протеомных исследований обогащает это разнообразие.
Автоматизация существующих методов и разработка принципиально новых подходов к изучению структуры нуклеиновых кислот, наряду с ускоренными темпами изучения генома человека и клонирования генов, ответственных за развитие моногенных заболеваний, позволяют прогнозировать рутинное проведение биохимической и молекулярно-генетической диагностики большинства известных наследственных болезней человека и включение таких тестов в профилактические просеивающие программы.
В настоящее время все большее распространение получают секвенаторы нового поколения, которые обеспечивают параллельное секвенирование сотен тысяч последовательностей ДНК. В подавляющем числе случаев такое дорогостоящее оборудование используют в научных целях. Стремительное развитие этого научнотехнического направления приводит к неуклонному повышению производительности и снижению стоимости оборудования и проведения анализа. По состоянию на конец 2011 г., на рынке существуют параллельные секвенаторы, предназначенные для клинико-лабораторной диагностики, отличающиеся относительно невысокой производительностью, но низкой стоимостью одного анализа и усовершенствованными возможностями исследования одновременно нескольких образцов. В 2011 г. стоимость полного секвенирования генома человека составила около 5000 долларов США. В ближайшие 1-2 года можно ожидать начала их применения в клинических целях: для неинвазивной пренатальной диагностики, быстрого и недорогого определения всех известных моногенных заболеваний и обнаружения сотен полиморфизмов, ассоциированных с риском возникновения многофакторных болезней.
В настоящее время разрабатывают методы неинвазивной пренатальной молекулярно-генетической диагностики. В этом случае в качестве материала для анализа используют кровь матери (ткани плода при заборе материала не затрагивают), которая во время беременности содержит не только плодные клетки, но и внеклеточные ДНК и РНК плода. Такое тестирование требует использования современного высокопроизводительного оборудования, позволяющего анализировать миллионы генных последовательностей. Это помогает распознать и правильно генотипировать молекулы плода, составляющие лишь 4-10% общей внеклеточной ДНК. С этой целью применяют системы параллельного секвенирования или масс-спектрометрии. В ноябре 2011 г. состоялся запуск коммерчески доступной неинвазивной пренатальной диагностики синдрома Дауна компанией «Секвеном» (США). Тест основан на технологии массивного параллельного секвенирования. Учитывая экспоненциальное удешевление секвенирования наряду с повышением его точности и скорости, в ближайшие три года можно предполагать создание коммерчески доступных неинвазивных пренатальных тестов как на распространенные хромосомные, так и генные заболевания.
Другая задача, с которой могут справиться системы параллельного секвенирования, - просеивающее тестирование новорожденных. До некоторой степени его можно рассматривать как диагностическое тестирование. В качестве заболеваний отбирают не только распространенные, но и поддающиеся достаточно простой и эффективной коррекции. К сожалению, для большинства таких заболеваний не характерно существование какого-либо одного универсального повреждения ДНК, что существенно затрудняет разработку молекулярно-генетических диагностических подходов. В то же время часто более чувствительным и дешевым методом служит биохимическое тестирование. Несомненно, что со временем бурно развивающиеся технологии ДНК-диагностики, в том числе секвенирование, позволят повысить соотношение цена-качество молекулярных методов, что приведет к разработке не только дешевых и чувствительных, но и высокоспецифичных методов. Кроме того, это расширит перечень заболеваний, которые можно будет диагностировать в рамках просеивающего тестирования. В настоящее время в России с помощью этого тестирования определяют пять заболеваний новорожденных: фенилкетонурию, муковисцидоз, адреногенитальный синдром, врожденный гипотиреоз и галактоземию. Во всех случаях в качестве первого метода используют биохимический анализ крови новорожденного. В случае подозрения проводят ДНК-диагностику. В разных странах утверждены несколько различающиеся перечни заболеваний для просеивающего тестирования новорожденных, что определяет как эпидемиологическая обстановка в конкретном регионе, так и финансовые возможности системы здравоохранения. Чаще всего, помимо вышеупомянутых, в такие программы включают следующие заболевания: гемоглобинопатии, лейциноз (болезнь «кленового сиропа»), дефицит биотинидазы, гомоцистинурию, тирозинемию, миодистрофию Дюшенна, гиперхолестеролемию, врожденную глухоту, дефицит α1-антитрипсина и дефицит G-6-фосфатдегидрогеназы. Развитие технологий секвенирования позволило бы не только существенно расширить перечень диагностируемых заболеваний, но и сократить в конечном итоге стоимость неонатального тестирования.
Гарантией успешности и эффективности диагностических программ считают гармоничное сочетание биохимических и молекулярно-генетических методов с учетом рекомендаций врача-генетика, основанных на анализе родословной.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Клиническая генетика: Учебник для мед. вузов / Под общ. ред. Н.П. Бочкова. - М.: ГЭОТАР-Медиа, 2011. - 537 с.
Кондрашева Е.А., Островский А.Ю., Юрасов В.В. Инвитро диагностика. Лабораторная диагностика. - М.: Медиздат, 2007. - 560 с.
Молекулярная клиническая диагностика / Под общ. ред. С. Херрингтон. - М.: Мир, 1999. - 558 с.
ПЦР «в реальном времени» / Под ред. Д.В. Ребрикова. - М.: Бином, 2009. - 215 с.
Баранов В.С., Баранова Е.В., Иващенко Т.Э., Асеев М.В. Геном человека и гены «предрасположенности». Введение в предиктивную медицину. - СПб.: Интермедика, 2000. - 271 с.
Генетический паспорт - основа индивидуальной и предиктивной медицины / Под общ. ред. В.С. Баранова. - СПб., 2009. - 528 с.
Свердлов Е.Д. Взгляд на жизнь через окно генома. В 3 т. - М.: Наука, 2009.
Краснопольская К.Д. Наследственные болезни обмена. - М.: Медицина, 2005.
Grody W.W., Seligson D.B., Telatar M. Diagnostic Molecular Genetics in Emery and Rimon?s Principles and Practice of Medical Genetics. - Churchill Livingstone, 2002. - P. 723-751.
Sambrook J., Russell D.W. Molecular Cloning: A Laboratory Manual. - New York: Cold Spring Harbor Laboratory Press, 2001. - 2344 p.