Наследственные болезни : национальное руководство / Под ред. Н. П. Бочкова, Е. К. Гинтера, В. П. Пузырева - Москва : ГЭОТАР-Медиа, 2012. - 936 с. (Серия "Национальные руководства") - ISBN 978-5-9704-2231-1 |
Аннотация
Национальные руководства - первая в России серия практических руководств по основным медицинским специальностям, включающих всю основную информацию, необходимую врачу для непрерывного последипломного образования.
Национальное руководство "Наследственные болезни" содержит актуальную, современную информацию о геноме человека, общих вопросах медицинской генетики, клинической генетике. Руководство состоит из двух частей, в которых излагаются теоретические и клинические вопросы медицинской генетики. В первой части представлены новейшие данные по теоретическим вопросам медицинской генетики. Сведения об организации и функциях генома, генов и хромосом изложены в понятной для врачей форме, но без излишнего упрощения. Во второй части представлены вопросы клинической генетики, а именно методы диагностики наследственных болезней (от клинического уровня до секвенирования ДНК и РНК), принципов лечения и профилактики отдельных нозологических форм. Поскольку в национальных руководствах по другим специальностям описаны многочисленные наследственные болезни, на них можно найти ссылки [см. "Перечень наследственных болезней (синдромов), описание которых представлено в других национальных руководствах" на компакт-диске]. Приложение к руководству на компакт-диске включает более полную информацию по некоторым главам, электронную версию руководства, обширный иллюстративный материал, приложения, перечень наследственных болезней, описанных в других руководствах, фармакологический справочник. В подготовке настоящего издания в качестве авторов-составителей и рецензентов принимали участие ведущие ученые разных специальностей: генетики, иммунологи, невропатологи, фармакологи, онкологи и другие специалисты. Все рекомендации прошли этап независимого рецензирования.
Руководство предназначено для врачей-генетиков, врачей лаборантов-генетиков, врачей смежных специальностей, интернов, ординаторов, аспирантов, особенно по таким дисциплинам, как педиатрия, акушерство-гинекология, нервные болезни.
Гриф
Национальное руководство рекомендовано Российским обществом медицинских генетиков и Ассоциацией медицинских обществ по качеству
Глава 17. Методы цитогенетической диагностики хромосомных болезней
Хромосомным болезням отводят существенное место в структуре наследственных заболеваний человека. Аномалии хромосомного набора - причина ранней остановки развития и внутриутробной гибели примерно 50-60% зародышей в I триместре беременности (Назаренко, 1993; Баранов, Кузнецова, 2007). Примерно 5-7% мертворождений обусловлены хромосомным дисбалансом, а частота хромосомных нарушений у детей с множественными врожденными пороками развития достигает 40%. Среди новорожденных распространенность хромосомных аберраций равна 0,6-1,0%, при этом около половины из них составляют анеуплоидии. В постнатальном онтогенезе хромосомный дисбаланс играет заметную роль в этиологии умственной отсталости, бесплодия, привычного невынашивания беременности и развития злокачественных новообразований (Ворсанова и др., 2006; Бочков и др., 2010). Пациенты с такими формами нарушений формируют группы риска и должны быть обследованы с помощью цитогенетических методов исследования. Ниже приведены основные показания для проведения цитогенетической диагностики (Назаренко, Яковлева, 2001).
Нарушение репродуктивной функции неясной этиологии у мужчин и женщин:
Существование у ребенка множественных врожденных пороков развития.
Задержка умственного и физического развития ребенка.
Подозрение на хромосомную болезнь на основании клинических симптомов.
Подозрения на синдромы, характеризующиеся хромосомной нестабильностью (учет хромосомных аберраций и сестринских хроматидных обменов).
Гемобластозы и онкологические заболевания.
Пренатальная и преимплантационная диагностика в супружеских парах повышенного генетического риска.
Оценка мутагенных воздействий.
Круг задач, с которыми приходится сталкиваться при проведении цитогенетического анализа в перечисленных ситуациях, отличается довольно большим разнообразием. В значительной степени это связано с широким спектром числовых и структурных аномалий хромосом, обусловливающих возникновение хромосомных болезней и требующих применения разнообразных методов детекции. Кроме того, существуют определенные трудности и ограничения при проведении цитогенетического анализа, связанные как со сложностями культивирования клеток и получения качественных препаратов хромосом, так и с уровнем разрешения светового микроскопа, ограничивающим идентификацию микроструктурных хромосомных аберраций. Соответственно возникает вопрос о выборе наиболее информативного способа исследования кариотипа. Цель настоящей главы - характеристика существующих методов цитогенетической диагностики хромосомных болезней, областей их применения и разрешающих возможностей и ограничений.
На современном этапе развития цитогенетики человека можно выделить два основных направления цитогенетической диагностики. Первое связано с приготовлением препаратов метафазных хромосом. В этом случае проводят стандартные процедуры цитогенетического анализа, связанные с культивированием клеток, получением хромосомных препаратов и исследованием рутинно или дифференциально окрашенных хромосом, либо метафазные пластинки становятся объектом более детального изучения с применением высокоразрешающих методов молекулярной цитогенетики. В случае невозможности приготовления хромосомных препаратов и проведения классического метафазного анализа цитогенетическая диагностика, тем не менее, остается возможной. Ее обеспечивают методы молекулярно-цитогенетического, а в последнее время и молекулярногенетического анализа. Объектом исследования в этом случае становится уже не метафазная хромосома, а хроматин интерфазных ядер или молекула ДНК.
«Золотым стандартом» при проведении цитогенетической диагностики по-прежнему остается метафазный анализ хромосом, позволяющий идентифицировать все хромосомы в кариотипе человека по их морфологическим характеристикам. Традиционно препараты метафазных хромосом получают из культур активно пролиферирующих клеток или клеток с высоким митотическим индексом. Наиболее распространенный источник метафазных пластинок - культуры лимфоцитов периферической крови человека. Кроме того, для получения метафазных хромосом можно использовать культуры фибробластов кожи, клеток амниотической жидкости, ворсин хориона и костного мозга.
Говоря о выборе материала для проведения цитогенетического исследования, следует подчеркнуть, что он не всегда ограничивается перечисленными типами клеток. В последние годы с развитием преимплантационной генетической диагностики все чаще необходим анализ хромосомного дисбаланса в отдельных бластомерах или полярных тельцах, т.е. до наступления беременности или даже до оплодотворения. Несмотря на некоторые попытки получения метафазных хромосом из этих клеток, трудоемкость и невысокая эффективность предложенных методик заставляет обратить внимание на использование технологий молекулярно-цитогенетического исследования, не требующих приготовления хромосомных препаратов. Определенные трудности существуют и при проведении цитогенетического анализа солидных злокачественных новообразований, когда практически невозможно получить качественные препараты метафазных хромосом. В тех же случаях, когда это удается сделать (например, при использовании трансформированных клеточных линий), неизбежно встает вопрос о соответствии хромосомных аберраций в культуре и нативной опухоли. Этот вопрос связан с возможностью возникновения новых мутаций при трансформации и длительном культивировании клеток, а также вследствие их клональной селекции in vitro. Таким образом, для проведения цитогенетического исследования можно использовать достаточно широкий спектр биологического материала, но его особенности определяют выбор наиболее подходящего метода классического метафазного или молекулярно-цитогенетического анализа (Рубцов, Карамышева, 2009).
Традиционно получение препаратов хромосом требует проведения нескольких стандартных процедур (Rooney, Czepulkowski, 1992; Назаренко, Яковлева, 2001; Рубцов, 2006):
Непременное условие получения качественных препаратов хромосом с достаточным числом метафазных пластинок - высокая митотическая активность клеток. При использовании лимфоцитов периферической крови стимуляции клеточной пролиферации in vitro достигают с помощью фитогемагглютинина - белка бобовых растений. Некоторые клетки (фибробласты, амниоциты) способны к пролиферации в культуре без стимуляции клеточного деления. Ряд же других клеток (например, цитотрофобласта ворсин хориона), обладая высокой митотической активностью, требует краткосрочного культивирования для получения метафазных хромосом. Кроме того, их можно использовать для приготовления так называемых прямых препаратов хромосом без этапа культивирования.
Продолжительность культивирования также определяют индивидуальные свойства клеток и прежде всего длительность клеточного цикла. Так, для получения препаратов метафазных хромосом из лимфоцитов периферической крови, как правило, требуется их культивирование в течение 72 ч, когда число делящихся клеток в суспензионной культуре достигнет максимума. Культивирование фибробластов или амниоцитов, пролиферирующих на поверхности силиконизированного стекла или пластика, для получения монослоя требует нескольких дней. По вполне очевидным причинам еще более продолжительным оказывается культивирование клеток внутриутробно погибших эмбрионов и плодов, требующее для накопления достаточного количества активно пролиферирующих клеток несколько недель. Невысокая пролиферативная активность клеток, тем не менее, не может служить критическим препятствием для получения препаратов хромосом. Существующие в культуре единичные клетки на стадии метафазы можно изолировать с помощью методов микродиссекции и в дальнейшем использовать для получения препаратов хромосом. Такой способ приготовления хромосомных препаратов, получивший название «пипет-метод», позволяет существенно сократить продолжительность проведения цитогенетического исследования, что особенно актуально, например, при пренатальной диагностике хромосомных аномалий с использованием культур клеток амниотической жидкости.
Для культивирования используют среды (обычно RPMI 1640, DMEM, F10, F12, среда Игла), специфичные для определенных типов клеток, с добавлением пуповинной сыворотки крови человека или эмбриональной телячьей сыворотки. В некоторых случаях для улучшения клеточной пролиферации в культуры добавляют растворы витаминов и незаменимых аминокислот. Обычно культивирование проводят при температуре 37 ?С либо во флаконах или чашках Петри в условиях 5% CO2. Накопления клеток в стадии метафазы достигают за счет добавления в культуры цитостатиков (колхицин, колцемид, демеколцин), блокирующих веретено клеточного деления. В ряде случаев для увеличения доли митотических клеток можно применять синхронизацию культур.
Гипотоническая обработка - один из важнейших этапов получения качественных препаратов метафазных хромосом. Воздействие на клетки свежеприготовленным гипотоническим раствором хлорида калия или цитрата натрия приводит к их набуханию и значительному увеличению размеров, способствует разрыву межхромосомных связей и обеспечивает в конечном итоге хороший разброс хромосом в метафазной пластинке. Применение гипотонической обработки, предложенной Хсю в 1952 г., стало ключевым событием в развитии методов цитогенетических исследований. Именно с ее использованием в 1956 г. Тио и Леван при изучении культур фибробластов легкого эмбрионов человека, а также Форд и Хамертон при исследовании сперматоцитов тестикулярной ткани впервые установили нормальное число хромосом в кариотипе человека.
Фиксацию клеток, необходимую для сохранения морфологии хромосом, осуществляют с использованием охлажденного (4 ?С) фиксатора Карнуа (метанол и ледяная уксусная кислота в соотношении 3:1). Свежеприготовленную суспензию клеток можно непосредственно нанести на предметное стекло для микроскопии либо хранить в архиве при температуре -20 ?С весьма продолжительное время.
В зависимости от цели диагностического исследования используют различные методы окрашивания хромосом, которые можно подразделить на методы рутинной и дифференциальной окраски. Среди последних, в свою очередь, выделяют методы, приводящие к образованию сегментов вдоль длины всех хромосом (Q-, G-, R-окраска), и методы, обеспечивающие окрашивание специфических хромосомных структур (C-, NOR-, T-окраска).
Исторически первым методом, используемым в цитогенетике человека, стало рутинное окрашивание хромосом. Его достигают путем обработки хромосомных препаратов красителем Романовского-Гимзы (азур-эозином) без какой-либо предварительной подготовки. Это приводит к сплошному прокрашиванию хромосом по всей длине. Рутинное окрашивание позволяет установить лишь общее число хромосом в метафазной пластинке и провести некоторый анализ их морфологии, в частности определить размер хромосомных плеч, положение первичных и вторичных перетяжек, а также центромерный индекс. В настоящее время рутинную окраску практически не применяют для диагностики хромосомных заболеваний, но она остается актуальной для анализа хромосомных аберраций при тестировании мутагенных факторов (Бочков, Чеботарев, 1989).
Создание методов дифференциального окрашивания хромосом позволило существенным образом повысить разрешающие возможности цитогенетического анализа в идентификации прежде всего структурных аберраций хромосом. Первым методом дифференциальной окраски стало Q-окрашивание, предложенное Касперссоном и соавт. в 1970 г. Q-окраска (от англ. Quinacrine - акрихин) присутствует на хромосомах в виде чередования ярко- и темно-флюоресцирующих сегментов после окрашивания препаратов интеркалирующими в ДНК красителями - акрихин-ипритом, акрихин дигидрохлоридом или Hoechst 33258. Для анализа Q-окрашенных хромосом требуется применение люминесцентного микроскопа. Согласно Международной цитогенетической номенклатуре (ISCN 2009), Q-окраску, в зависимости от типа используемого красителя, обозначают как QFQ или QFH, где первая буква обозначает тип окраски (Q), вторая - основную применяемую методику (F - флюоресцентное окрашивание) и третья - используемый краситель (Q - акрихин, H - Hoechst 33258).
Наиболее распространенный на практике метод дифференциального окрашивания - G-окраска хромосом (G -banding, от англ. Giemsa - Гимза). Она включает обработку хромосомных препаратов протеолитическим ферментом (трипсином) с последующим окрашиванием красителем Гимзы. В результате возникает поперечная исчерченность хромосом, где темные полосы соответствуют, как правило, гетерохроматиновым, а светлые - эухроматиновым районам. На метафазных хромосомах возможна идентификация порядка 300-400 дифференциально окрашенных сегментов на гаплоидный геном. По цитогенетической номенклатуре G-окраску обозначают как GTG (G -bands by trypsin using Giemsa).
Существует три основных способа R-окраски хромосом (от англ. reverse - обратный). Первый связан с использованием флюорохромов, имеющих сродство к ГЦ-богатым участкам ДНК. Второй основан на обработке хромосомных препаратов гидроксидом бария при высоких температурах (60 ?С) с последующим окрашиванием красителем Гимзы. И, наконец, третий вариант связан с введением в клеточные культуры за несколько часов до фиксации 5-бромдезоксиуридина (BrdU), что приводит к его включению в средне- и позднореплицирующуюся ДНК. Хромосомные регионы, содержащие ДНК с включенным бромдезоксиуридином, более слабо окрашиваются красителем Гимзы или акридиновым оранжевым. В то же время интенсивное окрашивание остальных районов указывает на полное отсутствие в них бромдезоксиуридина и завершение репликации. В результате на хромосомах образуется поперечная исчерченность, характер которой противоположен наблюдаемой при G-окрашивании: темноокрашенные полосы соответствуют эухроматиновым, а светлоокрашенные - гетерохроматиновым районам хромосом.
C-окраска (от англ. constitutive heterochromatin) возникает после обработки хромосомных препаратов щелочью (обычно - гидроксидом бария или натрия) с последующей инкубацией в растворе 2×SSC и окрашиванием красителем Гимзы. В результате преимущественно в прицентромерных районах хромосом возникают темноокрашенные сегменты конститутивного гетерохроматина, тогда как эухроматиновые районы прокрашиваются очень слабо. По локализации выделяют четыре типа С-позитивного хроматина:
В практике клинической цитогенетики С-окраску применяют преимущественно для уточнения происхождения хромосомных перестроек, в частности для идентификации маркерных хромосом. По Международной цитогенетической номенклатуре C-окраска имеет обозначение CBG (C -bands by barium hydroxide using Giemsa).
NOR-окраску (от англ. nucleolar organizer region - ядрышкообразующие районы) или Ag-окраску применяют для идентификации ядрышкообразующих районов, расположенных в коротких плечах акроцентрических хромосом 13, 14, 15, 21 и 22. Для их визуализации используют различные модификации метода, основанные на применении нитрата серебра. В результате на спутничных нитях акроцентрических хромосом обнаруживают черные зерна восстановленного серебра, причем их размер значительно варьирует - от практически полного отсутствия окраски до достаточно крупных блоков серебра. Такая вариабельность обусловливает Ag-поли морфизм хромосом человека.
T-окраску (от англ. telomere - теломера) используют для обнаружения теломерных районов хромосом. Метод основан на инкубации хромосомных препаратов в растворе фосфатного буфера (pH 5,1) при 87 ?С в течение 20-60 мин с последующей обработкой красителем Гимзы.
Кроме перечисленных методов, существует еще ряд способов визуализации определенных хромосомных структур. Среди них можно отметить культивирование лимфоцитов периферической крови в среде с низким содержанием фолиевой кислоты, которое используют для определения ломких сайтов хромосом и широко применяют на практике для цитогенетической диагностики синдрома Мартина- Белл (синдрома ломкой хромосомы X) - наиболее частой формы Х-сцепленной умственной отсталости.
Введение в клеточные культуры в течение двух последовательных циклов репликации 5-бромдезоксиуридина дает возможность дифференциации сестринских хроматид. Хроматида, содержащая бромдезоксиуридин в обеих нитях ДНК, окрашивается более слабо по сравнению с хроматидой, в которой он включен только в одну из цепей ДНК. Хроматидные обмены обусловливают формирование специфического рисунка метафазной хромосомы, состоящего из чередующихся светлых и темных полос. Этот способ окрашивания был разработан отечественными цитогенетиками Е.Н. Еголиной и А.Ф. Захаровым в 1972 г. (Еголина, Захаров, 1972). Увеличение частоты сестринских хроматидных обменов служит диагностическим признаком ряда заболеваний, обусловленных нестабильностью структуры хромосом (например, синдрома Блюма). Кроме того, анализ сестринских хроматидных обменов - классический тест в оценке уровня химического мутагенеза.
Использование стандартного метафазного анализа дифференциально окрашенных хромосом обеспечивает достаточно эффективную диагностику числовых аномалий хромосом и ряда структурных аберраций. Следует отметить, что такой подход обладает рядом ограничений, затрудняющих проведение цитогенетических исследований. Одно из них связано с разрешающими возможностями световой микроскопии: с ее помощью можно идентифицировать порядка 250-400 сегментов на гаплоидный геном. Это затрудняет анализ происхождения маркерных и сверхчисленных хромосом в кариотипе, идентификацию сложных хромосомных транслокаций, а также диагностику микроделеционных и микродупликационных синдромов. Зачастую идентично описываемые структурные хромосомные аберрации могут отличаться друг от друга по локализации областей разрывов хромосом и размеру перестроенных участков, что неизбежно скажется на особенностях их клинической картины. В некоторой степени отмеченное ограничение можно преодолеть при анализе менее конденсированных прометафазных хромосом, обеспечивающих уровень разрешения около 850-1000 сегментов. Существует два основных подхода для получения таких хромосом. Первый связан с использованием синхронизации клеточных культур, а второй основан на применении различных ингибиторов конденсации хромосом (бромистый этидий, актиномицин D) при вступлении клетки в митотическое деление. В целом разработка протоколов получения прометафазных хромосом послужила заметным этапом в развитии цитогенетики человека, обеспечив возможность диагностики ряда микроделеционных и микродупликационных синдромов.
Как видно из табл. 17-1, методы световой микроскопии позволяют довольно успешно определять числовые и структурные перестройки хромосом, затрагивающие участки размером не менее нескольких миллионов пар азотистых оснований. Аберрации меньшего размера находятся за границами разрешающих возможностей световой микроскопии и требуют применения специальных методов молекулярно-цитогенетического анализа, обеспечивающих детекцию изменений на уровне даже в один нуклеотид. Впрочем, это очень редко требуется на практике для проведения цитогенетической диагностики.
Таблица 17-1. Уровень разрешения методов классической и молекулярной цитогенетики
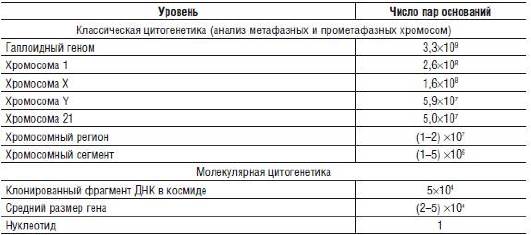
В то же время разрешающая возможность световой микроскопии - далеко не единственное препятствие, ограничивающее качество и саму возможность проведения цитогенетического исследования. Так, успех в получении препаратов метафазных хромосом во многом зависит от характера клеточной пролиферации в культуре. В частности, именно по этой причине большинство образцов солидных новообразований остаются недоступными для классического метафазного анализа. Еще одну проблему представляет хромосомный мозаицизм - ситуации, при которых в организме существуют два или более клеточных клона с различным набором хромосом. Присутствие небольшого процента клеток с хромосомной аномалией может иметь решающее значение в формировании патологического фенотипа. Минорный клеточный клон при анализе небольшой выборки метафазных пластинок может быть пропущен. С другой стороны, обнаружение нескольких аномальных клеток, например с моносомией, также оставляет вопросы об их происхождении, в частности о возможной потере метафазной хромосомы из пластинки при приготовлении препаратов. Более того, хромосомный мозаицизм может быть ограничен некоторыми типами клеток (например, эпителиальными), недоступными для культивирования и проведения метафазного анализа. Все это диктует необходимость применения альтернативных методов цитогенетического исследования, обеспечивающих возможность изучения больших выборок клеток, в том числе без их предварительного культивирования. Такую возможность предоставляют методы молекулярно-цитогенетического анализа.
В основе диагностических технологий всех методов молекулярной цитогенетики лежит использование принципа гибридизации нуклеиновых кислот in situ. Реакция гибридизации in situ - комплементарное взаимодействие ДНК-зондов с участками ДНК исследуемого кариотипа, осуществляемое непосредственно на цитологических препаратах (рис. 17-1, см. цв. вклейку). Исторически первым методом гибридизации in situ был радиоактивный вариант, предложенный в 1969 г. для определения локализации генов рРНК. Позднее были разработаны принципы флюоресцентной детекции нуклеиновых кислот с использованием антител, меченных флюорохромами, а также синтезированы модифицированные нуклеотиды, несущие флюорохромные группировки. Используя эти разработки, Дэниель Пинкель и соавт. в 1986 г. предложили протокол флюоресцентной in situ гибридизации (FISH) на метафазных хромосомах, открывшей эру молекулярной цитогенетики человека.
Для проведения гибридизации используют ДНК-зонды - любые клонированные последовательности ДНК (повторяющиеся или уникальные последовательности, фрагменты хромосом или целые хромосомы), комплементарные участку ДНК исследуемого кариотипа и маркированные специфическими молекулами, обеспечивающими их обнаружение. В зависимости от размера фрагментов ДНК их клонируют в различных векторах: плазмидах, космидах, YAC (от англ. yeast artificial chromosomes - дрожжевые искусственные хромосомы), BAC (от англ. bacterial artificial chromosomes - бактериальные искусственные хромосомы) или PAC (от англ. P1-derived artificial chromosomes - искусственные хромосомы на основе репликона фага P1). Для получения ДНК-зондов, кроме клонирования, используют методы хромосомной микродиссекции и проточной сортировки хромосом. ДНК-зонды маркируют («метят») репортерными молекулами (например, биотином или дигоксигенином), имеющими высокое сродство с молекулами, впоследствии окрашиваемыми флюоресцентными красителями [например, авидин-флюоресцеинизотиоцианатом (авидин-FITC) или родамином]. В некоторых случаях мечение осуществляют непосредственно флюорохромами (FITC, тетраметилизотиоцианат - TRITC). Его проводят с использованием реакции ник-трансляции, в ходе которой в молекулу ДНК с помощью фермента ДНКазы вносят одноцепочечные разрывы (ники; от англ. nick - разрыв) с последующим восстановлением структуры за счет имеющихся в реакционной смеси свободных нуклеотидов, в том числе конъюгированных с репортерными молекулами (флюорохромами). Кроме ник-трансляции, для мечения ДНК-зондов используют другие технологии, в частности DOP-PCR (от англ. degenerated oligonucleotide primer - polymerase chain reaction - полимеразная цепная реакция с универсальным или вырожденным праймером).
Проведение FISH-реакции включает ряд стандартных процедур. На первом этапе осуществляют обработку хромосомных препаратов РНКазой А для удаления фрагментов РНК и протеолитическими ферментами (пепсином) - для более эффективного проникновения зонда к ДНК-мишени. Далее проводят денатурацию ДНК на хромосомном препарате, для чего его выдерживают в 70% растворе формамида при 70 ?С в течение 2 мин. После этого препарат проводят по серии холодных спиртов (70-80-96%) при -20 ?С. Далее на препарат наносят гибридизационную смесь, в состав которой входят предварительно денатурированный ДНК-зонд, формамид, декстрансульфат для предотвращения испарения гибридизационной смеси в ходе реакции и немеченая флюорохромами конкурентная ДНК для супрессии высокоповторяющихся последовательностей ДНК и повышения специфичности гибридизации. В зависимости от типа зондов и условий гибридизации, в качестве конкурентной ДНК используют ДНК, полученную из спермы лососевых рыб, или фракцию C0 t-1 ДНК из плаценты человека. Хромосомный препарат накрывают покровным стеклом, заклеивают по периметру полимерным клеем для предотвращения испарения гибридизационной смеси и помещают во влажную камеру при 37 ?С. Продолжительность гибридизации варьирует в зависимости от типов ДНК-зондов и может составлять несколько часов для центромероспецифичных ДНК-проб, 15-18 ч - для хромосомоспецифичных ДНК-библиотек и до 3 сут - для геномных ДНК-зондов при проведении сравнительной геномной гибридизации.
После гибридизации проводят процедуру удаления неспецифически связавшихся ДНК-зондов с хромосомного препарата, для чего инкубируют его в денатурирующем 50% растворе формамида. Далее, в зависимости от способа мечения ДНК-зондов, используют прямую или непрямую детекцию флюоресцентных сигналов. В том случае, если ДНК-зонд помечен непосредственно флюорохромом, хромосомный препарат окрашивают красителем (как правило, DAPI) и проводят микроскопию в люминесцентном микроскопе с использованием специфических светофильтров. При использовании ДНК-зондов, меченных репортерными молекулами, предварительно проводят дополнительный этап детекции сигналов, для чего на препарат наносят антитела, конъюгированные с флюорохромами. Более того, при непрямой детекции (например, в случае использования биотинилированного ДНК-зонда) есть возможность усиления (амплификации) сигнала за счет последовательной обработки препарата антиавидином (антителом, специфичным к авидину) и авидином, несущим флюорохромные молекулы (FITC). Визуализацию гибридизационных сигналов проводят на люминесцентном микроскопе, а регистрацию изображений и документирование результатов диагностики - с использованием специального программного обеспечения.
В настоящее время при проведении FISH-анализа используют целый арсенал различных ДНК-зондов, позволяющих идентифицировать тот или иной тип хромосомной аномалии. Среди их многообразия необходимо отметить следующие основные типы.
Центромероспецифичные ДНК-зонды. В их основе лежат высокоповторяющиеся последовательности ДНК, комплементарные к центромерному гетерохроматину (α- и β-сателлиты) и обладающие полной или относительной специфичностью к центромерным районам хромосом. Такие зонды используют для анализа числовых нарушений хромосом, происхождения маркерных и сверхчисленных хромосом, при исследовании хромосомного мозаицизма и определении пола. Коммерчески доступные зонды имеют маркировку CEN (centromere enumeration probes). Центромерные ДНК-зонды хорошо заметны не только на метафазных хромосомах, но и в интерфазных ядрах (рис. 17-2, см. цв. вклейку), что дало начало особому направлению в молекулярно-цитогенетической диагностике - интерфазной цитогенетике. Этот подход позволяет получать достоверную информацию о числе копий анализируемых хромосом непосредственно в интерфазных ядрах, избегая при этом необходимости получения препаратов метафазных хромосом. Кроме того, его применяют в тех случаях, когда невозможно получить качественные препараты. Так, например, именно на основе интерфазной цитогенетики в настоящее время осуществляют преимплантационный скрининг анеуплоидий в единичных бластомерах или полярных тельцах.
Вместе с тем применение центромероспецифичных ДНК-зондов имеет некоторые ограничения. Например, с их помощью нельзя исследовать структурные перестройки хромосом. Присутствие дополнительного сигнала зонда в интерфазном ядре не позволяет однозначно дифференцировать случаи трисомии и присутствия маркерной хромосомы. Кроме того, некоторые зонды весьма чувствительны к условиям гибридизации, и при значительном изменении жесткости может возникать перекрестная гибридизация (существование флюоресцентных сигналов в центромерных районах других хромосом) либо, напротив, полное отсутствие сигналов. Явление гетероморфизма гомологов по числу копий альфоидной ДНК может сказываться на интенсивности сигналов на разных гомологичных хромосомах, тем самым затрудняя их подсчет. Особенно остро эта проблема встает при проведении пренатальной диагностики анеуплоидий, в связи с чем рекомендовано использовать ДНК-зонды, комплементарные уникальным последовательностям ДНК исследуемых хромосом.
Уникальные ДНК-зонды - клонированные уникальные последовательности ДНК, строго специфичные для определенных районов хромосом или отдельных генов (LSI - locus-specific identifiers). Такие зонды применяют для диагностики синдромов, связанных с микроделециями и микродупликациями хромосом [например, синдрома Смита-Магениса (рис. 17-3, см. цв. вклейку), Лангера-Гидеона, Вольфа-Хиршхорна, Прадера-Вилли, Ангельмана], а также в целях картирования генов.
Теломерные и субтеломерные ДНК-зонды - меченые фрагменты ДНК, комплементарные повторяющимся теломерным и уникальным субтеломерным последовательностям ДНК соответственно. Они находят применение для диагностики скрытых хромосомных перестроек, главным образом микроделеций в теломерных областях хромосом у пациентов с множественными врожденными пороками развития и идиопатическими формами умственной отсталости. С внедрением таких ДНК-зондов стало возможным прояснить молекулярную этиологию некоторых хромосомных болезней, которые ранее нельзя было диагностировать с использованием метафазного анализа. Кроме того, был описан ряд новых хромосомных синдромов, например ATR-16 (α-thalassemia, retardation - синдром α-талассемии и умственной отсталости, обусловленный делецией кластера α-глобиновых генов и гена SOX8, локализованного в субтеломерной области короткого плеча хромосомы 16).
Хромосомоспецифичные ДНК-библиотеки - совокупность последовательностей ДНК, покрывающих всю длину исследуемой хромосомы. В результате гибридизации хромосома оказывается полностью окрашенной в определенный цвет. Именно поэтому хромосомоспецифичные ДНК-библиотеки также называют «painting»-пробами (окрашивающими пробами; WCP - whole chromosome paints). Их применяют для идентификации целых хромосом и их фрагментов, а также установления происхождения сложных транслокаций, инсерций и маркерных хромосом. Вариант FISH с использованием хромосомоспецифичных ДНК-библиотек (Lichter et al., 1988) получил название хромосомной супрессии in situ (CISS - chromosomal in situ supression). Принцип модификации заключается в использовании фракции не меченной флюорохромами высокоповторяющейся ДНК (Co t1), получаемой из плаценты человека. Диспергированные повторяющиеся последовательности, присутствующие в составе хромосомоспецифичной ДНК-библиотеки, быстро гибридизуются (супрессируются) с Co t1 ДНК и уже не участвуют в дальнейшем взаимодействии с хромосомной мишенью. Это в конечном итоге повышает специфичность связывания уникальных последовательностей в составе ДНК-зонда (рис. 17-4, см. цв. вклейку).
Геномный ДНК-зонд - тотальная фракция геномной ДНК, выделенная из ядросодержащих клеток организма, опухолевых образцов и клеточных культур, меченная флюоресцентным красителем. Такие ДНК-зонды используют для проведения сравнительной геномной гибридизации.
Циклические олигонуклеотидные ДНК-зонды были предложены Нильссоном и соавт. в 1994 г. для дифференциации α-сателлитных центромерных последовательностей хромосом человека, которые имеют высокую гомологию друг с другом. На практике это затрудняет диагностику изменений числа копий этих хромосом. Речь идет, в первую очередь, о таких хромосомах, как 13 и 21, а также 14, 22 и 1, 5, 19, традиционные центромероспецифичные зонды для которых обнаруживают перекрестную гибридизацию. Известно, что в составе 168-нуклеотидных мономерных единиц α-сателлитных повторов, присутствующих в центромерных регионах хромосом 13 и 21, отличаются только лишь два нуклеотида в положении 38 (тимин - в хромосоме 13 и цитозин - в хромосоме 21) и 101 (цитозин и гуанин соответственно). Циклические зонды были сконструированы таким образом, что своими 5?-концевыми последовательностями они оказывались комплементарными к этим полиморфным основаниям. Таким образом, на 5?- конце зонда, специфичного к хромосоме 13, находился аденин, комплементарный Т38, а в зонде на хромосому 21 - гуанин, комплементарный С38. Далее после небольшого комплементарного участка в 15-20 нуклеотидов, одинакового для обеих хромосом, следовала некомплементарная последовательность (40-60 нуклеотидов), которая служила мишенью включения репортерных молекул - биотина для зонда на хромосому 13 и дигоксигенина для зонда на хромосому 21. 3?-концы зондов снова оказывались комплементарными фрагменту α-сателлитного повтора. При гибридизации зонды распознавали соответствующие полиморфные нуклеотиды в разных хромосомах, и ДНК-лигаза, присутствующая в реакционной смеси, сшивала 3? и 5?-концы комплементарно связавшихся зондов. Именно поэтому такие зонды получили название Padlock-probes (зонды типа навесного замка). В результате различия последовательности ДНК всего лишь в один нуклеотид стало возможным визуализировать на цитогенетическом уровне. В дальнейшем было предложено использовать подобные аллельспецифичные ДНК-зонды для детекции однонуклеотидных замен, точковых мутаций и даже родительского происхождения хромосомных аномалий. Несмотря на высокую разрешающую способность, метод не нашел практического применения ввиду трудоемкости, а также существования менее затратных молекулярно-генетических технологий, успешно решающих вышеперечисленные задачи.
Создание FISH-анализа положило начало развитию целого комплекса молекулярно-цитогенетических методов и направлений (Speicher, Carter, 2005). Далее будет представлена их характеристика.
Как было отмечено ранее, объектом изучения FISH-анализа может быть не только метафазная хромосома, но и хроматин интерфазного ядра. Интерфазный FISH-анализ занял заметное место в современной диагностике хромосомных аномалий. Можно выделить несколько областей его применения. В первую очередь - диагностика нарушений числа хромосом. Использование центромероспецифичных ДНК-зондов позволяет сравнительно легко определить число копий хромосом в клетке. Заключение делают на основании подсчета числа флюоресцентных сигналов. В норме в интерфазном ядре визуализируют два флюоресцентных сигнала (по одному для каждого гомолога), при трисомии - три, а при моносомии - один. Следует отметить, что существуют определенные критерии подсчета сигналов, которых следует придерживаться при интерпретации результатов исследования. Так, сигналы в контакте друг с другом считают соответствующими одной хромосоме, с высокой вероятностью находящейся в реплицирующемся состоянии. Близлежащие сигналы считают принадлежащими разным хромосомам, если они разделены расстоянием большим, чем диаметр сигнала. В каждой реакции гибридизации выполняют подсчет не менее 50 ядер с четкими сигналами без повреждений и следов цитоплазмы или клеточной мембраны. При спорных результатах для увеличения информативности число анализируемых ядер можно увеличить до 100 и более. В случае проведения пренатальной диагностики с помощью интерфазного FISH-анализа делается заключение о наличии хромосомных нарушений в виде анеуплоидии:
-
отрицательное заключение выносится, когда менее 10% ядер демонстрируют аномальное число сигналов;
-
если наблюдается от 7-10 до 20% анеуплоидных ядер, то возникает подозрение на мозаицизм. В таких случаях рекомендуется дополнительно провести исследование кариотипа с помощью стандартных методов цитогенетического анализа;
-
более 20% трисомных клеток свидетельствует о существовании аномалий числа хромосом, по крайней мере в мозаичной форме.
Для диагностики мозаицизма низкого уровня предложены особые алгоритмы, оценивающие достоверность превышения некоторых контрольных значений, полученных при предварительном исследовании клеток с нормальным кариотипом (Lomax et al., 1994). Так, предел обнаружения клеток с числовыми нарушениями хромосом (lim) при интерфазном FISH-анализе можно определить по формуле:
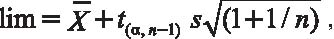
где Х - средняя частота анеуплоидных (или полиплоидных) ядер, t - нормированное отклонение, α - степень значимости, n - число обследованных контрольных образцов, s - стандартное отклонение.
В формирование фонового уровня анеуплоидии (полиплоидии), регистрируемого при интерфазном FISH-анализе, вносит вклад как спонтанная частота нарушений сегрегации хромосом, так и ошибки метода (нерезультативная гибридизация, наложение гибридизационных сигналов в пространстве интерфазного ядра). При анализе анеуплоидии, особенно по половым хромосомам, следует также учитывать вероятность контаминации материала клетками матери.
Доверительный интервал (CI 95%) для предела обнаружения мутации определяют по формуле:
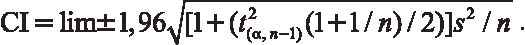
На основании верхней границы доверительного интервала уже в анализируемой выборке интерфазных ядер определяют ожидаемое число клеток с аномальным хромосомным набором. Далее с помощью критерия χ2 или точного критерия Фишера проводят сравнение ожидаемого и наблюдаемого числа клеток с хромосомной аномалией и делают заключение о присутствии мозаицизма низкого уровня.
На практике зачастую используют вариант гибридизации с применением двух центромероспецифичных ДНК-зондов, меченных флюорохромами разного цвета. Такой подход позволяет оценивать дисбаланс одновременно по двум парам хромосом, осуществлять пренатальную и преимплантационную диагностику пола (при применении проб на хромосомы X и Y). Кроме того, двухцветная флюоресцентная in situ гибридизация оказывается удобным методом регистрации три- и тетраплоидии в интерфазных клетках.
Точность интерфазного FISH-анализа при пренатальной диагностике анеуплоидии с помощью коммерческих наборов довольно высока. По данным разных лабораторий, чувствительность таких исследований составляет от 83 до 100%, а специфичность - 98-100%. Кроме того, технология интерфазной FISH - составная часть анализа происхождения маркерных хромосом (при условии интактности их центромерных последовательностей) как в пренатальной диагностике, так и в клинической цитогенетической практике. Для интерфазной диагностики анеуплоидии обычным считают использование α-сателлитных ДНК-зондов для хромосом 18, X и Y. Для определения в клетках плода числа копий хромосом 13 и 21 используют уникальные хромосомоспецифичные маркеры LSI13 (локус гена RB1 13q14) и LSI21 (локус 21q22.13-22.2). Использование ДНК-зондов для подсчета числа хромосом 13, 18, 21, Х и Y дает возможность идентифицировать 69-87% всех аномалий, обнаруживаемых при амниоцентезе, в зависимости от уровня риска для пациента и показаний к инвазивной процедуре. Если известно, что статус плоидности в норме, общий остаточный риск хромосомных аномалий существенно снижается. Например, в группе с возрастными показателями для пренатальной диагностики частота хромосомных аберраций составляет 3,4%. Если пробы для перечисленных хромосом показывают нормальный статус плоидности для них, то риск снижается до 0,5%, т.е. почти в 7 раз. Частота обнаружения хромосомных аномалий с помощью интерфазного FISH-анализа по сравнению с дифференциальной G-окраской, включая мозаицизм и структурные перестройки, составляет 87,5%. Таким образом, около 13% хромосомных аномалий, обнаруживаемых пренатально, составляют маркерные хромосомы и структурные перестройки, которые нельзя диагностировать при интерфазном FISH-анализе и использовании стандартного набора ДНК-зондов на хромосомы 13, 18, 21, X и Y. Эту величину, несомненно, следует принимать во внимание при интерпретации результатов пренатальной диагностики хромосомных аномалий в тех случаях, когда ее проводят с использованием исключительно интерфазного FISH-анализа.
В настоящее время интерфазная цитогенетика заняла заметное место в преимплантационной диагностике анеуплоидий. Интерфазный FISH-анализ на отдельных бластомерах и полярных тельцах, как правило, с использованием набора из пяти ДНК-проб (на хромосомы 13, 18, 21, X и Y), меченных разными флюорохромами, уже считают стандартной процедурой (рис. 17-5, см. цв. вклейку).
Выбор перечисленных хромосом для проведения диагностики вполне очевиден и определяется серьезной клинической значимостью возникающей по ним анеуплоидии. Наряду с этим необходимо отметить, что набор исследуемых хромосом нельзя считать исчерпывающим, поскольку анеуплоидия по другим хромосомам также оказывает негативное влияние на течение эмбрионального развития, имплантацию зародыша и наступление беременности. Очевидно, существуют определенные ограничения на одновременную идентификацию большего числа флюоресцентных сигналов в пределах интерфазного ядра. Для их преодоления предложены протоколы последовательной двукратной гибридизации нескольких ДНК-зондов в одной и той же клетке, но они не отличаются высокой эффективностью и, так или иначе, не позволяют исключить анеуплоидию по другим хромосомам, не включенным в анализ. Эта проблема, как будет отмечено ниже, находит решение при применении метода сравнительной геномной гибридизации.
Неоспоримое преимущество интерфазной цитогенетики - отсутствие необходимости в приготовлении препаратов метафазных хромосом и культивировании клеток. Это снимает многие вопросы, связанные с возникновением артефактов, присущих длительным культурам клеток (полиплоидизация in vitro, возникновение и клональная селекция клеток с аберрациями кариотипа, изменение пропорций клеточных клонов при хромосомном мозаицизме). Сама диагностика хромосомного мозаицизма становится более эффективной. Во-первых, для анализа оказываются доступными большие выборки интерфазных клеток. Во-вторых, возникает возможность исследования тканей или клеток, недоступных для культивирования и получения метафазных пластинок (например, клеток эпителия ротовой полости при диагностике межтканевого мозаицизма при синдроме Шерешевского-Тернера).
В отличие от числовых аномалий хромосом, диагностика структурных аберраций с помощью интерфазной цитогенетики более затруднительна. Тем не менее при знании структуры перестроенной хромосомы она становится реальной. Одним из ярких примеров служит обнаружение «филадельфийской хромосомы» (транслокации между хромосомами 9 и 22) в клетках костного мозга при хроническом миелоидном лейкозе. Эта транслокация приводит к слиянию последовательностей генов BCR и ABL1 с формированием химерного гена BCR-ABL, продукт которого обладает тирозинкиназной активностью, стимулирующей пролиферацию опухолевых клеток. Эта транслокация типична для 95% пациентов с хроническим миелоидным лейкозом, служит ранним маркером заболевания и имеет важное прогностическое значение. Для ее диагностики в интерфазных ядрах предложен набор из двух уникальных ДНК-зондов, комплементарных последовательностям генов BCR (9q34) и ABL (22q11.2) и меченных флюорохромами зеленого и красного цвета соответственно. При проведении гибридизации в нормальных интерфазных ядрах будут возникать два флюоресцентных сигнала, соответствующих ДНК-зонду на ген BCR (зеленое свечение), и два сигнала красного цвета, соответствующих зонду на ген ABL. В случае транслокации будет зарегистрировано не четыре, а три гибридизационных сигнала - два специфичных нормальным гомологам хромосом 9 и 22 и один сигнал оранжевого цвета, образовавшийся от слияния последовательностей генов (рис. 17-6, см. цв. вклейку). Возможность проведения анализа на достаточно больших выборках интерфазных клеток костного мозга обеспечивает эффективную диагностику транслокации даже в небольшом проценте клеток. Следует отметить, что подобные принципы анализа транслокаций находят свое применение и при диагностике других форм лейкозов. Кроме того, актуальным для диагностики гемобластозов, мониторинга лечения, оценки рецидивов и прогноза течения заболевания считают интерфазный FISH-анализ и анеуплоидии по ряду хромосом, в частности 7, 8, 12.
С необходимостью анализа структурных перестроек хромосом в интерфазных клетках приходится сталкиваться и при проведении преимплантационной цитогенетической диагностики. Так, для обнаружения реципрокных транслокаций предложено использовать два основных подхода. Первый связан с использованием ДНК-зондов, фланкирующих область разрыва хромосомы. Обычно в этом случае применяют два центромерных зонда, меченных разными флюохромами и специфичных для хромосом, вовлеченных в перестройку. Третий зонд, маркированный другим флюорохромом, подбирают таким образом, чтобы он был комплементарен терминальной последовательности одной из хромосом. Альтернативно можно использовать два субтеломерных ДНК-зонда и один центромероспецифичный. Заключение о существовании транслокации делают на основании колокализации в пределах интерфазного ядра двух ДНК-зондов, специфичных для разных хромосом, вовлеченных в транслокацию (аналогично тому, как проводят интерфазную FISH-диагностику «филадельфийской хромосомы»). Второй подход связан с использованием зондов, комплементарных областям разрывов хромосом, что требует предварительного детального изучения структуры реципрокной транслокации у ее носителя на метафазных хромосомах. В случае наследования перестроенной хромосомы в бластомерах также можно будет зарегистрировать слияние гибридизационных сигналов от флюорохромов разного цвета.
У носителей робертсоновских транслокаций существует высокий риск формирования анеуплоидных гамет. Для проведения преимплантационной диагностики в таких случаях можно использовать уникальные субтеломерные ДНК-зонды, комплементарные терминальным последовательностям длинных плеч акроцентрических хромосом, вовлеченных в робертсоновскую транслокацию. После оплодотворения в бластомерах с нормальным кариотипом будут обнаружены четыре гибридизационных сигнала. Впрочем, такой же результат будет получен и в клетках с унаследованной робертсоновской транслокацией. В случае же моносомии или трисомии будут определены один или три сигнала соответственно.
Интерфазный анализ нашел применение в цитогенетике ранних репродуктивных потерь у человека. Известно, что основной вклад в остановку внутриутробного развития и элиминацию эмбрионов на ранних сроках беременности вносят числовые хромосомные нарушения, регистрируемые в среднем в 50-60% случаев спонтанных абортов в I триместре (Назаренко, 1993; Баранов, Кузнецова, 2007). Цитогенетические исследования абортивного материала с использованием рутинных технологий культивирования клеток и получения препаратов метафазных хромосом сталкиваются с рядом проблем и прежде всего с явлением низкой пролиферативной активности клеток внутриутробно погибших эмбрионов in vitro. По результатам работ разных лабораторий, именно по этой причине в среднем около 25% образцов абортированных тканей оказываются недоступными для цитогенетического исследования. Кроме того, существуют проблемы контаминации культур клетками материнского организма, что в ряде случаев приводит к ложному заключению о нормальном кариотипе эмбриональных клеток. Наконец, при длительном культивировании клеток есть вероятность как возникновения некоторых мутаций (например, полиплоидии) in vitro, так и клональной селекции клеток с разным хромосомным набором. На фоне доступности ограниченного набора тканей для получения препаратов метафазных хромосом это может привести к недооценке уровня внутри- и межтканевого хромосомного мозаицизма.
Использование центромероспецифичных ДНК-зондов при проведении интерфазного FISH-анализа позволяет сравнительно легко диагностировать числовые хромосомные нарушения в некультивированных клетках различных зародышевых листков. В проведенном исследовании с помощью поэтапной двухцветной in situ гибридизации с использованием центромероспецифичных ДНК-зондов на все хромосомы набора было показано, что частота регистрируемых числовых нарушений кариотипа в целом не отличается от таковых при культивировании клеток и метафазном анализе (Lebedev et al., 2004). Спектр хромосомных нарушений был различен. Наиболее яркое отличие - обнаружение в эмбриональных клетках с низкой пролиферативной активностью мозаичных моносомий по аутосомам 7, 15, 21 и 22, причем моносомии 7 и 15 были описаны впервые. Традиционно считают, что аутосомные моносомии - тяжелое хромосомное нарушение, несовместимое с нормальным протеканием даже самых ранних этапов развития. Элиминация большинства зародышей с таким типом хромосомного дисбаланса происходит еще до имплантации бластоцисты. Обнаружение в выборке спонтанных абортусов I триместра аутосомных моносомий указывает на то, что присутствуя в мозаичном состоянии с нормальной клеточной линией и возникая на более поздних постимплантационных этапах онтогенеза, такие аномалии могут вносить определенный вклад в структуру репродуктивных потерь и в I триместре беременности. Аутосомные моносомии по широкому спектру хромосом также были зарегистрированы у спонтанных абортусов и в других исследованиях, проведенных как с помощью интерфазного FISH-анализа, так и с применением сравнительной геномной гибридизации на метафазных хромосомах или микрочипах. Кроме того, в работах, выполненных с помощью сравнительной геномной гибридизации, о которой речь пойдет ниже, было продемонстрировано присутствие в эмбриональных клетках двойных и тройных анеуплоидий. Наконец, еще одним итогом молекулярно-цитогенетических исследований спонтанных абортусов стала регистрация у них высокой частоты хромосомного мозаицизма.
Интерфазный FISH-анализ в комбинации с микроядерным тестом на двухъядерных цитокинезблокированных лимфоцитах нашел широкое применение и в современных генотоксикологических исследованиях. Введение в клеточные культуры цитохалазина B блокирует цитокинез и приводит к образованию двухъядерных клеток. Использование центромероспецифичных ДНК-зондов позволяет легко фиксировать события хромосомного нерасхождения и отставания, приводящие к формированию трисомных и моносомных клеток (рис. 17-7, см. цв. вклейку). При этом анализ двухъядерных клеток имеет заметное преимущество перед традиционным интерфазным анализом одиночных ядер, поскольку каждое из ядер в цитокинезблокированной клетке может служить контролем по отношению к другому ядру. Это, в свою очередь, ведет к более достоверной оценке гипо- и гипердиплоидии.
Кроме регистрации анеугенных событий, такой подход позволят проводить оценку кластогенных (структурных) нарушений хромосом, индикатором которых служит образование микроядер. Следует отметить, что микроядра, содержащие центромерный сигнал, являются маркером хромосомного отставания, тогда как центромеронегативные микроядра содержат фрагменты хромосомного материала, не включившегоcя в основное ядро (рис. 17-7, г, см. цв. вклейку). Очевидно, что точная дифференциация центромеропозитивных и центромеронегативных микроядер возможна при применении проб на центромерные последовательности всех хромосом кариотипа человека (рис. 17-8, см. цв. вклейку).
Обратная гибридизация (reverse painting). Это вариант гибридизации in situ, используемый для быстрого анализа происхождения маркерных хромосом и хромосомных фрагментов, вовлеченных в перестройки (Carter et al., 1992). Его осуществляют в три этапа. На первом этапе проводят изоляцию маркерной хромосомы или фрагмента аберрантной хромосомы из метафазной пластинки с помощью методов механической или лазерной микродиссекции либо с использованием проточной сортировки. На втором этапе выполняют амплификацию и мечение ДНК изолированного фрагмента методом DOP-PCR. Далее полученный ДНК-зонд гибридизуют сначала с метафазными хромосомами пробанда для проверки его специфичности, а затем с нормальными метафазными хромосомами здорового индивидуума. По локализации сигналов гибридизации делают вывод о происхождении маркерной или аберрантной хромосомы.
Гибридизация в условиях различной жесткости. Метод направлен на быстрый и экономичный анализ хромосомных нарушений. Он основан на особенностях структурной организации α-сателлитной ДНК: в зависимости от числа мономеров, образующих повторяющуюся единицу, альфоидная ДНК подразделяется на несколько субсемейств, локализованных на различных хромосомах. При гибридизации в условиях низкой жесткости набор определенных ДНК-зондов связывается с группой хромосом одного субсемейства. Проведение последующей гибридизации в условиях высокой жесткости с ДНК-библиотеками одной группы обеспечивает точную идентификацию аберрантной хромосомы.
Fiber-FISH - вариант гибридизации in situ на деконденсированном хроматине или отдельных фибриллах ДНК. Разрешающая возможность такого метода составляет порядка 5-300 тыс. пар оснований, что позволяет проводить анализ даже внутригенных мутаций. Основные области применения: исследование структурных аберраций хромосом (микроделеций, микродупликаций, инверсий, транслокаций) и картирование генов путем непосредственного визуального определения порядка расположения отдельных участков ДНК в хромосоме относительно друг друга.
PRINS (Oligonucleotide Primed In Situ DNA Synthesis). Метод заключается в синтезе ДНК in situ непосредственно на цитологических препаратах с использованием олигонуклеотидных праймеров, фланкирующих анализируемый фрагмент ДНК, и набора нуклеотидтрифосфатов, один из которых конъюгирован с флюорохромом. Такой подход позволяет провести быструю идентификацию фрагментов анализируемых хромосом за счет амплификации высококопийных хромосомоспецифичных семейств повторяющихся последовательностей ДНК. К настоящему времени разработаны модификации PRINS-анализа, в частности Cycling-PRINS для идентификации уникальных последовательностей хромосом. Известен и вариант мультицветного PRINS-анализа - Multicolour PRINS. По сути, PRINS-технологии нельзя считать прямой модификацией FISH-метода, поскольку они не требуют использования ДНК-зондов. Скорее, это альтернатива FISH, основанная на принципе синтеза или амплификации ДНК на цитологическом препарате с включением флюоресцентной метки для идентификации исследуемого участка хромосомы.
Технологии мультицветной FISH. Диагностика некоторых типов хромосомных аномалий, например таких, как сложные транслокации с вовлечением нескольких хромосом или идентификация маркерных хромосом, ставит задачу быстрого и эффективного анализа происхождения хромосомной перестройки. Одним из подходов к ее решению может быть одновременное использование в единой реакции гибридизации нескольких ДНК-зондов, меченных разными флюорохромами. Тем не менее такой вариант имеет определенные ограничения, связанные с проблемой корректной идентификации большого числа флюорохромов при микроскопии вследствие возможного перекрывания спектров их флюоресценции. Решение этой проблемы было найдено в 1990 г., когда П. Недерлоф и соавт. предложили принцип комбинаторного мечения, заключающийся в комбинировании различных вариантов соотношения небольшого числа флюорохромов при мечении разных хромосомных ДНК-библиотек (Nederlof et al., 1990). Число возможных комбинаций из n флюорохромов определяют по формуле 2n-1. Очевидно, что для идентификации каждой отдельной хромосомы набора достаточно использовать всего пять флюорохромов (рис. 17-9, см. цв. вклейку). В 1996 г. на основе этого принципа были созданы две технологии многоцветной гибридизации in situ - мультицветная FISH [Multicolour FISH (mFISH)] и спектральное кариотипирование [Spectral Karyotyping (SKY)].
При mFISH проводят детекцию каждого отдельного флюорохрома с использованием набора специальных фильтров, характерных для строго определенной длины волны, а суммарное изображение получают после компьютерной обработки всех индивидуальных изображений (рис. 17-10, см. цв. вклейку). Технология SKY не имеет принципиальных отличий от mFISH, за исключением способа детекции изображения, при котором в данном случае используют интерферометр, позволяющий зарегистрировать интенсивность свечения всего набора флюорохромов одновременно в каждой точке изображения (рис. 17-11, см. цв. вклейку). В отличие от mFISH, спектральное кариотипирование обеспечивает одновременный анализ множества флюоресцентных проб и дает возможность использования образцов с перекрывающимися спектрами флюоресценции. Кроме того, возникает возможность включения в анализ хромосом, находящихся в наложении на метафазных пластинках. Метод также способен обнаруживать числовые и структурные аномалии хромосом даже в интерфазных ядрах. Следует отметить, что результаты, полученные двумя методами многоцветного окрашивания хромосом, демонстрируют хорошую корреляцию друг с другом.
Многоцветное сегментирование хромосом. Мультицветная FISH, основанная на использовании только хромосомоспецифичных ДНК-библиотек, делает невозможным исследование таких внутрихромосомных аберраций, как инверсии, делеции и дупликации. Именно поэтому дальнейшее развитие технологии многоцветной гибридизации пошло по пути создания многоцветных ДНК-зондов, специ фичных к плечам или даже сегментам отдельных хромосом. Одной из первых разработок в этом направлении была технология межвидового цветного сегментирования хромосом - Rx-FISH. В основу этого метода были положены результаты сравнительных исследований геномов разных видов организмов в пределах определенных таксономических групп. Они показали, в частности, что последовательности ДНК в хромосомах гиббона и человека на 98% гомологичны. Вместе с тем определенные хромосомы гиббона отличаются наличием существенных перестроек относительно хромосом человека, что служит отражением эволюционных особенностей кариотипа приматов. В связи с этим ДНК-зонды, полученные на основе хромосомоспецифических ДНК-библиотек гиббона, способны гибридизироваться с хромосомами человека с обнаружением специфических цветных сегментов на отдельных хромосомах. Был создан набор таких ДНК-зондов двух видов гиббонов (Halobates concolor и H. syndactylus). Для мечения использовали комбинацию трех флюорохромов, что позволило получить семь различных вариантов окраски. ДНК-зонды гибридизировали на метафазные хромосомы человека и дифференцировали их на специфические сегменты (рис. 17-12, см. цв. вклейку).
Rx-FISH находит применение в основном в фундаментальных исследованиях, особенно в изучении проблем эволюции кариотипа в различных таксономических группах. Вместе с тем метод имеет потенциал и для решения ряда диагностических задач, а именно для детекции скрытых внутрихромосомных перестроек (дупликаций, делеций, инсерций и инверсий), анализа сложных хромосомных транслокаций, определения точек разрывов при структурных аберрациях, дифференциации отдельных плеч хромосом, вовлеченных в структурную перестройку, и идентификации маркерных хромосом. Перспективы развития Rx-FISH связаны как с увеличением цветовой гаммы за счет применения большего числа флюорохромов, так и с увеличением числа дифференцированных сегментов хромосом путем использования геномных библиотек других видов приматов, искусственных хромосом и сегментспецифичных микродиссекционных проб.
Многоцветное сегментирование хромосом в очередной раз поставило задачу увеличения числа флюорохромов для мечения ДНК-библиотек. Спустя 10 лет после предложения принципа комбинаторного мечения он был дополнен идеей не только качественного, но и количественного соотношения флюорохромов при мечении. Так возник метод бинарного комбинаторного мечения - COBRA (COmbined Binary RAtio labelling). Он заключается в использовании комплексов из трех флюорохромов для мечения хромосомных библиотек, при этом для мечения каждой отдельной хромосомоспецифичной библиотеки выбирают строго определенное количественное соотношение двух из трех флюорохромов, входящих в состав комплекса. Для каждой пары флюорохромов применяют пять вариантов соотношения концентраций (0%:100%, 25%:75%, 50%:50%, 75%:25% и 100%:0%), что в конечном счете позволяет получить 12 различных оттенков. Добавление к каждой комбинации четвертого флюорохрома позволяет получить еще 12 дополнительных вариантов цвета. В итоге с помощью всего четырех флюорохромов можно индивидуально идентифицировать каждую хромосому набора. В целом число получаемых цветов определяет формула:
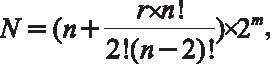
где N - число получаемых цветов, n - число первичных флюорохромов, m - число дополнительных флюорохромов, r - число соотношений первичных флюорохромов.
Очевидно, что при увеличении числа дополнительных флюорохромов или используемых комбинаций концентраций можно достичь 48, 96 и более различных оттенков, что при использовании плечеили сегментспецифичных ДНКбиблиотек открывает широкие возможности для идентификации внутри- и межхромосомных структурных аберраций. Метод COBRA успешно используют для многоцветного окрашивания как целых хромосом, так и отдельных хромосомных районов. В частности, предложен вариант субтеломерной S-COBRA-FISH. Следует отметить, что методы многоцветного сегментирования хромосом с использованием сегментспецифичных ДНК-библиотек, меченных различными комбинациями флюорохромов (Chudoba et al., 1999), уже достигли степени разрешения до 450- 550 цветных сегментов на гаплоидный геном (рис. 17-13, см. цв. вклейку).
Сравнительная геномная гибридизация (Comparative Genomic Hybri dization - CGH). В 1992 г. Анне Каллиониеми и соавт. предложили во многих отношениях революционный для цитогенетики человека метод сравнительной геномной гибридизации, позволяющий провести скрининг всего кариотипа на предмет числовых и несбалансированных хромосомных перестроек, не получая при этом препаратов хромосом из анализируемых образцов тканей (Kallioniemi et al., 1992). Первоначально CGH была разработана для анализа хромосомных аберраций в клетках солидных опухолей, не поддающихся успешному культивированию, и позволила совершить серьезный прорыв в цитогенетике злокачественных новообразований. Тем не менее вскоре метод нашел применение и в практике клинической цитогенетики, пренатальной и даже преимплантационной диагностики. CGH - конкурентная гибридизация in situ на нормальных метафазных пластинках здорового человека двух геномных ДНКбиблиотек. Одна из них получена из анализируемой ткани, вторая - из контрольного образца, взятых в эквимолярных количествах и меченных разными флюорохромами (рис. 17-14). Современные модификации метода позволяют провести гибридизацию не только на метафазных хромосомах, но и на микрочипах, представленных наборами клонированных фрагментов ДНК (BAC, YAC, PAC-клоны, олигонуклеотидные последовательности). Такой вариант гибридизации известен как матричная CGH (array CGH).
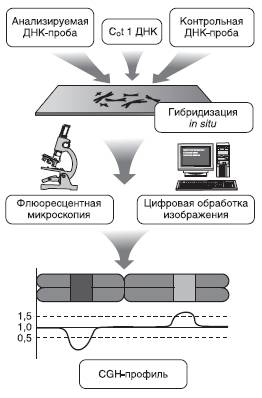
Рис. 17-14. Принцип сравнительной геномной гибридизации
Источником анализируемой ДНК могут быть любые ядросодержащие клетки организма: лимфоциты периферической крови, фибробласты, клетки амниотической жидкости и хориона, отдельные бластомеры или полярные тельца, а также образцы опухолевой ткани. Для исследования может быть доступен и архивный материал, зафиксированный в формалине и заключенный в парафиновые блоки. В качестве источника ДНК для контрольной библиотеки, как правило, используют лимфоциты периферической крови мужчины. Мечение геномных ДНК-зондов осуществляют непосредственно флюорохромами либо репортерными молекулами, детекцию которых производят с помощью соответствующих антител. На практике в качестве метки для тестируемой ДНК выбирают флюорохромы, имеющие зеленое свечение (например, FITC), а для контрольного образца - красное свечение (например, TAMRA). Отношение интенсивности зеленого сигнала к красному вдоль каждой хромосомы (в каждой точке микрочипа) отражает относительное содержание последовательностей ДНК в исследуемом образце по сравнению с контролем и обозначается как флюоресцентное отношение (в англоязычной литературе - green/red ratio). В норме при отсутствии хромосомного дисбаланса флюоресцентное отношение интенсивности зеленого сигнала к красному будет равно 1,0. Дупликация определенного региона или трисомия по какой-либо хромосоме набора в клетках тестируемой ткани приведет к увеличению флюоресцентного отношения, тогда как в случае делеции или моносомии будет зарегистрировано его уменьшение. Теоретически при трисомии флюоресцентное отношение должно составлять 1,5, а при моносомии - 0,5.
Очевидное преимущество CGH заключается в возможности молекулярного скрининга всего хромосомного набора в течение одной реакции гибридизации. Кроме того, этот анализ не требует приготовления препаратов метафазных хромосом из анализируемой ткани, что открывает новые перспективы в исследовании хромосомного дисбаланса в клетках, неспособных к нормальной пролиферации в культуре. Для проведения исследования используют исключительно образец геномной ДНК из анализируемой ткани или клетки. В связи с этим в последнее время в отношении CGH и особенно ее варианта на микрочипах все чаще можно услышать новый для цитогенетики человека термин - «молекулярное» или «виртуальное кариотипирование» (Sanlaville et al., 2005). CGH позволяет диагностировать анеуплоидию хромосом (рис. 17-15, см. цв. вклейку), несбалансированные структурные аберрации, амплификации и делеции отдельных хромосомных регионов.
Среди ограничений CGH необходимо отметить следующие.
Невозможность детекции сбалансированных хромосомных перестроек и полиплоидии. Сбалансированные аберрации хромосом не приводят к изменению числа копий ДНК, поэтому и не могут быть обнаружены с использованием принципа сравнительной геномной гибридизации. Применение в реакции эквимолярных количеств тестируемой и контрольной ДНК не позволяет диагностировать нарушения плоидности.
Сложности в диагностике мозаичных форм хромосомных нарушений, идентификация которых зависит от частоты аномальной клеточной линии в исследуемом образце.
Невозможность определения точной структуры хромосомной перестройки. Порядок и ориентацию сегментов хромосом, вовлеченных в перестройку, нельзя определить с помощью CGH, поэтому требуется применение дополнительных методов исследования. Впрочем, здесь же следует отметить, что CGH - скрининговый метод анализа кариотипа, и его результаты требуют верификации с помощью молекулярно-цитогенетических (например, FISH) или молекулярно-генетических (ПЦР, секвенирование) технологий.
Невысокая разрешающая способность метода на метафазных хромосомах, которая составляет 10-20 млн пар оснований и, по существу, оказывается сопоставимой с разрешающими возможностями стандартного цитогенетического анализа.
К настоящему времени уже найден ряд оригинальных подходов, позволяющих решить некоторые из указанных проблем. Так, для анализа сбалансированных транслокаций предложен метод матричного окрашивания хромосом (array painting). В данном случае на микрочипе из BAC-клонов проводят гибридизацию двух дифференциально-меченых ДНК-библиотек, полученных из аберрантных хромосом методом проточной сортировки. Гибридизация библиотек проходит только с теми клонами микрочипа, которые комплементарны последовательностям хромосом, вовлеченных в транслокацию. Величина флюоресцентного отношения оказывается меньше или больше 1,0 в тех точках, которые соответствуют одной из анализируемых хромосом, в зависимости от протяженности участка хромосомы, вовлеченного в перестройку. При этом граница перехода флюоресцентного отношения (1,0) соответствует точке разрыва при транслокации (рис. 17-16, см. цв. вклейку). Матричное окрашивание обеспечивает высокоразрешающее картирование регионов разрывов хромосом, однако следует отметить, что оно позволяет только анализировать происхождение уже известных транслокаций, но не обнаруживать их.
С целью идентификации некоторых вариантов триплоидии предложено в качестве контрольной ДНК при гибридизации использовать не клетки с нормальным кариотипом, а клеточные линии с кариотипом 47,XXY от пациентов с синдромом Клайнфелтера. Что касается проблемы хромосомного мозаицизма, то возможности CGH в обнаружении анеуплоидии в мозаичном состоянии с доминирующей эуплоидной клеточной линией остаются дискуссионными. Несмотря на то что нижнюю границу чувствительности метода CGH при анализе мозаицизма оценивают около 40% (Bryndorf et al., 1995), описаны отдельные случаи детекции анеуплоидии в образцах и с более низким процентом аномальных клеток. В практике авторов описан случай мозаичной моносомии хромосомы 22 в 33% клеток внутриутробно погибшего эмбриона, подтвержденной с помощью интерфазного FISH-анализа (Островерхова и др., 2002). Следует отметить, что комбинированное использование методов CGH и FISH остается наиболее эффективным подходом к диагностике мозаичных форм хромосомных аномалий.
Повышения разрешающей способности классического варианта CGH на метафазных хромосомах можно достичь при использовании оригинального подхода, предложенного Марией Киркхов, - сравнительной геномной гибридизации высокого разрешения (High-Resolution CGH, HR-CGH). Суть метода заключается в построении доверительных референсных интервалов для каждой отдельной хромосомы, в пределах которых вариацию профиля флюоресцентного отношения считают нормальной. Такие интервалы можно получить при проведении гибридизации с использованием серии дифференциально-меченых образцов ДНК, полученных от нескольких индивидуумов с нормальным кариотипом. При диагностике аномалий заключение о хромосомном дисбалансе делают в том случае, если анализируемый профиль флюоресцентного отношения (его доверительный интервал) выходит за границы контрольного доверительного интервала (рис. 17-17, см. цв. вклейку). Этот подход обеспечивает точную идентификацию скрытых структурных аберраций на метафазных хромосомах с разрешением 3-5 Mb. Программное обеспечение для HR-CGH ведущие мировые производители все чаще включают в пакеты программ для проведения сравнительной геномной гибридизации на метафазных хромосомах (Applied Imaging, Applied Spectral Imaging).
Преимущества CGH наиболее очевидны в цитогенетике злокачественных новообразований, где ее успешно используют в качестве основного скринингового метода для анализа хромосомных аберраций в опухолевых клетках (рис. 17-18, см. цв. вклейку). В базе данных Progenetix (www.progenetix.com) происходит накопление и систематизация результатов цитогенетических исследований опухолей различных локализаций, проведенных с помощью CGH как на метафазных хромосомах, так и на микрочипах. На момент написания настоящей главы (август 2010 г.) в базе содержится информация о 25 880 обследованных образцах по данным 907 публикаций. Использование архивного материала дает возможность исследовать с помощью CGH опухоли, охарактеризованные гистологически, патологически и с известным клиническим результатом. Архивные банки опухолевых тканей, созданные во многих лабораториях, позволяют выполнить ретроспективное исследование злокачественной прогрессии (включая генетический анализ редких опухолей) и провести анализ корреляции изменений генома с клиническими данными. Метод обеспечивает уникальную возможность идентификации определенного спектра хромосомных аберраций, значимых для оценки риска возникновения и прогноза течения онкологических заболеваний. Действительно, за последние несколько лет возникла серия сообщений о применении технологии матричной CGH для идентификации геномных изменений в специфических локусах или отдельных участках хромосом при тех или иных формах рака. В частности, разработаны и рекомендованы к практическому применению микрочипы на короткое плечо хромосомы 3 для ранней диагностики геномных мутаций при раке эпителия ротовой полости, а также «5p» и «1p» биочипы для диагностики остеосарком.
Отсутствие необходимости культивирования клеток, а также получение результатов в относительно короткое время обусловило возможность использования CGH для пренатальной диагностики хромосомных аномалий. Более того, показан потенциал успешного применения матричной CGH для пренатальной диагностики анеуплоидий с использованием в качестве источника анализируемой ДНК внеклеточной ДНК плода в периферической крови матери. Такой подход открывает новые перспективы в развитии процедур неинвазивной пренатальной диагностики хромосомных болезней.
Учитывая, что хромосомные аномалии - причина ранней внутриутробной гибели более половины зародышей, CGH становится одним из эффективных инструментов диагностики причин невынашивания беременности, обеспечивая возможность полного скрининга хромосомного набора с целью обнаружения анеуплоидии. Результаты проведенных исследований демонстрируют присутствие у внутриутробно погибших эмбрионов моносомий по аутосомам, двойных и тройных анеуплоидий, не обнаруживаемых стандартными методами метафазного анализа вследствие низкой пролиферативной активности зародышевых клеток в культуре. Кроме того, применение матричной CGH позволило идентифицировать ряд микроструктурных аберраций хромосом, роль которых в этиологии остановки внутриутробного развития зародышей еще предстоит прояснить.
Одним из приоритетных направлений становится применение CGH для преимплантационного скрининга анеуплоидий. Числовые аномалии хромосом - доминирующий фактор, ограничивающий возможность успешной имплантации бластоцисты и наступления беременности в циклах вспомогательных репродуктивных технологий. Использование ограниченного числа ДНК-зондов (как правило, на 5-9 хромосом) для диагностики анеуплоидий с помощью интерфазной FISH в одном-двух доступных для анализа бластомерах не позволяет полностью исключить присутствие дисбаланса по другим хромосомам у развивающегося зародыша. Получение препаратов метафазных хромосом из отдельных бластомеров также представляет серьезную методическую проблему. В связи с этим CGH - альтернативный метод преимплантационной диагностики анеуплоидий. Показано, что его применение по сравнению с интерфазным FISH-анализом по пяти хромосомам набора способствует практически двукратному повышению вероятности имплантации бластоцисты и наступлению беременности. Вместе с тем необходимо отметить, что успешная реализация CGH для преимплантационной диагностики хромосомных нарушений должна быть тесно связана с развитием эффективных и репрезентативных методов полногеномной амплификации ДНК единичной клетки. Недавно появились первые сообщения об успешной преимплантационной диагностике анеуплоидий с помощью матричной CGH как на единичных бластомерах, так и на полярных тельцах.
Кроме перспектив практического применения, использование сравнительной геномной гибридизации позволяет получить принципиально новые данные для цитогенетики раннего развития человека (Лебедев, 2007). Так, например, установлено, что частота обнаружения эмбрионов с нормальным кариотипом во всех доступных для исследования бластомерах варьирует в пределах от 25 до 43%. Очевидно, что эти зародыши обладают наибольшими шансами для нормальной имплантации. Примечательно, что частота определения эмбрионов с нормальным кариотипом в целом оказывается сопоставимой с шансами наступления и нормального протекания беременности, которые, по некоторым оценкам, в среднем составляют около 25% на один менструальный цикл у женщин в возрасте 20-30 лет. Среди хромосомных нарушений у преимплантационных зародышей преобладают числовые аномалии хромосом, представленные трисомиями, моносомиями и даже нуллисомиями по отдельным аутосомам. В относительно небольших по объему выборках обследованных к настоящему времени эмбрионов уже идентифицированы три- и моносомии по всем хромосомам набора. Наконец, у преимплантационных эмбрионов зарегистрирована высокая частота хромосомного мозаицизма, которая варьирует в пределах от 40 до 60%, а от 8 до 17% зародышей обладают хаотичным кариотипом, имея в своем составе бластомеры с различными вариантами аномалий.
Одна из задач медико-генетического консультирования и пренатальной диагностики - идентификация несбалансированных структурных хромосомных перестроек, что имеет важное диагностическое и прогностическое значение, а также позволяет обнаружить гены, ответственные за формирование клинической картины заболевания. Кроме того, хромосомная этиология ряда дисморфических нарушений и пороков развития связана со скрытыми хромосомными перестройками, например с субхромосомными делециями, которые обычно не обнаруживают при стандартном цитогенетическом исследовании. Все эти типы хромосомных аберраций можно диагностировать при использовании CGH, особенно на платформе микрочипов. В подавляющем большинстве случаев сбалансированные хромосомные перестройки не приводят к формированию аномального фенотипа у их носителей, но некоторые носители de novo сбалансированных перестроек или унаследованных от родителей аберраций могут демонстрировать аномальные фенотипические признаки. Патологический фенотип в таких случаях можно объяснить повреждениями генов, позиционным эффектом или скрытым хромосомным дисбалансом в точке разрыва или другой области генома. Матричная CGH - удобный подход для обнаружения скрытых хромосомных аберраций в таких случаях. К настоящему времени уже проведена серия исследований, в которых обнаружены дополнительные хромосомные перестройки у пациентов со сбалансированными аберрациями (Sanlaville et al., 2005). Большинство из установленных аномалий имели размер менее 3-5 Mb и поэтому были пропущены как при использовании стандартного цитогенетического анализа, так и классического варианта CGH на метафазных хромосомах.
Следует отметить, что особую проблему при интерпретации результатов матричной CGH и установлении генофенотипических корреляций представляет полиморфизм по числу копий крупных блоков хромосом (CNV - Copy Number Variation). Его неожиданно высокая частота с размером повторяющихся элементов от 100 kb до 2,2 Mb впервые была обнаружена в геноме человека в 2004 г. В отличие от SNP, CNV-полиморфизм пока еще остается плохо каталогизированным: отсутствуют четкие данные как о размере повторяющихся единиц, так и об их копийности и локализации в хромосомных регионах. В значительной степени это обусловлено низкой чувствительностью микрочиповых технологий по сравнению с методами секвенирования генома. Так, число CNV, обнаруживаемых с помощью матричной CGH, обычно составляет от нескольких десятков до нескольких сотен на геном, тогда как секвенирование целых геномов позволяет идентифицировать несколько тысяч CNV.
Значимость CNV вызывает множество дискуссий, при этом фенотипический эффект такого полиморфизма остается практически неизученным. Есть мнение, что вариабельность по числу копий повторов нельзя считать нейтральным полиморфизмом, несмотря на то что его обнаруживают и у здоровых индивидуумов. Не исключено, что изменчивость по числу копий крупных участков генома может вести к серьезным фенотипическим последствиям, присутствуя в гомозиготном состоянии или в сочетании с другим неаллельным полиморфизмом. Так, например, полиморфные блоки, сцепленные с локусом нефрофтизиса (2q13), оказываются делетированными в гетерозиготном состоянии у некоторых здоровых индивидуумов. В гомозиготном состоянии такие делеции ведут к серьезному поражению почек. Кроме того, отмечено, что полиморфные регионы фланкируют области частых делеций и амплификаций в раковых клетках. Некоторые полиморфные области содержат и структурные гены, в частности ген рецептора нейропептида Y4 (PPYR1), продукт которого вовлечен в регуляцию массы тела. Необходимо отметить, что, кроме CNV, описаны и эухроматиновые полиморфные варианты, например в сегменте 8p23 и некоторых субтеломерных регионах хромосом, которые также затрудняют интерпретацию результатов гибридизации (Sanlaville et al., 2005).
Применительно к пренатальной диагностике хромосомных аномалий дилемма в трактовке факта изменения числа копий того или иного локуса приобретает особую значимость, так как анализ становится менее информативным, а факт обнаружения дисбаланса, имеющего неясное клиническое значение, вероятно, вызовет определенное беспокойство. Таким образом, решающим становится дизайн полногеномного биологического чипа, так как именно от него зависят качество и информативность анализа. Кроме того, до момента использования матричной CGH в клинической практике представляется необходимым накопление и систематизация информации о распространении CNV-полиморфизма в геноме человека. Для этих целей организована специальная база данных DECIPHER (DatabasE of Chromosomal Imbalance and Phenotype in Humans using Ensembl Resources), в которой обобщена информация о полиморфных участках генома (www.decipher.sanger. ac.uk). Она позволяет визуализировать хромосомную локализацию того или иного клона ДНК, с помощью которого обнаружена делеция или дупликация, и сопоставить полученный результат с уже имеющейся информацией об известных полиморфизмах или микроделеционных (микродупликационных) синдромах, связанных с этим участком хромосомы.
Наряду с полногеномными CGH-чипами, существуют и так называемые мишеневые матрицы (targeted genomic microarrays), сконструированные с использованием клонов, представляющих регионы, вовлеченные в частые хромосомные перестройки. Аналогичный вариант чипа уже был обсужден выше при рассмотрении вопросов диагностики специфических аберраций при некоторых типах рака. Мишеневые матрицы начинают использовать в клинической практике для диагностики хромосомных аномалий у детей с врожденными пороками развития, умственной отсталостью или инвалидностью вследствие пороков развития. Хотя при их применении существует возможность анализа только определенных хромосомных аберраций, в отличие от полногеномного скрининга с помощью матричной CGH этот подход позволяет существенно уменьшить число CNV. До тех пор пока не будут детально охарактеризованы различные варианты полиморфизма числа копий в геноме, представляется предпочтительным использование именно мишеневых биологических чипов, специально разработанных для пренатального тестирования.
Говоря о перспективах применения матричной CGH в целях пренатальной диагностики, следует отметить, что с ее использованием для большого числа хромосомных аномалий можно будет определить мозаицизм с частотой анеуплоидного клона не менее 20%. Это дает твердые основания для использования матричной CGH в пренатальной диагностике, так как возможная контаминация материнской кровью не окажет заметного влияния на идентификацию хромосомных нарушений. Еще одно преимущество этого метода - возможность получения результата с использованием внеклеточной фетальной ДНК, выделенной из амниотической жидкости.
Применение матричной CGH оказывается ценным для картирования и точного измерения размера хромосомной перестройки, что открывает возможности определения и уточнения генофенотипических корреляций при тех или иных хромосомных синдромах. Так, например, моносомия 1p36 - одна из наиболее частых терминальных делециий, регистрируемая с частотой 1:5000 новорожденных. Клинически она манифестирует аномалиями лица, задержкой развития, нарушениями поведения, гипотонией, кардиомиопатией, аномалиями зрения, сенсорной потерей слуха и судорогами. Размер терминальной делеции варьирует от 1,5 до 10,5 Mb, определяя вариабельность клинических признаков. С использованием CGH на микрочипе с последовательностями, комплементарными региону 1pter, становится возможной корректная идентификация интерстициальных и терминальных делеций, а также дериватных хромосом у пациентов с клиническими признаками этого синдрома.
Наконец, матричная CGH - мощный инструмент, используемый в целях генетического картирования, особенно в тех случаях, когда анализ сцепления оказывается неинформативным вследствие спорадической этиологии заболевания. Так, например, с помощью матричной CGH была исследована субмикроскопическая хромосомная аберрация - делеция 8q12 у пациентов с ассоциацией CHARGE (Coloboma, Heart malformation, choanal Atresia, Retarded growth, Genital hypoplasia, Ear abnormalities and/or deafness). В результате был идентифицирован новый ген CDH7 (Chromodomain Helicase DNA binding 7), локализованный в области делеции. В дальнейшем у части обследованных пациентов с ассоциацией CHARGE были обнаружены точковые мутации в этом гене.
Таким образом, технология CGH позволяет провести скрининг хромосомного набора с целью обнаружения числовых и несбалансированных хромосомных аномалий в рамках одного эксперимента. Результаты, полученные с помощью этого метода, служат основой для более полного и детального исследования конкретных районов хромосом, что позволяет подойти к идентификации мутантных генов, причастных к развитию заболевания. Можно ожидать, что CGH, как наиболее экономичная, информативная и быстрая технология по сравнению с другими методами молекулярно-генетического анализа, со временем займет достойное место в практике клинической цитогенетики и медико-генетического консультирования.
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ ТЕХНОЛОГИИ В ДИАГНОСТИКЕ ХРОМОСОМНЫХ БОЛЕЗНЕЙ
Как было отмечено в самом начале настоящей главы, существуют два основных подхода к анализу хромосомных перестроек, связанных с необходимостью приготовления хромосомных препаратов или ее отсутствием. Интерфазный FISH-анализ и сравнительная геномная гибридизация - яркая иллюстрация молекулярно-цитогенетических технологий, обеспечивающих диагностику хромосомных аномалий и не требующих приготовления препаратов метафазных хромосом. Объектом исследования в первом случае становится хроматин интерфазного ядра, во втором - метафазные хромосомы, которые служат исключительно матрицами для проведения гибридизации, либо клонированные последовательности ДНК, размещенные на микрочипе. Так или иначе, существуют предпосылки к использованию в качестве объекта цитогенетического анализа не только метафазных хромосом, но и молекул ДНК. В связи с этим применение ряда методов молекулярно-генетического анализа для диагностики хромосомных аномалий выглядит вполне обоснованным (см. главу 16).
ЗАКЛЮЧЕНИЕ
Завершая обзор современных методов диагностики хромосомных болезней, следует обратить внимание на исключительно широкий диапазон их диагностических возможностей. В настоящее время становится возможным проведение цитогенетического исследования на различных уровнях организации хромосомного материала - от отдельных молекул ДНК (микрочипы) и деконденсированного хроматина (fiber-FISH) до хроматина интерфазных ядер (интерфазная цитогенетика) и суперспирализованных метафазных хромосом (FISH, CISS). ДНК-зонды, применяемые для диагностики хромосомных аномалий, могут быть аллельспецифичными, комплементарными повторяющимся или уникальным последовательностям генома, либо вовсе представленными всей геномной ДНК. Для проведения различных вариантов молекулярно-цитогенетического исследования можно использовать цитологические препараты метафазных хромосом, интерфазных ядер или срезов тканей. Анализ возможен как для культивированных, так и для некультивированных клеток, в том числе и для клеток вовсе неспособных к нормальной пролиферации in vitro. В некоторых случаях диагностику хромосомных аберраций можно проводить с использованием образцов ДНК без получения препаратов метафазных хромосом. Анализ возможен как на свежеприготовленных препаратах, так и на архивном биологическом материале. Отмеченные особенности, наряду с возможностью идентификации всех типов хромосомного дисбаланса, делают методы молекулярно-цитогенетического анализа практически универсальным инструментом для всестороннего исследования и диагностики хромосомных нарушений у человека.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Артюхова В.Г., Лебедев И.Н., Маркова Е.В., Светлаков А.В. Структура числовых хромосомных нарушений и особенности их фенотипических эффектов на преимплантационных этапах развития человека // Мед. генетика. - 2009. - Т. 8, № 2. - С. 19-24.
Баранов В.С., Кузнецова Т.В. Цитогенетика эмбрионального развития человека: Научнопрактические аспекты. - СПб., 2007. - 640 с.
Бочков Н.П., Пузырев В.П., Смирнихина С.А. Клиническая генетика: Учебник. - М.: ГЭОТАР-Медиа, 2011. - 544 с.
Бочков Н.П., Чеботарев А.Н. Наследственность и мутагены внешней среды. - М.: Медицина, 1989. - 272 с.
Ворсанова С.Г., Юров Ю.Б., Чернышов В.Н. Медицинская цитогенетика (учебное пособие). - М.: Медпрактика-М, 2006. - 300 с.
Еголина Н.А., Захаров А.Ф. Спирализация хромосом китайского хомячка после обработки клеток 5-бромдеоксиуридном в двух последовательных митотических циклах // Цитология. - 1972. - Т. 14, № 2. - С. 165-171.
Лебедев И.Н. Современные молекулярно-цитогенетические технологии в репродуктивной биологии и медицине // Мед. генетика. - 2007. - Т. 6, № 10. - С. 21-26.
Назаренко С.А. Изменчивость хромосом и развитие человека. - Томск: Изд-во Томского университета, 1993. - 200 с.
Назаренко С.А., Яковлева Ю.С. Цитогенетика человека и хромосомные болезни: Методическое пособие. - Томск: STT, 2001. - 83 с.
Островерхова Н.В., Назаренко С.А., Лебедев И.Н. и др. Детекция анеуплоидии у спонтанных абортусов методом сравнительной геномной гибридизации // Генетика. - 2002. - Т. 38, № 12. - С. 1435-1442.
Рубцов Н.Б. Методы работы с хромосомами млекопитающих: Учебное пособие. - Новосибирск: Изд-во Новосибирского государственного университета, 2006. - 152 с.
Рубцов Н.Б., Карамышева Т.В. Прямая и обратная цитогенетика // Молекулярнобиологические технологии в медицинской практике / Под общ. ред. А.Б. Масленникова. - Новосибирск: Альфа Виста Н., 2009. - С. 274-280.
Bryndorf T., Kirchhoff M., Rose H. et al. Comparative genomic hybridization in clinical cytogenetics // Am. J. Hum. Genet. - 1995. - Vol. 57. - P. 1211-1220.
Carter N.P., Ferguson-Smith M.A., Perryman M.T. et al. Reverse chromosome painting: a method for the rapid analysis of aberrant chromosomes in clinical cytogenetics // J. Med. Genet. - 1992. - Vol. 29. - P. 299-307.
Chudoba I., Plesch A., Lörch T. High-resolution multicolour-banding: a new technique for refined FISH analysis of human chromosomes // Cytogenet. Cell Genet. - 1999. - Vol. 84. - P. 156-160.
ISCN (2009): An International System for Human Cytogenetic Nomenclature / Shaffer L.G., Slovak M.L., Campbell L.J. - Basel, 2009. - 138 p. Kallioniemi A., Kallioniemi O.P., Sudar D. et al. Comparative genomic hybridization for molecular cytogenetic analysis of solid tumors // Science. - 1992. - Vol. 258. - P. 818-821.
Lebedev I.N., Ostroverkhova N.V., Nikitina T.V. et al. Features of chromosomal abnormalities in spontaneous abortion cell culture failures detected by interphase FISH analysis // Eur. J. Hum. Genet. - 2004. - Vol. 12. - P. 513-520.
Lichter P., Cremer T., Borden J. et al. Delineation of individual human chromosomes in metaphase and interphase cells by in situ suppression hybridization using recombinant DNA libraries // Hum. Genet. - 1988. - Vol. 80. - P. 224-234.
Lomax B., Kalousek D., Kuchinca B. et al. The utilization of interphase cytogenetic analysis for the detection of mosaicism // Hum. Genet. - 1994. - Vol. 93. - P. 243-247.
Nederlof P.M., van der Flier S., Wiegant J. et al. Multiple fluorescence in situ hybridization // Cytometry. - 1990. - Vol. 11. - P. 126-131.
Pinkel D., Straume T., Gray J.W. Cytogenetic analysis using quantitative, high sensitivity fluorescence hybridization // Proc. Natl Acad. Sci. USA. - 1986. - Vol. 83. - P. 2943-2938.
Rooney D.E., Czepulkowski B.H. Human Cytogenetics. A Practical Approach. - New York: Oxford University Press, 1992. - Vol. 1. - 274 p., Vol. 2. - 293 p.
Sanlaville D., Lapierre J., Turleau C. et al. Molecular karyotyping in human constitutional cytogenetics // Eur. J. Med. Genet. - 2005. - Vol. 48. - P. 214-231.
Speicher M.R., Carter N.P. The new cytogenetics: blurring the boundaries with molecular biology // Nat. Rev. Genet. - 2005. - Vol. 6. - P. 782-792.