Реперфузионная терапия в остром периоде инфаркта миокарда. - М.: ГЭОТАР-Медиа, 2010. - 168 с.: ил. - ISBN 978-5-9704-1856-7. |
Аннотация
Книга посвящена разработке новых стратегий реперфузионной терапии при инфаркте миокарда, основанных на пролонгировании применения первичных и спасительных ЧКВ в остром периоде у больных с исходно повышенным риском смерти при отсутствии возможности своевременного их выполнения, а также вмешательств через 12-24 часа после успешного тромболизиса, направленных на предупреждение развития рецидивов ишемии и реокклюзии. Приведены данные сравнительной оценки эффективности различных стратегий лечения 1245 больных, поступивших в НИИ СП им. Н.В. Склифосовского с 2003 по 2007 год включительно. Рассмотрены требования, предъявляемые к эндоваскулярным методам лечения острого инфаркта миокарда, количественные способы оценки риска смерти, ЭКГ и эхокардиографические алгоритмы определения инфаркт-связанной артерии, уровня окклюзии и зоны риска, методы оценки реперфузионной терапии. Представлены рекомендации Европейского общества кардиологов, направленные на повышение эффективности лечения острого инфаркта миокарда, рассмотрены алгоритмы применения реперфузионной терапии в разных странах, представлен опыт института по оптимизации доступности реперфузионной терапии, применимый в нашей стране и за рубежом.
Книга рассчитана на кардиологов, специалистов в области рентгенэндоваскулярной диагностики и лечения, кардиохирургов, анестезиологов-реаниматологов, врачей скорой помощи и поликлиник, специалистов ЭКГ и функциональной диагностики, терапевтов.
АНАТОМИЯ КОРОНАРНОГО КРОВОСНАБЖЕНИЯ
Сердце расположено в центрально-левой части грудной клетки. Оно лежит на диафрагме, верхушка его направлена вперед, вниз и влево. Анатомия кровоснабжения сердца весьма вариабельна. Глубина и распространенность инфаркта зависит от анатомических особенностей коронарного русла, выраженности атеросклеротического процесса, степени развития коллатералей и других факторов.
Известно, что сердце кровоснабжается двумя коронарными артериями, отходящими первыми ветвями от аорты. Левая коронарная артерия начинается стволом от левого синуса, идет позади выносящего тракта правого желудочка. Протяженность ее составляет 10 мм, диаметр - от 3 до 6 мм. Ствол левой коронарной артерии обычно делится на две ветви: переднюю межжелудочковую и огибающую. Место деления ствола прикрыто ушком левого предсердия. В 30% случаев между ними берет начало третья ветвь - срединная (промежуточная), которая является аналогом диагональной ветви передней межжелудочковой артерии, кровоснабжающей передние отделы левого желудочка.
С клинической точки зрения из трех коронарных артерий, васкуляризирующих левый желудочек, основной является передняя межжелудочковая ветвь. Она кровоснабжает более 50% сердечной мышцы. В англоязычной литературе ее называют «widow maker» [1], так как тромбоз в проксимальной ее части зачастую приводит к смерти мужчин в расцвете сил. Передняя межжелудочковая ветвь идет в одноименной борозде в направлении верхушки сердца. Главными ее ветвями являются перегородочные (септальные) и диагональные. Септальные ветви отходят под прямым углом и углубляются в толщу межжелудочковой перегородки, где анастомозируют с аналогичными ветвями задней межжелудочковой ветви правой коронарной артерии. Они различаются по количеству, длине и направлению, снабжают передние две трети межжелудочковой перегородки. Диагональные ветви расположены на переднебоковой поверхности сердца. У большинства больных таких ветвей бывает от одной до трех. Они обеспечивают кровоснабжение передней и частично боковой стенки левого желудочка. В 80% случаев передняя межжелудочковая ветвь заходит на диафрагмальную поверхность нижней стенки, кровоснабжая верхушку и частично заднедиафрагмальные отделы левого желудочка. В остальных 20% случаев передняя межжелудочковая ветвь заканчивается на уровне верхушки или не доходит до нее. В этих случаях ее кровоснабжение осуществляется задней межжелудочковой ветвью, отходящей от правой коронарной артерии или огибающей ветви. Между проксимальной частью передней межжелудочковой ветви и правой коронарной артерией по передней стенке правого желудочка проходят крупные анастомозы. В передней межжелудочковой артерии выделяют проксимальный участок от устья до отхождения первой значимой септальной или диагональной ветви, средний - до второй или третьей диагональной ветви и дистальный.
Огибающая ветвь начинается под углом от ствола левой коронарной артерии. Она идет по левой атриовентрикулярной борозде и дает от одной до трех ветвей тупого края, кровоснабжающих боковую стенку левого желудочка. После отхождения краевых ветвей диаметр огибающей ветви значительно уменьшается, она не достигает задней межжелудочковой борозды. Однако в 15% случаев огибающая ветвь переходит на заднюю поверхность, образует заднебоковую ветвь и кровоснабжает заднебоковую поверхность левого желудочка. В половине этих случаев огибающая ветвь доходит до пересечения межжелудочковой, межпредсердной и предсердножелудочковой борозд, образует заднюю межжелудочковую ветвь и кровоснабжает еще и нижнюю треть межжелудочковой перегородки. В огибающей ветви выделяют проксимальный участок от устья до отхождения ветви тупого края, средний - до второй или третьей ветви тупого края и дистальный.
Правая коронарная артерия отходит от правого переднего синуса аорты и идет к правой атриовентрикулярной борозде сверху вниз и вправо в направлении перекреста. Первая ветвь, отходящая от правой коронарной артерии, ведет к артериальному конусу. При окклюзии передней межжелудочковой ветви она участвует в поддержании коллатерального кровотока. Вторая - ветвь синусового узла - идет в противоположном направлении, кровоснабжая одноименный узел и правое предсердие. За ними следуют ветви к правому желудочку, которые снабжают кровью переднюю поверхность правого желудочка. В средней части, несколько выше острого правого края сердца, правая коронарная артерия дает начало одной или более ветвям острого края, которые идут в сторону верхушки сердца. Они снабжают кровью переднюю и заднюю стенки правого желудочка, а также обеспечивают коллатеральный кровоток при окклюзии передней межжелудочковой ветви. Затем правая коронарная артерия переходит на заднюю поверхность сердца и, загнувшись под прямым углом, следует по задней межжелудочковой борозде до верхушки, давая, в свою очередь, начало небольшим нижним септальным ветвям, а также ветви к задней поверхности правого желудочка. Перед местом схождения всех борозд сердца на задней поверхности правая коронарная артерия дает ветвь к атриовентрикулярному узлу. Ствол пучка Гиса имеет двойное кровоснабжение. Проксимальные отделы правой ножки получают кровь от передней межжелудочковой ветви и/или ветви к атриовентрикулярному узлу. Дистальные отделы кровоснабжаются ветвями передней межжелудочковой артерии. Кровоснабжение передней ветви левой ножки пучка Гиса аналогично таковому проксимальных отделов правой ножки. Задняя ветвь левой ножки пучка Гиса получает кровь от огибающей ветви, а также от ветви к атриовентрикулярному узлу и задней межжелудочковой ветви. Проксимальным участком правой коронарной артерии называют часть от устья до отхождения первой правожелудочковой ветви. Последняя из ветвей острого края ограничивает средний отдел, затем следует дистальный участок правой коронарной артерии.
Тип кровоснабжения определяют по васкуляризации нижнебоковой зоны левого желудочка. При наиболее часто встречаемом правом типе (85%) большая часть этой зоны питается за счет правой коронарной артерии. Посредством задней межжелудочковой ветви она кровоснабжает нижнюю часть межжелудочковой перегородки, а через заднебоковую ветвь - нижнезаднюю стенку левого желудочка. Боковая стенка кровоснабжается огибающей ветвью. Она развита слабо, доходит лишь до тупого края. При сбалансированном типе кровоснабжения, который встречается в 7,5% случаев, соотношение меняется в пользу огибающей ветви. Помимо ветвей тупого края, она образует заднебоковую ветвь, которая кровоснабжает значительную часть нижнебоковой зоны левого желудочка, а правая коронарная артерия через заднюю межжелудочковую ветвь питает только нижнюю треть межжелудочковой перегородки. В 7,5% случаев встречается левый тип, при котором огибающая ветвь, помимо ветвей тупого края, образует и заднебоковую ветвь, и заднюю межжелудочковую ветвь, кровоснабжая всю нижнебоковую зону левого желудочка; правая коронарная артерия в васкуляризации левого желудочка участия не принимает.
Между коронарными артериями и их ветвями существуют внутри- и межсистемные анастомозы диаметром 200-350 мкм. Несмотря на относительно большой диаметр, стенки этих сосудов состоят только из эндотелия. D.C. Levin и соавт. (1973) считают, что эти анастомозы в норме не функционируют, окклюзия ветвей коронарных артерий приводит к их раскрытию, они расширяются и становятся визуализируемыми при коронарографии.
ТРЕБОВАНИЯ ПРИ ПРИМЕНЕНИИ КОРОНАРОГРАФИИ И ЧРЕСКОЖНЫХ КОРОНАРНЫХ ВМЕШАТЕЛЬСТВ
В настоящее время существует три метода катетеризации аорты с возможностью выполнения коронарографии и левой вентрикулографии: трансфеморальный, трансаксиллярный и трансрадиальный. Наиболее распространенным является трансфеморальный доступ. Трансрадиальный доступ имеет ряд преимуществ, что делает его идеальным для амбулаторного лечения. Он позволяет снизить риск осложнений и сократить затраты на проведение процедуры. Трансаксиллярный доступ применяется значительно реже.
При проведении коронарографии, в зависимости от того, к какой поверхности грудной клетки обследуемого обращена регистрирующая камера, различают переднезаднюю, правую и левую косые и боковую проекции. Для лучшей визуализации артерий регистрирующую камеру отклоняют от строго вертикальной плоскости ближе к голове или к ногам обследуемого - краниальное и каудальное отклонение соответственно. Краниальное отклонение используют для лучшей визуализации передней межжелудочковой ветви, а каудальное - огибающей ветви. Коронарография левой коронарной артерии выполняется в 4-8 проекциях:
-
правая косая проекция с каудальной ангуляцией (RAO 30°, CD 20°);
-
правая косая проекция с краниальной ангуляцией (RAO 45°, CR 20°);
-
переднезадняя проекция с краниальной ангуляцией (АР, CR 30°);
-
переднезадняя проекция с каудальной ангуляцией (АР, CD 30°);
-
левая косая проекция с краниальной ангуляцией (LAO 55°, CR 20°);
-
левая косая проекция с каудальной ангуляцией (LAO 60°, CD 30°);
При необходимости исследование дополняют и другими проекциями. Коронарография правой коронарной артерии выполняется в 4-6 проекциях:
В ряде случаев исследование может быть дополнено и другими проекциями.
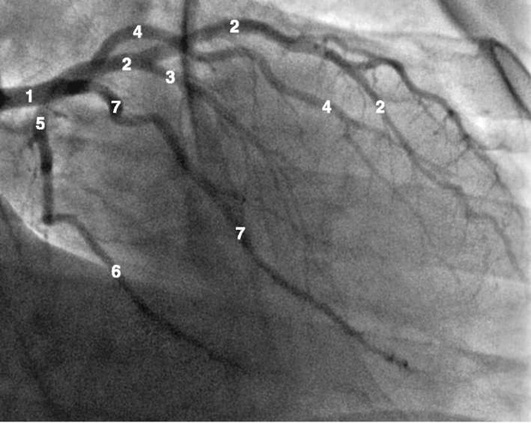
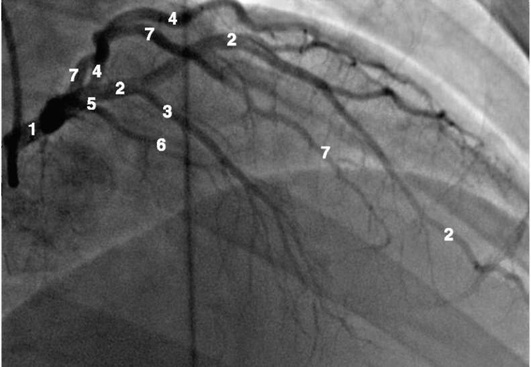
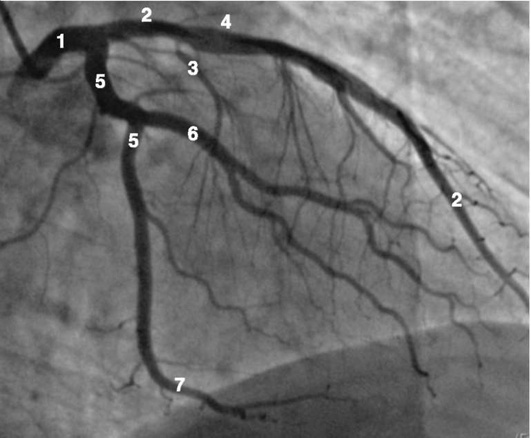
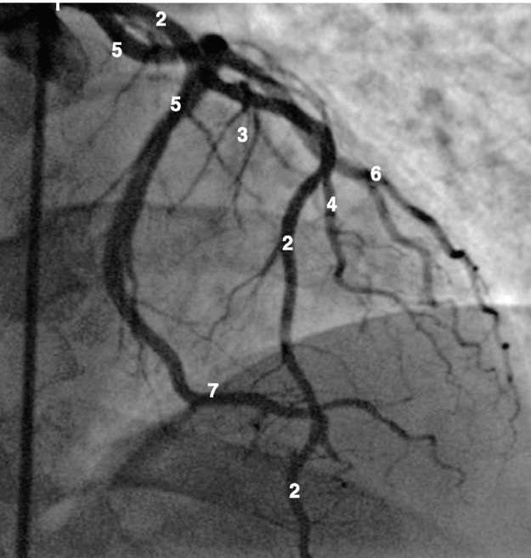
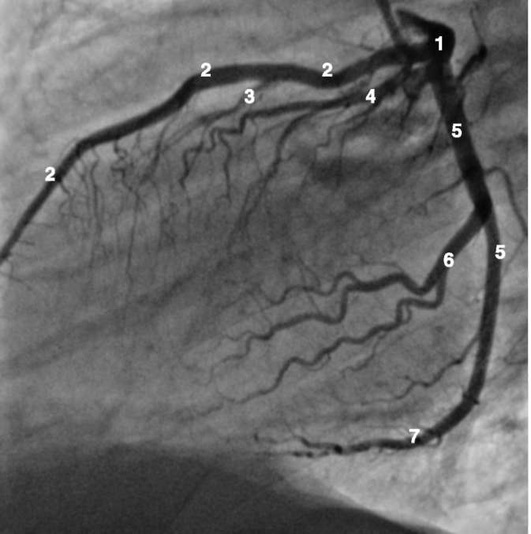
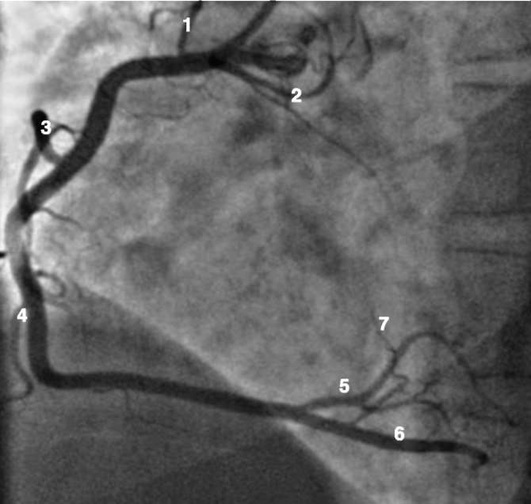
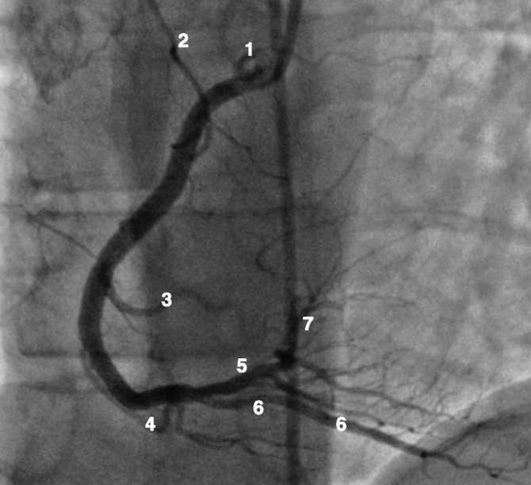
Рентгенанатомия коронарных артерий при правом, левом и сбалансированном типах кровоснабжения миокарда представлена на коронарограммах (рис. 1-1-1-30, см. с. 16-30). Исследование проводят под мониторным контролем ЭКГ и артериального давления. При возникновении сложных нарушений ритма, снижении артериального давления более чем на 25% от исходного, ишемических изменениях на ЭКГ исследование прерывают и проводят соответствующую терапию. Адекватное обезболивание и кислородотерапия, инфузии нитроглицерина и β-блокаторов, атропина и симпатотмиметиков - это не полный перечень медикаментозной терапии, которая может сопровождать выполнение вмешательств.
При выполнении коронарографии необходимо визуализировать все коронарные артерии. Это позволяет определить тип коронарного кровоснабжения, оценить коллатеральный кровоток в инфаркт-связанной зоне, выявить множественность поражения. Отсутствие возможности идентифицировать инфаркт-связанную артерию является показанием для выполнения вентрикулографии. По завершении исследования интервенционный кардиолог должен определить инфаркт-связанную артерию и возможность ее восстановления, рассмотреть целесообразность консервативного лечения в случаях спонтанной реперфузии, небольшой площади поражения и хорошо развитой сети коллатералей или, напротив, необходимость шунтирования коронарных артерий в экстренном или плановом порядке.
Перед проведением чрескожных коронарных вмешательств важно оценить необходимость обеспечения венозного доступа, временной стимуляции или внутриаортальной баллонной контрпульсации. Реканализация инфаркт-связанной правой коронарной артерии может осложниться развитием брадикардии и гипотонии, требующих внутривенного введения большого количества растворов, атропина или симпатомиметиков. При низком профессиональном уровне интервенционного кардиолога эти осложнения могут завершиться летальным исходом.
Реканализацию инфаркт-связанной артерии следует выполнять мягким, свободно управляемым проводником. Последующее интракоронарное введение нитратов дает первое представление о дистальной части инфаркт-связанной артерии. Первоначальное восстановление кровотока может быть достигнуто одним или двумя раздуваниями баллона при 8-12 атмосферах. С целью предупреждения серьезной недооценки реального размера инфаркт-связанной артерии после первоначального восстановления кровотока необходимо производить повторные болюсные введения нитратов. Конечный размер баллона и/или стента должен быть адекватным величине сосуда в соотношении приблизительно 1,1:1. Для оценки результата и определения необходимости дальнейшего раздувания баллона и стентирования необходима визуализация места поражения и дистальной части инфаркт-связанной артерии в различных проекциях. Большинство исследователей считает необходимым завершать вмешательство стентированием, закрывая и изолируя разорванную бляшку.
Профессиональный уровень инвазивного кардиолога должен соответствовать возможности достижения оптимального результата как в восстановлении нормального кровотока в инфаркт-связанной артерии, так и в обеспечении миокардиальной реперфузии. Последняя прогностически более значима, чем восстановление эпикардиального кровотока. О достижении миокарди-альной реперфузии свидетельствует ускоренная эволюция ЭКГ-признаков инфаркта. Напротив, сохраняющаяся элевация сегмента ST и депрессия в реципрокных отведениях указывает на ее отсутствие.
Основные требования, предъявляемые к выполнению чрескожных коронарных вмешательств, могут быть сведены к следующим 10 положениям.
-
Первичный осмотр больного с острым коронарным синдромом не должен превышать 10-15 мин. «Time is muscle, and muscle is life [2]».
-
При постановке диагноза «инфаркт миокарда с подъемом сегмента ST» на догоспитальном этапе больного необходимо доставить в ангиографическую лабораторию, минуя отделение интенсивной терапии.
-
Необходимо своевременное назначение медикаментозной терапии, включающей аспирин, клопидогрель, гепарин, β-блокаторы и нитраты, последние - при отсутствии противопоказаний.
-
При выполнении коронарографии необходимо визуализировать обе коронарные артерии, используя дополнительные проекции.
-
По результатам коронарографии следует рассмотреть возможность консервативного лечения или необходимость шунтирования коронарных артерий.
-
При выполнении вмешательства необходимо использовать баллон и стент, усиливающий стабильность кровотока и предотвращающий реокклюзию.
-
Коронарография и вмешательство должны сопровождаться постоянным наблюдением за больным.
-
Необходима готовность к появлению реперфузионной аритмии, брадикардии и гипотонии.
-
При проведении вмешательства недопустимо уменьшать диаметр восстанавливаемой артерии.
-
Необходимо стентировать инфаркт-связанный стеноз, а не артерию.
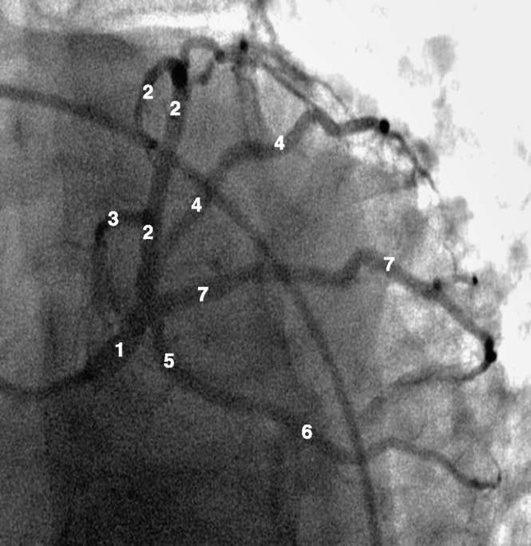
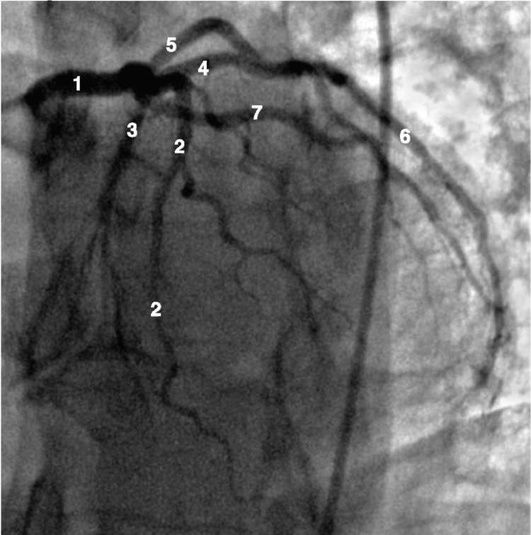
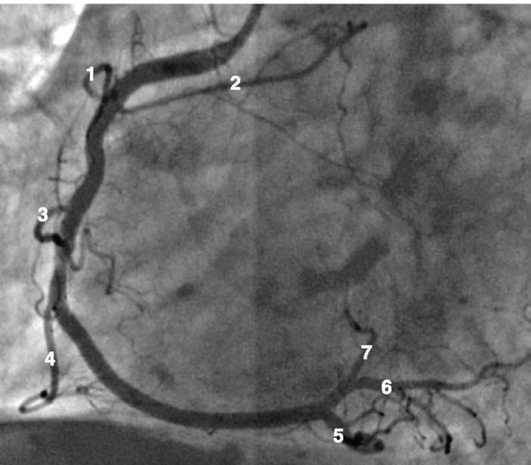
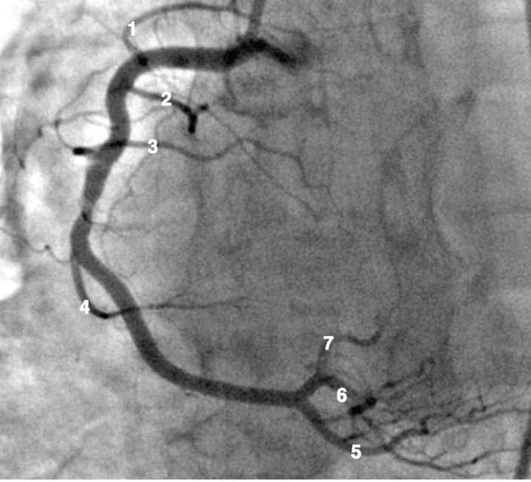
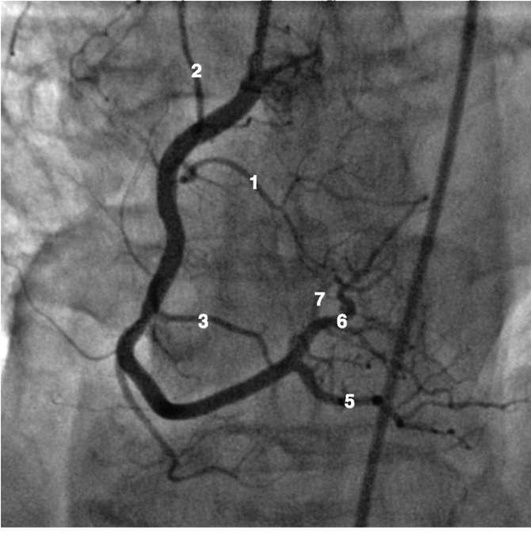
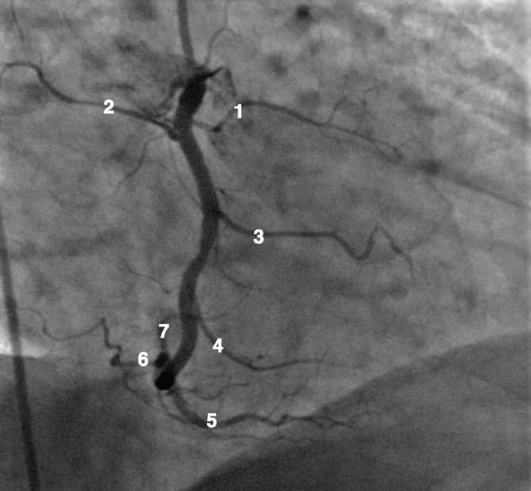
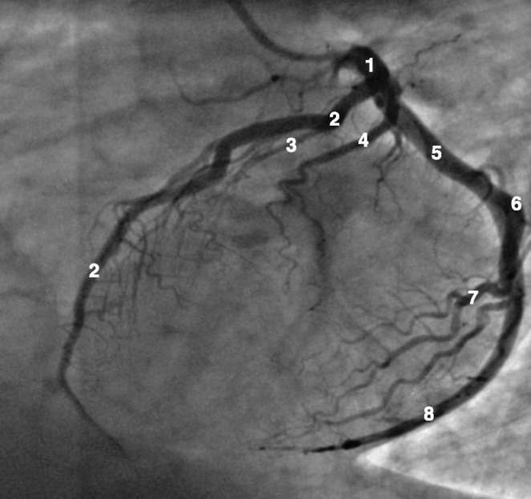
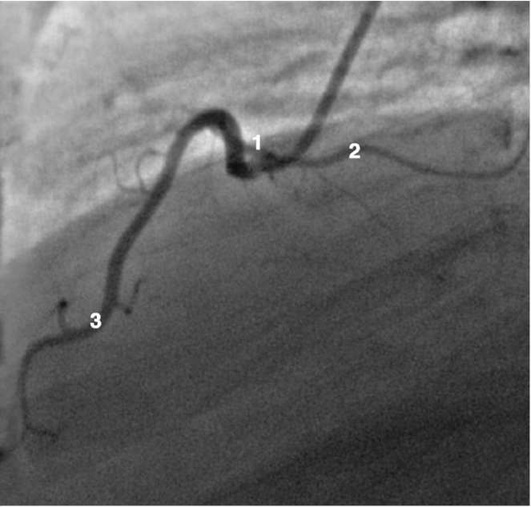
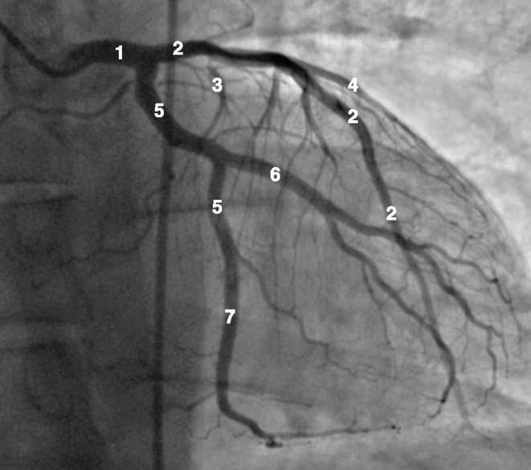
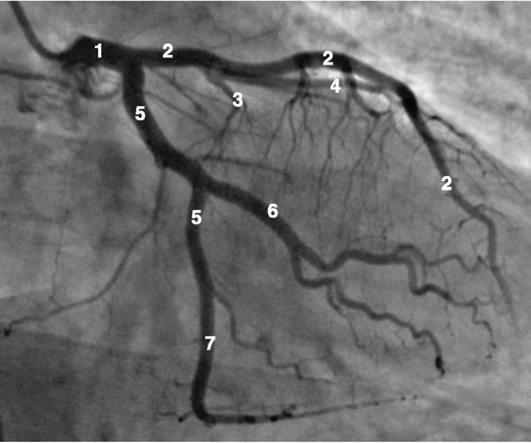
Коронарограммы при различных типах кровоснабжения миокарда
Левая коронарная артерия
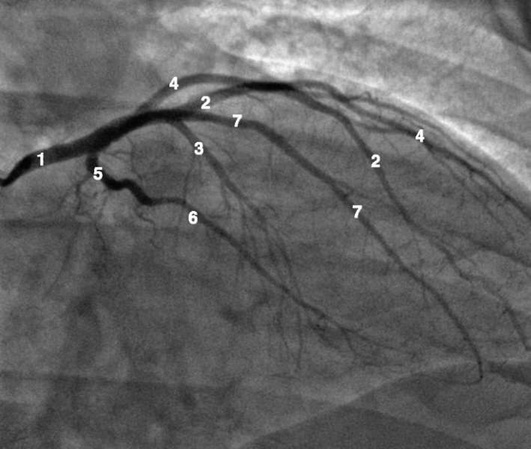
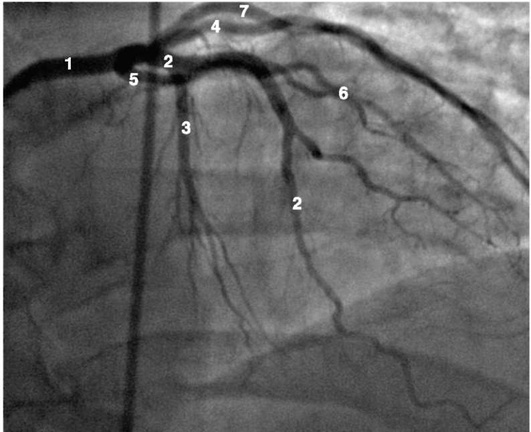
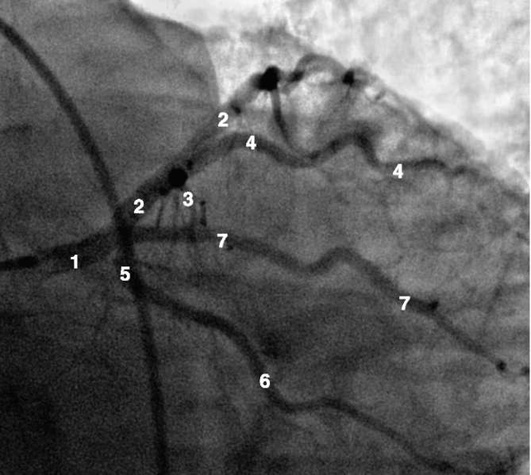
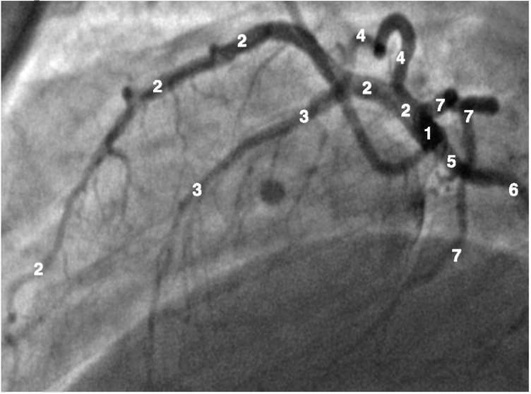
Правая коронарная артерия
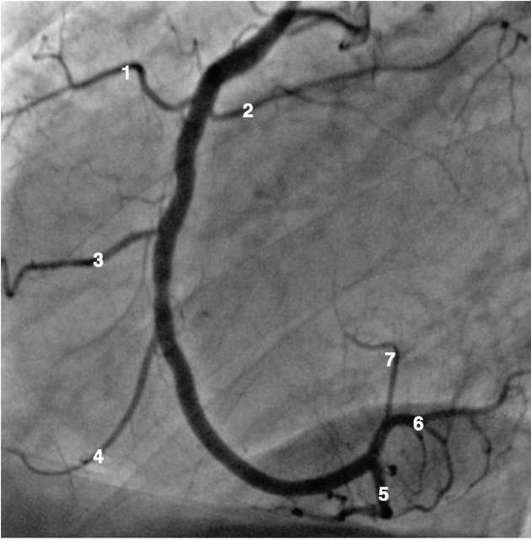
Левая коронарная артерия
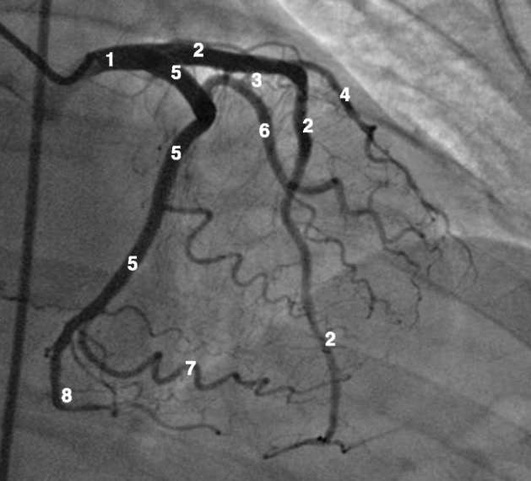

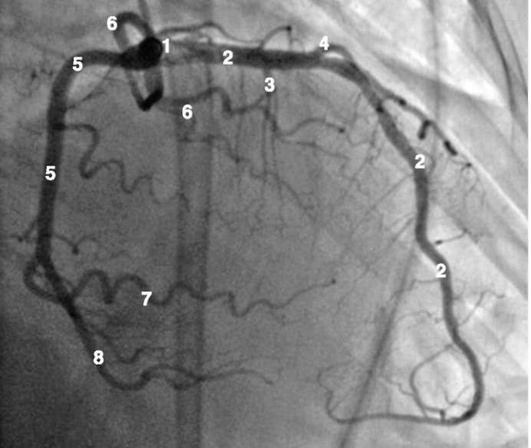
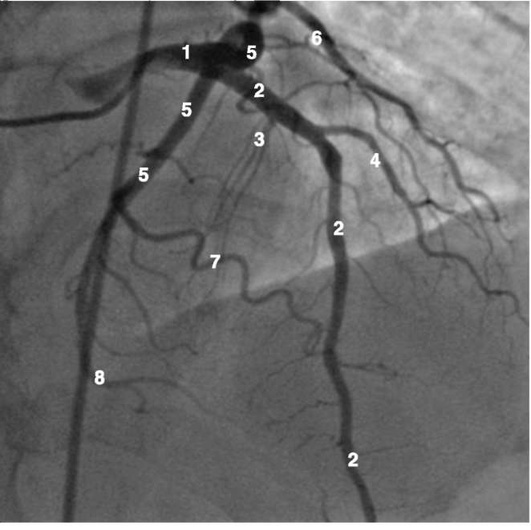
Правая коронарная артерия
Левая коронарная артерия
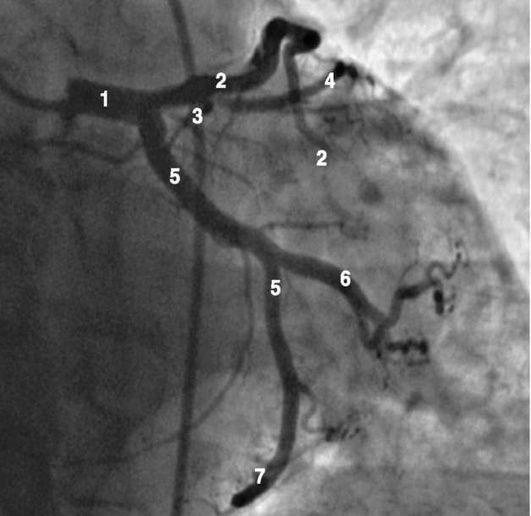
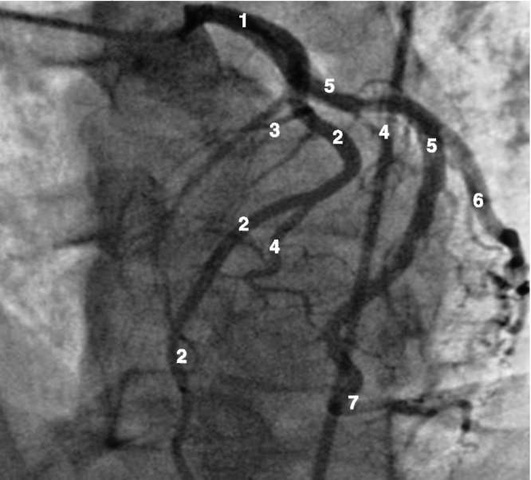
Правая коронарная артерия
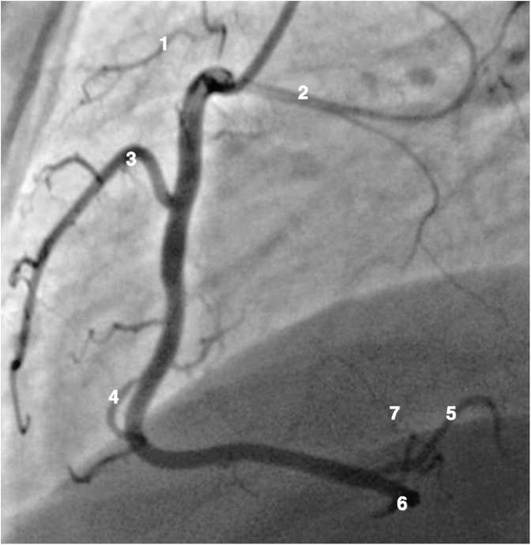
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ СТЕНОЗОВ КОРОНАРНЫХ АРТЕРИЙ
Ангиометрия проводится с помощью интегрированной компьютерной системы количественного автоматического анализа коронарных артерий (QСА). В фазу конечной диастолы выбирается кадр в проекции с наилучшей визуализацией стеноза. После выполнения калибровки системы с использованием известного диаметра концевой части коронарного катетера вручную отмечаются ближайшие неизмененные проксимальная и дистальная точки анализируемого сегмента коронарной артерии. Автоматически проводится средняя линия указанного сегмента, при необходимости выполняется ее ручная корректировка. Далее автоматически в обе стороны от средней линии по уровню разности контрастности изображения отмечаются контуры выбранного сегмента артерии, при необходимости выполняется их мануальная коррекция. На основании метода восстановленного диаметра проксимальный и дистальный контуры (верхний и нижний) отмеченного сегмента соединяются между собой. Место прохождения верхнего и нижнего контуров в месте наибольшего сужения сосуда определяются как восстановленный референтный диаметр артерии (в мм) и принимаются за 100%, далее определяется процент сужения по диаметру и по площади. Также определяется абсолютный диаметр артерии в месте наибольшего сужения в мм, протяженность пораженного участка артерии в мм.
Гемодинамически значимыми считаются сужения коронарной артерии от 50% в диаметре (75% и более по площади). Из них стенозы от 50% до 70% в диаметре (менее 90% по площади) расцениваются как пограничные, стенозы более 70% - как выраженные, полное перекрытие просвета коронарной артерии расценивается как тотальная окклюзия.
ОЦЕНКА ЭПИКАРДИАЛЬНОГО КРОВОТОКА И МИОКАРДИАЛЬНОЙ ПЕРФУЗИИ ПО TIMI
Оценка степени кровотока в эпикардиальных коронарных артериях проводится в соответствии с классификацией TIMI [3], предусматривающей четыре степени.
-
TIMI 0 - отсутствие антеградного кровотока дистальнее места сужения или окклюзии.
-
TIMI I - контрастное вещество проникает за область сужения, но не может адекватно заполнить дистальное коронарное русло за время выполнения ангиографии.
-
TIMI II - контрастное вещество проникает за зону сужения и заполняет дистальное русло артерии, однако скорость проникновения и скорость вымывания контраста значительно замедлены по сравнению с аналогичными показателями в кровоснабжаемых нестенозированными сосудами сопоставимых областях миокарда.
-
TIMI III - антеградный кровоток дистальнее места стеноза, контрастирование сопоставимо по скорости заполнения и вымывания с контрастированием сравнимых участков коронарного русла, кровоснабжаемых несуженными венечными артериями.
На протяжении многих лет восстановление кровотока до III и даже II степени по TIMI считалось золотым стандартом, подтверждающим состоявшуюся реперфузию. В дальнейшем было обнаружено, что у больных с достижением кровотока TIMI III результаты реперфузионной терапии могут быть различными, в зависимости от степени редукции сегмента ST. У пациентов с восстановлением сегмента ST больше чем на 50% сократительная функция левого желудочка и выживаемость была значительно лучше, чем у больных с менее выраженной редукцией. Эти различия связывали с феноменом «no-reflow»: отсутствием перфузии на миокардиальном уровне, несмотря на восстановление эпикардиального кровотока. В связи с этим исследователи пришли к выводу, что определение степени кровотока в инфаркт-связанной артерии недостаточно для адекватной оценки миокардиальной реперфузии. В качестве эффективного ангиографического метода предложена перфузионная миокардиальная ангиография, позволяющая оценить степень контрастирования миокарда - «ангиографического румянца» [4]. Она проводится в соответствии с классификацией TMPG [5], предусматривающей 4 степени реперфузии.
-
TMPG 0 - отсутствие проникновения контрастного вещества в микро-циркуляторное русло. Помутнение участка миокарда в бассейне инфаркт-связанной артерии отсутствует или минимально.
-
TMPG I - замедленное проникновение без вымывания контрастного вещества из микроциркуляторного русла. Помутнение участка миокарда в бассейне инфаркт-связанной артерии не исчезает до следующей инъекции (интервал - 30 сек).
-
TMPG II - замедленное проникновение и выведение контрастного вещества из микроциркуляторного русла. Помутнение участка миокарда в бассейне инфаркт-связанной артерии сохраняется в конце фазы вымывания (после 3 сердечных циклов).
-
TMPG III - свободное проникновение и вымывание контрастного вещества из микроциркуляторного русла. Помутнение участка миокарда в бассейне инфаркт-связанной артерии исчезает полностью или присутствует в незначительной степени в конце фазы вымывания (после 3 сердечных циклов).
По данным Zijlstra F., у больных с достижением кровотока TIMI III при первичных чрескожных коронарных вмешательствах в 20% случаев «ангиографический румянец» не превышал TMPG 0-I. Это свидетельствовало об отсутствии миокардиальной реперфузии, чреватом развитием дисфункции левого желудочка и других осложнений.
ОПРЕДЕЛЕНИЕ ИНФАРКТ-СВЯЗАННОЙ АРТЕРИИ ПЕРЕД ПРИМЕНЕНИЕМ ЧРЕСКОЖНЫХ КОРОНАРНЫХ ВМЕШАТЕЛЬСТВ
Идентификация инфаркт-связанной артерии необходима для выбора оптимальной тактики лечения. В большинстве случаев она может быть определена по данным ЭКГ при первичном осмотре больного с острым коронарным синдромом с элевацией сегмента ST. Прекардиальные отведения отражают трансмуральную ишемию в бассейне передней межжелудочковой ветви, нижние - в бассейне правой коронарной артерии или огибающей ветви. Использование ЭКГ-алгоритмов позволяет уточнить, какая из них является инфаркт-связанной и на каком уровне имеет место острая окклюзия.
Данные электрокардиографического метода определения инфаркт-связанной артерии и уровня окклюзии в ней сопоставляют с результатами коронарографии. Учитывают тип коронарного кровообращения, количественные и качественные характеристики стенозирующего поражения коронарного русла. В случаях, когда в кровоснабжении ишемизированной зоны участвует одна коронарная артерия, она и принимается за инфаркт-связанную; если в кровоснабжении принимают участие две или три стенозированные артерии, то инфаркт-связанной считают артерию с наибольшей степенью сужения; при равнозначном их поражении инфаркт-связанной признают артерию с «осложненной» формой бляшки - с признаками изъязвления или разрыва в виде неровных и нечетких контуров, внутрипросветного дефекта наполнения. При равнозначности морфологических характеристик инфаркт-связанной артерией считают артерию большего диаметра или со сниженным кровотоком. В очень редких случаях, когда данные коронарографии не позволяют уточнить, какая из артерий является инфаркт-связанной, прибегают к вентрикулографии.
ОЦЕНКА «УСПЕХА ЧРЕСКОЖНЫХ КОРОНАРНЫХ ВМЕШАТЕЛЬСТВ»
При оценке эффективности чрескожных коронарных вмешательств выделяют три категории успеха: ангиографический успех, успех вмешательства и успех по клиническим критериям.
Ангиографическим успехом считают достижение эпикардиального кровотока TIMI-III при остаточном стенозе менее 20% после имплантации стента. Неудовлетворительным результатом считают наличие остаточного стеноза более 20% после стентирования, кровоток TIMI-II-0 в дилатированной артерии, развитие диссекций типа D-F. Диссекцию определяют как наличие одного из ангиографических признаков: внутрипросветного дефекта наполнения, поступления контрастного вещества за контур сосуда, линейного внутрипросветного уплотнения, внутрипросветной задержки контрастного вещества. Тип диссекций коронарных артерий определяют в соответствии с классификацией NHLBI [6] (табл. 1-1).
Диссекция типа А: наличие рентгенонегативной области в просвете артерии во время введения контрастного вещества с минимальным присутствием контраста или при его отсутствии после окончания инъекции |
Диссекция типа В: параллельный ход или двойной просвет сосуда, разделенный рентгенонегативной областью во время введения контрастного вещества, с минимальным присутствием контраста или при его отсутствии после окончания инъекции. |
Диссекция типа С: появление контрастного вещества за пределами контура сосуда с остающимся контрастированием после окончания введения контраста |
Диссекция типа D: наличие спирального внутрипросветного дефекта наполнения и задержки контрастного вещества в сосуде. Диссекция типа Е: появление нового устойчивого дефекта наполнения (определяется как тромбоз). |
Диссекция типа F: наличие таких диссекций, которые приводят к тотальной окклюзии коронарной артерии с отсутствием антеградного кровотока (определяется как тромбоз) |
Ангиографический успех в сочетании с отсутствием серьезных госпитальных осложнений - смерти, инфаркта миокарда или экстренного шунтирования коронарных артерий - объединяют в успех вмешательства. Среди других осложнений выделяют нарушение мозгового кровообращения и сосудистые нарушения. К последним относят перфорацию артерии с развитием забрюшинной гематомы, пульсирующую гематому в области пункции, тромбоз артерии.
Успех вмешательства в сочетании с уменьшением или исчезновением признаков ишемии миокарда расценивают как «клинический успех». В нем выделяют ближайший и отдаленные результаты. Последние предполагают, что клинический эффект должен сохраняться не менее 6 месяцев после вмешательства. Достижению «отдаленного клинического успеха» препятствует развитие рестеноза. О рестенозе свидетельствует уменьшение диаметра просвета стентированного сегмента коронарной артерии со степенью сужения, превышающей 50%. Выделяют рестеноз внутри стента («in-stent») и в пределах 5 мм проксимальнее или дистальнее ранее имплантированного стента («in-lesion»). Вероятность рестенозов возрастает при вмешательствах на сосудах диаметром менее 3,0 мм и стенозах протяженностью более 20,0 мм. Уменьшение диаметра просвета за счет не устраненных при первичном вмешательстве стенозов или ранее не измененных сегментов коронарной артерии указывает на прогрессирование атеросклеротического процесса.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
-
Бокерия Л.А., Алекян Б.Γ., Коломбо А., Бузиашвили Ю.И. Интервенционные методы лечения ишемической болезни сердца. - М.: НЦССХ им. А.Н. Бакулева РАМН, 2002.
-
Крыжановский В.А., Пауэрс Э.Р. Электрокардио-ангиографические параллели при инфаркте миокарда // Кардиология. - 1999. - № 1. - С. 64-74.
-
Петросян Ю.С., Зингерман Л.С. Коронарография. - М.: Медицина, 1974.
-
Самойлова С.В. Анатомия кровеносных сосудов сердца. - М.: Медицина, 1970.
-
Тихонов К.Б. Функциональная рентгеноанатомия сердца. - М.: Медицина, 1978.
-
Barbeau G.R., Carrier G., Ferland S. et al. Right transradial approach for coronary procedures. Preliminary results // Journal of Invasive Cardiology. - 1996. - Vol. 8. - P. 19D-21D.
-
Freek W.A. Verheugt. Eric Boersma Prehospital triage and treatment of suspected acute myocardial infarction. Coronary reperfusion therapy in clinical practice. - UK, 2006. - Р. 19-43.
-
Gibson C.M., de Lemos G.A., Murphy S.A. Metodologic clinical validation of the TIMI myocardial perfusion grade in acute myocardial infarction // J. Thromb Trombolysis. - 2002. - Vol. 14. - P. 233-237.
-
Levin D.C., Kauff M., Baltaxe H. Coronary collateral circulation // Am. J. Roent-genol. - 1973. - Vol. 119. - P. 463-473.
-
Lotan С., Hasin Y., Mosseri М. et al. Transradial approach for coronary angiography and angioplasty // American Journal of Cardiology. - 1995. - Vol. 76. - P. 164-167.
-
The TIMI Study Group. The trombolysis in myocardial infarction trial. Phase I finding // N. Engl. J. Med. - 1985. - Vol. 312. - P. 932-936.